核酸の均一増幅方法および高感度検出方法
【課題】 微量の核酸を、迅速かつ簡便に、高増幅率で増幅する方法を提供すること。
【解決手段】 核酸の増幅方法であって、ターゲット配列またはその相補配列を含むターゲット核酸鎖の3'末端に既知配列を含む繰り返し配列を導入するステップ、該繰り返し配列にハイブリダイズするオリゴヌクレオチドを、該ターゲット核酸鎖に導入した繰り返し配列に複数個ハイブリダイズさせるステップ、該オリゴヌクレオチドをプライマーとして用いて該ターゲット核酸鎖を鋳型とした相補鎖合成を行い、1つのターゲット核酸鎖から複数の核酸相補鎖を生成するステップを含む方法。
【解決手段】 核酸の増幅方法であって、ターゲット配列またはその相補配列を含むターゲット核酸鎖の3'末端に既知配列を含む繰り返し配列を導入するステップ、該繰り返し配列にハイブリダイズするオリゴヌクレオチドを、該ターゲット核酸鎖に導入した繰り返し配列に複数個ハイブリダイズさせるステップ、該オリゴヌクレオチドをプライマーとして用いて該ターゲット核酸鎖を鋳型とした相補鎖合成を行い、1つのターゲット核酸鎖から複数の核酸相補鎖を生成するステップを含む方法。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、核酸の増幅方法および検出方法に関するものである。具体的には、本発明は、DNAまたはmRNAを均一にかつ効率的に増幅する方法、および該増幅方法を利用して核酸を検出する方法に関するものである。
【背景技術】
【0002】
遺伝子の発現解析や遺伝子診断など種々DNA(あるいはmRNA)の比較解析では、対象とするDNAのコピー数が少ないためにそのコピー数を増幅してから計測することが広く行われている。一般的な増幅方法には、ターゲットとなるDNAの領域を挟んで2箇所をプライミング領域として選択し、その領域にプライマーをハイブリダイズさせ、ターゲット領域を繰り返し相補鎖合成してコピー数を増やすPCR(Polymerase Chain Reaction)や、ターゲット領域にプローブをハイブリダイズさせ、ライゲーションによりリング状のDNAを作製してそれにハイブリダイズするプライマーを用いて相補鎖合成をリングに沿って何周にもわたって行い、ターゲット領域を増幅するRCA(Rolling Circle Amplification)、あるいは鎖置換増幅(SDA)などが知られている。また、多くのプライマーセットと鎖置換増幅を組み合わせたDNA増幅方法などが報告されている(特許文献1)。しかし、これら増幅方法には、増幅対象となる領域の長さや構成する塩基の配列もしくは種類などによって増幅率が異なることがある。これは詳細な遺伝子発現を調べる上で大きな課題である。
【0003】
遺伝子の発現分析は生命科学の基本データとして重要であるばかりでなく、診断あるいは創薬など幅広い分野に用いられている。現在、遺伝子の発現を調べるには多くの細胞をサンプルとして使用し、mRNAを取り出してcDNAを作製し、これらを一括してPCRなどにより増幅してからDNAチップなどを用いてmRNAの発現量を定量分析している。これら多くの細胞を用いた測定ばかりでなく、1つの細胞を対象にそこで発現している遺伝子の解析が注目されつつある(非特許文献1)。このような遺伝子発現解析では多くの細胞を用いた方法よりはるかに少ないmRNAを用いて精密に定量分析することが求められる。このためにmRNAの増幅が重要である。現在mRNAを対象とした一括増幅を行うための試薬キットが市販されている(QIAGEN社;QuantiTect Whole Transcriptome Kit)。これはmRNAからcDNAを生成する際に種々の部位にハイブリダイズするランダムプライマーを用いてcDNAを作製し、得られたcDNA断片混合物をライゲーションにより連結して種々の断片の混ざったリング状のDNAとし、そこにランダムプライマーを再度作用させてRCA増幅するものである。この方法は500〜1000細胞以上の多くの細胞を用いた場合には比較的良好に動作するが、少ない細胞では対象とするDNA断片ごとの増幅率が変化してしまう。また、PCRを用いる一括増幅方法も用いられている(非特許文献1)が、これはまず、アンカー配列付きのポリT配列を有するDNAプローブを用いてmRNAからcDNAを作製し、その3'末端にターミナルトランスフェラーゼを用いてポリA鎖を付加して増幅のための鋳型DNAとする。アンカー配列とポリA配列部分を用いてPCR増幅するが、ターゲットの配列や長さにより増幅率がやはり異なることになる。より精密な遺伝子発現分析には均一なDNA増幅方法が望まれる。
【0004】
少ないDNAコピーを含むサンプルを用いて遺伝子発現解析のような精密な比較分析を行う場合には、対象となる種々DNAを均一に増幅することが必要不可欠である。増幅方法として一般に用いられているポリメラーゼ連鎖反応(PCR)法は、温度を上下して2本鎖DNAを1本鎖にし、プライマーをハイブリダイズさせて相補鎖合成するプロセスを繰り返す方法である。相補鎖合成の効率は対象とするDNAの配列や長さにより若干変化する。PCRでは1サイクル当たりの増幅率をY、温度サイクルの数をnとすると約Yn倍に増幅される。Yは理想的に行けば2であるが実際には1.6前後である。nは通常30〜40であるが熱サイクル当たりの増幅率が少し変化すると増幅率が大きく変化する。たとえば2%だけYが変化した場合に35回熱サイクル反応を行うと増幅率には2倍の差ができる。熱サイクル1回当たりの増幅率は温度やターゲットDNAの長さおよび配列に依存するので、DNAの種類が異なると数倍の増幅率の差ができてしまう。このような差は精密なDNAの存在比を計測するときには障害となる。
【0005】
一方、リング状のDNAを作製してプライマーをハイブリダイズさせて相補鎖合成を繰り返すローリングサークル増幅(RCA)法では対象とするリングのサイズに依存して増幅率が変化するものの、相補鎖合成時間でほぼ増幅率が決定される利点がある。しかし、増幅対象とする領域をリング状のDNAとすることが必要で、短い既知配列部分を増幅する際には有効であるが、長い未知配列部分を対象とした増幅には単位時間当たりの増幅率が低く不向きである。たとえば、具体的な例として遺伝子の発現プロフィール分析のためにmRNAから得られるcDNAを増幅しようとすると、cDNAの長さがそれぞれ異なることなどからRCAを利用することはできない。
【0006】
また、複数のプライマーセットと鎖置換DNA相補鎖合成を用いた方法では対象とするDNAごとに多くのプライマーセットを必要とするので、複数の対象DNA断片が存在する場合には煩雑である上、予期せぬ副産物が生じることもあり、やはり有効ではない。
【0007】
さらにDNAを用いた遺伝子診断が感染症の判定に用いられており、できる限り迅速にDNAを増幅して検出することが望まれているが、現状では少なくとも1時間程度の時間を要する。例えばPCRでは1回の熱プロセスに要する時間は通常1〜2分程度である。充分な増幅を行おうとすると40サイクル程の熱サイクルが必要で、これには1時間を要する。このように長い時間を要するDNA増幅検査はウィルスなどの感染症検査では望ましくない。できるだけ短時間に検査を行い、その後の方針を決定するためである。そこで増幅率が大きく、短時間でDNA増幅できる方法が望まれている。
【先行技術文献】
【特許文献】
【0008】
【特許文献1】特表2001−519172号公報
【非特許文献】
【0009】
【非特許文献1】Nucreic Acids Res. 34, e42(2006)
【発明の概要】
【発明が解決しようとする課題】
【0010】
上述のように、微量のDNA増幅に適用でき、配列やDNAの長さの如何にかかわらず増幅する方法や短時間にDNAを増幅する方法の確立が求められている。
【0011】
従って、本発明の課題は、微量の核酸を、迅速かつ簡便に、高増幅率で増幅する方法を提供することである。また本発明の別の課題は、微量の核酸を、迅速に高増幅率で増幅し、検出する方法を提供することである。
【課題を解決するための手段】
【0012】
上記課題を解決するため鋭意検討を行った結果、本発明者は、増幅対象の核酸の末端に繰り返し配列を導入し、該繰り返し配列に複数のプライマーをハイブリダイズさせて鎖置換型相補鎖合成を行うことにより、増幅対象の核酸およびその相補鎖を同時並行的に合成することができ、核酸を短時間に高増幅率で増幅できるという知見を得、本発明を完成するに至った。
【0013】
すなわち本発明は以下のとおりである。
【0014】
(1)核酸の増幅方法であって、
ターゲット配列またはその相補配列を含むターゲット核酸鎖の3'末端に既知配列を含む繰り返し配列を導入するステップ、
該繰り返し配列にハイブリダイズするオリゴヌクレオチドを、該ターゲット核酸鎖に導入した繰り返し配列に複数個ハイブリダイズさせるステップ、
該オリゴヌクレオチドをプライマーとして用いて該ターゲット核酸鎖を鋳型とした相補鎖合成を行い、1つのターゲット核酸鎖から複数の核酸相補鎖を生成するステップ
を含む方法。
(2)繰り返し配列が、ターゲット配列またはその相補配列の長さよりも短いものである、(1)に記載の方法。
(3)繰り返し配列が、ターゲット配列またはその相補配列の長さよりも長いものである、(1)に記載の方法。
(4)繰り返し配列に含まれる繰り返し単位の数が100を超えるものである、(1)〜(3)のいずれかに記載の方法。
(5)繰り返し配列に含まれる繰り返し単位の数が1000を超えるものである、(1)〜(3)のいずれかに記載の方法。
(6)ターゲット核酸鎖が複数種の核酸鎖を含むものであり、それらの複数種の核酸鎖に対して共通の繰り返し配列を導入するものである、(1)〜(5)のいずれかに記載の方法。
【0015】
(7)繰り返し配列の導入が、繰り返し配列を有する核酸鎖をターゲット核酸鎖にライゲーションにより導入することにより行う、(1)〜(6)のいずれかに記載の方法。
(8)繰り返し配列の導入が、繰り返し配列を有する核酸鎖を鋳型とし、ターゲット核酸鎖の3'末端部分を繰り返し配列導入用プライマーとしてまたはターゲット核酸鎖の3'末端に付加した配列部分を繰り返し配列導入用プライマーとして用いる相補鎖合成により行う、(1)〜(6)のいずれかに記載の方法。
(9)繰り返し配列を有する核酸鎖が、リング状の核酸を鋳型とした相補鎖合成によって生成されたものである、(7)または(8)に記載の方法。
【0016】
(10)繰り返し配列の導入が、ターゲット核酸鎖に含まれる配列部分、または該ターゲット核酸鎖に付加した配列部分を繰り返し配列導入用プライマーとして使用し、リング状の核酸を鋳型とする相補鎖合成により行う、(1)〜(6)のいずれかに記載の方法。
(11)繰り返し配列の導入が、ターゲット核酸鎖に付加した配列部分を繰り返し配列導入用プライマーとして使用し、該配列部分にハイブリダイズしかつライゲーションによりリング状の核酸を形成することができるオリゴヌクレオチドを用いて形成されたリング状の核酸を鋳型とする相補鎖合成により行う、(1)〜(6)のいずれかに記載の方法。
(12)繰り返し配列導入用プライマーの少なくとも一部が、ターゲット核酸鎖の3'末端に付加した配列部分を利用するものである、(10)または(11)に記載の方法。
(13)繰り返し配列の導入が、ターゲット核酸鎖の3'末端に付加した配列部分の少なくとも一部にハイブリダイズするオリゴヌクレオチドを鋳型として相補鎖合成により得られた配列部分の相補配列を繰り返し配列導入用プライマーとして使用し、リング状の核酸を鋳型とする相補鎖合成により行う、(1)〜(6)のいずれかに記載の方法。
(14)ターゲット核酸鎖の3'末端に、ターミナルトランスフェラーゼにより配列部分を付加する、(8)〜(13)のいずれかに記載の方法。
(15)ターゲット核酸鎖の3'末端に付加した配列部分に隣接する該ターゲット核酸鎖の3'末端側の配列部分と、付加した配列部分の全てまたは一部分とにハイブリダイズし、かつ既知配列を含むオリゴヌクレオチドを鋳型として相補鎖合成を行い、該ターゲット核酸鎖の3'末端に付加した配列部分の一部を必要に応じて除去し、続いてハイブリダイズしたオリゴヌクレオチドを鋳型として相補鎖合成により該ターゲット核酸鎖の3'末端側に付加された該既知配列を繰り返し配列導入用プライマーとして用いて、リング状核酸を鋳型として相補鎖合成を行うことにより、繰り返し配列を導入するものである、(13)に記載の方法。
(16)ターゲット核酸鎖の3'末端に付加した配列部分の一部の除去が、該配列部分におけるオリゴヌクレオチドがハイブリダイズしていない部分の塩基をエキソヌクレアーゼを含む酵素を用いて除去することにより行う、(15)に記載の方法。
【0017】
(17)ターゲット核酸鎖の3'末端に付加した、繰り返し配列導入用プライマーとして使用する配列部分が、制限酵素切断に続くオリゴヌクレオチドのライゲーションまたはオリゴヌクレオチドを鋳型とする相補鎖合成により生成されたものである、(10)〜(13)のいずれかに記載の方法。
(18)繰り返し配列導入用プライマーとして、ターゲット核酸鎖に含まれる既知配列部分を利用するものである、(10)に記載の方法。
(19)ターゲット核酸鎖の既知配列部分を切断して、得られるターゲット核酸鎖の3'末端を含む部分を繰り返し配列導入用プライマーとして使用する、(18)に記載の方法。
(20)ターゲット核酸鎖の既知配列部分の切断が、Cleavaseを含む酵素により行う、(19)に記載の方法。
【0018】
(21)ターゲット核酸鎖の既知配列部分にハイブリダイズし、かつ5'末端側にアンカー配列を有するオリゴヌクレオチドをターゲット核酸鎖にハイブリダイズさせ、該オリゴヌクレオチドを伸張する相補鎖合成を行って2本鎖核酸を生成し、1本鎖核酸を3'末端から分解する酵素を用いてターゲット核酸鎖の1本鎖部分を分解除去し、次いで該オリゴヌクレオチドのアンカー配列を鋳型としてターゲット核酸鎖の3'末端側を伸張する相補鎖合成によりターゲット核酸鎖に配列部分を付加して、繰り返し配列導入用のプライマーを生成するものである、(10)〜(13)のいずれかに記載の方法。
(22)ターゲット核酸鎖の既知配列部分にハイブリダイズし、かつ5'末端側にアンカー配列を有するオリゴヌクレオチドをターゲット核酸鎖にハイブリダイズさせ、該オリゴヌクレオチドを伸張する相補鎖合成を行って2本鎖核酸を生成し、ターゲット核酸鎖の1本鎖部分を除去し、次いで該オリゴヌクレオチドのアンカー配列を鋳型とした相補鎖合成によりターゲット核酸鎖の3'末端に既知配列部分を付加し、該オリゴヌクレオチドを除去することにより、繰り返し配列導入用のプライマーを生成するものである、(10)〜(13)のいずれかに記載の方法。
(23)ターゲット核酸鎖の3'末端および5'末端に既知配列部分を付加し、ターゲット核酸鎖およびその相補核酸鎖の両方について3'末端の該既知配列部分を繰り返し配列導入用プライマーとして、該既知配列部分にハイブリダイズすることができるリング状のDNAを鋳型として用いて相補鎖合成を行うことにより、該3'末端および5'末端に繰り返し配列を導入するものである、(8)〜(11)のいずれかに記載の方法。
(24)ターゲット核酸鎖に導入された繰り返し配列にハイブリダイズする第1のオリゴヌクレオチドをプライマーとして用いる相補鎖合成を行い、生成された相補核酸鎖を鋳型として、その3'末端にハイブリダイズする第2のオリゴヌクレオチドをプライマーとして用いて相補鎖合成を行い、ターゲット核酸鎖のコピーを増幅するステップを含む、(1)〜(23)のいずれかに記載の方法。
(25)ターゲット核酸鎖に導入された繰り返し配列にハイブリダイズするオリゴヌクレオチドをプライマーとして用いる相補鎖合成を行い、得られた2本鎖核酸を1本鎖核酸とし、次いで該オリゴヌクレオチドをプライマーとして、生成された1本鎖核酸を鋳型として相補鎖合成を行うステップを繰り返すものである、(1)〜(23)のいずれかに記載の方法。
【0019】
(26)ターゲット配列またはその相補配列を含み、3'末端に繰り返し配列を有し、かつ5'末端にループ配列を有するターゲット核酸鎖を生成するステップを含む、(1)〜(25)のいずれかに記載の方法。
(27)核酸鎖がDNA鎖である、(1)〜(26)のいずれかに記載の方法。
【0020】
(28)ターゲット核酸鎖の5'末端側が固体表面に固定されている、(1)〜(27)のいずれかに記載の方法。
(29)ターゲット核酸鎖に導入される繰り返し配列にハイブリダイズするオリゴヌクレオチドが固体表面に固定されている、(1)〜(28)のいずれかに記載の方法。
(30)ターゲット核酸鎖に導入される繰り返し配列にハイブリダイズする第1のオリゴヌクレオチドを用いて生成された相補核酸鎖を、固体表面に固定した第2のオリゴヌクレオチドを用いて捕獲し、第2のオリゴヌクレオチドをプライマーとして相補鎖合成を行うステップを含む、(1)〜(29)のいずれかに記載の方法。
(31)固体がビーズである、(28)〜(30)のいずれかに記載の方法。
(32)固体が区画化された平面固体である、(28)〜(30)のいずれかに記載の方法。
(33)固体表面が多孔質または細孔アレーの内壁である、(28)〜(30)のいずれかに記載の方法。
(34)ターゲット核酸鎖またはその相補核酸鎖にハイブリダイズする少なくとも2種のオリゴヌクレオチドが同一固体表面に固定されている、(28)〜(33)のいずれかに記載の方法。
【0021】
(35)ターゲット核酸鎖に導入された繰り返し配列の前または後ろに制限酵素切断認識配列が導入されるように相補鎖合成を行い、得られた相補核酸鎖から制限酵素を用いて繰り返し配列を切断除去するステップを含む、(1)〜(34)のいずれかに記載の方法。
(36)ターゲット核酸鎖に相補的な配列と5'末端に第1のアンカー配列とを有するキャプチャープローブを用いてターゲット核酸鎖を鋳型として相補鎖合成するステップ、生成した相補核酸鎖を1本鎖とするステップ、1本鎖相補核酸鎖にハイブリダイズする第1のオリゴヌクレオチドを用いて相補鎖合成を行い、第1のオリゴヌクレオチドが伸張した3'末端側に第1のアンカー配列に基づく既知配列部分を導入するステップ、該既知配列部分をプライマーとしてリング状の核酸鎖にハイブリダイズさせて相補鎖合成を行い、3'末端側に第1の繰り返し配列が導入された相補核酸鎖を生成するステップ、ならびに第1の繰り返し配列に複数の第2のオリゴヌクレオチドをハイブリダイズさせて、同時並行的に相補鎖合成するステップを含む、(1)に記載の方法。
(37)第1のオリゴヌクレオチドが5'末端側に第2のアンカー配列を含み、第1の繰り返し配列にハイブリダイズする第2のオリゴヌクレオチドをプライマーとして相補鎖合成した相補鎖の3'末端側に第2のアンカー配列に基づく既知配列部分を導入し、該既知配列部分をプライマーとして使用して、リング状の核酸を鋳型として相補鎖合成を行い、3'末端側に第2の繰り返し配列が導入された相補核酸鎖を生成するステップをさらに含む、(36)に記載の方法。
(38)複数種のmRNAからcDNAライブラリを作製し、cDNAライブラリに含まれる複数種のcDNAをターゲット核酸鎖として均一にDNAを増幅するものである、(1)〜(37)のいずれかに記載の方法。
(39)mRNAまたはcDNAを捕捉するビーズとは異なるビーズ上に増幅したDNAコピーを作製するものである、(38)に記載の方法。
【0022】
(40)単一種または複数種の核酸鎖を含む核酸プールを均一に増幅する方法であって、
核酸プールに含まれる核酸鎖の3'末端に既知配列を含む繰り返し配列を導入するステップ、該繰り返し配列にハイブリダイズするオリゴヌクレオチドと、鎖置換型ポリメラーゼを用いて相補鎖合成を行うステップを含む方法。
(41)核酸の増幅方法であって、ターゲット配列またはその相補配列を含むターゲット核酸鎖の3'末端に既知配列を含む繰り返し配列を導入するステップ、該繰り返し配列にハイブリダイズするオリゴヌクレオチドを用いて相補鎖合成を行うステップ、生成される2本鎖核酸に切断部(ニック)を導入するステップ、切断部(ニック)から相補鎖合成を行い、複数の核酸鎖を生成するステップを含む方法。
(42)サンプル中の核酸の検出方法であって、サンプル中の核酸を、(1)〜(41)のいずれかに記載の方法により増幅するステップ、得られる増幅産物を用いて、検出対象の核酸を検出するステップを含む方法。
(43)サンプル中の全ての核酸または検出対象の核酸のみを増幅するものである、(42)に記載の方法。
【発明の効果】
【0023】
本発明により、核酸の増幅方法が提供される。かかる方法は、複数種の核酸が共存しても、どの核酸についても同じ増幅率で増幅することができる。また、かかる方法では、核酸の配列や長さの如何にかかわらず均一に、短時間に高い増幅率で核酸を増幅することができる。従って、本発明に係る増幅方法は、mRNAの均一な増幅、特に1つの細胞から得られる少量のmRNAからcDNAを合成し、そのcDNAを均一にバイアスなく増幅する方法として優れている。また本発明に係る方法は、核酸の迅速な増幅と検出が望まれる、遺伝子発現解析、細胞機能解析、生体組織の解析方法、病気の診断、感染症検査、創薬などの分野に有用である。
【図面の簡単な説明】
【0024】
【図1−1a】本発明の一態様の概要を示す。ターゲットDNAの3'末端に既知配列を導入し、この既知配列をプライマー(プライマーP1-1)として、リングDNAを鋳型として用いて相補鎖合成を行い、繰り返し配列をターゲットDNAの3'末端に導入する。次いで繰り返し配列部分にハイブリダイズするプライマー(プライマーP1-2)を用いて同時並行的に相補鎖合成を行い、ターゲットDNAの相補鎖コピーを増幅する。次いでさらに相補鎖合成を行ってターゲットDNAと相同配列を有するDNA鎖を増幅する。
【図1−1b】図1−1aの続きである。
【図1−1c】図1−1aの続きである。
【図1−2】増幅反応に使用するリングDNA1の構造を示す。
【図2−1】本発明の一態様として、既知配列部分の付加を、ループ状のプローブのハイブリダイゼーションと酵素Cleavaseを利用する方法で行う概要を示す。
【図2−2】増幅反応に使用するリングDNAの一例の構造を示す。
【図3−1a】本発明の一態様として、両末端に繰り返し配列を導入して高効率でDNAを増幅する方法の原理を示す。
【図3−1b】図3−1aの続きである。
【図3−2a】本発明の一態様として、ターゲットDNAがビーズに固定されている例で、ビーズに固定されたキャプチャープローブを活用して繰り返し配列をターゲットDNAの末端に導入する方法の概要を示す。
【図3−2b】図3−2aの続きである。
【図4−1】本発明の一態様として、ターゲットDNAにループ配列と繰り返し配列を導入して増幅する方法の概要を示す。
【図4−2】図4−1の続きである。
【図5−1a】本発明の一態様として、ビーズ固定ターゲットDNAと固体表面に固定された増幅用のプライマーを用いる方法の概要を示す。固体表面の狭い領域に1個のDNAから多数の増幅産物を生成することができる。
【図5−1b】図5−1aの続きである。
【図5−2】本発明の一態様として、プローブを固定した種々の方法の例を示す。
【図6−1】本発明の一態様として、相補鎖合成時に切断部(ニック)を生じる酵素の認識部位を導入し、ニックから相補鎖合成を行う方法の概要を示す。
【図6−2】図6−1の続きである。
【発明を実施するための形態】
【0025】
本発明は、核酸を均一に効率よく増幅する方法に関する。具体的には、本発明の核酸の増幅方法は、
ターゲット配列またはその相補配列を含むターゲット核酸鎖の3'末端に既知配列を含む繰り返し配列を導入するステップ、
該繰り返し配列にハイブリダイズするオリゴヌクレオチドを、該ターゲット核酸鎖に導入した繰り返し配列に複数個ハイブリダイズさせるステップ、
該オリゴヌクレオチドをプライマーとして用いて該ターゲット核酸鎖を鋳型とした相補鎖合成を行い、1つのターゲット核酸鎖から複数の核酸相補鎖を生成するステップ
を含む。
【0026】
ターゲット配列またはその相補配列を含むターゲット核酸鎖は、増幅しようとする配列を含む核酸であれば特に限定されるものではなく、デオキシリボ核酸(DNA)、例えばcDNA、およびリボ核酸(RNA)、例えばメッセンジャーRNA(mRNA)、ならびにそれらの断片およびハイブリッド核酸などである。ターゲット核酸鎖は、当技術分野で公知の方法により調製することができる。例えば、細胞からターゲット核酸を調製する場合には、Proteinase Kのようなタンパク質分解酵素、チオシアン酸グアニジン・グアニジン塩酸といったカオトロピック塩、TweenおよびSDSといった界面活性剤、あるいは市販の細胞溶解用試薬を用いて、細胞を溶解し、それに含まれる核酸、すなわちDNAおよびRNAを溶出することができる。RNAを調製する場合には、上記の細胞溶解により溶出された核酸のうち、DNAをDNA分解酵素(DNase)により分解し、核酸としてRNAのみを含む試料が得られる。mRNAを調製する場合には、mRNAはポリA配列を含むことから、上記のように調製したRNA試料から、ポリT配列を含むDNAプローブを用いてmRNAのみを捕捉することができる。またcDNAを調製する場合には、上記のようにして得られるmRNAから逆転写酵素を用いる逆転写反応を行うことによってcDNAを合成することができ、例えばmRNA調製時に使用したポリT配列を含むDNAプローブをプライマーとし、mRNAを鋳型として、デオキシヌクレオチドの存在下、逆転写酵素を用いて反応させることによりcDNAを合成することができる。
【0027】
ターゲット核酸鎖は、単一種の核酸鎖を含むものであってもよいし、または複数種の核酸鎖を含むものであってもよい。すなわち、ターゲット核酸鎖は、同じターゲット配列またはその相補配列を含むものであってもよいし、異なる配列を含むものであってもよい。例えば、ターゲット核酸鎖は、核酸プール、cDNAライブラリなどとすることができる。例えば本発明においては、複数種のmRNAからcDNAライブラリを作製し、そのcDNAライブラリに含まれる複数種のcDNAをターゲット核酸鎖として、均一に増幅することができる。
【0028】
またターゲット核酸鎖は、遊離状態であってもよいし、または5'末端側が固体表面に固定されていてもよい。ターゲット核酸鎖を固定することができる固体は、核酸の操作に一般的に使用される固体であれば特に限定されるものではない。具体的には、水不溶性で、加熱変性時に溶融しない固体であることが好ましい。その材料としては、例えば、金、銀、銅、アルミニウム、タングステン、モリブデン、クロム、白金、チタン、ニッケル等の金属;ステンレス、ハステロイ、インコネル、モネル、ジュラルミン等の合金;シリコン;ガラス、石英ガラス、溶融石英、合成石英、アルミナ、サファイア、セラミクス、フォルステライトおよび感光性ガラス等のガラス材料;ポリエステル樹脂、ポリスチレン、ポリエチレン樹脂、ポリプロピレン樹脂、ABS樹脂(Acrylonitrile Butadiene Styrene 樹脂)、ナイロン、アクリル樹脂、フッ素樹脂、ポリカーボネート樹脂、ポリウレタン樹脂、メチルペンテン樹脂、フェノール樹脂、メラミン樹脂、エポキシ樹脂および塩化ビニル樹脂等のプラスチック;アガロース、デキストラン、セルロース、ポリビニルアルコール、ニトロセルロース、キチン、キトサンが挙げられる。また、固体の形状についても、特に限定はなく、区画化された平面(例えばタイタープレート、多孔質もしくは細孔アレーなど)、平板、フィルム、チューブおよび粒子等が挙げられる。固体として粒子を用いることによって、単位体積あたりより大きな表面積を利用することができるので、迅速かつ効率的な処理を行うことができる。さらに、粒子として磁化されたまたは磁化可能な磁気ビーズを用いることによって、分離処理等について、自動化、効率化または迅速化することができる。また固体として粒子を用いる場合、粒子の径は、通常50μm以下、例えば1.0μm〜3.0μmである。
【0029】
ターゲット核酸鎖などの核酸を固体表面に固定化する方法は、特に限定されないが、例えば、共有結合、イオン結合、物理吸着、生物学的結合(例えば、ビオチンとアビジンまたはストレプトアビジンとの結合、抗原と抗体との結合など)によって固定化する方法などを例示することができる。核酸は、スペーサー配列、例えば1〜10個の炭素原子を含む炭化水素基を介して、固体表面に固定してもよい。
例えば、ターゲット核酸鎖がcDNAである場合には、cDNA合成時にポリT配列を含むプローブ核酸を固体表面に結合させ、そのポリT配列にmRNAを結合させ、相補鎖合成によりcDNAを合成することによって、該プローブ核酸を介してターゲットcDNAを固体表面に固定することができる。ポリT配列を含むプローブ核酸も、上記のように核酸を固体表面に固定化する方法によって、固体表面に結合させることができる。
【0030】
共有結合を介した核酸の固体表面への固定化は、例えば、核酸に官能基を導入しかつ該官能基と反応性の官能基を固体表面に導入して両者を反応させることにより実施できる。例えば、核酸にアミノ基を導入し、固体表面に活性エステル基、エポキシ基、アルデヒド基、カルボジイミド基、イソチオシアネート基またはイソシアネート基を導入することにより共有結合を形成できる。また、核酸にメルカプト基を導入し、固体表面に活性エステル基、マレイミド基またはジスルフィド基を導入してもよい。活性エステル基としては、例えば、p-ニトロフェニル基、N-ヒドロキシスクシンイミド基、コハク酸イミド基、フタル酸イミド基、5-ノルボルネン-2、3-ジカルボキシイミド基等が挙げられる。
【0031】
官能基を固体表面に導入する方法の一つとしては、所望の官能基を有するシランカップリング剤によって固体表面を処理する方法が挙げられる。カップリング剤の例としては、γ-アミノプロピルトリエトキシシラン、N-β-(アミノエチル)-γ-アミノプロピルトリメトキシシラン、N-β-(アミノエチル)-β-アミノプロピルメチルジメトキシシラン、あるいはγ-グリシドキシプロピルトリメトキシシラン等を用いることができる。結合部位となる官能基を固体表面に導入する別の方法としては、プラズマ処理が挙げられる。このようなプラズマ処理により、固体表面に、水酸基やアミノ基等の官能基を導入することができる。プラズマ処理は、当業者には既知の装置を用いて行うことができる。
【0032】
物理吸着によって核酸を固体表面に固定する方法としては、ポリ陽イオン(ポリリシン、ポリアリルアミン、ポリエチレンイミン等)で表面処理した固体に、核酸の荷電を利用して静電結合させる方法などが挙げられる。
【0033】
本発明においては、上述のようにして調製したターゲット核酸鎖の3'末端に繰り返し配列を導入する。本発明において「繰り返し配列」とは、一定の長さの繰り返し単位を反復して含む配列を意味し、本発明においては、後述する増幅反応または相補鎖合成においてプライマーがハイブリダイズするためのプライミングサイトを提供する。従って、繰り返し単位は、少なくとも1つのプライミングサイトの配列(相同配列または相補配列)を含み、任意により予備のプライミングサイトの配列、制限酵素切断認識配列などを含んでもよい。その繰り返し単位は約30〜300塩基長、例えば約50〜100塩基長、好ましくは約70塩基長とすることができる。この繰り返し配列に含まれる繰り返し単位の数は、50〜10000程度、好ましくは100を超えるものであり、より好ましくは1000を超えるものである。繰り返し配列は、ターゲット核酸鎖のターゲット配列またはその相補配列の長さよりも短いものであってもよいし、または長いものであってもよい。
【0034】
また、ターゲット核酸鎖として複数種の核酸鎖を対象とする場合、それらの複数種の核酸鎖に対して、共通の繰り返し配列を導入してもよいし、または異なる繰り返し配列を導入してもよい。その後の相補鎖合成を同時並行的に簡便に行うことができる点で、共通の繰り返し配列を複数種のターゲット核酸鎖に導入することが好ましい。
繰り返し配列を導入するための1つの方法は、繰り返し配列を有する核酸鎖をターゲット核酸鎖にライゲーションにより導入する方法である。ライゲーションは、当技術分野で公知の方法により、例えば制限酵素やリガーゼを用いる方法によって行うことができる。また別の方法は、繰り返し配列を有する核酸鎖を鋳型とし、ターゲット核酸鎖の3'末端部分を繰り返し配列導入用プライマーとしてまたはターゲット核酸鎖の3'末端に付加した配列部分を繰り返し配列導入用プライマーとして用いる相補鎖合成により、繰り返し配列を有する核酸鎖をターゲット核酸鎖に導入する方法である。
【0035】
本発明の方法において、相補鎖合成は、当技術分野で公知の方法に従って、例えば基質となる塩基(dNTPなど)の存在下で適当なポリメラーゼを用いることにより行うことができる。また、本発明の方法において相補鎖合成およびローリングサークル増幅(RCA)反応に使用するプライマーおよびプローブとして機能するオリゴヌクレオチドは、ハイブリダイズさせる対象の配列に基づいて、増幅しようとするターゲット配列の領域、塩基配列の長さや融解温度(Tm)などを考慮して、例えば公知のプログラムを利用して容易に設計することができる。例えば、プライマーまたはプローブとしての機能を有するオリゴヌクレオチドの長さとしては、10塩基以上が好ましく、さらに好ましくは15〜50塩基であり、さらに好ましくは20〜30塩基である。
【0036】
上記の方法で使用する繰り返し配列を有する核酸鎖は、当技術分野で公知の方法により調製することができる。例えば、繰り返し配列を有する核酸鎖は、リング状の核酸を鋳型とした相補鎖合成によって生成することができる。具体的には、繰り返し単位の配列からなるリング状の核酸(例えばリングDNA)を鋳型として、ローリングサークル増幅(RCA)反応を行うことによって、繰り返し配列を有する核酸鎖を生成することができる。本発明において「リング状の核酸」とは、いわゆる環状の核酸を意味し、直鎖状ではないことを意味する。リング状核酸は、上述した繰り返し単位に相補的な配列を含み、約30〜300塩基長、例えば約50〜100塩基長、好ましくは約70塩基長である。
【0037】
繰り返し配列の導入のためにリング状の核酸を鋳型とした相補鎖合成を行う場合、導入される繰り返し配列の繰り返し単位数は、ターゲット核酸の配列や長さにまったく無関係にリング状核酸を構成する配列の長さと相補鎖合成時間で決まる。1塩基相補鎖合成するときに要する時間は2〜3msec程度であるので、15分間相補鎖合成を行うと、繰り返し配列として約2〜3×105の塩基長が伸長する。リング状核酸のサイズを約70塩基とすると約3〜4×103倍の増幅(繰り返し配列)が得られることになる。これを2回繰り返せば短時間に約107倍の増幅が得られる。
【0038】
繰り返し配列を導入するための別の方法として、例えばターゲット核酸鎖の末端の配列が既知の場合には、該ターゲット核酸鎖に含まれる配列部分を繰り返し配列導入用プライマーとして使用し、リング状の核酸を鋳型とする相補鎖合成により、繰り返し配列を導入することができる。ここで使用するリング状の核酸も、上記と同様に、繰り返し単位の配列からなる。
【0039】
あるいは、ターゲット核酸鎖の末端の配列が既知ではない場合には、繰り返し配列を導入するための別の方法として、ターゲット核酸鎖に付加した配列部分を繰り返し配列導入用プライマーとして使用し、リング状の核酸を鋳型とする相補鎖合成により、繰り返し配列を導入することができる。また、繰り返し配列を導入するために、ターゲット核酸鎖に付加した配列部分を繰り返し配列導入用プライマーとして使用し、該配列部分にハイブリダイズしかつライゲーションによりリング状の核酸を形成することができるオリゴヌクレオチドを用いて形成されたリング状の核酸を鋳型とする相補鎖合成を行うことも可能である。
【0040】
上記の方法で使用する繰り返し配列導入用プライマーは、例えばその少なくとも一部がターゲット核酸鎖の3'末端に付加した配列部分を利用するものである。また、ターミナルトランスフェラーゼにより、ターゲット核酸鎖の3'末端に、例えばポリA配列またはポリC配列などの配列部分を付加することができる。
【0041】
またさらに繰り返し配列を導入する方法として、ターゲット核酸鎖の3'末端に付加した配列部分の少なくとも一部にハイブリダイズするオリゴヌクレオチドを鋳型として相補鎖合成により得られた該配列部分の相補配列を繰り返し配列導入用プライマーとして使用し、リング状の核酸を鋳型とする相補鎖合成を行う方法を用いることができる。ここで、ターミナルトランスフェラーゼにより、ターゲット核酸鎖の3'末端に配列部分を付加することができる。この方法は、具体的には、ターゲット核酸鎖の3'末端に付加した配列部分に隣接する該ターゲット核酸鎖の3'末端側の配列部分と、付加した配列部分の全てまたは一部分とにハイブリダイズし、かつ既知配列を含むオリゴヌクレオチドを鋳型として相補鎖合成を行い、該ターゲット核酸鎖の3'末端に付加した配列部分の一部を必要に応じて除去し、続いてハイブリダイズしたオリゴヌクレオチドを鋳型として相補鎖合成により該ターゲット核酸鎖の3'末端側に付加された該既知配列を繰り返し配列導入用プライマーとして用いて、リング状核酸を鋳型として相補鎖合成を行うことにより、繰り返し配列を導入する。
【0042】
上記の方法において、ターゲット核酸鎖の3'末端に付加した配列部分の一部の除去は、該配列部分におけるオリゴヌクレオチドがハイブリダイズしていない部分の塩基を、1本鎖核酸を3'末端から分解する酵素、例えばエキソヌクレアーゼ(ExoI)などの酵素を用いて除去することにより行うことができる。
【0043】
また上述した繰り返し配列の導入の際に、ターゲット核酸鎖の3'末端に付加した、繰り返し配列導入用プライマーとして使用する配列部分は、制限酵素切断に続くオリゴヌクレオチドのライゲーションまたはオリゴヌクレオチドを鋳型とする相補鎖合成により生成することができる。
【0044】
あるいは、繰り返し配列導入用プライマーとして、ターゲット核酸鎖に含まれる既知配列部分を利用することも可能である。例えば、ターゲット核酸鎖の既知配列部分を切断して、得られるターゲット核酸鎖の3'末端を含む部分を繰り返し配列導入用プライマーとして使用することができる。この切断は、例えばCleavaseなどの酵素を用いて行うことができる。
【0045】
また別の方法として、ターゲット核酸鎖の既知配列部分にハイブリダイズし、かつ5'末端側にアンカー配列を有するオリゴヌクレオチドをターゲット核酸鎖にハイブリダイズさせ、該オリゴヌクレオチドを伸張する相補鎖合成を行って2本鎖核酸を生成し、1本鎖核酸を3'末端から分解する酵素を用いてターゲット核酸鎖の1本鎖部分を分解除去し、次いで該オリゴヌクレオチドのアンカー配列を鋳型としてターゲット核酸鎖の3'末端側を伸張する相補鎖合成によりターゲット核酸鎖に配列部分を付加して、繰り返し配列導入用のプライマーを生成することもできる。
【0046】
あるいは、ターゲット核酸鎖の既知配列部分にハイブリダイズし、かつ5'末端側にアンカー配列を有するオリゴヌクレオチドをターゲット核酸鎖にハイブリダイズさせ、該オリゴヌクレオチドを伸張する相補鎖合成を行って2本鎖核酸を生成し、ターゲット核酸鎖の1本鎖部分を除去し、次いで該オリゴヌクレオチドのアンカー配列を鋳型とした相補鎖合成によりターゲット核酸鎖の3'末端に既知配列部分を付加し、該オリゴヌクレオチドを除去することにより、繰り返し配列導入用のプライマーを生成することができる。
【0047】
また、繰り返し配列は、ターゲット核酸鎖の5'末端側にさらに導入してもよい。例えば、ターゲット核酸鎖の3'末端および5'末端に既知配列部分を付加し、ターゲット核酸鎖およびその相補核酸鎖の両方について3'末端の該既知配列部分を繰り返し配列導入用プライマーとして、該既知配列部分にハイブリダイズすることができるリング状のDNAを鋳型として用いて相補鎖合成を行うことにより、該3'末端および5'末端に繰り返し配列を導入することができる。
【0048】
続いて、ターゲット核酸鎖に導入された繰り返し配列にハイブリダイズするオリゴヌクレオチドを用いて、該繰り返し配列に複数のオリゴヌクレオチドをハイブリダイズさせ、同時に相補鎖合成を行う。
【0049】
相補鎖合成に使用するポリメラーゼとして、鋳型核酸の2本鎖部分をはがして相補鎖合成を行うタイプ(鎖置換型)のポリメラーゼを使用する。本発明において使用可能なポリメラーゼは、このような鎖置換活性を有するものであれば特に限定されるものではなく、例えばBst DNAポリメラーゼ(ラージフラグメント)、Bca(exo-)DNAポリメラーゼ、大腸菌DNAポリメラーゼIのクレノウフラグメント、Vent(Exo-)DNAポリメラーゼ(Vent DNAポリメラーゼからエクソヌクレアーゼ活性を除いたもの)、DeepVent(Exo-)DNAポリメラーゼ(DeepVent DNAポリメラーゼからエクソヌクレアーゼ活性を除いたもの)およびKOD DNAポリメラーゼ等が挙げられる。好ましくはBst DNAポリメラーゼ(ラージフラグメント)を使用する。Bst DNAポリメラーゼを用いる場合は、その反応至適温度である60〜65℃付近で反応を行うことが望ましい。
【0050】
このような鎖置換型ポリメラーゼを使用した場合、ターゲット核酸鎖の末端に繰り返し配列を導入してそれを鋳型として用いるが、繰り返し配列部分には複数のオリゴヌクレオチドがプライマーとしてハイブリダイズし、これらがほぼ同時に相補鎖合成を行う。例えば、ターゲット核酸鎖1分子につき、約100〜約100000個の、例えば約1000〜50000個のオリゴヌクレオチドをプライマーとしてハイブリダイズさせることができる。1つのプライマーから生成された核酸鎖が、それより下流にハイブリダイズした他のプライマーから生成された核酸鎖にまで伸張すると、それを引き剥がしながら相補鎖合成を続ける。この結果、ターゲット核酸鎖に近い位置にハイブリダイズしたプライマーを起点として合成された核酸鎖は次々に引き剥がされ1本鎖として遊離してくる。最後には鋳型となるターゲット核酸鎖の最も3'末端側にハイブリダイズしたプライマーが相補鎖合成を終えて2本鎖DNAを形成するが、より短い位置(3'末端から遠い位置)にハイブリダイズしたプライマーにより合成された核酸鎖は全て引き剥がされて1本鎖として遊離する。
【0051】
具体的な相補鎖合成ステップは、例えば以下のようにして行うことができる。1つの方法では、ターゲット核酸鎖に導入された繰り返し配列にハイブリダイズする第1のオリゴヌクレオチドをプライマーとして用いる相補鎖合成を行い、生成された相補核酸鎖を鋳型として、その3'末端にハイブリダイズする第2のオリゴヌクレオチドをプライマーとして用いて相補鎖合成を行い、ターゲット核酸鎖のコピーを増幅するステップを行う。また別の方法では、ターゲット核酸鎖に導入された繰り返し配列にハイブリダイズするオリゴヌクレオチドをプライマーとして用いる相補鎖合成を行い、得られた2本鎖核酸を1本鎖核酸とし、次いで該オリゴヌクレオチドをプライマーとして、生成された1本鎖核酸を鋳型として相補鎖合成を行うステップを繰り返す。
【0052】
ここで使用するオリゴヌクレオチドは、固体表面に固定してもよい。例えば、ターゲット核酸鎖に導入される繰り返し配列にハイブリダイズする第1のオリゴヌクレオチドを固体表面に固定してもよいし、あるいは最初の相補鎖合成により生成された相補核酸鎖にハイブリダイズする第2のオリゴヌクレオチドを固体表面に固定してもよいし、あるいは少なくとも2種のオリゴヌクレオチド(例えば第1および第2のオリゴヌクレオチド)を同じまたは異なる固体表面に固定してもよい。例えば第2のオリゴヌクレオチドを固体表面に固定する場合には、ターゲット核酸鎖に導入される繰り返し配列にハイブリダイズする第1のオリゴヌクレオチドを用いて生成された相補核酸鎖を、固体表面に固定した第2のオリゴヌクレオチドを用いて捕獲し、第2のオリゴヌクレオチドをプライマーとして相補鎖合成を行う。ここで使用する固体は、上述したような核酸の操作に一般的に使用される固体であれば任意の固体を使用することができ、また固体とオリゴヌクレオチドとの結合も上述したように行うことができる。
【0053】
また本発明の方法は、例えば、ターゲット核酸鎖に相補的な配列と5'末端に第1のアンカー配列とを有するキャプチャープローブを用いてターゲット核酸鎖を鋳型として相補鎖合成するステップ、生成した相補核酸鎖を1本鎖とするステップ、1本鎖相補核酸鎖にハイブリダイズする第1のオリゴヌクレオチドを用いて相補鎖合成を行い、第1のオリゴヌクレオチドが伸張した3'末端側に第1のアンカー配列に基づく既知配列部分を導入するステップ、該既知配列部分をプライマーとしてリング状の核酸鎖にハイブリダイズさせて相補鎖合成を行い、3'末端側に第1の繰り返し配列が導入された相補核酸鎖を生成するステップ、ならびに第1の繰り返し配列に複数の第2のオリゴヌクレオチドをハイブリダイズさせて、同時並行的に相補鎖合成するステップによって行うことができる。この方法では、第1のオリゴヌクレオチドの5'末端側に第2のアンカー配列を含有させることによって、第1の繰り返し配列にハイブリダイズする第2のオリゴヌクレオチドをプライマーとして相補鎖合成した相補鎖の3'末端側に第2のアンカー配列に基づく既知配列部分を導入し、該既知配列部分をプライマーとして使用して、リング状の核酸を鋳型として相補鎖合成を行い、3'末端側に第2の繰り返し配列が導入された相補核酸鎖を生成するステップをさらに行うことができ、この第2の繰り返し配列からも同時並行的に相補鎖合成を行うことができる。
【0054】
上記の相補鎖合成においては、導入した繰り返し配列の長さがターゲット核酸鎖の種類または配列によって異なることなく、ほぼ一定であるため、ターゲット核酸鎖の種類または配列にかかわらず均一な増幅が可能となる。また、短時間で高増幅率で増幅を行うことができる。この増幅プロセスは、増幅効率に優れた線形増幅と熱サイクルなどを併用することによって、さらに増幅率を高めることも可能である。例えば、相補鎖合成の際に、ターゲット配列またはその相補配列を含み、3'末端に繰り返し配列を有し、かつ5'末端にループ配列(すなわち2本鎖を形成しない1本鎖の配列部分)を有するターゲット核酸鎖を生成するステップを行うことによって、増幅されたターゲット核酸鎖のループ配列にハイブリダイズするオリゴヌクレオチドを用いて、さらにループ配列から2本鎖のターゲット核酸鎖を引き剥がしながら相補鎖合成を繰り返すことができる。また例えば、相補鎖合成によって生成される2本鎖核酸に切断部(ニック)を導入することによって、その切断部(ニック)から2本鎖核酸を引き剥がしながら相補鎖合成を繰り返すことができる。切断部(ニック)は、ある認識配列を認識して2本鎖のうち1本鎖を切断する酵素(例えばN.BstNBIなど)を用いることによって、相補鎖合成時にその認識配列が2本鎖核酸に導入されるようにプライマーとして使用するオリゴヌクレオチドを設計して、相補鎖合成により該認識配列を2本鎖核酸に導入し、上記酵素を反応させることによって、切断部を形成することができる。
【0055】
また、上記の反応で増幅されたターゲット核酸鎖またはその相補鎖には、繰り返し配列が導入されているが、これは繰り返し配列の前または後ろに制限酵素切断認識配列が導入されるように相補鎖合成を行うことによって、生成される相補核酸鎖から制限酵素を用いて繰り返し配列を切断除去することができる。例えば、繰り返し配列の繰り返し単位中にそのような制限酵素切断認識配列を入れておくことが好ましい。
【0056】
以上の方法により、非常に短時間で高い増幅率での核酸増幅が可能となる。この方法は、均一増幅が必要とされる遺伝子発現解析(定量解析)や高効率の核酸増幅が必要な感染症を始めとする病気の診断検査に有効に使用される。
【0057】
そのような用途の一例として、本発明は、上記の増幅方法を利用して、サンプル中の核酸を増幅し、その増幅産物を検出することによって、サンプル中の核酸を検出する方法に関する。
【0058】
サンプルは、検出が望まれる核酸を含む生体由来サンプルであれば特に限定されるものではなく、細胞サンプル、組織サンプル、液体サンプルなどの任意のサンプルを用いることができる。またサンプルの由来となる生体も特に限定されるものではなく、脊椎動物(例えば哺乳類、鳥類、爬虫類、魚類、両生類など)、無脊椎動物(例えば昆虫、線虫、甲殻類など)、原生生物、植物、真菌、細菌、ウイルスなどの任意の生体に由来するサンプルを用いることができる。サンプルからの核酸の調製は、上述したように実施することができる。
【0059】
続いて、サンプル由来の核酸を、上述した増幅反応に従って増幅する。ここで、サンプル中の全ての核酸を増幅してもよいし、あるいは検出対象の核酸のみを増幅してもよい。
【0060】
検出対象の核酸が存在するか否かを検出するには、得られる増幅産物を特異的に認識することができる公知の手段を用いることができる。例えば、増幅反応時にプライマーとして使用するオリゴヌクレオチドを標識し、得られる増幅産物を検出対象の核酸に特異的なプローブとハイブリダイズさせ、標識を利用してそのハイブリダイゼーションを検出することによって、対象の核酸を検出することができる。あるいは、得られる増幅産物を、検出対象の核酸に特異的な標識プローブとハイブリダイズさせ、標識を利用してそのハイブリダイゼーションを検出することによって、対象の核酸を検出することができる。あるいは、モレキュラービーコンなどのターゲット配列が存在する場合には蛍光を発するプローブが知られており、このようなプローブと特異的にハイブリダイズする増幅産物を蛍光に基づいて検出することによって、対象の核酸を検出することができる。
【0061】
このようなハイブリダイゼーション反応は、当技術分野で公知であり、ストリンジェントな条件下にて核酸を特異的に結合させる反応であり、その条件なども公知である。ハイブリダイゼーションを行う場合、サンプル由来の核酸の増幅産物を適当な固体表面(スライドグラス、メンブラン、マイクロタイタープレート等)に固定してもよいし、あるいはプローブを適当な固体表面に固定してもよい。いずれかを固定した場合には、ハイブリダイズしていない核酸などを洗浄によって簡便に除去することができる。
【0062】
あるいは、増幅方法においてサンプルに含まれる検出対象の核酸のみを増幅する場合には、増幅産物が得られるか否かによって対象の核酸を検出することができ、例えば増幅反応時にプライマーとして使用するオリゴヌクレオチドを標識したり、相補鎖合成時に使用する基質(塩基)を標識することによって、得られる増幅産物に標識を取り込ませ、その標識に基づいて増幅産物の有無を検出することができる。
【0063】
標識は、任意の標識でよく、放射性同位体、蛍光物質、発光物質、酵素、ビオチン標識などを用いることができる。放射性同位体としては、32P、125I、35Sなどを用いることができる。また蛍光物質としては、例えば、フルオレセインイソチオシアネート(FITC)、スルホローダミン(SR)、テトラメチルローダミン(TRITC)などを用いることができる。また発光物質としてはルシフェリンなどを用いることができる。酵素としては、βガラクトシダーゼなどを用いることができる。これら標識体の種類や標識体の導入方法等に関しては、特に制限されることはなく、従来公知の各種手段を用いることができる。例えば標識体の導入方法としては、放射性同位体を用いるランダムプライム法が挙げられる。
【0064】
標識に基づく検出は、上述した標識体を検出するための当技術分野で公知の方法であればいずれの方法でもよい。例えば、標識体として放射性同位体を用いた場合には、放射活性を、例えば液体シンチレーションカウンター、γ-カウンターなどにより計測することができる。また標識体として蛍光を用いた場合には、その蛍光を蛍光顕微鏡、蛍光プレートリーダーなどを用いて検出することができる。標識が検出された場合には、サンプル中に検出対象の核酸が存在することとなる。
【0065】
また、標識の濃度を指標とすることにより、定量的な検出も可能となる。標識プローブを用いた検出方法の例としては、サザンハイブリダイゼーション法、ノーザンハイブリダイゼーション法等を挙げることができる。
【0066】
また、上述した増幅方法において、その増幅率が高い場合には、濁度測定を行うことによって、検出対象の核酸の有無を知ることもできる。
【0067】
さらに、得られる増幅産物を小分けにして、検出対象の核酸の発現をリアルタイムPCR(Taqman)などにより定量分析することもできる。
【0068】
本発明の核酸増幅方法は、核酸の均一増幅、特に1つの細胞から得られる僅かなmRNAをcDNAに変換してそれらを均一にバイアスなく増幅する方法として優れており、さらに増幅操作を繰り返すことで短時間に多くの核酸コピーが得られるので、感染症検査などで要求されるDNAの迅速検査にも有効である。
【0069】
以下、本発明を実施例によりさらに具体的に説明する。ただし、以下の実施例は、本発明を限定するものではない。
【実施例】
【0070】
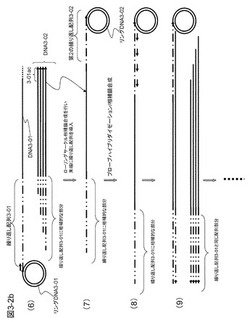
[実施例1]繰り返し配列の導入のためにターゲットcDNAの末端に既知配列を付加する方法
本実施例は、1細胞由来のcDNAライブラリーに含まれるcDNAを一括して均一増幅する例である。方法の概略を図1−1に示した。文献(Nature Method 6, 503-506(2009))に従って、アンカー配列およびポリT配列からなるプローブを固定した磁気ビーズを用いてcDNAライブラリーを作製する。すなわち、図1−1の(1)に示すように、アンカー配列1とポリT配列からなるmRNAキャプチャープローブを表面に固定した直径1μmのダイナビーズを用いてmRNAをキャプチャーし、続いてcDNA合成を行い、cDNAの5'末端側がビーズに固定されたcDNAライブラリーを得る。ここではポリT配列として、その途中に5塩基置きにG塩基を3箇所挿入した配列を用いた。これは後に、cDNAを鋳型として相補鎖合成する際にポリT配列の相補鎖合成を行いやすくするためにTmを高くする目的で導入した。このポリT配列部分のcDNA合成は温度が充分に低く問題なく進行するが、後のステップで行うこれを鋳型とする相補鎖合成では温度が少し高くなり、Tmの低い部分の2本鎖DNAが乖離したりして相補鎖合成の中断が起こるのを避けることができる。
【0071】
cDNA合成後に、洗浄して余分な試薬などを除去した後、3'末端に既知配列を付加する。この方法としてターミナルトランスフェラーゼを用いてポリAまたはポリCなどの配列を付加する方法や、3'側の3塩基が突出した形の2本鎖オリゴマーを末端にハイブリダイズさせ、オリゴマーを相補鎖合成し、続いてライゲーションにより3'末端に既知配列を付加する方法がある。また、制限酵素で切断した切断末端にライゲーションで既知配列を有するオリゴマーを結合して既知配列を付加する方法などもある。ここではターゲットDNAの末端にポリC配列を付加し、次いで3塩基ランダム配列を3'末端に有し、続いて4塩基からなるG配列とアンカー配列2を有するランダムプライマーを用いて末端に既知配列を付加する方法を用いた例で説明する。ここでは3塩基からなるランダム配列の混合物(全て合わせると64種類であるが3塩基目はG塩基以外とすることができるので48種)からなるプライマーを用いた。ランダム配列部分を長くしてGGGG配列をGGGに変更するなども可能である。他の方法も同様に利用できるのでこの限りでない。
【0072】
本実施例では、図1−1の(2)に示すようにターミナルトランスフェラーゼを用いて5〜10個のC塩基(図1−1ではCCCCCCC)が末端に付加した例を示した。続いて、図1−1の(3)に示すように、プライマーは、cDNAにおけるランダム配列およびそれに続くCCCC部分とハイブリダイズし、相補鎖合成を行う。次いで、図1−1の(4)に示すように、エキソヌクレアーゼ(ExoI酵素:3'末端から1本鎖を切断する酵素)を反応液中に添加し、cDNAの3'末端側の1本鎖部分を切断して除去する。1本鎖部分を除去するとターゲットcDNAの3'末端はアンカー配列2を有するDNA鎖にハイブリダイズした形となり、これを鋳型として相補鎖合成可能となるので、図1−1の(5)に示すようにターゲットcDNAの末端にアンカー配列2に相補的な配列を付加することができる。この部分は、後の反応においてリングDNAを鋳型とする相補鎖合成でプライマーP1-1として機能する部分である。なお、mRNAからcDNAを生成するときにターミナルトランスフェラーゼ活性のあるMoloney Murine Leukemia Virus由来の逆転写酵素(例えば、SuperScriptII)を用いると、末端に3塩基程度のCCCを導入することができるので都合がよい。この場合にはアンカー配列部分に相補鎖がハイブリダイズした2本鎖DNAをライゲーション反応によりターゲットcDNAの末端に導入することによって、既知配列を付加することができる。
【0073】
ここで、ターゲットcDNAは磁気ビーズに固定した形で得ると、精製には都合がよい。末端に既知配列プライマーP1-1を導入した後に磁気ビーズに捕獲されたcDNAを残して余分な共存物を除去する(図1−1の(6))。次に、図1−1の(7)に示すように、ターゲットcDNAに、70塩基程度の1本鎖DNAからなるリングDNA、核酸基質、鎖置換型DNAポリメラーゼ(例えば、Bst DNAポリメラーゼ、φ29DNAポリメラーゼ)などを加えて相補鎖合成を行う。ここではおよそ30℃で動作するφ29DNAポリメラーゼを使用している。リングDNAのサイズは小さいほうが増幅上有利であり、ターゲットDNAの長さよりもはるかに短い配列からなるリングDNAを通常は用いる。リングDNAの構成は、図1−2に示すように、プライマーP1-1がハイブリダイズする領域(約20塩基)、制限酵素切断認識配列、第2のプライマーP1-2が生成するDNA鎖にハイブリダイズするプライミングサイト1-2を作るためのプライマーP1-2と相同配列を有する領域、および予備のプライミングサイト1-4を含むものである。図1−1の(8)における矢印は参考までに3'側を示す。プライマーP1-2は逆向きにハイブリダイズして矢印とは反対方向に伸張する。制限酵素切断認識配列の配列はできる限りmRNAなどに存在しない配列としたほうがよく、認識配列の長いレアカッター制限酵素による認識配列を使用することが好ましい。このようなレアカッター制限酵素として、6塩基認識酵素Bam HI(認識配列5'-G|GATCC---3')または8塩基認識酵素Sda I(認識配列5'---CCTGCA|GG---3')などがあるが、この限りでない。
【0074】
導入される繰り返し配列の数は目的にもよるが、単に均一に全てのターゲットDNAを増幅してコピーを増やした後、溶液を分割して定量PCRを行うような場合には、数百程度の繰り返し配列の単位が導入できればよい。一方、大きな増幅率を達成することが望ましい場合には、導入する繰り返し配列の単位は数千以上とすることが好ましい。さらに3'および5'の両末端に繰り返し配列を導入したり、増幅操作を繰り返したりすることによって、繰り返し配列の導入単位数を増加させることができる。
【0075】
ここでは繰り返し配列を導入するためのリングDNAを鋳型とする相補鎖合成を5分間行った(図1−1の(7))。リングDNAを鋳型とする相補鎖合成は全てのターゲットcDNAについてcDNAの配列の如何にかかわらず同じリング配列の相補鎖を合成するように進む。一定時間でターゲットcDNAの末端に導入される繰り返し配列の長さはcDNAの種類によらずほぼ同じである。DNA相補鎖合成のスピードは1秒間に50〜300塩基程度であるので5分間で数百〜千個の繰り返し配列単位を導入することができる。相補鎖合成による繰り返し配列導入終了後、リングDNAを除去してリングDNAの相補鎖からなる繰り返し配列部分(プライマーP1-1の配列、制限酵素切断認識配列、プライミングサイト1-2の配列および予備のプライミングサイト1-4の配列からなる)のプライミングサイト1-2にハイブリダイズするプライマーP1-2を加えて相補鎖合成を行う(図1−1の(8))。プライマーP1-2は1つのターゲットcDNAに導入した繰り返し配列におよそ1000個がハイブリダイズして同時並行的に相補鎖合成を行う。10分ほど相補鎖合成を行うと繰り返し配列部分の最も3'末端側にハイブリダイズしたプライマーP1-2からの相補鎖合成が終了し、それよりもターゲットcDNA側(5'末端側)にハイブリダイズしたプライマーP1-2から生成した相補鎖は引き剥がされ、1本鎖状態で液中に遊離する(図1−1の(9))。ここではターゲットcDNAを作製する際にアンカー配列1およびポリT配列を有するキャプチャープローブを用いたため(図1−1の(1))、生成した相補鎖にも同じ配列が含まれることになり、そのためこれをビーズ上に固定化された余剰のキャプチャープローブで捕獲することができる。また、捕獲後、キャプチャープローブが相補鎖を鋳型として伸長するためビーズの表面に2本鎖状態で保持される(図1−1の(10))。以上の操作により、約1000倍に増幅されたcDNAライブラリーがビーズ表面に保持された状態となる。
【0076】
この状態で、制限酵素を用いて余分な配列(例えば導入した繰り返し配列など)を切断除去して、ターゲットcDNAにハイブリダイズした相補鎖を種々の測定に活用してもよいが、さらにコピー数を増やすには、熱サイクルに供して相補鎖合成を繰り返す。このプロセス1回に付き、約5分で1000倍の増幅を行うことができるので、2回の相補鎖合成プロセスで1000×1000/2=0.5×106のコピー増幅が行える。さらに、熱サイクルで3回の相補鎖合成を行えば、約108のコピー増幅が実現できる。これだけの増幅を行う場合にも、熱乖離およびアニーリングの時間を加えて所要時間は30分以下であり、効率よく、しかも複数のDNAを同時並行的にかつ均一に増幅することができる。
【0077】
この実施例ではあらかじめ用意された既知配列を有するリングDNAを鋳型にしてローリングサークル増幅(RCA)反応を行い、リングDNAを除去後にプライマーP1-2を加えて再度相補鎖合成を行ったが、最初からプライマーP1-2を反応系に加えておき、ターゲットcDNAの末端に繰り返し配列を導入すると同時にプライマーP1-2からの相補鎖合成を同時進行させてもよい。この場合にはリングDNAの量は0.1〜1pmole程度でよいが、第2のプライマーP1-2の量は数〜10pmoleとするとよい。また、あらかじめリングDNAを準備して用いたが、ターゲットcDNA末端部のプライマーP1-1部分に3'末端および5'末端がハイブリダイズするプローブを用いてハイブリダイズさせた後でライゲーションによりリングDNAを形成させてもよい。また、ここではターミナルトランスフェラーゼで付加した配列部分に続くオリゴマーを導入してプライマー配列としたが、ターミナルトランスフェラーゼで導入した配列部分をプライマーP1-2(繰り返し配列を導入するためのプライマー)としてもよい。
【0078】
この方法は多くの種類のDNAを含む試料を同時に均一に増幅できるので、種々の計測方法と組み合わせた定量分析などに有効である。
【0079】
[実施例2]Cleavaseを用いる方法
実施例1では、種々DNA断片からなるDNAプール(cDNAライブラリーを含む)の全てのDNAを均一に増幅する方法を開示したが、ここでは特定の複数種のDNAを均一に増幅する方法を開示する。もちろん単一のDNA増幅に適用することも可能である。
【0080】
本実施例の概要を図2−1に示した。試料としてcDNAライブラリーを再び用いる。cDNAライブラリーは作製過程でmRNAの最後まで相補鎖合成できたものと途中で相補鎖合成が止まってしまったものとが含まれており、同じmRNA由来でも種々の長さのcDNAが含まれることがある(図2−1の(1))。このため、末端配列を既知配列を有するものとして扱うことができない。ただし、対象となるcDNA群は、個々のcDNAのcDNA合成がどこまで進んでいるかは不明であるが、全体の配列は既知であるのでこれを利用する。ここでは10種の遺伝子に注目してこれらを均一に増幅する例を開示する。cDNA合成は通常500塩基位までは障害なく相補鎖合成されることが多いので、cDNAライブラリーのポリT部位から500塩基以内の部分に特異的な配列を選び、そこにハイブリダイズするプローブP2-1を作製する。プローブP2-1はターゲットcDNAにハイブリダイズする配列部分とアンカー配列部分からなる。アンカー配列部分は自己ハイブリダイゼーションしてループ構造を形成し、ターゲットcDNAに1塩基部位でのみ3重鎖となってハイブリダイズするように設計されている(図2−1の(2))。
【0081】
1本鎖cDNAを含む溶液に、対象となる複数の遺伝子に対するプローブP2-1(対象となる遺伝子の数だけ異なるプローブP2-1が必要)を加えてターゲットcDNAにハイブリダイズさせる。ついで切断酵素Cleavaseを加えてプローブP2-1がターゲットcDNAと3重鎖を形成した部位を切断する(図2−1の(3))。この反応は遺伝子検査などで使われるインベーダーアッセイで用いられる酵素切断反応と同じである。切断されたcDNA断片のうちビーズに固定された側の断片を回収して使用する。切断部位に続く配列はmRNAデータベースを参照して既知であり、ここにハイブリダイズするアンカー配列(既知配列)付きのオリゴマー(プローブP2-2)を使用して既知配列を導入する(図2−1の(4))。すなわちこのプロセスでターゲットcDNA種にだけ既知配列を導入することができる。もちろんターゲットcDNAの配列の一部をプライマーとして用いてリングDNAを鋳型として増幅反応を行って繰り返し配列を導入してもよいが、この場合にはリングDNAの配列の中に対応する遺伝子の数だけ配列の異なるプライミングサイトを作る必要がある。ここではプローブP2-2のアンカー配列部分に相補的な配列をまず相補鎖合成により合成し、この部分を繰り返し配列導入用のプライマーとして用いる。図2−1の(5)に示すように、この配列部分をプライマーとしてリングDNAを鋳型として用いて相補鎖合成を行い、cDNAの3'末端に繰り返し配列を実施例1と同様に導入した。この繰り返し部分にハイブリダイズするプローブP2-3を用いて実施例1で述べたようにターゲットcDNAを均一に増幅することができる。増幅産物は実施例1と同様にcDNAを固定したビーズにより回収できる。増幅産物をcDNAライブラリーが固定されたビーズと異なるビーズなどに固定して取り出すかあるいは溶液状態で取り出すことが望ましい場合には、ビーズに固定されたアンカー配列とポリT配列からなるキャプチャープローブ(mRNAを捕獲するのに用いたもの)と同じ配列を有しかつ固定されていないプローブP2-4を加えておけば、遊離してきた合成相補鎖はプローブP2-4にハイブリダイズして固定されない2本鎖を生成するので、これを回収することができる。このとき、プローブP2-4としてビオチン付きのプローブを用いると生成したDNA鎖の回収を容易に行うことができる。
【0082】
本実施例では、Cleavaseによる切断に続いて既知配列を有するプローブP2-2をターゲットcDNAの末端にハイブリダイズさせて相補鎖合成により既知配列を付加したが、切断末端部位の配列が既知であることを利用してこの部分がリングDNAにハイブリダイズするように設計してもよい。この場合、リングDNAはターゲットの種類と同じだけ必要なことになるが、リングDNA内に複数種のターゲットcDNAに対応したプライミングサイトを導入して1種類のリングDNAで済ませることもできる。この場合には、リングDNAには上記プライミングサイトに加えて、制限酵素切断認識配列、および相補鎖合成のためのプライミングサイト群(プライマーP2-3と相同配列領域と予備のプライミングサイト2-5領域)が含まれることになる(図2−2)。
【0083】
対象とする遺伝子の種類が多い場合にはこのプロセスを繰り返し行ってもよいが、一度に行ったほうが増幅率の均一度は高くなる。
【0084】
このように対象とするDNAを鋳型として相補鎖合成するときのプライミングサイトをRCA反応により多数導入した後に各プライミングサイトから一斉に相補鎖合成を並列的に行うことで、均一な効率のよい増幅を実現できる。対象となったDNAと同じ配列が必要な場合には、合成された相補鎖を鋳型として再度相補鎖合成することで対応できる。
【0085】
上記実施例ではターゲットDNAの既知配列部分にハイブリダイズするループ状のプローブとCleavaseを用いてターゲットDNAを配列既知の部分で切断して末端部分を既知配列とし、次いでここにアンカー付きのプローブをハイブリダイズさせて相補鎖合成を行い、末端に共通の既知配列を導入した。別の実施例として、ターゲットDNAにアンカー付きのプローブをまずハイブリダイズさせ、相補鎖合成を行って安定な2重鎖を形成し、エキソヌクレアーゼ(ExoIなど)のような3'末端から1本鎖DNAを切断する酵素を用いる例がある。ターゲットDNAは5'末端を固定されており、3'末端側が1本鎖状態の場合にはその1本鎖部分が分解除去される。すなわち、アンカー付きのプローブP2-2をターゲットcDNAにハイブリダイズさせ、相補鎖合成により2本鎖部分を安定化させた後、残った3'末端を含むターゲットcDNA鎖を3'末端側から2本鎖部分まで分解して、相補鎖合成によりプライマーP2-1の配列を導入することもできる。
【0086】
[実施例3]
実施例1および2は、ターゲットとなるcDNAの3'末端に繰り返し配列を導入してプライミング領域とし、ターゲットDNAの5'末端までの全領域を増幅したが、本実施例ではターゲットDNAの特定の領域を増幅する方法を開示する。これはターゲットとなるDNAが非常に長い場合などに有利である。また、ターゲットDNAから増幅対象のターゲット配列を含む短いDNAを作製するが、このDNAの両末端に既知配列を導入してこれをプライマーとして両末端に繰り返し配列を導入して多数のプライミングサイトを作り、これら多数のプライミングサイトからの相補鎖合成により増幅率を大幅に上げる技術についても開示する。
【0087】
概要を図3−1に示した。まずターゲットDNAの増幅領域をはさんでターゲットDNAおよびその相補鎖DNAにハイブリダイズするアンカー配列3-1a付きのプライマーP3-1およびアンカー配列3-2a付きのプライマーP3-2とその外側にハイブリダイズするプライマーP3-3とP3-4を用意する。ターゲットは2本鎖DNAでもよいがここでは1本鎖のcDNAとする。プライマーP3-1およびプライマーP3-3の量はそれぞれ1pmolおよび0.2pmolとした。プライマーP3-3の量を少なくしたのはターゲットDNAにプライマーP3-1がより速やかにハイブリダイズするようにするためである。これらプライマーはターゲットDNAの種類だけ用意するがアンカー配列部分3-1aは共通である。
【0088】
図3−1の(1)に示すように、プライマーP3-1およびプライマーP3-3はターゲットDNAにハイブリダイズして相補鎖合成を行う。プライマーP3-3は、プライマーP3-1が生成するDNA鎖(DNA3-1)をはがしながら相補鎖合成を行い、プライマーP3-1を起点とした相補鎖(DNA3-1)を1本鎖として遊離する役割を果たす(図3−1の(2))。図3−1の(3)に示すように、1本鎖として遊離してきた相補鎖DNA3-1にはプライマーP3-2とプライマーP3-4がハイブリダイズして相補鎖合成を行う。プライマーP3-4は、プライマーP3-3と同様にプライマーP3-2を起点として生成したDNA鎖(DNA3-2)を1本鎖として遊離させる役割を果たす(図3−1の(4))。
【0089】
このようにしてできたプライマーP3-2を起点とする1本鎖DNA(DNA3-2)の3'末端にはアンカー配列3-1aと相補的な配列(「プライマー配列P3-1ac」という)が付加されている。このプライマーP3-1acがハイブリダイズするのはプライマーP3-1のアンカー配列3-1aである。そこで、図3−1の(5)に示すように、これと同じ配列を含むリングDNA3-1をあらかじめ反応液中に加えておく。リングDNA3-1の配列には、アンカー配列3-1aに加えて、DNA3-2に相補的な鎖を合成するときに用いるプライマーP3-5の配列および制限酵素切断認識配列を入れておく。遊離したプライマーP3-2を起点とするDNA鎖(DNA3-2)は、このリングDNA3-1に3'末端がハイブリダイズして相補鎖合成を行い、繰り返し配列を3'末端に導入する(図3−1の(6))。繰り返し配列にはプライマーP3-5がハイブリダイズする配列が繰り返し現れるので、反応系にプライマーP3-5を加えておくと相補鎖合成がいっせいに起こり、DNA3-1と同じ配列を含みかつ繰り返し配列を有する多くのDNA鎖(DNA3-5)が合成され、遊離してくる(図3−1の(7))。この遊離したDNA鎖(DNA3-5)の末端はアンカー配列3-2aに相補的である。そのため、図3−1の(8)に示されるように、アンカー配列3-2aを有するリングDNA3-2を加えておくと、DNA3-5はこれにハイブリダイズしてプライマー(P3-6)として機能し、第2の繰り返し配列を合成DNA鎖(DNA3-5)に付加する(図3−1の(9))。リングDNA3-2にはリングDNA3-1と同様にプライマーP3-5の配列をあらかじめ入れておく。するとプライマーP3-5がハイブリダイズするプライミングサイトがDNA3-5にも作製されるので相補鎖合成がさらに進み、DNA3-5に相補的な配列を有するDNA3-5cが生成する(図3−1の(10))。このDNA3-5cにはプライマーP3-5のプライミングサイトが含まれることになるので、これを鋳型として次々に合成DNA鎖が生成することになる。
【0090】
このようにプライマーP3-5を起点とし、DNA3-2配列あるいはその相補配列を含み、3'末端に繰り返し配列を有するDNA(DNA3-5およびDNA3-5c)が次々に生成する(図3−1の(10)〜(12))。この反応は繰り返され、非常に短時間にDNAの増幅が行われる。なお、両末端に繰り返し配列を導入した場合の増幅率は片側(例えば3'末端)の場合をn倍とすると両末端の反応が進行するごとにほぼn倍ずつ増えていく。さらに生成した2本鎖DNA群を含む反応液を昇温し、1本鎖とした後に再度上述した反応を繰り返す(熱サイクル反応)と10〜20分の短時間に1010倍以上の増幅率を得ることも可能である。これは感染症の診断など短時間に大きなDNA増幅が必要な用途には重要な利点である。
【0091】
上記の実施例の変形として、以下の方法によっても本発明を実施することができる(図3−2)。
【0092】
対象とするのはmRNAから作製したcDNAライブラリーなど5'末端に既知配列を有するDNA群である。cDNAを例として説明する。図3−2の(1)に示すように、mRNAをビーズに固定したキャプチャープローブ(アンカー配列+ポリT配列を有するものまたはそのポリT配列の一部にG塩基を混入させた配列を有するもの)で捕獲し、キャプチャー配列を有するcDNAを作製する。もちろん固定されたプローブでなく、浮遊プローブを用いてもよい。
【0093】
ターゲットcDNAにハイブリダイズしかつアンカー配列3-01aを有するプライマーP3-01をターゲットの種類分だけ用意する。このプライマーP3-01は実施例2におけるプライマーP2-2と同じものでもよい。図3−2の(2)に示すように、これをターゲットcDNAにハイブリダイズさせ相補鎖合成を行う。合成したDNA鎖の3'末端にはキャプチャープローブに相補的な配列ができる。相補鎖合成の後、温度を上げて2本鎖DNAを1本鎖に乖離して上澄み液を採取する(図3−2の(3))。ここで、cDNA作製時に固定プローブではなく浮遊プローブを用いたときには、本実施例のプローブP3-3に相当するプローブを反応系に添加し、合成されたDNAを鋳型DNAから遊離させることができる。
【0094】
図3−2の(4)に示すように、この溶液中にキャプチャープローブのアンカー配列と同じ配列を有するリングDNA3-01とφ29DNAポリメラーゼを加えて相補鎖合成を行う。最初の反応で合成された相補鎖DNA(DNA3-01)の3'末端はキャプチャー配列を含むのでリングDNA3-01にハイブリダイズする。この結果、RCA反応が起こり、プライミングサイト配列3-02を多数持つ相補鎖が生成する(図3−2の(5))。このとき、プライミングサイト3-02にハイブリダイズするプライマーP3-02を加えると、これはRCAで合成されたDNA3-01に繰り返し現れるプライミングサイト配列(3-02)にハイブリダイズして相補鎖合成を開始するので、ターゲットcDNAと同じ配列のDNAコピー(DNA3-02)を多数得ることができる(図3−2の(6))。このDNA3-02は、3'末端にアンカー配列3-01aに相補的な配列(3-01ac)を有しており、ここにハイブリダイズするリングDNA3-02を用意しておけば末端に第2の繰り返し配列が導入されるのでさらに増幅率を上げることができる(図3−2の(7)〜(9))。得られるDNAには繰り返し配列部分が導入されているが、リングDNAに制限酵素切断認識配列を入れておき、実施例1と同様に2本鎖を形成してこの部分を制限酵素で切断除去することが可能である。
【0095】
また、リングDNAにプライミングサイトを複数入れると1つの繰り返し配列の中に複数のプライミングサイトができることになり、その分だけさらに増幅率を上げることができる。特に両側に繰り返し配列を導入する方法では、繰り返し配列の単位数の2乗または3乗で増幅されるので増幅率は大きくなる。
【0096】
[実施例4]
本実施例は、増幅の対象となるDNA配列部分の5'末端側にループ配列を導入すると共に、3'末端側に繰り返し配列を導入した場合の例である。図4−1に概要を示した。3'末端に繰り返し配列を導入する方法には、末端に既知配列を導入し、これをプライマーとしてあらかじめ用意されたリングDNAを鋳型として相補鎖合成により導入する方法や、あらかじめリングDNAを用いて繰り返し配列を有するDNA鎖を合成しておいてこれを鋳型として相補鎖合成する方法がある。もちろんこのような繰り返し配列を有するDNA鎖をライゲーションによりターゲットDNAに結合してもよい。ここではループ配列を有するプライマーを用いて相補鎖合成により増幅しようとする配列を含んだDNA断片を作製し、その末端にある既知配列を利用してリングDNAを鋳型にして繰り返し配列を導入する例を開示する。また、増幅しようとするターゲットDNAの5'末端にはループ配列が連結されているが、これもループ配列をアンカー配列として有するプローブをターゲットDNAにハイブリダイズし、相補鎖合成を行うことにより図4−1に示したように容易にループ配列を連結することができる。また、mRNAからcDNAを合成して得た試料ではmRNAをキャプチャーするプローブの末端にループ配列を入れておくことも可能である。
【0097】
ここでは、図4−1の(1)および(2)に示すように、ターゲットDNAにアンカー配列を有するプローブP4-1およびその外側にハイブリダイズするプローブP4-3を用いて鎖置換型の相補鎖合成を行い、前記アンカー配列を有するプローブP4-1を起点としたDNA鎖(DNA4-1)を遊離させることからスタートする。アンカー配列4-1aは、後述する反応で使用する、鋳型となるリングDNA4-1にも同じ配列が含まれており、ローリングサークル増幅(RCA)反応で繰り返し配列を導入するために使用される。この相補鎖DNA4-1にループ配列4-2loopを有するプライマーP4-2をハイブリダイズさせて再度相補鎖合成を行い(図4−1の(3))、ターゲットDNAと同じ配列を有し、そして3'末端にはリングDNA4-1にハイブリダイズするプライマー配列4-1ac(アンカー配列4-1aの相補配列)を有し、かつ5'末端にはループ配列4-2loopを有する鋳型DNA4-2を作る(図4−1の(4))。これが増幅用の鋳型DNAとなる。ターゲットDNAの種類は複数でもよく、その種類に応じてターゲットDNAにハイブリダイズする部分の配列は異なるが、アンカー配列およびループ配列は同じものを用いる。mRNAからcDNAを合成して用いる場合にはキャプチャープローブにループ配列を付加したものを使用すれば以後の操作は同じである。ループ配列のTmは鎖置換型相補鎖合成の最適温度と同じかまたは少し低い温度に設計するのが好ましい。この部分の相補鎖合成が行われると高い確率でループ配列となり、合成された相補鎖が自己を鋳型として相補鎖合成を行うように設計する。
【0098】
図4−1は、本実施例によるDNA増幅の概要を示したものである。図4−1の(1)に示すように、ターゲットDNAにアンカー配列4-1aを有するプローブP4-1およびその外側にプローブP4-3をハイブリダイズさせて鎖置換型DNAポリメラーゼ(φ29あるいはBstポリメラーゼなど)を用いて相補鎖合成を行う。プローブP4-3を起点として生成した相補鎖はプローブP4-1を起点として合成されたDNA相補鎖(DNA4-1)を引き剥がす役割をする。結果として、図4−1の(2)に示すように1本鎖DNA4-1が遊離してくる。このDNA4-1にハイブリダイズする配列とループ配列4-2loopを有するプローブP4-2とプローブP4-4をDNA4-1にハイブリダイズさせ、相補鎖合成を行う(図4−1の(3))。先ほどと同じように、プローブP4-2を起点としたDNA4-2が遊離してくる。DNA4-2は3'末端にリングDNAにハイブリダイズするプライマー配列4-1ac(アンカー配列に相補的な配列)を有し、増幅しようとする配列を含み、そして5'末端にループ配列を有するDNA(増幅用の鋳型DNA)である(図4−1の(4))。このDNA4-2は、図4−1の(5)に示すように、リングDNA4-1にハイブリダイズして相補鎖合成を行い、3'末端に繰り返し配列を生成する。この繰り返し部分のプライミングサイトに複数のプライマーP4-5がハイブリダイズして相補鎖合成を同時並列的に行う(図4−1の(6))。生成する相補鎖は後からくる合成鎖により鋳型DNAから引き剥がされる形で1本鎖DNA4-5を形成するが、相補鎖合成の終端部の3'末端部分がループ状になり、自己ハイブリダイズしてさらに相補鎖合成が進行して2本鎖DNAを生じる(図4−1の(7))。ループ部分には1本鎖状態のところがあり、図4−1の(8)に示すようにこの領域にハイブリダイズするプライマーP4-6を加えておくと、中間部分のループ配列にハイブリダイズして相補鎖合成を開始する。新たな相補鎖合成は既に完成した2本鎖DNA4-5を引き剥がす形で進行し、結果として3'末端の繰り返し配列部分が1本鎖状態でループ配列から5'末端にかけて2本鎖となったDNA鎖ができる。繰り返し配列を含む1本鎖部分にはさらにプローブP4-5がハイブリダイズして相補鎖合成を繰り返す(図4−1の(9)および(10))。一番長い鎖は2本鎖を形成して後から合成されるDNA鎖に引き剥がされることはないが、末端のループ配列は2本鎖状態とループ状態との平衡状態にあり、ある確率でループ状態にプライマーP4-6がハイブリダイズして相補鎖合成が進行する。すなわち生成物は自動的にいつまでも相補鎖合成反応を続け得ることになり大きな増幅効率が得られる。このようなループ配列を有するDNAの増幅はLAMP(Loop-Mediated Isothermal Amplification)法などでも行われているが、本発明の方法では、繰り返し配列が導入されているため、同時並列的に核酸を増幅できる点でより増幅率が高い方法といえる。
【0099】
[実施例5]
本実施例は、1つのビーズに平均1個以下のcDNAを作製して、同じビーズ上でそのコピーを増幅する例である。概要を図5−1に示した。本実施例で使用する繰り返し配列にハイブリダイズするプローブP5-2は固体表面に固定されている。実施例1と同様にビーズに固定したキャプチャープローブを用いてcDNAライブラリーを作製する(図5−1の(1))。ビーズとしては直径1μmのダイナビーズを使用した。1細胞中のmRNAのコピー数は106程度といわれているがそれよりはるかに多い108個のビーズを用いてcDNAライブラリーを作製する。この場合には1つのビーズに複数個のcDNAができる確率が限りなく小さくなる。
【0100】
実施例1と同様に、図5−1の(2)〜(5)に示すようにターゲットDNAの3'末端にアンカー配列5-1aを有するプライマー(プライマーP5-1)をハイブリダイズさせて、このアンカー配列5-1aに相補的な配列5-1ac(プライミングサイト5-1ac)を3'末端に導入する。次に、アンカー配列5-1a、プローブP5-2の相同配列部分、および制限酵素切断認識配列を含む約70塩基のリングDNA5-1を鋳型として用いて10分ほどRCA反応を行う(図5−1の(6))。これにより多くのプライミングサイト5-2c(プローブP5-2がハイブリダイズする部位)をcDNAの3'末端に繰り返し配列として導入する。この場合には相補鎖合成で生成する塩基長は約2×105程度であり、プライミングサイト5-2cの数は3000程度である。伸長したターゲットcDNAの鎖の長さは1塩基の間隔を0.3nmと仮定すると約60μmとなるが実際には引き伸ばされた状態ではないので10ミクロン以下の広がりと予想される。このようにしてビーズ固定のcDNA鎖は相補鎖合成された繰り返し配列を含む長いcDNA(末端に繰り返し配列が導入されている)とした後、底面積の広い反応室に入れて以後の反応を行う。
【0101】
108個のビーズが密集して並ぶと10mm四方の領域に収まるが、少し広い30mm四方の反応室を用いる。反応室の厚さは0.5mmほどで、側面から溶液を注入する。底面には密集して(30〜100nm2に1個のプローブ密度)プローブP5-2を固定しておく(図5−1の(7))。上部および下部は磁石を装着可能で必要に応じて磁気ビーズを上部または下部に密着することができる。反応液を反応室に入れて放置するか、磁石を用いて下部に沈殿させると、図5−1の(7)に示されるように、プローブP5-2はターゲットcDNAに導入された繰り返し配列部分にハイブリダイズするので、cDNAを有するビーズは複数のプローブにより強固に底面に捕捉される。cDNAと結合していないビーズは底面には捕捉されないので、上部に磁石を当てることにより浮き上がらせることができ、それを溶液と共に洗い流してcDNAを有するビーズだけを反応室に残す。残されたビーズの数は平均106程度であり、平均として30μm四方に1個のビーズがあることになる。図5−1の(8)に示すように、プローブP5-2を起点とした相補鎖合成により、まず3000個のプライミングサイトから相補鎖合成が同時並行的に進行して約3000個の1本鎖DNA(DNA5-2)が生じるがその3'末端近傍にはビーズに固定された多くのキャプチャープローブがあり、これらにハイブリダイズしてキャプチャープローブからの相補鎖合成が続いて進行する。結果として多くの2本鎖DNAが底面とビーズの間を架橋するように生成される。この状態で温度を上げてDNA鎖を1本鎖とした後に再度プローブP5-2でビーズを捕獲する。この段階でビーズに固定されたcDNAは元の量の3000倍になっており、プローブP5-2がハイブリダイズするプライミングサイトの数は計算では約4×106程度に増加している。単純に二乗にならないのは種々の長さの繰り返し配列部分のDNA鋳型があるためである。実際には計算通りにはいかないが106程度のプライミングサイトが生じると推定できる。
【0102】
上記と同様にプローブP5-2を用いて相補鎖合成を行うことで106個程度のcDNAの相補鎖コピー(DNA5-2)を固体表面上に生成し、続いての相補鎖合成でビーズ上にcDNAコピーを同程度の量だけ作ることができる。このプロセスを繰り返すことで1つのコピーから膨大な数のコピーを同一ビーズ上あるいはビーズが捕獲された平面の位置の近傍に生成することができる。最初にRCA反応でcDNAの3'末端に繰り返し配列を導入するが、この繰り返し配列が長すぎると異なるDNA間で交差反応が起こることがある。最初に導入する繰り返し配列部分の長さは10μm程度(例えば70塩基の繰り返し単位を約500倍にする)とし、増幅プロセスを繰り返したほうが都合の良い場合もある。
【0103】
以上述べたように繰り返し配列を導入することによる増幅方法では固体表面に固定したプローブを活用することにより、増幅に関与する領域を空間的に制限することができるので1つのDNA分子を基に作製したコピーをビーズなど空間的に分離された素材に固定して取り出すことができる。
【0104】
さらに、測定によっては、cDNAライブラリーの作製は小さなビーズで効率よく行い、増幅した後の種々の計測は比較的操作しやすい大きなビーズに増幅産物を移して行うことが望ましい場合がある。このような場合には、プローブP5-2が固定された表面上に作製した局在化したDNA相補鎖(DNA5-2)を用いるとよい。上記の例では1つのビーズから3000個の相補鎖が局在化した状態で生成する。その相補鎖の3'末端にはキャプチャープローブに相補的な配列が付加されている。そこで、温度を上げて、cDNAを固定したビーズと固体表面との間に形成されている2本鎖DNAを乖離させた後にビーズを洗い流す。次いでキャプチャープローブが固定された大きなビーズを反応室に流し込み、プローブP5-2が伸長して生成された先端にキャプチャープローブと相補的な配列を有するDNA鎖にキャプチャープローブをハイブリダイズさせてビーズに保持した後、余剰のビーズを洗い流して前述と同じ操作を行えばよい。このように本方法は種々の活用が可能な優れたDNA増幅方法である。
【0105】
この実施例では、ターゲットとなるDNAをまずビーズ上に作製して用いたが、遊離状態のDNAを対象にすることもできる。この場合にはビーズ上に固定されたプローブ(キャプチャープローブ)に代わって、同じ配列を有するプローブを遊離状態で反応液中に加えたり、あるいはプローブP5-2が固定された固体表面にプローブP5-2に対して一定の割合でキャプチャープローブP5-3を固定しておいたりなどすればよい(図5−2の(a))。さらに、別の実施例では、図5−2の(b)に示したように反応室を細かい反応セルの集合体(細孔アレー)で形成することもできる。各反応セルには平均として1個以下のターゲットDNAが含まれるようにする。反応セル内にはプローブP5-2が固定されており、また、キャプチャープローブに相当するプローブP5-3は浮遊した状態で溶液中に存在する形とした例を示した。ターゲットDNAの繰り返し配列部分にプローブP5-2が多くハイブリダイズして相補鎖合成を並列して行う。この結果、多くのプローブP5-2からDNA伸長鎖が生じる。これらは1本鎖として生成するが、プローブP5-3が3'末端にハイブリダイズして相補鎖合成を行うので2本鎖DNAを生じる。熱を掛けてそれぞれ1本鎖とするが、反応セルは相互に隔離されているので生じた浮遊DNA鎖は反応セルから外に出ない。そして速やかにセル表面に固定されたプローブP5-2にキャプチャーされる。引き続き相補鎖合成を行い、DNAを反応セルの中で増幅することができる。熱サイクルごとにn倍になるので数回の熱サイクルを加えることで膨大な数のコピーDNAを反応セル内に短時間で作ることができる。
【0106】
ここでは分離された反応セルを用いることを開示したが、このような反応場としてキャピラリープレートなどのキャピラリーチューブアレーを用いてもよい。この場合にはチューブの内部にプローブP5-2を固定して用いる。繰り返し配列を有するターゲットDNAを含む溶液をチューブアレーを通すと効率よくターゲットをプローブで捕獲できる。続いて相補鎖合成を行い、多くのコピーをチューブ内に作製できる。プローブP5-3を併せて加えておくと2本鎖DNAが壁に固定された状態で生じる。熱変性などによって増幅されたターゲットDNAのコピーを取り出して利用することができる。
【0107】
[実施例6]
本実施例では、繰り返し配列部分にハイブリダイズして相補鎖合成して生じる相補DNA鎖の3'末端にハイブリダイズするプローブが相補鎖合成する際に、ニックを生じる酵素の認識部位を含む部分を導入する例を開示する。繰り返し配列部分にハイブリダイズするプライマーP6-2を起点として合成した相補DNA鎖を鋳型として、その3'末端にハイブリダイズするプライマーP6-3を起点とするDNA相補鎖合成を行い、ターゲットDNA配列と相同の配列部分を含むDNA鎖を合成する。プライマーP6-2が相補鎖合成すると切断酵素の認識部位にN.BstNBIなどの酵素が結合して認識配列の外側を片方の鎖だけ切断する。この酵素の認識配列は-----GAGTCT|-----である。もちろん他の酵素を用いてもよく、この限りでない。このような酵素の活用はAnal. Chem. 77, 7984-7972(2005)に報告されている。DNAポリメラーゼとして前述の鎖置換型のポリメラーゼを用いているので、このように形成されたニックの部分から相補鎖合成が再スタートする。この新しい鎖は既に合成されたDNA鎖を引き剥がしながらDNA相補鎖合成するので繰り返しDNA一本鎖を作る。このDNA鎖の3'末端側には繰り返し配列があるので相補鎖合成がスタートして繰り返しDNAを増幅できる。以下、図を用いて説明する。
【0108】
図6のプロセス(6-1)は、3'末端に繰り返し配列を有し、かつ5'末端にプライマーP6-3と一部の配列が同じ配列のプライミングサイトになる部位を有するターゲットDNA6-1を用いた例を示した。繰り返し配列部分にハイブリダイズするプライマーP6-2から次々に鎖置換型の相補鎖合成によりDNA鎖が生じる。生じたDNA鎖は1本鎖状態で反応溶液中に遊離してくる。プロセス(6-2)に示されるように、3'末端にはプライミングサイトができ、プライマーP6-3がハイブリダイズする。プライマーP6-3は相補鎖DNA6-2を鋳型にして相補鎖合成を行い、ターゲットDNA6-1と同じ配列を含むDNA6-3を合成する(プロセス(6-3))。プライマーP6-3には2本鎖になると酵素に認識されて切断される部位を導入するが、相補鎖合成により2本鎖が形成されてこの部位が酵素で認識されるのでプロセス(6-4)に示したように配列の途中に切り込み(ニック)が生じる。鎖置換型のDNAポリメラーゼはこの切り込み部分から相補鎖合成を開始できるので、プロセス(6-5)から(6-6)に示したように既に合成されたDNA鎖をはがしながら相補鎖合成が進行する。相補鎖合成が進行すると再びニックが形成されて次の相補鎖合成が開始される。このようにして多くの同じ配列を有するDNAを生成することができる。生成されたDNA6-3sは5'末端がニック部位以降の配列となるのでDNA6-3より少し短い配列となっている(プロセス(6-7))。DNA6-3sは3'末端に繰り返し配列を有しているので、プロセス(6-7)および(6-8)に示されるように、プライマーP6-2がハイブリダイズして相補鎖DNA6-2sを生成する。DNA6-2sはプライマーP6-3にハイブリダイズしてDNA6-2と同じ配列となり、プライマーP6-3は相補鎖合成によりDNA6-3を作る(プロセス(6-9)および(6-10))。DNA6-3のプライマー部位には再びニックが入り、プロセス(6-4)からのプロセスが繰り返される。このように繰り返しDNAコピーを作るプロセスが繰り返されるので短時間に非常に多くのDNAコピーを生成することができる。
【0109】
本実施例では、プライマー配列中にニックの部位を入れたが相補鎖合成で初めてこの部位が現れるようにすることもできる。この場合には切断により短くなったDNA6-3sを鋳型として合成されたDNA6-2sにはプライミングサイトがないのでプライマーP6-3がハイブリダイズできず、全体的な増幅率は若干低下する。
【0110】
なお、プライマーP6-3はターゲットDNAにハイブリダイズしただけでは切断されず、相補鎖合成が起こって初めて切断されるように設計すると効果的である。
【産業上の利用可能性】
【0111】
本発明により、核酸の増幅方法が提供される。かかる方法は、複数種の核酸が共存しても、どの核酸についても同じ増幅率で増幅することができる。また、かかる方法では、核酸の配列や長さの如何にかかわらず均一に、短時間に高い増幅率で核酸を増幅することができる。従って、本発明に係る増幅方法は、mRNAの均一な増幅、特に1つの細胞から得られる少量のmRNAからcDNAを合成し、そのcDNAを均一にバイアスなく増幅する方法として優れている。また本発明に係る方法は、核酸の迅速な増幅と検出が望まれる、遺伝子発現解析、細胞機能解析、生体組織の解析方法、病気の診断、感染症検査、創薬などの分野に有用である。
【技術分野】
【0001】
本発明は、核酸の増幅方法および検出方法に関するものである。具体的には、本発明は、DNAまたはmRNAを均一にかつ効率的に増幅する方法、および該増幅方法を利用して核酸を検出する方法に関するものである。
【背景技術】
【0002】
遺伝子の発現解析や遺伝子診断など種々DNA(あるいはmRNA)の比較解析では、対象とするDNAのコピー数が少ないためにそのコピー数を増幅してから計測することが広く行われている。一般的な増幅方法には、ターゲットとなるDNAの領域を挟んで2箇所をプライミング領域として選択し、その領域にプライマーをハイブリダイズさせ、ターゲット領域を繰り返し相補鎖合成してコピー数を増やすPCR(Polymerase Chain Reaction)や、ターゲット領域にプローブをハイブリダイズさせ、ライゲーションによりリング状のDNAを作製してそれにハイブリダイズするプライマーを用いて相補鎖合成をリングに沿って何周にもわたって行い、ターゲット領域を増幅するRCA(Rolling Circle Amplification)、あるいは鎖置換増幅(SDA)などが知られている。また、多くのプライマーセットと鎖置換増幅を組み合わせたDNA増幅方法などが報告されている(特許文献1)。しかし、これら増幅方法には、増幅対象となる領域の長さや構成する塩基の配列もしくは種類などによって増幅率が異なることがある。これは詳細な遺伝子発現を調べる上で大きな課題である。
【0003】
遺伝子の発現分析は生命科学の基本データとして重要であるばかりでなく、診断あるいは創薬など幅広い分野に用いられている。現在、遺伝子の発現を調べるには多くの細胞をサンプルとして使用し、mRNAを取り出してcDNAを作製し、これらを一括してPCRなどにより増幅してからDNAチップなどを用いてmRNAの発現量を定量分析している。これら多くの細胞を用いた測定ばかりでなく、1つの細胞を対象にそこで発現している遺伝子の解析が注目されつつある(非特許文献1)。このような遺伝子発現解析では多くの細胞を用いた方法よりはるかに少ないmRNAを用いて精密に定量分析することが求められる。このためにmRNAの増幅が重要である。現在mRNAを対象とした一括増幅を行うための試薬キットが市販されている(QIAGEN社;QuantiTect Whole Transcriptome Kit)。これはmRNAからcDNAを生成する際に種々の部位にハイブリダイズするランダムプライマーを用いてcDNAを作製し、得られたcDNA断片混合物をライゲーションにより連結して種々の断片の混ざったリング状のDNAとし、そこにランダムプライマーを再度作用させてRCA増幅するものである。この方法は500〜1000細胞以上の多くの細胞を用いた場合には比較的良好に動作するが、少ない細胞では対象とするDNA断片ごとの増幅率が変化してしまう。また、PCRを用いる一括増幅方法も用いられている(非特許文献1)が、これはまず、アンカー配列付きのポリT配列を有するDNAプローブを用いてmRNAからcDNAを作製し、その3'末端にターミナルトランスフェラーゼを用いてポリA鎖を付加して増幅のための鋳型DNAとする。アンカー配列とポリA配列部分を用いてPCR増幅するが、ターゲットの配列や長さにより増幅率がやはり異なることになる。より精密な遺伝子発現分析には均一なDNA増幅方法が望まれる。
【0004】
少ないDNAコピーを含むサンプルを用いて遺伝子発現解析のような精密な比較分析を行う場合には、対象となる種々DNAを均一に増幅することが必要不可欠である。増幅方法として一般に用いられているポリメラーゼ連鎖反応(PCR)法は、温度を上下して2本鎖DNAを1本鎖にし、プライマーをハイブリダイズさせて相補鎖合成するプロセスを繰り返す方法である。相補鎖合成の効率は対象とするDNAの配列や長さにより若干変化する。PCRでは1サイクル当たりの増幅率をY、温度サイクルの数をnとすると約Yn倍に増幅される。Yは理想的に行けば2であるが実際には1.6前後である。nは通常30〜40であるが熱サイクル当たりの増幅率が少し変化すると増幅率が大きく変化する。たとえば2%だけYが変化した場合に35回熱サイクル反応を行うと増幅率には2倍の差ができる。熱サイクル1回当たりの増幅率は温度やターゲットDNAの長さおよび配列に依存するので、DNAの種類が異なると数倍の増幅率の差ができてしまう。このような差は精密なDNAの存在比を計測するときには障害となる。
【0005】
一方、リング状のDNAを作製してプライマーをハイブリダイズさせて相補鎖合成を繰り返すローリングサークル増幅(RCA)法では対象とするリングのサイズに依存して増幅率が変化するものの、相補鎖合成時間でほぼ増幅率が決定される利点がある。しかし、増幅対象とする領域をリング状のDNAとすることが必要で、短い既知配列部分を増幅する際には有効であるが、長い未知配列部分を対象とした増幅には単位時間当たりの増幅率が低く不向きである。たとえば、具体的な例として遺伝子の発現プロフィール分析のためにmRNAから得られるcDNAを増幅しようとすると、cDNAの長さがそれぞれ異なることなどからRCAを利用することはできない。
【0006】
また、複数のプライマーセットと鎖置換DNA相補鎖合成を用いた方法では対象とするDNAごとに多くのプライマーセットを必要とするので、複数の対象DNA断片が存在する場合には煩雑である上、予期せぬ副産物が生じることもあり、やはり有効ではない。
【0007】
さらにDNAを用いた遺伝子診断が感染症の判定に用いられており、できる限り迅速にDNAを増幅して検出することが望まれているが、現状では少なくとも1時間程度の時間を要する。例えばPCRでは1回の熱プロセスに要する時間は通常1〜2分程度である。充分な増幅を行おうとすると40サイクル程の熱サイクルが必要で、これには1時間を要する。このように長い時間を要するDNA増幅検査はウィルスなどの感染症検査では望ましくない。できるだけ短時間に検査を行い、その後の方針を決定するためである。そこで増幅率が大きく、短時間でDNA増幅できる方法が望まれている。
【先行技術文献】
【特許文献】
【0008】
【特許文献1】特表2001−519172号公報
【非特許文献】
【0009】
【非特許文献1】Nucreic Acids Res. 34, e42(2006)
【発明の概要】
【発明が解決しようとする課題】
【0010】
上述のように、微量のDNA増幅に適用でき、配列やDNAの長さの如何にかかわらず増幅する方法や短時間にDNAを増幅する方法の確立が求められている。
【0011】
従って、本発明の課題は、微量の核酸を、迅速かつ簡便に、高増幅率で増幅する方法を提供することである。また本発明の別の課題は、微量の核酸を、迅速に高増幅率で増幅し、検出する方法を提供することである。
【課題を解決するための手段】
【0012】
上記課題を解決するため鋭意検討を行った結果、本発明者は、増幅対象の核酸の末端に繰り返し配列を導入し、該繰り返し配列に複数のプライマーをハイブリダイズさせて鎖置換型相補鎖合成を行うことにより、増幅対象の核酸およびその相補鎖を同時並行的に合成することができ、核酸を短時間に高増幅率で増幅できるという知見を得、本発明を完成するに至った。
【0013】
すなわち本発明は以下のとおりである。
【0014】
(1)核酸の増幅方法であって、
ターゲット配列またはその相補配列を含むターゲット核酸鎖の3'末端に既知配列を含む繰り返し配列を導入するステップ、
該繰り返し配列にハイブリダイズするオリゴヌクレオチドを、該ターゲット核酸鎖に導入した繰り返し配列に複数個ハイブリダイズさせるステップ、
該オリゴヌクレオチドをプライマーとして用いて該ターゲット核酸鎖を鋳型とした相補鎖合成を行い、1つのターゲット核酸鎖から複数の核酸相補鎖を生成するステップ
を含む方法。
(2)繰り返し配列が、ターゲット配列またはその相補配列の長さよりも短いものである、(1)に記載の方法。
(3)繰り返し配列が、ターゲット配列またはその相補配列の長さよりも長いものである、(1)に記載の方法。
(4)繰り返し配列に含まれる繰り返し単位の数が100を超えるものである、(1)〜(3)のいずれかに記載の方法。
(5)繰り返し配列に含まれる繰り返し単位の数が1000を超えるものである、(1)〜(3)のいずれかに記載の方法。
(6)ターゲット核酸鎖が複数種の核酸鎖を含むものであり、それらの複数種の核酸鎖に対して共通の繰り返し配列を導入するものである、(1)〜(5)のいずれかに記載の方法。
【0015】
(7)繰り返し配列の導入が、繰り返し配列を有する核酸鎖をターゲット核酸鎖にライゲーションにより導入することにより行う、(1)〜(6)のいずれかに記載の方法。
(8)繰り返し配列の導入が、繰り返し配列を有する核酸鎖を鋳型とし、ターゲット核酸鎖の3'末端部分を繰り返し配列導入用プライマーとしてまたはターゲット核酸鎖の3'末端に付加した配列部分を繰り返し配列導入用プライマーとして用いる相補鎖合成により行う、(1)〜(6)のいずれかに記載の方法。
(9)繰り返し配列を有する核酸鎖が、リング状の核酸を鋳型とした相補鎖合成によって生成されたものである、(7)または(8)に記載の方法。
【0016】
(10)繰り返し配列の導入が、ターゲット核酸鎖に含まれる配列部分、または該ターゲット核酸鎖に付加した配列部分を繰り返し配列導入用プライマーとして使用し、リング状の核酸を鋳型とする相補鎖合成により行う、(1)〜(6)のいずれかに記載の方法。
(11)繰り返し配列の導入が、ターゲット核酸鎖に付加した配列部分を繰り返し配列導入用プライマーとして使用し、該配列部分にハイブリダイズしかつライゲーションによりリング状の核酸を形成することができるオリゴヌクレオチドを用いて形成されたリング状の核酸を鋳型とする相補鎖合成により行う、(1)〜(6)のいずれかに記載の方法。
(12)繰り返し配列導入用プライマーの少なくとも一部が、ターゲット核酸鎖の3'末端に付加した配列部分を利用するものである、(10)または(11)に記載の方法。
(13)繰り返し配列の導入が、ターゲット核酸鎖の3'末端に付加した配列部分の少なくとも一部にハイブリダイズするオリゴヌクレオチドを鋳型として相補鎖合成により得られた配列部分の相補配列を繰り返し配列導入用プライマーとして使用し、リング状の核酸を鋳型とする相補鎖合成により行う、(1)〜(6)のいずれかに記載の方法。
(14)ターゲット核酸鎖の3'末端に、ターミナルトランスフェラーゼにより配列部分を付加する、(8)〜(13)のいずれかに記載の方法。
(15)ターゲット核酸鎖の3'末端に付加した配列部分に隣接する該ターゲット核酸鎖の3'末端側の配列部分と、付加した配列部分の全てまたは一部分とにハイブリダイズし、かつ既知配列を含むオリゴヌクレオチドを鋳型として相補鎖合成を行い、該ターゲット核酸鎖の3'末端に付加した配列部分の一部を必要に応じて除去し、続いてハイブリダイズしたオリゴヌクレオチドを鋳型として相補鎖合成により該ターゲット核酸鎖の3'末端側に付加された該既知配列を繰り返し配列導入用プライマーとして用いて、リング状核酸を鋳型として相補鎖合成を行うことにより、繰り返し配列を導入するものである、(13)に記載の方法。
(16)ターゲット核酸鎖の3'末端に付加した配列部分の一部の除去が、該配列部分におけるオリゴヌクレオチドがハイブリダイズしていない部分の塩基をエキソヌクレアーゼを含む酵素を用いて除去することにより行う、(15)に記載の方法。
【0017】
(17)ターゲット核酸鎖の3'末端に付加した、繰り返し配列導入用プライマーとして使用する配列部分が、制限酵素切断に続くオリゴヌクレオチドのライゲーションまたはオリゴヌクレオチドを鋳型とする相補鎖合成により生成されたものである、(10)〜(13)のいずれかに記載の方法。
(18)繰り返し配列導入用プライマーとして、ターゲット核酸鎖に含まれる既知配列部分を利用するものである、(10)に記載の方法。
(19)ターゲット核酸鎖の既知配列部分を切断して、得られるターゲット核酸鎖の3'末端を含む部分を繰り返し配列導入用プライマーとして使用する、(18)に記載の方法。
(20)ターゲット核酸鎖の既知配列部分の切断が、Cleavaseを含む酵素により行う、(19)に記載の方法。
【0018】
(21)ターゲット核酸鎖の既知配列部分にハイブリダイズし、かつ5'末端側にアンカー配列を有するオリゴヌクレオチドをターゲット核酸鎖にハイブリダイズさせ、該オリゴヌクレオチドを伸張する相補鎖合成を行って2本鎖核酸を生成し、1本鎖核酸を3'末端から分解する酵素を用いてターゲット核酸鎖の1本鎖部分を分解除去し、次いで該オリゴヌクレオチドのアンカー配列を鋳型としてターゲット核酸鎖の3'末端側を伸張する相補鎖合成によりターゲット核酸鎖に配列部分を付加して、繰り返し配列導入用のプライマーを生成するものである、(10)〜(13)のいずれかに記載の方法。
(22)ターゲット核酸鎖の既知配列部分にハイブリダイズし、かつ5'末端側にアンカー配列を有するオリゴヌクレオチドをターゲット核酸鎖にハイブリダイズさせ、該オリゴヌクレオチドを伸張する相補鎖合成を行って2本鎖核酸を生成し、ターゲット核酸鎖の1本鎖部分を除去し、次いで該オリゴヌクレオチドのアンカー配列を鋳型とした相補鎖合成によりターゲット核酸鎖の3'末端に既知配列部分を付加し、該オリゴヌクレオチドを除去することにより、繰り返し配列導入用のプライマーを生成するものである、(10)〜(13)のいずれかに記載の方法。
(23)ターゲット核酸鎖の3'末端および5'末端に既知配列部分を付加し、ターゲット核酸鎖およびその相補核酸鎖の両方について3'末端の該既知配列部分を繰り返し配列導入用プライマーとして、該既知配列部分にハイブリダイズすることができるリング状のDNAを鋳型として用いて相補鎖合成を行うことにより、該3'末端および5'末端に繰り返し配列を導入するものである、(8)〜(11)のいずれかに記載の方法。
(24)ターゲット核酸鎖に導入された繰り返し配列にハイブリダイズする第1のオリゴヌクレオチドをプライマーとして用いる相補鎖合成を行い、生成された相補核酸鎖を鋳型として、その3'末端にハイブリダイズする第2のオリゴヌクレオチドをプライマーとして用いて相補鎖合成を行い、ターゲット核酸鎖のコピーを増幅するステップを含む、(1)〜(23)のいずれかに記載の方法。
(25)ターゲット核酸鎖に導入された繰り返し配列にハイブリダイズするオリゴヌクレオチドをプライマーとして用いる相補鎖合成を行い、得られた2本鎖核酸を1本鎖核酸とし、次いで該オリゴヌクレオチドをプライマーとして、生成された1本鎖核酸を鋳型として相補鎖合成を行うステップを繰り返すものである、(1)〜(23)のいずれかに記載の方法。
【0019】
(26)ターゲット配列またはその相補配列を含み、3'末端に繰り返し配列を有し、かつ5'末端にループ配列を有するターゲット核酸鎖を生成するステップを含む、(1)〜(25)のいずれかに記載の方法。
(27)核酸鎖がDNA鎖である、(1)〜(26)のいずれかに記載の方法。
【0020】
(28)ターゲット核酸鎖の5'末端側が固体表面に固定されている、(1)〜(27)のいずれかに記載の方法。
(29)ターゲット核酸鎖に導入される繰り返し配列にハイブリダイズするオリゴヌクレオチドが固体表面に固定されている、(1)〜(28)のいずれかに記載の方法。
(30)ターゲット核酸鎖に導入される繰り返し配列にハイブリダイズする第1のオリゴヌクレオチドを用いて生成された相補核酸鎖を、固体表面に固定した第2のオリゴヌクレオチドを用いて捕獲し、第2のオリゴヌクレオチドをプライマーとして相補鎖合成を行うステップを含む、(1)〜(29)のいずれかに記載の方法。
(31)固体がビーズである、(28)〜(30)のいずれかに記載の方法。
(32)固体が区画化された平面固体である、(28)〜(30)のいずれかに記載の方法。
(33)固体表面が多孔質または細孔アレーの内壁である、(28)〜(30)のいずれかに記載の方法。
(34)ターゲット核酸鎖またはその相補核酸鎖にハイブリダイズする少なくとも2種のオリゴヌクレオチドが同一固体表面に固定されている、(28)〜(33)のいずれかに記載の方法。
【0021】
(35)ターゲット核酸鎖に導入された繰り返し配列の前または後ろに制限酵素切断認識配列が導入されるように相補鎖合成を行い、得られた相補核酸鎖から制限酵素を用いて繰り返し配列を切断除去するステップを含む、(1)〜(34)のいずれかに記載の方法。
(36)ターゲット核酸鎖に相補的な配列と5'末端に第1のアンカー配列とを有するキャプチャープローブを用いてターゲット核酸鎖を鋳型として相補鎖合成するステップ、生成した相補核酸鎖を1本鎖とするステップ、1本鎖相補核酸鎖にハイブリダイズする第1のオリゴヌクレオチドを用いて相補鎖合成を行い、第1のオリゴヌクレオチドが伸張した3'末端側に第1のアンカー配列に基づく既知配列部分を導入するステップ、該既知配列部分をプライマーとしてリング状の核酸鎖にハイブリダイズさせて相補鎖合成を行い、3'末端側に第1の繰り返し配列が導入された相補核酸鎖を生成するステップ、ならびに第1の繰り返し配列に複数の第2のオリゴヌクレオチドをハイブリダイズさせて、同時並行的に相補鎖合成するステップを含む、(1)に記載の方法。
(37)第1のオリゴヌクレオチドが5'末端側に第2のアンカー配列を含み、第1の繰り返し配列にハイブリダイズする第2のオリゴヌクレオチドをプライマーとして相補鎖合成した相補鎖の3'末端側に第2のアンカー配列に基づく既知配列部分を導入し、該既知配列部分をプライマーとして使用して、リング状の核酸を鋳型として相補鎖合成を行い、3'末端側に第2の繰り返し配列が導入された相補核酸鎖を生成するステップをさらに含む、(36)に記載の方法。
(38)複数種のmRNAからcDNAライブラリを作製し、cDNAライブラリに含まれる複数種のcDNAをターゲット核酸鎖として均一にDNAを増幅するものである、(1)〜(37)のいずれかに記載の方法。
(39)mRNAまたはcDNAを捕捉するビーズとは異なるビーズ上に増幅したDNAコピーを作製するものである、(38)に記載の方法。
【0022】
(40)単一種または複数種の核酸鎖を含む核酸プールを均一に増幅する方法であって、
核酸プールに含まれる核酸鎖の3'末端に既知配列を含む繰り返し配列を導入するステップ、該繰り返し配列にハイブリダイズするオリゴヌクレオチドと、鎖置換型ポリメラーゼを用いて相補鎖合成を行うステップを含む方法。
(41)核酸の増幅方法であって、ターゲット配列またはその相補配列を含むターゲット核酸鎖の3'末端に既知配列を含む繰り返し配列を導入するステップ、該繰り返し配列にハイブリダイズするオリゴヌクレオチドを用いて相補鎖合成を行うステップ、生成される2本鎖核酸に切断部(ニック)を導入するステップ、切断部(ニック)から相補鎖合成を行い、複数の核酸鎖を生成するステップを含む方法。
(42)サンプル中の核酸の検出方法であって、サンプル中の核酸を、(1)〜(41)のいずれかに記載の方法により増幅するステップ、得られる増幅産物を用いて、検出対象の核酸を検出するステップを含む方法。
(43)サンプル中の全ての核酸または検出対象の核酸のみを増幅するものである、(42)に記載の方法。
【発明の効果】
【0023】
本発明により、核酸の増幅方法が提供される。かかる方法は、複数種の核酸が共存しても、どの核酸についても同じ増幅率で増幅することができる。また、かかる方法では、核酸の配列や長さの如何にかかわらず均一に、短時間に高い増幅率で核酸を増幅することができる。従って、本発明に係る増幅方法は、mRNAの均一な増幅、特に1つの細胞から得られる少量のmRNAからcDNAを合成し、そのcDNAを均一にバイアスなく増幅する方法として優れている。また本発明に係る方法は、核酸の迅速な増幅と検出が望まれる、遺伝子発現解析、細胞機能解析、生体組織の解析方法、病気の診断、感染症検査、創薬などの分野に有用である。
【図面の簡単な説明】
【0024】
【図1−1a】本発明の一態様の概要を示す。ターゲットDNAの3'末端に既知配列を導入し、この既知配列をプライマー(プライマーP1-1)として、リングDNAを鋳型として用いて相補鎖合成を行い、繰り返し配列をターゲットDNAの3'末端に導入する。次いで繰り返し配列部分にハイブリダイズするプライマー(プライマーP1-2)を用いて同時並行的に相補鎖合成を行い、ターゲットDNAの相補鎖コピーを増幅する。次いでさらに相補鎖合成を行ってターゲットDNAと相同配列を有するDNA鎖を増幅する。
【図1−1b】図1−1aの続きである。
【図1−1c】図1−1aの続きである。
【図1−2】増幅反応に使用するリングDNA1の構造を示す。
【図2−1】本発明の一態様として、既知配列部分の付加を、ループ状のプローブのハイブリダイゼーションと酵素Cleavaseを利用する方法で行う概要を示す。
【図2−2】増幅反応に使用するリングDNAの一例の構造を示す。
【図3−1a】本発明の一態様として、両末端に繰り返し配列を導入して高効率でDNAを増幅する方法の原理を示す。
【図3−1b】図3−1aの続きである。
【図3−2a】本発明の一態様として、ターゲットDNAがビーズに固定されている例で、ビーズに固定されたキャプチャープローブを活用して繰り返し配列をターゲットDNAの末端に導入する方法の概要を示す。
【図3−2b】図3−2aの続きである。
【図4−1】本発明の一態様として、ターゲットDNAにループ配列と繰り返し配列を導入して増幅する方法の概要を示す。
【図4−2】図4−1の続きである。
【図5−1a】本発明の一態様として、ビーズ固定ターゲットDNAと固体表面に固定された増幅用のプライマーを用いる方法の概要を示す。固体表面の狭い領域に1個のDNAから多数の増幅産物を生成することができる。
【図5−1b】図5−1aの続きである。
【図5−2】本発明の一態様として、プローブを固定した種々の方法の例を示す。
【図6−1】本発明の一態様として、相補鎖合成時に切断部(ニック)を生じる酵素の認識部位を導入し、ニックから相補鎖合成を行う方法の概要を示す。
【図6−2】図6−1の続きである。
【発明を実施するための形態】
【0025】
本発明は、核酸を均一に効率よく増幅する方法に関する。具体的には、本発明の核酸の増幅方法は、
ターゲット配列またはその相補配列を含むターゲット核酸鎖の3'末端に既知配列を含む繰り返し配列を導入するステップ、
該繰り返し配列にハイブリダイズするオリゴヌクレオチドを、該ターゲット核酸鎖に導入した繰り返し配列に複数個ハイブリダイズさせるステップ、
該オリゴヌクレオチドをプライマーとして用いて該ターゲット核酸鎖を鋳型とした相補鎖合成を行い、1つのターゲット核酸鎖から複数の核酸相補鎖を生成するステップ
を含む。
【0026】
ターゲット配列またはその相補配列を含むターゲット核酸鎖は、増幅しようとする配列を含む核酸であれば特に限定されるものではなく、デオキシリボ核酸(DNA)、例えばcDNA、およびリボ核酸(RNA)、例えばメッセンジャーRNA(mRNA)、ならびにそれらの断片およびハイブリッド核酸などである。ターゲット核酸鎖は、当技術分野で公知の方法により調製することができる。例えば、細胞からターゲット核酸を調製する場合には、Proteinase Kのようなタンパク質分解酵素、チオシアン酸グアニジン・グアニジン塩酸といったカオトロピック塩、TweenおよびSDSといった界面活性剤、あるいは市販の細胞溶解用試薬を用いて、細胞を溶解し、それに含まれる核酸、すなわちDNAおよびRNAを溶出することができる。RNAを調製する場合には、上記の細胞溶解により溶出された核酸のうち、DNAをDNA分解酵素(DNase)により分解し、核酸としてRNAのみを含む試料が得られる。mRNAを調製する場合には、mRNAはポリA配列を含むことから、上記のように調製したRNA試料から、ポリT配列を含むDNAプローブを用いてmRNAのみを捕捉することができる。またcDNAを調製する場合には、上記のようにして得られるmRNAから逆転写酵素を用いる逆転写反応を行うことによってcDNAを合成することができ、例えばmRNA調製時に使用したポリT配列を含むDNAプローブをプライマーとし、mRNAを鋳型として、デオキシヌクレオチドの存在下、逆転写酵素を用いて反応させることによりcDNAを合成することができる。
【0027】
ターゲット核酸鎖は、単一種の核酸鎖を含むものであってもよいし、または複数種の核酸鎖を含むものであってもよい。すなわち、ターゲット核酸鎖は、同じターゲット配列またはその相補配列を含むものであってもよいし、異なる配列を含むものであってもよい。例えば、ターゲット核酸鎖は、核酸プール、cDNAライブラリなどとすることができる。例えば本発明においては、複数種のmRNAからcDNAライブラリを作製し、そのcDNAライブラリに含まれる複数種のcDNAをターゲット核酸鎖として、均一に増幅することができる。
【0028】
またターゲット核酸鎖は、遊離状態であってもよいし、または5'末端側が固体表面に固定されていてもよい。ターゲット核酸鎖を固定することができる固体は、核酸の操作に一般的に使用される固体であれば特に限定されるものではない。具体的には、水不溶性で、加熱変性時に溶融しない固体であることが好ましい。その材料としては、例えば、金、銀、銅、アルミニウム、タングステン、モリブデン、クロム、白金、チタン、ニッケル等の金属;ステンレス、ハステロイ、インコネル、モネル、ジュラルミン等の合金;シリコン;ガラス、石英ガラス、溶融石英、合成石英、アルミナ、サファイア、セラミクス、フォルステライトおよび感光性ガラス等のガラス材料;ポリエステル樹脂、ポリスチレン、ポリエチレン樹脂、ポリプロピレン樹脂、ABS樹脂(Acrylonitrile Butadiene Styrene 樹脂)、ナイロン、アクリル樹脂、フッ素樹脂、ポリカーボネート樹脂、ポリウレタン樹脂、メチルペンテン樹脂、フェノール樹脂、メラミン樹脂、エポキシ樹脂および塩化ビニル樹脂等のプラスチック;アガロース、デキストラン、セルロース、ポリビニルアルコール、ニトロセルロース、キチン、キトサンが挙げられる。また、固体の形状についても、特に限定はなく、区画化された平面(例えばタイタープレート、多孔質もしくは細孔アレーなど)、平板、フィルム、チューブおよび粒子等が挙げられる。固体として粒子を用いることによって、単位体積あたりより大きな表面積を利用することができるので、迅速かつ効率的な処理を行うことができる。さらに、粒子として磁化されたまたは磁化可能な磁気ビーズを用いることによって、分離処理等について、自動化、効率化または迅速化することができる。また固体として粒子を用いる場合、粒子の径は、通常50μm以下、例えば1.0μm〜3.0μmである。
【0029】
ターゲット核酸鎖などの核酸を固体表面に固定化する方法は、特に限定されないが、例えば、共有結合、イオン結合、物理吸着、生物学的結合(例えば、ビオチンとアビジンまたはストレプトアビジンとの結合、抗原と抗体との結合など)によって固定化する方法などを例示することができる。核酸は、スペーサー配列、例えば1〜10個の炭素原子を含む炭化水素基を介して、固体表面に固定してもよい。
例えば、ターゲット核酸鎖がcDNAである場合には、cDNA合成時にポリT配列を含むプローブ核酸を固体表面に結合させ、そのポリT配列にmRNAを結合させ、相補鎖合成によりcDNAを合成することによって、該プローブ核酸を介してターゲットcDNAを固体表面に固定することができる。ポリT配列を含むプローブ核酸も、上記のように核酸を固体表面に固定化する方法によって、固体表面に結合させることができる。
【0030】
共有結合を介した核酸の固体表面への固定化は、例えば、核酸に官能基を導入しかつ該官能基と反応性の官能基を固体表面に導入して両者を反応させることにより実施できる。例えば、核酸にアミノ基を導入し、固体表面に活性エステル基、エポキシ基、アルデヒド基、カルボジイミド基、イソチオシアネート基またはイソシアネート基を導入することにより共有結合を形成できる。また、核酸にメルカプト基を導入し、固体表面に活性エステル基、マレイミド基またはジスルフィド基を導入してもよい。活性エステル基としては、例えば、p-ニトロフェニル基、N-ヒドロキシスクシンイミド基、コハク酸イミド基、フタル酸イミド基、5-ノルボルネン-2、3-ジカルボキシイミド基等が挙げられる。
【0031】
官能基を固体表面に導入する方法の一つとしては、所望の官能基を有するシランカップリング剤によって固体表面を処理する方法が挙げられる。カップリング剤の例としては、γ-アミノプロピルトリエトキシシラン、N-β-(アミノエチル)-γ-アミノプロピルトリメトキシシラン、N-β-(アミノエチル)-β-アミノプロピルメチルジメトキシシラン、あるいはγ-グリシドキシプロピルトリメトキシシラン等を用いることができる。結合部位となる官能基を固体表面に導入する別の方法としては、プラズマ処理が挙げられる。このようなプラズマ処理により、固体表面に、水酸基やアミノ基等の官能基を導入することができる。プラズマ処理は、当業者には既知の装置を用いて行うことができる。
【0032】
物理吸着によって核酸を固体表面に固定する方法としては、ポリ陽イオン(ポリリシン、ポリアリルアミン、ポリエチレンイミン等)で表面処理した固体に、核酸の荷電を利用して静電結合させる方法などが挙げられる。
【0033】
本発明においては、上述のようにして調製したターゲット核酸鎖の3'末端に繰り返し配列を導入する。本発明において「繰り返し配列」とは、一定の長さの繰り返し単位を反復して含む配列を意味し、本発明においては、後述する増幅反応または相補鎖合成においてプライマーがハイブリダイズするためのプライミングサイトを提供する。従って、繰り返し単位は、少なくとも1つのプライミングサイトの配列(相同配列または相補配列)を含み、任意により予備のプライミングサイトの配列、制限酵素切断認識配列などを含んでもよい。その繰り返し単位は約30〜300塩基長、例えば約50〜100塩基長、好ましくは約70塩基長とすることができる。この繰り返し配列に含まれる繰り返し単位の数は、50〜10000程度、好ましくは100を超えるものであり、より好ましくは1000を超えるものである。繰り返し配列は、ターゲット核酸鎖のターゲット配列またはその相補配列の長さよりも短いものであってもよいし、または長いものであってもよい。
【0034】
また、ターゲット核酸鎖として複数種の核酸鎖を対象とする場合、それらの複数種の核酸鎖に対して、共通の繰り返し配列を導入してもよいし、または異なる繰り返し配列を導入してもよい。その後の相補鎖合成を同時並行的に簡便に行うことができる点で、共通の繰り返し配列を複数種のターゲット核酸鎖に導入することが好ましい。
繰り返し配列を導入するための1つの方法は、繰り返し配列を有する核酸鎖をターゲット核酸鎖にライゲーションにより導入する方法である。ライゲーションは、当技術分野で公知の方法により、例えば制限酵素やリガーゼを用いる方法によって行うことができる。また別の方法は、繰り返し配列を有する核酸鎖を鋳型とし、ターゲット核酸鎖の3'末端部分を繰り返し配列導入用プライマーとしてまたはターゲット核酸鎖の3'末端に付加した配列部分を繰り返し配列導入用プライマーとして用いる相補鎖合成により、繰り返し配列を有する核酸鎖をターゲット核酸鎖に導入する方法である。
【0035】
本発明の方法において、相補鎖合成は、当技術分野で公知の方法に従って、例えば基質となる塩基(dNTPなど)の存在下で適当なポリメラーゼを用いることにより行うことができる。また、本発明の方法において相補鎖合成およびローリングサークル増幅(RCA)反応に使用するプライマーおよびプローブとして機能するオリゴヌクレオチドは、ハイブリダイズさせる対象の配列に基づいて、増幅しようとするターゲット配列の領域、塩基配列の長さや融解温度(Tm)などを考慮して、例えば公知のプログラムを利用して容易に設計することができる。例えば、プライマーまたはプローブとしての機能を有するオリゴヌクレオチドの長さとしては、10塩基以上が好ましく、さらに好ましくは15〜50塩基であり、さらに好ましくは20〜30塩基である。
【0036】
上記の方法で使用する繰り返し配列を有する核酸鎖は、当技術分野で公知の方法により調製することができる。例えば、繰り返し配列を有する核酸鎖は、リング状の核酸を鋳型とした相補鎖合成によって生成することができる。具体的には、繰り返し単位の配列からなるリング状の核酸(例えばリングDNA)を鋳型として、ローリングサークル増幅(RCA)反応を行うことによって、繰り返し配列を有する核酸鎖を生成することができる。本発明において「リング状の核酸」とは、いわゆる環状の核酸を意味し、直鎖状ではないことを意味する。リング状核酸は、上述した繰り返し単位に相補的な配列を含み、約30〜300塩基長、例えば約50〜100塩基長、好ましくは約70塩基長である。
【0037】
繰り返し配列の導入のためにリング状の核酸を鋳型とした相補鎖合成を行う場合、導入される繰り返し配列の繰り返し単位数は、ターゲット核酸の配列や長さにまったく無関係にリング状核酸を構成する配列の長さと相補鎖合成時間で決まる。1塩基相補鎖合成するときに要する時間は2〜3msec程度であるので、15分間相補鎖合成を行うと、繰り返し配列として約2〜3×105の塩基長が伸長する。リング状核酸のサイズを約70塩基とすると約3〜4×103倍の増幅(繰り返し配列)が得られることになる。これを2回繰り返せば短時間に約107倍の増幅が得られる。
【0038】
繰り返し配列を導入するための別の方法として、例えばターゲット核酸鎖の末端の配列が既知の場合には、該ターゲット核酸鎖に含まれる配列部分を繰り返し配列導入用プライマーとして使用し、リング状の核酸を鋳型とする相補鎖合成により、繰り返し配列を導入することができる。ここで使用するリング状の核酸も、上記と同様に、繰り返し単位の配列からなる。
【0039】
あるいは、ターゲット核酸鎖の末端の配列が既知ではない場合には、繰り返し配列を導入するための別の方法として、ターゲット核酸鎖に付加した配列部分を繰り返し配列導入用プライマーとして使用し、リング状の核酸を鋳型とする相補鎖合成により、繰り返し配列を導入することができる。また、繰り返し配列を導入するために、ターゲット核酸鎖に付加した配列部分を繰り返し配列導入用プライマーとして使用し、該配列部分にハイブリダイズしかつライゲーションによりリング状の核酸を形成することができるオリゴヌクレオチドを用いて形成されたリング状の核酸を鋳型とする相補鎖合成を行うことも可能である。
【0040】
上記の方法で使用する繰り返し配列導入用プライマーは、例えばその少なくとも一部がターゲット核酸鎖の3'末端に付加した配列部分を利用するものである。また、ターミナルトランスフェラーゼにより、ターゲット核酸鎖の3'末端に、例えばポリA配列またはポリC配列などの配列部分を付加することができる。
【0041】
またさらに繰り返し配列を導入する方法として、ターゲット核酸鎖の3'末端に付加した配列部分の少なくとも一部にハイブリダイズするオリゴヌクレオチドを鋳型として相補鎖合成により得られた該配列部分の相補配列を繰り返し配列導入用プライマーとして使用し、リング状の核酸を鋳型とする相補鎖合成を行う方法を用いることができる。ここで、ターミナルトランスフェラーゼにより、ターゲット核酸鎖の3'末端に配列部分を付加することができる。この方法は、具体的には、ターゲット核酸鎖の3'末端に付加した配列部分に隣接する該ターゲット核酸鎖の3'末端側の配列部分と、付加した配列部分の全てまたは一部分とにハイブリダイズし、かつ既知配列を含むオリゴヌクレオチドを鋳型として相補鎖合成を行い、該ターゲット核酸鎖の3'末端に付加した配列部分の一部を必要に応じて除去し、続いてハイブリダイズしたオリゴヌクレオチドを鋳型として相補鎖合成により該ターゲット核酸鎖の3'末端側に付加された該既知配列を繰り返し配列導入用プライマーとして用いて、リング状核酸を鋳型として相補鎖合成を行うことにより、繰り返し配列を導入する。
【0042】
上記の方法において、ターゲット核酸鎖の3'末端に付加した配列部分の一部の除去は、該配列部分におけるオリゴヌクレオチドがハイブリダイズしていない部分の塩基を、1本鎖核酸を3'末端から分解する酵素、例えばエキソヌクレアーゼ(ExoI)などの酵素を用いて除去することにより行うことができる。
【0043】
また上述した繰り返し配列の導入の際に、ターゲット核酸鎖の3'末端に付加した、繰り返し配列導入用プライマーとして使用する配列部分は、制限酵素切断に続くオリゴヌクレオチドのライゲーションまたはオリゴヌクレオチドを鋳型とする相補鎖合成により生成することができる。
【0044】
あるいは、繰り返し配列導入用プライマーとして、ターゲット核酸鎖に含まれる既知配列部分を利用することも可能である。例えば、ターゲット核酸鎖の既知配列部分を切断して、得られるターゲット核酸鎖の3'末端を含む部分を繰り返し配列導入用プライマーとして使用することができる。この切断は、例えばCleavaseなどの酵素を用いて行うことができる。
【0045】
また別の方法として、ターゲット核酸鎖の既知配列部分にハイブリダイズし、かつ5'末端側にアンカー配列を有するオリゴヌクレオチドをターゲット核酸鎖にハイブリダイズさせ、該オリゴヌクレオチドを伸張する相補鎖合成を行って2本鎖核酸を生成し、1本鎖核酸を3'末端から分解する酵素を用いてターゲット核酸鎖の1本鎖部分を分解除去し、次いで該オリゴヌクレオチドのアンカー配列を鋳型としてターゲット核酸鎖の3'末端側を伸張する相補鎖合成によりターゲット核酸鎖に配列部分を付加して、繰り返し配列導入用のプライマーを生成することもできる。
【0046】
あるいは、ターゲット核酸鎖の既知配列部分にハイブリダイズし、かつ5'末端側にアンカー配列を有するオリゴヌクレオチドをターゲット核酸鎖にハイブリダイズさせ、該オリゴヌクレオチドを伸張する相補鎖合成を行って2本鎖核酸を生成し、ターゲット核酸鎖の1本鎖部分を除去し、次いで該オリゴヌクレオチドのアンカー配列を鋳型とした相補鎖合成によりターゲット核酸鎖の3'末端に既知配列部分を付加し、該オリゴヌクレオチドを除去することにより、繰り返し配列導入用のプライマーを生成することができる。
【0047】
また、繰り返し配列は、ターゲット核酸鎖の5'末端側にさらに導入してもよい。例えば、ターゲット核酸鎖の3'末端および5'末端に既知配列部分を付加し、ターゲット核酸鎖およびその相補核酸鎖の両方について3'末端の該既知配列部分を繰り返し配列導入用プライマーとして、該既知配列部分にハイブリダイズすることができるリング状のDNAを鋳型として用いて相補鎖合成を行うことにより、該3'末端および5'末端に繰り返し配列を導入することができる。
【0048】
続いて、ターゲット核酸鎖に導入された繰り返し配列にハイブリダイズするオリゴヌクレオチドを用いて、該繰り返し配列に複数のオリゴヌクレオチドをハイブリダイズさせ、同時に相補鎖合成を行う。
【0049】
相補鎖合成に使用するポリメラーゼとして、鋳型核酸の2本鎖部分をはがして相補鎖合成を行うタイプ(鎖置換型)のポリメラーゼを使用する。本発明において使用可能なポリメラーゼは、このような鎖置換活性を有するものであれば特に限定されるものではなく、例えばBst DNAポリメラーゼ(ラージフラグメント)、Bca(exo-)DNAポリメラーゼ、大腸菌DNAポリメラーゼIのクレノウフラグメント、Vent(Exo-)DNAポリメラーゼ(Vent DNAポリメラーゼからエクソヌクレアーゼ活性を除いたもの)、DeepVent(Exo-)DNAポリメラーゼ(DeepVent DNAポリメラーゼからエクソヌクレアーゼ活性を除いたもの)およびKOD DNAポリメラーゼ等が挙げられる。好ましくはBst DNAポリメラーゼ(ラージフラグメント)を使用する。Bst DNAポリメラーゼを用いる場合は、その反応至適温度である60〜65℃付近で反応を行うことが望ましい。
【0050】
このような鎖置換型ポリメラーゼを使用した場合、ターゲット核酸鎖の末端に繰り返し配列を導入してそれを鋳型として用いるが、繰り返し配列部分には複数のオリゴヌクレオチドがプライマーとしてハイブリダイズし、これらがほぼ同時に相補鎖合成を行う。例えば、ターゲット核酸鎖1分子につき、約100〜約100000個の、例えば約1000〜50000個のオリゴヌクレオチドをプライマーとしてハイブリダイズさせることができる。1つのプライマーから生成された核酸鎖が、それより下流にハイブリダイズした他のプライマーから生成された核酸鎖にまで伸張すると、それを引き剥がしながら相補鎖合成を続ける。この結果、ターゲット核酸鎖に近い位置にハイブリダイズしたプライマーを起点として合成された核酸鎖は次々に引き剥がされ1本鎖として遊離してくる。最後には鋳型となるターゲット核酸鎖の最も3'末端側にハイブリダイズしたプライマーが相補鎖合成を終えて2本鎖DNAを形成するが、より短い位置(3'末端から遠い位置)にハイブリダイズしたプライマーにより合成された核酸鎖は全て引き剥がされて1本鎖として遊離する。
【0051】
具体的な相補鎖合成ステップは、例えば以下のようにして行うことができる。1つの方法では、ターゲット核酸鎖に導入された繰り返し配列にハイブリダイズする第1のオリゴヌクレオチドをプライマーとして用いる相補鎖合成を行い、生成された相補核酸鎖を鋳型として、その3'末端にハイブリダイズする第2のオリゴヌクレオチドをプライマーとして用いて相補鎖合成を行い、ターゲット核酸鎖のコピーを増幅するステップを行う。また別の方法では、ターゲット核酸鎖に導入された繰り返し配列にハイブリダイズするオリゴヌクレオチドをプライマーとして用いる相補鎖合成を行い、得られた2本鎖核酸を1本鎖核酸とし、次いで該オリゴヌクレオチドをプライマーとして、生成された1本鎖核酸を鋳型として相補鎖合成を行うステップを繰り返す。
【0052】
ここで使用するオリゴヌクレオチドは、固体表面に固定してもよい。例えば、ターゲット核酸鎖に導入される繰り返し配列にハイブリダイズする第1のオリゴヌクレオチドを固体表面に固定してもよいし、あるいは最初の相補鎖合成により生成された相補核酸鎖にハイブリダイズする第2のオリゴヌクレオチドを固体表面に固定してもよいし、あるいは少なくとも2種のオリゴヌクレオチド(例えば第1および第2のオリゴヌクレオチド)を同じまたは異なる固体表面に固定してもよい。例えば第2のオリゴヌクレオチドを固体表面に固定する場合には、ターゲット核酸鎖に導入される繰り返し配列にハイブリダイズする第1のオリゴヌクレオチドを用いて生成された相補核酸鎖を、固体表面に固定した第2のオリゴヌクレオチドを用いて捕獲し、第2のオリゴヌクレオチドをプライマーとして相補鎖合成を行う。ここで使用する固体は、上述したような核酸の操作に一般的に使用される固体であれば任意の固体を使用することができ、また固体とオリゴヌクレオチドとの結合も上述したように行うことができる。
【0053】
また本発明の方法は、例えば、ターゲット核酸鎖に相補的な配列と5'末端に第1のアンカー配列とを有するキャプチャープローブを用いてターゲット核酸鎖を鋳型として相補鎖合成するステップ、生成した相補核酸鎖を1本鎖とするステップ、1本鎖相補核酸鎖にハイブリダイズする第1のオリゴヌクレオチドを用いて相補鎖合成を行い、第1のオリゴヌクレオチドが伸張した3'末端側に第1のアンカー配列に基づく既知配列部分を導入するステップ、該既知配列部分をプライマーとしてリング状の核酸鎖にハイブリダイズさせて相補鎖合成を行い、3'末端側に第1の繰り返し配列が導入された相補核酸鎖を生成するステップ、ならびに第1の繰り返し配列に複数の第2のオリゴヌクレオチドをハイブリダイズさせて、同時並行的に相補鎖合成するステップによって行うことができる。この方法では、第1のオリゴヌクレオチドの5'末端側に第2のアンカー配列を含有させることによって、第1の繰り返し配列にハイブリダイズする第2のオリゴヌクレオチドをプライマーとして相補鎖合成した相補鎖の3'末端側に第2のアンカー配列に基づく既知配列部分を導入し、該既知配列部分をプライマーとして使用して、リング状の核酸を鋳型として相補鎖合成を行い、3'末端側に第2の繰り返し配列が導入された相補核酸鎖を生成するステップをさらに行うことができ、この第2の繰り返し配列からも同時並行的に相補鎖合成を行うことができる。
【0054】
上記の相補鎖合成においては、導入した繰り返し配列の長さがターゲット核酸鎖の種類または配列によって異なることなく、ほぼ一定であるため、ターゲット核酸鎖の種類または配列にかかわらず均一な増幅が可能となる。また、短時間で高増幅率で増幅を行うことができる。この増幅プロセスは、増幅効率に優れた線形増幅と熱サイクルなどを併用することによって、さらに増幅率を高めることも可能である。例えば、相補鎖合成の際に、ターゲット配列またはその相補配列を含み、3'末端に繰り返し配列を有し、かつ5'末端にループ配列(すなわち2本鎖を形成しない1本鎖の配列部分)を有するターゲット核酸鎖を生成するステップを行うことによって、増幅されたターゲット核酸鎖のループ配列にハイブリダイズするオリゴヌクレオチドを用いて、さらにループ配列から2本鎖のターゲット核酸鎖を引き剥がしながら相補鎖合成を繰り返すことができる。また例えば、相補鎖合成によって生成される2本鎖核酸に切断部(ニック)を導入することによって、その切断部(ニック)から2本鎖核酸を引き剥がしながら相補鎖合成を繰り返すことができる。切断部(ニック)は、ある認識配列を認識して2本鎖のうち1本鎖を切断する酵素(例えばN.BstNBIなど)を用いることによって、相補鎖合成時にその認識配列が2本鎖核酸に導入されるようにプライマーとして使用するオリゴヌクレオチドを設計して、相補鎖合成により該認識配列を2本鎖核酸に導入し、上記酵素を反応させることによって、切断部を形成することができる。
【0055】
また、上記の反応で増幅されたターゲット核酸鎖またはその相補鎖には、繰り返し配列が導入されているが、これは繰り返し配列の前または後ろに制限酵素切断認識配列が導入されるように相補鎖合成を行うことによって、生成される相補核酸鎖から制限酵素を用いて繰り返し配列を切断除去することができる。例えば、繰り返し配列の繰り返し単位中にそのような制限酵素切断認識配列を入れておくことが好ましい。
【0056】
以上の方法により、非常に短時間で高い増幅率での核酸増幅が可能となる。この方法は、均一増幅が必要とされる遺伝子発現解析(定量解析)や高効率の核酸増幅が必要な感染症を始めとする病気の診断検査に有効に使用される。
【0057】
そのような用途の一例として、本発明は、上記の増幅方法を利用して、サンプル中の核酸を増幅し、その増幅産物を検出することによって、サンプル中の核酸を検出する方法に関する。
【0058】
サンプルは、検出が望まれる核酸を含む生体由来サンプルであれば特に限定されるものではなく、細胞サンプル、組織サンプル、液体サンプルなどの任意のサンプルを用いることができる。またサンプルの由来となる生体も特に限定されるものではなく、脊椎動物(例えば哺乳類、鳥類、爬虫類、魚類、両生類など)、無脊椎動物(例えば昆虫、線虫、甲殻類など)、原生生物、植物、真菌、細菌、ウイルスなどの任意の生体に由来するサンプルを用いることができる。サンプルからの核酸の調製は、上述したように実施することができる。
【0059】
続いて、サンプル由来の核酸を、上述した増幅反応に従って増幅する。ここで、サンプル中の全ての核酸を増幅してもよいし、あるいは検出対象の核酸のみを増幅してもよい。
【0060】
検出対象の核酸が存在するか否かを検出するには、得られる増幅産物を特異的に認識することができる公知の手段を用いることができる。例えば、増幅反応時にプライマーとして使用するオリゴヌクレオチドを標識し、得られる増幅産物を検出対象の核酸に特異的なプローブとハイブリダイズさせ、標識を利用してそのハイブリダイゼーションを検出することによって、対象の核酸を検出することができる。あるいは、得られる増幅産物を、検出対象の核酸に特異的な標識プローブとハイブリダイズさせ、標識を利用してそのハイブリダイゼーションを検出することによって、対象の核酸を検出することができる。あるいは、モレキュラービーコンなどのターゲット配列が存在する場合には蛍光を発するプローブが知られており、このようなプローブと特異的にハイブリダイズする増幅産物を蛍光に基づいて検出することによって、対象の核酸を検出することができる。
【0061】
このようなハイブリダイゼーション反応は、当技術分野で公知であり、ストリンジェントな条件下にて核酸を特異的に結合させる反応であり、その条件なども公知である。ハイブリダイゼーションを行う場合、サンプル由来の核酸の増幅産物を適当な固体表面(スライドグラス、メンブラン、マイクロタイタープレート等)に固定してもよいし、あるいはプローブを適当な固体表面に固定してもよい。いずれかを固定した場合には、ハイブリダイズしていない核酸などを洗浄によって簡便に除去することができる。
【0062】
あるいは、増幅方法においてサンプルに含まれる検出対象の核酸のみを増幅する場合には、増幅産物が得られるか否かによって対象の核酸を検出することができ、例えば増幅反応時にプライマーとして使用するオリゴヌクレオチドを標識したり、相補鎖合成時に使用する基質(塩基)を標識することによって、得られる増幅産物に標識を取り込ませ、その標識に基づいて増幅産物の有無を検出することができる。
【0063】
標識は、任意の標識でよく、放射性同位体、蛍光物質、発光物質、酵素、ビオチン標識などを用いることができる。放射性同位体としては、32P、125I、35Sなどを用いることができる。また蛍光物質としては、例えば、フルオレセインイソチオシアネート(FITC)、スルホローダミン(SR)、テトラメチルローダミン(TRITC)などを用いることができる。また発光物質としてはルシフェリンなどを用いることができる。酵素としては、βガラクトシダーゼなどを用いることができる。これら標識体の種類や標識体の導入方法等に関しては、特に制限されることはなく、従来公知の各種手段を用いることができる。例えば標識体の導入方法としては、放射性同位体を用いるランダムプライム法が挙げられる。
【0064】
標識に基づく検出は、上述した標識体を検出するための当技術分野で公知の方法であればいずれの方法でもよい。例えば、標識体として放射性同位体を用いた場合には、放射活性を、例えば液体シンチレーションカウンター、γ-カウンターなどにより計測することができる。また標識体として蛍光を用いた場合には、その蛍光を蛍光顕微鏡、蛍光プレートリーダーなどを用いて検出することができる。標識が検出された場合には、サンプル中に検出対象の核酸が存在することとなる。
【0065】
また、標識の濃度を指標とすることにより、定量的な検出も可能となる。標識プローブを用いた検出方法の例としては、サザンハイブリダイゼーション法、ノーザンハイブリダイゼーション法等を挙げることができる。
【0066】
また、上述した増幅方法において、その増幅率が高い場合には、濁度測定を行うことによって、検出対象の核酸の有無を知ることもできる。
【0067】
さらに、得られる増幅産物を小分けにして、検出対象の核酸の発現をリアルタイムPCR(Taqman)などにより定量分析することもできる。
【0068】
本発明の核酸増幅方法は、核酸の均一増幅、特に1つの細胞から得られる僅かなmRNAをcDNAに変換してそれらを均一にバイアスなく増幅する方法として優れており、さらに増幅操作を繰り返すことで短時間に多くの核酸コピーが得られるので、感染症検査などで要求されるDNAの迅速検査にも有効である。
【0069】
以下、本発明を実施例によりさらに具体的に説明する。ただし、以下の実施例は、本発明を限定するものではない。
【実施例】
【0070】
[実施例1]繰り返し配列の導入のためにターゲットcDNAの末端に既知配列を付加する方法
本実施例は、1細胞由来のcDNAライブラリーに含まれるcDNAを一括して均一増幅する例である。方法の概略を図1−1に示した。文献(Nature Method 6, 503-506(2009))に従って、アンカー配列およびポリT配列からなるプローブを固定した磁気ビーズを用いてcDNAライブラリーを作製する。すなわち、図1−1の(1)に示すように、アンカー配列1とポリT配列からなるmRNAキャプチャープローブを表面に固定した直径1μmのダイナビーズを用いてmRNAをキャプチャーし、続いてcDNA合成を行い、cDNAの5'末端側がビーズに固定されたcDNAライブラリーを得る。ここではポリT配列として、その途中に5塩基置きにG塩基を3箇所挿入した配列を用いた。これは後に、cDNAを鋳型として相補鎖合成する際にポリT配列の相補鎖合成を行いやすくするためにTmを高くする目的で導入した。このポリT配列部分のcDNA合成は温度が充分に低く問題なく進行するが、後のステップで行うこれを鋳型とする相補鎖合成では温度が少し高くなり、Tmの低い部分の2本鎖DNAが乖離したりして相補鎖合成の中断が起こるのを避けることができる。
【0071】
cDNA合成後に、洗浄して余分な試薬などを除去した後、3'末端に既知配列を付加する。この方法としてターミナルトランスフェラーゼを用いてポリAまたはポリCなどの配列を付加する方法や、3'側の3塩基が突出した形の2本鎖オリゴマーを末端にハイブリダイズさせ、オリゴマーを相補鎖合成し、続いてライゲーションにより3'末端に既知配列を付加する方法がある。また、制限酵素で切断した切断末端にライゲーションで既知配列を有するオリゴマーを結合して既知配列を付加する方法などもある。ここではターゲットDNAの末端にポリC配列を付加し、次いで3塩基ランダム配列を3'末端に有し、続いて4塩基からなるG配列とアンカー配列2を有するランダムプライマーを用いて末端に既知配列を付加する方法を用いた例で説明する。ここでは3塩基からなるランダム配列の混合物(全て合わせると64種類であるが3塩基目はG塩基以外とすることができるので48種)からなるプライマーを用いた。ランダム配列部分を長くしてGGGG配列をGGGに変更するなども可能である。他の方法も同様に利用できるのでこの限りでない。
【0072】
本実施例では、図1−1の(2)に示すようにターミナルトランスフェラーゼを用いて5〜10個のC塩基(図1−1ではCCCCCCC)が末端に付加した例を示した。続いて、図1−1の(3)に示すように、プライマーは、cDNAにおけるランダム配列およびそれに続くCCCC部分とハイブリダイズし、相補鎖合成を行う。次いで、図1−1の(4)に示すように、エキソヌクレアーゼ(ExoI酵素:3'末端から1本鎖を切断する酵素)を反応液中に添加し、cDNAの3'末端側の1本鎖部分を切断して除去する。1本鎖部分を除去するとターゲットcDNAの3'末端はアンカー配列2を有するDNA鎖にハイブリダイズした形となり、これを鋳型として相補鎖合成可能となるので、図1−1の(5)に示すようにターゲットcDNAの末端にアンカー配列2に相補的な配列を付加することができる。この部分は、後の反応においてリングDNAを鋳型とする相補鎖合成でプライマーP1-1として機能する部分である。なお、mRNAからcDNAを生成するときにターミナルトランスフェラーゼ活性のあるMoloney Murine Leukemia Virus由来の逆転写酵素(例えば、SuperScriptII)を用いると、末端に3塩基程度のCCCを導入することができるので都合がよい。この場合にはアンカー配列部分に相補鎖がハイブリダイズした2本鎖DNAをライゲーション反応によりターゲットcDNAの末端に導入することによって、既知配列を付加することができる。
【0073】
ここで、ターゲットcDNAは磁気ビーズに固定した形で得ると、精製には都合がよい。末端に既知配列プライマーP1-1を導入した後に磁気ビーズに捕獲されたcDNAを残して余分な共存物を除去する(図1−1の(6))。次に、図1−1の(7)に示すように、ターゲットcDNAに、70塩基程度の1本鎖DNAからなるリングDNA、核酸基質、鎖置換型DNAポリメラーゼ(例えば、Bst DNAポリメラーゼ、φ29DNAポリメラーゼ)などを加えて相補鎖合成を行う。ここではおよそ30℃で動作するφ29DNAポリメラーゼを使用している。リングDNAのサイズは小さいほうが増幅上有利であり、ターゲットDNAの長さよりもはるかに短い配列からなるリングDNAを通常は用いる。リングDNAの構成は、図1−2に示すように、プライマーP1-1がハイブリダイズする領域(約20塩基)、制限酵素切断認識配列、第2のプライマーP1-2が生成するDNA鎖にハイブリダイズするプライミングサイト1-2を作るためのプライマーP1-2と相同配列を有する領域、および予備のプライミングサイト1-4を含むものである。図1−1の(8)における矢印は参考までに3'側を示す。プライマーP1-2は逆向きにハイブリダイズして矢印とは反対方向に伸張する。制限酵素切断認識配列の配列はできる限りmRNAなどに存在しない配列としたほうがよく、認識配列の長いレアカッター制限酵素による認識配列を使用することが好ましい。このようなレアカッター制限酵素として、6塩基認識酵素Bam HI(認識配列5'-G|GATCC---3')または8塩基認識酵素Sda I(認識配列5'---CCTGCA|GG---3')などがあるが、この限りでない。
【0074】
導入される繰り返し配列の数は目的にもよるが、単に均一に全てのターゲットDNAを増幅してコピーを増やした後、溶液を分割して定量PCRを行うような場合には、数百程度の繰り返し配列の単位が導入できればよい。一方、大きな増幅率を達成することが望ましい場合には、導入する繰り返し配列の単位は数千以上とすることが好ましい。さらに3'および5'の両末端に繰り返し配列を導入したり、増幅操作を繰り返したりすることによって、繰り返し配列の導入単位数を増加させることができる。
【0075】
ここでは繰り返し配列を導入するためのリングDNAを鋳型とする相補鎖合成を5分間行った(図1−1の(7))。リングDNAを鋳型とする相補鎖合成は全てのターゲットcDNAについてcDNAの配列の如何にかかわらず同じリング配列の相補鎖を合成するように進む。一定時間でターゲットcDNAの末端に導入される繰り返し配列の長さはcDNAの種類によらずほぼ同じである。DNA相補鎖合成のスピードは1秒間に50〜300塩基程度であるので5分間で数百〜千個の繰り返し配列単位を導入することができる。相補鎖合成による繰り返し配列導入終了後、リングDNAを除去してリングDNAの相補鎖からなる繰り返し配列部分(プライマーP1-1の配列、制限酵素切断認識配列、プライミングサイト1-2の配列および予備のプライミングサイト1-4の配列からなる)のプライミングサイト1-2にハイブリダイズするプライマーP1-2を加えて相補鎖合成を行う(図1−1の(8))。プライマーP1-2は1つのターゲットcDNAに導入した繰り返し配列におよそ1000個がハイブリダイズして同時並行的に相補鎖合成を行う。10分ほど相補鎖合成を行うと繰り返し配列部分の最も3'末端側にハイブリダイズしたプライマーP1-2からの相補鎖合成が終了し、それよりもターゲットcDNA側(5'末端側)にハイブリダイズしたプライマーP1-2から生成した相補鎖は引き剥がされ、1本鎖状態で液中に遊離する(図1−1の(9))。ここではターゲットcDNAを作製する際にアンカー配列1およびポリT配列を有するキャプチャープローブを用いたため(図1−1の(1))、生成した相補鎖にも同じ配列が含まれることになり、そのためこれをビーズ上に固定化された余剰のキャプチャープローブで捕獲することができる。また、捕獲後、キャプチャープローブが相補鎖を鋳型として伸長するためビーズの表面に2本鎖状態で保持される(図1−1の(10))。以上の操作により、約1000倍に増幅されたcDNAライブラリーがビーズ表面に保持された状態となる。
【0076】
この状態で、制限酵素を用いて余分な配列(例えば導入した繰り返し配列など)を切断除去して、ターゲットcDNAにハイブリダイズした相補鎖を種々の測定に活用してもよいが、さらにコピー数を増やすには、熱サイクルに供して相補鎖合成を繰り返す。このプロセス1回に付き、約5分で1000倍の増幅を行うことができるので、2回の相補鎖合成プロセスで1000×1000/2=0.5×106のコピー増幅が行える。さらに、熱サイクルで3回の相補鎖合成を行えば、約108のコピー増幅が実現できる。これだけの増幅を行う場合にも、熱乖離およびアニーリングの時間を加えて所要時間は30分以下であり、効率よく、しかも複数のDNAを同時並行的にかつ均一に増幅することができる。
【0077】
この実施例ではあらかじめ用意された既知配列を有するリングDNAを鋳型にしてローリングサークル増幅(RCA)反応を行い、リングDNAを除去後にプライマーP1-2を加えて再度相補鎖合成を行ったが、最初からプライマーP1-2を反応系に加えておき、ターゲットcDNAの末端に繰り返し配列を導入すると同時にプライマーP1-2からの相補鎖合成を同時進行させてもよい。この場合にはリングDNAの量は0.1〜1pmole程度でよいが、第2のプライマーP1-2の量は数〜10pmoleとするとよい。また、あらかじめリングDNAを準備して用いたが、ターゲットcDNA末端部のプライマーP1-1部分に3'末端および5'末端がハイブリダイズするプローブを用いてハイブリダイズさせた後でライゲーションによりリングDNAを形成させてもよい。また、ここではターミナルトランスフェラーゼで付加した配列部分に続くオリゴマーを導入してプライマー配列としたが、ターミナルトランスフェラーゼで導入した配列部分をプライマーP1-2(繰り返し配列を導入するためのプライマー)としてもよい。
【0078】
この方法は多くの種類のDNAを含む試料を同時に均一に増幅できるので、種々の計測方法と組み合わせた定量分析などに有効である。
【0079】
[実施例2]Cleavaseを用いる方法
実施例1では、種々DNA断片からなるDNAプール(cDNAライブラリーを含む)の全てのDNAを均一に増幅する方法を開示したが、ここでは特定の複数種のDNAを均一に増幅する方法を開示する。もちろん単一のDNA増幅に適用することも可能である。
【0080】
本実施例の概要を図2−1に示した。試料としてcDNAライブラリーを再び用いる。cDNAライブラリーは作製過程でmRNAの最後まで相補鎖合成できたものと途中で相補鎖合成が止まってしまったものとが含まれており、同じmRNA由来でも種々の長さのcDNAが含まれることがある(図2−1の(1))。このため、末端配列を既知配列を有するものとして扱うことができない。ただし、対象となるcDNA群は、個々のcDNAのcDNA合成がどこまで進んでいるかは不明であるが、全体の配列は既知であるのでこれを利用する。ここでは10種の遺伝子に注目してこれらを均一に増幅する例を開示する。cDNA合成は通常500塩基位までは障害なく相補鎖合成されることが多いので、cDNAライブラリーのポリT部位から500塩基以内の部分に特異的な配列を選び、そこにハイブリダイズするプローブP2-1を作製する。プローブP2-1はターゲットcDNAにハイブリダイズする配列部分とアンカー配列部分からなる。アンカー配列部分は自己ハイブリダイゼーションしてループ構造を形成し、ターゲットcDNAに1塩基部位でのみ3重鎖となってハイブリダイズするように設計されている(図2−1の(2))。
【0081】
1本鎖cDNAを含む溶液に、対象となる複数の遺伝子に対するプローブP2-1(対象となる遺伝子の数だけ異なるプローブP2-1が必要)を加えてターゲットcDNAにハイブリダイズさせる。ついで切断酵素Cleavaseを加えてプローブP2-1がターゲットcDNAと3重鎖を形成した部位を切断する(図2−1の(3))。この反応は遺伝子検査などで使われるインベーダーアッセイで用いられる酵素切断反応と同じである。切断されたcDNA断片のうちビーズに固定された側の断片を回収して使用する。切断部位に続く配列はmRNAデータベースを参照して既知であり、ここにハイブリダイズするアンカー配列(既知配列)付きのオリゴマー(プローブP2-2)を使用して既知配列を導入する(図2−1の(4))。すなわちこのプロセスでターゲットcDNA種にだけ既知配列を導入することができる。もちろんターゲットcDNAの配列の一部をプライマーとして用いてリングDNAを鋳型として増幅反応を行って繰り返し配列を導入してもよいが、この場合にはリングDNAの配列の中に対応する遺伝子の数だけ配列の異なるプライミングサイトを作る必要がある。ここではプローブP2-2のアンカー配列部分に相補的な配列をまず相補鎖合成により合成し、この部分を繰り返し配列導入用のプライマーとして用いる。図2−1の(5)に示すように、この配列部分をプライマーとしてリングDNAを鋳型として用いて相補鎖合成を行い、cDNAの3'末端に繰り返し配列を実施例1と同様に導入した。この繰り返し部分にハイブリダイズするプローブP2-3を用いて実施例1で述べたようにターゲットcDNAを均一に増幅することができる。増幅産物は実施例1と同様にcDNAを固定したビーズにより回収できる。増幅産物をcDNAライブラリーが固定されたビーズと異なるビーズなどに固定して取り出すかあるいは溶液状態で取り出すことが望ましい場合には、ビーズに固定されたアンカー配列とポリT配列からなるキャプチャープローブ(mRNAを捕獲するのに用いたもの)と同じ配列を有しかつ固定されていないプローブP2-4を加えておけば、遊離してきた合成相補鎖はプローブP2-4にハイブリダイズして固定されない2本鎖を生成するので、これを回収することができる。このとき、プローブP2-4としてビオチン付きのプローブを用いると生成したDNA鎖の回収を容易に行うことができる。
【0082】
本実施例では、Cleavaseによる切断に続いて既知配列を有するプローブP2-2をターゲットcDNAの末端にハイブリダイズさせて相補鎖合成により既知配列を付加したが、切断末端部位の配列が既知であることを利用してこの部分がリングDNAにハイブリダイズするように設計してもよい。この場合、リングDNAはターゲットの種類と同じだけ必要なことになるが、リングDNA内に複数種のターゲットcDNAに対応したプライミングサイトを導入して1種類のリングDNAで済ませることもできる。この場合には、リングDNAには上記プライミングサイトに加えて、制限酵素切断認識配列、および相補鎖合成のためのプライミングサイト群(プライマーP2-3と相同配列領域と予備のプライミングサイト2-5領域)が含まれることになる(図2−2)。
【0083】
対象とする遺伝子の種類が多い場合にはこのプロセスを繰り返し行ってもよいが、一度に行ったほうが増幅率の均一度は高くなる。
【0084】
このように対象とするDNAを鋳型として相補鎖合成するときのプライミングサイトをRCA反応により多数導入した後に各プライミングサイトから一斉に相補鎖合成を並列的に行うことで、均一な効率のよい増幅を実現できる。対象となったDNAと同じ配列が必要な場合には、合成された相補鎖を鋳型として再度相補鎖合成することで対応できる。
【0085】
上記実施例ではターゲットDNAの既知配列部分にハイブリダイズするループ状のプローブとCleavaseを用いてターゲットDNAを配列既知の部分で切断して末端部分を既知配列とし、次いでここにアンカー付きのプローブをハイブリダイズさせて相補鎖合成を行い、末端に共通の既知配列を導入した。別の実施例として、ターゲットDNAにアンカー付きのプローブをまずハイブリダイズさせ、相補鎖合成を行って安定な2重鎖を形成し、エキソヌクレアーゼ(ExoIなど)のような3'末端から1本鎖DNAを切断する酵素を用いる例がある。ターゲットDNAは5'末端を固定されており、3'末端側が1本鎖状態の場合にはその1本鎖部分が分解除去される。すなわち、アンカー付きのプローブP2-2をターゲットcDNAにハイブリダイズさせ、相補鎖合成により2本鎖部分を安定化させた後、残った3'末端を含むターゲットcDNA鎖を3'末端側から2本鎖部分まで分解して、相補鎖合成によりプライマーP2-1の配列を導入することもできる。
【0086】
[実施例3]
実施例1および2は、ターゲットとなるcDNAの3'末端に繰り返し配列を導入してプライミング領域とし、ターゲットDNAの5'末端までの全領域を増幅したが、本実施例ではターゲットDNAの特定の領域を増幅する方法を開示する。これはターゲットとなるDNAが非常に長い場合などに有利である。また、ターゲットDNAから増幅対象のターゲット配列を含む短いDNAを作製するが、このDNAの両末端に既知配列を導入してこれをプライマーとして両末端に繰り返し配列を導入して多数のプライミングサイトを作り、これら多数のプライミングサイトからの相補鎖合成により増幅率を大幅に上げる技術についても開示する。
【0087】
概要を図3−1に示した。まずターゲットDNAの増幅領域をはさんでターゲットDNAおよびその相補鎖DNAにハイブリダイズするアンカー配列3-1a付きのプライマーP3-1およびアンカー配列3-2a付きのプライマーP3-2とその外側にハイブリダイズするプライマーP3-3とP3-4を用意する。ターゲットは2本鎖DNAでもよいがここでは1本鎖のcDNAとする。プライマーP3-1およびプライマーP3-3の量はそれぞれ1pmolおよび0.2pmolとした。プライマーP3-3の量を少なくしたのはターゲットDNAにプライマーP3-1がより速やかにハイブリダイズするようにするためである。これらプライマーはターゲットDNAの種類だけ用意するがアンカー配列部分3-1aは共通である。
【0088】
図3−1の(1)に示すように、プライマーP3-1およびプライマーP3-3はターゲットDNAにハイブリダイズして相補鎖合成を行う。プライマーP3-3は、プライマーP3-1が生成するDNA鎖(DNA3-1)をはがしながら相補鎖合成を行い、プライマーP3-1を起点とした相補鎖(DNA3-1)を1本鎖として遊離する役割を果たす(図3−1の(2))。図3−1の(3)に示すように、1本鎖として遊離してきた相補鎖DNA3-1にはプライマーP3-2とプライマーP3-4がハイブリダイズして相補鎖合成を行う。プライマーP3-4は、プライマーP3-3と同様にプライマーP3-2を起点として生成したDNA鎖(DNA3-2)を1本鎖として遊離させる役割を果たす(図3−1の(4))。
【0089】
このようにしてできたプライマーP3-2を起点とする1本鎖DNA(DNA3-2)の3'末端にはアンカー配列3-1aと相補的な配列(「プライマー配列P3-1ac」という)が付加されている。このプライマーP3-1acがハイブリダイズするのはプライマーP3-1のアンカー配列3-1aである。そこで、図3−1の(5)に示すように、これと同じ配列を含むリングDNA3-1をあらかじめ反応液中に加えておく。リングDNA3-1の配列には、アンカー配列3-1aに加えて、DNA3-2に相補的な鎖を合成するときに用いるプライマーP3-5の配列および制限酵素切断認識配列を入れておく。遊離したプライマーP3-2を起点とするDNA鎖(DNA3-2)は、このリングDNA3-1に3'末端がハイブリダイズして相補鎖合成を行い、繰り返し配列を3'末端に導入する(図3−1の(6))。繰り返し配列にはプライマーP3-5がハイブリダイズする配列が繰り返し現れるので、反応系にプライマーP3-5を加えておくと相補鎖合成がいっせいに起こり、DNA3-1と同じ配列を含みかつ繰り返し配列を有する多くのDNA鎖(DNA3-5)が合成され、遊離してくる(図3−1の(7))。この遊離したDNA鎖(DNA3-5)の末端はアンカー配列3-2aに相補的である。そのため、図3−1の(8)に示されるように、アンカー配列3-2aを有するリングDNA3-2を加えておくと、DNA3-5はこれにハイブリダイズしてプライマー(P3-6)として機能し、第2の繰り返し配列を合成DNA鎖(DNA3-5)に付加する(図3−1の(9))。リングDNA3-2にはリングDNA3-1と同様にプライマーP3-5の配列をあらかじめ入れておく。するとプライマーP3-5がハイブリダイズするプライミングサイトがDNA3-5にも作製されるので相補鎖合成がさらに進み、DNA3-5に相補的な配列を有するDNA3-5cが生成する(図3−1の(10))。このDNA3-5cにはプライマーP3-5のプライミングサイトが含まれることになるので、これを鋳型として次々に合成DNA鎖が生成することになる。
【0090】
このようにプライマーP3-5を起点とし、DNA3-2配列あるいはその相補配列を含み、3'末端に繰り返し配列を有するDNA(DNA3-5およびDNA3-5c)が次々に生成する(図3−1の(10)〜(12))。この反応は繰り返され、非常に短時間にDNAの増幅が行われる。なお、両末端に繰り返し配列を導入した場合の増幅率は片側(例えば3'末端)の場合をn倍とすると両末端の反応が進行するごとにほぼn倍ずつ増えていく。さらに生成した2本鎖DNA群を含む反応液を昇温し、1本鎖とした後に再度上述した反応を繰り返す(熱サイクル反応)と10〜20分の短時間に1010倍以上の増幅率を得ることも可能である。これは感染症の診断など短時間に大きなDNA増幅が必要な用途には重要な利点である。
【0091】
上記の実施例の変形として、以下の方法によっても本発明を実施することができる(図3−2)。
【0092】
対象とするのはmRNAから作製したcDNAライブラリーなど5'末端に既知配列を有するDNA群である。cDNAを例として説明する。図3−2の(1)に示すように、mRNAをビーズに固定したキャプチャープローブ(アンカー配列+ポリT配列を有するものまたはそのポリT配列の一部にG塩基を混入させた配列を有するもの)で捕獲し、キャプチャー配列を有するcDNAを作製する。もちろん固定されたプローブでなく、浮遊プローブを用いてもよい。
【0093】
ターゲットcDNAにハイブリダイズしかつアンカー配列3-01aを有するプライマーP3-01をターゲットの種類分だけ用意する。このプライマーP3-01は実施例2におけるプライマーP2-2と同じものでもよい。図3−2の(2)に示すように、これをターゲットcDNAにハイブリダイズさせ相補鎖合成を行う。合成したDNA鎖の3'末端にはキャプチャープローブに相補的な配列ができる。相補鎖合成の後、温度を上げて2本鎖DNAを1本鎖に乖離して上澄み液を採取する(図3−2の(3))。ここで、cDNA作製時に固定プローブではなく浮遊プローブを用いたときには、本実施例のプローブP3-3に相当するプローブを反応系に添加し、合成されたDNAを鋳型DNAから遊離させることができる。
【0094】
図3−2の(4)に示すように、この溶液中にキャプチャープローブのアンカー配列と同じ配列を有するリングDNA3-01とφ29DNAポリメラーゼを加えて相補鎖合成を行う。最初の反応で合成された相補鎖DNA(DNA3-01)の3'末端はキャプチャー配列を含むのでリングDNA3-01にハイブリダイズする。この結果、RCA反応が起こり、プライミングサイト配列3-02を多数持つ相補鎖が生成する(図3−2の(5))。このとき、プライミングサイト3-02にハイブリダイズするプライマーP3-02を加えると、これはRCAで合成されたDNA3-01に繰り返し現れるプライミングサイト配列(3-02)にハイブリダイズして相補鎖合成を開始するので、ターゲットcDNAと同じ配列のDNAコピー(DNA3-02)を多数得ることができる(図3−2の(6))。このDNA3-02は、3'末端にアンカー配列3-01aに相補的な配列(3-01ac)を有しており、ここにハイブリダイズするリングDNA3-02を用意しておけば末端に第2の繰り返し配列が導入されるのでさらに増幅率を上げることができる(図3−2の(7)〜(9))。得られるDNAには繰り返し配列部分が導入されているが、リングDNAに制限酵素切断認識配列を入れておき、実施例1と同様に2本鎖を形成してこの部分を制限酵素で切断除去することが可能である。
【0095】
また、リングDNAにプライミングサイトを複数入れると1つの繰り返し配列の中に複数のプライミングサイトができることになり、その分だけさらに増幅率を上げることができる。特に両側に繰り返し配列を導入する方法では、繰り返し配列の単位数の2乗または3乗で増幅されるので増幅率は大きくなる。
【0096】
[実施例4]
本実施例は、増幅の対象となるDNA配列部分の5'末端側にループ配列を導入すると共に、3'末端側に繰り返し配列を導入した場合の例である。図4−1に概要を示した。3'末端に繰り返し配列を導入する方法には、末端に既知配列を導入し、これをプライマーとしてあらかじめ用意されたリングDNAを鋳型として相補鎖合成により導入する方法や、あらかじめリングDNAを用いて繰り返し配列を有するDNA鎖を合成しておいてこれを鋳型として相補鎖合成する方法がある。もちろんこのような繰り返し配列を有するDNA鎖をライゲーションによりターゲットDNAに結合してもよい。ここではループ配列を有するプライマーを用いて相補鎖合成により増幅しようとする配列を含んだDNA断片を作製し、その末端にある既知配列を利用してリングDNAを鋳型にして繰り返し配列を導入する例を開示する。また、増幅しようとするターゲットDNAの5'末端にはループ配列が連結されているが、これもループ配列をアンカー配列として有するプローブをターゲットDNAにハイブリダイズし、相補鎖合成を行うことにより図4−1に示したように容易にループ配列を連結することができる。また、mRNAからcDNAを合成して得た試料ではmRNAをキャプチャーするプローブの末端にループ配列を入れておくことも可能である。
【0097】
ここでは、図4−1の(1)および(2)に示すように、ターゲットDNAにアンカー配列を有するプローブP4-1およびその外側にハイブリダイズするプローブP4-3を用いて鎖置換型の相補鎖合成を行い、前記アンカー配列を有するプローブP4-1を起点としたDNA鎖(DNA4-1)を遊離させることからスタートする。アンカー配列4-1aは、後述する反応で使用する、鋳型となるリングDNA4-1にも同じ配列が含まれており、ローリングサークル増幅(RCA)反応で繰り返し配列を導入するために使用される。この相補鎖DNA4-1にループ配列4-2loopを有するプライマーP4-2をハイブリダイズさせて再度相補鎖合成を行い(図4−1の(3))、ターゲットDNAと同じ配列を有し、そして3'末端にはリングDNA4-1にハイブリダイズするプライマー配列4-1ac(アンカー配列4-1aの相補配列)を有し、かつ5'末端にはループ配列4-2loopを有する鋳型DNA4-2を作る(図4−1の(4))。これが増幅用の鋳型DNAとなる。ターゲットDNAの種類は複数でもよく、その種類に応じてターゲットDNAにハイブリダイズする部分の配列は異なるが、アンカー配列およびループ配列は同じものを用いる。mRNAからcDNAを合成して用いる場合にはキャプチャープローブにループ配列を付加したものを使用すれば以後の操作は同じである。ループ配列のTmは鎖置換型相補鎖合成の最適温度と同じかまたは少し低い温度に設計するのが好ましい。この部分の相補鎖合成が行われると高い確率でループ配列となり、合成された相補鎖が自己を鋳型として相補鎖合成を行うように設計する。
【0098】
図4−1は、本実施例によるDNA増幅の概要を示したものである。図4−1の(1)に示すように、ターゲットDNAにアンカー配列4-1aを有するプローブP4-1およびその外側にプローブP4-3をハイブリダイズさせて鎖置換型DNAポリメラーゼ(φ29あるいはBstポリメラーゼなど)を用いて相補鎖合成を行う。プローブP4-3を起点として生成した相補鎖はプローブP4-1を起点として合成されたDNA相補鎖(DNA4-1)を引き剥がす役割をする。結果として、図4−1の(2)に示すように1本鎖DNA4-1が遊離してくる。このDNA4-1にハイブリダイズする配列とループ配列4-2loopを有するプローブP4-2とプローブP4-4をDNA4-1にハイブリダイズさせ、相補鎖合成を行う(図4−1の(3))。先ほどと同じように、プローブP4-2を起点としたDNA4-2が遊離してくる。DNA4-2は3'末端にリングDNAにハイブリダイズするプライマー配列4-1ac(アンカー配列に相補的な配列)を有し、増幅しようとする配列を含み、そして5'末端にループ配列を有するDNA(増幅用の鋳型DNA)である(図4−1の(4))。このDNA4-2は、図4−1の(5)に示すように、リングDNA4-1にハイブリダイズして相補鎖合成を行い、3'末端に繰り返し配列を生成する。この繰り返し部分のプライミングサイトに複数のプライマーP4-5がハイブリダイズして相補鎖合成を同時並列的に行う(図4−1の(6))。生成する相補鎖は後からくる合成鎖により鋳型DNAから引き剥がされる形で1本鎖DNA4-5を形成するが、相補鎖合成の終端部の3'末端部分がループ状になり、自己ハイブリダイズしてさらに相補鎖合成が進行して2本鎖DNAを生じる(図4−1の(7))。ループ部分には1本鎖状態のところがあり、図4−1の(8)に示すようにこの領域にハイブリダイズするプライマーP4-6を加えておくと、中間部分のループ配列にハイブリダイズして相補鎖合成を開始する。新たな相補鎖合成は既に完成した2本鎖DNA4-5を引き剥がす形で進行し、結果として3'末端の繰り返し配列部分が1本鎖状態でループ配列から5'末端にかけて2本鎖となったDNA鎖ができる。繰り返し配列を含む1本鎖部分にはさらにプローブP4-5がハイブリダイズして相補鎖合成を繰り返す(図4−1の(9)および(10))。一番長い鎖は2本鎖を形成して後から合成されるDNA鎖に引き剥がされることはないが、末端のループ配列は2本鎖状態とループ状態との平衡状態にあり、ある確率でループ状態にプライマーP4-6がハイブリダイズして相補鎖合成が進行する。すなわち生成物は自動的にいつまでも相補鎖合成反応を続け得ることになり大きな増幅効率が得られる。このようなループ配列を有するDNAの増幅はLAMP(Loop-Mediated Isothermal Amplification)法などでも行われているが、本発明の方法では、繰り返し配列が導入されているため、同時並列的に核酸を増幅できる点でより増幅率が高い方法といえる。
【0099】
[実施例5]
本実施例は、1つのビーズに平均1個以下のcDNAを作製して、同じビーズ上でそのコピーを増幅する例である。概要を図5−1に示した。本実施例で使用する繰り返し配列にハイブリダイズするプローブP5-2は固体表面に固定されている。実施例1と同様にビーズに固定したキャプチャープローブを用いてcDNAライブラリーを作製する(図5−1の(1))。ビーズとしては直径1μmのダイナビーズを使用した。1細胞中のmRNAのコピー数は106程度といわれているがそれよりはるかに多い108個のビーズを用いてcDNAライブラリーを作製する。この場合には1つのビーズに複数個のcDNAができる確率が限りなく小さくなる。
【0100】
実施例1と同様に、図5−1の(2)〜(5)に示すようにターゲットDNAの3'末端にアンカー配列5-1aを有するプライマー(プライマーP5-1)をハイブリダイズさせて、このアンカー配列5-1aに相補的な配列5-1ac(プライミングサイト5-1ac)を3'末端に導入する。次に、アンカー配列5-1a、プローブP5-2の相同配列部分、および制限酵素切断認識配列を含む約70塩基のリングDNA5-1を鋳型として用いて10分ほどRCA反応を行う(図5−1の(6))。これにより多くのプライミングサイト5-2c(プローブP5-2がハイブリダイズする部位)をcDNAの3'末端に繰り返し配列として導入する。この場合には相補鎖合成で生成する塩基長は約2×105程度であり、プライミングサイト5-2cの数は3000程度である。伸長したターゲットcDNAの鎖の長さは1塩基の間隔を0.3nmと仮定すると約60μmとなるが実際には引き伸ばされた状態ではないので10ミクロン以下の広がりと予想される。このようにしてビーズ固定のcDNA鎖は相補鎖合成された繰り返し配列を含む長いcDNA(末端に繰り返し配列が導入されている)とした後、底面積の広い反応室に入れて以後の反応を行う。
【0101】
108個のビーズが密集して並ぶと10mm四方の領域に収まるが、少し広い30mm四方の反応室を用いる。反応室の厚さは0.5mmほどで、側面から溶液を注入する。底面には密集して(30〜100nm2に1個のプローブ密度)プローブP5-2を固定しておく(図5−1の(7))。上部および下部は磁石を装着可能で必要に応じて磁気ビーズを上部または下部に密着することができる。反応液を反応室に入れて放置するか、磁石を用いて下部に沈殿させると、図5−1の(7)に示されるように、プローブP5-2はターゲットcDNAに導入された繰り返し配列部分にハイブリダイズするので、cDNAを有するビーズは複数のプローブにより強固に底面に捕捉される。cDNAと結合していないビーズは底面には捕捉されないので、上部に磁石を当てることにより浮き上がらせることができ、それを溶液と共に洗い流してcDNAを有するビーズだけを反応室に残す。残されたビーズの数は平均106程度であり、平均として30μm四方に1個のビーズがあることになる。図5−1の(8)に示すように、プローブP5-2を起点とした相補鎖合成により、まず3000個のプライミングサイトから相補鎖合成が同時並行的に進行して約3000個の1本鎖DNA(DNA5-2)が生じるがその3'末端近傍にはビーズに固定された多くのキャプチャープローブがあり、これらにハイブリダイズしてキャプチャープローブからの相補鎖合成が続いて進行する。結果として多くの2本鎖DNAが底面とビーズの間を架橋するように生成される。この状態で温度を上げてDNA鎖を1本鎖とした後に再度プローブP5-2でビーズを捕獲する。この段階でビーズに固定されたcDNAは元の量の3000倍になっており、プローブP5-2がハイブリダイズするプライミングサイトの数は計算では約4×106程度に増加している。単純に二乗にならないのは種々の長さの繰り返し配列部分のDNA鋳型があるためである。実際には計算通りにはいかないが106程度のプライミングサイトが生じると推定できる。
【0102】
上記と同様にプローブP5-2を用いて相補鎖合成を行うことで106個程度のcDNAの相補鎖コピー(DNA5-2)を固体表面上に生成し、続いての相補鎖合成でビーズ上にcDNAコピーを同程度の量だけ作ることができる。このプロセスを繰り返すことで1つのコピーから膨大な数のコピーを同一ビーズ上あるいはビーズが捕獲された平面の位置の近傍に生成することができる。最初にRCA反応でcDNAの3'末端に繰り返し配列を導入するが、この繰り返し配列が長すぎると異なるDNA間で交差反応が起こることがある。最初に導入する繰り返し配列部分の長さは10μm程度(例えば70塩基の繰り返し単位を約500倍にする)とし、増幅プロセスを繰り返したほうが都合の良い場合もある。
【0103】
以上述べたように繰り返し配列を導入することによる増幅方法では固体表面に固定したプローブを活用することにより、増幅に関与する領域を空間的に制限することができるので1つのDNA分子を基に作製したコピーをビーズなど空間的に分離された素材に固定して取り出すことができる。
【0104】
さらに、測定によっては、cDNAライブラリーの作製は小さなビーズで効率よく行い、増幅した後の種々の計測は比較的操作しやすい大きなビーズに増幅産物を移して行うことが望ましい場合がある。このような場合には、プローブP5-2が固定された表面上に作製した局在化したDNA相補鎖(DNA5-2)を用いるとよい。上記の例では1つのビーズから3000個の相補鎖が局在化した状態で生成する。その相補鎖の3'末端にはキャプチャープローブに相補的な配列が付加されている。そこで、温度を上げて、cDNAを固定したビーズと固体表面との間に形成されている2本鎖DNAを乖離させた後にビーズを洗い流す。次いでキャプチャープローブが固定された大きなビーズを反応室に流し込み、プローブP5-2が伸長して生成された先端にキャプチャープローブと相補的な配列を有するDNA鎖にキャプチャープローブをハイブリダイズさせてビーズに保持した後、余剰のビーズを洗い流して前述と同じ操作を行えばよい。このように本方法は種々の活用が可能な優れたDNA増幅方法である。
【0105】
この実施例では、ターゲットとなるDNAをまずビーズ上に作製して用いたが、遊離状態のDNAを対象にすることもできる。この場合にはビーズ上に固定されたプローブ(キャプチャープローブ)に代わって、同じ配列を有するプローブを遊離状態で反応液中に加えたり、あるいはプローブP5-2が固定された固体表面にプローブP5-2に対して一定の割合でキャプチャープローブP5-3を固定しておいたりなどすればよい(図5−2の(a))。さらに、別の実施例では、図5−2の(b)に示したように反応室を細かい反応セルの集合体(細孔アレー)で形成することもできる。各反応セルには平均として1個以下のターゲットDNAが含まれるようにする。反応セル内にはプローブP5-2が固定されており、また、キャプチャープローブに相当するプローブP5-3は浮遊した状態で溶液中に存在する形とした例を示した。ターゲットDNAの繰り返し配列部分にプローブP5-2が多くハイブリダイズして相補鎖合成を並列して行う。この結果、多くのプローブP5-2からDNA伸長鎖が生じる。これらは1本鎖として生成するが、プローブP5-3が3'末端にハイブリダイズして相補鎖合成を行うので2本鎖DNAを生じる。熱を掛けてそれぞれ1本鎖とするが、反応セルは相互に隔離されているので生じた浮遊DNA鎖は反応セルから外に出ない。そして速やかにセル表面に固定されたプローブP5-2にキャプチャーされる。引き続き相補鎖合成を行い、DNAを反応セルの中で増幅することができる。熱サイクルごとにn倍になるので数回の熱サイクルを加えることで膨大な数のコピーDNAを反応セル内に短時間で作ることができる。
【0106】
ここでは分離された反応セルを用いることを開示したが、このような反応場としてキャピラリープレートなどのキャピラリーチューブアレーを用いてもよい。この場合にはチューブの内部にプローブP5-2を固定して用いる。繰り返し配列を有するターゲットDNAを含む溶液をチューブアレーを通すと効率よくターゲットをプローブで捕獲できる。続いて相補鎖合成を行い、多くのコピーをチューブ内に作製できる。プローブP5-3を併せて加えておくと2本鎖DNAが壁に固定された状態で生じる。熱変性などによって増幅されたターゲットDNAのコピーを取り出して利用することができる。
【0107】
[実施例6]
本実施例では、繰り返し配列部分にハイブリダイズして相補鎖合成して生じる相補DNA鎖の3'末端にハイブリダイズするプローブが相補鎖合成する際に、ニックを生じる酵素の認識部位を含む部分を導入する例を開示する。繰り返し配列部分にハイブリダイズするプライマーP6-2を起点として合成した相補DNA鎖を鋳型として、その3'末端にハイブリダイズするプライマーP6-3を起点とするDNA相補鎖合成を行い、ターゲットDNA配列と相同の配列部分を含むDNA鎖を合成する。プライマーP6-2が相補鎖合成すると切断酵素の認識部位にN.BstNBIなどの酵素が結合して認識配列の外側を片方の鎖だけ切断する。この酵素の認識配列は-----GAGTCT|-----である。もちろん他の酵素を用いてもよく、この限りでない。このような酵素の活用はAnal. Chem. 77, 7984-7972(2005)に報告されている。DNAポリメラーゼとして前述の鎖置換型のポリメラーゼを用いているので、このように形成されたニックの部分から相補鎖合成が再スタートする。この新しい鎖は既に合成されたDNA鎖を引き剥がしながらDNA相補鎖合成するので繰り返しDNA一本鎖を作る。このDNA鎖の3'末端側には繰り返し配列があるので相補鎖合成がスタートして繰り返しDNAを増幅できる。以下、図を用いて説明する。
【0108】
図6のプロセス(6-1)は、3'末端に繰り返し配列を有し、かつ5'末端にプライマーP6-3と一部の配列が同じ配列のプライミングサイトになる部位を有するターゲットDNA6-1を用いた例を示した。繰り返し配列部分にハイブリダイズするプライマーP6-2から次々に鎖置換型の相補鎖合成によりDNA鎖が生じる。生じたDNA鎖は1本鎖状態で反応溶液中に遊離してくる。プロセス(6-2)に示されるように、3'末端にはプライミングサイトができ、プライマーP6-3がハイブリダイズする。プライマーP6-3は相補鎖DNA6-2を鋳型にして相補鎖合成を行い、ターゲットDNA6-1と同じ配列を含むDNA6-3を合成する(プロセス(6-3))。プライマーP6-3には2本鎖になると酵素に認識されて切断される部位を導入するが、相補鎖合成により2本鎖が形成されてこの部位が酵素で認識されるのでプロセス(6-4)に示したように配列の途中に切り込み(ニック)が生じる。鎖置換型のDNAポリメラーゼはこの切り込み部分から相補鎖合成を開始できるので、プロセス(6-5)から(6-6)に示したように既に合成されたDNA鎖をはがしながら相補鎖合成が進行する。相補鎖合成が進行すると再びニックが形成されて次の相補鎖合成が開始される。このようにして多くの同じ配列を有するDNAを生成することができる。生成されたDNA6-3sは5'末端がニック部位以降の配列となるのでDNA6-3より少し短い配列となっている(プロセス(6-7))。DNA6-3sは3'末端に繰り返し配列を有しているので、プロセス(6-7)および(6-8)に示されるように、プライマーP6-2がハイブリダイズして相補鎖DNA6-2sを生成する。DNA6-2sはプライマーP6-3にハイブリダイズしてDNA6-2と同じ配列となり、プライマーP6-3は相補鎖合成によりDNA6-3を作る(プロセス(6-9)および(6-10))。DNA6-3のプライマー部位には再びニックが入り、プロセス(6-4)からのプロセスが繰り返される。このように繰り返しDNAコピーを作るプロセスが繰り返されるので短時間に非常に多くのDNAコピーを生成することができる。
【0109】
本実施例では、プライマー配列中にニックの部位を入れたが相補鎖合成で初めてこの部位が現れるようにすることもできる。この場合には切断により短くなったDNA6-3sを鋳型として合成されたDNA6-2sにはプライミングサイトがないのでプライマーP6-3がハイブリダイズできず、全体的な増幅率は若干低下する。
【0110】
なお、プライマーP6-3はターゲットDNAにハイブリダイズしただけでは切断されず、相補鎖合成が起こって初めて切断されるように設計すると効果的である。
【産業上の利用可能性】
【0111】
本発明により、核酸の増幅方法が提供される。かかる方法は、複数種の核酸が共存しても、どの核酸についても同じ増幅率で増幅することができる。また、かかる方法では、核酸の配列や長さの如何にかかわらず均一に、短時間に高い増幅率で核酸を増幅することができる。従って、本発明に係る増幅方法は、mRNAの均一な増幅、特に1つの細胞から得られる少量のmRNAからcDNAを合成し、そのcDNAを均一にバイアスなく増幅する方法として優れている。また本発明に係る方法は、核酸の迅速な増幅と検出が望まれる、遺伝子発現解析、細胞機能解析、生体組織の解析方法、病気の診断、感染症検査、創薬などの分野に有用である。
【特許請求の範囲】
【請求項1】
核酸の増幅方法であって、
ターゲット配列またはその相補配列を含むターゲット核酸鎖の3'末端に既知配列を含む繰り返し配列を導入するステップ、
該繰り返し配列にハイブリダイズするオリゴヌクレオチドを、該ターゲット核酸鎖に導入した繰り返し配列に複数個ハイブリダイズさせるステップ、
該オリゴヌクレオチドをプライマーとして用いて該ターゲット核酸鎖を鋳型とした相補鎖合成を行い、1つのターゲット核酸鎖から複数の核酸相補鎖を生成するステップ
を含む方法。
【請求項2】
繰り返し配列が、ターゲット配列またはその相補配列の長さよりも短いものである、請求項1に記載の方法。
【請求項3】
繰り返し配列が、ターゲット配列またはその相補配列の長さよりも長いものである、請求項1に記載の方法。
【請求項4】
繰り返し配列に含まれる繰り返し単位の数が100を超えるものである、請求項1〜3のいずれか1項に記載の方法。
【請求項5】
繰り返し配列に含まれる繰り返し単位の数が1000を超えるものである、請求項1〜3のいずれか1項に記載の方法。
【請求項6】
ターゲット核酸鎖が複数種の核酸鎖を含むものであり、それらの複数種の核酸鎖に対して共通の繰り返し配列を導入するものである、請求項1〜5のいずれか1項に記載の方法。
【請求項7】
繰り返し配列の導入が、繰り返し配列を有する核酸鎖をターゲット核酸鎖にライゲーションにより導入することにより行う、請求項1〜6のいずれか1項に記載の方法。
【請求項8】
繰り返し配列の導入が、繰り返し配列を有する核酸鎖を鋳型とし、ターゲット核酸鎖の3'末端部分を繰り返し配列導入用プライマーとしてまたはターゲット核酸鎖の3'末端に付加した配列部分を繰り返し配列導入用プライマーとして用いる相補鎖合成により行う、請求項1〜6のいずれか1項に記載の方法。
【請求項9】
繰り返し配列を有する核酸鎖が、リング状の核酸を鋳型とした相補鎖合成によって生成されたものである、請求項7または8に記載の方法。
【請求項10】
繰り返し配列の導入が、ターゲット核酸鎖に含まれる配列部分、または該ターゲット核酸鎖に付加した配列部分を繰り返し配列導入用プライマーとして使用し、リング状の核酸を鋳型とする相補鎖合成により行う、請求項1〜6のいずれか1項に記載の方法。
【請求項11】
繰り返し配列の導入が、ターゲット核酸鎖に付加した配列部分を繰り返し配列導入用プライマーとして使用し、該配列部分にハイブリダイズしかつライゲーションによりリング状の核酸を形成することができるオリゴヌクレオチドを用いて形成されたリング状の核酸を鋳型とする相補鎖合成により行う、請求項1〜6のいずれか1項に記載の方法。
【請求項12】
繰り返し配列導入用プライマーの少なくとも一部が、ターゲット核酸鎖の3'末端に付加した配列部分を利用するものである、請求項10または11に記載の方法。
【請求項13】
繰り返し配列の導入が、ターゲット核酸鎖の3'末端に付加した配列部分の少なくとも一部にハイブリダイズするオリゴヌクレオチドを鋳型として相補鎖合成により得られた配列部分の相補配列を繰り返し配列導入用プライマーとして使用し、リング状の核酸を鋳型とする相補鎖合成により行う、請求項1〜6のいずれか1項に記載の方法。
【請求項14】
ターゲット核酸鎖の3'末端に、ターミナルトランスフェラーゼにより配列部分を付加する、請求項8〜13のいずれか1項に記載の方法。
【請求項15】
ターゲット核酸鎖の3'末端に付加した配列部分に隣接する該ターゲット核酸鎖の3'末端側の配列部分と、付加した配列部分の全てまたは一部分とにハイブリダイズし、かつ既知配列を含むオリゴヌクレオチドを鋳型として相補鎖合成を行い、該ターゲット核酸鎖の3'末端に付加した配列部分の一部を必要に応じて除去し、続いてハイブリダイズしたオリゴヌクレオチドを鋳型として相補鎖合成により該ターゲット核酸鎖の3'末端側に付加された該既知配列を繰り返し配列導入用プライマーとして用いて、リング状核酸を鋳型として相補鎖合成を行うことにより、繰り返し配列を導入するものである、請求項13に記載の方法。
【請求項16】
ターゲット核酸鎖の3'末端に付加した配列部分の一部の除去が、該配列部分におけるオリゴヌクレオチドがハイブリダイズしていない部分の塩基をエキソヌクレアーゼを含む酵素を用いて除去することにより行う、請求項15に記載の方法。
【請求項17】
ターゲット核酸鎖の3'末端に付加した、繰り返し配列導入用プライマーとして使用する配列部分が、制限酵素切断に続くオリゴヌクレオチドのライゲーションまたはオリゴヌクレオチドを鋳型とする相補鎖合成により生成されたものである、請求項10〜13のいずれか1項に記載の方法。
【請求項18】
繰り返し配列導入用プライマーとして、ターゲット核酸鎖に含まれる既知配列部分を利用するものである、請求項10に記載の方法。
【請求項19】
ターゲット核酸鎖の既知配列部分を切断して、得られるターゲット核酸鎖の3'末端を含む部分を繰り返し配列導入用プライマーとして使用する、請求項18に記載の方法。
【請求項20】
ターゲット核酸鎖の既知配列部分の切断が、Cleavaseを含む酵素により行う、請求項19に記載の方法。
【請求項21】
ターゲット核酸鎖の既知配列部分にハイブリダイズし、かつ5'末端側にアンカー配列を有するオリゴヌクレオチドをターゲット核酸鎖にハイブリダイズさせ、該オリゴヌクレオチドを伸張する相補鎖合成を行って2本鎖核酸を生成し、1本鎖核酸を3'末端から分解する酵素を用いてターゲット核酸鎖の1本鎖部分を分解除去し、次いで該オリゴヌクレオチドのアンカー配列を鋳型としてターゲット核酸鎖の3'末端側を伸張する相補鎖合成によりターゲット核酸鎖に配列部分を付加して、繰り返し配列導入用のプライマーを生成するものである、請求項10〜13のいずれか1項に記載の方法。
【請求項22】
ターゲット核酸鎖の既知配列部分にハイブリダイズし、かつ5'末端側にアンカー配列を有するオリゴヌクレオチドをターゲット核酸鎖にハイブリダイズさせ、該オリゴヌクレオチドを伸張する相補鎖合成を行って2本鎖核酸を生成し、ターゲット核酸鎖の1本鎖部分を除去し、次いで該オリゴヌクレオチドのアンカー配列を鋳型とした相補鎖合成によりターゲット核酸鎖の3'末端に既知配列部分を付加し、該オリゴヌクレオチドを除去することにより、繰り返し配列導入用のプライマーを生成するものである、請求項10〜13のいずれか1項に記載の方法。
【請求項23】
ターゲット核酸鎖の3'末端および5'末端に既知配列部分を付加し、ターゲット核酸鎖およびその相補核酸鎖の両方について3'末端の該既知配列部分を繰り返し配列導入用プライマーとして、該既知配列部分にハイブリダイズすることができるリング状のDNAを鋳型として用いて相補鎖合成を行うことにより、該3'末端および5'末端に繰り返し配列を導入するものである、請求項8〜11のいずれか1項に記載の方法。
【請求項24】
ターゲット核酸鎖に導入された繰り返し配列にハイブリダイズする第1のオリゴヌクレオチドをプライマーとして用いる相補鎖合成を行い、生成された相補核酸鎖を鋳型として、その3'末端にハイブリダイズする第2のオリゴヌクレオチドをプライマーとして用いて相補鎖合成を行い、ターゲット核酸鎖のコピーを増幅するステップを含む、請求項1〜23のいずれか1項に記載の方法。
【請求項25】
ターゲット核酸鎖に導入された繰り返し配列にハイブリダイズするオリゴヌクレオチドをプライマーとして用いる相補鎖合成を行い、得られた2本鎖核酸を1本鎖核酸とし、次いで該オリゴヌクレオチドをプライマーとして、生成された1本鎖核酸を鋳型として相補鎖合成を行うステップを繰り返すものである、請求項1〜23のいずれか1項に記載の方法。
【請求項26】
ターゲット配列またはその相補配列を含み、3'末端に繰り返し配列を有し、かつ5'末端にループ配列を有するターゲット核酸鎖を生成するステップを含む、請求項1〜25のいずれか1項に記載の方法。
【請求項27】
核酸鎖がDNA鎖である、請求項1〜26のいずれか1項に記載の方法。
【請求項28】
ターゲット核酸鎖の5'末端側が固体表面に固定されている、請求項1〜27のいずれか1項に記載の方法。
【請求項29】
ターゲット核酸鎖に導入される繰り返し配列にハイブリダイズするオリゴヌクレオチドが固体表面に固定されている、請求項1〜28のいずれか1項に記載の方法。
【請求項30】
ターゲット核酸鎖に導入される繰り返し配列にハイブリダイズする第1のオリゴヌクレオチドを用いて生成された相補核酸鎖を、固体表面に固定した第2のオリゴヌクレオチドを用いて捕獲し、第2のオリゴヌクレオチドをプライマーとして相補鎖合成を行うステップを含む、請求項1〜29のいずれか1項に記載の方法。
【請求項31】
固体がビーズである、請求項28〜30のいずれか1項に記載の方法。
【請求項32】
固体が区画化された平面固体である、請求項28〜30のいずれか1項に記載の方法。
【請求項33】
固体表面が多孔質または細孔アレーの内壁である、請求項28〜30のいずれか1項に記載の方法。
【請求項34】
ターゲット核酸鎖またはその相補核酸鎖にハイブリダイズする少なくとも2種のオリゴヌクレオチドが同一固体表面に固定されている、請求項29〜33のいずれか1項に記載の方法。
【請求項35】
ターゲット核酸鎖に導入された繰り返し配列の前または後ろに制限酵素切断認識配列が導入されるように相補鎖合成を行い、得られた相補核酸鎖から制限酵素を用いて繰り返し配列を切断除去するステップを含む、請求項1〜34のいずれか1項に記載の方法。
【請求項36】
ターゲット核酸鎖に相補的な配列と5'末端に第1のアンカー配列とを有するキャプチャープローブを用いてターゲット核酸鎖を鋳型として相補鎖合成するステップ、
生成した相補核酸鎖を1本鎖とするステップ、
1本鎖相補核酸鎖にハイブリダイズする第1のオリゴヌクレオチドを用いて相補鎖合成を行い、第1のオリゴヌクレオチドが伸張した3'末端側に第1のアンカー配列に基づく既知配列部分を導入するステップ、
該既知配列部分をプライマーとしてリング状の核酸鎖にハイブリダイズさせて相補鎖合成を行い、3'末端側に第1の繰り返し配列が導入された相補核酸鎖を生成するステップ、ならびに
第1の繰り返し配列に複数の第2のオリゴヌクレオチドをハイブリダイズさせて、同時並行的に相補鎖合成するステップ
を含む、請求項1に記載の方法。
【請求項37】
第1のオリゴヌクレオチドが5'末端側に第2のアンカー配列を含み、第1の繰り返し配列にハイブリダイズする第2のオリゴヌクレオチドをプライマーとして相補鎖合成した相補鎖の3'末端側に第2のアンカー配列に基づく既知配列部分を導入し、該既知配列部分をプライマーとして使用して、リング状の核酸を鋳型として相補鎖合成を行い、3'末端側に第2の繰り返し配列が導入された相補核酸鎖を生成するステップをさらに含む、請求項36に記載の方法。
【請求項38】
複数種のmRNAからcDNAライブラリを作製し、cDNAライブラリに含まれる複数種のcDNAをターゲット核酸鎖として均一にDNAを増幅するものである、請求項1〜37のいずれか1項に記載の方法。
【請求項39】
mRNAまたはcDNAを捕捉するビーズとは異なるビーズ上に増幅したDNAコピーを作製するものである、請求項38に記載の方法。
【請求項40】
単一種または複数種の核酸鎖を含む核酸プールを均一に増幅する方法であって、
核酸プールに含まれる核酸鎖の3'末端に既知配列を含む繰り返し配列を導入するステップ、
該繰り返し配列にハイブリダイズするオリゴヌクレオチドと、鎖置換型ポリメラーゼを用いて相補鎖合成を行うステップ
を含む方法。
【請求項41】
核酸の増幅方法であって、
ターゲット配列またはその相補配列を含むターゲット核酸鎖の3'末端に既知配列を含む繰り返し配列を導入するステップ、
該繰り返し配列にハイブリダイズするオリゴヌクレオチドを用いて相補鎖合成を行うステップ、
生成される2本鎖核酸に切断部(ニック)を導入するステップ、
切断部(ニック)から相補鎖合成を行い、複数の核酸鎖を生成するステップ
を含む方法。
【請求項42】
サンプル中の核酸の検出方法であって、
サンプル中の核酸を、請求項1〜41のいずれか1項に記載の方法により増幅するステップ、
得られる増幅産物を用いて、検出対象の核酸を検出するステップ
を含む方法。
【請求項43】
サンプル中の全ての核酸または検出対象の核酸のみを増幅するものである、請求項42に記載の方法。
【請求項1】
核酸の増幅方法であって、
ターゲット配列またはその相補配列を含むターゲット核酸鎖の3'末端に既知配列を含む繰り返し配列を導入するステップ、
該繰り返し配列にハイブリダイズするオリゴヌクレオチドを、該ターゲット核酸鎖に導入した繰り返し配列に複数個ハイブリダイズさせるステップ、
該オリゴヌクレオチドをプライマーとして用いて該ターゲット核酸鎖を鋳型とした相補鎖合成を行い、1つのターゲット核酸鎖から複数の核酸相補鎖を生成するステップ
を含む方法。
【請求項2】
繰り返し配列が、ターゲット配列またはその相補配列の長さよりも短いものである、請求項1に記載の方法。
【請求項3】
繰り返し配列が、ターゲット配列またはその相補配列の長さよりも長いものである、請求項1に記載の方法。
【請求項4】
繰り返し配列に含まれる繰り返し単位の数が100を超えるものである、請求項1〜3のいずれか1項に記載の方法。
【請求項5】
繰り返し配列に含まれる繰り返し単位の数が1000を超えるものである、請求項1〜3のいずれか1項に記載の方法。
【請求項6】
ターゲット核酸鎖が複数種の核酸鎖を含むものであり、それらの複数種の核酸鎖に対して共通の繰り返し配列を導入するものである、請求項1〜5のいずれか1項に記載の方法。
【請求項7】
繰り返し配列の導入が、繰り返し配列を有する核酸鎖をターゲット核酸鎖にライゲーションにより導入することにより行う、請求項1〜6のいずれか1項に記載の方法。
【請求項8】
繰り返し配列の導入が、繰り返し配列を有する核酸鎖を鋳型とし、ターゲット核酸鎖の3'末端部分を繰り返し配列導入用プライマーとしてまたはターゲット核酸鎖の3'末端に付加した配列部分を繰り返し配列導入用プライマーとして用いる相補鎖合成により行う、請求項1〜6のいずれか1項に記載の方法。
【請求項9】
繰り返し配列を有する核酸鎖が、リング状の核酸を鋳型とした相補鎖合成によって生成されたものである、請求項7または8に記載の方法。
【請求項10】
繰り返し配列の導入が、ターゲット核酸鎖に含まれる配列部分、または該ターゲット核酸鎖に付加した配列部分を繰り返し配列導入用プライマーとして使用し、リング状の核酸を鋳型とする相補鎖合成により行う、請求項1〜6のいずれか1項に記載の方法。
【請求項11】
繰り返し配列の導入が、ターゲット核酸鎖に付加した配列部分を繰り返し配列導入用プライマーとして使用し、該配列部分にハイブリダイズしかつライゲーションによりリング状の核酸を形成することができるオリゴヌクレオチドを用いて形成されたリング状の核酸を鋳型とする相補鎖合成により行う、請求項1〜6のいずれか1項に記載の方法。
【請求項12】
繰り返し配列導入用プライマーの少なくとも一部が、ターゲット核酸鎖の3'末端に付加した配列部分を利用するものである、請求項10または11に記載の方法。
【請求項13】
繰り返し配列の導入が、ターゲット核酸鎖の3'末端に付加した配列部分の少なくとも一部にハイブリダイズするオリゴヌクレオチドを鋳型として相補鎖合成により得られた配列部分の相補配列を繰り返し配列導入用プライマーとして使用し、リング状の核酸を鋳型とする相補鎖合成により行う、請求項1〜6のいずれか1項に記載の方法。
【請求項14】
ターゲット核酸鎖の3'末端に、ターミナルトランスフェラーゼにより配列部分を付加する、請求項8〜13のいずれか1項に記載の方法。
【請求項15】
ターゲット核酸鎖の3'末端に付加した配列部分に隣接する該ターゲット核酸鎖の3'末端側の配列部分と、付加した配列部分の全てまたは一部分とにハイブリダイズし、かつ既知配列を含むオリゴヌクレオチドを鋳型として相補鎖合成を行い、該ターゲット核酸鎖の3'末端に付加した配列部分の一部を必要に応じて除去し、続いてハイブリダイズしたオリゴヌクレオチドを鋳型として相補鎖合成により該ターゲット核酸鎖の3'末端側に付加された該既知配列を繰り返し配列導入用プライマーとして用いて、リング状核酸を鋳型として相補鎖合成を行うことにより、繰り返し配列を導入するものである、請求項13に記載の方法。
【請求項16】
ターゲット核酸鎖の3'末端に付加した配列部分の一部の除去が、該配列部分におけるオリゴヌクレオチドがハイブリダイズしていない部分の塩基をエキソヌクレアーゼを含む酵素を用いて除去することにより行う、請求項15に記載の方法。
【請求項17】
ターゲット核酸鎖の3'末端に付加した、繰り返し配列導入用プライマーとして使用する配列部分が、制限酵素切断に続くオリゴヌクレオチドのライゲーションまたはオリゴヌクレオチドを鋳型とする相補鎖合成により生成されたものである、請求項10〜13のいずれか1項に記載の方法。
【請求項18】
繰り返し配列導入用プライマーとして、ターゲット核酸鎖に含まれる既知配列部分を利用するものである、請求項10に記載の方法。
【請求項19】
ターゲット核酸鎖の既知配列部分を切断して、得られるターゲット核酸鎖の3'末端を含む部分を繰り返し配列導入用プライマーとして使用する、請求項18に記載の方法。
【請求項20】
ターゲット核酸鎖の既知配列部分の切断が、Cleavaseを含む酵素により行う、請求項19に記載の方法。
【請求項21】
ターゲット核酸鎖の既知配列部分にハイブリダイズし、かつ5'末端側にアンカー配列を有するオリゴヌクレオチドをターゲット核酸鎖にハイブリダイズさせ、該オリゴヌクレオチドを伸張する相補鎖合成を行って2本鎖核酸を生成し、1本鎖核酸を3'末端から分解する酵素を用いてターゲット核酸鎖の1本鎖部分を分解除去し、次いで該オリゴヌクレオチドのアンカー配列を鋳型としてターゲット核酸鎖の3'末端側を伸張する相補鎖合成によりターゲット核酸鎖に配列部分を付加して、繰り返し配列導入用のプライマーを生成するものである、請求項10〜13のいずれか1項に記載の方法。
【請求項22】
ターゲット核酸鎖の既知配列部分にハイブリダイズし、かつ5'末端側にアンカー配列を有するオリゴヌクレオチドをターゲット核酸鎖にハイブリダイズさせ、該オリゴヌクレオチドを伸張する相補鎖合成を行って2本鎖核酸を生成し、ターゲット核酸鎖の1本鎖部分を除去し、次いで該オリゴヌクレオチドのアンカー配列を鋳型とした相補鎖合成によりターゲット核酸鎖の3'末端に既知配列部分を付加し、該オリゴヌクレオチドを除去することにより、繰り返し配列導入用のプライマーを生成するものである、請求項10〜13のいずれか1項に記載の方法。
【請求項23】
ターゲット核酸鎖の3'末端および5'末端に既知配列部分を付加し、ターゲット核酸鎖およびその相補核酸鎖の両方について3'末端の該既知配列部分を繰り返し配列導入用プライマーとして、該既知配列部分にハイブリダイズすることができるリング状のDNAを鋳型として用いて相補鎖合成を行うことにより、該3'末端および5'末端に繰り返し配列を導入するものである、請求項8〜11のいずれか1項に記載の方法。
【請求項24】
ターゲット核酸鎖に導入された繰り返し配列にハイブリダイズする第1のオリゴヌクレオチドをプライマーとして用いる相補鎖合成を行い、生成された相補核酸鎖を鋳型として、その3'末端にハイブリダイズする第2のオリゴヌクレオチドをプライマーとして用いて相補鎖合成を行い、ターゲット核酸鎖のコピーを増幅するステップを含む、請求項1〜23のいずれか1項に記載の方法。
【請求項25】
ターゲット核酸鎖に導入された繰り返し配列にハイブリダイズするオリゴヌクレオチドをプライマーとして用いる相補鎖合成を行い、得られた2本鎖核酸を1本鎖核酸とし、次いで該オリゴヌクレオチドをプライマーとして、生成された1本鎖核酸を鋳型として相補鎖合成を行うステップを繰り返すものである、請求項1〜23のいずれか1項に記載の方法。
【請求項26】
ターゲット配列またはその相補配列を含み、3'末端に繰り返し配列を有し、かつ5'末端にループ配列を有するターゲット核酸鎖を生成するステップを含む、請求項1〜25のいずれか1項に記載の方法。
【請求項27】
核酸鎖がDNA鎖である、請求項1〜26のいずれか1項に記載の方法。
【請求項28】
ターゲット核酸鎖の5'末端側が固体表面に固定されている、請求項1〜27のいずれか1項に記載の方法。
【請求項29】
ターゲット核酸鎖に導入される繰り返し配列にハイブリダイズするオリゴヌクレオチドが固体表面に固定されている、請求項1〜28のいずれか1項に記載の方法。
【請求項30】
ターゲット核酸鎖に導入される繰り返し配列にハイブリダイズする第1のオリゴヌクレオチドを用いて生成された相補核酸鎖を、固体表面に固定した第2のオリゴヌクレオチドを用いて捕獲し、第2のオリゴヌクレオチドをプライマーとして相補鎖合成を行うステップを含む、請求項1〜29のいずれか1項に記載の方法。
【請求項31】
固体がビーズである、請求項28〜30のいずれか1項に記載の方法。
【請求項32】
固体が区画化された平面固体である、請求項28〜30のいずれか1項に記載の方法。
【請求項33】
固体表面が多孔質または細孔アレーの内壁である、請求項28〜30のいずれか1項に記載の方法。
【請求項34】
ターゲット核酸鎖またはその相補核酸鎖にハイブリダイズする少なくとも2種のオリゴヌクレオチドが同一固体表面に固定されている、請求項29〜33のいずれか1項に記載の方法。
【請求項35】
ターゲット核酸鎖に導入された繰り返し配列の前または後ろに制限酵素切断認識配列が導入されるように相補鎖合成を行い、得られた相補核酸鎖から制限酵素を用いて繰り返し配列を切断除去するステップを含む、請求項1〜34のいずれか1項に記載の方法。
【請求項36】
ターゲット核酸鎖に相補的な配列と5'末端に第1のアンカー配列とを有するキャプチャープローブを用いてターゲット核酸鎖を鋳型として相補鎖合成するステップ、
生成した相補核酸鎖を1本鎖とするステップ、
1本鎖相補核酸鎖にハイブリダイズする第1のオリゴヌクレオチドを用いて相補鎖合成を行い、第1のオリゴヌクレオチドが伸張した3'末端側に第1のアンカー配列に基づく既知配列部分を導入するステップ、
該既知配列部分をプライマーとしてリング状の核酸鎖にハイブリダイズさせて相補鎖合成を行い、3'末端側に第1の繰り返し配列が導入された相補核酸鎖を生成するステップ、ならびに
第1の繰り返し配列に複数の第2のオリゴヌクレオチドをハイブリダイズさせて、同時並行的に相補鎖合成するステップ
を含む、請求項1に記載の方法。
【請求項37】
第1のオリゴヌクレオチドが5'末端側に第2のアンカー配列を含み、第1の繰り返し配列にハイブリダイズする第2のオリゴヌクレオチドをプライマーとして相補鎖合成した相補鎖の3'末端側に第2のアンカー配列に基づく既知配列部分を導入し、該既知配列部分をプライマーとして使用して、リング状の核酸を鋳型として相補鎖合成を行い、3'末端側に第2の繰り返し配列が導入された相補核酸鎖を生成するステップをさらに含む、請求項36に記載の方法。
【請求項38】
複数種のmRNAからcDNAライブラリを作製し、cDNAライブラリに含まれる複数種のcDNAをターゲット核酸鎖として均一にDNAを増幅するものである、請求項1〜37のいずれか1項に記載の方法。
【請求項39】
mRNAまたはcDNAを捕捉するビーズとは異なるビーズ上に増幅したDNAコピーを作製するものである、請求項38に記載の方法。
【請求項40】
単一種または複数種の核酸鎖を含む核酸プールを均一に増幅する方法であって、
核酸プールに含まれる核酸鎖の3'末端に既知配列を含む繰り返し配列を導入するステップ、
該繰り返し配列にハイブリダイズするオリゴヌクレオチドと、鎖置換型ポリメラーゼを用いて相補鎖合成を行うステップ
を含む方法。
【請求項41】
核酸の増幅方法であって、
ターゲット配列またはその相補配列を含むターゲット核酸鎖の3'末端に既知配列を含む繰り返し配列を導入するステップ、
該繰り返し配列にハイブリダイズするオリゴヌクレオチドを用いて相補鎖合成を行うステップ、
生成される2本鎖核酸に切断部(ニック)を導入するステップ、
切断部(ニック)から相補鎖合成を行い、複数の核酸鎖を生成するステップ
を含む方法。
【請求項42】
サンプル中の核酸の検出方法であって、
サンプル中の核酸を、請求項1〜41のいずれか1項に記載の方法により増幅するステップ、
得られる増幅産物を用いて、検出対象の核酸を検出するステップ
を含む方法。
【請求項43】
サンプル中の全ての核酸または検出対象の核酸のみを増幅するものである、請求項42に記載の方法。
【図1−1a】


【図1−1b】


【図1−1c】


【図1−2】


【図2−1】


【図2−2】


【図3−1a】


【図3−1b】


【図3−2a】


【図3−2b】


【図4−1】


【図4−2】


【図5−1a】


【図5−1b】


【図5−2】


【図6−1】


【図6−2】




【図1−1b】


【図1−1c】


【図1−2】


【図2−1】


【図2−2】


【図3−1a】


【図3−1b】


【図3−2a】


【図3−2b】


【図4−1】


【図4−2】


【図5−1a】


【図5−1b】


【図5−2】


【図6−1】


【図6−2】


【公開番号】特開2011−147415(P2011−147415A)
【公開日】平成23年8月4日(2011.8.4)
【国際特許分類】
【出願番号】特願2010−13159(P2010−13159)
【出願日】平成22年1月25日(2010.1.25)
【出願人】(000005108)株式会社日立製作所 (27,607)
【Fターム(参考)】
【公開日】平成23年8月4日(2011.8.4)
【国際特許分類】
【出願日】平成22年1月25日(2010.1.25)
【出願人】(000005108)株式会社日立製作所 (27,607)
【Fターム(参考)】
[ Back to top ]

