核酸分析デバイス,核酸分析装置、及び核酸分析方法
【課題】微小な核酸プローブを高密度に1つずつ並べるためには、事前に嵩高い微粒子に核酸プローブを一分子だけ捕捉させ、その微粒子を任意に配列した構造体に選択的に固定する方法が大変有効である。しかし、固定反応の観点からは微粒子径と接着用パッドは大きい方が望ましいが、励起の観点からは微粒子は小さい方が望ましい。そのため、微粒子径と接着用パッド径はその間に限定されてしまい、固定反応と励起それぞれに関して最適な条件を両立できていない。
【解決手段】そこで、嵩高い微粒子として外部刺激応答性微粒子を用いる。はじめに一分子の核酸試料断片を保持した外部刺激応答性微粒子を基板上に一つずつ高密度に且つ規則正しくに整列させて固定し、次いで外部刺激を与え該微粒子の体積を減少させる。
【解決手段】そこで、嵩高い微粒子として外部刺激応答性微粒子を用いる。はじめに一分子の核酸試料断片を保持した外部刺激応答性微粒子を基板上に一つずつ高密度に且つ規則正しくに整列させて固定し、次いで外部刺激を与え該微粒子の体積を減少させる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、核酸分析デバイスおよびそれを用いた核酸分析装置および核酸分析方法に関する。
【背景技術】
【0002】
DNAやタンパク質等の標的物質を検出する手段として、標的物質に蛍光標識を施し、レーザ等所定の励起光を照射して発生する蛍光を検出する方法が広く用いられている。例えば、これらの応用として、P.N.A.S. 2003, Vol. 100, pp. 3960-3964.(非特許文献1)にあるように、基板にDNAなどを固定してその塩基配列を決定する方法が提案されている。この方法は一般にSequencing by synthesisと呼ばれ、基板表面にランダムに分析すべき試料DNA断片を一分子ずつ捕捉し、1塩基ずつ伸長させて、その結果を蛍光計測より検出することにより塩基配列を決定するものである。本方式では、単一DNA分子毎に塩基配列が決定できるため、従来技術の問題であったクローニングやPCR等での試料DNAの精製、増幅が不要にでき、ゲノム解析や遺伝子診断の迅速化が期待できる。また、本方式を用いた塩基配列決定においては蛍光分子励起方法としてエバネッセント光励起が有効である。
【0003】
以下、エバネッセント光について記す。入射側媒質の屈折率n1,出射側媒質の屈折率n2である界面に対し、入射角θで波長λの電磁波(光)を入射する際、θc=sin-1(n2/n1)で与えられるθcを臨界角と呼ぶ(ただし、sin-1はsinの逆関数)。入射角がθ≧θcであるときに電磁波は全反射し、このとき界面の出射側近傍には界面からの距離に従い指数関数的に減衰する電磁場が生じる。この電磁場はエバネッセント場(光)と呼ばれる。エバネッセント場相対強度(E)は界面からの距離(z)の関数で、界面上(z=0)の時に1で最大となり、波長,入射角,屈折率で決まる値dを用いて、E=exp(−z/d)と表される。この値dを染み出し距離と呼ぶ。dは、屈折率n1,出射側媒質の屈折率n2,入射角θ,波長λを用いて、d=λ/4π(n12・sin2θ−n22)-1/2で与えられることが知られている。
【0004】
エバネッセント場は界面からの距離に応じて指数関数的に減衰するため、界面付近に存在する蛍光色素のみを励起することができ、SN比の向上に有効である。一方、励起照射系にレーザで発生させたエバネッセント場を利用した場合、その照野はレーザのスポット径に限定される。そのため、プローブの並列数を増加するには、照野内に核酸試料断片を高密度で一分子ずつ固定する技術が必要である。このとき、できるだけ高密度、且つ規則正しく、平滑な基板上に核酸試料を整列させて固定することが望まれる。これは一回に並列解析できるサンプル数を増やすことと、データ処理時間を短縮するためである。核酸試料を担持させた微粒子を平滑支持基板上にばらまいて固定させる方法は容易であるが、蛍光測定で配列を読み取る段になると、CCDカメラで検出したランダムに存在する微粒子画像から数値データを取得する際、膨大なデータ処理時間がかかってしまうためである。
【0005】
これらの課題を解決するため、特許文献1では予め嵩高い微粒子に核酸プローブを一分子だけ捕捉させ、その微粒子を任意に配列した構造体に選択的に固定する方法を提示している。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特開2010−172271号公報
【非特許文献】
【0007】
【非特許文献1】P.N.A.S. 2003, Vol. 100, pp. 3960-3964.
【非特許文献2】P.N.A.S. 2006, vol. 103, pp. 19635-19640.
【発明の概要】
【発明が解決しようとする課題】
【0008】
特許文献1に記載の方法は一分子の配列固定方法として非常に有効であるが、エバネッセント光励起と併用する場合、微粒子の直径分、微粒子上部と基板表面に距離が発生し励起光が減衰する。上記で述べたように、嵩高い微粒子を用いることで核酸プローブの一分子固定は容易になる反面、エバネッセント場を利用した励起の場合、微粒子径が大きくなることで微粒子表面に捕捉された核酸プローブは界面から離れるため、それに応じて励起光が減衰する。
【0009】
こうした減衰は分子プローブが小さい場合にはほとんど問題にはならないが、例えば、分子プローブが何百塩基から何千塩基にも及ぶ核酸である場合、界面から一定距離離れた核酸の先端部分では取り込まれた蛍光分子が励起できないほど減衰し分析不能になる。
【0010】
さらに流路内で微粒子固定や溶液交換が行われる場合、微粒子径が大きくなるほど液流の抵抗が増大するため、一度固定された微粒子も剥がれやすくなる。以上のような影響を小さくするためには微粒子径は50nm以下であることが望ましい。
【0011】
一方、微粒子径を小さくすることによる弊害もある。微粒子を一つずつ固定する反応に際しては微粒子径に対する接着パッド径は同等程度か同等以下が望ましく、衝突頻度の観点から各々は大きいほど固定され易い。
【0012】
したがって、小さい微粒子(ここでは50nm以下とする)では接着用パッドへの反応効率は低い。さらに接着用パッド径に関しても製造し易さと安定性の面で、大きいほどよく、少なくとも30nm以上であることが望ましい。
【0013】
すなわち、固定反応の観点からは微粒子径と接着用パッドは大きい方が望ましいが、励起の観点からは微粒子は小さい方が望ましい。そのため、微粒子径と接着用パッドは30〜50nm程度に限定されてしまい、固定反応と励起それぞれに関して最適な条件を両立できていない。
【課題を解決するための手段】
【0014】
そこで、嵩高い微粒子として外部刺激応答性微粒子を用いる。はじめに一分子の核酸試料断片を保持した外部刺激応答性微粒子を基板上に一つずつ高密度に且つ規則正しくに整列させて固定し、次いで外部刺激を与え該微粒子の体積を減少させる。
【発明の効果】
【0015】
本発明により、プローブ分子を嵩高い外部刺激応答性微粒子を介して容易に所定位置に一分子ずつ固定でき、次いで外部刺激を与え該微粒子の体積を減少させることで、界面とプローブ間の距離を縮小させ励起光であるエバネッセント光の減衰を抑え、さらに該微粒子と接着パッドとの接着面積が増大することにより核酸プローブ分子を強固に固定できる。さらに、比較的大きい径の微粒子を使用できるため、その大きさに応じた比較的大きい径で製造しやすい接着用パッドを使用できる。
【図面の簡単な説明】
【0016】
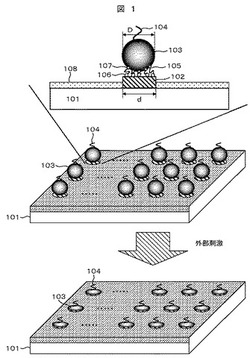
【図1】実施例1および実施例2における分子プローブが捕捉された微粒子を配列し、外部刺激により変形したデバイスについての説明図。
【図2】実施例2における微粒子の形状とエバネッセント場の距離の変化についての説明図。
【図3】実施例3におけるデバイスの製造法に関する説明図。
【図4】実施例3におけるデバイスの製造法に関する説明図。
【図5】実施例4における核酸分析装置の構成に関する説明図。
【発明を実施するための形態】
【0017】
本実施例では、検出対象の核酸を捕捉できるプローブ分子を有する微粒子を基板上に規則的に固定した核酸分析用デバイスであって、基板上の微粒子の固定位置に接着用パッドを備え、微粒子と検出用パッドとが化学結合を介して結合しており、前記微粒子が外部刺激により変形することを特徴とする核酸分析デバイスを開示する。
【0018】
さらに、本実施例では、分子プローブを一分子有する微粒子だけを選別し、その微粒子を基板上の接着用パッドに規則的に固定し、前記微粒子を外部刺激により変形させて作製した核酸分析デバイスに対して、蛍光色素を有するヌクレオチド、及び核酸試料を供給する手段と、該核酸分析デバイスにエバネッセント光を照射する手段と、核酸分析デバイス上においてヌクレオチド,核酸合成酵素、及び核酸試料が共存することにより起きる核酸伸長反応により核酸鎖中に取り込まれた蛍光色素の蛍光を測定する発光検出手段と、を備えた核酸試料の塩基配列情報を取得する核酸分析装置を開示する。
【0019】
さらに、本実施例では基板上の前記微粒子の固定位置に接着用のパッドを備え、微粒子と接着用パッドとが化学結合を介して結合しており、接着用パッドの直径が微粒子の直径と同等あるいはそれ以下の大きさであり、基板表面に非特異的吸着防止用の有機物ポリマーを材料とする薄膜層を有する、核酸分析デバイスを開示する。
【0020】
さらに、本実施例では、微粒子1個に対して、一分子の分子プローブが固定されていることを開示する。
【0021】
さらに、本実施例では微粒子が外部刺激応答性重合体から選ばれる材料からなることを特徴とするデバイスであって、外部刺激が、加熱,凍結,減圧,遠心,マイクロ波照射,化学処理から選ばれるものであることを開示する。
【0022】
さらに、本実施例では接着用パッドが、金,チタン,ニッケル、またはアルミから選ばれる材料からなることを開示する。
【0023】
さらに、本実施例では前記核酸分析デバイスに光を照射する手段として、エバネッセント場を利用することを開示する。
【0024】
以下、上記及びその他の本発明の新規な特徴と効果について、図を参照して説明する。ここでは、本発明を完全に理解してもらうため、特定の実施形態について詳細な説明を行うが、本発明はここに記した内容に限定されるものではない。
【0025】
本実施例で例示する刺激応答性微粒子は、形状が外部刺激では変形しづらいコア部、例えば、磁性微粒子と、刺激応答性ポリマーとが、多価アルコールまたは多価アルコール誘導体を介して固定されている。この刺激応答性ポリマーは、磁性微粒子表面に固定された多価アルコールまたは多価アルコール誘導体にグラフト重合されるか、またはそのポリマー末端または側鎖の官能基と、多価アルコールまたは多価アルコール誘導体の有する官能基との結合によって、固定されている。その刺激応答性ポリマー固定化磁性微粒子の平均粒径は、1〜1000nmであることが好ましく、より好ましくは、30〜200nmである。
【0026】
今回使用した刺激応答性ポリマーは、熱応答性ポリマーである。熱応答性ポリマーは特定の分子構造を持ち、水中で下限臨界溶液温度(LOWER Critical Solution temperature,LCST)を有し、ある温度を境にそれより高い温度ではその分子内、或いは分子間の疎水結合が強まりポリマー鎖が凝集し、逆に、低い温度ではポリマー鎖が水分子を結合し水和する相転移挙動を示す。その相転移現象は可逆的であり、スイッチング基剤と呼ばれる。また、上限臨界溶液温度(Upper Critical Solution temperature,UCST)を有するものは、ある温度を境にそれより低い温度で凝集し、高い温度ではポリマー鎖が水分子を結合し水和する相転移挙動を示す。
【0027】
熱応答性ポリマーの中で、N−イソプロピルアクリルアミドは最もよく研究されており、側鎖に親水性部分と疎水性部分両方を持つLCSTが32℃のポリマーである。すなわち、32℃以上の温度では側鎖の疎水性部分であるイソプロピル基によって分子内,分子間において疎水結合が強まりポリマー鎖が凝集し、32℃より低い温度ではもう一方の親水性部分のアミド結合と水分子とが結合するため水に溶解する。こうした相転移現象はアクリレートの添加などで阻害することもできる。
【0028】
熱応答性ポリマーは、下限臨界溶液温度を有するポリマー及び上限臨界溶液温度を有するポリマーに区別される。
【0029】
下限臨界溶液温度を有するポリマーは、N置換(メタ)アクリルアミド誘導体からなるポリマー,ポリオキシエチレンアルキルアミン誘導体,ポリオキシエチレンソルビタンラウレート等のポリオキシエチレンソルビタンエステル誘導体,(ポリオキシエチレンアルキルフェニルエーテル)(メタ)アクリレート類、および(ポリオキシエチレンアルキルエーテル)(メタ)アクリレート類等のポリオキシエチレン(メタ)アクリル酸エステル誘導体等である。また、これらの重合体及びこれらの少なくとも2種の単量体からなるコポリマーも利用できる。これらのなかでも、N−n−プロピルアクリルアミド,N−イソプロピルアクリルアミド,N−エチルアクリルアミド,N,N−ジメチルアクリルアミド,N−アクリロイルピロリジン,N−アクリロイルピペリジン,N−アクリロイルモルホリン,N−n−プロピルメタクリルアミド,N−イソプロピルメタクリルアミド,N−エチルメタクリルアミド,N,N−ジメチルメタクリルアミド,N−メタクリロイルピロリジン,N−メタクリロイルピペリジン,N−メタクリロイルモルホリンからなる群から選ばれる少なくとも1種の単量体からなるポリマーが好ましく利用できる。
【0030】
また、上限臨界溶液温度を有するポリマーは、アクリルアミド,アセチルアクリルアミド,ビオチノールアクリレート,N−ビオチニル−N′−メタクロイルトリメチレンアミド,アクロイルグリシンアミド,アクロイルザルコシンアミド,メタクリルザルコシンアミド,アクロイルニペコタミド及びアクロイルメチルウラシル等からなる群から選ばれる少なくとも1種の単量体からなるポリマーである。また、これらの少なくとも2種の単量体からなるコポリマーも利用できる。これらのなかでも、アクリルアミド,アセチルアクリルアミド,ビオチノールアクリレート,N−ビオチニル−N′−メタクロイルトリメチレンアミド,アクロイルグリシンアミド,アクロイルザルコシンアミド,メタクリルザルコシンアミド,アクロイルニペコタミド及びアクロイルメチルウラシルからなる群から選ばれる少なくとも1種が好ましく利用できる。
【0031】
以上の材料により製造されたゲル状微粒子は加熱,凍結,減圧,遠心,マイクロ波照射,化学処理による脱水処理により水分を失い体積が減少する。体積の減少の評価は走査型電子顕微鏡(以下、SEM)や原子間力顕微鏡(AFM)などにより観察と計測ができる。
【0032】
接着用パッドあるいはプローブ分子を相互に特異的吸着作用する部位として、ビオチン,アビジン,グルタチオン,レクチン及び抗体等を刺激応答性ポリマー固定化磁性微粒子に固定することで、それらに親和性を有する分子と特異的に結合できる。ビオチンの場合は、アビジンとの特異的な結合を介してビオチン化された目的タンパク質と、またビオチン化された抗体を用いてそれらの抗原である種々のタンパク質と更に結合することが可能である。
【0033】
本発明では、市販されているアビジン,ビオチン化タンパクが利用でき、ビオチン化は、当技術分野で周知の方法に従えばよい。また、ポリマーの重合時にカルボン酸,アミノ基またはエポキシ基等の官能基を持つモノマーを他のモノマーと共重合させ、当技術分野で周知の方法に従い、この官能基を介して、リガンドをポリマー上に固定する方法が利用できる。これにより、刺激応答性ポリマー固定化磁性微粒子と、リガンドとからなる吸着材が得られる。
【0034】
核酸を捕捉するプローブ分子には、DNAやRNAの核酸分子の一本鎖を用いることができる。核酸分子の末端を官能基と同様に予め修飾しておき、微粒子と反応させておく。また、核酸を捕捉するプローブ分子として核酸結合タンパク質や核酸合成酵素を用いることもできる。発現タンパク質にアビジンタグを導入する試薬が市販されており、このような試薬を用いて核酸結合タンパク質や核酸合成酵素を合成することにより、例えば、市販のビオチンで表面が修飾された微粒子表面に容易に核酸結合タンパク質や核酸合成酵素を固定できる。核酸を捕捉するプローブ分子として核酸分子の一本鎖を用いた場合には、特定の相補配列を有する核酸試料分子を捕捉することができる。捕捉後に、核酸合成酵素やヌクレオチドを供給することにより、基板上で核酸伸張反応を起こすこともできる。また、核酸結合タンパク質を用いた場合にも特定の配列を持っている核酸を捕捉することができる。そして、プローブ分子として核酸合成酵素を用いた場合には、非特定の核酸試料分子を捕捉できる。この場合も、ヌクレオチドを供給することにより基板上で核酸伸長反応を起こすことができる。
【0035】
一つの微粒子に固定するプローブ分子は、一分子であることが好ましい。プローブ分子が短い核酸試料断片である場合、微粒子を結合させた後に、一つのプローブ分子が結合した微粒子だけを選択的に取得することができる。例えば、微粒子の数をプローブ分子の数よりも10倍多くして反応させると、約90%の微粒子にはプローブ分子が捕捉されず、約9%の微粒子にはプローブ分子が一分子補足されていた。この結果は、ポアソン分布を仮定した場合の予測結果とよく一致している。したがって、プローブ分子を捕捉した微粒子のみを捕捉すれば、捕集した微粒子のうち90%以上はプローブ分子を一分子のみ捕捉した微粒子となる。この状態で、分子量による分離や磁気微粒子による捕集、電荷の差を用いた電気泳動分離などを利用してプローブ分子が一分子結合した微粒子をさらに高い純度で取得することができる。
【0036】
接着用パッドを平滑支持基板上に形成する方法としては、半導体で既に実用化されている薄膜プロセスを活用することができる。例えば、マスクを通した蒸着・スパッタリング、あるいは蒸着・スパッタリングにより薄膜を形成した後、ドライあるいはウエットエッチングにより製造することができる。規則正しく配置することは、薄膜プロセスを用いることで容易に実現できる。パッド間の間隔は任意に設定できるが、検出手段として光計測を行う場合、光検出の回折限界を考えると500nm以上が好ましい。
【0037】
本実施例の核酸分析デバイスから核酸試料に関する情報を検出するやり方にはいくつかの方式が考えられるが、感度や簡便性の観点から蛍光検出法を用いる方式が好ましい。まず、核酸分析デバイスに対して核酸試料を供給し、プローブ分子に核酸試料を捕捉させる。次に、蛍光色素を有するヌクレオチドを供給し、プローブ分子がDNAプローブである場合には、核酸合成酵素を供給する。デバイス上で核酸伸長反応を起こし、伸長反応中に核酸鎖中に取り込まれた蛍光色素の蛍光測定を行う。この場合、ヌクレオチドの一種類を供給,未反応ヌクレオチドの洗浄,蛍光観察,違う種類のヌクレオチドの供給、以降を繰り返し行う、いわゆる逐次伸長反応方式は容易に実現できる。蛍光観察後に蛍光色素を消光するか、蛍光色素がリン酸部位に付いたヌクレオチドを用いることにより、連続的な反応を起こし、核酸試料の塩基配列情報を得ることができる。一方、4種類のヌクレオチドが各々異なる蛍光色素を有するものを供給し、洗浄することなく、連続的な核酸伸長反応を起こし、連続的に蛍光観察を行うことで、いわゆるリアルタイム反応方式を実現することもできる。この場合、蛍光色素がリン酸部位に付いたヌクレオチドを用いると、伸長反応後リン酸部位が切断されるため、消光することなく連続的に蛍光測定して核酸試料の塩基配列情報を得ることができる。
【0038】
(実施例)
〔デバイスの構成〕
本実施例のデバイスの構成を、図1を用いて説明する。平滑支持基板101の上に接着用パッド102が規則正しく、例えば図1に示すように格子状に形成されている。接着用パッド102と微粒子103は、線状分子105を介して化学結合により結ばれている。線状分子105の末端の官能基106と、接着用パッド102とは化学的相互作用により結合していることが好ましい。その際、官能基106は、平滑支持基板101との相互作用が弱く、接着用パッド102との相互作用が強いことが好ましい。このような観点から、平滑支持基板としては、石英ガラス,サファイア,シリコン基板などを用いることができる。また、接着用パッド102には、金,チタン,ニッケル,アルミから選ばれる材料で構成することができる。官能基106には、平滑支持基板101と接着用パッド102との組合せを考えて選択せねばならないが、例えば、スルホヒドリル基,アミノ基,カルボキシル基,リン酸基,アルデヒド基等を用いることができる。線状分子105は、微粒子103と接着用パッド102を結ぶ役割を果たし、長さに大きな限定はないが、炭素数にして3から20程度の直鎖状分子が好ましい。線状分子105の末端の官能基107は、微粒子103との接着性をもたらす。平滑支持基板には非特異的吸着防止用の薄膜(非特異的吸着防止膜)108が形成されている。薄膜108は微粒子103の非特異的吸着を防止する有機ポリマーを材料としていることが好ましい。例えば、有機ポリマーとしてポリエチレングリコール(PEG),ポリアクリルアミド,3−グリシドキシプロピルメトキシシラン(GOPS)などを用いることができる。微粒子103としては、形状が外部刺激では変形しづらいコア部、例えば、磁性微粒子と、刺激応答性ポリマーとが結合したものを用いることができる。微粒子103の平均粒径は、1〜1000nmであることが好ましく、より好ましくは、30〜200nmである。
【0039】
このように基板を作製した上で、外部刺激を与えることで、微粒子103を変形させて微粒子径を縮小させることで、分子プローブ104と平滑支持基板101との距離を縮めることができる。
【0040】
〔本実施例の効果〕
本実施例のデバイスにおける外部刺激による微粒子の変形の効果について、図2を用いて説明する。平滑支持基板201として厚み0.725mmの石英ガラス基板を用い、その上に接着用パッド202としてTiパッド(直径50nm、厚み10nm)を実施例3に記載の方法で作製した。Tiパッド上にはアミノプロピルリン酸を反応させた後、スクシンイミドービオチンを反応させることにより、Tiパッド上にビオチンを導入した。その後、微粒子203として表面にアビジンがコートされている刺激応答性ポリマー固定化磁性微粒子であるマグナビート社製Therma−Max(登録商標) LA avidinを基板表面に反応させた。次に、基板に100nMのAtto532−biotinを15分間室温で反応させることで固定化された微粒子上に蛍光色素(Atto532)を固定させた。固定反応後、基板上を水で満たした状態で、基板裏面側よりYAGレーザ(532nm)を全反射条件で入射し、発生する蛍光を基板上面側から対物レンズを通して集光しCCDカメラで観察した。次に、基板を取り出し、外部刺激として10分間10-7Paで減圧乾燥した、その後、再度同じ装置・条件で蛍光を測定した。その結果、Atto532の蛍光強度は減圧乾燥処理前後で大きく変動し、減圧乾燥処理後は処理前の凡そ1.7倍ほど強くなっていることが確認された。その後、基板表面を走査型電子顕微鏡(以下、SEM)で2.0kV、50k倍の条件で観察した結果、潰れた微粒子が観察された。厚みは凡そ3〜5nm程度と見積もられた。以上の結果から、微粒子が水を十分含んだ状態では、基板と色素の距離が微粒子の大きさだけ離れているのに対して、乾燥後は微粒子が潰れることで基板と色素の距離が近くなり、その分、色素を励起するエバネッセント光が強くなったために蛍光強度が強くなったものと理解される。
【0041】
以上のように、外部刺激によって形状が変化する(径が小さくなる)微粒子上に評価対象の蛍光色素を持つ分子を固定すると、外部刺激で微粒子径を小さくすることで、蛍光強度を強く観察できることが示された。
【0042】
〔デバイスの製造方法〕
核酸分析デバイスの製造方法の一例を、図3と図4を用いて説明する。平滑支持基板301上に接着用パッド305を構成する材料、例えば、金,チタン,ニッケル,アルミ、をスパッタリングで製膜する。これを金属の薄膜302とする。平滑支持基板301としてガラス基板,サファイア基板を用い、接着用パッド305の材料として金,アルミ,ニッケルを用いる場合には、基板材料と接着用パッド305材料との間に接着を補強するためにチタンやクロムの薄膜を入れることが好ましい。また、接着用パッド305はできる限り薄いほうが好ましい。これは、平滑支持基板301に厚みがあると側面部の面積が増え、接着用パッド305直径が微粒子の直径以下の場合でも、複数の微粒子が固定される可能性が高まるためである。そのため、金属の薄膜302は成膜の時点でできる限り薄く作製するほうが好ましい。
【0043】
この金属の薄膜302の上にレジストでパターンを形成する。次にレジストパターン以外の金属の薄膜302をエッチングにより除去する。さらに電子線用ポジ型レジスト303を剥離すると接着用パッド305が完成する。次に、平滑支持基板301には吸着せず、接着用パッド305には吸着する線状分子304を反応させる。接着用パッド305が金,チタン,アルミ,ニッケルの場合には、線状分子304末端の官能基としては、各々、スルホヒドニル基,リン酸基,チアゾール基を用いることが好ましい。線状分子304の官能基には、例えばビオチンを用いることができる。線状分子304を平滑支持基板301と反応させた後、接着用パッド305を形成した以外の平滑支持基板301表面に薄膜を作製する。
【0044】
薄膜108は微粒子103の非特異的吸着を防止する有機ポリマーを材料とする。非特異的吸着を防止する有機ポリマーの種類は微粒子103の表面状態に合わせて適宜選択する。微粒子103の表面状態が負の電荷を有している場合は、反発するように負に帯電している有機ポリマーを選択する。微粒子103の表面が親水性ならば、有機ポリマーは疎水性のものを選択し、微粒子103の表面が疎水性ならば、有機ポリマーは親水性のものを選択する。例えば、親水性のアビジンが修飾された微粒子103に対して非特異的吸着防止膜306としてポリエチレングリコール(PEG),ポリアクリルアミド,3−グリシドキシプロピルメトキシシラン(GOPS)などを用いることができる。
【0045】
核酸分析デバイスの製造法の一例を図4で説明する。この方法を用いることで、接着用パッド406と平滑支持基板401に選択性を持たない線状分子403でも接着用パッド406上のみに線状分子403を残すことができる。線状分子403は製膜した金属の薄膜402のエッチングの前に反応させることもできる。その場合、線状分子403を反応させてから電子線用ポジ型レジスト404でパターンを形成する。電子線用ポジ型レジスト404で保護された部分以外はエッチングにより、線状分子403ごと除去される。次いで表面に非特異的吸着防止膜405を製膜する。電子線用ポジ型レジスト404剥離をすることで接着用パッド406上のみに線状分子403を残すことができる。
【0046】
微粒子表面には、予めアビジンを修飾しておくことが好ましい。金または白金微粒子を用いる場合には、アミノチオールを反応させた後、ビオチン−スクシンイミド(Pierce社製NHS−Biotin)を反応させ、最後にストレプトアビジンを反応させることにより、アビジン修飾することが容易にできる。金または白金以外の金属微粒子を用いる場合には、酸素雰囲気中で加熱処理することにより表面を酸化処理した後、アミノシランを反応させ、次にビオチン−スクシンイミド(Pierce社製NHS−Biotin)を反応させ、最後にストレプトアビジンを反応させる。これにより、金属微粒子表面をアビジン修飾することが容易にできる。核酸捕捉プローブを固定した微粒子を平滑支持基板401と反応させることにより、本実施例の核酸分析デバイスを製造することができる。
【0047】
〔核酸分析装置の構成〕
本実施例では、核酸分析デバイスを用いた核酸分析装置の好ましい構成の一例について図5を参照しながら説明する。本実施例の核酸分析装置は、核酸分析デバイスに対して、蛍光色素を有するヌクレオチド,核酸合成酵素、及び核酸試料を供給する手段と、核酸分析デバイスに光を照射する手段と、核酸分析デバイス上においてヌクレオチド,核酸合成酵素、及び核酸試料が共存することにより起きる核酸伸長反応により核酸鎖中に取り込まれた蛍光色素の蛍光を測定する発光検出手段と、を備える。より具体的には、カバープレート501と検出窓502と溶液交換用口である注入口503と排出口504から構成される反応チャンバに前記のデバイスを設置する。なお、カバープレート501と検出窓の材質として、PDMS(Polydimethylsiloxane)を使用する。また、検出窓の厚さは0.17mmとする。YAGレーザ光源(波長532nm,出力20mW)507およびYAGレーザ光源(波長355nm,出力20mW)508から発振するレーザ光509および510を、レーザ光509のみをλ/4板511によって円偏光し、ダイクロイックミラー(410nm以下を反射)512によって、前記2つのレーザ光を同軸になるよう調整した後、レンズ513によって集光し、その後、プリズム514を介してデバイス505へ臨界角以上で照射する。蛍光体はレーザ光で励起され、その蛍光の一部は検出窓を介して出射される。また、検出窓より出射される蛍光は、対物レンズ(×60,NA1.35,作動距離0.15mm)515により平行光束とされ、光学フィルタ516により背景光及び励起光が遮断され、結像レンズにより2次元CCDカメラ518上に結像される。
【0048】
逐次反応方式の場合には、蛍光色素付きヌクレオチドとして、P.N.A.S. 2006, vol. 103, pp 19635-19640(非特許文献2)に開示されているような、リボースの3′OHの位置に3′−O−アリル基を保護基として入れ、また、ピリミジンの5位の位置にあるいはプリンの7位の位置にアリル基を介して蛍光色素と結びつけたものが使用できる。アリル基は光照射あるいはパラジウムと接触することで切断されるため、色素の消光と伸長反応の制御を同時に達成することができる。逐次反応でも、未反応のヌクレオチドを洗浄で除去する必要はない。さらに、洗浄工程が必要ないことからリアルタイムで伸長反応を計測することも可能である。この場合には、前記ヌクレオチドにおいて、リボースの3′OHの位置に3′−O−アリル基を保護基として入れる必要は無く、光照射で切断可能な官能基を介して色素と結びついているヌクレオチドを用いれば良い。
【0049】
蛍光色素へのエネルギー移動媒体として半導体微粒子を用いた場合にも、上述の核酸分析装置の例は適用可能である。例えば、半導体微粒子としてQdot(R)565 conjugate(インビトロジェン社製)を用いると、YAGレーザ光源(波長532nm,出力20mW)で十分に励起できる。この励起エネルギーは532nmの光では励起されないアレクサ633(インビトロジェン社製)へ移動することにより蛍光を発するようになる。つまり、未反応のヌクレオチドに付随する色素は励起されることはなく、DNAプローブに捕捉され半導体微粒子に近接しエネルギー移動が起きてはじめて発光するので、捕捉されたヌクレオチドを蛍光測定で識別することが可能である。分子プローブ固定用の微粒子の材質が有機ポリマーである場合は、外部光源の光を照射しても励起しない。そのため、励起エネルギーの移動による蛍光色素の発光は起こらず、未反応のヌクレオチドも発光し、ノイズとなる可能性がある。しかし、核酸合成酵素に半導体微粒子などのエネルギー移動をもたらす微粒子を結合することで、取り込まれたヌクレオチドだけを発光させることができる。あるいは、核酸合成酵素に金,銀,白金,アルミニウム等を結合させれば、取り込まれたヌクレオチドの蛍光を増強させることができる。あるいは、微粒子を固定する金属パッドの材料に金,銀,白金,アルミニウム等を用いれば、金属パッド周囲の蛍光が増強されるため、SN比を向上できる。
【0050】
上記のように、本実施例の核酸分析デバイスを用いて核酸分析装置を組上げることにより、洗浄工程を入れることなく、解析時間の短縮化,デバイス及び分析装置の簡便化が図れ、逐次反応方式のみならず、リアルタイムで塩基の伸長反応を計測することが可能となり、従来技術に対して大幅な時間短縮になる。
【産業上の利用可能性】
【0051】
核酸分析デバイスを用いた核酸分析において、「dephasing」が起こることがないため読み取塩基長を長くでき、かつ、多種類の被解析DNA断片を一度に解析可能であるため、非常に高いスループットとすることができる。
【符号の説明】
【0052】
101,201,301,401 平滑支持基板
102,202,305,406 接着用パッド
103,203 微粒子
104,204 分子プローブ
105,304,403 線状分子
106,107 官能基
108,306,405 非特異的吸着防止膜
302,402 金属の薄膜
303,404 電子線用ポジ型レジスト
501 カバープレート
502 検出窓
503 注入口
504 排出口
505 デバイス
506 流路
507,508 YAGレーザ光源
509,510 レーザ光
511 λ/4板
512 ダイクロイックミラー
513 レンズ
514 プリズム
515 対物レンズ
516 光学フィルタ
517 結像レンズ
518 2次元CCDカメラ
【技術分野】
【0001】
本発明は、核酸分析デバイスおよびそれを用いた核酸分析装置および核酸分析方法に関する。
【背景技術】
【0002】
DNAやタンパク質等の標的物質を検出する手段として、標的物質に蛍光標識を施し、レーザ等所定の励起光を照射して発生する蛍光を検出する方法が広く用いられている。例えば、これらの応用として、P.N.A.S. 2003, Vol. 100, pp. 3960-3964.(非特許文献1)にあるように、基板にDNAなどを固定してその塩基配列を決定する方法が提案されている。この方法は一般にSequencing by synthesisと呼ばれ、基板表面にランダムに分析すべき試料DNA断片を一分子ずつ捕捉し、1塩基ずつ伸長させて、その結果を蛍光計測より検出することにより塩基配列を決定するものである。本方式では、単一DNA分子毎に塩基配列が決定できるため、従来技術の問題であったクローニングやPCR等での試料DNAの精製、増幅が不要にでき、ゲノム解析や遺伝子診断の迅速化が期待できる。また、本方式を用いた塩基配列決定においては蛍光分子励起方法としてエバネッセント光励起が有効である。
【0003】
以下、エバネッセント光について記す。入射側媒質の屈折率n1,出射側媒質の屈折率n2である界面に対し、入射角θで波長λの電磁波(光)を入射する際、θc=sin-1(n2/n1)で与えられるθcを臨界角と呼ぶ(ただし、sin-1はsinの逆関数)。入射角がθ≧θcであるときに電磁波は全反射し、このとき界面の出射側近傍には界面からの距離に従い指数関数的に減衰する電磁場が生じる。この電磁場はエバネッセント場(光)と呼ばれる。エバネッセント場相対強度(E)は界面からの距離(z)の関数で、界面上(z=0)の時に1で最大となり、波長,入射角,屈折率で決まる値dを用いて、E=exp(−z/d)と表される。この値dを染み出し距離と呼ぶ。dは、屈折率n1,出射側媒質の屈折率n2,入射角θ,波長λを用いて、d=λ/4π(n12・sin2θ−n22)-1/2で与えられることが知られている。
【0004】
エバネッセント場は界面からの距離に応じて指数関数的に減衰するため、界面付近に存在する蛍光色素のみを励起することができ、SN比の向上に有効である。一方、励起照射系にレーザで発生させたエバネッセント場を利用した場合、その照野はレーザのスポット径に限定される。そのため、プローブの並列数を増加するには、照野内に核酸試料断片を高密度で一分子ずつ固定する技術が必要である。このとき、できるだけ高密度、且つ規則正しく、平滑な基板上に核酸試料を整列させて固定することが望まれる。これは一回に並列解析できるサンプル数を増やすことと、データ処理時間を短縮するためである。核酸試料を担持させた微粒子を平滑支持基板上にばらまいて固定させる方法は容易であるが、蛍光測定で配列を読み取る段になると、CCDカメラで検出したランダムに存在する微粒子画像から数値データを取得する際、膨大なデータ処理時間がかかってしまうためである。
【0005】
これらの課題を解決するため、特許文献1では予め嵩高い微粒子に核酸プローブを一分子だけ捕捉させ、その微粒子を任意に配列した構造体に選択的に固定する方法を提示している。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特開2010−172271号公報
【非特許文献】
【0007】
【非特許文献1】P.N.A.S. 2003, Vol. 100, pp. 3960-3964.
【非特許文献2】P.N.A.S. 2006, vol. 103, pp. 19635-19640.
【発明の概要】
【発明が解決しようとする課題】
【0008】
特許文献1に記載の方法は一分子の配列固定方法として非常に有効であるが、エバネッセント光励起と併用する場合、微粒子の直径分、微粒子上部と基板表面に距離が発生し励起光が減衰する。上記で述べたように、嵩高い微粒子を用いることで核酸プローブの一分子固定は容易になる反面、エバネッセント場を利用した励起の場合、微粒子径が大きくなることで微粒子表面に捕捉された核酸プローブは界面から離れるため、それに応じて励起光が減衰する。
【0009】
こうした減衰は分子プローブが小さい場合にはほとんど問題にはならないが、例えば、分子プローブが何百塩基から何千塩基にも及ぶ核酸である場合、界面から一定距離離れた核酸の先端部分では取り込まれた蛍光分子が励起できないほど減衰し分析不能になる。
【0010】
さらに流路内で微粒子固定や溶液交換が行われる場合、微粒子径が大きくなるほど液流の抵抗が増大するため、一度固定された微粒子も剥がれやすくなる。以上のような影響を小さくするためには微粒子径は50nm以下であることが望ましい。
【0011】
一方、微粒子径を小さくすることによる弊害もある。微粒子を一つずつ固定する反応に際しては微粒子径に対する接着パッド径は同等程度か同等以下が望ましく、衝突頻度の観点から各々は大きいほど固定され易い。
【0012】
したがって、小さい微粒子(ここでは50nm以下とする)では接着用パッドへの反応効率は低い。さらに接着用パッド径に関しても製造し易さと安定性の面で、大きいほどよく、少なくとも30nm以上であることが望ましい。
【0013】
すなわち、固定反応の観点からは微粒子径と接着用パッドは大きい方が望ましいが、励起の観点からは微粒子は小さい方が望ましい。そのため、微粒子径と接着用パッドは30〜50nm程度に限定されてしまい、固定反応と励起それぞれに関して最適な条件を両立できていない。
【課題を解決するための手段】
【0014】
そこで、嵩高い微粒子として外部刺激応答性微粒子を用いる。はじめに一分子の核酸試料断片を保持した外部刺激応答性微粒子を基板上に一つずつ高密度に且つ規則正しくに整列させて固定し、次いで外部刺激を与え該微粒子の体積を減少させる。
【発明の効果】
【0015】
本発明により、プローブ分子を嵩高い外部刺激応答性微粒子を介して容易に所定位置に一分子ずつ固定でき、次いで外部刺激を与え該微粒子の体積を減少させることで、界面とプローブ間の距離を縮小させ励起光であるエバネッセント光の減衰を抑え、さらに該微粒子と接着パッドとの接着面積が増大することにより核酸プローブ分子を強固に固定できる。さらに、比較的大きい径の微粒子を使用できるため、その大きさに応じた比較的大きい径で製造しやすい接着用パッドを使用できる。
【図面の簡単な説明】
【0016】
【図1】実施例1および実施例2における分子プローブが捕捉された微粒子を配列し、外部刺激により変形したデバイスについての説明図。
【図2】実施例2における微粒子の形状とエバネッセント場の距離の変化についての説明図。
【図3】実施例3におけるデバイスの製造法に関する説明図。
【図4】実施例3におけるデバイスの製造法に関する説明図。
【図5】実施例4における核酸分析装置の構成に関する説明図。
【発明を実施するための形態】
【0017】
本実施例では、検出対象の核酸を捕捉できるプローブ分子を有する微粒子を基板上に規則的に固定した核酸分析用デバイスであって、基板上の微粒子の固定位置に接着用パッドを備え、微粒子と検出用パッドとが化学結合を介して結合しており、前記微粒子が外部刺激により変形することを特徴とする核酸分析デバイスを開示する。
【0018】
さらに、本実施例では、分子プローブを一分子有する微粒子だけを選別し、その微粒子を基板上の接着用パッドに規則的に固定し、前記微粒子を外部刺激により変形させて作製した核酸分析デバイスに対して、蛍光色素を有するヌクレオチド、及び核酸試料を供給する手段と、該核酸分析デバイスにエバネッセント光を照射する手段と、核酸分析デバイス上においてヌクレオチド,核酸合成酵素、及び核酸試料が共存することにより起きる核酸伸長反応により核酸鎖中に取り込まれた蛍光色素の蛍光を測定する発光検出手段と、を備えた核酸試料の塩基配列情報を取得する核酸分析装置を開示する。
【0019】
さらに、本実施例では基板上の前記微粒子の固定位置に接着用のパッドを備え、微粒子と接着用パッドとが化学結合を介して結合しており、接着用パッドの直径が微粒子の直径と同等あるいはそれ以下の大きさであり、基板表面に非特異的吸着防止用の有機物ポリマーを材料とする薄膜層を有する、核酸分析デバイスを開示する。
【0020】
さらに、本実施例では、微粒子1個に対して、一分子の分子プローブが固定されていることを開示する。
【0021】
さらに、本実施例では微粒子が外部刺激応答性重合体から選ばれる材料からなることを特徴とするデバイスであって、外部刺激が、加熱,凍結,減圧,遠心,マイクロ波照射,化学処理から選ばれるものであることを開示する。
【0022】
さらに、本実施例では接着用パッドが、金,チタン,ニッケル、またはアルミから選ばれる材料からなることを開示する。
【0023】
さらに、本実施例では前記核酸分析デバイスに光を照射する手段として、エバネッセント場を利用することを開示する。
【0024】
以下、上記及びその他の本発明の新規な特徴と効果について、図を参照して説明する。ここでは、本発明を完全に理解してもらうため、特定の実施形態について詳細な説明を行うが、本発明はここに記した内容に限定されるものではない。
【0025】
本実施例で例示する刺激応答性微粒子は、形状が外部刺激では変形しづらいコア部、例えば、磁性微粒子と、刺激応答性ポリマーとが、多価アルコールまたは多価アルコール誘導体を介して固定されている。この刺激応答性ポリマーは、磁性微粒子表面に固定された多価アルコールまたは多価アルコール誘導体にグラフト重合されるか、またはそのポリマー末端または側鎖の官能基と、多価アルコールまたは多価アルコール誘導体の有する官能基との結合によって、固定されている。その刺激応答性ポリマー固定化磁性微粒子の平均粒径は、1〜1000nmであることが好ましく、より好ましくは、30〜200nmである。
【0026】
今回使用した刺激応答性ポリマーは、熱応答性ポリマーである。熱応答性ポリマーは特定の分子構造を持ち、水中で下限臨界溶液温度(LOWER Critical Solution temperature,LCST)を有し、ある温度を境にそれより高い温度ではその分子内、或いは分子間の疎水結合が強まりポリマー鎖が凝集し、逆に、低い温度ではポリマー鎖が水分子を結合し水和する相転移挙動を示す。その相転移現象は可逆的であり、スイッチング基剤と呼ばれる。また、上限臨界溶液温度(Upper Critical Solution temperature,UCST)を有するものは、ある温度を境にそれより低い温度で凝集し、高い温度ではポリマー鎖が水分子を結合し水和する相転移挙動を示す。
【0027】
熱応答性ポリマーの中で、N−イソプロピルアクリルアミドは最もよく研究されており、側鎖に親水性部分と疎水性部分両方を持つLCSTが32℃のポリマーである。すなわち、32℃以上の温度では側鎖の疎水性部分であるイソプロピル基によって分子内,分子間において疎水結合が強まりポリマー鎖が凝集し、32℃より低い温度ではもう一方の親水性部分のアミド結合と水分子とが結合するため水に溶解する。こうした相転移現象はアクリレートの添加などで阻害することもできる。
【0028】
熱応答性ポリマーは、下限臨界溶液温度を有するポリマー及び上限臨界溶液温度を有するポリマーに区別される。
【0029】
下限臨界溶液温度を有するポリマーは、N置換(メタ)アクリルアミド誘導体からなるポリマー,ポリオキシエチレンアルキルアミン誘導体,ポリオキシエチレンソルビタンラウレート等のポリオキシエチレンソルビタンエステル誘導体,(ポリオキシエチレンアルキルフェニルエーテル)(メタ)アクリレート類、および(ポリオキシエチレンアルキルエーテル)(メタ)アクリレート類等のポリオキシエチレン(メタ)アクリル酸エステル誘導体等である。また、これらの重合体及びこれらの少なくとも2種の単量体からなるコポリマーも利用できる。これらのなかでも、N−n−プロピルアクリルアミド,N−イソプロピルアクリルアミド,N−エチルアクリルアミド,N,N−ジメチルアクリルアミド,N−アクリロイルピロリジン,N−アクリロイルピペリジン,N−アクリロイルモルホリン,N−n−プロピルメタクリルアミド,N−イソプロピルメタクリルアミド,N−エチルメタクリルアミド,N,N−ジメチルメタクリルアミド,N−メタクリロイルピロリジン,N−メタクリロイルピペリジン,N−メタクリロイルモルホリンからなる群から選ばれる少なくとも1種の単量体からなるポリマーが好ましく利用できる。
【0030】
また、上限臨界溶液温度を有するポリマーは、アクリルアミド,アセチルアクリルアミド,ビオチノールアクリレート,N−ビオチニル−N′−メタクロイルトリメチレンアミド,アクロイルグリシンアミド,アクロイルザルコシンアミド,メタクリルザルコシンアミド,アクロイルニペコタミド及びアクロイルメチルウラシル等からなる群から選ばれる少なくとも1種の単量体からなるポリマーである。また、これらの少なくとも2種の単量体からなるコポリマーも利用できる。これらのなかでも、アクリルアミド,アセチルアクリルアミド,ビオチノールアクリレート,N−ビオチニル−N′−メタクロイルトリメチレンアミド,アクロイルグリシンアミド,アクロイルザルコシンアミド,メタクリルザルコシンアミド,アクロイルニペコタミド及びアクロイルメチルウラシルからなる群から選ばれる少なくとも1種が好ましく利用できる。
【0031】
以上の材料により製造されたゲル状微粒子は加熱,凍結,減圧,遠心,マイクロ波照射,化学処理による脱水処理により水分を失い体積が減少する。体積の減少の評価は走査型電子顕微鏡(以下、SEM)や原子間力顕微鏡(AFM)などにより観察と計測ができる。
【0032】
接着用パッドあるいはプローブ分子を相互に特異的吸着作用する部位として、ビオチン,アビジン,グルタチオン,レクチン及び抗体等を刺激応答性ポリマー固定化磁性微粒子に固定することで、それらに親和性を有する分子と特異的に結合できる。ビオチンの場合は、アビジンとの特異的な結合を介してビオチン化された目的タンパク質と、またビオチン化された抗体を用いてそれらの抗原である種々のタンパク質と更に結合することが可能である。
【0033】
本発明では、市販されているアビジン,ビオチン化タンパクが利用でき、ビオチン化は、当技術分野で周知の方法に従えばよい。また、ポリマーの重合時にカルボン酸,アミノ基またはエポキシ基等の官能基を持つモノマーを他のモノマーと共重合させ、当技術分野で周知の方法に従い、この官能基を介して、リガンドをポリマー上に固定する方法が利用できる。これにより、刺激応答性ポリマー固定化磁性微粒子と、リガンドとからなる吸着材が得られる。
【0034】
核酸を捕捉するプローブ分子には、DNAやRNAの核酸分子の一本鎖を用いることができる。核酸分子の末端を官能基と同様に予め修飾しておき、微粒子と反応させておく。また、核酸を捕捉するプローブ分子として核酸結合タンパク質や核酸合成酵素を用いることもできる。発現タンパク質にアビジンタグを導入する試薬が市販されており、このような試薬を用いて核酸結合タンパク質や核酸合成酵素を合成することにより、例えば、市販のビオチンで表面が修飾された微粒子表面に容易に核酸結合タンパク質や核酸合成酵素を固定できる。核酸を捕捉するプローブ分子として核酸分子の一本鎖を用いた場合には、特定の相補配列を有する核酸試料分子を捕捉することができる。捕捉後に、核酸合成酵素やヌクレオチドを供給することにより、基板上で核酸伸張反応を起こすこともできる。また、核酸結合タンパク質を用いた場合にも特定の配列を持っている核酸を捕捉することができる。そして、プローブ分子として核酸合成酵素を用いた場合には、非特定の核酸試料分子を捕捉できる。この場合も、ヌクレオチドを供給することにより基板上で核酸伸長反応を起こすことができる。
【0035】
一つの微粒子に固定するプローブ分子は、一分子であることが好ましい。プローブ分子が短い核酸試料断片である場合、微粒子を結合させた後に、一つのプローブ分子が結合した微粒子だけを選択的に取得することができる。例えば、微粒子の数をプローブ分子の数よりも10倍多くして反応させると、約90%の微粒子にはプローブ分子が捕捉されず、約9%の微粒子にはプローブ分子が一分子補足されていた。この結果は、ポアソン分布を仮定した場合の予測結果とよく一致している。したがって、プローブ分子を捕捉した微粒子のみを捕捉すれば、捕集した微粒子のうち90%以上はプローブ分子を一分子のみ捕捉した微粒子となる。この状態で、分子量による分離や磁気微粒子による捕集、電荷の差を用いた電気泳動分離などを利用してプローブ分子が一分子結合した微粒子をさらに高い純度で取得することができる。
【0036】
接着用パッドを平滑支持基板上に形成する方法としては、半導体で既に実用化されている薄膜プロセスを活用することができる。例えば、マスクを通した蒸着・スパッタリング、あるいは蒸着・スパッタリングにより薄膜を形成した後、ドライあるいはウエットエッチングにより製造することができる。規則正しく配置することは、薄膜プロセスを用いることで容易に実現できる。パッド間の間隔は任意に設定できるが、検出手段として光計測を行う場合、光検出の回折限界を考えると500nm以上が好ましい。
【0037】
本実施例の核酸分析デバイスから核酸試料に関する情報を検出するやり方にはいくつかの方式が考えられるが、感度や簡便性の観点から蛍光検出法を用いる方式が好ましい。まず、核酸分析デバイスに対して核酸試料を供給し、プローブ分子に核酸試料を捕捉させる。次に、蛍光色素を有するヌクレオチドを供給し、プローブ分子がDNAプローブである場合には、核酸合成酵素を供給する。デバイス上で核酸伸長反応を起こし、伸長反応中に核酸鎖中に取り込まれた蛍光色素の蛍光測定を行う。この場合、ヌクレオチドの一種類を供給,未反応ヌクレオチドの洗浄,蛍光観察,違う種類のヌクレオチドの供給、以降を繰り返し行う、いわゆる逐次伸長反応方式は容易に実現できる。蛍光観察後に蛍光色素を消光するか、蛍光色素がリン酸部位に付いたヌクレオチドを用いることにより、連続的な反応を起こし、核酸試料の塩基配列情報を得ることができる。一方、4種類のヌクレオチドが各々異なる蛍光色素を有するものを供給し、洗浄することなく、連続的な核酸伸長反応を起こし、連続的に蛍光観察を行うことで、いわゆるリアルタイム反応方式を実現することもできる。この場合、蛍光色素がリン酸部位に付いたヌクレオチドを用いると、伸長反応後リン酸部位が切断されるため、消光することなく連続的に蛍光測定して核酸試料の塩基配列情報を得ることができる。
【0038】
(実施例)
〔デバイスの構成〕
本実施例のデバイスの構成を、図1を用いて説明する。平滑支持基板101の上に接着用パッド102が規則正しく、例えば図1に示すように格子状に形成されている。接着用パッド102と微粒子103は、線状分子105を介して化学結合により結ばれている。線状分子105の末端の官能基106と、接着用パッド102とは化学的相互作用により結合していることが好ましい。その際、官能基106は、平滑支持基板101との相互作用が弱く、接着用パッド102との相互作用が強いことが好ましい。このような観点から、平滑支持基板としては、石英ガラス,サファイア,シリコン基板などを用いることができる。また、接着用パッド102には、金,チタン,ニッケル,アルミから選ばれる材料で構成することができる。官能基106には、平滑支持基板101と接着用パッド102との組合せを考えて選択せねばならないが、例えば、スルホヒドリル基,アミノ基,カルボキシル基,リン酸基,アルデヒド基等を用いることができる。線状分子105は、微粒子103と接着用パッド102を結ぶ役割を果たし、長さに大きな限定はないが、炭素数にして3から20程度の直鎖状分子が好ましい。線状分子105の末端の官能基107は、微粒子103との接着性をもたらす。平滑支持基板には非特異的吸着防止用の薄膜(非特異的吸着防止膜)108が形成されている。薄膜108は微粒子103の非特異的吸着を防止する有機ポリマーを材料としていることが好ましい。例えば、有機ポリマーとしてポリエチレングリコール(PEG),ポリアクリルアミド,3−グリシドキシプロピルメトキシシラン(GOPS)などを用いることができる。微粒子103としては、形状が外部刺激では変形しづらいコア部、例えば、磁性微粒子と、刺激応答性ポリマーとが結合したものを用いることができる。微粒子103の平均粒径は、1〜1000nmであることが好ましく、より好ましくは、30〜200nmである。
【0039】
このように基板を作製した上で、外部刺激を与えることで、微粒子103を変形させて微粒子径を縮小させることで、分子プローブ104と平滑支持基板101との距離を縮めることができる。
【0040】
〔本実施例の効果〕
本実施例のデバイスにおける外部刺激による微粒子の変形の効果について、図2を用いて説明する。平滑支持基板201として厚み0.725mmの石英ガラス基板を用い、その上に接着用パッド202としてTiパッド(直径50nm、厚み10nm)を実施例3に記載の方法で作製した。Tiパッド上にはアミノプロピルリン酸を反応させた後、スクシンイミドービオチンを反応させることにより、Tiパッド上にビオチンを導入した。その後、微粒子203として表面にアビジンがコートされている刺激応答性ポリマー固定化磁性微粒子であるマグナビート社製Therma−Max(登録商標) LA avidinを基板表面に反応させた。次に、基板に100nMのAtto532−biotinを15分間室温で反応させることで固定化された微粒子上に蛍光色素(Atto532)を固定させた。固定反応後、基板上を水で満たした状態で、基板裏面側よりYAGレーザ(532nm)を全反射条件で入射し、発生する蛍光を基板上面側から対物レンズを通して集光しCCDカメラで観察した。次に、基板を取り出し、外部刺激として10分間10-7Paで減圧乾燥した、その後、再度同じ装置・条件で蛍光を測定した。その結果、Atto532の蛍光強度は減圧乾燥処理前後で大きく変動し、減圧乾燥処理後は処理前の凡そ1.7倍ほど強くなっていることが確認された。その後、基板表面を走査型電子顕微鏡(以下、SEM)で2.0kV、50k倍の条件で観察した結果、潰れた微粒子が観察された。厚みは凡そ3〜5nm程度と見積もられた。以上の結果から、微粒子が水を十分含んだ状態では、基板と色素の距離が微粒子の大きさだけ離れているのに対して、乾燥後は微粒子が潰れることで基板と色素の距離が近くなり、その分、色素を励起するエバネッセント光が強くなったために蛍光強度が強くなったものと理解される。
【0041】
以上のように、外部刺激によって形状が変化する(径が小さくなる)微粒子上に評価対象の蛍光色素を持つ分子を固定すると、外部刺激で微粒子径を小さくすることで、蛍光強度を強く観察できることが示された。
【0042】
〔デバイスの製造方法〕
核酸分析デバイスの製造方法の一例を、図3と図4を用いて説明する。平滑支持基板301上に接着用パッド305を構成する材料、例えば、金,チタン,ニッケル,アルミ、をスパッタリングで製膜する。これを金属の薄膜302とする。平滑支持基板301としてガラス基板,サファイア基板を用い、接着用パッド305の材料として金,アルミ,ニッケルを用いる場合には、基板材料と接着用パッド305材料との間に接着を補強するためにチタンやクロムの薄膜を入れることが好ましい。また、接着用パッド305はできる限り薄いほうが好ましい。これは、平滑支持基板301に厚みがあると側面部の面積が増え、接着用パッド305直径が微粒子の直径以下の場合でも、複数の微粒子が固定される可能性が高まるためである。そのため、金属の薄膜302は成膜の時点でできる限り薄く作製するほうが好ましい。
【0043】
この金属の薄膜302の上にレジストでパターンを形成する。次にレジストパターン以外の金属の薄膜302をエッチングにより除去する。さらに電子線用ポジ型レジスト303を剥離すると接着用パッド305が完成する。次に、平滑支持基板301には吸着せず、接着用パッド305には吸着する線状分子304を反応させる。接着用パッド305が金,チタン,アルミ,ニッケルの場合には、線状分子304末端の官能基としては、各々、スルホヒドニル基,リン酸基,チアゾール基を用いることが好ましい。線状分子304の官能基には、例えばビオチンを用いることができる。線状分子304を平滑支持基板301と反応させた後、接着用パッド305を形成した以外の平滑支持基板301表面に薄膜を作製する。
【0044】
薄膜108は微粒子103の非特異的吸着を防止する有機ポリマーを材料とする。非特異的吸着を防止する有機ポリマーの種類は微粒子103の表面状態に合わせて適宜選択する。微粒子103の表面状態が負の電荷を有している場合は、反発するように負に帯電している有機ポリマーを選択する。微粒子103の表面が親水性ならば、有機ポリマーは疎水性のものを選択し、微粒子103の表面が疎水性ならば、有機ポリマーは親水性のものを選択する。例えば、親水性のアビジンが修飾された微粒子103に対して非特異的吸着防止膜306としてポリエチレングリコール(PEG),ポリアクリルアミド,3−グリシドキシプロピルメトキシシラン(GOPS)などを用いることができる。
【0045】
核酸分析デバイスの製造法の一例を図4で説明する。この方法を用いることで、接着用パッド406と平滑支持基板401に選択性を持たない線状分子403でも接着用パッド406上のみに線状分子403を残すことができる。線状分子403は製膜した金属の薄膜402のエッチングの前に反応させることもできる。その場合、線状分子403を反応させてから電子線用ポジ型レジスト404でパターンを形成する。電子線用ポジ型レジスト404で保護された部分以外はエッチングにより、線状分子403ごと除去される。次いで表面に非特異的吸着防止膜405を製膜する。電子線用ポジ型レジスト404剥離をすることで接着用パッド406上のみに線状分子403を残すことができる。
【0046】
微粒子表面には、予めアビジンを修飾しておくことが好ましい。金または白金微粒子を用いる場合には、アミノチオールを反応させた後、ビオチン−スクシンイミド(Pierce社製NHS−Biotin)を反応させ、最後にストレプトアビジンを反応させることにより、アビジン修飾することが容易にできる。金または白金以外の金属微粒子を用いる場合には、酸素雰囲気中で加熱処理することにより表面を酸化処理した後、アミノシランを反応させ、次にビオチン−スクシンイミド(Pierce社製NHS−Biotin)を反応させ、最後にストレプトアビジンを反応させる。これにより、金属微粒子表面をアビジン修飾することが容易にできる。核酸捕捉プローブを固定した微粒子を平滑支持基板401と反応させることにより、本実施例の核酸分析デバイスを製造することができる。
【0047】
〔核酸分析装置の構成〕
本実施例では、核酸分析デバイスを用いた核酸分析装置の好ましい構成の一例について図5を参照しながら説明する。本実施例の核酸分析装置は、核酸分析デバイスに対して、蛍光色素を有するヌクレオチド,核酸合成酵素、及び核酸試料を供給する手段と、核酸分析デバイスに光を照射する手段と、核酸分析デバイス上においてヌクレオチド,核酸合成酵素、及び核酸試料が共存することにより起きる核酸伸長反応により核酸鎖中に取り込まれた蛍光色素の蛍光を測定する発光検出手段と、を備える。より具体的には、カバープレート501と検出窓502と溶液交換用口である注入口503と排出口504から構成される反応チャンバに前記のデバイスを設置する。なお、カバープレート501と検出窓の材質として、PDMS(Polydimethylsiloxane)を使用する。また、検出窓の厚さは0.17mmとする。YAGレーザ光源(波長532nm,出力20mW)507およびYAGレーザ光源(波長355nm,出力20mW)508から発振するレーザ光509および510を、レーザ光509のみをλ/4板511によって円偏光し、ダイクロイックミラー(410nm以下を反射)512によって、前記2つのレーザ光を同軸になるよう調整した後、レンズ513によって集光し、その後、プリズム514を介してデバイス505へ臨界角以上で照射する。蛍光体はレーザ光で励起され、その蛍光の一部は検出窓を介して出射される。また、検出窓より出射される蛍光は、対物レンズ(×60,NA1.35,作動距離0.15mm)515により平行光束とされ、光学フィルタ516により背景光及び励起光が遮断され、結像レンズにより2次元CCDカメラ518上に結像される。
【0048】
逐次反応方式の場合には、蛍光色素付きヌクレオチドとして、P.N.A.S. 2006, vol. 103, pp 19635-19640(非特許文献2)に開示されているような、リボースの3′OHの位置に3′−O−アリル基を保護基として入れ、また、ピリミジンの5位の位置にあるいはプリンの7位の位置にアリル基を介して蛍光色素と結びつけたものが使用できる。アリル基は光照射あるいはパラジウムと接触することで切断されるため、色素の消光と伸長反応の制御を同時に達成することができる。逐次反応でも、未反応のヌクレオチドを洗浄で除去する必要はない。さらに、洗浄工程が必要ないことからリアルタイムで伸長反応を計測することも可能である。この場合には、前記ヌクレオチドにおいて、リボースの3′OHの位置に3′−O−アリル基を保護基として入れる必要は無く、光照射で切断可能な官能基を介して色素と結びついているヌクレオチドを用いれば良い。
【0049】
蛍光色素へのエネルギー移動媒体として半導体微粒子を用いた場合にも、上述の核酸分析装置の例は適用可能である。例えば、半導体微粒子としてQdot(R)565 conjugate(インビトロジェン社製)を用いると、YAGレーザ光源(波長532nm,出力20mW)で十分に励起できる。この励起エネルギーは532nmの光では励起されないアレクサ633(インビトロジェン社製)へ移動することにより蛍光を発するようになる。つまり、未反応のヌクレオチドに付随する色素は励起されることはなく、DNAプローブに捕捉され半導体微粒子に近接しエネルギー移動が起きてはじめて発光するので、捕捉されたヌクレオチドを蛍光測定で識別することが可能である。分子プローブ固定用の微粒子の材質が有機ポリマーである場合は、外部光源の光を照射しても励起しない。そのため、励起エネルギーの移動による蛍光色素の発光は起こらず、未反応のヌクレオチドも発光し、ノイズとなる可能性がある。しかし、核酸合成酵素に半導体微粒子などのエネルギー移動をもたらす微粒子を結合することで、取り込まれたヌクレオチドだけを発光させることができる。あるいは、核酸合成酵素に金,銀,白金,アルミニウム等を結合させれば、取り込まれたヌクレオチドの蛍光を増強させることができる。あるいは、微粒子を固定する金属パッドの材料に金,銀,白金,アルミニウム等を用いれば、金属パッド周囲の蛍光が増強されるため、SN比を向上できる。
【0050】
上記のように、本実施例の核酸分析デバイスを用いて核酸分析装置を組上げることにより、洗浄工程を入れることなく、解析時間の短縮化,デバイス及び分析装置の簡便化が図れ、逐次反応方式のみならず、リアルタイムで塩基の伸長反応を計測することが可能となり、従来技術に対して大幅な時間短縮になる。
【産業上の利用可能性】
【0051】
核酸分析デバイスを用いた核酸分析において、「dephasing」が起こることがないため読み取塩基長を長くでき、かつ、多種類の被解析DNA断片を一度に解析可能であるため、非常に高いスループットとすることができる。
【符号の説明】
【0052】
101,201,301,401 平滑支持基板
102,202,305,406 接着用パッド
103,203 微粒子
104,204 分子プローブ
105,304,403 線状分子
106,107 官能基
108,306,405 非特異的吸着防止膜
302,402 金属の薄膜
303,404 電子線用ポジ型レジスト
501 カバープレート
502 検出窓
503 注入口
504 排出口
505 デバイス
506 流路
507,508 YAGレーザ光源
509,510 レーザ光
511 λ/4板
512 ダイクロイックミラー
513 レンズ
514 プリズム
515 対物レンズ
516 光学フィルタ
517 結像レンズ
518 2次元CCDカメラ
【特許請求の範囲】
【請求項1】
検出対象の核酸を捕捉できるプローブ分子を有する微粒子を基板上に固定した核酸分析デバイスであって、
前記基板上の前記微粒子の固定位置に接着用パッドを備え、前記微粒子と前記接着用パッドとが化学結合を介して結合しており、前記微粒子は外部刺激により変形することを特徴とする核酸分析デバイス。
【請求項2】
請求項1に記載の核酸分析デバイスであって、
前記微粒子は、外部刺激応答性重合体から選ばれる材料であることを特徴とする核酸分析デバイス。
【請求項3】
請求項2に記載の核酸分析デバイスであって、
前記微粒子は、磁性微粒子と刺激応答性ポリマーとが多価アルコールまたは多価アルコール誘導体を介して固定されて成ることを特徴とする核酸分析デバイス。
【請求項4】
請求項3に記載の核酸分析デバイスであって、
前記刺激応答性ポリマーは、熱応答性ポリマーであることを特徴とする核酸分析デバイス。
【請求項5】
請求項1に記載の核酸分析デバイスであって、
上記外部刺激は、加熱,凍結,減圧,遠心,マイクロ波照射、および化学処理から選ばれるものである核酸分析デバイス。
【請求項6】
請求項1に記載の核酸分析デバイスであって、
前記プローブ分子は、核酸、または核酸合成酵素であることを特徴とする核酸分析デバイス。
【請求項7】
請求項1に記載の核酸分析デバイスであって、
前記微粒子1つには、前記プローブ分子1つが固定されていることを特徴とする核酸分析デバイス。
【請求項8】
請求項1に記載の核酸分析デバイスであって、
前記接着用パッドが、金,チタン,ニッケル、又はアルミから選ばれる材料からなることを特徴とする核酸分析デバイス。
【請求項9】
検出対象の核酸を捕捉できるプローブ分子を有する微粒子を基板上に固定して成る核酸分析デバイスと、前記核酸分析デバイスに対して、蛍光色素を有するヌクレオチド,核酸合成酵素、及び核酸試料を供給する手段と、前記核酸分析デバイスに光を照射する手段と、前記核酸分析デバイス上において前記ヌクレオチド,前記核酸合成酵素、及び前記核酸試料が共存することにより起きる核酸伸長反応により核酸鎖中に取り込まれた蛍光色素の蛍光を測定する発光検出手段を備え、
前記微粒子は、外部刺激により変形することを特徴とする核酸分析装置。
【請求項10】
請求項9に記載の核酸分析装置において、
前記基板上の前記微粒子の固定位置に接着用パッドを備え、前記微粒子と前記接着用パッドとが化学結合を介して結合していることを特徴とする核酸分析装置。
【請求項11】
請求項9に記載の核酸分析装置であって、
前記微粒子は、外部刺激応答性重合体から選ばれる材料であることを特徴とする核酸分析装置。
【請求項12】
請求項9に記載の核酸分析装置であって、
前記微粒子は、磁性微粒子と刺激応答性ポリマーとが多価アルコールまたは多価アルコール誘導体を介して固定されて成ることを特徴とする核酸分析装置。
【請求項13】
請求項12に記載の核酸分析装置であって、
前記刺激応答性ポリマーは、熱応答性ポリマーであることを特徴とする核酸分析装置。
【請求項14】
請求項9に記載の核酸分析デバイスであって、
上記外部刺激は、加熱,凍結,減圧,遠心,マイクロ波照射、および化学処理から選ばれるものである核酸分析装置。
【請求項15】
請求項9に記載の核酸分析装置であって、
前記プローブ分子は、核酸、または核酸合成酵素であることを特徴とする核酸分析装置。
【請求項16】
請求項9に記載の核酸分析装置であって、
前記微粒子1つには、前記プローブ分子1つが固定されていることを特徴とする核酸分析装置。
【請求項17】
請求項10に記載の核酸分析装置であって、
接着用パッドが、金,チタン,ニッケル、又はアルミから選ばれる材料からなることを特徴とする核酸分析装置。
【請求項18】
検出対象の核酸を捕捉できるプローブ分子を有する微粒子を基板上に固定した核酸分析デバイスであって、
前記基板上の前記微粒子の固定位置に接着用パッドを備え、前記微粒子と前記接着用パッドとが化学結合を介して結合しており、前記微粒子は外部刺激により変形していることを特徴とする核酸分析デバイス。
【請求項19】
請求項18に記載の核酸分析デバイスであって、
前記微粒子は、基板側へ圧縮された形状を有することを特徴とする核酸分析デバイス。
【請求項20】
請求項18に記載の核酸分析デバイスであって、
前記微粒子は、変形後は変形前よりも前記微粒子の上部から基板表面までの距離が短いことを特徴とする核酸分析デバイス。
【請求項21】
請求項18〜20のいずれかの核酸分析デバイスと、前記核酸分析デバイスに対して、蛍光色素を有するヌクレオチド,核酸合成酵素、及び核酸試料を供給する手段と、前記核酸分析デバイスに光を照射する手段と、前記核酸分析デバイス上において前記ヌクレオチド,前記核酸合成酵素、及び前記核酸試料が共存することにより起きる核酸伸長反応により核酸鎖中に取り込まれた蛍光色素の蛍光を測定する発光検出手段とを備えたことを特徴とする核酸分析装置。
【請求項22】
検出対象の核酸を捕捉できるプローブ分子を有する微粒子を基板上に固定した核酸分析デバイスを用いた核酸分析方法であって、
前記基板上の前記微粒子の固定位置に備えられた接着用パッドと前記微粒子とを化学結合を介して結合させる工程、前記微粒子は外部刺激により変形させる工程を有することを特徴とする核酸分析方法。
【請求項23】
請求項22に記載の核酸分析方法であって、
上記外部刺激は、加熱,凍結,減圧,遠心,マイクロ波照射、および化学処理から選ばれるものである核酸分析方法。
【請求項1】
検出対象の核酸を捕捉できるプローブ分子を有する微粒子を基板上に固定した核酸分析デバイスであって、
前記基板上の前記微粒子の固定位置に接着用パッドを備え、前記微粒子と前記接着用パッドとが化学結合を介して結合しており、前記微粒子は外部刺激により変形することを特徴とする核酸分析デバイス。
【請求項2】
請求項1に記載の核酸分析デバイスであって、
前記微粒子は、外部刺激応答性重合体から選ばれる材料であることを特徴とする核酸分析デバイス。
【請求項3】
請求項2に記載の核酸分析デバイスであって、
前記微粒子は、磁性微粒子と刺激応答性ポリマーとが多価アルコールまたは多価アルコール誘導体を介して固定されて成ることを特徴とする核酸分析デバイス。
【請求項4】
請求項3に記載の核酸分析デバイスであって、
前記刺激応答性ポリマーは、熱応答性ポリマーであることを特徴とする核酸分析デバイス。
【請求項5】
請求項1に記載の核酸分析デバイスであって、
上記外部刺激は、加熱,凍結,減圧,遠心,マイクロ波照射、および化学処理から選ばれるものである核酸分析デバイス。
【請求項6】
請求項1に記載の核酸分析デバイスであって、
前記プローブ分子は、核酸、または核酸合成酵素であることを特徴とする核酸分析デバイス。
【請求項7】
請求項1に記載の核酸分析デバイスであって、
前記微粒子1つには、前記プローブ分子1つが固定されていることを特徴とする核酸分析デバイス。
【請求項8】
請求項1に記載の核酸分析デバイスであって、
前記接着用パッドが、金,チタン,ニッケル、又はアルミから選ばれる材料からなることを特徴とする核酸分析デバイス。
【請求項9】
検出対象の核酸を捕捉できるプローブ分子を有する微粒子を基板上に固定して成る核酸分析デバイスと、前記核酸分析デバイスに対して、蛍光色素を有するヌクレオチド,核酸合成酵素、及び核酸試料を供給する手段と、前記核酸分析デバイスに光を照射する手段と、前記核酸分析デバイス上において前記ヌクレオチド,前記核酸合成酵素、及び前記核酸試料が共存することにより起きる核酸伸長反応により核酸鎖中に取り込まれた蛍光色素の蛍光を測定する発光検出手段を備え、
前記微粒子は、外部刺激により変形することを特徴とする核酸分析装置。
【請求項10】
請求項9に記載の核酸分析装置において、
前記基板上の前記微粒子の固定位置に接着用パッドを備え、前記微粒子と前記接着用パッドとが化学結合を介して結合していることを特徴とする核酸分析装置。
【請求項11】
請求項9に記載の核酸分析装置であって、
前記微粒子は、外部刺激応答性重合体から選ばれる材料であることを特徴とする核酸分析装置。
【請求項12】
請求項9に記載の核酸分析装置であって、
前記微粒子は、磁性微粒子と刺激応答性ポリマーとが多価アルコールまたは多価アルコール誘導体を介して固定されて成ることを特徴とする核酸分析装置。
【請求項13】
請求項12に記載の核酸分析装置であって、
前記刺激応答性ポリマーは、熱応答性ポリマーであることを特徴とする核酸分析装置。
【請求項14】
請求項9に記載の核酸分析デバイスであって、
上記外部刺激は、加熱,凍結,減圧,遠心,マイクロ波照射、および化学処理から選ばれるものである核酸分析装置。
【請求項15】
請求項9に記載の核酸分析装置であって、
前記プローブ分子は、核酸、または核酸合成酵素であることを特徴とする核酸分析装置。
【請求項16】
請求項9に記載の核酸分析装置であって、
前記微粒子1つには、前記プローブ分子1つが固定されていることを特徴とする核酸分析装置。
【請求項17】
請求項10に記載の核酸分析装置であって、
接着用パッドが、金,チタン,ニッケル、又はアルミから選ばれる材料からなることを特徴とする核酸分析装置。
【請求項18】
検出対象の核酸を捕捉できるプローブ分子を有する微粒子を基板上に固定した核酸分析デバイスであって、
前記基板上の前記微粒子の固定位置に接着用パッドを備え、前記微粒子と前記接着用パッドとが化学結合を介して結合しており、前記微粒子は外部刺激により変形していることを特徴とする核酸分析デバイス。
【請求項19】
請求項18に記載の核酸分析デバイスであって、
前記微粒子は、基板側へ圧縮された形状を有することを特徴とする核酸分析デバイス。
【請求項20】
請求項18に記載の核酸分析デバイスであって、
前記微粒子は、変形後は変形前よりも前記微粒子の上部から基板表面までの距離が短いことを特徴とする核酸分析デバイス。
【請求項21】
請求項18〜20のいずれかの核酸分析デバイスと、前記核酸分析デバイスに対して、蛍光色素を有するヌクレオチド,核酸合成酵素、及び核酸試料を供給する手段と、前記核酸分析デバイスに光を照射する手段と、前記核酸分析デバイス上において前記ヌクレオチド,前記核酸合成酵素、及び前記核酸試料が共存することにより起きる核酸伸長反応により核酸鎖中に取り込まれた蛍光色素の蛍光を測定する発光検出手段とを備えたことを特徴とする核酸分析装置。
【請求項22】
検出対象の核酸を捕捉できるプローブ分子を有する微粒子を基板上に固定した核酸分析デバイスを用いた核酸分析方法であって、
前記基板上の前記微粒子の固定位置に備えられた接着用パッドと前記微粒子とを化学結合を介して結合させる工程、前記微粒子は外部刺激により変形させる工程を有することを特徴とする核酸分析方法。
【請求項23】
請求項22に記載の核酸分析方法であって、
上記外部刺激は、加熱,凍結,減圧,遠心,マイクロ波照射、および化学処理から選ばれるものである核酸分析方法。
【図1】


【図2】


【図3】


【図4】


【図5】




【図2】


【図3】


【図4】


【図5】


【公開番号】特開2012−58114(P2012−58114A)
【公開日】平成24年3月22日(2012.3.22)
【国際特許分類】
【出願番号】特願2010−202630(P2010−202630)
【出願日】平成22年9月10日(2010.9.10)
【出願人】(501387839)株式会社日立ハイテクノロジーズ (4,325)
【Fターム(参考)】
【公開日】平成24年3月22日(2012.3.22)
【国際特許分類】
【出願日】平成22年9月10日(2010.9.10)
【出願人】(501387839)株式会社日立ハイテクノロジーズ (4,325)
【Fターム(参考)】
[ Back to top ]

