核酸分析装置、及び、核酸の分離精製方法
【課題】精度の高い遺伝子検査を簡便に行うことができる核酸分析装置、及び核酸の分離精製方法を提供する。
【解決手段】核酸分析装置は、被検体から核酸を分離精製する核酸精製キット10を備え、核酸精製キット10は、(オイル)分注チップ201が収容された分注チップラック200と;試薬カートリッジ100と;分注チップラック200に収容された複数の(試薬)分注チップ200と;を有し、試薬カートリッジ100は、被検体を収容するサンプルウェル110と;オイルを収容するオイルウェル127と;核酸の分離精製を行う液体試薬を収容する試薬ウェル121(122〜126)と;分離精製後の廃液を収容する廃液ウェル130と;被検体の核酸を精製する抽出フィルターカートリッジ150と;オイルウェル127及び試薬ウェル121を封止し貫通可能に形成された封止フィルムと;を有し、被検体から核酸を分離精製することを特徴とする。
【解決手段】核酸分析装置は、被検体から核酸を分離精製する核酸精製キット10を備え、核酸精製キット10は、(オイル)分注チップ201が収容された分注チップラック200と;試薬カートリッジ100と;分注チップラック200に収容された複数の(試薬)分注チップ200と;を有し、試薬カートリッジ100は、被検体を収容するサンプルウェル110と;オイルを収容するオイルウェル127と;核酸の分離精製を行う液体試薬を収容する試薬ウェル121(122〜126)と;分離精製後の廃液を収容する廃液ウェル130と;被検体の核酸を精製する抽出フィルターカートリッジ150と;オイルウェル127及び試薬ウェル121を封止し貫通可能に形成された封止フィルムと;を有し、被検体から核酸を分離精製することを特徴とする。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、核酸分析装置に関する。
【背景技術】
【0002】
一塩基多型(SNP:single nucleotide polymorphisms)は、複数の塩基によって構成されるDNAの配列のうち1塩基に変異を有する多型である。この塩基配列の違いによって、例えば薬剤代謝機能などに個人差を生じることがあることが知られている。
近年の遺伝子検査技術の発達により、例えば患者から採取した生体試料などの被検体から核酸を抽出して一塩基多型のような遺伝子の差異を検出する。この遺伝子の差異により、医薬品に対する感受性をあらかじめ予測できる可能性が示唆されている。これにより、例えば医薬品の副作用を低減して患者個人毎に最適な医療(薬剤)を提供するいわゆるテー
ラーメイド医療(またはオーダーメイド医療とも呼ばれる)が利用可能になると考えられている。
【0003】
このような遺伝子検査を行う装置として、例えば特許文献1には、患者から採取した全血試料をカートリッジに供給し、カートリッジを用いて核酸の精製と核酸の分析とを行う核酸分析装置が記載されている。特許文献1に記載の核酸分析装置によれば、ユーザの手作業に依存する部分を低減したことによって、核酸分析におけるユーザの負担を軽減することができる。さらには、ユーザの技量差によって核酸の回収率がばらつくことなく核酸分析の再現性を高めることができる。
【0004】
また、特許文献2には、複数のSNPを測定するための複数の反応室を形成することで複数のSNPを一度に測定することができる遺伝子検出判定装置が記載されている。この遺伝子検出判定装置によれば、ヒューマンエラーやコンタミネーションの発生を少なくすることができ、遺伝子検査の精度を高めることができる。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】国際公開第2005/118772号明細書
【特許文献2】国際公開第2009/005001号明細書
【発明の概要】
【発明が解決しようとする課題】
【0006】
しかしながら、特許文献1に記載の核酸分析装置では、ひとつのカートリッジを用いて一種類の反応を行う構成であるので、一回の分析で測定可能なSNPの種類が制限されていた。このため、複数種類のSNPを一度に測定する場合には、複数のカートリッジに同一検体を供給して複数回の分析を行うことが必要となり、作業が煩雑である。また、同一検体に対して使い捨てのカートリッジを複数使用する必要があるため、核酸分析装置を運用する場合の消耗品コストが高いという問題もある。
【0007】
また、特許文献2に記載の遺伝子検出判定装置では、核酸の精製処理を遺伝子検出判定装置とは別の装置あるいは手作業によって行う必要がある。精製された核酸は、ユーザの手作業によって遺伝子検出判定装置に供給される必要があった。このため、操作が煩雑であり、また精製された核酸を手作業によって供給するので、計量誤差などによって検査結果にばらつきが発生する可能性がある。
【0008】
本発明は、上述した事情に鑑みてなされたものであって、その目的は精度の高い遺伝子検査を簡便に行うことができる核酸分析装置、及び核酸の分離精製方法を提供することである。
【課題を解決するための手段】
【0009】
上記課題を解決するために、この発明は以下の手段を提案している。
(1)本発明の一態様に係る核酸分析装置は、被検体から核酸を分離精製して核酸溶液とする核酸精製キットと;前記核酸精製キットが載置される被検体導入部と;を備え、前記核酸精製キットは、オイルの分注を行うオイル分注チップが収容された分注チップ収容体と;箱状の試薬カートリッジと;前記分注チップ収容体に収容された複数の試薬分注チップと;を有し、前記試薬カートリッジは、前記被検体を収容する被検体収容部と;前記オイルを収容するオイル収容部と;前記核酸の分離精製を行う液体試薬を収容する試薬収容部と;前記分離精製において発生する廃液を収容する廃液収容部と;前記被検体の前記核酸を精製する抽出フィルターカートリッジと;前記オイル収容部と前記試薬収容部とをそれぞれ封止し、前記試薬分注チップあるいは前記オイル分注チップの先端によって貫通可能に形成された穴部封止フィルムと;を有し、前記被検体から前記核酸を分離精製することを特徴とする。
【0010】
(2)上記(1)に記載の核酸分析装置では、前記核酸精製キットは、前記オイル分注チップの先端側の外面に付着した余剰オイルを除去するオイル除去部を備えていてもよい。
【0011】
(3)上記(2)に記載の核酸分析装置では、前記オイル除去部は、前記オイル分注チップの先端が挿入されることで前記オイル分注チップの外面に接触する親油性の拭い部を有していてもよい。
【0012】
(4)上記(1)から(3)のいずれか一項に記載の核酸分析装置では、前記試薬カートリッジは、前記抽出フィルターカートリッジを着脱自在に保持する保持部を有していてもよい。
【0013】
(5)上記(4)に記載の核酸分析装置では、前記保持部は、前記抽出フィルターカートリッジを通過した液体を吸収する吸収体を有していてもよい。
【0014】
(6)本発明の一態様に係る核酸の分離精製方法は、上記(1)から(5)のいずれか一項に記載の核酸分析装置による核酸の分離精製方法であって、前記試薬カートリッジの前記被検体収容部に前記被検体を注入する工程と、前記試薬収容部に貯留された前記液体試薬の前記試薬分注チップへの出し入れを、前記穴部封止フィルムを貫通して行い、前記被検体収容部の前記被検体に分注、混合して細胞溶解液を得る工程と、前記細胞溶解液を前記抽出フィルターカートリッジに供給する工程と、前記分注チップを前記分注チップ収容体に戻す工程と、前記抽出フィルターカートリッジを通過した液体から吸収体によって前記核酸を吸収する工程と、前記分注チップによって、前記液体試薬を前記吸収体に供給し、該液体試薬中に溶出させた核酸溶液を回収する工程とを備えることを特徴とする。
【発明の効果】
【0015】
本発明の核酸分析装置、及び核酸の分離精製方法によれば、核酸の精製を自動的に行うことができるので、精度の高い遺伝子検査を簡便に行うことができる。
【図面の簡単な説明】
【0016】
【図1】本発明の一実施形態の核酸分析装置の概観を示す斜視図である。
【図2】同核酸分析装置の構成を示す平面図である。
【図3】同核酸分析装置における核酸精製キットの構成を示す斜視図である。
【図4】同核酸分析装置における核酸精製キットの構成を示す斜視図である。
【図5】同核酸精製キットにおける抽出フィルターカートリッジの構成を示す断面図 である。
【図6A】同核酸精製キットにおけるオイル除去部の構成を示す拡大断面図である。
【図6B】同オイル除去部の一部の構成を示す分解斜視図である。
【図7A】同オイル除去部における一部の構成を示す平面図である。
【図7B】同オイル除去部における一部の構成の変形例を示す平面図である。
【図7C】同オイル除去部における一部の構成の他の変形例を示す平面図である。
【図8A】同核酸分析装置における核酸分析チップの構成を示す平面図である。
【図8B】同核酸分析チップの構成の側面図である。
【図8C】同核酸分析チップの構成の注入口の部分を示す拡大断面図である。
【図9】同核酸分析装置の使用時の動作を示す動作説明図である。
【図10】同核酸分析装置における核酸の精製の動作を説明するための動作説明図で ある。
【図11】同核酸分析装置における核酸の精製の動作を説明するための動作説明図で ある。
【図12】同核酸分析装置における核酸の精製の動作を説明するための動作説明図で ある。
【図13】同核酸分析装置の使用時の動作を説明するための動作説明図である。
【図14A】同核酸分析装置におけるオイル除去部の作用を説明するための断面図で ある。
【図14B】同核酸分析装置におけるオイル除去部の作用を説明するための断面図で ある。
【図15】同核酸分析装置の使用時の動作を説明するための動作説明図である。
【図16】同核酸分析装置における核酸分析チップの作用を説明するための断面図で ある。
【図17】同核酸分析装置の使用時の動作について説明したフローチャートである。
【図18】同核酸分析装置の使用時の動作を説明するための動作説明図である。
【発明を実施するための形態】
【0017】
以下、本発明の一実施形態の核酸分析装置について説明する。
まず、本実施形態の核酸分析装置1の全体の構成について図1及び図2を参照して説明する。図1は、本実施形態の核酸分析装置1の外観を示す斜視図である。また、図2は核酸分析装置1の一部の構成を示す平面図である。
本実施形態では、核酸分析装置1は、被検体から核酸を精製し、精製された核酸に対して検査対象となるSNP(Single Nucleotide Polymorphisms)を含む領域を増幅し、増幅された核酸に対してインベーダー法(登録商標)によってSNPの測定をするという一連の動作を自動的に行う。
【0018】
図1に示すように、核酸分析装置1は、例えば据置型の筐体31の内部に設けられている。核酸分析装置1には、図示しない信号線を介して端末2が接続されている。端末2によって核酸分析装置1に対するユーザの操作を入力したり、核酸を分析した結果を端末2に表示したりすることができる。
【0019】
図2及び図8Aに示すように、核酸分析装置1は、被検体から核酸を分離精製して核酸溶液とする核酸精製キット10と;中央に中心軸線(回転軸)Oが位置し、中心軸線Oの径方向外側に複数の反応容器22を有し、核酸精製キット10によって精製された核酸が中心軸線O回りの遠心力によって反応容器22に送液される核酸分析チップ20と;核酸精製キット10が載置される被検体導入部40と;分析装置本体30とを備えている。
具体的には、核酸精製キット10は、生体試料などの被検体に含まれる細胞を破壊し、細胞内に含まれる核酸を担体に吸着させて分離精製する。核酸分析チップ20は、核酸精製キット10によって精製された核酸に対して生化学反応を行う。
また、分析装置本体30は、核酸精製キット10と核酸分析チップ20とのそれぞれが内部に配置されて核酸精製キット10及び核酸分析チップ20に対して精製や分析の操作を行う。
具体的には、図2に示すように、分析装置本体30は、被検体導入部40に設けられ、核酸分析チップ20を支持する分析チップホルダ42と;核酸精製キット10による分離精製を行い、精製された核酸を含有する核酸溶液を核酸分析チップ20の内部に注入する精製処理部50と;中心軸線O回りに核酸分析チップ20を回転動作させて反応容器22のそれぞれに核酸溶液を送液する遠心送液部60と;反応容器22の内部の反応産物の分析を行う分析部70と;精製処理部50と遠心送液部60と分析部70とのそれぞれに被検体導入部40を相対的に搬送する搬送部(搬送手段)55と;を備えている。
【0020】
以下では、図3から図7Cを参照して、核酸精製キット10の構成について説明する。
図3及び図4は、核酸精製キット10の構成を示す斜視図である。また、図5は、核酸精製キット10における抽出フィルターカートリッジ150の構成を示す断面図である。また、図6Aは、核酸精製キット10におけるオイル除去部128の構成を示す拡大断面図であり、図6Bは拭い部129の構成を示す分解斜視図である。また、図7A,図7B,図7Cは、オイル除去部128における一部の構成を示す平面図である。
【0021】
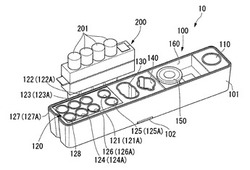
図4に示すように、核酸精製キット10は、被検体から核酸を抽出するための試薬などが収容された試薬カートリッジ100と、液体を分注するための分注チップ(オイル分注チップ,試薬分注チップ)201が複数収容された分注チップラック(分注チップ収容体)200とを備えている。本実施形態では、分注チップラック200は、分注チップ201を複数備えている。試薬カートリッジ100に収容された液体は、複数の分注チップ201のいずれかによって分注操作あるいは攪拌操作され、分注チップ201によって液体の間で交差汚染が生じない。また、分注チップラック200は、使用後の分注チップ201を回収するための容器でもあり、核酸分析装置1における分注チップ201の使用終了後には感染性廃棄物として分注チップ201を分注チップラック200ごと廃棄することができる。
【0022】
図3に示すように、試薬カートリッジ100は、開口を有する箱状に形成された本体101と、本体101の外面から側方へ突出して形成された爪部102とを有している。爪部102は、分析装置本体30において後述する被検体導入部40に試薬カートリッジ100を固定する。
本体101の外面の一部には、核酸精製キット10の使用時には取り外される薄膜状の封止フィルム103が貼り付けられていることが好ましい。封止フィルム103によって本体101の開口は封止される。これにより、本体101の内部に配置された後述する抽出フィルターカートリッジ150などが、本体101から落下するのを防止することができる。さらには、本体101内部に埃などの異物が混入することを防止することができる。
【0023】
図4に示すように、本体101の内部には、生体試料などの被検体が投入されるサンプルウエル(被検体収容部)110と、被検体から核酸を抽出するための試薬などが収容されている試薬ウエル部120と、被検体から核酸を抽出する工程で分離された不要な溶液を廃棄する廃液ウエル(廃液収容部)130と、被検体から抽出された核酸を回収する回収ウエル140と、が一体に形成されている。
【0024】
また、試薬カートリッジ100は、核酸を吸着させる担体を含有する抽出フィルターカートリッジ150を有し、試薬カートリッジ100には、抽出フィルターカートリッジ150が収容される保持部160が一体に形成されている。
【0025】
試薬ウエル部120は、複数の試薬ウエル(試薬収容部)121、122、123、124、125、126と、オイルウエル(オイル収容部)127と、オイル除去部128とを有している。また、試薬ウエル部120において、複数の試薬ウエル121、122、123、124、125、126の開口及びオイルウエル127の開口は、図3に示す封止フィルム104によって封止されている。封止フィルム104により、本体101への気体の透過が抑制されている。また分注チップ201を封止フィルム104に突き刺すことにより、封止フィルム104を破ることができる構成とすることが好ましく、例えば金属製の薄膜や、プラスチックフィルム等を用いることができる。
【0026】
試薬ウエル121〜126には、細胞膜などの生体物質を溶解する溶解液121Aと、前記溶解液121Aで溶解しきれず担体へ目詰まりを起こしている細胞質などの生体物質を溶解する溶解液122Aと、担体に吸着された核酸以外の不要物を洗い流すための洗浄液123A、124Aと、担体から核酸を溶出させる溶出液125Aと、溶出液中の核酸濃度を調整するための希釈液126Aとがそれぞれの試薬ウエルに個別に収容されている。
また後述の使用様態では、分析用の試薬は核酸分析チップに配置した構成としているが、これとは別に試薬ウエルに分析用の試薬を収容した使用方法としても良い。例えば、核酸に対してPCR(Polymerase Chain Reaction)、及びインベーダー(登録商標)法に
よるSNP測定を行う試薬の一部があらかじめ混合された分析試薬プレミックスと、をそれぞれの試薬ウエルに個別に収容することができる。
【0027】
分析試薬プレミックスは、PCR用のDNAポリメラーゼ及び塩基と、インベーダー(登録商標)法に用いられるCleavase(登録商標)と、PCR及びインベーダー(登録商標
)法による反応を共に行うための緩衝液(バッファー)とを含有する混合液である。分析試薬プレミックスは、試薬ウエルに貯留されている状態での酵素活性を抑えるために、反応時の至適濃度よりも濃縮された状態で試薬ウエルに貯留されていることが好ましい。
【0028】
オイルウエル127には、例えばPCR反応において反応溶液に重層して用いられる周知のオイル127Aが収容されている。オイル127Aとしては、例えばミネラルオイルやシリコンオイルなどを好適に採用することができる。
【0029】
図6Aに示すように、オイル除去部128は、分注チップ201(図4参照)の外面に付着するオイル127Aを除去するための拭い部129を内部に有することが好ましい。
【0030】
図6A及び図6Bに示すように、拭い部129は、親油性を有する拭いフィルター129Aと、オイル除去部128の内部で拭いフィルター129Aを支持する円筒状の支持部129B、129Dとを有している。拭いフィルター129Aは、オイル除去部128の内径に沿う略円柱形状あるいは略円板形状に形成されており、拭いフィルター129Aの中央には拭いフィルター129Aの中心軸線方向に貫通して形成された切り込み部129Cが設けられている。
【0031】
図7Aに示すように、切り込み部129Cは、拭いフィルター129Aを中心軸線方向に見たときに、拭いフィルター129Aの中心に位置し、十字形状に形成されている。図7Bに示すように、切り込み部129Cに代えて、拭いフィルター129Aを中心軸線方向に見たときに真円形に形成された切り込み部129Eを有していてもよい。また図7Cに示すように、切り込み部129Cに代えて、拭いフィルター129Aの径方向内側に膨出した膨出部を有する円形の切り込み部129Fを有していてもよい。
【0032】
図4に示すように、廃液ウエル130は、抽出フィルターカートリッジ150の外径形状に沿って形成された凹部で、抽出フィルターカートリッジ150を支持可能な形状である。廃液ウエル130に抽出フィルターカートリッジ150が取り付けられた状態では、抽出フィルターカートリッジ150は試薬カートリッジ100内で転倒しないようになっている。
【0033】
回収ウエル140は、廃棄ウエル130と同様に抽出フィルターカートリッジ150を支持可能な形状である。回収ウエル140の底部は、抽出フィルターカートリッジ150の担体から溶出液125Aによって溶出された核酸溶液を貯留できる容器形状である。
【0034】
廃液ウエル130と回収ウエル140とは、試薬カートリッジ100内で隣り合う位置関係に設けられている。この配置は、抽出フィルターカートリッジ150の洗浄を廃液ウエル130において行った後に、抽出フィルターカートリッジ150を回収ウエル140に移動させるときの抽出フィルターカートリッジ150の動線を短くするためである。これにより、試薬カートリッジ100上を通過する抽出フィルターカートリッジ150が試薬カートリッジ100などを汚染する可能性を軽減することができる。
【0035】
図5に示すように、抽出フィルターカートリッジ150は、抽出フィルターカートリッジの外枠となる略筒状の本体151と、本体151の内部に設けられた抽出フィルターユニット152とを有している。
【0036】
本体151は、上端151Aと下端151Bとがいずれも開口している。また、抽出フィルターユニット152よりも下端151B側において、上端151A側の開口よりも開口径が小さくなる漏斗状に本体151は形成されている。下端151Bにはノズル状の排出口151Cが下方向に突出して設けられている。
本実施形態では、被検体が溶解された状態の溶解液121Aや、洗浄液123A、124A、溶出液125Aなどが上端151A側の開口から供給されてフィルターユニット152を通過して排出口151Cから排出される構成である。
【0037】
フィルターユニット152は、核酸を吸着する性質を有する担体を含有する吸着フィルター152Aと、吸着フィルター152Aよりも下端151B側に配置され吸着フィルター152Aの変形を防止するサポート部材152Bとを有している。
【0038】
吸着フィルター152Aは、核酸を吸着可能な多孔性材料によって膜状に形成されている。吸着フィルター152Aの材料としては、洗浄液123A、124A内では核酸が吸着状態となり、溶出液125A内では核酸の吸着状態が弱まる性質を有する材料であることが好ましい。また、吸着フィルター152Aは、親水基として水酸基を導入した多孔性材料であることが好ましい。具体的には、吸着フィルター152Aは、シリカによって、あるいは他の物質上にシリカを結合させて形成されている。吸着フィルター152Aの材料としては、有機物質の存在下で生体物質を吸着することができる材料であれば、特に限定されない。また、吸着フィルター152Aは、例えばガラスウールなどの繊維材を重ね合わせて形成することで多孔性を有していてもよい。
【0039】
サポート部材152Bは、少なくとも核酸に対する吸着性が低く、かつ被検体から核酸を抽出する反応を阻害しない材料によって形成されていることが好ましい。例えば、サポート部材152Bは樹脂の粒を焼き固めて、多孔質性を有するように形成することができる。サポート部材152Bの剛性は吸着フィルター152Aよりも高くなっており、吸着フィルター152Aが本体151内で変形することがサポート部材152Bによって抑制されている。
【0040】
図4に示す保持部160の底部には、液体を吸収する吸収体(不図示)を設けることが好ましい。この場合、抽出フィルターカートリッジ150を保持部160に収容したときに、抽出フィルターカートリッジ150の排出口151C側の外面に吸収体を接触させる。これにより、例えば抽出フィルターカートリッジ150内に洗浄液123Aを供給したときに排出口151Cの外面に洗浄液123Aが付着した場合に、吸収体に洗浄液123Aを吸収させて洗浄液123Aを除去することができる。
【0041】
以下では、図8A〜図8Cを参照して、核酸分析チップ20の構成について説明する。
核酸分析チップ20は、円板状のチップ本体21と、チップ本体21に貼り付けられた蓋体29とを有している。
【0042】
チップ本体21は、チップ本体21の中心から等距離になるようにチップ本体21の周方向に並べて配置された複数の反応容器22と、チップ本体21上で反応容器22のそれぞれに連通して設けられた流路23とを有している。本実施形態では23個の反応容器22がチップ本体21に設けられている。
【0043】
また、チップ本体21の中央部には、上述の核酸精製キット10によって精製された核酸を含有する核酸溶液などを反応容器22に送液するための注入口26と、注入口26の近傍に形成された出口27とを有している。注入口26及び出口27は、流路23に連通している。さらに、チップ本体21には、注入口26及び出口27を取り囲むようにチップ本体21の外面から突出して形成された突出壁部28が設けられている。
【0044】
チップ本体21の材料は、核酸の分析に影響を与えない材料であることが好ましい。具体的には、チップ本体21の材料は、ポリプロピレン、ポリカーボネート、アクリルのうち少なくとも1以上を含む樹脂材料であることが好ましい。ポリプロピレンとしては、ホモポリプロピレンや、ポリプロピレンとポリエチレンとのランダム共重合体を使用することができる。また、アクリルとしては、ポリメタクリル酸メチル、あるいはメタクリル酸メチルとその他のメタクリル酸エステル、アクリル酸エステル、スチレンなどのモノマーとの共重合体を使用することができる。
【0045】
チップ本体21は、少なくとも反応容器22の部分において光透過性を有することが好ましく、反応容器22内で起こる生化学的反応によって発生する蛍光や着色などを反応容器22の外部から検出可能であることが好ましい。具体的には、可視光領域(波長350nm以上780nm以下)の光を、光透過率70%以上で透過可能であることが好ましい。また、チップ本体21が光透過性を有する樹脂材料で形成されていても良い。
【0046】
反応容器22は、内部に液体を貯留可能な略半球形状の凹部としてチップ本体21に形成されている。反応容器22の内壁面には、生化学反応を行うための試薬類が配置されている。具体的には、反応容器22のそれぞれには、検査対象となるSNPを含む遺伝子領域を増幅するための少なくとも一対のプライマーセットと、インベーダー(登録商標)法に使用されるインベーダー(登録商標)オリゴ及びシグナルプローブと、が収容されている。検査対象となる遺伝子の領域に応じて、複数種類のプライマーセット、インベーダー(登録商標)オリゴ及びシグナルプローブを反応容器22ごとに異ならせてあらかじめ配置しておくことが好ましい。この場合、反応容器22ごとに異なる種類のSNPの測定を行うことができ、例えば本実施形態の核酸分析チップ20によれば同時に23種類のSNPに対して測定を行うことができる。
【0047】
流路23は、反応容器22よりも径方向内側のチップ本体21上に凹部が形成されることで設けられている。また、流路23は、主流路24と、分岐流路25とを有している。
主流路24は、チップ本体21の中心とチップ本体21の径方向外側との間で蛇行しつつチップ本体21の周方向に延びて形成されている。分岐流路25は、主流路24と反応容器22のそれぞれとを連絡するように主流路24から分岐して形成されている。
【0048】
主流路24の一端24Aが注入口26に連通し、主流路24の他端24Bが出口27に連通している。また、主流路24は、チップ本体21の周方向で隣り合う反応容器22の間で、中心軸Oに沿って突出する山形24Cを有するように形成されている。チップ本体21の周方向に隣り合う反応容器22の間で中心軸線O方向に山形状24Cを有することで、核酸分析チップ20を中心軸線O回りに回転させたときに、主流路24に貯留している液体は、山形状24Cの頂点24Dにおいて途切れて反応容器22のそれぞれに液体が送液される。
【0049】
分岐流路25は、主流路24との接続部分において主流路24の流路面積よりも狭く形成されている。分岐流路25の主流路24に接続された部分は、液体が主流路24から分岐流路25に流動することを制限する流動制限部25Aになっている。
【0050】
蓋体29は、チップ本体21において反応容器22及び流路23が形成された側に設けられている。蓋体29がチップ本体21に貼り付けられることで、反応容器22及び流路23となる凹部に蓋がされて、独立した反応空間及び流路になっている。
【0051】
蓋体29の材料としては、熱伝導性が高い材料であることが好ましく、例えばアルミニウム、銅、銀、ニッケル、真鍮、及び金などの金属材料を採用することができる。熱伝導性を有する部分は少なくとも反応容器22が位置する部分にあればよい。また、反応容器22内での生化学反応(例えばPCR反応)に十分な速度で反応容器22の内部の液体などに熱を伝達可能であれば、上述のチップ本体21と同様の樹脂材料で形成された薄板材によって蓋体29が構成されていてもかまわない。
【0052】
本実施形態の核酸分析チップ20は、核酸分析チップ20が中心軸線O回りに回転して生じる遠心力によって、主流路24に貯留された液体を分岐流路25のそれぞれに送液し、分岐流路25を通じて反応容器22のそれぞれに液体を送液する。
【0053】
以下では、図2を参照して分析装置本体30の構成について説明する。
分析装置本体30は、上述の核酸精製キット10と核酸分析チップ20とが配置される被検体導入部40と、核酸精製キット10を用いて被検体から核酸を抽出する操作を行う精製処理部50と、核酸分析チップ20を中心軸線O回りに回転させる遠心送液部60と、核酸分析チップ20の反応容器22内で核酸の分析を行う分析部70と、を備えている。
【0054】
被検体導入部40は、核酸精製キット10の試薬カートリッジ100及び分注チップラック200が配置されるトレイ41と、核酸分析チップ20を載置するための分析チップホルダ42とを有している。
【0055】
トレイ41は、被検体導入部40において着脱自在に設けられており、被検体などが付着した場合に滅菌処理、あるいは感染性廃棄物として廃棄できるようになっている。また、トレイ41には、試薬カートリッジ100に形成された上述の爪部102が係合する被係合部43が設けられており、トレイ41上で試薬カートリッジ100が転倒しないようになっている。本実施形態では、爪部102は、試薬カートリッジ100を被検体導入部40に位置決めするための位置決め機構になっている。
分析チップホルダ42は、円形の貫通孔に核酸分析チップ20が嵌合することで核酸分析チップ20を支持することができる。
【0056】
精製処理部50は、分注チップラック200内に配置された分注チップ201を搬送し、かつ、ロボットハンド51及び分注チップ201を用いて液体を吸引、保持、及び吐出する分注部52と、試薬カートリッジ100に収容された抽出フィルターカートリッジ150の上端から空気を流入させて抽出フィルターカートリッジ150の内部を加圧する加圧部53とを有している。
分注部52には、分注チップ201が圧入によって着脱可能に接続される。この状態で、分注チップ201を用いて、分注作業や、各液の運搬が行われる(図10、11)。また、分注チップ201は複数用意され、コンタミネーション防止の観点から適宜交換される。
分注チップ201を交換するときは、分注チップ201の上端をリリース部(不図示)で下方に押し下げることにより、分注チップ201を分注部52から開放することができる。リリース部は分注部52に備えられる。例えば、分注チップ201の上端に、リリース部と容易に係合する突出部を設けてもよい。
抽出フィルターカートリッジ150は、ロボットハンド51により移動され、加圧部53によって加圧される。この加圧時、加圧部53と抽出フィルターカートリッジ150とは気密に係合可能である(図12)。係合状態を気密にするために適する構成としては、例えば、加圧部53の下端、あるいは、抽出フィルターカートリッジ150の上端151Aに弾性部材を設けた構成が挙げられる。このように加圧部53と抽出フィルターカートリッジ150とを係合させた状態で、加圧部53を用いて抽出フィルターカートリッジ150の内部を加圧することができる。
【0057】
遠心送液部60は、公知の遠心装置を適宜採用することができ、核酸分析チップ20を支持して中心軸線O回りに核酸分析チップ20を回転させることができる。遠心送液部60において核酸分析チップ20を回転させる速度は、核酸分析チップ20の内部に供給された液体に加わる遠心力によって液体が主流路24から分岐流路25へ流入する程度の速度であることが好ましい。核酸分析チップを回転させる最適な速度は、核酸分析チップの形状に依存する。例えば、本実施形態の核酸分析チップ20の場合には、遠心送液部60において核酸分析チップ20を回転させる速度は、1000rpm以上であることが好ましい。
【0058】
分析部70は、核酸分析チップ20に接触して核酸分析チップ20の反応容器22内を所定の温度変化に従うように温度変化させる温度制御機構80と、核酸分析チップ20の反応容器22内の蛍光を測定する蛍光測定部90と、を有している。
【0059】
温度制御機構80は、対向する平面を有する上部ヒートプレート81及び下部ヒートプレート82と、図示しない温調制御部とを有している。詳細は後述するが、図16に示すように、上部ヒートプレート81と下部ヒートプレート82との間に核酸分析チップ20が挟み込まれている。上部ヒートプレート81には、リング状の凸部領域81Aが設けられている。この凸部領域81Aにより、上部ヒートプレート81は、少なくとも核酸分析チップ20の反応溶液22の領域と、突出壁部28とに接触する。上部ヒートプレート81及び下部ヒートプレート82には、アルミニウム、金、銀、銅等の熱伝導率の高い金属材料を用いることができる。また核酸分析チップ20との密着性を高めるために各ヒートプレートの核酸分析チップとの接触面を熱伝導性の良好な弾性体で構成するようにしても良い。
【0060】
上部ヒートプレート81と下部ヒートプレート82とは上述の温調制御部にあらかじめ設定された温度変化に従って温度変化する。温調制御部における温度制御方法は、周知のサーマルサイクラーにおける温度制御方法を適宜採用することができる。これにより、核酸分析チップ20の反応容器22内でPCR及びインベーダー(登録商標)法による反応を行うことができる。
【0061】
蛍光測定部90は、LEDなどの光源部やPMTなどの受光部、励起用光学フィルターや受光用光学フィルターを備えた光学部91から光ファイバー(図示略)を介して、反応容器22内の蛍光物質を励起するための励起光を反応容器22に照射して、蛍光物質の蛍光強度を測定する。励起光は、光源やフィルターの組合せにより任意の波長を得ることができる。
【0062】
また、分析装置本体30は、被検体導入部40および分析部70を筐体31の内部で移動させる搬送部(搬送手段)55を有している。搬送部55の一例として、筐体31の内部に設けられたレール56と、このレール56に沿って移動する移動ステージ57とを備えた搬送部を採用することができる。また、搬送部55の他に、ロボットハンド51によって被検体導入部40および分析部70を筐体31の内部で移動させても良い。さらには、本発明の搬送手段としては、上記の例に限らず、核酸精製キット10と核酸分析チップ20とが配置された被検体導入部40が、精製処理部50、遠心送液部60、分析部70でそれぞれ処理可能な様に搬送される機構を有していれば良い。例えば、精製処理部50、遠心送液部60、分析部70がそれぞれ移動して相対的に被検体導入部40が各処理部に搬送されるようにしても良い。
【0063】
図2に示した構成の本実施形態の核酸分析装置1の例では、被検体導入部40が、分析装置本体30の筐体31の内部で図2に示すX方向に搬送部によって直線移動可能になっており、精製処理部50、遠心送液部60、分析部70の位置まで搬送可能となっている。また、分析部70は、被検体導入部40の搬送部とは別の搬送手段として分析部70の移動機構を有している。この移動機構により、分析装置本体30の筐体31の内部で図2に示すY方向に直線移動可能になっている。これにより核酸分析チップ20に対して処理を行なう処理部を温度制御機構80と蛍光測定部90とで切り替えることができる。具体的には、PCR反応時には核酸分析チップ20を上部ヒートプレート81および下部ヒートプレート82で温度制御を行い、インベーダー反応移行前に上部ヒートプレート81がY方向に移動して、光ファイバーが核酸分析チップ20の上部に位置するようになる。これによって、下部ヒートプレート82でインベーダー反応温度に温度制御を行いながら、核酸分析チップ20の上部を光ファイバーが移動して反応容器22内の蛍光強度を測定することができる。
【0064】
以上に説明した構成の、本実施形態の核酸分析装置1の使用時の動作について図17のフローチャート図を参照しながら説明する。
核酸分析装置1を動作させる前に、まず、ユーザの手作業によって図3に示す試薬カートリッジ100の封止フィルム103が取り外される。続いて、試薬カートリッジ100のサンプルウエル110に例えば全血試料をユーザの手作業によって注入する。続いて、ユーザは試薬カートリッジ100及び分注チップラック200を図2に示すようにトレイ41上に載置する。このとき、試薬カートリッジ100に設けられた爪部102がトレイ41の被係合部43に係合して、試薬カートリッジ100はトレイ41に固定される。
さらに、ユーザの手作業によって、核酸分析チップ20は分析チップホルダ42に載置される。
【0065】
続いて、図9に示すように、被検体導入部40は、精製処理部50へ移動される(S1)。精製処理部50では、図10に示すように、分注部52を移動させる。試薬ウエル121〜126に貯留された各種の試薬を所定の手順に従って、分注部52により、空気を送り(加圧し)、または空気を吸引し(減圧し)、分注チップ201への試薬の出し入れを行い、分注、混合する。これにより、サンプルウエル110に供給された全血試料中の細胞は溶解され、細胞溶解液が得られる。試薬ウエル121〜126から液体を分注チップ201内に吸引するときには、試薬ウエル121〜126を封止している封止フィルム104には分注チップ201の先端が差し込まれる。封止フィルム104には貫通孔が形成され、分注チップ201によって試薬ウエル121〜126の内部の各種試薬類を吸引される。
【0066】
続いて、抽出フィルターカートリッジ150を廃液ウエル130へ搬送し、細胞が溶解された溶液を図11に示すように抽出フィルターカートリッジ150に供給する。その後、図12に示すように、分注チップ201を分注チップラック200に戻した後、加圧部53と抽出フィルターカートリッジ150の上端151Aとを当接させる。そして、加圧部53が抽出フィルターカートリッジ150の上端151Aから抽出フィルターカートリッジ150内に気体を送り込み、液体が吸着フィルター152Aを通過する。このように、加圧部53により、抽出フィルターカートリッジ本体151を加圧することにより、液体が吸着フィルター152Aを通過する速度を高めることができる。細胞が溶解された溶液は、吸着フィルター152Aを通過して、核酸は吸着フィルター152Aに吸着される。その後、生体物質を溶解する溶解液122Aで吸着フィルター152Aを洗浄する。前記生体物質は、前記溶解液121Aで溶解しきれず担体へ目詰まりを起こしている細胞質などである。
【0067】
さらに、洗浄液123A、124Aを吸着フィルター152Aに供給して吸着フィルター152Aを洗浄液123A、124Aによって洗浄する。その後、ロボットハンド51によって抽出フィルターカートリッジ150を回収ウエル140へ搬送し、分注部52と分注チップ201とによって、溶出液125Aを吸着フィルター152Aに供給する。これにより、吸着フィルター152Aに吸着されていた核酸を溶出液125A中に溶出させて、核酸を含有する核酸溶液を回収ウエル140にて回収する。このとき、吸着フィルター152Aをロボットハンド51と加圧部53によって加圧し、回収する時間を短縮することが好ましい。
【0068】
さらに、希釈液126Aと核酸を含む溶出液125Aとを混ぜ合わせ、サンプルの準備が完了となる。
以上で核酸精製キット10による核酸の分離精製は終了する。
【0069】
核酸精製キット10によって被検体から核酸が精製されたら(S2)、核酸を含む核酸溶液は、回収ウエル140から核酸分析チップ20へと分注チップ201を用いて分注部52によって搬送される(S3)。さらに、核酸分析チップ20の注入口26から核酸分析チップ20の主流路24へ核酸溶液が送液される。このとき、主流路24から分岐流路25へは核酸溶液は進入しない。
【0070】
核酸分析チップ20を載せた状態で、被検体導入部40は、図13に示すように遠心送液部60へと移動する(S4)。さらに、核酸分析チップ20は遠心送液部60によって中心軸線O回りに回転し、核酸分析チップ20の主流路24に貯留している核酸溶液に遠心力が加わることで、核酸溶液は、核酸分析チップ20の反応容器22のそれぞれへと送液される(S5)。
【0071】
遠心送液部60における送液が終了したら、核酸分析チップ20を載せた状態で、被検体導入部40は再び精製処理部50へと移動する(図9参照、S6)。精製処理部50では、図4に示す核酸抽出キット10のオイルウエル127に収容されたオイル127Aを分注チップ201の内部に吸引する。このとき、オイル127Aは、分注チップ201の素材がオイル127Aとの親和性が高いため、図14Aに示すように、分注チップ201の外面に液滴状に付着することがある。
【0072】
分注部52は、図14Aに示すようにオイル除去部128へと分注チップ201を移動させる。さらに、図14Bに示すように分注部52は、オイル除去部128の拭いフィルター129Aの切り込み部129Cに分注チップ201の先端201Aを挿入する。分注チップ201の先端201Aの外周面に付着したオイル127Aは、拭いフィルター129Aに吸い取られて分注チップ201の外周面から除去される。分注チップ201を切り込み部129Cから引き抜くことで、分注チップ201の外周面は拭いフィルター129Aに再度接触し、分注チップ201の外周面に付着したオイル127Aは拭き取られる。
【0073】
内部にオイル127Aが保持され外周面のオイル127Aが除去された分注チップ201は、核酸分析チップ20まで分注部52によって搬送される。さらに、図8Aに示す核酸分析チップ20の注入口26に分注チップ201の先端201Aが挿入されて、注入口26から主流路24へとオイル127Aが送液される(S7)。このとき、オイル127Aは、主流路24に充填されるが、分岐流路25には進入しない。
【0074】
主流路24へオイル127Aが供給されたら、核酸分析チップ20を載せた状態で、被検体導入部40は再度遠心送液部60へと移動する(図13参照、S8)。さらに、核酸分析チップ20は、遠心送液部60によって中心軸線O回りに回転される。図8Aに示す核酸分析チップ20の主流路24に貯留しているオイル127Aに遠心力が加わることで、オイル127Aは分岐流路25にある空気と置換され、分岐流路25のそれぞれに充填される(S9)。オイル127Aは核酸溶液よりも比重が小さい。遠心送液部60によってオイル127Aと核酸溶液とに等しい加速度がかかっている状態では、核酸溶液が核酸分析チップ20の径方向外側に位置する。これにより、反応容器内22に核酸溶液が充填されている状態では、反応容器22内にオイル127Aは侵入しない。
【0075】
分岐流路25にオイル127Aが送液されたら、核酸分析チップ20を載せた状態で、被検体導入部40は分析部70の温度制御機構80へと移動する(S10)。温度制御機構80では、核酸分析チップ20は、上部ヒートプレート81と下部ヒートプレート82との間に挿入される。さらに、上部ヒートプレート81と下部ヒートプレート82とによって核酸分析チップ20は図16に示すように挟み込まれる。このとき、突出壁部28は上部ヒートプレート81に当接して弾性変形することで上部ヒートプレート81に密着する。これにより、注入口26及び出口27(図8A参照)は突出壁部28によって密封される。
【0076】
上部ヒートプレート81と下部ヒートプレート82ともに、あらかじめ設定された温度変化に従って加熱あるいは冷却される。これにより、核酸分析チップ20の反応容器22の内部に収容された核酸溶液の温度は、あらかじめ設定された温度変化に従って変化する。その後、反応容器22のそれぞれの内部では、反応容器22に収容されたプライマーセットの特異性に応じた核酸増幅反応(PCR反応)が行われる(S11)。
【0077】
反応容器22内での核酸増幅反応が終了したら、反応容器22内のDNAポリメラーゼを失活させるために例えば99℃で10分間反応容器22を加熱する(S13)。拡散増幅反応において、反応容器22に収容した試薬類などから気泡が発生して、反応容器22内に残留することがある。この場合、必要に応じて、PCR反応において反応容器22内に発生した気泡を除去する気泡除去工程(S12)を、PCR反応の終了後、DNAポリメラーゼを失活させる(S13)前に行っても良い。また、必要に応じて、DNAポリメラーゼを失活させた(S13)後に、気泡除去工程(S14)を行っても良い。すなわち、気泡除去工程(S12,S14)は、どちらか1回実施しても、2回実施しても良い。
【0078】
気泡除去工程は、温度制御機構80によって核酸分析チップ20の反応容器22の温度を室温まで急冷し、分析部70から遠心送液部60へ核酸分析チップ20を移動させて、核酸分析チップ20を中心軸線O回りに回転させる工程である。これにより、反応容器22および流路23内の液体に加わる遠心力によって反応容器22内の気泡が流路23側へ押し出される。
本実施形態の核酸分析装置1では、特に上記S4〜S13、あるいは、S14を含む工程を自動的に行うことができるため、反応容器22のそれぞれに核酸溶液を送液するタイミングを一致させることができる。また、核酸溶液を送液後、PCR反応(S11)を開始するまでの時間間隔を最小限に短縮できる。この結果、核酸増幅反応への意図しない人為的な影響を防ぎ、測定結果の精度を向上できる。
【0079】
続いて、反応容器22の内部でインベーダー(登録商標)法によるSNPの測定を行う。
まず、図18に示すように、分析部70の蛍光測定部90が核酸分析チップ20に重畳するように、分析部70が被検体導入部40に対して移動する(S15)。次に、反応容器22の内部の液体の温度が60℃から70℃の間、好ましくは63℃になるように、下部ヒートプレート82を温度制御する。これにより、核酸分析チップ20においてインベーダー(登録商標)法による酵素反応が行われる。
【0080】
蛍光測定部90では、図示していない光ファイバーを介して光学部91で発生された励起光を反応容器22に照射する。本実施形態では、インベーダー(登録商標)法による測定を用いるため、波長が480nmと545nmとなる二種類の励起光を用いる。インベーダー(登録商標)法に用いる蛍光物質は具体的にはFAMとRedmondRedである。反応容器22は透明で波長350nm以上780nm以下の光を透過可能であるので、励起光は反応容器22の内部に到達し、反応容器22の内部でシグナルプローブから遊離した蛍光物質に到達する。反応容器22の内部では、遊離した蛍光物質の量に比例して蛍光強度が強くなる。蛍光測定部90は、核酸分析チップ20の周方向に順番に反応容器22の内部の蛍光強度をFAMとRedmondRedとのそれぞれについて測定する(S16)。蛍光測定部90において測定された情報は図1に示す端末2に表示され(S17)、ユーザは核酸にどのようなSNPが含まれているかを知ることができる。
【0081】
以上説明したように、本実施形態の核酸分析装置1によれば、核酸精製キット10を用いた核酸の精製が精製処理部50によって行われる。そして、遠心送液部60によって核酸分析チップ20の反応容器22のそれぞれに核酸溶液を送液した後に、分析部70において核酸の分析が行われる。このように、各部が連動して核酸分析を行い、核酸の精製から核酸の分析までの工程を分析装置本体30によって自動的に行うことができるので、精度の高い遺伝子検査を簡便に行うことができる。
【0082】
また、核酸分析装置1の動作の工程において、ユーザの手作業が発生する工程は、核酸精製キット10のサンプルウエル11に被検体(全血試料)を供給して核酸精製キット10をトレイ41に載置する工程である。この工程は精度の高い液体操作を要求するのではなく、精度の高い液体操作はすべて分析装置本体30によって行われる。従って、ユーザが液体操作に熟練していなくても再現性の高い遺伝子検査を行うことができる。
【0083】
また、分析部70が温度制御機構80を備えているので、核酸分析チップ20に核酸溶液及びオイル127Aを供給してから核酸分析チップ20の反応容器22の内部でPCR反応を直ちに行うことができる。このため、手作業が介在しないので、操作が簡便であり、さらには、PCR反応の特異性を高めて遺伝子検査を精度よく行うことができる。
【0084】
また、分析部70が蛍光測定部90を備えているので、反応容器22の内部で励起光によって励起される蛍光物質の蛍光を測定することができる。
【0085】
また、核酸精製キット10がオイル除去部128を備えているので、オイル除去部128の拭いフィルター129Aによって分注チップ201の先端201Aの外周面に付着したオイル127Aを除去することができる。これにより、分注チップ201の先端201Aが核酸分析チップ20の注入口26に挿入されたときに注入口26の周囲の核酸分析チップ20の外面にオイル127Aが付着することを抑制することができる。その結果、遠心送液部60において核酸分析チップ20を回転させたときに、遠心力によってオイル127Aが飛散することが抑制できる。
【0086】
また、核酸を抽出するために必要な試薬やフィルターユニットが試薬カートリッジ100の内部に設けられ、一組として一体化されているので、被検体をサンプルウエル110に添加して被検体導入部40のトレイ41に載置する操作のみ手作業によって行えばよいので、遺伝子検査を簡便に行うことができる。また、試薬カートリッジ100に廃液ウエル130が一体に設けられているので、遺伝子検査が終了した後は、試薬カートリッジ100を、トレイ41から取り外して廃棄するだけでよい。このため、廃液処理が簡便であり、被検体などの残液によって周囲が汚染されるおそれがない。
【0087】
また、試薬カートリッジ100に設けられた封止フィルム104によって試薬ウエル部120のそれぞれが封止されており、分注チップ201の先端201Aによって封止フィルム104を貫通して試薬などを吸引することができるので、試薬などが必要になる直前まで試薬ウエル部120を密封しておくことができる。
【0088】
また、試薬カートリッジ100に、抽出フィルターカートリッジ150を保持する保持部160が設けられている。これにより、抽出フィルターカートリッジ150が試薬カートリッジ100内で転倒したり、抽出フィルターカートリッジ150が試薬カートリッジ100内で位置ずれを起こしたりすることがない。このため、抽出フィルターカートリッジ150の姿勢を安定させて核酸の精製を自動化することができる。
【0089】
また、試薬カートリッジ100の開口を封止する封止フィルム103が設けられているので、抽出フィルターカートリッジ150やサンプルウエル110、回収ウエル140などに異物が混入することを抑制することができる。
【0090】
また、試薬カートリッジ100にはトレイ41に固定するための爪部102が設けられているので、分析装置本体30の内部で被検体導入部40が移動しても試薬カートリッジ100が転倒したり試薬カートリッジ100の位置がずれたりすることがない。
【0091】
また、核酸分析チップ20の流路23が反応容器22よりも中心軸線O側に設けられているので、核酸分析チップ20を中心軸線O回りに回転させることで流路23から反応容器22のそれぞれへ液体を送液することができる。
【0092】
また、注入口26が中心軸線O上に位置しているので、注入口26の周囲の外面に付着した試薬やオイルなどの液体にかかる遠心力が少ない。これにより、遠心送液部60において核酸分析チップ20が中心軸線O回りに回転したときに、試薬やオイルなどの液体が飛散することが抑制されている。
【0093】
また、注入口26を取り囲むように、核酸分析チップ本体21の外面から突出して形成された突出壁部28が設けられているので、突出壁部28を上部ヒートプレート81などに当接させることで注入口26の周囲を密封することができる。このため、注入口26から液体などが吹き出すことを防止することができる。
また、突出壁部28が弾性を有するので、突出壁部28と上部ヒートプレート81とを密着させることができる。
【0094】
また、主流路24と分岐流路25との間に流動制限部25Aが設けられているので、主流路24の全体に液体を充填した後に、分岐流路25を通じて反応容器22に遠心力によって液体を送液することができる。
【0095】
また、主流路24に山形状24Cが形成されているので、山形状24Cによって仕切られた主流路24のそれぞれには等量の液体を貯留することができる。このため、反応容器22のそれぞれに送液される液体の量を均等にすることができ、反応容器22ごとの生化学反応の誤差を低減することができる。
【0096】
また、反応容器22が光透過性を有するので、核酸分析チップ20の外部から反応容器22の内部の光学的な測定を行うことができる。
【0097】
また、核酸分析チップ20が、反応容器22と流路23とが形成されたチップ本体21と、チップ本体21に貼り合わせられた蓋体29とを有しているので、反応容器22のそれぞれに異なるプローブ、プライマー、および試薬類を配置することが容易である。また、チップ本体21に蓋体29を貼り合わせたあとは、反応容器22のそれぞれを独立した反応空間として生化学反応を好適に行うことができる。
【0098】
また、蓋体29が金属材料によって形成されているので、反応容器22のそれぞれに対して加熱及び冷却を迅速に行うことができる。
【0099】
以下では、本実施形態の核酸分析装置1を使用した遺伝子解析の例について説明する。
核酸分析装置1を使用した遺伝子解析の例としては、例えばK−ras遺伝子変異の検出や、生殖細胞変異の検出を挙げることができる。
K−ras遺伝子は、ウイルス由来の癌遺伝子として知られており、GTPase活性を有するG蛋白の一種をコードする遺伝子である。K−ras遺伝子に点突然変異が発生すると、GTPase活性が低下することで細胞の癌化を引き起こすと考えられている。
生殖細胞変異は、生殖細胞に変異を有する状態で発生した個体に特徴的な変異で、個体のすべての細胞に同一の変異がある。生殖細胞変異を解析することで例えば薬剤感受性の差などの推定ができると考えられている。
【0100】
(K−ras遺伝子変異の検出)
まず、K−ras遺伝子変異の検出に本実施形態の核酸分析装置1を使用する例を説明する。
反応容器22のそれぞれの内部には、K−ras遺伝子の野生型と、13種の変異型とのそれぞれに対応するプローブと、核酸を増幅するための上述の酵素及び塩があらかじめ収容されている。この場合、プローブの種類は14種類となるので、核酸分析チップ20において14個の反応容器22を使用するようになっている。
【0101】
ユーザは、膵臓癌や大腸癌などが疑われる被検体を核酸精製キット10の試薬カートリッジ100のサンプルウエル110に供給し、上述の様に核酸分析装置1を動作させて核酸の抽出、核酸中の遺伝子の増幅反応、及び蛍光強度の測定を行う。これにより、被検体がK−ras遺伝子変異を有しているか否か、またK−rasの変異型のうちどの変異型であるかを知ることができる。
【0102】
(生殖細胞変異の検出)
生殖細胞変異は、個体のすべての細胞に共通する変異であるので、例えば全血試料などを用いて生殖細胞変異の検出を行うことができる。具体的には、生殖細胞変異は、被検体のSNPを特定することによって検出することができる。このようなSNPの特定方法としては、例えばPCR−PHFA(PCR−Preferential Homoduplex Formation Assay)法が知られている。
【0103】
本実施形態の核酸分析チップ20を用いてPCR−PHFA法を行うことで、反応容器22のそれぞれに送液される液体の量を揃えることができるので、複数の反応容器22の間での測定誤差が低減され、複数の反応容器22における蛍光強度の差によってSNPの有無を検出する場合の検出精度を高めることができる。
【0104】
また、SNPを検出する方法としては、インベーダー法(登録商標)、Taqman PCR法などが知られているが、これらの方法に対しても本実施形態の核酸分析装置1を好適に使用することができる。
【0105】
以上、本発明の実施形態について図面を参照して詳述したが、具体的な構成はこの実施形態に限られず、本発明の要旨を逸脱しない範囲の設計変更等も含まれる。また、上述の実施形態及び変形例において示した構成要素は適宜に組み合わせて構成することが可能である。
例えば、分析部70が、温度制御機構80と蛍光測定部90とを備えた構成としたが、分析部70が、温度制御機構80と蛍光測定部90とを備えていなくても、精度の高い遺伝子検査をより簡便に行うことができる。
また、核酸精製キット10は、オイル127Aと少なくともオイルの分注を行うオイル分注チップ201が収容された分注チップラック200とオイル分注チップ201の先端側の外面に付着した余剰オイルを除去するオイル除去部128とを備えることが好ましい。
また、核酸精製キット10は、箱状の試薬カートリッジ100と試薬分注チップ201とを有し、試薬カートリッジ100は、サンプルウエル110とオイルウエル127と試薬ウエル121、122、123、124、125、126と廃液ウエル130と抽出フィルターカートリッジ150とを有することが好ましい。
【0106】
また、試薬分注チップ201あるいはオイル分注チップ201の先端によって貫通可能に形成された封止フィルム(穴部封止フィルム)104が試薬カートリッジ100に設けられた構成としたが、これに限定されることはない。試薬カートリッジ100には、抽出フィルターカートリッジ150が収容される保持部160が一体に形成された構成にしたがこれに限定されることはない。
また、試薬カートリッジ100を被検体導入部40に位置決めするための位置決め機構として、爪部102を設けたが、これに限定されることはない。
また、核酸分析チップ20は、流路23と、注入口26とを有する構成としたが、これに限定されることはなく、チップ本体21と、蓋体29とを有する構成としたが、これに限定されることはない。このチップ本体21と蓋体29の少なくともいずれかは光透過性を有することが好ましい。
さらに、注入口26及び出口27を取り囲むようにチップ本体21の外面から突出して形成された突出壁部28が設けられた構成としたが、これに限定されることはない。
また、突出壁部28は、弾性を有したが、これに限定されることはない。また、流路23が、主流路24と、分岐流路25とを有する構成としたが、これに限定されることはなく、さらには、主流路24は山形状を有する形状としたが、これに限定されることはない。
【符号の説明】
【0107】
1 核酸分析装置
2 端末
10 核酸精製キット
20 核酸分析チップ
21 チップ本体
22 反応容器
23 流路
24 主流路
24A 一端
24B 他端
24C 山形状
24D 頂点
25 分岐流路
25A 流動制限部
26 注入口
27 出口
28 突出壁部
29 蓋体
30 分析装置本体
31 筐体
40 被検体導入部
41 トレイ
42 分析チップホルダ
43 被係合部
50 精製処理部
51 ロボットハンド
52 分注部
53 加圧部
55 搬送部(搬送手段)
60 遠心送液部
70 分析部
80 温度制御機構
81 上部ヒートプレート
81A 凸部領域81A
82 下部ヒートプレート
90 蛍光測定部
91 光学部
100 試薬カートリッジ
101 本体
102 爪部(位置決め機構)
103 封止フィルム
104 封止フィルム
110 サンプルウエル(被検体収容部)
120 試薬ウエル部
121、122、123、124、125、126 試薬ウエル(試薬収容部)
121A、122A 溶解液
123A、124A 洗浄液
125A 溶出液
126A 希釈液
127 オイルウエル(オイル収容部)
127A オイル
128 オイル除去部
129 拭い部
129A 拭いフィルター
129B、129D 支持部
129C 切り込み部(貫通孔)
129E 切り込み部(真円形)
129F 切り込み部(膨出部のある円形)
130 廃液ウエル(廃液収容部)
140 回収ウエル
150 抽出フィルターカートリッジ
151 本体(略筒状)
151A 上端
151B 下端
151C 排出口(ノズル状)
152 抽出フィルターユニット
152A 吸着フィルター
152B サポート部材
160 保持部
200 分注チップラック
201 分注チップ(オイル分注チップ、試薬分注チップ)
201A 先端
O 中心軸線(回転軸)
【技術分野】
【0001】
本発明は、核酸分析装置に関する。
【背景技術】
【0002】
一塩基多型(SNP:single nucleotide polymorphisms)は、複数の塩基によって構成されるDNAの配列のうち1塩基に変異を有する多型である。この塩基配列の違いによって、例えば薬剤代謝機能などに個人差を生じることがあることが知られている。
近年の遺伝子検査技術の発達により、例えば患者から採取した生体試料などの被検体から核酸を抽出して一塩基多型のような遺伝子の差異を検出する。この遺伝子の差異により、医薬品に対する感受性をあらかじめ予測できる可能性が示唆されている。これにより、例えば医薬品の副作用を低減して患者個人毎に最適な医療(薬剤)を提供するいわゆるテー
ラーメイド医療(またはオーダーメイド医療とも呼ばれる)が利用可能になると考えられている。
【0003】
このような遺伝子検査を行う装置として、例えば特許文献1には、患者から採取した全血試料をカートリッジに供給し、カートリッジを用いて核酸の精製と核酸の分析とを行う核酸分析装置が記載されている。特許文献1に記載の核酸分析装置によれば、ユーザの手作業に依存する部分を低減したことによって、核酸分析におけるユーザの負担を軽減することができる。さらには、ユーザの技量差によって核酸の回収率がばらつくことなく核酸分析の再現性を高めることができる。
【0004】
また、特許文献2には、複数のSNPを測定するための複数の反応室を形成することで複数のSNPを一度に測定することができる遺伝子検出判定装置が記載されている。この遺伝子検出判定装置によれば、ヒューマンエラーやコンタミネーションの発生を少なくすることができ、遺伝子検査の精度を高めることができる。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】国際公開第2005/118772号明細書
【特許文献2】国際公開第2009/005001号明細書
【発明の概要】
【発明が解決しようとする課題】
【0006】
しかしながら、特許文献1に記載の核酸分析装置では、ひとつのカートリッジを用いて一種類の反応を行う構成であるので、一回の分析で測定可能なSNPの種類が制限されていた。このため、複数種類のSNPを一度に測定する場合には、複数のカートリッジに同一検体を供給して複数回の分析を行うことが必要となり、作業が煩雑である。また、同一検体に対して使い捨てのカートリッジを複数使用する必要があるため、核酸分析装置を運用する場合の消耗品コストが高いという問題もある。
【0007】
また、特許文献2に記載の遺伝子検出判定装置では、核酸の精製処理を遺伝子検出判定装置とは別の装置あるいは手作業によって行う必要がある。精製された核酸は、ユーザの手作業によって遺伝子検出判定装置に供給される必要があった。このため、操作が煩雑であり、また精製された核酸を手作業によって供給するので、計量誤差などによって検査結果にばらつきが発生する可能性がある。
【0008】
本発明は、上述した事情に鑑みてなされたものであって、その目的は精度の高い遺伝子検査を簡便に行うことができる核酸分析装置、及び核酸の分離精製方法を提供することである。
【課題を解決するための手段】
【0009】
上記課題を解決するために、この発明は以下の手段を提案している。
(1)本発明の一態様に係る核酸分析装置は、被検体から核酸を分離精製して核酸溶液とする核酸精製キットと;前記核酸精製キットが載置される被検体導入部と;を備え、前記核酸精製キットは、オイルの分注を行うオイル分注チップが収容された分注チップ収容体と;箱状の試薬カートリッジと;前記分注チップ収容体に収容された複数の試薬分注チップと;を有し、前記試薬カートリッジは、前記被検体を収容する被検体収容部と;前記オイルを収容するオイル収容部と;前記核酸の分離精製を行う液体試薬を収容する試薬収容部と;前記分離精製において発生する廃液を収容する廃液収容部と;前記被検体の前記核酸を精製する抽出フィルターカートリッジと;前記オイル収容部と前記試薬収容部とをそれぞれ封止し、前記試薬分注チップあるいは前記オイル分注チップの先端によって貫通可能に形成された穴部封止フィルムと;を有し、前記被検体から前記核酸を分離精製することを特徴とする。
【0010】
(2)上記(1)に記載の核酸分析装置では、前記核酸精製キットは、前記オイル分注チップの先端側の外面に付着した余剰オイルを除去するオイル除去部を備えていてもよい。
【0011】
(3)上記(2)に記載の核酸分析装置では、前記オイル除去部は、前記オイル分注チップの先端が挿入されることで前記オイル分注チップの外面に接触する親油性の拭い部を有していてもよい。
【0012】
(4)上記(1)から(3)のいずれか一項に記載の核酸分析装置では、前記試薬カートリッジは、前記抽出フィルターカートリッジを着脱自在に保持する保持部を有していてもよい。
【0013】
(5)上記(4)に記載の核酸分析装置では、前記保持部は、前記抽出フィルターカートリッジを通過した液体を吸収する吸収体を有していてもよい。
【0014】
(6)本発明の一態様に係る核酸の分離精製方法は、上記(1)から(5)のいずれか一項に記載の核酸分析装置による核酸の分離精製方法であって、前記試薬カートリッジの前記被検体収容部に前記被検体を注入する工程と、前記試薬収容部に貯留された前記液体試薬の前記試薬分注チップへの出し入れを、前記穴部封止フィルムを貫通して行い、前記被検体収容部の前記被検体に分注、混合して細胞溶解液を得る工程と、前記細胞溶解液を前記抽出フィルターカートリッジに供給する工程と、前記分注チップを前記分注チップ収容体に戻す工程と、前記抽出フィルターカートリッジを通過した液体から吸収体によって前記核酸を吸収する工程と、前記分注チップによって、前記液体試薬を前記吸収体に供給し、該液体試薬中に溶出させた核酸溶液を回収する工程とを備えることを特徴とする。
【発明の効果】
【0015】
本発明の核酸分析装置、及び核酸の分離精製方法によれば、核酸の精製を自動的に行うことができるので、精度の高い遺伝子検査を簡便に行うことができる。
【図面の簡単な説明】
【0016】
【図1】本発明の一実施形態の核酸分析装置の概観を示す斜視図である。
【図2】同核酸分析装置の構成を示す平面図である。
【図3】同核酸分析装置における核酸精製キットの構成を示す斜視図である。
【図4】同核酸分析装置における核酸精製キットの構成を示す斜視図である。
【図5】同核酸精製キットにおける抽出フィルターカートリッジの構成を示す断面図 である。
【図6A】同核酸精製キットにおけるオイル除去部の構成を示す拡大断面図である。
【図6B】同オイル除去部の一部の構成を示す分解斜視図である。
【図7A】同オイル除去部における一部の構成を示す平面図である。
【図7B】同オイル除去部における一部の構成の変形例を示す平面図である。
【図7C】同オイル除去部における一部の構成の他の変形例を示す平面図である。
【図8A】同核酸分析装置における核酸分析チップの構成を示す平面図である。
【図8B】同核酸分析チップの構成の側面図である。
【図8C】同核酸分析チップの構成の注入口の部分を示す拡大断面図である。
【図9】同核酸分析装置の使用時の動作を示す動作説明図である。
【図10】同核酸分析装置における核酸の精製の動作を説明するための動作説明図で ある。
【図11】同核酸分析装置における核酸の精製の動作を説明するための動作説明図で ある。
【図12】同核酸分析装置における核酸の精製の動作を説明するための動作説明図で ある。
【図13】同核酸分析装置の使用時の動作を説明するための動作説明図である。
【図14A】同核酸分析装置におけるオイル除去部の作用を説明するための断面図で ある。
【図14B】同核酸分析装置におけるオイル除去部の作用を説明するための断面図で ある。
【図15】同核酸分析装置の使用時の動作を説明するための動作説明図である。
【図16】同核酸分析装置における核酸分析チップの作用を説明するための断面図で ある。
【図17】同核酸分析装置の使用時の動作について説明したフローチャートである。
【図18】同核酸分析装置の使用時の動作を説明するための動作説明図である。
【発明を実施するための形態】
【0017】
以下、本発明の一実施形態の核酸分析装置について説明する。
まず、本実施形態の核酸分析装置1の全体の構成について図1及び図2を参照して説明する。図1は、本実施形態の核酸分析装置1の外観を示す斜視図である。また、図2は核酸分析装置1の一部の構成を示す平面図である。
本実施形態では、核酸分析装置1は、被検体から核酸を精製し、精製された核酸に対して検査対象となるSNP(Single Nucleotide Polymorphisms)を含む領域を増幅し、増幅された核酸に対してインベーダー法(登録商標)によってSNPの測定をするという一連の動作を自動的に行う。
【0018】
図1に示すように、核酸分析装置1は、例えば据置型の筐体31の内部に設けられている。核酸分析装置1には、図示しない信号線を介して端末2が接続されている。端末2によって核酸分析装置1に対するユーザの操作を入力したり、核酸を分析した結果を端末2に表示したりすることができる。
【0019】
図2及び図8Aに示すように、核酸分析装置1は、被検体から核酸を分離精製して核酸溶液とする核酸精製キット10と;中央に中心軸線(回転軸)Oが位置し、中心軸線Oの径方向外側に複数の反応容器22を有し、核酸精製キット10によって精製された核酸が中心軸線O回りの遠心力によって反応容器22に送液される核酸分析チップ20と;核酸精製キット10が載置される被検体導入部40と;分析装置本体30とを備えている。
具体的には、核酸精製キット10は、生体試料などの被検体に含まれる細胞を破壊し、細胞内に含まれる核酸を担体に吸着させて分離精製する。核酸分析チップ20は、核酸精製キット10によって精製された核酸に対して生化学反応を行う。
また、分析装置本体30は、核酸精製キット10と核酸分析チップ20とのそれぞれが内部に配置されて核酸精製キット10及び核酸分析チップ20に対して精製や分析の操作を行う。
具体的には、図2に示すように、分析装置本体30は、被検体導入部40に設けられ、核酸分析チップ20を支持する分析チップホルダ42と;核酸精製キット10による分離精製を行い、精製された核酸を含有する核酸溶液を核酸分析チップ20の内部に注入する精製処理部50と;中心軸線O回りに核酸分析チップ20を回転動作させて反応容器22のそれぞれに核酸溶液を送液する遠心送液部60と;反応容器22の内部の反応産物の分析を行う分析部70と;精製処理部50と遠心送液部60と分析部70とのそれぞれに被検体導入部40を相対的に搬送する搬送部(搬送手段)55と;を備えている。
【0020】
以下では、図3から図7Cを参照して、核酸精製キット10の構成について説明する。
図3及び図4は、核酸精製キット10の構成を示す斜視図である。また、図5は、核酸精製キット10における抽出フィルターカートリッジ150の構成を示す断面図である。また、図6Aは、核酸精製キット10におけるオイル除去部128の構成を示す拡大断面図であり、図6Bは拭い部129の構成を示す分解斜視図である。また、図7A,図7B,図7Cは、オイル除去部128における一部の構成を示す平面図である。
【0021】
図4に示すように、核酸精製キット10は、被検体から核酸を抽出するための試薬などが収容された試薬カートリッジ100と、液体を分注するための分注チップ(オイル分注チップ,試薬分注チップ)201が複数収容された分注チップラック(分注チップ収容体)200とを備えている。本実施形態では、分注チップラック200は、分注チップ201を複数備えている。試薬カートリッジ100に収容された液体は、複数の分注チップ201のいずれかによって分注操作あるいは攪拌操作され、分注チップ201によって液体の間で交差汚染が生じない。また、分注チップラック200は、使用後の分注チップ201を回収するための容器でもあり、核酸分析装置1における分注チップ201の使用終了後には感染性廃棄物として分注チップ201を分注チップラック200ごと廃棄することができる。
【0022】
図3に示すように、試薬カートリッジ100は、開口を有する箱状に形成された本体101と、本体101の外面から側方へ突出して形成された爪部102とを有している。爪部102は、分析装置本体30において後述する被検体導入部40に試薬カートリッジ100を固定する。
本体101の外面の一部には、核酸精製キット10の使用時には取り外される薄膜状の封止フィルム103が貼り付けられていることが好ましい。封止フィルム103によって本体101の開口は封止される。これにより、本体101の内部に配置された後述する抽出フィルターカートリッジ150などが、本体101から落下するのを防止することができる。さらには、本体101内部に埃などの異物が混入することを防止することができる。
【0023】
図4に示すように、本体101の内部には、生体試料などの被検体が投入されるサンプルウエル(被検体収容部)110と、被検体から核酸を抽出するための試薬などが収容されている試薬ウエル部120と、被検体から核酸を抽出する工程で分離された不要な溶液を廃棄する廃液ウエル(廃液収容部)130と、被検体から抽出された核酸を回収する回収ウエル140と、が一体に形成されている。
【0024】
また、試薬カートリッジ100は、核酸を吸着させる担体を含有する抽出フィルターカートリッジ150を有し、試薬カートリッジ100には、抽出フィルターカートリッジ150が収容される保持部160が一体に形成されている。
【0025】
試薬ウエル部120は、複数の試薬ウエル(試薬収容部)121、122、123、124、125、126と、オイルウエル(オイル収容部)127と、オイル除去部128とを有している。また、試薬ウエル部120において、複数の試薬ウエル121、122、123、124、125、126の開口及びオイルウエル127の開口は、図3に示す封止フィルム104によって封止されている。封止フィルム104により、本体101への気体の透過が抑制されている。また分注チップ201を封止フィルム104に突き刺すことにより、封止フィルム104を破ることができる構成とすることが好ましく、例えば金属製の薄膜や、プラスチックフィルム等を用いることができる。
【0026】
試薬ウエル121〜126には、細胞膜などの生体物質を溶解する溶解液121Aと、前記溶解液121Aで溶解しきれず担体へ目詰まりを起こしている細胞質などの生体物質を溶解する溶解液122Aと、担体に吸着された核酸以外の不要物を洗い流すための洗浄液123A、124Aと、担体から核酸を溶出させる溶出液125Aと、溶出液中の核酸濃度を調整するための希釈液126Aとがそれぞれの試薬ウエルに個別に収容されている。
また後述の使用様態では、分析用の試薬は核酸分析チップに配置した構成としているが、これとは別に試薬ウエルに分析用の試薬を収容した使用方法としても良い。例えば、核酸に対してPCR(Polymerase Chain Reaction)、及びインベーダー(登録商標)法に
よるSNP測定を行う試薬の一部があらかじめ混合された分析試薬プレミックスと、をそれぞれの試薬ウエルに個別に収容することができる。
【0027】
分析試薬プレミックスは、PCR用のDNAポリメラーゼ及び塩基と、インベーダー(登録商標)法に用いられるCleavase(登録商標)と、PCR及びインベーダー(登録商標
)法による反応を共に行うための緩衝液(バッファー)とを含有する混合液である。分析試薬プレミックスは、試薬ウエルに貯留されている状態での酵素活性を抑えるために、反応時の至適濃度よりも濃縮された状態で試薬ウエルに貯留されていることが好ましい。
【0028】
オイルウエル127には、例えばPCR反応において反応溶液に重層して用いられる周知のオイル127Aが収容されている。オイル127Aとしては、例えばミネラルオイルやシリコンオイルなどを好適に採用することができる。
【0029】
図6Aに示すように、オイル除去部128は、分注チップ201(図4参照)の外面に付着するオイル127Aを除去するための拭い部129を内部に有することが好ましい。
【0030】
図6A及び図6Bに示すように、拭い部129は、親油性を有する拭いフィルター129Aと、オイル除去部128の内部で拭いフィルター129Aを支持する円筒状の支持部129B、129Dとを有している。拭いフィルター129Aは、オイル除去部128の内径に沿う略円柱形状あるいは略円板形状に形成されており、拭いフィルター129Aの中央には拭いフィルター129Aの中心軸線方向に貫通して形成された切り込み部129Cが設けられている。
【0031】
図7Aに示すように、切り込み部129Cは、拭いフィルター129Aを中心軸線方向に見たときに、拭いフィルター129Aの中心に位置し、十字形状に形成されている。図7Bに示すように、切り込み部129Cに代えて、拭いフィルター129Aを中心軸線方向に見たときに真円形に形成された切り込み部129Eを有していてもよい。また図7Cに示すように、切り込み部129Cに代えて、拭いフィルター129Aの径方向内側に膨出した膨出部を有する円形の切り込み部129Fを有していてもよい。
【0032】
図4に示すように、廃液ウエル130は、抽出フィルターカートリッジ150の外径形状に沿って形成された凹部で、抽出フィルターカートリッジ150を支持可能な形状である。廃液ウエル130に抽出フィルターカートリッジ150が取り付けられた状態では、抽出フィルターカートリッジ150は試薬カートリッジ100内で転倒しないようになっている。
【0033】
回収ウエル140は、廃棄ウエル130と同様に抽出フィルターカートリッジ150を支持可能な形状である。回収ウエル140の底部は、抽出フィルターカートリッジ150の担体から溶出液125Aによって溶出された核酸溶液を貯留できる容器形状である。
【0034】
廃液ウエル130と回収ウエル140とは、試薬カートリッジ100内で隣り合う位置関係に設けられている。この配置は、抽出フィルターカートリッジ150の洗浄を廃液ウエル130において行った後に、抽出フィルターカートリッジ150を回収ウエル140に移動させるときの抽出フィルターカートリッジ150の動線を短くするためである。これにより、試薬カートリッジ100上を通過する抽出フィルターカートリッジ150が試薬カートリッジ100などを汚染する可能性を軽減することができる。
【0035】
図5に示すように、抽出フィルターカートリッジ150は、抽出フィルターカートリッジの外枠となる略筒状の本体151と、本体151の内部に設けられた抽出フィルターユニット152とを有している。
【0036】
本体151は、上端151Aと下端151Bとがいずれも開口している。また、抽出フィルターユニット152よりも下端151B側において、上端151A側の開口よりも開口径が小さくなる漏斗状に本体151は形成されている。下端151Bにはノズル状の排出口151Cが下方向に突出して設けられている。
本実施形態では、被検体が溶解された状態の溶解液121Aや、洗浄液123A、124A、溶出液125Aなどが上端151A側の開口から供給されてフィルターユニット152を通過して排出口151Cから排出される構成である。
【0037】
フィルターユニット152は、核酸を吸着する性質を有する担体を含有する吸着フィルター152Aと、吸着フィルター152Aよりも下端151B側に配置され吸着フィルター152Aの変形を防止するサポート部材152Bとを有している。
【0038】
吸着フィルター152Aは、核酸を吸着可能な多孔性材料によって膜状に形成されている。吸着フィルター152Aの材料としては、洗浄液123A、124A内では核酸が吸着状態となり、溶出液125A内では核酸の吸着状態が弱まる性質を有する材料であることが好ましい。また、吸着フィルター152Aは、親水基として水酸基を導入した多孔性材料であることが好ましい。具体的には、吸着フィルター152Aは、シリカによって、あるいは他の物質上にシリカを結合させて形成されている。吸着フィルター152Aの材料としては、有機物質の存在下で生体物質を吸着することができる材料であれば、特に限定されない。また、吸着フィルター152Aは、例えばガラスウールなどの繊維材を重ね合わせて形成することで多孔性を有していてもよい。
【0039】
サポート部材152Bは、少なくとも核酸に対する吸着性が低く、かつ被検体から核酸を抽出する反応を阻害しない材料によって形成されていることが好ましい。例えば、サポート部材152Bは樹脂の粒を焼き固めて、多孔質性を有するように形成することができる。サポート部材152Bの剛性は吸着フィルター152Aよりも高くなっており、吸着フィルター152Aが本体151内で変形することがサポート部材152Bによって抑制されている。
【0040】
図4に示す保持部160の底部には、液体を吸収する吸収体(不図示)を設けることが好ましい。この場合、抽出フィルターカートリッジ150を保持部160に収容したときに、抽出フィルターカートリッジ150の排出口151C側の外面に吸収体を接触させる。これにより、例えば抽出フィルターカートリッジ150内に洗浄液123Aを供給したときに排出口151Cの外面に洗浄液123Aが付着した場合に、吸収体に洗浄液123Aを吸収させて洗浄液123Aを除去することができる。
【0041】
以下では、図8A〜図8Cを参照して、核酸分析チップ20の構成について説明する。
核酸分析チップ20は、円板状のチップ本体21と、チップ本体21に貼り付けられた蓋体29とを有している。
【0042】
チップ本体21は、チップ本体21の中心から等距離になるようにチップ本体21の周方向に並べて配置された複数の反応容器22と、チップ本体21上で反応容器22のそれぞれに連通して設けられた流路23とを有している。本実施形態では23個の反応容器22がチップ本体21に設けられている。
【0043】
また、チップ本体21の中央部には、上述の核酸精製キット10によって精製された核酸を含有する核酸溶液などを反応容器22に送液するための注入口26と、注入口26の近傍に形成された出口27とを有している。注入口26及び出口27は、流路23に連通している。さらに、チップ本体21には、注入口26及び出口27を取り囲むようにチップ本体21の外面から突出して形成された突出壁部28が設けられている。
【0044】
チップ本体21の材料は、核酸の分析に影響を与えない材料であることが好ましい。具体的には、チップ本体21の材料は、ポリプロピレン、ポリカーボネート、アクリルのうち少なくとも1以上を含む樹脂材料であることが好ましい。ポリプロピレンとしては、ホモポリプロピレンや、ポリプロピレンとポリエチレンとのランダム共重合体を使用することができる。また、アクリルとしては、ポリメタクリル酸メチル、あるいはメタクリル酸メチルとその他のメタクリル酸エステル、アクリル酸エステル、スチレンなどのモノマーとの共重合体を使用することができる。
【0045】
チップ本体21は、少なくとも反応容器22の部分において光透過性を有することが好ましく、反応容器22内で起こる生化学的反応によって発生する蛍光や着色などを反応容器22の外部から検出可能であることが好ましい。具体的には、可視光領域(波長350nm以上780nm以下)の光を、光透過率70%以上で透過可能であることが好ましい。また、チップ本体21が光透過性を有する樹脂材料で形成されていても良い。
【0046】
反応容器22は、内部に液体を貯留可能な略半球形状の凹部としてチップ本体21に形成されている。反応容器22の内壁面には、生化学反応を行うための試薬類が配置されている。具体的には、反応容器22のそれぞれには、検査対象となるSNPを含む遺伝子領域を増幅するための少なくとも一対のプライマーセットと、インベーダー(登録商標)法に使用されるインベーダー(登録商標)オリゴ及びシグナルプローブと、が収容されている。検査対象となる遺伝子の領域に応じて、複数種類のプライマーセット、インベーダー(登録商標)オリゴ及びシグナルプローブを反応容器22ごとに異ならせてあらかじめ配置しておくことが好ましい。この場合、反応容器22ごとに異なる種類のSNPの測定を行うことができ、例えば本実施形態の核酸分析チップ20によれば同時に23種類のSNPに対して測定を行うことができる。
【0047】
流路23は、反応容器22よりも径方向内側のチップ本体21上に凹部が形成されることで設けられている。また、流路23は、主流路24と、分岐流路25とを有している。
主流路24は、チップ本体21の中心とチップ本体21の径方向外側との間で蛇行しつつチップ本体21の周方向に延びて形成されている。分岐流路25は、主流路24と反応容器22のそれぞれとを連絡するように主流路24から分岐して形成されている。
【0048】
主流路24の一端24Aが注入口26に連通し、主流路24の他端24Bが出口27に連通している。また、主流路24は、チップ本体21の周方向で隣り合う反応容器22の間で、中心軸Oに沿って突出する山形24Cを有するように形成されている。チップ本体21の周方向に隣り合う反応容器22の間で中心軸線O方向に山形状24Cを有することで、核酸分析チップ20を中心軸線O回りに回転させたときに、主流路24に貯留している液体は、山形状24Cの頂点24Dにおいて途切れて反応容器22のそれぞれに液体が送液される。
【0049】
分岐流路25は、主流路24との接続部分において主流路24の流路面積よりも狭く形成されている。分岐流路25の主流路24に接続された部分は、液体が主流路24から分岐流路25に流動することを制限する流動制限部25Aになっている。
【0050】
蓋体29は、チップ本体21において反応容器22及び流路23が形成された側に設けられている。蓋体29がチップ本体21に貼り付けられることで、反応容器22及び流路23となる凹部に蓋がされて、独立した反応空間及び流路になっている。
【0051】
蓋体29の材料としては、熱伝導性が高い材料であることが好ましく、例えばアルミニウム、銅、銀、ニッケル、真鍮、及び金などの金属材料を採用することができる。熱伝導性を有する部分は少なくとも反応容器22が位置する部分にあればよい。また、反応容器22内での生化学反応(例えばPCR反応)に十分な速度で反応容器22の内部の液体などに熱を伝達可能であれば、上述のチップ本体21と同様の樹脂材料で形成された薄板材によって蓋体29が構成されていてもかまわない。
【0052】
本実施形態の核酸分析チップ20は、核酸分析チップ20が中心軸線O回りに回転して生じる遠心力によって、主流路24に貯留された液体を分岐流路25のそれぞれに送液し、分岐流路25を通じて反応容器22のそれぞれに液体を送液する。
【0053】
以下では、図2を参照して分析装置本体30の構成について説明する。
分析装置本体30は、上述の核酸精製キット10と核酸分析チップ20とが配置される被検体導入部40と、核酸精製キット10を用いて被検体から核酸を抽出する操作を行う精製処理部50と、核酸分析チップ20を中心軸線O回りに回転させる遠心送液部60と、核酸分析チップ20の反応容器22内で核酸の分析を行う分析部70と、を備えている。
【0054】
被検体導入部40は、核酸精製キット10の試薬カートリッジ100及び分注チップラック200が配置されるトレイ41と、核酸分析チップ20を載置するための分析チップホルダ42とを有している。
【0055】
トレイ41は、被検体導入部40において着脱自在に設けられており、被検体などが付着した場合に滅菌処理、あるいは感染性廃棄物として廃棄できるようになっている。また、トレイ41には、試薬カートリッジ100に形成された上述の爪部102が係合する被係合部43が設けられており、トレイ41上で試薬カートリッジ100が転倒しないようになっている。本実施形態では、爪部102は、試薬カートリッジ100を被検体導入部40に位置決めするための位置決め機構になっている。
分析チップホルダ42は、円形の貫通孔に核酸分析チップ20が嵌合することで核酸分析チップ20を支持することができる。
【0056】
精製処理部50は、分注チップラック200内に配置された分注チップ201を搬送し、かつ、ロボットハンド51及び分注チップ201を用いて液体を吸引、保持、及び吐出する分注部52と、試薬カートリッジ100に収容された抽出フィルターカートリッジ150の上端から空気を流入させて抽出フィルターカートリッジ150の内部を加圧する加圧部53とを有している。
分注部52には、分注チップ201が圧入によって着脱可能に接続される。この状態で、分注チップ201を用いて、分注作業や、各液の運搬が行われる(図10、11)。また、分注チップ201は複数用意され、コンタミネーション防止の観点から適宜交換される。
分注チップ201を交換するときは、分注チップ201の上端をリリース部(不図示)で下方に押し下げることにより、分注チップ201を分注部52から開放することができる。リリース部は分注部52に備えられる。例えば、分注チップ201の上端に、リリース部と容易に係合する突出部を設けてもよい。
抽出フィルターカートリッジ150は、ロボットハンド51により移動され、加圧部53によって加圧される。この加圧時、加圧部53と抽出フィルターカートリッジ150とは気密に係合可能である(図12)。係合状態を気密にするために適する構成としては、例えば、加圧部53の下端、あるいは、抽出フィルターカートリッジ150の上端151Aに弾性部材を設けた構成が挙げられる。このように加圧部53と抽出フィルターカートリッジ150とを係合させた状態で、加圧部53を用いて抽出フィルターカートリッジ150の内部を加圧することができる。
【0057】
遠心送液部60は、公知の遠心装置を適宜採用することができ、核酸分析チップ20を支持して中心軸線O回りに核酸分析チップ20を回転させることができる。遠心送液部60において核酸分析チップ20を回転させる速度は、核酸分析チップ20の内部に供給された液体に加わる遠心力によって液体が主流路24から分岐流路25へ流入する程度の速度であることが好ましい。核酸分析チップを回転させる最適な速度は、核酸分析チップの形状に依存する。例えば、本実施形態の核酸分析チップ20の場合には、遠心送液部60において核酸分析チップ20を回転させる速度は、1000rpm以上であることが好ましい。
【0058】
分析部70は、核酸分析チップ20に接触して核酸分析チップ20の反応容器22内を所定の温度変化に従うように温度変化させる温度制御機構80と、核酸分析チップ20の反応容器22内の蛍光を測定する蛍光測定部90と、を有している。
【0059】
温度制御機構80は、対向する平面を有する上部ヒートプレート81及び下部ヒートプレート82と、図示しない温調制御部とを有している。詳細は後述するが、図16に示すように、上部ヒートプレート81と下部ヒートプレート82との間に核酸分析チップ20が挟み込まれている。上部ヒートプレート81には、リング状の凸部領域81Aが設けられている。この凸部領域81Aにより、上部ヒートプレート81は、少なくとも核酸分析チップ20の反応溶液22の領域と、突出壁部28とに接触する。上部ヒートプレート81及び下部ヒートプレート82には、アルミニウム、金、銀、銅等の熱伝導率の高い金属材料を用いることができる。また核酸分析チップ20との密着性を高めるために各ヒートプレートの核酸分析チップとの接触面を熱伝導性の良好な弾性体で構成するようにしても良い。
【0060】
上部ヒートプレート81と下部ヒートプレート82とは上述の温調制御部にあらかじめ設定された温度変化に従って温度変化する。温調制御部における温度制御方法は、周知のサーマルサイクラーにおける温度制御方法を適宜採用することができる。これにより、核酸分析チップ20の反応容器22内でPCR及びインベーダー(登録商標)法による反応を行うことができる。
【0061】
蛍光測定部90は、LEDなどの光源部やPMTなどの受光部、励起用光学フィルターや受光用光学フィルターを備えた光学部91から光ファイバー(図示略)を介して、反応容器22内の蛍光物質を励起するための励起光を反応容器22に照射して、蛍光物質の蛍光強度を測定する。励起光は、光源やフィルターの組合せにより任意の波長を得ることができる。
【0062】
また、分析装置本体30は、被検体導入部40および分析部70を筐体31の内部で移動させる搬送部(搬送手段)55を有している。搬送部55の一例として、筐体31の内部に設けられたレール56と、このレール56に沿って移動する移動ステージ57とを備えた搬送部を採用することができる。また、搬送部55の他に、ロボットハンド51によって被検体導入部40および分析部70を筐体31の内部で移動させても良い。さらには、本発明の搬送手段としては、上記の例に限らず、核酸精製キット10と核酸分析チップ20とが配置された被検体導入部40が、精製処理部50、遠心送液部60、分析部70でそれぞれ処理可能な様に搬送される機構を有していれば良い。例えば、精製処理部50、遠心送液部60、分析部70がそれぞれ移動して相対的に被検体導入部40が各処理部に搬送されるようにしても良い。
【0063】
図2に示した構成の本実施形態の核酸分析装置1の例では、被検体導入部40が、分析装置本体30の筐体31の内部で図2に示すX方向に搬送部によって直線移動可能になっており、精製処理部50、遠心送液部60、分析部70の位置まで搬送可能となっている。また、分析部70は、被検体導入部40の搬送部とは別の搬送手段として分析部70の移動機構を有している。この移動機構により、分析装置本体30の筐体31の内部で図2に示すY方向に直線移動可能になっている。これにより核酸分析チップ20に対して処理を行なう処理部を温度制御機構80と蛍光測定部90とで切り替えることができる。具体的には、PCR反応時には核酸分析チップ20を上部ヒートプレート81および下部ヒートプレート82で温度制御を行い、インベーダー反応移行前に上部ヒートプレート81がY方向に移動して、光ファイバーが核酸分析チップ20の上部に位置するようになる。これによって、下部ヒートプレート82でインベーダー反応温度に温度制御を行いながら、核酸分析チップ20の上部を光ファイバーが移動して反応容器22内の蛍光強度を測定することができる。
【0064】
以上に説明した構成の、本実施形態の核酸分析装置1の使用時の動作について図17のフローチャート図を参照しながら説明する。
核酸分析装置1を動作させる前に、まず、ユーザの手作業によって図3に示す試薬カートリッジ100の封止フィルム103が取り外される。続いて、試薬カートリッジ100のサンプルウエル110に例えば全血試料をユーザの手作業によって注入する。続いて、ユーザは試薬カートリッジ100及び分注チップラック200を図2に示すようにトレイ41上に載置する。このとき、試薬カートリッジ100に設けられた爪部102がトレイ41の被係合部43に係合して、試薬カートリッジ100はトレイ41に固定される。
さらに、ユーザの手作業によって、核酸分析チップ20は分析チップホルダ42に載置される。
【0065】
続いて、図9に示すように、被検体導入部40は、精製処理部50へ移動される(S1)。精製処理部50では、図10に示すように、分注部52を移動させる。試薬ウエル121〜126に貯留された各種の試薬を所定の手順に従って、分注部52により、空気を送り(加圧し)、または空気を吸引し(減圧し)、分注チップ201への試薬の出し入れを行い、分注、混合する。これにより、サンプルウエル110に供給された全血試料中の細胞は溶解され、細胞溶解液が得られる。試薬ウエル121〜126から液体を分注チップ201内に吸引するときには、試薬ウエル121〜126を封止している封止フィルム104には分注チップ201の先端が差し込まれる。封止フィルム104には貫通孔が形成され、分注チップ201によって試薬ウエル121〜126の内部の各種試薬類を吸引される。
【0066】
続いて、抽出フィルターカートリッジ150を廃液ウエル130へ搬送し、細胞が溶解された溶液を図11に示すように抽出フィルターカートリッジ150に供給する。その後、図12に示すように、分注チップ201を分注チップラック200に戻した後、加圧部53と抽出フィルターカートリッジ150の上端151Aとを当接させる。そして、加圧部53が抽出フィルターカートリッジ150の上端151Aから抽出フィルターカートリッジ150内に気体を送り込み、液体が吸着フィルター152Aを通過する。このように、加圧部53により、抽出フィルターカートリッジ本体151を加圧することにより、液体が吸着フィルター152Aを通過する速度を高めることができる。細胞が溶解された溶液は、吸着フィルター152Aを通過して、核酸は吸着フィルター152Aに吸着される。その後、生体物質を溶解する溶解液122Aで吸着フィルター152Aを洗浄する。前記生体物質は、前記溶解液121Aで溶解しきれず担体へ目詰まりを起こしている細胞質などである。
【0067】
さらに、洗浄液123A、124Aを吸着フィルター152Aに供給して吸着フィルター152Aを洗浄液123A、124Aによって洗浄する。その後、ロボットハンド51によって抽出フィルターカートリッジ150を回収ウエル140へ搬送し、分注部52と分注チップ201とによって、溶出液125Aを吸着フィルター152Aに供給する。これにより、吸着フィルター152Aに吸着されていた核酸を溶出液125A中に溶出させて、核酸を含有する核酸溶液を回収ウエル140にて回収する。このとき、吸着フィルター152Aをロボットハンド51と加圧部53によって加圧し、回収する時間を短縮することが好ましい。
【0068】
さらに、希釈液126Aと核酸を含む溶出液125Aとを混ぜ合わせ、サンプルの準備が完了となる。
以上で核酸精製キット10による核酸の分離精製は終了する。
【0069】
核酸精製キット10によって被検体から核酸が精製されたら(S2)、核酸を含む核酸溶液は、回収ウエル140から核酸分析チップ20へと分注チップ201を用いて分注部52によって搬送される(S3)。さらに、核酸分析チップ20の注入口26から核酸分析チップ20の主流路24へ核酸溶液が送液される。このとき、主流路24から分岐流路25へは核酸溶液は進入しない。
【0070】
核酸分析チップ20を載せた状態で、被検体導入部40は、図13に示すように遠心送液部60へと移動する(S4)。さらに、核酸分析チップ20は遠心送液部60によって中心軸線O回りに回転し、核酸分析チップ20の主流路24に貯留している核酸溶液に遠心力が加わることで、核酸溶液は、核酸分析チップ20の反応容器22のそれぞれへと送液される(S5)。
【0071】
遠心送液部60における送液が終了したら、核酸分析チップ20を載せた状態で、被検体導入部40は再び精製処理部50へと移動する(図9参照、S6)。精製処理部50では、図4に示す核酸抽出キット10のオイルウエル127に収容されたオイル127Aを分注チップ201の内部に吸引する。このとき、オイル127Aは、分注チップ201の素材がオイル127Aとの親和性が高いため、図14Aに示すように、分注チップ201の外面に液滴状に付着することがある。
【0072】
分注部52は、図14Aに示すようにオイル除去部128へと分注チップ201を移動させる。さらに、図14Bに示すように分注部52は、オイル除去部128の拭いフィルター129Aの切り込み部129Cに分注チップ201の先端201Aを挿入する。分注チップ201の先端201Aの外周面に付着したオイル127Aは、拭いフィルター129Aに吸い取られて分注チップ201の外周面から除去される。分注チップ201を切り込み部129Cから引き抜くことで、分注チップ201の外周面は拭いフィルター129Aに再度接触し、分注チップ201の外周面に付着したオイル127Aは拭き取られる。
【0073】
内部にオイル127Aが保持され外周面のオイル127Aが除去された分注チップ201は、核酸分析チップ20まで分注部52によって搬送される。さらに、図8Aに示す核酸分析チップ20の注入口26に分注チップ201の先端201Aが挿入されて、注入口26から主流路24へとオイル127Aが送液される(S7)。このとき、オイル127Aは、主流路24に充填されるが、分岐流路25には進入しない。
【0074】
主流路24へオイル127Aが供給されたら、核酸分析チップ20を載せた状態で、被検体導入部40は再度遠心送液部60へと移動する(図13参照、S8)。さらに、核酸分析チップ20は、遠心送液部60によって中心軸線O回りに回転される。図8Aに示す核酸分析チップ20の主流路24に貯留しているオイル127Aに遠心力が加わることで、オイル127Aは分岐流路25にある空気と置換され、分岐流路25のそれぞれに充填される(S9)。オイル127Aは核酸溶液よりも比重が小さい。遠心送液部60によってオイル127Aと核酸溶液とに等しい加速度がかかっている状態では、核酸溶液が核酸分析チップ20の径方向外側に位置する。これにより、反応容器内22に核酸溶液が充填されている状態では、反応容器22内にオイル127Aは侵入しない。
【0075】
分岐流路25にオイル127Aが送液されたら、核酸分析チップ20を載せた状態で、被検体導入部40は分析部70の温度制御機構80へと移動する(S10)。温度制御機構80では、核酸分析チップ20は、上部ヒートプレート81と下部ヒートプレート82との間に挿入される。さらに、上部ヒートプレート81と下部ヒートプレート82とによって核酸分析チップ20は図16に示すように挟み込まれる。このとき、突出壁部28は上部ヒートプレート81に当接して弾性変形することで上部ヒートプレート81に密着する。これにより、注入口26及び出口27(図8A参照)は突出壁部28によって密封される。
【0076】
上部ヒートプレート81と下部ヒートプレート82ともに、あらかじめ設定された温度変化に従って加熱あるいは冷却される。これにより、核酸分析チップ20の反応容器22の内部に収容された核酸溶液の温度は、あらかじめ設定された温度変化に従って変化する。その後、反応容器22のそれぞれの内部では、反応容器22に収容されたプライマーセットの特異性に応じた核酸増幅反応(PCR反応)が行われる(S11)。
【0077】
反応容器22内での核酸増幅反応が終了したら、反応容器22内のDNAポリメラーゼを失活させるために例えば99℃で10分間反応容器22を加熱する(S13)。拡散増幅反応において、反応容器22に収容した試薬類などから気泡が発生して、反応容器22内に残留することがある。この場合、必要に応じて、PCR反応において反応容器22内に発生した気泡を除去する気泡除去工程(S12)を、PCR反応の終了後、DNAポリメラーゼを失活させる(S13)前に行っても良い。また、必要に応じて、DNAポリメラーゼを失活させた(S13)後に、気泡除去工程(S14)を行っても良い。すなわち、気泡除去工程(S12,S14)は、どちらか1回実施しても、2回実施しても良い。
【0078】
気泡除去工程は、温度制御機構80によって核酸分析チップ20の反応容器22の温度を室温まで急冷し、分析部70から遠心送液部60へ核酸分析チップ20を移動させて、核酸分析チップ20を中心軸線O回りに回転させる工程である。これにより、反応容器22および流路23内の液体に加わる遠心力によって反応容器22内の気泡が流路23側へ押し出される。
本実施形態の核酸分析装置1では、特に上記S4〜S13、あるいは、S14を含む工程を自動的に行うことができるため、反応容器22のそれぞれに核酸溶液を送液するタイミングを一致させることができる。また、核酸溶液を送液後、PCR反応(S11)を開始するまでの時間間隔を最小限に短縮できる。この結果、核酸増幅反応への意図しない人為的な影響を防ぎ、測定結果の精度を向上できる。
【0079】
続いて、反応容器22の内部でインベーダー(登録商標)法によるSNPの測定を行う。
まず、図18に示すように、分析部70の蛍光測定部90が核酸分析チップ20に重畳するように、分析部70が被検体導入部40に対して移動する(S15)。次に、反応容器22の内部の液体の温度が60℃から70℃の間、好ましくは63℃になるように、下部ヒートプレート82を温度制御する。これにより、核酸分析チップ20においてインベーダー(登録商標)法による酵素反応が行われる。
【0080】
蛍光測定部90では、図示していない光ファイバーを介して光学部91で発生された励起光を反応容器22に照射する。本実施形態では、インベーダー(登録商標)法による測定を用いるため、波長が480nmと545nmとなる二種類の励起光を用いる。インベーダー(登録商標)法に用いる蛍光物質は具体的にはFAMとRedmondRedである。反応容器22は透明で波長350nm以上780nm以下の光を透過可能であるので、励起光は反応容器22の内部に到達し、反応容器22の内部でシグナルプローブから遊離した蛍光物質に到達する。反応容器22の内部では、遊離した蛍光物質の量に比例して蛍光強度が強くなる。蛍光測定部90は、核酸分析チップ20の周方向に順番に反応容器22の内部の蛍光強度をFAMとRedmondRedとのそれぞれについて測定する(S16)。蛍光測定部90において測定された情報は図1に示す端末2に表示され(S17)、ユーザは核酸にどのようなSNPが含まれているかを知ることができる。
【0081】
以上説明したように、本実施形態の核酸分析装置1によれば、核酸精製キット10を用いた核酸の精製が精製処理部50によって行われる。そして、遠心送液部60によって核酸分析チップ20の反応容器22のそれぞれに核酸溶液を送液した後に、分析部70において核酸の分析が行われる。このように、各部が連動して核酸分析を行い、核酸の精製から核酸の分析までの工程を分析装置本体30によって自動的に行うことができるので、精度の高い遺伝子検査を簡便に行うことができる。
【0082】
また、核酸分析装置1の動作の工程において、ユーザの手作業が発生する工程は、核酸精製キット10のサンプルウエル11に被検体(全血試料)を供給して核酸精製キット10をトレイ41に載置する工程である。この工程は精度の高い液体操作を要求するのではなく、精度の高い液体操作はすべて分析装置本体30によって行われる。従って、ユーザが液体操作に熟練していなくても再現性の高い遺伝子検査を行うことができる。
【0083】
また、分析部70が温度制御機構80を備えているので、核酸分析チップ20に核酸溶液及びオイル127Aを供給してから核酸分析チップ20の反応容器22の内部でPCR反応を直ちに行うことができる。このため、手作業が介在しないので、操作が簡便であり、さらには、PCR反応の特異性を高めて遺伝子検査を精度よく行うことができる。
【0084】
また、分析部70が蛍光測定部90を備えているので、反応容器22の内部で励起光によって励起される蛍光物質の蛍光を測定することができる。
【0085】
また、核酸精製キット10がオイル除去部128を備えているので、オイル除去部128の拭いフィルター129Aによって分注チップ201の先端201Aの外周面に付着したオイル127Aを除去することができる。これにより、分注チップ201の先端201Aが核酸分析チップ20の注入口26に挿入されたときに注入口26の周囲の核酸分析チップ20の外面にオイル127Aが付着することを抑制することができる。その結果、遠心送液部60において核酸分析チップ20を回転させたときに、遠心力によってオイル127Aが飛散することが抑制できる。
【0086】
また、核酸を抽出するために必要な試薬やフィルターユニットが試薬カートリッジ100の内部に設けられ、一組として一体化されているので、被検体をサンプルウエル110に添加して被検体導入部40のトレイ41に載置する操作のみ手作業によって行えばよいので、遺伝子検査を簡便に行うことができる。また、試薬カートリッジ100に廃液ウエル130が一体に設けられているので、遺伝子検査が終了した後は、試薬カートリッジ100を、トレイ41から取り外して廃棄するだけでよい。このため、廃液処理が簡便であり、被検体などの残液によって周囲が汚染されるおそれがない。
【0087】
また、試薬カートリッジ100に設けられた封止フィルム104によって試薬ウエル部120のそれぞれが封止されており、分注チップ201の先端201Aによって封止フィルム104を貫通して試薬などを吸引することができるので、試薬などが必要になる直前まで試薬ウエル部120を密封しておくことができる。
【0088】
また、試薬カートリッジ100に、抽出フィルターカートリッジ150を保持する保持部160が設けられている。これにより、抽出フィルターカートリッジ150が試薬カートリッジ100内で転倒したり、抽出フィルターカートリッジ150が試薬カートリッジ100内で位置ずれを起こしたりすることがない。このため、抽出フィルターカートリッジ150の姿勢を安定させて核酸の精製を自動化することができる。
【0089】
また、試薬カートリッジ100の開口を封止する封止フィルム103が設けられているので、抽出フィルターカートリッジ150やサンプルウエル110、回収ウエル140などに異物が混入することを抑制することができる。
【0090】
また、試薬カートリッジ100にはトレイ41に固定するための爪部102が設けられているので、分析装置本体30の内部で被検体導入部40が移動しても試薬カートリッジ100が転倒したり試薬カートリッジ100の位置がずれたりすることがない。
【0091】
また、核酸分析チップ20の流路23が反応容器22よりも中心軸線O側に設けられているので、核酸分析チップ20を中心軸線O回りに回転させることで流路23から反応容器22のそれぞれへ液体を送液することができる。
【0092】
また、注入口26が中心軸線O上に位置しているので、注入口26の周囲の外面に付着した試薬やオイルなどの液体にかかる遠心力が少ない。これにより、遠心送液部60において核酸分析チップ20が中心軸線O回りに回転したときに、試薬やオイルなどの液体が飛散することが抑制されている。
【0093】
また、注入口26を取り囲むように、核酸分析チップ本体21の外面から突出して形成された突出壁部28が設けられているので、突出壁部28を上部ヒートプレート81などに当接させることで注入口26の周囲を密封することができる。このため、注入口26から液体などが吹き出すことを防止することができる。
また、突出壁部28が弾性を有するので、突出壁部28と上部ヒートプレート81とを密着させることができる。
【0094】
また、主流路24と分岐流路25との間に流動制限部25Aが設けられているので、主流路24の全体に液体を充填した後に、分岐流路25を通じて反応容器22に遠心力によって液体を送液することができる。
【0095】
また、主流路24に山形状24Cが形成されているので、山形状24Cによって仕切られた主流路24のそれぞれには等量の液体を貯留することができる。このため、反応容器22のそれぞれに送液される液体の量を均等にすることができ、反応容器22ごとの生化学反応の誤差を低減することができる。
【0096】
また、反応容器22が光透過性を有するので、核酸分析チップ20の外部から反応容器22の内部の光学的な測定を行うことができる。
【0097】
また、核酸分析チップ20が、反応容器22と流路23とが形成されたチップ本体21と、チップ本体21に貼り合わせられた蓋体29とを有しているので、反応容器22のそれぞれに異なるプローブ、プライマー、および試薬類を配置することが容易である。また、チップ本体21に蓋体29を貼り合わせたあとは、反応容器22のそれぞれを独立した反応空間として生化学反応を好適に行うことができる。
【0098】
また、蓋体29が金属材料によって形成されているので、反応容器22のそれぞれに対して加熱及び冷却を迅速に行うことができる。
【0099】
以下では、本実施形態の核酸分析装置1を使用した遺伝子解析の例について説明する。
核酸分析装置1を使用した遺伝子解析の例としては、例えばK−ras遺伝子変異の検出や、生殖細胞変異の検出を挙げることができる。
K−ras遺伝子は、ウイルス由来の癌遺伝子として知られており、GTPase活性を有するG蛋白の一種をコードする遺伝子である。K−ras遺伝子に点突然変異が発生すると、GTPase活性が低下することで細胞の癌化を引き起こすと考えられている。
生殖細胞変異は、生殖細胞に変異を有する状態で発生した個体に特徴的な変異で、個体のすべての細胞に同一の変異がある。生殖細胞変異を解析することで例えば薬剤感受性の差などの推定ができると考えられている。
【0100】
(K−ras遺伝子変異の検出)
まず、K−ras遺伝子変異の検出に本実施形態の核酸分析装置1を使用する例を説明する。
反応容器22のそれぞれの内部には、K−ras遺伝子の野生型と、13種の変異型とのそれぞれに対応するプローブと、核酸を増幅するための上述の酵素及び塩があらかじめ収容されている。この場合、プローブの種類は14種類となるので、核酸分析チップ20において14個の反応容器22を使用するようになっている。
【0101】
ユーザは、膵臓癌や大腸癌などが疑われる被検体を核酸精製キット10の試薬カートリッジ100のサンプルウエル110に供給し、上述の様に核酸分析装置1を動作させて核酸の抽出、核酸中の遺伝子の増幅反応、及び蛍光強度の測定を行う。これにより、被検体がK−ras遺伝子変異を有しているか否か、またK−rasの変異型のうちどの変異型であるかを知ることができる。
【0102】
(生殖細胞変異の検出)
生殖細胞変異は、個体のすべての細胞に共通する変異であるので、例えば全血試料などを用いて生殖細胞変異の検出を行うことができる。具体的には、生殖細胞変異は、被検体のSNPを特定することによって検出することができる。このようなSNPの特定方法としては、例えばPCR−PHFA(PCR−Preferential Homoduplex Formation Assay)法が知られている。
【0103】
本実施形態の核酸分析チップ20を用いてPCR−PHFA法を行うことで、反応容器22のそれぞれに送液される液体の量を揃えることができるので、複数の反応容器22の間での測定誤差が低減され、複数の反応容器22における蛍光強度の差によってSNPの有無を検出する場合の検出精度を高めることができる。
【0104】
また、SNPを検出する方法としては、インベーダー法(登録商標)、Taqman PCR法などが知られているが、これらの方法に対しても本実施形態の核酸分析装置1を好適に使用することができる。
【0105】
以上、本発明の実施形態について図面を参照して詳述したが、具体的な構成はこの実施形態に限られず、本発明の要旨を逸脱しない範囲の設計変更等も含まれる。また、上述の実施形態及び変形例において示した構成要素は適宜に組み合わせて構成することが可能である。
例えば、分析部70が、温度制御機構80と蛍光測定部90とを備えた構成としたが、分析部70が、温度制御機構80と蛍光測定部90とを備えていなくても、精度の高い遺伝子検査をより簡便に行うことができる。
また、核酸精製キット10は、オイル127Aと少なくともオイルの分注を行うオイル分注チップ201が収容された分注チップラック200とオイル分注チップ201の先端側の外面に付着した余剰オイルを除去するオイル除去部128とを備えることが好ましい。
また、核酸精製キット10は、箱状の試薬カートリッジ100と試薬分注チップ201とを有し、試薬カートリッジ100は、サンプルウエル110とオイルウエル127と試薬ウエル121、122、123、124、125、126と廃液ウエル130と抽出フィルターカートリッジ150とを有することが好ましい。
【0106】
また、試薬分注チップ201あるいはオイル分注チップ201の先端によって貫通可能に形成された封止フィルム(穴部封止フィルム)104が試薬カートリッジ100に設けられた構成としたが、これに限定されることはない。試薬カートリッジ100には、抽出フィルターカートリッジ150が収容される保持部160が一体に形成された構成にしたがこれに限定されることはない。
また、試薬カートリッジ100を被検体導入部40に位置決めするための位置決め機構として、爪部102を設けたが、これに限定されることはない。
また、核酸分析チップ20は、流路23と、注入口26とを有する構成としたが、これに限定されることはなく、チップ本体21と、蓋体29とを有する構成としたが、これに限定されることはない。このチップ本体21と蓋体29の少なくともいずれかは光透過性を有することが好ましい。
さらに、注入口26及び出口27を取り囲むようにチップ本体21の外面から突出して形成された突出壁部28が設けられた構成としたが、これに限定されることはない。
また、突出壁部28は、弾性を有したが、これに限定されることはない。また、流路23が、主流路24と、分岐流路25とを有する構成としたが、これに限定されることはなく、さらには、主流路24は山形状を有する形状としたが、これに限定されることはない。
【符号の説明】
【0107】
1 核酸分析装置
2 端末
10 核酸精製キット
20 核酸分析チップ
21 チップ本体
22 反応容器
23 流路
24 主流路
24A 一端
24B 他端
24C 山形状
24D 頂点
25 分岐流路
25A 流動制限部
26 注入口
27 出口
28 突出壁部
29 蓋体
30 分析装置本体
31 筐体
40 被検体導入部
41 トレイ
42 分析チップホルダ
43 被係合部
50 精製処理部
51 ロボットハンド
52 分注部
53 加圧部
55 搬送部(搬送手段)
60 遠心送液部
70 分析部
80 温度制御機構
81 上部ヒートプレート
81A 凸部領域81A
82 下部ヒートプレート
90 蛍光測定部
91 光学部
100 試薬カートリッジ
101 本体
102 爪部(位置決め機構)
103 封止フィルム
104 封止フィルム
110 サンプルウエル(被検体収容部)
120 試薬ウエル部
121、122、123、124、125、126 試薬ウエル(試薬収容部)
121A、122A 溶解液
123A、124A 洗浄液
125A 溶出液
126A 希釈液
127 オイルウエル(オイル収容部)
127A オイル
128 オイル除去部
129 拭い部
129A 拭いフィルター
129B、129D 支持部
129C 切り込み部(貫通孔)
129E 切り込み部(真円形)
129F 切り込み部(膨出部のある円形)
130 廃液ウエル(廃液収容部)
140 回収ウエル
150 抽出フィルターカートリッジ
151 本体(略筒状)
151A 上端
151B 下端
151C 排出口(ノズル状)
152 抽出フィルターユニット
152A 吸着フィルター
152B サポート部材
160 保持部
200 分注チップラック
201 分注チップ(オイル分注チップ、試薬分注チップ)
201A 先端
O 中心軸線(回転軸)
【特許請求の範囲】
【請求項1】
被検体から核酸を分離精製して核酸溶液とする核酸精製キットと;
前記核酸精製キットが載置される被検体導入部と;
を備え、
前記核酸精製キットは、
オイルの分注を行うオイル分注チップが収容された分注チップ収容体と;
箱状の試薬カートリッジと;
前記分注チップ収容体に収容された複数の試薬分注チップと;を有し、
前記試薬カートリッジは、
前記被検体を収容する被検体収容部と;
前記オイルを収容するオイル収容部と;
前記核酸の分離精製を行う液体試薬を収容する試薬収容部と;
前記分離精製において発生する廃液を収容する廃液収容部と;
前記被検体の前記核酸を精製する抽出フィルターカートリッジと;
前記オイル収容部と前記試薬収容部とをそれぞれ封止し、前記試薬分注チップあるいは前記オイル分注チップの先端によって貫通可能に形成された穴部封止フィルムと;を有し、
前記被検体から前記核酸を分離精製することを特徴とする核酸分析装置。
【請求項2】
前記核酸精製キットは、
前記オイル分注チップの先端側の外面に付着した余剰オイルを除去するオイル除去部を備えることを特徴とする請求項1に記載の核酸分析装置。
【請求項3】
前記オイル除去部は、前記オイル分注チップの先端が挿入されることで前記オイル分注チップの外面に接触する親油性の拭い部を有することを特徴とする請求項2に記載の核酸分析装置。
【請求項4】
前記試薬カートリッジは、前記抽出フィルターカートリッジを着脱自在に保持する保持部を有することを特徴とする請求項1から3のいずれか一項に記載の核酸分析装置。
【請求項5】
前記保持部は、前記抽出フィルターカートリッジを通過した液体を吸収する吸収体を有することを特徴とする請求項4に記載の核酸分析装置。
【請求項6】
請求項1から5のいずれか一項に記載の核酸分析装置による核酸の分離精製方法であって、
前記試薬カートリッジの前記被検体収容部に前記被検体を注入する工程と、
前記試薬収容部に貯留された前記液体試薬の前記試薬分注チップへの出し入れを、前記穴部封止フィルムを貫通して行い、前記被検体収容部の前記被検体に分注、混合して細胞溶解液を得る工程と、
前記細胞溶解液を前記抽出フィルターカートリッジに供給する工程と、
前記分注チップを前記分注チップ収容体に戻す工程と、
前記抽出フィルターカートリッジを通過した液体から吸収体によって前記核酸を吸収する工程と、
前記分注チップによって、前記液体試薬を前記吸収体に供給し、該液体試薬中に溶出させた核酸溶液を回収する工程とを備えることを特徴とする核酸の分離精製方法。
【請求項1】
被検体から核酸を分離精製して核酸溶液とする核酸精製キットと;
前記核酸精製キットが載置される被検体導入部と;
を備え、
前記核酸精製キットは、
オイルの分注を行うオイル分注チップが収容された分注チップ収容体と;
箱状の試薬カートリッジと;
前記分注チップ収容体に収容された複数の試薬分注チップと;を有し、
前記試薬カートリッジは、
前記被検体を収容する被検体収容部と;
前記オイルを収容するオイル収容部と;
前記核酸の分離精製を行う液体試薬を収容する試薬収容部と;
前記分離精製において発生する廃液を収容する廃液収容部と;
前記被検体の前記核酸を精製する抽出フィルターカートリッジと;
前記オイル収容部と前記試薬収容部とをそれぞれ封止し、前記試薬分注チップあるいは前記オイル分注チップの先端によって貫通可能に形成された穴部封止フィルムと;を有し、
前記被検体から前記核酸を分離精製することを特徴とする核酸分析装置。
【請求項2】
前記核酸精製キットは、
前記オイル分注チップの先端側の外面に付着した余剰オイルを除去するオイル除去部を備えることを特徴とする請求項1に記載の核酸分析装置。
【請求項3】
前記オイル除去部は、前記オイル分注チップの先端が挿入されることで前記オイル分注チップの外面に接触する親油性の拭い部を有することを特徴とする請求項2に記載の核酸分析装置。
【請求項4】
前記試薬カートリッジは、前記抽出フィルターカートリッジを着脱自在に保持する保持部を有することを特徴とする請求項1から3のいずれか一項に記載の核酸分析装置。
【請求項5】
前記保持部は、前記抽出フィルターカートリッジを通過した液体を吸収する吸収体を有することを特徴とする請求項4に記載の核酸分析装置。
【請求項6】
請求項1から5のいずれか一項に記載の核酸分析装置による核酸の分離精製方法であって、
前記試薬カートリッジの前記被検体収容部に前記被検体を注入する工程と、
前記試薬収容部に貯留された前記液体試薬の前記試薬分注チップへの出し入れを、前記穴部封止フィルムを貫通して行い、前記被検体収容部の前記被検体に分注、混合して細胞溶解液を得る工程と、
前記細胞溶解液を前記抽出フィルターカートリッジに供給する工程と、
前記分注チップを前記分注チップ収容体に戻す工程と、
前記抽出フィルターカートリッジを通過した液体から吸収体によって前記核酸を吸収する工程と、
前記分注チップによって、前記液体試薬を前記吸収体に供給し、該液体試薬中に溶出させた核酸溶液を回収する工程とを備えることを特徴とする核酸の分離精製方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6A】


【図6B】


【図7A】


【図7B】


【図7C】


【図8A】


【図8B】


【図8C】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14A】


【図14B】


【図15】


【図16】


【図17】


【図18】




【図2】


【図3】


【図4】


【図5】


【図6A】


【図6B】


【図7A】


【図7B】


【図7C】


【図8A】


【図8B】


【図8C】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14A】


【図14B】


【図15】


【図16】


【図17】


【図18】


【公開番号】特開2012−161340(P2012−161340A)
【公開日】平成24年8月30日(2012.8.30)
【国際特許分類】
【出願番号】特願2012−118973(P2012−118973)
【出願日】平成24年5月24日(2012.5.24)
【分割の表示】特願2011−527917(P2011−527917)の分割
【原出願日】平成22年9月30日(2010.9.30)
【出願人】(000003193)凸版印刷株式会社 (10,630)
【Fターム(参考)】
【公開日】平成24年8月30日(2012.8.30)
【国際特許分類】
【出願日】平成24年5月24日(2012.5.24)
【分割の表示】特願2011−527917(P2011−527917)の分割
【原出願日】平成22年9月30日(2010.9.30)
【出願人】(000003193)凸版印刷株式会社 (10,630)
【Fターム(参考)】
[ Back to top ]

