核酸分析装置及び核酸分析方法
【課題】 核酸試料の保持部材を強固な構成とする。また、試料保持部や保持部材の取り付け操作を容易にする。
【解決手段】 核酸伸張を光検出して核酸分析する装置であって、核酸試料に対して相補鎖合成基質を供給する分注器と、相補鎖合成反応による生成物と反応して発光させる発光酵素と相補鎖合成基質分解酵素とを含む反応溶液を保持する反応部との間に、試料保持部の分注器と対面する面が反応部と対面するように試料保持部材を回転させる回転機構を備える。
【解決手段】 核酸伸張を光検出して核酸分析する装置であって、核酸試料に対して相補鎖合成基質を供給する分注器と、相補鎖合成反応による生成物と反応して発光させる発光酵素と相補鎖合成基質分解酵素とを含む反応溶液を保持する反応部との間に、試料保持部の分注器と対面する面が反応部と対面するように試料保持部材を回転させる回転機構を備える。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、化学発光を利用した核酸(DNA、RNA)を分析する装置に関するものである。
【背景技術】
【0002】
DNAの塩基配列決定には、サンガー法を用いたキャピラリDNAシーケンサが最も広く普及している。この装置は30億塩基対からなるヒトゲノムDNAの全配列を解読するヒトゲノム計画に大きく貢献した。2003年にヒトゲノム配列解析は終了したが、微生物、植物などの研究対象の広がりや遺伝子機能解析を目指した比較ゲノム解析などが残されており、大規模ゲノム解析センタ向けに高速・高スループットな大規模DNAシーケンシングの需要はいまだ伸びている。一方で、遺伝子診断向け、一般研究室向けなどへのDNAシーケンサの普及のためには、低コスト化、そして容易な操作性といった性能をもたせる必要があると考えられる。
【0003】
上記要望を満たすために、サンガー法と異なる方法を用いたDNAの塩基配列決定法がいくつか提案されている。その中の一つに、DNAの伸長時に生成されるピロリン酸(PPi)を、化学発光を用いて検出することにより、塩基配列を決定する方法(パイロシーケンス法)がある(特許文献1)。この方法では、まず、ターゲットとなるDNA鎖にプライマをハイブリダイズさせ、相補鎖合成酵素(ポリメラーゼなど)が入った反応液に導入し、相補鎖合成核酸基質であるdNTP(dATP、dCTP、dGTP、dTTP)を1種類ずつ順番に前記反応液に加えて相補鎖合成を行う。前記反応液には、ポリメラーゼの他に、ATPスルフリラーゼ、アデノシン5’ホスホ硫酸(APS)、ルシフェラーゼ、ルシフェリン、dNTP分解酵素(アピラーゼ)が存在する。相補鎖合成反応が起きるとDNA相補鎖が伸長し、副産物としてPPiが生成される。このPPiがATPスルフリラーゼの働きによってAPSに付加されてATPが生じる。前記ATPとルシフェリンからルシフェラーゼの働きよって発光を生じる。この光を検出することで、加えた相補鎖合成基質がDNA鎖に取り込まれたかを判断できる。相補鎖合成が行われなかったdNTPは、反応液中に含まれるアピラーゼによって分解される。上記工程を4種のdNTPで順次行われることで、相補鎖の塩基配列を決定していくことが可能となる。dNTPの一つであるdATPは、ルシフェリンとルシフェラーゼによって発光を生じさせるため背景光が上昇し、計測・解析精度の劣化につながる。Nyrenらは、dATPの代わりにdATPのアナログであるdATPαSを用いることで前記問題を解決している(特許文献2)。また、APSもルシフェリンとルシフェラーゼによって光を生じさせるため、背景光の原因となる。神原らは、APSとATPスルフリラーゼに変わり、アデノシン一リン酸(AMP)とホスホエノールピルビン酸(PEP)とピルビン酸リン酸ジキナーゼPPDKを用いることで上記問題を解決している(特許文献3)。
【0004】
上述のようにパイロシーケンス法は、レーザのような光源を使わずに塩基配列決定が可能となるため、サンガー法を用いたDNAシーケンサに比べて、装置構成が簡易になり、安価かつ小型化が容易となる。実際に、神原らはこのパイロシーケンス法を用いた小型のDNAシーケンサを開発している(非特許文献1)。
【0005】
一方、パイロシーケンス法では、相補鎖合成反応とdNTPの分解反応が共存することに由来する問題がある。dNTP分解酵素が多いと、相補鎖合成前にdNTPがすべて分解され、いくつかの未反応のDNA鎖が反応液中に存在することになる。また、dNTP分解酵素が少ないと、dNTPの分解が遅くなるため、次のdNTPが反応液に導入する際に未分解のdNTPが残存し、一度に相補鎖合成が進行するいくつかのDNA鎖が反応液中に存在することになる。いずれの場合でもDNA鎖間で伸長度合いのばらつきが生じ、DNA鎖の配列解析精度の低下につながる。神原らは、これらの問題を解決するために、相補鎖合成反応とdNTP分解反応を含めた発光反応を空間的に分離する方法を提案している(分離反応方式)(特許文献4)。
【0006】
図1に、特許文献4に記載の相補鎖合成反応とdNTP分解反応を含めた発光反応を空間的に分離する構成を示す。試薬(例えばdNTP)を分注する分注器303と反応液が入った反応容器101が上下に配置され(分注器303が反応容器101の上に位置する)、DNA鎖を保持する保持部材401が分注器303と反応容器101の間に配置され、保持部材401の上下移動により、保持部材401の反応液102からの出し入れを繰り返して測定を行う構成である。保持部材401にはプライマとハイブリしたDNA鎖とポリメラーゼが、反応液102中にはdNTP分解酵素と発光反応に関わる試薬が含まれており、保持部材401が反応液102外部にある時にdNTPを保持部材401に導入して相補鎖合成反応を行い、保持部材401が反応液102内部にある時に発光液反応とdNTP分解反応を行う。上記方法により相補鎖合成反応とdNTP分解反応・発光反応を空間的に分離する。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】特許第3533223号
【特許文献2】特許第3510272号
【特許文献3】特開2007-97471号公報
【特許文献4】特開2009-247297号公報
【非特許文献】
【0008】
【非特許文献1】Electrophoresis、 22、 3497-3504、2001
【発明の概要】
【発明が解決しようとする課題】
【0009】
特許文献4の構成において、保持部材401の例として、直径3mmのメンブレンを挙げている。そして、保持部材401は、固定・上下移動させる手段である移動台(ここでは固定ピン403とする)に固定されている。固定ピン403の保持部材401への固定位置は、保持部材401のdNTPが分注される分注面402側(上方側)となっている。保持部材401は、dNTPを精度良く分注するために、分注器303のdNTP分注位置から0.5mm程度の距離のところまで近づくことになる。そのため、固定ピン403と分注器303は干渉することとなる。分注器303は、4種のdNTPに対応した200μLの容量のリザーバ301を持ち、それぞれのリザーバ301の下部にキャピラリ302が備えられている。前記4つのリザーバ301の中央に1mmの貫通穴304があり、固定ピン403は貫通穴304に通されている。そのため、固定ピン403の直径は1mm以下となる。一方、ある程度量(数十μL以上)のdNTPを保持するために必要なリザーバ301の高さ、リザーバ301へ圧力を供給するための配管部等を考慮すると、固定ピン403の長さは20mm以上必要となる。
【0010】
以上より、分注器303と固定ピン403の干渉を防ぐため、保持部材401の固定・移動手段である固定ピン403は直径1mm以下長さ20mm以上の棒材となり、非常に脆弱となり(折れやすい)、取り扱いが困難な形状となる。
【0011】
また、保持部材401と固定ピン403を装置に取り付ける際には、固定ピン403を分注器303の貫通穴304に通す作業が必要となってしまう。
【0012】
固定ピン403の強度向上のために、直径を太くすることが考えられる。例えば、直径4mmのメンブレン(保持部材401)に直径3mmの固定ピン403を取付けることも可能だが、dNTPを分注する領域が小さくなるため、分注精度が低下する。メンブレン(保持部材401)の面積を拡大することで上記問題を解決できるが、大きなメンブレン(保持部材401)を入れるために反応容器101を大きくする必要があり、その分、反応試薬の量が増大するため試薬コストが上昇してしまう。
【課題を解決するための手段】
【0013】
上記課題を解決するため、核酸分析装置として、核酸試料の試料保持部を備える試料保持部材と、試料保持部に対し核酸試料と相補鎖合成反応をする相補鎖合成基質を供給する分注器と、試料保持部が浸漬され相補鎖合成反応による生成物と反応して発光させる発光酵素と相補鎖合成基質の分解酵素とを含む反応溶液を保持する反応部と、発光酵素による発光を検出する光検出器と、試料保持部材を支持し分注器と反応部との間に設けられ、試料保持部の分注器と対面する面が反応部と対面するように回転する回転機構と、分注器による分注及び回転機構による回転を制御する制御部を備える。
【0014】
また、核酸試料が試料保持部に固定された試料保持部材を用いた分析方法として、当該試料保持部を前記核酸試料と相補鎖合成反応する相補鎖合成基質を供給する分注器に対面させる工程と、分注器から相補鎖合成基質を試料保持部に対して供給する工程と、試料保持部の分注器と対面する面が、相補鎖合成反応による生成物と反応して発光させる発光酵素と相補鎖合成基質の分解酵素とを含む反応溶液を保持する反応部と対面するように試料保持部材を回転させる工程と、試料保持部を反応溶液に浸漬する工程と、発光酵素による発光を検出する工程とを有する。
【発明の効果】
【0015】
上記構成により、試料保持部を保持する保持部材が分注器と干渉しない構成となり、試料保持部材を強固な構成とすることができる。また、試料保持部や保持部材の取り付け操作も容易になる。
【図面の簡単な説明】
【0016】
【図1】課題を説明するための分離反応方式の例。
【図2】本発明による分離反応方式の一例。
【図3】パイロシーケンス反応様式概略図。
【図4】本発明による分析装置の概略図の一例。
【図5】回転機構部周辺拡大図。
【図6】回転機構駆動プロセスの一例。
【図7】メンブレン方式の一例。
【図8】シーケンス操作フローチャート。
【図9】磁気ビーズを用いた例でのスティックとスティックホルダの断面図。
【図10】磁気ビーズのスティック分注面での固定概念図。
【図11】磁気回路を用いたスティックとスティックホルダの断面図。
【図12】磁石回転型のスティックとスティックホルダの断面図。
【図13】磁石移動型のスティックとスティックホルダの断面図。
【図14】電磁石型のスティックとスティックホルダの断面図。
【図15】セファロースビーズを用いた実施例でのスティックとスティックホルダの断面図。
【図16】反応プレート型分析装置の概略図の一例。
【図17】実施例4における回転機構駆動プロセス。
【図18】磁気回路構造の概略図。
【発明を実施するための形態】
【0017】
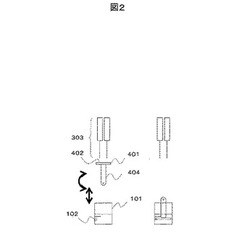
図2に、固定ピン404の固定部が保持部材401の分注面402と異なる面にあり、試薬分注後に分注面402が反応液102に浸漬可能な構造を示す。これを実現するために、固定ピン404を回転運動可能な構成とする。具体的には、保持部材401の分注面402の裏面に固定ピン404を固定する。分注面402に試薬が分注された後に、固定ピン404は回転して分注面402が反応容器101側(下側)に向く。その後、固定ピン404を下降させ、反応容器101内の反応液102に保持部材401を浸漬させる。固定ピン404と保持部材401は同一でも良く、例えば棒状固定ピンの片端面に核酸(DNAやRNA)が固定され、かつ前記面が分注面という構成でも良い。固定ピン404の回転運動と上下運動を同時に行っても良い。さらに、図16に示すように、反応溶液102が反応プレートに載っているような場合、固定ピン404は上下運動を行わずに回転運動のみでも良い。
【0018】
このような構成を用いた分離反応方式においては、保持部材を固定する固定ピンを分注器と干渉しない構成となるため、固定ピンの太さは保持部材と同等以上の太さにでき、非常に強固なもとなり、また、保持部材・固定ピンの取り付け操作も容易となる。
【0019】
以下、実施例にしたがって、具体的な構成を説明する。
【実施例1】
【0020】
本実施例では、パイロシーケンシング法を用いて、測定対象の塩基配列を決定する。パイロシーケンスに関しては、特許文献2に記載の反応と配列決定の原理を採用した。図3にその反応様式の概略図を示す。パイロシーケンス反応では、配列を決定したいターゲットDNAを一本鎖(ssDNA)にした後に、プライマをハイブリダイズさせ、DNAポリメラーゼを加え、4種のdNTP(dATP、dCTP、dGTP、dTTP)を順次反応液中に加えて相補鎖合成反応を行い、相補鎖合成の際に副産物して生成されるPPiをAMPとPEPとPPDKによりATPに変換し、ATPとルシフェリンをルシフェラーゼ存在下で反応させて発光させる。余剰のdNTPはアピラーゼによって分解される。本実施例では、PPiをATPに変換させるために、AMP、PEP、PPDKを用いたが、ATPスルフリラーゼとAPSを用いた系でも良い。
【0021】
図4に本発明の分析装置の概観を示す。本装置は、反応収容部、光検出部、試薬分注部、回転機構部から構成される。これらの構成部は遮光されるように筺体に覆われている。
【0022】
反応収容部106は直径5mm深さ10mmの4つの反応容器101が9mmピッチで1列に配置されている。反応容器101の直径、深さ、数およびピッチは任意であり、限定されるものではない。さらに、反応容器101は複数列で配置しても良い。また、反応収容部106は、市販の反応容器(例えばNunc−ImmunoTMModules;CAT No.473539)とそれを固定するホルダを組み合わせた形状でも良い。パイロシーケンス反応では室温よりも高い温度で実施される場合がある(28℃〜35℃)。そこで、反応液を効率よく温調するために、反応収容部106には温度制御手段105が接続されている。本実施例では温度制御手段105としてペルチェ素子を使用したが、ヒータなどでも良い。また、反応液を攪拌するために、反応収容部106には攪拌手段104が接続されている。本実施例では、攪拌手段104として、回転軸に偏心カムが付いているモータを用い、前記偏心カムを反応収容部106に掘られた溝にあてがい、モータが回転することで、反応収容部106が振動する構成とした。温度制御手段105と攪拌手段104は、H8マイコン501(HD64F3052BF25、ルネサステクノロジ)によって動作が制御される。
【0023】
光検出部は、全体を導電性材料で作られた導電性筺体205で覆われている。導電性筺体205内部には4つの光検出器201が収納されており、各光検出器201は各反応容器101の下方に1:1の関係で配置されている。光検出器201としてフォトダイオード(SiフォトダイオードS1133−01、浜松ホトニクス)を使用したが、ラインセンサやCCDを用いて4つの反応容器101からの発光を1つの光検出器で検出しても良い。光検出器201と反応収容部106底部の間には、裏面に透明電極層(ここではITOを用いた)を有したガラス基板202が配置されており、前記透明電極層は導電性筺体205に電気的に接続され、装置の設置電位に接続されている。光検出器201からの信号は、導電性筺体205内に内蔵されたアンプ203(opA129UB、Texas Instruments)により増幅され、導電性筺体205外部に配置されたマルチプレクサ204(MAX4051ACSE、 Maxim Integrated Products)により4つの光検出器201からの信号を時分割してA/D変換され、H8マイコン501で信号処理され、パーソナルコンピュータ(PC)に出力される。
【0024】
試薬分注部は、分注器303、分注器ホルダ305、圧力配管ブロック306で構成される。分注器303は、試薬(ここではdNTP4種)が50μL収容できる4つのリザーバ301が一体となっており、各リザーバ301の底部にはキャピラリ302(外径370μm、内径50μm)が具備されている。リザーバ301に収容されたdNTPは、リザーバ301上面より加圧され、キャピラリ302端面から分注される。各分注器303は各反応容器101と対向する配置となるよう分注器ホルダ305によって保持される。dNTPを加圧分注するために、分注器303上面には圧力配管ブロック306が接続されている。圧力配管ブロック306では、4種のdNTPが収容されるリザーバ301それぞれに、かつ、4つの分注器303において同じdNTPが収容されたリザーバ301には同時に圧力を印加できるような流路307が形成されている。最終的には、圧力配管ブロック306の背面で4本の流路に集約される。圧力配管ブロック306背部にて、前記4本の流路に4本の配管チューブ308がそれぞれ接続されており、すべての配管チューブ308が1つの圧力供給源502に接続されている。ここでは、圧力供給源502としてCO2高圧ガスタンクを使用したが、それ以外の手段を用いても良い。各配管チューブ308と圧力供給源502の間には電磁弁309が設けてある。電磁弁309はH8マイコン501に接続されており、電磁弁309の開閉のタイミングを制御し、各dNTPの分注タイミングと量を制御する。
【0025】
回転機構部は、スティック405、スティックホルダ406、回転駆動部407で構成され、試薬分注部と反応収容部の間に配置される。本実施例では、DNA鎖を固定する保持部材と保持部材を固定する固定ピンは一体となった棒状構造(スティック)を使用した。回転機構部周辺の拡大図を図5に示す。スティック405は、直径は3mm、長さは15mmであり、材質をポリエーテルエーテルケトン(PEEK)とした。直径と長さは、反応容器101内に導入できるサイズであれば、特に限定されるものではない。また、材質はPEEKに限定されるものではない。スティック405の分注面402には、DNA鎖を固定できるよう表面処理がされている。具体的には分注面402にアビジンをコートした。4本のスティック405は、各分注器303と各反応容器101に対して1:1になるようにスティックホルダ406に固定される。スティック405はスティックホルダ406から着脱可能な構成とした。着脱可能な構成として、スティックホルダ406内部に内蔵されたボールプランジャとスティック側面に設けられたスティック溝408を利用した。
【0026】
回転駆動部407は、ホルダ固定プレート409、アーム410、リニアガイド416、上下モータ419で構成される。スティックホルダ406はホルダ固定プレート409を介して回転駆動部407に固定される。スティックホルダ406をホルダ固定プレート409に固定する際は、磁石412を用いて容易に着脱可能な構成とした。また、取り付け位置はガイドピン411を用いて取付再現性を確保した。ホルダ固定プレート409はアーム410に対して回転軸415を中心に回転できるように接続されており、回転軸415の片端には偏心カム413が、もう一方の端にはピニオン417が固定されている。アーム410はリニアガイド416に固定されており、上下モータ419によって上下に駆動する。上下モータ419はH8マイコン501に接続されており、上下モータ419を介して回転駆動部407の上下動を制御する。
【0027】
図6に回転機構部407の駆動プロセスを示す。リザーバ301に収容されたdNTPをスティック405の分注面402に分注し、伸長反応のために数秒静置する(図6(a))。上下モータ419によってアーム410を下降させる。その際に、ピニオン417の歯が装置筺体に取付けられたラック418の歯とかみ合いながらアーム410が下降するため、回転軸415を中心にスティックホルダ406が回転する(図6(b))。アーム410が所定の距離下降すると、ラック48の歯からピニオン417の歯が外れるため、スティックホルダ406とスティック405の回転運動は停止する。偏心カム413とストッパ414を用いて、スティックホルダ406とスティック405の回転を完全に止める。この動作により、スティック405の分注面402はdNTPが分注された時から180度回転したことになる。また、この時スティック405の分注面402は反応容器101にはまだ入っていない(図6(c))。アーム410はさらに下降し、反応容器101内底面から1mmの位置で下方移動を停止し、分注面402が反応容器101内の反応液に浸漬される(図6(d))。アーム410が上昇する際は、前記工程と逆の動作となる。
【0028】
スティックホルダ406は、ピニオン417の歯がラック418の歯に当たるまでは回転運動を行わずに上昇し、ピニオン417とラック418の歯が当たると回転運動を行いながら上昇し、アーム410が最上面まで上昇すると分注面402が上方を向く状態で回転運動を停止し、dNTPが分注される状態となる。この時、分注面402と分注器303のキャピラリ302dNTP吐出端との距離は1mmになるようにした。以上のプロセスを繰り返すことでパイロシーケンス反応を行う。本実施例では、ピニオン417とラック418を用いて分注面402の回転運動を行ったが、回転軸415に小型モータを接続し、小型モータをH8マイコン501に接続して、小型モータをコントロールすることで、分注面402の回転運動を行っても良い。
【0029】
また、ここでは上下モータ419によってアーム410を上下に動かしている例を示したが、スティック405と反応容器101との相対位置を制御できればよいので、例えば、反応容器101が上下に動くような機構を設けるようにしてもよい。
【0030】
本実施例では、DNA鎖を固定する保持部材と保持部材を固定する固定ピンは一体となったスティックを使用したが、保持部材と固定ピンを分割して取り外せるようになっていても良い。保持部材としてメンブレンを用いた例を示す(図7)。ここでは、メンブレン420として直径3mmのSAM2(R) Biotin Capture Membrane(V7861、Promega)を使用した。このメンブレン420には共有結合によりストレプトアビジンがコートされている。メンブレン420の分注面402とは異なる面に直径1mm、長さ5mmのピン421が固定されており、ピン421はピンホルダ422を介してスティックホルダ406に固定される。ピン421の直径と長さは、反応容器101内に導入できるサイズであれば、特に限定されるものではない。しかし、メンブレン420が反応液に浸漬する際に、分注面402と反対の面からも効率良く反応液がメンブレンに伝わるようにするため、ピン421は、強度を考慮しながら可能な限り細くした方が良い。なお、ピンホルダ422とスティックホルダ406は着脱可能な構成とした。スティックホルダ406は、保持部材と固定ピンが一体となったスティックの場合と同様に回転駆動部407に固定する。上記方法により、保持部材と保持部材を固定する固定ピンを分離した場合でも、固定ピンは分注器と干渉しないため、固定ピンの直径が細くても短くできる、つまり強固にすることができる。
【0031】
以下、図8のフローチャートに沿って測定対象のDNAのパイロシーケンス反応の方法を説明する。まず、5’末端にビオチン標識された配列解析対象の一本鎖DNA(ssDNA)をプライマとハイブリダイズさせる(601)。前記プライマ−ssDNA複合体を分注面402に滴下、5分間静置し、ビオチン−アビジン結合を介してプライマ−ssDNA複合体を分注面402に固定する(602)。スティック405の分注面402を2×Cバッファ(組成:120mM Tricine、4mM EDTA、40mM MgAc2)で洗浄する(603)。次いで、分注面402にポリメラーゼ(Klenow)を滴下、5分間静置し、分注面402に固定されたプライマ−ssDNA複合体と結合させる(604)。ポリメラーゼのプライマ−ssDNA複合体への固定を,ポリメラーゼを反応液に導入し,下記分注面402を反応液に1分間浸漬する工程608で行っても良い。前記プライマ−ssDNA複合体が固定されたスティック405をスティックホルダ406に取付け、スティックホルダ406を装置に取り付ける(605)。前記操作はすべて装置外部で行われる。4種のdNTPを分注器303のそれぞれのリザーバ301に導入し、また反応液を反応容器101に導入し、分注器303と反応容器101を装置に取り付ける(606)。反応液の組成は、発光のための酵素とdNTP分解酵素が満たされているように、例えば、60mM Tricine、2mM EDTA、20mMMgAc、15mU/μL PPDK、60μM ルシフェラーゼ、400μM ルシフェリン、80μM PEP・3Na、400μM AMP、1nL/μL BSA、200μM DTT、1.2mU/μL アピラーゼとした。
【0032】
上下モータ419を駆動して、スティック405の回転・下降動作を行い(607)、分注面402を反応液に1分間浸漬する(608)。前記浸漬工程により、プライマ−ssDNA複合体やポリメラーゼに含まれるATPやPPiを分解し、背景光の上昇を防ぐことができる。次いで、スティック405の回転・上昇動作を行い(609)、分注面402にdNTPを0.5μL滴下し、相補鎖合成反応のために6秒間静置した(610)。0.5μL程度の量であれば、スティック405の回転速度にもよるが、液体の表面張力により、スティック405を回転運動させてもdNTP溶液が分注面402からこぼれ落ちることはない。分注量は0.5μLに限る必要はないが、スティック405の回転運動時にこぼれない程度の量以下である必要がある。スティックを6秒間静置した後に、スティック405の回転・下降動作を行い(611)、分注面402を反応液に浸漬させる(612)。分注面402を反応液に浸漬した直後に攪拌手段104であるモータを駆動させ、反応液を攪拌するとともに、発光計測を行う(613)。この時、PPDK、ルシフェラーゼによる発光反応とアピラーゼによる余剰のdNTPの分解反応が行われる。前記発光の有無と強度を確認して、分注したdNTPによって相補鎖合成が行われたか、何塩基分相補鎖合成が行われたかを判断する。攪拌を114秒間行った後に、攪拌動作をやめ、スティック405の回転・上昇動作を行い(614)、分注面402を分注器303直下に配置し、次のdNTPを分注する。610から614の動作を分注面402へのdNTPの分注(610)からスティック405の回転・上昇動作(614)を繰り返して発光計測することにより、測定対象の塩基配列を決定できる。
【0033】
本実施例では、ビオチン−アビジン結合を用いて保持部材にDNAを固定したが、固定方法はその限りではない。例えば、ポリメラーゼにビオチンを標識し、前記ビオチン標識ポリメラーゼを保持部材に固定して、前記ビオチン標識ポリメラーゼにプライマ−ssDNA複合体を結合させる方法を用いても良い。
【0034】
DNAの相補鎖合成反応では,プライマ−ssDNA複合体の自己ハイブリダイゼーションなどの高次構造形成により,相補鎖合成反応の効率が著しく低下する場合がある。前記問題を解決するため,スティック405の分注面402に温度調節(30℃〜40℃)機構を設ける,反応液にSSB(single−strand binding protein)や変性剤となるDMSOなどを加えても良い。
【実施例2】
【0035】
本実施例では、保持部材として磁気ビーズを用いて、パイロシーケンシング法による測定対象の塩基配列を決定する。スティックとスティックホルダ以外の装置構成、DNA鎖の保持部材への固定方法以外の反応プロセスは実施例1と同等である。
【0036】
図9にDNA鎖が固定された磁気ビーズを固定する柱状のスティックとスティックホルダの断面図を示す。スティック405は直径4mm、長さ15mmで片端面が塞がれた筒状の形状である。ここでは、円筒状の構成を示しているがこれに限られない。材質はPEEKを用いた。スティック405の直径、長さ、材質は、この限りではない。但し、材質に関しては、すべて磁性体だとスティック405全体に磁気ビーズが固定されてしまうため、非磁性体が良い。円筒を塞ぐ片端面のみ磁性体とし、それ以外は非磁性体であっても良い。
【0037】
スティック405の内側面に磁気シールドシート426を覆い、磁気ビーズがスティック405側面に固定されないようにした。さらに、分注面402の周囲にヘリ447を設けて、分注面が攪拌している反応液中に存在する時に、磁気ビーズが反応液の攪拌によりスティック405の側面に移動しないような工夫を施した。磁気ビーズのスティック側面への移動防止対策として前記方法以外に,磁気回路を用いた方法(図18)も考えられる。図9の磁石423の代わりに、内底面に磁石449が固定された片端面が閉じた筒状構造の磁性体(例えば78パーマロイ)キャップ450を用いることにより,磁場は図18磁性体キャップ450と磁石449の上面に形成され,磁性体キャップ450の側面には形成されなくなる。そのため,磁気シールドシート426,ヘリ447が無くても,磁気ビーズはスティック405の分注面のみに安定して固定されることになる。
【0038】
スティック405とスティックホルダ406は,実施例1と同じように、ボールプランジャ425とスティック405の側面に設けられたスティック溝408を用いて、着脱可能な構成とした。スティックホルダ406には、スティック205の筒内部に内包されるよう、磁石423が先端に固定された磁石固定ピン424が具備されている。磁石固定ピン424の磁石423が固定された面と異なる面をバネ427で押すことにより、磁石423が常にスティック内底面430を押し、スティック外底面(つまり分注面402)の磁場強度の着脱再現性が得られる構成とした。また、磁石固定ピン424の片端に突起428を作り、突起428がスティックホルダ406内部の受け面429と干渉することで、磁石固定ピン424がスティックホルダ406から外れない構成とした。
【0039】
磁気ビーズへの測定対象となるDNA鎖の固定方法および前記DNA固定磁気ビーズのスティック405への固定方法を説明する。測定対象のDNAを、PCRを用いて5’末端にビオチン602標識させ、ビオチン602標識DNAをアビジン604が標識された磁気ビーズ605(DynaBeads(R) M−280 Streptavidin、invitrogen)に固定した(図10(a))。磁気ビーズ605は、直径2.8μm、疎水性のビーズであるが、これ以外のものを使用しても良い。また、DNA鎖と磁気ビーズの固定手段として、ビオチン−アビジン結合を利用したが、それ以外の方法で固定しても良い。次いで、DNA鎖が固定された磁気ビーズ605に0.2N NaOHを加え、アルカリ変性する。アルカリ変性した後に、磁石台を用いて磁気ビーズ固定鎖と上清に含まれる遊離鎖に分け、磁気ビーズ605に固定されたssDNA601を作製する。磁気ビーズ605に固定されたssDNA601(0.5pmol)に4倍量(2pmol)のプライマ603を加え、ssDNA601へプライマ603をハイブリダイズさせ、プライマ−ssDNA複合体を作製する。前記ハイブリダイズ後に、磁気ビーズ605が入った溶液にポリメラーゼ(Klenow)を加えて5分間静置し、プライマ−ssDNA複合体にポリメラーゼを結合させる。前記磁気ビーズ605が入った溶液をスティックホルダ406に取り付けられたスティック405の分注面402に滴下し、磁気ビーズを分注面402に固定する(図10(b))。前記固定作業の後に、余剰の溶液を取り除き、装置に取り付け、実施例1と同等のシーケンスプロセスを行う。
【0040】
図9に示した磁石1個のみを用いた場合では、分注面402の中心に磁気ビーズが固まりを形成する。磁気ビーズの量によっては、磁気ビーズの固定領域の面積に対する高さの割合が大きくなり、前記磁気ビーズ塊の中心へのdNTPの浸透が遅くなることがある。このような場合、磁気ビーズ塊の中心部のDNA鎖の相補鎖合成反応の効率が低下し、DNA鎖間での相補鎖合成反応の不均一が生じることによるシーケンス解析精度低下につながる。前記問題を防ぐ手段として、図11に示すように、リング型磁石432を用いることが考えられる。これにより、磁気ビーズが分注面402の外周に分散固定され、磁気ビーズの固定領域の面積に対する高さの割合が小さくなり、dNTPの磁気ビーズへの浸透をより速く、均等に行うことができ、相補鎖合成の不均一を抑えることができる。リング形状は、スティック205の内部側面に沿った形が望ましい。上記方法以外に、分注面で固定した磁気ビーズを攪拌させることで、dNTPの磁気ビーズへの浸透の効率を向上させることも考えられる。
【0041】
図12に磁石回転型のスティックとスティックホルダ断面図を示す。磁石、磁石固定ピン、バネ以外の構成は図9と同等である。スティックホルダ436に小型のモータ435が内蔵されており、モータ435の軸にはシャフト434が接続されており、シャフト434の先端には小型の磁石433が固定されている。小型磁石433は、少なくともスティック405の内径よりも小さい径を有するような大きさである。そして、固定される部位としては、スティックの中心軸から小型磁石433が遠ざかるようにするとよい。スティック405をスティックホルダ436に取付けると、シャフト434と磁石433はスティック405内に配置される。dNTP分注後にモータ435を回転させることで、磁石433がスティック405内部で回転し、分注面402に固定された磁気ビーズも回転する。磁気ビーズの回転動作による攪拌により、dNTPの磁気ビーズへの浸透の効率を向上させることができる。磁場強度を弱めることにより強固に集積した磁気ビーズの集積度合い(固定度合い)を緩め、dNTPが磁気ビーズ塊の中心に浸透しやすくする方法も考えられる。
【0042】
図13に磁石移動型のスティックとスティック断面図を示す。磁石、磁石固定ピン、バネ以外の構成は図9と同等である。スティックホルダ440にはシャフト439が具備されており、シャフト439の先端にはスプリング438が接続されており、スプリング438の片端には磁石437が固定されている。スティック405をスティックホルダ440に取付けると、シャフト439、スプリング438、磁石437はスティック405内部に入る構成となっている。スプリング438の伸張方向は、スティック405の中心軸方向である。分注面402が上方を向いている時は、磁石437の重さでスプリング438が縮まり、磁石437は分注面402から離れる。磁石437が分注面402から離れることにより、磁場強度が弱くなり、磁気ビーズの集積度合いが緩まり、dNTPが磁気ビーズ塊の中心に浸透しやすくなる。分注面402が下方に向いている時は、スプリング438によって磁石437をスティック内底面に押しつけるため、磁気ビーズが分注面402に固定され、磁気ビーズが反応容器101に落ちることを防ぐ。上記方法以外に、dNTP分注時に磁場強度を弱める方法として電磁石を用いる方法がある。
【0043】
図14に電磁石型スティックとスティックホルダの断面図を示す。磁石、磁石固定ピン、バネ以外の構成は図9と同等である。スティックホルダ440には、磁性体シャフト441(ここでは鉄性のシャフト)が具備されており、磁性体シャフト441には絶縁性被覆の付いた電線(ここではニクロム線442)が巻き付けられている。ニクロム線442は、ON/OFFをH8マイコン501で制御される電源に接続されている。dNTPをスティック450の分注面402に分注する際には、前記電源をOFFにし、磁性体シャフト441から磁場が発生しないようにする。前記操作により、磁場強度が弱くなり、磁気ビーズの集積度合いが緩まり、dNTPが磁気ビーズ塊の中心に浸透しやすくなる。スティック405が回転・下降する際には、前記電源をONにし、磁性体シャフト441から磁場を発生させ、磁気ビーズを分注面402に固定する。前記操作により、分注面402が反応液に浸漬した際に、磁気ビーズが反応液に拡散することを防ぐ。また、分注面402が反応液に浸漬する際に、あえて前記電源をOFFにすることで、磁気ビーズを反応液に拡散させ、相補鎖合成によって生成されたPPiや余剰のdNTPの反応液の拡散効率を向上させても良い。この場合、分注面402を反応液から取出す際に、前記電源をONにして、反応液に分散した磁気ビーズを分注面402に再固定する必要がある。
【0044】
以上のように本発明を用いると、分注面裏面での固定ピン配置により、固定ピンが分注器と干渉することがないため、固定ピンの脆弱性の抑制や取り付け容易性の向上以外に、様々な形状の磁石を使用でき、反応効率の向上などが可能となる。
【実施例3】
【0045】
本実施例では、保持部材としてセファロースビーズを用いて、パイロシーケンシング法による測定対象の塩基配列を決定する。スティックとスティックホルダ以外の装置構成、DNA鎖の保持部材への固定方法以外の反応プロセスは実施例1と同等である。
【0046】
図15に保持部材としてセファロースビーズを用いた時に使用するスティックとスティックホルダ断面図を示す。スティック443の片端面にセファロースビーズ444を導入し、メンブレンフィルタで作られたフィルタキャップ445で閉じ込める。図15のように凹部を有するとセファロースビーズを導入しやすい。セファロースビーズ444として、ストレプトアビジンがコートされた平均粒子径34μmのビーズ(Streptavidin Sepharose High Performance Lab Pack and Hitrap Streptavidin HP、GE Healthcare)を使用した。フィルタキャップ445のメンブレンフィルタとして、メッシュサイズ12μm、polycarbonate製(ISOPORETM MEMBRANE FILTERS、MILLIPORE)を使用した。セファロースビーズ444の大きさよりもメンブレンフィルタのメッシュサイズの方が小さいため、フィルタキャップ445内部にdNTP溶液は浸透するが、セファロースビーズ444はフィルタキャップ445外部には移動できない。メンブレンフィルタとして、多数の孔が開いたものを用いてもよく、そのときに孔の大きさについてもビーズの大きさよりも小さくなるようなものを用いる。
【0047】
セファロースビーズ444へのDNA固定方法を説明する。セファロースビーズ444を、カラムを用いてバッファで洗浄し、5’末端ビオチン標識二本鎖DNA(dsDNA)をセファロースビーズ444に添加し、dsDNAをセファロースビーズ444に固定する。次いで、カラムを用いてセファロースビーズ444をバッファで洗浄し、未結合のdsDNAを洗い流す。0.2N NaOHを添加して、変性させ、バッファでセファロースビーズ444を洗浄してセファロースビーズ444に固定されたssDNAを作製する。前記工程で得られたssDNAが固定されたセファロースビーズ444をスティック443に導入し、フィルタキャップ445をスティック443先端に取付ける。その後、スティック443をスティックホルダ446に取付け、スティックホルダ446を装置に取り付け、実施例1と同等のシーケンスプロセスを行う。
【実施例4】
【0048】
本実施例では、回転駆動のみでスティック分注面の位置制御を行い、パイロシーケンシング法による測定対象の塩基配列を決定する。回転機構部、反応収容部以外の装置構成、反応プロセスは実施例1と同等である。
【0049】
図16に本実施例で使用する分析装置の概観を示す。本実施例では、反応収容部を構成する反応容器に代わり、反応プレート107を使用する。反応プレート107の材質として、ステンレスを使用したが、その限りではない。また、反応プレート107の表面は疎水処理が施されている。反応プレート107には光学的に透明な材質の検出窓108が具備されている。検出窓108の材質として石英ガラスを使用したが、光学的に透明であれば、その限りではない。検出窓108の図16の上側の端面には親水処理が施されている。そのため、反応プレート107に実施例1と同等の反応液を滴下すると、検出窓108を中心に反応液滴109が形成される。反応プレート107を光学的に透明な材質を使用することで、検出窓108を使用しなくても良い。この場合、反応液滴109が所定の位置に維持されるように、前記所定の位置のみに親水処理を施し、それ以外の表面には疎水処理を施すことが望ましい。尚、親水処理、疎水処理は、親水処理部が疎水処理部よりも相対的に反応溶液に対する親水度が高くなるように処理されればよい。
【0050】
反応プレート107には温度制御手段105が接続されており、反応プレートを介して反応液滴の温度調節が可能となっている。温度制御手段105としてペルチェを用いたが、その限りではない。反応プレート107は、検出窓108の直下に検出器201が位置するように、ガラス基板202の上部に配置した。
【0051】
回転機構部は、実施例1と同様にスティック405、スティックホルダ406、回転駆動部407で構成され、試薬分注部と反応収容部の間に配置される。スティック405とスティックホルダ406は実施例1と同等である。また、スティック405とスティックホルダ406の回転駆動部407への取付方法も実施例1と同等である。回転駆動部407は、ホルダ固定プレート409、アーム410、モータ448で構成される。ホルダ固定プレート409はアーム410に対して回転軸415を中心に回転できるように接続されており、回転軸415の片端にはモータ448が接続されている。モータ448はH8マイコン501に接続されており、モータ448を介して回転駆動部407の回転運動を制御する。
【0052】
図17に回転機構部407の駆動プロセスを示す。リザーバ301に収容されたdNTPをスティック405の分注面402に分注し、伸長反応のために数秒静置する(図17(a))。次いで、モータ448によって、回転軸415を中心にホルダ固定プレート409を介してスティックホルダ406を回転させる。この動作により、スティック405の分注面402はdNTPが分注された時から180度回転し、分注面402が反応プレート107上の反応液滴109に接触する(図17(b))。相補鎖合成反応によって生成されたPPiや余剰のdNTPを効率良く反応液滴109に拡散させるために、分注面402を反応液滴109に接触した際に、モータ448によってスティック405を図17(b)で左右にわずかに回転動作させた。反応プレート107を振動させて、相補鎖合成反応によって生成されたPPiや余剰のdNTPを効率良く反応液滴109に拡散させても良い。分注面402にdNTPを分注する時は、前記工程と逆の動作となる。
【0053】
モータ448によって、回転軸415を中心にスティックホルダ406を180度回転させ、dNTPが分注される状態にする。この時、分注面402と分注器303のキャピラリ302dNTP吐出端との距離は1mmになるようにした。以上のプロセスを繰り返すことでパイロシーケンス反応を行う。
【符号の説明】
【0054】
101:反応容器、102:反応液、103:溝、104:攪拌手段、105:温度制御手段、106:反応収容部、107:反応プレート、108:検出窓、109:反応液滴、201:光検出器、202:ガラス基板、230:アンプ、204:マルチプレクサ、205:導電性筺体、301:リザーバ、302:キャピラリ、303:分注器、304:貫通穴、305:分注器ホルダ、306:圧力配管ブロック、307:流路、308:配管チューブ、309:電磁弁、401:保持部材、402:分注面、403:固定ピン、404:固定ピン、405:スティック、406:スティックホルダ、407:回転駆動部、408:スティック溝、409:ホルダ固定プレート、410:アーム、411:ガイドピン、412:磁石、413:偏心カム、414:ストッパ、415:回転軸、416:リニアガイド、417:ピニオン、418:ラック、419:上下モータ、420:メンブレン、421:ピン、422:ピンホルダ、423:磁石、424:磁石固定ピン、425:ボールプランジャ、426:磁気シールド、427:バネ、428:突起、429:受け面、430:スティック内底面、432:リング型磁石、433:磁石、434:シャフト、435:モータ、436:スティックホルダ、437:磁石、438:スプリング、439:シャフト、440:スティックホルダ、441:磁性体シャフト、442:ニクロム線、443:スティック、444:セファロースビーズ、445:フィルタキャップ、446:スティックホルダ、447:ヘリ、448:モータ、449:磁石、450:磁性体キャップ、501:H8マイコン、502:圧力供給源、601:ssDNA、602:ビオチン、603:プライマ、604:アビジン、605:磁気ビーズ
【技術分野】
【0001】
本発明は、化学発光を利用した核酸(DNA、RNA)を分析する装置に関するものである。
【背景技術】
【0002】
DNAの塩基配列決定には、サンガー法を用いたキャピラリDNAシーケンサが最も広く普及している。この装置は30億塩基対からなるヒトゲノムDNAの全配列を解読するヒトゲノム計画に大きく貢献した。2003年にヒトゲノム配列解析は終了したが、微生物、植物などの研究対象の広がりや遺伝子機能解析を目指した比較ゲノム解析などが残されており、大規模ゲノム解析センタ向けに高速・高スループットな大規模DNAシーケンシングの需要はいまだ伸びている。一方で、遺伝子診断向け、一般研究室向けなどへのDNAシーケンサの普及のためには、低コスト化、そして容易な操作性といった性能をもたせる必要があると考えられる。
【0003】
上記要望を満たすために、サンガー法と異なる方法を用いたDNAの塩基配列決定法がいくつか提案されている。その中の一つに、DNAの伸長時に生成されるピロリン酸(PPi)を、化学発光を用いて検出することにより、塩基配列を決定する方法(パイロシーケンス法)がある(特許文献1)。この方法では、まず、ターゲットとなるDNA鎖にプライマをハイブリダイズさせ、相補鎖合成酵素(ポリメラーゼなど)が入った反応液に導入し、相補鎖合成核酸基質であるdNTP(dATP、dCTP、dGTP、dTTP)を1種類ずつ順番に前記反応液に加えて相補鎖合成を行う。前記反応液には、ポリメラーゼの他に、ATPスルフリラーゼ、アデノシン5’ホスホ硫酸(APS)、ルシフェラーゼ、ルシフェリン、dNTP分解酵素(アピラーゼ)が存在する。相補鎖合成反応が起きるとDNA相補鎖が伸長し、副産物としてPPiが生成される。このPPiがATPスルフリラーゼの働きによってAPSに付加されてATPが生じる。前記ATPとルシフェリンからルシフェラーゼの働きよって発光を生じる。この光を検出することで、加えた相補鎖合成基質がDNA鎖に取り込まれたかを判断できる。相補鎖合成が行われなかったdNTPは、反応液中に含まれるアピラーゼによって分解される。上記工程を4種のdNTPで順次行われることで、相補鎖の塩基配列を決定していくことが可能となる。dNTPの一つであるdATPは、ルシフェリンとルシフェラーゼによって発光を生じさせるため背景光が上昇し、計測・解析精度の劣化につながる。Nyrenらは、dATPの代わりにdATPのアナログであるdATPαSを用いることで前記問題を解決している(特許文献2)。また、APSもルシフェリンとルシフェラーゼによって光を生じさせるため、背景光の原因となる。神原らは、APSとATPスルフリラーゼに変わり、アデノシン一リン酸(AMP)とホスホエノールピルビン酸(PEP)とピルビン酸リン酸ジキナーゼPPDKを用いることで上記問題を解決している(特許文献3)。
【0004】
上述のようにパイロシーケンス法は、レーザのような光源を使わずに塩基配列決定が可能となるため、サンガー法を用いたDNAシーケンサに比べて、装置構成が簡易になり、安価かつ小型化が容易となる。実際に、神原らはこのパイロシーケンス法を用いた小型のDNAシーケンサを開発している(非特許文献1)。
【0005】
一方、パイロシーケンス法では、相補鎖合成反応とdNTPの分解反応が共存することに由来する問題がある。dNTP分解酵素が多いと、相補鎖合成前にdNTPがすべて分解され、いくつかの未反応のDNA鎖が反応液中に存在することになる。また、dNTP分解酵素が少ないと、dNTPの分解が遅くなるため、次のdNTPが反応液に導入する際に未分解のdNTPが残存し、一度に相補鎖合成が進行するいくつかのDNA鎖が反応液中に存在することになる。いずれの場合でもDNA鎖間で伸長度合いのばらつきが生じ、DNA鎖の配列解析精度の低下につながる。神原らは、これらの問題を解決するために、相補鎖合成反応とdNTP分解反応を含めた発光反応を空間的に分離する方法を提案している(分離反応方式)(特許文献4)。
【0006】
図1に、特許文献4に記載の相補鎖合成反応とdNTP分解反応を含めた発光反応を空間的に分離する構成を示す。試薬(例えばdNTP)を分注する分注器303と反応液が入った反応容器101が上下に配置され(分注器303が反応容器101の上に位置する)、DNA鎖を保持する保持部材401が分注器303と反応容器101の間に配置され、保持部材401の上下移動により、保持部材401の反応液102からの出し入れを繰り返して測定を行う構成である。保持部材401にはプライマとハイブリしたDNA鎖とポリメラーゼが、反応液102中にはdNTP分解酵素と発光反応に関わる試薬が含まれており、保持部材401が反応液102外部にある時にdNTPを保持部材401に導入して相補鎖合成反応を行い、保持部材401が反応液102内部にある時に発光液反応とdNTP分解反応を行う。上記方法により相補鎖合成反応とdNTP分解反応・発光反応を空間的に分離する。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】特許第3533223号
【特許文献2】特許第3510272号
【特許文献3】特開2007-97471号公報
【特許文献4】特開2009-247297号公報
【非特許文献】
【0008】
【非特許文献1】Electrophoresis、 22、 3497-3504、2001
【発明の概要】
【発明が解決しようとする課題】
【0009】
特許文献4の構成において、保持部材401の例として、直径3mmのメンブレンを挙げている。そして、保持部材401は、固定・上下移動させる手段である移動台(ここでは固定ピン403とする)に固定されている。固定ピン403の保持部材401への固定位置は、保持部材401のdNTPが分注される分注面402側(上方側)となっている。保持部材401は、dNTPを精度良く分注するために、分注器303のdNTP分注位置から0.5mm程度の距離のところまで近づくことになる。そのため、固定ピン403と分注器303は干渉することとなる。分注器303は、4種のdNTPに対応した200μLの容量のリザーバ301を持ち、それぞれのリザーバ301の下部にキャピラリ302が備えられている。前記4つのリザーバ301の中央に1mmの貫通穴304があり、固定ピン403は貫通穴304に通されている。そのため、固定ピン403の直径は1mm以下となる。一方、ある程度量(数十μL以上)のdNTPを保持するために必要なリザーバ301の高さ、リザーバ301へ圧力を供給するための配管部等を考慮すると、固定ピン403の長さは20mm以上必要となる。
【0010】
以上より、分注器303と固定ピン403の干渉を防ぐため、保持部材401の固定・移動手段である固定ピン403は直径1mm以下長さ20mm以上の棒材となり、非常に脆弱となり(折れやすい)、取り扱いが困難な形状となる。
【0011】
また、保持部材401と固定ピン403を装置に取り付ける際には、固定ピン403を分注器303の貫通穴304に通す作業が必要となってしまう。
【0012】
固定ピン403の強度向上のために、直径を太くすることが考えられる。例えば、直径4mmのメンブレン(保持部材401)に直径3mmの固定ピン403を取付けることも可能だが、dNTPを分注する領域が小さくなるため、分注精度が低下する。メンブレン(保持部材401)の面積を拡大することで上記問題を解決できるが、大きなメンブレン(保持部材401)を入れるために反応容器101を大きくする必要があり、その分、反応試薬の量が増大するため試薬コストが上昇してしまう。
【課題を解決するための手段】
【0013】
上記課題を解決するため、核酸分析装置として、核酸試料の試料保持部を備える試料保持部材と、試料保持部に対し核酸試料と相補鎖合成反応をする相補鎖合成基質を供給する分注器と、試料保持部が浸漬され相補鎖合成反応による生成物と反応して発光させる発光酵素と相補鎖合成基質の分解酵素とを含む反応溶液を保持する反応部と、発光酵素による発光を検出する光検出器と、試料保持部材を支持し分注器と反応部との間に設けられ、試料保持部の分注器と対面する面が反応部と対面するように回転する回転機構と、分注器による分注及び回転機構による回転を制御する制御部を備える。
【0014】
また、核酸試料が試料保持部に固定された試料保持部材を用いた分析方法として、当該試料保持部を前記核酸試料と相補鎖合成反応する相補鎖合成基質を供給する分注器に対面させる工程と、分注器から相補鎖合成基質を試料保持部に対して供給する工程と、試料保持部の分注器と対面する面が、相補鎖合成反応による生成物と反応して発光させる発光酵素と相補鎖合成基質の分解酵素とを含む反応溶液を保持する反応部と対面するように試料保持部材を回転させる工程と、試料保持部を反応溶液に浸漬する工程と、発光酵素による発光を検出する工程とを有する。
【発明の効果】
【0015】
上記構成により、試料保持部を保持する保持部材が分注器と干渉しない構成となり、試料保持部材を強固な構成とすることができる。また、試料保持部や保持部材の取り付け操作も容易になる。
【図面の簡単な説明】
【0016】
【図1】課題を説明するための分離反応方式の例。
【図2】本発明による分離反応方式の一例。
【図3】パイロシーケンス反応様式概略図。
【図4】本発明による分析装置の概略図の一例。
【図5】回転機構部周辺拡大図。
【図6】回転機構駆動プロセスの一例。
【図7】メンブレン方式の一例。
【図8】シーケンス操作フローチャート。
【図9】磁気ビーズを用いた例でのスティックとスティックホルダの断面図。
【図10】磁気ビーズのスティック分注面での固定概念図。
【図11】磁気回路を用いたスティックとスティックホルダの断面図。
【図12】磁石回転型のスティックとスティックホルダの断面図。
【図13】磁石移動型のスティックとスティックホルダの断面図。
【図14】電磁石型のスティックとスティックホルダの断面図。
【図15】セファロースビーズを用いた実施例でのスティックとスティックホルダの断面図。
【図16】反応プレート型分析装置の概略図の一例。
【図17】実施例4における回転機構駆動プロセス。
【図18】磁気回路構造の概略図。
【発明を実施するための形態】
【0017】
図2に、固定ピン404の固定部が保持部材401の分注面402と異なる面にあり、試薬分注後に分注面402が反応液102に浸漬可能な構造を示す。これを実現するために、固定ピン404を回転運動可能な構成とする。具体的には、保持部材401の分注面402の裏面に固定ピン404を固定する。分注面402に試薬が分注された後に、固定ピン404は回転して分注面402が反応容器101側(下側)に向く。その後、固定ピン404を下降させ、反応容器101内の反応液102に保持部材401を浸漬させる。固定ピン404と保持部材401は同一でも良く、例えば棒状固定ピンの片端面に核酸(DNAやRNA)が固定され、かつ前記面が分注面という構成でも良い。固定ピン404の回転運動と上下運動を同時に行っても良い。さらに、図16に示すように、反応溶液102が反応プレートに載っているような場合、固定ピン404は上下運動を行わずに回転運動のみでも良い。
【0018】
このような構成を用いた分離反応方式においては、保持部材を固定する固定ピンを分注器と干渉しない構成となるため、固定ピンの太さは保持部材と同等以上の太さにでき、非常に強固なもとなり、また、保持部材・固定ピンの取り付け操作も容易となる。
【0019】
以下、実施例にしたがって、具体的な構成を説明する。
【実施例1】
【0020】
本実施例では、パイロシーケンシング法を用いて、測定対象の塩基配列を決定する。パイロシーケンスに関しては、特許文献2に記載の反応と配列決定の原理を採用した。図3にその反応様式の概略図を示す。パイロシーケンス反応では、配列を決定したいターゲットDNAを一本鎖(ssDNA)にした後に、プライマをハイブリダイズさせ、DNAポリメラーゼを加え、4種のdNTP(dATP、dCTP、dGTP、dTTP)を順次反応液中に加えて相補鎖合成反応を行い、相補鎖合成の際に副産物して生成されるPPiをAMPとPEPとPPDKによりATPに変換し、ATPとルシフェリンをルシフェラーゼ存在下で反応させて発光させる。余剰のdNTPはアピラーゼによって分解される。本実施例では、PPiをATPに変換させるために、AMP、PEP、PPDKを用いたが、ATPスルフリラーゼとAPSを用いた系でも良い。
【0021】
図4に本発明の分析装置の概観を示す。本装置は、反応収容部、光検出部、試薬分注部、回転機構部から構成される。これらの構成部は遮光されるように筺体に覆われている。
【0022】
反応収容部106は直径5mm深さ10mmの4つの反応容器101が9mmピッチで1列に配置されている。反応容器101の直径、深さ、数およびピッチは任意であり、限定されるものではない。さらに、反応容器101は複数列で配置しても良い。また、反応収容部106は、市販の反応容器(例えばNunc−ImmunoTMModules;CAT No.473539)とそれを固定するホルダを組み合わせた形状でも良い。パイロシーケンス反応では室温よりも高い温度で実施される場合がある(28℃〜35℃)。そこで、反応液を効率よく温調するために、反応収容部106には温度制御手段105が接続されている。本実施例では温度制御手段105としてペルチェ素子を使用したが、ヒータなどでも良い。また、反応液を攪拌するために、反応収容部106には攪拌手段104が接続されている。本実施例では、攪拌手段104として、回転軸に偏心カムが付いているモータを用い、前記偏心カムを反応収容部106に掘られた溝にあてがい、モータが回転することで、反応収容部106が振動する構成とした。温度制御手段105と攪拌手段104は、H8マイコン501(HD64F3052BF25、ルネサステクノロジ)によって動作が制御される。
【0023】
光検出部は、全体を導電性材料で作られた導電性筺体205で覆われている。導電性筺体205内部には4つの光検出器201が収納されており、各光検出器201は各反応容器101の下方に1:1の関係で配置されている。光検出器201としてフォトダイオード(SiフォトダイオードS1133−01、浜松ホトニクス)を使用したが、ラインセンサやCCDを用いて4つの反応容器101からの発光を1つの光検出器で検出しても良い。光検出器201と反応収容部106底部の間には、裏面に透明電極層(ここではITOを用いた)を有したガラス基板202が配置されており、前記透明電極層は導電性筺体205に電気的に接続され、装置の設置電位に接続されている。光検出器201からの信号は、導電性筺体205内に内蔵されたアンプ203(opA129UB、Texas Instruments)により増幅され、導電性筺体205外部に配置されたマルチプレクサ204(MAX4051ACSE、 Maxim Integrated Products)により4つの光検出器201からの信号を時分割してA/D変換され、H8マイコン501で信号処理され、パーソナルコンピュータ(PC)に出力される。
【0024】
試薬分注部は、分注器303、分注器ホルダ305、圧力配管ブロック306で構成される。分注器303は、試薬(ここではdNTP4種)が50μL収容できる4つのリザーバ301が一体となっており、各リザーバ301の底部にはキャピラリ302(外径370μm、内径50μm)が具備されている。リザーバ301に収容されたdNTPは、リザーバ301上面より加圧され、キャピラリ302端面から分注される。各分注器303は各反応容器101と対向する配置となるよう分注器ホルダ305によって保持される。dNTPを加圧分注するために、分注器303上面には圧力配管ブロック306が接続されている。圧力配管ブロック306では、4種のdNTPが収容されるリザーバ301それぞれに、かつ、4つの分注器303において同じdNTPが収容されたリザーバ301には同時に圧力を印加できるような流路307が形成されている。最終的には、圧力配管ブロック306の背面で4本の流路に集約される。圧力配管ブロック306背部にて、前記4本の流路に4本の配管チューブ308がそれぞれ接続されており、すべての配管チューブ308が1つの圧力供給源502に接続されている。ここでは、圧力供給源502としてCO2高圧ガスタンクを使用したが、それ以外の手段を用いても良い。各配管チューブ308と圧力供給源502の間には電磁弁309が設けてある。電磁弁309はH8マイコン501に接続されており、電磁弁309の開閉のタイミングを制御し、各dNTPの分注タイミングと量を制御する。
【0025】
回転機構部は、スティック405、スティックホルダ406、回転駆動部407で構成され、試薬分注部と反応収容部の間に配置される。本実施例では、DNA鎖を固定する保持部材と保持部材を固定する固定ピンは一体となった棒状構造(スティック)を使用した。回転機構部周辺の拡大図を図5に示す。スティック405は、直径は3mm、長さは15mmであり、材質をポリエーテルエーテルケトン(PEEK)とした。直径と長さは、反応容器101内に導入できるサイズであれば、特に限定されるものではない。また、材質はPEEKに限定されるものではない。スティック405の分注面402には、DNA鎖を固定できるよう表面処理がされている。具体的には分注面402にアビジンをコートした。4本のスティック405は、各分注器303と各反応容器101に対して1:1になるようにスティックホルダ406に固定される。スティック405はスティックホルダ406から着脱可能な構成とした。着脱可能な構成として、スティックホルダ406内部に内蔵されたボールプランジャとスティック側面に設けられたスティック溝408を利用した。
【0026】
回転駆動部407は、ホルダ固定プレート409、アーム410、リニアガイド416、上下モータ419で構成される。スティックホルダ406はホルダ固定プレート409を介して回転駆動部407に固定される。スティックホルダ406をホルダ固定プレート409に固定する際は、磁石412を用いて容易に着脱可能な構成とした。また、取り付け位置はガイドピン411を用いて取付再現性を確保した。ホルダ固定プレート409はアーム410に対して回転軸415を中心に回転できるように接続されており、回転軸415の片端には偏心カム413が、もう一方の端にはピニオン417が固定されている。アーム410はリニアガイド416に固定されており、上下モータ419によって上下に駆動する。上下モータ419はH8マイコン501に接続されており、上下モータ419を介して回転駆動部407の上下動を制御する。
【0027】
図6に回転機構部407の駆動プロセスを示す。リザーバ301に収容されたdNTPをスティック405の分注面402に分注し、伸長反応のために数秒静置する(図6(a))。上下モータ419によってアーム410を下降させる。その際に、ピニオン417の歯が装置筺体に取付けられたラック418の歯とかみ合いながらアーム410が下降するため、回転軸415を中心にスティックホルダ406が回転する(図6(b))。アーム410が所定の距離下降すると、ラック48の歯からピニオン417の歯が外れるため、スティックホルダ406とスティック405の回転運動は停止する。偏心カム413とストッパ414を用いて、スティックホルダ406とスティック405の回転を完全に止める。この動作により、スティック405の分注面402はdNTPが分注された時から180度回転したことになる。また、この時スティック405の分注面402は反応容器101にはまだ入っていない(図6(c))。アーム410はさらに下降し、反応容器101内底面から1mmの位置で下方移動を停止し、分注面402が反応容器101内の反応液に浸漬される(図6(d))。アーム410が上昇する際は、前記工程と逆の動作となる。
【0028】
スティックホルダ406は、ピニオン417の歯がラック418の歯に当たるまでは回転運動を行わずに上昇し、ピニオン417とラック418の歯が当たると回転運動を行いながら上昇し、アーム410が最上面まで上昇すると分注面402が上方を向く状態で回転運動を停止し、dNTPが分注される状態となる。この時、分注面402と分注器303のキャピラリ302dNTP吐出端との距離は1mmになるようにした。以上のプロセスを繰り返すことでパイロシーケンス反応を行う。本実施例では、ピニオン417とラック418を用いて分注面402の回転運動を行ったが、回転軸415に小型モータを接続し、小型モータをH8マイコン501に接続して、小型モータをコントロールすることで、分注面402の回転運動を行っても良い。
【0029】
また、ここでは上下モータ419によってアーム410を上下に動かしている例を示したが、スティック405と反応容器101との相対位置を制御できればよいので、例えば、反応容器101が上下に動くような機構を設けるようにしてもよい。
【0030】
本実施例では、DNA鎖を固定する保持部材と保持部材を固定する固定ピンは一体となったスティックを使用したが、保持部材と固定ピンを分割して取り外せるようになっていても良い。保持部材としてメンブレンを用いた例を示す(図7)。ここでは、メンブレン420として直径3mmのSAM2(R) Biotin Capture Membrane(V7861、Promega)を使用した。このメンブレン420には共有結合によりストレプトアビジンがコートされている。メンブレン420の分注面402とは異なる面に直径1mm、長さ5mmのピン421が固定されており、ピン421はピンホルダ422を介してスティックホルダ406に固定される。ピン421の直径と長さは、反応容器101内に導入できるサイズであれば、特に限定されるものではない。しかし、メンブレン420が反応液に浸漬する際に、分注面402と反対の面からも効率良く反応液がメンブレンに伝わるようにするため、ピン421は、強度を考慮しながら可能な限り細くした方が良い。なお、ピンホルダ422とスティックホルダ406は着脱可能な構成とした。スティックホルダ406は、保持部材と固定ピンが一体となったスティックの場合と同様に回転駆動部407に固定する。上記方法により、保持部材と保持部材を固定する固定ピンを分離した場合でも、固定ピンは分注器と干渉しないため、固定ピンの直径が細くても短くできる、つまり強固にすることができる。
【0031】
以下、図8のフローチャートに沿って測定対象のDNAのパイロシーケンス反応の方法を説明する。まず、5’末端にビオチン標識された配列解析対象の一本鎖DNA(ssDNA)をプライマとハイブリダイズさせる(601)。前記プライマ−ssDNA複合体を分注面402に滴下、5分間静置し、ビオチン−アビジン結合を介してプライマ−ssDNA複合体を分注面402に固定する(602)。スティック405の分注面402を2×Cバッファ(組成:120mM Tricine、4mM EDTA、40mM MgAc2)で洗浄する(603)。次いで、分注面402にポリメラーゼ(Klenow)を滴下、5分間静置し、分注面402に固定されたプライマ−ssDNA複合体と結合させる(604)。ポリメラーゼのプライマ−ssDNA複合体への固定を,ポリメラーゼを反応液に導入し,下記分注面402を反応液に1分間浸漬する工程608で行っても良い。前記プライマ−ssDNA複合体が固定されたスティック405をスティックホルダ406に取付け、スティックホルダ406を装置に取り付ける(605)。前記操作はすべて装置外部で行われる。4種のdNTPを分注器303のそれぞれのリザーバ301に導入し、また反応液を反応容器101に導入し、分注器303と反応容器101を装置に取り付ける(606)。反応液の組成は、発光のための酵素とdNTP分解酵素が満たされているように、例えば、60mM Tricine、2mM EDTA、20mMMgAc、15mU/μL PPDK、60μM ルシフェラーゼ、400μM ルシフェリン、80μM PEP・3Na、400μM AMP、1nL/μL BSA、200μM DTT、1.2mU/μL アピラーゼとした。
【0032】
上下モータ419を駆動して、スティック405の回転・下降動作を行い(607)、分注面402を反応液に1分間浸漬する(608)。前記浸漬工程により、プライマ−ssDNA複合体やポリメラーゼに含まれるATPやPPiを分解し、背景光の上昇を防ぐことができる。次いで、スティック405の回転・上昇動作を行い(609)、分注面402にdNTPを0.5μL滴下し、相補鎖合成反応のために6秒間静置した(610)。0.5μL程度の量であれば、スティック405の回転速度にもよるが、液体の表面張力により、スティック405を回転運動させてもdNTP溶液が分注面402からこぼれ落ちることはない。分注量は0.5μLに限る必要はないが、スティック405の回転運動時にこぼれない程度の量以下である必要がある。スティックを6秒間静置した後に、スティック405の回転・下降動作を行い(611)、分注面402を反応液に浸漬させる(612)。分注面402を反応液に浸漬した直後に攪拌手段104であるモータを駆動させ、反応液を攪拌するとともに、発光計測を行う(613)。この時、PPDK、ルシフェラーゼによる発光反応とアピラーゼによる余剰のdNTPの分解反応が行われる。前記発光の有無と強度を確認して、分注したdNTPによって相補鎖合成が行われたか、何塩基分相補鎖合成が行われたかを判断する。攪拌を114秒間行った後に、攪拌動作をやめ、スティック405の回転・上昇動作を行い(614)、分注面402を分注器303直下に配置し、次のdNTPを分注する。610から614の動作を分注面402へのdNTPの分注(610)からスティック405の回転・上昇動作(614)を繰り返して発光計測することにより、測定対象の塩基配列を決定できる。
【0033】
本実施例では、ビオチン−アビジン結合を用いて保持部材にDNAを固定したが、固定方法はその限りではない。例えば、ポリメラーゼにビオチンを標識し、前記ビオチン標識ポリメラーゼを保持部材に固定して、前記ビオチン標識ポリメラーゼにプライマ−ssDNA複合体を結合させる方法を用いても良い。
【0034】
DNAの相補鎖合成反応では,プライマ−ssDNA複合体の自己ハイブリダイゼーションなどの高次構造形成により,相補鎖合成反応の効率が著しく低下する場合がある。前記問題を解決するため,スティック405の分注面402に温度調節(30℃〜40℃)機構を設ける,反応液にSSB(single−strand binding protein)や変性剤となるDMSOなどを加えても良い。
【実施例2】
【0035】
本実施例では、保持部材として磁気ビーズを用いて、パイロシーケンシング法による測定対象の塩基配列を決定する。スティックとスティックホルダ以外の装置構成、DNA鎖の保持部材への固定方法以外の反応プロセスは実施例1と同等である。
【0036】
図9にDNA鎖が固定された磁気ビーズを固定する柱状のスティックとスティックホルダの断面図を示す。スティック405は直径4mm、長さ15mmで片端面が塞がれた筒状の形状である。ここでは、円筒状の構成を示しているがこれに限られない。材質はPEEKを用いた。スティック405の直径、長さ、材質は、この限りではない。但し、材質に関しては、すべて磁性体だとスティック405全体に磁気ビーズが固定されてしまうため、非磁性体が良い。円筒を塞ぐ片端面のみ磁性体とし、それ以外は非磁性体であっても良い。
【0037】
スティック405の内側面に磁気シールドシート426を覆い、磁気ビーズがスティック405側面に固定されないようにした。さらに、分注面402の周囲にヘリ447を設けて、分注面が攪拌している反応液中に存在する時に、磁気ビーズが反応液の攪拌によりスティック405の側面に移動しないような工夫を施した。磁気ビーズのスティック側面への移動防止対策として前記方法以外に,磁気回路を用いた方法(図18)も考えられる。図9の磁石423の代わりに、内底面に磁石449が固定された片端面が閉じた筒状構造の磁性体(例えば78パーマロイ)キャップ450を用いることにより,磁場は図18磁性体キャップ450と磁石449の上面に形成され,磁性体キャップ450の側面には形成されなくなる。そのため,磁気シールドシート426,ヘリ447が無くても,磁気ビーズはスティック405の分注面のみに安定して固定されることになる。
【0038】
スティック405とスティックホルダ406は,実施例1と同じように、ボールプランジャ425とスティック405の側面に設けられたスティック溝408を用いて、着脱可能な構成とした。スティックホルダ406には、スティック205の筒内部に内包されるよう、磁石423が先端に固定された磁石固定ピン424が具備されている。磁石固定ピン424の磁石423が固定された面と異なる面をバネ427で押すことにより、磁石423が常にスティック内底面430を押し、スティック外底面(つまり分注面402)の磁場強度の着脱再現性が得られる構成とした。また、磁石固定ピン424の片端に突起428を作り、突起428がスティックホルダ406内部の受け面429と干渉することで、磁石固定ピン424がスティックホルダ406から外れない構成とした。
【0039】
磁気ビーズへの測定対象となるDNA鎖の固定方法および前記DNA固定磁気ビーズのスティック405への固定方法を説明する。測定対象のDNAを、PCRを用いて5’末端にビオチン602標識させ、ビオチン602標識DNAをアビジン604が標識された磁気ビーズ605(DynaBeads(R) M−280 Streptavidin、invitrogen)に固定した(図10(a))。磁気ビーズ605は、直径2.8μm、疎水性のビーズであるが、これ以外のものを使用しても良い。また、DNA鎖と磁気ビーズの固定手段として、ビオチン−アビジン結合を利用したが、それ以外の方法で固定しても良い。次いで、DNA鎖が固定された磁気ビーズ605に0.2N NaOHを加え、アルカリ変性する。アルカリ変性した後に、磁石台を用いて磁気ビーズ固定鎖と上清に含まれる遊離鎖に分け、磁気ビーズ605に固定されたssDNA601を作製する。磁気ビーズ605に固定されたssDNA601(0.5pmol)に4倍量(2pmol)のプライマ603を加え、ssDNA601へプライマ603をハイブリダイズさせ、プライマ−ssDNA複合体を作製する。前記ハイブリダイズ後に、磁気ビーズ605が入った溶液にポリメラーゼ(Klenow)を加えて5分間静置し、プライマ−ssDNA複合体にポリメラーゼを結合させる。前記磁気ビーズ605が入った溶液をスティックホルダ406に取り付けられたスティック405の分注面402に滴下し、磁気ビーズを分注面402に固定する(図10(b))。前記固定作業の後に、余剰の溶液を取り除き、装置に取り付け、実施例1と同等のシーケンスプロセスを行う。
【0040】
図9に示した磁石1個のみを用いた場合では、分注面402の中心に磁気ビーズが固まりを形成する。磁気ビーズの量によっては、磁気ビーズの固定領域の面積に対する高さの割合が大きくなり、前記磁気ビーズ塊の中心へのdNTPの浸透が遅くなることがある。このような場合、磁気ビーズ塊の中心部のDNA鎖の相補鎖合成反応の効率が低下し、DNA鎖間での相補鎖合成反応の不均一が生じることによるシーケンス解析精度低下につながる。前記問題を防ぐ手段として、図11に示すように、リング型磁石432を用いることが考えられる。これにより、磁気ビーズが分注面402の外周に分散固定され、磁気ビーズの固定領域の面積に対する高さの割合が小さくなり、dNTPの磁気ビーズへの浸透をより速く、均等に行うことができ、相補鎖合成の不均一を抑えることができる。リング形状は、スティック205の内部側面に沿った形が望ましい。上記方法以外に、分注面で固定した磁気ビーズを攪拌させることで、dNTPの磁気ビーズへの浸透の効率を向上させることも考えられる。
【0041】
図12に磁石回転型のスティックとスティックホルダ断面図を示す。磁石、磁石固定ピン、バネ以外の構成は図9と同等である。スティックホルダ436に小型のモータ435が内蔵されており、モータ435の軸にはシャフト434が接続されており、シャフト434の先端には小型の磁石433が固定されている。小型磁石433は、少なくともスティック405の内径よりも小さい径を有するような大きさである。そして、固定される部位としては、スティックの中心軸から小型磁石433が遠ざかるようにするとよい。スティック405をスティックホルダ436に取付けると、シャフト434と磁石433はスティック405内に配置される。dNTP分注後にモータ435を回転させることで、磁石433がスティック405内部で回転し、分注面402に固定された磁気ビーズも回転する。磁気ビーズの回転動作による攪拌により、dNTPの磁気ビーズへの浸透の効率を向上させることができる。磁場強度を弱めることにより強固に集積した磁気ビーズの集積度合い(固定度合い)を緩め、dNTPが磁気ビーズ塊の中心に浸透しやすくする方法も考えられる。
【0042】
図13に磁石移動型のスティックとスティック断面図を示す。磁石、磁石固定ピン、バネ以外の構成は図9と同等である。スティックホルダ440にはシャフト439が具備されており、シャフト439の先端にはスプリング438が接続されており、スプリング438の片端には磁石437が固定されている。スティック405をスティックホルダ440に取付けると、シャフト439、スプリング438、磁石437はスティック405内部に入る構成となっている。スプリング438の伸張方向は、スティック405の中心軸方向である。分注面402が上方を向いている時は、磁石437の重さでスプリング438が縮まり、磁石437は分注面402から離れる。磁石437が分注面402から離れることにより、磁場強度が弱くなり、磁気ビーズの集積度合いが緩まり、dNTPが磁気ビーズ塊の中心に浸透しやすくなる。分注面402が下方に向いている時は、スプリング438によって磁石437をスティック内底面に押しつけるため、磁気ビーズが分注面402に固定され、磁気ビーズが反応容器101に落ちることを防ぐ。上記方法以外に、dNTP分注時に磁場強度を弱める方法として電磁石を用いる方法がある。
【0043】
図14に電磁石型スティックとスティックホルダの断面図を示す。磁石、磁石固定ピン、バネ以外の構成は図9と同等である。スティックホルダ440には、磁性体シャフト441(ここでは鉄性のシャフト)が具備されており、磁性体シャフト441には絶縁性被覆の付いた電線(ここではニクロム線442)が巻き付けられている。ニクロム線442は、ON/OFFをH8マイコン501で制御される電源に接続されている。dNTPをスティック450の分注面402に分注する際には、前記電源をOFFにし、磁性体シャフト441から磁場が発生しないようにする。前記操作により、磁場強度が弱くなり、磁気ビーズの集積度合いが緩まり、dNTPが磁気ビーズ塊の中心に浸透しやすくなる。スティック405が回転・下降する際には、前記電源をONにし、磁性体シャフト441から磁場を発生させ、磁気ビーズを分注面402に固定する。前記操作により、分注面402が反応液に浸漬した際に、磁気ビーズが反応液に拡散することを防ぐ。また、分注面402が反応液に浸漬する際に、あえて前記電源をOFFにすることで、磁気ビーズを反応液に拡散させ、相補鎖合成によって生成されたPPiや余剰のdNTPの反応液の拡散効率を向上させても良い。この場合、分注面402を反応液から取出す際に、前記電源をONにして、反応液に分散した磁気ビーズを分注面402に再固定する必要がある。
【0044】
以上のように本発明を用いると、分注面裏面での固定ピン配置により、固定ピンが分注器と干渉することがないため、固定ピンの脆弱性の抑制や取り付け容易性の向上以外に、様々な形状の磁石を使用でき、反応効率の向上などが可能となる。
【実施例3】
【0045】
本実施例では、保持部材としてセファロースビーズを用いて、パイロシーケンシング法による測定対象の塩基配列を決定する。スティックとスティックホルダ以外の装置構成、DNA鎖の保持部材への固定方法以外の反応プロセスは実施例1と同等である。
【0046】
図15に保持部材としてセファロースビーズを用いた時に使用するスティックとスティックホルダ断面図を示す。スティック443の片端面にセファロースビーズ444を導入し、メンブレンフィルタで作られたフィルタキャップ445で閉じ込める。図15のように凹部を有するとセファロースビーズを導入しやすい。セファロースビーズ444として、ストレプトアビジンがコートされた平均粒子径34μmのビーズ(Streptavidin Sepharose High Performance Lab Pack and Hitrap Streptavidin HP、GE Healthcare)を使用した。フィルタキャップ445のメンブレンフィルタとして、メッシュサイズ12μm、polycarbonate製(ISOPORETM MEMBRANE FILTERS、MILLIPORE)を使用した。セファロースビーズ444の大きさよりもメンブレンフィルタのメッシュサイズの方が小さいため、フィルタキャップ445内部にdNTP溶液は浸透するが、セファロースビーズ444はフィルタキャップ445外部には移動できない。メンブレンフィルタとして、多数の孔が開いたものを用いてもよく、そのときに孔の大きさについてもビーズの大きさよりも小さくなるようなものを用いる。
【0047】
セファロースビーズ444へのDNA固定方法を説明する。セファロースビーズ444を、カラムを用いてバッファで洗浄し、5’末端ビオチン標識二本鎖DNA(dsDNA)をセファロースビーズ444に添加し、dsDNAをセファロースビーズ444に固定する。次いで、カラムを用いてセファロースビーズ444をバッファで洗浄し、未結合のdsDNAを洗い流す。0.2N NaOHを添加して、変性させ、バッファでセファロースビーズ444を洗浄してセファロースビーズ444に固定されたssDNAを作製する。前記工程で得られたssDNAが固定されたセファロースビーズ444をスティック443に導入し、フィルタキャップ445をスティック443先端に取付ける。その後、スティック443をスティックホルダ446に取付け、スティックホルダ446を装置に取り付け、実施例1と同等のシーケンスプロセスを行う。
【実施例4】
【0048】
本実施例では、回転駆動のみでスティック分注面の位置制御を行い、パイロシーケンシング法による測定対象の塩基配列を決定する。回転機構部、反応収容部以外の装置構成、反応プロセスは実施例1と同等である。
【0049】
図16に本実施例で使用する分析装置の概観を示す。本実施例では、反応収容部を構成する反応容器に代わり、反応プレート107を使用する。反応プレート107の材質として、ステンレスを使用したが、その限りではない。また、反応プレート107の表面は疎水処理が施されている。反応プレート107には光学的に透明な材質の検出窓108が具備されている。検出窓108の材質として石英ガラスを使用したが、光学的に透明であれば、その限りではない。検出窓108の図16の上側の端面には親水処理が施されている。そのため、反応プレート107に実施例1と同等の反応液を滴下すると、検出窓108を中心に反応液滴109が形成される。反応プレート107を光学的に透明な材質を使用することで、検出窓108を使用しなくても良い。この場合、反応液滴109が所定の位置に維持されるように、前記所定の位置のみに親水処理を施し、それ以外の表面には疎水処理を施すことが望ましい。尚、親水処理、疎水処理は、親水処理部が疎水処理部よりも相対的に反応溶液に対する親水度が高くなるように処理されればよい。
【0050】
反応プレート107には温度制御手段105が接続されており、反応プレートを介して反応液滴の温度調節が可能となっている。温度制御手段105としてペルチェを用いたが、その限りではない。反応プレート107は、検出窓108の直下に検出器201が位置するように、ガラス基板202の上部に配置した。
【0051】
回転機構部は、実施例1と同様にスティック405、スティックホルダ406、回転駆動部407で構成され、試薬分注部と反応収容部の間に配置される。スティック405とスティックホルダ406は実施例1と同等である。また、スティック405とスティックホルダ406の回転駆動部407への取付方法も実施例1と同等である。回転駆動部407は、ホルダ固定プレート409、アーム410、モータ448で構成される。ホルダ固定プレート409はアーム410に対して回転軸415を中心に回転できるように接続されており、回転軸415の片端にはモータ448が接続されている。モータ448はH8マイコン501に接続されており、モータ448を介して回転駆動部407の回転運動を制御する。
【0052】
図17に回転機構部407の駆動プロセスを示す。リザーバ301に収容されたdNTPをスティック405の分注面402に分注し、伸長反応のために数秒静置する(図17(a))。次いで、モータ448によって、回転軸415を中心にホルダ固定プレート409を介してスティックホルダ406を回転させる。この動作により、スティック405の分注面402はdNTPが分注された時から180度回転し、分注面402が反応プレート107上の反応液滴109に接触する(図17(b))。相補鎖合成反応によって生成されたPPiや余剰のdNTPを効率良く反応液滴109に拡散させるために、分注面402を反応液滴109に接触した際に、モータ448によってスティック405を図17(b)で左右にわずかに回転動作させた。反応プレート107を振動させて、相補鎖合成反応によって生成されたPPiや余剰のdNTPを効率良く反応液滴109に拡散させても良い。分注面402にdNTPを分注する時は、前記工程と逆の動作となる。
【0053】
モータ448によって、回転軸415を中心にスティックホルダ406を180度回転させ、dNTPが分注される状態にする。この時、分注面402と分注器303のキャピラリ302dNTP吐出端との距離は1mmになるようにした。以上のプロセスを繰り返すことでパイロシーケンス反応を行う。
【符号の説明】
【0054】
101:反応容器、102:反応液、103:溝、104:攪拌手段、105:温度制御手段、106:反応収容部、107:反応プレート、108:検出窓、109:反応液滴、201:光検出器、202:ガラス基板、230:アンプ、204:マルチプレクサ、205:導電性筺体、301:リザーバ、302:キャピラリ、303:分注器、304:貫通穴、305:分注器ホルダ、306:圧力配管ブロック、307:流路、308:配管チューブ、309:電磁弁、401:保持部材、402:分注面、403:固定ピン、404:固定ピン、405:スティック、406:スティックホルダ、407:回転駆動部、408:スティック溝、409:ホルダ固定プレート、410:アーム、411:ガイドピン、412:磁石、413:偏心カム、414:ストッパ、415:回転軸、416:リニアガイド、417:ピニオン、418:ラック、419:上下モータ、420:メンブレン、421:ピン、422:ピンホルダ、423:磁石、424:磁石固定ピン、425:ボールプランジャ、426:磁気シールド、427:バネ、428:突起、429:受け面、430:スティック内底面、432:リング型磁石、433:磁石、434:シャフト、435:モータ、436:スティックホルダ、437:磁石、438:スプリング、439:シャフト、440:スティックホルダ、441:磁性体シャフト、442:ニクロム線、443:スティック、444:セファロースビーズ、445:フィルタキャップ、446:スティックホルダ、447:ヘリ、448:モータ、449:磁石、450:磁性体キャップ、501:H8マイコン、502:圧力供給源、601:ssDNA、602:ビオチン、603:プライマ、604:アビジン、605:磁気ビーズ
【特許請求の範囲】
【請求項1】
核酸試料の試料保持部を備える試料保持部材と、
前記試料保持部に対し、前記核酸試料と相補鎖合成反応をする相補鎖合成基質を供給する分注器と、
前記試料保持部が浸漬され、前記相補鎖合成反応による生成物と反応して発光させる発光酵素と、前記相補鎖合成基質の分解酵素とを含む反応溶液を保持する反応部と、
前記発光酵素による発光を検出する光検出器と、
前記試料保持部材を支持し、前記分注器と前記反応部との間に設けられ、前記試料保持部の前記分注器と対面する面が、前記反応部と対面するように回転する回転機構と、
前記分注器による分注、前記回転機構による回転を制御する制御部と、を備えた核酸分析装置。
【請求項2】
前記試料保持部と前記反応部との相対距離を制御するように前記試料保持部材を移動させる上下機構を備えることを特徴とする請求項1記載の核酸分析装置。
【請求項3】
前記回転機構は、前記上下機構による前記試料保持部材の移動に伴い回転する回転部材を備えることを特徴とする請求項2記載の核酸分析装置。
【請求項4】
前記試料保持部材は、前記試料保持部を有する柱状構造をしていることを特徴とする請求項1記載の核酸分析装置。
【請求項5】
前記試料保持部材は、前記試料保持部としてのメンブレンを固定したものであることを特徴とする請求項1記載の核酸分析装置。
【請求項6】
前記試料保持部材をはめ込むホルダを備え、前記ホルダを介して前記試料保持部材が前記回転機構に支持されることを特徴とする請求項1記載の核酸分析装置。
【請求項7】
前記反応部は、前記反応溶液を保持する容器を備えることを特徴とする請求項2記載の核酸分析装置。
【請求項8】
前記反応部は、前記反応溶液を保持する親水性領域と、前記親水性領域よりも親水度の低い疎水性領域を有するプレートであることを特徴とする請求項1記載の核酸分析装置。
【請求項9】
前記試料保持部材は、前記試料保持部を底面とする筒状部材と、前記筒状部材の内部に磁性体を備えていることを特徴とする請求項4記載の核酸分析装置。
【請求項10】
前記筒状部材の内側面は磁気シールドを備えていることを特徴とする請求項9記載の核酸分析装置。
【請求項11】
前記磁性体は、前記筒状部材の内側面に沿ったリング形状の磁石であることを特徴とする請求項9記載の核酸分析装置。
【請求項12】
前記磁性体は、前記筒状部材の内径よりも小さい径を有する磁石であって、前記磁石の中心軸が前記筒状部材の中心軸と異なるように固定部材によって固定され、前記固定部材を前記筒状部材の内周に沿って回転させる回転機構を備えることを特徴とする請求項9記載の核酸分析装置。
【請求項13】
前記筒状部材は、内部に前記筒状部材の中心軸方向に伸縮するバネを備え、前記磁性体は、前記試料保持部と前記バネとの間に置かれた磁石であることを特徴とする請求項9記載の核酸分析装置。
【請求項14】
前記磁性体は電線が巻かれた電磁石であり、前記制御部は、前記試料保持部が前記分注器に対面しているときには電源OFF、前記試料保持部が前記反応部と対面しているときには電源ONするように制御することを特徴とする請求項9記載の核酸分析装置。
【請求項15】
前記試料保持部は、測定対象の試料が固定されたビーズを保持する凹部と、前記凹部をカバーし前記ビーズよりも小さい孔を有するメンブレンを備えることを特徴とする請求項1記載の核酸分析装置。
【請求項16】
ポリメラーゼが結合した核酸試料が試料保持部に固定された試料保持部材を用いた分析方法であって、
前記試料保持部を、前記核酸試料と相補鎖合成反応する相補鎖合成基質を供給する分注器に対面させる工程と、
前記分注器から相補鎖合成基質を前記試料保持部に対して供給する工程と、
前記試料保持部の前記分注器と対面する面が、相補鎖合成反応による生成物と反応して発光させる発光酵素と前記相補鎖合成基質の分解酵素とを含む反応溶液を保持する反応部と対面するように前記試料保持部材を回転させる工程と、
前記試料保持部を、前記反応溶液に浸漬する工程と、
前記発光酵素による発光を検出する工程とを有する核酸分析方法。
【請求項17】
前記分注器から相補鎖合成基質を前記試料保持部に対して供給する工程の前に、前記試料保持部を前記反応溶液に浸漬する工程を有することを特徴とする請求項16記載の核酸分析方法。
【請求項1】
核酸試料の試料保持部を備える試料保持部材と、
前記試料保持部に対し、前記核酸試料と相補鎖合成反応をする相補鎖合成基質を供給する分注器と、
前記試料保持部が浸漬され、前記相補鎖合成反応による生成物と反応して発光させる発光酵素と、前記相補鎖合成基質の分解酵素とを含む反応溶液を保持する反応部と、
前記発光酵素による発光を検出する光検出器と、
前記試料保持部材を支持し、前記分注器と前記反応部との間に設けられ、前記試料保持部の前記分注器と対面する面が、前記反応部と対面するように回転する回転機構と、
前記分注器による分注、前記回転機構による回転を制御する制御部と、を備えた核酸分析装置。
【請求項2】
前記試料保持部と前記反応部との相対距離を制御するように前記試料保持部材を移動させる上下機構を備えることを特徴とする請求項1記載の核酸分析装置。
【請求項3】
前記回転機構は、前記上下機構による前記試料保持部材の移動に伴い回転する回転部材を備えることを特徴とする請求項2記載の核酸分析装置。
【請求項4】
前記試料保持部材は、前記試料保持部を有する柱状構造をしていることを特徴とする請求項1記載の核酸分析装置。
【請求項5】
前記試料保持部材は、前記試料保持部としてのメンブレンを固定したものであることを特徴とする請求項1記載の核酸分析装置。
【請求項6】
前記試料保持部材をはめ込むホルダを備え、前記ホルダを介して前記試料保持部材が前記回転機構に支持されることを特徴とする請求項1記載の核酸分析装置。
【請求項7】
前記反応部は、前記反応溶液を保持する容器を備えることを特徴とする請求項2記載の核酸分析装置。
【請求項8】
前記反応部は、前記反応溶液を保持する親水性領域と、前記親水性領域よりも親水度の低い疎水性領域を有するプレートであることを特徴とする請求項1記載の核酸分析装置。
【請求項9】
前記試料保持部材は、前記試料保持部を底面とする筒状部材と、前記筒状部材の内部に磁性体を備えていることを特徴とする請求項4記載の核酸分析装置。
【請求項10】
前記筒状部材の内側面は磁気シールドを備えていることを特徴とする請求項9記載の核酸分析装置。
【請求項11】
前記磁性体は、前記筒状部材の内側面に沿ったリング形状の磁石であることを特徴とする請求項9記載の核酸分析装置。
【請求項12】
前記磁性体は、前記筒状部材の内径よりも小さい径を有する磁石であって、前記磁石の中心軸が前記筒状部材の中心軸と異なるように固定部材によって固定され、前記固定部材を前記筒状部材の内周に沿って回転させる回転機構を備えることを特徴とする請求項9記載の核酸分析装置。
【請求項13】
前記筒状部材は、内部に前記筒状部材の中心軸方向に伸縮するバネを備え、前記磁性体は、前記試料保持部と前記バネとの間に置かれた磁石であることを特徴とする請求項9記載の核酸分析装置。
【請求項14】
前記磁性体は電線が巻かれた電磁石であり、前記制御部は、前記試料保持部が前記分注器に対面しているときには電源OFF、前記試料保持部が前記反応部と対面しているときには電源ONするように制御することを特徴とする請求項9記載の核酸分析装置。
【請求項15】
前記試料保持部は、測定対象の試料が固定されたビーズを保持する凹部と、前記凹部をカバーし前記ビーズよりも小さい孔を有するメンブレンを備えることを特徴とする請求項1記載の核酸分析装置。
【請求項16】
ポリメラーゼが結合した核酸試料が試料保持部に固定された試料保持部材を用いた分析方法であって、
前記試料保持部を、前記核酸試料と相補鎖合成反応する相補鎖合成基質を供給する分注器に対面させる工程と、
前記分注器から相補鎖合成基質を前記試料保持部に対して供給する工程と、
前記試料保持部の前記分注器と対面する面が、相補鎖合成反応による生成物と反応して発光させる発光酵素と前記相補鎖合成基質の分解酵素とを含む反応溶液を保持する反応部と対面するように前記試料保持部材を回転させる工程と、
前記試料保持部を、前記反応溶液に浸漬する工程と、
前記発光酵素による発光を検出する工程とを有する核酸分析方法。
【請求項17】
前記分注器から相補鎖合成基質を前記試料保持部に対して供給する工程の前に、前記試料保持部を前記反応溶液に浸漬する工程を有することを特徴とする請求項16記載の核酸分析方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【公開番号】特開2012−34612(P2012−34612A)
【公開日】平成24年2月23日(2012.2.23)
【国際特許分類】
【出願番号】特願2010−176918(P2010−176918)
【出願日】平成22年8月6日(2010.8.6)
【出願人】(000005108)株式会社日立製作所 (27,607)
【Fターム(参考)】
【公開日】平成24年2月23日(2012.2.23)
【国際特許分類】
【出願日】平成22年8月6日(2010.8.6)
【出願人】(000005108)株式会社日立製作所 (27,607)
【Fターム(参考)】
[ Back to top ]

