核酸分解剤および核酸の分解方法
【課題】殺菌、消毒剤等の抗菌剤として有用な核酸分解剤を提供する。
【解決手段】エチジウムモノアジドを核酸分解剤の有効成分とする。
【解決手段】エチジウムモノアジドを核酸分解剤の有効成分とする。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、エチジウムモノアジド(エチジウムモノアザイドとも呼ぶ)を有効成分とする核酸分解剤、および細胞を含む試料にエチジウムモノアジドを添加し、当該細胞を含む試料に可視光線を照射して細胞内の核酸を分解する工程を含む、細胞の核酸を分解する方法である。
【背景技術】
【0002】
従来、殺菌・消毒剤としては、アルコールやクレゾール、酸化剤等が代表的薬剤として汎用されているが、これらはタンパク質変性剤であり、細菌を死滅させる点においては即効性に欠けるものであった。また、抗菌剤としては、細胞壁合成阻害剤、タンパク質合成阻害剤、核酸代謝阻害剤、エネルギー代謝阻害剤、代謝拮抗剤等が例示されるが、抗菌剤としての作用の発揮には、いずれも細菌の増殖が関与しており、瞬時に効果を期待するという点では十分ではなかった。
【0003】
エチジウムモノアジド(3-amino-8-azido-5-ethyl-6-phenyl-phenanthridinium chloride:以下EMAと略記することがある)は、DNAに光ラベリングを行うために合成された臭化エチジウムを基本骨格とするアジド化合物である(非特許文献1)。また、EMAは、真核細胞のトポイソメラーゼポイズンとして知られており(非特許文献2)、核染色剤であるプロピジウムヨーダイドのような薬剤と同様に、細胞の生死判別剤として利用されていた(非特許文献3)。
【0004】
しかしながら、EMAが細胞の核酸をランダムに切断するという作用については従来より知られていなかった。
【非特許文献1】ヌクレイック・アシッズ・リサーチ(Nucleic Acids Res.)、第5巻、1978年、第4891−4903頁
【非特許文献2】バイオケミストリー(Biochemistry)、第36巻、第50号、1997年、第15884〜15891頁
【非特許文献3】アプライド・アンド・エンバイロメンタル・マイクロバイオロジー(Appl. Environ. Microbiol.)、第71巻、第2号、2005年、第1018〜1024頁
【発明の開示】
【発明が解決しようとする課題】
【0005】
本発明は、殺菌、消毒剤等の抗菌剤として有用な核酸分解剤を提供することを課題とする。
【課題を解決するための手段】
【0006】
本発明者らは、抗菌剤、特に細菌を死滅させる薬剤について鋭意検討を重ね、細菌の細胞壁を透過して、直接、細菌の核酸に作用し、当該核酸を切断する核酸分解剤に着目し、このような作用を有する物質について探索を行った結果、アジド化合物であるEMAが、生細菌の細胞壁を透過し、核酸を切断する効果を有することを見出し、本発明を完成させた。
【0007】
前記課題を解決する本発明の第一の発明は、エチジウムモノアジドを有効成分とする核酸分解剤である。
前記課題を解決する本発明の第二の発明は、第一の発明の核酸分解剤を含む抗菌剤である。
前記課題を解決する本発明の第三の発明は、核酸を含む試料にエチジウムモノアジドを添加する工程、および当該核酸を含む試料に可視光線を照射して試料中の核酸を分解する工程を含む、核酸を含む試料中の核酸を分解する方法である。
前記課題を解決する本発明の第四の発明は、細胞を含む試料にエチジウムモノアジドを添加する工程、および当該細胞を含む試料に可視光線を照射して細胞内の核酸を分解する工程を含む、細胞内の核酸を分解する方法である。
【発明の効果】
【0008】
本発明の核酸分解剤は、生細菌の細胞壁を透過する性質を有し、当該細菌の核酸を至る所で切断することが可能である。従って、本発明の核酸分解剤は、殺菌、消毒剤等の抗菌剤の有効成分として使用することができる。また、本発明の核酸分解剤は、研究分野にも好適に使用することができる。
【発明を実施するための最良の形態】
【0009】
次に、本発明の好ましい実施形態について詳細に説明する。ただし、本発明は以下の好ましい実施形態に限定されず、本発明の範囲内で自由に変更することができるものである。尚、本明細書において百分率は特に断りのない限り質量による表示である。
【0010】
本発明の核酸分解剤は、単離された核酸に直接作用してランダムに分解する効果を有するとともに、核酸を含む試料中に存在する核酸に対しても、有効成分であるEMAが試料中に浸透して直接作用し、それらの核酸をランダムに切断する効果を有する。
なお、本発明において、核酸にはDNA及びRNAが含まれる。本発明の核酸分解剤が対象とする核酸には、1本鎖DNA、2本鎖DNA、1本鎖RNA、及び2本鎖RNAが含まれる。本発明を適用する試料にはこれらのいずれが含まれていても良く、2種以上が含まれていても良い。また、本発明の核酸分解剤の対象としては、例えば、染色体DNA及びプラスミドDNA、並びにrRNA、mRNA及びtRNA等が挙げられる。
【0011】
核酸を含む試料としては、全ての生物細胞、例えば、原核細胞(バクテリア)や真核細胞等(原生生物、真菌、植物、動物等)、ウイルス等が挙げられるが、バクテリアや真菌、ウイルス等が特に好ましい。
【0012】
本発明の核酸分解剤は、バクテリアや真菌、ウイルス等に作用させた場合、細胞内の核酸を直接分解する作用により、それらのバクテリアや真菌、ウイルス等の増殖を停止させ、死滅させる効果を有する。従って、例えば、本発明の核酸分解剤は、環境微生物に対する抗菌剤若しくは殺菌・消毒剤等、又は抗ウイルス剤等として使用することができる。
【0013】
本発明の抗菌剤が対象とする環境微生物は特に限定されないが、例としてバクテリア及び真菌類が挙げられる。バクテリアにはグラム陽性菌及びグラム陰性菌のいずれもが含まれる。グラム陽性菌としては、ブドウ球菌(スタフィロコッカス・エピダーミディス(Staphylococcus epidermidis))等のスタフィロコッカス属細菌、ストレプトコッカス属細菌、リステリア属細菌、バチルス属細菌、マイコバクテリウム属細菌、クロストリジウム属細菌等が挙げられる。また、グラム陰性菌としては、エシェリヒア・コリ(Escherichia coli)等のエシェリヒア属細菌、エンテロバクター属細菌に代表される腸内細菌群、サルモネラ属細菌、ビブリオ属細菌、シュードモナス属細菌、レジオネラ属細菌、カンピロバクター属細菌等が挙げられる。
【0014】
本発明の抗菌剤が対象とする真菌類は特に限定されないが、カンジダ属細菌、アスペルギルス属細菌、サッカロマイセス属細菌、ペニシリウム属細菌等が挙げられる。
【0015】
本発明の有効成分である、エチジウムモノアジド(3-amino-8-azido-5-ethyl-6-phenyl
-phenanthridinium chloride:EMA)は、化学式(1)で示される化合物である。エチジウムモノアジドは市販のものを使用することが可能である。
【化1】

【0016】
本発明の核酸分解剤の使用量は、細胞外、又は細胞内のいずれの核酸を分解するかに応じて、また、分解する核酸の量に応じて適宜選択することが可能である。また、使用時に核酸分解剤中に含まれるEMA量としては、1μg/ml〜1000μg/ml、好ましくは、10μg/ml〜1000μg/ml、特に好ましくは、100μg/ml〜1000μg/mlの濃度が挙げられる。このような濃度の核酸分解剤を対象に作用させることによって、効果的に核酸を分解することが可能である。
なお、本発明の核酸分解剤は液体であっても、EMAそのものであっても良く、使用時に適宜希釈、溶解すればよい。
【0017】
また、本発明の核酸分解剤は抗菌剤としても使用可能である。本発明の核酸分解剤を抗菌剤として使用する場合も、核酸分解剤と同様である。
【0018】
また、核酸を分解させる際には、可視光線を照射する。照射する可視光線の波長は、380nm〜800nm、好ましくは450nm〜600nmである。また、可視光線は単波長であっても良く、前記範囲に分布する混合光であってもよい。また、上記範囲外の波長の光を含んでいてもよい。なお、照射の際は、対象となる試料に対して十分量照射が可能であれば、光源から試料までの距離は適宜選択することが可能である。
【0019】
なお、本発明の核酸分解剤または抗菌剤の対象を、太陽光など自然光の照射下に置くことによっても、可視光線を照射することができる。
【0020】
また、本発明の核酸分解剤は、例えば、0.5〜100W/cm2の光強度で照射した場合、5分〜1時間程度、好ましくは5〜30分程度で十分に核酸分解効果を発揮させることができる。
例えば、500Wのハロゲン電球を20cmの距離から照射する場合、照射時間は5分〜1時間程度、好ましくは5〜30分で十分に核酸分解効果を発揮させることが可能である。
【0021】
本発明の核酸分解剤の効果は、核酸分解剤の添加及び可視光線照射処理の前後における核酸を電気泳動し、それらを比較することによって評価することができる。また、菌に対して適用した際には、生菌数を測定することによっても間接的に評価することができる。
【0022】
本発明の核酸分解剤は、単独で使用してもよく、他の成分と併用してもよい。他の成分としては、公知の核酸分解剤、例えばDNAやRNAに対するエキソヌクレアーゼや制限酵素類等のエンドヌクレアーゼ等が挙げられ、これらと併用することによってさらに核酸
分解効果を高めることができる。
【0023】
本発明の抗菌剤の使用形態は特に限定されないが、例えば、溶液中に添加して使用してもよく、適宜希釈した溶液を散布してもよい。また、本発明の抗菌剤の剤型は、用途、使用形態等に応じて適宜選択することができ、特に限定されないが、例えば、液剤、粒剤、錠剤等が挙げられる。
【0024】
また、本発明の抗菌剤は、単独で使用してもよく、他の成分と併用してもよい。他の成分としては、公知の抗菌剤や殺菌剤、例えば、抗生物質、エタノールやイソプロピルアルコール等のアルコール類、フェノールやクレゾール、ハロゲン化合物(塩素、ヨード等)や過酸化物(オゾン、過酸化水素等)等の酸化剤、重金属化合物等が挙げられ、これらと併用することによりさらに抗菌効果を高めることができる。
【0025】
本発明の抗菌剤は、例えば、器具等の消毒、壁面や床面等の消毒に好適に用いることができる。また、本発明の抗菌剤を室内空間に散布することにより、ヒトへ感染した場合に重篤化の恐れが高い細菌類(病原性大腸菌、結核菌、ボツリヌス菌、炭疽菌等)の殺菌に極めて有用である。
【0026】
本発明の抗菌剤は、細胞内の核酸に直接作用して分解させることが可能であることから、菌における耐性に対する問題を殆ど考慮する必要が無い点で、公知の抗菌剤に比して優れた抗菌活性を有し、また、広い抗菌スペクトルを有する。
【0027】
次に実施例を示して本発明を更に詳細に説明するが、本発明は以下の実施例に限定されるものではない。
【実施例1】
【0028】
インビトロにおけるEMAが大腸菌染色体DNA、およびrRNA等の核酸に及ぼす影響を調べるために行った。
(1)試験方法
1.0×106CFU/mlの大腸菌E.coli/DH5α株の生菌懸濁液1mlについて冷却遠心処理を行ない、上清を除いたペレットに、0.5mlの10mMトリス-塩酸緩衝溶液(pH8.0)を添加し、1250U/mlプロテイナーゼK溶液を10μl、および10%SDS溶液を200μl添加後、50℃にて、一晩、溶菌操作を行った。
【0029】
その後、各処理液を2ml用マイクロチューブ2本に半量ずつ分注し、それぞれに飽和フェノール溶液0.5mlを添加して15分間穏やかに混合した後、クロロホルムを0.5ml添加して5分間穏やかに混合した。次いで、6,000×g、4℃で10分間冷却遠心分離を行い、上層の水層部分を新しく用意した2ml容マイクロチューブに移し、3M酢酸ナトリウム(pH5.2)を70μl、および99.5%冷エタノール1.21mlをそれぞれ添加して穏やかに混合した。次いで、15,000×g、4℃で10分間冷却遠心分離を行い、上清を除去した後、70%冷エタノールを0.4ml添加して、ペレット(沈殿物)を洗浄した(以下、上記一連の操作をフェノール/クロロホルム抽出と略記することがある。)。その後、ペレットに10mMトリス−塩酸緩衝液(pH8.0)+1mM EDTA・2Na溶液(TEバッファー)を0.5ml添加し、4℃にて一晩放置して核酸を溶解した。精製核酸溶液の濃度をUV260nmの吸光値(核酸50μg/mlをOD=1、セル長1cm:OD260)により評価した。
【0030】
調製した核酸溶液は滅菌水で175ng/μlに調整し、この核酸溶液をマイクロチューブに4μl分取し、それぞれにEMA水溶液(それぞれ0、0.02、0.2、2、2
0、200μg/ml)を4μl添加して、遮光下、4℃で1時間放置した。その後、サンプルから20cm離した状態で500Wのハロゲン電球(FLOOD PRF 100V 500W;岩崎電気、東京)の可視光線を20分間照射し、全量を0.7%アガロースゲルにより電気泳動した。分子量マーカーとしてλ-EcoT14 I digest(宝バイオ社製)を使用した。泳動後のゲルは1μg/ml臭化エチジウム溶液で染色し、UVトランスイルミネーターを用いてUV254nmで照射し、その映像をポラロイドフィルム667に記録した。コントロールとして無処理(EMA:0μg/ml、可視光未照射)の核酸溶液を用いて、同様に電気泳動した。
【0031】
(2)試験結果
本試験の結果を図1に示す。その結果、19,329bp付近の染色体DNA由来のバンドは、EMAの濃度が100ng/mlから1μg/mlにかけて徐々に減少し、10μg/mlの時点で顕著に消失することが確認され、EMAにより生菌(大腸菌)から単離した核酸中の染色体DNAが分解されることが明らかとなった。
また、EMAの濃度が1μg/mlで、rRNA(16SrRNA、23SrRNA)のバンド強度が減少し、10μg/ml以上において消失することが確認され、rRNAも分解されることが明らかとなった。
【実施例2】
【0032】
インビボにおけるEMAが大腸菌染色体DNA、およびrRNA等の核酸に及ぼす影響を調べるために行った。
(1)試験方法
EMAを滅菌水で溶解して1000μg/mlEMA溶液を調製し、これを0.2μmのフィルター(Minisart-plus; ザルトリウスAG社製)により無菌ろ過した。当該EMA溶液を用いて、1.0×106CFU/mlの大腸菌E.coli/DH5α株の生菌懸濁液1mlに対して、EMAの終濃度が0(未添加)、0.01、0.1、1、10、及び100μg/mlとなるように添加後、遮光下4℃、1時間放置した。
【0033】
その後、氷上で前記生菌懸濁液から20cm離した状態で、500Wのハロゲン電球(FLOOD PRF 100V 500W;岩崎電気、東京)の可視光線を20分間照射した。15,000×g、4℃、10分間で冷却遠心処理を行ない、上清を除き、核酸に共有結合しなかったEMAの可視光照射物が、水と反応してできた生成物(ヒドロキシアミノエチジウム)を除去した。ペレットに、0.5mlの10mMトリス−塩酸緩衝溶液(pH8.0)を添加し、1250U/mlプロテイナーゼK溶液を10μl、および10%SDS溶液を200μl添加後、50℃にて、一晩、溶菌操作を行った。
【0034】
各処理液を、2ml用マイクロチューブ2本に半量ずつ分注し、それぞれに飽和フェノール溶液0.5mlを添加して15分間穏やかに混合した後、クロロホルムを0.5ml添加して5分間穏やかに混合した。次いで、6,000×g、4℃で10分間冷却遠心分離を行い、上層の水層部分を新しく用意した2ml容マイクロチューブに移し、3M酢酸ナトリウム(pH5.2)を70μl、および99.5%冷エタノール1.21mlをそれぞれ添加して穏やかに混合した。次いで、15,000×g、4℃で10分間冷却遠心分離を行い、上清を除去した後、70%冷エタノールを0.4ml添加して、ペレット(沈殿物)を洗浄した(以下、上記一連の操作をフェノール/クロロホルム抽出と略記することがある。)。その後、ペレットに10mMトリス塩酸緩衝液+1mM EDTA・2Na溶液(TEバッファー)を0.5ml添加し、4℃にて一晩放置して核酸を溶解した。精製核酸溶液の濃度をUV260nmの吸光値(核酸50μg/mlをOD=1、セル長1cm:OD260)により評価し、精製核酸の純度をOD260/OD280により評価した。
【0035】
各核酸溶液を175ng/μlに調製し、それぞれ4μlを、0.7%アガロースゲルにて電気泳動した。分子量マーカーとしてλ-EcoT14 I digest(宝バイオ社製)を使用した。泳動後のゲルは1μg/ml臭化エチジウム溶液で染色し、UVトランスイルミネーターを用いてUV254nmで照射し、その映像をポラロイドフィルム667に記録した。コントロールとして、大腸菌生菌懸濁液の無処理(EMA 0μg/ml、可視光未照射)のものについて核酸抽出を行ったものを使用した。
【0036】
(2)試験結果
本試験の結果を図2に示す。その結果、19,329bp付近の染色体DNA由来のバンドは、EMAの濃度が10μg/mlから徐々に減少し、100μg/mlの時点で顕著に消失することが確認され、EMAにより生菌(大腸菌)内に存在する染色体DNAが分解されることが明らかとなった。
また、EMAの濃度が10μg/mlで、rRNA(16SrRNA、23SrRNA)のバンド強度が減少し、生菌(大腸菌)内のrRNAも分解されることが明らかとなった。
【実施例3】
【0037】
EMAによる生菌に対する抗菌効果を調べるために行った。
(1)試験方法
エチジウムモノアジド(EMA)を滅菌水で溶解して1000μg/mlEMA溶液を調製し、これを0.2μmのフィルター(Minisart-plus; ザルトリウスAG社製)により無菌ろ過した。当該EMA溶液を用いて、1.0×106CFU/mlの大腸菌E.coli/DH5α株の生菌懸濁液1mlに対して、EMAの終濃度が0(未添加)、0.01、0.1、1、10、及び100μg/mlとなるように添加後、遮光下4℃、1時間放置した。
【0038】
その後、氷上で前記生菌懸濁液から20cm離した状態で、500Wのハロゲン電球(FLOOD PRF 100V 500W;岩崎電気、東京)の可視光線を20分間照射した。15,000×g、4℃、10分間冷却遠心処理を行ない、上清を除き、核酸に共有結合しなかったEMAの可視光照射物が、水と反応してできた生成物(ヒドロキシアミノエチジウム)を除去した。ペレットに同量の生理食塩水を注いだ後、段階希釈を行ないL寒天平板培地を用いて37℃、24時間培養により生菌数を測定した。
【0039】
(2)試験結果
EMAによる抗菌効果を、用量反応曲線として図3に示す。その結果、大腸菌にEMAを10μg/mlの濃度で反応させた場合に、初発生菌数と比較して、生菌数が102 CFU/mlのオーダーで低減し、100μg/mlの濃度で反応させた場合に、初発生菌数に比して生菌数は105CFU/mlのオーダーで低減させることが可能であることが確認された。
すなわち、EMAは大腸菌(生菌)に対して抗菌効果を有することが明らかとなった。
【実施例4】
【0040】
インビトロにおけるEMAが大腸菌染色体DNAに及ぼす影響を、電子顕微鏡で観察するために行った。
(1)試験方法
前記実施例1と同様の方法により、核酸を抽出した後、滅菌水9mlに核酸を溶解した。調製した核酸溶液を32ml蔗糖密度勾配(16mlの10%蔗糖溶液と16mlの40%蔗糖溶液を使用)の上端に静かにロードし、スイングローター(日立工機社製:RPS-27-2)を用いて、20℃において26,000rpmで18時間の超遠心処理を行った。遠心処理後、蔗糖密度勾配溶液の底に穴を空け、1mlずつ分画した。
【0041】
その後、各分画液に対し、10%(vol/vol)となるように3M酢酸ナトリウム溶液(pH5.2)を添加し、更に2倍量の99.5%エタノールを添加した。次いで、4℃において15,000×gで10分間冷却遠心処理を行ってペレットを回収し、このペレットを70%エタノールで洗浄後、滅菌水100μlで溶解した。
【0042】
各分画液から得られたサンプルのうち、アガロースゲル電気泳動で、48kbpの長い染色体DNAのみを含むサンプルについて、さらに滅菌水を用いてDNA濃度が175ng/μlとなるように調製し、当該DNA溶液4μlに対して、EMA水溶液(0、0.02、2、20μg/ml)を4μl添加し、遮光下で、4℃、1時間放置した。その後、氷上で前記の500Wハロゲン電球の可視光線を20分間照射した。
【0043】
前記可視光照射後のDNA溶液(8μl)について、滅菌水を用いて5倍希釈(32μl添加)した。0.02%チトクロームC溶液1μlを、8%ホルムアルデヒド溶液5μlに添加し、この全量を、先ほどのDNA溶液40μlに混合し、10分間室温にて放置した。その後、チトクロームC膜をピンセットで採取し、90%エタノールで脱水処理を行った。次いで、0.5mM酢酸ウラニウム/0.5mM塩酸/90%エタノール溶液で染色後、90%エタノール、およびイソペンタンで脱水処理した。
電子顕微鏡で観察する際、シャドウイングを白金−パラジウム粉末で行い、電子顕微鏡(日本電子社製、JEOL T-2000 EX)にて写真撮影を行った。
【0044】
(2)試験結果
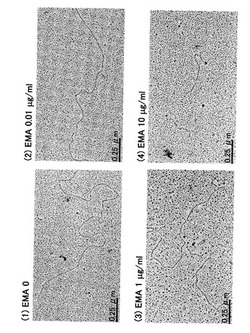
本試験の結果を図4に示す。図4は大腸菌の染色体DNAについて、EMAを0〜10μg/mlの濃度で作用させ、可視光照射(500Wハロゲン電球、20分間)後に電子顕微鏡下で観察した結果を示している。その結果、EMAを0〜0.01μg/mlで反応させても染色体DNAが切断されるという影響は観察されなかったが、1μg/ml以上で反応させることによって、染色体DNAの切断現象が確認された。この結果は、実施例1における結果とも対応し、EMAによる染色体DNAの切断現象が視覚的に確認された。
【産業上の利用可能性】
【0045】
本発明の核酸分解剤は、生細菌の細胞壁を透過する性質を有し、当該細菌の染色体DNAやRNA等をランダムに切断することが可能であることから、細菌学及び生化学分野において、環境微生物に対する抗菌剤、特に殺菌・消毒剤として極めて有用である。
【図面の簡単な説明】
【0046】
【図1】インビトロにおけるEMAが大腸菌染色体DNAおよびrRNA等に及ぼす影響を示す電気泳動写真である。Mは分子量マーカー(λ/EcoT14 I digest)を表す。IR(-)は可視光照射無し、IRは可視光照射(500Wハロゲン電球、20分)を表す。E0−100 nまたはμの数値はEMAの終濃度(0-100 ng/mlまたはμg/ml)を表す。
【図2】インビボにおけるEMAが大腸菌染色体DNAおよびrRNA等に及ぼす影響を示す電気泳動写真である。Mは分子量マーカー(λ/EcoT14 I digest)を表す。IR(-)は可視光照射無し、IRは可視光照射(500Wハロゲン電球、20分)を表す。E0−100 nまたはμの数値はEMAの終濃度(0-100 ng/mlまたはμg/ml)を表す。
【図3】EMAによる抗菌効果及び用量反応曲線である。X軸はEMAの終濃度 (μg/ml)を示す。Y軸は各EMA処理区における生菌数(CFU/ml)の初発生菌数に対する減少を常用対数によって表示している。
【図4】大腸菌E. coli DH5α染色体DNAをEMA及び可視光照射処理(500Wハロゲン電球、20分)し、電子顕微鏡下で観察した結果を示す写真である。EMAの終濃度は、(1)0、(2)0.01μg/ml、(3)1μg/ml、及び(4)10μg/mlである。
【技術分野】
【0001】
本発明は、エチジウムモノアジド(エチジウムモノアザイドとも呼ぶ)を有効成分とする核酸分解剤、および細胞を含む試料にエチジウムモノアジドを添加し、当該細胞を含む試料に可視光線を照射して細胞内の核酸を分解する工程を含む、細胞の核酸を分解する方法である。
【背景技術】
【0002】
従来、殺菌・消毒剤としては、アルコールやクレゾール、酸化剤等が代表的薬剤として汎用されているが、これらはタンパク質変性剤であり、細菌を死滅させる点においては即効性に欠けるものであった。また、抗菌剤としては、細胞壁合成阻害剤、タンパク質合成阻害剤、核酸代謝阻害剤、エネルギー代謝阻害剤、代謝拮抗剤等が例示されるが、抗菌剤としての作用の発揮には、いずれも細菌の増殖が関与しており、瞬時に効果を期待するという点では十分ではなかった。
【0003】
エチジウムモノアジド(3-amino-8-azido-5-ethyl-6-phenyl-phenanthridinium chloride:以下EMAと略記することがある)は、DNAに光ラベリングを行うために合成された臭化エチジウムを基本骨格とするアジド化合物である(非特許文献1)。また、EMAは、真核細胞のトポイソメラーゼポイズンとして知られており(非特許文献2)、核染色剤であるプロピジウムヨーダイドのような薬剤と同様に、細胞の生死判別剤として利用されていた(非特許文献3)。
【0004】
しかしながら、EMAが細胞の核酸をランダムに切断するという作用については従来より知られていなかった。
【非特許文献1】ヌクレイック・アシッズ・リサーチ(Nucleic Acids Res.)、第5巻、1978年、第4891−4903頁
【非特許文献2】バイオケミストリー(Biochemistry)、第36巻、第50号、1997年、第15884〜15891頁
【非特許文献3】アプライド・アンド・エンバイロメンタル・マイクロバイオロジー(Appl. Environ. Microbiol.)、第71巻、第2号、2005年、第1018〜1024頁
【発明の開示】
【発明が解決しようとする課題】
【0005】
本発明は、殺菌、消毒剤等の抗菌剤として有用な核酸分解剤を提供することを課題とする。
【課題を解決するための手段】
【0006】
本発明者らは、抗菌剤、特に細菌を死滅させる薬剤について鋭意検討を重ね、細菌の細胞壁を透過して、直接、細菌の核酸に作用し、当該核酸を切断する核酸分解剤に着目し、このような作用を有する物質について探索を行った結果、アジド化合物であるEMAが、生細菌の細胞壁を透過し、核酸を切断する効果を有することを見出し、本発明を完成させた。
【0007】
前記課題を解決する本発明の第一の発明は、エチジウムモノアジドを有効成分とする核酸分解剤である。
前記課題を解決する本発明の第二の発明は、第一の発明の核酸分解剤を含む抗菌剤である。
前記課題を解決する本発明の第三の発明は、核酸を含む試料にエチジウムモノアジドを添加する工程、および当該核酸を含む試料に可視光線を照射して試料中の核酸を分解する工程を含む、核酸を含む試料中の核酸を分解する方法である。
前記課題を解決する本発明の第四の発明は、細胞を含む試料にエチジウムモノアジドを添加する工程、および当該細胞を含む試料に可視光線を照射して細胞内の核酸を分解する工程を含む、細胞内の核酸を分解する方法である。
【発明の効果】
【0008】
本発明の核酸分解剤は、生細菌の細胞壁を透過する性質を有し、当該細菌の核酸を至る所で切断することが可能である。従って、本発明の核酸分解剤は、殺菌、消毒剤等の抗菌剤の有効成分として使用することができる。また、本発明の核酸分解剤は、研究分野にも好適に使用することができる。
【発明を実施するための最良の形態】
【0009】
次に、本発明の好ましい実施形態について詳細に説明する。ただし、本発明は以下の好ましい実施形態に限定されず、本発明の範囲内で自由に変更することができるものである。尚、本明細書において百分率は特に断りのない限り質量による表示である。
【0010】
本発明の核酸分解剤は、単離された核酸に直接作用してランダムに分解する効果を有するとともに、核酸を含む試料中に存在する核酸に対しても、有効成分であるEMAが試料中に浸透して直接作用し、それらの核酸をランダムに切断する効果を有する。
なお、本発明において、核酸にはDNA及びRNAが含まれる。本発明の核酸分解剤が対象とする核酸には、1本鎖DNA、2本鎖DNA、1本鎖RNA、及び2本鎖RNAが含まれる。本発明を適用する試料にはこれらのいずれが含まれていても良く、2種以上が含まれていても良い。また、本発明の核酸分解剤の対象としては、例えば、染色体DNA及びプラスミドDNA、並びにrRNA、mRNA及びtRNA等が挙げられる。
【0011】
核酸を含む試料としては、全ての生物細胞、例えば、原核細胞(バクテリア)や真核細胞等(原生生物、真菌、植物、動物等)、ウイルス等が挙げられるが、バクテリアや真菌、ウイルス等が特に好ましい。
【0012】
本発明の核酸分解剤は、バクテリアや真菌、ウイルス等に作用させた場合、細胞内の核酸を直接分解する作用により、それらのバクテリアや真菌、ウイルス等の増殖を停止させ、死滅させる効果を有する。従って、例えば、本発明の核酸分解剤は、環境微生物に対する抗菌剤若しくは殺菌・消毒剤等、又は抗ウイルス剤等として使用することができる。
【0013】
本発明の抗菌剤が対象とする環境微生物は特に限定されないが、例としてバクテリア及び真菌類が挙げられる。バクテリアにはグラム陽性菌及びグラム陰性菌のいずれもが含まれる。グラム陽性菌としては、ブドウ球菌(スタフィロコッカス・エピダーミディス(Staphylococcus epidermidis))等のスタフィロコッカス属細菌、ストレプトコッカス属細菌、リステリア属細菌、バチルス属細菌、マイコバクテリウム属細菌、クロストリジウム属細菌等が挙げられる。また、グラム陰性菌としては、エシェリヒア・コリ(Escherichia coli)等のエシェリヒア属細菌、エンテロバクター属細菌に代表される腸内細菌群、サルモネラ属細菌、ビブリオ属細菌、シュードモナス属細菌、レジオネラ属細菌、カンピロバクター属細菌等が挙げられる。
【0014】
本発明の抗菌剤が対象とする真菌類は特に限定されないが、カンジダ属細菌、アスペルギルス属細菌、サッカロマイセス属細菌、ペニシリウム属細菌等が挙げられる。
【0015】
本発明の有効成分である、エチジウムモノアジド(3-amino-8-azido-5-ethyl-6-phenyl
-phenanthridinium chloride:EMA)は、化学式(1)で示される化合物である。エチジウムモノアジドは市販のものを使用することが可能である。
【化1】

【0016】
本発明の核酸分解剤の使用量は、細胞外、又は細胞内のいずれの核酸を分解するかに応じて、また、分解する核酸の量に応じて適宜選択することが可能である。また、使用時に核酸分解剤中に含まれるEMA量としては、1μg/ml〜1000μg/ml、好ましくは、10μg/ml〜1000μg/ml、特に好ましくは、100μg/ml〜1000μg/mlの濃度が挙げられる。このような濃度の核酸分解剤を対象に作用させることによって、効果的に核酸を分解することが可能である。
なお、本発明の核酸分解剤は液体であっても、EMAそのものであっても良く、使用時に適宜希釈、溶解すればよい。
【0017】
また、本発明の核酸分解剤は抗菌剤としても使用可能である。本発明の核酸分解剤を抗菌剤として使用する場合も、核酸分解剤と同様である。
【0018】
また、核酸を分解させる際には、可視光線を照射する。照射する可視光線の波長は、380nm〜800nm、好ましくは450nm〜600nmである。また、可視光線は単波長であっても良く、前記範囲に分布する混合光であってもよい。また、上記範囲外の波長の光を含んでいてもよい。なお、照射の際は、対象となる試料に対して十分量照射が可能であれば、光源から試料までの距離は適宜選択することが可能である。
【0019】
なお、本発明の核酸分解剤または抗菌剤の対象を、太陽光など自然光の照射下に置くことによっても、可視光線を照射することができる。
【0020】
また、本発明の核酸分解剤は、例えば、0.5〜100W/cm2の光強度で照射した場合、5分〜1時間程度、好ましくは5〜30分程度で十分に核酸分解効果を発揮させることができる。
例えば、500Wのハロゲン電球を20cmの距離から照射する場合、照射時間は5分〜1時間程度、好ましくは5〜30分で十分に核酸分解効果を発揮させることが可能である。
【0021】
本発明の核酸分解剤の効果は、核酸分解剤の添加及び可視光線照射処理の前後における核酸を電気泳動し、それらを比較することによって評価することができる。また、菌に対して適用した際には、生菌数を測定することによっても間接的に評価することができる。
【0022】
本発明の核酸分解剤は、単独で使用してもよく、他の成分と併用してもよい。他の成分としては、公知の核酸分解剤、例えばDNAやRNAに対するエキソヌクレアーゼや制限酵素類等のエンドヌクレアーゼ等が挙げられ、これらと併用することによってさらに核酸
分解効果を高めることができる。
【0023】
本発明の抗菌剤の使用形態は特に限定されないが、例えば、溶液中に添加して使用してもよく、適宜希釈した溶液を散布してもよい。また、本発明の抗菌剤の剤型は、用途、使用形態等に応じて適宜選択することができ、特に限定されないが、例えば、液剤、粒剤、錠剤等が挙げられる。
【0024】
また、本発明の抗菌剤は、単独で使用してもよく、他の成分と併用してもよい。他の成分としては、公知の抗菌剤や殺菌剤、例えば、抗生物質、エタノールやイソプロピルアルコール等のアルコール類、フェノールやクレゾール、ハロゲン化合物(塩素、ヨード等)や過酸化物(オゾン、過酸化水素等)等の酸化剤、重金属化合物等が挙げられ、これらと併用することによりさらに抗菌効果を高めることができる。
【0025】
本発明の抗菌剤は、例えば、器具等の消毒、壁面や床面等の消毒に好適に用いることができる。また、本発明の抗菌剤を室内空間に散布することにより、ヒトへ感染した場合に重篤化の恐れが高い細菌類(病原性大腸菌、結核菌、ボツリヌス菌、炭疽菌等)の殺菌に極めて有用である。
【0026】
本発明の抗菌剤は、細胞内の核酸に直接作用して分解させることが可能であることから、菌における耐性に対する問題を殆ど考慮する必要が無い点で、公知の抗菌剤に比して優れた抗菌活性を有し、また、広い抗菌スペクトルを有する。
【0027】
次に実施例を示して本発明を更に詳細に説明するが、本発明は以下の実施例に限定されるものではない。
【実施例1】
【0028】
インビトロにおけるEMAが大腸菌染色体DNA、およびrRNA等の核酸に及ぼす影響を調べるために行った。
(1)試験方法
1.0×106CFU/mlの大腸菌E.coli/DH5α株の生菌懸濁液1mlについて冷却遠心処理を行ない、上清を除いたペレットに、0.5mlの10mMトリス-塩酸緩衝溶液(pH8.0)を添加し、1250U/mlプロテイナーゼK溶液を10μl、および10%SDS溶液を200μl添加後、50℃にて、一晩、溶菌操作を行った。
【0029】
その後、各処理液を2ml用マイクロチューブ2本に半量ずつ分注し、それぞれに飽和フェノール溶液0.5mlを添加して15分間穏やかに混合した後、クロロホルムを0.5ml添加して5分間穏やかに混合した。次いで、6,000×g、4℃で10分間冷却遠心分離を行い、上層の水層部分を新しく用意した2ml容マイクロチューブに移し、3M酢酸ナトリウム(pH5.2)を70μl、および99.5%冷エタノール1.21mlをそれぞれ添加して穏やかに混合した。次いで、15,000×g、4℃で10分間冷却遠心分離を行い、上清を除去した後、70%冷エタノールを0.4ml添加して、ペレット(沈殿物)を洗浄した(以下、上記一連の操作をフェノール/クロロホルム抽出と略記することがある。)。その後、ペレットに10mMトリス−塩酸緩衝液(pH8.0)+1mM EDTA・2Na溶液(TEバッファー)を0.5ml添加し、4℃にて一晩放置して核酸を溶解した。精製核酸溶液の濃度をUV260nmの吸光値(核酸50μg/mlをOD=1、セル長1cm:OD260)により評価した。
【0030】
調製した核酸溶液は滅菌水で175ng/μlに調整し、この核酸溶液をマイクロチューブに4μl分取し、それぞれにEMA水溶液(それぞれ0、0.02、0.2、2、2
0、200μg/ml)を4μl添加して、遮光下、4℃で1時間放置した。その後、サンプルから20cm離した状態で500Wのハロゲン電球(FLOOD PRF 100V 500W;岩崎電気、東京)の可視光線を20分間照射し、全量を0.7%アガロースゲルにより電気泳動した。分子量マーカーとしてλ-EcoT14 I digest(宝バイオ社製)を使用した。泳動後のゲルは1μg/ml臭化エチジウム溶液で染色し、UVトランスイルミネーターを用いてUV254nmで照射し、その映像をポラロイドフィルム667に記録した。コントロールとして無処理(EMA:0μg/ml、可視光未照射)の核酸溶液を用いて、同様に電気泳動した。
【0031】
(2)試験結果
本試験の結果を図1に示す。その結果、19,329bp付近の染色体DNA由来のバンドは、EMAの濃度が100ng/mlから1μg/mlにかけて徐々に減少し、10μg/mlの時点で顕著に消失することが確認され、EMAにより生菌(大腸菌)から単離した核酸中の染色体DNAが分解されることが明らかとなった。
また、EMAの濃度が1μg/mlで、rRNA(16SrRNA、23SrRNA)のバンド強度が減少し、10μg/ml以上において消失することが確認され、rRNAも分解されることが明らかとなった。
【実施例2】
【0032】
インビボにおけるEMAが大腸菌染色体DNA、およびrRNA等の核酸に及ぼす影響を調べるために行った。
(1)試験方法
EMAを滅菌水で溶解して1000μg/mlEMA溶液を調製し、これを0.2μmのフィルター(Minisart-plus; ザルトリウスAG社製)により無菌ろ過した。当該EMA溶液を用いて、1.0×106CFU/mlの大腸菌E.coli/DH5α株の生菌懸濁液1mlに対して、EMAの終濃度が0(未添加)、0.01、0.1、1、10、及び100μg/mlとなるように添加後、遮光下4℃、1時間放置した。
【0033】
その後、氷上で前記生菌懸濁液から20cm離した状態で、500Wのハロゲン電球(FLOOD PRF 100V 500W;岩崎電気、東京)の可視光線を20分間照射した。15,000×g、4℃、10分間で冷却遠心処理を行ない、上清を除き、核酸に共有結合しなかったEMAの可視光照射物が、水と反応してできた生成物(ヒドロキシアミノエチジウム)を除去した。ペレットに、0.5mlの10mMトリス−塩酸緩衝溶液(pH8.0)を添加し、1250U/mlプロテイナーゼK溶液を10μl、および10%SDS溶液を200μl添加後、50℃にて、一晩、溶菌操作を行った。
【0034】
各処理液を、2ml用マイクロチューブ2本に半量ずつ分注し、それぞれに飽和フェノール溶液0.5mlを添加して15分間穏やかに混合した後、クロロホルムを0.5ml添加して5分間穏やかに混合した。次いで、6,000×g、4℃で10分間冷却遠心分離を行い、上層の水層部分を新しく用意した2ml容マイクロチューブに移し、3M酢酸ナトリウム(pH5.2)を70μl、および99.5%冷エタノール1.21mlをそれぞれ添加して穏やかに混合した。次いで、15,000×g、4℃で10分間冷却遠心分離を行い、上清を除去した後、70%冷エタノールを0.4ml添加して、ペレット(沈殿物)を洗浄した(以下、上記一連の操作をフェノール/クロロホルム抽出と略記することがある。)。その後、ペレットに10mMトリス塩酸緩衝液+1mM EDTA・2Na溶液(TEバッファー)を0.5ml添加し、4℃にて一晩放置して核酸を溶解した。精製核酸溶液の濃度をUV260nmの吸光値(核酸50μg/mlをOD=1、セル長1cm:OD260)により評価し、精製核酸の純度をOD260/OD280により評価した。
【0035】
各核酸溶液を175ng/μlに調製し、それぞれ4μlを、0.7%アガロースゲルにて電気泳動した。分子量マーカーとしてλ-EcoT14 I digest(宝バイオ社製)を使用した。泳動後のゲルは1μg/ml臭化エチジウム溶液で染色し、UVトランスイルミネーターを用いてUV254nmで照射し、その映像をポラロイドフィルム667に記録した。コントロールとして、大腸菌生菌懸濁液の無処理(EMA 0μg/ml、可視光未照射)のものについて核酸抽出を行ったものを使用した。
【0036】
(2)試験結果
本試験の結果を図2に示す。その結果、19,329bp付近の染色体DNA由来のバンドは、EMAの濃度が10μg/mlから徐々に減少し、100μg/mlの時点で顕著に消失することが確認され、EMAにより生菌(大腸菌)内に存在する染色体DNAが分解されることが明らかとなった。
また、EMAの濃度が10μg/mlで、rRNA(16SrRNA、23SrRNA)のバンド強度が減少し、生菌(大腸菌)内のrRNAも分解されることが明らかとなった。
【実施例3】
【0037】
EMAによる生菌に対する抗菌効果を調べるために行った。
(1)試験方法
エチジウムモノアジド(EMA)を滅菌水で溶解して1000μg/mlEMA溶液を調製し、これを0.2μmのフィルター(Minisart-plus; ザルトリウスAG社製)により無菌ろ過した。当該EMA溶液を用いて、1.0×106CFU/mlの大腸菌E.coli/DH5α株の生菌懸濁液1mlに対して、EMAの終濃度が0(未添加)、0.01、0.1、1、10、及び100μg/mlとなるように添加後、遮光下4℃、1時間放置した。
【0038】
その後、氷上で前記生菌懸濁液から20cm離した状態で、500Wのハロゲン電球(FLOOD PRF 100V 500W;岩崎電気、東京)の可視光線を20分間照射した。15,000×g、4℃、10分間冷却遠心処理を行ない、上清を除き、核酸に共有結合しなかったEMAの可視光照射物が、水と反応してできた生成物(ヒドロキシアミノエチジウム)を除去した。ペレットに同量の生理食塩水を注いだ後、段階希釈を行ないL寒天平板培地を用いて37℃、24時間培養により生菌数を測定した。
【0039】
(2)試験結果
EMAによる抗菌効果を、用量反応曲線として図3に示す。その結果、大腸菌にEMAを10μg/mlの濃度で反応させた場合に、初発生菌数と比較して、生菌数が102 CFU/mlのオーダーで低減し、100μg/mlの濃度で反応させた場合に、初発生菌数に比して生菌数は105CFU/mlのオーダーで低減させることが可能であることが確認された。
すなわち、EMAは大腸菌(生菌)に対して抗菌効果を有することが明らかとなった。
【実施例4】
【0040】
インビトロにおけるEMAが大腸菌染色体DNAに及ぼす影響を、電子顕微鏡で観察するために行った。
(1)試験方法
前記実施例1と同様の方法により、核酸を抽出した後、滅菌水9mlに核酸を溶解した。調製した核酸溶液を32ml蔗糖密度勾配(16mlの10%蔗糖溶液と16mlの40%蔗糖溶液を使用)の上端に静かにロードし、スイングローター(日立工機社製:RPS-27-2)を用いて、20℃において26,000rpmで18時間の超遠心処理を行った。遠心処理後、蔗糖密度勾配溶液の底に穴を空け、1mlずつ分画した。
【0041】
その後、各分画液に対し、10%(vol/vol)となるように3M酢酸ナトリウム溶液(pH5.2)を添加し、更に2倍量の99.5%エタノールを添加した。次いで、4℃において15,000×gで10分間冷却遠心処理を行ってペレットを回収し、このペレットを70%エタノールで洗浄後、滅菌水100μlで溶解した。
【0042】
各分画液から得られたサンプルのうち、アガロースゲル電気泳動で、48kbpの長い染色体DNAのみを含むサンプルについて、さらに滅菌水を用いてDNA濃度が175ng/μlとなるように調製し、当該DNA溶液4μlに対して、EMA水溶液(0、0.02、2、20μg/ml)を4μl添加し、遮光下で、4℃、1時間放置した。その後、氷上で前記の500Wハロゲン電球の可視光線を20分間照射した。
【0043】
前記可視光照射後のDNA溶液(8μl)について、滅菌水を用いて5倍希釈(32μl添加)した。0.02%チトクロームC溶液1μlを、8%ホルムアルデヒド溶液5μlに添加し、この全量を、先ほどのDNA溶液40μlに混合し、10分間室温にて放置した。その後、チトクロームC膜をピンセットで採取し、90%エタノールで脱水処理を行った。次いで、0.5mM酢酸ウラニウム/0.5mM塩酸/90%エタノール溶液で染色後、90%エタノール、およびイソペンタンで脱水処理した。
電子顕微鏡で観察する際、シャドウイングを白金−パラジウム粉末で行い、電子顕微鏡(日本電子社製、JEOL T-2000 EX)にて写真撮影を行った。
【0044】
(2)試験結果
本試験の結果を図4に示す。図4は大腸菌の染色体DNAについて、EMAを0〜10μg/mlの濃度で作用させ、可視光照射(500Wハロゲン電球、20分間)後に電子顕微鏡下で観察した結果を示している。その結果、EMAを0〜0.01μg/mlで反応させても染色体DNAが切断されるという影響は観察されなかったが、1μg/ml以上で反応させることによって、染色体DNAの切断現象が確認された。この結果は、実施例1における結果とも対応し、EMAによる染色体DNAの切断現象が視覚的に確認された。
【産業上の利用可能性】
【0045】
本発明の核酸分解剤は、生細菌の細胞壁を透過する性質を有し、当該細菌の染色体DNAやRNA等をランダムに切断することが可能であることから、細菌学及び生化学分野において、環境微生物に対する抗菌剤、特に殺菌・消毒剤として極めて有用である。
【図面の簡単な説明】
【0046】
【図1】インビトロにおけるEMAが大腸菌染色体DNAおよびrRNA等に及ぼす影響を示す電気泳動写真である。Mは分子量マーカー(λ/EcoT14 I digest)を表す。IR(-)は可視光照射無し、IRは可視光照射(500Wハロゲン電球、20分)を表す。E0−100 nまたはμの数値はEMAの終濃度(0-100 ng/mlまたはμg/ml)を表す。
【図2】インビボにおけるEMAが大腸菌染色体DNAおよびrRNA等に及ぼす影響を示す電気泳動写真である。Mは分子量マーカー(λ/EcoT14 I digest)を表す。IR(-)は可視光照射無し、IRは可視光照射(500Wハロゲン電球、20分)を表す。E0−100 nまたはμの数値はEMAの終濃度(0-100 ng/mlまたはμg/ml)を表す。
【図3】EMAによる抗菌効果及び用量反応曲線である。X軸はEMAの終濃度 (μg/ml)を示す。Y軸は各EMA処理区における生菌数(CFU/ml)の初発生菌数に対する減少を常用対数によって表示している。
【図4】大腸菌E. coli DH5α染色体DNAをEMA及び可視光照射処理(500Wハロゲン電球、20分)し、電子顕微鏡下で観察した結果を示す写真である。EMAの終濃度は、(1)0、(2)0.01μg/ml、(3)1μg/ml、及び(4)10μg/mlである。
【特許請求の範囲】
【請求項1】
エチジウムモノアジドを有効成分とする核酸分解剤。
【請求項2】
請求項1に記載の核酸分解剤を含む抗菌剤。
【請求項3】
核酸を含む試料にエチジウムモノアジドを添加する工程、および当該核酸を含む試料に可視光線を照射して試料中の核酸を分解する工程を含む、核酸を含む試料中の核酸を分解する方法。
【請求項4】
細胞を含む試料にエチジウムモノアジドを添加する工程、および当該細胞を含む試料に可視光線を照射して細胞内の核酸を分解する工程を含む、細胞内の核酸を分解する方法。
【請求項1】
エチジウムモノアジドを有効成分とする核酸分解剤。
【請求項2】
請求項1に記載の核酸分解剤を含む抗菌剤。
【請求項3】
核酸を含む試料にエチジウムモノアジドを添加する工程、および当該核酸を含む試料に可視光線を照射して試料中の核酸を分解する工程を含む、核酸を含む試料中の核酸を分解する方法。
【請求項4】
細胞を含む試料にエチジウムモノアジドを添加する工程、および当該細胞を含む試料に可視光線を照射して細胞内の核酸を分解する工程を含む、細胞内の核酸を分解する方法。
【図1】


【図2】


【図3】


【図4】




【図2】


【図3】


【図4】


【公開番号】特開2008−137962(P2008−137962A)
【公開日】平成20年6月19日(2008.6.19)
【国際特許分類】
【出願番号】特願2006−326825(P2006−326825)
【出願日】平成18年12月4日(2006.12.4)
【公序良俗違反の表示】
(特許庁注:以下のものは登録商標)
1.ポラロイド
【出願人】(504145342)国立大学法人九州大学 (960)
【出願人】(000006127)森永乳業株式会社 (269)
【Fターム(参考)】
【公開日】平成20年6月19日(2008.6.19)
【国際特許分類】
【出願日】平成18年12月4日(2006.12.4)
【公序良俗違反の表示】
(特許庁注:以下のものは登録商標)
1.ポラロイド
【出願人】(504145342)国立大学法人九州大学 (960)
【出願人】(000006127)森永乳業株式会社 (269)
【Fターム(参考)】
[ Back to top ]

