核酸分離用担体、マイクロ流路系及び核酸分離装置、並びに核酸分離方法、捕捉鎖の固相化方法。
【課題】核酸分離用担体が充填されたマイクロ流路において、標的とする核酸鎖を効率良く分離するための技術を提供すること。
【解決手段】多孔質担体表面に導入されたスルホン基と、標的核酸鎖に相補的な塩基配列を有する捕捉鎖のアミノ基とが、スルホンアミド結合により固相化した核酸分離用担体。
【解決手段】多孔質担体表面に導入されたスルホン基と、標的核酸鎖に相補的な塩基配列を有する捕捉鎖のアミノ基とが、スルホンアミド結合により固相化した核酸分離用担体。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、核酸分離用担体、マイクロ流路系及び核酸分離装置、並びに核酸分離方法、捕捉鎖の固相化方法に関する。より詳しくは、スルホンアミド結合により捕捉鎖を固相化した多孔質担体を用いた核酸分離用担体等に関する。
【背景技術】
【0002】
近年、遺伝子の変異解析、SNPs(一塩基多型)分析、遺伝子発現頻度解析、遺伝子ネットワーク解明等に利用され得るバイオアッセイ技術の開発が進んでいる。例えば、いわゆるDNAチップ又はDNAマイクロアレイ(以下、「DNAチップ」と総称する)と呼ばれる集積基板を用いた方法が挙げられる。
【0003】
このDNAチップやタンパク質を集積したプロテインチップ等に代表されるようなセンターチップ技術は、標準物質と検出物質との間の特異的な相互作用を利用して、サンプル中の標的物質を分離・検出し、その含有量を調べる方法である。
【0004】
最近では、流路やキャピラリーを利用して、標準物質と検出用物質とを相互作用させる技術が提案されている。また、物質間相互作用の応用として、核酸間のハイブリダイゼーション反応を、流路や細管内で進行させる技術も提案されている。
例えば、特許文献1には、ポリヌクレオチドの増幅幅を行う部分と、検出用オリゴヌクレオチドが固定されている多孔質層を有するハイブリダイゼーション部分とが、流路によって連結されているポリヌクレオチドの分析用部材が開示されている。
また、特許文献2には、毛細管状の流路の内壁にプローブ化合物を固定して、被検ポリヌクレオチドとハイブリダイゼーションを進行させるポリヌクレオチドの分析方法が開示されている。
【0005】
このように流路やキャピラリー等の細い流路内において、物質間相互作用を進行させる場合、サンプル液等の送液に伴ない、流路の内圧が著しく上昇してしまうことが問題となる。特に、標的物質を核酸鎖とする場合には、細い流路内で核酸鎖のハイブリッド形成が進行することにより、流路の実質的体積が減少し、流路内圧が上昇することがある。また、標的核酸鎖以外の核酸鎖が流路内に非特異的に吸着すると、流路の目詰まりが生じ、流路内圧が上昇してしまう。
【0006】
流路内圧が上昇すると、配管系の継ぎ目等の圧力に弱い部分で送液する溶液の漏れを生じる。このような漏れによる溶液の損失(ロス)は、反応物質の量や濃度の低下を引き起こし、その結果期待する物質間相互作用が行われなくなるおそれが生じる。また、サンプル液等に有害物質を含む場合には、溶液の漏れによって安全性が低下するという問題があった。
【0007】
そこで、本発明者らは、特許文献3において、マイクロ流路内での根詰まりを防止し、内圧上昇を防止することが可能なマイクロ流路系を提供している。このマイクロ流路系は、表面にカチオン交換性のイオン交換基を有する多孔質担体に対し、標的核酸鎖に相補的な塩基配列を有し、正電荷を有する官能基が修飾された捕捉鎖を、イオン交換結合法か、イオン交換結合後に水分子を脱離させて共有結合を形成する脱水縮合により固相化された核酸分離用担体を充填している。
【先行技術文献】
【特許文献】
【0008】
【特許文献1】特開2005−130795号公報
【特許文献2】特開2004−309900号公報
【特許文献3】特開2009−268385号公報
【発明の概要】
【発明が解決しようとする課題】
【0009】
上記特許文献3に開示されているマイクロ流路系では、核酸分離用担体として多孔質担体を用いることで、流路内の内圧上昇を防止して高流量の送液を行うことができる。
【0010】
一方で、多孔質担体表面のカチオン交換性のイオン交換基と、捕捉鎖の正電荷を有する官能基とを、イオン交換結合法や、脱水縮合法により固相化した核酸分離用担体では、試料溶液中の捕捉すべき標的の核酸鎖を捕捉する性能が低下してしまう。
【0011】
そこで、本発明は、核酸分離用担体が充填されたマイクロ流路において、標的とする核酸鎖を効率良く分離するための技術を提供することを主な目的とする。
【課題を解決するための手段】
【0012】
上記課題解決のため、本発明は、多孔質担体表面に導入されたスルホン基と、標的核酸鎖に相補的な塩基配列を有する捕捉鎖のアミノ基とが、スルホンアミド結合により固相化した核酸分離用担体を提供する。
前記核酸分離用担体では多孔質担体を用いているので、細胞溶解液を通液しても根詰まりを起こしにくい。
更に、前記核酸分離用担体では、多孔質担体の広表面積に、標的核酸鎖に相補的な塩基配列を有する捕捉鎖がスルホンアミド結合による固相化によって安定的に修飾されている。また、捕捉鎖と結合しているスルホン基の負電荷と核酸鎖のリン酸基の負電荷との電気的反発に基づき、標的核酸鎖以外の非特異的な吸着を抑制できる。
【0013】
また、本発明は、前記核酸分離用担体を充填したマイクロ流路系及び前記核酸分離用担体を充填したマイクロ流路系を備える核酸分離装置を提供する。
【0014】
また、本発明は、標的核酸鎖を含む試料溶液を前記核酸分離用担体に接触させる手順と、標的核酸鎖とこれに相補的な塩基配列を有する捕捉鎖とが二本鎖を形成する手順、を含む核酸分離方法を提供する。
【0015】
また、本発明は、多孔質担体表面に導入されたスルホン基と、標的核酸鎖に相補的な塩基配列を有する捕捉鎖のアミノ基とが、スルホンアミド結合を形成させる手順、を含む捕捉鎖の固相化方法を提供する。この固相化反応は短時間で行うことができ、しかも反応率も高い。
【発明の効果】
【0016】
本発明により、核酸分離用担体が充填されたマイクロ流路において、標的とする核酸鎖を効率良く分離するための技術が提供される。
【図面の簡単な説明】
【0017】
【図1】本発明に係わる核酸分離用担体の表面の物質構成を説明する模式図である。
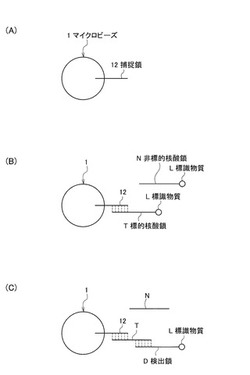
【図2】本発明に係わる核酸分離方法の各ステップにおけるマクロビーズ表面上の物質構成を示す模式図である。(A)開始状態、(B)ハイブリダイゼーション法の場合、(C)サンドイッチハイブリダイゼーション法の場合。
【図3】本発明に係わるマイクロ流路系の実施形態の一例を示す図である。
【図4】本発明に係わる核酸分離方法(ハイブリダイゼーション法)の手段を説明するフォローチャートである。
【図5】本発明に係わる核酸分離方法(サンドイッチハイブリダイゼーション法)の手段を説明するフォローチャートである。
【図6】本発明に係わる核酸分離装置の実施形態の一例を示す図である。
【図7】各種マイクロビーズを充填した各マイクロ流路系での細胞溶解液移送性を示す図である。
【図8】各種マイクロビーズを充填した各マイクロ流路系での標的核酸鎖の捕捉性能を示す図である。
【図9】本発明のマイクロビーズを充填したマイクロ流路系での標的核酸鎖(フルマッチ、1ミスマッチ)及び非標的核酸鎖(フルミスマッチ)の捕捉性能及び熱変性後の解離性能を示す図である。「ディネイチャー前」及び「ディネイチャー後」の棒グラフは、左から、フルマッチ、フルミスマッチ、1ミスマッチ、ブランクを示すものである。
【発明を実施するための形態】
【0018】
以下、本発明を実施するための好適な形態について図面を参照しながら説明する。なお、以下に説明する実施形態は、本発明の代表的な実施形態の一例を示したものであり、これにより本発明の範囲が狭く解釈されることはない。
1.核酸分離用担体
1−1 スルホンアミド結合による核酸分離用担体
1−2 スルホンアミド結合による捕捉鎖の固相化方法
2.マイクロ流路系
2−1 核酸分離方法
3.核酸分離装置
【0019】
<1.核酸分離用担体>
[1−1 スルホンアミド結合による核酸分離用担体]
図1は、本発明に係わる核酸分離用担体の表面上の物質構成の一例を示す模式図である。図は、担体としてマイクロビーズを採用した場合を示している。
また、図2中、符号Tは試料溶液に含まれる標的核酸鎖、符号Nは標的核酸鎖以外の核酸鎖(非標的核酸鎖)、符号Dは検出鎖、符号Lは標識物質を示す。
【0020】
マイクロビーズ1の表面には、分離の対象とする標的核酸鎖をマイクロビーズ上に捕捉するための捕捉鎖12が固相化されている。
【0021】
マイクロビーズ1は、マイクロビーズ1内部に多孔質の構造を有するものである。具体的には、貫通孔と拡散孔という大小のポアを有しており、この内部構造により、通液される溶液そのものは貫通孔を通り貫いて速やかに通流される。一方で試料溶液中に含まれる物質は拡散孔の隅々まで広がって通流される。一般的に細胞溶解液は粘性が高くまた様々な混雑物が含まれているので、これから核酸以外のものを除去し核酸精製物とした後に使用しているが、この通流性を利用して、混雑物を含む試料溶液(例えば、粘稠性の高い細胞培養液)等の背圧を抑え、通液させることができる。また、多孔質担体特有の広表面積により高密度に捕捉鎖を固相化できるので、効率良く標的核酸鎖を捕捉することができる。
マイクロビーズ1として、例えば、パーフュージョンクロマトグラフィー粒子を好適に採用できる。
また、マイクロビーズ1の材質は、特に限定されず、例えば、ポリスチレン、ポリメタクリレート、シリカ、及びアガロース等が挙げられ、このうち、ポリスチレン、ポリスチレン、ポリメタクリレート、シリカが、耐圧性の点で好ましい。
マイクロビーズ1の大きさは、直径3〜200μm程度であればよく、好ましくは、5〜30μmである。
【0022】
本発明の分離対象の標的核酸鎖は、DNAやRNAに加えて、これらのリボース部分の構造を改変して得られる核酸類似体(例えば、LNA(Locked Nucleic Acid))等とされる。尚、標的核酸鎖は、回収対象やハイブリダイゼーション対象であってもよい。
【0023】
捕捉鎖12は、標的核酸鎖に対し相補的な塩基配列を有し、高い親和性をもってこれと相互作用し、二本鎖(ハイブリッド)を形成し得るものである。また、捕捉鎖12のアミノ基は、マイクロビーズ1表面上のスルホン基と共有結合している。
ここで、捕捉鎖12は、標的核酸鎖の種類に応じて、DNAやRNA、核酸類似体等から適宜選択して用いればよい。
捕捉鎖12の塩基配列の長さ(塩基数)は、任意であり、標的核酸鎖の塩基配列の少なくとも一部に相補的な塩基配列を有していれば塩基数は特に限定されない。
通常、捕捉鎖12の長さは、数塩基〜数百塩基であり、好ましくは、20〜30塩基である。
また、捕捉鎖12は、標的核酸鎖に対して完全に相補的な塩基配列を有している必要はなく、当該相補的な塩基配列と標的核酸鎖とで二本鎖形成(ハイブリダイズ)が可能な限りにおいて、その相補的な塩基配列中に1塩基又は2塩基以上のミスマッチ(非相補塩基)を有していてもよい。
【0024】
本発明の核酸分離用担体は、多孔質担体表面に導入されたスルホン基、具体的にはスルホン基で置換されている炭素数1〜5のアルキル基における「スルホン基」と、標的核酸鎖に相補的な塩基配列を有する捕捉鎖の「アミノ基」とが、スルホンアミド結合により固相化したものである。
【0025】
スルホン基で置換されている炭素数1〜5のアルキル基における「アルキル基」としては、直鎖又は分岐鎖のものが包含される。また、当該アルキル基は、更にスルホン基以外の置換基(例えば水酸基等)で置換されていてもよい。
前記アルキル基の炭素数は、1〜4が好ましく、前記スルホン基で置換されているアルキル基のうち、スルホエチル基、スルホプロピル基等が好ましい。
【0026】
多孔質担体表面へのスルホン基の導入は、多孔質担体表面の官能基にスルホン基を直接結合させることにより行うことができ、これによりスルホン基末端を有する多孔質担体を得ることができる。具体的には、例えば、多孔質担体表面の水酸基にエポキシ基やアクリル基を導入後、スルホン化する方法により行うこと等が挙げられる。
【0027】
標的核酸鎖に相補的な塩基配列を有する捕捉鎖のアミノ基は、相補的な塩基配列の5’末端のアミノ基でもよく、また相補的な塩基配列の5’末端や相補的な塩基配列を有する捕捉鎖の末端に、通常の化学修飾を行って得られたものでもよい。
【0028】
[1−2 スルホンアミド結合による捕捉鎖の固相化方法]
多孔質担体表面への捕捉鎖の固相化は、多孔質担体表面のスルホン基と捕捉鎖のアミノ基とをスルホンアミド結合させることによって行うことができる。
具体的には、上述のようにしてマイクロビーズの表面に導入されたスルホン基と標的核酸鎖に相補的な塩基配列を有する捕捉鎖のアミノ基とが、スルホンアミド結合を形成させる手順、を含む捕捉鎖の固相化方法で行うことができる。この固相化方法であれば、短時間で反応を行うことができるので、生産効率も高い。
【0029】
このとき、マイクロビーズの表面に導入されたスルホン基を、塩化チオニルで活性化させて塩化スルホニル基に変換する手順と、当該塩化スルホニル基と標的核酸鎖に相補的な塩基配列を有する捕捉鎖のアミノ基とを、トリエチルアミン等の第三級アミンを触媒として反応させる手順、を含む固相化方法で行うのが、好ましい。これによって、固相化効率がよいので、多孔質担体の表面積に高密度に捕捉鎖を修飾させることができる。
【0030】
上記固相化方法において、担体上のスルホン基を塩化スルホニル基に変換する前に、真空加熱等の乾燥手段にて、マイクロビーズの脱水処理を行うのが好ましい。例えば、この脱水処理条件の乾燥温度は、好ましくは80〜120℃(特に100〜120℃)であり、処理時間は、好ましくは6時間程度である。
また、塩化スルホニル基の変換は、95質量%程度の塩化チオニルの中にて、スルホン基末端を有するマイクロビーズを40〜60℃(特に40〜50℃)で0.5〜2時間程度撹拌することにて行うのが好ましい。変換後は、当該マイクロビーズを遠心フィルタによって分離し、適宜無水非プロトン性溶媒(例えば、アセトン、DMF、DMSO、NMP等)で洗浄する。
塩化スルホニル基に変換されたマイクロビーズ、及びアミノ基を有する捕捉鎖を、高沸点非プロトン性溶媒(例えば、DMF、DMSO、NMP等の単独又は2種以上のもの)に添加する。これに、更に第三級アミン(例えば、トリエチルアミン、トリプロピルアミン、トリブチルアミン等、好ましくはトリエチルアミン)の触媒を適当量添加する。添加後、この溶液を、好ましくは40〜60℃(特に40〜50℃)で、0.5〜2時間程度撹拌して、スルホンアミド結合を形成させる。反応後、遠心フィルタで分離し、適宜、非プロトン性溶媒(例えば、アセトン、DMSO、DMF、NMP)及びプロトン性溶媒(例えば、水、エタノール)の混合液で洗浄する。
このとき、マイクロビーズ表面のスルホン基1モルに対し、捕捉鎖の末端アミノ基は、大過剰にするのが好ましい。具体的な一例として、スルホン基又は塩化スルホニル基を有するマイクロビーズ25mgに対して、末端アミノ基を有する捕捉鎖含有溶液10〜200μM(好ましくは50〜150μM)を50〜200μL添加するのが好適である。
【0031】
<2.マイクロ流路系>
図3を参照して、本発明のマイクロ流路系について説明する。
本発明のマイクロ流路系は、上述の本発明の核酸分離用担体を充填したものである。当該マイクロ流路系は、核酸の分離、回収やハイブリダイゼーション等に使用することができる。
図3は、本発明に係わるマクロ流路系が形成された核酸分離用マイクロチップの構成を説明する模式図である。図1(A)は上面図、(B)は(A)中P−P断面に対応する断面図である。
【0032】
図中、符号2で示す核酸分離用マイクロチップ(以下、「マイクロチップ」ともいう)には、標的核酸鎖が含まれる試料溶液(以下、「サンプル液」ともいう)が通流されるマイクロ流路21が形成されている。マイクロ流路21の流路には、サンプル液をマイクロ流路21に導入する導入口211と、マイクロ流路21からのサンプル液の排出口を示す排出口212とを有する。これによって、導入口211から送液されたサンプル液は、マイクロ流路21内を通流して排出口212から排液される。
【0033】
マイクロ流路21内には、標的核酸鎖を分離するための核酸分離用担体であるマイクロビーズ1が充填されている。マイクロビーズ1のサンプル液送液方向下流側には、フィルタ213が配設されている。
フィルタ213には細孔が形成されており、この細孔はサンプル液やサンプル液中の標的核酸鎖や塩、界面活性剤等の物質を透過させるが、マイクロビーズ1の担体を通過させないような孔径とされている。フィルタ213はマイクロ流路21内に充填されたマイクロビーズ1を保持して、流路内を通流するサンプル液とマイクロビーズ1が排出口212から排出されるのを防止する。
【0034】
マイクロチップ2は、マイクロ流路21が形成された基板層2bと導入口の211及び排出口が形成された基板層2aと、を張り合わせて構成されている。基板層2a,2bの材質は、標的核酸鎖の光学検出のための光透過性を有する材質とされ、例えばガラスや各種プラスチック(PP、PC、COC、PDMS等)とされる。基板層2a,2bの材質は、自家蛍光が少なく、波長分散が小さいため、光学誤差の少ない材質を選択するのが好ましい。
【0035】
マイクロ流路21等の基板層2a,2bへの成形は、ガラス製基板層のウェットエッチングやドライエッチングによって、またプラスチック製基板層のナノインプリントや射出成型、切削加工によって行うことができる。そして、マイクロチップ2を形成できる。基板層の貼り合わせは、例えば熱融着、接着剤、陽極接合、粘着シート等を用いた接合、プラズマ活性化接合、超音波接合等の公知の手法によって行うことができる。なお、ここでは、マイクロチップ2に流路を一つ設ける場合を例に説明するが、流路の配設数は2つ以上でもよい。
【0036】
[2−1 核酸分離方法]
本発明の核酸分離用担体を用いた核酸分離方法、具体的には標的核酸鎖を含む試料溶液を本発明の核酸分離用担体に接触させる手順と、標的核酸鎖とこれに相補的な塩基配列を有する捕捉鎖とが二本鎖を形成する手順、を含む核酸分離方法について、図2〜5を参照して説明する。
図4は、本発明に係わる核酸分離方法(ハイブリダイゼーション法)の手順を説明するフローチャートである。尚、この説明における核酸分離方法は、核酸回収方法や核酸ハイブリダイゼーション法を包含するものである。
【0037】
〔ステップ1:コンディショニング〕
ステップ1では、本発明の核酸分離用担体のコンディショニングを、緩衝液を用いて通液で行う。
図3を参照すると、導入口211からハイブリダイゼーション反応用の緩衝液を導入しマイクロ流路21内に通液させて、マイクロビーズ1のコンディショニングを行う。コンディショニングは、マイクロ流路21内の液体を置換し、脱気するために行われる。
【0038】
〔ステップ2:標的核酸鎖の接触と洗浄〕
ステップ2では、標的核酸鎖を含む試料溶液を、本発明の核酸分離用担体に接触させる。接触手段としては、通液や撹拌等が挙げられる。
図3を参照すると、導入口211からサンプル液を導入しマイクロ流路21内に通液させる。本ステップ2では、標的核酸鎖に対し相補的な塩基配列を有する捕捉鎖12と標的核酸鎖とが二本鎖を形成(ハイブリダイズ)し、標的核酸鎖がマイクロビーズ1表面に捕捉される。
【0039】
ここで、捕捉鎖12と標的核酸鎖とのハイブリダイゼーション反応は、ハイブリダイゼーション反応用緩衝溶液の組成(例えば、塩や界面活性剤等の濃度)やマイクロ流路内の温度を調整し、適当なハイブリッド形成条件において行われる。標的核酸鎖の自己ハイブリット形成を抑制するため、サンプル液を予め加温してマイクロ流路21内に導入することが有効である。また、標的核酸鎖の捕捉鎖12への非特異的な吸着を抑制するため、サンプル液の通流時のマイクロ流路内を加温することが有効である。
尚、試料溶液中に含まれる標的核酸鎖を、マイクロ流路21に導入する前に、予め、蛍光物質、化学発光物質や放射性物質等の標識物質で標識(ラベル)する。当該標識物質から発生する蛍光、発光や放射線を後述するステップ3(検出)で検知することで、標的核酸鎖の検出が行われる。
【0040】
そして、本発明の核酸分離担体の捕捉鎖12はスルホンアミド結合によってマイクロビーズ表面に化学的、温度的に安定して固定化されているので、このハイブリダイゼーション反応においても、高塩濃度条件や高温条件のハイブリッド形成条件下においても、捕捉鎖12をビーズ表面に安定に保持して、標的核酸鎖を効率良く補足することができる。
【0041】
〔ステップ3:検出〕
ステップ3では、標識物質が標識された標的核酸鎖Tのハイブリッド形成を維持したまま、洗浄用の緩衝液を接触させてマイクロビーズ1の洗浄を行う。洗浄後、マイクロビーズ1表面に捕捉された標的核酸鎖を、当該標的核酸鎖に標識された蛍光物質、発光物質や放射性物質から発生する蛍光、発光や放射線によって検出する。
【0042】
より具体的には、例えば、捕捉鎖12をポリ(dA)配列に相補的なポリ(dT)配列やポリ(dU)配列とすることにより、真核生物のメッセンジャーRNA(mRNA)中の標的とするmRNA(標的核酸鎖)を捕捉する。この捕捉前に、標的核酸鎖を含むmRNAは、標識物質で標識されている。
そして、標的核酸鎖の蛍光、発光又は放射線の強度を測定し、測定強度に基づいて標的mRNAを定量的に検出する。
なお、捕捉鎖12には、ポリ(A)配列に相補的であればRNAであるポリ(T)やポリ(U)を用いてもよい。
標的核酸鎖溶液の接触後、マイクロビーズ1の洗浄を行う。洗浄は、捕捉鎖と標的核酸鎖とのハイブリッド形成が維持される条件にて行い、非標的核酸鎖等の不要な物質を除去するために行う。
【0043】
また、本発明の核酸分離用担体は、図4に示す一般的なハイブリダイゼーション法の他に、図5に示すサンドイッチハイブリダイゼーション法にも用いることができる。上述のハイブリダイゼーション法で説明したところについては省略する。
〔ステップ1:コンディショニング〕
上述のステップ1に準じて行う。
〔ステップ2a:標的核酸鎖の通流と洗浄〕
上述のステップ2に準じて行う。尚、試料溶液中の標的核酸鎖に標識物質を標識しなくともよい。
【0044】
〔ステップ2b:検出鎖の接触と洗浄〕
ステップ2bでは、前記ステップ2aで行った捕捉鎖12と標的核酸鎖とのハイブリッド形成を維持したまま、このビーズを緩衝液で洗浄する。洗浄後、ビーズ表面に補足された標的核酸鎖を検出するための検出鎖を接触させる。
本ステップ2bでは、標的核酸鎖に対し、相補的な塩基配列を有する検出鎖と標的核酸鎖とが二本鎖を形成し、捕捉鎖12−標的核酸鎖T−検出鎖D(標識物質L)のサンドイッチハイブリッドが形成される。
【0045】
ここで、検出鎖は、捕捉鎖12と同様に、標的核酸鎖に対し相補的な塩基配列を有し、高い親和性をもってこれを相互作用し、ハイブリッドを形成し得るものである。検出鎖も、標的核酸鎖の種類に応じて、DNAやRNA、核酸類似体等から適宜選択されて用いられ、塩基配列の長さ(塩基数)は任意に設定することができる。標的核酸鎖に対し完全に相補的な塩基配列を有している必要がない点も、捕捉鎖12と同様である。
検出鎖には、蛍光物質、化学発光物質や放射性物質等の標識物質が標識(ラベル)される。当該標識物質から発生する蛍光、発光や放射線を検知することで、標的核酸鎖の検出が行われる。
【0046】
前記ハイブリッド形成を維持したままのマイクロビーズ1を検出鎖溶液に接触させることによって、捕捉鎖12とハイブリッドを形成した標的核酸鎖に対し、更に検出鎖がハイブリダイズする。これにより、標的核酸鎖Tは捕捉鎖12及び検出鎖とハイブリッドを形成し、サンドイッチハイブリッド(ダブルハイブリッド)となる。
検出鎖と標的核酸鎖とのハイブリダイゼーション反応は、ハイブリダイゼーション反応用緩衝溶液の組成(例えば、塩や界面活性剤の濃度)や反応温度を調整し、適当なハイブリッド形成条件下において行われる。検出鎖の標的核酸鎖への非特異的な吸着を抑制するため、接触させる前の検出鎖溶液は加温することが有効である。
【0047】
〔ステップ3:検出〕
ステップ3では、標識物質が標識された標的核酸鎖Tのハイブリッド形成を維持したまま、洗浄用の緩衝液を接触させてマイクロビーズ1の洗浄を行う。洗浄後、マイクロビーズ1表面に捕捉された標的核酸鎖を、検出鎖に標識された蛍光物質、発光物質や放射性物質から発生する蛍光、発光や放射線によって検出する。
より具体的には、例えば、捕捉した標的とするmRNA(標的核酸鎖)を、これに相補的な塩基配列とした検出鎖によって検出する。そして、検出鎖の蛍光、発光又は放射線の強度を測定し、測定強度に基づいて標的mRNAを定量的に検出する。
検出鎖溶液の接触後、マイクロビーズ1の洗浄を行う。洗浄は、検出鎖と標的核酸鎖とのハイブリッド形成が維持される条件にて行い、標的核酸鎖に非特異的に吸着した検出鎖を除去するために行う。
【0048】
以上に説明した本発明の核酸分離担体を用いた核酸分離方法によれば、溶液通液時の流路内の内圧上昇を防止して高流量の送液を行うことが可能である。更に通液した溶液中に含まれる捕捉鎖12や標的核酸鎖、検出鎖をマイクロビーズ1の拡散孔に広く行き渡らせて、マイクロビーズ1表面への捕捉鎖12の固相化や、捕捉鎖12と標的核酸鎖、検出鎖との間のハイブリダイゼーション反応を効率よく行うことが可能である。
また、多孔質担体は高表面積であるので、この広い表面に捕捉鎖12がスルホンアミド結合にて固相化されているので、化学的や温度的に安定して高密度に存在している。これによって、高密度に標的核酸鎖を補足することが可能となる。
また、マイクロビーズ1では、表面に導入したスルホン基の強い負電荷と、核酸鎖のリン酸基の負電荷との電気的は反発に基づき、マイクロビーズ1の表面への核酸鎖の非特異的吸収を抑制することができる。このことは、後記実施例に示されているが、当該マイクロビーズ1は、捕捉鎖(標的核酸鎖のマッチング部分)に対応する塩基配列と、好ましくは90%以上、より好ましくは95%以上、更に好ましくは98%以上の同一性を有する標的核酸鎖を好適に捕捉することができる。
【0049】
従って、捕捉鎖等のビーズ表面への非特異的な吸着によって生じる内圧の上昇を抑制することができる。更に、標的核酸鎖の検出時に、非特異的吸収に起因する蛍光、発光や放射線(ノイズ信号)を減少させ、高い検出精度を得ることも可能である。
【0050】
<3.核酸分離装置>
本発明に係わる核酸分離装置は、上記で説明したステップ1〜3の各工程を自動で実施し得る装置であり、少なくとも、表面に捕捉鎖がスルホンアミド結合により固相化された多孔質担体を内部に充填したマイクロ流路系を有するものである。これにより、効率良く標的核酸鎖を捕捉することが可能となる。更に、本発明の核酸分離装置は、試料溶液や検出鎖溶液等を流路通液するための送液手段を有し、自動で上記ステップ1〜3を実施し、標的核酸鎖の分離・検出を行う。
尚、本発明の核酸分離装置を、核酸回収装置や核酸ハイブリダイゼーション装置として使用してもよい。
【0051】
図5は、本発明に係わる核酸分離装置の構成を説明する模式図である。
【0052】
核酸分離装置は、マイクロチップ2と、マイクロチップ2のマイクロ流路21内の温度を制御するヒートブロック203と、マイクロチップ2の導入口211に溶液を送液して排出口212から排液させる送液手段と、マイクロチップ2のマイクロ流路21内に充填されたマイクロビーズ1に励起光を照射し、発生する蛍光を検出するための光学検出手段と、を備えている。
【0053】
ヒートブロック203は、マイクロチップ2のマイクロ流路21内を加熱又は冷却する温度制御部として機能する。ヒートブロック203は、上記のステップ3において標的核酸鎖の捕捉鎖21への非特異的な吸着を抑制するため、サンプル液の通液時にマイクロ流路21内を加温する。また、ヒートブロック203は、上記のステップ4において検出鎖の標的核酸鎖への非特異的な吸着を抑制するため、検出鎖溶液の通流時にもマイクロ流路21内を加温する。
尚、ヒートブロック203は、通常使用されるヒーターであってもよく、ペルチェ素子やジュール・トムソン素子等に置換してもよい。ヒートブロック203の温度は、例えば50〜60℃とされる。
【0054】
送液手段は、通常使用されるポンプやシリンジポンプ、チューブやバルブ等によって構成できる。送液手段には、導入口211に導入されるサンプル液を加熱する加熱部としてインラインヒーター202が含まれる。インラインヒーター202は、上記ステップ2において標的核酸鎖の自己ハイブリッド形成を抑制するため、サンプル液を予め加温してマイクロ流路21内に導入する。インラインヒーター202における加熱(熱変性)後、マイクロ流路21のマイクロビーズ2の充填領域まで送液される間に、サンプル液を急冷させることで、標的核酸鎖の自己ハイブリッド形成を抑制できる。インラインヒーター202の温度は、例えば95℃とされる。
【0055】
光学検出手段は、励起光光源と、マイクロ流路21内に充填されたマイクロビーズ1に対して励起光を集光・照射する集光レンズやダイクロイックミラー、バンドパスフィルター等からなる照射系と、励起光の照射によって検出鎖に標識された蛍光物質から発生する蛍光を検出する検出系と、によって構成される。検出系は、例えばPMT(photo multiplier tube)やCCDやCMOS素子等のエリア撮像素子等によって構成される。
なお、図5では、光学検出手段として、集光レンズ201により構成した場合を示したが、照射系と検出系は別個の光学経路により構成してもよい。
【実施例】
【0056】
試験例1:各担体を充填したマイクロ流路系の内圧
(a)スルホンアミド結合型多孔質球ビーズAの作製
直径20μmで、表面にスルホプロピル基を有する多孔質性マイクロビーズ(POROS 20HS,Applied Biosystems)を用いた。この多孔質ビーズは、上述した貫通孔(Through pore)と拡散孔(Diffusive pore)を備えたパーフュージョンクロマトグラフィー粒子である。
スルホプロピル基を有する多孔質性マイクロビーズを前処理として、100℃での真空加熱の乾燥を行い、脱水処理を行った。乾燥したスルホン基末端修飾ビーズを、塩化チオニル中に、50℃で、1時間撹拌し、ビーズ上のスルホン基を塩化スルホニル基に変換した。反応後、塩化スルホニル基末端修飾ビーズは遠心フィルタによって分離し、これを無水DMSOで洗浄した。
続いて、無水DMF500μLに、塩化スルホニル基末端修飾ビーズ25mg、捕捉鎖(アミノ末端の一本鎖DNA(NH2-poly(dT)50)100μL(100μM)、触媒のトリエチルアミン400μLを加え、50℃で、1時間撹拌して、ビーズ上にスルホンアミド結合を形成させ、反応後、スルホンアミド結合により固相化したマイクロビーズA(以下、「ビーズA」という)を遠心フィルタによって分離した。これを、DMSO及び純水で洗浄した。
(b)スルホンアミド結合型真球ビーズB及びCの作製
上記「直径20μmで、表面にスルホプロピル基を有する多孔質性マイクロビーズ(POROS 20S,Applied Biosystems)」を、「直径6μmで、表面にスルホプロピル基を有する真球型マイクロビーズ(polybeads、polyscience社)」に代えた以外は、上記ビーズAの作製と同様に行い、スルホンアミド結合型真球ビーズB(以下、「ビーズB」という)を得た。
また、「直径6μmの真球マイクロビーズ」を「直径20μmの真球型マイクロビーズ(商品名、会社)」に代えた以外は、上記ビーズBの作製と同様に行い、スルホンアミド結合型真球ビーズC(以下、「ビーズC」という)を得た。
【0057】
(c)ビーズA〜Cの各ビーズを充填したマイクロ流路系A〜Cの作製
アクリル製マイクロチップ(流路長2 mm x 横幅0.8 mm x 断面縦幅0.3 mm)に、上記ビーズAを充填し、マイクロ流路系であるマイクロチップAを得た。上記ビーズB及びCについても同様にして、それぞれマイクロチップB及びCを得た。
(d)各マイクロ流路系A〜Cの各内圧の測定
各マイクロチップA〜C及び空チップ(充填なし)に、それぞれ細胞溶解液を移送し、流路内圧を測定した。
上記充填マイクロチップA〜Cのそれぞれに、細胞溶解液をシリンジポンプで通液した。マイクロチップとシリンジポンプとの間には圧力計を設置し、流量を変化させたときの一定状態になった圧力を測定した。
用いた細胞溶解液は、培養したHeLa細胞からBuffer RLT(RNeasy Lysis Buffer, Qiagen)に溶解し、0.2%SDS水溶液(0.3MNaCl)でグアニジンイソチオネート濃度を1.0Mに調整したものであり、水よりも粘性が高いものであった。
粘性のある細胞溶解液を通液した場合、ある流量を超えると急激に圧力の上昇が見られ、マイクロチップの根詰まりが起こったが、図6に示すように、ビーズAを充填したマイクロチップAが最も背圧が低くなることが確認できた。
【0058】
試験例2:各捕捉鎖を固相化した多孔質担体を用いた標的核酸鎖の検出
(1)ストレプトアビジン−ビオチン法によるSA−B型マイクロビーズ
市販の直径6μmのストレプトアビジン修飾ビーズ(polybeads、polyscience社)に対し、ビオチン末端の一本鎖DNA(B-poly(dT)50)を室温で30分間撹拌し、ストレプトアビジン−ビオチン結合して固定化し、SA−B法による相補鎖DNA固定化ビーズ(以下、「SA−B型マイクロビーズ)という)を得た。
(2)脱水縮合法による脱水縮合型マイクロビーズ
市販の直径20μmで多孔質性のスルホプロピル基修飾ビーズ(POROS20HS、applied biosystems社)(以下、「スルホプロピル基修飾ビーズ」という)に対し、捕捉鎖であるアミノ末端の一本鎖DNA(NH2-poly(dT)50)を下記要領の脱水縮合法で、固定化し、脱水縮合法による捕捉鎖固定化ビーズ(以下、「脱水縮合型マイクロビーズ」という)を得た。
脱水縮合法としては、修飾ビーズを、孔内まで十分にエタノールを濡らすようにエタノール中に十分に浸漬した。その後、修飾ビーズのエタノールを、NH2-poly(dT)50水溶液(100μM)で置換して、修飾ビーズのスルホプロピル基と捕捉鎖のアミノ基でイオン結合を形成させ、その後修飾ビーズをアセトンで置換し、水分を取り除いた。イオン結合で捕捉鎖と結合している修飾ビーズを100℃で6時間真空乾燥し、脱水縮合型ビーズを得た。
(3)スルホン活性化法によるスルホンアミド結合型マイクロビーズ
上記試験例1(a)と同様にして、スルホンアミド結合型マイクロビーズを得た。
【0059】
<核酸分離装置の構成>
ガラス製のマイクロチップ内(流路長2mm×断面縦幅0.5mm×横幅0.5mm)内に、孔径10μmのフィルタを装着した。更に前記(1)の製造方法にて得られたSA−B型マイクロビーズを流路に注入し、充填し、マイクロチップDを得た。
【0060】
流路に流路切換バルブとシリンジポンプを配管した。また、マイクロチップの流路と流路切換バルブとの間に50℃に保ったインラインヒーターを配管した。マイクロチップは、60℃に保ったヒートブロック上に配置した。
緑色LED光源を用意し、Cy3励起用フィルタと組み合わせて、Cy3の励起光源とした。分光器を用意し、Cy3蛍光用フィルタと組み合わせて、Cy3の蛍光検出器とした。2つの光ファイバを同軸にバンドルした光ファイバケーブルを用意し、励起光用光ファイバを励起光源に、受光用光ファイバを蛍光検出器に結線した。光ファイバケーブルの先端に向けた対物レンズを、流路内のマイクロビーズに対向させた。これにより、流路内に充填されたマイクロビーズに励起光を照射し、発生する蛍光を検出する光学系を構成した。なお、励起光の照射スポット径は、500μmとした。
【0061】
また、前記脱水縮合型マイクロビーズ及び前記スルホンアミド結合型マイクロビーズについても、前記マイクロチップDの作製手順と同様にして、それぞれマイクロチップE及びFを作製した。更に、それぞれの核酸分離装置を作製した。
【0062】
<測定>
インラインヒーター及びヒートブロックを50℃に設定した。ハイブリッド形成液(0.3M塩化ナトリウムを含む0.2%SDS溶液)を流路に送液し、マイクロビーズのコンディショニングを行い、蛍光測定を行った。送液速度は、50μL/分とした。
サンプル液(捕捉鎖DNAと相補鎖となる5μM Cy3-poly(dA)50水溶液)を300μL送液し、捕捉鎖と標的核酸鎖と検出鎖のサンドイッチハイブリダイゼーションを行った。洗浄液(0.3M塩化ナトリウムを含む0.2%SDS溶液)を2mL送液し、蛍光測定を行った。送液速度は、50μL/分とした。
【0063】
次に、インラインヒーターを95℃、ヒートブロックを80℃に昇温し、液相を純水に変更して2.4mL送液することにより、ハイブリッドを解離(変性)させた。変性操作後に蛍光測定を行った。
【0064】
各種ビーズにおけるコンディショニング蛍光からの差分蛍光強度値を図7に示す。図7は、570nmにおけるCy3ピーク蛍光値を示す。
以上の結果より、スルホンアミド結合法は、ストレプトアビジン法、脱水縮合法に比べ、高い蛍光値を示すマイクロビーズを得ることができ、多孔質担体の高表面に対し、捕捉鎖DNAが安定的に修飾されていることが確認できた。
【0065】
試験例3:核酸ハイブリダイゼーション
標的核酸鎖aのDNA(配列番号1)を、フルマッチとして合成し、また、これに1ミスマッチの標的核酸鎖bのDNA(配列番号2)を1ミスマッチとして合成した。また、非標的核酸鎖のDNA(配列番号3)をフルミスマッチとして合成した。また、標的核酸鎖aの5‘末端の塩基配列に相補的な塩基配列を有する捕捉鎖を合成した。
各標的核酸鎖及び非標的核酸鎖の塩基配列を表1に示す。標的核酸鎖a、標的核酸鎖b及び非標的核酸鎖は、下表1に示す塩基配列の5’末端を末端蛍光色素(Cy3)により標識したものを使用した。捕捉鎖は、下表1に示す塩基配列の5’末端をアミノ修飾したものを使用した。
【0066】
【表1】

【0067】
ビーズ上のスルホン基と捕捉鎖末端のアミノ基とを試験例1(a)のスルホン活性化法により、スルホンアミド結合型マイクロビーズを作製した。更に、このビーズを充填したマイクロチップ及び当該マイクロチップを備えた核酸分離装置を、試験例2と同様にして作製し、試験例2に準じて測定を行った。
【0068】
標的核酸鎖a及びbの場合には、良好に蛍光検出を行うことができた一方で非標的核酸鎖では蛍光検出を行うことができなかったことから、精度良く検出できることが確認できた。
また、ハイブリッド解離処理をした後、標的核酸鎖a及びb共に蛍光強度が非標的核酸鎖とほぼ同レベルとなり、ブランクに近くなったことから、ハイブリッド解離処理後も繰り返し測定を行うことができることが確認できた。
【0069】
以上のことから、スルホンアミド結合にて多孔質担体と捕捉鎖を結合させることにより、担体表面積に高密度に存在し、かつ化学的、温度的に安定な捕捉鎖を有する核酸分離用担体を得ることができる。また、スルホンアミド結合法は、脱水縮合法による反応に比し、短時間で、スルホンアミド結合ビーズの収率の高い核酸分離用担体を得ることができ、また高密度に捕捉鎖を担体表面に修飾させることができる。
また、多孔質担体の広表面積に捕捉鎖を固定し、固定化された捕捉鎖の耐久性もよく、捕捉鎖中のスルホン基特有の負電荷によって標的核酸鎖以外の非特異的な吸着を抑制できるので、標的核酸鎖を高収率(高精度)に捕捉(分離、回収、検出等)することができる。
【産業上の利用可能性】
【0070】
本発明により提供される核酸分離用担体等によれば、流路内圧の上昇を防止し、高流量で核酸ハイブリダイゼーションを行うことができる。しかも、捕捉鎖が安定的に修飾されていると共に捕捉鎖中のスルホン基特有の負電荷によって標的核酸鎖以外の非特異的な吸着を抑制できる。従って、本発明は、核酸の分離操作性や分離性能の向上に寄与し得る。
【符号の説明】
【0071】
1 マイクロビーズ;12 捕捉鎖;T 標的核酸鎖;N 非標的核酸鎖;D 検出鎖;L 標識物質;2 マイクロチップ;21 マイクロ流路
【技術分野】
【0001】
本発明は、核酸分離用担体、マイクロ流路系及び核酸分離装置、並びに核酸分離方法、捕捉鎖の固相化方法に関する。より詳しくは、スルホンアミド結合により捕捉鎖を固相化した多孔質担体を用いた核酸分離用担体等に関する。
【背景技術】
【0002】
近年、遺伝子の変異解析、SNPs(一塩基多型)分析、遺伝子発現頻度解析、遺伝子ネットワーク解明等に利用され得るバイオアッセイ技術の開発が進んでいる。例えば、いわゆるDNAチップ又はDNAマイクロアレイ(以下、「DNAチップ」と総称する)と呼ばれる集積基板を用いた方法が挙げられる。
【0003】
このDNAチップやタンパク質を集積したプロテインチップ等に代表されるようなセンターチップ技術は、標準物質と検出物質との間の特異的な相互作用を利用して、サンプル中の標的物質を分離・検出し、その含有量を調べる方法である。
【0004】
最近では、流路やキャピラリーを利用して、標準物質と検出用物質とを相互作用させる技術が提案されている。また、物質間相互作用の応用として、核酸間のハイブリダイゼーション反応を、流路や細管内で進行させる技術も提案されている。
例えば、特許文献1には、ポリヌクレオチドの増幅幅を行う部分と、検出用オリゴヌクレオチドが固定されている多孔質層を有するハイブリダイゼーション部分とが、流路によって連結されているポリヌクレオチドの分析用部材が開示されている。
また、特許文献2には、毛細管状の流路の内壁にプローブ化合物を固定して、被検ポリヌクレオチドとハイブリダイゼーションを進行させるポリヌクレオチドの分析方法が開示されている。
【0005】
このように流路やキャピラリー等の細い流路内において、物質間相互作用を進行させる場合、サンプル液等の送液に伴ない、流路の内圧が著しく上昇してしまうことが問題となる。特に、標的物質を核酸鎖とする場合には、細い流路内で核酸鎖のハイブリッド形成が進行することにより、流路の実質的体積が減少し、流路内圧が上昇することがある。また、標的核酸鎖以外の核酸鎖が流路内に非特異的に吸着すると、流路の目詰まりが生じ、流路内圧が上昇してしまう。
【0006】
流路内圧が上昇すると、配管系の継ぎ目等の圧力に弱い部分で送液する溶液の漏れを生じる。このような漏れによる溶液の損失(ロス)は、反応物質の量や濃度の低下を引き起こし、その結果期待する物質間相互作用が行われなくなるおそれが生じる。また、サンプル液等に有害物質を含む場合には、溶液の漏れによって安全性が低下するという問題があった。
【0007】
そこで、本発明者らは、特許文献3において、マイクロ流路内での根詰まりを防止し、内圧上昇を防止することが可能なマイクロ流路系を提供している。このマイクロ流路系は、表面にカチオン交換性のイオン交換基を有する多孔質担体に対し、標的核酸鎖に相補的な塩基配列を有し、正電荷を有する官能基が修飾された捕捉鎖を、イオン交換結合法か、イオン交換結合後に水分子を脱離させて共有結合を形成する脱水縮合により固相化された核酸分離用担体を充填している。
【先行技術文献】
【特許文献】
【0008】
【特許文献1】特開2005−130795号公報
【特許文献2】特開2004−309900号公報
【特許文献3】特開2009−268385号公報
【発明の概要】
【発明が解決しようとする課題】
【0009】
上記特許文献3に開示されているマイクロ流路系では、核酸分離用担体として多孔質担体を用いることで、流路内の内圧上昇を防止して高流量の送液を行うことができる。
【0010】
一方で、多孔質担体表面のカチオン交換性のイオン交換基と、捕捉鎖の正電荷を有する官能基とを、イオン交換結合法や、脱水縮合法により固相化した核酸分離用担体では、試料溶液中の捕捉すべき標的の核酸鎖を捕捉する性能が低下してしまう。
【0011】
そこで、本発明は、核酸分離用担体が充填されたマイクロ流路において、標的とする核酸鎖を効率良く分離するための技術を提供することを主な目的とする。
【課題を解決するための手段】
【0012】
上記課題解決のため、本発明は、多孔質担体表面に導入されたスルホン基と、標的核酸鎖に相補的な塩基配列を有する捕捉鎖のアミノ基とが、スルホンアミド結合により固相化した核酸分離用担体を提供する。
前記核酸分離用担体では多孔質担体を用いているので、細胞溶解液を通液しても根詰まりを起こしにくい。
更に、前記核酸分離用担体では、多孔質担体の広表面積に、標的核酸鎖に相補的な塩基配列を有する捕捉鎖がスルホンアミド結合による固相化によって安定的に修飾されている。また、捕捉鎖と結合しているスルホン基の負電荷と核酸鎖のリン酸基の負電荷との電気的反発に基づき、標的核酸鎖以外の非特異的な吸着を抑制できる。
【0013】
また、本発明は、前記核酸分離用担体を充填したマイクロ流路系及び前記核酸分離用担体を充填したマイクロ流路系を備える核酸分離装置を提供する。
【0014】
また、本発明は、標的核酸鎖を含む試料溶液を前記核酸分離用担体に接触させる手順と、標的核酸鎖とこれに相補的な塩基配列を有する捕捉鎖とが二本鎖を形成する手順、を含む核酸分離方法を提供する。
【0015】
また、本発明は、多孔質担体表面に導入されたスルホン基と、標的核酸鎖に相補的な塩基配列を有する捕捉鎖のアミノ基とが、スルホンアミド結合を形成させる手順、を含む捕捉鎖の固相化方法を提供する。この固相化反応は短時間で行うことができ、しかも反応率も高い。
【発明の効果】
【0016】
本発明により、核酸分離用担体が充填されたマイクロ流路において、標的とする核酸鎖を効率良く分離するための技術が提供される。
【図面の簡単な説明】
【0017】
【図1】本発明に係わる核酸分離用担体の表面の物質構成を説明する模式図である。
【図2】本発明に係わる核酸分離方法の各ステップにおけるマクロビーズ表面上の物質構成を示す模式図である。(A)開始状態、(B)ハイブリダイゼーション法の場合、(C)サンドイッチハイブリダイゼーション法の場合。
【図3】本発明に係わるマイクロ流路系の実施形態の一例を示す図である。
【図4】本発明に係わる核酸分離方法(ハイブリダイゼーション法)の手段を説明するフォローチャートである。
【図5】本発明に係わる核酸分離方法(サンドイッチハイブリダイゼーション法)の手段を説明するフォローチャートである。
【図6】本発明に係わる核酸分離装置の実施形態の一例を示す図である。
【図7】各種マイクロビーズを充填した各マイクロ流路系での細胞溶解液移送性を示す図である。
【図8】各種マイクロビーズを充填した各マイクロ流路系での標的核酸鎖の捕捉性能を示す図である。
【図9】本発明のマイクロビーズを充填したマイクロ流路系での標的核酸鎖(フルマッチ、1ミスマッチ)及び非標的核酸鎖(フルミスマッチ)の捕捉性能及び熱変性後の解離性能を示す図である。「ディネイチャー前」及び「ディネイチャー後」の棒グラフは、左から、フルマッチ、フルミスマッチ、1ミスマッチ、ブランクを示すものである。
【発明を実施するための形態】
【0018】
以下、本発明を実施するための好適な形態について図面を参照しながら説明する。なお、以下に説明する実施形態は、本発明の代表的な実施形態の一例を示したものであり、これにより本発明の範囲が狭く解釈されることはない。
1.核酸分離用担体
1−1 スルホンアミド結合による核酸分離用担体
1−2 スルホンアミド結合による捕捉鎖の固相化方法
2.マイクロ流路系
2−1 核酸分離方法
3.核酸分離装置
【0019】
<1.核酸分離用担体>
[1−1 スルホンアミド結合による核酸分離用担体]
図1は、本発明に係わる核酸分離用担体の表面上の物質構成の一例を示す模式図である。図は、担体としてマイクロビーズを採用した場合を示している。
また、図2中、符号Tは試料溶液に含まれる標的核酸鎖、符号Nは標的核酸鎖以外の核酸鎖(非標的核酸鎖)、符号Dは検出鎖、符号Lは標識物質を示す。
【0020】
マイクロビーズ1の表面には、分離の対象とする標的核酸鎖をマイクロビーズ上に捕捉するための捕捉鎖12が固相化されている。
【0021】
マイクロビーズ1は、マイクロビーズ1内部に多孔質の構造を有するものである。具体的には、貫通孔と拡散孔という大小のポアを有しており、この内部構造により、通液される溶液そのものは貫通孔を通り貫いて速やかに通流される。一方で試料溶液中に含まれる物質は拡散孔の隅々まで広がって通流される。一般的に細胞溶解液は粘性が高くまた様々な混雑物が含まれているので、これから核酸以外のものを除去し核酸精製物とした後に使用しているが、この通流性を利用して、混雑物を含む試料溶液(例えば、粘稠性の高い細胞培養液)等の背圧を抑え、通液させることができる。また、多孔質担体特有の広表面積により高密度に捕捉鎖を固相化できるので、効率良く標的核酸鎖を捕捉することができる。
マイクロビーズ1として、例えば、パーフュージョンクロマトグラフィー粒子を好適に採用できる。
また、マイクロビーズ1の材質は、特に限定されず、例えば、ポリスチレン、ポリメタクリレート、シリカ、及びアガロース等が挙げられ、このうち、ポリスチレン、ポリスチレン、ポリメタクリレート、シリカが、耐圧性の点で好ましい。
マイクロビーズ1の大きさは、直径3〜200μm程度であればよく、好ましくは、5〜30μmである。
【0022】
本発明の分離対象の標的核酸鎖は、DNAやRNAに加えて、これらのリボース部分の構造を改変して得られる核酸類似体(例えば、LNA(Locked Nucleic Acid))等とされる。尚、標的核酸鎖は、回収対象やハイブリダイゼーション対象であってもよい。
【0023】
捕捉鎖12は、標的核酸鎖に対し相補的な塩基配列を有し、高い親和性をもってこれと相互作用し、二本鎖(ハイブリッド)を形成し得るものである。また、捕捉鎖12のアミノ基は、マイクロビーズ1表面上のスルホン基と共有結合している。
ここで、捕捉鎖12は、標的核酸鎖の種類に応じて、DNAやRNA、核酸類似体等から適宜選択して用いればよい。
捕捉鎖12の塩基配列の長さ(塩基数)は、任意であり、標的核酸鎖の塩基配列の少なくとも一部に相補的な塩基配列を有していれば塩基数は特に限定されない。
通常、捕捉鎖12の長さは、数塩基〜数百塩基であり、好ましくは、20〜30塩基である。
また、捕捉鎖12は、標的核酸鎖に対して完全に相補的な塩基配列を有している必要はなく、当該相補的な塩基配列と標的核酸鎖とで二本鎖形成(ハイブリダイズ)が可能な限りにおいて、その相補的な塩基配列中に1塩基又は2塩基以上のミスマッチ(非相補塩基)を有していてもよい。
【0024】
本発明の核酸分離用担体は、多孔質担体表面に導入されたスルホン基、具体的にはスルホン基で置換されている炭素数1〜5のアルキル基における「スルホン基」と、標的核酸鎖に相補的な塩基配列を有する捕捉鎖の「アミノ基」とが、スルホンアミド結合により固相化したものである。
【0025】
スルホン基で置換されている炭素数1〜5のアルキル基における「アルキル基」としては、直鎖又は分岐鎖のものが包含される。また、当該アルキル基は、更にスルホン基以外の置換基(例えば水酸基等)で置換されていてもよい。
前記アルキル基の炭素数は、1〜4が好ましく、前記スルホン基で置換されているアルキル基のうち、スルホエチル基、スルホプロピル基等が好ましい。
【0026】
多孔質担体表面へのスルホン基の導入は、多孔質担体表面の官能基にスルホン基を直接結合させることにより行うことができ、これによりスルホン基末端を有する多孔質担体を得ることができる。具体的には、例えば、多孔質担体表面の水酸基にエポキシ基やアクリル基を導入後、スルホン化する方法により行うこと等が挙げられる。
【0027】
標的核酸鎖に相補的な塩基配列を有する捕捉鎖のアミノ基は、相補的な塩基配列の5’末端のアミノ基でもよく、また相補的な塩基配列の5’末端や相補的な塩基配列を有する捕捉鎖の末端に、通常の化学修飾を行って得られたものでもよい。
【0028】
[1−2 スルホンアミド結合による捕捉鎖の固相化方法]
多孔質担体表面への捕捉鎖の固相化は、多孔質担体表面のスルホン基と捕捉鎖のアミノ基とをスルホンアミド結合させることによって行うことができる。
具体的には、上述のようにしてマイクロビーズの表面に導入されたスルホン基と標的核酸鎖に相補的な塩基配列を有する捕捉鎖のアミノ基とが、スルホンアミド結合を形成させる手順、を含む捕捉鎖の固相化方法で行うことができる。この固相化方法であれば、短時間で反応を行うことができるので、生産効率も高い。
【0029】
このとき、マイクロビーズの表面に導入されたスルホン基を、塩化チオニルで活性化させて塩化スルホニル基に変換する手順と、当該塩化スルホニル基と標的核酸鎖に相補的な塩基配列を有する捕捉鎖のアミノ基とを、トリエチルアミン等の第三級アミンを触媒として反応させる手順、を含む固相化方法で行うのが、好ましい。これによって、固相化効率がよいので、多孔質担体の表面積に高密度に捕捉鎖を修飾させることができる。
【0030】
上記固相化方法において、担体上のスルホン基を塩化スルホニル基に変換する前に、真空加熱等の乾燥手段にて、マイクロビーズの脱水処理を行うのが好ましい。例えば、この脱水処理条件の乾燥温度は、好ましくは80〜120℃(特に100〜120℃)であり、処理時間は、好ましくは6時間程度である。
また、塩化スルホニル基の変換は、95質量%程度の塩化チオニルの中にて、スルホン基末端を有するマイクロビーズを40〜60℃(特に40〜50℃)で0.5〜2時間程度撹拌することにて行うのが好ましい。変換後は、当該マイクロビーズを遠心フィルタによって分離し、適宜無水非プロトン性溶媒(例えば、アセトン、DMF、DMSO、NMP等)で洗浄する。
塩化スルホニル基に変換されたマイクロビーズ、及びアミノ基を有する捕捉鎖を、高沸点非プロトン性溶媒(例えば、DMF、DMSO、NMP等の単独又は2種以上のもの)に添加する。これに、更に第三級アミン(例えば、トリエチルアミン、トリプロピルアミン、トリブチルアミン等、好ましくはトリエチルアミン)の触媒を適当量添加する。添加後、この溶液を、好ましくは40〜60℃(特に40〜50℃)で、0.5〜2時間程度撹拌して、スルホンアミド結合を形成させる。反応後、遠心フィルタで分離し、適宜、非プロトン性溶媒(例えば、アセトン、DMSO、DMF、NMP)及びプロトン性溶媒(例えば、水、エタノール)の混合液で洗浄する。
このとき、マイクロビーズ表面のスルホン基1モルに対し、捕捉鎖の末端アミノ基は、大過剰にするのが好ましい。具体的な一例として、スルホン基又は塩化スルホニル基を有するマイクロビーズ25mgに対して、末端アミノ基を有する捕捉鎖含有溶液10〜200μM(好ましくは50〜150μM)を50〜200μL添加するのが好適である。
【0031】
<2.マイクロ流路系>
図3を参照して、本発明のマイクロ流路系について説明する。
本発明のマイクロ流路系は、上述の本発明の核酸分離用担体を充填したものである。当該マイクロ流路系は、核酸の分離、回収やハイブリダイゼーション等に使用することができる。
図3は、本発明に係わるマクロ流路系が形成された核酸分離用マイクロチップの構成を説明する模式図である。図1(A)は上面図、(B)は(A)中P−P断面に対応する断面図である。
【0032】
図中、符号2で示す核酸分離用マイクロチップ(以下、「マイクロチップ」ともいう)には、標的核酸鎖が含まれる試料溶液(以下、「サンプル液」ともいう)が通流されるマイクロ流路21が形成されている。マイクロ流路21の流路には、サンプル液をマイクロ流路21に導入する導入口211と、マイクロ流路21からのサンプル液の排出口を示す排出口212とを有する。これによって、導入口211から送液されたサンプル液は、マイクロ流路21内を通流して排出口212から排液される。
【0033】
マイクロ流路21内には、標的核酸鎖を分離するための核酸分離用担体であるマイクロビーズ1が充填されている。マイクロビーズ1のサンプル液送液方向下流側には、フィルタ213が配設されている。
フィルタ213には細孔が形成されており、この細孔はサンプル液やサンプル液中の標的核酸鎖や塩、界面活性剤等の物質を透過させるが、マイクロビーズ1の担体を通過させないような孔径とされている。フィルタ213はマイクロ流路21内に充填されたマイクロビーズ1を保持して、流路内を通流するサンプル液とマイクロビーズ1が排出口212から排出されるのを防止する。
【0034】
マイクロチップ2は、マイクロ流路21が形成された基板層2bと導入口の211及び排出口が形成された基板層2aと、を張り合わせて構成されている。基板層2a,2bの材質は、標的核酸鎖の光学検出のための光透過性を有する材質とされ、例えばガラスや各種プラスチック(PP、PC、COC、PDMS等)とされる。基板層2a,2bの材質は、自家蛍光が少なく、波長分散が小さいため、光学誤差の少ない材質を選択するのが好ましい。
【0035】
マイクロ流路21等の基板層2a,2bへの成形は、ガラス製基板層のウェットエッチングやドライエッチングによって、またプラスチック製基板層のナノインプリントや射出成型、切削加工によって行うことができる。そして、マイクロチップ2を形成できる。基板層の貼り合わせは、例えば熱融着、接着剤、陽極接合、粘着シート等を用いた接合、プラズマ活性化接合、超音波接合等の公知の手法によって行うことができる。なお、ここでは、マイクロチップ2に流路を一つ設ける場合を例に説明するが、流路の配設数は2つ以上でもよい。
【0036】
[2−1 核酸分離方法]
本発明の核酸分離用担体を用いた核酸分離方法、具体的には標的核酸鎖を含む試料溶液を本発明の核酸分離用担体に接触させる手順と、標的核酸鎖とこれに相補的な塩基配列を有する捕捉鎖とが二本鎖を形成する手順、を含む核酸分離方法について、図2〜5を参照して説明する。
図4は、本発明に係わる核酸分離方法(ハイブリダイゼーション法)の手順を説明するフローチャートである。尚、この説明における核酸分離方法は、核酸回収方法や核酸ハイブリダイゼーション法を包含するものである。
【0037】
〔ステップ1:コンディショニング〕
ステップ1では、本発明の核酸分離用担体のコンディショニングを、緩衝液を用いて通液で行う。
図3を参照すると、導入口211からハイブリダイゼーション反応用の緩衝液を導入しマイクロ流路21内に通液させて、マイクロビーズ1のコンディショニングを行う。コンディショニングは、マイクロ流路21内の液体を置換し、脱気するために行われる。
【0038】
〔ステップ2:標的核酸鎖の接触と洗浄〕
ステップ2では、標的核酸鎖を含む試料溶液を、本発明の核酸分離用担体に接触させる。接触手段としては、通液や撹拌等が挙げられる。
図3を参照すると、導入口211からサンプル液を導入しマイクロ流路21内に通液させる。本ステップ2では、標的核酸鎖に対し相補的な塩基配列を有する捕捉鎖12と標的核酸鎖とが二本鎖を形成(ハイブリダイズ)し、標的核酸鎖がマイクロビーズ1表面に捕捉される。
【0039】
ここで、捕捉鎖12と標的核酸鎖とのハイブリダイゼーション反応は、ハイブリダイゼーション反応用緩衝溶液の組成(例えば、塩や界面活性剤等の濃度)やマイクロ流路内の温度を調整し、適当なハイブリッド形成条件において行われる。標的核酸鎖の自己ハイブリット形成を抑制するため、サンプル液を予め加温してマイクロ流路21内に導入することが有効である。また、標的核酸鎖の捕捉鎖12への非特異的な吸着を抑制するため、サンプル液の通流時のマイクロ流路内を加温することが有効である。
尚、試料溶液中に含まれる標的核酸鎖を、マイクロ流路21に導入する前に、予め、蛍光物質、化学発光物質や放射性物質等の標識物質で標識(ラベル)する。当該標識物質から発生する蛍光、発光や放射線を後述するステップ3(検出)で検知することで、標的核酸鎖の検出が行われる。
【0040】
そして、本発明の核酸分離担体の捕捉鎖12はスルホンアミド結合によってマイクロビーズ表面に化学的、温度的に安定して固定化されているので、このハイブリダイゼーション反応においても、高塩濃度条件や高温条件のハイブリッド形成条件下においても、捕捉鎖12をビーズ表面に安定に保持して、標的核酸鎖を効率良く補足することができる。
【0041】
〔ステップ3:検出〕
ステップ3では、標識物質が標識された標的核酸鎖Tのハイブリッド形成を維持したまま、洗浄用の緩衝液を接触させてマイクロビーズ1の洗浄を行う。洗浄後、マイクロビーズ1表面に捕捉された標的核酸鎖を、当該標的核酸鎖に標識された蛍光物質、発光物質や放射性物質から発生する蛍光、発光や放射線によって検出する。
【0042】
より具体的には、例えば、捕捉鎖12をポリ(dA)配列に相補的なポリ(dT)配列やポリ(dU)配列とすることにより、真核生物のメッセンジャーRNA(mRNA)中の標的とするmRNA(標的核酸鎖)を捕捉する。この捕捉前に、標的核酸鎖を含むmRNAは、標識物質で標識されている。
そして、標的核酸鎖の蛍光、発光又は放射線の強度を測定し、測定強度に基づいて標的mRNAを定量的に検出する。
なお、捕捉鎖12には、ポリ(A)配列に相補的であればRNAであるポリ(T)やポリ(U)を用いてもよい。
標的核酸鎖溶液の接触後、マイクロビーズ1の洗浄を行う。洗浄は、捕捉鎖と標的核酸鎖とのハイブリッド形成が維持される条件にて行い、非標的核酸鎖等の不要な物質を除去するために行う。
【0043】
また、本発明の核酸分離用担体は、図4に示す一般的なハイブリダイゼーション法の他に、図5に示すサンドイッチハイブリダイゼーション法にも用いることができる。上述のハイブリダイゼーション法で説明したところについては省略する。
〔ステップ1:コンディショニング〕
上述のステップ1に準じて行う。
〔ステップ2a:標的核酸鎖の通流と洗浄〕
上述のステップ2に準じて行う。尚、試料溶液中の標的核酸鎖に標識物質を標識しなくともよい。
【0044】
〔ステップ2b:検出鎖の接触と洗浄〕
ステップ2bでは、前記ステップ2aで行った捕捉鎖12と標的核酸鎖とのハイブリッド形成を維持したまま、このビーズを緩衝液で洗浄する。洗浄後、ビーズ表面に補足された標的核酸鎖を検出するための検出鎖を接触させる。
本ステップ2bでは、標的核酸鎖に対し、相補的な塩基配列を有する検出鎖と標的核酸鎖とが二本鎖を形成し、捕捉鎖12−標的核酸鎖T−検出鎖D(標識物質L)のサンドイッチハイブリッドが形成される。
【0045】
ここで、検出鎖は、捕捉鎖12と同様に、標的核酸鎖に対し相補的な塩基配列を有し、高い親和性をもってこれを相互作用し、ハイブリッドを形成し得るものである。検出鎖も、標的核酸鎖の種類に応じて、DNAやRNA、核酸類似体等から適宜選択されて用いられ、塩基配列の長さ(塩基数)は任意に設定することができる。標的核酸鎖に対し完全に相補的な塩基配列を有している必要がない点も、捕捉鎖12と同様である。
検出鎖には、蛍光物質、化学発光物質や放射性物質等の標識物質が標識(ラベル)される。当該標識物質から発生する蛍光、発光や放射線を検知することで、標的核酸鎖の検出が行われる。
【0046】
前記ハイブリッド形成を維持したままのマイクロビーズ1を検出鎖溶液に接触させることによって、捕捉鎖12とハイブリッドを形成した標的核酸鎖に対し、更に検出鎖がハイブリダイズする。これにより、標的核酸鎖Tは捕捉鎖12及び検出鎖とハイブリッドを形成し、サンドイッチハイブリッド(ダブルハイブリッド)となる。
検出鎖と標的核酸鎖とのハイブリダイゼーション反応は、ハイブリダイゼーション反応用緩衝溶液の組成(例えば、塩や界面活性剤の濃度)や反応温度を調整し、適当なハイブリッド形成条件下において行われる。検出鎖の標的核酸鎖への非特異的な吸着を抑制するため、接触させる前の検出鎖溶液は加温することが有効である。
【0047】
〔ステップ3:検出〕
ステップ3では、標識物質が標識された標的核酸鎖Tのハイブリッド形成を維持したまま、洗浄用の緩衝液を接触させてマイクロビーズ1の洗浄を行う。洗浄後、マイクロビーズ1表面に捕捉された標的核酸鎖を、検出鎖に標識された蛍光物質、発光物質や放射性物質から発生する蛍光、発光や放射線によって検出する。
より具体的には、例えば、捕捉した標的とするmRNA(標的核酸鎖)を、これに相補的な塩基配列とした検出鎖によって検出する。そして、検出鎖の蛍光、発光又は放射線の強度を測定し、測定強度に基づいて標的mRNAを定量的に検出する。
検出鎖溶液の接触後、マイクロビーズ1の洗浄を行う。洗浄は、検出鎖と標的核酸鎖とのハイブリッド形成が維持される条件にて行い、標的核酸鎖に非特異的に吸着した検出鎖を除去するために行う。
【0048】
以上に説明した本発明の核酸分離担体を用いた核酸分離方法によれば、溶液通液時の流路内の内圧上昇を防止して高流量の送液を行うことが可能である。更に通液した溶液中に含まれる捕捉鎖12や標的核酸鎖、検出鎖をマイクロビーズ1の拡散孔に広く行き渡らせて、マイクロビーズ1表面への捕捉鎖12の固相化や、捕捉鎖12と標的核酸鎖、検出鎖との間のハイブリダイゼーション反応を効率よく行うことが可能である。
また、多孔質担体は高表面積であるので、この広い表面に捕捉鎖12がスルホンアミド結合にて固相化されているので、化学的や温度的に安定して高密度に存在している。これによって、高密度に標的核酸鎖を補足することが可能となる。
また、マイクロビーズ1では、表面に導入したスルホン基の強い負電荷と、核酸鎖のリン酸基の負電荷との電気的は反発に基づき、マイクロビーズ1の表面への核酸鎖の非特異的吸収を抑制することができる。このことは、後記実施例に示されているが、当該マイクロビーズ1は、捕捉鎖(標的核酸鎖のマッチング部分)に対応する塩基配列と、好ましくは90%以上、より好ましくは95%以上、更に好ましくは98%以上の同一性を有する標的核酸鎖を好適に捕捉することができる。
【0049】
従って、捕捉鎖等のビーズ表面への非特異的な吸着によって生じる内圧の上昇を抑制することができる。更に、標的核酸鎖の検出時に、非特異的吸収に起因する蛍光、発光や放射線(ノイズ信号)を減少させ、高い検出精度を得ることも可能である。
【0050】
<3.核酸分離装置>
本発明に係わる核酸分離装置は、上記で説明したステップ1〜3の各工程を自動で実施し得る装置であり、少なくとも、表面に捕捉鎖がスルホンアミド結合により固相化された多孔質担体を内部に充填したマイクロ流路系を有するものである。これにより、効率良く標的核酸鎖を捕捉することが可能となる。更に、本発明の核酸分離装置は、試料溶液や検出鎖溶液等を流路通液するための送液手段を有し、自動で上記ステップ1〜3を実施し、標的核酸鎖の分離・検出を行う。
尚、本発明の核酸分離装置を、核酸回収装置や核酸ハイブリダイゼーション装置として使用してもよい。
【0051】
図5は、本発明に係わる核酸分離装置の構成を説明する模式図である。
【0052】
核酸分離装置は、マイクロチップ2と、マイクロチップ2のマイクロ流路21内の温度を制御するヒートブロック203と、マイクロチップ2の導入口211に溶液を送液して排出口212から排液させる送液手段と、マイクロチップ2のマイクロ流路21内に充填されたマイクロビーズ1に励起光を照射し、発生する蛍光を検出するための光学検出手段と、を備えている。
【0053】
ヒートブロック203は、マイクロチップ2のマイクロ流路21内を加熱又は冷却する温度制御部として機能する。ヒートブロック203は、上記のステップ3において標的核酸鎖の捕捉鎖21への非特異的な吸着を抑制するため、サンプル液の通液時にマイクロ流路21内を加温する。また、ヒートブロック203は、上記のステップ4において検出鎖の標的核酸鎖への非特異的な吸着を抑制するため、検出鎖溶液の通流時にもマイクロ流路21内を加温する。
尚、ヒートブロック203は、通常使用されるヒーターであってもよく、ペルチェ素子やジュール・トムソン素子等に置換してもよい。ヒートブロック203の温度は、例えば50〜60℃とされる。
【0054】
送液手段は、通常使用されるポンプやシリンジポンプ、チューブやバルブ等によって構成できる。送液手段には、導入口211に導入されるサンプル液を加熱する加熱部としてインラインヒーター202が含まれる。インラインヒーター202は、上記ステップ2において標的核酸鎖の自己ハイブリッド形成を抑制するため、サンプル液を予め加温してマイクロ流路21内に導入する。インラインヒーター202における加熱(熱変性)後、マイクロ流路21のマイクロビーズ2の充填領域まで送液される間に、サンプル液を急冷させることで、標的核酸鎖の自己ハイブリッド形成を抑制できる。インラインヒーター202の温度は、例えば95℃とされる。
【0055】
光学検出手段は、励起光光源と、マイクロ流路21内に充填されたマイクロビーズ1に対して励起光を集光・照射する集光レンズやダイクロイックミラー、バンドパスフィルター等からなる照射系と、励起光の照射によって検出鎖に標識された蛍光物質から発生する蛍光を検出する検出系と、によって構成される。検出系は、例えばPMT(photo multiplier tube)やCCDやCMOS素子等のエリア撮像素子等によって構成される。
なお、図5では、光学検出手段として、集光レンズ201により構成した場合を示したが、照射系と検出系は別個の光学経路により構成してもよい。
【実施例】
【0056】
試験例1:各担体を充填したマイクロ流路系の内圧
(a)スルホンアミド結合型多孔質球ビーズAの作製
直径20μmで、表面にスルホプロピル基を有する多孔質性マイクロビーズ(POROS 20HS,Applied Biosystems)を用いた。この多孔質ビーズは、上述した貫通孔(Through pore)と拡散孔(Diffusive pore)を備えたパーフュージョンクロマトグラフィー粒子である。
スルホプロピル基を有する多孔質性マイクロビーズを前処理として、100℃での真空加熱の乾燥を行い、脱水処理を行った。乾燥したスルホン基末端修飾ビーズを、塩化チオニル中に、50℃で、1時間撹拌し、ビーズ上のスルホン基を塩化スルホニル基に変換した。反応後、塩化スルホニル基末端修飾ビーズは遠心フィルタによって分離し、これを無水DMSOで洗浄した。
続いて、無水DMF500μLに、塩化スルホニル基末端修飾ビーズ25mg、捕捉鎖(アミノ末端の一本鎖DNA(NH2-poly(dT)50)100μL(100μM)、触媒のトリエチルアミン400μLを加え、50℃で、1時間撹拌して、ビーズ上にスルホンアミド結合を形成させ、反応後、スルホンアミド結合により固相化したマイクロビーズA(以下、「ビーズA」という)を遠心フィルタによって分離した。これを、DMSO及び純水で洗浄した。
(b)スルホンアミド結合型真球ビーズB及びCの作製
上記「直径20μmで、表面にスルホプロピル基を有する多孔質性マイクロビーズ(POROS 20S,Applied Biosystems)」を、「直径6μmで、表面にスルホプロピル基を有する真球型マイクロビーズ(polybeads、polyscience社)」に代えた以外は、上記ビーズAの作製と同様に行い、スルホンアミド結合型真球ビーズB(以下、「ビーズB」という)を得た。
また、「直径6μmの真球マイクロビーズ」を「直径20μmの真球型マイクロビーズ(商品名、会社)」に代えた以外は、上記ビーズBの作製と同様に行い、スルホンアミド結合型真球ビーズC(以下、「ビーズC」という)を得た。
【0057】
(c)ビーズA〜Cの各ビーズを充填したマイクロ流路系A〜Cの作製
アクリル製マイクロチップ(流路長2 mm x 横幅0.8 mm x 断面縦幅0.3 mm)に、上記ビーズAを充填し、マイクロ流路系であるマイクロチップAを得た。上記ビーズB及びCについても同様にして、それぞれマイクロチップB及びCを得た。
(d)各マイクロ流路系A〜Cの各内圧の測定
各マイクロチップA〜C及び空チップ(充填なし)に、それぞれ細胞溶解液を移送し、流路内圧を測定した。
上記充填マイクロチップA〜Cのそれぞれに、細胞溶解液をシリンジポンプで通液した。マイクロチップとシリンジポンプとの間には圧力計を設置し、流量を変化させたときの一定状態になった圧力を測定した。
用いた細胞溶解液は、培養したHeLa細胞からBuffer RLT(RNeasy Lysis Buffer, Qiagen)に溶解し、0.2%SDS水溶液(0.3MNaCl)でグアニジンイソチオネート濃度を1.0Mに調整したものであり、水よりも粘性が高いものであった。
粘性のある細胞溶解液を通液した場合、ある流量を超えると急激に圧力の上昇が見られ、マイクロチップの根詰まりが起こったが、図6に示すように、ビーズAを充填したマイクロチップAが最も背圧が低くなることが確認できた。
【0058】
試験例2:各捕捉鎖を固相化した多孔質担体を用いた標的核酸鎖の検出
(1)ストレプトアビジン−ビオチン法によるSA−B型マイクロビーズ
市販の直径6μmのストレプトアビジン修飾ビーズ(polybeads、polyscience社)に対し、ビオチン末端の一本鎖DNA(B-poly(dT)50)を室温で30分間撹拌し、ストレプトアビジン−ビオチン結合して固定化し、SA−B法による相補鎖DNA固定化ビーズ(以下、「SA−B型マイクロビーズ)という)を得た。
(2)脱水縮合法による脱水縮合型マイクロビーズ
市販の直径20μmで多孔質性のスルホプロピル基修飾ビーズ(POROS20HS、applied biosystems社)(以下、「スルホプロピル基修飾ビーズ」という)に対し、捕捉鎖であるアミノ末端の一本鎖DNA(NH2-poly(dT)50)を下記要領の脱水縮合法で、固定化し、脱水縮合法による捕捉鎖固定化ビーズ(以下、「脱水縮合型マイクロビーズ」という)を得た。
脱水縮合法としては、修飾ビーズを、孔内まで十分にエタノールを濡らすようにエタノール中に十分に浸漬した。その後、修飾ビーズのエタノールを、NH2-poly(dT)50水溶液(100μM)で置換して、修飾ビーズのスルホプロピル基と捕捉鎖のアミノ基でイオン結合を形成させ、その後修飾ビーズをアセトンで置換し、水分を取り除いた。イオン結合で捕捉鎖と結合している修飾ビーズを100℃で6時間真空乾燥し、脱水縮合型ビーズを得た。
(3)スルホン活性化法によるスルホンアミド結合型マイクロビーズ
上記試験例1(a)と同様にして、スルホンアミド結合型マイクロビーズを得た。
【0059】
<核酸分離装置の構成>
ガラス製のマイクロチップ内(流路長2mm×断面縦幅0.5mm×横幅0.5mm)内に、孔径10μmのフィルタを装着した。更に前記(1)の製造方法にて得られたSA−B型マイクロビーズを流路に注入し、充填し、マイクロチップDを得た。
【0060】
流路に流路切換バルブとシリンジポンプを配管した。また、マイクロチップの流路と流路切換バルブとの間に50℃に保ったインラインヒーターを配管した。マイクロチップは、60℃に保ったヒートブロック上に配置した。
緑色LED光源を用意し、Cy3励起用フィルタと組み合わせて、Cy3の励起光源とした。分光器を用意し、Cy3蛍光用フィルタと組み合わせて、Cy3の蛍光検出器とした。2つの光ファイバを同軸にバンドルした光ファイバケーブルを用意し、励起光用光ファイバを励起光源に、受光用光ファイバを蛍光検出器に結線した。光ファイバケーブルの先端に向けた対物レンズを、流路内のマイクロビーズに対向させた。これにより、流路内に充填されたマイクロビーズに励起光を照射し、発生する蛍光を検出する光学系を構成した。なお、励起光の照射スポット径は、500μmとした。
【0061】
また、前記脱水縮合型マイクロビーズ及び前記スルホンアミド結合型マイクロビーズについても、前記マイクロチップDの作製手順と同様にして、それぞれマイクロチップE及びFを作製した。更に、それぞれの核酸分離装置を作製した。
【0062】
<測定>
インラインヒーター及びヒートブロックを50℃に設定した。ハイブリッド形成液(0.3M塩化ナトリウムを含む0.2%SDS溶液)を流路に送液し、マイクロビーズのコンディショニングを行い、蛍光測定を行った。送液速度は、50μL/分とした。
サンプル液(捕捉鎖DNAと相補鎖となる5μM Cy3-poly(dA)50水溶液)を300μL送液し、捕捉鎖と標的核酸鎖と検出鎖のサンドイッチハイブリダイゼーションを行った。洗浄液(0.3M塩化ナトリウムを含む0.2%SDS溶液)を2mL送液し、蛍光測定を行った。送液速度は、50μL/分とした。
【0063】
次に、インラインヒーターを95℃、ヒートブロックを80℃に昇温し、液相を純水に変更して2.4mL送液することにより、ハイブリッドを解離(変性)させた。変性操作後に蛍光測定を行った。
【0064】
各種ビーズにおけるコンディショニング蛍光からの差分蛍光強度値を図7に示す。図7は、570nmにおけるCy3ピーク蛍光値を示す。
以上の結果より、スルホンアミド結合法は、ストレプトアビジン法、脱水縮合法に比べ、高い蛍光値を示すマイクロビーズを得ることができ、多孔質担体の高表面に対し、捕捉鎖DNAが安定的に修飾されていることが確認できた。
【0065】
試験例3:核酸ハイブリダイゼーション
標的核酸鎖aのDNA(配列番号1)を、フルマッチとして合成し、また、これに1ミスマッチの標的核酸鎖bのDNA(配列番号2)を1ミスマッチとして合成した。また、非標的核酸鎖のDNA(配列番号3)をフルミスマッチとして合成した。また、標的核酸鎖aの5‘末端の塩基配列に相補的な塩基配列を有する捕捉鎖を合成した。
各標的核酸鎖及び非標的核酸鎖の塩基配列を表1に示す。標的核酸鎖a、標的核酸鎖b及び非標的核酸鎖は、下表1に示す塩基配列の5’末端を末端蛍光色素(Cy3)により標識したものを使用した。捕捉鎖は、下表1に示す塩基配列の5’末端をアミノ修飾したものを使用した。
【0066】
【表1】

【0067】
ビーズ上のスルホン基と捕捉鎖末端のアミノ基とを試験例1(a)のスルホン活性化法により、スルホンアミド結合型マイクロビーズを作製した。更に、このビーズを充填したマイクロチップ及び当該マイクロチップを備えた核酸分離装置を、試験例2と同様にして作製し、試験例2に準じて測定を行った。
【0068】
標的核酸鎖a及びbの場合には、良好に蛍光検出を行うことができた一方で非標的核酸鎖では蛍光検出を行うことができなかったことから、精度良く検出できることが確認できた。
また、ハイブリッド解離処理をした後、標的核酸鎖a及びb共に蛍光強度が非標的核酸鎖とほぼ同レベルとなり、ブランクに近くなったことから、ハイブリッド解離処理後も繰り返し測定を行うことができることが確認できた。
【0069】
以上のことから、スルホンアミド結合にて多孔質担体と捕捉鎖を結合させることにより、担体表面積に高密度に存在し、かつ化学的、温度的に安定な捕捉鎖を有する核酸分離用担体を得ることができる。また、スルホンアミド結合法は、脱水縮合法による反応に比し、短時間で、スルホンアミド結合ビーズの収率の高い核酸分離用担体を得ることができ、また高密度に捕捉鎖を担体表面に修飾させることができる。
また、多孔質担体の広表面積に捕捉鎖を固定し、固定化された捕捉鎖の耐久性もよく、捕捉鎖中のスルホン基特有の負電荷によって標的核酸鎖以外の非特異的な吸着を抑制できるので、標的核酸鎖を高収率(高精度)に捕捉(分離、回収、検出等)することができる。
【産業上の利用可能性】
【0070】
本発明により提供される核酸分離用担体等によれば、流路内圧の上昇を防止し、高流量で核酸ハイブリダイゼーションを行うことができる。しかも、捕捉鎖が安定的に修飾されていると共に捕捉鎖中のスルホン基特有の負電荷によって標的核酸鎖以外の非特異的な吸着を抑制できる。従って、本発明は、核酸の分離操作性や分離性能の向上に寄与し得る。
【符号の説明】
【0071】
1 マイクロビーズ;12 捕捉鎖;T 標的核酸鎖;N 非標的核酸鎖;D 検出鎖;L 標識物質;2 マイクロチップ;21 マイクロ流路
【特許請求の範囲】
【請求項1】
多孔質担体表面に導入されたスルホン基と、標的核酸鎖に相補的な塩基配列を有する捕捉鎖のアミノ基とが、スルホンアミド結合により固相化した核酸分離用担体。
【請求項2】
前記スルホン基を、塩化チオニルで活性化させて塩化スルホニル基に変換する手順と、
当該塩化スルホニル基と前記捕捉鎖のアミノ基とを、第三級アミンを触媒として反応させてスルホンアミド結合を形成させる手順、を含んでなる請求項1記載の核酸分離用担体。
【請求項3】
請求項1又は2記載の核酸分離用担体を充填したマイクロ流路系。
【請求項4】
請求項1又は2記載の核酸分離用担体を充填したマイクロ流路系を備える核酸分離装置。
【請求項5】
標的核酸鎖を含む試料溶液を請求項1又は2記載の核酸分離用担体に接触させる手順と、標的核酸鎖とこれに相補的な塩基配列を有する捕捉鎖とが二本鎖を形成する手順、を含む核酸分離方法。
【請求項6】
多孔質担体表面に導入されたスルホン基と、標的核酸鎖に相補的な塩基配列を有する捕捉鎖のアミノ基とが、スルホンアミド結合を形成させる手順、を含む捕捉鎖の固相化方法。
【請求項7】
前記スルホン基を、塩化チオニルで活性化させて塩化スルホニル基に変換する手順と、
当該塩化スルホニル基と前記捕捉鎖のアミノ基とを、第三級アミンを触媒として反応させる手順、を含む請求項6記載の捕捉鎖の固相化方法。
【請求項1】
多孔質担体表面に導入されたスルホン基と、標的核酸鎖に相補的な塩基配列を有する捕捉鎖のアミノ基とが、スルホンアミド結合により固相化した核酸分離用担体。
【請求項2】
前記スルホン基を、塩化チオニルで活性化させて塩化スルホニル基に変換する手順と、
当該塩化スルホニル基と前記捕捉鎖のアミノ基とを、第三級アミンを触媒として反応させてスルホンアミド結合を形成させる手順、を含んでなる請求項1記載の核酸分離用担体。
【請求項3】
請求項1又は2記載の核酸分離用担体を充填したマイクロ流路系。
【請求項4】
請求項1又は2記載の核酸分離用担体を充填したマイクロ流路系を備える核酸分離装置。
【請求項5】
標的核酸鎖を含む試料溶液を請求項1又は2記載の核酸分離用担体に接触させる手順と、標的核酸鎖とこれに相補的な塩基配列を有する捕捉鎖とが二本鎖を形成する手順、を含む核酸分離方法。
【請求項6】
多孔質担体表面に導入されたスルホン基と、標的核酸鎖に相補的な塩基配列を有する捕捉鎖のアミノ基とが、スルホンアミド結合を形成させる手順、を含む捕捉鎖の固相化方法。
【請求項7】
前記スルホン基を、塩化チオニルで活性化させて塩化スルホニル基に変換する手順と、
当該塩化スルホニル基と前記捕捉鎖のアミノ基とを、第三級アミンを触媒として反応させる手順、を含む請求項6記載の捕捉鎖の固相化方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【公開番号】特開2012−24017(P2012−24017A)
【公開日】平成24年2月9日(2012.2.9)
【国際特許分類】
【出願番号】特願2010−165507(P2010−165507)
【出願日】平成22年7月23日(2010.7.23)
【出願人】(000002185)ソニー株式会社 (34,172)
【Fターム(参考)】
【公開日】平成24年2月9日(2012.2.9)
【国際特許分類】
【出願日】平成22年7月23日(2010.7.23)
【出願人】(000002185)ソニー株式会社 (34,172)
【Fターム(参考)】
[ Back to top ]

