核酸定量方法及び核酸増幅反応用マイクロチップ
【課題】サンプル中に含まれる検出対象核酸鎖の凡その量を簡便に測定するための技術の提供。
【解決手段】外部から液体が導入される導入口1と、核酸増幅反応の反応場となる複数の反応領域41〜49と、導入口1から導入される液体を各反応領域内に供給する流路2,3と、が配設され、かつ、各反応領域内における核酸増幅反応の起こり易さの程度が変化するように構成された核酸増幅反応用マイクロチップAを用いて、検出対象核酸鎖を含む溶液を流路2,3に通流して各反応領域内に導入し、核酸増幅反応を行う手順と、各反応領域内の増幅産物を検出することにより、核酸増幅反応が生じた反応領域を特定する手順と、を行う核酸定量方法。
【解決手段】外部から液体が導入される導入口1と、核酸増幅反応の反応場となる複数の反応領域41〜49と、導入口1から導入される液体を各反応領域内に供給する流路2,3と、が配設され、かつ、各反応領域内における核酸増幅反応の起こり易さの程度が変化するように構成された核酸増幅反応用マイクロチップAを用いて、検出対象核酸鎖を含む溶液を流路2,3に通流して各反応領域内に導入し、核酸増幅反応を行う手順と、各反応領域内の増幅産物を検出することにより、核酸増幅反応が生じた反応領域を特定する手順と、を行う核酸定量方法。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、核酸定量方法及び核酸増幅反応用マイクロチップに関する。より詳しくは、サンプル中に含まれる検出対象核酸鎖の凡その量を簡便に測定するための核酸定量方法等に関する。
【背景技術】
【0002】
従来、PCR(Polymerase Chain Reaction)法等の核酸増幅法が、感染症や遺伝性疾患の診断、遺伝子の発現量解析やクローニングなどのために用いられている。また、蛍光色素や蛍光色素を標識した蛍光プローブを用い、これらの蛍光強度の増加量に基づいて検出対象核酸鎖の増幅量をリアルタイムに測定し、当初の検出対象核酸鎖量を定量するリアルタイム核酸増幅法も行われている。
【0003】
非特許文献1では、微量な核酸鎖を正確に定量するための「デジタルPCR」と称される技術が提案されている。デジタルPCRでは、検出対象核酸鎖を含むサンプルを反応溶液中に限界希釈し、複数の反応場(ウェル)に分注して、PCR反応を行なう。そして、蛍光プローブ等を用い、増幅産物に由来する蛍光を発するウェルの数を計数する。限界希釈によって各ウェルには最大1分子(コピー)の検出対象核酸鎖しか存在しないと仮定できるため、蛍光を発するウェルの数によってサンプルに含まれる検出対象核酸鎖のコピー数を定量できる。
【0004】
特許文献1には、デジタルPCRにおいて、反応場となるチャネルをプレートに数千〜数百万配設し、サンプルに含まれる検出対象核酸鎖が各チャネルに1コピーずつ入るようにした核酸定量方法が提案されている。この方法によれば、1つのチャネルに検出対象核酸鎖が2コピー以上入ってしまうことにより蛍光を発するウェルの数と検出対象核酸鎖のコピー数とが不一致となってしまうことがなく、検出対象核酸鎖のコピー数を正確に定量できるとされている。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特開2001−269196号公報
【非特許文献】
【0006】
【非特許文献1】"Digital PCR" Proc. Natl. Acad. Sci. 1999, Vol.96, p.9236-9241
【発明の概要】
【発明が解決しようとする課題】
【0007】
上述のように、デジタルPCRでは、サンプル中の検出対象核酸鎖のコピー数を正確に定量できる。一方で、核酸鎖量の定量を目的とした核酸増幅法において、特に感染症の診断を行うような場合には、サンプル中の病原体ゲノムの凡その量を測定し、病原体が多いか少ないかを調べることによって、重症度や発症段階の判定に役立てたいという要求がある。また、このような半定量的な測定は、遺伝子の発現量解析において、mRNAのコピー数を正確に測定することまでは要せず、mRNAの発現量が多いか少ないかを調べたいような場合にも望ましい。
【0008】
そこで、本発明は、サンプル中に含まれる検出対象核酸鎖の凡その量を簡便に測定するための技術を提供することを主な目的とする。
【課題を解決するための手段】
【0009】
上記課題解決のため、本発明は、外部から液体が導入される導入口と、核酸増幅反応の反応場となる複数の反応領域と、導入口から導入される液体を各反応領域内に供給する流路と、が配設され、かつ、各反応領域内における核酸増幅反応の起こり易さの程度が変化するように構成された核酸増幅反応用マイクロチップを用いて、検出対象核酸鎖を含む溶液を前記流路に通流して各反応領域内に導入し、核酸増幅反応を行う手順と、各反応領域内の増幅産物を検出することにより、核酸増幅反応が生じた反応領域を特定する手順と、を行う核酸定量方法を提供する。
この核酸定量方法では、特定された反応領域における核酸増幅反応の起こり易さの程度に基づいて、前記溶液に含まれる検出対象核酸鎖の凡その量を測定できる。すなわち、この核酸定量方法では、特定された反応領域が、核酸増幅反応がより起こり難く構成されたものである程、多くの検出対象核酸鎖が前記溶液に含まれていたと判定できる。
この核酸定量方法において、前記核酸増幅反応用マイクロチップは、前記反応領域の内容積が異なることにより、あるいは、前記反応領域内に反応に必要な物質の少なくとも一部が異なる量で予め収容されていることにより、各反応領域内における核酸増幅反応の起こり易さの程度が変化するように構成されたものを用いることができる。この際、前記反応領域内に予め収容されている反応に必要な物質は、オリゴヌクレオチドプライマー及び/又は酵素とできる。
【0010】
また、本発明は、外部から液体が導入される導入口と、核酸増幅反応の反応場となる複数の反応領域と、導入口から導入される液体を各反応領域内に供給する流路と、が配設され、かつ、各反応領域内における核酸増幅反応の起こり易さの程度が変化するように構成された核酸増幅反応用マイクロチップを提供する。
この核酸増幅反応用マイクロチップは、前記反応領域の内容積が異なることにより、あるいは、前記反応領域内に反応に必要な物質の少なくとも一部が異なる量で予め収容されていることにより、各反応領域内における核酸増幅反応の起こり易さの程度が変化するように構成できる。
これら核酸増幅反応用マイクロチップにおいて、前記反応領域は、一本の前記流路によって、一の反応領域内に導入された液体が該流路に溢流して隣り合う他の一の反応領域に順次導入されるように配設されたものとできる。
【0011】
本発明において、「核酸増幅反応」には、熱変性、アニーリング、伸長反応の3つのステップからなる温度サイクルを伴うPCR反応と、温度を伴わない各種等温増幅反応が含まれる。等温増幅反応としては、例えば、LAMP(Loop-Mediated Isothermal Amplification)法やSMAP(SMart Amplification Process)法、NASBA(Nucleic Acid Sequence-Based Amplification)法、ICAN(Isothermal and Chimeric primer-initiated Amplification of Nucleic acids)法(登録商標)、TRC(transcription-reverse transcription concerted)法、SDA(strand displacement amplification)法、TMA(transcription-mediated amplification)法、RCA(rolling circle amplification)法等が挙げられる。この他、「核酸増幅反応」には、核酸の増幅を目的とする変温あるいは等温による核酸増幅反応が広く包含されるものとする。
【発明の効果】
【0012】
本発明により、サンプル中に含まれる検出対象核酸鎖の凡その量を簡便に測定するための技術が提供される。
【図面の簡単な説明】
【0013】
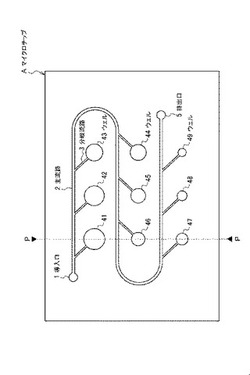
【図1】本発明の第一実施形態に係る核酸増幅反応用マイクロチップAの構成を説明するための上面模式図である。
【図2】マイクロチップAの構成を説明するための断面模式図である。
【図3】本発明の第二実施形態に係る核酸増幅反応用マイクロチップBの構成を説明するための上面模式図である。
【図4】マイクロチップBのウェル内に存在する核酸増幅反応に必要な物質を説明するための模式図である。
【図5】本発明の変形例に係る核酸増幅反応用マイクロチップCの構成を説明するための上面模式図である。
【図6】インフルエンザウイルスゲノムの定量を行った結果を示すグラフである。
【発明を実施するための形態】
【0014】
以下、本発明を実施するための好適な形態について図面を参照しながら説明する。なお、以下に説明する実施形態は、本発明の代表的な実施形態の一例を示したものであり、これにより本発明の範囲が狭く解釈されることはない。なお、説明は以下の順序により行う。
1.本発明の第一実施形態に係る核酸定量方法及び核酸増幅反応用マイクロチップ
(1)核酸増幅反応用マイクロチップ
(2)核酸定量方法
2.本発明の第二実施形態に係る核酸定量方法及び核酸増幅反応用マイクロチップ
(1)核酸増幅反応用マイクロチップ
(2)核酸定量方法
3.本発明の第三実施形態に係る核酸定量方法及び核酸増幅反応用マイクロチップ
(1)核酸増幅反応用マイクロチップ
(2)核酸定量方法
【0015】
1.本発明の第一実施形態に係る核酸定量方法及び核酸増幅反応用マイクロチップ
(1)核酸増幅反応用マイクロチップ
図1及び図2は、本発明の第一実施形態に係る核酸増幅反応用マイクロチップ(以下、単に「マイクロチップ」とも称する)の構成を説明する模式図である。図1は上面模式図、図2は図1中のP−P断面に対応する断面模式図である。
【0016】
図中、符号Aで示すマイクロチップには、外部から液体(サンプル溶液)が導入される導入口1と、一端において導入口1に連通する主流路2と、主流路2から分岐する分岐流路3と、核酸増幅反応の反応場となる複数のウェル41〜49(反応領域)が配設されている。主流路2の他端は、サンプル溶液を外部に排出する排出口5に連通されている。分岐流路3は、主流路2の導入口1への連通部と排出口5への連通部との間において主流路2から分岐し、各ウェルに接続されている。なお、マイクロチップAにおいて、排出口5は必須の構成とはならず、導入口1から導入されたサンプル溶液が外部に排出されない構成であってもよい。
【0017】
導入口1から主流路2に送液されるサンプル溶液は、分岐流路3を通流して、導入口1近位(送液方向上流)のウェル41内から排出口5近位(送液方向下流)のウェル49内にまで順次導入される。サンプル液には、検出対象核酸鎖となるDNAやゲノムRNA、mRNAなどが含まれる。また、サンプル溶液には、核酸増幅反応に必要なオリゴヌクレオチドプライマー(以下、単に「プライマー」とも称する)や酵素、核酸モノマー(dNTP)、反応緩衝液(バッファー)溶質などの試薬が含まれ得る。
【0018】
ウェル41〜49は、送液方向上流のウェル41から下流のウェル49の順で、内容積が次第に小さくされており、ウェル内に導入されるサンプル溶液の容量が導入口1近位のウェルほど多く、排出口5近位のウェルほど少なくなるように構成されている。ウェル41〜49の内容積は、送液方向に従って、例えば0.9〜0.01倍程度、好ましくは0.5〜0.1倍程度の範囲で順次小さくなるように形成される。
【0019】
各ウェル内における核酸増幅反応の起こり易さ(反応効率)は、該ウェル内に導入される検出対象核酸鎖の量に依存し、各ウェル内に導入される検出対象核酸鎖の量は、該ウェル内に導入されるサンプル溶液の容量、すなわちウェルの内容積に依存する。そのため、送液方向上流のウェル41から下流のウェル49の順で、ウェルの内容積を次第に小さく構成することにより、ウェル内における核酸増幅反応が同順で次第に起こり難くなるように構成できる。
【0020】
マイクロチップAは、導入口1、主流路2、分岐流路3、ウェル41〜49及び排出口5を形成した基板層a1に基板層a2を貼り合わせて構成されている。基板層a1,a2の材質は、ガラスや各種プラスチック(ポリプロピレン、ポリカーボネート、シクロオレフィンポリマー、ポリジメチルシロキサン)とすることができる。ウェル内で増幅産物の検出を光学的に行う場合には、基板層a1,a2の材質は、光透過性を有し、自家蛍光が少なく、波長分散が小さいために光学誤差の少ない材料を選択することが好ましい。なお、導入口1等は、基板層a2に形成されていてもよく、基板層a1及び基板層a2の両方に一部ずつ形成されていてもよい。また、マイクロチップを構成する基板層は2以上であってよい。
【0021】
(2)核酸定量方法
次に、マイクロチップAを用いた本発明の第一実施形態に係る核酸定量方法について説明する。
【0022】
まず、サンプル溶液を導入口1から主流路2に送液し、ウェル41〜49内に導入し、定法に従ってPCR反応やLAMP反応などの核酸増幅反応を行なう。例えばPCR法では、熱変性、アニーリング、伸長反応の3つのステップからなる所定の温度サイクルを実施することにより、核酸増幅反応を進行させる。また、例えばLAMP法では、所定の反応温度に保持することにより、核酸増幅反応を進行させる。
【0023】
上述のように、マイクロチップAは、送液方向上流のウェル41から下流のウェル49の順で、ウェルの内容積を次第に小さく構成することにより、ウェル内における核酸増幅反応が同順で次第に起こり難くなるように構成されている。従って、この手順では、サンプル溶液に含まれる検出対象核酸鎖の量が多いほど、送液方向下流のウェル内でまで核酸増幅反応が生じ、逆に、サンプル溶液に含まれる検出対象核酸鎖の量が少ない場合には、より送液方向上流のウェル内でしか反応が生じない。
【0024】
次に、各ウェル内の増幅産物を検出することにより、核酸増幅反応が生じたウェルを特定する。増幅産物の検出は、蛍光色素や蛍光色素を標識した蛍光プローブを用い、増幅産物の生成に伴って蛍光色素から生じる蛍光を検出することにより行うことができる。また、核酸増幅反応が生じたウェルの特定は、マイクロチップAの蛍光像を撮像し、得られた画像を画像処理システムで解析し、各ウェル内の蛍光色素からの蛍光信号をウェル毎に自動計測することによって行うことができる。また、核酸増幅反応が生じたウェルの特定は、上記画像を目視によって観察し、あるいは蛍光顕微鏡等を用いてマイクロチップAを観察し、各ウェル内からの蛍光の有無を確認することによって行ってもよい。
【0025】
最後に、特定されたウェルにおける核酸増幅反応の起こり易さの程度に基づいて、サンプル溶液に含まれる検出対象核酸鎖の量を測定する。マイクロチップAでは、サンプル溶液に含まれる検出対象核酸鎖の量が多いほど、送液方向下流のウェル内でまで核酸増幅反応が生じる。そのため、核酸増幅反応が生じたウェルを特定することで、サンプル溶液に含まれる検出対象核酸鎖量の多寡を判定できる。具体的には、ウェル41,42で核酸増幅反応が生じた場合には、ウェル41でのみ反応が生じた場合に比べて、サンプル溶液により多くの検出対象核酸鎖が含まれていたと判定できる。同様に、ウェル41からより送液方向下流のウェルを含むウェルで核酸増幅反応が生じている程、サンプル溶液により多くの検出対象核酸鎖が含まれていたと判定できる。
【0026】
さらに、検出対象核酸鎖を既知量で含む溶液を用いて、検出対象核酸鎖量と核酸増幅反応が生じるウェル(あるいはその容量)との関係を予め取得しておけば、サンプル溶液に含まれる検出対象核酸鎖量をより正確に測定できる。
【0027】
以上のように、本実施形態に係る核酸定量方法によれば、核酸増幅反応の起こり易さの程度が変化するように構成されたマイクロチップを用いて核酸増幅反応を行ない、反応が生じたウェルを特定することで、サンプル溶液に含まれる検出対象核酸鎖の凡その量を測定できる。
【0028】
本実施形態では、マイクロチップに縦横3例で合計9つのウェルを均等間隔で配設する場合を例として説明したが、ウェルの数や配設位置は任意とでき、ウェルの形状も図に示した円柱形状に限定されない。また、導入口1に導入されたサンプル溶液を各ウェル内に供給するための流路の構成も、図に示した主流路2及び分岐流路3の態様に限定されない。
【0029】
また、本実施形態では、ウェルの面積を変化させて内容積を小さく(あるいは大きく)する場合を例として説明したが、ウェルの内容積は深さを変化させることにより小さくしてもよい。また、内容積を異ならせたウェルの配列順序は、送液方向上流のウェルから下流の順で次第に小さくなる態様に限定されないものとする。
【0030】
2.本発明の第二実施形態に係る核酸定量方法及び核酸増幅反応用マイクロチップ
(1)核酸増幅反応用マイクロチップ
図3は、本発明の第二実施形態に係る核酸増幅反応用マイクロチップ(以下、単に「マイクロチップ」とも称する)の構成を説明する上面模式図である。
【0031】
図中、符号Bで示すマイクロチップには、外部からサンプル溶液が導入される導入口1と、一端において導入口1に連通する主流路2と、主流路2から分岐する分岐流路3と、核酸増幅反応の反応場となる複数のウェル41〜49が配設されている。主流路2の他端は、サンプル溶液を外部に排出する排出口5に連通されている。分岐流路3は、主流路2の導入口1への連通部と排出口5への連通部との間において主流路2から分岐し、各ウェルに接続されている。なお、マイクロチップBにおいて、排出口5は必須の構成とはならず、導入口1から導入されたサンプル溶液が外部に排出されない構成であってもよい。
【0032】
導入口1から主流路2に送液されるサンプル溶液は、分岐流路3を通流して、導入口1近位(送液方向上流)のウェル41内から排出口5近位(送液方向下流)のウェル49内にまで順次導入される。サンプル液には、検出対象核酸鎖となるDNAやゲノムRNA、mRNAなどが含まれる。
【0033】
ウェル41〜49内には、核酸等幅反応に必要な物質の少なくとも一部が異なる量で予め収容されている。ウェル内に予め収容される物質は、核酸等幅反応において増幅産物を得るために必要な物質であって、具体的には、プライマーや酵素、核酸モノマー、反応緩衝液溶質などとされる。ウェル内に収容される物質はこれらのうち1あるいは2以上とでき、残りの物質はサンプル液中に含まれて導入口1からウェル内に導入される。
【0034】
図4に、ウェル内にプライマーと酵素を異なる量で収容した例を示す。ウェル41〜49は、送液方向上流のウェル41から下流のウェル49の順で、収容されるプライマーP及び酵素Eの量が次第に少なくなるようにされている。図では、ウェル41,42,43について、積層されて収容されたプライマーP及び酵素Eの積層厚を次第に小さくすることにより量を変化させた場合を示した。
【0035】
ウェル41〜49のプライマーP及び酵素Eの量は、送液方向に従って、例えば0.9〜0.01倍程度、好ましくは0.5〜0.1倍程度の範囲で順次少なくなるように収容される。
【0036】
各ウェル内における核酸増幅反応の起こり易さ(反応効率)は、該ウェル内に収容された反応に必要な物質の量に依存する。そのため、送液方向上流のウェル41から下流のウェル49の順で、ウェル内に収容するプライマーP及び酵素Eの量を次第に少なくすることにより、ウェル内における核酸増幅反応が同順で次第に起こり難くなるように構成できる。
【0037】
(2)核酸定量方法
次に、マイクロチップBを用いた本発明の第二実施形態に係る核酸定量方法について説明する。
【0038】
まず、サンプル溶液を導入口1から主流路2に送液し、ウェル41〜49内に導入する。これによって、ウェル内に予め収容されている反応に必要な物質(ここでは、プライマーP及び酵素E)と、サンプル溶液に含まれる残りの物質を検出対象核酸鎖が混合される。サンプル溶液の導入後、定法に従ってPCR反応やLAMP反応などの核酸増幅反応を行なう。例えばPCR法では、熱変性、アニーリング、伸長反応の3つのステップからなる所定の温度サイクルを実施することにより、核酸増幅反応を進行させる。また、例えばLAMP法では、所定の反応温度に保持することにより、核酸増幅反応を進行させる。
【0039】
上述のように、マイクロチップBは、送液方向上流のウェル41から下流のウェル49の順で、ウェル内に収容された反応に必要な物質の量を次第に少なくすることにより、ウェル内における核酸増幅反応が同順で次第に起こり難くなるように構成されている。従って、この手順では、サンプル溶液に含まれる検出対象核酸鎖の量が多いほど、送液方向下流のウェル内でまで核酸増幅反応が生じ、逆に、サンプル溶液に含まれる検出対象核酸鎖の量が少ない場合には、より送液方向上流のウェル内でしか反応が生じない。
【0040】
次に、各ウェル内の増幅産物を検出することにより、核酸増幅反応が生じたウェルを特定する。増幅産物の検出は、蛍光色素や蛍光色素を標識した蛍光プローブを用い、増幅産物の生成に伴って蛍光色素から生じる蛍光を検出することにより行うことができる。また、核酸増幅反応が生じたウェルの特定は、マイクロチップBの蛍光像を撮像し、得られた画像を画像処理システムで解析し、各ウェル内の蛍光色素からの蛍光信号をウェル毎に自動計測することによって行うことができる。また、核酸増幅反応が生じたウェルの特定は、上記画像を目視によって観察し、あるいは蛍光顕微鏡等を用いてマイクロチップBを観察し、各ウェル内からの蛍光の有無を確認することによって行ってもよい。
【0041】
最後に、特定されたウェルにおける核酸増幅反応の起こり易さの程度に基づいて、サンプル溶液に含まれる検出対象核酸鎖の量を測定する。マイクロチップBでは、サンプル溶液に含まれる検出対象核酸鎖の量が多いほど、送液方向下流のウェル内でまで核酸増幅反応が生じる。そのため、核酸増幅反応が生じたウェルを特定することで、サンプル溶液に含まれる検出対象核酸鎖量の多寡を判定できる。具体的には、ウェル41,42で核酸増幅反応が生じた場合には、ウェル41でのみ反応が生じた場合に比べて、サンプル溶液により多くの検出対象核酸鎖が含まれていたと判定できる。同様に、ウェル41からより送液方向下流のウェルを含むウェルで核酸増幅反応が生じている程、サンプル溶液により多くの検出対象核酸鎖が含まれていたと判定できる。
【0042】
さらに、検出対象核酸鎖を既知量で含む溶液を用いて、検出対象核酸鎖量と核酸増幅反応が生じるウェル(あるいはその容量)との関係を予め取得しておけば、サンプル溶液に含まれる検出対象核酸鎖量をより正確に測定できる。
【0043】
以上のように、本実施形態に係る核酸定量方法によれば、核酸増幅反応の起こり易さの程度が変化するように構成されたマイクロチップを用いて核酸増幅反応を行ない、反応が生じたウェルを特定することで、サンプル溶液に含まれる検出対象核酸鎖の凡その量を測定できる。
【0044】
本実施形態においても、第一実施形態において説明したように、ウェルの数や配設位置は任意とでき、ウェルの形状も図に示した円柱形状に限定されない。また、収容する反応に必要な物質の量を異ならせたウェルの配列順序は、送液方向上流のウェルから下流の順で次第に少なくなる態様に限定されないものとする。
【0045】
さらに、導入口1に導入されたサンプル溶液を各ウェル内に供給するための流路の構成も、図に示した主流路2及び分岐流路3の態様に限定されず、例えば図5に示すような分岐流路を有さない構成を採用してもよい。図5に示すマイクロチップCでは、ウェル41〜49は、主流路2によって、一のウェル内に導入されたサンプル溶液が主流路2に溢流して隣り合う他の一のウェルに順次導入されるように連通されて配設されている。導入口1から主流路2に送液されるサンプル溶液はまず導入口1近位のウェル41に充填され、ウェル41から溢流したサンプル溶液が隣接するウェル42内に導入される。同様にして、ウェル42から溢流したサンプル溶液が送液方向下流のウェルに順次導入される。
【0046】
マイクロチップBは、マイクロチップAと同様に、2枚の基板層の貼り合わせによって構成できる。核酸増幅反応に必要な物質のウェル内への収容は、導入口1、主流路2、分岐流路3、ウェル41〜49及び排出口5の成型後、基板層の貼り合せ前に、ウェル内にプライマー溶液や酵素溶液等を滴下し乾燥させることによって行うことができる。
【0047】
導入口1等の成型は、ガラス製基板層のウェットエッチングやドライエッチングによって、あるいはプラスチック製基板層のナノインプリントや射出成型、切削加工によって行うことができる。
【0048】
プライマー溶液や酵素溶液等の乾燥は、風乾、真空乾燥あるいは凍結乾燥等によって、好ましくは緩徐に行う。ウェル内に収容する物質を酵素とする場合には、活性の低下や失活を防止するため、滴下した酵素溶液は、臨界点乾燥により乾燥させることが好ましい。また、ウェル内には、増幅産物の検出のための蛍光色素や蛍光色素を標識した蛍光プローブも収容しておいてよい。ここで、プライマー溶液や酵素溶液等の滴下及び乾燥の順序は特に限定されず、プライマーや酵素は図4に示したように積層されて収容される必要はないものとする。
【0049】
基板層の貼り合わせは、例えば、基板層の表面を酸素プラズマ処理又は真空紫外光処理により活性化して貼り合せる方法を採用できる。酸素プラズマ処理又は真空紫外光処理は、基板層の材料に応じて適宜な条件を設定して行う。
【0050】
3.本発明の第三実施形態に係る核酸定量方法及び核酸増幅反応用マイクロチップ
(1)核酸増幅反応用マイクロチップ
次に、本発明の第三実施形態に係る核酸増幅反応用マイクロチップ(以下、単に「マイクロチップ」とも称する)について説明する。ここで、本実施形態に係る核酸増幅反応用マイクロチップの構成については、収容される物質以外、第二実施形態に係るマイクロチップBと実質的に同一であるため、図3を参照しながら以下説明する。
【0051】
図中、本実施形態に係るマイクロチップでは、ウェル41〜49のうち、少なくとも1つのウェルが、補正用ウェルとして用いられるという点以外は、第二実施形態に係るマイクロチップと実質的に同一である。そのため、ここでは、補正用ウェルについて主に説明する。また、特に、ウェル49が補正用ウェルとして用いられる場合を例に以下説明する。ここでいう、補正用ウェルとは、濃度が予め認識されている核酸鎖が収容されたウェルである。
【0052】
補正用ウェルには、他のウェル41〜48と同様に酵素E及びプライマーPが収容され、更に、濃度が予め認識されている補正用核酸鎖が収容されている。なお、サンプル液に含まれる検出対象核酸鎖と、補正用核酸鎖とは、同一の配列であっても一部同一の配列であってもよい。検出対象核酸鎖と、補正用核酸鎖とが同一の配列の場合、例えば、検出対象核酸鎖にRNA、補正用核酸鎖にDNAを用い、ウェル41〜48には、逆転写酵素、DNAポリメラーゼを収容し、補正用ウェルには、DNAポリメラーゼを収容する。一方、補正用核酸鎖と、補正用核酸鎖とが一部のみ同一の配列の場合、補正用ウェル及び他のウェル41〜48には、夫々に対応する異なるプライマーを収容すればよい。
【0053】
(2)核酸定量方法
次に、本発明の第三実施形態に係る核酸定量方法について説明する。なお、第三実施形態に係る核酸定量方法は、第二実施形態に係る核酸定量方法と比し、ウェル41〜49のうち、ウェル49が補正用ウェルとして用いられる点以外は、実質的に同一であるため、ここでは、補正用ウェルが用いられる点についてのみ説明する。
【0054】
すなわち、導入口1から送液したサンプル溶液は、送液方向上流のウェル41から下流のウェル49の順で導入され、核酸増幅反応が進行する。そして、補正用ウェルでは、予め濃度が認識されている補正用核酸鎖の核酸増幅反応が進行する。次に、増幅産物の検出は、蛍光色素や蛍光色素を標識した蛍光プローブを用い、増幅産物の生成に伴って蛍光色素から生じる蛍光を検出することにより行う。
【0055】
各ウェル41〜49に導入されるサンプル溶液には、夾雑物や反応阻害物等が含まれている可能性がある。そのため、上記夾雑物や反応阻害物等が、反応効率に影響を与え、測定のばらつきの要因となる。この点、本実施形態に係るマイクロチップでは、濃度が予め認識されている補正用核酸鎖が収容された補正用ウェルを設けているので、上記ばらつきを補正して蛍光の強度等から増幅産物の濃度の認識を可能にする。
【0056】
以上のように、本実施形態に係る核酸定量方法によれば、マイクロチップの1又は複数のウェルを補正用ウェルとして用いるため、検出対象核酸鎖を含むサンプル溶液中の夾雑物、反応阻害物等の影響を把握することができる。より具体的には、サンプル内の検出対象核酸鎖の量が同じでもサンプルに由来する夾雑物や反応阻害物等の影響の大小によって反応効率に差が生じ、蛍光強度が変わってくる。本実施形態に係る核酸定量方法によれば、このようなばらつきを補正することができる。
【0057】
また、上述では、補正ウェルについては、1つのウェル49のみを用いる例を挙げたが、2以上のウェルを用いてもよい。例えば、濃度が異なる複数のウェルを補正用ウェルとして用い、検出対象核酸鎖と補正用核酸鎖が同一配列である場合には、補正用ウェルの蛍光強度測定に基づいて、検量線を作成してサンプル溶液に含まれる検出対象核酸鎖の量を測定することができる。
【0058】
なお、本実施形態では、マイクロチップBのウェルを補正用ウェルとして用いる場合を例に説明したが、本発明に係る第一実施形態に係るマイクロチップAの1又は複数のウェルを補正用ウェルとして用いてもよい。
【実施例】
【0059】
以下の手順に従って、従来のRT−PCR法と本発明に係る方法とを用いて核酸定量を行った。
【0060】
インフルエンザ感染の疑いのある患者由来の鼻腔拭い液(17検体)を130μLの緩衝液に懸濁した。懸濁液の半量を、市販のインフルエンザウイルス用抽出試薬(栄研化学株式会社、Cat.No.LMP801)と混合した。市販のプライマーセット(栄研化学株式会社、Cat.No.PM0021)とRT−RAMPキット(栄研化学株式会社、Cat.No.LMP244)を用いて、混合液中のインフルエンザゲノムのRAMP反応を行った。装置にはBio−Rad製のリアルタイムRT−PCR装置(Chromo4)を用い、マイクロチップには9ウェルのチップを用いた。RAMP反応の開始30分以内に蛍光強度の増加が確認されたウェルをインフルエンザゲノム陽性と判定した。
【0061】
また、鼻腔拭い液の懸濁液の半量から、市販のRNA抽出キット(QIAGEN、Cat.No.52904)を用いてインフルエンザゲノムを精製し、世界保健機関(WHO)推奨のプロトコール(“WHO information for laboratory diagnosis of pandemic (H1N1) 2009 virus in humans - revised” 23 November 2009)に従ってRT−PCR解析を行った。
【0062】
結果を、図6に示す。縦軸は、RAMP反応の開始30分以内に蛍光強度の増加が確認された陽性ウェル数を示す。また、横軸は、RT−PCR解析による検出サイクル数を示す。RT−PCR解析による検出サイクル数と陽性ウェル数との間に相関が認められ、陽性ウェルの数によって検体中のインフルエンザゲノム量を定量可能であることが示された。
【産業上の利用可能性】
【0063】
本発明に係る核酸定量方法等によれば、サンプル中に含まれる検出対象核酸鎖の凡その量を簡便に測定することができる。従って、本発明に係る核酸定量方法等は、サンプル中の病原体ゲノムの凡その量を測定し、病原体が多いか少ないかを調べることによって、感染症の重症度や発症段階を簡易に診断するために特に有用である。
【符号の説明】
【0064】
A,B,C:核酸増幅反応用マイクロチップ、P:プライマー、E:酵素、1:導入口、2:主流路、3:分岐流路、41,42,43,44,45,46,47,48,49:ウェル、5:排出口
【技術分野】
【0001】
本発明は、核酸定量方法及び核酸増幅反応用マイクロチップに関する。より詳しくは、サンプル中に含まれる検出対象核酸鎖の凡その量を簡便に測定するための核酸定量方法等に関する。
【背景技術】
【0002】
従来、PCR(Polymerase Chain Reaction)法等の核酸増幅法が、感染症や遺伝性疾患の診断、遺伝子の発現量解析やクローニングなどのために用いられている。また、蛍光色素や蛍光色素を標識した蛍光プローブを用い、これらの蛍光強度の増加量に基づいて検出対象核酸鎖の増幅量をリアルタイムに測定し、当初の検出対象核酸鎖量を定量するリアルタイム核酸増幅法も行われている。
【0003】
非特許文献1では、微量な核酸鎖を正確に定量するための「デジタルPCR」と称される技術が提案されている。デジタルPCRでは、検出対象核酸鎖を含むサンプルを反応溶液中に限界希釈し、複数の反応場(ウェル)に分注して、PCR反応を行なう。そして、蛍光プローブ等を用い、増幅産物に由来する蛍光を発するウェルの数を計数する。限界希釈によって各ウェルには最大1分子(コピー)の検出対象核酸鎖しか存在しないと仮定できるため、蛍光を発するウェルの数によってサンプルに含まれる検出対象核酸鎖のコピー数を定量できる。
【0004】
特許文献1には、デジタルPCRにおいて、反応場となるチャネルをプレートに数千〜数百万配設し、サンプルに含まれる検出対象核酸鎖が各チャネルに1コピーずつ入るようにした核酸定量方法が提案されている。この方法によれば、1つのチャネルに検出対象核酸鎖が2コピー以上入ってしまうことにより蛍光を発するウェルの数と検出対象核酸鎖のコピー数とが不一致となってしまうことがなく、検出対象核酸鎖のコピー数を正確に定量できるとされている。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特開2001−269196号公報
【非特許文献】
【0006】
【非特許文献1】"Digital PCR" Proc. Natl. Acad. Sci. 1999, Vol.96, p.9236-9241
【発明の概要】
【発明が解決しようとする課題】
【0007】
上述のように、デジタルPCRでは、サンプル中の検出対象核酸鎖のコピー数を正確に定量できる。一方で、核酸鎖量の定量を目的とした核酸増幅法において、特に感染症の診断を行うような場合には、サンプル中の病原体ゲノムの凡その量を測定し、病原体が多いか少ないかを調べることによって、重症度や発症段階の判定に役立てたいという要求がある。また、このような半定量的な測定は、遺伝子の発現量解析において、mRNAのコピー数を正確に測定することまでは要せず、mRNAの発現量が多いか少ないかを調べたいような場合にも望ましい。
【0008】
そこで、本発明は、サンプル中に含まれる検出対象核酸鎖の凡その量を簡便に測定するための技術を提供することを主な目的とする。
【課題を解決するための手段】
【0009】
上記課題解決のため、本発明は、外部から液体が導入される導入口と、核酸増幅反応の反応場となる複数の反応領域と、導入口から導入される液体を各反応領域内に供給する流路と、が配設され、かつ、各反応領域内における核酸増幅反応の起こり易さの程度が変化するように構成された核酸増幅反応用マイクロチップを用いて、検出対象核酸鎖を含む溶液を前記流路に通流して各反応領域内に導入し、核酸増幅反応を行う手順と、各反応領域内の増幅産物を検出することにより、核酸増幅反応が生じた反応領域を特定する手順と、を行う核酸定量方法を提供する。
この核酸定量方法では、特定された反応領域における核酸増幅反応の起こり易さの程度に基づいて、前記溶液に含まれる検出対象核酸鎖の凡その量を測定できる。すなわち、この核酸定量方法では、特定された反応領域が、核酸増幅反応がより起こり難く構成されたものである程、多くの検出対象核酸鎖が前記溶液に含まれていたと判定できる。
この核酸定量方法において、前記核酸増幅反応用マイクロチップは、前記反応領域の内容積が異なることにより、あるいは、前記反応領域内に反応に必要な物質の少なくとも一部が異なる量で予め収容されていることにより、各反応領域内における核酸増幅反応の起こり易さの程度が変化するように構成されたものを用いることができる。この際、前記反応領域内に予め収容されている反応に必要な物質は、オリゴヌクレオチドプライマー及び/又は酵素とできる。
【0010】
また、本発明は、外部から液体が導入される導入口と、核酸増幅反応の反応場となる複数の反応領域と、導入口から導入される液体を各反応領域内に供給する流路と、が配設され、かつ、各反応領域内における核酸増幅反応の起こり易さの程度が変化するように構成された核酸増幅反応用マイクロチップを提供する。
この核酸増幅反応用マイクロチップは、前記反応領域の内容積が異なることにより、あるいは、前記反応領域内に反応に必要な物質の少なくとも一部が異なる量で予め収容されていることにより、各反応領域内における核酸増幅反応の起こり易さの程度が変化するように構成できる。
これら核酸増幅反応用マイクロチップにおいて、前記反応領域は、一本の前記流路によって、一の反応領域内に導入された液体が該流路に溢流して隣り合う他の一の反応領域に順次導入されるように配設されたものとできる。
【0011】
本発明において、「核酸増幅反応」には、熱変性、アニーリング、伸長反応の3つのステップからなる温度サイクルを伴うPCR反応と、温度を伴わない各種等温増幅反応が含まれる。等温増幅反応としては、例えば、LAMP(Loop-Mediated Isothermal Amplification)法やSMAP(SMart Amplification Process)法、NASBA(Nucleic Acid Sequence-Based Amplification)法、ICAN(Isothermal and Chimeric primer-initiated Amplification of Nucleic acids)法(登録商標)、TRC(transcription-reverse transcription concerted)法、SDA(strand displacement amplification)法、TMA(transcription-mediated amplification)法、RCA(rolling circle amplification)法等が挙げられる。この他、「核酸増幅反応」には、核酸の増幅を目的とする変温あるいは等温による核酸増幅反応が広く包含されるものとする。
【発明の効果】
【0012】
本発明により、サンプル中に含まれる検出対象核酸鎖の凡その量を簡便に測定するための技術が提供される。
【図面の簡単な説明】
【0013】
【図1】本発明の第一実施形態に係る核酸増幅反応用マイクロチップAの構成を説明するための上面模式図である。
【図2】マイクロチップAの構成を説明するための断面模式図である。
【図3】本発明の第二実施形態に係る核酸増幅反応用マイクロチップBの構成を説明するための上面模式図である。
【図4】マイクロチップBのウェル内に存在する核酸増幅反応に必要な物質を説明するための模式図である。
【図5】本発明の変形例に係る核酸増幅反応用マイクロチップCの構成を説明するための上面模式図である。
【図6】インフルエンザウイルスゲノムの定量を行った結果を示すグラフである。
【発明を実施するための形態】
【0014】
以下、本発明を実施するための好適な形態について図面を参照しながら説明する。なお、以下に説明する実施形態は、本発明の代表的な実施形態の一例を示したものであり、これにより本発明の範囲が狭く解釈されることはない。なお、説明は以下の順序により行う。
1.本発明の第一実施形態に係る核酸定量方法及び核酸増幅反応用マイクロチップ
(1)核酸増幅反応用マイクロチップ
(2)核酸定量方法
2.本発明の第二実施形態に係る核酸定量方法及び核酸増幅反応用マイクロチップ
(1)核酸増幅反応用マイクロチップ
(2)核酸定量方法
3.本発明の第三実施形態に係る核酸定量方法及び核酸増幅反応用マイクロチップ
(1)核酸増幅反応用マイクロチップ
(2)核酸定量方法
【0015】
1.本発明の第一実施形態に係る核酸定量方法及び核酸増幅反応用マイクロチップ
(1)核酸増幅反応用マイクロチップ
図1及び図2は、本発明の第一実施形態に係る核酸増幅反応用マイクロチップ(以下、単に「マイクロチップ」とも称する)の構成を説明する模式図である。図1は上面模式図、図2は図1中のP−P断面に対応する断面模式図である。
【0016】
図中、符号Aで示すマイクロチップには、外部から液体(サンプル溶液)が導入される導入口1と、一端において導入口1に連通する主流路2と、主流路2から分岐する分岐流路3と、核酸増幅反応の反応場となる複数のウェル41〜49(反応領域)が配設されている。主流路2の他端は、サンプル溶液を外部に排出する排出口5に連通されている。分岐流路3は、主流路2の導入口1への連通部と排出口5への連通部との間において主流路2から分岐し、各ウェルに接続されている。なお、マイクロチップAにおいて、排出口5は必須の構成とはならず、導入口1から導入されたサンプル溶液が外部に排出されない構成であってもよい。
【0017】
導入口1から主流路2に送液されるサンプル溶液は、分岐流路3を通流して、導入口1近位(送液方向上流)のウェル41内から排出口5近位(送液方向下流)のウェル49内にまで順次導入される。サンプル液には、検出対象核酸鎖となるDNAやゲノムRNA、mRNAなどが含まれる。また、サンプル溶液には、核酸増幅反応に必要なオリゴヌクレオチドプライマー(以下、単に「プライマー」とも称する)や酵素、核酸モノマー(dNTP)、反応緩衝液(バッファー)溶質などの試薬が含まれ得る。
【0018】
ウェル41〜49は、送液方向上流のウェル41から下流のウェル49の順で、内容積が次第に小さくされており、ウェル内に導入されるサンプル溶液の容量が導入口1近位のウェルほど多く、排出口5近位のウェルほど少なくなるように構成されている。ウェル41〜49の内容積は、送液方向に従って、例えば0.9〜0.01倍程度、好ましくは0.5〜0.1倍程度の範囲で順次小さくなるように形成される。
【0019】
各ウェル内における核酸増幅反応の起こり易さ(反応効率)は、該ウェル内に導入される検出対象核酸鎖の量に依存し、各ウェル内に導入される検出対象核酸鎖の量は、該ウェル内に導入されるサンプル溶液の容量、すなわちウェルの内容積に依存する。そのため、送液方向上流のウェル41から下流のウェル49の順で、ウェルの内容積を次第に小さく構成することにより、ウェル内における核酸増幅反応が同順で次第に起こり難くなるように構成できる。
【0020】
マイクロチップAは、導入口1、主流路2、分岐流路3、ウェル41〜49及び排出口5を形成した基板層a1に基板層a2を貼り合わせて構成されている。基板層a1,a2の材質は、ガラスや各種プラスチック(ポリプロピレン、ポリカーボネート、シクロオレフィンポリマー、ポリジメチルシロキサン)とすることができる。ウェル内で増幅産物の検出を光学的に行う場合には、基板層a1,a2の材質は、光透過性を有し、自家蛍光が少なく、波長分散が小さいために光学誤差の少ない材料を選択することが好ましい。なお、導入口1等は、基板層a2に形成されていてもよく、基板層a1及び基板層a2の両方に一部ずつ形成されていてもよい。また、マイクロチップを構成する基板層は2以上であってよい。
【0021】
(2)核酸定量方法
次に、マイクロチップAを用いた本発明の第一実施形態に係る核酸定量方法について説明する。
【0022】
まず、サンプル溶液を導入口1から主流路2に送液し、ウェル41〜49内に導入し、定法に従ってPCR反応やLAMP反応などの核酸増幅反応を行なう。例えばPCR法では、熱変性、アニーリング、伸長反応の3つのステップからなる所定の温度サイクルを実施することにより、核酸増幅反応を進行させる。また、例えばLAMP法では、所定の反応温度に保持することにより、核酸増幅反応を進行させる。
【0023】
上述のように、マイクロチップAは、送液方向上流のウェル41から下流のウェル49の順で、ウェルの内容積を次第に小さく構成することにより、ウェル内における核酸増幅反応が同順で次第に起こり難くなるように構成されている。従って、この手順では、サンプル溶液に含まれる検出対象核酸鎖の量が多いほど、送液方向下流のウェル内でまで核酸増幅反応が生じ、逆に、サンプル溶液に含まれる検出対象核酸鎖の量が少ない場合には、より送液方向上流のウェル内でしか反応が生じない。
【0024】
次に、各ウェル内の増幅産物を検出することにより、核酸増幅反応が生じたウェルを特定する。増幅産物の検出は、蛍光色素や蛍光色素を標識した蛍光プローブを用い、増幅産物の生成に伴って蛍光色素から生じる蛍光を検出することにより行うことができる。また、核酸増幅反応が生じたウェルの特定は、マイクロチップAの蛍光像を撮像し、得られた画像を画像処理システムで解析し、各ウェル内の蛍光色素からの蛍光信号をウェル毎に自動計測することによって行うことができる。また、核酸増幅反応が生じたウェルの特定は、上記画像を目視によって観察し、あるいは蛍光顕微鏡等を用いてマイクロチップAを観察し、各ウェル内からの蛍光の有無を確認することによって行ってもよい。
【0025】
最後に、特定されたウェルにおける核酸増幅反応の起こり易さの程度に基づいて、サンプル溶液に含まれる検出対象核酸鎖の量を測定する。マイクロチップAでは、サンプル溶液に含まれる検出対象核酸鎖の量が多いほど、送液方向下流のウェル内でまで核酸増幅反応が生じる。そのため、核酸増幅反応が生じたウェルを特定することで、サンプル溶液に含まれる検出対象核酸鎖量の多寡を判定できる。具体的には、ウェル41,42で核酸増幅反応が生じた場合には、ウェル41でのみ反応が生じた場合に比べて、サンプル溶液により多くの検出対象核酸鎖が含まれていたと判定できる。同様に、ウェル41からより送液方向下流のウェルを含むウェルで核酸増幅反応が生じている程、サンプル溶液により多くの検出対象核酸鎖が含まれていたと判定できる。
【0026】
さらに、検出対象核酸鎖を既知量で含む溶液を用いて、検出対象核酸鎖量と核酸増幅反応が生じるウェル(あるいはその容量)との関係を予め取得しておけば、サンプル溶液に含まれる検出対象核酸鎖量をより正確に測定できる。
【0027】
以上のように、本実施形態に係る核酸定量方法によれば、核酸増幅反応の起こり易さの程度が変化するように構成されたマイクロチップを用いて核酸増幅反応を行ない、反応が生じたウェルを特定することで、サンプル溶液に含まれる検出対象核酸鎖の凡その量を測定できる。
【0028】
本実施形態では、マイクロチップに縦横3例で合計9つのウェルを均等間隔で配設する場合を例として説明したが、ウェルの数や配設位置は任意とでき、ウェルの形状も図に示した円柱形状に限定されない。また、導入口1に導入されたサンプル溶液を各ウェル内に供給するための流路の構成も、図に示した主流路2及び分岐流路3の態様に限定されない。
【0029】
また、本実施形態では、ウェルの面積を変化させて内容積を小さく(あるいは大きく)する場合を例として説明したが、ウェルの内容積は深さを変化させることにより小さくしてもよい。また、内容積を異ならせたウェルの配列順序は、送液方向上流のウェルから下流の順で次第に小さくなる態様に限定されないものとする。
【0030】
2.本発明の第二実施形態に係る核酸定量方法及び核酸増幅反応用マイクロチップ
(1)核酸増幅反応用マイクロチップ
図3は、本発明の第二実施形態に係る核酸増幅反応用マイクロチップ(以下、単に「マイクロチップ」とも称する)の構成を説明する上面模式図である。
【0031】
図中、符号Bで示すマイクロチップには、外部からサンプル溶液が導入される導入口1と、一端において導入口1に連通する主流路2と、主流路2から分岐する分岐流路3と、核酸増幅反応の反応場となる複数のウェル41〜49が配設されている。主流路2の他端は、サンプル溶液を外部に排出する排出口5に連通されている。分岐流路3は、主流路2の導入口1への連通部と排出口5への連通部との間において主流路2から分岐し、各ウェルに接続されている。なお、マイクロチップBにおいて、排出口5は必須の構成とはならず、導入口1から導入されたサンプル溶液が外部に排出されない構成であってもよい。
【0032】
導入口1から主流路2に送液されるサンプル溶液は、分岐流路3を通流して、導入口1近位(送液方向上流)のウェル41内から排出口5近位(送液方向下流)のウェル49内にまで順次導入される。サンプル液には、検出対象核酸鎖となるDNAやゲノムRNA、mRNAなどが含まれる。
【0033】
ウェル41〜49内には、核酸等幅反応に必要な物質の少なくとも一部が異なる量で予め収容されている。ウェル内に予め収容される物質は、核酸等幅反応において増幅産物を得るために必要な物質であって、具体的には、プライマーや酵素、核酸モノマー、反応緩衝液溶質などとされる。ウェル内に収容される物質はこれらのうち1あるいは2以上とでき、残りの物質はサンプル液中に含まれて導入口1からウェル内に導入される。
【0034】
図4に、ウェル内にプライマーと酵素を異なる量で収容した例を示す。ウェル41〜49は、送液方向上流のウェル41から下流のウェル49の順で、収容されるプライマーP及び酵素Eの量が次第に少なくなるようにされている。図では、ウェル41,42,43について、積層されて収容されたプライマーP及び酵素Eの積層厚を次第に小さくすることにより量を変化させた場合を示した。
【0035】
ウェル41〜49のプライマーP及び酵素Eの量は、送液方向に従って、例えば0.9〜0.01倍程度、好ましくは0.5〜0.1倍程度の範囲で順次少なくなるように収容される。
【0036】
各ウェル内における核酸増幅反応の起こり易さ(反応効率)は、該ウェル内に収容された反応に必要な物質の量に依存する。そのため、送液方向上流のウェル41から下流のウェル49の順で、ウェル内に収容するプライマーP及び酵素Eの量を次第に少なくすることにより、ウェル内における核酸増幅反応が同順で次第に起こり難くなるように構成できる。
【0037】
(2)核酸定量方法
次に、マイクロチップBを用いた本発明の第二実施形態に係る核酸定量方法について説明する。
【0038】
まず、サンプル溶液を導入口1から主流路2に送液し、ウェル41〜49内に導入する。これによって、ウェル内に予め収容されている反応に必要な物質(ここでは、プライマーP及び酵素E)と、サンプル溶液に含まれる残りの物質を検出対象核酸鎖が混合される。サンプル溶液の導入後、定法に従ってPCR反応やLAMP反応などの核酸増幅反応を行なう。例えばPCR法では、熱変性、アニーリング、伸長反応の3つのステップからなる所定の温度サイクルを実施することにより、核酸増幅反応を進行させる。また、例えばLAMP法では、所定の反応温度に保持することにより、核酸増幅反応を進行させる。
【0039】
上述のように、マイクロチップBは、送液方向上流のウェル41から下流のウェル49の順で、ウェル内に収容された反応に必要な物質の量を次第に少なくすることにより、ウェル内における核酸増幅反応が同順で次第に起こり難くなるように構成されている。従って、この手順では、サンプル溶液に含まれる検出対象核酸鎖の量が多いほど、送液方向下流のウェル内でまで核酸増幅反応が生じ、逆に、サンプル溶液に含まれる検出対象核酸鎖の量が少ない場合には、より送液方向上流のウェル内でしか反応が生じない。
【0040】
次に、各ウェル内の増幅産物を検出することにより、核酸増幅反応が生じたウェルを特定する。増幅産物の検出は、蛍光色素や蛍光色素を標識した蛍光プローブを用い、増幅産物の生成に伴って蛍光色素から生じる蛍光を検出することにより行うことができる。また、核酸増幅反応が生じたウェルの特定は、マイクロチップBの蛍光像を撮像し、得られた画像を画像処理システムで解析し、各ウェル内の蛍光色素からの蛍光信号をウェル毎に自動計測することによって行うことができる。また、核酸増幅反応が生じたウェルの特定は、上記画像を目視によって観察し、あるいは蛍光顕微鏡等を用いてマイクロチップBを観察し、各ウェル内からの蛍光の有無を確認することによって行ってもよい。
【0041】
最後に、特定されたウェルにおける核酸増幅反応の起こり易さの程度に基づいて、サンプル溶液に含まれる検出対象核酸鎖の量を測定する。マイクロチップBでは、サンプル溶液に含まれる検出対象核酸鎖の量が多いほど、送液方向下流のウェル内でまで核酸増幅反応が生じる。そのため、核酸増幅反応が生じたウェルを特定することで、サンプル溶液に含まれる検出対象核酸鎖量の多寡を判定できる。具体的には、ウェル41,42で核酸増幅反応が生じた場合には、ウェル41でのみ反応が生じた場合に比べて、サンプル溶液により多くの検出対象核酸鎖が含まれていたと判定できる。同様に、ウェル41からより送液方向下流のウェルを含むウェルで核酸増幅反応が生じている程、サンプル溶液により多くの検出対象核酸鎖が含まれていたと判定できる。
【0042】
さらに、検出対象核酸鎖を既知量で含む溶液を用いて、検出対象核酸鎖量と核酸増幅反応が生じるウェル(あるいはその容量)との関係を予め取得しておけば、サンプル溶液に含まれる検出対象核酸鎖量をより正確に測定できる。
【0043】
以上のように、本実施形態に係る核酸定量方法によれば、核酸増幅反応の起こり易さの程度が変化するように構成されたマイクロチップを用いて核酸増幅反応を行ない、反応が生じたウェルを特定することで、サンプル溶液に含まれる検出対象核酸鎖の凡その量を測定できる。
【0044】
本実施形態においても、第一実施形態において説明したように、ウェルの数や配設位置は任意とでき、ウェルの形状も図に示した円柱形状に限定されない。また、収容する反応に必要な物質の量を異ならせたウェルの配列順序は、送液方向上流のウェルから下流の順で次第に少なくなる態様に限定されないものとする。
【0045】
さらに、導入口1に導入されたサンプル溶液を各ウェル内に供給するための流路の構成も、図に示した主流路2及び分岐流路3の態様に限定されず、例えば図5に示すような分岐流路を有さない構成を採用してもよい。図5に示すマイクロチップCでは、ウェル41〜49は、主流路2によって、一のウェル内に導入されたサンプル溶液が主流路2に溢流して隣り合う他の一のウェルに順次導入されるように連通されて配設されている。導入口1から主流路2に送液されるサンプル溶液はまず導入口1近位のウェル41に充填され、ウェル41から溢流したサンプル溶液が隣接するウェル42内に導入される。同様にして、ウェル42から溢流したサンプル溶液が送液方向下流のウェルに順次導入される。
【0046】
マイクロチップBは、マイクロチップAと同様に、2枚の基板層の貼り合わせによって構成できる。核酸増幅反応に必要な物質のウェル内への収容は、導入口1、主流路2、分岐流路3、ウェル41〜49及び排出口5の成型後、基板層の貼り合せ前に、ウェル内にプライマー溶液や酵素溶液等を滴下し乾燥させることによって行うことができる。
【0047】
導入口1等の成型は、ガラス製基板層のウェットエッチングやドライエッチングによって、あるいはプラスチック製基板層のナノインプリントや射出成型、切削加工によって行うことができる。
【0048】
プライマー溶液や酵素溶液等の乾燥は、風乾、真空乾燥あるいは凍結乾燥等によって、好ましくは緩徐に行う。ウェル内に収容する物質を酵素とする場合には、活性の低下や失活を防止するため、滴下した酵素溶液は、臨界点乾燥により乾燥させることが好ましい。また、ウェル内には、増幅産物の検出のための蛍光色素や蛍光色素を標識した蛍光プローブも収容しておいてよい。ここで、プライマー溶液や酵素溶液等の滴下及び乾燥の順序は特に限定されず、プライマーや酵素は図4に示したように積層されて収容される必要はないものとする。
【0049】
基板層の貼り合わせは、例えば、基板層の表面を酸素プラズマ処理又は真空紫外光処理により活性化して貼り合せる方法を採用できる。酸素プラズマ処理又は真空紫外光処理は、基板層の材料に応じて適宜な条件を設定して行う。
【0050】
3.本発明の第三実施形態に係る核酸定量方法及び核酸増幅反応用マイクロチップ
(1)核酸増幅反応用マイクロチップ
次に、本発明の第三実施形態に係る核酸増幅反応用マイクロチップ(以下、単に「マイクロチップ」とも称する)について説明する。ここで、本実施形態に係る核酸増幅反応用マイクロチップの構成については、収容される物質以外、第二実施形態に係るマイクロチップBと実質的に同一であるため、図3を参照しながら以下説明する。
【0051】
図中、本実施形態に係るマイクロチップでは、ウェル41〜49のうち、少なくとも1つのウェルが、補正用ウェルとして用いられるという点以外は、第二実施形態に係るマイクロチップと実質的に同一である。そのため、ここでは、補正用ウェルについて主に説明する。また、特に、ウェル49が補正用ウェルとして用いられる場合を例に以下説明する。ここでいう、補正用ウェルとは、濃度が予め認識されている核酸鎖が収容されたウェルである。
【0052】
補正用ウェルには、他のウェル41〜48と同様に酵素E及びプライマーPが収容され、更に、濃度が予め認識されている補正用核酸鎖が収容されている。なお、サンプル液に含まれる検出対象核酸鎖と、補正用核酸鎖とは、同一の配列であっても一部同一の配列であってもよい。検出対象核酸鎖と、補正用核酸鎖とが同一の配列の場合、例えば、検出対象核酸鎖にRNA、補正用核酸鎖にDNAを用い、ウェル41〜48には、逆転写酵素、DNAポリメラーゼを収容し、補正用ウェルには、DNAポリメラーゼを収容する。一方、補正用核酸鎖と、補正用核酸鎖とが一部のみ同一の配列の場合、補正用ウェル及び他のウェル41〜48には、夫々に対応する異なるプライマーを収容すればよい。
【0053】
(2)核酸定量方法
次に、本発明の第三実施形態に係る核酸定量方法について説明する。なお、第三実施形態に係る核酸定量方法は、第二実施形態に係る核酸定量方法と比し、ウェル41〜49のうち、ウェル49が補正用ウェルとして用いられる点以外は、実質的に同一であるため、ここでは、補正用ウェルが用いられる点についてのみ説明する。
【0054】
すなわち、導入口1から送液したサンプル溶液は、送液方向上流のウェル41から下流のウェル49の順で導入され、核酸増幅反応が進行する。そして、補正用ウェルでは、予め濃度が認識されている補正用核酸鎖の核酸増幅反応が進行する。次に、増幅産物の検出は、蛍光色素や蛍光色素を標識した蛍光プローブを用い、増幅産物の生成に伴って蛍光色素から生じる蛍光を検出することにより行う。
【0055】
各ウェル41〜49に導入されるサンプル溶液には、夾雑物や反応阻害物等が含まれている可能性がある。そのため、上記夾雑物や反応阻害物等が、反応効率に影響を与え、測定のばらつきの要因となる。この点、本実施形態に係るマイクロチップでは、濃度が予め認識されている補正用核酸鎖が収容された補正用ウェルを設けているので、上記ばらつきを補正して蛍光の強度等から増幅産物の濃度の認識を可能にする。
【0056】
以上のように、本実施形態に係る核酸定量方法によれば、マイクロチップの1又は複数のウェルを補正用ウェルとして用いるため、検出対象核酸鎖を含むサンプル溶液中の夾雑物、反応阻害物等の影響を把握することができる。より具体的には、サンプル内の検出対象核酸鎖の量が同じでもサンプルに由来する夾雑物や反応阻害物等の影響の大小によって反応効率に差が生じ、蛍光強度が変わってくる。本実施形態に係る核酸定量方法によれば、このようなばらつきを補正することができる。
【0057】
また、上述では、補正ウェルについては、1つのウェル49のみを用いる例を挙げたが、2以上のウェルを用いてもよい。例えば、濃度が異なる複数のウェルを補正用ウェルとして用い、検出対象核酸鎖と補正用核酸鎖が同一配列である場合には、補正用ウェルの蛍光強度測定に基づいて、検量線を作成してサンプル溶液に含まれる検出対象核酸鎖の量を測定することができる。
【0058】
なお、本実施形態では、マイクロチップBのウェルを補正用ウェルとして用いる場合を例に説明したが、本発明に係る第一実施形態に係るマイクロチップAの1又は複数のウェルを補正用ウェルとして用いてもよい。
【実施例】
【0059】
以下の手順に従って、従来のRT−PCR法と本発明に係る方法とを用いて核酸定量を行った。
【0060】
インフルエンザ感染の疑いのある患者由来の鼻腔拭い液(17検体)を130μLの緩衝液に懸濁した。懸濁液の半量を、市販のインフルエンザウイルス用抽出試薬(栄研化学株式会社、Cat.No.LMP801)と混合した。市販のプライマーセット(栄研化学株式会社、Cat.No.PM0021)とRT−RAMPキット(栄研化学株式会社、Cat.No.LMP244)を用いて、混合液中のインフルエンザゲノムのRAMP反応を行った。装置にはBio−Rad製のリアルタイムRT−PCR装置(Chromo4)を用い、マイクロチップには9ウェルのチップを用いた。RAMP反応の開始30分以内に蛍光強度の増加が確認されたウェルをインフルエンザゲノム陽性と判定した。
【0061】
また、鼻腔拭い液の懸濁液の半量から、市販のRNA抽出キット(QIAGEN、Cat.No.52904)を用いてインフルエンザゲノムを精製し、世界保健機関(WHO)推奨のプロトコール(“WHO information for laboratory diagnosis of pandemic (H1N1) 2009 virus in humans - revised” 23 November 2009)に従ってRT−PCR解析を行った。
【0062】
結果を、図6に示す。縦軸は、RAMP反応の開始30分以内に蛍光強度の増加が確認された陽性ウェル数を示す。また、横軸は、RT−PCR解析による検出サイクル数を示す。RT−PCR解析による検出サイクル数と陽性ウェル数との間に相関が認められ、陽性ウェルの数によって検体中のインフルエンザゲノム量を定量可能であることが示された。
【産業上の利用可能性】
【0063】
本発明に係る核酸定量方法等によれば、サンプル中に含まれる検出対象核酸鎖の凡その量を簡便に測定することができる。従って、本発明に係る核酸定量方法等は、サンプル中の病原体ゲノムの凡その量を測定し、病原体が多いか少ないかを調べることによって、感染症の重症度や発症段階を簡易に診断するために特に有用である。
【符号の説明】
【0064】
A,B,C:核酸増幅反応用マイクロチップ、P:プライマー、E:酵素、1:導入口、2:主流路、3:分岐流路、41,42,43,44,45,46,47,48,49:ウェル、5:排出口
【特許請求の範囲】
【請求項1】
外部から液体が導入される導入口と、核酸増幅反応の反応場となる複数の反応領域と、導入口から導入される液体を各反応領域内に供給する流路と、が配設され、かつ、各反応領域内における核酸増幅反応の起こり易さの程度が変化するように構成された核酸増幅反応用マイクロチップを用いて、
検出対象核酸鎖を含む溶液を前記流路に通流して各反応領域内に導入し、核酸増幅反応を行う手順と、
各反応領域内の増幅産物を検出することにより、核酸増幅反応が生じた反応領域を特定する手順と、
を行う核酸定量方法。
【請求項2】
前記反応領域の内容積が異なることにより、各反応領域内における核酸増幅反応の起こり易さの程度が変化するように構成された核酸増幅反応用マイクロチップを用いる請求項1記載の核酸定量方法。
【請求項3】
前記反応領域内に反応に必要な物質の少なくとも一部が異なる量で予め収容されていることにより、各反応領域内における核酸増幅反応の起こり易さの程度が変化するように構成された核酸増幅反応用マイクロチップを用いる請求項1記載の核酸定量方法。
【請求項4】
前記反応領域内に予め収容されている反応に必要な物質が、オリゴヌクレオチドプライマー及び/又は酵素である請求項3記載の核酸定量方法。
【請求項5】
外部から液体が導入される導入口と、核酸増幅反応の反応場となる複数の反応領域と、導入口から導入される液体を各反応領域内に供給する流路と、が配設され、かつ、各反応領域内における核酸増幅反応の起こり易さの程度が変化するように構成された核酸増幅反応用マイクロチップ。
【請求項6】
前記反応領域の内容積が異なることにより、各反応領域内における核酸増幅反応の起こり易さの程度が変化するように構成された請求項5記載の核酸増幅反応用マイクロチップ。
【請求項7】
前記反応領域内に反応に必要な物質の少なくとも一部が異なる量で予め収容されていることにより、各反応領域内における核酸増幅反応の起こり易さの程度が変化するように構成された請求項5記載の核酸増幅反応用マイクロチップ。
【請求項8】
前記反応領域が、一本の前記流路によって、一の反応領域内に導入された液体が該流路に溢流して隣り合う他の一の反応領域に順次導入されるように配設された請求項5〜7のいずれか一項に記載の核酸増幅反応用マイクロチップ。
【請求項1】
外部から液体が導入される導入口と、核酸増幅反応の反応場となる複数の反応領域と、導入口から導入される液体を各反応領域内に供給する流路と、が配設され、かつ、各反応領域内における核酸増幅反応の起こり易さの程度が変化するように構成された核酸増幅反応用マイクロチップを用いて、
検出対象核酸鎖を含む溶液を前記流路に通流して各反応領域内に導入し、核酸増幅反応を行う手順と、
各反応領域内の増幅産物を検出することにより、核酸増幅反応が生じた反応領域を特定する手順と、
を行う核酸定量方法。
【請求項2】
前記反応領域の内容積が異なることにより、各反応領域内における核酸増幅反応の起こり易さの程度が変化するように構成された核酸増幅反応用マイクロチップを用いる請求項1記載の核酸定量方法。
【請求項3】
前記反応領域内に反応に必要な物質の少なくとも一部が異なる量で予め収容されていることにより、各反応領域内における核酸増幅反応の起こり易さの程度が変化するように構成された核酸増幅反応用マイクロチップを用いる請求項1記載の核酸定量方法。
【請求項4】
前記反応領域内に予め収容されている反応に必要な物質が、オリゴヌクレオチドプライマー及び/又は酵素である請求項3記載の核酸定量方法。
【請求項5】
外部から液体が導入される導入口と、核酸増幅反応の反応場となる複数の反応領域と、導入口から導入される液体を各反応領域内に供給する流路と、が配設され、かつ、各反応領域内における核酸増幅反応の起こり易さの程度が変化するように構成された核酸増幅反応用マイクロチップ。
【請求項6】
前記反応領域の内容積が異なることにより、各反応領域内における核酸増幅反応の起こり易さの程度が変化するように構成された請求項5記載の核酸増幅反応用マイクロチップ。
【請求項7】
前記反応領域内に反応に必要な物質の少なくとも一部が異なる量で予め収容されていることにより、各反応領域内における核酸増幅反応の起こり易さの程度が変化するように構成された請求項5記載の核酸増幅反応用マイクロチップ。
【請求項8】
前記反応領域が、一本の前記流路によって、一の反応領域内に導入された液体が該流路に溢流して隣り合う他の一の反応領域に順次導入されるように配設された請求項5〜7のいずれか一項に記載の核酸増幅反応用マイクロチップ。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】




【図2】


【図3】


【図4】


【図5】


【図6】


【公開番号】特開2012−80870(P2012−80870A)
【公開日】平成24年4月26日(2012.4.26)
【国際特許分類】
【出願番号】特願2010−261934(P2010−261934)
【出願日】平成22年11月25日(2010.11.25)
【出願人】(000002185)ソニー株式会社 (34,172)
【Fターム(参考)】
【公開日】平成24年4月26日(2012.4.26)
【国際特許分類】
【出願日】平成22年11月25日(2010.11.25)
【出願人】(000002185)ソニー株式会社 (34,172)
【Fターム(参考)】
[ Back to top ]

