核酸抽出方法及び核酸抽出用カートリッジ
【課題】操作が簡便であり、短時間で高効率に核酸を抽出できる核酸抽出方法及び核酸抽出用カートリッジの提供。
【解決手段】
核酸を含有するサンプルの超音波処理をする手順、吸着担体により前記サンプルに含まれる物質を吸着する手順、及び電気泳動により移動する前記核酸を堰き止めることで前記核酸を濃縮する手順の各手順を同一セル内で行う核酸抽出方法を提供する。この核酸抽出方法では、同一セル内で、超音波処理、吸着、及び電気泳動を行うことができ、操作毎にセル内からサンプルを移し換えたりする作業を省略することが可能である。
【解決手段】
核酸を含有するサンプルの超音波処理をする手順、吸着担体により前記サンプルに含まれる物質を吸着する手順、及び電気泳動により移動する前記核酸を堰き止めることで前記核酸を濃縮する手順の各手順を同一セル内で行う核酸抽出方法を提供する。この核酸抽出方法では、同一セル内で、超音波処理、吸着、及び電気泳動を行うことができ、操作毎にセル内からサンプルを移し換えたりする作業を省略することが可能である。
【発明の詳細な説明】
【技術分野】
【0001】
本技術は、核酸抽出方法及び核酸抽出用カートリッジに関する。より詳しくは、同一のチャネル内で、超音波処理、夾雑物等の吸着、及び電気泳動をすることによって核酸を抽出する方法に関する。
【背景技術】
【0002】
PCR(Polymerase Chain Reaction)法やLAMP(Loop-Mediated Isothermal Amplification)法等の核酸増幅反応はバイオテクノロジーにおける様々な分野で応用されている。例えば、医学分野では、DNAやRNAの塩基配列に基づいた診断が行われており、農業分野では遺伝子組み換え作物の判定等でDNA鑑定が活用されている。
【0003】
核酸増幅反応では、微量サンプル中の核酸を高効率に増幅して検出できる。しかし、サンプルに含まれる核酸が極めて微量である場合には、検出下限量未満となる場合がある。さらに、サンプル中の核酸濃度が極めて低い場合には、反応場へ導入可能な容積のサンプル中に増幅対象核酸が含まれなかったために検出が不能となる場合がある。これらの場合には、予め精製及び濃縮をして抽出した核酸を反応場に導入することが有効となる。
【0004】
従来、核酸の抽出方法としては、フェノール/クロロホルム/エタノールを用いた方法、核酸を吸着するカラムやフィルタ等を用いた方法、磁性シリカビーズを用いた方法等が知られている。
【0005】
例えば、特許文献1には、核酸吸着能を有する多孔質担体を用いた核酸の濃縮方法が開示されている。また、非特許文献1には、キャピラリー電気泳動によって核酸を濃縮する方法が記載されている。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特開2005−080555号公報
【特許文献2】特開平7−51065号公報
【特許文献3】特開平9−19292号公報
【特許文献4】特開2003−128691号公報
【非特許文献】
【0007】
【非特許文献1】"On-line sample preconcentration in capillary electrophoresis: Fundamentals and applications." Journal of Chromatography A., Vol.1184 (2008)p.504-541
【発明の概要】
【発明が解決しようとする課題】
【0008】
しかしながら、従来のフェノール/クロロホルム/エタノールを用いた方法は、有害な有機溶媒を使用する必要があり、遠心分離操作等に手間がかかっていた。また、核酸を吸着するカラムやフィルタ等を用いた方法は、カラムやフィルタ等が目詰まりを起こしやすく、操作の簡便性からも課題があった。
【0009】
そこで、本技術は、操作が簡便であり、短時間で高効率に核酸を抽出することができる核酸抽出方法を提供することを主な目的とする。
【課題を解決するための手段】
【0010】
上記課題解決のため、本技術は、核酸を含有するサンプルの超音波処理をする手順、吸着担体により上記サンプルに含まれる物質を吸着する手順、及び電気泳動により移動する上記核酸を堰き止めることで上記核酸を濃縮する手順の各手順を同一セル内で行う核酸抽出方法を提供する。この核酸抽出方法では、同一セル内で、超音波処理、吸着、及び電気泳動を行うことができ、操作毎にセル内からサンプルを移し換えたりする作業を省略することが可能である。
また、上記吸着担体としては、好ましくは、陽イオン交換樹脂又はゼオライトを用いる。また、上記陽イオン交換樹脂としては、強酸性陽イオン交換樹脂を用いることが好ましい。
また、上記超音波処理は、上記サンプルにビーズ粒子を混合してから行うことが好ましい。また、上記物質は、上記核酸以外の夾雑物であることが好ましい。
また、上記サンプルの超音波処理をする手順は、上記サンプルを緩衝液で希釈し、該サンプルの超音波処理をする手順であり、上記緩衝液のpHは、4.0〜8.0であることが好ましい。また、上記緩衝液には増粘剤が含まれることが好ましい。また、上記増粘剤にはポリエチレングリコール及び/又はヒドロキシエチルセルロースが含まれることが好ましい。なお、上記セルとは、後述する核酸抽出用カートリッジを主に指す。また、夾雑物とは、サンプル中の核酸の分析において、不要な種々のタンパク質、ペプチド、糖、塩、金属イオン等の物質を主に指す。
【0011】
また、本技術は、核酸を含有するサンプルを導入可能なチャネルと、上記チャネルの両端に電極と、上記チャネルを負極側領域と正極側領域とに区分けし、上記核酸を堰き止める堰止部と、上記負極側領域に、上記サンプルに含まれる物質を吸着する吸着担体と、上記サンプルを超音波処理する超音波発生部と、からなる核酸抽出用カートリッジを提供する。また、上記超音波発生部は、上記電極と同一部材で構成されていてもよい。また、上記堰止部は、透析膜又は高分子ゲルであることが好ましい。また、上記超音波発生部は、超音波プローブ又は超音波ホーンであることが好ましい。
【発明の効果】
【0012】
本技術により、操作が簡便であり、短時間で高効率に核酸を抽出することができる核酸抽出方法が提供される。
【図面の簡単な説明】
【0013】
【図1】本技術の第1実施形態に係る核酸抽出用カートリッジの構成を説明するための模式図である。
【図2】本技術の第1実施形態に係る核酸抽出方法の手順を説明する模式図である。
【図3】本技術の第1実施形態の変形例に係る核酸抽出用カートリッジの構成を説明するための模式図である。
【図4】サンプルのゼオライトに対する吸着率を示すグラフである。
【図5】サンプルの強酸性陽イオン交換樹脂に対する吸着率を示すグラフである。
【図6】サンプルのLAMP反応の結果を示すグラフである。
【発明を実施するための形態】
【0014】
以下、本技術を実施するための好適な形態について説明する。なお、以下に説明する実施形態は、本技術の代表的な実施形態の一例を示したものであり、これにより本技術の範囲が狭く解釈されることはない。説明は以下の順序で行う。
1.本技術の第1実施形態に係る核酸抽出用カートリッジ、核酸抽出方法、及び核酸抽出用カートリッジの製造方法
(1)核酸抽出用カートリッジ
(2)核酸抽出方法
(3)核酸抽出用カートリッジの製造方法
2.本技術の第1実施形態の変形例に係る核酸抽出用カートリッジ、核酸抽出方法、及び核酸抽出用カートリッジの製造方法
【0015】
1.本技術の第1実施形態に係る核酸抽出用カートリッジ、核酸抽出方法、及び核酸抽出用カートリッジの製造方法
(1)核酸抽出用カートリッジ
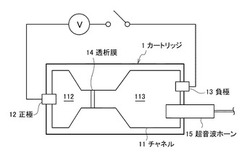
図1は、本技術の第1実施形態に係る核酸抽出用カートリッジの構成を説明するための模式図である。
【0016】
図1中、符号1で示す核酸抽出用カートリッジは、基材中に形成されたチャネル11と、チャネル11の両端にそれぞれ配された正極12と負極13とからなる電極を有する。チャネル11内にはサンプルが導入可能とされており、チャネル11の正極12と負極13との間には透析膜14が配されている。また、正極12と負極13には電源Vが接続され、チャネル11に導入されたサンプルに電圧を印加/解除できるよう構成されている。また、チャネル11の負極側領域113には、吸着担体が収容されている。また、負極側領域113には、超音波ホーン15が配されている。
【0017】
基材の材質は、ガラスや各種プラスチック(ポリプロピレン、ポリカーボネート、シクロオレフィンポリマー、ポリジメチルシロキサン)とできる。
【0018】
チャネル11は、透析膜14により、正極側領域112と負極側領域113とに区分けされる。核酸抽出用カートリッジ1を用いた本技術に係る核酸抽出方法では、核酸を負極13側から正極12側に電気泳動し、透析膜14で堰止めるものである。そのために、サンプルは、チャネル11において、負極側領域113に導入される。
【0019】
また、チャネル11の形状については、特に限定されるものではないが、負極側領域113については、例えば、図1に示すように、負極13から透析膜14に向かうに従い徐々に陥凹する形状に形成される。
【0020】
負極側領域113には、吸着担体が収容される。吸着担体としては、サンプル中の核酸以外の物質を吸着することが可能であれば、特に限定されるものではないが、陽イオン交換樹脂やゼオライト等が好適に用いられる。このように、負極側領域113に吸着担体が収容されることで、本技術に係る核酸抽出方法では、サンプルの電気泳動前に負極側領域113でサンプルに含まれる所定の物質(主にサンプルに含まれる核酸以外の物質)を吸着除去することが可能になる。
【0021】
また、負極側領域113には、ビーズ粒子が収容されていることが好ましい。これにより、後述するように、本技術に係る核酸抽出方法では、より精度良くサンプルの超音波処理を行うことが可能になる。
【0022】
正極12及び負極13については、好適には、電気めっき、スパッタ又は蒸着された金(Au)、または白金を含んでなるものが採用される。もしくは、グラファイトやチタン、ステンレスなどの腐食に強い材料を利用しても良い。
【0023】
透析膜14は、本技術における堰止部の一例である。堰止部は、電気泳動の際にサンプル中の核酸を堰き止めることが可能であれば、特に限定されるものではない。また、堰止部としては、透析膜14の他に、逆浸透膜、半透膜、イオン交換膜などの多孔質膜、又はセルロース、ポリアクリルニトリル、セラミック、ゼオライト、ポリスルホン、ポリイミド、パラジウムなどの多孔質膜等を用いることも可能である。また、透析膜14の代わりに、高分子ゲルを用いることも可能である。
【0024】
高分子ゲルとしては、ポリアクリルアミドが好適に採用され、より好ましくはアニオン性官能基を含有するポリアクリルアミド、さらに好ましくは酸解離定数(pKa)が1〜5であるアニオン性官能基を含有するポリアクリルアミドが用いられる。なお、本実施形態において、アクリルアミドとは、アクリルアミド又は(メタ)アクリルアミドを意味するものとする。
【0025】
アニオン性官能基としては、特に限定されないが、例えば、酢酸、プロピオン酸、酪酸等のカルボン酸;シュウ酸、フタル酸等の多塩基酸;クエン酸、グリコール酸、乳酸等のヒドロキシ酸;アクリル酸、メタクリル酸等の不飽和酸または不飽和多塩基酸;グリシン等のアミノ酸、リン酸の部分エステル、硫酸の部分エステル、ホスホン酸、スルホン酸などが挙げられる。
【0026】
具体的には、例えばカルボン酸としては、蟻酸(pKa:3.55)、酢酸(pKa:4.56)、プロピオン酸(pKa:4.67)、ブタン酸(pKa:4.63)、ペンテン酸(pKa:4.68)、ヘキサン酸(pKa:4.63)、ヘプタン酸(pKa:4.66)、パルミチン酸(pKa:4.64)、ステアリン酸(pKa:4.69)などの脂肪族モノカルボン酸;コハク酸(pKa1 :4.00、pKa2 :5.24)、グルタル酸(pKa1 :4.13、pKa2 :5.03)、アジピン酸(pKa1 :4.26、pKa2 :5.03)、ピメリン酸(pKa1:4.31、pKa2 :5.08)、スベリン酸(pKa1 :4.35、pKa2 :5.10)、アゼライン酸(pKa1 :4.39、pKa2 :5.12)、リンゴ酸(pKa1 :3.24、pKa2 :4.71)、テレフタル酸(pKa1 :3.54、pKa2 :4.46)などの脂肪族又は芳香族のジカルボン酸;クロトン酸(pKa:4.69)、アクリル酸(pKa:4.26)、メタクリル酸(pKa:4.66)などの不飽和カルボン酸;アニス酸(pKa:4.09)、m−アミノ安息香酸(pKa1 :3.12、pKa2 :4.74)、m−,p−クロロ安息香酸(pKa1 :3.82、pKa2 :3.99)、ヒドロキシ安息香酸(pKa1 :4.08、pKa2 :9.96)等の置換安息香酸類;クエン酸(pKa1 :2.87、pKa2 :4,35、pKa3 5.69)などのポリカルボン酸及びその誘導体を挙げることができる。
【0027】
アニオン性官能基を含有するアクリルアミドモノマーは、特にアクリルアミドアルカンスルホン酸が好ましい。スルホン酸としては、例えば、スチレンスルホン酸(pKa=−2.8)、m−アニリンスルホン酸(pKa=3.74)、p−アニリンスルホン酸(pKa=3.23)、2−(メタ)アクリルアミド−2−アルキル(炭素数1〜4)プロパンスルホン酸、より具体的には2−アクリルアミド−2−メチルプロパンスルホン酸(pKa=−1.7)等の重合性の不飽和基を有するスルホン酸が挙げられる。
【0028】
ポリアクリルアミドゲル中のアニオン性官能基の濃度(質量%)は、0〜30%が好ましい。
【0029】
超音波ホーン15は、本技術におけるサンプルを超音波処理する超音波発生部の一例である。超音波ホーン15としては、核酸抽出方法においてサンプルを超音波処理することが可能であれば、形状等は特に限定されるものではなく、超音波ホーン15の代わりに、例えば、超音波プローブ等を用いることも可能である。以下、本実施形態(本技術の第2実施形態でも同様である。)では、本技術における超音波発生部として、超音波ホーン15を主に例に挙げて説明する。
【0030】
(2)核酸抽出方法
次に、本技術に係る核酸抽出方法の手順について、図2(A)〜(D)を参照しながら説明する。
【0031】
ここで、本技術に係る核酸抽出方法を説明する前に、まず、本技術の関連技術に係る核酸抽出方法について説明する。
【0032】
関連技術に係る核酸抽出方法としては、アルカリ化剤を混合して得られたアルカリ化試料を加熱処理し、プロテアーゼ等の酵素によりタンパク質を分解した後、フェノール・クロロフォルム抽出法によりタンパク質、糖質、脂溶性物質を取り除く方法であるAGPC(Acid guanidinium Thiocyanate−Phenol−Chloroform Extraction)法等が挙げられる。しかしながら、この方法は、用いる試薬の種類や多検体の処理の適性等、安全性や迅速性等の面で改良が求められている。
【0033】
また、シリカ等の粒子表面に物理的又は化学的にDNAやRNA等の核酸を結合(吸着)させ、サンプルからDNAやRNA等を分離する方法も挙げられる(例えば、上記特許文献2参照)。しかしながら、この方法では、溶液に懸濁された磁性シリカ粒子を試薬容器からマイクロチューブ等へ分注する場合、粒子水溶液を攪拌し、粒子が分散している間に分注を完了することが求められる。また、このようにして分注した溶液の濃度は均一になりにくく、分注のタイミングにより粒子の濃度が異なる傾向にあり、定量的な解析において改良が求められている。
【0034】
また、核酸を単離するために用いられる粒子として、磁力によって核酸を回収する方法も挙げられる。例えば、超常磁性酸化鉄からなる芯微粒子の表面に、核酸などが共有結合し得る重合性シランからなる被膜が形成されてなる磁性シリカ粒子を使用する方法が挙げられる(例えば、上記特許文献3参照)。
【0035】
また、遺伝子検査業界では、シリカをメンブレンフィルタ状にし、スピンカラムに組み込んで、吸引濾過もしくは遠心濾過を行う核酸抽出方法が行われている。他にも、シリカメンブレンフィルタの代わりに高分子多孔質膜を用いた方法(例えば、上記特許文献4参照)も挙げられる。しかし、これらの方法では、多くの工程、多量の洗浄液、更にポンプもしくは遠心機等の装置が必要になり、全体の装置を大型化させる必要がある。
【0036】
この点、以下に詳述する本技術に係る核酸抽出方法は、本願発明者らの鋭意検討の結果見出されたものであり、操作を非常に簡便にし、短時間で高効率に核酸を抽出可能にしたものである。
【0037】
本技術に係る核酸抽出方法では、まず、チャネル11の透析膜14と負極13との間の負極側領域113に核酸を含有するサンプルを導入する(図2(A)参照)。このとき、チャネル11内には電気泳動用のサンプルを希釈する緩衝液を満たしておく。ここで、導入されるサンプルとしては、例えば、ぬぐい液、口腔スワブ、唾液、全血、血清、血漿、末梢血単球細胞、脳脊髄液、糞、尿、汗、精液、細菌培養液、培養細胞、又は生検組織等の生体由来の液体が用いられる。また、食品中の液体、水、土壌、海水、湖水、川水などの液体も用いられる。そのため、サンプル液には核酸の分析においては不要な種々のタンパク質、糖、金属イオン等の核酸増幅反応を阻害する物質(以下、夾雑物と呼ぶ。)も含まれることがある。
【0038】
次に、超音波ホーン15によりサンプルの超音波処理を行う(図2(B)参照)。上述したようにサンプルとしては、種々の生体由来の液体が用いられるため、上記超音波処理を行うことにより、サンプル中の細胞膜、糖質、脂質膜、ペプチドグリカン層等の強固な膜を破砕することが可能になる。超音波処理するための周波数や処理時間等については、サンプルの種類等に応じて適宜設定することが可能であるが、例えば、菌やウイルス等を精度良く破砕するためには、10kHz以上3MHz以下、より好ましくは30kHz以上の周波数で、5秒〜10分程度超音波処理をすることが好ましい。
【0039】
また、超音波処理による上記の膜の破砕を促進するために、負極側領域113には、ビーズ粒子を収容しておくことが好ましい。ビーズ粒子のサイズや種類等については、特に限定されるものではなく、用いるサンプルに応じて、適宜選択することが可能であるが、例えば、ジルコニア、シリカ、ゼオライト等の無機の粒子、イオン交換樹脂等の有機の粒子が挙げられる。この中でも特に、0.1mm程度の直径を有するジルコニアビーズを用いることが好ましい。また、ビーズ粒子については、サンプルのチャネル11への導入と同時に負極側領域113に収容してもよいし、サンプルの導入前に予め負極側領域113に収容しておいてもよい。
【0040】
また、超音波処理による上記の膜の破砕を更に促進するためには、サンプルに中性もしくは陰イオン性の界面活性剤を含有させておくことが好ましい。界面活性剤としては、サンプルの種類に応じ、適宜選択することが可能であるが、例えば、SDS、Triton−X100、Tween20やBrij35等が挙げられる。
【0041】
また、サンプルを希釈する際に用いる緩衝液には、pH4.0から8.0の領域に緩衝能をもつ緩衝液を用いることが好ましい。具体的には、グリシン塩酸緩衝液、クエン酸緩衝液、酢酸緩衝液、クエン酸−リン酸緩衝液、リン酸緩衝液、トリス−塩酸緩衝液、MES(pKa6.2)、Bis−Tris(pKa6.5)、ADA(pKa6.6)、PIPES(pKa6.8)、ACES(pKa6.9)、MOPSO(pKa6.95)、BES(pKa7.15)、MOPS(pKa7.2)が好ましいがこれに限定されるものではない。
【0042】
また、超音波処理については、ここでは、負極側領域113内で行う場合を例に挙げて説明したが、かかる例に限定されるものではない。例えば、超音波処理は、負極側領域113に隣接した領域内で行い、チューブ等を介して超音波処理後のサンプルを負極側領域113内に流入させてもよい。
【0043】
次に、吸着担体によりサンプルに含まれる物質を吸着する(図2(C)参照)。サンプルに含まれる物質は、主に上述した核酸以外の夾雑物である。これにより、上記夾雑物を吸着担体に吸着しサンプルから除去することで、サンプル中の核酸を選択的に精度良く、後述する電気泳動をさせることが可能になる。ここで、夾雑物の吸着には疎水結合や静電力による吸着を利用することが望ましい。そのため、吸着担体としては、特に疎水表面や負電荷表面を有するものが良く、例えば、ゼオライトや陽イオン交換樹脂等を用いることが好ましい。ゼオライトとしては、ハイシリカのプロトン型ゼオライトがより好ましい。陽イオン交換樹脂としては、強酸性陽イオン交換樹脂がより好ましく、更にはプロトン型強酸性陽イオン交換樹脂がより好ましい。このような吸着担体を用いることで、サンプルのpHを低下させたり、サンプルを脱塩させたりすることが可能になる。強酸性陽イオン交換樹脂としては、交換基にスルホン酸基プロトン型(−SO3H)スルホン酸基ナトリウム型(−SO3Na)を持つものが好ましい。
【0044】
夾雑物の吸着方法については、特に限定されるものではないが、例えば、吸着担体を充填したフィルタを負極側領域113に挿入し超音波処理で破砕したサンプルをフィルタに通液すること等により実行することが可能である。また、上述したサンプルの超音波処理の前に吸着担体を負極側領域113に入れておき、超音波処理と同時に夾雑物の吸着を行うことも可能である。
【0045】
次に、サンプルを電気泳動させる(図2(D)参照)。負に帯電した核酸はチャネル11内を正極12方向へ電気泳動される。この際、透析膜14が核酸の移動を阻み、核酸を堰き止めることによって、透析膜14の界面とその近傍に核酸が濃縮される。電気泳動時間は、チャネル11のサイズに応じて適宜設定されるが、例えば10秒〜10分程度でよい。なお、透析膜14の「界面」とは、透析膜14と領域113側に充填された緩衝液との接触面を指す。
【0046】
また、上記緩衝液には、増粘剤が添加されていてもよい。増粘剤としては、特に限定されないが、緩衝液の粘性を調節することで、電気泳動の速度を制御することができるものが好ましく、例えば、ポリエチレングリコールやヒドロキシエチルセルロース等を用いることが可能であり、それらを混合して用いてもよい。また、緩衝液の粘性を調節することで、電気泳動中に発生するジュール熱が原因で生じる熱対流による濃縮部における核酸の再分散を低減することもできる。
【0047】
更に、領域113の透析膜14近傍の緩衝液を吸引する際に、正極12と負極13に逆電圧を短時間印加することも、核酸の回収量を高めるために有効である。核酸の回収時に短時間逆電圧を印加することで、透析膜14の界面に存在する核酸を、領域113の透析膜14近傍に移動させ、マイクロピペットによって吸引、回収できる。逆電圧を印加する時間は、チャネル11のサイズに応じて適宜設定されるが、例えば1〜10秒程度でよい。
【0048】
最後に、領域113の透析膜14近傍の緩衝液をマイクロピペット等によって吸引することによって、濃縮された核酸を回収する。
【0049】
このように、本技術に係る核酸抽出方法では、サンプルを負極側領域113に導入した後、超音波処理を行い、夾雑物を吸着担体で吸着処理し、電気泳動で核酸を濃縮するものである。このようにして濃縮し、抽出した核酸についての核酸増幅反応を実行することが可能である。なお、サンプルの超音波処理、吸着処理、及び電気泳動の各工程については、夫々独立して行ってもよいし、何れかを組み合わせて実行してもよい。例えば、超音波処理と吸着処理とを同時に行ってから、電気泳動を行ってもよい。また、超音波処理を行ってから、吸着処理と電気泳動とを同時に行ってもよい。また、超音波処理と吸着処理と電気泳動とを全て同時に行ってもよい。
【0050】
更に、本技術に係る核酸抽出方法に用いる吸着担体については、核酸の電気泳動を行う前に、沈降またはフィルタリングの手段で除いてもよい。沈降の方法については、例えば、自然に沈降させる方法や遠心力を用いて沈降させる方法等、多様な方法を採用することができる。また、フィルタリングの方法についても、吸着担体の種類等に応じて、適宜所定の形状を有する多孔質膜等を用いる方法を採用することができる。
【0051】
本技術に係る核酸抽出方法に用いるサンプルについては、超音波処理による上記の膜の破砕を促進し、また、電気泳動をよりスムーズの実行するために、pHは4.0から8.0であることが好ましい。
【0052】
以上説明した本技術に係る核酸抽出方法によれば、サンプルを超音波処理し、吸着処理をし、電気泳動させる手順を同一セル内で行うことが可能である。すなわち、同一セル内で、超音波処理、吸着、及び電気泳動を行うことができ、操作毎にセル内からサンプルを移し換えることを省略することが可能である。そのため、核酸の抽出を非常に簡便に行うことができる。また、短時間で高効率に核酸を抽出することができる。
【0053】
また、本技術に係る核酸抽出方法では、同一セル内で全工程を行い、他の装置等にサンプルを移す必要がないため、サンプルとして感染性を有する検体等を扱う場合には、操作者に対する感染のリスクを低減することができる。サンプルとして血液試料等を用いる際にも、核酸抽出用カートリッジ1の同一領域内でサンプルの導入から核酸の抽出までダイレクトに実行することができる。
【0054】
また、本技術に係る核酸抽出方法では超音波処理を行うことによって、細胞膜、糖質、脂質膜やペプチドグリカン層等の強固な膜を超音波で破砕する。そのため、本技術に係る核酸抽出方法では、核酸増幅反応を阻害するカオトロピックイオンであるグアニジウム塩や強アルカリ等を使用せずに行うことができる。
【0055】
また、本技術に係る核酸抽出方法では、強アルカリや酵素等を用いずに超音波処理で細胞膜、外膜、グラム陽性菌のペプチドグリカン層を破砕することを特徴としている。そのため、例えば、喀痰中の結核菌などの検査時に、還元剤による検体処理等を省略し、簡便に核酸を精度良く抽出することができる。
【0056】
また、特殊の有機溶剤を用いた化学処理等を介さずに超音波処理を行うため、安全に、且つサンプルの劣化を抑制しつつ、上記膜等の破砕を行うことができる。また、強アルカリを使用せずに核酸の抽出をすることができるため、アルカリによるRNAの分解を抑制しつつ、RNAを抽出することができる。
【0057】
また、本技術に係る核酸抽出方法では、加熱する工程も不要であるため、加熱によるRNAの分解も抑制しつつ、RNAを抽出することができる。また、緩衝液のpHを4.0〜8.0とし、サンプルを酸性条件下で超音波処理を行うことにより、RNaseの働きを抑制することができる。
【0058】
また、本技術に係る核酸抽出方法では、吸着担体で夾雑物を除去することが可能である。そのため、電気泳動において核酸だけを効率的に濃縮することが可能になり、検体中の低濃度のターゲット核酸を精度良く検出することが可能になる。
【0059】
また、本技術に係る核酸抽出方法では、サンプルを洗浄する工程を介さず行うことが可能であるため、液切りのためのポンプ、遠心装置、複雑な送液機構等を設けずに核酸抽出方法を行う核酸抽出用カートリッジ1を設計することが可能である。従って、核酸抽出用カートリッジ1の装置の構成は、図1に示したように単純化及び小型化することができる。また、本技術に係る核酸抽出方法では、洗浄する工程を介さず行うことが可能であるため、少量のサンプルから核酸を抽出することができる。
【0060】
(3)核酸抽出用カートリッジの製造方法
本技術の第1実施形態に係る核酸抽出用カートリッジ1は、基材中に形成されたチャネル11内に透析膜14を挿入し、チャネル11を正極側領域112と負極側領域113とに区分けし、負極側領域113内に吸着担体を収容し、超音波ホーン15を設置することによって製造することができる。
【0061】
基材中へのチャネル11の成形は、例えば、ガラス製基材のウェットエッチングやドライエッチングによって、あるいはプラスチック製基材層の切削加工等によって行うことができる。なお、チャネル11はカートリッジ1に1又は2以上形成することができる。
【0062】
正極12及び負極13については、好ましくは金(Au)または白金(Pt)をスパッタまたは蒸着することにより作製される。この点、関連技術に係るカートリッジでは、電極に白金線を用いるものがある。この場合、実験を行う度に白金線を核酸抽出用カートリッジ内に配置する必要が生じ、更に白金線が高価である点等も鑑みると、カートリッジを使い捨てにすることができないでいた。一方、上述したように、本実施形態に係る核酸抽出用カートリッジ1では、金をスパッタまたは蒸着することにより正極12及び負極13を作製し、予めカートリッジ1に電極を作製しておくため、カートリッジ1を簡便に取り扱うことができる。また、このような核酸抽出用カートリッジ1については、関連技術に係る核酸抽出用カートリッジに比し、使い捨てにすることも可能である。従って、核酸抽出用カートリッジ1では、サンプルのコンタミを防止することができる。
【0063】
超音波ホーン15については、サンプルを超音波処理することが可能であれば、適宜設計することが可能であるが、例えば、基材中に埋設することで設置することが可能である。
【0064】
2.本技術の第1実施形態の変形例に係る核酸抽出用カートリッジ、核酸抽出方法、及び核酸抽出用カートリッジの製造方法
次に、ここで、図3を参照しながら、本技術の第1実施形態の変形例に係る核酸抽出用カートリッジ101について説明する。図3は、本技術の第1実施形態の変形例に係る核酸抽出用カートリッジ101の構成を説明するための模式図である。なお、本変形例において、本実施形態と実質的に同一の機能構成を有する構成要素については、重複説明を省略する。
【0065】
本変形例に係る核酸抽出用カートリッジ101に設けられる、チャネル11、正極12、負極13、及び透析膜14は、上述した本実施形態に係る核酸抽出用カートリッジ1と同一の機能構成を有するものである。本変形例に係る核酸抽出用カートリッジ101において、負極と超音波ホーンとが同一部材で形成されている点以外は、本実施形態に係る核酸抽出用カートリッジ1と実質的に同一である。そのため、ここでは、負極と超音波ホーン15とが同一部材で形成された電極/超音波ホーン25についてのみ説明する。
【0066】
本変形例における核酸抽出方法及び核酸抽出用カートリッジ101の製造方法については、負極と超音波ホーンとが同一部材で形成されている点以外は、本技術の第1実施形態に係る核酸抽出方法及び核酸抽出用カートリッジ1の製造方法と同一であるため、ここでは重複説明を省略する。
【0067】
電極/超音波ホーン25は、上述した負極13と同様の機能構成を有するため、好適にはスパッタ又は蒸着された金(Au)または白金を含んでなるものが採用される。また、電極/超音波ホーン25は、上述した超音波ホーン15と同様の機能構成を有するため、核酸抽出方法においてサンプルを超音波処理することが可能であれば、形状等は特に限定されるものではなく、超音波ホーン15の代わりに、例えば、超音波プローブ等を用いることも可能である。
【0068】
なお、本技術は以下のような構成も取ることができる。
(1)核酸を含有するサンプルの超音波処理をする手順、吸着担体により前記サンプルに含まれる物質を吸着する手順、及び電気泳動により移動する前記核酸を堰き止めることで前記核酸を濃縮する手順の各手順を同一セル内で行う核酸抽出方法。
(2)前記吸着担体としては、陽イオン交換樹脂又はゼオライトを用いる、前記(1)記載の核酸抽出方法。
(3)前記陽イオン交換樹脂としては、強酸性陽イオン交換樹脂を用いる、前記(2)記載の核酸抽出方法。
(4)前記サンプルにビーズ粒子を混合し、前記超音波処理をする、前記(1)〜(3)のいずれか1つに記載の核酸抽出方法。
(5)前記物質は、前記核酸以外の夾雑物である、前記(1)〜(4)のいずれか1つに記載の核酸抽出方法。
(6)前記サンプルの超音波処理をする手順は、前記サンプルを緩衝液で希釈し、該サンプルの超音波処理をする手順であり、前記緩衝液のpHは、4.0〜8.0である、前記(1)〜(5)のいずれか1つに記載の核酸抽出方法
(7)前記緩衝液には増粘剤が含まれる、前記(1)〜(6)のいずれか1つに記載の核酸抽出方法。
(8)前記増粘剤にはポリエチレングリコール及び/又はヒドロキシエチルセルロースが含まれる、前記(1)〜(7)記載の核酸抽出方法。
(9)核酸を含有するサンプルを導入可能なチャネルと、前記チャネルの両端に電極と、前記チャネルを負極側領域と正極側領域とに区分けし、前記核酸を堰き止める堰止部と、前記負極側領域に、前記サンプルに含まれる物質を吸着する吸着担体と、前記サンプルを超音波処理する超音波発生部と、からなる核酸抽出用カートリッジ。
(10)前記超音波発生部は、前記電極と同一部材で構成されている、前記(9)記載の核酸抽出用カートリッジ。
(11)前記堰止部は、透析膜又は高分子ゲルである、前記(9)又は(10)記載の核酸抽出用カートリッジ。
(12)前記超音波発生部は、超音波プローブ又は超音波ホーンである、前記(9)〜(11)のいずれか1つに記載の核酸抽出用カートリッジ。
【実施例】
【0069】
1.サンプルの吸着担体に対する吸着量の確認
(1−1.ゼオライトによる核酸精製能)
スピンフィルタカラム(Ultrafree-MC,0.45μm)にプロトン型ゼオライトを100mg計量して入れた。次いで、0.5%SDSを含む50mM MESバッファー(pH5)を調整し、BSAを0.5%となるように加え、さらにCy3修飾した20merオリゴDNAを5μMとなるように加えた。このタンパク質と核酸の混合液を、常温にて十分に攪拌させた後、ゼオライト封入スピンカラムに200ul滴下し、十分に攪拌させた。その後、12000Gにて2分間遠心し、混合液をスピンダウンした。スピンダウンした液をNanodropにて吸光度測定し、ゼオライト処理前後の吸光度の違いから、核酸精製能を評価した。BSAの吸光度はProtein A280モードで評価し、核酸の吸光度はmicro arrayモードでCy3の吸光度で評価した。評価結果を図4に示す。
【0070】
図4に示すように、ゼオライト処理前後のBSA濃度減少量より、ゼオライトへの吸着量は約70%であった。一方、核酸の非特異的吸着量は約45%であった。このことから、ゼオライト処理することにより、タンパク質-核酸の混在系においても、DNA存在比を向上させることができることを確認できた(図4参照)。
【0071】
(1−2.強酸性陽イオン交換樹脂による核酸精製能)
スピンフィルタカラム(Ultrafree-MC,0.45μm)に強酸性陽イオン交換樹脂(Nuvia S(Bio Rad社製))を100mg計量して入れた。次いで、50mM MESバッファー(pH5)を調整し、BSAを0.5%となるように加え、さらにCy3修飾した20merオリゴDNAを5μMとなるように加えた。このタンパク質と核酸の混合液を、常温にて十分に攪拌させた後、強酸性陽イオン交換樹脂封入スピンカラムに200ul滴下し、十分に攪拌させた。その後、12000Gにて2分間遠心し、混合液をスピンダウンした。スピンダウンした液をNanodropにて吸光度測定し、強酸性陽イオン交換樹脂処理前後の吸光度の違いから、核酸精製能を評価した。BSAの吸光度はProtein A280モードで評価し、核酸の吸光度はmicro arrayモードでCy3の吸光度で評価した。評価結果を図5に示す。
【0072】
図5に示すように、強酸性陽イオン交換樹脂処理前後のBSA濃度減少量より、強酸性陽イオン交換樹脂への吸着量は約85%であった。一方、核酸の非特異的吸着量は約28%であった。このことから、強酸性陽イオン交換樹脂処理することにより、タンパク質-核酸の混在系においても、DNA存在比を向上させることができることを確認できた(図5参照)。
【0073】
2.LAMP反応及びRT−LAMP反応
(実施例1)
<超音波処理>
EDTA採血ウシ全血にビフィズス菌を濃度が1000個/uLになるように添加し、2mLのポリプロピレンチューブに1mL分注して、超音波ホーンを浸漬し振動数40kHzで2分間破砕処理を行った。
【0074】
<吸着処理>
次に、スピンフィルタカラム(Ultrafree-MC,0.45μm)にプロトン型ゼオライトを100mg計量して入れた。上記のタンパク質と核酸の混合液を、常温にて十分に攪拌させた後、ゼオライト封入スピンカラムに200ul滴下し、十分に攪拌させた。
【0075】
<電気泳動>
次に、核酸抽出用カートリッジの電極に電圧をDC100Vで20分間印加し、サンプルの電気泳動を行った。
【0076】
<LAMP反応>
次に、サンプル、酵素、蛍光色素、核酸モノマー、バッファー、ターゲット核酸鎖増幅用のプライマーセット、リアルタイム測定用のプローブを混合し、LAMP反応液を調製した。LAMP反応は、リアルタイム計測が可能なサーマルサイクラーChromo4(バイオラッド、米国)を用いて測定を行った。プローブは、消光プローブのQPプローブ(J-bio21, 日本: http://www.j-bio21.co.jp/tech/qpmethod.htm([平成23年7月19日]、題目:QP法))を使用しているので、核酸の増幅と共に蛍光強度の低下が観察される。
【0077】
(結果)
図6に、前処理の各工程から抜き出してLAMP反応を評価した結果を示す。図中、「超音波」と記した結果は、超音波破砕処理のみを行ったサンプルを用いた場合の標的核酸鎖の増幅量をリアルタイムで測定したものである。また、「超音波+ゼオライト」と記した結果は、超音波破砕処理及び吸着処理を行ったサンプルを用いた場合の標的核酸鎖の増幅量をリアルタイムで測定したものである。また、「超音波+ゼオライト+電気泳動濃縮」と記した結果は、超音波破砕処理、吸着処理、及び電気泳動濃縮を行ったサンプルを用いた場合の標的核酸鎖の増幅量をリアルタイムで測定したものである。
【0078】
図6に示されるように、超音波破砕のみのサンプルは核酸の増幅反応を検出できなかった。一方で、ゼオライト処理を実施したものは、蛍光の消光を確認することができた。さらに、超音波破砕+ゼオライト処理+泳動濃縮を行った試料は、消光の開始時期が早まることが確認できた。つまり、ゼオライト処理によって、反応阻害物質と夾雑物の除去が行え、電気泳動により標的核酸の濃縮が行えることが示されている。
【産業上の利用可能性】
【0079】
本技術に係る核酸抽出方法は、操作が簡便であり、短時間で高効率に核酸を抽出することができる。従って、PCR(Polymerase Chain Reaction)法やLAMP(Loop-Mediated Isothermal Amplification)法等の核酸増幅反応のための核酸抽出処理に適用され、核酸が微量あるいは極低濃度でしか含まれないサンプル中の核酸を検出するために用いられ得る。
【符号の説明】
【0080】
1、101:カートリッジ、11:チャネル、12:正極、13:負極、14:透析膜、15:超音波ホーン、25:電極/超音波ホーン
【技術分野】
【0001】
本技術は、核酸抽出方法及び核酸抽出用カートリッジに関する。より詳しくは、同一のチャネル内で、超音波処理、夾雑物等の吸着、及び電気泳動をすることによって核酸を抽出する方法に関する。
【背景技術】
【0002】
PCR(Polymerase Chain Reaction)法やLAMP(Loop-Mediated Isothermal Amplification)法等の核酸増幅反応はバイオテクノロジーにおける様々な分野で応用されている。例えば、医学分野では、DNAやRNAの塩基配列に基づいた診断が行われており、農業分野では遺伝子組み換え作物の判定等でDNA鑑定が活用されている。
【0003】
核酸増幅反応では、微量サンプル中の核酸を高効率に増幅して検出できる。しかし、サンプルに含まれる核酸が極めて微量である場合には、検出下限量未満となる場合がある。さらに、サンプル中の核酸濃度が極めて低い場合には、反応場へ導入可能な容積のサンプル中に増幅対象核酸が含まれなかったために検出が不能となる場合がある。これらの場合には、予め精製及び濃縮をして抽出した核酸を反応場に導入することが有効となる。
【0004】
従来、核酸の抽出方法としては、フェノール/クロロホルム/エタノールを用いた方法、核酸を吸着するカラムやフィルタ等を用いた方法、磁性シリカビーズを用いた方法等が知られている。
【0005】
例えば、特許文献1には、核酸吸着能を有する多孔質担体を用いた核酸の濃縮方法が開示されている。また、非特許文献1には、キャピラリー電気泳動によって核酸を濃縮する方法が記載されている。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特開2005−080555号公報
【特許文献2】特開平7−51065号公報
【特許文献3】特開平9−19292号公報
【特許文献4】特開2003−128691号公報
【非特許文献】
【0007】
【非特許文献1】"On-line sample preconcentration in capillary electrophoresis: Fundamentals and applications." Journal of Chromatography A., Vol.1184 (2008)p.504-541
【発明の概要】
【発明が解決しようとする課題】
【0008】
しかしながら、従来のフェノール/クロロホルム/エタノールを用いた方法は、有害な有機溶媒を使用する必要があり、遠心分離操作等に手間がかかっていた。また、核酸を吸着するカラムやフィルタ等を用いた方法は、カラムやフィルタ等が目詰まりを起こしやすく、操作の簡便性からも課題があった。
【0009】
そこで、本技術は、操作が簡便であり、短時間で高効率に核酸を抽出することができる核酸抽出方法を提供することを主な目的とする。
【課題を解決するための手段】
【0010】
上記課題解決のため、本技術は、核酸を含有するサンプルの超音波処理をする手順、吸着担体により上記サンプルに含まれる物質を吸着する手順、及び電気泳動により移動する上記核酸を堰き止めることで上記核酸を濃縮する手順の各手順を同一セル内で行う核酸抽出方法を提供する。この核酸抽出方法では、同一セル内で、超音波処理、吸着、及び電気泳動を行うことができ、操作毎にセル内からサンプルを移し換えたりする作業を省略することが可能である。
また、上記吸着担体としては、好ましくは、陽イオン交換樹脂又はゼオライトを用いる。また、上記陽イオン交換樹脂としては、強酸性陽イオン交換樹脂を用いることが好ましい。
また、上記超音波処理は、上記サンプルにビーズ粒子を混合してから行うことが好ましい。また、上記物質は、上記核酸以外の夾雑物であることが好ましい。
また、上記サンプルの超音波処理をする手順は、上記サンプルを緩衝液で希釈し、該サンプルの超音波処理をする手順であり、上記緩衝液のpHは、4.0〜8.0であることが好ましい。また、上記緩衝液には増粘剤が含まれることが好ましい。また、上記増粘剤にはポリエチレングリコール及び/又はヒドロキシエチルセルロースが含まれることが好ましい。なお、上記セルとは、後述する核酸抽出用カートリッジを主に指す。また、夾雑物とは、サンプル中の核酸の分析において、不要な種々のタンパク質、ペプチド、糖、塩、金属イオン等の物質を主に指す。
【0011】
また、本技術は、核酸を含有するサンプルを導入可能なチャネルと、上記チャネルの両端に電極と、上記チャネルを負極側領域と正極側領域とに区分けし、上記核酸を堰き止める堰止部と、上記負極側領域に、上記サンプルに含まれる物質を吸着する吸着担体と、上記サンプルを超音波処理する超音波発生部と、からなる核酸抽出用カートリッジを提供する。また、上記超音波発生部は、上記電極と同一部材で構成されていてもよい。また、上記堰止部は、透析膜又は高分子ゲルであることが好ましい。また、上記超音波発生部は、超音波プローブ又は超音波ホーンであることが好ましい。
【発明の効果】
【0012】
本技術により、操作が簡便であり、短時間で高効率に核酸を抽出することができる核酸抽出方法が提供される。
【図面の簡単な説明】
【0013】
【図1】本技術の第1実施形態に係る核酸抽出用カートリッジの構成を説明するための模式図である。
【図2】本技術の第1実施形態に係る核酸抽出方法の手順を説明する模式図である。
【図3】本技術の第1実施形態の変形例に係る核酸抽出用カートリッジの構成を説明するための模式図である。
【図4】サンプルのゼオライトに対する吸着率を示すグラフである。
【図5】サンプルの強酸性陽イオン交換樹脂に対する吸着率を示すグラフである。
【図6】サンプルのLAMP反応の結果を示すグラフである。
【発明を実施するための形態】
【0014】
以下、本技術を実施するための好適な形態について説明する。なお、以下に説明する実施形態は、本技術の代表的な実施形態の一例を示したものであり、これにより本技術の範囲が狭く解釈されることはない。説明は以下の順序で行う。
1.本技術の第1実施形態に係る核酸抽出用カートリッジ、核酸抽出方法、及び核酸抽出用カートリッジの製造方法
(1)核酸抽出用カートリッジ
(2)核酸抽出方法
(3)核酸抽出用カートリッジの製造方法
2.本技術の第1実施形態の変形例に係る核酸抽出用カートリッジ、核酸抽出方法、及び核酸抽出用カートリッジの製造方法
【0015】
1.本技術の第1実施形態に係る核酸抽出用カートリッジ、核酸抽出方法、及び核酸抽出用カートリッジの製造方法
(1)核酸抽出用カートリッジ
図1は、本技術の第1実施形態に係る核酸抽出用カートリッジの構成を説明するための模式図である。
【0016】
図1中、符号1で示す核酸抽出用カートリッジは、基材中に形成されたチャネル11と、チャネル11の両端にそれぞれ配された正極12と負極13とからなる電極を有する。チャネル11内にはサンプルが導入可能とされており、チャネル11の正極12と負極13との間には透析膜14が配されている。また、正極12と負極13には電源Vが接続され、チャネル11に導入されたサンプルに電圧を印加/解除できるよう構成されている。また、チャネル11の負極側領域113には、吸着担体が収容されている。また、負極側領域113には、超音波ホーン15が配されている。
【0017】
基材の材質は、ガラスや各種プラスチック(ポリプロピレン、ポリカーボネート、シクロオレフィンポリマー、ポリジメチルシロキサン)とできる。
【0018】
チャネル11は、透析膜14により、正極側領域112と負極側領域113とに区分けされる。核酸抽出用カートリッジ1を用いた本技術に係る核酸抽出方法では、核酸を負極13側から正極12側に電気泳動し、透析膜14で堰止めるものである。そのために、サンプルは、チャネル11において、負極側領域113に導入される。
【0019】
また、チャネル11の形状については、特に限定されるものではないが、負極側領域113については、例えば、図1に示すように、負極13から透析膜14に向かうに従い徐々に陥凹する形状に形成される。
【0020】
負極側領域113には、吸着担体が収容される。吸着担体としては、サンプル中の核酸以外の物質を吸着することが可能であれば、特に限定されるものではないが、陽イオン交換樹脂やゼオライト等が好適に用いられる。このように、負極側領域113に吸着担体が収容されることで、本技術に係る核酸抽出方法では、サンプルの電気泳動前に負極側領域113でサンプルに含まれる所定の物質(主にサンプルに含まれる核酸以外の物質)を吸着除去することが可能になる。
【0021】
また、負極側領域113には、ビーズ粒子が収容されていることが好ましい。これにより、後述するように、本技術に係る核酸抽出方法では、より精度良くサンプルの超音波処理を行うことが可能になる。
【0022】
正極12及び負極13については、好適には、電気めっき、スパッタ又は蒸着された金(Au)、または白金を含んでなるものが採用される。もしくは、グラファイトやチタン、ステンレスなどの腐食に強い材料を利用しても良い。
【0023】
透析膜14は、本技術における堰止部の一例である。堰止部は、電気泳動の際にサンプル中の核酸を堰き止めることが可能であれば、特に限定されるものではない。また、堰止部としては、透析膜14の他に、逆浸透膜、半透膜、イオン交換膜などの多孔質膜、又はセルロース、ポリアクリルニトリル、セラミック、ゼオライト、ポリスルホン、ポリイミド、パラジウムなどの多孔質膜等を用いることも可能である。また、透析膜14の代わりに、高分子ゲルを用いることも可能である。
【0024】
高分子ゲルとしては、ポリアクリルアミドが好適に採用され、より好ましくはアニオン性官能基を含有するポリアクリルアミド、さらに好ましくは酸解離定数(pKa)が1〜5であるアニオン性官能基を含有するポリアクリルアミドが用いられる。なお、本実施形態において、アクリルアミドとは、アクリルアミド又は(メタ)アクリルアミドを意味するものとする。
【0025】
アニオン性官能基としては、特に限定されないが、例えば、酢酸、プロピオン酸、酪酸等のカルボン酸;シュウ酸、フタル酸等の多塩基酸;クエン酸、グリコール酸、乳酸等のヒドロキシ酸;アクリル酸、メタクリル酸等の不飽和酸または不飽和多塩基酸;グリシン等のアミノ酸、リン酸の部分エステル、硫酸の部分エステル、ホスホン酸、スルホン酸などが挙げられる。
【0026】
具体的には、例えばカルボン酸としては、蟻酸(pKa:3.55)、酢酸(pKa:4.56)、プロピオン酸(pKa:4.67)、ブタン酸(pKa:4.63)、ペンテン酸(pKa:4.68)、ヘキサン酸(pKa:4.63)、ヘプタン酸(pKa:4.66)、パルミチン酸(pKa:4.64)、ステアリン酸(pKa:4.69)などの脂肪族モノカルボン酸;コハク酸(pKa1 :4.00、pKa2 :5.24)、グルタル酸(pKa1 :4.13、pKa2 :5.03)、アジピン酸(pKa1 :4.26、pKa2 :5.03)、ピメリン酸(pKa1:4.31、pKa2 :5.08)、スベリン酸(pKa1 :4.35、pKa2 :5.10)、アゼライン酸(pKa1 :4.39、pKa2 :5.12)、リンゴ酸(pKa1 :3.24、pKa2 :4.71)、テレフタル酸(pKa1 :3.54、pKa2 :4.46)などの脂肪族又は芳香族のジカルボン酸;クロトン酸(pKa:4.69)、アクリル酸(pKa:4.26)、メタクリル酸(pKa:4.66)などの不飽和カルボン酸;アニス酸(pKa:4.09)、m−アミノ安息香酸(pKa1 :3.12、pKa2 :4.74)、m−,p−クロロ安息香酸(pKa1 :3.82、pKa2 :3.99)、ヒドロキシ安息香酸(pKa1 :4.08、pKa2 :9.96)等の置換安息香酸類;クエン酸(pKa1 :2.87、pKa2 :4,35、pKa3 5.69)などのポリカルボン酸及びその誘導体を挙げることができる。
【0027】
アニオン性官能基を含有するアクリルアミドモノマーは、特にアクリルアミドアルカンスルホン酸が好ましい。スルホン酸としては、例えば、スチレンスルホン酸(pKa=−2.8)、m−アニリンスルホン酸(pKa=3.74)、p−アニリンスルホン酸(pKa=3.23)、2−(メタ)アクリルアミド−2−アルキル(炭素数1〜4)プロパンスルホン酸、より具体的には2−アクリルアミド−2−メチルプロパンスルホン酸(pKa=−1.7)等の重合性の不飽和基を有するスルホン酸が挙げられる。
【0028】
ポリアクリルアミドゲル中のアニオン性官能基の濃度(質量%)は、0〜30%が好ましい。
【0029】
超音波ホーン15は、本技術におけるサンプルを超音波処理する超音波発生部の一例である。超音波ホーン15としては、核酸抽出方法においてサンプルを超音波処理することが可能であれば、形状等は特に限定されるものではなく、超音波ホーン15の代わりに、例えば、超音波プローブ等を用いることも可能である。以下、本実施形態(本技術の第2実施形態でも同様である。)では、本技術における超音波発生部として、超音波ホーン15を主に例に挙げて説明する。
【0030】
(2)核酸抽出方法
次に、本技術に係る核酸抽出方法の手順について、図2(A)〜(D)を参照しながら説明する。
【0031】
ここで、本技術に係る核酸抽出方法を説明する前に、まず、本技術の関連技術に係る核酸抽出方法について説明する。
【0032】
関連技術に係る核酸抽出方法としては、アルカリ化剤を混合して得られたアルカリ化試料を加熱処理し、プロテアーゼ等の酵素によりタンパク質を分解した後、フェノール・クロロフォルム抽出法によりタンパク質、糖質、脂溶性物質を取り除く方法であるAGPC(Acid guanidinium Thiocyanate−Phenol−Chloroform Extraction)法等が挙げられる。しかしながら、この方法は、用いる試薬の種類や多検体の処理の適性等、安全性や迅速性等の面で改良が求められている。
【0033】
また、シリカ等の粒子表面に物理的又は化学的にDNAやRNA等の核酸を結合(吸着)させ、サンプルからDNAやRNA等を分離する方法も挙げられる(例えば、上記特許文献2参照)。しかしながら、この方法では、溶液に懸濁された磁性シリカ粒子を試薬容器からマイクロチューブ等へ分注する場合、粒子水溶液を攪拌し、粒子が分散している間に分注を完了することが求められる。また、このようにして分注した溶液の濃度は均一になりにくく、分注のタイミングにより粒子の濃度が異なる傾向にあり、定量的な解析において改良が求められている。
【0034】
また、核酸を単離するために用いられる粒子として、磁力によって核酸を回収する方法も挙げられる。例えば、超常磁性酸化鉄からなる芯微粒子の表面に、核酸などが共有結合し得る重合性シランからなる被膜が形成されてなる磁性シリカ粒子を使用する方法が挙げられる(例えば、上記特許文献3参照)。
【0035】
また、遺伝子検査業界では、シリカをメンブレンフィルタ状にし、スピンカラムに組み込んで、吸引濾過もしくは遠心濾過を行う核酸抽出方法が行われている。他にも、シリカメンブレンフィルタの代わりに高分子多孔質膜を用いた方法(例えば、上記特許文献4参照)も挙げられる。しかし、これらの方法では、多くの工程、多量の洗浄液、更にポンプもしくは遠心機等の装置が必要になり、全体の装置を大型化させる必要がある。
【0036】
この点、以下に詳述する本技術に係る核酸抽出方法は、本願発明者らの鋭意検討の結果見出されたものであり、操作を非常に簡便にし、短時間で高効率に核酸を抽出可能にしたものである。
【0037】
本技術に係る核酸抽出方法では、まず、チャネル11の透析膜14と負極13との間の負極側領域113に核酸を含有するサンプルを導入する(図2(A)参照)。このとき、チャネル11内には電気泳動用のサンプルを希釈する緩衝液を満たしておく。ここで、導入されるサンプルとしては、例えば、ぬぐい液、口腔スワブ、唾液、全血、血清、血漿、末梢血単球細胞、脳脊髄液、糞、尿、汗、精液、細菌培養液、培養細胞、又は生検組織等の生体由来の液体が用いられる。また、食品中の液体、水、土壌、海水、湖水、川水などの液体も用いられる。そのため、サンプル液には核酸の分析においては不要な種々のタンパク質、糖、金属イオン等の核酸増幅反応を阻害する物質(以下、夾雑物と呼ぶ。)も含まれることがある。
【0038】
次に、超音波ホーン15によりサンプルの超音波処理を行う(図2(B)参照)。上述したようにサンプルとしては、種々の生体由来の液体が用いられるため、上記超音波処理を行うことにより、サンプル中の細胞膜、糖質、脂質膜、ペプチドグリカン層等の強固な膜を破砕することが可能になる。超音波処理するための周波数や処理時間等については、サンプルの種類等に応じて適宜設定することが可能であるが、例えば、菌やウイルス等を精度良く破砕するためには、10kHz以上3MHz以下、より好ましくは30kHz以上の周波数で、5秒〜10分程度超音波処理をすることが好ましい。
【0039】
また、超音波処理による上記の膜の破砕を促進するために、負極側領域113には、ビーズ粒子を収容しておくことが好ましい。ビーズ粒子のサイズや種類等については、特に限定されるものではなく、用いるサンプルに応じて、適宜選択することが可能であるが、例えば、ジルコニア、シリカ、ゼオライト等の無機の粒子、イオン交換樹脂等の有機の粒子が挙げられる。この中でも特に、0.1mm程度の直径を有するジルコニアビーズを用いることが好ましい。また、ビーズ粒子については、サンプルのチャネル11への導入と同時に負極側領域113に収容してもよいし、サンプルの導入前に予め負極側領域113に収容しておいてもよい。
【0040】
また、超音波処理による上記の膜の破砕を更に促進するためには、サンプルに中性もしくは陰イオン性の界面活性剤を含有させておくことが好ましい。界面活性剤としては、サンプルの種類に応じ、適宜選択することが可能であるが、例えば、SDS、Triton−X100、Tween20やBrij35等が挙げられる。
【0041】
また、サンプルを希釈する際に用いる緩衝液には、pH4.0から8.0の領域に緩衝能をもつ緩衝液を用いることが好ましい。具体的には、グリシン塩酸緩衝液、クエン酸緩衝液、酢酸緩衝液、クエン酸−リン酸緩衝液、リン酸緩衝液、トリス−塩酸緩衝液、MES(pKa6.2)、Bis−Tris(pKa6.5)、ADA(pKa6.6)、PIPES(pKa6.8)、ACES(pKa6.9)、MOPSO(pKa6.95)、BES(pKa7.15)、MOPS(pKa7.2)が好ましいがこれに限定されるものではない。
【0042】
また、超音波処理については、ここでは、負極側領域113内で行う場合を例に挙げて説明したが、かかる例に限定されるものではない。例えば、超音波処理は、負極側領域113に隣接した領域内で行い、チューブ等を介して超音波処理後のサンプルを負極側領域113内に流入させてもよい。
【0043】
次に、吸着担体によりサンプルに含まれる物質を吸着する(図2(C)参照)。サンプルに含まれる物質は、主に上述した核酸以外の夾雑物である。これにより、上記夾雑物を吸着担体に吸着しサンプルから除去することで、サンプル中の核酸を選択的に精度良く、後述する電気泳動をさせることが可能になる。ここで、夾雑物の吸着には疎水結合や静電力による吸着を利用することが望ましい。そのため、吸着担体としては、特に疎水表面や負電荷表面を有するものが良く、例えば、ゼオライトや陽イオン交換樹脂等を用いることが好ましい。ゼオライトとしては、ハイシリカのプロトン型ゼオライトがより好ましい。陽イオン交換樹脂としては、強酸性陽イオン交換樹脂がより好ましく、更にはプロトン型強酸性陽イオン交換樹脂がより好ましい。このような吸着担体を用いることで、サンプルのpHを低下させたり、サンプルを脱塩させたりすることが可能になる。強酸性陽イオン交換樹脂としては、交換基にスルホン酸基プロトン型(−SO3H)スルホン酸基ナトリウム型(−SO3Na)を持つものが好ましい。
【0044】
夾雑物の吸着方法については、特に限定されるものではないが、例えば、吸着担体を充填したフィルタを負極側領域113に挿入し超音波処理で破砕したサンプルをフィルタに通液すること等により実行することが可能である。また、上述したサンプルの超音波処理の前に吸着担体を負極側領域113に入れておき、超音波処理と同時に夾雑物の吸着を行うことも可能である。
【0045】
次に、サンプルを電気泳動させる(図2(D)参照)。負に帯電した核酸はチャネル11内を正極12方向へ電気泳動される。この際、透析膜14が核酸の移動を阻み、核酸を堰き止めることによって、透析膜14の界面とその近傍に核酸が濃縮される。電気泳動時間は、チャネル11のサイズに応じて適宜設定されるが、例えば10秒〜10分程度でよい。なお、透析膜14の「界面」とは、透析膜14と領域113側に充填された緩衝液との接触面を指す。
【0046】
また、上記緩衝液には、増粘剤が添加されていてもよい。増粘剤としては、特に限定されないが、緩衝液の粘性を調節することで、電気泳動の速度を制御することができるものが好ましく、例えば、ポリエチレングリコールやヒドロキシエチルセルロース等を用いることが可能であり、それらを混合して用いてもよい。また、緩衝液の粘性を調節することで、電気泳動中に発生するジュール熱が原因で生じる熱対流による濃縮部における核酸の再分散を低減することもできる。
【0047】
更に、領域113の透析膜14近傍の緩衝液を吸引する際に、正極12と負極13に逆電圧を短時間印加することも、核酸の回収量を高めるために有効である。核酸の回収時に短時間逆電圧を印加することで、透析膜14の界面に存在する核酸を、領域113の透析膜14近傍に移動させ、マイクロピペットによって吸引、回収できる。逆電圧を印加する時間は、チャネル11のサイズに応じて適宜設定されるが、例えば1〜10秒程度でよい。
【0048】
最後に、領域113の透析膜14近傍の緩衝液をマイクロピペット等によって吸引することによって、濃縮された核酸を回収する。
【0049】
このように、本技術に係る核酸抽出方法では、サンプルを負極側領域113に導入した後、超音波処理を行い、夾雑物を吸着担体で吸着処理し、電気泳動で核酸を濃縮するものである。このようにして濃縮し、抽出した核酸についての核酸増幅反応を実行することが可能である。なお、サンプルの超音波処理、吸着処理、及び電気泳動の各工程については、夫々独立して行ってもよいし、何れかを組み合わせて実行してもよい。例えば、超音波処理と吸着処理とを同時に行ってから、電気泳動を行ってもよい。また、超音波処理を行ってから、吸着処理と電気泳動とを同時に行ってもよい。また、超音波処理と吸着処理と電気泳動とを全て同時に行ってもよい。
【0050】
更に、本技術に係る核酸抽出方法に用いる吸着担体については、核酸の電気泳動を行う前に、沈降またはフィルタリングの手段で除いてもよい。沈降の方法については、例えば、自然に沈降させる方法や遠心力を用いて沈降させる方法等、多様な方法を採用することができる。また、フィルタリングの方法についても、吸着担体の種類等に応じて、適宜所定の形状を有する多孔質膜等を用いる方法を採用することができる。
【0051】
本技術に係る核酸抽出方法に用いるサンプルについては、超音波処理による上記の膜の破砕を促進し、また、電気泳動をよりスムーズの実行するために、pHは4.0から8.0であることが好ましい。
【0052】
以上説明した本技術に係る核酸抽出方法によれば、サンプルを超音波処理し、吸着処理をし、電気泳動させる手順を同一セル内で行うことが可能である。すなわち、同一セル内で、超音波処理、吸着、及び電気泳動を行うことができ、操作毎にセル内からサンプルを移し換えることを省略することが可能である。そのため、核酸の抽出を非常に簡便に行うことができる。また、短時間で高効率に核酸を抽出することができる。
【0053】
また、本技術に係る核酸抽出方法では、同一セル内で全工程を行い、他の装置等にサンプルを移す必要がないため、サンプルとして感染性を有する検体等を扱う場合には、操作者に対する感染のリスクを低減することができる。サンプルとして血液試料等を用いる際にも、核酸抽出用カートリッジ1の同一領域内でサンプルの導入から核酸の抽出までダイレクトに実行することができる。
【0054】
また、本技術に係る核酸抽出方法では超音波処理を行うことによって、細胞膜、糖質、脂質膜やペプチドグリカン層等の強固な膜を超音波で破砕する。そのため、本技術に係る核酸抽出方法では、核酸増幅反応を阻害するカオトロピックイオンであるグアニジウム塩や強アルカリ等を使用せずに行うことができる。
【0055】
また、本技術に係る核酸抽出方法では、強アルカリや酵素等を用いずに超音波処理で細胞膜、外膜、グラム陽性菌のペプチドグリカン層を破砕することを特徴としている。そのため、例えば、喀痰中の結核菌などの検査時に、還元剤による検体処理等を省略し、簡便に核酸を精度良く抽出することができる。
【0056】
また、特殊の有機溶剤を用いた化学処理等を介さずに超音波処理を行うため、安全に、且つサンプルの劣化を抑制しつつ、上記膜等の破砕を行うことができる。また、強アルカリを使用せずに核酸の抽出をすることができるため、アルカリによるRNAの分解を抑制しつつ、RNAを抽出することができる。
【0057】
また、本技術に係る核酸抽出方法では、加熱する工程も不要であるため、加熱によるRNAの分解も抑制しつつ、RNAを抽出することができる。また、緩衝液のpHを4.0〜8.0とし、サンプルを酸性条件下で超音波処理を行うことにより、RNaseの働きを抑制することができる。
【0058】
また、本技術に係る核酸抽出方法では、吸着担体で夾雑物を除去することが可能である。そのため、電気泳動において核酸だけを効率的に濃縮することが可能になり、検体中の低濃度のターゲット核酸を精度良く検出することが可能になる。
【0059】
また、本技術に係る核酸抽出方法では、サンプルを洗浄する工程を介さず行うことが可能であるため、液切りのためのポンプ、遠心装置、複雑な送液機構等を設けずに核酸抽出方法を行う核酸抽出用カートリッジ1を設計することが可能である。従って、核酸抽出用カートリッジ1の装置の構成は、図1に示したように単純化及び小型化することができる。また、本技術に係る核酸抽出方法では、洗浄する工程を介さず行うことが可能であるため、少量のサンプルから核酸を抽出することができる。
【0060】
(3)核酸抽出用カートリッジの製造方法
本技術の第1実施形態に係る核酸抽出用カートリッジ1は、基材中に形成されたチャネル11内に透析膜14を挿入し、チャネル11を正極側領域112と負極側領域113とに区分けし、負極側領域113内に吸着担体を収容し、超音波ホーン15を設置することによって製造することができる。
【0061】
基材中へのチャネル11の成形は、例えば、ガラス製基材のウェットエッチングやドライエッチングによって、あるいはプラスチック製基材層の切削加工等によって行うことができる。なお、チャネル11はカートリッジ1に1又は2以上形成することができる。
【0062】
正極12及び負極13については、好ましくは金(Au)または白金(Pt)をスパッタまたは蒸着することにより作製される。この点、関連技術に係るカートリッジでは、電極に白金線を用いるものがある。この場合、実験を行う度に白金線を核酸抽出用カートリッジ内に配置する必要が生じ、更に白金線が高価である点等も鑑みると、カートリッジを使い捨てにすることができないでいた。一方、上述したように、本実施形態に係る核酸抽出用カートリッジ1では、金をスパッタまたは蒸着することにより正極12及び負極13を作製し、予めカートリッジ1に電極を作製しておくため、カートリッジ1を簡便に取り扱うことができる。また、このような核酸抽出用カートリッジ1については、関連技術に係る核酸抽出用カートリッジに比し、使い捨てにすることも可能である。従って、核酸抽出用カートリッジ1では、サンプルのコンタミを防止することができる。
【0063】
超音波ホーン15については、サンプルを超音波処理することが可能であれば、適宜設計することが可能であるが、例えば、基材中に埋設することで設置することが可能である。
【0064】
2.本技術の第1実施形態の変形例に係る核酸抽出用カートリッジ、核酸抽出方法、及び核酸抽出用カートリッジの製造方法
次に、ここで、図3を参照しながら、本技術の第1実施形態の変形例に係る核酸抽出用カートリッジ101について説明する。図3は、本技術の第1実施形態の変形例に係る核酸抽出用カートリッジ101の構成を説明するための模式図である。なお、本変形例において、本実施形態と実質的に同一の機能構成を有する構成要素については、重複説明を省略する。
【0065】
本変形例に係る核酸抽出用カートリッジ101に設けられる、チャネル11、正極12、負極13、及び透析膜14は、上述した本実施形態に係る核酸抽出用カートリッジ1と同一の機能構成を有するものである。本変形例に係る核酸抽出用カートリッジ101において、負極と超音波ホーンとが同一部材で形成されている点以外は、本実施形態に係る核酸抽出用カートリッジ1と実質的に同一である。そのため、ここでは、負極と超音波ホーン15とが同一部材で形成された電極/超音波ホーン25についてのみ説明する。
【0066】
本変形例における核酸抽出方法及び核酸抽出用カートリッジ101の製造方法については、負極と超音波ホーンとが同一部材で形成されている点以外は、本技術の第1実施形態に係る核酸抽出方法及び核酸抽出用カートリッジ1の製造方法と同一であるため、ここでは重複説明を省略する。
【0067】
電極/超音波ホーン25は、上述した負極13と同様の機能構成を有するため、好適にはスパッタ又は蒸着された金(Au)または白金を含んでなるものが採用される。また、電極/超音波ホーン25は、上述した超音波ホーン15と同様の機能構成を有するため、核酸抽出方法においてサンプルを超音波処理することが可能であれば、形状等は特に限定されるものではなく、超音波ホーン15の代わりに、例えば、超音波プローブ等を用いることも可能である。
【0068】
なお、本技術は以下のような構成も取ることができる。
(1)核酸を含有するサンプルの超音波処理をする手順、吸着担体により前記サンプルに含まれる物質を吸着する手順、及び電気泳動により移動する前記核酸を堰き止めることで前記核酸を濃縮する手順の各手順を同一セル内で行う核酸抽出方法。
(2)前記吸着担体としては、陽イオン交換樹脂又はゼオライトを用いる、前記(1)記載の核酸抽出方法。
(3)前記陽イオン交換樹脂としては、強酸性陽イオン交換樹脂を用いる、前記(2)記載の核酸抽出方法。
(4)前記サンプルにビーズ粒子を混合し、前記超音波処理をする、前記(1)〜(3)のいずれか1つに記載の核酸抽出方法。
(5)前記物質は、前記核酸以外の夾雑物である、前記(1)〜(4)のいずれか1つに記載の核酸抽出方法。
(6)前記サンプルの超音波処理をする手順は、前記サンプルを緩衝液で希釈し、該サンプルの超音波処理をする手順であり、前記緩衝液のpHは、4.0〜8.0である、前記(1)〜(5)のいずれか1つに記載の核酸抽出方法
(7)前記緩衝液には増粘剤が含まれる、前記(1)〜(6)のいずれか1つに記載の核酸抽出方法。
(8)前記増粘剤にはポリエチレングリコール及び/又はヒドロキシエチルセルロースが含まれる、前記(1)〜(7)記載の核酸抽出方法。
(9)核酸を含有するサンプルを導入可能なチャネルと、前記チャネルの両端に電極と、前記チャネルを負極側領域と正極側領域とに区分けし、前記核酸を堰き止める堰止部と、前記負極側領域に、前記サンプルに含まれる物質を吸着する吸着担体と、前記サンプルを超音波処理する超音波発生部と、からなる核酸抽出用カートリッジ。
(10)前記超音波発生部は、前記電極と同一部材で構成されている、前記(9)記載の核酸抽出用カートリッジ。
(11)前記堰止部は、透析膜又は高分子ゲルである、前記(9)又は(10)記載の核酸抽出用カートリッジ。
(12)前記超音波発生部は、超音波プローブ又は超音波ホーンである、前記(9)〜(11)のいずれか1つに記載の核酸抽出用カートリッジ。
【実施例】
【0069】
1.サンプルの吸着担体に対する吸着量の確認
(1−1.ゼオライトによる核酸精製能)
スピンフィルタカラム(Ultrafree-MC,0.45μm)にプロトン型ゼオライトを100mg計量して入れた。次いで、0.5%SDSを含む50mM MESバッファー(pH5)を調整し、BSAを0.5%となるように加え、さらにCy3修飾した20merオリゴDNAを5μMとなるように加えた。このタンパク質と核酸の混合液を、常温にて十分に攪拌させた後、ゼオライト封入スピンカラムに200ul滴下し、十分に攪拌させた。その後、12000Gにて2分間遠心し、混合液をスピンダウンした。スピンダウンした液をNanodropにて吸光度測定し、ゼオライト処理前後の吸光度の違いから、核酸精製能を評価した。BSAの吸光度はProtein A280モードで評価し、核酸の吸光度はmicro arrayモードでCy3の吸光度で評価した。評価結果を図4に示す。
【0070】
図4に示すように、ゼオライト処理前後のBSA濃度減少量より、ゼオライトへの吸着量は約70%であった。一方、核酸の非特異的吸着量は約45%であった。このことから、ゼオライト処理することにより、タンパク質-核酸の混在系においても、DNA存在比を向上させることができることを確認できた(図4参照)。
【0071】
(1−2.強酸性陽イオン交換樹脂による核酸精製能)
スピンフィルタカラム(Ultrafree-MC,0.45μm)に強酸性陽イオン交換樹脂(Nuvia S(Bio Rad社製))を100mg計量して入れた。次いで、50mM MESバッファー(pH5)を調整し、BSAを0.5%となるように加え、さらにCy3修飾した20merオリゴDNAを5μMとなるように加えた。このタンパク質と核酸の混合液を、常温にて十分に攪拌させた後、強酸性陽イオン交換樹脂封入スピンカラムに200ul滴下し、十分に攪拌させた。その後、12000Gにて2分間遠心し、混合液をスピンダウンした。スピンダウンした液をNanodropにて吸光度測定し、強酸性陽イオン交換樹脂処理前後の吸光度の違いから、核酸精製能を評価した。BSAの吸光度はProtein A280モードで評価し、核酸の吸光度はmicro arrayモードでCy3の吸光度で評価した。評価結果を図5に示す。
【0072】
図5に示すように、強酸性陽イオン交換樹脂処理前後のBSA濃度減少量より、強酸性陽イオン交換樹脂への吸着量は約85%であった。一方、核酸の非特異的吸着量は約28%であった。このことから、強酸性陽イオン交換樹脂処理することにより、タンパク質-核酸の混在系においても、DNA存在比を向上させることができることを確認できた(図5参照)。
【0073】
2.LAMP反応及びRT−LAMP反応
(実施例1)
<超音波処理>
EDTA採血ウシ全血にビフィズス菌を濃度が1000個/uLになるように添加し、2mLのポリプロピレンチューブに1mL分注して、超音波ホーンを浸漬し振動数40kHzで2分間破砕処理を行った。
【0074】
<吸着処理>
次に、スピンフィルタカラム(Ultrafree-MC,0.45μm)にプロトン型ゼオライトを100mg計量して入れた。上記のタンパク質と核酸の混合液を、常温にて十分に攪拌させた後、ゼオライト封入スピンカラムに200ul滴下し、十分に攪拌させた。
【0075】
<電気泳動>
次に、核酸抽出用カートリッジの電極に電圧をDC100Vで20分間印加し、サンプルの電気泳動を行った。
【0076】
<LAMP反応>
次に、サンプル、酵素、蛍光色素、核酸モノマー、バッファー、ターゲット核酸鎖増幅用のプライマーセット、リアルタイム測定用のプローブを混合し、LAMP反応液を調製した。LAMP反応は、リアルタイム計測が可能なサーマルサイクラーChromo4(バイオラッド、米国)を用いて測定を行った。プローブは、消光プローブのQPプローブ(J-bio21, 日本: http://www.j-bio21.co.jp/tech/qpmethod.htm([平成23年7月19日]、題目:QP法))を使用しているので、核酸の増幅と共に蛍光強度の低下が観察される。
【0077】
(結果)
図6に、前処理の各工程から抜き出してLAMP反応を評価した結果を示す。図中、「超音波」と記した結果は、超音波破砕処理のみを行ったサンプルを用いた場合の標的核酸鎖の増幅量をリアルタイムで測定したものである。また、「超音波+ゼオライト」と記した結果は、超音波破砕処理及び吸着処理を行ったサンプルを用いた場合の標的核酸鎖の増幅量をリアルタイムで測定したものである。また、「超音波+ゼオライト+電気泳動濃縮」と記した結果は、超音波破砕処理、吸着処理、及び電気泳動濃縮を行ったサンプルを用いた場合の標的核酸鎖の増幅量をリアルタイムで測定したものである。
【0078】
図6に示されるように、超音波破砕のみのサンプルは核酸の増幅反応を検出できなかった。一方で、ゼオライト処理を実施したものは、蛍光の消光を確認することができた。さらに、超音波破砕+ゼオライト処理+泳動濃縮を行った試料は、消光の開始時期が早まることが確認できた。つまり、ゼオライト処理によって、反応阻害物質と夾雑物の除去が行え、電気泳動により標的核酸の濃縮が行えることが示されている。
【産業上の利用可能性】
【0079】
本技術に係る核酸抽出方法は、操作が簡便であり、短時間で高効率に核酸を抽出することができる。従って、PCR(Polymerase Chain Reaction)法やLAMP(Loop-Mediated Isothermal Amplification)法等の核酸増幅反応のための核酸抽出処理に適用され、核酸が微量あるいは極低濃度でしか含まれないサンプル中の核酸を検出するために用いられ得る。
【符号の説明】
【0080】
1、101:カートリッジ、11:チャネル、12:正極、13:負極、14:透析膜、15:超音波ホーン、25:電極/超音波ホーン
【特許請求の範囲】
【請求項1】
核酸を含有するサンプルの超音波処理をする手順、
吸着担体により前記サンプルに含まれる物質を吸着する手順、及び
電気泳動により移動する前記核酸を堰き止めることで前記核酸を濃縮する手順の各手順を同一セル内で行う核酸抽出方法。
【請求項2】
前記吸着担体としては、陽イオン交換樹脂又はゼオライトを用いる、請求項1記載の核酸抽出方法。
【請求項3】
前記陽イオン交換樹脂としては、強酸性陽イオン交換樹脂を用いる、請求項2記載の核酸抽出方法。
【請求項4】
前記サンプルにビーズ粒子を混合し、前記超音波処理をする、請求項3記載の核酸抽出方法。
【請求項5】
前記物質は、前記核酸以外の夾雑物である、請求項4記載の核酸抽出方法。
【請求項6】
前記サンプルの超音波処理をする手順は、
前記サンプルを緩衝液で希釈し、該サンプルの超音波処理をする手順であり、
前記緩衝液のpHは、4.0〜8.0である、請求項5記載の核酸抽出方法。
【請求項7】
前記緩衝液には、増粘剤が含まれる、請求項6記載の核酸抽出方法。
【請求項8】
前記増粘剤には、ポリエチレングリコール及び/又はヒドロキシエチルセルロースが含まれる、請求項7記載の核酸抽出方法。
【請求項9】
核酸を含有するサンプルを導入可能なチャネルと、
前記チャネルの両端に電極と、
前記チャネルを負極側領域と正極側領域とに区分けし、前記核酸を堰き止める堰止部と、
前記負極側領域に、前記サンプルに含まれる物質を吸着する吸着担体と、
前記サンプルを超音波処理する超音波発生部と、からなる核酸抽出用カートリッジ。
【請求項10】
前記超音波発生部は、前記電極と同一部材で構成されている、請求項9記載の核酸抽出用カートリッジ。
【請求項11】
前記堰止部は、透析膜又は高分子ゲルである、請求項10記載の核酸抽出用カートリッジ。
【請求項12】
前記超音波発生部は、超音波プローブ又は超音波ホーンである、請求項11記載の核酸抽出用カートリッジ。
【請求項1】
核酸を含有するサンプルの超音波処理をする手順、
吸着担体により前記サンプルに含まれる物質を吸着する手順、及び
電気泳動により移動する前記核酸を堰き止めることで前記核酸を濃縮する手順の各手順を同一セル内で行う核酸抽出方法。
【請求項2】
前記吸着担体としては、陽イオン交換樹脂又はゼオライトを用いる、請求項1記載の核酸抽出方法。
【請求項3】
前記陽イオン交換樹脂としては、強酸性陽イオン交換樹脂を用いる、請求項2記載の核酸抽出方法。
【請求項4】
前記サンプルにビーズ粒子を混合し、前記超音波処理をする、請求項3記載の核酸抽出方法。
【請求項5】
前記物質は、前記核酸以外の夾雑物である、請求項4記載の核酸抽出方法。
【請求項6】
前記サンプルの超音波処理をする手順は、
前記サンプルを緩衝液で希釈し、該サンプルの超音波処理をする手順であり、
前記緩衝液のpHは、4.0〜8.0である、請求項5記載の核酸抽出方法。
【請求項7】
前記緩衝液には、増粘剤が含まれる、請求項6記載の核酸抽出方法。
【請求項8】
前記増粘剤には、ポリエチレングリコール及び/又はヒドロキシエチルセルロースが含まれる、請求項7記載の核酸抽出方法。
【請求項9】
核酸を含有するサンプルを導入可能なチャネルと、
前記チャネルの両端に電極と、
前記チャネルを負極側領域と正極側領域とに区分けし、前記核酸を堰き止める堰止部と、
前記負極側領域に、前記サンプルに含まれる物質を吸着する吸着担体と、
前記サンプルを超音波処理する超音波発生部と、からなる核酸抽出用カートリッジ。
【請求項10】
前記超音波発生部は、前記電極と同一部材で構成されている、請求項9記載の核酸抽出用カートリッジ。
【請求項11】
前記堰止部は、透析膜又は高分子ゲルである、請求項10記載の核酸抽出用カートリッジ。
【請求項12】
前記超音波発生部は、超音波プローブ又は超音波ホーンである、請求項11記載の核酸抽出用カートリッジ。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】




【図2】


【図3】


【図4】


【図5】


【図6】


【公開番号】特開2013−21959(P2013−21959A)
【公開日】平成25年2月4日(2013.2.4)
【国際特許分類】
【出願番号】特願2011−158991(P2011−158991)
【出願日】平成23年7月20日(2011.7.20)
【出願人】(000002185)ソニー株式会社 (34,172)
【Fターム(参考)】
【公開日】平成25年2月4日(2013.2.4)
【国際特許分類】
【出願日】平成23年7月20日(2011.7.20)
【出願人】(000002185)ソニー株式会社 (34,172)
【Fターム(参考)】
[ Back to top ]

