核酸検出用のイオン化支援キット及びこれを使用した質量分析方法
【課題】核酸検出に適したイオン化支援キット及びこれを用いた質量分析方法を提供する。
【解決手段】本発明の質量分析用イオン化支援キットは、Fe2O3を含んだ酸化鉄からなるコアを有した機能性ナノ微粒子(溶液)と、クエン酸塩水溶液と、を含み、分析対象物中の核酸のイオン化を支援することを特徴とする。このイオン化支援キットを用いた質量分析方法によって得られたマススペクトルから核酸の有無や塩基鎖長を解析することができる。解析工程では、マススペクトルの質量電荷比がFe2+−2Hの質量で示された間隔で2つ以上存在するか否かを判定することを含む。
【解決手段】本発明の質量分析用イオン化支援キットは、Fe2O3を含んだ酸化鉄からなるコアを有した機能性ナノ微粒子(溶液)と、クエン酸塩水溶液と、を含み、分析対象物中の核酸のイオン化を支援することを特徴とする。このイオン化支援キットを用いた質量分析方法によって得られたマススペクトルから核酸の有無や塩基鎖長を解析することができる。解析工程では、マススペクトルの質量電荷比がFe2+−2Hの質量で示された間隔で2つ以上存在するか否かを判定することを含む。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、核酸のイオン化および検出に優れたイオン化支援キット及び質量分析法に関する。
【背景技術】
【0002】
遺伝情報を担う核酸(DNA、RNA)は、遺伝子治療やオーダーメイド医療の医薬品候補化合物として利用されるとともに、血液等から人物の特定などを行う犯罪捜査や親子鑑定、感染症の病原菌の同定などに利用されている重要な天然化合物である。
【0003】
核酸の検出は、PCR(Polymerase chain reaction)法での増幅および蛍光法による検出が主流であるが、細胞や組織などからの核酸の抽出などの前処理工程を要する。
【0004】
一方、近年の質量分析の発達により、微量成分の核酸を検出するために、種々のイオン化法が検討されており、例えば、エレクトロンスプレーイオン化法、マトリックス支援型脱離イオン化法(Matrix assisted laser desorption/ionization:MALDI)、高速原子衝撃法が挙げられる。しかしながら、これらの方法は、手法や測定条件によって、マススペクトルで生成する質量電荷比(m/z)が異なり、法則性がわかりにくい。従って、これらの方法を用いて試料を検出しても解析が困難であり、DNAの判断がつきにくいといった問題が指摘されていた(非特許文献1及び非特許文献2を参照)。
【0005】
ところで、近年、直径1.3〜3nmのサイズの磁気超ナノ微粒子を機能化し、生きた細胞、組織内に導入する技術が開発されている(特許文献1を参照)。また、ナノ微粒子を用いて生体試料のイオン化が可能なナノ微粒子レーザー脱離イオン化法(nano−PALDI)と呼ばれた手法も既に提案されている(特許文献2を参照)。なお、この従来のnano‐PALDI法で分析可能な物質は、蛋白質、ペプチド、糖、脂質などの生体物質や、合成低分子化合物、合成ポリマーなどとされているが、今までに開発されている微粒子では核酸をイオン化することが比較的困難であった。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特開2008−170326号公報
【特許文献2】特開2008−261837号公報
【非特許文献】
【0007】
【非特許文献1】Wu J., McLuckey S.A., International Journal of Mass Spectrometry2004, 237, 197-241
【非特許文献2】横澤 勉,小野 晶,神奈川大学工学研究所所報,2007,30,92−94
【発明の概要】
【発明が解決しようとする課題】
【0008】
本発明は、このような事情に鑑みてなされたものであり、nano‐PALDI法に基づいて核酸の検出に特化した質量分析方法を提供することを目的とする。また、本発明の別の目的は、この質量分析における核酸の検出に適したイオン化支援キットを提供することである。
【課題を解決するための手段】
【0009】
本発明者らは、上記課題を解決するために鋭意検討した結果、機能性ナノ微粒子を含んだイオン化支援剤にクエン酸塩を加えて質量分析を行うことで、核酸のイオン化効率を上昇させることができること、得られたマススペクトルの質量電荷比(m/z)が特有の法則性を有すること、及びこれらの現象を利用すれば容易に核酸を検出できることを見出し、本発明を完成するに至った。
【0010】
すなわち、本発明によれば、以下の態様の発明が提供される。
(態様1)
Fe2O3を含んだ酸化鉄からなるコアを有した機能性ナノ微粒子と、
クエン酸塩水溶液と、
を含み、かつ、分析対象物中の核酸のイオン化を支援することを特徴とするイオン化支援キット。
(態様2)
前記微粒子は、前記コアを覆うアモルファスシリカネットワークからなるシェルと、
前記シェルの表面に共有結合的に導入された官能基と、
を有していることを特徴とする態様1記載のイオン化支援キット。
(態様3)
機能性ナノ微粒子を質量分析用プレートに固定化する工程と、
分析対象物にクエン酸塩を添加する工程と、
前記プレート上に修飾した前記微粒子に前記分析対象物を近接させる工程と、
前記プレート上の前記分析対象物に向けて紫外線レーザー照射を行い、前記分析対象物のイオン化を支援する工程と、
質量分析によって得られたマススペクトルから核酸の有無や塩基鎖長を解析する工程と、
を含む質量分析方法であって、
前記微粒子はFe2O3を含んだ酸化鉄からなるコアを有し、
前記解析工程では、前記マススペクトルの質量電荷比がFe2+−2Hの質量で示された間隔で2つ以上存在するか否かを判定することを含むことを特徴とする質量分析方法。
(態様4)
前記解析工程では、前記マススペクトルのシグナルの総数と各シグナルにおける質量電荷比とをNsと(m/z)xとによって表した場合に、Nsと(m/z)xとが次式で示される規則性を示すか否かを判定することを含むことを特徴とする態様3記載の質量分析方法。
【数1】

ここで、nとMとは前記核酸の塩基数と質量とであり、Hは水素イオンの質量であり、
Fe2+は鉄イオンの質量、xは1からNsまでの整数である。
(態様5)
前記核酸が、分子量が104以下のオリゴヌクレオチドであることを特徴とする態様3又は態様4記載の質量分析方法。
【発明の効果】
【0011】
本発明のイオン化支援キットは、以上のように、酸化鉄ナノ微粒子とクエン酸塩とを含んでおり、質量分析の際にFe3+から変換したFe2+が核酸中のリン酸に特異的に配位することで、核酸のイオン化効率を上昇させ、核酸の検出を容易にするものである。
【0012】
また、上記イオン化支援キットを用いた質量分析によって得られた核酸のマススペクトルの質量電荷比(m/z)は、ナトリウムやカリウムなどの通常のイオン付加体とは異なるFe2+付加体特有の法則性を有するので、核酸の検出を容易にする。ゆえに、試料中に複数の他の成分が核酸と共存していても、m/zの法則性から核酸の存在を容易に検出することができる。従って、本発明の質量分析方法によれば、組織や細胞など生体試料中での微量な核酸が検出可能となり、その他、代謝解析、遺伝子治療薬やオーダーメイド薬の開発、個体識別などの鑑定に応用できる。
【図面の簡単な説明】
【0013】
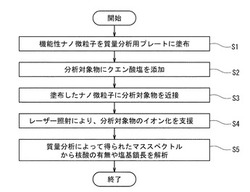
【図1】本発明の質量分析方法の各工程を示したフローチャートである。
【図2】本発明において酸化鉄ナノ微粒子にクエン酸塩を添加する役割を説明した図である。
【図3】実施例の質量分析法により得られたマススペクトルと従来技術(比較例1)の質量分析法により得られたマススペクトルとを示した図である。
【図4】実施例の質量分析法により得られたマススペクトルを示した図である。
【図5】実施例の質量分析法により得られたマススペクトルを示した図である。
【図6】比較例2の質量分析法により得られたマススペクトルを示した図である。
【発明を実施するための形態】
【0014】
以下に本発明を詳細に説明するが、これらの記載は本発明の実施形態の一例(代表例)であり、本発明の範囲を限定するものではない。
【0015】
(1)本発明の質量分析方法の概要
図1は本発明の質量分析方法の各工程を示したフローチャートである。図1に示すように、本発明の質量分析方法は、機能性ナノ微粒子を質量分析用プレートに塗布(固定化)する工程(工程S1)と、分析対象物にクエン酸塩水溶液を添加する工程(工程S2)と、質量分析用プレート上に修飾したナノ微粒子に分析対象物を近接させる工程(工程S3)と、質量分析用プレート上の分析対象物に向けてレーザー照射を行い、分析対象物のイオン化を支援する工程(工程S4)と、質量分析によって得られたマススペクトルから核酸の有無や種類を解析する工程(工程S5)と、を含む。
【0016】
次に、各工程S1〜S5について詳細に説明する。
(工程S1:機能性ナノ微粒子溶液の滴下・乾燥)
工程S1の機能性ナノ粒子の塗布(固定化)は、例えば、機能性ナノ微粒子溶液を質量分析用プレートに滴下して乾燥させることで可能となる。ここで、工程S1で使用する機能性ナノ微粒子溶液は、以下のように調製されることが好ましい。先ず、溶質となる機能性ナノ微粒子として、例えば、以下の式で与えられるナノ微粒子[xM(OH)2・ySiO2]が挙げられる。ここで、xM(OH)2はコア成分を、ySiO2はシェル成分を表す。なお、詳しくは、シェル成分はコア成分の表面上に形成されるSi−Oの層である。
【0017】
【数2】

【0018】
上記式中、Mは遷移金属を示し、具体的にはFeである。XはF,Cl,Br,Iから選ばれるハロゲン元素を示す。pは2または3、nは0から9までの整数、mは9または0である。xおよびyはともに1未満の正数である。
【0019】
なお、ナノ微粒子のコア成分は、後述するクエン酸塩との適切な反応を生じるように、Fe2O3を含んだ酸化鉄から構成される。なお、この酸化鉄に含まれる成分としてFe2O3のみを用いることは本発明の効果を発揮する上で好ましいが、Fe2O3は微量であっても後述のクエン酸塩と反応(Fe2+への変換)していくため、酸化鉄中にはFe2O3の以外にも、FeOやFe3O4等の他の酸化鉄成分が含まれていても良い。
【0020】
本発明の上記ナノ微粒子は、例えば、上記コアを覆うアモルファスシリカネットワークからなるシェルを調製する工程と、このシェルの表面に共有結合的に官能基を導入する工程との二段階の工程を経た手法により調製することができる。調製された機能性微粒子の平均粒子径は、30nm以下であればよいが、好ましくは1〜20nmである。
【0021】
なお、この最初の工程では、コア成分の表面では、Si−Oが非晶質(アモルファス)状態のネットワークを形成するため、コア成分全体がSi−Oの層に被覆された状態となる。これがナノ微粒子のシェル成分となる。ここで作られたシェル成分は、後述の官能基を共有結合的に導入するために用いられる。
【0022】
また、核酸検出用の官能基は、核酸を構成する糖と親和性を示すことから、アミノ基が好ましい。官能基は、例えばシランカップリング剤を介して共有結合的に導入できる。特に、シランカップリング剤は、上述したように、分析対象物質と複合体を形成できるような反応性または親和性を有する官能基を有しているものが好ましく、以下の理由から、特に、3−アミノプロピルトリエトキシシラン(3−Aminopropyltriethoxysilane、また、本明細書ではAPTESとも呼ぶ。)又は3−アミノプロピルトリメトキシシラン(3−Aminopropylmethoxysilane)が好ましい。
【0023】
また、シランカップリング剤は、それ自身が有する官能基(例えば、アミノ基)に加えてシラノール基を有するため、水酸基も導入される。なお、3−アミノプロピルトリエトキシシラン、または3−アミノプロピルトリメトキシシランなどは、それ自体が水中でアルカリ性を示すために、水溶性金属塩の水溶液(例えば、塩化鉄水溶液)に混ぜるだけで核酸検出に好適なアミノ基と水酸基とを有するナノ微粒子を調製することができる。またマコーレート様構造を有する微粒子を調製することも可能である。
【0024】
また、二段階の工程を経て微粒子を調整する上述の方法とは別に、水溶性金属塩の水溶液とシランカップリング剤をアルカリ条件下で混合する一段階の工程のみで微粒子を調製する方法(特許文献2を参照)を用いても良い。アルカリ条件下とはpH7を超えるpHであればよいが、好ましくはpH10〜12である。なお、水溶性金属塩としては、コア金属の塩であって水に溶解して金属イオンを生じさせるものであれば良いが、核酸検出に用いるには、塩化鉄、例えば、FeCl2・4H2Oが好ましい。なお、得られたナノ微粒子をさらに焼結することによって、微粒子の粒径を調節することができる。
【0025】
なお、工程S1の湿式沈殿法(一段階処理)を行う際には、水溶性金属塩(例えば、塩化鉄)及びシランカップリング剤(例えば、APTES)に対して超純水を注水して、水溶性金属塩の分散処理及び沈殿物の洗浄を行うことが好ましい。また、水溶性金属塩とシランカップリング剤との仕込み比(単位はモル比)は、水溶性金属塩を1とした場合に1〜100が好ましく、40〜50がさらに好ましく、約45が最も好ましい。以上のように作製されたナノ微粒子析出物を蒸留水などで懸濁することで、機能性ナノ微粒子溶液(好ましくは飽和溶液)が調製される。ナノ微粒子を懸濁する溶液は、微粒子本体や官能基を分解・変性させないものであれば、特に限定されるものではないが、メタノール又はエタノール等のアルコールや蒸留水等の水溶液に懸濁させることが好ましい。
【0026】
工程S1では、以上のように調整された機能性ナノ微粒子溶液を質量分析用プレートに滴下し、乾燥させる。溶液の滴下量及び乾燥温度は、分析対象試料の種類や大きさに依存するが、通常、室温程度(25℃程度)に設定された環境で、1mg/ml濃度のナノ微粒子溶液(懸濁液)を1μl程度、基板上に滴下することが好ましい。
【0027】
(工程S2:サンプル溶液へのクエン酸塩の添加)
本発明の質量分析方法では、工程S1の後に、分析対象物にクエン酸塩を添加する工程(工程S2)を行う。工程S2は、具体的には、分析対象物(核酸)を含んだサンプル溶液にクエン酸塩水溶液を添加して混合溶液の調整を行うことで達成される。
【0028】
(工程S3:ナノ微粒子と分析対象物との近接)
次いで、上述の工程S1に従って質量分析用プレート上に修飾したナノ微粒子に分析対象物を近接させる(工程S3)。工程S3は、工程S2で調整された混合溶液を質量分析用プレート上に修飾したナノ微粒子に向けて滴下し、乾燥させることで達成される。
【0029】
分析対象物質である核酸は、塩基と糖とリン酸とからなるヌクレオチドがリン酸エステル結合で連なった生体高分子である。糖の違い(2’位が、水素基か水酸基であるか)によって、2−デオキシリボースを持つデオキシリボ核酸(DNA)と、リボースを持つリボ核酸(RNA)とに分類される。本発明に用いられる核酸として、微粒子のイオン化効率の面から、その塩基数が30以下のオリゴヌクレオチドが望ましく、その分子量が104以下であるものが好ましい。
【0030】
分析対象物質の核酸は必ずしも精製された物質である必要はなく、核酸を含む試料をそのまま微粒子に添加することによって核酸とナノ微粒子とを近接させてもよい。核酸を含む試料としては、植物、動物または微生物などに由来する細胞、組織、血液や体液、またはこれらからの抽出物など核酸を含んだ生体試料が挙げられる。また、土壌や排水などから単離された試料であってもよい。
【0031】
なお、添加するクエン酸塩としては、クエン酸を含み、微粒子のコア成分Fe3+をFe2+にするものであればよく、例えば、クエン酸ナトリウム、クエン酸カリウム、クエン酸カルシウム、クエン酸アンモニウムなどが挙げられる。クエン酸塩水溶液を調製する際には、クエン酸塩の濃度は、ナノ微粒子を沈殿させないようにするため、終濃度で0.1〜1.0mM、好ましくは、0.5〜1.0mMである。
【0032】
本発明では、以上のようにnano−PALDI法に基づいて核酸を検出する際には、酸化鉄ナノ微粒子(コア成分:Fe2O3:Fe(III))をプレートに塗布させる他に、クエン酸アンモニウム等のクエン酸塩をサンプル溶液に添加することを特徴とする。
【0033】
(従来のクエン酸の役割)
質量分析の分野において、クエン酸は、一般に、サンプル溶液中に溶存したアルカリ金属イオンをキレートするために添加される。これにより、アルカリ金属付加体を減らし、核酸を優先的にイオン化する。実験操作上、クエン酸がアルカリ金属をキレートするのは、サンプル溶液にクエン酸を添加した時(溶液状態)である。このキレート効果を発揮させるために、例えば、従来のMALDI法に基づく質量分析では、クエン酸を組み合わせた専用マトリクス(3−Hydroxypicolinic acid(つまり、3−HPA)とDiammonium hydrogen citrate(つまり、AHC)との組み合わせ)が知られている(John M. Asara and John Allison, Enhanced Detection of Oligonucleotides in UV MALDI MS Using the Tetraamine Spermine as a Matrix Additive, Anal. Chem. 1999, 71, 2866−2870を参照)。
【0034】
(工程S2におけるクエン酸の役割)
これに対して、本発明においてクエン酸を添加する主な役割は、次式及び図2(a)に示すように、酸化鉄ナノ微粒子コア成分に含まれる三価の鉄イオンFe3+(式中では、Fe(III))に対してクエン酸存在下で紫外光(紫外線レーザー)を照射することで、このFe3+を二価の鉄イオンFe2+(式中では、Fe(II))に変換することである。なお、図2(b)は、図2(a)中に示した矩形枠部分の組成を詳しく示した図である。
【0035】
【数3】

【0036】
これにより、図2(b)に示すように、プレート上に修飾されたナノ微粒子中の鉄がFe2+として、近接した核酸骨格のリン酸2個に配位するものと考えられる。なお、本発明の手法によって質量分析を行うと、アルカリ金属付加体のシグナルが観察されず、Fe2+付加体のみが観察されるようになる。これは、鉄イオンがナノ微粒子(固体)のコアに存在し、気相中でFe(III)からFe(II)に変換されるためにクエン酸がFe2+をキレートしないと推察される。但し、本発明においてもサンプル溶液中に溶存している他のアルカリ金属については、サンプル調製(溶液状態)の過程でキレートされていると推察される。
【0037】
言い換えれば、本発明においてクエン酸塩を添加することの効果は、(1)レーザー照射反応と組み合わせて気相中でFe(III)をFe(II)に変換することと、(2)Fe2+付加体以外のサンプル溶液中の他のアルカリ金属については、これらをサンプル調製段階でキレートすることと、の2つの現象を得ることであるといえる。
【0038】
従来のMALDIでは、核酸専用マトリクスを用いるので、試料中に核酸以外に薬剤やペプチドが混入した場合には混入物の分析は望めない。これに対して、本発明の質量分析方法で用いる酸化鉄ナノ微粒子は、ペプチド、薬剤、配糖体、タンパク質もイオン化できるため、混合物の各成分を検出できる可能性がある。これはイオン化支援剤としての汎用性を高める。
【0039】
但し、従来のMALDIでも、マトリクスの選択を正しく行えば効率よく分析対象物をイオン化できる。故に、例えば、試料が低分子のものについてはnano−PALDIに基づく本発明の手法で検出を行い、タンパク質を含む試料についてはMALDIで行うことが考えられる。また、未知の混合物があったときの、最初のスクリーニングとして、本発明のnano−PALDI法を用い、その後、詳細に検出したい領域をMALDIで行うなどの棲み分けを行えば、既存法を否定せずに、既存法と本発明のnano−PALDI法との双方を有効に利用して分析対象物の検出と分析とを行うことができる。
【0040】
(工程S4:レーザー照射)
工程S3の後、質量分析用プレート上の乾燥物に向けて紫外線レーザー照射を行い、分析対象物をイオン化する(工程S4)。この工程S4は市販の質量分析装置によって行うことができる。質量分析で用いる紫外線レーザーには、例えば、窒素レーザー(337nm)やYAGレーザー(357nm)が挙げられる。レーザーの強度は、1〜20マイクロジュール(μJ)/cm2の範囲が好ましい。
【0041】
(工程S5:分析対象物の解析)
工程S4の後、質量分析によって得られたマススペクトルから核酸の有無を判断する(工程S5)。工程S4にて核酸をイオン化すると、上述したように、核酸内のリン酸2個からH+イオンが脱離し、その部分に、1個のFe2+イオン(以下、Fe2+とも呼ぶ。)が付与される(図2(b)を参照)。これは分析対象物の中でも核酸に対して特異的に表れる事象であり、核酸のFe2+付加体の質量を測定できる他、Fe2+の付与数から核酸の塩基鎖長を推測できる。
【0042】
すなわち、本発明の質量分析法によって得られるマススペクトルのシグナルの総数と、各シグナルにおける質量電荷比と、をNsと(m/z)xとよって表した場合に、以下の関係式が成立する。
【0043】
【数4】

【0044】
ここで、nとMとは核酸の塩基数と質量とであり、Hは水素イオンの質量であり、
Fe2+は鉄イオンの質量、xは1からNsまでの整数である。
【0045】
なお、この分野の質量分析において、単にリン酸基2個に対して、Fe2+が1個配位したマススペクトルのシグナルが1本観察されたのでは、分析対象物が核酸であるか否かを推測できず、また、元の核酸の質量が分からない。しかしながら、本手法では、元の質量[M−H]−の他に、Fe2+が複数配位した配位シグナルが複数本Ns(上記式を参照)だけ観察される。例えば、核酸の鎖長が6塩基(n=6)であれば、[M−H]−のシグナルの他に、Fe2+が1個、2個、又は3個配位したシグナルが1本ずつ観察される(合計4本のスペクトル)。塩基鎖長の総本数は、質量電荷比の所定の間隔のシグナル(具体的にはFe2+−2Hの質量(つまり約54(=55.85−2))おきのシグナル)の数から推測できる。これにより、混合サンプル溶液中の核酸の有無の判定のみならず、存在する核酸の種類を特定することができるようになる。
【実施例】
【0046】
次に本発明の具体的な実施例を示すが、本発明は以下の実施例によって何ら限定されるものではない。
【0047】
(1)ナノ微粒子の調製(露出される官能基;水酸基及びアミノ基)
微粒子は単分散に微粒子が得られる湿式沈殿法を用いた。調製に際して、上述した金属塩水溶液とシランカップリング剤の材料として、FeCl2・4H2Oと3−アミノプロピルトリエトキシシラン(APTES)を用いて、酸化鉄(Fe2O3)をコア成分とするマコーレート様構造を持つナノ微粒子を調製した(Fe−O)。より詳しくは、FeCl2・4H2O、2gを秤量し100mlの超純水に溶解させて(終濃度10mM)、水溶液を得た。さらに、この水溶液を室温で約10分、充分攪拌したのち、100mlの3−アミノプロピルトリエトキシシラン(APTES)混合させ60分間反応を完結させた。その後、この溶液を60分間遠心分離器に掛け上澄み液を捨て、超純水を注いで再分散させてから遠心分離器に掛け上澄み液を捨てる操作を数回繰り返し、沈殿物を洗浄した。ついで、約77℃に保持した恒温槽で乾燥後、乳鉢で微粉砕して酸化鉄ナノ微粒子を得た。この場合の水溶性金属塩とシランカップリング剤との仕込み比は、FeCl2・4H2O:APTES=1:45とした。
【0048】
(2)ナノ微粒子溶液の調製
上記(1)で得られた酸化鉄ナノ微粒子粉末を、蒸留水0.5mlに懸濁し、ナノ微粒子析出物を有するナノ微粒子飽和液を調製した。
【0049】
(3)核酸水溶液の調製
オリゴヌクレオチドを蒸留水で溶解して核酸水溶液を調整した。ここでは、以下の表1に示すように、7種類のオリゴヌクレオチド(終濃度各100 pmol/μL)を用意して、7種類の核酸水溶液を調製した。尚、表中(a)、(c)、(d)、(e)及び(g)の核酸の種類はDNAであり、一方(b)及び(f)の核酸の種類はRNAである。
【0050】
【表1】

【0051】
(4)ナノ微粒子による質量分析
酸化鉄ナノ微粒子溶液を質量分析専用プレート(V700813;Applied Biosytems社)に1μL滴下し真空乾燥させた。乾燥後、上記(3)で調製した核酸水溶液とクエン酸2アンモニウム(ACH)水溶液(終濃度1mM)の混合溶液1μLを質量分析専用プレートに滴下し、自然乾燥させた。その後、質量分析装置(Voyager−DE−RP;Applied Biosytems社)によりレーザー照射を行い、サンプル検出を行った。
【0052】
(塩基数n=6の核酸(DNA及びRNA)に対する本発明手法による質量分析)
上記核酸水溶液(a)及び(b)に対して本発明の質量分析を実施して得られた質量電荷比のマススペクトルを図3(a)及び(c)に示す。ここで、マススペクトルとは、図3の各図中に示された質量電荷比(m/z)の強度曲線全体を指し、シグナルとは、マススペクトルのうち、強度が顕著に変化(上昇)している部分を指す。この点、図4及び図5の説明においても同様である。
【0053】
先ず、図3(a)は、塩基数n=6(この場合、nは偶数)の核酸水溶液(DNA)を用いた結果である。図3(a)では、質量電荷比(m/z)が[M−H]−に相当するシグナルの他、[M+Fe2+−3H]−、[M+2Fe2+−5H]−、及び[M+3Fe2+−7H]−に相当する合計4本のシグナルが観測された。この結果より、塩基数とシグナルの総数とをそれぞれn、NsとするとNs=(n)/2+1=4の関係が成立していることが分かる(上述の数4の上段の式を参照)。
【0054】
一方、各シグナルの順序xに対応した質量電荷比(m/z)xで表現すると、(m/z)x=1=[M−H]−、(m/z)x=2=[M+Fe2+−3H]−、(m/z)x=3=[M+2Fe2+−5H]−、及び(m/z)x=4=[M+3Fe2+−7H]−となる。この結果より、上述の数式(数4の下段の式)に示す関係が成立していることが分かる。
【0055】
また、各シグナルの(m/z)xの質量間隔(図3(a)中、隣接するシグナルの間隔)はFe2+−2Hの質量である約54の質量間隔に対応していることが分かる。
【0056】
図3(c)に示す塩基数n=6(nは偶数)の核酸水溶液(RNA)の場合も同様に、合計4つのシグナル(つまり、Ns=4)が観測され、質量電荷比を上述のn=6のDNAの場合と同様に(m/z)xで表現することができ、上述の数式(数4の上段と下段の式)の関係が成立することが分かった。
【0057】
(比較例1 塩基数n=6の核酸に対する従来手法による質量分析)
これらの結果と比較するため、上記核酸水溶液(a)及び(c)に対して従来のマトリックス支援型(MALDI)法の質量分析手法を実施して得られた結果を図3(b)及び(d)に示す。
【0058】
これらの比較例の核酸水溶液の作製にあたっては、3−ヒドロキシピコリン酸粉末10mgを990μLに溶解し、クエン酸2アンモニウム(100mg/mL)水溶液10μLを添加したものをマトリックスとした。該マトリックス溶液を質量分析専用プレート(V700813;Applied Biosytems社)に1μL滴下し自然乾燥させた。乾燥後、前述の核酸1μLを滴下し自然乾燥させ共結晶体を調製した。その後、質量分析装置(Voyager−DE−RP;Applied Biosytems社)によりLinear Negativeモードでサンプル解析を行った。
【0059】
図3(b)及び図3(d)では、通常観察される脱プロトン体(各図中、[M−H]−のシグナル)と、ナトリウム及びカリウム付加体のシグナルは検出されたが、上述したような法則性(上記数式(数4)に示す関係)を示さなかった。言い換えれば、従前の手法と異なり、核酸溶液に対して本発明の分析手法を適用すると上記の法則性が表れてくるため、本発明の分析手法はサンプル溶液中の核酸の有無を判断したり、核酸の種類を特定したりすることができるのである。
【0060】
以上、表1中の(a)及び(b)の核酸水溶液に対して本発明の質量分析手法を適用し、これらの結果を図3の(a)及び(c)に示しながら説明を加えた。次に、表1中の(c)〜(g)の核酸水溶液に対して本発明の質量分析手法を適用した結果を図4及び図5に示す。
【0061】
先ず、図4(a)は、塩基数n=8(nは偶数)のDNA水溶液に対する本発明の質量分析結果である。この図4(a)では、(m/z)が[M−H]−に相当するシグナルの他、[M+Fe2+−3H]−、[M+2Fe2+−5H]−、[M+3Fe2+−7H]−、及び[M+4Fe2+−9H]−に相当する合計5本のシグナル(つまり、Ns=5)が、図3(a)及び(c)と同様の質量間隔(つまり質量約54)で観測された。また、上述のn=6のDNAの場合(図3(a)の場合)と同様に(m/z)xで表現することができ、上述の数式(数4の上段と下段の式)の関係が成立することが分かった。
【0062】
次に、図4(b)は、塩基数n=9(nは奇数)のDNA水溶液に対する本発明の質量分析結果である。この図4(b)では、(m/z)が[M−H]−に相当するシグナルの他、[M+Fe2+−3H]−、[M+2Fe2+−5H]−、[M+3Fe2+−7H]−、及び[M+4Fe2+−9H]−に相当する合計5本のシグナルが、図3(a)及び(c)と同様の質量間隔(つまり質量約54)で観測された。この結果より、塩基数とシグナルの総数とをそれぞれn、NsとするとNs=((n−1)/2)+1=5の関係が成立していることが分かる(上述の数4の中段の式を参照)。加えて、上述のn=6のDNAの場合(図3(a)の場合)と同様に(m/z)xで表現することができ、上述の数式(数4の下段の数式)の関係が成立することが分かった。
【0063】
また、図4(c)は、塩基数n=10(nは偶数)のDNA水溶液に対する本発明の質量分析結果である。この図4(c)では、(m/z)が[M−H]−に相当するシグナルの他、[M+Fe2+−3H]−、[M+2Fe2+−5H]−、[M+3Fe2+−7H]−、[M+4Fe2+−9H]−及び[M+5Fe2+−11H]−に相当する合計6本のシグナル(つまり、Ns=6)が、図3(a)及び(c)と同様の質量間隔(つまり質量約54)で観測された。また、上述のn=6のDNAの場合(図3(a)の場合)と同様に(m/z)xで表現することができ、上述の数式(数4の上段と下段の式)の関係が成立することが分かった。
【0064】
また、図4(d)は、塩基数n=12(nは偶数)のDNA水溶液に対する本発明の質量分析結果である。この図4(d)では、(m/z)が[M−H]−に相当するシグナルの他、[M+Fe2+−3H]−、[M+2Fe2+−5H]−、[M+3Fe2+−7H]−、[M+4Fe2+−9H]−、[M+5Fe2+−11H]−及び[M+6Fe2+−13H]−に相当する合計7本のシグナル(つまり、Ns=7)が、図3(a)及び(c)と同様の質量間隔(つまり質量約54)で観測された。また、上述のn=6のDNAの場合(図3(a)の場合)と同様に(m/z)xで表現することができ、上述の数式(数4の上段と下段の式)の関係が成立することが分かった。
【0065】
また、図5は、塩基数n=10(nは偶数)のRNA水溶液に対する本発明の質量分析結果である。この図5では、(m/z)が[M−H]−に相当するシグナルの他、[M+Fe2+−3H]−、[M+2Fe2+−5H]−、[M+3Fe2+−7H]−、[M+4Fe2+−9H]−、及び[M+5Fe2+−11H]−に相当する合計6本のシグナル(つまり、Ns=6)が図3(a)及び(c)と同様の質量間隔(つまり質量約54)で観測された。また、上述のn=6のDNAの場合(図3(a)の場合)と同様に(m/z)xで表現することができ、上述の数式(数4の上段と下段の式)の関係が成立することが分かった。
【0066】
以上のように、本発明の質量分析を行った各オリゴヌクレオチドは効率よくイオン化され、分析に依って得られたNegativeイオンの質量電荷比(m/z)は、前記(1)の式で表現される法則性を有したFe2+付加体が観察されることが分かった。従って、この法則性を利用すれば、サンプル溶液中での核酸の有無や存在する核酸の種類の特定が可能になる。
【0067】
(比較例2)
核酸以外の成分(物質)を、酸化鉄ナノ微粒子を用いて、実施例1と同様に質量分析を行った。試料は、Negativeイオンとして、(a)タウロコール酸ナトリウム(牛胆汁由来、M=537.4)と、(b)ポリエチレングリコール 600スルファート(平均分子量M=600)との2種類を、Positiveイオンとして、(c)ペプチドのサブスタンスP(M=1347.6)の1種類を用いた。三種類の各サンプル(a)〜(c)の終濃度は100pmol/μLとした。各サンプル(a)〜(c)に対する質量分析によって得られたマススペクトルを図6(a)〜(c)に示す。図6の各グラフに示すように、得られたマススペクトルのm/zには、Fe2+の付加体を観察することはできなかった。
【産業上の利用可能性】
【0068】
本発明のイオン化支援キットは、質量分析において核酸の効率的なイオン化を支援する。また、本発明の質量分析方法によって得られたマススペクトルの質量電荷比(m/z)は、特有の法則性を示すことにより、混合物中の微量な核酸の検出を容易にする。従って、本発明は、代謝解析、遺伝子治療薬やオーダーメイド薬の開発、個体識別などの鑑定に利用できる。
【技術分野】
【0001】
本発明は、核酸のイオン化および検出に優れたイオン化支援キット及び質量分析法に関する。
【背景技術】
【0002】
遺伝情報を担う核酸(DNA、RNA)は、遺伝子治療やオーダーメイド医療の医薬品候補化合物として利用されるとともに、血液等から人物の特定などを行う犯罪捜査や親子鑑定、感染症の病原菌の同定などに利用されている重要な天然化合物である。
【0003】
核酸の検出は、PCR(Polymerase chain reaction)法での増幅および蛍光法による検出が主流であるが、細胞や組織などからの核酸の抽出などの前処理工程を要する。
【0004】
一方、近年の質量分析の発達により、微量成分の核酸を検出するために、種々のイオン化法が検討されており、例えば、エレクトロンスプレーイオン化法、マトリックス支援型脱離イオン化法(Matrix assisted laser desorption/ionization:MALDI)、高速原子衝撃法が挙げられる。しかしながら、これらの方法は、手法や測定条件によって、マススペクトルで生成する質量電荷比(m/z)が異なり、法則性がわかりにくい。従って、これらの方法を用いて試料を検出しても解析が困難であり、DNAの判断がつきにくいといった問題が指摘されていた(非特許文献1及び非特許文献2を参照)。
【0005】
ところで、近年、直径1.3〜3nmのサイズの磁気超ナノ微粒子を機能化し、生きた細胞、組織内に導入する技術が開発されている(特許文献1を参照)。また、ナノ微粒子を用いて生体試料のイオン化が可能なナノ微粒子レーザー脱離イオン化法(nano−PALDI)と呼ばれた手法も既に提案されている(特許文献2を参照)。なお、この従来のnano‐PALDI法で分析可能な物質は、蛋白質、ペプチド、糖、脂質などの生体物質や、合成低分子化合物、合成ポリマーなどとされているが、今までに開発されている微粒子では核酸をイオン化することが比較的困難であった。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特開2008−170326号公報
【特許文献2】特開2008−261837号公報
【非特許文献】
【0007】
【非特許文献1】Wu J., McLuckey S.A., International Journal of Mass Spectrometry2004, 237, 197-241
【非特許文献2】横澤 勉,小野 晶,神奈川大学工学研究所所報,2007,30,92−94
【発明の概要】
【発明が解決しようとする課題】
【0008】
本発明は、このような事情に鑑みてなされたものであり、nano‐PALDI法に基づいて核酸の検出に特化した質量分析方法を提供することを目的とする。また、本発明の別の目的は、この質量分析における核酸の検出に適したイオン化支援キットを提供することである。
【課題を解決するための手段】
【0009】
本発明者らは、上記課題を解決するために鋭意検討した結果、機能性ナノ微粒子を含んだイオン化支援剤にクエン酸塩を加えて質量分析を行うことで、核酸のイオン化効率を上昇させることができること、得られたマススペクトルの質量電荷比(m/z)が特有の法則性を有すること、及びこれらの現象を利用すれば容易に核酸を検出できることを見出し、本発明を完成するに至った。
【0010】
すなわち、本発明によれば、以下の態様の発明が提供される。
(態様1)
Fe2O3を含んだ酸化鉄からなるコアを有した機能性ナノ微粒子と、
クエン酸塩水溶液と、
を含み、かつ、分析対象物中の核酸のイオン化を支援することを特徴とするイオン化支援キット。
(態様2)
前記微粒子は、前記コアを覆うアモルファスシリカネットワークからなるシェルと、
前記シェルの表面に共有結合的に導入された官能基と、
を有していることを特徴とする態様1記載のイオン化支援キット。
(態様3)
機能性ナノ微粒子を質量分析用プレートに固定化する工程と、
分析対象物にクエン酸塩を添加する工程と、
前記プレート上に修飾した前記微粒子に前記分析対象物を近接させる工程と、
前記プレート上の前記分析対象物に向けて紫外線レーザー照射を行い、前記分析対象物のイオン化を支援する工程と、
質量分析によって得られたマススペクトルから核酸の有無や塩基鎖長を解析する工程と、
を含む質量分析方法であって、
前記微粒子はFe2O3を含んだ酸化鉄からなるコアを有し、
前記解析工程では、前記マススペクトルの質量電荷比がFe2+−2Hの質量で示された間隔で2つ以上存在するか否かを判定することを含むことを特徴とする質量分析方法。
(態様4)
前記解析工程では、前記マススペクトルのシグナルの総数と各シグナルにおける質量電荷比とをNsと(m/z)xとによって表した場合に、Nsと(m/z)xとが次式で示される規則性を示すか否かを判定することを含むことを特徴とする態様3記載の質量分析方法。
【数1】

ここで、nとMとは前記核酸の塩基数と質量とであり、Hは水素イオンの質量であり、
Fe2+は鉄イオンの質量、xは1からNsまでの整数である。
(態様5)
前記核酸が、分子量が104以下のオリゴヌクレオチドであることを特徴とする態様3又は態様4記載の質量分析方法。
【発明の効果】
【0011】
本発明のイオン化支援キットは、以上のように、酸化鉄ナノ微粒子とクエン酸塩とを含んでおり、質量分析の際にFe3+から変換したFe2+が核酸中のリン酸に特異的に配位することで、核酸のイオン化効率を上昇させ、核酸の検出を容易にするものである。
【0012】
また、上記イオン化支援キットを用いた質量分析によって得られた核酸のマススペクトルの質量電荷比(m/z)は、ナトリウムやカリウムなどの通常のイオン付加体とは異なるFe2+付加体特有の法則性を有するので、核酸の検出を容易にする。ゆえに、試料中に複数の他の成分が核酸と共存していても、m/zの法則性から核酸の存在を容易に検出することができる。従って、本発明の質量分析方法によれば、組織や細胞など生体試料中での微量な核酸が検出可能となり、その他、代謝解析、遺伝子治療薬やオーダーメイド薬の開発、個体識別などの鑑定に応用できる。
【図面の簡単な説明】
【0013】
【図1】本発明の質量分析方法の各工程を示したフローチャートである。
【図2】本発明において酸化鉄ナノ微粒子にクエン酸塩を添加する役割を説明した図である。
【図3】実施例の質量分析法により得られたマススペクトルと従来技術(比較例1)の質量分析法により得られたマススペクトルとを示した図である。
【図4】実施例の質量分析法により得られたマススペクトルを示した図である。
【図5】実施例の質量分析法により得られたマススペクトルを示した図である。
【図6】比較例2の質量分析法により得られたマススペクトルを示した図である。
【発明を実施するための形態】
【0014】
以下に本発明を詳細に説明するが、これらの記載は本発明の実施形態の一例(代表例)であり、本発明の範囲を限定するものではない。
【0015】
(1)本発明の質量分析方法の概要
図1は本発明の質量分析方法の各工程を示したフローチャートである。図1に示すように、本発明の質量分析方法は、機能性ナノ微粒子を質量分析用プレートに塗布(固定化)する工程(工程S1)と、分析対象物にクエン酸塩水溶液を添加する工程(工程S2)と、質量分析用プレート上に修飾したナノ微粒子に分析対象物を近接させる工程(工程S3)と、質量分析用プレート上の分析対象物に向けてレーザー照射を行い、分析対象物のイオン化を支援する工程(工程S4)と、質量分析によって得られたマススペクトルから核酸の有無や種類を解析する工程(工程S5)と、を含む。
【0016】
次に、各工程S1〜S5について詳細に説明する。
(工程S1:機能性ナノ微粒子溶液の滴下・乾燥)
工程S1の機能性ナノ粒子の塗布(固定化)は、例えば、機能性ナノ微粒子溶液を質量分析用プレートに滴下して乾燥させることで可能となる。ここで、工程S1で使用する機能性ナノ微粒子溶液は、以下のように調製されることが好ましい。先ず、溶質となる機能性ナノ微粒子として、例えば、以下の式で与えられるナノ微粒子[xM(OH)2・ySiO2]が挙げられる。ここで、xM(OH)2はコア成分を、ySiO2はシェル成分を表す。なお、詳しくは、シェル成分はコア成分の表面上に形成されるSi−Oの層である。
【0017】
【数2】

【0018】
上記式中、Mは遷移金属を示し、具体的にはFeである。XはF,Cl,Br,Iから選ばれるハロゲン元素を示す。pは2または3、nは0から9までの整数、mは9または0である。xおよびyはともに1未満の正数である。
【0019】
なお、ナノ微粒子のコア成分は、後述するクエン酸塩との適切な反応を生じるように、Fe2O3を含んだ酸化鉄から構成される。なお、この酸化鉄に含まれる成分としてFe2O3のみを用いることは本発明の効果を発揮する上で好ましいが、Fe2O3は微量であっても後述のクエン酸塩と反応(Fe2+への変換)していくため、酸化鉄中にはFe2O3の以外にも、FeOやFe3O4等の他の酸化鉄成分が含まれていても良い。
【0020】
本発明の上記ナノ微粒子は、例えば、上記コアを覆うアモルファスシリカネットワークからなるシェルを調製する工程と、このシェルの表面に共有結合的に官能基を導入する工程との二段階の工程を経た手法により調製することができる。調製された機能性微粒子の平均粒子径は、30nm以下であればよいが、好ましくは1〜20nmである。
【0021】
なお、この最初の工程では、コア成分の表面では、Si−Oが非晶質(アモルファス)状態のネットワークを形成するため、コア成分全体がSi−Oの層に被覆された状態となる。これがナノ微粒子のシェル成分となる。ここで作られたシェル成分は、後述の官能基を共有結合的に導入するために用いられる。
【0022】
また、核酸検出用の官能基は、核酸を構成する糖と親和性を示すことから、アミノ基が好ましい。官能基は、例えばシランカップリング剤を介して共有結合的に導入できる。特に、シランカップリング剤は、上述したように、分析対象物質と複合体を形成できるような反応性または親和性を有する官能基を有しているものが好ましく、以下の理由から、特に、3−アミノプロピルトリエトキシシラン(3−Aminopropyltriethoxysilane、また、本明細書ではAPTESとも呼ぶ。)又は3−アミノプロピルトリメトキシシラン(3−Aminopropylmethoxysilane)が好ましい。
【0023】
また、シランカップリング剤は、それ自身が有する官能基(例えば、アミノ基)に加えてシラノール基を有するため、水酸基も導入される。なお、3−アミノプロピルトリエトキシシラン、または3−アミノプロピルトリメトキシシランなどは、それ自体が水中でアルカリ性を示すために、水溶性金属塩の水溶液(例えば、塩化鉄水溶液)に混ぜるだけで核酸検出に好適なアミノ基と水酸基とを有するナノ微粒子を調製することができる。またマコーレート様構造を有する微粒子を調製することも可能である。
【0024】
また、二段階の工程を経て微粒子を調整する上述の方法とは別に、水溶性金属塩の水溶液とシランカップリング剤をアルカリ条件下で混合する一段階の工程のみで微粒子を調製する方法(特許文献2を参照)を用いても良い。アルカリ条件下とはpH7を超えるpHであればよいが、好ましくはpH10〜12である。なお、水溶性金属塩としては、コア金属の塩であって水に溶解して金属イオンを生じさせるものであれば良いが、核酸検出に用いるには、塩化鉄、例えば、FeCl2・4H2Oが好ましい。なお、得られたナノ微粒子をさらに焼結することによって、微粒子の粒径を調節することができる。
【0025】
なお、工程S1の湿式沈殿法(一段階処理)を行う際には、水溶性金属塩(例えば、塩化鉄)及びシランカップリング剤(例えば、APTES)に対して超純水を注水して、水溶性金属塩の分散処理及び沈殿物の洗浄を行うことが好ましい。また、水溶性金属塩とシランカップリング剤との仕込み比(単位はモル比)は、水溶性金属塩を1とした場合に1〜100が好ましく、40〜50がさらに好ましく、約45が最も好ましい。以上のように作製されたナノ微粒子析出物を蒸留水などで懸濁することで、機能性ナノ微粒子溶液(好ましくは飽和溶液)が調製される。ナノ微粒子を懸濁する溶液は、微粒子本体や官能基を分解・変性させないものであれば、特に限定されるものではないが、メタノール又はエタノール等のアルコールや蒸留水等の水溶液に懸濁させることが好ましい。
【0026】
工程S1では、以上のように調整された機能性ナノ微粒子溶液を質量分析用プレートに滴下し、乾燥させる。溶液の滴下量及び乾燥温度は、分析対象試料の種類や大きさに依存するが、通常、室温程度(25℃程度)に設定された環境で、1mg/ml濃度のナノ微粒子溶液(懸濁液)を1μl程度、基板上に滴下することが好ましい。
【0027】
(工程S2:サンプル溶液へのクエン酸塩の添加)
本発明の質量分析方法では、工程S1の後に、分析対象物にクエン酸塩を添加する工程(工程S2)を行う。工程S2は、具体的には、分析対象物(核酸)を含んだサンプル溶液にクエン酸塩水溶液を添加して混合溶液の調整を行うことで達成される。
【0028】
(工程S3:ナノ微粒子と分析対象物との近接)
次いで、上述の工程S1に従って質量分析用プレート上に修飾したナノ微粒子に分析対象物を近接させる(工程S3)。工程S3は、工程S2で調整された混合溶液を質量分析用プレート上に修飾したナノ微粒子に向けて滴下し、乾燥させることで達成される。
【0029】
分析対象物質である核酸は、塩基と糖とリン酸とからなるヌクレオチドがリン酸エステル結合で連なった生体高分子である。糖の違い(2’位が、水素基か水酸基であるか)によって、2−デオキシリボースを持つデオキシリボ核酸(DNA)と、リボースを持つリボ核酸(RNA)とに分類される。本発明に用いられる核酸として、微粒子のイオン化効率の面から、その塩基数が30以下のオリゴヌクレオチドが望ましく、その分子量が104以下であるものが好ましい。
【0030】
分析対象物質の核酸は必ずしも精製された物質である必要はなく、核酸を含む試料をそのまま微粒子に添加することによって核酸とナノ微粒子とを近接させてもよい。核酸を含む試料としては、植物、動物または微生物などに由来する細胞、組織、血液や体液、またはこれらからの抽出物など核酸を含んだ生体試料が挙げられる。また、土壌や排水などから単離された試料であってもよい。
【0031】
なお、添加するクエン酸塩としては、クエン酸を含み、微粒子のコア成分Fe3+をFe2+にするものであればよく、例えば、クエン酸ナトリウム、クエン酸カリウム、クエン酸カルシウム、クエン酸アンモニウムなどが挙げられる。クエン酸塩水溶液を調製する際には、クエン酸塩の濃度は、ナノ微粒子を沈殿させないようにするため、終濃度で0.1〜1.0mM、好ましくは、0.5〜1.0mMである。
【0032】
本発明では、以上のようにnano−PALDI法に基づいて核酸を検出する際には、酸化鉄ナノ微粒子(コア成分:Fe2O3:Fe(III))をプレートに塗布させる他に、クエン酸アンモニウム等のクエン酸塩をサンプル溶液に添加することを特徴とする。
【0033】
(従来のクエン酸の役割)
質量分析の分野において、クエン酸は、一般に、サンプル溶液中に溶存したアルカリ金属イオンをキレートするために添加される。これにより、アルカリ金属付加体を減らし、核酸を優先的にイオン化する。実験操作上、クエン酸がアルカリ金属をキレートするのは、サンプル溶液にクエン酸を添加した時(溶液状態)である。このキレート効果を発揮させるために、例えば、従来のMALDI法に基づく質量分析では、クエン酸を組み合わせた専用マトリクス(3−Hydroxypicolinic acid(つまり、3−HPA)とDiammonium hydrogen citrate(つまり、AHC)との組み合わせ)が知られている(John M. Asara and John Allison, Enhanced Detection of Oligonucleotides in UV MALDI MS Using the Tetraamine Spermine as a Matrix Additive, Anal. Chem. 1999, 71, 2866−2870を参照)。
【0034】
(工程S2におけるクエン酸の役割)
これに対して、本発明においてクエン酸を添加する主な役割は、次式及び図2(a)に示すように、酸化鉄ナノ微粒子コア成分に含まれる三価の鉄イオンFe3+(式中では、Fe(III))に対してクエン酸存在下で紫外光(紫外線レーザー)を照射することで、このFe3+を二価の鉄イオンFe2+(式中では、Fe(II))に変換することである。なお、図2(b)は、図2(a)中に示した矩形枠部分の組成を詳しく示した図である。
【0035】
【数3】

【0036】
これにより、図2(b)に示すように、プレート上に修飾されたナノ微粒子中の鉄がFe2+として、近接した核酸骨格のリン酸2個に配位するものと考えられる。なお、本発明の手法によって質量分析を行うと、アルカリ金属付加体のシグナルが観察されず、Fe2+付加体のみが観察されるようになる。これは、鉄イオンがナノ微粒子(固体)のコアに存在し、気相中でFe(III)からFe(II)に変換されるためにクエン酸がFe2+をキレートしないと推察される。但し、本発明においてもサンプル溶液中に溶存している他のアルカリ金属については、サンプル調製(溶液状態)の過程でキレートされていると推察される。
【0037】
言い換えれば、本発明においてクエン酸塩を添加することの効果は、(1)レーザー照射反応と組み合わせて気相中でFe(III)をFe(II)に変換することと、(2)Fe2+付加体以外のサンプル溶液中の他のアルカリ金属については、これらをサンプル調製段階でキレートすることと、の2つの現象を得ることであるといえる。
【0038】
従来のMALDIでは、核酸専用マトリクスを用いるので、試料中に核酸以外に薬剤やペプチドが混入した場合には混入物の分析は望めない。これに対して、本発明の質量分析方法で用いる酸化鉄ナノ微粒子は、ペプチド、薬剤、配糖体、タンパク質もイオン化できるため、混合物の各成分を検出できる可能性がある。これはイオン化支援剤としての汎用性を高める。
【0039】
但し、従来のMALDIでも、マトリクスの選択を正しく行えば効率よく分析対象物をイオン化できる。故に、例えば、試料が低分子のものについてはnano−PALDIに基づく本発明の手法で検出を行い、タンパク質を含む試料についてはMALDIで行うことが考えられる。また、未知の混合物があったときの、最初のスクリーニングとして、本発明のnano−PALDI法を用い、その後、詳細に検出したい領域をMALDIで行うなどの棲み分けを行えば、既存法を否定せずに、既存法と本発明のnano−PALDI法との双方を有効に利用して分析対象物の検出と分析とを行うことができる。
【0040】
(工程S4:レーザー照射)
工程S3の後、質量分析用プレート上の乾燥物に向けて紫外線レーザー照射を行い、分析対象物をイオン化する(工程S4)。この工程S4は市販の質量分析装置によって行うことができる。質量分析で用いる紫外線レーザーには、例えば、窒素レーザー(337nm)やYAGレーザー(357nm)が挙げられる。レーザーの強度は、1〜20マイクロジュール(μJ)/cm2の範囲が好ましい。
【0041】
(工程S5:分析対象物の解析)
工程S4の後、質量分析によって得られたマススペクトルから核酸の有無を判断する(工程S5)。工程S4にて核酸をイオン化すると、上述したように、核酸内のリン酸2個からH+イオンが脱離し、その部分に、1個のFe2+イオン(以下、Fe2+とも呼ぶ。)が付与される(図2(b)を参照)。これは分析対象物の中でも核酸に対して特異的に表れる事象であり、核酸のFe2+付加体の質量を測定できる他、Fe2+の付与数から核酸の塩基鎖長を推測できる。
【0042】
すなわち、本発明の質量分析法によって得られるマススペクトルのシグナルの総数と、各シグナルにおける質量電荷比と、をNsと(m/z)xとよって表した場合に、以下の関係式が成立する。
【0043】
【数4】

【0044】
ここで、nとMとは核酸の塩基数と質量とであり、Hは水素イオンの質量であり、
Fe2+は鉄イオンの質量、xは1からNsまでの整数である。
【0045】
なお、この分野の質量分析において、単にリン酸基2個に対して、Fe2+が1個配位したマススペクトルのシグナルが1本観察されたのでは、分析対象物が核酸であるか否かを推測できず、また、元の核酸の質量が分からない。しかしながら、本手法では、元の質量[M−H]−の他に、Fe2+が複数配位した配位シグナルが複数本Ns(上記式を参照)だけ観察される。例えば、核酸の鎖長が6塩基(n=6)であれば、[M−H]−のシグナルの他に、Fe2+が1個、2個、又は3個配位したシグナルが1本ずつ観察される(合計4本のスペクトル)。塩基鎖長の総本数は、質量電荷比の所定の間隔のシグナル(具体的にはFe2+−2Hの質量(つまり約54(=55.85−2))おきのシグナル)の数から推測できる。これにより、混合サンプル溶液中の核酸の有無の判定のみならず、存在する核酸の種類を特定することができるようになる。
【実施例】
【0046】
次に本発明の具体的な実施例を示すが、本発明は以下の実施例によって何ら限定されるものではない。
【0047】
(1)ナノ微粒子の調製(露出される官能基;水酸基及びアミノ基)
微粒子は単分散に微粒子が得られる湿式沈殿法を用いた。調製に際して、上述した金属塩水溶液とシランカップリング剤の材料として、FeCl2・4H2Oと3−アミノプロピルトリエトキシシラン(APTES)を用いて、酸化鉄(Fe2O3)をコア成分とするマコーレート様構造を持つナノ微粒子を調製した(Fe−O)。より詳しくは、FeCl2・4H2O、2gを秤量し100mlの超純水に溶解させて(終濃度10mM)、水溶液を得た。さらに、この水溶液を室温で約10分、充分攪拌したのち、100mlの3−アミノプロピルトリエトキシシラン(APTES)混合させ60分間反応を完結させた。その後、この溶液を60分間遠心分離器に掛け上澄み液を捨て、超純水を注いで再分散させてから遠心分離器に掛け上澄み液を捨てる操作を数回繰り返し、沈殿物を洗浄した。ついで、約77℃に保持した恒温槽で乾燥後、乳鉢で微粉砕して酸化鉄ナノ微粒子を得た。この場合の水溶性金属塩とシランカップリング剤との仕込み比は、FeCl2・4H2O:APTES=1:45とした。
【0048】
(2)ナノ微粒子溶液の調製
上記(1)で得られた酸化鉄ナノ微粒子粉末を、蒸留水0.5mlに懸濁し、ナノ微粒子析出物を有するナノ微粒子飽和液を調製した。
【0049】
(3)核酸水溶液の調製
オリゴヌクレオチドを蒸留水で溶解して核酸水溶液を調整した。ここでは、以下の表1に示すように、7種類のオリゴヌクレオチド(終濃度各100 pmol/μL)を用意して、7種類の核酸水溶液を調製した。尚、表中(a)、(c)、(d)、(e)及び(g)の核酸の種類はDNAであり、一方(b)及び(f)の核酸の種類はRNAである。
【0050】
【表1】

【0051】
(4)ナノ微粒子による質量分析
酸化鉄ナノ微粒子溶液を質量分析専用プレート(V700813;Applied Biosytems社)に1μL滴下し真空乾燥させた。乾燥後、上記(3)で調製した核酸水溶液とクエン酸2アンモニウム(ACH)水溶液(終濃度1mM)の混合溶液1μLを質量分析専用プレートに滴下し、自然乾燥させた。その後、質量分析装置(Voyager−DE−RP;Applied Biosytems社)によりレーザー照射を行い、サンプル検出を行った。
【0052】
(塩基数n=6の核酸(DNA及びRNA)に対する本発明手法による質量分析)
上記核酸水溶液(a)及び(b)に対して本発明の質量分析を実施して得られた質量電荷比のマススペクトルを図3(a)及び(c)に示す。ここで、マススペクトルとは、図3の各図中に示された質量電荷比(m/z)の強度曲線全体を指し、シグナルとは、マススペクトルのうち、強度が顕著に変化(上昇)している部分を指す。この点、図4及び図5の説明においても同様である。
【0053】
先ず、図3(a)は、塩基数n=6(この場合、nは偶数)の核酸水溶液(DNA)を用いた結果である。図3(a)では、質量電荷比(m/z)が[M−H]−に相当するシグナルの他、[M+Fe2+−3H]−、[M+2Fe2+−5H]−、及び[M+3Fe2+−7H]−に相当する合計4本のシグナルが観測された。この結果より、塩基数とシグナルの総数とをそれぞれn、NsとするとNs=(n)/2+1=4の関係が成立していることが分かる(上述の数4の上段の式を参照)。
【0054】
一方、各シグナルの順序xに対応した質量電荷比(m/z)xで表現すると、(m/z)x=1=[M−H]−、(m/z)x=2=[M+Fe2+−3H]−、(m/z)x=3=[M+2Fe2+−5H]−、及び(m/z)x=4=[M+3Fe2+−7H]−となる。この結果より、上述の数式(数4の下段の式)に示す関係が成立していることが分かる。
【0055】
また、各シグナルの(m/z)xの質量間隔(図3(a)中、隣接するシグナルの間隔)はFe2+−2Hの質量である約54の質量間隔に対応していることが分かる。
【0056】
図3(c)に示す塩基数n=6(nは偶数)の核酸水溶液(RNA)の場合も同様に、合計4つのシグナル(つまり、Ns=4)が観測され、質量電荷比を上述のn=6のDNAの場合と同様に(m/z)xで表現することができ、上述の数式(数4の上段と下段の式)の関係が成立することが分かった。
【0057】
(比較例1 塩基数n=6の核酸に対する従来手法による質量分析)
これらの結果と比較するため、上記核酸水溶液(a)及び(c)に対して従来のマトリックス支援型(MALDI)法の質量分析手法を実施して得られた結果を図3(b)及び(d)に示す。
【0058】
これらの比較例の核酸水溶液の作製にあたっては、3−ヒドロキシピコリン酸粉末10mgを990μLに溶解し、クエン酸2アンモニウム(100mg/mL)水溶液10μLを添加したものをマトリックスとした。該マトリックス溶液を質量分析専用プレート(V700813;Applied Biosytems社)に1μL滴下し自然乾燥させた。乾燥後、前述の核酸1μLを滴下し自然乾燥させ共結晶体を調製した。その後、質量分析装置(Voyager−DE−RP;Applied Biosytems社)によりLinear Negativeモードでサンプル解析を行った。
【0059】
図3(b)及び図3(d)では、通常観察される脱プロトン体(各図中、[M−H]−のシグナル)と、ナトリウム及びカリウム付加体のシグナルは検出されたが、上述したような法則性(上記数式(数4)に示す関係)を示さなかった。言い換えれば、従前の手法と異なり、核酸溶液に対して本発明の分析手法を適用すると上記の法則性が表れてくるため、本発明の分析手法はサンプル溶液中の核酸の有無を判断したり、核酸の種類を特定したりすることができるのである。
【0060】
以上、表1中の(a)及び(b)の核酸水溶液に対して本発明の質量分析手法を適用し、これらの結果を図3の(a)及び(c)に示しながら説明を加えた。次に、表1中の(c)〜(g)の核酸水溶液に対して本発明の質量分析手法を適用した結果を図4及び図5に示す。
【0061】
先ず、図4(a)は、塩基数n=8(nは偶数)のDNA水溶液に対する本発明の質量分析結果である。この図4(a)では、(m/z)が[M−H]−に相当するシグナルの他、[M+Fe2+−3H]−、[M+2Fe2+−5H]−、[M+3Fe2+−7H]−、及び[M+4Fe2+−9H]−に相当する合計5本のシグナル(つまり、Ns=5)が、図3(a)及び(c)と同様の質量間隔(つまり質量約54)で観測された。また、上述のn=6のDNAの場合(図3(a)の場合)と同様に(m/z)xで表現することができ、上述の数式(数4の上段と下段の式)の関係が成立することが分かった。
【0062】
次に、図4(b)は、塩基数n=9(nは奇数)のDNA水溶液に対する本発明の質量分析結果である。この図4(b)では、(m/z)が[M−H]−に相当するシグナルの他、[M+Fe2+−3H]−、[M+2Fe2+−5H]−、[M+3Fe2+−7H]−、及び[M+4Fe2+−9H]−に相当する合計5本のシグナルが、図3(a)及び(c)と同様の質量間隔(つまり質量約54)で観測された。この結果より、塩基数とシグナルの総数とをそれぞれn、NsとするとNs=((n−1)/2)+1=5の関係が成立していることが分かる(上述の数4の中段の式を参照)。加えて、上述のn=6のDNAの場合(図3(a)の場合)と同様に(m/z)xで表現することができ、上述の数式(数4の下段の数式)の関係が成立することが分かった。
【0063】
また、図4(c)は、塩基数n=10(nは偶数)のDNA水溶液に対する本発明の質量分析結果である。この図4(c)では、(m/z)が[M−H]−に相当するシグナルの他、[M+Fe2+−3H]−、[M+2Fe2+−5H]−、[M+3Fe2+−7H]−、[M+4Fe2+−9H]−及び[M+5Fe2+−11H]−に相当する合計6本のシグナル(つまり、Ns=6)が、図3(a)及び(c)と同様の質量間隔(つまり質量約54)で観測された。また、上述のn=6のDNAの場合(図3(a)の場合)と同様に(m/z)xで表現することができ、上述の数式(数4の上段と下段の式)の関係が成立することが分かった。
【0064】
また、図4(d)は、塩基数n=12(nは偶数)のDNA水溶液に対する本発明の質量分析結果である。この図4(d)では、(m/z)が[M−H]−に相当するシグナルの他、[M+Fe2+−3H]−、[M+2Fe2+−5H]−、[M+3Fe2+−7H]−、[M+4Fe2+−9H]−、[M+5Fe2+−11H]−及び[M+6Fe2+−13H]−に相当する合計7本のシグナル(つまり、Ns=7)が、図3(a)及び(c)と同様の質量間隔(つまり質量約54)で観測された。また、上述のn=6のDNAの場合(図3(a)の場合)と同様に(m/z)xで表現することができ、上述の数式(数4の上段と下段の式)の関係が成立することが分かった。
【0065】
また、図5は、塩基数n=10(nは偶数)のRNA水溶液に対する本発明の質量分析結果である。この図5では、(m/z)が[M−H]−に相当するシグナルの他、[M+Fe2+−3H]−、[M+2Fe2+−5H]−、[M+3Fe2+−7H]−、[M+4Fe2+−9H]−、及び[M+5Fe2+−11H]−に相当する合計6本のシグナル(つまり、Ns=6)が図3(a)及び(c)と同様の質量間隔(つまり質量約54)で観測された。また、上述のn=6のDNAの場合(図3(a)の場合)と同様に(m/z)xで表現することができ、上述の数式(数4の上段と下段の式)の関係が成立することが分かった。
【0066】
以上のように、本発明の質量分析を行った各オリゴヌクレオチドは効率よくイオン化され、分析に依って得られたNegativeイオンの質量電荷比(m/z)は、前記(1)の式で表現される法則性を有したFe2+付加体が観察されることが分かった。従って、この法則性を利用すれば、サンプル溶液中での核酸の有無や存在する核酸の種類の特定が可能になる。
【0067】
(比較例2)
核酸以外の成分(物質)を、酸化鉄ナノ微粒子を用いて、実施例1と同様に質量分析を行った。試料は、Negativeイオンとして、(a)タウロコール酸ナトリウム(牛胆汁由来、M=537.4)と、(b)ポリエチレングリコール 600スルファート(平均分子量M=600)との2種類を、Positiveイオンとして、(c)ペプチドのサブスタンスP(M=1347.6)の1種類を用いた。三種類の各サンプル(a)〜(c)の終濃度は100pmol/μLとした。各サンプル(a)〜(c)に対する質量分析によって得られたマススペクトルを図6(a)〜(c)に示す。図6の各グラフに示すように、得られたマススペクトルのm/zには、Fe2+の付加体を観察することはできなかった。
【産業上の利用可能性】
【0068】
本発明のイオン化支援キットは、質量分析において核酸の効率的なイオン化を支援する。また、本発明の質量分析方法によって得られたマススペクトルの質量電荷比(m/z)は、特有の法則性を示すことにより、混合物中の微量な核酸の検出を容易にする。従って、本発明は、代謝解析、遺伝子治療薬やオーダーメイド薬の開発、個体識別などの鑑定に利用できる。
【特許請求の範囲】
【請求項1】
Fe2O3を含んだ酸化鉄からなるコアを有した機能性ナノ微粒子と、
クエン酸塩水溶液と、
を含み、かつ、分析対象物中の核酸のイオン化を支援することを特徴とするイオン化支援キット。
【請求項2】
前記微粒子は、前記コアを覆うアモルファスシリカネットワークからなるシェルと、
前記シェルの表面に共有結合的に導入された官能基と、
を有していることを特徴とする請求項1記載のイオン化支援キット。
【請求項3】
機能性ナノ微粒子を質量分析用プレートに固定化する工程と、
分析対象物にクエン酸塩を添加する工程と、
前記プレート上に修飾した前記微粒子に前記分析対象物を近接させる工程と、
前記プレート上の前記分析対象物に向けて紫外線レーザー照射を行い、前記分析対象物のイオン化を支援する工程と、
質量分析によって得られたマススペクトルから核酸の有無や塩基鎖長を解析する工程と、
を含む質量分析方法であって、
前記微粒子はFe2O3を含んだ酸化鉄からなるコアを有し、
前記解析工程では、前記マススペクトルの質量電荷比がFe2+−2Hの質量で示された間隔で2つ以上存在するか否かを判定することを含むことを特徴とする質量分析方法。
【請求項4】
前記解析工程では、前記マススペクトルのシグナルの総数と各シグナルにおける質量電荷比とをNsと(m/z)xとによって表した場合に、Nsと(m/z)xとが次式で示される規則性を示すか否かを判定することを含むことを特徴とする請求項3記載の質量分析方法。
【数1】

ここで、nとMとは前記核酸の塩基数と質量とであり、Hは水素イオンの質量であり、
Fe2+は鉄イオンの質量、xは1からNsまでの整数である。
【請求項5】
前記核酸が、分子量が104以下のオリゴヌクレオチドであることを特徴とする請求項3又は請求項4記載の質量分析方法。
【請求項1】
Fe2O3を含んだ酸化鉄からなるコアを有した機能性ナノ微粒子と、
クエン酸塩水溶液と、
を含み、かつ、分析対象物中の核酸のイオン化を支援することを特徴とするイオン化支援キット。
【請求項2】
前記微粒子は、前記コアを覆うアモルファスシリカネットワークからなるシェルと、
前記シェルの表面に共有結合的に導入された官能基と、
を有していることを特徴とする請求項1記載のイオン化支援キット。
【請求項3】
機能性ナノ微粒子を質量分析用プレートに固定化する工程と、
分析対象物にクエン酸塩を添加する工程と、
前記プレート上に修飾した前記微粒子に前記分析対象物を近接させる工程と、
前記プレート上の前記分析対象物に向けて紫外線レーザー照射を行い、前記分析対象物のイオン化を支援する工程と、
質量分析によって得られたマススペクトルから核酸の有無や塩基鎖長を解析する工程と、
を含む質量分析方法であって、
前記微粒子はFe2O3を含んだ酸化鉄からなるコアを有し、
前記解析工程では、前記マススペクトルの質量電荷比がFe2+−2Hの質量で示された間隔で2つ以上存在するか否かを判定することを含むことを特徴とする質量分析方法。
【請求項4】
前記解析工程では、前記マススペクトルのシグナルの総数と各シグナルにおける質量電荷比とをNsと(m/z)xとによって表した場合に、Nsと(m/z)xとが次式で示される規則性を示すか否かを判定することを含むことを特徴とする請求項3記載の質量分析方法。
【数1】

ここで、nとMとは前記核酸の塩基数と質量とであり、Hは水素イオンの質量であり、
Fe2+は鉄イオンの質量、xは1からNsまでの整数である。
【請求項5】
前記核酸が、分子量が104以下のオリゴヌクレオチドであることを特徴とする請求項3又は請求項4記載の質量分析方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】




【図2】


【図3】


【図4】


【図5】


【図6】


【公開番号】特開2013−11586(P2013−11586A)
【公開日】平成25年1月17日(2013.1.17)
【国際特許分類】
【出願番号】特願2012−54376(P2012−54376)
【出願日】平成24年3月12日(2012.3.12)
【出願人】(304024430)国立大学法人北陸先端科学技術大学院大学 (169)
【出願人】(000003964)日東電工株式会社 (5,557)
【Fターム(参考)】
【公開日】平成25年1月17日(2013.1.17)
【国際特許分類】
【出願日】平成24年3月12日(2012.3.12)
【出願人】(304024430)国立大学法人北陸先端科学技術大学院大学 (169)
【出願人】(000003964)日東電工株式会社 (5,557)
【Fターム(参考)】
[ Back to top ]

