核酸検査装置及び容器搬送方法
【課題】PCR法や恒温増幅法に代表される核酸分析手法を実施することができ、特に、異なる分析項目を効率的に処理することを目的とする。
【解決手段】温度調節装置としてのペルチェ素子66b及び温度センサ66cがそれぞれ設けられ、互いの熱が干渉しないように複数設けられている温調ブロック66それぞれに、検体と試薬とを混合して反応液を調製する反応液調製装置から反応液を収容した反応容器17を搭載し、各温調ブロック66に搭載された反応容器17に収容されている反応液に対応させて予め設定されている温度調整方法としての温調制御プロトコルに従って、各温調ブロック66の温度調節を独立に並行して行う。
【解決手段】温度調節装置としてのペルチェ素子66b及び温度センサ66cがそれぞれ設けられ、互いの熱が干渉しないように複数設けられている温調ブロック66それぞれに、検体と試薬とを混合して反応液を調製する反応液調製装置から反応液を収容した反応容器17を搭載し、各温調ブロック66に搭載された反応容器17に収容されている反応液に対応させて予め設定されている温度調整方法としての温調制御プロトコルに従って、各温調ブロック66の温度調節を独立に並行して行う。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、血液や尿等の生体由来の検体、いわゆる生体試料中に含まれる核酸を分析する核酸検査装置、及びこの核酸検査装置での反応容器の容器搬送方法に関する。
【背景技術】
【0002】
従来、生体由来の検体中に含まれる核酸の検査を行う場合に用いられる核酸増幅技術としては、例えば、ポリメラーゼ連鎖反応(Polymerase Chain Reaction;以下、PCRと略称する)法を用いたものがある。PCR法では、検体と試薬を混合した反応液の温度を予め定められた条件に従って制御することにより、反応液中の所望の塩基配列を選択的に増幅させることができる。
【0003】
また、その他の核酸増幅法として、NASBA(Nucleic Acid Sequence-Based Amplification)法やLAMP(Loop-Mediated Isothermal Amplification)法のように、反応液の温度を一定に制御し、核酸増幅をはかる恒温増幅法が開発されている。
【0004】
このような核酸増幅手法は、例えばウイルス性感染の診断等、臨床検査分野でも積極的に用いられており、自動化による検査の効率化・省力化・高精度化が求められている。
【0005】
特表2002−513936号公報(特許文献1)には、標的核酸の検出を自動的に行う装置が記載されている。この装置は、反応容器に試料を調製する機構と、反応容器に収容された標的核酸中に含まれる標的配列を単離し、増幅するための1以上のインキュベータとが配置された構成になっており、各インキュベータは、複数の反応容器を保持するためのカルーセルを備えた構成になっている。反応容器は、自動化された運搬機構を用いて、核酸の分析処理工程に従いそれぞれ適切な温度に制御された複数のインキュベータに順次移動されて所定時間だけそのカルーセルに配置されることよって、同一の反応容器に対する温度変化を実現している。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特表2002−513936号公報
【発明の概要】
【発明が解決しようとする課題】
【0007】
ところで、核酸増幅技術においては、増幅対象の塩基配列の種類によって、増幅のために用いる試薬や、増幅処理工程においての調整温度やその調整時間、等といった条件(プロトコル)が異なる。そのため、増幅対象の塩基配列が異なる複数種類の検体を並行して核酸増幅処理する場合には、各検体の増幅対象の塩基配列プロトコルに規定される調整温度やその調整時間を、検体個々に対し設定する必要がある。
【0008】
しかしながら、上述した特許文献1に記載された自動分析装置では、インキュベータそれぞれは予め設定された一定温度に制御されているため、複数のプロトコルを並行して実行するためには、制御温度が異なる多数のインキュベータが必要となり、装置構成ばかりか、インキュベータ間の反応容器の移動手順も複雑化する。
【0009】
本発明は上記問題点を鑑みてなされたものであり、PCR法や恒温増幅法に代表される核酸分析手法を実施することができ、特に、異なる分析項目を効率的に処理することができる核酸検査装置を提供することを目的とする。
【課題を解決するための手段】
【0010】
上記目的を達成するために、本発明に係る核酸検査装置は、検体,試薬,分注チップ,反応容器の搭載機構と、選択された一の反応容器内に分注チップを用いて検体及び試薬を分注して反応液を調製する液体分注機構と、反応容器を保持して移動する搬送機構と、反応液が収容された反応容器を閉栓する閉栓ユニットと、閉栓された反応容器に分注された検体及び試薬を均一に混合する攪拌ユニットと、攪拌が終わった反応容器を一時的に保持しておく待機バッファと、攪拌が終わった反応容器内の反応液の核酸をプロトコルに従って増幅し、核酸濃度測定を行う核酸増幅装置とを備えるものである。
【0011】
そして、核酸増幅装置は、反応液を収容した少なくとも1つの反応容器を保持する複数の温調ブロックを配置したカローセルと、前記複数の温調ブロックのそれぞれに設けられ、前記反応液の温度を調製する温度調節装置とを備えることを特徴とするものである。
【発明の効果】
【0012】
本発明の核酸検査装置によれば、同一又は異なる分析項目を、効率的に核酸検査処理することができる。すなわち、核酸増幅装置は、反応液を収容した少なくとも1つの反応容器をそれぞれ保持し、互いに独立に温度制御することができる温調ブロックを複数備えるため、各温調ブロックでは、互いに任意のタイミングで、増幅対象の塩基配列の種類に応じたプロトコルに従って反応容器の温度調節を開始することができる。
【0013】
さらに、攪拌が終わった反応容器を一時保持しておくための待機バッファを備えるようにしておけば、核酸増幅処理のプロトコルが同じ若しくは共通の反応容器を、核酸増幅装置に搭載する前にこの待機バッファに待機させておくことできるので、一の温調ブロックに備えられた、反応容器を搭載するための測定配置ポジション数の範囲内で、同一若しくは共通の検査項目が依頼された反応容器について温度調節を始めるタイミングを揃えることができ、核酸増幅装置の温調ブロック及びその測定配置ポジションの効率的な利用が可能になる。
【図面の簡単な説明】
【0014】
【図1】本発明の一実施の形態に係る核酸検査装置の概略構成を示した全体図である。
【図2】本実施の形態の核酸検査装置に含まれる核酸増幅装置の一実施例の概略構成を示した平面図である。
【図3】図2に示した核酸増幅装置の概略構成を示した側面図である。
【図4】検体容器ラック情報の一例を模式的に表わした図である。
【図5】試薬容器ラック情報の一例を模式的に表わした図である。
【図6】核酸検査の実行内容情報の一例を模式的に表わした図である。
【図7】本実施の形態の核酸検査装置で制御装置が反応液調製制御手段として行う反応液調製処理の一実施例を示したフローチャートである。
【図8】待機バッファテーブルの一例の構成を模式的に表わした図である。
【図9】本実施の形態の核酸検査装置で核酸増幅制御手段として核酸増幅処理を行う制御装置の機能ブロック図である。
【図10】本実施の形態の核酸検査装置で制御装置が温調ブロック全体制御部として行う温調ブロック全体制御処理の一実施例を示したフローチャートである。
【図11】本実施の形態の核酸検査装置で制御装置が温調ブロック全体制御部として行う温調ブロック全体制御処理の一実施例を示したフローチャートである。
【図12】温調ブロック全体制御テーブルの一実施例の構成を模式的に表わした図である。
【図13】本発明の別の実施の形態に係る核酸検査装置の概略構成を示した平面図である。
【図14】本発明のさらに別の実施の形態に係る核酸検査装置の概略構成を示した平面図である。
【発明を実施するための形態】
【0015】
以下、本発明に係る核酸検査装置及び容器搬送方法の実施の形態について、図面に基づき説明する。
【0016】
図1は、本発明の一実施の形態に係る核酸検査装置の概略構成を示した全体図である。
図1に示す実施の形態において、核酸検査装置1は、検査に用いられる検体,試薬,分注チップ,反応容器が配備されるラック搭載部10と、反応容器等を保持しながら移動させる搬送機構20と、選択された一の反応容器内に分注チップを用いて検体と試薬とを分注して反応液を調製する液体分注機構30と、反応液を収容した反応容器を閉栓する閉栓ユニット40と、反応容器に収容された反応液の検体及び試薬を均一に混合する攪拌ユニット50と、攪拌が終わった反応容器が搭載され、反応液の核酸を予め定められているプロトコルに従って増幅して核酸濃度測定を行う核酸増幅装置60と、を備えている。
【0017】
ラック搭載部10は、核酸検査装置1の作業台2上の所定位置に設けられ、検体容器ラック12,試薬容器ラック14,反応容器ラック16,ノズルチップラック18がそれぞれ搭載される。
【0018】
検体容器ラック12には、増幅処理の対象となる核酸を含む検体が収容された複数の検体容器13が配列収納されている。試薬容器ラック14には、検体に加えるための試薬が収容された複数の試薬容器15が配列収納されている。反応容器ラック16には、検体と試薬とを混合するために用いられる複数の未使用の空の反応容器17が配列収納されている。ノズルチップラック18には、検体及び試薬の分注に用いられる複数の未使用のノズルチップ19が配列収納されている。
【0019】
搬送機構20は、核酸検査装置1の作業台2上にX軸方向(図中、左右方向)に延在させて配置されたX軸方向ガイド21と、このX軸方向ガイド21上を移動可能に設けられたX軸方向可動子22と、このX軸方向可動子22に一体的に取り付けられ、Y軸方向(図中、上下方向)に延在させて配置されたY軸方向ガイド23と、このY軸方向ガイド23上を移動可能に設けられた作業ヘッド(Y軸方向可動子)24とを備え、制御信号に基づいて作業ヘッド24を作業台上で二次元移動させて、作業台上の所望の位置に配置できる構成になっている。
【0020】
作業ヘッド24には、バーコードリーダ25と、グリッパユニット26と、分注ユニット27とが設けられ、各部25〜27は作業ヘッド24と一体的に作業台上を移動し、作業台2上の所望位置に配置される。
【0021】
バーコードリーダ25は、検体容器13,試薬容器15,反応容器17それぞれに付されている識別情報を読み取り、これらの識別情報を取得する。
【0022】
グリッパユニット26は、制御信号に基づくグリッパの作動に応動して反応容器17を把持又は解放し、作業台2上の装置各部間での作業ヘッド24の移動に伴って反応容器17を搬送する。
【0023】
分注ユニット27は、ノズルチップ19を着脱可能な構成になっており、制御信号に基づいてノズルチップラック18からノズルチップ19を装着し、検体容器13内の検体又は試薬容器15内の試薬にノズルチップ19を浸漬し、検体又は試薬をノズルチップ19内に吸引して採取する。また、分注ユニット27は、制御信号に基づいてこのノズルチップ19内に貯留された検体や試薬を反応容器17に吐出して分注する。分注ユニット27は、液体分注機構30の主部をなす。
【0024】
また、図示の核酸検査装置1では、ラック搭載部10と核酸増幅装置60との間の作業台2上には、反応液を調製するために反応容器ラック16から取り出した未使用の反応容器17が載置される反応液調製ポジション70が形成されている。反応液調製ポジション70には、反応容器17を保持するための容器搭載部72が設けられている。核酸検査装置1では、反応容器ラック16からこの反応液調製ポジション70にグリッパユニット26を用いて移した未使用の反応容器17に対し、分注ユニット27を用いて検体容器13及び試薬容器15から検体及び試薬の分注を行って、反応容器17内に検体及び試薬を混合した反応液を調製する。複数の容器搭載部72を備えることで、例えば、同じ検体又は同じ試薬の分注を複数の反応容器17に対し一緒に行うこともでき、複数の反応液の調製を纏めて行うバッチ処理ができるようになっている。
【0025】
閉栓ユニット40は、反応液調製ポジション70からグリッパユニット26を用いて移された、反応液が収容されている反応容器17の開口(分注口)を閉栓して、反応液の蒸発や外部からの異物の進入等を防ぐ。
【0026】
攪拌ユニット50は、閉栓ユニット40からグリッパユニット26を用いて移された、密閉された反応容器17に収容されている反応液を攪拌し、検体及び試薬の混合を行う。
【0027】
さらに、図示の核酸検査装置1では、反応液調製ポジション70とラック搭載部10との間の作業台2上には、分注ユニット27に装着されて検体又は試薬の分注に使用された使用済みのノズルチップ19や、核酸増幅装置60による核酸増幅処理が終わった検査済みの反応容器17を廃棄する廃棄ボックス80の投入口80aが設けられている。
【0028】
また、反応液調製ポジション70と核酸増幅装置60との間の作業台2上には、攪拌ユニット50から反応液の攪拌を終えた反応容器17がグリッパユニット26を用いて移され、核酸増幅装置60による核酸増幅処理待ちの反応容器17を一時的に保持しておく待機バッファ90が設けられている。待機バッファ90は、反応容器17を保持するための待機ポジション92を複数有し、温度調節装置94が付設されている。温度調節装置94は、待機ポジション92に搭載された反応容器17に収容されている反応液の劣化を防止するため、反応容器17を例えば約4℃に保つよう制御されている。この待機バッファ90に保持されている反応容器17は、グリッパユニット26を用い、後述する手順に従って核酸増幅装置60に適宜搬送され、核酸増幅装置60で反応容器17に収容された反応液に核酸増幅処理が施される。
【0029】
次に、図1に示された核酸増幅装置60の詳細構成について、図2及び図3を基に説明する。
【0030】
図2は、本実施の形態の核酸検査装置に含まれる核酸増幅装置の一実施例の概略構成を示した平面図である。
【0031】
図3は、図2に示した核酸増幅装置の概略構成を示した側面図である。
なお、図2,図3では、核酸増幅装置60の構成理解を容易するため、図1に現れているカバー62は図示省略してある。
【0032】
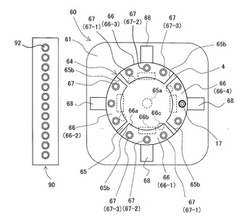
図2及び図3に示すように、核酸増幅装置60は、基台61と、反応容器17の保持具としての円盤形状の回転可能なカローセル64と、カローセル64に複数設けられ、反応容器17が搭載される搭載部としての測定配置ポジション67を少なくとも1つ以上有する温調ブロック66と、反応容器17に収容された反応液の蛍光検出を行う蛍光検出器68と、カローセル64の回転駆動装置としてのステッピングモータ69(図3に記載)とを備えている。
【0033】
そして、このカローセル64や蛍光検出器68等が配置された核酸増幅装置60内の収容空間は、図1に示したように、通常は、開閉可能なゲート63を有するカバー62によって覆われた構成になっている。カバー62は、基台61とともにカローセル64及び蛍光検出器68を覆うことにより、蛍光測定が行われる収容空間への外光の入射を抑制する。カバー62には、開閉可能なゲート63が設けられている。ゲート63は、温調ブロック66の測定配置ポジション67に対しての、グリッパユニット26を用いての反応容器17の搭載/取り出しに連動して開閉制御される。ゲート63は、反応容器17の搭載/取り出しの際に収容空間内の対象の測定配置ポジション67だけを臨ませ、反応容器17の搭載/取り出しの際の外光の入射を低減する。
【0034】
カローセル64は、上下方向に延びる回転軸65aを中心にして回動可能な円盤状のフレーム65を有し、回転駆動装置としてのステッピングモータ69の駆動に応動して、検査中は回転軸65aを中心に所定回転量ずつ回転駆動される。
【0035】
フレーム65の周縁側部分には、温調ブロック66を取り付ける取付凹部65bが、フレーム65の周方向に沿って複数形成されている。各取付凹部65bには、それぞれ温調ブロック66が設けられ、図示の例では、フレーム65の周方向に沿って、大きさが等しい4つの温調ブロック66-1〜66-4が備えられている。
【0036】
フレーム65は、周方向に隣り合った取付凹部65b間に介在する部分も含め、例えば、断熱プラスチック等の断熱性に優れた部材を用いて構成されている。これにより、フレーム65は、温調ブロック66を個別に取り囲み、互いに隣り合う温調ブロック66間でそれぞれの調整温度が干渉しにくくなっている。
【0037】
なお、この温調ブロック66間の断熱構成は、フレーム65自体を断熱性に優れた部材で形成するだけではなく、フレーム65と温調ブロック66との間にポリウレタンフォーム等の断熱材による断熱層を介在させて、温調ブロック66からフレーム65への温度干渉や、周方向の沿って隣り合う温調ブロック66間の温度干渉を低減する構成としてもよい。この場合、温調ブロック66のフレーム65に対する取付構成も、図示のような取付凹部65bを用いた取付構成に限るものではなく、例えば、フレーム65を径方向にそれぞれ延びる腕部を備えた構成とし、各腕部に断熱材を介して温調ブロック66を支持させる等の構成としてもよい。さらに、カローセル64の形状自体も円盤形状に限定されず、適宜変更可能である。
【0038】
図示の例では、各温調ブロック66-1〜66-4は、3つの測定配置ポジション67-1〜67-3を有する同一形状の温調ブロック66によってそれぞれ構成されている。各温調ブロック66は、測定配置ポジション67が形成されたブロック基材66aと、温度調整装置としてのペルチェ素子(図3に記載)66bと、温度センサ66cと、図示省略した放熱手段とを備えた構成になっている。
【0039】
ブロック基材66aは、例えば、銅,アルミニウム又は各種合金等の熱伝導体によって形成されている。測定配置ポジション67は、例えば、ブロック基材66aの表面から裏面に貫通した容器支持孔として構成され、透過性若しくは透光性素材により形成された反応容器17の底部側容器部分をブロック基材66aの裏面側に露出させて観察可能に挿通させて臨ませた状態で、熱伝達可能に反応容器17を着脱自在に保持する。ペルチェ素子66b及び図示省略した放熱手段は、測定配置ポジション67に搭載された反応容器17及び内部の反応液を、ブロック基材66aを介して加熱又は冷却する。温度センサ66cは、例えば、サーミスタ,熱電対,測温抵抗体等を用いて構成され、測定配置ポジション67の近傍のブロック基材66aの温度を測定することにより、反応容器17及び内部の反応液の温度を検出する。
【0040】
各温調ブロック66に配置されたペルチェ素子66bや温度センサ66cの配線は、図3に示すように、カローセル64の裏面側へ引回しされ、回転軸65aに遊嵌させて巻回された屈曲性のある配線ケーブル66dに連結されている。配線ケーブル66dは、カローセル64の回転動作により、その巻回部分がカローセル64の回転回数(回転量)に応じて拡縮し、かつ回転軸65aに対し適度な緩みを確保しながらその巻回数が調整され、カローセル64の回転を許容する構成になっている。さらに、回転軸65aの同一方向に連続した回転量をモニタする回転検知センサ66eが配置されており、配線ケーブル66dが一方向にだけ所定量以上巻き付き又は巻き解かれた場合には、回転軸65aの回転方向を逆転させて、配線ケーブル66dの断線を防止する。この回転方向の逆転は、蛍光検出器68による測定配置ポジション67に搭載された反応容器67の計測インターバルがずれないようにタイミングをはかって実行される。
【0041】
上述した構成により、各温調ブロック66は、このペルチェ素子66b及び図示省略した放熱手段を用いて、温度センサ66cによる検出出力に基に反応容器17を加熱又は冷却することにより、温調ブロック66の測定配置ポジション67に保持された反応容器17内の反応液の温度を、温調ブロック66別にそれぞれ独立に調整する。なお、このペルチェ素子66bや温度センサ66cは、1つの温調ブロック66に対して複数備えられていてもよい。
【0042】
また、各温調ブロック66-1〜66-4の各測定配置ポジション67-1〜67-3は、図1に示すように、各温調ブロック66がフレーム65に取り付けられた状態で、各温調ブロック66-1〜66-4間で、さらに各温調ブロック66の測定配置ポジション67-1〜67-3間で、各蛍光検出器68による各反応容器17までの距離(検出距離)が変わらないようになっている。図示の例では、各温調ブロック66-1〜66-4の各測定配置ポジション67-1〜67-3は、いずれもフレーム65の回転軸65aを中心とした同じ半径方向位置に位置するようになっている。これにより、同じ蛍光検出器68で、各温調ブロック66-1〜66-4の各測定配置ポジション67-1〜67-3にそれぞれ搭載された反応容器17内の反応液の蛍光強度を、温調ブロック66-1〜66-4及びその測定配置ポジション67-1〜67-3の違いに拘らず、同じ観察条件、観察精度で測定できる。また、カローセル64に設けられる温調ブロック66の数、及び各温調ブロック66における測定配置ポジション67の数については、上述した複数の同じ蛍光検出器68で同じ観察条件、観察精度で蛍光測定できるならば、任意に選択可能である。
【0043】
図示のカローセル64の場合、円盤状のフレーム65の周方向に沿って、4つの同じ温調ブロック66-1〜66-4が均等配置されている。各測定配置ポジション67-1〜67-3の配置も、フレーム65の周方向に沿って、ブロック基材66a内でも、隣り合う温調ブロック66間の隣り合う測定配置ポジション67間でも、均等になるように配置されている。これにより、蛍光測定タイミング毎のカローセル64の回転量は、測定対象の温調ブロック66-1〜66-4や測定配置ポジション67-1〜67-3の違いに拘らず一定となり、複数の蛍光検出器68を共用することができ、蛍光検出器68に対する位置決めも容易化がはかれるようになっている。
【0044】
カローセル64の周囲には、蛍光検出器68が1つ以上設けられている。各蛍光検出器68は、測定配置ポジション67に搭載された反応容器17が対向した状態で、その検出素子がカローセル64のブロック基材66aの裏面側に露出している反応容器17の底部側の容器部分と対向するように、基台61上に設けられている。
【0045】
各蛍光検出器68は、対向した反応容器17の露出した底部側の容器部分に励起光を照射する励起光源と、この励起光の照射に基づいた反応液からの蛍光を検出する検出素子とを含む。励起光源としては、例えば、発光ダイオード(LED),半導体レーザー,キセノンランプ,ハロゲンランプ等が用いられる。検出素子としては、フォトダイオード、フォトマルチプライヤー、CCD等が用いられる。
【0046】
これにより、蛍光検出器68は、カローセル64の回転によって反応容器17がその励起光源及び検出素子に対し対向位置(通過も含む)した場合に、励起光源からの励起光の照射によって反応液から生じる蛍光を検出素子により検出して測定することによって、反応液中の、試薬により蛍光標識された増幅対象の塩基配列の定量を経時的に並行して行うことができる。
【0047】
図1に示す例では、蛍光検出器68は、カローセル64の外周上に4つ、周方向に沿って均等間隔で配置されている。この場合、隣り合う2つの蛍光検出器68のカローセル64の周方向に沿った間隔は、上述のようにカローセル64の周方向に沿って温調ブロック66の相違に関係なく均等間隔で配置された測定配置ポジション67の間隔の倍数になっている。この結果、4つの蛍光検出器68のそれぞれは、4つの温調ブロック66-1〜66-4それぞれの各測定配置ポジション67-1〜67-3に搭載された反応容器17の蛍光検出器を兼ね、一の測定配置ポジション67に搭載された反応容器17に対する測定分解能を向上させる構成になっている。なお、蛍光検出器68が複数ある場合でも、例えば、各蛍光検出器68がそれぞれ対応する特定の温調ブロック66の測定配置ポジション67に搭載された反応容器17に対してのみ蛍光測定を行う等、互いに独立的に反応容器17内の反応液の検出又は測定を行う構成とすることもできる。
【0048】
このように構成された核酸検査装置1の核酸増幅装置60を含む装置各部は、図1に示すように、キーボード,マウス等の入力装置110や液晶モニタ等の表示装置120を備えた制御装置100により、その作動が制御される。制御装置100は、核酸検査装置1の核酸増幅装置60を含む上述した装置各部を制御し、入力装置110により設定されたプロトコルに基づいて、予め記憶部に記憶された各種ソフトウェア等を用いて、反応液調製処理及び核酸増幅処理を含む核酸検査処理を実行する。そして、制御装置100は、この核酸検査処理の際の装置各部の可動状況等を記憶部に記憶するとともに、核酸増幅装置60によって得られた蛍光検出結果等の分析結果を記憶部に記憶し、表示装置120に表示する。
【0049】
次に、この制御装置100が行う核酸検査処理に係り、上述した反応液調製処理及び核酸増幅処理について詳細に説明する。
【0050】
ここで、反応液調製処理とは、核酸検査装置1の制御装置100によって行われる核酸検査処理の中、反応容器17内に検体及び試薬を分注した反応液を調製する処理を指す。また、核酸増幅処理とは、この反応液調製処理によって反応容器17内に調製された反応液を、増幅対象の塩基配列の種類に応じたプロトコルに従って温度調節し、塩基配列の核酸増幅を反応液の蛍光測定によって確認しながら行う処理を指す。
【0051】
まず、核酸検査装置1には、核酸検査を行うに当たって、準備として、核酸検査装置1のラック搭載部10の所定位置に、反応容器ラック16と、ノズルチップラック18と、検体容器ラック12と、試薬容器ラック14とが搭載される。反応容器ラック16には、未使用の空の反応容器17が配列収納されている。ノズルチップラック18には、未使用のノズルチップ19が配列収納されている。検体容器ラック12には、これから行う核酸増幅処理で増幅対象となる核酸を含む検体を収容した検体容器13が配列収納されている。試薬容器ラック14には、検体と混合して反応液の調製に用いられる試薬を収容した試薬容器15が配列収納されている。
【0052】
この検体容器ラック12及び試薬容器ラック14のラック搭載部10への搭載に関連して、検体容器ラック12に配列収納されている検体容器13それぞれに収容された検体の識別等を含む検体情報と、試薬容器ラック14に配列収納されている試薬容器15それぞれに収容された試薬の識別等を含む試薬情報とが、制御装置100の記憶部に入力装置110から登録される。
【0053】
図4,図5は、制御装置の記憶部に登録された検体容器ラック情報及び試薬容器ラック情報のそれぞれ一例を模式的に表わした図である。
【0054】
図示の例では、検体容器ラック情報及び試薬容器ラック情報いずれとも、検体容器ラック12又は試薬容器ラック14の識別情報に対応させ、検体又は試薬の識別等を含む検体情報又は試薬情報が、その検体又は試薬が収容された検体容器13又は試薬容器15が収納保持されている検体容器ラック12又は試薬容器ラック14上のラック位置情報に対応付けて記憶されているデータ形式になっている。この検体容器ラック情報及び試薬容器ラック情報の記憶部への登録は、例えば、入力装置110から搭載する検体容器ラック12及び試薬容器ラック14のラック識別情報を入力すれば、入力したラック識別情報に対応する上述のような検体容器ラック情報及び試薬容器ラック情報が制御装置100に取り込まれ、その記憶部に登録される。これにより、制御装置100は、分注ユニット27を用いて検体又は試薬の分注を行うに当たり、調製に必要な検体及び試薬の識別に係る情報やラック搭載部10上、延いては作業台2上でのそれぞれの所在位置を把握することができる。
【0055】
なお、この検体容器ラック情報及び試薬容器ラック情報の登録については、検体容器ラック12及び試薬容器ラック14のラック搭載部10への搭載後、検体容器13及び試薬容器15自体に装着されている、収容されている検体や試薬の識別を示すバーコードラベルを、バーコードリーダ25を用いて順次直接読み取らせ、制御装置100自身で検体容器ラック情報及び試薬容器ラック情報を作成することも可能である。
【0056】
核酸検査装置1には、核酸検査を行うに当たって、準備として、検体情報や試薬情報に加えて、入力装置110を用いてプロトコルとして設定した、これから行う核酸検査の実行内容情報も取り込まれる。
【0057】
図6は、制御装置に取り込まれた核酸検査の実行内容情報の一例を模式的に表わした図である。
【0058】
図示の場合、核酸検査の実行内容情報には、核酸検査処理として、N個の個別核酸検査処理を行うことが指示されている。通常、実行内容情報に個別核酸検査処理が複数含まれている場合は、その個別核酸検査処理は、検体容器ラック12に収納された検体容器13の配置順に応じて作成されている。その上で、各個別核酸検査処理には、反応液調製処理情報と、核酸増幅処理情報とが含まれている。そして、反応液調製処理情報には、検体分注情報、試薬分注情報が含まれている。この検体分注情報には、反応液を調製するために分注する検体についての検体情報やその分注量情報等が含まれ、その試薬分注情報には、反応液を調製するために分注する試薬についての試薬情報やその分注量情報等が含まれている。一方、核酸増幅処理情報には、上述した反応液調製処理情報を基に調製された個別核酸検査処理に係る反応液について、核酸増幅装置60で温調ブロック66を作動制御して温度調節を行う温調制御プロトコル等が含まれている。この温調制御プロトコルには、その核酸増幅処理に係る反応液及び反応容器17の加熱温度及び加熱時間、又は冷却温度及び冷却時間等の温度調節についての情報が含まれている。
【0059】
その上で、制御装置100は、分注ユニット27を含む液体分注機構を用いた反応液調製処理、及び核酸増幅装置60を用いたこの調製した反応液の核酸増幅処理を、反応容器17の容器識別情報をキー情報として管理し、反応液調製制御手段及び核酸増幅制御手段として両処理を並行して行いながら、核酸検査の実行内容情報に含まれた個別核酸検査処理の全数について行う。
【0060】
そのために、ラック搭載部10の所定位置に搭載される反応容器ラック16の各ラック位置に搭載されている未使用の反応容器17それぞれには、搬送機構20の作業ヘッド24のバーコードリーダ25で読み取り可能な、他の反応容器17との間で自身を識別するための容器識別情報を含むバーコードラベルが直接装着され、個々の反応容器17を識別管理できるようになっている。
【0061】
制御装置100は、例えば、反応容器ラック16内の任意のラック位置にある反応容器17を、作業ヘッド24のグリッパユニット26を用いて把持して移送しようとすれば、グリッパユニット26とともに作業ヘッド24に設けられたバーコードリーダ25によって、この移送しようとする反応容器17の容器識別情報を取得できるようになっている。
【0062】
図7は、本実施の形態の核酸検査装置で制御装置が反応液調製制御手段として行う反応液調製処理の一実施例を示したフローチャートである。
【0063】
制御装置100は、反応液調製制御手段として反応液調製処理を開始するに当たって、まず記憶部に設けられている反応液調製処理のための各種作業エリアをイニシャライズする(S100)。これにより、例えば、各種作業エリアの中の、反応液調製ポジション70の各容器搭載部72の稼動状況を随時監視しておくための反応液調製ポジションテーブルは、各容器搭載部72の稼動状況がリセットされる。同様に、待機バッファ90の各待機ポジション92の稼動状況を随時監視しておくための待機バッファテーブルは、各待機ポジション92の稼動状況がリセットされる。そして、反応液調製ポジション70の各容器搭載部72、及び待機バッファ90の各待機ポジション92は、反応容器17が受け入れ可能な非搭載状態になる。
【0064】
その後、反応液調製ポジションテーブルには、例えば、一の容器搭載部72に反応容器ラック16から反応容器17を搬送機構20で搬送して搭載した場合、この反応容器17を反応容器ラック16からグリッパユニット26を用いて取り出す際にバーコードリーダ25により読み取った反応容器17の容器識別情報をその一の容器搭載部72に対応させて分注作業の間に記憶しておくことにより、その一の容器搭載部72の稼動状態(容器搭載状態)が記憶される。これに対し、反応液の調製後、その一の容器搭載部72の反応容器17を閉栓ユニットに搬送機構20で搬送する場合に、記憶してある容器識別情報をクリアすることによって、待機状態(容器非搭載状態)が記憶される。また、待機バッファテーブルには、例えば、一の待機ポジション92に攪拌ユニット50から反応容器17を搬送機構20で搬送した場合に、反応容器17を攪拌ユニット50か取り出す際にバーコードリーダ25により反応容器17から読み取った容器識別情報をその一の待機ポジション92に対応させて反応容器17が搭載されている間に記憶しておくことにより、その一の待機ポジション92の稼動状態(容器搭載状態)が記憶される。これに対し、核酸増幅処理のため、その一の待機ポジション92の反応容器17を核酸増幅装置60の温調ブロック66に搬送機構20で搬送した場合に、記憶してある容器識別情報をクリアすることによって、待機状態(容器非搭載状態)が記憶される。
【0065】
制御装置100は、このような反応液の調製処理に係るイニシャライズが済むと、入力装置110によって設定された、図4,図5に示した検体容器ラック情報及び試薬容器ラック情報や、図6に示した核酸検査の実行内容情報の読み込み処理を行う(S102)。
【0066】
制御装置100は、図6に示した核酸検査の実行内容情報に含まれた1又は複数の個別核酸検査処理の中から予め設定された手順に基づいて、今回、反応液作製処理を行う1又は複数の個別核酸処理を選択抽出する(S104)。この場合における予め設定された手順とは、例えば、反応液調製ポジション70の容器搭載部72の数だけ纏めて反応容器17それぞれに反応液を調製してから、閉栓ユニット40や攪拌ユニット50による後段処理に反応容器17を纏めて移すバッチ処理を行うか、反応液調製ポジション70の容器搭載部72のいずれかで反応容器17への検体及び試薬の分注が終わる度に、閉栓ユニット40や攪拌ユニット50による後段処理に反応容器17を随時移す逐次処理を行うか、等である。
【0067】
次に、制御装置100は、この反応液調製ポジション70で、反応容器ラック16から事前に搬送し反応液調製ポジション70の容器搭載部72に搭載した未処理の反応容器17に対して、選択抽出された個別核酸処理の反応液調製処理情報に基づいて液体分注機構30を作動制御して、反応液の調製を行う(S106)。具体的には、制御装置100は、ノズルチップ19が未装着な分注ユニット27をノズルチップラック18に移動して未使用のノズルチップ19を装着する。この未使用のノズルチップ19の装着に当たって、分注ユニット27に装着されていた使用済みのノズルチップ19は、事前に、分注ユニット27を廃棄ボックス80の投入口80aに移動し、分注ユニット27から切り離して廃棄してある。そして、この未使用のノズルチップ19を装着した分注ユニット27を例えば検体容器ラック12の所定の検体容器13に移動して、この未使用のノズルチップ19内に検体を吸引して採取する。その上で、分注ユニット27を反応液調製ポジション70の所定の容器搭載部72に移動して、ノズルチップ19に収容している検体を分注量情報に記載された所定量だけ、搭載されている反応容器17に吐出して分注する。制御装置100は、このような未使用のノズルチップ19を用いての分注作業を、試薬容器ラック14の所定の試薬容器15についても行い、反応容器17に反応液を調製する。
【0068】
制御装置100は、例えば、グリッパユニット26を用いてこの反応液の調製に用いる反応容器17を反応容器ラック16から取り出し、反応液調製ポジション70の容器搭載部72に予め搭載する際に、バーコードリーダ25で読み取ったこの反応容器17の容器識別情報をこの搭載部72に対応付けることができる。そして、この搭載部72に搭載された反応容器17に対し、選択抽出された個別核酸検査処理の反応液調製処理情報に基づいて検体及び試薬を分注することによって、この反応容器17の容器識別情報に対し、核酸増幅装置60でのこの個別核酸検査処理による核酸増幅処理情報を対応付けることができる。制御装置100は、このようにして得られた反応容器17の容器識別情報と、核酸増幅処理情報を含む個別核酸検査処理との対応を、記憶部に記憶しておくようになっている。
【0069】
反応液調製ポジション70で反応液が調製された反応容器17は、制御装置100によって、反応液調製ポジション70からグリッパユニット26を用いて閉栓ユニット40に移され、閉栓された後、閉栓ユニット40からグリッパユニット26を用いて攪拌ユニット50に移され、分注した検体及び試薬の攪拌が行われる。
【0070】
制御装置100は、この攪拌処理が終わった反応容器17を待機バッファ90の空いている待機ポジション92に搬送することができるか否かを判断するために、前述した記憶部の待機バッファテーブルの記憶内容を照会する(S108)。
【0071】
図8は、待機バッファテーブルの一例の構成を模式的に示した図である。
待機バッファテーブルは、待機バッファ90の各待機ポジション92-1〜92-m(図1の場合、m=12)について、反応容器17の受け入れ状態を記憶している。図示の例では、待機ポジション92-1には、容器識別情報ZZXXXAの、反応液が調製済みで核酸増幅処理待ちの反応容器17が搭載されており、待機ポジション92-(m−2)には、反応容器17が搭載されておらず、反応容器17が受け入れ可能状態(容器非搭載状態)になっている。
【0072】
これにより、制御装置100は、図7に示すように、この待機バッファテーブルの記憶内容により、待機バッファ90に反応容器17を受け入れ可能な待機ポジション92-(m−2)があれば(S110)、攪拌処理が終わった反応容器17をグリッパユニット26を用いて攪拌ユニット50から待機バッファ90のこの待機ポジション92-(m−2)に搬送して搭載する(S112)。これに伴い、制御装置100は、待機バッファテーブルの反応容器17を搭載した待機ポジション92-(m−2)に対応して、搭載した反応容器17の容器識別情報を記憶し、待機バッファテーブルに記憶されている反応容器17の受け入れ状態を更新する(S114)。
【0073】
そして、制御装置100は、核酸検査の実行内容情報に含まれた個別核酸検査処理全てについて反応液調製処理が終わっていない個別核酸検査処理があるか否かを、例えば、容器識別情報が未だ対応付けられていない個別核酸検査処理があるか否かによって確認し(S116)、反応液調製処理が未だ終わっていない個別核酸検査処理がある場合には、その反応液調製処理を行う。
【0074】
一方、制御装置100は、待機バッファテーブルの記憶内容の照会により(S108)、待機バッファ90に反応容器17が受け入れ可能な待機ポジション92がない場合は(S110)、待機バッファ90に反応容器17が受け入れ可能な待機ポジション92ができるまで、例えば、反応液調製処理が未だ終わっていない個別核酸検査処理の反応液調製処理を新たに行わないようにする。
【0075】
このような反応液調製処理では、核酸検査の実行内容情報に含まれている個別核酸検査処理の順番が、検体容器ラック12に収納された検体容器13の配置順に対応しているため、待機バッファ90に搬送される反応容器17に対しての核酸増幅のための温調制御プロトコルは様々である。さらに、反応容器17毎に検体や試薬の種類・量、又、攪拌時間等も変わるため、待機バッファ90に搬送されるタイミングも異なってしまうこともある。
【0076】
次に、核酸検査装置1の制御装置100によって上述した反応液調製処理と並行して行われる、反応容器17内に調製された反応液を核酸増幅する核酸増幅処理の一実施例について説明する。
【0077】
図9は、本実施の形態の核酸検査装置で核酸増幅制御手段として核酸増幅処理を行う制御装置の機能ブロック図である。
【0078】
制御装置100は、核酸増幅制御手段として、温調ブロック66-1〜66-4それぞれを互いに独立に作動制御する温調ブロック対応制御部102(102-1〜102-4)と、各温調ブロック対応制御部102(102-1〜102-4)それぞれの作動制御を行う温調ブロック全体制御部104とを含む構成になっている。制御装置100は、核酸増幅制御手段として、温調ブロック全体制御部104としての処理を行いながら、さらに各温調ブロック66-1〜66-4の温調ブロック対応制御部102(102-1〜102-4)としての処理を並行して行う。
【0079】
制御装置100は、まず、温調ブロック66-1〜66-4それぞれに対応した温調ブロック対応制御部102(102-1〜102-4)として、待機バッファ90からグリッパユニット26を用いて温調ブロック全体制御部104によって指定された容器識別情報の反応容器17を測定配置ポジション67に搭載する。そして、温調ブロック全体制御部104としての制御装置100から提供される、反応容器17に対応付けられた個別核酸検査処理の核酸増幅処理情報に含まれる温調制御プロトコルに従って、温度センサ66cの出力を基にペルチェ素子66b等を駆動制御して、その測定配置ポジション67-1〜67-3に搭載されている反応容器17の温度を周期的に段階的に変化させて温調制御を行う。加えて、制御装置100は、蛍光検出器68を用いてこの温調制御プロトコルによる温調制御中の反応液の蛍光測定を周期的に行い、反応液における増幅対象となる塩基配列の定量を経時的に行う。
【0080】
制御装置100は、温調ブロック対応制御部102(102-1〜102-4)として、上述した温調ブロック対応制御処理を各温調ブロック66-1〜66-4間で独立に並行して行いながら、核酸増幅制御手段の温調ブロック全体制御部104として、図10,図11に示すような温調ブロック全体制御処理を行う。
【0081】
図10,図11は、本実施の形態の核酸検査装置で制御装置が温調ブロック全体制御部として行う温調ブロック全体制御処理の一実施例を示したフローチャートである。
【0082】
この温調ブロック全体制御処理では、制御装置100は、温調ブロック全体制御部104としての処理を開始するに当たって、まず記憶部に設けられている温調ブロック全体制御処理に係る各種作業エリアをイニシャライズする(S200)。この温調ブロック全体制御処理に係る各種作業エリアの中には、複数の温調ブロック66-1〜66-4それぞれに対応する各温調ブロック対応制御部102(102-1〜102-4)がそれぞれ独立に並行して行う温調制御や蛍光測定を指示するために用いられる温調ブロック全体制御テーブルのイニシャライズも含まれる。
【0083】
図12は、温調ブロック全体制御テーブルの一実施例の構成を模式的に示した図である。
【0084】
温調ブロック全体制御テーブルは、各温調ブロック66-1〜66-4別の温調ブロック個別制御テーブルを含む。各温調ブロック個別制御テーブルは、個別の温調ブロック66の測定配置ポジション67-1〜67-3にそれぞれ搭載する反応容器17の容器識別情報を示した測定配置ポジション情報と、その実行すべき温調制御、すなわち図6に示された所定の個別核酸増幅処理の核酸増幅処理情報における温調制御プロトコルとを記憶内容として含む。
【0085】
したがって、前述した各温調ブロック対応制御部102(102-1〜102-4)としての制御装置100は、この温調ブロック全体制御テーブルにおける自身の温調ブロック個別制御テーブルに核酸増幅処理情報としての温調制御プロトコルが提供されている場合には、自身の温調ブロック個別制御テーブルに記憶されている測定配置ポジション情報及び図8に示した待機バッファテーブルの記載情報を基に、待機バッファ90から指定された反応容器17をグリッパユニット26を用いて自身の指定された測定配置ポジション67に搭載する。
【0086】
そして、各温調ブロック対応制御部102(102-1〜102-4)としての制御装置100は、指定された反応容器17の測定配置ポジション67への搭載が完了したならば、温度センサ66cの出力を基にペルチェ素子66b等を制御しながら、核酸増幅処理情報として提供された温調制御プロトコルに従った温調制御を実行する。その際、搭載された反応容器17毎に蛍光検出器68,・・・を用いて測定された反応液の蛍光強度は、測定結果として、容器識別情報を基に、図6に示した該当する個別核酸処理と対応付けて記憶部に保存して、表示装置120に表示する。なお、この搭載された反応容器17毎の反応液の蛍光強度は、各蛍光検出器68からの励起光の検出結果を、温調ブロック66が設けられているフレーム65の回転を基にして、蛍光検出器68それぞれの励起光の検出結果がどの温調ブロック66の、どの測定配置ポジション67に搭載されている反応容器17のものであるかを判別することによって行われる。
【0087】
そして、温調ブロック対応制御部102(102-1〜102-4)としての制御装置100は、温調制御プロトコルによる温調制御の実行による、対応する温調ブロック66においての核酸増幅処理を終了したならば、新たな核酸増幅処理に備えて、温調制御による核酸増幅処理が終わった使用済み(検査済み)の反応容器17を、搬送機構20のグリッパユニット26を用いて測定配置ポジション67から廃棄ボックス80の投入口80aに搬送して廃棄する。その際には、該当する温調ブロック個別制御テーブルに記憶されているポジション情報や核酸増幅処理情報をクリアして、自身の温調ブロック個別制御テーブルを次の核酸増幅処理の実行に備えた待機状態にし、図6に示した該当する個別核酸処理については核酸検査処理が終了している旨を、反応液調製処理で既に対応付けられている容器識別情報を基にして記憶する。
【0088】
なお、図12では、温調ブロック個別制御テーブルにおいて、測定配置ポジション情報の測定配置ポジション67-3の容器識別情報が記憶されていないままで、核酸増幅処理情報の温度制御プロトコルに増幅処理Aが記憶されているのは、測定配置ポジション67-3には反応容器17を搭載しないまま、測定配置ポジション67-1,67-2に搭載する2つの反応容器17‘ZZXXXA’,‘ZZXXXB’に対し、増幅処理Aの温度制御プロトコルで温調ブロック66-1の温度調節を行うことを指す。
【0089】
温調ブロック全体制御部104としての制御装置100は、図10に示した温調ブロック全体制御処理において、図12に示した温調ブロック全体制御テーブルを含む各種作業エリアをイニシャライズすると(S200)、このイニシャライズにより、この温調ブロック全体制御テーブルの各温調ブロック個別制御テーブルの記憶内容もリセットする。この温調ブロック個別制御テーブルのリセットにより、複数の温調ブロック66-1〜66-4それぞれは、反応容器17が受け入れ可能な、核酸増幅処理の実行に備えた待機状態になる。
【0090】
そして、温調ブロック全体制御部104としての制御装置100は、図8に示した待機バッファテーブルを確認し、待機バッファ90の待機ポジション92それぞれの反応容器17の搭載状況を確認する(S202)。この確認により、温調ブロック全体制御部104としての制御装置100は、図8に示した待機バッファ90から、反応容器17が搭載されている待機ポジション92それぞれの位置や数と、反応容器17が搭載されていていない待機ポジション92それぞれの位置や数とを把握することができる。したがって、未だ待機バッファ90に反応容器17が搭載されていない図7に示した反応液調製処理におけるイニシャライズ当初は、図1に示した核酸検査装置1では、待機バッファ90の反応容器17が搭載されている待機ポジション92の数は‘0’になり、反応容器17が搭載されていていない待機ポジション92の数は‘12’になる。
【0091】
さらに、温調ブロック全体制御部104としての制御装置100は、同様にして、図12に示した温調ブロック全体制御テーブルを確認し、温調ブロック個別制御テーブルそれぞれの測定配置ポジション情報及び核酸増幅情報の記憶状況を確認する(S204)。この確認により、温調ブロック全体制御部104としての制御装置100は、温調ブロック個別制御テーブルに測定配置ポジション情報及び核酸増幅情報を記憶してあるか否かに基づいて、対応する温調ブロック66が稼動中であるか、待機中であるかを確認する。さらに、測定配置ポジション情報及び核酸増幅情報が記憶されている稼動中の温調ブロック個別制御テーブルについては、その測定配置ポジション情報から反応容器が搭載されている測定配置ポジションの位置や数を、その核酸増幅情報からは実行されている温調プロトコルを確認することができる。したがって、図1に示した核酸検査装置1の場合、未だ反応容器17が温調ブロック66-1〜66-4いずれにも搭載されていないイニシャライズ当初は、稼動中の温調ブロック66の数は‘0’になり、待機中の温調ブロック66の数は‘4’になる。
【0092】
その上で、温調ブロック全体制御部104としての制御装置100は、反応液調製制御手段としての制御装置100が行う反応液調製処理に係り、待機バッファ90にこれから搭載する予定の反応容器17の状況としてその数を確認する(S206)。この待機バッファ90にこれから搭載予定の反応容器17の数は、図7に示した反応液調製処理に係り、ステップS102の設定情報の読み込みにより得られる、図6に示した核酸検査の実行内容情報の読み込みによって得られる個別核酸検査処理の数から、核酸検査処理が既に終了している個別核酸検査処理の数と、ステップS202の確認処理の結果から得られる待機バッファに搭載されている反応容器17の数と、ステップS204の確認処理の結果から得られる稼動中の温調ブロック66の測定配置ポジション67に搭載されている温調制御中の反応容器17の数とを減算することにより、確認することができる。
【0093】
その上で、温調ブロック全体制御部104としての制御装置100は、待機バッファ90にこれから搭載予定の反応容器17の数が予め設定されている所定数以下で、核酸増幅処理すべき検体数が少ないか否かを判定し(S210)、待機バッファ90にこれから搭載予定の反応容器17の数が所定数よりも大きく、核酸増幅処理すべき検体数が少なくない場合は、図11に示したステップS220〜S233の処理を行い、待機バッファ90にこれから搭載予定の反応容器17の数が予め設定されている所定数以下で、核酸増幅処理すべき検体数が少ない場合には、図10に示したS240以下の処理を行う。
【0094】
このステップS210以下の処理では、一の温調ブロック66の複数の測定配置ポジション67-1〜67-4に、温調制御が同じ(すなわち、図6に示した核酸検査の実行内容情報の読み込みによって得られる個別核酸検査処理の中で、核酸増幅処理情報の温調制御プロトコルが同じ)である個別核酸検査処理の反応容器17をなるべく纏めて搭載してから、この一の温調ブロック66について、温調制御を開始する制御を行う。
【0095】
そのために、温調ブロック全体制御部104としての制御装置100は、次のような処理を行う。
1) 待機バッファ90の複数の待機ポジション92に、温調制御が同じである個別核酸検査処理の反応容器17が待機中の一の温調ブロック66の複数の測定配置ポジション67-1〜67-4数分ある場合は(図10及び図11で示した、S210「No」−S220「No」−S230「Yes」−S231「Yes」の場合、又は、S210「No」−S220「Yes」−S221「Yes」−S222「Yes」の場合)、これら複数の温調制御が同じである個別核酸検査処理の反応容器17それぞれを、グリッパユニット26を用いて待機バッファ90から一の温調ブロック66の複数の測定配置ポジション67-1〜67-4に搬送して搭載し、この同じ温度制御プロトコルに従ってこの温調ブロック66の温調制御を開始することを指示する(例えば、図11で示すS223又はS232)。その際、温調ブロック全体制御部104としての制御装置100は、図12に示した温調ブロック全体制御テーブルの、温調制御を開始させる待機中の温調ブロック66の温調ブロック個別制御テーブルに、測定位置ポジション情報として測定配置ポジション67-1〜67-4にそれぞれに搭載する反応容器17の識別情報を記憶し、かつ核酸増幅処理情報として同じと判別した図6に示した温調制御プロトコルの識別又は温調制御プロトコル自体を記憶することよって、この温調ブロック66の温調ブロック対応制御部102としての制御装置100に対して、これら温調制御が同じである、温調ブロック66の複数の測定配置ポジション67-1〜67-4数分の個別核酸検査処理の反応容器17について、この同じ温調制御プロトコルに従った温調制御を開始することを指示する。
【0096】
なお、この場合、複数の測定配置ポジション67-1〜67-4数分の温調制御が同じである個別核酸検査処理の反応容器17の中、最後に待機バッファ90の測定配置ポジション92に搭載されるはずの反応容器17については、攪拌ユニット50から待機バッファ90への搬送開始する時点で、待機バッファ90の待機ポジション92には実際に搭載されずとも、温調ブロック全体制御部104としての制御装置100が、複数の測定配置ポジション67-1〜67-4数分の温調制御が同じ個別核酸検査処理の反応容器17の存在について確認ができる。そこで、この確認によって最後に待機バッファ90の待機ポジション92に搭載されるはずの反応容器17については、待機バッファ90の待機ポジション92への実際の搭載を経ずとも、攪拌ユニット50から直接、温調ブロック66の測定配置ポジション67に移すようにすることも可能である。
【0097】
そして、温調ブロック全体制御部104としての制御装置100は、指示した容器識別情報の反応容器17が待機バッファ90から指示された温調ブロック66の測定配置ポジション67に移されると、図8に示した待機バッファテーブルの、この反応容器17が移された待機ポジション92に対応して記憶されている容器識別情報をクリアする(図11で示した、S225又はS233)。これにより、待機バッファ90は、その待機ポジション92は新たな反応容器17を搭載できる状態に更新される。
【0098】
2) 核酸増幅処理すべき検体数が少なくないものの、待機バッファ90の複数の待機ポジション92に、待機中の一の温調ブロック66の複数の測定配置ポジション67-1〜67-4数分の温調制御が同じである個別核酸検査処理の反応容器17が未だ搭載されていない場合は(図10及び図11で示した、S210「No」の場合)は、待機バッファ90の待機ポジション92に反応容器17が満杯であるか否かに応じて、温調ブロック全体制御部104としての制御装置100は、さらに次のような処理を行う。
【0099】
2-1) 待機バッファ90の待機ポジション92に反応容器17が満杯ではなく、未だ残りの待機ポジション92に新たな反応容器17を搭載できる状態にある場合は(例えば、図10及び図11で示した、S210「No」−S220「No」−S230「No」の場合)、温調制御が同じ個別核酸検査処理の反応容器17が複数あっても一の待機中の温調ブロック66の複数の測定配置ポジション67-1〜67-4数分には不足しているので、待機バッファ90が反応容器17で満杯になるまで(図10及び図11で示した、S210「No」−S220「Yes」の場合)、又は、待機バッファ90は未だ満杯にならずとも、温調制御が同じである個別核酸検査処理の反応容器17が待機中の一の温調ブロック66の複数の測定配置ポジション67-1〜67-4数分になるまで(図10及び図11で示した、S210「No」−S220「No」−S230「Yes」−S231「Yes」の場合になるまで)、この温調制御が同じ複数の個別核酸検査処理の反応容器17を、グリッパユニット26を用いて待機バッファ90から待機中の一の温調ブロック66の測定配置ポジション67に搬送搭載させないとともに、待機中の温調ブロック66の温調制御を開始させない(図10及び図11で示した、S210「No」−S220「No」−S230「No」の場合)。
【0100】
2-2) 待機バッファ90の待機ポジション92に反応容器17が満杯であり、一の待機中の温調ブロック66の複数の測定配置ポジション67-1〜67-4数分に対して、温調制御が同じ個別核酸検査処理の反応容器17の数が不足している場合は(図10及び図11で示した、S210「No」−S220「Yes」の場合)、温調ブロック全体制御部104としての制御装置100は、一の待機中の温調ブロック66の複数の測定配置ポジション67-1〜67-4数分に対して温調制御が同じ個別核酸検査処理の反応容器17の数が足らずとも、温調制御が同じ個別核酸検査処理の反応容器17がある場合は(図10及び図11で示した、S210「No」−S220「Yes」−S221「Yes」−S222「Yes」の場合)、複数の温調制御が同じ個別核酸検査処理の反応容器17を、グリッパユニット26を用いて待機バッファ90から待機中の一の温調ブロック66の複数の測定配置ポジション67-1〜67-4それぞれに搬送して搭載し、この同じ温度制御プロトコルに従ってこの温調ブロック66の温調制御を開始することを指示する(図11で示した、S223)。ただし、この場合は、一の待機中の温調ブロック66の複数の測定配置ポジション67-1〜67-4の中、少なくとも1つの測定配置ポジション67には反応容器17を搭載できないまま、この同じ温度制御プロトコルに従ってこの温調ブロック66の温調制御を開始することを指示することになる。そして、図8に示した待機バッファテーブルの更新が行われる(S225)。
【0101】
2-3)これに対して、待機バッファ90の待機ポジション92に反応容器17が満杯であっても、温調制御が同じ個別核酸検査処理の反応容器17がない場合は(例えば、図10及び図11で示す、S210「No」−S220「Yes」−S221「Yes」−S222「No」である場合)、調整温度やその調整時間、等の他の要素を基にした予め定めた手順で、一又は複数の個別核酸検査処理の反応容器17を、これに対応させた一又は複数の待機中の温調ブロック66の測定配置ポジション67-1〜67-4に搬送して搭載し、それぞれの温度制御プロトコルに従ってそれぞれの温調ブロック66の温調制御を開始することを指示する(図11で示した、S224)。そして、図8に示した待機バッファテーブルの更新が行われる(S225)。
【0102】
3) 一方、待機バッファ90にこれから搭載予定の反応容器17の数が予め設定されている所定数以下で、核酸増幅処理すべき検体数が少ない場合には、温調ブロック全体制御部104としての制御装置100は、次のような処理を行う。
【0103】
3-1) 待機バッファ90に搭載されている反応容器17がなく、待機バッファ90にこれから搭載予定の反応容器17もない場合は(例えば、図10で示す、S210「Yes」−S240「Yes」である場合)、図6に示した核酸検査の実行内容情報の読み込みによって得られる個別核酸検査処理全てについて核酸増幅処理が終了していると判断する。
【0104】
3-2) 一の待機中の温調ブロック66の複数の測定配置ポジション67-1〜67-4数分に対して、温調制御が同じ個別核酸検査処理の反応容器17の数が不足しているかいないかに係わらず、待機バッファ90に温調制御が同じ個別核酸検査処理の反応容器17が搭載されている場合は(図10で示した、S210「Yes」−S240「No」−S241「Yes」−S242「Yes」である場合)、複数の温調制御が同じ個別核酸検査処理の反応容器17を、グリッパユニット26を用いて待機バッファ90から待機中の一の温調ブロック66の複数の測定配置ポジション67-1〜67-4それぞれに搬送して搭載し、この同じ温度制御プロトコルに従ってこの温調ブロック66の温調制御を開始することを指示する(図10で示した、S243)。そして、図8に示した待機バッファテーブルの更新が行われる(S245)。
【0105】
3-3) 待機バッファ90に反応容器17が搭載されてはいるが、温調制御が同じ個別核酸検査処理の反応容器17がない場合は(図10で示した、S210「Yes」−S240「No」−S241「Yes」−S242「No」である場合)、待機バッファ90に搭載されている一又は複数の個別核酸検査処理の反応容器17を、これに対応させた一又は複数の待機中の温調ブロック66の測定配置ポジション67-1〜67-4に搬送して搭載し、それぞれの温度制御プロトコルに従ってそれぞれの温調ブロック66の温調制御を開始することを指示する(図10で示した、S243)。そして、図8に示した待機バッファテーブルの更新が行われる(S245)。
【0106】
このような構成からなる本実施の形態に係る核酸検査装置1は、次のように作用する。
まず、本実施の形態に係る核酸検査装置1によれば、その核酸増幅装置60は、一のカローセル64上に互いに独立に温調制御することができる複数の温調ブロック66を設け、各温調ブロック66の各測定配置ポジション67に搭載された各反応容器17が、このカローセル64の回転によって一又は複数の蛍光検出器68が配置された同一の円周上を移動する構成になっている。
【0107】
これにより、例えば、温度制御プロトコルが異なる複数の反応容器17に収容されている1つの所定の蛍光色素について、この複数の反応容器17それぞれにおける蛍光強度を測定するような場合であっても、その測定のための蛍光検出器17を、同じカローセル64の下で温調ブロック66の相違にかかわらず、共通にすることができるので、カローセル毎にインキュベータとしての機能を持たせてカローセル毎に蛍光検出器を配置した場合と比べて、同じ蛍光色素の測定結果であっても、カローセル64や蛍光検出器17自体の器差に基づく誤差要因を排除することができる。
【0108】
次に、本実施の形態に係る核酸検査装置1は、制御装置100が温調ブロック全体制御部として、図10及び図11で示した温調ブロック全体制御処理を行うので、次のように作用する。
【0109】
まず、核酸増幅処理すべき検体数が少ない場合、すなわち反応液を調製する反応容器17の数が所定数以下の場合は(図10で示した、S210「Yes」−S240「No」である場合)、攪拌処理を終えて待機バッファ90に搭載された反応容器17は、待機バッファ90に温調制御プロトコルが同一の反応容器17があるか否かを確認した上で(S242)、順番に待機中の温調ブロック66の測定配置ポジション67-1〜67-4に搬送に搬送される(S241〜S245)。
【0110】
これにより、待機バッファ90に搭載された反応容器17は、待機バッファ90に温調制御プロトコルが同一の反応容器17がなければ、逐次、待機中の温調ブロック66に分散させてその温調制御プロトコルによる温調制御を行うことで、反応容器17毎に攪拌処理を終えて待機バッファ90に搭載されたタイミングで、反応容器17の温度調節を開始することができ、待ち時間を少なくすることができる。これは、一の反応液の調製工程と核酸増幅処理工程の所要時間を比較すると、一般に核酸増幅処理工程の方が長時間必要となるが、核酸検査における反応容器の数が少ない場合は、待機バッファ90が満杯になるのを待たずに待機バッファ90に搭載されている反応容器17を、待機中の温調ブロック66に随時搭載して反応容器17の温度調節を開始しても全体の検査時間には大きな相違を生じず、一の反応容器17についてみれば、反応液の調製工程と核酸増幅処理工程の所要時間が短くなるケースも生じ得るようになるためである。なお、この核酸検査における核酸増幅処理すべき検体数が少ない場合は、反応液を調製する反応容器17の数が所定数よりも多い場合であっても、その進行により、核酸増幅処理が行われていない反応容器が所定数以下に減った場合にも適用可能である。
【0111】
これに対し、核酸増幅処理すべき検体数が少なくない場合、すなわち反応液を調製する反応容器17の数が所定数よりも多い場合は(図10で示した、S210「No」である場合)、待機バッファ90の複数の待機ポジション92に、温調制御が同じである個別核酸検査処理の反応容器17が、待機中の一の温調ブロック66の複数の測定配置ポジション67-1〜67-4数分だけ揃うのをできるだけ待って、温調制御プロトコルが同一の複数の反応容器を同じ温調ブロック66を用いて纏めて温度調節する(S210「No」〜S233)。
【0112】
これにより、一の温調ブロック66に備えられた、反応容器17を搭載するための測定配置ポジション67の数の範囲内で、温調制御プロトコルが同一さらには途中まで共通の温度調節が依頼された反応容器17について、使用する温調ブロック66及び温度調節を開始するタイミングを揃えることができ、核酸増幅装置60の温調ブロック66及び測定配置ポジション67の効率的な利用も可能になる。さらに、使用する温調ブロック66及び温度調節を開始するタイミングを揃えることで、できるだけ同一状況下で同じ温調制御プロトコルの反応容器17については核酸増幅処理を行えるので、温調ブロック66の器差や検査時の時間ずれ等に起因する誤差を極力抑制することも期待できる。核酸増幅装置60の温調ブロック66及び測定配置ポジション67の効率的な利用がはかれることから、全体の検査時間を短縮することも期待できる。
【0113】
なお、本実施の形態に係る核酸検査装置1では、反応液を調製する反応容器17の数が所定数よりも多い場合は(図10で示した、S210「No」である場合)、一の温調ブロック66の複数の測定配置ポジション67-1〜67-4数分だけ揃うまで待機バッファ90を反応容器17で満杯にするが(図10で示した、S210「No」−S220「No」−S230「No」である場合)、別途、攪拌ユニット50から待機バッファ90への反応容器17の搭載間隔を測定しておき、所定時間経過しても待機バッファ90に追加されない場合は、図10で示したステップS221〜S225の処理を実行し、待機バッファ90に現在搭載されている反応容器17の範囲で核酸増幅処理を進めておくことも可能である。また、緊急に検体の分析を終える必要がある場合等は、図10で示したステップS210以降の処理を行う代わりに、緊急の検体の分析に係る反応容器17を優先して待機中の温調ブロック66に搭載することも可能である。また、例えば図6に示した核酸検査の実行内容情報における個別核酸処理に基づいて等、予め1つだけしかない温調制御プロトコルに係る反応容器17が判っている場合は、待機バッファ90を経由せず、攪拌処理を終えた反応容器17を待機中の温調ブロック66の測定配置ポジション67に直接搬送し、この1つだけしかない温調制御プロトコルに基づく温度調節を開始することも可能である。
【0114】
核酸増幅技術においては、増幅対象の塩基配列によって用いる試薬や温度、時間等の条件(プロトコル)が異なる。また、増幅対象の塩基配列が異なる複数種類の検体を並行して処理する場合には、各種検体のプロトコルに規定される温度及びその時間を個々に設定する必要がある。そのため、従来技術においては、一度に対応できるプロトコルは1種類であり、プロトコルの異なる複数種類の検体を並行して処理する並列処理ができなった。また、同一プロトコルの検体であっても開始時間の異なる処理を行うことができないので、実行中の処理が終了するまでは別検体の処理を新たに開始することができなかった。
【0115】
このような従来の核酸検査装置に対し、上記説明した本実施の形態に係る核酸検査装置1によれば、次に述べるような特有な効果を奏する。
【0116】
反応液を収容した反応容器17を保持する複数の温調ブロック66を設けたカローセル64を備え、温調ブロック66のそれぞれに設けた温度調節装置(ペルチェ素子66b, 温調ブロック対応制御部102等が該当)によって反応液の温度を調整するように構成したので、プロトコルの異なる複数種類の検体を並列処理することがき、かつ、実行中の核酸検査処理があっても別検体の核酸検査処理を開始することができ、処理効率を大きく向上することができる。
【0117】
また、検体や試薬を混合する工程の処理能力と、核酸増幅工程での処理能力とが異なる場合に、待機バッファ90に反応容器17を適宜保持し、両工程の処理速度の差を調整することができ、反応液の劣化を防止しながら、核酸検査装置1として処理効率を高めることができる。
【0118】
また、温調ブロック66に複数の測定配置ポジション67を配置することで、カローセル64を簡潔な構造とし、個々の温度調節装置の機能調整を省力化しながらも、処理効率を高めることができる。同一の温調制御プロトコルを依頼された反応容器17に対して同一の温度調節を行うことができるため、温度調節や蛍光強度の測定のばらつきを低減することができる。
【0119】
また、温調ブロック66の数やその測定配置ポジション67の数、並びに待機バッファ90の待機ポジション92の数は、装置の使用形態により任意に決定することができるので汎用性があり、温調ブロック66は、形状や材質、温度調節装置の性能を分析項目に応じて最適化し、複数の種類を取混ぜて配置することができる。
【0120】
また、複数の温調ブロック66を設けたカローセル64自体を複数設置し、処理能力の向上や、分析可能な項目の拡大をはかることができる。また、分析を終了した反応容器17を、さらに別の温調ブロック66やカローセル64に運搬し、最適化された温度調節機能や光学検出器を用いて、別の分析を行うことができる。このとき、1度目の分析を終えた反応容器17を待機バッファ90に保持し、出力された結果から2度目以降の分析の要否を判断することもできる。
【0121】
また、検体容器13と試薬容器15とは、核酸検査装置1が分析を開始する時点に検体容器ラック12や試薬容器ラック14に搭載されているものに限定されず、新たに分析を依頼された検体容器13と、実行中の実行内容情報に新たに追加されたこの検体に係る個別検査処理に必要な試薬容器14とを補充しながら、核酸検査装置1を運用することもできる。
【0122】
また、待機バッファ90を複数配置し、各待機バッファ90での制御温度を変えることで、反応容器17を個別検査処理の検体それぞれに適した保存温度に制御された待機バッファ90に一時的に保持することで、データ精度を向上させることができる。
【0123】
また、検体と試薬を混合した反応液を用手法で調製し、反応容器17に収容生成したものを、別途設けた緊急検体ラック投入ポジション又は待機バッファ90にユーザーが直接架設した後に、搬送機構20が反応容器17を核酸増幅装置1に搬送し、核酸増幅処理を行うこともできる。これにより、緊急検体の検体数が少ない場合等、ユーザーはより簡便な方法を選択することができる。
【0124】
また、核酸増幅装置60を含む核酸検査装置1が稼動中であっても、ユーザーは検体容器ラック12と、試薬容器ラック14と、反応容器ラック16と、ノズルチップラック18とを交換することができるため、装置状態を初動状態に初期化することなく、新たに投入される検体の核酸増幅処理を継続して行うことができる。
【0125】
なお、本実施の形態による核酸検査装置1では、次に述べるような種々の変形例が考えられる。
【0126】
例えば、保持部材としてのカローセル64に複数の温調ブロック66を設けた構成については、矩形板状の保持具に、格子状に温調ブロック66を配置することもできる。この場合、蛍光検出器68は温調ブロック66の配置に沿って保持具上を移動させることで、搭載された反応容器17それぞれに収容されている反応液の蛍光検出が可能である。
【0127】
また、恒温増幅法で分析する場合は、1以上の温調ブロック66を一定温度に制御しておくことで、待機バッファ90を必ずしも経由することなく、反応容器17を順次核酸増幅装置1に投入してもよい。
【0128】
また、PCR法において、温度調節の開始から終了まで、常に同じ温度変化を周期的に繰り返す分析項目があれば、待機バッファ90を必ずしも経由することなく、反応容器17を周期的に温度変化する温調ブロック66に同期をとって搭載してもよい。
【0129】
また、本実施の形態では、検体と試薬を反応容器17に分注する処理と、閉栓処理及び攪拌処理とを終えた反応容器17を待機バッファ90に収容する場合について説明したが、個別検査処理で設定された指示により待機バッファ90に収容する反応容器17の状態を変化させることができる。例えば、分注を終えた反応容器17、又は、分注と閉栓処理を終えた反応容器17を、待機バッファ90に一旦搭載するようにしてもよい。
【0130】
次に、本発明の核酸検査装置に係り、他の実施の形態について図面を基に説明する。
【0131】
図13は、本発明の別の実施の形態に係る核酸検査装置の概略構成を示した平面図である。
【0132】
なお、図13においては、図1及び図2に示した実施の形態と同一構成部分については同一符号を付してその説明を省略するとともに、図2と同様に、核酸増幅装置60のカバー62については図示省略してある。
【0133】
本実施の形態では、カローセル64の周方向に沿って配置された各温調ブロック66-1〜66-5は、測定配置ポジション67-1〜67-3が同数ではなく、1〜4個の測定配置ポジション67を有し、測定配置ポジション67の数が異なる構成になっている。なお、各温調ブロック66-1〜66-5それぞれにはペルチェ素子(図3に記載)66bと温度センサ66cとが設けられ、互いに独立に温度調節できる点では前述した実施の形態と変わりない。各測定配置ポジション67の配置も、フレーム65の周方向に沿って、ブロック基材66内でも、隣り合う温調ブロック66間の隣り合う測定配置ポジション67間でも、均等になるように配置されている。これにより、蛍光測定タイミング毎のカローセル64の回転量は、測定対象の温調ブロック66-1〜66-5や測定配置ポジション67-1〜67-4の違いに拘らず一定となり、複数の蛍光検出器68を共用することができ、蛍光検出器68に対する位置決めも容易化がはかれるようになっている。
【0134】
その上で、このような構成からなる温調ブロック66-1〜66-5の中、例えば、温調ブロック66-5は緊急検体用温調ブロックとして使用され、図6に示した通常の実行内容情報による個別検査処理では、使用されないようになっている。
【0135】
そして、本実施の形態では、検査に用いられる検体,試薬,分注チップ,反応容器が配備される作業台2上のラック搭載部10の外方側の位置には、緊急な検査依頼に対応するための緊急検体ラック搭載部10aが設けられている。緊急検体ラック搭載部10aには、核酸検査装置1が分析を実施している最中に緊急検査が必要な検体が生じた場合に、この緊急検体が収容された検体容器132が収納された緊急検体ラック130が搭載される。そして、緊急検体ラック130が搭載され、入力装置120により緊急検体ラック130に収納されている検体容器132の緊急検査依頼が入力された場合には、反応液調製制御手段及び核酸増幅制御手段として両処理を並行して行う制御装置100は、さらに次に述べるような緊急検体処理を行う構成になっている。
【0136】
制御装置100は、この緊急検査依頼の入力により検体容器13に係る図6に示した実行内容情報とは別の緊急検査依頼に基づく一又は複数の緊急個別検査処理を含む緊急実行内容情報が提供されると、既に実行中の実行内容情報の個別検査処理について、例えば、反応液を反応容器17に調製する処理及び反応容器17を搬送する処理を実行中であるならばそれを完了させ、閉栓ユニット40で閉栓中や攪拌ユニット50で攪拌中の反応容器17についてはその処理を完了させる等して、実行中の実行内容情報に係る個別核酸処理をその途中で切りよく一旦中断させる。そして、制御装置100は、これらの反応容器17をグリッパユニット26を用いて待機バッファ90の空き待機ポジション92等の所定の退避先に運搬して待機させる。その際、待機させた反応容器17に収容されている反応液の意図しない反応開始や品質の劣化を防止するため、これら反応容器17の退避先においては、例えば、4℃に制御することが好ましい。そのため、4℃に保たなければ反応液の劣化の恐れがある反応容器17については、退避先として4℃に保たれている待機バッファ90に優先的に搬送して待機させる。
【0137】
この反応容器17の待機によって、反応調製ポジション70等には緊急検査の検体の反応液を調製するための各部の容器搭載ポジションが確保されることになる。そして、制御装置100は、この待機させた反応容器17の退避先のポジションについては、緊急検査依頼の対応後の中断した実行内容情報の個別検査処理の続行に備えて、その搬送時に記憶部に記憶しておく。
【0138】
この後、核酸検査装置100は、緊急検体ラック130に搭載されている検体の核酸検査処理を開始する。その際、制御装置100は、まず、反応容器ラック16から未使用の反応容器17を反応調製ポジション70に搬送して搭載し、緊急個別検査処理の反応液調製処理情報に基づいて、反応容器17に緊急検体ラック130に収納されている検体容器132の検体を分注するとともに、試薬容器ラック14に収納されている試薬容器15の試薬を分注して、反応液17を調製する。そして、制御装置100は、反応容器17を閉栓ユニット40に搬送して閉栓し、攪拌ユニット50に搬送して攪拌した後、攪拌ユニット50から、待機バッファ90を介さずに、緊急検体用温調ブロック66-5に直接搬送してその測定配置ポジション67に搭載し、緊急個別検査処理の核酸増幅処理情報に基づいて核酸増幅処理を行う。
【0139】
以上のように構成される本実施の形態に係る核酸検査装置1によれば、図6に示した通常の実行内容情報による個別検査処理を実施しながらも、その途中で、緊急検査依頼が生じた場合には、緊急検体の緊急核酸検査処理を行うことができる。
【0140】
なお、本実施の形態の核酸検査装置にあっては、緊急検体の核酸検査処理を開始するに当たって、既に処理中の反応容器17については、反応液調製処理、閉栓処理、攪拌処理といったその実行中の各処理を完了させた後に、これら処理中の反応容器17全てを待機バッファ90に搬送することは必ずしも必要ではない。反応液調製ポジション70や閉栓ユニット40や攪拌ユニット50でこの緊急検体の緊急核酸検査処理の実行に伴う新たな反応容器17が収容可能な状態になるように、必要な数だけ搬送すればよい。
【0141】
本実施の形態に係る核酸検査装置1によれば、緊急検査依頼が生じた場合であっても、既に実行中の核酸検査処理に及ぼす影響を最小限に抑えて、迅速に対応することができる。
【0142】
図14は、本発明のさらに別の実施の形態に係る核酸検査装置の概略構成を示した平面図である。
【0143】
なお、図14においては、図1及び図2に示した実施の形態と同一構成部分については同一符号を付してその説明を省略するとともに、図2と同様に、核酸増幅装置60のカバー62については図示省略してある。
【0144】
本実施の形態に係る核酸検査装置1は、核酸増幅装置60の温調ブロック66や測定配置ポジション67を効率的に使用するために、待機バッファ90を配置しない構成になっている。
【0145】
そのため、核酸検査装置1では、攪拌ユニット50から直接、反応容器17を核酸増幅装置60の温調ブロック66に搬送して搭載する構成を採用するため、反応液調製ポジション70には温度調節装置94が設けられている。これにより、反応液調製ポジション70は、容器搭載部72に搭載されている反応液を4℃に制御でき、検体及び試薬の分注によって反応容器17内に作製した反応液の品質の劣化を防ぐための温度調節が可能になっている。一の反応液の調製工程と核酸増幅処理工程の所要時間を比較すると、一般に核酸増幅処理工程の方が長時間必要となるが、この核酸検査装置1では、その時間調整を、一の反応容器17の反応液調製ポジション70における滞在時間を調整して行えるようになっている。図示の例では、そのため、反応液調製ポジション70における容器搭載部72の数は、待機バッファ90を配置しているものよりも多くなっている。
【0146】
核酸増幅装置1では、反応液調製制御手段としての制御装置100が、まず、反応容器ラック16からグリッパユニット26を用いて必要数の未使用反応容器17が反応液調製ポジション70に搬送する。反応液調製ポジション70上における各反応容器17の識別は、バーコードリーダ25で読み取り可能な、反応容器17それぞれに予め付されている識別情報と、各反応容器17が搭載された反応液調製ポジション70の容器搭載部72の位置情報との対応で、制御装置100が管理している。
【0147】
一方で、反応液調製制御手段としての制御装置100は、入力装置110により図6に示した実行内容情報による個別検査処理が提供されると、予めその個別検査処理それぞれの核酸増幅処理情報をソートして、その個別検査処理の実行順を同じ温度制御プロトコルを含む個別検査処理を連続して行うように並べ替える。この結果、反応液調製制御手段としての制御装置100は、検体及び試薬の分注を含む反応液の調製処理を、この並べ替えた個別検査処理の実行順に従って、その同一の温度制御プロトコルを含む個別検査処理を順に行う。
【0148】
そこで、本実施の形態に係る核酸検査装置1では、核酸増幅装置1の温調ブロック66は、測定配置ポジション67に搭載された温調制御開始待ちの反応容器17内の反応液の劣化を防止するため、温度制御プロトコルに基づく温度調節を実行していない待機状態では、4℃に保たれているようになっている。
【0149】
そして、反応液調製制御手段としての制御装置100が、反応液を調製した反応容器17を、反応液調製ポジション70から閉栓ユニット40に搬送して閉栓し、攪拌ユニット50に搬送して攪拌した後、核酸増幅制御手段としての制御装置100は、攪拌ユニット50から核酸増幅装置60の温調ブロック66に反応容器17を直接搬送して、その測定配置ポジション67に搭載する。
【0150】
この反応液調製ポジション70での反応容器17に対する反応液の調製は、同一の温調制御プロトコルで核酸増幅処理が行われる反応容器17を連続して調製するようになっている。そのため、反応液調製制御手段としての制御装置100が、同一の温調制御プロトコルを有する反応容器17それぞれについて調製し続けている間は、核酸増幅制御手段としての制御装置100は、この調製した同一の温調制御プロトコルを有する反応容器17を、核酸増幅装置60の温調ブロック66へ搬送し続けるようになる。その際、核酸増幅制御手段としての制御装置100は、待機中の一の温調ブロック66の測定配置ポジション67それぞれに対して反応容器17を順次搬送する。そして、待機中の一の温調ブロック66の測定配置ポジション67それぞれに同一の温調制御プロトコルを有する反応容器17を搭載し終えても、未だ搬送待ちの同一の温調制御プロトコルを有する反応容器17がある場合には、核酸増幅制御手段としての制御装置100は、別の待機中の一の温調ブロック66の測定配置ポジション67それぞれに対して反応容器17を順次搬送する。これとともに、核酸増幅制御手段としての制御装置100は、待機中の一の温調ブロック66の測定配置ポジション67それぞれに同一の温調制御プロトコルを有する反応容器17を搭載し終える毎、又は同一の温調制御プロトコルを有する反応容器17全てが一若しくは複数の温調ブロック66の測定配置ポジション67に搭載し終えたときに、対応する温調ブロック66についてこの同一の温調制御プロトコルに従った温調制御を開始させる。また、核酸増幅制御手段としての制御装置100は、それぞれの温調ブロック66で分析が終了したものから、分析結果を出力し、その測定配置ポジション67に搭載されている反応容器17を取り出して廃棄ボックス80の投入口80aに搬送して廃棄する。このようにして、反応液調製制御手段及び核酸増幅制御手段としての制御装置100は、上述した反応液調製処理及び核酸増幅制御処理を、同一の温度制御プロトコルを含む個別検査処理毎に順に行っていく。
【0151】
なお、反応液調製制御手段としての制御装置100は、同一の温調制御プロトコルを有する反応容器17の数、又はこの同一の温調制御プロトコルを有する反応容器17を搭載する温調ブロック66に備えられている測定配置ポジション67の数、等に合わせて、同一の温調制御プロトコルを有する個別検査処理に係る反応液を複数本ずつバッチ処理で作成することも可能である。また、核酸検査を行う同一の温度制御プロトコルを含む個別検査処理毎のグループの並び順も、入力装置110により設定された編集条件を基に、例えば、各グループに含まれる個別検査処理の数,各グループの温度制御プロトコル間の核酸増幅処理時間(加熱時間又は冷却時間)の長さ,温調ブロック66それぞれの測定配置ポジション67の数,等を基に適宜調整可能である。
【0152】
本実施の形態によれば、同一の温度制御プロトコルを含む個別検査処理については、反応液の調製が順次して行われるので、同一又は異なる分析項目を、効率的に核酸検査処理することができる。
【符号の説明】
【0153】
1 核酸検査装置、 2 作業台、 10 ラック搭載部、 12 検体容器ラック、
13 検体容器、 14 試薬容器ラック、 15 試薬容器、
16 反応容器ラック、 17 反応容器、 18 ノズルチップラック、
19 ノズルチップ、 20 搬送機構、 21 X軸方向ガイド、
22 X軸方向可動子、 23 Y軸方向ガイド、
24 作業ヘッド(Y軸方向可動子)、 25 バーコードリーダ、
26 グリッパユニット、 27 分注ユニット、 30 液体分注機構、
40 閉栓ユニット、 50 攪拌ユニット、 60 核酸増幅装置、
61 基台、 62 カバー、 63 ゲート、 64 カローセル、
65 フレーム、 65a 回転軸、 64b 取付凹部、 66 温調ブロック、
66-5 緊急検体用温調ブロック、 66a ブロック基材、
66b ペルチェ素子、 66c 温度センサ、 66d 配線ケーブル、
66e 回転検知センサ、 67 測定配置ポジション、 68 蛍光検出器、
69 ステッピングモータ、 70 反応液調製ポジション、 72 容器搭載部、
80 廃棄ボックス、 90 待機バッファ、 92 待機ポジション、
94 温度調節装置、 100 制御装置、 102 温調ブロック対応制御部、
104 温調ブロック全体制御部、 110 入力装置、 120 表示装置、
130 緊急検体ラック、 132 検体容器、
【技術分野】
【0001】
本発明は、血液や尿等の生体由来の検体、いわゆる生体試料中に含まれる核酸を分析する核酸検査装置、及びこの核酸検査装置での反応容器の容器搬送方法に関する。
【背景技術】
【0002】
従来、生体由来の検体中に含まれる核酸の検査を行う場合に用いられる核酸増幅技術としては、例えば、ポリメラーゼ連鎖反応(Polymerase Chain Reaction;以下、PCRと略称する)法を用いたものがある。PCR法では、検体と試薬を混合した反応液の温度を予め定められた条件に従って制御することにより、反応液中の所望の塩基配列を選択的に増幅させることができる。
【0003】
また、その他の核酸増幅法として、NASBA(Nucleic Acid Sequence-Based Amplification)法やLAMP(Loop-Mediated Isothermal Amplification)法のように、反応液の温度を一定に制御し、核酸増幅をはかる恒温増幅法が開発されている。
【0004】
このような核酸増幅手法は、例えばウイルス性感染の診断等、臨床検査分野でも積極的に用いられており、自動化による検査の効率化・省力化・高精度化が求められている。
【0005】
特表2002−513936号公報(特許文献1)には、標的核酸の検出を自動的に行う装置が記載されている。この装置は、反応容器に試料を調製する機構と、反応容器に収容された標的核酸中に含まれる標的配列を単離し、増幅するための1以上のインキュベータとが配置された構成になっており、各インキュベータは、複数の反応容器を保持するためのカルーセルを備えた構成になっている。反応容器は、自動化された運搬機構を用いて、核酸の分析処理工程に従いそれぞれ適切な温度に制御された複数のインキュベータに順次移動されて所定時間だけそのカルーセルに配置されることよって、同一の反応容器に対する温度変化を実現している。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特表2002−513936号公報
【発明の概要】
【発明が解決しようとする課題】
【0007】
ところで、核酸増幅技術においては、増幅対象の塩基配列の種類によって、増幅のために用いる試薬や、増幅処理工程においての調整温度やその調整時間、等といった条件(プロトコル)が異なる。そのため、増幅対象の塩基配列が異なる複数種類の検体を並行して核酸増幅処理する場合には、各検体の増幅対象の塩基配列プロトコルに規定される調整温度やその調整時間を、検体個々に対し設定する必要がある。
【0008】
しかしながら、上述した特許文献1に記載された自動分析装置では、インキュベータそれぞれは予め設定された一定温度に制御されているため、複数のプロトコルを並行して実行するためには、制御温度が異なる多数のインキュベータが必要となり、装置構成ばかりか、インキュベータ間の反応容器の移動手順も複雑化する。
【0009】
本発明は上記問題点を鑑みてなされたものであり、PCR法や恒温増幅法に代表される核酸分析手法を実施することができ、特に、異なる分析項目を効率的に処理することができる核酸検査装置を提供することを目的とする。
【課題を解決するための手段】
【0010】
上記目的を達成するために、本発明に係る核酸検査装置は、検体,試薬,分注チップ,反応容器の搭載機構と、選択された一の反応容器内に分注チップを用いて検体及び試薬を分注して反応液を調製する液体分注機構と、反応容器を保持して移動する搬送機構と、反応液が収容された反応容器を閉栓する閉栓ユニットと、閉栓された反応容器に分注された検体及び試薬を均一に混合する攪拌ユニットと、攪拌が終わった反応容器を一時的に保持しておく待機バッファと、攪拌が終わった反応容器内の反応液の核酸をプロトコルに従って増幅し、核酸濃度測定を行う核酸増幅装置とを備えるものである。
【0011】
そして、核酸増幅装置は、反応液を収容した少なくとも1つの反応容器を保持する複数の温調ブロックを配置したカローセルと、前記複数の温調ブロックのそれぞれに設けられ、前記反応液の温度を調製する温度調節装置とを備えることを特徴とするものである。
【発明の効果】
【0012】
本発明の核酸検査装置によれば、同一又は異なる分析項目を、効率的に核酸検査処理することができる。すなわち、核酸増幅装置は、反応液を収容した少なくとも1つの反応容器をそれぞれ保持し、互いに独立に温度制御することができる温調ブロックを複数備えるため、各温調ブロックでは、互いに任意のタイミングで、増幅対象の塩基配列の種類に応じたプロトコルに従って反応容器の温度調節を開始することができる。
【0013】
さらに、攪拌が終わった反応容器を一時保持しておくための待機バッファを備えるようにしておけば、核酸増幅処理のプロトコルが同じ若しくは共通の反応容器を、核酸増幅装置に搭載する前にこの待機バッファに待機させておくことできるので、一の温調ブロックに備えられた、反応容器を搭載するための測定配置ポジション数の範囲内で、同一若しくは共通の検査項目が依頼された反応容器について温度調節を始めるタイミングを揃えることができ、核酸増幅装置の温調ブロック及びその測定配置ポジションの効率的な利用が可能になる。
【図面の簡単な説明】
【0014】
【図1】本発明の一実施の形態に係る核酸検査装置の概略構成を示した全体図である。
【図2】本実施の形態の核酸検査装置に含まれる核酸増幅装置の一実施例の概略構成を示した平面図である。
【図3】図2に示した核酸増幅装置の概略構成を示した側面図である。
【図4】検体容器ラック情報の一例を模式的に表わした図である。
【図5】試薬容器ラック情報の一例を模式的に表わした図である。
【図6】核酸検査の実行内容情報の一例を模式的に表わした図である。
【図7】本実施の形態の核酸検査装置で制御装置が反応液調製制御手段として行う反応液調製処理の一実施例を示したフローチャートである。
【図8】待機バッファテーブルの一例の構成を模式的に表わした図である。
【図9】本実施の形態の核酸検査装置で核酸増幅制御手段として核酸増幅処理を行う制御装置の機能ブロック図である。
【図10】本実施の形態の核酸検査装置で制御装置が温調ブロック全体制御部として行う温調ブロック全体制御処理の一実施例を示したフローチャートである。
【図11】本実施の形態の核酸検査装置で制御装置が温調ブロック全体制御部として行う温調ブロック全体制御処理の一実施例を示したフローチャートである。
【図12】温調ブロック全体制御テーブルの一実施例の構成を模式的に表わした図である。
【図13】本発明の別の実施の形態に係る核酸検査装置の概略構成を示した平面図である。
【図14】本発明のさらに別の実施の形態に係る核酸検査装置の概略構成を示した平面図である。
【発明を実施するための形態】
【0015】
以下、本発明に係る核酸検査装置及び容器搬送方法の実施の形態について、図面に基づき説明する。
【0016】
図1は、本発明の一実施の形態に係る核酸検査装置の概略構成を示した全体図である。
図1に示す実施の形態において、核酸検査装置1は、検査に用いられる検体,試薬,分注チップ,反応容器が配備されるラック搭載部10と、反応容器等を保持しながら移動させる搬送機構20と、選択された一の反応容器内に分注チップを用いて検体と試薬とを分注して反応液を調製する液体分注機構30と、反応液を収容した反応容器を閉栓する閉栓ユニット40と、反応容器に収容された反応液の検体及び試薬を均一に混合する攪拌ユニット50と、攪拌が終わった反応容器が搭載され、反応液の核酸を予め定められているプロトコルに従って増幅して核酸濃度測定を行う核酸増幅装置60と、を備えている。
【0017】
ラック搭載部10は、核酸検査装置1の作業台2上の所定位置に設けられ、検体容器ラック12,試薬容器ラック14,反応容器ラック16,ノズルチップラック18がそれぞれ搭載される。
【0018】
検体容器ラック12には、増幅処理の対象となる核酸を含む検体が収容された複数の検体容器13が配列収納されている。試薬容器ラック14には、検体に加えるための試薬が収容された複数の試薬容器15が配列収納されている。反応容器ラック16には、検体と試薬とを混合するために用いられる複数の未使用の空の反応容器17が配列収納されている。ノズルチップラック18には、検体及び試薬の分注に用いられる複数の未使用のノズルチップ19が配列収納されている。
【0019】
搬送機構20は、核酸検査装置1の作業台2上にX軸方向(図中、左右方向)に延在させて配置されたX軸方向ガイド21と、このX軸方向ガイド21上を移動可能に設けられたX軸方向可動子22と、このX軸方向可動子22に一体的に取り付けられ、Y軸方向(図中、上下方向)に延在させて配置されたY軸方向ガイド23と、このY軸方向ガイド23上を移動可能に設けられた作業ヘッド(Y軸方向可動子)24とを備え、制御信号に基づいて作業ヘッド24を作業台上で二次元移動させて、作業台上の所望の位置に配置できる構成になっている。
【0020】
作業ヘッド24には、バーコードリーダ25と、グリッパユニット26と、分注ユニット27とが設けられ、各部25〜27は作業ヘッド24と一体的に作業台上を移動し、作業台2上の所望位置に配置される。
【0021】
バーコードリーダ25は、検体容器13,試薬容器15,反応容器17それぞれに付されている識別情報を読み取り、これらの識別情報を取得する。
【0022】
グリッパユニット26は、制御信号に基づくグリッパの作動に応動して反応容器17を把持又は解放し、作業台2上の装置各部間での作業ヘッド24の移動に伴って反応容器17を搬送する。
【0023】
分注ユニット27は、ノズルチップ19を着脱可能な構成になっており、制御信号に基づいてノズルチップラック18からノズルチップ19を装着し、検体容器13内の検体又は試薬容器15内の試薬にノズルチップ19を浸漬し、検体又は試薬をノズルチップ19内に吸引して採取する。また、分注ユニット27は、制御信号に基づいてこのノズルチップ19内に貯留された検体や試薬を反応容器17に吐出して分注する。分注ユニット27は、液体分注機構30の主部をなす。
【0024】
また、図示の核酸検査装置1では、ラック搭載部10と核酸増幅装置60との間の作業台2上には、反応液を調製するために反応容器ラック16から取り出した未使用の反応容器17が載置される反応液調製ポジション70が形成されている。反応液調製ポジション70には、反応容器17を保持するための容器搭載部72が設けられている。核酸検査装置1では、反応容器ラック16からこの反応液調製ポジション70にグリッパユニット26を用いて移した未使用の反応容器17に対し、分注ユニット27を用いて検体容器13及び試薬容器15から検体及び試薬の分注を行って、反応容器17内に検体及び試薬を混合した反応液を調製する。複数の容器搭載部72を備えることで、例えば、同じ検体又は同じ試薬の分注を複数の反応容器17に対し一緒に行うこともでき、複数の反応液の調製を纏めて行うバッチ処理ができるようになっている。
【0025】
閉栓ユニット40は、反応液調製ポジション70からグリッパユニット26を用いて移された、反応液が収容されている反応容器17の開口(分注口)を閉栓して、反応液の蒸発や外部からの異物の進入等を防ぐ。
【0026】
攪拌ユニット50は、閉栓ユニット40からグリッパユニット26を用いて移された、密閉された反応容器17に収容されている反応液を攪拌し、検体及び試薬の混合を行う。
【0027】
さらに、図示の核酸検査装置1では、反応液調製ポジション70とラック搭載部10との間の作業台2上には、分注ユニット27に装着されて検体又は試薬の分注に使用された使用済みのノズルチップ19や、核酸増幅装置60による核酸増幅処理が終わった検査済みの反応容器17を廃棄する廃棄ボックス80の投入口80aが設けられている。
【0028】
また、反応液調製ポジション70と核酸増幅装置60との間の作業台2上には、攪拌ユニット50から反応液の攪拌を終えた反応容器17がグリッパユニット26を用いて移され、核酸増幅装置60による核酸増幅処理待ちの反応容器17を一時的に保持しておく待機バッファ90が設けられている。待機バッファ90は、反応容器17を保持するための待機ポジション92を複数有し、温度調節装置94が付設されている。温度調節装置94は、待機ポジション92に搭載された反応容器17に収容されている反応液の劣化を防止するため、反応容器17を例えば約4℃に保つよう制御されている。この待機バッファ90に保持されている反応容器17は、グリッパユニット26を用い、後述する手順に従って核酸増幅装置60に適宜搬送され、核酸増幅装置60で反応容器17に収容された反応液に核酸増幅処理が施される。
【0029】
次に、図1に示された核酸増幅装置60の詳細構成について、図2及び図3を基に説明する。
【0030】
図2は、本実施の形態の核酸検査装置に含まれる核酸増幅装置の一実施例の概略構成を示した平面図である。
【0031】
図3は、図2に示した核酸増幅装置の概略構成を示した側面図である。
なお、図2,図3では、核酸増幅装置60の構成理解を容易するため、図1に現れているカバー62は図示省略してある。
【0032】
図2及び図3に示すように、核酸増幅装置60は、基台61と、反応容器17の保持具としての円盤形状の回転可能なカローセル64と、カローセル64に複数設けられ、反応容器17が搭載される搭載部としての測定配置ポジション67を少なくとも1つ以上有する温調ブロック66と、反応容器17に収容された反応液の蛍光検出を行う蛍光検出器68と、カローセル64の回転駆動装置としてのステッピングモータ69(図3に記載)とを備えている。
【0033】
そして、このカローセル64や蛍光検出器68等が配置された核酸増幅装置60内の収容空間は、図1に示したように、通常は、開閉可能なゲート63を有するカバー62によって覆われた構成になっている。カバー62は、基台61とともにカローセル64及び蛍光検出器68を覆うことにより、蛍光測定が行われる収容空間への外光の入射を抑制する。カバー62には、開閉可能なゲート63が設けられている。ゲート63は、温調ブロック66の測定配置ポジション67に対しての、グリッパユニット26を用いての反応容器17の搭載/取り出しに連動して開閉制御される。ゲート63は、反応容器17の搭載/取り出しの際に収容空間内の対象の測定配置ポジション67だけを臨ませ、反応容器17の搭載/取り出しの際の外光の入射を低減する。
【0034】
カローセル64は、上下方向に延びる回転軸65aを中心にして回動可能な円盤状のフレーム65を有し、回転駆動装置としてのステッピングモータ69の駆動に応動して、検査中は回転軸65aを中心に所定回転量ずつ回転駆動される。
【0035】
フレーム65の周縁側部分には、温調ブロック66を取り付ける取付凹部65bが、フレーム65の周方向に沿って複数形成されている。各取付凹部65bには、それぞれ温調ブロック66が設けられ、図示の例では、フレーム65の周方向に沿って、大きさが等しい4つの温調ブロック66-1〜66-4が備えられている。
【0036】
フレーム65は、周方向に隣り合った取付凹部65b間に介在する部分も含め、例えば、断熱プラスチック等の断熱性に優れた部材を用いて構成されている。これにより、フレーム65は、温調ブロック66を個別に取り囲み、互いに隣り合う温調ブロック66間でそれぞれの調整温度が干渉しにくくなっている。
【0037】
なお、この温調ブロック66間の断熱構成は、フレーム65自体を断熱性に優れた部材で形成するだけではなく、フレーム65と温調ブロック66との間にポリウレタンフォーム等の断熱材による断熱層を介在させて、温調ブロック66からフレーム65への温度干渉や、周方向の沿って隣り合う温調ブロック66間の温度干渉を低減する構成としてもよい。この場合、温調ブロック66のフレーム65に対する取付構成も、図示のような取付凹部65bを用いた取付構成に限るものではなく、例えば、フレーム65を径方向にそれぞれ延びる腕部を備えた構成とし、各腕部に断熱材を介して温調ブロック66を支持させる等の構成としてもよい。さらに、カローセル64の形状自体も円盤形状に限定されず、適宜変更可能である。
【0038】
図示の例では、各温調ブロック66-1〜66-4は、3つの測定配置ポジション67-1〜67-3を有する同一形状の温調ブロック66によってそれぞれ構成されている。各温調ブロック66は、測定配置ポジション67が形成されたブロック基材66aと、温度調整装置としてのペルチェ素子(図3に記載)66bと、温度センサ66cと、図示省略した放熱手段とを備えた構成になっている。
【0039】
ブロック基材66aは、例えば、銅,アルミニウム又は各種合金等の熱伝導体によって形成されている。測定配置ポジション67は、例えば、ブロック基材66aの表面から裏面に貫通した容器支持孔として構成され、透過性若しくは透光性素材により形成された反応容器17の底部側容器部分をブロック基材66aの裏面側に露出させて観察可能に挿通させて臨ませた状態で、熱伝達可能に反応容器17を着脱自在に保持する。ペルチェ素子66b及び図示省略した放熱手段は、測定配置ポジション67に搭載された反応容器17及び内部の反応液を、ブロック基材66aを介して加熱又は冷却する。温度センサ66cは、例えば、サーミスタ,熱電対,測温抵抗体等を用いて構成され、測定配置ポジション67の近傍のブロック基材66aの温度を測定することにより、反応容器17及び内部の反応液の温度を検出する。
【0040】
各温調ブロック66に配置されたペルチェ素子66bや温度センサ66cの配線は、図3に示すように、カローセル64の裏面側へ引回しされ、回転軸65aに遊嵌させて巻回された屈曲性のある配線ケーブル66dに連結されている。配線ケーブル66dは、カローセル64の回転動作により、その巻回部分がカローセル64の回転回数(回転量)に応じて拡縮し、かつ回転軸65aに対し適度な緩みを確保しながらその巻回数が調整され、カローセル64の回転を許容する構成になっている。さらに、回転軸65aの同一方向に連続した回転量をモニタする回転検知センサ66eが配置されており、配線ケーブル66dが一方向にだけ所定量以上巻き付き又は巻き解かれた場合には、回転軸65aの回転方向を逆転させて、配線ケーブル66dの断線を防止する。この回転方向の逆転は、蛍光検出器68による測定配置ポジション67に搭載された反応容器67の計測インターバルがずれないようにタイミングをはかって実行される。
【0041】
上述した構成により、各温調ブロック66は、このペルチェ素子66b及び図示省略した放熱手段を用いて、温度センサ66cによる検出出力に基に反応容器17を加熱又は冷却することにより、温調ブロック66の測定配置ポジション67に保持された反応容器17内の反応液の温度を、温調ブロック66別にそれぞれ独立に調整する。なお、このペルチェ素子66bや温度センサ66cは、1つの温調ブロック66に対して複数備えられていてもよい。
【0042】
また、各温調ブロック66-1〜66-4の各測定配置ポジション67-1〜67-3は、図1に示すように、各温調ブロック66がフレーム65に取り付けられた状態で、各温調ブロック66-1〜66-4間で、さらに各温調ブロック66の測定配置ポジション67-1〜67-3間で、各蛍光検出器68による各反応容器17までの距離(検出距離)が変わらないようになっている。図示の例では、各温調ブロック66-1〜66-4の各測定配置ポジション67-1〜67-3は、いずれもフレーム65の回転軸65aを中心とした同じ半径方向位置に位置するようになっている。これにより、同じ蛍光検出器68で、各温調ブロック66-1〜66-4の各測定配置ポジション67-1〜67-3にそれぞれ搭載された反応容器17内の反応液の蛍光強度を、温調ブロック66-1〜66-4及びその測定配置ポジション67-1〜67-3の違いに拘らず、同じ観察条件、観察精度で測定できる。また、カローセル64に設けられる温調ブロック66の数、及び各温調ブロック66における測定配置ポジション67の数については、上述した複数の同じ蛍光検出器68で同じ観察条件、観察精度で蛍光測定できるならば、任意に選択可能である。
【0043】
図示のカローセル64の場合、円盤状のフレーム65の周方向に沿って、4つの同じ温調ブロック66-1〜66-4が均等配置されている。各測定配置ポジション67-1〜67-3の配置も、フレーム65の周方向に沿って、ブロック基材66a内でも、隣り合う温調ブロック66間の隣り合う測定配置ポジション67間でも、均等になるように配置されている。これにより、蛍光測定タイミング毎のカローセル64の回転量は、測定対象の温調ブロック66-1〜66-4や測定配置ポジション67-1〜67-3の違いに拘らず一定となり、複数の蛍光検出器68を共用することができ、蛍光検出器68に対する位置決めも容易化がはかれるようになっている。
【0044】
カローセル64の周囲には、蛍光検出器68が1つ以上設けられている。各蛍光検出器68は、測定配置ポジション67に搭載された反応容器17が対向した状態で、その検出素子がカローセル64のブロック基材66aの裏面側に露出している反応容器17の底部側の容器部分と対向するように、基台61上に設けられている。
【0045】
各蛍光検出器68は、対向した反応容器17の露出した底部側の容器部分に励起光を照射する励起光源と、この励起光の照射に基づいた反応液からの蛍光を検出する検出素子とを含む。励起光源としては、例えば、発光ダイオード(LED),半導体レーザー,キセノンランプ,ハロゲンランプ等が用いられる。検出素子としては、フォトダイオード、フォトマルチプライヤー、CCD等が用いられる。
【0046】
これにより、蛍光検出器68は、カローセル64の回転によって反応容器17がその励起光源及び検出素子に対し対向位置(通過も含む)した場合に、励起光源からの励起光の照射によって反応液から生じる蛍光を検出素子により検出して測定することによって、反応液中の、試薬により蛍光標識された増幅対象の塩基配列の定量を経時的に並行して行うことができる。
【0047】
図1に示す例では、蛍光検出器68は、カローセル64の外周上に4つ、周方向に沿って均等間隔で配置されている。この場合、隣り合う2つの蛍光検出器68のカローセル64の周方向に沿った間隔は、上述のようにカローセル64の周方向に沿って温調ブロック66の相違に関係なく均等間隔で配置された測定配置ポジション67の間隔の倍数になっている。この結果、4つの蛍光検出器68のそれぞれは、4つの温調ブロック66-1〜66-4それぞれの各測定配置ポジション67-1〜67-3に搭載された反応容器17の蛍光検出器を兼ね、一の測定配置ポジション67に搭載された反応容器17に対する測定分解能を向上させる構成になっている。なお、蛍光検出器68が複数ある場合でも、例えば、各蛍光検出器68がそれぞれ対応する特定の温調ブロック66の測定配置ポジション67に搭載された反応容器17に対してのみ蛍光測定を行う等、互いに独立的に反応容器17内の反応液の検出又は測定を行う構成とすることもできる。
【0048】
このように構成された核酸検査装置1の核酸増幅装置60を含む装置各部は、図1に示すように、キーボード,マウス等の入力装置110や液晶モニタ等の表示装置120を備えた制御装置100により、その作動が制御される。制御装置100は、核酸検査装置1の核酸増幅装置60を含む上述した装置各部を制御し、入力装置110により設定されたプロトコルに基づいて、予め記憶部に記憶された各種ソフトウェア等を用いて、反応液調製処理及び核酸増幅処理を含む核酸検査処理を実行する。そして、制御装置100は、この核酸検査処理の際の装置各部の可動状況等を記憶部に記憶するとともに、核酸増幅装置60によって得られた蛍光検出結果等の分析結果を記憶部に記憶し、表示装置120に表示する。
【0049】
次に、この制御装置100が行う核酸検査処理に係り、上述した反応液調製処理及び核酸増幅処理について詳細に説明する。
【0050】
ここで、反応液調製処理とは、核酸検査装置1の制御装置100によって行われる核酸検査処理の中、反応容器17内に検体及び試薬を分注した反応液を調製する処理を指す。また、核酸増幅処理とは、この反応液調製処理によって反応容器17内に調製された反応液を、増幅対象の塩基配列の種類に応じたプロトコルに従って温度調節し、塩基配列の核酸増幅を反応液の蛍光測定によって確認しながら行う処理を指す。
【0051】
まず、核酸検査装置1には、核酸検査を行うに当たって、準備として、核酸検査装置1のラック搭載部10の所定位置に、反応容器ラック16と、ノズルチップラック18と、検体容器ラック12と、試薬容器ラック14とが搭載される。反応容器ラック16には、未使用の空の反応容器17が配列収納されている。ノズルチップラック18には、未使用のノズルチップ19が配列収納されている。検体容器ラック12には、これから行う核酸増幅処理で増幅対象となる核酸を含む検体を収容した検体容器13が配列収納されている。試薬容器ラック14には、検体と混合して反応液の調製に用いられる試薬を収容した試薬容器15が配列収納されている。
【0052】
この検体容器ラック12及び試薬容器ラック14のラック搭載部10への搭載に関連して、検体容器ラック12に配列収納されている検体容器13それぞれに収容された検体の識別等を含む検体情報と、試薬容器ラック14に配列収納されている試薬容器15それぞれに収容された試薬の識別等を含む試薬情報とが、制御装置100の記憶部に入力装置110から登録される。
【0053】
図4,図5は、制御装置の記憶部に登録された検体容器ラック情報及び試薬容器ラック情報のそれぞれ一例を模式的に表わした図である。
【0054】
図示の例では、検体容器ラック情報及び試薬容器ラック情報いずれとも、検体容器ラック12又は試薬容器ラック14の識別情報に対応させ、検体又は試薬の識別等を含む検体情報又は試薬情報が、その検体又は試薬が収容された検体容器13又は試薬容器15が収納保持されている検体容器ラック12又は試薬容器ラック14上のラック位置情報に対応付けて記憶されているデータ形式になっている。この検体容器ラック情報及び試薬容器ラック情報の記憶部への登録は、例えば、入力装置110から搭載する検体容器ラック12及び試薬容器ラック14のラック識別情報を入力すれば、入力したラック識別情報に対応する上述のような検体容器ラック情報及び試薬容器ラック情報が制御装置100に取り込まれ、その記憶部に登録される。これにより、制御装置100は、分注ユニット27を用いて検体又は試薬の分注を行うに当たり、調製に必要な検体及び試薬の識別に係る情報やラック搭載部10上、延いては作業台2上でのそれぞれの所在位置を把握することができる。
【0055】
なお、この検体容器ラック情報及び試薬容器ラック情報の登録については、検体容器ラック12及び試薬容器ラック14のラック搭載部10への搭載後、検体容器13及び試薬容器15自体に装着されている、収容されている検体や試薬の識別を示すバーコードラベルを、バーコードリーダ25を用いて順次直接読み取らせ、制御装置100自身で検体容器ラック情報及び試薬容器ラック情報を作成することも可能である。
【0056】
核酸検査装置1には、核酸検査を行うに当たって、準備として、検体情報や試薬情報に加えて、入力装置110を用いてプロトコルとして設定した、これから行う核酸検査の実行内容情報も取り込まれる。
【0057】
図6は、制御装置に取り込まれた核酸検査の実行内容情報の一例を模式的に表わした図である。
【0058】
図示の場合、核酸検査の実行内容情報には、核酸検査処理として、N個の個別核酸検査処理を行うことが指示されている。通常、実行内容情報に個別核酸検査処理が複数含まれている場合は、その個別核酸検査処理は、検体容器ラック12に収納された検体容器13の配置順に応じて作成されている。その上で、各個別核酸検査処理には、反応液調製処理情報と、核酸増幅処理情報とが含まれている。そして、反応液調製処理情報には、検体分注情報、試薬分注情報が含まれている。この検体分注情報には、反応液を調製するために分注する検体についての検体情報やその分注量情報等が含まれ、その試薬分注情報には、反応液を調製するために分注する試薬についての試薬情報やその分注量情報等が含まれている。一方、核酸増幅処理情報には、上述した反応液調製処理情報を基に調製された個別核酸検査処理に係る反応液について、核酸増幅装置60で温調ブロック66を作動制御して温度調節を行う温調制御プロトコル等が含まれている。この温調制御プロトコルには、その核酸増幅処理に係る反応液及び反応容器17の加熱温度及び加熱時間、又は冷却温度及び冷却時間等の温度調節についての情報が含まれている。
【0059】
その上で、制御装置100は、分注ユニット27を含む液体分注機構を用いた反応液調製処理、及び核酸増幅装置60を用いたこの調製した反応液の核酸増幅処理を、反応容器17の容器識別情報をキー情報として管理し、反応液調製制御手段及び核酸増幅制御手段として両処理を並行して行いながら、核酸検査の実行内容情報に含まれた個別核酸検査処理の全数について行う。
【0060】
そのために、ラック搭載部10の所定位置に搭載される反応容器ラック16の各ラック位置に搭載されている未使用の反応容器17それぞれには、搬送機構20の作業ヘッド24のバーコードリーダ25で読み取り可能な、他の反応容器17との間で自身を識別するための容器識別情報を含むバーコードラベルが直接装着され、個々の反応容器17を識別管理できるようになっている。
【0061】
制御装置100は、例えば、反応容器ラック16内の任意のラック位置にある反応容器17を、作業ヘッド24のグリッパユニット26を用いて把持して移送しようとすれば、グリッパユニット26とともに作業ヘッド24に設けられたバーコードリーダ25によって、この移送しようとする反応容器17の容器識別情報を取得できるようになっている。
【0062】
図7は、本実施の形態の核酸検査装置で制御装置が反応液調製制御手段として行う反応液調製処理の一実施例を示したフローチャートである。
【0063】
制御装置100は、反応液調製制御手段として反応液調製処理を開始するに当たって、まず記憶部に設けられている反応液調製処理のための各種作業エリアをイニシャライズする(S100)。これにより、例えば、各種作業エリアの中の、反応液調製ポジション70の各容器搭載部72の稼動状況を随時監視しておくための反応液調製ポジションテーブルは、各容器搭載部72の稼動状況がリセットされる。同様に、待機バッファ90の各待機ポジション92の稼動状況を随時監視しておくための待機バッファテーブルは、各待機ポジション92の稼動状況がリセットされる。そして、反応液調製ポジション70の各容器搭載部72、及び待機バッファ90の各待機ポジション92は、反応容器17が受け入れ可能な非搭載状態になる。
【0064】
その後、反応液調製ポジションテーブルには、例えば、一の容器搭載部72に反応容器ラック16から反応容器17を搬送機構20で搬送して搭載した場合、この反応容器17を反応容器ラック16からグリッパユニット26を用いて取り出す際にバーコードリーダ25により読み取った反応容器17の容器識別情報をその一の容器搭載部72に対応させて分注作業の間に記憶しておくことにより、その一の容器搭載部72の稼動状態(容器搭載状態)が記憶される。これに対し、反応液の調製後、その一の容器搭載部72の反応容器17を閉栓ユニットに搬送機構20で搬送する場合に、記憶してある容器識別情報をクリアすることによって、待機状態(容器非搭載状態)が記憶される。また、待機バッファテーブルには、例えば、一の待機ポジション92に攪拌ユニット50から反応容器17を搬送機構20で搬送した場合に、反応容器17を攪拌ユニット50か取り出す際にバーコードリーダ25により反応容器17から読み取った容器識別情報をその一の待機ポジション92に対応させて反応容器17が搭載されている間に記憶しておくことにより、その一の待機ポジション92の稼動状態(容器搭載状態)が記憶される。これに対し、核酸増幅処理のため、その一の待機ポジション92の反応容器17を核酸増幅装置60の温調ブロック66に搬送機構20で搬送した場合に、記憶してある容器識別情報をクリアすることによって、待機状態(容器非搭載状態)が記憶される。
【0065】
制御装置100は、このような反応液の調製処理に係るイニシャライズが済むと、入力装置110によって設定された、図4,図5に示した検体容器ラック情報及び試薬容器ラック情報や、図6に示した核酸検査の実行内容情報の読み込み処理を行う(S102)。
【0066】
制御装置100は、図6に示した核酸検査の実行内容情報に含まれた1又は複数の個別核酸検査処理の中から予め設定された手順に基づいて、今回、反応液作製処理を行う1又は複数の個別核酸処理を選択抽出する(S104)。この場合における予め設定された手順とは、例えば、反応液調製ポジション70の容器搭載部72の数だけ纏めて反応容器17それぞれに反応液を調製してから、閉栓ユニット40や攪拌ユニット50による後段処理に反応容器17を纏めて移すバッチ処理を行うか、反応液調製ポジション70の容器搭載部72のいずれかで反応容器17への検体及び試薬の分注が終わる度に、閉栓ユニット40や攪拌ユニット50による後段処理に反応容器17を随時移す逐次処理を行うか、等である。
【0067】
次に、制御装置100は、この反応液調製ポジション70で、反応容器ラック16から事前に搬送し反応液調製ポジション70の容器搭載部72に搭載した未処理の反応容器17に対して、選択抽出された個別核酸処理の反応液調製処理情報に基づいて液体分注機構30を作動制御して、反応液の調製を行う(S106)。具体的には、制御装置100は、ノズルチップ19が未装着な分注ユニット27をノズルチップラック18に移動して未使用のノズルチップ19を装着する。この未使用のノズルチップ19の装着に当たって、分注ユニット27に装着されていた使用済みのノズルチップ19は、事前に、分注ユニット27を廃棄ボックス80の投入口80aに移動し、分注ユニット27から切り離して廃棄してある。そして、この未使用のノズルチップ19を装着した分注ユニット27を例えば検体容器ラック12の所定の検体容器13に移動して、この未使用のノズルチップ19内に検体を吸引して採取する。その上で、分注ユニット27を反応液調製ポジション70の所定の容器搭載部72に移動して、ノズルチップ19に収容している検体を分注量情報に記載された所定量だけ、搭載されている反応容器17に吐出して分注する。制御装置100は、このような未使用のノズルチップ19を用いての分注作業を、試薬容器ラック14の所定の試薬容器15についても行い、反応容器17に反応液を調製する。
【0068】
制御装置100は、例えば、グリッパユニット26を用いてこの反応液の調製に用いる反応容器17を反応容器ラック16から取り出し、反応液調製ポジション70の容器搭載部72に予め搭載する際に、バーコードリーダ25で読み取ったこの反応容器17の容器識別情報をこの搭載部72に対応付けることができる。そして、この搭載部72に搭載された反応容器17に対し、選択抽出された個別核酸検査処理の反応液調製処理情報に基づいて検体及び試薬を分注することによって、この反応容器17の容器識別情報に対し、核酸増幅装置60でのこの個別核酸検査処理による核酸増幅処理情報を対応付けることができる。制御装置100は、このようにして得られた反応容器17の容器識別情報と、核酸増幅処理情報を含む個別核酸検査処理との対応を、記憶部に記憶しておくようになっている。
【0069】
反応液調製ポジション70で反応液が調製された反応容器17は、制御装置100によって、反応液調製ポジション70からグリッパユニット26を用いて閉栓ユニット40に移され、閉栓された後、閉栓ユニット40からグリッパユニット26を用いて攪拌ユニット50に移され、分注した検体及び試薬の攪拌が行われる。
【0070】
制御装置100は、この攪拌処理が終わった反応容器17を待機バッファ90の空いている待機ポジション92に搬送することができるか否かを判断するために、前述した記憶部の待機バッファテーブルの記憶内容を照会する(S108)。
【0071】
図8は、待機バッファテーブルの一例の構成を模式的に示した図である。
待機バッファテーブルは、待機バッファ90の各待機ポジション92-1〜92-m(図1の場合、m=12)について、反応容器17の受け入れ状態を記憶している。図示の例では、待機ポジション92-1には、容器識別情報ZZXXXAの、反応液が調製済みで核酸増幅処理待ちの反応容器17が搭載されており、待機ポジション92-(m−2)には、反応容器17が搭載されておらず、反応容器17が受け入れ可能状態(容器非搭載状態)になっている。
【0072】
これにより、制御装置100は、図7に示すように、この待機バッファテーブルの記憶内容により、待機バッファ90に反応容器17を受け入れ可能な待機ポジション92-(m−2)があれば(S110)、攪拌処理が終わった反応容器17をグリッパユニット26を用いて攪拌ユニット50から待機バッファ90のこの待機ポジション92-(m−2)に搬送して搭載する(S112)。これに伴い、制御装置100は、待機バッファテーブルの反応容器17を搭載した待機ポジション92-(m−2)に対応して、搭載した反応容器17の容器識別情報を記憶し、待機バッファテーブルに記憶されている反応容器17の受け入れ状態を更新する(S114)。
【0073】
そして、制御装置100は、核酸検査の実行内容情報に含まれた個別核酸検査処理全てについて反応液調製処理が終わっていない個別核酸検査処理があるか否かを、例えば、容器識別情報が未だ対応付けられていない個別核酸検査処理があるか否かによって確認し(S116)、反応液調製処理が未だ終わっていない個別核酸検査処理がある場合には、その反応液調製処理を行う。
【0074】
一方、制御装置100は、待機バッファテーブルの記憶内容の照会により(S108)、待機バッファ90に反応容器17が受け入れ可能な待機ポジション92がない場合は(S110)、待機バッファ90に反応容器17が受け入れ可能な待機ポジション92ができるまで、例えば、反応液調製処理が未だ終わっていない個別核酸検査処理の反応液調製処理を新たに行わないようにする。
【0075】
このような反応液調製処理では、核酸検査の実行内容情報に含まれている個別核酸検査処理の順番が、検体容器ラック12に収納された検体容器13の配置順に対応しているため、待機バッファ90に搬送される反応容器17に対しての核酸増幅のための温調制御プロトコルは様々である。さらに、反応容器17毎に検体や試薬の種類・量、又、攪拌時間等も変わるため、待機バッファ90に搬送されるタイミングも異なってしまうこともある。
【0076】
次に、核酸検査装置1の制御装置100によって上述した反応液調製処理と並行して行われる、反応容器17内に調製された反応液を核酸増幅する核酸増幅処理の一実施例について説明する。
【0077】
図9は、本実施の形態の核酸検査装置で核酸増幅制御手段として核酸増幅処理を行う制御装置の機能ブロック図である。
【0078】
制御装置100は、核酸増幅制御手段として、温調ブロック66-1〜66-4それぞれを互いに独立に作動制御する温調ブロック対応制御部102(102-1〜102-4)と、各温調ブロック対応制御部102(102-1〜102-4)それぞれの作動制御を行う温調ブロック全体制御部104とを含む構成になっている。制御装置100は、核酸増幅制御手段として、温調ブロック全体制御部104としての処理を行いながら、さらに各温調ブロック66-1〜66-4の温調ブロック対応制御部102(102-1〜102-4)としての処理を並行して行う。
【0079】
制御装置100は、まず、温調ブロック66-1〜66-4それぞれに対応した温調ブロック対応制御部102(102-1〜102-4)として、待機バッファ90からグリッパユニット26を用いて温調ブロック全体制御部104によって指定された容器識別情報の反応容器17を測定配置ポジション67に搭載する。そして、温調ブロック全体制御部104としての制御装置100から提供される、反応容器17に対応付けられた個別核酸検査処理の核酸増幅処理情報に含まれる温調制御プロトコルに従って、温度センサ66cの出力を基にペルチェ素子66b等を駆動制御して、その測定配置ポジション67-1〜67-3に搭載されている反応容器17の温度を周期的に段階的に変化させて温調制御を行う。加えて、制御装置100は、蛍光検出器68を用いてこの温調制御プロトコルによる温調制御中の反応液の蛍光測定を周期的に行い、反応液における増幅対象となる塩基配列の定量を経時的に行う。
【0080】
制御装置100は、温調ブロック対応制御部102(102-1〜102-4)として、上述した温調ブロック対応制御処理を各温調ブロック66-1〜66-4間で独立に並行して行いながら、核酸増幅制御手段の温調ブロック全体制御部104として、図10,図11に示すような温調ブロック全体制御処理を行う。
【0081】
図10,図11は、本実施の形態の核酸検査装置で制御装置が温調ブロック全体制御部として行う温調ブロック全体制御処理の一実施例を示したフローチャートである。
【0082】
この温調ブロック全体制御処理では、制御装置100は、温調ブロック全体制御部104としての処理を開始するに当たって、まず記憶部に設けられている温調ブロック全体制御処理に係る各種作業エリアをイニシャライズする(S200)。この温調ブロック全体制御処理に係る各種作業エリアの中には、複数の温調ブロック66-1〜66-4それぞれに対応する各温調ブロック対応制御部102(102-1〜102-4)がそれぞれ独立に並行して行う温調制御や蛍光測定を指示するために用いられる温調ブロック全体制御テーブルのイニシャライズも含まれる。
【0083】
図12は、温調ブロック全体制御テーブルの一実施例の構成を模式的に示した図である。
【0084】
温調ブロック全体制御テーブルは、各温調ブロック66-1〜66-4別の温調ブロック個別制御テーブルを含む。各温調ブロック個別制御テーブルは、個別の温調ブロック66の測定配置ポジション67-1〜67-3にそれぞれ搭載する反応容器17の容器識別情報を示した測定配置ポジション情報と、その実行すべき温調制御、すなわち図6に示された所定の個別核酸増幅処理の核酸増幅処理情報における温調制御プロトコルとを記憶内容として含む。
【0085】
したがって、前述した各温調ブロック対応制御部102(102-1〜102-4)としての制御装置100は、この温調ブロック全体制御テーブルにおける自身の温調ブロック個別制御テーブルに核酸増幅処理情報としての温調制御プロトコルが提供されている場合には、自身の温調ブロック個別制御テーブルに記憶されている測定配置ポジション情報及び図8に示した待機バッファテーブルの記載情報を基に、待機バッファ90から指定された反応容器17をグリッパユニット26を用いて自身の指定された測定配置ポジション67に搭載する。
【0086】
そして、各温調ブロック対応制御部102(102-1〜102-4)としての制御装置100は、指定された反応容器17の測定配置ポジション67への搭載が完了したならば、温度センサ66cの出力を基にペルチェ素子66b等を制御しながら、核酸増幅処理情報として提供された温調制御プロトコルに従った温調制御を実行する。その際、搭載された反応容器17毎に蛍光検出器68,・・・を用いて測定された反応液の蛍光強度は、測定結果として、容器識別情報を基に、図6に示した該当する個別核酸処理と対応付けて記憶部に保存して、表示装置120に表示する。なお、この搭載された反応容器17毎の反応液の蛍光強度は、各蛍光検出器68からの励起光の検出結果を、温調ブロック66が設けられているフレーム65の回転を基にして、蛍光検出器68それぞれの励起光の検出結果がどの温調ブロック66の、どの測定配置ポジション67に搭載されている反応容器17のものであるかを判別することによって行われる。
【0087】
そして、温調ブロック対応制御部102(102-1〜102-4)としての制御装置100は、温調制御プロトコルによる温調制御の実行による、対応する温調ブロック66においての核酸増幅処理を終了したならば、新たな核酸増幅処理に備えて、温調制御による核酸増幅処理が終わった使用済み(検査済み)の反応容器17を、搬送機構20のグリッパユニット26を用いて測定配置ポジション67から廃棄ボックス80の投入口80aに搬送して廃棄する。その際には、該当する温調ブロック個別制御テーブルに記憶されているポジション情報や核酸増幅処理情報をクリアして、自身の温調ブロック個別制御テーブルを次の核酸増幅処理の実行に備えた待機状態にし、図6に示した該当する個別核酸処理については核酸検査処理が終了している旨を、反応液調製処理で既に対応付けられている容器識別情報を基にして記憶する。
【0088】
なお、図12では、温調ブロック個別制御テーブルにおいて、測定配置ポジション情報の測定配置ポジション67-3の容器識別情報が記憶されていないままで、核酸増幅処理情報の温度制御プロトコルに増幅処理Aが記憶されているのは、測定配置ポジション67-3には反応容器17を搭載しないまま、測定配置ポジション67-1,67-2に搭載する2つの反応容器17‘ZZXXXA’,‘ZZXXXB’に対し、増幅処理Aの温度制御プロトコルで温調ブロック66-1の温度調節を行うことを指す。
【0089】
温調ブロック全体制御部104としての制御装置100は、図10に示した温調ブロック全体制御処理において、図12に示した温調ブロック全体制御テーブルを含む各種作業エリアをイニシャライズすると(S200)、このイニシャライズにより、この温調ブロック全体制御テーブルの各温調ブロック個別制御テーブルの記憶内容もリセットする。この温調ブロック個別制御テーブルのリセットにより、複数の温調ブロック66-1〜66-4それぞれは、反応容器17が受け入れ可能な、核酸増幅処理の実行に備えた待機状態になる。
【0090】
そして、温調ブロック全体制御部104としての制御装置100は、図8に示した待機バッファテーブルを確認し、待機バッファ90の待機ポジション92それぞれの反応容器17の搭載状況を確認する(S202)。この確認により、温調ブロック全体制御部104としての制御装置100は、図8に示した待機バッファ90から、反応容器17が搭載されている待機ポジション92それぞれの位置や数と、反応容器17が搭載されていていない待機ポジション92それぞれの位置や数とを把握することができる。したがって、未だ待機バッファ90に反応容器17が搭載されていない図7に示した反応液調製処理におけるイニシャライズ当初は、図1に示した核酸検査装置1では、待機バッファ90の反応容器17が搭載されている待機ポジション92の数は‘0’になり、反応容器17が搭載されていていない待機ポジション92の数は‘12’になる。
【0091】
さらに、温調ブロック全体制御部104としての制御装置100は、同様にして、図12に示した温調ブロック全体制御テーブルを確認し、温調ブロック個別制御テーブルそれぞれの測定配置ポジション情報及び核酸増幅情報の記憶状況を確認する(S204)。この確認により、温調ブロック全体制御部104としての制御装置100は、温調ブロック個別制御テーブルに測定配置ポジション情報及び核酸増幅情報を記憶してあるか否かに基づいて、対応する温調ブロック66が稼動中であるか、待機中であるかを確認する。さらに、測定配置ポジション情報及び核酸増幅情報が記憶されている稼動中の温調ブロック個別制御テーブルについては、その測定配置ポジション情報から反応容器が搭載されている測定配置ポジションの位置や数を、その核酸増幅情報からは実行されている温調プロトコルを確認することができる。したがって、図1に示した核酸検査装置1の場合、未だ反応容器17が温調ブロック66-1〜66-4いずれにも搭載されていないイニシャライズ当初は、稼動中の温調ブロック66の数は‘0’になり、待機中の温調ブロック66の数は‘4’になる。
【0092】
その上で、温調ブロック全体制御部104としての制御装置100は、反応液調製制御手段としての制御装置100が行う反応液調製処理に係り、待機バッファ90にこれから搭載する予定の反応容器17の状況としてその数を確認する(S206)。この待機バッファ90にこれから搭載予定の反応容器17の数は、図7に示した反応液調製処理に係り、ステップS102の設定情報の読み込みにより得られる、図6に示した核酸検査の実行内容情報の読み込みによって得られる個別核酸検査処理の数から、核酸検査処理が既に終了している個別核酸検査処理の数と、ステップS202の確認処理の結果から得られる待機バッファに搭載されている反応容器17の数と、ステップS204の確認処理の結果から得られる稼動中の温調ブロック66の測定配置ポジション67に搭載されている温調制御中の反応容器17の数とを減算することにより、確認することができる。
【0093】
その上で、温調ブロック全体制御部104としての制御装置100は、待機バッファ90にこれから搭載予定の反応容器17の数が予め設定されている所定数以下で、核酸増幅処理すべき検体数が少ないか否かを判定し(S210)、待機バッファ90にこれから搭載予定の反応容器17の数が所定数よりも大きく、核酸増幅処理すべき検体数が少なくない場合は、図11に示したステップS220〜S233の処理を行い、待機バッファ90にこれから搭載予定の反応容器17の数が予め設定されている所定数以下で、核酸増幅処理すべき検体数が少ない場合には、図10に示したS240以下の処理を行う。
【0094】
このステップS210以下の処理では、一の温調ブロック66の複数の測定配置ポジション67-1〜67-4に、温調制御が同じ(すなわち、図6に示した核酸検査の実行内容情報の読み込みによって得られる個別核酸検査処理の中で、核酸増幅処理情報の温調制御プロトコルが同じ)である個別核酸検査処理の反応容器17をなるべく纏めて搭載してから、この一の温調ブロック66について、温調制御を開始する制御を行う。
【0095】
そのために、温調ブロック全体制御部104としての制御装置100は、次のような処理を行う。
1) 待機バッファ90の複数の待機ポジション92に、温調制御が同じである個別核酸検査処理の反応容器17が待機中の一の温調ブロック66の複数の測定配置ポジション67-1〜67-4数分ある場合は(図10及び図11で示した、S210「No」−S220「No」−S230「Yes」−S231「Yes」の場合、又は、S210「No」−S220「Yes」−S221「Yes」−S222「Yes」の場合)、これら複数の温調制御が同じである個別核酸検査処理の反応容器17それぞれを、グリッパユニット26を用いて待機バッファ90から一の温調ブロック66の複数の測定配置ポジション67-1〜67-4に搬送して搭載し、この同じ温度制御プロトコルに従ってこの温調ブロック66の温調制御を開始することを指示する(例えば、図11で示すS223又はS232)。その際、温調ブロック全体制御部104としての制御装置100は、図12に示した温調ブロック全体制御テーブルの、温調制御を開始させる待機中の温調ブロック66の温調ブロック個別制御テーブルに、測定位置ポジション情報として測定配置ポジション67-1〜67-4にそれぞれに搭載する反応容器17の識別情報を記憶し、かつ核酸増幅処理情報として同じと判別した図6に示した温調制御プロトコルの識別又は温調制御プロトコル自体を記憶することよって、この温調ブロック66の温調ブロック対応制御部102としての制御装置100に対して、これら温調制御が同じである、温調ブロック66の複数の測定配置ポジション67-1〜67-4数分の個別核酸検査処理の反応容器17について、この同じ温調制御プロトコルに従った温調制御を開始することを指示する。
【0096】
なお、この場合、複数の測定配置ポジション67-1〜67-4数分の温調制御が同じである個別核酸検査処理の反応容器17の中、最後に待機バッファ90の測定配置ポジション92に搭載されるはずの反応容器17については、攪拌ユニット50から待機バッファ90への搬送開始する時点で、待機バッファ90の待機ポジション92には実際に搭載されずとも、温調ブロック全体制御部104としての制御装置100が、複数の測定配置ポジション67-1〜67-4数分の温調制御が同じ個別核酸検査処理の反応容器17の存在について確認ができる。そこで、この確認によって最後に待機バッファ90の待機ポジション92に搭載されるはずの反応容器17については、待機バッファ90の待機ポジション92への実際の搭載を経ずとも、攪拌ユニット50から直接、温調ブロック66の測定配置ポジション67に移すようにすることも可能である。
【0097】
そして、温調ブロック全体制御部104としての制御装置100は、指示した容器識別情報の反応容器17が待機バッファ90から指示された温調ブロック66の測定配置ポジション67に移されると、図8に示した待機バッファテーブルの、この反応容器17が移された待機ポジション92に対応して記憶されている容器識別情報をクリアする(図11で示した、S225又はS233)。これにより、待機バッファ90は、その待機ポジション92は新たな反応容器17を搭載できる状態に更新される。
【0098】
2) 核酸増幅処理すべき検体数が少なくないものの、待機バッファ90の複数の待機ポジション92に、待機中の一の温調ブロック66の複数の測定配置ポジション67-1〜67-4数分の温調制御が同じである個別核酸検査処理の反応容器17が未だ搭載されていない場合は(図10及び図11で示した、S210「No」の場合)は、待機バッファ90の待機ポジション92に反応容器17が満杯であるか否かに応じて、温調ブロック全体制御部104としての制御装置100は、さらに次のような処理を行う。
【0099】
2-1) 待機バッファ90の待機ポジション92に反応容器17が満杯ではなく、未だ残りの待機ポジション92に新たな反応容器17を搭載できる状態にある場合は(例えば、図10及び図11で示した、S210「No」−S220「No」−S230「No」の場合)、温調制御が同じ個別核酸検査処理の反応容器17が複数あっても一の待機中の温調ブロック66の複数の測定配置ポジション67-1〜67-4数分には不足しているので、待機バッファ90が反応容器17で満杯になるまで(図10及び図11で示した、S210「No」−S220「Yes」の場合)、又は、待機バッファ90は未だ満杯にならずとも、温調制御が同じである個別核酸検査処理の反応容器17が待機中の一の温調ブロック66の複数の測定配置ポジション67-1〜67-4数分になるまで(図10及び図11で示した、S210「No」−S220「No」−S230「Yes」−S231「Yes」の場合になるまで)、この温調制御が同じ複数の個別核酸検査処理の反応容器17を、グリッパユニット26を用いて待機バッファ90から待機中の一の温調ブロック66の測定配置ポジション67に搬送搭載させないとともに、待機中の温調ブロック66の温調制御を開始させない(図10及び図11で示した、S210「No」−S220「No」−S230「No」の場合)。
【0100】
2-2) 待機バッファ90の待機ポジション92に反応容器17が満杯であり、一の待機中の温調ブロック66の複数の測定配置ポジション67-1〜67-4数分に対して、温調制御が同じ個別核酸検査処理の反応容器17の数が不足している場合は(図10及び図11で示した、S210「No」−S220「Yes」の場合)、温調ブロック全体制御部104としての制御装置100は、一の待機中の温調ブロック66の複数の測定配置ポジション67-1〜67-4数分に対して温調制御が同じ個別核酸検査処理の反応容器17の数が足らずとも、温調制御が同じ個別核酸検査処理の反応容器17がある場合は(図10及び図11で示した、S210「No」−S220「Yes」−S221「Yes」−S222「Yes」の場合)、複数の温調制御が同じ個別核酸検査処理の反応容器17を、グリッパユニット26を用いて待機バッファ90から待機中の一の温調ブロック66の複数の測定配置ポジション67-1〜67-4それぞれに搬送して搭載し、この同じ温度制御プロトコルに従ってこの温調ブロック66の温調制御を開始することを指示する(図11で示した、S223)。ただし、この場合は、一の待機中の温調ブロック66の複数の測定配置ポジション67-1〜67-4の中、少なくとも1つの測定配置ポジション67には反応容器17を搭載できないまま、この同じ温度制御プロトコルに従ってこの温調ブロック66の温調制御を開始することを指示することになる。そして、図8に示した待機バッファテーブルの更新が行われる(S225)。
【0101】
2-3)これに対して、待機バッファ90の待機ポジション92に反応容器17が満杯であっても、温調制御が同じ個別核酸検査処理の反応容器17がない場合は(例えば、図10及び図11で示す、S210「No」−S220「Yes」−S221「Yes」−S222「No」である場合)、調整温度やその調整時間、等の他の要素を基にした予め定めた手順で、一又は複数の個別核酸検査処理の反応容器17を、これに対応させた一又は複数の待機中の温調ブロック66の測定配置ポジション67-1〜67-4に搬送して搭載し、それぞれの温度制御プロトコルに従ってそれぞれの温調ブロック66の温調制御を開始することを指示する(図11で示した、S224)。そして、図8に示した待機バッファテーブルの更新が行われる(S225)。
【0102】
3) 一方、待機バッファ90にこれから搭載予定の反応容器17の数が予め設定されている所定数以下で、核酸増幅処理すべき検体数が少ない場合には、温調ブロック全体制御部104としての制御装置100は、次のような処理を行う。
【0103】
3-1) 待機バッファ90に搭載されている反応容器17がなく、待機バッファ90にこれから搭載予定の反応容器17もない場合は(例えば、図10で示す、S210「Yes」−S240「Yes」である場合)、図6に示した核酸検査の実行内容情報の読み込みによって得られる個別核酸検査処理全てについて核酸増幅処理が終了していると判断する。
【0104】
3-2) 一の待機中の温調ブロック66の複数の測定配置ポジション67-1〜67-4数分に対して、温調制御が同じ個別核酸検査処理の反応容器17の数が不足しているかいないかに係わらず、待機バッファ90に温調制御が同じ個別核酸検査処理の反応容器17が搭載されている場合は(図10で示した、S210「Yes」−S240「No」−S241「Yes」−S242「Yes」である場合)、複数の温調制御が同じ個別核酸検査処理の反応容器17を、グリッパユニット26を用いて待機バッファ90から待機中の一の温調ブロック66の複数の測定配置ポジション67-1〜67-4それぞれに搬送して搭載し、この同じ温度制御プロトコルに従ってこの温調ブロック66の温調制御を開始することを指示する(図10で示した、S243)。そして、図8に示した待機バッファテーブルの更新が行われる(S245)。
【0105】
3-3) 待機バッファ90に反応容器17が搭載されてはいるが、温調制御が同じ個別核酸検査処理の反応容器17がない場合は(図10で示した、S210「Yes」−S240「No」−S241「Yes」−S242「No」である場合)、待機バッファ90に搭載されている一又は複数の個別核酸検査処理の反応容器17を、これに対応させた一又は複数の待機中の温調ブロック66の測定配置ポジション67-1〜67-4に搬送して搭載し、それぞれの温度制御プロトコルに従ってそれぞれの温調ブロック66の温調制御を開始することを指示する(図10で示した、S243)。そして、図8に示した待機バッファテーブルの更新が行われる(S245)。
【0106】
このような構成からなる本実施の形態に係る核酸検査装置1は、次のように作用する。
まず、本実施の形態に係る核酸検査装置1によれば、その核酸増幅装置60は、一のカローセル64上に互いに独立に温調制御することができる複数の温調ブロック66を設け、各温調ブロック66の各測定配置ポジション67に搭載された各反応容器17が、このカローセル64の回転によって一又は複数の蛍光検出器68が配置された同一の円周上を移動する構成になっている。
【0107】
これにより、例えば、温度制御プロトコルが異なる複数の反応容器17に収容されている1つの所定の蛍光色素について、この複数の反応容器17それぞれにおける蛍光強度を測定するような場合であっても、その測定のための蛍光検出器17を、同じカローセル64の下で温調ブロック66の相違にかかわらず、共通にすることができるので、カローセル毎にインキュベータとしての機能を持たせてカローセル毎に蛍光検出器を配置した場合と比べて、同じ蛍光色素の測定結果であっても、カローセル64や蛍光検出器17自体の器差に基づく誤差要因を排除することができる。
【0108】
次に、本実施の形態に係る核酸検査装置1は、制御装置100が温調ブロック全体制御部として、図10及び図11で示した温調ブロック全体制御処理を行うので、次のように作用する。
【0109】
まず、核酸増幅処理すべき検体数が少ない場合、すなわち反応液を調製する反応容器17の数が所定数以下の場合は(図10で示した、S210「Yes」−S240「No」である場合)、攪拌処理を終えて待機バッファ90に搭載された反応容器17は、待機バッファ90に温調制御プロトコルが同一の反応容器17があるか否かを確認した上で(S242)、順番に待機中の温調ブロック66の測定配置ポジション67-1〜67-4に搬送に搬送される(S241〜S245)。
【0110】
これにより、待機バッファ90に搭載された反応容器17は、待機バッファ90に温調制御プロトコルが同一の反応容器17がなければ、逐次、待機中の温調ブロック66に分散させてその温調制御プロトコルによる温調制御を行うことで、反応容器17毎に攪拌処理を終えて待機バッファ90に搭載されたタイミングで、反応容器17の温度調節を開始することができ、待ち時間を少なくすることができる。これは、一の反応液の調製工程と核酸増幅処理工程の所要時間を比較すると、一般に核酸増幅処理工程の方が長時間必要となるが、核酸検査における反応容器の数が少ない場合は、待機バッファ90が満杯になるのを待たずに待機バッファ90に搭載されている反応容器17を、待機中の温調ブロック66に随時搭載して反応容器17の温度調節を開始しても全体の検査時間には大きな相違を生じず、一の反応容器17についてみれば、反応液の調製工程と核酸増幅処理工程の所要時間が短くなるケースも生じ得るようになるためである。なお、この核酸検査における核酸増幅処理すべき検体数が少ない場合は、反応液を調製する反応容器17の数が所定数よりも多い場合であっても、その進行により、核酸増幅処理が行われていない反応容器が所定数以下に減った場合にも適用可能である。
【0111】
これに対し、核酸増幅処理すべき検体数が少なくない場合、すなわち反応液を調製する反応容器17の数が所定数よりも多い場合は(図10で示した、S210「No」である場合)、待機バッファ90の複数の待機ポジション92に、温調制御が同じである個別核酸検査処理の反応容器17が、待機中の一の温調ブロック66の複数の測定配置ポジション67-1〜67-4数分だけ揃うのをできるだけ待って、温調制御プロトコルが同一の複数の反応容器を同じ温調ブロック66を用いて纏めて温度調節する(S210「No」〜S233)。
【0112】
これにより、一の温調ブロック66に備えられた、反応容器17を搭載するための測定配置ポジション67の数の範囲内で、温調制御プロトコルが同一さらには途中まで共通の温度調節が依頼された反応容器17について、使用する温調ブロック66及び温度調節を開始するタイミングを揃えることができ、核酸増幅装置60の温調ブロック66及び測定配置ポジション67の効率的な利用も可能になる。さらに、使用する温調ブロック66及び温度調節を開始するタイミングを揃えることで、できるだけ同一状況下で同じ温調制御プロトコルの反応容器17については核酸増幅処理を行えるので、温調ブロック66の器差や検査時の時間ずれ等に起因する誤差を極力抑制することも期待できる。核酸増幅装置60の温調ブロック66及び測定配置ポジション67の効率的な利用がはかれることから、全体の検査時間を短縮することも期待できる。
【0113】
なお、本実施の形態に係る核酸検査装置1では、反応液を調製する反応容器17の数が所定数よりも多い場合は(図10で示した、S210「No」である場合)、一の温調ブロック66の複数の測定配置ポジション67-1〜67-4数分だけ揃うまで待機バッファ90を反応容器17で満杯にするが(図10で示した、S210「No」−S220「No」−S230「No」である場合)、別途、攪拌ユニット50から待機バッファ90への反応容器17の搭載間隔を測定しておき、所定時間経過しても待機バッファ90に追加されない場合は、図10で示したステップS221〜S225の処理を実行し、待機バッファ90に現在搭載されている反応容器17の範囲で核酸増幅処理を進めておくことも可能である。また、緊急に検体の分析を終える必要がある場合等は、図10で示したステップS210以降の処理を行う代わりに、緊急の検体の分析に係る反応容器17を優先して待機中の温調ブロック66に搭載することも可能である。また、例えば図6に示した核酸検査の実行内容情報における個別核酸処理に基づいて等、予め1つだけしかない温調制御プロトコルに係る反応容器17が判っている場合は、待機バッファ90を経由せず、攪拌処理を終えた反応容器17を待機中の温調ブロック66の測定配置ポジション67に直接搬送し、この1つだけしかない温調制御プロトコルに基づく温度調節を開始することも可能である。
【0114】
核酸増幅技術においては、増幅対象の塩基配列によって用いる試薬や温度、時間等の条件(プロトコル)が異なる。また、増幅対象の塩基配列が異なる複数種類の検体を並行して処理する場合には、各種検体のプロトコルに規定される温度及びその時間を個々に設定する必要がある。そのため、従来技術においては、一度に対応できるプロトコルは1種類であり、プロトコルの異なる複数種類の検体を並行して処理する並列処理ができなった。また、同一プロトコルの検体であっても開始時間の異なる処理を行うことができないので、実行中の処理が終了するまでは別検体の処理を新たに開始することができなかった。
【0115】
このような従来の核酸検査装置に対し、上記説明した本実施の形態に係る核酸検査装置1によれば、次に述べるような特有な効果を奏する。
【0116】
反応液を収容した反応容器17を保持する複数の温調ブロック66を設けたカローセル64を備え、温調ブロック66のそれぞれに設けた温度調節装置(ペルチェ素子66b, 温調ブロック対応制御部102等が該当)によって反応液の温度を調整するように構成したので、プロトコルの異なる複数種類の検体を並列処理することがき、かつ、実行中の核酸検査処理があっても別検体の核酸検査処理を開始することができ、処理効率を大きく向上することができる。
【0117】
また、検体や試薬を混合する工程の処理能力と、核酸増幅工程での処理能力とが異なる場合に、待機バッファ90に反応容器17を適宜保持し、両工程の処理速度の差を調整することができ、反応液の劣化を防止しながら、核酸検査装置1として処理効率を高めることができる。
【0118】
また、温調ブロック66に複数の測定配置ポジション67を配置することで、カローセル64を簡潔な構造とし、個々の温度調節装置の機能調整を省力化しながらも、処理効率を高めることができる。同一の温調制御プロトコルを依頼された反応容器17に対して同一の温度調節を行うことができるため、温度調節や蛍光強度の測定のばらつきを低減することができる。
【0119】
また、温調ブロック66の数やその測定配置ポジション67の数、並びに待機バッファ90の待機ポジション92の数は、装置の使用形態により任意に決定することができるので汎用性があり、温調ブロック66は、形状や材質、温度調節装置の性能を分析項目に応じて最適化し、複数の種類を取混ぜて配置することができる。
【0120】
また、複数の温調ブロック66を設けたカローセル64自体を複数設置し、処理能力の向上や、分析可能な項目の拡大をはかることができる。また、分析を終了した反応容器17を、さらに別の温調ブロック66やカローセル64に運搬し、最適化された温度調節機能や光学検出器を用いて、別の分析を行うことができる。このとき、1度目の分析を終えた反応容器17を待機バッファ90に保持し、出力された結果から2度目以降の分析の要否を判断することもできる。
【0121】
また、検体容器13と試薬容器15とは、核酸検査装置1が分析を開始する時点に検体容器ラック12や試薬容器ラック14に搭載されているものに限定されず、新たに分析を依頼された検体容器13と、実行中の実行内容情報に新たに追加されたこの検体に係る個別検査処理に必要な試薬容器14とを補充しながら、核酸検査装置1を運用することもできる。
【0122】
また、待機バッファ90を複数配置し、各待機バッファ90での制御温度を変えることで、反応容器17を個別検査処理の検体それぞれに適した保存温度に制御された待機バッファ90に一時的に保持することで、データ精度を向上させることができる。
【0123】
また、検体と試薬を混合した反応液を用手法で調製し、反応容器17に収容生成したものを、別途設けた緊急検体ラック投入ポジション又は待機バッファ90にユーザーが直接架設した後に、搬送機構20が反応容器17を核酸増幅装置1に搬送し、核酸増幅処理を行うこともできる。これにより、緊急検体の検体数が少ない場合等、ユーザーはより簡便な方法を選択することができる。
【0124】
また、核酸増幅装置60を含む核酸検査装置1が稼動中であっても、ユーザーは検体容器ラック12と、試薬容器ラック14と、反応容器ラック16と、ノズルチップラック18とを交換することができるため、装置状態を初動状態に初期化することなく、新たに投入される検体の核酸増幅処理を継続して行うことができる。
【0125】
なお、本実施の形態による核酸検査装置1では、次に述べるような種々の変形例が考えられる。
【0126】
例えば、保持部材としてのカローセル64に複数の温調ブロック66を設けた構成については、矩形板状の保持具に、格子状に温調ブロック66を配置することもできる。この場合、蛍光検出器68は温調ブロック66の配置に沿って保持具上を移動させることで、搭載された反応容器17それぞれに収容されている反応液の蛍光検出が可能である。
【0127】
また、恒温増幅法で分析する場合は、1以上の温調ブロック66を一定温度に制御しておくことで、待機バッファ90を必ずしも経由することなく、反応容器17を順次核酸増幅装置1に投入してもよい。
【0128】
また、PCR法において、温度調節の開始から終了まで、常に同じ温度変化を周期的に繰り返す分析項目があれば、待機バッファ90を必ずしも経由することなく、反応容器17を周期的に温度変化する温調ブロック66に同期をとって搭載してもよい。
【0129】
また、本実施の形態では、検体と試薬を反応容器17に分注する処理と、閉栓処理及び攪拌処理とを終えた反応容器17を待機バッファ90に収容する場合について説明したが、個別検査処理で設定された指示により待機バッファ90に収容する反応容器17の状態を変化させることができる。例えば、分注を終えた反応容器17、又は、分注と閉栓処理を終えた反応容器17を、待機バッファ90に一旦搭載するようにしてもよい。
【0130】
次に、本発明の核酸検査装置に係り、他の実施の形態について図面を基に説明する。
【0131】
図13は、本発明の別の実施の形態に係る核酸検査装置の概略構成を示した平面図である。
【0132】
なお、図13においては、図1及び図2に示した実施の形態と同一構成部分については同一符号を付してその説明を省略するとともに、図2と同様に、核酸増幅装置60のカバー62については図示省略してある。
【0133】
本実施の形態では、カローセル64の周方向に沿って配置された各温調ブロック66-1〜66-5は、測定配置ポジション67-1〜67-3が同数ではなく、1〜4個の測定配置ポジション67を有し、測定配置ポジション67の数が異なる構成になっている。なお、各温調ブロック66-1〜66-5それぞれにはペルチェ素子(図3に記載)66bと温度センサ66cとが設けられ、互いに独立に温度調節できる点では前述した実施の形態と変わりない。各測定配置ポジション67の配置も、フレーム65の周方向に沿って、ブロック基材66内でも、隣り合う温調ブロック66間の隣り合う測定配置ポジション67間でも、均等になるように配置されている。これにより、蛍光測定タイミング毎のカローセル64の回転量は、測定対象の温調ブロック66-1〜66-5や測定配置ポジション67-1〜67-4の違いに拘らず一定となり、複数の蛍光検出器68を共用することができ、蛍光検出器68に対する位置決めも容易化がはかれるようになっている。
【0134】
その上で、このような構成からなる温調ブロック66-1〜66-5の中、例えば、温調ブロック66-5は緊急検体用温調ブロックとして使用され、図6に示した通常の実行内容情報による個別検査処理では、使用されないようになっている。
【0135】
そして、本実施の形態では、検査に用いられる検体,試薬,分注チップ,反応容器が配備される作業台2上のラック搭載部10の外方側の位置には、緊急な検査依頼に対応するための緊急検体ラック搭載部10aが設けられている。緊急検体ラック搭載部10aには、核酸検査装置1が分析を実施している最中に緊急検査が必要な検体が生じた場合に、この緊急検体が収容された検体容器132が収納された緊急検体ラック130が搭載される。そして、緊急検体ラック130が搭載され、入力装置120により緊急検体ラック130に収納されている検体容器132の緊急検査依頼が入力された場合には、反応液調製制御手段及び核酸増幅制御手段として両処理を並行して行う制御装置100は、さらに次に述べるような緊急検体処理を行う構成になっている。
【0136】
制御装置100は、この緊急検査依頼の入力により検体容器13に係る図6に示した実行内容情報とは別の緊急検査依頼に基づく一又は複数の緊急個別検査処理を含む緊急実行内容情報が提供されると、既に実行中の実行内容情報の個別検査処理について、例えば、反応液を反応容器17に調製する処理及び反応容器17を搬送する処理を実行中であるならばそれを完了させ、閉栓ユニット40で閉栓中や攪拌ユニット50で攪拌中の反応容器17についてはその処理を完了させる等して、実行中の実行内容情報に係る個別核酸処理をその途中で切りよく一旦中断させる。そして、制御装置100は、これらの反応容器17をグリッパユニット26を用いて待機バッファ90の空き待機ポジション92等の所定の退避先に運搬して待機させる。その際、待機させた反応容器17に収容されている反応液の意図しない反応開始や品質の劣化を防止するため、これら反応容器17の退避先においては、例えば、4℃に制御することが好ましい。そのため、4℃に保たなければ反応液の劣化の恐れがある反応容器17については、退避先として4℃に保たれている待機バッファ90に優先的に搬送して待機させる。
【0137】
この反応容器17の待機によって、反応調製ポジション70等には緊急検査の検体の反応液を調製するための各部の容器搭載ポジションが確保されることになる。そして、制御装置100は、この待機させた反応容器17の退避先のポジションについては、緊急検査依頼の対応後の中断した実行内容情報の個別検査処理の続行に備えて、その搬送時に記憶部に記憶しておく。
【0138】
この後、核酸検査装置100は、緊急検体ラック130に搭載されている検体の核酸検査処理を開始する。その際、制御装置100は、まず、反応容器ラック16から未使用の反応容器17を反応調製ポジション70に搬送して搭載し、緊急個別検査処理の反応液調製処理情報に基づいて、反応容器17に緊急検体ラック130に収納されている検体容器132の検体を分注するとともに、試薬容器ラック14に収納されている試薬容器15の試薬を分注して、反応液17を調製する。そして、制御装置100は、反応容器17を閉栓ユニット40に搬送して閉栓し、攪拌ユニット50に搬送して攪拌した後、攪拌ユニット50から、待機バッファ90を介さずに、緊急検体用温調ブロック66-5に直接搬送してその測定配置ポジション67に搭載し、緊急個別検査処理の核酸増幅処理情報に基づいて核酸増幅処理を行う。
【0139】
以上のように構成される本実施の形態に係る核酸検査装置1によれば、図6に示した通常の実行内容情報による個別検査処理を実施しながらも、その途中で、緊急検査依頼が生じた場合には、緊急検体の緊急核酸検査処理を行うことができる。
【0140】
なお、本実施の形態の核酸検査装置にあっては、緊急検体の核酸検査処理を開始するに当たって、既に処理中の反応容器17については、反応液調製処理、閉栓処理、攪拌処理といったその実行中の各処理を完了させた後に、これら処理中の反応容器17全てを待機バッファ90に搬送することは必ずしも必要ではない。反応液調製ポジション70や閉栓ユニット40や攪拌ユニット50でこの緊急検体の緊急核酸検査処理の実行に伴う新たな反応容器17が収容可能な状態になるように、必要な数だけ搬送すればよい。
【0141】
本実施の形態に係る核酸検査装置1によれば、緊急検査依頼が生じた場合であっても、既に実行中の核酸検査処理に及ぼす影響を最小限に抑えて、迅速に対応することができる。
【0142】
図14は、本発明のさらに別の実施の形態に係る核酸検査装置の概略構成を示した平面図である。
【0143】
なお、図14においては、図1及び図2に示した実施の形態と同一構成部分については同一符号を付してその説明を省略するとともに、図2と同様に、核酸増幅装置60のカバー62については図示省略してある。
【0144】
本実施の形態に係る核酸検査装置1は、核酸増幅装置60の温調ブロック66や測定配置ポジション67を効率的に使用するために、待機バッファ90を配置しない構成になっている。
【0145】
そのため、核酸検査装置1では、攪拌ユニット50から直接、反応容器17を核酸増幅装置60の温調ブロック66に搬送して搭載する構成を採用するため、反応液調製ポジション70には温度調節装置94が設けられている。これにより、反応液調製ポジション70は、容器搭載部72に搭載されている反応液を4℃に制御でき、検体及び試薬の分注によって反応容器17内に作製した反応液の品質の劣化を防ぐための温度調節が可能になっている。一の反応液の調製工程と核酸増幅処理工程の所要時間を比較すると、一般に核酸増幅処理工程の方が長時間必要となるが、この核酸検査装置1では、その時間調整を、一の反応容器17の反応液調製ポジション70における滞在時間を調整して行えるようになっている。図示の例では、そのため、反応液調製ポジション70における容器搭載部72の数は、待機バッファ90を配置しているものよりも多くなっている。
【0146】
核酸増幅装置1では、反応液調製制御手段としての制御装置100が、まず、反応容器ラック16からグリッパユニット26を用いて必要数の未使用反応容器17が反応液調製ポジション70に搬送する。反応液調製ポジション70上における各反応容器17の識別は、バーコードリーダ25で読み取り可能な、反応容器17それぞれに予め付されている識別情報と、各反応容器17が搭載された反応液調製ポジション70の容器搭載部72の位置情報との対応で、制御装置100が管理している。
【0147】
一方で、反応液調製制御手段としての制御装置100は、入力装置110により図6に示した実行内容情報による個別検査処理が提供されると、予めその個別検査処理それぞれの核酸増幅処理情報をソートして、その個別検査処理の実行順を同じ温度制御プロトコルを含む個別検査処理を連続して行うように並べ替える。この結果、反応液調製制御手段としての制御装置100は、検体及び試薬の分注を含む反応液の調製処理を、この並べ替えた個別検査処理の実行順に従って、その同一の温度制御プロトコルを含む個別検査処理を順に行う。
【0148】
そこで、本実施の形態に係る核酸検査装置1では、核酸増幅装置1の温調ブロック66は、測定配置ポジション67に搭載された温調制御開始待ちの反応容器17内の反応液の劣化を防止するため、温度制御プロトコルに基づく温度調節を実行していない待機状態では、4℃に保たれているようになっている。
【0149】
そして、反応液調製制御手段としての制御装置100が、反応液を調製した反応容器17を、反応液調製ポジション70から閉栓ユニット40に搬送して閉栓し、攪拌ユニット50に搬送して攪拌した後、核酸増幅制御手段としての制御装置100は、攪拌ユニット50から核酸増幅装置60の温調ブロック66に反応容器17を直接搬送して、その測定配置ポジション67に搭載する。
【0150】
この反応液調製ポジション70での反応容器17に対する反応液の調製は、同一の温調制御プロトコルで核酸増幅処理が行われる反応容器17を連続して調製するようになっている。そのため、反応液調製制御手段としての制御装置100が、同一の温調制御プロトコルを有する反応容器17それぞれについて調製し続けている間は、核酸増幅制御手段としての制御装置100は、この調製した同一の温調制御プロトコルを有する反応容器17を、核酸増幅装置60の温調ブロック66へ搬送し続けるようになる。その際、核酸増幅制御手段としての制御装置100は、待機中の一の温調ブロック66の測定配置ポジション67それぞれに対して反応容器17を順次搬送する。そして、待機中の一の温調ブロック66の測定配置ポジション67それぞれに同一の温調制御プロトコルを有する反応容器17を搭載し終えても、未だ搬送待ちの同一の温調制御プロトコルを有する反応容器17がある場合には、核酸増幅制御手段としての制御装置100は、別の待機中の一の温調ブロック66の測定配置ポジション67それぞれに対して反応容器17を順次搬送する。これとともに、核酸増幅制御手段としての制御装置100は、待機中の一の温調ブロック66の測定配置ポジション67それぞれに同一の温調制御プロトコルを有する反応容器17を搭載し終える毎、又は同一の温調制御プロトコルを有する反応容器17全てが一若しくは複数の温調ブロック66の測定配置ポジション67に搭載し終えたときに、対応する温調ブロック66についてこの同一の温調制御プロトコルに従った温調制御を開始させる。また、核酸増幅制御手段としての制御装置100は、それぞれの温調ブロック66で分析が終了したものから、分析結果を出力し、その測定配置ポジション67に搭載されている反応容器17を取り出して廃棄ボックス80の投入口80aに搬送して廃棄する。このようにして、反応液調製制御手段及び核酸増幅制御手段としての制御装置100は、上述した反応液調製処理及び核酸増幅制御処理を、同一の温度制御プロトコルを含む個別検査処理毎に順に行っていく。
【0151】
なお、反応液調製制御手段としての制御装置100は、同一の温調制御プロトコルを有する反応容器17の数、又はこの同一の温調制御プロトコルを有する反応容器17を搭載する温調ブロック66に備えられている測定配置ポジション67の数、等に合わせて、同一の温調制御プロトコルを有する個別検査処理に係る反応液を複数本ずつバッチ処理で作成することも可能である。また、核酸検査を行う同一の温度制御プロトコルを含む個別検査処理毎のグループの並び順も、入力装置110により設定された編集条件を基に、例えば、各グループに含まれる個別検査処理の数,各グループの温度制御プロトコル間の核酸増幅処理時間(加熱時間又は冷却時間)の長さ,温調ブロック66それぞれの測定配置ポジション67の数,等を基に適宜調整可能である。
【0152】
本実施の形態によれば、同一の温度制御プロトコルを含む個別検査処理については、反応液の調製が順次して行われるので、同一又は異なる分析項目を、効率的に核酸検査処理することができる。
【符号の説明】
【0153】
1 核酸検査装置、 2 作業台、 10 ラック搭載部、 12 検体容器ラック、
13 検体容器、 14 試薬容器ラック、 15 試薬容器、
16 反応容器ラック、 17 反応容器、 18 ノズルチップラック、
19 ノズルチップ、 20 搬送機構、 21 X軸方向ガイド、
22 X軸方向可動子、 23 Y軸方向ガイド、
24 作業ヘッド(Y軸方向可動子)、 25 バーコードリーダ、
26 グリッパユニット、 27 分注ユニット、 30 液体分注機構、
40 閉栓ユニット、 50 攪拌ユニット、 60 核酸増幅装置、
61 基台、 62 カバー、 63 ゲート、 64 カローセル、
65 フレーム、 65a 回転軸、 64b 取付凹部、 66 温調ブロック、
66-5 緊急検体用温調ブロック、 66a ブロック基材、
66b ペルチェ素子、 66c 温度センサ、 66d 配線ケーブル、
66e 回転検知センサ、 67 測定配置ポジション、 68 蛍光検出器、
69 ステッピングモータ、 70 反応液調製ポジション、 72 容器搭載部、
80 廃棄ボックス、 90 待機バッファ、 92 待機ポジション、
94 温度調節装置、 100 制御装置、 102 温調ブロック対応制御部、
104 温調ブロック全体制御部、 110 入力装置、 120 表示装置、
130 緊急検体ラック、 132 検体容器、
【特許請求の範囲】
【請求項1】
検体と試薬を混合した反応液の核酸を増幅させる核酸検査装置であって、
反応液を収容した反応容器が搭載される温調ブロックと、
該温調ブロックが互いの熱が干渉しないようにして複数設けられている保持具と、
該保持具に設けられた複数の前記温調ブロックそれぞれに対応して設けられ、当該対応する前記温調ブロックの温度調節を行う温度調節装置と、
該温度調節装置それぞれに、当該対応する前記温調ブロックに搭載された反応容器に収容されている反応液に対応させて予め設定されている温度調整方法に従って、当該対応する前記温調ブロックの温度調節を行わせる制御装置と
を備えていることを特徴とする核酸検査装置。
【請求項2】
前記保持具に設けられた複数の前記温調ブロックの中には、複数の反応容器を搭載可能な前記温調ブロックが含まれ、
前記制御装置は、当該複数の反応容器を搭載可能な前記温調ブロックに、反応液に対応させて予め設定されている温度調整方法が同一な複数の反応容器を搭載し、当該対応する温度調節装置に当該同一な温度調整方法に従った温度調節を行わせる
ことを特徴とする請求項1記載の核酸検査装置。
【請求項3】
前記温調ブロックに搭載する前の、反応液を収容した反応容器が一時的に複数保持される待機バッファが備えられている
ことを特徴とする請求項2記載の核酸検査装置。
【請求項4】
前記待機バッファには、一時的に保持されている反応容器の温度を所定温度に保ち、当該反応容器に収容されている反応液の劣化を防止する温度保持装置が設けられている
ことを特徴とする請求項3記載の核酸検査装置。
【請求項5】
前記温度保持装置によって保持される所定温度は4℃である
ことを特徴とする請求項4記載の核酸検査装置。
【請求項6】
反応液を収容した反応容器は、未使用の反応容器に予め設定された検体及び試薬を分注して反応液を調製する反応液調製装置から供給される
ことを特徴とする請求項1乃至5いずれかに記載の核酸検査装置。
【請求項7】
反応容器が未搭載の温調ブロックは、所定温度に保持されている
ことを特徴とする請求項1又は2記載の核酸検査装置。
【請求項8】
前記温度調整方法が、一の所定温度の所定時間保持とその後の他の所定温度の所定時間保持である
ことを特徴とする請求項1又は2記載の核酸検査装置。
【請求項9】
前記温度調整方法が、互いに異なる複数の所定温度の周期的な繰り返しである
ことを特徴とする請求項1又は2記載の核酸検査装置。
【請求項10】
前記保持具に設けられた複数の前記温調ブロックの中、少なくとも一の前記温調ブロックは、分析を優先して行う必要のある緊急検体が分注された反応容器の搭載用に割り当てられている
ことを特徴とする請求項6記載の核酸検査装置。
【請求項11】
反応容器に分注するための緊急検体を収容した検体容器を搭載するための投入位置を備えた
ことを特徴とする請求項10記載の核酸検査装置。
【請求項12】
前記投入位置に緊急検体を収容した検体容器が投入された場合は、反応液調製処理途中である反応液の生成処理を中断し、前記温調ブロックに搭載する前の、反応液を収容した反応容器が一時的に複数保持される待機バッファに搬送した後に、前記反応液調製装置による緊急検体の反応液調製処理を開始する
ことを特徴とする請求項11記載の核酸検査装置。
【請求項13】
温度調節装置がそれぞれ設けられ、互いの熱が干渉しないように複数設けられている温調ブロックそれぞれに、検体と試薬とを混合して反応液を調製する反応液調製装置から、反応液を収容した反応容器を搭載する容器搬送方法であって、
温度調節方法が同一である反応液の反応容器を同一の温調ブロックに順次投入する
ことを特徴とする容器搬送方法。
【請求項14】
前記温度調節装置は、温度調節方法が同一である反応液の反応容器が順次投入される間、前記温調ブロックを所定温度に保持している
ことを特徴とする請求項13記載の容器搬送方法。
【請求項15】
前記反応液調製装置により調製された反応液を収容した反応容器を待機バッファに一時的に複数保持し、当該待機バッファから温度調節方法が同一である反応液の反応容器を同一の温調ブロックに順次投入する
ことを特徴とする請求項13記載の容器搬送方法。
【請求項1】
検体と試薬を混合した反応液の核酸を増幅させる核酸検査装置であって、
反応液を収容した反応容器が搭載される温調ブロックと、
該温調ブロックが互いの熱が干渉しないようにして複数設けられている保持具と、
該保持具に設けられた複数の前記温調ブロックそれぞれに対応して設けられ、当該対応する前記温調ブロックの温度調節を行う温度調節装置と、
該温度調節装置それぞれに、当該対応する前記温調ブロックに搭載された反応容器に収容されている反応液に対応させて予め設定されている温度調整方法に従って、当該対応する前記温調ブロックの温度調節を行わせる制御装置と
を備えていることを特徴とする核酸検査装置。
【請求項2】
前記保持具に設けられた複数の前記温調ブロックの中には、複数の反応容器を搭載可能な前記温調ブロックが含まれ、
前記制御装置は、当該複数の反応容器を搭載可能な前記温調ブロックに、反応液に対応させて予め設定されている温度調整方法が同一な複数の反応容器を搭載し、当該対応する温度調節装置に当該同一な温度調整方法に従った温度調節を行わせる
ことを特徴とする請求項1記載の核酸検査装置。
【請求項3】
前記温調ブロックに搭載する前の、反応液を収容した反応容器が一時的に複数保持される待機バッファが備えられている
ことを特徴とする請求項2記載の核酸検査装置。
【請求項4】
前記待機バッファには、一時的に保持されている反応容器の温度を所定温度に保ち、当該反応容器に収容されている反応液の劣化を防止する温度保持装置が設けられている
ことを特徴とする請求項3記載の核酸検査装置。
【請求項5】
前記温度保持装置によって保持される所定温度は4℃である
ことを特徴とする請求項4記載の核酸検査装置。
【請求項6】
反応液を収容した反応容器は、未使用の反応容器に予め設定された検体及び試薬を分注して反応液を調製する反応液調製装置から供給される
ことを特徴とする請求項1乃至5いずれかに記載の核酸検査装置。
【請求項7】
反応容器が未搭載の温調ブロックは、所定温度に保持されている
ことを特徴とする請求項1又は2記載の核酸検査装置。
【請求項8】
前記温度調整方法が、一の所定温度の所定時間保持とその後の他の所定温度の所定時間保持である
ことを特徴とする請求項1又は2記載の核酸検査装置。
【請求項9】
前記温度調整方法が、互いに異なる複数の所定温度の周期的な繰り返しである
ことを特徴とする請求項1又は2記載の核酸検査装置。
【請求項10】
前記保持具に設けられた複数の前記温調ブロックの中、少なくとも一の前記温調ブロックは、分析を優先して行う必要のある緊急検体が分注された反応容器の搭載用に割り当てられている
ことを特徴とする請求項6記載の核酸検査装置。
【請求項11】
反応容器に分注するための緊急検体を収容した検体容器を搭載するための投入位置を備えた
ことを特徴とする請求項10記載の核酸検査装置。
【請求項12】
前記投入位置に緊急検体を収容した検体容器が投入された場合は、反応液調製処理途中である反応液の生成処理を中断し、前記温調ブロックに搭載する前の、反応液を収容した反応容器が一時的に複数保持される待機バッファに搬送した後に、前記反応液調製装置による緊急検体の反応液調製処理を開始する
ことを特徴とする請求項11記載の核酸検査装置。
【請求項13】
温度調節装置がそれぞれ設けられ、互いの熱が干渉しないように複数設けられている温調ブロックそれぞれに、検体と試薬とを混合して反応液を調製する反応液調製装置から、反応液を収容した反応容器を搭載する容器搬送方法であって、
温度調節方法が同一である反応液の反応容器を同一の温調ブロックに順次投入する
ことを特徴とする容器搬送方法。
【請求項14】
前記温度調節装置は、温度調節方法が同一である反応液の反応容器が順次投入される間、前記温調ブロックを所定温度に保持している
ことを特徴とする請求項13記載の容器搬送方法。
【請求項15】
前記反応液調製装置により調製された反応液を収容した反応容器を待機バッファに一時的に複数保持し、当該待機バッファから温度調節方法が同一である反応液の反応容器を同一の温調ブロックに順次投入する
ことを特徴とする請求項13記載の容器搬送方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【公開番号】特開2012−75413(P2012−75413A)
【公開日】平成24年4月19日(2012.4.19)
【国際特許分類】
【出願番号】特願2010−225762(P2010−225762)
【出願日】平成22年10月5日(2010.10.5)
【出願人】(501387839)株式会社日立ハイテクノロジーズ (4,325)
【Fターム(参考)】
【公開日】平成24年4月19日(2012.4.19)
【国際特許分類】
【出願日】平成22年10月5日(2010.10.5)
【出願人】(501387839)株式会社日立ハイテクノロジーズ (4,325)
【Fターム(参考)】
[ Back to top ]

