核酸等温増幅反応用マイクロチップ及びその製造方法並びに核酸等温増幅方法
【課題】等温増幅方法において、反応時間を正確に制御するための技術の提供。
【解決手段】核酸の等温増幅反応の反応場となる反応領域内に、反応に必要な物質の少なくとも一部が、常温より高く前記反応の反応温度より低い温度で融解する薄膜により被覆された状態で存在する核酸等温増幅反応用マイクロチップを提供する。この核酸等温増幅反応用マイクロチップでは、予め反応領域内に収容された物質を被覆する薄膜を、残りの物質と標的核酸鎖を含むサンプル溶液を反応領域内に供給した後に加熱融解させることによって、任意のタイミングで反応を開始できる。
【解決手段】核酸の等温増幅反応の反応場となる反応領域内に、反応に必要な物質の少なくとも一部が、常温より高く前記反応の反応温度より低い温度で融解する薄膜により被覆された状態で存在する核酸等温増幅反応用マイクロチップを提供する。この核酸等温増幅反応用マイクロチップでは、予め反応領域内に収容された物質を被覆する薄膜を、残りの物質と標的核酸鎖を含むサンプル溶液を反応領域内に供給した後に加熱融解させることによって、任意のタイミングで反応を開始できる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、核酸等温増幅反応用マイクロチップ及びその製造方法並びに核酸等温増幅方法に関する。より詳しくは、核酸増幅反応の反応時間を正確に制御するための核酸等温増幅反応用マイクロチップ等に関する。
【背景技術】
【0002】
従来、核酸増幅方法として、PCR(Polymerase Chain Reaction)法が用いられてきている。PCR法は、(1)熱変性、(2)アニーリング、(3)伸長反応の3つのステップからなる温度サイクルを繰り返すことによって、鋳型となる核酸鎖の増幅を行うものである。
【0003】
ステップ(1)の熱変性は、鋳型核酸鎖を二本鎖から一本鎖に解離させるためのステップである。熱変性時の反応温度は、通常94℃前後とされる。ステップ(2)のアニーリングは、一本鎖に解離した鋳型核酸鎖にオリゴヌクレオチドプライマーを結合させるためのステップである。アニーリング時の反応温度は、通常50〜60℃程度とされる。ステップ(3)の伸長反応は、DNAポリメラーゼによって、オリゴヌクレオチドプライマーが結合した部分を起点として一本鎖部分と相補的なDNAを合成するステップである。伸長反応時の反応温度は、通常72℃前後とされる。
【0004】
近年、核酸増幅方法として、温度サイクルの繰り返しを要せず、より簡便な等温増幅と呼ばれる方法が用いられるようになっている。例えば、LAMP(Loop−Mediated Isothermal Amplification)法では、オリゴヌクレオチドプライマー、鎖置換型DNA合成酵素、核酸モノマー等の試薬と鋳型核酸鎖を混合し、一定温度(65℃付近)で保温することによって反応が進行する。このため、LAMP法によれば、1ステップで核酸の増幅を行うことできる。
【0005】
本発明に関連して、近年、マイクロチップのウェル内で核酸増幅反応を進行させ、増幅核酸鎖を光学的に検出あるいは定量する核酸増幅装置(例えば、リアルタイムPCR装置)が開発されている。
【0006】
特許文献1には、流路内に、核酸増幅反応に必要なオリゴヌクレオチドプライマー、基質、酵素及びその他の試薬が固体状態で入れられたマイクロ流体チップが開示されている。このマイクロ流体チップは、反応に必要な残りの試薬を液体状態で流路に送液することで、液体状態の試薬と固体状態の試薬が接触し、固体状態の試薬が溶解することにより反応が開始されるものである。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】特開2007−43998号公報
【発明の概要】
【発明が解決しようとする課題】
【0008】
PCR法では、反応時間を厳密に制御するため、ホットスタート法と称される方法が採用されている。ホットスタート法は、オリゴヌクレオチドプライマーのミスアニーリングに起因する非特異的増幅反応を回避し、目的の増幅産物を得るための方法である。ホットスタート法は、DNAポリメラーゼ以外の試薬及び標的核酸鎖の混合液を、一旦、オリゴヌクレオチドプライマーの変性温度まで加温し、変性温度下で初めて酵素を添加後、温度サイクルを実施することで達成される。
【0009】
一方、等温増幅方法では、一定温度の1ステップで反応を行なうために、ホットスタート法を採用できず、試薬と鋳型核酸鎖を混合した時点で反応が緩徐に進行してしまうため、反応時間を厳密に制御することが難しい。
【0010】
従来、マイクロチップ型の核酸増幅装置では、試薬と鋳型核酸鎖を予め混合し、この混合液をマイクロチップのウェル内に導入して反応を行なう方法が採られている。そのため、混合液を調製する間、あるいは混合液をウェル内に導入する間に、混合液内で反応が進行してしまう場合があり、反応時間を厳密に制御できず、増幅核酸鎖の定量性に問題が生じていた。
【0011】
そこで、本発明は、等温増幅方法において、反応時間を正確に制御するための技術を提供することを主な目的とする。
【課題を解決するための手段】
【0012】
上記課題解決のため、本発明は、核酸の等温増幅反応の反応場となる反応領域内に、反応に必要な物質の少なくとも一部が、常温より高く前記反応の反応温度より低い温度で融解する薄膜により被覆された状態で存在する核酸等温増幅反応用マイクロチップを提供する。
この核酸増幅反応用マイクロチップでは、反応に必要な物質の少なくとも一部を被覆する前記薄膜上に、反応に必要な他の物質の少なくとも一部が固着されて存在することが好適となる。
この核酸等温増幅反応用マイクロチップにおいて、前記反応領域内に存在する物質は、オリゴヌクレオチドプライマー及び酵素、核酸モノマーから選択される一以上とすることができる。
この核酸等温増幅反応用マイクロチップでは、予め反応領域内に収容された物質を被覆する薄膜を、残りの物質と標的核酸鎖を含むサンプル溶液を反応領域内に供給した後に加熱融解させることによって、任意のタイミングで反応を開始できる。
また、核酸等温増幅反応用マイクロチップでは、酵素を被覆する前記薄膜上に、オリゴヌクレオチドプライマーが固着されて存在することが好適となる。
この核酸等温増幅反応用マイクロチップにおいて、前記薄膜は、ステアリン酸又はパラフィンワックスの材料の蒸着によって形成することが好適となる。
また、この核酸等温増幅反応用マイクロチップは、外部から液体が導入される導入口と、複数の前記反応領域と、導入口から導入される液体を各反応領域内に供給する流路と、が配設されることが好適となる。
【0013】
本発明は、また、核酸の等温増幅反応の反応場となる反応領域内に収容された、反応に必要な物質の少なくとも一部を、常温より高く前記反応の反応温度より低い温度で融解する薄膜により被覆する工程を含む核酸等温増幅反応用マイクロチップの製造方法を提供する。
【0014】
本発明は、さらに、核酸の等温増幅反応に必要な物質の少なくとも一部が、常温より高く前記反応の反応温度より低い温度で融解する薄膜により被覆されて存在する反応領域内に、反応に必要な残りの物質を導入し、反応温度まで昇温する手順を含む核酸等温増幅方法をも提供する。
【0015】
本発明において、「核酸等温増幅反応」には、温度サイクルを伴わない各種増幅反応が含まれる。等温増幅反応としては、例えば、LAMP(Loop−Mediated Isothermal Amplification)法やSMAP(SMartAmplification Process)法、NASBA(Nucleic Acid Sequence−Based Amplification)法、ICAN(Isothermal and Chimeric primer−initiated Amplification of Nucleic acids)法(登録商標)、TRC(transcription−reverse transcription concerted)法、SDA(strand displacement amplification)法、TMA(transcription−mediated amplification)法、RCA(rolling circle amplification)法等が挙げられる。この他、「核酸増幅反応」には、核酸の増幅を目的とする等温による核酸増幅反応が広く包含されるものとする。また、これらの核酸増幅反応には、リアルタイム(RT)−LAMP法などの核酸鎖の増幅とともに増幅された核酸鎖の定量を伴う反応も包含される。
【0016】
また、「反応に必要な物質」には、核酸等温増幅反応において増幅核酸鎖を得るために必要な物質であって、具体的には、標的核酸鎖に相補的な塩基配列とされたオリゴヌクレオチドプライマー、核酸モノマー(dNTP)、酵素、反応緩衝液(バッファー)溶質などが含まれる。
【発明の効果】
【0017】
本発明により、等温増幅方法において、反応時間を正確に制御するための技術が提供される。
【図面の簡単な説明】
【0018】
【図1】本発明に係る核酸増幅反応用マイクロチップの上面模式図である。
【図2】マイクロチップの断面模式図(図1、P−P断面)である。
【図3】マイクロチップのウェル内に存在する反応に必要な物質を説明するための模式図である。
【図4】本発明に係る核酸増幅反応用マイクロチップの製造方法を説明するためのフローチャートである。
【図5】変形例に係るマイクロチップのウェル内に存在する反応に必要な物質を説明するための模式図である。
【図6】変形例に係る核酸増幅反応用マイクロチップの製造方法を説明するためのフローチャートである。
【図7】プライマーをステアリン酸あるいはパラフィンワックスで被覆して固着した反応系でのLAMP反応の結果を示す図である(実施例2)。
【図8】酵素をステアリン酸あるいはパラフィンワックスで被覆して固着した反応系でのLAMP反応の結果を示す図である(実施例2)。
【発明を実施するための形態】
【0019】
以下、本発明を実施するための好適な形態について図面を参照しながら説明する。なお、以下に説明する実施形態は、本発明の代表的な実施形態の一例を示したものであり、これにより本発明の範囲が狭く解釈されることはない。なお、説明は以下の順序により行う。
1.核酸増幅反応用マイクロチップと核酸等温増幅方法
2.核酸増幅反応用マイクロチップの製造方法
(2−1)基板層a1の成形
(2−2)ウェルへの物質の収容
(2−3)薄膜による被覆
(2−4)基板層a1,a2の表面活性化と貼り合せ
3.本実施形態の変形例に係る核酸増幅反応用マイクロチップ及びその製造方法
【0020】
1.核酸等温増幅反応用マイクロチップと核酸等温増幅方法
[核酸等温増幅反応用マイクロチップ]
本発明に係る核酸等温増幅反応用マイクロチップ(以下、単に「マイクロチップ」とも称する)の上面模式図を図1に、断面模式図を図2に示す。図2は、図1中P−P断面に対応する。
【0021】
符号Aで示すマイクロチップには、外部から液体(サンプル溶液)が導入される導入口1と、核酸増幅反応の反応場となる複数のウェル(反応領域)と、一端において導入口1に連通する主流路2と、この主流路2から分岐する分岐流路3が配設されている。主流路2の他端は、サンプル溶液を外部に排出する排出口5として構成されており、分岐流路3は、主流路2の導入口1への連通部と排出口5への連通部との間において主流路2から分岐し、各ウェルに接続されている。サンプル液には、核酸増幅反応において鋳型核酸鎖となるDNAやゲノムRNA、mRNAなどが含まれ得る。
【0022】
ここでは、マイクロチップAに縦横3例で合計9つのウェルを均等間隔で配設する場合を例として、これら9つのウェルを3区分し、図1上段の3つのウェルを符号41で、中段の3つのウェルを符号42で、下段の3つのウェルを符号43で示す。導入口1から導入されたサンプル溶液は、主流路2を排出口5に向かって送液され、送液方向上流に配設された分岐流路3及びウェルから順に内部に供給される。なお、マイクロチップAにおいて、排出口5は必須の構成とはならないものとする。すなわち、マイクロチップAは、導入口1から導入されたサンプル溶液が外部に排出されない構成でもよい。
【0023】
マイクロチップAは、導入口1、主流路2、分岐流路3、ウェル41,42,43及び排出口5を形成した基板層a1に基板層a2を貼り合わせて構成されている。基板層a1,a2の材質は、ガラスや各種プラスチック(ポリプロピレン、ポリカーボネート、シクロオレフィンポリマー、ポリジメチルシロキサン)とすることができる。ウェル41,42,43内で増幅された核酸鎖の検出あるいは定量を光学的に行う場合には、基板層a1,a2の材質は、光透過性を有し、自家蛍光が少なく、波長分散が小さいために光学誤差の少ない材料を選択することが好ましい。
【0024】
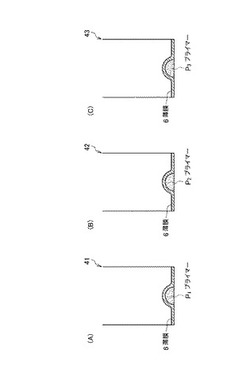
ウェル41,42,43内には、反応に必要な物質の少なくとも一部が、加熱融解性を有する薄膜6により被覆された状態で存在している。図3に、各ウェル内に収容された物質を示す。図3(A)はウェル41、(B)はウェル42、(C)はウェル43内に収容された物質を示している。
【0025】
ウェル内に存在する物質は、核酸等温増幅反応において増幅核酸鎖を得るために必要な物質であって、具体的には、標的核酸鎖に相補的な塩基配列とされたオリゴヌクレオチドプライマー、核酸モノマー(dNTP)、酵素、反応緩衝液(バッファー)溶質などとされる。ウェル内に存在する物質は、これらのうち1あるいは2以上とできる。また、ウェル内には、増幅核酸鎖を得るために必須ではないが、蛍光試薬(蛍光色素)やリン光試薬(リン光色素)などの増幅核酸鎖の検出及び定量のために必要な試薬を、必要に応じて収容しておくこともできる。
【0026】
ここでは、ウェル41,42,43内にオリゴヌクレオチドプライマー(以下、単に「プライマー」とも称する」)P1,P2,P3を収容する場合を図示している。
【0027】
プライマーP1,P2,P3は、同一の塩基配列を有するプライマーであってもよいが、マイクロチップAにおいて複数の標的核酸鎖の増幅を行う場合には、異なる塩基配列を有するプライマーとされる。例えば、マイクロチップAを用いて遺伝子型の判定を行う場合には、各遺伝子型の塩基配列に応じて異なる塩基配列を有するプライマーを、それぞれウェル41,42,43内に収容しておく。また、マイクロチップAを用いて感染病原体の判定を行う場合には、各ウイルスや微生物の遺伝子配列に応じて異なる塩基配列を有するプライマーを同様に収容する。
【0028】
プライマーP1,P2,P3は、常温より高く、かつ核酸等温増幅反応の反応温度よりも低い温度で加熱融解する薄膜6により被覆されて各ウェル内に存在している。
【0029】
薄膜6は、融解温度未満(室温を含む)では、流動性を失って固形状態となり、融解温度以上では、融解あるいは流動化して液状あるいはゲル状となる材料によって形成される。薄膜6により被覆されたプライマーP1,P2,P3は、融解温度未満では固形状態の薄膜6内に外部から隔絶されて存在し、融解温度以上では流動化して崩壊した薄膜6から放出されて外部と接触可能な状態とされる。
【0030】
核酸等温増幅反応の反応温度は、通常50〜75℃であり、薄膜6の融解温度あるいは流動化温度は、常温(室温)である25℃前後よりも高く、反応温度である50〜75℃よりも低く設定される。薄膜6の融解温度等をこの範囲に設計することで、プライマーP1,P2,P3を、融解温度未満において確実に外部から隔絶するとともに、融解温度以上において迅速に放出させることができる。
【0031】
融解温度未満におけるプライマーP1,P2,P3の外部からの隔絶を確実にするため、薄膜6は撥水性を有することが好ましい。薄膜6に撥水性を付与することで、ウェル内に導入されたサンプル溶液によって融解温度未満で薄膜6が溶解することを防止できる。
【0032】
薄膜6の材料は、上記の融解温度等と、好ましくは撥水性とを具備する材料であれば特に限定されない。薄膜6の材料としては、ステアリン酸、パラミチン酸、又はミリスチン酸などの脂肪酸、ヘベニルアルコール、アガロース、パラフィンワックス、マイクロクリスタリンワックス、ゼラチンなどが挙げられる。
各材料の融点は、ステアリン酸69℃、パラミチン酸63℃、ミリスチン酸54℃、ヘベニルアルコール65〜73℃、アガロース65℃、パラフィンワックス40〜70℃、マイクロクリスタリンワックス60〜90℃、ゼラチン40〜50℃である。
【0033】
また、薄膜6の天然材料として以下が挙げられる。ヤシ科植物の葉の分泌物から得られ、ヒドロキシ酸エステルを多く(30-35%)含むカルナバワックス。北アフリカ南部の乾燥地帯に植生する植物から得られ、炭化水素比率が高い(40-50%)キャンデリラワックス。ハゼの実から得られ、グリセライドを主成分とする木蝋。この他の植物性硬化油脂。
各材料の融点は、カルナバワックス80〜86℃、キャンデリラワックス66〜71℃、木蝋50〜56℃であり、植物性硬化油脂には融点が48〜70℃のものが多くある。
【0034】
さらに、薄膜6の材料として以下の化合物も上記の融解温度等を具備する。Nb(NtC5H11)[N(CH3)2]3(融点47℃)、シクロペンタジエニル(tCp)錯体であるトリ(エチルシクロペンタジエニル)プラセオジム(Pr(EtCp)3)(70〜73℃)、TaNバリヤ膜形成用材料として用いられるTa(NtC5H11)[N(CH3)2]3(36℃)、スチレン系樹脂であるトリエチレングリコール-ビス[3−(3−t−ブチル−5−メチル−4−ヒドロキシフェニル)プロピオネート(76〜79℃)、酸化防止剤として用いられる2, 2−チオ-ジエチレンビス[3−(3,5−ジ−t−ブチル−4−ヒドロキシフェニル)プロピオネート(63℃以上)やオクタデシル−3−(3,5−ジ−t−ブチル−4−ヒドロキシフェニル)プロピオネート(50〜53℃)、重曹(70℃)、イオン液体である1−エチルー3−メチルイミダゾリウムバイフルオライド(51℃)。
【0035】
薄膜6の材料は、サンプル液中に融解、混合して、核酸増幅反応を阻害しないような材料を選択すること望ましい。実施例で後述するように、例えば、ステアリン酸やパラフィンワックスは反応阻害性がない。あるいは、薄膜6の膜厚を、サンプル液中に融解、混合した際の反応阻害を無視し得るような薄さとすることが望ましい。薄膜6の膜厚は、例えば1000nm(体積1nl)以下とすることで、薄膜6が融解した際のサンプル液中における材料の濃度を0.1%程度に抑え、反応阻害を生じないようにできる。薄膜6の膜厚は、上記材料の蒸着によって形成することで、1000nmから10nm程度までの範囲の任意の厚さとできる。
【0036】
[核酸等温増幅方法]
次に、マイクロチップAを用いた核酸等温増幅方法について説明する。
【0037】
まず、薄膜6により被覆された状態で予め各ウェル内に収容されたプライマー以外の反応に必要な物質(酵素、dNTP、バッファー溶質など)と標的核酸鎖とを含むサンプル溶液を導入口1から各ウェル内に供給する。このとき、サンプル溶液は常温に維持されており、薄膜6により被覆されたプライマーはサンプル溶液から隔絶された状態とされている。そのため、プライマーとサンプル溶液が混合して反応が進行することはない。
【0038】
各ウェル内にサンプル液を供給した後、サンプル溶液を反応温度まで昇温する。これにより、薄膜6が流動化して崩壊し、プライマーが放出されてサンプル溶液と混合し、反応が開始される。
【0039】
このように、マイクロチップAでは、サンプル溶液を各ウェル内に供給した後、反応温度まで昇温することによって初めて反応が開始される。そのため、マイクロチップAでは、反応時間を厳密に制御することが可能である。
【0040】
ここでは、反応に必要な物質としてプライマーを薄膜6により被覆された状態で予めウェル内に収容しておく場合を例に説明したが、ウェル内に収容する物質は、酵素、dNTPあるいはバッファー溶質であってもよい。また、ウェル内には、プライマーと酵素、プライマーとdNTP、プライマーと酵素とdNTPというように2以上を組み合わせて収容してもよい。
【0041】
本発明に係るマイクロチップでは、反応に必要な物質を加熱融解性を有する薄膜により被覆された状態で予めウェル内に収容し、残りの物質と標的核酸鎖を含むサンプル溶液をウェル内に供給した後、反応温度まで昇温することにより、任意のタイミングで反応を開始できる。従って、このマイクロチップによれば、反応時間を厳密に制御でき、増幅核酸鎖の定量を高精度に行うことができる。
【0042】
なお、本発明に係るマイクロチップにおいて、ウェルの数や配設位置は任意とでき、ウェルの形状も図に示した円柱形状に限定されない。また、導入口1に導入されたサンプル溶液を各ウェル内に供給するための流路の構成も、図に示した主流路2及び分岐流路3の態様に限定されない。さらに、ここでは、導入口1等を基板層a1に形成する場合を説明したが、導入口1等は基板層a1及び基板層a2の両方に一部ずつ形成されていてもよい。マイクロチップを構成する基板層も2以上であってよい。
【0043】
2.核酸増幅反応用マイクロチップの製造方法
続いて、図4に示すフローチャートを参照して、本発明に係るマイクロチップの製造方法を説明する。以下、上述のマイクロチップAを例に説明する。
【0044】
(2−1)基板層a1の成形
図4中、符号S1は、基板層a1の成形工程である。本工程では、基板層a1に、導入口1、主流路2、分岐流路3、ウェル41,42,43及び排出口5を成形する。基板層a1への導入口1等の成形は、例えば、ガラス製基板層のウェットエッチングやドライエッチングによって、あるいはプラスチック製基板層のナノインプリントや射出成型、切削加工によって行うことができる。
【0045】
(2−2)ウェル内への物質の収容
符号S2は、反応に必要な物質をウェル内へ収容する工程である。本工程では、ウェル41,42,43内にそれぞれプライマーP1,P2,P3の溶液を滴下し乾燥させることにより、プライマーをウェル内に収容する。既に説明したように、ウェル内に収容する物質は、オリゴヌクレオチドプライマーに限定されず、dNTP、酵素、バッファー溶質などであってもよい。
【0046】
滴下したプライマー溶液は、風乾、真空乾燥あるいは凍結乾燥等によって、好ましくは緩徐に乾燥させる。ウェル内に収容する物質を酵素とする場合には、活性の低下や失活を防止するため、滴下した酵素溶液は、臨界点乾燥により乾燥させることが好ましい。
【0047】
(2−3)薄膜による被覆
符号S3は、ウェル内に収容した物質を薄膜6により被覆する工程である。
【0048】
薄膜6は、ウェル内に収容されたプライマー上に、薄膜6の材料溶液を滴下し乾燥させることにより形成できる。薄膜6の材料溶液は、プライマーの溶解や変質を防止するため、プライマーと接触すると同時に硬化させることが好ましい。また、薄膜6は、好適には、ウェル内にプライマーを収容した基板層a1を真空蒸着槽に入れ、薄膜6の材料を蒸着させることによって形成する。薄膜6の蒸着は、汎用の真空蒸着装置を使用し、材料に応じて適宜条件を設定することにより行う。ウェル内に酵素を収容しておく場合には、酵素の失活を防ぐため、基板を30℃以下の温度に制御する機構を有する装置を使用することが好ましい。
【0049】
(2−4)基板層a1,a2表面の活性化と貼り合せ
符号S4は、基板層a1,a2表面の活性化工程である。また、符号S5は、基板層a1,a2の貼り合せ工程である。
【0050】
基板層a1と基板層a2の貼り合わせは、例えば、基板層の表面を酸素プラズマ処理又は真空紫外光処理により活性化して貼り合せる方法を採用できる。ポリジメチルシロキサン等のプラスチックとガラスは親和性が高く、表面を活性化処理して接触させると、ダングリングボンドが反応して強固な共有結合であるSi−O−Siシラノール結合を形成し、十分な強度の接合が得られる。酸素プラズマ処理又は真空紫外光処理は、基板層の材料に応じて適宜な条件を設定して行う。
【0051】
このとき、基板層の表面を酸素プラズマ処理又は真空紫外光処理により活性化する際に、薄膜6がプライマーを保護するため、プラズマや紫外線の照射などによるプライマーの劣化や変性を防止できる。特にウェル内に予め収容する物質を酵素とする場合には、薄膜6により、プラズマや紫外線の照射などによる酵素の活性低下や失活を効果的に防止できる。
【0052】
3.本実施形態の変形例に係る核酸増幅反応用マイクロチップ及びその製造方法
次に、上述した本実施形態の変形例に係る核酸増幅反応用マイクロチップ及びその製造方法について説明する。なお、本変形例において、本実施形態と実質的に同一の機能構成を有する構成要素については、同一の符号を付することにより重複説明を省略する。
【0053】
[核酸増幅反応用マイクロチップ]
本変形例に係るマイクロチップA2(図示せず)に設けられる、導入口1、主流路2、分岐流路3、ウェル41、42、43、排出口5、及び薄膜6は、上述した本実施形態に係るマイクロチップAと同一の機能構成を有するものである。本変形例に係るマイクロチップA2において、反応に必要な物質の少なくとも一部が被覆された薄膜上に、反応に必要な他の物質の少なくとも一部が固着されている点以外は、本実施形態に係るマイクロチップAと実質的に同一である。そのため、ここでは、ウェル内において反応に必要な物質の少なくとも一部が被覆された薄膜上に、反応に必要な他の物質の少なくとも一部が固着されている点についてのみ説明する。
【0054】
また、ウェル内に存在する物質のうち、何れの物質が薄膜6により被覆され、何れの物質が薄膜6上に固着されるかについては、特に限定されるものではないが、以下では、酵素を被覆する薄膜6上に、プライマーが固着されている場合を例に説明する。
【0055】
図5に各ウェル内に収容された物質を示す。図5(A)はウェル41、(B)はウェル42、(C)はウェル43に収容された物質を示している。ここでは、ウェル41、42、43内に酵素Eを収容し、且つ酵素Eを被覆する薄膜6上にプライマーP11、P12、P13が固着されている場合を図示している。
【0056】
薄膜6により被覆された酵素Eは、融解温度未満では固形状態の薄膜6内に外部から隔絶されて存在し、融解温度以上では流動化して崩壊した薄膜6から放出されて外部と接触可能な状態とされる。
【0057】
プライマーP11、P12、P13は、薄膜6上で固着されており、ウェル内にサンプル溶液が供給されることで再溶解される。また、プライマーP11、P12、P13は、上述したプライマーP1、P2、P3と同様に、同一の塩基配列を有するプライマーであってもよいが、マイクロチップA2において複数の標的核酸鎖の増幅を行う場合には、異なる塩基配列を有するプライマーとされる。
【0058】
[核酸等温増幅方法]
本変形例に係るマイクロチップA2を用いた核酸等温増幅方法は、反応に必要な物質の少なくとも一部が被覆された薄膜上に、反応に必要な他の物質の少なくとも一部が固着されている点以外は、本実施形態に係る核酸等温増幅方法と実質的に同一である。
【0059】
すなわち、本変形例に係るマイクロチップA2において、まず、酵素が薄膜6により被覆された状態で、薄膜6上にプライマーが固着される。そして、各ウェル内に収容された酵素及びプライマー以外の反応に必要な物質(dNTP、バッファー溶質など)を含む常温のサンプル溶液を導入口1から各ウェル内に供給する。サンプル溶液のウェル内への供給後においては、本実施形態に係る核酸等温増幅方法と同様にして核酸等温増幅方法が行われる。
【0060】
まず、薄膜6により被覆された状態で予め各ウェル内に収容された酵素及びプライマー以外の反応に必要な物質(dNTP、バッファー溶質など)と標的核酸鎖とを含むサンプル溶液を導入口1から各ウェル内に供給する。これにより、プライマーはサンプル溶液によって再溶解される。このとき、サンプル溶液は常温に維持されており、薄膜6により被覆された酵素はサンプル溶液から隔絶された状態とされている。そのため、酵素とサンプル溶液が混合して反応が進行することはない。
【0061】
各ウェル内にサンプル液を供給した後、サンプル溶液を反応温度まで昇温する。これにより、薄膜6が流動化して崩壊し、酵素が放出されてサンプル溶液と混合し、反応が開始される。
【0062】
このように、マイクロチップAでは、サンプル溶液を各ウェル内に供給した後、反応温度まで昇温することによって初めて反応が開始される。そのため、マイクロチップAでは、反応時間を厳密に制御することが可能である。
【0063】
更に、本変形例に係る核酸等温増幅方法は、酵素を薄膜に被覆させ、薄膜上にプライマーを固着してから行われる。そのため、複数のウェルに酵素及び異なるプライマーを収容した場合、反応時間を正確に制御しつつ、且つ感染病原体判定等を容易に行うことができる。
【0064】
[核酸増幅反応用マイクロチップの製造方法]
次に、図6に示すフローチャートを参照して、本変形例に係るマイクロチップの製造方法を説明する。以下、上述のマイクロチップA2を例に説明する。ただし、符号S1、S3、S4、S5における工程は、本実施形態に係る核酸増幅反応用マイクロチップAの製造方法と実質的に同一である。そのため、ここでは、符合S6、S7における工程についてのみ説明する。
【0065】
図6中、符号S6は、反応に必要な物質をウェル内へ収容する工程である。本工程では、ウェル41、42、43内にそれぞれ酵素Eの溶液を滴下し乾燥させることにより、酵素Eをウェル内に収容する。既に説明したように、ウェル内に収容する物質は、酵素に限定されず、dNTP、プライマー、バッファー溶質などであってもよい。本変形例に示すように、ウェル内に収容する物質を酵素とする場合には、活性の低下や失活を防止するため、滴下した酵素溶液は、臨界点乾燥により乾燥させることが好ましい。
【0066】
また、符合S7は、薄膜6上に反応に必要な物質を固着させる工程である。本工程では、薄膜6上にそれぞれプライマーP11、P12、P13の溶液を滴下し乾燥させることにより、プライマーをウェル内に収容する。本工程においても、既に説明したように、ウェル内に収容する物質は、プライマーに限定されず、dNTP、酵素、バッファー溶質などの物質、すなわち、薄膜6により被覆される物質以外の反応に必要な物質であってもよい。滴下したプライマー溶液は、風乾、真空乾燥あるいは凍結乾燥等によって、好ましくは緩徐に乾燥させる。
【実施例】
【0067】
<実施例1>
1.核酸等温増幅反応用マイクロチップの作製
(1)プライマーの固着化
鋳型核酸鎖に対して、「表1」に示す6種のLAMP用プライマーを設計した。PDMS製基板に形成したウェル内にプライマー溶液を0.5μl滴下し、真空乾燥(室温、0.1Pa、5分)によりウェル内に固着させた。
【0068】
【表1】

【0069】
(2)薄膜の被覆
タングステン製の蒸着ボートにステアリン酸をのせ、熱電ヒーターを接続し、真空蒸着槽内に配置した。ウェル内にプライマーを固着させた基板を真空蒸着槽内に入れて、真空(1.0×10-6Torr)とし、熱電ヒーターに電流を流してタングステンボードを加熱した。ステアリン酸が蒸着ボート上で溶液化し始めた時点でシャッターを開け、蒸着を開始した。
【0070】
蒸着は、真空飽和蒸気圧が0.1Torrになるように、ステアリン酸(融点69℃)を85℃に加熱して行った。蒸着は、基板温度30℃にて膜厚が100nmになるように行った。
【0071】
蒸着後、真空蒸着槽から取り出し、ウェル内に固着されたプライマーの表面にステアリン酸が皮膜を作っていることを干渉色で確認した。その後、基板表面をDPアッシング(O2:10cc, 100W, 30sec)により親水化し、カバーガラスと貼り合わせてマイクロチップを得た。
【0072】
2.LAMP反応
鋳型核酸鎖と酵素、インターカレーター蛍光色素(SYBR Green I, Molecular Probes Inc.)、核酸モノマー、バッファーを混合し、反応液を調製した。実施例1で作製したマイクチップの流路に反応液を注入し、ウェル内に導入した。ウェル毎に蛍光検出部や加熱部を備えた蛍光検出装置にマイクチップをセットし、反応を開始した。蛍光色素の蛍光強度に基づいて、標的核酸鎖の増幅量をリアルタイムで測定した。
【0073】
結果、LAMP反応開始後10分程度で増幅核酸鎖が検出され、良好な標的核酸鎖の定量性が確認された。
【0074】
<実施例2>
2.薄膜材料の検討
(1)LAMP反応
マイクロチューブに「表1」に示したプライマーの溶液を分注し、真空乾燥(室温、0.1Pa、5分)によりチューブ内に固着させた。ステアリン酸あるいはパラフィンワックス(Paraffin 115, 125, 130, 135, 140)をマイクロチューブに分注した後、反応液を添加した。
【0075】
また、マイクロチューブに酵素溶液を分注し、真空乾燥(室温、0.1Pa、5分)によりチューブ内に固着させた。ステアリン酸あるいはパラフィンワックス(Paraffin 115, 125, 130, 135, 140)をマイクロチューブに分注した後、プライマー溶液と、酵素以外の試薬を含む反応液とを添加した。
【0076】
チューブ毎に蛍光検出部や加熱部を備えた蛍光検出装置にマイクロチューブをセットし、反応を開始した。蛍光色素の蛍光強度に基づいて、標的核酸鎖の増幅量をリアルタイムで測定した。
【0077】
結果を、図7・8に示す。図7は、固着したプライマーをステアリン酸あるいはパラフィンワックスで被覆した反応系の結果、図8は、酵素を固着させてステアリン酸あるいはパラフィンワックスで被覆した反応系の結果を示す。いずれも、LAMP反応開始後10〜15分程度で増幅核酸鎖が検出され、パラフィンワックスについても反応阻害性がないことが確認できた。
【産業上の利用可能性】
【0078】
本発明に係る核酸増幅反応用マイクロチップ等によれば、反応時間を正確に制御して、高精度な分析を行うことができる。そのため、本発明に係る核酸増幅反応用マイクロチップ等は、遺伝子型判定や感染病原体判定などのためのマイクロチップ型の核酸増幅装置に好適に用いられ得る。
【符号の説明】
【0079】
A:核酸等温増幅反応用マイクロチップ、P1,P2,P3:プライマー、1:導入口、2:主流路、3:分岐流路、41,42,43:ウェル、5:排出口、E:酵素
【技術分野】
【0001】
本発明は、核酸等温増幅反応用マイクロチップ及びその製造方法並びに核酸等温増幅方法に関する。より詳しくは、核酸増幅反応の反応時間を正確に制御するための核酸等温増幅反応用マイクロチップ等に関する。
【背景技術】
【0002】
従来、核酸増幅方法として、PCR(Polymerase Chain Reaction)法が用いられてきている。PCR法は、(1)熱変性、(2)アニーリング、(3)伸長反応の3つのステップからなる温度サイクルを繰り返すことによって、鋳型となる核酸鎖の増幅を行うものである。
【0003】
ステップ(1)の熱変性は、鋳型核酸鎖を二本鎖から一本鎖に解離させるためのステップである。熱変性時の反応温度は、通常94℃前後とされる。ステップ(2)のアニーリングは、一本鎖に解離した鋳型核酸鎖にオリゴヌクレオチドプライマーを結合させるためのステップである。アニーリング時の反応温度は、通常50〜60℃程度とされる。ステップ(3)の伸長反応は、DNAポリメラーゼによって、オリゴヌクレオチドプライマーが結合した部分を起点として一本鎖部分と相補的なDNAを合成するステップである。伸長反応時の反応温度は、通常72℃前後とされる。
【0004】
近年、核酸増幅方法として、温度サイクルの繰り返しを要せず、より簡便な等温増幅と呼ばれる方法が用いられるようになっている。例えば、LAMP(Loop−Mediated Isothermal Amplification)法では、オリゴヌクレオチドプライマー、鎖置換型DNA合成酵素、核酸モノマー等の試薬と鋳型核酸鎖を混合し、一定温度(65℃付近)で保温することによって反応が進行する。このため、LAMP法によれば、1ステップで核酸の増幅を行うことできる。
【0005】
本発明に関連して、近年、マイクロチップのウェル内で核酸増幅反応を進行させ、増幅核酸鎖を光学的に検出あるいは定量する核酸増幅装置(例えば、リアルタイムPCR装置)が開発されている。
【0006】
特許文献1には、流路内に、核酸増幅反応に必要なオリゴヌクレオチドプライマー、基質、酵素及びその他の試薬が固体状態で入れられたマイクロ流体チップが開示されている。このマイクロ流体チップは、反応に必要な残りの試薬を液体状態で流路に送液することで、液体状態の試薬と固体状態の試薬が接触し、固体状態の試薬が溶解することにより反応が開始されるものである。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】特開2007−43998号公報
【発明の概要】
【発明が解決しようとする課題】
【0008】
PCR法では、反応時間を厳密に制御するため、ホットスタート法と称される方法が採用されている。ホットスタート法は、オリゴヌクレオチドプライマーのミスアニーリングに起因する非特異的増幅反応を回避し、目的の増幅産物を得るための方法である。ホットスタート法は、DNAポリメラーゼ以外の試薬及び標的核酸鎖の混合液を、一旦、オリゴヌクレオチドプライマーの変性温度まで加温し、変性温度下で初めて酵素を添加後、温度サイクルを実施することで達成される。
【0009】
一方、等温増幅方法では、一定温度の1ステップで反応を行なうために、ホットスタート法を採用できず、試薬と鋳型核酸鎖を混合した時点で反応が緩徐に進行してしまうため、反応時間を厳密に制御することが難しい。
【0010】
従来、マイクロチップ型の核酸増幅装置では、試薬と鋳型核酸鎖を予め混合し、この混合液をマイクロチップのウェル内に導入して反応を行なう方法が採られている。そのため、混合液を調製する間、あるいは混合液をウェル内に導入する間に、混合液内で反応が進行してしまう場合があり、反応時間を厳密に制御できず、増幅核酸鎖の定量性に問題が生じていた。
【0011】
そこで、本発明は、等温増幅方法において、反応時間を正確に制御するための技術を提供することを主な目的とする。
【課題を解決するための手段】
【0012】
上記課題解決のため、本発明は、核酸の等温増幅反応の反応場となる反応領域内に、反応に必要な物質の少なくとも一部が、常温より高く前記反応の反応温度より低い温度で融解する薄膜により被覆された状態で存在する核酸等温増幅反応用マイクロチップを提供する。
この核酸増幅反応用マイクロチップでは、反応に必要な物質の少なくとも一部を被覆する前記薄膜上に、反応に必要な他の物質の少なくとも一部が固着されて存在することが好適となる。
この核酸等温増幅反応用マイクロチップにおいて、前記反応領域内に存在する物質は、オリゴヌクレオチドプライマー及び酵素、核酸モノマーから選択される一以上とすることができる。
この核酸等温増幅反応用マイクロチップでは、予め反応領域内に収容された物質を被覆する薄膜を、残りの物質と標的核酸鎖を含むサンプル溶液を反応領域内に供給した後に加熱融解させることによって、任意のタイミングで反応を開始できる。
また、核酸等温増幅反応用マイクロチップでは、酵素を被覆する前記薄膜上に、オリゴヌクレオチドプライマーが固着されて存在することが好適となる。
この核酸等温増幅反応用マイクロチップにおいて、前記薄膜は、ステアリン酸又はパラフィンワックスの材料の蒸着によって形成することが好適となる。
また、この核酸等温増幅反応用マイクロチップは、外部から液体が導入される導入口と、複数の前記反応領域と、導入口から導入される液体を各反応領域内に供給する流路と、が配設されることが好適となる。
【0013】
本発明は、また、核酸の等温増幅反応の反応場となる反応領域内に収容された、反応に必要な物質の少なくとも一部を、常温より高く前記反応の反応温度より低い温度で融解する薄膜により被覆する工程を含む核酸等温増幅反応用マイクロチップの製造方法を提供する。
【0014】
本発明は、さらに、核酸の等温増幅反応に必要な物質の少なくとも一部が、常温より高く前記反応の反応温度より低い温度で融解する薄膜により被覆されて存在する反応領域内に、反応に必要な残りの物質を導入し、反応温度まで昇温する手順を含む核酸等温増幅方法をも提供する。
【0015】
本発明において、「核酸等温増幅反応」には、温度サイクルを伴わない各種増幅反応が含まれる。等温増幅反応としては、例えば、LAMP(Loop−Mediated Isothermal Amplification)法やSMAP(SMartAmplification Process)法、NASBA(Nucleic Acid Sequence−Based Amplification)法、ICAN(Isothermal and Chimeric primer−initiated Amplification of Nucleic acids)法(登録商標)、TRC(transcription−reverse transcription concerted)法、SDA(strand displacement amplification)法、TMA(transcription−mediated amplification)法、RCA(rolling circle amplification)法等が挙げられる。この他、「核酸増幅反応」には、核酸の増幅を目的とする等温による核酸増幅反応が広く包含されるものとする。また、これらの核酸増幅反応には、リアルタイム(RT)−LAMP法などの核酸鎖の増幅とともに増幅された核酸鎖の定量を伴う反応も包含される。
【0016】
また、「反応に必要な物質」には、核酸等温増幅反応において増幅核酸鎖を得るために必要な物質であって、具体的には、標的核酸鎖に相補的な塩基配列とされたオリゴヌクレオチドプライマー、核酸モノマー(dNTP)、酵素、反応緩衝液(バッファー)溶質などが含まれる。
【発明の効果】
【0017】
本発明により、等温増幅方法において、反応時間を正確に制御するための技術が提供される。
【図面の簡単な説明】
【0018】
【図1】本発明に係る核酸増幅反応用マイクロチップの上面模式図である。
【図2】マイクロチップの断面模式図(図1、P−P断面)である。
【図3】マイクロチップのウェル内に存在する反応に必要な物質を説明するための模式図である。
【図4】本発明に係る核酸増幅反応用マイクロチップの製造方法を説明するためのフローチャートである。
【図5】変形例に係るマイクロチップのウェル内に存在する反応に必要な物質を説明するための模式図である。
【図6】変形例に係る核酸増幅反応用マイクロチップの製造方法を説明するためのフローチャートである。
【図7】プライマーをステアリン酸あるいはパラフィンワックスで被覆して固着した反応系でのLAMP反応の結果を示す図である(実施例2)。
【図8】酵素をステアリン酸あるいはパラフィンワックスで被覆して固着した反応系でのLAMP反応の結果を示す図である(実施例2)。
【発明を実施するための形態】
【0019】
以下、本発明を実施するための好適な形態について図面を参照しながら説明する。なお、以下に説明する実施形態は、本発明の代表的な実施形態の一例を示したものであり、これにより本発明の範囲が狭く解釈されることはない。なお、説明は以下の順序により行う。
1.核酸増幅反応用マイクロチップと核酸等温増幅方法
2.核酸増幅反応用マイクロチップの製造方法
(2−1)基板層a1の成形
(2−2)ウェルへの物質の収容
(2−3)薄膜による被覆
(2−4)基板層a1,a2の表面活性化と貼り合せ
3.本実施形態の変形例に係る核酸増幅反応用マイクロチップ及びその製造方法
【0020】
1.核酸等温増幅反応用マイクロチップと核酸等温増幅方法
[核酸等温増幅反応用マイクロチップ]
本発明に係る核酸等温増幅反応用マイクロチップ(以下、単に「マイクロチップ」とも称する)の上面模式図を図1に、断面模式図を図2に示す。図2は、図1中P−P断面に対応する。
【0021】
符号Aで示すマイクロチップには、外部から液体(サンプル溶液)が導入される導入口1と、核酸増幅反応の反応場となる複数のウェル(反応領域)と、一端において導入口1に連通する主流路2と、この主流路2から分岐する分岐流路3が配設されている。主流路2の他端は、サンプル溶液を外部に排出する排出口5として構成されており、分岐流路3は、主流路2の導入口1への連通部と排出口5への連通部との間において主流路2から分岐し、各ウェルに接続されている。サンプル液には、核酸増幅反応において鋳型核酸鎖となるDNAやゲノムRNA、mRNAなどが含まれ得る。
【0022】
ここでは、マイクロチップAに縦横3例で合計9つのウェルを均等間隔で配設する場合を例として、これら9つのウェルを3区分し、図1上段の3つのウェルを符号41で、中段の3つのウェルを符号42で、下段の3つのウェルを符号43で示す。導入口1から導入されたサンプル溶液は、主流路2を排出口5に向かって送液され、送液方向上流に配設された分岐流路3及びウェルから順に内部に供給される。なお、マイクロチップAにおいて、排出口5は必須の構成とはならないものとする。すなわち、マイクロチップAは、導入口1から導入されたサンプル溶液が外部に排出されない構成でもよい。
【0023】
マイクロチップAは、導入口1、主流路2、分岐流路3、ウェル41,42,43及び排出口5を形成した基板層a1に基板層a2を貼り合わせて構成されている。基板層a1,a2の材質は、ガラスや各種プラスチック(ポリプロピレン、ポリカーボネート、シクロオレフィンポリマー、ポリジメチルシロキサン)とすることができる。ウェル41,42,43内で増幅された核酸鎖の検出あるいは定量を光学的に行う場合には、基板層a1,a2の材質は、光透過性を有し、自家蛍光が少なく、波長分散が小さいために光学誤差の少ない材料を選択することが好ましい。
【0024】
ウェル41,42,43内には、反応に必要な物質の少なくとも一部が、加熱融解性を有する薄膜6により被覆された状態で存在している。図3に、各ウェル内に収容された物質を示す。図3(A)はウェル41、(B)はウェル42、(C)はウェル43内に収容された物質を示している。
【0025】
ウェル内に存在する物質は、核酸等温増幅反応において増幅核酸鎖を得るために必要な物質であって、具体的には、標的核酸鎖に相補的な塩基配列とされたオリゴヌクレオチドプライマー、核酸モノマー(dNTP)、酵素、反応緩衝液(バッファー)溶質などとされる。ウェル内に存在する物質は、これらのうち1あるいは2以上とできる。また、ウェル内には、増幅核酸鎖を得るために必須ではないが、蛍光試薬(蛍光色素)やリン光試薬(リン光色素)などの増幅核酸鎖の検出及び定量のために必要な試薬を、必要に応じて収容しておくこともできる。
【0026】
ここでは、ウェル41,42,43内にオリゴヌクレオチドプライマー(以下、単に「プライマー」とも称する」)P1,P2,P3を収容する場合を図示している。
【0027】
プライマーP1,P2,P3は、同一の塩基配列を有するプライマーであってもよいが、マイクロチップAにおいて複数の標的核酸鎖の増幅を行う場合には、異なる塩基配列を有するプライマーとされる。例えば、マイクロチップAを用いて遺伝子型の判定を行う場合には、各遺伝子型の塩基配列に応じて異なる塩基配列を有するプライマーを、それぞれウェル41,42,43内に収容しておく。また、マイクロチップAを用いて感染病原体の判定を行う場合には、各ウイルスや微生物の遺伝子配列に応じて異なる塩基配列を有するプライマーを同様に収容する。
【0028】
プライマーP1,P2,P3は、常温より高く、かつ核酸等温増幅反応の反応温度よりも低い温度で加熱融解する薄膜6により被覆されて各ウェル内に存在している。
【0029】
薄膜6は、融解温度未満(室温を含む)では、流動性を失って固形状態となり、融解温度以上では、融解あるいは流動化して液状あるいはゲル状となる材料によって形成される。薄膜6により被覆されたプライマーP1,P2,P3は、融解温度未満では固形状態の薄膜6内に外部から隔絶されて存在し、融解温度以上では流動化して崩壊した薄膜6から放出されて外部と接触可能な状態とされる。
【0030】
核酸等温増幅反応の反応温度は、通常50〜75℃であり、薄膜6の融解温度あるいは流動化温度は、常温(室温)である25℃前後よりも高く、反応温度である50〜75℃よりも低く設定される。薄膜6の融解温度等をこの範囲に設計することで、プライマーP1,P2,P3を、融解温度未満において確実に外部から隔絶するとともに、融解温度以上において迅速に放出させることができる。
【0031】
融解温度未満におけるプライマーP1,P2,P3の外部からの隔絶を確実にするため、薄膜6は撥水性を有することが好ましい。薄膜6に撥水性を付与することで、ウェル内に導入されたサンプル溶液によって融解温度未満で薄膜6が溶解することを防止できる。
【0032】
薄膜6の材料は、上記の融解温度等と、好ましくは撥水性とを具備する材料であれば特に限定されない。薄膜6の材料としては、ステアリン酸、パラミチン酸、又はミリスチン酸などの脂肪酸、ヘベニルアルコール、アガロース、パラフィンワックス、マイクロクリスタリンワックス、ゼラチンなどが挙げられる。
各材料の融点は、ステアリン酸69℃、パラミチン酸63℃、ミリスチン酸54℃、ヘベニルアルコール65〜73℃、アガロース65℃、パラフィンワックス40〜70℃、マイクロクリスタリンワックス60〜90℃、ゼラチン40〜50℃である。
【0033】
また、薄膜6の天然材料として以下が挙げられる。ヤシ科植物の葉の分泌物から得られ、ヒドロキシ酸エステルを多く(30-35%)含むカルナバワックス。北アフリカ南部の乾燥地帯に植生する植物から得られ、炭化水素比率が高い(40-50%)キャンデリラワックス。ハゼの実から得られ、グリセライドを主成分とする木蝋。この他の植物性硬化油脂。
各材料の融点は、カルナバワックス80〜86℃、キャンデリラワックス66〜71℃、木蝋50〜56℃であり、植物性硬化油脂には融点が48〜70℃のものが多くある。
【0034】
さらに、薄膜6の材料として以下の化合物も上記の融解温度等を具備する。Nb(NtC5H11)[N(CH3)2]3(融点47℃)、シクロペンタジエニル(tCp)錯体であるトリ(エチルシクロペンタジエニル)プラセオジム(Pr(EtCp)3)(70〜73℃)、TaNバリヤ膜形成用材料として用いられるTa(NtC5H11)[N(CH3)2]3(36℃)、スチレン系樹脂であるトリエチレングリコール-ビス[3−(3−t−ブチル−5−メチル−4−ヒドロキシフェニル)プロピオネート(76〜79℃)、酸化防止剤として用いられる2, 2−チオ-ジエチレンビス[3−(3,5−ジ−t−ブチル−4−ヒドロキシフェニル)プロピオネート(63℃以上)やオクタデシル−3−(3,5−ジ−t−ブチル−4−ヒドロキシフェニル)プロピオネート(50〜53℃)、重曹(70℃)、イオン液体である1−エチルー3−メチルイミダゾリウムバイフルオライド(51℃)。
【0035】
薄膜6の材料は、サンプル液中に融解、混合して、核酸増幅反応を阻害しないような材料を選択すること望ましい。実施例で後述するように、例えば、ステアリン酸やパラフィンワックスは反応阻害性がない。あるいは、薄膜6の膜厚を、サンプル液中に融解、混合した際の反応阻害を無視し得るような薄さとすることが望ましい。薄膜6の膜厚は、例えば1000nm(体積1nl)以下とすることで、薄膜6が融解した際のサンプル液中における材料の濃度を0.1%程度に抑え、反応阻害を生じないようにできる。薄膜6の膜厚は、上記材料の蒸着によって形成することで、1000nmから10nm程度までの範囲の任意の厚さとできる。
【0036】
[核酸等温増幅方法]
次に、マイクロチップAを用いた核酸等温増幅方法について説明する。
【0037】
まず、薄膜6により被覆された状態で予め各ウェル内に収容されたプライマー以外の反応に必要な物質(酵素、dNTP、バッファー溶質など)と標的核酸鎖とを含むサンプル溶液を導入口1から各ウェル内に供給する。このとき、サンプル溶液は常温に維持されており、薄膜6により被覆されたプライマーはサンプル溶液から隔絶された状態とされている。そのため、プライマーとサンプル溶液が混合して反応が進行することはない。
【0038】
各ウェル内にサンプル液を供給した後、サンプル溶液を反応温度まで昇温する。これにより、薄膜6が流動化して崩壊し、プライマーが放出されてサンプル溶液と混合し、反応が開始される。
【0039】
このように、マイクロチップAでは、サンプル溶液を各ウェル内に供給した後、反応温度まで昇温することによって初めて反応が開始される。そのため、マイクロチップAでは、反応時間を厳密に制御することが可能である。
【0040】
ここでは、反応に必要な物質としてプライマーを薄膜6により被覆された状態で予めウェル内に収容しておく場合を例に説明したが、ウェル内に収容する物質は、酵素、dNTPあるいはバッファー溶質であってもよい。また、ウェル内には、プライマーと酵素、プライマーとdNTP、プライマーと酵素とdNTPというように2以上を組み合わせて収容してもよい。
【0041】
本発明に係るマイクロチップでは、反応に必要な物質を加熱融解性を有する薄膜により被覆された状態で予めウェル内に収容し、残りの物質と標的核酸鎖を含むサンプル溶液をウェル内に供給した後、反応温度まで昇温することにより、任意のタイミングで反応を開始できる。従って、このマイクロチップによれば、反応時間を厳密に制御でき、増幅核酸鎖の定量を高精度に行うことができる。
【0042】
なお、本発明に係るマイクロチップにおいて、ウェルの数や配設位置は任意とでき、ウェルの形状も図に示した円柱形状に限定されない。また、導入口1に導入されたサンプル溶液を各ウェル内に供給するための流路の構成も、図に示した主流路2及び分岐流路3の態様に限定されない。さらに、ここでは、導入口1等を基板層a1に形成する場合を説明したが、導入口1等は基板層a1及び基板層a2の両方に一部ずつ形成されていてもよい。マイクロチップを構成する基板層も2以上であってよい。
【0043】
2.核酸増幅反応用マイクロチップの製造方法
続いて、図4に示すフローチャートを参照して、本発明に係るマイクロチップの製造方法を説明する。以下、上述のマイクロチップAを例に説明する。
【0044】
(2−1)基板層a1の成形
図4中、符号S1は、基板層a1の成形工程である。本工程では、基板層a1に、導入口1、主流路2、分岐流路3、ウェル41,42,43及び排出口5を成形する。基板層a1への導入口1等の成形は、例えば、ガラス製基板層のウェットエッチングやドライエッチングによって、あるいはプラスチック製基板層のナノインプリントや射出成型、切削加工によって行うことができる。
【0045】
(2−2)ウェル内への物質の収容
符号S2は、反応に必要な物質をウェル内へ収容する工程である。本工程では、ウェル41,42,43内にそれぞれプライマーP1,P2,P3の溶液を滴下し乾燥させることにより、プライマーをウェル内に収容する。既に説明したように、ウェル内に収容する物質は、オリゴヌクレオチドプライマーに限定されず、dNTP、酵素、バッファー溶質などであってもよい。
【0046】
滴下したプライマー溶液は、風乾、真空乾燥あるいは凍結乾燥等によって、好ましくは緩徐に乾燥させる。ウェル内に収容する物質を酵素とする場合には、活性の低下や失活を防止するため、滴下した酵素溶液は、臨界点乾燥により乾燥させることが好ましい。
【0047】
(2−3)薄膜による被覆
符号S3は、ウェル内に収容した物質を薄膜6により被覆する工程である。
【0048】
薄膜6は、ウェル内に収容されたプライマー上に、薄膜6の材料溶液を滴下し乾燥させることにより形成できる。薄膜6の材料溶液は、プライマーの溶解や変質を防止するため、プライマーと接触すると同時に硬化させることが好ましい。また、薄膜6は、好適には、ウェル内にプライマーを収容した基板層a1を真空蒸着槽に入れ、薄膜6の材料を蒸着させることによって形成する。薄膜6の蒸着は、汎用の真空蒸着装置を使用し、材料に応じて適宜条件を設定することにより行う。ウェル内に酵素を収容しておく場合には、酵素の失活を防ぐため、基板を30℃以下の温度に制御する機構を有する装置を使用することが好ましい。
【0049】
(2−4)基板層a1,a2表面の活性化と貼り合せ
符号S4は、基板層a1,a2表面の活性化工程である。また、符号S5は、基板層a1,a2の貼り合せ工程である。
【0050】
基板層a1と基板層a2の貼り合わせは、例えば、基板層の表面を酸素プラズマ処理又は真空紫外光処理により活性化して貼り合せる方法を採用できる。ポリジメチルシロキサン等のプラスチックとガラスは親和性が高く、表面を活性化処理して接触させると、ダングリングボンドが反応して強固な共有結合であるSi−O−Siシラノール結合を形成し、十分な強度の接合が得られる。酸素プラズマ処理又は真空紫外光処理は、基板層の材料に応じて適宜な条件を設定して行う。
【0051】
このとき、基板層の表面を酸素プラズマ処理又は真空紫外光処理により活性化する際に、薄膜6がプライマーを保護するため、プラズマや紫外線の照射などによるプライマーの劣化や変性を防止できる。特にウェル内に予め収容する物質を酵素とする場合には、薄膜6により、プラズマや紫外線の照射などによる酵素の活性低下や失活を効果的に防止できる。
【0052】
3.本実施形態の変形例に係る核酸増幅反応用マイクロチップ及びその製造方法
次に、上述した本実施形態の変形例に係る核酸増幅反応用マイクロチップ及びその製造方法について説明する。なお、本変形例において、本実施形態と実質的に同一の機能構成を有する構成要素については、同一の符号を付することにより重複説明を省略する。
【0053】
[核酸増幅反応用マイクロチップ]
本変形例に係るマイクロチップA2(図示せず)に設けられる、導入口1、主流路2、分岐流路3、ウェル41、42、43、排出口5、及び薄膜6は、上述した本実施形態に係るマイクロチップAと同一の機能構成を有するものである。本変形例に係るマイクロチップA2において、反応に必要な物質の少なくとも一部が被覆された薄膜上に、反応に必要な他の物質の少なくとも一部が固着されている点以外は、本実施形態に係るマイクロチップAと実質的に同一である。そのため、ここでは、ウェル内において反応に必要な物質の少なくとも一部が被覆された薄膜上に、反応に必要な他の物質の少なくとも一部が固着されている点についてのみ説明する。
【0054】
また、ウェル内に存在する物質のうち、何れの物質が薄膜6により被覆され、何れの物質が薄膜6上に固着されるかについては、特に限定されるものではないが、以下では、酵素を被覆する薄膜6上に、プライマーが固着されている場合を例に説明する。
【0055】
図5に各ウェル内に収容された物質を示す。図5(A)はウェル41、(B)はウェル42、(C)はウェル43に収容された物質を示している。ここでは、ウェル41、42、43内に酵素Eを収容し、且つ酵素Eを被覆する薄膜6上にプライマーP11、P12、P13が固着されている場合を図示している。
【0056】
薄膜6により被覆された酵素Eは、融解温度未満では固形状態の薄膜6内に外部から隔絶されて存在し、融解温度以上では流動化して崩壊した薄膜6から放出されて外部と接触可能な状態とされる。
【0057】
プライマーP11、P12、P13は、薄膜6上で固着されており、ウェル内にサンプル溶液が供給されることで再溶解される。また、プライマーP11、P12、P13は、上述したプライマーP1、P2、P3と同様に、同一の塩基配列を有するプライマーであってもよいが、マイクロチップA2において複数の標的核酸鎖の増幅を行う場合には、異なる塩基配列を有するプライマーとされる。
【0058】
[核酸等温増幅方法]
本変形例に係るマイクロチップA2を用いた核酸等温増幅方法は、反応に必要な物質の少なくとも一部が被覆された薄膜上に、反応に必要な他の物質の少なくとも一部が固着されている点以外は、本実施形態に係る核酸等温増幅方法と実質的に同一である。
【0059】
すなわち、本変形例に係るマイクロチップA2において、まず、酵素が薄膜6により被覆された状態で、薄膜6上にプライマーが固着される。そして、各ウェル内に収容された酵素及びプライマー以外の反応に必要な物質(dNTP、バッファー溶質など)を含む常温のサンプル溶液を導入口1から各ウェル内に供給する。サンプル溶液のウェル内への供給後においては、本実施形態に係る核酸等温増幅方法と同様にして核酸等温増幅方法が行われる。
【0060】
まず、薄膜6により被覆された状態で予め各ウェル内に収容された酵素及びプライマー以外の反応に必要な物質(dNTP、バッファー溶質など)と標的核酸鎖とを含むサンプル溶液を導入口1から各ウェル内に供給する。これにより、プライマーはサンプル溶液によって再溶解される。このとき、サンプル溶液は常温に維持されており、薄膜6により被覆された酵素はサンプル溶液から隔絶された状態とされている。そのため、酵素とサンプル溶液が混合して反応が進行することはない。
【0061】
各ウェル内にサンプル液を供給した後、サンプル溶液を反応温度まで昇温する。これにより、薄膜6が流動化して崩壊し、酵素が放出されてサンプル溶液と混合し、反応が開始される。
【0062】
このように、マイクロチップAでは、サンプル溶液を各ウェル内に供給した後、反応温度まで昇温することによって初めて反応が開始される。そのため、マイクロチップAでは、反応時間を厳密に制御することが可能である。
【0063】
更に、本変形例に係る核酸等温増幅方法は、酵素を薄膜に被覆させ、薄膜上にプライマーを固着してから行われる。そのため、複数のウェルに酵素及び異なるプライマーを収容した場合、反応時間を正確に制御しつつ、且つ感染病原体判定等を容易に行うことができる。
【0064】
[核酸増幅反応用マイクロチップの製造方法]
次に、図6に示すフローチャートを参照して、本変形例に係るマイクロチップの製造方法を説明する。以下、上述のマイクロチップA2を例に説明する。ただし、符号S1、S3、S4、S5における工程は、本実施形態に係る核酸増幅反応用マイクロチップAの製造方法と実質的に同一である。そのため、ここでは、符合S6、S7における工程についてのみ説明する。
【0065】
図6中、符号S6は、反応に必要な物質をウェル内へ収容する工程である。本工程では、ウェル41、42、43内にそれぞれ酵素Eの溶液を滴下し乾燥させることにより、酵素Eをウェル内に収容する。既に説明したように、ウェル内に収容する物質は、酵素に限定されず、dNTP、プライマー、バッファー溶質などであってもよい。本変形例に示すように、ウェル内に収容する物質を酵素とする場合には、活性の低下や失活を防止するため、滴下した酵素溶液は、臨界点乾燥により乾燥させることが好ましい。
【0066】
また、符合S7は、薄膜6上に反応に必要な物質を固着させる工程である。本工程では、薄膜6上にそれぞれプライマーP11、P12、P13の溶液を滴下し乾燥させることにより、プライマーをウェル内に収容する。本工程においても、既に説明したように、ウェル内に収容する物質は、プライマーに限定されず、dNTP、酵素、バッファー溶質などの物質、すなわち、薄膜6により被覆される物質以外の反応に必要な物質であってもよい。滴下したプライマー溶液は、風乾、真空乾燥あるいは凍結乾燥等によって、好ましくは緩徐に乾燥させる。
【実施例】
【0067】
<実施例1>
1.核酸等温増幅反応用マイクロチップの作製
(1)プライマーの固着化
鋳型核酸鎖に対して、「表1」に示す6種のLAMP用プライマーを設計した。PDMS製基板に形成したウェル内にプライマー溶液を0.5μl滴下し、真空乾燥(室温、0.1Pa、5分)によりウェル内に固着させた。
【0068】
【表1】

【0069】
(2)薄膜の被覆
タングステン製の蒸着ボートにステアリン酸をのせ、熱電ヒーターを接続し、真空蒸着槽内に配置した。ウェル内にプライマーを固着させた基板を真空蒸着槽内に入れて、真空(1.0×10-6Torr)とし、熱電ヒーターに電流を流してタングステンボードを加熱した。ステアリン酸が蒸着ボート上で溶液化し始めた時点でシャッターを開け、蒸着を開始した。
【0070】
蒸着は、真空飽和蒸気圧が0.1Torrになるように、ステアリン酸(融点69℃)を85℃に加熱して行った。蒸着は、基板温度30℃にて膜厚が100nmになるように行った。
【0071】
蒸着後、真空蒸着槽から取り出し、ウェル内に固着されたプライマーの表面にステアリン酸が皮膜を作っていることを干渉色で確認した。その後、基板表面をDPアッシング(O2:10cc, 100W, 30sec)により親水化し、カバーガラスと貼り合わせてマイクロチップを得た。
【0072】
2.LAMP反応
鋳型核酸鎖と酵素、インターカレーター蛍光色素(SYBR Green I, Molecular Probes Inc.)、核酸モノマー、バッファーを混合し、反応液を調製した。実施例1で作製したマイクチップの流路に反応液を注入し、ウェル内に導入した。ウェル毎に蛍光検出部や加熱部を備えた蛍光検出装置にマイクチップをセットし、反応を開始した。蛍光色素の蛍光強度に基づいて、標的核酸鎖の増幅量をリアルタイムで測定した。
【0073】
結果、LAMP反応開始後10分程度で増幅核酸鎖が検出され、良好な標的核酸鎖の定量性が確認された。
【0074】
<実施例2>
2.薄膜材料の検討
(1)LAMP反応
マイクロチューブに「表1」に示したプライマーの溶液を分注し、真空乾燥(室温、0.1Pa、5分)によりチューブ内に固着させた。ステアリン酸あるいはパラフィンワックス(Paraffin 115, 125, 130, 135, 140)をマイクロチューブに分注した後、反応液を添加した。
【0075】
また、マイクロチューブに酵素溶液を分注し、真空乾燥(室温、0.1Pa、5分)によりチューブ内に固着させた。ステアリン酸あるいはパラフィンワックス(Paraffin 115, 125, 130, 135, 140)をマイクロチューブに分注した後、プライマー溶液と、酵素以外の試薬を含む反応液とを添加した。
【0076】
チューブ毎に蛍光検出部や加熱部を備えた蛍光検出装置にマイクロチューブをセットし、反応を開始した。蛍光色素の蛍光強度に基づいて、標的核酸鎖の増幅量をリアルタイムで測定した。
【0077】
結果を、図7・8に示す。図7は、固着したプライマーをステアリン酸あるいはパラフィンワックスで被覆した反応系の結果、図8は、酵素を固着させてステアリン酸あるいはパラフィンワックスで被覆した反応系の結果を示す。いずれも、LAMP反応開始後10〜15分程度で増幅核酸鎖が検出され、パラフィンワックスについても反応阻害性がないことが確認できた。
【産業上の利用可能性】
【0078】
本発明に係る核酸増幅反応用マイクロチップ等によれば、反応時間を正確に制御して、高精度な分析を行うことができる。そのため、本発明に係る核酸増幅反応用マイクロチップ等は、遺伝子型判定や感染病原体判定などのためのマイクロチップ型の核酸増幅装置に好適に用いられ得る。
【符号の説明】
【0079】
A:核酸等温増幅反応用マイクロチップ、P1,P2,P3:プライマー、1:導入口、2:主流路、3:分岐流路、41,42,43:ウェル、5:排出口、E:酵素
【特許請求の範囲】
【請求項1】
核酸の等温増幅反応の反応場となる反応領域内に、反応に必要な物質の少なくとも一部が、常温より高く前記反応の反応温度より低い温度で融解する薄膜により被覆された状態で存在する核酸等温増幅反応用マイクロチップ。
【請求項2】
反応に必要な物質の少なくとも一部を被覆する前記薄膜上に、反応に必要な他の物質の少なくとも一部が固着されて存在する請求項1記載の核酸等温増幅反応用マイクロチップ。
【請求項3】
前記薄膜が、ステアリン酸又はパラフィンワックスの蒸着によって形成された請求項1又は2記載の核酸等温増幅反応用マイクロチップ。
【請求項4】
前記反応領域内に存在する物質が、オリゴヌクレオチドプライマー及び酵素、核酸モノマーから選択される一以上である請求項3記載の核酸等温増幅反応用マイクロチップ。
【請求項5】
酵素を被覆する前記薄膜上に、オリゴヌクレオチドプライマーが固着されて存在する請求項2記載の核酸等温増幅反応用マイクロチップ。
【請求項6】
外部から液体が導入される導入口と、複数の前記反応領域と、導入口から導入される液体を各反応領域内に供給する流路と、が配設された請求項1に記載の核酸等温増幅反応用マイクロチップ
【請求項7】
核酸の等温増幅反応の反応場となる反応領域内に収容された、反応に必要な物質の少なくとも一部を、常温より高く前記反応の反応温度より低い温度で融解する薄膜により被覆する工程を含む核酸等温増幅反応用マイクロチップの製造方法。
【請求項8】
核酸の等温増幅反応に必要な物質の少なくとも一部が、常温より高く前記反応の反応温度より低い温度で融解する薄膜により被覆されて存在する反応領域内に、反応に必要な残りの物質を導入し、反応温度まで昇温する手順を含む核酸等温増幅方法。
【請求項1】
核酸の等温増幅反応の反応場となる反応領域内に、反応に必要な物質の少なくとも一部が、常温より高く前記反応の反応温度より低い温度で融解する薄膜により被覆された状態で存在する核酸等温増幅反応用マイクロチップ。
【請求項2】
反応に必要な物質の少なくとも一部を被覆する前記薄膜上に、反応に必要な他の物質の少なくとも一部が固着されて存在する請求項1記載の核酸等温増幅反応用マイクロチップ。
【請求項3】
前記薄膜が、ステアリン酸又はパラフィンワックスの蒸着によって形成された請求項1又は2記載の核酸等温増幅反応用マイクロチップ。
【請求項4】
前記反応領域内に存在する物質が、オリゴヌクレオチドプライマー及び酵素、核酸モノマーから選択される一以上である請求項3記載の核酸等温増幅反応用マイクロチップ。
【請求項5】
酵素を被覆する前記薄膜上に、オリゴヌクレオチドプライマーが固着されて存在する請求項2記載の核酸等温増幅反応用マイクロチップ。
【請求項6】
外部から液体が導入される導入口と、複数の前記反応領域と、導入口から導入される液体を各反応領域内に供給する流路と、が配設された請求項1に記載の核酸等温増幅反応用マイクロチップ
【請求項7】
核酸の等温増幅反応の反応場となる反応領域内に収容された、反応に必要な物質の少なくとも一部を、常温より高く前記反応の反応温度より低い温度で融解する薄膜により被覆する工程を含む核酸等温増幅反応用マイクロチップの製造方法。
【請求項8】
核酸の等温増幅反応に必要な物質の少なくとも一部が、常温より高く前記反応の反応温度より低い温度で融解する薄膜により被覆されて存在する反応領域内に、反応に必要な残りの物質を導入し、反応温度まで昇温する手順を含む核酸等温増幅方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【公開番号】特開2012−24072(P2012−24072A)
【公開日】平成24年2月9日(2012.2.9)
【国際特許分類】
【出願番号】特願2010−195780(P2010−195780)
【出願日】平成22年9月1日(2010.9.1)
【出願人】(000002185)ソニー株式会社 (34,172)
【Fターム(参考)】
【公開日】平成24年2月9日(2012.2.9)
【国際特許分類】
【出願日】平成22年9月1日(2010.9.1)
【出願人】(000002185)ソニー株式会社 (34,172)
【Fターム(参考)】
[ Back to top ]

