核酸精製装置及び核酸精製方法
【課題】核酸精製装置及び前記核酸精製装置を用いる核酸精製方法を提供する。
【解決手段】試料導入口が形成されており、試料導入口を通じて試料及び磁性ビーズを収容する細胞溶解毛細管、前記細胞溶解毛細管に装着され、前記細胞溶解毛細管内で試料及び磁性ビーズを混合する振動器、前記細胞溶解毛細管に装着され、前記細胞溶解毛細管にレーザーを供給するレーザー発生部、及び前記細胞溶解毛細管に装着され、磁性ビーズを前記細胞溶解毛細管の壁に固定させる磁気力発生部を備える細胞またはウイルスの核酸精製装置、並びに前記核酸精製装置を用いる核酸精製方法である。
【解決手段】試料導入口が形成されており、試料導入口を通じて試料及び磁性ビーズを収容する細胞溶解毛細管、前記細胞溶解毛細管に装着され、前記細胞溶解毛細管内で試料及び磁性ビーズを混合する振動器、前記細胞溶解毛細管に装着され、前記細胞溶解毛細管にレーザーを供給するレーザー発生部、及び前記細胞溶解毛細管に装着され、磁性ビーズを前記細胞溶解毛細管の壁に固定させる磁気力発生部を備える細胞またはウイルスの核酸精製装置、並びに前記核酸精製装置を用いる核酸精製方法である。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、レーザー及び磁性ビーズを用いた核酸精製装置、及び核酸精製方法に関する。
【背景技術】
【0002】
細胞からDNAの効率的な抽出は、多くの用途で必要であり、分子学的診断、特に病原菌同定及び定量化に必須である。分子学的診断は、一般的にDNA抽出ステップ後のDNA増幅により行われる。DNA増幅反応には、重合酵素連鎖反応(Polymerase Chain Reaction:PCR)、リガーゼ連鎖反応、SDA(strand displacement amplification)法、核酸増幅、修復連鎖反応、ヘリカーゼ連鎖反応、QB複製酵素増幅、及び転写活性化連結が含まれる。
【0003】
細胞からDNAの分離方法は、DNAを結合する傾向を有する物質を利用して行われる。DNAの分離のための物質の例は、シリカ、ガラス繊維、陰イオン交換樹脂、及び磁性ビーズである(非特許文献1、非特許文献2参照)。手作業ステップを避け、作業者の誤りを取り除くために、いくつかの自動化機械が大量DNA抽出のために開発されている。
【0004】
細胞溶解は、一般的に機械的、化学的、熱的、電気的、超音波、及びマイクロウエーブ方法で行われる(非特許文献3参照)。
【0005】
レーザーは、細胞の破壊に対して多くの長所を有し、LOC(Lab−On−a−Chip)によく適用される(非特許文献4参照)。
【0006】
特許文献1には、レーザー誘導された細胞溶解システムが開示されている。レーザーのみを用いたとき、効果的な細胞溶解が起こらない。透明度の高い溶液内に入れた大腸菌を用いて実験した結果、レーザーのみを照射した場合、細胞溶解効率が低いということが確認されている。150秒間レーザーを照射した後のDNA濃度は3.77ng/μlであったが、これは、レーザーエネルギーが効果的に細胞に伝達されなかったためである。一般的な加熱方法によって95℃で5分間沸騰させた後のDNA濃度は6.15ng/μlである。
【0007】
特許文献2には、増加した組織修復のための、光を吸収するナノ粒子が記載されている。この特許は、一つ以上の波長で光を吸収する、直径が1〜1000nmであるナノ粒子を、組織に運んで連結させ、前記ナノ粒子を、ナノ粒子により吸収された一つ以上の波長の光に露出させることを含む、組織を連結する方法に関するものである。この方法は、レーザー及びナノ粒子を用いて細胞の機能のみを失わせる方法であり、細胞及び粒子を含む溶液を振動させて細胞を破壊する方法については記載されていない。
【0008】
従来から、固相を用いた核酸の精製方法が知られている。例えば、特許文献3には、固相に結合した核酸を用いた核酸精製方法が開示されている。具体的には、前記方法は、出発物質、カオトロピック物質、及び固相に結合した核酸を混合するステップ、前記核酸を有する固相を液体から分離するステップ、並びに前記固相核酸複合体を洗浄するステップを含む。
【特許文献1】米国特許出願公開第2003/96429A1号明細書
【特許文献2】米国特許第6,685,730号明細書
【特許文献3】米国特許第5,234,809号明細書
【非特許文献1】Rudi,K.et al.、Biotechniqures 22,506〜511(1997)
【非特許文献2】Deggerdal,A.et al.、Biotechniqures 22、554〜557(1997)
【非特許文献3】Michael T.Taylor et al.、Anal.Chem.、73、492〜496(2001)
【非特許文献4】Huaina Li et al.、Anal Chem、73、4625〜4631(2001)
【発明の開示】
【発明が解決しようとする課題】
【0009】
しかし、特許文献3に開示されている方法は、時間が長くかかり、複雑であり、それゆえLOCに適さない。また、この方法は、カオトロピック物質の使用の問題を有する。すなわち、カオトロピック物質を使用しない場合には、固相に核酸が結合しない。また、カオトロピック物質は、人体に有害な物質であるので注意して扱わなければならない。さらに、カオトロピック物質は、PCRなどの後続の工程を妨害する物質として作用するので、核酸の精製中または精製後に、精製された核酸から除去しなければならない。
【0010】
LOCの実施のためには、DNA分離の全体のステップを可能な限り減らさなければならず、このためには、細胞溶解後直ちにPCRを行うことが必要である。細胞溶解後直ちにPCRを行うためには、細胞溶解後のPCR阻害剤の濃度を減少させなければならない。したがって、LOCの実施のための、細胞溶解の間のPCR阻害剤を除去する方法が必要とされている。よって、本発明の目的は、レーザー及び磁性ビーズを用いて核酸を効率的に精製する装置及び前記核酸精製装置を用いた核酸精製方法を提供することにある。
【0011】
本発明者らは、前記従来技術の問題点を解決するために鋭意研究を積み重ねた結果、レーザー及びマイクロ磁性ビーズを共に使用して振動させて細胞またはウイルスを破壊した後、生成したPCR阻害剤を磁性ビーズに付着させ、PCR阻害剤が付着した磁性ビーズを、毛細管状の容器の壁に装着した磁石で除去することによって、核酸を効率的に精製できるということを見出し、本発明を完成するに至った。
【課題を解決するための手段】
【0012】
本発明の目的を達成するために、本発明の第一は、試料導入口が形成されており、前記試料導入口を通じて試料及び磁性ビーズを収容する細胞溶解毛細管、前記細胞溶解毛細管に装着され、前記細胞溶解毛細管内で試料及び磁性ビーズを混合する振動器、前記細胞溶解毛細管に装着され、前記細胞溶解毛細管にレーザーを供給するレーザー発生部、及び前記細胞溶解毛細管に装着され、磁性ビーズを前記細胞溶解毛細管の壁に固定させる磁気力発生部を備える、細胞またはウイルスの核酸精製装置を提供する。
【0013】
本発明の第二は、細胞またはウイルスを含む溶液を、磁性ビーズを含む毛細管状の容器に注入するステップと、前記磁性ビーズを振動させるステップと、前記磁性ビーズにレーザーを照射して細胞またはウイルスを破壊し、細胞またはウイルス溶解液中の化合物を前記磁性ビーズに結合させるステップと、前記細胞またはウイルス溶解液中の化合物が結合した磁性ビーズを、磁気力発生部によって前記毛細管状の容器の壁に固定させるステップと、前記磁性ビーズが除去された溶液を得るステップを含む、前記核酸精製装置を用いて核酸を精製する方法である。
【0014】
本発明の第三は、細胞またはウイルスを含む溶液を、磁性ビーズを含む毛細管状の容器に注入するステップと、前記磁性ビーズを振動させるステップと、前記磁性ビーズにレーザーを照射して細胞またはウイルスを破壊し、細胞またはウイルス溶解液中の化合物を前記磁性ビーズに結合させるステップと、前記細胞またはウイルス溶解液中の化合物が結合した磁性ビーズを、磁気力発生部によって前記毛細管状の容器の壁に固定させるステップと、前記磁性ビーズが除去された溶液を得た後、前記溶液を、前記毛細管状の容器及び増幅チャンバを連結する流路を通じて増幅チャンバに移送して増幅を行うステップを含む、前記核酸精製装置を用いて核酸の精製及び増幅を連続的に行う方法である。
【0015】
本発明の装置内の細胞溶解毛細管において、試料導入口を通じて投入された試料及び磁性ビーズが混合され、ここにレーザーを照射すれば細胞溶解が起こる。振動器は、細胞溶解毛細管内の試料及び磁性ビーズを混合する装置であって、振動を起こすいかなる装置でも可能である。レーザー発生部は、前記細胞溶解毛細管にレーザーを供給する装置であって、特定の一つの波長の光か、または二つ以上の波長の光を出すことができる。レーザーにより、磁性ビーズは沸騰する。
【0016】
本発明の装置において、前記振動器は、超音波振動器、磁場を利用した振動器、電場を利用した振動器、ボルテックスなどの機械式振動器、及び圧電物質を含むことができる。
【0017】
本発明の装置において、前記磁気力発生部は、レーザーの通路の上部に位置し、前記細胞溶解毛細管内の磁性ビーズが沸騰するときに電源が入る電磁石であることが望ましい。
【0018】
本発明の装置は、前記細胞溶解毛細管と流路を通じて連結されているDNA増幅チャンバをさらに備えてもよい。
【0019】
本発明の装置において、前記細胞溶解毛細管は、毛細管状の容器に対応する。
【0020】
本発明の方法において、前記レーザーは、パルスレーザーまたは連続波動(Continuous Wave:CW)レーザーを含むことができる。
【0021】
本発明の方法において、前記パルスレーザーが1mJ/パルス以上の出力を有し、CWレーザーが10mW以上の出力を有する。望ましくは、前記パルスレーザーが10mJ/パルス以上の出力を有し、前記CWレーザーが100mW以上の出力を有する。さらに望ましくは前記パルスレーザーが32mJ/パルス以上の出力を有し、前記CWレーザーが10W以上の出力を有する。
【0022】
本発明の方法において、前記レーザーは、400nm以上の波長帯で発生することが望ましく、さらに望ましくは、前記レーザーは、750nm〜1300nmの波長帯で発生する。また、前記レーザーは、一つ以上の波長帯で発生してもよい。
【0023】
本発明の方法において、前記磁性ビーズの大きさが50nm〜1,000μmであることが望ましく、さらに望ましくは1μm〜50μmである。また、前記磁性ビーズが二つ以上の大きさを有するビーズの混合物でありうる。
【0024】
本発明の方法において、前記毛細管状の容器は、直径と長さとの比率が1:2〜1:50(直径:長さ)であり、直径が1nm〜5mmである。
【0025】
本発明の方法において、前記毛細管状の容器の材質は、重合体、有機物質、ケイ素、ガラス、及び金属からなる群より選択されうる。
【0026】
本発明の方法において、前記磁性ビーズは、強磁性を有する金属であるFe、Ni、Cr、及びそれらの酸化物からなる群より選択される少なくとも一つの物質を含むことが望ましい。
【0027】
本発明の方法において、前記磁性ビーズは、強磁性を有する金属でコーティングされた重合体、有機物質、ケイ素、またはガラスでありうる。
【0028】
本発明の方法において、前記磁性ビーズの表面は、負電荷を帯びていることが望ましい。
【0029】
本発明の方法において、前記溶解液は、唾液、尿、血液、血清、及び細胞培養液からなる群より選択されうる。
【発明の効果】
【0030】
本発明の方法によれば、毛細管における層分離によって容易にPCR阻害剤を除去できるため、PCRの収率を高めることができる。さらに電磁石の使用により、PCR阻害剤の除去が確実になる。また、細胞溶解と同時にDNA精製を行えるので、LOCのステップを減らすことができる。
【発明を実施するための最良の形態】
【0031】
以下、本発明をステップ別にさらに具体的に説明する。
【0032】
本発明は、試料導入口が形成されており、前記試料導入口を通じて試料及び磁性ビーズを収容する細胞溶解毛細管、前記細胞溶解毛細管に装着され、前記細胞溶解毛細管内で試料及び磁性ビーズを混合する振動器、前記細胞溶解毛細管に装着され、前記細胞溶解毛細管にレーザーを供給するレーザー発生部、及び前記細胞溶解毛細管に装着され、磁性ビーズを前記細胞溶解毛細管の壁に固定させる磁気力発生部を備える細胞またはウイルスの核酸精製装置に関する。
【0033】
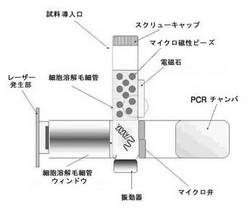
図1は、レーザー及びマイクロ磁性ビーズを用いて、細胞溶解後、磁性ビーズ層とDNA溶液層とを分離するために用いられるシステムの一実施形態を示す模式図である。試料及び磁性ビーズを、試料導入口を通じて細胞溶解毛細管に投入し、振動器によって投入された試料及び磁性ビーズを混合する。振動の間混合物にレーザーが照射されると、磁性ビーズは、レーザーを受けてレーザーアブレーション現象により光エネルギーを熱に変化させる。レーザーにより加熱された磁性ビーズは沸騰し、沸騰により変性した蛋白質及び細胞の残骸などのPCR阻害剤が磁性ビーズに付着する。PCR阻害剤が付着した磁性ビーズは、毛細管の壁に付着する。それゆえ、毛細管の下部に位置するDNAが含まれた溶液と、毛細管の上部に位置する毛細管の壁に付着したほとんどの磁性ビーズとの間の層分離が起きる。毛細管の下部に分離したDNAを含む溶液層は、PCRを実施するためにPCRチャンバに移動される。前記移動は、電気的、機械的な力を用いたポンプなどにより行われる。
【0034】
細胞溶解毛細管は、レーザーが十分に通過できる材質から構成されているか、または前記材質から構成されるウィンドウを有することができる。分離された磁性ビーズを含む層は、ガラス壁の表面に非特異的に結合するが、これは、制限的な直径を有する毛細管でさらに効率的に起きる。固定された電磁石または永久磁石は、分離された層をさらに確実に固定すると共に、固定化領域を指定するために使われうる。
【0035】
本発明の一実施形態において、前記振動器は、超音波振動器、磁場を利用した振動器、電場を利用した振動器、ボルテックスなどの機械式振動器、または圧電物質を含むことができる。振動器は、前記細胞溶解毛細管に装着されており、細胞及びマイクロ磁性ビーズの混合溶液を振動できるいかなる装置でも可能である。
【0036】
本発明の一実施形態において、前記磁気力発生部は、レーザーの通路の上部に位置し、前記細胞溶解毛細管内の磁性ビーズが沸騰するときに電源が入る電磁石であることが望ましい。図1に示すように、前記電磁石は、レーザーの通路の上部に位置させなければならないが、これは、レーザーの通路内に位置すれば、磁性ビーズがPCR阻害剤を吸着する前に電磁石に付着して、それによりPCR阻害剤の吸着の効果が低下するためである。また、細胞溶解毛細管内の磁性ビーズが沸騰するときに電源が入る電磁石であることが望ましい。磁性ビーズが沸騰する前に電源が入っていても、磁性ビーズ及び電磁石は空間的に離れていて磁気力が磁性ビーズに影響を及ぼさないので、磁性ビーズを付着できないためである。また、電磁石で除去するためには、ビーズは磁性を有していなければならない。
【0037】
本発明の一実施形態において、前記細胞溶解毛細管と弁によって開閉される流路を通じて連結されているDNA増幅チャンバをさらに備えることができる。LOCの実施のためには、精製されたDNAを増幅するシステムが必要である。精製されたDNAは、分光光度計を用いる方法、マイクロ磁性ビーズを用いる方法、電気化学的方法、電気化学発光(ECL)法、放射線及び蛍光標識を用いる方法、リアルタイムPCR法などを用いて検出されうる。所望のDNAを十分に増幅するためには、PCR法が最も適している。その他のDNA増幅の方法も適用され、リアルタイムPCR法などを通じた直接検出も可能である。
【0038】
本発明の一実施形態において、前記細胞溶解毛細管は、直径と長さとの比率が1:2〜1:50(直径:長さ)であり、直径が100nm〜5mmであることが望ましい。
【0039】
また本発明は、細胞またはウイルスを含む溶液を、磁性ビーズを含む毛細管状の容器に注入するステップ、前記磁性ビーズを振動させるステップ、前記磁性ビーズにレーザーを照射して細胞またはウイルスを破壊し、細胞またはウイルス溶解液中の化合物を前記磁性ビーズに結合させるステップ、前記細胞またはウイルス溶解液中の化合物が結合した磁性ビーズを、磁気力発生部を通じて毛細管状の容器の壁に固定させるステップ、及び前記磁性ビーズが除去された溶液を得るステップを含む、前記核酸精製装置を利用して核酸を精製する方法に関する。
【0040】
前記方法において、磁性ビーズを含む溶液にレーザーを照射し、磁性ビーズがレーザーによりアブレーション現象を起こすことによって、衝撃波、蒸気圧、及び熱を細胞の表面に伝達する。このとき、物理的衝撃も細胞表面に加えられる。レーザーアブレーションとは、レーザービームが照射された物質に発生する一般的な現象を総称する。レーザーアブレーションにより、物質表面の温度は、数百から数千度まで急速に上昇する。物質表面の温度が蒸発点以上に上昇すれば、液層の物質の蒸発と共に、表面での飽和蒸気圧が急速に上昇する。
【0041】
レーザーにより加熱された磁性ビーズは、溶液の温度を上げ、細胞を直接破壊する。溶液中の磁性ビーズは、単純な熱伝達体として存在するものではなく、熱的、機械的、及び物理的な衝撃を細胞の表面に与え、それにより細胞の表面を効果的に破壊する。
【0042】
破壊された細胞またはウイルスの溶解液は、PCRを妨害する化合物を含む。したがって、PCRを効率的に行うためには、前記溶解液からPCR阻害剤を除去する工程が必要であるが、これは、LOCを効率的に実施することに適していない。本発明の方法は、PCR阻害剤が付着した磁性ビーズを、磁気力発生部を通じて細胞溶解毛細管の壁に固定させ、PCRを容易にする。
【0043】
具体的には、沸騰により変性された蛋白質及び細胞の残骸などのPCR阻害剤が付着した磁性ビーズはレーザーにより沸騰する。PCR阻害剤が付着した磁性ビーズは、容器の壁に付着する。それゆえ、容器の下部に、磁性ビーズを含まない、DNAを含む溶液が存在し、容器の上部には、PCR阻害剤が付着したほとんどの磁性ビーズがガラス壁に付着するので、PCR阻害剤が容易に除去される。この層分離は、制限的な直径を有する毛細管でさらに効率的に起こる。固定された電磁石または永久磁石は、分離された層をさらに確実に固定すると共に、固定化領域を指定するために使われうる。
【0044】
また本発明は、細胞またはウイルスを含む溶液を、磁性ビーズを含む毛細管状の容器に注入するステップ、前記磁性ビーズを振動させるステップ、前記磁性ビーズにレーザーを照射して細胞またはウイルスを破壊し、細胞またはウイルス溶解液中の化合物を前記磁性ビーズに結合させるステップ、前記細胞またはウイルス溶解液中の化合物が結合した磁性ビーズを、磁気力発生部を通じて毛細管状の容器の壁に固定させるステップ、並びに前記磁性ビーズが除去された溶液を得た後、前記溶液を、前記毛細管状の容器及び増幅チャンバを連結する流路を通じて増幅チャンバに移送して増幅を行うステップを含む、前記核酸精製装置を用いて核酸の精製及び増幅を連続的に行う方法に関する。
【0045】
LOCを実施するためには、核酸の分離、精製、及び増幅を連続して行う必要がある。したがって、磁性ビーズによって精製されたDNA溶液を、前記毛細管状の容器及び増幅チャンバを連結する流路を通じて増幅チャンバに直ちに移送して核酸を増幅すれば、前記目的は達成される。核酸の増幅チャンバへの移送は、電気的、機械的な力を用いたポンプなどにより行われうる。
【0046】
本発明の一実施形態において、前記レーザーは、パルスレーザーまたはCWレーザーを含むことができる。
【0047】
低すぎるレーザー出力では、効率的にレーザーアブレーション現象は起こらない。レーザー出力は、CWレーザーの場合10mW〜300Wであり、パルスレーザーの場合1mJ/パルス〜1J/パルスである。望ましくは、CWレーザーは100mW〜300Wの出力を有し、パルスレーザーは10mJ/パルス〜1J/パルスの出力を有する。さらに望ましくは、CWレーザーは10W〜300Wの出力を有し、パルスレーザーは32mJ/パルス〜1J/パルスの出力を有する。CWの出力が10mW未満であり、パルスレーザーの出力が1mJ/パルス未満であれば、細胞を破壊するために十分なエネルギーが伝達されない。CWの出力が300W以上であり、パルスレーザーの出力が1J/パルス以上の場合、DNAが損傷する。
【0048】
本発明の一実施形態において、前記レーザーは、磁性ビーズがレーザーを吸収する特定の波長帯で発生しなければならない。前記レーザーは、400nm以上の波長帯で発生することが望ましく、さらに望ましくは、750nm〜1300nmの波長帯である。これは、400nm未満の波長では、DNAが変性または損傷されるためである。また、前記レーザーは、一つ以上の波長帯で発生しうる。すなわち、レーザーは、前記波長範囲内の一つの波長でもよく、相異なる二つ以上の波長でもよい。
【0049】
本発明の一実施形態において、前記磁性ビーズの大きさは50nm〜1,000μmであることが望ましく、さらに望ましくは、1μm〜50μmである。磁性ビーズの大きさが50nm未満であれば、細胞溶解を引き起こすのに不十分である。1,000μmを超えれば、LOCに効果的でない。また、前記磁性ビーズは、二つ以上の大きさを有する磁性ビーズの混合物であってもよい。すなわち、前記磁性ビーズは、互いに同じ大きさでもよく、相異なる大きさの磁性ビーズの混合物でもよい。
【0050】
本発明の一実施形態において、前記毛細管状の容器は、直径と長さとの比率が1:2〜1:50(直径:長さ)であり、直径は1nm〜5mmでありうる。磁性ビーズを含む層は、ガラス壁の表面に非特異的に結合するが、これは、制限的な直径を有する毛細管において効率的に起こる。したがって、直径が前記範囲を外れた容器の場合には、層分離が難しくなって精製効果が低下する。
【0051】
本発明の一実施形態において、前記毛細管状の容器の材質は、重合体、有機物質、ケイ素、ガラス、及び金属からなる群より選択されうる。前記容器は、ビーズが固定化されうるいかなる材質でも可能である。
【0052】
本発明の一実施形態において、前記磁性ビーズは、磁性を有するいかなるものも可能である。特に、強磁性を有する金属であるFe、Ni、Cr、及びそれらの酸化物からなる群より選択される少なくとも一つの物質を含むことが望ましい。
【0053】
本発明の一実施形態において、前記磁性ビーズは、強磁性を有する金属でコーティングされた重合体、有機物質、ケイ素、またはガラスでありうる。
【0054】
本発明の一実施形態において、前記磁性ビーズの表面は、DNAが付着しない負電荷を帯びていることが望ましい。前記負電荷は、COO−でありうる。DNAが負電荷を有しているため、反発力により、負電荷を帯びた磁性ビーズの表面にDNAは付着しない。磁性ビーズの表面にDNAが付着すれば、細胞が破壊された後で磁性ビーズからDNAを分離することが難しくなり、DNAの精製がより難しくなる。
【0055】
本発明の一実施形態において、前記溶解液が、唾液、尿、血液、血清、及び細胞培養液からなる群より選択されうる。前記溶解液は、動物細胞、植物細胞、バクテリア、ウイルス、ファージなど核酸を有するいかなるものでも可能である。
【実施例】
【0056】
以下、実施例を通じて本発明をさらに詳細に説明する。これらの実施例は、単に本発明を例示するためのものであり、本発明の範囲がこれらの実施例により制限されると解釈されてはならない。
【0057】
調製例1:細胞溶解システム
図1に示すように、下記のように調製されたB型肝炎ウイルス(HBV)(60μl)、血清(30μl)、及びマイクロ磁性ビーズ(30μl、Dynabeads(登録商標)M−270カルボン酸、ノルウェー、DYNAL社製)を毛細管内で混合した。毛細管をボルテキシングにより攪拌しながら、各実験で指定された時間内に細胞を破壊するために808nm、21.1W(HLU25F100−808、ドイツ、LIMO社製)の高出力レーザービームを照射した(図1参照)。
【0058】
調製例2:HBV、プライマー、及びPCR
細胞から放出されたDNAは、下記の対のPCRプライマーを使用して検出された:プライマーTMP5−F(配列番号1)、及びプライマーTMP5−R(配列番号2)。このプライマー対は、HBVゲノムの2,269〜2,387ヌクレオチドに該当する部位であった。PCR増幅を、Taq重合酵素(韓国、Takara社製)を用いて40サイクル(50℃で10分、95℃で1分間予備変性、95℃で5秒間変性、62℃で15秒間アニーリング及び伸長)行った。増幅されたDNAを、市販のDNA500アッセイサイジングの試薬セットを用いて、Agilent BioAnalyzer 2100(カリフォルニア州パロアルト、Agilent Technologies社製)で分析した。
【0059】
実施例1:磁性ビーズ層及びDNA溶液層の分離
容器の形態による磁性ビーズ層及びDNAを含む溶液層の層分離の程度を調べるために、多様な種類の容器を用いて層分離の程度を観察した。図2は、内径が9.95mmであり、レーザー照射後の磁性ビーズ層及びDNA溶液層が混合されている容器の写真である。図2に示すように、容器の内径が9.95mmである場合には、変性された蛋白質及び細胞の残骸などのPCR阻害剤が付着した磁性ビーズがガラス壁に付着せず、DNAを含む溶液に混合されて、磁性ビーズ層及びDNAを含む溶液層が分離されないということが分かる。
【0060】
図3は、内径が4.88mmであり、レーザー照射後の磁性ビーズ層及びDNA溶液層が分離されている容器の写真である。Aは、磁性ビーズ層及びDNAを含む溶液層が分離されている容器を示し、Bは、Aに示す容器の拡大写真である。図3に示すように、内径が4.88mmである毛細管の場合には、PCR阻害剤が付着した磁性ビーズ層及びDNAを含む溶液層が明確に分離されるということが分かる。すなわち、分離された層に含まれている磁性ビーズは、ガラス壁の表面に非特異的に結合し、これは、直径が5mm以下である毛細管でのみ起こる。
【0061】
実施例2:磁性ビーズへのPCR阻害剤の結合
磁性ビーズにPCR阻害剤が結合されるか否かを確認するために、走査電子顕微鏡(SEM)観察を実施した。図4は、Pure Dynabeads(登録商標)M−270カルボン酸のSEM写真である。Pure Dynabeads(登録商標)M−270カルボン酸は、直径が2.8±0.2μmであり、溶液内のビーズの濃度は6×107ビーズ/30μlであった。図4に示すように、純粋な磁性ビーズは、何も付着していなかった。また、DNAは負電荷を帯びているので、磁性ビーズに付着していなかった。図5は、レーザー処理による細胞溶解後、ガラス壁に付着したDynabeads(登録商標)M−270カルボン酸のSEM写真である。図5から明らかなように、多くの粒子が磁性ビーズに付着していた。前記粒子は、主に変性された蛋白質及び細胞の残骸であり、それらは、PCRを妨害する主要なPCR阻害剤であった。図6は、レーザー処理による細胞溶解後、ガラス容器の中央部から採取したDynabeads(登録商標)M−270カルボン酸のSEM写真である。図6から明らかなように、多くの粒子が磁性ビーズに付着していた。このことから、PCR阻害剤として作用する変性された蛋白質及び細胞の残骸は、磁性ビーズを用いて容易に除去できる。
【0062】
実施例3:DNA精製方法によるPCR増幅効果
DNA精製方法を変えたときのPCR増幅効果を研究するために、Lightcycler毛細管(内径:2.42mm、高さ:35.40mm、内径:高さ=1:14.63)内で細胞を溶解させ、得られた溶解液を用いてPCRを行った。図7は、DNA精製方法を変えたときのPCR産物の、電気泳動の結果を示す図である。矢印で表示されたバンドは、所望のPCR産物に該当する。レーン1、2は、磁性ビーズの不在下でレーザーをそれぞれ60秒、及び90秒照射した後PCRを行った結果であり、レーン3、4は、磁性ビーズの存在下でレーザーをそれぞれ5秒、及び10秒照射した後PCRを行った結果であり、レーン5は、組み替えHBV(rHBV)の直接PCRの結果であり、レーン6は、PCR陽性コントロールであって、Qiagen Ultrasenseキットを用いてDNAを精製した後でPCRを行った結果であり、レーン7は、PCR陰性コントロールであって、蒸留水のみを用いてPCRを行った結果である。各試料の組成は、下記の表の通りであった。
【0063】
【表1】

【0064】
図7から明らかなように、磁性ビーズなしにレーザーの照射のみを行った場合(レーン1、2)には、PCR産物が観察されず、また、rHBVを直接PCRした場合(レーン5)にも、PCR産物が観察されなかった。しかし、本発明の場合、すなわち磁性ビーズの存在下でレーザーを照射した場合(レーン3、4)には、所望の位置にPCR産物が観察された。また、Qiagen Ultrasenseキットを用いてDNAを精製した後でPCRを行った場合(レーン6)にも、所望のPCR産物が観察された。これらの結果から、本発明の方法は、精製に多くの時間及びステップが必要とされる陽性コントロールであるQiagen Ultrasenseキットを用いてDNAを精製した場合と、同様のPCR効率を表す。したがって、本発明の方法は、別途のDNA精製のステップなしに、PCR効率よく行われるので、LOCに有効に適用されうる。
【0065】
図8は、増幅されたPCR産物の濃度を示すグラフである。縦軸は、増幅されたDNAの濃度(ng/μl)を表す。PCR産物の量は、Agilent BioAnalyzer 2100を用いて定量化された。図8から明らかなように、本発明の方法を用いたPCRの結果は、Qiagen Ultrasenseキットを用いた結果と同様であるか、または優れている。したがって、本発明の方法によれば、別途の精製工程なしで、DNA分析のためのPCRが容易に行われうる。
【0066】
実施例4:レーザー照射時間による溶液中の蛋白質の量の比較
細胞溶解後、磁性ビーズにより吸収された蛋白質の量がどれほどかを研究するために、レーザー照射時間を変えたときの細胞溶解物中に存在する蛋白質の量を調べた。細胞溶解後に溶解物中に存在する蛋白質の量は、CBQCA蛋白質定量キット(C−6667、Molecular Probes社製、調製マニュアルを参考にした)を用いて測定した。図9は、レーザー照射時間を変えたときの細胞溶解物中に存在する蛋白質の量を示すグラフである。図9に示すように、レーザー照射時間が10秒、及び15秒であるとき、溶解物中の蛋白質の量が顕著に減少した。レーザー照射時間が10秒であるとき、溶解物中の蛋白質量の顕著な減少は、PCR増幅が十分に行われるということを示しており、これは、前記図7及び図8の結果とも一致する。
【産業上の利用可能性】
【0067】
本発明は、レーザー及び磁性ビーズを利用した核酸精製装置関連の技術分野に適用可能である。
【図面の簡単な説明】
【0068】
【図1】レーザー及びマイクロ磁性ビーズを用いて細胞溶解を行った後に、マイクロ磁性ビーズ層及びDNA溶解液層が分離されている、システムの一実施形態を表す模式図である。
【図2】内径が9.95mmであり、レーザー照射後磁性ビーズ層及びDNA溶液層が混合されている容器の写真である。
【図3】内径が4.88mmであり、レーザー照射後磁性ビーズ層及びDNA溶液層が分離されている容器の写真である。
【図4】Pure Dynabeads(登録商標)M−270カルボン酸のSEM写真である。
【図5】レーザー照射による細胞溶解後、ガラス壁に付着したDynabeads(登録商標)M−270カルボン酸のSEM写真である。
【図6】レーザー照射による細胞溶解後、ガラス容器の中央部から採取したDynabeads(登録商標)M−270カルボン酸のSEM写真である。
【図7】DNAの精製方法を変えたときのPCR産物の電気泳動の結果を示す図である。
【図8】増幅されたPCR産物の濃度を示すグラフである。
【図9】レーザー照射時間を変えたときの細胞溶解物中の蛋白質の量を示すグラフである。
【技術分野】
【0001】
本発明は、レーザー及び磁性ビーズを用いた核酸精製装置、及び核酸精製方法に関する。
【背景技術】
【0002】
細胞からDNAの効率的な抽出は、多くの用途で必要であり、分子学的診断、特に病原菌同定及び定量化に必須である。分子学的診断は、一般的にDNA抽出ステップ後のDNA増幅により行われる。DNA増幅反応には、重合酵素連鎖反応(Polymerase Chain Reaction:PCR)、リガーゼ連鎖反応、SDA(strand displacement amplification)法、核酸増幅、修復連鎖反応、ヘリカーゼ連鎖反応、QB複製酵素増幅、及び転写活性化連結が含まれる。
【0003】
細胞からDNAの分離方法は、DNAを結合する傾向を有する物質を利用して行われる。DNAの分離のための物質の例は、シリカ、ガラス繊維、陰イオン交換樹脂、及び磁性ビーズである(非特許文献1、非特許文献2参照)。手作業ステップを避け、作業者の誤りを取り除くために、いくつかの自動化機械が大量DNA抽出のために開発されている。
【0004】
細胞溶解は、一般的に機械的、化学的、熱的、電気的、超音波、及びマイクロウエーブ方法で行われる(非特許文献3参照)。
【0005】
レーザーは、細胞の破壊に対して多くの長所を有し、LOC(Lab−On−a−Chip)によく適用される(非特許文献4参照)。
【0006】
特許文献1には、レーザー誘導された細胞溶解システムが開示されている。レーザーのみを用いたとき、効果的な細胞溶解が起こらない。透明度の高い溶液内に入れた大腸菌を用いて実験した結果、レーザーのみを照射した場合、細胞溶解効率が低いということが確認されている。150秒間レーザーを照射した後のDNA濃度は3.77ng/μlであったが、これは、レーザーエネルギーが効果的に細胞に伝達されなかったためである。一般的な加熱方法によって95℃で5分間沸騰させた後のDNA濃度は6.15ng/μlである。
【0007】
特許文献2には、増加した組織修復のための、光を吸収するナノ粒子が記載されている。この特許は、一つ以上の波長で光を吸収する、直径が1〜1000nmであるナノ粒子を、組織に運んで連結させ、前記ナノ粒子を、ナノ粒子により吸収された一つ以上の波長の光に露出させることを含む、組織を連結する方法に関するものである。この方法は、レーザー及びナノ粒子を用いて細胞の機能のみを失わせる方法であり、細胞及び粒子を含む溶液を振動させて細胞を破壊する方法については記載されていない。
【0008】
従来から、固相を用いた核酸の精製方法が知られている。例えば、特許文献3には、固相に結合した核酸を用いた核酸精製方法が開示されている。具体的には、前記方法は、出発物質、カオトロピック物質、及び固相に結合した核酸を混合するステップ、前記核酸を有する固相を液体から分離するステップ、並びに前記固相核酸複合体を洗浄するステップを含む。
【特許文献1】米国特許出願公開第2003/96429A1号明細書
【特許文献2】米国特許第6,685,730号明細書
【特許文献3】米国特許第5,234,809号明細書
【非特許文献1】Rudi,K.et al.、Biotechniqures 22,506〜511(1997)
【非特許文献2】Deggerdal,A.et al.、Biotechniqures 22、554〜557(1997)
【非特許文献3】Michael T.Taylor et al.、Anal.Chem.、73、492〜496(2001)
【非特許文献4】Huaina Li et al.、Anal Chem、73、4625〜4631(2001)
【発明の開示】
【発明が解決しようとする課題】
【0009】
しかし、特許文献3に開示されている方法は、時間が長くかかり、複雑であり、それゆえLOCに適さない。また、この方法は、カオトロピック物質の使用の問題を有する。すなわち、カオトロピック物質を使用しない場合には、固相に核酸が結合しない。また、カオトロピック物質は、人体に有害な物質であるので注意して扱わなければならない。さらに、カオトロピック物質は、PCRなどの後続の工程を妨害する物質として作用するので、核酸の精製中または精製後に、精製された核酸から除去しなければならない。
【0010】
LOCの実施のためには、DNA分離の全体のステップを可能な限り減らさなければならず、このためには、細胞溶解後直ちにPCRを行うことが必要である。細胞溶解後直ちにPCRを行うためには、細胞溶解後のPCR阻害剤の濃度を減少させなければならない。したがって、LOCの実施のための、細胞溶解の間のPCR阻害剤を除去する方法が必要とされている。よって、本発明の目的は、レーザー及び磁性ビーズを用いて核酸を効率的に精製する装置及び前記核酸精製装置を用いた核酸精製方法を提供することにある。
【0011】
本発明者らは、前記従来技術の問題点を解決するために鋭意研究を積み重ねた結果、レーザー及びマイクロ磁性ビーズを共に使用して振動させて細胞またはウイルスを破壊した後、生成したPCR阻害剤を磁性ビーズに付着させ、PCR阻害剤が付着した磁性ビーズを、毛細管状の容器の壁に装着した磁石で除去することによって、核酸を効率的に精製できるということを見出し、本発明を完成するに至った。
【課題を解決するための手段】
【0012】
本発明の目的を達成するために、本発明の第一は、試料導入口が形成されており、前記試料導入口を通じて試料及び磁性ビーズを収容する細胞溶解毛細管、前記細胞溶解毛細管に装着され、前記細胞溶解毛細管内で試料及び磁性ビーズを混合する振動器、前記細胞溶解毛細管に装着され、前記細胞溶解毛細管にレーザーを供給するレーザー発生部、及び前記細胞溶解毛細管に装着され、磁性ビーズを前記細胞溶解毛細管の壁に固定させる磁気力発生部を備える、細胞またはウイルスの核酸精製装置を提供する。
【0013】
本発明の第二は、細胞またはウイルスを含む溶液を、磁性ビーズを含む毛細管状の容器に注入するステップと、前記磁性ビーズを振動させるステップと、前記磁性ビーズにレーザーを照射して細胞またはウイルスを破壊し、細胞またはウイルス溶解液中の化合物を前記磁性ビーズに結合させるステップと、前記細胞またはウイルス溶解液中の化合物が結合した磁性ビーズを、磁気力発生部によって前記毛細管状の容器の壁に固定させるステップと、前記磁性ビーズが除去された溶液を得るステップを含む、前記核酸精製装置を用いて核酸を精製する方法である。
【0014】
本発明の第三は、細胞またはウイルスを含む溶液を、磁性ビーズを含む毛細管状の容器に注入するステップと、前記磁性ビーズを振動させるステップと、前記磁性ビーズにレーザーを照射して細胞またはウイルスを破壊し、細胞またはウイルス溶解液中の化合物を前記磁性ビーズに結合させるステップと、前記細胞またはウイルス溶解液中の化合物が結合した磁性ビーズを、磁気力発生部によって前記毛細管状の容器の壁に固定させるステップと、前記磁性ビーズが除去された溶液を得た後、前記溶液を、前記毛細管状の容器及び増幅チャンバを連結する流路を通じて増幅チャンバに移送して増幅を行うステップを含む、前記核酸精製装置を用いて核酸の精製及び増幅を連続的に行う方法である。
【0015】
本発明の装置内の細胞溶解毛細管において、試料導入口を通じて投入された試料及び磁性ビーズが混合され、ここにレーザーを照射すれば細胞溶解が起こる。振動器は、細胞溶解毛細管内の試料及び磁性ビーズを混合する装置であって、振動を起こすいかなる装置でも可能である。レーザー発生部は、前記細胞溶解毛細管にレーザーを供給する装置であって、特定の一つの波長の光か、または二つ以上の波長の光を出すことができる。レーザーにより、磁性ビーズは沸騰する。
【0016】
本発明の装置において、前記振動器は、超音波振動器、磁場を利用した振動器、電場を利用した振動器、ボルテックスなどの機械式振動器、及び圧電物質を含むことができる。
【0017】
本発明の装置において、前記磁気力発生部は、レーザーの通路の上部に位置し、前記細胞溶解毛細管内の磁性ビーズが沸騰するときに電源が入る電磁石であることが望ましい。
【0018】
本発明の装置は、前記細胞溶解毛細管と流路を通じて連結されているDNA増幅チャンバをさらに備えてもよい。
【0019】
本発明の装置において、前記細胞溶解毛細管は、毛細管状の容器に対応する。
【0020】
本発明の方法において、前記レーザーは、パルスレーザーまたは連続波動(Continuous Wave:CW)レーザーを含むことができる。
【0021】
本発明の方法において、前記パルスレーザーが1mJ/パルス以上の出力を有し、CWレーザーが10mW以上の出力を有する。望ましくは、前記パルスレーザーが10mJ/パルス以上の出力を有し、前記CWレーザーが100mW以上の出力を有する。さらに望ましくは前記パルスレーザーが32mJ/パルス以上の出力を有し、前記CWレーザーが10W以上の出力を有する。
【0022】
本発明の方法において、前記レーザーは、400nm以上の波長帯で発生することが望ましく、さらに望ましくは、前記レーザーは、750nm〜1300nmの波長帯で発生する。また、前記レーザーは、一つ以上の波長帯で発生してもよい。
【0023】
本発明の方法において、前記磁性ビーズの大きさが50nm〜1,000μmであることが望ましく、さらに望ましくは1μm〜50μmである。また、前記磁性ビーズが二つ以上の大きさを有するビーズの混合物でありうる。
【0024】
本発明の方法において、前記毛細管状の容器は、直径と長さとの比率が1:2〜1:50(直径:長さ)であり、直径が1nm〜5mmである。
【0025】
本発明の方法において、前記毛細管状の容器の材質は、重合体、有機物質、ケイ素、ガラス、及び金属からなる群より選択されうる。
【0026】
本発明の方法において、前記磁性ビーズは、強磁性を有する金属であるFe、Ni、Cr、及びそれらの酸化物からなる群より選択される少なくとも一つの物質を含むことが望ましい。
【0027】
本発明の方法において、前記磁性ビーズは、強磁性を有する金属でコーティングされた重合体、有機物質、ケイ素、またはガラスでありうる。
【0028】
本発明の方法において、前記磁性ビーズの表面は、負電荷を帯びていることが望ましい。
【0029】
本発明の方法において、前記溶解液は、唾液、尿、血液、血清、及び細胞培養液からなる群より選択されうる。
【発明の効果】
【0030】
本発明の方法によれば、毛細管における層分離によって容易にPCR阻害剤を除去できるため、PCRの収率を高めることができる。さらに電磁石の使用により、PCR阻害剤の除去が確実になる。また、細胞溶解と同時にDNA精製を行えるので、LOCのステップを減らすことができる。
【発明を実施するための最良の形態】
【0031】
以下、本発明をステップ別にさらに具体的に説明する。
【0032】
本発明は、試料導入口が形成されており、前記試料導入口を通じて試料及び磁性ビーズを収容する細胞溶解毛細管、前記細胞溶解毛細管に装着され、前記細胞溶解毛細管内で試料及び磁性ビーズを混合する振動器、前記細胞溶解毛細管に装着され、前記細胞溶解毛細管にレーザーを供給するレーザー発生部、及び前記細胞溶解毛細管に装着され、磁性ビーズを前記細胞溶解毛細管の壁に固定させる磁気力発生部を備える細胞またはウイルスの核酸精製装置に関する。
【0033】
図1は、レーザー及びマイクロ磁性ビーズを用いて、細胞溶解後、磁性ビーズ層とDNA溶液層とを分離するために用いられるシステムの一実施形態を示す模式図である。試料及び磁性ビーズを、試料導入口を通じて細胞溶解毛細管に投入し、振動器によって投入された試料及び磁性ビーズを混合する。振動の間混合物にレーザーが照射されると、磁性ビーズは、レーザーを受けてレーザーアブレーション現象により光エネルギーを熱に変化させる。レーザーにより加熱された磁性ビーズは沸騰し、沸騰により変性した蛋白質及び細胞の残骸などのPCR阻害剤が磁性ビーズに付着する。PCR阻害剤が付着した磁性ビーズは、毛細管の壁に付着する。それゆえ、毛細管の下部に位置するDNAが含まれた溶液と、毛細管の上部に位置する毛細管の壁に付着したほとんどの磁性ビーズとの間の層分離が起きる。毛細管の下部に分離したDNAを含む溶液層は、PCRを実施するためにPCRチャンバに移動される。前記移動は、電気的、機械的な力を用いたポンプなどにより行われる。
【0034】
細胞溶解毛細管は、レーザーが十分に通過できる材質から構成されているか、または前記材質から構成されるウィンドウを有することができる。分離された磁性ビーズを含む層は、ガラス壁の表面に非特異的に結合するが、これは、制限的な直径を有する毛細管でさらに効率的に起きる。固定された電磁石または永久磁石は、分離された層をさらに確実に固定すると共に、固定化領域を指定するために使われうる。
【0035】
本発明の一実施形態において、前記振動器は、超音波振動器、磁場を利用した振動器、電場を利用した振動器、ボルテックスなどの機械式振動器、または圧電物質を含むことができる。振動器は、前記細胞溶解毛細管に装着されており、細胞及びマイクロ磁性ビーズの混合溶液を振動できるいかなる装置でも可能である。
【0036】
本発明の一実施形態において、前記磁気力発生部は、レーザーの通路の上部に位置し、前記細胞溶解毛細管内の磁性ビーズが沸騰するときに電源が入る電磁石であることが望ましい。図1に示すように、前記電磁石は、レーザーの通路の上部に位置させなければならないが、これは、レーザーの通路内に位置すれば、磁性ビーズがPCR阻害剤を吸着する前に電磁石に付着して、それによりPCR阻害剤の吸着の効果が低下するためである。また、細胞溶解毛細管内の磁性ビーズが沸騰するときに電源が入る電磁石であることが望ましい。磁性ビーズが沸騰する前に電源が入っていても、磁性ビーズ及び電磁石は空間的に離れていて磁気力が磁性ビーズに影響を及ぼさないので、磁性ビーズを付着できないためである。また、電磁石で除去するためには、ビーズは磁性を有していなければならない。
【0037】
本発明の一実施形態において、前記細胞溶解毛細管と弁によって開閉される流路を通じて連結されているDNA増幅チャンバをさらに備えることができる。LOCの実施のためには、精製されたDNAを増幅するシステムが必要である。精製されたDNAは、分光光度計を用いる方法、マイクロ磁性ビーズを用いる方法、電気化学的方法、電気化学発光(ECL)法、放射線及び蛍光標識を用いる方法、リアルタイムPCR法などを用いて検出されうる。所望のDNAを十分に増幅するためには、PCR法が最も適している。その他のDNA増幅の方法も適用され、リアルタイムPCR法などを通じた直接検出も可能である。
【0038】
本発明の一実施形態において、前記細胞溶解毛細管は、直径と長さとの比率が1:2〜1:50(直径:長さ)であり、直径が100nm〜5mmであることが望ましい。
【0039】
また本発明は、細胞またはウイルスを含む溶液を、磁性ビーズを含む毛細管状の容器に注入するステップ、前記磁性ビーズを振動させるステップ、前記磁性ビーズにレーザーを照射して細胞またはウイルスを破壊し、細胞またはウイルス溶解液中の化合物を前記磁性ビーズに結合させるステップ、前記細胞またはウイルス溶解液中の化合物が結合した磁性ビーズを、磁気力発生部を通じて毛細管状の容器の壁に固定させるステップ、及び前記磁性ビーズが除去された溶液を得るステップを含む、前記核酸精製装置を利用して核酸を精製する方法に関する。
【0040】
前記方法において、磁性ビーズを含む溶液にレーザーを照射し、磁性ビーズがレーザーによりアブレーション現象を起こすことによって、衝撃波、蒸気圧、及び熱を細胞の表面に伝達する。このとき、物理的衝撃も細胞表面に加えられる。レーザーアブレーションとは、レーザービームが照射された物質に発生する一般的な現象を総称する。レーザーアブレーションにより、物質表面の温度は、数百から数千度まで急速に上昇する。物質表面の温度が蒸発点以上に上昇すれば、液層の物質の蒸発と共に、表面での飽和蒸気圧が急速に上昇する。
【0041】
レーザーにより加熱された磁性ビーズは、溶液の温度を上げ、細胞を直接破壊する。溶液中の磁性ビーズは、単純な熱伝達体として存在するものではなく、熱的、機械的、及び物理的な衝撃を細胞の表面に与え、それにより細胞の表面を効果的に破壊する。
【0042】
破壊された細胞またはウイルスの溶解液は、PCRを妨害する化合物を含む。したがって、PCRを効率的に行うためには、前記溶解液からPCR阻害剤を除去する工程が必要であるが、これは、LOCを効率的に実施することに適していない。本発明の方法は、PCR阻害剤が付着した磁性ビーズを、磁気力発生部を通じて細胞溶解毛細管の壁に固定させ、PCRを容易にする。
【0043】
具体的には、沸騰により変性された蛋白質及び細胞の残骸などのPCR阻害剤が付着した磁性ビーズはレーザーにより沸騰する。PCR阻害剤が付着した磁性ビーズは、容器の壁に付着する。それゆえ、容器の下部に、磁性ビーズを含まない、DNAを含む溶液が存在し、容器の上部には、PCR阻害剤が付着したほとんどの磁性ビーズがガラス壁に付着するので、PCR阻害剤が容易に除去される。この層分離は、制限的な直径を有する毛細管でさらに効率的に起こる。固定された電磁石または永久磁石は、分離された層をさらに確実に固定すると共に、固定化領域を指定するために使われうる。
【0044】
また本発明は、細胞またはウイルスを含む溶液を、磁性ビーズを含む毛細管状の容器に注入するステップ、前記磁性ビーズを振動させるステップ、前記磁性ビーズにレーザーを照射して細胞またはウイルスを破壊し、細胞またはウイルス溶解液中の化合物を前記磁性ビーズに結合させるステップ、前記細胞またはウイルス溶解液中の化合物が結合した磁性ビーズを、磁気力発生部を通じて毛細管状の容器の壁に固定させるステップ、並びに前記磁性ビーズが除去された溶液を得た後、前記溶液を、前記毛細管状の容器及び増幅チャンバを連結する流路を通じて増幅チャンバに移送して増幅を行うステップを含む、前記核酸精製装置を用いて核酸の精製及び増幅を連続的に行う方法に関する。
【0045】
LOCを実施するためには、核酸の分離、精製、及び増幅を連続して行う必要がある。したがって、磁性ビーズによって精製されたDNA溶液を、前記毛細管状の容器及び増幅チャンバを連結する流路を通じて増幅チャンバに直ちに移送して核酸を増幅すれば、前記目的は達成される。核酸の増幅チャンバへの移送は、電気的、機械的な力を用いたポンプなどにより行われうる。
【0046】
本発明の一実施形態において、前記レーザーは、パルスレーザーまたはCWレーザーを含むことができる。
【0047】
低すぎるレーザー出力では、効率的にレーザーアブレーション現象は起こらない。レーザー出力は、CWレーザーの場合10mW〜300Wであり、パルスレーザーの場合1mJ/パルス〜1J/パルスである。望ましくは、CWレーザーは100mW〜300Wの出力を有し、パルスレーザーは10mJ/パルス〜1J/パルスの出力を有する。さらに望ましくは、CWレーザーは10W〜300Wの出力を有し、パルスレーザーは32mJ/パルス〜1J/パルスの出力を有する。CWの出力が10mW未満であり、パルスレーザーの出力が1mJ/パルス未満であれば、細胞を破壊するために十分なエネルギーが伝達されない。CWの出力が300W以上であり、パルスレーザーの出力が1J/パルス以上の場合、DNAが損傷する。
【0048】
本発明の一実施形態において、前記レーザーは、磁性ビーズがレーザーを吸収する特定の波長帯で発生しなければならない。前記レーザーは、400nm以上の波長帯で発生することが望ましく、さらに望ましくは、750nm〜1300nmの波長帯である。これは、400nm未満の波長では、DNAが変性または損傷されるためである。また、前記レーザーは、一つ以上の波長帯で発生しうる。すなわち、レーザーは、前記波長範囲内の一つの波長でもよく、相異なる二つ以上の波長でもよい。
【0049】
本発明の一実施形態において、前記磁性ビーズの大きさは50nm〜1,000μmであることが望ましく、さらに望ましくは、1μm〜50μmである。磁性ビーズの大きさが50nm未満であれば、細胞溶解を引き起こすのに不十分である。1,000μmを超えれば、LOCに効果的でない。また、前記磁性ビーズは、二つ以上の大きさを有する磁性ビーズの混合物であってもよい。すなわち、前記磁性ビーズは、互いに同じ大きさでもよく、相異なる大きさの磁性ビーズの混合物でもよい。
【0050】
本発明の一実施形態において、前記毛細管状の容器は、直径と長さとの比率が1:2〜1:50(直径:長さ)であり、直径は1nm〜5mmでありうる。磁性ビーズを含む層は、ガラス壁の表面に非特異的に結合するが、これは、制限的な直径を有する毛細管において効率的に起こる。したがって、直径が前記範囲を外れた容器の場合には、層分離が難しくなって精製効果が低下する。
【0051】
本発明の一実施形態において、前記毛細管状の容器の材質は、重合体、有機物質、ケイ素、ガラス、及び金属からなる群より選択されうる。前記容器は、ビーズが固定化されうるいかなる材質でも可能である。
【0052】
本発明の一実施形態において、前記磁性ビーズは、磁性を有するいかなるものも可能である。特に、強磁性を有する金属であるFe、Ni、Cr、及びそれらの酸化物からなる群より選択される少なくとも一つの物質を含むことが望ましい。
【0053】
本発明の一実施形態において、前記磁性ビーズは、強磁性を有する金属でコーティングされた重合体、有機物質、ケイ素、またはガラスでありうる。
【0054】
本発明の一実施形態において、前記磁性ビーズの表面は、DNAが付着しない負電荷を帯びていることが望ましい。前記負電荷は、COO−でありうる。DNAが負電荷を有しているため、反発力により、負電荷を帯びた磁性ビーズの表面にDNAは付着しない。磁性ビーズの表面にDNAが付着すれば、細胞が破壊された後で磁性ビーズからDNAを分離することが難しくなり、DNAの精製がより難しくなる。
【0055】
本発明の一実施形態において、前記溶解液が、唾液、尿、血液、血清、及び細胞培養液からなる群より選択されうる。前記溶解液は、動物細胞、植物細胞、バクテリア、ウイルス、ファージなど核酸を有するいかなるものでも可能である。
【実施例】
【0056】
以下、実施例を通じて本発明をさらに詳細に説明する。これらの実施例は、単に本発明を例示するためのものであり、本発明の範囲がこれらの実施例により制限されると解釈されてはならない。
【0057】
調製例1:細胞溶解システム
図1に示すように、下記のように調製されたB型肝炎ウイルス(HBV)(60μl)、血清(30μl)、及びマイクロ磁性ビーズ(30μl、Dynabeads(登録商標)M−270カルボン酸、ノルウェー、DYNAL社製)を毛細管内で混合した。毛細管をボルテキシングにより攪拌しながら、各実験で指定された時間内に細胞を破壊するために808nm、21.1W(HLU25F100−808、ドイツ、LIMO社製)の高出力レーザービームを照射した(図1参照)。
【0058】
調製例2:HBV、プライマー、及びPCR
細胞から放出されたDNAは、下記の対のPCRプライマーを使用して検出された:プライマーTMP5−F(配列番号1)、及びプライマーTMP5−R(配列番号2)。このプライマー対は、HBVゲノムの2,269〜2,387ヌクレオチドに該当する部位であった。PCR増幅を、Taq重合酵素(韓国、Takara社製)を用いて40サイクル(50℃で10分、95℃で1分間予備変性、95℃で5秒間変性、62℃で15秒間アニーリング及び伸長)行った。増幅されたDNAを、市販のDNA500アッセイサイジングの試薬セットを用いて、Agilent BioAnalyzer 2100(カリフォルニア州パロアルト、Agilent Technologies社製)で分析した。
【0059】
実施例1:磁性ビーズ層及びDNA溶液層の分離
容器の形態による磁性ビーズ層及びDNAを含む溶液層の層分離の程度を調べるために、多様な種類の容器を用いて層分離の程度を観察した。図2は、内径が9.95mmであり、レーザー照射後の磁性ビーズ層及びDNA溶液層が混合されている容器の写真である。図2に示すように、容器の内径が9.95mmである場合には、変性された蛋白質及び細胞の残骸などのPCR阻害剤が付着した磁性ビーズがガラス壁に付着せず、DNAを含む溶液に混合されて、磁性ビーズ層及びDNAを含む溶液層が分離されないということが分かる。
【0060】
図3は、内径が4.88mmであり、レーザー照射後の磁性ビーズ層及びDNA溶液層が分離されている容器の写真である。Aは、磁性ビーズ層及びDNAを含む溶液層が分離されている容器を示し、Bは、Aに示す容器の拡大写真である。図3に示すように、内径が4.88mmである毛細管の場合には、PCR阻害剤が付着した磁性ビーズ層及びDNAを含む溶液層が明確に分離されるということが分かる。すなわち、分離された層に含まれている磁性ビーズは、ガラス壁の表面に非特異的に結合し、これは、直径が5mm以下である毛細管でのみ起こる。
【0061】
実施例2:磁性ビーズへのPCR阻害剤の結合
磁性ビーズにPCR阻害剤が結合されるか否かを確認するために、走査電子顕微鏡(SEM)観察を実施した。図4は、Pure Dynabeads(登録商標)M−270カルボン酸のSEM写真である。Pure Dynabeads(登録商標)M−270カルボン酸は、直径が2.8±0.2μmであり、溶液内のビーズの濃度は6×107ビーズ/30μlであった。図4に示すように、純粋な磁性ビーズは、何も付着していなかった。また、DNAは負電荷を帯びているので、磁性ビーズに付着していなかった。図5は、レーザー処理による細胞溶解後、ガラス壁に付着したDynabeads(登録商標)M−270カルボン酸のSEM写真である。図5から明らかなように、多くの粒子が磁性ビーズに付着していた。前記粒子は、主に変性された蛋白質及び細胞の残骸であり、それらは、PCRを妨害する主要なPCR阻害剤であった。図6は、レーザー処理による細胞溶解後、ガラス容器の中央部から採取したDynabeads(登録商標)M−270カルボン酸のSEM写真である。図6から明らかなように、多くの粒子が磁性ビーズに付着していた。このことから、PCR阻害剤として作用する変性された蛋白質及び細胞の残骸は、磁性ビーズを用いて容易に除去できる。
【0062】
実施例3:DNA精製方法によるPCR増幅効果
DNA精製方法を変えたときのPCR増幅効果を研究するために、Lightcycler毛細管(内径:2.42mm、高さ:35.40mm、内径:高さ=1:14.63)内で細胞を溶解させ、得られた溶解液を用いてPCRを行った。図7は、DNA精製方法を変えたときのPCR産物の、電気泳動の結果を示す図である。矢印で表示されたバンドは、所望のPCR産物に該当する。レーン1、2は、磁性ビーズの不在下でレーザーをそれぞれ60秒、及び90秒照射した後PCRを行った結果であり、レーン3、4は、磁性ビーズの存在下でレーザーをそれぞれ5秒、及び10秒照射した後PCRを行った結果であり、レーン5は、組み替えHBV(rHBV)の直接PCRの結果であり、レーン6は、PCR陽性コントロールであって、Qiagen Ultrasenseキットを用いてDNAを精製した後でPCRを行った結果であり、レーン7は、PCR陰性コントロールであって、蒸留水のみを用いてPCRを行った結果である。各試料の組成は、下記の表の通りであった。
【0063】
【表1】

【0064】
図7から明らかなように、磁性ビーズなしにレーザーの照射のみを行った場合(レーン1、2)には、PCR産物が観察されず、また、rHBVを直接PCRした場合(レーン5)にも、PCR産物が観察されなかった。しかし、本発明の場合、すなわち磁性ビーズの存在下でレーザーを照射した場合(レーン3、4)には、所望の位置にPCR産物が観察された。また、Qiagen Ultrasenseキットを用いてDNAを精製した後でPCRを行った場合(レーン6)にも、所望のPCR産物が観察された。これらの結果から、本発明の方法は、精製に多くの時間及びステップが必要とされる陽性コントロールであるQiagen Ultrasenseキットを用いてDNAを精製した場合と、同様のPCR効率を表す。したがって、本発明の方法は、別途のDNA精製のステップなしに、PCR効率よく行われるので、LOCに有効に適用されうる。
【0065】
図8は、増幅されたPCR産物の濃度を示すグラフである。縦軸は、増幅されたDNAの濃度(ng/μl)を表す。PCR産物の量は、Agilent BioAnalyzer 2100を用いて定量化された。図8から明らかなように、本発明の方法を用いたPCRの結果は、Qiagen Ultrasenseキットを用いた結果と同様であるか、または優れている。したがって、本発明の方法によれば、別途の精製工程なしで、DNA分析のためのPCRが容易に行われうる。
【0066】
実施例4:レーザー照射時間による溶液中の蛋白質の量の比較
細胞溶解後、磁性ビーズにより吸収された蛋白質の量がどれほどかを研究するために、レーザー照射時間を変えたときの細胞溶解物中に存在する蛋白質の量を調べた。細胞溶解後に溶解物中に存在する蛋白質の量は、CBQCA蛋白質定量キット(C−6667、Molecular Probes社製、調製マニュアルを参考にした)を用いて測定した。図9は、レーザー照射時間を変えたときの細胞溶解物中に存在する蛋白質の量を示すグラフである。図9に示すように、レーザー照射時間が10秒、及び15秒であるとき、溶解物中の蛋白質の量が顕著に減少した。レーザー照射時間が10秒であるとき、溶解物中の蛋白質量の顕著な減少は、PCR増幅が十分に行われるということを示しており、これは、前記図7及び図8の結果とも一致する。
【産業上の利用可能性】
【0067】
本発明は、レーザー及び磁性ビーズを利用した核酸精製装置関連の技術分野に適用可能である。
【図面の簡単な説明】
【0068】
【図1】レーザー及びマイクロ磁性ビーズを用いて細胞溶解を行った後に、マイクロ磁性ビーズ層及びDNA溶解液層が分離されている、システムの一実施形態を表す模式図である。
【図2】内径が9.95mmであり、レーザー照射後磁性ビーズ層及びDNA溶液層が混合されている容器の写真である。
【図3】内径が4.88mmであり、レーザー照射後磁性ビーズ層及びDNA溶液層が分離されている容器の写真である。
【図4】Pure Dynabeads(登録商標)M−270カルボン酸のSEM写真である。
【図5】レーザー照射による細胞溶解後、ガラス壁に付着したDynabeads(登録商標)M−270カルボン酸のSEM写真である。
【図6】レーザー照射による細胞溶解後、ガラス容器の中央部から採取したDynabeads(登録商標)M−270カルボン酸のSEM写真である。
【図7】DNAの精製方法を変えたときのPCR産物の電気泳動の結果を示す図である。
【図8】増幅されたPCR産物の濃度を示すグラフである。
【図9】レーザー照射時間を変えたときの細胞溶解物中の蛋白質の量を示すグラフである。
【特許請求の範囲】
【請求項1】
試料導入口が形成されており、前記試料導入口を通じて試料及び磁性ビーズを収容する細胞溶解毛細管と、
前記細胞溶解毛細管に装着され、前記細胞溶解毛細管内で試料及び磁性ビーズを混合する振動器と、
前記細胞溶解毛細管に装着され、前記細胞溶解毛細管にレーザーを供給するレーザー発生部と、
前記細胞溶解毛細管に装着され、磁性ビーズを前記細胞溶解毛細管の壁に固定させる磁気力発生部と、
を備えることを特徴とする、細胞またはウイルスの核酸精製装置。
【請求項2】
前記振動器は、超音波振動器、磁場を利用した振動器、電場を利用した振動器、機械式振動器、及び圧電物質からなる群より選択されることを特徴とする、請求項1に記載の装置。
【請求項3】
前記磁気力発生部が、レーザーの通路の上部に位置し、前記細胞溶解毛細管内の磁性ビーズが沸騰するときに電源が入る電磁石であることを特徴とする、請求項1に記載の装置。
【請求項4】
前記細胞溶解毛細管と、弁により開閉される流路を通じて連結されているDNA増幅チャンバをさらに備えることを特徴とする、請求項1に記載の装置。
【請求項5】
細胞またはウイルスを含む溶液を、磁性ビーズを含む毛細管状の容器に注入するステップと、
前記磁性ビーズを振動させるステップと、
前記磁性ビーズにレーザーを照射して細胞またはウイルスを破壊し、細胞またはウイルス溶解液中の化合物を前記磁性ビーズに結合させるステップと、
前記細胞またはウイルス溶解液中の化合物が結合した磁性ビーズを、磁気力発生部によって前記毛細管状の容器の壁に固定させるステップと、
前記磁性ビーズが除去された溶液を得るステップと、
を含むことを特徴とする、請求項1に記載の核酸精製装置を用いて核酸を精製する方法。
【請求項6】
細胞またはウイルスを含む溶液を、磁性ビーズを含む毛細管状の容器に注入するステップと、
前記磁性ビーズを振動させるステップと、
前記磁性ビーズにレーザーを照射して細胞またはウイルスを破壊し、細胞またはウイルス溶解液中の化合物を前記磁性ビーズに結合させるステップと、
前記細胞またはウイルス溶解液中の化合物が結合した磁性ビーズを、磁気力発生部によって前記毛細管状の容器の壁に固定させるステップと、
前記磁性ビーズが除去された溶液を得た後、前記溶液を、前記毛細管状の容器及び増幅チャンバを連結する流路を通じて増幅チャンバに移送して増幅を行うステップと、
を含むことを特徴とする、請求項4に記載の核酸精製装置を用いて核酸の精製及び増幅を連続的に行う方法。
【請求項7】
前記レーザーが、パルスレーザーまたは連続波動レーザーを含むことを特徴とする、請求項5または請求項6に記載の方法。
【請求項8】
前記パルスレーザーが1mJ/パルス以上の出力を有するか、または連続波動レーザーが10mW以上の出力を有することを特徴とする、請求項7に記載の方法。
【請求項9】
前記パルスレーザーが10mJ/パルス以上の出力を有するか、または連続波動レーザーが100mW以上の出力を有することを特徴とする、請求項8に記載の方法。
【請求項10】
前記レーザーが、400nm以上の波長帯で発生することを特徴とする、請求項5または請求項6に記載の方法。
【請求項11】
前記レーザーが、750nm〜1300nmの波長帯で発生することを特徴とする、請求項10に記載の方法。
【請求項12】
前記レーザーが、一つ以上の波長帯で発生することを特徴とする、請求項10に記載の方法。
【請求項13】
前記磁性ビーズの大きさは、50nm〜1,000μmであることを特徴とする請求項5または請求項6に記載の方法。
【請求項14】
前記磁性ビーズの大きさは、1μm〜50μmであることを特徴とする、請求項13に記載の方法。
【請求項15】
前記磁性ビーズは、二つ以上の大きさを有するビーズの混合物であることを特徴とする、請求項13に記載の方法。
【請求項16】
前記毛細管状の容器は、直径と長さとの比率が1:2〜1:50(直径:長さ)であることを特徴とする、請求項5または請求項6に記載の方法。
【請求項17】
前記毛細管状の容器は、直径が1nm〜5mmであることを特徴とする、請求項16に記載の方法。
【請求項18】
前記毛細管状の容器の材質は、重合体、有機物質、ケイ素、ガラス、及び金属からなる群より選択されることを特徴とする、請求項5または請求項6に記載の方法。
【請求項19】
前記磁性ビーズは、強磁性を有する金属であるFe、Ni、Cr、及びそれらの酸化物からなる群より選択される少なくとも一つの物質を含むことを特徴とする、請求項5または請求項6に記載の方法。
【請求項20】
前記磁性ビーズは、強磁性を有する金属でコーティングされている重合体、有機物質、ケイ素、またはガラスであることを特徴とする、請求項5または請求項6に記載の方法。
【請求項21】
前記磁性ビーズの表面は、負電荷を帯びていることを特徴とする、請求項5または請求項6に記載の方法。
【請求項22】
前記溶解液は、唾液、尿、血液、血清、及び細胞培養液からなる群より選択されることを特徴とする、請求項5または請求項6に記載の方法。
【請求項1】
試料導入口が形成されており、前記試料導入口を通じて試料及び磁性ビーズを収容する細胞溶解毛細管と、
前記細胞溶解毛細管に装着され、前記細胞溶解毛細管内で試料及び磁性ビーズを混合する振動器と、
前記細胞溶解毛細管に装着され、前記細胞溶解毛細管にレーザーを供給するレーザー発生部と、
前記細胞溶解毛細管に装着され、磁性ビーズを前記細胞溶解毛細管の壁に固定させる磁気力発生部と、
を備えることを特徴とする、細胞またはウイルスの核酸精製装置。
【請求項2】
前記振動器は、超音波振動器、磁場を利用した振動器、電場を利用した振動器、機械式振動器、及び圧電物質からなる群より選択されることを特徴とする、請求項1に記載の装置。
【請求項3】
前記磁気力発生部が、レーザーの通路の上部に位置し、前記細胞溶解毛細管内の磁性ビーズが沸騰するときに電源が入る電磁石であることを特徴とする、請求項1に記載の装置。
【請求項4】
前記細胞溶解毛細管と、弁により開閉される流路を通じて連結されているDNA増幅チャンバをさらに備えることを特徴とする、請求項1に記載の装置。
【請求項5】
細胞またはウイルスを含む溶液を、磁性ビーズを含む毛細管状の容器に注入するステップと、
前記磁性ビーズを振動させるステップと、
前記磁性ビーズにレーザーを照射して細胞またはウイルスを破壊し、細胞またはウイルス溶解液中の化合物を前記磁性ビーズに結合させるステップと、
前記細胞またはウイルス溶解液中の化合物が結合した磁性ビーズを、磁気力発生部によって前記毛細管状の容器の壁に固定させるステップと、
前記磁性ビーズが除去された溶液を得るステップと、
を含むことを特徴とする、請求項1に記載の核酸精製装置を用いて核酸を精製する方法。
【請求項6】
細胞またはウイルスを含む溶液を、磁性ビーズを含む毛細管状の容器に注入するステップと、
前記磁性ビーズを振動させるステップと、
前記磁性ビーズにレーザーを照射して細胞またはウイルスを破壊し、細胞またはウイルス溶解液中の化合物を前記磁性ビーズに結合させるステップと、
前記細胞またはウイルス溶解液中の化合物が結合した磁性ビーズを、磁気力発生部によって前記毛細管状の容器の壁に固定させるステップと、
前記磁性ビーズが除去された溶液を得た後、前記溶液を、前記毛細管状の容器及び増幅チャンバを連結する流路を通じて増幅チャンバに移送して増幅を行うステップと、
を含むことを特徴とする、請求項4に記載の核酸精製装置を用いて核酸の精製及び増幅を連続的に行う方法。
【請求項7】
前記レーザーが、パルスレーザーまたは連続波動レーザーを含むことを特徴とする、請求項5または請求項6に記載の方法。
【請求項8】
前記パルスレーザーが1mJ/パルス以上の出力を有するか、または連続波動レーザーが10mW以上の出力を有することを特徴とする、請求項7に記載の方法。
【請求項9】
前記パルスレーザーが10mJ/パルス以上の出力を有するか、または連続波動レーザーが100mW以上の出力を有することを特徴とする、請求項8に記載の方法。
【請求項10】
前記レーザーが、400nm以上の波長帯で発生することを特徴とする、請求項5または請求項6に記載の方法。
【請求項11】
前記レーザーが、750nm〜1300nmの波長帯で発生することを特徴とする、請求項10に記載の方法。
【請求項12】
前記レーザーが、一つ以上の波長帯で発生することを特徴とする、請求項10に記載の方法。
【請求項13】
前記磁性ビーズの大きさは、50nm〜1,000μmであることを特徴とする請求項5または請求項6に記載の方法。
【請求項14】
前記磁性ビーズの大きさは、1μm〜50μmであることを特徴とする、請求項13に記載の方法。
【請求項15】
前記磁性ビーズは、二つ以上の大きさを有するビーズの混合物であることを特徴とする、請求項13に記載の方法。
【請求項16】
前記毛細管状の容器は、直径と長さとの比率が1:2〜1:50(直径:長さ)であることを特徴とする、請求項5または請求項6に記載の方法。
【請求項17】
前記毛細管状の容器は、直径が1nm〜5mmであることを特徴とする、請求項16に記載の方法。
【請求項18】
前記毛細管状の容器の材質は、重合体、有機物質、ケイ素、ガラス、及び金属からなる群より選択されることを特徴とする、請求項5または請求項6に記載の方法。
【請求項19】
前記磁性ビーズは、強磁性を有する金属であるFe、Ni、Cr、及びそれらの酸化物からなる群より選択される少なくとも一つの物質を含むことを特徴とする、請求項5または請求項6に記載の方法。
【請求項20】
前記磁性ビーズは、強磁性を有する金属でコーティングされている重合体、有機物質、ケイ素、またはガラスであることを特徴とする、請求項5または請求項6に記載の方法。
【請求項21】
前記磁性ビーズの表面は、負電荷を帯びていることを特徴とする、請求項5または請求項6に記載の方法。
【請求項22】
前記溶解液は、唾液、尿、血液、血清、及び細胞培養液からなる群より選択されることを特徴とする、請求項5または請求項6に記載の方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【公開番号】特開2006−129869(P2006−129869A)
【公開日】平成18年5月25日(2006.5.25)
【国際特許分類】
【出願番号】特願2005−319853(P2005−319853)
【出願日】平成17年11月2日(2005.11.2)
【出願人】(390019839)三星電子株式会社 (8,520)
【氏名又は名称原語表記】Samsung Electronics Co.,Ltd.
【住所又は居所原語表記】416,Maetan−dong,Yeongtong−gu,Suwon−si Gyeonggi−do,Republic of Korea
【Fターム(参考)】
【公開日】平成18年5月25日(2006.5.25)
【国際特許分類】
【出願日】平成17年11月2日(2005.11.2)
【出願人】(390019839)三星電子株式会社 (8,520)
【氏名又は名称原語表記】Samsung Electronics Co.,Ltd.
【住所又は居所原語表記】416,Maetan−dong,Yeongtong−gu,Suwon−si Gyeonggi−do,Republic of Korea
【Fターム(参考)】
[ Back to top ]

