核酸解析方法、その方法を実施する装置、及び核酸解析用試薬セット
【課題】安価で信頼性が高く、また操作性の良い単一核酸分子の塩基配列を解読する方法・装置を提供する。
【解決手段】第1のアクセプタで標識された1〜3種類の塩基及び第2のアクセプタで標識されたそれ以外の塩基を混合した基質溶液と、アクセプタを共鳴励起するための1種類のドナーにより標識されたDNAポリメラーゼ或いは鋳型DNAとを用いて、核酸増幅の塩基配列伸長反応を行う。ドナーの発光波長帯の信号強度の時間変化情報と、少なくとも1種類のアクセプタの発光波長帯の信号強度の時間変化情報を検出する。検出されるドナーの発光強度の低下と、検出されるアクセプタの発光強度の上昇から、任意の塩基が取り込まれたことを判定する。
【解決手段】第1のアクセプタで標識された1〜3種類の塩基及び第2のアクセプタで標識されたそれ以外の塩基を混合した基質溶液と、アクセプタを共鳴励起するための1種類のドナーにより標識されたDNAポリメラーゼ或いは鋳型DNAとを用いて、核酸増幅の塩基配列伸長反応を行う。ドナーの発光波長帯の信号強度の時間変化情報と、少なくとも1種類のアクセプタの発光波長帯の信号強度の時間変化情報を検出する。検出されるドナーの発光強度の低下と、検出されるアクセプタの発光強度の上昇から、任意の塩基が取り込まれたことを判定する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、鋳型DNA或いはその相補鎖に取り込まれる単一核酸分子である塩基(ヌクレオチド:dNTP)の種類や部位の特定、或いは塩基配列を解析するのに適した塩基解析方法、その方法を実施する装置、及び核酸解析用試薬セットに関する。特にFRET(Fluorescence Resonance Energy Transfer:蛍光共鳴エネルギー移動)を利用した、核酸解析方法、その方法を実施する装置、及び核酸解析用試薬セットに関する。
【背景技術】
【0002】
(1)近年、非特許文献1にあるように、基板に固定した鋳型DNA或いはその相補鎖に単一核酸分子であるヌクレオチド(dNTP)を順次、捕捉伸長させて、その塩基配列を決定することが提案されている。すなわち基板表面にランダムに分析すべき試料DNA断片(単一核酸分子)を1分子ずつ捕捉し伸長させて、その結果を蛍光計測より検出することにより塩基配列を決定するものである。
【0003】
具体的には、DNAポリメラーゼの基質として、鋳型DNAに取り込まれてDNA鎖伸長反応を保護基の存在により停止することができ、且つ検出され得る標識を持つ4種のdNTPの誘導体(MdNTP)を、DNAポリメラーゼ反応により相補的に順次取り込む工程、次いで取り込まれたMdNTPを、蛍光等で検出する工程、及びMdNTPを伸長可能な状態に戻す工程を1サイクルとし、それを繰り返すことにより試料DNAの塩基配列を決定する。本技術では、DNA断片を1分子ずつ配列決定することができるため、同時に数多くの断片を解析することができ、解析スループットを大きくすることができる。また、本方式では、全反射エバネッセント照射検出方式により、単一DNA分子毎に塩基配列が決定できる可能性があるため、従来技術の問題であったクローニングやPCR等での試料DNAを精製、増幅が不要にできる可能性があり、ゲノム解析や遺伝子診断の迅速化が期待できる。
【0004】
(2)一方、非特許文献2および特許文献1では、全反射エバネッセント照射検出方式よりも励起光照射体積の一層の低減が可能となるナノ開口エバネッセント照射検出方式によって、核酸増幅の塩素配列の蛍光検出の感度を更に向上させている。
【0005】
具体的には、2枚のガラス基板であるガラス基板Aとガラス基板Bを平行に対向配置し、ガラス基板Aのガラス基板Bと対面する側の表面に、径50nmのナノ開口を有する膜厚約100nmの平面状のアルミニウム薄膜を積層する。アルミニウム薄膜は遮光性能を有している必要がある。2枚のガラス基板の中間に前記ナノ開口により反応槽を構成し、反応槽に溶液を充填することによって、2枚のガラス基板の間に溶液層の反応槽を形成する。反応槽には溶液の注入口と排出口があり、注入口から溶液を注入し、排出口から溶液を排出させることで、溶液をガラス基板およびアルミニウム薄膜と平行方向にフローさせることができる。これにより、溶液層の溶液を任意の組成に交換することが可能である。Arイオンレーザから発振した波長488nmの励起光を、ガラス基板Bと反対方向より、ガラス基板Aに対して垂直に、対物レンズで絞って照射すると、ナノ開口内部の底平面近傍の溶液層に励起光のエバネッセント場が形成され、それ以上先の溶液層内部に励起光が伝播することはない。一方、蛍光発光は、前記対物レンズを用いて2次元CCD上に結像することによって検出される。エバネッセント場では、励起光強度がナノ開口底平面から離れるに従って指数関数的に減衰し、ナノ開口底平面から30nm程度の距離で励起光強度が1/10となる。更に、ナノ開口エバネッセント照射検出方式では、全反射エバネッセント照射検出法と異なり、ガラス基板と平行方向の励起光照射幅が開口径すなわち50nmに限定されるため、励起光照射体積が一層低減される。このため、遊離の蛍光体の蛍光発光や水のラマン散乱を始めとする背景光を飛躍的に低減することが可能となる。その結果、より高濃度の遊離の蛍光体存在下で、対象とする生体分子に標識された蛍光体だけを選択的に検出することが可能となり、非常に高感度な蛍光検出を実現できる。本文献では、以上の蛍光検出方式をDNA分子の伸長反応によるdNTPの取り込み計測に応用している。
【0006】
(3)特許文献2では、核酸増幅された塩基配列解析にFRET方式を採用して、蛍光標識(ドナー)で修飾されたポリメラーゼ(蛍光標識ポリメラーゼ又は蛍光修飾ポリメラーゼと称せられる)と蛍光標識(アクセプタ)で修飾されたヌクレオチド(蛍光標識ヌクレオチド又は蛍光修飾ヌクレオチドと称せられる)との相互作用により、鋳型鎖(鋳型DNA)上での1核酸分子ずつのヌクレオチド捕捉,伸長を、光源により励起されるドナーの蛍光により共鳴励起されるアクセプタの蛍光を検出して、核酸配列(ヌクレオチド配列)をリアルタイムに決定する技術が提案されている。ヌクレオチド(dNTP)を修飾する蛍光標識(アクセプタ)として、4種類のdNTP(ATCG)に応じた4種類の蛍光色素を使用する。本技術は、DNAポリメラーゼによるDNA合成反応(ヌクレオチド捕捉伸長反応)を1核酸分子(ヌクレオチド)レベルで観察する方法で、ポリメラーゼと捕捉されるヌクレオチドの間の蛍光標識(ドナー、アクセプタ)による蛍光共鳴励起エネルギーの転移(FRET) を逐次検出することにより配列を読み取るというものである。具体的には、ドナーとしての蛍光色素に標識されたDNAポリメラーゼがスライドガラス上にガラス面から一定の距離を置いて固定され、別の蛍光標識(アクセプタ)を持つ4種のdNTPの誘導体(MdNTP)をDNAポリメラーゼ反応により鋳型DNA鎖上で相補的に捕捉し伸長させる。このとき、DNAポリメラーゼに標識された蛍光色素(ドナー)の蛍光波長は、MdNTPに標識された蛍光色素(アクセプタ)を励起可能である。ポリメラーゼに標識された蛍光色素(ドナー)を励起すると、捕捉したMdNTの取り込みが行われた際、ポリメラーゼとMdNTPが相互作用し、ポリメラーゼからMdNTPに励起エネルギーが転移(FRET)し、MdNTP(アクセプタ)の蛍光色素が励起され蛍光を発する。こうして生じたMdNTPからの種類別の蛍光を検出することで塩基種ATCGの配列を決定する。一般的にFRET は、ドナーとアクセプタ間の距離が1〜10 nm の範囲で起こることが知られている。またFRETの強度は両分子間の距離の6乗の関数として、距離とともに急速に減少する。すなわちdNTPを標識する蛍光色素(アクセプタ)は、ポリメラーゼを標識する蛍光色素(ドナー)の近傍においてのみ発光するため、実質的に限られた空間のみが励起されている状態となる。その結果、浮遊MdNTPの蛍光発光や水のラマン散乱を始めとする背景光を飛躍的に低減し、非常に高感度な蛍光観察が可能となる。本技術は背景光低減に有効な手段であるが、ドナー色素を常に励起し続ける必要があるため、退色が課題であった。この問題を解決する手段として、量子ドット(Quantum Dot、 Qdot)の利用が挙げられる。Qdotは通常の蛍光色素と比較して光安定性が強く、長時間露光しても退色が遅いという特徴がある。このためFRETのドナー色素として非常に有効である。加えてQdotの蛍光強度は極めて強いため、QdotをFRETのドナーとして用いる場合、アクセプタ側の蛍光色素の組み合わせによっては、1種類のQdotで4種類以上のアクセプタ色素を励起できる可能性がある。即ち、Qdotを励起するための1種類の光源で4色の蛍光色素を励起できるため、他の従来法と比較して操作性、コストの面で有利である。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】米国特許第6917726号公報
【特許文献2】特開2009−118847号公報
【非特許文献】
【0008】
【非特許文献1】Proc. Natl. Acad. Sci. USA、 vol.100、 pp.3960、 2003
【非特許文献2】SCIENCE 2003、 Vol.299、 pp. 682−686
【発明の概要】
【発明が解決しようとする課題】
【0009】
上記した背景技術の(1)及び(2)の項で述べた手法は、FRETを使わない所謂、通常の蛍光色素を使用するものである。一方、背景技術の(3)の項で述べた手法は、FRETを採用しているものである。前者、すなわち通常の蛍光色素の場合には、蛍光色素を励起する励起波長と、それにより蛍光したときの蛍光波長とが近いために、励起光の影響が大きい。また、消光までの時間が短い。一方、後者、すなわちFRETの場合には、特にQdotをドナーとして使用する場合には、ドナーの励起波長とアクセプタの蛍光波長が遠いために、励起光の影響が小さい、また消光までの時間が長いといった特長を有している。
【0010】
ただし、QdotをドナーとしてFRETを利用して4種類のMdNTPを励起する場合、4種類の波長の異なる蛍光標識(蛍光色素)のうち、ドナーの励起光を基準にして長波長側に遠くなる波長を有する蛍光色素へのFRET効率が低くなるという傾向がある。ドナーとしてのQdotの蛍光波長は、少なくともdNTPを標識する4種類の蛍光色素(アクセプタ)の蛍光波長よりも短い必要があるが、Qdotの蛍光も分布を持っているため、FRET効果はアクセプタ側の蛍光色素の励起波長が長くなるほど効果が低くなる。また一般的な蛍光色素の励起光の波長は、およそ450nm〜800nmの領域であるが、4種類のdNTPを標識するため、その範囲内で4種類の蛍光色素を選択しようとすると、蛍光色素同士の蛍光スペクトルが一部重なり、隣接する蛍光波長のピークを有する蛍光色素同士が、互いの信号に影響を及ぼすという、いわゆるクロストークが生じる。また4種類の蛍光色素を波長成分ごとに抽出して観察するために、フィルタやミラーなどの光学素子の点数が多く使用せねばならず、それに伴い信号強度が損失する。このため、特に長波長領域におけるアクセプタ側の蛍光色素のS/Nが低く、十分な検出感度を得られない傾向がある。
【0011】
本発明の目的は、FRETを採用した場合でも、上記したような課題を解消し、しかも、安価で信頼性が高く、また操作性の良い単一核酸分子の塩基配列を解読する方法・装置を提供することにある。
【課題を解決するための手段】
【0012】
本発明は、上記目的を達成するために、基本的には、次のような核酸解読方法及び装置を提案する。
(1)一つは、単一核酸分子の塩基配列を、蛍光共鳴エネルギー移動を利用して解析する核酸解析方法であって、
ドナーにより励起される第1のアクセプタによって標識されたdATP及び前記第1のアクセプタと種類の異なる第2のアクセプタによって標識されたdCTP、dGTP、dTTPのヌクレオチドからなる第1のヌクレオチドセットと、
前記同様の第1のアクセプタによって標識されたdCTP、及び前記同様の第2のアクセプタによって標識されたdATP、dGTP、dTTPのヌクレオチドからなる第2のヌクレオチドセットと、
前記同様の第1のアクセプタによって標識されたdGTP、及び前記同様の第2のアクセプタによって標識されたdATP、dCTP、dTTPのヌクレオチドからなる第3のヌクレオチドセットと、
前記同様の第1のアクセプタによって標識されたdTTP、及び前記同様の第2のアクセプタによって標識されたdATP、dCTP、dGTPのヌクレオチドからなる第4のヌクレオチドセットと、
DNAポリメラーゼ,鋳型DNA及びプライマと、
アクセプタ励起用として、前記DNAポリメラーゼ,鋳型DNA及びプライマのいずれか一つに標識されている前記ドナーと、を用いて、
前記第1〜第4のヌクレオチドセットのセットごとに順次、前記鋳型DNA或いはその相補鎖及びプライマを介してポリメラーゼ反応によるヌクレオチドの捕捉,伸長を行い、
前記鋳型DNA或いは前記相補鎖に取り込まれていくヌクレオチドの近傍に位置する前記ドナーを励起して、このドナーと前記取り込まれたヌクレオチドの第1のアクセプタ或いは第2のアクセプタとの間で生じる蛍光共鳴エネルギー移動により、前記取り込まれたヌクレオチドの第1のアクセプタ或いは第2のアクセプタを励起し、
前記ドナーの信号強度変化及び前記第1,第2のアクセプタからの信号をリアルタイムにモニタリングし、前記第1〜第4のヌクレオチドセットを使用して得られたこれらのモニタリングデータから、前記鋳型DNA或いは前記相補鎖に取り込まれた前記ヌクレオチドの種類とその位置を特定することを特徴とする。
【0013】
例えば、第1のアクセプタは、ドナーにより励起されて蛍光する特性を有し、第2のアクセプタは、第ドナーにより励起されるが、光を生じない或いは第1のアクセプタに対して識別できる発光強度差を有する或いは第1のアクセプタと波長の異なる特性を有している。
【0014】
或いは、第1のアクセプタは、前記ドナーにより励起されて蛍光する或いは励起されるが光を生じない特性を有し、前記第2のアクセプタは、前記ドナーにより励起されて前記第1のアクセプタに対して識別できる発光強度差を有する或いは前記第1のアクセプタと蛍光波長の異なる特性を有している。
(2)さらに、前記核酸解析方法のために使用する核酸解析用試薬セットとして、前記第1〜第4のヌクレオチドセットを有するものを提案する。
(3)本発明に係る核酸解析方法のもう一つは、単一核酸分子の塩基配列を、蛍光共鳴エネルギー移動を利用して解析する核酸解析方法であって、
第1のアクセプタで標識された1〜3種類の塩基及び前記第1のアクセプタと種類の異なる第2のアクセプタで標識されたそれ以外の塩基を混合した基質溶液と、前記アクセプタを共鳴励起するための1種類のドナーにより標識されたDNAポリメラーゼ或いは前記鋳型DNAとを用いて、核酸増幅の塩基配列伸長反応を行い、
前記ドナーの発光波長帯の信号強度の時間変化情報と、少なくとも1種類のアクセプタの発光波長帯の信号強度の時間変化情報を検出し、
検出される前記ドナーの発光強度の低下と、検出される前記アクセプタの発光強度の上昇から、任意の塩基が取り込まれたことを判定することを特徴とする。
【0015】
例えば、4種類の塩基を有する第1の基質溶液と、同じく4種類の塩基を有する第2の基質溶液とからなり、前記第1,第2の基質溶液における塩基に標識される前記第1,第2のアクセプタの組み合わせは、4種の塩基のうち、前記第1,第2の基質溶液間で同一の1種については前記第1のアクセプタで標識され、前記基質溶液間で同一のもう1種については前記第2のアクセプタで標識され、前記基質溶液間で同一のさらにもう1種については第1の基質溶液のものが第1のアクセプタで標識され第2基質溶液のものが第2のアクセプタで標識され、前記基質溶液間で同一のさらにもう1種については第1の基質溶液のものが第2のアクセプタで標識され第2基質溶液のものが第1のアクセプタで標識されている。ここで、第1、第2のアクセプタの特性は、前記(1)の方法と同様である。
(4)さらに、上記(3)の方法を実施するために、例えば、上記(3)の互いにアクセプタの組み合わせが異なる4種の塩基を内容とする前記第1、第2の基質溶液を有する核酸解析用試薬セットを提案する。
(5)また、上記(1)、(2)の方法を実施するために、前記第1〜第4のヌクレオチドセットを有する核酸解析用試薬セットと、
アクセプタ励起用の蛍光物質よりなるドナーが標識されているDNAポリメラーゼ,鋳型DNA或いはプライマと、
前記第1〜第4のヌクレオチドセットの各々ごとに、前記鋳型DNA及びプライマを介してポリメラーゼ反応により行われる核酸増幅にて、前記鋳型DNAもしくはその相補鎖に捕捉されていくヌクレオチドのうち最新捕捉のヌクレオチドを標識しているアクセプタを励起する光照射系と、
蛍光共鳴エネルギーにより、前記ドナーの蛍光で前記最新捕捉のヌクレオチドを標識しているアクセプタを励起して、前記ドナーによる信号強度変化及び前記第1,第2アクセプタからの信号をリアルタイムにモニタリングする光検出系と、
前記第1〜第4のヌクレオチドセットを使用して得られたこれらのモニタリングデータから、前記鋳型DNA或いは前記相補鎖に取り込まれた前記ヌクレオチドの塩基配列を解析するデータ演算処理部と、を有することを特徴とする核酸増幅の塩基配列解析装置を提案する。
【発明の効果】
【0016】
本発明によれば、核酸増幅解析にFRET方式を採用した場合であっても、DNAポリメラーゼ反応により核酸増幅される4種の塩基配列を検出する場合に、捕捉される核酸分子(ヌクレオチド)を標識するアクセプタは、第1、第2のアクセプタの2種類だけで済むので、従来課題とされていたヌクレオチド側の4種類の蛍光色素同士のクロストークの影響を排除でき、それにより、ノイズ成分が抑制され、各蛍光色素のS/Nが向上する。
【0017】
またS/Nの向上に伴い、従来方法で必要とされていた高性能センサや光学部品、高出力光源を安価な部品に置き換えることが可能であるため、コスト削減に繋がる。
【0018】
また、色素識別のための複雑な計算が不要となるため、観察後のデータ処理が簡便となり、操作性が向上する。結果として、塩基配列解読の信頼性が向上する
【図面の簡単な説明】
【0019】
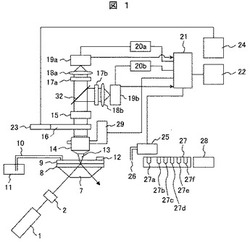
【図1】本発明の第1の実施例の蛍光分析方法に使用される蛍光検出装置の構成図
【図2(A)】本発明の各実施例に用いられる基板の構造を示す斜視図。
【図2(B)】本発明の各実施例に用いられる基板とプリズムの組み合わせを示す縦断面図。
【図2(C)】本発明の各実施例に用いられる基板上に載せられるチャンバを裏返してみた斜視図。
【図3(A)】第1の実施例に用いるフィルタ、ミラーの特性図。
【図3(B)】第1の実施例に用いるフィルタ、ミラーの特性図。
【図3(C)】第1の実施例に用いるフィルタ、ミラーの特性図。
【図4】第1の実施例での反応フロー図。
【図5(A)】第1の実施例での第1ヌクレオチドセットにおける蛍光観察結果の模式図。
【図5(B)】第1の実施例での第2ヌクレオチドセットにおける蛍光観察結果の模式図。
【図5(C)】第1の実施例での第3ヌクレオチドセットにおける蛍光観察結果の模式図。
【図5(D)】第1の実施例での第4ヌクレオチドセットにおける蛍光観察結果の模式図。
【図6】第2の実施例での反応フロー図
【図7】第3の実施例での反応フロー図
【図8】第5の実施例での反応フロー図
【図9】上記各実施例に用いる蛍光集光系の一例を示す図。
【図10】上記各実施例に用いる蛍光集光系の他の例を示す図。
【図11】ドナーとして用いるQdot525と蛍光アクセプタとして用いるAlexaの波長特性を示す説明図。
【図12】第10の実施例に用いる第1、第2の基質溶液(ヌクレオチドセット)のアクセプタの組み合わせを示す説明図。
【発明を実施するための形態】
【0020】
以下、本発明を実施の形態について下記の示す実施例により説明する。
【実施例1】
【0021】
基板表面に分析すべき試料DNA断片を1分子ずつ捕捉し、伸長させて、取り込まれたDNA断片(ヌクレオチド:dNTP)に修飾された蛍光標識を検出して塩基配列を決定する装置、方法について説明する。
【0022】
本実施例では、DNAポリメラーゼの基質として、4つの塩基種(ATCG)のdNTP(dATP、dCTP、dGTP、dTTPの総称)を鋳型DNA或いはその相補鎖に一分子ずつ捕捉し、且つ取り込まれるdNTPの標識(アクセプタ)を、FERTを利用して励起する蛍光色素(ドナー)を有する。また、4つの塩基種について、一核酸分子(ヌクレオチド)ごとに取り込まれるdNTPを修飾する標識については、1種類の蛍光色素(第1のアクセプタ)と1種類の無蛍光物質(第2のアクセプタ)、すなわちトータルで2種類のアクセプタを使用する。ここで、アクセプタとして機能する無蛍光物質としては、例えば消光色素(クエンチャ)が例示される。4種類のdNTPは、第1のアクセプタ(1種類の蛍光色素)と第2のアクセプタ(クエンチャ)の組み合わせであり、次のようなアクセプタ組み合わせを4つのヌクレオチドセットを使用する。
【0023】
すなわち、(i)蛍光共鳴エネルギー移動の励起により光を生じる第1のアクセプタ(蛍光色素)によって標識されたdATP及び第2のアクセプタ(クエンチャ)によって標識されたdCTP、dGTP、dTTPのヌクレオチドからなる第1のヌクレオチドセットと、上記同様に(ii)第1のアクセプタによって標識されたdCTP、及び第2のアクセプタによって標識されたdATP、dGTP、dTTPからなる第2のヌクレオチド セットと、(iii)第1のアクセプタによって標識されたdGTP、及び第2のアクセプタによって標識されたdATP、dCTP、dTTPからなる第3のヌクレオチドセットと、(iv)第1のアクセプタによって標識されたdTTP、及び第2のアクセプタによって標識されたdATP、dCTP、dGTPのヌクレオチドからなる第4のヌクレオチドセットである。
【0024】
第1〜第4のヌクレオチドセットごとに順次、DNAポリメラーゼ反応によるdNTPの捕捉、伸長を行い、取り込まれるdNTPの第1の蛍光色素(第1のアクセプタ)或いはクエンチャ(第2のアクセプタ)とその近傍に位置する第2の標識(ドナー)との間の蛍光共鳴による励起エネルギーの移動(FRET)を利用した蛍光及び無蛍光の測定データ(リアルタイムモニタリングデータ)を用いることで、塩基配列の解読を行う。
【0025】
より具体的には、第1〜第4のヌクレオチドセットのセットごとに、ターゲット鋳型DNA、プライマ及びポリメラーゼを用いて、順次、dNTPの捕捉,伸長を行う(FRETによるリアルタイム蛍光検出を伴う)。この場合、セットごとのdNTPの捕捉,伸長が完了する度に、鋳型DNA上で合成された伸長鎖を熱変性で分離し,洗浄により除去が行われる。したがって、ヌクレオチドセットごとのdNTPの捕捉,伸長,熱変性,洗浄を1サイクルとする。
【0026】
本実施例によれば、ドナーのFRETによる信号変化と第1、第2のアクセプタの信号から、第1のヌクレオチドセットでは、捕捉された塩基配列のうちdATPの位置を特定でき、第2のヌクレオチドセットでは、捕捉された塩基配列のうちdCTPの位置を特定でき、第3のヌクレオチドセットでは、捕捉された塩基配列のうちdGTPの位置を特定でき、第4のヌクレオチドセットでは、捕捉された塩基配列のうちdTTPの位置を特定できる。したがって、第1から第4のヌクレオチドセットのデータを組み合わせることで、4種の全体的な塩基配列を解読することができる。
【0027】
以上のように、本実施例では、FRET利用の核酸解析、すなわち試料DNAの塩基配列の決定を、1種類のドナー、1種類の蛍光アクセプタ(第1アクセプタ)、及び1種類の無蛍光アクセプタ(第2のアクセプタ:クエンチャ)を用いて、4サイクルにより行う。具体的な装置や核酸解析のための準備及び反応工程については、以下に詳述する。なお、本操作は単分子蛍光検出を行うため、測定はHEPAフィルタなどを介したクリーンルーム様の環境にて行うのが望ましい。
(装置構成)
図1は、本発明の核酸解析方法(蛍光分析方法)に用いるDNA検査装置(核酸解析装置)の構成図である。基板8にDNA分子を順次捕捉してヌクレオチド伸長状態をFRET方式により蛍光検出するものである。
【0028】
ここで、図1の装置全体を説明するに先立ち、図2により基板8の構造について説明する。
【0029】
図2(A)は、基板(固相)8の斜視図であり、図2(B)は、基板8と、基板8の下面側に配置したプリズム7と、基板8の上面側に配置したフローチャンバ9とからなる積層体の縦断面図を示す。図2(C)は、フローチャンバ9を、裏面すなわち基板8に対向する面側からみた斜視図である。図2(C)のA−A線で断面したものが、図2(B)のフローチャンバ9の断面に相当する。
【0030】
基板8は少なくとも反応領域8aが透明材質でできており、材質としては合成石英などが用いられる。反応領域8aは、フローチャンバ9によって形成される液槽9aに導入される試薬、試料などが接触する。フローチャンバ9については、後述する。
【0031】
反応領域8a内に検出対象となるDNA分子(核酸分子:ヌクレオチド)を捕捉するためのスポット8ijが複数形成されている。スポット8ijの個々の大きさは直径100nm以下である。各スポット8ijには、DNAを捕捉するための表面処理が施されている。
【0032】
その表面処理は、例えば、変性により得られた一本鎖化されたターゲットである鋳型DNAをチオール化(図4の符号50に示すような5’末端のチオール化)によりスポット8ij上に捕捉(固定)し、その3’末端にポリA配列(例えば、図4の符号30で示す)を付加する。すなわち、スポット8ijに、図4に示すように、金構造体上にポリA付加鋳型DNA33を固定する。ポリA配列30は、ポリTプライマ34をハイブリダイズにより捕捉するものである。或いは、その表面処理は、ポリTのオリゴヌクレオチド(例えば図6のポリTプライマ34)を捕捉しておき、また、DNA断片(例えば図6のターゲットである鋳型DNA33)の一端をポリA化処理して、この標的DNA断片をハイブリダイゼーション反応にて捕捉する。その際、DNA断片濃度を適当に調製することで、個々のスポット8ijに鋳型DNAに相補的に取り込まれるべきヌクレオチド(dNTP)のみが入るようにすることができる。なお、スポット8ijをより小さくしていくことで、スポット内に捕捉できる分子が1個になるようにすることができる。このような基板では、すべてのスポット8ijに単一分子のdNTPが捕捉されている場合と、スポット8ijのうち一部のスポットのみdNTPが捕捉されている場合がある。スポット8ijのうち、一部のスポットのみdNTPが捕捉されている場合は、残りのスポットには捕捉されておらず、空きの状態となる。なお、一例として、スポット8ij同士の間隔dxは2マイクロメータ、間隔dyは2マイクロメータとする。
【0033】
スポット8ijは基板表面上にランダムに存在していても構わないが、観察時の効率を考慮して規則的に配置されていることが望ましい。例えば図2(A)のように、格子配列構造(2次元の格子構造)を形成し、その格子点の位置にスポット8ijが配置される。このような、均等間隔の基板の作成法としては、例えば、特開2002−214142号公報に記載の手法(金属ナノウェルを用いた蛍光分析用素子の製造方法)などがある。なお、dx、dyは、スポット8ijの個々の径の大きさより大きく、0.2〜10マイクロメータ以下、さらには0.5〜6マイクロメータ程度が好ましい。なお、スポット8ijの格子配列構造は正方格子構造、長方格子構造、三角格子構造などにしてもよい。基板の反応スポット8aは、例えば1mm×1mmの大きさとする。反応スポット8aの大きさは、それより大きくても可であるし、0.5mm×0.5mmの大きさのものを一定間隔で、1次元または2次元に複数個並べたようなものでもよいし、長方形、丸型、三角形、六角形の形状などでもよい。
【0034】
なお、スポット8ijには金属構造体を配置してもよい。金属構造体は半導体プロセスにて作成でき、また、電子線描画、光リソグラフィー、ドライエッチング、ウェットエッチングなどの手法によっても作製できる。金属構造体は、金、銀、アルミ、クロム、チタン、タングステン、白金等で、励起光の波長以下の大きさを有する形状であり、直方体、円錐、円柱、三角柱、一部が突起状のものを有する構造、あるいは、これらを2個または複数個近接して並べた構造など、また金属微粒子なども使用可能である。たとえば、直径10nmから100nm程度の大きさの金の膜状のドットを上記dx、dyの間隔、たとえば、1×1、1×2、1×3、2×3、2×4、3×5、3×6(マイクロメータ×マイクロメータ)などの間隔の格子状に構築できる。直径20nm程度のドットに、大きさ20nm程度の蛋白や蛍光物質、リンカーをその上部に捕捉すれば、確率的にその大きさからドットあたり1分子を捕捉し、格子状に単一分子を配置することが可能になる。また、周知の手法でドットに選択的なリンカーを結合させ、それにオリゴヌクレオチド、たんぱく質などを捕捉することで、ドットに目的の分子を捕捉することが可能であり、これを使うことができる。以後このような状態の基板8を用いて核酸増幅を行い蛍光計測する。
【0035】
dNTPおよびポリメラーゼに加える蛍光標識として、種々の蛍光体を使うことができる。Alexa系やCy系などの一般的な蛍光化合物のほか、量子ドットであるQdotなどを使うことができる。ただし、冒頭で述べたとおり、両者の間にはFRETにおけるドナーとアクセプタの関係が成立する組み合わせでなければならない。例えばポリメラーゼへの蛍光標識(ドナー)はQdot525、前述した第1〜第4のヌクレオチドセットにおける、それぞれ1種の塩基(ヌクレオチドセット毎に異なる)の蛍光標識(蛍光アクセプタ:第1のアクセプタ)はAlexa555、残り3種への標識(無蛍光アクセプタ:第2のアクセプタ)についてはクエンチャ(消光色素)など種々の物質を使うことができる。ここで、クエンチャは、Alexa555と同様にアクセプタ(ただしこの場合には無蛍光アクセプタ)として機能するので、蛍光共鳴エネルギー移動により、ドナーは発光強度低下する。第2のアクセプタについては、Qdot(ドナー)や第1のアクセプタ(Alexa555)との検出信号の明瞭な識別化を図るために、励起によって蛍光を生じない無蛍光ダーククエンチャを用いることが望ましい。クエンチャは、例えばBHQ−1などである。なおdNTPへの標識は、ヌクレオチド3リン酸のγリン酸に付加することが望ましい。これは標識物質が伸長鎖に残らないようにするためである。
【0036】
ここで、図1に戻り、蛍光測定装置全体について説明する。
【0037】
Qdot525励起用のレーザ装置1(例えば、LDレーザ、405nm)からのレーザ光をλ/4波長板2を通して円偏光とする。なおレーザは上記に特定されず、ドナーを励起できるものなら種類は問わない。例えば今回のようにQdot525を励起する際、He−Cdレーザ(442nm)などを使用しても良い。レーザ光を、レンズを介して全反射照明用の石英製プリズム7に図のように入射面に垂直に入射し、DNA分子を捕捉する基板8の裏側から照射する。石英製プリズム7と基板8はマッチングオイル(無蛍光グリセリン等)を介して接触させており、レーザ光はその界面で反射することなく、基板8に導入される。基板8の反応領域8a表面は反応液(水)で覆われており、その界面にてレーザ光は全反射し、エバネッセント照明となる。これにより、高いS/Nで蛍光測定が可能になる。
【0038】
なお、基板8の近傍には、温調器が配置されているが、図では省略した。また、通常観察のため、プリズム下部よりハロゲン照明、LED照明ができる構造としているが、図ではこれを省略している。
【0039】
基板8の上部には、試薬などを流し、反応させるためのフローチャンバ9が構成されている。図2(C)に示すように、フローチャンバ9のうち、基板8の反応領域8aと対向する領域が、既述した液槽9aとなるために、液槽となる長方形(形状は問わない)で窪みを有しており、その窪みの両端に液体導入孔9bと液体排出孔9cが設けられている。フローチャンバ9は、石英材などの透明材質より形成されている。また、図1に示すように、フローチャンバ9の上面には、試薬導入口12が設けてあり、分注ノズル26を有する分注ユニット25、試薬保管ユニット27、チップボックス28に収容された分注チップを用いて、目的の試薬液の注入などを行う。
【0040】
具体的には、試薬保管ユニット27には、試料液容器27a、4種類(第1〜第4)のヌクレオチドセット溶液容器27b、27c、27d、27e及び洗浄液容器27f等が用意される。チップボックス28内の分注チップを分注ノズル26に取り付け、適当な試薬液を吸引し、試薬導入口12から基板の反応領域に導入し、反応させる。廃液は廃液チューブ10を介して廃液容器11に排出される。これらは制御ユニット(PC)21により自動的に行われる。
【0041】
フローチャンバ9は、光軸方向に透明な材質で形成される。フローチャンバ内の蛍光標識ポリメラーゼのドナーの蛍光及びそれに共鳴励起される蛍光標識ヌクレオチドのアクセプタの蛍光は、符号13に示すようにフローチャンバ9を透過して、自動ピント合わせ装置29で制御される集光レンズ(対物レンズ)14で集められ、フィルタユニット15で必要な波長の蛍光を取り出され、不必要な波長の光が除去される。フィルタユニット15を透過する蛍光は、ダイクロイックミラー32により、波長ごとに分割された光束に分離される。分離された光束は、それぞれ補助フィルタ17a、17bを介して、結像レンズ18a、18bにより、それぞれ、2次元センサカメラ19a、19b(高感度冷却2次元CCDカメラ)に結像させられ、検出される。カメラの露光時間の設定、蛍光画像の取り込みタイミングなどの制御は、2次元センサカメラコントローラ20a、20bを介して制御PC21が行う。結果はモニタ22に表示される。なお、フィルタユニット15には、レーザ光除去用のロングパスフィルタ(405nm)、検出する波長帯を透過させるバンドパスフィルタ(透過帯域:440−680nm)を組み合わせて用いる。レーザ光除去用のハイパスフィルタの概略特性を図3(A)に、バンドパスフィルタを図3(B)に、ダイクロイックミラー32を図3(C)に示す。
【0042】
なお、装置は、調整などのため、透過光観察用鏡筒16とTVカメラ23とモニタ24を備えており、ハロゲン照明などで基板8の状態をリアルタイムで観察できるようになっている。
【0043】
図2(A)に示すように、基板8には位置決めマーカ80、81が刻印されている。マーカ80、81は、スポット8ijの並びと平行に配置され、その間隔が規定されている。そこで、透過照明での観測でマーカ80,81を検出することで、スポット8ijの位置を計算することができる。
【0044】
本実施例で使用する2次元センサカメラ19a,19bとして、CCDエリアセンサを使用する。種々の画素サイズ、画素数のCCDエリアセンサを使うことができる。たとえば、画素サイズが7.4×7.4マイクロメータで、画素数2048×2048画素の冷却CCDカメラを使用する。なお、2次元センサカメラとしては、CCDエリアセンサの他、C−MOSエリアセンサなどの撮像カメラなどを一般に使うことができる。CCDエリアセンサにも、構造によって、背面照射型、正面照射型があり、どちらも使用できる。また、素子内部に信号の増倍機能を有する電子増倍型CCDカメラなども高感度化を図る上で有効である。また、センサは冷却型が望ましく、−20℃程度以下にすることで、センサの持つダークノイズを低減でき、測定の精度を高めることができる。
【0045】
反応領域8aからの蛍光像を一度に検出してもいいし、分割することもできる。この場合、基板の位置を移動させるためのX−Y移動機構部をステージ下部に配置し、制御PCで照射位置への移動、光照射、蛍光像検出を制御する。本例ではX−Y移動機構部は図示していない。
(反応の工程)
図4に本実施例の反応フローを示す。基板8のDNA捕捉スポット8ijの表面に、金を材質とした構造体が配置されている場合を例として説明する。
<準備工程>
ターゲットである鋳型DNA33を変性等によって一本鎖化し、その鋳型DNA33の5’末端をチオール化し(符号50で示す)、3’末端にポリA配列30を付加する。例えば、試薬バッファを導入口12よりフローチャンバ9の液槽9aに導入することにより、金−チオール結合を利用して、金構造体上にポリA付加鋳型DNA33を固定する。ポリTプライマ34をチャンバに導入し、ポリA付加鋳型DNA33にハイブリダイズさせる。余剰な鋳型DNA33およびプライマ34を洗浄用バッファにてチャンバより洗い流す。
<伸長反応工程1>
次に、Alexa555(第1のアクセプタ:蛍光アクセプタ)で標識されたdATP及びBHQ−1(第2のアクセプタ:無蛍光アクセプタ:クエンチャ)で標識されたdCTP、dGTP、dTTPからなる第1のヌクレオチドセットと、Qdot525(ドナー)で標識されたThermo Sequenaseポリメラーゼ35とを加えたThermo Sequenase Reactionバッファを導入口12よりフローチャンバ9aへ導入し、伸長反応を開始する。反応中は、LDレーザを連続的に照射し、常にQdot525を励起し続け、レーザ光により励起されて蛍光するQdot525およびそのQdot525からの蛍光波長によりFRETにより励起されるAlexa555の蛍光強度の変化をモニタリングし続ける。照射方法はエバネッセント照射であり、反応領域8a表面近傍のみが励起光照射領域となるため、それ以外の領域に存在するQdot525ポリメラーゼ35は励起されず、背景光の少ない測定ができる。
【0046】
Qdot525とAlexa555の蛍光はダイクロイックミラー32で波長ごとに分けられ、補助フィルタ17a,17bおよびレンズ18a,18bを介してそれぞれ2台のCCDカメラ19a,19bに結像される。第1のCCDカメラ19aでは、Qdot525の蛍光が、第2のCCDカメラ19bではAlexa555の蛍光がそれぞれ常時モニタリングされる。伸長反応においてヌクレオチド(dNTP)の取り込みが生じた際、Qdot525とAlexa555またはBHQ−1の距離は十分に近くなり、両者の間にはFRETにおけるドナー・アクセプタの関係が成立する。すなわち、ドナーであるQdot525の蛍光強度が低下した場合、アクセプタ或いはクエンチャが近傍に存在しdNTPの取り込みが生じたことになる。同時にAlexa555の蛍光強度が観察された場合は、取り込まれたdNTPの種類がAlexa555によって標識されたdNTPであると特定できる。例えば上記第1のヌクレオチドセットを用いて伸長反応を行った際、Qdot525の信号が低下すると同時にAlexa555の信号が観察された場合、そのdNTPの種類は塩基種Aである。一方、Qdot525の信号が低下したが、Alexa555の蛍光強度が観察されない場合には、クエンチャ(消光色素)であるBHQ−1に標識されたdNTP(ここでは、C、G、Tのうちいずれか一つ)が取り込まれたことになる。Qdot525の蛍光強度低下のイベント数は、また、取り込まれたdNTPの数に等しいため、上記第1のヌクレオチドセットを用いた場合、上記したAlexa555の蛍光信号とBHQ−1の消光信号の配列により、伸長鎖(ヌクレオチド配列)36中の何塩基の間隔で塩基種A(dATP)が存在しているかという情報を得ることができる。例えば、Qdot525の信号強度低下が10回観察され、Alexa555の信号強度の変化が、(0=信号なし、1=信号あり)として、[0010000100]というデータを得た場合、鋳型DNA33は10bpであり、その3番目と8番目は塩基種Aであるので、これに相補的なターゲット鋳型DNAの塩基種は、Tであることが特定できる。伸長反応終了後、熱変性等を行い、遊離した伸長鎖36を洗浄バッファによって除去する。
<伸長反応工程2>
前記洗浄バッファによる伸長鎖除去後に、残存する前記ターゲット鋳型DNA(ポリA付加鋳型DNA)33及び新たに導入したプライマ34を用い、且つAlexa555で標識されたdCTPと、BHQ−1で標識されたdATP、dGTP、dTTPとからなる第2のヌクレオチドセットを用いて、反応工程1と同様の手順で反応・観察を行う。本工程によって、ターゲット鋳型DNA33に取り込まれる伸長鎖(ヌクレオチド配列)36中の塩基種C(dCPT)については、FRETによりAlexa555が蛍光する。したがって、これと相補的なターゲット鋳型DNAの塩基種Gの位置が特定する。伸長反応終了後、熱変性等を行い、遊離した伸長鎖36を洗浄バッファによって除去する。
<伸長反応工程3>
前記洗浄バッファによる伸長鎖除去後に、前記ターゲット鋳型DNA(ポリA付加鋳型DNA)33及び新たに導入したプライマ34を用い、且つAlexa555で標識されたdGTPと、BHQ−1で標識されたdATP、dCTP、dTTPとからなる第3のヌクレオチドセットを用いて、反応工程1、2と同様の手順で反応・観察を行う。本工程によって、ターゲット鋳型DNA33に取り込まれる伸長鎖(ヌクレオチド配列中)36の塩基種GについてはFRETによりAlexa555が蛍光するので、Gに相補的なターゲット鋳型DNAのCの位置を特定する。伸長反応終了後、熱変性等を行い、遊離した伸長鎖36を洗浄バッファによって除去する。
<伸長反応工程4>
前記洗浄バッファによる伸長鎖除去後に、前記ターゲット鋳型DNA(ポリA付加鋳型DNA)33及び新たに導入したプライマ34を用い、且つAlexa555で標識されたdTTPと、BHQ−1で標識されたdATP、dCTP、dGTPからなる第4のヌクレオチドセットを用いて、反応工程1と同様の手順で反応・観察を行う。本工程によって、ターゲット鋳型DNA33に取り込まれる塩基種(ヌクレオチド配列中)36の塩基種TについてはFRETによりAlexa555が蛍光するので、Tに相補的なターゲット鋳型DNAのAの位置を特定する。伸長反応終了後、熱変性等を行い、遊離した伸長鎖36を洗浄バッファによって除去する。
【0047】
以上の1〜4の反応工程(4サイクル)で得られた蛍光強度信号のモニタリング(検出)データを総合して、鋳型DNA33の配列を決定する。サンプルとして10bpの未知配列をシーケンシングした際の、第1のヌクレオチドセットによって得られるデータの模式図を図5(A)に、第2のヌクレオチドセットによって得られるデータの模式図を図5(B)に、第3のヌクレオチドセットによって得られるデータの模式図を図5(C)に、第4のヌクレオチドセットによって得られるデータの模式図を図5(D)に示す。図5(A)〜図5(D)は、Qdot525およびAlexa555の信号強度の時間変化を表し、上側の信号が第1のCCD19aで検出されるQdot525(ドナー蛍光)由来の信号、下側の信号が第2のCCD19bで検出されるAlexa555(第1のアクセプタ:蛍光アクセプタ)由来およびクエンチャ(第2のアクセプタ:無蛍光アクセプタ)由来の信号である。
【0048】
本実施例では、第1のヌクレオチドセットによって得られるdNTP配列情報は、BBABBBABBB(B=C、G、Tのいずれか)、第2のヌクレオチドセットによって得られるdNTP配列情報は、DDDDDCDDCD(D=A、G、Tのいずれか)、第3のヌクレオチドセットによって得られるdNTP配列情報はGHHHHHHGHH(H=A、C、Tのいずれか)、第4のヌクレオチドセットによって得られるdNTP配列情報はVTVTTVVVVT(V=A、C、Gのいずれか)となる。以上の結果より、鋳型DNA33に取り込まれたヌクレオチドは順にGTATTCAGCTであると特定できる。それにより、相補的なターゲット鋳型DNAの塩基配列は、CATAAGTCGAと解読される。
【0049】
かような核酸解析(本実施例では塩基配列)は、演算装置(制御ユニット)21が、dNTPの捕捉,伸長が確認されたスポット8ijの位置データ(二次元センサカメラ19a,19bの座標データ)と、その位置における蛍光検出データ(二次元センサカメラセンサ19a,19bの光測定強度)を取り込み、これらのデータに基づき上記の配列情報を演算することで行われる。
【0050】
なお本システムでは、反応領域8aの複数のスポット8ijからの発光を同時計測できるため、スポット8ijにそれぞれ異なる鋳型DNAを設置する場合には、前記複数の異なる鋳型DNA−プライマ複合体に取り込まれたdNTPの塩基種を、つまり複数の鋳型DNAの配列を上記の位置データおよび蛍光検出データにより同時に決定することができる。
【0051】
また、使用できる蛍光体(ドナー、アクセプタ)は本実施例に示すものに限らず、所定の励起光を使い、異なる蛍光特性を有する蛍光体の組み合わせであれば同様に使用できる。一般には、蛍光極大波長が各々異なる種類の組み合わせであればよい。本実施例では、ドナーとしてのQdot525は、405nm励起、525nm蛍光であり、アクセプタとしてのAlexa555は、525nm励起、570nm蛍光であり、図11の蛍光波長特性に示すように両者の蛍光波長特性が十分に離れているので、両者の蛍光識別の精度が高められる。
【0052】
さらに、本実施例では、第1のアクセプタをドナー励起により発光する蛍光物質により構成し、第2のアクセプタとして、無蛍光アクセプタを用いるが、第2のアクセプタについては、第1のアクセプタに対して識別できる程度の弱い光(例えば、第1のアクセプタの1/10程度の光)、換言すれば識別可能な発光強度を有する蛍光物質であってもよい(後述の他の実施例でも同様である)。換言すれば、第1のアクセプタの発光強度は、第2のアクセプタの発光強度の10倍以上である。また、第1のアクセプタと第2のアクセプタとして、互いの波長が顕著に離れている蛍光色素を使用してもよい。
【0053】
例えば、ドナーがQdot 525の場合には、第1のアクセプタとしては、Alexa555のほかにCy3があり、第2のアクセプタとして消光させるタイプのものにはBHQ-1のほかに、BHQ-2、DABCYL、Eclipse dark quencher、Iowa black FQ等がある。また、第1のアクセプタとして、上記同様にAlexa555或いはCy3とした場合、第2のアクセプタとして蛍光強度・波長特性の異なるタイプのものには、TAMRA、Cy3.5などがある。
【0054】
本実施例ではまた、石英製プリズム7に対してレーザ光をその入射面に垂直つまり入射角度0度で入射している。これにより、基板8とプリズム7を一体化して移動させても、対物レンズ14の観察視野からレーザ照射位置がずれないため、基板とプリズムを一体化することができ、プリズムと基板とのカップリング方式を種々選ぶことが可能になる。オイルカップリングのほか、光学接着も可能になり、装置構成を容易に選ぶことができる。
【0055】
本実施例では、基板8の各8ijの反応領域に結合しているドナー蛍光分子が1分子であり、複数の異なる蛍光分子が同じ位置にいないため、本発明のような装置及び方法で効率よく蛍光体種つまりは塩基種が識別でき、しかも高密度な基板に対応できる。
【0056】
なお、本実施例では、検出する波長帯域が480−680nmであるが、これに制限されることはない。使用する蛍光体の波長帯域に応じて、任意に対応できる。
【0057】
実施例では、オリゴヌクレオチド等の生体関連分子が捕捉される基板8に、蛍光測定用の励起光を照射し、それにより生じるドナー蛍光及びFRETによるアクセプタ蛍光を集光し、2次元検出器に結像させ、2次元検出器にて蛍光検出する。基板は実質的に透明な基板であり、分子が捕捉されうるスポットが複数設けられ、それらが格子配列構造の格子点位置(スポット8ij)に配置されている。該基板上で必要な試薬や試料などを反応させ、全反射照明のための光励起用の光源と、照射光学系により該基板上の蛍光体を励起し、発する蛍光を蛍光集光系で集光し、その光束を指定の波長範囲において実質的に各々の波長で異なる比率で分割する分光部により分割し、結像光学系で各々検出器に結像し、複数の検出画素を備えた検出器により検出する。これにより、簡便に多種の蛍光体種を識別検出することができる。
【0058】
実施例では、基板に金属構造物を形成している。この場合、構造物の光ルミネセンス、光散乱を検出することで、構造物の空間位置を検出することができ、位置の基準マーカとして活用でき、効果的である。
【0059】
格子点位置の領域(スポット、格子点の領域)の大きさは100nm径以下にする。少なくとも、隣接する最短の格子点の間隔の1/3以下が好ましい。これにより、光学的に解像しやすくなり、識別が容易になる。格子点位置の捕捉のための領域を10nm〜30nm程度にすれば、単一分子の捕捉に有効である。
【0060】
また、本例では、一定間隔の格子状に捕捉スポットを配置する基板を使用する。格子状に配置することで、透過像と反射像内の相対応する輝点の識別が容易になる。格子状に捕捉スポットを配置する基板を使わない場合にも対応する。分子をランダムに分散させて捕捉する場合など、捕捉位置が、ランダムに分散する場合は、両方の画像を比較し、パターン解析し、または基準マーカを参照して、相対応する輝点を判定すればよい、これによっても同様の効果が得られる。
【実施例2】
【0061】
本実施例は、図6の反応フローに示すように、基板8表面のdNTP捕捉スポットに、プライマ34を固定配置し、これにターゲットとなる鋳型DNA33をハイブリダイズさせ、伸長反応によって鋳型DNA33に相補鎖な伸長鎖36を合成し、その伸長鎖36にさらに相補的に捕捉される伸長鎖38の配列を解読することで、ターゲット鋳型DNA33の配列を決定する。この場合、伸長鎖38の配列は、ターゲット鋳型DNA33の配列そのものとなる。
(装置構成)
実施例1と同様の構成である
(反応の工程)
<準備工程>
前準備として、ターゲットである鋳型DNA33を変性等によって一本鎖化し、その鋳型DNA33の3’末端にポリA配列30を付加してポリA付加鋳型DNA33を作成しておく。そして、図6の上段に示すように、基板8表面のdNTP捕捉スポット8ijには、ポリTプライマ34を固定する。固定方法は、例えばポリTプライマ34の5’末端をチオール化し(符号50で示す)、dNTP捕捉スポット8ij(測定スポット)に配置した金構造体に対し、金−チオール結合を利用する。そして、ターゲット鋳型DNA33をチャンバに導入し、ポリTプライマ34とハイブリダイズさせる。任意のヌクレオチドセット(第1〜第4のヌクレオチドセットのいずれか)およびQdot525で標識されたThermo Sequenaseポリメラーゼ35を加えたThermo Sequenase Reactionバッファを導入口12よりチャンバへ導入し、ポリメラーゼ反応により、dNTPの捕捉・伸長反応を開始する。伸長反応完了後、熱変性を行い、遊離した鋳型DNA33を洗浄によって除去する。基板8(スポット8ij)に残った伸長鎖36の3’末端に、プライマ認識部位として、ターミナルトランスフェラーゼ等によりポリA配列37を付加する。なおプライマ認識配列としては、既知の配列を付加しても構わない。
<伸長反応工程1>
上記準備工程後に、図6の下段に示すように、新たなポリTプライマ34をフローチャンバ9に導入し、鋳型DNA33に相補的な伸長鎖36の末端3’に付加したポリA配列37とハイブリダイズさせる。そして、Alexa555(蛍光アクセプタ:第1アクセプタ)で標識されたdATPと、BHQ−1(無蛍光アクセプタ:第2アクセプタ)で標識されたdCTP、dGTP、dTTPとからなる第1のヌクレオチドセット、および、Qdot525(ドナー)で標識されたThermo Sequenaseポリメラーゼ35を加えたThermo Sequenase Reactionバッファを、導入口12よりフローチャンバへ導入し、伸長反応を開始する。伸長鎖(鋳型33に対する相補鎖)36にとり取り込まれる一分子ずつのdNTPの伸長により相補的な伸長鎖38が形成される過程で、実施例1と同様の手順で観察を行う。本工程によってターゲット鋳型DNA33中の塩基種Aの位置を伸長鎖38から特定する。伸長反応終了後、熱変性等を行って伸長鎖38を遊離させ、遊離した伸長鎖38を洗浄バッファによって除去する。
<伸長反応工程2>
前記洗浄バッファによる伸長鎖38の除去後に、図6の下段に示すように、新たに導入したポリA37及びプライマ34を用い、且つAlexa555で標識されたdCTPと、BHQ−1で標識されたdATP、dGTP、dTTPとからなる第2のヌクレオチドセットを用いて、反応工程1と同様の手順(反応)で新たに伸長鎖38を形成し、観察を行う。本工程によって、鋳型DNA33中のCの位置を特定する。伸長反応終了後、熱変性等を行い、遊離した伸長鎖38を洗浄バッファによって除去する。
<伸長反応工程3>
前記洗浄バッファによる伸長鎖38の除去後に、再度、新たに導入したポリA37及びプライマ34を用い、且つAlexa555で標識されたdGTPと、BHQ−1で標識されたdATP、dCTP、dTTPからなる第2のヌクレオチドセットを用いて、反応工程1と同様の手順で新たに伸長鎖を形成し、観察を行う。本工程によって、鋳型DNA33中のGの位置を特定する。伸長反応終了後、熱変性等を行い、遊離した伸長鎖38を洗浄バッファによって除去する。
<伸長反応工程4>
前記洗浄バッファによる伸長鎖38の除去後に、再度、新たに導入したポリA37及びプライマ34を用い、且つAlexa555で標識されたdTTPと、BHQ−1で標識されたdATP、dCTP、dGTPからなる第2のヌクレオチドセットを用いて、反応工程1と同様の手順で新たな伸長鎖を形成し、観察を行う。本工程によって、鋳型DNA33中のTの位置を特定する。伸長反応終了後、熱変性等を行い、遊離した伸長鎖38を洗浄バッファによって除去する。
【0062】
以上1〜4の反応工程で得られたデータを総合して、実施例1同様にターゲットである鋳型DNA33の配列を決定する。
【実施例3】
【0063】
本実施例では、図7に反応フローに示すように、基板表面に配置したプライマ34に対し、ターゲットとなる鋳型DNA33を環状化してハイブリダイズさせ、RCA(Rolling Circle Amplification)反応によってターゲット鋳型DNA33に取り込まれたヌクレオチド(dNTP)の種類を決定することで、鋳型DNA33の配列を決定する。RCA法とは、鎖置換活性を有するDNAポリメラーゼを用いて、鋳型となる環状DNAから相補鎖を連続して合成する手法である。使用するポリメラーゼは、例えばバクテリオファージ由来のphi29DNAポリメラーゼやBstDNAポリメラーゼラージフラグメント(New England Biolabs)などである。
(装置構成)
実施例1と同様の構成である。
(反応の工程)
<準備工程>
前準備として、ターゲットである鋳型DNA33を変性等によって一本鎖化し、その鋳型DNA33の3’末端にポリA配列70を付加して、鋳型DNAを環状化しておく。そして、図7に示すように、基板表面のdNTP捕捉スポット8ijには、ポリTプライマ34を固定する。固定方法は例えばポリTプライマ34の5’末端をチオール化(50)し、dNTP捕捉スポット8ij(測定スポット)に配置した金構造体に対し、金−チオール結合を利用する。そして、上記環状鋳型DNA33をフローチャンバに導入し、ポリA配列70に、ポリTプライマ34とハイブリダイズさせる。
<伸長反応工程1>
上記準備工程後に、Alexa555(蛍光アクセプタ:第1アクセプタ)で標識されたdATP及びBHQ−1(無蛍光アクセプタ:第2アクセプタ)で標識されたdCTP、dGTP、dTTPからなる第1のヌクレオチドセットと、Qdot525(ドナー)で標識されたphi29DNAポリメラーゼ35とを加えた反応バッファを、導入口12よりフローチャンバへ導入し、RCA反応を開始する。実施例1と同様の手順で観察を行う。本工程によって鋳型DNA33と相補のdNTPが順次捕捉され伸長して伸長鎖71a(総称としては、71で示す)が得られ、その伸長鎖71a中の塩基A(dATP)の位置を実施例1、2同様のFRETを利用して特定する。ちなみに、伸長が続くと、伸長鎖の5’末端で鋳型DNAのポリA配列70の部分との置換が始まり(新たなプライマ合成)鋳型DNA一周分の合成が終了する。伸長鎖71aの合成が終了した時点からポリA配列70での置換が終了する時点(新たなプライマ合成が終了する時点)間の任意の時点で、2−ニトロベンジル基が結合するケージドdNTPをチャンバに導入して伸長反応を停止させる。フローチャンバ9内を洗浄し、遊離dNTPを除去する。
<伸長反応工程2>
次いで、Alexa555で標識されたdCTP及びBHQ−1で標識されたdATP、dGTP、dTTPからなる第2のヌクレオチドセットをフローチャンバ内に導入する。360nm以下の紫外線を照射し、ケージド物質(2−ニトロベンジル基)を遊離させ、伸長鎖71の伸長反応を再開することにより新たなプライマを拠点として伸長鎖71bを得る。この場合の伸長反応の工程および観察は、伸長反応1の工程と同様の手順である。本工程によって、伸長鎖71b中の塩基C(dCTP)の位置を特定する。伸長鎖71bの合成終了時点後、反応工程1同様にタイミングで、2−ニトロベンジル基が結合するケージドdNTPをチャンバに導入して伸長反応を停止する。チャンバ内を洗浄し、遊離dNTPを除去する。
<伸長反応工程3>
次いで、Alexa555で標識されたdGTP及びBHQ−1で標識されたdATP、dCTP、dTTPからなる第3のヌクレオチドセットをフローチャンバ内に導入する。上記伸長反応2の工程同様に、360nm以下の紫外線を照射し、ケージド物質(2−ニトロベンジル基)を遊離させ、伸長鎖71の伸長反応を再開することにより、伸長鎖71cを得る。この場合の伸長反応の工程および観察は、伸長反応1、2の工程と同様の手順である。本工程によって、伸長鎖71c中の塩基G(dGPT)の位置を特定する。一定時間伸長反応後、2−ニトロベンジル基が結合するケージドdNTPをチャンバに導入して伸長反応を停止する。チャンバ内を洗浄し、遊離dNTPを除去する。
<伸長反応工程4>
次いで、Alexa555で標識されたdTTP及びBHQ−1で標識されたdATP、dCTP、dGTPからなる第4のヌクレオチドセットをチャンバ内に導入する。360nm以下の紫外線を照射し、ケージド物質(2−ニトロベンジル基)を遊離させ、伸長反応を再開し、伸長鎖71dを得る。この場合、伸長反応工程1〜3と同様の手順で反応・観察を行う。本工程によって、伸長鎖71d中の塩基T(dTPT)の位置を特定する。一定時間伸長反応後、2−ニトロベンジル基が結合するケージドdNTPをチャンバに導入して伸長反応を停止する。チャンバ内を洗浄し、遊離dNTPを除去する。
【0064】
伸長鎖71a〜71dの塩基配列パターンは、いずれも同一であるので、1〜4の伸長反応工程で得られたFRET(Qdot525、Alexa555、BHQ−1)の蛍光検出データを総合して、ターゲットである鋳型DNA33の配列を決定する。本例によれば、熱変性が不要であるため、操作が簡便となる。本実施例では最初のヌクレオチドセットで鋳型鎖1周分のシーケンシングを完了した時点で反応を停止し、次のヌクレオチドセットを導入しているが、複数周分のシーケンスを行うことも可能である。この場合、配列を複数回読むことで精度が向上するとい
うメリットがある。
【0065】
DNAポリメラーゼ35の基質としては、鋳型DNAに取り込まれてDNA鎖伸長反応を保護基の存在により停止することができ、かつ検出され得る標識を持つ4種のdNTPの誘導体であり、なんらかの手段により該dNTP誘導体を伸長可能な状態に戻す(再開する)ことのできるものである。このような伸長可能な状態に戻す試薬として、本例では、蛍光標識ケージドdNTPを使用するが、蛍光体とヌクレオチドをジスルフィド結合により結合するdNTPの誘導体などでも同様に実施可能である。この場合、蛍光体の存在で、伸長が停止し、Tris[2−carboxyethyl]phosphine試薬などでジスルフィド結合を化学的に解離させて伸長可能な状態に戻すことが可能である。
【0066】
なお本実施例では、使用者の利便性を考慮し、ヌクレオチドセット交換時に反応を停止するような試薬および機能を追加したが、これらの工程が無くともシーケンシングは成立する。
【実施例4】
【0067】
実施例3では、ターゲットとなる鋳型DNA33を環状化し、プライマ34を介して基板表面に結合させているが、別方式として、ドナーであるQdot525−ポリメラーゼ複合体35を基板表面に配置して(図示省略)、環状の鋳型DNA33を上記複合体と結合させ伸長反応を行い、取り込まれたdNTPの種類を決定してもよい。装置構成および反応工程は実施例3と同様である。
【実施例5】
【0068】
本実施例の反応フローを図8に示す。本実施例では、実施例3同様の反応手順により、基板表面に配置したプライマ34に対し、ターゲットとなる鋳型DNA33を環状化してハイブリダイズさせ、RCA反応によって鋳型DNA33に相補鎖な配列を連続して持つ伸長鎖71を、前記した第1〜第4のヌクレオチドセットごとに順次合成する(すなわち伸長鎖71a〜71dを順次合成する)。さらに、熱変性、洗浄により環状DNA鋳型33及びポリメラーゼ35を洗浄除去した後に、ポリG配列72を伸長鎖71の末端3’に付加し、このポリG72にプライマ73をハイブリダイズする。この状態で、再度、第1〜第4のヌクレオチドセットを順次、標識ポリメラーゼと共に加えることで、伸長鎖71a〜71dに相補のdNTP伸長鎖74a〜74dを合成する。この伸長鎖74a〜74dのFRETによる蛍光検出データの配列を解読することで、ターゲット鋳型DNA33の配列を決定することが可能になる。
(装置構成)
実施例1と同様の構成である
(反応の工程)
<準備工程>
前準備として、ターゲットである鋳型DNA33を変性等によって一本鎖化し、その鋳型DNA33の3’末端にポリA配列70を付加して、鋳型DNAを環状化しておく。そして、図8に示すように、基板表面のdNTP捕捉スポット8ijには、ポリTプライマ34を固定する。固定方法は例えばポリTプライマ34の5’末端をチオール化(50)し、dNTP捕捉スポット8ij(測定スポット)に配置した金構造体に対し、金−チオール結合を利用する。そして、上記環状鋳型DNA33をフローチャンバに導入し、ポリA配列70を、ポリTプライマ34にハイブリダイズさせる。さらに、既述した第1〜第4のヌクレオチドセットを順次、Qdot525で標識された鎖置換活性を有するポリメラーゼ35と共に反応バッファとして導入口12よりフローチャンバへ導入し、実施例3同様のRCA反応工程により伸長鎖71(71a〜71d)を合成する。ここまでは、図7の一連の反応工程と同様であるが、本実施例では、ここまでが前準備工程であるので、蛍光検出は行われない。伸長鎖71の合成後、熱変性を行い、鋳型DNA33を遊離し且つそれを洗浄によって除去する。残った伸長鎖71の3’末端に、プライマ認識部位として、ターミナルトランスフェラーゼ等によりポリG配列72を付加する。なおプライマ認識配列としては、既知の配列を付加しても構わない。
<伸長反応工程1>
次いで、ポリCプライマ73をフローチャンバに導入し、鋳型DNA33に伸長鎖71(71a〜71d)のポリG配列72にハイブリダイズさせる。この状態で、Alexa555(第1のアクセプタ)で標識されたdATP及びBHQ−1(第2のアクセプタ)で標識されたdCTP、dGTP、dTTPからなる第1のヌクレオチドセットと、Qdot525(ドナー)で標識されたphi29DNAポリメラーゼ35とを加えた反応バッファを、導入口12よりフローチャンバ9へ導入し、RCA反応を開始する。本工程で伸長鎖71(71a〜71d)に相補な伸長鎖74(74a〜74d)を得る。本工程によって伸長鎖74(74a〜74d)のうち塩基Aの蛍光検出データ(前述の実施例同様のFRETによる蛍光検出データ)が得られ、このデータを下に鋳型DNA33中の塩基Aの位置を特定する。伸長反応終了後、熱変性等を行い、遊離した伸長鎖74及びプライマ73を洗浄バッファによって除去する。
<伸長反応工程2>
次いで、新たにポリCプライマ73をチャンバに導入し、反応工程1同様に、残存する伸長鎖71のポリG配列72とハイブリダイズさせる。この状態で、Alexa555で標識されたdCTP及びBHQ−1で標識されたdATP、dGTP、dTTPからなる第2のヌクレオチドセットと、Qdot525で標識されたphi29DNAポリメラーゼ35とを加えた反応バッファをフローチャンバ9へ導入する。これにより、反応工程1同様にして、伸長鎖71に相補な伸長鎖74を得る。本工程によって伸長鎖74のうち塩基Cの蛍光検出データが得られ、このデータを下に鋳型DNA33中の塩基Cの位置を特定する。伸長反応終了後、熱変性等を行い、遊離した伸長鎖38を洗浄バッファによって除去する。伸長反応終了後、熱変性等を行い、遊離した伸長鎖74及びプライマ73を洗浄バッファによって除去する。
<伸長反応工程3>
次いで、新たなポリCプライマ34をチャンバに導入し、反応工程1、2同様に、残存する伸長鎖71のポリG配列72とハイブリダイズさせる。この状態で、Alexa555で標識されたdGTP及びBHQ−1で標識されたdATP、dCTP、dTTPからなる第3のヌクレオチドセットと、Qdot525で標識されたphi29DNAポリメラーゼ35とを加えた反応バッファをフローチャンバ9へ導入する。これにより、反応工程1、2同様にして、伸長鎖71に相補な伸長鎖74を得る。本工程によって伸長鎖74のうち塩基Gの蛍光検出データが得られ、このデータを下に鋳型DNA33中の塩基Gの位置を特定する。伸長反応終了後、熱変性等を行い、遊離した伸長鎖38を洗浄バッファによって除去する。伸長反応終了後、熱変性等を行い、遊離した伸長鎖74及びプライマ73を洗浄バッファによって除去する。
<伸長反応工程4>
次いで、新たなポリCプライマ34をチャンバに導入し、反応工程1、2、3同様に、残存する伸長鎖71のポリG配列72とハイブリダイズさせる。この状態で、Alexa555で標識されたdTTP及びBHQ−1で標識されたdATP、dCTP、dGTPからなる第4のヌクレオチドセットと、Qdot525で標識されたphi29DNAポリメラーゼ35とを加えた反応バッファをフローチャンバ9へ導入する。これにより、反応工程1、2、3同様にして、伸長鎖71に相補な伸長鎖74を得る。本工程によって伸長鎖74のうち塩基Tの蛍光検出データが得られ、このデータを下に鋳型DNA33中の塩基Tの位置を特定する。伸長反応終了後、熱変性等を行い、遊離した伸長鎖38を洗浄バッファによって除去する。伸長反応終了後、熱変性等を行い、遊離した伸長鎖74及びプライマ73を洗浄バッファによって除去する。
【0069】
以上1〜4の反応工程で得られたデータを総合して、ターゲットである鋳型DNA33の配列を決定する。本実施例によれば、塩基配列を、塩基種ごとに、いずれも伸長鎖74a〜74bから読むので、複数回(本実施例では、4回)読むことで精度が向上する。
【実施例6】
【0070】
上記実施例1から3の変形例として、Qdot525(ドナー)を、ポリメラーゼに代えて鋳型DNA33に標識し、すなわち基板上に鋳型DNA33を介してQdot525を固定し、前記第1〜第4のヌクレオチドセットと蛍光標識無しのポリメラーゼとを前記実施例同様に用いてdNTP伸長反応を行うことも可能である。鋳型DNA上のQdot525の位置は、FRETに必要なドナー・アクセプタ間の距離がおおよそ10nmに制限される関係上、伸長鎖として取り込まれるdNTPの位置に対して常にFRET反応が可能な距離(例えば10nm)内を保てる箇所に設定する必要がある。このような条件の下で、実施例1〜3同様の蛍光検出をヌクレオチドセットごとのdNTP伸長反応工程で行えば、鋳型DNAの配列解析が可能になる。本実施例は、短鎖DNAの塩基配列の解析に適している。本実施例によれば、ポリメラーゼ反応によりに蛍光標識を行わずに済むため、構造変化や立体障害に伴うポリメラーゼの酵素活性が損なわれる可能性がなくなる。
【実施例7】
【0071】
さらに、上記実施例1、2、5等の変形例として、これまた、ポリメラーゼに代えて、プライマ34にQdot525(ドナー)を標識し、上記実施例同様のdNTP伸長反応を行い、鋳型DNA33の配列を解読しても良い。本例もまた実施例6同様、ポリメラーゼに蛍光標識を行わずに済むため、構造変化や立体障害に伴うポリメラーゼの酵素活性が損なわれる可能背がなくなる。同じく本例は、FRETに必要なドナー・アクセプタ間の距離がおおよそ10nmに制限される関係上、短鎖DNAの解析に適している。
【実施例8】
【0072】
上記各実施例の変形例として、プライマ34の3’末端を2−ニトロベンジル化することで、伸長反応開始のタイミングを制御することができる。この場合、装置に360nm以下のUV光源を追加する。プライマ34を鋳型DNA33にハイブリダイズ後、ヌクレオチドセットを導入した状態でUVを照射することで、保護基が遊離し、伸長反応が開始する。伸長反応の開始を制御することで、より信頼性の高い配列データを得ることが可能となる。
【実施例9】
【0073】
これまで述べてきた各実施例では、第1〜第4のヌクレオチドセットの各セットにおいて、4種類のヌクレオチド(dNTP)のうち、1種の塩基を標識する第1のアクセプタAlexa555(蛍光アクセプタ)で標識し、残りの3種類を標識する第2のアクセプタをBHQ−1(無蛍光アクセプタ:クエンチャ)で標識したヌクレオチドセットを使用しているが、他の種々の組み合わせを利用することもできる。
【0074】
例えば、上記の組み合わせとは逆に、4種類のヌクレオチド(dNTP)のうち、1種の塩基を標識する第1のアクセプタをBHQ−1(無蛍光アクセプタ:クエンチャ)或いは信号強度の弱い蛍光色素で標識し、残りの3種の塩基を標識する第2のアクセプタをAlexa555(蛍光アクセプタ)で標識したヌクレオチドセットを使用してもよい。
【0075】
具体的には、BHQ−1(第1のアクセプタ)によって標識されたdATP及びAlexa555(第2のアクセプタ)によって標識されたdCTP、dGTP、dTTPのヌクレオチドからなる第1のヌクレオチドセットと、
BHQ−1によって標識されたdCTP、及びAlexa555によって標識されたdATP、dGTP、dTTPのヌクレオチドからなる第2のヌクレオチドセットと、
BHQ−1によって標識されたdGTP、及びAlexa555によって標識されたdATP、dCTP、dTTPのヌクレオチドからなる第3のヌクレオチドセットと、
BHQ−1によって標識されたdTTP、及びAlexa555によって標識されたdATP、dCTP、dGTPのヌクレオチドからなる第4のヌクレオチドセットと、を用いる。
【0076】
このようなヌクレオチドセットを用いれば、既述したFRETを利用した場合、例えば、第1のヌクレオチドセットによって得られた伸長鎖のうち、Qdot(ドナー)の信号が低下し、Alexa555(第2のアクセプタ)の信号が上昇した場合、取り込まれた塩基はC、G、Tのいずれかである。逆にQdotの信号が低下したが、Alexa555の信号が変化しない(上昇しない)場合、BHQ−1(第1のアクセプタ)標識のdATPが取り込まれ、取り込まれた塩基はAである。
【0077】
同様の手順にして、第2〜第4のヌクレオチドセットの場合にも、それぞれの伸長鎖から、塩基の種類C、G、Tとその位置が特定される。
【実施例10】
【0078】
また、上記実施例のヌクレオチドセットに代えて、4種類のヌクレオチドのうち、2種類をAlexa555(蛍光アクセプタ:第1のアクセプタ)で標識し、他の2種類をクエンチャ(無蛍光アクセプタ:第2のアクセプタ)で標識した複数のヌクレオチドセットを使用することもできる。図12(a)〜(d)は、その組み合わせ例を示すものであり、それぞれ、上段が第1のヌクレオチドセット(第1の基質溶液)、下段が第2のヌクレオチドセット(第2の基質溶液)を示す。四角枠が蛍光アクセプタ(第1のアクセプタ)による塩基種であり、○枠が無蛍光アクセプタ(第2のアクセプタ)による塩基種である。
【0079】
例えば、図12(a)に示すように、Alexa555(蛍光アクセプタ)で標識されたdATPおよびdCTPと、BHQ−1(無蛍光アクセプタ:クエンチャ)で標識されたdGTPおよびdTTPからなる第1のヌクレオチドセットを用いてdNTP伸長反応を行い、合成される伸長鎖について、Alexa555と、Qdotの信号強度変化を観察する。次にAlexa555で標識されたdCTPおよびdGTPと、BHQ−1で標識されたdATPおよびdTTPからなる第2のヌクレオチドセットを用いて同様にdNTP伸長反応を行い、Alexa555と、Qdotの信号強度変化を観察する。
【0080】
以上2回の伸長反応において、2回(1回目及び2回目)ともAlexa555の信号が上昇した位置はC、1回目のみAlexa555の信号が上昇した位置はA、2回目のみAlexa555の信号が上昇した位置はG、どちらの結果でもAlexa555の信号が変化しなかった位置はTと推定できる。本例によれば、使用するヌクレオチドセットが2種類で済むため、操作が簡便になる。
【0081】
第1のヌクレオチドセットと第2のヌクレオチドセットの、セットごとのAlexa555(第1のアクセプタ)で標識される2種類のdNTPと、BHQ−1(第2のアクセプタ)で標識される2種類のdNTPは、2回(1回目及び2回目)ともAlexa555の信号上昇(1、1)、1回目がAlexa555の信号上昇(1、0)、2回目がAlexa555の信号上昇(0,1)、いずれもAlexa555の信号上昇無し(0,0)の2値信号が成立すればよく、上記の一例に限定されるものではない。例えば、そのほか、図12(b)〜(d)のような組み合わせが考えられる。
【0082】
本実施例に用いる第1,第2の基質溶液(ヌクレオチドセット)における塩基は、第1,第2のアクセプタとの関係で、次のように定義される。
【0083】
4種の塩基のうち、(i)第1,第2の基質溶液間で同一の1種については第1のアクセプタで標識され、(ii)基質溶液間で同一のもう1種については第2のアクセプタで標識され、(iii)基質溶液間で同一のさらにもう1種については第1の基質溶液のものが第1のアクセプタで標識され第2基質溶液のものが第2のアクセプタで標識され、(iv)基質溶液間で同一のさらにもう1種については第1の基質溶液のものが第2のアクセプタで標識され第2基質溶液のものが第1のアクセプタで標識されている。
【0084】
本例の場合にも、第1のアクセプタは、ドナー励起により蛍光する蛍光色素、第2のアクセプタは、ドナー励起により発光しないクエンチャを使用するが、それに限定されず、両者のアクセプタについて発光強度差を有するもの、波長特性の異なるものを使用しても同様の効果が得られる。
【0085】
また、Alexa555を標識させるdNTPの種類の数は、全反応工程で一定である必要は無く、特定したい塩基種の数に応じて、例えば第1のヌクレオチドセットでは、上記同様に2種類のdNTPをアクセプタで標識し、残り2種類のdNTPをクエンチャで標識し、第2のヌクレオチドセットでは3種類のヌクレオチドを標識するといったような、種々の組み合わせも可能である。
【実施例11】
【0086】
上記の実施例1〜10に適用可能な蛍光検出装置の一例は、図1に示されているが、その光学系の一部を変形した実施例を図9に示す。
【0087】
本実施例では、2種類の蛍光をダイクロイックミラー等で分離し、1台のCCDの異なる領域に結像させる、いわゆる分割型結像光学系の例である。
【0088】
分割型結像光学系では、まず、集光レンズ(対物レンズ)で集められた蛍光13は、フィルタユニット15で必要な波長の蛍光を取り出し、分割のためのダイクロイックミラー32により、波長ごとに透過光と反射光に分割する。分割された光束をそれぞれ、反射光はミラー39aで反射し、結像レンズ40に指定の角度で導く。透過光はミラー39bと39cで折り曲げ、同じ結像レンズ40に別の指定の角度で導く。両光束は異なる角度で結像レンズ40に入射することで、2次元センサカメラ41(高感度冷却2次元CCDカメラ)に対して、それぞれの画像をずらして結像させる。
【0089】
フィルタユニット15には、レーザ光除去用のロングパスフィルタ(405nm)、検出する波長体を透過させるバンドパス干渉フィルタ(透過帯域:440-680nm)を用いる。補助フィルタ42a、42bは迷光除去のため、バンドパス干渉フィルタ(透過帯域:440−680nm、透過率95%以上)を使う。場合により、補助フィルタ42abは使わなくてもよい。なお、分割透過光と分割反射光の光路の長さは、なるべく同じになるようにしているが、必ずしも同じでなくてもかまわない。図では結像倍率は、両光束で同じであるが、異なるようにしてもよい。同じ輝点の分割透過光像と分割反射光像であることが判断されれば解析可能である。
【0090】
反射光と透過光を異なる角度で結像レンズ40に入射させることで、それぞれの蛍光像を同じ2次元センサカメラ41の異なる位置に結像され、デュアル・ビュー状態で蛍光像を検出することができる。本例により、1個の2次元センサカメラで2種の蛍光体を識別することが可能であり、多種類の蛍光体を同時に簡便に識別検出することができる。
【0091】
本例によれば、抗原、抗体を測定対象にした蛋白チップ、DNAチップ、抗原検査装置などにも適用できる。同時に2種類のラベルを使うことができるので、2種類の標識抗体などを準備し、同時に反応させ、反応結果を同時に測定でき、各標識抗体ごとの強度を算定することができる。単一分子の測定だけでなく、定量も可能になる。なお、基板に捕捉する抗体、抗原の位置は格子状でなくても良いので、種々のチップに対応することができる。
【0092】
また、本例を細胞染色、細胞チップ等に適用することもできる。例えば、細胞表面抗原に特異的に結合する抗体を準備し、それぞれ蛍光体で標識する。2種類の標識抗体を同時に反応させ、同時に蛍光測定することで、2種の抗体の分布、濃度などを測定することもできる。表面抗原だけでなく、細胞質内のマーカ、膜マーカ、DNA、RNAなどを同時に検出することができる
【実施例12】
【0093】
本実施例も、既述した蛍光検出装置のうち光学系の一部を変えた例である。本実施例では、2種類の蛍光をプリズム等で分散させ、1台のCCDに結像させる、いわゆる分散型結像光学系の例である。図10に本実施例の検出部分の構成を示す。
【0094】
分散型結像系ではまず、集光レンズ(対物レンズ)で集められた蛍光13は、フィルタユニット15で必要な波長の蛍光を取り出し、不必要な波長の光を除去し、波長分散プリズム43で分光し、その像を結像レンズ40で、2次元センサカメラ41(高感度冷却CCDカメラ)に結像させ、検出する。フィルタユニット15には、レーザ光除去用のロングパスフィルタ(405nm)、検出する波長体を透過させるバンドパス干渉フィルタ(透過帯域:440−680nm)を用いる。
【0095】
なお、波長分散プリズム43により光軸が傾くが、分散の異なるプリズムを複数枚組み合わせ、光軸が傾かないようにすることもできる。
【0096】
本実施例により、1個の2次元センサカメラで2種の蛍光体を識別することが可能であり、多種類(ドナー,アクセプタ)の蛍光体を同時に簡便に識別検出することができる。なお波長を分散させる角度に指定は無いが、分散した結果生じた波長成分のピークは、隣接するスポットの領域と分離可能な距離を置いて存在することが必要である。
【符号の説明】
【0097】
1…レーザ装置、2…波長板、7…プリズム、8…基板、8a…反応領域、8ij…DNAが捕捉されるスポット、9…フローチャンバ、10…廃液チューブ、11…廃液容器、
12…試薬導入口、13…蛍光、14…集光レンズ(対物レンズ)、15…フィルタユニット、16…透過光観察用鏡筒、17a,17b,42a,42b…補助フィルタ、18a,18b,40…結像レンズ、19a,19b,41…2次元センサカメラ、20a,20b…2次元センサカメラコントローラ、21…制御PC(制御手段、演算手段)、22,24…モニタ、23…TVカメラ、25…分注ユニット、26…分注ノズル、27…試薬保管ユニット、27a…試料液容器、27b,27c,27d,27e…ヌクレオチドセット溶液容器、27f…洗浄液容器、28…チップボックス、29…自動ピントあわせ装置、
80,81…位置決めマーカ、32…ダイクロイックミラー、33…鋳型DNA、34…プライマ、35…標識ポリメラーゼ、36…鋳型DNAと相補的な伸長鎖、37…プライマ認識部位、38…鋳型DNAと同じ配列の伸長鎖、39…ミラー、43…波長分散プリズム、dx、dy…スポット8ijの間隔の寸法
【技術分野】
【0001】
本発明は、鋳型DNA或いはその相補鎖に取り込まれる単一核酸分子である塩基(ヌクレオチド:dNTP)の種類や部位の特定、或いは塩基配列を解析するのに適した塩基解析方法、その方法を実施する装置、及び核酸解析用試薬セットに関する。特にFRET(Fluorescence Resonance Energy Transfer:蛍光共鳴エネルギー移動)を利用した、核酸解析方法、その方法を実施する装置、及び核酸解析用試薬セットに関する。
【背景技術】
【0002】
(1)近年、非特許文献1にあるように、基板に固定した鋳型DNA或いはその相補鎖に単一核酸分子であるヌクレオチド(dNTP)を順次、捕捉伸長させて、その塩基配列を決定することが提案されている。すなわち基板表面にランダムに分析すべき試料DNA断片(単一核酸分子)を1分子ずつ捕捉し伸長させて、その結果を蛍光計測より検出することにより塩基配列を決定するものである。
【0003】
具体的には、DNAポリメラーゼの基質として、鋳型DNAに取り込まれてDNA鎖伸長反応を保護基の存在により停止することができ、且つ検出され得る標識を持つ4種のdNTPの誘導体(MdNTP)を、DNAポリメラーゼ反応により相補的に順次取り込む工程、次いで取り込まれたMdNTPを、蛍光等で検出する工程、及びMdNTPを伸長可能な状態に戻す工程を1サイクルとし、それを繰り返すことにより試料DNAの塩基配列を決定する。本技術では、DNA断片を1分子ずつ配列決定することができるため、同時に数多くの断片を解析することができ、解析スループットを大きくすることができる。また、本方式では、全反射エバネッセント照射検出方式により、単一DNA分子毎に塩基配列が決定できる可能性があるため、従来技術の問題であったクローニングやPCR等での試料DNAを精製、増幅が不要にできる可能性があり、ゲノム解析や遺伝子診断の迅速化が期待できる。
【0004】
(2)一方、非特許文献2および特許文献1では、全反射エバネッセント照射検出方式よりも励起光照射体積の一層の低減が可能となるナノ開口エバネッセント照射検出方式によって、核酸増幅の塩素配列の蛍光検出の感度を更に向上させている。
【0005】
具体的には、2枚のガラス基板であるガラス基板Aとガラス基板Bを平行に対向配置し、ガラス基板Aのガラス基板Bと対面する側の表面に、径50nmのナノ開口を有する膜厚約100nmの平面状のアルミニウム薄膜を積層する。アルミニウム薄膜は遮光性能を有している必要がある。2枚のガラス基板の中間に前記ナノ開口により反応槽を構成し、反応槽に溶液を充填することによって、2枚のガラス基板の間に溶液層の反応槽を形成する。反応槽には溶液の注入口と排出口があり、注入口から溶液を注入し、排出口から溶液を排出させることで、溶液をガラス基板およびアルミニウム薄膜と平行方向にフローさせることができる。これにより、溶液層の溶液を任意の組成に交換することが可能である。Arイオンレーザから発振した波長488nmの励起光を、ガラス基板Bと反対方向より、ガラス基板Aに対して垂直に、対物レンズで絞って照射すると、ナノ開口内部の底平面近傍の溶液層に励起光のエバネッセント場が形成され、それ以上先の溶液層内部に励起光が伝播することはない。一方、蛍光発光は、前記対物レンズを用いて2次元CCD上に結像することによって検出される。エバネッセント場では、励起光強度がナノ開口底平面から離れるに従って指数関数的に減衰し、ナノ開口底平面から30nm程度の距離で励起光強度が1/10となる。更に、ナノ開口エバネッセント照射検出方式では、全反射エバネッセント照射検出法と異なり、ガラス基板と平行方向の励起光照射幅が開口径すなわち50nmに限定されるため、励起光照射体積が一層低減される。このため、遊離の蛍光体の蛍光発光や水のラマン散乱を始めとする背景光を飛躍的に低減することが可能となる。その結果、より高濃度の遊離の蛍光体存在下で、対象とする生体分子に標識された蛍光体だけを選択的に検出することが可能となり、非常に高感度な蛍光検出を実現できる。本文献では、以上の蛍光検出方式をDNA分子の伸長反応によるdNTPの取り込み計測に応用している。
【0006】
(3)特許文献2では、核酸増幅された塩基配列解析にFRET方式を採用して、蛍光標識(ドナー)で修飾されたポリメラーゼ(蛍光標識ポリメラーゼ又は蛍光修飾ポリメラーゼと称せられる)と蛍光標識(アクセプタ)で修飾されたヌクレオチド(蛍光標識ヌクレオチド又は蛍光修飾ヌクレオチドと称せられる)との相互作用により、鋳型鎖(鋳型DNA)上での1核酸分子ずつのヌクレオチド捕捉,伸長を、光源により励起されるドナーの蛍光により共鳴励起されるアクセプタの蛍光を検出して、核酸配列(ヌクレオチド配列)をリアルタイムに決定する技術が提案されている。ヌクレオチド(dNTP)を修飾する蛍光標識(アクセプタ)として、4種類のdNTP(ATCG)に応じた4種類の蛍光色素を使用する。本技術は、DNAポリメラーゼによるDNA合成反応(ヌクレオチド捕捉伸長反応)を1核酸分子(ヌクレオチド)レベルで観察する方法で、ポリメラーゼと捕捉されるヌクレオチドの間の蛍光標識(ドナー、アクセプタ)による蛍光共鳴励起エネルギーの転移(FRET) を逐次検出することにより配列を読み取るというものである。具体的には、ドナーとしての蛍光色素に標識されたDNAポリメラーゼがスライドガラス上にガラス面から一定の距離を置いて固定され、別の蛍光標識(アクセプタ)を持つ4種のdNTPの誘導体(MdNTP)をDNAポリメラーゼ反応により鋳型DNA鎖上で相補的に捕捉し伸長させる。このとき、DNAポリメラーゼに標識された蛍光色素(ドナー)の蛍光波長は、MdNTPに標識された蛍光色素(アクセプタ)を励起可能である。ポリメラーゼに標識された蛍光色素(ドナー)を励起すると、捕捉したMdNTの取り込みが行われた際、ポリメラーゼとMdNTPが相互作用し、ポリメラーゼからMdNTPに励起エネルギーが転移(FRET)し、MdNTP(アクセプタ)の蛍光色素が励起され蛍光を発する。こうして生じたMdNTPからの種類別の蛍光を検出することで塩基種ATCGの配列を決定する。一般的にFRET は、ドナーとアクセプタ間の距離が1〜10 nm の範囲で起こることが知られている。またFRETの強度は両分子間の距離の6乗の関数として、距離とともに急速に減少する。すなわちdNTPを標識する蛍光色素(アクセプタ)は、ポリメラーゼを標識する蛍光色素(ドナー)の近傍においてのみ発光するため、実質的に限られた空間のみが励起されている状態となる。その結果、浮遊MdNTPの蛍光発光や水のラマン散乱を始めとする背景光を飛躍的に低減し、非常に高感度な蛍光観察が可能となる。本技術は背景光低減に有効な手段であるが、ドナー色素を常に励起し続ける必要があるため、退色が課題であった。この問題を解決する手段として、量子ドット(Quantum Dot、 Qdot)の利用が挙げられる。Qdotは通常の蛍光色素と比較して光安定性が強く、長時間露光しても退色が遅いという特徴がある。このためFRETのドナー色素として非常に有効である。加えてQdotの蛍光強度は極めて強いため、QdotをFRETのドナーとして用いる場合、アクセプタ側の蛍光色素の組み合わせによっては、1種類のQdotで4種類以上のアクセプタ色素を励起できる可能性がある。即ち、Qdotを励起するための1種類の光源で4色の蛍光色素を励起できるため、他の従来法と比較して操作性、コストの面で有利である。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】米国特許第6917726号公報
【特許文献2】特開2009−118847号公報
【非特許文献】
【0008】
【非特許文献1】Proc. Natl. Acad. Sci. USA、 vol.100、 pp.3960、 2003
【非特許文献2】SCIENCE 2003、 Vol.299、 pp. 682−686
【発明の概要】
【発明が解決しようとする課題】
【0009】
上記した背景技術の(1)及び(2)の項で述べた手法は、FRETを使わない所謂、通常の蛍光色素を使用するものである。一方、背景技術の(3)の項で述べた手法は、FRETを採用しているものである。前者、すなわち通常の蛍光色素の場合には、蛍光色素を励起する励起波長と、それにより蛍光したときの蛍光波長とが近いために、励起光の影響が大きい。また、消光までの時間が短い。一方、後者、すなわちFRETの場合には、特にQdotをドナーとして使用する場合には、ドナーの励起波長とアクセプタの蛍光波長が遠いために、励起光の影響が小さい、また消光までの時間が長いといった特長を有している。
【0010】
ただし、QdotをドナーとしてFRETを利用して4種類のMdNTPを励起する場合、4種類の波長の異なる蛍光標識(蛍光色素)のうち、ドナーの励起光を基準にして長波長側に遠くなる波長を有する蛍光色素へのFRET効率が低くなるという傾向がある。ドナーとしてのQdotの蛍光波長は、少なくともdNTPを標識する4種類の蛍光色素(アクセプタ)の蛍光波長よりも短い必要があるが、Qdotの蛍光も分布を持っているため、FRET効果はアクセプタ側の蛍光色素の励起波長が長くなるほど効果が低くなる。また一般的な蛍光色素の励起光の波長は、およそ450nm〜800nmの領域であるが、4種類のdNTPを標識するため、その範囲内で4種類の蛍光色素を選択しようとすると、蛍光色素同士の蛍光スペクトルが一部重なり、隣接する蛍光波長のピークを有する蛍光色素同士が、互いの信号に影響を及ぼすという、いわゆるクロストークが生じる。また4種類の蛍光色素を波長成分ごとに抽出して観察するために、フィルタやミラーなどの光学素子の点数が多く使用せねばならず、それに伴い信号強度が損失する。このため、特に長波長領域におけるアクセプタ側の蛍光色素のS/Nが低く、十分な検出感度を得られない傾向がある。
【0011】
本発明の目的は、FRETを採用した場合でも、上記したような課題を解消し、しかも、安価で信頼性が高く、また操作性の良い単一核酸分子の塩基配列を解読する方法・装置を提供することにある。
【課題を解決するための手段】
【0012】
本発明は、上記目的を達成するために、基本的には、次のような核酸解読方法及び装置を提案する。
(1)一つは、単一核酸分子の塩基配列を、蛍光共鳴エネルギー移動を利用して解析する核酸解析方法であって、
ドナーにより励起される第1のアクセプタによって標識されたdATP及び前記第1のアクセプタと種類の異なる第2のアクセプタによって標識されたdCTP、dGTP、dTTPのヌクレオチドからなる第1のヌクレオチドセットと、
前記同様の第1のアクセプタによって標識されたdCTP、及び前記同様の第2のアクセプタによって標識されたdATP、dGTP、dTTPのヌクレオチドからなる第2のヌクレオチドセットと、
前記同様の第1のアクセプタによって標識されたdGTP、及び前記同様の第2のアクセプタによって標識されたdATP、dCTP、dTTPのヌクレオチドからなる第3のヌクレオチドセットと、
前記同様の第1のアクセプタによって標識されたdTTP、及び前記同様の第2のアクセプタによって標識されたdATP、dCTP、dGTPのヌクレオチドからなる第4のヌクレオチドセットと、
DNAポリメラーゼ,鋳型DNA及びプライマと、
アクセプタ励起用として、前記DNAポリメラーゼ,鋳型DNA及びプライマのいずれか一つに標識されている前記ドナーと、を用いて、
前記第1〜第4のヌクレオチドセットのセットごとに順次、前記鋳型DNA或いはその相補鎖及びプライマを介してポリメラーゼ反応によるヌクレオチドの捕捉,伸長を行い、
前記鋳型DNA或いは前記相補鎖に取り込まれていくヌクレオチドの近傍に位置する前記ドナーを励起して、このドナーと前記取り込まれたヌクレオチドの第1のアクセプタ或いは第2のアクセプタとの間で生じる蛍光共鳴エネルギー移動により、前記取り込まれたヌクレオチドの第1のアクセプタ或いは第2のアクセプタを励起し、
前記ドナーの信号強度変化及び前記第1,第2のアクセプタからの信号をリアルタイムにモニタリングし、前記第1〜第4のヌクレオチドセットを使用して得られたこれらのモニタリングデータから、前記鋳型DNA或いは前記相補鎖に取り込まれた前記ヌクレオチドの種類とその位置を特定することを特徴とする。
【0013】
例えば、第1のアクセプタは、ドナーにより励起されて蛍光する特性を有し、第2のアクセプタは、第ドナーにより励起されるが、光を生じない或いは第1のアクセプタに対して識別できる発光強度差を有する或いは第1のアクセプタと波長の異なる特性を有している。
【0014】
或いは、第1のアクセプタは、前記ドナーにより励起されて蛍光する或いは励起されるが光を生じない特性を有し、前記第2のアクセプタは、前記ドナーにより励起されて前記第1のアクセプタに対して識別できる発光強度差を有する或いは前記第1のアクセプタと蛍光波長の異なる特性を有している。
(2)さらに、前記核酸解析方法のために使用する核酸解析用試薬セットとして、前記第1〜第4のヌクレオチドセットを有するものを提案する。
(3)本発明に係る核酸解析方法のもう一つは、単一核酸分子の塩基配列を、蛍光共鳴エネルギー移動を利用して解析する核酸解析方法であって、
第1のアクセプタで標識された1〜3種類の塩基及び前記第1のアクセプタと種類の異なる第2のアクセプタで標識されたそれ以外の塩基を混合した基質溶液と、前記アクセプタを共鳴励起するための1種類のドナーにより標識されたDNAポリメラーゼ或いは前記鋳型DNAとを用いて、核酸増幅の塩基配列伸長反応を行い、
前記ドナーの発光波長帯の信号強度の時間変化情報と、少なくとも1種類のアクセプタの発光波長帯の信号強度の時間変化情報を検出し、
検出される前記ドナーの発光強度の低下と、検出される前記アクセプタの発光強度の上昇から、任意の塩基が取り込まれたことを判定することを特徴とする。
【0015】
例えば、4種類の塩基を有する第1の基質溶液と、同じく4種類の塩基を有する第2の基質溶液とからなり、前記第1,第2の基質溶液における塩基に標識される前記第1,第2のアクセプタの組み合わせは、4種の塩基のうち、前記第1,第2の基質溶液間で同一の1種については前記第1のアクセプタで標識され、前記基質溶液間で同一のもう1種については前記第2のアクセプタで標識され、前記基質溶液間で同一のさらにもう1種については第1の基質溶液のものが第1のアクセプタで標識され第2基質溶液のものが第2のアクセプタで標識され、前記基質溶液間で同一のさらにもう1種については第1の基質溶液のものが第2のアクセプタで標識され第2基質溶液のものが第1のアクセプタで標識されている。ここで、第1、第2のアクセプタの特性は、前記(1)の方法と同様である。
(4)さらに、上記(3)の方法を実施するために、例えば、上記(3)の互いにアクセプタの組み合わせが異なる4種の塩基を内容とする前記第1、第2の基質溶液を有する核酸解析用試薬セットを提案する。
(5)また、上記(1)、(2)の方法を実施するために、前記第1〜第4のヌクレオチドセットを有する核酸解析用試薬セットと、
アクセプタ励起用の蛍光物質よりなるドナーが標識されているDNAポリメラーゼ,鋳型DNA或いはプライマと、
前記第1〜第4のヌクレオチドセットの各々ごとに、前記鋳型DNA及びプライマを介してポリメラーゼ反応により行われる核酸増幅にて、前記鋳型DNAもしくはその相補鎖に捕捉されていくヌクレオチドのうち最新捕捉のヌクレオチドを標識しているアクセプタを励起する光照射系と、
蛍光共鳴エネルギーにより、前記ドナーの蛍光で前記最新捕捉のヌクレオチドを標識しているアクセプタを励起して、前記ドナーによる信号強度変化及び前記第1,第2アクセプタからの信号をリアルタイムにモニタリングする光検出系と、
前記第1〜第4のヌクレオチドセットを使用して得られたこれらのモニタリングデータから、前記鋳型DNA或いは前記相補鎖に取り込まれた前記ヌクレオチドの塩基配列を解析するデータ演算処理部と、を有することを特徴とする核酸増幅の塩基配列解析装置を提案する。
【発明の効果】
【0016】
本発明によれば、核酸増幅解析にFRET方式を採用した場合であっても、DNAポリメラーゼ反応により核酸増幅される4種の塩基配列を検出する場合に、捕捉される核酸分子(ヌクレオチド)を標識するアクセプタは、第1、第2のアクセプタの2種類だけで済むので、従来課題とされていたヌクレオチド側の4種類の蛍光色素同士のクロストークの影響を排除でき、それにより、ノイズ成分が抑制され、各蛍光色素のS/Nが向上する。
【0017】
またS/Nの向上に伴い、従来方法で必要とされていた高性能センサや光学部品、高出力光源を安価な部品に置き換えることが可能であるため、コスト削減に繋がる。
【0018】
また、色素識別のための複雑な計算が不要となるため、観察後のデータ処理が簡便となり、操作性が向上する。結果として、塩基配列解読の信頼性が向上する
【図面の簡単な説明】
【0019】
【図1】本発明の第1の実施例の蛍光分析方法に使用される蛍光検出装置の構成図
【図2(A)】本発明の各実施例に用いられる基板の構造を示す斜視図。
【図2(B)】本発明の各実施例に用いられる基板とプリズムの組み合わせを示す縦断面図。
【図2(C)】本発明の各実施例に用いられる基板上に載せられるチャンバを裏返してみた斜視図。
【図3(A)】第1の実施例に用いるフィルタ、ミラーの特性図。
【図3(B)】第1の実施例に用いるフィルタ、ミラーの特性図。
【図3(C)】第1の実施例に用いるフィルタ、ミラーの特性図。
【図4】第1の実施例での反応フロー図。
【図5(A)】第1の実施例での第1ヌクレオチドセットにおける蛍光観察結果の模式図。
【図5(B)】第1の実施例での第2ヌクレオチドセットにおける蛍光観察結果の模式図。
【図5(C)】第1の実施例での第3ヌクレオチドセットにおける蛍光観察結果の模式図。
【図5(D)】第1の実施例での第4ヌクレオチドセットにおける蛍光観察結果の模式図。
【図6】第2の実施例での反応フロー図
【図7】第3の実施例での反応フロー図
【図8】第5の実施例での反応フロー図
【図9】上記各実施例に用いる蛍光集光系の一例を示す図。
【図10】上記各実施例に用いる蛍光集光系の他の例を示す図。
【図11】ドナーとして用いるQdot525と蛍光アクセプタとして用いるAlexaの波長特性を示す説明図。
【図12】第10の実施例に用いる第1、第2の基質溶液(ヌクレオチドセット)のアクセプタの組み合わせを示す説明図。
【発明を実施するための形態】
【0020】
以下、本発明を実施の形態について下記の示す実施例により説明する。
【実施例1】
【0021】
基板表面に分析すべき試料DNA断片を1分子ずつ捕捉し、伸長させて、取り込まれたDNA断片(ヌクレオチド:dNTP)に修飾された蛍光標識を検出して塩基配列を決定する装置、方法について説明する。
【0022】
本実施例では、DNAポリメラーゼの基質として、4つの塩基種(ATCG)のdNTP(dATP、dCTP、dGTP、dTTPの総称)を鋳型DNA或いはその相補鎖に一分子ずつ捕捉し、且つ取り込まれるdNTPの標識(アクセプタ)を、FERTを利用して励起する蛍光色素(ドナー)を有する。また、4つの塩基種について、一核酸分子(ヌクレオチド)ごとに取り込まれるdNTPを修飾する標識については、1種類の蛍光色素(第1のアクセプタ)と1種類の無蛍光物質(第2のアクセプタ)、すなわちトータルで2種類のアクセプタを使用する。ここで、アクセプタとして機能する無蛍光物質としては、例えば消光色素(クエンチャ)が例示される。4種類のdNTPは、第1のアクセプタ(1種類の蛍光色素)と第2のアクセプタ(クエンチャ)の組み合わせであり、次のようなアクセプタ組み合わせを4つのヌクレオチドセットを使用する。
【0023】
すなわち、(i)蛍光共鳴エネルギー移動の励起により光を生じる第1のアクセプタ(蛍光色素)によって標識されたdATP及び第2のアクセプタ(クエンチャ)によって標識されたdCTP、dGTP、dTTPのヌクレオチドからなる第1のヌクレオチドセットと、上記同様に(ii)第1のアクセプタによって標識されたdCTP、及び第2のアクセプタによって標識されたdATP、dGTP、dTTPからなる第2のヌクレオチド セットと、(iii)第1のアクセプタによって標識されたdGTP、及び第2のアクセプタによって標識されたdATP、dCTP、dTTPからなる第3のヌクレオチドセットと、(iv)第1のアクセプタによって標識されたdTTP、及び第2のアクセプタによって標識されたdATP、dCTP、dGTPのヌクレオチドからなる第4のヌクレオチドセットである。
【0024】
第1〜第4のヌクレオチドセットごとに順次、DNAポリメラーゼ反応によるdNTPの捕捉、伸長を行い、取り込まれるdNTPの第1の蛍光色素(第1のアクセプタ)或いはクエンチャ(第2のアクセプタ)とその近傍に位置する第2の標識(ドナー)との間の蛍光共鳴による励起エネルギーの移動(FRET)を利用した蛍光及び無蛍光の測定データ(リアルタイムモニタリングデータ)を用いることで、塩基配列の解読を行う。
【0025】
より具体的には、第1〜第4のヌクレオチドセットのセットごとに、ターゲット鋳型DNA、プライマ及びポリメラーゼを用いて、順次、dNTPの捕捉,伸長を行う(FRETによるリアルタイム蛍光検出を伴う)。この場合、セットごとのdNTPの捕捉,伸長が完了する度に、鋳型DNA上で合成された伸長鎖を熱変性で分離し,洗浄により除去が行われる。したがって、ヌクレオチドセットごとのdNTPの捕捉,伸長,熱変性,洗浄を1サイクルとする。
【0026】
本実施例によれば、ドナーのFRETによる信号変化と第1、第2のアクセプタの信号から、第1のヌクレオチドセットでは、捕捉された塩基配列のうちdATPの位置を特定でき、第2のヌクレオチドセットでは、捕捉された塩基配列のうちdCTPの位置を特定でき、第3のヌクレオチドセットでは、捕捉された塩基配列のうちdGTPの位置を特定でき、第4のヌクレオチドセットでは、捕捉された塩基配列のうちdTTPの位置を特定できる。したがって、第1から第4のヌクレオチドセットのデータを組み合わせることで、4種の全体的な塩基配列を解読することができる。
【0027】
以上のように、本実施例では、FRET利用の核酸解析、すなわち試料DNAの塩基配列の決定を、1種類のドナー、1種類の蛍光アクセプタ(第1アクセプタ)、及び1種類の無蛍光アクセプタ(第2のアクセプタ:クエンチャ)を用いて、4サイクルにより行う。具体的な装置や核酸解析のための準備及び反応工程については、以下に詳述する。なお、本操作は単分子蛍光検出を行うため、測定はHEPAフィルタなどを介したクリーンルーム様の環境にて行うのが望ましい。
(装置構成)
図1は、本発明の核酸解析方法(蛍光分析方法)に用いるDNA検査装置(核酸解析装置)の構成図である。基板8にDNA分子を順次捕捉してヌクレオチド伸長状態をFRET方式により蛍光検出するものである。
【0028】
ここで、図1の装置全体を説明するに先立ち、図2により基板8の構造について説明する。
【0029】
図2(A)は、基板(固相)8の斜視図であり、図2(B)は、基板8と、基板8の下面側に配置したプリズム7と、基板8の上面側に配置したフローチャンバ9とからなる積層体の縦断面図を示す。図2(C)は、フローチャンバ9を、裏面すなわち基板8に対向する面側からみた斜視図である。図2(C)のA−A線で断面したものが、図2(B)のフローチャンバ9の断面に相当する。
【0030】
基板8は少なくとも反応領域8aが透明材質でできており、材質としては合成石英などが用いられる。反応領域8aは、フローチャンバ9によって形成される液槽9aに導入される試薬、試料などが接触する。フローチャンバ9については、後述する。
【0031】
反応領域8a内に検出対象となるDNA分子(核酸分子:ヌクレオチド)を捕捉するためのスポット8ijが複数形成されている。スポット8ijの個々の大きさは直径100nm以下である。各スポット8ijには、DNAを捕捉するための表面処理が施されている。
【0032】
その表面処理は、例えば、変性により得られた一本鎖化されたターゲットである鋳型DNAをチオール化(図4の符号50に示すような5’末端のチオール化)によりスポット8ij上に捕捉(固定)し、その3’末端にポリA配列(例えば、図4の符号30で示す)を付加する。すなわち、スポット8ijに、図4に示すように、金構造体上にポリA付加鋳型DNA33を固定する。ポリA配列30は、ポリTプライマ34をハイブリダイズにより捕捉するものである。或いは、その表面処理は、ポリTのオリゴヌクレオチド(例えば図6のポリTプライマ34)を捕捉しておき、また、DNA断片(例えば図6のターゲットである鋳型DNA33)の一端をポリA化処理して、この標的DNA断片をハイブリダイゼーション反応にて捕捉する。その際、DNA断片濃度を適当に調製することで、個々のスポット8ijに鋳型DNAに相補的に取り込まれるべきヌクレオチド(dNTP)のみが入るようにすることができる。なお、スポット8ijをより小さくしていくことで、スポット内に捕捉できる分子が1個になるようにすることができる。このような基板では、すべてのスポット8ijに単一分子のdNTPが捕捉されている場合と、スポット8ijのうち一部のスポットのみdNTPが捕捉されている場合がある。スポット8ijのうち、一部のスポットのみdNTPが捕捉されている場合は、残りのスポットには捕捉されておらず、空きの状態となる。なお、一例として、スポット8ij同士の間隔dxは2マイクロメータ、間隔dyは2マイクロメータとする。
【0033】
スポット8ijは基板表面上にランダムに存在していても構わないが、観察時の効率を考慮して規則的に配置されていることが望ましい。例えば図2(A)のように、格子配列構造(2次元の格子構造)を形成し、その格子点の位置にスポット8ijが配置される。このような、均等間隔の基板の作成法としては、例えば、特開2002−214142号公報に記載の手法(金属ナノウェルを用いた蛍光分析用素子の製造方法)などがある。なお、dx、dyは、スポット8ijの個々の径の大きさより大きく、0.2〜10マイクロメータ以下、さらには0.5〜6マイクロメータ程度が好ましい。なお、スポット8ijの格子配列構造は正方格子構造、長方格子構造、三角格子構造などにしてもよい。基板の反応スポット8aは、例えば1mm×1mmの大きさとする。反応スポット8aの大きさは、それより大きくても可であるし、0.5mm×0.5mmの大きさのものを一定間隔で、1次元または2次元に複数個並べたようなものでもよいし、長方形、丸型、三角形、六角形の形状などでもよい。
【0034】
なお、スポット8ijには金属構造体を配置してもよい。金属構造体は半導体プロセスにて作成でき、また、電子線描画、光リソグラフィー、ドライエッチング、ウェットエッチングなどの手法によっても作製できる。金属構造体は、金、銀、アルミ、クロム、チタン、タングステン、白金等で、励起光の波長以下の大きさを有する形状であり、直方体、円錐、円柱、三角柱、一部が突起状のものを有する構造、あるいは、これらを2個または複数個近接して並べた構造など、また金属微粒子なども使用可能である。たとえば、直径10nmから100nm程度の大きさの金の膜状のドットを上記dx、dyの間隔、たとえば、1×1、1×2、1×3、2×3、2×4、3×5、3×6(マイクロメータ×マイクロメータ)などの間隔の格子状に構築できる。直径20nm程度のドットに、大きさ20nm程度の蛋白や蛍光物質、リンカーをその上部に捕捉すれば、確率的にその大きさからドットあたり1分子を捕捉し、格子状に単一分子を配置することが可能になる。また、周知の手法でドットに選択的なリンカーを結合させ、それにオリゴヌクレオチド、たんぱく質などを捕捉することで、ドットに目的の分子を捕捉することが可能であり、これを使うことができる。以後このような状態の基板8を用いて核酸増幅を行い蛍光計測する。
【0035】
dNTPおよびポリメラーゼに加える蛍光標識として、種々の蛍光体を使うことができる。Alexa系やCy系などの一般的な蛍光化合物のほか、量子ドットであるQdotなどを使うことができる。ただし、冒頭で述べたとおり、両者の間にはFRETにおけるドナーとアクセプタの関係が成立する組み合わせでなければならない。例えばポリメラーゼへの蛍光標識(ドナー)はQdot525、前述した第1〜第4のヌクレオチドセットにおける、それぞれ1種の塩基(ヌクレオチドセット毎に異なる)の蛍光標識(蛍光アクセプタ:第1のアクセプタ)はAlexa555、残り3種への標識(無蛍光アクセプタ:第2のアクセプタ)についてはクエンチャ(消光色素)など種々の物質を使うことができる。ここで、クエンチャは、Alexa555と同様にアクセプタ(ただしこの場合には無蛍光アクセプタ)として機能するので、蛍光共鳴エネルギー移動により、ドナーは発光強度低下する。第2のアクセプタについては、Qdot(ドナー)や第1のアクセプタ(Alexa555)との検出信号の明瞭な識別化を図るために、励起によって蛍光を生じない無蛍光ダーククエンチャを用いることが望ましい。クエンチャは、例えばBHQ−1などである。なおdNTPへの標識は、ヌクレオチド3リン酸のγリン酸に付加することが望ましい。これは標識物質が伸長鎖に残らないようにするためである。
【0036】
ここで、図1に戻り、蛍光測定装置全体について説明する。
【0037】
Qdot525励起用のレーザ装置1(例えば、LDレーザ、405nm)からのレーザ光をλ/4波長板2を通して円偏光とする。なおレーザは上記に特定されず、ドナーを励起できるものなら種類は問わない。例えば今回のようにQdot525を励起する際、He−Cdレーザ(442nm)などを使用しても良い。レーザ光を、レンズを介して全反射照明用の石英製プリズム7に図のように入射面に垂直に入射し、DNA分子を捕捉する基板8の裏側から照射する。石英製プリズム7と基板8はマッチングオイル(無蛍光グリセリン等)を介して接触させており、レーザ光はその界面で反射することなく、基板8に導入される。基板8の反応領域8a表面は反応液(水)で覆われており、その界面にてレーザ光は全反射し、エバネッセント照明となる。これにより、高いS/Nで蛍光測定が可能になる。
【0038】
なお、基板8の近傍には、温調器が配置されているが、図では省略した。また、通常観察のため、プリズム下部よりハロゲン照明、LED照明ができる構造としているが、図ではこれを省略している。
【0039】
基板8の上部には、試薬などを流し、反応させるためのフローチャンバ9が構成されている。図2(C)に示すように、フローチャンバ9のうち、基板8の反応領域8aと対向する領域が、既述した液槽9aとなるために、液槽となる長方形(形状は問わない)で窪みを有しており、その窪みの両端に液体導入孔9bと液体排出孔9cが設けられている。フローチャンバ9は、石英材などの透明材質より形成されている。また、図1に示すように、フローチャンバ9の上面には、試薬導入口12が設けてあり、分注ノズル26を有する分注ユニット25、試薬保管ユニット27、チップボックス28に収容された分注チップを用いて、目的の試薬液の注入などを行う。
【0040】
具体的には、試薬保管ユニット27には、試料液容器27a、4種類(第1〜第4)のヌクレオチドセット溶液容器27b、27c、27d、27e及び洗浄液容器27f等が用意される。チップボックス28内の分注チップを分注ノズル26に取り付け、適当な試薬液を吸引し、試薬導入口12から基板の反応領域に導入し、反応させる。廃液は廃液チューブ10を介して廃液容器11に排出される。これらは制御ユニット(PC)21により自動的に行われる。
【0041】
フローチャンバ9は、光軸方向に透明な材質で形成される。フローチャンバ内の蛍光標識ポリメラーゼのドナーの蛍光及びそれに共鳴励起される蛍光標識ヌクレオチドのアクセプタの蛍光は、符号13に示すようにフローチャンバ9を透過して、自動ピント合わせ装置29で制御される集光レンズ(対物レンズ)14で集められ、フィルタユニット15で必要な波長の蛍光を取り出され、不必要な波長の光が除去される。フィルタユニット15を透過する蛍光は、ダイクロイックミラー32により、波長ごとに分割された光束に分離される。分離された光束は、それぞれ補助フィルタ17a、17bを介して、結像レンズ18a、18bにより、それぞれ、2次元センサカメラ19a、19b(高感度冷却2次元CCDカメラ)に結像させられ、検出される。カメラの露光時間の設定、蛍光画像の取り込みタイミングなどの制御は、2次元センサカメラコントローラ20a、20bを介して制御PC21が行う。結果はモニタ22に表示される。なお、フィルタユニット15には、レーザ光除去用のロングパスフィルタ(405nm)、検出する波長帯を透過させるバンドパスフィルタ(透過帯域:440−680nm)を組み合わせて用いる。レーザ光除去用のハイパスフィルタの概略特性を図3(A)に、バンドパスフィルタを図3(B)に、ダイクロイックミラー32を図3(C)に示す。
【0042】
なお、装置は、調整などのため、透過光観察用鏡筒16とTVカメラ23とモニタ24を備えており、ハロゲン照明などで基板8の状態をリアルタイムで観察できるようになっている。
【0043】
図2(A)に示すように、基板8には位置決めマーカ80、81が刻印されている。マーカ80、81は、スポット8ijの並びと平行に配置され、その間隔が規定されている。そこで、透過照明での観測でマーカ80,81を検出することで、スポット8ijの位置を計算することができる。
【0044】
本実施例で使用する2次元センサカメラ19a,19bとして、CCDエリアセンサを使用する。種々の画素サイズ、画素数のCCDエリアセンサを使うことができる。たとえば、画素サイズが7.4×7.4マイクロメータで、画素数2048×2048画素の冷却CCDカメラを使用する。なお、2次元センサカメラとしては、CCDエリアセンサの他、C−MOSエリアセンサなどの撮像カメラなどを一般に使うことができる。CCDエリアセンサにも、構造によって、背面照射型、正面照射型があり、どちらも使用できる。また、素子内部に信号の増倍機能を有する電子増倍型CCDカメラなども高感度化を図る上で有効である。また、センサは冷却型が望ましく、−20℃程度以下にすることで、センサの持つダークノイズを低減でき、測定の精度を高めることができる。
【0045】
反応領域8aからの蛍光像を一度に検出してもいいし、分割することもできる。この場合、基板の位置を移動させるためのX−Y移動機構部をステージ下部に配置し、制御PCで照射位置への移動、光照射、蛍光像検出を制御する。本例ではX−Y移動機構部は図示していない。
(反応の工程)
図4に本実施例の反応フローを示す。基板8のDNA捕捉スポット8ijの表面に、金を材質とした構造体が配置されている場合を例として説明する。
<準備工程>
ターゲットである鋳型DNA33を変性等によって一本鎖化し、その鋳型DNA33の5’末端をチオール化し(符号50で示す)、3’末端にポリA配列30を付加する。例えば、試薬バッファを導入口12よりフローチャンバ9の液槽9aに導入することにより、金−チオール結合を利用して、金構造体上にポリA付加鋳型DNA33を固定する。ポリTプライマ34をチャンバに導入し、ポリA付加鋳型DNA33にハイブリダイズさせる。余剰な鋳型DNA33およびプライマ34を洗浄用バッファにてチャンバより洗い流す。
<伸長反応工程1>
次に、Alexa555(第1のアクセプタ:蛍光アクセプタ)で標識されたdATP及びBHQ−1(第2のアクセプタ:無蛍光アクセプタ:クエンチャ)で標識されたdCTP、dGTP、dTTPからなる第1のヌクレオチドセットと、Qdot525(ドナー)で標識されたThermo Sequenaseポリメラーゼ35とを加えたThermo Sequenase Reactionバッファを導入口12よりフローチャンバ9aへ導入し、伸長反応を開始する。反応中は、LDレーザを連続的に照射し、常にQdot525を励起し続け、レーザ光により励起されて蛍光するQdot525およびそのQdot525からの蛍光波長によりFRETにより励起されるAlexa555の蛍光強度の変化をモニタリングし続ける。照射方法はエバネッセント照射であり、反応領域8a表面近傍のみが励起光照射領域となるため、それ以外の領域に存在するQdot525ポリメラーゼ35は励起されず、背景光の少ない測定ができる。
【0046】
Qdot525とAlexa555の蛍光はダイクロイックミラー32で波長ごとに分けられ、補助フィルタ17a,17bおよびレンズ18a,18bを介してそれぞれ2台のCCDカメラ19a,19bに結像される。第1のCCDカメラ19aでは、Qdot525の蛍光が、第2のCCDカメラ19bではAlexa555の蛍光がそれぞれ常時モニタリングされる。伸長反応においてヌクレオチド(dNTP)の取り込みが生じた際、Qdot525とAlexa555またはBHQ−1の距離は十分に近くなり、両者の間にはFRETにおけるドナー・アクセプタの関係が成立する。すなわち、ドナーであるQdot525の蛍光強度が低下した場合、アクセプタ或いはクエンチャが近傍に存在しdNTPの取り込みが生じたことになる。同時にAlexa555の蛍光強度が観察された場合は、取り込まれたdNTPの種類がAlexa555によって標識されたdNTPであると特定できる。例えば上記第1のヌクレオチドセットを用いて伸長反応を行った際、Qdot525の信号が低下すると同時にAlexa555の信号が観察された場合、そのdNTPの種類は塩基種Aである。一方、Qdot525の信号が低下したが、Alexa555の蛍光強度が観察されない場合には、クエンチャ(消光色素)であるBHQ−1に標識されたdNTP(ここでは、C、G、Tのうちいずれか一つ)が取り込まれたことになる。Qdot525の蛍光強度低下のイベント数は、また、取り込まれたdNTPの数に等しいため、上記第1のヌクレオチドセットを用いた場合、上記したAlexa555の蛍光信号とBHQ−1の消光信号の配列により、伸長鎖(ヌクレオチド配列)36中の何塩基の間隔で塩基種A(dATP)が存在しているかという情報を得ることができる。例えば、Qdot525の信号強度低下が10回観察され、Alexa555の信号強度の変化が、(0=信号なし、1=信号あり)として、[0010000100]というデータを得た場合、鋳型DNA33は10bpであり、その3番目と8番目は塩基種Aであるので、これに相補的なターゲット鋳型DNAの塩基種は、Tであることが特定できる。伸長反応終了後、熱変性等を行い、遊離した伸長鎖36を洗浄バッファによって除去する。
<伸長反応工程2>
前記洗浄バッファによる伸長鎖除去後に、残存する前記ターゲット鋳型DNA(ポリA付加鋳型DNA)33及び新たに導入したプライマ34を用い、且つAlexa555で標識されたdCTPと、BHQ−1で標識されたdATP、dGTP、dTTPとからなる第2のヌクレオチドセットを用いて、反応工程1と同様の手順で反応・観察を行う。本工程によって、ターゲット鋳型DNA33に取り込まれる伸長鎖(ヌクレオチド配列)36中の塩基種C(dCPT)については、FRETによりAlexa555が蛍光する。したがって、これと相補的なターゲット鋳型DNAの塩基種Gの位置が特定する。伸長反応終了後、熱変性等を行い、遊離した伸長鎖36を洗浄バッファによって除去する。
<伸長反応工程3>
前記洗浄バッファによる伸長鎖除去後に、前記ターゲット鋳型DNA(ポリA付加鋳型DNA)33及び新たに導入したプライマ34を用い、且つAlexa555で標識されたdGTPと、BHQ−1で標識されたdATP、dCTP、dTTPとからなる第3のヌクレオチドセットを用いて、反応工程1、2と同様の手順で反応・観察を行う。本工程によって、ターゲット鋳型DNA33に取り込まれる伸長鎖(ヌクレオチド配列中)36の塩基種GについてはFRETによりAlexa555が蛍光するので、Gに相補的なターゲット鋳型DNAのCの位置を特定する。伸長反応終了後、熱変性等を行い、遊離した伸長鎖36を洗浄バッファによって除去する。
<伸長反応工程4>
前記洗浄バッファによる伸長鎖除去後に、前記ターゲット鋳型DNA(ポリA付加鋳型DNA)33及び新たに導入したプライマ34を用い、且つAlexa555で標識されたdTTPと、BHQ−1で標識されたdATP、dCTP、dGTPからなる第4のヌクレオチドセットを用いて、反応工程1と同様の手順で反応・観察を行う。本工程によって、ターゲット鋳型DNA33に取り込まれる塩基種(ヌクレオチド配列中)36の塩基種TについてはFRETによりAlexa555が蛍光するので、Tに相補的なターゲット鋳型DNAのAの位置を特定する。伸長反応終了後、熱変性等を行い、遊離した伸長鎖36を洗浄バッファによって除去する。
【0047】
以上の1〜4の反応工程(4サイクル)で得られた蛍光強度信号のモニタリング(検出)データを総合して、鋳型DNA33の配列を決定する。サンプルとして10bpの未知配列をシーケンシングした際の、第1のヌクレオチドセットによって得られるデータの模式図を図5(A)に、第2のヌクレオチドセットによって得られるデータの模式図を図5(B)に、第3のヌクレオチドセットによって得られるデータの模式図を図5(C)に、第4のヌクレオチドセットによって得られるデータの模式図を図5(D)に示す。図5(A)〜図5(D)は、Qdot525およびAlexa555の信号強度の時間変化を表し、上側の信号が第1のCCD19aで検出されるQdot525(ドナー蛍光)由来の信号、下側の信号が第2のCCD19bで検出されるAlexa555(第1のアクセプタ:蛍光アクセプタ)由来およびクエンチャ(第2のアクセプタ:無蛍光アクセプタ)由来の信号である。
【0048】
本実施例では、第1のヌクレオチドセットによって得られるdNTP配列情報は、BBABBBABBB(B=C、G、Tのいずれか)、第2のヌクレオチドセットによって得られるdNTP配列情報は、DDDDDCDDCD(D=A、G、Tのいずれか)、第3のヌクレオチドセットによって得られるdNTP配列情報はGHHHHHHGHH(H=A、C、Tのいずれか)、第4のヌクレオチドセットによって得られるdNTP配列情報はVTVTTVVVVT(V=A、C、Gのいずれか)となる。以上の結果より、鋳型DNA33に取り込まれたヌクレオチドは順にGTATTCAGCTであると特定できる。それにより、相補的なターゲット鋳型DNAの塩基配列は、CATAAGTCGAと解読される。
【0049】
かような核酸解析(本実施例では塩基配列)は、演算装置(制御ユニット)21が、dNTPの捕捉,伸長が確認されたスポット8ijの位置データ(二次元センサカメラ19a,19bの座標データ)と、その位置における蛍光検出データ(二次元センサカメラセンサ19a,19bの光測定強度)を取り込み、これらのデータに基づき上記の配列情報を演算することで行われる。
【0050】
なお本システムでは、反応領域8aの複数のスポット8ijからの発光を同時計測できるため、スポット8ijにそれぞれ異なる鋳型DNAを設置する場合には、前記複数の異なる鋳型DNA−プライマ複合体に取り込まれたdNTPの塩基種を、つまり複数の鋳型DNAの配列を上記の位置データおよび蛍光検出データにより同時に決定することができる。
【0051】
また、使用できる蛍光体(ドナー、アクセプタ)は本実施例に示すものに限らず、所定の励起光を使い、異なる蛍光特性を有する蛍光体の組み合わせであれば同様に使用できる。一般には、蛍光極大波長が各々異なる種類の組み合わせであればよい。本実施例では、ドナーとしてのQdot525は、405nm励起、525nm蛍光であり、アクセプタとしてのAlexa555は、525nm励起、570nm蛍光であり、図11の蛍光波長特性に示すように両者の蛍光波長特性が十分に離れているので、両者の蛍光識別の精度が高められる。
【0052】
さらに、本実施例では、第1のアクセプタをドナー励起により発光する蛍光物質により構成し、第2のアクセプタとして、無蛍光アクセプタを用いるが、第2のアクセプタについては、第1のアクセプタに対して識別できる程度の弱い光(例えば、第1のアクセプタの1/10程度の光)、換言すれば識別可能な発光強度を有する蛍光物質であってもよい(後述の他の実施例でも同様である)。換言すれば、第1のアクセプタの発光強度は、第2のアクセプタの発光強度の10倍以上である。また、第1のアクセプタと第2のアクセプタとして、互いの波長が顕著に離れている蛍光色素を使用してもよい。
【0053】
例えば、ドナーがQdot 525の場合には、第1のアクセプタとしては、Alexa555のほかにCy3があり、第2のアクセプタとして消光させるタイプのものにはBHQ-1のほかに、BHQ-2、DABCYL、Eclipse dark quencher、Iowa black FQ等がある。また、第1のアクセプタとして、上記同様にAlexa555或いはCy3とした場合、第2のアクセプタとして蛍光強度・波長特性の異なるタイプのものには、TAMRA、Cy3.5などがある。
【0054】
本実施例ではまた、石英製プリズム7に対してレーザ光をその入射面に垂直つまり入射角度0度で入射している。これにより、基板8とプリズム7を一体化して移動させても、対物レンズ14の観察視野からレーザ照射位置がずれないため、基板とプリズムを一体化することができ、プリズムと基板とのカップリング方式を種々選ぶことが可能になる。オイルカップリングのほか、光学接着も可能になり、装置構成を容易に選ぶことができる。
【0055】
本実施例では、基板8の各8ijの反応領域に結合しているドナー蛍光分子が1分子であり、複数の異なる蛍光分子が同じ位置にいないため、本発明のような装置及び方法で効率よく蛍光体種つまりは塩基種が識別でき、しかも高密度な基板に対応できる。
【0056】
なお、本実施例では、検出する波長帯域が480−680nmであるが、これに制限されることはない。使用する蛍光体の波長帯域に応じて、任意に対応できる。
【0057】
実施例では、オリゴヌクレオチド等の生体関連分子が捕捉される基板8に、蛍光測定用の励起光を照射し、それにより生じるドナー蛍光及びFRETによるアクセプタ蛍光を集光し、2次元検出器に結像させ、2次元検出器にて蛍光検出する。基板は実質的に透明な基板であり、分子が捕捉されうるスポットが複数設けられ、それらが格子配列構造の格子点位置(スポット8ij)に配置されている。該基板上で必要な試薬や試料などを反応させ、全反射照明のための光励起用の光源と、照射光学系により該基板上の蛍光体を励起し、発する蛍光を蛍光集光系で集光し、その光束を指定の波長範囲において実質的に各々の波長で異なる比率で分割する分光部により分割し、結像光学系で各々検出器に結像し、複数の検出画素を備えた検出器により検出する。これにより、簡便に多種の蛍光体種を識別検出することができる。
【0058】
実施例では、基板に金属構造物を形成している。この場合、構造物の光ルミネセンス、光散乱を検出することで、構造物の空間位置を検出することができ、位置の基準マーカとして活用でき、効果的である。
【0059】
格子点位置の領域(スポット、格子点の領域)の大きさは100nm径以下にする。少なくとも、隣接する最短の格子点の間隔の1/3以下が好ましい。これにより、光学的に解像しやすくなり、識別が容易になる。格子点位置の捕捉のための領域を10nm〜30nm程度にすれば、単一分子の捕捉に有効である。
【0060】
また、本例では、一定間隔の格子状に捕捉スポットを配置する基板を使用する。格子状に配置することで、透過像と反射像内の相対応する輝点の識別が容易になる。格子状に捕捉スポットを配置する基板を使わない場合にも対応する。分子をランダムに分散させて捕捉する場合など、捕捉位置が、ランダムに分散する場合は、両方の画像を比較し、パターン解析し、または基準マーカを参照して、相対応する輝点を判定すればよい、これによっても同様の効果が得られる。
【実施例2】
【0061】
本実施例は、図6の反応フローに示すように、基板8表面のdNTP捕捉スポットに、プライマ34を固定配置し、これにターゲットとなる鋳型DNA33をハイブリダイズさせ、伸長反応によって鋳型DNA33に相補鎖な伸長鎖36を合成し、その伸長鎖36にさらに相補的に捕捉される伸長鎖38の配列を解読することで、ターゲット鋳型DNA33の配列を決定する。この場合、伸長鎖38の配列は、ターゲット鋳型DNA33の配列そのものとなる。
(装置構成)
実施例1と同様の構成である
(反応の工程)
<準備工程>
前準備として、ターゲットである鋳型DNA33を変性等によって一本鎖化し、その鋳型DNA33の3’末端にポリA配列30を付加してポリA付加鋳型DNA33を作成しておく。そして、図6の上段に示すように、基板8表面のdNTP捕捉スポット8ijには、ポリTプライマ34を固定する。固定方法は、例えばポリTプライマ34の5’末端をチオール化し(符号50で示す)、dNTP捕捉スポット8ij(測定スポット)に配置した金構造体に対し、金−チオール結合を利用する。そして、ターゲット鋳型DNA33をチャンバに導入し、ポリTプライマ34とハイブリダイズさせる。任意のヌクレオチドセット(第1〜第4のヌクレオチドセットのいずれか)およびQdot525で標識されたThermo Sequenaseポリメラーゼ35を加えたThermo Sequenase Reactionバッファを導入口12よりチャンバへ導入し、ポリメラーゼ反応により、dNTPの捕捉・伸長反応を開始する。伸長反応完了後、熱変性を行い、遊離した鋳型DNA33を洗浄によって除去する。基板8(スポット8ij)に残った伸長鎖36の3’末端に、プライマ認識部位として、ターミナルトランスフェラーゼ等によりポリA配列37を付加する。なおプライマ認識配列としては、既知の配列を付加しても構わない。
<伸長反応工程1>
上記準備工程後に、図6の下段に示すように、新たなポリTプライマ34をフローチャンバ9に導入し、鋳型DNA33に相補的な伸長鎖36の末端3’に付加したポリA配列37とハイブリダイズさせる。そして、Alexa555(蛍光アクセプタ:第1アクセプタ)で標識されたdATPと、BHQ−1(無蛍光アクセプタ:第2アクセプタ)で標識されたdCTP、dGTP、dTTPとからなる第1のヌクレオチドセット、および、Qdot525(ドナー)で標識されたThermo Sequenaseポリメラーゼ35を加えたThermo Sequenase Reactionバッファを、導入口12よりフローチャンバへ導入し、伸長反応を開始する。伸長鎖(鋳型33に対する相補鎖)36にとり取り込まれる一分子ずつのdNTPの伸長により相補的な伸長鎖38が形成される過程で、実施例1と同様の手順で観察を行う。本工程によってターゲット鋳型DNA33中の塩基種Aの位置を伸長鎖38から特定する。伸長反応終了後、熱変性等を行って伸長鎖38を遊離させ、遊離した伸長鎖38を洗浄バッファによって除去する。
<伸長反応工程2>
前記洗浄バッファによる伸長鎖38の除去後に、図6の下段に示すように、新たに導入したポリA37及びプライマ34を用い、且つAlexa555で標識されたdCTPと、BHQ−1で標識されたdATP、dGTP、dTTPとからなる第2のヌクレオチドセットを用いて、反応工程1と同様の手順(反応)で新たに伸長鎖38を形成し、観察を行う。本工程によって、鋳型DNA33中のCの位置を特定する。伸長反応終了後、熱変性等を行い、遊離した伸長鎖38を洗浄バッファによって除去する。
<伸長反応工程3>
前記洗浄バッファによる伸長鎖38の除去後に、再度、新たに導入したポリA37及びプライマ34を用い、且つAlexa555で標識されたdGTPと、BHQ−1で標識されたdATP、dCTP、dTTPからなる第2のヌクレオチドセットを用いて、反応工程1と同様の手順で新たに伸長鎖を形成し、観察を行う。本工程によって、鋳型DNA33中のGの位置を特定する。伸長反応終了後、熱変性等を行い、遊離した伸長鎖38を洗浄バッファによって除去する。
<伸長反応工程4>
前記洗浄バッファによる伸長鎖38の除去後に、再度、新たに導入したポリA37及びプライマ34を用い、且つAlexa555で標識されたdTTPと、BHQ−1で標識されたdATP、dCTP、dGTPからなる第2のヌクレオチドセットを用いて、反応工程1と同様の手順で新たな伸長鎖を形成し、観察を行う。本工程によって、鋳型DNA33中のTの位置を特定する。伸長反応終了後、熱変性等を行い、遊離した伸長鎖38を洗浄バッファによって除去する。
【0062】
以上1〜4の反応工程で得られたデータを総合して、実施例1同様にターゲットである鋳型DNA33の配列を決定する。
【実施例3】
【0063】
本実施例では、図7に反応フローに示すように、基板表面に配置したプライマ34に対し、ターゲットとなる鋳型DNA33を環状化してハイブリダイズさせ、RCA(Rolling Circle Amplification)反応によってターゲット鋳型DNA33に取り込まれたヌクレオチド(dNTP)の種類を決定することで、鋳型DNA33の配列を決定する。RCA法とは、鎖置換活性を有するDNAポリメラーゼを用いて、鋳型となる環状DNAから相補鎖を連続して合成する手法である。使用するポリメラーゼは、例えばバクテリオファージ由来のphi29DNAポリメラーゼやBstDNAポリメラーゼラージフラグメント(New England Biolabs)などである。
(装置構成)
実施例1と同様の構成である。
(反応の工程)
<準備工程>
前準備として、ターゲットである鋳型DNA33を変性等によって一本鎖化し、その鋳型DNA33の3’末端にポリA配列70を付加して、鋳型DNAを環状化しておく。そして、図7に示すように、基板表面のdNTP捕捉スポット8ijには、ポリTプライマ34を固定する。固定方法は例えばポリTプライマ34の5’末端をチオール化(50)し、dNTP捕捉スポット8ij(測定スポット)に配置した金構造体に対し、金−チオール結合を利用する。そして、上記環状鋳型DNA33をフローチャンバに導入し、ポリA配列70に、ポリTプライマ34とハイブリダイズさせる。
<伸長反応工程1>
上記準備工程後に、Alexa555(蛍光アクセプタ:第1アクセプタ)で標識されたdATP及びBHQ−1(無蛍光アクセプタ:第2アクセプタ)で標識されたdCTP、dGTP、dTTPからなる第1のヌクレオチドセットと、Qdot525(ドナー)で標識されたphi29DNAポリメラーゼ35とを加えた反応バッファを、導入口12よりフローチャンバへ導入し、RCA反応を開始する。実施例1と同様の手順で観察を行う。本工程によって鋳型DNA33と相補のdNTPが順次捕捉され伸長して伸長鎖71a(総称としては、71で示す)が得られ、その伸長鎖71a中の塩基A(dATP)の位置を実施例1、2同様のFRETを利用して特定する。ちなみに、伸長が続くと、伸長鎖の5’末端で鋳型DNAのポリA配列70の部分との置換が始まり(新たなプライマ合成)鋳型DNA一周分の合成が終了する。伸長鎖71aの合成が終了した時点からポリA配列70での置換が終了する時点(新たなプライマ合成が終了する時点)間の任意の時点で、2−ニトロベンジル基が結合するケージドdNTPをチャンバに導入して伸長反応を停止させる。フローチャンバ9内を洗浄し、遊離dNTPを除去する。
<伸長反応工程2>
次いで、Alexa555で標識されたdCTP及びBHQ−1で標識されたdATP、dGTP、dTTPからなる第2のヌクレオチドセットをフローチャンバ内に導入する。360nm以下の紫外線を照射し、ケージド物質(2−ニトロベンジル基)を遊離させ、伸長鎖71の伸長反応を再開することにより新たなプライマを拠点として伸長鎖71bを得る。この場合の伸長反応の工程および観察は、伸長反応1の工程と同様の手順である。本工程によって、伸長鎖71b中の塩基C(dCTP)の位置を特定する。伸長鎖71bの合成終了時点後、反応工程1同様にタイミングで、2−ニトロベンジル基が結合するケージドdNTPをチャンバに導入して伸長反応を停止する。チャンバ内を洗浄し、遊離dNTPを除去する。
<伸長反応工程3>
次いで、Alexa555で標識されたdGTP及びBHQ−1で標識されたdATP、dCTP、dTTPからなる第3のヌクレオチドセットをフローチャンバ内に導入する。上記伸長反応2の工程同様に、360nm以下の紫外線を照射し、ケージド物質(2−ニトロベンジル基)を遊離させ、伸長鎖71の伸長反応を再開することにより、伸長鎖71cを得る。この場合の伸長反応の工程および観察は、伸長反応1、2の工程と同様の手順である。本工程によって、伸長鎖71c中の塩基G(dGPT)の位置を特定する。一定時間伸長反応後、2−ニトロベンジル基が結合するケージドdNTPをチャンバに導入して伸長反応を停止する。チャンバ内を洗浄し、遊離dNTPを除去する。
<伸長反応工程4>
次いで、Alexa555で標識されたdTTP及びBHQ−1で標識されたdATP、dCTP、dGTPからなる第4のヌクレオチドセットをチャンバ内に導入する。360nm以下の紫外線を照射し、ケージド物質(2−ニトロベンジル基)を遊離させ、伸長反応を再開し、伸長鎖71dを得る。この場合、伸長反応工程1〜3と同様の手順で反応・観察を行う。本工程によって、伸長鎖71d中の塩基T(dTPT)の位置を特定する。一定時間伸長反応後、2−ニトロベンジル基が結合するケージドdNTPをチャンバに導入して伸長反応を停止する。チャンバ内を洗浄し、遊離dNTPを除去する。
【0064】
伸長鎖71a〜71dの塩基配列パターンは、いずれも同一であるので、1〜4の伸長反応工程で得られたFRET(Qdot525、Alexa555、BHQ−1)の蛍光検出データを総合して、ターゲットである鋳型DNA33の配列を決定する。本例によれば、熱変性が不要であるため、操作が簡便となる。本実施例では最初のヌクレオチドセットで鋳型鎖1周分のシーケンシングを完了した時点で反応を停止し、次のヌクレオチドセットを導入しているが、複数周分のシーケンスを行うことも可能である。この場合、配列を複数回読むことで精度が向上するとい
うメリットがある。
【0065】
DNAポリメラーゼ35の基質としては、鋳型DNAに取り込まれてDNA鎖伸長反応を保護基の存在により停止することができ、かつ検出され得る標識を持つ4種のdNTPの誘導体であり、なんらかの手段により該dNTP誘導体を伸長可能な状態に戻す(再開する)ことのできるものである。このような伸長可能な状態に戻す試薬として、本例では、蛍光標識ケージドdNTPを使用するが、蛍光体とヌクレオチドをジスルフィド結合により結合するdNTPの誘導体などでも同様に実施可能である。この場合、蛍光体の存在で、伸長が停止し、Tris[2−carboxyethyl]phosphine試薬などでジスルフィド結合を化学的に解離させて伸長可能な状態に戻すことが可能である。
【0066】
なお本実施例では、使用者の利便性を考慮し、ヌクレオチドセット交換時に反応を停止するような試薬および機能を追加したが、これらの工程が無くともシーケンシングは成立する。
【実施例4】
【0067】
実施例3では、ターゲットとなる鋳型DNA33を環状化し、プライマ34を介して基板表面に結合させているが、別方式として、ドナーであるQdot525−ポリメラーゼ複合体35を基板表面に配置して(図示省略)、環状の鋳型DNA33を上記複合体と結合させ伸長反応を行い、取り込まれたdNTPの種類を決定してもよい。装置構成および反応工程は実施例3と同様である。
【実施例5】
【0068】
本実施例の反応フローを図8に示す。本実施例では、実施例3同様の反応手順により、基板表面に配置したプライマ34に対し、ターゲットとなる鋳型DNA33を環状化してハイブリダイズさせ、RCA反応によって鋳型DNA33に相補鎖な配列を連続して持つ伸長鎖71を、前記した第1〜第4のヌクレオチドセットごとに順次合成する(すなわち伸長鎖71a〜71dを順次合成する)。さらに、熱変性、洗浄により環状DNA鋳型33及びポリメラーゼ35を洗浄除去した後に、ポリG配列72を伸長鎖71の末端3’に付加し、このポリG72にプライマ73をハイブリダイズする。この状態で、再度、第1〜第4のヌクレオチドセットを順次、標識ポリメラーゼと共に加えることで、伸長鎖71a〜71dに相補のdNTP伸長鎖74a〜74dを合成する。この伸長鎖74a〜74dのFRETによる蛍光検出データの配列を解読することで、ターゲット鋳型DNA33の配列を決定することが可能になる。
(装置構成)
実施例1と同様の構成である
(反応の工程)
<準備工程>
前準備として、ターゲットである鋳型DNA33を変性等によって一本鎖化し、その鋳型DNA33の3’末端にポリA配列70を付加して、鋳型DNAを環状化しておく。そして、図8に示すように、基板表面のdNTP捕捉スポット8ijには、ポリTプライマ34を固定する。固定方法は例えばポリTプライマ34の5’末端をチオール化(50)し、dNTP捕捉スポット8ij(測定スポット)に配置した金構造体に対し、金−チオール結合を利用する。そして、上記環状鋳型DNA33をフローチャンバに導入し、ポリA配列70を、ポリTプライマ34にハイブリダイズさせる。さらに、既述した第1〜第4のヌクレオチドセットを順次、Qdot525で標識された鎖置換活性を有するポリメラーゼ35と共に反応バッファとして導入口12よりフローチャンバへ導入し、実施例3同様のRCA反応工程により伸長鎖71(71a〜71d)を合成する。ここまでは、図7の一連の反応工程と同様であるが、本実施例では、ここまでが前準備工程であるので、蛍光検出は行われない。伸長鎖71の合成後、熱変性を行い、鋳型DNA33を遊離し且つそれを洗浄によって除去する。残った伸長鎖71の3’末端に、プライマ認識部位として、ターミナルトランスフェラーゼ等によりポリG配列72を付加する。なおプライマ認識配列としては、既知の配列を付加しても構わない。
<伸長反応工程1>
次いで、ポリCプライマ73をフローチャンバに導入し、鋳型DNA33に伸長鎖71(71a〜71d)のポリG配列72にハイブリダイズさせる。この状態で、Alexa555(第1のアクセプタ)で標識されたdATP及びBHQ−1(第2のアクセプタ)で標識されたdCTP、dGTP、dTTPからなる第1のヌクレオチドセットと、Qdot525(ドナー)で標識されたphi29DNAポリメラーゼ35とを加えた反応バッファを、導入口12よりフローチャンバ9へ導入し、RCA反応を開始する。本工程で伸長鎖71(71a〜71d)に相補な伸長鎖74(74a〜74d)を得る。本工程によって伸長鎖74(74a〜74d)のうち塩基Aの蛍光検出データ(前述の実施例同様のFRETによる蛍光検出データ)が得られ、このデータを下に鋳型DNA33中の塩基Aの位置を特定する。伸長反応終了後、熱変性等を行い、遊離した伸長鎖74及びプライマ73を洗浄バッファによって除去する。
<伸長反応工程2>
次いで、新たにポリCプライマ73をチャンバに導入し、反応工程1同様に、残存する伸長鎖71のポリG配列72とハイブリダイズさせる。この状態で、Alexa555で標識されたdCTP及びBHQ−1で標識されたdATP、dGTP、dTTPからなる第2のヌクレオチドセットと、Qdot525で標識されたphi29DNAポリメラーゼ35とを加えた反応バッファをフローチャンバ9へ導入する。これにより、反応工程1同様にして、伸長鎖71に相補な伸長鎖74を得る。本工程によって伸長鎖74のうち塩基Cの蛍光検出データが得られ、このデータを下に鋳型DNA33中の塩基Cの位置を特定する。伸長反応終了後、熱変性等を行い、遊離した伸長鎖38を洗浄バッファによって除去する。伸長反応終了後、熱変性等を行い、遊離した伸長鎖74及びプライマ73を洗浄バッファによって除去する。
<伸長反応工程3>
次いで、新たなポリCプライマ34をチャンバに導入し、反応工程1、2同様に、残存する伸長鎖71のポリG配列72とハイブリダイズさせる。この状態で、Alexa555で標識されたdGTP及びBHQ−1で標識されたdATP、dCTP、dTTPからなる第3のヌクレオチドセットと、Qdot525で標識されたphi29DNAポリメラーゼ35とを加えた反応バッファをフローチャンバ9へ導入する。これにより、反応工程1、2同様にして、伸長鎖71に相補な伸長鎖74を得る。本工程によって伸長鎖74のうち塩基Gの蛍光検出データが得られ、このデータを下に鋳型DNA33中の塩基Gの位置を特定する。伸長反応終了後、熱変性等を行い、遊離した伸長鎖38を洗浄バッファによって除去する。伸長反応終了後、熱変性等を行い、遊離した伸長鎖74及びプライマ73を洗浄バッファによって除去する。
<伸長反応工程4>
次いで、新たなポリCプライマ34をチャンバに導入し、反応工程1、2、3同様に、残存する伸長鎖71のポリG配列72とハイブリダイズさせる。この状態で、Alexa555で標識されたdTTP及びBHQ−1で標識されたdATP、dCTP、dGTPからなる第4のヌクレオチドセットと、Qdot525で標識されたphi29DNAポリメラーゼ35とを加えた反応バッファをフローチャンバ9へ導入する。これにより、反応工程1、2、3同様にして、伸長鎖71に相補な伸長鎖74を得る。本工程によって伸長鎖74のうち塩基Tの蛍光検出データが得られ、このデータを下に鋳型DNA33中の塩基Tの位置を特定する。伸長反応終了後、熱変性等を行い、遊離した伸長鎖38を洗浄バッファによって除去する。伸長反応終了後、熱変性等を行い、遊離した伸長鎖74及びプライマ73を洗浄バッファによって除去する。
【0069】
以上1〜4の反応工程で得られたデータを総合して、ターゲットである鋳型DNA33の配列を決定する。本実施例によれば、塩基配列を、塩基種ごとに、いずれも伸長鎖74a〜74bから読むので、複数回(本実施例では、4回)読むことで精度が向上する。
【実施例6】
【0070】
上記実施例1から3の変形例として、Qdot525(ドナー)を、ポリメラーゼに代えて鋳型DNA33に標識し、すなわち基板上に鋳型DNA33を介してQdot525を固定し、前記第1〜第4のヌクレオチドセットと蛍光標識無しのポリメラーゼとを前記実施例同様に用いてdNTP伸長反応を行うことも可能である。鋳型DNA上のQdot525の位置は、FRETに必要なドナー・アクセプタ間の距離がおおよそ10nmに制限される関係上、伸長鎖として取り込まれるdNTPの位置に対して常にFRET反応が可能な距離(例えば10nm)内を保てる箇所に設定する必要がある。このような条件の下で、実施例1〜3同様の蛍光検出をヌクレオチドセットごとのdNTP伸長反応工程で行えば、鋳型DNAの配列解析が可能になる。本実施例は、短鎖DNAの塩基配列の解析に適している。本実施例によれば、ポリメラーゼ反応によりに蛍光標識を行わずに済むため、構造変化や立体障害に伴うポリメラーゼの酵素活性が損なわれる可能性がなくなる。
【実施例7】
【0071】
さらに、上記実施例1、2、5等の変形例として、これまた、ポリメラーゼに代えて、プライマ34にQdot525(ドナー)を標識し、上記実施例同様のdNTP伸長反応を行い、鋳型DNA33の配列を解読しても良い。本例もまた実施例6同様、ポリメラーゼに蛍光標識を行わずに済むため、構造変化や立体障害に伴うポリメラーゼの酵素活性が損なわれる可能背がなくなる。同じく本例は、FRETに必要なドナー・アクセプタ間の距離がおおよそ10nmに制限される関係上、短鎖DNAの解析に適している。
【実施例8】
【0072】
上記各実施例の変形例として、プライマ34の3’末端を2−ニトロベンジル化することで、伸長反応開始のタイミングを制御することができる。この場合、装置に360nm以下のUV光源を追加する。プライマ34を鋳型DNA33にハイブリダイズ後、ヌクレオチドセットを導入した状態でUVを照射することで、保護基が遊離し、伸長反応が開始する。伸長反応の開始を制御することで、より信頼性の高い配列データを得ることが可能となる。
【実施例9】
【0073】
これまで述べてきた各実施例では、第1〜第4のヌクレオチドセットの各セットにおいて、4種類のヌクレオチド(dNTP)のうち、1種の塩基を標識する第1のアクセプタAlexa555(蛍光アクセプタ)で標識し、残りの3種類を標識する第2のアクセプタをBHQ−1(無蛍光アクセプタ:クエンチャ)で標識したヌクレオチドセットを使用しているが、他の種々の組み合わせを利用することもできる。
【0074】
例えば、上記の組み合わせとは逆に、4種類のヌクレオチド(dNTP)のうち、1種の塩基を標識する第1のアクセプタをBHQ−1(無蛍光アクセプタ:クエンチャ)或いは信号強度の弱い蛍光色素で標識し、残りの3種の塩基を標識する第2のアクセプタをAlexa555(蛍光アクセプタ)で標識したヌクレオチドセットを使用してもよい。
【0075】
具体的には、BHQ−1(第1のアクセプタ)によって標識されたdATP及びAlexa555(第2のアクセプタ)によって標識されたdCTP、dGTP、dTTPのヌクレオチドからなる第1のヌクレオチドセットと、
BHQ−1によって標識されたdCTP、及びAlexa555によって標識されたdATP、dGTP、dTTPのヌクレオチドからなる第2のヌクレオチドセットと、
BHQ−1によって標識されたdGTP、及びAlexa555によって標識されたdATP、dCTP、dTTPのヌクレオチドからなる第3のヌクレオチドセットと、
BHQ−1によって標識されたdTTP、及びAlexa555によって標識されたdATP、dCTP、dGTPのヌクレオチドからなる第4のヌクレオチドセットと、を用いる。
【0076】
このようなヌクレオチドセットを用いれば、既述したFRETを利用した場合、例えば、第1のヌクレオチドセットによって得られた伸長鎖のうち、Qdot(ドナー)の信号が低下し、Alexa555(第2のアクセプタ)の信号が上昇した場合、取り込まれた塩基はC、G、Tのいずれかである。逆にQdotの信号が低下したが、Alexa555の信号が変化しない(上昇しない)場合、BHQ−1(第1のアクセプタ)標識のdATPが取り込まれ、取り込まれた塩基はAである。
【0077】
同様の手順にして、第2〜第4のヌクレオチドセットの場合にも、それぞれの伸長鎖から、塩基の種類C、G、Tとその位置が特定される。
【実施例10】
【0078】
また、上記実施例のヌクレオチドセットに代えて、4種類のヌクレオチドのうち、2種類をAlexa555(蛍光アクセプタ:第1のアクセプタ)で標識し、他の2種類をクエンチャ(無蛍光アクセプタ:第2のアクセプタ)で標識した複数のヌクレオチドセットを使用することもできる。図12(a)〜(d)は、その組み合わせ例を示すものであり、それぞれ、上段が第1のヌクレオチドセット(第1の基質溶液)、下段が第2のヌクレオチドセット(第2の基質溶液)を示す。四角枠が蛍光アクセプタ(第1のアクセプタ)による塩基種であり、○枠が無蛍光アクセプタ(第2のアクセプタ)による塩基種である。
【0079】
例えば、図12(a)に示すように、Alexa555(蛍光アクセプタ)で標識されたdATPおよびdCTPと、BHQ−1(無蛍光アクセプタ:クエンチャ)で標識されたdGTPおよびdTTPからなる第1のヌクレオチドセットを用いてdNTP伸長反応を行い、合成される伸長鎖について、Alexa555と、Qdotの信号強度変化を観察する。次にAlexa555で標識されたdCTPおよびdGTPと、BHQ−1で標識されたdATPおよびdTTPからなる第2のヌクレオチドセットを用いて同様にdNTP伸長反応を行い、Alexa555と、Qdotの信号強度変化を観察する。
【0080】
以上2回の伸長反応において、2回(1回目及び2回目)ともAlexa555の信号が上昇した位置はC、1回目のみAlexa555の信号が上昇した位置はA、2回目のみAlexa555の信号が上昇した位置はG、どちらの結果でもAlexa555の信号が変化しなかった位置はTと推定できる。本例によれば、使用するヌクレオチドセットが2種類で済むため、操作が簡便になる。
【0081】
第1のヌクレオチドセットと第2のヌクレオチドセットの、セットごとのAlexa555(第1のアクセプタ)で標識される2種類のdNTPと、BHQ−1(第2のアクセプタ)で標識される2種類のdNTPは、2回(1回目及び2回目)ともAlexa555の信号上昇(1、1)、1回目がAlexa555の信号上昇(1、0)、2回目がAlexa555の信号上昇(0,1)、いずれもAlexa555の信号上昇無し(0,0)の2値信号が成立すればよく、上記の一例に限定されるものではない。例えば、そのほか、図12(b)〜(d)のような組み合わせが考えられる。
【0082】
本実施例に用いる第1,第2の基質溶液(ヌクレオチドセット)における塩基は、第1,第2のアクセプタとの関係で、次のように定義される。
【0083】
4種の塩基のうち、(i)第1,第2の基質溶液間で同一の1種については第1のアクセプタで標識され、(ii)基質溶液間で同一のもう1種については第2のアクセプタで標識され、(iii)基質溶液間で同一のさらにもう1種については第1の基質溶液のものが第1のアクセプタで標識され第2基質溶液のものが第2のアクセプタで標識され、(iv)基質溶液間で同一のさらにもう1種については第1の基質溶液のものが第2のアクセプタで標識され第2基質溶液のものが第1のアクセプタで標識されている。
【0084】
本例の場合にも、第1のアクセプタは、ドナー励起により蛍光する蛍光色素、第2のアクセプタは、ドナー励起により発光しないクエンチャを使用するが、それに限定されず、両者のアクセプタについて発光強度差を有するもの、波長特性の異なるものを使用しても同様の効果が得られる。
【0085】
また、Alexa555を標識させるdNTPの種類の数は、全反応工程で一定である必要は無く、特定したい塩基種の数に応じて、例えば第1のヌクレオチドセットでは、上記同様に2種類のdNTPをアクセプタで標識し、残り2種類のdNTPをクエンチャで標識し、第2のヌクレオチドセットでは3種類のヌクレオチドを標識するといったような、種々の組み合わせも可能である。
【実施例11】
【0086】
上記の実施例1〜10に適用可能な蛍光検出装置の一例は、図1に示されているが、その光学系の一部を変形した実施例を図9に示す。
【0087】
本実施例では、2種類の蛍光をダイクロイックミラー等で分離し、1台のCCDの異なる領域に結像させる、いわゆる分割型結像光学系の例である。
【0088】
分割型結像光学系では、まず、集光レンズ(対物レンズ)で集められた蛍光13は、フィルタユニット15で必要な波長の蛍光を取り出し、分割のためのダイクロイックミラー32により、波長ごとに透過光と反射光に分割する。分割された光束をそれぞれ、反射光はミラー39aで反射し、結像レンズ40に指定の角度で導く。透過光はミラー39bと39cで折り曲げ、同じ結像レンズ40に別の指定の角度で導く。両光束は異なる角度で結像レンズ40に入射することで、2次元センサカメラ41(高感度冷却2次元CCDカメラ)に対して、それぞれの画像をずらして結像させる。
【0089】
フィルタユニット15には、レーザ光除去用のロングパスフィルタ(405nm)、検出する波長体を透過させるバンドパス干渉フィルタ(透過帯域:440-680nm)を用いる。補助フィルタ42a、42bは迷光除去のため、バンドパス干渉フィルタ(透過帯域:440−680nm、透過率95%以上)を使う。場合により、補助フィルタ42abは使わなくてもよい。なお、分割透過光と分割反射光の光路の長さは、なるべく同じになるようにしているが、必ずしも同じでなくてもかまわない。図では結像倍率は、両光束で同じであるが、異なるようにしてもよい。同じ輝点の分割透過光像と分割反射光像であることが判断されれば解析可能である。
【0090】
反射光と透過光を異なる角度で結像レンズ40に入射させることで、それぞれの蛍光像を同じ2次元センサカメラ41の異なる位置に結像され、デュアル・ビュー状態で蛍光像を検出することができる。本例により、1個の2次元センサカメラで2種の蛍光体を識別することが可能であり、多種類の蛍光体を同時に簡便に識別検出することができる。
【0091】
本例によれば、抗原、抗体を測定対象にした蛋白チップ、DNAチップ、抗原検査装置などにも適用できる。同時に2種類のラベルを使うことができるので、2種類の標識抗体などを準備し、同時に反応させ、反応結果を同時に測定でき、各標識抗体ごとの強度を算定することができる。単一分子の測定だけでなく、定量も可能になる。なお、基板に捕捉する抗体、抗原の位置は格子状でなくても良いので、種々のチップに対応することができる。
【0092】
また、本例を細胞染色、細胞チップ等に適用することもできる。例えば、細胞表面抗原に特異的に結合する抗体を準備し、それぞれ蛍光体で標識する。2種類の標識抗体を同時に反応させ、同時に蛍光測定することで、2種の抗体の分布、濃度などを測定することもできる。表面抗原だけでなく、細胞質内のマーカ、膜マーカ、DNA、RNAなどを同時に検出することができる
【実施例12】
【0093】
本実施例も、既述した蛍光検出装置のうち光学系の一部を変えた例である。本実施例では、2種類の蛍光をプリズム等で分散させ、1台のCCDに結像させる、いわゆる分散型結像光学系の例である。図10に本実施例の検出部分の構成を示す。
【0094】
分散型結像系ではまず、集光レンズ(対物レンズ)で集められた蛍光13は、フィルタユニット15で必要な波長の蛍光を取り出し、不必要な波長の光を除去し、波長分散プリズム43で分光し、その像を結像レンズ40で、2次元センサカメラ41(高感度冷却CCDカメラ)に結像させ、検出する。フィルタユニット15には、レーザ光除去用のロングパスフィルタ(405nm)、検出する波長体を透過させるバンドパス干渉フィルタ(透過帯域:440−680nm)を用いる。
【0095】
なお、波長分散プリズム43により光軸が傾くが、分散の異なるプリズムを複数枚組み合わせ、光軸が傾かないようにすることもできる。
【0096】
本実施例により、1個の2次元センサカメラで2種の蛍光体を識別することが可能であり、多種類(ドナー,アクセプタ)の蛍光体を同時に簡便に識別検出することができる。なお波長を分散させる角度に指定は無いが、分散した結果生じた波長成分のピークは、隣接するスポットの領域と分離可能な距離を置いて存在することが必要である。
【符号の説明】
【0097】
1…レーザ装置、2…波長板、7…プリズム、8…基板、8a…反応領域、8ij…DNAが捕捉されるスポット、9…フローチャンバ、10…廃液チューブ、11…廃液容器、
12…試薬導入口、13…蛍光、14…集光レンズ(対物レンズ)、15…フィルタユニット、16…透過光観察用鏡筒、17a,17b,42a,42b…補助フィルタ、18a,18b,40…結像レンズ、19a,19b,41…2次元センサカメラ、20a,20b…2次元センサカメラコントローラ、21…制御PC(制御手段、演算手段)、22,24…モニタ、23…TVカメラ、25…分注ユニット、26…分注ノズル、27…試薬保管ユニット、27a…試料液容器、27b,27c,27d,27e…ヌクレオチドセット溶液容器、27f…洗浄液容器、28…チップボックス、29…自動ピントあわせ装置、
80,81…位置決めマーカ、32…ダイクロイックミラー、33…鋳型DNA、34…プライマ、35…標識ポリメラーゼ、36…鋳型DNAと相補的な伸長鎖、37…プライマ認識部位、38…鋳型DNAと同じ配列の伸長鎖、39…ミラー、43…波長分散プリズム、dx、dy…スポット8ijの間隔の寸法
【特許請求の範囲】
【請求項1】
単一核酸分子の塩基配列を、蛍光共鳴エネルギー移動を利用して解析する核酸解析方法であって、
ドナーにより励起される第1のアクセプタによって標識されたdATP及び前記第1のアクセプタと種類の異なる第2のアクセプタによって標識されたdCTP、dGTP、dTTPのヌクレオチドからなる第1のヌクレオチドセットと、
前記同様の第1のアクセプタによって標識されたdCTP、及び前記同様の第2のアクセプタによって標識されたdATP、dGTP、dTTPのヌクレオチドからなる第2のヌクレオチドセットと、
前記同様の第1のアクセプタによって標識されたdGTP、及び前記同様の第2のアクセプタによって標識されたdATP、dCTP、dTTPのヌクレオチドからなる第3のヌクレオチドセットと、
前記同様の第1のアクセプタによって標識されたdTTP、及び前記同様の第2のアクセプタによって標識されたdATP、dCTP、dGTPのヌクレオチドからなる第4のヌクレオチドセットと、
DNAポリメラーゼ,鋳型DNA及びプライマと、
アクセプタ励起用として、前記DNAポリメラーゼ,鋳型DNA及びプライマのいずれか一つに標識されている前記ドナーと、を用いて、
前記第1〜第4のヌクレオチドセットのセットごとに順次、前記鋳型DNA或いはその相補鎖及びプライマを介してポリメラーゼ反応によるヌクレオチドの捕捉,伸長を行い、
前記鋳型DNA或いは前記相補鎖に捕捉される最新に捕捉されるヌクレオチドの近傍に位置する前記ドナーを励起して、このドナーと前記最新捕捉ヌクレオチドの第1のアクセプタ或いは第2のアクセプタとの間で生じる蛍光共鳴エネルギー移動により、前記取り込まれたヌクレオチドの第1のアクセプタ或いは第2のアクセプタを励起し、
前記ドナーの信号強度変化及び前記第1,第2のアクセプタからの信号をリアルタイムにモニタリングし、前記第1〜第4のヌクレオチドセットを使用して得られたこれらのモニタリングデータから、前記鋳型DNA或いは前記相補鎖に取り込まれた前記ヌクレオチドの種類とその位置を特定することを特徴とする核酸解析方法。
【請求項2】
前記第1のアクセプタは、前記ドナーにより励起されて蛍光する特性を有し、前記第2のアクセプタは、前記第ドナーにより励起されるが、光を生じない或いは前記第1のアクセプタに対して識別できる発光強度差を有する或いは前記第1のアクセプタと蛍光波長の異なる特性を有している請求項1記載の核酸解析方法。
【請求項3】
前記第1のアクセプタは、前記ドナーにより励起されて蛍光する或いは励起されるが光を生じない特性を有し、前記第2のアクセプタは、前記ドナーにより励起されて前記第1のアクセプタに対して識別できる発光強度差を有する或いは前記第1のアクセプタと蛍光波長の異なる特性を有している請求項1記載の核酸解析方法。
【請求項4】
前記第1のアクセプタは、前記ドナーにより励起されて蛍光する蛍光色素よりなり、前記第2のアクセプタは、前記ドナーにより励起されるが光を生じない無蛍光ダーククエンチャよりなる請求項1又は2記載の核酸解析方法。
【請求項5】
前記第1のアクセプタは、前記ドナーにより励起されるが光を生じない無蛍光ダーククエンチャよりなり、前記第2のアクセプタは、前記ドナーにより励起されて蛍光する蛍光色素よりなる請求項1又は3記載の核酸解析方法。
【請求項6】
前記第1および第2のアクセプタは、前記ドナーを励起するための光源によって励起されない請求項1ないし5のいずれか1項記載の核酸増幅の塩基配列解析方法。
【請求項7】
前記第1のアクセプタもしくは前記第2のアクセプタにより標識されたヌクレオチドが前記鋳型DNAに捕捉される際に、最新捕捉ヌクレオチドの前記第1又は第2のアクセプタと前記ドナーとの距離が1nm〜10nmである請求項1ないし6のいずれか1項記載の核酸解析方法。
【請求項8】
前記ドナーが、量子ドットの蛍光色素である請求項1ないし7のいずれか1項記載の核酸解析方法。
【請求項9】
前記ポリメラーゼ反応によるヌクレオチド伸長反応は、固相上に固定された直鎖状の鋳型DNA、もしくはその相補鎖に対して行われる請求項1ないし8のいずれか1項記載の核酸解析方法。
【請求項10】
前記ポリメラーゼ反応によるヌクレオチド伸長反応は、固相上に固定された環状の鋳型DNA、もしくはその相補鎖に対して行われる請求項1ないし8のいずれか1項記載の核酸解析方法。
【請求項11】
前記ポリメラーゼ反応によるヌクレオチド伸長反応は、固相上に固定されたポリメラーゼと環状の鋳型DNAを用いて行われる請求項1ないし8のいずれか1項記載の核酸解析方法。
【請求項12】
伸長反応に用いる前記プライマは、3’末端にヌクレオチド伸長を阻害するための保護基を有する請求項1ないし11のいずれか1項記載の核酸解析方法。
【請求項13】
ヌクレオチド伸長反応の際、反応を停止するために、各ヌクレオチドセットは、3’末端に伸長を阻害するための保護基を有するヌクレオチド溶液を用いる請求項1ないし11のいずれか1項記載の核酸解析方法。
【請求項14】
蛍光共鳴エネルギー移動を利用して、ドナーにより励起される第1のアクセプタによって標識されたdATP及び前記第1のアクセプタと種類の異なる第2のアクセプタによって標識されたdCTP、dGTP、dTTPのヌクレオチドからなる第1のヌクレオチドセットと、
前記同様の第1のアクセプタによって標識されたdCTP、及び前記同様の第2のアクセプタによって標識されたdATP、dGTP、dTTPのヌクレオチドからなる第2のヌクレオチドセットと、
前記同様の第1のアクセプタによって標識されたdGTP、及び前記同様の第2のアクセプタによって標識されたdATP、dCTP、dTTPのヌクレオチドからなる第3のヌクレオチドセットと、
前記同様の第1のアクセプタによって標識されたdTTP、及び前記同様の第2のアクセプタによって標識されたdATP、dCTP、dGTPのヌクレオチドからなる第4のヌクレオチドセットと、
アクセプタ励起用の蛍光物質よりなるドナーが標識されているDNAポリメラーゼ,鋳型DNA或いはプライマと、を有することを特徴とする核酸解析用試薬セット。
【請求項15】
前記第1のアクセプタは、前記ドナーにより励起されて蛍光する特性を有し、前記第2のアクセプタは、前記第ドナーにより励起されるが、光を生じない或いは前記第1のアクセプタに対して識別できる発光強度差を有する或いは前記第1のアクセプタと波長の異なる特性を有している請求項14記載の核酸解析用試薬セット。
【請求項16】
前記第1のアクセプタは、前記ドナーにより励起されて蛍光する或いは励起されるが光を生じない特性を有し、前記第2のアクセプタは、前記ドナーにより励起されて前記第1のアクセプタに対して識別できる発光強度差を有する或いは前記第1のアクセプタと波長の異なる特性を有している請求項14記載の核酸解析用試薬セット。
【請求項17】
前記第1のアクセプタは、前記ドナーにより励起されて蛍光する蛍光色素よりなり、前記第2のアクセプタは、前記ドナーにより励起されるが光を生じない無蛍光ダーククエンチャよりなる請求項14又は15記載の核酸解析用試薬セット。
【請求項18】
前記第1のアクセプタは、前記ドナーにより励起されるが光を生じない無蛍光ダーククエンチャよりなり、前記第2のアクセプタは、前記ドナーにより励起されて蛍光する蛍光色素よりなる請求項14又は16記載の核酸解析用試薬セット。
【請求項19】
単一核酸分子の塩基配列を、蛍光共鳴エネルギー移動を利用して解析する核酸解析方法であって、
第1のアクセプタで標識された1〜3種類の塩基及び前記第1のアクセプタと種類の異なる第2のアクセプタで標識されたそれ以外の塩基を混合した基質溶液と、前記アクセプタを共鳴励起するための1種類のドナーにより標識されたDNAポリメラーゼ或いは前記鋳型DNAとを用いて、核酸増幅の塩基配列伸長反応を行い、
前記ドナーの発光波長帯の信号強度の時間変化情報と、少なくとも1種類のアクセプタの発光波長帯の信号強度の時間変化情報を検出し、
検出される前記ドナーの発光強度の低下と、検出される前記アクセプタの発光強度の上昇から、任意の塩基が取り込まれたことを判定することを特徴とする核酸解析方法。
【請求項20】
前記基質溶液は、4種類の塩基を有する第1の基質溶液と、同じく4種類の塩基を有する第2の基質溶液とからなり、前記第1,第2の基質溶液における塩基に標識される前記第1,第2のアクセプタの組み合わせは、4種の塩基のうち、前記第1,第2の基質溶液間で同一の1種については前記第1のアクセプタで標識され、前記基質溶液間で同一のもう1種については前記第2のアクセプタで標識され、前記基質溶液間で同一のさらにもう1種については第1の基質溶液のものが第1のアクセプタで標識され第2基質溶液のものが第2のアクセプタで標識され、前記基質溶液間で同一のさらにもう1種については第1の基質溶液のものが第2のアクセプタで標識され第2基質溶液のものが第1のアクセプタで標識されている請求項19記載の核酸解析方法。
【請求項21】
前記第1のアクセプタは、照射光源からの照射光により励起されて蛍光する蛍光色素であり、前記第2のアクセプタは、前記第1のアクセプタからの蛍光共鳴エネルギーにより励起され、且つ励起されるが光を生じない或いは前記第1のアクセプタに対して識別できる発光強度差を有する或いは前記第1のアクセプタと波長の異なる特性を有している請求項19又は20記載の核酸解析方法。
【請求項22】
前記第1のアクセプタの発光強度は、第2のアクセプタの発光強度の10倍以上である請求項19ないし21のいずれか1項記載の核酸解析方法。
【請求項23】
4種類の塩基を有する第1の基質溶液と、同じく4種類の塩基を有する第2の基質溶液とを備え、前記第1,第2の基質溶液における塩基は、蛍光共鳴エネルギー移動に用いる種類の異なる第1,第2のアクセプタのいずれかにより標識され、このアクセプタの組み合わせは、4種の塩基のうち、前記第1,第2の基質溶液間で同一の1種については前記第1のアクセプタで標識され、前記基質溶液間で同一のもう1種については前記第2のアクセプタで標識され、前記基質溶液間で同一のさらにもう1種については第1の基質溶液のものが第1のアクセプタで標識され第2基質溶液のものが第2のアクセプタで標識され、前記基質溶液間で同一のさらにもう1種については第1の基質溶液のものが第2のアクセプタで標識され第2基質溶液のものが第1のアクセプタで標識されていることを特徴とする核酸解析用試薬セット。
【請求項24】
単一核酸分子の塩基配列を、蛍光共鳴エネルギー移動を利用して解析する核酸解析装置であって、
ドナーにより励起される第1のアクセプタによって標識されたdATP及び前記第1のアクセプタと種類の異なる第2のアクセプタによって標識されたdCTP、dGTP、dTTPのヌクレオチドからなる第1のヌクレオチドセットと、
前記同様の第1のアクセプタによって標識されたdCTP、及び前記同様の第2のアクセプタによって標識されたdATP、dGTP、dTTPのヌクレオチドからなる第2のヌクレオチドセットと、
前記同様の第1のアクセプタによって標識されたdGTP、及び前記同様の第2のアクセプタによって標識されたdATP、dCTP、dTTPのヌクレオチドからなる第3のヌクレオチドセットと、
前記同様の第1のアクセプタによって標識されたdTTP、及び前記同様の第2のアクセプタによって標識されたdATP、dCTP、dGTPのヌクレオチドからなる第4のヌクレオチドセットと、
アクセプタ励起用の蛍光物質よりなるドナーが標識されているDNAポリメラーゼ,鋳型DNA或いはプライマと、
前記第1〜第4のヌクレオチドセットの各々ごとに、前記鋳型DNA及びプライマを介してポリメラーゼ反応により行われる核酸増幅にて、前記鋳型DNAもしくはその相補鎖に捕捉されていくヌクレオチドのうち最新捕捉のヌクレオチドを標識しているアクセプタを励起する光照射系と、
蛍光共鳴エネルギーにより、前記ドナーの蛍光で前記最新捕捉のヌクレオチドを標識しているアクセプタを励起して、前記ドナーによる信号強度変化及び前記第1,第2アクセプタからの信号をリアルタイムにモニタリングする光検出系と、
前記第1〜第4のヌクレオチドセットを使用して得られたこれらのモニタリングデータから、前記鋳型DNA或いは前記相補鎖に取り込まれた前記ヌクレオチドの塩基配列を解析するデータ演算処理部と、を有することを特徴とする核酸増幅の塩基配列解析装置。
【請求項25】
単一核酸分子の塩基配列を、蛍光共鳴エネルギー移動を利用して解析する核酸解析装置であって、
4種類の塩基を有する第1の基質溶液と、同じく4種類の塩基を有する第2の基質溶液とを備え、前記第1,第2の基質溶液における塩基は、蛍光共鳴エネルギー移動に用いる種類の異なる第1,第2のアクセプタのいずれかにより標識され、このアクセプタの組み合わせは、4種の塩基のうち、前記第1,第2の基質溶液間で同一の1種については前記第1のアクセプタで標識され、前記基質溶液間で同一のもう1種については前記第2のアクセプタで標識され、前記基質溶液間で同一のさらにもう1種については第1の基質溶液のものが第1のアクセプタで標識され第2基質溶液のものが第2のアクセプタで標識され、前記基質溶液間で同一のさらにもう1種については第1の基質溶液のものが第2のアクセプタで標識され第2基質溶液のものが第1のアクセプタで標識されており、
さらに、前記核酸解析装置は、
アクセプタ励起用の蛍光物質よりなるドナーが標識されているDNAポリメラーゼ,鋳型DNA或いはプライマと、
前記第1,第2の基質溶液ごとに、前記鋳型DNA及びプライマを介してポリメラーゼ反応により行われる核酸増幅にて、前記鋳型DNAもしくはその相補鎖に捕捉されていく塩基のうち最新の捕捉塩基を標識しているアクセプタを励起する光照射系と、
蛍光共鳴エネルギーにより、前記ドナーの蛍光で前記最新の捕捉塩基を標識しているアクセプタを励起して、前記ドナーによる信号強度変化及び前記第1,第2アクセプタからの信号をリアルタイムにモニタリングする光検出系と、
前記第1,第2の基質溶液を使用して得られたこれらのモニタリングデータから、前記鋳型DNA或いは前記相補鎖に取り込まれた前記ヌクレオチドの塩基配列を解析するデータ演算処理部と、を有することを特徴とする核酸増幅の塩基配列解析装置。
【請求項26】
前記第1のアクセプタは、前記ドナーにより励起されて蛍光する特性を有し、前記第2のアクセプタは、前記第ドナーにより励起されるが、光を生じない或いは前記第1のアクセプタに対して識別できる発光強度差を有する或いは前記第1のアクセプタと波長の異なる特性を有している請求項24又は25記載の核酸増幅の塩基配列解析装置。
【請求項27】
前記第1のアクセプタは、前記ドナーにより励起されて蛍光する或いは励起されるが光を生じない特性を有し、前記第2のアクセプタは、前記ドナーにより励起されて前記第1のアクセプタに対して識別できる発光強度差を有する或いは前記第1のアクセプタと波長の異なる特性を有している請求項24又は25記載の核酸増幅の塩基配列解析装置。
【請求項28】
単一核酸分子の塩基配列を解析するために用いる核酸解析用の蛍光検出装置であって、
ポリメラーゼ反応により前記核酸分子を捕捉,伸長させるためのスポットが複数設けられた基板と、
前記スポットに向けて照射される全反射エバネッセント照射方式の光励起用の照射光源と、
前記スポット位置で、捕捉された核酸分子に修飾された蛍光色素から発せられる蛍光を集光するための蛍光集光系と、
前記蛍光集光系で集光した光を指定の波長ごとに分割するための分離部と、
前記分離部で分割された光を検出器に結像する結像光学系と、
分割され結像される各々の光の時間変化を、同時に検出するための複数の検出画素を備えた検出器と、
検出された光強度の時間変化から核酸の種類を判定するデータ処理部と、を具備する核酸解析用蛍光検出装置。
【請求項29】
前記スポットは、光学的に透明であり、規則的に配置されており、且つ前記基板は、前記スポットでのDNA変性、ハイブリダイゼーション、伸長反応を行うための温調機構を備える請求項27記載の核酸解析用蛍光検出装置。
【請求項30】
前記照射光源は、1種類の単一波長光源である請求項27記載の核酸解析用蛍光検出装置。
【請求項31】
前記照射光源は、蛍光色素を励起するための1種類の単一波長光源と、反応を制御するためのUV光源である請求項27記載の核酸解析用蛍光検出装置
【請求項32】
前記分離部は、波長ごとに透過率の異なるダイクロイックミラーである請求項27記載の核酸解析用蛍光検出装置。
【請求項33】
前記分離部は、波長ごとに進行角度が異なるプリズム分光素子である請求項27記載の核酸解析用蛍光検出装置
【請求項1】
単一核酸分子の塩基配列を、蛍光共鳴エネルギー移動を利用して解析する核酸解析方法であって、
ドナーにより励起される第1のアクセプタによって標識されたdATP及び前記第1のアクセプタと種類の異なる第2のアクセプタによって標識されたdCTP、dGTP、dTTPのヌクレオチドからなる第1のヌクレオチドセットと、
前記同様の第1のアクセプタによって標識されたdCTP、及び前記同様の第2のアクセプタによって標識されたdATP、dGTP、dTTPのヌクレオチドからなる第2のヌクレオチドセットと、
前記同様の第1のアクセプタによって標識されたdGTP、及び前記同様の第2のアクセプタによって標識されたdATP、dCTP、dTTPのヌクレオチドからなる第3のヌクレオチドセットと、
前記同様の第1のアクセプタによって標識されたdTTP、及び前記同様の第2のアクセプタによって標識されたdATP、dCTP、dGTPのヌクレオチドからなる第4のヌクレオチドセットと、
DNAポリメラーゼ,鋳型DNA及びプライマと、
アクセプタ励起用として、前記DNAポリメラーゼ,鋳型DNA及びプライマのいずれか一つに標識されている前記ドナーと、を用いて、
前記第1〜第4のヌクレオチドセットのセットごとに順次、前記鋳型DNA或いはその相補鎖及びプライマを介してポリメラーゼ反応によるヌクレオチドの捕捉,伸長を行い、
前記鋳型DNA或いは前記相補鎖に捕捉される最新に捕捉されるヌクレオチドの近傍に位置する前記ドナーを励起して、このドナーと前記最新捕捉ヌクレオチドの第1のアクセプタ或いは第2のアクセプタとの間で生じる蛍光共鳴エネルギー移動により、前記取り込まれたヌクレオチドの第1のアクセプタ或いは第2のアクセプタを励起し、
前記ドナーの信号強度変化及び前記第1,第2のアクセプタからの信号をリアルタイムにモニタリングし、前記第1〜第4のヌクレオチドセットを使用して得られたこれらのモニタリングデータから、前記鋳型DNA或いは前記相補鎖に取り込まれた前記ヌクレオチドの種類とその位置を特定することを特徴とする核酸解析方法。
【請求項2】
前記第1のアクセプタは、前記ドナーにより励起されて蛍光する特性を有し、前記第2のアクセプタは、前記第ドナーにより励起されるが、光を生じない或いは前記第1のアクセプタに対して識別できる発光強度差を有する或いは前記第1のアクセプタと蛍光波長の異なる特性を有している請求項1記載の核酸解析方法。
【請求項3】
前記第1のアクセプタは、前記ドナーにより励起されて蛍光する或いは励起されるが光を生じない特性を有し、前記第2のアクセプタは、前記ドナーにより励起されて前記第1のアクセプタに対して識別できる発光強度差を有する或いは前記第1のアクセプタと蛍光波長の異なる特性を有している請求項1記載の核酸解析方法。
【請求項4】
前記第1のアクセプタは、前記ドナーにより励起されて蛍光する蛍光色素よりなり、前記第2のアクセプタは、前記ドナーにより励起されるが光を生じない無蛍光ダーククエンチャよりなる請求項1又は2記載の核酸解析方法。
【請求項5】
前記第1のアクセプタは、前記ドナーにより励起されるが光を生じない無蛍光ダーククエンチャよりなり、前記第2のアクセプタは、前記ドナーにより励起されて蛍光する蛍光色素よりなる請求項1又は3記載の核酸解析方法。
【請求項6】
前記第1および第2のアクセプタは、前記ドナーを励起するための光源によって励起されない請求項1ないし5のいずれか1項記載の核酸増幅の塩基配列解析方法。
【請求項7】
前記第1のアクセプタもしくは前記第2のアクセプタにより標識されたヌクレオチドが前記鋳型DNAに捕捉される際に、最新捕捉ヌクレオチドの前記第1又は第2のアクセプタと前記ドナーとの距離が1nm〜10nmである請求項1ないし6のいずれか1項記載の核酸解析方法。
【請求項8】
前記ドナーが、量子ドットの蛍光色素である請求項1ないし7のいずれか1項記載の核酸解析方法。
【請求項9】
前記ポリメラーゼ反応によるヌクレオチド伸長反応は、固相上に固定された直鎖状の鋳型DNA、もしくはその相補鎖に対して行われる請求項1ないし8のいずれか1項記載の核酸解析方法。
【請求項10】
前記ポリメラーゼ反応によるヌクレオチド伸長反応は、固相上に固定された環状の鋳型DNA、もしくはその相補鎖に対して行われる請求項1ないし8のいずれか1項記載の核酸解析方法。
【請求項11】
前記ポリメラーゼ反応によるヌクレオチド伸長反応は、固相上に固定されたポリメラーゼと環状の鋳型DNAを用いて行われる請求項1ないし8のいずれか1項記載の核酸解析方法。
【請求項12】
伸長反応に用いる前記プライマは、3’末端にヌクレオチド伸長を阻害するための保護基を有する請求項1ないし11のいずれか1項記載の核酸解析方法。
【請求項13】
ヌクレオチド伸長反応の際、反応を停止するために、各ヌクレオチドセットは、3’末端に伸長を阻害するための保護基を有するヌクレオチド溶液を用いる請求項1ないし11のいずれか1項記載の核酸解析方法。
【請求項14】
蛍光共鳴エネルギー移動を利用して、ドナーにより励起される第1のアクセプタによって標識されたdATP及び前記第1のアクセプタと種類の異なる第2のアクセプタによって標識されたdCTP、dGTP、dTTPのヌクレオチドからなる第1のヌクレオチドセットと、
前記同様の第1のアクセプタによって標識されたdCTP、及び前記同様の第2のアクセプタによって標識されたdATP、dGTP、dTTPのヌクレオチドからなる第2のヌクレオチドセットと、
前記同様の第1のアクセプタによって標識されたdGTP、及び前記同様の第2のアクセプタによって標識されたdATP、dCTP、dTTPのヌクレオチドからなる第3のヌクレオチドセットと、
前記同様の第1のアクセプタによって標識されたdTTP、及び前記同様の第2のアクセプタによって標識されたdATP、dCTP、dGTPのヌクレオチドからなる第4のヌクレオチドセットと、
アクセプタ励起用の蛍光物質よりなるドナーが標識されているDNAポリメラーゼ,鋳型DNA或いはプライマと、を有することを特徴とする核酸解析用試薬セット。
【請求項15】
前記第1のアクセプタは、前記ドナーにより励起されて蛍光する特性を有し、前記第2のアクセプタは、前記第ドナーにより励起されるが、光を生じない或いは前記第1のアクセプタに対して識別できる発光強度差を有する或いは前記第1のアクセプタと波長の異なる特性を有している請求項14記載の核酸解析用試薬セット。
【請求項16】
前記第1のアクセプタは、前記ドナーにより励起されて蛍光する或いは励起されるが光を生じない特性を有し、前記第2のアクセプタは、前記ドナーにより励起されて前記第1のアクセプタに対して識別できる発光強度差を有する或いは前記第1のアクセプタと波長の異なる特性を有している請求項14記載の核酸解析用試薬セット。
【請求項17】
前記第1のアクセプタは、前記ドナーにより励起されて蛍光する蛍光色素よりなり、前記第2のアクセプタは、前記ドナーにより励起されるが光を生じない無蛍光ダーククエンチャよりなる請求項14又は15記載の核酸解析用試薬セット。
【請求項18】
前記第1のアクセプタは、前記ドナーにより励起されるが光を生じない無蛍光ダーククエンチャよりなり、前記第2のアクセプタは、前記ドナーにより励起されて蛍光する蛍光色素よりなる請求項14又は16記載の核酸解析用試薬セット。
【請求項19】
単一核酸分子の塩基配列を、蛍光共鳴エネルギー移動を利用して解析する核酸解析方法であって、
第1のアクセプタで標識された1〜3種類の塩基及び前記第1のアクセプタと種類の異なる第2のアクセプタで標識されたそれ以外の塩基を混合した基質溶液と、前記アクセプタを共鳴励起するための1種類のドナーにより標識されたDNAポリメラーゼ或いは前記鋳型DNAとを用いて、核酸増幅の塩基配列伸長反応を行い、
前記ドナーの発光波長帯の信号強度の時間変化情報と、少なくとも1種類のアクセプタの発光波長帯の信号強度の時間変化情報を検出し、
検出される前記ドナーの発光強度の低下と、検出される前記アクセプタの発光強度の上昇から、任意の塩基が取り込まれたことを判定することを特徴とする核酸解析方法。
【請求項20】
前記基質溶液は、4種類の塩基を有する第1の基質溶液と、同じく4種類の塩基を有する第2の基質溶液とからなり、前記第1,第2の基質溶液における塩基に標識される前記第1,第2のアクセプタの組み合わせは、4種の塩基のうち、前記第1,第2の基質溶液間で同一の1種については前記第1のアクセプタで標識され、前記基質溶液間で同一のもう1種については前記第2のアクセプタで標識され、前記基質溶液間で同一のさらにもう1種については第1の基質溶液のものが第1のアクセプタで標識され第2基質溶液のものが第2のアクセプタで標識され、前記基質溶液間で同一のさらにもう1種については第1の基質溶液のものが第2のアクセプタで標識され第2基質溶液のものが第1のアクセプタで標識されている請求項19記載の核酸解析方法。
【請求項21】
前記第1のアクセプタは、照射光源からの照射光により励起されて蛍光する蛍光色素であり、前記第2のアクセプタは、前記第1のアクセプタからの蛍光共鳴エネルギーにより励起され、且つ励起されるが光を生じない或いは前記第1のアクセプタに対して識別できる発光強度差を有する或いは前記第1のアクセプタと波長の異なる特性を有している請求項19又は20記載の核酸解析方法。
【請求項22】
前記第1のアクセプタの発光強度は、第2のアクセプタの発光強度の10倍以上である請求項19ないし21のいずれか1項記載の核酸解析方法。
【請求項23】
4種類の塩基を有する第1の基質溶液と、同じく4種類の塩基を有する第2の基質溶液とを備え、前記第1,第2の基質溶液における塩基は、蛍光共鳴エネルギー移動に用いる種類の異なる第1,第2のアクセプタのいずれかにより標識され、このアクセプタの組み合わせは、4種の塩基のうち、前記第1,第2の基質溶液間で同一の1種については前記第1のアクセプタで標識され、前記基質溶液間で同一のもう1種については前記第2のアクセプタで標識され、前記基質溶液間で同一のさらにもう1種については第1の基質溶液のものが第1のアクセプタで標識され第2基質溶液のものが第2のアクセプタで標識され、前記基質溶液間で同一のさらにもう1種については第1の基質溶液のものが第2のアクセプタで標識され第2基質溶液のものが第1のアクセプタで標識されていることを特徴とする核酸解析用試薬セット。
【請求項24】
単一核酸分子の塩基配列を、蛍光共鳴エネルギー移動を利用して解析する核酸解析装置であって、
ドナーにより励起される第1のアクセプタによって標識されたdATP及び前記第1のアクセプタと種類の異なる第2のアクセプタによって標識されたdCTP、dGTP、dTTPのヌクレオチドからなる第1のヌクレオチドセットと、
前記同様の第1のアクセプタによって標識されたdCTP、及び前記同様の第2のアクセプタによって標識されたdATP、dGTP、dTTPのヌクレオチドからなる第2のヌクレオチドセットと、
前記同様の第1のアクセプタによって標識されたdGTP、及び前記同様の第2のアクセプタによって標識されたdATP、dCTP、dTTPのヌクレオチドからなる第3のヌクレオチドセットと、
前記同様の第1のアクセプタによって標識されたdTTP、及び前記同様の第2のアクセプタによって標識されたdATP、dCTP、dGTPのヌクレオチドからなる第4のヌクレオチドセットと、
アクセプタ励起用の蛍光物質よりなるドナーが標識されているDNAポリメラーゼ,鋳型DNA或いはプライマと、
前記第1〜第4のヌクレオチドセットの各々ごとに、前記鋳型DNA及びプライマを介してポリメラーゼ反応により行われる核酸増幅にて、前記鋳型DNAもしくはその相補鎖に捕捉されていくヌクレオチドのうち最新捕捉のヌクレオチドを標識しているアクセプタを励起する光照射系と、
蛍光共鳴エネルギーにより、前記ドナーの蛍光で前記最新捕捉のヌクレオチドを標識しているアクセプタを励起して、前記ドナーによる信号強度変化及び前記第1,第2アクセプタからの信号をリアルタイムにモニタリングする光検出系と、
前記第1〜第4のヌクレオチドセットを使用して得られたこれらのモニタリングデータから、前記鋳型DNA或いは前記相補鎖に取り込まれた前記ヌクレオチドの塩基配列を解析するデータ演算処理部と、を有することを特徴とする核酸増幅の塩基配列解析装置。
【請求項25】
単一核酸分子の塩基配列を、蛍光共鳴エネルギー移動を利用して解析する核酸解析装置であって、
4種類の塩基を有する第1の基質溶液と、同じく4種類の塩基を有する第2の基質溶液とを備え、前記第1,第2の基質溶液における塩基は、蛍光共鳴エネルギー移動に用いる種類の異なる第1,第2のアクセプタのいずれかにより標識され、このアクセプタの組み合わせは、4種の塩基のうち、前記第1,第2の基質溶液間で同一の1種については前記第1のアクセプタで標識され、前記基質溶液間で同一のもう1種については前記第2のアクセプタで標識され、前記基質溶液間で同一のさらにもう1種については第1の基質溶液のものが第1のアクセプタで標識され第2基質溶液のものが第2のアクセプタで標識され、前記基質溶液間で同一のさらにもう1種については第1の基質溶液のものが第2のアクセプタで標識され第2基質溶液のものが第1のアクセプタで標識されており、
さらに、前記核酸解析装置は、
アクセプタ励起用の蛍光物質よりなるドナーが標識されているDNAポリメラーゼ,鋳型DNA或いはプライマと、
前記第1,第2の基質溶液ごとに、前記鋳型DNA及びプライマを介してポリメラーゼ反応により行われる核酸増幅にて、前記鋳型DNAもしくはその相補鎖に捕捉されていく塩基のうち最新の捕捉塩基を標識しているアクセプタを励起する光照射系と、
蛍光共鳴エネルギーにより、前記ドナーの蛍光で前記最新の捕捉塩基を標識しているアクセプタを励起して、前記ドナーによる信号強度変化及び前記第1,第2アクセプタからの信号をリアルタイムにモニタリングする光検出系と、
前記第1,第2の基質溶液を使用して得られたこれらのモニタリングデータから、前記鋳型DNA或いは前記相補鎖に取り込まれた前記ヌクレオチドの塩基配列を解析するデータ演算処理部と、を有することを特徴とする核酸増幅の塩基配列解析装置。
【請求項26】
前記第1のアクセプタは、前記ドナーにより励起されて蛍光する特性を有し、前記第2のアクセプタは、前記第ドナーにより励起されるが、光を生じない或いは前記第1のアクセプタに対して識別できる発光強度差を有する或いは前記第1のアクセプタと波長の異なる特性を有している請求項24又は25記載の核酸増幅の塩基配列解析装置。
【請求項27】
前記第1のアクセプタは、前記ドナーにより励起されて蛍光する或いは励起されるが光を生じない特性を有し、前記第2のアクセプタは、前記ドナーにより励起されて前記第1のアクセプタに対して識別できる発光強度差を有する或いは前記第1のアクセプタと波長の異なる特性を有している請求項24又は25記載の核酸増幅の塩基配列解析装置。
【請求項28】
単一核酸分子の塩基配列を解析するために用いる核酸解析用の蛍光検出装置であって、
ポリメラーゼ反応により前記核酸分子を捕捉,伸長させるためのスポットが複数設けられた基板と、
前記スポットに向けて照射される全反射エバネッセント照射方式の光励起用の照射光源と、
前記スポット位置で、捕捉された核酸分子に修飾された蛍光色素から発せられる蛍光を集光するための蛍光集光系と、
前記蛍光集光系で集光した光を指定の波長ごとに分割するための分離部と、
前記分離部で分割された光を検出器に結像する結像光学系と、
分割され結像される各々の光の時間変化を、同時に検出するための複数の検出画素を備えた検出器と、
検出された光強度の時間変化から核酸の種類を判定するデータ処理部と、を具備する核酸解析用蛍光検出装置。
【請求項29】
前記スポットは、光学的に透明であり、規則的に配置されており、且つ前記基板は、前記スポットでのDNA変性、ハイブリダイゼーション、伸長反応を行うための温調機構を備える請求項27記載の核酸解析用蛍光検出装置。
【請求項30】
前記照射光源は、1種類の単一波長光源である請求項27記載の核酸解析用蛍光検出装置。
【請求項31】
前記照射光源は、蛍光色素を励起するための1種類の単一波長光源と、反応を制御するためのUV光源である請求項27記載の核酸解析用蛍光検出装置
【請求項32】
前記分離部は、波長ごとに透過率の異なるダイクロイックミラーである請求項27記載の核酸解析用蛍光検出装置。
【請求項33】
前記分離部は、波長ごとに進行角度が異なるプリズム分光素子である請求項27記載の核酸解析用蛍光検出装置
【図1】


【図2(A)】


【図2(B)】


【図2(C)】


【図3(A)】


【図3(B)】


【図3(C)】


【図4】


【図5(A)】


【図5(B)】


【図5(C)】


【図5(D)】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】




【図2(A)】


【図2(B)】


【図2(C)】


【図3(A)】


【図3(B)】


【図3(C)】


【図4】


【図5(A)】


【図5(B)】


【図5(C)】


【図5(D)】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【公開番号】特開2012−23988(P2012−23988A)
【公開日】平成24年2月9日(2012.2.9)
【国際特許分類】
【出願番号】特願2010−163775(P2010−163775)
【出願日】平成22年7月21日(2010.7.21)
【出願人】(501387839)株式会社日立ハイテクノロジーズ (4,325)
【Fターム(参考)】
【公開日】平成24年2月9日(2012.2.9)
【国際特許分類】
【出願日】平成22年7月21日(2010.7.21)
【出願人】(501387839)株式会社日立ハイテクノロジーズ (4,325)
【Fターム(参考)】
[ Back to top ]

