核酸試料から標的配列を増幅するための方法および組成物
本発明は、概して、所定の標的配列のホットスタートプライマーおよび非ホットスタートプライマーの混合物を含むPCR反応混合物、たとえば多重PCR反応混合物;1以上の標的ポリヌクレオチド配列の検出のためにこれを利用する方法;およびこれを含むキットに関する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、概して、所定の標的配列のホットスタートプライマーおよび非ホットスタートプライマーの混合物を含むポリメラーゼ連鎖反応(PCR)混合物、例えば多重PCR反応混合物;対象の標的ポリヌクレオチド配列の検出のためにこれを利用する方法;ならびにこれを含むキットに関する。
【背景技術】
【0002】
ポリメラーゼ連鎖反応(PCR)およびリアルタイム定量PCR
ポリメラーゼ連鎖反応(PCR)の発明により、核酸配列のインビトロ増幅が可能になった。PCRは、米国特許第US4,683,195号;第US4,683,202号;および第US4,965,188号に記載されている。
【0003】
さらに、Applied Biosystems(カリフォルニア州フォスターシティー)などの商業的製造供給元が、PCR試薬を販売し、PCRプロトコルを公開している。
【0004】
PCRは、典型的には、第1増幅サイクルにおいてテンプレートの有効な利用を可能にする初期変性ステップから開始し、続いてPCR増幅のサイクルを行う。PCR増幅の各サイクルで、二本鎖標的配列を変性させ、プライマーを変性した標的の各鎖にアニールし、そしてプライマーは、「変性」、「アニーリング」、および「伸長」ステップと呼ばれるDNAポリメラーゼの作用により伸長される。新たに合成されたPCR産物の突出末端を埋めるために、最終伸長ステップを含めることができる。増幅の特異性は、プライマーハイブリダイゼーションの特異性に依存する。プライマーは、標的核酸配列の核鎖の3’末端に存在する配列と相補性であるか、または実質的に相補性であるように選択される。
【0005】
定量PCR(「リアルタイムPCR」または「qPCR」と呼ばれる場合もある)は、2つのオリゴヌクレオチドプライマーが増幅されるDNAの側面に位置する、PCRと同じ増幅スキームを利用する。qPCRでは、反応産物が形成される際にそれらをモニタリングする。蛍光標識に依存するいくつかの方法を、リアルタイムモニタリングに用いることができる。リアルタイムモニタリングで用いられる一般的な一方法は、SYBR(登録商標)Green蛍光染料などのDNA結合蛍光染料を用いる。別の方法は、蛍光タグで一端が標識され、蛍光クエンチャー(FRETプローブ)で他端が標識された標的特異的オリゴヌクレオチドプローブを添加する。蛍光共鳴エネルギー転移(FRET)は、2つの蛍光分子間のエネルギー転移機構である。TaqMan(登録商標)変異体では、オリゴヌクレオチドの一端の蛍光標識をその特異的蛍光励起波長で励起する。この励起状態を次いでオリゴヌクレオチドの他端のクエンチャー分子標識に非放射活性的に移す。定量PCR反応では、DNA標的と結合するプローブをプライマー伸長中にプローブから切断し、それにより蛍光タグを放出して、エネルギーが転移することなくその特異的蛍光励起波長でシグナルを放出する。
【0006】
オリゴヌクレオチドFRETプローブにより放出されるシグナルは、典型的には、反応におけるPCR産物の量に正比例して増大する。各サイクルでの蛍光発光の量を記録することにより、PCR反応を、PCR産物の量における第1の有意な増加が標的テンプレートの初期量に相関する対数期中モニタリングする。出発核酸標的のコピー数が高いほど早く蛍光において有意な増加が観察される。サイクル10を越える各サイクルで測定されるベースライン値を上回る蛍光における有意な増加は、蓄積されたPCR産物の検出を示す。当業者は、米国特許第5,925,517号、第6,037,130号、第6,103,476号、第6,150,097号、第6,461,817号および第7,385,043号に記載されている分子ビーコン、エクリプスプローブ(Eclipse Probes)、およびスコーピオンプライマー(Scorpion Primer)およびサンライズプライマー(Sunrise Primer)変異体におけるような蛍光標識されたプライマーの使用をはじめとするさらなる周知方法を認識しているであろう。
【0007】
臨床材料において対象のポリヌクレオチド配列を検出するためのqPCRの使用
試験試料において対象の標的ポリヌクレオチド配列を検出するために、qPCRが使用されてきた。標的ポリヌクレオチド配列の1つの例示的タイプは、典型的には、感染性疾患について試験するために臨床材料において分析される、対象の病原体に特徴的なものである。US6664080(Klaus Pfeffer、標題“TaqMan■−PCR for the detection of pathogenic E. coli strains”)は、PCRベースのアッセイにおいて、腸毒素原性、腸管凝集性、腸管組織侵入性、腸内病原性および腸管出血性大腸菌株をはじめとする病原性大腸菌株のサブグループを検出するために有用なプローブおよびプライマーを記載している。中でも、米国特許出願第2009/0181363号、標題“Non−Invasive Detection of Fish Viruses by Real−Time PCR”、米国特許出願第2006/0177818号、標題“Method of Detection of classical swine fever”、およびその中での引用文献に記載されているように、qPCRは、ウイルスを検出するためにも用いられてきた。
【0008】
qPCRは、メチシリン耐性黄色ブドウ球菌(Staphylococcus aureus)(MRSA)などの抗生物質耐性病原体を特異的に検出するためにも用いられてきた。米国特許出願第2009/0081663号(Yosef Paitan、標題“Methods, Compositions and Kits for Detection and Analysis of Antibiotic−Resistant Bacteria”は、例えば、(a)標的細菌に対して特異的な遺伝子;(b)抗生物質耐性遺伝子;および(c)細菌ゲノムの既知領域と抗生物質耐性カセットの通常の組み込み部位との間の架橋領域を増幅する多重qPCRの使用を記載している。US6329138(Hans De Beenhouwerら、標題“Method for detection of the antibiotic resistance spectrum of mycobacterium species”は、リファンピシンおよびその類似体に対して耐性であるヒト結核菌(M.tuberculosis)株を検出するためのPCRベースのアッセイで有用なプローブおよびプライマーを記載している。US7045291(Nancy Hansonら、標題“Multiplex PCR for the detection of AmpC beta−lactamase genes”は、あるAmpCベータラクタマーゼを検出するためのプローブを記載している。US5994066、US6001564、および国際特許出願第WO/1996/008582号(Bergeronら、クレイトン大学に譲渡)は、インフルエンザ菌(H. influenzae)、肺炎桿菌(K.pneumoniae)、プロテウス・ミラビリス(P.mirabilis)、腐性ブドウ球菌(S.saprophyticus)、エンテロコッカス・フェシウム(E.faecium)、および種々のストレプトコッカス種(Streptococcus species)から選択される特定の細菌種からのblatem、blarod、blashv、blaoxa、balz、aadB、aacC1、aacC2、aacC3、aacA4、aac6’−IIa、ermA、ermB、ermC、mecA、vanH、vanX、vanB、satA、aacA−aphD、vat、vga、msrA、sulおよびintから選択される細菌の抗生物質耐性遺伝子を検出するためのプローブを記載している。米国特許出願第2004/0185478は、微生物学研究室での診断のために臨床材料から細菌性および真菌性病原体ならびにそれらの抗生物質耐性遺伝子を迅速に検出および同定するための種特異的プローブ、属特異的プローブおよびユニバーサルDNAプローブおよび増幅プライマーを記載している。Huletsky Aら(New real−time PCR assay for rapid detection of methicillin−resistant S. aureus directly from specimens containing a mixture of staphylococci. J Clin Microbiol. 2004;42(5):1875−84)も参照。
【0009】
qPCRは、とりわけUS6673541および5861504ならびに米国特許出願第2009/0023603号、第2006/0099620号、および第2008/0286773号で記載されているように、法医学試料において標的ポリヌクレオチド配列を特異的に検出するためにも用いられてきた。多くの場合、いくつかの増幅反応を多重アッセイで実施して、非常に限られた利用可能なDNA試料を最大限利用する。
【0010】
qPCRは、とりわけUS7507800および6083698ならびに米国特許出願第2005/0095592号で記載されているように、ヒトDNAマーカー、例えばBRCA1およびBRCA2を特異的に検出するためにも用いられてきた。多くの場合、いくつかの増幅反応を多重アッセイで実施して、コストおよび速度を最小限に抑える。
【0011】
PCRにおける非特異的ハイブリダイゼーション
PCRでは、非特異的増幅産物の生成が起こる可能性がある。人工物が、プライマー間またはプライマーとTaqMan(登録商標)や分子ビーコンプローブなどのプローブとの間の弱い相互作用の結果として、「プライマー−二量体」(Rychlik, 1995)および「プライマー−プローブ二量体」として表される不適切なハイブリダイゼーション産物から誘導される場合がある。プライマーの3’末端と反応ミックス中の非標的オリゴヌクレオチド鎖中の塩基との間の弱い相補性の結果として、望ましくない産物が形成される可能性がある。これにより、プライマーの非標的鎖へのアニーリングと、それに続く熱安定性DNAポリメラーゼによる非特異的二量体の開始および伸長が可能になり、望ましくない副生成物の増幅に至る。
【0012】
リアルタイムPCRでは、アッセイの感度のためにこの問題が悪化する可能性がある。この問題は、多重PCR増幅反応では、反応ミックス中に複数のプライマーセットおよびプローブが存在することにより、非特異的ハイブリダイゼーションの尤度が増大して、さらに悪化する。これらの問題は、Chou et al., 1992, Nucleic Acids Research 20(7):1717−1723でさらに議論されるように、感度およびデータ品質の低下につながる可能性がある。非特異的増幅はまた、実施できるサイクル数を減少させ、アッセイの感度を低下させる。
【0013】
「ホットスタート」法および非特異的増幅に対する他の解決策
反応の開始前に、非標的配列に結合したプライマーからの伸長産物の形成を減少させることによって、非特異的増幅を低減することができる。非特異的増幅の問題に対処する一方法は、「ホットスタート」プロトコルと呼ばれ、この方法では、温度が、必要とされるハイブリダイゼーション特異性を提供するために十分上昇するまで、1以上の重要な試薬を反応混合物に添加しない。このように、反応混合物は、反応条件が非特異的プライマーハイブリダイゼーションを許容する期間中はプライマー伸長を支援することができない。
【0014】
最初の高温インキュベーションステップ後に反応管を開け、そして失われた試薬を添加することにより、ホットスタート法を手動で実施することができる。しかし、手動ホットスタート法は、労力を要し、反応混合物の汚染のリスクも増加することは言うまでもない。反応成分を分離または隔離するためにワックスなどの熱不安定材料を使用するホットスタート法は、米国特許第5,411,876号およびChou et al., 1992(上記)に記載されている。これらの方法では、高温プレ反応インキュベーションにより熱不安定材料を融解させ、それにより試薬を混合させる。
【0015】
反応開始前に非標的配列に結合したプライマーからの伸長産物の形成を低減する別の方法は、熱可逆的な方法でDNAポリメラーゼに非共有結合する化合物を用いて、DNAポリメラーゼを阻害することによる。米国特許第5,338,671号は、DNAポリメラーゼ活性を阻害するための、熱安定性DNAポリメラーゼに対して特異的な抗体の使用を記載している。この方法の短所は、DNAポリメラーゼに特異的な抗体の産生が、特に大量では、高価であり、時間がかかることである。さらに、反応混合物に抗体を添加することは、増幅反応の再設計を必要とする可能性がある。
【0016】
米国特許第5,677,152号および第5,773,258号(David Edward Birchら、Roche Molecular Systems, Incに譲渡、どちらも標題 “Nucleic Acid Amplication Using a Reversible Inactivated Thermostable Enzyme”)は、「ホットスタートポリメラーゼ」として知られる、非特異的増幅反応を減少させる別の方法を記載している。Taqポリメラーゼ酵素は、化学修飾によって可逆的に不活性化される。酵素活性は、増幅反応前に、または増幅反応の一部として、反応混合物を高温でインキュベートすることにより回復される。非特異的増幅は減少する。なぜなら、反応混合物は、活性化高温インキュベーション前に伸長産物の形成を支援しないからである。
【0017】
米国特許出願第2004/0197800(Michael Borns、Stratageneに譲渡)は、ホットスタートおよび非ホットスタートDNAポリメラーゼのブレンドを開示している。
【0018】
非特異的増幅反応を減少させる別の方法は、米国特許出願第2005/0255486号および第2008/0038724号(Mark Behlkeら、Integrated DNA Technologies, Incに譲渡、標題“Methods for amplifying polymeric nucleic acids”に記載されている。増幅で用いられるプライマーセットは、2種のプライマーの混合物から構成されている。一方向の伸長に関しては、プライマーは、プライマーとして機能的であるが、すべて、DNAポリメラーゼによって複製できるテンプレートとして機能するそれらの能力を排除する修飾を含む。反対方向の伸長に関しては、セットは、テンプレートとして機能でき、その全長にわたってDNAポリメラーゼにより複製できる少なくとも1つプライマーを含む。プライマーセット中の少なくとも1つプライマーは核酸ポリマーとハイブリダイズする。非複製可能プライマーが核酸ポリマーとハイブリダイズし、伸長されて、核酸ポリマー由来の配列を含む伸長産物を産生し、これに対して複製可能なプライマーが次にハイブリダイズするのが好ましい。
【0019】
LG Puskasらによる論文(Reduction of mispriming in amplification reactions with restricted PCR;Genome Res. 1995;5(3):309−11)は、3’−ジデオキシ−末端コンペティターオリゴヌクレオチドを増幅混合物に添加することにより、非特異的増幅を減少させる別の方法を記載している。コンペティターオリゴヌクレオチドは、報告によると、非特異的増幅反応を阻害する。
【0020】
非特異的ハイブリダイゼーションを減少させるために修飾されたプライマー
US6,001,611(Stephen Gordon Will、Roche Molecular Systems, Incに譲渡、標題“Modified nucleic acid amplification primers”, は、一般構造:
【化1】

(式中、S1は、約5〜約50ヌクレオチドの長さのヌクレオチドの第1の配列を表し;
式中、S2は、1〜3ヌクレオチドの長さの第2の配列を表し;
式中、Nは、環外アミンを含むプリンまたはピリミジン塩基を含むヌクレオチドを表し;
式中、Rはモディファイアー基を表し、Rは環外アミンの窒素原子と共有結合し、Rは構造:
【化2】

を有する)
を有する別の種類の修飾されたオリゴヌクレオチドプライマーを記載している。
【0021】
修飾されたプライマーは報告によると、非特異的増幅、特にプライマー−二量体形成を減少させ、および/または、修飾された塩基と相補性塩基とのワトソン・クリック塩基対形成および/または修飾されたプライマーの伸長と干渉することにより、修飾されていないプライマーを用いて実施した増幅に関して意図される標的の収率を付随して増大させる。
【0022】
ホットスタートプライマー
非特異的反応を減少させるための別の機構は、「ホットスタートプライマー」として知られる、高温で活性化されるプライマーの使用である。ホットスタートプライマーの1種は、US6,482,590(Edwin Ullmanら、Aventis Behring GmbHに譲渡、標題“Method for polynucleotide amplification”、これはポリヌクレオチドにそって非効率的にしか伸長できない3’末端を有する修飾オリゴヌクレオチドを記載する)に記載されている。修飾されたヌクレオチドは、報告によれば、周囲温度でのPfuポリメラーゼ活性の3’−エキソヌクレアーゼ活性に対して比較的耐性であるが、温度が上昇するにつれてゆっくりと分解されて、修飾されたヌクレオチドが除去され、結果として、機能的プライマーがPCR反応中に徐々に導入され、それにより全体的な特異性が改善される。
【0023】
米国特許出願第2007/0128621号(Applera Corporationに譲渡)は、ステムループ構造を有し、mRNA標的に対するホットスタートプライマーとミクロRNA標的に対するレギュラープライマーとを含むmRNAおよびミクロRNA標的の多重増幅のPCR反応混合物を記載している。
【0024】
米国特許出願第2007/0281308号(Gerald Zonら、標題“Chemically Modified Oligonucleotide Primers for Nucleic Acid Amplification”は、熱により除去可能な修飾基を、好ましくは3’末端で含むプライマーを開示し、この基は、増幅の初期変性ステップ中に解離する。不活性プライマーが機能的プライマーとの混合集団中に存在する可能性がある。
【0025】
国際特許出願第WO2009/004630(Ofer Peleg of Genaphora Ltd、標題“Chimeric Primers for Improved Nucleic Acid Amplification Reactions”)、およびPelegらによる論文(The use of chimeric DNA/RNA primers in quantitative PCR for the detection of Ehrlichia canis and Babesia canis. Appl Environ Microbiol. 2009;75(19):6393−8)は、非特異的増幅反応を減少させるために用いられる別の種類のプライマーを記載している。開始ゾーンに近接した隣接しない位置にいくつかのリボヌクレオチドを組み入れるこれらのプライマーは、報告によれば、非特異的増幅産物の形成を減少させる。
【0026】
別の種類のホットスタートプライマーが、M Ailenbergらによる論文(Controlled hot start and improved specificity in carrying out PCR utilizing touch−up and loop incorporated primers (TULIPS). Biotechniques. 2000;29(5):1018−20, 1022−4)およびOK Kaboevら(PCR hot start using primers with the structure of molecular beacons(hairpin−like structure). Nucleic Acids Res. 2000;28(21):E94)(これらは、3’領域にセルフアニーリングし、重合の開始を阻害するさらなる非テンプレート5’配列を含むループプライマーを記載している)に記載されている。反応混合物を加熱すると、プライマーのループ領域は、報告によれば融解し、活性化する。
【0027】
共有結合性化学修飾を含むホットスタートプライマーも文献で記載されている。米国特許出願第2003/0119150号(Waltraud Ankenbauerら、Roche Diagnosticsに譲渡、標題“Composition and method for hot start nucleic acid amplification”は、少なくとも1つプライマーの3’末端で化学修飾を含むプライマーの使用を記載している。反応混合物はさらに、周囲温度で不活性であり、熱安定性エキソヌクレアーゼも含み、したがって修飾されたプライマーが影響を受けないまま残る。温度が上昇すると、エキソヌクレアーゼは活性になり、プライマーの3’修飾を除去し、増幅のためにプライマーを活性化する。
【0028】
米国特許出願第2003/0162199号(Alex Bonner、BioLink Partners, Incに譲渡、標題“Reversible chemical modification of nucleic acids and improved method for nucleic acid hybridization”は、標的核酸(複数可)、プライマー(複数可)またはヌクレオシド三リン酸の、熱を用いて核酸から放出することができる除去可能な保護基での修飾を記載している。化学修飾は、グリオキサール、その誘導体、3,4,5,6−テトラヒドロフタル酸無水物、3−エトキシ−2−ケトブチルアルデヒド(ケトキサール)、ニンヒドリン、ヒドロキシアセトン、シュウ酸ジエチル、メソシュウ酸ジエチル、1,2−ナフトキノン−4−スルホン酸、ピルボアルデヒド、アミド、γ−カルボキシアシルアミド、アミジン、およびカーバメートから選択することができる。
【0029】
AV Lebedevらによる論文(Hot Start PCR with heat−activatable primers: a novel approach for improved PCR performance. Nucleic Acids Res. 2008. 36(20):e131)は、1〜2個の熱不安定性4−オキソ−1−ペンチル(OXP)ホスホトリエステル(PTE)修飾基を3’末端で、そして3’末端から2番目のヌクレオチド間結合を含む別の種類のホットスタートプライマーを記載している。これらの修飾は、報告によれば、プレ反応条件下でDNAポリメラーゼプライマー伸長を損なう。高温でのOXP修飾プライマーのインキュベーションにより、対応する非修飾ホスホジエステル(PDE)プライマーを得、これは好適なDNAポリメラーゼ基質である。
【0030】
US6,794,142号(Walter J. Lairdら、Roche Molecular Systems, Incに譲渡、標題“Amplification using modified primers”)は、3つの3’末端ヌクレオチド位置内に修飾ヌクレオチドを含むホットスタートプライマーを記載し;この場合、修飾ヌクレオチドは、2’−O−メチルヌクレオチド、2’−フルオロ−ヌクレオチド、2’−アミノヌクレオチド、またはアラビノースヌクレオチドである。これらの修飾プライマーは、報告によれば、初期プライマー伸長が起こるのに必要な時間を増加させることにより、おそらくはプライマー−標的二本鎖を伸長に関してあまり好ましくないテンプレートにすることによって、非特異的増幅を減少させる。これにより、プレ反応条件下でのプライマー間などの不安定で一時的なハイブリダイゼーション二本鎖が、プライマー伸長が起こるために十分な時間存在する可能性が減少する。
【0031】
異なる種類のホットスタートプライマーがDD Youngら(Light−triggered polymerase chain reaction. Chem Commun (Camb). 2008;(4):462−4)による論文で記載されている。これらのプライマーは、UV照射により除去可能である立体的に要求が厳しいケージ作用を有する基で修飾されている。修飾されていないプライマーは、報告によれば、UV照射に暴露されるまではPCR反応を触媒することができず、その後、反応は正常に進行する。そのようなプライマーは、反応混合物がアニーリング温度まで加熱され、次いでUV照射に暴露される、ホットスタートプロトコルに好適である。
【0032】
「リボプライマー」
米国特許出願第20090325169号およびが第20100167353号(どちらもIntegrated DNA Technologies Inc.(IDT)に譲渡、標題“RNase H−Based Assay Utilizing Modified RNA Monomers”は、別の種類のホットスタートPCRプライマーである「リボプライマー」を記載している。これらのプライマーは、ホットスタート成分が熱安定性RNase Hまたはこの反応で用いられる高温で活性を獲得する他のニッキング酵素であるPCR反応ミックスに好適である。修飾プライマーは、DNAと結合する場合にRNase H2切断部位を生成する内部修飾ヌクレオチドを有する。加えて、プライマーは、3’ブロッキング基を含み、これは、ブロッキング基が除去されるまでPCRを支援するプライマーの能力を排除する。RNase H2による切断は、プライマーおよび標的の二本鎖形成を必要とし、プライミングの特異性を増大させ、これはプライマー−二量体形成の影響を減少させて、これによりバックグラウンドシグナルを低下させ、全体的な反応特異性を改善する。
【0033】
核酸増幅反応における他の種類の非機能的プライマー
多くの他の参考文献は、核酸増幅反応における非機能的または拮抗的プライマーの使用を記載している。米国特許出願第2003/0104430号および国際出願第WO00/61817号(Michael Nerenbergら、標題“Amplification and separation of nucleic acids using strand displacement amplification and bioelectronic microchip technology”)は、たとえば、バイオ電子マイクロチップ技術と組みあわせた、ストランド置換増幅(SDA)のためのプライマーミックス中の非切断性プライマーの使用を記載している。SDAは、等温性非同期性核酸増幅プロセスである。非切断性プライマーは、二本鎖テンプレートの変性前にニッキングされ、かくして固定SDAにおけるシグナル強度を改善するシグナルを保持するか、または増幅を所望の方向になるようバイアスをかけることが意図される。非切断性プライマーは、正常なSDAプライマーとの組みあわせで提供することができる。
【0034】
米国特許第5,712,386号(Chang−Ning Wangら、Biotronics Corporationに譲渡)は、プライマーとハイブリダイズするブロッキングヌクレオチドを開示している。ブロッキングヌクレオチドおよびプライマーは、0.3〜5.0のブロッキングヌクレオチド/プライマーモル比で存在し得る。
【0035】
ホットスタートプライマーを使用する多重PCR反応で増幅に失敗する問題
理想的には、コストや複雑さを最小限に抑え、できるだけはやく試験結果を得るために、qPCRアッセイは、広範なDNA精製手順を必要とすべきではなく、1つの試験管中で実施するべきである。しかし、ある種類の多重PCR、たとえば(a)抗生物質耐性病原体の検出;(b)細菌性もしくはウイルス性病原体またはヒトDNAマーカーの1以上のパネルの検出のための多重PCRスクリーニング試験;および(c)法医学試料のPCRアッセイは、この点に関して独自の課題を提示する。いくつかの増幅反応は平行して実施しなければならないので、そのような高感度アッセイで重大なシグナルを生成しやすい非特異的増幅の可能性が増大する。菌株間の配列変動は、問題をさらに複雑にする。したがって、臨床材料の多重PCR増幅を可能にする反応混合物が当該技術分野で差し迫って必要とされている。これらの問題に対処するために、リボプライマーなどのホットスタートプライマーが開発されてきた。
【0036】
しかし、本明細書中で示されるように、リボプライマーなどのホットスタートプライマーに関してさらなる問題が観察される可能性がある。これらのプライマーは、特に多重反応で、広範に精製されなかったDNA試料では1以上の標的を効率的に増幅できない可能性がある。このように、従来技術では、臨床材料の多重PCR増幅を可能にする反応混合物を提供する問題に有効に対処することができなかった。本発明の方法および組成物は、従来技術のこれらの不備を克服することを目的とする。
【発明の概要】
【発明が解決しようとする課題】
【0037】
本明細書中で以下に記載する本発明は、既存のqPCR法の限界、特に背景技術の部分で記載した不備の少なくとも一部を克服することに関する。
【0038】
本発明の実施形態は、効率的な多重PCR増幅の問題に対する簡単で経済的な解決策を提供する、プライマーベースのインビトロ核酸増幅のための方法および試薬に関する。
【0039】
本発明の一態様は、プライマーベースの増幅反応を用いた核酸配列のインビトロ増幅用キットに関し、このキットは、ホットスタートプライマーおよびレギュラープライマーの混合物(どちらも特定のアンプリコンの同じ末端に対する)を含む。異なるプライマーによって認識される配列は、同一であるか、重複するか、または重複しない可能性がある。キットは、典型的には1以上の増幅試薬、たとえば、核酸ポリメラーゼ,ヌクレオシド三リン酸、および/または好適な緩衝液を含む。さらに、キットは、増幅産物を検出するための手段などのさらなる成分を含んでもよい。
【0040】
本発明の別の態様は、核酸を増幅するための方法に関し、この方法は、ホットスタートプライマーおよびレギュラープライマーの混合物(どちらも特定のアンプリコンの同じ末端に対する)を用いてプライマーベースの核酸増幅反応を実施するステップを含む。したがって、本発明は、試料中に含まれる標的核酸を増幅するための方法であって:(a)標的核酸および1対のプライマー(ホットスタートプライマーおよびレギュラープライマーの前記混合物を含む)を含む増幅反応混合物を提供するステップ;および(b)ステップ(a)の反応混合物を核酸の増幅に好適な条件下で処理するステップを含む方法を提供する。ある実施形態では、多重PCR反応が実施されるように、複数のプライマーセットが含まれる。ある他の実施形態では、分析される試料は臨床材料由来であり、試料の核酸は広範に精製されていない。
【0041】
本発明のある実施形態では、本発明の方法および組成物は、ホットスタートプライマーおよびレギュラープライマーの混合物である、1以上の標的に対するプライマー、ならびにホットスタートプライマーのみである、1以上の他の標的に対するプライマーのどちらも使用する。
【0042】
本発明の別の態様は、ホットスタートプライマーおよびレギュラープライマーの混合物(どちらも特定のアンプリコンの同じ末端に対する)を含む増幅反応混合物に関する。
【0043】
本発明の別の態様は、不活性化化学修飾を含む少なくとも1つのホットスタートプライマーを利用するPCR増幅の改善法に関し、この場合、ホットスタートプライマーが高温で相補配列とハイブリダイズする場合、不活性化化学修飾は可逆性であり、改善は、ホットスタートプライマーと同じ標的に対する(同じ配向で、同じアンプリコンに対する)非ホットスタート/機能的プライマーを提供することからなる。別の実施形態において、改善は、ホットスタートプライマーと同じ標的に対する非ホットスタート/機能的プライマーを提供することを含む。ある実施形態では、多重PCR反応が実施されるように、複数のプライマーセットが含まれる。ある他の実施形態では、分析される試料は臨床材料由来であり、この試料の核酸は広範に精製されていない。ある実施形態では、改善は、本明細書中に記載される本発明のさらなる態様をさらに構成し得る。
【0044】
本発明の方法および組成物のある実施形態は、特にこれらは一般的に広範なDNA精製手順を必要とせず、単一の試験管中で実施することができるので、コストや複雑さの低減および試験結果の迅速な取得を可能にする。ヒト同一性を決定するためにまとめて用いることができる複数のヒトDNAマーカーの検出のために法医学試料をスクリーニングするための多重PCRでは、複数の増幅反応を平行して実施して、多くの場合、非常に限られた利用可能なDNA試料を最大限に利用する。抗生物質耐性病原体を検出するための多重PCRでは、複数の増幅反応を平行して実施し(たとえば、米国特許出願第2009/0081663号を参照)、qPCRなどの高感度法を用いて検出されやすい非特異的増幅の可能性を増大しなければならない。細菌性またはウイルス性病原体の1以上のパネルを検出するための多重PCRスクリーニング試験についても同じ要求が存在し、この場合、相対的定量的な細菌またはウイルス負荷は臨床的に関連するものである。加えて、本明細書中に提示される知見は、臨床材料が、ミスマッチまたはプライマー−標的ハイブリダイゼーション結合の弱化に寄与する他の因子が存在する場合に、PCRの効率を低下させ、ホットスタートプライマーを用いるPCRを阻害する物質を含むことが多いことを示す。これらの課題は、本発明の範囲内の特定の方法および組成物によって対処される。
【0045】
ホットスタートプライマー、たとえばリボプライマー、および類似した種類のプライマーは、プライマー−二量体形成および他の非特異的反応を低減し、したがって多重PCR反応において著しい進歩である。しかし、高度の精製に付されていない臨床材料が、リボプライマーを利用するPCR反応を阻害し得る1以上の因子を含むということがここでは意外にも見いだされた。場合によっては、阻害は、1以上の特異的増幅シグナルを減少させ、アッセイ感度に対して悪影響を及ぼす可能性がある。本発明の方法および組成物のある実施形態は、意外にも、この種の阻害を劇的に改善することが見いだされた。これらの方法および組成物が、反応の特異性を損なったり、または非特異的増幅産物を導入したりすることなく、前記阻害を克服できることは、さらに予想外であった。
【0046】
本明細書中で用いられる場合、「含む」とは、記載される所定の特徴、整数、ステップ、または成分の存在を規定するが、1以上の特徴、整数、ステップ、もしくは成分、またはそれらの群の存在または付加を排除しないと解釈される。したがって、たとえば、所与の配列を含むプライマーは、所与の配列の5’末端もしくは3’末端の一方または両方でさらなる核酸を含み得る。さらに、「含む」という用語は、「本質的に〜からなる」および「〜からなる」という用語により含まれる実施形態を包含することが意図される。同様に、「本質的に〜からなる」という用語は、「〜からなる」という用語により含まれる実施形態を包含することが意図される。
【0047】
量、濃度、または他の値もしくはパラメータが好ましい上限値および好ましい下限値のリストのいずれかとして与えられる場合、これは、範囲が個別に開示されているかどうかに関係なく、任意の上限範囲または好ましい値および任意の下限範囲または好ましい値の任意の対から形成される全範囲を具体的に開示すると理解されるべきである。数値範囲が本明細書中で記載される場合、特に明記しない限り、範囲はそれらのエンドポイント、ならびにその範囲内のすべての整数及び分数を包含することが意図される。本発明の範囲は、範囲を規定する場合、記載される具体的な値に限定されることは意図されない。
【図面の簡単な説明】
【0048】
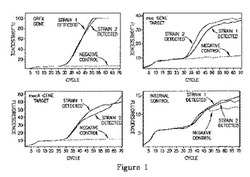
【図1】すべてのリボプライマーを利用し、細菌試料由来の精製されたDNAを標的とするPCR増幅。この図面や後に続くすべての図面では、水平軸はサイクル数を表し、垂直軸は適切な波長の蛍光レベルを表す。
【図2A】全ホットスタートプライマーを利用し、2つのバージョン:直接抽出された細菌(「直接試料」)および鼻腔用綿棒上にスパイクされた細菌の試料(「スパイクされた鼻試料」)でMRSA株#2から抽出されたDNAを標的とするPCR増幅。
【図2B】全ホットスタートプライマーを利用し、2つのバージョン:直接試料およびスパイクされた鼻試料でMRSA株#1から抽出されたDNAを標的とするPCR増幅。
【図3A】2つの別のプライマー混合物を利用する、スパイクされた鼻試料由来のMRSA株#3から抽出されたDNAを標的とするPCR増幅。混合物#1は、全ホットスタートプライマーを含み、そして混合物#2は、ホットスタートプライマー+非ホットスタートプライマー(3つの臨床的遺伝子標的アッセイについて10%のホットスタートプライマーモル濃度)と、ICについてはホットスタートプライマーのみのセットを含む。
【図3B】内部標準標的アッセイのホットスタートプライマーおよび3つの臨床的遺伝子標的アッセイについては10%の濃度のレギュラープライマーのみを含む第3の交互プリマ−混合物を利用するスパイクされた鼻試料から誘導されたMRSA株#3から抽出されたDNAを標的とするPCR増幅。
【図4A】MRSA株#3の直接試料およびスパイクされた鼻DNA試料を標的とし、OrfXおよび内部標準アッセイに関してはホットスタートプライマーのみ、そしてmecAおよびnucに関してはレギュラープライマーのみを含む、PCR増幅。
【図4B】全ホットスタートプライマーを利用し、MRSA株#3の直接試料およびスパイクされた鼻DNA試料を標的とするPCR増幅。
【図4C】AおよびBについて記載されたPCR混合物を用いるスパイクされた鼻試料の増幅を並べた図。
【図5】スパイクされた鼻試料由来の未精製MRSA株#3を標的とするPCR増幅。多重アッセイは、ICについてはホットスタートプライマーのみ、そしてorfX、nucおよびmecAのプライマーについては3つの異なるプライマー混合物を利用する。混合物#1:80%のホットスタートプライマーおよび20%のレギュラープライマー。混合物#2:レギュラープライマーのみ(混合物#1と同じ量)。混合物#3:100%のホットスタートプライマーおよび0%のレギュラープライマー。
【図6】図5について記載したのと類似しているが、nucおよびmecA遺伝子を標的とするアッセイ用のレギュラープライマーよびホットスタートプライマーの比が最適化されたPCR増幅。
【発明を実施するための形態】
【0049】
本発明は、特定のアンプリコンの同じ末端に対するホットスタートプライマーおよび非ホットスタートプライマーの混合物を含むPCR反応混合物、例えば多重PCR反応混合物;これを用いる方法;およびこれを含むキットを提供する。
【0050】
これを可能にする範囲で、本明細書中で言及されるすべての特許、特許出願、及び刊行物は、上記のもの及び下記のもののどちらも、参照することによって本明細書中に組み込まれる。
【0051】
一般的定義
「株」という用語は、本明細書中で用いられる場合、識別可能な差異により同じ種の他の細菌とは異なる細菌種のサブセットを指す。
【0052】
一実施形態では、本発明は:a)対象の種に特徴的な標的ポリヌクレオチド配列(本明細書中では、以下、「種特異的遺伝子」と呼ぶ)を増幅できる少なくとも1つの順方向プライマーおよび少なくとも1つ逆方向プライマーを含む、プライマーのセット;およびb)活性化酵素を含むPCR反応混合物を提供し、この場合、前記順方向プライマーおよび前記逆方向プライマーの少なくとも1つは、ホットスタートプライマーおよび非ホットスタートプライマーの混合物として提供される。典型的には、反応混合物は、DNAポリメラーゼ酵素、デオキシヌクレオシド三リン酸(dNTP)、及び二価カチオン(多くの場合、マグネシウムイオン)の1以上をさらに含む。ホットスタートプライマーは、反応混合物中に存在する活性化酵素の作用により逆転される不活性化化学修飾を含む。個々のホットスタートプライマー分子は、ホットスタートプライマーがプライマーに対して相補的な配列と高温でハイブリダイズする場合に、活性化酵素の基質になる。ある実施形態では、PCR反応混合物はリアルタイムPCRに好適なプローブをさらに含む。
【0053】
いくつかの実施形態では、ホットスタートプライマーおよび非ホットスタートプライマーは、ホットスタートプライマーの非ホットスタートプライマーに対する比が1:9〜19:1(両端を含む)で存在する。最適の好ましい比の決定は、種々の多重PCRアッセイによって変わり、1つには、プライマーの非特異的結合の可能性に依存するであろう。これは次に、アッセイのプライマーの一方または両方とそれら自身、または試料中に存在する他のオリゴヌクレオチド、および/または非標的核酸配列との間の相補性の程度に主に依存するであろう。高い非特異的相補性の存在下で、非ホットスタートプライマーの割合は、典型的には20%以下、言い換えれば、ホットスタート対非ホットスタートプライマーの比が4:1〜19:1(両端を含む)に限定される。
【0054】
プライマーハイブリダイゼーションが増幅の一端のみで問題となる他のある実施形態では、非ホットスタートプライマーおよびホットスタートプライマーの混合物を増幅の一端のみについて使用し、一方、増幅の他端はホットスタートプライマーのみにより支配される。経験的方法を用いて、順方向プライマー、逆方向プライマー、または両者を、ホットスタートプライマーおよび非ホットスタートプライマーの混合物の使用のために選択するかどうかを決定することができることは、当業者には理解されるであろう。
【0055】
別の実施形態において、本発明は、:(a)第1標的ポリヌクレオチド配列を増幅するためのプライマーの第1セット;(b)第2標的ポリヌクレオチド配列を増幅するためのプライマーの第2セット;および(c)活性化酵素を含む、多重PCRのためのPCR反応混合物を提供し、ここで:
(i)第1標的ポリヌクレオチド配列の少なくとも1つの末端にハイブリダイズするプライマーはホットスタートプライマーおよび非ホットスタートプライマーの混合物であり、この場合、非ホットスタートプライマーを用いて第1標的ポリヌクレオチド配列を増幅する反応の生成物は、ホットスタートプライマーを用いる増幅の基質であり;そして
(ii)プライマーの第2セットはホットスタートプライマーからなる。
【0056】
典型的には、反応混合物は、DNAポリメラーゼ酵素、デオキシヌクレオシド三リン酸(dNTP)、およびマグネシウム、マンガン、ニッケル、またはコバルトイオンから選択される二価カチオンの1以上をさらに含む。本明細書中で「非ホットスタートプライマーを用いて[標的ポリヌクレオチド配列]を増幅する反応の生成物」、または類似の言い回しについての言及が、順方向および逆方向非ホットスタートプライマー(それらが反応混合物中に存在するならば)を用いた増幅を指すことを当業者は容易に理解するであろう。非ホットスタートプライマーが増幅の一端でのみ存在するならば、非ホットスタートプライマーを逆の配向を有する供給されたホットスタートプライマーとの組みあわせで用いる増幅を意味する。同様に、「ホットスタートプライマーを用いる増幅」、または類似の言い回しは、順方向および逆方向ホットスタートプライマー(それらが反応混合物中に存在するならば)を用いる増幅を指す。ホットスタートプライマーが増幅の一端でのみ存在するならば、ホットスタートプライマーを、逆の配向を有する供給された非ホットスタートプライマーと組みあわせて使用する増幅を意図する。
【0057】
ある実施形態では、ホットスタートプライマーは不活性化化学修飾を含み、これは反応混合物中に存在する活性化酵素の作用により逆転される。個々のホットスタートプライマーは、プライマーに対して相補性である配列にホットスタートプライマーが高温でハイブリダイズする場合、活性化酵素の基質になる。典型的には、ホットスタートプライマーおよび非ホットスタートプライマーの混合物は、ホットスタートプライマー対非ホットスタートプライマーの比が1:9〜19:1(両端を含む)で存在する。
【0058】
ある実施形態では、PCR反応混合物はリアルタイムPCRに好適なプローブをさらに含む。
【0059】
上述のように、最適の好ましい比の決定は、異なる多重PCRアッセイについて様々であり、1つには、非特異的ハイブリダイゼーションをもたらし得る標的を含有する反応混合物中に存在する相補性の程度および増幅の阻害の程度に依存するであろう。増幅の2つの末端のうちの一端だけが伸長から阻害されるようであり、阻害アッセイのホットスタートプライマーに相補性である配列の存在が低いので、阻害アッセイのための非ホットスタートプライマーの使用することで非特異的増幅の存在が実質的に増加しないある実施形態では、その位置でのホットスタート−プライマーおよび非ホットスタートプライマーの混合物が最適には非ホットスタートプライマーの大部分を含むであろう。そのような場合でも、おそらく標的配列に対するハイブリダイゼーションについて非ホットスタートプライマーと競合することにより、ホットスタートプライマーは有利には非ホットスタートプライマーが関与する増幅を減速させることが本明細書中で示されている。
【0060】
本明細書中で提示する実験の前に、DNeasy(商標)Blood & Tissue Kit(QIAGEN GmbH)を用いて精製されたDNA試料に関してリボプライマーを用いる多重PCRの実施に成功した。これらのアッセイが、たとえば、広範の精製手順を用いることなく鼻腔用綿棒からの単離された核酸などの臨床設定でうまく機能するかどうかを判定することにした。このために、精製されたDNAをボランティアの鼻腔用綿棒上にスパイクした。本明細書中で以下に記載するように、リボプライマーを用いる多重PCRを阻害した鼻腔用綿棒中に生物学的因子が存在することが見いだされた。阻害は、DNAをさらに広範の精製に付すか、またはテンプレートの量を増やすか、または単一アッセイで個々にアッセイを実施するかのいずれかにより、克服することができる。これらの解決策のそれぞれは、実施不可能および/または臨床設定で不好適であり、この不備に対処するために本発明が開発された。
【0061】
本発明のいくつかの実施形態のキットは、広範の核酸精製を必要とすることなく、実在の試料とともにうまく用いることができ、それ自体が多くの実際的利点をもたらす。たとえば、実施例2で記載するように、Detect−Ready(商標)MRSA Lysis Kit(Molecular Detection, Inc.)を用いることができる。本発明のいくつかの実施形態がPCR増幅前の試料調製を簡素化できることは、したがって、時間やヘルスケア設備の出費を節約することができる。節約された時間は、ある実施形態では、タイムリーな臨床介入と患者を救うには遅すぎる臨床介入との間の差をも意味する。他の実施形態では、試料調製を簡素化することで、試料汚染の機会も減少する。
【0062】
本明細書中、実施例で提供するようにプライマー−標的ミスマッチを含む標的ポリヌクレオチド配列のホットスタートプライマーqPCR増幅は、明らかに弱い(実施例1)。この阻害は、広範の精製(実施例2)に付されていない臨床材料由来の核酸に対して実施された多重PCRにおいても観察することができる。「〜に由来する」とは、この文脈では、任意の形態の均質化、溶媒もしくは溶液中の溶解、分画、またはそれらの組みあわせを、単独またはPCR増幅に好適な試料を臨床材料から生成させることができる任意の他の適切な手段と組みあわせて包含することが意図される。本発明の方法および組成物のある実施形態は、意外にも、あるPCT反応においてリボプライマーで観察される阻害を劇的に改善することが見いだされた。
【0063】
いくつかの実施形態では、本発明の方法および組成物は、広範の精製に必ずしも付されてない臨床材料由来の核酸調製に用いられる。たとえば、非限定的実施形態において、本発明の方法および組成物は、2.0未満のA260/A280比を有する試料とともに使用するために好適である(A260/A280比は核酸調製の純度の尺度である)。別の実施形態において、本発明の方法および組成物は、1.9未満のA260/A280比を有する試料とともに使用するために好適である。別の実施形態において、本発明の方法および組成物は、1.8未満のA260/A280比を有する試料とともに使用するために好適である。別の実施形態において、本発明の方法および組成物は、1.7未満のA260/A280比を有する試料とともに使用するために好適である。別の実施形態において、本発明の方法および組成物は、1.0〜2.0のA260/A280比を有する試料とともに使用するために好適である。別の実施形態において、本発明の方法および組成物は、1.0〜1.9のA260/A280比を有する試料とともに使用するために好適である。別の実施形態において、本発明の方法および組成物は、1.0〜1.8のA260/A280比を有する試料とともに使用するために好適である。別の実施形態において、本発明の方法および組成物は、1.0〜1.7のA260/A280比を有する試料とともに使用するために好適である。それぞれの可能性は本発明の別の実施形態であると見なすことができる。
【0064】
臨床材料に関する多重PCRのさらなる潜在的な危険性を実施例4で示し、これは、ホットスタートプライマーのみを利用する増幅が、レギュラープライマーのみを利用する他の増幅の存在下で阻害される可能性が高いことを示す。同じ検体を用いて個々に実施する場合、増幅は阻害されなかった(データは不掲載)。特定の理論または作用機構により拘束されることを望まないが、この場合のホットスタート増幅の阻害は、反応管中のdNTPなどのリソースについての増幅間の競合によると考えられる。
【0065】
本明細書中でさらに提供されるように、1つの増幅のためのホットスタートプライマー
およびレギュラープライマーの混合物の使用は、レギュラープライマーおよびホットスタートプライマーが同じ標的配列を認識するか(実施例5〜6)またはレギュラープライマーがホットスタートプライマーの側面に位置するネスト化構造で設計されているか(実施例3)にかかわらず、多重qPCRにおいてリボプライマーを使用する限界を克服し、すべての標的の効率的な増幅を可能にする。さらに、本発明のいくつかの実施形態は、本発明者らが知っている従来技術の解決策に対して、臨床材料由来の未精製核酸から増幅することができるアンプリコンの数を増大させ、それによりコストを著しく低下させ、アッセイ速度を増大させる。
【0066】
特定の標的ポリヌクレオチド配列を増幅させるためのプライマーのセットを含む反応混合物もここでは提供され、この場合、標的配列の少なくとも1つの末端を増幅するためのプライマーは、10〜95%のホットスタートプライマーおよび5〜90%の非ホットスタートプライマーの混合物を含む。本明細書中で提供されるように、そのような反応混合物は、ホットスタートプライマー単独または非ホットスタートプライマー単独のいずれかを含む混合物よりも優れた特性を示す。
【0067】
たとえば、標的配列を増幅するための順方向プライマーセットは、ホットスタートプライマーおよび非ホットスタートプライマーの混合物から構成され得る。別の実施形態において、逆方向プライマーセットは、ホットスタートプライマーおよび非ホットスタートプライマーの混合物から構成される。他の実施形態では、順方向及び逆方向プライマーセットはどちらもホットスタートプライマーおよび非ホットスタートプライマーの混合物から構成される。それぞれの可能性は、本発明の別の実施形態であると見なすことができる。
【0068】
別の実施形態において、細菌性「架橋領域」の順方向プライマーについて本明細書中で例示されるように、配列変動は、複数の順方向プライマーおよび/または複数の逆方向プライマーを配列変異体の増幅のために必要とする可能性がある。この場合、ある実施形態では、交互プライマーの各プライマーセット(プライマーのセットは、この場合、特定の配列変異体を認識するプライマーを示すために用いられる)は、ホットスタートプライマーおよび非ホットスタートプライマーの所定の比での混合物である。ある他の実施形態では、交互プライマーのセットの1以上は、ホットスタートプライマーから構成され、一方、交互プライマーの他のセットは、ホットスタートプライマーおよび非ホットスタートプライマーの所定の比での混合物を含む。典型的には、ホットスタート:非ホットスタート混合物比は交互プライマーの各セットについて同じである。それぞれの可能性は、本発明の別の実施形態であると見なすことができる。
【0069】
本明細書中で提供されるように、非ホットスタートプライマーを使用する増幅産物が、ホットスタートプライマーを使用する増幅の基質である本発明の反応混合物は、特に有効である。ある実施形態では、本明細書中の実施例で示されるように、非ホットスタートプライマーの相補配列は、ホットスタートプライマーの相補配列の側面に位置する可能性がある(「ネスト化構造」)。他の実施形態では、非ホットスタートプライマーが1つの配向でのみ存在するならば、非ホットスタートプライマーは、対応するホットスタートプライマーの上流の配列を結合することができる。他の実施形態では、本明細書中の実施例で示されるように、非ホットスタートプライマーの相補配列は、ホットスタートプライマーの相補配列と重複し得るか、またはホットスタートプライマーの相補配列と同一であり得る。場合によっては、ホットスタートプライマーは、ホットスタート修飾以外は非ホットスタートプライマーと同一であり得る。たとえば、CGCATGACCCAAGGGCArAAGCG−■(配列番号5)は、配列CGCATGACCCAAGGGCAAAGCG(配列番号35)と、リボヌクレオシド残基(「リボ塩基」)およびブロッキング基が前者において存在する以外は同一である。他の実施形態では、ホットスタートプライマーは、非ホットスタートプライマーと、とりわけ配列対5と18および12と25によりそれぞれ本明細書中で例示されるように、ホットスタート修飾およびリボ塩基に対して3’側のさらなる相補配列以外は同一であり得る。本明細書中で提示される知見を考慮して、非ホットスタートプライマーの増幅産物がホットスタートプライマーを用いた増幅の基質であるとすると、本発明の方法及び組成物の有効性は、非ホットスタートプライマーおよびホットスタートプライマーの標的配列の正確な関係に依存しないことは、当業者には理解されるであろう。それぞれの可能性は本発明の別の実施形態であると見なすことができる。
【0070】
別の実施形態において、プライマーの第1セットに加えて、PCR反応混合物は、異なる標的ポリヌクレオチド配列を標的とするプライマーの第2セットを含む。第2標的ポリヌクレオチド配列は当該技術分野で公知の任意の標的配列であり得ることは当業者には明かであろう。
【0071】
いくつかの非限定的実施形態において、典型的には、これもまた1:9〜19:1のホットスタートプライマー対非ホットスタートプライマー比で存在する、異なるポリヌクレオチド配列に対する別のホットスタートプライマーおよび非ホットスタートプライマーの混合物を用いることができる。他の実施形態では、本明細書中で記載される他の比のいずれかを用いることができ、そのそれぞれは本発明の別の実施形態を構成する。本明細書中、実施例3および5で記載するように、ホットスタートプライマーのみであるプライマーセットを含み、ホットスタートプライマーおよび非ホットスタートプライマーの混合物である他のプライマーセットを含み、各プライマーセットが異なる核酸標的を標的とするプライマーセットを含む多重増幅反応は、ホットスタートプライマーPCRの阻害物質を含む可能性がある臨床材料中の抗生物質耐性病原体株を検出するアッセイにより例示されるように、臨床材料に関する多重PCRにおいて特に有効であることが示されている。
【0072】
たとえば、第2標的ポリヌクレオチド配列を増幅するための順方向プライマーは、ホットスタートプライマーおよび非ホットスタートプライマーの混合物から構成される可能性がある。別の実施形態において、逆方向プライマーは、ホットスタートプライマーおよび非ホットスタートプライマーの混合物から構成される。他の実施形態では、順方向プライマーおよび逆方向プライマーはどちらもホットスタートプライマーおよび非ホットスタートプライマーの混合物から構成される。それぞれの可能性は本発明の別の実施形態であると見なすことができる。
【0073】
別の実施形態において、プライマーの第1および第2セットに加えて、PCR反応混合物は異なる標的ポリヌクレオチド配列を標的とするプライマーの第3セットを含む。第3の標的ポリヌクレオチド配列が当該技術分野で公知の任意の標的配列であり得ることは、当業者には明かであろう。
【0074】
さらなる非限定的実施形態では、標的ポリヌクレオチド配列の少なくとも一端とハイブリダイズするプライマーの第3セット中のプライマーは、ホットスタートプライマーおよび非ホットスタートプライマーの混合物である。典型的には、この混合物もまた、1:9〜19:1(両端を含む)のホットスタートプライマー対非ホットスタートプライマーで存在する。他の実施形態では、本明細書中で記載する他の比のいずれかを用いることができ、そのそれぞれが本発明の別の実施形態を構成する。たとえば、順方向プライマーは、ホットスタートプライマーおよび非ホットスタートプライマーの混合物から構成され得る。別の実施形態において、逆方向プライマーは、ホットスタートプライマーおよび非ホットスタートプライマーの混合物から構成される。他の実施形態では、順方向プライマーおよび逆方向プライマーはどちらもホットスタートプライマーおよび非ホットスタートプライマーの混合物から構成される。それぞれの可能性は本発明の別の実施形態であると見なすことができる。
【0075】
本明細書中、実施例3および5で記載するように、多重qPCRにおいて3つの異なる標的ポリヌクレオチド配列(アンプリコン)を標的とするホットスタートプライマーおよび非ホットスタートプライマーの混合物を、第4のアンプリコン標的とするホットスタートプライマーのみとともに含む多重増幅反応は、ある増幅反応がミスマッチおよび/またはあるハイブリダイゼーションを阻害する可能性がある試料中の物質に対して感受性である多重PCRにおいて効率的に機能した。
【0076】
さらなる非限定的実施形態では、本発明のPCR反応混合物または方法は、3つのプライマーセットを含み、それぞれは異なるアンプリコンを増幅することができる。別の実施形態において、本発明のPCR反応混合物または方法は4つのプライマーセットを含み、それぞれは異なるアンプリコンを増幅することができる。更に別の非限定的実施形態において、本発明のPCR反応混合物または方法は5つのプライマーセットを含み、それぞれは異なるアンプリコンを増幅することができる。本発明のさらに別の実施形態では、本発明のPCR反応混合物または方法は6つのプライマーセットを含み、それぞれは異なるアンプリコンを増幅することができる。本発明のさらに別の実施形態では、本発明のPCR反応混合物または方法は6以上のプライマーセットを含み、それぞれは異なるアンプリコンを増幅することができる。本発明のさらに別の実施形態では、本発明のPCR反応混合物または方法は6〜500(両端を含む)のプライマーセットを含み、それぞれは異なるアンプリコンを増幅することができる。実施例1〜6は4つのプライマーセットを含むPCR混合物を提示し、それぞれは異なるDNA標的を増幅することができる。当業者には知られているように、Rotor−Gene(登録商標)Q(Qiagen)およびLightCycler(登録商標)(Roche Molecular Detection)などの装置は、6セットまでのプライマーを含む多重PCR反応の実施を可能にし、FLEXMAP 3D(商標)(Luminex Corporation)は500までの異なるPCRプライマーセットを用いる多重PCRを可能にする。
【0077】
本発明の方法および組成物は、典型的には1:9〜19:1(両端を含む)のホットスタートプライマー対非ホットスタートプライマー比で存在する、特定のポリヌクレオチド配列に対するホットスタートプライマーおよび非ホットスタートプライマーの1以上の混合物を含むことを記載した。さらに具体的な実施形態では、ホットスタートプライマーおよび非ホットスタートプライマーの各混合物(言い換えれば、特定のアンプリコンの各末端に対する混合物)は1:5および19:1(両端を含む)のホットスタートプライマー対非ホットスタートプライマー比で存在する。他の実施形態では、ホットスタートプライマーおよび非ホットスタートプライマーの各混合物は、1:4〜14:1(両端を含む)のホットスタートプライマー対非ホットスタートプライマー比で存在する。他の実施形態では、ホットスタートプライマーおよび非ホットスタートプライマーの各混合物は、1:3〜14:1(両端を含む)のホットスタートプライマー対非ホットスタートプライマー比で存在する。他の実施形態では、ホットスタートプライマーおよび非ホットスタートプライマーの各混合物は1:2〜14:1(両端を含む)のホットスタートプライマー対非ホットスタートプライマー比で存在する。他の実施形態では、ホットスタートプライマーおよび非ホットスタートプライマーの各混合物は1:1〜14:1(両端を含む)のホットスタートプライマー対非ホットスタートプライマー比で存在する。他の実施形態では、ホットスタートプライマーおよび非ホットスタートプライマーの各混合物は1:1〜9:1(両端を含む)のホットスタートプライマー対非ホットスタートプライマー比で存在する。他の実施形態では、ホットスタートプライマーおよび非ホットスタートプライマーの各混合物は2:1〜14:1(両端を含む)のホットスタートプライマー対非ホットスタートプライマー比で存在する。他の実施形態では、ホットスタートプライマーおよび非ホットスタートプライマーの各混合物は2:1〜9:1(両端を含む)のホットスタートプライマー対非ホットスタートプライマー比で存在する。他の実施形態では、ホットスタートプライマーおよび非ホットスタートプライマーの各混合物は3:1〜9:1(両端を含む)のホットスタートプライマー対非ホットスタートプライマー比で存在する。他の実施形態では、ホットスタートプライマーおよび非ホットスタートプライマーの各混合物は4:1〜9:1(両端を含む)のホットスタートプライマー対非ホットスタートプライマー比で存在する。それぞれの可能性は本発明の別の実施形態であると見なすことができる。
【0078】
いくつかの実施形態では、本発明の方法および組成物において用いられる二価カチオンは、反応混合物の他の成分と別々に貯蔵及び/または提供され、テンプレートが添加される後まで保留され得る。他の実施形態では、二価カチオンは反応混合物の他の成分とともに提供される。
【0079】
qPCRおよび他のサイクル閾値増幅反応アッセイ
本明細書中で提供する開示を考慮して、本発明の方法は、定量的(「リアルタイム」)または非定量的のいずれであっても、任意の種類のPCR反応に好適であることは当業者には理解されるであろう。ある実施形態では、本発明の方法は、リアルタイムPCRがその非限定的実施形態として提供される、閾値増幅反応に特に好適である。「閾値増幅反応」とは、閾値レベルより高い特定の標的配列の増幅が達成されるサイクル数などの閾値を決定する核酸増幅反応を指す。非限定的な一実施形態では、蛍光標識されたプローブを用いて増幅をモニタリングする。別の実施形態において、増幅をモニタリングするための当該技術分野で公知の任意の他の手段、たとえば二本鎖DNA結合色素、たとえばSYBR Greenが用いられる。それぞれの可能性は本発明の別の実施形態であると見なすことができる。
【0080】
試験試料中の対象の配列を検出するためのqPCRベースのアッセイ
qPCRは、当該技術分野で周知である。qPCR反応混合物は、典型的には、4つの天然に存在するデオキシヌクレオシド三リン酸(dNTP);二価カチオン、およびポリメラーゼ酵素を含む。最も多くの場合、二価カチオンはマグネシウムイオンである。ある実施形態では、好熱性DNAポリメラーゼ酵素が用いられる。qPCRは、ヒト動物標的核酸配列ならびに種々の用途で病原体について特異的な配列を検出するために用いられてきた。
【0081】
標的ポリヌクレオチド配列の例示的な一種は、典型的には臨床材料中で分析される、対象の病原体に特徴的なポリヌクレオチド配列である。病原体一般および特に抗生物質耐性病原体の両方を検出するためのqPCRベースのアッセイの使用は当該技術分野で周知であり、たとえば、US6664080(Klaus Pfeffer、標題“TaqMan(商標)−PCR for the detection of pathogenic E. coli strains”);米国特許出願第2009/0081663(Yosef Paitan、標題“Methods, Compositions and Kits for Detection and Analysis of Antibiotic−Resistant Bacteria”);US6329138(Hans De Beenhouwer et al、標題“Method for detection of the aantibiotic resistance spectrum of mycobacterium species”);US7045291(Nancy Hansonら、標題“Multiplex PCR for the detection of AmpC beta−lactamase genes”;US5994066および6001564(Bergeronら、クレイトン大学に譲渡);ならびに国際特許出願第WO/1996/008582号および米国特許出願第2004/0185478号(それぞれBergeronら)で記載されている。これらの特許および出願のそれぞれは、参照することによって本明細書中に組み込まれる。
【0082】
別の具体的な用途は、たとえばヒトの同一性を究明するために用いることができるDNAマーカーなどの法医学試料中の標的ポリヌクレオチド配列を検出するためのqPCRベースのアッセイの使用である。そのような方法は、当該技術分野で周知であり、とりわけ、US6673541および5861504ならびに米国特許出願第2009/0023603号、第2006/0099620号、および第2008/0286773号(参照することによって本明細書中に組み込まれる)で記載されている。多くの場合、複数の増幅反応を平行して実施して、非常に限られた利用可能なDNA試料を最大限に利用する。
【0083】
別の具体的な用途は、qPCRにより、たとえば、BRCA1およびBRCA2などの疾患および罹病性のヌクレオチドマーカーなどの標的ポリヌクレオチド配列を検出するためのqPCRベースのアッセイの使用である。そのような方法は、当該技術分野で周知であり、とりわけ、US7507800および6083698ならびに米国特許出願第20050095592号(参照することによって本明細書中に組み込まれる)で記載されている。
【0084】
水和低減PCR反応混合物
本明細書中で提供する開示を考慮して、当業者は、本発明の組成物および方法が、たとえばこれらに限定されるものではないが水和低減PCR反応混合物などの通常および貯蔵安定化されたPCR反応混合物の両方と適合性であることを理解するであろう。本明細書中の実施例で使用される反応混合物を、処理して、水和を低減し、そして使用するまで室温で貯蔵した。しかし、同じでなくても非常によく似た結果を、通常のPCR反応混合物で得ることができる。したがって、一実施形態では、本発明のPCR反応混合物は水和低減PCR反応混合物である。別の実施形態において、それらは通常の反応混合物である。別の実施形態において、それらは当該技術分野で公知の任意の種類の反応混合物である。それぞれの可能性は本発明の別の実施形態であると見なすことができる。
【0085】
周囲温度安定化された水和低減PCR反応混合物は、係属中の米国特許出願第2008/0050737号でさらに記載されている。そのような混合物は、DNAポリメラーゼおよび/またはdNTPを含み、少なくとも1つ安定剤を含む緩衝液化合物も含む溶液を水和低減することにより調製され、25℃〜100℃の温度、典型的には約55℃で貯蔵される。安定剤(複数可)は、とりわけ、糖およびタンパク質、たとえばスクロースおよび/またはBSAであり得る。典型的には、1〜20%のスクロースおよび0.5〜3mg/mlのBSAが含まれる。別の実施形態において、当該技術分野で公知の、任意の他の種類の水和低減PCR混合物が利用される。別の実施形態において、当該技術分野で公知の任意の他の種類の周囲温度安定化PCR混合物が利用される。それぞれの可能性は、本発明の別の実施形態と見なすことができる。
【0086】
プライマー
「プライマー」という用語は、本明細書中で用いられる場合、天然または合成のいずれかのオリゴヌクレオチド、すなわち、ポリヌクレオチドテンプレートと二本鎖を形成する際に、核酸合成の開始点として作用することができ、一端からテンプレートに沿って伸び、したがって伸長された二本鎖(二重鎖)が形成されるものを指す。一実施形態では、ポリヌクレオチドテンプレートはDNA分子である。一実施形態では、ポリヌクレオチドテンプレートはRNA分子である。本発明のプライマーは、検出可能に標識してもよいし、または標識しなくてもよい。プライマーは、ホットスタートプライマーまたはレギュラープライマーであり得る。ホットスタートプライマーは本明細書中で後述する。「レギュラープライマー」および「非ホットスタートプライマー」という用語は、本明細書中で定義されるようなホットスタートプライマーでないプライマーを指す。特定の標的配列「についての」、特定の標的配列「に対する」、または特定の標的配列「を増幅することができる」として記載されるプライマーは、標的配列の末端に対して相補性であり、3’末端は内側に向き、したがって標的配列をPCR反応で増幅させることができる。
【0087】
「ヌクレオチド」、「ヌクレオシド」、「ヌクレオチド残基」、および「ヌクレオシド残基」という用語は、本明細書中で用いられる場合、デオキシリボヌクレオチドもしくはリボヌクレオチド残基、またはPCR反応での使用に好適なプライマーの成分としての働きをすることができる他の類似のヌクレオシド類似体を指す。そのようなヌクレオシドおよびその誘導体は、別の表示がされる場合を除いて、本明細書中で記載されるプライマーのビルディングブロックとして用いられる。本出願では、PCR反応におけるそれらの安定性または有用性を増強するために化学修飾されたヌクレオシド誘導体または塩基の利用を排除することを意味しない。ただし、化学修飾は、必要に応じて、デオキシグアニン、デオキシシトシン、デオキシチミジン、またはデオキシアデニンとしてのDNAポリメラーゼによるそれらの認識を妨害しないものとする。
【0088】
ある実施形態では、本発明の方法および組成物で使用することができるヌクレオチド類似体には、2’−O−メチル、2’−O−アリル、2’−デオキシ−2’−フルオロ、および2’,3’−ジデオキシヌクレオシド誘導体、たとえばトレオース、ロックされた核酸誘導体、二環式糖、またはヘキソース、グリセロールおよびグリコール糖などの他の糖主鎖に基づく核酸類似体、非イオン性主鎖に基づく核酸類似体、たとえばペプチド核酸、たとえばデンドリマー、櫛構造、およびナノ構造などの非線形トポロジーのこれらの核酸およびそれらの類似体、ならびにそれらの末端、糖、または核酸塩基に結合したタグ(たとえば、蛍光、官能化、または結合)を有するこれらの核酸およびそれらの類似体においてと同様に、糖が修飾された誘導体が含まれる。
【0089】
本発明の方法および組成物での使用に好適な非古典的ヌクレオチド類似体の非限定的な一例は、ロックされた核酸(LNA)ヌクレオチド類似体である。LNAヌクレオチド類似体のある実施形態は、1以上の2’−O、4’−Cメチレン結合を含む二環式核酸類似体であり、これは、C3’−エンドコンフォメーションでフラノース環を有効にロックする。このメチレン結合「ブリッジ」は、リボフラノース環の柔軟性を制限し、構造をロックして硬質の二環式フォーメーションにする。その独自の構造的コンフォメーションのために、LNAヌクレオチド類似体を含むオリゴヌクレオチドは、天然のDNAカウンターパートよりも、それらの相補性核酸に対してはるかに高い親和性および特異性を示す。LNAは、典型的には、低い塩濃度などの悪条件下でも相補性核酸とハイブリダイズする。LNAヌクレオチド類似体は市販されており、とりわけ、米国特許第6,130,038号、第6,268,490号、および第6,670,461号で記載されている。
【0090】
本発明の方法および組成物での使用に好適な非古典的ヌクレオチド類似体の別の非限定的例は、ペプチド核酸(PNA)ヌクレオチド類似体である。PNAヌクレオチド類似体のある実施形態では、DNAの負に荷電した糖−リン酸主鎖が、N−(2−アミノエチル)グリシン単位から構成される中性のポリアミド主鎖により置換されている(下図参照、図中、Bはヌクレオシド塩基を表す)。PNAの化学構造は、典型的には、ヌクレオチド塩基が天然のDNAとほぼ同じ場所に位置することを可能にし、PNAを相補性DNAまたはRNA配列とハイブリダイズさせる。PNAヌクレオチド類似体は、市販されており、とりわけ、第WO92/20702号、第WO92/20703号および第WO93/12129号の公開番号を有するPCT出願に記載されている。
【化3】

【0091】
本発明の方法および組成物での使用に好適な非古典的ヌクレオチド類似体の別の非限定的例は、グリコール核酸(GNA)ヌクレオチド類似体である(Zhang, L et al (2005) A simple glycol nucleic acid. J. Am. Chem. Soc. 127:4174−4175)。GNAヌクレオチド類似体のある実施形態は、非環式プロピレングリコールホスホジエステル主鎖を有し、そして下記構造のうちの1つ(図中、Bはヌクレオシド塩基を表す)を有する:
【化4】

【0092】
本発明の方法および組成物における使用に好適な非古典的ヌクレオチド類似体の別の非限定的例は、トレオース核酸(TNA)ヌクレオチド類似体である(Wu et al, Organic Letters, 2002, 4(8):1279−1282)。TNAヌクレオチド類似体のある実施形態は、下記構造(図中、Bはヌクレオシド塩基を表す)を有する:
【化5】

【0093】
本発明の方法および組成物における使用に好適な非古典的ヌクレオチド類似体の別の非限定的例は、二環式および三環式ヌクレオシド類似体である(Steffens et al, Helv Chim Acta (1997) 80:2426−2439;Steffens et al, J Am Chem Soc (1999) 121: 3249−3255;Renneberg et al, J Am Chem Soc (2002) 124: 5993−6002;およびRenneberg et al, Nucl Acids Res (2002) 30: 2751−2757)。
【0094】
本発明の方法および組成物における使用に好適な非古典的ヌクレオチド類似体の別の非限定的例は、リン基を主鎖中に組み入れるホスホノモノエステル(phosphonomonoester)核酸、例えば、ホスホノアセテートおよびチオホスホノアセテートヌクレオシド間結合を有する類似体である(米国特許出願第2005/0106598;Sheehan et al, Nucleic Acids Res (2003);31(14):4109−18)。他の実施形態では、シクロブチル環は、天然に存在するフラノシル環を置換する。
【0095】
本発明の方法および組成物における使用に好適な非古典的ヌクレオチド類似体の他の実施形態では、塩基が修飾されている。修飾された核酸塩基の代表的な非限定的リストには、5−メチルシトシン(5-me−C)、5−ヒドロキシメチルシトシン、キサンチン、ヒポキサンチン、2−アミノアデニン、アデニンおよびグアニンの6−メチルおよび他のアルキル誘導体、アデニンおよびグアニンの2−プロピルおよび他のアルキル誘導体、2−チオウラシル、2−チオチミンおよび2−チオシトシン、5−ハロウラシルおよびシトシン、5−プロピニル(−C=C−CH3)ウラシルおよびシトシンならびにピリミジン塩基の他のアルキニル誘導体、6−アザウラシル、シトシンおよびチミン、5−ウラシル(シュードウラシル)、4−チオウラシル、8−ハロ、8−アミノ、8−チオール、8−チオアルキル、8−ヒドロキシルならびに他の8−置換アデニンおよびグアニン、5−ハロ、特に5−ブロモ、5−トリフルオロメチルおよび他の5−置換ウラシルおよびシトシン、7−メチルグアニンおよび7−メチルアデニン、2−F−アデニン、2−アミノ−アデニン、8−アザグアニンおよび8−アザアデニン、7−デアザグアニンおよび7−デアザアデニンならびに3−デアザグアニンおよび3−デアザアデニンが挙げられる。さらなる修飾核酸塩基としては、三環式ピリミジン、例えばフェノキサジンシチジン(1H−ピリミド(5,4−b)(1,4)ベンゾキサジン−2(3H)−オン)、フェノチアジンシチジン(1H−ピリミド(5,4−b)(1,4)ベンゾチアジン−2(3H)−オン)、G−クランプ、例えば置換フェノキサジンシチジン(たとえば、9−(2−アミノエトキシ)−H−ピリミド(5,4−b)(1,4)ベンゾキサジン−2(3H)−オン)、カルバゾールシチジン(2H−ピリミド(4,5−b)インドール−2−オン)、およびピリドインドールシチジン(H−ピリド(3’,2’:4,5)ピロロ(2,3−d)ピリミジン−2−オン)が挙げられる。修飾核酸塩基には、プリンまたはピリミジン塩基が他のヘテロ環で置換されたもの、例えば7−デアザ−アデニン、7−デアザグアノシン、2−アミノピリジンおよび2−ピリドンも含まれ得る。さらなる核酸塩基としては、米国特許第3,687,808号で開示されているもの;The Concise Encyclopedia Of Polymer Science And Engineering, pages 858−859, Kroschwitz, J. I., ed. John Wiley & Sons, 1990で開示されているもの;Englisch et al., Angewandte Chemie, International Edition, 1991, 30, 613により開示されているもの;およびSanghvi, Y. S., Chapter 15, Antisense Research and Applications, pages 289−302, Crooke, S. T. and Lebleu, B., ed., CRC Press, 1993により開示されているものが挙げられる。これらの核酸塩基のうちのいくつかは、本発明の化合物の結合親和性を増大させるのに好適であるとして当業者に知られている。これらには、5−置換ピリミジン、6−アザピリミジンならびにN−2、N−6およびO−6置換プリン、たとえば2−アミノプロピルアデニン、5−プロピニルウラシルおよび5−プロピニルシトシンが含まれる。修飾された核酸塩基およびそれらの使用は、とりわけ、米国特許US3,687,808、US4,845,205;US5,130,302;US5,134,066;US5,175,273;US5,367,066;US5,432,272;US5,457,187;US5,459,255;US5,484,908;US5,502,177;US5,525,711;US5,552,540;US5,587,469;US5,594,121、US5,596,091;US5,614,617;US5,645,985;US5,830,653;US5,763,588;US6,005,096;US5,681,941;およびUS5,750,692に記載されている。
【0096】
本発明の方法および組成物における使用に好適な非古典的ヌクレオチド類似体の別の非限定的例は、天然に存在する複素環式塩基部分の1以上の代わりに多環式複素環式化合物である。多くの三環式複素環式化合物は以前に報告されている。これらの化合物は、アンチセンス適用において、標的鎖に対する修飾鎖の結合特性を増大させるために慣例的に用いられる。最も研究されている修飾は、グアノシンを標的とし、したがって、G−クランプまたはシチジン類似体と呼ばれる。第2の鎖中のグアノシンと3つの水素結合を形成する代表的なシトシン類似体としては、1,3−ジアザフェノキサジン−2−オン(Kurchavov, et al., Nucleosides and Nucleotides, 1997, 16, 1837−1846)、1,3−ジアザフェノチアジン−2−オン、(Lin, K.−Y.;Jones, R. J.;Matteucci, M. J. Am. Chem. Soc. 1995, 117, 3873−3874)および6,7,8,9−テトラフルオロ−1,3−ジアザフェノキサジン−2−オン(Wang, J.;Lin, K.−Y., Matteucci, M. Tetrahedron Lett. 1998, 39, 8385−8388)が挙げられる。オリゴヌクレオチド中に組み入れられると、これらの塩基修飾は相補性グアニンとハイブリダイズすることが示され、後者はさらに、アデニンとハイブリダイズし、拡張されたスタッキング相互作用により螺旋熱安定性を増強することが示された(米国特許付与前公開第2003/0207804号および第2003/0175906号も参照)。
【0097】
別の実施形態において、本発明の方法および組成物において用いられるプライマーは、1以上のユニバーサルヌクレオシドを含み得る。ユニバーサルヌクレオシドの非限定的例は、とりわけUS2009/0325169および2010/0167353で記載されているような5−ニトロインドールおよびイノシンである。
【0098】
ホットスタートプライマー
「ホットスタートプライマー」という用語は、本明細書中で用いられる場合、高温にさらされるまでは、不活性であるか、または低い活性を有するプライマーを指す。これらに限定されるものではないが、プライマーの3’末端で修飾ヌクレオチドを含むプライマー(例えば、米国特許第6,482,590号を参照)、ステムループまたはヘアピン構造を有するプライマー(例えば、米国特許出願第2007/0128621号を参照)、プライマーの3’末端で熱により除去可能な化学修飾を含むプライマー(例えば、米国特許出願第2007/0281308号を参照)、ブロッキングオリゴヌクレオチドに結合したプライマー(例えば、米国特許第5,712,386号を参照)、およびリボプライマー(例えば、米国特許出願第2009/0325169号および第2010/0167353号を参照)をはじめとする多種のホットスタートプライマーが当該技術分野では存在し、当業者には周知である。ホットスタートプライマーのサブセットは、多サイクル増幅の過程全体にわたって伸長可能なプライマーを徐々に生成するプライマーである。これらの種類のプライマーは、変性ステップ中に多量の伸長可能なプライマーを生成するある種のホットスタートプライマーとは対照的に、すべてのサイクルで増大した反応特異性を付与する。
【0099】
ある他の実施形態では、本発明で有用なホットスタートプライマーは、高温である際に相補配列にハイブリダイズする場合だけ、伸長可能なプライマーを生成するような修飾を含むものである。本明細書中で「リボプライマー」と総称されるこの種のホットスタートプライマーの1つの例示的非限定的サブクラスは、それらがDNAポリメラーゼのプライマーとしての働きをすることができないように可逆的に化学修飾されているものである。リボプライマーはまた、DNA標的配列とハイブリダイズする場合、本明細書中で例示されるように、結果として化学修飾の除去をもたらす、RNaseH2エンドヌクレアーゼなどのエンドヌクレアーゼによる切断の基質である。ある実施形態では、そのような修飾されたプライマーは、RNA部分を含み得、これはRNase H切断部位としての働きをする。リボプライマーの種々の実施形態を本明細書中、以下でさらに記載する。
【0100】
リボプライマーのブロッキング修飾(あるいは本明細書中では「不活性化化学修飾」とも称する)は、好ましくはRNaseH2エンドヌクレアーゼの切断部位の3’側(下流)に位置する。更に好ましくは、ブロッキング修飾はリボプライマーの3’末端に位置する。ある実施形態では、ブロッキング修飾は、本発明のオリゴヌクレオチドの3’末端から約10残基までに位置する可能性があり、続いて標的に対してほぼ非相補性でもなく完全に非相補性でもないヌクレオチド配列がある。いずれの場合も、本明細書中で定義される「リボプライマー」は、伸長のためのプライマーとしてのその適合性を排除し、エンドヌクレアーゼ(本明細書中では「活性化酵素」とも称する)の作用により逆転される修飾を含む。典型的には、逆転は、修飾の物理的除去を含む。
【0101】
他の実施形態では、「リボプライマー」という用語は、以下の修飾を含む、標準的DNAオリゴヌクレオチドプライマーの変異体を指す:少なくとも1つのRNA残基が標準的DNAオリゴヌクレオチドプライマーの3’末端で付加され、続いて少なくとも3つのさらなるDNA残基およびブロッキング基が付加される。リボプライマーのRNAおよびDNA残基によって形成されるプライマー配列は、標的DNAの配列と部分的または完全な相補性を示す。DNA標的に結合したリボプライマー内の1つのRNA残基は、典型的には、ヘテロ二重鎖をRNaseH2によるエンドヌクレアーゼ切断の基質にするために十分であり、切断はRNA残基のすぐ5’側で起こり、RNA残基自体、ならびにRNA残基に対して3’側のすべての残基および修飾を除去する。第1のRNA残基に対して3’側に位置する1以上のさらなる相補性RNA残基がリボプライマー内に存在することは、プライマーがRNaseH2によるエンドヌクレアーゼ切断の基質としての働きをする能力に、典型的には悪影響を及ぼさないことを、当業者は理解するであろう。
【0102】
別の実施形態において、本発明の方法または組成物で用いられるリボプライマーは、その内部位置で1つの2’−フルオロ−修飾残基を含む。RNase H2による切断は、典型的には、2’−フルオロ−修飾残基の5’側で起こる。別の実施形態において、リボプライマーは、2つの隣接する2’−フルオロ−修飾残基を含むRNase H2切断ドメインを含む。この実施形態では、切断は主に2’−フルオロ−修飾残基間で起こる。一実施形態では、1以上の2’−フルオロ−修飾残基はDNA残基である。別の実施形態において、1以上の2’−フルオロ−修飾残基はRNA残基である。それぞれの可能性は、本発明の別の実施形態である。
【0103】
これらに限定されるものではないが、2’−O−アルキル−修飾残基、好ましくは2’−O−メチル−修飾残基、ロックされた核酸(LNA)、2’−ENA残基(エチレン核酸)、2’−アルキル−修飾残基、2’−アミノ−修飾残基、および2’−チオ−修飾残基をはじめとする他の種類の修飾残基もリボプライマー中に存在する可能性がある。ある実施形態では、これらの修飾は、RNA残基のすぐ隣、またはそれからさらに離れた位置のいずれかの意図される酵素切断部位でRNA残基以外の残基に対してなすことができる。他の実施形態では、これらの修飾残基を、意図される酵素切断部位でRNA残基の代わりに導入することができる。1以上の具体的な実施形態では、2’−フルオロ−修飾RNA残基を2’LNA−修飾RNA残基と組み合わせて用いる。
【0104】
さらに具体的な実施形態では、RNA残基の2’−ヒドロキシ基は、前記の別の官能基のうちの1つと置換されている。他の実施形態では、意図されるRNase HのRNA残基に対してすぐ3’側のリン酸基を、ヌクレアーゼ耐性結合で置換して、RNase H酵素による異常な切断を防止する。他の実施形態では、オリゴヌクレオチドを、RNA残基の3’−リン酸基からさらに下流またはRNA残基の5’側のヌクレアーゼ耐性結合または残基で修飾する。ある実施形態では、使用されるヌクレアーゼ耐性結合は、ホスホロチオエート、ホスホロジチオエート、メチルホスホネート、またはボロネート結合から選択される。別の実施形態において、C3スペーサーなどの脱塩基残基をRNA残基に対してすぐ3’側に挿入して、異常な切断を防止する。あるいは、隣接する残基の5’炭素上の水素原子の一方または両方をメチル基などのさらに嵩高い置換基で置換して、リボヌクレオチド残基のバックグラウンド切断を阻害することができる。これらの種々の修飾の組み合わせも用いることができる。前記修飾は、当該技術分野で周知である。典型的には、そのような修飾は、AS−PCR(本明細書中で後述する)などのミスマッチ識別に使用されるPCR反応に最も有用である。
【0105】
ある実施形態では、Mn2+、Ni2+又はCo2+(Mg2+の有無を問わない)などの別の二価カチオンを、リボプライマーとともに使用されるアッセイ緩衝液中に組み入れる。本発明のある実施形態では、そのような別の二価カチオンが存在する場合、RNase H2による増強された切断が達成される。1以上の具体的な実施形態では、Mg2+と組み合わされたMn2+を、2つの隣接した2’−フルオロ−修飾残基を含むリボプライマーとともに使用することが意図される緩衝液中に含める。
【0106】
本明細書中で記載する実施形態をはじめとするリボプライマーの種々の実施形態は、米国特許出願公開第20090325169号及び第20100167353号で記載されている。
【0107】
リボヌクレオチドまたは他の修飾残基の位置は、リボプライマーがRNase H2の基質としての働きをする能力に影響を及ぼす。好ましくは、本発明の方法および組成物で用いられるリボプライマーのリボヌクレオチドまたは他の修飾残基は、その3’側で合計約1〜10個のDNA残基の側面に位置する。他の実施形態では、合計約3〜6個のDNA残基がその3’側でリボヌクレオチドまたは他の修飾残基の側面に位置する。他の実施形態では、合計約2〜5個のDNA残基がその3’側でリボヌクレオチドまたは他の修飾残基の側面に位置する。他の実施形態では、合計約3〜5個のDNA残基がその3’側でリボヌクレオチドまたは他の修飾残基の側面に位置する。他の実施形態では、合計約4〜5個のDNA残基がその3’側でリボヌクレオチドまたは他の修飾残基の側面に位置する。他の実施形態では、標的配列に対して相補性である約4〜5個のDNA残基がその3’側でリボヌクレオチドまたは他の修飾残基のすぐ隣に位置する。場合によって、標的配列に対して相補性でない1以上のさらなるDNA残基が、これらの4〜5個の相補性DNA残基に対して3’側に存在する可能性がある。
【0108】
他の実施形態では、標的配列に対して相補性である少なくとも8個のデオキシリボヌクレオチドがその5’側でリボヌクレオチドまたは他の修飾残基の側面に位置する。別の実施形態において、標的配列に対して相補性である少なくとも10個のDNA残基がその5’側でリボヌクレオチドまたは他の修飾残基の側面に位置する。他の実施形態では、標的配列に対して相補性である少なくとも12個のDNA残基がその5’側でリボヌクレオチドまたは他の修飾残基の側面に位置する。他の実施形態では、標的配列に対して相補性である8〜50個のDNA残基がその5’側で修飾残基の側面に位置する。別の実施形態において、標的配列に対して相補性である10〜50個のDNA残基がその5’側で修飾残基の側面に位置する。別の実施形態において、標的配列に対して相補性である12〜50個のDNA残基がその5’側で修飾残基の側面に位置する。場合によって、標的配列に対して相補性でない1以上のさらなるDNA残基が修飾残基の5’側に位置するこれらの相補性DNA残基の5’側に存在する可能性がある。
【0109】
前述の様に、ある実施形態では、本発明のホットスタートプライマーは、RNase Hなどのヌクレアーゼ酵素により切断されるまで、DNAポリメラーゼのプライマーとしての働きをするそれらの適合性を排除する可逆的化学修飾、例えば3’ブロッキング基を含む。ある実施形態では、ヌクレアーゼは、活性化されるようになるために、高温で切断部位の近くで正しい塩基対形成を必要とする。この文脈で「高温」という用語は、種々の実施形態で、50℃超、60℃超、70℃超、または80℃超の温度を指す。他の好ましい実施形態では、ヌクレアーゼは50〜80℃の温度で活性を示し、25℃では感知され得る活性を示さない。他の好ましい実施形態では、ヌクレアーゼは反応のアニーリング温度の活性を示し、25℃では感知され得る活性を示さない。ある他の好ましい実施形態では、ヌクレアーゼは熱安定性であり、95℃の温度で30分のインキュベーション後に活性を保持する。それぞれの可能性は本発明の別の実施形態であると見なすことができる。
【0110】
ブロッキング修飾
本明細書中で例示されるC3スペーサーは、切断前のプライマー伸長を防止し、これにより非特異的プライマー伸長を減少させる。当業者は、本明細書中で提供される開示を考慮して、C3スペーサーは単にブロッキング部分の典型例であり、種々の別のスペーサー修飾およびIntegrated DNA Technologies, Inc.(アイオワ州コーラルビル)やEurogentec North America Inc.(カリフォルニア州サンディエゴ)などの特別に合成されるオリゴヌクレオチドの商業的供給業者から容易に入手可能な他の一般的なオリゴヌクレオチド修飾は、DNAポリメラーゼによるプライマーの3’伸長をブロックすることができ、C3スペーサーの代わりにまたはC3スペーサーに加えて使用できることを認識するであろう。そのような別のブロッキング修飾としては、これらに限定されるものではないが、ヘキサンジオール、スペーサー9、スペーサー18、2’,3’−ジデオキシ−C、ジデオキシ−A、ジデオキシ−G、ジデオキシ−T、3’デオキシリボヌクレオチド残基(例えば、デオキシリボ−C、A、G、もしくはT、またはコルジセピン)、非ヌクレオチド結合、アルカン−ジオール修飾(とりわけ、米国特許第5,554,516号で記載のとおり)、3’ヒドロキシル置換(例えば、3−ヒドロキシプロピルなどのアルコールとの3’−ホスフェート、3’−トリホスフェートまたは3’−ホスフェートジエステル)、2’3’−環状ホスフェートの付加、末端RNA残基の2’ヒドロキシル置換(例えば、ホスフェートまたはトリイソプロピルシリル(TIPS)もしくはtert−ブチルジメチルシリル(TBDMS)などの立体的に嵩高い基)、および例えば、米国特許出願第2007/0218490号で記載されているような、オリゴヌクレオチドの3’末端で置換されたTIPSおよびTBDMSなどの2’−アルキルシリル基が挙げられる。嵩高い置換基はさらに、オリゴヌクレオチドの3’−末端残基の塩基上に組み入れて、プライマー伸長をブロックすることができる。他の実施形態では、ブロッキング修飾は、IBFQ(Iowa Black FQ, Integrated DNA Technologies、アイオワ州コーラルビル)、または任意の他の好適なクエンチャー部分などの蛍光クエンチャーとしての働きをすることもできる。本明細書中で提供される開示を考慮して、本発明で用いられるリボプライマーは、プライマー特異性、結合親和性または融解温度を増加または減少させるという要望などの既知PCRプライマー設計考察に基づいて、RNA残基の3’側またはブロッキング基の3’側に1以上のさらなるDNAヌクレオチド残基をさらに含み得ることを、当業者は理解するであろう。
【0111】
本明細書中で用いられるリボプライマー中に存在するC3部分は、式C33H43N2O5Pを有し、以下の構造:
【化6】

を有する。
【0112】
他の実施形態では、リボ−プライムのブロッキング基は1つのC3部分(本明細書中で後述する)である。ある実施形態では、1つのRNA残基に続いてC3部分があり、それに続いて第2のC3部分があり、それに続いて1以上のさらなるDNA残基がある。
【0113】
RNase H酵素
本発明の方法および組成物で用いられるリボプライマーのいくつかの実施形態は、典型的には熱安定性、好熱性RNase H2酵素であるRNase H2酵素を用いて活性化される。熱安定性RNase H2酵素およびこれを使用する方法は、当該技術分野で周知である(Haruki et al,Gene Cloning and Characterization of Recombinant RNase HII from a Hyperthermophilic Archaeon. Journal of Bacteriology, December 1998, p. 6207−6214.)。例示的非限定的熱安定性RNase H2酵素は、本明細書中の実施例で用いられるピロコッカス・アビシ(P.abyssi)リボヌクレアーゼH2酵素である。ピロコッカス・アビシRNaseH2は熱安定性好熱性RNaseH酵素である。RNaseH酵素は、リボヌクレオチドがデオキシリボヌクレオチドに結合する領域に結合する。結合すると、酵素はRNA残基のすぐ3’側を切断する。種々の実施形態では、本発明の方法および組成物でリボプライマーとともに用いられるRNase H2酵素のホットスタート/好熱性特性は、当該技術分野で周知のように、酵素に固有のものであるか、または可逆的化学不活性化もしくはブロッキング抗体の結果のいずれかであり得る。
【0114】
いくつかの実施形態では、洗浄剤を反応緩衝液中に含めて、RNase H2の効率を増大させる。いくつかの更に具体的な実施形態では、洗浄剤は、Triton−X100、Tween−20、および臭化セチルトリメチルアンモニウム(CTAB)から選択される。
【0115】
PCRおよびqPCR反応インキュベーションでは、RNaseH2は典型的には高温に達したら活性化されるようになり、その基質を切断することを可能にし、それによりRNA残基およびC3スペーサーに対して3’側の残基を遊離させ、増幅を可能にする。RNaseH2は、プライマー/標的マッチがリボヌクレオチドに近い領域で強力なDNA−RNA二本鎖を形成するために十分であることを必要とし、リボプライマー反応は、通常、標準的オリゴヌクレオチドプライマーよりもさらに特異的である。さらに、酵素は高温で活性化されるだけであるので、リボプライマー反応は、典型的には非特異的プライマー伸長を減少させ、かくして望ましくないヌクレオチド伸長および増幅を減少させる。
【0116】
プローブ
本明細書中で用いられる「プローブ」という用語は、一般的に検出可能に標識され、ハイブリダイゼーションにより相補性核酸配列を同定するために用いられる、天然または合成のいずれかのオリゴヌクレオチドを指す。本発明で用いられるプライマーおよびプローブは、同一または異なる配列を有し得る。「リアルタイムPCRに好適なプローブ」は、米国特許第5,925,517号、第6,037,130号、第6,103,476号、第6,150,097号、第6,461,817号および第7,385,043号(参照することによって本明細書中に組み込まれる)で記載されているものをはじめとする、標的配列の存在下、リアルタイムで検出可能なシグナルを放出する任意のプローブを指す。
【0117】
別の実施形態において、プローブは、本明細書中の実施例で用いられるような二重修飾オリゴヌクレオチドである。二重修飾オリゴヌクレオチドは当該技術分野で周知であり、そしてとりわけ、国際特許出願第WO2008/063194号および米国特許出願公開第2009/0068643号、第2009/0325169号、および第2010/0167353号で記載されている。これらとしては、TaqMan(登録商標)プローブ、Eclipse(商標)および分子ビーコンが挙げられるが、これらに限定されるものではない。例示的非限定的種類の好適なプローブは、分子ビーコンである。分子ビーコンの使用は、当該技術分野で周知であり、とりわけ、Tyagi S and Kramer FR (1996) Molecular beacons: probes that fluoresce upon hybridization. Nat Biotechnol 14, 303−308で記載されている。分子ビーコンおよびリアルタイムPCRに好適な他のプローブは、典型的には、蛍光レポーター分子を5’末端で、そしてクエンチャー分子を3’末端で含む。広範囲のフルオロフォアのいずれか1つで修飾されたプローブは市販されており、Integrated DNA Technologies, Inc.(アイオワ州コーラルビル)、Eurogentec North America Inc. (カリフォルニア州サンディエゴ)およびBiosearch Technologies Inc.(カリフォルニア州ナヴァト)などの製造業者の製品カタログに記載されている。非限定例としては、FAM、HEX、TET、ROX、Texas Red、Cy 5、TYE 665、TYE 563、Quasarカルボン酸およびQuasar活性エステルが挙げられる。当業者に周知であるように、適切なクエンチャー部分の選択は、プローブのフルオロフォアの蛍光発光により決定され、これらに限定されるものではないが、Black Hole Quencher−1、Black Hole Quencher−2、Black Hole Quencher−3、Iowa Black FQ、Iowa Black RQ−Sp、Dabcyl、Deep Dark Quencher I、Deep Dark Quencher IIおよびDeep Dark Quencher IIIが挙げられる。
【0118】
他の実施形態では、プローブは、当該技術分野で公知の任意の他の種類のプローブである。当業者は、本明細書中で提供される開示を考慮して、本発明の性能にはっきりと影響を及ぼすことなく、様々な種類のプローブを本発明の増幅反応で用いることができ、異なるフルオロフォアおよびクエンチャーの任意の組み合わせを反応混合物中のプローブのそれぞれについて容易に用いることができることを理解するであろう。それぞれの可能性は本発明の別の実施形態であると見なすことができる。
【0119】
標的配列
「標的核酸」、「標的ポリヌクレオチド」、「標的ポリヌクレオチド配列」、「標的ポリヌクレオチド分子」、および「標的遺伝子」という用語は、本明細書中では交換可能かつ同義的に使用され、プライマーがハイブリダイズすることが意図されるテンプレート核酸鎖上のヌクレオチド配列を指す。種々の実施形態では、標的配列はRNAまたはDNA鎖を含み得る。この用語は、標的遺伝子の一部または標的遺伝子全体を指す可能性がある。別の実施形態において、本発明の方法またはキットは、対象の種に特徴的な(特異的な)標的遺伝子またはポリヌクレオチド配列を増幅するためのプライマーを使用する。1対のプライマーは、それらが内側に向いた方向で配列の反対の末端とハイブリダイズするならば、PCR反応において特定の標的ポリヌクレオチド配列を増幅することができることを、当業者は容易に理解するであろう。ある実施形態では、遺伝子またはポリヌクレオチド配列は、対象の病原体におけるその配列が、一般的な微生物間で独特である任意の遺伝子またはポリヌクレオチド配列であり得る。「種特異的遺伝子」という用語は、本明細書中では一般的に、遺伝子または遺伝子間領域のいずれであっても任意の種特異的配列を指すために用いられる。ある実施形態では、プライマーとハイブリダイズする配列は、好ましくは反応混合物で独特である。
【0120】
試験試料において対象の標的配列を検出するための方法
別の実施形態において、本発明は、試験試料における2以上の標的ポリヌクレオチド配列を検出する方法を提供し、この場合、前記試験試料は臨床材料由来であり、広範に精製されておらず、当該方法は:(a)PCR反応混合物を用いて試験試料から1以上の核酸を増幅するステップ;および(b)増幅されたPCR産物を検出するステップを含み、ここで、PCR反応混合物は:i)前記第1標的ポリヌクレオチド配列の第1配列を増幅することができる、少なくとも1つの順方向プライマーおよび少なくとも1つ逆方向プライマーを含むプライマーの第1セット;およびii)前記第2標的ポリヌクレオチド配列の第1配列を増幅することができる、少なくとも1つの順方向プライマーおよび少なくとも1つ逆方向プライマーを含むプライマーの第2セットを含み、ここで、前記第1プライマーセットの前記順方向プライマーおよび前記逆方向プライマーのうちの少なくとも1つは、ホットスタートプライマーおよび非ホットスタートプライマーの混合物として提供される。好ましくは、標的ポリヌクレオチド配列の両方を増幅するために用いられるプライマーのセットは、ホットスタートプライマーおよび非ホットスタートプライマーの混合物として提供される順方向および/または前記逆方向プライマーを含む。典型的には、反応混合物は、核酸ポリメラーゼ酵素、dNTP、および二価カチオン(ほとんどの場合、マグネシウムイオン)の1以上を更に含む。ホットスタートプライマーは、反応混合物中に存在する活性化酵素の作用により逆転される不活性化化学修飾を含み得るか、または当該技術分野で公知の他の種類のホットスタートプライマーを含み得る。ある実施形態では、PCR反応混合物は、リアルタイムPCRに好適なプローブまたは二本鎖DNA結合色素をさらに含む。この方法で用いられるPCR反応混合物は、付加標的配列の増幅のためのさらなるプライマーセットをさらに含み得ることは、当業者には理解されるであろう。
【0121】
別の実施形態において、本発明は、試験試料において種特異的標的ポリヌクレオチド配列を検出する方法を提供し、当該方法は:(a)本発明の反応混合物を用いて試験試料由来の核酸に対してPCRを実施するステップ(ここで、PCRは、対象の病原体におけるその配列が一般的な微生物間で独特である配列を標的とする少なくとも1つの増幅反応を含む);および(b)増幅されたPCR産物を検出するステップを含む。
【0122】
別の実施形態において、本発明は、試験試料において種特異的標的ポリヌクレオチド配列を検出する方法を提供し、当該方法は:(a)本発明の反応混合物を用いて試験試料由来の核酸に対してリアルタイムPCRを実施するステップ(ここで、PCRにおける1つの増幅反応は、対象の病原体におけるその配列が一般的な微生物間で独特である配列を標的とする);(b)種特異的遺伝子を検出するプローブによって生成するシグナルを測定するステップ;および(c)サイクル数を標準試料と比較するステップを含む。この方法のある実施形態では、標準試料は、種特異的遺伝子を検出するプローブにより生成するシグナルがあらかじめ設定された強度を越えるシグナルサイクル数(「サイクル閾値」または「Ct値」)に関する。さらに具体的な実施形態では、Ct値が標準試料以下であるならば、配列は試験試料中に存在すると見なされる。別の実施形態において、本発明は、試験試料中の標的配列を検出するためのキットを提供する。それぞれの可能性は本発明の別の実施形態であると見なすことができる。
【0123】
種々の実施形態では、本発明のキットは、病原体特異的遺伝子、ヒトDNAマーカーまたは動物DNAマーカーであり得る。PCRによる病原体特異的配列の検出は、当該技術分野で周知であり、とりわけ、本明細書中で後述される参考文献で言及されている。
【0124】
「試験試料由来の核酸」は、対象の試験試料から誘導される核酸を指す。無傷細胞を含む試験試料が、典型的にはPCR反応を実施する前に溶解処理に付されることは、当業者には理解されるであろう。ある実施形態では、試料溶解物は、増幅反応の前に核酸精製処理に付されない。他の実施形態では、試料溶解物を粗核酸精製処理に付すことができるが、広範精製処理には付されない。本明細書中で提供されるように、本発明の方法は、非精製核酸試料の増幅で遭遇する問題を克服する。
【0125】
いくつかの実施形態では、本発明のキットは、必ずしも広範の精製に付されていない核酸試料に用いられる。
【0126】
本明細書中で用いられる場合、「広範に精製されていない」または「広範の精製に付され」ていない核酸への言及は、溶解した細胞から抽出されるが、非核酸、可溶性細胞成分の大部分から分離されない核酸を含むことが意図される。これには、細菌培養などの臨床試料または他の種類の試料から細胞をペレット化し;それらの細胞を溶解させ;そして細胞壁成分などの不溶性細胞成分を溶解した細胞から、例えば遠心分離または濾過により除去することにより得られる核酸が含まれる。
【0127】
ある実施形態では、「広範に生成されない」核酸は、2.0未満のA260/A280比を有する(A260/A280比は核酸調製の純度の尺度である)。別の実施形態において、本発明の方法および組成物は、1.9未満のA260/A280比を有する試料とともに使用するのに好適である。別の実施形態において、本発明のキットは、1.8未満のA260/A280比を有する試料とともに使用するのに好適である。別の実施形態において、本発明のキットは、1.7未満のA260/A280比を有する試料とともに使用するのに好適である。別の実施形態において、本発明のキットは、1.0〜2.0のA260/A280比を有する試料とともに使用するのに好適である。別の実施形態において、本発明のキットは、1.0〜1.9のA260/A280比を有する試料とともに使用するのに好適である。別の実施形態において、本発明のキットは、1.0〜1.8のA260/A280比を有する試料とともに使用するのに好適である。別の実施形態において、本発明のキットは、1.0〜1.7のA260/A280比を有する試料とともに使用するのに好適である。それぞれの可能性は本発明の別の実施形態であると見なすことができる。
【0128】
試験試料
「試験試料」という用語は、本明細書中で用いられる場合、標的配列を含むことが疑われる任意の試料、たとえば対象の病原体または対象のヒトもしくは動物DNAマーカーを含むことが疑われる試料を指す。ある実施形態では、試験試料はほ乳類由来の臨床材料である。ある他の実施形態では、試験試料は、ヒト由来の臨床材料である。あるいは、「臨床材料」という用語は、本明細書中で用いられる場合、ほ乳類由来の体液、組織、または任意の種類の生検を処理することから得られる検体を指す。本明細書中で提供されるように、特にプライマー−テンプレート結合が弱まっている場合、たとえばホットスタートプライマーのRNA残基の近くにプライマーテンプレートミスマッチが存在する場合、ほ乳類一般および特にヒト由来の臨床材料は、ホットスタートプライマーPCRを阻害する物質、たとえば多糖または粘液(たとえば、鼻、喀痰、咽頭、もしくは膣スワブ)を含む。非限定的典型例では、プライマーテンプレートミスマッチは、ホットスタートプライマー内のRNA残基に対してすぐ5’側のDNA残基である。
【0129】
ある実施形態では、臨床材料は体液である。別の実施形態において、臨床材料は鼻汁である。別の実施形態において、臨床材料は鼻腔用綿棒である。別の実施形態において、臨床材料は腋窩から得たスワブである。別の実施形態において、臨床材料は鼠径部から得られるスワブである。別の実施形態において、臨床材料は全血である。別の実施形態において、臨床材料は血清である。別の実施形態において、臨床材料は血漿である。別の実施形態において、臨床材料は脳脊髄液である。別の実施形態において、臨床材料は尿である。別の実施形態において、臨床材料はリンパ液である。別の実施形態において、臨床材料は涙である。別の実施形態において、臨床材料は唾液である。別の実施形態において、臨床材料は対象の乳である。別の実施形態において、臨床材料は羊水である。別の実施形態において、臨床材料は気道の外分泌物である。別の実施形態において、臨床材料は腸管の外分泌物である。別の実施形態において、臨床材料は泌尿生殖器の外分泌物である。別の実施形態において、臨床材料は、対象の標的配列についての試験を必要とする対象の鼻汁、膣分泌物、全血、血清、血漿、脳脊髄液、尿、リンパ液、涙、唾液、乳、羊水および気道、腸管または泌尿生殖器の外分泌物からなる群から選択される。それぞれの可能性は本発明の別の実施形態であると見なすことができる。
【0130】
別の実施形態において、臨床材料は対象の生検由来の組織である。典型的には、組織を、適切に(たとえば、均質化により)処理し、それをPCR増幅用の基質にする。ある実施形態では、組織は白血球である。ある実施形態では、組織は悪性組織である。ある実施形態では、組織は絨毛膜絨毛である。ある実施形態では、組織は、白血球、悪性組織、および絨毛膜絨毛からなる群から選択される。ある実施形態では、組織は、白血球、悪性組織、および絨毛膜絨毛からなる群から選択される細胞型を含む。ある実施形態では、組織は、本質的に、白血球、悪性組織、および絨毛膜絨毛からなる群から選択される細胞型からなる。それぞれの可能性は本発明の別の実施形態であると見なすことができる。
【0131】
別の実施形態において、試験試料は、法医学目的で使用され、カード上に含浸させた阻害剤を含むFTAカード上の血痕、組織、皮膚、毛包、唾液およびたばこの吸い殻を含む。
【0132】
臨床材料中の病原体を検出するための方法
本発明の具体的な一実施形態は、臨床材料中の病原体の抗生物質耐性株を検出する方法であって、当該方法は:(a)試験試料由来の核酸に関してリアルタイムPCRを実施するステップ(ここで、PCR反応混合物は本発明の反応混合物である);(b)遺伝子または遺伝子間領域(本明細書中では「病原体−特異的遺伝子」と称する)に関わらず、病原体−特異的配列および抗生物質耐性を付与するポリヌクレオチド配列(本明細書中では、「抗生物質耐性遺伝子」と称する)を検出するプローブによって生成するシグナルのCt値を測定するステップ;ならびに(c)病原体特異的遺伝子のCt値と抗生物質耐性遺伝子のCt値とを比較するステップを含む。別の実施形態において、当該方法は、「架橋領域」(抗生物質耐性遺伝子を含むエレメントの挿入の通常の地点[「挿入点」]および標的病原体のゲノム中の既知位置を連結する領域)を増幅し、そして架橋領域のCt値を測定するステップをさらに含む。別の実施形態において、本発明は、試験試料中の抗生物質耐性株を検出するためのキットを提供する。それぞれの可能性は本発明の別の実施形態であると見なすことができる。
【0133】
前記方法で用いることができる病原体−特異的遺伝子の非限定的実施形態は、黄色ブドウ球菌のnuc、Sa442、およびfemBである。これを増幅するための病原体−特異的ポリヌクレオチド配列およびプライマーは、当該技術分野において周知であり、とりわけ、米国特許出願第2009/0081663号で記載されている。抗生物質耐性遺伝子の非限定例は、mecA(GenBank受入番号AB097677)である。当業者は、抗生物質耐性に関連する遺伝子がカセットもしくはプラスミド上に位置し得るか、または病原体の染色体上に組み入れられ得ることを理解するであろう。利用できる架橋領域の非限定例は、SCCmec:orfXである。架橋領域は当該技術分野で周知であり、とりわけ、CunyおよびWitteで記載されている(PCR for the identification of methicillin−resistant Staphylococcus aureus(MRSA) strains using a single perimer pair specific for SCCmec elements and the neighbouring chromosomeborne orfX. Clin Microbiol Infect. 2005;11(10):834−7)。当該技術分野で既知の任意の病原体−特異的遺伝子、抗生物質耐性遺伝子、または架橋領域を前記方法で用いることができることは、当業者には理解されるであろう。それぞれの可能性は本発明の別の実施形態であると見なすことができる。
【0134】
前記方法において、標的病原体(「対象の病原体」)は、ある実施形態では、細菌であり得る。他の実施形態では、標的病原体はウイルスである。他の実施形態では、標的病原体は真菌である。他の実施形態では、標的病原体は原虫である。他の実施形態では、標的病原体は抗生物質耐性細菌である。他の実施形態では、標的病原体は抗生物質耐性ウイルスである。他の実施形態では、標的病原体は抗生物質耐性真菌である。他の実施形態では、標的病原体は抗生物質耐性原虫である。ある実施形態では、本明細書中で例示されるように、標的病原体は黄色ブドウ球菌である。ある他の実施形態では、本明細書中で例示されるように、標的病原体はメチシリン耐性黄色ブドウ球菌(MRSA)である。ある他の実施形態では、標的病原体はVRSA(バンコマイシン耐性黄色ブドウ球菌)、VRE(バンコマイシン耐性腸球菌)、C型肝炎ウイルス(HCV)、クロストリジウム・ディフィシル(Clostridium Difficile)である。他の実施形態では、標的病原体は当該技術分野で公知の任意の標的病原体である。それぞれの可能性は本発明の別の実施形態であると見なすことができる。
【0135】
前記方法により標的とされ得る抗生物質耐性遺伝子には、非限定例を挙げれば、mecA、vanA、vanB、vanC1、vanC2 vanC3、vanD、vanE、およびvanGが含まれる。それぞれの可能性は、本発明の別の実施形態と見なすことができる。
【0136】
別の実施形態において、抗生物質耐性遺伝子は、メチシリン、バンコマイシン、リネゾリド、ペニシリンクラスの抗生物質、セファロスポリンクラスの抗生物質、カルバペネムクラスの抗生物質、およびモノバクタムクラスの抗生物質からなる群から選択される1以上の抗生剤に対する耐性を付与する遺伝子である。別の実施形態において、当該技術分野で公知の任意の他の抗生剤に対して耐性を付与する抗生物質耐性遺伝子。それぞれの可能性は、本発明の別の実施形態と見なすことができる。
【0137】
いくつかの実施形態では、本発明のPCR反応は、対立遺伝子−特異的PCR(AS−PCR)反応である。AS−PCRは当該技術分野で周知であり、とりわけ、米国特許第5,496,699号で記載されている。
【0138】
キット
別の実施形態において、本発明は、本発明のPCR反応混合物およびその使用説明書を含む、たとえば、臨床材料中の特異的標的配列を増幅するためのキットを提供する。別の実施形態において、キットは、試験試料中の病原体を検出するために使用され、検出のための使用説明書を含む。別の実施形態において、キットは、ヒトまたは動物DNAマーカーの検出を必要とする医学用途で使用される。それぞれの可能性は本発明の別の実施形態であると見なすことができる。
【0139】
本明細書中では、特定の種特異的遺伝子を増幅するためのプライマーのセットを含む反応混合物が提供され、ここで、標的配列の少なくとも1つの末端を増幅するためのプライマーは、ホットスタートプライマーおよび非ホットスタートプライマーの両方を含む。本明細書中で提供されるように、そのような反応混合物は、ホットスタートプライマー単独または非ホットスタートプライマー単独のいずれかを含む混合物よりも優れた特性を示す。
【0140】
前記事項と併せて、本発明を非限定的に説明する以下の実施例を参照する。
【0141】
一般的に、本明細書中で用いられる命名法および本発明で用いられる実験法には、分子、生化学、微生物学、および組換えDNA技術が含まれる。そのような技術は、文献で十分に説明されている。たとえば、“Molecular Cloning: A Laboratory Manual” Sambrook et al., (2001);“Current Protocols in Molecular Biology” Volumes I−III Ausubel, R. M., ed. (1994);Ausubel et al., “Current Protocols in Molecular Biology”, John Wiley and Sons, Baltimore, Maryland (2009);Perbal, “A Practical Guide to Molecular Cloning”, John Wiley & Sons, New York (1988);Watson et al., “Recombinant DNA”, Scientific American Books, New York;Birren et al. (eds) “Genome Analysis: A Laboratory Manual Series”, Vols. 1−4, Cold Spring Harbor Laboratory Press, New York (1998);as set forth in 米国特許第4,666,828号;第4,683,202号;第4,801,531号;第5,192,659号および第5,272,057号に記載されている方法;“Cell Biology: A Laboratory Handbook”, Volumes I−III Cellis, J. E., ed. (1994);“Culture of Animal Cells −A Manual of Basic Technique” by Freshney, Wiley−Liss, N. Y. (1994), Third Edition;“Current Protocols in Immunology” Volumes I−III Coligan J. E., ed. (1994);Stites et al. (eds), “Basic and Clinical Immunology” (8th Edition), Appleton & Lange, Norwalk, CT (1994);Mishell and Shiigi (eds), “Selected Methods in Cellular Immunology”, W. H. Freeman and Co., New York (1980);特許および科学文献に広範囲に記載されている利用可能なイムノアッセイ、たとえば、米国特許第3,791,932号;第3,839,153号;第3,850,752号;第3,850,578号;第3,853,987号;第3,867,517号;第3,879,262号;第3,901,654号;第3,935,074号;第3,984,533号;第3,996,345号;第4,034,074号;第4,098,876号;第4,879,219号;第5,011,771および5,281,521号;“Oligonucleotide Synthesis” Gait, M. J., ed. (1984);“Nucleic Acid Hybridization” Hames, B. D., and Higgins S. J., eds. (1985);“Transcription and Translation” Hames, B. D., and Higgins S. J., eds. (1984);“Animal Cell Culture” Freshney, R. I., ed. (1986);“Immobilized Cells and Enzymes” IRL Press, (1986);“A Practical Guide to Molecular Cloning” Perbal, B., (1984) and “Methods in Enzymology” Vol. 1−317, Academic Press;“PCR Protocols: A Guide To Methods And Applications”, Academic Press, San Diego, CA (1990);Marshak et al., “Strategies for Protein Purification and Characterization −A Laboratory Course Manual” CSHL Press (1996);“Molecular Beacons: Probes that Fluoresce upon Hybridization”, Sanjay Tyagi1 & Fred Russell Kramer, Nature Bio技術 14, 303 −308 (1996)を参照;(すべて、全体が本明細書中で完全に記載されているかのように本明細書中に組み込まれる)。他の一般的な文献をこの文書全体にわたって提供する。この文献中の手順は、当該技術分野で周知であると考えられ、読者の便宜のために提供する。その文献に含まれるすべての情報は、参照することによって本明細書中に組み込まれる。
【0142】
実験の詳細のセクション
材料および実験法
材料
MRSA株#1: ATCC700699 (ATCC、バージニア州マナッサス)
MRSA株#2: BAA1556 (ATCC、バージニア州マナッサス)
MRSA株#3: BAA40 (ATCC、バージニア州マナッサス)
Prep Tube:分子生物学等級の水からなる、TrisおよびNa−EDTAからなる試料調製緩衝液1mlを含むドルフィン管。
Dri−Lyse Tube:分子生物学等級の水、Tris、およびNa−EDTAからなる溶菌緩衝液により水和されて、溶解溶液を形成する安定化されたアクロモペプチダーゼを含む2mlの管。
RNAse H2酵素:ピロコッカス・アビシ(Pyrococcus abyssi)リボヌクレアーゼ H2酵素をIntegrated DNA Technologies, Inc.(アイオワ州コーラルビル)から入手した。
【0143】
実験法(全実施例について一般的)
「リボプライマー」ホットスタートプライマー
本明細書中で用いられるリボプライマーは、以下の修飾を含む標準的DNAオリゴヌクレオチドプライマーの変異体である:1つのRNA残基が標準的DNAオリゴヌクレオチドプライマーの3’末端に付加され、続いて4つの相補性DNA残基およびプライマー伸長を防止するブロッキング基が付加される。RNA残基は、プライマーを高温での3’末端による切断のための基質にする。ただし、プライマーはその標的とハイブリダイズするものとする。これらの条件が満たされた場合、RNaseH2エンドヌクレアーゼは活性になり、結果として得られるヘテロ二重鎖を切断し、それによりブロッキング修飾を放出し、伸長可能なPCRプライマーを得る。
【0144】
qPCRアッセイ
qPCRをPaitanら(米国特許出願第2009/0081663号)により記載されているようにして実施した。複数のプライマーおよび二重標識された分子ビーコンプローブをMRSAで見出される3つのDNA標的に対するハイブリダイゼーションに使用した。プライマー対および合成DNAの検出のプローブを内部標準として添加した。
【0145】
対照DNA
内部標準プライマー対およびプローブに対して相補性のプラスミド中344塩基対(bp)の合成DNAを使用して、リアルタイムPCR反応の全体性を確認した。
【0146】
RNaseH2混合物
32.5ミリ単位/反応のRNaseH2エンドヌクレアーゼ(Integrated DNA Technologies, Inc.)をTris、グリセロール、NaCl、EDTAおよびTriton X100からなる緩衝液混合物中で希釈した。
【0147】
PCR MasterMix
PCR反応混合物は、DNAポリメラーゼ(Taq Pol from Jena Bioscience)、dNTP(Jena Bioscience)、Tris、KCl、MgCl2、BSAおよびスクロースを含んでいた。
【0148】
実施例1:ホットスタートプライマーを用いる多重PCRは、ある条件下で増幅の問題を示す可能性がある
材料および実験法
実施例1のプローブ及びプライマー
プローブ
表1に示すような4つの二重標識された分子ビーコンプローブを使用した;1つは黄色ブドウ球菌orfX領域に対して相補性であり(配列番号1)、第2のものは黄色ブドウ球菌特異的nuc遺伝子に対して相補性であり(配列番号2)、第3のものはmecA遺伝子に対して相補性であり(配列番号3)、そして第4のものは内部標準DNAに対して相補性である(配列番号4)。
【0149】
【表1】

【0150】
二重標識された分子ビーコンプローブをBiosearch Technologies Inc. (カリフォルニア州ナヴァト)から購入し、標準的フルオロフォアおよびクエンチャーを組み入れた。
【0151】
順方向プライマー
表2に示すような4つの順方向プライマーを使用した;1つは黄色ブドウ球菌orfX領域に対して相補性であり(配列番号5)、第2のものは黄色ブドウ球菌特異的nuc遺伝子に対して相補性であり(配列番号12)、第3のものはmecA遺伝子に対して相補性であり(配列番号14)、そして第4のものは内部標準DNAに対して相補性である(配列番号16)。各プライマーは「リボプライマー」ホットスタートプライマーであり;表中のリボヌクレオチド残基の前に「r」をつけ、下線を施す。
【0152】
逆方向プライマー
表2に示すような9つの逆方向プライマー(リボプライマーも)を使用した:6つはSCCmec遺伝子の異なる株に対して相補性であり(配列番号6〜11);7番目は黄色ブドウ球菌特異的nuc遺伝子に対して相補性であり(配列番号13);8番目はmecA遺伝子に対して相補性であり(配列番号15);そして9番目は内部標準DNAを検出するために用いられる逆方向プライマーである(配列番号17)。
【0153】
【表2】

【0154】
実験設定
13の「リボプライマー」ホットスタートプライマー、4つの分子ビーコンプローブ、内部標準DNAおよびPCR MasterMixを含むアッセイ混合物を調製し、水和低減して、55℃で2時間加熱することにより安定性を増強した。
【0155】
使用直前に、RNaseH2混合物およびMRSAの培養試料からの精製DNAを含む溶液25μlにより混合物を水和し、多重qPCR反応を実施した。
【0156】
MRSAの2つの別個の株(MRSA株#1およびMRSA株#2)を用いてアッセイを試験し、それぞれ2連で実施した。実施例#1について、各MRSA株からのDNAを、DNeasy(商標)Blood & Tissue Kit(QIAGEN GmbH)を用いて精製し、そして合計0.01ナノグラムの精製DNA(約300CFUの細菌に等しい)をそれぞれの反応について使用した。TE中アッセイ混合物を含み、テンプレートDNAを含まない負の対照試料を実施に含めた。
【0157】
Corbett Life Science製のRotorGene 6000 System Real Time PCR装置を標準的qPCRプロトコルにしたがって使用して、増幅および検出反応を実施した:
1.95℃にて3分でDNAを変性させる。
2.それぞれ以下の3つのステップを含む増幅サイクル:(a)95℃で20秒;(b)56℃で60秒;(c)72℃で30秒(ステップ (b)の最後で、4つの蛍光染料のそれぞれについて読み取った)。
【0158】
結果
メチシリン耐性黄色ブドウ球菌(MRSA)を検出するための多重qPCRアッセイを実施した。このアッセイは3つの異なる配列を検出する:メチシリン耐性と関連するmecA遺伝子(「黄色チャンネル」);黄色ブドウ球菌特異的nuc遺伝子(「オレンジ色チャンネル」);およびSCCmec:orfX、SCCmec挿入カセットと黄色ブドウ球菌ゲノムのorfX領域との間の領域(「架橋領域」とも称する)(「緑色チャンネル」)。アッセイは複数のプライマーおよびSCCmec:orfXの右端の接点のハイブリダイゼーション用の二重標識されたプローブを使用する。なぜなら、この領域は異なる黄色ブドウ球菌株間で配列変動を示すからである。プライマー対および合成DNAの検出用プローブが内部標準として含まれ(「赤色チャンネル」)、同様にテンプレートDNAのない負の対照も含まれていた。MRSAの2つの別個の株MRSA株#1および#2(それぞれ2連で実施)の培養試料から抽出された精製DNAでアッセイを実施した。nucプライマーは黄色ブドウ球菌nucに特異的な配列を認識し;したがってそれらは表皮ブドウ球菌(S. epidermis)を増幅しない。
【0159】
図1に示すように、内部標準(IC)、orfXおよびmecA遺伝子のプローブは、それぞれ、2つのMRSA株にわたってほぼ同一である正のシグナルを産生した。nuc遺伝子を標的とするプローブは正のシグナルを産生するが、株#2よりも明らかに遅れて株#1からDNAを増幅する点で、2つの株間で顕著な差を示した。2連試料は高い再現性を示した。
【0160】
2つの株の公開された配列を調べることにより、株#2は、検出アッセイで用いられる順方向および逆方向nucプライマーの両方に対する完全な相補性を形成し、一方、株#1は、逆nucプライマーのRNA塩基の1塩基前二位位置する1つのミスマッチ塩基を含むことが明らかになった。まとめると、ホットスタートプライマーを含む反応混合物は、全DNA標的を4重アッセイで増幅することができ、ミスマッチ塩基を含む1つのDNA標的は、ミスマッチ塩基を含まないDNA標的よりも明らかに弱い増幅を示した。
【0161】
実施例2:臨床的鼻腔用綿棒試料hzホットスタートプライマーを用いたPCRを阻害する可能性がある
実験法
第1の試料タイプの調製(「スパイクされた鼻試料」)
1.単分散溶液をTE中各菌株からpH8.3で、Detect−Ready(商標)MRSA Lysis Kitを用いて以下のようにして調製した:
a.1つのコロニーを滅菌細菌学的ループで取り、1mlのTE(pH8.3)緩衝液中で振とうした。
b.100μlを900μlのTE(Tris−EDTA)中に移し、次いで混合し、このステップをさらに2回繰り返すことにより、希釈を実施して、104cfu/mlの濃度に達した。
2.滅菌ピペットチップで、10μlの希釈細菌コロニー(約300cfuに等しい)を除去し、生理食塩水で湿らせた鼻腔用綿棒上にスパイクし、これでヒトボランティアの鼻孔内部を拭き取った。
3.Prep Tubeをあけ、スワブの頭部が試料調製緩衝溶液中に完全に浸されるまで、スワブを挿入した。
4.スワブを緩衝液中で10〜15秒間撹拌し(激しく、ただし管の内容物がこぼれないように注意して)、細菌を放出させた。
5.スワブを捨て、Prep Tubeをしっかり閉じた。
6.Prep Tubeを遠心分離機に入れ、10,000〜12,000gで5分間、室温にて遠心分離した。
7.遠心分離ステップ中、Dri−Lyse管を、1mlの溶菌緩衝液を添加することにより再水和した。Dri−Lyse Tubeを閉じ、5秒間ボルテックスして、溶菌液を再構成した。
8.Prep Tubeを遠心分離機から取り出し、管を反転することによって上清を注いだ。
9.管の底部に付着したペレットに触れることなく、ペレットを上方向に向けて管を水平な位置に保持しつつ、200μlのマイクロピペットで穏やかに吸引することにより、残存する緩衝液を除去した。
10.90μlの溶菌液を、それぞれのペレットを含むPrep Tubeに添加した。
11.ペレットをピペットにより管の底部から引き離した。
12.Prep Tubeを37℃にて10分間加熱ブロック中でインキュベートし、99℃で5分間加熱し、そして加熱ブロックから取り出した。
13.試料を1分間、最大速度で遠心分離した。
14.それぞれの試料を含むPrep Tubeに10μlのRNaseH2溶液混合物を添加した。
15.各Prep Tube中の25μlの溶液を次いで実施例1で前述されているqPCR反応混合物を含むPCR反応管中に移し、そして多重qPCR反応を実施例1で記載されているようにして実施した。
【0162】
第2の試料タイプの調製(「直接試料」)
10μlの希釈細菌コロニー(約300cfuに等しい)を除去し、90μlの液体を含む再水和されたDri−Lyse Tube中に直接ピペットで移した。管を次いで37℃で10分間、加熱ブロック中でインキュベートし、99℃で5分間加熱し、そして加熱ブロックから取り出した。10μlのRNaseH2混合物を添加し、その後、25μlの結果として得られた溶液を次いで実施例1で前述されたqPCR反応混合物を含むPCR反応管に移した。多重qPCR反応を実施例1で記載されているようにして実施した。
【0163】
結果
実施例1で記載したのと同じ反応混合物およびホットスタートプライマーを用いて、この場合は、広範の精製(Detect−Ready(商標)MRSA Lysis Kitを使用)をすることなく実施例1で試験した2つのMRSA菌株のそれぞれから得られた2種のDNA試料を標的として、MRSAを検出するための多重qPCRアッセイを実施した。試料の第1のタイプ(「スパイクされた鼻試料」)を臨床的鼻試料スワブ上にスパイクし、一方、第2の(「直接試料」)はスパイクしなかった。
【0164】
MRSA株#2について、4つのプローブは全て鼻および直接試料のどちらの場合も正のシグナルを生成したが;スパイクされた鼻試料は、体系的により高いサイクル数を示し、このことは増幅の遅延を示す(図2A)。これは、MRSA株#1の場合のIC、mecAおよびOrfXについても当てはまった。しかし、MRSA株#1のnuc遺伝子の増幅は、スパイクされた鼻試料において完全に阻害された(図2B)。2連の試料は、高い再現性を示した。この阻害を克服するために20を越える方法を試み、その大部分は阻害に対して影響を及ぼさなかった、および/またはアッセイ感度に対して悪影響を及ぼした(データは不掲載)。
【0165】
これらの結果は、スパイクされた鼻試料が、完全なプライマー−標的マッチの場合にはPCR反応の最適性能を妨害する成分を含み、プライマー−標的ミスマッチが存在する場合は、反応を完全に阻害することを示す。
【0166】
実施例3: ホットスタートプライマーおよびレギュラープライマーのネスト化組み合わせは、鼻腔用綿棒試料によるqPCRの阻害を克服する
実験法
プライマー
実施例3で用いられる非ホットスタート順方向及び逆方向プライマーを表3に示し、以下で記載する。
【0167】
【表3】

【0168】
実験プロトコル
2種の広範に精製されていないDNA試料を、実施例2に記載されているようにして、この場合はMRSA株#3を用いて調製した。MRSAを検出するための多重qPCRアッセイを、以下のようにしていくつかの異なる反応混合物を用いて実施した:
混合物#3−1:実施例1〜2で記載されているのと同じ反応混合物であって、ホットスタートプライマーのみを含むもの。
混合物#3−2:先の混合物においてと同じプローブおよび13のホットスタートプライマーの、nuc、orfXおよびmecA(配列番号18〜28)の11のさらなるレギュラー(非ホットスタート)非修飾オリゴヌクレオチドプライマー(それぞれ、その対応するホットスタートプライマーのモル量の10%で存在する)との混合物であって、ネスト化プライマー設計を形成する。各レギュラープライマーの配列は、対応するホットスタートプライマーよりも若干長く、ホットスタートプライマーにより標的とされる領域の1〜70塩基外側の領域に対して相補性であった。内部標準アッセイはホットスタートプライマーのみを使用した。
混合物#3−3:orfX、nuc、およびmecAの非ホットスタートネスト化プライマーのみを通常の濃度の10%(混合物#2中のレギュラープライマーと同じ濃度の100%);ICのホットスタートプライマーのみ。
【0169】
結果
スパイクされた鼻試料および直接試料を、実施例2で記載されているようにして、、この場合はMRSA株#3を用いて、広範に精製されていないDNAから調製した。MRSA株#3を選択した。なぜなら、nucを標的とするアッセイおよびmecAを標的とするアッセイの両方についてのホットスタートプライマーを用いるqPCR反応は、株#3を含む臨床鼻腔用綿棒試料に適用された場合に、実質的に損なわれることが見出されたからである。多重qRT−PCRアッセイは、この実施例の方法のセクションで記載した3つの混合物を用いて実施した。2連の試料は、高い再現性を示した。
【0170】
混合物#3−1について、先の実施例においてと同様に、ICおよびOrfXは、実施例2におけるMRSA株#1および#2で見られた結果と同様に、スパイクされた鼻試料および直接試料のどちらの場合も効率的に増幅された。mecAおよびnucでの結果は、試料の種類によって変化した。直接試料では、これらの領域は効率的に増幅され(不掲載)、一方、スパイクされた鼻試料では、mecAおよびnucの増幅は、それぞれかなり阻害され、完全に阻害された(図3A)。これらの結果は、臨床材料のPCR阻害効果がホットスタートプライマーのみを用いるアッセイでより顕著であり、プライマー標的ハイブリダイゼーションの程度に応じてその大きさが様々であることを裏付ける。この実験では、たとえば、阻害効果はorfXの場合は最小であり、mecAについてはさらに実質的であり、そしてnuc遺伝子標的アッセイについてはほぼ完全であった。混合物#3−1の負の対照も示す;この対照は、競合するチャンネルからの比較的低い競合のために、内部標準チャンネルに対して高いシグナルを示した。
【0171】
混合物#3−2については、それに反して(図3Aでも示す)、スパイクされた鼻試料において3つの実験チャンネル全てに関して強固な増幅が観察された。これらの結果は、ホットスタートプライマーおよび非ホットスタートプライマーの混合物の利用が、10%の非ホットスタートプライマーしか含んでいなくても、臨床材料のPCR阻害効果を主に克服するブースター効果を提供することを示す。
【0172】
混合物#3−3について、3つの増幅は全て、スパイクされた鼻試料において、各DNA標的が検出される範囲で成功した(図3B)。しかし、これらの結果をホットスタート−プライマーおよびネスト化レギュラープライマーの混合物(混合物#3−2;図3A)と比較すると、混合物#3−2は、PCR阻害が存在する場合でも、実質的により強力な増幅したことがわかる。後者の場合、非ホットスタートプライマーによる増幅は平坦域に達し、ホットスタートプライマーはその時点から順方向へさらなる増幅をおこない続けた。混合物#3−3の負の対照も示す。
【0173】
したがって、ホットスタートプライマーおよびレギュラープライマーのネスト化組み合わせ(混合物#3−2)は、臨床材料の存在下(混合物#3−1)で観察されるホットスタートプライマーPCRの阻害を克服し、さらに、減少したハイブリダイゼーションを示す標的のみについてのホットスタートプライマーと非阻害標的のみについての非ホットスタートプライマーとの組み合わせ(混合物#3−3)の使用よりも優れていた。
【0174】
実施例4:ホットスタートプライマーを使用するqPCR反応は、レギュラープライマーを用いた平行増幅により阻害される
この実験は、実施例3について記載したように、スパイク後に広範の精製に付されていないスパイクされた鼻試料および直接試料のいずれかとして存在する精製されたMRSA株#3DNA試料も使用した。この場合、ICおよびOrfXを標的とするアッセイにホットスタートプライマーのみを使用し(すなわち、臨床用スワブ試料由来のPCR阻害の存在下でさえも、強いPCR増幅を達成することが先に示されたもの);一方、実施例1〜2で用いられるホットスタートプライマーに使用したものと同じ配列を有する通常の修飾されていないプライマーを、nucおよびmecAに利用した(臨床用スワブ試料の存在下で広範なPCR阻害を示したもの)。スパイクされた鼻試料を2連で実施し、負の対照試料を含めた。さらなる対照反応も実施し、全ての反応についてホットスタートプライマーを単独で使用した。
【0175】
ホットスタートプライマー単独を含む対照反応において、以前に観察されたように、orfXおよびICは増幅され、一方、nucおよびmecAの検出は阻害された(図4B)。レギュラープライマー(nucおよびmecA)を用いる増幅は、うまく機能することが判明し;mecAは、特に先の実施例よりも強い増幅を示した(図4A)。この実施例で用いられるスパイクされた鼻試料は、別の調査で、mecA遺伝子のさらに強い増幅の原因である可能性が高いメチシリン耐性表皮ブドウ球菌(Staphylococcus Epidermis)の鼻保因を有することがわかっている個体由来であることが判明した。orfXおよびICは両試料で増幅されたが、スパイクされた鼻試料の増幅は、ホットスタートのみの対照反応との比較により示されるように、他のチャンネルでレギュラープライマーを使用することにより若干遅延した(図4C)。2連の試料は、高い再現性を示した。
【0176】
mecAおよびOrfXの阻害を減少させようとして、nucおよびmecAを標的とするレギュラープライマーの濃度を減少させた。この方法はICの増幅をはっきりとは改善しなかった(データは不掲載)。
【0177】
したがって、ホットスタートプライマーのみを使用する増幅は、レギュラープライマーのみを利用する他の増幅の存在下で、多重アッセイに関連して阻害される可能性が高い。特定の理論または作用機構により拘束されることを望まないが、この場合のホットスタート増幅の阻害は、反応管中のdNTPなどのリソースについての競合のためである可能性が高い。
【0178】
実施例5:ホットスタートおよびレギュラープライマーの混合物の使用は、多重qPCRで競合する増幅の阻害を防止する
プライマー
実施例5で使用した非ホットスタート(レギュラー)順方向及び逆方向プライマーを表4に示し、以下で記載する。
【0179】
【表4】

【0180】
この実験では、3つの異なるプライマーミックスを、orfX、nucおよびmecA遺伝子を標的とするアッセイのそれぞれについて使用した:
混合物#5−1は、ホットスタートおよび非ホットスタート(レギュラー)プライマーの混合物を含んでいた。各ホットスタートプライマーに関して、ホットスタートプライマーと同じ配列を有するが、いずれかの末端でさらなる相補性塩基が付加されたレギュラープライマーが含まれて、表5に示すような優先的結合が得られた。実施例1および2で記載されるプライマーの濃度は、80%のホットスタートプライマーおよび20%のレギュラープライマーを含む以外は、アッセイ混合物においてと同じであった。混合物#5−2は、ホットスタートプライマーを含まず、混合物#5−1におけるレギュラープライマーの両と同じ量のレギュラープライマーを含む対照混合物であった。
【0181】
混合物#5−3は、実施例1および2で前述した濃度レベルでホットスタートプライマーのみを含んでいた。
【0182】
実施例4においてと同様に、ICの増幅用の全ての混合物においてホットスタートプライマーのみを使用した。広範に精製されていないDNAを、実施例3について記載されているように、MRSA株#3の鼻試料上にスパイクされた細菌および直接試料から調製した。鼻試料を2連で実施し、負の対照試料を含めた。
【0183】
正の増幅は、ホットスタートプライマーおよびレギュラープライマーの混合物を用いる試料において4つのチャンネル全てで明らかであった(図5、混合物#1)。これらの結果は、全反応についてのホットスタートプライマー単独の使用(混合物#3)、またはる反応についてのホットスタートプライマーのみの使用および他の反応についてのレギュラープライマーのみの使用(実施例4)よりも優れた著しい改善であった。この実施例は、したがって、阻害剤を含む可能性が高い臨床材料に対する多重qPCR反応、および/またはプライマー−標的ミスマッチの場合のように、いくつかの増幅は弱いプライマー−標的ハイブリダイゼーションを示すことが予想され、他の増幅が強いプライマー−標的ハイブリダイゼーションを示すことが予想される反応を実施するための有効な方法を示す。加えて、この実施例は、ホットスタートプライマー単独を使用するPCR反応が阻害される場合(図5、nuc遺伝子標的、混合物#3)、対応するレギュラープライマーを含めることにより、ホットスタートプライマーが標的を増幅することを可能にするブーストを提供することを証明する(図5、nuc遺伝子標的、混合物#2を混合物#1と比較)。特定の理論または作用機構により拘束されることを望まないが、nucおよびmecA増幅のブースト効果と、この場合のorfXおよびIC増幅の保存された有効性との間の改善されたバランスが、ホットスタートと非ホットスタートプライマーとの間の標的配列の結合競合による可能性が高い。
【0184】
実施例6:先の実施例で用いられるプライマーの濃度を変えることにより得られる優れた結果
以下のように(表5)、orfXおよびICを標的とするアッセイのプライマーの濃度が先の実施例と同じであり、nucおよびmecAプライマー濃度を調節して、多重アッセイ反応混合物における4つの別個のアッセイの性能を最適化するように調節して、先の実施例の実験を繰り返した:
【0185】
【表5】

【0186】
orfX/SCCmec領域を、の7つのホットスタートプライマー各0.5mMマイクロモル濃度(0.5mM)を用いて増幅した。nuc遺伝子領域を、2つのホットスタートプライマー各0.105mMおよび2つの非ホットスタートプライマー(各0.175mM)を用いて増幅した。mecA遺伝子領域を、2つのホットスタートプライマー各0.105mMおよび2つの非ホットスタートプライマー各0.245mMを用いて増幅した。内部標準を、2つのホットスタートプライマー各0.15mMを用いて増幅した。容易に定量化可能な増幅が4つのチャンネル全てで得られた(図6)。
【0187】
この実施例及び先の実施例は、したがって、阻害剤を含む可能性がある臨床材料に関する多重qPCR反応を実施するためのべつの有効な方法を提供し、この場合、プライマー−標的ミスマッチの場合と同様に、弱いプライマー−標的ハイブリダイゼーションを示す増幅もあれば、強いプライマー−標的ハイブリダイゼーションを示す増幅もある。ホットスタートプライマーおよびレギュラープライマーの混合物を、ミスマッチまたは他の弱いプライマー−標的ハイブリダイゼーションが存在する可能性がある増幅に使用し、ホットスタートプライマーのみを、プライマー−標的ハイブリダイゼーションが存在する可能性がある増幅に利用する。
【0188】
実施例7:ホットスタートプライマーおよび非ホットスタートプライマーを使用し、臨床便試料中にスパイクされた細菌培養物から抽出されたDNAを標的とする多重qPCRアッセイ
細菌標的
クロストリジウム・ディフィシル株:ATCC43598(ATCC、バージニア州マナッサス)
大腸菌(Escherichia coli)(O157)株:ATCC700728(ATCC、バージニア州マナッサス)
ブドウ球菌(Staphylococcus)株:BAA1556(ATCC、バージニア州マナッサス)
【0189】
臨床便試料
凍結した残存する負の臨床便試料をHadassah Medical Center (イスラエル国エルサレム)から入手する。
【0190】
試料調製
1.単分散溶液を緩衝溶液中菌株から次のようにして調製する:
a.1つのコロニーを細菌学的ループで取り、緩衝液中で振とうする。
b.連続希釈を実施して、適切な濃度にする。
2.滅菌ピペットチップで、細菌の溶液のアリコートを除去し、便試料からの臨床用スワブ上にスパイクする。
3.上清を次いでPrep Tube中にピペットで移し、これを閉鎖し、遠心分離して、粒子状物質のレベルを減少させる。
4.上清をデカントし、残留緩衝液を除去する。
5.ペレットを溶菌緩衝液中に溶解させる。
6.Prep管を加熱ブロック上でインキュベートし、次いで遠心分離する。
7.RNaseH2溶液混合物を各Prep Tubeに添加する。
8.各Prep Tube中の溶液のアリコートを次いでqPCR反応混合物を含むPCR反応管中に移す。
【0191】
ホットスタートプライマーおよび非ホットスタートプライマー
各プライマーの2つのバージョンを設計する。第1のバージョンは、先の実施例で記載したリボプライマー構造を用いるホットスタートプライマーである。第2のバージョンは、添加されたRNA塩基、4つの相補性塩基、および3’末端でブロッキング基を含まない非ホットスタート修飾されていないプライマー構造である。
【0192】
プローブ
クロストリジウム・ディフィシル(C. Difficile)tcdB(配列番号40)、大腸菌(E. coli)eae(配列番号41)、およびスタフィロコッカス(Staphylococcus)tuf(配列番号42)に対して相補性である3つの二重標識された分子ビーコンプローブ(Biosearch Technologies Inc、カリフォルニア州ナヴァト)をそれぞれ使用する(表6)。
【0193】
【表6】

【0194】
順方向プライマー
表7〜8に示すような3セットのリボ−および非修飾順方向プライマーをそれぞれ使用する;Tcd B(配列番号43および49)、eae(配列番号45および51)、ならびにtuf(配列番号47および53)に対して相補性。
【0195】
逆方向プライマー
表7〜8に示すような3セットのリボ−および非修飾逆方向プライマーをそれぞれ使用する:Tcd B(配列番号44および50)、eae(配列番号46および52)、ならびにtuf(配列番号48および54)に対して相補性。
【0196】
実施例7で使用する順方向および逆方向ホットスタートプライマー。「−■」はブロッキング基を表す。
【0197】
【表7】

【0198】
【表8】

【0199】
RNaseH2混合物
ピロコッカス・アビシ RNaseH2エンドヌクレアーゼをIntegrated DNA Technologies, Inc.から入手する。
【0200】
PCR MasterMix
Taq Pol DNAポリメラーゼ、dNTP、Tris、KCl、MgCl2、BSAおよびスクロースを含むPCR反応混合物を使用する。
【0201】
qPCRアッセイ
3つの異なるアッセイ混合物(それぞれ、3つの分子ビーコンプローブ、PCR MasterMix、および異なるプライマーセットを含む)を調製する。第1のアッセイ混合物中のプライマーは6つの「リボプライマー」ホットスタートプライマーである。第2のアッセイ混合物中のプライマーは6つの非ホットスタートプライマーである。第3のアッセイ混合物は、6つのホットスタートプライマーおよび6つの非ホットスタートプライマーの混合物を含む。
【0202】
手順
アッセイ混合物のそれぞれを用いて多重qPCR反応を実施する。負の対照試料を実施に含め、TE中第3の多重アッセイ混合物を含み、テンプレートDNAを含まない。
【0203】
Corbett Life Science製のRotorGene 6000 System Real Time PCR装置を用いて増幅および検出反応を実施する:
1.95℃にて3分で、DNAを変性させる。
2.増幅サイクルはそれぞれ以下の3つのステップからなる:(a)95℃で20秒;(b)56℃で60秒;(c)72℃で30秒(ステップ(b)の最後で、3つの蛍光染料のそれぞれについて読み取る)。
【0204】
結果
毒性クロストリジウム・ディフィシル、病原性大腸菌およびStaphylococcusを検出するための多重qPCRアッセイを実施する。各多重アッセイは、同じ3つの異なる配列:(a)毒性クロストリジウム・ディフィシルと関連するtcd B遺伝子;(b)病原性大腸菌と関連するeae遺伝子、ならびに(c)Staphylococcus特異的tuf遺伝子を検出するために設計される。ホットスタートプライマーおよび修飾されていないプライマーの混合物の使用は、あるホットスタートPCR反応を阻害することが判明している臨床材料においてでさえも、すべての標的の効率的な増幅を可能にする。
【0205】
実施例8:種々の臨床材料中にスパイクされた培養試料から抽出された非精製DNAを標的とするホットスタートプライマーを用いる多重qPCRアッセイ材料および実験法
実験法
実施例1に類似したホットスタートプライマーのみを含む反応混合物を用い、そして先の実施例と同じqPCTプロトコルまたは類似のプロトコルを用いて、多重qPCRアッセイを実施して、MRSA株#3から抽出されたDNAを検出する。一試料をプロトコル8−1にしたがって調製し、以下の方法のうちの1つを用いてqPCR分析のために調製した試料と比較する:
MRSA株を、臨床用スワブ上に咽喉培養試料からスパイクし、そしてプロトコル8−2にしたがって試料を調製する。
MRSA株を、臨床用スワブ上に、便試料からスパイクし、そして試料を緩衝溶液中で希釈し、低速で遠心分離して、試料中の粒子状物質のレベルを減少させ、そしてプロトコル8−2にしたがって試料を調製する。
MRSA株を、臨床用スワブ上に、膣分泌物、脳脊髄液、尿、リンパ液、涙、唾液、乳、羊水、または気道、腸管もしくは泌尿生殖器の外分泌物の試料からスパイクし、そして試料を緩衝溶液中で希釈し、低速で遠心分離して、試料中の粒子状物質のレベルを減少させ、そしてプロトコル8−2にしたがって調製する。
MRSA株を喀痰試料から臨床用スワブ上にスパイクし、そして試料を緩衝溶液中で希釈し、低速で遠心分離して、試料中の粒子状物質のレベルを減少させ、そしてプロトコル8−2にしたがって試料を調製する。
MRSA株を、全血、血漿、血清試料を含む溶液中にスパイクし、試料を緩衝溶液中で希釈し、低速(全血の場合)で遠心分離して、試料中の粒子状物質のレベルを減少させる。次いで、10μlの希釈細菌コロニーを臨床用スワブ上にスパイクする代わりに、10μlの希釈細菌コロニーを、血液試料を含む試験管中に直接スパイクする以外は、プロトコル8−2にしたがって、試料を調製する。
MRSA株を、均質化された鼠径部皮膚試料または他の組織試料を含む溶液中にスパイクする。DNAを次いで抽出し、D−Tailキット(Syntezza Bioscience Ltd.、イスラエル国エルサレム)などの、組織試料からDNAを抽出するための市販のキットを用いて試料を調製する。
【0206】
プロトコル8−1:直接的細菌性DNA試料の調製
希釈された細菌コロニーの試料を取り出し、溶菌緩衝液を含む試験管中にピペットで移す。試験管を次に加熱ブロック中でインキュベートする。RNaseH2混合物を添加し、次いで結果として得られる溶液のアリコートを次いで、qPCR反応混合物を含むPCR反応管中に移す。
【0207】
プロトコル8−2:臨床用スワブ上にスパイクされた細菌DNA試料の調製
臨床用スワブ上にスパイクされた細菌DNA試料を先の実施例で記載されているようにして調製する。
【0208】
結果
MRSA株#3由来のスパイクされた鼻試料について実施例3で見られるように、orfX領域および内部標準を標的とするアッセイはPCR増幅を示す。しかし、nucおよびmecA遺伝子を標的とするアッセイはPCR阻害を示す。これらの結果はPCR阻害因子が多くの臨床材料中に存在することを示す。さらに、これらのPCR阻害因子は、本明細書中で例示されるnucおよびmecAアッセイなどの弱いプライマー−標的ハイブリダイゼーションを示すホットスタートプライマーのみのアッセイの性能に悪影響を及ぼすが、本明細書中で例示されるorfXおよび内部標準標的アッセイなどの強力なプライマー−標的ハイブリダイゼーションを示すホットスタートプライマー−のみのアッセイには及ぼさないことが示されている。
【0209】
実施例9:ホットスタートプライマーと通常のプライマーとの組み合わせは臨床材料によるqPCRの阻害を克服する
この場合は、OrfX領域およびICのためだけのホットスタートプライマーならびにnucおよびmecA遺伝子のホットスタートプライマーおよび非ホットスタートプライマーの混合物を使用して、先の実施例の実験を繰り返す。このプライマー混合物の使用により、あるホットスタートPCR反応を阻害することが示された臨床材料においても、4つの標的すべての効率的な増幅が可能になる。
【技術分野】
【0001】
本発明は、概して、所定の標的配列のホットスタートプライマーおよび非ホットスタートプライマーの混合物を含むポリメラーゼ連鎖反応(PCR)混合物、例えば多重PCR反応混合物;対象の標的ポリヌクレオチド配列の検出のためにこれを利用する方法;ならびにこれを含むキットに関する。
【背景技術】
【0002】
ポリメラーゼ連鎖反応(PCR)およびリアルタイム定量PCR
ポリメラーゼ連鎖反応(PCR)の発明により、核酸配列のインビトロ増幅が可能になった。PCRは、米国特許第US4,683,195号;第US4,683,202号;および第US4,965,188号に記載されている。
【0003】
さらに、Applied Biosystems(カリフォルニア州フォスターシティー)などの商業的製造供給元が、PCR試薬を販売し、PCRプロトコルを公開している。
【0004】
PCRは、典型的には、第1増幅サイクルにおいてテンプレートの有効な利用を可能にする初期変性ステップから開始し、続いてPCR増幅のサイクルを行う。PCR増幅の各サイクルで、二本鎖標的配列を変性させ、プライマーを変性した標的の各鎖にアニールし、そしてプライマーは、「変性」、「アニーリング」、および「伸長」ステップと呼ばれるDNAポリメラーゼの作用により伸長される。新たに合成されたPCR産物の突出末端を埋めるために、最終伸長ステップを含めることができる。増幅の特異性は、プライマーハイブリダイゼーションの特異性に依存する。プライマーは、標的核酸配列の核鎖の3’末端に存在する配列と相補性であるか、または実質的に相補性であるように選択される。
【0005】
定量PCR(「リアルタイムPCR」または「qPCR」と呼ばれる場合もある)は、2つのオリゴヌクレオチドプライマーが増幅されるDNAの側面に位置する、PCRと同じ増幅スキームを利用する。qPCRでは、反応産物が形成される際にそれらをモニタリングする。蛍光標識に依存するいくつかの方法を、リアルタイムモニタリングに用いることができる。リアルタイムモニタリングで用いられる一般的な一方法は、SYBR(登録商標)Green蛍光染料などのDNA結合蛍光染料を用いる。別の方法は、蛍光タグで一端が標識され、蛍光クエンチャー(FRETプローブ)で他端が標識された標的特異的オリゴヌクレオチドプローブを添加する。蛍光共鳴エネルギー転移(FRET)は、2つの蛍光分子間のエネルギー転移機構である。TaqMan(登録商標)変異体では、オリゴヌクレオチドの一端の蛍光標識をその特異的蛍光励起波長で励起する。この励起状態を次いでオリゴヌクレオチドの他端のクエンチャー分子標識に非放射活性的に移す。定量PCR反応では、DNA標的と結合するプローブをプライマー伸長中にプローブから切断し、それにより蛍光タグを放出して、エネルギーが転移することなくその特異的蛍光励起波長でシグナルを放出する。
【0006】
オリゴヌクレオチドFRETプローブにより放出されるシグナルは、典型的には、反応におけるPCR産物の量に正比例して増大する。各サイクルでの蛍光発光の量を記録することにより、PCR反応を、PCR産物の量における第1の有意な増加が標的テンプレートの初期量に相関する対数期中モニタリングする。出発核酸標的のコピー数が高いほど早く蛍光において有意な増加が観察される。サイクル10を越える各サイクルで測定されるベースライン値を上回る蛍光における有意な増加は、蓄積されたPCR産物の検出を示す。当業者は、米国特許第5,925,517号、第6,037,130号、第6,103,476号、第6,150,097号、第6,461,817号および第7,385,043号に記載されている分子ビーコン、エクリプスプローブ(Eclipse Probes)、およびスコーピオンプライマー(Scorpion Primer)およびサンライズプライマー(Sunrise Primer)変異体におけるような蛍光標識されたプライマーの使用をはじめとするさらなる周知方法を認識しているであろう。
【0007】
臨床材料において対象のポリヌクレオチド配列を検出するためのqPCRの使用
試験試料において対象の標的ポリヌクレオチド配列を検出するために、qPCRが使用されてきた。標的ポリヌクレオチド配列の1つの例示的タイプは、典型的には、感染性疾患について試験するために臨床材料において分析される、対象の病原体に特徴的なものである。US6664080(Klaus Pfeffer、標題“TaqMan■−PCR for the detection of pathogenic E. coli strains”)は、PCRベースのアッセイにおいて、腸毒素原性、腸管凝集性、腸管組織侵入性、腸内病原性および腸管出血性大腸菌株をはじめとする病原性大腸菌株のサブグループを検出するために有用なプローブおよびプライマーを記載している。中でも、米国特許出願第2009/0181363号、標題“Non−Invasive Detection of Fish Viruses by Real−Time PCR”、米国特許出願第2006/0177818号、標題“Method of Detection of classical swine fever”、およびその中での引用文献に記載されているように、qPCRは、ウイルスを検出するためにも用いられてきた。
【0008】
qPCRは、メチシリン耐性黄色ブドウ球菌(Staphylococcus aureus)(MRSA)などの抗生物質耐性病原体を特異的に検出するためにも用いられてきた。米国特許出願第2009/0081663号(Yosef Paitan、標題“Methods, Compositions and Kits for Detection and Analysis of Antibiotic−Resistant Bacteria”は、例えば、(a)標的細菌に対して特異的な遺伝子;(b)抗生物質耐性遺伝子;および(c)細菌ゲノムの既知領域と抗生物質耐性カセットの通常の組み込み部位との間の架橋領域を増幅する多重qPCRの使用を記載している。US6329138(Hans De Beenhouwerら、標題“Method for detection of the antibiotic resistance spectrum of mycobacterium species”は、リファンピシンおよびその類似体に対して耐性であるヒト結核菌(M.tuberculosis)株を検出するためのPCRベースのアッセイで有用なプローブおよびプライマーを記載している。US7045291(Nancy Hansonら、標題“Multiplex PCR for the detection of AmpC beta−lactamase genes”は、あるAmpCベータラクタマーゼを検出するためのプローブを記載している。US5994066、US6001564、および国際特許出願第WO/1996/008582号(Bergeronら、クレイトン大学に譲渡)は、インフルエンザ菌(H. influenzae)、肺炎桿菌(K.pneumoniae)、プロテウス・ミラビリス(P.mirabilis)、腐性ブドウ球菌(S.saprophyticus)、エンテロコッカス・フェシウム(E.faecium)、および種々のストレプトコッカス種(Streptococcus species)から選択される特定の細菌種からのblatem、blarod、blashv、blaoxa、balz、aadB、aacC1、aacC2、aacC3、aacA4、aac6’−IIa、ermA、ermB、ermC、mecA、vanH、vanX、vanB、satA、aacA−aphD、vat、vga、msrA、sulおよびintから選択される細菌の抗生物質耐性遺伝子を検出するためのプローブを記載している。米国特許出願第2004/0185478は、微生物学研究室での診断のために臨床材料から細菌性および真菌性病原体ならびにそれらの抗生物質耐性遺伝子を迅速に検出および同定するための種特異的プローブ、属特異的プローブおよびユニバーサルDNAプローブおよび増幅プライマーを記載している。Huletsky Aら(New real−time PCR assay for rapid detection of methicillin−resistant S. aureus directly from specimens containing a mixture of staphylococci. J Clin Microbiol. 2004;42(5):1875−84)も参照。
【0009】
qPCRは、とりわけUS6673541および5861504ならびに米国特許出願第2009/0023603号、第2006/0099620号、および第2008/0286773号で記載されているように、法医学試料において標的ポリヌクレオチド配列を特異的に検出するためにも用いられてきた。多くの場合、いくつかの増幅反応を多重アッセイで実施して、非常に限られた利用可能なDNA試料を最大限利用する。
【0010】
qPCRは、とりわけUS7507800および6083698ならびに米国特許出願第2005/0095592号で記載されているように、ヒトDNAマーカー、例えばBRCA1およびBRCA2を特異的に検出するためにも用いられてきた。多くの場合、いくつかの増幅反応を多重アッセイで実施して、コストおよび速度を最小限に抑える。
【0011】
PCRにおける非特異的ハイブリダイゼーション
PCRでは、非特異的増幅産物の生成が起こる可能性がある。人工物が、プライマー間またはプライマーとTaqMan(登録商標)や分子ビーコンプローブなどのプローブとの間の弱い相互作用の結果として、「プライマー−二量体」(Rychlik, 1995)および「プライマー−プローブ二量体」として表される不適切なハイブリダイゼーション産物から誘導される場合がある。プライマーの3’末端と反応ミックス中の非標的オリゴヌクレオチド鎖中の塩基との間の弱い相補性の結果として、望ましくない産物が形成される可能性がある。これにより、プライマーの非標的鎖へのアニーリングと、それに続く熱安定性DNAポリメラーゼによる非特異的二量体の開始および伸長が可能になり、望ましくない副生成物の増幅に至る。
【0012】
リアルタイムPCRでは、アッセイの感度のためにこの問題が悪化する可能性がある。この問題は、多重PCR増幅反応では、反応ミックス中に複数のプライマーセットおよびプローブが存在することにより、非特異的ハイブリダイゼーションの尤度が増大して、さらに悪化する。これらの問題は、Chou et al., 1992, Nucleic Acids Research 20(7):1717−1723でさらに議論されるように、感度およびデータ品質の低下につながる可能性がある。非特異的増幅はまた、実施できるサイクル数を減少させ、アッセイの感度を低下させる。
【0013】
「ホットスタート」法および非特異的増幅に対する他の解決策
反応の開始前に、非標的配列に結合したプライマーからの伸長産物の形成を減少させることによって、非特異的増幅を低減することができる。非特異的増幅の問題に対処する一方法は、「ホットスタート」プロトコルと呼ばれ、この方法では、温度が、必要とされるハイブリダイゼーション特異性を提供するために十分上昇するまで、1以上の重要な試薬を反応混合物に添加しない。このように、反応混合物は、反応条件が非特異的プライマーハイブリダイゼーションを許容する期間中はプライマー伸長を支援することができない。
【0014】
最初の高温インキュベーションステップ後に反応管を開け、そして失われた試薬を添加することにより、ホットスタート法を手動で実施することができる。しかし、手動ホットスタート法は、労力を要し、反応混合物の汚染のリスクも増加することは言うまでもない。反応成分を分離または隔離するためにワックスなどの熱不安定材料を使用するホットスタート法は、米国特許第5,411,876号およびChou et al., 1992(上記)に記載されている。これらの方法では、高温プレ反応インキュベーションにより熱不安定材料を融解させ、それにより試薬を混合させる。
【0015】
反応開始前に非標的配列に結合したプライマーからの伸長産物の形成を低減する別の方法は、熱可逆的な方法でDNAポリメラーゼに非共有結合する化合物を用いて、DNAポリメラーゼを阻害することによる。米国特許第5,338,671号は、DNAポリメラーゼ活性を阻害するための、熱安定性DNAポリメラーゼに対して特異的な抗体の使用を記載している。この方法の短所は、DNAポリメラーゼに特異的な抗体の産生が、特に大量では、高価であり、時間がかかることである。さらに、反応混合物に抗体を添加することは、増幅反応の再設計を必要とする可能性がある。
【0016】
米国特許第5,677,152号および第5,773,258号(David Edward Birchら、Roche Molecular Systems, Incに譲渡、どちらも標題 “Nucleic Acid Amplication Using a Reversible Inactivated Thermostable Enzyme”)は、「ホットスタートポリメラーゼ」として知られる、非特異的増幅反応を減少させる別の方法を記載している。Taqポリメラーゼ酵素は、化学修飾によって可逆的に不活性化される。酵素活性は、増幅反応前に、または増幅反応の一部として、反応混合物を高温でインキュベートすることにより回復される。非特異的増幅は減少する。なぜなら、反応混合物は、活性化高温インキュベーション前に伸長産物の形成を支援しないからである。
【0017】
米国特許出願第2004/0197800(Michael Borns、Stratageneに譲渡)は、ホットスタートおよび非ホットスタートDNAポリメラーゼのブレンドを開示している。
【0018】
非特異的増幅反応を減少させる別の方法は、米国特許出願第2005/0255486号および第2008/0038724号(Mark Behlkeら、Integrated DNA Technologies, Incに譲渡、標題“Methods for amplifying polymeric nucleic acids”に記載されている。増幅で用いられるプライマーセットは、2種のプライマーの混合物から構成されている。一方向の伸長に関しては、プライマーは、プライマーとして機能的であるが、すべて、DNAポリメラーゼによって複製できるテンプレートとして機能するそれらの能力を排除する修飾を含む。反対方向の伸長に関しては、セットは、テンプレートとして機能でき、その全長にわたってDNAポリメラーゼにより複製できる少なくとも1つプライマーを含む。プライマーセット中の少なくとも1つプライマーは核酸ポリマーとハイブリダイズする。非複製可能プライマーが核酸ポリマーとハイブリダイズし、伸長されて、核酸ポリマー由来の配列を含む伸長産物を産生し、これに対して複製可能なプライマーが次にハイブリダイズするのが好ましい。
【0019】
LG Puskasらによる論文(Reduction of mispriming in amplification reactions with restricted PCR;Genome Res. 1995;5(3):309−11)は、3’−ジデオキシ−末端コンペティターオリゴヌクレオチドを増幅混合物に添加することにより、非特異的増幅を減少させる別の方法を記載している。コンペティターオリゴヌクレオチドは、報告によると、非特異的増幅反応を阻害する。
【0020】
非特異的ハイブリダイゼーションを減少させるために修飾されたプライマー
US6,001,611(Stephen Gordon Will、Roche Molecular Systems, Incに譲渡、標題“Modified nucleic acid amplification primers”, は、一般構造:
【化1】

(式中、S1は、約5〜約50ヌクレオチドの長さのヌクレオチドの第1の配列を表し;
式中、S2は、1〜3ヌクレオチドの長さの第2の配列を表し;
式中、Nは、環外アミンを含むプリンまたはピリミジン塩基を含むヌクレオチドを表し;
式中、Rはモディファイアー基を表し、Rは環外アミンの窒素原子と共有結合し、Rは構造:
【化2】

を有する)
を有する別の種類の修飾されたオリゴヌクレオチドプライマーを記載している。
【0021】
修飾されたプライマーは報告によると、非特異的増幅、特にプライマー−二量体形成を減少させ、および/または、修飾された塩基と相補性塩基とのワトソン・クリック塩基対形成および/または修飾されたプライマーの伸長と干渉することにより、修飾されていないプライマーを用いて実施した増幅に関して意図される標的の収率を付随して増大させる。
【0022】
ホットスタートプライマー
非特異的反応を減少させるための別の機構は、「ホットスタートプライマー」として知られる、高温で活性化されるプライマーの使用である。ホットスタートプライマーの1種は、US6,482,590(Edwin Ullmanら、Aventis Behring GmbHに譲渡、標題“Method for polynucleotide amplification”、これはポリヌクレオチドにそって非効率的にしか伸長できない3’末端を有する修飾オリゴヌクレオチドを記載する)に記載されている。修飾されたヌクレオチドは、報告によれば、周囲温度でのPfuポリメラーゼ活性の3’−エキソヌクレアーゼ活性に対して比較的耐性であるが、温度が上昇するにつれてゆっくりと分解されて、修飾されたヌクレオチドが除去され、結果として、機能的プライマーがPCR反応中に徐々に導入され、それにより全体的な特異性が改善される。
【0023】
米国特許出願第2007/0128621号(Applera Corporationに譲渡)は、ステムループ構造を有し、mRNA標的に対するホットスタートプライマーとミクロRNA標的に対するレギュラープライマーとを含むmRNAおよびミクロRNA標的の多重増幅のPCR反応混合物を記載している。
【0024】
米国特許出願第2007/0281308号(Gerald Zonら、標題“Chemically Modified Oligonucleotide Primers for Nucleic Acid Amplification”は、熱により除去可能な修飾基を、好ましくは3’末端で含むプライマーを開示し、この基は、増幅の初期変性ステップ中に解離する。不活性プライマーが機能的プライマーとの混合集団中に存在する可能性がある。
【0025】
国際特許出願第WO2009/004630(Ofer Peleg of Genaphora Ltd、標題“Chimeric Primers for Improved Nucleic Acid Amplification Reactions”)、およびPelegらによる論文(The use of chimeric DNA/RNA primers in quantitative PCR for the detection of Ehrlichia canis and Babesia canis. Appl Environ Microbiol. 2009;75(19):6393−8)は、非特異的増幅反応を減少させるために用いられる別の種類のプライマーを記載している。開始ゾーンに近接した隣接しない位置にいくつかのリボヌクレオチドを組み入れるこれらのプライマーは、報告によれば、非特異的増幅産物の形成を減少させる。
【0026】
別の種類のホットスタートプライマーが、M Ailenbergらによる論文(Controlled hot start and improved specificity in carrying out PCR utilizing touch−up and loop incorporated primers (TULIPS). Biotechniques. 2000;29(5):1018−20, 1022−4)およびOK Kaboevら(PCR hot start using primers with the structure of molecular beacons(hairpin−like structure). Nucleic Acids Res. 2000;28(21):E94)(これらは、3’領域にセルフアニーリングし、重合の開始を阻害するさらなる非テンプレート5’配列を含むループプライマーを記載している)に記載されている。反応混合物を加熱すると、プライマーのループ領域は、報告によれば融解し、活性化する。
【0027】
共有結合性化学修飾を含むホットスタートプライマーも文献で記載されている。米国特許出願第2003/0119150号(Waltraud Ankenbauerら、Roche Diagnosticsに譲渡、標題“Composition and method for hot start nucleic acid amplification”は、少なくとも1つプライマーの3’末端で化学修飾を含むプライマーの使用を記載している。反応混合物はさらに、周囲温度で不活性であり、熱安定性エキソヌクレアーゼも含み、したがって修飾されたプライマーが影響を受けないまま残る。温度が上昇すると、エキソヌクレアーゼは活性になり、プライマーの3’修飾を除去し、増幅のためにプライマーを活性化する。
【0028】
米国特許出願第2003/0162199号(Alex Bonner、BioLink Partners, Incに譲渡、標題“Reversible chemical modification of nucleic acids and improved method for nucleic acid hybridization”は、標的核酸(複数可)、プライマー(複数可)またはヌクレオシド三リン酸の、熱を用いて核酸から放出することができる除去可能な保護基での修飾を記載している。化学修飾は、グリオキサール、その誘導体、3,4,5,6−テトラヒドロフタル酸無水物、3−エトキシ−2−ケトブチルアルデヒド(ケトキサール)、ニンヒドリン、ヒドロキシアセトン、シュウ酸ジエチル、メソシュウ酸ジエチル、1,2−ナフトキノン−4−スルホン酸、ピルボアルデヒド、アミド、γ−カルボキシアシルアミド、アミジン、およびカーバメートから選択することができる。
【0029】
AV Lebedevらによる論文(Hot Start PCR with heat−activatable primers: a novel approach for improved PCR performance. Nucleic Acids Res. 2008. 36(20):e131)は、1〜2個の熱不安定性4−オキソ−1−ペンチル(OXP)ホスホトリエステル(PTE)修飾基を3’末端で、そして3’末端から2番目のヌクレオチド間結合を含む別の種類のホットスタートプライマーを記載している。これらの修飾は、報告によれば、プレ反応条件下でDNAポリメラーゼプライマー伸長を損なう。高温でのOXP修飾プライマーのインキュベーションにより、対応する非修飾ホスホジエステル(PDE)プライマーを得、これは好適なDNAポリメラーゼ基質である。
【0030】
US6,794,142号(Walter J. Lairdら、Roche Molecular Systems, Incに譲渡、標題“Amplification using modified primers”)は、3つの3’末端ヌクレオチド位置内に修飾ヌクレオチドを含むホットスタートプライマーを記載し;この場合、修飾ヌクレオチドは、2’−O−メチルヌクレオチド、2’−フルオロ−ヌクレオチド、2’−アミノヌクレオチド、またはアラビノースヌクレオチドである。これらの修飾プライマーは、報告によれば、初期プライマー伸長が起こるのに必要な時間を増加させることにより、おそらくはプライマー−標的二本鎖を伸長に関してあまり好ましくないテンプレートにすることによって、非特異的増幅を減少させる。これにより、プレ反応条件下でのプライマー間などの不安定で一時的なハイブリダイゼーション二本鎖が、プライマー伸長が起こるために十分な時間存在する可能性が減少する。
【0031】
異なる種類のホットスタートプライマーがDD Youngら(Light−triggered polymerase chain reaction. Chem Commun (Camb). 2008;(4):462−4)による論文で記載されている。これらのプライマーは、UV照射により除去可能である立体的に要求が厳しいケージ作用を有する基で修飾されている。修飾されていないプライマーは、報告によれば、UV照射に暴露されるまではPCR反応を触媒することができず、その後、反応は正常に進行する。そのようなプライマーは、反応混合物がアニーリング温度まで加熱され、次いでUV照射に暴露される、ホットスタートプロトコルに好適である。
【0032】
「リボプライマー」
米国特許出願第20090325169号およびが第20100167353号(どちらもIntegrated DNA Technologies Inc.(IDT)に譲渡、標題“RNase H−Based Assay Utilizing Modified RNA Monomers”は、別の種類のホットスタートPCRプライマーである「リボプライマー」を記載している。これらのプライマーは、ホットスタート成分が熱安定性RNase Hまたはこの反応で用いられる高温で活性を獲得する他のニッキング酵素であるPCR反応ミックスに好適である。修飾プライマーは、DNAと結合する場合にRNase H2切断部位を生成する内部修飾ヌクレオチドを有する。加えて、プライマーは、3’ブロッキング基を含み、これは、ブロッキング基が除去されるまでPCRを支援するプライマーの能力を排除する。RNase H2による切断は、プライマーおよび標的の二本鎖形成を必要とし、プライミングの特異性を増大させ、これはプライマー−二量体形成の影響を減少させて、これによりバックグラウンドシグナルを低下させ、全体的な反応特異性を改善する。
【0033】
核酸増幅反応における他の種類の非機能的プライマー
多くの他の参考文献は、核酸増幅反応における非機能的または拮抗的プライマーの使用を記載している。米国特許出願第2003/0104430号および国際出願第WO00/61817号(Michael Nerenbergら、標題“Amplification and separation of nucleic acids using strand displacement amplification and bioelectronic microchip technology”)は、たとえば、バイオ電子マイクロチップ技術と組みあわせた、ストランド置換増幅(SDA)のためのプライマーミックス中の非切断性プライマーの使用を記載している。SDAは、等温性非同期性核酸増幅プロセスである。非切断性プライマーは、二本鎖テンプレートの変性前にニッキングされ、かくして固定SDAにおけるシグナル強度を改善するシグナルを保持するか、または増幅を所望の方向になるようバイアスをかけることが意図される。非切断性プライマーは、正常なSDAプライマーとの組みあわせで提供することができる。
【0034】
米国特許第5,712,386号(Chang−Ning Wangら、Biotronics Corporationに譲渡)は、プライマーとハイブリダイズするブロッキングヌクレオチドを開示している。ブロッキングヌクレオチドおよびプライマーは、0.3〜5.0のブロッキングヌクレオチド/プライマーモル比で存在し得る。
【0035】
ホットスタートプライマーを使用する多重PCR反応で増幅に失敗する問題
理想的には、コストや複雑さを最小限に抑え、できるだけはやく試験結果を得るために、qPCRアッセイは、広範なDNA精製手順を必要とすべきではなく、1つの試験管中で実施するべきである。しかし、ある種類の多重PCR、たとえば(a)抗生物質耐性病原体の検出;(b)細菌性もしくはウイルス性病原体またはヒトDNAマーカーの1以上のパネルの検出のための多重PCRスクリーニング試験;および(c)法医学試料のPCRアッセイは、この点に関して独自の課題を提示する。いくつかの増幅反応は平行して実施しなければならないので、そのような高感度アッセイで重大なシグナルを生成しやすい非特異的増幅の可能性が増大する。菌株間の配列変動は、問題をさらに複雑にする。したがって、臨床材料の多重PCR増幅を可能にする反応混合物が当該技術分野で差し迫って必要とされている。これらの問題に対処するために、リボプライマーなどのホットスタートプライマーが開発されてきた。
【0036】
しかし、本明細書中で示されるように、リボプライマーなどのホットスタートプライマーに関してさらなる問題が観察される可能性がある。これらのプライマーは、特に多重反応で、広範に精製されなかったDNA試料では1以上の標的を効率的に増幅できない可能性がある。このように、従来技術では、臨床材料の多重PCR増幅を可能にする反応混合物を提供する問題に有効に対処することができなかった。本発明の方法および組成物は、従来技術のこれらの不備を克服することを目的とする。
【発明の概要】
【発明が解決しようとする課題】
【0037】
本明細書中で以下に記載する本発明は、既存のqPCR法の限界、特に背景技術の部分で記載した不備の少なくとも一部を克服することに関する。
【0038】
本発明の実施形態は、効率的な多重PCR増幅の問題に対する簡単で経済的な解決策を提供する、プライマーベースのインビトロ核酸増幅のための方法および試薬に関する。
【0039】
本発明の一態様は、プライマーベースの増幅反応を用いた核酸配列のインビトロ増幅用キットに関し、このキットは、ホットスタートプライマーおよびレギュラープライマーの混合物(どちらも特定のアンプリコンの同じ末端に対する)を含む。異なるプライマーによって認識される配列は、同一であるか、重複するか、または重複しない可能性がある。キットは、典型的には1以上の増幅試薬、たとえば、核酸ポリメラーゼ,ヌクレオシド三リン酸、および/または好適な緩衝液を含む。さらに、キットは、増幅産物を検出するための手段などのさらなる成分を含んでもよい。
【0040】
本発明の別の態様は、核酸を増幅するための方法に関し、この方法は、ホットスタートプライマーおよびレギュラープライマーの混合物(どちらも特定のアンプリコンの同じ末端に対する)を用いてプライマーベースの核酸増幅反応を実施するステップを含む。したがって、本発明は、試料中に含まれる標的核酸を増幅するための方法であって:(a)標的核酸および1対のプライマー(ホットスタートプライマーおよびレギュラープライマーの前記混合物を含む)を含む増幅反応混合物を提供するステップ;および(b)ステップ(a)の反応混合物を核酸の増幅に好適な条件下で処理するステップを含む方法を提供する。ある実施形態では、多重PCR反応が実施されるように、複数のプライマーセットが含まれる。ある他の実施形態では、分析される試料は臨床材料由来であり、試料の核酸は広範に精製されていない。
【0041】
本発明のある実施形態では、本発明の方法および組成物は、ホットスタートプライマーおよびレギュラープライマーの混合物である、1以上の標的に対するプライマー、ならびにホットスタートプライマーのみである、1以上の他の標的に対するプライマーのどちらも使用する。
【0042】
本発明の別の態様は、ホットスタートプライマーおよびレギュラープライマーの混合物(どちらも特定のアンプリコンの同じ末端に対する)を含む増幅反応混合物に関する。
【0043】
本発明の別の態様は、不活性化化学修飾を含む少なくとも1つのホットスタートプライマーを利用するPCR増幅の改善法に関し、この場合、ホットスタートプライマーが高温で相補配列とハイブリダイズする場合、不活性化化学修飾は可逆性であり、改善は、ホットスタートプライマーと同じ標的に対する(同じ配向で、同じアンプリコンに対する)非ホットスタート/機能的プライマーを提供することからなる。別の実施形態において、改善は、ホットスタートプライマーと同じ標的に対する非ホットスタート/機能的プライマーを提供することを含む。ある実施形態では、多重PCR反応が実施されるように、複数のプライマーセットが含まれる。ある他の実施形態では、分析される試料は臨床材料由来であり、この試料の核酸は広範に精製されていない。ある実施形態では、改善は、本明細書中に記載される本発明のさらなる態様をさらに構成し得る。
【0044】
本発明の方法および組成物のある実施形態は、特にこれらは一般的に広範なDNA精製手順を必要とせず、単一の試験管中で実施することができるので、コストや複雑さの低減および試験結果の迅速な取得を可能にする。ヒト同一性を決定するためにまとめて用いることができる複数のヒトDNAマーカーの検出のために法医学試料をスクリーニングするための多重PCRでは、複数の増幅反応を平行して実施して、多くの場合、非常に限られた利用可能なDNA試料を最大限に利用する。抗生物質耐性病原体を検出するための多重PCRでは、複数の増幅反応を平行して実施し(たとえば、米国特許出願第2009/0081663号を参照)、qPCRなどの高感度法を用いて検出されやすい非特異的増幅の可能性を増大しなければならない。細菌性またはウイルス性病原体の1以上のパネルを検出するための多重PCRスクリーニング試験についても同じ要求が存在し、この場合、相対的定量的な細菌またはウイルス負荷は臨床的に関連するものである。加えて、本明細書中に提示される知見は、臨床材料が、ミスマッチまたはプライマー−標的ハイブリダイゼーション結合の弱化に寄与する他の因子が存在する場合に、PCRの効率を低下させ、ホットスタートプライマーを用いるPCRを阻害する物質を含むことが多いことを示す。これらの課題は、本発明の範囲内の特定の方法および組成物によって対処される。
【0045】
ホットスタートプライマー、たとえばリボプライマー、および類似した種類のプライマーは、プライマー−二量体形成および他の非特異的反応を低減し、したがって多重PCR反応において著しい進歩である。しかし、高度の精製に付されていない臨床材料が、リボプライマーを利用するPCR反応を阻害し得る1以上の因子を含むということがここでは意外にも見いだされた。場合によっては、阻害は、1以上の特異的増幅シグナルを減少させ、アッセイ感度に対して悪影響を及ぼす可能性がある。本発明の方法および組成物のある実施形態は、意外にも、この種の阻害を劇的に改善することが見いだされた。これらの方法および組成物が、反応の特異性を損なったり、または非特異的増幅産物を導入したりすることなく、前記阻害を克服できることは、さらに予想外であった。
【0046】
本明細書中で用いられる場合、「含む」とは、記載される所定の特徴、整数、ステップ、または成分の存在を規定するが、1以上の特徴、整数、ステップ、もしくは成分、またはそれらの群の存在または付加を排除しないと解釈される。したがって、たとえば、所与の配列を含むプライマーは、所与の配列の5’末端もしくは3’末端の一方または両方でさらなる核酸を含み得る。さらに、「含む」という用語は、「本質的に〜からなる」および「〜からなる」という用語により含まれる実施形態を包含することが意図される。同様に、「本質的に〜からなる」という用語は、「〜からなる」という用語により含まれる実施形態を包含することが意図される。
【0047】
量、濃度、または他の値もしくはパラメータが好ましい上限値および好ましい下限値のリストのいずれかとして与えられる場合、これは、範囲が個別に開示されているかどうかに関係なく、任意の上限範囲または好ましい値および任意の下限範囲または好ましい値の任意の対から形成される全範囲を具体的に開示すると理解されるべきである。数値範囲が本明細書中で記載される場合、特に明記しない限り、範囲はそれらのエンドポイント、ならびにその範囲内のすべての整数及び分数を包含することが意図される。本発明の範囲は、範囲を規定する場合、記載される具体的な値に限定されることは意図されない。
【図面の簡単な説明】
【0048】
【図1】すべてのリボプライマーを利用し、細菌試料由来の精製されたDNAを標的とするPCR増幅。この図面や後に続くすべての図面では、水平軸はサイクル数を表し、垂直軸は適切な波長の蛍光レベルを表す。
【図2A】全ホットスタートプライマーを利用し、2つのバージョン:直接抽出された細菌(「直接試料」)および鼻腔用綿棒上にスパイクされた細菌の試料(「スパイクされた鼻試料」)でMRSA株#2から抽出されたDNAを標的とするPCR増幅。
【図2B】全ホットスタートプライマーを利用し、2つのバージョン:直接試料およびスパイクされた鼻試料でMRSA株#1から抽出されたDNAを標的とするPCR増幅。
【図3A】2つの別のプライマー混合物を利用する、スパイクされた鼻試料由来のMRSA株#3から抽出されたDNAを標的とするPCR増幅。混合物#1は、全ホットスタートプライマーを含み、そして混合物#2は、ホットスタートプライマー+非ホットスタートプライマー(3つの臨床的遺伝子標的アッセイについて10%のホットスタートプライマーモル濃度)と、ICについてはホットスタートプライマーのみのセットを含む。
【図3B】内部標準標的アッセイのホットスタートプライマーおよび3つの臨床的遺伝子標的アッセイについては10%の濃度のレギュラープライマーのみを含む第3の交互プリマ−混合物を利用するスパイクされた鼻試料から誘導されたMRSA株#3から抽出されたDNAを標的とするPCR増幅。
【図4A】MRSA株#3の直接試料およびスパイクされた鼻DNA試料を標的とし、OrfXおよび内部標準アッセイに関してはホットスタートプライマーのみ、そしてmecAおよびnucに関してはレギュラープライマーのみを含む、PCR増幅。
【図4B】全ホットスタートプライマーを利用し、MRSA株#3の直接試料およびスパイクされた鼻DNA試料を標的とするPCR増幅。
【図4C】AおよびBについて記載されたPCR混合物を用いるスパイクされた鼻試料の増幅を並べた図。
【図5】スパイクされた鼻試料由来の未精製MRSA株#3を標的とするPCR増幅。多重アッセイは、ICについてはホットスタートプライマーのみ、そしてorfX、nucおよびmecAのプライマーについては3つの異なるプライマー混合物を利用する。混合物#1:80%のホットスタートプライマーおよび20%のレギュラープライマー。混合物#2:レギュラープライマーのみ(混合物#1と同じ量)。混合物#3:100%のホットスタートプライマーおよび0%のレギュラープライマー。
【図6】図5について記載したのと類似しているが、nucおよびmecA遺伝子を標的とするアッセイ用のレギュラープライマーよびホットスタートプライマーの比が最適化されたPCR増幅。
【発明を実施するための形態】
【0049】
本発明は、特定のアンプリコンの同じ末端に対するホットスタートプライマーおよび非ホットスタートプライマーの混合物を含むPCR反応混合物、例えば多重PCR反応混合物;これを用いる方法;およびこれを含むキットを提供する。
【0050】
これを可能にする範囲で、本明細書中で言及されるすべての特許、特許出願、及び刊行物は、上記のもの及び下記のもののどちらも、参照することによって本明細書中に組み込まれる。
【0051】
一般的定義
「株」という用語は、本明細書中で用いられる場合、識別可能な差異により同じ種の他の細菌とは異なる細菌種のサブセットを指す。
【0052】
一実施形態では、本発明は:a)対象の種に特徴的な標的ポリヌクレオチド配列(本明細書中では、以下、「種特異的遺伝子」と呼ぶ)を増幅できる少なくとも1つの順方向プライマーおよび少なくとも1つ逆方向プライマーを含む、プライマーのセット;およびb)活性化酵素を含むPCR反応混合物を提供し、この場合、前記順方向プライマーおよび前記逆方向プライマーの少なくとも1つは、ホットスタートプライマーおよび非ホットスタートプライマーの混合物として提供される。典型的には、反応混合物は、DNAポリメラーゼ酵素、デオキシヌクレオシド三リン酸(dNTP)、及び二価カチオン(多くの場合、マグネシウムイオン)の1以上をさらに含む。ホットスタートプライマーは、反応混合物中に存在する活性化酵素の作用により逆転される不活性化化学修飾を含む。個々のホットスタートプライマー分子は、ホットスタートプライマーがプライマーに対して相補的な配列と高温でハイブリダイズする場合に、活性化酵素の基質になる。ある実施形態では、PCR反応混合物はリアルタイムPCRに好適なプローブをさらに含む。
【0053】
いくつかの実施形態では、ホットスタートプライマーおよび非ホットスタートプライマーは、ホットスタートプライマーの非ホットスタートプライマーに対する比が1:9〜19:1(両端を含む)で存在する。最適の好ましい比の決定は、種々の多重PCRアッセイによって変わり、1つには、プライマーの非特異的結合の可能性に依存するであろう。これは次に、アッセイのプライマーの一方または両方とそれら自身、または試料中に存在する他のオリゴヌクレオチド、および/または非標的核酸配列との間の相補性の程度に主に依存するであろう。高い非特異的相補性の存在下で、非ホットスタートプライマーの割合は、典型的には20%以下、言い換えれば、ホットスタート対非ホットスタートプライマーの比が4:1〜19:1(両端を含む)に限定される。
【0054】
プライマーハイブリダイゼーションが増幅の一端のみで問題となる他のある実施形態では、非ホットスタートプライマーおよびホットスタートプライマーの混合物を増幅の一端のみについて使用し、一方、増幅の他端はホットスタートプライマーのみにより支配される。経験的方法を用いて、順方向プライマー、逆方向プライマー、または両者を、ホットスタートプライマーおよび非ホットスタートプライマーの混合物の使用のために選択するかどうかを決定することができることは、当業者には理解されるであろう。
【0055】
別の実施形態において、本発明は、:(a)第1標的ポリヌクレオチド配列を増幅するためのプライマーの第1セット;(b)第2標的ポリヌクレオチド配列を増幅するためのプライマーの第2セット;および(c)活性化酵素を含む、多重PCRのためのPCR反応混合物を提供し、ここで:
(i)第1標的ポリヌクレオチド配列の少なくとも1つの末端にハイブリダイズするプライマーはホットスタートプライマーおよび非ホットスタートプライマーの混合物であり、この場合、非ホットスタートプライマーを用いて第1標的ポリヌクレオチド配列を増幅する反応の生成物は、ホットスタートプライマーを用いる増幅の基質であり;そして
(ii)プライマーの第2セットはホットスタートプライマーからなる。
【0056】
典型的には、反応混合物は、DNAポリメラーゼ酵素、デオキシヌクレオシド三リン酸(dNTP)、およびマグネシウム、マンガン、ニッケル、またはコバルトイオンから選択される二価カチオンの1以上をさらに含む。本明細書中で「非ホットスタートプライマーを用いて[標的ポリヌクレオチド配列]を増幅する反応の生成物」、または類似の言い回しについての言及が、順方向および逆方向非ホットスタートプライマー(それらが反応混合物中に存在するならば)を用いた増幅を指すことを当業者は容易に理解するであろう。非ホットスタートプライマーが増幅の一端でのみ存在するならば、非ホットスタートプライマーを逆の配向を有する供給されたホットスタートプライマーとの組みあわせで用いる増幅を意味する。同様に、「ホットスタートプライマーを用いる増幅」、または類似の言い回しは、順方向および逆方向ホットスタートプライマー(それらが反応混合物中に存在するならば)を用いる増幅を指す。ホットスタートプライマーが増幅の一端でのみ存在するならば、ホットスタートプライマーを、逆の配向を有する供給された非ホットスタートプライマーと組みあわせて使用する増幅を意図する。
【0057】
ある実施形態では、ホットスタートプライマーは不活性化化学修飾を含み、これは反応混合物中に存在する活性化酵素の作用により逆転される。個々のホットスタートプライマーは、プライマーに対して相補性である配列にホットスタートプライマーが高温でハイブリダイズする場合、活性化酵素の基質になる。典型的には、ホットスタートプライマーおよび非ホットスタートプライマーの混合物は、ホットスタートプライマー対非ホットスタートプライマーの比が1:9〜19:1(両端を含む)で存在する。
【0058】
ある実施形態では、PCR反応混合物はリアルタイムPCRに好適なプローブをさらに含む。
【0059】
上述のように、最適の好ましい比の決定は、異なる多重PCRアッセイについて様々であり、1つには、非特異的ハイブリダイゼーションをもたらし得る標的を含有する反応混合物中に存在する相補性の程度および増幅の阻害の程度に依存するであろう。増幅の2つの末端のうちの一端だけが伸長から阻害されるようであり、阻害アッセイのホットスタートプライマーに相補性である配列の存在が低いので、阻害アッセイのための非ホットスタートプライマーの使用することで非特異的増幅の存在が実質的に増加しないある実施形態では、その位置でのホットスタート−プライマーおよび非ホットスタートプライマーの混合物が最適には非ホットスタートプライマーの大部分を含むであろう。そのような場合でも、おそらく標的配列に対するハイブリダイゼーションについて非ホットスタートプライマーと競合することにより、ホットスタートプライマーは有利には非ホットスタートプライマーが関与する増幅を減速させることが本明細書中で示されている。
【0060】
本明細書中で提示する実験の前に、DNeasy(商標)Blood & Tissue Kit(QIAGEN GmbH)を用いて精製されたDNA試料に関してリボプライマーを用いる多重PCRの実施に成功した。これらのアッセイが、たとえば、広範の精製手順を用いることなく鼻腔用綿棒からの単離された核酸などの臨床設定でうまく機能するかどうかを判定することにした。このために、精製されたDNAをボランティアの鼻腔用綿棒上にスパイクした。本明細書中で以下に記載するように、リボプライマーを用いる多重PCRを阻害した鼻腔用綿棒中に生物学的因子が存在することが見いだされた。阻害は、DNAをさらに広範の精製に付すか、またはテンプレートの量を増やすか、または単一アッセイで個々にアッセイを実施するかのいずれかにより、克服することができる。これらの解決策のそれぞれは、実施不可能および/または臨床設定で不好適であり、この不備に対処するために本発明が開発された。
【0061】
本発明のいくつかの実施形態のキットは、広範の核酸精製を必要とすることなく、実在の試料とともにうまく用いることができ、それ自体が多くの実際的利点をもたらす。たとえば、実施例2で記載するように、Detect−Ready(商標)MRSA Lysis Kit(Molecular Detection, Inc.)を用いることができる。本発明のいくつかの実施形態がPCR増幅前の試料調製を簡素化できることは、したがって、時間やヘルスケア設備の出費を節約することができる。節約された時間は、ある実施形態では、タイムリーな臨床介入と患者を救うには遅すぎる臨床介入との間の差をも意味する。他の実施形態では、試料調製を簡素化することで、試料汚染の機会も減少する。
【0062】
本明細書中、実施例で提供するようにプライマー−標的ミスマッチを含む標的ポリヌクレオチド配列のホットスタートプライマーqPCR増幅は、明らかに弱い(実施例1)。この阻害は、広範の精製(実施例2)に付されていない臨床材料由来の核酸に対して実施された多重PCRにおいても観察することができる。「〜に由来する」とは、この文脈では、任意の形態の均質化、溶媒もしくは溶液中の溶解、分画、またはそれらの組みあわせを、単独またはPCR増幅に好適な試料を臨床材料から生成させることができる任意の他の適切な手段と組みあわせて包含することが意図される。本発明の方法および組成物のある実施形態は、意外にも、あるPCT反応においてリボプライマーで観察される阻害を劇的に改善することが見いだされた。
【0063】
いくつかの実施形態では、本発明の方法および組成物は、広範の精製に必ずしも付されてない臨床材料由来の核酸調製に用いられる。たとえば、非限定的実施形態において、本発明の方法および組成物は、2.0未満のA260/A280比を有する試料とともに使用するために好適である(A260/A280比は核酸調製の純度の尺度である)。別の実施形態において、本発明の方法および組成物は、1.9未満のA260/A280比を有する試料とともに使用するために好適である。別の実施形態において、本発明の方法および組成物は、1.8未満のA260/A280比を有する試料とともに使用するために好適である。別の実施形態において、本発明の方法および組成物は、1.7未満のA260/A280比を有する試料とともに使用するために好適である。別の実施形態において、本発明の方法および組成物は、1.0〜2.0のA260/A280比を有する試料とともに使用するために好適である。別の実施形態において、本発明の方法および組成物は、1.0〜1.9のA260/A280比を有する試料とともに使用するために好適である。別の実施形態において、本発明の方法および組成物は、1.0〜1.8のA260/A280比を有する試料とともに使用するために好適である。別の実施形態において、本発明の方法および組成物は、1.0〜1.7のA260/A280比を有する試料とともに使用するために好適である。それぞれの可能性は本発明の別の実施形態であると見なすことができる。
【0064】
臨床材料に関する多重PCRのさらなる潜在的な危険性を実施例4で示し、これは、ホットスタートプライマーのみを利用する増幅が、レギュラープライマーのみを利用する他の増幅の存在下で阻害される可能性が高いことを示す。同じ検体を用いて個々に実施する場合、増幅は阻害されなかった(データは不掲載)。特定の理論または作用機構により拘束されることを望まないが、この場合のホットスタート増幅の阻害は、反応管中のdNTPなどのリソースについての増幅間の競合によると考えられる。
【0065】
本明細書中でさらに提供されるように、1つの増幅のためのホットスタートプライマー
およびレギュラープライマーの混合物の使用は、レギュラープライマーおよびホットスタートプライマーが同じ標的配列を認識するか(実施例5〜6)またはレギュラープライマーがホットスタートプライマーの側面に位置するネスト化構造で設計されているか(実施例3)にかかわらず、多重qPCRにおいてリボプライマーを使用する限界を克服し、すべての標的の効率的な増幅を可能にする。さらに、本発明のいくつかの実施形態は、本発明者らが知っている従来技術の解決策に対して、臨床材料由来の未精製核酸から増幅することができるアンプリコンの数を増大させ、それによりコストを著しく低下させ、アッセイ速度を増大させる。
【0066】
特定の標的ポリヌクレオチド配列を増幅させるためのプライマーのセットを含む反応混合物もここでは提供され、この場合、標的配列の少なくとも1つの末端を増幅するためのプライマーは、10〜95%のホットスタートプライマーおよび5〜90%の非ホットスタートプライマーの混合物を含む。本明細書中で提供されるように、そのような反応混合物は、ホットスタートプライマー単独または非ホットスタートプライマー単独のいずれかを含む混合物よりも優れた特性を示す。
【0067】
たとえば、標的配列を増幅するための順方向プライマーセットは、ホットスタートプライマーおよび非ホットスタートプライマーの混合物から構成され得る。別の実施形態において、逆方向プライマーセットは、ホットスタートプライマーおよび非ホットスタートプライマーの混合物から構成される。他の実施形態では、順方向及び逆方向プライマーセットはどちらもホットスタートプライマーおよび非ホットスタートプライマーの混合物から構成される。それぞれの可能性は、本発明の別の実施形態であると見なすことができる。
【0068】
別の実施形態において、細菌性「架橋領域」の順方向プライマーについて本明細書中で例示されるように、配列変動は、複数の順方向プライマーおよび/または複数の逆方向プライマーを配列変異体の増幅のために必要とする可能性がある。この場合、ある実施形態では、交互プライマーの各プライマーセット(プライマーのセットは、この場合、特定の配列変異体を認識するプライマーを示すために用いられる)は、ホットスタートプライマーおよび非ホットスタートプライマーの所定の比での混合物である。ある他の実施形態では、交互プライマーのセットの1以上は、ホットスタートプライマーから構成され、一方、交互プライマーの他のセットは、ホットスタートプライマーおよび非ホットスタートプライマーの所定の比での混合物を含む。典型的には、ホットスタート:非ホットスタート混合物比は交互プライマーの各セットについて同じである。それぞれの可能性は、本発明の別の実施形態であると見なすことができる。
【0069】
本明細書中で提供されるように、非ホットスタートプライマーを使用する増幅産物が、ホットスタートプライマーを使用する増幅の基質である本発明の反応混合物は、特に有効である。ある実施形態では、本明細書中の実施例で示されるように、非ホットスタートプライマーの相補配列は、ホットスタートプライマーの相補配列の側面に位置する可能性がある(「ネスト化構造」)。他の実施形態では、非ホットスタートプライマーが1つの配向でのみ存在するならば、非ホットスタートプライマーは、対応するホットスタートプライマーの上流の配列を結合することができる。他の実施形態では、本明細書中の実施例で示されるように、非ホットスタートプライマーの相補配列は、ホットスタートプライマーの相補配列と重複し得るか、またはホットスタートプライマーの相補配列と同一であり得る。場合によっては、ホットスタートプライマーは、ホットスタート修飾以外は非ホットスタートプライマーと同一であり得る。たとえば、CGCATGACCCAAGGGCArAAGCG−■(配列番号5)は、配列CGCATGACCCAAGGGCAAAGCG(配列番号35)と、リボヌクレオシド残基(「リボ塩基」)およびブロッキング基が前者において存在する以外は同一である。他の実施形態では、ホットスタートプライマーは、非ホットスタートプライマーと、とりわけ配列対5と18および12と25によりそれぞれ本明細書中で例示されるように、ホットスタート修飾およびリボ塩基に対して3’側のさらなる相補配列以外は同一であり得る。本明細書中で提示される知見を考慮して、非ホットスタートプライマーの増幅産物がホットスタートプライマーを用いた増幅の基質であるとすると、本発明の方法及び組成物の有効性は、非ホットスタートプライマーおよびホットスタートプライマーの標的配列の正確な関係に依存しないことは、当業者には理解されるであろう。それぞれの可能性は本発明の別の実施形態であると見なすことができる。
【0070】
別の実施形態において、プライマーの第1セットに加えて、PCR反応混合物は、異なる標的ポリヌクレオチド配列を標的とするプライマーの第2セットを含む。第2標的ポリヌクレオチド配列は当該技術分野で公知の任意の標的配列であり得ることは当業者には明かであろう。
【0071】
いくつかの非限定的実施形態において、典型的には、これもまた1:9〜19:1のホットスタートプライマー対非ホットスタートプライマー比で存在する、異なるポリヌクレオチド配列に対する別のホットスタートプライマーおよび非ホットスタートプライマーの混合物を用いることができる。他の実施形態では、本明細書中で記載される他の比のいずれかを用いることができ、そのそれぞれは本発明の別の実施形態を構成する。本明細書中、実施例3および5で記載するように、ホットスタートプライマーのみであるプライマーセットを含み、ホットスタートプライマーおよび非ホットスタートプライマーの混合物である他のプライマーセットを含み、各プライマーセットが異なる核酸標的を標的とするプライマーセットを含む多重増幅反応は、ホットスタートプライマーPCRの阻害物質を含む可能性がある臨床材料中の抗生物質耐性病原体株を検出するアッセイにより例示されるように、臨床材料に関する多重PCRにおいて特に有効であることが示されている。
【0072】
たとえば、第2標的ポリヌクレオチド配列を増幅するための順方向プライマーは、ホットスタートプライマーおよび非ホットスタートプライマーの混合物から構成される可能性がある。別の実施形態において、逆方向プライマーは、ホットスタートプライマーおよび非ホットスタートプライマーの混合物から構成される。他の実施形態では、順方向プライマーおよび逆方向プライマーはどちらもホットスタートプライマーおよび非ホットスタートプライマーの混合物から構成される。それぞれの可能性は本発明の別の実施形態であると見なすことができる。
【0073】
別の実施形態において、プライマーの第1および第2セットに加えて、PCR反応混合物は異なる標的ポリヌクレオチド配列を標的とするプライマーの第3セットを含む。第3の標的ポリヌクレオチド配列が当該技術分野で公知の任意の標的配列であり得ることは、当業者には明かであろう。
【0074】
さらなる非限定的実施形態では、標的ポリヌクレオチド配列の少なくとも一端とハイブリダイズするプライマーの第3セット中のプライマーは、ホットスタートプライマーおよび非ホットスタートプライマーの混合物である。典型的には、この混合物もまた、1:9〜19:1(両端を含む)のホットスタートプライマー対非ホットスタートプライマーで存在する。他の実施形態では、本明細書中で記載する他の比のいずれかを用いることができ、そのそれぞれが本発明の別の実施形態を構成する。たとえば、順方向プライマーは、ホットスタートプライマーおよび非ホットスタートプライマーの混合物から構成され得る。別の実施形態において、逆方向プライマーは、ホットスタートプライマーおよび非ホットスタートプライマーの混合物から構成される。他の実施形態では、順方向プライマーおよび逆方向プライマーはどちらもホットスタートプライマーおよび非ホットスタートプライマーの混合物から構成される。それぞれの可能性は本発明の別の実施形態であると見なすことができる。
【0075】
本明細書中、実施例3および5で記載するように、多重qPCRにおいて3つの異なる標的ポリヌクレオチド配列(アンプリコン)を標的とするホットスタートプライマーおよび非ホットスタートプライマーの混合物を、第4のアンプリコン標的とするホットスタートプライマーのみとともに含む多重増幅反応は、ある増幅反応がミスマッチおよび/またはあるハイブリダイゼーションを阻害する可能性がある試料中の物質に対して感受性である多重PCRにおいて効率的に機能した。
【0076】
さらなる非限定的実施形態では、本発明のPCR反応混合物または方法は、3つのプライマーセットを含み、それぞれは異なるアンプリコンを増幅することができる。別の実施形態において、本発明のPCR反応混合物または方法は4つのプライマーセットを含み、それぞれは異なるアンプリコンを増幅することができる。更に別の非限定的実施形態において、本発明のPCR反応混合物または方法は5つのプライマーセットを含み、それぞれは異なるアンプリコンを増幅することができる。本発明のさらに別の実施形態では、本発明のPCR反応混合物または方法は6つのプライマーセットを含み、それぞれは異なるアンプリコンを増幅することができる。本発明のさらに別の実施形態では、本発明のPCR反応混合物または方法は6以上のプライマーセットを含み、それぞれは異なるアンプリコンを増幅することができる。本発明のさらに別の実施形態では、本発明のPCR反応混合物または方法は6〜500(両端を含む)のプライマーセットを含み、それぞれは異なるアンプリコンを増幅することができる。実施例1〜6は4つのプライマーセットを含むPCR混合物を提示し、それぞれは異なるDNA標的を増幅することができる。当業者には知られているように、Rotor−Gene(登録商標)Q(Qiagen)およびLightCycler(登録商標)(Roche Molecular Detection)などの装置は、6セットまでのプライマーを含む多重PCR反応の実施を可能にし、FLEXMAP 3D(商標)(Luminex Corporation)は500までの異なるPCRプライマーセットを用いる多重PCRを可能にする。
【0077】
本発明の方法および組成物は、典型的には1:9〜19:1(両端を含む)のホットスタートプライマー対非ホットスタートプライマー比で存在する、特定のポリヌクレオチド配列に対するホットスタートプライマーおよび非ホットスタートプライマーの1以上の混合物を含むことを記載した。さらに具体的な実施形態では、ホットスタートプライマーおよび非ホットスタートプライマーの各混合物(言い換えれば、特定のアンプリコンの各末端に対する混合物)は1:5および19:1(両端を含む)のホットスタートプライマー対非ホットスタートプライマー比で存在する。他の実施形態では、ホットスタートプライマーおよび非ホットスタートプライマーの各混合物は、1:4〜14:1(両端を含む)のホットスタートプライマー対非ホットスタートプライマー比で存在する。他の実施形態では、ホットスタートプライマーおよび非ホットスタートプライマーの各混合物は、1:3〜14:1(両端を含む)のホットスタートプライマー対非ホットスタートプライマー比で存在する。他の実施形態では、ホットスタートプライマーおよび非ホットスタートプライマーの各混合物は1:2〜14:1(両端を含む)のホットスタートプライマー対非ホットスタートプライマー比で存在する。他の実施形態では、ホットスタートプライマーおよび非ホットスタートプライマーの各混合物は1:1〜14:1(両端を含む)のホットスタートプライマー対非ホットスタートプライマー比で存在する。他の実施形態では、ホットスタートプライマーおよび非ホットスタートプライマーの各混合物は1:1〜9:1(両端を含む)のホットスタートプライマー対非ホットスタートプライマー比で存在する。他の実施形態では、ホットスタートプライマーおよび非ホットスタートプライマーの各混合物は2:1〜14:1(両端を含む)のホットスタートプライマー対非ホットスタートプライマー比で存在する。他の実施形態では、ホットスタートプライマーおよび非ホットスタートプライマーの各混合物は2:1〜9:1(両端を含む)のホットスタートプライマー対非ホットスタートプライマー比で存在する。他の実施形態では、ホットスタートプライマーおよび非ホットスタートプライマーの各混合物は3:1〜9:1(両端を含む)のホットスタートプライマー対非ホットスタートプライマー比で存在する。他の実施形態では、ホットスタートプライマーおよび非ホットスタートプライマーの各混合物は4:1〜9:1(両端を含む)のホットスタートプライマー対非ホットスタートプライマー比で存在する。それぞれの可能性は本発明の別の実施形態であると見なすことができる。
【0078】
いくつかの実施形態では、本発明の方法および組成物において用いられる二価カチオンは、反応混合物の他の成分と別々に貯蔵及び/または提供され、テンプレートが添加される後まで保留され得る。他の実施形態では、二価カチオンは反応混合物の他の成分とともに提供される。
【0079】
qPCRおよび他のサイクル閾値増幅反応アッセイ
本明細書中で提供する開示を考慮して、本発明の方法は、定量的(「リアルタイム」)または非定量的のいずれであっても、任意の種類のPCR反応に好適であることは当業者には理解されるであろう。ある実施形態では、本発明の方法は、リアルタイムPCRがその非限定的実施形態として提供される、閾値増幅反応に特に好適である。「閾値増幅反応」とは、閾値レベルより高い特定の標的配列の増幅が達成されるサイクル数などの閾値を決定する核酸増幅反応を指す。非限定的な一実施形態では、蛍光標識されたプローブを用いて増幅をモニタリングする。別の実施形態において、増幅をモニタリングするための当該技術分野で公知の任意の他の手段、たとえば二本鎖DNA結合色素、たとえばSYBR Greenが用いられる。それぞれの可能性は本発明の別の実施形態であると見なすことができる。
【0080】
試験試料中の対象の配列を検出するためのqPCRベースのアッセイ
qPCRは、当該技術分野で周知である。qPCR反応混合物は、典型的には、4つの天然に存在するデオキシヌクレオシド三リン酸(dNTP);二価カチオン、およびポリメラーゼ酵素を含む。最も多くの場合、二価カチオンはマグネシウムイオンである。ある実施形態では、好熱性DNAポリメラーゼ酵素が用いられる。qPCRは、ヒト動物標的核酸配列ならびに種々の用途で病原体について特異的な配列を検出するために用いられてきた。
【0081】
標的ポリヌクレオチド配列の例示的な一種は、典型的には臨床材料中で分析される、対象の病原体に特徴的なポリヌクレオチド配列である。病原体一般および特に抗生物質耐性病原体の両方を検出するためのqPCRベースのアッセイの使用は当該技術分野で周知であり、たとえば、US6664080(Klaus Pfeffer、標題“TaqMan(商標)−PCR for the detection of pathogenic E. coli strains”);米国特許出願第2009/0081663(Yosef Paitan、標題“Methods, Compositions and Kits for Detection and Analysis of Antibiotic−Resistant Bacteria”);US6329138(Hans De Beenhouwer et al、標題“Method for detection of the aantibiotic resistance spectrum of mycobacterium species”);US7045291(Nancy Hansonら、標題“Multiplex PCR for the detection of AmpC beta−lactamase genes”;US5994066および6001564(Bergeronら、クレイトン大学に譲渡);ならびに国際特許出願第WO/1996/008582号および米国特許出願第2004/0185478号(それぞれBergeronら)で記載されている。これらの特許および出願のそれぞれは、参照することによって本明細書中に組み込まれる。
【0082】
別の具体的な用途は、たとえばヒトの同一性を究明するために用いることができるDNAマーカーなどの法医学試料中の標的ポリヌクレオチド配列を検出するためのqPCRベースのアッセイの使用である。そのような方法は、当該技術分野で周知であり、とりわけ、US6673541および5861504ならびに米国特許出願第2009/0023603号、第2006/0099620号、および第2008/0286773号(参照することによって本明細書中に組み込まれる)で記載されている。多くの場合、複数の増幅反応を平行して実施して、非常に限られた利用可能なDNA試料を最大限に利用する。
【0083】
別の具体的な用途は、qPCRにより、たとえば、BRCA1およびBRCA2などの疾患および罹病性のヌクレオチドマーカーなどの標的ポリヌクレオチド配列を検出するためのqPCRベースのアッセイの使用である。そのような方法は、当該技術分野で周知であり、とりわけ、US7507800および6083698ならびに米国特許出願第20050095592号(参照することによって本明細書中に組み込まれる)で記載されている。
【0084】
水和低減PCR反応混合物
本明細書中で提供する開示を考慮して、当業者は、本発明の組成物および方法が、たとえばこれらに限定されるものではないが水和低減PCR反応混合物などの通常および貯蔵安定化されたPCR反応混合物の両方と適合性であることを理解するであろう。本明細書中の実施例で使用される反応混合物を、処理して、水和を低減し、そして使用するまで室温で貯蔵した。しかし、同じでなくても非常によく似た結果を、通常のPCR反応混合物で得ることができる。したがって、一実施形態では、本発明のPCR反応混合物は水和低減PCR反応混合物である。別の実施形態において、それらは通常の反応混合物である。別の実施形態において、それらは当該技術分野で公知の任意の種類の反応混合物である。それぞれの可能性は本発明の別の実施形態であると見なすことができる。
【0085】
周囲温度安定化された水和低減PCR反応混合物は、係属中の米国特許出願第2008/0050737号でさらに記載されている。そのような混合物は、DNAポリメラーゼおよび/またはdNTPを含み、少なくとも1つ安定剤を含む緩衝液化合物も含む溶液を水和低減することにより調製され、25℃〜100℃の温度、典型的には約55℃で貯蔵される。安定剤(複数可)は、とりわけ、糖およびタンパク質、たとえばスクロースおよび/またはBSAであり得る。典型的には、1〜20%のスクロースおよび0.5〜3mg/mlのBSAが含まれる。別の実施形態において、当該技術分野で公知の、任意の他の種類の水和低減PCR混合物が利用される。別の実施形態において、当該技術分野で公知の任意の他の種類の周囲温度安定化PCR混合物が利用される。それぞれの可能性は、本発明の別の実施形態と見なすことができる。
【0086】
プライマー
「プライマー」という用語は、本明細書中で用いられる場合、天然または合成のいずれかのオリゴヌクレオチド、すなわち、ポリヌクレオチドテンプレートと二本鎖を形成する際に、核酸合成の開始点として作用することができ、一端からテンプレートに沿って伸び、したがって伸長された二本鎖(二重鎖)が形成されるものを指す。一実施形態では、ポリヌクレオチドテンプレートはDNA分子である。一実施形態では、ポリヌクレオチドテンプレートはRNA分子である。本発明のプライマーは、検出可能に標識してもよいし、または標識しなくてもよい。プライマーは、ホットスタートプライマーまたはレギュラープライマーであり得る。ホットスタートプライマーは本明細書中で後述する。「レギュラープライマー」および「非ホットスタートプライマー」という用語は、本明細書中で定義されるようなホットスタートプライマーでないプライマーを指す。特定の標的配列「についての」、特定の標的配列「に対する」、または特定の標的配列「を増幅することができる」として記載されるプライマーは、標的配列の末端に対して相補性であり、3’末端は内側に向き、したがって標的配列をPCR反応で増幅させることができる。
【0087】
「ヌクレオチド」、「ヌクレオシド」、「ヌクレオチド残基」、および「ヌクレオシド残基」という用語は、本明細書中で用いられる場合、デオキシリボヌクレオチドもしくはリボヌクレオチド残基、またはPCR反応での使用に好適なプライマーの成分としての働きをすることができる他の類似のヌクレオシド類似体を指す。そのようなヌクレオシドおよびその誘導体は、別の表示がされる場合を除いて、本明細書中で記載されるプライマーのビルディングブロックとして用いられる。本出願では、PCR反応におけるそれらの安定性または有用性を増強するために化学修飾されたヌクレオシド誘導体または塩基の利用を排除することを意味しない。ただし、化学修飾は、必要に応じて、デオキシグアニン、デオキシシトシン、デオキシチミジン、またはデオキシアデニンとしてのDNAポリメラーゼによるそれらの認識を妨害しないものとする。
【0088】
ある実施形態では、本発明の方法および組成物で使用することができるヌクレオチド類似体には、2’−O−メチル、2’−O−アリル、2’−デオキシ−2’−フルオロ、および2’,3’−ジデオキシヌクレオシド誘導体、たとえばトレオース、ロックされた核酸誘導体、二環式糖、またはヘキソース、グリセロールおよびグリコール糖などの他の糖主鎖に基づく核酸類似体、非イオン性主鎖に基づく核酸類似体、たとえばペプチド核酸、たとえばデンドリマー、櫛構造、およびナノ構造などの非線形トポロジーのこれらの核酸およびそれらの類似体、ならびにそれらの末端、糖、または核酸塩基に結合したタグ(たとえば、蛍光、官能化、または結合)を有するこれらの核酸およびそれらの類似体においてと同様に、糖が修飾された誘導体が含まれる。
【0089】
本発明の方法および組成物での使用に好適な非古典的ヌクレオチド類似体の非限定的な一例は、ロックされた核酸(LNA)ヌクレオチド類似体である。LNAヌクレオチド類似体のある実施形態は、1以上の2’−O、4’−Cメチレン結合を含む二環式核酸類似体であり、これは、C3’−エンドコンフォメーションでフラノース環を有効にロックする。このメチレン結合「ブリッジ」は、リボフラノース環の柔軟性を制限し、構造をロックして硬質の二環式フォーメーションにする。その独自の構造的コンフォメーションのために、LNAヌクレオチド類似体を含むオリゴヌクレオチドは、天然のDNAカウンターパートよりも、それらの相補性核酸に対してはるかに高い親和性および特異性を示す。LNAは、典型的には、低い塩濃度などの悪条件下でも相補性核酸とハイブリダイズする。LNAヌクレオチド類似体は市販されており、とりわけ、米国特許第6,130,038号、第6,268,490号、および第6,670,461号で記載されている。
【0090】
本発明の方法および組成物での使用に好適な非古典的ヌクレオチド類似体の別の非限定的例は、ペプチド核酸(PNA)ヌクレオチド類似体である。PNAヌクレオチド類似体のある実施形態では、DNAの負に荷電した糖−リン酸主鎖が、N−(2−アミノエチル)グリシン単位から構成される中性のポリアミド主鎖により置換されている(下図参照、図中、Bはヌクレオシド塩基を表す)。PNAの化学構造は、典型的には、ヌクレオチド塩基が天然のDNAとほぼ同じ場所に位置することを可能にし、PNAを相補性DNAまたはRNA配列とハイブリダイズさせる。PNAヌクレオチド類似体は、市販されており、とりわけ、第WO92/20702号、第WO92/20703号および第WO93/12129号の公開番号を有するPCT出願に記載されている。
【化3】

【0091】
本発明の方法および組成物での使用に好適な非古典的ヌクレオチド類似体の別の非限定的例は、グリコール核酸(GNA)ヌクレオチド類似体である(Zhang, L et al (2005) A simple glycol nucleic acid. J. Am. Chem. Soc. 127:4174−4175)。GNAヌクレオチド類似体のある実施形態は、非環式プロピレングリコールホスホジエステル主鎖を有し、そして下記構造のうちの1つ(図中、Bはヌクレオシド塩基を表す)を有する:
【化4】

【0092】
本発明の方法および組成物における使用に好適な非古典的ヌクレオチド類似体の別の非限定的例は、トレオース核酸(TNA)ヌクレオチド類似体である(Wu et al, Organic Letters, 2002, 4(8):1279−1282)。TNAヌクレオチド類似体のある実施形態は、下記構造(図中、Bはヌクレオシド塩基を表す)を有する:
【化5】

【0093】
本発明の方法および組成物における使用に好適な非古典的ヌクレオチド類似体の別の非限定的例は、二環式および三環式ヌクレオシド類似体である(Steffens et al, Helv Chim Acta (1997) 80:2426−2439;Steffens et al, J Am Chem Soc (1999) 121: 3249−3255;Renneberg et al, J Am Chem Soc (2002) 124: 5993−6002;およびRenneberg et al, Nucl Acids Res (2002) 30: 2751−2757)。
【0094】
本発明の方法および組成物における使用に好適な非古典的ヌクレオチド類似体の別の非限定的例は、リン基を主鎖中に組み入れるホスホノモノエステル(phosphonomonoester)核酸、例えば、ホスホノアセテートおよびチオホスホノアセテートヌクレオシド間結合を有する類似体である(米国特許出願第2005/0106598;Sheehan et al, Nucleic Acids Res (2003);31(14):4109−18)。他の実施形態では、シクロブチル環は、天然に存在するフラノシル環を置換する。
【0095】
本発明の方法および組成物における使用に好適な非古典的ヌクレオチド類似体の他の実施形態では、塩基が修飾されている。修飾された核酸塩基の代表的な非限定的リストには、5−メチルシトシン(5-me−C)、5−ヒドロキシメチルシトシン、キサンチン、ヒポキサンチン、2−アミノアデニン、アデニンおよびグアニンの6−メチルおよび他のアルキル誘導体、アデニンおよびグアニンの2−プロピルおよび他のアルキル誘導体、2−チオウラシル、2−チオチミンおよび2−チオシトシン、5−ハロウラシルおよびシトシン、5−プロピニル(−C=C−CH3)ウラシルおよびシトシンならびにピリミジン塩基の他のアルキニル誘導体、6−アザウラシル、シトシンおよびチミン、5−ウラシル(シュードウラシル)、4−チオウラシル、8−ハロ、8−アミノ、8−チオール、8−チオアルキル、8−ヒドロキシルならびに他の8−置換アデニンおよびグアニン、5−ハロ、特に5−ブロモ、5−トリフルオロメチルおよび他の5−置換ウラシルおよびシトシン、7−メチルグアニンおよび7−メチルアデニン、2−F−アデニン、2−アミノ−アデニン、8−アザグアニンおよび8−アザアデニン、7−デアザグアニンおよび7−デアザアデニンならびに3−デアザグアニンおよび3−デアザアデニンが挙げられる。さらなる修飾核酸塩基としては、三環式ピリミジン、例えばフェノキサジンシチジン(1H−ピリミド(5,4−b)(1,4)ベンゾキサジン−2(3H)−オン)、フェノチアジンシチジン(1H−ピリミド(5,4−b)(1,4)ベンゾチアジン−2(3H)−オン)、G−クランプ、例えば置換フェノキサジンシチジン(たとえば、9−(2−アミノエトキシ)−H−ピリミド(5,4−b)(1,4)ベンゾキサジン−2(3H)−オン)、カルバゾールシチジン(2H−ピリミド(4,5−b)インドール−2−オン)、およびピリドインドールシチジン(H−ピリド(3’,2’:4,5)ピロロ(2,3−d)ピリミジン−2−オン)が挙げられる。修飾核酸塩基には、プリンまたはピリミジン塩基が他のヘテロ環で置換されたもの、例えば7−デアザ−アデニン、7−デアザグアノシン、2−アミノピリジンおよび2−ピリドンも含まれ得る。さらなる核酸塩基としては、米国特許第3,687,808号で開示されているもの;The Concise Encyclopedia Of Polymer Science And Engineering, pages 858−859, Kroschwitz, J. I., ed. John Wiley & Sons, 1990で開示されているもの;Englisch et al., Angewandte Chemie, International Edition, 1991, 30, 613により開示されているもの;およびSanghvi, Y. S., Chapter 15, Antisense Research and Applications, pages 289−302, Crooke, S. T. and Lebleu, B., ed., CRC Press, 1993により開示されているものが挙げられる。これらの核酸塩基のうちのいくつかは、本発明の化合物の結合親和性を増大させるのに好適であるとして当業者に知られている。これらには、5−置換ピリミジン、6−アザピリミジンならびにN−2、N−6およびO−6置換プリン、たとえば2−アミノプロピルアデニン、5−プロピニルウラシルおよび5−プロピニルシトシンが含まれる。修飾された核酸塩基およびそれらの使用は、とりわけ、米国特許US3,687,808、US4,845,205;US5,130,302;US5,134,066;US5,175,273;US5,367,066;US5,432,272;US5,457,187;US5,459,255;US5,484,908;US5,502,177;US5,525,711;US5,552,540;US5,587,469;US5,594,121、US5,596,091;US5,614,617;US5,645,985;US5,830,653;US5,763,588;US6,005,096;US5,681,941;およびUS5,750,692に記載されている。
【0096】
本発明の方法および組成物における使用に好適な非古典的ヌクレオチド類似体の別の非限定的例は、天然に存在する複素環式塩基部分の1以上の代わりに多環式複素環式化合物である。多くの三環式複素環式化合物は以前に報告されている。これらの化合物は、アンチセンス適用において、標的鎖に対する修飾鎖の結合特性を増大させるために慣例的に用いられる。最も研究されている修飾は、グアノシンを標的とし、したがって、G−クランプまたはシチジン類似体と呼ばれる。第2の鎖中のグアノシンと3つの水素結合を形成する代表的なシトシン類似体としては、1,3−ジアザフェノキサジン−2−オン(Kurchavov, et al., Nucleosides and Nucleotides, 1997, 16, 1837−1846)、1,3−ジアザフェノチアジン−2−オン、(Lin, K.−Y.;Jones, R. J.;Matteucci, M. J. Am. Chem. Soc. 1995, 117, 3873−3874)および6,7,8,9−テトラフルオロ−1,3−ジアザフェノキサジン−2−オン(Wang, J.;Lin, K.−Y., Matteucci, M. Tetrahedron Lett. 1998, 39, 8385−8388)が挙げられる。オリゴヌクレオチド中に組み入れられると、これらの塩基修飾は相補性グアニンとハイブリダイズすることが示され、後者はさらに、アデニンとハイブリダイズし、拡張されたスタッキング相互作用により螺旋熱安定性を増強することが示された(米国特許付与前公開第2003/0207804号および第2003/0175906号も参照)。
【0097】
別の実施形態において、本発明の方法および組成物において用いられるプライマーは、1以上のユニバーサルヌクレオシドを含み得る。ユニバーサルヌクレオシドの非限定的例は、とりわけUS2009/0325169および2010/0167353で記載されているような5−ニトロインドールおよびイノシンである。
【0098】
ホットスタートプライマー
「ホットスタートプライマー」という用語は、本明細書中で用いられる場合、高温にさらされるまでは、不活性であるか、または低い活性を有するプライマーを指す。これらに限定されるものではないが、プライマーの3’末端で修飾ヌクレオチドを含むプライマー(例えば、米国特許第6,482,590号を参照)、ステムループまたはヘアピン構造を有するプライマー(例えば、米国特許出願第2007/0128621号を参照)、プライマーの3’末端で熱により除去可能な化学修飾を含むプライマー(例えば、米国特許出願第2007/0281308号を参照)、ブロッキングオリゴヌクレオチドに結合したプライマー(例えば、米国特許第5,712,386号を参照)、およびリボプライマー(例えば、米国特許出願第2009/0325169号および第2010/0167353号を参照)をはじめとする多種のホットスタートプライマーが当該技術分野では存在し、当業者には周知である。ホットスタートプライマーのサブセットは、多サイクル増幅の過程全体にわたって伸長可能なプライマーを徐々に生成するプライマーである。これらの種類のプライマーは、変性ステップ中に多量の伸長可能なプライマーを生成するある種のホットスタートプライマーとは対照的に、すべてのサイクルで増大した反応特異性を付与する。
【0099】
ある他の実施形態では、本発明で有用なホットスタートプライマーは、高温である際に相補配列にハイブリダイズする場合だけ、伸長可能なプライマーを生成するような修飾を含むものである。本明細書中で「リボプライマー」と総称されるこの種のホットスタートプライマーの1つの例示的非限定的サブクラスは、それらがDNAポリメラーゼのプライマーとしての働きをすることができないように可逆的に化学修飾されているものである。リボプライマーはまた、DNA標的配列とハイブリダイズする場合、本明細書中で例示されるように、結果として化学修飾の除去をもたらす、RNaseH2エンドヌクレアーゼなどのエンドヌクレアーゼによる切断の基質である。ある実施形態では、そのような修飾されたプライマーは、RNA部分を含み得、これはRNase H切断部位としての働きをする。リボプライマーの種々の実施形態を本明細書中、以下でさらに記載する。
【0100】
リボプライマーのブロッキング修飾(あるいは本明細書中では「不活性化化学修飾」とも称する)は、好ましくはRNaseH2エンドヌクレアーゼの切断部位の3’側(下流)に位置する。更に好ましくは、ブロッキング修飾はリボプライマーの3’末端に位置する。ある実施形態では、ブロッキング修飾は、本発明のオリゴヌクレオチドの3’末端から約10残基までに位置する可能性があり、続いて標的に対してほぼ非相補性でもなく完全に非相補性でもないヌクレオチド配列がある。いずれの場合も、本明細書中で定義される「リボプライマー」は、伸長のためのプライマーとしてのその適合性を排除し、エンドヌクレアーゼ(本明細書中では「活性化酵素」とも称する)の作用により逆転される修飾を含む。典型的には、逆転は、修飾の物理的除去を含む。
【0101】
他の実施形態では、「リボプライマー」という用語は、以下の修飾を含む、標準的DNAオリゴヌクレオチドプライマーの変異体を指す:少なくとも1つのRNA残基が標準的DNAオリゴヌクレオチドプライマーの3’末端で付加され、続いて少なくとも3つのさらなるDNA残基およびブロッキング基が付加される。リボプライマーのRNAおよびDNA残基によって形成されるプライマー配列は、標的DNAの配列と部分的または完全な相補性を示す。DNA標的に結合したリボプライマー内の1つのRNA残基は、典型的には、ヘテロ二重鎖をRNaseH2によるエンドヌクレアーゼ切断の基質にするために十分であり、切断はRNA残基のすぐ5’側で起こり、RNA残基自体、ならびにRNA残基に対して3’側のすべての残基および修飾を除去する。第1のRNA残基に対して3’側に位置する1以上のさらなる相補性RNA残基がリボプライマー内に存在することは、プライマーがRNaseH2によるエンドヌクレアーゼ切断の基質としての働きをする能力に、典型的には悪影響を及ぼさないことを、当業者は理解するであろう。
【0102】
別の実施形態において、本発明の方法または組成物で用いられるリボプライマーは、その内部位置で1つの2’−フルオロ−修飾残基を含む。RNase H2による切断は、典型的には、2’−フルオロ−修飾残基の5’側で起こる。別の実施形態において、リボプライマーは、2つの隣接する2’−フルオロ−修飾残基を含むRNase H2切断ドメインを含む。この実施形態では、切断は主に2’−フルオロ−修飾残基間で起こる。一実施形態では、1以上の2’−フルオロ−修飾残基はDNA残基である。別の実施形態において、1以上の2’−フルオロ−修飾残基はRNA残基である。それぞれの可能性は、本発明の別の実施形態である。
【0103】
これらに限定されるものではないが、2’−O−アルキル−修飾残基、好ましくは2’−O−メチル−修飾残基、ロックされた核酸(LNA)、2’−ENA残基(エチレン核酸)、2’−アルキル−修飾残基、2’−アミノ−修飾残基、および2’−チオ−修飾残基をはじめとする他の種類の修飾残基もリボプライマー中に存在する可能性がある。ある実施形態では、これらの修飾は、RNA残基のすぐ隣、またはそれからさらに離れた位置のいずれかの意図される酵素切断部位でRNA残基以外の残基に対してなすことができる。他の実施形態では、これらの修飾残基を、意図される酵素切断部位でRNA残基の代わりに導入することができる。1以上の具体的な実施形態では、2’−フルオロ−修飾RNA残基を2’LNA−修飾RNA残基と組み合わせて用いる。
【0104】
さらに具体的な実施形態では、RNA残基の2’−ヒドロキシ基は、前記の別の官能基のうちの1つと置換されている。他の実施形態では、意図されるRNase HのRNA残基に対してすぐ3’側のリン酸基を、ヌクレアーゼ耐性結合で置換して、RNase H酵素による異常な切断を防止する。他の実施形態では、オリゴヌクレオチドを、RNA残基の3’−リン酸基からさらに下流またはRNA残基の5’側のヌクレアーゼ耐性結合または残基で修飾する。ある実施形態では、使用されるヌクレアーゼ耐性結合は、ホスホロチオエート、ホスホロジチオエート、メチルホスホネート、またはボロネート結合から選択される。別の実施形態において、C3スペーサーなどの脱塩基残基をRNA残基に対してすぐ3’側に挿入して、異常な切断を防止する。あるいは、隣接する残基の5’炭素上の水素原子の一方または両方をメチル基などのさらに嵩高い置換基で置換して、リボヌクレオチド残基のバックグラウンド切断を阻害することができる。これらの種々の修飾の組み合わせも用いることができる。前記修飾は、当該技術分野で周知である。典型的には、そのような修飾は、AS−PCR(本明細書中で後述する)などのミスマッチ識別に使用されるPCR反応に最も有用である。
【0105】
ある実施形態では、Mn2+、Ni2+又はCo2+(Mg2+の有無を問わない)などの別の二価カチオンを、リボプライマーとともに使用されるアッセイ緩衝液中に組み入れる。本発明のある実施形態では、そのような別の二価カチオンが存在する場合、RNase H2による増強された切断が達成される。1以上の具体的な実施形態では、Mg2+と組み合わされたMn2+を、2つの隣接した2’−フルオロ−修飾残基を含むリボプライマーとともに使用することが意図される緩衝液中に含める。
【0106】
本明細書中で記載する実施形態をはじめとするリボプライマーの種々の実施形態は、米国特許出願公開第20090325169号及び第20100167353号で記載されている。
【0107】
リボヌクレオチドまたは他の修飾残基の位置は、リボプライマーがRNase H2の基質としての働きをする能力に影響を及ぼす。好ましくは、本発明の方法および組成物で用いられるリボプライマーのリボヌクレオチドまたは他の修飾残基は、その3’側で合計約1〜10個のDNA残基の側面に位置する。他の実施形態では、合計約3〜6個のDNA残基がその3’側でリボヌクレオチドまたは他の修飾残基の側面に位置する。他の実施形態では、合計約2〜5個のDNA残基がその3’側でリボヌクレオチドまたは他の修飾残基の側面に位置する。他の実施形態では、合計約3〜5個のDNA残基がその3’側でリボヌクレオチドまたは他の修飾残基の側面に位置する。他の実施形態では、合計約4〜5個のDNA残基がその3’側でリボヌクレオチドまたは他の修飾残基の側面に位置する。他の実施形態では、標的配列に対して相補性である約4〜5個のDNA残基がその3’側でリボヌクレオチドまたは他の修飾残基のすぐ隣に位置する。場合によって、標的配列に対して相補性でない1以上のさらなるDNA残基が、これらの4〜5個の相補性DNA残基に対して3’側に存在する可能性がある。
【0108】
他の実施形態では、標的配列に対して相補性である少なくとも8個のデオキシリボヌクレオチドがその5’側でリボヌクレオチドまたは他の修飾残基の側面に位置する。別の実施形態において、標的配列に対して相補性である少なくとも10個のDNA残基がその5’側でリボヌクレオチドまたは他の修飾残基の側面に位置する。他の実施形態では、標的配列に対して相補性である少なくとも12個のDNA残基がその5’側でリボヌクレオチドまたは他の修飾残基の側面に位置する。他の実施形態では、標的配列に対して相補性である8〜50個のDNA残基がその5’側で修飾残基の側面に位置する。別の実施形態において、標的配列に対して相補性である10〜50個のDNA残基がその5’側で修飾残基の側面に位置する。別の実施形態において、標的配列に対して相補性である12〜50個のDNA残基がその5’側で修飾残基の側面に位置する。場合によって、標的配列に対して相補性でない1以上のさらなるDNA残基が修飾残基の5’側に位置するこれらの相補性DNA残基の5’側に存在する可能性がある。
【0109】
前述の様に、ある実施形態では、本発明のホットスタートプライマーは、RNase Hなどのヌクレアーゼ酵素により切断されるまで、DNAポリメラーゼのプライマーとしての働きをするそれらの適合性を排除する可逆的化学修飾、例えば3’ブロッキング基を含む。ある実施形態では、ヌクレアーゼは、活性化されるようになるために、高温で切断部位の近くで正しい塩基対形成を必要とする。この文脈で「高温」という用語は、種々の実施形態で、50℃超、60℃超、70℃超、または80℃超の温度を指す。他の好ましい実施形態では、ヌクレアーゼは50〜80℃の温度で活性を示し、25℃では感知され得る活性を示さない。他の好ましい実施形態では、ヌクレアーゼは反応のアニーリング温度の活性を示し、25℃では感知され得る活性を示さない。ある他の好ましい実施形態では、ヌクレアーゼは熱安定性であり、95℃の温度で30分のインキュベーション後に活性を保持する。それぞれの可能性は本発明の別の実施形態であると見なすことができる。
【0110】
ブロッキング修飾
本明細書中で例示されるC3スペーサーは、切断前のプライマー伸長を防止し、これにより非特異的プライマー伸長を減少させる。当業者は、本明細書中で提供される開示を考慮して、C3スペーサーは単にブロッキング部分の典型例であり、種々の別のスペーサー修飾およびIntegrated DNA Technologies, Inc.(アイオワ州コーラルビル)やEurogentec North America Inc.(カリフォルニア州サンディエゴ)などの特別に合成されるオリゴヌクレオチドの商業的供給業者から容易に入手可能な他の一般的なオリゴヌクレオチド修飾は、DNAポリメラーゼによるプライマーの3’伸長をブロックすることができ、C3スペーサーの代わりにまたはC3スペーサーに加えて使用できることを認識するであろう。そのような別のブロッキング修飾としては、これらに限定されるものではないが、ヘキサンジオール、スペーサー9、スペーサー18、2’,3’−ジデオキシ−C、ジデオキシ−A、ジデオキシ−G、ジデオキシ−T、3’デオキシリボヌクレオチド残基(例えば、デオキシリボ−C、A、G、もしくはT、またはコルジセピン)、非ヌクレオチド結合、アルカン−ジオール修飾(とりわけ、米国特許第5,554,516号で記載のとおり)、3’ヒドロキシル置換(例えば、3−ヒドロキシプロピルなどのアルコールとの3’−ホスフェート、3’−トリホスフェートまたは3’−ホスフェートジエステル)、2’3’−環状ホスフェートの付加、末端RNA残基の2’ヒドロキシル置換(例えば、ホスフェートまたはトリイソプロピルシリル(TIPS)もしくはtert−ブチルジメチルシリル(TBDMS)などの立体的に嵩高い基)、および例えば、米国特許出願第2007/0218490号で記載されているような、オリゴヌクレオチドの3’末端で置換されたTIPSおよびTBDMSなどの2’−アルキルシリル基が挙げられる。嵩高い置換基はさらに、オリゴヌクレオチドの3’−末端残基の塩基上に組み入れて、プライマー伸長をブロックすることができる。他の実施形態では、ブロッキング修飾は、IBFQ(Iowa Black FQ, Integrated DNA Technologies、アイオワ州コーラルビル)、または任意の他の好適なクエンチャー部分などの蛍光クエンチャーとしての働きをすることもできる。本明細書中で提供される開示を考慮して、本発明で用いられるリボプライマーは、プライマー特異性、結合親和性または融解温度を増加または減少させるという要望などの既知PCRプライマー設計考察に基づいて、RNA残基の3’側またはブロッキング基の3’側に1以上のさらなるDNAヌクレオチド残基をさらに含み得ることを、当業者は理解するであろう。
【0111】
本明細書中で用いられるリボプライマー中に存在するC3部分は、式C33H43N2O5Pを有し、以下の構造:
【化6】

を有する。
【0112】
他の実施形態では、リボ−プライムのブロッキング基は1つのC3部分(本明細書中で後述する)である。ある実施形態では、1つのRNA残基に続いてC3部分があり、それに続いて第2のC3部分があり、それに続いて1以上のさらなるDNA残基がある。
【0113】
RNase H酵素
本発明の方法および組成物で用いられるリボプライマーのいくつかの実施形態は、典型的には熱安定性、好熱性RNase H2酵素であるRNase H2酵素を用いて活性化される。熱安定性RNase H2酵素およびこれを使用する方法は、当該技術分野で周知である(Haruki et al,Gene Cloning and Characterization of Recombinant RNase HII from a Hyperthermophilic Archaeon. Journal of Bacteriology, December 1998, p. 6207−6214.)。例示的非限定的熱安定性RNase H2酵素は、本明細書中の実施例で用いられるピロコッカス・アビシ(P.abyssi)リボヌクレアーゼH2酵素である。ピロコッカス・アビシRNaseH2は熱安定性好熱性RNaseH酵素である。RNaseH酵素は、リボヌクレオチドがデオキシリボヌクレオチドに結合する領域に結合する。結合すると、酵素はRNA残基のすぐ3’側を切断する。種々の実施形態では、本発明の方法および組成物でリボプライマーとともに用いられるRNase H2酵素のホットスタート/好熱性特性は、当該技術分野で周知のように、酵素に固有のものであるか、または可逆的化学不活性化もしくはブロッキング抗体の結果のいずれかであり得る。
【0114】
いくつかの実施形態では、洗浄剤を反応緩衝液中に含めて、RNase H2の効率を増大させる。いくつかの更に具体的な実施形態では、洗浄剤は、Triton−X100、Tween−20、および臭化セチルトリメチルアンモニウム(CTAB)から選択される。
【0115】
PCRおよびqPCR反応インキュベーションでは、RNaseH2は典型的には高温に達したら活性化されるようになり、その基質を切断することを可能にし、それによりRNA残基およびC3スペーサーに対して3’側の残基を遊離させ、増幅を可能にする。RNaseH2は、プライマー/標的マッチがリボヌクレオチドに近い領域で強力なDNA−RNA二本鎖を形成するために十分であることを必要とし、リボプライマー反応は、通常、標準的オリゴヌクレオチドプライマーよりもさらに特異的である。さらに、酵素は高温で活性化されるだけであるので、リボプライマー反応は、典型的には非特異的プライマー伸長を減少させ、かくして望ましくないヌクレオチド伸長および増幅を減少させる。
【0116】
プローブ
本明細書中で用いられる「プローブ」という用語は、一般的に検出可能に標識され、ハイブリダイゼーションにより相補性核酸配列を同定するために用いられる、天然または合成のいずれかのオリゴヌクレオチドを指す。本発明で用いられるプライマーおよびプローブは、同一または異なる配列を有し得る。「リアルタイムPCRに好適なプローブ」は、米国特許第5,925,517号、第6,037,130号、第6,103,476号、第6,150,097号、第6,461,817号および第7,385,043号(参照することによって本明細書中に組み込まれる)で記載されているものをはじめとする、標的配列の存在下、リアルタイムで検出可能なシグナルを放出する任意のプローブを指す。
【0117】
別の実施形態において、プローブは、本明細書中の実施例で用いられるような二重修飾オリゴヌクレオチドである。二重修飾オリゴヌクレオチドは当該技術分野で周知であり、そしてとりわけ、国際特許出願第WO2008/063194号および米国特許出願公開第2009/0068643号、第2009/0325169号、および第2010/0167353号で記載されている。これらとしては、TaqMan(登録商標)プローブ、Eclipse(商標)および分子ビーコンが挙げられるが、これらに限定されるものではない。例示的非限定的種類の好適なプローブは、分子ビーコンである。分子ビーコンの使用は、当該技術分野で周知であり、とりわけ、Tyagi S and Kramer FR (1996) Molecular beacons: probes that fluoresce upon hybridization. Nat Biotechnol 14, 303−308で記載されている。分子ビーコンおよびリアルタイムPCRに好適な他のプローブは、典型的には、蛍光レポーター分子を5’末端で、そしてクエンチャー分子を3’末端で含む。広範囲のフルオロフォアのいずれか1つで修飾されたプローブは市販されており、Integrated DNA Technologies, Inc.(アイオワ州コーラルビル)、Eurogentec North America Inc. (カリフォルニア州サンディエゴ)およびBiosearch Technologies Inc.(カリフォルニア州ナヴァト)などの製造業者の製品カタログに記載されている。非限定例としては、FAM、HEX、TET、ROX、Texas Red、Cy 5、TYE 665、TYE 563、Quasarカルボン酸およびQuasar活性エステルが挙げられる。当業者に周知であるように、適切なクエンチャー部分の選択は、プローブのフルオロフォアの蛍光発光により決定され、これらに限定されるものではないが、Black Hole Quencher−1、Black Hole Quencher−2、Black Hole Quencher−3、Iowa Black FQ、Iowa Black RQ−Sp、Dabcyl、Deep Dark Quencher I、Deep Dark Quencher IIおよびDeep Dark Quencher IIIが挙げられる。
【0118】
他の実施形態では、プローブは、当該技術分野で公知の任意の他の種類のプローブである。当業者は、本明細書中で提供される開示を考慮して、本発明の性能にはっきりと影響を及ぼすことなく、様々な種類のプローブを本発明の増幅反応で用いることができ、異なるフルオロフォアおよびクエンチャーの任意の組み合わせを反応混合物中のプローブのそれぞれについて容易に用いることができることを理解するであろう。それぞれの可能性は本発明の別の実施形態であると見なすことができる。
【0119】
標的配列
「標的核酸」、「標的ポリヌクレオチド」、「標的ポリヌクレオチド配列」、「標的ポリヌクレオチド分子」、および「標的遺伝子」という用語は、本明細書中では交換可能かつ同義的に使用され、プライマーがハイブリダイズすることが意図されるテンプレート核酸鎖上のヌクレオチド配列を指す。種々の実施形態では、標的配列はRNAまたはDNA鎖を含み得る。この用語は、標的遺伝子の一部または標的遺伝子全体を指す可能性がある。別の実施形態において、本発明の方法またはキットは、対象の種に特徴的な(特異的な)標的遺伝子またはポリヌクレオチド配列を増幅するためのプライマーを使用する。1対のプライマーは、それらが内側に向いた方向で配列の反対の末端とハイブリダイズするならば、PCR反応において特定の標的ポリヌクレオチド配列を増幅することができることを、当業者は容易に理解するであろう。ある実施形態では、遺伝子またはポリヌクレオチド配列は、対象の病原体におけるその配列が、一般的な微生物間で独特である任意の遺伝子またはポリヌクレオチド配列であり得る。「種特異的遺伝子」という用語は、本明細書中では一般的に、遺伝子または遺伝子間領域のいずれであっても任意の種特異的配列を指すために用いられる。ある実施形態では、プライマーとハイブリダイズする配列は、好ましくは反応混合物で独特である。
【0120】
試験試料において対象の標的配列を検出するための方法
別の実施形態において、本発明は、試験試料における2以上の標的ポリヌクレオチド配列を検出する方法を提供し、この場合、前記試験試料は臨床材料由来であり、広範に精製されておらず、当該方法は:(a)PCR反応混合物を用いて試験試料から1以上の核酸を増幅するステップ;および(b)増幅されたPCR産物を検出するステップを含み、ここで、PCR反応混合物は:i)前記第1標的ポリヌクレオチド配列の第1配列を増幅することができる、少なくとも1つの順方向プライマーおよび少なくとも1つ逆方向プライマーを含むプライマーの第1セット;およびii)前記第2標的ポリヌクレオチド配列の第1配列を増幅することができる、少なくとも1つの順方向プライマーおよび少なくとも1つ逆方向プライマーを含むプライマーの第2セットを含み、ここで、前記第1プライマーセットの前記順方向プライマーおよび前記逆方向プライマーのうちの少なくとも1つは、ホットスタートプライマーおよび非ホットスタートプライマーの混合物として提供される。好ましくは、標的ポリヌクレオチド配列の両方を増幅するために用いられるプライマーのセットは、ホットスタートプライマーおよび非ホットスタートプライマーの混合物として提供される順方向および/または前記逆方向プライマーを含む。典型的には、反応混合物は、核酸ポリメラーゼ酵素、dNTP、および二価カチオン(ほとんどの場合、マグネシウムイオン)の1以上を更に含む。ホットスタートプライマーは、反応混合物中に存在する活性化酵素の作用により逆転される不活性化化学修飾を含み得るか、または当該技術分野で公知の他の種類のホットスタートプライマーを含み得る。ある実施形態では、PCR反応混合物は、リアルタイムPCRに好適なプローブまたは二本鎖DNA結合色素をさらに含む。この方法で用いられるPCR反応混合物は、付加標的配列の増幅のためのさらなるプライマーセットをさらに含み得ることは、当業者には理解されるであろう。
【0121】
別の実施形態において、本発明は、試験試料において種特異的標的ポリヌクレオチド配列を検出する方法を提供し、当該方法は:(a)本発明の反応混合物を用いて試験試料由来の核酸に対してPCRを実施するステップ(ここで、PCRは、対象の病原体におけるその配列が一般的な微生物間で独特である配列を標的とする少なくとも1つの増幅反応を含む);および(b)増幅されたPCR産物を検出するステップを含む。
【0122】
別の実施形態において、本発明は、試験試料において種特異的標的ポリヌクレオチド配列を検出する方法を提供し、当該方法は:(a)本発明の反応混合物を用いて試験試料由来の核酸に対してリアルタイムPCRを実施するステップ(ここで、PCRにおける1つの増幅反応は、対象の病原体におけるその配列が一般的な微生物間で独特である配列を標的とする);(b)種特異的遺伝子を検出するプローブによって生成するシグナルを測定するステップ;および(c)サイクル数を標準試料と比較するステップを含む。この方法のある実施形態では、標準試料は、種特異的遺伝子を検出するプローブにより生成するシグナルがあらかじめ設定された強度を越えるシグナルサイクル数(「サイクル閾値」または「Ct値」)に関する。さらに具体的な実施形態では、Ct値が標準試料以下であるならば、配列は試験試料中に存在すると見なされる。別の実施形態において、本発明は、試験試料中の標的配列を検出するためのキットを提供する。それぞれの可能性は本発明の別の実施形態であると見なすことができる。
【0123】
種々の実施形態では、本発明のキットは、病原体特異的遺伝子、ヒトDNAマーカーまたは動物DNAマーカーであり得る。PCRによる病原体特異的配列の検出は、当該技術分野で周知であり、とりわけ、本明細書中で後述される参考文献で言及されている。
【0124】
「試験試料由来の核酸」は、対象の試験試料から誘導される核酸を指す。無傷細胞を含む試験試料が、典型的にはPCR反応を実施する前に溶解処理に付されることは、当業者には理解されるであろう。ある実施形態では、試料溶解物は、増幅反応の前に核酸精製処理に付されない。他の実施形態では、試料溶解物を粗核酸精製処理に付すことができるが、広範精製処理には付されない。本明細書中で提供されるように、本発明の方法は、非精製核酸試料の増幅で遭遇する問題を克服する。
【0125】
いくつかの実施形態では、本発明のキットは、必ずしも広範の精製に付されていない核酸試料に用いられる。
【0126】
本明細書中で用いられる場合、「広範に精製されていない」または「広範の精製に付され」ていない核酸への言及は、溶解した細胞から抽出されるが、非核酸、可溶性細胞成分の大部分から分離されない核酸を含むことが意図される。これには、細菌培養などの臨床試料または他の種類の試料から細胞をペレット化し;それらの細胞を溶解させ;そして細胞壁成分などの不溶性細胞成分を溶解した細胞から、例えば遠心分離または濾過により除去することにより得られる核酸が含まれる。
【0127】
ある実施形態では、「広範に生成されない」核酸は、2.0未満のA260/A280比を有する(A260/A280比は核酸調製の純度の尺度である)。別の実施形態において、本発明の方法および組成物は、1.9未満のA260/A280比を有する試料とともに使用するのに好適である。別の実施形態において、本発明のキットは、1.8未満のA260/A280比を有する試料とともに使用するのに好適である。別の実施形態において、本発明のキットは、1.7未満のA260/A280比を有する試料とともに使用するのに好適である。別の実施形態において、本発明のキットは、1.0〜2.0のA260/A280比を有する試料とともに使用するのに好適である。別の実施形態において、本発明のキットは、1.0〜1.9のA260/A280比を有する試料とともに使用するのに好適である。別の実施形態において、本発明のキットは、1.0〜1.8のA260/A280比を有する試料とともに使用するのに好適である。別の実施形態において、本発明のキットは、1.0〜1.7のA260/A280比を有する試料とともに使用するのに好適である。それぞれの可能性は本発明の別の実施形態であると見なすことができる。
【0128】
試験試料
「試験試料」という用語は、本明細書中で用いられる場合、標的配列を含むことが疑われる任意の試料、たとえば対象の病原体または対象のヒトもしくは動物DNAマーカーを含むことが疑われる試料を指す。ある実施形態では、試験試料はほ乳類由来の臨床材料である。ある他の実施形態では、試験試料は、ヒト由来の臨床材料である。あるいは、「臨床材料」という用語は、本明細書中で用いられる場合、ほ乳類由来の体液、組織、または任意の種類の生検を処理することから得られる検体を指す。本明細書中で提供されるように、特にプライマー−テンプレート結合が弱まっている場合、たとえばホットスタートプライマーのRNA残基の近くにプライマーテンプレートミスマッチが存在する場合、ほ乳類一般および特にヒト由来の臨床材料は、ホットスタートプライマーPCRを阻害する物質、たとえば多糖または粘液(たとえば、鼻、喀痰、咽頭、もしくは膣スワブ)を含む。非限定的典型例では、プライマーテンプレートミスマッチは、ホットスタートプライマー内のRNA残基に対してすぐ5’側のDNA残基である。
【0129】
ある実施形態では、臨床材料は体液である。別の実施形態において、臨床材料は鼻汁である。別の実施形態において、臨床材料は鼻腔用綿棒である。別の実施形態において、臨床材料は腋窩から得たスワブである。別の実施形態において、臨床材料は鼠径部から得られるスワブである。別の実施形態において、臨床材料は全血である。別の実施形態において、臨床材料は血清である。別の実施形態において、臨床材料は血漿である。別の実施形態において、臨床材料は脳脊髄液である。別の実施形態において、臨床材料は尿である。別の実施形態において、臨床材料はリンパ液である。別の実施形態において、臨床材料は涙である。別の実施形態において、臨床材料は唾液である。別の実施形態において、臨床材料は対象の乳である。別の実施形態において、臨床材料は羊水である。別の実施形態において、臨床材料は気道の外分泌物である。別の実施形態において、臨床材料は腸管の外分泌物である。別の実施形態において、臨床材料は泌尿生殖器の外分泌物である。別の実施形態において、臨床材料は、対象の標的配列についての試験を必要とする対象の鼻汁、膣分泌物、全血、血清、血漿、脳脊髄液、尿、リンパ液、涙、唾液、乳、羊水および気道、腸管または泌尿生殖器の外分泌物からなる群から選択される。それぞれの可能性は本発明の別の実施形態であると見なすことができる。
【0130】
別の実施形態において、臨床材料は対象の生検由来の組織である。典型的には、組織を、適切に(たとえば、均質化により)処理し、それをPCR増幅用の基質にする。ある実施形態では、組織は白血球である。ある実施形態では、組織は悪性組織である。ある実施形態では、組織は絨毛膜絨毛である。ある実施形態では、組織は、白血球、悪性組織、および絨毛膜絨毛からなる群から選択される。ある実施形態では、組織は、白血球、悪性組織、および絨毛膜絨毛からなる群から選択される細胞型を含む。ある実施形態では、組織は、本質的に、白血球、悪性組織、および絨毛膜絨毛からなる群から選択される細胞型からなる。それぞれの可能性は本発明の別の実施形態であると見なすことができる。
【0131】
別の実施形態において、試験試料は、法医学目的で使用され、カード上に含浸させた阻害剤を含むFTAカード上の血痕、組織、皮膚、毛包、唾液およびたばこの吸い殻を含む。
【0132】
臨床材料中の病原体を検出するための方法
本発明の具体的な一実施形態は、臨床材料中の病原体の抗生物質耐性株を検出する方法であって、当該方法は:(a)試験試料由来の核酸に関してリアルタイムPCRを実施するステップ(ここで、PCR反応混合物は本発明の反応混合物である);(b)遺伝子または遺伝子間領域(本明細書中では「病原体−特異的遺伝子」と称する)に関わらず、病原体−特異的配列および抗生物質耐性を付与するポリヌクレオチド配列(本明細書中では、「抗生物質耐性遺伝子」と称する)を検出するプローブによって生成するシグナルのCt値を測定するステップ;ならびに(c)病原体特異的遺伝子のCt値と抗生物質耐性遺伝子のCt値とを比較するステップを含む。別の実施形態において、当該方法は、「架橋領域」(抗生物質耐性遺伝子を含むエレメントの挿入の通常の地点[「挿入点」]および標的病原体のゲノム中の既知位置を連結する領域)を増幅し、そして架橋領域のCt値を測定するステップをさらに含む。別の実施形態において、本発明は、試験試料中の抗生物質耐性株を検出するためのキットを提供する。それぞれの可能性は本発明の別の実施形態であると見なすことができる。
【0133】
前記方法で用いることができる病原体−特異的遺伝子の非限定的実施形態は、黄色ブドウ球菌のnuc、Sa442、およびfemBである。これを増幅するための病原体−特異的ポリヌクレオチド配列およびプライマーは、当該技術分野において周知であり、とりわけ、米国特許出願第2009/0081663号で記載されている。抗生物質耐性遺伝子の非限定例は、mecA(GenBank受入番号AB097677)である。当業者は、抗生物質耐性に関連する遺伝子がカセットもしくはプラスミド上に位置し得るか、または病原体の染色体上に組み入れられ得ることを理解するであろう。利用できる架橋領域の非限定例は、SCCmec:orfXである。架橋領域は当該技術分野で周知であり、とりわけ、CunyおよびWitteで記載されている(PCR for the identification of methicillin−resistant Staphylococcus aureus(MRSA) strains using a single perimer pair specific for SCCmec elements and the neighbouring chromosomeborne orfX. Clin Microbiol Infect. 2005;11(10):834−7)。当該技術分野で既知の任意の病原体−特異的遺伝子、抗生物質耐性遺伝子、または架橋領域を前記方法で用いることができることは、当業者には理解されるであろう。それぞれの可能性は本発明の別の実施形態であると見なすことができる。
【0134】
前記方法において、標的病原体(「対象の病原体」)は、ある実施形態では、細菌であり得る。他の実施形態では、標的病原体はウイルスである。他の実施形態では、標的病原体は真菌である。他の実施形態では、標的病原体は原虫である。他の実施形態では、標的病原体は抗生物質耐性細菌である。他の実施形態では、標的病原体は抗生物質耐性ウイルスである。他の実施形態では、標的病原体は抗生物質耐性真菌である。他の実施形態では、標的病原体は抗生物質耐性原虫である。ある実施形態では、本明細書中で例示されるように、標的病原体は黄色ブドウ球菌である。ある他の実施形態では、本明細書中で例示されるように、標的病原体はメチシリン耐性黄色ブドウ球菌(MRSA)である。ある他の実施形態では、標的病原体はVRSA(バンコマイシン耐性黄色ブドウ球菌)、VRE(バンコマイシン耐性腸球菌)、C型肝炎ウイルス(HCV)、クロストリジウム・ディフィシル(Clostridium Difficile)である。他の実施形態では、標的病原体は当該技術分野で公知の任意の標的病原体である。それぞれの可能性は本発明の別の実施形態であると見なすことができる。
【0135】
前記方法により標的とされ得る抗生物質耐性遺伝子には、非限定例を挙げれば、mecA、vanA、vanB、vanC1、vanC2 vanC3、vanD、vanE、およびvanGが含まれる。それぞれの可能性は、本発明の別の実施形態と見なすことができる。
【0136】
別の実施形態において、抗生物質耐性遺伝子は、メチシリン、バンコマイシン、リネゾリド、ペニシリンクラスの抗生物質、セファロスポリンクラスの抗生物質、カルバペネムクラスの抗生物質、およびモノバクタムクラスの抗生物質からなる群から選択される1以上の抗生剤に対する耐性を付与する遺伝子である。別の実施形態において、当該技術分野で公知の任意の他の抗生剤に対して耐性を付与する抗生物質耐性遺伝子。それぞれの可能性は、本発明の別の実施形態と見なすことができる。
【0137】
いくつかの実施形態では、本発明のPCR反応は、対立遺伝子−特異的PCR(AS−PCR)反応である。AS−PCRは当該技術分野で周知であり、とりわけ、米国特許第5,496,699号で記載されている。
【0138】
キット
別の実施形態において、本発明は、本発明のPCR反応混合物およびその使用説明書を含む、たとえば、臨床材料中の特異的標的配列を増幅するためのキットを提供する。別の実施形態において、キットは、試験試料中の病原体を検出するために使用され、検出のための使用説明書を含む。別の実施形態において、キットは、ヒトまたは動物DNAマーカーの検出を必要とする医学用途で使用される。それぞれの可能性は本発明の別の実施形態であると見なすことができる。
【0139】
本明細書中では、特定の種特異的遺伝子を増幅するためのプライマーのセットを含む反応混合物が提供され、ここで、標的配列の少なくとも1つの末端を増幅するためのプライマーは、ホットスタートプライマーおよび非ホットスタートプライマーの両方を含む。本明細書中で提供されるように、そのような反応混合物は、ホットスタートプライマー単独または非ホットスタートプライマー単独のいずれかを含む混合物よりも優れた特性を示す。
【0140】
前記事項と併せて、本発明を非限定的に説明する以下の実施例を参照する。
【0141】
一般的に、本明細書中で用いられる命名法および本発明で用いられる実験法には、分子、生化学、微生物学、および組換えDNA技術が含まれる。そのような技術は、文献で十分に説明されている。たとえば、“Molecular Cloning: A Laboratory Manual” Sambrook et al., (2001);“Current Protocols in Molecular Biology” Volumes I−III Ausubel, R. M., ed. (1994);Ausubel et al., “Current Protocols in Molecular Biology”, John Wiley and Sons, Baltimore, Maryland (2009);Perbal, “A Practical Guide to Molecular Cloning”, John Wiley & Sons, New York (1988);Watson et al., “Recombinant DNA”, Scientific American Books, New York;Birren et al. (eds) “Genome Analysis: A Laboratory Manual Series”, Vols. 1−4, Cold Spring Harbor Laboratory Press, New York (1998);as set forth in 米国特許第4,666,828号;第4,683,202号;第4,801,531号;第5,192,659号および第5,272,057号に記載されている方法;“Cell Biology: A Laboratory Handbook”, Volumes I−III Cellis, J. E., ed. (1994);“Culture of Animal Cells −A Manual of Basic Technique” by Freshney, Wiley−Liss, N. Y. (1994), Third Edition;“Current Protocols in Immunology” Volumes I−III Coligan J. E., ed. (1994);Stites et al. (eds), “Basic and Clinical Immunology” (8th Edition), Appleton & Lange, Norwalk, CT (1994);Mishell and Shiigi (eds), “Selected Methods in Cellular Immunology”, W. H. Freeman and Co., New York (1980);特許および科学文献に広範囲に記載されている利用可能なイムノアッセイ、たとえば、米国特許第3,791,932号;第3,839,153号;第3,850,752号;第3,850,578号;第3,853,987号;第3,867,517号;第3,879,262号;第3,901,654号;第3,935,074号;第3,984,533号;第3,996,345号;第4,034,074号;第4,098,876号;第4,879,219号;第5,011,771および5,281,521号;“Oligonucleotide Synthesis” Gait, M. J., ed. (1984);“Nucleic Acid Hybridization” Hames, B. D., and Higgins S. J., eds. (1985);“Transcription and Translation” Hames, B. D., and Higgins S. J., eds. (1984);“Animal Cell Culture” Freshney, R. I., ed. (1986);“Immobilized Cells and Enzymes” IRL Press, (1986);“A Practical Guide to Molecular Cloning” Perbal, B., (1984) and “Methods in Enzymology” Vol. 1−317, Academic Press;“PCR Protocols: A Guide To Methods And Applications”, Academic Press, San Diego, CA (1990);Marshak et al., “Strategies for Protein Purification and Characterization −A Laboratory Course Manual” CSHL Press (1996);“Molecular Beacons: Probes that Fluoresce upon Hybridization”, Sanjay Tyagi1 & Fred Russell Kramer, Nature Bio技術 14, 303 −308 (1996)を参照;(すべて、全体が本明細書中で完全に記載されているかのように本明細書中に組み込まれる)。他の一般的な文献をこの文書全体にわたって提供する。この文献中の手順は、当該技術分野で周知であると考えられ、読者の便宜のために提供する。その文献に含まれるすべての情報は、参照することによって本明細書中に組み込まれる。
【0142】
実験の詳細のセクション
材料および実験法
材料
MRSA株#1: ATCC700699 (ATCC、バージニア州マナッサス)
MRSA株#2: BAA1556 (ATCC、バージニア州マナッサス)
MRSA株#3: BAA40 (ATCC、バージニア州マナッサス)
Prep Tube:分子生物学等級の水からなる、TrisおよびNa−EDTAからなる試料調製緩衝液1mlを含むドルフィン管。
Dri−Lyse Tube:分子生物学等級の水、Tris、およびNa−EDTAからなる溶菌緩衝液により水和されて、溶解溶液を形成する安定化されたアクロモペプチダーゼを含む2mlの管。
RNAse H2酵素:ピロコッカス・アビシ(Pyrococcus abyssi)リボヌクレアーゼ H2酵素をIntegrated DNA Technologies, Inc.(アイオワ州コーラルビル)から入手した。
【0143】
実験法(全実施例について一般的)
「リボプライマー」ホットスタートプライマー
本明細書中で用いられるリボプライマーは、以下の修飾を含む標準的DNAオリゴヌクレオチドプライマーの変異体である:1つのRNA残基が標準的DNAオリゴヌクレオチドプライマーの3’末端に付加され、続いて4つの相補性DNA残基およびプライマー伸長を防止するブロッキング基が付加される。RNA残基は、プライマーを高温での3’末端による切断のための基質にする。ただし、プライマーはその標的とハイブリダイズするものとする。これらの条件が満たされた場合、RNaseH2エンドヌクレアーゼは活性になり、結果として得られるヘテロ二重鎖を切断し、それによりブロッキング修飾を放出し、伸長可能なPCRプライマーを得る。
【0144】
qPCRアッセイ
qPCRをPaitanら(米国特許出願第2009/0081663号)により記載されているようにして実施した。複数のプライマーおよび二重標識された分子ビーコンプローブをMRSAで見出される3つのDNA標的に対するハイブリダイゼーションに使用した。プライマー対および合成DNAの検出のプローブを内部標準として添加した。
【0145】
対照DNA
内部標準プライマー対およびプローブに対して相補性のプラスミド中344塩基対(bp)の合成DNAを使用して、リアルタイムPCR反応の全体性を確認した。
【0146】
RNaseH2混合物
32.5ミリ単位/反応のRNaseH2エンドヌクレアーゼ(Integrated DNA Technologies, Inc.)をTris、グリセロール、NaCl、EDTAおよびTriton X100からなる緩衝液混合物中で希釈した。
【0147】
PCR MasterMix
PCR反応混合物は、DNAポリメラーゼ(Taq Pol from Jena Bioscience)、dNTP(Jena Bioscience)、Tris、KCl、MgCl2、BSAおよびスクロースを含んでいた。
【0148】
実施例1:ホットスタートプライマーを用いる多重PCRは、ある条件下で増幅の問題を示す可能性がある
材料および実験法
実施例1のプローブ及びプライマー
プローブ
表1に示すような4つの二重標識された分子ビーコンプローブを使用した;1つは黄色ブドウ球菌orfX領域に対して相補性であり(配列番号1)、第2のものは黄色ブドウ球菌特異的nuc遺伝子に対して相補性であり(配列番号2)、第3のものはmecA遺伝子に対して相補性であり(配列番号3)、そして第4のものは内部標準DNAに対して相補性である(配列番号4)。
【0149】
【表1】

【0150】
二重標識された分子ビーコンプローブをBiosearch Technologies Inc. (カリフォルニア州ナヴァト)から購入し、標準的フルオロフォアおよびクエンチャーを組み入れた。
【0151】
順方向プライマー
表2に示すような4つの順方向プライマーを使用した;1つは黄色ブドウ球菌orfX領域に対して相補性であり(配列番号5)、第2のものは黄色ブドウ球菌特異的nuc遺伝子に対して相補性であり(配列番号12)、第3のものはmecA遺伝子に対して相補性であり(配列番号14)、そして第4のものは内部標準DNAに対して相補性である(配列番号16)。各プライマーは「リボプライマー」ホットスタートプライマーであり;表中のリボヌクレオチド残基の前に「r」をつけ、下線を施す。
【0152】
逆方向プライマー
表2に示すような9つの逆方向プライマー(リボプライマーも)を使用した:6つはSCCmec遺伝子の異なる株に対して相補性であり(配列番号6〜11);7番目は黄色ブドウ球菌特異的nuc遺伝子に対して相補性であり(配列番号13);8番目はmecA遺伝子に対して相補性であり(配列番号15);そして9番目は内部標準DNAを検出するために用いられる逆方向プライマーである(配列番号17)。
【0153】
【表2】

【0154】
実験設定
13の「リボプライマー」ホットスタートプライマー、4つの分子ビーコンプローブ、内部標準DNAおよびPCR MasterMixを含むアッセイ混合物を調製し、水和低減して、55℃で2時間加熱することにより安定性を増強した。
【0155】
使用直前に、RNaseH2混合物およびMRSAの培養試料からの精製DNAを含む溶液25μlにより混合物を水和し、多重qPCR反応を実施した。
【0156】
MRSAの2つの別個の株(MRSA株#1およびMRSA株#2)を用いてアッセイを試験し、それぞれ2連で実施した。実施例#1について、各MRSA株からのDNAを、DNeasy(商標)Blood & Tissue Kit(QIAGEN GmbH)を用いて精製し、そして合計0.01ナノグラムの精製DNA(約300CFUの細菌に等しい)をそれぞれの反応について使用した。TE中アッセイ混合物を含み、テンプレートDNAを含まない負の対照試料を実施に含めた。
【0157】
Corbett Life Science製のRotorGene 6000 System Real Time PCR装置を標準的qPCRプロトコルにしたがって使用して、増幅および検出反応を実施した:
1.95℃にて3分でDNAを変性させる。
2.それぞれ以下の3つのステップを含む増幅サイクル:(a)95℃で20秒;(b)56℃で60秒;(c)72℃で30秒(ステップ (b)の最後で、4つの蛍光染料のそれぞれについて読み取った)。
【0158】
結果
メチシリン耐性黄色ブドウ球菌(MRSA)を検出するための多重qPCRアッセイを実施した。このアッセイは3つの異なる配列を検出する:メチシリン耐性と関連するmecA遺伝子(「黄色チャンネル」);黄色ブドウ球菌特異的nuc遺伝子(「オレンジ色チャンネル」);およびSCCmec:orfX、SCCmec挿入カセットと黄色ブドウ球菌ゲノムのorfX領域との間の領域(「架橋領域」とも称する)(「緑色チャンネル」)。アッセイは複数のプライマーおよびSCCmec:orfXの右端の接点のハイブリダイゼーション用の二重標識されたプローブを使用する。なぜなら、この領域は異なる黄色ブドウ球菌株間で配列変動を示すからである。プライマー対および合成DNAの検出用プローブが内部標準として含まれ(「赤色チャンネル」)、同様にテンプレートDNAのない負の対照も含まれていた。MRSAの2つの別個の株MRSA株#1および#2(それぞれ2連で実施)の培養試料から抽出された精製DNAでアッセイを実施した。nucプライマーは黄色ブドウ球菌nucに特異的な配列を認識し;したがってそれらは表皮ブドウ球菌(S. epidermis)を増幅しない。
【0159】
図1に示すように、内部標準(IC)、orfXおよびmecA遺伝子のプローブは、それぞれ、2つのMRSA株にわたってほぼ同一である正のシグナルを産生した。nuc遺伝子を標的とするプローブは正のシグナルを産生するが、株#2よりも明らかに遅れて株#1からDNAを増幅する点で、2つの株間で顕著な差を示した。2連試料は高い再現性を示した。
【0160】
2つの株の公開された配列を調べることにより、株#2は、検出アッセイで用いられる順方向および逆方向nucプライマーの両方に対する完全な相補性を形成し、一方、株#1は、逆nucプライマーのRNA塩基の1塩基前二位位置する1つのミスマッチ塩基を含むことが明らかになった。まとめると、ホットスタートプライマーを含む反応混合物は、全DNA標的を4重アッセイで増幅することができ、ミスマッチ塩基を含む1つのDNA標的は、ミスマッチ塩基を含まないDNA標的よりも明らかに弱い増幅を示した。
【0161】
実施例2:臨床的鼻腔用綿棒試料hzホットスタートプライマーを用いたPCRを阻害する可能性がある
実験法
第1の試料タイプの調製(「スパイクされた鼻試料」)
1.単分散溶液をTE中各菌株からpH8.3で、Detect−Ready(商標)MRSA Lysis Kitを用いて以下のようにして調製した:
a.1つのコロニーを滅菌細菌学的ループで取り、1mlのTE(pH8.3)緩衝液中で振とうした。
b.100μlを900μlのTE(Tris−EDTA)中に移し、次いで混合し、このステップをさらに2回繰り返すことにより、希釈を実施して、104cfu/mlの濃度に達した。
2.滅菌ピペットチップで、10μlの希釈細菌コロニー(約300cfuに等しい)を除去し、生理食塩水で湿らせた鼻腔用綿棒上にスパイクし、これでヒトボランティアの鼻孔内部を拭き取った。
3.Prep Tubeをあけ、スワブの頭部が試料調製緩衝溶液中に完全に浸されるまで、スワブを挿入した。
4.スワブを緩衝液中で10〜15秒間撹拌し(激しく、ただし管の内容物がこぼれないように注意して)、細菌を放出させた。
5.スワブを捨て、Prep Tubeをしっかり閉じた。
6.Prep Tubeを遠心分離機に入れ、10,000〜12,000gで5分間、室温にて遠心分離した。
7.遠心分離ステップ中、Dri−Lyse管を、1mlの溶菌緩衝液を添加することにより再水和した。Dri−Lyse Tubeを閉じ、5秒間ボルテックスして、溶菌液を再構成した。
8.Prep Tubeを遠心分離機から取り出し、管を反転することによって上清を注いだ。
9.管の底部に付着したペレットに触れることなく、ペレットを上方向に向けて管を水平な位置に保持しつつ、200μlのマイクロピペットで穏やかに吸引することにより、残存する緩衝液を除去した。
10.90μlの溶菌液を、それぞれのペレットを含むPrep Tubeに添加した。
11.ペレットをピペットにより管の底部から引き離した。
12.Prep Tubeを37℃にて10分間加熱ブロック中でインキュベートし、99℃で5分間加熱し、そして加熱ブロックから取り出した。
13.試料を1分間、最大速度で遠心分離した。
14.それぞれの試料を含むPrep Tubeに10μlのRNaseH2溶液混合物を添加した。
15.各Prep Tube中の25μlの溶液を次いで実施例1で前述されているqPCR反応混合物を含むPCR反応管中に移し、そして多重qPCR反応を実施例1で記載されているようにして実施した。
【0162】
第2の試料タイプの調製(「直接試料」)
10μlの希釈細菌コロニー(約300cfuに等しい)を除去し、90μlの液体を含む再水和されたDri−Lyse Tube中に直接ピペットで移した。管を次いで37℃で10分間、加熱ブロック中でインキュベートし、99℃で5分間加熱し、そして加熱ブロックから取り出した。10μlのRNaseH2混合物を添加し、その後、25μlの結果として得られた溶液を次いで実施例1で前述されたqPCR反応混合物を含むPCR反応管に移した。多重qPCR反応を実施例1で記載されているようにして実施した。
【0163】
結果
実施例1で記載したのと同じ反応混合物およびホットスタートプライマーを用いて、この場合は、広範の精製(Detect−Ready(商標)MRSA Lysis Kitを使用)をすることなく実施例1で試験した2つのMRSA菌株のそれぞれから得られた2種のDNA試料を標的として、MRSAを検出するための多重qPCRアッセイを実施した。試料の第1のタイプ(「スパイクされた鼻試料」)を臨床的鼻試料スワブ上にスパイクし、一方、第2の(「直接試料」)はスパイクしなかった。
【0164】
MRSA株#2について、4つのプローブは全て鼻および直接試料のどちらの場合も正のシグナルを生成したが;スパイクされた鼻試料は、体系的により高いサイクル数を示し、このことは増幅の遅延を示す(図2A)。これは、MRSA株#1の場合のIC、mecAおよびOrfXについても当てはまった。しかし、MRSA株#1のnuc遺伝子の増幅は、スパイクされた鼻試料において完全に阻害された(図2B)。2連の試料は、高い再現性を示した。この阻害を克服するために20を越える方法を試み、その大部分は阻害に対して影響を及ぼさなかった、および/またはアッセイ感度に対して悪影響を及ぼした(データは不掲載)。
【0165】
これらの結果は、スパイクされた鼻試料が、完全なプライマー−標的マッチの場合にはPCR反応の最適性能を妨害する成分を含み、プライマー−標的ミスマッチが存在する場合は、反応を完全に阻害することを示す。
【0166】
実施例3: ホットスタートプライマーおよびレギュラープライマーのネスト化組み合わせは、鼻腔用綿棒試料によるqPCRの阻害を克服する
実験法
プライマー
実施例3で用いられる非ホットスタート順方向及び逆方向プライマーを表3に示し、以下で記載する。
【0167】
【表3】

【0168】
実験プロトコル
2種の広範に精製されていないDNA試料を、実施例2に記載されているようにして、この場合はMRSA株#3を用いて調製した。MRSAを検出するための多重qPCRアッセイを、以下のようにしていくつかの異なる反応混合物を用いて実施した:
混合物#3−1:実施例1〜2で記載されているのと同じ反応混合物であって、ホットスタートプライマーのみを含むもの。
混合物#3−2:先の混合物においてと同じプローブおよび13のホットスタートプライマーの、nuc、orfXおよびmecA(配列番号18〜28)の11のさらなるレギュラー(非ホットスタート)非修飾オリゴヌクレオチドプライマー(それぞれ、その対応するホットスタートプライマーのモル量の10%で存在する)との混合物であって、ネスト化プライマー設計を形成する。各レギュラープライマーの配列は、対応するホットスタートプライマーよりも若干長く、ホットスタートプライマーにより標的とされる領域の1〜70塩基外側の領域に対して相補性であった。内部標準アッセイはホットスタートプライマーのみを使用した。
混合物#3−3:orfX、nuc、およびmecAの非ホットスタートネスト化プライマーのみを通常の濃度の10%(混合物#2中のレギュラープライマーと同じ濃度の100%);ICのホットスタートプライマーのみ。
【0169】
結果
スパイクされた鼻試料および直接試料を、実施例2で記載されているようにして、、この場合はMRSA株#3を用いて、広範に精製されていないDNAから調製した。MRSA株#3を選択した。なぜなら、nucを標的とするアッセイおよびmecAを標的とするアッセイの両方についてのホットスタートプライマーを用いるqPCR反応は、株#3を含む臨床鼻腔用綿棒試料に適用された場合に、実質的に損なわれることが見出されたからである。多重qRT−PCRアッセイは、この実施例の方法のセクションで記載した3つの混合物を用いて実施した。2連の試料は、高い再現性を示した。
【0170】
混合物#3−1について、先の実施例においてと同様に、ICおよびOrfXは、実施例2におけるMRSA株#1および#2で見られた結果と同様に、スパイクされた鼻試料および直接試料のどちらの場合も効率的に増幅された。mecAおよびnucでの結果は、試料の種類によって変化した。直接試料では、これらの領域は効率的に増幅され(不掲載)、一方、スパイクされた鼻試料では、mecAおよびnucの増幅は、それぞれかなり阻害され、完全に阻害された(図3A)。これらの結果は、臨床材料のPCR阻害効果がホットスタートプライマーのみを用いるアッセイでより顕著であり、プライマー標的ハイブリダイゼーションの程度に応じてその大きさが様々であることを裏付ける。この実験では、たとえば、阻害効果はorfXの場合は最小であり、mecAについてはさらに実質的であり、そしてnuc遺伝子標的アッセイについてはほぼ完全であった。混合物#3−1の負の対照も示す;この対照は、競合するチャンネルからの比較的低い競合のために、内部標準チャンネルに対して高いシグナルを示した。
【0171】
混合物#3−2については、それに反して(図3Aでも示す)、スパイクされた鼻試料において3つの実験チャンネル全てに関して強固な増幅が観察された。これらの結果は、ホットスタートプライマーおよび非ホットスタートプライマーの混合物の利用が、10%の非ホットスタートプライマーしか含んでいなくても、臨床材料のPCR阻害効果を主に克服するブースター効果を提供することを示す。
【0172】
混合物#3−3について、3つの増幅は全て、スパイクされた鼻試料において、各DNA標的が検出される範囲で成功した(図3B)。しかし、これらの結果をホットスタート−プライマーおよびネスト化レギュラープライマーの混合物(混合物#3−2;図3A)と比較すると、混合物#3−2は、PCR阻害が存在する場合でも、実質的により強力な増幅したことがわかる。後者の場合、非ホットスタートプライマーによる増幅は平坦域に達し、ホットスタートプライマーはその時点から順方向へさらなる増幅をおこない続けた。混合物#3−3の負の対照も示す。
【0173】
したがって、ホットスタートプライマーおよびレギュラープライマーのネスト化組み合わせ(混合物#3−2)は、臨床材料の存在下(混合物#3−1)で観察されるホットスタートプライマーPCRの阻害を克服し、さらに、減少したハイブリダイゼーションを示す標的のみについてのホットスタートプライマーと非阻害標的のみについての非ホットスタートプライマーとの組み合わせ(混合物#3−3)の使用よりも優れていた。
【0174】
実施例4:ホットスタートプライマーを使用するqPCR反応は、レギュラープライマーを用いた平行増幅により阻害される
この実験は、実施例3について記載したように、スパイク後に広範の精製に付されていないスパイクされた鼻試料および直接試料のいずれかとして存在する精製されたMRSA株#3DNA試料も使用した。この場合、ICおよびOrfXを標的とするアッセイにホットスタートプライマーのみを使用し(すなわち、臨床用スワブ試料由来のPCR阻害の存在下でさえも、強いPCR増幅を達成することが先に示されたもの);一方、実施例1〜2で用いられるホットスタートプライマーに使用したものと同じ配列を有する通常の修飾されていないプライマーを、nucおよびmecAに利用した(臨床用スワブ試料の存在下で広範なPCR阻害を示したもの)。スパイクされた鼻試料を2連で実施し、負の対照試料を含めた。さらなる対照反応も実施し、全ての反応についてホットスタートプライマーを単独で使用した。
【0175】
ホットスタートプライマー単独を含む対照反応において、以前に観察されたように、orfXおよびICは増幅され、一方、nucおよびmecAの検出は阻害された(図4B)。レギュラープライマー(nucおよびmecA)を用いる増幅は、うまく機能することが判明し;mecAは、特に先の実施例よりも強い増幅を示した(図4A)。この実施例で用いられるスパイクされた鼻試料は、別の調査で、mecA遺伝子のさらに強い増幅の原因である可能性が高いメチシリン耐性表皮ブドウ球菌(Staphylococcus Epidermis)の鼻保因を有することがわかっている個体由来であることが判明した。orfXおよびICは両試料で増幅されたが、スパイクされた鼻試料の増幅は、ホットスタートのみの対照反応との比較により示されるように、他のチャンネルでレギュラープライマーを使用することにより若干遅延した(図4C)。2連の試料は、高い再現性を示した。
【0176】
mecAおよびOrfXの阻害を減少させようとして、nucおよびmecAを標的とするレギュラープライマーの濃度を減少させた。この方法はICの増幅をはっきりとは改善しなかった(データは不掲載)。
【0177】
したがって、ホットスタートプライマーのみを使用する増幅は、レギュラープライマーのみを利用する他の増幅の存在下で、多重アッセイに関連して阻害される可能性が高い。特定の理論または作用機構により拘束されることを望まないが、この場合のホットスタート増幅の阻害は、反応管中のdNTPなどのリソースについての競合のためである可能性が高い。
【0178】
実施例5:ホットスタートおよびレギュラープライマーの混合物の使用は、多重qPCRで競合する増幅の阻害を防止する
プライマー
実施例5で使用した非ホットスタート(レギュラー)順方向及び逆方向プライマーを表4に示し、以下で記載する。
【0179】
【表4】

【0180】
この実験では、3つの異なるプライマーミックスを、orfX、nucおよびmecA遺伝子を標的とするアッセイのそれぞれについて使用した:
混合物#5−1は、ホットスタートおよび非ホットスタート(レギュラー)プライマーの混合物を含んでいた。各ホットスタートプライマーに関して、ホットスタートプライマーと同じ配列を有するが、いずれかの末端でさらなる相補性塩基が付加されたレギュラープライマーが含まれて、表5に示すような優先的結合が得られた。実施例1および2で記載されるプライマーの濃度は、80%のホットスタートプライマーおよび20%のレギュラープライマーを含む以外は、アッセイ混合物においてと同じであった。混合物#5−2は、ホットスタートプライマーを含まず、混合物#5−1におけるレギュラープライマーの両と同じ量のレギュラープライマーを含む対照混合物であった。
【0181】
混合物#5−3は、実施例1および2で前述した濃度レベルでホットスタートプライマーのみを含んでいた。
【0182】
実施例4においてと同様に、ICの増幅用の全ての混合物においてホットスタートプライマーのみを使用した。広範に精製されていないDNAを、実施例3について記載されているように、MRSA株#3の鼻試料上にスパイクされた細菌および直接試料から調製した。鼻試料を2連で実施し、負の対照試料を含めた。
【0183】
正の増幅は、ホットスタートプライマーおよびレギュラープライマーの混合物を用いる試料において4つのチャンネル全てで明らかであった(図5、混合物#1)。これらの結果は、全反応についてのホットスタートプライマー単独の使用(混合物#3)、またはる反応についてのホットスタートプライマーのみの使用および他の反応についてのレギュラープライマーのみの使用(実施例4)よりも優れた著しい改善であった。この実施例は、したがって、阻害剤を含む可能性が高い臨床材料に対する多重qPCR反応、および/またはプライマー−標的ミスマッチの場合のように、いくつかの増幅は弱いプライマー−標的ハイブリダイゼーションを示すことが予想され、他の増幅が強いプライマー−標的ハイブリダイゼーションを示すことが予想される反応を実施するための有効な方法を示す。加えて、この実施例は、ホットスタートプライマー単独を使用するPCR反応が阻害される場合(図5、nuc遺伝子標的、混合物#3)、対応するレギュラープライマーを含めることにより、ホットスタートプライマーが標的を増幅することを可能にするブーストを提供することを証明する(図5、nuc遺伝子標的、混合物#2を混合物#1と比較)。特定の理論または作用機構により拘束されることを望まないが、nucおよびmecA増幅のブースト効果と、この場合のorfXおよびIC増幅の保存された有効性との間の改善されたバランスが、ホットスタートと非ホットスタートプライマーとの間の標的配列の結合競合による可能性が高い。
【0184】
実施例6:先の実施例で用いられるプライマーの濃度を変えることにより得られる優れた結果
以下のように(表5)、orfXおよびICを標的とするアッセイのプライマーの濃度が先の実施例と同じであり、nucおよびmecAプライマー濃度を調節して、多重アッセイ反応混合物における4つの別個のアッセイの性能を最適化するように調節して、先の実施例の実験を繰り返した:
【0185】
【表5】

【0186】
orfX/SCCmec領域を、の7つのホットスタートプライマー各0.5mMマイクロモル濃度(0.5mM)を用いて増幅した。nuc遺伝子領域を、2つのホットスタートプライマー各0.105mMおよび2つの非ホットスタートプライマー(各0.175mM)を用いて増幅した。mecA遺伝子領域を、2つのホットスタートプライマー各0.105mMおよび2つの非ホットスタートプライマー各0.245mMを用いて増幅した。内部標準を、2つのホットスタートプライマー各0.15mMを用いて増幅した。容易に定量化可能な増幅が4つのチャンネル全てで得られた(図6)。
【0187】
この実施例及び先の実施例は、したがって、阻害剤を含む可能性がある臨床材料に関する多重qPCR反応を実施するためのべつの有効な方法を提供し、この場合、プライマー−標的ミスマッチの場合と同様に、弱いプライマー−標的ハイブリダイゼーションを示す増幅もあれば、強いプライマー−標的ハイブリダイゼーションを示す増幅もある。ホットスタートプライマーおよびレギュラープライマーの混合物を、ミスマッチまたは他の弱いプライマー−標的ハイブリダイゼーションが存在する可能性がある増幅に使用し、ホットスタートプライマーのみを、プライマー−標的ハイブリダイゼーションが存在する可能性がある増幅に利用する。
【0188】
実施例7:ホットスタートプライマーおよび非ホットスタートプライマーを使用し、臨床便試料中にスパイクされた細菌培養物から抽出されたDNAを標的とする多重qPCRアッセイ
細菌標的
クロストリジウム・ディフィシル株:ATCC43598(ATCC、バージニア州マナッサス)
大腸菌(Escherichia coli)(O157)株:ATCC700728(ATCC、バージニア州マナッサス)
ブドウ球菌(Staphylococcus)株:BAA1556(ATCC、バージニア州マナッサス)
【0189】
臨床便試料
凍結した残存する負の臨床便試料をHadassah Medical Center (イスラエル国エルサレム)から入手する。
【0190】
試料調製
1.単分散溶液を緩衝溶液中菌株から次のようにして調製する:
a.1つのコロニーを細菌学的ループで取り、緩衝液中で振とうする。
b.連続希釈を実施して、適切な濃度にする。
2.滅菌ピペットチップで、細菌の溶液のアリコートを除去し、便試料からの臨床用スワブ上にスパイクする。
3.上清を次いでPrep Tube中にピペットで移し、これを閉鎖し、遠心分離して、粒子状物質のレベルを減少させる。
4.上清をデカントし、残留緩衝液を除去する。
5.ペレットを溶菌緩衝液中に溶解させる。
6.Prep管を加熱ブロック上でインキュベートし、次いで遠心分離する。
7.RNaseH2溶液混合物を各Prep Tubeに添加する。
8.各Prep Tube中の溶液のアリコートを次いでqPCR反応混合物を含むPCR反応管中に移す。
【0191】
ホットスタートプライマーおよび非ホットスタートプライマー
各プライマーの2つのバージョンを設計する。第1のバージョンは、先の実施例で記載したリボプライマー構造を用いるホットスタートプライマーである。第2のバージョンは、添加されたRNA塩基、4つの相補性塩基、および3’末端でブロッキング基を含まない非ホットスタート修飾されていないプライマー構造である。
【0192】
プローブ
クロストリジウム・ディフィシル(C. Difficile)tcdB(配列番号40)、大腸菌(E. coli)eae(配列番号41)、およびスタフィロコッカス(Staphylococcus)tuf(配列番号42)に対して相補性である3つの二重標識された分子ビーコンプローブ(Biosearch Technologies Inc、カリフォルニア州ナヴァト)をそれぞれ使用する(表6)。
【0193】
【表6】

【0194】
順方向プライマー
表7〜8に示すような3セットのリボ−および非修飾順方向プライマーをそれぞれ使用する;Tcd B(配列番号43および49)、eae(配列番号45および51)、ならびにtuf(配列番号47および53)に対して相補性。
【0195】
逆方向プライマー
表7〜8に示すような3セットのリボ−および非修飾逆方向プライマーをそれぞれ使用する:Tcd B(配列番号44および50)、eae(配列番号46および52)、ならびにtuf(配列番号48および54)に対して相補性。
【0196】
実施例7で使用する順方向および逆方向ホットスタートプライマー。「−■」はブロッキング基を表す。
【0197】
【表7】

【0198】
【表8】

【0199】
RNaseH2混合物
ピロコッカス・アビシ RNaseH2エンドヌクレアーゼをIntegrated DNA Technologies, Inc.から入手する。
【0200】
PCR MasterMix
Taq Pol DNAポリメラーゼ、dNTP、Tris、KCl、MgCl2、BSAおよびスクロースを含むPCR反応混合物を使用する。
【0201】
qPCRアッセイ
3つの異なるアッセイ混合物(それぞれ、3つの分子ビーコンプローブ、PCR MasterMix、および異なるプライマーセットを含む)を調製する。第1のアッセイ混合物中のプライマーは6つの「リボプライマー」ホットスタートプライマーである。第2のアッセイ混合物中のプライマーは6つの非ホットスタートプライマーである。第3のアッセイ混合物は、6つのホットスタートプライマーおよび6つの非ホットスタートプライマーの混合物を含む。
【0202】
手順
アッセイ混合物のそれぞれを用いて多重qPCR反応を実施する。負の対照試料を実施に含め、TE中第3の多重アッセイ混合物を含み、テンプレートDNAを含まない。
【0203】
Corbett Life Science製のRotorGene 6000 System Real Time PCR装置を用いて増幅および検出反応を実施する:
1.95℃にて3分で、DNAを変性させる。
2.増幅サイクルはそれぞれ以下の3つのステップからなる:(a)95℃で20秒;(b)56℃で60秒;(c)72℃で30秒(ステップ(b)の最後で、3つの蛍光染料のそれぞれについて読み取る)。
【0204】
結果
毒性クロストリジウム・ディフィシル、病原性大腸菌およびStaphylococcusを検出するための多重qPCRアッセイを実施する。各多重アッセイは、同じ3つの異なる配列:(a)毒性クロストリジウム・ディフィシルと関連するtcd B遺伝子;(b)病原性大腸菌と関連するeae遺伝子、ならびに(c)Staphylococcus特異的tuf遺伝子を検出するために設計される。ホットスタートプライマーおよび修飾されていないプライマーの混合物の使用は、あるホットスタートPCR反応を阻害することが判明している臨床材料においてでさえも、すべての標的の効率的な増幅を可能にする。
【0205】
実施例8:種々の臨床材料中にスパイクされた培養試料から抽出された非精製DNAを標的とするホットスタートプライマーを用いる多重qPCRアッセイ材料および実験法
実験法
実施例1に類似したホットスタートプライマーのみを含む反応混合物を用い、そして先の実施例と同じqPCTプロトコルまたは類似のプロトコルを用いて、多重qPCRアッセイを実施して、MRSA株#3から抽出されたDNAを検出する。一試料をプロトコル8−1にしたがって調製し、以下の方法のうちの1つを用いてqPCR分析のために調製した試料と比較する:
MRSA株を、臨床用スワブ上に咽喉培養試料からスパイクし、そしてプロトコル8−2にしたがって試料を調製する。
MRSA株を、臨床用スワブ上に、便試料からスパイクし、そして試料を緩衝溶液中で希釈し、低速で遠心分離して、試料中の粒子状物質のレベルを減少させ、そしてプロトコル8−2にしたがって試料を調製する。
MRSA株を、臨床用スワブ上に、膣分泌物、脳脊髄液、尿、リンパ液、涙、唾液、乳、羊水、または気道、腸管もしくは泌尿生殖器の外分泌物の試料からスパイクし、そして試料を緩衝溶液中で希釈し、低速で遠心分離して、試料中の粒子状物質のレベルを減少させ、そしてプロトコル8−2にしたがって調製する。
MRSA株を喀痰試料から臨床用スワブ上にスパイクし、そして試料を緩衝溶液中で希釈し、低速で遠心分離して、試料中の粒子状物質のレベルを減少させ、そしてプロトコル8−2にしたがって試料を調製する。
MRSA株を、全血、血漿、血清試料を含む溶液中にスパイクし、試料を緩衝溶液中で希釈し、低速(全血の場合)で遠心分離して、試料中の粒子状物質のレベルを減少させる。次いで、10μlの希釈細菌コロニーを臨床用スワブ上にスパイクする代わりに、10μlの希釈細菌コロニーを、血液試料を含む試験管中に直接スパイクする以外は、プロトコル8−2にしたがって、試料を調製する。
MRSA株を、均質化された鼠径部皮膚試料または他の組織試料を含む溶液中にスパイクする。DNAを次いで抽出し、D−Tailキット(Syntezza Bioscience Ltd.、イスラエル国エルサレム)などの、組織試料からDNAを抽出するための市販のキットを用いて試料を調製する。
【0206】
プロトコル8−1:直接的細菌性DNA試料の調製
希釈された細菌コロニーの試料を取り出し、溶菌緩衝液を含む試験管中にピペットで移す。試験管を次に加熱ブロック中でインキュベートする。RNaseH2混合物を添加し、次いで結果として得られる溶液のアリコートを次いで、qPCR反応混合物を含むPCR反応管中に移す。
【0207】
プロトコル8−2:臨床用スワブ上にスパイクされた細菌DNA試料の調製
臨床用スワブ上にスパイクされた細菌DNA試料を先の実施例で記載されているようにして調製する。
【0208】
結果
MRSA株#3由来のスパイクされた鼻試料について実施例3で見られるように、orfX領域および内部標準を標的とするアッセイはPCR増幅を示す。しかし、nucおよびmecA遺伝子を標的とするアッセイはPCR阻害を示す。これらの結果はPCR阻害因子が多くの臨床材料中に存在することを示す。さらに、これらのPCR阻害因子は、本明細書中で例示されるnucおよびmecAアッセイなどの弱いプライマー−標的ハイブリダイゼーションを示すホットスタートプライマーのみのアッセイの性能に悪影響を及ぼすが、本明細書中で例示されるorfXおよび内部標準標的アッセイなどの強力なプライマー−標的ハイブリダイゼーションを示すホットスタートプライマー−のみのアッセイには及ぼさないことが示されている。
【0209】
実施例9:ホットスタートプライマーと通常のプライマーとの組み合わせは臨床材料によるqPCRの阻害を克服する
この場合は、OrfX領域およびICのためだけのホットスタートプライマーならびにnucおよびmecA遺伝子のホットスタートプライマーおよび非ホットスタートプライマーの混合物を使用して、先の実施例の実験を繰り返す。このプライマー混合物の使用により、あるホットスタートPCR反応を阻害することが示された臨床材料においても、4つの標的すべての効率的な増幅が可能になる。
【特許請求の範囲】
【請求項1】
a)第1標的ポリヌクレオチド配列を増幅するためのプライマーの第1セット;
b)第2標的ポリヌクレオチド配列を増幅するためのプライマーの第2セット;および
c)活性化酵素
を含むPCR反応混合物であって、
前記第1標的ポリヌクレオチド配列の少なくとも1端とハイブリダイズするプライマーがホットスタートプライマーおよび非ホットスタートプライマーの混合物であり、前記非ホットスタートプライマーを用いて前記第1標的ポリヌクレオチド配列を増幅する反応生成物が前記ホットスタートプライマーを用いる増幅の基質であり;そして
前記ホットスタートプライマーが、前記活性化酵素の作用により逆転される不活性化化学修飾を含み、前記ホットスタートプライマーは、前記ホットスタートプライマーが相補配列と高温でハイブリダイズする場合に前記活性化酵素の基質になる、PCR反応混合物。
【請求項2】
前記非ホットスタートプライマーにより認識される配列が、前記ホットスタートプライマーにより認識される配列の側面に位置する、請求項1記載のPCR反応混合物。
【請求項3】
前記非ホットスタートプライマーにより認識される配列が、前記ホットスタートプライマーにより認識される配列と重なり合うか、または同一である、請求項1記載のPCR反応混合物。
【請求項4】
前記第1標的ポリヌクレオチド配列の一端だけとハイブリダイズするプライマーがホットスタートプライマーおよび非ホットスタートプライマーの前記混合物である、請求項1記載のPCR反応混合物。
【請求項5】
前記第1標的ポリヌクレオチド配列の両端とハイブリダイズするプライマーがホットスタートプライマーおよび非ホットスタートプライマーの前記混合物である、請求項1記載のPCR反応混合物。
【請求項6】
前記ホットスタートプライマーの前記非ホットスタートプライマーに対する比が1:9〜19:1(両端を含む)である、請求項1記載のPCR反応混合物。
【請求項7】
前記不活性化化学修飾が3’ブロッキング基である、請求項1記載のPCR反応混合物。
【請求項8】
前記活性化酵素が熱安定性RNase H酵素である、請求項1記載のPCR反応混合物。
【請求項9】
前記第2標的ポリヌクレオチド配列の少なくとも1つの末端とハイブリダイズするプライマーが、請求項1で定義されるホットスタートプライマーと、非ホットスタートプライマーとの混合物であり、前記非ホットスタートプライマーを用いて前記第2標的ポリヌクレオチド配列を増幅させる反応生成物が、前記ホットスタートプライマーを用いる増幅の基質である、請求項1記載のPCR反応混合物。
【請求項10】
第3標的ポリヌクレオチド配列を増幅するためのプライマーの第3セットをさらに含む、請求項1記載のPCR反応混合物。
【請求項11】
リアルタイムPCRに好適なプローブを更に含む、請求項1記載のPCR反応混合物。
【請求項12】
請求項1記載のPCR反応混合物およびその使用説明書を含むキット。
【請求項13】
試験試料において標的ポリヌクレオチド配列を検出する方法であって、請求項11記載のPCR反応混合物を用いて前記試験試料由来の核酸に関してリアルタイムPCRを実施するステップ;前記標的ポリヌクレオチド配列の増幅により生成したシグナルを測定するステップ;および前記シグナルを標準試料と比較するステップを含み、
前記シグナルが前記標準試料以下であるならば、前記標的ポリヌクレオチド配列が前記試験試料中に存在する、方法。
【請求項14】
試験試料において第1標的ポリヌクレオチド配列および第2標的ポリヌクレオチド配列を検出する方法であって、前記試料の核酸が臨床材料から誘導され、広範に精製されていない方法であり:
(a)PCR反応混合物を用いて前記試験試料から核酸を増幅するステップ;および
(b)増幅されたPCR産物を検出するステップ
を含み、前記PCR反応混合物が:i)前記第1標的ポリヌクレオチド配列を増幅できる、少なくとも1つの順方向プライマーおよび少なくとも1つ逆方向プライマーを含むプライマーの第1セット;ならびにii)前記第2標的ポリヌクレオチド配列を増幅できる、少なくとも1つの順方向プライマーおよび少なくとも1つ逆方向プライマーを含むプライマーの第2セットを含み、プライマーの前記第1セットの前記順方向プライマーおよび前記逆方向プライマーのうちの少なくとも1つが、ホットスタートプライマーおよび非ホットスタートプライマーの混合物として提供される、方法。
【請求項15】
前記非ホットスタートプライマーにより認識される配列が、前記ホットスタートプライマーにより認識される配列の側面に位置する、請求項14記載の方法。
【請求項16】
前記非ホットスタートプライマーにより認識される配列が、前記ホットスタートプライマーにより認識される配列と重なるか、または同一である、請求項14記載の方法。
【請求項17】
前記第1標的ポリヌクレオチド配列の一端だけとハイブリダイズするプライマーが、ホットスタートプライマーおよび非ホットスタートプライマーの前記混合物である、請求項14記載の方法。
【請求項18】
前記第1標的ポリヌクレオチド配列の両端にハイブリダイズするプライマーがホットスタートプライマーおよび非ホットスタートプライマーの前記混合物である、請求項14記載の方法。
【請求項19】
前記ホットスタートプライマーの前記非ホットスタートプライマーに対する比が1:9〜19:1(両端を含む)である、請求項14記載の方法。
【請求項20】
PCR反応混合物がリアルタイムPCRに好適なプローブを更に含む、請求項14記載の方法。
【請求項1】
a)第1標的ポリヌクレオチド配列を増幅するためのプライマーの第1セット;
b)第2標的ポリヌクレオチド配列を増幅するためのプライマーの第2セット;および
c)活性化酵素
を含むPCR反応混合物であって、
前記第1標的ポリヌクレオチド配列の少なくとも1端とハイブリダイズするプライマーがホットスタートプライマーおよび非ホットスタートプライマーの混合物であり、前記非ホットスタートプライマーを用いて前記第1標的ポリヌクレオチド配列を増幅する反応生成物が前記ホットスタートプライマーを用いる増幅の基質であり;そして
前記ホットスタートプライマーが、前記活性化酵素の作用により逆転される不活性化化学修飾を含み、前記ホットスタートプライマーは、前記ホットスタートプライマーが相補配列と高温でハイブリダイズする場合に前記活性化酵素の基質になる、PCR反応混合物。
【請求項2】
前記非ホットスタートプライマーにより認識される配列が、前記ホットスタートプライマーにより認識される配列の側面に位置する、請求項1記載のPCR反応混合物。
【請求項3】
前記非ホットスタートプライマーにより認識される配列が、前記ホットスタートプライマーにより認識される配列と重なり合うか、または同一である、請求項1記載のPCR反応混合物。
【請求項4】
前記第1標的ポリヌクレオチド配列の一端だけとハイブリダイズするプライマーがホットスタートプライマーおよび非ホットスタートプライマーの前記混合物である、請求項1記載のPCR反応混合物。
【請求項5】
前記第1標的ポリヌクレオチド配列の両端とハイブリダイズするプライマーがホットスタートプライマーおよび非ホットスタートプライマーの前記混合物である、請求項1記載のPCR反応混合物。
【請求項6】
前記ホットスタートプライマーの前記非ホットスタートプライマーに対する比が1:9〜19:1(両端を含む)である、請求項1記載のPCR反応混合物。
【請求項7】
前記不活性化化学修飾が3’ブロッキング基である、請求項1記載のPCR反応混合物。
【請求項8】
前記活性化酵素が熱安定性RNase H酵素である、請求項1記載のPCR反応混合物。
【請求項9】
前記第2標的ポリヌクレオチド配列の少なくとも1つの末端とハイブリダイズするプライマーが、請求項1で定義されるホットスタートプライマーと、非ホットスタートプライマーとの混合物であり、前記非ホットスタートプライマーを用いて前記第2標的ポリヌクレオチド配列を増幅させる反応生成物が、前記ホットスタートプライマーを用いる増幅の基質である、請求項1記載のPCR反応混合物。
【請求項10】
第3標的ポリヌクレオチド配列を増幅するためのプライマーの第3セットをさらに含む、請求項1記載のPCR反応混合物。
【請求項11】
リアルタイムPCRに好適なプローブを更に含む、請求項1記載のPCR反応混合物。
【請求項12】
請求項1記載のPCR反応混合物およびその使用説明書を含むキット。
【請求項13】
試験試料において標的ポリヌクレオチド配列を検出する方法であって、請求項11記載のPCR反応混合物を用いて前記試験試料由来の核酸に関してリアルタイムPCRを実施するステップ;前記標的ポリヌクレオチド配列の増幅により生成したシグナルを測定するステップ;および前記シグナルを標準試料と比較するステップを含み、
前記シグナルが前記標準試料以下であるならば、前記標的ポリヌクレオチド配列が前記試験試料中に存在する、方法。
【請求項14】
試験試料において第1標的ポリヌクレオチド配列および第2標的ポリヌクレオチド配列を検出する方法であって、前記試料の核酸が臨床材料から誘導され、広範に精製されていない方法であり:
(a)PCR反応混合物を用いて前記試験試料から核酸を増幅するステップ;および
(b)増幅されたPCR産物を検出するステップ
を含み、前記PCR反応混合物が:i)前記第1標的ポリヌクレオチド配列を増幅できる、少なくとも1つの順方向プライマーおよび少なくとも1つ逆方向プライマーを含むプライマーの第1セット;ならびにii)前記第2標的ポリヌクレオチド配列を増幅できる、少なくとも1つの順方向プライマーおよび少なくとも1つ逆方向プライマーを含むプライマーの第2セットを含み、プライマーの前記第1セットの前記順方向プライマーおよび前記逆方向プライマーのうちの少なくとも1つが、ホットスタートプライマーおよび非ホットスタートプライマーの混合物として提供される、方法。
【請求項15】
前記非ホットスタートプライマーにより認識される配列が、前記ホットスタートプライマーにより認識される配列の側面に位置する、請求項14記載の方法。
【請求項16】
前記非ホットスタートプライマーにより認識される配列が、前記ホットスタートプライマーにより認識される配列と重なるか、または同一である、請求項14記載の方法。
【請求項17】
前記第1標的ポリヌクレオチド配列の一端だけとハイブリダイズするプライマーが、ホットスタートプライマーおよび非ホットスタートプライマーの前記混合物である、請求項14記載の方法。
【請求項18】
前記第1標的ポリヌクレオチド配列の両端にハイブリダイズするプライマーがホットスタートプライマーおよび非ホットスタートプライマーの前記混合物である、請求項14記載の方法。
【請求項19】
前記ホットスタートプライマーの前記非ホットスタートプライマーに対する比が1:9〜19:1(両端を含む)である、請求項14記載の方法。
【請求項20】
PCR反応混合物がリアルタイムPCRに好適なプローブを更に含む、請求項14記載の方法。
【図1】


【図2A】


【図2B】


【図3A】


【図3B】


【図4A】


【図4B】


【図4C】


【図5】


【図6】




【図2A】


【図2B】


【図3A】


【図3B】


【図4A】


【図4B】


【図4C】


【図5】


【図6】


【公表番号】特表2013−507910(P2013−507910A)
【公表日】平成25年3月7日(2013.3.7)
【国際特許分類】
【出願番号】特願2012−533730(P2012−533730)
【出願日】平成22年10月12日(2010.10.12)
【国際出願番号】PCT/IB2010/054613
【国際公開番号】WO2011/045744
【国際公開日】平成23年4月21日(2011.4.21)
【出願人】(512098083)シンテッツァ モレキュラー ディテクション イスラエル リミテッド (1)
【Fターム(参考)】
【公表日】平成25年3月7日(2013.3.7)
【国際特許分類】
【出願日】平成22年10月12日(2010.10.12)
【国際出願番号】PCT/IB2010/054613
【国際公開番号】WO2011/045744
【国際公開日】平成23年4月21日(2011.4.21)
【出願人】(512098083)シンテッツァ モレキュラー ディテクション イスラエル リミテッド (1)
【Fターム(参考)】
[ Back to top ]

