核酸配列の検出方法及び核酸配列検出基板
【課題】検出すべき特定の標的核酸配列の濃度が極めて微量である場合であっても、高感度な検出が可能であり、しかも低コスト・短時間での検出が可能である。
【解決手段】基板16表面に一対のオリゴヌクレオチド鎖12の一方の末端を固定化して立設し、固定化したオリゴヌクレオチド鎖それぞれと相補的な配列を有する標的核酸配列10(1本鎖)を結合させ、基板16上に架橋状態の架橋構造体を形成させることにより微細な網目状空間20を作り出し、この網目状空間20にリガンド22を物理的な吸着作用で取り込み、リガンド22に反応する活性物質で発色させるようにした。
【解決手段】基板16表面に一対のオリゴヌクレオチド鎖12の一方の末端を固定化して立設し、固定化したオリゴヌクレオチド鎖それぞれと相補的な配列を有する標的核酸配列10(1本鎖)を結合させ、基板16上に架橋状態の架橋構造体を形成させることにより微細な網目状空間20を作り出し、この網目状空間20にリガンド22を物理的な吸着作用で取り込み、リガンド22に反応する活性物質で発色させるようにした。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は核酸配列の検出方法及び核酸配列検出基板に係り、特に検体サンプル中に検出標的とする特定の標的核酸配列が存在するかを高感度で、しかも簡易かつ低コストで検出するための技術に関する。
【背景技術】
【0002】
従来、検体固有の核酸配列を標的として検出する方法としては、基板上に固定化させたオリゴヌクレオチド鎖に標的核酸配列を結合させ、結合した標的核酸配列に蛍光物質を標識した異なるオリゴヌクレオチド鎖を結合させる。そして、特定波長の光(レーザー光等)を当てることで、標識蛍光物質の反射光シグナルを検出・増幅することで特定の核酸配列が検体サンプル中に存在するかを検出する。別の検出方法としては、基板上に固定化したオリゴヌクレオチド鎖に、標的核酸配列を結合させ、オリゴヌクレオチド鎖をプライマーとし、結合した標的核酸配列を鋳型として伸長反応させ、その際に取り込まれる塩基物
質に蛍光物質を標識する。そして、特定波長の光(レーザー光等)を当てることで、標識蛍光物質の反射光シグナルを検出・増幅する。
【0003】
しかし、これらの検出方法は、蛍光物質を検出しなくてはならないため、特定波長光を出す特殊な検出装置を必要とするため検出装置が高価であり、一部の研究期間や大学機関等に使用が限定されている状況である。したがって、例えば水処理現場等において、水(検体サンプル)中におけるノロウイルス、クリプトスポリジウム等の病原微生物を簡易に検出する手法としては、操作が繁雑なうえ分析装置が高価な為、採用できないという問題がある。
【0004】
このような背景から、例えば水処理等の検出を行う現場において低コストで簡便に特定の核酸配列を標的として検出する方法として、非特許文献1、特許文献1、特許文献2に記載されるMPEX法(Multiple Primers EXtension 法)が開発されている。
【0005】
このMPEX法は、基板上で酵素(DNAポリメラーゼ)によるDNA伸長反応を利用した遺伝子検査方法で、遺伝子変異解析、一塩基遺伝子変異SNPs(Single Nucleotide Polymorphisms)解析、微生物同定にも使用される方法である。リン脂質の親水部を構成するリン酸エステルより誘導される基を有する第一単位と活性エステル基を有する第二単位とを含む高分子物質を表面に有する基板上に固定化したオリゴヌクレオチド鎖をプライマーとし、標的核酸配列を投入後、2本鎖DNAは基板上で熱変性させ1本鎖にし、それを鋳型としてDNAポリメラーゼによるDNA伸長反応を行う際、全体もしくは一部の塩基にリガンドを修飾することで伸長反応産物(増幅DNA)に取り込み、最後にリガンドに対する活性物質を投入、反応させることで、高感度な遺伝子検出を可能とする方法である。
【非特許文献1】K. Kinoshita et al., Multiple primer extension by DNA polymerase on a novel plastic DNA array coated with a biocompatible polymer, Nucleic Acid Research, Vol.35, No.1, 2007, pp.e3
【特許文献1】特開2006−174788号公報
【特許文献2】特開2007−222010号公報
【発明の開示】
【発明が解決しようとする課題】
【0006】
しかしながら、発色色素は蛍光物質に比べて検出シグナルの増幅感度が劣るため、例えばノロウイルス、クリプトスポリジウム等のように、水(検体サンプル)中に極微量のオーダでしか存在せず、しかも培養により増殖できない病原微生物を、MPEX法を用いて検出するには、高感度な検出ができないという課題がある。
【0007】
MPEX法により高感度で検出するには標識を増やす必要があり、そのためにはPCR法等により標的核酸配列の濃度を高める工程が必要となるため、結果が得られるまでに長時間を要するという欠点がある。
【0008】
したがって、ノロウイルス、クリプトスポリジウム等のように、水中に極微量のオーダでしか存在せず、しかも培養により増殖できない病原微生物を、MPEX法を用いて検出するには更なる改良が必要となる。
【0009】
また、たとえ蛍光物質を使用したとしても、上記の病原微生物のように検出すべき特定の遺伝子が極めて微量である場合には、検出感度の不安定化を招き、精度のよい検出ができない。
【0010】
本発明はこのような事情に鑑みてなされたもので、検出すべき特定の標的核酸配列の濃度が極めて微量である場合であっても、高感度な検出が可能であり、しかも低コスト・短時間での検出が可能である核酸配列の検出方法及びその方法を用いた核酸配列検出基板を提供することを目的とする。
【課題を解決するための手段】
【0011】
請求項1に記載の発明は、前記目的を達成するために、検体サンプル中に検出標的とする特定の標的核酸配列が存在するかを検出する核酸配列の検出方法において、基板上に、オリゴヌクレオチド鎖の5’末端と3’末端のうちの一方の末端を固定化することにより複数の前記オリゴヌクレオチド鎖を前記基板上に立たせる固定化工程と、前記複数のオリゴヌクレオチド鎖と前記標的核酸配列の少なくとも二箇所の相補的部分を結合させることによって架橋状態の多数の架橋構造体を形成し、前記基板上に前記架橋構造体が多数絡み合った微細な網目状空間を形成する網目状空間形成工程と、前記網目状空間にリガンドを物理的な吸着作用により取り込む取込み工程と、前記取り込んだリガンドに対して、該リガンドに反応する活性物質を用いて発色させる発色工程と、前記発色した発色シグナルを検出することにより前記標的核酸配列を検出する検出工程と、を備えたことを特徴とする核酸配列の検出方法を提供する。
【0012】
ここで標的核酸配列とは、検出標的の塩基配列を有するRNA又はDNAをいう。
【0013】
本発明の請求項1によれば、基板表面にオリゴヌクレオチド鎖の一方の末端を固定化して立設し、固定化したオリゴヌクレオチド鎖と相補的な配列を有する標的核酸配列(1本鎖)を少なくとも二箇所で結合させ、基板上に架橋状態の架橋構造体を形成させることにより微細な網目状空間を作り出し、この網目状空間にリガンドを物理的な吸着作用で取り込み、リガンドに反応する活性物質で発色させるようにした。
【0014】
このように、検体サンプル中に検出標的とする特定の標的核酸配列が存在する場合には、基板上に網目状空間が形成されるようにし、この網目状空間に発色させるため発色関係物質の構成成分であるリガンドを物理的な吸着作用で取り込まれるようにしたので、発色関係物質の構成成分でリガンドに反応する活性物質を投入することで、発色形成物質を網目状空間に高濃度に取り込むことができる。これにより、検出すべき特定の標的核酸配列の濃度が極めて微量である場合であっても、高感度に検出できる。また、伸長反応を必要としないので、検出に要する時間を短時間で行うことができる。更には、蛍光色素とは異なり、発色色素を使用することができるため、高価な検出装置等が必要なくなるので、低コストでの検出を行うことができる。
【0015】
なお、オリゴヌクレオチド鎖は、標的核酸配列の少なくとも2箇所に対して相補的な核酸配列を有するものを予め設計するとよい。ここで、標的核酸配列の情報は、DNAデータバンク(DDBJ(DNA Data Bank of Japan)、EMBL(European Molecular Biology Laboratory)、GenBank)等を利用してインターネット等により知ることができる。したがって、標的核酸配列の2箇所の部位において検体固有の核酸配列を探し出し、2つの固有核酸配列を、第1のオリゴヌクレオチド鎖と第2のオリゴヌクレオチド鎖とにそれぞれ割り当てればよい。
【0016】
請求項2に記載の発明は、前記目的を達成するために、検体サンプル中に検出標的とする特定の標的核酸配列が存在するかを検出する核酸配列の検出方法において、基板上に、多数のオリゴヌクレオチド鎖を固定化し、その後、前記標的核酸配列を含む前記検体サンプルを投入すると共に、発色関係物質の構成成分であるリガンドを投入し、投入した反応系の温度を前記標的核酸配列が熱変性し一本鎖になる温度にし、その後、前記反応系の温度を前記オリゴヌクレオチド鎖と前記標的核酸配列の少なくとも二箇所とが相補的に結合するハイブリダイゼーション温度にし、その後、前記基板上に、発色関係物質の構成成分である活性物質を投入して前記リガンドと反応させ、前記発色関係物質により発色した発色シグナルを検出することを特徴とする核酸配列の検出方法を提供する。
【0017】
請求項2は、請求項1が発明をメカニズム的な特徴からとらえたのに対して、操作手順の特徴として発明をとらえたものである。
【0018】
請求項2によれば、発色関係物質の構成成分であるリガンドを含む反応系においてハイブリダイゼーション反応を行うことにより、請求項1に示す架橋構造体が多数形成される。そして、この架橋構造体にリガンドが物理的な吸着作用により多数取り込まれることにより、強い発色シグナルを発色することができ、高感度な検出が可能となる。
【0019】
請求項3は請求項1又は2において、前記オリゴヌクレオチド鎖として、前記標的核酸配列の少なくとも二箇所に対して相補的な核酸配列を有する一対の組み合わせを、前記固定化の前に予め設計し、該設定した一対のオリゴヌクレオチド鎖を多数組、前記基板上に固定化することを特徴とする。
【0020】
請求項4に記載の発明は、前記目的を達成するために、検体サンプル中に検出標的とする特定の標的核酸配列が存在するかを検出する核酸配列の検出方法において、前記標的核酸配列と第1のオリゴヌクレオチド鎖とが相補的に結合した後に、前記第1のオリゴヌクレオチド鎖をプライマーとすると共に前記標的核酸配列を鋳型として伸長反応をさせて形成される伸長反応鎖から解離した伸長反応産物に対して第2のオリゴヌクレオチド鎖が相補的な核酸配列を有するように、前記第1及び第2のオリゴヌクレオチド鎖を予め設計する設計工程と、基板上に、前記第1及び第2のオリゴヌクレオチド鎖の5’末端を固定化することにより前記第1及び前記第2のオリゴヌクレオチド鎖を前記基板上に立たせる固定化工程と、前記第1のオリゴヌクレオチド鎖と前記標的核酸配列とを相補的に結合して前記第1のオリゴヌクレオチド鎖をプライマーとすると共に前記標的核酸配列を鋳型として第1の伸長反応をさせる第1の伸長反応工程と、前記標的核酸配列から前記第1の伸長反応工程で伸長した第1の伸長反応産物を解離させる第1の解離工程と、前記第2のオリゴヌクレオチド鎖に前記解離した第1の伸長反応産物を結合して前記第1と第2のオリゴヌクレオチド鎖の間に架橋構造を形成する第1の架橋工程と、前記第2のオリゴヌクレオチド鎖をプライマーとすると共に前記第1の伸長反応産物を鋳型として第2の伸長反応をさせる第2の伸長反応工程と、前記第2の伸長反応工程で伸長した第2の伸長反応産物を解離させる第2の解離工程と、多数の前記第1及び第2のオリゴヌクレオチド鎖について前記第1の伸長反応工程から前記第2の解離工程までを行い、前記第1のオリゴヌクレオチド鎖とは別の第1のオリゴヌクレオチド鎖に前記解離した第2の伸長反応産物を結合して前記第2と1のオリゴヌクレオチド鎖間に架橋構造を形成する第2の架橋工程と、多数の前記第1及び第2のオリゴヌクレオチド鎖の間で第1と第2の架橋工程を繰り返す、繰返し架橋工程と、前記繰返し架橋工程により、架橋構造体が多数絡み合った微細な網目状空間を形成する網目状空間形成工程と、前記網目状空間にリガンドを物理的な吸着作用により取り込む取込み工程と、前記取り込んだリガンドに対して、該リガンドに反応する活性物質を用いて発色させる発色工程と、前記発色した発色シグナルを検出することにより前記標的核酸配列を検出する検出工程と、を備えたことを特徴とする核酸配列の検出方法を提供する。
【0021】
本発明の請求項4は、網目状空間を請求項1とは別の方法で形成するようにしたものである。即ち、本発明の請求項4によれば、基板表面に5’末端を固定化した第1のオリゴヌクレオチド鎖と標的核酸配列とを相補的に結合させた後、第1のオリゴヌクレオチド鎖がプライマーとなると共に標的核酸配列を鋳型として伸長反応することにより形成され、標的核酸配列と相補的な核酸配列である第1の伸長反応鎖が解離する。そして、解離した第1の伸長反応産物と、基板表面に一方の末端を固定化した第2のオリゴヌクレオチド鎖とを相補的に結合させた後、第2のオリゴヌクレオチド鎖をプライマーとすると共に第1の伸長反応産物を鋳型として伸長反応させることにより第2の伸長反応鎖を形成し、第2の伸長反応鎖から第2の伸長反応産物を解離させる。
【0022】
これにより、基板上には、伸長反応及び解離反応によって核酸配列による架橋構造が多数形成され、この多数の架橋構造体が複雑に絡み合うことにより、基板上に網目状空間を形成することができる。
【0023】
ここで、標的核酸配列の情報は、DNAデータバンク(DDBJ(DNA Data Bank of Japan)、EMBL(European Molecular Biology Laboratory)、GenBank)等を利用してインターネット等により知ることができる。したがって、標的核酸配列において検体固有の核酸配列を探し出し、第1のオリゴヌクレオチド鎖とする。また、第2のオリゴヌクレオチド鎖は、第1の伸長反応産物と相補的な核酸配列となるように設計する。また、請求項4の場合には、第1及び第2のオリゴヌクレオチド鎖は異なる核酸配列に設計することになる。
【0024】
本発明の請求項4は、網目状空間にリガンドを物理的な吸着作用で取り込み、リガンドに反応する活性物質で発色させるようにしている。このように、検体サンプル中に検出標的とする特定の標的核酸配列が存在する場合には、基板上に網目状空間が形成されるようにし、この網目状空間に発色させるため発色関係物質の構成成分であるリガンドを物理的な吸着作用で取り込まれるようにし、このリガンドに対しする活性物質を投入することで、発色形成物質を網目状空間に高濃度に取り込むことができる。これにより、検出すべき特定の標的核酸配列の濃度が極めて微量である場合であっても、高感度に検出できる。また、発色シグナル量は伸長反応量に大きく依存しない為、検出に要する時間を短時間で行うことができ、高価な検出装置等が必要なくなるので、低コストでの検出を行うことができる。
【0025】
請求項5は請求項4において、前記第2の解離工程で解離した第2の伸長反応産物が、前記第2の伸長反応産物と相補的な核酸配列を有するように設計された第3のオリゴヌクレオチド鎖に結合して、第3のオリゴヌクレオチド鎖をプライマーとし、前記第2の伸長反応産物を鋳型とした第3の伸長反応工程と、第2の伸長反応産物と前記第3の伸長反応工程で伸長した第3の伸長反応産物を解離させる第3の解離工程と、前記第1のオリゴヌクレオチド鎖とは別の第1のオリゴヌクレオチド鎖に前記解離した第3の伸長反応産物を結合して前記第3と1のオリゴヌクレオチド鎖間に架橋構造を形成する第3の架橋工程と、多数の前記第1、第2及び第3のオリゴヌクレオチド鎖の間で第1、第2と第3の架橋工程を繰り返す、繰返し架橋工程と、を備えたことを特徴とする。
【0026】
請求項5は、3個のオリゴヌクレオチド鎖を用いる場合であり、結合反応→伸長反応→解離反応を繰り返すことで、解離した伸長反応産物を次々に利用して網目状空間を形成することができるので、標的核酸配列の濃度が更に小さい場合でも高感度の検出が可能となる。また、仮に第1のオリゴヌクレオチド鎖が標的核酸配列に結合できなくとも、変わりに第3のオリゴヌクレオチド鎖が結合できれば反応は進行するため、検出感度の安定化が図れる。尚、請求項5では、3個のオリゴヌクレオチド鎖を用いる場合であるが、4個以上であれば更に好ましい。したがって、検体サンプル中に存在する標的核酸配列の濃度に応じて、濃度が小さい場合には、設計するオリゴヌクレオチド鎖を多くすれば、より高い感度での検出が可能となる。
【0027】
請求項6は請求項4又は5において、前記繰返し架橋工程後において、設定温度をオリゴヌクレオチド鎖のハイブリダイゼーション温度にするハイブリダイゼーション工程を備えたことを特徴とする。
【0028】
これにより、前記繰返し架橋工程後において、架橋反応できていない伸長反応産物を基板上に5’末端固定したオリゴヌクレオチド鎖と結合させ、より多くの架橋構造が多数形成され、この多数の架橋構造体が複雑に絡み合うことにより、より高い感度での検出が可能となる。
【0029】
請求項7に記載の発明は、前記目的を達成するために、検体サンプル中に検出標的とする特定の標的核酸配列が存在するかを検出する核酸配列の検出方法において、前記標的核酸配列と第1のオリゴヌクレオチド鎖とが相補的に結合した後に、前記第1のオリゴヌクレオチド鎖をプライマーとすると共に前記標的核酸配列を鋳型として伸長反応させて形成される伸長反応鎖から解離した伸長反応産物に対して第2のオリゴヌクレオチド鎖が相補的な核酸配列を有するように、前記第1及び第2のオリゴヌクレオチド鎖を予め設計し、基板上に、前記設計した第1及び第2のオリゴヌクレオチド鎖を多数固定化し、前記標的核酸配列を含む前記検体サンプルと発色関係物質の構成成分であるリガンドとを混合した混合液を調製し、前記混合液を基板に投入すると共に、投入した反応系の温度を前記標的核酸配列が熱変性する熱変性温度にし、その後、前記反応系の温度を、前記第1のオリゴヌクレオチド鎖と前記標的核酸配列とが相補的に結合して第1の伸長反応を行う第1の伸長反応温度にし、その後、前記反応系の温度を、前記第1の伸長反応により形成された第1の伸長反応鎖から第1の伸長反応産物が解離する第1の解離温度にし、その後、前記反応系の温度を、前記解離した第1の伸長反応産物反と前記第2のオリゴヌクレオチド鎖とが相補的に結合して第2の伸長反応を行う第2の伸長反応温度にし、その後、前記反応系の温度を、前記第2の伸長反応により形成された第2の伸長反応鎖から第2の伸長反応産物が解離する第2の解離温度にし、その後、前記反応系の温度を、前記解離した第2の伸長反応産物反と前記第1のオリゴヌクレオチド鎖とが相補的に結合する温度にし、その後、前記基板上に、発色関係物質の構成成分である活性物質を投入して前記リガンドと反応する温度にし、前記発色関係物質により発色した発色シグナルを検出することを特徴とする核酸配列の検出方法を提供する。
【0030】
請求項7は、請求項4が発明をメカニズム的な特徴からとらえたのに対して、操作手順の特徴として発明をとらえたものである。
【0031】
請求項8は請求項1〜7の何れか1において、前記リガンドが、ビオチン、アビジン、抗原、抗体、オリゴヌクレオチド、酵素よりなる群から選ばれた何れかであることを特徴とする。
【0032】
請求項8は、リガンドとして好ましい具体例を挙げたものである。
【0033】
請求項9は請求項1〜7の何れか1において、前記リガンドが、ビオチン化酵素、アビジン化酵素、ストレプトアビジン化酵素、酵素標識体、酵素標識オリゴヌクレオチドよりなる群から選ばれた何れかであることを特徴とする。
【0034】
請求項9は、リガンドとして好ましい更に別の具体例を挙げたものである。
【0035】
請求項10は請求項1〜9の何れか1において、前記活性物質が、酵素標識レセプター、蛍光物質標識レセプター、基質よりなる群から選ばれた何れかであることを特徴とする。
【0036】
請求項10は、活性物質として好ましい具体例を挙げたものである。
【0037】
請求項11は請求項1〜9の何れか1において、前記基板表面には、親水性ポリマーからなる層と、及びアミノ基と反応する官能基とを有することを特徴とする。
【0038】
請求項11によれば、これにより、オリゴヌクレオチド鎖の非特異的結合を抑制する性質と、オリゴヌクレオチド鎖を基板上に強固に固定化することができる。
【0039】
本発明の請求項12は、前記目的を達成するために、請求項1〜11の何れか1の核酸配列の検出方法を行うための核酸配列検出基板であって、前記基板上にオリゴヌクレオチド鎖がスポットされていることを特徴とする核酸配列検出基板を提供する。
【0040】
本発明の請求項12によれば、標的核酸配列を検出するための検体サンプルを、本発明の核酸配列検出基板にスポット(滴下)させ、反応させることにより、目視により、検体サンプル中に検出標的とする特定の標的核酸配列が存在するかを高感度で検出することができる。
【発明の効果】
【0041】
以上説明したように、本発明に係る核酸配列の検出方法及び核酸配列検出基板によれば、検出すべき特定の標的核酸配列の濃度が極めて微量である場合であっても、高感度な検出が可能であり、しかも低コスト・短時間での検出が可能である。
【発明を実施するための最良の形態】
【0042】
以下、添付図面に従って本発明に係る核酸配列の検出方法及び核酸配列検出基板の好ましい実施の形態について詳説する。
【0043】
[本発明の第1の実施の形態]
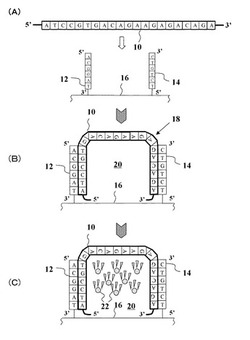
図1は、本発明の核酸配列の検出方法の第1の実施の形態のメカニズムを概念的に示した概念図である。
【0044】
図1におけるA、C、G、Tは、核酸配列を構成する塩基を示し、A:アデニン、C:シトシン、G:グアニン、T:チミンである。
【0045】
本発明の核酸配列の検出方法の第1の実施の形態は、主として、設計工程と、固定化工程と、架橋工程と、網目状空間形成工程と、取込み工程と、発色工程と、検出工程とで構成される。なお、設計工程は、標的核酸配列ごとに行う工程であり、標的核酸配列が予め分かっている場合には省略してもよい。また、本実施形態では、架橋工程と網目状空間形成工程とを別々に説明するが、同時に行われる一つの工程(網目状空間形成工程)としてもよい。
【0046】
予め、検体サンプル中の検出標的である標的核酸配列(例えば標的DNA)10を一対のオリゴヌクレオチド鎖12、14に架橋させるためのオリゴヌクレオチド鎖12、14の核酸配列の設計を行う(設計工程)。ここで、架橋される標的核酸配列10は、熱変性により2本鎖から1本鎖になったものを指す。
【0047】
即ち、インターネット等によりDNAデータバンクに保管されている情報の中から、検出しようとする標的核酸配列10の核酸配列を予め調べておき、その核酸配列の2箇所の部位と一対のオリゴヌクレオチド鎖12、14とがそれぞれ相補的に結合するように一対のオリゴヌクレオチド鎖12、14の核酸配列を設計する。
【0048】
図1(A)の左側のオリゴヌクレオチド鎖12の核酸配列を基板16側から3’-TAGGCA-5’として、標的核酸配列10の一方端の配列部分5’-ATCCGT-3’と相補性を有するように設計する。また、図1(A)の右側のオリゴヌクレオチド鎖14の核酸配列を基板16側から5’-TCTGTC-3’として、標的核酸配列10の他方端の配列部分3’-AGACAG-5’と相補性を有するように設計する。即ち、標的核酸配列10の2箇所の部位において相補性を有する核酸配列を、一対のオリゴヌクレオチド鎖12、14にそれぞれ割り当てる。尚、設計するオリゴヌクレオチド鎖12、14の塩基数は、6〜30の範囲であることが好ましい。
【0049】
オリゴヌクレオチド鎖12、14の設計において、検体サンプル中に含まれる標的核酸配列10以外の核酸配列(例えば、動物、植物、人等のDNA)が一対のオリゴヌクレオチド鎖12、14に結合されないように、標的核酸配列10固有の核酸配列を有するオリゴヌクレオチド鎖12、14を設計する。
【0050】
一対のオリゴヌクレオチド鎖12、14は、核酸配列が同じものでもよく、あるいは異なっていてもよいが、標的核酸配列10が一対のオリゴヌクレオチド鎖12、14、標的核酸配列10の間で架橋を形成可能なように、それぞれのオリゴヌクレオチド鎖12、14に対応する標的核酸配列10の2箇所の部位が離れていることが必要である。但し、2箇所の部位が標的核酸配列10の両端に位置する必要はない。
【0051】
次に、図1(A)に示すように、基板16上に、一対のオリゴヌクレオチド鎖12、14の5’末端と3’末端のうちの一方の末端を固定化することにより、一対のオリゴヌクレオチド鎖12、14を基板上に立たせる(固定化工程)。図1(A)では、一対のオリゴヌクレオチド鎖12、14のみを示したが、基板16上には一対のオリゴヌクレオチド鎖12、14が多数組立設される。尚、一対のオリゴヌクレオチド鎖12、14が多数組とは、オリゴヌクレオチド鎖12とオリゴヌクレオチド鎖14とが完全に等量関係にあることを意味するものではない。
【0052】
上記の如く準備された基板16上に、標的核酸配列10を含む検体サンプルをスポット(滴下して投入)して、架橋工程〜検出工程までを行う。即ち、図1(B)に示すように、一対のオリゴヌクレオチド鎖12、14のそれぞれと、標的核酸配列10の相補的部分が結合し、架橋状態の架橋構造体18を形成する。
【0053】
この架橋工程において、検体サンプルに含まれる標的核酸配列10以外の核酸配列は、一対のオリゴヌクレオチド鎖12、14と相補的な関係にはないので、架橋構造体18を形成することはない。
【0054】
この一対のオリゴヌクレオチド鎖12、14の多数組について架橋工程を行うことにより、基板16上には、図2に示すように、架橋構造体18が多数複雑に絡み合った微細な網目状空間20を形成する(網目状空間形成工程)。尚、図2では分かり易いように、網目状空間18を簡素化して図示したが、実際には架橋構造体18が複雑に絡み合って密集した網目状空間20となる。網目状空間20が形成されることは、例えば電子顕微鏡で直接的に確認可能であると推察される。また、一対のオリゴヌクレオチド鎖12、14について、標的核酸配列10と相補性を小さくするように核酸配列を設計することで、発色工程での発色シグナルが小さくなり、オリゴヌクレオチド鎖のどちらか一方を排除すると、発色シグナルが得られないことから、間接的に確認することができる。
【0055】
この網目状空間20に、図1(C)に示すように、発色関係物質の構成成分である多数のリガンド22を物理的な吸着作用により取り込むことができる(取込み工程)。尚、図1(C)では分かり易いように、1つの架橋構造体18で示してあるが、実際には図2に示したように、多数の架橋構造体18が複雑に絡み合った網目状空間20にリガンド22が物理的な吸着作用で取り込まれる。ここで物理的な吸着作用とは、小さい孔には小さな化学物質が入り込み易いことを利用したもので、特定の化学物質に特定の化学物質が結合し易いのとは異なり、非特異的な作用を意味する。
【0056】
したがって、取り込んだ多数のリガンド22に対して、該リガンド22に反応する発色関係物質の構成成分である活性物質(図示せず)を用いて発色させ(発色工程)、発色した発色シグナルを検出すれば、高感度の検出を行うことができる。また、発色シグナルの検出は、吸光度装置、イメージスキャナ等の汎用装置を使用することができるだけでなく、発色色素により可視化されることで目視により簡便に検出することができる。
【0057】
リガンド22としては、ビオチン、アビジン、抗原、抗体、オリゴヌクレオチド、酵素よりなる群から選ばれた何れかを好ましく使用できる。更に、リガンドとして、ビオチン化酵素、アビジン化酵素、ストレプトアビジン化酵素、酵素標識体、酵素標識オリゴヌクレオチドよりなる群から選ばれた何れかを使用することができる。また、活性物質としては、酵素標識レセプター、蛍光物質標識レセプター、基質よりなる群から選ばれた何れかを好ましく使用することができる。
【0058】
発色工程を、リガンドとしてビオチンを用い、リガンドと反応する活性物質としてアルカリフォスファターゼ標識アビジンを用いた例で説明すると、ビオチンはアビジンと反応(ビオチン反応)して、特異的に強固な結合を形成する。したがって、網目状空間20にビオチンを取り込み、アルカリフォスファターゼ標識アジビンをビオチンに反応させることで、たくさんのアルカリフォスファターゼ(AP)がビオチンに結合する。アジビン1に対してビオチン4の割合で結合する。そして、アルカリフォスファターゼは、BCIP/NBTという基質に反応(BCIP/NBT反応)して青紫色になるので、この色を検出する。
【0059】
BCIP:5-ブロモ-4-クロロ-3-インドリルリン酸
NBT:ニトロブルーテトラゾリウム
したがって、本発明のように網目状空間20にリガンド22であるビオチンを多量に取り込むことで、ビオチン反応と、アルカリフォスファターゼに対するBCIP/NBT反応とが増幅され、強い発色シグナルが形成される。
【0060】
ビオチンの代わりに、薬用植物ジギタリスから得られる強心配糖体のジゴキシゲニン(DIG)を用いる方法もある。この場合アルカリホスファターゼ標識抗ジゴキシゲニン抗体にて免疫反応を行わせる。これをビオチンの場合と同様にBCIP/NBTで青紫色に発色させる。これにより、高感度な検出が可能になる。
【0061】
本発明の実施の形態において使用される基板16表面には、親水性ポリマーからなる層、及びアミノ基と反応する官能基が存在することが好ましい。親水性ポリマーからなる層は、主としてオリゴヌクレオチド鎖の非特異的結合を抑制する役割を果たし、アミノ基と反応する官能基はオリゴヌクレオチド鎖を化学的に基板上に固定化する役割を果たす。特に、オリゴヌクレオチド鎖は、アミノ基と反応する官能基の部位で共有結合することによって、当該基板16の表面に強固に固定化される。
【0062】
本実施の形態で使用する親水性ポリマーとしては、親水性基を主鎖又は側鎖に有する高分子物質が挙げられ、ポリアルキレンオキシド、ポリエチレンオキシド、ポリプロピレンオキシド、ポリアクリルアミド、及びこれらの共重合体のいずれかを構造中に含むものであることが好ましい。特にポリアクリルアミドを光架橋性化合物等で3次元架橋した網目構造を有するポリアクリルアミドゲルが好ましい。
【0063】
また、本実施の形態に使用するアミノ基と反応する官能基としては、アルデヒド基、活性エステル基等が挙げられるが、活性エステル基が好ましい。活性エステル基は、カルボン酸のカルボキシル基が活性化されたものであり、C=Oを介して脱離基を有するカルボン酸である。活性化されたカルボン酸誘導体としては、例えば、カルボン酸であるアクリル酸、メタクリル酸、クロトン酸、マレイン酸、フマル酸などのカルボキシル基が、酸無水物、酸ハロゲン化物、活性エステル、活性化アミドに変換された化合物が挙げられる。活性エステル基としては、例えばp−ニトロフェニルエステル基、N−ヒドロキシスクシンイミドエステル基、コハク酸イミドエステル基、フタル酸イミドエステル基、5−ノルボルネン−2,3−ジカルボキシイミドエステル基、等が好ましく、p−ニトロフェニルエステル基又はN−ヒドロキシスクシンイミドエステル基がより好ましい。
【0064】
アミノ基と反応する官能基は、基板表面に直接導入されていても良いし、親水性ポリマー構造の主鎖又は側鎖に有していても良い。
【0065】
(第1の実施の形態の検出方法を行う操作手順)
次に、図3のフローチャートにより、第1の実施の形態の検出方法を行う操作手順のフローを説明する。尚、基板16は、基板表面に、親水性ポリマーからなる層、及びアミノ基と反応する官能基が存在する場合で説明する。
【0066】
ステップ1では、上記したように、一対のオリゴヌクレオチド鎖12、14の間に標的核酸配列10が架橋するように、標的核酸配列10の2箇所の部位に対して、それぞれ相補的な関係を有する一対のオリゴヌクレオチド鎖12、14を設計する。
【0067】
次に、ステップ2において、基板16上に一対のオリゴヌクレオチド鎖12、14を固定化する。固定化する方法としては、基板16上の表面に存在する、又は親水性ポリマーに含まれるアミノ基と反応する官能基のうち、少なくとも一部のアミノ基と反応する官能基とオリゴヌクレオチド鎖12、14とを反応させて共有結合を形成させることにより、基板16表面でオリゴヌクレオチド鎖12、14を固定化する。続いて、オリゴヌクレオチド鎖12、14を固定化した以外の基板16表面のアミノ基と反応する官能基を不活性化する。即ち、残りのアミノ基と反応する官能基を不活性化することにより、オリゴヌクレオチド鎖12、14を基板16の表面に固定することができる。基板16表面に固定化されなかったオリゴヌクレオチド鎖12、14を除去するため、純水や緩衝液で洗浄してもよい。洗浄後はオリゴヌクレオチド鎖12、14を固定化した以外の基板16表面のアミノ基と反応する官能基の不活性化処理をアルカリ化合物、あるいは一級アミノ基を有する化合物で行う。
【0068】
ステップ3では、標的核酸配列10を含む検体サンプルと発色関係物質の構成成分であるリガンド22(例えばビオチン)とを混合した混合液を調製する。
【0069】
次に、ステップ4では、標的核酸配列が一本鎖か、二本鎖かが判断され、NOであれば、ステップ5において、検体サンプルを投入した反応系の温度を、標的核酸配列10の融解温度(melting temperature:Tm)以上、例えば90〜95℃に上昇させる。加熱時間は1〜10分程度が好ましい。これにより、2本鎖の標的核酸配列10を解離して1本鎖の標的核酸配列10にする。また、一本鎖であっても、複雑な二次構造等を形成している場合は、熱変性処理を行う。YESであれば、ステップ6へ進む。
【0070】
ステップ6では、基板16及び検体サンプルとリガンドの混合液をハイブリダイゼーション温度に調節して、混合液を基板へ投入(滴下)する。ハイブリダイゼーション温度は、オリゴヌクレオチド鎖12、14の融解温度(Tm)の2〜8℃低い値が好ましい。
【0071】
ステップ7では、オリゴヌクレオチド鎖12、14の融解温度(Tm)の2〜8℃低い温度でハイブリダイゼーション反応を行う。反応時間としては、60分以上であることが好ましい。これにより、上記の如く設計された一対のオリゴヌクレオチド鎖12、14と、標的核酸配列10の相補的部分(2箇所)とがそれぞれ相補的に結合し、架橋状態の架橋構造体18を形成する。かかる架橋構造体18が多数形成され、複雑に絡み合うことで網目状空間20が形成される。そして、この網目状空間20に投入したリガンド22が物理的な吸着作用で取り込まれることにより、多数のリガンド22を取り込むことができる。
【0072】
次に、ステップ8では、基板16反応液を捨てて、基板16を洗浄液、例えば0.1wt%のSDS溶液を用いて洗浄する。
【0073】
次に、ステップ9では、活性物質(例えばアルカリフォスファターゼ標識アビジン)を基板16上に投入して、網目状空間20に取り込まれたリガンド22との反応により結合させる。反応温度及び反応時間としては、反応温度が20〜40℃の範囲が好ましく、反応時間が5〜60分の範囲が好ましい。
【0074】
次のステップ10では、前記したステップ9の反応を更に続けるか否かが判断され、反応が十分であり、NOであれば次のステップ11に進み、反応が未だ不十分であり、YESであればステップ8に戻り、洗浄工程を経て、ステップ9で、活性物質(例えばBCIP/NBT)を基板16上に投入して、網目状空間20に取り込まれたリガンド22と反応した活性物質に、更に反応させる。反応温度及び反応時間としては、反応温度が20〜40℃の範囲が好ましく、反応時間が5〜60分の範囲が好ましい。
【0075】
ステップ11では、再び基板16の洗浄を行い、ステップ12で発色シグナルの検出を行う。例えば、リガンド22としてビオチンを用い、活性物質としてアルカリフォスファターゼ標識アビジン用いた場合には、BCIP/NBT試薬中に基板16を浸漬して青紫色のスポットを発色させる。発色させた発色シグナルは、目視で検出してもよく、あるいは発色画像をイメージスキャナでパソコンに取り込んで解析してもよく、更には吸光度測定装置で発色度合いを測定してもよい。
【0076】
このように、検体サンプル中に標的核酸配列10が存在する場合には、網目状空間20が形成され、網目状空間20に発色関係物質に構成成分であるリガンド22が多数保持されることになるので、強い発色シグナルを発色することが可能になる。これにより、検体サンプル中に標的核酸配列10が存在する場合には、高感度な検出が可能となる。
【0077】
[本発明の第2の実施の形態]
図4は、本発明の核酸配列の検出方法の第2の実施の形態のメカニズムを概念的に示した概念図であり、網目状空間20を第1の実施の形態とは別の方法で形成する。尚、第1の実施の形態と同じものについては同符号を付して説明する。
【0078】
本発明の核酸配列の検出方法の第2の実施の形態は、主として、設計工程と、固定化工程と、第1の伸長反応工程と、第1の解離工程と、第1の架橋工程と、第2の伸長反応工程と、第2の解離工程と、第2の架橋工程と、繰返し架橋工程と、ハイブリダイゼーション工程と、網目状空間形成工程と、取込み工程と、発色工程と、検出工程とで構成される。
【0079】
予め、標的核酸配列19と、第1のオリゴヌクレオチド鎖24と、第2のオリゴヌクレオチド鎖26との各核酸配列の関係において、伸長反応により産出された伸長反応産物28、36が架橋構造を形成するように、第1及び第2のオリゴヌクレオチド鎖24、26の核酸配列を設計する(設計工程)。即ち、標的核酸配列19と第1のオリゴヌクレオチド鎖24とが相補的に結合した後に、第1のオリゴヌクレオチド鎖24をプライマーとすると共に標的核酸配列19を鋳型として第1の伸長反応をさせて形成される第1の伸長反応鎖30が標的核酸配列19から解離して、相補的な核酸配列を有する第2のオリゴヌクレオチド鎖26と結合できるように、第1及び第2のオリゴヌクレオチド鎖24、26を設計する。標的核酸配列19の核酸配列については、第1の実施の形態と同様にDNAデータバンクから情報を得ることができる。
【0080】
図4(A)の左側の第1のオリゴヌクレオチド鎖24の核酸配列を基板16側から5’-TAGGCA-3’として、標的核酸配列19の片端の配列部分3’-ATCCGT-5’と相補性を有するように設計する。また、図4(A)の右側の第2のオリゴヌクレオチド鎖26の核酸配列を基板16側から5’-AGACAG-3’として、第1の伸長反応産物28の片端の配列部分3’-UCUGUC-5’と相補性を有するように設計する。尚、伸長反応に使用された塩基U(ウラシル)にはビオチンが付けられた場合で示してある。ビオチン非標識時は塩基Tを使用。塩基のUは、本来RNAを構成する塩基だが、ビオチンを標識とすることで化学構造的に塩基のTに近くなるため、DNAポリメラーゼでの伸長反応が可能となる。
【0081】
次に、図4(A)に示すように、基板16上に、第1及び第2のオリゴヌクレオチド鎖24、26の5’末端を固定化することにより、一対のオリゴヌクレオチド鎖24、26を基板上に立たせる(固定化工程)。
【0082】
図4(A)では、第1及び第2のオリゴヌクレオチド鎖24、26をそれぞれ1本ずつのみを示したが、基板16上には第1及び第2のオリゴヌクレオチド鎖24、26が多数立設される。
【0083】
上記の如く準備された基板16上に、標的核酸配列19を含む検体サンプルをスポット(滴下により投入)し、第1の伸長反応工程〜検出工程までを行う。即ち、第1のオリゴヌクレオチド鎖24と、熱変性により解離した1本鎖の標的核酸配列19の相補的部分が結合した後、標的核酸配列19を鋳型とし、第1のオリゴヌクレオチド鎖24をプライマーとして伸長反応を行うと、従来のMPEX法と同様に図4(B)のような二本鎖核酸配列が形成される(第1の伸長反応工程)。しかし、伸長反応を第1及び第2のオリゴヌクレオチド鎖24、26のTm(融解温度)温度領域で行った場合、伸長反応産物28のオリゴヌクレオチド鎖24、26と相補的な領域は、常に一本鎖に解離する可能性があり、また、基板16上には、伸長反応産物28と相補的に結合するよう予め設計された第2のオリゴヌクレオチド鎖26が固定化されているため、伸長反応産物28の一部は、標的核酸配列19と解離した後に(第1の解離工程)、第2のオリゴヌクレオチド鎖26と結合し、架橋状態を形成する(第1の架橋工程)。
【0084】
即ち、第1の伸長反応により伸長する第1の伸長反応産物28のオリゴヌクレオチド鎖24、26と相補的な領域は、Tm温度領域という不安定なエネルギー状態において、分子構造的に安定した状態を目指すため、図4(C)に示すように、相補的な配列を有する第2のオリゴヌクレオチド鎖26と結合することとなる。図4(C)に記載した「ブリッジング」との用語は、2つ以上の一端が固定化されたオリゴヌクレオチド間を標的核酸配列が架橋することを意味する。そうした意味で、第1の実施の形態のように一対のオリゴヌクレオチド鎖24、26に標的核酸配列10が架橋することもブリッジングと言える。
【0085】
尚、検体サンプルに含まれる標的核酸配列19以外の核酸配列のものは、第1のオリゴヌクレオチド鎖24と相補的な関係にはないので、第1のオリゴヌクレオチド鎖24に結合して伸長反応を行うことはない。
【0086】
第1の伸長反応の際、使用する酵素には、DNAポリメラーゼ、RNAポリメラーゼ、双方を混合したものが含まれる。
【0087】
次に、第2のオリゴヌクレオチド鎖26をプライマーとすると共に第1の伸長反応産物28を鋳型として図4(D)に示すような伸長反応が起こる(第2の伸長反応工程)。尚、図4(D)では、図を簡素化するために、標的核酸配列19は図示していないが、このとき標的核酸配列19は第1のオリゴヌクレオチド鎖24から解離し、別の第1のオリゴヌクレオチド鎖と結合する。
【0088】
第2以降の伸長反応の際、酵素はDNAポリメラーゼを使用する。この時、DNAポリメラーゼはpolI型のもの(例えば、Taq(タカラバイオ))でも可能だが、耐熱性α型のもの(例えば、KOD(TOYOBO))が好ましく、鎖置換活性を有するものを使用することがより好ましい。鎖置換活性を有することにより、鋳型DNAもしくはcDNAに二本鎖を形成している箇所が存在しても、水素結合を切断しながら伸長反応を進めることが容易となる。鎖置換活性を有するDNAポリメラーゼとしては、Klenow Fragment、phi29 DNA polymerase、BcaBEST DNA polymerase、Bst DNA polymerase等が上げられる。反応温度は前記第1及び第2のオリゴヌクレオチド鎖24、26のTm値以上、65℃未満が好ましく、反応時間は20〜90分が好ましい。
【0089】
前記第1及び第2のオリゴヌクレオチド鎖24、26は多数を基板16上に固定化している。そこで、第2の伸長反応工程で伸長した第2の伸長反応産物36が、第1の伸長反応産物28から解離し(第2の解離工程)、前記第1のオリゴヌクレオチド鎖24とは別であり、かつ、同じ核酸配列の第1のオリゴヌクレオチド鎖24と結合し、架橋状態を形成する(第2の架橋工程)。この状態から、第1のオリゴヌクレオチド鎖24がプライマーとなるため、第1及び第2のオリゴヌクレオチド鎖24、26、の間で第1と第2の架橋工程が繰り返されることとなる(繰返し架橋工程)。その後、設定温度をオリゴヌクレオチド鎖のハイブリダイゼーション温度にすることで(ハイブリダイゼーション工程)、基板16上に、より多くの架橋構造体を形成させることとなる。ハイブリダイゼーション温度は、オリゴヌクレオチド鎖24、26の融解温度(Tm)から2〜8℃低い温度が好ましい。
【0090】
これにより、図5に示すように、架橋構造体が多数絡み合った微細な網目状空間20が形成され(網目状空間形成工程)、第1の実施の形態と同様に、網目状空間20に取り込んだ多数のリガンド22に対して(取込み工程)、該リガンド22に反応する活性物質を用いて発色させ(発色工程)、発色した発色シグナルを検出すれば、高感度の検出を行うことができる。
【0091】
(第2の実施の形態の検出方法を行う操作手順)
次に、図6のフローチャートにより、第2の実施の形態の検出方法を行う操作手順のフローを説明する。尚、基板16は、基板表面に、親水性ポリマーからなる層、及びアミノ基と反応する官能基が存在する場合で説明する。
【0092】
ステップ1では、上記したように、標的核酸配列19と、第1のオリゴヌクレオチド鎖24と、第2のオリゴヌクレオチド鎖26との各核酸配列の関係において、伸長反応により産出された第1の伸長反応産物28、36が架橋構造を形成するように、第1及び第2のオリゴヌクレオチド鎖24、26の核酸配列を設計する。
【0093】
ステップ2では、基板16上に、設計した第1及び第2のオリゴヌクレオチド鎖24、26を固定化する。固定化する方法としては第1の実施の形態で説明したので省略する。
【0094】
ステップ3では、標的核酸配列19を含む検体サンプルと、発色関係物質の構成成分であるリガンド22(例えばビオチン標識dUTP)とを混合した混合液を調製する。
【0095】
次に、ステップ4では、標的核酸配列が一本鎖か、二本鎖かが判断され、NOであれば、ステップ5において、検体サンプルを投入した反応系の温度を、標的核酸配列10の融解温度(melting temperature:Tm)以上、例えば90〜95℃に上昇させる。加熱時間は1〜10分程度が好ましい。これにより、2本鎖の標的核酸配列10を解離して1本鎖の標的核酸配列10にする。また、一本鎖であっても、複雑な二次構造等を形成している場合は、熱変性処理を行う。YESであれば、ステップ6へ進む。
【0096】
ステップ6では、基板16及び検体サンプルとリガンドの混合液を基板へ投入(滴下)する。
【0097】
次に、ステップ7では、第1の伸長反応工程と、第1の解離工程と、第1の架橋工程と、第2の伸長反応工程と、第2の解離工程と、第2の架橋工程と、繰返し架橋工程と、ハイブリダイゼーション工程と、網目状空間形成工程と、取込み工程と、を実施する。
【0098】
即ち、第1の伸長反応工程において、標的核酸配列19を鋳型とし、第1のオリゴヌクレオチド鎖24をプライマーとして伸長反応を行い、第1の解離工程において、伸長反応産物28を、標的核酸配列19と解離させ、第1の架橋工程において、第2のオリゴヌクレオチド鎖26と結合させ、架橋状態を形成させる。
【0099】
次に、第2の伸長反応工程において、第2のオリゴヌクレオチド鎖26をプライマーとすると共に第1の伸長反応産物28を鋳型として伸長反応させ、第2の解離工程において、第2の伸長反応工程で伸長した第2の伸長反応産物36を、第1の伸長反応産物28から解離させ、第2の架橋工程において、前記第1のオリゴヌクレオチド鎖24とは別であり、かつ、同じ核酸配列の第1のオリゴヌクレオチド鎖24と結合させ、架橋状態を形成させる。
【0100】
その後、繰返し架橋工程において、第1及び第2のオリゴヌクレオチド鎖24、26、の間で第1と第2の架橋工程が繰り返させ、その後、ハイブリダイゼーション工程において、設定温度をオリゴヌクレオチド鎖のハイブリダイゼーション温度にし、基板16上に、より多くの架橋構造体を形成させる。これにより、基板16上に架橋構造体が多数絡み合った微細な網目状空間20が形成される(網目状空間形成工程)。
【0101】
網目状空間20が形成された後は、第1の実施の形態と同様に、ステップ8〜ステップ12を実施することで、標的核酸配列19を高感度に検出することができる。
【0102】
尚、ステップ3において、標的核酸配列19とリガンド22の混合液を調製したが、リガンド22はステップ6とステップ7との間で投入してもよい。
【0103】
[本発明の第2の実施の形態の変形例]
上記説明した本発明の第2の実施の形態では、第1及び第2の、2種類のオリゴヌクレオチド鎖24、26を用いることで説明したが、3種類以上のオリゴヌクレオチド鎖を使用することもできる。
【0104】
例えば、3種類のオリゴヌクレオチド鎖の例で説明すると、第2の実施の形態における第2の解離工程で解離した第2の伸長反応産物36が、該第2の伸長反応産物36と相補的な核酸配列を有するように設計された第3のオリゴヌクレオチド鎖に結合する。結合した後は、同様に伸長反応させ、伸長反応産物を解離し、第1のオリゴヌクレオチド鎖に結合し、基板16上に、架橋構造を形成する。これら第1から第3の繰返し架橋工程を経て微細な網目状空間を形成させる。
【0105】
したがって、次々に解離される伸長反応産物と相補的な関係のオリゴヌクレオチド鎖を予め設計することで3種類以上のオリゴヌクレオチド鎖についても本発明の第2の実施の形態を適用することができる。
【0106】
第2の実施の形態において、基板16表面には、親水性ポリマーからなる層、及びアミノ基と反応する官能基が存在することが好ましい。これにより、伸長反応による2本鎖の伸長反応鎖が熱変性処理により解離し、解離した伸長反応産物が別のオリゴヌクレオチド鎖と結合して再び伸長反応する。
【0107】
[核酸配列検出基板]
上述した第1及び第2の実施の形態において、オリゴヌクレオチド鎖を基板に固定化した核酸配列検出基板を製作し、この核酸配列検出基板に、例えば標的核酸配列を含む検体サンプルをスポット(投入)するだけで、検体サンプル中に検出標的とする特定の標的核酸配列が存在するかを高感度で検出することができる。
【実施例】
【0108】
[実施例1]
次に、本発明の第1の実施の形態の検出方法の実施例を説明する。標的核酸配列としては、ノロウイスル固有の核酸配列を用い、この標的核酸配列を検出する例で説明する。
【0109】
即ち、以下の手法にて、標的核酸配列に対して相補的な一対のオリゴヌクレオチド鎖をプラスチック基板表面に固定化することで、検体サンプルとして標的核酸配列を投入した際に、基板上の一対のオリゴヌクレオチド鎖と結合し架橋状態の核酸配列構造を形成させ、その構造下に微細な網目状空間を作り出した。そして、その網目状空間に発色関係物質の構成成分であるリガンドを物理的な吸着作用で多量に取り込むことができ、これによって、標的核酸配列を高感度に検出した。
【0110】
即ち、標的核酸配列を、ノロウイルスcDNAのPCR産物として実験を行った。このPCR産物は、ノロウイルスの構造蛋白質であるカプシド蛋白質をコードしている領域ORF2を対象とした。また、ノロウイルスはG1とG2の2つのグループに分けられるため、PCR産物は、G1とG2の2種類を準備して実験を行った。
【0111】
(標的核酸配列の調整)
糞便をリン酸緩衝液に溶解し、10%乳剤を作製し、12,000rpmで冷却遠心後、遠心上清からRNAの抽出を行った。遠心上清を室温に戻し、RNA抽出精製キット(QIAamp Viral RNA Mini Kit (QIAGEN))を用いRNA抽出精製後、RNA抽出液24μLに対し5倍濃縮したRT-PCR用Buffer3μL、滅菌水1μL、DNase (1U/μL)2μL(DNase I(タカラバイオ))を加え、37℃−30分、75℃−5分を経て氷冷した。得られたRNAをランダムプライマー(Random Primer Hexamer(Amersham Pharmacia))とRT反応キット(SuperScript II Reverse Transcriptase Rnase H- Reverse Transcriptase(Invitrogen))を用いcDNAへ逆転写し(42℃−1時間(1サイクル)、99℃−5分(1サイクル)、4℃)、そのcDNAを鋳型として、プライマー1(25μM)とプライマー2(25μM)、プライマー3(25μM)、プライマー4(25μM)と、DNAポリメラーゼ(Ex Taq(タカバイオ))とを用いたPCR反応(94℃−3分(1サイクル)、94℃−1分、50℃−1分、72℃−2分(40サイクル)、72℃−15分(1サイクル))によりG1のPCR産物、G2のPCR産物をそれぞれ準備し、電気泳動で増幅を確認し精製後、標的核酸配列として実験に用いた。
【0112】
(使用したプラスチック基板)
市販のDNAアレイプラスチック基板(住友ベークライト製S-BIO(R) PrimeSurface(R))を実験に用いた。この基板は、実施の形態で述べた親水性ポリマーからなる層、及びアミノ基と反応する官能基を表面に有するプラスチック製の基板である。図7に示すように、横4(1〜4)×縦6(A〜F)の合計24箇所のスポット領域があり、各スポット領域で、各核酸配列の有無を評価した。本実験では、G1のPCR産物検出用スポット領域を12箇所、G2のPCR産物検出用スポット領域を12箇所のプラスチック基板を作製して使用した。
【0113】
(オリゴヌクレオチド鎖の固定)
G1のPCR産物検出のため、下記に示す核酸配列で構成された一対のオリゴヌクレオチド鎖1及びオリゴヌクレオチド鎖2を合成した。それぞれのオリゴヌクレオチド鎖1、2は、G1のPCR産物と相補的な配列となるようにした。オリゴヌクレオチド鎖1は、5’末端がアミノ基で修飾されたヌクレオチド(20塩基鎖)であり、これを0.25M炭酸バッファ(pH9.0)で溶解し、1μMのオリゴヌクレオチド溶液を調製した。
【0114】
一方、オリゴヌクレオチド鎖2は、3’末端がアミノ基で修飾されたヌクレオチド(20塩基鎖)であり、これを0.25M炭酸バッファ(pH9.0)で溶解し、1μMのオリゴヌクレオチド溶液を調製した。
【0115】
そして、オリゴヌクレオチド鎖1の溶液と、オリゴヌクレオチド鎖2の溶液とを混合し、スポッタ(日立ソフトウェア−エンジニアリング製Marks-I)を用い、100μm径クロスカットピンでプラスチック基板の表面上にスポットした。即ち、図7(C)に示すプラスチック基板の横1〜4×縦A〜Cで区画される12個のスポット領域にスポットした(スポット領域1〜12)。そして、オリゴヌクレオチド鎖をスポットした各基板を、80℃で1時間加熱して、各オリゴヌクレオチド鎖を固定化させた。
【0116】
また、G2のPCR産物検出のため、下記に示す核酸配列のオリゴヌクレオチド鎖3及びオリゴヌクレオチド鎖4を合成した。それぞれのオリゴヌクレオチド鎖3、4は、G2のPCR産物と相補的な配列となるようにした。オリゴヌクレオチド鎖3は、5’末端がアミノ基で修飾されたヌクレオチド(20塩基鎖)であり、これを0.25M炭酸バッファ(pH9.0)で溶解し、1μMのオリゴヌクレオチド溶液を調製した。
【0117】
一方、オリゴヌクレオチド鎖4は、3’末端がアミノ基で修飾されたヌクレオチド(23塩基鎖)であり、これを0.25M炭酸バッファ(pH9.0)で溶解し、1μMのオリゴヌクレオチド溶液を調製した。
【0118】
そして、オリゴヌクレオチド鎖3の溶液と、オリゴヌクレオチド鎖4の溶液とを混合し、スポッタ(日立ソフトウェア−エンジニアリング製Marks-I)を用い、100μm径クロスカットピンでプラスチック基板の表面上にスポットした。即ち、図7(B)に示すプラスチック基板の横1〜4×縦D〜Fで区画される12個のスポット領域にスポットした(スポット領域13〜24)。そして、オリゴヌクレオチド鎖をスポットした各基板を、80℃で1時間加熱して、各オリゴヌクレオチド鎖を固定化させた。
【0119】
上記したG1及びG2のPCR産物を調製したときのプライマー1〜4の核酸配列、及びプラスチック基板に固定化したオリゴヌクレオチド鎖1〜4の核酸配列は次のとおりである。
・プライマー1(COG1F):5’-CGYTGGATGCGNTTYCATGA-3’
・プライマー2(G1-SKR):5’-CCAACCCARCCATTRTACA-3’
・プライマー3(COG2F): 5’-CARGARBCNATGTTYAGRTGGATGAG -3’
・プライマー4(G2-SKR):5’-CCRCCNGCATRHCCRTTRTACAT-3’
・オリゴヌクレオチド鎖1(G1SKF):5’-CTGCCCGAATTYGTAAATGA-3’
・オリゴヌクレオチド鎖2(G1-1’): 5’-CCAACAAACATGGATGGCAC-3’
・オリゴヌクレオチド鎖3(RING2AL-TP): 5’-TGGGAGGGSGATCGCRATCT-3’
・オリゴヌクレオチド鎖4(G2SKRrc)5’-ATGTAYAAYGGDYATGCNGGYGG-3’
IUB Codes(Code of international Union of Biochemistry). R=A or G ; B=C, G or T ; Y=C or T ; D=A, G or T ; K=G or T ; H=A, C or T ; M=A. or C ; V=A, C or G ; S=G or C ; W=A or T ; N=any base.
(ハイブリダイゼーション)
上記の如く一対のオリゴヌクレオチド鎖(オリゴヌクレオチド鎖1とオリゴヌクレオチド鎖2の一対、オリゴヌクレオチド鎖3とオリゴヌクレオチド鎖4の一対)を固定化したプラスチック基板に、準備した標的核酸配列を59μmと、ハイブリバッファーを13μLと、8μLのビオチンを混合した混合液を投入した。
【0120】
尚、図7(A)の基板は、上記の如く各オリゴヌクレオチド鎖を固定化した基板に、標的核酸配列を含まない検体サンプルを投入した場合である。
【0121】
そして、基板上の反応系を95℃、8分間の加熱条件で加熱することにより、標的核酸配列の2本鎖を熱変性して解離させて1本鎖にし、更に反応系を54℃で90分間ハイブリダイズさせた。
【0122】
次に、洗浄後、0.01mg/mLのアルカリフォスファターゼ標識ストレフトアビジンを基板上へ投入し、カバーガラスで覆い、反応系を37℃で30分反応させた。その後、洗浄を行い、BCIP/NBT(BCIP/NBT Phosphatase Substrate(1-Component System)(KPL))発色試薬中に基板を浸漬し、37℃で30分間反応させて洗浄し、青紫色のスポットを発色させた。発色画像はイメージスキャナ(キヤノン製、PIXUS MP470)でパソコンへ取り込み、画像解析ソフト(住友ベークライト製、誰でもDNAアレイ解析ソフト)で発色強度を数値化した。発色画像を図7に示す。また、数値化結果の平均S/N比(Signal to Noise Ratio)を下記の式1から求め、図8の表1に示す。
【0123】
S/N比=1×S/(S+N)…式1
S/N:非測定時に対する測定時の発色強度の比率:最大値1.0
S:測定時の発色シグナルの強度
N:非測定時の発色シグナルの強度
その結果、G1のPCR産物を標的核酸配列とした場合、図7(C)から分かるように、スポット領域1〜12のみが発色した。一方、G2のPCR産物を標的核酸配列とした場合、図7(B)から分かるように、スポット領域13〜24のみが発色した。
【0124】
比較対象としてPCR産物(標的核酸配列)を加えなかった場合は、図7(A)から分かるように、オリゴヌクレオチド鎖1、2を固定化した場合、及びオリゴヌクレオチド鎖3、4を固定化した場合のいずれについても発色が得られなかった。
【0125】
尚、図示しなかったが、DNAアレイプラスチック基板のオリゴヌクレオチドの固定において、G1のPCR産物検出の為のスポットがオリゴヌクレオチド鎖1のみ(スポット領域1〜6)、オリゴヌクレオチド鎖2のみ(スポット領域7〜12)、G2のPCR産物検出の為のスポットがオリゴヌクレオチド鎖3のみ(スポット領域13〜18)、オリゴヌクレオチド鎖4のみ(スポット領域19〜24)のものを18枚作製した。そして、G1のPCR産物、G2のPCR産物をそれぞれ6枚ずつ前記方法でハイブリダイズさせ、同時にビオチンを投入し、洗浄後、アルカリフォスファターゼ標識アビジンを基板上へ投入し、カバーガラスで覆い37℃で30分放置した後、洗浄を行い、BCIP/NBT発色試薬中に基板を浸漬し、37℃で30分間反応させ洗浄し、青紫色のスポットを発色させた。
【0126】
発色画像はイメージスキャナ(キヤノン製、PIXUS MP470)でパソコンへ取り込み、画像解析ソフト(住友ベークライト製、誰でもDNAアレイ解析ソフト)で発色強度を数値化した。
【0127】
その結果、スポット領域1〜24のいずれにおいても発色は確認されず、比較対象としてPCR産物を加えなかった6枚のDNAアレイプラスチック基板においても、発色が得られなかった。
【0128】
また、図8の表1から分かるように、図7(C)のスポット1〜12に示したG1のPCR産物の発色シグナル強度(S)の平均値と、図7(A)での発色ノイズ強度(N)の平均値との、S/N比は0.97と極めて高感度な検出を行うことができた。
【0129】
同様に、図7(B)のスポット13〜24に示したG2のPCR産物の発色シグナル強度(S)の平均値と、図7(A)での発色ノイズ強度(N)の平均値とのS/N比は0.98と極めて高感度な検出を行うことができた。
【0130】
[実施例2]
次に、本発明の第2の実施の形態の検出方法の実施例を説明する。標的核酸配列としては、実施例1と同様に、ノロウイスル固有の核酸配列を標的核酸配列として検出する例で説明する。
【0131】
即ち、以下の手法にて、基板表面に固定化した第1のオリゴヌクレオチド鎖と標的核酸配列が相補的に結合後、第1のオリゴヌクレオチド鎖がプライマーとなり、標的核酸配列を鋳型として伸長反応し、解離反応により標的核酸配列と相補的な配列である伸長反応産物が解離する。
【0132】
そして、解離した第1の伸長反応産物が、基板表面に固定化した別の第2のオリゴヌクレオチド鎖と相補的に結合後、第2のオリゴヌクレオチド鎖がプライマーとなり、第1の伸長反応産物を鋳型として伸長反応し、解離反応により第1の伸長反応産物と相補的な配列の伸長反応産物が解離する。
【0133】
これを繰り返すことで基板上に微細な網目状空間を作り出し、該網目状空間にリガンドを物理的な吸着効果により取り込み、リガンドに反応する活性物質を用いることで、標的核酸配列を検出した。
【0134】
(標的核酸配列の調整)
実施例1で示したノロウイルスcDNAのG1のPCR産物、G2のPCR産物をそれぞれ準備し精製後、0、100、101、102、104、106、108 copies/μLとなるよう濃度調整し、標的核酸配列として実験に用いた。バックグラウンドとしては滅菌水を添加したもので評価した。
【0135】
(プラスチック基板)
実施例1で示したプラスチック基板(住友ベークライト製S-BIO(R) PrimeSurface(R))のMPEX(Multiple Primers EXtension)法対応基板を使用し、基板表面へ各種オリゴヌクレオチド鎖の一端を固定化し、実験に用いた。
【0136】
MPEX法は、従来技術において非特許文献1、特許文献1、特許文献2で説明した通りであるが、本実施例2の比較対照としては、基板上に固定化するオリゴヌクレオチド鎖が1種類のみで、伸長反応産物が架橋構造を形成しないMPEX法を実施することにより、標的核酸配列の検出を行った。また、バックグラウンドとしては、滅菌水を添加したもので実施した。
【0137】
(オリゴヌクレオチド鎖の固定)
実施例2では、G1のPCR産物検出の為、下記に示すオリゴヌクレオチド鎖5及びオリゴヌクレオチド鎖6を合成した。オリゴヌクレオチド鎖5は、G1のPCR産物と相補的な配列となるようにした。また、オリゴヌクレオチド鎖5は、5’末端がアミノ基で修飾されたヌクレオチド(20塩基鎖)であり、これを0.25M炭酸バッファ(pH9.0)を用いて溶解し、1μMのオリゴヌクレオチド溶液を調製した。
【0138】
一方、オリゴヌクレオチド鎖6も5’末端がアミノ基で修飾されたヌクレオチド(19塩基鎖)であり、これを0.25M炭酸バッファ(pH9.0)を用いて溶解し、1μMのオリゴヌクレオチド溶液を調製した。
【0139】
実施例2では、これらオリゴヌクレオチド鎖5及びオリゴヌクレオチド鎖6の溶液を混合し、スポッタ(日立ソフトウェアーエンジニアリング製Marks-I)を用い100μm径クロスカットピンでプラスチック基板の表面上にスポットした(スポット領域1〜4)。尚、実施例2は、図7のように基板の図は示さないが、同様である。
【0140】
一方、上記した比較対照実験として、1μMのオリゴヌクレオチド鎖5と6のうちの1種類のオリゴヌクレオチド鎖のみを基板のスポット領域に別々にスポットした(スポット領域5〜8、9〜12)。
【0141】
そして、実施例2の基板及び比較対照の基板のそれぞれを、80℃で1時間加熱して、各オリゴヌクレオチド鎖を固定化させた。
【0142】
また、実施例2では、G2のPCR産物検出の為、オリゴヌクレオチド鎖7及びオリゴヌクレオチド鎖8を合成した。オリゴヌクレオチド鎖7は、G2のPCR産物と相補的な配列となるようにした。また、オリゴヌクレオチド鎖7は、5’末端がアミノ基で修飾されたヌクレオチド(26塩基鎖)であり、これを0.25M炭酸バッファ(pH9.0)を用いて溶解し、1μMのオリゴヌクレオチド溶液を調製した。
【0143】
一方、オリゴヌクレオチド鎖8も5’末端がアミノ基で修飾されたヌクレオチド(20塩基鎖)であり、これを0.25M炭酸バッファ(pH9.0)を用いて溶解し、1μMのオリゴヌクレオチド溶液を調製した。
【0144】
そして、実施例2では、これらのオリゴヌクレオチド鎖7とオリゴヌクレオチド鎖8の溶液を混合し、スポッタ(日立ソフトウェアーエンジニアリング製Marks-I)を用い100μm径クロスカットピンでプラスチック基板の表面上にスポットした(スポット領域13〜16)。
【0145】
一方、上記した比較対照実験では、1μMのオリゴヌクレオチド鎖7と8のうちの1種類のオリゴヌクレオチド鎖のみを基板上のスポット領域に別々にスポットした(スポット領域17〜20、21〜24)。
【0146】
そして、実施例2の基板及び比較対照の基板のそれぞれを、80℃で1時間加熱して、各オリゴヌクレオチド鎖を固定化させた。
【0147】
上記したプラスチック基板に固定化したオリゴヌクレオチド鎖5〜8の核酸配列は次のとおりである。
・オリゴヌクレオチド鎖5(RING1-TP(a)):5’-AGATYGCGATCYCCTGTCCA -3’
・オリゴヌクレオチド鎖6(G1SKR):5’-CCAACCCARCCATTRTACA-3’
・オリゴヌクレオチド鎖7(COG2F):5’-CARGARBCNATGTTYAGRTGGATGAG-3’
・オリゴヌクレオチド鎖8(RING2AL-TP rc):5’-AGATYGCGATCWCCCTCCCA-3’
IUB Codes(Code of international Union of Biochemistry). R=A or G ; B=C, G or T ; Y=C or T ; D=A, G or T ; K=G or T ; H=A, C or T ; M=A. or C ; V=A, C or G ; S=G or C ; W=A or T ; N=any base.
そして、実施例2の基板上に、標的核酸配列を59μL、10×MPEX バッファーAを8.0μL、10×KOD-Plusバッファー(TOYOBO)を8.0μL、0.1mMビオチン標識dUTPを0.80μL、0.1mM dATPを0.8μL、0.1mM dCTPを0.8μL、0.1mM dGTPを0.8μL、KOD-Plus (TOYOBO)を2μLを混合した混合液を投入し、基板上の反応系を、95℃で8分間加熱し、核酸配列の2重鎖を熱変性で解離させ1本鎖にした。
【0148】
次に、基板上にカバーガラスをかけ、200μLの0.25Mリン酸バッファ(pH8.5)で内部を湿らせた密閉容器(10cm×15cm×3cm)中において、56℃で90分間反応させた。
【0149】
次に、カバーガラスをはずして洗浄後、0.01mg/mL濃度のアルカリフォスファターゼ標識ストレプトアビジンを8μL、10×MPEXバッファーAを8.0μL、2×MPEXバッファーBを40μL、滅菌水を24μLの割合で混合した混合液をプラスチック基板へ投入した。
【0150】
次に、カバーガラスをかけ、200μLの0.25Mリン酸バッファ(pH8.5)で内部を湿らせた密閉容器(10cm×15cm×3cm)中において、37℃で30分間反応させた。それから基板を洗浄後、BCIP/NBT溶液(BCIP/NBT Phosphatase Substrate(1-Component System)(KPL))に浸漬し、37℃で30分間反応させてから基板を洗浄し、青紫色のスポットを発色させた。
【0151】
発色画像はイメージスキャナ(キヤノン製、PIXUS MP470)でパソコンへ取り込み、画像解析ソフト(住友ベークライト製、誰でもDNAアレイ解析ソフト)で発色強度を数値化した。
【0152】
実施例2について、上記検出実験を、標的核酸配列の濃度が0、100、101、102、104、106、108copies/μL の7水準の濃度について実施した。同様に、1種類のオリゴヌクレオチド鎖のみを固定化した比較対照実験についても、標的核酸配列の濃度が0、100、101、102、104、106、108copies/μL の7水準の濃度について実施した。
【0153】
そして、実施例2と比較対照実験での上記各濃度における発色シグナル量を比較した。比較結果を図9に示す。その結果、図9から分かるように、オリゴヌクレオチド鎖が1種類のみである比較対照実験は、標的核酸配列を検出する為には標的核酸配列濃度が106 copies/μL以上必要であった。
【0154】
これに対して、実施例2の、オリゴヌクレオチドが2種類で伸長反応産物から架橋構造を形成する場合、標的核酸配列を検出する為には標的核酸配列濃度が100 copies/μL以上あれば十分であり、極めて低濃度の標的核酸配列であっても検出が可能であった。
【図面の簡単な説明】
【0155】
【図1】本発明の核酸配列の検出方法の第1の実施の形態のメカニズムを概念的に示した概念図
【図2】本発明の第1の実施の形態で形成される網目状空間の概念図
【図3】本発明の第1の実施の形態の操作手順を示すフローチャート
【図4】本発明の核酸配列の検出方法の第2の実施の形態のメカニズムを概念的に示した概念図
【図5】本発明の第2の実施の形態で形成される網目状空間の概念図
【図6】本発明の第2の実施の形態の操作手順を示すフローチャート
【図7】実施例における基板上に発色した発色画像の説明図
【図8】第1の実施例において発色画像を数値化した結果の平均S/N比を示す表図
【図9】第2実施例における結果を示すグラフ
【符号の説明】
【0156】
10…標的核酸配列、12…オリゴヌクレオチド鎖、14…オリゴヌクレオチド鎖、16…基板、18…架橋構造体、19…標的核酸配列、20…網目状空間、22…リガンド、24…第1のオリゴヌクレオチド鎖、26…第2のオリゴヌクレオチド鎖、28…第1の伸長反応産物、30…第1の伸長反応鎖(2本鎖)、34…第2の伸長反応鎖(2本鎖)、36…第2の伸長反応産物
【技術分野】
【0001】
本発明は核酸配列の検出方法及び核酸配列検出基板に係り、特に検体サンプル中に検出標的とする特定の標的核酸配列が存在するかを高感度で、しかも簡易かつ低コストで検出するための技術に関する。
【背景技術】
【0002】
従来、検体固有の核酸配列を標的として検出する方法としては、基板上に固定化させたオリゴヌクレオチド鎖に標的核酸配列を結合させ、結合した標的核酸配列に蛍光物質を標識した異なるオリゴヌクレオチド鎖を結合させる。そして、特定波長の光(レーザー光等)を当てることで、標識蛍光物質の反射光シグナルを検出・増幅することで特定の核酸配列が検体サンプル中に存在するかを検出する。別の検出方法としては、基板上に固定化したオリゴヌクレオチド鎖に、標的核酸配列を結合させ、オリゴヌクレオチド鎖をプライマーとし、結合した標的核酸配列を鋳型として伸長反応させ、その際に取り込まれる塩基物
質に蛍光物質を標識する。そして、特定波長の光(レーザー光等)を当てることで、標識蛍光物質の反射光シグナルを検出・増幅する。
【0003】
しかし、これらの検出方法は、蛍光物質を検出しなくてはならないため、特定波長光を出す特殊な検出装置を必要とするため検出装置が高価であり、一部の研究期間や大学機関等に使用が限定されている状況である。したがって、例えば水処理現場等において、水(検体サンプル)中におけるノロウイルス、クリプトスポリジウム等の病原微生物を簡易に検出する手法としては、操作が繁雑なうえ分析装置が高価な為、採用できないという問題がある。
【0004】
このような背景から、例えば水処理等の検出を行う現場において低コストで簡便に特定の核酸配列を標的として検出する方法として、非特許文献1、特許文献1、特許文献2に記載されるMPEX法(Multiple Primers EXtension 法)が開発されている。
【0005】
このMPEX法は、基板上で酵素(DNAポリメラーゼ)によるDNA伸長反応を利用した遺伝子検査方法で、遺伝子変異解析、一塩基遺伝子変異SNPs(Single Nucleotide Polymorphisms)解析、微生物同定にも使用される方法である。リン脂質の親水部を構成するリン酸エステルより誘導される基を有する第一単位と活性エステル基を有する第二単位とを含む高分子物質を表面に有する基板上に固定化したオリゴヌクレオチド鎖をプライマーとし、標的核酸配列を投入後、2本鎖DNAは基板上で熱変性させ1本鎖にし、それを鋳型としてDNAポリメラーゼによるDNA伸長反応を行う際、全体もしくは一部の塩基にリガンドを修飾することで伸長反応産物(増幅DNA)に取り込み、最後にリガンドに対する活性物質を投入、反応させることで、高感度な遺伝子検出を可能とする方法である。
【非特許文献1】K. Kinoshita et al., Multiple primer extension by DNA polymerase on a novel plastic DNA array coated with a biocompatible polymer, Nucleic Acid Research, Vol.35, No.1, 2007, pp.e3
【特許文献1】特開2006−174788号公報
【特許文献2】特開2007−222010号公報
【発明の開示】
【発明が解決しようとする課題】
【0006】
しかしながら、発色色素は蛍光物質に比べて検出シグナルの増幅感度が劣るため、例えばノロウイルス、クリプトスポリジウム等のように、水(検体サンプル)中に極微量のオーダでしか存在せず、しかも培養により増殖できない病原微生物を、MPEX法を用いて検出するには、高感度な検出ができないという課題がある。
【0007】
MPEX法により高感度で検出するには標識を増やす必要があり、そのためにはPCR法等により標的核酸配列の濃度を高める工程が必要となるため、結果が得られるまでに長時間を要するという欠点がある。
【0008】
したがって、ノロウイルス、クリプトスポリジウム等のように、水中に極微量のオーダでしか存在せず、しかも培養により増殖できない病原微生物を、MPEX法を用いて検出するには更なる改良が必要となる。
【0009】
また、たとえ蛍光物質を使用したとしても、上記の病原微生物のように検出すべき特定の遺伝子が極めて微量である場合には、検出感度の不安定化を招き、精度のよい検出ができない。
【0010】
本発明はこのような事情に鑑みてなされたもので、検出すべき特定の標的核酸配列の濃度が極めて微量である場合であっても、高感度な検出が可能であり、しかも低コスト・短時間での検出が可能である核酸配列の検出方法及びその方法を用いた核酸配列検出基板を提供することを目的とする。
【課題を解決するための手段】
【0011】
請求項1に記載の発明は、前記目的を達成するために、検体サンプル中に検出標的とする特定の標的核酸配列が存在するかを検出する核酸配列の検出方法において、基板上に、オリゴヌクレオチド鎖の5’末端と3’末端のうちの一方の末端を固定化することにより複数の前記オリゴヌクレオチド鎖を前記基板上に立たせる固定化工程と、前記複数のオリゴヌクレオチド鎖と前記標的核酸配列の少なくとも二箇所の相補的部分を結合させることによって架橋状態の多数の架橋構造体を形成し、前記基板上に前記架橋構造体が多数絡み合った微細な網目状空間を形成する網目状空間形成工程と、前記網目状空間にリガンドを物理的な吸着作用により取り込む取込み工程と、前記取り込んだリガンドに対して、該リガンドに反応する活性物質を用いて発色させる発色工程と、前記発色した発色シグナルを検出することにより前記標的核酸配列を検出する検出工程と、を備えたことを特徴とする核酸配列の検出方法を提供する。
【0012】
ここで標的核酸配列とは、検出標的の塩基配列を有するRNA又はDNAをいう。
【0013】
本発明の請求項1によれば、基板表面にオリゴヌクレオチド鎖の一方の末端を固定化して立設し、固定化したオリゴヌクレオチド鎖と相補的な配列を有する標的核酸配列(1本鎖)を少なくとも二箇所で結合させ、基板上に架橋状態の架橋構造体を形成させることにより微細な網目状空間を作り出し、この網目状空間にリガンドを物理的な吸着作用で取り込み、リガンドに反応する活性物質で発色させるようにした。
【0014】
このように、検体サンプル中に検出標的とする特定の標的核酸配列が存在する場合には、基板上に網目状空間が形成されるようにし、この網目状空間に発色させるため発色関係物質の構成成分であるリガンドを物理的な吸着作用で取り込まれるようにしたので、発色関係物質の構成成分でリガンドに反応する活性物質を投入することで、発色形成物質を網目状空間に高濃度に取り込むことができる。これにより、検出すべき特定の標的核酸配列の濃度が極めて微量である場合であっても、高感度に検出できる。また、伸長反応を必要としないので、検出に要する時間を短時間で行うことができる。更には、蛍光色素とは異なり、発色色素を使用することができるため、高価な検出装置等が必要なくなるので、低コストでの検出を行うことができる。
【0015】
なお、オリゴヌクレオチド鎖は、標的核酸配列の少なくとも2箇所に対して相補的な核酸配列を有するものを予め設計するとよい。ここで、標的核酸配列の情報は、DNAデータバンク(DDBJ(DNA Data Bank of Japan)、EMBL(European Molecular Biology Laboratory)、GenBank)等を利用してインターネット等により知ることができる。したがって、標的核酸配列の2箇所の部位において検体固有の核酸配列を探し出し、2つの固有核酸配列を、第1のオリゴヌクレオチド鎖と第2のオリゴヌクレオチド鎖とにそれぞれ割り当てればよい。
【0016】
請求項2に記載の発明は、前記目的を達成するために、検体サンプル中に検出標的とする特定の標的核酸配列が存在するかを検出する核酸配列の検出方法において、基板上に、多数のオリゴヌクレオチド鎖を固定化し、その後、前記標的核酸配列を含む前記検体サンプルを投入すると共に、発色関係物質の構成成分であるリガンドを投入し、投入した反応系の温度を前記標的核酸配列が熱変性し一本鎖になる温度にし、その後、前記反応系の温度を前記オリゴヌクレオチド鎖と前記標的核酸配列の少なくとも二箇所とが相補的に結合するハイブリダイゼーション温度にし、その後、前記基板上に、発色関係物質の構成成分である活性物質を投入して前記リガンドと反応させ、前記発色関係物質により発色した発色シグナルを検出することを特徴とする核酸配列の検出方法を提供する。
【0017】
請求項2は、請求項1が発明をメカニズム的な特徴からとらえたのに対して、操作手順の特徴として発明をとらえたものである。
【0018】
請求項2によれば、発色関係物質の構成成分であるリガンドを含む反応系においてハイブリダイゼーション反応を行うことにより、請求項1に示す架橋構造体が多数形成される。そして、この架橋構造体にリガンドが物理的な吸着作用により多数取り込まれることにより、強い発色シグナルを発色することができ、高感度な検出が可能となる。
【0019】
請求項3は請求項1又は2において、前記オリゴヌクレオチド鎖として、前記標的核酸配列の少なくとも二箇所に対して相補的な核酸配列を有する一対の組み合わせを、前記固定化の前に予め設計し、該設定した一対のオリゴヌクレオチド鎖を多数組、前記基板上に固定化することを特徴とする。
【0020】
請求項4に記載の発明は、前記目的を達成するために、検体サンプル中に検出標的とする特定の標的核酸配列が存在するかを検出する核酸配列の検出方法において、前記標的核酸配列と第1のオリゴヌクレオチド鎖とが相補的に結合した後に、前記第1のオリゴヌクレオチド鎖をプライマーとすると共に前記標的核酸配列を鋳型として伸長反応をさせて形成される伸長反応鎖から解離した伸長反応産物に対して第2のオリゴヌクレオチド鎖が相補的な核酸配列を有するように、前記第1及び第2のオリゴヌクレオチド鎖を予め設計する設計工程と、基板上に、前記第1及び第2のオリゴヌクレオチド鎖の5’末端を固定化することにより前記第1及び前記第2のオリゴヌクレオチド鎖を前記基板上に立たせる固定化工程と、前記第1のオリゴヌクレオチド鎖と前記標的核酸配列とを相補的に結合して前記第1のオリゴヌクレオチド鎖をプライマーとすると共に前記標的核酸配列を鋳型として第1の伸長反応をさせる第1の伸長反応工程と、前記標的核酸配列から前記第1の伸長反応工程で伸長した第1の伸長反応産物を解離させる第1の解離工程と、前記第2のオリゴヌクレオチド鎖に前記解離した第1の伸長反応産物を結合して前記第1と第2のオリゴヌクレオチド鎖の間に架橋構造を形成する第1の架橋工程と、前記第2のオリゴヌクレオチド鎖をプライマーとすると共に前記第1の伸長反応産物を鋳型として第2の伸長反応をさせる第2の伸長反応工程と、前記第2の伸長反応工程で伸長した第2の伸長反応産物を解離させる第2の解離工程と、多数の前記第1及び第2のオリゴヌクレオチド鎖について前記第1の伸長反応工程から前記第2の解離工程までを行い、前記第1のオリゴヌクレオチド鎖とは別の第1のオリゴヌクレオチド鎖に前記解離した第2の伸長反応産物を結合して前記第2と1のオリゴヌクレオチド鎖間に架橋構造を形成する第2の架橋工程と、多数の前記第1及び第2のオリゴヌクレオチド鎖の間で第1と第2の架橋工程を繰り返す、繰返し架橋工程と、前記繰返し架橋工程により、架橋構造体が多数絡み合った微細な網目状空間を形成する網目状空間形成工程と、前記網目状空間にリガンドを物理的な吸着作用により取り込む取込み工程と、前記取り込んだリガンドに対して、該リガンドに反応する活性物質を用いて発色させる発色工程と、前記発色した発色シグナルを検出することにより前記標的核酸配列を検出する検出工程と、を備えたことを特徴とする核酸配列の検出方法を提供する。
【0021】
本発明の請求項4は、網目状空間を請求項1とは別の方法で形成するようにしたものである。即ち、本発明の請求項4によれば、基板表面に5’末端を固定化した第1のオリゴヌクレオチド鎖と標的核酸配列とを相補的に結合させた後、第1のオリゴヌクレオチド鎖がプライマーとなると共に標的核酸配列を鋳型として伸長反応することにより形成され、標的核酸配列と相補的な核酸配列である第1の伸長反応鎖が解離する。そして、解離した第1の伸長反応産物と、基板表面に一方の末端を固定化した第2のオリゴヌクレオチド鎖とを相補的に結合させた後、第2のオリゴヌクレオチド鎖をプライマーとすると共に第1の伸長反応産物を鋳型として伸長反応させることにより第2の伸長反応鎖を形成し、第2の伸長反応鎖から第2の伸長反応産物を解離させる。
【0022】
これにより、基板上には、伸長反応及び解離反応によって核酸配列による架橋構造が多数形成され、この多数の架橋構造体が複雑に絡み合うことにより、基板上に網目状空間を形成することができる。
【0023】
ここで、標的核酸配列の情報は、DNAデータバンク(DDBJ(DNA Data Bank of Japan)、EMBL(European Molecular Biology Laboratory)、GenBank)等を利用してインターネット等により知ることができる。したがって、標的核酸配列において検体固有の核酸配列を探し出し、第1のオリゴヌクレオチド鎖とする。また、第2のオリゴヌクレオチド鎖は、第1の伸長反応産物と相補的な核酸配列となるように設計する。また、請求項4の場合には、第1及び第2のオリゴヌクレオチド鎖は異なる核酸配列に設計することになる。
【0024】
本発明の請求項4は、網目状空間にリガンドを物理的な吸着作用で取り込み、リガンドに反応する活性物質で発色させるようにしている。このように、検体サンプル中に検出標的とする特定の標的核酸配列が存在する場合には、基板上に網目状空間が形成されるようにし、この網目状空間に発色させるため発色関係物質の構成成分であるリガンドを物理的な吸着作用で取り込まれるようにし、このリガンドに対しする活性物質を投入することで、発色形成物質を網目状空間に高濃度に取り込むことができる。これにより、検出すべき特定の標的核酸配列の濃度が極めて微量である場合であっても、高感度に検出できる。また、発色シグナル量は伸長反応量に大きく依存しない為、検出に要する時間を短時間で行うことができ、高価な検出装置等が必要なくなるので、低コストでの検出を行うことができる。
【0025】
請求項5は請求項4において、前記第2の解離工程で解離した第2の伸長反応産物が、前記第2の伸長反応産物と相補的な核酸配列を有するように設計された第3のオリゴヌクレオチド鎖に結合して、第3のオリゴヌクレオチド鎖をプライマーとし、前記第2の伸長反応産物を鋳型とした第3の伸長反応工程と、第2の伸長反応産物と前記第3の伸長反応工程で伸長した第3の伸長反応産物を解離させる第3の解離工程と、前記第1のオリゴヌクレオチド鎖とは別の第1のオリゴヌクレオチド鎖に前記解離した第3の伸長反応産物を結合して前記第3と1のオリゴヌクレオチド鎖間に架橋構造を形成する第3の架橋工程と、多数の前記第1、第2及び第3のオリゴヌクレオチド鎖の間で第1、第2と第3の架橋工程を繰り返す、繰返し架橋工程と、を備えたことを特徴とする。
【0026】
請求項5は、3個のオリゴヌクレオチド鎖を用いる場合であり、結合反応→伸長反応→解離反応を繰り返すことで、解離した伸長反応産物を次々に利用して網目状空間を形成することができるので、標的核酸配列の濃度が更に小さい場合でも高感度の検出が可能となる。また、仮に第1のオリゴヌクレオチド鎖が標的核酸配列に結合できなくとも、変わりに第3のオリゴヌクレオチド鎖が結合できれば反応は進行するため、検出感度の安定化が図れる。尚、請求項5では、3個のオリゴヌクレオチド鎖を用いる場合であるが、4個以上であれば更に好ましい。したがって、検体サンプル中に存在する標的核酸配列の濃度に応じて、濃度が小さい場合には、設計するオリゴヌクレオチド鎖を多くすれば、より高い感度での検出が可能となる。
【0027】
請求項6は請求項4又は5において、前記繰返し架橋工程後において、設定温度をオリゴヌクレオチド鎖のハイブリダイゼーション温度にするハイブリダイゼーション工程を備えたことを特徴とする。
【0028】
これにより、前記繰返し架橋工程後において、架橋反応できていない伸長反応産物を基板上に5’末端固定したオリゴヌクレオチド鎖と結合させ、より多くの架橋構造が多数形成され、この多数の架橋構造体が複雑に絡み合うことにより、より高い感度での検出が可能となる。
【0029】
請求項7に記載の発明は、前記目的を達成するために、検体サンプル中に検出標的とする特定の標的核酸配列が存在するかを検出する核酸配列の検出方法において、前記標的核酸配列と第1のオリゴヌクレオチド鎖とが相補的に結合した後に、前記第1のオリゴヌクレオチド鎖をプライマーとすると共に前記標的核酸配列を鋳型として伸長反応させて形成される伸長反応鎖から解離した伸長反応産物に対して第2のオリゴヌクレオチド鎖が相補的な核酸配列を有するように、前記第1及び第2のオリゴヌクレオチド鎖を予め設計し、基板上に、前記設計した第1及び第2のオリゴヌクレオチド鎖を多数固定化し、前記標的核酸配列を含む前記検体サンプルと発色関係物質の構成成分であるリガンドとを混合した混合液を調製し、前記混合液を基板に投入すると共に、投入した反応系の温度を前記標的核酸配列が熱変性する熱変性温度にし、その後、前記反応系の温度を、前記第1のオリゴヌクレオチド鎖と前記標的核酸配列とが相補的に結合して第1の伸長反応を行う第1の伸長反応温度にし、その後、前記反応系の温度を、前記第1の伸長反応により形成された第1の伸長反応鎖から第1の伸長反応産物が解離する第1の解離温度にし、その後、前記反応系の温度を、前記解離した第1の伸長反応産物反と前記第2のオリゴヌクレオチド鎖とが相補的に結合して第2の伸長反応を行う第2の伸長反応温度にし、その後、前記反応系の温度を、前記第2の伸長反応により形成された第2の伸長反応鎖から第2の伸長反応産物が解離する第2の解離温度にし、その後、前記反応系の温度を、前記解離した第2の伸長反応産物反と前記第1のオリゴヌクレオチド鎖とが相補的に結合する温度にし、その後、前記基板上に、発色関係物質の構成成分である活性物質を投入して前記リガンドと反応する温度にし、前記発色関係物質により発色した発色シグナルを検出することを特徴とする核酸配列の検出方法を提供する。
【0030】
請求項7は、請求項4が発明をメカニズム的な特徴からとらえたのに対して、操作手順の特徴として発明をとらえたものである。
【0031】
請求項8は請求項1〜7の何れか1において、前記リガンドが、ビオチン、アビジン、抗原、抗体、オリゴヌクレオチド、酵素よりなる群から選ばれた何れかであることを特徴とする。
【0032】
請求項8は、リガンドとして好ましい具体例を挙げたものである。
【0033】
請求項9は請求項1〜7の何れか1において、前記リガンドが、ビオチン化酵素、アビジン化酵素、ストレプトアビジン化酵素、酵素標識体、酵素標識オリゴヌクレオチドよりなる群から選ばれた何れかであることを特徴とする。
【0034】
請求項9は、リガンドとして好ましい更に別の具体例を挙げたものである。
【0035】
請求項10は請求項1〜9の何れか1において、前記活性物質が、酵素標識レセプター、蛍光物質標識レセプター、基質よりなる群から選ばれた何れかであることを特徴とする。
【0036】
請求項10は、活性物質として好ましい具体例を挙げたものである。
【0037】
請求項11は請求項1〜9の何れか1において、前記基板表面には、親水性ポリマーからなる層と、及びアミノ基と反応する官能基とを有することを特徴とする。
【0038】
請求項11によれば、これにより、オリゴヌクレオチド鎖の非特異的結合を抑制する性質と、オリゴヌクレオチド鎖を基板上に強固に固定化することができる。
【0039】
本発明の請求項12は、前記目的を達成するために、請求項1〜11の何れか1の核酸配列の検出方法を行うための核酸配列検出基板であって、前記基板上にオリゴヌクレオチド鎖がスポットされていることを特徴とする核酸配列検出基板を提供する。
【0040】
本発明の請求項12によれば、標的核酸配列を検出するための検体サンプルを、本発明の核酸配列検出基板にスポット(滴下)させ、反応させることにより、目視により、検体サンプル中に検出標的とする特定の標的核酸配列が存在するかを高感度で検出することができる。
【発明の効果】
【0041】
以上説明したように、本発明に係る核酸配列の検出方法及び核酸配列検出基板によれば、検出すべき特定の標的核酸配列の濃度が極めて微量である場合であっても、高感度な検出が可能であり、しかも低コスト・短時間での検出が可能である。
【発明を実施するための最良の形態】
【0042】
以下、添付図面に従って本発明に係る核酸配列の検出方法及び核酸配列検出基板の好ましい実施の形態について詳説する。
【0043】
[本発明の第1の実施の形態]
図1は、本発明の核酸配列の検出方法の第1の実施の形態のメカニズムを概念的に示した概念図である。
【0044】
図1におけるA、C、G、Tは、核酸配列を構成する塩基を示し、A:アデニン、C:シトシン、G:グアニン、T:チミンである。
【0045】
本発明の核酸配列の検出方法の第1の実施の形態は、主として、設計工程と、固定化工程と、架橋工程と、網目状空間形成工程と、取込み工程と、発色工程と、検出工程とで構成される。なお、設計工程は、標的核酸配列ごとに行う工程であり、標的核酸配列が予め分かっている場合には省略してもよい。また、本実施形態では、架橋工程と網目状空間形成工程とを別々に説明するが、同時に行われる一つの工程(網目状空間形成工程)としてもよい。
【0046】
予め、検体サンプル中の検出標的である標的核酸配列(例えば標的DNA)10を一対のオリゴヌクレオチド鎖12、14に架橋させるためのオリゴヌクレオチド鎖12、14の核酸配列の設計を行う(設計工程)。ここで、架橋される標的核酸配列10は、熱変性により2本鎖から1本鎖になったものを指す。
【0047】
即ち、インターネット等によりDNAデータバンクに保管されている情報の中から、検出しようとする標的核酸配列10の核酸配列を予め調べておき、その核酸配列の2箇所の部位と一対のオリゴヌクレオチド鎖12、14とがそれぞれ相補的に結合するように一対のオリゴヌクレオチド鎖12、14の核酸配列を設計する。
【0048】
図1(A)の左側のオリゴヌクレオチド鎖12の核酸配列を基板16側から3’-TAGGCA-5’として、標的核酸配列10の一方端の配列部分5’-ATCCGT-3’と相補性を有するように設計する。また、図1(A)の右側のオリゴヌクレオチド鎖14の核酸配列を基板16側から5’-TCTGTC-3’として、標的核酸配列10の他方端の配列部分3’-AGACAG-5’と相補性を有するように設計する。即ち、標的核酸配列10の2箇所の部位において相補性を有する核酸配列を、一対のオリゴヌクレオチド鎖12、14にそれぞれ割り当てる。尚、設計するオリゴヌクレオチド鎖12、14の塩基数は、6〜30の範囲であることが好ましい。
【0049】
オリゴヌクレオチド鎖12、14の設計において、検体サンプル中に含まれる標的核酸配列10以外の核酸配列(例えば、動物、植物、人等のDNA)が一対のオリゴヌクレオチド鎖12、14に結合されないように、標的核酸配列10固有の核酸配列を有するオリゴヌクレオチド鎖12、14を設計する。
【0050】
一対のオリゴヌクレオチド鎖12、14は、核酸配列が同じものでもよく、あるいは異なっていてもよいが、標的核酸配列10が一対のオリゴヌクレオチド鎖12、14、標的核酸配列10の間で架橋を形成可能なように、それぞれのオリゴヌクレオチド鎖12、14に対応する標的核酸配列10の2箇所の部位が離れていることが必要である。但し、2箇所の部位が標的核酸配列10の両端に位置する必要はない。
【0051】
次に、図1(A)に示すように、基板16上に、一対のオリゴヌクレオチド鎖12、14の5’末端と3’末端のうちの一方の末端を固定化することにより、一対のオリゴヌクレオチド鎖12、14を基板上に立たせる(固定化工程)。図1(A)では、一対のオリゴヌクレオチド鎖12、14のみを示したが、基板16上には一対のオリゴヌクレオチド鎖12、14が多数組立設される。尚、一対のオリゴヌクレオチド鎖12、14が多数組とは、オリゴヌクレオチド鎖12とオリゴヌクレオチド鎖14とが完全に等量関係にあることを意味するものではない。
【0052】
上記の如く準備された基板16上に、標的核酸配列10を含む検体サンプルをスポット(滴下して投入)して、架橋工程〜検出工程までを行う。即ち、図1(B)に示すように、一対のオリゴヌクレオチド鎖12、14のそれぞれと、標的核酸配列10の相補的部分が結合し、架橋状態の架橋構造体18を形成する。
【0053】
この架橋工程において、検体サンプルに含まれる標的核酸配列10以外の核酸配列は、一対のオリゴヌクレオチド鎖12、14と相補的な関係にはないので、架橋構造体18を形成することはない。
【0054】
この一対のオリゴヌクレオチド鎖12、14の多数組について架橋工程を行うことにより、基板16上には、図2に示すように、架橋構造体18が多数複雑に絡み合った微細な網目状空間20を形成する(網目状空間形成工程)。尚、図2では分かり易いように、網目状空間18を簡素化して図示したが、実際には架橋構造体18が複雑に絡み合って密集した網目状空間20となる。網目状空間20が形成されることは、例えば電子顕微鏡で直接的に確認可能であると推察される。また、一対のオリゴヌクレオチド鎖12、14について、標的核酸配列10と相補性を小さくするように核酸配列を設計することで、発色工程での発色シグナルが小さくなり、オリゴヌクレオチド鎖のどちらか一方を排除すると、発色シグナルが得られないことから、間接的に確認することができる。
【0055】
この網目状空間20に、図1(C)に示すように、発色関係物質の構成成分である多数のリガンド22を物理的な吸着作用により取り込むことができる(取込み工程)。尚、図1(C)では分かり易いように、1つの架橋構造体18で示してあるが、実際には図2に示したように、多数の架橋構造体18が複雑に絡み合った網目状空間20にリガンド22が物理的な吸着作用で取り込まれる。ここで物理的な吸着作用とは、小さい孔には小さな化学物質が入り込み易いことを利用したもので、特定の化学物質に特定の化学物質が結合し易いのとは異なり、非特異的な作用を意味する。
【0056】
したがって、取り込んだ多数のリガンド22に対して、該リガンド22に反応する発色関係物質の構成成分である活性物質(図示せず)を用いて発色させ(発色工程)、発色した発色シグナルを検出すれば、高感度の検出を行うことができる。また、発色シグナルの検出は、吸光度装置、イメージスキャナ等の汎用装置を使用することができるだけでなく、発色色素により可視化されることで目視により簡便に検出することができる。
【0057】
リガンド22としては、ビオチン、アビジン、抗原、抗体、オリゴヌクレオチド、酵素よりなる群から選ばれた何れかを好ましく使用できる。更に、リガンドとして、ビオチン化酵素、アビジン化酵素、ストレプトアビジン化酵素、酵素標識体、酵素標識オリゴヌクレオチドよりなる群から選ばれた何れかを使用することができる。また、活性物質としては、酵素標識レセプター、蛍光物質標識レセプター、基質よりなる群から選ばれた何れかを好ましく使用することができる。
【0058】
発色工程を、リガンドとしてビオチンを用い、リガンドと反応する活性物質としてアルカリフォスファターゼ標識アビジンを用いた例で説明すると、ビオチンはアビジンと反応(ビオチン反応)して、特異的に強固な結合を形成する。したがって、網目状空間20にビオチンを取り込み、アルカリフォスファターゼ標識アジビンをビオチンに反応させることで、たくさんのアルカリフォスファターゼ(AP)がビオチンに結合する。アジビン1に対してビオチン4の割合で結合する。そして、アルカリフォスファターゼは、BCIP/NBTという基質に反応(BCIP/NBT反応)して青紫色になるので、この色を検出する。
【0059】
BCIP:5-ブロモ-4-クロロ-3-インドリルリン酸
NBT:ニトロブルーテトラゾリウム
したがって、本発明のように網目状空間20にリガンド22であるビオチンを多量に取り込むことで、ビオチン反応と、アルカリフォスファターゼに対するBCIP/NBT反応とが増幅され、強い発色シグナルが形成される。
【0060】
ビオチンの代わりに、薬用植物ジギタリスから得られる強心配糖体のジゴキシゲニン(DIG)を用いる方法もある。この場合アルカリホスファターゼ標識抗ジゴキシゲニン抗体にて免疫反応を行わせる。これをビオチンの場合と同様にBCIP/NBTで青紫色に発色させる。これにより、高感度な検出が可能になる。
【0061】
本発明の実施の形態において使用される基板16表面には、親水性ポリマーからなる層、及びアミノ基と反応する官能基が存在することが好ましい。親水性ポリマーからなる層は、主としてオリゴヌクレオチド鎖の非特異的結合を抑制する役割を果たし、アミノ基と反応する官能基はオリゴヌクレオチド鎖を化学的に基板上に固定化する役割を果たす。特に、オリゴヌクレオチド鎖は、アミノ基と反応する官能基の部位で共有結合することによって、当該基板16の表面に強固に固定化される。
【0062】
本実施の形態で使用する親水性ポリマーとしては、親水性基を主鎖又は側鎖に有する高分子物質が挙げられ、ポリアルキレンオキシド、ポリエチレンオキシド、ポリプロピレンオキシド、ポリアクリルアミド、及びこれらの共重合体のいずれかを構造中に含むものであることが好ましい。特にポリアクリルアミドを光架橋性化合物等で3次元架橋した網目構造を有するポリアクリルアミドゲルが好ましい。
【0063】
また、本実施の形態に使用するアミノ基と反応する官能基としては、アルデヒド基、活性エステル基等が挙げられるが、活性エステル基が好ましい。活性エステル基は、カルボン酸のカルボキシル基が活性化されたものであり、C=Oを介して脱離基を有するカルボン酸である。活性化されたカルボン酸誘導体としては、例えば、カルボン酸であるアクリル酸、メタクリル酸、クロトン酸、マレイン酸、フマル酸などのカルボキシル基が、酸無水物、酸ハロゲン化物、活性エステル、活性化アミドに変換された化合物が挙げられる。活性エステル基としては、例えばp−ニトロフェニルエステル基、N−ヒドロキシスクシンイミドエステル基、コハク酸イミドエステル基、フタル酸イミドエステル基、5−ノルボルネン−2,3−ジカルボキシイミドエステル基、等が好ましく、p−ニトロフェニルエステル基又はN−ヒドロキシスクシンイミドエステル基がより好ましい。
【0064】
アミノ基と反応する官能基は、基板表面に直接導入されていても良いし、親水性ポリマー構造の主鎖又は側鎖に有していても良い。
【0065】
(第1の実施の形態の検出方法を行う操作手順)
次に、図3のフローチャートにより、第1の実施の形態の検出方法を行う操作手順のフローを説明する。尚、基板16は、基板表面に、親水性ポリマーからなる層、及びアミノ基と反応する官能基が存在する場合で説明する。
【0066】
ステップ1では、上記したように、一対のオリゴヌクレオチド鎖12、14の間に標的核酸配列10が架橋するように、標的核酸配列10の2箇所の部位に対して、それぞれ相補的な関係を有する一対のオリゴヌクレオチド鎖12、14を設計する。
【0067】
次に、ステップ2において、基板16上に一対のオリゴヌクレオチド鎖12、14を固定化する。固定化する方法としては、基板16上の表面に存在する、又は親水性ポリマーに含まれるアミノ基と反応する官能基のうち、少なくとも一部のアミノ基と反応する官能基とオリゴヌクレオチド鎖12、14とを反応させて共有結合を形成させることにより、基板16表面でオリゴヌクレオチド鎖12、14を固定化する。続いて、オリゴヌクレオチド鎖12、14を固定化した以外の基板16表面のアミノ基と反応する官能基を不活性化する。即ち、残りのアミノ基と反応する官能基を不活性化することにより、オリゴヌクレオチド鎖12、14を基板16の表面に固定することができる。基板16表面に固定化されなかったオリゴヌクレオチド鎖12、14を除去するため、純水や緩衝液で洗浄してもよい。洗浄後はオリゴヌクレオチド鎖12、14を固定化した以外の基板16表面のアミノ基と反応する官能基の不活性化処理をアルカリ化合物、あるいは一級アミノ基を有する化合物で行う。
【0068】
ステップ3では、標的核酸配列10を含む検体サンプルと発色関係物質の構成成分であるリガンド22(例えばビオチン)とを混合した混合液を調製する。
【0069】
次に、ステップ4では、標的核酸配列が一本鎖か、二本鎖かが判断され、NOであれば、ステップ5において、検体サンプルを投入した反応系の温度を、標的核酸配列10の融解温度(melting temperature:Tm)以上、例えば90〜95℃に上昇させる。加熱時間は1〜10分程度が好ましい。これにより、2本鎖の標的核酸配列10を解離して1本鎖の標的核酸配列10にする。また、一本鎖であっても、複雑な二次構造等を形成している場合は、熱変性処理を行う。YESであれば、ステップ6へ進む。
【0070】
ステップ6では、基板16及び検体サンプルとリガンドの混合液をハイブリダイゼーション温度に調節して、混合液を基板へ投入(滴下)する。ハイブリダイゼーション温度は、オリゴヌクレオチド鎖12、14の融解温度(Tm)の2〜8℃低い値が好ましい。
【0071】
ステップ7では、オリゴヌクレオチド鎖12、14の融解温度(Tm)の2〜8℃低い温度でハイブリダイゼーション反応を行う。反応時間としては、60分以上であることが好ましい。これにより、上記の如く設計された一対のオリゴヌクレオチド鎖12、14と、標的核酸配列10の相補的部分(2箇所)とがそれぞれ相補的に結合し、架橋状態の架橋構造体18を形成する。かかる架橋構造体18が多数形成され、複雑に絡み合うことで網目状空間20が形成される。そして、この網目状空間20に投入したリガンド22が物理的な吸着作用で取り込まれることにより、多数のリガンド22を取り込むことができる。
【0072】
次に、ステップ8では、基板16反応液を捨てて、基板16を洗浄液、例えば0.1wt%のSDS溶液を用いて洗浄する。
【0073】
次に、ステップ9では、活性物質(例えばアルカリフォスファターゼ標識アビジン)を基板16上に投入して、網目状空間20に取り込まれたリガンド22との反応により結合させる。反応温度及び反応時間としては、反応温度が20〜40℃の範囲が好ましく、反応時間が5〜60分の範囲が好ましい。
【0074】
次のステップ10では、前記したステップ9の反応を更に続けるか否かが判断され、反応が十分であり、NOであれば次のステップ11に進み、反応が未だ不十分であり、YESであればステップ8に戻り、洗浄工程を経て、ステップ9で、活性物質(例えばBCIP/NBT)を基板16上に投入して、網目状空間20に取り込まれたリガンド22と反応した活性物質に、更に反応させる。反応温度及び反応時間としては、反応温度が20〜40℃の範囲が好ましく、反応時間が5〜60分の範囲が好ましい。
【0075】
ステップ11では、再び基板16の洗浄を行い、ステップ12で発色シグナルの検出を行う。例えば、リガンド22としてビオチンを用い、活性物質としてアルカリフォスファターゼ標識アビジン用いた場合には、BCIP/NBT試薬中に基板16を浸漬して青紫色のスポットを発色させる。発色させた発色シグナルは、目視で検出してもよく、あるいは発色画像をイメージスキャナでパソコンに取り込んで解析してもよく、更には吸光度測定装置で発色度合いを測定してもよい。
【0076】
このように、検体サンプル中に標的核酸配列10が存在する場合には、網目状空間20が形成され、網目状空間20に発色関係物質に構成成分であるリガンド22が多数保持されることになるので、強い発色シグナルを発色することが可能になる。これにより、検体サンプル中に標的核酸配列10が存在する場合には、高感度な検出が可能となる。
【0077】
[本発明の第2の実施の形態]
図4は、本発明の核酸配列の検出方法の第2の実施の形態のメカニズムを概念的に示した概念図であり、網目状空間20を第1の実施の形態とは別の方法で形成する。尚、第1の実施の形態と同じものについては同符号を付して説明する。
【0078】
本発明の核酸配列の検出方法の第2の実施の形態は、主として、設計工程と、固定化工程と、第1の伸長反応工程と、第1の解離工程と、第1の架橋工程と、第2の伸長反応工程と、第2の解離工程と、第2の架橋工程と、繰返し架橋工程と、ハイブリダイゼーション工程と、網目状空間形成工程と、取込み工程と、発色工程と、検出工程とで構成される。
【0079】
予め、標的核酸配列19と、第1のオリゴヌクレオチド鎖24と、第2のオリゴヌクレオチド鎖26との各核酸配列の関係において、伸長反応により産出された伸長反応産物28、36が架橋構造を形成するように、第1及び第2のオリゴヌクレオチド鎖24、26の核酸配列を設計する(設計工程)。即ち、標的核酸配列19と第1のオリゴヌクレオチド鎖24とが相補的に結合した後に、第1のオリゴヌクレオチド鎖24をプライマーとすると共に標的核酸配列19を鋳型として第1の伸長反応をさせて形成される第1の伸長反応鎖30が標的核酸配列19から解離して、相補的な核酸配列を有する第2のオリゴヌクレオチド鎖26と結合できるように、第1及び第2のオリゴヌクレオチド鎖24、26を設計する。標的核酸配列19の核酸配列については、第1の実施の形態と同様にDNAデータバンクから情報を得ることができる。
【0080】
図4(A)の左側の第1のオリゴヌクレオチド鎖24の核酸配列を基板16側から5’-TAGGCA-3’として、標的核酸配列19の片端の配列部分3’-ATCCGT-5’と相補性を有するように設計する。また、図4(A)の右側の第2のオリゴヌクレオチド鎖26の核酸配列を基板16側から5’-AGACAG-3’として、第1の伸長反応産物28の片端の配列部分3’-UCUGUC-5’と相補性を有するように設計する。尚、伸長反応に使用された塩基U(ウラシル)にはビオチンが付けられた場合で示してある。ビオチン非標識時は塩基Tを使用。塩基のUは、本来RNAを構成する塩基だが、ビオチンを標識とすることで化学構造的に塩基のTに近くなるため、DNAポリメラーゼでの伸長反応が可能となる。
【0081】
次に、図4(A)に示すように、基板16上に、第1及び第2のオリゴヌクレオチド鎖24、26の5’末端を固定化することにより、一対のオリゴヌクレオチド鎖24、26を基板上に立たせる(固定化工程)。
【0082】
図4(A)では、第1及び第2のオリゴヌクレオチド鎖24、26をそれぞれ1本ずつのみを示したが、基板16上には第1及び第2のオリゴヌクレオチド鎖24、26が多数立設される。
【0083】
上記の如く準備された基板16上に、標的核酸配列19を含む検体サンプルをスポット(滴下により投入)し、第1の伸長反応工程〜検出工程までを行う。即ち、第1のオリゴヌクレオチド鎖24と、熱変性により解離した1本鎖の標的核酸配列19の相補的部分が結合した後、標的核酸配列19を鋳型とし、第1のオリゴヌクレオチド鎖24をプライマーとして伸長反応を行うと、従来のMPEX法と同様に図4(B)のような二本鎖核酸配列が形成される(第1の伸長反応工程)。しかし、伸長反応を第1及び第2のオリゴヌクレオチド鎖24、26のTm(融解温度)温度領域で行った場合、伸長反応産物28のオリゴヌクレオチド鎖24、26と相補的な領域は、常に一本鎖に解離する可能性があり、また、基板16上には、伸長反応産物28と相補的に結合するよう予め設計された第2のオリゴヌクレオチド鎖26が固定化されているため、伸長反応産物28の一部は、標的核酸配列19と解離した後に(第1の解離工程)、第2のオリゴヌクレオチド鎖26と結合し、架橋状態を形成する(第1の架橋工程)。
【0084】
即ち、第1の伸長反応により伸長する第1の伸長反応産物28のオリゴヌクレオチド鎖24、26と相補的な領域は、Tm温度領域という不安定なエネルギー状態において、分子構造的に安定した状態を目指すため、図4(C)に示すように、相補的な配列を有する第2のオリゴヌクレオチド鎖26と結合することとなる。図4(C)に記載した「ブリッジング」との用語は、2つ以上の一端が固定化されたオリゴヌクレオチド間を標的核酸配列が架橋することを意味する。そうした意味で、第1の実施の形態のように一対のオリゴヌクレオチド鎖24、26に標的核酸配列10が架橋することもブリッジングと言える。
【0085】
尚、検体サンプルに含まれる標的核酸配列19以外の核酸配列のものは、第1のオリゴヌクレオチド鎖24と相補的な関係にはないので、第1のオリゴヌクレオチド鎖24に結合して伸長反応を行うことはない。
【0086】
第1の伸長反応の際、使用する酵素には、DNAポリメラーゼ、RNAポリメラーゼ、双方を混合したものが含まれる。
【0087】
次に、第2のオリゴヌクレオチド鎖26をプライマーとすると共に第1の伸長反応産物28を鋳型として図4(D)に示すような伸長反応が起こる(第2の伸長反応工程)。尚、図4(D)では、図を簡素化するために、標的核酸配列19は図示していないが、このとき標的核酸配列19は第1のオリゴヌクレオチド鎖24から解離し、別の第1のオリゴヌクレオチド鎖と結合する。
【0088】
第2以降の伸長反応の際、酵素はDNAポリメラーゼを使用する。この時、DNAポリメラーゼはpolI型のもの(例えば、Taq(タカラバイオ))でも可能だが、耐熱性α型のもの(例えば、KOD(TOYOBO))が好ましく、鎖置換活性を有するものを使用することがより好ましい。鎖置換活性を有することにより、鋳型DNAもしくはcDNAに二本鎖を形成している箇所が存在しても、水素結合を切断しながら伸長反応を進めることが容易となる。鎖置換活性を有するDNAポリメラーゼとしては、Klenow Fragment、phi29 DNA polymerase、BcaBEST DNA polymerase、Bst DNA polymerase等が上げられる。反応温度は前記第1及び第2のオリゴヌクレオチド鎖24、26のTm値以上、65℃未満が好ましく、反応時間は20〜90分が好ましい。
【0089】
前記第1及び第2のオリゴヌクレオチド鎖24、26は多数を基板16上に固定化している。そこで、第2の伸長反応工程で伸長した第2の伸長反応産物36が、第1の伸長反応産物28から解離し(第2の解離工程)、前記第1のオリゴヌクレオチド鎖24とは別であり、かつ、同じ核酸配列の第1のオリゴヌクレオチド鎖24と結合し、架橋状態を形成する(第2の架橋工程)。この状態から、第1のオリゴヌクレオチド鎖24がプライマーとなるため、第1及び第2のオリゴヌクレオチド鎖24、26、の間で第1と第2の架橋工程が繰り返されることとなる(繰返し架橋工程)。その後、設定温度をオリゴヌクレオチド鎖のハイブリダイゼーション温度にすることで(ハイブリダイゼーション工程)、基板16上に、より多くの架橋構造体を形成させることとなる。ハイブリダイゼーション温度は、オリゴヌクレオチド鎖24、26の融解温度(Tm)から2〜8℃低い温度が好ましい。
【0090】
これにより、図5に示すように、架橋構造体が多数絡み合った微細な網目状空間20が形成され(網目状空間形成工程)、第1の実施の形態と同様に、網目状空間20に取り込んだ多数のリガンド22に対して(取込み工程)、該リガンド22に反応する活性物質を用いて発色させ(発色工程)、発色した発色シグナルを検出すれば、高感度の検出を行うことができる。
【0091】
(第2の実施の形態の検出方法を行う操作手順)
次に、図6のフローチャートにより、第2の実施の形態の検出方法を行う操作手順のフローを説明する。尚、基板16は、基板表面に、親水性ポリマーからなる層、及びアミノ基と反応する官能基が存在する場合で説明する。
【0092】
ステップ1では、上記したように、標的核酸配列19と、第1のオリゴヌクレオチド鎖24と、第2のオリゴヌクレオチド鎖26との各核酸配列の関係において、伸長反応により産出された第1の伸長反応産物28、36が架橋構造を形成するように、第1及び第2のオリゴヌクレオチド鎖24、26の核酸配列を設計する。
【0093】
ステップ2では、基板16上に、設計した第1及び第2のオリゴヌクレオチド鎖24、26を固定化する。固定化する方法としては第1の実施の形態で説明したので省略する。
【0094】
ステップ3では、標的核酸配列19を含む検体サンプルと、発色関係物質の構成成分であるリガンド22(例えばビオチン標識dUTP)とを混合した混合液を調製する。
【0095】
次に、ステップ4では、標的核酸配列が一本鎖か、二本鎖かが判断され、NOであれば、ステップ5において、検体サンプルを投入した反応系の温度を、標的核酸配列10の融解温度(melting temperature:Tm)以上、例えば90〜95℃に上昇させる。加熱時間は1〜10分程度が好ましい。これにより、2本鎖の標的核酸配列10を解離して1本鎖の標的核酸配列10にする。また、一本鎖であっても、複雑な二次構造等を形成している場合は、熱変性処理を行う。YESであれば、ステップ6へ進む。
【0096】
ステップ6では、基板16及び検体サンプルとリガンドの混合液を基板へ投入(滴下)する。
【0097】
次に、ステップ7では、第1の伸長反応工程と、第1の解離工程と、第1の架橋工程と、第2の伸長反応工程と、第2の解離工程と、第2の架橋工程と、繰返し架橋工程と、ハイブリダイゼーション工程と、網目状空間形成工程と、取込み工程と、を実施する。
【0098】
即ち、第1の伸長反応工程において、標的核酸配列19を鋳型とし、第1のオリゴヌクレオチド鎖24をプライマーとして伸長反応を行い、第1の解離工程において、伸長反応産物28を、標的核酸配列19と解離させ、第1の架橋工程において、第2のオリゴヌクレオチド鎖26と結合させ、架橋状態を形成させる。
【0099】
次に、第2の伸長反応工程において、第2のオリゴヌクレオチド鎖26をプライマーとすると共に第1の伸長反応産物28を鋳型として伸長反応させ、第2の解離工程において、第2の伸長反応工程で伸長した第2の伸長反応産物36を、第1の伸長反応産物28から解離させ、第2の架橋工程において、前記第1のオリゴヌクレオチド鎖24とは別であり、かつ、同じ核酸配列の第1のオリゴヌクレオチド鎖24と結合させ、架橋状態を形成させる。
【0100】
その後、繰返し架橋工程において、第1及び第2のオリゴヌクレオチド鎖24、26、の間で第1と第2の架橋工程が繰り返させ、その後、ハイブリダイゼーション工程において、設定温度をオリゴヌクレオチド鎖のハイブリダイゼーション温度にし、基板16上に、より多くの架橋構造体を形成させる。これにより、基板16上に架橋構造体が多数絡み合った微細な網目状空間20が形成される(網目状空間形成工程)。
【0101】
網目状空間20が形成された後は、第1の実施の形態と同様に、ステップ8〜ステップ12を実施することで、標的核酸配列19を高感度に検出することができる。
【0102】
尚、ステップ3において、標的核酸配列19とリガンド22の混合液を調製したが、リガンド22はステップ6とステップ7との間で投入してもよい。
【0103】
[本発明の第2の実施の形態の変形例]
上記説明した本発明の第2の実施の形態では、第1及び第2の、2種類のオリゴヌクレオチド鎖24、26を用いることで説明したが、3種類以上のオリゴヌクレオチド鎖を使用することもできる。
【0104】
例えば、3種類のオリゴヌクレオチド鎖の例で説明すると、第2の実施の形態における第2の解離工程で解離した第2の伸長反応産物36が、該第2の伸長反応産物36と相補的な核酸配列を有するように設計された第3のオリゴヌクレオチド鎖に結合する。結合した後は、同様に伸長反応させ、伸長反応産物を解離し、第1のオリゴヌクレオチド鎖に結合し、基板16上に、架橋構造を形成する。これら第1から第3の繰返し架橋工程を経て微細な網目状空間を形成させる。
【0105】
したがって、次々に解離される伸長反応産物と相補的な関係のオリゴヌクレオチド鎖を予め設計することで3種類以上のオリゴヌクレオチド鎖についても本発明の第2の実施の形態を適用することができる。
【0106】
第2の実施の形態において、基板16表面には、親水性ポリマーからなる層、及びアミノ基と反応する官能基が存在することが好ましい。これにより、伸長反応による2本鎖の伸長反応鎖が熱変性処理により解離し、解離した伸長反応産物が別のオリゴヌクレオチド鎖と結合して再び伸長反応する。
【0107】
[核酸配列検出基板]
上述した第1及び第2の実施の形態において、オリゴヌクレオチド鎖を基板に固定化した核酸配列検出基板を製作し、この核酸配列検出基板に、例えば標的核酸配列を含む検体サンプルをスポット(投入)するだけで、検体サンプル中に検出標的とする特定の標的核酸配列が存在するかを高感度で検出することができる。
【実施例】
【0108】
[実施例1]
次に、本発明の第1の実施の形態の検出方法の実施例を説明する。標的核酸配列としては、ノロウイスル固有の核酸配列を用い、この標的核酸配列を検出する例で説明する。
【0109】
即ち、以下の手法にて、標的核酸配列に対して相補的な一対のオリゴヌクレオチド鎖をプラスチック基板表面に固定化することで、検体サンプルとして標的核酸配列を投入した際に、基板上の一対のオリゴヌクレオチド鎖と結合し架橋状態の核酸配列構造を形成させ、その構造下に微細な網目状空間を作り出した。そして、その網目状空間に発色関係物質の構成成分であるリガンドを物理的な吸着作用で多量に取り込むことができ、これによって、標的核酸配列を高感度に検出した。
【0110】
即ち、標的核酸配列を、ノロウイルスcDNAのPCR産物として実験を行った。このPCR産物は、ノロウイルスの構造蛋白質であるカプシド蛋白質をコードしている領域ORF2を対象とした。また、ノロウイルスはG1とG2の2つのグループに分けられるため、PCR産物は、G1とG2の2種類を準備して実験を行った。
【0111】
(標的核酸配列の調整)
糞便をリン酸緩衝液に溶解し、10%乳剤を作製し、12,000rpmで冷却遠心後、遠心上清からRNAの抽出を行った。遠心上清を室温に戻し、RNA抽出精製キット(QIAamp Viral RNA Mini Kit (QIAGEN))を用いRNA抽出精製後、RNA抽出液24μLに対し5倍濃縮したRT-PCR用Buffer3μL、滅菌水1μL、DNase (1U/μL)2μL(DNase I(タカラバイオ))を加え、37℃−30分、75℃−5分を経て氷冷した。得られたRNAをランダムプライマー(Random Primer Hexamer(Amersham Pharmacia))とRT反応キット(SuperScript II Reverse Transcriptase Rnase H- Reverse Transcriptase(Invitrogen))を用いcDNAへ逆転写し(42℃−1時間(1サイクル)、99℃−5分(1サイクル)、4℃)、そのcDNAを鋳型として、プライマー1(25μM)とプライマー2(25μM)、プライマー3(25μM)、プライマー4(25μM)と、DNAポリメラーゼ(Ex Taq(タカバイオ))とを用いたPCR反応(94℃−3分(1サイクル)、94℃−1分、50℃−1分、72℃−2分(40サイクル)、72℃−15分(1サイクル))によりG1のPCR産物、G2のPCR産物をそれぞれ準備し、電気泳動で増幅を確認し精製後、標的核酸配列として実験に用いた。
【0112】
(使用したプラスチック基板)
市販のDNAアレイプラスチック基板(住友ベークライト製S-BIO(R) PrimeSurface(R))を実験に用いた。この基板は、実施の形態で述べた親水性ポリマーからなる層、及びアミノ基と反応する官能基を表面に有するプラスチック製の基板である。図7に示すように、横4(1〜4)×縦6(A〜F)の合計24箇所のスポット領域があり、各スポット領域で、各核酸配列の有無を評価した。本実験では、G1のPCR産物検出用スポット領域を12箇所、G2のPCR産物検出用スポット領域を12箇所のプラスチック基板を作製して使用した。
【0113】
(オリゴヌクレオチド鎖の固定)
G1のPCR産物検出のため、下記に示す核酸配列で構成された一対のオリゴヌクレオチド鎖1及びオリゴヌクレオチド鎖2を合成した。それぞれのオリゴヌクレオチド鎖1、2は、G1のPCR産物と相補的な配列となるようにした。オリゴヌクレオチド鎖1は、5’末端がアミノ基で修飾されたヌクレオチド(20塩基鎖)であり、これを0.25M炭酸バッファ(pH9.0)で溶解し、1μMのオリゴヌクレオチド溶液を調製した。
【0114】
一方、オリゴヌクレオチド鎖2は、3’末端がアミノ基で修飾されたヌクレオチド(20塩基鎖)であり、これを0.25M炭酸バッファ(pH9.0)で溶解し、1μMのオリゴヌクレオチド溶液を調製した。
【0115】
そして、オリゴヌクレオチド鎖1の溶液と、オリゴヌクレオチド鎖2の溶液とを混合し、スポッタ(日立ソフトウェア−エンジニアリング製Marks-I)を用い、100μm径クロスカットピンでプラスチック基板の表面上にスポットした。即ち、図7(C)に示すプラスチック基板の横1〜4×縦A〜Cで区画される12個のスポット領域にスポットした(スポット領域1〜12)。そして、オリゴヌクレオチド鎖をスポットした各基板を、80℃で1時間加熱して、各オリゴヌクレオチド鎖を固定化させた。
【0116】
また、G2のPCR産物検出のため、下記に示す核酸配列のオリゴヌクレオチド鎖3及びオリゴヌクレオチド鎖4を合成した。それぞれのオリゴヌクレオチド鎖3、4は、G2のPCR産物と相補的な配列となるようにした。オリゴヌクレオチド鎖3は、5’末端がアミノ基で修飾されたヌクレオチド(20塩基鎖)であり、これを0.25M炭酸バッファ(pH9.0)で溶解し、1μMのオリゴヌクレオチド溶液を調製した。
【0117】
一方、オリゴヌクレオチド鎖4は、3’末端がアミノ基で修飾されたヌクレオチド(23塩基鎖)であり、これを0.25M炭酸バッファ(pH9.0)で溶解し、1μMのオリゴヌクレオチド溶液を調製した。
【0118】
そして、オリゴヌクレオチド鎖3の溶液と、オリゴヌクレオチド鎖4の溶液とを混合し、スポッタ(日立ソフトウェア−エンジニアリング製Marks-I)を用い、100μm径クロスカットピンでプラスチック基板の表面上にスポットした。即ち、図7(B)に示すプラスチック基板の横1〜4×縦D〜Fで区画される12個のスポット領域にスポットした(スポット領域13〜24)。そして、オリゴヌクレオチド鎖をスポットした各基板を、80℃で1時間加熱して、各オリゴヌクレオチド鎖を固定化させた。
【0119】
上記したG1及びG2のPCR産物を調製したときのプライマー1〜4の核酸配列、及びプラスチック基板に固定化したオリゴヌクレオチド鎖1〜4の核酸配列は次のとおりである。
・プライマー1(COG1F):5’-CGYTGGATGCGNTTYCATGA-3’
・プライマー2(G1-SKR):5’-CCAACCCARCCATTRTACA-3’
・プライマー3(COG2F): 5’-CARGARBCNATGTTYAGRTGGATGAG -3’
・プライマー4(G2-SKR):5’-CCRCCNGCATRHCCRTTRTACAT-3’
・オリゴヌクレオチド鎖1(G1SKF):5’-CTGCCCGAATTYGTAAATGA-3’
・オリゴヌクレオチド鎖2(G1-1’): 5’-CCAACAAACATGGATGGCAC-3’
・オリゴヌクレオチド鎖3(RING2AL-TP): 5’-TGGGAGGGSGATCGCRATCT-3’
・オリゴヌクレオチド鎖4(G2SKRrc)5’-ATGTAYAAYGGDYATGCNGGYGG-3’
IUB Codes(Code of international Union of Biochemistry). R=A or G ; B=C, G or T ; Y=C or T ; D=A, G or T ; K=G or T ; H=A, C or T ; M=A. or C ; V=A, C or G ; S=G or C ; W=A or T ; N=any base.
(ハイブリダイゼーション)
上記の如く一対のオリゴヌクレオチド鎖(オリゴヌクレオチド鎖1とオリゴヌクレオチド鎖2の一対、オリゴヌクレオチド鎖3とオリゴヌクレオチド鎖4の一対)を固定化したプラスチック基板に、準備した標的核酸配列を59μmと、ハイブリバッファーを13μLと、8μLのビオチンを混合した混合液を投入した。
【0120】
尚、図7(A)の基板は、上記の如く各オリゴヌクレオチド鎖を固定化した基板に、標的核酸配列を含まない検体サンプルを投入した場合である。
【0121】
そして、基板上の反応系を95℃、8分間の加熱条件で加熱することにより、標的核酸配列の2本鎖を熱変性して解離させて1本鎖にし、更に反応系を54℃で90分間ハイブリダイズさせた。
【0122】
次に、洗浄後、0.01mg/mLのアルカリフォスファターゼ標識ストレフトアビジンを基板上へ投入し、カバーガラスで覆い、反応系を37℃で30分反応させた。その後、洗浄を行い、BCIP/NBT(BCIP/NBT Phosphatase Substrate(1-Component System)(KPL))発色試薬中に基板を浸漬し、37℃で30分間反応させて洗浄し、青紫色のスポットを発色させた。発色画像はイメージスキャナ(キヤノン製、PIXUS MP470)でパソコンへ取り込み、画像解析ソフト(住友ベークライト製、誰でもDNAアレイ解析ソフト)で発色強度を数値化した。発色画像を図7に示す。また、数値化結果の平均S/N比(Signal to Noise Ratio)を下記の式1から求め、図8の表1に示す。
【0123】
S/N比=1×S/(S+N)…式1
S/N:非測定時に対する測定時の発色強度の比率:最大値1.0
S:測定時の発色シグナルの強度
N:非測定時の発色シグナルの強度
その結果、G1のPCR産物を標的核酸配列とした場合、図7(C)から分かるように、スポット領域1〜12のみが発色した。一方、G2のPCR産物を標的核酸配列とした場合、図7(B)から分かるように、スポット領域13〜24のみが発色した。
【0124】
比較対象としてPCR産物(標的核酸配列)を加えなかった場合は、図7(A)から分かるように、オリゴヌクレオチド鎖1、2を固定化した場合、及びオリゴヌクレオチド鎖3、4を固定化した場合のいずれについても発色が得られなかった。
【0125】
尚、図示しなかったが、DNAアレイプラスチック基板のオリゴヌクレオチドの固定において、G1のPCR産物検出の為のスポットがオリゴヌクレオチド鎖1のみ(スポット領域1〜6)、オリゴヌクレオチド鎖2のみ(スポット領域7〜12)、G2のPCR産物検出の為のスポットがオリゴヌクレオチド鎖3のみ(スポット領域13〜18)、オリゴヌクレオチド鎖4のみ(スポット領域19〜24)のものを18枚作製した。そして、G1のPCR産物、G2のPCR産物をそれぞれ6枚ずつ前記方法でハイブリダイズさせ、同時にビオチンを投入し、洗浄後、アルカリフォスファターゼ標識アビジンを基板上へ投入し、カバーガラスで覆い37℃で30分放置した後、洗浄を行い、BCIP/NBT発色試薬中に基板を浸漬し、37℃で30分間反応させ洗浄し、青紫色のスポットを発色させた。
【0126】
発色画像はイメージスキャナ(キヤノン製、PIXUS MP470)でパソコンへ取り込み、画像解析ソフト(住友ベークライト製、誰でもDNAアレイ解析ソフト)で発色強度を数値化した。
【0127】
その結果、スポット領域1〜24のいずれにおいても発色は確認されず、比較対象としてPCR産物を加えなかった6枚のDNAアレイプラスチック基板においても、発色が得られなかった。
【0128】
また、図8の表1から分かるように、図7(C)のスポット1〜12に示したG1のPCR産物の発色シグナル強度(S)の平均値と、図7(A)での発色ノイズ強度(N)の平均値との、S/N比は0.97と極めて高感度な検出を行うことができた。
【0129】
同様に、図7(B)のスポット13〜24に示したG2のPCR産物の発色シグナル強度(S)の平均値と、図7(A)での発色ノイズ強度(N)の平均値とのS/N比は0.98と極めて高感度な検出を行うことができた。
【0130】
[実施例2]
次に、本発明の第2の実施の形態の検出方法の実施例を説明する。標的核酸配列としては、実施例1と同様に、ノロウイスル固有の核酸配列を標的核酸配列として検出する例で説明する。
【0131】
即ち、以下の手法にて、基板表面に固定化した第1のオリゴヌクレオチド鎖と標的核酸配列が相補的に結合後、第1のオリゴヌクレオチド鎖がプライマーとなり、標的核酸配列を鋳型として伸長反応し、解離反応により標的核酸配列と相補的な配列である伸長反応産物が解離する。
【0132】
そして、解離した第1の伸長反応産物が、基板表面に固定化した別の第2のオリゴヌクレオチド鎖と相補的に結合後、第2のオリゴヌクレオチド鎖がプライマーとなり、第1の伸長反応産物を鋳型として伸長反応し、解離反応により第1の伸長反応産物と相補的な配列の伸長反応産物が解離する。
【0133】
これを繰り返すことで基板上に微細な網目状空間を作り出し、該網目状空間にリガンドを物理的な吸着効果により取り込み、リガンドに反応する活性物質を用いることで、標的核酸配列を検出した。
【0134】
(標的核酸配列の調整)
実施例1で示したノロウイルスcDNAのG1のPCR産物、G2のPCR産物をそれぞれ準備し精製後、0、100、101、102、104、106、108 copies/μLとなるよう濃度調整し、標的核酸配列として実験に用いた。バックグラウンドとしては滅菌水を添加したもので評価した。
【0135】
(プラスチック基板)
実施例1で示したプラスチック基板(住友ベークライト製S-BIO(R) PrimeSurface(R))のMPEX(Multiple Primers EXtension)法対応基板を使用し、基板表面へ各種オリゴヌクレオチド鎖の一端を固定化し、実験に用いた。
【0136】
MPEX法は、従来技術において非特許文献1、特許文献1、特許文献2で説明した通りであるが、本実施例2の比較対照としては、基板上に固定化するオリゴヌクレオチド鎖が1種類のみで、伸長反応産物が架橋構造を形成しないMPEX法を実施することにより、標的核酸配列の検出を行った。また、バックグラウンドとしては、滅菌水を添加したもので実施した。
【0137】
(オリゴヌクレオチド鎖の固定)
実施例2では、G1のPCR産物検出の為、下記に示すオリゴヌクレオチド鎖5及びオリゴヌクレオチド鎖6を合成した。オリゴヌクレオチド鎖5は、G1のPCR産物と相補的な配列となるようにした。また、オリゴヌクレオチド鎖5は、5’末端がアミノ基で修飾されたヌクレオチド(20塩基鎖)であり、これを0.25M炭酸バッファ(pH9.0)を用いて溶解し、1μMのオリゴヌクレオチド溶液を調製した。
【0138】
一方、オリゴヌクレオチド鎖6も5’末端がアミノ基で修飾されたヌクレオチド(19塩基鎖)であり、これを0.25M炭酸バッファ(pH9.0)を用いて溶解し、1μMのオリゴヌクレオチド溶液を調製した。
【0139】
実施例2では、これらオリゴヌクレオチド鎖5及びオリゴヌクレオチド鎖6の溶液を混合し、スポッタ(日立ソフトウェアーエンジニアリング製Marks-I)を用い100μm径クロスカットピンでプラスチック基板の表面上にスポットした(スポット領域1〜4)。尚、実施例2は、図7のように基板の図は示さないが、同様である。
【0140】
一方、上記した比較対照実験として、1μMのオリゴヌクレオチド鎖5と6のうちの1種類のオリゴヌクレオチド鎖のみを基板のスポット領域に別々にスポットした(スポット領域5〜8、9〜12)。
【0141】
そして、実施例2の基板及び比較対照の基板のそれぞれを、80℃で1時間加熱して、各オリゴヌクレオチド鎖を固定化させた。
【0142】
また、実施例2では、G2のPCR産物検出の為、オリゴヌクレオチド鎖7及びオリゴヌクレオチド鎖8を合成した。オリゴヌクレオチド鎖7は、G2のPCR産物と相補的な配列となるようにした。また、オリゴヌクレオチド鎖7は、5’末端がアミノ基で修飾されたヌクレオチド(26塩基鎖)であり、これを0.25M炭酸バッファ(pH9.0)を用いて溶解し、1μMのオリゴヌクレオチド溶液を調製した。
【0143】
一方、オリゴヌクレオチド鎖8も5’末端がアミノ基で修飾されたヌクレオチド(20塩基鎖)であり、これを0.25M炭酸バッファ(pH9.0)を用いて溶解し、1μMのオリゴヌクレオチド溶液を調製した。
【0144】
そして、実施例2では、これらのオリゴヌクレオチド鎖7とオリゴヌクレオチド鎖8の溶液を混合し、スポッタ(日立ソフトウェアーエンジニアリング製Marks-I)を用い100μm径クロスカットピンでプラスチック基板の表面上にスポットした(スポット領域13〜16)。
【0145】
一方、上記した比較対照実験では、1μMのオリゴヌクレオチド鎖7と8のうちの1種類のオリゴヌクレオチド鎖のみを基板上のスポット領域に別々にスポットした(スポット領域17〜20、21〜24)。
【0146】
そして、実施例2の基板及び比較対照の基板のそれぞれを、80℃で1時間加熱して、各オリゴヌクレオチド鎖を固定化させた。
【0147】
上記したプラスチック基板に固定化したオリゴヌクレオチド鎖5〜8の核酸配列は次のとおりである。
・オリゴヌクレオチド鎖5(RING1-TP(a)):5’-AGATYGCGATCYCCTGTCCA -3’
・オリゴヌクレオチド鎖6(G1SKR):5’-CCAACCCARCCATTRTACA-3’
・オリゴヌクレオチド鎖7(COG2F):5’-CARGARBCNATGTTYAGRTGGATGAG-3’
・オリゴヌクレオチド鎖8(RING2AL-TP rc):5’-AGATYGCGATCWCCCTCCCA-3’
IUB Codes(Code of international Union of Biochemistry). R=A or G ; B=C, G or T ; Y=C or T ; D=A, G or T ; K=G or T ; H=A, C or T ; M=A. or C ; V=A, C or G ; S=G or C ; W=A or T ; N=any base.
そして、実施例2の基板上に、標的核酸配列を59μL、10×MPEX バッファーAを8.0μL、10×KOD-Plusバッファー(TOYOBO)を8.0μL、0.1mMビオチン標識dUTPを0.80μL、0.1mM dATPを0.8μL、0.1mM dCTPを0.8μL、0.1mM dGTPを0.8μL、KOD-Plus (TOYOBO)を2μLを混合した混合液を投入し、基板上の反応系を、95℃で8分間加熱し、核酸配列の2重鎖を熱変性で解離させ1本鎖にした。
【0148】
次に、基板上にカバーガラスをかけ、200μLの0.25Mリン酸バッファ(pH8.5)で内部を湿らせた密閉容器(10cm×15cm×3cm)中において、56℃で90分間反応させた。
【0149】
次に、カバーガラスをはずして洗浄後、0.01mg/mL濃度のアルカリフォスファターゼ標識ストレプトアビジンを8μL、10×MPEXバッファーAを8.0μL、2×MPEXバッファーBを40μL、滅菌水を24μLの割合で混合した混合液をプラスチック基板へ投入した。
【0150】
次に、カバーガラスをかけ、200μLの0.25Mリン酸バッファ(pH8.5)で内部を湿らせた密閉容器(10cm×15cm×3cm)中において、37℃で30分間反応させた。それから基板を洗浄後、BCIP/NBT溶液(BCIP/NBT Phosphatase Substrate(1-Component System)(KPL))に浸漬し、37℃で30分間反応させてから基板を洗浄し、青紫色のスポットを発色させた。
【0151】
発色画像はイメージスキャナ(キヤノン製、PIXUS MP470)でパソコンへ取り込み、画像解析ソフト(住友ベークライト製、誰でもDNAアレイ解析ソフト)で発色強度を数値化した。
【0152】
実施例2について、上記検出実験を、標的核酸配列の濃度が0、100、101、102、104、106、108copies/μL の7水準の濃度について実施した。同様に、1種類のオリゴヌクレオチド鎖のみを固定化した比較対照実験についても、標的核酸配列の濃度が0、100、101、102、104、106、108copies/μL の7水準の濃度について実施した。
【0153】
そして、実施例2と比較対照実験での上記各濃度における発色シグナル量を比較した。比較結果を図9に示す。その結果、図9から分かるように、オリゴヌクレオチド鎖が1種類のみである比較対照実験は、標的核酸配列を検出する為には標的核酸配列濃度が106 copies/μL以上必要であった。
【0154】
これに対して、実施例2の、オリゴヌクレオチドが2種類で伸長反応産物から架橋構造を形成する場合、標的核酸配列を検出する為には標的核酸配列濃度が100 copies/μL以上あれば十分であり、極めて低濃度の標的核酸配列であっても検出が可能であった。
【図面の簡単な説明】
【0155】
【図1】本発明の核酸配列の検出方法の第1の実施の形態のメカニズムを概念的に示した概念図
【図2】本発明の第1の実施の形態で形成される網目状空間の概念図
【図3】本発明の第1の実施の形態の操作手順を示すフローチャート
【図4】本発明の核酸配列の検出方法の第2の実施の形態のメカニズムを概念的に示した概念図
【図5】本発明の第2の実施の形態で形成される網目状空間の概念図
【図6】本発明の第2の実施の形態の操作手順を示すフローチャート
【図7】実施例における基板上に発色した発色画像の説明図
【図8】第1の実施例において発色画像を数値化した結果の平均S/N比を示す表図
【図9】第2実施例における結果を示すグラフ
【符号の説明】
【0156】
10…標的核酸配列、12…オリゴヌクレオチド鎖、14…オリゴヌクレオチド鎖、16…基板、18…架橋構造体、19…標的核酸配列、20…網目状空間、22…リガンド、24…第1のオリゴヌクレオチド鎖、26…第2のオリゴヌクレオチド鎖、28…第1の伸長反応産物、30…第1の伸長反応鎖(2本鎖)、34…第2の伸長反応鎖(2本鎖)、36…第2の伸長反応産物
【特許請求の範囲】
【請求項1】
検体サンプル中に検出標的とする特定の標的核酸配列が存在するかを検出する核酸配列の検出方法において、
基板上に、オリゴヌクレオチド鎖の5’末端と3’末端のうちの一方の末端を固定化することにより複数の前記オリゴヌクレオチド鎖を前記基板上に立たせる固定化工程と、
前記複数のオリゴヌクレオチド鎖と前記標的核酸配列の少なくとも二箇所の相補的部分を結合させることによって架橋状態の多数の架橋構造体を形成し、前記基板上に前記架橋構造体が多数絡み合った微細な網目状空間を形成する網目状空間形成工程と、
前記網目状空間にリガンドを物理的な吸着作用により取り込む取込み工程と、
前記取り込んだリガンドに対して、該リガンドに反応する活性物質を用いて発色させる発色工程と、
前記発色した発色シグナルを検出することにより前記標的核酸配列を検出する検出工程と、を備えたことを特徴とする核酸配列の検出方法。
【請求項2】
検体サンプル中に検出標的とする特定の標的核酸配列が存在するかを検出する核酸配列の検出方法において、
基板上に、多数のオリゴヌクレオチド鎖を固定化し、
その後、前記標的核酸配列を含む前記検体サンプルを投入すると共に、発色関係物質の構成成分であるリガンドを投入し、投入した反応系の温度を前記標的核酸配列が熱変性し一本鎖になる温度にし、
その後、前記反応系の温度を前記オリゴヌクレオチド鎖と前記標的核酸配列の少なくとも二箇所とが相補的に結合するハイブリダイゼーション温度にし、
その後、前記基板上に、発色関係物質の構成成分である活性物質を投入して前記リガンドと反応させ、
前記発色関係物質により発色した発色シグナルを検出することを特徴とする核酸配列の検出方法。
【請求項3】
前記オリゴヌクレオチド鎖として、前記標的核酸配列の少なくとも二箇所に対して相補的な核酸配列を有する一対の組み合わせを、前記固定化の前に予め設計し、
該設定した一対のオリゴヌクレオチド鎖を多数組、前記基板上に固定化することを特徴とする請求項1又は2の核酸配列の検出方法。
【請求項4】
検体サンプル中に検出標的とする特定の標的核酸配列が存在するかを検出する核酸配列の検出方法において、
前記標的核酸配列と第1のオリゴヌクレオチド鎖とが相補的に結合した後に、前記第1のオリゴヌクレオチド鎖をプライマーとすると共に前記標的核酸配列を鋳型として伸長反応をさせて形成される伸長反応鎖から解離した伸長反応産物に対して第2のオリゴヌクレオチド鎖が相補的な核酸配列を有するように、前記第1及び第2のオリゴヌクレオチド鎖を予め設計する設計工程と、
基板上に、前記第1及び第2のオリゴヌクレオチド鎖の5’末端を固定化することにより前記第1及び前記第2のオリゴヌクレオチド鎖を前記基板上に立たせる固定化工程と、
前記第1のオリゴヌクレオチド鎖と前記標的核酸配列とを相補的に結合して前記第1のオリゴヌクレオチド鎖をプライマーとすると共に前記標的核酸配列を鋳型として第1の伸長反応をさせる第1の伸長反応工程と、
前記標的核酸配列から前記第1の伸長反応工程で伸長した第1の伸長反応産物を解離させる第1の解離工程と、
前記第2のオリゴヌクレオチド鎖に前記解離した第1の伸長反応産物を結合して前記第1と第2のオリゴヌクレオチド鎖の間に架橋構造を形成する第1の架橋工程と、
前記第2のオリゴヌクレオチド鎖をプライマーとすると共に前記第1の伸長反応産物を鋳型として第2の伸長反応をさせる第2の伸長反応工程と、
前記第2の伸長反応工程で伸長した第2の伸長反応産物を解離させる第2の解離工程と、
多数の前記第1及び第2のオリゴヌクレオチド鎖について前記第1の伸長反応工程から前記第2の解離工程までを行い、前記第1のオリゴヌクレオチド鎖とは別の第1のオリゴヌクレオチド鎖に前記解離した第2の伸長反応産物を結合して前記第2と1のオリゴヌクレオチド鎖間に架橋構造を形成する第2の架橋工程と、
多数の前記第1及び第2のオリゴヌクレオチド鎖の間で第1と第2の架橋工程を繰り返す、繰返し架橋工程と、
前記繰返し架橋工程により、架橋構造体が多数絡み合った微細な網目状空間を形成する網目状空間形成工程と、
前記網目状空間にリガンドを物理的な吸着作用により取り込む取込み工程と、前記取り込んだリガンドに対して、該リガンドに反応する活性物質を用いて発色させる発色工程と、
前記発色した発色シグナルを検出することにより前記標的核酸配列を検出する検出工程と、を備えたことを特徴とする核酸配列の検出方法。
【請求項5】
前記第2の解離工程で解離した第2の伸長反応産物が、前記第2の伸長反応産物と相補的な核酸配列を有するように設計された第3のオリゴヌクレオチド鎖に結合して、第3のオリゴヌクレオチド鎖をプライマーとし、前記第2の伸長反応産物を鋳型とした第3の伸長反応工程と、
第2の伸長反応産物と前記第3の伸長反応工程で伸長した第3の伸長反応産物を解離させる第3の解離工程と、
前記第1のオリゴヌクレオチド鎖とは別の第1のオリゴヌクレオチド鎖に前記解離した第3の伸長反応産物を結合して前記第3と1のオリゴヌクレオチド鎖間に架橋構造を形成する第3の架橋工程と、
多数の前記第1、第2及び第3のオリゴヌクレオチド鎖の間で第1、第2と第3の架橋工程を繰り返す、繰返し架橋工程と、
を備えたことを特徴とする請求項4の核酸配列の検出方法。
【請求項6】
前記繰返し架橋工程後において、設定温度をオリゴヌクレオチド鎖のハイブリダイゼーション温度にするハイブリダイゼーション工程を備えたことを特徴とする請求項4又は5の核酸配列の検出方法。
【請求項7】
検体サンプル中に検出標的とする特定の標的核酸配列が存在するかを検出する核酸配列の検出方法において、
前記標的核酸配列と第1のオリゴヌクレオチド鎖とが相補的に結合した後に、前記第1のオリゴヌクレオチド鎖をプライマーとすると共に前記標的核酸配列を鋳型として伸長反応させて形成される伸長反応鎖から解離した伸長反応産物に対して第2のオリゴヌクレオチド鎖が相補的な核酸配列を有するように、前記第1及び第2のオリゴヌクレオチド鎖を予め設計し、
基板上に、前記設計した第1及び第2のオリゴヌクレオチド鎖を多数固定化し、
前記標的核酸配列を含む前記検体サンプルと発色関係物質の構成成分であるリガンドとを混合した混合液を調製し、
前記混合液を基板に投入すると共に、投入した反応系の温度を前記標的核酸配列が熱変性する熱変性温度にし、
その後、前記反応系の温度を、前記第1のオリゴヌクレオチド鎖と前記標的核酸配列とが相補的に結合して第1の伸長反応を行う第1の伸長反応温度にし、
その後、前記反応系の温度を、前記第1の伸長反応により形成された第1の伸長反応鎖から第1の伸長反応産物が解離する第1の解離温度にし、
その後、前記反応系の温度を、前記解離した第1の伸長反応産物反と前記第2のオリゴヌクレオチド鎖とが相補的に結合して第2の伸長反応を行う第2の伸長反応温度にし、
その後、前記反応系の温度を、前記第2の伸長反応により形成された第2の伸長反応鎖から第2の伸長反応産物が解離する第2の解離温度にし、
その後、前記反応系の温度を、前記解離した第2の伸長反応産物反と前記第1のオリゴヌクレオチド鎖とが相補的に結合する温度にし、
その後、前記基板上に、発色関係物質の構成成分である活性物質を投入して前記リガンドと反応する温度にし、
前記発色関係物質により発色した発色シグナルを検出することを特徴とする核酸配列の検出方法。
【請求項8】
前記リガンドが、ビオチン、アビジン、抗原、抗体、オリゴヌクレオチド、酵素よりなる群から選ばれた何れかであることを特徴とする請求項1〜7の何れか1の核酸配列の検出方法。
【請求項9】
前記リガンドが、ビオチン化酵素、アビジン化酵素、ストレプトアビジン化酵素、酵素標識体、酵素標識オリゴヌクレオチドよりなる群から選ばれた何れかであることを特徴とする請求項1〜7の何れか1の核酸配列の検出方法。
【請求項10】
前記活性物質が、酵素標識レセプター、蛍光物質標識レセプター、基質よりなる群から選ばれた何れかであることを特徴とする請求項1〜9の何れか1の核酸配列の検出方法。
【請求項11】
前記基板表面には、親水性ポリマーからなる層と、及びアミノ基と反応する官能基とを有することを特徴とする請求項1〜10の何れか1の核酸配列の検出方法。
【請求項12】
請求項1〜11の何れか1の核酸配列の検出方法を行うための核酸配列検出基板であって、
前記基板上にオリゴヌクレオチド鎖がスポットされていることを特徴とする核酸配列検出基板。
【請求項1】
検体サンプル中に検出標的とする特定の標的核酸配列が存在するかを検出する核酸配列の検出方法において、
基板上に、オリゴヌクレオチド鎖の5’末端と3’末端のうちの一方の末端を固定化することにより複数の前記オリゴヌクレオチド鎖を前記基板上に立たせる固定化工程と、
前記複数のオリゴヌクレオチド鎖と前記標的核酸配列の少なくとも二箇所の相補的部分を結合させることによって架橋状態の多数の架橋構造体を形成し、前記基板上に前記架橋構造体が多数絡み合った微細な網目状空間を形成する網目状空間形成工程と、
前記網目状空間にリガンドを物理的な吸着作用により取り込む取込み工程と、
前記取り込んだリガンドに対して、該リガンドに反応する活性物質を用いて発色させる発色工程と、
前記発色した発色シグナルを検出することにより前記標的核酸配列を検出する検出工程と、を備えたことを特徴とする核酸配列の検出方法。
【請求項2】
検体サンプル中に検出標的とする特定の標的核酸配列が存在するかを検出する核酸配列の検出方法において、
基板上に、多数のオリゴヌクレオチド鎖を固定化し、
その後、前記標的核酸配列を含む前記検体サンプルを投入すると共に、発色関係物質の構成成分であるリガンドを投入し、投入した反応系の温度を前記標的核酸配列が熱変性し一本鎖になる温度にし、
その後、前記反応系の温度を前記オリゴヌクレオチド鎖と前記標的核酸配列の少なくとも二箇所とが相補的に結合するハイブリダイゼーション温度にし、
その後、前記基板上に、発色関係物質の構成成分である活性物質を投入して前記リガンドと反応させ、
前記発色関係物質により発色した発色シグナルを検出することを特徴とする核酸配列の検出方法。
【請求項3】
前記オリゴヌクレオチド鎖として、前記標的核酸配列の少なくとも二箇所に対して相補的な核酸配列を有する一対の組み合わせを、前記固定化の前に予め設計し、
該設定した一対のオリゴヌクレオチド鎖を多数組、前記基板上に固定化することを特徴とする請求項1又は2の核酸配列の検出方法。
【請求項4】
検体サンプル中に検出標的とする特定の標的核酸配列が存在するかを検出する核酸配列の検出方法において、
前記標的核酸配列と第1のオリゴヌクレオチド鎖とが相補的に結合した後に、前記第1のオリゴヌクレオチド鎖をプライマーとすると共に前記標的核酸配列を鋳型として伸長反応をさせて形成される伸長反応鎖から解離した伸長反応産物に対して第2のオリゴヌクレオチド鎖が相補的な核酸配列を有するように、前記第1及び第2のオリゴヌクレオチド鎖を予め設計する設計工程と、
基板上に、前記第1及び第2のオリゴヌクレオチド鎖の5’末端を固定化することにより前記第1及び前記第2のオリゴヌクレオチド鎖を前記基板上に立たせる固定化工程と、
前記第1のオリゴヌクレオチド鎖と前記標的核酸配列とを相補的に結合して前記第1のオリゴヌクレオチド鎖をプライマーとすると共に前記標的核酸配列を鋳型として第1の伸長反応をさせる第1の伸長反応工程と、
前記標的核酸配列から前記第1の伸長反応工程で伸長した第1の伸長反応産物を解離させる第1の解離工程と、
前記第2のオリゴヌクレオチド鎖に前記解離した第1の伸長反応産物を結合して前記第1と第2のオリゴヌクレオチド鎖の間に架橋構造を形成する第1の架橋工程と、
前記第2のオリゴヌクレオチド鎖をプライマーとすると共に前記第1の伸長反応産物を鋳型として第2の伸長反応をさせる第2の伸長反応工程と、
前記第2の伸長反応工程で伸長した第2の伸長反応産物を解離させる第2の解離工程と、
多数の前記第1及び第2のオリゴヌクレオチド鎖について前記第1の伸長反応工程から前記第2の解離工程までを行い、前記第1のオリゴヌクレオチド鎖とは別の第1のオリゴヌクレオチド鎖に前記解離した第2の伸長反応産物を結合して前記第2と1のオリゴヌクレオチド鎖間に架橋構造を形成する第2の架橋工程と、
多数の前記第1及び第2のオリゴヌクレオチド鎖の間で第1と第2の架橋工程を繰り返す、繰返し架橋工程と、
前記繰返し架橋工程により、架橋構造体が多数絡み合った微細な網目状空間を形成する網目状空間形成工程と、
前記網目状空間にリガンドを物理的な吸着作用により取り込む取込み工程と、前記取り込んだリガンドに対して、該リガンドに反応する活性物質を用いて発色させる発色工程と、
前記発色した発色シグナルを検出することにより前記標的核酸配列を検出する検出工程と、を備えたことを特徴とする核酸配列の検出方法。
【請求項5】
前記第2の解離工程で解離した第2の伸長反応産物が、前記第2の伸長反応産物と相補的な核酸配列を有するように設計された第3のオリゴヌクレオチド鎖に結合して、第3のオリゴヌクレオチド鎖をプライマーとし、前記第2の伸長反応産物を鋳型とした第3の伸長反応工程と、
第2の伸長反応産物と前記第3の伸長反応工程で伸長した第3の伸長反応産物を解離させる第3の解離工程と、
前記第1のオリゴヌクレオチド鎖とは別の第1のオリゴヌクレオチド鎖に前記解離した第3の伸長反応産物を結合して前記第3と1のオリゴヌクレオチド鎖間に架橋構造を形成する第3の架橋工程と、
多数の前記第1、第2及び第3のオリゴヌクレオチド鎖の間で第1、第2と第3の架橋工程を繰り返す、繰返し架橋工程と、
を備えたことを特徴とする請求項4の核酸配列の検出方法。
【請求項6】
前記繰返し架橋工程後において、設定温度をオリゴヌクレオチド鎖のハイブリダイゼーション温度にするハイブリダイゼーション工程を備えたことを特徴とする請求項4又は5の核酸配列の検出方法。
【請求項7】
検体サンプル中に検出標的とする特定の標的核酸配列が存在するかを検出する核酸配列の検出方法において、
前記標的核酸配列と第1のオリゴヌクレオチド鎖とが相補的に結合した後に、前記第1のオリゴヌクレオチド鎖をプライマーとすると共に前記標的核酸配列を鋳型として伸長反応させて形成される伸長反応鎖から解離した伸長反応産物に対して第2のオリゴヌクレオチド鎖が相補的な核酸配列を有するように、前記第1及び第2のオリゴヌクレオチド鎖を予め設計し、
基板上に、前記設計した第1及び第2のオリゴヌクレオチド鎖を多数固定化し、
前記標的核酸配列を含む前記検体サンプルと発色関係物質の構成成分であるリガンドとを混合した混合液を調製し、
前記混合液を基板に投入すると共に、投入した反応系の温度を前記標的核酸配列が熱変性する熱変性温度にし、
その後、前記反応系の温度を、前記第1のオリゴヌクレオチド鎖と前記標的核酸配列とが相補的に結合して第1の伸長反応を行う第1の伸長反応温度にし、
その後、前記反応系の温度を、前記第1の伸長反応により形成された第1の伸長反応鎖から第1の伸長反応産物が解離する第1の解離温度にし、
その後、前記反応系の温度を、前記解離した第1の伸長反応産物反と前記第2のオリゴヌクレオチド鎖とが相補的に結合して第2の伸長反応を行う第2の伸長反応温度にし、
その後、前記反応系の温度を、前記第2の伸長反応により形成された第2の伸長反応鎖から第2の伸長反応産物が解離する第2の解離温度にし、
その後、前記反応系の温度を、前記解離した第2の伸長反応産物反と前記第1のオリゴヌクレオチド鎖とが相補的に結合する温度にし、
その後、前記基板上に、発色関係物質の構成成分である活性物質を投入して前記リガンドと反応する温度にし、
前記発色関係物質により発色した発色シグナルを検出することを特徴とする核酸配列の検出方法。
【請求項8】
前記リガンドが、ビオチン、アビジン、抗原、抗体、オリゴヌクレオチド、酵素よりなる群から選ばれた何れかであることを特徴とする請求項1〜7の何れか1の核酸配列の検出方法。
【請求項9】
前記リガンドが、ビオチン化酵素、アビジン化酵素、ストレプトアビジン化酵素、酵素標識体、酵素標識オリゴヌクレオチドよりなる群から選ばれた何れかであることを特徴とする請求項1〜7の何れか1の核酸配列の検出方法。
【請求項10】
前記活性物質が、酵素標識レセプター、蛍光物質標識レセプター、基質よりなる群から選ばれた何れかであることを特徴とする請求項1〜9の何れか1の核酸配列の検出方法。
【請求項11】
前記基板表面には、親水性ポリマーからなる層と、及びアミノ基と反応する官能基とを有することを特徴とする請求項1〜10の何れか1の核酸配列の検出方法。
【請求項12】
請求項1〜11の何れか1の核酸配列の検出方法を行うための核酸配列検出基板であって、
前記基板上にオリゴヌクレオチド鎖がスポットされていることを特徴とする核酸配列検出基板。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【公開番号】特開2009−178159(P2009−178159A)
【公開日】平成21年8月13日(2009.8.13)
【国際特許分類】
【出願番号】特願2008−274214(P2008−274214)
【出願日】平成20年10月24日(2008.10.24)
【出願人】(000005452)株式会社日立プラントテクノロジー (1,767)
【Fターム(参考)】
【公開日】平成21年8月13日(2009.8.13)
【国際特許分類】
【出願日】平成20年10月24日(2008.10.24)
【出願人】(000005452)株式会社日立プラントテクノロジー (1,767)
【Fターム(参考)】
[ Back to top ]

