核酸配列増殖を実施するための診断システムおよび検出方法
細胞および/または粒子を含む液状試料に関する試料調製方法を実施するための一体型ラボオンチップ診断システムは、(a)液状試料の入口と、(b)液状試料に含まれる細胞および/または粒子を溶解するための溶解ユニットと、(c)液状試料に含まれる細胞および/または粒子から核酸を抽出するための核酸抽出ユニットと、(d)溶解流体を収納する貯留所と、(e)核酸抽出ユニットで集められた核酸を取り出すための溶離剤を収納する貯留所と、を含み、試料入口が溶解ユニットと流体連通接続されて、それらの間の流体の流れをコントロールする任意バルブが在り、溶解ユニットが核酸抽出ユニットと流体連通接続されて、それらの間の流体の流れをコントロールする任意バルブが在り、溶解流体を収納する貯留所が溶解ユニットと流体連通接続されて、それらの間の流体の流れをコントロールする任意バルブが在り、および溶離剤を収納する貯留所が核酸抽出ユニットと流体連通接続されて、それらの間の流体の流れをコントロールする任意バルブが在ることを特徴とする。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は核酸抽出、特に核酸抽出と濃縮を組み合わせて実施するための一体型ラボオンチップ(lab-on-a-chip)診断システムに関する。このシステムは、細胞を含む液状試料に関して核酸配列増殖および検出方法を実施するのに用いることができる。
【背景技術】
【0002】
未熟練の使用者が、過度の誤りなく複雑な検定手順を実施できる生物学上の分子を検出する単純化された検定システムの開発に大きな関心がある。さらに、液体試薬の最小の取扱で、検定手順が使用者の最小の介入で実施されるように自動化され、好ましくはポイントオブケア診断の簡便なシステムも提供する小型化された包含検定システムの開発に非常に大きな関心がある。このことは医療分野、特に診断に関し、医師の外科、クリニック、獣医外科または患者の家庭もしくは現場でさえ、効率的かつ安全に操作できる生物学上の検定システムに対するニーズが増加している。
【0003】
微細加工されたラボオンチップ装置は、使用者の最小の試薬取扱が要求され、また、少ない試料体積の使用が可能、高価な試薬を必要とする生物学の反応にとって有意な利点を可能とする包含された生物学上の反応を実施する魅力的な選択肢である。
【0004】
精製と前濃縮とを達成するため、分析化学者は一般的にある種の抽出手順を使用してきた。これらの方法は試料母体から対象の検体を取出すこと、または別の方法として、試料母体から他のすべての種を取り除いて対象の検体を残すことを伴う。抽出プロセスは種を1つの液相から他の液相に移転する、または種を1つの液相から固体表面に捕捉することを伴う。前者の場合、溶媒が種を含む相から積極的に除去されなければ、前濃縮は一般的に達成されない。しかし、後者の場合、以下の場合は前濃縮が達成されるだろう。即ち、(a)ある時点で表面に接触して溶液内に存在する以上の分子を結合するのに十分に大きな結合領域が入手可能な場合、(b)種が極少量の溶離剤を用いて固相から効率的に取出せる場合である。前濃縮は核酸試料前処理手順の重要な局面であるので固相抽出が採用されてきた。カオトロピック剤の存在下、DNAのシリカ粒子への結合を伴う公知の核酸抽出方法がある。(Boomら、J.Clin.Microbiol.1990,28,495-503頁参照)本発明はDNAの固相抽出方法をミクロ流体装置に一体化することを含む。
【0005】
本発明において、核酸抽出と濃縮は組み合わせることができる。
【0006】
本明細書で用いる微細加工された装置またはシステムなる用語は、排他的ではなく典型的には、半導体超小型電子技術装置のバッチ生産で、および近年の半導体微小機械装置の生産で用いられるプロセスを用いて製作されるいかなる装置を意味する。そのような微細加工技術には、例えば、エピタキシャル成長(例、気相、液相、分子ビーム、金属有機化学的気相蒸着)、リソグラフィー(例、光ビーム、電子ビーム、X線ビーム、イオンビーム)、エッチング(例、化学的、気相、プラズマ)、電子蒸着、スパッタリング、拡散不純物添加、イオン注入が挙げられる。ガラスのような非晶質材料が使用できるかもしれないが、微細加工装置は典型的にシリコンまたは砒化ガリウムのような結晶性半導体基板上に形成され、従来の集積回路製作技術の使用により電子回路が集積される利点がある。微細加工部品をガラス板または補助的な微細加工素子のような1つ以上の他の素子との組み合わせは頻繁に用いられ、本明細書で用いる微細加工の用語の範囲に入ることを意図している。また、例えば結晶性半導体基板から作られる高分子の複製も微細加工の用語の範囲に入ることを意図している。
【0007】
DNAおよび/またはRNAのバクテリア細胞およびウイルス粒子からの分離および精製は、例えば、診断学、環境監査、法医学および分子生物学上の研究のような多くの分野において重要なステップである。
【0008】
微細加工は、DNA配列分析および検出のような非常に少ない試料体積が望まれる生物学的プロセスを実施するための装置を製造する魅力的な組み立て方法である。
【0009】
そのような装置の1つ、ポリメラーゼ連鎖反応(PCR)を実施し、続く検出工程が米国特許第5,674,742号で開示されている。ラム波ポンプは、PCRプロセスを実施するのに必要な限り、DNAプライマー、ポリメラーゼ試薬およびヌクレオチド試薬を3つの別個の貯蔵室から1つの単一反応室に輸送するために用いられ、反応室の温度を必要に応じてサイクルさせる。
【0010】
化学反応工程を実施し、続いて電気泳動分離工程を実施する他の微細加工装置が分析化学(Analytical Chemistry1994,66,4127-4132頁)に開示されている。ガラス板で覆われたシリコン基板のエッチングされた構造によって、反応室、および緩衝液、検体、試薬および検体廃棄貯蔵室、その他廃棄貯蔵室に連結された電気泳動カラムへの連結が提供される。
【0011】
核酸配列系増幅(NASBA)はプライマー依存技術であり、ある温度で単一混合中の核酸の連続増殖(等温核酸増殖方法)用に用いることができ、上述した最初のRNA転写法に基づく増殖方法の1つであった。通常、NASBAは核酸増殖用に単純で迅速なPCR代替法を提供し、90分で10億倍のRNAの増殖ができる。PCR技術のような他の増殖システムに関して、RNA検体を均一に等温的に増殖するNASBAの能力によりその応用範囲を、ウイルス診断から遺伝子発現および細胞生存のような生物学的活性の示唆に広げられる。NASBA技術は例えば、ネイチャー(Nature350巻、91および92頁)で議論されている。NASBAでの核酸増殖はプライマー対と共にAMV逆転写酵素、Ranase HおよびT7 RNA ポリメラーゼの協奏的酵素活性により達成され、その結果、混成法(hybridization)による検出用に容易に使用できる主として1本鎖RNAが蓄積される。内部RNA標準をNASBAに適用することにより、定量化を通じて6つの増殖反応が必要であるが、4対数の動的範囲を有する定量的な核酸検出方法となる。この方法は異なる量に添加された複数の識別可能な内部RNA標準および電気化学発光(ECL)検出技術によって劇的に改良される。この1管(one-tube)定量(Q)NASBAでは、定量化を通して増殖プロセスの1つの工程のみが必要であり、核酸の実際の分離前に内部標準を溶解緩衝液中の臨床試料に内部標準の添加ができる。この方法は核酸分離効率が定量化の結果に影響しない利点を有し、臨床試料の分離後、内部標準が野生型核酸と混合される方法と対照的である。定量的NASBAは、核酸研究(Nucleic Acid Research (1998)26巻、2150-2155頁)で議論されている。しかしながら、次のNASBA製品検出は未だに労働集約的な手順であり、通常、酵素ビーズに基づく検出で、電気化学発光検出(ECL)または蛍光相関分光分析を伴う。しかしながら、これらの方法論は異質、即ち、試料取扱を必要とするまたは現在コストパフォーマンスがなく高生産性途用に相対的にほとんど使用されないロボット利用の装置を必要とする。製品検出が標的特有の信号の発生によって標的増殖と同時である同質の手順は大規模スクリーニングおよび完全自動化が容易だろう。標的との混成にのみ蛍光発光するプローブ(分子標識)に基づいて新規の核酸検出技術が最近導入されている。
【0012】
流体工学は例えば、管内の液体の流れの科学である。微細加工装置にとって、1つ以上のミクロまたはナノサイズの反応室を通って流体の流れは注射器、回転ポンプのようなポンプの使用、または予め課した真空もしくは装置外の加圧源の使用で達成されるのが典型的である。別の方法として、マイクロポンプまたは真空室、またはラム波ポンプ素子が装置自体の1部として備えられる。ポンプを含む流れコントロール素子、バルブおよび予め課した真空もしくは加圧室を、反応室を通る流体の流れをコントロールするのに用いてもよい。システム内の流体の輸送の他の機構は電気浸透圧流を含む。
【0013】
国際公開第WO02/22265号は、微細加工反応室システムに関し、NASBAを実施する方法に使用できる。国際出願第PCT/GB02/005945号は、微細加工反応室システムおよび流体輸送の方法に関している。そのシステムもNASBAを実施する方法に使用できる。国際出願第PCT/GB03/004768号は、核酸切断のためのミクロ流体装置に関している。その装置はNASBAを実施する微細加工反応室システムに、または関連して用いることができる。
【特許文献1】米国特許第5,674,742号
【特許文献2】国際公開第WO02/22265号
【特許文献3】国際出願第PCT/GB02/005945号
【特許文献4】国際出願第PCT/GB03/004768号
【非特許文献1】BoomらのJ.Clin.Microbiol.1990,28,495-503頁
【非特許文献2】分析化学(Analytical Chemistry)1994,66,4127-4132頁
【非特許文献3】ネイチャー(Nature)350巻、91および92頁)
【非特許文献4】核酸研究(Nucleic Acid Research)1998,26巻、2150-2155頁
【発明の開示】
【0014】
本発明は、細胞および/または粒子を含む液状試料に関する試料調製方法を実施するためのシステムであって、
(a)液状試料の入口、
(b)液状試料に含まれる細胞および/または粒子を溶解するための溶解ユニット、
(c)液状試料に含まれる細胞および/または粒子から核酸を抽出するための核酸抽出ユニット、
(d)溶解流体を収納する貯留所、
(e)核酸抽出ユニットで集められる核酸を取り出すための溶離剤を収納する貯留所を含み、
試料入口が溶解ユニットと流体連通接続されて、それらの間の流体の流れをコントロールする任意バルブが在り、
溶解ユニットが核酸抽出ユニットと流体連通接続されて、それらの間の流体の流れをコントロールする任意バルブが在り、
溶解流体を収納する貯留所が溶解ユニットと流体連通接続されて、それらの間の流体の流れをコントロールする任意バルブが在り、および
溶離剤を収納する貯留所が核酸抽出ユニットと流体連通接続されて、それらの間の流体の流れをコントロールする任意バルブが在る、ことを特徴とするシステムを提供する。
【0015】
そのシステムは日常業務の診断用にミリリットルの試料体積で使用できる。そのシステムは予め入れられている一定の試薬を基にする。
【0016】
本発明において、核酸抽出と濃縮とを組み合わせることができる。従って、本発明により、試料調製方法を実施するための一体型ラボオンチップ診断システムが提供される。そのシステムはNASBAを実施するために微細加工反応室にまたは関連して使用できる。
【0017】
システムの少なくともいくつかの部品は微細加工されるのが好ましい。溶解ユニット、核酸抽出ユニット、溶解流体貯留所および溶離剤貯留所が微細加工され、一体化すなわち共通の基板上に形成されるのが好ましい。
【0018】
溶解流体を収納する貯留所は好ましくは入口と流体連通接続され、それらの間の流体の流れをコントロールする任意バルブが在る。
【0019】
溶離剤を収納する貯留所が好ましくは入口と流体連通接続されて、それらの間の流体の流れをコントロールする任意バルブが在る。
【0020】
本発明によるシステムは典型的にさらに(g)核酸反応ユニットを含み、核酸抽出ユニットが核酸反応ユニットと流体連通接続されて、それらの間の流体の流れをコントロールする任意バルブが在る。好ましくは核酸反応ユニットが微細加工され、好ましくは他の部品と一体化されている。いかなる従来の反応は反応ユニットで実施される。好ましくは、反応は特定の対象配列および/または定量分析の検出が可能となるだろう。核酸反応は典型的に核酸配列増殖および検出ユニットを含み、核酸配列増殖反応によって特定の配列の検出が可能である。例えば、PCRおよびNASBAのような等温増殖技術が挙げられる。分子標識を用いたリアルタイムNASBAが最も好まし。したがって、好ましい1つの局面として、本発明は、細胞および/または粒子を含む液状試料に関し、試料作製、核酸配列増殖および検出プロセスのための一体型ラボオンチップ診断システム、より好ましくはリアルタイムNASBAを提供する。国際公開第WO02/22265号には、NASBAを実施するための微細加工反応室システムが記載されている。
【0021】
本発明によるシステムは好ましくは、例えば感染上皮細胞やmRNAの溶解および濃縮、リアルタイム増殖および検出などの濃縮を含む。
【0022】
システムは例えば、頚癌のスクリーニングに用いてもよい。
【0023】
本発明によるシステムは、典型的にさらに(h)廃棄ユニットを含み、廃棄ユニットが溶解ユニットと流体連通接続されて、それらの間の流体の流れをコントロールする任意バルブが在る。好ましくは廃棄ユニットが微細加工され、好ましくは他の部品と一体化されている。
【0024】
システムは、典型的にさらに(i)洗浄溶媒を収納する貯留所を含み、貯留所が核酸抽出ユニットと流体連通接続されて、それらの間の流体の流れをコントロールする任意バルブが在る。好ましくは、洗浄溶媒を収納する貯留所が微細加工され、好ましくは他の部品と一体化されている。洗浄溶媒はいかなる適当な溶媒から選択できるが、容易に蒸発できる溶媒、例えばエタノールが好ましい。
【0025】
システムは、典型的にさらに(j)洗浄溶媒を収納する貯留所を含み、貯留所が核酸抽出ユニットと流体連通接続されて、それらの間の流体の流れをコントロールする任意バルブが在る。好ましくは、洗浄溶媒を収納する貯留所が微細加工され、好ましくは他の部品と一体化されている。洗浄溶媒はいかなる適当な溶媒から選択できるが、容易に蒸発できる溶媒、例えばイソプロパノールが好ましい。
【0026】
溶離剤を収納する貯留所が第一洗浄溶媒(例、エタノール)および/または第二洗浄溶媒(例、イソプロパノール)を収納する貯留所と流体連通接続されているのが有利である。
【0027】
より有利には、溶離剤、第一洗浄溶媒(例、エタノール)および/または第二洗浄溶媒(例、イソプロパノール)が共通の貯留所に収納される。このことは溶離剤、第一洗浄溶媒および/または第二洗浄溶媒が共通の貯留所で流体、例えば空気で、互いに分離することで達成できる。しかしながら、不混和性または少なくとも溶離剤、第一洗浄溶媒および/または第二洗浄溶媒と実質的に不混和性である限り、他の分離流体(液体または気体)を用いてもよい。
【0028】
好適な実施形態において、溶離剤、エタノールおよび/またはイソプロパノールが、入口および溶解ユニットと流体連通接続である導管またはチャンネルに収納される。溶離剤、エタノールおよび/またはイソプロパノールが、例えば空気の隙間のような流体の隙間で分離される。
【0029】
システムは、典型的にさらに(k)液状試料および/または空気を入口に導入するための手段を含む。前記手段は、好ましくはポンプまたは注射器を含む。別の方法として、そのような手段は入口取付け口と流体連通接続にある1つ以上の容積可変室を含んでもよく、容積可変室の容積が、液状試料の入口へ入るおよび/または出る流れに影響および/または制限する。容積可変室は典型的に、基礎になる基板の中空の窪みを覆う柔軟な膜を含む。国際出願第PCT/GB02/005945号には、好適な流体輸送システムが記載されている。
【0030】
このシステムは単一のポンプシステムで駆動されるのが有利である。
【0031】
溶解ユニットはいかなる形状および構成でよいが、チャンネルまたは室の形体は、典型的であるだろう。溶解ユニットは好ましくは液状試料に含まれる真核細胞、原核細胞および粒子の溶解用である。
【0032】
必要に応じて、システムはさらにろ過ユニットを含むことができ、そのユニットは溶解ユニットと流体連通接続されている。ろ過ユニットは例えばクロスフローフィルターまたは中空フィルターを含んでもよい。別の方法として、溶解ユニット自体がさらに液状試料をろ過する手段を含んでもよい。前記手段は例えばクロスフローフィルターまたは中空フィルターを含んでもよく、溶解ユニットと一体化されていてもよい。
【0033】
必要に応じて、システムはさらに、切断ユニットを含むことができ、溶解ユニットと流体連通接続されている。別の方法として、溶解ユニット自体が液状試料を切断する手段を含んでもよい。DNAまたはRNAの無作為切断は試料の前処理工程としてしばしば必要である。切断は制限酵素を用いて生物学的に、または分子を破壊するため物理的な力を加えることにより達成できる(参照:例えば、P. N. Hengen, Trends in Biochem. Sci., 22巻、273-274頁、1997および、P.F.Davison, Proc. Nat. Acad. Sci. USA, 45巻、1560-1568頁、1959)。せん断によるDNA切断は通常、試料を短い制限領域を通過させることを伴う。好適な実施形態において、DNAおよび/またはRNAは狭いオリフィスに送り込まれ、力学的な力のもと、分子の急速な伸張により切断する。圧力駆動の流れがせん断力を生じ、それが核酸の切断に至る。国際特許出願公開第PCT/GB03/004768号には、核酸切断のためのミクロ流体装置が記載されている。
【0034】
溶解ユニット自体はさらに液状試料をろ過する手段および液状試料を切断する手段を含むことができる。
【0035】
システムは、さらに溶解ユニットおよび/または核酸抽出ユニットの内容物を加熱する手段を含む。前記手段は例えば、溶解ユニットおよび/または核酸抽出ユニット中に、または隣接して位置する1つ以上のペルチェ素子を含む。
【0036】
核酸抽出ユニットはいかなる適当な形状および構成でよいが、チャンネルまたは室の形体は典型的であるだろう。核酸抽出ユニットは好ましくは液状試料に含まれる真核細胞、原核細胞および粒子の抽出用である。
【0037】
核酸抽出ユニットは、少なくとも1部がシリカビーズまたは粒子で満たされてもよい。溶離した核酸を収集および/または前濃縮するため、シリカビーズまたは粒子に隣接する1組以上の電極が提供される。例えば、その1組以上の電極はプラチナ電極を含む。それゆえ、手段は電極間に電位差を与えることで提供される。抽出セルは好ましくは、ポリジメチルシロキサン(PDMS)からの形成またはそれを含む。そのユニットは典型的に基板および覆う蓋を含み、抽出ユニットは基板の表面および蓋の隣接する表面の窪みによって定義される。基板は好ましくはシリコン・ポリジメチルシロキサン(PDMS)から形成される。核酸はカオトロピック剤の下、シリカ表面に結合する。
【0038】
電極(例、プラチナ電極)の一体化はチップ上に溶離した核酸を逆に収集および前濃縮をするために有利に使用できる。このように、本発明において核酸抽出と濃縮の組み合わせを達成することができる。
【0039】
好適な実施形態において、核酸抽出ユニットはシリカビーズ搭載ポリジメチルシロキサン(PDMS)チャンネルを含む。
【0040】
そのシステムまたは少なくともその原版は、典型的に半導体材料から形成または含有するが、誘電体(例、ガラス、溶融シリカ、石英、高分子材料およびセラミックス材料)および/または金属材料も使用できる。半導体材料の例として、1つ以上のIV族元素(即ち
シリコン、ゲルマニウム)、III−V族化合物(例、砒化ガリウム、リン化ガリウム、アンチモン化ガリウム、リン化インジウム、砒化インジウム、砒化アルミニウムおよびアンチモン化アルミニウム)、II−VI化合物(例、硫化カドミウム、セレン化カドミウム、硫化亜鉛、セレン化亜鉛)、およびIV−VI化合物(例、硫化鉛、セレン化鉛、テルル化鉛、テルル化錫)が挙げられる。シリコンおよび砒化ガリウムが好ましい半導体材料である。システムは半導体超小型電子装置のバッチ生産に伝統的に関連するプロセス、および最近の半導体微小機械のバッチ生産を用いて製作される。このような微細加工技術として例えば、エピタキシャル成長(例、気相、液相、分子ビーム、金属有機化学的気相蒸着)、リソグラフィー(例、光ビーム、電子ビーム、X線ビーム、イオンビーム)、エッチング(例、化学的、気相、プラズマ)、電子蒸着、スパッタリング、拡散不純物添加、イオン注入およびミクロ機械加工が挙げられる。ガラスおよび高分子材料のような非晶質材料も使用できる。
【0041】
高分子材料の例として、PMMA(ポリメチルメタクリレート)、COC(シクロオレフィン共重合体)、ポリエチレン、ポリプロピレン、PL(ポリラクチド)、PBT(ポリブチレンテレフタレート)およびPSU(ポリスルホン)、これら2つ以上の混合物が挙げられる。好ましい高分子はPDMSまたはCOCである。
【0042】
デバイス/システムは典型的に一体化して形成される。デバイス/システムは共通の、例えば本明細書で記載したような半導体材料などの共通の基板材料上に微細加工されるが、例えば、ガラスまたはセラミックス材料のような誘電体基板材料も使用できる。しかしながら、共通の基板材料は好ましくは樹脂または高分子材料であり、適当な例は上述されている。システムは好ましくは、例えばシリコン原版の複製によって形成される。
【0043】
小型化構造としてシリコン−ガラスの代わりに樹脂を使用する利点は、少なくとも生物学的な用途で多くある。1つの最大の恩恵はミクロ射出成形、熱エンボスおよび注型のような方法を用いた量産時のコスト削減である。複雑な構造に対して100倍以上の係数もありえないことではない。多層金型挿入物の構造複製の可能性によりデザインの自由度に大きな柔軟性が得られる。ミクロとマクロの世界の接続は、通常使用する標準パーツを任意に組み合わせられるので多くの場合、より容易である。異なるアプローチが例えば微細構造支援のUS溶接、レーザー溶接、接着および積層のような組立技術のために用いられる。有益な他の特徴は表面改質である。生物学的分析に対応する小型化構造にとって、表面に生体適合性があることが重要である。プラズマ処理およびプラズマ重合を活用して柔軟で多様な品揃えがコーティングに適合できる。酸および塩基に対する薬品耐性は容易に食刻されるシリコン基板よりも樹脂のほうがずっと良好である。バイオテクノロジー分野で多くの検出方法は光学測定を伴う。それゆえ、樹脂の透明性は透明でないシリコンと比較して大きな特徴である。現在、高分子ミクロ流体技術はラボオンチップ市場で確立され成長している。
【0044】
本明細書で説明した微細(ミクロ)加工システムはナノ加工デバイスをも包含する。
【0045】
シリコンまたは半導体原版に対し、例えばエッチングまたはミクロ機械加工によって、1つ以上の容積可変室、ミクロ流体チャンネル、反応室および正確な微細寸法を有するシリコン基板内の流体接続を定義することが可能である。その結果、樹脂複製はシリコン原版から作ることができる。このように、エッチングされたまたは機械加工された樹脂基板はいかなる適当な手段(例えば接着剤または加熱)で蓋に結合できる。
【0046】
本システムで使用する任意のバルブは、いかなる便利な形体でよい。例えば、バルブにより2つのユニットが、導管またはチャンネルに沿って流れを単純に規制する。ピン装置の作用により導管またはチャンネル内の孔で上げ下げできるピストンのような部材が備えられる。
【0047】
本システムの使用は、実施例に示す以下の可能な工程を伴う。
選択肢1
(i)試料採取および溶解
(ii)mRNA抽出(手動または自動手順)
(iii)リアルタイム増殖および検出(好ましくは多重)
選択肢2
(iv)切断ユニットが試料溶解と試料作製の両方を含むことができる。
(v)リアルタイム増殖(NASBA)および検出(好ましくは多重)
【0048】
本発明は、また本明細書で記載した一体型ラボオンチップ診断システムの作製のための方法を提供するが、その方法は、
A.入口の窪み、溶解ユニット窪み、核酸抽出ユニット窪み、溶解流体貯留所窪みおよび溶離剤貯留所窪みを表面に有する基板を備えること、
B.蓋を備えること、および
C.(a)入口、(b)溶解ユニット、(c)核酸抽出ユニット、(d)溶解流体貯留所、(e)溶離剤貯留所、を創るように基板に蓋を取り付け、各々は基板の前記表面および蓋の隣接する表面にそれぞれの窪みにより定義される方法である。
【0049】
本明細書で用いる用語の窪みは例えば、溝、スロット、孔、トレンチおよびチャンネル、これらの1部を含む多様な特徴を網羅する意図もある。
【0050】
方法はさらに基板に蓋を取り付ける前または後で溶解流体を溶解流体貯留所に導入する工程を含む。
【0051】
方法はさらに基板に蓋を取り付ける前または後で溶離剤を溶離剤貯留所に導入する工程を含む。
【0052】
方法はさらに基板に蓋を取り付ける前または後でエタノールを溶離剤貯留所に導入する工程を含む。
【0053】
方法はさらに基板に蓋を取り付ける前または後でイソプロパノールを溶離剤貯留所に導入する工程を含む。
【0054】
任意の不混和性流体(液体または気体)が使用されるが、方法は溶離剤および/または、エタノールおよび/またはイソプロパノールが流体、好ましくは空気で互いに分離される。
【0055】
好適な実施形態において方法は、
基板に蓋を取り付けた後で溶離剤を溶離剤貯留所に導入する工程、
第一体積の空気を溶離剤貯留所に導入する工程、
エタノールを溶離剤貯留所に導入し、エタノールを前記第一量の空気で溶離剤から分離される工程、
第二体積の空気を溶離剤貯留所に導入する工程、および
イソプロパノールを溶離剤貯留所に導入し、イソプロパノールを前記第二体積の空気でエタノールから分離する工程を含むものである。
【0056】
基板は例えばシリコンから、覆う蓋は例えばガラスから形成できる。この場合、ガラスの蓋は好ましくはシリコン基板に陽極として結合され、任意選択的に基板表面に形成された酸化シリコン中間体を通して結合される。シリコン内の窪みは活性イオンエッチングを用いて形成されてよい。高分子材料のような他の材料は基板および/または蓋にも用いられてもよい。そのような材料は例えばシリコン複製を用いて製作できる。別の方法として、デバイスは機械加工および放電加工(EDM)によって金型挿入物の構造化により、続いてチップパーツの射出成形、高分子パーツの例えば穴あけ、平削り、絞りなどの機械的な後加工によって製作されてよい。その後、フィルターの挿入、溶媒溶接および流体接続の実装が行われる。
【0057】
高分子材料の例として、PMMA(ポリメチルメタクリレート)、COC(シクロオレフィン共重合体)、ポリエチレン、ポリプロピレン、PL(ポリラクチド)、PBT(ポリブチレンテレフタレート)およびPSU(ポリスルホン)、これら2つ以上の混合物が挙げられるが、COCが好ましい。
【0058】
好ましくは、および特にセル内の内容物の光学的観察が要求される場合、覆う蓋はガラス、パイレックス(登録商標)またはCOCのような光学的に透明な物質または材料で作られる。
【0059】
ガラス板のような1つ以上の他のエレメントまたは補完的な微細加工エレメントを有する微細加工部品の組み合わせは頻繁に用いられ、本明細書で用いる用語の微細加工の範囲にある。
【0060】
基板のベースの一部または全部はコーティングの厚みが典型的に1μmまで、好ましくは0.5μm未満である。コーティングは好ましくは、ポリエチレングリコール(PEG)、ウシ血清アルブミン(BSA),トゥウィーン(tweens)およびデキストランを含む1つ以上のグループから形成される。好ましいデキストランは分子量が9,000〜200,000、特に好ましくは20,000〜100,000、特に25,000〜75,000、例えば35,000〜65,000である。トゥウィーン(即ち、ポリオキシエチレンソルビタン)はシグマ社(Sigma Aldrich Company)から入手可能である。PEGは単一でも、組み合わせてもコーティングとして好ましい。PEGは包括的に純粋なポリエチレングリコール、即ち、式HO−(CH2CH2O)n−Hであり、ここで、nは整数で分子量が典型的に200〜10,000を有するPEGを与え、特に1,000〜5,000のPEGまたは化学的に変性されたPEGであり、1つ以上のポリエチレングリコールオリゴマーが例えばリン酸基または芳香族スペーサーのような同種の2価の基と結合している。特に好ましいのは、FK108(1つのポリエチレングリコール鎖がリン酸塩を介して他と結合)として公知のポリエチレングリコールおよびシグマ社(Sigma Aldrich Company)から製品P2263として販売されているPEGである。セル/室、入口、出口および/またはチャンネルの表面に塗布された上記のコーティングによりシステムを通って流体の流れが向上される。特に、試料がそのような表面に接着または固着するのが少なくなることが見出されている。PEGコーティングが好ましい。
【0061】
シリコンまたは半導体原版に対し、例えばエッチングまたはミクロ機械加工によって、1つ以上の容積可変室、ミクロ流体チャンネル、反応室および正確な微細寸法(深度活性イオンエッチング(DRIE)は好ましい技術)を有するシリコン基板内の流体接続を定義することが可能である。樹脂複製はシリコン原版から作ることができる。このように、エッチングされたまたは機械加工されたミクロ構造の樹脂基板はいかなる適当な手段(例えば接着剤または加熱)で蓋に結合でき、それによって区画された切断セル、入口、出口および連結チャンネルが形成される。
【0062】
デバイスはその上部表面に形成された望ましい微細構造を有する基板を含む。基板は例えばシリコンまたはシリコン原版から複製で形成された樹脂基板でもよい。基板はその上部表面で蓋と結合し、それによって一連のユニット/セル、入口、出口および/またはチャンネルを定義する。蓋は例えば、樹脂またはガラスで形成されてもよい。蓋は好ましくは透明であり流体の観察が可能になる。一般に、デバイスは、好ましくは高アスペクト比構成にシリコンの深度活性イオンエッチング(DRIE)で製作され、続いてガラス蓋と陽極結合される。別の方法として、デバイスは機械加工および放電加工(EDM)による金型挿入物の構造化により、続いてチップパーツの射出成形、高分子パーツの例えば穴あけ、平削り、絞りなどの機械的な後加工によって製作されてもよい。これはその後、フィルターの挿入、溶媒溶接および流体接続の実装が行われる。
【0063】
核酸試料は例えば生物学的流体、乳製品、環境上の流体および/または飲料水であり、またはそれらから誘導されるものでもよい。例として、血液、血清、唾液、尿、ミルク、飲料水、海水および池の水が挙げられる。例えば血液およびミルクのような多くの複雑な生物学的流体に対して、試料中のバクテリア細胞およびウイルス粒子からDNAおよび/またはRNAを分離し精製するまでに、まず試料中の他の粒子からウイルス粒子およびバクテリア細胞を分離する必要があることが理解されるだろう。バクテリア細胞壁またはウイルスたんぱく質皮膜を破壊して核酸を分離する前に、バクテリア細胞およびウイルス粒子を濃縮、即ち、出発材料の体積を減ずるためにさらに試料調製工程を実施する必要があることも理解されるだろう。このことは、出発材料が大量の体積からなるとき、例えば相対的に少ないバクテリア細胞またはウイルス粒子を含む水溶液のとき重要である。このタイプの出発材料は、飲料水中のバクテリア汚染を日常監視するような環境上の試験用途に共通的にみられる。
【0064】
本システムは好ましくは試料体積が10〜100mlに対して、満足するように設計されている。
【0065】
また、本発明において生物学上および/または環境上の試料を分析する装置を提供し、装置は本明細書で記載されるシステムを含む。この装置は使い捨て装置であってもよい。
【0066】
また、本発明において生物学上および/または環境上の試料を分析する検定キットを提供し、キットは本明細書で記載されるシステムおよび本システムで試料に接触するための手段を含む。この検定キットは使い捨てキットであってもよい。
【発明を実施するための最良の形態】
【0067】
本発明は実施例によって、添付する図面を参照して以下に説明される。
【0068】
本発明の実施形態によるチップ設計は好ましくは供給チャンネル、反応室およびミクロ流体駆動システムが一体になっており、シクロオレフィン共重合体(COC)の射出成形により製作される。例えば、12チャンネルチップ用の金型挿入物が高精度機械加工を用いて作製されても良い。検出容積は、典型的に約80nL(400×2000×100ミクロン)である。樹脂チップは好ましくは、最初に酸素プラズマで活性化後、5%のポリエチレングリコール(PEG)溶液(Sigma chemical Co, St. Louis, MO)でコーティングされる。コーティング後、チップは約75ミクロンのCOC膜を、例えばビシクロヘキシルを用いて溶媒溶接で密閉される。薄い金層(約25nm)が、ペルチェ素子の上部の熱パッドからバックグランド蛍光発光を防ぐためにチップの裏側に蒸着されるのが好ましい。
【0069】
必要に応じて、ペルチェ素子は樹脂製チップの熱的コントロールを行う試料ホルダーに一体化されてもよい。アルミニウムブロックがチップの均一な熱分布を保証するよう、ペルチェ素子の上部に取り付けられてもよい。熱パッドは好ましくはチップと熱源との間に熱的接触を確立するためアルミニウムブロックに取り付けられてよい。熱伝対は典型的に試料ホルダーに配置され、空気温度を測定し、ペルチェ素子にフィードバック回路を有する。温度制御は外部のラップトップコンピューターで管理できる。
【0070】
上述したように、NASBAは等温(約41℃)増幅方法であり、具体的にはいかなる1本鎖RNA配列を増幅するために設計される。NASBA反応は広範囲の用途、例えば特定のウイルスRNA、他の感染性または病原物質のRNA、ある種の細胞のRNAの存在検出に適用される。AMV逆転写酵素、RNase HおよびT7 RNAポリメラーゼの3種の酵素の同時活性が増殖反応の中心技術をなす。2つのオリゴヌクレオチドプライマーによって反応の特異性および標的RNAに特有の蛍光発光分子標識プローブが決定される。約90分で対象の核酸配列が>109の複製に増殖できる。光学検出単位は、反応室内で蛍光体が約494nmで励起、約525nmで蛍光発光を検出するよう設計されるのが好ましい。励起光は光がレンズを通して集光される前にバンド幅(465nm〜500nm)のフィルターを用いてろ過される。同じフレネルレンズが発光の焦点合わせ、および蛍光の集光に用いてもよい。他のレンズが蛍光発光を検出器(例、光増幅管)の表面に焦点合わせするのに用いてもよい。データ収集および検出した信号の調整は、ラップトップでMATLAB 6.0.088 Release 12(The Mathworks Inc., Natick, MA)を用いて処理できる。
【0071】
効率的な試料前処理は、ミクロ技術分析システムの文脈の中で重要な因子である。特に、濃縮デバイスは、例えば生理学的試料中に存在するバクテリア細胞またはウイルスのように特定の粒子の少ない数を検出するために必要である。多種の濃縮方法が当該技術で公知であり、例えば、種々のろ過媒体(微細構造チャンネル、多孔中空繊維または膜)を用いて袋小路ろ過およびクロスフローろ過、重力沈降機、遠心分離機、吸音セルフィルター、光学トラップ、誘電泳動法(DEP)、電気泳動法、フローサイトメトリーおよび吸着に基づく方法などがある。
【0072】
濃縮の好ましい方法は袋小路ろ過を必要とする。これは相対的に単純で安価な方法であり、使い捨て高分子チップに容易に組み入れることができる。さらに、平膜の使用で用途分野を考慮すると高い柔軟性が保証される。なぜなら、多様な膜が入手可能であり、PEGまたはTween20コーティングのような表面処理が容易に実施できるからである。
【0073】
平膜を高分子製使い捨てチップに一体化するのは、図1に模式的に示されるような組み立てられたサンドイッチを用いて達成できる。チップは蓋の膜40、流体チャンネル41およびフィルター膜44を含む。チップの頂部および底部は42および43でそれぞれ示される。
【0074】
好ましくは、チップ上の流れのコントロールが行えるように1つ以上のバルブがデバイスに組み入れられる。適当なバルブ設計が図2および3に示される。図2に関して、予め成形した膜または平膜を用いてもよい。チップ45は流体チャンネル46および予め成形した膜47を含む。垂直の矢印は開放位置を示す。
【0075】
図3a〜dに関して、本体を有するチップが示されており、上部本体部分50、主本体部分52およびそれらの間に挟まれた膜51を含む。ミクロ流体チャンネル57が膜51に隣接して備えられる。ピストン54およびバルブ55が主本体部分52の適当な窪みに備えられる。流体/液体はピストン54(図3a参照)上の体積53中にある。バルブ55は上部位置(図3a参照)に内嵌で備え付けられる。この位置でバルブは流体が流れないようにミクロ流体チャンネル57を密封する。円錐ピン56bはバルブ55を下げて開位置(図3b,3c,3c参照)なるように使用される。特に、ピン56bが上方に押されるとき、摩擦適合によりバルブ55内の対応する窪みに確保される。同様に、ピストン54との関係で、円錐ピン56aが上方に押されるとき、摩擦適合によりバルブ54内の対応する窪みに確保される。体積53から液体を輸送するために、ピン56aおよび56bがピストン54およびバルブ55それぞれに対応する窪みに押し込まれて液体は体積53から押し出される(図3c,3d参照)。チップが使用されたとき、円錐ピン56aおよび56bでそれぞれピストン54およびバルブ55から後退される。
【0076】
本発明者はシリカビーズがRNA抽出および精製に好適であることを見出した。典型的に、直径15〜35μmのビーズ0.3〜0.4mgが抽出に使用できるが、大きなシリカビーズ(直径200μmまで)も使用できる。1つの可能なビーズ室の配置が図4に示される。ビーズ室60は予め湿潤したビーズ61で、チップ−チップ結合の前に詰められる。結合後、ビーズ包みは100μmの障壁で保持される。ビーズ室の形状および流体接合62(入口)と63(出口)の配置により、適用された液体は、例えビーズ室60が完全には充満していなくても、シリカビーズ61を通過するのが保証される。ビーズ室60の体積は約6.5μLであり、典型的に10〜50μLの試料から抽出するのに適している。
【0077】
4つの液体が好ましくは前処理プロセスと通して用いられる。溶解緩衝液(典型的に約100μL)、イソプロパノール(典型的に約40μL)、エタノール(典型的に約40μL)および溶離緩衝液(典型的に約5〜20μL)である。後者3つは抽出に必要である。本発明者は、溶解緩衝液をチップ70aの上部にある(図5a参照)チャンネル(典型的に曲がりくねったチャンネル)に貯蔵すること、底部70b(図5b参照)に2つのW字型および1つのU字型貯留所に抽出液を貯蔵することが有利であると見出した。
【0078】
すべての貯蔵貯留所は、略図の注射器75a〜dの針の位置で図5に示される小さな(0.5mm×0.5mm)側面チャンネルによって単純に充填されてもよい。充填後、側面チャンネルは液状の膠またはテープのようないかなる適当な手段を用いて密封できる。
【0079】
有利なことに、比較的に単純な取扱システムを可能とするため、単一(注射器)ポンプを全溶液の駆動に用いるのが好ましい。
【0080】
本発明の好適な実施形態によるチップ配列は、図6に示される。
【0081】
4つの液体貯留所(溶解緩衝液、イソプロパノール、エタノールおよび溶離緩衝液)は順次、従来の注射器(針の直径0.4mm)を用いて充填され、充填チャンネルは密封される。
【0082】
第一に、細胞懸濁液が注射器ポンプによってろ過ユニットに適用される。粒子状懸濁液のほかに、注射器に約200μL〜300μLの空気が入れられ、チップ上液体(用途によるが、他の不混和性液体が用いられてよいことが理解される)の駆動に用いられる。
【0083】
第二に、空気が溶解緩衝液貯留所にポンプで送られ、移動した緩衝液がフィルターに保たれて細胞に適用される。細胞溶解がフィルターを通して押されビーズ室に方向付けられる。追加的なろ過工程により、ビーズ室で凝集する確率が減少される。
【0084】
第三に、駆動ポンプ(注射器)が、ろ過室および溶解緩衝液貯留所への接続が閉鎖されながら抽出液貯留所に接続される。抽出液体は空気栓で分離された単一の貯留所に貯蔵される。貯留所の一方の側に圧力がかけられると、液体は平行に移動し、ビーズ室を通って順次導かれる。
【0085】
バルブ操作を含む作業手順は、図6も参照して以下に要約される。リストにないバルブは閉鎖状態に、一方リストに記載されたバルブは対応する作業のために開放される。
ろ過
バルブ5、7: 細胞懸濁液入り、濾液−>左出口
溶解
バルブ2、3、7: 空気入り、移動した流体−>左出口
バルブ2、3、6: 空気入り、溶解物→ビーズ包み、右出口
精製
バルブ1、4、6: 空気入り、イソプロパノール−>ビーズ包み
空気入り、エタノール−>ビーズ包み
空気入り、溶離緩衝液−>ビーズ包み
【0086】
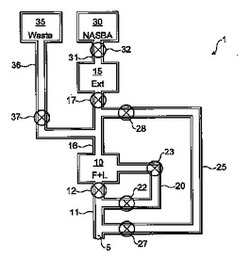
図7を参照すると、本発明の他の好適な実施形態が示されている。上記説明は、この実施形態にもあてはまる。システム1は液状試料用入口5、溶解/ろ過ユニット10、核酸抽出ユニット15、溶解流体を含むチャンネル20、溶離剤、エタノール、イソプロパノールを含むチャンネル25、核酸配列増殖および検出ユニット30および廃棄ユニット35を含む。
【0087】
チャンネル11は試料入口5と接続し、溶解/ろ過ユニット10に導く。バルブ12はそれらの間の流体の流れをコントロールするために設けられる。
【0088】
チャンネル16は溶解/ろ過ユニット10と接続し、核酸抽出ユニット15に導く。バルブ17はそれらの間の流体の流れをコントロールするために設けられる。
【0089】
溶解流体を含むチャンネル20は溶解/ろ過ユニット10および試料入口5と接続する。バルブ22および23は流体の流れをコントロールするために設けられる。
【0090】
溶離剤、エタノール、イソプロパノールを含むチャンネル25は核酸抽出ユニット15および試料入口5と接続する。バルブ27および28は流体の流れをコントロールするために設けられる。
【0091】
チャンネル31は核酸抽出ユニット15に接続し、核酸配列増殖および検出ユニット30に導く。バルブ32はその間の流体の流れをコントロールするために設けられる。
【0092】
チャンネル36は溶解/ろ過ユニット10に接続し、廃棄ユニット35に導く。バルブ37はその間の流体の流れをコントロールするために設けられる。
【0093】
チャンネル25は溶離剤、エタノールおよびイソプロパノールのような洗浄溶媒を含む。溶離剤および洗浄溶媒は、お互いに液を分離するための空気間隙を用いてチャンネルに予め入れられている。
【0094】
適当な溶解緩衝液の1つの例は、100mMのTris/HCl、8MのGuSCN(pH6.4)である。
【0095】
適当な溶離剤の1つの例は、10mMのTris/HCl、1mMのEDTA Na2(pH8)+1mMのYOYO−1である。
【0096】
核酸の定量は、蛍光顕微鏡および画素強度分析プログラム(Lispix)を用いて達成される。
【0097】
核酸抽出ユニットは、また、シリカビーズ、例えばサイズ15〜30μmのシリカビーズ0.3mgを含む。白金電極は、核酸を溶離する負に帯電した動電学的収集のための充てん層のすぐ下に備えられる。(図示せず)
【0098】
作業手順は以下に要約される。
【0099】
ろ過
バルブ12および37を除いてすべてのバルブが閉められる。液状試料を含む注射器(分析される細胞を含む)が試料入口5に接続され、試料はろ過/溶解ユニット10に圧力で注入される。このように、細胞はユニット10に保持され、液状試料の残った部分はそれから廃棄ユニット35を通過させる。
【0100】
溶解
バルブ22、23および37を除いてすべてのバルブが閉められる。第一工程(任意選択)において、注射器内に含まれる空気が試料入口5に注入される。これにより、チャンネル20に含まれる溶解物をろ過/溶解ユニット10に向けて動かす。しかしながら、溶解流体がろ過/溶解ユニット10に入る前に、溶解流体に先立つ空気、すなわちバルブ23とユニット10との間のチャンネル20の領域の空気によって、ユニット10に残る流体を動かし、廃棄ユニット35を移動させ、流す。次に、第二工程において、バルブ37が閉じられバルブ17が開かれる。注射器内に含まれる空気を試料入口5に注入し続けながら、チャンネル20に含まれる溶解流体が圧力下、ろ過/溶解ユニット10に流れる。その結果、そこに保持された細胞が溶解され、溶解物が核酸抽出ユニット15に流れる。
【0101】
精製/抽出
バルブ27、28および32を除いてすべてのバルブが閉められる。第一工程において、注射器に含まれた空気が試料入口5に注入される。これにより、チャンネル25に含まれる流体(イソプロパノール、空気間隙、エタノール、空気間隙、溶離緩衝液)が核酸抽出ユニット15に向かって流体カラムのように動く。このプロセスはすべてのイソプロパノール(即ち、流体のカラムの最初の部分)が核酸抽出ユニット15を通過した段階で止められる。その後(任意選択のユニット15の内容物の加熱も一緒に)、プロセスは続けられ、イソプロパノールとエタノールとの間の空気間隙がイソプロパノールを移動させる。イソプロパノールが蒸発および/または廃棄される。それからエタノールが圧力下、核酸抽出ユニット15に流れる。このプロセスは、すべてのエタノールがユニット15を通過した段階で再度止められる。その後(任意選択のユニット15の内容物の加熱も一緒に)、プロセスは続けられ、エタノールと溶離緩衝液との間の空気間隙がエタノールを移動させる。エタノールが蒸発および/または廃棄される。それから溶離緩衝液が圧力下、核酸抽出ユニット15に流れ、シリカビーズの表面から離れた核酸を溶離する。そして溶離した核酸が核酸配列増殖および検出ユニット30に通過する。
【0102】
本発明は、核酸(NA)抽出および分析のための装置および方法を提供する。人間の細胞溶解物のような生物学的試料からの抽出は、最初の15mLの溶離液中の核酸を収集して成功に至っている。
【0103】
リアルタイム核酸配列に基づく増殖(NASBA)は、シクロオレフィン共重合体樹脂チップ中で一体化した供給チャンネルおよび並列反応室で測定された。人工の人乳頭腫ウイルス(HPV)16配列、統合HPV16を有するSiHa細胞株およびHPV16に陽性と検査された患者試料の検出が成功裏に実施された。チップに適用された試料材料は11の並列反応室に分けられ、そこで80nLの検出体積において同時に検出された。
【0104】
ここで本発明を以下の制限のない実施例を参照して、さらに詳細に説明する。
【実施例】
【0105】
試料材料
頚癌細胞株SiHa(扁平上皮細胞癌)は米国タイプ菌株収集(American Type Culture Collection, USA)から入手した。SiHa細胞株はダルベッコ改良イーグル培地(DMEM)に、10%のウシ胎仔血清(FBS)、2mMのL−グルタミンおよび25μg/mlゲンタマイシンで補完して保持した。その細胞が5%のCO2雰囲気下、37℃で培養された。細胞はトリプシン処理され、Burkers室で計数され、NASBA溶解緩衝液(bioMerieux,オランダ、5Mグアニジンチオシアン酸塩含有)に溶解した。核酸は分離され、Boom法によりNucliSense抽出器で抽出した(Boom, R., Sol. J. A., Salimans, M. M. M., Jansen, C. L., Wertheimvandillen P. M. E., Vandernoordaa, J. J. ; Clinical Microbiol., 1990, 28, (3),495-503頁)。SiHa細胞は細胞当たり統合HPV16DNAの1〜2の複製を含む(Syrjanen, S., Partanen, P., Mantyjarvi, R., and Syrjanen, K. ; J Virol Methods, 1988, 19, 225-238頁)。SiHa細胞株抽出物の10倍連続希釈法が試験された。なお、HPV−Prooferキット(NorChip A, Norway)から得た人工HPVタイプ16配列を標的として使用した。希釈シリーズはシステムの検出限界を定義するために試験された。
【0106】
NASBA
PreTectRHPV−Prooferキットの試薬は製造元(NorChip A, Norway)の仕様に従い混合した。プライマーおよびプローブのすべてがそのキットで得られた。なお、BSAは動的コーティングとして0.05%の最終濃度にいたるまで混合物に添加した。キットからの試薬溶液(26μL)および試料材料(SiHa細胞株およびキットからのHPVタイプ16配列試料)の13μLを混合して2分で65℃まで加熱した。続いて、その混合物を2分で41℃まで冷却し、酵素(13μL)を添加した。各反応チャンネルの1つの駆動室を切って開き、混合物を高分子ミクロチップに添加した。チップ中の各反応チャンネルは毛細管力により混合物で充満した。残った混合物は供給チャンネルの末端にある廃棄室に引き入れられた。チップホルダーを光学系に移し、次々とチャンネルを測定した。測定値は30秒ごとに採取した。2×2mm2の領域だけがLEDで照射され、この領域は80nLの検出領域に相当する。HPV16配列およびSiHa細胞株の両方の10倍連続希釈法がミクロチップ検出との比較のため従来の装置で試験された。すべての実験は2.5時間で実施した。
【0107】
計算
すべての結果は、PreTectデータ分析機(PDA)(NorChip AS)を用いて計算された。ミクロチップは12反応室に合わせて設計されているが、測定値の系統的誤差の理由から各サイドの2つの反応チャンネルを計算から削除した。計算は多重回帰計算法に基づいた。比率は反応終了時の蛍光発光レベルと反応開始時の蛍光発光レベルとの差として定義された。比率が1.7以上の試料すべてを陽性と定義した。時間―陽性化、すなわち曲線が対数的に増加するように開始する出発点をセットした。平均勾配は出発点から蛍光発光レベルで10%増加時の値および蛍光発光レベルで80%増加時の値を用いて算出した。高分子ミクロチップの検出限界は10の反応チャンネルのすべてが陽性になる最後の濃度になるようにセットした。
【0108】
結果
リアルタイムNASBAを活用してHPV16ウイルスの同定が80nLの検出体積で高分子ミクロチップを用いて成功裏に実施された。図8および9はそれぞれSiHa細胞株、HPV16オリゴ配列に関し、実施した実験からの結果を示す。両図は明瞭に陽性であり、正規の20μL体積で実施した試料および従来の結果(図示せず)と同じ曲率のグラフを示す。表1は高分子ミクロチップを用いて得られた人工HPV16配列およびSiHa細胞株の連続希釈法の結果を示す。増殖反応を特徴づけるため、いくつかの異なる以下の因子が評価された。蛍光発光比率、時間−陽性化、曲線の直線部の勾配、陽性増殖数および試験した高分子ミクロチップの数である。表の値は試験した陽性試料の平均値および陽性試料の標準偏差を示す。ミクロチップで試験したHPV16配列およびSiHa細胞株の両方に対して比率はおおよそ一定であった。同じ試料材料の従来の試験(表2)との比較で、比率はより低濃度で減少した。一方、他の因子はミクロチップおよび従来の方法の両方で非常によく対応する。時間−陽性化はより低濃度で増加した。平均勾配はより低濃度とともに減少した。100aMから100nMに10倍希釈法が人工HPV16配列で試験され、一方、SiHa細胞株では0.02細胞数/μLから2000細胞数/μLに渡り試験された。特注の光学検出システムは、人工HPV16配列およびSiHa細胞株の検出限界はそれぞれ1pMおよび20細胞数/μLであった。これらは従来のBiotekリーダーで得られた検出限界と同じであった。両方のシステムでより低い濃度を検出できたが、結果は一貫性がなかった。また、結果は入力ターゲットの試料濃度が減少するとき、標準偏差が増加したことを示す。HPV16オリゴ配列およびSiHa細胞株に対するNASBAの比較から、出発時点と増殖反応終了時での蛍光発光レベルの比率を除き、すべての因子は従来の方法と同様、ミクロシステムに対して同じ傾向が示された。バックグラウンド雑音は、巨視的蛍光発光法よりも小さな反応室ではより顕著になる。バックグラウンド蛍光発光の一部は、高分子ミクロチップの裏側に薄い金層を設けることにより検定から取り除いた。COC自体は自己蛍光発光であり、常にバックグラウンド蛍光発光している。雑音検出に寄与するものは完全でない高分子表面による光散乱である。時間−陽性化は、長時間用いた基板が基板と相互作用するのが見出されたので予想通りより低濃度で減少した。実験において人工HPV16に対して特に、最高濃度で時間−陽性化が増加する。非常に高試料濃度も反応を阻害するかも知れず、それゆえ理想的な反応混合物の場合よりも長時間を要する。同様に、平均勾配が減少する。より少量の標的が開始にあたり反応混合物に存在するとき、単位複製配列はより少なく、より高い濃度の場合より勾配は低くなる。NASBA反応の検出限界は対象の標的、プライマーおよびプローブの設計に依存する。これらの実験で、両検出システムに対し、1pMおよび20細胞数/μLに至る濃度を検出できた。従って、本実施例はリアルタイムNASBAを活用して高分子ミクロチップで人工HPV16配列に対して1pM濃度まで検出することが可能であることを示す。細胞株に対しては、検出限界は20細胞数/μLであった。これらの検出限界は従来のBiotekリーダーで実施された実験で得られたものと同じである。
【0109】
【表1】

【0110】
【表2】

【図面の簡単な説明】
【0111】
【図1】本発明で使用する使い捨て高分子チップデバイスに平膜の一体化に用いるサンドイッチ配置の模式的な説明図である。
【図2】本発明によるシステムの使用のためのバルブ設計の模式的な説明図である。
【図3a−3d】本発明によるシステムの使用のためのバルブ設計の模式的な説明図である。
【図4】本発明によるビーズ室の1つの可能な配置の模式的な説明図である。
【図5】本発明によるシステムの模式的な説明図であり、図5aは溶解緩衝液の充填、および図5bは抽出流体の充填を示す。
【図6】本発明の好適な実施形態によるチップ配置の模式的な説明図である。
【図7】本発明の他の好適な実施形態によるシステム設計の模式的な説明図である。
【図8】実施例に関連するグラフである。
【図9】実施例に関連するグラフである。
【技術分野】
【0001】
本発明は核酸抽出、特に核酸抽出と濃縮を組み合わせて実施するための一体型ラボオンチップ(lab-on-a-chip)診断システムに関する。このシステムは、細胞を含む液状試料に関して核酸配列増殖および検出方法を実施するのに用いることができる。
【背景技術】
【0002】
未熟練の使用者が、過度の誤りなく複雑な検定手順を実施できる生物学上の分子を検出する単純化された検定システムの開発に大きな関心がある。さらに、液体試薬の最小の取扱で、検定手順が使用者の最小の介入で実施されるように自動化され、好ましくはポイントオブケア診断の簡便なシステムも提供する小型化された包含検定システムの開発に非常に大きな関心がある。このことは医療分野、特に診断に関し、医師の外科、クリニック、獣医外科または患者の家庭もしくは現場でさえ、効率的かつ安全に操作できる生物学上の検定システムに対するニーズが増加している。
【0003】
微細加工されたラボオンチップ装置は、使用者の最小の試薬取扱が要求され、また、少ない試料体積の使用が可能、高価な試薬を必要とする生物学の反応にとって有意な利点を可能とする包含された生物学上の反応を実施する魅力的な選択肢である。
【0004】
精製と前濃縮とを達成するため、分析化学者は一般的にある種の抽出手順を使用してきた。これらの方法は試料母体から対象の検体を取出すこと、または別の方法として、試料母体から他のすべての種を取り除いて対象の検体を残すことを伴う。抽出プロセスは種を1つの液相から他の液相に移転する、または種を1つの液相から固体表面に捕捉することを伴う。前者の場合、溶媒が種を含む相から積極的に除去されなければ、前濃縮は一般的に達成されない。しかし、後者の場合、以下の場合は前濃縮が達成されるだろう。即ち、(a)ある時点で表面に接触して溶液内に存在する以上の分子を結合するのに十分に大きな結合領域が入手可能な場合、(b)種が極少量の溶離剤を用いて固相から効率的に取出せる場合である。前濃縮は核酸試料前処理手順の重要な局面であるので固相抽出が採用されてきた。カオトロピック剤の存在下、DNAのシリカ粒子への結合を伴う公知の核酸抽出方法がある。(Boomら、J.Clin.Microbiol.1990,28,495-503頁参照)本発明はDNAの固相抽出方法をミクロ流体装置に一体化することを含む。
【0005】
本発明において、核酸抽出と濃縮は組み合わせることができる。
【0006】
本明細書で用いる微細加工された装置またはシステムなる用語は、排他的ではなく典型的には、半導体超小型電子技術装置のバッチ生産で、および近年の半導体微小機械装置の生産で用いられるプロセスを用いて製作されるいかなる装置を意味する。そのような微細加工技術には、例えば、エピタキシャル成長(例、気相、液相、分子ビーム、金属有機化学的気相蒸着)、リソグラフィー(例、光ビーム、電子ビーム、X線ビーム、イオンビーム)、エッチング(例、化学的、気相、プラズマ)、電子蒸着、スパッタリング、拡散不純物添加、イオン注入が挙げられる。ガラスのような非晶質材料が使用できるかもしれないが、微細加工装置は典型的にシリコンまたは砒化ガリウムのような結晶性半導体基板上に形成され、従来の集積回路製作技術の使用により電子回路が集積される利点がある。微細加工部品をガラス板または補助的な微細加工素子のような1つ以上の他の素子との組み合わせは頻繁に用いられ、本明細書で用いる微細加工の用語の範囲に入ることを意図している。また、例えば結晶性半導体基板から作られる高分子の複製も微細加工の用語の範囲に入ることを意図している。
【0007】
DNAおよび/またはRNAのバクテリア細胞およびウイルス粒子からの分離および精製は、例えば、診断学、環境監査、法医学および分子生物学上の研究のような多くの分野において重要なステップである。
【0008】
微細加工は、DNA配列分析および検出のような非常に少ない試料体積が望まれる生物学的プロセスを実施するための装置を製造する魅力的な組み立て方法である。
【0009】
そのような装置の1つ、ポリメラーゼ連鎖反応(PCR)を実施し、続く検出工程が米国特許第5,674,742号で開示されている。ラム波ポンプは、PCRプロセスを実施するのに必要な限り、DNAプライマー、ポリメラーゼ試薬およびヌクレオチド試薬を3つの別個の貯蔵室から1つの単一反応室に輸送するために用いられ、反応室の温度を必要に応じてサイクルさせる。
【0010】
化学反応工程を実施し、続いて電気泳動分離工程を実施する他の微細加工装置が分析化学(Analytical Chemistry1994,66,4127-4132頁)に開示されている。ガラス板で覆われたシリコン基板のエッチングされた構造によって、反応室、および緩衝液、検体、試薬および検体廃棄貯蔵室、その他廃棄貯蔵室に連結された電気泳動カラムへの連結が提供される。
【0011】
核酸配列系増幅(NASBA)はプライマー依存技術であり、ある温度で単一混合中の核酸の連続増殖(等温核酸増殖方法)用に用いることができ、上述した最初のRNA転写法に基づく増殖方法の1つであった。通常、NASBAは核酸増殖用に単純で迅速なPCR代替法を提供し、90分で10億倍のRNAの増殖ができる。PCR技術のような他の増殖システムに関して、RNA検体を均一に等温的に増殖するNASBAの能力によりその応用範囲を、ウイルス診断から遺伝子発現および細胞生存のような生物学的活性の示唆に広げられる。NASBA技術は例えば、ネイチャー(Nature350巻、91および92頁)で議論されている。NASBAでの核酸増殖はプライマー対と共にAMV逆転写酵素、Ranase HおよびT7 RNA ポリメラーゼの協奏的酵素活性により達成され、その結果、混成法(hybridization)による検出用に容易に使用できる主として1本鎖RNAが蓄積される。内部RNA標準をNASBAに適用することにより、定量化を通じて6つの増殖反応が必要であるが、4対数の動的範囲を有する定量的な核酸検出方法となる。この方法は異なる量に添加された複数の識別可能な内部RNA標準および電気化学発光(ECL)検出技術によって劇的に改良される。この1管(one-tube)定量(Q)NASBAでは、定量化を通して増殖プロセスの1つの工程のみが必要であり、核酸の実際の分離前に内部標準を溶解緩衝液中の臨床試料に内部標準の添加ができる。この方法は核酸分離効率が定量化の結果に影響しない利点を有し、臨床試料の分離後、内部標準が野生型核酸と混合される方法と対照的である。定量的NASBAは、核酸研究(Nucleic Acid Research (1998)26巻、2150-2155頁)で議論されている。しかしながら、次のNASBA製品検出は未だに労働集約的な手順であり、通常、酵素ビーズに基づく検出で、電気化学発光検出(ECL)または蛍光相関分光分析を伴う。しかしながら、これらの方法論は異質、即ち、試料取扱を必要とするまたは現在コストパフォーマンスがなく高生産性途用に相対的にほとんど使用されないロボット利用の装置を必要とする。製品検出が標的特有の信号の発生によって標的増殖と同時である同質の手順は大規模スクリーニングおよび完全自動化が容易だろう。標的との混成にのみ蛍光発光するプローブ(分子標識)に基づいて新規の核酸検出技術が最近導入されている。
【0012】
流体工学は例えば、管内の液体の流れの科学である。微細加工装置にとって、1つ以上のミクロまたはナノサイズの反応室を通って流体の流れは注射器、回転ポンプのようなポンプの使用、または予め課した真空もしくは装置外の加圧源の使用で達成されるのが典型的である。別の方法として、マイクロポンプまたは真空室、またはラム波ポンプ素子が装置自体の1部として備えられる。ポンプを含む流れコントロール素子、バルブおよび予め課した真空もしくは加圧室を、反応室を通る流体の流れをコントロールするのに用いてもよい。システム内の流体の輸送の他の機構は電気浸透圧流を含む。
【0013】
国際公開第WO02/22265号は、微細加工反応室システムに関し、NASBAを実施する方法に使用できる。国際出願第PCT/GB02/005945号は、微細加工反応室システムおよび流体輸送の方法に関している。そのシステムもNASBAを実施する方法に使用できる。国際出願第PCT/GB03/004768号は、核酸切断のためのミクロ流体装置に関している。その装置はNASBAを実施する微細加工反応室システムに、または関連して用いることができる。
【特許文献1】米国特許第5,674,742号
【特許文献2】国際公開第WO02/22265号
【特許文献3】国際出願第PCT/GB02/005945号
【特許文献4】国際出願第PCT/GB03/004768号
【非特許文献1】BoomらのJ.Clin.Microbiol.1990,28,495-503頁
【非特許文献2】分析化学(Analytical Chemistry)1994,66,4127-4132頁
【非特許文献3】ネイチャー(Nature)350巻、91および92頁)
【非特許文献4】核酸研究(Nucleic Acid Research)1998,26巻、2150-2155頁
【発明の開示】
【0014】
本発明は、細胞および/または粒子を含む液状試料に関する試料調製方法を実施するためのシステムであって、
(a)液状試料の入口、
(b)液状試料に含まれる細胞および/または粒子を溶解するための溶解ユニット、
(c)液状試料に含まれる細胞および/または粒子から核酸を抽出するための核酸抽出ユニット、
(d)溶解流体を収納する貯留所、
(e)核酸抽出ユニットで集められる核酸を取り出すための溶離剤を収納する貯留所を含み、
試料入口が溶解ユニットと流体連通接続されて、それらの間の流体の流れをコントロールする任意バルブが在り、
溶解ユニットが核酸抽出ユニットと流体連通接続されて、それらの間の流体の流れをコントロールする任意バルブが在り、
溶解流体を収納する貯留所が溶解ユニットと流体連通接続されて、それらの間の流体の流れをコントロールする任意バルブが在り、および
溶離剤を収納する貯留所が核酸抽出ユニットと流体連通接続されて、それらの間の流体の流れをコントロールする任意バルブが在る、ことを特徴とするシステムを提供する。
【0015】
そのシステムは日常業務の診断用にミリリットルの試料体積で使用できる。そのシステムは予め入れられている一定の試薬を基にする。
【0016】
本発明において、核酸抽出と濃縮とを組み合わせることができる。従って、本発明により、試料調製方法を実施するための一体型ラボオンチップ診断システムが提供される。そのシステムはNASBAを実施するために微細加工反応室にまたは関連して使用できる。
【0017】
システムの少なくともいくつかの部品は微細加工されるのが好ましい。溶解ユニット、核酸抽出ユニット、溶解流体貯留所および溶離剤貯留所が微細加工され、一体化すなわち共通の基板上に形成されるのが好ましい。
【0018】
溶解流体を収納する貯留所は好ましくは入口と流体連通接続され、それらの間の流体の流れをコントロールする任意バルブが在る。
【0019】
溶離剤を収納する貯留所が好ましくは入口と流体連通接続されて、それらの間の流体の流れをコントロールする任意バルブが在る。
【0020】
本発明によるシステムは典型的にさらに(g)核酸反応ユニットを含み、核酸抽出ユニットが核酸反応ユニットと流体連通接続されて、それらの間の流体の流れをコントロールする任意バルブが在る。好ましくは核酸反応ユニットが微細加工され、好ましくは他の部品と一体化されている。いかなる従来の反応は反応ユニットで実施される。好ましくは、反応は特定の対象配列および/または定量分析の検出が可能となるだろう。核酸反応は典型的に核酸配列増殖および検出ユニットを含み、核酸配列増殖反応によって特定の配列の検出が可能である。例えば、PCRおよびNASBAのような等温増殖技術が挙げられる。分子標識を用いたリアルタイムNASBAが最も好まし。したがって、好ましい1つの局面として、本発明は、細胞および/または粒子を含む液状試料に関し、試料作製、核酸配列増殖および検出プロセスのための一体型ラボオンチップ診断システム、より好ましくはリアルタイムNASBAを提供する。国際公開第WO02/22265号には、NASBAを実施するための微細加工反応室システムが記載されている。
【0021】
本発明によるシステムは好ましくは、例えば感染上皮細胞やmRNAの溶解および濃縮、リアルタイム増殖および検出などの濃縮を含む。
【0022】
システムは例えば、頚癌のスクリーニングに用いてもよい。
【0023】
本発明によるシステムは、典型的にさらに(h)廃棄ユニットを含み、廃棄ユニットが溶解ユニットと流体連通接続されて、それらの間の流体の流れをコントロールする任意バルブが在る。好ましくは廃棄ユニットが微細加工され、好ましくは他の部品と一体化されている。
【0024】
システムは、典型的にさらに(i)洗浄溶媒を収納する貯留所を含み、貯留所が核酸抽出ユニットと流体連通接続されて、それらの間の流体の流れをコントロールする任意バルブが在る。好ましくは、洗浄溶媒を収納する貯留所が微細加工され、好ましくは他の部品と一体化されている。洗浄溶媒はいかなる適当な溶媒から選択できるが、容易に蒸発できる溶媒、例えばエタノールが好ましい。
【0025】
システムは、典型的にさらに(j)洗浄溶媒を収納する貯留所を含み、貯留所が核酸抽出ユニットと流体連通接続されて、それらの間の流体の流れをコントロールする任意バルブが在る。好ましくは、洗浄溶媒を収納する貯留所が微細加工され、好ましくは他の部品と一体化されている。洗浄溶媒はいかなる適当な溶媒から選択できるが、容易に蒸発できる溶媒、例えばイソプロパノールが好ましい。
【0026】
溶離剤を収納する貯留所が第一洗浄溶媒(例、エタノール)および/または第二洗浄溶媒(例、イソプロパノール)を収納する貯留所と流体連通接続されているのが有利である。
【0027】
より有利には、溶離剤、第一洗浄溶媒(例、エタノール)および/または第二洗浄溶媒(例、イソプロパノール)が共通の貯留所に収納される。このことは溶離剤、第一洗浄溶媒および/または第二洗浄溶媒が共通の貯留所で流体、例えば空気で、互いに分離することで達成できる。しかしながら、不混和性または少なくとも溶離剤、第一洗浄溶媒および/または第二洗浄溶媒と実質的に不混和性である限り、他の分離流体(液体または気体)を用いてもよい。
【0028】
好適な実施形態において、溶離剤、エタノールおよび/またはイソプロパノールが、入口および溶解ユニットと流体連通接続である導管またはチャンネルに収納される。溶離剤、エタノールおよび/またはイソプロパノールが、例えば空気の隙間のような流体の隙間で分離される。
【0029】
システムは、典型的にさらに(k)液状試料および/または空気を入口に導入するための手段を含む。前記手段は、好ましくはポンプまたは注射器を含む。別の方法として、そのような手段は入口取付け口と流体連通接続にある1つ以上の容積可変室を含んでもよく、容積可変室の容積が、液状試料の入口へ入るおよび/または出る流れに影響および/または制限する。容積可変室は典型的に、基礎になる基板の中空の窪みを覆う柔軟な膜を含む。国際出願第PCT/GB02/005945号には、好適な流体輸送システムが記載されている。
【0030】
このシステムは単一のポンプシステムで駆動されるのが有利である。
【0031】
溶解ユニットはいかなる形状および構成でよいが、チャンネルまたは室の形体は、典型的であるだろう。溶解ユニットは好ましくは液状試料に含まれる真核細胞、原核細胞および粒子の溶解用である。
【0032】
必要に応じて、システムはさらにろ過ユニットを含むことができ、そのユニットは溶解ユニットと流体連通接続されている。ろ過ユニットは例えばクロスフローフィルターまたは中空フィルターを含んでもよい。別の方法として、溶解ユニット自体がさらに液状試料をろ過する手段を含んでもよい。前記手段は例えばクロスフローフィルターまたは中空フィルターを含んでもよく、溶解ユニットと一体化されていてもよい。
【0033】
必要に応じて、システムはさらに、切断ユニットを含むことができ、溶解ユニットと流体連通接続されている。別の方法として、溶解ユニット自体が液状試料を切断する手段を含んでもよい。DNAまたはRNAの無作為切断は試料の前処理工程としてしばしば必要である。切断は制限酵素を用いて生物学的に、または分子を破壊するため物理的な力を加えることにより達成できる(参照:例えば、P. N. Hengen, Trends in Biochem. Sci., 22巻、273-274頁、1997および、P.F.Davison, Proc. Nat. Acad. Sci. USA, 45巻、1560-1568頁、1959)。せん断によるDNA切断は通常、試料を短い制限領域を通過させることを伴う。好適な実施形態において、DNAおよび/またはRNAは狭いオリフィスに送り込まれ、力学的な力のもと、分子の急速な伸張により切断する。圧力駆動の流れがせん断力を生じ、それが核酸の切断に至る。国際特許出願公開第PCT/GB03/004768号には、核酸切断のためのミクロ流体装置が記載されている。
【0034】
溶解ユニット自体はさらに液状試料をろ過する手段および液状試料を切断する手段を含むことができる。
【0035】
システムは、さらに溶解ユニットおよび/または核酸抽出ユニットの内容物を加熱する手段を含む。前記手段は例えば、溶解ユニットおよび/または核酸抽出ユニット中に、または隣接して位置する1つ以上のペルチェ素子を含む。
【0036】
核酸抽出ユニットはいかなる適当な形状および構成でよいが、チャンネルまたは室の形体は典型的であるだろう。核酸抽出ユニットは好ましくは液状試料に含まれる真核細胞、原核細胞および粒子の抽出用である。
【0037】
核酸抽出ユニットは、少なくとも1部がシリカビーズまたは粒子で満たされてもよい。溶離した核酸を収集および/または前濃縮するため、シリカビーズまたは粒子に隣接する1組以上の電極が提供される。例えば、その1組以上の電極はプラチナ電極を含む。それゆえ、手段は電極間に電位差を与えることで提供される。抽出セルは好ましくは、ポリジメチルシロキサン(PDMS)からの形成またはそれを含む。そのユニットは典型的に基板および覆う蓋を含み、抽出ユニットは基板の表面および蓋の隣接する表面の窪みによって定義される。基板は好ましくはシリコン・ポリジメチルシロキサン(PDMS)から形成される。核酸はカオトロピック剤の下、シリカ表面に結合する。
【0038】
電極(例、プラチナ電極)の一体化はチップ上に溶離した核酸を逆に収集および前濃縮をするために有利に使用できる。このように、本発明において核酸抽出と濃縮の組み合わせを達成することができる。
【0039】
好適な実施形態において、核酸抽出ユニットはシリカビーズ搭載ポリジメチルシロキサン(PDMS)チャンネルを含む。
【0040】
そのシステムまたは少なくともその原版は、典型的に半導体材料から形成または含有するが、誘電体(例、ガラス、溶融シリカ、石英、高分子材料およびセラミックス材料)および/または金属材料も使用できる。半導体材料の例として、1つ以上のIV族元素(即ち
シリコン、ゲルマニウム)、III−V族化合物(例、砒化ガリウム、リン化ガリウム、アンチモン化ガリウム、リン化インジウム、砒化インジウム、砒化アルミニウムおよびアンチモン化アルミニウム)、II−VI化合物(例、硫化カドミウム、セレン化カドミウム、硫化亜鉛、セレン化亜鉛)、およびIV−VI化合物(例、硫化鉛、セレン化鉛、テルル化鉛、テルル化錫)が挙げられる。シリコンおよび砒化ガリウムが好ましい半導体材料である。システムは半導体超小型電子装置のバッチ生産に伝統的に関連するプロセス、および最近の半導体微小機械のバッチ生産を用いて製作される。このような微細加工技術として例えば、エピタキシャル成長(例、気相、液相、分子ビーム、金属有機化学的気相蒸着)、リソグラフィー(例、光ビーム、電子ビーム、X線ビーム、イオンビーム)、エッチング(例、化学的、気相、プラズマ)、電子蒸着、スパッタリング、拡散不純物添加、イオン注入およびミクロ機械加工が挙げられる。ガラスおよび高分子材料のような非晶質材料も使用できる。
【0041】
高分子材料の例として、PMMA(ポリメチルメタクリレート)、COC(シクロオレフィン共重合体)、ポリエチレン、ポリプロピレン、PL(ポリラクチド)、PBT(ポリブチレンテレフタレート)およびPSU(ポリスルホン)、これら2つ以上の混合物が挙げられる。好ましい高分子はPDMSまたはCOCである。
【0042】
デバイス/システムは典型的に一体化して形成される。デバイス/システムは共通の、例えば本明細書で記載したような半導体材料などの共通の基板材料上に微細加工されるが、例えば、ガラスまたはセラミックス材料のような誘電体基板材料も使用できる。しかしながら、共通の基板材料は好ましくは樹脂または高分子材料であり、適当な例は上述されている。システムは好ましくは、例えばシリコン原版の複製によって形成される。
【0043】
小型化構造としてシリコン−ガラスの代わりに樹脂を使用する利点は、少なくとも生物学的な用途で多くある。1つの最大の恩恵はミクロ射出成形、熱エンボスおよび注型のような方法を用いた量産時のコスト削減である。複雑な構造に対して100倍以上の係数もありえないことではない。多層金型挿入物の構造複製の可能性によりデザインの自由度に大きな柔軟性が得られる。ミクロとマクロの世界の接続は、通常使用する標準パーツを任意に組み合わせられるので多くの場合、より容易である。異なるアプローチが例えば微細構造支援のUS溶接、レーザー溶接、接着および積層のような組立技術のために用いられる。有益な他の特徴は表面改質である。生物学的分析に対応する小型化構造にとって、表面に生体適合性があることが重要である。プラズマ処理およびプラズマ重合を活用して柔軟で多様な品揃えがコーティングに適合できる。酸および塩基に対する薬品耐性は容易に食刻されるシリコン基板よりも樹脂のほうがずっと良好である。バイオテクノロジー分野で多くの検出方法は光学測定を伴う。それゆえ、樹脂の透明性は透明でないシリコンと比較して大きな特徴である。現在、高分子ミクロ流体技術はラボオンチップ市場で確立され成長している。
【0044】
本明細書で説明した微細(ミクロ)加工システムはナノ加工デバイスをも包含する。
【0045】
シリコンまたは半導体原版に対し、例えばエッチングまたはミクロ機械加工によって、1つ以上の容積可変室、ミクロ流体チャンネル、反応室および正確な微細寸法を有するシリコン基板内の流体接続を定義することが可能である。その結果、樹脂複製はシリコン原版から作ることができる。このように、エッチングされたまたは機械加工された樹脂基板はいかなる適当な手段(例えば接着剤または加熱)で蓋に結合できる。
【0046】
本システムで使用する任意のバルブは、いかなる便利な形体でよい。例えば、バルブにより2つのユニットが、導管またはチャンネルに沿って流れを単純に規制する。ピン装置の作用により導管またはチャンネル内の孔で上げ下げできるピストンのような部材が備えられる。
【0047】
本システムの使用は、実施例に示す以下の可能な工程を伴う。
選択肢1
(i)試料採取および溶解
(ii)mRNA抽出(手動または自動手順)
(iii)リアルタイム増殖および検出(好ましくは多重)
選択肢2
(iv)切断ユニットが試料溶解と試料作製の両方を含むことができる。
(v)リアルタイム増殖(NASBA)および検出(好ましくは多重)
【0048】
本発明は、また本明細書で記載した一体型ラボオンチップ診断システムの作製のための方法を提供するが、その方法は、
A.入口の窪み、溶解ユニット窪み、核酸抽出ユニット窪み、溶解流体貯留所窪みおよび溶離剤貯留所窪みを表面に有する基板を備えること、
B.蓋を備えること、および
C.(a)入口、(b)溶解ユニット、(c)核酸抽出ユニット、(d)溶解流体貯留所、(e)溶離剤貯留所、を創るように基板に蓋を取り付け、各々は基板の前記表面および蓋の隣接する表面にそれぞれの窪みにより定義される方法である。
【0049】
本明細書で用いる用語の窪みは例えば、溝、スロット、孔、トレンチおよびチャンネル、これらの1部を含む多様な特徴を網羅する意図もある。
【0050】
方法はさらに基板に蓋を取り付ける前または後で溶解流体を溶解流体貯留所に導入する工程を含む。
【0051】
方法はさらに基板に蓋を取り付ける前または後で溶離剤を溶離剤貯留所に導入する工程を含む。
【0052】
方法はさらに基板に蓋を取り付ける前または後でエタノールを溶離剤貯留所に導入する工程を含む。
【0053】
方法はさらに基板に蓋を取り付ける前または後でイソプロパノールを溶離剤貯留所に導入する工程を含む。
【0054】
任意の不混和性流体(液体または気体)が使用されるが、方法は溶離剤および/または、エタノールおよび/またはイソプロパノールが流体、好ましくは空気で互いに分離される。
【0055】
好適な実施形態において方法は、
基板に蓋を取り付けた後で溶離剤を溶離剤貯留所に導入する工程、
第一体積の空気を溶離剤貯留所に導入する工程、
エタノールを溶離剤貯留所に導入し、エタノールを前記第一量の空気で溶離剤から分離される工程、
第二体積の空気を溶離剤貯留所に導入する工程、および
イソプロパノールを溶離剤貯留所に導入し、イソプロパノールを前記第二体積の空気でエタノールから分離する工程を含むものである。
【0056】
基板は例えばシリコンから、覆う蓋は例えばガラスから形成できる。この場合、ガラスの蓋は好ましくはシリコン基板に陽極として結合され、任意選択的に基板表面に形成された酸化シリコン中間体を通して結合される。シリコン内の窪みは活性イオンエッチングを用いて形成されてよい。高分子材料のような他の材料は基板および/または蓋にも用いられてもよい。そのような材料は例えばシリコン複製を用いて製作できる。別の方法として、デバイスは機械加工および放電加工(EDM)によって金型挿入物の構造化により、続いてチップパーツの射出成形、高分子パーツの例えば穴あけ、平削り、絞りなどの機械的な後加工によって製作されてよい。その後、フィルターの挿入、溶媒溶接および流体接続の実装が行われる。
【0057】
高分子材料の例として、PMMA(ポリメチルメタクリレート)、COC(シクロオレフィン共重合体)、ポリエチレン、ポリプロピレン、PL(ポリラクチド)、PBT(ポリブチレンテレフタレート)およびPSU(ポリスルホン)、これら2つ以上の混合物が挙げられるが、COCが好ましい。
【0058】
好ましくは、および特にセル内の内容物の光学的観察が要求される場合、覆う蓋はガラス、パイレックス(登録商標)またはCOCのような光学的に透明な物質または材料で作られる。
【0059】
ガラス板のような1つ以上の他のエレメントまたは補完的な微細加工エレメントを有する微細加工部品の組み合わせは頻繁に用いられ、本明細書で用いる用語の微細加工の範囲にある。
【0060】
基板のベースの一部または全部はコーティングの厚みが典型的に1μmまで、好ましくは0.5μm未満である。コーティングは好ましくは、ポリエチレングリコール(PEG)、ウシ血清アルブミン(BSA),トゥウィーン(tweens)およびデキストランを含む1つ以上のグループから形成される。好ましいデキストランは分子量が9,000〜200,000、特に好ましくは20,000〜100,000、特に25,000〜75,000、例えば35,000〜65,000である。トゥウィーン(即ち、ポリオキシエチレンソルビタン)はシグマ社(Sigma Aldrich Company)から入手可能である。PEGは単一でも、組み合わせてもコーティングとして好ましい。PEGは包括的に純粋なポリエチレングリコール、即ち、式HO−(CH2CH2O)n−Hであり、ここで、nは整数で分子量が典型的に200〜10,000を有するPEGを与え、特に1,000〜5,000のPEGまたは化学的に変性されたPEGであり、1つ以上のポリエチレングリコールオリゴマーが例えばリン酸基または芳香族スペーサーのような同種の2価の基と結合している。特に好ましいのは、FK108(1つのポリエチレングリコール鎖がリン酸塩を介して他と結合)として公知のポリエチレングリコールおよびシグマ社(Sigma Aldrich Company)から製品P2263として販売されているPEGである。セル/室、入口、出口および/またはチャンネルの表面に塗布された上記のコーティングによりシステムを通って流体の流れが向上される。特に、試料がそのような表面に接着または固着するのが少なくなることが見出されている。PEGコーティングが好ましい。
【0061】
シリコンまたは半導体原版に対し、例えばエッチングまたはミクロ機械加工によって、1つ以上の容積可変室、ミクロ流体チャンネル、反応室および正確な微細寸法(深度活性イオンエッチング(DRIE)は好ましい技術)を有するシリコン基板内の流体接続を定義することが可能である。樹脂複製はシリコン原版から作ることができる。このように、エッチングされたまたは機械加工されたミクロ構造の樹脂基板はいかなる適当な手段(例えば接着剤または加熱)で蓋に結合でき、それによって区画された切断セル、入口、出口および連結チャンネルが形成される。
【0062】
デバイスはその上部表面に形成された望ましい微細構造を有する基板を含む。基板は例えばシリコンまたはシリコン原版から複製で形成された樹脂基板でもよい。基板はその上部表面で蓋と結合し、それによって一連のユニット/セル、入口、出口および/またはチャンネルを定義する。蓋は例えば、樹脂またはガラスで形成されてもよい。蓋は好ましくは透明であり流体の観察が可能になる。一般に、デバイスは、好ましくは高アスペクト比構成にシリコンの深度活性イオンエッチング(DRIE)で製作され、続いてガラス蓋と陽極結合される。別の方法として、デバイスは機械加工および放電加工(EDM)による金型挿入物の構造化により、続いてチップパーツの射出成形、高分子パーツの例えば穴あけ、平削り、絞りなどの機械的な後加工によって製作されてもよい。これはその後、フィルターの挿入、溶媒溶接および流体接続の実装が行われる。
【0063】
核酸試料は例えば生物学的流体、乳製品、環境上の流体および/または飲料水であり、またはそれらから誘導されるものでもよい。例として、血液、血清、唾液、尿、ミルク、飲料水、海水および池の水が挙げられる。例えば血液およびミルクのような多くの複雑な生物学的流体に対して、試料中のバクテリア細胞およびウイルス粒子からDNAおよび/またはRNAを分離し精製するまでに、まず試料中の他の粒子からウイルス粒子およびバクテリア細胞を分離する必要があることが理解されるだろう。バクテリア細胞壁またはウイルスたんぱく質皮膜を破壊して核酸を分離する前に、バクテリア細胞およびウイルス粒子を濃縮、即ち、出発材料の体積を減ずるためにさらに試料調製工程を実施する必要があることも理解されるだろう。このことは、出発材料が大量の体積からなるとき、例えば相対的に少ないバクテリア細胞またはウイルス粒子を含む水溶液のとき重要である。このタイプの出発材料は、飲料水中のバクテリア汚染を日常監視するような環境上の試験用途に共通的にみられる。
【0064】
本システムは好ましくは試料体積が10〜100mlに対して、満足するように設計されている。
【0065】
また、本発明において生物学上および/または環境上の試料を分析する装置を提供し、装置は本明細書で記載されるシステムを含む。この装置は使い捨て装置であってもよい。
【0066】
また、本発明において生物学上および/または環境上の試料を分析する検定キットを提供し、キットは本明細書で記載されるシステムおよび本システムで試料に接触するための手段を含む。この検定キットは使い捨てキットであってもよい。
【発明を実施するための最良の形態】
【0067】
本発明は実施例によって、添付する図面を参照して以下に説明される。
【0068】
本発明の実施形態によるチップ設計は好ましくは供給チャンネル、反応室およびミクロ流体駆動システムが一体になっており、シクロオレフィン共重合体(COC)の射出成形により製作される。例えば、12チャンネルチップ用の金型挿入物が高精度機械加工を用いて作製されても良い。検出容積は、典型的に約80nL(400×2000×100ミクロン)である。樹脂チップは好ましくは、最初に酸素プラズマで活性化後、5%のポリエチレングリコール(PEG)溶液(Sigma chemical Co, St. Louis, MO)でコーティングされる。コーティング後、チップは約75ミクロンのCOC膜を、例えばビシクロヘキシルを用いて溶媒溶接で密閉される。薄い金層(約25nm)が、ペルチェ素子の上部の熱パッドからバックグランド蛍光発光を防ぐためにチップの裏側に蒸着されるのが好ましい。
【0069】
必要に応じて、ペルチェ素子は樹脂製チップの熱的コントロールを行う試料ホルダーに一体化されてもよい。アルミニウムブロックがチップの均一な熱分布を保証するよう、ペルチェ素子の上部に取り付けられてもよい。熱パッドは好ましくはチップと熱源との間に熱的接触を確立するためアルミニウムブロックに取り付けられてよい。熱伝対は典型的に試料ホルダーに配置され、空気温度を測定し、ペルチェ素子にフィードバック回路を有する。温度制御は外部のラップトップコンピューターで管理できる。
【0070】
上述したように、NASBAは等温(約41℃)増幅方法であり、具体的にはいかなる1本鎖RNA配列を増幅するために設計される。NASBA反応は広範囲の用途、例えば特定のウイルスRNA、他の感染性または病原物質のRNA、ある種の細胞のRNAの存在検出に適用される。AMV逆転写酵素、RNase HおよびT7 RNAポリメラーゼの3種の酵素の同時活性が増殖反応の中心技術をなす。2つのオリゴヌクレオチドプライマーによって反応の特異性および標的RNAに特有の蛍光発光分子標識プローブが決定される。約90分で対象の核酸配列が>109の複製に増殖できる。光学検出単位は、反応室内で蛍光体が約494nmで励起、約525nmで蛍光発光を検出するよう設計されるのが好ましい。励起光は光がレンズを通して集光される前にバンド幅(465nm〜500nm)のフィルターを用いてろ過される。同じフレネルレンズが発光の焦点合わせ、および蛍光の集光に用いてもよい。他のレンズが蛍光発光を検出器(例、光増幅管)の表面に焦点合わせするのに用いてもよい。データ収集および検出した信号の調整は、ラップトップでMATLAB 6.0.088 Release 12(The Mathworks Inc., Natick, MA)を用いて処理できる。
【0071】
効率的な試料前処理は、ミクロ技術分析システムの文脈の中で重要な因子である。特に、濃縮デバイスは、例えば生理学的試料中に存在するバクテリア細胞またはウイルスのように特定の粒子の少ない数を検出するために必要である。多種の濃縮方法が当該技術で公知であり、例えば、種々のろ過媒体(微細構造チャンネル、多孔中空繊維または膜)を用いて袋小路ろ過およびクロスフローろ過、重力沈降機、遠心分離機、吸音セルフィルター、光学トラップ、誘電泳動法(DEP)、電気泳動法、フローサイトメトリーおよび吸着に基づく方法などがある。
【0072】
濃縮の好ましい方法は袋小路ろ過を必要とする。これは相対的に単純で安価な方法であり、使い捨て高分子チップに容易に組み入れることができる。さらに、平膜の使用で用途分野を考慮すると高い柔軟性が保証される。なぜなら、多様な膜が入手可能であり、PEGまたはTween20コーティングのような表面処理が容易に実施できるからである。
【0073】
平膜を高分子製使い捨てチップに一体化するのは、図1に模式的に示されるような組み立てられたサンドイッチを用いて達成できる。チップは蓋の膜40、流体チャンネル41およびフィルター膜44を含む。チップの頂部および底部は42および43でそれぞれ示される。
【0074】
好ましくは、チップ上の流れのコントロールが行えるように1つ以上のバルブがデバイスに組み入れられる。適当なバルブ設計が図2および3に示される。図2に関して、予め成形した膜または平膜を用いてもよい。チップ45は流体チャンネル46および予め成形した膜47を含む。垂直の矢印は開放位置を示す。
【0075】
図3a〜dに関して、本体を有するチップが示されており、上部本体部分50、主本体部分52およびそれらの間に挟まれた膜51を含む。ミクロ流体チャンネル57が膜51に隣接して備えられる。ピストン54およびバルブ55が主本体部分52の適当な窪みに備えられる。流体/液体はピストン54(図3a参照)上の体積53中にある。バルブ55は上部位置(図3a参照)に内嵌で備え付けられる。この位置でバルブは流体が流れないようにミクロ流体チャンネル57を密封する。円錐ピン56bはバルブ55を下げて開位置(図3b,3c,3c参照)なるように使用される。特に、ピン56bが上方に押されるとき、摩擦適合によりバルブ55内の対応する窪みに確保される。同様に、ピストン54との関係で、円錐ピン56aが上方に押されるとき、摩擦適合によりバルブ54内の対応する窪みに確保される。体積53から液体を輸送するために、ピン56aおよび56bがピストン54およびバルブ55それぞれに対応する窪みに押し込まれて液体は体積53から押し出される(図3c,3d参照)。チップが使用されたとき、円錐ピン56aおよび56bでそれぞれピストン54およびバルブ55から後退される。
【0076】
本発明者はシリカビーズがRNA抽出および精製に好適であることを見出した。典型的に、直径15〜35μmのビーズ0.3〜0.4mgが抽出に使用できるが、大きなシリカビーズ(直径200μmまで)も使用できる。1つの可能なビーズ室の配置が図4に示される。ビーズ室60は予め湿潤したビーズ61で、チップ−チップ結合の前に詰められる。結合後、ビーズ包みは100μmの障壁で保持される。ビーズ室の形状および流体接合62(入口)と63(出口)の配置により、適用された液体は、例えビーズ室60が完全には充満していなくても、シリカビーズ61を通過するのが保証される。ビーズ室60の体積は約6.5μLであり、典型的に10〜50μLの試料から抽出するのに適している。
【0077】
4つの液体が好ましくは前処理プロセスと通して用いられる。溶解緩衝液(典型的に約100μL)、イソプロパノール(典型的に約40μL)、エタノール(典型的に約40μL)および溶離緩衝液(典型的に約5〜20μL)である。後者3つは抽出に必要である。本発明者は、溶解緩衝液をチップ70aの上部にある(図5a参照)チャンネル(典型的に曲がりくねったチャンネル)に貯蔵すること、底部70b(図5b参照)に2つのW字型および1つのU字型貯留所に抽出液を貯蔵することが有利であると見出した。
【0078】
すべての貯蔵貯留所は、略図の注射器75a〜dの針の位置で図5に示される小さな(0.5mm×0.5mm)側面チャンネルによって単純に充填されてもよい。充填後、側面チャンネルは液状の膠またはテープのようないかなる適当な手段を用いて密封できる。
【0079】
有利なことに、比較的に単純な取扱システムを可能とするため、単一(注射器)ポンプを全溶液の駆動に用いるのが好ましい。
【0080】
本発明の好適な実施形態によるチップ配列は、図6に示される。
【0081】
4つの液体貯留所(溶解緩衝液、イソプロパノール、エタノールおよび溶離緩衝液)は順次、従来の注射器(針の直径0.4mm)を用いて充填され、充填チャンネルは密封される。
【0082】
第一に、細胞懸濁液が注射器ポンプによってろ過ユニットに適用される。粒子状懸濁液のほかに、注射器に約200μL〜300μLの空気が入れられ、チップ上液体(用途によるが、他の不混和性液体が用いられてよいことが理解される)の駆動に用いられる。
【0083】
第二に、空気が溶解緩衝液貯留所にポンプで送られ、移動した緩衝液がフィルターに保たれて細胞に適用される。細胞溶解がフィルターを通して押されビーズ室に方向付けられる。追加的なろ過工程により、ビーズ室で凝集する確率が減少される。
【0084】
第三に、駆動ポンプ(注射器)が、ろ過室および溶解緩衝液貯留所への接続が閉鎖されながら抽出液貯留所に接続される。抽出液体は空気栓で分離された単一の貯留所に貯蔵される。貯留所の一方の側に圧力がかけられると、液体は平行に移動し、ビーズ室を通って順次導かれる。
【0085】
バルブ操作を含む作業手順は、図6も参照して以下に要約される。リストにないバルブは閉鎖状態に、一方リストに記載されたバルブは対応する作業のために開放される。
ろ過
バルブ5、7: 細胞懸濁液入り、濾液−>左出口
溶解
バルブ2、3、7: 空気入り、移動した流体−>左出口
バルブ2、3、6: 空気入り、溶解物→ビーズ包み、右出口
精製
バルブ1、4、6: 空気入り、イソプロパノール−>ビーズ包み
空気入り、エタノール−>ビーズ包み
空気入り、溶離緩衝液−>ビーズ包み
【0086】
図7を参照すると、本発明の他の好適な実施形態が示されている。上記説明は、この実施形態にもあてはまる。システム1は液状試料用入口5、溶解/ろ過ユニット10、核酸抽出ユニット15、溶解流体を含むチャンネル20、溶離剤、エタノール、イソプロパノールを含むチャンネル25、核酸配列増殖および検出ユニット30および廃棄ユニット35を含む。
【0087】
チャンネル11は試料入口5と接続し、溶解/ろ過ユニット10に導く。バルブ12はそれらの間の流体の流れをコントロールするために設けられる。
【0088】
チャンネル16は溶解/ろ過ユニット10と接続し、核酸抽出ユニット15に導く。バルブ17はそれらの間の流体の流れをコントロールするために設けられる。
【0089】
溶解流体を含むチャンネル20は溶解/ろ過ユニット10および試料入口5と接続する。バルブ22および23は流体の流れをコントロールするために設けられる。
【0090】
溶離剤、エタノール、イソプロパノールを含むチャンネル25は核酸抽出ユニット15および試料入口5と接続する。バルブ27および28は流体の流れをコントロールするために設けられる。
【0091】
チャンネル31は核酸抽出ユニット15に接続し、核酸配列増殖および検出ユニット30に導く。バルブ32はその間の流体の流れをコントロールするために設けられる。
【0092】
チャンネル36は溶解/ろ過ユニット10に接続し、廃棄ユニット35に導く。バルブ37はその間の流体の流れをコントロールするために設けられる。
【0093】
チャンネル25は溶離剤、エタノールおよびイソプロパノールのような洗浄溶媒を含む。溶離剤および洗浄溶媒は、お互いに液を分離するための空気間隙を用いてチャンネルに予め入れられている。
【0094】
適当な溶解緩衝液の1つの例は、100mMのTris/HCl、8MのGuSCN(pH6.4)である。
【0095】
適当な溶離剤の1つの例は、10mMのTris/HCl、1mMのEDTA Na2(pH8)+1mMのYOYO−1である。
【0096】
核酸の定量は、蛍光顕微鏡および画素強度分析プログラム(Lispix)を用いて達成される。
【0097】
核酸抽出ユニットは、また、シリカビーズ、例えばサイズ15〜30μmのシリカビーズ0.3mgを含む。白金電極は、核酸を溶離する負に帯電した動電学的収集のための充てん層のすぐ下に備えられる。(図示せず)
【0098】
作業手順は以下に要約される。
【0099】
ろ過
バルブ12および37を除いてすべてのバルブが閉められる。液状試料を含む注射器(分析される細胞を含む)が試料入口5に接続され、試料はろ過/溶解ユニット10に圧力で注入される。このように、細胞はユニット10に保持され、液状試料の残った部分はそれから廃棄ユニット35を通過させる。
【0100】
溶解
バルブ22、23および37を除いてすべてのバルブが閉められる。第一工程(任意選択)において、注射器内に含まれる空気が試料入口5に注入される。これにより、チャンネル20に含まれる溶解物をろ過/溶解ユニット10に向けて動かす。しかしながら、溶解流体がろ過/溶解ユニット10に入る前に、溶解流体に先立つ空気、すなわちバルブ23とユニット10との間のチャンネル20の領域の空気によって、ユニット10に残る流体を動かし、廃棄ユニット35を移動させ、流す。次に、第二工程において、バルブ37が閉じられバルブ17が開かれる。注射器内に含まれる空気を試料入口5に注入し続けながら、チャンネル20に含まれる溶解流体が圧力下、ろ過/溶解ユニット10に流れる。その結果、そこに保持された細胞が溶解され、溶解物が核酸抽出ユニット15に流れる。
【0101】
精製/抽出
バルブ27、28および32を除いてすべてのバルブが閉められる。第一工程において、注射器に含まれた空気が試料入口5に注入される。これにより、チャンネル25に含まれる流体(イソプロパノール、空気間隙、エタノール、空気間隙、溶離緩衝液)が核酸抽出ユニット15に向かって流体カラムのように動く。このプロセスはすべてのイソプロパノール(即ち、流体のカラムの最初の部分)が核酸抽出ユニット15を通過した段階で止められる。その後(任意選択のユニット15の内容物の加熱も一緒に)、プロセスは続けられ、イソプロパノールとエタノールとの間の空気間隙がイソプロパノールを移動させる。イソプロパノールが蒸発および/または廃棄される。それからエタノールが圧力下、核酸抽出ユニット15に流れる。このプロセスは、すべてのエタノールがユニット15を通過した段階で再度止められる。その後(任意選択のユニット15の内容物の加熱も一緒に)、プロセスは続けられ、エタノールと溶離緩衝液との間の空気間隙がエタノールを移動させる。エタノールが蒸発および/または廃棄される。それから溶離緩衝液が圧力下、核酸抽出ユニット15に流れ、シリカビーズの表面から離れた核酸を溶離する。そして溶離した核酸が核酸配列増殖および検出ユニット30に通過する。
【0102】
本発明は、核酸(NA)抽出および分析のための装置および方法を提供する。人間の細胞溶解物のような生物学的試料からの抽出は、最初の15mLの溶離液中の核酸を収集して成功に至っている。
【0103】
リアルタイム核酸配列に基づく増殖(NASBA)は、シクロオレフィン共重合体樹脂チップ中で一体化した供給チャンネルおよび並列反応室で測定された。人工の人乳頭腫ウイルス(HPV)16配列、統合HPV16を有するSiHa細胞株およびHPV16に陽性と検査された患者試料の検出が成功裏に実施された。チップに適用された試料材料は11の並列反応室に分けられ、そこで80nLの検出体積において同時に検出された。
【0104】
ここで本発明を以下の制限のない実施例を参照して、さらに詳細に説明する。
【実施例】
【0105】
試料材料
頚癌細胞株SiHa(扁平上皮細胞癌)は米国タイプ菌株収集(American Type Culture Collection, USA)から入手した。SiHa細胞株はダルベッコ改良イーグル培地(DMEM)に、10%のウシ胎仔血清(FBS)、2mMのL−グルタミンおよび25μg/mlゲンタマイシンで補完して保持した。その細胞が5%のCO2雰囲気下、37℃で培養された。細胞はトリプシン処理され、Burkers室で計数され、NASBA溶解緩衝液(bioMerieux,オランダ、5Mグアニジンチオシアン酸塩含有)に溶解した。核酸は分離され、Boom法によりNucliSense抽出器で抽出した(Boom, R., Sol. J. A., Salimans, M. M. M., Jansen, C. L., Wertheimvandillen P. M. E., Vandernoordaa, J. J. ; Clinical Microbiol., 1990, 28, (3),495-503頁)。SiHa細胞は細胞当たり統合HPV16DNAの1〜2の複製を含む(Syrjanen, S., Partanen, P., Mantyjarvi, R., and Syrjanen, K. ; J Virol Methods, 1988, 19, 225-238頁)。SiHa細胞株抽出物の10倍連続希釈法が試験された。なお、HPV−Prooferキット(NorChip A, Norway)から得た人工HPVタイプ16配列を標的として使用した。希釈シリーズはシステムの検出限界を定義するために試験された。
【0106】
NASBA
PreTectRHPV−Prooferキットの試薬は製造元(NorChip A, Norway)の仕様に従い混合した。プライマーおよびプローブのすべてがそのキットで得られた。なお、BSAは動的コーティングとして0.05%の最終濃度にいたるまで混合物に添加した。キットからの試薬溶液(26μL)および試料材料(SiHa細胞株およびキットからのHPVタイプ16配列試料)の13μLを混合して2分で65℃まで加熱した。続いて、その混合物を2分で41℃まで冷却し、酵素(13μL)を添加した。各反応チャンネルの1つの駆動室を切って開き、混合物を高分子ミクロチップに添加した。チップ中の各反応チャンネルは毛細管力により混合物で充満した。残った混合物は供給チャンネルの末端にある廃棄室に引き入れられた。チップホルダーを光学系に移し、次々とチャンネルを測定した。測定値は30秒ごとに採取した。2×2mm2の領域だけがLEDで照射され、この領域は80nLの検出領域に相当する。HPV16配列およびSiHa細胞株の両方の10倍連続希釈法がミクロチップ検出との比較のため従来の装置で試験された。すべての実験は2.5時間で実施した。
【0107】
計算
すべての結果は、PreTectデータ分析機(PDA)(NorChip AS)を用いて計算された。ミクロチップは12反応室に合わせて設計されているが、測定値の系統的誤差の理由から各サイドの2つの反応チャンネルを計算から削除した。計算は多重回帰計算法に基づいた。比率は反応終了時の蛍光発光レベルと反応開始時の蛍光発光レベルとの差として定義された。比率が1.7以上の試料すべてを陽性と定義した。時間―陽性化、すなわち曲線が対数的に増加するように開始する出発点をセットした。平均勾配は出発点から蛍光発光レベルで10%増加時の値および蛍光発光レベルで80%増加時の値を用いて算出した。高分子ミクロチップの検出限界は10の反応チャンネルのすべてが陽性になる最後の濃度になるようにセットした。
【0108】
結果
リアルタイムNASBAを活用してHPV16ウイルスの同定が80nLの検出体積で高分子ミクロチップを用いて成功裏に実施された。図8および9はそれぞれSiHa細胞株、HPV16オリゴ配列に関し、実施した実験からの結果を示す。両図は明瞭に陽性であり、正規の20μL体積で実施した試料および従来の結果(図示せず)と同じ曲率のグラフを示す。表1は高分子ミクロチップを用いて得られた人工HPV16配列およびSiHa細胞株の連続希釈法の結果を示す。増殖反応を特徴づけるため、いくつかの異なる以下の因子が評価された。蛍光発光比率、時間−陽性化、曲線の直線部の勾配、陽性増殖数および試験した高分子ミクロチップの数である。表の値は試験した陽性試料の平均値および陽性試料の標準偏差を示す。ミクロチップで試験したHPV16配列およびSiHa細胞株の両方に対して比率はおおよそ一定であった。同じ試料材料の従来の試験(表2)との比較で、比率はより低濃度で減少した。一方、他の因子はミクロチップおよび従来の方法の両方で非常によく対応する。時間−陽性化はより低濃度で増加した。平均勾配はより低濃度とともに減少した。100aMから100nMに10倍希釈法が人工HPV16配列で試験され、一方、SiHa細胞株では0.02細胞数/μLから2000細胞数/μLに渡り試験された。特注の光学検出システムは、人工HPV16配列およびSiHa細胞株の検出限界はそれぞれ1pMおよび20細胞数/μLであった。これらは従来のBiotekリーダーで得られた検出限界と同じであった。両方のシステムでより低い濃度を検出できたが、結果は一貫性がなかった。また、結果は入力ターゲットの試料濃度が減少するとき、標準偏差が増加したことを示す。HPV16オリゴ配列およびSiHa細胞株に対するNASBAの比較から、出発時点と増殖反応終了時での蛍光発光レベルの比率を除き、すべての因子は従来の方法と同様、ミクロシステムに対して同じ傾向が示された。バックグラウンド雑音は、巨視的蛍光発光法よりも小さな反応室ではより顕著になる。バックグラウンド蛍光発光の一部は、高分子ミクロチップの裏側に薄い金層を設けることにより検定から取り除いた。COC自体は自己蛍光発光であり、常にバックグラウンド蛍光発光している。雑音検出に寄与するものは完全でない高分子表面による光散乱である。時間−陽性化は、長時間用いた基板が基板と相互作用するのが見出されたので予想通りより低濃度で減少した。実験において人工HPV16に対して特に、最高濃度で時間−陽性化が増加する。非常に高試料濃度も反応を阻害するかも知れず、それゆえ理想的な反応混合物の場合よりも長時間を要する。同様に、平均勾配が減少する。より少量の標的が開始にあたり反応混合物に存在するとき、単位複製配列はより少なく、より高い濃度の場合より勾配は低くなる。NASBA反応の検出限界は対象の標的、プライマーおよびプローブの設計に依存する。これらの実験で、両検出システムに対し、1pMおよび20細胞数/μLに至る濃度を検出できた。従って、本実施例はリアルタイムNASBAを活用して高分子ミクロチップで人工HPV16配列に対して1pM濃度まで検出することが可能であることを示す。細胞株に対しては、検出限界は20細胞数/μLであった。これらの検出限界は従来のBiotekリーダーで実施された実験で得られたものと同じである。
【0109】
【表1】

【0110】
【表2】

【図面の簡単な説明】
【0111】
【図1】本発明で使用する使い捨て高分子チップデバイスに平膜の一体化に用いるサンドイッチ配置の模式的な説明図である。
【図2】本発明によるシステムの使用のためのバルブ設計の模式的な説明図である。
【図3a−3d】本発明によるシステムの使用のためのバルブ設計の模式的な説明図である。
【図4】本発明によるビーズ室の1つの可能な配置の模式的な説明図である。
【図5】本発明によるシステムの模式的な説明図であり、図5aは溶解緩衝液の充填、および図5bは抽出流体の充填を示す。
【図6】本発明の好適な実施形態によるチップ配置の模式的な説明図である。
【図7】本発明の他の好適な実施形態によるシステム設計の模式的な説明図である。
【図8】実施例に関連するグラフである。
【図9】実施例に関連するグラフである。
【特許請求の範囲】
【請求項1】
細胞および/または粒子を含む液状試料に関する試料調製方法を実施するための一体型ラボオンチップ診断システムであって、
(a)液状試料の入口、
(b)液状試料に含まれる細胞および/または粒子を溶解するための溶解ユニット、
(c)液状試料に含まれる細胞および/または粒子から核酸を抽出するための核酸抽出ユニット、
(d)溶解流体を収納する貯留所、
(e)核酸抽出ユニットで集められる核酸を取り出すための溶離剤を収納する貯留所を含み、
試料入口が溶解ユニットと流体連通接続されて、それらの間の流体の流れをコントロールする任意バルブが在り、
溶解ユニットが核酸抽出ユニットと流体連通接続されて、それらの間の流体の流れをコントロールする任意バルブが在り、
溶解流体を収納する貯留所が溶解ユニットと流体連通接続されて、それらの間の流体の流れをコントロールする任意バルブが在り、および
溶離剤を収納する貯留所が核酸抽出ユニットと流体連通接続されて、それらの間の流体の流れをコントロールする任意バルブが在る、ことを特徴とするシステム。
【請求項2】
溶解流体を収納する貯留所が、入口と流体連通接続されて、それらの間の流体の流れをコントロールする任意バルブが在る、請求項1に記載のシステム。
【請求項3】
溶離剤を収納する貯留所が、入口と流体連通接続されて、それらの間の流体の流れをコントロールする任意バルブが在る、請求項1または請求項2に記載のシステム。
【請求項4】
さらに(g)核酸反応ユニット、好ましくは核酸配列増幅および検出ユニットを含み、核酸抽出ユニットが、核酸反応ユニットと流体連通接続されて、それらの間の流体の流れをコントロールする任意バルブが在る、請求項1ないし3のいずれか一項に記載のシステム。
【請求項5】
さらに(h)廃棄ユニットを含み、廃棄ユニットが溶解ユニットと流体連通接続されて、それらの間の流体の流れをコントロールする任意バルブが在る、請求項1ないし4のいずれか一項に記載のシステム。
【請求項6】
さらに(i)洗浄溶媒、好ましくはエタノールを収納する貯留所を含み、貯留所が核酸抽出ユニットと流体連通接続されて、それらの間の流体の流れをコントロールする任意バルブが在る、請求項1ないし5のいずれか一項に記載のシステム。
【請求項7】
さらに(j)さらに洗浄溶媒、好ましくはイソプロパノールを収納する貯留所を含み、貯留所が核酸抽出ユニットと流体連通接続されて、それらの間の流体の流れをコントロールする任意バルブが在る、請求項1ないし6のいずれか一項に記載のシステム。
【請求項8】
溶離剤を収納する貯留所が第一洗浄溶媒を収納する貯留所および/または第二洗浄溶媒を収納する貯留所と流体連通接続される、請求項6または請求項7に記載のシステム。
【請求項9】
溶離剤、第一洗浄溶媒および/または第二洗浄溶媒が共通の貯留所に収納される、請求項8に記載のシステム。
【請求項10】
溶離剤、第一洗浄溶媒および/または第二洗浄溶媒が共通の貯留所で流体、好ましくは空気で、互いに分離される、請求項9に記載のシステム。
【請求項11】
共通の貯留所が入口および溶解ユニットと流体連通接続において導管を含む、請求項9または請求項10に記載のシステム。
【請求項12】
さらに(k)液状試料および/または空気を入口に導入するための手段を含み、前記手段が好ましくはポンプまたは注射器を含む、請求項1ないし11のいずれか一項に記載のシステム。
【請求項13】
さらにろ過ユニットを含み、当該ユニットが溶解ユニットと流体連通接続されている、請求項1ないし11のいずれか一項に記載のシステム。
【請求項14】
ろ過ユニットが1つ以上の袋小路フィルター、クロスフローフィルター(例えば、微細構造チャンネル、多孔中空繊維または膜)、重力沈降機、遠心分離機、吸音セルフィルター、光学トラップ、誘電泳動法(DEP)、電気泳動法、フローサイトメトリーおよび吸着に基づく方法を含む、請求項13に記載のシステム。
【請求項15】
溶解ユニットがさらに液状試料をろ過する手段を含む、請求項1ないし11のいずれか一項に記載のシステム。
【請求項16】
前記手段が1つ以上の袋小路フィルター、クロスフローフィルター(例えば、微細構造チャンネル、多孔中空繊維または膜)、重力沈降機、遠心分離機、吸音セルフィルター、光学トラップ、誘電泳動法(DEP)、電気泳動法、フローサイトメトリーおよび吸着系の方法を含む、請求項15に記載のシステム。
【請求項17】
システムがさらに溶解ユニットおよび/または核酸抽出ユニットの内容物を加熱する手段を含む、前請求項のいずれか一項に記載のシステム。
【請求項18】
前記手段が溶解ユニットおよび/または核酸抽出ユニット内または隣接して位置する1つ以上のペルチェ素子を含む、請求項17に記載のシステム。
【請求項19】
核酸抽出ユニットの少なくとも1部がシリカビーズまたは粒子で満たされる前請求項のいずれか一項に記載のシステム。
【請求項20】
核酸抽出ユニットがさらに溶離した核酸を収集および/または前濃縮するためシリカビーズまたは粒子に隣接する1組以上の電極を含む、請求項19に記載のシステム。
【請求項21】
前記1組以上の電極がプラチナ電極を含む、請求項20に記載のシステム。
【請求項22】
生物学上の流体、乳製品、環境上の流体または飲料水に存在する核酸を抽出するため前請求項のいずれか一項に記載のシステム。
【請求項23】
生物学上および/または環境上の試料を分析する装置であって、前請求項のいずれか一項で定義されるシステムを含む装置。
【請求項24】
生物学上および/または環境上の試料を分析する検定キットであって、キットが請求項1ないし22のいずれか一項に定義されるシステムおよび試料を当該システムと接触させる手段を含む検定キット。
【請求項25】
使い捨てである、請求項23に記載の装置または請求項24に記載の検定キット。
【請求項26】
前請求項のいずれか一項に記載の一体型ラボオンチップ診断システムを製作する方法であって、
A.表面に、入口窪み、溶解ユニット窪み、核酸抽出ユニット窪み、溶解流体貯留窪みおよび溶離剤貯留窪みを有する基板を備えること、
B.蓋を備えること、および
C.(a)入口、(b)溶解ユニット、(c)核酸抽出ユニット、(d)溶解流体貯留所および(e)溶離剤貯留所、を創るように基板に蓋を取り付け、各々は基板の前記表面および蓋の隣接する表面にそれぞれの窪みにより定義される方法。
【請求項27】
さらに基板に蓋を取り付ける前または後で溶解流体を溶解流体貯留所に導入する工程を含む、請求項26に記載の方法。
【請求項28】
さらに基板に蓋を取り付ける前または後で溶解剤を溶解剤貯留所に導入する工程を含む、請求項26または請求項27に記載の方法。
【請求項29】
さらに基板に蓋を取り付ける前または後で第一洗浄溶媒、好ましくはエタノールを溶解剤貯留所に導入する工程を含む、請求項26ないし28のいずれか一項に記載の方法。
【請求項30】
さらに基板に蓋を取り付ける前または後で第二洗浄溶媒、好ましくはイソプロパノールを溶解剤貯留所に導入する工程を含む、請求項26ないし29のいずれか一項に記載の方法。
【請求項31】
溶離剤および/または、第一洗浄溶媒および/または第二洗浄溶媒が流体、好ましくは空気で、互いに分離される、請求項26ないし30のいずれか一項に記載の方法。
【請求項32】
さらに、
基板に蓋を取り付け後、溶離剤を溶離剤貯留所に導入する工程、
第一体積の不混和性流体、好ましくは空気を溶離剤貯留所に導入する工程、
第一洗浄溶媒、好ましくはエタノールを溶離剤貯留所に導入し、第一洗浄溶媒を前記第一体積の不混和性流体で溶離剤から分離される工程、
第二体積の不混和性流体、好ましくは空気を溶離剤貯留所に導入する工程、および
第二洗浄溶媒、好ましくはイソプロパノールを溶解剤貯留所に導入し、第二洗浄溶媒を前記第二体積の不混和性流体で第一の洗浄溶媒から分離される工程を含む、請求項26または請求項27に記載の方法。
【請求項1】
細胞および/または粒子を含む液状試料に関する試料調製方法を実施するための一体型ラボオンチップ診断システムであって、
(a)液状試料の入口、
(b)液状試料に含まれる細胞および/または粒子を溶解するための溶解ユニット、
(c)液状試料に含まれる細胞および/または粒子から核酸を抽出するための核酸抽出ユニット、
(d)溶解流体を収納する貯留所、
(e)核酸抽出ユニットで集められる核酸を取り出すための溶離剤を収納する貯留所を含み、
試料入口が溶解ユニットと流体連通接続されて、それらの間の流体の流れをコントロールする任意バルブが在り、
溶解ユニットが核酸抽出ユニットと流体連通接続されて、それらの間の流体の流れをコントロールする任意バルブが在り、
溶解流体を収納する貯留所が溶解ユニットと流体連通接続されて、それらの間の流体の流れをコントロールする任意バルブが在り、および
溶離剤を収納する貯留所が核酸抽出ユニットと流体連通接続されて、それらの間の流体の流れをコントロールする任意バルブが在る、ことを特徴とするシステム。
【請求項2】
溶解流体を収納する貯留所が、入口と流体連通接続されて、それらの間の流体の流れをコントロールする任意バルブが在る、請求項1に記載のシステム。
【請求項3】
溶離剤を収納する貯留所が、入口と流体連通接続されて、それらの間の流体の流れをコントロールする任意バルブが在る、請求項1または請求項2に記載のシステム。
【請求項4】
さらに(g)核酸反応ユニット、好ましくは核酸配列増幅および検出ユニットを含み、核酸抽出ユニットが、核酸反応ユニットと流体連通接続されて、それらの間の流体の流れをコントロールする任意バルブが在る、請求項1ないし3のいずれか一項に記載のシステム。
【請求項5】
さらに(h)廃棄ユニットを含み、廃棄ユニットが溶解ユニットと流体連通接続されて、それらの間の流体の流れをコントロールする任意バルブが在る、請求項1ないし4のいずれか一項に記載のシステム。
【請求項6】
さらに(i)洗浄溶媒、好ましくはエタノールを収納する貯留所を含み、貯留所が核酸抽出ユニットと流体連通接続されて、それらの間の流体の流れをコントロールする任意バルブが在る、請求項1ないし5のいずれか一項に記載のシステム。
【請求項7】
さらに(j)さらに洗浄溶媒、好ましくはイソプロパノールを収納する貯留所を含み、貯留所が核酸抽出ユニットと流体連通接続されて、それらの間の流体の流れをコントロールする任意バルブが在る、請求項1ないし6のいずれか一項に記載のシステム。
【請求項8】
溶離剤を収納する貯留所が第一洗浄溶媒を収納する貯留所および/または第二洗浄溶媒を収納する貯留所と流体連通接続される、請求項6または請求項7に記載のシステム。
【請求項9】
溶離剤、第一洗浄溶媒および/または第二洗浄溶媒が共通の貯留所に収納される、請求項8に記載のシステム。
【請求項10】
溶離剤、第一洗浄溶媒および/または第二洗浄溶媒が共通の貯留所で流体、好ましくは空気で、互いに分離される、請求項9に記載のシステム。
【請求項11】
共通の貯留所が入口および溶解ユニットと流体連通接続において導管を含む、請求項9または請求項10に記載のシステム。
【請求項12】
さらに(k)液状試料および/または空気を入口に導入するための手段を含み、前記手段が好ましくはポンプまたは注射器を含む、請求項1ないし11のいずれか一項に記載のシステム。
【請求項13】
さらにろ過ユニットを含み、当該ユニットが溶解ユニットと流体連通接続されている、請求項1ないし11のいずれか一項に記載のシステム。
【請求項14】
ろ過ユニットが1つ以上の袋小路フィルター、クロスフローフィルター(例えば、微細構造チャンネル、多孔中空繊維または膜)、重力沈降機、遠心分離機、吸音セルフィルター、光学トラップ、誘電泳動法(DEP)、電気泳動法、フローサイトメトリーおよび吸着に基づく方法を含む、請求項13に記載のシステム。
【請求項15】
溶解ユニットがさらに液状試料をろ過する手段を含む、請求項1ないし11のいずれか一項に記載のシステム。
【請求項16】
前記手段が1つ以上の袋小路フィルター、クロスフローフィルター(例えば、微細構造チャンネル、多孔中空繊維または膜)、重力沈降機、遠心分離機、吸音セルフィルター、光学トラップ、誘電泳動法(DEP)、電気泳動法、フローサイトメトリーおよび吸着系の方法を含む、請求項15に記載のシステム。
【請求項17】
システムがさらに溶解ユニットおよび/または核酸抽出ユニットの内容物を加熱する手段を含む、前請求項のいずれか一項に記載のシステム。
【請求項18】
前記手段が溶解ユニットおよび/または核酸抽出ユニット内または隣接して位置する1つ以上のペルチェ素子を含む、請求項17に記載のシステム。
【請求項19】
核酸抽出ユニットの少なくとも1部がシリカビーズまたは粒子で満たされる前請求項のいずれか一項に記載のシステム。
【請求項20】
核酸抽出ユニットがさらに溶離した核酸を収集および/または前濃縮するためシリカビーズまたは粒子に隣接する1組以上の電極を含む、請求項19に記載のシステム。
【請求項21】
前記1組以上の電極がプラチナ電極を含む、請求項20に記載のシステム。
【請求項22】
生物学上の流体、乳製品、環境上の流体または飲料水に存在する核酸を抽出するため前請求項のいずれか一項に記載のシステム。
【請求項23】
生物学上および/または環境上の試料を分析する装置であって、前請求項のいずれか一項で定義されるシステムを含む装置。
【請求項24】
生物学上および/または環境上の試料を分析する検定キットであって、キットが請求項1ないし22のいずれか一項に定義されるシステムおよび試料を当該システムと接触させる手段を含む検定キット。
【請求項25】
使い捨てである、請求項23に記載の装置または請求項24に記載の検定キット。
【請求項26】
前請求項のいずれか一項に記載の一体型ラボオンチップ診断システムを製作する方法であって、
A.表面に、入口窪み、溶解ユニット窪み、核酸抽出ユニット窪み、溶解流体貯留窪みおよび溶離剤貯留窪みを有する基板を備えること、
B.蓋を備えること、および
C.(a)入口、(b)溶解ユニット、(c)核酸抽出ユニット、(d)溶解流体貯留所および(e)溶離剤貯留所、を創るように基板に蓋を取り付け、各々は基板の前記表面および蓋の隣接する表面にそれぞれの窪みにより定義される方法。
【請求項27】
さらに基板に蓋を取り付ける前または後で溶解流体を溶解流体貯留所に導入する工程を含む、請求項26に記載の方法。
【請求項28】
さらに基板に蓋を取り付ける前または後で溶解剤を溶解剤貯留所に導入する工程を含む、請求項26または請求項27に記載の方法。
【請求項29】
さらに基板に蓋を取り付ける前または後で第一洗浄溶媒、好ましくはエタノールを溶解剤貯留所に導入する工程を含む、請求項26ないし28のいずれか一項に記載の方法。
【請求項30】
さらに基板に蓋を取り付ける前または後で第二洗浄溶媒、好ましくはイソプロパノールを溶解剤貯留所に導入する工程を含む、請求項26ないし29のいずれか一項に記載の方法。
【請求項31】
溶離剤および/または、第一洗浄溶媒および/または第二洗浄溶媒が流体、好ましくは空気で、互いに分離される、請求項26ないし30のいずれか一項に記載の方法。
【請求項32】
さらに、
基板に蓋を取り付け後、溶離剤を溶離剤貯留所に導入する工程、
第一体積の不混和性流体、好ましくは空気を溶離剤貯留所に導入する工程、
第一洗浄溶媒、好ましくはエタノールを溶離剤貯留所に導入し、第一洗浄溶媒を前記第一体積の不混和性流体で溶離剤から分離される工程、
第二体積の不混和性流体、好ましくは空気を溶離剤貯留所に導入する工程、および
第二洗浄溶媒、好ましくはイソプロパノールを溶解剤貯留所に導入し、第二洗浄溶媒を前記第二体積の不混和性流体で第一の洗浄溶媒から分離される工程を含む、請求項26または請求項27に記載の方法。
【図1】


【図2】


【図3a】


【図3b】


【図3c】


【図3d】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】




【図2】


【図3a】


【図3b】


【図3c】


【図3d】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【公表番号】特表2007−519917(P2007−519917A)
【公表日】平成19年7月19日(2007.7.19)
【国際特許分類】
【出願番号】特願2006−550304(P2006−550304)
【出願日】平成17年1月28日(2005.1.28)
【国際出願番号】PCT/GB2005/000308
【国際公開番号】WO2005/073691
【国際公開日】平成17年8月11日(2005.8.11)
【出願人】(503204565)
【Fターム(参考)】
【公表日】平成19年7月19日(2007.7.19)
【国際特許分類】
【出願日】平成17年1月28日(2005.1.28)
【国際出願番号】PCT/GB2005/000308
【国際公開番号】WO2005/073691
【国際公開日】平成17年8月11日(2005.8.11)
【出願人】(503204565)

【Fターム(参考)】
[ Back to top ]

