植物のネコブセンチュウ抵抗性の増加方法
【課題】植物のネコブセンチュウ抵抗性の増加方法の提供。
【解決手段】ネコブセンチュウ易感染性植物種の植物において、エチレン感受性の低下をもたらすエチレン受容体遺伝子の機能抑制変異を検出することを特徴とする、ネコブセンチュウ抵抗性が増加した植物を選択する方法。
【解決手段】ネコブセンチュウ易感染性植物種の植物において、エチレン感受性の低下をもたらすエチレン受容体遺伝子の機能抑制変異を検出することを特徴とする、ネコブセンチュウ抵抗性が増加した植物を選択する方法。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、植物のネコブセンチュウ抵抗性を増加させる方法に関する。
【背景技術】
【0002】
植物寄生性センチュウの宿主範囲は広く、2000種を超える植物に寄生するとされている。農業上重要な作物も例外ではなく、露地根菜類から施設果菜類に著しい減収や枯死を起こし、その被害額は全世界で1500億ドルに上ると報告されている。「イモムシ状」の小動物であるネコブセンチュウは、様々な農作物の根に寄生し、根系の形成異常、病原体感受性の亢進、生産性の顕著な低下を引き起こす。土壌中に隠れた状態で被害が進行するため制御が難しく、現在唯一有効な防御法とされているのは、毒性の強い化学物質(殺センチュウ剤)の散布である。国内では、予防手段として、同時に2、3種類の殺センチュウ剤を土壌散布した後播種するのが通例となっている。我が国は、世界で最も多く殺センチュウ剤を使用している国の一つである。
【0003】
殺センチュウ剤のように強い毒性を示す化学物質は土壌汚染の原因となっており、環境や生態系への悪影響が懸念されている。主要な殺センチュウ剤である臭化メチルは、成層圏のオゾン層破壊を引き起こすとして、2005年以降使用が禁止された。更に、化学合成農薬の環境や家畜、土壌生態系に与える影響、また食の安全に対する意識向上から、環境保全型、持続型防除技術の導入が強く求められている。
【0004】
世界的に大きな問題であるにも関わらず、これまでに単離されているセンチュウ抵抗性遺伝子は極めて少なく、トマトでは野生種に由来するMi-1が数少ない例である(非特許文献1)。この遺伝子はロイシンリッチリピートを有する抵抗性(R)遺伝子であり、交雑によってトマト栽培種に導入されてきた。しかしながら、一部のネコブセンチュウ種(キタネコブセンチュウ)に対して効果が無いことや、高温(30℃以上)で効果が失われる点が問題であった。更に、この抵抗性は国内の一部地域において既に打破されているとの報告があることから、今後利用できなくなる可能性が高い。現在、抵抗性を付与する新たな遺伝資源の開発が強く望まれている。
【0005】
一方、植物では、果実の成熟、休眠打破、花や葉の老化促進等を初めとするエチレンの様々な生理作用が知られている。エチレン非感受性変異体等のエチレン感受性(応答性)が変化した変異体は多数報告されており、例えばトマトでは、Nr(非特許文献2)、rin(非特許文献3)、Gr(非特許文献4)等がある。エチレン受容体は膜貫通ドメインとヒスチジンキナーゼドメインを有する膜タンパク質である。エチレンがエチレン受容体に結合すると、負の応答制御シグナルが遮断されてエチレン応答が生じる。エチレン受容体の構造を改変する変異はエチレン感受性を大幅に低下させることが知られており、そのような変異を有する変異型エチレン受容体遺伝子を組換え発現させることでエチレン感受性を低下させた植物変異体や、RNAi(RNA干渉)によりエチレン受容体遺伝子発現を抑制することによりエチレン感受性を低下させた形質転換植物が多数作製されている(非特許文献5、6及び7、特許文献1及び2)。しかしエチレン感受性については依然として不明な点も多い。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】国際公開第95/01439号
【特許文献2】特開2004−147511号公報
【非特許文献】
【0007】
【非特許文献1】Milligan S.B., et al., Plant Cell., 10(8):1307-1319. (1998)
【非特許文献2】Wilkinson et al., Science, 270(5243): 1807-1809 (1995)
【非特許文献3】Vrebalov et al., Sciece, 296(5566): 343-346, (2002)
【非特許文献4】Barry and Giovannoni, Proc. Natl. Acad. Sci. U.S.A., 103(20): 7923-7928 (2006)
【非特許文献5】Wilkinson et al., Nature Biotechnol., 15(5): 444-447 (1997)
【非特許文献6】Shibuya et al., Plant Physiol., 136(2): 2900-2912 (2004)
【非特許文献7】Lohar et al., Ann Bot., 104(2): 277-285 (2009)
【発明の概要】
【発明が解決しようとする課題】
【0008】
本発明は、植物のネコブセンチュウ抵抗性の増加方法を提供することを課題とする。
【課題を解決するための手段】
【0009】
本発明者らは、上記課題を解決するため鋭意検討を重ねた結果、植物におけるエチレン受容体変異に基づくエチレン感受性の低下が植物のネコブセンチュウ抵抗性の増加と関連することを見出し、本発明を完成するに至った。
【0010】
すなわち、本発明は以下を包含する。
[1] ネコブセンチュウ易感染性植物種の植物において、エチレン感受性の低下をもたらすエチレン受容体遺伝子の機能抑制変異を検出することを特徴とする、ネコブセンチュウ抵抗性が増加した植物を選択する方法。
本方法で検出対象となるエチレン受容体は、好ましくはETR1である。
本方法で検出するエチレン受容体遺伝子の機能抑制変異は、好ましくは、エチレン受容体のアミノ酸変異又はエチレン受容体遺伝子の欠失を生じる塩基変異である。
そのようなエチレン受容体のアミノ酸変異は、エチレン受容体の膜貫通領域内のアミノ酸変異であることが好ましい。
本方法において被験植物となるネコブセンチュウ易感染性植物種は、好ましくはナス科である。
【0011】
[2] ネコブセンチュウ易感染性植物種の植物にエチレン受容体遺伝子の機能抑制変異を導入し、エチレン感受性を低下させることを特徴とする、ネコブセンチュウ抵抗性が増加した植物の作製方法。
この方法におけるエチレン受容体遺伝子の機能抑制変異の導入は、好ましくはエチレン受容体のアミノ酸変異又はエチレン受容体遺伝子の欠失を生じる塩基変異の導入である。
そのようなエチレン受容体のアミノ酸変異は、エチレン受容体の膜貫通領域内のアミノ酸変異であることが好ましい。
本方法において変異が導入されるネコブセンチュウ易感染性植物種は好ましくはナス科である。
本方法におけるエチレン受容体遺伝子の機能抑制変異の導入は、好ましくは、上記[1]の方法により選択された、ネコブセンチュウ抵抗性が増加した植物を育種親として用いる交雑によるものである。
【0012】
[3] 上記[1]の方法又は上記[2]の方法によって得られる、ネコブセンチュウ抵抗性が増加した植物を、ネコブセンチュウ易感染性植物種の植物の栽培においてネコブセンチュウによる植物病害の防除のために使用することを特徴とする、植物の栽培方法。
【発明の効果】
【0013】
本発明に従えば、ネコブセンチュウ抵抗性が増加した植物を効率よく取得することができる。
【図面の簡単な説明】
【0014】
【図1】図1は、変異型エチレン受容体遺伝子を有する変異トマト個体におけるエチレン感受性試験の結果を示す写真である。WTは野生型エチレン受容体遺伝子を有するトマト個体、etr1-2は変異型エチレン受容体遺伝子etr1-2をホモ接合で有する変異トマト個体、etr1-1は変異型エチレン受容体遺伝子etr1-1をホモ接合で有する変異トマト個体を表す。それぞれ、「−」はエチレン非存在下、「+」はエチレン存在下での実生の状態を示す。
【図2】図2はネコブセンチュウ感染試験方法の模式図である。
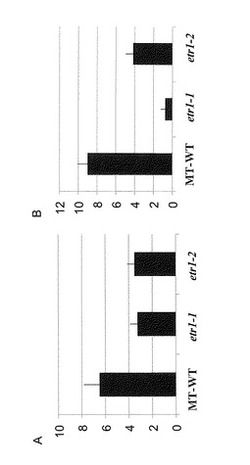
【図3】図3はネコブセンチュウ感染試験で測定された野生型トマト及び変異体トマトの根における瘤の数(A)及び卵塊数(B)を示すグラフである。
【発明を実施するための形態】
【0015】
以下、本発明を詳細に説明する。
ネコブセンチュウは、植物の根に寄生して瘤を形成することが知られている。ネコブセンチュウ(Meloidogyne属センチュウ)には、ジャワネコブセンチュウ(Meloidogyne javamica)、サツマイモネコブセンチュウ(Meloidogyne incognita)、キタネコブセンチュウ(Meloidogyne hapla)、及びアレナリアネコブセンチュウ(Meloidogyne arenaria)等が知られている。ネコブセンチュウは、種により寄生する宿主に多少の違いはあるものの、ナス科、イネ科、アブラナ科、マメ科、ウリ科、ヒルガオ科、ユリ科、キク科、アカザ科、セリ科、サトイモ科、ショウガ科、アオイ科等の幅広い宿主範囲を有し、様々な農作物に寄生して植物病害をもたらす。
【0016】
ネコブセンチュウは、主に卵の状態で越冬するが、ハウスなどで植物が栽培されている場合には成虫や幼虫の状態でも越冬し、春先に10〜15℃以上の地温になると活動を開始する。幼虫は卵の中で1回脱皮し、第2期(J2)幼虫となってから孵化する。第2期幼虫は土壌中を移動し、植物の根の根幹部付近(先端近く)から組織内に侵入し、維管束付近に定着して養分を摂取した後、2回目の脱皮を行って成虫となる。幼虫の形は雌雄とも線状であり、雄成虫は成長しても同じ線状(およそ1mm)であるが、雌成虫は成長するとおよそ0.5mmの球形〜洋ナシ形になる。雌成虫は卵のうを排出し、その中に約400〜800個、多いもので約1500個の卵を産卵する。1世代に要する期間は好適条件下で約25〜30日であり、一年に数世代を経過する。
【0017】
ネコブセンチュウに寄生(感染)された植物では、葉がしおれ、全体の生育が悪くなって病害が発生する。ネコブセンチュウが感染した根には多くの瘤が形成されるが、この瘤形成によって根の組織が壊され、水分、養分の吸収が妨げられ、枯死することさえある。
【0018】
本発明では、このようなネコブセンチュウによる植物病害を防除するため、ネコブセンチュウ易感染性植物において植物ホルモンであるエチレンに対する感受性の低下をもたらすエチレン受容体変異を指標として、ネコブセンチュウ高抵抗性を有する植物を取得し、これを利用する方法を提供する。
【0019】
本発明において対象となる「ネコブセンチュウ」は、ジャワネコブセンチュウ、サツマイモネコブセンチュウ、キタネコブセンチュウ、アレナリアネコブセンチュウ等の任意のネコブセンチュウ類(Meloidogyne属センチュウ)であるが、特にキタネコブセンチュウが好ましい。
【0020】
本発明において「ネコブセンチュウ易感染性植物種」とは、ネコブセンチュウによる感染(寄生)やその感染による植物病害の発生が知られている植物種を意味する。「ネコブセンチュウ易感染性植物種」の例としては、例えば、ナス科、イネ科、アブラナ科、マメ科、ウリ科、ヒルガオ科、ユリ科、キク科、アカザ科、セリ科、サトイモ科、ショウガ科、アオイ科等の植物種が挙げられる。「ネコブセンチュウ易感染性植物種」は、単子葉植物であっても双子葉植物であってもよいが、双子葉植物がより好ましい。具体的には例えば、ナス科[ナス(Solanum melongena L.)、トマト(Solanum lycopersicum)、ピーマン(Capsicum annuum L. var. angulosum Mill.)、トウガラシ(Capsicum annuum L.)、タバコ(Nicotiana tabacum L.)、ジャガイモ(Solanum tuberosum L.)等]、アブラナ科[シロイヌナズナ(Arabidopsis thaliana)、アブラナ(Brassica campestris L.)、ハクサイ(Brassica pekinensis Rupr.)、キャベツ(Brassica oleracea L. var. capitata L.)、ダイコン(Raphanus sativus L.)、ナタネ(Brassica campestris L., B. napus L.)等]、マメ科[ダイズ(Glycine max)、アズキ(Vigna angularis Willd.)、インゲン(Phaseolus vulgaris L.)、ソラマメ(Vicia faba L.)等]、ウリ科[キュウリ(Cucumis sativus L.)、メロン(Cucumis melo L.)、スイカ(Citrullus vulgaris Schrad.)、カボチャ(C. moschata Duch., C. maxima Duch.)等]、ヒルガオ科[サツマイモ(Ipomoea batatas)等]、キク科[キク(Chrysanthemum morifolium)、シュンギク(Chrysanthemum coronarium L.)、レタス(Lactuca sativa L. var. capitata L.)等]、バラ科[バラ(Rose hybrida Hort.)、イチゴ(Fragaria x ananassa Duch.)、リンゴ(Malus x domestica)等]、アカザ科[ホウレンソウ(Spinacia oleracea L.)、テンサイ(Beta vulgaris L.)等]、セリ科[ニンジン(Daucus carota L.)等]、サトイモ科[サトイモ(Colocasia esculenta L.)等]、ショウガ科[ショウガ(Zingiber officinale)等]、アオイ科[オクラ(Abelmoschus esculentus)等]などが、ネコブセンチュウ易感染性植物種の好ましい例として挙げられる。とりわけナス科、中でもトマトがより好ましい。ネコブセンチュウ易感染性植物種は、野生型ではエチレン感受性であるものが好ましい。
【0021】
本発明は、好ましい一実施形態として、ネコブセンチュウ抵抗性が増加した植物をスクリーニングすべく、ネコブセンチュウ易感染性植物種の植物(被験植物)において、エチレン感受性の低下をもたらすエチレン受容体遺伝子の機能抑制変異を検出することを特徴とする、ネコブセンチュウ抵抗性が増加した植物を選択する方法を提供する。このネコブセンチュウ抵抗性の増加は、そのエチレン受容体遺伝子の機能抑制変異を有しない野生型植物と比較した増加である。
【0022】
本発明において遺伝子変異の検出対象となるエチレン受容体としては、限定するものではないが、例えばETR1、ETR2、ETR3、ETR4、ETR5等が挙げられ、ETR1が特に好ましい。様々な植物でエチレン受容体遺伝子の塩基配列が決定されており、一例だが、トマト(Solanum lycopersicum)のETR1(GenBankアクセッション番号U41103)、ETR2(AF043085)、ETR3(AY600437)、ETR4(AY600438)、ETR5(AY600439)の他、タバコ(Nicotiana tabacum)のETR1(AF022727)、カンタロープメロン(Cucumis melo var. cantalupensis)のETR2(AB293427)、レタス(Lactuca sativa)のETR3(AF350323)、イネ(Oryza sativa)のETR4(AY434734)、リンゴ(Malus x domestica)のETR5(DQ847146)等も挙げられる。他の植物のエチレン受容体遺伝子を、これら既知のエチレン受容体遺伝子の配列情報に基づいて容易に単離し、配列決定することもできる。対象となるエチレン受容体遺伝子の野生型は、例えば、(a)配列番号1に示される塩基配列を含む核酸、(b)配列番号1に示される塩基配列に対して70%以上、好ましくは80%以上、より好ましくは90%以上さらに好ましくは95%以上の配列同一性を有する塩基配列を含み、かつエチレン存在下でエチレン応答誘導活性を有するエチレン受容体タンパク質をコードする核酸、(c)配列番号2に示されるアミノ酸配列をコードする核酸、(d)配列番号2に示されるアミノ酸配列に対して80%以上、好ましくは90%以上、より好ましくは95%以上、さらに好ましくは98%以上の配列同一性を有するアミノ酸配列を含み、かつエチレン存在下でエチレン応答誘導活性を有するエチレン受容体タンパク質をコードする核酸である、エチレン受容体遺伝子であり得る。エチレン存在下でのエチレン応答誘導活性は、エチレン感受性試験によって調べることができる。
【0023】
被験植物における「エチレン感受性の低下をもたらすエチレン受容体遺伝子の機能抑制変異」とは、そのエチレン受容体遺伝子によってコードされるエチレン受容体タンパク質の機能(活性)が抑制(低下又は阻害)され、当該植物のエチレン感受性のレベルが低下(好ましくは有意に低下)するか又はエチレン感受性が完全に喪失するようなエチレン受容体遺伝子における遺伝的変異を意味する。このような遺伝的変異は、エチレン受容体のエチレン応答誘導活性を野生型と比較して有意に(例えば10%以上、好ましくは30%以上、より好ましくは50%以上、特に好ましくは90%以上、とりわけ好ましくは98%以上、例えば99%以上)低下させるか又は活性を完全に喪失させるアミノ酸変異をエチレン受容体タンパク質中に生じる塩基変異であってよい。このアミノ酸変異は、いわゆる非保存的置換であることが好ましい。エチレン受容体遺伝子の機能抑制変異がエチレン感受性の低下をもたらすかどうかは、その変異を有しないエチレン感受性の野生型植物と比較して、その変異を有する以外は野生型の遺伝子型を有する植物において当該植物のエチレン感受性のレベルが低下(好ましくは有意に低下)するか又はエチレン感受性が完全に喪失することを調べることにより、確認することができる。植物のエチレン感受性のレベルは、後述するエチレン感受性試験によって調べることができる。
【0024】
このようなエチレン感受性の低下をもたらすエチレン受容体遺伝子の機能抑制変異は、例えば、エチレン受容体タンパク質の膜貫通領域内にアミノ酸変異(1つ以上、好ましくは1〜10個のアミノ酸の欠失、置換及び/又は付加)を生じる塩基変異(1塩基以上、好ましくは1〜30塩基のヌクレオチドの欠失、置換及び/又は付加)であってよい。例えばトマトエチレン受容体遺伝子ETR1(配列番号1)の膜貫通領域は配列番号1の39位〜58位、68位〜88位、及び108位〜128位に相当する。なお本明細書において「膜貫通領域」の用語は、エチレン受容体タンパク質についていうときは膜貫通ドメインを、エチレン受容体遺伝子についていうときは膜貫通ドメインをコードする塩基配列を意味する。エチレン受容体の膜貫通ドメインはエチレン受容に重要な機能を果たすことから、エチレン受容体遺伝子の膜貫通領域内に生じるアミノ酸変異は高い確率でエチレン感受性の低下をもたらす。膜貫通領域内に生じるエチレン受容体遺伝子の機能抑制変異の具体例としては、限定するものではないが、例えばトマトエチレン受容体遺伝子ETR1において、野生型ETR1の配列番号2に示されるアミノ酸配列を基準とした場合に51位のアミノ酸(プロリン)から他のアミノ酸への置換(例えば、グリシン以外のアミノ酸への非保存的置換)、特に、51位のプロリンからロイシンへの置換を生じる塩基変異が挙げられる。別の例では、トマトエチレン受容体遺伝子ETR1において、配列番号2に示されるアミノ酸配列を基準とした場合に69位のアミノ酸(バリン)から他のアミノ酸への置換(例えば、ロイシン及びイソロイシン以外のアミノ酸への非保存的置換)、特に、69位のバリンからアスパラギン酸への置換を生じる塩基変異が挙げられる。なおエチレン感受性の低下をもたらすエチレン受容体遺伝子の機能抑制変異は、被験植物に内在するエチレン受容体遺伝子中の変異であってもよいし、被験植物に遺伝子組換え等により導入された外来性変異型エチレン受容体遺伝子中の変異であってもよい。
【0025】
あるいはエチレン感受性の低下をもたらすエチレン受容体遺伝子の機能抑制変異は、被験植物に内在するエチレン受容体遺伝子の欠失を生じる塩基変異であってもよい。エチレン受容体遺伝子の欠失を生じる塩基変異とは、エチレン受容体遺伝子の全体又はその大部分の塩基配列がゲノムから欠落する変異の他、ゲノム上のエチレン受容体遺伝子内への外来DNAの挿入や塩基の挿入/欠失によりフレームシフト又はスプライシングの変更等が生じた結果エチレン受容体遺伝子の遺伝子座からエチレン受容体タンパク質が発現されなくなる遺伝的変異も包含する。
【0026】
さらに、エチレン感受性の低下をもたらすエチレン受容体遺伝子の機能抑制変異はまた、そのエチレン受容体遺伝子の上流の転写開始部位又はプロモーター領域中に存在し、エチレン受容体遺伝子の転写及び/又は翻訳を阻害する塩基変異であってもよい。
【0027】
なお本明細書においては、配列番号で示されるアミノ酸配列中の特定の位置のアミノ酸を、「配列番号“X”に示される…アミノ酸配列を基準とした場合に“Y”位の(アミノ酸)」という表現により指定することがある。例えば「配列番号2に示されるアミノ酸配列を基準とした場合に“Y”番目の(アミノ酸)」という記載は、そのアミノ酸が、配列番号2に示されるアミノ酸配列のN末端に位置する第1アミノ酸を1位としたときに“Y”位に位置するアミノ酸であるか、又は配列番号2のアミノ酸配列に対し相同性を有する他のポリペプチドのアミノ酸配列において配列番号2に示されるアミノ酸配列の“Y”位に位置するアミノ酸に相当する(アラインメントされる)アミノ酸であることを意味する。
【0028】
上記のようなエチレン感受性の低下をもたらすエチレン受容体遺伝子の機能抑制変異は、ネコブセンチュウ易感染性植物種の植物においてエチレン感受性を低下させ、その結果、植物におけるネコブセンチュウ抵抗性が増加することになる。
【0029】
被験植物におけるエチレン感受性を低下させるエチレン受容体遺伝子の機能抑制変異の検出は、遺伝的変異を検出することができる任意の方法によって行えばよい。例えば、エチレン受容体遺伝子の少なくとも一部、例えばその膜貫通領域の少なくとも一部、好ましくは膜貫通領域全体を含むエチレン受容体遺伝子の全体又は一部を増幅するプライマーセットを設計し、被験植物から常法により調製した核酸(ゲノムDNA、又はトータルmRNAから逆転写したcDNA)からそのプライマーセットを用いて核酸増幅を行い、得られた増幅産物の塩基配列を決定し、その塩基配列を野生型エチレン受容体遺伝子の塩基配列と比較し解析することにより、エチレン受容体遺伝子における塩基変異を検出することができる。検出された塩基変異がエチレン受容体タンパク質のアミノ酸配列を変異(例えば、1つ以上のアミノ酸の欠失、置換及び/又は付加)させるものである場合、エチレン受容体の機能を抑制する変異である可能性がある。あるいは検出された塩基変異が、エチレン受容体遺伝子においてフレームシフトや開始コドンのすぐ下流での終止コドンの生起等を引き起こしている場合には、その変異型エチレン受容体遺伝子はエチレン受容体タンパク質をコードしておらず、すなわちそれはエチレン受容体遺伝子の欠失を生じる塩基変異であり、当該塩基変異はエチレン受容体の機能を抑制する。
【0030】
核酸増幅は、公知の任意の核酸増幅法に従って行えばよい。例えばPCR(ポリメラーゼ連鎖反応)法、LAMP(Loop-Mediated Isothermal Amplification)法、ICAN(Isothermal and Chimeric primer-initiated Amplification of Nucleic acids)法、SDA(Strand Displacement Amplification)法などを利用することができる。核酸増幅を行う際の反応液組成や温度サイクル条件の各温度及び反応時間等は、当業者であれば、使用する核酸増幅法、プライマーのTm値、サーマルサイクラーの仕様などに合わせて適宜定めることができる。
【0031】
本発明でエチレン受容体遺伝子の機能抑制変異の検出に用いるプライマー(オリゴヌクレオチドプライマー)は、少なくとも15塩基(bp)、好ましくは15〜50塩基(bp)、より好ましくは18〜30塩基(bp)、さらに好ましくは18〜25塩基(bp)である。本発明に係るプライマーは、当業者に周知の任意の化学合成法により作製することができ、例えば市販の自動DNA合成装置を使用して慣用手順により合成することができる。本発明に係るプライマーは、オリゴヌクレオチドにさらに任意の修飾が施されたものでもよい。例えば本発明に係るプライマーは、その5'末端又は3'末端に当該プライマーの検出や増幅を容易にするための標識物質(例えば、蛍光分子、色素分子、放射性同位元素、ジゴキシゲニンやビオチン等の有機化合物など)及び/又は付加配列(LAMP法で用いるループプライマー部分等)を含んでいてもよい。本発明に係るプライマーは、5'末端でリン酸化又はアミン化されていてもよい。本発明に係るプライマーはまた、天然塩基のみを含んでもよいし、修飾塩基を含んでもよい。修飾塩基としては、デオキシイノシン、デオキシウラシル、S化塩基などが挙げられるが、これらに限定されるものではない。本発明に係るプライマーは、ホスホロチオエート結合やホスホロアミデート結合などを含む任意の誘導体オリゴヌクレオチドを含むものであってもよいし、ペプチド核酸結合を含むペプチド-核酸(PNA)を含んでいてもよい。本発明に係るプライマーは、DNAであってもRNAであってもよく、RNAである場合には、その塩基配列はDNA配列における「T(チミン)」を「U(ウラシル)」に読み替えるものとする。
【0032】
一実施形態では、変異検出対象のエチレン受容体遺伝子の少なくとも一部、例えば膜貫通領域の全体又はその少なくとも一部を含む配列を増幅するように設計されたプライマーセットを、機能抑制変異の検出に用いることができる。当該プライマーセットは、例えば、エチレン受容体遺伝子の配列番号1に示される塩基配列上の15〜30塩基の配列、及び配列番号1に示される塩基配列に相補的な配列上の15〜30塩基の配列をそれぞれ含むプライマーのセットであって、配列番号1に示される塩基配列を基準とした場合に39位〜58位、68位〜88位及び108位〜128位に位置するエチレン受容体遺伝子膜貫通領域の少なくとも一部、好ましくはこれら3つの配列のいずれか又は全部を含む配列を増幅するように設計されたプライマーセットでありうる。エチレン受容体遺伝子の機能抑制変異の検出に用いることができるプライマーセットの具体例としては、例えば、配列番号3に示される塩基配列を含むプライマーと配列番号4に示される塩基配列を含むプライマーを含むプライマーセットが挙げられる。上記プライマーセットの設計は被験植物又はその近縁植物のエチレン受容体遺伝子の塩基配列に基づいて当業者であれば容易に行うことができる。上記プライマーセットは、ネコブセンチュウ抵抗性が野生型植物と比較して増加している、植物のネコブセンチュウ抵抗性検査用として好適である。本発明は、このようなプライマーセットも提供する。
【0033】
エチレン受容体遺伝子における塩基変異の検出は、TILLING(登録商標)法(Targeting Induced Local Lesion In Genomes)(Till et al., Methods Mol. Biol., 236: 205-220 (2003))を用いて実施することもできる。TILLING法では、ミスマッチ対認識酵素(CEL1やエンドヌクレアーゼ)で核酸二重鎖において塩基対を形成していない変異部位を切断することにより、変異塩基の位置を同定することができる。具体的には、変異型エチレン受容体遺伝子を含む可能性がある被験植物由来核酸プールのDNAを鋳型として、変異を検出しようとする領域を特異的に増幅するプライマーセットを用いてPCR増幅し、増幅産物を熱変性で一本鎖とした後、冷却して再度巻き戻させることで変異型遺伝子と野生型遺伝子の増幅DNA鎖間で形成されたヘテロ二重鎖を含む二本鎖DNAプールを調製し、これをミスマッチ対認識酵素で処理して変異部位を切断することにより、上記増幅産物から切断部位に応じて異なる長さのDNA断片を生成させ、これを電気泳動することにより、増幅産物に加えて変異部位での切断で生じた異なる長さのDNA断片のバンドが検出される。さらに、変異を含むことが示された植物系統から抽出したDNAについて変異部位を含むDNA断片を核酸増幅し、それについて塩基配列を決定・解析すれば、変異部位及び変異後の塩基を同定することができる。次いで得られた配列を解析することにより、エチレン受容体遺伝子の機能抑制変異又はその可能性が高い変異に該当するかどうかを調べることができる。この方法は変異体プールからエチレン受容体遺伝子の未知の機能抑制変異を検出する際に特に有用である。 あるいは、エチレン受容体遺伝子の機能抑制変異の検出は、被験植物から調製した核酸(好ましくは、抽出したトータルRNAから逆転写したcDNA)を鋳型として、当該変異を含む配列を核酸増幅することに基づいて行うことができる。変異を含む配列に対して設計した特異的プライマーを核酸増幅に用いれば、そのエチレン受容体遺伝子の機能抑制変異を含有する領域を特異的に増幅することができる。また変異を含む領域について増幅した核酸を配列決定し解析することにより、所定のエチレン受容体遺伝子の機能抑制変異の有無を決定することができる。この方法は、エチレン受容体の活性が抑制されエチレン感受性の低下をもたらすことが既知のエチレン受容体遺伝子の機能抑制変異を検出する場合に、特に有用である。
【0034】
以上のようにしてエチレン受容体遺伝子においてエチレン受容体の機能を抑制する変異又はその可能性がある塩基変異が見出された場合には、その変異に基づくエチレン感受性の低下を確認するため、当該変異を有する植物についてエチレン感受性を調べることが好ましい。
【0035】
被験植物のエチレン感受性は当業者に公知の任意のエチレン感受性判定方法により検査すればよい。好ましい例では、エチレン感受性の検査は、後述の実施例2に記載のようにして種子を用いて行うことができる。例えば、検査対象の植物の種子を培地中で発芽させた後、エチレンを適当量(例えば、1〜50ppm、好ましくは10 ppm濃度)で注入して密閉状態とし、実生を暗黒下で野生型で胚軸と根が一定程度成長するのに適切な温度及び期間(例えば、25℃で7日間)にわたり育成した後、胚軸と根の長さを測定する(エチレン存在下)。またコントロールとしてエチレンを注入しないこと以外は同様にして実生を育成し、胚軸と根の長さを測定する(エチレン非存在下)。野生型ネコブセンチュウ易感染性植物では、エチレン感受性のため、エチレン存在下の育成ではコントロールと比較して胚軸と根の長さが顕著に短くなる。これに対し、被験植物においてエチレン存在下での育成後に測定した胚軸及び根の長さが、野生型と比較して有意に長く、コントロールと比較してあまり短くならない場合、当該被験植物はエチレン感受性が低下していると判定することができる。具体的には、被験植物においてエチレン存在下で測定した胚軸及び根の少なくとも一方(好ましくは両方)の長さ(好ましくは平均値)をコントロールでの長さと比較した比率(%)が、対応する野生型植物のエチレン存在下での長さを野生型コントロールでの長さと比較した比率(%)の1.3倍以上、好ましくは2.2倍以上高い場合、被験植物のエチレン感受性が低下していると判断することができる。あるいは、例えばトマトの場合には、被験植物においてエチレン存在下で測定した胚軸及び根の少なくとも一方(好ましくは両方)の長さがコントロールの40%以上である場合には被験植物のエチレン感受性が低下していると判断することもできる。エチレン感受性の低下をもたらすエチレン受容体遺伝子の機能抑制変異を有する被験トマト植物においては、エチレン存在下で測定した胚軸及び根の少なくとも一方(好ましくは両方)の長さはコントロールの40%以上、好ましくは60%以上、より好ましくは80%以上、特に好ましくは90%以上、非常に好適な例では95%以上である。被験植物のエチレン感受性の低下が示された場合、被験植物において上記のように見出されたエチレン受容体遺伝子の変異がエチレン受容体遺伝子の機能抑制変異であることが裏付けられる。胚軸及び根の長さがコントロールの95%以上、例えば98%以上である場合、被験植物はほぼエチレン非感受性である。このエチレン感受性の低下レベルは、ネコブセンチュウに対する被験植物の抵抗性の強さと相関する。
【0036】
本発明では、以上のような検出方法により、エチレン感受性の低下をもたらすエチレン受容体遺伝子の機能抑制変異を有する被験植物を判別し、それを選択することができる。このような被験植物においては、ネコブセンチュウに対する抵抗性の増加が認められる。ネコブセンチュウに対する抵抗性の増加は、エチレン受容体遺伝子の機能抑制変異をヘテロ接合で有する被験植物においても認められるが、エチレン受容体遺伝子の機能抑制変異をホモ接合で有する被験植物において顕著に認められる。
【0037】
被験植物のネコブセンチュウに対する抵抗性は、当業者に公知の任意の方法を用いて検査することができるが、例えば図2に示すようなネコブセンチュウ感染試験によって検査することができる。具体的には例えば、ネコブセンチュウ感染試験は、被験植物の植物体を育成後、植物体1個について一定数(一例では200匹)のネコブセンチュウ第2期(J2)幼虫をその培養土に接種し、2ヶ月後に感染状態の評価を行うことにより行う。評価は、植物体の根における瘤の数、及び/又はネコブセンチュウの卵塊数を計数することが好ましい。この評価ではまた、染色法によるセンチュウの形態の観察を行うことも好ましい。瘤の数は、目視により計数することができる。卵塊数はフロキシンB(例えば0.015 %(w/v))により根を染色(例えば15分間)した後、染色された卵塊を計数すればよい。感染根におけるセンチュウの形態の観察は、感染根を水で洗浄し土を除去した後、有効塩素濃度2 %(v/v)の次亜塩素酸ナトリウム溶液を入れたチューブ中でインキュベート(例えば2〜5分、好ましくは3分間)し、溶液を除去後、感染根を洗浄し、蒸留水中でインキュベートし、蒸留水を除き、0.05 %酸性フクシン染色液に浸し、高温(好ましくは95℃)のウォーターバス中でインキュベート(例えば3分間)した後、酸性フクシン染色液を除き、溶液が透明になるまで蒸留水で数回洗浄し、蒸留水を除き、酸性グリセロール溶液を感染根が完全に浸るように加え、高温(好ましくは95℃)のウォーターバス中でインキュベート(例えば30分間)後、室温になるまで静置した後、実体顕微鏡を用いて感染根におけるセンチュウの形態を観察することができる。
【0038】
ネコブセンチュウ感染試験の結果、瘤の数及び/又は卵塊数を、野生型植物とエチレン受容体遺伝子の機能抑制変異を有する被験植物(変異型植物)との間で比較し、変異型植物における瘤の数又は卵塊数の少なくとも一方、好ましくは両方が、通常は平均値で、野生型植物と比較して有意に少ない場合、ネコブセンチュウに対する抵抗性が増加したことが示される。本発明に係るエチレン感受性の低下をもたらすエチレン受容体遺伝子の機能抑制変異を有する被験植物では、通常、瘤の数又は卵塊数の少なくとも一方、好ましくは両方が、野生型植物と比較して70%未満、典型的には60%未満、好ましくは50%未満、より好ましくは30%未満、さらに好ましくは20%未満、特に好ましくは10%未満である。このようにしてエチレン受容体遺伝子の機能抑制変異を有する被験植物のネコブセンチュウに対する抵抗性の増加を確認することができる。
【0039】
本発明では、以上のようにして、ネコブセンチュウ抵抗性が増加した植物を選択し、それを取得することができる。この方法は、例えば、ネコブセンチュウ易感染性植物種の植物に対する変異誘発によって得られた変異体植物集団から、ネコブセンチュウ抵抗性が増加した植物を選抜するために実施してもよい。植物における変異誘発は、当業者に公知の任意の方法によって実施することができ、例えば、変異原化合物への曝露、放射線やレーザービームの照射等によって行うことができる。
【0040】
あるいは、本発明の上記選択方法は、植物新品種育種過程において新品種候補となる複数の植物系統について、ネコブセンチュウ抵抗性が増加した植物系統を選抜するために実施してもよい。この本発明の方法は、ネコブセンチュウ抵抗性品種育種のための母材を提供し、また育種過程での効果的なネコブセンチュウ抵抗性選抜手法を提供する。
【0041】
本発明はまた、ネコブセンチュウ易感染性植物種の植物にエチレン受容体遺伝子の機能抑制変異を導入し、エチレン感受性を低下させることを特徴とする、ネコブセンチュウ抵抗性が増加した植物の作製方法も提供する。この方法は、ネコブセンチュウ高抵抗性植物品種の育種のために好適に利用できる。
【0042】
ネコブセンチュウ易感染性植物種の植物に導入するエチレン受容体遺伝子の機能抑制変異は、上記で説明したとおりである。植物への変異導入は、一実施形態では、変異原曝露等の任意の突然変異誘発技術によって行うこともできるし、変異型エチレン受容体遺伝子を導入して過剰発現させる等の手法により遺伝子工学的に導入することもできる。ネコブセンチュウ易感染性植物種の植物への変異型エチレン受容体遺伝子の導入は、例えば、エチレン感受性の低下をもたらす機能抑制変異を有するエチレン受容体遺伝子を、ネコブセンチュウ易感染性植物種の植物(例えば、トマト)等で利用可能な発現ベクター又は発現カセット等の核酸構築物に挿入し、それをネコブセンチュウ易感染性植物種の植物に導入して形質転換植物を作成することにより、実施することができる。
【0043】
変異型エチレン受容体遺伝子を挿入する植物発現ベクターとしては、アグロバクテリウム法を用いる場合には、バイナリーベクターなどのアグロバクテリウム法に適した発現ベクター又はその改変ベクターを用いることが好ましい。そのような植物発現用ベクターとしては、例えば、pBI121、pBIN19、pSMAB704、pCAMBIA、pGreen等が挙げられる。変異型エチレン受容体遺伝子を含む発現ベクターはまた、ベクターが細胞内に保持されていることを示す選択マーカー遺伝子やレポーター遺伝子、ベクター内に簡単に正しい向きで遺伝子を挿入するためのポリリンカー、ポリA付加配列、分泌シグナル配列、精製用のヒスチジンタグ配列等の有用な配列を必要に応じてさらに含んでもよい。選択マーカー遺伝子としては、例えばジヒドロ葉酸還元酵素遺伝子、ハイグロマイシン耐性遺伝子、アンピシリン耐性遺伝子、カナマイシン耐性遺伝子、ネオマイシン耐性遺伝子、クロラムフェニコール耐性遺伝子(CAT遺伝子)等が挙げられる。本発明では、植物プロモーターの制御下に変異型エチレン受容体遺伝子を含む発現カセットも遺伝子導入用に使用できる。本発明において「発現カセット」とは、プロモーターの制御下に発現対象の遺伝子を含む、自律複製能を有しないDNA断片をいう。
【0044】
変異型エチレン受容体遺伝子を含む発現ベクター又は発現カセットのネコブセンチュウ易感染性植物種の植物への導入は、常法により行うことができる。アグロバクテリウム法を用いる場合は、アグロバクテリウム法に適した発現ベクターに変異型エチレン受容体遺伝子を挿入した後、適当なアグロバクテリウム、例えばアグロバクテリウム・ツメファシエンス(Agrobacterium tumefaciens)にエレクトロポレーション法などにより導入し、この菌株を植物細胞、カルス、又は子葉切片等に接種して感染させればよい。好適なアグロバクテリウムとしては、限定するものではないが、GV3101、C58、C58C1Rif(R)、EHA101、EHA105、AGL1、LBA4404等の株を利用することができる。
【0045】
遺伝子導入はパーティクルガン法やエレクトロポレーション法を利用してもよい。導入対象の宿主試料としては、植物の葉などの切片を使用してもよく、プロトプラストを調製して使用してもよい(Christou P, et al., Bio/technology (1991) 9: 957-962)。例えばパーティクルガン法では、遺伝子導入装置(例えばPDS-1000(BIO-RAD社)等)を製造業者の説明書に従って使用して、本発明に係る発現ベクター又はDNA構築物をまぶした金属粒子をこのような試料に打ち込むことにより、植物細胞内に導入させ、形質転換植物細胞を得ることができる。操作条件は、通常は450〜2000psi程度の圧力、4〜12cm程度の距離で行う。
【0046】
次いで、本発明に係る発現ベクター又は核酸構築物を導入した植物細胞や子葉切片等を、例えば従来知られている植物組織培養法に従って選択培地で培養し、生存したカルスを再分化培地(適当な濃度の植物ホルモン(オーキシン、サイトカイニン、ジベレリン、アブシジン酸、エチレン、ブラシノライド等)を含む)で培養することにより、形質転換された植物体を再生することができる。このようにして形質転換植物を取得できる。
【0047】
別の実施形態では、変異導入は、RNAi(RNA干渉)を利用した方法で遺伝子工学的に行うこともできる。例えば、エチレン受容体遺伝子の全部又は一部の塩基配列に対して相補的な塩基配列を含むアンチセンス核酸をコードするDNAを含む核酸構築物(発現ベクターや発現カセット)、又はエチレン受容体遺伝子の全部又は一部の塩基配列とそれに相補的な塩基配列を含むアンチセンス核酸を含むRNAをコードするDNAを含む核酸構築物(発現ベクターや発現カセット)をネコブセンチュウ易感染性植物種の植物に導入し、発現させる方法が挙げられる。植物への導入方法は上記と同じである。その発現により、アンチセンス核酸、又は分子内会合によりヘアピン構造を有する長鎖又は短鎖dsRNAが植物細胞内で生成され、これがRNAiを誘導し、エチレン受容体遺伝子のmRNAの特異的分解を促進し、エチレン受容体遺伝子の機能を効果的にノックダウンすることができる。好ましい実施形態では、発現カセットから発現されるdsRNAは、エチレン受容体遺伝子中の連続した21塩基以上の塩基配列からなるセンス配列とその塩基配列に対して相補的なアンチセンス配列とが、スペーサー配列を挟んで連結されている配列を含むRNA分子であることが好ましい。このようなRNA分子は、ステムループ構造(ヘアピン構造)を有するdsRNAを形成する。そのようなRNAにおいては、そのセンス配列とアンチセンス配列とがスペーサー配列に対していずれが5'側又は3'側に位置するように配置されていてもよい。例えば、そのようなdsRNA中のセンス配列がスペーサー配列の3'末端に、アンチセンス配列がスペーサー配列の5'末端に連結されていてもよい。スペーサー配列は、分子内会合による二本鎖形成を阻害せずにステムループのループ構造部分を構成可能なものであることが好ましい。そのようなdsRNA中のセンス配列及びアンチセンス配列は、短鎖dsRNAを形成させる場合には、エチレン受容体遺伝子中の連続した21〜49塩基、好ましくは21〜25塩基、より好ましくは21〜23塩基の塩基配列である。一方、長鎖dsRNAを形成させる場合には、センス配列及びアンチセンス配列は、、エチレン受容体遺伝子中の連続した50塩基以上、2000塩基以下、さらに好ましくは100塩基以上、特に好ましくは500塩基以上であり、典型的には1000塩基以下、より好ましくは800塩基以下、さらに好ましくは500〜700塩基、特に好ましくは500〜600塩基の塩基配列である。本発明では、このようなRNAサイレンシングに基づく方法により、被験植物に内在するエチレン受容体遺伝子の発現を抑制することもできる。このようにして変異を導入した植物細胞から、上記と同様にして形質転換植物を取得することができる。
【0048】
以上のようにして遺伝子工学的に作製された形質転換植物(遺伝子組換え植物)について、エチレン感受性試験を行ってエチレン感受性の低下を確認することが好ましい。また得られた形質転換植物を自家交雑することにより、ヘテロ接合個体に加えてホモ接合個体を得ることができる。これらの形質転換植物は、ヘテロ接合体もホモ接合体もネコブセンチュウ抵抗性の増加を示す。このようにしてネコブセンチュウ高抵抗性を安定的に有する植物を遺伝子工学的に作製することができる。
【0049】
別の実施形態では、植物への変異導入は、エチレン受容体遺伝子の機能抑制変異を有するネコブセンチュウ易感染性植物種の植物を育種親として用いる交雑によって当該変異を導入することが好ましい。エチレン受容体遺伝子の機能抑制変異を導入した植物については、上述のエチレン感受性試験により、エチレン感受性の低下を確認することが望ましい。「エチレン受容体遺伝子の機能抑制変異を有するネコブセンチュウ易感染性植物種の植物を育種親として用いる交雑」とは、当該植物を種子親及び花粉親の少なくとも一方として利用して交雑させることを意味する。交雑に用いるエチレン受容体遺伝子の機能抑制変異を有するネコブセンチュウ易感染性植物種の植物は、上述のネコブセンチュウ抵抗性が増加した植物を選択する方法によって得られた、エチレン感受性の低下をもたらすエチレン受容体遺伝子の機能抑制変異をヘテロ接合又はホモ接合で有する植物個体であってもよいし、その植物個体を野生型又は他の植物品種・系統と交雑(例えば、戻し交雑)するか又は自家交雑して得られる子孫植物であってもよい。子孫植物は、F1個体であってもよいし、F2〜F5個体であってもよいし、そのさらに後代の個体であってもよい。戻し交雑は、限定するものではないが、特定の交雑相手との戻し交雑を繰り返し行う連続戻し交雑であることが好ましく、この場合、交雑相手は反復親と呼ばれることがある。エチレン受容体遺伝子の機能抑制変異を有するネコブセンチュウ易感染性植物種の植物を育種親として用いる交雑による育種では、ネコブセンチュウ高抵抗性形質だけを野生型植物に導入するために、エチレン受容体遺伝子の機能抑制変異をヘテロ接合で有する植物個体を、野生型個体に繰り返し戻し交雑する連続戻し交雑を行うことも好ましい。得られた子孫植物個体については、エチレン感受性を検査してエチレン感受性の低下を確認することが好ましい。このような、エチレン受容体遺伝子の機能抑制変異を有するネコブセンチュウ易感染性植物種の植物を育種親として用いる交雑により当該変異を導入する育種方法によれば、ネコブセンチュウ高抵抗性を安定的に有する植物を作製することができる。
【0050】
以上のようにして得られるネコブセンチュウ抵抗性が増加した植物は、ネコブセンチュウ易感染性植物種の植物の栽培において、ネコブセンチュウによる植物病害の防除のために使用することができる。本発明はこのような植物の栽培方法も提供する。
【0051】
具体的には、例えば、上述の方法によりネコブセンチュウ抵抗性を増加させた、エチレン受容体遺伝子の機能抑制変異を有する植物を台木とし、ネコブセンチュウ易感染性植物種の当該変異を有しない他の植物を穂木として接ぎ木を行うことにより、そのネコブセンチュウ易感染性植物種の植物のネコブセンチュウ抵抗性を高めることができる。これにより、ネコブセンチュウ易感染性植物種の栽培においてネコブセンチュウによる植物病害を防除することができる。
【0052】
別の実施形態では、例えば、上述の方法によりネコブセンチュウ抵抗性を増加させた、エチレン受容体遺伝子の機能抑制変異を有する植物を、ネコブセンチュウ易感染性植物とを混合栽培することによる植物の栽培方法も提供する。ネコブセンチュウ抵抗性を増加させた植物を同じ栽培区画内で一緒に栽培することにより、栽培区画全体でのネコブセンチュウの量を低減することができ、それにより、当該栽培区画でのネコブセンチュウによる植物病害を軽減することができる。
【0053】
別の実施形態では、ネコブセンチュウによる植物病害が認められる栽培区画において、上述の方法によりネコブセンチュウ抵抗性を増加させた植物を栽培することにより、土壌中のネコブセンチュウを低減することができ、ネコブセンチュウによる植物病害を防除することができる。すなわち上述の方法によりネコブセンチュウ抵抗性を増加させた植物はセンチュウへの対抗植物として有利に使用できる。
【実施例】
【0054】
以下、実施例を用いて本発明をさらに具体的に説明する。但し、本発明の技術的範囲はこれら実施例に限定されるものではない。
【0055】
[実施例1]
(変異誘発系統におけるエチレン受容体遺伝子変異の同定)
矮性トマト(Solanum lycopersicum)系統マイクロトム(Micro-Tom)の種子(National BioResource Project(NBRP), MEXT, JAPANより分譲可能)を、0.7%、1.0%、1.5%濃度のメタンスルホン酸エチル(EMS)で変異処理した。各処理区につき、1000〜3000粒の種子を用いた。この処理は、室温で8時間種子を水に浸した後、EMS溶液中でゆっくり撹拌しながら16時間浸すことで行った。この変異処理した当代種子をM1種子と称した。EMS処理後のM1種子を蒸留水中で4時間洗浄した。この洗浄ステップを3回繰り返し、残存するEMSを除去した。M1種子を温室に播種し、育成したM1植物の果実から次世代のM2種子を収穫した。単一のM1植物個体(変異誘発系統)から得られたM2種子をファミリーとして各10粒を播種し、植物個体を育成した。
【0056】
各M1植物個体由来のM2ファミリー10個体から葉を1枚ずつ採集し、ゲノムDNAを抽出した。抽出には、Promega社のDNA精製キットMaxwell 16 Tissue DNA Purification Kitを使用した。96穴プレートに抽出したDNA溶液を整列化し、スーパープールを作製した。スーパープールでは、一つのウェル(穴)には、8ファミリーに由来するDNA溶液を混合して入れた。DNA濃度調整は、各ウェルから一部を取って電気泳動し、同時に濃度マーカーを泳動して染色後のDNAバンドの濃さを目安に予測した。
【0057】
次いで上記のようにして得られたゲノムDNAを鋳型として、トマト(Solanum lycopersicum)エチレン受容体遺伝子(ETR1)(SlETR1とも称する)(GenBankアクセッション番号AF043084、U41103.1;開始コドンから終止コドンまでのタンパク質コード領域(CDS)の塩基配列を配列番号1に示し、この遺伝子にコードされるエチレン受容体タンパク質のアミノ酸配列を配列番号2に示す)をPCR増幅した。なお数千の変異誘発系統について得たゲノムDNAをそれぞれPCR増幅に用いた。PCRには、エチレン受容体遺伝子ETR1の膜貫通領域(配列番号1の39位〜58位と、68位〜88位と、108位〜128位)の全体を含む配列を標的として設計した以下のトマトエチレン受容体遺伝子ETR1増幅用プライマーセットを用いた。
【0058】
フォワードプライマー SlETR1-Fw: 5'-gtataaaaggagttggggcaaag-3'(配列番号3)
リバースプライマー SlETR1-Rev: 5'-cacccagaactcagtatgtcaacg-3'(配列番号4)
なおプライマーSlETR1-Fwは蛍光色素IRD700(蛍光波長715nm;Biomers)で、プライマーSlETR1-RevはIRD-800(蛍光波長815nm;Biomers)で標識したものを用いた。PCRは、5〜10 ngの上記スーパープールDNAを鋳型に用いて、次の条件で行った。
【0059】
PCR反応液は、1.5 μlの5x Green Gotaq Flexi buffer、2.0 μlの25 mM MgCl2、1.2 μlの2.5 mM dNTP、0.3 μlの10 μMの各プライマー及び0.075 μlの5 U/μl DNAポリメラーゼ(Gotaq Hotstart DNA polymerase又はGotaq Flexi DNA Polymerase; Promega)を加えて全量で15 μlとしたものを用いた。PCRサイクルは以下の通り:95℃で2分、次いで95℃で30秒、60℃で30秒、及び72℃で60秒を40サイクル、そして72℃で5分の最終伸長。
【0060】
得られた増幅産物を用い、TILLING(登録商標)法(Targeting Induced Local Lesion In Genomes)に基づき、エチレン受容体遺伝子に変異を有する個体の検出を以下のようにして行った。TILLING法における二本鎖DNAのミスマッチ部位検出には、トマトエンドヌクレアーゼ1を使用した。
【0061】
トマトエンドヌクレアーゼ1の調製のため、トマトエンドヌクレアーゼ1(SlENDO1)遺伝子(GenBankアクセッション番号 AB667996、配列番号5;この遺伝子にコードされるエンドヌクレアーゼ1アミノ酸配列を配列番号6に示す)を含むDNA断片をバイナリベクターpGWB8(Nakagawa T et al., J. Biosci. Bioeng., 104(1):34-41 (2007))にクローニングした。これをトマト品種マイクロトムに導入して形質転換体を作製し、C末端側にヒスチジンタグが付加されたトマトエンドヌクレアーゼ1タンパク質を発現させた。タンパク質の精製は次のように行った。形質転換マイクロトムの葉約2 gを10 mlの溶出バッファー[0.1 M Tris-HCl(pH8.0)、1 mM フェニルメチルスルホニルフルオリド(PMSF)、0.125 mM 2-メルカプトエタノール、及び10% グリセロール]中で潰した後、遠心分離によって上清を得た。この上清をHistrap HPカラム(GE healthcare)にかけて、ヒスチジンタグ付きトマトエンドヌクレアーゼ1を精製した。
【0062】
TILLING法による変異検出は、LI-COR DNA Analyzerを用いて行った。上記で得た増幅産物を加熱変性し、次いで冷却することで野生型DNA鎖と変異型DNA鎖とのヘテロ二重鎖を形成させ、それをトマトエンドヌクレアーゼ1で処理することでミスマッチのある変異部位で切断し、それを加熱変性し、得られた一本鎖断片を電気泳動してフラグメント解析にかけることにより、標的領域であるトマトエチレン受容体遺伝子中に導入された変異を検出した。さらに得られた変異を含むDNA断片の配列決定を行い、野生型配列と比較して変異の同定を行った。特にアミノ酸置換を引き起こす塩基変異を選抜した。
【0063】
その結果、2つの個体のトマトエチレン受容体遺伝子中にアミノ酸置換を引き起こす塩基変異が見出された。これらの変異型遺伝子をそれぞれSletr1-1及びSletr1-2と名付けた。表1にSletr1-1及びSletr1-2で見出された変異を示す。
【0064】
【表1】

【0065】
表1に示す変異型トマトエチレン受容体遺伝子中のアミノ酸置換P51LとV69Dは、それぞれ、野生型トマトエチレン受容体タンパク質(配列番号2)の51位のプロリンのロイシンへの置換、及び69位のバリンのアスパラギン酸への置換(いずれも膜貫通領域内)を表す。
【0066】
[実施例2]
(変異型エチレン受容体遺伝子を有する変異個体におけるエチレン感受性の解析)
実施例1で取得した変異型SlETR1(Sletr1-1、Sletr1-2)をホモ接合で有する変異トマト個体のエチレン感受性試験を次のように行った。
【0067】
容量50 mlのガラス製容器に1/2 濃度MS固形培地(Murashige and Skoog, Physiol Plant 15(3): 473-497, 1962)を適量入れ、その中で変異個体の種子を発芽させた。ここで試験した種子は、実施例1で得たM2個体を自家交雑して得た、エチレン受容体遺伝子変異についてホモ接合性であるM3種子である。次いでエチレンを10 ppm濃度で注入し(エチレン存在下)、シリコン栓で密閉した状態で実生を暗黒下、25℃で7日間育成した後、胚軸と根の長さを計測した。コントロールではエチレンを注入せずに(エチレン非存在下;コントロール)同様に育成を行い、計測を行った。その結果を図1及び表2に示す。
【0068】
【表2】

【0069】
野生型個体ではエチレン存在下の胚軸と根の長さはエチレン非存在下と比較して顕著に短くなるが、エチレン非感受性を有する個体の場合、胚軸と根は短縮化せず、野生型と比較するとエチレン存在下での胚軸と根が長くなる。測定の結果、Sletr1-1ホモ接合個体における10 ppmエチレン存在下での胚軸と根の長さは、エチレン存在下の野生型個体よりも長く、またエチレン非存在下のSletr1-1ホモ接合個体と比較してもほぼ変化が見られなかった(図1及び表2)。この結果はSletr1-1ホモ接合個体の明らかなエチレン非感受性を示していた。一方、Sletr1-2ホモ接合個体での10 ppmエチレン存在下での胚軸と根の長さは、野生型個体よりも長いがSletr1-1ホモ接合個体よりは短く、エチレン非存在下のSletr1-2ホモ接合個体と比べると少し短かった(図1及び表2)。この結果はSletr1-2ホモ接合個体ではエチレン感受性が低下しているがその低下レベルはSletr1-1ホモ接合個体よりも低いことを示していた。
【0070】
以上より、上記で同定されたエチレン受容体遺伝子における変異(表1)がトマト変異個体Sletr1-1及びSletr1-2においてエチレン感受性の低下をもたらしたこと、すなわち上記変異がエチレン受容体の少なくとも一部の機能抑制をもたらすことが示された。
【0071】
なお、Sletr1-1、Sletr1-2をそれぞれヘテロ接合で有する変異トマト個体についても、エチレン感受性を調べた。その結果、両方の変異個体において、野生型と比較してエチレン感受性の低下が示されたが、対応するホモ接合性変異個体よりはエチレン感受性の低下レベルは小さかった。したがってエチレン受容体遺伝子の機能抑制変異は、変異個体のエチレン感受性を、アレル数依存的にホモ接合体においてより大きく低下させることが示された。
【0072】
[実施例3]
実施例2で使用したSletr1-1、Sletr1-2ホモ接合個体に対してネコブセンチュウ感染試験を行った。図2に試験方法の模式図を示した。
【0073】
供試トマト植物体は、植物培養用インキュベーター(TOMY, CF-305)、クレハ園芸培土及び5×5連結ポット(信和株式会社)を用いて、一定栽培条件下(16時間明期、23〜25℃、照度13,000 lx)で栽培した。
【0074】
また、キタネコブセンチュウ感染トマト個体から瘤及び卵塊を含む感染根を適量の水を入れたガラスビーカーに採取し、エアーポンプを用いて酸素を供給し、孵化したネコブセンチュウを新しいガラスビーカーに回収することによって、ネコブセンチュウ第2期幼虫(J2)を取得した。回収したJ2幼虫について、500 μlあたりの匹数を実体顕微鏡下でカウントした後、ネコブセンチュウ感染試験に供試した。
【0075】
ネコブセンチュウ感染試験は供試トマト植物体(マイクロトム野生型及びその変異体)を、上記の一定栽培条件で3週間育成後、植物体あたり約200匹のJ2幼虫をその培養土に接種し、2ヶ月後に感染状態の評価を行った。評価は、植物体の根における瘤の数、卵塊数、及び染色法によるセンチュウの形態の観察により行った。瘤の数は、目視によりカウントした。卵塊数は0.015 %(w/v)のフロキシンB(WAKO)により根を15分間染色した後、染色された卵塊をカウントした。感染根におけるセンチュウの形態の観察は、感染根を水で洗浄し土を除去した後、有効塩素濃度2 %(v/v)の次亜塩素酸ナトリウム溶液を入れた15 mlチューブ中で3分間インキュベートし、溶液を除去後、蒸留水で数回感染根を洗浄し、蒸留水中で10分間インキュベートした。次に蒸留水を除き、0.05 %の酸性フクシン染色液に浸し、95℃のウォーターバス中で3分間インキュベートした。酸性フクシン染色液を除き、溶液が透明になるまで蒸留水で数回洗浄した。蒸留水を除き、酸性グリセロール溶液を感染根が完全に浸るように15 mlに加え、95℃のウォーターバス中で30分間インキュベート後、室温になるまで静置した。感染根をシャーレに移し、実体顕微鏡を用いて感染根におけるセンチュウの形態を観察した。その結果、野生型では脱皮した第4期幼虫(J4)が確認できたが、変異体ではJ4の形態を示す幼虫の存在が確認できないか、極めて少数であった。
【0076】
感染試験の結果、瘤の数は野生型で6.5個(n=4, SE=1.3)、エチレン受容体変異体ではSletr1-1で3.3個(n=4, SE=0.63)、Sletr1-2で3.5個(n=6, SE=0.62)であった(図3A)。卵塊数は野生型で9個(SE=1.1)、エチレン受容体変異体ではSletr1-1で0.75個(SE=0.5)、Sletr1-2で4.2個(SE=0.8)であった(図3B)。
【0077】
この結果から、エチレン感受性の減少は、ネコブセンチュウの卵塊形成に対して強い抑制効果をもつことが示された。さらに、ネコブセンチュウの卵塊形成が野生型よりもSletr1-2の方が少なく、Sletr1-2よりもSletr1-1の方がさらに少ないことが示されたが、これは実施例2でエチレン感受性の高さが野生型 > Sletr1-2 > Sletr1-1であった結果と完全に一致している。すなわち、本実施例の結果は、植物のエチレン感受性が低いほど、ネコブセンチュウの卵塊形成に対する抑制能も増大することを示している。これにより、エチレン感受性を低下させるほど、植物のネコブセンチュウへの抵抗性をより増加させることができることが示された。特にSletr1-1では、感染試験において、エチレン受容体変異体の根における卵塊形成が野生型と比較して10%未満に大幅に減少した。Sletr1-1では、実施例2でエチレンに対しほぼ非感受性であることが示されており、機能欠損したエチレン受容体を有する植物個体がネコブセンチュウに対し特に強い抵抗性を有することが明らかとなった。このようなエチレン受容体機能抑制変異個体、特にエチレン受容体機能欠損変異個体はネコブセンチュウに対する対抗植物として有用と考えられる。
【産業上の利用可能性】
【0078】
本発明は、植物のネコブセンチュウへの抵抗性を増加させるために使用することができる。本発明の方法は、ネコブセンチュウによる植物病害を生物的に防除するために利用できる。本発明の方法によれば、従来から行われている化学的防除法と異なり、土壌汚染等の環境負荷を軽減でき、家畜や生態系への影響もより軽微なものに留めることができることが期待される。すなわち本発明の方法は、作物の安定性を高めながら、安定的かつ持続的にネコブセンチュウによる植物病害を防除するために利用できる。
【配列表フリーテキスト】
【0079】
配列番号3及び4:プライマー
【技術分野】
【0001】
本発明は、植物のネコブセンチュウ抵抗性を増加させる方法に関する。
【背景技術】
【0002】
植物寄生性センチュウの宿主範囲は広く、2000種を超える植物に寄生するとされている。農業上重要な作物も例外ではなく、露地根菜類から施設果菜類に著しい減収や枯死を起こし、その被害額は全世界で1500億ドルに上ると報告されている。「イモムシ状」の小動物であるネコブセンチュウは、様々な農作物の根に寄生し、根系の形成異常、病原体感受性の亢進、生産性の顕著な低下を引き起こす。土壌中に隠れた状態で被害が進行するため制御が難しく、現在唯一有効な防御法とされているのは、毒性の強い化学物質(殺センチュウ剤)の散布である。国内では、予防手段として、同時に2、3種類の殺センチュウ剤を土壌散布した後播種するのが通例となっている。我が国は、世界で最も多く殺センチュウ剤を使用している国の一つである。
【0003】
殺センチュウ剤のように強い毒性を示す化学物質は土壌汚染の原因となっており、環境や生態系への悪影響が懸念されている。主要な殺センチュウ剤である臭化メチルは、成層圏のオゾン層破壊を引き起こすとして、2005年以降使用が禁止された。更に、化学合成農薬の環境や家畜、土壌生態系に与える影響、また食の安全に対する意識向上から、環境保全型、持続型防除技術の導入が強く求められている。
【0004】
世界的に大きな問題であるにも関わらず、これまでに単離されているセンチュウ抵抗性遺伝子は極めて少なく、トマトでは野生種に由来するMi-1が数少ない例である(非特許文献1)。この遺伝子はロイシンリッチリピートを有する抵抗性(R)遺伝子であり、交雑によってトマト栽培種に導入されてきた。しかしながら、一部のネコブセンチュウ種(キタネコブセンチュウ)に対して効果が無いことや、高温(30℃以上)で効果が失われる点が問題であった。更に、この抵抗性は国内の一部地域において既に打破されているとの報告があることから、今後利用できなくなる可能性が高い。現在、抵抗性を付与する新たな遺伝資源の開発が強く望まれている。
【0005】
一方、植物では、果実の成熟、休眠打破、花や葉の老化促進等を初めとするエチレンの様々な生理作用が知られている。エチレン非感受性変異体等のエチレン感受性(応答性)が変化した変異体は多数報告されており、例えばトマトでは、Nr(非特許文献2)、rin(非特許文献3)、Gr(非特許文献4)等がある。エチレン受容体は膜貫通ドメインとヒスチジンキナーゼドメインを有する膜タンパク質である。エチレンがエチレン受容体に結合すると、負の応答制御シグナルが遮断されてエチレン応答が生じる。エチレン受容体の構造を改変する変異はエチレン感受性を大幅に低下させることが知られており、そのような変異を有する変異型エチレン受容体遺伝子を組換え発現させることでエチレン感受性を低下させた植物変異体や、RNAi(RNA干渉)によりエチレン受容体遺伝子発現を抑制することによりエチレン感受性を低下させた形質転換植物が多数作製されている(非特許文献5、6及び7、特許文献1及び2)。しかしエチレン感受性については依然として不明な点も多い。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】国際公開第95/01439号
【特許文献2】特開2004−147511号公報
【非特許文献】
【0007】
【非特許文献1】Milligan S.B., et al., Plant Cell., 10(8):1307-1319. (1998)
【非特許文献2】Wilkinson et al., Science, 270(5243): 1807-1809 (1995)
【非特許文献3】Vrebalov et al., Sciece, 296(5566): 343-346, (2002)
【非特許文献4】Barry and Giovannoni, Proc. Natl. Acad. Sci. U.S.A., 103(20): 7923-7928 (2006)
【非特許文献5】Wilkinson et al., Nature Biotechnol., 15(5): 444-447 (1997)
【非特許文献6】Shibuya et al., Plant Physiol., 136(2): 2900-2912 (2004)
【非特許文献7】Lohar et al., Ann Bot., 104(2): 277-285 (2009)
【発明の概要】
【発明が解決しようとする課題】
【0008】
本発明は、植物のネコブセンチュウ抵抗性の増加方法を提供することを課題とする。
【課題を解決するための手段】
【0009】
本発明者らは、上記課題を解決するため鋭意検討を重ねた結果、植物におけるエチレン受容体変異に基づくエチレン感受性の低下が植物のネコブセンチュウ抵抗性の増加と関連することを見出し、本発明を完成するに至った。
【0010】
すなわち、本発明は以下を包含する。
[1] ネコブセンチュウ易感染性植物種の植物において、エチレン感受性の低下をもたらすエチレン受容体遺伝子の機能抑制変異を検出することを特徴とする、ネコブセンチュウ抵抗性が増加した植物を選択する方法。
本方法で検出対象となるエチレン受容体は、好ましくはETR1である。
本方法で検出するエチレン受容体遺伝子の機能抑制変異は、好ましくは、エチレン受容体のアミノ酸変異又はエチレン受容体遺伝子の欠失を生じる塩基変異である。
そのようなエチレン受容体のアミノ酸変異は、エチレン受容体の膜貫通領域内のアミノ酸変異であることが好ましい。
本方法において被験植物となるネコブセンチュウ易感染性植物種は、好ましくはナス科である。
【0011】
[2] ネコブセンチュウ易感染性植物種の植物にエチレン受容体遺伝子の機能抑制変異を導入し、エチレン感受性を低下させることを特徴とする、ネコブセンチュウ抵抗性が増加した植物の作製方法。
この方法におけるエチレン受容体遺伝子の機能抑制変異の導入は、好ましくはエチレン受容体のアミノ酸変異又はエチレン受容体遺伝子の欠失を生じる塩基変異の導入である。
そのようなエチレン受容体のアミノ酸変異は、エチレン受容体の膜貫通領域内のアミノ酸変異であることが好ましい。
本方法において変異が導入されるネコブセンチュウ易感染性植物種は好ましくはナス科である。
本方法におけるエチレン受容体遺伝子の機能抑制変異の導入は、好ましくは、上記[1]の方法により選択された、ネコブセンチュウ抵抗性が増加した植物を育種親として用いる交雑によるものである。
【0012】
[3] 上記[1]の方法又は上記[2]の方法によって得られる、ネコブセンチュウ抵抗性が増加した植物を、ネコブセンチュウ易感染性植物種の植物の栽培においてネコブセンチュウによる植物病害の防除のために使用することを特徴とする、植物の栽培方法。
【発明の効果】
【0013】
本発明に従えば、ネコブセンチュウ抵抗性が増加した植物を効率よく取得することができる。
【図面の簡単な説明】
【0014】
【図1】図1は、変異型エチレン受容体遺伝子を有する変異トマト個体におけるエチレン感受性試験の結果を示す写真である。WTは野生型エチレン受容体遺伝子を有するトマト個体、etr1-2は変異型エチレン受容体遺伝子etr1-2をホモ接合で有する変異トマト個体、etr1-1は変異型エチレン受容体遺伝子etr1-1をホモ接合で有する変異トマト個体を表す。それぞれ、「−」はエチレン非存在下、「+」はエチレン存在下での実生の状態を示す。
【図2】図2はネコブセンチュウ感染試験方法の模式図である。
【図3】図3はネコブセンチュウ感染試験で測定された野生型トマト及び変異体トマトの根における瘤の数(A)及び卵塊数(B)を示すグラフである。
【発明を実施するための形態】
【0015】
以下、本発明を詳細に説明する。
ネコブセンチュウは、植物の根に寄生して瘤を形成することが知られている。ネコブセンチュウ(Meloidogyne属センチュウ)には、ジャワネコブセンチュウ(Meloidogyne javamica)、サツマイモネコブセンチュウ(Meloidogyne incognita)、キタネコブセンチュウ(Meloidogyne hapla)、及びアレナリアネコブセンチュウ(Meloidogyne arenaria)等が知られている。ネコブセンチュウは、種により寄生する宿主に多少の違いはあるものの、ナス科、イネ科、アブラナ科、マメ科、ウリ科、ヒルガオ科、ユリ科、キク科、アカザ科、セリ科、サトイモ科、ショウガ科、アオイ科等の幅広い宿主範囲を有し、様々な農作物に寄生して植物病害をもたらす。
【0016】
ネコブセンチュウは、主に卵の状態で越冬するが、ハウスなどで植物が栽培されている場合には成虫や幼虫の状態でも越冬し、春先に10〜15℃以上の地温になると活動を開始する。幼虫は卵の中で1回脱皮し、第2期(J2)幼虫となってから孵化する。第2期幼虫は土壌中を移動し、植物の根の根幹部付近(先端近く)から組織内に侵入し、維管束付近に定着して養分を摂取した後、2回目の脱皮を行って成虫となる。幼虫の形は雌雄とも線状であり、雄成虫は成長しても同じ線状(およそ1mm)であるが、雌成虫は成長するとおよそ0.5mmの球形〜洋ナシ形になる。雌成虫は卵のうを排出し、その中に約400〜800個、多いもので約1500個の卵を産卵する。1世代に要する期間は好適条件下で約25〜30日であり、一年に数世代を経過する。
【0017】
ネコブセンチュウに寄生(感染)された植物では、葉がしおれ、全体の生育が悪くなって病害が発生する。ネコブセンチュウが感染した根には多くの瘤が形成されるが、この瘤形成によって根の組織が壊され、水分、養分の吸収が妨げられ、枯死することさえある。
【0018】
本発明では、このようなネコブセンチュウによる植物病害を防除するため、ネコブセンチュウ易感染性植物において植物ホルモンであるエチレンに対する感受性の低下をもたらすエチレン受容体変異を指標として、ネコブセンチュウ高抵抗性を有する植物を取得し、これを利用する方法を提供する。
【0019】
本発明において対象となる「ネコブセンチュウ」は、ジャワネコブセンチュウ、サツマイモネコブセンチュウ、キタネコブセンチュウ、アレナリアネコブセンチュウ等の任意のネコブセンチュウ類(Meloidogyne属センチュウ)であるが、特にキタネコブセンチュウが好ましい。
【0020】
本発明において「ネコブセンチュウ易感染性植物種」とは、ネコブセンチュウによる感染(寄生)やその感染による植物病害の発生が知られている植物種を意味する。「ネコブセンチュウ易感染性植物種」の例としては、例えば、ナス科、イネ科、アブラナ科、マメ科、ウリ科、ヒルガオ科、ユリ科、キク科、アカザ科、セリ科、サトイモ科、ショウガ科、アオイ科等の植物種が挙げられる。「ネコブセンチュウ易感染性植物種」は、単子葉植物であっても双子葉植物であってもよいが、双子葉植物がより好ましい。具体的には例えば、ナス科[ナス(Solanum melongena L.)、トマト(Solanum lycopersicum)、ピーマン(Capsicum annuum L. var. angulosum Mill.)、トウガラシ(Capsicum annuum L.)、タバコ(Nicotiana tabacum L.)、ジャガイモ(Solanum tuberosum L.)等]、アブラナ科[シロイヌナズナ(Arabidopsis thaliana)、アブラナ(Brassica campestris L.)、ハクサイ(Brassica pekinensis Rupr.)、キャベツ(Brassica oleracea L. var. capitata L.)、ダイコン(Raphanus sativus L.)、ナタネ(Brassica campestris L., B. napus L.)等]、マメ科[ダイズ(Glycine max)、アズキ(Vigna angularis Willd.)、インゲン(Phaseolus vulgaris L.)、ソラマメ(Vicia faba L.)等]、ウリ科[キュウリ(Cucumis sativus L.)、メロン(Cucumis melo L.)、スイカ(Citrullus vulgaris Schrad.)、カボチャ(C. moschata Duch., C. maxima Duch.)等]、ヒルガオ科[サツマイモ(Ipomoea batatas)等]、キク科[キク(Chrysanthemum morifolium)、シュンギク(Chrysanthemum coronarium L.)、レタス(Lactuca sativa L. var. capitata L.)等]、バラ科[バラ(Rose hybrida Hort.)、イチゴ(Fragaria x ananassa Duch.)、リンゴ(Malus x domestica)等]、アカザ科[ホウレンソウ(Spinacia oleracea L.)、テンサイ(Beta vulgaris L.)等]、セリ科[ニンジン(Daucus carota L.)等]、サトイモ科[サトイモ(Colocasia esculenta L.)等]、ショウガ科[ショウガ(Zingiber officinale)等]、アオイ科[オクラ(Abelmoschus esculentus)等]などが、ネコブセンチュウ易感染性植物種の好ましい例として挙げられる。とりわけナス科、中でもトマトがより好ましい。ネコブセンチュウ易感染性植物種は、野生型ではエチレン感受性であるものが好ましい。
【0021】
本発明は、好ましい一実施形態として、ネコブセンチュウ抵抗性が増加した植物をスクリーニングすべく、ネコブセンチュウ易感染性植物種の植物(被験植物)において、エチレン感受性の低下をもたらすエチレン受容体遺伝子の機能抑制変異を検出することを特徴とする、ネコブセンチュウ抵抗性が増加した植物を選択する方法を提供する。このネコブセンチュウ抵抗性の増加は、そのエチレン受容体遺伝子の機能抑制変異を有しない野生型植物と比較した増加である。
【0022】
本発明において遺伝子変異の検出対象となるエチレン受容体としては、限定するものではないが、例えばETR1、ETR2、ETR3、ETR4、ETR5等が挙げられ、ETR1が特に好ましい。様々な植物でエチレン受容体遺伝子の塩基配列が決定されており、一例だが、トマト(Solanum lycopersicum)のETR1(GenBankアクセッション番号U41103)、ETR2(AF043085)、ETR3(AY600437)、ETR4(AY600438)、ETR5(AY600439)の他、タバコ(Nicotiana tabacum)のETR1(AF022727)、カンタロープメロン(Cucumis melo var. cantalupensis)のETR2(AB293427)、レタス(Lactuca sativa)のETR3(AF350323)、イネ(Oryza sativa)のETR4(AY434734)、リンゴ(Malus x domestica)のETR5(DQ847146)等も挙げられる。他の植物のエチレン受容体遺伝子を、これら既知のエチレン受容体遺伝子の配列情報に基づいて容易に単離し、配列決定することもできる。対象となるエチレン受容体遺伝子の野生型は、例えば、(a)配列番号1に示される塩基配列を含む核酸、(b)配列番号1に示される塩基配列に対して70%以上、好ましくは80%以上、より好ましくは90%以上さらに好ましくは95%以上の配列同一性を有する塩基配列を含み、かつエチレン存在下でエチレン応答誘導活性を有するエチレン受容体タンパク質をコードする核酸、(c)配列番号2に示されるアミノ酸配列をコードする核酸、(d)配列番号2に示されるアミノ酸配列に対して80%以上、好ましくは90%以上、より好ましくは95%以上、さらに好ましくは98%以上の配列同一性を有するアミノ酸配列を含み、かつエチレン存在下でエチレン応答誘導活性を有するエチレン受容体タンパク質をコードする核酸である、エチレン受容体遺伝子であり得る。エチレン存在下でのエチレン応答誘導活性は、エチレン感受性試験によって調べることができる。
【0023】
被験植物における「エチレン感受性の低下をもたらすエチレン受容体遺伝子の機能抑制変異」とは、そのエチレン受容体遺伝子によってコードされるエチレン受容体タンパク質の機能(活性)が抑制(低下又は阻害)され、当該植物のエチレン感受性のレベルが低下(好ましくは有意に低下)するか又はエチレン感受性が完全に喪失するようなエチレン受容体遺伝子における遺伝的変異を意味する。このような遺伝的変異は、エチレン受容体のエチレン応答誘導活性を野生型と比較して有意に(例えば10%以上、好ましくは30%以上、より好ましくは50%以上、特に好ましくは90%以上、とりわけ好ましくは98%以上、例えば99%以上)低下させるか又は活性を完全に喪失させるアミノ酸変異をエチレン受容体タンパク質中に生じる塩基変異であってよい。このアミノ酸変異は、いわゆる非保存的置換であることが好ましい。エチレン受容体遺伝子の機能抑制変異がエチレン感受性の低下をもたらすかどうかは、その変異を有しないエチレン感受性の野生型植物と比較して、その変異を有する以外は野生型の遺伝子型を有する植物において当該植物のエチレン感受性のレベルが低下(好ましくは有意に低下)するか又はエチレン感受性が完全に喪失することを調べることにより、確認することができる。植物のエチレン感受性のレベルは、後述するエチレン感受性試験によって調べることができる。
【0024】
このようなエチレン感受性の低下をもたらすエチレン受容体遺伝子の機能抑制変異は、例えば、エチレン受容体タンパク質の膜貫通領域内にアミノ酸変異(1つ以上、好ましくは1〜10個のアミノ酸の欠失、置換及び/又は付加)を生じる塩基変異(1塩基以上、好ましくは1〜30塩基のヌクレオチドの欠失、置換及び/又は付加)であってよい。例えばトマトエチレン受容体遺伝子ETR1(配列番号1)の膜貫通領域は配列番号1の39位〜58位、68位〜88位、及び108位〜128位に相当する。なお本明細書において「膜貫通領域」の用語は、エチレン受容体タンパク質についていうときは膜貫通ドメインを、エチレン受容体遺伝子についていうときは膜貫通ドメインをコードする塩基配列を意味する。エチレン受容体の膜貫通ドメインはエチレン受容に重要な機能を果たすことから、エチレン受容体遺伝子の膜貫通領域内に生じるアミノ酸変異は高い確率でエチレン感受性の低下をもたらす。膜貫通領域内に生じるエチレン受容体遺伝子の機能抑制変異の具体例としては、限定するものではないが、例えばトマトエチレン受容体遺伝子ETR1において、野生型ETR1の配列番号2に示されるアミノ酸配列を基準とした場合に51位のアミノ酸(プロリン)から他のアミノ酸への置換(例えば、グリシン以外のアミノ酸への非保存的置換)、特に、51位のプロリンからロイシンへの置換を生じる塩基変異が挙げられる。別の例では、トマトエチレン受容体遺伝子ETR1において、配列番号2に示されるアミノ酸配列を基準とした場合に69位のアミノ酸(バリン)から他のアミノ酸への置換(例えば、ロイシン及びイソロイシン以外のアミノ酸への非保存的置換)、特に、69位のバリンからアスパラギン酸への置換を生じる塩基変異が挙げられる。なおエチレン感受性の低下をもたらすエチレン受容体遺伝子の機能抑制変異は、被験植物に内在するエチレン受容体遺伝子中の変異であってもよいし、被験植物に遺伝子組換え等により導入された外来性変異型エチレン受容体遺伝子中の変異であってもよい。
【0025】
あるいはエチレン感受性の低下をもたらすエチレン受容体遺伝子の機能抑制変異は、被験植物に内在するエチレン受容体遺伝子の欠失を生じる塩基変異であってもよい。エチレン受容体遺伝子の欠失を生じる塩基変異とは、エチレン受容体遺伝子の全体又はその大部分の塩基配列がゲノムから欠落する変異の他、ゲノム上のエチレン受容体遺伝子内への外来DNAの挿入や塩基の挿入/欠失によりフレームシフト又はスプライシングの変更等が生じた結果エチレン受容体遺伝子の遺伝子座からエチレン受容体タンパク質が発現されなくなる遺伝的変異も包含する。
【0026】
さらに、エチレン感受性の低下をもたらすエチレン受容体遺伝子の機能抑制変異はまた、そのエチレン受容体遺伝子の上流の転写開始部位又はプロモーター領域中に存在し、エチレン受容体遺伝子の転写及び/又は翻訳を阻害する塩基変異であってもよい。
【0027】
なお本明細書においては、配列番号で示されるアミノ酸配列中の特定の位置のアミノ酸を、「配列番号“X”に示される…アミノ酸配列を基準とした場合に“Y”位の(アミノ酸)」という表現により指定することがある。例えば「配列番号2に示されるアミノ酸配列を基準とした場合に“Y”番目の(アミノ酸)」という記載は、そのアミノ酸が、配列番号2に示されるアミノ酸配列のN末端に位置する第1アミノ酸を1位としたときに“Y”位に位置するアミノ酸であるか、又は配列番号2のアミノ酸配列に対し相同性を有する他のポリペプチドのアミノ酸配列において配列番号2に示されるアミノ酸配列の“Y”位に位置するアミノ酸に相当する(アラインメントされる)アミノ酸であることを意味する。
【0028】
上記のようなエチレン感受性の低下をもたらすエチレン受容体遺伝子の機能抑制変異は、ネコブセンチュウ易感染性植物種の植物においてエチレン感受性を低下させ、その結果、植物におけるネコブセンチュウ抵抗性が増加することになる。
【0029】
被験植物におけるエチレン感受性を低下させるエチレン受容体遺伝子の機能抑制変異の検出は、遺伝的変異を検出することができる任意の方法によって行えばよい。例えば、エチレン受容体遺伝子の少なくとも一部、例えばその膜貫通領域の少なくとも一部、好ましくは膜貫通領域全体を含むエチレン受容体遺伝子の全体又は一部を増幅するプライマーセットを設計し、被験植物から常法により調製した核酸(ゲノムDNA、又はトータルmRNAから逆転写したcDNA)からそのプライマーセットを用いて核酸増幅を行い、得られた増幅産物の塩基配列を決定し、その塩基配列を野生型エチレン受容体遺伝子の塩基配列と比較し解析することにより、エチレン受容体遺伝子における塩基変異を検出することができる。検出された塩基変異がエチレン受容体タンパク質のアミノ酸配列を変異(例えば、1つ以上のアミノ酸の欠失、置換及び/又は付加)させるものである場合、エチレン受容体の機能を抑制する変異である可能性がある。あるいは検出された塩基変異が、エチレン受容体遺伝子においてフレームシフトや開始コドンのすぐ下流での終止コドンの生起等を引き起こしている場合には、その変異型エチレン受容体遺伝子はエチレン受容体タンパク質をコードしておらず、すなわちそれはエチレン受容体遺伝子の欠失を生じる塩基変異であり、当該塩基変異はエチレン受容体の機能を抑制する。
【0030】
核酸増幅は、公知の任意の核酸増幅法に従って行えばよい。例えばPCR(ポリメラーゼ連鎖反応)法、LAMP(Loop-Mediated Isothermal Amplification)法、ICAN(Isothermal and Chimeric primer-initiated Amplification of Nucleic acids)法、SDA(Strand Displacement Amplification)法などを利用することができる。核酸増幅を行う際の反応液組成や温度サイクル条件の各温度及び反応時間等は、当業者であれば、使用する核酸増幅法、プライマーのTm値、サーマルサイクラーの仕様などに合わせて適宜定めることができる。
【0031】
本発明でエチレン受容体遺伝子の機能抑制変異の検出に用いるプライマー(オリゴヌクレオチドプライマー)は、少なくとも15塩基(bp)、好ましくは15〜50塩基(bp)、より好ましくは18〜30塩基(bp)、さらに好ましくは18〜25塩基(bp)である。本発明に係るプライマーは、当業者に周知の任意の化学合成法により作製することができ、例えば市販の自動DNA合成装置を使用して慣用手順により合成することができる。本発明に係るプライマーは、オリゴヌクレオチドにさらに任意の修飾が施されたものでもよい。例えば本発明に係るプライマーは、その5'末端又は3'末端に当該プライマーの検出や増幅を容易にするための標識物質(例えば、蛍光分子、色素分子、放射性同位元素、ジゴキシゲニンやビオチン等の有機化合物など)及び/又は付加配列(LAMP法で用いるループプライマー部分等)を含んでいてもよい。本発明に係るプライマーは、5'末端でリン酸化又はアミン化されていてもよい。本発明に係るプライマーはまた、天然塩基のみを含んでもよいし、修飾塩基を含んでもよい。修飾塩基としては、デオキシイノシン、デオキシウラシル、S化塩基などが挙げられるが、これらに限定されるものではない。本発明に係るプライマーは、ホスホロチオエート結合やホスホロアミデート結合などを含む任意の誘導体オリゴヌクレオチドを含むものであってもよいし、ペプチド核酸結合を含むペプチド-核酸(PNA)を含んでいてもよい。本発明に係るプライマーは、DNAであってもRNAであってもよく、RNAである場合には、その塩基配列はDNA配列における「T(チミン)」を「U(ウラシル)」に読み替えるものとする。
【0032】
一実施形態では、変異検出対象のエチレン受容体遺伝子の少なくとも一部、例えば膜貫通領域の全体又はその少なくとも一部を含む配列を増幅するように設計されたプライマーセットを、機能抑制変異の検出に用いることができる。当該プライマーセットは、例えば、エチレン受容体遺伝子の配列番号1に示される塩基配列上の15〜30塩基の配列、及び配列番号1に示される塩基配列に相補的な配列上の15〜30塩基の配列をそれぞれ含むプライマーのセットであって、配列番号1に示される塩基配列を基準とした場合に39位〜58位、68位〜88位及び108位〜128位に位置するエチレン受容体遺伝子膜貫通領域の少なくとも一部、好ましくはこれら3つの配列のいずれか又は全部を含む配列を増幅するように設計されたプライマーセットでありうる。エチレン受容体遺伝子の機能抑制変異の検出に用いることができるプライマーセットの具体例としては、例えば、配列番号3に示される塩基配列を含むプライマーと配列番号4に示される塩基配列を含むプライマーを含むプライマーセットが挙げられる。上記プライマーセットの設計は被験植物又はその近縁植物のエチレン受容体遺伝子の塩基配列に基づいて当業者であれば容易に行うことができる。上記プライマーセットは、ネコブセンチュウ抵抗性が野生型植物と比較して増加している、植物のネコブセンチュウ抵抗性検査用として好適である。本発明は、このようなプライマーセットも提供する。
【0033】
エチレン受容体遺伝子における塩基変異の検出は、TILLING(登録商標)法(Targeting Induced Local Lesion In Genomes)(Till et al., Methods Mol. Biol., 236: 205-220 (2003))を用いて実施することもできる。TILLING法では、ミスマッチ対認識酵素(CEL1やエンドヌクレアーゼ)で核酸二重鎖において塩基対を形成していない変異部位を切断することにより、変異塩基の位置を同定することができる。具体的には、変異型エチレン受容体遺伝子を含む可能性がある被験植物由来核酸プールのDNAを鋳型として、変異を検出しようとする領域を特異的に増幅するプライマーセットを用いてPCR増幅し、増幅産物を熱変性で一本鎖とした後、冷却して再度巻き戻させることで変異型遺伝子と野生型遺伝子の増幅DNA鎖間で形成されたヘテロ二重鎖を含む二本鎖DNAプールを調製し、これをミスマッチ対認識酵素で処理して変異部位を切断することにより、上記増幅産物から切断部位に応じて異なる長さのDNA断片を生成させ、これを電気泳動することにより、増幅産物に加えて変異部位での切断で生じた異なる長さのDNA断片のバンドが検出される。さらに、変異を含むことが示された植物系統から抽出したDNAについて変異部位を含むDNA断片を核酸増幅し、それについて塩基配列を決定・解析すれば、変異部位及び変異後の塩基を同定することができる。次いで得られた配列を解析することにより、エチレン受容体遺伝子の機能抑制変異又はその可能性が高い変異に該当するかどうかを調べることができる。この方法は変異体プールからエチレン受容体遺伝子の未知の機能抑制変異を検出する際に特に有用である。 あるいは、エチレン受容体遺伝子の機能抑制変異の検出は、被験植物から調製した核酸(好ましくは、抽出したトータルRNAから逆転写したcDNA)を鋳型として、当該変異を含む配列を核酸増幅することに基づいて行うことができる。変異を含む配列に対して設計した特異的プライマーを核酸増幅に用いれば、そのエチレン受容体遺伝子の機能抑制変異を含有する領域を特異的に増幅することができる。また変異を含む領域について増幅した核酸を配列決定し解析することにより、所定のエチレン受容体遺伝子の機能抑制変異の有無を決定することができる。この方法は、エチレン受容体の活性が抑制されエチレン感受性の低下をもたらすことが既知のエチレン受容体遺伝子の機能抑制変異を検出する場合に、特に有用である。
【0034】
以上のようにしてエチレン受容体遺伝子においてエチレン受容体の機能を抑制する変異又はその可能性がある塩基変異が見出された場合には、その変異に基づくエチレン感受性の低下を確認するため、当該変異を有する植物についてエチレン感受性を調べることが好ましい。
【0035】
被験植物のエチレン感受性は当業者に公知の任意のエチレン感受性判定方法により検査すればよい。好ましい例では、エチレン感受性の検査は、後述の実施例2に記載のようにして種子を用いて行うことができる。例えば、検査対象の植物の種子を培地中で発芽させた後、エチレンを適当量(例えば、1〜50ppm、好ましくは10 ppm濃度)で注入して密閉状態とし、実生を暗黒下で野生型で胚軸と根が一定程度成長するのに適切な温度及び期間(例えば、25℃で7日間)にわたり育成した後、胚軸と根の長さを測定する(エチレン存在下)。またコントロールとしてエチレンを注入しないこと以外は同様にして実生を育成し、胚軸と根の長さを測定する(エチレン非存在下)。野生型ネコブセンチュウ易感染性植物では、エチレン感受性のため、エチレン存在下の育成ではコントロールと比較して胚軸と根の長さが顕著に短くなる。これに対し、被験植物においてエチレン存在下での育成後に測定した胚軸及び根の長さが、野生型と比較して有意に長く、コントロールと比較してあまり短くならない場合、当該被験植物はエチレン感受性が低下していると判定することができる。具体的には、被験植物においてエチレン存在下で測定した胚軸及び根の少なくとも一方(好ましくは両方)の長さ(好ましくは平均値)をコントロールでの長さと比較した比率(%)が、対応する野生型植物のエチレン存在下での長さを野生型コントロールでの長さと比較した比率(%)の1.3倍以上、好ましくは2.2倍以上高い場合、被験植物のエチレン感受性が低下していると判断することができる。あるいは、例えばトマトの場合には、被験植物においてエチレン存在下で測定した胚軸及び根の少なくとも一方(好ましくは両方)の長さがコントロールの40%以上である場合には被験植物のエチレン感受性が低下していると判断することもできる。エチレン感受性の低下をもたらすエチレン受容体遺伝子の機能抑制変異を有する被験トマト植物においては、エチレン存在下で測定した胚軸及び根の少なくとも一方(好ましくは両方)の長さはコントロールの40%以上、好ましくは60%以上、より好ましくは80%以上、特に好ましくは90%以上、非常に好適な例では95%以上である。被験植物のエチレン感受性の低下が示された場合、被験植物において上記のように見出されたエチレン受容体遺伝子の変異がエチレン受容体遺伝子の機能抑制変異であることが裏付けられる。胚軸及び根の長さがコントロールの95%以上、例えば98%以上である場合、被験植物はほぼエチレン非感受性である。このエチレン感受性の低下レベルは、ネコブセンチュウに対する被験植物の抵抗性の強さと相関する。
【0036】
本発明では、以上のような検出方法により、エチレン感受性の低下をもたらすエチレン受容体遺伝子の機能抑制変異を有する被験植物を判別し、それを選択することができる。このような被験植物においては、ネコブセンチュウに対する抵抗性の増加が認められる。ネコブセンチュウに対する抵抗性の増加は、エチレン受容体遺伝子の機能抑制変異をヘテロ接合で有する被験植物においても認められるが、エチレン受容体遺伝子の機能抑制変異をホモ接合で有する被験植物において顕著に認められる。
【0037】
被験植物のネコブセンチュウに対する抵抗性は、当業者に公知の任意の方法を用いて検査することができるが、例えば図2に示すようなネコブセンチュウ感染試験によって検査することができる。具体的には例えば、ネコブセンチュウ感染試験は、被験植物の植物体を育成後、植物体1個について一定数(一例では200匹)のネコブセンチュウ第2期(J2)幼虫をその培養土に接種し、2ヶ月後に感染状態の評価を行うことにより行う。評価は、植物体の根における瘤の数、及び/又はネコブセンチュウの卵塊数を計数することが好ましい。この評価ではまた、染色法によるセンチュウの形態の観察を行うことも好ましい。瘤の数は、目視により計数することができる。卵塊数はフロキシンB(例えば0.015 %(w/v))により根を染色(例えば15分間)した後、染色された卵塊を計数すればよい。感染根におけるセンチュウの形態の観察は、感染根を水で洗浄し土を除去した後、有効塩素濃度2 %(v/v)の次亜塩素酸ナトリウム溶液を入れたチューブ中でインキュベート(例えば2〜5分、好ましくは3分間)し、溶液を除去後、感染根を洗浄し、蒸留水中でインキュベートし、蒸留水を除き、0.05 %酸性フクシン染色液に浸し、高温(好ましくは95℃)のウォーターバス中でインキュベート(例えば3分間)した後、酸性フクシン染色液を除き、溶液が透明になるまで蒸留水で数回洗浄し、蒸留水を除き、酸性グリセロール溶液を感染根が完全に浸るように加え、高温(好ましくは95℃)のウォーターバス中でインキュベート(例えば30分間)後、室温になるまで静置した後、実体顕微鏡を用いて感染根におけるセンチュウの形態を観察することができる。
【0038】
ネコブセンチュウ感染試験の結果、瘤の数及び/又は卵塊数を、野生型植物とエチレン受容体遺伝子の機能抑制変異を有する被験植物(変異型植物)との間で比較し、変異型植物における瘤の数又は卵塊数の少なくとも一方、好ましくは両方が、通常は平均値で、野生型植物と比較して有意に少ない場合、ネコブセンチュウに対する抵抗性が増加したことが示される。本発明に係るエチレン感受性の低下をもたらすエチレン受容体遺伝子の機能抑制変異を有する被験植物では、通常、瘤の数又は卵塊数の少なくとも一方、好ましくは両方が、野生型植物と比較して70%未満、典型的には60%未満、好ましくは50%未満、より好ましくは30%未満、さらに好ましくは20%未満、特に好ましくは10%未満である。このようにしてエチレン受容体遺伝子の機能抑制変異を有する被験植物のネコブセンチュウに対する抵抗性の増加を確認することができる。
【0039】
本発明では、以上のようにして、ネコブセンチュウ抵抗性が増加した植物を選択し、それを取得することができる。この方法は、例えば、ネコブセンチュウ易感染性植物種の植物に対する変異誘発によって得られた変異体植物集団から、ネコブセンチュウ抵抗性が増加した植物を選抜するために実施してもよい。植物における変異誘発は、当業者に公知の任意の方法によって実施することができ、例えば、変異原化合物への曝露、放射線やレーザービームの照射等によって行うことができる。
【0040】
あるいは、本発明の上記選択方法は、植物新品種育種過程において新品種候補となる複数の植物系統について、ネコブセンチュウ抵抗性が増加した植物系統を選抜するために実施してもよい。この本発明の方法は、ネコブセンチュウ抵抗性品種育種のための母材を提供し、また育種過程での効果的なネコブセンチュウ抵抗性選抜手法を提供する。
【0041】
本発明はまた、ネコブセンチュウ易感染性植物種の植物にエチレン受容体遺伝子の機能抑制変異を導入し、エチレン感受性を低下させることを特徴とする、ネコブセンチュウ抵抗性が増加した植物の作製方法も提供する。この方法は、ネコブセンチュウ高抵抗性植物品種の育種のために好適に利用できる。
【0042】
ネコブセンチュウ易感染性植物種の植物に導入するエチレン受容体遺伝子の機能抑制変異は、上記で説明したとおりである。植物への変異導入は、一実施形態では、変異原曝露等の任意の突然変異誘発技術によって行うこともできるし、変異型エチレン受容体遺伝子を導入して過剰発現させる等の手法により遺伝子工学的に導入することもできる。ネコブセンチュウ易感染性植物種の植物への変異型エチレン受容体遺伝子の導入は、例えば、エチレン感受性の低下をもたらす機能抑制変異を有するエチレン受容体遺伝子を、ネコブセンチュウ易感染性植物種の植物(例えば、トマト)等で利用可能な発現ベクター又は発現カセット等の核酸構築物に挿入し、それをネコブセンチュウ易感染性植物種の植物に導入して形質転換植物を作成することにより、実施することができる。
【0043】
変異型エチレン受容体遺伝子を挿入する植物発現ベクターとしては、アグロバクテリウム法を用いる場合には、バイナリーベクターなどのアグロバクテリウム法に適した発現ベクター又はその改変ベクターを用いることが好ましい。そのような植物発現用ベクターとしては、例えば、pBI121、pBIN19、pSMAB704、pCAMBIA、pGreen等が挙げられる。変異型エチレン受容体遺伝子を含む発現ベクターはまた、ベクターが細胞内に保持されていることを示す選択マーカー遺伝子やレポーター遺伝子、ベクター内に簡単に正しい向きで遺伝子を挿入するためのポリリンカー、ポリA付加配列、分泌シグナル配列、精製用のヒスチジンタグ配列等の有用な配列を必要に応じてさらに含んでもよい。選択マーカー遺伝子としては、例えばジヒドロ葉酸還元酵素遺伝子、ハイグロマイシン耐性遺伝子、アンピシリン耐性遺伝子、カナマイシン耐性遺伝子、ネオマイシン耐性遺伝子、クロラムフェニコール耐性遺伝子(CAT遺伝子)等が挙げられる。本発明では、植物プロモーターの制御下に変異型エチレン受容体遺伝子を含む発現カセットも遺伝子導入用に使用できる。本発明において「発現カセット」とは、プロモーターの制御下に発現対象の遺伝子を含む、自律複製能を有しないDNA断片をいう。
【0044】
変異型エチレン受容体遺伝子を含む発現ベクター又は発現カセットのネコブセンチュウ易感染性植物種の植物への導入は、常法により行うことができる。アグロバクテリウム法を用いる場合は、アグロバクテリウム法に適した発現ベクターに変異型エチレン受容体遺伝子を挿入した後、適当なアグロバクテリウム、例えばアグロバクテリウム・ツメファシエンス(Agrobacterium tumefaciens)にエレクトロポレーション法などにより導入し、この菌株を植物細胞、カルス、又は子葉切片等に接種して感染させればよい。好適なアグロバクテリウムとしては、限定するものではないが、GV3101、C58、C58C1Rif(R)、EHA101、EHA105、AGL1、LBA4404等の株を利用することができる。
【0045】
遺伝子導入はパーティクルガン法やエレクトロポレーション法を利用してもよい。導入対象の宿主試料としては、植物の葉などの切片を使用してもよく、プロトプラストを調製して使用してもよい(Christou P, et al., Bio/technology (1991) 9: 957-962)。例えばパーティクルガン法では、遺伝子導入装置(例えばPDS-1000(BIO-RAD社)等)を製造業者の説明書に従って使用して、本発明に係る発現ベクター又はDNA構築物をまぶした金属粒子をこのような試料に打ち込むことにより、植物細胞内に導入させ、形質転換植物細胞を得ることができる。操作条件は、通常は450〜2000psi程度の圧力、4〜12cm程度の距離で行う。
【0046】
次いで、本発明に係る発現ベクター又は核酸構築物を導入した植物細胞や子葉切片等を、例えば従来知られている植物組織培養法に従って選択培地で培養し、生存したカルスを再分化培地(適当な濃度の植物ホルモン(オーキシン、サイトカイニン、ジベレリン、アブシジン酸、エチレン、ブラシノライド等)を含む)で培養することにより、形質転換された植物体を再生することができる。このようにして形質転換植物を取得できる。
【0047】
別の実施形態では、変異導入は、RNAi(RNA干渉)を利用した方法で遺伝子工学的に行うこともできる。例えば、エチレン受容体遺伝子の全部又は一部の塩基配列に対して相補的な塩基配列を含むアンチセンス核酸をコードするDNAを含む核酸構築物(発現ベクターや発現カセット)、又はエチレン受容体遺伝子の全部又は一部の塩基配列とそれに相補的な塩基配列を含むアンチセンス核酸を含むRNAをコードするDNAを含む核酸構築物(発現ベクターや発現カセット)をネコブセンチュウ易感染性植物種の植物に導入し、発現させる方法が挙げられる。植物への導入方法は上記と同じである。その発現により、アンチセンス核酸、又は分子内会合によりヘアピン構造を有する長鎖又は短鎖dsRNAが植物細胞内で生成され、これがRNAiを誘導し、エチレン受容体遺伝子のmRNAの特異的分解を促進し、エチレン受容体遺伝子の機能を効果的にノックダウンすることができる。好ましい実施形態では、発現カセットから発現されるdsRNAは、エチレン受容体遺伝子中の連続した21塩基以上の塩基配列からなるセンス配列とその塩基配列に対して相補的なアンチセンス配列とが、スペーサー配列を挟んで連結されている配列を含むRNA分子であることが好ましい。このようなRNA分子は、ステムループ構造(ヘアピン構造)を有するdsRNAを形成する。そのようなRNAにおいては、そのセンス配列とアンチセンス配列とがスペーサー配列に対していずれが5'側又は3'側に位置するように配置されていてもよい。例えば、そのようなdsRNA中のセンス配列がスペーサー配列の3'末端に、アンチセンス配列がスペーサー配列の5'末端に連結されていてもよい。スペーサー配列は、分子内会合による二本鎖形成を阻害せずにステムループのループ構造部分を構成可能なものであることが好ましい。そのようなdsRNA中のセンス配列及びアンチセンス配列は、短鎖dsRNAを形成させる場合には、エチレン受容体遺伝子中の連続した21〜49塩基、好ましくは21〜25塩基、より好ましくは21〜23塩基の塩基配列である。一方、長鎖dsRNAを形成させる場合には、センス配列及びアンチセンス配列は、、エチレン受容体遺伝子中の連続した50塩基以上、2000塩基以下、さらに好ましくは100塩基以上、特に好ましくは500塩基以上であり、典型的には1000塩基以下、より好ましくは800塩基以下、さらに好ましくは500〜700塩基、特に好ましくは500〜600塩基の塩基配列である。本発明では、このようなRNAサイレンシングに基づく方法により、被験植物に内在するエチレン受容体遺伝子の発現を抑制することもできる。このようにして変異を導入した植物細胞から、上記と同様にして形質転換植物を取得することができる。
【0048】
以上のようにして遺伝子工学的に作製された形質転換植物(遺伝子組換え植物)について、エチレン感受性試験を行ってエチレン感受性の低下を確認することが好ましい。また得られた形質転換植物を自家交雑することにより、ヘテロ接合個体に加えてホモ接合個体を得ることができる。これらの形質転換植物は、ヘテロ接合体もホモ接合体もネコブセンチュウ抵抗性の増加を示す。このようにしてネコブセンチュウ高抵抗性を安定的に有する植物を遺伝子工学的に作製することができる。
【0049】
別の実施形態では、植物への変異導入は、エチレン受容体遺伝子の機能抑制変異を有するネコブセンチュウ易感染性植物種の植物を育種親として用いる交雑によって当該変異を導入することが好ましい。エチレン受容体遺伝子の機能抑制変異を導入した植物については、上述のエチレン感受性試験により、エチレン感受性の低下を確認することが望ましい。「エチレン受容体遺伝子の機能抑制変異を有するネコブセンチュウ易感染性植物種の植物を育種親として用いる交雑」とは、当該植物を種子親及び花粉親の少なくとも一方として利用して交雑させることを意味する。交雑に用いるエチレン受容体遺伝子の機能抑制変異を有するネコブセンチュウ易感染性植物種の植物は、上述のネコブセンチュウ抵抗性が増加した植物を選択する方法によって得られた、エチレン感受性の低下をもたらすエチレン受容体遺伝子の機能抑制変異をヘテロ接合又はホモ接合で有する植物個体であってもよいし、その植物個体を野生型又は他の植物品種・系統と交雑(例えば、戻し交雑)するか又は自家交雑して得られる子孫植物であってもよい。子孫植物は、F1個体であってもよいし、F2〜F5個体であってもよいし、そのさらに後代の個体であってもよい。戻し交雑は、限定するものではないが、特定の交雑相手との戻し交雑を繰り返し行う連続戻し交雑であることが好ましく、この場合、交雑相手は反復親と呼ばれることがある。エチレン受容体遺伝子の機能抑制変異を有するネコブセンチュウ易感染性植物種の植物を育種親として用いる交雑による育種では、ネコブセンチュウ高抵抗性形質だけを野生型植物に導入するために、エチレン受容体遺伝子の機能抑制変異をヘテロ接合で有する植物個体を、野生型個体に繰り返し戻し交雑する連続戻し交雑を行うことも好ましい。得られた子孫植物個体については、エチレン感受性を検査してエチレン感受性の低下を確認することが好ましい。このような、エチレン受容体遺伝子の機能抑制変異を有するネコブセンチュウ易感染性植物種の植物を育種親として用いる交雑により当該変異を導入する育種方法によれば、ネコブセンチュウ高抵抗性を安定的に有する植物を作製することができる。
【0050】
以上のようにして得られるネコブセンチュウ抵抗性が増加した植物は、ネコブセンチュウ易感染性植物種の植物の栽培において、ネコブセンチュウによる植物病害の防除のために使用することができる。本発明はこのような植物の栽培方法も提供する。
【0051】
具体的には、例えば、上述の方法によりネコブセンチュウ抵抗性を増加させた、エチレン受容体遺伝子の機能抑制変異を有する植物を台木とし、ネコブセンチュウ易感染性植物種の当該変異を有しない他の植物を穂木として接ぎ木を行うことにより、そのネコブセンチュウ易感染性植物種の植物のネコブセンチュウ抵抗性を高めることができる。これにより、ネコブセンチュウ易感染性植物種の栽培においてネコブセンチュウによる植物病害を防除することができる。
【0052】
別の実施形態では、例えば、上述の方法によりネコブセンチュウ抵抗性を増加させた、エチレン受容体遺伝子の機能抑制変異を有する植物を、ネコブセンチュウ易感染性植物とを混合栽培することによる植物の栽培方法も提供する。ネコブセンチュウ抵抗性を増加させた植物を同じ栽培区画内で一緒に栽培することにより、栽培区画全体でのネコブセンチュウの量を低減することができ、それにより、当該栽培区画でのネコブセンチュウによる植物病害を軽減することができる。
【0053】
別の実施形態では、ネコブセンチュウによる植物病害が認められる栽培区画において、上述の方法によりネコブセンチュウ抵抗性を増加させた植物を栽培することにより、土壌中のネコブセンチュウを低減することができ、ネコブセンチュウによる植物病害を防除することができる。すなわち上述の方法によりネコブセンチュウ抵抗性を増加させた植物はセンチュウへの対抗植物として有利に使用できる。
【実施例】
【0054】
以下、実施例を用いて本発明をさらに具体的に説明する。但し、本発明の技術的範囲はこれら実施例に限定されるものではない。
【0055】
[実施例1]
(変異誘発系統におけるエチレン受容体遺伝子変異の同定)
矮性トマト(Solanum lycopersicum)系統マイクロトム(Micro-Tom)の種子(National BioResource Project(NBRP), MEXT, JAPANより分譲可能)を、0.7%、1.0%、1.5%濃度のメタンスルホン酸エチル(EMS)で変異処理した。各処理区につき、1000〜3000粒の種子を用いた。この処理は、室温で8時間種子を水に浸した後、EMS溶液中でゆっくり撹拌しながら16時間浸すことで行った。この変異処理した当代種子をM1種子と称した。EMS処理後のM1種子を蒸留水中で4時間洗浄した。この洗浄ステップを3回繰り返し、残存するEMSを除去した。M1種子を温室に播種し、育成したM1植物の果実から次世代のM2種子を収穫した。単一のM1植物個体(変異誘発系統)から得られたM2種子をファミリーとして各10粒を播種し、植物個体を育成した。
【0056】
各M1植物個体由来のM2ファミリー10個体から葉を1枚ずつ採集し、ゲノムDNAを抽出した。抽出には、Promega社のDNA精製キットMaxwell 16 Tissue DNA Purification Kitを使用した。96穴プレートに抽出したDNA溶液を整列化し、スーパープールを作製した。スーパープールでは、一つのウェル(穴)には、8ファミリーに由来するDNA溶液を混合して入れた。DNA濃度調整は、各ウェルから一部を取って電気泳動し、同時に濃度マーカーを泳動して染色後のDNAバンドの濃さを目安に予測した。
【0057】
次いで上記のようにして得られたゲノムDNAを鋳型として、トマト(Solanum lycopersicum)エチレン受容体遺伝子(ETR1)(SlETR1とも称する)(GenBankアクセッション番号AF043084、U41103.1;開始コドンから終止コドンまでのタンパク質コード領域(CDS)の塩基配列を配列番号1に示し、この遺伝子にコードされるエチレン受容体タンパク質のアミノ酸配列を配列番号2に示す)をPCR増幅した。なお数千の変異誘発系統について得たゲノムDNAをそれぞれPCR増幅に用いた。PCRには、エチレン受容体遺伝子ETR1の膜貫通領域(配列番号1の39位〜58位と、68位〜88位と、108位〜128位)の全体を含む配列を標的として設計した以下のトマトエチレン受容体遺伝子ETR1増幅用プライマーセットを用いた。
【0058】
フォワードプライマー SlETR1-Fw: 5'-gtataaaaggagttggggcaaag-3'(配列番号3)
リバースプライマー SlETR1-Rev: 5'-cacccagaactcagtatgtcaacg-3'(配列番号4)
なおプライマーSlETR1-Fwは蛍光色素IRD700(蛍光波長715nm;Biomers)で、プライマーSlETR1-RevはIRD-800(蛍光波長815nm;Biomers)で標識したものを用いた。PCRは、5〜10 ngの上記スーパープールDNAを鋳型に用いて、次の条件で行った。
【0059】
PCR反応液は、1.5 μlの5x Green Gotaq Flexi buffer、2.0 μlの25 mM MgCl2、1.2 μlの2.5 mM dNTP、0.3 μlの10 μMの各プライマー及び0.075 μlの5 U/μl DNAポリメラーゼ(Gotaq Hotstart DNA polymerase又はGotaq Flexi DNA Polymerase; Promega)を加えて全量で15 μlとしたものを用いた。PCRサイクルは以下の通り:95℃で2分、次いで95℃で30秒、60℃で30秒、及び72℃で60秒を40サイクル、そして72℃で5分の最終伸長。
【0060】
得られた増幅産物を用い、TILLING(登録商標)法(Targeting Induced Local Lesion In Genomes)に基づき、エチレン受容体遺伝子に変異を有する個体の検出を以下のようにして行った。TILLING法における二本鎖DNAのミスマッチ部位検出には、トマトエンドヌクレアーゼ1を使用した。
【0061】
トマトエンドヌクレアーゼ1の調製のため、トマトエンドヌクレアーゼ1(SlENDO1)遺伝子(GenBankアクセッション番号 AB667996、配列番号5;この遺伝子にコードされるエンドヌクレアーゼ1アミノ酸配列を配列番号6に示す)を含むDNA断片をバイナリベクターpGWB8(Nakagawa T et al., J. Biosci. Bioeng., 104(1):34-41 (2007))にクローニングした。これをトマト品種マイクロトムに導入して形質転換体を作製し、C末端側にヒスチジンタグが付加されたトマトエンドヌクレアーゼ1タンパク質を発現させた。タンパク質の精製は次のように行った。形質転換マイクロトムの葉約2 gを10 mlの溶出バッファー[0.1 M Tris-HCl(pH8.0)、1 mM フェニルメチルスルホニルフルオリド(PMSF)、0.125 mM 2-メルカプトエタノール、及び10% グリセロール]中で潰した後、遠心分離によって上清を得た。この上清をHistrap HPカラム(GE healthcare)にかけて、ヒスチジンタグ付きトマトエンドヌクレアーゼ1を精製した。
【0062】
TILLING法による変異検出は、LI-COR DNA Analyzerを用いて行った。上記で得た増幅産物を加熱変性し、次いで冷却することで野生型DNA鎖と変異型DNA鎖とのヘテロ二重鎖を形成させ、それをトマトエンドヌクレアーゼ1で処理することでミスマッチのある変異部位で切断し、それを加熱変性し、得られた一本鎖断片を電気泳動してフラグメント解析にかけることにより、標的領域であるトマトエチレン受容体遺伝子中に導入された変異を検出した。さらに得られた変異を含むDNA断片の配列決定を行い、野生型配列と比較して変異の同定を行った。特にアミノ酸置換を引き起こす塩基変異を選抜した。
【0063】
その結果、2つの個体のトマトエチレン受容体遺伝子中にアミノ酸置換を引き起こす塩基変異が見出された。これらの変異型遺伝子をそれぞれSletr1-1及びSletr1-2と名付けた。表1にSletr1-1及びSletr1-2で見出された変異を示す。
【0064】
【表1】

【0065】
表1に示す変異型トマトエチレン受容体遺伝子中のアミノ酸置換P51LとV69Dは、それぞれ、野生型トマトエチレン受容体タンパク質(配列番号2)の51位のプロリンのロイシンへの置換、及び69位のバリンのアスパラギン酸への置換(いずれも膜貫通領域内)を表す。
【0066】
[実施例2]
(変異型エチレン受容体遺伝子を有する変異個体におけるエチレン感受性の解析)
実施例1で取得した変異型SlETR1(Sletr1-1、Sletr1-2)をホモ接合で有する変異トマト個体のエチレン感受性試験を次のように行った。
【0067】
容量50 mlのガラス製容器に1/2 濃度MS固形培地(Murashige and Skoog, Physiol Plant 15(3): 473-497, 1962)を適量入れ、その中で変異個体の種子を発芽させた。ここで試験した種子は、実施例1で得たM2個体を自家交雑して得た、エチレン受容体遺伝子変異についてホモ接合性であるM3種子である。次いでエチレンを10 ppm濃度で注入し(エチレン存在下)、シリコン栓で密閉した状態で実生を暗黒下、25℃で7日間育成した後、胚軸と根の長さを計測した。コントロールではエチレンを注入せずに(エチレン非存在下;コントロール)同様に育成を行い、計測を行った。その結果を図1及び表2に示す。
【0068】
【表2】

【0069】
野生型個体ではエチレン存在下の胚軸と根の長さはエチレン非存在下と比較して顕著に短くなるが、エチレン非感受性を有する個体の場合、胚軸と根は短縮化せず、野生型と比較するとエチレン存在下での胚軸と根が長くなる。測定の結果、Sletr1-1ホモ接合個体における10 ppmエチレン存在下での胚軸と根の長さは、エチレン存在下の野生型個体よりも長く、またエチレン非存在下のSletr1-1ホモ接合個体と比較してもほぼ変化が見られなかった(図1及び表2)。この結果はSletr1-1ホモ接合個体の明らかなエチレン非感受性を示していた。一方、Sletr1-2ホモ接合個体での10 ppmエチレン存在下での胚軸と根の長さは、野生型個体よりも長いがSletr1-1ホモ接合個体よりは短く、エチレン非存在下のSletr1-2ホモ接合個体と比べると少し短かった(図1及び表2)。この結果はSletr1-2ホモ接合個体ではエチレン感受性が低下しているがその低下レベルはSletr1-1ホモ接合個体よりも低いことを示していた。
【0070】
以上より、上記で同定されたエチレン受容体遺伝子における変異(表1)がトマト変異個体Sletr1-1及びSletr1-2においてエチレン感受性の低下をもたらしたこと、すなわち上記変異がエチレン受容体の少なくとも一部の機能抑制をもたらすことが示された。
【0071】
なお、Sletr1-1、Sletr1-2をそれぞれヘテロ接合で有する変異トマト個体についても、エチレン感受性を調べた。その結果、両方の変異個体において、野生型と比較してエチレン感受性の低下が示されたが、対応するホモ接合性変異個体よりはエチレン感受性の低下レベルは小さかった。したがってエチレン受容体遺伝子の機能抑制変異は、変異個体のエチレン感受性を、アレル数依存的にホモ接合体においてより大きく低下させることが示された。
【0072】
[実施例3]
実施例2で使用したSletr1-1、Sletr1-2ホモ接合個体に対してネコブセンチュウ感染試験を行った。図2に試験方法の模式図を示した。
【0073】
供試トマト植物体は、植物培養用インキュベーター(TOMY, CF-305)、クレハ園芸培土及び5×5連結ポット(信和株式会社)を用いて、一定栽培条件下(16時間明期、23〜25℃、照度13,000 lx)で栽培した。
【0074】
また、キタネコブセンチュウ感染トマト個体から瘤及び卵塊を含む感染根を適量の水を入れたガラスビーカーに採取し、エアーポンプを用いて酸素を供給し、孵化したネコブセンチュウを新しいガラスビーカーに回収することによって、ネコブセンチュウ第2期幼虫(J2)を取得した。回収したJ2幼虫について、500 μlあたりの匹数を実体顕微鏡下でカウントした後、ネコブセンチュウ感染試験に供試した。
【0075】
ネコブセンチュウ感染試験は供試トマト植物体(マイクロトム野生型及びその変異体)を、上記の一定栽培条件で3週間育成後、植物体あたり約200匹のJ2幼虫をその培養土に接種し、2ヶ月後に感染状態の評価を行った。評価は、植物体の根における瘤の数、卵塊数、及び染色法によるセンチュウの形態の観察により行った。瘤の数は、目視によりカウントした。卵塊数は0.015 %(w/v)のフロキシンB(WAKO)により根を15分間染色した後、染色された卵塊をカウントした。感染根におけるセンチュウの形態の観察は、感染根を水で洗浄し土を除去した後、有効塩素濃度2 %(v/v)の次亜塩素酸ナトリウム溶液を入れた15 mlチューブ中で3分間インキュベートし、溶液を除去後、蒸留水で数回感染根を洗浄し、蒸留水中で10分間インキュベートした。次に蒸留水を除き、0.05 %の酸性フクシン染色液に浸し、95℃のウォーターバス中で3分間インキュベートした。酸性フクシン染色液を除き、溶液が透明になるまで蒸留水で数回洗浄した。蒸留水を除き、酸性グリセロール溶液を感染根が完全に浸るように15 mlに加え、95℃のウォーターバス中で30分間インキュベート後、室温になるまで静置した。感染根をシャーレに移し、実体顕微鏡を用いて感染根におけるセンチュウの形態を観察した。その結果、野生型では脱皮した第4期幼虫(J4)が確認できたが、変異体ではJ4の形態を示す幼虫の存在が確認できないか、極めて少数であった。
【0076】
感染試験の結果、瘤の数は野生型で6.5個(n=4, SE=1.3)、エチレン受容体変異体ではSletr1-1で3.3個(n=4, SE=0.63)、Sletr1-2で3.5個(n=6, SE=0.62)であった(図3A)。卵塊数は野生型で9個(SE=1.1)、エチレン受容体変異体ではSletr1-1で0.75個(SE=0.5)、Sletr1-2で4.2個(SE=0.8)であった(図3B)。
【0077】
この結果から、エチレン感受性の減少は、ネコブセンチュウの卵塊形成に対して強い抑制効果をもつことが示された。さらに、ネコブセンチュウの卵塊形成が野生型よりもSletr1-2の方が少なく、Sletr1-2よりもSletr1-1の方がさらに少ないことが示されたが、これは実施例2でエチレン感受性の高さが野生型 > Sletr1-2 > Sletr1-1であった結果と完全に一致している。すなわち、本実施例の結果は、植物のエチレン感受性が低いほど、ネコブセンチュウの卵塊形成に対する抑制能も増大することを示している。これにより、エチレン感受性を低下させるほど、植物のネコブセンチュウへの抵抗性をより増加させることができることが示された。特にSletr1-1では、感染試験において、エチレン受容体変異体の根における卵塊形成が野生型と比較して10%未満に大幅に減少した。Sletr1-1では、実施例2でエチレンに対しほぼ非感受性であることが示されており、機能欠損したエチレン受容体を有する植物個体がネコブセンチュウに対し特に強い抵抗性を有することが明らかとなった。このようなエチレン受容体機能抑制変異個体、特にエチレン受容体機能欠損変異個体はネコブセンチュウに対する対抗植物として有用と考えられる。
【産業上の利用可能性】
【0078】
本発明は、植物のネコブセンチュウへの抵抗性を増加させるために使用することができる。本発明の方法は、ネコブセンチュウによる植物病害を生物的に防除するために利用できる。本発明の方法によれば、従来から行われている化学的防除法と異なり、土壌汚染等の環境負荷を軽減でき、家畜や生態系への影響もより軽微なものに留めることができることが期待される。すなわち本発明の方法は、作物の安定性を高めながら、安定的かつ持続的にネコブセンチュウによる植物病害を防除するために利用できる。
【配列表フリーテキスト】
【0079】
配列番号3及び4:プライマー
【特許請求の範囲】
【請求項1】
ネコブセンチュウ易感染性植物種の植物において、エチレン感受性の低下をもたらすエチレン受容体遺伝子の機能抑制変異を検出することを特徴とする、ネコブセンチュウ抵抗性が増加した植物を選択する方法。
【請求項2】
エチレン受容体がETR1である、請求項1記載の方法。
【請求項3】
エチレン受容体遺伝子の機能抑制変異が、エチレン受容体のアミノ酸変異又はエチレン受容体遺伝子の欠失を生じる塩基変異である、請求項1又は2に記載の方法。
【請求項4】
エチレン受容体のアミノ酸変異が、エチレン受容体の膜貫通領域内のアミノ酸変異である、請求項3に記載の方法。
【請求項5】
ネコブセンチュウ易感染性植物種がナス科である、請求項1〜4のいずれか1項記載の方法。
【請求項6】
ネコブセンチュウ易感染性植物種の植物にエチレン受容体遺伝子の機能抑制変異を導入し、エチレン感受性を低下させることを特徴とする、ネコブセンチュウ抵抗性が増加した植物の作製方法。
【請求項7】
エチレン受容体遺伝子の機能抑制変異の導入が、エチレン受容体のアミノ酸変異又はエチレン受容体遺伝子の欠失を生じる塩基変異の導入である、請求項6に記載の方法。
【請求項8】
エチレン受容体のアミノ酸変異が、エチレン受容体の膜貫通領域内のアミノ酸変異である、請求項7に記載の方法。
【請求項9】
ネコブセンチュウ易感染性植物種がナス科である、請求項6〜8のいずれか1項記載の方法。
【請求項10】
エチレン受容体遺伝子の機能抑制変異の導入が、請求項1〜5のいずれか1項の方法により選択されたネコブセンチュウ抵抗性が増加した植物を育種親として用いる交雑によるものである、請求項6〜9のいずれか1項記載の方法。
【請求項11】
請求項1〜5のいずれか1項に記載の方法、又は請求項6〜10のいずれか1項に記載の方法によって得られる、ネコブセンチュウ抵抗性が増加した植物を、ネコブセンチュウ易感染性植物種の植物の栽培においてネコブセンチュウによる植物病害の防除のために使用することを特徴とする、植物の栽培方法。
【請求項1】
ネコブセンチュウ易感染性植物種の植物において、エチレン感受性の低下をもたらすエチレン受容体遺伝子の機能抑制変異を検出することを特徴とする、ネコブセンチュウ抵抗性が増加した植物を選択する方法。
【請求項2】
エチレン受容体がETR1である、請求項1記載の方法。
【請求項3】
エチレン受容体遺伝子の機能抑制変異が、エチレン受容体のアミノ酸変異又はエチレン受容体遺伝子の欠失を生じる塩基変異である、請求項1又は2に記載の方法。
【請求項4】
エチレン受容体のアミノ酸変異が、エチレン受容体の膜貫通領域内のアミノ酸変異である、請求項3に記載の方法。
【請求項5】
ネコブセンチュウ易感染性植物種がナス科である、請求項1〜4のいずれか1項記載の方法。
【請求項6】
ネコブセンチュウ易感染性植物種の植物にエチレン受容体遺伝子の機能抑制変異を導入し、エチレン感受性を低下させることを特徴とする、ネコブセンチュウ抵抗性が増加した植物の作製方法。
【請求項7】
エチレン受容体遺伝子の機能抑制変異の導入が、エチレン受容体のアミノ酸変異又はエチレン受容体遺伝子の欠失を生じる塩基変異の導入である、請求項6に記載の方法。
【請求項8】
エチレン受容体のアミノ酸変異が、エチレン受容体の膜貫通領域内のアミノ酸変異である、請求項7に記載の方法。
【請求項9】
ネコブセンチュウ易感染性植物種がナス科である、請求項6〜8のいずれか1項記載の方法。
【請求項10】
エチレン受容体遺伝子の機能抑制変異の導入が、請求項1〜5のいずれか1項の方法により選択されたネコブセンチュウ抵抗性が増加した植物を育種親として用いる交雑によるものである、請求項6〜9のいずれか1項記載の方法。
【請求項11】
請求項1〜5のいずれか1項に記載の方法、又は請求項6〜10のいずれか1項に記載の方法によって得られる、ネコブセンチュウ抵抗性が増加した植物を、ネコブセンチュウ易感染性植物種の植物の栽培においてネコブセンチュウによる植物病害の防除のために使用することを特徴とする、植物の栽培方法。
【図1】


【図2】


【図3】




【図2】


【図3】


【公開番号】特開2013−51911(P2013−51911A)
【公開日】平成25年3月21日(2013.3.21)
【国際特許分類】
【出願番号】特願2011−191888(P2011−191888)
【出願日】平成23年9月2日(2011.9.2)
【出願人】(504171134)国立大学法人 筑波大学 (510)
【Fターム(参考)】
【公開日】平成25年3月21日(2013.3.21)
【国際特許分類】
【出願日】平成23年9月2日(2011.9.2)
【出願人】(504171134)国立大学法人 筑波大学 (510)
【Fターム(参考)】
[ Back to top ]

