植物の油脂生産性を増大させる遺伝子及びその利用方法
【課題】植物における油脂生産性を大幅に向上させる。
【解決手段】At3g19990遺伝子若しくは当該遺伝子に機能的に等価な遺伝子を導入する、又は内在する当該遺伝子の発現制御領域を改変する。
【解決手段】At3g19990遺伝子若しくは当該遺伝子に機能的に等価な遺伝子を導入する、又は内在する当該遺伝子の発現制御領域を改変する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、所定の遺伝子を導入した、又は内在する当該遺伝子の発現制御領域を改変した植物体、及び所定の遺伝子を導入する又は内在する当該遺伝子の発現制御領域を改変することによる油脂生産性を増大させる方法、油脂生産性が増大した植物体の製造方法に関する。
【背景技術】
【0002】
植物は、その一部の組織自体(種子、根、葉茎など)を目的として栽培されたり、油脂などの種々の物質生産を目的として栽培されたりする。例えば、植物が生産する油脂としては、大豆油、ごま油、オリーブ油、椰子油、米油、綿実油、ひまわり油、コーン油、べに花油、パーム油及び菜種油等が古来より知られており、家庭用途や工業用途に広く利用されている。また、植物が生産する油脂は、バイオディーゼル燃料やバイオプラスチックの原料としても使用され、石油代替エネルギーとして適用性が広がっている。
【0003】
非特許文献1には、シロイヌナズナにおけるトリアシルグリセロール(TAG)合成遺伝子(DGAT1遺伝子)過剰発現株は種子における油脂含量及び種子重量の増加をもたらすことが報告されている。DGAT1遺伝子は、TAG合成の最終ステップの律速酵素の遺伝子である。DGAT1遺伝子の発現を活性化する転写因子などを同定できれば、種子における油脂貯蔵量を増大させることができ、油脂の生産性を向上できることが期待される。また、本技術を応用すればナタネなどの実用植物においても、油脂の生産性を向上できることが期待される。
【先行技術文献】
【非特許文献】
【0004】
【非特許文献1】Jako, C. et al, 2001 Plant Physiol., 126: 861-874
【発明の開示】
【発明が解決しようとする課題】
【0005】
ところが、現在までDGAT1遺伝子の発現を活性化させるような技術は開発されておらず、DGAT1遺伝子の発現強化に基づく油脂の生産性向上技術は知られていなかった。そこで、上述したような実情に鑑み、植物における油脂生産性を大幅に向上させる新規な機能を有する遺伝子を探索し、植物における油脂生産性を大幅に増大できる技術を提供することを目的とする。
【課題を解決するための手段】
【0006】
上述した目的を達成するため、本発明者らが鋭意検討した結果、機能未知ではあるものの所定の遺伝子を導入する、又は内在する当該遺伝子の発現制御領域を改変することで、植物における油脂生産性を大幅に増大できるといった新規知見を見いだし、本発明を完成するに至った。
【0007】
すなわち、本発明に係る植物体は、At3g19990遺伝子若しくは当該遺伝子に機能的に等価な遺伝子を導入した、又は内在する当該遺伝子の発現制御領域を改変したものである。
【0008】
また、本発明に係る油脂生産性を増大させる方法は、At3g19990遺伝子若しくは当該遺伝子に機能的に等価な遺伝子を導入する、又は内在する当該遺伝子の発現制御領域を改変する方法である。
【0009】
さらに、本発明に係る植物体の製造方法は、At3g19990遺伝子若しくは当該遺伝子に機能的に等価な遺伝子を導入した、又は内在する当該遺伝子の発現制御領域を改変した形質転換植物を準備する工程と、前記形質転換植物の後代植物の油脂生産性を測定し、油脂生産性が有意に向上した系統を選抜する工程とを含む方法である。
【0010】
本発明において、上記遺伝子は、以下の(a)〜(c)のいずれかのタンパク質をコードするものであることが好ましい。
【0011】
(a)配列番号2に示すアミノ酸配列を含むタンパク質
(b)配列番号2に示すアミノ酸配列において1又は複数個のアミノ酸が欠失、置換、付加又は挿入されたアミノ酸配列を含み、種子に特異的に発現し、種子内の種子合成に関与する機能を有するタンパク質
(c)配列番号1に示す塩基配列の相補的な塩基配列からなるポリヌクレオチドに対してストリンジェントな条件下においてハイブリダイズするポリヌクレオチドによってコードされ、種子に特異的に発現し、種子内の種子合成に関与する機能を有するタンパク質
【0012】
また、本発明において、上記機能的に等価な遺伝子は、シロイヌナズナ以外の生物由来であって、種子に特異的に発現し、種子内の種子合成に関与する機能を有するタンパク質をコードする遺伝子を挙げることができる。
【0013】
本発明において対象とする植物は、双子葉植物、例えばアブラナ科植物、アブラナ科植物の中でもシロイヌナズナやナタネを挙げることができる。一方、本発明において対象とする植物は、単子葉植物、例えばイネ科植物、イネ科植物の中でもイネやサトウキビを挙げることができる。
【発明の効果】
【0014】
本発明に係る植物体は、野生型と比較して種子一粒あたりの油脂含量及び種子の大きさが有意に増大するといった特徴を示すため油脂生産性が顕著に向上したものとなる。また、本発明に係る油脂生産性を増大させる方法は、対象とする植物の野生型と比較して、種子一粒あたりの油脂含量及び種子の大きさを大幅に増大することができる。さらに、本発明に係る植物体の製造方法は、野生型と比較して油脂生産性が大幅に向上した植物体を製造することができる。したがって、本発明を適用することによって、例えば、植物に含まれる油脂を生産物としたとき及び/又は種子を生産物としたときの生産性の向上を達成することができる。
【図面の簡単な説明】
【0015】
【図1】DGAT1p::LUC導入植物のLUC遺伝子に基づく蛍光を、葉、根、花、果実について測定した結果を示す写真である。
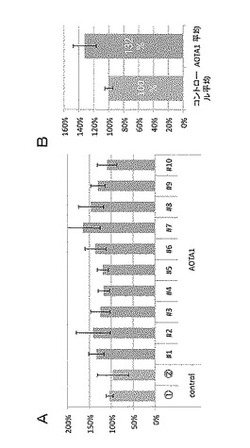
【図2】AOTA1遺伝子(At3g19990)の発現を増強したシロイヌナズナから採取した種子に含まれるTGA量を測定した結果を示す特性図である。
【図3】AOTA1遺伝子(At3g19990)の発現を増強したシロイヌナズナから採取した種子の大きさを測定した結果を示す特性図である。
【発明を実施するための形態】
【0016】
以下、本発明を詳細に説明する。
【0017】
本発明に係る植物体は、シロイヌナズナAt3g19990遺伝子若しくは当該遺伝子に機能的に等価な遺伝子を植物体内に導入したもの、又は内在する当該遺伝子の発現制御領域を改変したものであり、野生型と比較して油脂生産性が有意に増大したものである。対象とする遺伝子を外来的に植物体内に導入するか、内在する遺伝子の発現制御領域を改変することによって、対象とする遺伝子の発現量を野生型における発現量と比較して有意に大とすることができる。本発明に係る植物体としては、上記At3g19990遺伝子を植物組織の全体に亘って発現させたものであっても良いが、植物組織の少なくとも一部において発現させたものであっても良い。ここで植物組織とは、葉、茎、種子、根及び花等の植物器官を含む意味である。特に、上記At3g19990遺伝子を種子において特異的に発現させることが好ましい。
【0018】
また、発現制御領域とは、RNAポリメラーゼが結合するプロモーター領域及びその他の転写因子が結合する領域を含む意味である。転写制御領域の改変としては、内在する転写制御領域のうち例えばプロモーター領域を、より高発現が可能なプロモーター領域に置換することが好ましい。
【0019】
ここで、油脂生産性が増大するとは、種子一粒あたりに含まれる油脂量が増大すると言い換えることができる。また、油脂生産性が増大するとは、種子の大きさが増大すると言い換えることができる。すなわち、本発明に係る植物体は、At3g19990遺伝子若しくは当該遺伝子に機能的に等価な遺伝子を植物体内に導入したもの、又は内在する当該遺伝子の発現制御領域を改変したものであり、野生型と比較して種子一粒あたりに含まれる油脂量及び種子の大きさが有意に増大したものであると言い換えることができる。
【0020】
At3g19990遺伝子
本発明において、植物体には、シロイヌナズナAt3g19990遺伝子を導入する。ここで、At3g19990遺伝子におけるコーディング領域の塩基配列を配列番号1に示し、At3g19990遺伝子によりコードされるタンパク質のアミノ酸配列を配列番号2に示す。また、本発明において、At3g19990遺伝子と機能的に等価な遺伝子を植物体内に導入しても良い。ここで機能的に等価な遺伝子とは、例えばシロイヌナズナ以外の生物由来であって、At3g19990遺伝子に相当する遺伝子の意味である。
【0021】
上記シロイヌナズナ以外の生物に由来するAt3g19990遺伝子と機能的に等価な遺伝子は、特に限定されず、種々の生物に関する遺伝子配列を格納したデータベースを検索することで特定することができる。すなわち、配列番号1に示した塩基配列又は配列番号2に示した塩基配列をクエリー配列として、例えばDDBJ/EMBL/GenBank国際塩基配列データベースやSWISS-PROTデータベースを検索し、公知のデータベースから容易に検索・同定することができる。
【0022】
なお、本発明においてAt3g19990遺伝子としては、上述したような配列番号で特定される塩基配列及びアミノ酸配列からなる遺伝子に限定されるものではない。すなわち、At3g19990遺伝子としては、配列番号2で特定されるアミノ酸配列において1又は複数個のアミノ酸配列が欠失、置換、付加又は挿入されたアミノ酸配列を含み、且つ、種子特異的に発現し、種子内の種子合成に関与する機能を有するタンパク質であっても良い。ここで、複数個のアミノ酸としては、例えば、1から40個、好ましくは1から20個、より好ましくは1から10個、さらに好ましくは1個から5個、特に好ましくは1個から3個を意味する。なお、アミノ酸の欠失、置換若しくは付加は、上記At3g19990遺伝子を当該技術分野で公知の手法によって改変することによって行うことができる。塩基配列に変異を導入するには、Kunkel法またはGapped duplex法等の公知手法又はこれに準ずる方法により行うことができ、例えば部位特異的突然変異誘発法を利用した変異導入用キット(例えばMutant-KやMutant-G(何れも商品名、TAKARA Bio社製))等を用いて、あるいはLA PCR in vitro Mutagenesisシリーズキット(商品名、TAKARA Bio社製)を用いて変異が導入される。また、変異導入方法としては、EMS(エチルメタンスルホン酸)、5-ブロモウラシル、2-アミノプリン、ヒドロキシルアミン、N-メチル-N’-ニトロ-Nニトロソグアニジン、その他の発ガン性化合物に代表されるような化学的変異剤を使用する方法でも良いし、X線、アルファ線、ベータ線、ガンマ線、イオンビームに代表されるような放射線処理や紫外線処理による方法でも良い。
【0023】
また、At3g19990遺伝子としては、上述したような配列番号で特定される塩基配列及びアミノ酸配列からなるAt3g19990遺伝子の相同遺伝子であってもよい。ここで、相同遺伝子とは、一般的に、共通の祖先遺伝子から進化分岐した遺伝子を意味しており、2種類の種の相同遺伝子(オルソログ(ortholog))及び同一種内で重複分岐により生じた相同遺伝子(パラログ(paralog))を含む意味である。換言すると、上述した「機能的に等価な遺伝子」にはオルソログやパラログといった相同遺伝子を含む意味である。但し、上述した「機能的に等価な遺伝子」には、共通遺伝子から進化せず、単に類似した機能を有する遺伝子も含まれている。
【0024】
上述したような配列番号1の塩基配列及び配列番号2のアミノ酸配列で特定されるAt3g19990遺伝子に類似する遺伝子としては、これらアミノ酸配列に対する類似度(Similarity)が例えば70%以上、好ましくは80%以上、より好ましくは90%以上、最も好ましくは95%以上であるアミノ酸配列を有し、種子特異的に発現し、種子内の種子合成に関与する機能を有するタンパク質をコードする遺伝子を挙げることができる。ここで、類似度の値は、BLAST(Basic Local Alignment Search Tool)プログラムを実装したコンピュータプログラム及び遺伝子配列情報を格納したデータベースを用いてデフォルトの設定で求められる値を意味する。
【0025】
また、配列番号1の塩基配列及び配列番号2のアミノ酸配列で特定されるAt3g19990遺伝子に類似する遺伝子は、植物ゲノム情報が明らかとなっていない場合には、対象となる植物からゲノムを抽出するか或いは対象となる植物のcDNAライブラリーを構築し、配列番号1の塩基配列からなるポリヌクレオチドの少なくとも一部に対して、ストリンジェントな条件下でハイブリダイズするゲノム領域或いはcDNAを単離することで同定することができる。ここで、ストリンジェントな条件とは、いわゆる特異的なハイブリッドが形成され、非特異的なハイブリッドが形成されない条件をいう。例えば、45℃、6×SSC(塩化ナトリウム/クエン酸ナトリウム)でのハイブリダイゼーション、その後の50〜65℃、0.2〜1×SSC、0.1%SDSでの洗浄が挙げられ、或いはそのような条件として、65〜70℃、1×SSCでのハイブリダイゼーション、その後の65〜70℃、0.3×SSCでの洗浄を挙げることができる。ハイブリダイゼーションは、J. Sambrook et al. Molecular Cloning, A Laboratory Manual, 2nd Ed., Cold Spring Harbor Laboratory(1989)に記載されている方法等、従来公知の方法で行うことができる。
【0026】
本発明に係る植物体は、At3g19990遺伝子若しくは当該遺伝子に機能的に等価な遺伝子を植物体内に導入するか、内在する当該遺伝子の発現制御領域を改変することによって、油脂生産性(種子一粒あたりの油脂含量及び種子の大きさ)が野生型と比較して有意に向上したものとなる。このAt3g19990遺伝子を植物体内に導入する手法としては、植物体内で発現を可能とするプロモーターの制御下に外因性のAt3g19990遺伝子を配置した発現ベクターを導入する手法をあげることができる。内在する当該遺伝子の発現制御領域を改変する手法としては、対象とする植物体における内在性のAt3g19990遺伝子のプロモーターを改変する手法を挙げることができる。
【0027】
一例としては、植物体内で発現を可能とするプロモーターの制御下に上述したAt3g19990遺伝子を配置した発現ベクターを対象の植物体に導入する手法が好ましい。
【0028】
発現ベクター
発現ベクターは、植物体内で発現を可能とするプロモーターと、上述したAt3g19990遺伝子とを含むように構築する。発現ベクターの母体となるベクターとしては、従来公知の種々のベクターを用いることができる。例えば、プラスミド、ファージ、またはコスミド等を用いることができ、導入される植物細胞や導入方法に応じて適宜選択することができる。具体的には、例えば、pBR322、pBR325、pUC19、pUC119、pBluescript、pBluescriptSK、pBI系のベクター等を挙げることができる。特に、植物体へのベクターの導入法がアグロバクテリウムを用いる方法である場合には、pBI系のバイナリーベクターを用いることが好ましい。pBI系のバイナリーベクターとしては、具体的には、例えば、pBIG、pBIN19、pBI101、pBI121、pBI221等を挙げることができる。
【0029】
プロモーターは、植物体内でAt3g19990遺伝子を発現させることが可能なプロモーターであれば特に限定されるものではなく、公知のプロモーターを好適に用いることができる。かかるプロモーターとしては、例えば、カリフラワーモザイクウイルス35Sプロモーター(CaMV35S)、各種アクチン遺伝子プロモーター、各種ユビキチン遺伝子プロモーター、ノパリン合成酵素遺伝子のプロモーター、タバコのPR1a遺伝子プロモーター、ナピン遺伝子プロモーター、オレオシン遺伝子プロモーター等を挙げることができる。この中でも、カリフラワーモザイクウイルス35Sプロモーター、アクチン遺伝子プロモーター又はユビキチン遺伝子プロモーターをより好ましく用いることができる。上記各プロモーターを用いれば、植物細胞内に導入されたときに任意の遺伝子を強く発現させることが可能となる。
【0030】
また、プロモーターとしては、植物における部位特異的に発現させる機能を有するものを使用することもできる。このようなプロモーターとしては、従来公知の如何なるプロモーターを使用することができる。このようなプロモーターを使用して、上記At3g19990遺伝子を部位特異的に発現させることによって、発現した植物器官を野生型と比較して増大させることができる。特に、種子特異的プロモーターを使用することによって、上記At3g19990遺伝子を種子において発現させることができ、種子に含まれる油脂含量及び種子の大きさを増大させることができる。
【0031】
なお、発現ベクターは、プロモーター及び上記At3g19990遺伝子に加えて、さらに他のDNAセグメントを含んでいてもよい。当該他のDNAセグメントは特に限定されるものではないが、ターミネーター、選別マーカー、エンハンサー、翻訳効率を高めるための塩基配列等を挙げることができる。また、上記組換え発現ベクターは、さらにT−DNA領域を有していてもよい。T−DNA領域は特にアグロバクテリウムを用いて上記組換え発現ベクターを植物体に導入する場合に遺伝子導入の効率を高めることができる。
【0032】
転写ターミネーターは転写終結部位としての機能を有していれば特に限定されるものではなく、公知のものであってもよい。例えば、具体的には、ノパリン合成酵素遺伝子の転写終結領域(Nosターミネーター)、カリフラワーモザイクウイルス35Sの転写終結領域(CaMV35Sターミネーター)等を好ましく用いることができる。この中でもNosターミネーターをより好ましく用いることできる。上記組換えベクターにおいては、転写ターミネーターを適当な位置に配置することにより、植物細胞に導入された後に、不必要に長い転写物を合成し、強力なプロモーターがプラスミドのコピー数を減少させるといった現象の発生を防止することができる。
【0033】
形質転換体選別マーカーとしては、例えば薬剤耐性遺伝子を用いることができる。かかる薬剤耐性遺伝子の具体的な一例としては、例えば、ハイグロマイシン、ブレオマイシン、カナマイシン、ゲンタマイシン、クロラムフェニコール等に対する薬剤耐性遺伝子を挙げることができる。これにより、上記抗生物質を含む培地中で生育する植物体を選択することによって、形質転換された植物体を容易に選別することができる。
【0034】
翻訳効率を高めるための塩基配列としては、例えばタバコモザイクウイルス由来のomega配列を挙げることができる。このomega配列をプロモーターの非翻訳領域(5’UTR)に配置させることによって、上記融合遺伝子の翻訳効率を高めることができる。このように、上記組換え発現ベクターには、その目的に応じて、さまざまなDNAセグメントを含ませることができる。
【0035】
組換え発現ベクターの構築方法についても特に限定されるものではなく、適宜選択された母体となるベクターに、上記プロモーター、上記At3g19990遺伝子、および転写抑制転換ポリヌクレオチド、並びに必要に応じて上記他のDNAセグメントを所定の順序となるように導入すればよい。例えば、上記At3g19990遺伝子とプロモーターと(必要に応じて転写ターミネーター等)とを連結して発現カセットを構築し、これをベクターに導入すればよい。発現カセットの構築では、例えば、各DNAセグメントの切断部位を互いに相補的な突出末端としておき、ライゲーション酵素で反応させることで、当該DNAセグメントの順序を規定することが可能となる。なお、発現カセットにターミネーターが含まれる場合には、上流から、プロモーター、上記At3g19990遺伝子、ターミネーターの順となっていればよい。また、発現ベクターを構築するための試薬類、すなわち制限酵素やライゲーション酵素等の種類についても特に限定されるものではなく、市販のものを適宜選択して用いればよい。
【0036】
また、上記発現ベクターの増殖方法(生産方法)も特に限定されるものではなく、従来公知の方法を用いることができる。一般的には大腸菌をホストとして当該大腸菌内で増殖させればよい。このとき、ベクターの種類に応じて、好ましい大腸菌の種類を選択してもよい。
【0037】
形質転換
上述した発現ベクターは、一般的な形質転換方法によって対象の植物内に導入される。発現ベクターを植物細胞に導入する方法(形質転換方法)は特に限定されるものではなく、植物細胞に応じた適切な従来公知の方法を用いることができる。具体的には、例えば、アグロバクテリウムを用いる方法や直接植物細胞に導入する方法を用いることができる。アグロバクテリウムを用いる方法としては、例えば、Bechtold, E., Ellis, J. and Pelletier, G. (1993) In Planta Agrobacterium-mediated gene transfer by infiltration of adult Arabidopsis plants. C.R. Acad. Sci. Paris Sci. Vie, 316, 1194-1199. あるいは、Zyprian E, Kado Cl, Agrobacterium-mediated plant transformation by novel mini-T vectors in conjunction with a high-copy vir region helper plasmid. Plant Molecular Biology, 1990, 15(2), 245-256.に記載された方法を用いることができる。
【0038】
発現ベクターを直接植物細胞に導入する方法としては、例えば、マイクロインジェクション法、エレクトロポレーション法(電気穿孔法)、ポリエチレングリコール法、パーティクルガン法、プロトプラスト融合法、リン酸カルシウム法等を用いることができる。
【0039】
また、DNAを直接植物細胞に導入する方法を採るなら、対象とする遺伝子の発現に必要な転写ユニット、例えばプロモーターや転写ターミネーターと、対象とする遺伝子を含んだDNAであれば十分であり、ベクター機能は必須ではない。さらに、転写ユニットを有さない対象とする遺伝子のタンパク質コード領域のみを含むDNAであっても、宿主の転写ユニット内にインテグレートし、対象となる遺伝子を発現することができればよい。
【0040】
上記発現ベクターや、発現ベクターを含まず対象となる遺伝子を含んだ発現カセットが導入される植物細胞としては、例えば、花、葉、根等の植物器官における各組織の細胞、カルス、懸濁培養細胞等を挙げることができる。ここで、発現ベクターは、生産しようとする種類の植物体に合わせて適切なものを適宜構築してもよいが、汎用的な発現ベクターを予め構築しておき、それを植物細胞に導入してもよい。
【0041】
発現ベクターの導入対象となる植物、換言すると油脂生産性(種子一粒あたりの油脂含量及び種子の大きさ)を増大させる対象の植物としては、特に限定されない。すなわち、上述したAt3g19990を発現させることによって、あらゆる植物体について油脂生産性(種子一粒あたりの油脂含量及び種子の大きさ)の増大効果を期待することができる。対象となる植物としては、例えば、双子葉植物、単子葉植物、例えばアブラナ科、イネ科、ナス科、マメ科、ヤナギ科等に属する植物(下記参照)が挙げられるが、これらの植物に限定されるものではない。
【0042】
アブラナ科:シロイヌナズナ(Arabidopsis thaliana)、キャベツ(Brassica oleracea var. capitata)、ナタネ(Brassica rapa、Brassica napus)、ハクサイ(Brassica rapa var. pekinensis)、チンゲンサイ(Brassica rapa var. chinensis)、カブ(Brassica rapa var. rapa)、ノザワナ(Brassica rapa var. hakabura)、ミズナ(Brassica rapa var. lancinifolia)、コマツナ(Brassica rapa var. peruviridis)、パクチョイ(Brassica rapa var. chinensis)、ダイコン(Raphanus sativus)、ワサビ(Wasabia japonica)など。
【0043】
ナス科:タバコ(Nicotiana tabacum)、ナス(Solanum melongena)、ジャガイモ(Solanum tuberosum)、トマト(Lycopersicon lycopersicum)、トウガラシ(Capsicum annuum)、ペチュニア(Petunia)など。
【0044】
マメ科:ダイズ(Glycine max)、エンドウ(Pisum sativum)、ソラマメ(Vicia faba)、フジ(Wisteria floribunda)、ラッカセイ(Arachis. hypogaea)、ミヤコグサ(Lotus corniculatus var. japonicus)、インゲンマメ(Phaseolus vulgaris)、アズキ(Vigna angularis)、アカシア(Acacia)など。
【0045】
キク科:キク(Chrysanthemum morifolium)、ヒマワリ(Helianthus annuus)など。
ヤシ科:アブラヤシ(Elaeis guineensis、Elaeis oleifera)、ココヤシ(Cocos nucifera)、ナツメヤシ(Phoenix dactylifera)、ロウヤシ(Copernicia)
ウルシ科:ハゼノキ(Rhus succedanea)、カシューナットノキ(Anacardium occidentale)、ウルシ(Toxicodendron vernicifluum)、マンゴー(Mangifera indica)、ピスタチオ(Pistacia vera)
【0046】
ウリ科:カボチャ(Cucurbita maxima、Cucurbita moschata、Cucurbita pepo)、キュウリ(Cucumis sativus)、カラスウリ(Trichosanthes cucumeroides)、ヒョウタン(Lagenaria siceraria var. gourda)
【0047】
バラ科:アーモンド(Amygdalus communis)、バラ(Rosa)、イチゴ(Fragaria)、サクラ(Prunus)、リンゴ(Malus pumila var. domestica)など。
ナデシコ科:カーネーション(Dianthus caryophyllus)など。
ヤナギ科:ポプラ(Populus trichocarpa、Populus nigra、Populus tremula)
イネ科:トウモロコシ(Zea mays)、イネ(Oryza sativa)、オオムギ(Hordeum vulgare)、コムギ(Triticum aestivum)、タケ(Phyllostachys)、サトウキビ(Saccharum officinarum)、ネピアグラス(Pennisetum pupureum)、エリアンサス(Erianthus ravenae)、ミスキャンタス(ススキ)(Miscanthus virgatum)、ソルガム(Sorghum)スイッチグラス(Panicum)など。
ユリ科:チューリップ(Tulipa)、ユリ(Lilium)など。
【0048】
なかでも、ナタネ等の油脂生産の原料となりうる作物を対象とすることが好ましい。植物由来の種子生産の低コスト化を実現できるからである。
【0049】
また、上述したように、本発明で使用可能なAt3g19990遺伝子は、種々の植物から単離して使用することができるが、油脂生産性(種子一粒あたりの油脂含量及び種子の大きさ)を増大する対象の植物の種類に応じて、適宜選択して用いることができる。すなわち、油脂生産性(種子一粒あたりの油脂含量及び種子の大きさ)を増産する対象の植物が単子葉植物である場合には、At3g19990遺伝子として単子葉植物から単離したものを発現させることが好ましい。
【0050】
なお、本発明においては、油脂生産性(種子一粒あたりの油脂含量及び種子の大きさ)を増大する対象の植物が単子葉植物であったとしても、双子葉植物由来のAt3g19990遺伝子を導入しても良い。すなわち、例えば、シロイヌナズナ由来のAt3g19990遺伝子(配列番号1)は、双子葉植物に限らず、広く単子葉植物に分類される植物に発現するように導入されてもよい。
【0051】
その他の工程、その他の方法
上述した形質転換処理後、植物体のなかから適切な形質転換体を選抜する選抜工程を、従来公知の方法で行うことができる。選抜の方法は特に限定されるものではなく、例えば、ハイグロマイシン耐性等の薬剤耐性を基準として選抜してもよいし、形質転換体を育成した後に、植物体そのもの、または任意の器官や組織の重量を測定して野生型と比較して有意に増産しているものを選抜してもよい。
【0052】
また、形質転換処理で得られた形質転換植物から定法に従って後代植物を得ることができる。上記At3g19990遺伝子が導入された形質又は内在する当該At3g19990遺伝子の発現制御領域が改変された形質を保持した後代植物を、その油脂生産性(種子一粒あたりの油脂含量及び種子の大きさ)を基準として選抜することによって、上記形質を有することで油脂生産性(種子一粒あたりの油脂含量及び種子の大きさ)が増大した安定的な植物系統を作出することができる。なお、形質転換植物やその子孫から、植物細胞や種子、果実、株、カルス、塊茎、切穂、塊等の繁殖材料を得て、これらを基に上記形質を有することで油脂生産性(種子一粒あたりの油脂含量及び種子の大きさ)が増大した安定的な植物系統を量産することも可能である。
【0053】
なお、本発明における植物体とは、成育した植物個体、植物細胞、植物組織、カルス、種子の少なくとも何れかが含まれる。つまり、本発明では、最終的に植物個体まで成育させることができる状態のものであれば、全て植物体とみなす。また、上記植物細胞には、種々の形態の植物細胞が含まれる。かかる植物細胞としては、例えば、懸濁培養細胞、プロトプラスト、葉の切片等が含まれる。これらの植物細胞を増殖・分化させることにより植物体を得ることができる。なお、植物細胞からの植物体の再生は、植物細胞の種類に応じて、従来公知の方法を用いて行うことができる。
【0054】
以上説明したように、本発明によれば、At3g19990遺伝子を植物体内に導入する、又は内在する当該At3g19990遺伝子の発現制御領域を改変することで、野生型の植物体と比較して、油脂生産性(種子一粒あたりの油脂含量及び種子の大きさ)が有意に増大した植物体を提供することができる。ここで、油性量が有意に増大するとは、野生型と比較して一個体あたりに生産される油脂の総重量又は種子一粒に含まれる油脂の総重量が統計的に有意に大となっていることを意味する。また、種子の大きさが有意に増大するとは、野生型と比較して種子一粒の表面積が統計的に有意に大となっていることを意味する。
【0055】
本発明によれば、植物体の油脂生産性(種子一粒あたりの油脂含量及び種子の大きさ)が増大するため、例えば、種子に含まれる油脂を生産目的とした場合、作付け面積あたりで回収できる油脂量を大幅に向上させることができる。ここで油脂としては、特に限定されず、例えば、大豆油、ごま油、オリーブ油、椰子油、米油、綿実油、ひまわり油、コーン油、べに花油及び菜種油等の植物由来の油脂(トリアシルグリセロール、中性脂肪)を例示することができる。また、製造した油脂は、家庭用途や工業用途に広く利用することができ、更にはバイオディーゼル燃料の原料としても使用することができる。すなわち、本発明によれば上記At3g19990遺伝子が導入された、又は内在する当該At3g19990遺伝子の発現制御領域が改変された植物体を利用することによって、上述した家庭用途又は工業用途の油脂や、バイオディーゼル燃料等を低コストに製造することができる。
【実施例】
【0056】
以下、実施例により本発明をより詳細に説明するが、本発明の技術的範囲はこれら実施例に限定されるものではない。
【0057】
〔実施例1〕
DGAT1p::LUC導入植物の作製
シロイヌナズナで予測されている4つのTAG合成酵素遺伝子DGAT1、DGAT2、PDAT1、PDAT2-likeの内、種子成熟過程で最も強く発現しているDGAT1に着目し、DGAT1を直接転写活性化する因子の探索を行った。生きたまま観察可能な生物発光を指標としてスクリーニングを行うために、DGAT1p::LUC導入植物を作製した。DGAT1p::LUC導入植物を使用することにより、内在DGAT1遺伝子のmRNAの挙動をLUC発光レベルで追跡することが可能である。
【0058】
先ず、DGAT1遺伝子(At2g19450)の翻訳開始点上流+1から+2076を含むようCol-0のゲノムを鋳型にPrimeSTAR (TAKARA Bio社製)を使用してDGAT1遺伝子のプロモーター領域をPCR増幅した。PCR増幅にはTAG1p(Xba)attB1(ggggACAAGTTTGTACAAAAAAGCAGGCTctagattaatattccacttactacttcc:配列番号3)及びTAG1p-attab2(ggggACCACTTTGTACAAGAAAGCTGGGTtcgccatttcgaaaagggttg:配列番号4)をプライマーとして使用した。
【0059】
増幅したDNA断片及びInvitorogen社のGATEWAYシステムを利用して、エントリークローンを得た。バイナリーベクターpGWB435(GenBank AB294498)( Nakagawa, T. et al., (2007) Biosci. Biotechnol. Biochem. 71, 2095-2100参照)とともに反応させ、DGAT1p::LUCバイナリープラスミドを作製した。DGAT11p::LUC バイナリープラスミドをエレクトロポレーションにより、アグロバクテリウムC58C1株に導入し、Floral dip法にてシロイヌナズナCol-0をDGAT11p::LUCで形質転換した。
【0060】
DGAT1p::LUCを導入した植物体からとれた種子(T1:T-DNA挿入へテロ)を抗生物質カナマイシン(Km)耐性で選抜し、生育させてT2種子(T-DNA挿入ホモ、ヘテロ、なしの混合)を得た。T2種子をKm培地で発芽させ、抗生物質耐性がおよそ3:1の比になるラインからさらに数個体ずつを生育させ、T3種子を得た。T3種子がすべてKm耐性を示したラインをT-DNA挿入ホモライン、DGAT1p::LUC導入植物として用いた。得られたDGAT1p::LUC導入植物のLUC遺伝子に基づく蛍光を測定した結果を図1に示した。
【0061】
DGAT1p::LUC導入植物のアクティベーションタグラインの作製
DGAT1p::LUC 導入植物に対して、バイナリーベクターpPCVICEn4HPT(H. Hayashi et al., Science 258, 1350 (1992))を保有するアグロバクテリウム(GV3101(pMP90RK) 株)を用いFloral dip法で感染させ、DGAT1p::LUC導入植物のアクティベーションタグラインを作製した。なお、pPCVICEn4HPTは、ハイグロマイシン(Hyg)耐性遺伝子及び4コピーのエンハンサーを含んでいる。その結果、エンハンサーT-DNAがゲノム中にランダムに挿入されたアクティベーションタグライン(形質転換植物)を多数作製することができた。
【0062】
これらのうちLUC活性が高い候補株について、インバースPCR法によりエンハンサー挿入位置決定した。このうち、1つの変異株は、次世代の芽生えのLUC発光レベルが約3倍と高く、芽生えのmRNA解析の結果、エンハンサー近傍の遺伝子の活性化と、DGAT1p::LUCのみならず内在のDGAT1の活性化を確認できた。また、当該変異株において、活性化されていたエンハンサー近傍遺伝子には、種子特異的に発現するものが存在していた。
【0063】
35Sp::AOTA1を導入したDGAT1p::LUC導入植物の作製
全長cDNAのクローニング
この上記変異株において特定された種子特異的発現をする機能未知遺伝子(At3g19990)をAOTA1遺伝子(Activator of TAG Synthesis)と称する。AOTA1遺伝子の全長cDNA断片を、シロイヌナズナCol-0植物体の葉および果実のtotal RNAを鋳型とし、Pyrobest(TAKARA Bio社製)酵素により増幅した。増幅反応には、AT3g19990-B1(GGGGACAAGTTTGTACAAAAAAGCAGGCTAAATGGGTTCATCATCATCTCCATCC:配列番号5)及びAT3g19990-B2(GGGGACCACTTTGTACAAGAAAGCTGGGTAGCGCACGAGACCCAAGTT:配列番号6)をプライマーとして使用した。
【0064】
増幅したDNA断片、pDONR201(Invitrogen社製)及びBP Clonase II酵素(Invitrogen社製)を用いてエントリークローンを得た。
【0065】
35Sp::AOTA1の調整
上記エントリークローン、pGWB502Ω(35SプロモーターとΩ配列を持つGATEWAYバイナリベクター)及びBP Clonase II酵素(Invitrogen社製)を反応させ、35Sp::AOTA1バイナリープラスミドを作製した。
【0066】
DGAT1::LUC導入植物への導入
35Sp::AOTA1バイナリープラスミドをエレクトロポレーションによりアグロバクテリウム(C58C1株)に導入し、Floral dip法にてDGAT1p::LUC導入植物を形質転換した。
【0067】
過剰発現株の作製
上記アグロバクテリウム感染後の植物から取れた種子を1% ショ糖、MS、0.3% Gerlite、ハイグロマイシン20mg/L培地で選抜した。薬剤耐性を示す株をバーミキュライト、6cm鉢、連続光条件下で生育させ種子を取得した。
【0068】
TGA量の評価
得られたシロイヌナズナ種子20粒をマルチビーズショッカー(安井器械社製、2000rpm 30秒x2)で破砕し、クロロホルム:メタノール(2:1)200μlに溶解させ、1.5 mlチューブに回収し、15.000rpmで5分遠心した。上清100μlを新しいチューブに回収し、真空ポンプにて溶媒を揮発させた。ペレットを20μlエタノールに溶解後、水80μlを加え、4μlをTAG定量に使用した。トリアシルグリセリド(TAG)スタンダードには、1mg/mlコーン油を0、1、2、3、4、5、6μl使用し、試料にクオリジェントTG(第一化学社製)の酵素溶液(1)120μlを加え、37℃で15分間反応させ、酵素液(2)を40μl分注し、さらに37℃で15分間反応させ、600nmの吸光度を測定し、種子あたりのTAG量を算出した。1株由来種子について、4連で行った。
【0069】
種子の体積の測定
得られたシロイヌナズナ種子を顕微鏡下で観察し、デジタル画像を取得し、画像解析アプリケーションソフトImage Jにより、種子の写真を白黒2階調化し、100粒分の種子の形から、面積を算出した。
【0070】
結果
種子に含まれるTAG量を測定した結果を図2A及びBに示した。図2Aは、AOTA1過剰発現株10個体(#1〜#10)について、各個体から採取した種子20粒に含まれるTAG量を、コントロールの平均を100%として示している(N=4)。また、図2Bは、コントロール2個体の平均を100%としたときの、AOTA1過剰発現株10個体のTGA含有量を相対値として示している。
【0071】
図2A及びBから判るように、AOTA1遺伝子(At3g19990)を35Sプロモーターの発現制御下に導入したシロイヌナズナにおいては、種子に含まれるTGA量がコントロールと比較して有意に増大していることが明らかとなった。
【0072】
また、種子の大きさを測定した結果を図3A及びBに示した。図3Aは、AOTA1過剰発現株10個体(#1〜#10)について、各個体から採取した種子100粒の平均面積を、コントロールの平均を100%として示している(N=4)。また、図3Bは、コントロール2個体の平均を100%としたときの、AOTA1過剰発現株10個体から採取した種子の平均面積を相対値として示している。
【0073】
図3A及びBから判るように、AOTA1遺伝子(At3g19990)を35Sプロモーターの発現制御下に導入したシロイヌナズナにおいては、種子の大きさがコントロールと比較して有意に増大していることが明らかとなった。
【0074】
以上の結果から、AOTA1遺伝子(At3g19990)を導入する、又は内在するAOTA1遺伝子(At3g19990)の発現制御領域を改変して、AOTA1遺伝子(At3g19990)の発現量を増強することによって、植物の油脂生産性(種子一粒あたりの油脂含量及び種子の大きさ)を有意に増大できることが明らかとなった。
【技術分野】
【0001】
本発明は、所定の遺伝子を導入した、又は内在する当該遺伝子の発現制御領域を改変した植物体、及び所定の遺伝子を導入する又は内在する当該遺伝子の発現制御領域を改変することによる油脂生産性を増大させる方法、油脂生産性が増大した植物体の製造方法に関する。
【背景技術】
【0002】
植物は、その一部の組織自体(種子、根、葉茎など)を目的として栽培されたり、油脂などの種々の物質生産を目的として栽培されたりする。例えば、植物が生産する油脂としては、大豆油、ごま油、オリーブ油、椰子油、米油、綿実油、ひまわり油、コーン油、べに花油、パーム油及び菜種油等が古来より知られており、家庭用途や工業用途に広く利用されている。また、植物が生産する油脂は、バイオディーゼル燃料やバイオプラスチックの原料としても使用され、石油代替エネルギーとして適用性が広がっている。
【0003】
非特許文献1には、シロイヌナズナにおけるトリアシルグリセロール(TAG)合成遺伝子(DGAT1遺伝子)過剰発現株は種子における油脂含量及び種子重量の増加をもたらすことが報告されている。DGAT1遺伝子は、TAG合成の最終ステップの律速酵素の遺伝子である。DGAT1遺伝子の発現を活性化する転写因子などを同定できれば、種子における油脂貯蔵量を増大させることができ、油脂の生産性を向上できることが期待される。また、本技術を応用すればナタネなどの実用植物においても、油脂の生産性を向上できることが期待される。
【先行技術文献】
【非特許文献】
【0004】
【非特許文献1】Jako, C. et al, 2001 Plant Physiol., 126: 861-874
【発明の開示】
【発明が解決しようとする課題】
【0005】
ところが、現在までDGAT1遺伝子の発現を活性化させるような技術は開発されておらず、DGAT1遺伝子の発現強化に基づく油脂の生産性向上技術は知られていなかった。そこで、上述したような実情に鑑み、植物における油脂生産性を大幅に向上させる新規な機能を有する遺伝子を探索し、植物における油脂生産性を大幅に増大できる技術を提供することを目的とする。
【課題を解決するための手段】
【0006】
上述した目的を達成するため、本発明者らが鋭意検討した結果、機能未知ではあるものの所定の遺伝子を導入する、又は内在する当該遺伝子の発現制御領域を改変することで、植物における油脂生産性を大幅に増大できるといった新規知見を見いだし、本発明を完成するに至った。
【0007】
すなわち、本発明に係る植物体は、At3g19990遺伝子若しくは当該遺伝子に機能的に等価な遺伝子を導入した、又は内在する当該遺伝子の発現制御領域を改変したものである。
【0008】
また、本発明に係る油脂生産性を増大させる方法は、At3g19990遺伝子若しくは当該遺伝子に機能的に等価な遺伝子を導入する、又は内在する当該遺伝子の発現制御領域を改変する方法である。
【0009】
さらに、本発明に係る植物体の製造方法は、At3g19990遺伝子若しくは当該遺伝子に機能的に等価な遺伝子を導入した、又は内在する当該遺伝子の発現制御領域を改変した形質転換植物を準備する工程と、前記形質転換植物の後代植物の油脂生産性を測定し、油脂生産性が有意に向上した系統を選抜する工程とを含む方法である。
【0010】
本発明において、上記遺伝子は、以下の(a)〜(c)のいずれかのタンパク質をコードするものであることが好ましい。
【0011】
(a)配列番号2に示すアミノ酸配列を含むタンパク質
(b)配列番号2に示すアミノ酸配列において1又は複数個のアミノ酸が欠失、置換、付加又は挿入されたアミノ酸配列を含み、種子に特異的に発現し、種子内の種子合成に関与する機能を有するタンパク質
(c)配列番号1に示す塩基配列の相補的な塩基配列からなるポリヌクレオチドに対してストリンジェントな条件下においてハイブリダイズするポリヌクレオチドによってコードされ、種子に特異的に発現し、種子内の種子合成に関与する機能を有するタンパク質
【0012】
また、本発明において、上記機能的に等価な遺伝子は、シロイヌナズナ以外の生物由来であって、種子に特異的に発現し、種子内の種子合成に関与する機能を有するタンパク質をコードする遺伝子を挙げることができる。
【0013】
本発明において対象とする植物は、双子葉植物、例えばアブラナ科植物、アブラナ科植物の中でもシロイヌナズナやナタネを挙げることができる。一方、本発明において対象とする植物は、単子葉植物、例えばイネ科植物、イネ科植物の中でもイネやサトウキビを挙げることができる。
【発明の効果】
【0014】
本発明に係る植物体は、野生型と比較して種子一粒あたりの油脂含量及び種子の大きさが有意に増大するといった特徴を示すため油脂生産性が顕著に向上したものとなる。また、本発明に係る油脂生産性を増大させる方法は、対象とする植物の野生型と比較して、種子一粒あたりの油脂含量及び種子の大きさを大幅に増大することができる。さらに、本発明に係る植物体の製造方法は、野生型と比較して油脂生産性が大幅に向上した植物体を製造することができる。したがって、本発明を適用することによって、例えば、植物に含まれる油脂を生産物としたとき及び/又は種子を生産物としたときの生産性の向上を達成することができる。
【図面の簡単な説明】
【0015】
【図1】DGAT1p::LUC導入植物のLUC遺伝子に基づく蛍光を、葉、根、花、果実について測定した結果を示す写真である。
【図2】AOTA1遺伝子(At3g19990)の発現を増強したシロイヌナズナから採取した種子に含まれるTGA量を測定した結果を示す特性図である。
【図3】AOTA1遺伝子(At3g19990)の発現を増強したシロイヌナズナから採取した種子の大きさを測定した結果を示す特性図である。
【発明を実施するための形態】
【0016】
以下、本発明を詳細に説明する。
【0017】
本発明に係る植物体は、シロイヌナズナAt3g19990遺伝子若しくは当該遺伝子に機能的に等価な遺伝子を植物体内に導入したもの、又は内在する当該遺伝子の発現制御領域を改変したものであり、野生型と比較して油脂生産性が有意に増大したものである。対象とする遺伝子を外来的に植物体内に導入するか、内在する遺伝子の発現制御領域を改変することによって、対象とする遺伝子の発現量を野生型における発現量と比較して有意に大とすることができる。本発明に係る植物体としては、上記At3g19990遺伝子を植物組織の全体に亘って発現させたものであっても良いが、植物組織の少なくとも一部において発現させたものであっても良い。ここで植物組織とは、葉、茎、種子、根及び花等の植物器官を含む意味である。特に、上記At3g19990遺伝子を種子において特異的に発現させることが好ましい。
【0018】
また、発現制御領域とは、RNAポリメラーゼが結合するプロモーター領域及びその他の転写因子が結合する領域を含む意味である。転写制御領域の改変としては、内在する転写制御領域のうち例えばプロモーター領域を、より高発現が可能なプロモーター領域に置換することが好ましい。
【0019】
ここで、油脂生産性が増大するとは、種子一粒あたりに含まれる油脂量が増大すると言い換えることができる。また、油脂生産性が増大するとは、種子の大きさが増大すると言い換えることができる。すなわち、本発明に係る植物体は、At3g19990遺伝子若しくは当該遺伝子に機能的に等価な遺伝子を植物体内に導入したもの、又は内在する当該遺伝子の発現制御領域を改変したものであり、野生型と比較して種子一粒あたりに含まれる油脂量及び種子の大きさが有意に増大したものであると言い換えることができる。
【0020】
At3g19990遺伝子
本発明において、植物体には、シロイヌナズナAt3g19990遺伝子を導入する。ここで、At3g19990遺伝子におけるコーディング領域の塩基配列を配列番号1に示し、At3g19990遺伝子によりコードされるタンパク質のアミノ酸配列を配列番号2に示す。また、本発明において、At3g19990遺伝子と機能的に等価な遺伝子を植物体内に導入しても良い。ここで機能的に等価な遺伝子とは、例えばシロイヌナズナ以外の生物由来であって、At3g19990遺伝子に相当する遺伝子の意味である。
【0021】
上記シロイヌナズナ以外の生物に由来するAt3g19990遺伝子と機能的に等価な遺伝子は、特に限定されず、種々の生物に関する遺伝子配列を格納したデータベースを検索することで特定することができる。すなわち、配列番号1に示した塩基配列又は配列番号2に示した塩基配列をクエリー配列として、例えばDDBJ/EMBL/GenBank国際塩基配列データベースやSWISS-PROTデータベースを検索し、公知のデータベースから容易に検索・同定することができる。
【0022】
なお、本発明においてAt3g19990遺伝子としては、上述したような配列番号で特定される塩基配列及びアミノ酸配列からなる遺伝子に限定されるものではない。すなわち、At3g19990遺伝子としては、配列番号2で特定されるアミノ酸配列において1又は複数個のアミノ酸配列が欠失、置換、付加又は挿入されたアミノ酸配列を含み、且つ、種子特異的に発現し、種子内の種子合成に関与する機能を有するタンパク質であっても良い。ここで、複数個のアミノ酸としては、例えば、1から40個、好ましくは1から20個、より好ましくは1から10個、さらに好ましくは1個から5個、特に好ましくは1個から3個を意味する。なお、アミノ酸の欠失、置換若しくは付加は、上記At3g19990遺伝子を当該技術分野で公知の手法によって改変することによって行うことができる。塩基配列に変異を導入するには、Kunkel法またはGapped duplex法等の公知手法又はこれに準ずる方法により行うことができ、例えば部位特異的突然変異誘発法を利用した変異導入用キット(例えばMutant-KやMutant-G(何れも商品名、TAKARA Bio社製))等を用いて、あるいはLA PCR in vitro Mutagenesisシリーズキット(商品名、TAKARA Bio社製)を用いて変異が導入される。また、変異導入方法としては、EMS(エチルメタンスルホン酸)、5-ブロモウラシル、2-アミノプリン、ヒドロキシルアミン、N-メチル-N’-ニトロ-Nニトロソグアニジン、その他の発ガン性化合物に代表されるような化学的変異剤を使用する方法でも良いし、X線、アルファ線、ベータ線、ガンマ線、イオンビームに代表されるような放射線処理や紫外線処理による方法でも良い。
【0023】
また、At3g19990遺伝子としては、上述したような配列番号で特定される塩基配列及びアミノ酸配列からなるAt3g19990遺伝子の相同遺伝子であってもよい。ここで、相同遺伝子とは、一般的に、共通の祖先遺伝子から進化分岐した遺伝子を意味しており、2種類の種の相同遺伝子(オルソログ(ortholog))及び同一種内で重複分岐により生じた相同遺伝子(パラログ(paralog))を含む意味である。換言すると、上述した「機能的に等価な遺伝子」にはオルソログやパラログといった相同遺伝子を含む意味である。但し、上述した「機能的に等価な遺伝子」には、共通遺伝子から進化せず、単に類似した機能を有する遺伝子も含まれている。
【0024】
上述したような配列番号1の塩基配列及び配列番号2のアミノ酸配列で特定されるAt3g19990遺伝子に類似する遺伝子としては、これらアミノ酸配列に対する類似度(Similarity)が例えば70%以上、好ましくは80%以上、より好ましくは90%以上、最も好ましくは95%以上であるアミノ酸配列を有し、種子特異的に発現し、種子内の種子合成に関与する機能を有するタンパク質をコードする遺伝子を挙げることができる。ここで、類似度の値は、BLAST(Basic Local Alignment Search Tool)プログラムを実装したコンピュータプログラム及び遺伝子配列情報を格納したデータベースを用いてデフォルトの設定で求められる値を意味する。
【0025】
また、配列番号1の塩基配列及び配列番号2のアミノ酸配列で特定されるAt3g19990遺伝子に類似する遺伝子は、植物ゲノム情報が明らかとなっていない場合には、対象となる植物からゲノムを抽出するか或いは対象となる植物のcDNAライブラリーを構築し、配列番号1の塩基配列からなるポリヌクレオチドの少なくとも一部に対して、ストリンジェントな条件下でハイブリダイズするゲノム領域或いはcDNAを単離することで同定することができる。ここで、ストリンジェントな条件とは、いわゆる特異的なハイブリッドが形成され、非特異的なハイブリッドが形成されない条件をいう。例えば、45℃、6×SSC(塩化ナトリウム/クエン酸ナトリウム)でのハイブリダイゼーション、その後の50〜65℃、0.2〜1×SSC、0.1%SDSでの洗浄が挙げられ、或いはそのような条件として、65〜70℃、1×SSCでのハイブリダイゼーション、その後の65〜70℃、0.3×SSCでの洗浄を挙げることができる。ハイブリダイゼーションは、J. Sambrook et al. Molecular Cloning, A Laboratory Manual, 2nd Ed., Cold Spring Harbor Laboratory(1989)に記載されている方法等、従来公知の方法で行うことができる。
【0026】
本発明に係る植物体は、At3g19990遺伝子若しくは当該遺伝子に機能的に等価な遺伝子を植物体内に導入するか、内在する当該遺伝子の発現制御領域を改変することによって、油脂生産性(種子一粒あたりの油脂含量及び種子の大きさ)が野生型と比較して有意に向上したものとなる。このAt3g19990遺伝子を植物体内に導入する手法としては、植物体内で発現を可能とするプロモーターの制御下に外因性のAt3g19990遺伝子を配置した発現ベクターを導入する手法をあげることができる。内在する当該遺伝子の発現制御領域を改変する手法としては、対象とする植物体における内在性のAt3g19990遺伝子のプロモーターを改変する手法を挙げることができる。
【0027】
一例としては、植物体内で発現を可能とするプロモーターの制御下に上述したAt3g19990遺伝子を配置した発現ベクターを対象の植物体に導入する手法が好ましい。
【0028】
発現ベクター
発現ベクターは、植物体内で発現を可能とするプロモーターと、上述したAt3g19990遺伝子とを含むように構築する。発現ベクターの母体となるベクターとしては、従来公知の種々のベクターを用いることができる。例えば、プラスミド、ファージ、またはコスミド等を用いることができ、導入される植物細胞や導入方法に応じて適宜選択することができる。具体的には、例えば、pBR322、pBR325、pUC19、pUC119、pBluescript、pBluescriptSK、pBI系のベクター等を挙げることができる。特に、植物体へのベクターの導入法がアグロバクテリウムを用いる方法である場合には、pBI系のバイナリーベクターを用いることが好ましい。pBI系のバイナリーベクターとしては、具体的には、例えば、pBIG、pBIN19、pBI101、pBI121、pBI221等を挙げることができる。
【0029】
プロモーターは、植物体内でAt3g19990遺伝子を発現させることが可能なプロモーターであれば特に限定されるものではなく、公知のプロモーターを好適に用いることができる。かかるプロモーターとしては、例えば、カリフラワーモザイクウイルス35Sプロモーター(CaMV35S)、各種アクチン遺伝子プロモーター、各種ユビキチン遺伝子プロモーター、ノパリン合成酵素遺伝子のプロモーター、タバコのPR1a遺伝子プロモーター、ナピン遺伝子プロモーター、オレオシン遺伝子プロモーター等を挙げることができる。この中でも、カリフラワーモザイクウイルス35Sプロモーター、アクチン遺伝子プロモーター又はユビキチン遺伝子プロモーターをより好ましく用いることができる。上記各プロモーターを用いれば、植物細胞内に導入されたときに任意の遺伝子を強く発現させることが可能となる。
【0030】
また、プロモーターとしては、植物における部位特異的に発現させる機能を有するものを使用することもできる。このようなプロモーターとしては、従来公知の如何なるプロモーターを使用することができる。このようなプロモーターを使用して、上記At3g19990遺伝子を部位特異的に発現させることによって、発現した植物器官を野生型と比較して増大させることができる。特に、種子特異的プロモーターを使用することによって、上記At3g19990遺伝子を種子において発現させることができ、種子に含まれる油脂含量及び種子の大きさを増大させることができる。
【0031】
なお、発現ベクターは、プロモーター及び上記At3g19990遺伝子に加えて、さらに他のDNAセグメントを含んでいてもよい。当該他のDNAセグメントは特に限定されるものではないが、ターミネーター、選別マーカー、エンハンサー、翻訳効率を高めるための塩基配列等を挙げることができる。また、上記組換え発現ベクターは、さらにT−DNA領域を有していてもよい。T−DNA領域は特にアグロバクテリウムを用いて上記組換え発現ベクターを植物体に導入する場合に遺伝子導入の効率を高めることができる。
【0032】
転写ターミネーターは転写終結部位としての機能を有していれば特に限定されるものではなく、公知のものであってもよい。例えば、具体的には、ノパリン合成酵素遺伝子の転写終結領域(Nosターミネーター)、カリフラワーモザイクウイルス35Sの転写終結領域(CaMV35Sターミネーター)等を好ましく用いることができる。この中でもNosターミネーターをより好ましく用いることできる。上記組換えベクターにおいては、転写ターミネーターを適当な位置に配置することにより、植物細胞に導入された後に、不必要に長い転写物を合成し、強力なプロモーターがプラスミドのコピー数を減少させるといった現象の発生を防止することができる。
【0033】
形質転換体選別マーカーとしては、例えば薬剤耐性遺伝子を用いることができる。かかる薬剤耐性遺伝子の具体的な一例としては、例えば、ハイグロマイシン、ブレオマイシン、カナマイシン、ゲンタマイシン、クロラムフェニコール等に対する薬剤耐性遺伝子を挙げることができる。これにより、上記抗生物質を含む培地中で生育する植物体を選択することによって、形質転換された植物体を容易に選別することができる。
【0034】
翻訳効率を高めるための塩基配列としては、例えばタバコモザイクウイルス由来のomega配列を挙げることができる。このomega配列をプロモーターの非翻訳領域(5’UTR)に配置させることによって、上記融合遺伝子の翻訳効率を高めることができる。このように、上記組換え発現ベクターには、その目的に応じて、さまざまなDNAセグメントを含ませることができる。
【0035】
組換え発現ベクターの構築方法についても特に限定されるものではなく、適宜選択された母体となるベクターに、上記プロモーター、上記At3g19990遺伝子、および転写抑制転換ポリヌクレオチド、並びに必要に応じて上記他のDNAセグメントを所定の順序となるように導入すればよい。例えば、上記At3g19990遺伝子とプロモーターと(必要に応じて転写ターミネーター等)とを連結して発現カセットを構築し、これをベクターに導入すればよい。発現カセットの構築では、例えば、各DNAセグメントの切断部位を互いに相補的な突出末端としておき、ライゲーション酵素で反応させることで、当該DNAセグメントの順序を規定することが可能となる。なお、発現カセットにターミネーターが含まれる場合には、上流から、プロモーター、上記At3g19990遺伝子、ターミネーターの順となっていればよい。また、発現ベクターを構築するための試薬類、すなわち制限酵素やライゲーション酵素等の種類についても特に限定されるものではなく、市販のものを適宜選択して用いればよい。
【0036】
また、上記発現ベクターの増殖方法(生産方法)も特に限定されるものではなく、従来公知の方法を用いることができる。一般的には大腸菌をホストとして当該大腸菌内で増殖させればよい。このとき、ベクターの種類に応じて、好ましい大腸菌の種類を選択してもよい。
【0037】
形質転換
上述した発現ベクターは、一般的な形質転換方法によって対象の植物内に導入される。発現ベクターを植物細胞に導入する方法(形質転換方法)は特に限定されるものではなく、植物細胞に応じた適切な従来公知の方法を用いることができる。具体的には、例えば、アグロバクテリウムを用いる方法や直接植物細胞に導入する方法を用いることができる。アグロバクテリウムを用いる方法としては、例えば、Bechtold, E., Ellis, J. and Pelletier, G. (1993) In Planta Agrobacterium-mediated gene transfer by infiltration of adult Arabidopsis plants. C.R. Acad. Sci. Paris Sci. Vie, 316, 1194-1199. あるいは、Zyprian E, Kado Cl, Agrobacterium-mediated plant transformation by novel mini-T vectors in conjunction with a high-copy vir region helper plasmid. Plant Molecular Biology, 1990, 15(2), 245-256.に記載された方法を用いることができる。
【0038】
発現ベクターを直接植物細胞に導入する方法としては、例えば、マイクロインジェクション法、エレクトロポレーション法(電気穿孔法)、ポリエチレングリコール法、パーティクルガン法、プロトプラスト融合法、リン酸カルシウム法等を用いることができる。
【0039】
また、DNAを直接植物細胞に導入する方法を採るなら、対象とする遺伝子の発現に必要な転写ユニット、例えばプロモーターや転写ターミネーターと、対象とする遺伝子を含んだDNAであれば十分であり、ベクター機能は必須ではない。さらに、転写ユニットを有さない対象とする遺伝子のタンパク質コード領域のみを含むDNAであっても、宿主の転写ユニット内にインテグレートし、対象となる遺伝子を発現することができればよい。
【0040】
上記発現ベクターや、発現ベクターを含まず対象となる遺伝子を含んだ発現カセットが導入される植物細胞としては、例えば、花、葉、根等の植物器官における各組織の細胞、カルス、懸濁培養細胞等を挙げることができる。ここで、発現ベクターは、生産しようとする種類の植物体に合わせて適切なものを適宜構築してもよいが、汎用的な発現ベクターを予め構築しておき、それを植物細胞に導入してもよい。
【0041】
発現ベクターの導入対象となる植物、換言すると油脂生産性(種子一粒あたりの油脂含量及び種子の大きさ)を増大させる対象の植物としては、特に限定されない。すなわち、上述したAt3g19990を発現させることによって、あらゆる植物体について油脂生産性(種子一粒あたりの油脂含量及び種子の大きさ)の増大効果を期待することができる。対象となる植物としては、例えば、双子葉植物、単子葉植物、例えばアブラナ科、イネ科、ナス科、マメ科、ヤナギ科等に属する植物(下記参照)が挙げられるが、これらの植物に限定されるものではない。
【0042】
アブラナ科:シロイヌナズナ(Arabidopsis thaliana)、キャベツ(Brassica oleracea var. capitata)、ナタネ(Brassica rapa、Brassica napus)、ハクサイ(Brassica rapa var. pekinensis)、チンゲンサイ(Brassica rapa var. chinensis)、カブ(Brassica rapa var. rapa)、ノザワナ(Brassica rapa var. hakabura)、ミズナ(Brassica rapa var. lancinifolia)、コマツナ(Brassica rapa var. peruviridis)、パクチョイ(Brassica rapa var. chinensis)、ダイコン(Raphanus sativus)、ワサビ(Wasabia japonica)など。
【0043】
ナス科:タバコ(Nicotiana tabacum)、ナス(Solanum melongena)、ジャガイモ(Solanum tuberosum)、トマト(Lycopersicon lycopersicum)、トウガラシ(Capsicum annuum)、ペチュニア(Petunia)など。
【0044】
マメ科:ダイズ(Glycine max)、エンドウ(Pisum sativum)、ソラマメ(Vicia faba)、フジ(Wisteria floribunda)、ラッカセイ(Arachis. hypogaea)、ミヤコグサ(Lotus corniculatus var. japonicus)、インゲンマメ(Phaseolus vulgaris)、アズキ(Vigna angularis)、アカシア(Acacia)など。
【0045】
キク科:キク(Chrysanthemum morifolium)、ヒマワリ(Helianthus annuus)など。
ヤシ科:アブラヤシ(Elaeis guineensis、Elaeis oleifera)、ココヤシ(Cocos nucifera)、ナツメヤシ(Phoenix dactylifera)、ロウヤシ(Copernicia)
ウルシ科:ハゼノキ(Rhus succedanea)、カシューナットノキ(Anacardium occidentale)、ウルシ(Toxicodendron vernicifluum)、マンゴー(Mangifera indica)、ピスタチオ(Pistacia vera)
【0046】
ウリ科:カボチャ(Cucurbita maxima、Cucurbita moschata、Cucurbita pepo)、キュウリ(Cucumis sativus)、カラスウリ(Trichosanthes cucumeroides)、ヒョウタン(Lagenaria siceraria var. gourda)
【0047】
バラ科:アーモンド(Amygdalus communis)、バラ(Rosa)、イチゴ(Fragaria)、サクラ(Prunus)、リンゴ(Malus pumila var. domestica)など。
ナデシコ科:カーネーション(Dianthus caryophyllus)など。
ヤナギ科:ポプラ(Populus trichocarpa、Populus nigra、Populus tremula)
イネ科:トウモロコシ(Zea mays)、イネ(Oryza sativa)、オオムギ(Hordeum vulgare)、コムギ(Triticum aestivum)、タケ(Phyllostachys)、サトウキビ(Saccharum officinarum)、ネピアグラス(Pennisetum pupureum)、エリアンサス(Erianthus ravenae)、ミスキャンタス(ススキ)(Miscanthus virgatum)、ソルガム(Sorghum)スイッチグラス(Panicum)など。
ユリ科:チューリップ(Tulipa)、ユリ(Lilium)など。
【0048】
なかでも、ナタネ等の油脂生産の原料となりうる作物を対象とすることが好ましい。植物由来の種子生産の低コスト化を実現できるからである。
【0049】
また、上述したように、本発明で使用可能なAt3g19990遺伝子は、種々の植物から単離して使用することができるが、油脂生産性(種子一粒あたりの油脂含量及び種子の大きさ)を増大する対象の植物の種類に応じて、適宜選択して用いることができる。すなわち、油脂生産性(種子一粒あたりの油脂含量及び種子の大きさ)を増産する対象の植物が単子葉植物である場合には、At3g19990遺伝子として単子葉植物から単離したものを発現させることが好ましい。
【0050】
なお、本発明においては、油脂生産性(種子一粒あたりの油脂含量及び種子の大きさ)を増大する対象の植物が単子葉植物であったとしても、双子葉植物由来のAt3g19990遺伝子を導入しても良い。すなわち、例えば、シロイヌナズナ由来のAt3g19990遺伝子(配列番号1)は、双子葉植物に限らず、広く単子葉植物に分類される植物に発現するように導入されてもよい。
【0051】
その他の工程、その他の方法
上述した形質転換処理後、植物体のなかから適切な形質転換体を選抜する選抜工程を、従来公知の方法で行うことができる。選抜の方法は特に限定されるものではなく、例えば、ハイグロマイシン耐性等の薬剤耐性を基準として選抜してもよいし、形質転換体を育成した後に、植物体そのもの、または任意の器官や組織の重量を測定して野生型と比較して有意に増産しているものを選抜してもよい。
【0052】
また、形質転換処理で得られた形質転換植物から定法に従って後代植物を得ることができる。上記At3g19990遺伝子が導入された形質又は内在する当該At3g19990遺伝子の発現制御領域が改変された形質を保持した後代植物を、その油脂生産性(種子一粒あたりの油脂含量及び種子の大きさ)を基準として選抜することによって、上記形質を有することで油脂生産性(種子一粒あたりの油脂含量及び種子の大きさ)が増大した安定的な植物系統を作出することができる。なお、形質転換植物やその子孫から、植物細胞や種子、果実、株、カルス、塊茎、切穂、塊等の繁殖材料を得て、これらを基に上記形質を有することで油脂生産性(種子一粒あたりの油脂含量及び種子の大きさ)が増大した安定的な植物系統を量産することも可能である。
【0053】
なお、本発明における植物体とは、成育した植物個体、植物細胞、植物組織、カルス、種子の少なくとも何れかが含まれる。つまり、本発明では、最終的に植物個体まで成育させることができる状態のものであれば、全て植物体とみなす。また、上記植物細胞には、種々の形態の植物細胞が含まれる。かかる植物細胞としては、例えば、懸濁培養細胞、プロトプラスト、葉の切片等が含まれる。これらの植物細胞を増殖・分化させることにより植物体を得ることができる。なお、植物細胞からの植物体の再生は、植物細胞の種類に応じて、従来公知の方法を用いて行うことができる。
【0054】
以上説明したように、本発明によれば、At3g19990遺伝子を植物体内に導入する、又は内在する当該At3g19990遺伝子の発現制御領域を改変することで、野生型の植物体と比較して、油脂生産性(種子一粒あたりの油脂含量及び種子の大きさ)が有意に増大した植物体を提供することができる。ここで、油性量が有意に増大するとは、野生型と比較して一個体あたりに生産される油脂の総重量又は種子一粒に含まれる油脂の総重量が統計的に有意に大となっていることを意味する。また、種子の大きさが有意に増大するとは、野生型と比較して種子一粒の表面積が統計的に有意に大となっていることを意味する。
【0055】
本発明によれば、植物体の油脂生産性(種子一粒あたりの油脂含量及び種子の大きさ)が増大するため、例えば、種子に含まれる油脂を生産目的とした場合、作付け面積あたりで回収できる油脂量を大幅に向上させることができる。ここで油脂としては、特に限定されず、例えば、大豆油、ごま油、オリーブ油、椰子油、米油、綿実油、ひまわり油、コーン油、べに花油及び菜種油等の植物由来の油脂(トリアシルグリセロール、中性脂肪)を例示することができる。また、製造した油脂は、家庭用途や工業用途に広く利用することができ、更にはバイオディーゼル燃料の原料としても使用することができる。すなわち、本発明によれば上記At3g19990遺伝子が導入された、又は内在する当該At3g19990遺伝子の発現制御領域が改変された植物体を利用することによって、上述した家庭用途又は工業用途の油脂や、バイオディーゼル燃料等を低コストに製造することができる。
【実施例】
【0056】
以下、実施例により本発明をより詳細に説明するが、本発明の技術的範囲はこれら実施例に限定されるものではない。
【0057】
〔実施例1〕
DGAT1p::LUC導入植物の作製
シロイヌナズナで予測されている4つのTAG合成酵素遺伝子DGAT1、DGAT2、PDAT1、PDAT2-likeの内、種子成熟過程で最も強く発現しているDGAT1に着目し、DGAT1を直接転写活性化する因子の探索を行った。生きたまま観察可能な生物発光を指標としてスクリーニングを行うために、DGAT1p::LUC導入植物を作製した。DGAT1p::LUC導入植物を使用することにより、内在DGAT1遺伝子のmRNAの挙動をLUC発光レベルで追跡することが可能である。
【0058】
先ず、DGAT1遺伝子(At2g19450)の翻訳開始点上流+1から+2076を含むようCol-0のゲノムを鋳型にPrimeSTAR (TAKARA Bio社製)を使用してDGAT1遺伝子のプロモーター領域をPCR増幅した。PCR増幅にはTAG1p(Xba)attB1(ggggACAAGTTTGTACAAAAAAGCAGGCTctagattaatattccacttactacttcc:配列番号3)及びTAG1p-attab2(ggggACCACTTTGTACAAGAAAGCTGGGTtcgccatttcgaaaagggttg:配列番号4)をプライマーとして使用した。
【0059】
増幅したDNA断片及びInvitorogen社のGATEWAYシステムを利用して、エントリークローンを得た。バイナリーベクターpGWB435(GenBank AB294498)( Nakagawa, T. et al., (2007) Biosci. Biotechnol. Biochem. 71, 2095-2100参照)とともに反応させ、DGAT1p::LUCバイナリープラスミドを作製した。DGAT11p::LUC バイナリープラスミドをエレクトロポレーションにより、アグロバクテリウムC58C1株に導入し、Floral dip法にてシロイヌナズナCol-0をDGAT11p::LUCで形質転換した。
【0060】
DGAT1p::LUCを導入した植物体からとれた種子(T1:T-DNA挿入へテロ)を抗生物質カナマイシン(Km)耐性で選抜し、生育させてT2種子(T-DNA挿入ホモ、ヘテロ、なしの混合)を得た。T2種子をKm培地で発芽させ、抗生物質耐性がおよそ3:1の比になるラインからさらに数個体ずつを生育させ、T3種子を得た。T3種子がすべてKm耐性を示したラインをT-DNA挿入ホモライン、DGAT1p::LUC導入植物として用いた。得られたDGAT1p::LUC導入植物のLUC遺伝子に基づく蛍光を測定した結果を図1に示した。
【0061】
DGAT1p::LUC導入植物のアクティベーションタグラインの作製
DGAT1p::LUC 導入植物に対して、バイナリーベクターpPCVICEn4HPT(H. Hayashi et al., Science 258, 1350 (1992))を保有するアグロバクテリウム(GV3101(pMP90RK) 株)を用いFloral dip法で感染させ、DGAT1p::LUC導入植物のアクティベーションタグラインを作製した。なお、pPCVICEn4HPTは、ハイグロマイシン(Hyg)耐性遺伝子及び4コピーのエンハンサーを含んでいる。その結果、エンハンサーT-DNAがゲノム中にランダムに挿入されたアクティベーションタグライン(形質転換植物)を多数作製することができた。
【0062】
これらのうちLUC活性が高い候補株について、インバースPCR法によりエンハンサー挿入位置決定した。このうち、1つの変異株は、次世代の芽生えのLUC発光レベルが約3倍と高く、芽生えのmRNA解析の結果、エンハンサー近傍の遺伝子の活性化と、DGAT1p::LUCのみならず内在のDGAT1の活性化を確認できた。また、当該変異株において、活性化されていたエンハンサー近傍遺伝子には、種子特異的に発現するものが存在していた。
【0063】
35Sp::AOTA1を導入したDGAT1p::LUC導入植物の作製
全長cDNAのクローニング
この上記変異株において特定された種子特異的発現をする機能未知遺伝子(At3g19990)をAOTA1遺伝子(Activator of TAG Synthesis)と称する。AOTA1遺伝子の全長cDNA断片を、シロイヌナズナCol-0植物体の葉および果実のtotal RNAを鋳型とし、Pyrobest(TAKARA Bio社製)酵素により増幅した。増幅反応には、AT3g19990-B1(GGGGACAAGTTTGTACAAAAAAGCAGGCTAAATGGGTTCATCATCATCTCCATCC:配列番号5)及びAT3g19990-B2(GGGGACCACTTTGTACAAGAAAGCTGGGTAGCGCACGAGACCCAAGTT:配列番号6)をプライマーとして使用した。
【0064】
増幅したDNA断片、pDONR201(Invitrogen社製)及びBP Clonase II酵素(Invitrogen社製)を用いてエントリークローンを得た。
【0065】
35Sp::AOTA1の調整
上記エントリークローン、pGWB502Ω(35SプロモーターとΩ配列を持つGATEWAYバイナリベクター)及びBP Clonase II酵素(Invitrogen社製)を反応させ、35Sp::AOTA1バイナリープラスミドを作製した。
【0066】
DGAT1::LUC導入植物への導入
35Sp::AOTA1バイナリープラスミドをエレクトロポレーションによりアグロバクテリウム(C58C1株)に導入し、Floral dip法にてDGAT1p::LUC導入植物を形質転換した。
【0067】
過剰発現株の作製
上記アグロバクテリウム感染後の植物から取れた種子を1% ショ糖、MS、0.3% Gerlite、ハイグロマイシン20mg/L培地で選抜した。薬剤耐性を示す株をバーミキュライト、6cm鉢、連続光条件下で生育させ種子を取得した。
【0068】
TGA量の評価
得られたシロイヌナズナ種子20粒をマルチビーズショッカー(安井器械社製、2000rpm 30秒x2)で破砕し、クロロホルム:メタノール(2:1)200μlに溶解させ、1.5 mlチューブに回収し、15.000rpmで5分遠心した。上清100μlを新しいチューブに回収し、真空ポンプにて溶媒を揮発させた。ペレットを20μlエタノールに溶解後、水80μlを加え、4μlをTAG定量に使用した。トリアシルグリセリド(TAG)スタンダードには、1mg/mlコーン油を0、1、2、3、4、5、6μl使用し、試料にクオリジェントTG(第一化学社製)の酵素溶液(1)120μlを加え、37℃で15分間反応させ、酵素液(2)を40μl分注し、さらに37℃で15分間反応させ、600nmの吸光度を測定し、種子あたりのTAG量を算出した。1株由来種子について、4連で行った。
【0069】
種子の体積の測定
得られたシロイヌナズナ種子を顕微鏡下で観察し、デジタル画像を取得し、画像解析アプリケーションソフトImage Jにより、種子の写真を白黒2階調化し、100粒分の種子の形から、面積を算出した。
【0070】
結果
種子に含まれるTAG量を測定した結果を図2A及びBに示した。図2Aは、AOTA1過剰発現株10個体(#1〜#10)について、各個体から採取した種子20粒に含まれるTAG量を、コントロールの平均を100%として示している(N=4)。また、図2Bは、コントロール2個体の平均を100%としたときの、AOTA1過剰発現株10個体のTGA含有量を相対値として示している。
【0071】
図2A及びBから判るように、AOTA1遺伝子(At3g19990)を35Sプロモーターの発現制御下に導入したシロイヌナズナにおいては、種子に含まれるTGA量がコントロールと比較して有意に増大していることが明らかとなった。
【0072】
また、種子の大きさを測定した結果を図3A及びBに示した。図3Aは、AOTA1過剰発現株10個体(#1〜#10)について、各個体から採取した種子100粒の平均面積を、コントロールの平均を100%として示している(N=4)。また、図3Bは、コントロール2個体の平均を100%としたときの、AOTA1過剰発現株10個体から採取した種子の平均面積を相対値として示している。
【0073】
図3A及びBから判るように、AOTA1遺伝子(At3g19990)を35Sプロモーターの発現制御下に導入したシロイヌナズナにおいては、種子の大きさがコントロールと比較して有意に増大していることが明らかとなった。
【0074】
以上の結果から、AOTA1遺伝子(At3g19990)を導入する、又は内在するAOTA1遺伝子(At3g19990)の発現制御領域を改変して、AOTA1遺伝子(At3g19990)の発現量を増強することによって、植物の油脂生産性(種子一粒あたりの油脂含量及び種子の大きさ)を有意に増大できることが明らかとなった。
【特許請求の範囲】
【請求項1】
At3g19990遺伝子若しくは当該遺伝子に機能的に等価な遺伝子を導入した、又は内在する当該遺伝子の発現制御領域を改変した植物体。
【請求項2】
上記遺伝子は、以下の(a)〜(c)のいずれかのタンパク質をコードすることを特徴とする請求項1記載の植物体。
(a)配列番号2に示すアミノ酸配列を含むタンパク質
(b)配列番号2に示すアミノ酸配列において1又は複数個のアミノ酸が欠失、置換、付加又は挿入されたアミノ酸配列を含み、種子に特異的に発現し、種子内の種子合成に関与する機能を有するタンパク質
(c)配列番号1に示す塩基配列の相補的な塩基配列からなるポリヌクレオチドに対してストリンジェントな条件下においてハイブリダイズするポリヌクレオチドによってコードされ、種子に特異的に発現し、種子内の種子合成に関与する機能を有するタンパク質
【請求項3】
上記機能的に等価な遺伝子は、シロイヌナズナ以外の生物由来であって種子に特異的に発現し、種子内の種子合成に関与する機能を有するタンパク質をコードする遺伝子であることを特徴とする請求項1記載の植物体。
【請求項4】
双子葉植物であることを特徴とする請求項1乃至3いずれか一項記載の植物体。
【請求項5】
アブラナ科植物であることを特徴とする請求項1乃至3いずれか一項記載の植物体。
【請求項6】
シロイヌナズナ又はナタネであることを特徴とする請求項1乃至3いずれか一項記載の植物体。
【請求項7】
At3g19990遺伝子若しくは当該遺伝子に機能的に等価な遺伝子を導入する、又は内在する当該遺伝子の発現制御領域を改変する、油脂生産性を増大させる方法。
【請求項8】
上記遺伝子は、以下の(a)〜(c)のいずれかのタンパク質をコードすることを特徴とする請求項7記載の方法。
(a)配列番号2に示すアミノ酸配列を含むタンパク質
(b)配列番号2に示すアミノ酸配列において1又は複数個のアミノ酸が欠失、置換、付加又は挿入されたアミノ酸配列を含み、種子に特異的に発現し、種子内の種子合成に関与する機能を有するタンパク質
(c)配列番号1に示す塩基配列の相補的な塩基配列からなるポリヌクレオチドに対してストリンジェントな条件下においてハイブリダイズするポリヌクレオチドによってコードされ、種子に特異的に発現し、種子内の種子合成に関与する機能を有するタンパク質
【請求項9】
上記機能的に等価な遺伝子は、シロイヌナズナ以外の生物由来であって種子に特異的に発現し、種子内の種子合成に関与する機能を有するタンパク質をコードする遺伝子であることを特徴とする請求項7記載の方法。
【請求項10】
双子葉植物であることを特徴とする請求項7乃至9いずれか一項記載の方法。
【請求項11】
アブラナ科植物であることを特徴とする請求項7乃至9いずれか一項記載の方法。
【請求項12】
シロイヌナズナ又はナタネであることを特徴とする請求項7乃至9いずれか一項記載の方法。
【請求項13】
At3g19990遺伝子若しくは当該遺伝子に機能的に等価な遺伝子を導入した、又は内在する当該遺伝子の発現制御領域を改変した形質転換植物を準備する工程と
前記形質転換植物の後代植物の油脂生産性を測定し、当該油脂生産性が有意に向上した系統を選抜する工程とを含む、植物体の製造方法。
【請求項14】
上記遺伝子は、以下の(a)〜(c)のいずれかのタンパク質をコードすることを特徴とする請求項13記載の製造方法。
(a)配列番号2に示すアミノ酸配列を含むタンパク質
(b)配列番号2に示すアミノ酸配列において1又は複数個のアミノ酸が欠失、置換、付加又は挿入されたアミノ酸配列を含み、種子に特異的に発現し、種子内の種子合成に関与する機能を有するタンパク質
(c)配列番号2に示す塩基配列の相補的な塩基配列からなるポリヌクレオチドに対してストリンジェントな条件下においてハイブリダイズするポリヌクレオチドによってコードされ、種子に特異的に発現し、種子内の種子合成に関与する機能を有するタンパク質
【請求項15】
上記機能的に等価な遺伝子は、シロイヌナズナ以外の生物由来であって種子に特異的に発現し、種子内の種子合成に関与する機能を有するタンパク質をコードする遺伝子であることを特徴とする請求項13記載の製造方法。
【請求項16】
双子葉植物であることを特徴とする請求項13乃至15いずれか一項記載の製造方法。
【請求項17】
アブラナ科植物であることを特徴とする請求項13乃至15いずれか一項記載の製造方法。
【請求項18】
シロイヌナズナ又はナタネであることを特徴とする請求項13乃至15いずれか一項記載の製造方法。
【請求項1】
At3g19990遺伝子若しくは当該遺伝子に機能的に等価な遺伝子を導入した、又は内在する当該遺伝子の発現制御領域を改変した植物体。
【請求項2】
上記遺伝子は、以下の(a)〜(c)のいずれかのタンパク質をコードすることを特徴とする請求項1記載の植物体。
(a)配列番号2に示すアミノ酸配列を含むタンパク質
(b)配列番号2に示すアミノ酸配列において1又は複数個のアミノ酸が欠失、置換、付加又は挿入されたアミノ酸配列を含み、種子に特異的に発現し、種子内の種子合成に関与する機能を有するタンパク質
(c)配列番号1に示す塩基配列の相補的な塩基配列からなるポリヌクレオチドに対してストリンジェントな条件下においてハイブリダイズするポリヌクレオチドによってコードされ、種子に特異的に発現し、種子内の種子合成に関与する機能を有するタンパク質
【請求項3】
上記機能的に等価な遺伝子は、シロイヌナズナ以外の生物由来であって種子に特異的に発現し、種子内の種子合成に関与する機能を有するタンパク質をコードする遺伝子であることを特徴とする請求項1記載の植物体。
【請求項4】
双子葉植物であることを特徴とする請求項1乃至3いずれか一項記載の植物体。
【請求項5】
アブラナ科植物であることを特徴とする請求項1乃至3いずれか一項記載の植物体。
【請求項6】
シロイヌナズナ又はナタネであることを特徴とする請求項1乃至3いずれか一項記載の植物体。
【請求項7】
At3g19990遺伝子若しくは当該遺伝子に機能的に等価な遺伝子を導入する、又は内在する当該遺伝子の発現制御領域を改変する、油脂生産性を増大させる方法。
【請求項8】
上記遺伝子は、以下の(a)〜(c)のいずれかのタンパク質をコードすることを特徴とする請求項7記載の方法。
(a)配列番号2に示すアミノ酸配列を含むタンパク質
(b)配列番号2に示すアミノ酸配列において1又は複数個のアミノ酸が欠失、置換、付加又は挿入されたアミノ酸配列を含み、種子に特異的に発現し、種子内の種子合成に関与する機能を有するタンパク質
(c)配列番号1に示す塩基配列の相補的な塩基配列からなるポリヌクレオチドに対してストリンジェントな条件下においてハイブリダイズするポリヌクレオチドによってコードされ、種子に特異的に発現し、種子内の種子合成に関与する機能を有するタンパク質
【請求項9】
上記機能的に等価な遺伝子は、シロイヌナズナ以外の生物由来であって種子に特異的に発現し、種子内の種子合成に関与する機能を有するタンパク質をコードする遺伝子であることを特徴とする請求項7記載の方法。
【請求項10】
双子葉植物であることを特徴とする請求項7乃至9いずれか一項記載の方法。
【請求項11】
アブラナ科植物であることを特徴とする請求項7乃至9いずれか一項記載の方法。
【請求項12】
シロイヌナズナ又はナタネであることを特徴とする請求項7乃至9いずれか一項記載の方法。
【請求項13】
At3g19990遺伝子若しくは当該遺伝子に機能的に等価な遺伝子を導入した、又は内在する当該遺伝子の発現制御領域を改変した形質転換植物を準備する工程と
前記形質転換植物の後代植物の油脂生産性を測定し、当該油脂生産性が有意に向上した系統を選抜する工程とを含む、植物体の製造方法。
【請求項14】
上記遺伝子は、以下の(a)〜(c)のいずれかのタンパク質をコードすることを特徴とする請求項13記載の製造方法。
(a)配列番号2に示すアミノ酸配列を含むタンパク質
(b)配列番号2に示すアミノ酸配列において1又は複数個のアミノ酸が欠失、置換、付加又は挿入されたアミノ酸配列を含み、種子に特異的に発現し、種子内の種子合成に関与する機能を有するタンパク質
(c)配列番号2に示す塩基配列の相補的な塩基配列からなるポリヌクレオチドに対してストリンジェントな条件下においてハイブリダイズするポリヌクレオチドによってコードされ、種子に特異的に発現し、種子内の種子合成に関与する機能を有するタンパク質
【請求項15】
上記機能的に等価な遺伝子は、シロイヌナズナ以外の生物由来であって種子に特異的に発現し、種子内の種子合成に関与する機能を有するタンパク質をコードする遺伝子であることを特徴とする請求項13記載の製造方法。
【請求項16】
双子葉植物であることを特徴とする請求項13乃至15いずれか一項記載の製造方法。
【請求項17】
アブラナ科植物であることを特徴とする請求項13乃至15いずれか一項記載の製造方法。
【請求項18】
シロイヌナズナ又はナタネであることを特徴とする請求項13乃至15いずれか一項記載の製造方法。
【図1】


【図2】


【図3】




【図2】


【図3】


【公開番号】特開2011−182759(P2011−182759A)
【公開日】平成23年9月22日(2011.9.22)
【国際特許分類】
【出願番号】特願2010−54484(P2010−54484)
【出願日】平成22年3月11日(2010.3.11)
【出願人】(000003207)トヨタ自動車株式会社 (59,920)
【出願人】(598014814)株式会社コンポン研究所 (24)
【出願人】(504139662)国立大学法人名古屋大学 (996)
【Fターム(参考)】
【公開日】平成23年9月22日(2011.9.22)
【国際特許分類】
【出願日】平成22年3月11日(2010.3.11)
【出願人】(000003207)トヨタ自動車株式会社 (59,920)
【出願人】(598014814)株式会社コンポン研究所 (24)
【出願人】(504139662)国立大学法人名古屋大学 (996)
【Fターム(参考)】
[ Back to top ]

