植物の鉄輸送能を強化する遺伝子
【課題】カドミウム等の金属存在下においても、これらに阻害されることなく鉄を特異的に輸送可能な担体タンパク質をコードする遺伝子と、当該遺伝子により形質転換してカドミウム等の金属存在下においても生育に十分な鉄を吸収して健全に生育し、カドミウム蓄積量が低減された植物体を得る。当該形質転換植物体により環境修復を行う方法を提供する。
【解決手段】ヘビノネゴザ由来の特定のアミノ酸配列からなるタンパク質、または該アミノ酸配列において、1個若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなり、且つ鉄輸送担体として機能するタンパク質をコードする遺伝子により植物を形質転換する。また、カドミウム蓄積能を有する植物を当該遺伝子により形質転換し、ハイパーアキュームレーターを得て、環境修復を行う。
【解決手段】ヘビノネゴザ由来の特定のアミノ酸配列からなるタンパク質、または該アミノ酸配列において、1個若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなり、且つ鉄輸送担体として機能するタンパク質をコードする遺伝子により植物を形質転換する。また、カドミウム蓄積能を有する植物を当該遺伝子により形質転換し、ハイパーアキュームレーターを得て、環境修復を行う。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、植物の鉄輸送能を強化する遺伝子に関する。さらに詳述すると、本発明は、ヘビノネゴザ由来の鉄輸送担体タンパク質をコードする遺伝子で形質転換することにより鉄輸送能が強化された植物体並びにこれを利用した環境修復方法に関する。
【背景技術】
【0002】
近年、広範囲に拡散した比較的低濃度の様々な汚染物質を、長期間にわたり低コストで穏やかに処理できる新しい技術としてファイトリメディエーション(植物による環境修復)が注目されている。理論的にはハイパーアキュームレーター(特定元素高濃度蓄積種)と呼ばれる数種類の既存の植物を用いて重金属の吸収・除去が可能であると考えられており、実用化に向けて様々な汚染物質に対する適用植物種の拡大、処理能力の向上を目的とした研究、特に、従来の育種法では困難な全く別の形質を付与しうる遺伝子組換え技術を用いた様々な研究が行われている。
【0003】
例えば特許文献1では、ABCトランスポーターに属する輸送体タンパク質の一つであるMRP1(multidrug resistance-associated protein 1)をコードする遺伝子を植物内に導入することにより、植物に重金属化合物や細胞毒有機化合物耐性を与えて、該耐性付与植物を汚染環境中で生育させることにより汚染環境中から重金属化合物や細胞毒有機化合物を回収する技術が開示されている。また、特許文献2では、酵母由来のzrcl遺伝子を導入して重金属の蓄積能を強化した植物体により、重金属に汚染された土壌を浄化する技術が開示されている。
【0004】
一方、近年の分子生物学的な研究の進展により、重金属の中でも特に河川・土壌等の拡散量と人体への健康への影響が大きいカドミウムについて、植物への吸収機構に関する様々な報告がなされている。例えば、一般的な植物ではカドミウムにより鉄の吸収が阻害されて鉄欠乏状態に陥る(カドミウム誘導性鉄欠乏)ことが報告されている(非特許文献1)。また、鉄輸送担体遺伝子の一つであるIRTやNrampがコードする鉄輸送担体タンパク質が、植物の生育に必須な元素である鉄と共にカドミウムも吸収することが報告されている(非特許文献2、非特許文献3)。
【特許文献1】特開2003−210057
【特許文献2】特開2004−275051
【非特許文献1】Marschner H (1995) Mineral Nutrition of Higher Plants, 2nd edn, Academic press, London, UK
【非特許文献2】Korshnova YO et al. (1999) Plant Mol Biol 40 p37-44
【非特許文献3】Thomine S et al. (2000) Proc Natl Acad Sci USA 97 p4991-4996
【発明の開示】
【発明が解決しようとする課題】
【0005】
特許文献1及び特許文献2に開示された技術により、カドミウム等の重金属耐性・蓄積能を植物体に付与することは可能である。しかしながら、植物の生育にとって必須である鉄を十分に取り込めなければ、植物は鉄欠乏状態に陥ってしまい、その生育状態に悪影響が及ぼされる。
【0006】
また、IRTやNrampがコードする鉄輸送担体タンパク質が、植物の生育に必須な元素である鉄と共にカドミウムも吸収することにより、生育に十分な量の鉄を取り込めなくなり、生育状態に悪影響が及ぼされる虞がある。
【0007】
そこで、本発明は、カドミウム等の陽イオン金属存在下においても、これらに阻害されることなく鉄を特異的に輸送可能な担体タンパク質をコードする遺伝子と、当該遺伝子により形質転換してカドミウム等の金属存在下においても生育に十分な鉄を吸収して健全に生育し、カドミウム蓄積量が低減された植物体を提供することを目的とする。
【0008】
さらに本発明は、形質転換植物体により環境修復を行う方法を提供することを目的とする。
【課題を解決するための手段】
【0009】
かかる目的を達成するため、本願発明者は、高カドミウム耐性を有するヘビノネゴザ(Athyrium yokoscense)について、組織培養法を確立し、その機能を解明するために鋭意研究を重ねた。その結果、ヘビノネゴザの高カドミウム耐性は、その鉄輸送担体タンパク質が鉄に対して特異的に親和することにより、カドミウムを吸収する確率が非常に低くなるという機構に起因するものであることを知見した。
【0010】
本発明は係る知見に基づくものであって、請求項1に記載の発明は、
(a)配列番号2、4、6又は8のアミノ酸配列からなるタンパク質、または
(b)配列番号2、4、6又は8のアミノ酸配列において、1個若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなり、且つ鉄と特異的に親和する輸送担体として機能するタンパク質
をコードする遺伝子である。
【0011】
ここで、「鉄と特異的に親和する」とは、カドミウム、ニッケル、マンガン、亜鉛、銅などの金属に曝露された条件下であっても、これらとほとんど親和することなく鉄と特異的に親和する輸送担体として機能することを意味している。
【0012】
請求項2に記載の発明は、
(a)配列番号2、4、6又は8のアミノ酸配列からなるタンパク質、または
(b)配列番号2、4、6又は8のアミノ酸配列において、1個若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなり、且つ鉄と特異的に親和する輸送担体として機能するタンパク質
である。
【0013】
上記タンパク質は、鉄輸送担体として機能し、カドミウム、ニッケル、マンガン、亜鉛、銅などの金属が存在しても、これらとほとんど親和することなく鉄と特異的に親和する。
【0014】
請求項3に記載の発明は、
(c)配列番号1、3、5又は7の塩基配列からなるDNA、または
(d)配列番号1、3、5又は7の塩基配列からなるDNA若しくはこれと相補的なDNAとストリンジェントな条件下でハイブリダイズし、且つ鉄と特異的に親和する輸送担体として機能するタンパク質をコードするDNA
からなる遺伝子である。
【0015】
上記遺伝子は、鉄輸送担体として機能するタンパク質をコードする。したがって、本遺伝子を持つ植物は、カドミウム、ニッケル、マンガン、亜鉛、銅などの金属が存在しても、これらとほとんど親和することなく鉄と特異的に親和する輸送担体を有するようになり、必須元素である鉄を取り込みやすくなる。
【0016】
請求項4に記載の発明は、請求項1又は3に記載の遺伝子を含有する形質転換された植物細胞である。当該植物細胞から、請求項5に記載の植物体とその部分並びにその繁殖体及び子孫が得られる。したがって、カドミウム、ニッケル、マンガン、亜鉛、銅などの金属が存在しても、生育に十分な量の鉄を取り込んで良好な生育状態を保ち、人体にとって非常に有害な元素であるカドミウムの蓄積量が少ない植物を提供することが可能となる。
【0017】
請求項6に記載の発明は、環境汚染物質蓄積能をさらに有することを特徴とする植物細胞であり、当該植物細胞から、請求項7に記載の植物体とその部分並びにその繁殖体及び子孫が得られる。
【0018】
環境汚染物質蓄積能のみを有していても、カドミウム、ニッケル、マンガン、亜鉛、銅などの金属存在下では必須元素である鉄を十分に取り込むことが出来なくなり、生育不良に陥る虞があるが、本発明の遺伝子を含有することで、カドミウム、ニッケル、マンガン、亜鉛、銅などの金属存在下においても鉄と特異的に親和する輸送担体が機能し、植物の生育に十分な量の鉄を取り込むことが可能となる。したがって、カドミウム、ニッケル、マンガン、亜鉛、銅などの金属存在下においても良好な生育状態を保ち、しかも環境汚染物質蓄積能をも有する植物を提供することが可能となる。
【0019】
ここで、環境汚染物質とは、カドミウム、コバルト、ニッケル、銅、鉛、亜鉛、水銀、クロム、ヒ素、マンガン、セレン、スズ、アンチモンである。
【0020】
請求項8に記載の発明は、請求項1又は3に記載の遺伝子を組み込んだベクターで形質転換してなる宿主細胞を培養し、培養物中に蓄積されるタンパク質を採取するというものである。これにより、請求項2に記載のタンパク質を得ることが出来る。
【0021】
請求項9に記載の発明は、請求項7に記載の植物を用いて、土壌から環境汚染物質を除去することを特徴とする環境修復方法である。上記したように、請求項7に記載の植物は環境汚染物質蓄積能及びカドミウム、ニッケル、マンガン、亜鉛、銅などの金属存在下であっても植物の生育に十分な鉄を取り込む機能を有する植物であり、この植物をハイパーアキュームレーターとして用いることで、効率よくファイトリメディエーションを行うことが可能となる。
【発明の効果】
【0022】
本発明によれば、カドミウム、ニッケル、マンガン、亜鉛、銅などの金属存在下においても鉄と特異的に親和して、これらとほとんど親和することのない輸送担体タンパク質をコードする遺伝子を提供することが可能となる。また、当該遺伝子を含有する形質転換された植物体は、土壌中にカドミウム、ニッケル、マンガン、亜鉛、銅などの金属が存在しても植物にとって必須元素である鉄の吸収が阻害されない。したがって、カドミウム、ニッケル、マンガン、亜鉛、銅などの金属存在下にあっても良好な生育状態を保ち、しかも人体にとって非常に有害な元素であるカドミウムの蓄積量が少ない植物を提供することが可能となる。さらに、環境汚染物質蓄積能を有し、且つ本発明の遺伝子を含有する形質転換された植物体は、その生育に十分な量の鉄を吸収しつつ、環境汚染物質も吸収するので、優れたハイパーアキュームレータとなり、当該ハイパーアキュームレーターにより、土壌から環境汚染物質を効率よく除去することが可能となる。
【0023】
また、本発明の鉄輸送担体タンパク質は、カドミウム、ニッケル、マンガン、亜鉛、銅などの金属存在下においても、鉄と特異的に親和するので、鉄濃度を測定するセンサーや鉄濃度による分子スイッチ(イオンコンデンサー)として利用することが可能である。
【発明を実施するための最良の形態】
【0024】
以下に、本発明の実施形態について詳細に説明する。
【0025】
本発明は、ヘビノネゴザから得られる、(a)配列番号2、4、6又は8のアミノ酸配列からなるタンパク質、または(b)配列番号2、4、6又は8のアミノ酸配列において、1個若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなり、且つ鉄と特異的に親和する輸送担体として機能するタンパク質をコードする遺伝子である。
【0026】
ここで、上記「数個」とは、配列番号2においては、好ましくは204個以下、より好ましくは128個以下、さらに好ましくは51個以下、特に好ましくは10個以下である。配列番号4においては、好ましくは154個以下、より好ましくは96個以下、さらに好ましくは39個以下、特に好ましくは10個以下である。配列番号6においては、好ましくは27個以下、より好ましくは17個以下、特に好ましくは7個以下である。配列番号8においては27個以下、より好ましくは17個以下、特に好ましくは7個以下である。
【0027】
ここで、(a)のタンパク質は鉄と特異的に親和する輸送担体として機能するタンパク質であり、(b)のタンパク質は(a)のタンパク質の1個若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列を有するもののうち、鉄と特異的に親和する輸送担体として機能するタンパク質であることを意味している。
【0028】
上記タンパク質は、これらをコードする遺伝子や、配列番号1,3,5又は7の遺伝子を適当な発現ベクターに挿入し、その遺伝子を大腸菌、酵母、昆虫細胞などの適当な宿主中で発現させることにより、生産することができる。ここで、使用するベクタ−システムとしては、pET系(Novagen)、pYES系(Invitrogen)pIZT系(Novagen)、BacVector系(Novagen)、ViraPowerアデノウィルス発現系(Invitrogen)などが挙げられる。宿主としては、Rosetta−gami(DE3)pLys(Novagen)、INVSc(Invitrogen)、Sf9(Novagen)などが挙げられる。また、別のタンパク質生産方法として、無細胞タンパク質発現系が挙げられる。無細胞タンパク質発現系の例としては、例えば、ラピッドトランスレーションシステム(ロッシュ社)などを挙げることができる。
【0029】
このようにして得られたタンパク質は、人工基盤や膜上に固定することで、鉄の濃度を測定するセンサー、鉄濃度による分子スイッチ(イオンコンデンサー)として利用可能である。
【0030】
次に、本発明の遺伝子は例えば以下の様にして得ることが可能である。まず、ヘビノネゴザ或いはヘビノネゴザカルスからtotalRNA抽出を行い、これを用いてmRNAを精製した後、市販のキットによりcDNAライブラリ−を構築する。totalRNA抽出法としては、例えばCTABとPVPを用いたJaakolaらの多糖質の材料からの高品質totalRNA抽出法(Jaakola L. et al. (2001) Mol Biotechnol. 19 p201-3)が挙げられるが、これに限られるものではない。一方、配列番号1、3、5又は7の塩基配列に基づいて、市販のキットにより、DIGプローブまたは放射性プローブを作製し、ストリンジェントな条件でコロニーハイブリダイゼーションを行うことにより得ることができる。
【0031】
ここで、「ストリンジェントな条件下でハイブリダイズする」とは、特異的なハイブリダイゼーションのみが起こり、非特異的なハイブリダイゼーションが起きないような条件を言い、相同性が高いDNA同士、即ち60%以上、好ましくは75%以上、さらに好ましくは90%以上の相同性を有するDNA同士がハイブリダイズし、それにより相同性が低いDNA同士がハイブリダイズしない条件が挙げられる。具体的には、塩類等を含む一般的なハイブリダイゼーション用バッファーの存在下において50℃〜70℃の条件とすればよく、好ましくは55℃〜70℃、さらに好ましくは60℃〜70℃の条件が挙げられる。
【0032】
次に、本発明の遺伝子を含有する形質転換された植物体を得る方法について説明する。
【0033】
本発明の遺伝子を発現させるための発現調節エレメントであるプロモーター或いはエンハンサーとして、植物細胞において本発明の遺伝子を発現しうる任意のもの、例えばアグロバクテリウムまたはリゾビウムのような植物細胞内で発現する遺伝子を含む植物、植物ウイルス、細菌由来のプロモーターを用いることができる。そのようなプロモーターの例として、Agrobacterium tumefaciensのT−DNA由来のプロモーター、Smasプロモーター、桂皮アルコールデヒドロゲナーゼプロモータ、Nosプロモーター、リブロース二リン酸カルボキシラーゼオキシゲナーゼ(Rubisco)プロモーター、GRP1−8プロモーター、カリフラワー・モザイク・ウイルス(CaMV)の35Sプロモーター、植物由来のアクチンやヒストン等のプロモーター或いはエンハンサーおよび公知である種々の植物遺伝子からのその他の転写開始領域が包含される。例えば、植物由来のプロモーター或いはエンハンサーを適宜選択することにより、本発明の遺伝子を植物全体、または特定の器官、例えば、葉や根などにおいて発現させることができる。
【0034】
また、本発明の遺伝子を効率よく発現させるために、遺伝子のコード領域のポリヌクレオチドコーディング領域の3′末端にポリ(A)+配列を包含させるのが好ましい。ポリ(A)+配列は、種々の植物遺伝子またはT−DNA由来のものを用いることができるが、これらに限定されるものではない。また、所望の遺伝子を高レベルにて発現させるのに有用な他の配列、例えば特定の遺伝子のイントロン配列、5′不翻訳領域の配列などを組換え発現ベクターに包含させることができる。
【0035】
組換え発現ベクターには、選択マーカー遺伝子として種々の抗生物質耐性遺伝子や他のマーカー遺伝子をコードする配列を包含させるのが好ましい。マーカー遺伝子の例には、抗スペクチノマイシン遺伝子、ストレプトマイシン耐性遺伝子(ストレプトマイシンホスホトランスフェラーゼ(SPT)遺伝子)、カナマイシンまたはジェネティシン耐性のネオマイシンホスホトランスフェラーゼ(NPTII)遺伝子、ハイグロマイシン耐性のハイグロマイシンホスホトランスフェラーゼ(HPT)遺伝子、アセト乳酸合成酵素(ALS)を阻害する除草剤に対する耐性遺伝子、グルタミン合成酵素を阻害する除草剤に対する耐性遺伝子(例えばbar 遺伝子)、β−グルクロニダーゼ遺伝子、ルシフェラーゼ遺伝子等が包含される。
【0036】
また、高等植物の遺伝子発現に有用な代表的なベクターは当該技術分野においてよく知られており、 Rogers et al., Methods Enzymol., 153: pp.253-277 (1987)に記載されるAgrobacterium tumefaciensのTiプラスミド由来のベクターなどのベクターDNAの一部を植物細胞に導入した際に宿主植物のゲノムに組込みうるベクター、例えばTiプラスミド由来のpKYLX6、pKYLX7、pBI101、pBH2113、pBI121(Clontech Laboratories, Inc., Palo Alto, CA)およびこれらから当該技術分野における標準的技術を用いて誘導し得る組換えプラスミドが含まれる。
【0037】
組換え発現ベクターは、外来性遺伝子を植物細胞に導入するための公知の方法、例えばパーティクルガン法、エレクトロポレーション法、ポリエチレングリコール(PEG)法、リン酸カルシウム法、DEAEデキストラン法、マイクロインジェクション、リポフェクション法およびアグロバクテリウム法などの微生物媒介トランスフェクション法を用いて所望の植物細胞に導入することができる。植物細胞においては、パーティクルガン法、エレクトロポレーション法、ポリエチレングリコール(PEG)法およびアグロバクテリウム法が好ましく、アグロバクテリウム法が特に好ましい(Bechtold N. & Pelletier G., Methods Mol. Biol. 82, pp.259-266, 1998)。
【0038】
上述のように植物に導入された本発明の遺伝子は、宿主の植物細胞のゲノムに組み込まれ、後の世代まで安定的に保持される。故に、本発明は、上記植物細胞から再生される植物体とその部分並びにその繁殖体(例えば種子や無性生殖体)および子孫を包含する。
【0039】
また、別の形質転換方法として、細胞融合が挙げられる。この場合には、ヘビノネゴザ細胞と融合させたい植物細胞の細胞壁を酵素により分解し、プロトプラスト化する。次に、細胞融合促進剤としてポリエチレングリコールを加えて、二つのプロトプラストを効率よく融合させることにより、二つの細胞核も融合して一つになる。これにより、ヘビノネゴザ及び融合させたい植物細胞の遺伝子を併せ持つ核が生じて、この融合細胞を培養、生育することにより、所望の植物体が得られる。
【0040】
尚、遺伝子組み換えや細胞融合を用いずとも、ヘビノネゴザを他の近親の植物と交配させ、最終的に所望の植物と交配させるようにすることで、遺伝子組み換えを用いることなく、ヘビノネゴザ由来の鉄輸送担体として機能するタンパク質をコードする遺伝子を含有する植物体を得るようにしても良い。
【0041】
上述の方法により形質転換された植物は、カドミウム、ニッケル、マンガン、亜鉛、銅などの金属に阻害されることなく、生育に十分な量の鉄を吸収することができる。したがって、カドミウム、ニッケル、マンガン、亜鉛、銅などの金属存在下存在下でもこれらの影響を受けずに生育に十分な量の鉄を吸収して良好な生育状態を保つ植物体を得ることが可能となる。しかも、人体にとって非常に有害な元素であるカドミウム蓄積量が減少するので、カドミウム汚染された土地を浄化することなく、農地等として採用してもカドミウムの蓄積量が少ない作物の作出して食用に供することが可能となる。さらに、植物体の特定の部分のみのカドミウム蓄積量を減少させることも可能であり、例えば、可食部のカドミウム蓄積量を減少させるといったことも可能である。
【0042】
また、上記植物体を環境汚染土壌で生育することで、汚染された土壌の飛散を防いで環境汚染物質の拡散を防ぐことも可能である。さらに、環境汚染土壌を緑で覆うことにより、景観を良好なものに保って、人々に安心感を与えることもできる。
【0043】
次に、環境汚染物質蓄積能を有し、且つ本発明の遺伝子を含有する植物体について説明する。
【0044】
環境汚染物質蓄積能を有する植物は、例えば、本願発明者が先に出願した特願2004−260091のファイトリメディエーション用植物種の選抜方法や、Yoshihara, T., Shoji K., Goto F., Screening for the Cd hyperaccumulator/ Ultra-low-accumulator from major herbal angiosperms in Japan. In: Plant nutrition for food security, human health and environmental protection (Eds. Li, CJ et al., Proc. 2005 IPNC, Beijing, China) pp.750-751.に記載の方法、電中研報告書U03521(吉原利一、後藤文之、庄子和博、カドミウムやホウ素に耐性・蓄積能をもつ草本性被子植物の探索)に記載の方法により選抜することができる。
【0045】
具体的には、種々の植物の種子を、植物の生育に必要な栄養塩、環境汚染物質の吸収・蓄積に影響を及ぼすと考えられる微量金属元素およびほとんどの植物において成長を阻害される濃度の前記環境汚染物質を含む培地または土壌、並びに植物の生育に必要な栄養塩、環境汚染物質の吸収・蓄積に影響を及ぼすと考えられる微量金属元素を含む培地または土壌にそれぞれ播種し、発芽生育後、植物の地上部および根部について環境汚染物質の蓄積量を測定し、環境汚染物質を含む場合と含まない場合における環境汚染物質の植物の地上部および根部における蓄積量の比から環境汚染物質の蓄積能を評価して選抜する。
【0046】
環境汚染物質がカドミウムの場合について例を挙げると、上記選抜方法により、地上部に高いカドミウム蓄積能力を有する種はアキノノゲシなどのキク科植物であり、根部に高いカドミウム蓄積能力を有する種はイグサであることが確認されているが、これらの植物はカドミウム耐性が低いことも確認されている。したがって、これら植物を本発明の遺伝子を含有するよう上述の方法で形質転換することにより、多量のカドミウムを吸収しつつ、しかも、生育に必須な鉄をも十分に吸収して生育状態を良好に保つ非常に優れたハイパーアキュームレーターを得ることが可能となる。
【0047】
また、本願発明者が先に出願した特開2004−016130に開示の技術を用いてもよい。具体的には、環境汚染物質に対して結合能を有するオリゴまたはポリペプチドおよびアポプラズマ輸送シグナルを含むポリペプチドをコードする核酸分子を構築し、これを用いてトランスジェニック植物を作製することにより、高い環境汚染物質蓄積能を有する植物体を得ることができる。環境汚染物質に対して結合能を有するオリゴまたはポリペプチドとしては、メタロチオイネン、フェリチン、トランスフェリン、ポリヒスチジン、ニッケリン、ファイトキレーチン、Zα4人工ペプチド、ほ乳類プラズマ金属輸送タンパク質およびこれらの金属結合性フラグメントが挙げられる。
【0048】
したがって、上記植物体を本発明の遺伝子を含有するようにさらに形質転換することにより、或いは本発明の遺伝子を含有するように形質転換された植物体を環境汚染物質に対して結合能を有するオリゴまたはポリペプチドおよびアポプラズマ輸送シグナルを含むポリペプチドをコードする核酸分子によりさらに形質転換することにより、環境汚染物質を多量に吸収しつつ、しかも、生育に必須な鉄をも十分に吸収して生育状態を良好に保つ非常に優れたハイパーアキュームレーターを得ることが可能となる。
【0049】
尚、上述の形態は本発明の好適な形態の一例ではあるがこれに限定されるものではなく本発明の要旨を逸脱しない範囲において種々変形実施可能である。例えば、環境汚染物質蓄積能を有する植物は、上記以外の方法により得るようにしても良い。
【実施例】
【0050】
以下の実施例により本発明をさらに具体的に説明するが、本発明はこれら実施例に限定されるものではない。
【0051】
<1:カルス及び再分化植物体培養>
ヘビノネゴザ(Athyrium yokoscense)は、栃木県足尾町の足尾銅山跡において採集したものを供試植物とした。また、対照植物として、カドミウムに対する耐性・蓄積能に関して一般的な性質を持つと考えられているタバコ(Nicotiana tabacum L. BY-2)を用いた。
【0052】
供試植物であるヘビノネゴザは、カルスを誘導した後、2001年9月以来液体振とう培養により継代を続けているもの、あるいは誘導したカルスから再び植物体に再分化させたものを用いた(Yoshihara, T. et al. (2005a) Plant Cell Rep 23 p579-585 )。対照植物であるタバコは、植物体を滅菌後、5mm角程度の葉片をMS固形培地に定置して約1ヶ月間培養することによってカルスを誘導した後、ゲランガムを除いたMS液体培地(増殖用MS培地)を用いて振とう培養(100rpm)により増殖させたものを用いた。尚、培養環境条件は全て周期光照射(約4000lux、12時間明期/12時間暗期)、温度は25±1℃とした。また、培地は約10日〜2週間に1回の頻度で交換した。尚、MS固形培地には、カイネチン0.1ppm、2,4−D 1ppm、3%シュークロースと0.2%ゲランガムを添加し、pH6.0としたものを用いた(Murashige T, Skoog F (1962) Physiol Plant 15 p473-497)。
【0053】
<2:カドミウム曝露下におけるカルス生育>
上述の培養方法により得られたヘビノネゴザカルスとタバコカルスを、0μM、100μMの2種類のCdSO4添加増殖用MS培地によりそれぞれ6週間培養し、その増殖量を調査した結果を図1に示す。培養開始時のカルス量は、ヘビノネゴザカルスについては生鮮重量として3g均一、タバコカルスについては極端に軟弱で水分含有量が多いため容積として20ml均一とした。増殖量の算定は、ヘビノネゴザカルスは生鮮重量として秤量、タバコカルスは15000gの遠心操作により容積として、あるいは吸引濾過後により生鮮重量として秤量するとともに、得られたカルスについて65℃、3日間の乾燥後、乾燥重量として再度秤量した。培養環境条件は上述したものと同様とした。
【0054】
図1において、◇はヘビノネゴザカルス、■はタバコカルスの相対的生育量を示す。ここで、相対的生育量とはカドミウムを添加しない増殖用MS培地で生育した量を1として換算した場合の生育量を意味する。尚、本実施例におけるデータは、それぞれ平均値と標準偏差を求め、各実験区間の差異についてStudentのt検定法、Tukeyの多重比較検定法のいずれかの方法により有意性を判定した。これらの計算には統計形算用ソフトウェア(KyplotR ver.3.0, (株)カイエンス)を用いた。対照に用いたタバコカルスはカドミウム曝露により増殖が著しく抑制され、6週間後には相対的生育量が0.2、つまり、カドミウム曝露を行わない場合に比べて20%程度しか増殖しなかった。一方、ヘビノネゴザカルスは、6週間後においても、カドミウム曝露を行わない場合と変わらない生育量を示した。したがって、誘導、増殖させたヘビノネゴザカルスは、その生育において、カドミウムの影響を全く受けていないことが確認された。
【0055】
<3:ファイトキレーチン合成酵素(PCS)遺伝子の発現に及ぼすカドミウムの影響>
100μMのCdSO4を添加した培地において0日、1日、3日、5日、7日および12日生育させたヘビノネゴザカルスおよびタバコカルス、あるいは0μM、100μM、300μM、500μM、1000μMおよび3000μMのCdSO4をそれぞれ添加した培地において1週間生育させたヘビノネゴザカルスおよびタバコカルスからtotalRNAを抽出し、RT−PCR法によってファイトキレーチン合成酵素(PCS)遺伝子の発現に及ぼすカドミウムの影響を調べた。尚、ファイトキレーチンは、カドミウムをキレート化可能な低分子の非タンパク質性ポリペプチドであり、カドミウム耐性に関与するポリペプチドである。ヘビノネゴザカルスのtotalRNA抽出は、CTABとPVPを用いたJaakolaらの多糖質の材料からの高品質totalRNA抽出法より行った(Jaakola L. et al. (2001) Mol Biotechnol. 19 p201-3)。タバコカルスのtotalRNA抽出は、市販のTrizol試薬(Invitrogen、USA)により行った。これらのtotalRNAとOligo−dTプライマーを用いて、市販のキット(Rever-tra Ace kit、TOYOBO)により逆転写反応を行い、それぞれのcDNAを得て、これらcDNAとGenBankに登録されている既知の配列であるAY235426、AB057412から設計したそれぞれのPCS遺伝子に特異的なプライマーセットを用いてPCRを行い、発現量の解析に用いた。発現量の解析には、画像解析装置(Image Reader LAS-2000、FUJIFILM)を用いた。尚、別途同様にそれぞれのアクチン(ACT)遺伝子の発現量を解析しておき、PCS遺伝子の発現量を標準化した。以下にそれぞれのPCS遺伝子、ACT遺伝子の発現量を解析するための特異プライマーセットの配列を列挙する。
AyPCs1F 5'-GCAAGGTTGCTGCCAAGGTG-3'(配列番号9)
AyPCs1R 5'-CTAGGTTTCCTCACTGCATGACC-3'(配列番号10)
NtPCs1F 5'-GCTTTTCGCCCTAATCATAGTA-3'(配列番号11)
NtPCs1R 5'-TGACCCAACTCTCATGTTTA-3'(配列番号12)
AyAc1F 5'-CGACATACAGGTGTGATGGGT-3'(配列番号13)
AyAc1R 5'-GCTTGAATAGCGACATACAT-3'(配列番号14)
NtAc1F 5'-TCAGAAAGATGCCTATGTGGGA-3'(配列番号15)
NtAc1R 5'-TGGCAACGTACATAGCTGGG-3'(配列番号16)
【0056】
図2にヘビノネゴザカルス及びタバコカルスにおけるPCS遺伝子の発現に及ぼすカドミウム(100μM)の影響を示す。図2において、(B)は画像解析装置によりえられた発現量データであり、(A)は(B)の画像に基づいて数値化したデータである。□はタバコカルス、◆はヘビノネゴザカルスのACT遺伝子発現量を1としたときのPCS発現量(相対的PCS発現量)を表す。100μMのカドミウム曝露条件下においてヘビノネゴザカルスではほとんどPCS遺伝子の発現量に変化が認められなかったのに対して、タバコカルスでは曝露開始後1日目にPCS遺伝子の発現量が2倍以上に増加した後、漸減して12日目にはほぼ元の発現量に戻るという変化を示した。
【0057】
図3に0μM、100μM、300μM、500μM、1000μMおよび3000μMのカドミウム曝露条件下で1週間培養したヘビノネゴザカルスのPCS遺伝子の発現量を示す。0μM、100μM、300μM、500μM、1000μMおよび3000μMのカドミウム曝露条件下で1週間培養した場合にも、ヘビノネゴザではPCS遺伝子の発現量にはほとんど変化が認められなかった。したがってヘビノネゴザではPCSがカドミウムの耐性に関与している可能性は低く、カドミウム耐性をPCS以外の別の機構により得ていることが考えられた。
【0058】
<4:カドミウム曝露下におけるカルス中必須金属元素の含有量>
上述の方法により培養したヘビノネゴザカルスとタバコカルスを、0μM(MS)、10μM(Cd10)、100μM(Cd100)のCdSO4添加増殖用MS培地、Fe無添加(ΔFe)増殖用MS培地にてそれぞれ1週間生育させたヘビノネゴザカルス及びタバコカルスの必須金属元素(カルシウム、銅、鉄、マグネシウム、マンガン、亜鉛)の含有量を、ICP(P4000、Hitachi、Japan)を用いて分析した結果を図4に示す。尚、培養環境条件は上述した条件と同様とした。また、ICP測定用試料液は、上述した条件下で育成したカルスをそれぞれ65℃/3昼夜以上乾燥して、乾燥重量を測定後に湿式灰化を行い(吉原ら、U97042)、灰化試料を蒸発乾固後して得られた残査に15mLの1N塩酸を加えて溶解して作製した。
【0059】
図4において、縦軸の相対濃度とは、各々カドミウムを含まない培地(MS)で増殖したカルスにおける値を1として計算した値である。また、(a)はカルシウム、(b)は銅、(c)は鉄、(d)はマグネシウム、(e)はマンガン、(f)は亜鉛の結果を示している。ヘビノネゴザカルスでは、カドミウム曝露によって(a)カルシウム、(d)マグネシウム、(e)マンガン含有量が有意に低下したのに対し、タバコカルスでは、(c)鉄含有量だけが有意な低下を示し、カドミウム曝露によって影響を受ける元素が異なることが明らかとなった。すなわち、ヘビノネゴザカルスでは(a)カルシウムが約20〜25%、(d)マグネシウムが約15〜25%、(e)マンガンが約30〜35%低下したのに対して、タバコカルスでは(c)鉄だけが約50〜60%低下した。一般的な植物ではカドミウムにより鉄の吸収が阻害されて鉄欠乏に陥る(カドミウム誘導性鉄欠乏)ことが報告されており(Marschner H (1995) Mineral Nutrition of Higher Plants, 2nd edn, Academic press, London, UK)、タバコカルスの鉄含有量の低下はこれを顕著に物語っている。しかし、ヘビノネゴザカルスではカドミウム曝露によって鉄ではなく、カルシウム、マグネシウムおよびマンガンの含有量が低下した。これは、ヘビノネゴザカルスにおいては、カドミウムによりマグネシウム、カルシウムおよびマンガンの吸収が阻害されることを示唆している。ただし、カドミウムの有無にかかわらずヘビノネゴザカルスは旺盛に生育したことから、これらの元素の欠乏症に陥るほど吸収は阻害されない。したがって、ヘビノネゴザカルスにおける鉄輸送担体は、他の植物の鉄輸送担体に比べて鉄に対する特異性が非常に高く、カドミウム存在下においても、カドミウムに阻害されることなく、生育に十分な量の鉄を吸収できることが判明した。
【0060】
<5:ヘビノネゴザ鉄吸収関連遺伝子の単離と発現に及ぼすカドミウムの影響>
ヘビノネゴザカルスからtotalRNAを抽出してcDNA化し、cDNAライブラリーを作製した。ヘビノネゴザtotalRNAは、鉄分を除いた培地において3週間生育させたヘビノネゴザカルスより、先に示したJaakolaらのtotalRNA抽出法に従って抽出し、逆転写反応を行って各遺伝子ホモログの部分シークエンス単離用のcDNAを得た。また、各遺伝子ホモログの完全長シークエンスを単離するために、別途同様にして得られたヘビノネゴザtotalRNAからcDNAライブラリーを作製した。尚、cDNAライブラリーの作製には、得られたtotalRNAよりMACS Column Typeμ(第一化学薬品)を用いてmRNAを精製した後、Creator SMART cDNAライブラリー作製キット(BD Bioscience Clontech)を使用した。
【0061】
次に、アラビドプシスなどにおいて既に配列の知られている鉄とカドミウム双方の輸送に関連しているとの報告があるGenBankに登録されている元素輸送担体遺伝子の既知の配列(IRT;NM_118089、AF065444、AF246266、AB126086、AB126087、AB070226、AJ320253: Nramp;L41217、NM_106731、NM_103618、NM_101464、AY196091: YSL;AY515566、AY515565、AY515560、AY512583、AP003936、CA758396)に、それぞれ特異的な共通配列を探索し、ディジェネレートプライマーを設計・作製した。以下にそのディジェネレートプライマーを列挙して示す。
degAyIRTF 5'-CCKTGGYMTAARTTYCCTTTYBCBGG-3'(配列番号17)
degAyIRTR 5'-GARTGWRMYAHRATBCCAASYTCCARNACC-3'(配列番号18)
degAyNrampF 5'-ATGCCBCAYAAYVTSTWYYTVCAYTCRGC-3’(配列番号19)
degAyNrampR 5'-ATVGTVSWRCTCTGHCCMGMWGC-3’(配列番号20)
degAyYSLF 5'-MMRCCNTTYACWMRNCARGAGAAYAC-3'(配列番号21)
degAyYSLR 5'-CWGTDGCNRWWCCACTNGGRTA-3'(配列番号22)
【0062】
これらのプライマーと先に示した部分シークエンス単離用のcDNAを用いてPCRを行い、得られた断片をTAクローニングキット(Invitrogen)によりpCR−TOPOベクターにクローニングした。得られた断片は、部分シークエンスとしてDNAシーケンサー(ABIモデル3100)によって配列を解析した後、既知の遺伝子と比較してシークエンスに類似性が認められたものをヘビノネゴザにおける各遺伝子ホモログの部分シークエンスとしてcDNAライブラリーからの完全長シークエンス単離のためのプローブ作製に用いた。完全長シークエンス単離のためのプローブは、先に示した部分シークエンスから設計し直したプライマーを用いてPCR−DIGラベル法により作製した(DIG DNA Labeling and Detection Kit、Roche)。プローブ用、RT−PCRとリアルタイムPCRによる発現解析用プライマーの位置(配列)は、各完全長配列中に示した。図5〜図8において、1Fと1RはリアルタイムPCR用プライマー、2Fと2Rはプローブ作成およびRT−PCR用プライマーである。また、図5〜図6において、四角で囲んだ部分は開始コドン及び終始コドンであり、陰付きの四角で囲んだ部分は鉄の輸送に関連すると考えられている共通配列を示している。cDNAライブラリーからの完全長cDNAの単離はこのプローブを用いて定法にしたがって行った(真壁和裕(1997) バイオ実験イラストレイテッド 第4巻 苦労なしのクローニング、秀潤社)。得られたクローンはDNAシーケンサー(ABIモデル3100)によって配列の解析を行い、先に示した既知のホモログとの比較を行った。
【0063】
ヘビノネゴザから単離した3種類の元素輸送担体遺伝子ホモログについてRT−PCR法、あるいはリアルタイムPCR法を用いてカドミウム曝露条件下における発現解析を行った。具体的には、100μMあるいは400μMの2種類のCdSO4を添加した培地において3週間生育させたヘビノネゴザカルス、および成植物体からtotalRNAをカルス、根、地上部の部分毎に上述のJaakolaらのtotalRNA抽出法に従って抽出し、逆転写反応によって得たcDNAをテンプレートに用いた。また、別途鉄欠乏培地において3週間生育させたヘビノネゴザカルス、および成植物体より得たtotalRNAを用いて同様の操作を行い、カドミウム曝露条件下におけるこれらの遺伝子の発現と比較した。
【0064】
単離したホモログのうち、AyNramp1(配列番号1:全長1903bp、ORF1530bp、510AA)、AyIRT1(配列番号3:全長1878bp、ORF1152bp、384AA)の2種類については完全長遺伝子であった。AyYSL1(配列番号5:全長301bp)、AyYSL2(配列番号7:全長295bp)についてはいずれもORFの部分遺伝子と考えられた。これらのうち、特に完全長を単離できたAyIRT1、およびAyNramp1について、それぞれアラビドプシスにおいて配列が明かとなっているホモログAtIRT1、およびAtNramp3とアミノ酸配列の相同性を比較した。その結果を図9〜図11に示す。図9において、(a)はヘビノネゴザAyIRT1のタンパク質膜構造、(b)はアラビドプシスAtIRT1タンパク質膜構造を示す。図10において、(a)はヘビノネゴザAyNramp1のタンパク質膜構造、(b)はアラビドプシスAtNramp1タンパク質膜構造を示す。また、図11において、(A)は植物由来のNrampとの比較、(B)は動物由来のNrampとの比較を示す。尚、図11において、GmDMTはダイズ、LeNrampはトマト、OsNrampはイネ、HsDMTはヒト、MmNrampはマウス、OmNrampはニジマス、TrDMTはトラフグである。AtIRT1のアミノ酸配列とAyIRT1のアミノ酸配列の相同性は44.0%、AtNramp1のアミノ酸配列とAyNramp1のアミノ酸配列の相同性は67.3%であり、相同性はそれほど高くはなかったが、アラビドプシスにおけるD100、E103及びC109を除いて、いずれにおいてもアラビドプシス(Rogers EE et al. (2000) PNAS 97 p12356-12360)やマウス(Lam-Yuk-Tseung et al. (2003) BLOOD 101 p3699-3707)において示されている鉄吸収に強く関連したアミノ酸配列が全て保存されていた。また、図11に示すように、AyNramp1については、そのアミノ酸配列が植物におけるものよりも動物におけるものに類似しており、図11中の矢印で示されるように、これまで配列が明らかにされている植物のNrampにおいては全てイソロイシンであるアミノ酸が、ヘビノネゴザでは動物と同じメチオニンに変わっていた。
【0065】
次に、タンパク質膜構造については、図9に示すアラビドプシスAtIRT1タンパク質膜構造においては、8ヶ所の膜貫通領域があるのに対し、ヘビノネゴザAyIRT1タンパク質膜構造における膜貫通領域は2ヶ所少ない6ヶ所であった。図10に示すアラビドプシスAtNramp1タンパク質膜構造においては、11ヶ所の膜貫通領域があるのに対し、ヘビノネゴザAyNramp1タンパク質膜構造における膜貫通領域は2ヶ所少ない9ヶ所であった。尚、図9及び図10において、1は膜外領域、2は膜貫通領域、3は膜内領域を示している。また、上記の「保存されている鉄吸収に強く関連したアミノ酸配列」に着目すると、例えば、AyIRTのH236、S237、H263、E267とAtIRTのH197、S198、H224、E228において示されるように膜の内外における存在を反対にしているものも多かった。
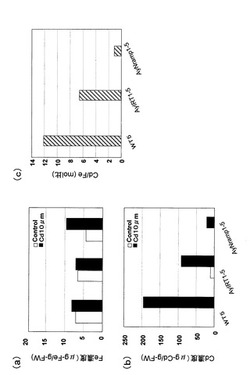
【0066】
次に、ヘビノネゴザカルスおよび成植物体を鉄欠乏処理、カドミウム曝露し、単離したこれらの4つの遺伝子について発現変化を調べた。結果を図12〜図14に示す。図12に示すように、ヘビノネゴザカルスにおいては、いずれの遺伝子においても強い鉄欠乏処理によって(2週間の鉄欠乏処理)有意な発現の増加が認められた。即ち、鉄欠乏応答性があることが確認された。尚、図12において、(a)は通常の増殖用MS培地で増殖させた場合、(b)は増殖用MS培地から鉄を除いて1週間増殖させた場合、(c)は増殖用MS培地から鉄を除いて2週間増殖させた場合である。次に、図13に示すように、カドミウムを曝露した場合にもAyYSL1、AyYSL2については発現の増加が認められたが、AyIRT1、AyNramp1については有意な発現の増加は認められなかった。尚、図13において、(a)は通常の増殖用MS培地で増殖させた場合、(b)はカドミウムを100μM添加した培地で1週間増殖させた場合、(c)はカドミウムを400μM添加した培地で1週間増殖させた場合である。また、図14に示すように、成植物体を用いた実験では、全ての遺伝子において根、植物体地上部ともに1週間の鉄欠乏処理(ΔFe)、あるいはカドミウム曝露(+Cd)によって有意な発現の変化は認められなかった。尚、図14において、(a)AyIRT1、(b)はAyYSL1、(c)はAyYSL2、(d)はAyNramp1である。
【0067】
<6:ヘビノネゴザ鉄吸収関連遺伝子を過剰発現した形質転換酵母におけるカドミウム耐性の向上>
ヘビノネゴザから全長を単離することができた2つの遺伝子(AyIRT1、AyNramp1)のORF部分をPCRによって増幅し、配列を確認後、酵母発現ベクター(pYES2.1vector/Invtrogen)を介して酵母(BY4741株)に導入した。酵母の形質転換は、Dohlmanの示す方法に従った(Dohlman HG (2002) "Lazy Bones" Plasmid Transformation, A quick method for plasmid transformation into yeast. http://www.med.unc.edu/~hdohlman/lazybones.html)。具体的には、酵母をSD寒天培地(BD bioscience・Clonetech)にて培養して単菌株を単離し、キャリアーDNAと単離した遺伝子を含むプラスミドDNA、および形質転換溶液(40% ポリエチレングリコール、0.1M 酢酸リチウム、10mM トリス塩酸(pH7.5)、1mM EDTA)を混合して一晩静置した後、42℃でヒートショックを行い形質転換した。さらにこの混合液を、ウラシルを除いたSD寒天培地において培養し、得られた菌株についてコロニーPCR法によって導入遺伝子の確認を行った。尚、プライマーはRT−PCR法で用いたものと同じ配列のものを用いた。
【0068】
上記により得られた菌株(AyIRT1、AyNramp1)と非形質転換株(WT)のカドミウム耐性を調査した。カドミウム耐性の検定には、ウラシルを除いたSD寒天培地を基本培地として、これに0μM、30μMのCdSO4を添加した培地を用い、1/1、1/10、1/100及び1/1000に希釈した株(希釈率は600nmの吸光度により確認)を滴下して、30℃において2〜5日間の培養の後、コロニーの形成状態を非形質転換系統と比較した。また、蓄積能については、30μMのCdSO4を添加した同組成の液体培地(100ml培地を500mlコルベンに分注、振とう強度140rpm、30℃において5日間培養)においてこれらの形質転換酵母系統を増殖させ、集菌後500μM CaCl2バッファーに顕濁・洗浄後、遠心操作により再集菌して、ICP(P4000、 Hitachi、 Japan)による金属濃度の分析のためのサンプルとした。
【0069】
上記により得られた形質転換株(AyIRT1、AyNramp1)と非形質転換株(WT)とをそれぞれ数株ずつカドミウムを含む培地に接種し、その生育を調べた結果を図15に示す。(a)はカドミウム無添加培地で2日間生育させた結果、(b)はカドミウムを30μM添加した培地で5日間生育させた結果である。いずれの形質転換株においても形質転換しない酵母株に比べて明らかに生育が良好であった。また、これらの株におけるカドミウム、および鉄含有量を調べた結果を図16に示す(a)は鉄濃度(含有量)、(b)はカドミウム濃度(含有量)、(c)は鉄に対するカドミウム量をモル比で表した図である。尚、図15及び図16において、WT5はpYES酵母形質転換用ベクターのみ導入したコントロール系統、AyIRT1−5はAyIRT1を用いて形質転換した系統、AyNramp1−5はAyNramp1を用いて形質転換した系統を表している。カドミウム含有量はAyIRT1−5形質転換株では約90μg/g−FW、AyNramp1−5形質転換株では約20μg/g−FWであるのに対し、非形質転換株であるWT5では約200μg/g−FWであった。鉄含有量はWT5で8μg/g−FW、AyIRT1−5形質転換株で7μg/g−FW、AyNramp1−5形質転換株で10μg/g−FWであり、形質転換株と非形質転換株とで鉄の吸収量にそれほど大きな差異は認められなかった。これは、本実施例で用いた培地中に鉄が十分に存在したため、鉄の供給量が十分であったことによるものであると考えられる。また、Cd/Fe値に関しては、形質転換株の方が小さかった。すなわち、いずれの形質転換株においても1分子の鉄を得るために混入するカドミウム分子の数が非形質転換株よりも少ないことが明らかとなった。この傾向はAyNramp1−5形質転換株において特に顕著であった。以上より、AyNramp1、AyIRT1により形質転換することで、カドミウム存在下においても生育に必須な鉄と特異的に親和するようになって、良好に生育する。即ち、植物体のカドミウム耐性を強化することが可能である。さらには、カドミウムの蓄積量も低減される。
【図面の簡単な説明】
【0070】
【図1】カドミウム(100μM)曝露条件下におけるヘビノネゴザカルスとタバコカルスの生育を示す図である。◇はヘビノネゴザカルスの相対的生育量、■はタバコの相対的生育量を示す。
【図2】ヘビノネゴザカルスとタバコカルスにおけるPCS遺伝子の発現に及ぼすカドミウム(100μM)の影響を示す図である。
【図3】種々のカドミウム曝露条件下において生育したヘビノネゴザカルスにおけるPCS遺伝子の発現を示す。
【図4】ヘビノネゴザカルスとタバコカルスにおけるカドミウム曝露による金属元素の含有量変化を示す図である。(a)はカルシウム、(b)は銅、(c)は鉄、(d)はマグネシウム、(e)はマンガン、(f)は亜鉛についての結果である。
【図5】ヘビノネゴザ鉄輸送担体遺伝子(AyNramp1:配列番号1)の配列である。
【図6】ヘビノネゴザ鉄輸送担体遺伝子(AyIRT1:配列番号3)の配列である。
【図7】ヘビノネゴザ鉄輸送担体遺伝子(AyYSL1:配列番号5)の配列である。
【図8】ヘビノネゴザ鉄輸送担体遺伝子(AyYSL2:配列番号7)の配列である。
【図9】IRTタンパク質膜構造比較を示す図である。
【図10】Nrampタンパク質膜構造比較を示す図である。
【図11】種々の生物のNrampにおけるアミノ酸配列の比較を示す図である。
【図12】ヘビノネゴザカルスにおける鉄欠乏条件下での鉄輸送担体遺伝子の発現を示す図である。
【図13】ヘビノネゴザカルスにおけるカドミウム曝露下での鉄輸送担体遺伝子の発現を示す図である。
【図14】ヘビノネゴザ成植物体におけるカドミウム曝露下での鉄輸送担体遺伝子の発現を示す図である。
【図15】AyIRT1及びAyNramp1により形質転換した酵母におけるカドミウム耐性を示す図である。
【図16】AyIRT1及びAyNramp1により形質転換した酵母における(a)鉄濃度、(b)カドミウム濃度、(c)Cd/Fe(mol比)を示す図である。
【技術分野】
【0001】
本発明は、植物の鉄輸送能を強化する遺伝子に関する。さらに詳述すると、本発明は、ヘビノネゴザ由来の鉄輸送担体タンパク質をコードする遺伝子で形質転換することにより鉄輸送能が強化された植物体並びにこれを利用した環境修復方法に関する。
【背景技術】
【0002】
近年、広範囲に拡散した比較的低濃度の様々な汚染物質を、長期間にわたり低コストで穏やかに処理できる新しい技術としてファイトリメディエーション(植物による環境修復)が注目されている。理論的にはハイパーアキュームレーター(特定元素高濃度蓄積種)と呼ばれる数種類の既存の植物を用いて重金属の吸収・除去が可能であると考えられており、実用化に向けて様々な汚染物質に対する適用植物種の拡大、処理能力の向上を目的とした研究、特に、従来の育種法では困難な全く別の形質を付与しうる遺伝子組換え技術を用いた様々な研究が行われている。
【0003】
例えば特許文献1では、ABCトランスポーターに属する輸送体タンパク質の一つであるMRP1(multidrug resistance-associated protein 1)をコードする遺伝子を植物内に導入することにより、植物に重金属化合物や細胞毒有機化合物耐性を与えて、該耐性付与植物を汚染環境中で生育させることにより汚染環境中から重金属化合物や細胞毒有機化合物を回収する技術が開示されている。また、特許文献2では、酵母由来のzrcl遺伝子を導入して重金属の蓄積能を強化した植物体により、重金属に汚染された土壌を浄化する技術が開示されている。
【0004】
一方、近年の分子生物学的な研究の進展により、重金属の中でも特に河川・土壌等の拡散量と人体への健康への影響が大きいカドミウムについて、植物への吸収機構に関する様々な報告がなされている。例えば、一般的な植物ではカドミウムにより鉄の吸収が阻害されて鉄欠乏状態に陥る(カドミウム誘導性鉄欠乏)ことが報告されている(非特許文献1)。また、鉄輸送担体遺伝子の一つであるIRTやNrampがコードする鉄輸送担体タンパク質が、植物の生育に必須な元素である鉄と共にカドミウムも吸収することが報告されている(非特許文献2、非特許文献3)。
【特許文献1】特開2003−210057
【特許文献2】特開2004−275051
【非特許文献1】Marschner H (1995) Mineral Nutrition of Higher Plants, 2nd edn, Academic press, London, UK
【非特許文献2】Korshnova YO et al. (1999) Plant Mol Biol 40 p37-44
【非特許文献3】Thomine S et al. (2000) Proc Natl Acad Sci USA 97 p4991-4996
【発明の開示】
【発明が解決しようとする課題】
【0005】
特許文献1及び特許文献2に開示された技術により、カドミウム等の重金属耐性・蓄積能を植物体に付与することは可能である。しかしながら、植物の生育にとって必須である鉄を十分に取り込めなければ、植物は鉄欠乏状態に陥ってしまい、その生育状態に悪影響が及ぼされる。
【0006】
また、IRTやNrampがコードする鉄輸送担体タンパク質が、植物の生育に必須な元素である鉄と共にカドミウムも吸収することにより、生育に十分な量の鉄を取り込めなくなり、生育状態に悪影響が及ぼされる虞がある。
【0007】
そこで、本発明は、カドミウム等の陽イオン金属存在下においても、これらに阻害されることなく鉄を特異的に輸送可能な担体タンパク質をコードする遺伝子と、当該遺伝子により形質転換してカドミウム等の金属存在下においても生育に十分な鉄を吸収して健全に生育し、カドミウム蓄積量が低減された植物体を提供することを目的とする。
【0008】
さらに本発明は、形質転換植物体により環境修復を行う方法を提供することを目的とする。
【課題を解決するための手段】
【0009】
かかる目的を達成するため、本願発明者は、高カドミウム耐性を有するヘビノネゴザ(Athyrium yokoscense)について、組織培養法を確立し、その機能を解明するために鋭意研究を重ねた。その結果、ヘビノネゴザの高カドミウム耐性は、その鉄輸送担体タンパク質が鉄に対して特異的に親和することにより、カドミウムを吸収する確率が非常に低くなるという機構に起因するものであることを知見した。
【0010】
本発明は係る知見に基づくものであって、請求項1に記載の発明は、
(a)配列番号2、4、6又は8のアミノ酸配列からなるタンパク質、または
(b)配列番号2、4、6又は8のアミノ酸配列において、1個若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなり、且つ鉄と特異的に親和する輸送担体として機能するタンパク質
をコードする遺伝子である。
【0011】
ここで、「鉄と特異的に親和する」とは、カドミウム、ニッケル、マンガン、亜鉛、銅などの金属に曝露された条件下であっても、これらとほとんど親和することなく鉄と特異的に親和する輸送担体として機能することを意味している。
【0012】
請求項2に記載の発明は、
(a)配列番号2、4、6又は8のアミノ酸配列からなるタンパク質、または
(b)配列番号2、4、6又は8のアミノ酸配列において、1個若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなり、且つ鉄と特異的に親和する輸送担体として機能するタンパク質
である。
【0013】
上記タンパク質は、鉄輸送担体として機能し、カドミウム、ニッケル、マンガン、亜鉛、銅などの金属が存在しても、これらとほとんど親和することなく鉄と特異的に親和する。
【0014】
請求項3に記載の発明は、
(c)配列番号1、3、5又は7の塩基配列からなるDNA、または
(d)配列番号1、3、5又は7の塩基配列からなるDNA若しくはこれと相補的なDNAとストリンジェントな条件下でハイブリダイズし、且つ鉄と特異的に親和する輸送担体として機能するタンパク質をコードするDNA
からなる遺伝子である。
【0015】
上記遺伝子は、鉄輸送担体として機能するタンパク質をコードする。したがって、本遺伝子を持つ植物は、カドミウム、ニッケル、マンガン、亜鉛、銅などの金属が存在しても、これらとほとんど親和することなく鉄と特異的に親和する輸送担体を有するようになり、必須元素である鉄を取り込みやすくなる。
【0016】
請求項4に記載の発明は、請求項1又は3に記載の遺伝子を含有する形質転換された植物細胞である。当該植物細胞から、請求項5に記載の植物体とその部分並びにその繁殖体及び子孫が得られる。したがって、カドミウム、ニッケル、マンガン、亜鉛、銅などの金属が存在しても、生育に十分な量の鉄を取り込んで良好な生育状態を保ち、人体にとって非常に有害な元素であるカドミウムの蓄積量が少ない植物を提供することが可能となる。
【0017】
請求項6に記載の発明は、環境汚染物質蓄積能をさらに有することを特徴とする植物細胞であり、当該植物細胞から、請求項7に記載の植物体とその部分並びにその繁殖体及び子孫が得られる。
【0018】
環境汚染物質蓄積能のみを有していても、カドミウム、ニッケル、マンガン、亜鉛、銅などの金属存在下では必須元素である鉄を十分に取り込むことが出来なくなり、生育不良に陥る虞があるが、本発明の遺伝子を含有することで、カドミウム、ニッケル、マンガン、亜鉛、銅などの金属存在下においても鉄と特異的に親和する輸送担体が機能し、植物の生育に十分な量の鉄を取り込むことが可能となる。したがって、カドミウム、ニッケル、マンガン、亜鉛、銅などの金属存在下においても良好な生育状態を保ち、しかも環境汚染物質蓄積能をも有する植物を提供することが可能となる。
【0019】
ここで、環境汚染物質とは、カドミウム、コバルト、ニッケル、銅、鉛、亜鉛、水銀、クロム、ヒ素、マンガン、セレン、スズ、アンチモンである。
【0020】
請求項8に記載の発明は、請求項1又は3に記載の遺伝子を組み込んだベクターで形質転換してなる宿主細胞を培養し、培養物中に蓄積されるタンパク質を採取するというものである。これにより、請求項2に記載のタンパク質を得ることが出来る。
【0021】
請求項9に記載の発明は、請求項7に記載の植物を用いて、土壌から環境汚染物質を除去することを特徴とする環境修復方法である。上記したように、請求項7に記載の植物は環境汚染物質蓄積能及びカドミウム、ニッケル、マンガン、亜鉛、銅などの金属存在下であっても植物の生育に十分な鉄を取り込む機能を有する植物であり、この植物をハイパーアキュームレーターとして用いることで、効率よくファイトリメディエーションを行うことが可能となる。
【発明の効果】
【0022】
本発明によれば、カドミウム、ニッケル、マンガン、亜鉛、銅などの金属存在下においても鉄と特異的に親和して、これらとほとんど親和することのない輸送担体タンパク質をコードする遺伝子を提供することが可能となる。また、当該遺伝子を含有する形質転換された植物体は、土壌中にカドミウム、ニッケル、マンガン、亜鉛、銅などの金属が存在しても植物にとって必須元素である鉄の吸収が阻害されない。したがって、カドミウム、ニッケル、マンガン、亜鉛、銅などの金属存在下にあっても良好な生育状態を保ち、しかも人体にとって非常に有害な元素であるカドミウムの蓄積量が少ない植物を提供することが可能となる。さらに、環境汚染物質蓄積能を有し、且つ本発明の遺伝子を含有する形質転換された植物体は、その生育に十分な量の鉄を吸収しつつ、環境汚染物質も吸収するので、優れたハイパーアキュームレータとなり、当該ハイパーアキュームレーターにより、土壌から環境汚染物質を効率よく除去することが可能となる。
【0023】
また、本発明の鉄輸送担体タンパク質は、カドミウム、ニッケル、マンガン、亜鉛、銅などの金属存在下においても、鉄と特異的に親和するので、鉄濃度を測定するセンサーや鉄濃度による分子スイッチ(イオンコンデンサー)として利用することが可能である。
【発明を実施するための最良の形態】
【0024】
以下に、本発明の実施形態について詳細に説明する。
【0025】
本発明は、ヘビノネゴザから得られる、(a)配列番号2、4、6又は8のアミノ酸配列からなるタンパク質、または(b)配列番号2、4、6又は8のアミノ酸配列において、1個若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなり、且つ鉄と特異的に親和する輸送担体として機能するタンパク質をコードする遺伝子である。
【0026】
ここで、上記「数個」とは、配列番号2においては、好ましくは204個以下、より好ましくは128個以下、さらに好ましくは51個以下、特に好ましくは10個以下である。配列番号4においては、好ましくは154個以下、より好ましくは96個以下、さらに好ましくは39個以下、特に好ましくは10個以下である。配列番号6においては、好ましくは27個以下、より好ましくは17個以下、特に好ましくは7個以下である。配列番号8においては27個以下、より好ましくは17個以下、特に好ましくは7個以下である。
【0027】
ここで、(a)のタンパク質は鉄と特異的に親和する輸送担体として機能するタンパク質であり、(b)のタンパク質は(a)のタンパク質の1個若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列を有するもののうち、鉄と特異的に親和する輸送担体として機能するタンパク質であることを意味している。
【0028】
上記タンパク質は、これらをコードする遺伝子や、配列番号1,3,5又は7の遺伝子を適当な発現ベクターに挿入し、その遺伝子を大腸菌、酵母、昆虫細胞などの適当な宿主中で発現させることにより、生産することができる。ここで、使用するベクタ−システムとしては、pET系(Novagen)、pYES系(Invitrogen)pIZT系(Novagen)、BacVector系(Novagen)、ViraPowerアデノウィルス発現系(Invitrogen)などが挙げられる。宿主としては、Rosetta−gami(DE3)pLys(Novagen)、INVSc(Invitrogen)、Sf9(Novagen)などが挙げられる。また、別のタンパク質生産方法として、無細胞タンパク質発現系が挙げられる。無細胞タンパク質発現系の例としては、例えば、ラピッドトランスレーションシステム(ロッシュ社)などを挙げることができる。
【0029】
このようにして得られたタンパク質は、人工基盤や膜上に固定することで、鉄の濃度を測定するセンサー、鉄濃度による分子スイッチ(イオンコンデンサー)として利用可能である。
【0030】
次に、本発明の遺伝子は例えば以下の様にして得ることが可能である。まず、ヘビノネゴザ或いはヘビノネゴザカルスからtotalRNA抽出を行い、これを用いてmRNAを精製した後、市販のキットによりcDNAライブラリ−を構築する。totalRNA抽出法としては、例えばCTABとPVPを用いたJaakolaらの多糖質の材料からの高品質totalRNA抽出法(Jaakola L. et al. (2001) Mol Biotechnol. 19 p201-3)が挙げられるが、これに限られるものではない。一方、配列番号1、3、5又は7の塩基配列に基づいて、市販のキットにより、DIGプローブまたは放射性プローブを作製し、ストリンジェントな条件でコロニーハイブリダイゼーションを行うことにより得ることができる。
【0031】
ここで、「ストリンジェントな条件下でハイブリダイズする」とは、特異的なハイブリダイゼーションのみが起こり、非特異的なハイブリダイゼーションが起きないような条件を言い、相同性が高いDNA同士、即ち60%以上、好ましくは75%以上、さらに好ましくは90%以上の相同性を有するDNA同士がハイブリダイズし、それにより相同性が低いDNA同士がハイブリダイズしない条件が挙げられる。具体的には、塩類等を含む一般的なハイブリダイゼーション用バッファーの存在下において50℃〜70℃の条件とすればよく、好ましくは55℃〜70℃、さらに好ましくは60℃〜70℃の条件が挙げられる。
【0032】
次に、本発明の遺伝子を含有する形質転換された植物体を得る方法について説明する。
【0033】
本発明の遺伝子を発現させるための発現調節エレメントであるプロモーター或いはエンハンサーとして、植物細胞において本発明の遺伝子を発現しうる任意のもの、例えばアグロバクテリウムまたはリゾビウムのような植物細胞内で発現する遺伝子を含む植物、植物ウイルス、細菌由来のプロモーターを用いることができる。そのようなプロモーターの例として、Agrobacterium tumefaciensのT−DNA由来のプロモーター、Smasプロモーター、桂皮アルコールデヒドロゲナーゼプロモータ、Nosプロモーター、リブロース二リン酸カルボキシラーゼオキシゲナーゼ(Rubisco)プロモーター、GRP1−8プロモーター、カリフラワー・モザイク・ウイルス(CaMV)の35Sプロモーター、植物由来のアクチンやヒストン等のプロモーター或いはエンハンサーおよび公知である種々の植物遺伝子からのその他の転写開始領域が包含される。例えば、植物由来のプロモーター或いはエンハンサーを適宜選択することにより、本発明の遺伝子を植物全体、または特定の器官、例えば、葉や根などにおいて発現させることができる。
【0034】
また、本発明の遺伝子を効率よく発現させるために、遺伝子のコード領域のポリヌクレオチドコーディング領域の3′末端にポリ(A)+配列を包含させるのが好ましい。ポリ(A)+配列は、種々の植物遺伝子またはT−DNA由来のものを用いることができるが、これらに限定されるものではない。また、所望の遺伝子を高レベルにて発現させるのに有用な他の配列、例えば特定の遺伝子のイントロン配列、5′不翻訳領域の配列などを組換え発現ベクターに包含させることができる。
【0035】
組換え発現ベクターには、選択マーカー遺伝子として種々の抗生物質耐性遺伝子や他のマーカー遺伝子をコードする配列を包含させるのが好ましい。マーカー遺伝子の例には、抗スペクチノマイシン遺伝子、ストレプトマイシン耐性遺伝子(ストレプトマイシンホスホトランスフェラーゼ(SPT)遺伝子)、カナマイシンまたはジェネティシン耐性のネオマイシンホスホトランスフェラーゼ(NPTII)遺伝子、ハイグロマイシン耐性のハイグロマイシンホスホトランスフェラーゼ(HPT)遺伝子、アセト乳酸合成酵素(ALS)を阻害する除草剤に対する耐性遺伝子、グルタミン合成酵素を阻害する除草剤に対する耐性遺伝子(例えばbar 遺伝子)、β−グルクロニダーゼ遺伝子、ルシフェラーゼ遺伝子等が包含される。
【0036】
また、高等植物の遺伝子発現に有用な代表的なベクターは当該技術分野においてよく知られており、 Rogers et al., Methods Enzymol., 153: pp.253-277 (1987)に記載されるAgrobacterium tumefaciensのTiプラスミド由来のベクターなどのベクターDNAの一部を植物細胞に導入した際に宿主植物のゲノムに組込みうるベクター、例えばTiプラスミド由来のpKYLX6、pKYLX7、pBI101、pBH2113、pBI121(Clontech Laboratories, Inc., Palo Alto, CA)およびこれらから当該技術分野における標準的技術を用いて誘導し得る組換えプラスミドが含まれる。
【0037】
組換え発現ベクターは、外来性遺伝子を植物細胞に導入するための公知の方法、例えばパーティクルガン法、エレクトロポレーション法、ポリエチレングリコール(PEG)法、リン酸カルシウム法、DEAEデキストラン法、マイクロインジェクション、リポフェクション法およびアグロバクテリウム法などの微生物媒介トランスフェクション法を用いて所望の植物細胞に導入することができる。植物細胞においては、パーティクルガン法、エレクトロポレーション法、ポリエチレングリコール(PEG)法およびアグロバクテリウム法が好ましく、アグロバクテリウム法が特に好ましい(Bechtold N. & Pelletier G., Methods Mol. Biol. 82, pp.259-266, 1998)。
【0038】
上述のように植物に導入された本発明の遺伝子は、宿主の植物細胞のゲノムに組み込まれ、後の世代まで安定的に保持される。故に、本発明は、上記植物細胞から再生される植物体とその部分並びにその繁殖体(例えば種子や無性生殖体)および子孫を包含する。
【0039】
また、別の形質転換方法として、細胞融合が挙げられる。この場合には、ヘビノネゴザ細胞と融合させたい植物細胞の細胞壁を酵素により分解し、プロトプラスト化する。次に、細胞融合促進剤としてポリエチレングリコールを加えて、二つのプロトプラストを効率よく融合させることにより、二つの細胞核も融合して一つになる。これにより、ヘビノネゴザ及び融合させたい植物細胞の遺伝子を併せ持つ核が生じて、この融合細胞を培養、生育することにより、所望の植物体が得られる。
【0040】
尚、遺伝子組み換えや細胞融合を用いずとも、ヘビノネゴザを他の近親の植物と交配させ、最終的に所望の植物と交配させるようにすることで、遺伝子組み換えを用いることなく、ヘビノネゴザ由来の鉄輸送担体として機能するタンパク質をコードする遺伝子を含有する植物体を得るようにしても良い。
【0041】
上述の方法により形質転換された植物は、カドミウム、ニッケル、マンガン、亜鉛、銅などの金属に阻害されることなく、生育に十分な量の鉄を吸収することができる。したがって、カドミウム、ニッケル、マンガン、亜鉛、銅などの金属存在下存在下でもこれらの影響を受けずに生育に十分な量の鉄を吸収して良好な生育状態を保つ植物体を得ることが可能となる。しかも、人体にとって非常に有害な元素であるカドミウム蓄積量が減少するので、カドミウム汚染された土地を浄化することなく、農地等として採用してもカドミウムの蓄積量が少ない作物の作出して食用に供することが可能となる。さらに、植物体の特定の部分のみのカドミウム蓄積量を減少させることも可能であり、例えば、可食部のカドミウム蓄積量を減少させるといったことも可能である。
【0042】
また、上記植物体を環境汚染土壌で生育することで、汚染された土壌の飛散を防いで環境汚染物質の拡散を防ぐことも可能である。さらに、環境汚染土壌を緑で覆うことにより、景観を良好なものに保って、人々に安心感を与えることもできる。
【0043】
次に、環境汚染物質蓄積能を有し、且つ本発明の遺伝子を含有する植物体について説明する。
【0044】
環境汚染物質蓄積能を有する植物は、例えば、本願発明者が先に出願した特願2004−260091のファイトリメディエーション用植物種の選抜方法や、Yoshihara, T., Shoji K., Goto F., Screening for the Cd hyperaccumulator/ Ultra-low-accumulator from major herbal angiosperms in Japan. In: Plant nutrition for food security, human health and environmental protection (Eds. Li, CJ et al., Proc. 2005 IPNC, Beijing, China) pp.750-751.に記載の方法、電中研報告書U03521(吉原利一、後藤文之、庄子和博、カドミウムやホウ素に耐性・蓄積能をもつ草本性被子植物の探索)に記載の方法により選抜することができる。
【0045】
具体的には、種々の植物の種子を、植物の生育に必要な栄養塩、環境汚染物質の吸収・蓄積に影響を及ぼすと考えられる微量金属元素およびほとんどの植物において成長を阻害される濃度の前記環境汚染物質を含む培地または土壌、並びに植物の生育に必要な栄養塩、環境汚染物質の吸収・蓄積に影響を及ぼすと考えられる微量金属元素を含む培地または土壌にそれぞれ播種し、発芽生育後、植物の地上部および根部について環境汚染物質の蓄積量を測定し、環境汚染物質を含む場合と含まない場合における環境汚染物質の植物の地上部および根部における蓄積量の比から環境汚染物質の蓄積能を評価して選抜する。
【0046】
環境汚染物質がカドミウムの場合について例を挙げると、上記選抜方法により、地上部に高いカドミウム蓄積能力を有する種はアキノノゲシなどのキク科植物であり、根部に高いカドミウム蓄積能力を有する種はイグサであることが確認されているが、これらの植物はカドミウム耐性が低いことも確認されている。したがって、これら植物を本発明の遺伝子を含有するよう上述の方法で形質転換することにより、多量のカドミウムを吸収しつつ、しかも、生育に必須な鉄をも十分に吸収して生育状態を良好に保つ非常に優れたハイパーアキュームレーターを得ることが可能となる。
【0047】
また、本願発明者が先に出願した特開2004−016130に開示の技術を用いてもよい。具体的には、環境汚染物質に対して結合能を有するオリゴまたはポリペプチドおよびアポプラズマ輸送シグナルを含むポリペプチドをコードする核酸分子を構築し、これを用いてトランスジェニック植物を作製することにより、高い環境汚染物質蓄積能を有する植物体を得ることができる。環境汚染物質に対して結合能を有するオリゴまたはポリペプチドとしては、メタロチオイネン、フェリチン、トランスフェリン、ポリヒスチジン、ニッケリン、ファイトキレーチン、Zα4人工ペプチド、ほ乳類プラズマ金属輸送タンパク質およびこれらの金属結合性フラグメントが挙げられる。
【0048】
したがって、上記植物体を本発明の遺伝子を含有するようにさらに形質転換することにより、或いは本発明の遺伝子を含有するように形質転換された植物体を環境汚染物質に対して結合能を有するオリゴまたはポリペプチドおよびアポプラズマ輸送シグナルを含むポリペプチドをコードする核酸分子によりさらに形質転換することにより、環境汚染物質を多量に吸収しつつ、しかも、生育に必須な鉄をも十分に吸収して生育状態を良好に保つ非常に優れたハイパーアキュームレーターを得ることが可能となる。
【0049】
尚、上述の形態は本発明の好適な形態の一例ではあるがこれに限定されるものではなく本発明の要旨を逸脱しない範囲において種々変形実施可能である。例えば、環境汚染物質蓄積能を有する植物は、上記以外の方法により得るようにしても良い。
【実施例】
【0050】
以下の実施例により本発明をさらに具体的に説明するが、本発明はこれら実施例に限定されるものではない。
【0051】
<1:カルス及び再分化植物体培養>
ヘビノネゴザ(Athyrium yokoscense)は、栃木県足尾町の足尾銅山跡において採集したものを供試植物とした。また、対照植物として、カドミウムに対する耐性・蓄積能に関して一般的な性質を持つと考えられているタバコ(Nicotiana tabacum L. BY-2)を用いた。
【0052】
供試植物であるヘビノネゴザは、カルスを誘導した後、2001年9月以来液体振とう培養により継代を続けているもの、あるいは誘導したカルスから再び植物体に再分化させたものを用いた(Yoshihara, T. et al. (2005a) Plant Cell Rep 23 p579-585 )。対照植物であるタバコは、植物体を滅菌後、5mm角程度の葉片をMS固形培地に定置して約1ヶ月間培養することによってカルスを誘導した後、ゲランガムを除いたMS液体培地(増殖用MS培地)を用いて振とう培養(100rpm)により増殖させたものを用いた。尚、培養環境条件は全て周期光照射(約4000lux、12時間明期/12時間暗期)、温度は25±1℃とした。また、培地は約10日〜2週間に1回の頻度で交換した。尚、MS固形培地には、カイネチン0.1ppm、2,4−D 1ppm、3%シュークロースと0.2%ゲランガムを添加し、pH6.0としたものを用いた(Murashige T, Skoog F (1962) Physiol Plant 15 p473-497)。
【0053】
<2:カドミウム曝露下におけるカルス生育>
上述の培養方法により得られたヘビノネゴザカルスとタバコカルスを、0μM、100μMの2種類のCdSO4添加増殖用MS培地によりそれぞれ6週間培養し、その増殖量を調査した結果を図1に示す。培養開始時のカルス量は、ヘビノネゴザカルスについては生鮮重量として3g均一、タバコカルスについては極端に軟弱で水分含有量が多いため容積として20ml均一とした。増殖量の算定は、ヘビノネゴザカルスは生鮮重量として秤量、タバコカルスは15000gの遠心操作により容積として、あるいは吸引濾過後により生鮮重量として秤量するとともに、得られたカルスについて65℃、3日間の乾燥後、乾燥重量として再度秤量した。培養環境条件は上述したものと同様とした。
【0054】
図1において、◇はヘビノネゴザカルス、■はタバコカルスの相対的生育量を示す。ここで、相対的生育量とはカドミウムを添加しない増殖用MS培地で生育した量を1として換算した場合の生育量を意味する。尚、本実施例におけるデータは、それぞれ平均値と標準偏差を求め、各実験区間の差異についてStudentのt検定法、Tukeyの多重比較検定法のいずれかの方法により有意性を判定した。これらの計算には統計形算用ソフトウェア(KyplotR ver.3.0, (株)カイエンス)を用いた。対照に用いたタバコカルスはカドミウム曝露により増殖が著しく抑制され、6週間後には相対的生育量が0.2、つまり、カドミウム曝露を行わない場合に比べて20%程度しか増殖しなかった。一方、ヘビノネゴザカルスは、6週間後においても、カドミウム曝露を行わない場合と変わらない生育量を示した。したがって、誘導、増殖させたヘビノネゴザカルスは、その生育において、カドミウムの影響を全く受けていないことが確認された。
【0055】
<3:ファイトキレーチン合成酵素(PCS)遺伝子の発現に及ぼすカドミウムの影響>
100μMのCdSO4を添加した培地において0日、1日、3日、5日、7日および12日生育させたヘビノネゴザカルスおよびタバコカルス、あるいは0μM、100μM、300μM、500μM、1000μMおよび3000μMのCdSO4をそれぞれ添加した培地において1週間生育させたヘビノネゴザカルスおよびタバコカルスからtotalRNAを抽出し、RT−PCR法によってファイトキレーチン合成酵素(PCS)遺伝子の発現に及ぼすカドミウムの影響を調べた。尚、ファイトキレーチンは、カドミウムをキレート化可能な低分子の非タンパク質性ポリペプチドであり、カドミウム耐性に関与するポリペプチドである。ヘビノネゴザカルスのtotalRNA抽出は、CTABとPVPを用いたJaakolaらの多糖質の材料からの高品質totalRNA抽出法より行った(Jaakola L. et al. (2001) Mol Biotechnol. 19 p201-3)。タバコカルスのtotalRNA抽出は、市販のTrizol試薬(Invitrogen、USA)により行った。これらのtotalRNAとOligo−dTプライマーを用いて、市販のキット(Rever-tra Ace kit、TOYOBO)により逆転写反応を行い、それぞれのcDNAを得て、これらcDNAとGenBankに登録されている既知の配列であるAY235426、AB057412から設計したそれぞれのPCS遺伝子に特異的なプライマーセットを用いてPCRを行い、発現量の解析に用いた。発現量の解析には、画像解析装置(Image Reader LAS-2000、FUJIFILM)を用いた。尚、別途同様にそれぞれのアクチン(ACT)遺伝子の発現量を解析しておき、PCS遺伝子の発現量を標準化した。以下にそれぞれのPCS遺伝子、ACT遺伝子の発現量を解析するための特異プライマーセットの配列を列挙する。
AyPCs1F 5'-GCAAGGTTGCTGCCAAGGTG-3'(配列番号9)
AyPCs1R 5'-CTAGGTTTCCTCACTGCATGACC-3'(配列番号10)
NtPCs1F 5'-GCTTTTCGCCCTAATCATAGTA-3'(配列番号11)
NtPCs1R 5'-TGACCCAACTCTCATGTTTA-3'(配列番号12)
AyAc1F 5'-CGACATACAGGTGTGATGGGT-3'(配列番号13)
AyAc1R 5'-GCTTGAATAGCGACATACAT-3'(配列番号14)
NtAc1F 5'-TCAGAAAGATGCCTATGTGGGA-3'(配列番号15)
NtAc1R 5'-TGGCAACGTACATAGCTGGG-3'(配列番号16)
【0056】
図2にヘビノネゴザカルス及びタバコカルスにおけるPCS遺伝子の発現に及ぼすカドミウム(100μM)の影響を示す。図2において、(B)は画像解析装置によりえられた発現量データであり、(A)は(B)の画像に基づいて数値化したデータである。□はタバコカルス、◆はヘビノネゴザカルスのACT遺伝子発現量を1としたときのPCS発現量(相対的PCS発現量)を表す。100μMのカドミウム曝露条件下においてヘビノネゴザカルスではほとんどPCS遺伝子の発現量に変化が認められなかったのに対して、タバコカルスでは曝露開始後1日目にPCS遺伝子の発現量が2倍以上に増加した後、漸減して12日目にはほぼ元の発現量に戻るという変化を示した。
【0057】
図3に0μM、100μM、300μM、500μM、1000μMおよび3000μMのカドミウム曝露条件下で1週間培養したヘビノネゴザカルスのPCS遺伝子の発現量を示す。0μM、100μM、300μM、500μM、1000μMおよび3000μMのカドミウム曝露条件下で1週間培養した場合にも、ヘビノネゴザではPCS遺伝子の発現量にはほとんど変化が認められなかった。したがってヘビノネゴザではPCSがカドミウムの耐性に関与している可能性は低く、カドミウム耐性をPCS以外の別の機構により得ていることが考えられた。
【0058】
<4:カドミウム曝露下におけるカルス中必須金属元素の含有量>
上述の方法により培養したヘビノネゴザカルスとタバコカルスを、0μM(MS)、10μM(Cd10)、100μM(Cd100)のCdSO4添加増殖用MS培地、Fe無添加(ΔFe)増殖用MS培地にてそれぞれ1週間生育させたヘビノネゴザカルス及びタバコカルスの必須金属元素(カルシウム、銅、鉄、マグネシウム、マンガン、亜鉛)の含有量を、ICP(P4000、Hitachi、Japan)を用いて分析した結果を図4に示す。尚、培養環境条件は上述した条件と同様とした。また、ICP測定用試料液は、上述した条件下で育成したカルスをそれぞれ65℃/3昼夜以上乾燥して、乾燥重量を測定後に湿式灰化を行い(吉原ら、U97042)、灰化試料を蒸発乾固後して得られた残査に15mLの1N塩酸を加えて溶解して作製した。
【0059】
図4において、縦軸の相対濃度とは、各々カドミウムを含まない培地(MS)で増殖したカルスにおける値を1として計算した値である。また、(a)はカルシウム、(b)は銅、(c)は鉄、(d)はマグネシウム、(e)はマンガン、(f)は亜鉛の結果を示している。ヘビノネゴザカルスでは、カドミウム曝露によって(a)カルシウム、(d)マグネシウム、(e)マンガン含有量が有意に低下したのに対し、タバコカルスでは、(c)鉄含有量だけが有意な低下を示し、カドミウム曝露によって影響を受ける元素が異なることが明らかとなった。すなわち、ヘビノネゴザカルスでは(a)カルシウムが約20〜25%、(d)マグネシウムが約15〜25%、(e)マンガンが約30〜35%低下したのに対して、タバコカルスでは(c)鉄だけが約50〜60%低下した。一般的な植物ではカドミウムにより鉄の吸収が阻害されて鉄欠乏に陥る(カドミウム誘導性鉄欠乏)ことが報告されており(Marschner H (1995) Mineral Nutrition of Higher Plants, 2nd edn, Academic press, London, UK)、タバコカルスの鉄含有量の低下はこれを顕著に物語っている。しかし、ヘビノネゴザカルスではカドミウム曝露によって鉄ではなく、カルシウム、マグネシウムおよびマンガンの含有量が低下した。これは、ヘビノネゴザカルスにおいては、カドミウムによりマグネシウム、カルシウムおよびマンガンの吸収が阻害されることを示唆している。ただし、カドミウムの有無にかかわらずヘビノネゴザカルスは旺盛に生育したことから、これらの元素の欠乏症に陥るほど吸収は阻害されない。したがって、ヘビノネゴザカルスにおける鉄輸送担体は、他の植物の鉄輸送担体に比べて鉄に対する特異性が非常に高く、カドミウム存在下においても、カドミウムに阻害されることなく、生育に十分な量の鉄を吸収できることが判明した。
【0060】
<5:ヘビノネゴザ鉄吸収関連遺伝子の単離と発現に及ぼすカドミウムの影響>
ヘビノネゴザカルスからtotalRNAを抽出してcDNA化し、cDNAライブラリーを作製した。ヘビノネゴザtotalRNAは、鉄分を除いた培地において3週間生育させたヘビノネゴザカルスより、先に示したJaakolaらのtotalRNA抽出法に従って抽出し、逆転写反応を行って各遺伝子ホモログの部分シークエンス単離用のcDNAを得た。また、各遺伝子ホモログの完全長シークエンスを単離するために、別途同様にして得られたヘビノネゴザtotalRNAからcDNAライブラリーを作製した。尚、cDNAライブラリーの作製には、得られたtotalRNAよりMACS Column Typeμ(第一化学薬品)を用いてmRNAを精製した後、Creator SMART cDNAライブラリー作製キット(BD Bioscience Clontech)を使用した。
【0061】
次に、アラビドプシスなどにおいて既に配列の知られている鉄とカドミウム双方の輸送に関連しているとの報告があるGenBankに登録されている元素輸送担体遺伝子の既知の配列(IRT;NM_118089、AF065444、AF246266、AB126086、AB126087、AB070226、AJ320253: Nramp;L41217、NM_106731、NM_103618、NM_101464、AY196091: YSL;AY515566、AY515565、AY515560、AY512583、AP003936、CA758396)に、それぞれ特異的な共通配列を探索し、ディジェネレートプライマーを設計・作製した。以下にそのディジェネレートプライマーを列挙して示す。
degAyIRTF 5'-CCKTGGYMTAARTTYCCTTTYBCBGG-3'(配列番号17)
degAyIRTR 5'-GARTGWRMYAHRATBCCAASYTCCARNACC-3'(配列番号18)
degAyNrampF 5'-ATGCCBCAYAAYVTSTWYYTVCAYTCRGC-3’(配列番号19)
degAyNrampR 5'-ATVGTVSWRCTCTGHCCMGMWGC-3’(配列番号20)
degAyYSLF 5'-MMRCCNTTYACWMRNCARGAGAAYAC-3'(配列番号21)
degAyYSLR 5'-CWGTDGCNRWWCCACTNGGRTA-3'(配列番号22)
【0062】
これらのプライマーと先に示した部分シークエンス単離用のcDNAを用いてPCRを行い、得られた断片をTAクローニングキット(Invitrogen)によりpCR−TOPOベクターにクローニングした。得られた断片は、部分シークエンスとしてDNAシーケンサー(ABIモデル3100)によって配列を解析した後、既知の遺伝子と比較してシークエンスに類似性が認められたものをヘビノネゴザにおける各遺伝子ホモログの部分シークエンスとしてcDNAライブラリーからの完全長シークエンス単離のためのプローブ作製に用いた。完全長シークエンス単離のためのプローブは、先に示した部分シークエンスから設計し直したプライマーを用いてPCR−DIGラベル法により作製した(DIG DNA Labeling and Detection Kit、Roche)。プローブ用、RT−PCRとリアルタイムPCRによる発現解析用プライマーの位置(配列)は、各完全長配列中に示した。図5〜図8において、1Fと1RはリアルタイムPCR用プライマー、2Fと2Rはプローブ作成およびRT−PCR用プライマーである。また、図5〜図6において、四角で囲んだ部分は開始コドン及び終始コドンであり、陰付きの四角で囲んだ部分は鉄の輸送に関連すると考えられている共通配列を示している。cDNAライブラリーからの完全長cDNAの単離はこのプローブを用いて定法にしたがって行った(真壁和裕(1997) バイオ実験イラストレイテッド 第4巻 苦労なしのクローニング、秀潤社)。得られたクローンはDNAシーケンサー(ABIモデル3100)によって配列の解析を行い、先に示した既知のホモログとの比較を行った。
【0063】
ヘビノネゴザから単離した3種類の元素輸送担体遺伝子ホモログについてRT−PCR法、あるいはリアルタイムPCR法を用いてカドミウム曝露条件下における発現解析を行った。具体的には、100μMあるいは400μMの2種類のCdSO4を添加した培地において3週間生育させたヘビノネゴザカルス、および成植物体からtotalRNAをカルス、根、地上部の部分毎に上述のJaakolaらのtotalRNA抽出法に従って抽出し、逆転写反応によって得たcDNAをテンプレートに用いた。また、別途鉄欠乏培地において3週間生育させたヘビノネゴザカルス、および成植物体より得たtotalRNAを用いて同様の操作を行い、カドミウム曝露条件下におけるこれらの遺伝子の発現と比較した。
【0064】
単離したホモログのうち、AyNramp1(配列番号1:全長1903bp、ORF1530bp、510AA)、AyIRT1(配列番号3:全長1878bp、ORF1152bp、384AA)の2種類については完全長遺伝子であった。AyYSL1(配列番号5:全長301bp)、AyYSL2(配列番号7:全長295bp)についてはいずれもORFの部分遺伝子と考えられた。これらのうち、特に完全長を単離できたAyIRT1、およびAyNramp1について、それぞれアラビドプシスにおいて配列が明かとなっているホモログAtIRT1、およびAtNramp3とアミノ酸配列の相同性を比較した。その結果を図9〜図11に示す。図9において、(a)はヘビノネゴザAyIRT1のタンパク質膜構造、(b)はアラビドプシスAtIRT1タンパク質膜構造を示す。図10において、(a)はヘビノネゴザAyNramp1のタンパク質膜構造、(b)はアラビドプシスAtNramp1タンパク質膜構造を示す。また、図11において、(A)は植物由来のNrampとの比較、(B)は動物由来のNrampとの比較を示す。尚、図11において、GmDMTはダイズ、LeNrampはトマト、OsNrampはイネ、HsDMTはヒト、MmNrampはマウス、OmNrampはニジマス、TrDMTはトラフグである。AtIRT1のアミノ酸配列とAyIRT1のアミノ酸配列の相同性は44.0%、AtNramp1のアミノ酸配列とAyNramp1のアミノ酸配列の相同性は67.3%であり、相同性はそれほど高くはなかったが、アラビドプシスにおけるD100、E103及びC109を除いて、いずれにおいてもアラビドプシス(Rogers EE et al. (2000) PNAS 97 p12356-12360)やマウス(Lam-Yuk-Tseung et al. (2003) BLOOD 101 p3699-3707)において示されている鉄吸収に強く関連したアミノ酸配列が全て保存されていた。また、図11に示すように、AyNramp1については、そのアミノ酸配列が植物におけるものよりも動物におけるものに類似しており、図11中の矢印で示されるように、これまで配列が明らかにされている植物のNrampにおいては全てイソロイシンであるアミノ酸が、ヘビノネゴザでは動物と同じメチオニンに変わっていた。
【0065】
次に、タンパク質膜構造については、図9に示すアラビドプシスAtIRT1タンパク質膜構造においては、8ヶ所の膜貫通領域があるのに対し、ヘビノネゴザAyIRT1タンパク質膜構造における膜貫通領域は2ヶ所少ない6ヶ所であった。図10に示すアラビドプシスAtNramp1タンパク質膜構造においては、11ヶ所の膜貫通領域があるのに対し、ヘビノネゴザAyNramp1タンパク質膜構造における膜貫通領域は2ヶ所少ない9ヶ所であった。尚、図9及び図10において、1は膜外領域、2は膜貫通領域、3は膜内領域を示している。また、上記の「保存されている鉄吸収に強く関連したアミノ酸配列」に着目すると、例えば、AyIRTのH236、S237、H263、E267とAtIRTのH197、S198、H224、E228において示されるように膜の内外における存在を反対にしているものも多かった。
【0066】
次に、ヘビノネゴザカルスおよび成植物体を鉄欠乏処理、カドミウム曝露し、単離したこれらの4つの遺伝子について発現変化を調べた。結果を図12〜図14に示す。図12に示すように、ヘビノネゴザカルスにおいては、いずれの遺伝子においても強い鉄欠乏処理によって(2週間の鉄欠乏処理)有意な発現の増加が認められた。即ち、鉄欠乏応答性があることが確認された。尚、図12において、(a)は通常の増殖用MS培地で増殖させた場合、(b)は増殖用MS培地から鉄を除いて1週間増殖させた場合、(c)は増殖用MS培地から鉄を除いて2週間増殖させた場合である。次に、図13に示すように、カドミウムを曝露した場合にもAyYSL1、AyYSL2については発現の増加が認められたが、AyIRT1、AyNramp1については有意な発現の増加は認められなかった。尚、図13において、(a)は通常の増殖用MS培地で増殖させた場合、(b)はカドミウムを100μM添加した培地で1週間増殖させた場合、(c)はカドミウムを400μM添加した培地で1週間増殖させた場合である。また、図14に示すように、成植物体を用いた実験では、全ての遺伝子において根、植物体地上部ともに1週間の鉄欠乏処理(ΔFe)、あるいはカドミウム曝露(+Cd)によって有意な発現の変化は認められなかった。尚、図14において、(a)AyIRT1、(b)はAyYSL1、(c)はAyYSL2、(d)はAyNramp1である。
【0067】
<6:ヘビノネゴザ鉄吸収関連遺伝子を過剰発現した形質転換酵母におけるカドミウム耐性の向上>
ヘビノネゴザから全長を単離することができた2つの遺伝子(AyIRT1、AyNramp1)のORF部分をPCRによって増幅し、配列を確認後、酵母発現ベクター(pYES2.1vector/Invtrogen)を介して酵母(BY4741株)に導入した。酵母の形質転換は、Dohlmanの示す方法に従った(Dohlman HG (2002) "Lazy Bones" Plasmid Transformation, A quick method for plasmid transformation into yeast. http://www.med.unc.edu/~hdohlman/lazybones.html)。具体的には、酵母をSD寒天培地(BD bioscience・Clonetech)にて培養して単菌株を単離し、キャリアーDNAと単離した遺伝子を含むプラスミドDNA、および形質転換溶液(40% ポリエチレングリコール、0.1M 酢酸リチウム、10mM トリス塩酸(pH7.5)、1mM EDTA)を混合して一晩静置した後、42℃でヒートショックを行い形質転換した。さらにこの混合液を、ウラシルを除いたSD寒天培地において培養し、得られた菌株についてコロニーPCR法によって導入遺伝子の確認を行った。尚、プライマーはRT−PCR法で用いたものと同じ配列のものを用いた。
【0068】
上記により得られた菌株(AyIRT1、AyNramp1)と非形質転換株(WT)のカドミウム耐性を調査した。カドミウム耐性の検定には、ウラシルを除いたSD寒天培地を基本培地として、これに0μM、30μMのCdSO4を添加した培地を用い、1/1、1/10、1/100及び1/1000に希釈した株(希釈率は600nmの吸光度により確認)を滴下して、30℃において2〜5日間の培養の後、コロニーの形成状態を非形質転換系統と比較した。また、蓄積能については、30μMのCdSO4を添加した同組成の液体培地(100ml培地を500mlコルベンに分注、振とう強度140rpm、30℃において5日間培養)においてこれらの形質転換酵母系統を増殖させ、集菌後500μM CaCl2バッファーに顕濁・洗浄後、遠心操作により再集菌して、ICP(P4000、 Hitachi、 Japan)による金属濃度の分析のためのサンプルとした。
【0069】
上記により得られた形質転換株(AyIRT1、AyNramp1)と非形質転換株(WT)とをそれぞれ数株ずつカドミウムを含む培地に接種し、その生育を調べた結果を図15に示す。(a)はカドミウム無添加培地で2日間生育させた結果、(b)はカドミウムを30μM添加した培地で5日間生育させた結果である。いずれの形質転換株においても形質転換しない酵母株に比べて明らかに生育が良好であった。また、これらの株におけるカドミウム、および鉄含有量を調べた結果を図16に示す(a)は鉄濃度(含有量)、(b)はカドミウム濃度(含有量)、(c)は鉄に対するカドミウム量をモル比で表した図である。尚、図15及び図16において、WT5はpYES酵母形質転換用ベクターのみ導入したコントロール系統、AyIRT1−5はAyIRT1を用いて形質転換した系統、AyNramp1−5はAyNramp1を用いて形質転換した系統を表している。カドミウム含有量はAyIRT1−5形質転換株では約90μg/g−FW、AyNramp1−5形質転換株では約20μg/g−FWであるのに対し、非形質転換株であるWT5では約200μg/g−FWであった。鉄含有量はWT5で8μg/g−FW、AyIRT1−5形質転換株で7μg/g−FW、AyNramp1−5形質転換株で10μg/g−FWであり、形質転換株と非形質転換株とで鉄の吸収量にそれほど大きな差異は認められなかった。これは、本実施例で用いた培地中に鉄が十分に存在したため、鉄の供給量が十分であったことによるものであると考えられる。また、Cd/Fe値に関しては、形質転換株の方が小さかった。すなわち、いずれの形質転換株においても1分子の鉄を得るために混入するカドミウム分子の数が非形質転換株よりも少ないことが明らかとなった。この傾向はAyNramp1−5形質転換株において特に顕著であった。以上より、AyNramp1、AyIRT1により形質転換することで、カドミウム存在下においても生育に必須な鉄と特異的に親和するようになって、良好に生育する。即ち、植物体のカドミウム耐性を強化することが可能である。さらには、カドミウムの蓄積量も低減される。
【図面の簡単な説明】
【0070】
【図1】カドミウム(100μM)曝露条件下におけるヘビノネゴザカルスとタバコカルスの生育を示す図である。◇はヘビノネゴザカルスの相対的生育量、■はタバコの相対的生育量を示す。
【図2】ヘビノネゴザカルスとタバコカルスにおけるPCS遺伝子の発現に及ぼすカドミウム(100μM)の影響を示す図である。
【図3】種々のカドミウム曝露条件下において生育したヘビノネゴザカルスにおけるPCS遺伝子の発現を示す。
【図4】ヘビノネゴザカルスとタバコカルスにおけるカドミウム曝露による金属元素の含有量変化を示す図である。(a)はカルシウム、(b)は銅、(c)は鉄、(d)はマグネシウム、(e)はマンガン、(f)は亜鉛についての結果である。
【図5】ヘビノネゴザ鉄輸送担体遺伝子(AyNramp1:配列番号1)の配列である。
【図6】ヘビノネゴザ鉄輸送担体遺伝子(AyIRT1:配列番号3)の配列である。
【図7】ヘビノネゴザ鉄輸送担体遺伝子(AyYSL1:配列番号5)の配列である。
【図8】ヘビノネゴザ鉄輸送担体遺伝子(AyYSL2:配列番号7)の配列である。
【図9】IRTタンパク質膜構造比較を示す図である。
【図10】Nrampタンパク質膜構造比較を示す図である。
【図11】種々の生物のNrampにおけるアミノ酸配列の比較を示す図である。
【図12】ヘビノネゴザカルスにおける鉄欠乏条件下での鉄輸送担体遺伝子の発現を示す図である。
【図13】ヘビノネゴザカルスにおけるカドミウム曝露下での鉄輸送担体遺伝子の発現を示す図である。
【図14】ヘビノネゴザ成植物体におけるカドミウム曝露下での鉄輸送担体遺伝子の発現を示す図である。
【図15】AyIRT1及びAyNramp1により形質転換した酵母におけるカドミウム耐性を示す図である。
【図16】AyIRT1及びAyNramp1により形質転換した酵母における(a)鉄濃度、(b)カドミウム濃度、(c)Cd/Fe(mol比)を示す図である。
【特許請求の範囲】
【請求項1】
以下の(a)又は(b)に示すタンパク質をコードする遺伝子。
(a)配列番号2、4、6又は8のアミノ酸配列からなるタンパク質
(b)配列番号2、4、6又は8のアミノ酸配列において、1個若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなり、且つ鉄と特異的に親和する輸送担体として機能するタンパク質
【請求項2】
以下の(a)又は(b)に示すタンパク質。
(a)配列番号2、4、6又は8のアミノ酸配列からなるタンパク質
(b)配列番号2、4、6又は8のアミノ酸配列において、1個若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなり、且つ鉄と特異的に親和する輸送担体として機能するタンパク質
【請求項3】
以下の(c)又は(d)のDNAからなる遺伝子。
(c)配列番号1、3、5又は7の塩基配列からなるDNA
(d)配列番号1、3、5又は7の塩基配列からなるDNA若しくはこれと相補的なDNAとストリンジェントな条件下でハイブリダイズし、且つ鉄と特異的に親和する輸送担体として機能するタンパク質をコードするDNA
【請求項4】
請求項1又は3に記載の遺伝子を含有する形質転換された植物細胞。
【請求項5】
請求項4に記載の植物細胞から得られる植物体とその部分並びにその繁殖体及び子孫。
【請求項6】
環境汚染物質蓄積能をさらに有することを特徴とする請求項4に記載の植物細胞。
【請求項7】
請求項6に記載の植物細胞から得られる植物体とその部分並びにその繁殖体及び子孫。
【請求項8】
請求項1又は3に記載の遺伝子を組み込んだベクターで形質転換してなる宿主細胞を培養し、培養物中に蓄積されるタンパク質を採取することを特徴とする請求項2に記載のタンパク質の生産方法。
【請求項9】
請求項7に記載の植物体を用いて、土壌から環境汚染物質を除去することを特徴とする環境修復方法。
【請求項1】
以下の(a)又は(b)に示すタンパク質をコードする遺伝子。
(a)配列番号2、4、6又は8のアミノ酸配列からなるタンパク質
(b)配列番号2、4、6又は8のアミノ酸配列において、1個若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなり、且つ鉄と特異的に親和する輸送担体として機能するタンパク質
【請求項2】
以下の(a)又は(b)に示すタンパク質。
(a)配列番号2、4、6又は8のアミノ酸配列からなるタンパク質
(b)配列番号2、4、6又は8のアミノ酸配列において、1個若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなり、且つ鉄と特異的に親和する輸送担体として機能するタンパク質
【請求項3】
以下の(c)又は(d)のDNAからなる遺伝子。
(c)配列番号1、3、5又は7の塩基配列からなるDNA
(d)配列番号1、3、5又は7の塩基配列からなるDNA若しくはこれと相補的なDNAとストリンジェントな条件下でハイブリダイズし、且つ鉄と特異的に親和する輸送担体として機能するタンパク質をコードするDNA
【請求項4】
請求項1又は3に記載の遺伝子を含有する形質転換された植物細胞。
【請求項5】
請求項4に記載の植物細胞から得られる植物体とその部分並びにその繁殖体及び子孫。
【請求項6】
環境汚染物質蓄積能をさらに有することを特徴とする請求項4に記載の植物細胞。
【請求項7】
請求項6に記載の植物細胞から得られる植物体とその部分並びにその繁殖体及び子孫。
【請求項8】
請求項1又は3に記載の遺伝子を組み込んだベクターで形質転換してなる宿主細胞を培養し、培養物中に蓄積されるタンパク質を採取することを特徴とする請求項2に記載のタンパク質の生産方法。
【請求項9】
請求項7に記載の植物体を用いて、土壌から環境汚染物質を除去することを特徴とする環境修復方法。
【図1】


【図4】


【図5】


【図6】


【図7】


【図8】


【図11】


【図14】


【図16】


【図2】


【図3】


【図9】


【図10】


【図12】


【図13】


【図15】




【図4】


【図5】


【図6】


【図7】


【図8】


【図11】


【図14】


【図16】


【図2】


【図3】


【図9】


【図10】


【図12】


【図13】


【図15】


【公開番号】特開2007−215402(P2007−215402A)
【公開日】平成19年8月30日(2007.8.30)
【国際特許分類】
【出願番号】特願2005−330821(P2005−330821)
【出願日】平成17年11月15日(2005.11.15)
【出願人】(000173809)財団法人電力中央研究所 (1,040)
【Fターム(参考)】
【公開日】平成19年8月30日(2007.8.30)
【国際特許分類】
【出願日】平成17年11月15日(2005.11.15)
【出願人】(000173809)財団法人電力中央研究所 (1,040)
【Fターム(参考)】
[ Back to top ]

