植物培養における高マンノースタンパク質の製造
【課題】
リソソーム蓄積疾患の処置のための組成物を提供する。
【解決手段】
有効成分としての、高マンノース組み換えタンパク質を発現する植物細胞、及び医薬的に許容され得るキャリアを含む医薬組成物。
リソソーム蓄積疾患の処置のための組成物を提供する。
【解決手段】
有効成分としての、高マンノース組み換えタンパク質を発現する植物細胞、及び医薬的に許容され得るキャリアを含む医薬組成物。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、高マンノースタンパク質を製造するための形質転換された宿主細胞、ならびに、特に植物培養において高マンノースタンパク質を製造するための方法およびシステムに関する。
【背景技術】
【0002】
ゴーシェ病は最も一般的なリソソームでの蓄積障害である。ゴーシェ病は、グリコスフィンゴ脂質であるグルコセレブロシド(グリコシルセラミド、GlcCer)のグルコースおよびセラミドへの加水分解を触媒する膜結合型リソソーム酵素であるグルコセレブロシダーゼ(これはまたグルコシルセラミダーゼとして知られている)の欠損をもたらす劣性の遺伝的障害(第1染色q21−q31)によって引き起こされる。ゴーシェ病は、hGCD(ヒトグルコセレブロシダーゼ)遺伝子(GBA)における点変異によって引き起こされ、これにより、マクロファージのリソソームにおけるGlcCerの蓄積がもたらされる。この特徴的な蓄積細胞はゴーシェ細胞と呼ばれており、肝臓、脾臓および骨髄において見出される。関連する臨床的症状には、重篤な肝脾腫大、貧血、血小板減少症、および骨格の劣化が含まれる。
【0003】
ヒトGCDをコードする遺伝子が1985年に初めて配列決定された(6)。タンパク質は、536マーのプロペプチドに由来する497アミノ酸からなる。成熟hGCDは5個のN−グリコシル化アミノ酸コンセンサス配列(Asn−X−Ser/Thr)を含有する。これらの部位のうちの4つが通常、グリコシル化される。最初の部位のグリコシル化が、活性なタンパク質を産生させるために必須である。高マンノース鎖および複合オリゴ糖鎖の2つが同定されている(7)。胎盤由来のhGCDは7%の炭水化物を含有し、そのうちの20%が高マンノース型である(8)。生化学的研究および部位特異的変異誘発研究により、折り畳み、活性化因子相互作用および活性部位位置に対して重要な領域および残基の最初のマップが提供されている(9)。
【0004】
胎盤hGCDのノイラミニダーゼ(これはアシアロ酵素を生じさせる)による処理は、ラット肝臓細胞による増大したクリアランス速度および取り込み速度をもたらし、同時に肝細胞の酵素活性の増大をもたらす(Furbish他、1981、Biochim.Biophys.Acta、673:425〜434)。このグリカン修飾型の胎盤hGCDは、現在、ゴーシェ病の処置における治療剤として使用されている。生化学的研究および部位特異的変異誘発研究により、折り畳み、活性化因子相互作用および活性部位位置に対して重要な領域および残基の最初のマップが提供されている[Grace他、J.Biol.Chem.、269:2283〜2291(1994)]。
【0005】
3つの異なるタイプのゴーシェ病が存在し、それぞれがhGCD活性のレベルによって決定される。この疾患によって冒される主な細胞はマクロファージであり、マクロファージはGlcCerの蓄積のために非常に肥大し、従って「ゴーシェ細胞」と呼ばれている。
【0006】
GCDにおける欠陥がゴーシェ病の主原因として同定されたことにより、この障害のための治療法としての酵素置換療法の開発がもたらされた。
【0007】
De Duveは、外因性の生物学的に活性な酵素による喪失リソソーム酵素の置換がリソソーム蓄積疾患の処置に対する実行可能な方法であり得ることを最初に示唆した[Fed Proc.、23:1045(1964)]。
【0008】
それ以降、様々な研究により、酵素置換療法が、様々なリソソーム蓄積疾患を処置するために有益であり得ることが示唆されている。最も良い成功が、外因性酵素(β−グルコセロブロシダーゼ)、すなわち、胎盤から調製された酵素(Ceredase(商標))またはより近年には組換え酵素(Cerezyme(商標))で処置されたI型ゴーシェ病者に関して示されている。
【0009】
天然起源の非改変のグルコセレブロシダーゼは、4つの炭水化物鎖を有する糖タンパク質である。このタンパク質は体内の食作用細胞を標的とせず、従って、治療的価値は限られている。ゴーシェ病のための現在の治療法を開発することにおいて、グルコセレブロシダーゼの炭水化物鎖における末端の糖が、3つの異なるグリコシダーゼによる処理によって順次除去されている。このグリコシダーゼ処理は、その末端糖がマンノース残基からなる糖タンパク質をもたらす。食細胞は、マンノース残基で終わるオリゴ糖鎖を有する糖タンパク質および糖ペプチドを認識するマンノース受容体を有するので、グルコセレブロシダーゼの炭水化物再構成では、これらの細胞に対する酵素の標的化が改善されている[Furbish他、Biochem.Biophys.Acta、673:425(1981)]。
【0010】
本明細書中に示されるように、グリコシル化はhGCD活性において極めて重要な役割を果たしている。従って、細胞株において、ツニカマイシンを使用したとき(Sf9細胞)、または、すべてのグリコシル化部位を無効にする点変異を使用したとき(Sf9細胞およびCOS−1細胞の両方)に発現するhGCDの脱グリコシル化は、酵素活性の完全な喪失をもたらす。また、大腸菌で発現させたhGCDは不活性であることが見出されていた。さらなる研究では、タンパク質活性に対する様々なグリコシル化部位の重要性が示されていた。実際のタンパク質活性におけるグリコシル化の役割に加えて、商業的に製造された酵素は、特異的な薬物送達を容易にするグリカン配列修飾を含有する。これらのグリコシル化タンパク質は、マンノース含有グリカン配列のみを含むために、抽出後、再構成されている。
【0011】
ヒトGCD酵素は4個のグリコシル化部位および22個のリシンを含有する。組換え産生された酵素(Cerezyme(商標))は、アルギニンがヒスチジンで置換されている495位において胎盤酵素(Ceredase(商標))とは異なる。さらに、オリゴ糖組成が組換えGCDと胎盤GCDとの間では異なる。前者はフコース残基およびN−アセチル−グルコサミン残基をより多く有し、一方、後者は1つの高マンノース鎖を保持する。上記で言及されたように、GCDの両方のタイプは、末端のマンノースを露出させ、これにより、食作用細胞の標的化を可能にするために3つの異なるグリコシダーゼ(ノイラミニダーゼ、ガラクトシダーゼおよびP−Nアセチルグルコサミニダーゼ)で処理されている。組換え産生された酵素を含む医薬調製物が米国特許第5549892号に記載される。言及されているすべての参考文献は、本明細書中に詳しく示されているかのように参考として本明細書により組み込まれることに留意しなければならない。
【0012】
既存のリソソーム酵素置換療法処置に関連する1つの欠点は、例えば、低い取り込み、基質が蓄積する特定の細胞のリソソームに対する低下した標的化、および、リソソームにおける機能的なインビボ半減期が短いことのために、酵素のインビボ生物活性が望ましくないほど低いということである。
【0013】
既存のGCD組換え酵素の別の大きな欠点は、健康保険システムに重い経済的負担を負わし得るその費用である。これらの組換え酵素のコストが大きいことは、複雑な精製プロトコル、および、既存の処置のために要求される治療剤の量が比較的大きいことから生じている。従って、この救命治療が、それを必要としている全員に、より手頃な価格で提供され得るようにGCDのコストを下げることが緊急に求められている。
【0014】
医薬品として使用されるタンパク質は、従来的には、哺乳動物発現システムまたは細菌発現システムで製造されている。この10年間において、新しい発現システムが植物において開発されてきている。この方法論では、アグロバクテリウム(一本鎖DNA分子(T−DNA)を植物のゲノムに挿入することができる細菌)が利用される。タンパク質およびペプチドの大量製造のために遺伝子を導入することが比較的簡便であるために、この方法論は、現在、代わりのタンパク質発現システムとしてますます広く知られるようになっている(1)。
【0015】
翻訳後修飾が細菌発現システムでは存在しないが、植物由来の発現システムは、タンパク質の発現および活性のために極めて重要であることが知られているこれらの修飾を容易にする。哺乳動物でのタンパク質発現システムと植物でのタンパク質発現システムとの間での大きな違いの1つが、生合成経路における違いにより引き起こされるタンパク質の糖側鎖の変化である。グリコシル化が、活性、折り畳み、安定性、溶解性、プロテアーゼ感受性、血中クリアランス速度、およびタンパク質の抗原性能力に対する顕著な影響を有することが示されていた。従って、植物におけるタンパク質製造はどれも、植物のグリコシル化の潜在的な枝分かれを考慮に入れなければならない。
【0016】
タンパク質のグリコシル化は、N結合型修飾およびO結合型修飾の2つのカテゴリーに分けられる(2)。これら2つのタイプは、グリカン成分が結合するアミノ酸が異なる:N結合型はAsn残基に結合し、一方、O結合型はSer残基またはThr残基に結合する。また、各タイプのグリカン配列は特有の特徴的な特徴を有する。2つのタイプのうち、N結合型グリコシル化の方が多く存在し、タンパク質の機能に対するその作用が広範囲に研究されている。他方、O結合型グリカンは比較的少なく、タンパク質に対するその影響に関する情報はあまり得られていない。
【発明の概要】
【0017】
背景技術では、グリコシル化されたタンパク質を植物培養において選択的に製造するためのデバイス、システムまたは方法は教示も、示唆もされていない。背景技術ではまた、高マンノースタンパク質を植物培養において製造するためのそのようなデバイス、システムまたは方法は教示も、示唆もされていない。背景技術ではまた、小胞体(ER)を介してタンパク質を植物培養において製造するためのデバイス、システムまたは方法は教示も、示唆もされていない。背景技術ではまた、ゴルジ体を迂回しながら、小胞体(ER)を介してタンパク質を植物培養において製造するためのそのようなデバイス、システムまたは方法は教示も、示唆もされていない。背景技術ではまた、ゴルジ体を迂回するためにERシグナルを使用することによってタンパク質を植物培養において製造するためのそのようなデバイス、システムまたは方法は教示も、示唆もされていない。
【0018】
本発明は、グリコシル化されたタンパク質(特に、高マンノースグリコシル化を有するタンパク質)を、場合により、そして好ましくは、ERシグナルを有するそのようなタンパク質を標的化し(かつ/または、そうでなければ、そのようなタンパク質のプロセシングを操作し)ながら、植物培養において製造するためのデバイス、システムおよび方法を提供することによって背景技術のこれらの欠点を克服している。1つだけの仮説により限定されることを望まないが、そのような標的化はタンパク質にゴルジ体を迂回させ、それにより、所望されるグリコシル化(特に、高マンノースグリコシル化)を保持させると考えられる。本明細書中で使用される用語「植物培養」は、培養で成長する任意のタイプの遺伝子組換え植物細胞、および/または、そうでなければ、遺伝子操作された植物細胞を包含することに留意しなければならない。遺伝子操作は、場合により、永続的または一過性であり得る。好ましくは、培養は、植物の少なくとも1つの生物学的構造が存在しないように、完全な植物を形成するために集成していない細胞を特徴とする。場合により、そして好ましくは、培養は複数の異なるタイプの植物細胞を特徴としてもよいが、好ましくは、培養は特定タイプの植物細胞を特徴とする。場合により、特定タイプの植物細胞を特徴とする植物培養は最初は、複数の異なるタイプのそのような植物細胞に由来し得ることに留意しなければならない。
【0019】
植物細胞は、固体表面(例えば、プラスチック製の培養容器または培養プレートなど)での培養、または懸濁状態(これらに限定されない)を含む任意のタイプの好適な培養方法に従って成長させることができる。
【0020】
本発明はさらに、遺伝子組換え植物の根(特に、ニンジン細胞)を使用して、酵素的に活性な高マンノースリソソーム酵素を発現および産生させるためのベクターおよび方法に関する。より詳細には、本発明は、生物学的に活性な高マンノース型グルコセレブロシダーゼ(GCD)を高収率で発現および産生させるための宿主細胞(特に、遺伝子組換えの懸濁されたニンジン細胞)、ベクターおよび方法に関する。本発明はさらに、リソソーム蓄積疾患を処置するための組成物および方法を提供する。
【0021】
本発明はまた、十分な量の生物学的に活性なリソソーム酵素(特に、ヒトGCD)を、不足している細胞に提供するためのデバイス、システムおよび方法に関する。本発明はまた、GCDなどのリソソーム酵素をコードする遺伝子の効率的な産生を可能にする新しいベクター組成物を含む宿主細胞に関する。
【0022】
従って、本発明は、特定のグリコシル化要件(例えば、GCDなどのリソソーム酵素の高マンノースグリコシル化など)を有するタンパク質を製造するための経済的に有益な技術について長年感じられていた必要性を解決する。本発明はまた、植物細胞培養を使用することによって、この長年感じられていた必要性を解決することができる。
【0023】
本発明をさらに説明するために、次に、高マンノースタンパク質の生合成経路の簡単な説明が示される。高マンノースグリカンおよび複合N結合型グリカンの基本的な生合成経路はすべての真核生物の間で高度に保存されている。生合成は、グリカン前駆体がドリコール脂質キャリアからタンパク質上の特定のAsn残基にオリゴサッカリルトランスフェラーゼにより転移されることで小胞体(ER)において始まる。前駆体は、続いて、グリコシダーゼIおよびグリコシダーゼIIならびに仮説的なマンノシダーゼによってERにおいて修飾されて、哺乳動物に存在するプロセスに類似する高マンノース構造をもたらす。
【0024】
グリカン配列の複合構造およびハイブリッド構造へのさらなる修飾がゴルジ体において行われる。そのような修飾には、α−マンノシダーゼIによる4つのマンノース残基の1つの除去、N−アセチルグルコサミン残基の付加、α−マンノシダーゼIIによる2つのさらなるマンノース残基の除去、N−アセチルグルコサミン残基の付加が含まれ、そして場合により、この段階において、キシロース残基およびフコース残基が付加されて、植物特異的なN結合型グリカンがもたらされ得る。キシロースおよびフコースがコアに転移した後、複合タイプのN−グリカンが、末端のフコースおよびガラクトースの付加によってさらにプロセシングされ得る。さらなる修飾が糖タンパク質の輸送時に行われ得る。
【0025】
いくつかの方法が、現在、植物におけるタンパク質グリコシル化を制御および調節するために背景技術では使用されているが、そのすべてが、特に本発明と比較して、著しい欠点を有している。全体的な修飾、例えば、グリコシル化の完全な阻害、または、ペプチド鎖からのグリコシル化部位の除去などは1つの方法である。しかしながら、この方法では、構造的欠陥が生じ得る。さらなる方法では、特定の炭水化物プロセシング酵素のノックアウトまたは導入を伴う。再度ではあるが、この方法は困難であり、そしてまた、植物細胞自身に対する有害な影響を有し得る。
【0026】
本発明は、ERシグナルを使用することによって、かつ/または、ERからゴルジ体への分泌を阻止することによって、背景技術の方法のこれらの欠点を克服する。1つだけの仮説により限定されることを望まないが、リソソーム酵素の高マンノース構造が好まれるので、分泌を阻止することができ、かつ、タンパク質をERに維持することができるならば、天然に存在する高マンノース構造が、再構成を必要とすることなく得られる。
【0027】
上記で示されたように、内膜系を介して輸送されるタンパク質は最初に小胞体に入る。この工程のための必要な輸送シグナルは分子のN末端におけるシグナル配列(いわゆるシグナルペプチド)によって表される。このシグナルペプチドがその機能(これは、それに結合している前駆体タンパク質を小胞体に入れることである)を果たすと直ちに、シグナルペプチドはタンパク質分解的に前駆体タンパク質から切断される。その特異的な機能によって、このタイプのシグナルペプチド配列は、細胞が細菌、酵母、菌類、動物または植物であるかどうかにかかわらず、すべての生存している細胞において進化時に高度に保存されてきている。
【0028】
多くの植物タンパク質は、シグナルペプチドによって小胞体に入れられるが、ERに留まらず、小胞体からゴルジ体に輸送され、引き続きゴルジ体から液胞に輸送される。この運搬残基のためのそのような仕分けシグナルの1つのタイプが、前駆体タンパク質のC末端部に存在するシグナルである[NeuhausおよびRogers(1998)、Plant Mol.Biol.、38:127〜144]。小胞体に入れるためのN末端シグナルペプチドと、C末端の液胞標的化シグナルとの両方を含有するタンパク質は、ゴルジ体においてタンパク質に取り付けられる複合グリカンを含有することが予想される[Lerouge他(1998)、Plant Mol.Biol.、38:31〜48]。そのようなC末端の仕分けシグナルの種類は非常に広範囲に異なり得る。米国特許第6054637号には、液胞標的化シグナルとして作用する液胞タンパク質であるタバコ塩基性キチナーゼの領域から得られたペプチドフラグメントが記載される。C末端の標的化シグナルと、複合グリカンとを含有する液胞タンパク質に対する一例が、エンドウマメの種子から得られるファゼオリン貯蔵タンパク質である[Frigerio他(1998)、Plant Cell、10:1031〜1042;Frigerio他(2001)、Plant Cell、13:1109〜1126]。
【0029】
理論的枠組みは、すべての真核生物細胞において、液胞タンパク質は、その最終目的地としての液胞に隔離される前にERおよびゴルジ体を通過するということである。驚くべきことに、本発明の形質転換された植物根細胞は予想外の高マンノースGCDを産生させた。好都合なことに、この高マンノース生成物は生物学的に活性であることが見出され、従って、さらなる工程をその活性化のために必要としなかった。1つだけの仮説により限定されることを望まないが、ERシグナルの使用は、組換えタンパク質が植物細胞培養で産生される場合、ゴルジ体への輸送を抑えることができ、従って、所望される高マンノースグリコシル化を保持することができると考えられる。場合により、ゴルジ体を迂回するための任意のタイプの機構を含めて、高マンノースグリコシル化をもたらすことができる任意のタイプの機構を、本発明に従って使用することができる。
【0030】
第1の局面において、本発明は、目的とする高マンノース組換えタンパク質を産生する宿主細胞に関する。この細胞は、目的とするタンパク質をコードする組換え核酸分子、または、そのような核酸分子を含む発現ベクターで形質転換またはトランスフェクションすることができる。そのような核酸分子は、目的とするタンパク質をコードする第1の核酸配列を、液胞標的化シグナルペプチドをコードする第2の核酸配列に機能的に連結されて含む。第1の核酸配列は、場合により、さらに、ER(小胞体)標的化シグナルペプチドをコードする第3の核酸配列に機能的に連結され得る。本発明の宿主細胞は、目的とするタンパク質が高度のマンノース化形態で細胞によって産生されることによって特徴づけられる。
【0031】
本発明の宿主細胞は真核生物細胞または原核生物細胞であり得る。
【0032】
1つの実施形態において、本発明の宿主細胞は原核生物細胞であり、好ましくは細菌細胞であり、最も好ましくはアグロバクテリウム・ツメファシエンス(Agrobacterium tumefaciens)細胞である。これらの細胞は、下記において記載される好ましい植物宿主細胞に感染させるために使用される。
【0033】
別の好ましい実施形態において、本発明の宿主細胞は真核生物細胞であり、好ましくは植物細胞であり、最も好ましくは、アグロバクテリウム・リゾゲネス(Agrobacterium rihzogenes)で形質転換された根細胞からなる群から選択される植物根細胞、セロリ細胞、ショウガ細胞、西洋ワサビ細胞およびニンジン細胞である。
【0034】
好ましい実施形態において、植物根細胞はニンジン細胞である。本発明の形質転換されたニンジン細胞は懸濁状態で成長することに留意しなければならない。上記で言及され、また、実施例において記載されるように、これらの細胞はアグロバクテリウム・ツメファシエンス細胞で形質転換された。
【0035】
別の実施形態において、本発明の宿主細胞に含まれる組換え核酸分子は、塩基性タバコキチナーゼA遺伝子に由来する液胞標的化シグナルペプチドをコードする第2の核酸配列との機能的な連結にある、リソソーム酵素をコードする第1の核酸配列を含む。この液胞シグナルペプチドは、配列番号2によって表されるようなアミノ酸配列を有する。第1の核酸配列は、場合により、さらに、配列番号1によって表されるようなER(小胞体)標的化シグナルペプチドをコードする第3の核酸配列と機能的な連結で連結され得る。1つの実施形態において、本発明の宿主細胞に含まれる組換え核酸分子はさらに、植物細胞において機能的であるプロモーターを含む。このプロモーターは本発明の組換え分子に機能的に連結されなければならない。
【0036】
別の実施形態において、本発明の組換え核酸分子は、場合により、さらに、植物細胞において好ましくは機能的である機能的に連結されたターミネーターを含むことができる。本発明の組換え核酸分子は、場合により、さらに、さらなる制御エレメント、促進エレメントおよび調節エレメント、ならびに/または選択マーカーを含むことができる。これらの調節エレメントは組換え分子に機能的に連結されることに留意しなければならない。
【0037】
好ましい実施形態において、本発明の宿主細胞によって産生される目的とする高マンノースタンパク質は、露出したマンノース末端残基を有する高マンノース糖タンパク質であり得る。
【0038】
そのような高マンノースタンパク質は、別の好ましい実施形態によれば、グルコセレブロシダーゼ(GCD)、酸性スフィンゴミエリナーゼ、ヘキソサミニダーゼ、α−N−アセチルガラクトサミニダーゼ、酸性リパーゼ、α−ガラクトシダーゼ、グルコセレブロシダーゼ、α−L−イズロニダーゼ、イズロナートスルファターゼ、α−マンノシダーゼおよびシアリダーゼからなる群から選択されるリソソーム酵素であり得る。好ましい実施形態において、リソソーム酵素はヒトグルコセレブロシダーゼ(GCD)であり得る。以降、組換えGCD、rGCD、rhGCDはすべて、別途示されない限り、組換えヒトGCDの様々な形態を示す。
【0039】
前記で記載されたように、ゴーシェ病(最も一般的なリソソームでの蓄積障害)は、マクロファージのリソソームにおけるGlcCerの蓄積をもたらす、hGCD(ヒトグルコセレブロシダーゼ)遺伝子(GBA)における点変異によって引き起こされる。GCD欠損がゴーシェ病の主原因として同定されたことにより、この障害のための治療方法としての酵素置換療法の開発がもたらされた。しかしながら、グリコシル化は、hGCDの活性および標的細胞に対する取り込みにおいて極めて重要な役割を果たしている。
【0040】
従って、本発明の他の好ましい実施形態によれば、好適にグリコシル化されたhGCDが、好ましくは、植物細胞培養におけるhGCDの発現を制御することにより提供され、これは、場合により、そしてより好ましくは、ERシグナルを提供することによって、かつ/または、そうでない場合、場合により、そしてより好ましくは、ゴルジ体への輸送を阻止することによって行われる。
【0041】
場合により、そして好ましくは、hGCDは、ゴーシェ病の処置または予防のために、露出したマンノース残基を含む少なくとも1つのオリゴ糖鎖を有する。
【0042】
なおかつ、さらには、特定の実施形態において、この好ましい宿主細胞は、カリフラワーモザイクウイルス由来の35Sプロモーター、アグロバクテリウム・ツメファシエンスのオクピンシンターゼターミネーター、およびTMV(タバコモザイクウイルス)のΩ翻訳エンハンサーエレメントをさらに含む組換え核酸分子によって形質転換またはトランスフェクションされる。好ましい実施形態によれば、この組換え核酸分子は、実質的には配列番号1によって表されるような核酸配列を含み、実質的には配列番号14によって表されるようなアミノ酸配列を有する高マンノースGCDをコードする。
【0043】
本発明はさらに、生物学的に活性なリソソーム酵素をコードする核酸分子を含む発現ベクターを提供することを理解しなければならない。
【0044】
1つの好ましい実施形態において、本発明の発現ベクターは、生物学的に活性な高マンノース型ヒトグルコセレブロシダーゼ(GCD)をコードする核酸分子を含む。好ましくは、本発明の好ましい発現ベクターは、実質的には配列番号13によって表されるような核酸配列を有する組換え核酸分子を含む。
【0045】
第2の局面において、本発明は、本発明の宿主細胞によって産生される組換え高マンノースタンパク質に関する。
【0046】
好ましい実施形態において、本発明の高マンノースタンパク質は、グルコセレブロシダーゼ(GCD)、酸性スフィンゴミエリナーゼ、ヘキソサミニダーゼ、α−N−アセチルガラクトサミニダーゼ、酸性リパーゼ、α−ガラクトシダーゼ、グルコセレブロシダーゼ、α−L−イズロニダーゼ、イズロナートスルファターゼ、α−マンノシダーゼおよびシアリダーゼからなる群から選択される生物学的に活性な高マンノースリソソーム酵素であり得る。最も好ましくは、本発明のリソソーム酵素はヒトグルコセレブロシダーゼ(GCD)であり得る。
【0047】
なおかつ、さらには、本発明は、露出したマンノース残基を含む少なくとも1つのオリゴ糖鎖を有する組換え産生された生物学的に活性な高マンノースリソソーム酵素を提供する。
【0048】
好ましい実施形態によれば、本発明の組換えリソソーム酵素は標的部位における標的細胞上のマンノース受容体に結合することができる。好ましくは、この部位は、リソソーム蓄積疾患に罹患している対象の体内に存在し得る。
【0049】
組換えリソソーム酵素は、天然に存在するリソソーム酵素の標的細胞に対する対応する親和性と比較して、標的細胞に対する増大した親和性を有することに留意しなければならない。具体的な実施形態において、標的部位における標的細胞は対象の肝臓におけるクッパー細胞であり得る。
【0050】
好ましい実施形態において、組換えリソソーム酵素は、グルコセレブロシダーゼ(GCD)、酸性スフィンゴミエリナーゼ、ヘキソサミニダーゼ、α−N−アセチルガラクトサミニダーゼ、酸性リパーゼ、α−ガラクトシダーゼ、グルコセレブロシダーゼ、α−L−イズロニダーゼ、イズロナートスルファターゼ、α−マンノシダーゼまたはシアリダーゼからなる群から選択され得る。
【0051】
最も好ましくは、本発明の組換えリソソーム酵素はグルコセレブロシダーゼ(GCD)である。
【0052】
第3の局面において、本発明は、高マンノースタンパク質を製造する方法に関する。それによれば、本発明の方法は、(a)目的とする組換えタンパク質をコードする組換え核酸分子、または、そのような組換え核酸分子を含む発現ベクターで形質転換またはトランスフェクションされた組換え宿主細胞の培養物を調製する工程;(b)工程(a)により調製されたこれらの宿主細胞培養物を、タンパク質の発現を可能にする条件のもとで培養する工程(この場合、宿主細胞はタンパク質を高度にマンノシル化された形態で産生する);(c)(a)において提供された培養物に由来する細胞からタンパク質を回収し、また、(a)において提供された培養物から細胞を集める工程;および(d)工程(c)のタンパク質を好適なタンパク質精製法によって精製する工程を含む。
【0053】
好ましい実施形態によれば、本発明の方法によって使用される宿主細胞は本発明の宿主細胞である。
【0054】
別の好ましい実施形態において、本発明の方法によって製造される高マンノースタンパク質は、露出したマンノース残基を含む少なくとも1つのオリゴ糖鎖を有する生物学的に活性な高マンノースリソソーム酵素であり得る。
【0055】
本発明の組換え酵素は標的部位における標的細胞上のマンノース受容体に結合することができる。より詳細には、本発明の方法によって製造される組換え酵素は、天然に存在するリソソーム酵素の標的細胞に対する対応する親和性と比較して、標的細胞に対する増大した親和性を有することに留意しなければならない。それによれば、標的部位における標的細胞は対象の肝臓におけるクッパー細胞であり得る。
【0056】
具体的な実施形態において、本発明の組換えリソソーム酵素は、グルコセレブロシダーゼ(GCD)、酸性スフィンゴミエリナーゼ、ヘキソサミニダーゼ、α−N−アセチルガラクトサミニダーゼ、酸性リパーゼ、α−ガラクトシダーゼ、グルコセレブロシダーゼ、α−L−イズロニダーゼ、イズロナートスルファターゼ、α−マンノシダーゼおよびシアリダーゼからなる群から選択され得る。最も好ましくは、本発明のリソソーム酵素はグルコセレブロシダーゼ(GCD)であり得る。
【0057】
別の好ましい実施形態において、本発明の方法によって使用される宿主細胞は、アグロバクテリウム・リゾゲネスで形質転換された根細胞からなる群から選択される植物根細胞、セロリ細胞、ショウガ細胞、西洋ワサビ細胞およびニンジン細胞であり得る。最も好ましくは、植物根細胞はニンジン細胞である。本発明の方法では、形質転換された宿主ニンジン細胞は懸濁状態で成長することには特に留意しなければならない。
【0058】
さらなる局面において、本発明は、外因性の組換えリソソーム酵素を使用して、リソソーム蓄積疾患を有する対象を処置するための方法に関し、この場合、この方法は、(a)形質転換された植物根細胞から精製され、かつ、リソソーム酵素が異常に不足している細胞を効率的に標的化することができる組換え産生された生物学的に活性な形態のリソソーム酵素を提供すること(この場合、この組換え産生された生物学的に活性な酵素は、露出した末端マンノース残基を結合しているオリゴ糖に有する);および(b)治療効果的な量の組換え産生された生物学的に活性なリソソーム酵素を対象に投与することを含む。好ましい実施形態において、本発明の方法によって使用される組換え高マンノースリソソーム酵素は本発明の宿主細胞によって産生され得る。好ましくは、本発明の宿主細胞はニンジン細胞である。
【0059】
別の好ましい実施形態において、本発明の方法によって使用されるリソソーム酵素は、露出したマンノース残基を含む少なくとも1つのオリゴ糖鎖を有する高マンノース酵素であり得る。本発明の組換え酵素は、対象の体内において標的部位における標的細胞上のマンノース受容体に結合することができる。より好ましくは、本発明の組換えリソソーム酵素は、天然に存在するリソソーム酵素の標的細胞に対する対応する親和性と比較して、これらの標的細胞に対する増大した親和性を有する。
【0060】
より詳細には、本発明の方法によって使用されるリソソーム酵素は、グルコセレブロシダーゼ(GCD)、酸性スフィンゴミエリナーゼ、ヘキソサミニダーゼ、α−N−アセチルガラクトサミニダーゼ、酸性リパーゼ、α−ガラクトシダーゼ、グルコセレブロシダーゼ、α−L−イズロニダーゼ、イズロナートスルファターゼ、α−マンノシダーゼまたはシアリダーゼからなる群から選択され得る。好ましくは、本発明の組換えリソソーム酵素はグルコセレブロシダーゼ(GCD)である。
【0061】
好ましい実施形態によれば、本発明の方法は、従って、リソソームでの蓄積疾患(特にゴーシェ病)を処置するために意図される。
【0062】
そのような場合、標的部位における標的細胞は対象の肝臓におけるクッパー細胞であり得る。
【0063】
本発明はさらに、本発明によって規定されるような組換え産生された生物学的に活性な高マンノースリソソーム酵素を主成分として含む、リソソームでの蓄積疾患を処置するための医薬組成物を提供する。本発明の組成物は、場合により、さらに、医薬的に許容され得る希釈剤、キャリアまたは賦形剤を含むことができる。
【0064】
具体的な実施形態において、本発明の組成物は、ゴーシェ病を処置するために意図される。そのような組成物は、好ましくは、本発明によって規定されるような生物学的に活性な高マンノース型ヒトグルコセレブロシダーゼ(GCD)を効果的な成分として含むことができる。
【0065】
本発明はさらに、リソソーム蓄積疾患を処置または防止するための医薬品を製造する際の、本発明の組換え産生された生物学的に活性な高マンノースリソソーム酵素の使用に関する。より詳細には、そのような疾患はゴーシェ病であり得る。
【0066】
それによれば、本発明の生物学的に活性なリソソーム酵素は、本発明によって規定されるような生物学的に活性な高マンノース型ヒトグルコセレブロシダーゼ(GCD)である。
【0067】
本発明によれば、組換えタンパク質と、組換えタンパク質を高マンノースタンパク質として産生させるためのシグナルとをコードするポリヌクレオチドを含む、高マンノース組換えタンパク質を産生する宿主細胞が提供される。好ましくは、ポリヌクレオチドは、目的とするタンパク質をコードする第1の核酸配列を、シグナルペプチドをコードする第2の核酸配列に機能的に連結されて含む。場合により、シグナルペプチドはER(小胞体)標的化シグナルペプチドを含む。好ましくは、ポリヌクレオチドはさらに、液胞標的化シグナルペプチドをコードする第3の核酸配列を含む。
【0068】
好ましくは、シグナルは、組換えタンパク質をERに対して標的化させる。より詳細には、シグナルは、組換えタンパク質をERに対して標的化させるためのシグナルペプチドを含む。最も好ましくは、ポリヌクレオチドは、シグナルペプチドをコードするための核酸セグメントを含む。
【0069】
場合により、そして好ましくは、シグナルは、組換えタンパク質にゴルジ体を迂回させる。好ましくは、シグナルは、組換えタンパク質をゴルジ体に対して標的化させないためのシグナルペプチドを含む。より好ましくは、ポリヌクレオチドは、シグナルペプチドをコードするための核酸セグメントを含む。
【0070】
場合により、そして好ましくは、宿主細胞は真核生物細胞または原核生物細胞のいずれかである。場合により、原核生物細胞は細菌細胞であり、好ましくはアグロバクテリウム・ツメファシエンス細胞である。好ましくは、真核生物細胞は植物細胞である。より詳細には、植物細胞は、アグロバクテリウム・リゾゲネスで形質転換された根細胞からなる群から選択される植物根細胞、セロリ細胞、ショウガ細胞、西洋ワサビ細胞およびニンジン細胞である。最も好ましくは、植物根細胞はニンジン細胞である。
【0071】
好ましくは、組換えポリヌクレオチドは、塩基性タバコキチナーゼA遺伝子に由来する液胞標的化シグナルペプチドをコードする第2の核酸配列との機能的な連結にある、目的とするタンパク質をコードする第1の核酸配列を含み、この場合、そのような液胞シグナルペプチドは、配列番号2によって表されるようなアミノ鎖配列を有し、また、第1の核酸配列は、場合により、さらに、配列番号1によって表されるようなER(小胞体)標的化シグナルペプチドをコードする第3の核酸配列に機能的に連結される。
【0072】
より好ましくは、組換えポリヌクレオチドはさらに、植物細胞において機能的であるプロモーターを含み、この場合、プロモーターは組換え分子に機能的に連結されている。
【0073】
最も好ましくは、組換えポリヌクレオチドはさらに、植物細胞において機能的であるターミネーターを含み、この場合、ターミネーターは組換え分子に機能的に連結されている。
【0074】
また、最も好ましくは、組換えポリヌクレオチドはさらに、場合により、さらに、さらなる制御エレメント、促進エレメントおよび調節エレメント、ならびに/または選択マーカーを含み、この場合、これらの調節エレメントは組換え分子に機能的に連結されている。
【0075】
好ましくは、高マンノースタンパク質は、少なくとも1つの露出したマンノース残基を伴うグリコシル化を有する高マンノース糖タンパク質である。より詳細には、高マンノースタンパク質は、グルコセレブロシダーゼ(GCD)、酸性スフィンゴミエリナーゼ、ヘキソサミニダーゼ、α−N−アセチルガラクトサミニダーゼ、酸性リパーゼ、α−ガラクトシダーゼ、グルコセレブロシダーゼ、α−L−イズロニダーゼ、イズロナートスルファターゼ、α−マンノシダーゼおよびシアリダーゼからなる群から選択される生物学的に活性な高マンノースリソソーム酵素である。
【0076】
最も好ましくは、リソソーム酵素はヒトグルコセレブロシダーゼ(GCD)である。
【0077】
好ましくは、GCDは、配列番号7によって表されるような核酸配列によりコードされる、実質的には配列番号8によって表されるようなアミノ配列を含む。
【0078】
より好ましくは、細胞は、組換えポリヌクレオチド、または該分子を含む発現ベクターで形質転換またはトランスフェクションされる。この場合、そのような組換えポリヌクレオチドは、カリフラワーモザイクウイルス由来の35Sプロモーター、アグロバクテリウム・ツメファシエンスのオクトピンシンターゼターミネーター、および、TMV(タバコモザイクウイルス)のΩ翻訳エンハンサーエレメントである調節エレメントをさらに含み、そして、実質的には配列番号14によって表されるようなアミノ酸配列を有するGCDをコードする、実質的には配列番号13によって表されるような核酸配列を有する。
【0079】
好ましい実施形態によれば、上記の宿主細胞によって産生される組換え高マンノースタンパク質が提供される。
【0080】
好ましくは、高マンノースタンパク質は、グルコセレブロシダーゼ(GCD)、酸性スフィンゴミエリナーゼ、ヘキソサミニダーゼ、α−N−アセチルガラクトサミニダーゼ、酸性リパーゼ、α−ガラクトシダーゼ、グルコセレブロシダーゼ、α−L−イズロニダーゼ、イズロナートスルファターゼ、α−マンノシダーゼおよびシアリダーゼからなる群から選択される生物学的に活性な高マンノースリソソーム酵素である。
【0081】
より好ましくは、リソソーム酵素はヒトグルコセレブロシダーゼ(GCD)である。
【0082】
本発明の他の好ましい実施形態によれば、露出したマンノース残基を含む少なくとも1つのオリゴ糖鎖を有する組換え産生された生物学的に活性な高マンノースリソソーム酵素が提供される。
【0083】
さらに他の好ましい実施形態によれば、シグナルペプチド活性を有する第1の部分と、リソソーム酵素活性を有する第2の部分とを含む組換えタンパク質が提供され、この場合、第1の部分は、露出したマンノース残基を含む少なくとも1つのオリゴ糖鎖により第2の部分を植物細胞においてプロセシングさせる。
【0084】
好ましくは、リソソーム酵素は、ゴーシェ病を処置または予防するためのタンパク質を含む。
【0085】
より好ましくは、タンパク質はhGCDを含む。
【0086】
好ましくは、第1の部分は植物細胞のER標的化シグナルペプチドを含む。より好ましくは、組換え酵素は、リソソーム蓄積疾患に罹患している対象の体内の標的部位おける標的細胞上のマンノース受容体に結合することができる。最も好ましくは、組換えリソソーム酵素は、天然に存在するリソソーム酵素の標的細胞に対する対応する親和性と比較して、標的細胞に対する増大した親和性を有する。
【0087】
また、最も好ましくは、組換えリソソーム酵素は、グルコセレブロシダーゼ(GCD)、酸性スフィンゴミエリナーゼ、ヘキソサミニダーゼ、α−N−アセチルガラクトサミニダーゼ、酸性リパーゼ、α−ガラクトシダーゼ、グルコセレブロシダーゼ、α−L−イズロニダーゼ、イズロナートスルファターゼ、α−マンノシダーゼまたはシアリダーゼからなる群から選択される。
【0088】
好ましくは、組換えリソソーム酵素はグルコセレブロシダーゼ(GCD)である。
【0089】
また、好ましくは、標的部位おける標的細胞は対象の肝臓におけるクッパー細胞である。
【0090】
さらに他の好ましい実施形態によれば、植物細胞培養において産生される組換え高マンノースタンパク質が提供される。好ましくは、タンパク質は、タンパク質をERに標的化するための植物シグナルペプチドを特徴とする。
【0091】
より好ましくは、植物シグナルペプチドは、根の植物細胞培養物においてタンパク質をERに標的化するためのペプチドを含む。最も好ましくは、根の植物細胞培養物はニンジン細胞を含む。
【0092】
なお他の好ましい実施形態によれば、植物細胞培養において産生される組換え高マンノースhGCDタンパク質が提供される。
【0093】
さらに他の好ましい実施形態によれば、組換え高マンノースタンパク質を製造するための植物細胞培養物の使用が提供される。
【0094】
他の好ましい実施形態によれば、高マンノースタンパク質を製造する方法が提供され、この場合、この方法は、組換えタンパク質をコードする組換えポリヌクレオチドで形質転換またはトランスフェクションされた組換え宿主細胞の培養物を調製すること;宿主細胞培養物を、タンパク質の発現を可能にする条件のもとで培養すること(この場合、宿主細胞はタンパク質を高度にマンノシル化された状態で産生する)を含む。
【0095】
好ましくは、宿主細胞培養物は懸濁状態で培養される。より好ましくは、この方法はさらに、タンパク質を精製することを含む。
【0096】
他の好ましい実施形態によれば、この方法は、前記に記載されるような宿主細胞を用いて行われる。好ましくは、高マンノースタンパク質は、露出したマンノース残基を含む少なくとも1つのオリゴ糖鎖を有する生物学的に活性な高マンノースリソソームタンパク質である。より好ましくは、組換え酵素は標的部位における標的細胞上のマンノース受容体に結合する。最も好ましくは、組換え酵素は、天然に存在するリソソーム酵素の標的細胞に対する対応する親和性と比較して、標的細胞に増大した親和性を有する。
【0097】
好ましくは、リソソーム酵素は、グルコセレブロシダーゼ(GCD)、酸性スフィンゴミエリナーゼ、ヘキソサミニダーゼ、α−N−アセチルガラクトサミニダーゼ、酸性リパーゼ、α−ガラクトシダーゼ、グルコセレブロシダーゼ、α−L−イズロニダーゼ、イズロナートスルファターゼ、α−マンノシダーゼおよびシアリダーゼからなる群から選択される。
【0098】
より好ましくは、リソソーム酵素はグルコセレブロシダーゼ(GCD)である。最も好ましくは、標的部位おける標的細胞は対象の肝臓におけるクッパー細胞である。
【0099】
好ましくは、宿主細胞は、アグロバクテリウム・リゾゲネスで形質転換された根細胞からなる群から選択される植物根細胞、セロリ細胞、ショウガ細胞、西洋ワサビ細胞およびニンジン細胞である。
【0100】
より好ましくは、植物根細胞はニンジン細胞である。
【0101】
最も好ましくは、形質転換された宿主ニンジン細胞は懸濁状態で成長する。
【0102】
さらに他の好ましい実施形態によれば、外因性の組換えリソソーム酵素を使用して、リソソーム蓄積疾患を有する対象を処置するための方法が提供され、この場合、この方法は、形質転換された植物根細胞から精製され、かつ、リソソーム酵素が異常に不足している細胞を効率的に標的化することができる組換え産生された生物学的に活性な形態のリソソーム酵素を提供すること(この場合、組換え産生された生物学的に活性な酵素は、露出した末端マンノース残基を結合しているオリゴ糖に有する);および、治療効果的な量の組換え産生された生物学的に活性なリソソーム酵素を対象に投与することを含む。この方法は、場合により、前記で記載されたような任意の宿主細胞および/またはタンパク質を用いて行うことができる。
【0103】
好ましくは、組換え酵素は、対象の体内において標的部位における標的細胞上のマンノース受容体に結合することができる。より好ましくは、組換えリソソーム酵素は、天然に存在するリソソーム酵素の標的細胞に対する対応する親和性と比較して、標的細胞に対する増大した親和性を有する。最も好ましくは、リソソーム酵素は、グルコセレブロシダーゼ(GCD)、酸性スフィンゴミエリナーゼ、ヘキソサミニダーゼ、α−N−アセチルガラクトサミニダーゼ、酸性リパーゼ、α−ガラクトシダーゼ、グルコセレブロシダーゼ、α−L−イズロニダーゼ、イズロナートスルファターゼ、α−マンノシダーゼまたはシアリダーゼからなる群から選択される。また、最も好ましくは、リソソーム酵素はグルコセレブロシダーゼ(GCD)である。
【0104】
また、最も好ましくは、リソソーム蓄積疾患はゴーシェ病である。また、最も好ましくは、標的部位おける標的細胞は対象の肝臓におけるクッパー細胞である。
【0105】
さらに他の好ましい実施形態によれば、上記で記載されたような組換え産生された生物学的に活性な高マンノースリソソーム酵素を有効成分として含む、リソソーム蓄積疾患を処置するための医薬組成物が提供される。この場合、そのような組成物は、場合により、さらに、医薬的に許容され得る希釈剤、キャリアまたは賦形剤を含む。好ましくは、リソソーム蓄積疾患はゴーシェ病である。より好ましくは、組換えリソソーム酵素は、生物学的に活性な高マンノース型ヒトグルコセレブロシダーゼ(GCD)である。
【0106】
さらに他の好ましい実施形態によれば、リソソーム蓄積疾患を処置または予防するための医薬品を製造することにおける、上記で記載されたような組換え産生された生物学的に活性な高マンノースリソソーム酵素の使用が提供される。好ましくは、疾患はゴーシェ病である。より好ましくは、生物学的に活性なリソソーム酵素は、生物学的に活性な高マンノース型ヒトグルコセレブロシダーゼ(GCD)である。
【0107】
本発明はさらに下記の図によって例示されるが、下記の図は例示にすぎず、本発明の範囲を限定せず、本発明はまた、添付された請求項によって規定される。
【図面の簡単な説明】
【0108】
本発明は、本明細書中では、例としてだけであるが、添付されている図面を参照して記載される。
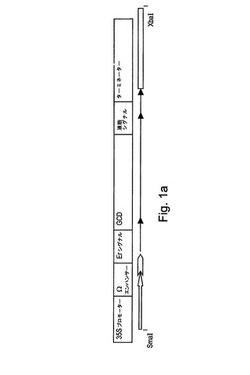
【図1a】図1aは、カリフラワーモザイクウイルス由来の35Sプロモーター、TMV(タバコモザイクウイルス)のΩ翻訳エンハンサーエレメント、ER標的化シグナル、ヒトGCD配列(これはまた配列番号7によって表される)、液胞シグナル、および、アグロバクテリウム・ツメファシエンス由来のオクトピンシンターゼターミネーター配列を含む得られた発現カセットを示す。
【図1b】図1bは、pGreenIIプラスミド骨格の概略マップを示す。
【図2】図2は、抗hGCD特異的抗体を使用するhGCD形質転換細胞抽出物のウエスタンブロット分析を示す。標準品Cerezyme(レーン1)が陽性コントロールとして使用され、非形質転換カルスが陰性コントロール(レーン2)として使用され、様々な選択されたカルスの抽出物がレーン3〜8に示される。
【図3a】図3aは、精製工程の標準的な処理を表す。XKカラム(2.6x20cm)に充填された強カチオン交換樹脂(Macro−Prep high−S担体、Bio−Rad)でrh−GCDを精製する最初の工程を示す。カラムは、伝導率モニターリング、pHおよび280nmでの吸光度を可能にするAKTAプライムシステム(Amersham Pharmacia Biotech)と一体化された。rh−GCDの溶出が、600mMのNaClを含有する平衡化緩衝液で得られた。
【図3b】図3bは、処理時に集められた分画物の酵素活性アッセイの結果である。酵素活性を示したチューブ(溶出ピークでの)がプールされた。
【図3c】図3cは、活性についてアッセイされた溶出分画物のクーマシーブルー染色を示す。
【図3d】図3dは、第2のカラムでの、図3aに対応するグラフを示す。
【図3e】図3eは、第2のカラムでの、図3bに対応するグラフを示す。
【図3f】図3fは、第2のカラムでの、活性についてアッセイされた溶出分画物のクーマシーブルー染色を示す。
【図4a】図4aは、精製工程の標準的な処理を表す。XKカラム(2.6x20cm)に充填された疎水性相互作用樹脂(TSKゲル、Toyopearl Phenyl−650M、Tosoh Corp.)での組換えhGCDの最終精製工程を示す。カラムは、伝導率モニターリング、pHおよび280nmでの吸光度を可能にするAKTAプライムシステム(Amersham Pharmacia Biotech)と一体化された。前カラムから得られたGCD溶出プールを6ml/分で負荷し、その後、UV吸光度がベースラインに達するまで平衡化緩衝液で洗浄した。純粋なGCDが、50%エタノールを含有する10mMクエン酸緩衝液によって溶出された。
【図4b】図4bは、酵素活性アッセイによりモニターされた処理時に集められた分画物を示す。
【図4c】図4cは、活性についてアッセイされた溶出画分のクーマシーブルー染色を示す。
【図5a】図5aは、腹腔マクロファージによる取り込みの後における組換えhGCDの活性を示す。
【図5b】図5bは、腹腔マクロファージによる取り込みの後における組換えhGCDの活性を示す。
【図5c】図5cは、腹腔マクロファージによる取り込みの後における組換えhGCDの活性を示す。
【図5d】図5dは、本発明による組換えGCDのウエスタンブロットを示す。
【図6】図6は、本発明によるrGCDおよびCerezyme(商標)についての比較されるグリコシル化構造を示す。
【図7】図7は、本発明によるrGCDについてのグリコシル化構造を示す。
【図8a】図8aは、本発明によるrGCDについてのさらなるN−グリカングリコシル化構造を示す。
【図8b】図8bは、本発明によるrGCDについてのさらなるN−グリカングリコシル化構造を示す。
【図8c】図8cは、本発明によるrGCDについてのさらなるN−グリカングリコシル化構造を示す。
【図8d】図8dは、本発明によるrGCDについてのさらなるN−グリカングリコシル化構造を示す。
【発明を実施するための形態】
【0109】
医薬的に使用されるタンパク質は、従来的には、哺乳動物発現システムまたは細菌発現システムで製造されている。この数年間において、有望な新しい発現システムが植物において見出された。新しい遺伝子を導入することが比較的簡便であること、そして、タンパク質およびペプチドの大量製造のための潜在的可能性のために、「分子ファーミング(pharming)」が、現在、タンパク質発現システムとしてますます広く知られるようになっている。
【0110】
哺乳動物でのタンパク質発現システムと植物でのタンパク質発現システムとの間での大きな違いの1つが、生合成経路における違いにより引き起こされるタンパク質グリコシル化配列の変化である。グリコシル化が、活性、折り畳み、安定性、溶解性、プロテアーゼ感受性、血中クリアランス速度、およびタンパク質の抗原性能力に対する顕著な影響を有することが示されていた。従って、植物におけるタンパク質製造ではどれも、植物のグリコシル化の潜在的な枝分かれを考慮に入れなければならない。
【0111】
炭水化物成分はタンパク質の最も一般的な翻訳後修飾の1つである。タンパク質のグリコシル化は、N結合型およびO結合型の2つのカテゴリーに分けられる。これら2つのタイプは、グリカン成分がタンパク質において結合するアミノ酸が異なる:N結合型はAsn残基に結合し、一方、O結合型はSer残基またはThr残基に結合する。また、各タイプのグリカン配列は特有の特徴的な特徴を有する。2つのタイプのうち、N結合型グリコシル化の方が多く存在し、タンパク質に対するその作用が広範囲に研究されている。他方、O結合型グリカンは比較的少なく、タンパク質に対するその影響に関する情報はあまり得られていない。植物におけるタンパク質のグリコシル化に関して得られるデータの大部分は、O結合型グリカンではなく、N結合型グリカンに集中している。
【0112】
本発明は、本明細書中において、場合により、そして好ましくは、懸濁状態で成長する遺伝子組換え植物細胞(これは好ましくは根細胞である)に基づく植物発現システムを記載する。この発現システムは、目的とする高マンノースタンパク質を効率的に製造するために特に設計されている。用語「高マンノース」は、少なくとも1つの露出したマンノース残基を有するグリコシル化を包含する。
【0113】
従って、第1の局面において、本発明は、目的とする高マンノース組換えタンパク質を産生する宿主細胞に関する。好ましくは、組換えタンパク質はER(小胞体)シグナルペプチドを特徴とし、より好ましくは、ER標的化シグナルペプチドを特徴とする。あるいは、またはさらに、組換えタンパク質は、タンパク質にゴルジ体を迂回させるシグナルを特徴とする。このようなシグナルは、好ましくは、組換えタンパク質が、高マンノースグリコシル化を、より好ましくは、そのようなグリコシル化を保持することによって特徴づけ、最も好ましくは、ERを標的化することによって、かつ/または、ゴルジ体を迂回することによって特徴づけることを可能にする。本明細書中においてより詳細に記載されるように、そのようなシグナルは、好ましくは、シグナルペプチドとして実行されるが、この場合、シグナルペプチドは、場合により、そしてより好ましくは、シグナルペプチドをタンパク質の一部としてもまた特徴づけるためにタンパク質を操作することによって、より好ましくはタンパク質配列の一部を形成する。シグナルは、場合により、標的化シグナル、保持シグナル、回避(迂回)シグナル、または、それらの任意の組合せ、あるいは、所望される高マンノースグリコシル化構造をもたらすことができる任意の他のタイプのシグナルであり得ることに留意しなければならない。
【0114】
1つだけの仮説により限定されることを望まないが、ER標的化シグナルの使用は、組換えタンパク質が植物細胞培養において産生される場合、ゴルジ体への輸送を抑えることができ、従って、所望される高マンノースグリコシル化を保持することができるようである。場合により、高マンノースグリコシル化をもたらすことができる任意のタイプの機構を、ゴルジ体を迂回するための任意のタイプの機構を含めて、本発明に従って使用することができる。様々なER標的化シグナルペプチドがこの分野では広く知られており、それらはN末端のシグナルペプチドである。場合により、任意の好適なER標的化シグナルペプチドを本発明とともに使用することができる。
【0115】
本発明による宿主細胞は、場合により、目的とするタンパク質をコードする組換え核酸分子、または、そのような核酸分子を含む発現ベクターで(永続的および/または一過性に)形質転換またはトランスフェクションすることができる。そのような核酸分子は、目的とするタンパク質をコードする第1の核酸配列を、場合により、そして好ましくは、液胞標的化シグナルペプチドをコードする第2の核酸分子に機能的に連結されて含む。本明細書中で使用される用語「機能的に」連結されては、物理的な連結を必ずしも示さないことに留意しなければならない。第1の核酸配列は、場合により、そして好ましくは、さらに、ER(小胞体)標的化シグナルペプチドをコードする第3の核酸配列に機能的に連結され得る。本発明の宿主細胞は、目的とするタンパク質が、少なくとも1つの露出されたマンノース残基を含む形態で細胞において産生されるが、好ましくは、高度にマンノシル化された形態であることによって特徴づけられる。
【0116】
「細胞」、「宿主細胞」または「組換え宿主細胞」は、本明細書中では交換可能に使用される用語である。そのような用語は、特定の対象とする細胞だけでなく、そのような細胞の子孫または潜在的な子孫を示すことが理解される。いくつかの変化が、変異または環境的影響のいずれかにより次世代において生じ得るので、そのような子孫は、実際、親細胞と同一でないことがあり、しかし、本明細書中で使用される用語の範囲には依然として含まれる。本明細書中で使用される「宿主細胞」は、ネイクドDNA、または、組換えDNA技術を使用して構築された発現ベクターで組換え的に形質転換され得る細胞を示す。本明細書中で使用される用語「トランスフェクション」は、核酸(例えば、ネイクドDNAまたは発現ベクター)をレシピエント細胞に核酸媒介遺伝子移入によって導入することを意味する。本明細書中で使用される「形質転換」は、細胞の表現型が、外因性のDNAまたはRNAの細胞取り込みの結果として変化させられるプロセスを示し、例えば、形質転換された細胞は、所望されるタンパク質の組換え形態を発現する。
【0117】
薬物抵抗性または他の選択マーカーが、部分的には、形質転換体の選択を容易にするために意図されることを理解しなければならない。また、選択マーカー(例えば、薬物抵抗性マーカーなど)の存在は、混入微生物を培養培地で増殖させないことにおいて有用であり得る。形質転換された宿主細胞のそのような純粋培養は、誘導された表現型の生存のために要求される条件のもとで細胞を培養することによって得られる。
【0118】
上記で示されたように、本発明の宿主細胞は核酸分子でトランスフェクションまたは形質転換することができる。本明細書中で使用される用語「核酸」は、デオキシリボ核酸(DNA)、および、適する場合にはリボ核酸(RNA)などのポリヌクレオチドを示す。これらの用語はまた、均等物として、ヌクレオチドのアナログから作製される、RNAまたはDNAのいずれかのアナログ、ならびに、記載されている実施形態に対して適用可能であるように、一本鎖(例えば、センスまたはアンチセンス)ポリヌクレオチドおよび二本鎖ポリヌクレオチドを含むことを理解しなければならない。
【0119】
なお別の実施形態において、本発明の宿主細胞は、組換え核酸分子を含む発現ベクターでトランスフェクションまたは形質転換することができる。本明細書中で使用される「発現ベクター」は、プラスミドなどのベクター、ウイルス、バクテリオファージ、組込み可能なDNAフラグメント、および、宿主のゲノムへのDNAフラグメントの組込みを可能にする他のビヒクルを包含する。発現ベクターは、典型的には、所望される遺伝子またはそのフラグメントと、好適な宿主細胞において認識される機能的に連結された遺伝的制御エレメントとを含有する自己複製性のDNA構築物またはRNA構築物であり、所望される遺伝子の発現をもたらす。これらの制御エレメントは、好適な宿主における発現をもたらすことができる。一般に、遺伝的制御エレメントは原核生物プロモーターシステムまたは真核生物プロモーター発現制御システムを含むことができる。そのようなシステムは、典型的には、転写プロモーター、転写の開始を制御するための必要に応じて使用されるオペレーター、RNA発現のレベルを上昇させるための転写エンハンサー、好適なリボソーム結合部位をコードする配列、RNAスプライス接合部、転写および翻訳を終結させる配列などを含む。発現ベクターは、通常、ベクターが宿主細胞とは無関係に複製することを可能にする複製起点を含有する。
【0120】
プラスミドはベクターの最も一般的に使用されている形態であるが、同等の機能を果たし、かつ、この分野で知られているか、または、この分野で知られるようになる他の形態のベクターが本発明における使用のために好適である。例えば、Pouwels他、Cloning Vectors:a Laboratory Manual(1985年および増刊)、Elsevier、N.Y.;Rodriquez他(編)、Vectors:a Survey of Molecular Cloning Vectors and their Uses、Buttersworh、Boston、Mass(1988)を参照のこと(これらは参照により本明細書中に組み込まれる)。
【0121】
一般に、そのようなベクターはまた、形質転換された細胞における表現型選択を提供することができる特定の遺伝子を含有する。本発明のポリペプチドをコードする遺伝子を発現させるための原核生物性および真核生物性のウイルス発現ベクターの使用もまた意図される。
【0122】
場合により、ベクターは、(下記の実施例に関して記載されるように)全体的な植物ベクターであり得る。あるいは、ベクターは、場合により、根細胞に対して特異的であり得る。
【0123】
1つの好ましい実施形態において、本発明の宿主細胞は真核生物細胞または原核生物細胞であり得る。
【0124】
具体的な実施形態において、本発明の宿主細胞は原核生物細胞であり、好ましくは細菌細胞であり、最も好ましくはアグロバクテリウム・ツメファシエンス細胞である。これらの細胞は、下記で記載される好ましい植物宿主細胞に感染させるために使用させる。
【0125】
別の好ましい実施形態において、本発明の宿主細胞は真核生物細胞であってもよく、好ましくは植物細胞、最も好ましくは、アグロバクテリウム・リゾゲネスで形質転換された植物根細胞からなる群から選択される植物根細胞、セロリ細胞、ショウガ細胞、西洋ワサビ細胞およびニンジン細胞であり得る。
【0126】
好ましい実施形態において、植物根細胞はニンジン細胞である。本発明の形質転換されたニンジン細胞は懸濁状態で成長することに留意しなければならない。上記で言及され、また、実施例において記載されるように、これらの細胞は本発明のアグロバクテリウム・ツメファシエンス細胞で形質転換される。
【0127】
本発明の宿主細胞をトランスフェクションまたは形質転換するために使用される発現ベクターまたは組換え核酸分子はさらに、ペプチドシグナル配列を付加し、または除去し、またはそうでなければ改変して、シグナルペプチドの切断を変化させるために、または、発現したリソソーム酵素の植物内膜形による標的化を増大もしくは変化させるために、当業者に知られている様々な方法に従って改変することができる。例えば、限定としてではないが、発現構築物を、分泌のために、または、液胞局在化のために、または、小胞体(ER)における保持のためにリソソーム酵素を標的化するために特に操作することができる。
【0128】
1つの実施形態において、発現ベクターまたは組換え核酸分子は、リソソーム酵素を植物の液胞に標的化するシグナルをコードするヌクレオチド配列を含むために操作することができる。例えば、限定としてではないが、本発明の宿主細胞に含まれる組換え核酸分子は、塩基性タバコキチナーゼA遺伝子に由来する液胞標的化シグナルペプチドをコードする第2の核酸配列との機能的な連結にある、リソソーム酵素をコードする第1の核酸配列を含む。この液胞シグナルペプチドは、配列番号2によって表されるようなアミノ酸配列を有する。第1の核酸配列は、場合により、さらに、配列番号1によって表されるようなER(小胞)標的化シグナルペプチドをコードする第3の核酸配列との機能的な連結で連結され得る。1つの実施形態において、本発明の宿主細胞に含まれる組換え核酸分子はさらに、植物細胞において機能的であるプロモーターを含む。このプロモーターは、本発明の組換え分子に機能的に連結されなければならない。
【0129】
用語「機能的に連結された(されている)」は、第1の核酸配列が第2の核酸配列との機能的な関係に置かれているとき、第1の核酸配列が第2の核酸配列と機能的に連結されていることを示すために本明細書中で使用される。例えば、プロモーターがコード配列の転写または発現に影響を及ぼす場合、プロモーターはコード配列に機能的に連結されている。場合により、そして好ましくは、機能的に連結されたDNA配列は連続し(例えば、物理的に連結され)ており、そして、2つのタンパク質コード領域をつなぐために必要な場合には同じリーディングフレームにある。従って、DNA配列および調節配列は、適切な分子(例えば、転写活性化因子タンパク質)が調節配列に結合したときに遺伝子発現を可能にするような様式でつながれる。
【0130】
別の実施形態において、本発明の組換え核酸分子は、場合により、さらに、植物細胞において好ましくは機能的である機能的に連結されたターミネーターを含むことができる。本発明の組換え核酸分子は、場合により、さらに、さらなる制御エレメント、促進エレメントおよび調節エレメント、ならびに/または、選択マーカーを含むことができる。これらの調節エレメントは組換え分子に機能的に連結されていることに留意しなければならない。
【0131】
発現構築物において使用され得る調節エレメントには、植物細胞にとって異種または同族的のいずれかであり得るプロモーターが含まれる。プロモーターは、連結された配列の高レベルの転写を植物細胞および植物において行わせることができる植物プロモーターまたは非植物プロモーターであり得る。本発明を実施する際に効果的に使用され得る植物プロモーターの非限定的な例には、カリフラワーモザイクウイルス(CaMV)の35S、rbcS、クロロフィルa/b結合タンパク質に対するプロモーター、AdhI、NOSおよびHMG2、またはそれらの改変体もしくは誘導体が含まれる。プロモーターは構成的または誘導可能のいずれかであり得る。例えば、限定としてではないが、誘導可能なプロモーターは、植物、植物組織または植物細胞の機構的な遺伝子活性化(MGA)の後、リソソーム酵素のヌクレオチド配列の発現または増大した発現を促進させるプロモーターであり得る。
【0132】
本発明の宿主細胞をトランスフェクションまたは形質転換するために使用される発現ベクターはさらに、植物および植物細胞における異種遺伝子の発現を増強または最適化するために、当業者に知られている様々な方法に従って改変することができる。そのような改変には、プロモーターの強さを増大させるために、または、目的とするタンパク質を変化させるためにDNA調節エレメントを変異することが含まれるが、これに限定されない。
【0133】
好ましい実施形態において、本発明の宿主細胞によって産生される目的とする高マンノースタンパク質は、少なくとも1つの露出したマンノース残基(少なくとも1つの末端マンノース残基)を有する高マンノースグリコシル化であり得る。
【0134】
そのような高マンノースタンパク質は、別の好ましい実施形態によれば、グルコセレブロシダーゼ(GCD)、酸性スフィンゴミエリナーゼ、ヘキソサミニダーゼ、α−N−アセチルガラクトサミニダーゼ、酸性リパーゼ、α−ガラクトシダーゼ、グルコセレブロシダーゼ、α−L−イズロニダーゼ、イズロナートスルファターゼ、α−マンノシダーゼおよびシアリダーゼからなる群から選択されるリソソーム酵素であり得る。
【0135】
用語「リソソーム酵素」は、本発明によって記載される植物発現システムにおいて産生される任意のそのような酵素および産物に関して本明細書中で記載される場合、ヒトまたは動物のリソソーム酵素、ヒトまたは動物の改変されたリソソーム酵素、あるいはそのような酵素のフラグメント、誘導体または改変体をコードするヌクレオチド配列から遺伝子組換え植物細胞において発現される組換えペプチドを示す。ヒトまたは動物の有用な改変されたリソソーム酵素には、天然に存在するか、または人為的に導入された1つまたは複数のアミノ酸付加、アミノ酸欠失および/またはアミノ酸置換を有する、ヒトまたは動物のリソソーム酵素が含まれるが、これらに限定されない。
【0136】
可溶性のリソソーム酵素は生合成の初期段階を分泌タンパク質と共有している:すなわち、リボソーム上での合成、粗面小胞体(ER)の表面に対するN末端シグナルペプチドの結合、シグナルペプチドが切断されるERの内腔への輸送、および、特定のアスパラギン残基へのオリゴ糖の付加(N結合型)、それに続く、ゴルジ装置における初期タンパク質のさらなる修飾[von FiguraおよびHasilik、Annu.Rev.Biochem.、55:167〜193(1986)]。N結合型オリゴ糖は、複雑で、多様で、かつ不均一であり得るし、高マンノース残基を含有する場合がある。タンパク質は、ER後のプレゴルジ区画において、また、シスゴルジにおいてさらなるプロセシングを受けて、リソソームの局在化酵素に対するN結合型マンノース6−リン酸(M−6−P)オリゴ糖依存性またはN結合型M−6−Pオリゴ糖非依存性のいずれかの認識シグナルを形成する[Kornfeld&Mellman、Ann.Rev.Cell Biol.、5:483〜525(1989);Kaplan他、Proc.Natl.Acad.Sci.USA、74:2026(1977)]。M−6−P認識シグナルの存在は、M−6−P受容体(MPR)に対する酵素の結合をもたらす。これらの結合した酵素は細胞内に留まり、最終的にはリソソームにパッケージングされ、従って、分泌のために標的化されたタンパク質、または形質膜に対して標的化されたタンパク質から隔離される。
【0137】
好ましい実施形態において、リソソーム酵素はヒトグルコセレブロシダーゼ(GCD)であり得る。
【0138】
なおかつ、さらに、特定の実施形態において、本発明の好ましい宿主細胞は、好ましくは、配列番号9によって表されるような核酸配列を有するカリフラワーモザイクウイルス由来の35Sプロモーターと、好ましくは、配列番号12によって表されるような核酸配列を有するアグロバクテリウム・ツメファシエンスのオクトピンシンターゼターミネーターと、TMV(タバコモザイクウイルス)のΩ翻訳エンハンサーエレメントとをさらに含む組換え核酸分子によって形質転換またはトランスフェクションされる。好ましい実施形態によれば、この組換え核酸分子は、実質的には配列番号13によって表されるような核酸配列を含み、実質的には配列番号14によって表されるようなアミノ酸配列を有する高マンノースGCDをコードする。
【0139】
本発明はさらに、生物学的に活性な高マンノースリソソーム酵素をコードする核酸分子を含む発現ベクターを提供することを理解しなければならない。
【0140】
この局面の1つの好ましい実施形態において、本発明の発現ベクターは、生物学的に活性な高マンノース型ヒトグルコセレブロシダーゼ(GCD)をコードする核酸分子を含む。好ましくは、本発明の好ましい発現ベクターは、実質的には配列番号13によって表されるような核酸配列を有する組換え核酸分子を含む。具体的な実施形態によれば、好ましい発現ベクターでは、下記の実施例1により記載されるようなpGREENIIプラスミドが利用される。
【0141】
さらには、本発明は、上記の発現ベクターに含まれる発現カセットを提供することに留意しなければならない。
【0142】
第2の局面において、本発明は、本発明の宿主細胞によって産生される組換え高マンノースタンパク質に関する。
【0143】
好ましい実施形態において、本発明の高マンノースタンパク質は、グルコセレブロシダーゼ(GCD)、酸性スフィンゴミエリナーゼ、ヘキソサミニダーゼ、α−N−アセチルガラクトサミニダーゼ、酸性リパーゼ、α−ガラクトシダーゼ、グルコセレブロシダーゼ、α−L−イズロニダーゼ、イズロナートスルファターゼ、α−マンノシダーゼおよびシアリダーゼからなる群から選択される生物学的に活性な高マンノースリソソーム酵素であり得る。最も好ましくは、本発明のリソソーム酵素はヒトグルコセレブロシダーゼ(GCD)であり得る。
【0144】
用語「生物学的に活性な」は、本明細書中では、植物発現システムにおいて産生される任意の組換えリソソーム酵素に関して使用されて、組換えリソソーム酵素が、ヒトまたは動物の対応するリソソーム酵素の天然基質またはアナログ基質または合成基質のいずれかを検出可能なレベルで加水分解することができることを意味する。
【0145】
なおかつ、さらに、本発明は、露出したマンノース残基を含む少なくとも1つのオリゴ糖鎖を有する組換え産生された生物学的に活性なリソソーム酵素を提供する。
【0146】
好ましい実施形態によれば、本発明の組換えリソソーム酵素は、標的部位における標的細胞上のマンノース受容体に結合することができる。好ましくは、この部位は、リソソーム蓄積疾患に罹患している対象の体内であり得る。
【0147】
場合により、そしてより好ましくは、組換えリソソーム酵素は、天然に存在するリソソーム酵素の標的細胞に対する親和性と比較して、標的細胞に対する増大した親和性を有する。具体的な実施形態において、標的部位における標的細胞は対象の肝臓におけるクッパー細胞であり得る。
【0148】
好ましい実施形態において、組換えリソソーム酵素は、グルコセレブロシダーゼ(GCD)、酸性スフィンゴミエリナーゼ、ヘキソサミニダーゼ、α−N−アセチルガラクトサミニダーゼ、酸性リパーゼ、α−ガラクトシダーゼ、グルコセレブロシダーゼ、α−L−イズロニダーゼ、イズロナートスルファターゼ、α−マンノシダーゼまたはシアリダーゼからなる群から選択され得る。
【0149】
最も好ましくは、本発明の組換えリソソーム酵素はグルコセレブロシダーゼ(GCD)である。
【0150】
第3の局面において、本発明は、高マンノースタンパク質を製造する方法に関する。それによれば、本発明の方法は、(a)目的とする組換えタンパク質をコードする組換え核酸分子、または、そのような組換え核酸分子を含む発現ベクターで形質転換またはトランスフェクションされた組換え宿主細胞の培養物を調製する工程;(b)工程(a)により調製された宿主細胞培養物を、高マンノースタンパク質の発現を可能にする条件のもとでの懸濁状態で培養する工程(この場合、宿主細胞はタンパク質を高度にマンノシル化された形態で産生する);(c)(a)において提供された培養物から細胞を集め、細胞からタンパク質を回収する工程;および(d)工程(c)のタンパク質を好適なタンパク質精製法によって精製する工程を含む。
【0151】
場合により、そして好ましくは、組換えタンパク質は、米国特許第6391638号(2002年5月21日発行、これは、本明細書中に詳しく示されているかのように本明細書により参考として組み込まれる)に関して記載される装置で培養することによって、本発明による植物細胞により産生され得る。この装置を用いた懸濁状態で植物細胞を培養するための条件が、「細胞/組織を培養するための装置、システムおよび方法」と題する米国特許出願に関して記載される(これは、本発明者らの一人によるものであり、本出願と共有である)(これは、本明細書中に詳しく示されているかのように本明細書により参考として組み込まれ、本出願と同じ日に出願された)。
【0152】
本発明の方法によって産生された目的とする高マンノースタンパク質を回収および精製するための具体的で、非限定的な例が、下記の実施例において見出され得る。実施例では、本発明によって産生された組換えh−GCDが、予想外にも、本発明の形質転換されたニンジン細胞の内膜に結合し、培地に分泌されなかったことが示される。可溶性のrh−GCDが、ろ過または沈殿化などのこの分野で知られている様々な手段に従って、細胞破砕物および他の不溶性成分から分離され得る。例えば、凍結解凍サイクルの後、細胞は破壊を受け、細胞内の可溶性タンパク質の放出を受け、これに対して、h−GCDは不溶性の膜破砕物に結合したままである。このような可溶性および不溶性膜破砕物の混合物は次に遠心分離され、可溶性画分が除かれ、このように、精製が簡略化された。膜に結合したh−GCDは、その後、穏和な界面活性剤、プロテアーゼ阻害剤および抗酸化剤試薬の存在下での機械的な破壊によって溶解させることができる。可溶性酵素はさらに、様々なクロマトグラフィー技術、例えば、カチオン交換クロマトグラフィーカラムおよび疎水性相互作用クロマトグラフィーカラムなどを使用して精製することができる。バイオリアクターでのrh−GCD製造時および精製プロセス時において、h−GCDの同一性、収率、純度および酵素活性を1つ以上の生化学的アッセイによって明らかにすることができる。これらには、酵素の基質または基質アナログの加水分解を検出すること、SDS−ポリアクリルアミドゲル電気泳動分析、および免疫学的分析(例えば、ELISAおよびウエスタンブロットなど)が含まれるが、これらに限定されない。
【0153】
好ましい実施形態によれば、本発明の方法によって使用される宿主細胞は本発明の宿主細胞を含む。
【0154】
別の好ましい実施形態において、本発明の方法によって産生される高マンノースタンパク質は、露出したマンノース残基を含む少なくとも1つのオリゴ糖鎖を有する生物学的に活性な高マンノースリソソーム酵素であり得る。
【0155】
本発明の組換え酵素は、標的部位における標的細胞上のマンノース受容体に結合することができる。より好ましくは、本発明の方法によって産生される組換え酵素は、天然に存在するリソソーム酵素の標的細胞に対する対応する親和性と比較して、標的細胞に対する増大した親和性を有する。それによれば、標的部位における標的細胞は対象の肝臓におけるクッパー細胞であり得る。
【0156】
具体的な実施形態において、本発明の組換えリソソーム酵素は、グルコセレブロシダーゼ(GCD)、酸性スフィンゴミエリナーゼ、ヘキソサミニダーゼ、α−N−アセチルガラクトサミニダーゼ、酸性リパーゼ、α−ガラクトシダーゼ、グルコセレブロシダーゼ、α−L−イズロニダーゼ、イズロナートスルファターゼ、α−マンノシダーゼおよびシアリダーゼからなる群から選択され得る。最も好ましくは、本発明の組換えリソソーム酵素はグルコセレブロシダーゼ(GCD)であり得る。
【0157】
別の好ましい実施形態において、本発明の方法によって使用される宿主細胞は、アグロバクテリウム・リゾゲネスで形質移転された根細胞からなる群から選択される植物根細胞、セロリ細胞、ショウガ細胞、西洋ワサビ細胞およびニンジン細胞であり得る。最も好ましくは、植物根細胞はニンジン細胞である。形質転換された宿主ニンジン細胞は懸濁状態で成長することに特に留意しなければならない。
【0158】
さらなる局面において、本発明は、外因性の組換えリソソーム酵素を使用することによって、リソソーム蓄積疾患を有する対象(好ましくは、哺乳動物対象)を処置するための方法に関する。
【0159】
開示および記載される場合、本発明は、本明細書中に開示される特定の例、プロセス工程および材料に限定されないことを理解しなければならない。これは、そのようなプロセス工程および材料は幾分異なり得るからである。本発明の範囲は、添付された請求項およびその均等物によってのみ限定されるので、本明細書中で使用されている用語法は、特定の実施形態を記載する目的のために使用されるだけであり、限定であることを意図していないこともまた理解しなければならない。
【0160】
本明細書および下記の請求項を通して、文脈がそうでないことを要求しない限り、語句「含む(comprise)」および変化形(例えば、「comprises」および「comprising」など)は、言及された完全体(integer)もしくは工程または完全体もしくは工程の群を包含するが、任意の他の完全体もしくは工程または完全体もしくは工程の群を排除しないことを意味することが理解される。
【0161】
本明細書および添付された請求項において使用されるように、「a」、「an」および「the」の単数形は、文脈が明らかにそうでないことを示さない限り、複数の参照物を含むことに留意しなければならない。
【0162】
下記の実施例は、本発明の様々な局面を実施する際に本発明者らによって用いられた様々な技術を表している。これらの技術は本発明の実施のための好ましい実施形態を例示しているが、当業者は、本開示に照らして、数多くの改変が、本発明の精神および意図された範囲から逸脱することなく行われ得ることを認識することを理解しなければならない。
【実施例】
【0163】
実験手順:
プラスミドベクター
*CE−T:これは、Galili教授から得られたプラスミドCEから構築された[米国特許第5367110号、1994年11月22日]。
プラスミドCEをSalIで消化した。
【0164】
SalI付着末端を、DNAポリメラーゼIのラージフラグメントを使用して平滑末端にした。その後、プラスミドをPstIで消化し、SmaIおよびPstIで消化された塩基性エンドキチナーゼ遺伝子[Arabidopsis thaliana]由来のER標的化シグナル(ATGAAGACTAATCTTTTTCTCTTTCTCATCTTTTCACTTCTCCTATCATTATCCTCGGCCGAATTC)およびタバコキチナーゼA由来の液胞標的化シグナル(GATCTTTTAGTCGATACTATG)をコードするDNAフラグメントに連結した。
【0165】
*pGREENII:これはP.Mullineaux博士から得られた[Roger P.Hellens他(2000)、Plant Mol.Biol.、42:819〜832]。pGREENIIベクターからの発現は、カリフラワーモザイクウイルス由来の35Sプロモーター、TMV(タバコモザイクウイルス)のΩ翻訳エンハンサーエレメント、および、アグロバクテリウム・ツメファシエンス由来のオクトピンシンターゼターミネーター配列によって制御される。
【0166】
cDNA
hGCD:これはATCC(アクセション番号65696)から得られ、グルコシダーゼβ(酸性)[グルコセレブロシダーゼ]を含有するGC−2.2[GCS−2kb;λEZZ−γ3ホモサピエンス]である。インサート長(kb):2.20;組織:繊維芽細胞WI−38細胞。
【0167】
発現プラスミドの構築
hGCDをコードするcDNA(ATTCクローン番号65696)を、フォワードプライマー(5’CAGAATTCGCCCGCCCCTGCA3’)およびリバースプライマー(5’CTCAGATCTTGGCGATGCCACA3’)を使用して増幅した。精製されたPCR DNA産物をEcoRIおよびBglIIのエンドヌクレアーゼ(プライマー内の下線部の認識配列を参照のこと)で消化し、同じ酵素で消化された、発現カセットE−Tを有する中間ベクターに連結した。発現カセットを、SmaIおよびXbaIの制限酵素を使用して切断し、中間ベクターから取り出し、バイナリーベクターpGREENIIに連結して、これにより、最終的な発現ベクターを形成させた。カナマイシン抵抗性が、pGREENIIベクターと一緒に得られるnosプロモーターにより駆動されるNPTII遺伝子によって付与される(図1B)。得られる発現カセットが図1Aにより示される。
【0168】
得られたプラスミドは、下記の配列決定用プライマーを使用して、シグナルの正しいインフレーム融合を保証するために配列決定された:5’の35Sプライマー:5’CTCAGAAGACCAGAGGGC3’、および3’ターミネーター:5’CAAAGCGGCCATCGTGC3’。
【0169】
ニンジンカルスの確立および細胞懸濁培養
本発明者らが行ったニンジンカルスの確立およびニンジン細胞懸濁培養は、Torres K.C.によって以前に記載された通りであった(Tissue culture techniques for horticular crops、111頁、169)。
【0170】
ニンジン細胞の形質転換および形質転換された細胞の単離
ニンジン細胞の形質転換を、以前に記載された方法[Wurtele,E.S.およびBulka,K.、Plant Sci.、61:253〜262(1989)]の適合化によるアグロバクテリウム形質転換を使用して行った。液体培地で成長する細胞を、カルスの代わりに、プロセスを通して使用した。インキュベーション時間および成長時間を、液体培養における細胞の形質転換のために適合させた。簡単に記載すると、アグロバクテリウム細菌をエレクトロポレーションによりpGREENIIベクターで形質転換し[den Dulk−Ra,A.およびHooykaas、P.J.(1995)、Methods Mol.Biol.、55:63〜72]、その後、30mg/mlのパロモマイシン抗生物質を使用して選択した。ニンジン細胞をアグロバクテリウム細菌で形質転換し、液体培地において60mg/mlのパロモマイシン抗生物質を使用して選択した。
【0171】
高レベルのGCDを発現するカルスを単離するための形質転換ニンジン細胞のスクリーニング
形質転換後14日目に、培養から得られた細胞を、個々の細胞クラスターからカルスを形成させるために3%充填細胞体積の希釈度で固体培地に置床した。個々のカルスが1cm〜2cmの直径に達したとき、細胞をSDSサンプル緩衝液においてホモジネートし、得られたタンパク質抽出物をSDS−PAGE[Laemmli U.(1970)、Nature、227:680〜685]で分離し、ニトロセルロースメンブラン(hybondCニトロセルロース、0.45ミクロン、カタログ番号:RPN203C、Amersham Life Scienceから得られる)に転写した。GCDを検出するためのウエスタンブロットを、ポリクローナル抗hGCD抗体(本明細書中下記に記載される)を使用して行った。著量のGCDを発現するカルスを拡大して、スケールアップ、タンパク質精製および分析のために液体培地での成長に移した。
【0172】
ポリクローナル抗体の調製
75マイクログラムの組換えGCD(Cerezyme(商標))を3mlの完全フロイントアジュバントに懸濁して、2羽のウサギのそれぞれに注射した。各ウサギには、追加免疫注射が2週間後に与えられた。ウサギは追加免疫注射後の約10日目に採血され、そして再び、抗体力価が低下し始めるまで1週間間隔で採血された。凝血塊を除いた後、血清を小分けして、−20℃で保存した。
【0173】
バイオリアクターにおけるスケールアップされた培養での成長
rh−GCD遺伝子を含有する遺伝子改変されたニンジン細胞の約1cm(直径)のカルスを、4.4gr/lのMSD培地(Duchefa)、9.9mg/lのチアミンHCl(Duchefa)、0.5mg/lの葉酸(Sigma)、0.5mg/lのビオチン(Duchefa)、0.8g/lのカゼイン加水分解物(Ducifa)、30g/lの糖、およびホルモンの2−4D(Sigma)を含有する、直径9cmのムラシゲ・スクーグ(MS)寒天培地平板に置床した。カルスを25℃で14日間増殖させた。
【0174】
懸濁細胞培養を、この分野で広く知られているように、形質転換されたカルスをMSD液体培地(0.2mg/lの2,4−ジクロロ酢酸を含有するムラシゲ・スクーグ(1962))で継代培養することによって調製した。懸濁細胞を、250ml三角フラスコにおいて、25℃で、60rpmの振とう速度で培養した(操作体積を25mlで開始し、7日後に50mlに増大させる)。その後、細胞培養体積を、同じ条件のもとで、操作体積を300mlまで増大することによって1L三角フラスコに増大させた。4LのMSD培地を含有する小型バイオリアクター(10L)の接種物[国際特許出願公開WO98/13469を参照のこと]を、7日間培養された2つの1L三角フラスコから得られた400mlの懸濁細胞を加えることによって得た。1Lpmの空気流を用いて25℃で1週間の培養の後、MDS培地を10Lにまで加え、培養を同じ条件のもとで継続した。さらに5日間の培養の後、細胞のほとんどを、細胞培地を80μの網に通すことによって集め、回収した。過剰な培地を絞り出し、充填細胞ケークを−70℃で保存した。
【0175】
バイオリアクター装置のさらなる詳細が、米国特許第6391638号(2002年5月21日発行、これは以前に参照により組み込まれている)に関して見出され得る。
【0176】
タンパク質精製
培地を不溶性GCDから分離するために、約100gの湿重量の細胞を含有する凍結細胞ケークを解凍し、その後、解凍された細胞を、17000xgで20分間、4℃で遠心分離した。不溶物および無傷の細胞を、100mlの洗浄緩衝液(20mMリン酸ナトリウム(pH7.2)、20mM EDTA)に再懸濁することによって洗浄し、次いで、17000xgで20分間の4℃での遠心分離によって沈殿させた。rh−GCD(組換えヒトGCD)を、ペレットを200mlの抽出緩衝液(20mMリン酸ナトリウム(pH7.2)、20mM EDTA、1mM PMSF、20mMアスコルビン酸、3.8gポリビニルピロリドン(PVPP)、1mM DTT、および1% Triton−x−100)においてホモジネートすることにより抽出し、可溶化した。その後、ホモジネートを、30分間、室温で振とうし、17000xgで20分間の4℃での遠心分離によって清澄化した。ペレットを捨て、上清のpHを濃クエン酸の添加によってpH5.5に調節した。pH調節後に生じた濁りを、上記に記載された同じ条件での遠心分離によって清澄化した。
【0177】
さらなる精製を下記のようなクロマトグラフィーカラム手順によって行った:200mlの清澄化された培地を、25mMクエン酸ナトリウム緩衝液(pH5.5)で平衡化され、XKカラム(2.6x20cm)に充填された20mlの強カチオン交換樹脂(Macro−Prep high−S担体、Bio−Rad)に負荷した。カラムは、伝導率、pHおよび280nmでの吸光度をモニターすることを可能にするAKTAプライムシステム(Amersham Pharmacia Biotech)と一体化された。サンプルを20ml/分で負荷し、その後、UV吸光度がベースラインに達するまで、カラムを、平衡化緩衝液(25mMクエン酸ナトリウム緩衝液、pH5.5)を用いて12ml/分の流速で洗浄した。rh−GCDのプレ溶出が、200mMのNaClを含有する平衡化緩衝液で行われ、溶出が、600mMのNaClを含有する平衡化緩衝液で得られた。処理時に集められた分画物は酵素活性アッセイによってモニターされ、酵素活性を示したチューブ(溶出ピークでの)がプールされた。プールされたサンプルは、5%エタノールを含有する水で希釈(1:5)され、NaOHでpH6.0にpH調節された。rh−GCDを含有するサンプルを、前カラムの場合と同じ樹脂の10mlが充填された第2のXKカラム(1.6x20cm)に加えた。このカラムにおける樹脂は、5%エタノールを含有する20mMクエン酸塩緩衝液(pH6.0)で平衡化された。サンプルを負荷した後、カラムを平衡化緩衝液で洗浄し、GCDを溶出緩衝液(20mMクエン酸塩緩衝液(pH6.0)、5%エタノール、および1M NaCl)によってカラムから溶出させた。溶出工程における吸収ピークの画分をプールして、第3のカラムに加えた。
【0178】
最終精製工程を、8mlの疎水性相互作用樹脂(TSKゲル、Toyopearl Phenyl−650C、Tosoh Corp.)が充填されたXKカラム(1.6x20cm)で行った。樹脂は、5%エタノールを含有する10mMクエン酸塩緩衝液(pH6.0)で平衡化された。前カラムからのGCD溶出プールを6ml/分で負荷し、その後、UV吸収がベースラインに達するまで、平衡化緩衝液で洗浄した。純粋なGCDが、50%エタノールを含有する10mMクエン酸塩緩衝液)により溶出され、プールされ、−20℃で保存された。
【0179】
タンパク質濃度の測定
細胞抽出物および分画物におけるタンパク質濃度を、ウシ血清アルブミン標準品(第V画分、Sigma)を使用してLowry/Bradfordの方法(Bio Radタンパク質アッセイ)[Bradford、M.、Anal.Biochem.(1976)、72:248]によってアッセイした。あるいは、均質なタンパク質サンプルの濃度は280nmにおける吸収によって決定された(1mg/ml=1.4O.D280)。純度は280/260nm比によって決定された。
【0180】
GCD酵素活性アッセイ
GCDの酵素活性を、p−ニトロフェニル−β−D−グルコピラノシド(Sigma)を基質として使用して測定した。アッセイ緩衝液は、60mMリン酸塩−クエン酸塩緩衝液(pH=6)、4mMのβ−メルカプトエタノール、1.3mMのEDTA、0.15%のTriton X−100、0.125%のタウロコール酸ナトリウムを含有した。アッセイを96ウエルELISAプレートで行った。0〜50マイクロリットルのサンプルを250マイクロリットルのアッセイ緩衝液とインキュベーションし、基質を4mMの最終濃度に添加した。反応液を37℃で60分間インキュベーションした。生成物(p−ニトロフェニル;pNP)の形成が405nmにおける吸光度によって検出された。405nmにおける吸光度をt=0および終点でモニターした。60分後、6マイクロリットルの5N NaOHを各ウエルに加え、405nmにおける吸光度を再びモニターした。並行してアッセイされた参照標準曲線を使用して、試験されたサンプルにおけるGCDの濃度を定量した[Friedman他(1999)、Blood、93(9):2807〜16]。
【0181】
生化学的分析:
ゲル内タンパク質分解および質量分析法による分析
ゲル内の染色されたタンパク質バンドを清浄なカミソリ刃で切り、ゲル内のタンパク質を10mMのDTTで還元し、100mMのヨードアセトアミド/10mM重炭酸アンモニウムで修飾した。ゲル片を50%アセトニトリル/10mM重炭酸アンモニウムで処理して、タンパク質から染色剤を除き、その後、ゲル片を乾燥した。乾燥したゲル片を、サンプルあたり約0.1μgのトリプシンを含有する10%アセトニトリル/10mM重炭酸アンモニウムで再水和した。ゲル片を37℃で一晩インキュベーションし、得られたペプチドを、0.1%トリフルオロアセタートを含む60%アセトニトリルで回収した。
【0182】
トリプシン消化ペプチドを、多孔性R2(Persepective)が充填(homo−filled)された0.1X300mm溶融シリカキャピラリー(J&W、内径:100マイクロメートル)での逆相クロマトグラフィーによって分離した。ペプチドを、約1μl/分の流速で、水における0.1%酢酸を伴う5%〜95%のアセトニトリルの80分間の直線グラジエントを使用して溶出した。カラムからの液体をイオントラップ質量分析計(LCQ、Finnegan、San Jose、CA)にエレクトロスプレーした。質量分析を、反復的に全域MS走査を使用し、その後、最初のMS走査から選択された最も優勢なイオンの衝突解離(CID)を使用して陽イオンモードで行った。質量分析データを、Sequestソフトウエア[J.EngおよびJ.Yates、ワシントン大学およびFinnegan(San Jose)]を使用して、シミュレートされたタンパク質分解、および、NR−NCBIデータベースにおけるタンパク質のCIDと比較した。
【0183】
タンパク質のアミノ末端をペプチドシーケンンサー494A(Perkin Elmer)において製造者の説明書に従って配列決定した。
【0184】
腹腔マクロファージのGCD取り込み
GCDのマクロファージに対する標的化および取り込みが、マンノース/N−アセチルグルコサミン受容体によって媒介されることが知られており、これは、Stahl P.およびGordon S.[J.Cell Biol.(1982)、93(1):49〜56]によって記載されるように、マウスから得られたチオグリコラート誘発の腹腔マクロファージを使用して測定することができる。簡単に記載すると、マウス(メス、C57−B6系統)に2.4%のデキストロース非含有Bacto−チオグリコラート培地(Difcoカタログ番号0363−17−2)の2.5mlを腹腔内注射した。4日後〜5日後、処置マウスを頸部脱臼によって屠殺し、腹膜腔をリン酸塩緩衝化生理的食塩水で洗い流した。細胞を遠心分離(1000xg、10分間)によってペレット化し、10%ウシ胎児血清を含有するDMEM(Beit Haemek、イスラエル)に再懸濁した。その後、細胞を1〜2x105細胞/mlで96ウエル組織培養プレートに置床して、37℃でインキュベーションした。90分後、非接着性細胞を、PBSを使用して3回洗浄して除き、接着性マクロファージを、酵母マンナン(2−10、5mg/ml)の非存在下および存在下、200マイクロリットルの最終体積における0〜40マイクログラムの範囲で指定量のrhGCDを含有する培養培地において37℃で90分間インキュベーションした。インキュベーション後、過剰なrGCDを含有する培地を除き、細胞をPBSで3回洗浄して、溶解緩衝液(10mM Tris(pH=7.3)、1mM MgCl2、0.5%NP−40、およびプロテアーゼ阻害剤)で溶解した。細胞によるrGCD取り込みの活性を、細胞溶解物を、上記のようなインビトログリコシダーゼアッセイに供することによって測定した。
【0185】
(実施例1)
発現プラスミドの構築
本実施例では、下記の実施例に関して使用される例示的な発現プラスミドの構築がより詳しく記載される。
【0186】
hGCDをコードするcDNA(ATTCクロン番号65696)を、フォワードプライマーの5’CAGAATTCGCCCGCCCCTGCA3’(これはまた配列番号1によって表される)およびリバースプライマーの5’CTCAGATCTTGGCGATGCCACA3’(これはまた配列番号2によって表される)を使用して増幅した。
【0187】
精製されたPCR DNA産物をEcoRIおよびBglIIのエンドヌクレアーゼ(プライマー内の下線部の認識配列を参照のこと)で消化し、同じ酵素で消化された、発現カセットCE−Tを有する中間ベクターに連結した。CE−Tは、塩基性エンドキチナーゼ遺伝子[Arabidopsis thaliana]由来のER標的化シグナルMKTNLFLFLIFSLLLSLSSAEA(これはまた配列番号3によって表される)、および、タバコキチナーゼA由来の液胞標的化シグナルDLLVDTM*(これはまた配列番号4によって表される)を含む。
【0188】
発現カセットを、SmaIおよびXbaIの制限酵素を使用して切断し、中間ベクターから取り出し、バイナリーベクターpGREENIIに連結して、これにより、最終的な発現ベクターを形成させた。カナマイシン抵抗性が、pGREENIIベクターと一緒にnosプロモーターにより駆動されるNPTII遺伝子によって付与される(図1B)。得られる発現カセットが図1Aにより示される。
【0189】
得られたプラスミドは、下記の配列決定用プライマーを使用して、シグナルの正しいインフレーム融合を保証するために配列決定された:
5’の35Sプライマーに由来するプライマー:5’CTCAGAAGACCAGAGGGC3’(これはまた配列番号5によって表される)、および3’のターミネーター:5’CAAAGCGGCCATCGTGC3’(これはまた配列番号6によって表される)。確認されたクローン化hGCDのコード配列が配列番号7によって表される。
【0190】
(実施例2)
ニンジン細胞の形質転換、およびrhGCDを発現する形質転換された細胞に対するスクリーニング
本実施例では、下記の実施例で使用されるような、本発明に従ってニンジン細胞を形質転換するための例示的な方法が記載される。
【0191】
ニンジン細胞の形質転換を、[WurteleおよびBulka(1989)、同上]によって以前に記載されたようにアグロバクテリウム形質転換によって行った。遺伝子改変されたニンジン細胞を、形質転換体を選択するための抗生物質を含むムラシゲ・スクーグ(MS)寒天培地に置床した。図2により示されるように、生成途中のカルスから調製された抽出物を、抗hGCD抗体を使用するウエスタンブロット分析によってGCDの発現について調べ、Cerezyme標準品(陽性コントロール)および非形質転換細胞の抽出物(陰性コントロール)と比較した。調べられた様々なカルスの中で、1つのカルス(No.22)がスケールアップ成長およびタンパク質精製のために選択された。
【0192】
ウエスタンブロットは下記のように行われた。
【0193】
このアッセイの場合、得られたサンプルからのタンパク質がSDSポリアクリルアミドゲル電気泳動で分離され、ニトロセルロースに転写された。この目的のために、SDSポリアクリルアミドゲルは下記のように調製された。SDSゲルは、(Laemmli,UK(1970)、バクテリオファージT4の頭部の組み立て時における構造タンパク質の切断、Nature、227、680〜685)に従って)濃縮ゲルおよび分離ゲルからなる。分離ゲルの組成は下記の通りであった:12%アクリルアミド(Bio−Rad)、10mlのゲル溶液あたり4マイクロリットルのTEMED(N,N,N’,N’−テトラメチルエチレンジアミン;Sigmaカタログ番号T9281)、0.1%SDS、375mM Tris−HCl(pH8.8)、および0.1%過硫酸アンモニウム(APS)。TEMEDおよび過硫酸アンモニウムは、この状況では、重合のためのフリーラジカル開始剤として使用された。重合を開始させた約20分後に、濃縮ゲル(3%アクリルアミド、0.1%SDS、126mM Tris−HCl(pH6.8)、0.1%APS、および、5mlの濃縮ゲル溶液あたり5マイクロリットルのTEMED)を分離ゲルの上に注ぎ、12スペースコームまたは18スペースコームを挿入して、サンプル用ウエルを作製した。
【0194】
陽極チャンバーおよび陰極チャンバーを同一の緩衝液溶液(SDSを含有するTrisグリシン緩衝液(Biorad、カタログ番号161−0772)、pH8.3)で満たした。抗原含有物質を0.5容量のサンプル負荷緩衝液(30mlグリセロール(Sigma、カタログ番号G9012)、9%SDS、15mlメルタプトエタノール(Sigma、カタログ番号M6250)、187.5mM Tris−HCl(pH6.8)、500マイクロリットルのブロモフェノールブルー、これらはすべて、100mlのサンプル緩衝液あたりの体積である)で処理した。その後、混合物を100℃で5分間加熱して、濃縮ゲルに負荷した。
【0195】
電気泳動を、室温で、好適な時間にわたって、例えば、サイズが13x9cmのゲルの場合、50ボルト〜70ボルトの定電流強度を使用して45分間〜60分間、その後、180V〜200Vで45分間〜60分間にわたって行った。その後、抗原をニトロセルロース(Schleicher and Schuell、Dassel)に転写した。
【0196】
タンパク質転写は、実質的には本明細書中に記載される通りに行われた。ゲルを、Whatmann3MMろ紙、厚さ0.5cmの導電性発泡物、および、白金電極により電流を通すワイヤ電極の間に、接するニトロセルロースと一緒に配置した。ろ紙、発泡物およびニトロセルロースを、転写緩衝液(Bioradから得られるTG緩衝液(カタログ番号161−0771);これは、メタノールおよび水の緩衝液(20%メタノール)で10倍希釈された)十分に浸した。転写は、100Vで90分間、4℃で行われた。
【0197】
転写後、ニトロセルロース上の未結合の結合部位を、リン酸塩緩衝液(Riedel deHaen、カタログ番号30435)で希釈された、1%乾燥乳(Dairy America)および0.1%Tween20(Sigma、カタログP1379)を含有するブロッキング緩衝液を用いて4℃で一晩飽和させた。ブロットストリップを抗体(希釈度、上記のように1%乾燥乳および0.1%Tween20を含有するリン酸塩緩衝液(pH7.5)において1:6500)と37℃で1時間インキュベーションした。
【0198】
抗体とインキュベーションした後、ブロットを、PBS(リン酸塩緩衝化リン酸ナトリウム緩衝液(Riedel deHaen、カタログ番号30435))で3回、それぞれの場合について10分間、洗浄した。その後、ブロットストリップを、室温で1時間、好適な二次抗体(ヤギ抗ウサギ(全分子)HRP(Sigma、カタログ#A−4914)、リン酸塩緩衝液(Riedel deHaen、カタログ番号30435)で希釈された、1%乾燥乳(Dairy America)および0.1%Tween20(Sigma、カタログP1379)を含有する緩衝液で1:3000希釈)とインキュベーションした。PBSで数回洗浄した後、ブロットストリップを、ECL発色剤試薬(Amersham RPN2209)で染色した。
【0199】
ブロットをECL試薬に浸けた後、ブロットをX線フィルム(FUJI Super RX 18x24)に感光させ、FUJI−ANATOMIX現像液および定着液(FUJI−X定着、カタログ#FIXRTU1/2)で現像した。抗体が結合したタンパク質を特徴づけるバンドが、この処理の後に視認された。
【0200】
バイオリアクターにおけるアップスケールされた培養での成長
カルス22の懸濁培養物を、形質転換されたカルスを液体培地で継代培養することによって得た。細胞を、(実験手順に記載されるように)、総体積がバイオリアクターへの接種のために十分になるまで振とう三角フラスコで培養した。遺伝子改変された遺伝子組換えニンジン細胞は数ヶ月間にわたって培養することができ、細胞収穫を5日〜7日のサイクルで行うことができる(データは示されず)。ニンジン細胞におけるrh−GCD産生量がピークに達する培養7日目に、細胞を、培養物を100メッシュの網に通すことによって集めた。細胞は、ろ過または遠心分離などのこの分野で知られている手段によって集めることができることには留意しなければならない。充填細胞ケーク(これは、h−GCDを均一に精製するための材料を提供する)は凍結温度で保存することができる。
【0201】
(実施例3)
形質転換ニンジン細胞からの組換え産生された活性なHGCDタンパク質の精製
形質転換されたニンジン細胞で発現した組換えh−GCDは、細胞の内膜に結合し、培地に分泌されないことが見出された。機械的な細胞破壊では、rGCDは不溶性の膜破砕物に結合したままである(データは示されず)。その場合、rGCDは、穏和な界面活性剤を使用して溶解され、細胞破砕物および他の不溶成分から分離された。可溶性酵素は、実験手順において記載されたように、カチオン交換クロマトグラフィーカラムおよび疎水性相互作用クロマトグラフィーカラムを含むクロマトグラフィー技術を使用してさらに精製された。
【0202】
培地を不溶性GCDから分離するために、約100gの湿重量の細胞を含有する凍結細胞ケークを解凍し、その後、17000xgで20分間、4℃で遠心分離した。不溶物および無傷の細胞を、100mlの洗浄緩衝液(20mMリン酸ナトリウム(pH7.2)、20mM EDTA)に再懸濁することによって洗浄し、17000xgで20分間の4℃での遠心分離によって沈殿させた。rh−GCDを、ペレットを200mlの抽出緩衝液(20mMリン酸ナトリウム(pH7.2)、20mM EDTA、1mM PMSF、20mMアスコルビン酸、3.8gポリビニルピロリドン(PVPP)、1mM DTT、および1% Triton−x−100(Sigma))においてホモジネートすることにより抽出し、可溶化した。ホモジネートを、30分間、室温で振とうして、17000xgで20分間の4℃での遠心分離によって清澄化した。ペレットを捨て、上清のpHを濃クエン酸の添加によってpH5.5に調節した。pH調節後に生じた濁りを、上記で記載された同じ条件での遠心分離によって清澄化した。
【0203】
さらなる精製を下記のようにクロマトグラフィーカラムによって行った:最初の段階では、200mlの清澄化された抽出物を、25mMクエン酸ナトリウム緩衝液(pH5.5)で平衡化され、XKカラム(2.6x20cm)に充填された20mlの強カチオン交換樹脂(Macro−Prep high−S担体、Bio−Rad)に負荷した。カラムは、伝導率、pHおよび280nmでの吸光度をモニターすることを可能にするAKTAプライムシステム(Amersham Pharmacia Biotech)と一体化された。サンプルを20ml/分で負荷し、その後、UV吸光度がベースラインに達するまで、カラムを、平衡化緩衝液(25mMクエン酸ナトリウム緩衝液、pH5.5)を用いて12ml/分の流速で洗浄した。rh−GCDのプレ溶出が、200mMのNaClを含有する平衡化緩衝液で行われ、溶出が、600mMのNaClを含有する平衡化緩衝液で得られた。処理時に集められた分画物は酵素活性アッセイによってモニターされ、酵素活性を示したチューブ(溶出ピークでの)がプールされた。プールされたサンプルは、5%エタノールを含有する水で希釈(1:5)され、NaOHでpH6.0にpH調節された。
【0204】
図3Aには、この精製段階の標準的な処理が表される。処理時に集められた分画物は、図3Bにより示されるように、酵素活性アッセイによってモニターされた。図3Cは、活性についてアッセイされた溶出分画物のクーマシーブルー染色を示す。
【0205】
rGCDを含有する溶出分画物を、第2の精製段階のために、前カラムの場合と同じ樹脂の10mlが充填された第2のXKカラム(1.6x20cm)に加えた。このカラムにおける樹脂は、5%エタノールを含有する20mMクエン酸塩緩衝液(pH6.0)で平衡化された。サンプルを負荷した後、カラムを平衡化緩衝液で洗浄し、rGCDを溶出緩衝液(20mMクエン酸塩緩衝液(pH6.0)、5%エタノール、および1M NaCl)によってカラムから溶出させた。図3Dには、この精製段階の標準的な処理が表される。処理時に集められた分画物は、図3Eにより示されるように、酵素活性アッセイによってモニターされた。図3Fは、活性についてアッセイされた溶出分画物のクーマシーブルー染色を示す。
【0206】
溶出工程における吸収ピークの分画物を、第3の精製段階のために、プールして、第3のカラムに加えた。第3の精製段階は、8mlの疎水性相互作用樹脂(TSKゲル、Toyopearl Phenyl−650C、Tosoh Corp.)が充填されたXKカラム(1.6x20cm)で行われた。樹脂は、5%エタノールを含有する10mMクエン酸塩緩衝液(pH6.0)で平衡化された。前カラムからのGCD溶出プールを6ml/分で負荷し、その後、UV吸光度がベースラインに達するまで、平衡化緩衝液で洗浄した。純粋なGCDが、50%エタノールを含有する10mMクエン酸塩緩衝液によって溶出され、プールされ、−20℃で保存された。
【0207】
図4Aには、この精製段階の標準的な処理が表される。処理時に集められた分画物は、酵素活性アッセイによってモニターされた(図4B)。図4Cは、活性についてアッセイされた溶出分画物のクーマシーブルー染色を示す。
【0208】
処理された細胞の回分精製において、rGCDタンパク質が、95%を超えるレベルに精製された。最初の段階および第3の段階だけが行われた場合、純度は約80%のレベルで達成される(データは示されず)。
【0209】
生化学的分析
精製されたrhGCDの同一性を確認するために、Mass−Spec Mass−Spec(MSMS)分析が行われた。得られた結果から、リーダーペプチド配列および標的化配列を含めて、タンパク質配列の49%の範囲が、発現カセットのDNAに基づく予測されたアミノ酸配列と一致することが示された。
【0210】
腹腔マクロファージにおける組換えhGCDの取り込みおよび活性
ニンジンにおいて産生されたrhGCDが正しくグリコシル化されており、また、標的細胞による取り込みを受けることができ、従って、ゴーシェ病を処置するために有用であるかどうかを明らかにするために、マクロファージに結合し、マクロファージによって取り込まれるrhGCDの能力を次にアッセイした。マクロファージに対するrhGCDの標的化は、マンノース/N−アセチルグルコサミン(Man/GlcNAc)受容体によって媒介されており、チオグリコラート誘発の腹腔マクロファージを使用して明らかにすることができる。図5によって示されるように、rGCDは、高いレベルで、細胞による取り込みを受ける。図5Aには、マンナン濃度に関して本発明によるrGCDの細胞による取り込みが示される。
【0211】
図5Aには、Cerezyme(商標)と匹敵するレベルでの取り込みが示される(この調製物は、上記の精製プロセスの最初の段階および第3の段階だけにより80%の純度に調製された)。
【0212】
図5Bおよび図5Cには、この調製物は、上記に記載された精製プロセスの3つの段階すべてによって95%を超える純度に調製されたので、rGCDの取り込みが、Cerezyme(商標)よりも高いレベルであることが示される。
【0213】
図5Cに関して、明らかに、4mg/mlのマンナンによって阻害される総活性からの比活性の割合は、本発明のGCD(rGCD、すなわち、組換えヒトGCD)の方が、下記のように、市場において現在得られる製造物よりも大きい:GCD(CB−mix1、これは本発明のrGCDである)−75%、Cerezyme−65%。
【0214】
さらに、図によって示されるように、マンナンの添加は、細胞によるrGCDの結合を明らかに阻害した。2mg/mlのマンナンの濃度では、rGCDの結合が50%阻害された。
【0215】
これらの結果は、グリカン構造の再構成がない場合でさえも、形質転換された二ンジン細胞から発現および精製されたrhGCDは、Man/GlcNAc受容体を介して特異的にマクロファージ細胞を標的化するために取り込みを受けることができることを示している。そのうえ、本発明の組換えrhGCDは酵素活性である。
【0216】
図5Dには、rhGCDがまた、ウエスタンブロットにおいて抗GCD抗体によって認識されることが示される:rGCDは本発明によるタンパク質を示し、一方、GCD標準品(レーンあたり5ng、10ngおよび25ngで示される)は市販のGCD(Cerezyme(登録商標))である。
【0217】
(実施例4)
毒物学試験
上記の精製手順に従って得られた物質を、標準的な毒物学試験プロトコル(医薬品のための単回用量急性毒性試験に関する業界指針、薬物評価研究センター(CDER)PT1(61FR43934、1996年8月26日)に従って、また、ICH M3(M)、医薬品のためのヒト臨床試験を実施するための非臨床的安全性研究、CPMP/ICH/286/95改訂、2000年11月16日)によって調べた。
【0218】
マウスに下記のように注射した。1.8mg/kg(臨床用量)を最初に投薬し、続いて9mg/kgおよび18mg/kgを投薬した。試験群には、6匹のマウス(ICR CD−1;3匹のオスおよび3匹のメス)が、本発明によるrGCD(25mMクエン酸塩緩衝液、150mM NaCl、0.01%Tween80、5%エタノールを特徴とする液体キャリアにおいて)を投与するために含まれ、別の6匹のマウスが、コントロール群としてキャリア単独で処置されるために含まれた。その後、マウスは14日間にわたって観察され、安楽死させられた。どのマウスも、計画された安楽死の前には死亡しなかった。どのマウスも、処置に由来する顕著な影響を何ら示さなかった。全体的な病理学的知見および/または体重変化がマウスのいずれにおいても見出されなかった。
【0219】
(実施例5)
グリコシル化分析
前記の実施例に関して記載されたように産生されたrGCDに存在するグリカン構造の分析を行った。より詳細には下記において記載されるように、結果は、グリカンの大部分が、高マンノース構造だけでなく、末端マンノース残基を含有することを示している。好都合には、この高マンノース精製物は生物学的に活性であることが見出され、従って、さらなる工程がその活性化のために必要とされなかった。
【0220】
下記の方法が、上記で示された実施例に従って産生された組換えhGCDのグリコシル化構造を決定するために使用された。簡単に記載すると、N−グリカンおよびO−グリカンの両方についての単糖の結合が、加水分解およびGC−MSの方法を使用することによって決定された。この方法では、ペプチドに対する炭水化物の結合タイプ、および、糖タンパク質の全体的な単糖組成が推定される。以前の知識、そしてまた、様々な単糖間の比率に基づいて、この方法では、糖タンパク質におけるグリカンのタイプが示唆され得る。この情報は、タンパク質に存在する可能なグリカン構造を推定するために重要である。
【0221】
別の方法はN−グリカン集団のオリゴ糖分析を特徴とした。FAB−MSおよびMALDI−TOF MSが、サンプルの一部をトリプシンおよびペプチドN−グリコシダーゼF(PNGaseF)で消化し、グリカンを完全メチル化した後に行われた。この方法は、N結合型炭水化物を酵素消化された糖タンパク質から分離および単離するために使用される。単離されたグリカン混合物におけるグリカン集団の質量が測定され、それらの質量が、データベースから得られる既知構造の質量と、単糖組成分析に照らして比較される。提案された構造はまた、供給源生物のグリコシル化パターンにも基づいている。
【0222】
別の方法では、トリプシンおよびPNGaseFで処理された糖タンパク質の還元的脱離、脱塩、そして完全メチル化の後におけるO−グリカン集団を分析することが含まれた。O−グリカンはPNGaseFによって遊離されず、従って、ペプチドに結合したままのグリカンは、O結合型グリカンである可能性が最も高い。その後、これらのグリカンは還元的脱離によって遊離させられ、その質量が分析される。
【0223】
単糖組成分析(下記に要約される)により、植物でのグリコシル化に特徴的な、ヘキソース、ヘキソサミンおよびペントースの特徴的な分布が明らかにされた。GlcNacとマンノースとの比率は、特徴的なN結合型構造が優勢なグリカン集団であることを示唆している。
【0224】
上記で記載されたように産生されたhGCDに由来するN−グリカンの質量分析法による分析では、優勢なN−グリカン集団は、Pent.deoxyHex.Hex3.HexNAc2の単糖組成を有することが示される。
【0225】
材料および方法
分析を、ガスクロマトグラフィー−質量分析(GC−MS)、高速原子衝撃質量分析(FAB−MS)および遅延抽出−マトリックス支援レーザー脱離イオン化−飛行時間質量分析(DE−MALDI−TOF MS)の組合せを使用して行った。
【0226】
オリゴ糖分析の場合、N−グリカン集団が、サンプルの一部をトリプシンおよびペプチドN−グリコシダーゼF(PNGaseF)で消化し、グリカンを完全メチル化した後、FAB−MSおよびMALDI−TOF MSによって分析された。O−グリカン集団は、トリプシンおよびPNGaseFで処理された糖タンパク質の還元的脱離、脱塩、そして完全メチル化の後に分析された。
【0227】
N−グリカンおよびO−グリカンの両方についての単糖結合が、加水分解、誘導体化およびGC−MSの方法を使用して決定された。
【0228】
実験の記載
サンプル
サンプルバイアルには、下記(表1)のように特有のサンプル番号が付けられた:
【表1】

サンプルは、必要とされるまで、−10℃および−30℃で保存された。
【0229】
タンパク質化学
無傷サンプルの透析
1個のバイアル(0.8mg/mlの規定された濃度で1mlのタンパク質を含有する)をSlide−A−Lyzer透析カセット(10kDaの分子量排除)に入れ、水に対して4℃で24時間にわたって透析した。水は3回交換された。透析後、サンプルをカセットから取り出し、凍結乾燥した。
【0230】
オリゴ糖スクリーニングのための無傷サンプルのトリプシン消化
透析された凍結乾燥サンプルを、10%アンモニア水でpH8.4に調節された50mM重炭酸アンモニウム緩衝液に再懸濁して、SOP B001およびSOP B003に従って37℃で4時間、TPCK処理トリプシンで消化した。反応を、95℃の加熱ブロックに2分間入れることによって停止させ、その後、凍結乾燥した。
【0231】
炭水化物化学
ペプチドN−グリコシダーゼAによる消化
糖タンパク質サンプルから得られる、トリプシン切断されたペプチド/糖タンパク質の混合物を、酢酸アンモニウム緩衝液(pH5.5)において37℃で15時間、酵素ペプチドN−グリコシダーゼA(PNGaseA)で処理した。反応を凍結乾燥によって停止させた。得られた生成物を、C18Sep−Pakカートリッジを使用して精製した。
【0232】
還元的脱離
潜在的なO結合型糖ペプチドを含有するSep−Pak画分を、0.05M水酸化ナトリウムにおける10mg/mlのホウ水素化ナトリウムの溶液に溶解し、45℃で16時間インキュベーションした。反応を氷酢酸の添加によって停止させた。
【0233】
還元的脱離物質の脱塩
Dowexビーズを使用する脱塩をSOP B022に従って行った。サンプルをカラムに負荷し、4mlの5%酢酸水溶液で溶出した。回収された画分を凍結乾燥した。
【0234】
遊離した炭水化物の完全メチル化
5%酢酸水溶液のSep−Pak画分に溶出しているN結合型炭水化物、および、還元的脱離により遊離する潜在的なO結合型グリカンを、水酸化ナトリウム(NaOH)/ヨウ化メチル(MeI)法(SOP B018)を使用して完全メチル化した。完全メチル化されたN結合型グリカン混合物の一部をFAB−MSおよびMALDI−TOF MSによって分析し、残りを結合分析に供した。
【0235】
N結合型炭水化物の結合分析
誘導体化
トリプシンおよびPNGaseAでの消化または還元的脱離の後に得られた完全メチル化グリカンサンプル混合物を加水分解し(2M TFA、120℃で2時間)、次いで還元した(2M NH4OHにおけるホウ重水素化ナトリウム(NaBD4)、室温で2時間、SOP B025)。ホウ重水素化物の分解時に生じるホウ酸塩を、メタノール/氷酢酸(90:10)の混合物の添加、それに続く凍結乾燥を3回行うことによって除いた。その後、サンプルを、無水酢酸を使用してアセチル化した(100℃で1時間)。アセチル化されたサンプルを、クロロホルムへの抽出によって精製した。部分的にメチル化されたアルジトールアセタートを、その後、ガスクロマトグラフィー/質量分析(GC/MS)によって調べた。部分的にメチル化されたアルジトールアセタートの標準物混合物、およびブランクもまた、同じ条件のもとで処理された。
【0236】
気液クロマトグラフィー/質量分析(GC/MS)
ヘキサンに溶解された誘導体化後の炭水化物サンプルの一部(1μl)を、Autosystem XLガスクロマトグラフおよびDellデータシステムを備えるPerkin Elmer Turbomass Gold質量分析計によって下記の条件のもとで分析した:
ガスクロマトグラフィー
カラム:DB5
注入:オンカラム
インジェクター温度:40℃
プログラム:40℃で1分間、その後、70℃/分で100℃に、100℃で1分間保持し、その後、8℃/分で290℃に、最後に、290℃で5分間保持する。
キャリアガス:ヘリウム
質量分析
イオン化電圧:70eV
取得モード:スキャニング
質量範囲:35〜450ダルトン
MS分解能:ユニット
【0237】
無傷グルコセレブロシダーゼの糖分析
誘導体化
500μgのグルコセレブロシダーゼに等しい小分け物を、内部標準としての10μgのアラビトールとともに凍結乾燥した。これを、その後、80℃で一晩のメタノリシスに供し、窒素下で乾燥した。遊離した単糖を、メタノール、ピリジンおよび無水酢酸の溶液を使用して再度N−アセチル化し、再び窒素下で乾燥して、SOP B023に従ってそれらのトリメチルシリル(TMS)誘導体に変換した。TMS誘導体を窒素下で濃縮し、2mlのヘキサンに溶解し、3分間超音波処理した。その後、サンプルを4℃で一晩平衡化させた。10μgのアラビトールを含有するブランクと、各10μgのフコース、キシロース、マンノース、ガラクトース、グルコース、N−アセチルガラクトサミン、N−アセチルグルコサミン、N−アセチルノイラミン酸およびアラビトールを含有する標準物単糖混合物とを、並行して調製した。その後、TMS誘導体をガスクロマトグラフィー/質量分析(GC/MS)によって調べた。
【0238】
気液クロマトグラフィー/質量分析(GC/MS)
ヘキサンに溶解された誘導体化後の炭水化物サンプルの一部(1μl)を、Autosystem XLガスクロマトグラフおよびDellデータシステムを備えるPerkin Elmer Turbomass Gold質量分析計によって下記の条件のもとで分析した:
ガスクロマトグラフィー
カラム:DB5
注入:オンカラム
インジェクター温度:40℃
プログラム:90℃で1分間、その後、25℃/分で140℃に、5℃/分で220℃に、最後に10℃/分で300℃に、そして300℃で5分間保持する。
キャリアガス:ヘリウム
質量分析
イオン化電圧:70eV
取得モード:スキャニング
質量範囲:50〜620ダルトン
MS分解能:ユニット
【0239】
遅延抽出−マトリックス支援レーザー脱離イオン化質量分析(DE−MALDI MS)および高速原子衝撃質量分析(FAB−MS)
MALDI−TOF質量分析を、遅延抽出(DE)と結合させたVoyager STR Biospectrometry Research Stationレーザー解離質量分析計を使用して行った。
【0240】
乾燥した完全メチル化グリカンをメタノール:水(80:20)に再溶解し、2,5−ジヒドロ安息香酸のマトリックスを使用して分析した。ブラジキニン、アンジオテンシンおよびACTHを外部校正物質として使用した。
【0241】
陽イオン高速原子衝撃質量分析による分析を、約2500の分解能を有する最大感度での4500の質量範囲についてVacc=8kVで稼働するM−Scan’s VG AutoSpecE質量分析計において行った。セシウムイオンガンを、30kVで稼働してスペクトルを作製するために使用した。スペクトルは、Opusソフトウエアを使用してVAXデータシステム3100M76に記録された。
【0242】
乾燥した完全メチル化グリカンをメタノールに溶解し、2μl〜4μlのチオグリセロールがマトリックスとして事前に塗られた標的に負荷し、その後、供給源に挿入した。
【0243】
結果および考察
グルコセレブロシダーゼのTMS糖分析
N結合型オリゴ糖スクリーニング
無傷の糖タンパク質を透析に供し、トリプシン消化して、凍結乾燥生成物を、PNGaseAを使用して消化し、その後、C18Sep−Pakを使用して精製した。5%酢酸水溶液(N結合型オリゴ糖含有)画分を完全メチル化し、FAB質量スペクトルを、誘導体化されたオリゴ糖の一部を使用して、フラグメントイオンについて低質量範囲において得た。DE−MALDI−TOF質量スペクトルを、誘導体化されたオリゴ糖の一部を使用して、分子イオンについて高質量範囲において得た。
【0244】
グルコセレブロシダーゼ由来のN−グリカンの分析
表1には、FABスペクトルに存在する優勢なフラグメントイオン、および、MALDIスペクトルに存在する分子イオンが列挙される。分子イオン領域(付録IIIに示される)には、優勢なシグナルが、1505.8のm/z(これは、Pent.deoxyHex.Hex3.HexNAc2の組成を有する構造について[M+Na]+擬分子イオンと一致する)において含まれる。強度がより小さい一連の擬分子イオンもまた、複合マンノース構造および高マンノース構造と一致して検出された。検出された高マンノース構造は、サイズが、1579.8のm/zでのHex5.HexNAc2から、2193.0のm/zでのHex8.HexNAc2まで及ぶ。複雑なシグナルが、1331.7のm/z(これは、Pent.Hex3.HexNAc2の組成を有する構造について[M+Na]+擬分子イオンと一致する)などのあまりプロセシングされていないN−グリカンから、または、例えば、1751.0のm/z(これは、Pent.deoxyHex.Hex3.HexNAc3の組成を有する構造について[M+Na]+擬分子イオンと一致する)、2375.4のm/z(これは、Pent.deoxyHex2.Hex4.HexNAc4の組成を有する構造について[M+Na]+擬分子イオンと一致する)、および、2753.6のm/z(これは、Pent.deoxyHex2.Hex5.HexNAc4の組成を有する構造について[M+Na]+擬分子イオンと一致する)でのより大きいN−グリカンから生じている。
【0245】
FAB質量スペクトルは、スペクトルの低質量範囲におけるフラグメントイオンによるアンテナ構造に関する情報をもたらす(データは示されず)。様々なシグナルが検出され、これらにより、ヘキソース(219のm/zにおいて)およびHexNAc(260のm/zにおいて)がN−グリカンにおける非還元末端の単糖として確認された。
【表2】

【0246】
第1欄の質量はすべて、別途言及されない限り、モノアイソトピックである。ソフトウエアは、特に1700Da超える質量については、質量数を13C同位体ピークに帰属することが多いので、質量数は生データを直接には示していない場合がある。
【0247】
グルコセレブロシダーゼ由来のN−グリカンの結合分析
結合分析を、PNGaseA消化、Sep−Pak精製および完全メチル化の後に遊離したN結合型炭水化物について行った。
【0248】
複雑なクロマトグラムが、誘導体化試薬に起因するいくつかの不純物ピークとともに得られた。保持時間およびスペクトルを標準物混合物と比較することにより、表3に列挙される糖含有ピークの暫定的な帰属が可能であった。
【表3】

【0249】
4.3 O結合型オリゴ糖スクリーニング
還元的脱離を、トリプシン消化およびPNGaseA消化の後におけるグルコセレブロシダーゼのSep−Pak精製から得られる60%2−プロパノール画分(潜在的なO結合型糖タンパク質画分)について行った。サンプルを反応停止後に脱塩し、ホウ酸塩の除去後、完全メチル化した。FAB質量スペクトルを、誘導体化されたオリゴ糖の一部を使用して、フラグメントイオンについて低質量範囲において得た。DE−MALDI−TOF質量スペクトルを、誘導体化されたオリゴ糖の一部を使用して、分子イオンについて高質量範囲において得た。O結合型グリカンと一致するシグナルは観測されなかった(データは示されず)。
【0250】
グルコセレブロシダーゼ由来のO−グリカンの結合分析
結合分析を、還元的脱離の生成物について、完全メチル化の後に行った。典型的なO結合型グリカンの存在と一致するシグナルは観測されなかった(データは示されず)。
【0251】
図6には、哺乳動物細胞であるCHO(チャイニーズハムスター卵巣)細胞から得られたGCD(Cerezyme(商標))と、ニンジン細胞から得られた本発明のGCDとの間での比較としてのいくつかの例示的なグリカン構造が示される。示されるように、これらの構造の再構成が、Cerezyme(商標)については、露出したマンノース残基を得るために必要である。これに対して、そのような露出したマンノース残基が、本発明に従って植物細胞から得られたGCDについては、例えば、グリコシラーゼによるさらなる操作を必要とすることなく、直接的に得られる。
【0252】
図7には、rGCDに見出される主要なグリカン構造が表される。図7には、a)ニンジン細胞の懸濁状態で発現させたhGCにおいて見出される優勢なオリゴ糖集団(1505.7のm/z);b)典型的なN結合型コア;c)フコシル化された植物N結合型コアからなる提案された構造が示される。N結合型グリカンは、アスパラギンを介して、かつ、図の右側におけるGlcNac(GC)残基の還元性末端を介してタンパク質に結合する。植物でのグリコシル化パターンにおいて、フコース残基は、α(1−3)グリコシド結合を使用して最初のGlcNacに結合するコア構造の一部であり得るが、一方、哺乳動物構造では、典型的には、α(1−6)グリコシド結合が使用される。
【0253】
図8A〜図8Dには、本発明によるrGCDタンパク質において検出されたN−グリカンについてすべての可能な構造が示される。
【0254】
同定された優勢なグリカン構造は、エンドウマメ、イネ、トウモロコシおよび他の食用植物から得られるほとんどの植物糖タンパク質において見出されるコアグリカン構造である。この構造には、コアのキシロース残基が、コアα−(1,3)−フコースと同様に含有される。Bardor他(33)によって行われた研究では、非アレルギー性供血者の50%がその血清中にコアキシロースについて特異的な抗体を有し、25%がコアα−(1,3)−フコースに対する特異的な抗体を有することが示されている。しかしながら、そのような抗体が植物由来の生物医薬的な糖タンパク質の使用に対する制限をもたらし得るかどうかは、今後、研究されなければならない。
【0255】
上記で記載されたように産生されたhGCDの副グリカン集団は、主として、Hex4HexNAc2からHex8HexNAc2の高マンノース構造であった。複雑な構造のなかには、Pent.deoxyHex2.Hex4.HexNAc3およびPent.deoxyHex3.Hex5.HexNAc3などの構造を示すものがあった。Pent.Hex3.HexNAc2がより小さい割合で検出された。
【0256】
主要な末端単糖はヘキソース(マンノースまたはガラクトース)およびN−アセチルヘキソアミンであり、このことは、高マンノース構造および部分的にプロセシングされた複合構造の存在と一致している。
【0257】
O結合型オリゴ糖スクリーニングに関しては、典型的なO結合型グリカンと一致するシグナルは観測されなかった。これらの結果は、哺乳動物培養システムで産生された天然型GCDおよび組換えGCDを含めて、他の細胞システムから得られたGCDの既知のグリコシル化と一致しているように、GCDはO結合型オリゴ糖を有しないことが知られている。しかしながら、単糖組成において、アラビノースと一致するシグナルが検出された。
【0258】
本発明に関して重要な点は、hGCDタンパク質のN−グリカン組成分析により、N−グリカンの大部分がマンノース残基で終了していることが示されたことである。このことは、マクロファージのマンノース受容体による治療的hGCDの取り込みを助けるマンノース末端N−グリカンのための条件と一致する。しかしながら、哺乳動物細胞において産生された天然型GCDおよび組換えGCDはいずれも高マンノース型ではない。従って、本発明は、これらのタンパク質が、上記で記載されたように産生されたタンパク質とは異なり、マンノース糖で終了するために改変されるという、商業的に製造されているhGCDタンパク質の顕著な欠点を克服している。
【0259】
(実施例6)
本発明による処置
本発明に従って製造される組換えタンパク質は、好ましくは、植物細胞培養物によって産生される好適にグリコシル化されたタンパク質(これは、好ましくは、例えば、リソソーム酵素である)、および/または高マンノース型のグリコシル化タンパク質を含む。
【0260】
本発明における好ましい実施形態によれば、本発明に従って産生されるタンパク質は、リソソーム関連疾患(例えば、リソソーム蓄積疾患など)を処置するために好適である。
【0261】
処置方法は、場合により、そして好ましくは、(a)形質転換された植物根細胞から精製され、かつ、リソソーム酵素が異常に不足している細胞を効率的に標的化することができる組換え産生された生物学的に活性な形態のリソソーム酵素を提供すること(この場合、この組換え産生された生物学的に活性な酵素は、露出した末端マンノース残基を結合しているオリゴ糖に有する);および(b)組換え産生された生物学的に活性なリソソーム酵素の治療効果的な量、または、そのようなリソソーム酵素を含む組成物の治療効果的な量を対象に投与することを含む。好ましい実施形態において、本発明の方法によって使用される組換え産生された高マンノースリソソーム酵素は、本発明の宿主細胞によって産生され得る。好ましくは、この宿主細胞はニンジン細胞である。
【0262】
「哺乳動物対象」または「哺乳動物患者」により、遺伝子治療が所望される任意の哺乳動物(これには、ヒト、ウシ、ウマ、イヌおよびネコの対象が含まれる)が意味され、最も好ましくは、ヒト対象が意味される。
【0263】
用語「処置」はまた、病理学的状態および/またはその1つ以上の症状を改善または緩和すること、そのような状態を治療すること、あるいは、そのような状態を発生を予防することを包含することに留意しなければならない。
【0264】
別の好ましい実施形態において、本発明の方法によって使用されるリソソーム酵素は、露出したマンノース残基を有する少なくとも1つのオリゴ糖鎖を含む高マンノース酵素であり得る。本発明の組換え酵素は、対象の体内において標的部位における標的細胞上のマンノース受容体に結合することができる。より好ましくは、本発明の組換え酵素は、天然に存在するリソソーム酵素の標的細胞に対する対応する親和性と比較して、これらの標的細胞に対する増大した親和性を有する。従って、各用量は、GCDが異常に異常に不足している細胞を効果的に標的化することに依存し、そのような形態のGCDの各用量は、そうでない場合に、治療効果を達成するために類似する様式で投与される天然に存在するGCDの用量よりも実質的に少ない。
【0265】
本発明の好ましい実施形態によれば、本発明のタンパク質は、リソソーム蓄積疾患を処置するために好適であり、その結果、本発明はまた、そのような疾患を処置するための方法を含む。リソソーム蓄積疾患は、細胞のリソソームにおいて糖脂質または多糖の廃棄産物を分解する酵素をコードする遺伝子における欠陥の結果である40以上の障害からなる一群である。酵素反応産物(例えば、糖および脂質)は、その後、新しい産物に再利用される。これらの障害のそれぞれが、リソソームにおける酵素レベルに影響を及ぼす常染色体連鎖またはX連鎖の遺伝する劣性形質から生じている。一般に、罹患者の細胞および組織における影響を受けた酵素の生物学的または機能的な活性は認められない。そのような疾患において、酵素機能の欠如は、体内において細胞内のリソソームにおける脂質基質または炭水化物基質の進行性の全身的な堆積をもたらし、最終的には器官機能の喪失および死を生じさせる。リソソーム蓄積疾患の遺伝的病因、臨床的発現、分子生物学および可能性が、Scriver他[Scriver他編、The Metabolic and Molecular Basis of Inherited Disease、第7版、第II巻、McGraw Hill(1995)]に詳しく記載される。
【0266】
リソソーム蓄積疾患(およびその関連する欠損酵素)の例には、ファブリー病(α−ガラクトシダーゼ)、ファーバー病(セラミダーゼ)、ゴーシェ病(グルコセレブロシダーゼ)、Gmlガングリオシド症(β−ガラクトシダーゼ)、テイ・サックス病(β−ヘキソサミニダーゼ)、ニーマン・ピック病(スフィンゴミエリナーゼ)、シンドラー病(α−N−アセチルガラクトサミニダーゼ)、ハンター症候群(イズロナート−2−スルファターゼ)、スライ症候群(β−グルクロニダーゼ)、フルラー症候群およびハーラー・シャイエ症候群(イズロニダーゼ)、ならびにI細胞/サン・フィリポ症候群(マンノース−6−ホスフェート輸送因子)が含まれるが、これらに限定されない。
【0267】
ゴーシェ病はヒトにおける最も一般的なリソソーム蓄積疾患であり、アシュケナージ系ユダヤ人住民において最も高頻度に遭遇する。合衆国では約5000人〜10000人がこの疾患に冒されている[Grabowski、Adv.Hum.Genet.、21:377〜441(1993)]。ゴーシェ病はグルコセレブロシダーゼ(hGCD;グルコシルセラミニダーゼ)の欠如から生じている。この欠如は、骨髄、脾臓および肝臓の細網内皮細胞における酵素基質(グルコセレブロシド)の蓄積を生じさせ、その結果、骨髄拡張および骨劣化などの著しい骨格合併症、そしてまた、脾機能亢進症、肝腫大、血小板減少症、貧血および肺合併症をもたらす[Grabowski(1993)、同上;Lee、Prog.Clin.Biol.Res.、95:177〜217(1982)]。
【0268】
より詳細には、本発明の方法によって使用されるリソソーム酵素は、グルコセレブロシダーゼ(GCD)、酸性スフィンゴミエリナーゼ、ヘキソサミニダーゼ、α−N−アセチルガラクトサミニダーゼ、酸性リパーゼ、α−ガラクトシダーゼ、グルコセレブロシダーゼ、α−L−イズロニダーゼ、イズロナートスルファターゼ、α−マンノシダーゼまたはシアリダーゼからなる群から選択され得る。好ましくは、処置される疾患がゴーシェ病である場合、本発明の方法によって使用されるリソソーム酵素はグルコセレブロシダーゼ(GCD)である。
【0269】
本発明のタンパク質は、医薬組成物を製造するために使用することができる。従って、本発明の別の局面によれば、その有効成分として、タンパク質と、医薬的に許容され得るキャリアとを含む医薬組成物が提供される。本明細書中で使用される「医薬組成物」は、本明細書中に記載される有効成分の1つまたは複数(例えば、組換えタンパク質)を、他の化学的成分(例えば、従来の薬物、生理学的に好適なキャリアおよび賦形剤など)とともに有する調製物を示す。医薬組成物の目的は、生物に対するタンパク質または細胞の投与を容易にすることである。本発明の医薬組成物は、この分野で十分に知られている様々なプロセスによって、例えば、混合、溶解、造粒、糖衣錠作製、研和、乳化、カプセル化、包括化または凍結乾燥の従来のプロセスによって製造することができる。
【0270】
好ましい実施形態において、用語「医薬的に許容され得る」は、動物(より具体的にはヒト)における使用について、連邦政府または州政府の規制当局によって承認されているか、あるいは、米国薬局方または他の一般的に認められている薬局方に収載されていることを意味する。以降、表現「生理学的に好適なキャリア」および表現「医薬的に許容され得るキャリア」は交換可能に使用され、著しい刺激を生物に対して生じさせず、かつ、投与されたコンジュゲートの生物学的な活性および性質を阻害しない承認されたキャリアまたは希釈剤を示す。
【0271】
用語「キャリア」は、治療剤が一緒に投与される希釈剤、補助剤、賦形剤またはビヒクルを示す。そのような医薬用キャリアは、無菌の液体、例えば、水およびオイル(石油起源、動物起源、植物起源または合成起源のものを含む)など、例えば、ピーナッツ油、ダイズ油、鉱油、ゴマ油などであり得る。水は、医薬組成物が静脈内投与されるときの好ましいキャリアである。生理的食塩水溶液およびデキストロース水溶液およびグリセロール溶液もまた、特に注射用溶液の場合、液体キャリアとして用いることができる。好適な医薬用賦形剤には、デンプン、グルコース、ラクトース、スクロース、ゼラチン、麦芽、コメ、小麦粉、チョーク、シリカゲル、ステアリン酸ナトリウム、グリセロールモノステアラート、タルク、塩化ナトリウム、乾燥スキムミルク、グリセロール、プロピレングリコール、水、エタノールなどが含まれる。組成物は、所望される場合、微量の湿潤化剤もしくは乳化剤、またはpH緩衝化剤を含有することができる。これらの組成物は、溶液剤、懸濁物、エマルション、錠剤、ピル、カプセル、粉末剤、持続放出配合物などの形態を取ることができる。組成物は、従来の結合剤およびキャリア(例えば、トリグリセリドなど)を用いて、座薬として配合することができる。経口用配合物は標準的なキャリア(例えば、医薬規格のマンニトール、ラクトース、デンプン、ステアリン酸マグネシウム、ナトリウムサッカリン、セルロース、炭酸マグネシウムなど)を含むことができる。好適な医薬用キャリアの様々な例が、E.W.Martinによる“Remingtons’s Pharmaceutical Sciences”に記載される。そのような組成物は、治療効果的な量のタンパク質(好ましくは、精製された形態である)を、患者に対する適正な投与のための形態を提供するように好適な量のキャリアと一緒に含有する。配合は投与様式のために適しなければならない。
【0272】
本明細書中において、用語「賦形剤」は、有効成分の加工および投与をさらに容易にするために医薬組成物に添加される不活性な物質を示す。賦形剤の非限定的な例には、炭酸カルシウム、リン酸カルシウム、様々な糖およびタイプのデンプン、セルロース誘導体、ゼラチン、植物油、ならびにポリエチレングリコールが含まれる。
【0273】
有効成分を配合および投与するためのさらなる技術が“Remingtons’s Pharmaceutical Sciences”(Mack Publishing Co.、Easton、PA、最新版)に見出され得る(これは、本明細書中に詳しく示されているかのように本明細書中に参考として組み込まれる)。
【0274】
本明細書中に記載される医薬組成物はまた、好適な固体または固相のキャリアまたは賦形剤を含むことができる。そのようなキャリアまたは賦形剤の例には、炭酸カルシウム、リン酸カルシウム、様々な糖、デンプン、セルロース誘導体、ゼラチン、およびポリマー(例えば、ポリエチレングリコールなど)が含まれるが、これらに限定されない。
【0275】
好適な投与経路には、例えば、経口送達、直腸送達、経粘膜送達、経皮送達、腸管送達または非経口送達(筋肉内注射、皮下注射および髄内注射、ならびに、くも膜下注射、直接的な心室内注射、静脈内注射、腹腔内注射、鼻腔内注射または眼内注射を含む)が含まれ得る。
【0276】
従って、本発明に従って使用される医薬組成物は、医薬的に使用することができる調製物への有効成分の加工を容易にする賦形剤および補助剤を含む1つ以上の医薬的に許容され得るキャリアを使用して、従来の様式で配合することができる。適正な配合は、選ばれた投与経路に依存する。
【0277】
注射の場合、本発明の有効成分は、水溶液において、好ましくは生理学的に適合し得る緩衝液(例えば、ハンクス溶液、リンゲル溶液または生理学的な生理的食塩水緩衝液など)において配合することができる。経粘膜投与の場合、浸透剤が配合において使用される。そのような浸透剤はこの分野では一般に知られている。
【0278】
経口投与の場合、有効成分は、場合により、本発明によるタンパク質(例えば、GCDなど)を産生する細胞全体の投与によって処方され得る。有効成分はまた、有効成分および/または細胞を、この分野で広く知られている医薬的に許容され得るキャリアと組み合わせることによって処方され得る。そのようなキャリアは、本発明の有効成分が、患者により経口摂取される錠剤、ピル、糖衣錠、カプセル、液剤、ゲル、シロップ、スラリー剤、懸濁物などとして処方されることを可能にする。経口使用される薬理学的調製物を、固体の賦形剤を使用し、得られた混合物を場合により粉砕し、そして錠剤または糖衣錠コアを得るために、所望する場合には好適な補助剤を添加した後、顆粒の混合物を加工して作製することができる。好適な賦形剤には、特に、ラクトース、スクロース、マンニトールまたはソルビトールを含む糖などの充填剤;セルロース調製物、例えば、トウモロコシデンプン、コムギデンプン、コメデンプン、ジャガイモデンプン、ゼラチン、トラガカントゴム、メチルセルロース、ヒドロキシプロピルメチルセルロース、ナトリウムカルボメチルセルロースなど;および/またはポリビニルピロリドン(PVP)などの生理学的に許容され得るポリマーがある。所望する場合には、架橋されたポリビニルピロリドン、寒天、またはアルギン酸もしくはその塩(アルギン酸ナトリウムなど)などの崩壊剤を加えることができる。
【0279】
糖衣錠コアには、好適なコーティングが施される。この目的のために、高濃度の糖溶液を使用することができ、この場合、糖溶液は、場合により、アラビアゴム、タルク、ポリビニルピロリドン、カルボポールゲル、ポリエチレングリコール、二酸化チタン、ラッカー溶液および好適な有機溶媒または溶媒混合物を含有し得る。色素または顔料を、有効成分の量を明らかにするために、または有効成分の量の種々の組合せを特徴づけるために、錠剤または糖衣錠コーティングに加えることができる。
【0280】
経口使用され得る医薬組成物には、ゼラチンから作製されたプッシュ・フィット型カプセル、ならびにゼラチンおよび可塑剤(例えば、グリセロールまたはソルビトールなど)から作製された軟いシールされたカプセルが含まれる。プッシュ・フィット型カプセルは、充填剤(例えば、ラクトースなど)、結合剤(例えば、デンプンなど)、滑剤(例えば、タルクまたはステアリン酸マグネシウムなど)および場合により安定化剤との混合で有効成分を含有することができる。軟カプセルでは、有効成分を好適な液体(例えば、脂肪油、流動パラフィンまたは液状のポリエチレングリコールなど)に溶解または懸濁させることができる。また、安定化剤を加えることができる。経口投与される配合物はすべて、選ばれた投与経路について好適な投薬形態でなければならない。
【0281】
口内投与の場合、組成物は、従来の様式で配合された錠剤またはトローチの形態を取ることができる。
【0282】
吸入による投与の場合、本発明に従って使用される有効成分は、好適な噴射剤(例えば、ジクロロジフルオロメタン、トリクロロフルオロメタン、ジクロロテトラフルオロエタンまたは二酸化炭素)の使用により加圧パックまたはネブライザーからのエアロゾルスプレー提示物の形態で都合よく送達される。加圧されたエアロゾルの場合、投薬量単位が、計量された量を送達するためのバルブを備えることによって決定され得る。吸入器または吹き入れ器において使用される、例えば、ゼラチン製のカプセルおよびカートリッジで、有効成分および好適な粉末基剤(例えば、ラクトースまたはデンプンなど)の粉末混合物を含有するカプセルおよびカートリッジを処方することができる。
【0283】
本明細書中に記載される有効成分は、例えば、ボーラス注射または連続注入による非経口投与のために処方することができる。注射用配合物は、場合により保存剤が添加された、例えば、アンプルまたは多回用量容器における単位投薬形態で提供され得る。組成物は、油性ビヒクルまたは水性ビヒクルにおける懸濁物または溶液剤またはエマルションにすることができ、そして、懸濁化剤、安定化剤および/または分散化剤などの配合剤を含有することができる。
【0284】
非経口投与される医薬組成物には、水溶性形態での活性な調製物の水溶液が含まれる。また、有効成分の懸濁物を適切な油性または水系の注射用懸濁物として調製することができる。好適な親油性の溶媒またはビヒクルには、脂肪油(例えば、ゴマ油など)、または合成脂肪酸エステル(例えば、オレイン酸エチルなど)、トリグリセリドまたはリポソームが含まれる。水性の注射用懸濁物は、懸濁物の粘度を増大させる物質、例えば、ナトリウムカルボキシメチルセルロース、ソルビトールまたはデキストランなどを含有することができる。場合により、懸濁物はまた、高濃度溶液の調製を可能にするために有効成分の溶解性を増大させる好適な安定化剤または薬剤を含有することができる。
【0285】
好ましい実施形態において、組成物は、ヒトに対する静脈内投与のために適合化された医薬組成物として、日常的な手法に従って配合される。典型的には、静脈内投与される医薬組成物は、無菌の等張性の水性緩衝液における溶液である。一般に、成分は別々に提供されるか、または、単位投薬形態で一緒に混合されて、例えば、活性な薬剤の量を示す気密容器(例えば、アンプルまたは小袋など)における乾燥した凍結乾燥粉末または無水高濃度物として提供される。組成物が注入によって投与されることになる場合、組成物は、無菌の医薬規格の水または生理的食塩水を含有する注入ボトルとともに分配され得る。組成物が注射によって投与される場合、成分が投与前に混合され得るように、注射用無菌水または生理的食塩水のアンプルが提供される。
【0286】
本発明の医薬組成物は中性形態または塩形態として配合することができる。医薬的に許容され得る塩には、アニオンとともに形成される塩、例えば、塩酸、リン酸、酢酸、シュウ酸、酒石酸などに由来する塩など、および、カチオンとともに形成される塩、例えば、ナトリウム、カリウム、アンモニウム、カルシウム、水酸化鉄(III)、イソプロピルアミン、トリエチルアミン、2−エチルアミノエタノール、ヒスチジン、プロカインなどに由来する塩などが含まれる。
【0287】
本発明の有効成分はまた、例えば、カカオバターまたは他のグリセリドなどの従来の坐薬基剤を使用して、坐薬または停留浣腸剤などの直腸用組成物に配合することができる。
【0288】
本明細書中に記載される医薬組成物はまた、ゲル相キャリアまたはゲル相賦形剤の好適な固体を含むことができる。そのようなキャリアまたは賦形剤の例には、炭酸カルシウム、リン酸カルシウム、様々な糖、デンプン、セルロース誘導体、ゼラチン、およびポリマー(例えば、ポリエチレングリコールなど)が含まれるが、これらに限定されない。
【0289】
局所経路が、場合により行われ、局所用キャリアによって支援される。局所用キャリアは、局所的な有効成分投与のために一般には好適であるキャリアであり、これには、この分野で知られている任意のそのような物質が含まれる。局所用キャリアは、組成物を、所望される形態で、例えば、液体または非液体のキャリア、ローション、クリーム、ペースト、ゲル、粉末、軟膏、溶媒、液体希釈剤および滴剤などとして提供するように選択され、そして、天然に存在する起源または合成起源の物質から構成され得る。明らかなことではあるが、選択されたキャリアは、局所用配合物の活性な薬剤または他の構成成分に悪影響を及ぼさないこと、そして、局所用配合物のすべての構成成分に関して安定であることが不可欠である。本発明において使用される好適な局所用キャリアの例には、水、アルコールおよび他の非毒性の有機溶媒、グリセリン、鉱油、シリコーン、ワセリン、ラノリン、脂肪酸、植物油、パラベン類およびワックスなどが含まれる。本発明における好ましい配合物は、無色無臭の軟膏、液体、ローション、クリームおよびゲルである。
【0290】
軟膏は、典型的にはペトラタムまたは他のペトラタム誘導体に基づく半固体の調製物である。使用される具体的な軟膏基剤は、当業者によって理解されるように、最適な有効成分送達をもたらし、好ましくは、他の所望される特徴(例えば、皮膚軟化性など)もまた提供するものである。他のキャリアまたはビヒクルの場合と同様に、軟膏基剤は、不活性で、安定で、非刺激性で、かつ非感作性でなければならない。Remington:The Science and Practice of Pharmacy(第19版、Easton、Pa.:Mack Publishing Co.、1995)において1399頁〜1404頁で説明されるように、軟膏基剤は、油性基剤、乳化可能な基剤、乳化基剤および水溶性基剤の4つのクラスに類別することができる。油性の軟膏基剤には、例えば、植物油、動物から得られる脂肪、および、石油から得られる半固体の炭化水素が含まれる。乳化可能な軟膏基剤は、吸収性軟膏基剤としてもまた知られており、水をほとんど含有せず、これには、例えば、ヒドロキシステアリンスルファート、無水ラノリンおよび親水性ペトラタムが含まれる。乳化軟膏基剤は油中水型(W/O)エマルションまたは水中油型(O/W)エマルションのいずれかであり、これには、例えば、セチルアルコール、グリセリルモノステアラート、ラノリンおよびステアリン酸が含まれる。好ましい水溶性軟膏基剤は、様々な分子量のエチレングリコールから調製される。再度ではあるが、さらなる情報については、Remington:The Science and Practice of Pharmacyを参照することができる。
【0291】
ローションは、摩擦を伴うことなく皮膚表面に塗布されるための調製物であり、典型的には、固体粒子(活性な薬剤を含む)が水またはアルコールの基剤に存在する液体または半液体の調製物である。ローションは、通常、固体の懸濁物であり、水中油型タイプの液体油性エマルションを含むことができる。ローションは、より多くの液体組成物を塗布することが容易であるので、大きな身体面積を処置するための本発明における好ましい配合物である。ローション中の不溶物は細かく分割されていることが一般に必要である。ローションは、典型的には、より良好な分散を提供するための懸濁化剤、ならびに、活性な薬剤を局在化させ、皮膚との接触状態で保つために有用な有効成分(例えば、メチルセルロースまたはナトリウムカルボキシメチルセルロースなど)を含有する。
【0292】
選択された有効成分を含有するクリームは、この分野では知られているように、水中油型または油中水型のいずれかであっても、粘性の液体エマルションまたは半固体エマルションである。クリーム基剤は水洗性であり、油相、乳化剤および水相を含有する。油相は、ときには「内部」相とも呼ばれることがあるが、一般には、ペトラタムおよび脂肪アルコール(例えば、セチルアルコールまたはステアリルアルコールなど)から構成される;水相は、通常、体積が油相を超えており、だが、必ずしも超える必要はなく、また、一般には保湿剤を含有する。クリーム配合物における乳化剤は、Remington(上掲)において説明されるように、一般には、非イオン性界面活性剤、アニオン性界面活性剤、カチオン性界面活性剤、または両性界面活性剤である。
【0293】
ゲル配合物は、頭皮への適用のために好ましい。局所用有効成分配合物の分野での当業者によって理解されるように、ゲルは半固体の懸濁物型の系である。単相ゲルは、キャリア液体全体に実質的に一様に分布させられた有機高分子を含有し、この場合、キャリア液体は、典型的には水性であるが、また、アルコールおよび場合によりオイルを好ましくは含有する。
【0294】
当業者に知られている様々な添加剤を本発明の局所用配合物に含めることができる。例えば、溶媒を、ある種の有効成分物質を可溶化するために使用することができる。必要に応じて使用される他の添加剤には、皮膚浸透増強剤、乳白剤、抗酸化剤、ゲル化剤、増粘剤および安定化剤などが含まれる。
【0295】
本発明の局所用組成物はまた、従来の皮膚型のパッチまたは物品を使用して皮膚に送達することができ、この場合、有効成分組成物は、皮膚に貼り付けられる薬物送達デバイスとして役立つ積層化された構造体の中に含有される。そのような構造体において、有効成分の組成物は、上部支持層の下に存在する層、すなわち、「リザーバー」に含有される。積層化された構造体は1つだけのリザーバーを含有することができ、または、複数のリザーバーを含有することができる。1つの実施形態において、リザーバーは、有効成分送達時にシステムを皮膚に貼り付けるために役立つ医薬的に許容され得る接触接着性物質のポリマーマトリックスを含む。好適な皮膚接触接着性物質の例には、ポリエチレン、ポリシロキサン、ポリイソブチレン、ポリアクリラートおよびポリウレタンなどが含まれるが、これらに限定されない。選択される特定のポリマー接着剤は、特定の有効成分、ビヒクルなどに依存する。すなわち、接着剤は、有効成分を含有する組成物のすべての構成成分との適合性を有しなければならない。あるいは、有効成分含有リザーバーおよび皮膚接触接着剤は別個の異なる層として存在し、この場合、接着剤はリザーバーの下に位置し、リザーバーは、この場合、上記のようなポリマーマトリックスであり得るか、または、液体もしくはヒドロゲルのリザーバーであり得るか、または、何らかの他の形態をとることができる。
【0296】
これらの積層体における支持層は、デバイスの上部表面として役立っており、積層化された構造体の主要な構造エレメントとして機能し、かつ、デバイスにその柔軟性の多くを提供する。支持物質のために選択される物質は、有効成分含有組成物の有効成分および任意の他の構成成分に対して実質的に不浸透性であるように、従って、デバイスの上部表面からの何らかの構成成分の喪失を妨げるように選択されなければならない。支持層は、皮膚が有効成分送達時に水和されることが所望されるかどうかに依存して、閉鎖性または非閉鎖性のいずれかであり得る。支持材は、好ましくは、柔軟性のエラストマー材料であることが好ましいシートまたはフィルムから作製される。支持層のために好適なポリマーの例には、ポリエチレン、ポリプロピレンおよびポリエステルが含まれる。
【0297】
貯蔵時または使用前には、積層化された構造体は剥離ライナーを含む。使用直前に、この層はデバイスから除かれて、その基層表面(有効成分リザーバーまたは別個の接触接着剤層のいずれか)が露出させられ、その結果、システムを皮膚に貼り付けることができるようにされる。剥離ライナーは、有効成分/ビヒクル不浸透性の材料から作製されなければならない。
【0298】
そのようなデバイスは、この分野で知られている従来の技術を使用して、例えば、接着剤、有効成分およびビヒクルの液状混合物を支持層に注入成型し、その後、剥離ライナーを積層化することによって製造することができる。同様に、接着剤混合物を剥離ライナー上に注入成型し、その後、支持層を積層化することができる。あるいは、有効成分リザーバーを有効成分または賦形剤の非存在下で調製し、その後、有効成分/賦形剤の混合物に「浸す」ことによって負荷することができる。
【0299】
本発明の局所用配合物の場合のように、これらの積層化システムの有効成分リザーバーに含有される有効成分組成物は数多くの構成成分を含有することができる。場合により、有効成分は、「そのまま(neat)」、すなわち、さらなる液体の非存在下で送達することができる。しかしながら、ほとんどの場合、有効成分は、好適な医薬的に許容され得るビヒクル(典型的には溶媒またはゲル)に溶解または分散または懸濁される。存在させることができる他の構成成分には、保存剤、安定化剤および界面活性剤などが含まれる。
【0300】
本発明のタンパク質(例えば、高マンノースリソソーム酵素など)は、好ましくは、必要としている患者に効果的な量で投与されることに留意しなければならない。本明細書中で使用される「効果的な量」は、選択された結果を達成するために必要な量を意味する。例えば、本発明の組成物の効果的な量は、リソソーム蓄積疾患を処置することについて有用であるために選択され得る。
【0301】
本発明に関連して使用される好適な医薬組成物には、有効成分が、意図された目的を達成するために効果的な量で含有される組成物が含まれる。より具体的には、治療効果的な量は、処置されている対象の疾患の症状を予防または緩和または改善するために効果的であるか、あるいは、処置されている対象の生存を延ばすために効果的である、有効成分の量を意味する。
【0302】
治療効果的な量の決定は、特に本明細書中に提供される詳細な開示に照らして、十分に当業者の能力の範囲内である。
【0303】
本発明の方法において使用される任意の有効成分について、治療効果的な量または用量は、動物における活性アッセイから最初に推定することができる。例えば、用量を、活性アッセイによって決定されるようなIC50を含む循環濃度範囲を達成するために動物モデルにおいて定めることができる。
【0304】
本明細書中に記載される有効成分の毒性および治療効力は、実験動物における標準的な薬学的手法によって、例えば、対象とする有効成分についてIC50およびLD50(処置された動物の50%において死を生じさせる致死量)を決定することによって明らかにすることができる。これらの活性アッセイおよび動物研究から得られたデータは、ヒトにおいて使用される投薬量範囲を定める際に使用することができる。例えば、遺伝的障害を処置するために好適な治療効果的な用量を、これらの疾患の動物モデルを用いた実験から決定することができる。
【0305】
投薬量は、用いられる投薬形態および利用される投与経路に依存して変化し得る。正確な配合、投与経路および投薬量は、患者の状態を考慮して個々の医師により選ぶことができる(例えば、Fingl他、1975、”The Pharmacological Basis of Therapeutics”、第1章、1頁を参照のこと)。
【0306】
投薬量および投薬間隔は、調節作用を維持するために十分な、活性成分の血漿レベル(これは最小有効濃度(MEC)と呼ばれる)をもたらすために個々に調節することができる。MECは、それぞれの調製物について変化するが、場合により、動物データ全体から推定することができる。
【0307】
投薬間隔はまた、MEC値を使用して決定することができる。調製物は、場合により、期間の10%〜90%について、好ましくは30%〜90%の間、最も好ましくは50%〜90%の間、MECを超えて血漿レベルを維持する治療方法を使用して投与することができる。
【0308】
処置される状態の重篤度および応答性に依存して、投薬はまた、本明細書中上記で記載された徐放性組成物の単回投与であり得る。この場合、処置の経過は、数日から数週間まで、または、治癒が達成されるまで、もしくは、疾患状態の軽減が達成されるまで続く。
【0309】
本発明の組成物は、所望される場合には、有効成分を含有する1つ以上の単位投薬形態物を含有し得る、FDA承認キットなどのパックまたはディスペンサーデバイスで提供され得る。パックは、例えば、金属箔またはプラスチック箔を含むことができ、例えば、ブリスターパックなどである。パックまたはディスペンサーデバイスには、投与のための説明書が添付され得る。パックまたはディスペンサーデバイスにはまた、医薬品の製造、使用または販売を規制する政府当局により定められた形式で容器に付けられた通知が伴い得る。この場合、そのような通知は、組成物の形態またはヒトもしくは動物への投与の当局による承認を反映する。そのような通知は、例えば、処方薬物に対する米国食品医薬品局により承認されたラベル書きであり得るか、または承認された製品添付文書であり得る。適合し得る医薬用キャリアに配合された本発明の有効成分を含む組成物はまた、適応状態を処置するために、調製され、適切な容器に入れられ、かつ表示され得る。
【0310】
本明細書中で使用される用語「調節する」は、疾患の進行を実質的に阻害し、遅くし、もしくは後戻りさせること、または、疾患もしくは状態の臨床的症状を実質的に改善すること、または、疾患もしくは状態の臨床的症状の出現を実質的に妨げることを包含する。従って、「調節剤」には、疾患もしくは状態を調節することができる薬剤が含まれる。
【0311】
本発明はその詳細な記述と関連して説明されているが、前述の説明は特許請求の範囲によって規定される発明の範囲を説明するためであって制限することを意図していないことは理解されるべきである。他の局面、利点、および変形例は特許請求の範囲内にある。
【0312】


【配列表フリーテキスト】
【0313】
配列番号1はERシグナルペプチドの配列を示す。
配列番号2はタバコキチナーゼAからの液胞標的化シグナルの配列を示す。
配列番号3〜6は一本鎖DNAオリゴヌクレオチドの配列を示す。
配列番号10はERシグナルペプチドをコードする核酸配列を示す。
配列番号11は液胞標的化配列をコードする核酸配列を示す。
配列番号12はアグロバクテリウム・ツメファシエンスのターミネーターの核酸配列を示す。
配列番号13は高マンノースヒトグルコセレブロシダーゼ(GCD)をコードする核酸配列を示す。
配列番号14は高マンノースヒトグルコセレブロシダーゼ(GCD)の配列を示す。
【技術分野】
【0001】
本発明は、高マンノースタンパク質を製造するための形質転換された宿主細胞、ならびに、特に植物培養において高マンノースタンパク質を製造するための方法およびシステムに関する。
【背景技術】
【0002】
ゴーシェ病は最も一般的なリソソームでの蓄積障害である。ゴーシェ病は、グリコスフィンゴ脂質であるグルコセレブロシド(グリコシルセラミド、GlcCer)のグルコースおよびセラミドへの加水分解を触媒する膜結合型リソソーム酵素であるグルコセレブロシダーゼ(これはまたグルコシルセラミダーゼとして知られている)の欠損をもたらす劣性の遺伝的障害(第1染色q21−q31)によって引き起こされる。ゴーシェ病は、hGCD(ヒトグルコセレブロシダーゼ)遺伝子(GBA)における点変異によって引き起こされ、これにより、マクロファージのリソソームにおけるGlcCerの蓄積がもたらされる。この特徴的な蓄積細胞はゴーシェ細胞と呼ばれており、肝臓、脾臓および骨髄において見出される。関連する臨床的症状には、重篤な肝脾腫大、貧血、血小板減少症、および骨格の劣化が含まれる。
【0003】
ヒトGCDをコードする遺伝子が1985年に初めて配列決定された(6)。タンパク質は、536マーのプロペプチドに由来する497アミノ酸からなる。成熟hGCDは5個のN−グリコシル化アミノ酸コンセンサス配列(Asn−X−Ser/Thr)を含有する。これらの部位のうちの4つが通常、グリコシル化される。最初の部位のグリコシル化が、活性なタンパク質を産生させるために必須である。高マンノース鎖および複合オリゴ糖鎖の2つが同定されている(7)。胎盤由来のhGCDは7%の炭水化物を含有し、そのうちの20%が高マンノース型である(8)。生化学的研究および部位特異的変異誘発研究により、折り畳み、活性化因子相互作用および活性部位位置に対して重要な領域および残基の最初のマップが提供されている(9)。
【0004】
胎盤hGCDのノイラミニダーゼ(これはアシアロ酵素を生じさせる)による処理は、ラット肝臓細胞による増大したクリアランス速度および取り込み速度をもたらし、同時に肝細胞の酵素活性の増大をもたらす(Furbish他、1981、Biochim.Biophys.Acta、673:425〜434)。このグリカン修飾型の胎盤hGCDは、現在、ゴーシェ病の処置における治療剤として使用されている。生化学的研究および部位特異的変異誘発研究により、折り畳み、活性化因子相互作用および活性部位位置に対して重要な領域および残基の最初のマップが提供されている[Grace他、J.Biol.Chem.、269:2283〜2291(1994)]。
【0005】
3つの異なるタイプのゴーシェ病が存在し、それぞれがhGCD活性のレベルによって決定される。この疾患によって冒される主な細胞はマクロファージであり、マクロファージはGlcCerの蓄積のために非常に肥大し、従って「ゴーシェ細胞」と呼ばれている。
【0006】
GCDにおける欠陥がゴーシェ病の主原因として同定されたことにより、この障害のための治療法としての酵素置換療法の開発がもたらされた。
【0007】
De Duveは、外因性の生物学的に活性な酵素による喪失リソソーム酵素の置換がリソソーム蓄積疾患の処置に対する実行可能な方法であり得ることを最初に示唆した[Fed Proc.、23:1045(1964)]。
【0008】
それ以降、様々な研究により、酵素置換療法が、様々なリソソーム蓄積疾患を処置するために有益であり得ることが示唆されている。最も良い成功が、外因性酵素(β−グルコセロブロシダーゼ)、すなわち、胎盤から調製された酵素(Ceredase(商標))またはより近年には組換え酵素(Cerezyme(商標))で処置されたI型ゴーシェ病者に関して示されている。
【0009】
天然起源の非改変のグルコセレブロシダーゼは、4つの炭水化物鎖を有する糖タンパク質である。このタンパク質は体内の食作用細胞を標的とせず、従って、治療的価値は限られている。ゴーシェ病のための現在の治療法を開発することにおいて、グルコセレブロシダーゼの炭水化物鎖における末端の糖が、3つの異なるグリコシダーゼによる処理によって順次除去されている。このグリコシダーゼ処理は、その末端糖がマンノース残基からなる糖タンパク質をもたらす。食細胞は、マンノース残基で終わるオリゴ糖鎖を有する糖タンパク質および糖ペプチドを認識するマンノース受容体を有するので、グルコセレブロシダーゼの炭水化物再構成では、これらの細胞に対する酵素の標的化が改善されている[Furbish他、Biochem.Biophys.Acta、673:425(1981)]。
【0010】
本明細書中に示されるように、グリコシル化はhGCD活性において極めて重要な役割を果たしている。従って、細胞株において、ツニカマイシンを使用したとき(Sf9細胞)、または、すべてのグリコシル化部位を無効にする点変異を使用したとき(Sf9細胞およびCOS−1細胞の両方)に発現するhGCDの脱グリコシル化は、酵素活性の完全な喪失をもたらす。また、大腸菌で発現させたhGCDは不活性であることが見出されていた。さらなる研究では、タンパク質活性に対する様々なグリコシル化部位の重要性が示されていた。実際のタンパク質活性におけるグリコシル化の役割に加えて、商業的に製造された酵素は、特異的な薬物送達を容易にするグリカン配列修飾を含有する。これらのグリコシル化タンパク質は、マンノース含有グリカン配列のみを含むために、抽出後、再構成されている。
【0011】
ヒトGCD酵素は4個のグリコシル化部位および22個のリシンを含有する。組換え産生された酵素(Cerezyme(商標))は、アルギニンがヒスチジンで置換されている495位において胎盤酵素(Ceredase(商標))とは異なる。さらに、オリゴ糖組成が組換えGCDと胎盤GCDとの間では異なる。前者はフコース残基およびN−アセチル−グルコサミン残基をより多く有し、一方、後者は1つの高マンノース鎖を保持する。上記で言及されたように、GCDの両方のタイプは、末端のマンノースを露出させ、これにより、食作用細胞の標的化を可能にするために3つの異なるグリコシダーゼ(ノイラミニダーゼ、ガラクトシダーゼおよびP−Nアセチルグルコサミニダーゼ)で処理されている。組換え産生された酵素を含む医薬調製物が米国特許第5549892号に記載される。言及されているすべての参考文献は、本明細書中に詳しく示されているかのように参考として本明細書により組み込まれることに留意しなければならない。
【0012】
既存のリソソーム酵素置換療法処置に関連する1つの欠点は、例えば、低い取り込み、基質が蓄積する特定の細胞のリソソームに対する低下した標的化、および、リソソームにおける機能的なインビボ半減期が短いことのために、酵素のインビボ生物活性が望ましくないほど低いということである。
【0013】
既存のGCD組換え酵素の別の大きな欠点は、健康保険システムに重い経済的負担を負わし得るその費用である。これらの組換え酵素のコストが大きいことは、複雑な精製プロトコル、および、既存の処置のために要求される治療剤の量が比較的大きいことから生じている。従って、この救命治療が、それを必要としている全員に、より手頃な価格で提供され得るようにGCDのコストを下げることが緊急に求められている。
【0014】
医薬品として使用されるタンパク質は、従来的には、哺乳動物発現システムまたは細菌発現システムで製造されている。この10年間において、新しい発現システムが植物において開発されてきている。この方法論では、アグロバクテリウム(一本鎖DNA分子(T−DNA)を植物のゲノムに挿入することができる細菌)が利用される。タンパク質およびペプチドの大量製造のために遺伝子を導入することが比較的簡便であるために、この方法論は、現在、代わりのタンパク質発現システムとしてますます広く知られるようになっている(1)。
【0015】
翻訳後修飾が細菌発現システムでは存在しないが、植物由来の発現システムは、タンパク質の発現および活性のために極めて重要であることが知られているこれらの修飾を容易にする。哺乳動物でのタンパク質発現システムと植物でのタンパク質発現システムとの間での大きな違いの1つが、生合成経路における違いにより引き起こされるタンパク質の糖側鎖の変化である。グリコシル化が、活性、折り畳み、安定性、溶解性、プロテアーゼ感受性、血中クリアランス速度、およびタンパク質の抗原性能力に対する顕著な影響を有することが示されていた。従って、植物におけるタンパク質製造はどれも、植物のグリコシル化の潜在的な枝分かれを考慮に入れなければならない。
【0016】
タンパク質のグリコシル化は、N結合型修飾およびO結合型修飾の2つのカテゴリーに分けられる(2)。これら2つのタイプは、グリカン成分が結合するアミノ酸が異なる:N結合型はAsn残基に結合し、一方、O結合型はSer残基またはThr残基に結合する。また、各タイプのグリカン配列は特有の特徴的な特徴を有する。2つのタイプのうち、N結合型グリコシル化の方が多く存在し、タンパク質の機能に対するその作用が広範囲に研究されている。他方、O結合型グリカンは比較的少なく、タンパク質に対するその影響に関する情報はあまり得られていない。
【発明の概要】
【0017】
背景技術では、グリコシル化されたタンパク質を植物培養において選択的に製造するためのデバイス、システムまたは方法は教示も、示唆もされていない。背景技術ではまた、高マンノースタンパク質を植物培養において製造するためのそのようなデバイス、システムまたは方法は教示も、示唆もされていない。背景技術ではまた、小胞体(ER)を介してタンパク質を植物培養において製造するためのデバイス、システムまたは方法は教示も、示唆もされていない。背景技術ではまた、ゴルジ体を迂回しながら、小胞体(ER)を介してタンパク質を植物培養において製造するためのそのようなデバイス、システムまたは方法は教示も、示唆もされていない。背景技術ではまた、ゴルジ体を迂回するためにERシグナルを使用することによってタンパク質を植物培養において製造するためのそのようなデバイス、システムまたは方法は教示も、示唆もされていない。
【0018】
本発明は、グリコシル化されたタンパク質(特に、高マンノースグリコシル化を有するタンパク質)を、場合により、そして好ましくは、ERシグナルを有するそのようなタンパク質を標的化し(かつ/または、そうでなければ、そのようなタンパク質のプロセシングを操作し)ながら、植物培養において製造するためのデバイス、システムおよび方法を提供することによって背景技術のこれらの欠点を克服している。1つだけの仮説により限定されることを望まないが、そのような標的化はタンパク質にゴルジ体を迂回させ、それにより、所望されるグリコシル化(特に、高マンノースグリコシル化)を保持させると考えられる。本明細書中で使用される用語「植物培養」は、培養で成長する任意のタイプの遺伝子組換え植物細胞、および/または、そうでなければ、遺伝子操作された植物細胞を包含することに留意しなければならない。遺伝子操作は、場合により、永続的または一過性であり得る。好ましくは、培養は、植物の少なくとも1つの生物学的構造が存在しないように、完全な植物を形成するために集成していない細胞を特徴とする。場合により、そして好ましくは、培養は複数の異なるタイプの植物細胞を特徴としてもよいが、好ましくは、培養は特定タイプの植物細胞を特徴とする。場合により、特定タイプの植物細胞を特徴とする植物培養は最初は、複数の異なるタイプのそのような植物細胞に由来し得ることに留意しなければならない。
【0019】
植物細胞は、固体表面(例えば、プラスチック製の培養容器または培養プレートなど)での培養、または懸濁状態(これらに限定されない)を含む任意のタイプの好適な培養方法に従って成長させることができる。
【0020】
本発明はさらに、遺伝子組換え植物の根(特に、ニンジン細胞)を使用して、酵素的に活性な高マンノースリソソーム酵素を発現および産生させるためのベクターおよび方法に関する。より詳細には、本発明は、生物学的に活性な高マンノース型グルコセレブロシダーゼ(GCD)を高収率で発現および産生させるための宿主細胞(特に、遺伝子組換えの懸濁されたニンジン細胞)、ベクターおよび方法に関する。本発明はさらに、リソソーム蓄積疾患を処置するための組成物および方法を提供する。
【0021】
本発明はまた、十分な量の生物学的に活性なリソソーム酵素(特に、ヒトGCD)を、不足している細胞に提供するためのデバイス、システムおよび方法に関する。本発明はまた、GCDなどのリソソーム酵素をコードする遺伝子の効率的な産生を可能にする新しいベクター組成物を含む宿主細胞に関する。
【0022】
従って、本発明は、特定のグリコシル化要件(例えば、GCDなどのリソソーム酵素の高マンノースグリコシル化など)を有するタンパク質を製造するための経済的に有益な技術について長年感じられていた必要性を解決する。本発明はまた、植物細胞培養を使用することによって、この長年感じられていた必要性を解決することができる。
【0023】
本発明をさらに説明するために、次に、高マンノースタンパク質の生合成経路の簡単な説明が示される。高マンノースグリカンおよび複合N結合型グリカンの基本的な生合成経路はすべての真核生物の間で高度に保存されている。生合成は、グリカン前駆体がドリコール脂質キャリアからタンパク質上の特定のAsn残基にオリゴサッカリルトランスフェラーゼにより転移されることで小胞体(ER)において始まる。前駆体は、続いて、グリコシダーゼIおよびグリコシダーゼIIならびに仮説的なマンノシダーゼによってERにおいて修飾されて、哺乳動物に存在するプロセスに類似する高マンノース構造をもたらす。
【0024】
グリカン配列の複合構造およびハイブリッド構造へのさらなる修飾がゴルジ体において行われる。そのような修飾には、α−マンノシダーゼIによる4つのマンノース残基の1つの除去、N−アセチルグルコサミン残基の付加、α−マンノシダーゼIIによる2つのさらなるマンノース残基の除去、N−アセチルグルコサミン残基の付加が含まれ、そして場合により、この段階において、キシロース残基およびフコース残基が付加されて、植物特異的なN結合型グリカンがもたらされ得る。キシロースおよびフコースがコアに転移した後、複合タイプのN−グリカンが、末端のフコースおよびガラクトースの付加によってさらにプロセシングされ得る。さらなる修飾が糖タンパク質の輸送時に行われ得る。
【0025】
いくつかの方法が、現在、植物におけるタンパク質グリコシル化を制御および調節するために背景技術では使用されているが、そのすべてが、特に本発明と比較して、著しい欠点を有している。全体的な修飾、例えば、グリコシル化の完全な阻害、または、ペプチド鎖からのグリコシル化部位の除去などは1つの方法である。しかしながら、この方法では、構造的欠陥が生じ得る。さらなる方法では、特定の炭水化物プロセシング酵素のノックアウトまたは導入を伴う。再度ではあるが、この方法は困難であり、そしてまた、植物細胞自身に対する有害な影響を有し得る。
【0026】
本発明は、ERシグナルを使用することによって、かつ/または、ERからゴルジ体への分泌を阻止することによって、背景技術の方法のこれらの欠点を克服する。1つだけの仮説により限定されることを望まないが、リソソーム酵素の高マンノース構造が好まれるので、分泌を阻止することができ、かつ、タンパク質をERに維持することができるならば、天然に存在する高マンノース構造が、再構成を必要とすることなく得られる。
【0027】
上記で示されたように、内膜系を介して輸送されるタンパク質は最初に小胞体に入る。この工程のための必要な輸送シグナルは分子のN末端におけるシグナル配列(いわゆるシグナルペプチド)によって表される。このシグナルペプチドがその機能(これは、それに結合している前駆体タンパク質を小胞体に入れることである)を果たすと直ちに、シグナルペプチドはタンパク質分解的に前駆体タンパク質から切断される。その特異的な機能によって、このタイプのシグナルペプチド配列は、細胞が細菌、酵母、菌類、動物または植物であるかどうかにかかわらず、すべての生存している細胞において進化時に高度に保存されてきている。
【0028】
多くの植物タンパク質は、シグナルペプチドによって小胞体に入れられるが、ERに留まらず、小胞体からゴルジ体に輸送され、引き続きゴルジ体から液胞に輸送される。この運搬残基のためのそのような仕分けシグナルの1つのタイプが、前駆体タンパク質のC末端部に存在するシグナルである[NeuhausおよびRogers(1998)、Plant Mol.Biol.、38:127〜144]。小胞体に入れるためのN末端シグナルペプチドと、C末端の液胞標的化シグナルとの両方を含有するタンパク質は、ゴルジ体においてタンパク質に取り付けられる複合グリカンを含有することが予想される[Lerouge他(1998)、Plant Mol.Biol.、38:31〜48]。そのようなC末端の仕分けシグナルの種類は非常に広範囲に異なり得る。米国特許第6054637号には、液胞標的化シグナルとして作用する液胞タンパク質であるタバコ塩基性キチナーゼの領域から得られたペプチドフラグメントが記載される。C末端の標的化シグナルと、複合グリカンとを含有する液胞タンパク質に対する一例が、エンドウマメの種子から得られるファゼオリン貯蔵タンパク質である[Frigerio他(1998)、Plant Cell、10:1031〜1042;Frigerio他(2001)、Plant Cell、13:1109〜1126]。
【0029】
理論的枠組みは、すべての真核生物細胞において、液胞タンパク質は、その最終目的地としての液胞に隔離される前にERおよびゴルジ体を通過するということである。驚くべきことに、本発明の形質転換された植物根細胞は予想外の高マンノースGCDを産生させた。好都合なことに、この高マンノース生成物は生物学的に活性であることが見出され、従って、さらなる工程をその活性化のために必要としなかった。1つだけの仮説により限定されることを望まないが、ERシグナルの使用は、組換えタンパク質が植物細胞培養で産生される場合、ゴルジ体への輸送を抑えることができ、従って、所望される高マンノースグリコシル化を保持することができると考えられる。場合により、ゴルジ体を迂回するための任意のタイプの機構を含めて、高マンノースグリコシル化をもたらすことができる任意のタイプの機構を、本発明に従って使用することができる。
【0030】
第1の局面において、本発明は、目的とする高マンノース組換えタンパク質を産生する宿主細胞に関する。この細胞は、目的とするタンパク質をコードする組換え核酸分子、または、そのような核酸分子を含む発現ベクターで形質転換またはトランスフェクションすることができる。そのような核酸分子は、目的とするタンパク質をコードする第1の核酸配列を、液胞標的化シグナルペプチドをコードする第2の核酸配列に機能的に連結されて含む。第1の核酸配列は、場合により、さらに、ER(小胞体)標的化シグナルペプチドをコードする第3の核酸配列に機能的に連結され得る。本発明の宿主細胞は、目的とするタンパク質が高度のマンノース化形態で細胞によって産生されることによって特徴づけられる。
【0031】
本発明の宿主細胞は真核生物細胞または原核生物細胞であり得る。
【0032】
1つの実施形態において、本発明の宿主細胞は原核生物細胞であり、好ましくは細菌細胞であり、最も好ましくはアグロバクテリウム・ツメファシエンス(Agrobacterium tumefaciens)細胞である。これらの細胞は、下記において記載される好ましい植物宿主細胞に感染させるために使用される。
【0033】
別の好ましい実施形態において、本発明の宿主細胞は真核生物細胞であり、好ましくは植物細胞であり、最も好ましくは、アグロバクテリウム・リゾゲネス(Agrobacterium rihzogenes)で形質転換された根細胞からなる群から選択される植物根細胞、セロリ細胞、ショウガ細胞、西洋ワサビ細胞およびニンジン細胞である。
【0034】
好ましい実施形態において、植物根細胞はニンジン細胞である。本発明の形質転換されたニンジン細胞は懸濁状態で成長することに留意しなければならない。上記で言及され、また、実施例において記載されるように、これらの細胞はアグロバクテリウム・ツメファシエンス細胞で形質転換された。
【0035】
別の実施形態において、本発明の宿主細胞に含まれる組換え核酸分子は、塩基性タバコキチナーゼA遺伝子に由来する液胞標的化シグナルペプチドをコードする第2の核酸配列との機能的な連結にある、リソソーム酵素をコードする第1の核酸配列を含む。この液胞シグナルペプチドは、配列番号2によって表されるようなアミノ酸配列を有する。第1の核酸配列は、場合により、さらに、配列番号1によって表されるようなER(小胞体)標的化シグナルペプチドをコードする第3の核酸配列と機能的な連結で連結され得る。1つの実施形態において、本発明の宿主細胞に含まれる組換え核酸分子はさらに、植物細胞において機能的であるプロモーターを含む。このプロモーターは本発明の組換え分子に機能的に連結されなければならない。
【0036】
別の実施形態において、本発明の組換え核酸分子は、場合により、さらに、植物細胞において好ましくは機能的である機能的に連結されたターミネーターを含むことができる。本発明の組換え核酸分子は、場合により、さらに、さらなる制御エレメント、促進エレメントおよび調節エレメント、ならびに/または選択マーカーを含むことができる。これらの調節エレメントは組換え分子に機能的に連結されることに留意しなければならない。
【0037】
好ましい実施形態において、本発明の宿主細胞によって産生される目的とする高マンノースタンパク質は、露出したマンノース末端残基を有する高マンノース糖タンパク質であり得る。
【0038】
そのような高マンノースタンパク質は、別の好ましい実施形態によれば、グルコセレブロシダーゼ(GCD)、酸性スフィンゴミエリナーゼ、ヘキソサミニダーゼ、α−N−アセチルガラクトサミニダーゼ、酸性リパーゼ、α−ガラクトシダーゼ、グルコセレブロシダーゼ、α−L−イズロニダーゼ、イズロナートスルファターゼ、α−マンノシダーゼおよびシアリダーゼからなる群から選択されるリソソーム酵素であり得る。好ましい実施形態において、リソソーム酵素はヒトグルコセレブロシダーゼ(GCD)であり得る。以降、組換えGCD、rGCD、rhGCDはすべて、別途示されない限り、組換えヒトGCDの様々な形態を示す。
【0039】
前記で記載されたように、ゴーシェ病(最も一般的なリソソームでの蓄積障害)は、マクロファージのリソソームにおけるGlcCerの蓄積をもたらす、hGCD(ヒトグルコセレブロシダーゼ)遺伝子(GBA)における点変異によって引き起こされる。GCD欠損がゴーシェ病の主原因として同定されたことにより、この障害のための治療方法としての酵素置換療法の開発がもたらされた。しかしながら、グリコシル化は、hGCDの活性および標的細胞に対する取り込みにおいて極めて重要な役割を果たしている。
【0040】
従って、本発明の他の好ましい実施形態によれば、好適にグリコシル化されたhGCDが、好ましくは、植物細胞培養におけるhGCDの発現を制御することにより提供され、これは、場合により、そしてより好ましくは、ERシグナルを提供することによって、かつ/または、そうでない場合、場合により、そしてより好ましくは、ゴルジ体への輸送を阻止することによって行われる。
【0041】
場合により、そして好ましくは、hGCDは、ゴーシェ病の処置または予防のために、露出したマンノース残基を含む少なくとも1つのオリゴ糖鎖を有する。
【0042】
なおかつ、さらには、特定の実施形態において、この好ましい宿主細胞は、カリフラワーモザイクウイルス由来の35Sプロモーター、アグロバクテリウム・ツメファシエンスのオクピンシンターゼターミネーター、およびTMV(タバコモザイクウイルス)のΩ翻訳エンハンサーエレメントをさらに含む組換え核酸分子によって形質転換またはトランスフェクションされる。好ましい実施形態によれば、この組換え核酸分子は、実質的には配列番号1によって表されるような核酸配列を含み、実質的には配列番号14によって表されるようなアミノ酸配列を有する高マンノースGCDをコードする。
【0043】
本発明はさらに、生物学的に活性なリソソーム酵素をコードする核酸分子を含む発現ベクターを提供することを理解しなければならない。
【0044】
1つの好ましい実施形態において、本発明の発現ベクターは、生物学的に活性な高マンノース型ヒトグルコセレブロシダーゼ(GCD)をコードする核酸分子を含む。好ましくは、本発明の好ましい発現ベクターは、実質的には配列番号13によって表されるような核酸配列を有する組換え核酸分子を含む。
【0045】
第2の局面において、本発明は、本発明の宿主細胞によって産生される組換え高マンノースタンパク質に関する。
【0046】
好ましい実施形態において、本発明の高マンノースタンパク質は、グルコセレブロシダーゼ(GCD)、酸性スフィンゴミエリナーゼ、ヘキソサミニダーゼ、α−N−アセチルガラクトサミニダーゼ、酸性リパーゼ、α−ガラクトシダーゼ、グルコセレブロシダーゼ、α−L−イズロニダーゼ、イズロナートスルファターゼ、α−マンノシダーゼおよびシアリダーゼからなる群から選択される生物学的に活性な高マンノースリソソーム酵素であり得る。最も好ましくは、本発明のリソソーム酵素はヒトグルコセレブロシダーゼ(GCD)であり得る。
【0047】
なおかつ、さらには、本発明は、露出したマンノース残基を含む少なくとも1つのオリゴ糖鎖を有する組換え産生された生物学的に活性な高マンノースリソソーム酵素を提供する。
【0048】
好ましい実施形態によれば、本発明の組換えリソソーム酵素は標的部位における標的細胞上のマンノース受容体に結合することができる。好ましくは、この部位は、リソソーム蓄積疾患に罹患している対象の体内に存在し得る。
【0049】
組換えリソソーム酵素は、天然に存在するリソソーム酵素の標的細胞に対する対応する親和性と比較して、標的細胞に対する増大した親和性を有することに留意しなければならない。具体的な実施形態において、標的部位における標的細胞は対象の肝臓におけるクッパー細胞であり得る。
【0050】
好ましい実施形態において、組換えリソソーム酵素は、グルコセレブロシダーゼ(GCD)、酸性スフィンゴミエリナーゼ、ヘキソサミニダーゼ、α−N−アセチルガラクトサミニダーゼ、酸性リパーゼ、α−ガラクトシダーゼ、グルコセレブロシダーゼ、α−L−イズロニダーゼ、イズロナートスルファターゼ、α−マンノシダーゼまたはシアリダーゼからなる群から選択され得る。
【0051】
最も好ましくは、本発明の組換えリソソーム酵素はグルコセレブロシダーゼ(GCD)である。
【0052】
第3の局面において、本発明は、高マンノースタンパク質を製造する方法に関する。それによれば、本発明の方法は、(a)目的とする組換えタンパク質をコードする組換え核酸分子、または、そのような組換え核酸分子を含む発現ベクターで形質転換またはトランスフェクションされた組換え宿主細胞の培養物を調製する工程;(b)工程(a)により調製されたこれらの宿主細胞培養物を、タンパク質の発現を可能にする条件のもとで培養する工程(この場合、宿主細胞はタンパク質を高度にマンノシル化された形態で産生する);(c)(a)において提供された培養物に由来する細胞からタンパク質を回収し、また、(a)において提供された培養物から細胞を集める工程;および(d)工程(c)のタンパク質を好適なタンパク質精製法によって精製する工程を含む。
【0053】
好ましい実施形態によれば、本発明の方法によって使用される宿主細胞は本発明の宿主細胞である。
【0054】
別の好ましい実施形態において、本発明の方法によって製造される高マンノースタンパク質は、露出したマンノース残基を含む少なくとも1つのオリゴ糖鎖を有する生物学的に活性な高マンノースリソソーム酵素であり得る。
【0055】
本発明の組換え酵素は標的部位における標的細胞上のマンノース受容体に結合することができる。より詳細には、本発明の方法によって製造される組換え酵素は、天然に存在するリソソーム酵素の標的細胞に対する対応する親和性と比較して、標的細胞に対する増大した親和性を有することに留意しなければならない。それによれば、標的部位における標的細胞は対象の肝臓におけるクッパー細胞であり得る。
【0056】
具体的な実施形態において、本発明の組換えリソソーム酵素は、グルコセレブロシダーゼ(GCD)、酸性スフィンゴミエリナーゼ、ヘキソサミニダーゼ、α−N−アセチルガラクトサミニダーゼ、酸性リパーゼ、α−ガラクトシダーゼ、グルコセレブロシダーゼ、α−L−イズロニダーゼ、イズロナートスルファターゼ、α−マンノシダーゼおよびシアリダーゼからなる群から選択され得る。最も好ましくは、本発明のリソソーム酵素はグルコセレブロシダーゼ(GCD)であり得る。
【0057】
別の好ましい実施形態において、本発明の方法によって使用される宿主細胞は、アグロバクテリウム・リゾゲネスで形質転換された根細胞からなる群から選択される植物根細胞、セロリ細胞、ショウガ細胞、西洋ワサビ細胞およびニンジン細胞であり得る。最も好ましくは、植物根細胞はニンジン細胞である。本発明の方法では、形質転換された宿主ニンジン細胞は懸濁状態で成長することには特に留意しなければならない。
【0058】
さらなる局面において、本発明は、外因性の組換えリソソーム酵素を使用して、リソソーム蓄積疾患を有する対象を処置するための方法に関し、この場合、この方法は、(a)形質転換された植物根細胞から精製され、かつ、リソソーム酵素が異常に不足している細胞を効率的に標的化することができる組換え産生された生物学的に活性な形態のリソソーム酵素を提供すること(この場合、この組換え産生された生物学的に活性な酵素は、露出した末端マンノース残基を結合しているオリゴ糖に有する);および(b)治療効果的な量の組換え産生された生物学的に活性なリソソーム酵素を対象に投与することを含む。好ましい実施形態において、本発明の方法によって使用される組換え高マンノースリソソーム酵素は本発明の宿主細胞によって産生され得る。好ましくは、本発明の宿主細胞はニンジン細胞である。
【0059】
別の好ましい実施形態において、本発明の方法によって使用されるリソソーム酵素は、露出したマンノース残基を含む少なくとも1つのオリゴ糖鎖を有する高マンノース酵素であり得る。本発明の組換え酵素は、対象の体内において標的部位における標的細胞上のマンノース受容体に結合することができる。より好ましくは、本発明の組換えリソソーム酵素は、天然に存在するリソソーム酵素の標的細胞に対する対応する親和性と比較して、これらの標的細胞に対する増大した親和性を有する。
【0060】
より詳細には、本発明の方法によって使用されるリソソーム酵素は、グルコセレブロシダーゼ(GCD)、酸性スフィンゴミエリナーゼ、ヘキソサミニダーゼ、α−N−アセチルガラクトサミニダーゼ、酸性リパーゼ、α−ガラクトシダーゼ、グルコセレブロシダーゼ、α−L−イズロニダーゼ、イズロナートスルファターゼ、α−マンノシダーゼまたはシアリダーゼからなる群から選択され得る。好ましくは、本発明の組換えリソソーム酵素はグルコセレブロシダーゼ(GCD)である。
【0061】
好ましい実施形態によれば、本発明の方法は、従って、リソソームでの蓄積疾患(特にゴーシェ病)を処置するために意図される。
【0062】
そのような場合、標的部位における標的細胞は対象の肝臓におけるクッパー細胞であり得る。
【0063】
本発明はさらに、本発明によって規定されるような組換え産生された生物学的に活性な高マンノースリソソーム酵素を主成分として含む、リソソームでの蓄積疾患を処置するための医薬組成物を提供する。本発明の組成物は、場合により、さらに、医薬的に許容され得る希釈剤、キャリアまたは賦形剤を含むことができる。
【0064】
具体的な実施形態において、本発明の組成物は、ゴーシェ病を処置するために意図される。そのような組成物は、好ましくは、本発明によって規定されるような生物学的に活性な高マンノース型ヒトグルコセレブロシダーゼ(GCD)を効果的な成分として含むことができる。
【0065】
本発明はさらに、リソソーム蓄積疾患を処置または防止するための医薬品を製造する際の、本発明の組換え産生された生物学的に活性な高マンノースリソソーム酵素の使用に関する。より詳細には、そのような疾患はゴーシェ病であり得る。
【0066】
それによれば、本発明の生物学的に活性なリソソーム酵素は、本発明によって規定されるような生物学的に活性な高マンノース型ヒトグルコセレブロシダーゼ(GCD)である。
【0067】
本発明によれば、組換えタンパク質と、組換えタンパク質を高マンノースタンパク質として産生させるためのシグナルとをコードするポリヌクレオチドを含む、高マンノース組換えタンパク質を産生する宿主細胞が提供される。好ましくは、ポリヌクレオチドは、目的とするタンパク質をコードする第1の核酸配列を、シグナルペプチドをコードする第2の核酸配列に機能的に連結されて含む。場合により、シグナルペプチドはER(小胞体)標的化シグナルペプチドを含む。好ましくは、ポリヌクレオチドはさらに、液胞標的化シグナルペプチドをコードする第3の核酸配列を含む。
【0068】
好ましくは、シグナルは、組換えタンパク質をERに対して標的化させる。より詳細には、シグナルは、組換えタンパク質をERに対して標的化させるためのシグナルペプチドを含む。最も好ましくは、ポリヌクレオチドは、シグナルペプチドをコードするための核酸セグメントを含む。
【0069】
場合により、そして好ましくは、シグナルは、組換えタンパク質にゴルジ体を迂回させる。好ましくは、シグナルは、組換えタンパク質をゴルジ体に対して標的化させないためのシグナルペプチドを含む。より好ましくは、ポリヌクレオチドは、シグナルペプチドをコードするための核酸セグメントを含む。
【0070】
場合により、そして好ましくは、宿主細胞は真核生物細胞または原核生物細胞のいずれかである。場合により、原核生物細胞は細菌細胞であり、好ましくはアグロバクテリウム・ツメファシエンス細胞である。好ましくは、真核生物細胞は植物細胞である。より詳細には、植物細胞は、アグロバクテリウム・リゾゲネスで形質転換された根細胞からなる群から選択される植物根細胞、セロリ細胞、ショウガ細胞、西洋ワサビ細胞およびニンジン細胞である。最も好ましくは、植物根細胞はニンジン細胞である。
【0071】
好ましくは、組換えポリヌクレオチドは、塩基性タバコキチナーゼA遺伝子に由来する液胞標的化シグナルペプチドをコードする第2の核酸配列との機能的な連結にある、目的とするタンパク質をコードする第1の核酸配列を含み、この場合、そのような液胞シグナルペプチドは、配列番号2によって表されるようなアミノ鎖配列を有し、また、第1の核酸配列は、場合により、さらに、配列番号1によって表されるようなER(小胞体)標的化シグナルペプチドをコードする第3の核酸配列に機能的に連結される。
【0072】
より好ましくは、組換えポリヌクレオチドはさらに、植物細胞において機能的であるプロモーターを含み、この場合、プロモーターは組換え分子に機能的に連結されている。
【0073】
最も好ましくは、組換えポリヌクレオチドはさらに、植物細胞において機能的であるターミネーターを含み、この場合、ターミネーターは組換え分子に機能的に連結されている。
【0074】
また、最も好ましくは、組換えポリヌクレオチドはさらに、場合により、さらに、さらなる制御エレメント、促進エレメントおよび調節エレメント、ならびに/または選択マーカーを含み、この場合、これらの調節エレメントは組換え分子に機能的に連結されている。
【0075】
好ましくは、高マンノースタンパク質は、少なくとも1つの露出したマンノース残基を伴うグリコシル化を有する高マンノース糖タンパク質である。より詳細には、高マンノースタンパク質は、グルコセレブロシダーゼ(GCD)、酸性スフィンゴミエリナーゼ、ヘキソサミニダーゼ、α−N−アセチルガラクトサミニダーゼ、酸性リパーゼ、α−ガラクトシダーゼ、グルコセレブロシダーゼ、α−L−イズロニダーゼ、イズロナートスルファターゼ、α−マンノシダーゼおよびシアリダーゼからなる群から選択される生物学的に活性な高マンノースリソソーム酵素である。
【0076】
最も好ましくは、リソソーム酵素はヒトグルコセレブロシダーゼ(GCD)である。
【0077】
好ましくは、GCDは、配列番号7によって表されるような核酸配列によりコードされる、実質的には配列番号8によって表されるようなアミノ配列を含む。
【0078】
より好ましくは、細胞は、組換えポリヌクレオチド、または該分子を含む発現ベクターで形質転換またはトランスフェクションされる。この場合、そのような組換えポリヌクレオチドは、カリフラワーモザイクウイルス由来の35Sプロモーター、アグロバクテリウム・ツメファシエンスのオクトピンシンターゼターミネーター、および、TMV(タバコモザイクウイルス)のΩ翻訳エンハンサーエレメントである調節エレメントをさらに含み、そして、実質的には配列番号14によって表されるようなアミノ酸配列を有するGCDをコードする、実質的には配列番号13によって表されるような核酸配列を有する。
【0079】
好ましい実施形態によれば、上記の宿主細胞によって産生される組換え高マンノースタンパク質が提供される。
【0080】
好ましくは、高マンノースタンパク質は、グルコセレブロシダーゼ(GCD)、酸性スフィンゴミエリナーゼ、ヘキソサミニダーゼ、α−N−アセチルガラクトサミニダーゼ、酸性リパーゼ、α−ガラクトシダーゼ、グルコセレブロシダーゼ、α−L−イズロニダーゼ、イズロナートスルファターゼ、α−マンノシダーゼおよびシアリダーゼからなる群から選択される生物学的に活性な高マンノースリソソーム酵素である。
【0081】
より好ましくは、リソソーム酵素はヒトグルコセレブロシダーゼ(GCD)である。
【0082】
本発明の他の好ましい実施形態によれば、露出したマンノース残基を含む少なくとも1つのオリゴ糖鎖を有する組換え産生された生物学的に活性な高マンノースリソソーム酵素が提供される。
【0083】
さらに他の好ましい実施形態によれば、シグナルペプチド活性を有する第1の部分と、リソソーム酵素活性を有する第2の部分とを含む組換えタンパク質が提供され、この場合、第1の部分は、露出したマンノース残基を含む少なくとも1つのオリゴ糖鎖により第2の部分を植物細胞においてプロセシングさせる。
【0084】
好ましくは、リソソーム酵素は、ゴーシェ病を処置または予防するためのタンパク質を含む。
【0085】
より好ましくは、タンパク質はhGCDを含む。
【0086】
好ましくは、第1の部分は植物細胞のER標的化シグナルペプチドを含む。より好ましくは、組換え酵素は、リソソーム蓄積疾患に罹患している対象の体内の標的部位おける標的細胞上のマンノース受容体に結合することができる。最も好ましくは、組換えリソソーム酵素は、天然に存在するリソソーム酵素の標的細胞に対する対応する親和性と比較して、標的細胞に対する増大した親和性を有する。
【0087】
また、最も好ましくは、組換えリソソーム酵素は、グルコセレブロシダーゼ(GCD)、酸性スフィンゴミエリナーゼ、ヘキソサミニダーゼ、α−N−アセチルガラクトサミニダーゼ、酸性リパーゼ、α−ガラクトシダーゼ、グルコセレブロシダーゼ、α−L−イズロニダーゼ、イズロナートスルファターゼ、α−マンノシダーゼまたはシアリダーゼからなる群から選択される。
【0088】
好ましくは、組換えリソソーム酵素はグルコセレブロシダーゼ(GCD)である。
【0089】
また、好ましくは、標的部位おける標的細胞は対象の肝臓におけるクッパー細胞である。
【0090】
さらに他の好ましい実施形態によれば、植物細胞培養において産生される組換え高マンノースタンパク質が提供される。好ましくは、タンパク質は、タンパク質をERに標的化するための植物シグナルペプチドを特徴とする。
【0091】
より好ましくは、植物シグナルペプチドは、根の植物細胞培養物においてタンパク質をERに標的化するためのペプチドを含む。最も好ましくは、根の植物細胞培養物はニンジン細胞を含む。
【0092】
なお他の好ましい実施形態によれば、植物細胞培養において産生される組換え高マンノースhGCDタンパク質が提供される。
【0093】
さらに他の好ましい実施形態によれば、組換え高マンノースタンパク質を製造するための植物細胞培養物の使用が提供される。
【0094】
他の好ましい実施形態によれば、高マンノースタンパク質を製造する方法が提供され、この場合、この方法は、組換えタンパク質をコードする組換えポリヌクレオチドで形質転換またはトランスフェクションされた組換え宿主細胞の培養物を調製すること;宿主細胞培養物を、タンパク質の発現を可能にする条件のもとで培養すること(この場合、宿主細胞はタンパク質を高度にマンノシル化された状態で産生する)を含む。
【0095】
好ましくは、宿主細胞培養物は懸濁状態で培養される。より好ましくは、この方法はさらに、タンパク質を精製することを含む。
【0096】
他の好ましい実施形態によれば、この方法は、前記に記載されるような宿主細胞を用いて行われる。好ましくは、高マンノースタンパク質は、露出したマンノース残基を含む少なくとも1つのオリゴ糖鎖を有する生物学的に活性な高マンノースリソソームタンパク質である。より好ましくは、組換え酵素は標的部位における標的細胞上のマンノース受容体に結合する。最も好ましくは、組換え酵素は、天然に存在するリソソーム酵素の標的細胞に対する対応する親和性と比較して、標的細胞に増大した親和性を有する。
【0097】
好ましくは、リソソーム酵素は、グルコセレブロシダーゼ(GCD)、酸性スフィンゴミエリナーゼ、ヘキソサミニダーゼ、α−N−アセチルガラクトサミニダーゼ、酸性リパーゼ、α−ガラクトシダーゼ、グルコセレブロシダーゼ、α−L−イズロニダーゼ、イズロナートスルファターゼ、α−マンノシダーゼおよびシアリダーゼからなる群から選択される。
【0098】
より好ましくは、リソソーム酵素はグルコセレブロシダーゼ(GCD)である。最も好ましくは、標的部位おける標的細胞は対象の肝臓におけるクッパー細胞である。
【0099】
好ましくは、宿主細胞は、アグロバクテリウム・リゾゲネスで形質転換された根細胞からなる群から選択される植物根細胞、セロリ細胞、ショウガ細胞、西洋ワサビ細胞およびニンジン細胞である。
【0100】
より好ましくは、植物根細胞はニンジン細胞である。
【0101】
最も好ましくは、形質転換された宿主ニンジン細胞は懸濁状態で成長する。
【0102】
さらに他の好ましい実施形態によれば、外因性の組換えリソソーム酵素を使用して、リソソーム蓄積疾患を有する対象を処置するための方法が提供され、この場合、この方法は、形質転換された植物根細胞から精製され、かつ、リソソーム酵素が異常に不足している細胞を効率的に標的化することができる組換え産生された生物学的に活性な形態のリソソーム酵素を提供すること(この場合、組換え産生された生物学的に活性な酵素は、露出した末端マンノース残基を結合しているオリゴ糖に有する);および、治療効果的な量の組換え産生された生物学的に活性なリソソーム酵素を対象に投与することを含む。この方法は、場合により、前記で記載されたような任意の宿主細胞および/またはタンパク質を用いて行うことができる。
【0103】
好ましくは、組換え酵素は、対象の体内において標的部位における標的細胞上のマンノース受容体に結合することができる。より好ましくは、組換えリソソーム酵素は、天然に存在するリソソーム酵素の標的細胞に対する対応する親和性と比較して、標的細胞に対する増大した親和性を有する。最も好ましくは、リソソーム酵素は、グルコセレブロシダーゼ(GCD)、酸性スフィンゴミエリナーゼ、ヘキソサミニダーゼ、α−N−アセチルガラクトサミニダーゼ、酸性リパーゼ、α−ガラクトシダーゼ、グルコセレブロシダーゼ、α−L−イズロニダーゼ、イズロナートスルファターゼ、α−マンノシダーゼまたはシアリダーゼからなる群から選択される。また、最も好ましくは、リソソーム酵素はグルコセレブロシダーゼ(GCD)である。
【0104】
また、最も好ましくは、リソソーム蓄積疾患はゴーシェ病である。また、最も好ましくは、標的部位おける標的細胞は対象の肝臓におけるクッパー細胞である。
【0105】
さらに他の好ましい実施形態によれば、上記で記載されたような組換え産生された生物学的に活性な高マンノースリソソーム酵素を有効成分として含む、リソソーム蓄積疾患を処置するための医薬組成物が提供される。この場合、そのような組成物は、場合により、さらに、医薬的に許容され得る希釈剤、キャリアまたは賦形剤を含む。好ましくは、リソソーム蓄積疾患はゴーシェ病である。より好ましくは、組換えリソソーム酵素は、生物学的に活性な高マンノース型ヒトグルコセレブロシダーゼ(GCD)である。
【0106】
さらに他の好ましい実施形態によれば、リソソーム蓄積疾患を処置または予防するための医薬品を製造することにおける、上記で記載されたような組換え産生された生物学的に活性な高マンノースリソソーム酵素の使用が提供される。好ましくは、疾患はゴーシェ病である。より好ましくは、生物学的に活性なリソソーム酵素は、生物学的に活性な高マンノース型ヒトグルコセレブロシダーゼ(GCD)である。
【0107】
本発明はさらに下記の図によって例示されるが、下記の図は例示にすぎず、本発明の範囲を限定せず、本発明はまた、添付された請求項によって規定される。
【図面の簡単な説明】
【0108】
本発明は、本明細書中では、例としてだけであるが、添付されている図面を参照して記載される。
【図1a】図1aは、カリフラワーモザイクウイルス由来の35Sプロモーター、TMV(タバコモザイクウイルス)のΩ翻訳エンハンサーエレメント、ER標的化シグナル、ヒトGCD配列(これはまた配列番号7によって表される)、液胞シグナル、および、アグロバクテリウム・ツメファシエンス由来のオクトピンシンターゼターミネーター配列を含む得られた発現カセットを示す。
【図1b】図1bは、pGreenIIプラスミド骨格の概略マップを示す。
【図2】図2は、抗hGCD特異的抗体を使用するhGCD形質転換細胞抽出物のウエスタンブロット分析を示す。標準品Cerezyme(レーン1)が陽性コントロールとして使用され、非形質転換カルスが陰性コントロール(レーン2)として使用され、様々な選択されたカルスの抽出物がレーン3〜8に示される。
【図3a】図3aは、精製工程の標準的な処理を表す。XKカラム(2.6x20cm)に充填された強カチオン交換樹脂(Macro−Prep high−S担体、Bio−Rad)でrh−GCDを精製する最初の工程を示す。カラムは、伝導率モニターリング、pHおよび280nmでの吸光度を可能にするAKTAプライムシステム(Amersham Pharmacia Biotech)と一体化された。rh−GCDの溶出が、600mMのNaClを含有する平衡化緩衝液で得られた。
【図3b】図3bは、処理時に集められた分画物の酵素活性アッセイの結果である。酵素活性を示したチューブ(溶出ピークでの)がプールされた。
【図3c】図3cは、活性についてアッセイされた溶出分画物のクーマシーブルー染色を示す。
【図3d】図3dは、第2のカラムでの、図3aに対応するグラフを示す。
【図3e】図3eは、第2のカラムでの、図3bに対応するグラフを示す。
【図3f】図3fは、第2のカラムでの、活性についてアッセイされた溶出分画物のクーマシーブルー染色を示す。
【図4a】図4aは、精製工程の標準的な処理を表す。XKカラム(2.6x20cm)に充填された疎水性相互作用樹脂(TSKゲル、Toyopearl Phenyl−650M、Tosoh Corp.)での組換えhGCDの最終精製工程を示す。カラムは、伝導率モニターリング、pHおよび280nmでの吸光度を可能にするAKTAプライムシステム(Amersham Pharmacia Biotech)と一体化された。前カラムから得られたGCD溶出プールを6ml/分で負荷し、その後、UV吸光度がベースラインに達するまで平衡化緩衝液で洗浄した。純粋なGCDが、50%エタノールを含有する10mMクエン酸緩衝液によって溶出された。
【図4b】図4bは、酵素活性アッセイによりモニターされた処理時に集められた分画物を示す。
【図4c】図4cは、活性についてアッセイされた溶出画分のクーマシーブルー染色を示す。
【図5a】図5aは、腹腔マクロファージによる取り込みの後における組換えhGCDの活性を示す。
【図5b】図5bは、腹腔マクロファージによる取り込みの後における組換えhGCDの活性を示す。
【図5c】図5cは、腹腔マクロファージによる取り込みの後における組換えhGCDの活性を示す。
【図5d】図5dは、本発明による組換えGCDのウエスタンブロットを示す。
【図6】図6は、本発明によるrGCDおよびCerezyme(商標)についての比較されるグリコシル化構造を示す。
【図7】図7は、本発明によるrGCDについてのグリコシル化構造を示す。
【図8a】図8aは、本発明によるrGCDについてのさらなるN−グリカングリコシル化構造を示す。
【図8b】図8bは、本発明によるrGCDについてのさらなるN−グリカングリコシル化構造を示す。
【図8c】図8cは、本発明によるrGCDについてのさらなるN−グリカングリコシル化構造を示す。
【図8d】図8dは、本発明によるrGCDについてのさらなるN−グリカングリコシル化構造を示す。
【発明を実施するための形態】
【0109】
医薬的に使用されるタンパク質は、従来的には、哺乳動物発現システムまたは細菌発現システムで製造されている。この数年間において、有望な新しい発現システムが植物において見出された。新しい遺伝子を導入することが比較的簡便であること、そして、タンパク質およびペプチドの大量製造のための潜在的可能性のために、「分子ファーミング(pharming)」が、現在、タンパク質発現システムとしてますます広く知られるようになっている。
【0110】
哺乳動物でのタンパク質発現システムと植物でのタンパク質発現システムとの間での大きな違いの1つが、生合成経路における違いにより引き起こされるタンパク質グリコシル化配列の変化である。グリコシル化が、活性、折り畳み、安定性、溶解性、プロテアーゼ感受性、血中クリアランス速度、およびタンパク質の抗原性能力に対する顕著な影響を有することが示されていた。従って、植物におけるタンパク質製造ではどれも、植物のグリコシル化の潜在的な枝分かれを考慮に入れなければならない。
【0111】
炭水化物成分はタンパク質の最も一般的な翻訳後修飾の1つである。タンパク質のグリコシル化は、N結合型およびO結合型の2つのカテゴリーに分けられる。これら2つのタイプは、グリカン成分がタンパク質において結合するアミノ酸が異なる:N結合型はAsn残基に結合し、一方、O結合型はSer残基またはThr残基に結合する。また、各タイプのグリカン配列は特有の特徴的な特徴を有する。2つのタイプのうち、N結合型グリコシル化の方が多く存在し、タンパク質に対するその作用が広範囲に研究されている。他方、O結合型グリカンは比較的少なく、タンパク質に対するその影響に関する情報はあまり得られていない。植物におけるタンパク質のグリコシル化に関して得られるデータの大部分は、O結合型グリカンではなく、N結合型グリカンに集中している。
【0112】
本発明は、本明細書中において、場合により、そして好ましくは、懸濁状態で成長する遺伝子組換え植物細胞(これは好ましくは根細胞である)に基づく植物発現システムを記載する。この発現システムは、目的とする高マンノースタンパク質を効率的に製造するために特に設計されている。用語「高マンノース」は、少なくとも1つの露出したマンノース残基を有するグリコシル化を包含する。
【0113】
従って、第1の局面において、本発明は、目的とする高マンノース組換えタンパク質を産生する宿主細胞に関する。好ましくは、組換えタンパク質はER(小胞体)シグナルペプチドを特徴とし、より好ましくは、ER標的化シグナルペプチドを特徴とする。あるいは、またはさらに、組換えタンパク質は、タンパク質にゴルジ体を迂回させるシグナルを特徴とする。このようなシグナルは、好ましくは、組換えタンパク質が、高マンノースグリコシル化を、より好ましくは、そのようなグリコシル化を保持することによって特徴づけ、最も好ましくは、ERを標的化することによって、かつ/または、ゴルジ体を迂回することによって特徴づけることを可能にする。本明細書中においてより詳細に記載されるように、そのようなシグナルは、好ましくは、シグナルペプチドとして実行されるが、この場合、シグナルペプチドは、場合により、そしてより好ましくは、シグナルペプチドをタンパク質の一部としてもまた特徴づけるためにタンパク質を操作することによって、より好ましくはタンパク質配列の一部を形成する。シグナルは、場合により、標的化シグナル、保持シグナル、回避(迂回)シグナル、または、それらの任意の組合せ、あるいは、所望される高マンノースグリコシル化構造をもたらすことができる任意の他のタイプのシグナルであり得ることに留意しなければならない。
【0114】
1つだけの仮説により限定されることを望まないが、ER標的化シグナルの使用は、組換えタンパク質が植物細胞培養において産生される場合、ゴルジ体への輸送を抑えることができ、従って、所望される高マンノースグリコシル化を保持することができるようである。場合により、高マンノースグリコシル化をもたらすことができる任意のタイプの機構を、ゴルジ体を迂回するための任意のタイプの機構を含めて、本発明に従って使用することができる。様々なER標的化シグナルペプチドがこの分野では広く知られており、それらはN末端のシグナルペプチドである。場合により、任意の好適なER標的化シグナルペプチドを本発明とともに使用することができる。
【0115】
本発明による宿主細胞は、場合により、目的とするタンパク質をコードする組換え核酸分子、または、そのような核酸分子を含む発現ベクターで(永続的および/または一過性に)形質転換またはトランスフェクションすることができる。そのような核酸分子は、目的とするタンパク質をコードする第1の核酸配列を、場合により、そして好ましくは、液胞標的化シグナルペプチドをコードする第2の核酸分子に機能的に連結されて含む。本明細書中で使用される用語「機能的に」連結されては、物理的な連結を必ずしも示さないことに留意しなければならない。第1の核酸配列は、場合により、そして好ましくは、さらに、ER(小胞体)標的化シグナルペプチドをコードする第3の核酸配列に機能的に連結され得る。本発明の宿主細胞は、目的とするタンパク質が、少なくとも1つの露出されたマンノース残基を含む形態で細胞において産生されるが、好ましくは、高度にマンノシル化された形態であることによって特徴づけられる。
【0116】
「細胞」、「宿主細胞」または「組換え宿主細胞」は、本明細書中では交換可能に使用される用語である。そのような用語は、特定の対象とする細胞だけでなく、そのような細胞の子孫または潜在的な子孫を示すことが理解される。いくつかの変化が、変異または環境的影響のいずれかにより次世代において生じ得るので、そのような子孫は、実際、親細胞と同一でないことがあり、しかし、本明細書中で使用される用語の範囲には依然として含まれる。本明細書中で使用される「宿主細胞」は、ネイクドDNA、または、組換えDNA技術を使用して構築された発現ベクターで組換え的に形質転換され得る細胞を示す。本明細書中で使用される用語「トランスフェクション」は、核酸(例えば、ネイクドDNAまたは発現ベクター)をレシピエント細胞に核酸媒介遺伝子移入によって導入することを意味する。本明細書中で使用される「形質転換」は、細胞の表現型が、外因性のDNAまたはRNAの細胞取り込みの結果として変化させられるプロセスを示し、例えば、形質転換された細胞は、所望されるタンパク質の組換え形態を発現する。
【0117】
薬物抵抗性または他の選択マーカーが、部分的には、形質転換体の選択を容易にするために意図されることを理解しなければならない。また、選択マーカー(例えば、薬物抵抗性マーカーなど)の存在は、混入微生物を培養培地で増殖させないことにおいて有用であり得る。形質転換された宿主細胞のそのような純粋培養は、誘導された表現型の生存のために要求される条件のもとで細胞を培養することによって得られる。
【0118】
上記で示されたように、本発明の宿主細胞は核酸分子でトランスフェクションまたは形質転換することができる。本明細書中で使用される用語「核酸」は、デオキシリボ核酸(DNA)、および、適する場合にはリボ核酸(RNA)などのポリヌクレオチドを示す。これらの用語はまた、均等物として、ヌクレオチドのアナログから作製される、RNAまたはDNAのいずれかのアナログ、ならびに、記載されている実施形態に対して適用可能であるように、一本鎖(例えば、センスまたはアンチセンス)ポリヌクレオチドおよび二本鎖ポリヌクレオチドを含むことを理解しなければならない。
【0119】
なお別の実施形態において、本発明の宿主細胞は、組換え核酸分子を含む発現ベクターでトランスフェクションまたは形質転換することができる。本明細書中で使用される「発現ベクター」は、プラスミドなどのベクター、ウイルス、バクテリオファージ、組込み可能なDNAフラグメント、および、宿主のゲノムへのDNAフラグメントの組込みを可能にする他のビヒクルを包含する。発現ベクターは、典型的には、所望される遺伝子またはそのフラグメントと、好適な宿主細胞において認識される機能的に連結された遺伝的制御エレメントとを含有する自己複製性のDNA構築物またはRNA構築物であり、所望される遺伝子の発現をもたらす。これらの制御エレメントは、好適な宿主における発現をもたらすことができる。一般に、遺伝的制御エレメントは原核生物プロモーターシステムまたは真核生物プロモーター発現制御システムを含むことができる。そのようなシステムは、典型的には、転写プロモーター、転写の開始を制御するための必要に応じて使用されるオペレーター、RNA発現のレベルを上昇させるための転写エンハンサー、好適なリボソーム結合部位をコードする配列、RNAスプライス接合部、転写および翻訳を終結させる配列などを含む。発現ベクターは、通常、ベクターが宿主細胞とは無関係に複製することを可能にする複製起点を含有する。
【0120】
プラスミドはベクターの最も一般的に使用されている形態であるが、同等の機能を果たし、かつ、この分野で知られているか、または、この分野で知られるようになる他の形態のベクターが本発明における使用のために好適である。例えば、Pouwels他、Cloning Vectors:a Laboratory Manual(1985年および増刊)、Elsevier、N.Y.;Rodriquez他(編)、Vectors:a Survey of Molecular Cloning Vectors and their Uses、Buttersworh、Boston、Mass(1988)を参照のこと(これらは参照により本明細書中に組み込まれる)。
【0121】
一般に、そのようなベクターはまた、形質転換された細胞における表現型選択を提供することができる特定の遺伝子を含有する。本発明のポリペプチドをコードする遺伝子を発現させるための原核生物性および真核生物性のウイルス発現ベクターの使用もまた意図される。
【0122】
場合により、ベクターは、(下記の実施例に関して記載されるように)全体的な植物ベクターであり得る。あるいは、ベクターは、場合により、根細胞に対して特異的であり得る。
【0123】
1つの好ましい実施形態において、本発明の宿主細胞は真核生物細胞または原核生物細胞であり得る。
【0124】
具体的な実施形態において、本発明の宿主細胞は原核生物細胞であり、好ましくは細菌細胞であり、最も好ましくはアグロバクテリウム・ツメファシエンス細胞である。これらの細胞は、下記で記載される好ましい植物宿主細胞に感染させるために使用させる。
【0125】
別の好ましい実施形態において、本発明の宿主細胞は真核生物細胞であってもよく、好ましくは植物細胞、最も好ましくは、アグロバクテリウム・リゾゲネスで形質転換された植物根細胞からなる群から選択される植物根細胞、セロリ細胞、ショウガ細胞、西洋ワサビ細胞およびニンジン細胞であり得る。
【0126】
好ましい実施形態において、植物根細胞はニンジン細胞である。本発明の形質転換されたニンジン細胞は懸濁状態で成長することに留意しなければならない。上記で言及され、また、実施例において記載されるように、これらの細胞は本発明のアグロバクテリウム・ツメファシエンス細胞で形質転換される。
【0127】
本発明の宿主細胞をトランスフェクションまたは形質転換するために使用される発現ベクターまたは組換え核酸分子はさらに、ペプチドシグナル配列を付加し、または除去し、またはそうでなければ改変して、シグナルペプチドの切断を変化させるために、または、発現したリソソーム酵素の植物内膜形による標的化を増大もしくは変化させるために、当業者に知られている様々な方法に従って改変することができる。例えば、限定としてではないが、発現構築物を、分泌のために、または、液胞局在化のために、または、小胞体(ER)における保持のためにリソソーム酵素を標的化するために特に操作することができる。
【0128】
1つの実施形態において、発現ベクターまたは組換え核酸分子は、リソソーム酵素を植物の液胞に標的化するシグナルをコードするヌクレオチド配列を含むために操作することができる。例えば、限定としてではないが、本発明の宿主細胞に含まれる組換え核酸分子は、塩基性タバコキチナーゼA遺伝子に由来する液胞標的化シグナルペプチドをコードする第2の核酸配列との機能的な連結にある、リソソーム酵素をコードする第1の核酸配列を含む。この液胞シグナルペプチドは、配列番号2によって表されるようなアミノ酸配列を有する。第1の核酸配列は、場合により、さらに、配列番号1によって表されるようなER(小胞)標的化シグナルペプチドをコードする第3の核酸配列との機能的な連結で連結され得る。1つの実施形態において、本発明の宿主細胞に含まれる組換え核酸分子はさらに、植物細胞において機能的であるプロモーターを含む。このプロモーターは、本発明の組換え分子に機能的に連結されなければならない。
【0129】
用語「機能的に連結された(されている)」は、第1の核酸配列が第2の核酸配列との機能的な関係に置かれているとき、第1の核酸配列が第2の核酸配列と機能的に連結されていることを示すために本明細書中で使用される。例えば、プロモーターがコード配列の転写または発現に影響を及ぼす場合、プロモーターはコード配列に機能的に連結されている。場合により、そして好ましくは、機能的に連結されたDNA配列は連続し(例えば、物理的に連結され)ており、そして、2つのタンパク質コード領域をつなぐために必要な場合には同じリーディングフレームにある。従って、DNA配列および調節配列は、適切な分子(例えば、転写活性化因子タンパク質)が調節配列に結合したときに遺伝子発現を可能にするような様式でつながれる。
【0130】
別の実施形態において、本発明の組換え核酸分子は、場合により、さらに、植物細胞において好ましくは機能的である機能的に連結されたターミネーターを含むことができる。本発明の組換え核酸分子は、場合により、さらに、さらなる制御エレメント、促進エレメントおよび調節エレメント、ならびに/または、選択マーカーを含むことができる。これらの調節エレメントは組換え分子に機能的に連結されていることに留意しなければならない。
【0131】
発現構築物において使用され得る調節エレメントには、植物細胞にとって異種または同族的のいずれかであり得るプロモーターが含まれる。プロモーターは、連結された配列の高レベルの転写を植物細胞および植物において行わせることができる植物プロモーターまたは非植物プロモーターであり得る。本発明を実施する際に効果的に使用され得る植物プロモーターの非限定的な例には、カリフラワーモザイクウイルス(CaMV)の35S、rbcS、クロロフィルa/b結合タンパク質に対するプロモーター、AdhI、NOSおよびHMG2、またはそれらの改変体もしくは誘導体が含まれる。プロモーターは構成的または誘導可能のいずれかであり得る。例えば、限定としてではないが、誘導可能なプロモーターは、植物、植物組織または植物細胞の機構的な遺伝子活性化(MGA)の後、リソソーム酵素のヌクレオチド配列の発現または増大した発現を促進させるプロモーターであり得る。
【0132】
本発明の宿主細胞をトランスフェクションまたは形質転換するために使用される発現ベクターはさらに、植物および植物細胞における異種遺伝子の発現を増強または最適化するために、当業者に知られている様々な方法に従って改変することができる。そのような改変には、プロモーターの強さを増大させるために、または、目的とするタンパク質を変化させるためにDNA調節エレメントを変異することが含まれるが、これに限定されない。
【0133】
好ましい実施形態において、本発明の宿主細胞によって産生される目的とする高マンノースタンパク質は、少なくとも1つの露出したマンノース残基(少なくとも1つの末端マンノース残基)を有する高マンノースグリコシル化であり得る。
【0134】
そのような高マンノースタンパク質は、別の好ましい実施形態によれば、グルコセレブロシダーゼ(GCD)、酸性スフィンゴミエリナーゼ、ヘキソサミニダーゼ、α−N−アセチルガラクトサミニダーゼ、酸性リパーゼ、α−ガラクトシダーゼ、グルコセレブロシダーゼ、α−L−イズロニダーゼ、イズロナートスルファターゼ、α−マンノシダーゼおよびシアリダーゼからなる群から選択されるリソソーム酵素であり得る。
【0135】
用語「リソソーム酵素」は、本発明によって記載される植物発現システムにおいて産生される任意のそのような酵素および産物に関して本明細書中で記載される場合、ヒトまたは動物のリソソーム酵素、ヒトまたは動物の改変されたリソソーム酵素、あるいはそのような酵素のフラグメント、誘導体または改変体をコードするヌクレオチド配列から遺伝子組換え植物細胞において発現される組換えペプチドを示す。ヒトまたは動物の有用な改変されたリソソーム酵素には、天然に存在するか、または人為的に導入された1つまたは複数のアミノ酸付加、アミノ酸欠失および/またはアミノ酸置換を有する、ヒトまたは動物のリソソーム酵素が含まれるが、これらに限定されない。
【0136】
可溶性のリソソーム酵素は生合成の初期段階を分泌タンパク質と共有している:すなわち、リボソーム上での合成、粗面小胞体(ER)の表面に対するN末端シグナルペプチドの結合、シグナルペプチドが切断されるERの内腔への輸送、および、特定のアスパラギン残基へのオリゴ糖の付加(N結合型)、それに続く、ゴルジ装置における初期タンパク質のさらなる修飾[von FiguraおよびHasilik、Annu.Rev.Biochem.、55:167〜193(1986)]。N結合型オリゴ糖は、複雑で、多様で、かつ不均一であり得るし、高マンノース残基を含有する場合がある。タンパク質は、ER後のプレゴルジ区画において、また、シスゴルジにおいてさらなるプロセシングを受けて、リソソームの局在化酵素に対するN結合型マンノース6−リン酸(M−6−P)オリゴ糖依存性またはN結合型M−6−Pオリゴ糖非依存性のいずれかの認識シグナルを形成する[Kornfeld&Mellman、Ann.Rev.Cell Biol.、5:483〜525(1989);Kaplan他、Proc.Natl.Acad.Sci.USA、74:2026(1977)]。M−6−P認識シグナルの存在は、M−6−P受容体(MPR)に対する酵素の結合をもたらす。これらの結合した酵素は細胞内に留まり、最終的にはリソソームにパッケージングされ、従って、分泌のために標的化されたタンパク質、または形質膜に対して標的化されたタンパク質から隔離される。
【0137】
好ましい実施形態において、リソソーム酵素はヒトグルコセレブロシダーゼ(GCD)であり得る。
【0138】
なおかつ、さらに、特定の実施形態において、本発明の好ましい宿主細胞は、好ましくは、配列番号9によって表されるような核酸配列を有するカリフラワーモザイクウイルス由来の35Sプロモーターと、好ましくは、配列番号12によって表されるような核酸配列を有するアグロバクテリウム・ツメファシエンスのオクトピンシンターゼターミネーターと、TMV(タバコモザイクウイルス)のΩ翻訳エンハンサーエレメントとをさらに含む組換え核酸分子によって形質転換またはトランスフェクションされる。好ましい実施形態によれば、この組換え核酸分子は、実質的には配列番号13によって表されるような核酸配列を含み、実質的には配列番号14によって表されるようなアミノ酸配列を有する高マンノースGCDをコードする。
【0139】
本発明はさらに、生物学的に活性な高マンノースリソソーム酵素をコードする核酸分子を含む発現ベクターを提供することを理解しなければならない。
【0140】
この局面の1つの好ましい実施形態において、本発明の発現ベクターは、生物学的に活性な高マンノース型ヒトグルコセレブロシダーゼ(GCD)をコードする核酸分子を含む。好ましくは、本発明の好ましい発現ベクターは、実質的には配列番号13によって表されるような核酸配列を有する組換え核酸分子を含む。具体的な実施形態によれば、好ましい発現ベクターでは、下記の実施例1により記載されるようなpGREENIIプラスミドが利用される。
【0141】
さらには、本発明は、上記の発現ベクターに含まれる発現カセットを提供することに留意しなければならない。
【0142】
第2の局面において、本発明は、本発明の宿主細胞によって産生される組換え高マンノースタンパク質に関する。
【0143】
好ましい実施形態において、本発明の高マンノースタンパク質は、グルコセレブロシダーゼ(GCD)、酸性スフィンゴミエリナーゼ、ヘキソサミニダーゼ、α−N−アセチルガラクトサミニダーゼ、酸性リパーゼ、α−ガラクトシダーゼ、グルコセレブロシダーゼ、α−L−イズロニダーゼ、イズロナートスルファターゼ、α−マンノシダーゼおよびシアリダーゼからなる群から選択される生物学的に活性な高マンノースリソソーム酵素であり得る。最も好ましくは、本発明のリソソーム酵素はヒトグルコセレブロシダーゼ(GCD)であり得る。
【0144】
用語「生物学的に活性な」は、本明細書中では、植物発現システムにおいて産生される任意の組換えリソソーム酵素に関して使用されて、組換えリソソーム酵素が、ヒトまたは動物の対応するリソソーム酵素の天然基質またはアナログ基質または合成基質のいずれかを検出可能なレベルで加水分解することができることを意味する。
【0145】
なおかつ、さらに、本発明は、露出したマンノース残基を含む少なくとも1つのオリゴ糖鎖を有する組換え産生された生物学的に活性なリソソーム酵素を提供する。
【0146】
好ましい実施形態によれば、本発明の組換えリソソーム酵素は、標的部位における標的細胞上のマンノース受容体に結合することができる。好ましくは、この部位は、リソソーム蓄積疾患に罹患している対象の体内であり得る。
【0147】
場合により、そしてより好ましくは、組換えリソソーム酵素は、天然に存在するリソソーム酵素の標的細胞に対する親和性と比較して、標的細胞に対する増大した親和性を有する。具体的な実施形態において、標的部位における標的細胞は対象の肝臓におけるクッパー細胞であり得る。
【0148】
好ましい実施形態において、組換えリソソーム酵素は、グルコセレブロシダーゼ(GCD)、酸性スフィンゴミエリナーゼ、ヘキソサミニダーゼ、α−N−アセチルガラクトサミニダーゼ、酸性リパーゼ、α−ガラクトシダーゼ、グルコセレブロシダーゼ、α−L−イズロニダーゼ、イズロナートスルファターゼ、α−マンノシダーゼまたはシアリダーゼからなる群から選択され得る。
【0149】
最も好ましくは、本発明の組換えリソソーム酵素はグルコセレブロシダーゼ(GCD)である。
【0150】
第3の局面において、本発明は、高マンノースタンパク質を製造する方法に関する。それによれば、本発明の方法は、(a)目的とする組換えタンパク質をコードする組換え核酸分子、または、そのような組換え核酸分子を含む発現ベクターで形質転換またはトランスフェクションされた組換え宿主細胞の培養物を調製する工程;(b)工程(a)により調製された宿主細胞培養物を、高マンノースタンパク質の発現を可能にする条件のもとでの懸濁状態で培養する工程(この場合、宿主細胞はタンパク質を高度にマンノシル化された形態で産生する);(c)(a)において提供された培養物から細胞を集め、細胞からタンパク質を回収する工程;および(d)工程(c)のタンパク質を好適なタンパク質精製法によって精製する工程を含む。
【0151】
場合により、そして好ましくは、組換えタンパク質は、米国特許第6391638号(2002年5月21日発行、これは、本明細書中に詳しく示されているかのように本明細書により参考として組み込まれる)に関して記載される装置で培養することによって、本発明による植物細胞により産生され得る。この装置を用いた懸濁状態で植物細胞を培養するための条件が、「細胞/組織を培養するための装置、システムおよび方法」と題する米国特許出願に関して記載される(これは、本発明者らの一人によるものであり、本出願と共有である)(これは、本明細書中に詳しく示されているかのように本明細書により参考として組み込まれ、本出願と同じ日に出願された)。
【0152】
本発明の方法によって産生された目的とする高マンノースタンパク質を回収および精製するための具体的で、非限定的な例が、下記の実施例において見出され得る。実施例では、本発明によって産生された組換えh−GCDが、予想外にも、本発明の形質転換されたニンジン細胞の内膜に結合し、培地に分泌されなかったことが示される。可溶性のrh−GCDが、ろ過または沈殿化などのこの分野で知られている様々な手段に従って、細胞破砕物および他の不溶性成分から分離され得る。例えば、凍結解凍サイクルの後、細胞は破壊を受け、細胞内の可溶性タンパク質の放出を受け、これに対して、h−GCDは不溶性の膜破砕物に結合したままである。このような可溶性および不溶性膜破砕物の混合物は次に遠心分離され、可溶性画分が除かれ、このように、精製が簡略化された。膜に結合したh−GCDは、その後、穏和な界面活性剤、プロテアーゼ阻害剤および抗酸化剤試薬の存在下での機械的な破壊によって溶解させることができる。可溶性酵素はさらに、様々なクロマトグラフィー技術、例えば、カチオン交換クロマトグラフィーカラムおよび疎水性相互作用クロマトグラフィーカラムなどを使用して精製することができる。バイオリアクターでのrh−GCD製造時および精製プロセス時において、h−GCDの同一性、収率、純度および酵素活性を1つ以上の生化学的アッセイによって明らかにすることができる。これらには、酵素の基質または基質アナログの加水分解を検出すること、SDS−ポリアクリルアミドゲル電気泳動分析、および免疫学的分析(例えば、ELISAおよびウエスタンブロットなど)が含まれるが、これらに限定されない。
【0153】
好ましい実施形態によれば、本発明の方法によって使用される宿主細胞は本発明の宿主細胞を含む。
【0154】
別の好ましい実施形態において、本発明の方法によって産生される高マンノースタンパク質は、露出したマンノース残基を含む少なくとも1つのオリゴ糖鎖を有する生物学的に活性な高マンノースリソソーム酵素であり得る。
【0155】
本発明の組換え酵素は、標的部位における標的細胞上のマンノース受容体に結合することができる。より好ましくは、本発明の方法によって産生される組換え酵素は、天然に存在するリソソーム酵素の標的細胞に対する対応する親和性と比較して、標的細胞に対する増大した親和性を有する。それによれば、標的部位における標的細胞は対象の肝臓におけるクッパー細胞であり得る。
【0156】
具体的な実施形態において、本発明の組換えリソソーム酵素は、グルコセレブロシダーゼ(GCD)、酸性スフィンゴミエリナーゼ、ヘキソサミニダーゼ、α−N−アセチルガラクトサミニダーゼ、酸性リパーゼ、α−ガラクトシダーゼ、グルコセレブロシダーゼ、α−L−イズロニダーゼ、イズロナートスルファターゼ、α−マンノシダーゼおよびシアリダーゼからなる群から選択され得る。最も好ましくは、本発明の組換えリソソーム酵素はグルコセレブロシダーゼ(GCD)であり得る。
【0157】
別の好ましい実施形態において、本発明の方法によって使用される宿主細胞は、アグロバクテリウム・リゾゲネスで形質移転された根細胞からなる群から選択される植物根細胞、セロリ細胞、ショウガ細胞、西洋ワサビ細胞およびニンジン細胞であり得る。最も好ましくは、植物根細胞はニンジン細胞である。形質転換された宿主ニンジン細胞は懸濁状態で成長することに特に留意しなければならない。
【0158】
さらなる局面において、本発明は、外因性の組換えリソソーム酵素を使用することによって、リソソーム蓄積疾患を有する対象(好ましくは、哺乳動物対象)を処置するための方法に関する。
【0159】
開示および記載される場合、本発明は、本明細書中に開示される特定の例、プロセス工程および材料に限定されないことを理解しなければならない。これは、そのようなプロセス工程および材料は幾分異なり得るからである。本発明の範囲は、添付された請求項およびその均等物によってのみ限定されるので、本明細書中で使用されている用語法は、特定の実施形態を記載する目的のために使用されるだけであり、限定であることを意図していないこともまた理解しなければならない。
【0160】
本明細書および下記の請求項を通して、文脈がそうでないことを要求しない限り、語句「含む(comprise)」および変化形(例えば、「comprises」および「comprising」など)は、言及された完全体(integer)もしくは工程または完全体もしくは工程の群を包含するが、任意の他の完全体もしくは工程または完全体もしくは工程の群を排除しないことを意味することが理解される。
【0161】
本明細書および添付された請求項において使用されるように、「a」、「an」および「the」の単数形は、文脈が明らかにそうでないことを示さない限り、複数の参照物を含むことに留意しなければならない。
【0162】
下記の実施例は、本発明の様々な局面を実施する際に本発明者らによって用いられた様々な技術を表している。これらの技術は本発明の実施のための好ましい実施形態を例示しているが、当業者は、本開示に照らして、数多くの改変が、本発明の精神および意図された範囲から逸脱することなく行われ得ることを認識することを理解しなければならない。
【実施例】
【0163】
実験手順:
プラスミドベクター
*CE−T:これは、Galili教授から得られたプラスミドCEから構築された[米国特許第5367110号、1994年11月22日]。
プラスミドCEをSalIで消化した。
【0164】
SalI付着末端を、DNAポリメラーゼIのラージフラグメントを使用して平滑末端にした。その後、プラスミドをPstIで消化し、SmaIおよびPstIで消化された塩基性エンドキチナーゼ遺伝子[Arabidopsis thaliana]由来のER標的化シグナル(ATGAAGACTAATCTTTTTCTCTTTCTCATCTTTTCACTTCTCCTATCATTATCCTCGGCCGAATTC)およびタバコキチナーゼA由来の液胞標的化シグナル(GATCTTTTAGTCGATACTATG)をコードするDNAフラグメントに連結した。
【0165】
*pGREENII:これはP.Mullineaux博士から得られた[Roger P.Hellens他(2000)、Plant Mol.Biol.、42:819〜832]。pGREENIIベクターからの発現は、カリフラワーモザイクウイルス由来の35Sプロモーター、TMV(タバコモザイクウイルス)のΩ翻訳エンハンサーエレメント、および、アグロバクテリウム・ツメファシエンス由来のオクトピンシンターゼターミネーター配列によって制御される。
【0166】
cDNA
hGCD:これはATCC(アクセション番号65696)から得られ、グルコシダーゼβ(酸性)[グルコセレブロシダーゼ]を含有するGC−2.2[GCS−2kb;λEZZ−γ3ホモサピエンス]である。インサート長(kb):2.20;組織:繊維芽細胞WI−38細胞。
【0167】
発現プラスミドの構築
hGCDをコードするcDNA(ATTCクローン番号65696)を、フォワードプライマー(5’CAGAATTCGCCCGCCCCTGCA3’)およびリバースプライマー(5’CTCAGATCTTGGCGATGCCACA3’)を使用して増幅した。精製されたPCR DNA産物をEcoRIおよびBglIIのエンドヌクレアーゼ(プライマー内の下線部の認識配列を参照のこと)で消化し、同じ酵素で消化された、発現カセットE−Tを有する中間ベクターに連結した。発現カセットを、SmaIおよびXbaIの制限酵素を使用して切断し、中間ベクターから取り出し、バイナリーベクターpGREENIIに連結して、これにより、最終的な発現ベクターを形成させた。カナマイシン抵抗性が、pGREENIIベクターと一緒に得られるnosプロモーターにより駆動されるNPTII遺伝子によって付与される(図1B)。得られる発現カセットが図1Aにより示される。
【0168】
得られたプラスミドは、下記の配列決定用プライマーを使用して、シグナルの正しいインフレーム融合を保証するために配列決定された:5’の35Sプライマー:5’CTCAGAAGACCAGAGGGC3’、および3’ターミネーター:5’CAAAGCGGCCATCGTGC3’。
【0169】
ニンジンカルスの確立および細胞懸濁培養
本発明者らが行ったニンジンカルスの確立およびニンジン細胞懸濁培養は、Torres K.C.によって以前に記載された通りであった(Tissue culture techniques for horticular crops、111頁、169)。
【0170】
ニンジン細胞の形質転換および形質転換された細胞の単離
ニンジン細胞の形質転換を、以前に記載された方法[Wurtele,E.S.およびBulka,K.、Plant Sci.、61:253〜262(1989)]の適合化によるアグロバクテリウム形質転換を使用して行った。液体培地で成長する細胞を、カルスの代わりに、プロセスを通して使用した。インキュベーション時間および成長時間を、液体培養における細胞の形質転換のために適合させた。簡単に記載すると、アグロバクテリウム細菌をエレクトロポレーションによりpGREENIIベクターで形質転換し[den Dulk−Ra,A.およびHooykaas、P.J.(1995)、Methods Mol.Biol.、55:63〜72]、その後、30mg/mlのパロモマイシン抗生物質を使用して選択した。ニンジン細胞をアグロバクテリウム細菌で形質転換し、液体培地において60mg/mlのパロモマイシン抗生物質を使用して選択した。
【0171】
高レベルのGCDを発現するカルスを単離するための形質転換ニンジン細胞のスクリーニング
形質転換後14日目に、培養から得られた細胞を、個々の細胞クラスターからカルスを形成させるために3%充填細胞体積の希釈度で固体培地に置床した。個々のカルスが1cm〜2cmの直径に達したとき、細胞をSDSサンプル緩衝液においてホモジネートし、得られたタンパク質抽出物をSDS−PAGE[Laemmli U.(1970)、Nature、227:680〜685]で分離し、ニトロセルロースメンブラン(hybondCニトロセルロース、0.45ミクロン、カタログ番号:RPN203C、Amersham Life Scienceから得られる)に転写した。GCDを検出するためのウエスタンブロットを、ポリクローナル抗hGCD抗体(本明細書中下記に記載される)を使用して行った。著量のGCDを発現するカルスを拡大して、スケールアップ、タンパク質精製および分析のために液体培地での成長に移した。
【0172】
ポリクローナル抗体の調製
75マイクログラムの組換えGCD(Cerezyme(商標))を3mlの完全フロイントアジュバントに懸濁して、2羽のウサギのそれぞれに注射した。各ウサギには、追加免疫注射が2週間後に与えられた。ウサギは追加免疫注射後の約10日目に採血され、そして再び、抗体力価が低下し始めるまで1週間間隔で採血された。凝血塊を除いた後、血清を小分けして、−20℃で保存した。
【0173】
バイオリアクターにおけるスケールアップされた培養での成長
rh−GCD遺伝子を含有する遺伝子改変されたニンジン細胞の約1cm(直径)のカルスを、4.4gr/lのMSD培地(Duchefa)、9.9mg/lのチアミンHCl(Duchefa)、0.5mg/lの葉酸(Sigma)、0.5mg/lのビオチン(Duchefa)、0.8g/lのカゼイン加水分解物(Ducifa)、30g/lの糖、およびホルモンの2−4D(Sigma)を含有する、直径9cmのムラシゲ・スクーグ(MS)寒天培地平板に置床した。カルスを25℃で14日間増殖させた。
【0174】
懸濁細胞培養を、この分野で広く知られているように、形質転換されたカルスをMSD液体培地(0.2mg/lの2,4−ジクロロ酢酸を含有するムラシゲ・スクーグ(1962))で継代培養することによって調製した。懸濁細胞を、250ml三角フラスコにおいて、25℃で、60rpmの振とう速度で培養した(操作体積を25mlで開始し、7日後に50mlに増大させる)。その後、細胞培養体積を、同じ条件のもとで、操作体積を300mlまで増大することによって1L三角フラスコに増大させた。4LのMSD培地を含有する小型バイオリアクター(10L)の接種物[国際特許出願公開WO98/13469を参照のこと]を、7日間培養された2つの1L三角フラスコから得られた400mlの懸濁細胞を加えることによって得た。1Lpmの空気流を用いて25℃で1週間の培養の後、MDS培地を10Lにまで加え、培養を同じ条件のもとで継続した。さらに5日間の培養の後、細胞のほとんどを、細胞培地を80μの網に通すことによって集め、回収した。過剰な培地を絞り出し、充填細胞ケークを−70℃で保存した。
【0175】
バイオリアクター装置のさらなる詳細が、米国特許第6391638号(2002年5月21日発行、これは以前に参照により組み込まれている)に関して見出され得る。
【0176】
タンパク質精製
培地を不溶性GCDから分離するために、約100gの湿重量の細胞を含有する凍結細胞ケークを解凍し、その後、解凍された細胞を、17000xgで20分間、4℃で遠心分離した。不溶物および無傷の細胞を、100mlの洗浄緩衝液(20mMリン酸ナトリウム(pH7.2)、20mM EDTA)に再懸濁することによって洗浄し、次いで、17000xgで20分間の4℃での遠心分離によって沈殿させた。rh−GCD(組換えヒトGCD)を、ペレットを200mlの抽出緩衝液(20mMリン酸ナトリウム(pH7.2)、20mM EDTA、1mM PMSF、20mMアスコルビン酸、3.8gポリビニルピロリドン(PVPP)、1mM DTT、および1% Triton−x−100)においてホモジネートすることにより抽出し、可溶化した。その後、ホモジネートを、30分間、室温で振とうし、17000xgで20分間の4℃での遠心分離によって清澄化した。ペレットを捨て、上清のpHを濃クエン酸の添加によってpH5.5に調節した。pH調節後に生じた濁りを、上記に記載された同じ条件での遠心分離によって清澄化した。
【0177】
さらなる精製を下記のようなクロマトグラフィーカラム手順によって行った:200mlの清澄化された培地を、25mMクエン酸ナトリウム緩衝液(pH5.5)で平衡化され、XKカラム(2.6x20cm)に充填された20mlの強カチオン交換樹脂(Macro−Prep high−S担体、Bio−Rad)に負荷した。カラムは、伝導率、pHおよび280nmでの吸光度をモニターすることを可能にするAKTAプライムシステム(Amersham Pharmacia Biotech)と一体化された。サンプルを20ml/分で負荷し、その後、UV吸光度がベースラインに達するまで、カラムを、平衡化緩衝液(25mMクエン酸ナトリウム緩衝液、pH5.5)を用いて12ml/分の流速で洗浄した。rh−GCDのプレ溶出が、200mMのNaClを含有する平衡化緩衝液で行われ、溶出が、600mMのNaClを含有する平衡化緩衝液で得られた。処理時に集められた分画物は酵素活性アッセイによってモニターされ、酵素活性を示したチューブ(溶出ピークでの)がプールされた。プールされたサンプルは、5%エタノールを含有する水で希釈(1:5)され、NaOHでpH6.0にpH調節された。rh−GCDを含有するサンプルを、前カラムの場合と同じ樹脂の10mlが充填された第2のXKカラム(1.6x20cm)に加えた。このカラムにおける樹脂は、5%エタノールを含有する20mMクエン酸塩緩衝液(pH6.0)で平衡化された。サンプルを負荷した後、カラムを平衡化緩衝液で洗浄し、GCDを溶出緩衝液(20mMクエン酸塩緩衝液(pH6.0)、5%エタノール、および1M NaCl)によってカラムから溶出させた。溶出工程における吸収ピークの画分をプールして、第3のカラムに加えた。
【0178】
最終精製工程を、8mlの疎水性相互作用樹脂(TSKゲル、Toyopearl Phenyl−650C、Tosoh Corp.)が充填されたXKカラム(1.6x20cm)で行った。樹脂は、5%エタノールを含有する10mMクエン酸塩緩衝液(pH6.0)で平衡化された。前カラムからのGCD溶出プールを6ml/分で負荷し、その後、UV吸収がベースラインに達するまで、平衡化緩衝液で洗浄した。純粋なGCDが、50%エタノールを含有する10mMクエン酸塩緩衝液)により溶出され、プールされ、−20℃で保存された。
【0179】
タンパク質濃度の測定
細胞抽出物および分画物におけるタンパク質濃度を、ウシ血清アルブミン標準品(第V画分、Sigma)を使用してLowry/Bradfordの方法(Bio Radタンパク質アッセイ)[Bradford、M.、Anal.Biochem.(1976)、72:248]によってアッセイした。あるいは、均質なタンパク質サンプルの濃度は280nmにおける吸収によって決定された(1mg/ml=1.4O.D280)。純度は280/260nm比によって決定された。
【0180】
GCD酵素活性アッセイ
GCDの酵素活性を、p−ニトロフェニル−β−D−グルコピラノシド(Sigma)を基質として使用して測定した。アッセイ緩衝液は、60mMリン酸塩−クエン酸塩緩衝液(pH=6)、4mMのβ−メルカプトエタノール、1.3mMのEDTA、0.15%のTriton X−100、0.125%のタウロコール酸ナトリウムを含有した。アッセイを96ウエルELISAプレートで行った。0〜50マイクロリットルのサンプルを250マイクロリットルのアッセイ緩衝液とインキュベーションし、基質を4mMの最終濃度に添加した。反応液を37℃で60分間インキュベーションした。生成物(p−ニトロフェニル;pNP)の形成が405nmにおける吸光度によって検出された。405nmにおける吸光度をt=0および終点でモニターした。60分後、6マイクロリットルの5N NaOHを各ウエルに加え、405nmにおける吸光度を再びモニターした。並行してアッセイされた参照標準曲線を使用して、試験されたサンプルにおけるGCDの濃度を定量した[Friedman他(1999)、Blood、93(9):2807〜16]。
【0181】
生化学的分析:
ゲル内タンパク質分解および質量分析法による分析
ゲル内の染色されたタンパク質バンドを清浄なカミソリ刃で切り、ゲル内のタンパク質を10mMのDTTで還元し、100mMのヨードアセトアミド/10mM重炭酸アンモニウムで修飾した。ゲル片を50%アセトニトリル/10mM重炭酸アンモニウムで処理して、タンパク質から染色剤を除き、その後、ゲル片を乾燥した。乾燥したゲル片を、サンプルあたり約0.1μgのトリプシンを含有する10%アセトニトリル/10mM重炭酸アンモニウムで再水和した。ゲル片を37℃で一晩インキュベーションし、得られたペプチドを、0.1%トリフルオロアセタートを含む60%アセトニトリルで回収した。
【0182】
トリプシン消化ペプチドを、多孔性R2(Persepective)が充填(homo−filled)された0.1X300mm溶融シリカキャピラリー(J&W、内径:100マイクロメートル)での逆相クロマトグラフィーによって分離した。ペプチドを、約1μl/分の流速で、水における0.1%酢酸を伴う5%〜95%のアセトニトリルの80分間の直線グラジエントを使用して溶出した。カラムからの液体をイオントラップ質量分析計(LCQ、Finnegan、San Jose、CA)にエレクトロスプレーした。質量分析を、反復的に全域MS走査を使用し、その後、最初のMS走査から選択された最も優勢なイオンの衝突解離(CID)を使用して陽イオンモードで行った。質量分析データを、Sequestソフトウエア[J.EngおよびJ.Yates、ワシントン大学およびFinnegan(San Jose)]を使用して、シミュレートされたタンパク質分解、および、NR−NCBIデータベースにおけるタンパク質のCIDと比較した。
【0183】
タンパク質のアミノ末端をペプチドシーケンンサー494A(Perkin Elmer)において製造者の説明書に従って配列決定した。
【0184】
腹腔マクロファージのGCD取り込み
GCDのマクロファージに対する標的化および取り込みが、マンノース/N−アセチルグルコサミン受容体によって媒介されることが知られており、これは、Stahl P.およびGordon S.[J.Cell Biol.(1982)、93(1):49〜56]によって記載されるように、マウスから得られたチオグリコラート誘発の腹腔マクロファージを使用して測定することができる。簡単に記載すると、マウス(メス、C57−B6系統)に2.4%のデキストロース非含有Bacto−チオグリコラート培地(Difcoカタログ番号0363−17−2)の2.5mlを腹腔内注射した。4日後〜5日後、処置マウスを頸部脱臼によって屠殺し、腹膜腔をリン酸塩緩衝化生理的食塩水で洗い流した。細胞を遠心分離(1000xg、10分間)によってペレット化し、10%ウシ胎児血清を含有するDMEM(Beit Haemek、イスラエル)に再懸濁した。その後、細胞を1〜2x105細胞/mlで96ウエル組織培養プレートに置床して、37℃でインキュベーションした。90分後、非接着性細胞を、PBSを使用して3回洗浄して除き、接着性マクロファージを、酵母マンナン(2−10、5mg/ml)の非存在下および存在下、200マイクロリットルの最終体積における0〜40マイクログラムの範囲で指定量のrhGCDを含有する培養培地において37℃で90分間インキュベーションした。インキュベーション後、過剰なrGCDを含有する培地を除き、細胞をPBSで3回洗浄して、溶解緩衝液(10mM Tris(pH=7.3)、1mM MgCl2、0.5%NP−40、およびプロテアーゼ阻害剤)で溶解した。細胞によるrGCD取り込みの活性を、細胞溶解物を、上記のようなインビトログリコシダーゼアッセイに供することによって測定した。
【0185】
(実施例1)
発現プラスミドの構築
本実施例では、下記の実施例に関して使用される例示的な発現プラスミドの構築がより詳しく記載される。
【0186】
hGCDをコードするcDNA(ATTCクロン番号65696)を、フォワードプライマーの5’CAGAATTCGCCCGCCCCTGCA3’(これはまた配列番号1によって表される)およびリバースプライマーの5’CTCAGATCTTGGCGATGCCACA3’(これはまた配列番号2によって表される)を使用して増幅した。
【0187】
精製されたPCR DNA産物をEcoRIおよびBglIIのエンドヌクレアーゼ(プライマー内の下線部の認識配列を参照のこと)で消化し、同じ酵素で消化された、発現カセットCE−Tを有する中間ベクターに連結した。CE−Tは、塩基性エンドキチナーゼ遺伝子[Arabidopsis thaliana]由来のER標的化シグナルMKTNLFLFLIFSLLLSLSSAEA(これはまた配列番号3によって表される)、および、タバコキチナーゼA由来の液胞標的化シグナルDLLVDTM*(これはまた配列番号4によって表される)を含む。
【0188】
発現カセットを、SmaIおよびXbaIの制限酵素を使用して切断し、中間ベクターから取り出し、バイナリーベクターpGREENIIに連結して、これにより、最終的な発現ベクターを形成させた。カナマイシン抵抗性が、pGREENIIベクターと一緒にnosプロモーターにより駆動されるNPTII遺伝子によって付与される(図1B)。得られる発現カセットが図1Aにより示される。
【0189】
得られたプラスミドは、下記の配列決定用プライマーを使用して、シグナルの正しいインフレーム融合を保証するために配列決定された:
5’の35Sプライマーに由来するプライマー:5’CTCAGAAGACCAGAGGGC3’(これはまた配列番号5によって表される)、および3’のターミネーター:5’CAAAGCGGCCATCGTGC3’(これはまた配列番号6によって表される)。確認されたクローン化hGCDのコード配列が配列番号7によって表される。
【0190】
(実施例2)
ニンジン細胞の形質転換、およびrhGCDを発現する形質転換された細胞に対するスクリーニング
本実施例では、下記の実施例で使用されるような、本発明に従ってニンジン細胞を形質転換するための例示的な方法が記載される。
【0191】
ニンジン細胞の形質転換を、[WurteleおよびBulka(1989)、同上]によって以前に記載されたようにアグロバクテリウム形質転換によって行った。遺伝子改変されたニンジン細胞を、形質転換体を選択するための抗生物質を含むムラシゲ・スクーグ(MS)寒天培地に置床した。図2により示されるように、生成途中のカルスから調製された抽出物を、抗hGCD抗体を使用するウエスタンブロット分析によってGCDの発現について調べ、Cerezyme標準品(陽性コントロール)および非形質転換細胞の抽出物(陰性コントロール)と比較した。調べられた様々なカルスの中で、1つのカルス(No.22)がスケールアップ成長およびタンパク質精製のために選択された。
【0192】
ウエスタンブロットは下記のように行われた。
【0193】
このアッセイの場合、得られたサンプルからのタンパク質がSDSポリアクリルアミドゲル電気泳動で分離され、ニトロセルロースに転写された。この目的のために、SDSポリアクリルアミドゲルは下記のように調製された。SDSゲルは、(Laemmli,UK(1970)、バクテリオファージT4の頭部の組み立て時における構造タンパク質の切断、Nature、227、680〜685)に従って)濃縮ゲルおよび分離ゲルからなる。分離ゲルの組成は下記の通りであった:12%アクリルアミド(Bio−Rad)、10mlのゲル溶液あたり4マイクロリットルのTEMED(N,N,N’,N’−テトラメチルエチレンジアミン;Sigmaカタログ番号T9281)、0.1%SDS、375mM Tris−HCl(pH8.8)、および0.1%過硫酸アンモニウム(APS)。TEMEDおよび過硫酸アンモニウムは、この状況では、重合のためのフリーラジカル開始剤として使用された。重合を開始させた約20分後に、濃縮ゲル(3%アクリルアミド、0.1%SDS、126mM Tris−HCl(pH6.8)、0.1%APS、および、5mlの濃縮ゲル溶液あたり5マイクロリットルのTEMED)を分離ゲルの上に注ぎ、12スペースコームまたは18スペースコームを挿入して、サンプル用ウエルを作製した。
【0194】
陽極チャンバーおよび陰極チャンバーを同一の緩衝液溶液(SDSを含有するTrisグリシン緩衝液(Biorad、カタログ番号161−0772)、pH8.3)で満たした。抗原含有物質を0.5容量のサンプル負荷緩衝液(30mlグリセロール(Sigma、カタログ番号G9012)、9%SDS、15mlメルタプトエタノール(Sigma、カタログ番号M6250)、187.5mM Tris−HCl(pH6.8)、500マイクロリットルのブロモフェノールブルー、これらはすべて、100mlのサンプル緩衝液あたりの体積である)で処理した。その後、混合物を100℃で5分間加熱して、濃縮ゲルに負荷した。
【0195】
電気泳動を、室温で、好適な時間にわたって、例えば、サイズが13x9cmのゲルの場合、50ボルト〜70ボルトの定電流強度を使用して45分間〜60分間、その後、180V〜200Vで45分間〜60分間にわたって行った。その後、抗原をニトロセルロース(Schleicher and Schuell、Dassel)に転写した。
【0196】
タンパク質転写は、実質的には本明細書中に記載される通りに行われた。ゲルを、Whatmann3MMろ紙、厚さ0.5cmの導電性発泡物、および、白金電極により電流を通すワイヤ電極の間に、接するニトロセルロースと一緒に配置した。ろ紙、発泡物およびニトロセルロースを、転写緩衝液(Bioradから得られるTG緩衝液(カタログ番号161−0771);これは、メタノールおよび水の緩衝液(20%メタノール)で10倍希釈された)十分に浸した。転写は、100Vで90分間、4℃で行われた。
【0197】
転写後、ニトロセルロース上の未結合の結合部位を、リン酸塩緩衝液(Riedel deHaen、カタログ番号30435)で希釈された、1%乾燥乳(Dairy America)および0.1%Tween20(Sigma、カタログP1379)を含有するブロッキング緩衝液を用いて4℃で一晩飽和させた。ブロットストリップを抗体(希釈度、上記のように1%乾燥乳および0.1%Tween20を含有するリン酸塩緩衝液(pH7.5)において1:6500)と37℃で1時間インキュベーションした。
【0198】
抗体とインキュベーションした後、ブロットを、PBS(リン酸塩緩衝化リン酸ナトリウム緩衝液(Riedel deHaen、カタログ番号30435))で3回、それぞれの場合について10分間、洗浄した。その後、ブロットストリップを、室温で1時間、好適な二次抗体(ヤギ抗ウサギ(全分子)HRP(Sigma、カタログ#A−4914)、リン酸塩緩衝液(Riedel deHaen、カタログ番号30435)で希釈された、1%乾燥乳(Dairy America)および0.1%Tween20(Sigma、カタログP1379)を含有する緩衝液で1:3000希釈)とインキュベーションした。PBSで数回洗浄した後、ブロットストリップを、ECL発色剤試薬(Amersham RPN2209)で染色した。
【0199】
ブロットをECL試薬に浸けた後、ブロットをX線フィルム(FUJI Super RX 18x24)に感光させ、FUJI−ANATOMIX現像液および定着液(FUJI−X定着、カタログ#FIXRTU1/2)で現像した。抗体が結合したタンパク質を特徴づけるバンドが、この処理の後に視認された。
【0200】
バイオリアクターにおけるアップスケールされた培養での成長
カルス22の懸濁培養物を、形質転換されたカルスを液体培地で継代培養することによって得た。細胞を、(実験手順に記載されるように)、総体積がバイオリアクターへの接種のために十分になるまで振とう三角フラスコで培養した。遺伝子改変された遺伝子組換えニンジン細胞は数ヶ月間にわたって培養することができ、細胞収穫を5日〜7日のサイクルで行うことができる(データは示されず)。ニンジン細胞におけるrh−GCD産生量がピークに達する培養7日目に、細胞を、培養物を100メッシュの網に通すことによって集めた。細胞は、ろ過または遠心分離などのこの分野で知られている手段によって集めることができることには留意しなければならない。充填細胞ケーク(これは、h−GCDを均一に精製するための材料を提供する)は凍結温度で保存することができる。
【0201】
(実施例3)
形質転換ニンジン細胞からの組換え産生された活性なHGCDタンパク質の精製
形質転換されたニンジン細胞で発現した組換えh−GCDは、細胞の内膜に結合し、培地に分泌されないことが見出された。機械的な細胞破壊では、rGCDは不溶性の膜破砕物に結合したままである(データは示されず)。その場合、rGCDは、穏和な界面活性剤を使用して溶解され、細胞破砕物および他の不溶成分から分離された。可溶性酵素は、実験手順において記載されたように、カチオン交換クロマトグラフィーカラムおよび疎水性相互作用クロマトグラフィーカラムを含むクロマトグラフィー技術を使用してさらに精製された。
【0202】
培地を不溶性GCDから分離するために、約100gの湿重量の細胞を含有する凍結細胞ケークを解凍し、その後、17000xgで20分間、4℃で遠心分離した。不溶物および無傷の細胞を、100mlの洗浄緩衝液(20mMリン酸ナトリウム(pH7.2)、20mM EDTA)に再懸濁することによって洗浄し、17000xgで20分間の4℃での遠心分離によって沈殿させた。rh−GCDを、ペレットを200mlの抽出緩衝液(20mMリン酸ナトリウム(pH7.2)、20mM EDTA、1mM PMSF、20mMアスコルビン酸、3.8gポリビニルピロリドン(PVPP)、1mM DTT、および1% Triton−x−100(Sigma))においてホモジネートすることにより抽出し、可溶化した。ホモジネートを、30分間、室温で振とうして、17000xgで20分間の4℃での遠心分離によって清澄化した。ペレットを捨て、上清のpHを濃クエン酸の添加によってpH5.5に調節した。pH調節後に生じた濁りを、上記で記載された同じ条件での遠心分離によって清澄化した。
【0203】
さらなる精製を下記のようにクロマトグラフィーカラムによって行った:最初の段階では、200mlの清澄化された抽出物を、25mMクエン酸ナトリウム緩衝液(pH5.5)で平衡化され、XKカラム(2.6x20cm)に充填された20mlの強カチオン交換樹脂(Macro−Prep high−S担体、Bio−Rad)に負荷した。カラムは、伝導率、pHおよび280nmでの吸光度をモニターすることを可能にするAKTAプライムシステム(Amersham Pharmacia Biotech)と一体化された。サンプルを20ml/分で負荷し、その後、UV吸光度がベースラインに達するまで、カラムを、平衡化緩衝液(25mMクエン酸ナトリウム緩衝液、pH5.5)を用いて12ml/分の流速で洗浄した。rh−GCDのプレ溶出が、200mMのNaClを含有する平衡化緩衝液で行われ、溶出が、600mMのNaClを含有する平衡化緩衝液で得られた。処理時に集められた分画物は酵素活性アッセイによってモニターされ、酵素活性を示したチューブ(溶出ピークでの)がプールされた。プールされたサンプルは、5%エタノールを含有する水で希釈(1:5)され、NaOHでpH6.0にpH調節された。
【0204】
図3Aには、この精製段階の標準的な処理が表される。処理時に集められた分画物は、図3Bにより示されるように、酵素活性アッセイによってモニターされた。図3Cは、活性についてアッセイされた溶出分画物のクーマシーブルー染色を示す。
【0205】
rGCDを含有する溶出分画物を、第2の精製段階のために、前カラムの場合と同じ樹脂の10mlが充填された第2のXKカラム(1.6x20cm)に加えた。このカラムにおける樹脂は、5%エタノールを含有する20mMクエン酸塩緩衝液(pH6.0)で平衡化された。サンプルを負荷した後、カラムを平衡化緩衝液で洗浄し、rGCDを溶出緩衝液(20mMクエン酸塩緩衝液(pH6.0)、5%エタノール、および1M NaCl)によってカラムから溶出させた。図3Dには、この精製段階の標準的な処理が表される。処理時に集められた分画物は、図3Eにより示されるように、酵素活性アッセイによってモニターされた。図3Fは、活性についてアッセイされた溶出分画物のクーマシーブルー染色を示す。
【0206】
溶出工程における吸収ピークの分画物を、第3の精製段階のために、プールして、第3のカラムに加えた。第3の精製段階は、8mlの疎水性相互作用樹脂(TSKゲル、Toyopearl Phenyl−650C、Tosoh Corp.)が充填されたXKカラム(1.6x20cm)で行われた。樹脂は、5%エタノールを含有する10mMクエン酸塩緩衝液(pH6.0)で平衡化された。前カラムからのGCD溶出プールを6ml/分で負荷し、その後、UV吸光度がベースラインに達するまで、平衡化緩衝液で洗浄した。純粋なGCDが、50%エタノールを含有する10mMクエン酸塩緩衝液によって溶出され、プールされ、−20℃で保存された。
【0207】
図4Aには、この精製段階の標準的な処理が表される。処理時に集められた分画物は、酵素活性アッセイによってモニターされた(図4B)。図4Cは、活性についてアッセイされた溶出分画物のクーマシーブルー染色を示す。
【0208】
処理された細胞の回分精製において、rGCDタンパク質が、95%を超えるレベルに精製された。最初の段階および第3の段階だけが行われた場合、純度は約80%のレベルで達成される(データは示されず)。
【0209】
生化学的分析
精製されたrhGCDの同一性を確認するために、Mass−Spec Mass−Spec(MSMS)分析が行われた。得られた結果から、リーダーペプチド配列および標的化配列を含めて、タンパク質配列の49%の範囲が、発現カセットのDNAに基づく予測されたアミノ酸配列と一致することが示された。
【0210】
腹腔マクロファージにおける組換えhGCDの取り込みおよび活性
ニンジンにおいて産生されたrhGCDが正しくグリコシル化されており、また、標的細胞による取り込みを受けることができ、従って、ゴーシェ病を処置するために有用であるかどうかを明らかにするために、マクロファージに結合し、マクロファージによって取り込まれるrhGCDの能力を次にアッセイした。マクロファージに対するrhGCDの標的化は、マンノース/N−アセチルグルコサミン(Man/GlcNAc)受容体によって媒介されており、チオグリコラート誘発の腹腔マクロファージを使用して明らかにすることができる。図5によって示されるように、rGCDは、高いレベルで、細胞による取り込みを受ける。図5Aには、マンナン濃度に関して本発明によるrGCDの細胞による取り込みが示される。
【0211】
図5Aには、Cerezyme(商標)と匹敵するレベルでの取り込みが示される(この調製物は、上記の精製プロセスの最初の段階および第3の段階だけにより80%の純度に調製された)。
【0212】
図5Bおよび図5Cには、この調製物は、上記に記載された精製プロセスの3つの段階すべてによって95%を超える純度に調製されたので、rGCDの取り込みが、Cerezyme(商標)よりも高いレベルであることが示される。
【0213】
図5Cに関して、明らかに、4mg/mlのマンナンによって阻害される総活性からの比活性の割合は、本発明のGCD(rGCD、すなわち、組換えヒトGCD)の方が、下記のように、市場において現在得られる製造物よりも大きい:GCD(CB−mix1、これは本発明のrGCDである)−75%、Cerezyme−65%。
【0214】
さらに、図によって示されるように、マンナンの添加は、細胞によるrGCDの結合を明らかに阻害した。2mg/mlのマンナンの濃度では、rGCDの結合が50%阻害された。
【0215】
これらの結果は、グリカン構造の再構成がない場合でさえも、形質転換された二ンジン細胞から発現および精製されたrhGCDは、Man/GlcNAc受容体を介して特異的にマクロファージ細胞を標的化するために取り込みを受けることができることを示している。そのうえ、本発明の組換えrhGCDは酵素活性である。
【0216】
図5Dには、rhGCDがまた、ウエスタンブロットにおいて抗GCD抗体によって認識されることが示される:rGCDは本発明によるタンパク質を示し、一方、GCD標準品(レーンあたり5ng、10ngおよび25ngで示される)は市販のGCD(Cerezyme(登録商標))である。
【0217】
(実施例4)
毒物学試験
上記の精製手順に従って得られた物質を、標準的な毒物学試験プロトコル(医薬品のための単回用量急性毒性試験に関する業界指針、薬物評価研究センター(CDER)PT1(61FR43934、1996年8月26日)に従って、また、ICH M3(M)、医薬品のためのヒト臨床試験を実施するための非臨床的安全性研究、CPMP/ICH/286/95改訂、2000年11月16日)によって調べた。
【0218】
マウスに下記のように注射した。1.8mg/kg(臨床用量)を最初に投薬し、続いて9mg/kgおよび18mg/kgを投薬した。試験群には、6匹のマウス(ICR CD−1;3匹のオスおよび3匹のメス)が、本発明によるrGCD(25mMクエン酸塩緩衝液、150mM NaCl、0.01%Tween80、5%エタノールを特徴とする液体キャリアにおいて)を投与するために含まれ、別の6匹のマウスが、コントロール群としてキャリア単独で処置されるために含まれた。その後、マウスは14日間にわたって観察され、安楽死させられた。どのマウスも、計画された安楽死の前には死亡しなかった。どのマウスも、処置に由来する顕著な影響を何ら示さなかった。全体的な病理学的知見および/または体重変化がマウスのいずれにおいても見出されなかった。
【0219】
(実施例5)
グリコシル化分析
前記の実施例に関して記載されたように産生されたrGCDに存在するグリカン構造の分析を行った。より詳細には下記において記載されるように、結果は、グリカンの大部分が、高マンノース構造だけでなく、末端マンノース残基を含有することを示している。好都合には、この高マンノース精製物は生物学的に活性であることが見出され、従って、さらなる工程がその活性化のために必要とされなかった。
【0220】
下記の方法が、上記で示された実施例に従って産生された組換えhGCDのグリコシル化構造を決定するために使用された。簡単に記載すると、N−グリカンおよびO−グリカンの両方についての単糖の結合が、加水分解およびGC−MSの方法を使用することによって決定された。この方法では、ペプチドに対する炭水化物の結合タイプ、および、糖タンパク質の全体的な単糖組成が推定される。以前の知識、そしてまた、様々な単糖間の比率に基づいて、この方法では、糖タンパク質におけるグリカンのタイプが示唆され得る。この情報は、タンパク質に存在する可能なグリカン構造を推定するために重要である。
【0221】
別の方法はN−グリカン集団のオリゴ糖分析を特徴とした。FAB−MSおよびMALDI−TOF MSが、サンプルの一部をトリプシンおよびペプチドN−グリコシダーゼF(PNGaseF)で消化し、グリカンを完全メチル化した後に行われた。この方法は、N結合型炭水化物を酵素消化された糖タンパク質から分離および単離するために使用される。単離されたグリカン混合物におけるグリカン集団の質量が測定され、それらの質量が、データベースから得られる既知構造の質量と、単糖組成分析に照らして比較される。提案された構造はまた、供給源生物のグリコシル化パターンにも基づいている。
【0222】
別の方法では、トリプシンおよびPNGaseFで処理された糖タンパク質の還元的脱離、脱塩、そして完全メチル化の後におけるO−グリカン集団を分析することが含まれた。O−グリカンはPNGaseFによって遊離されず、従って、ペプチドに結合したままのグリカンは、O結合型グリカンである可能性が最も高い。その後、これらのグリカンは還元的脱離によって遊離させられ、その質量が分析される。
【0223】
単糖組成分析(下記に要約される)により、植物でのグリコシル化に特徴的な、ヘキソース、ヘキソサミンおよびペントースの特徴的な分布が明らかにされた。GlcNacとマンノースとの比率は、特徴的なN結合型構造が優勢なグリカン集団であることを示唆している。
【0224】
上記で記載されたように産生されたhGCDに由来するN−グリカンの質量分析法による分析では、優勢なN−グリカン集団は、Pent.deoxyHex.Hex3.HexNAc2の単糖組成を有することが示される。
【0225】
材料および方法
分析を、ガスクロマトグラフィー−質量分析(GC−MS)、高速原子衝撃質量分析(FAB−MS)および遅延抽出−マトリックス支援レーザー脱離イオン化−飛行時間質量分析(DE−MALDI−TOF MS)の組合せを使用して行った。
【0226】
オリゴ糖分析の場合、N−グリカン集団が、サンプルの一部をトリプシンおよびペプチドN−グリコシダーゼF(PNGaseF)で消化し、グリカンを完全メチル化した後、FAB−MSおよびMALDI−TOF MSによって分析された。O−グリカン集団は、トリプシンおよびPNGaseFで処理された糖タンパク質の還元的脱離、脱塩、そして完全メチル化の後に分析された。
【0227】
N−グリカンおよびO−グリカンの両方についての単糖結合が、加水分解、誘導体化およびGC−MSの方法を使用して決定された。
【0228】
実験の記載
サンプル
サンプルバイアルには、下記(表1)のように特有のサンプル番号が付けられた:
【表1】

サンプルは、必要とされるまで、−10℃および−30℃で保存された。
【0229】
タンパク質化学
無傷サンプルの透析
1個のバイアル(0.8mg/mlの規定された濃度で1mlのタンパク質を含有する)をSlide−A−Lyzer透析カセット(10kDaの分子量排除)に入れ、水に対して4℃で24時間にわたって透析した。水は3回交換された。透析後、サンプルをカセットから取り出し、凍結乾燥した。
【0230】
オリゴ糖スクリーニングのための無傷サンプルのトリプシン消化
透析された凍結乾燥サンプルを、10%アンモニア水でpH8.4に調節された50mM重炭酸アンモニウム緩衝液に再懸濁して、SOP B001およびSOP B003に従って37℃で4時間、TPCK処理トリプシンで消化した。反応を、95℃の加熱ブロックに2分間入れることによって停止させ、その後、凍結乾燥した。
【0231】
炭水化物化学
ペプチドN−グリコシダーゼAによる消化
糖タンパク質サンプルから得られる、トリプシン切断されたペプチド/糖タンパク質の混合物を、酢酸アンモニウム緩衝液(pH5.5)において37℃で15時間、酵素ペプチドN−グリコシダーゼA(PNGaseA)で処理した。反応を凍結乾燥によって停止させた。得られた生成物を、C18Sep−Pakカートリッジを使用して精製した。
【0232】
還元的脱離
潜在的なO結合型糖ペプチドを含有するSep−Pak画分を、0.05M水酸化ナトリウムにおける10mg/mlのホウ水素化ナトリウムの溶液に溶解し、45℃で16時間インキュベーションした。反応を氷酢酸の添加によって停止させた。
【0233】
還元的脱離物質の脱塩
Dowexビーズを使用する脱塩をSOP B022に従って行った。サンプルをカラムに負荷し、4mlの5%酢酸水溶液で溶出した。回収された画分を凍結乾燥した。
【0234】
遊離した炭水化物の完全メチル化
5%酢酸水溶液のSep−Pak画分に溶出しているN結合型炭水化物、および、還元的脱離により遊離する潜在的なO結合型グリカンを、水酸化ナトリウム(NaOH)/ヨウ化メチル(MeI)法(SOP B018)を使用して完全メチル化した。完全メチル化されたN結合型グリカン混合物の一部をFAB−MSおよびMALDI−TOF MSによって分析し、残りを結合分析に供した。
【0235】
N結合型炭水化物の結合分析
誘導体化
トリプシンおよびPNGaseAでの消化または還元的脱離の後に得られた完全メチル化グリカンサンプル混合物を加水分解し(2M TFA、120℃で2時間)、次いで還元した(2M NH4OHにおけるホウ重水素化ナトリウム(NaBD4)、室温で2時間、SOP B025)。ホウ重水素化物の分解時に生じるホウ酸塩を、メタノール/氷酢酸(90:10)の混合物の添加、それに続く凍結乾燥を3回行うことによって除いた。その後、サンプルを、無水酢酸を使用してアセチル化した(100℃で1時間)。アセチル化されたサンプルを、クロロホルムへの抽出によって精製した。部分的にメチル化されたアルジトールアセタートを、その後、ガスクロマトグラフィー/質量分析(GC/MS)によって調べた。部分的にメチル化されたアルジトールアセタートの標準物混合物、およびブランクもまた、同じ条件のもとで処理された。
【0236】
気液クロマトグラフィー/質量分析(GC/MS)
ヘキサンに溶解された誘導体化後の炭水化物サンプルの一部(1μl)を、Autosystem XLガスクロマトグラフおよびDellデータシステムを備えるPerkin Elmer Turbomass Gold質量分析計によって下記の条件のもとで分析した:
ガスクロマトグラフィー
カラム:DB5
注入:オンカラム
インジェクター温度:40℃
プログラム:40℃で1分間、その後、70℃/分で100℃に、100℃で1分間保持し、その後、8℃/分で290℃に、最後に、290℃で5分間保持する。
キャリアガス:ヘリウム
質量分析
イオン化電圧:70eV
取得モード:スキャニング
質量範囲:35〜450ダルトン
MS分解能:ユニット
【0237】
無傷グルコセレブロシダーゼの糖分析
誘導体化
500μgのグルコセレブロシダーゼに等しい小分け物を、内部標準としての10μgのアラビトールとともに凍結乾燥した。これを、その後、80℃で一晩のメタノリシスに供し、窒素下で乾燥した。遊離した単糖を、メタノール、ピリジンおよび無水酢酸の溶液を使用して再度N−アセチル化し、再び窒素下で乾燥して、SOP B023に従ってそれらのトリメチルシリル(TMS)誘導体に変換した。TMS誘導体を窒素下で濃縮し、2mlのヘキサンに溶解し、3分間超音波処理した。その後、サンプルを4℃で一晩平衡化させた。10μgのアラビトールを含有するブランクと、各10μgのフコース、キシロース、マンノース、ガラクトース、グルコース、N−アセチルガラクトサミン、N−アセチルグルコサミン、N−アセチルノイラミン酸およびアラビトールを含有する標準物単糖混合物とを、並行して調製した。その後、TMS誘導体をガスクロマトグラフィー/質量分析(GC/MS)によって調べた。
【0238】
気液クロマトグラフィー/質量分析(GC/MS)
ヘキサンに溶解された誘導体化後の炭水化物サンプルの一部(1μl)を、Autosystem XLガスクロマトグラフおよびDellデータシステムを備えるPerkin Elmer Turbomass Gold質量分析計によって下記の条件のもとで分析した:
ガスクロマトグラフィー
カラム:DB5
注入:オンカラム
インジェクター温度:40℃
プログラム:90℃で1分間、その後、25℃/分で140℃に、5℃/分で220℃に、最後に10℃/分で300℃に、そして300℃で5分間保持する。
キャリアガス:ヘリウム
質量分析
イオン化電圧:70eV
取得モード:スキャニング
質量範囲:50〜620ダルトン
MS分解能:ユニット
【0239】
遅延抽出−マトリックス支援レーザー脱離イオン化質量分析(DE−MALDI MS)および高速原子衝撃質量分析(FAB−MS)
MALDI−TOF質量分析を、遅延抽出(DE)と結合させたVoyager STR Biospectrometry Research Stationレーザー解離質量分析計を使用して行った。
【0240】
乾燥した完全メチル化グリカンをメタノール:水(80:20)に再溶解し、2,5−ジヒドロ安息香酸のマトリックスを使用して分析した。ブラジキニン、アンジオテンシンおよびACTHを外部校正物質として使用した。
【0241】
陽イオン高速原子衝撃質量分析による分析を、約2500の分解能を有する最大感度での4500の質量範囲についてVacc=8kVで稼働するM−Scan’s VG AutoSpecE質量分析計において行った。セシウムイオンガンを、30kVで稼働してスペクトルを作製するために使用した。スペクトルは、Opusソフトウエアを使用してVAXデータシステム3100M76に記録された。
【0242】
乾燥した完全メチル化グリカンをメタノールに溶解し、2μl〜4μlのチオグリセロールがマトリックスとして事前に塗られた標的に負荷し、その後、供給源に挿入した。
【0243】
結果および考察
グルコセレブロシダーゼのTMS糖分析
N結合型オリゴ糖スクリーニング
無傷の糖タンパク質を透析に供し、トリプシン消化して、凍結乾燥生成物を、PNGaseAを使用して消化し、その後、C18Sep−Pakを使用して精製した。5%酢酸水溶液(N結合型オリゴ糖含有)画分を完全メチル化し、FAB質量スペクトルを、誘導体化されたオリゴ糖の一部を使用して、フラグメントイオンについて低質量範囲において得た。DE−MALDI−TOF質量スペクトルを、誘導体化されたオリゴ糖の一部を使用して、分子イオンについて高質量範囲において得た。
【0244】
グルコセレブロシダーゼ由来のN−グリカンの分析
表1には、FABスペクトルに存在する優勢なフラグメントイオン、および、MALDIスペクトルに存在する分子イオンが列挙される。分子イオン領域(付録IIIに示される)には、優勢なシグナルが、1505.8のm/z(これは、Pent.deoxyHex.Hex3.HexNAc2の組成を有する構造について[M+Na]+擬分子イオンと一致する)において含まれる。強度がより小さい一連の擬分子イオンもまた、複合マンノース構造および高マンノース構造と一致して検出された。検出された高マンノース構造は、サイズが、1579.8のm/zでのHex5.HexNAc2から、2193.0のm/zでのHex8.HexNAc2まで及ぶ。複雑なシグナルが、1331.7のm/z(これは、Pent.Hex3.HexNAc2の組成を有する構造について[M+Na]+擬分子イオンと一致する)などのあまりプロセシングされていないN−グリカンから、または、例えば、1751.0のm/z(これは、Pent.deoxyHex.Hex3.HexNAc3の組成を有する構造について[M+Na]+擬分子イオンと一致する)、2375.4のm/z(これは、Pent.deoxyHex2.Hex4.HexNAc4の組成を有する構造について[M+Na]+擬分子イオンと一致する)、および、2753.6のm/z(これは、Pent.deoxyHex2.Hex5.HexNAc4の組成を有する構造について[M+Na]+擬分子イオンと一致する)でのより大きいN−グリカンから生じている。
【0245】
FAB質量スペクトルは、スペクトルの低質量範囲におけるフラグメントイオンによるアンテナ構造に関する情報をもたらす(データは示されず)。様々なシグナルが検出され、これらにより、ヘキソース(219のm/zにおいて)およびHexNAc(260のm/zにおいて)がN−グリカンにおける非還元末端の単糖として確認された。
【表2】

【0246】
第1欄の質量はすべて、別途言及されない限り、モノアイソトピックである。ソフトウエアは、特に1700Da超える質量については、質量数を13C同位体ピークに帰属することが多いので、質量数は生データを直接には示していない場合がある。
【0247】
グルコセレブロシダーゼ由来のN−グリカンの結合分析
結合分析を、PNGaseA消化、Sep−Pak精製および完全メチル化の後に遊離したN結合型炭水化物について行った。
【0248】
複雑なクロマトグラムが、誘導体化試薬に起因するいくつかの不純物ピークとともに得られた。保持時間およびスペクトルを標準物混合物と比較することにより、表3に列挙される糖含有ピークの暫定的な帰属が可能であった。
【表3】

【0249】
4.3 O結合型オリゴ糖スクリーニング
還元的脱離を、トリプシン消化およびPNGaseA消化の後におけるグルコセレブロシダーゼのSep−Pak精製から得られる60%2−プロパノール画分(潜在的なO結合型糖タンパク質画分)について行った。サンプルを反応停止後に脱塩し、ホウ酸塩の除去後、完全メチル化した。FAB質量スペクトルを、誘導体化されたオリゴ糖の一部を使用して、フラグメントイオンについて低質量範囲において得た。DE−MALDI−TOF質量スペクトルを、誘導体化されたオリゴ糖の一部を使用して、分子イオンについて高質量範囲において得た。O結合型グリカンと一致するシグナルは観測されなかった(データは示されず)。
【0250】
グルコセレブロシダーゼ由来のO−グリカンの結合分析
結合分析を、還元的脱離の生成物について、完全メチル化の後に行った。典型的なO結合型グリカンの存在と一致するシグナルは観測されなかった(データは示されず)。
【0251】
図6には、哺乳動物細胞であるCHO(チャイニーズハムスター卵巣)細胞から得られたGCD(Cerezyme(商標))と、ニンジン細胞から得られた本発明のGCDとの間での比較としてのいくつかの例示的なグリカン構造が示される。示されるように、これらの構造の再構成が、Cerezyme(商標)については、露出したマンノース残基を得るために必要である。これに対して、そのような露出したマンノース残基が、本発明に従って植物細胞から得られたGCDについては、例えば、グリコシラーゼによるさらなる操作を必要とすることなく、直接的に得られる。
【0252】
図7には、rGCDに見出される主要なグリカン構造が表される。図7には、a)ニンジン細胞の懸濁状態で発現させたhGCにおいて見出される優勢なオリゴ糖集団(1505.7のm/z);b)典型的なN結合型コア;c)フコシル化された植物N結合型コアからなる提案された構造が示される。N結合型グリカンは、アスパラギンを介して、かつ、図の右側におけるGlcNac(GC)残基の還元性末端を介してタンパク質に結合する。植物でのグリコシル化パターンにおいて、フコース残基は、α(1−3)グリコシド結合を使用して最初のGlcNacに結合するコア構造の一部であり得るが、一方、哺乳動物構造では、典型的には、α(1−6)グリコシド結合が使用される。
【0253】
図8A〜図8Dには、本発明によるrGCDタンパク質において検出されたN−グリカンについてすべての可能な構造が示される。
【0254】
同定された優勢なグリカン構造は、エンドウマメ、イネ、トウモロコシおよび他の食用植物から得られるほとんどの植物糖タンパク質において見出されるコアグリカン構造である。この構造には、コアのキシロース残基が、コアα−(1,3)−フコースと同様に含有される。Bardor他(33)によって行われた研究では、非アレルギー性供血者の50%がその血清中にコアキシロースについて特異的な抗体を有し、25%がコアα−(1,3)−フコースに対する特異的な抗体を有することが示されている。しかしながら、そのような抗体が植物由来の生物医薬的な糖タンパク質の使用に対する制限をもたらし得るかどうかは、今後、研究されなければならない。
【0255】
上記で記載されたように産生されたhGCDの副グリカン集団は、主として、Hex4HexNAc2からHex8HexNAc2の高マンノース構造であった。複雑な構造のなかには、Pent.deoxyHex2.Hex4.HexNAc3およびPent.deoxyHex3.Hex5.HexNAc3などの構造を示すものがあった。Pent.Hex3.HexNAc2がより小さい割合で検出された。
【0256】
主要な末端単糖はヘキソース(マンノースまたはガラクトース)およびN−アセチルヘキソアミンであり、このことは、高マンノース構造および部分的にプロセシングされた複合構造の存在と一致している。
【0257】
O結合型オリゴ糖スクリーニングに関しては、典型的なO結合型グリカンと一致するシグナルは観測されなかった。これらの結果は、哺乳動物培養システムで産生された天然型GCDおよび組換えGCDを含めて、他の細胞システムから得られたGCDの既知のグリコシル化と一致しているように、GCDはO結合型オリゴ糖を有しないことが知られている。しかしながら、単糖組成において、アラビノースと一致するシグナルが検出された。
【0258】
本発明に関して重要な点は、hGCDタンパク質のN−グリカン組成分析により、N−グリカンの大部分がマンノース残基で終了していることが示されたことである。このことは、マクロファージのマンノース受容体による治療的hGCDの取り込みを助けるマンノース末端N−グリカンのための条件と一致する。しかしながら、哺乳動物細胞において産生された天然型GCDおよび組換えGCDはいずれも高マンノース型ではない。従って、本発明は、これらのタンパク質が、上記で記載されたように産生されたタンパク質とは異なり、マンノース糖で終了するために改変されるという、商業的に製造されているhGCDタンパク質の顕著な欠点を克服している。
【0259】
(実施例6)
本発明による処置
本発明に従って製造される組換えタンパク質は、好ましくは、植物細胞培養物によって産生される好適にグリコシル化されたタンパク質(これは、好ましくは、例えば、リソソーム酵素である)、および/または高マンノース型のグリコシル化タンパク質を含む。
【0260】
本発明における好ましい実施形態によれば、本発明に従って産生されるタンパク質は、リソソーム関連疾患(例えば、リソソーム蓄積疾患など)を処置するために好適である。
【0261】
処置方法は、場合により、そして好ましくは、(a)形質転換された植物根細胞から精製され、かつ、リソソーム酵素が異常に不足している細胞を効率的に標的化することができる組換え産生された生物学的に活性な形態のリソソーム酵素を提供すること(この場合、この組換え産生された生物学的に活性な酵素は、露出した末端マンノース残基を結合しているオリゴ糖に有する);および(b)組換え産生された生物学的に活性なリソソーム酵素の治療効果的な量、または、そのようなリソソーム酵素を含む組成物の治療効果的な量を対象に投与することを含む。好ましい実施形態において、本発明の方法によって使用される組換え産生された高マンノースリソソーム酵素は、本発明の宿主細胞によって産生され得る。好ましくは、この宿主細胞はニンジン細胞である。
【0262】
「哺乳動物対象」または「哺乳動物患者」により、遺伝子治療が所望される任意の哺乳動物(これには、ヒト、ウシ、ウマ、イヌおよびネコの対象が含まれる)が意味され、最も好ましくは、ヒト対象が意味される。
【0263】
用語「処置」はまた、病理学的状態および/またはその1つ以上の症状を改善または緩和すること、そのような状態を治療すること、あるいは、そのような状態を発生を予防することを包含することに留意しなければならない。
【0264】
別の好ましい実施形態において、本発明の方法によって使用されるリソソーム酵素は、露出したマンノース残基を有する少なくとも1つのオリゴ糖鎖を含む高マンノース酵素であり得る。本発明の組換え酵素は、対象の体内において標的部位における標的細胞上のマンノース受容体に結合することができる。より好ましくは、本発明の組換え酵素は、天然に存在するリソソーム酵素の標的細胞に対する対応する親和性と比較して、これらの標的細胞に対する増大した親和性を有する。従って、各用量は、GCDが異常に異常に不足している細胞を効果的に標的化することに依存し、そのような形態のGCDの各用量は、そうでない場合に、治療効果を達成するために類似する様式で投与される天然に存在するGCDの用量よりも実質的に少ない。
【0265】
本発明の好ましい実施形態によれば、本発明のタンパク質は、リソソーム蓄積疾患を処置するために好適であり、その結果、本発明はまた、そのような疾患を処置するための方法を含む。リソソーム蓄積疾患は、細胞のリソソームにおいて糖脂質または多糖の廃棄産物を分解する酵素をコードする遺伝子における欠陥の結果である40以上の障害からなる一群である。酵素反応産物(例えば、糖および脂質)は、その後、新しい産物に再利用される。これらの障害のそれぞれが、リソソームにおける酵素レベルに影響を及ぼす常染色体連鎖またはX連鎖の遺伝する劣性形質から生じている。一般に、罹患者の細胞および組織における影響を受けた酵素の生物学的または機能的な活性は認められない。そのような疾患において、酵素機能の欠如は、体内において細胞内のリソソームにおける脂質基質または炭水化物基質の進行性の全身的な堆積をもたらし、最終的には器官機能の喪失および死を生じさせる。リソソーム蓄積疾患の遺伝的病因、臨床的発現、分子生物学および可能性が、Scriver他[Scriver他編、The Metabolic and Molecular Basis of Inherited Disease、第7版、第II巻、McGraw Hill(1995)]に詳しく記載される。
【0266】
リソソーム蓄積疾患(およびその関連する欠損酵素)の例には、ファブリー病(α−ガラクトシダーゼ)、ファーバー病(セラミダーゼ)、ゴーシェ病(グルコセレブロシダーゼ)、Gmlガングリオシド症(β−ガラクトシダーゼ)、テイ・サックス病(β−ヘキソサミニダーゼ)、ニーマン・ピック病(スフィンゴミエリナーゼ)、シンドラー病(α−N−アセチルガラクトサミニダーゼ)、ハンター症候群(イズロナート−2−スルファターゼ)、スライ症候群(β−グルクロニダーゼ)、フルラー症候群およびハーラー・シャイエ症候群(イズロニダーゼ)、ならびにI細胞/サン・フィリポ症候群(マンノース−6−ホスフェート輸送因子)が含まれるが、これらに限定されない。
【0267】
ゴーシェ病はヒトにおける最も一般的なリソソーム蓄積疾患であり、アシュケナージ系ユダヤ人住民において最も高頻度に遭遇する。合衆国では約5000人〜10000人がこの疾患に冒されている[Grabowski、Adv.Hum.Genet.、21:377〜441(1993)]。ゴーシェ病はグルコセレブロシダーゼ(hGCD;グルコシルセラミニダーゼ)の欠如から生じている。この欠如は、骨髄、脾臓および肝臓の細網内皮細胞における酵素基質(グルコセレブロシド)の蓄積を生じさせ、その結果、骨髄拡張および骨劣化などの著しい骨格合併症、そしてまた、脾機能亢進症、肝腫大、血小板減少症、貧血および肺合併症をもたらす[Grabowski(1993)、同上;Lee、Prog.Clin.Biol.Res.、95:177〜217(1982)]。
【0268】
より詳細には、本発明の方法によって使用されるリソソーム酵素は、グルコセレブロシダーゼ(GCD)、酸性スフィンゴミエリナーゼ、ヘキソサミニダーゼ、α−N−アセチルガラクトサミニダーゼ、酸性リパーゼ、α−ガラクトシダーゼ、グルコセレブロシダーゼ、α−L−イズロニダーゼ、イズロナートスルファターゼ、α−マンノシダーゼまたはシアリダーゼからなる群から選択され得る。好ましくは、処置される疾患がゴーシェ病である場合、本発明の方法によって使用されるリソソーム酵素はグルコセレブロシダーゼ(GCD)である。
【0269】
本発明のタンパク質は、医薬組成物を製造するために使用することができる。従って、本発明の別の局面によれば、その有効成分として、タンパク質と、医薬的に許容され得るキャリアとを含む医薬組成物が提供される。本明細書中で使用される「医薬組成物」は、本明細書中に記載される有効成分の1つまたは複数(例えば、組換えタンパク質)を、他の化学的成分(例えば、従来の薬物、生理学的に好適なキャリアおよび賦形剤など)とともに有する調製物を示す。医薬組成物の目的は、生物に対するタンパク質または細胞の投与を容易にすることである。本発明の医薬組成物は、この分野で十分に知られている様々なプロセスによって、例えば、混合、溶解、造粒、糖衣錠作製、研和、乳化、カプセル化、包括化または凍結乾燥の従来のプロセスによって製造することができる。
【0270】
好ましい実施形態において、用語「医薬的に許容され得る」は、動物(より具体的にはヒト)における使用について、連邦政府または州政府の規制当局によって承認されているか、あるいは、米国薬局方または他の一般的に認められている薬局方に収載されていることを意味する。以降、表現「生理学的に好適なキャリア」および表現「医薬的に許容され得るキャリア」は交換可能に使用され、著しい刺激を生物に対して生じさせず、かつ、投与されたコンジュゲートの生物学的な活性および性質を阻害しない承認されたキャリアまたは希釈剤を示す。
【0271】
用語「キャリア」は、治療剤が一緒に投与される希釈剤、補助剤、賦形剤またはビヒクルを示す。そのような医薬用キャリアは、無菌の液体、例えば、水およびオイル(石油起源、動物起源、植物起源または合成起源のものを含む)など、例えば、ピーナッツ油、ダイズ油、鉱油、ゴマ油などであり得る。水は、医薬組成物が静脈内投与されるときの好ましいキャリアである。生理的食塩水溶液およびデキストロース水溶液およびグリセロール溶液もまた、特に注射用溶液の場合、液体キャリアとして用いることができる。好適な医薬用賦形剤には、デンプン、グルコース、ラクトース、スクロース、ゼラチン、麦芽、コメ、小麦粉、チョーク、シリカゲル、ステアリン酸ナトリウム、グリセロールモノステアラート、タルク、塩化ナトリウム、乾燥スキムミルク、グリセロール、プロピレングリコール、水、エタノールなどが含まれる。組成物は、所望される場合、微量の湿潤化剤もしくは乳化剤、またはpH緩衝化剤を含有することができる。これらの組成物は、溶液剤、懸濁物、エマルション、錠剤、ピル、カプセル、粉末剤、持続放出配合物などの形態を取ることができる。組成物は、従来の結合剤およびキャリア(例えば、トリグリセリドなど)を用いて、座薬として配合することができる。経口用配合物は標準的なキャリア(例えば、医薬規格のマンニトール、ラクトース、デンプン、ステアリン酸マグネシウム、ナトリウムサッカリン、セルロース、炭酸マグネシウムなど)を含むことができる。好適な医薬用キャリアの様々な例が、E.W.Martinによる“Remingtons’s Pharmaceutical Sciences”に記載される。そのような組成物は、治療効果的な量のタンパク質(好ましくは、精製された形態である)を、患者に対する適正な投与のための形態を提供するように好適な量のキャリアと一緒に含有する。配合は投与様式のために適しなければならない。
【0272】
本明細書中において、用語「賦形剤」は、有効成分の加工および投与をさらに容易にするために医薬組成物に添加される不活性な物質を示す。賦形剤の非限定的な例には、炭酸カルシウム、リン酸カルシウム、様々な糖およびタイプのデンプン、セルロース誘導体、ゼラチン、植物油、ならびにポリエチレングリコールが含まれる。
【0273】
有効成分を配合および投与するためのさらなる技術が“Remingtons’s Pharmaceutical Sciences”(Mack Publishing Co.、Easton、PA、最新版)に見出され得る(これは、本明細書中に詳しく示されているかのように本明細書中に参考として組み込まれる)。
【0274】
本明細書中に記載される医薬組成物はまた、好適な固体または固相のキャリアまたは賦形剤を含むことができる。そのようなキャリアまたは賦形剤の例には、炭酸カルシウム、リン酸カルシウム、様々な糖、デンプン、セルロース誘導体、ゼラチン、およびポリマー(例えば、ポリエチレングリコールなど)が含まれるが、これらに限定されない。
【0275】
好適な投与経路には、例えば、経口送達、直腸送達、経粘膜送達、経皮送達、腸管送達または非経口送達(筋肉内注射、皮下注射および髄内注射、ならびに、くも膜下注射、直接的な心室内注射、静脈内注射、腹腔内注射、鼻腔内注射または眼内注射を含む)が含まれ得る。
【0276】
従って、本発明に従って使用される医薬組成物は、医薬的に使用することができる調製物への有効成分の加工を容易にする賦形剤および補助剤を含む1つ以上の医薬的に許容され得るキャリアを使用して、従来の様式で配合することができる。適正な配合は、選ばれた投与経路に依存する。
【0277】
注射の場合、本発明の有効成分は、水溶液において、好ましくは生理学的に適合し得る緩衝液(例えば、ハンクス溶液、リンゲル溶液または生理学的な生理的食塩水緩衝液など)において配合することができる。経粘膜投与の場合、浸透剤が配合において使用される。そのような浸透剤はこの分野では一般に知られている。
【0278】
経口投与の場合、有効成分は、場合により、本発明によるタンパク質(例えば、GCDなど)を産生する細胞全体の投与によって処方され得る。有効成分はまた、有効成分および/または細胞を、この分野で広く知られている医薬的に許容され得るキャリアと組み合わせることによって処方され得る。そのようなキャリアは、本発明の有効成分が、患者により経口摂取される錠剤、ピル、糖衣錠、カプセル、液剤、ゲル、シロップ、スラリー剤、懸濁物などとして処方されることを可能にする。経口使用される薬理学的調製物を、固体の賦形剤を使用し、得られた混合物を場合により粉砕し、そして錠剤または糖衣錠コアを得るために、所望する場合には好適な補助剤を添加した後、顆粒の混合物を加工して作製することができる。好適な賦形剤には、特に、ラクトース、スクロース、マンニトールまたはソルビトールを含む糖などの充填剤;セルロース調製物、例えば、トウモロコシデンプン、コムギデンプン、コメデンプン、ジャガイモデンプン、ゼラチン、トラガカントゴム、メチルセルロース、ヒドロキシプロピルメチルセルロース、ナトリウムカルボメチルセルロースなど;および/またはポリビニルピロリドン(PVP)などの生理学的に許容され得るポリマーがある。所望する場合には、架橋されたポリビニルピロリドン、寒天、またはアルギン酸もしくはその塩(アルギン酸ナトリウムなど)などの崩壊剤を加えることができる。
【0279】
糖衣錠コアには、好適なコーティングが施される。この目的のために、高濃度の糖溶液を使用することができ、この場合、糖溶液は、場合により、アラビアゴム、タルク、ポリビニルピロリドン、カルボポールゲル、ポリエチレングリコール、二酸化チタン、ラッカー溶液および好適な有機溶媒または溶媒混合物を含有し得る。色素または顔料を、有効成分の量を明らかにするために、または有効成分の量の種々の組合せを特徴づけるために、錠剤または糖衣錠コーティングに加えることができる。
【0280】
経口使用され得る医薬組成物には、ゼラチンから作製されたプッシュ・フィット型カプセル、ならびにゼラチンおよび可塑剤(例えば、グリセロールまたはソルビトールなど)から作製された軟いシールされたカプセルが含まれる。プッシュ・フィット型カプセルは、充填剤(例えば、ラクトースなど)、結合剤(例えば、デンプンなど)、滑剤(例えば、タルクまたはステアリン酸マグネシウムなど)および場合により安定化剤との混合で有効成分を含有することができる。軟カプセルでは、有効成分を好適な液体(例えば、脂肪油、流動パラフィンまたは液状のポリエチレングリコールなど)に溶解または懸濁させることができる。また、安定化剤を加えることができる。経口投与される配合物はすべて、選ばれた投与経路について好適な投薬形態でなければならない。
【0281】
口内投与の場合、組成物は、従来の様式で配合された錠剤またはトローチの形態を取ることができる。
【0282】
吸入による投与の場合、本発明に従って使用される有効成分は、好適な噴射剤(例えば、ジクロロジフルオロメタン、トリクロロフルオロメタン、ジクロロテトラフルオロエタンまたは二酸化炭素)の使用により加圧パックまたはネブライザーからのエアロゾルスプレー提示物の形態で都合よく送達される。加圧されたエアロゾルの場合、投薬量単位が、計量された量を送達するためのバルブを備えることによって決定され得る。吸入器または吹き入れ器において使用される、例えば、ゼラチン製のカプセルおよびカートリッジで、有効成分および好適な粉末基剤(例えば、ラクトースまたはデンプンなど)の粉末混合物を含有するカプセルおよびカートリッジを処方することができる。
【0283】
本明細書中に記載される有効成分は、例えば、ボーラス注射または連続注入による非経口投与のために処方することができる。注射用配合物は、場合により保存剤が添加された、例えば、アンプルまたは多回用量容器における単位投薬形態で提供され得る。組成物は、油性ビヒクルまたは水性ビヒクルにおける懸濁物または溶液剤またはエマルションにすることができ、そして、懸濁化剤、安定化剤および/または分散化剤などの配合剤を含有することができる。
【0284】
非経口投与される医薬組成物には、水溶性形態での活性な調製物の水溶液が含まれる。また、有効成分の懸濁物を適切な油性または水系の注射用懸濁物として調製することができる。好適な親油性の溶媒またはビヒクルには、脂肪油(例えば、ゴマ油など)、または合成脂肪酸エステル(例えば、オレイン酸エチルなど)、トリグリセリドまたはリポソームが含まれる。水性の注射用懸濁物は、懸濁物の粘度を増大させる物質、例えば、ナトリウムカルボキシメチルセルロース、ソルビトールまたはデキストランなどを含有することができる。場合により、懸濁物はまた、高濃度溶液の調製を可能にするために有効成分の溶解性を増大させる好適な安定化剤または薬剤を含有することができる。
【0285】
好ましい実施形態において、組成物は、ヒトに対する静脈内投与のために適合化された医薬組成物として、日常的な手法に従って配合される。典型的には、静脈内投与される医薬組成物は、無菌の等張性の水性緩衝液における溶液である。一般に、成分は別々に提供されるか、または、単位投薬形態で一緒に混合されて、例えば、活性な薬剤の量を示す気密容器(例えば、アンプルまたは小袋など)における乾燥した凍結乾燥粉末または無水高濃度物として提供される。組成物が注入によって投与されることになる場合、組成物は、無菌の医薬規格の水または生理的食塩水を含有する注入ボトルとともに分配され得る。組成物が注射によって投与される場合、成分が投与前に混合され得るように、注射用無菌水または生理的食塩水のアンプルが提供される。
【0286】
本発明の医薬組成物は中性形態または塩形態として配合することができる。医薬的に許容され得る塩には、アニオンとともに形成される塩、例えば、塩酸、リン酸、酢酸、シュウ酸、酒石酸などに由来する塩など、および、カチオンとともに形成される塩、例えば、ナトリウム、カリウム、アンモニウム、カルシウム、水酸化鉄(III)、イソプロピルアミン、トリエチルアミン、2−エチルアミノエタノール、ヒスチジン、プロカインなどに由来する塩などが含まれる。
【0287】
本発明の有効成分はまた、例えば、カカオバターまたは他のグリセリドなどの従来の坐薬基剤を使用して、坐薬または停留浣腸剤などの直腸用組成物に配合することができる。
【0288】
本明細書中に記載される医薬組成物はまた、ゲル相キャリアまたはゲル相賦形剤の好適な固体を含むことができる。そのようなキャリアまたは賦形剤の例には、炭酸カルシウム、リン酸カルシウム、様々な糖、デンプン、セルロース誘導体、ゼラチン、およびポリマー(例えば、ポリエチレングリコールなど)が含まれるが、これらに限定されない。
【0289】
局所経路が、場合により行われ、局所用キャリアによって支援される。局所用キャリアは、局所的な有効成分投与のために一般には好適であるキャリアであり、これには、この分野で知られている任意のそのような物質が含まれる。局所用キャリアは、組成物を、所望される形態で、例えば、液体または非液体のキャリア、ローション、クリーム、ペースト、ゲル、粉末、軟膏、溶媒、液体希釈剤および滴剤などとして提供するように選択され、そして、天然に存在する起源または合成起源の物質から構成され得る。明らかなことではあるが、選択されたキャリアは、局所用配合物の活性な薬剤または他の構成成分に悪影響を及ぼさないこと、そして、局所用配合物のすべての構成成分に関して安定であることが不可欠である。本発明において使用される好適な局所用キャリアの例には、水、アルコールおよび他の非毒性の有機溶媒、グリセリン、鉱油、シリコーン、ワセリン、ラノリン、脂肪酸、植物油、パラベン類およびワックスなどが含まれる。本発明における好ましい配合物は、無色無臭の軟膏、液体、ローション、クリームおよびゲルである。
【0290】
軟膏は、典型的にはペトラタムまたは他のペトラタム誘導体に基づく半固体の調製物である。使用される具体的な軟膏基剤は、当業者によって理解されるように、最適な有効成分送達をもたらし、好ましくは、他の所望される特徴(例えば、皮膚軟化性など)もまた提供するものである。他のキャリアまたはビヒクルの場合と同様に、軟膏基剤は、不活性で、安定で、非刺激性で、かつ非感作性でなければならない。Remington:The Science and Practice of Pharmacy(第19版、Easton、Pa.:Mack Publishing Co.、1995)において1399頁〜1404頁で説明されるように、軟膏基剤は、油性基剤、乳化可能な基剤、乳化基剤および水溶性基剤の4つのクラスに類別することができる。油性の軟膏基剤には、例えば、植物油、動物から得られる脂肪、および、石油から得られる半固体の炭化水素が含まれる。乳化可能な軟膏基剤は、吸収性軟膏基剤としてもまた知られており、水をほとんど含有せず、これには、例えば、ヒドロキシステアリンスルファート、無水ラノリンおよび親水性ペトラタムが含まれる。乳化軟膏基剤は油中水型(W/O)エマルションまたは水中油型(O/W)エマルションのいずれかであり、これには、例えば、セチルアルコール、グリセリルモノステアラート、ラノリンおよびステアリン酸が含まれる。好ましい水溶性軟膏基剤は、様々な分子量のエチレングリコールから調製される。再度ではあるが、さらなる情報については、Remington:The Science and Practice of Pharmacyを参照することができる。
【0291】
ローションは、摩擦を伴うことなく皮膚表面に塗布されるための調製物であり、典型的には、固体粒子(活性な薬剤を含む)が水またはアルコールの基剤に存在する液体または半液体の調製物である。ローションは、通常、固体の懸濁物であり、水中油型タイプの液体油性エマルションを含むことができる。ローションは、より多くの液体組成物を塗布することが容易であるので、大きな身体面積を処置するための本発明における好ましい配合物である。ローション中の不溶物は細かく分割されていることが一般に必要である。ローションは、典型的には、より良好な分散を提供するための懸濁化剤、ならびに、活性な薬剤を局在化させ、皮膚との接触状態で保つために有用な有効成分(例えば、メチルセルロースまたはナトリウムカルボキシメチルセルロースなど)を含有する。
【0292】
選択された有効成分を含有するクリームは、この分野では知られているように、水中油型または油中水型のいずれかであっても、粘性の液体エマルションまたは半固体エマルションである。クリーム基剤は水洗性であり、油相、乳化剤および水相を含有する。油相は、ときには「内部」相とも呼ばれることがあるが、一般には、ペトラタムおよび脂肪アルコール(例えば、セチルアルコールまたはステアリルアルコールなど)から構成される;水相は、通常、体積が油相を超えており、だが、必ずしも超える必要はなく、また、一般には保湿剤を含有する。クリーム配合物における乳化剤は、Remington(上掲)において説明されるように、一般には、非イオン性界面活性剤、アニオン性界面活性剤、カチオン性界面活性剤、または両性界面活性剤である。
【0293】
ゲル配合物は、頭皮への適用のために好ましい。局所用有効成分配合物の分野での当業者によって理解されるように、ゲルは半固体の懸濁物型の系である。単相ゲルは、キャリア液体全体に実質的に一様に分布させられた有機高分子を含有し、この場合、キャリア液体は、典型的には水性であるが、また、アルコールおよび場合によりオイルを好ましくは含有する。
【0294】
当業者に知られている様々な添加剤を本発明の局所用配合物に含めることができる。例えば、溶媒を、ある種の有効成分物質を可溶化するために使用することができる。必要に応じて使用される他の添加剤には、皮膚浸透増強剤、乳白剤、抗酸化剤、ゲル化剤、増粘剤および安定化剤などが含まれる。
【0295】
本発明の局所用組成物はまた、従来の皮膚型のパッチまたは物品を使用して皮膚に送達することができ、この場合、有効成分組成物は、皮膚に貼り付けられる薬物送達デバイスとして役立つ積層化された構造体の中に含有される。そのような構造体において、有効成分の組成物は、上部支持層の下に存在する層、すなわち、「リザーバー」に含有される。積層化された構造体は1つだけのリザーバーを含有することができ、または、複数のリザーバーを含有することができる。1つの実施形態において、リザーバーは、有効成分送達時にシステムを皮膚に貼り付けるために役立つ医薬的に許容され得る接触接着性物質のポリマーマトリックスを含む。好適な皮膚接触接着性物質の例には、ポリエチレン、ポリシロキサン、ポリイソブチレン、ポリアクリラートおよびポリウレタンなどが含まれるが、これらに限定されない。選択される特定のポリマー接着剤は、特定の有効成分、ビヒクルなどに依存する。すなわち、接着剤は、有効成分を含有する組成物のすべての構成成分との適合性を有しなければならない。あるいは、有効成分含有リザーバーおよび皮膚接触接着剤は別個の異なる層として存在し、この場合、接着剤はリザーバーの下に位置し、リザーバーは、この場合、上記のようなポリマーマトリックスであり得るか、または、液体もしくはヒドロゲルのリザーバーであり得るか、または、何らかの他の形態をとることができる。
【0296】
これらの積層体における支持層は、デバイスの上部表面として役立っており、積層化された構造体の主要な構造エレメントとして機能し、かつ、デバイスにその柔軟性の多くを提供する。支持物質のために選択される物質は、有効成分含有組成物の有効成分および任意の他の構成成分に対して実質的に不浸透性であるように、従って、デバイスの上部表面からの何らかの構成成分の喪失を妨げるように選択されなければならない。支持層は、皮膚が有効成分送達時に水和されることが所望されるかどうかに依存して、閉鎖性または非閉鎖性のいずれかであり得る。支持材は、好ましくは、柔軟性のエラストマー材料であることが好ましいシートまたはフィルムから作製される。支持層のために好適なポリマーの例には、ポリエチレン、ポリプロピレンおよびポリエステルが含まれる。
【0297】
貯蔵時または使用前には、積層化された構造体は剥離ライナーを含む。使用直前に、この層はデバイスから除かれて、その基層表面(有効成分リザーバーまたは別個の接触接着剤層のいずれか)が露出させられ、その結果、システムを皮膚に貼り付けることができるようにされる。剥離ライナーは、有効成分/ビヒクル不浸透性の材料から作製されなければならない。
【0298】
そのようなデバイスは、この分野で知られている従来の技術を使用して、例えば、接着剤、有効成分およびビヒクルの液状混合物を支持層に注入成型し、その後、剥離ライナーを積層化することによって製造することができる。同様に、接着剤混合物を剥離ライナー上に注入成型し、その後、支持層を積層化することができる。あるいは、有効成分リザーバーを有効成分または賦形剤の非存在下で調製し、その後、有効成分/賦形剤の混合物に「浸す」ことによって負荷することができる。
【0299】
本発明の局所用配合物の場合のように、これらの積層化システムの有効成分リザーバーに含有される有効成分組成物は数多くの構成成分を含有することができる。場合により、有効成分は、「そのまま(neat)」、すなわち、さらなる液体の非存在下で送達することができる。しかしながら、ほとんどの場合、有効成分は、好適な医薬的に許容され得るビヒクル(典型的には溶媒またはゲル)に溶解または分散または懸濁される。存在させることができる他の構成成分には、保存剤、安定化剤および界面活性剤などが含まれる。
【0300】
本発明のタンパク質(例えば、高マンノースリソソーム酵素など)は、好ましくは、必要としている患者に効果的な量で投与されることに留意しなければならない。本明細書中で使用される「効果的な量」は、選択された結果を達成するために必要な量を意味する。例えば、本発明の組成物の効果的な量は、リソソーム蓄積疾患を処置することについて有用であるために選択され得る。
【0301】
本発明に関連して使用される好適な医薬組成物には、有効成分が、意図された目的を達成するために効果的な量で含有される組成物が含まれる。より具体的には、治療効果的な量は、処置されている対象の疾患の症状を予防または緩和または改善するために効果的であるか、あるいは、処置されている対象の生存を延ばすために効果的である、有効成分の量を意味する。
【0302】
治療効果的な量の決定は、特に本明細書中に提供される詳細な開示に照らして、十分に当業者の能力の範囲内である。
【0303】
本発明の方法において使用される任意の有効成分について、治療効果的な量または用量は、動物における活性アッセイから最初に推定することができる。例えば、用量を、活性アッセイによって決定されるようなIC50を含む循環濃度範囲を達成するために動物モデルにおいて定めることができる。
【0304】
本明細書中に記載される有効成分の毒性および治療効力は、実験動物における標準的な薬学的手法によって、例えば、対象とする有効成分についてIC50およびLD50(処置された動物の50%において死を生じさせる致死量)を決定することによって明らかにすることができる。これらの活性アッセイおよび動物研究から得られたデータは、ヒトにおいて使用される投薬量範囲を定める際に使用することができる。例えば、遺伝的障害を処置するために好適な治療効果的な用量を、これらの疾患の動物モデルを用いた実験から決定することができる。
【0305】
投薬量は、用いられる投薬形態および利用される投与経路に依存して変化し得る。正確な配合、投与経路および投薬量は、患者の状態を考慮して個々の医師により選ぶことができる(例えば、Fingl他、1975、”The Pharmacological Basis of Therapeutics”、第1章、1頁を参照のこと)。
【0306】
投薬量および投薬間隔は、調節作用を維持するために十分な、活性成分の血漿レベル(これは最小有効濃度(MEC)と呼ばれる)をもたらすために個々に調節することができる。MECは、それぞれの調製物について変化するが、場合により、動物データ全体から推定することができる。
【0307】
投薬間隔はまた、MEC値を使用して決定することができる。調製物は、場合により、期間の10%〜90%について、好ましくは30%〜90%の間、最も好ましくは50%〜90%の間、MECを超えて血漿レベルを維持する治療方法を使用して投与することができる。
【0308】
処置される状態の重篤度および応答性に依存して、投薬はまた、本明細書中上記で記載された徐放性組成物の単回投与であり得る。この場合、処置の経過は、数日から数週間まで、または、治癒が達成されるまで、もしくは、疾患状態の軽減が達成されるまで続く。
【0309】
本発明の組成物は、所望される場合には、有効成分を含有する1つ以上の単位投薬形態物を含有し得る、FDA承認キットなどのパックまたはディスペンサーデバイスで提供され得る。パックは、例えば、金属箔またはプラスチック箔を含むことができ、例えば、ブリスターパックなどである。パックまたはディスペンサーデバイスには、投与のための説明書が添付され得る。パックまたはディスペンサーデバイスにはまた、医薬品の製造、使用または販売を規制する政府当局により定められた形式で容器に付けられた通知が伴い得る。この場合、そのような通知は、組成物の形態またはヒトもしくは動物への投与の当局による承認を反映する。そのような通知は、例えば、処方薬物に対する米国食品医薬品局により承認されたラベル書きであり得るか、または承認された製品添付文書であり得る。適合し得る医薬用キャリアに配合された本発明の有効成分を含む組成物はまた、適応状態を処置するために、調製され、適切な容器に入れられ、かつ表示され得る。
【0310】
本明細書中で使用される用語「調節する」は、疾患の進行を実質的に阻害し、遅くし、もしくは後戻りさせること、または、疾患もしくは状態の臨床的症状を実質的に改善すること、または、疾患もしくは状態の臨床的症状の出現を実質的に妨げることを包含する。従って、「調節剤」には、疾患もしくは状態を調節することができる薬剤が含まれる。
【0311】
本発明はその詳細な記述と関連して説明されているが、前述の説明は特許請求の範囲によって規定される発明の範囲を説明するためであって制限することを意図していないことは理解されるべきである。他の局面、利点、および変形例は特許請求の範囲内にある。
【0312】


【配列表フリーテキスト】
【0313】
配列番号1はERシグナルペプチドの配列を示す。
配列番号2はタバコキチナーゼAからの液胞標的化シグナルの配列を示す。
配列番号3〜6は一本鎖DNAオリゴヌクレオチドの配列を示す。
配列番号10はERシグナルペプチドをコードする核酸配列を示す。
配列番号11は液胞標的化配列をコードする核酸配列を示す。
配列番号12はアグロバクテリウム・ツメファシエンスのターミネーターの核酸配列を示す。
配列番号13は高マンノースヒトグルコセレブロシダーゼ(GCD)をコードする核酸配列を示す。
配列番号14は高マンノースヒトグルコセレブロシダーゼ(GCD)の配列を示す。
【特許請求の範囲】
【請求項1】
有効成分としての、高マンノース組み換えタンパク質を発現する植物細胞、及び医薬的に許容され得るキャリアを含む医薬組成物。
【請求項2】
有効成分としての、組み換えリソソーム酵素を発現する植物細胞、及び医薬的に許容され得るキャリアを含む医薬組成物。
【請求項3】
前記植物細胞が植物細胞全体を含む請求項1又は2に記載の医薬組成物。
【請求項4】
前記高マンノース組み換えタンパク質又は組み換えリソソーム酵素が、そのN末端で小胞体シグナルペプチドに取り付けられている請求項1又は2に記載の医薬組成物。
【請求項5】
前記高マンノース組み換えタンパク質又は組み換えリソソーム酵素が、小胞体保持シグナルに取り付けられている請求項1又は4に記載の医薬組成物。
【請求項6】
前記組み換えリソソーム酵素が、液胞標的化シグナルに取り付けられている請求項1又は4に記載の医薬組成物。
【請求項7】
前記液胞標的化シグナルが、配列番号2に規定されるものである請求項6に記載の医薬組成物。
【請求項8】
前記高マンノース組み換えタンパク質が、α−L−イズロニダーゼ、酸性スフィンゴミエリナーゼ、ヘキソサミニダーゼ、α−N−アセチルガラクトサミニダーゼ、酸性リパーゼ、α−ガラクトシダーゼ、イズロナートスルファターゼ、α−マンノシダーゼおよびシアリダーゼからなる群から選択される請求項1に記載の医薬組成物。
【請求項9】
前記高マンノース組み換えタンパク質がリソソームタンパク質である請求項1に記載の医薬組成物。
【請求項10】
凍結乾燥されている請求項1に記載の医薬組成物。
【請求項11】
経口投与のために処方されている請求項1〜10のいずれか一項に記載の医薬組成物。
【請求項12】
前記高マンノース組み換えタンパク質がヒトα−ガラクトシダーゼである請求項1に記載の医薬組成物。
【請求項13】
ファブリー病の治療薬の製造のための請求項12に記載の医薬組成物の使用。
【請求項14】
前記高マンノース組み換えタンパク質がヒトイズロナートスルファターゼである請求項1に記載の医薬組成物。
【請求項15】
ハンター症候群の治療薬の製造のための請求項14に記載の医薬組成物の使用。
【請求項16】
N末端で植物の小胞体(ER)シグナルペプチドに取り付けられたイズロナート−2−スルファターゼ又はα−ガラクトシダーゼを含む組み換えタンパク質。
【請求項17】
高マンノースグリコシル化を有する請求項16に記載の組み換えタンパク質。
【請求項18】
アルファ(1−3)グリコシド結合を有する少なくとも1つのフコース残基及び少なくとも1つのキシロース残基を含む請求項16又は17に記載の組み換えタンパク質。
【請求項19】
生物学的に活性である請求項16に記載の組み換えタンパク質。
【請求項20】
ER保持シグナルをさらに含む請求項16に記載の組み換えタンパク質。
【請求項21】
前記ER保持シグナルが組み換えタンパク質のC末端に取り付けられている請求項20に記載の組み換えタンパク質。
【請求項22】
液胞標的化シグナルをさらに含む請求項16に記載の組み換えタンパク質。
【請求項23】
前記液胞標的化シグナルが組み換えタンパク質のC末端に取り付けられている請求項22に記載の組み換えタンパク質。
【請求項24】
前記液胞標的化シグナルが、配列番号2に規定されるものである請求項22に記載の組み換えタンパク質。
【請求項25】
単離されている請求項16に記載の組み換えタンパク質。
【請求項26】
ヒトイズロナート−2−スルファターゼを含む請求項16〜25のいずれか一項に記載の組み換えタンパク質。
【請求項27】
ヒトα−ガラクトシダーゼを含む請求項16〜25のいずれか一項に記載の組み換えタンパク質。
【請求項28】
有効成分としての、請求項16〜27のいずれか一項に記載の組み換えタンパク質、及び医薬的に許容され得るキャリアを含む医薬組成物。
【請求項29】
ハンター症候群の治療薬の製造のための請求項26に記載の組み換えタンパク質の使用。
【請求項30】
ファブリー病の治療薬の製造のための請求項27に記載の組み換えタンパク質の使用。
【請求項31】
請求項26の組み換えタンパク質をコードする、単離された核酸配列。
【請求項32】
請求項27の組み換えタンパク質をコードする、単離された核酸配列。
【請求項33】
請求項26に記載の組み換えタンパク質を製造する方法であって、請求項26に記載のヒトイズロナート−2−スルファターゼを発現する植物細胞の培養物を調製すること;及び前記植物細胞培養物を、前記イズロナート−2−スルファターゼの発現を可能にする条件のもとで培養することを含む方法。
【請求項34】
請求項27に記載の組み換えタンパク質を製造する方法であって、請求項27に記載のヒトα−ガラクトシダーゼを発現する植物細胞の培養物を調製すること;及び前記植物細胞培養物を、前記α−ガラクトシダーゼの発現を可能にする条件のもとで培養することを含む方法。
【請求項1】
有効成分としての、高マンノース組み換えタンパク質を発現する植物細胞、及び医薬的に許容され得るキャリアを含む医薬組成物。
【請求項2】
有効成分としての、組み換えリソソーム酵素を発現する植物細胞、及び医薬的に許容され得るキャリアを含む医薬組成物。
【請求項3】
前記植物細胞が植物細胞全体を含む請求項1又は2に記載の医薬組成物。
【請求項4】
前記高マンノース組み換えタンパク質又は組み換えリソソーム酵素が、そのN末端で小胞体シグナルペプチドに取り付けられている請求項1又は2に記載の医薬組成物。
【請求項5】
前記高マンノース組み換えタンパク質又は組み換えリソソーム酵素が、小胞体保持シグナルに取り付けられている請求項1又は4に記載の医薬組成物。
【請求項6】
前記組み換えリソソーム酵素が、液胞標的化シグナルに取り付けられている請求項1又は4に記載の医薬組成物。
【請求項7】
前記液胞標的化シグナルが、配列番号2に規定されるものである請求項6に記載の医薬組成物。
【請求項8】
前記高マンノース組み換えタンパク質が、α−L−イズロニダーゼ、酸性スフィンゴミエリナーゼ、ヘキソサミニダーゼ、α−N−アセチルガラクトサミニダーゼ、酸性リパーゼ、α−ガラクトシダーゼ、イズロナートスルファターゼ、α−マンノシダーゼおよびシアリダーゼからなる群から選択される請求項1に記載の医薬組成物。
【請求項9】
前記高マンノース組み換えタンパク質がリソソームタンパク質である請求項1に記載の医薬組成物。
【請求項10】
凍結乾燥されている請求項1に記載の医薬組成物。
【請求項11】
経口投与のために処方されている請求項1〜10のいずれか一項に記載の医薬組成物。
【請求項12】
前記高マンノース組み換えタンパク質がヒトα−ガラクトシダーゼである請求項1に記載の医薬組成物。
【請求項13】
ファブリー病の治療薬の製造のための請求項12に記載の医薬組成物の使用。
【請求項14】
前記高マンノース組み換えタンパク質がヒトイズロナートスルファターゼである請求項1に記載の医薬組成物。
【請求項15】
ハンター症候群の治療薬の製造のための請求項14に記載の医薬組成物の使用。
【請求項16】
N末端で植物の小胞体(ER)シグナルペプチドに取り付けられたイズロナート−2−スルファターゼ又はα−ガラクトシダーゼを含む組み換えタンパク質。
【請求項17】
高マンノースグリコシル化を有する請求項16に記載の組み換えタンパク質。
【請求項18】
アルファ(1−3)グリコシド結合を有する少なくとも1つのフコース残基及び少なくとも1つのキシロース残基を含む請求項16又は17に記載の組み換えタンパク質。
【請求項19】
生物学的に活性である請求項16に記載の組み換えタンパク質。
【請求項20】
ER保持シグナルをさらに含む請求項16に記載の組み換えタンパク質。
【請求項21】
前記ER保持シグナルが組み換えタンパク質のC末端に取り付けられている請求項20に記載の組み換えタンパク質。
【請求項22】
液胞標的化シグナルをさらに含む請求項16に記載の組み換えタンパク質。
【請求項23】
前記液胞標的化シグナルが組み換えタンパク質のC末端に取り付けられている請求項22に記載の組み換えタンパク質。
【請求項24】
前記液胞標的化シグナルが、配列番号2に規定されるものである請求項22に記載の組み換えタンパク質。
【請求項25】
単離されている請求項16に記載の組み換えタンパク質。
【請求項26】
ヒトイズロナート−2−スルファターゼを含む請求項16〜25のいずれか一項に記載の組み換えタンパク質。
【請求項27】
ヒトα−ガラクトシダーゼを含む請求項16〜25のいずれか一項に記載の組み換えタンパク質。
【請求項28】
有効成分としての、請求項16〜27のいずれか一項に記載の組み換えタンパク質、及び医薬的に許容され得るキャリアを含む医薬組成物。
【請求項29】
ハンター症候群の治療薬の製造のための請求項26に記載の組み換えタンパク質の使用。
【請求項30】
ファブリー病の治療薬の製造のための請求項27に記載の組み換えタンパク質の使用。
【請求項31】
請求項26の組み換えタンパク質をコードする、単離された核酸配列。
【請求項32】
請求項27の組み換えタンパク質をコードする、単離された核酸配列。
【請求項33】
請求項26に記載の組み換えタンパク質を製造する方法であって、請求項26に記載のヒトイズロナート−2−スルファターゼを発現する植物細胞の培養物を調製すること;及び前記植物細胞培養物を、前記イズロナート−2−スルファターゼの発現を可能にする条件のもとで培養することを含む方法。
【請求項34】
請求項27に記載の組み換えタンパク質を製造する方法であって、請求項27に記載のヒトα−ガラクトシダーゼを発現する植物細胞の培養物を調製すること;及び前記植物細胞培養物を、前記α−ガラクトシダーゼの発現を可能にする条件のもとで培養することを含む方法。
【図1a】


【図1b】


【図2】


【図3a】


【図3b】


【図3c】


【図3d】


【図3e】


【図3f】


【図4a】


【図4b】


【図4c】


【図5a】


【図5b】


【図5c】


【図5d】


【図6】


【図7】


【図8a】


【図8b】


【図8c】


【図8d】




【図1b】


【図2】


【図3a】


【図3b】


【図3c】


【図3d】


【図3e】


【図3f】


【図4a】


【図4b】


【図4c】


【図5a】


【図5b】


【図5c】


【図5d】


【図6】


【図7】


【図8a】


【図8b】


【図8c】


【図8d】


【公開番号】特開2011−184445(P2011−184445A)
【公開日】平成23年9月22日(2011.9.22)
【国際特許分類】
【出願番号】特願2011−99013(P2011−99013)
【出願日】平成23年4月27日(2011.4.27)
【分割の表示】特願2006−507577(P2006−507577)の分割
【原出願日】平成16年2月24日(2004.2.24)
【出願人】(505161910)プロタリクス リミテッド (8)
【Fターム(参考)】
【公開日】平成23年9月22日(2011.9.22)
【国際特許分類】
【出願日】平成23年4月27日(2011.4.27)
【分割の表示】特願2006−507577(P2006−507577)の分割
【原出願日】平成16年2月24日(2004.2.24)
【出願人】(505161910)プロタリクス リミテッド (8)
【Fターム(参考)】
[ Back to top ]

