植物組成物由来の多種類の生体活性物質の定量方法
多数の生体活性化合物の定量方法を開示する。
【発明の詳細な説明】
【技術分野】
【0001】
本出願は、植物組成物由来の多種類の生体活性物質の定量方法、1種類以上の単離分離された活性物質を含む組成物を患者に投与することを含む、閉経期の治療方法に関する。
【0002】
(関連出願の相互参照)
本出願は、2008年6月5日に出願された米国特許仮出願第61/059,255号の恩典を主張し、引用によりその全体が本明細書に組み込まれる。
【背景技術】
【0003】
閉経期は、正常な排卵サイクルが停止して正常な月経が停止した後の期間である。閉経期には、卵巣がエストラジオール(E2)を生成しなくなるため、E2生成の減少を伴う。このE2生成の減少は、体内のホルモンバランスの変化をもたらし、多くの場合、閉経期と関連するさまざまな症状が起こる。
【0004】
閉経前または更年期としても知られる閉経周辺期は、正常な排卵サイクルが徐々に月経の停止へと移行する閉経期前の期間である。排卵サイクルが長くなり、より不規則となるため、E2レベルは、最初は増大することがあり得るが、最終的には低下し、閉経期が始まる。閉経期症状は、多くの場合、E2レベルの低下を伴う。
【0005】
閉経周辺期、閉経期および閉経後の症状としては、血管運動の不安定性に副次的なのぼせおよび発汗などの身体症状が挙げられる。また、更年期の開始には、疲労感、イライラ感、不眠、集中力の低下、鬱、記憶力の減退、頭痛、不安感および神経質などの心理的および感情的症状を伴うことがあり得る。さらなる症状としては、断続的なめまい、感覚異常、動悸および頻脈ならびに吐き気、便秘、下痢、関節痛、筋肉痛、手足の冷えおよび体重増加が挙げられ得る。また、生殖器官に対する変化、尿失禁、膣乾燥、骨盤筋の緊張の低下、心血管疾患および骨粗鬆症のリスクの増大が、閉経期の始まりとともに増大する。
【0006】
のぼせは、閉経周辺期、閉経期および閉経後の多くの女性に一般的に見られ、厄介である。数十年の間、エストロゲンによるホルモン補充療法は、のぼせの標準的な治療であったが、多くの女性は、有害効果、特に乳癌の可能性に関する懸念のため、ホルモン療法(HT)を諦めていた。いくつかの最近の研究、特に、女性の健康イニシアチブ(Women’s Health Initiative)(WHI)により、HTは乳癌のリスクを増大させることがわかった。選択的エストロゲン受容体モジュレータ(「SERM」)であるラロキシフェンおよびタモキシフェンはエストロゲン受容体(ER)陽性乳癌を抑制するという観察結果は、エストロゲンが乳癌を促進させるというさらなる証拠を提供する。
【0007】
したがって、閉経期、特にのぼせなどの閉経期症状の治療のための、乳癌のリスクを増大させない治療用組成物および方法の必要性が存在する。本発明は、この必要性を満たし、また、関連する利点をもたらすものである。
【発明の概要】
【発明が解決しようとする課題】
【0008】
したがって、本明細書に記載の実施形態は、Herba Scutellaria Barbata、Radix Sophora Subprostratae、Radix Anamarrhena、Semen Glycine Sojae、Radix Glycyrrhiza、Rhizoma Rhei、Fructus Tritici Levis、Radix Astragali、Radix Rehmania、Fructus Ligustri Lucidi、Semen Zyziphi Spinozae、Plumula Nelumbinis、Poria Cocos、Rhizoma Alismatis、Cortex Moutan Radicis、Fructus Corni、Radix Achyranthis、Concha Ostrea、Radix Aspargi、Radix Pueraria、Radix Atractylodis MacrocephalaおよびHerba Epimediaの混合物のエキスの活性物質の定量方法であって、(a)前記エキスからタンパク質を沈殿させ、上清みを単離することと、(b)該上清みを抽出媒体上にインジェクトし、溶出液を該抽出媒体から収集することと、(c)(b)の溶出液をMS/MS分離および定量に供し、それにより、前記活性物質の定量を得ることとを含む方法を提供する。一部の実施形態において、前記タンパク質沈殿(a)はタンパク質分離用バイアル内で行われる。一部の実施形態において、抽出媒体は抽出カラムである。一部の実施形態において、MS/MS分離および定量は、API5000 MS/MSシステムにおいてターボスプレーネガティブSRMモードで行われる。一部の実施形態において、活性物質は、(i)ERαおよび/またはERβの存在下でのERE−tk−Lucアッセイの活性化を特徴とする、(ii)および/または活性物質がERαおよび/またはERβの存在下でのTNF−RE−Lucアッセイの活性化を特徴とする。一部の実施形態において、このプロセスによって得られる分離された活性物質を記載する。一部の実施形態において、1種類以上の前記活性物質を含む、1つ以上の閉経期症状の治療のための医薬を提供する。一部の実施形態は、1つ以上のエストロゲン関連の病状または疾患状態の治療のための医薬の調製のための記載の方法の単離分離された活性物質の使用を提供する。一部の実施形態は、開示した方法の1つによって同定、単離および/または調製される1種類以上の単離分離された活性物質を含む組成物を患者に投与することを含む、閉経期の治療方法を提供する。
【課題を解決するための手段】
【0009】
エストロゲン媒介性の病状または疾患状態の治療方法は、患者に、開示した方法の一つを特徴とする1種類以上の単離分離された活性物質を含む組成物を投与することを含む。一部の実施形態において、前記治療は少なくとも1つの閉経期症状の重症度または頻度の低減を含む。一部の実施形態において、前記閉経期症状は、のぼせである。一部の実施形態において、閉経期症状は、疲労感、イライラ感、不眠、集中力の低下、鬱、記憶力の減退、頭痛、不安感、神経質、断続的なめまい、感覚異常、動悸、頻脈、吐き気、便秘、下痢、関節痛、筋肉痛、手足の冷え、体重増加、尿失禁、膣乾燥および骨盤筋の緊張の低下からなる群より選択される。一部の実施形態において、患者に投与される前記活性物質の量は、患者の体重1kgあたり約0.1〜10mgの前記1種類以上の組成物である。
【0010】
一部の実施形態において、生物学的試料から活性物質を単離し、前記活性物質を定量する方法であって、前記活性物質が、Herba Scutellaria Barbata、Radix Sophora Subprostratae、Radix Anamarrhena、Semen Glycine Sojae、Radix Glycyrrhiza、Rhizoma Rhei、Fructus Tritici Levis、Radix Astragali、Radix Rehmania、Fructus Ligustri Lucidi、Semen Zyziphi Spinozae、Plumula Nelumbinis、Poria Cocos、Rhizoma Alismatis、Cortex Moutan Radicis、Fructus Corni、Radix Achyranthis、Concha Ostrea、Radix Aspargi、Radix Pueraria、Radix Atractylodis MacrocephalaおよびHerba Epimediaの混合物のエキス由来のエストロゲン様化合物であり、(a)前記生物学的試料からタンパク質を沈殿させ、上清みを単離することと、(b)該上清みを抽出媒体上にインジェクトし、溶出液を該抽出媒体から収集することと、(c)(b)の溶出液をMS/MS分離および定量に供し、それにより、前記活性物質の定量を得ることとを含む方法を提供する。一部の実施形態において、生物学的試料は、血液、器官または尿試料などの哺乳動物組織試料である。一部の実施形態において、生物学的試料は血液試料(例えば、血漿試料)、尿試料、肝臓試料、乳房組織試料、卵巣組織試料、子宮組織試料、外陰部組織試料、膣組織試料、頚部組織試料、ファローピウス管組織試料、子宮内膜組織試料、リンパ節組織試料および/または骨組織試料である。一部の実施形態において、哺乳動物組織試料は、ヒト血漿試料、ヒト尿試料、イヌ血漿試料、マウス血漿試料またはラット肝臓試料である。一部の実施形態において、前記タンパク質沈殿(a)はタンパク質分離用バイアル内で行われる。一部の実施形態において、抽出媒体は抽出カラムである。一部の実施形態において、MS/MS分離および定量は、API5000 MS/MSシステムにおいてターボスプレーネガティブSRMモードで行われる。一部の実施形態において、活性物質は、(i)ERαおよび/またはERβの存在下でのERE−tk−Luc活性化を特徴とする、(ii)および/または活性物質がERαおよび/またはERβの存在下でのTNF−RE−Lucアッセイの活性化を特徴とする。
【0011】
本明細書に開示する一部の実施形態は、(a)Herba Scutellaria Barbata、Radix Sophora Subprostratae、Radix Anamarrhena、Semen Glycine Sojae、Radix Glycyrrhiza、Rhizoma Rhei、Fructus Tritici Levis、Radix Astragali、Radix Rehmania、Fructus Ligustri Lucidi、Semen Zyziphi Spinozae、Plumula Nelumbinis、Poria Cocos、Rhizoma Alismatis、Cortex Moutan Radicis、Fructus Corni、Radix Achyranthis、Concha Ostrea、Radix Aspargi、Radix Pueraria、Radix Atractylodis Macro cephalaおよびHerba Epimediaを合わせ、ハーブ混合物を形成することと、(b)該ハーブ混合物を、抽出溶媒での抽出に供することと、(c)該ハーブ混合物を水から分離してエキスを形成し、任意選択で、前記エキスからタンパク質を沈殿させることと、(d)前記エキスから活性物質を分離することと、(e)前記(d)の活性物質の1種類以上を少なくとも1種類の薬学的に許容され得る成分と組み合わせ、それにより医薬を形成することとを含む、医薬の調製方法を提供する。
【0012】
一部の実施形態において、本発明は、閉経期の治療のための組成物を提供する。該組成物は、ハーブ混合物、ハーブ混合物のエキスまたはハーブエキスの混合物である。ハーブ混合物は、Herba Scutellaria Barbata、Radix Sophora Subprostratae、Radix Anamarrhena、Semen Glycine Sojae、Radix Glycyrrhiza、Rhizoma Rhei、Fructus Tritici Levis、Radix Astragali、Radix Rehmania、Fructus Ligustri Lucidi、Semen Zyziphi Spinozae、Plumula Nelumbinis、Poria Cocos、Rhizoma Alismatis、Cortex Moutan Radicis、Fructus Corni、Radix Achyranthis、Concha Ostrea、Radix AsparagiおよびRadix Puerariaを含む。該組成物は、インビトロアッセイにおいて、エストロゲン応答エレメント(ERE)を、エストロゲン受容体β(ERβ)により活性化させるが、エストロゲン受容体α(ERα)では活性化させない。
【0013】
また、本発明は、閉経期の治療方法を提供する。該方法は、被検体に、閉経期が治療されるのに充分な量の上記の組成物投与することを含む。一部の実施形態において、閉経期の治療としては、閉経期症状の重症度、頻度または重症度と頻度の低減が挙げられる。
【0014】
引用による組み込み
本明細書において挙げた刊行物および特許出願はすべて、引用により、個々の刊行物および特許出願が、引用により組み込まれて、あたかも具体的に個々に示されているのと同程度に本明細書に組み込まれる。
【図面の簡単な説明】
【0015】
本発明の新規な特徴は、特に、添付の特許請求の範囲に示したものである。本発明の原理を用いた例示的実施形態を示した以下の詳細な説明、および添付の図面を参照することにより、本発明の特徴および利点のより良好な理解が得られよう。
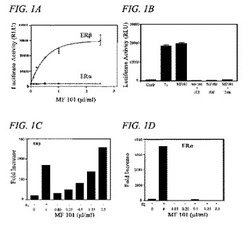
【図1A】ERβ発現細胞およびERα発現細胞に対するMF101の活性を比較する折れ線グラフである。MF101は、ERβでは、用量依存的なERE−tk−Luc活性化をもたらしたが、ERαでは、活性化は観察されなかった。
【図1B】E2、MF101ならびにMF101+ICI、MF101+ラロキシフェン(Ral)およびMF101+タモキシフェン(Tam)の組み合わせの効果を比較する棒グラフである。MF101によるERE−tk−Luc活性化は、ICI、RalおよびTamによってブロックされた。
【図1C】MF101の存在下で、U2OS−ERβ細胞におけるケラチン19mRNA発現の増大を示す棒グラフである。
【図1D】MF101は、U2OS−ERα細胞において、ケラチン19mRNA発現に対してほとんど効果がなかったことを示す棒グラフである。
【図2A】ERβおよびERαに対するMF101の結合を示す折れ線グラフである。
【図2B】MF101が、ケラチン19EREにERβを漸増させるが、ERαは漸増させないことを示すゲルである。
【図2C】ERαのエラスターゼ消化に対するエタノール(対照)、E2(陽性対照)およびMF101の効果を示すゲルである。MF101と結合している場合、ERαは対照と比べて、エラスターゼに対する保護のわずかな増大を示す。
【図2D】ERβのエラスターゼ消化に対するエタノール(対照)、E2(陽性対照)およびMF101の効果を示すゲルである。
【図3A】それぞれ、対照、E2およびMF101で処理した細胞における3H−チミジン取込みの違いを示す棒グラフである。一般的に、MF101は、対照と比べて、3H−チミジン取込みを大きく増大させなかった。
【図3B】細胞内で、MF101が、c−myc(図3B)遺伝子を活性化させなかったことを示す棒グラフである。
【図3C】細胞内で、MF101が、サイクリンD1(図3c)遺伝子を活性化させなかったことを示す棒グラフである。
【図3D】細胞増殖に対する対照、ジエチルスチルベルトロール(DES)およびMF101の効果を示す写真である。
【図3E】細胞増殖に対する対照、ジエチルスチルベルトロール(DES)およびMF101の効果を示す写真である。
【図3F】細胞増殖に対する対照、ジエチルスチルベルトロール(DES)およびMF101の効果を示す写真である。
【図3G】異種移植片の増殖に対する対照、DESおよびMF101の効果を示す棒グラフである。MF101は、移植片の増殖を刺激しなかったが、DESは、異種移植片の質量の相当な増加を引き起こした。
【図3H】子宮角塊の増殖に対する対照、DESおよびMF101の効果を示す棒グラフである。MF101は、子宮角増殖を刺激しなかったが、対照的に、DESは、子宮角増殖の相当な増大を刺激した。
【図4】エストラジオールあり、またはなしでのMCF細胞増殖に対するERβの効果を示す棒グラフである。
【図5】インビボ細胞増殖に対するERαおよびERβの効果を示す。
【図6】エストラジオールはERαをインビボで活性化するが、MF−101は活性化しないことを示す三次元の棒グラフである。
【図7】MF−101がERβと選択的に相互作用することを示す三次元の棒グラフである。
【図8】MF−101の抗増殖効果を示す折れ線グラフである。
【図9】MF−101が骨細胞をTNFβ活性から保護することを示す三次元の棒グラフである。
【図10】すべての活性物質と内部標準の標準的な混合物の高速液体クロマトグラムである。
【図11】6種類の主な活性物質(ヒト血漿中)の一組の典型的な標準曲線である。
【図12】低(0.5ng/mLまたは1ng/mL)、中(20ng/mL)および高(50ng/mL)濃度レベルでの、3回の凍結解凍サイクルを経た6種類の活性物質のヒト血漿中における安定性を示す。
【図13】ヒト血漿からの種々の活性物質の回収率を示す。低(BNER1103、BNER1104およびBNER1106では0.5ng/mL、BNER1101、BNER1105およびBNER1115では1ng/mL)、中(10ng/mL)および高(20ng/mL)。
【発明を実施するための形態】
【0016】
本明細書において、閉経期の治療に有用であることがわかっている諸成分の混合物から活性化合物を単離し、定量し、特性評価する方法を記載する。一部の実施形態において、本明細書に記載の方法は、本明細書においてより詳細に説明するハーブ混合物のエキスからの活性化合物(活性物質)の単離を伴う。一部の実施形態において、本明細書に記載の方法は、血漿からの活性物質の単離を伴う。エキスまたは血漿を、まず、タンパク質の沈殿および分離に供する。上清みを、沈澱したタンパク質から分離し、抽出媒体(抽出カラムなど)に適用し、適当な溶媒で溶出させる。次いで、溶出液を質量分析−質量分析分離に供し、活性物質の単離と定量の両方を行う。活性物質の活性は、ERαおよび/またはERβの一方または両方の存在下で、EREまたはTNF−REの活性化などのエストロゲン様効果の既知の試験方法によって確認され得る。活性物質を1種類以上の賦形剤と合わせ、医薬組成物を調製してもよく、これは、エストロゲン媒介性の病状または疾患状態、例えば、閉経期、骨粗鬆症、乳癌、子宮癌、卵巣癌、膣癌、外陰部の癌、頚部癌、子宮内膜癌、ファローピウス管癌など、またはリンパ系内に遊走した任意の癌の治療のために使用され得る。また、該単離および定量方法は、薬物試験の際に、生物学的組織から前記活性物質を単離および定量するため、ならびに薬物試験の際に、活性物質の薬物動態および全身分布を調べるために使用され得る。
【0017】
多くの女性は、HTは有益性よりもリスクが勝ることが示された女性の健康イニシアチブの治験の結果以来、閉経期症状のためのHTに使用される安全で有効なエストロゲン代替薬を心待ちにしている(Ettinger,B.、Grady,D.、Tosteson,A.N.、Pressman,A.&Macer、J.L.、「Effect of the Women’s Health Initiative on women’s decisions to discontinue postmenopausal hoemone therapy」、Obstet.Gynecol.102、1225−32(2003))。その一方で、最近の調査により、閉経周辺期および閉経後の女性の79%が、植物性ダイエタリーサプリメント(BDS)を使用していることが報告された(Mahady,G.B.、Parrot,J.、Lee,C.、Yun,G.S.&Dan,A.Botanical dietary supplement use in peri− and postmenopausal women.Menopause 10、65−72(2003))。BDSが広く使用されているにも関わらず、植物性物質の作用機序、有効性および安全性は、厳密には調べられていなかった。本発明は、Herba Scutellaria Barbata、Radix Sophora Subprostratae、Radix Anamarrhena、Semen Glycine Sojae、Radix Glycyrrhiza、Rhizoma Rhei、Fructus Tritici Levis、Radix Astragali、Radix Rehmania、Fructus Ligustri Lucidi、Semen Zyziphi Spinozae、Plumula Nelumbinis、Poria Cocos、Rhizoma Alismatis、Cortex Moutan Radicis、Fructus Corni、Radix Achyranthis、Concha Ostrea、Radix AsparagiおよびRadix Puerariaを含有するハーブ配合物を提供する。一部の実施形態において、該エキスは、各ハーブ、すなわちHerba Scutellaria Barbata、Radix Sophora Subprostratae、Radix Anamarrhena、Semen Glycine Sojae、Radix Glycyrrhiza、Rhizoma Rhei、Fructus Tritici Levis、Radix Astragali、Radix Rehmania、Fructus Ligustri Lucidi、Semen Zyziphi Spinozae、Plumula Nelumbinis、Poria Cocos、Rhizoma Alismatis、Cortex Moutan Radicis、Fructus Corni、Radix Achyranthis、Concha Ostrea、Radix AsparagiおよびRadix Puerariaが有意な量のエキスである。本発明の例示的な実施形態はMF101であり、これは、以下に、より詳細に説明する。MF101に含まれるハーブの多くは、更年期症状の治療のための伝統的な漢方薬草の調合薬に使用されているが、これまでの試験で、閉経期の治療のための混合物の個々の物質の有効性が確認されたことはない。本発明の組成物は、ERβ−選択的エストロゲン受容体活性を有し、したがって、閉経期の臨床的治療、特に、のぼせなどの閉経期症状の治療に充分に適している。
【0018】
本発明は、閉経期、特に、のぼせなどの閉経期症状の治療のための組成物および方法を提供する。本発明の組成物は、ハーブ混合物、ハーブ混合物のエキスまたはハーブエキスの混合物である。さらに、本発明の組成物は、U2OS骨肉種細胞アッセイにおいて、エストロゲン応答エレメント(ERE)を、エストロゲン受容体β(ERβ)により活性化するが、エストロゲン受容体α(ERα)では活性化しない。該組成物は、EREを、ERαではなくERβとの相互作用(前者のみ、エストロゲンHTの有害効果と関連している)によって活性化するため、本発明の組成物および方法は、エストロゲンホルモン療法の代わり使用され、WHIにおいて、乳癌のリスクの増大などのエストロゲン補充と関連していると確認された状態が起こりにくい
【0019】
本発明との関連において、「閉経期」は、閉経周辺期、閉経期および閉経後を含み、特に、閉経周辺期、閉経期および閉経後に伴うエストラジオール(E2)レベルの低下によって引き起こされる、または悪化する症状を含む。したがって、本発明との関連において、「閉経期の治療」は、閉経期症状の治療を意味する。例示的な閉経期症状としては、血管運動の不安定性に副次的なのぼせ、発汗、心理的および感情的症状(疲労感、イライラ感、不眠、集中力の低下、鬱、記憶力の減退、頭痛、不安感、神経質など)、断続的なめまい、感覚異常、動悸、頻脈、吐き気、便秘、下痢、関節痛、筋肉痛、手足の冷え、体重増加、尿失禁、膣乾燥、骨盤筋の緊張の低下、心血管疾患および骨粗鬆症のリスクの増大が挙げられる。
【0020】
したがって、「閉経期の治療」は、閉経周辺期、閉経期または閉経後と関連している1つ以上の症状の軽減、緩和または予防を意味し、少なくとも1つの閉経期症状の重症度または頻度の低減が挙げられる。「または/もしくは」の使用は、本明細書で用いる場合、特に記載のない限り、接続的であることを意図する。したがって、治療には、少なくとも1つの閉経期症状の重症度と頻度の両方の低減も包含される。症状の頻度および重症度の低減は完全なものであり得るという意味では、治療には、該症状の予防も包含され得る。これに関連して、閉経期の治療には、ヒト成人女性の月経の自然な停止の予防は含まれないが、閉経期と関連している少なくとも1つの症状の頻度および重症度の検出不可能なレベルまでの低減は含まれることに注意されたい。
【0021】
本発明との関連において、「閉経期の被検体」およびその文言上の変化形は、かつて初経が起こり、閉経周辺期、閉経期または閉経後である雌の成体、特にヒト成人女性をいう。婦人科学の当業者には、閉経期の始まりの診断上の特徴を確認することができ、当該技術分野で認められた臨床方法によって被検体を「閉経期の被検体」であると特定することができよう。
【0022】
本発明による組成物は、以下の各ハーブ、すなわちHerba Scutellaria Barbata、Radix Sophora Subprostratae、Radix Anamarrhena、Semen Glycine Sojae、Radix Glycyrrhiza、Rhizoma Rhei、Fructus Tritici Levis、Radix Astragali、Radix Rehmania、Fructus Ligustri Lucidi、Semen Zyziphi Spinozae、Plumula Nelumbinis、Poria Cocos、Rhizoma Alismatis、Cortex Moutan Radicis、Fructus Corni、Radix Achyranthis、Concha Ostrea、Radix AsparagiおよびRadix Puerariaを含むハーブ混合物を含むものである。一部の実施形態において、ハーブ混合物は、前述の各ハーブを有意な量で含むものである。これに関連して、有意な量は、ハーブ混合物中の全ハーブ物質の質量の約0.1重量%より多い、例えば約0.5%より多い、より詳細には約1重量%より多い量を意味する。また、本発明による組成物は、前述のハーブ混合物のエキスを含むものである。かかるエキスの作製方法は、以下に詳細に説明する。
【0023】
本発明の一部の実施形態において、ハーブ混合物は、ほぼまたは正確に表2に示した割合のハーブの混合物を含むもの、本質的に該混合物からなるもの、または該混合物からなるものである。
【表2】

【0024】
一部の実施形態において、本発明のハーブ混合物は、表3に示したほぼまたは正確な割合のハーブ成分を含むもの、本質的に該ハーブ成分からなるもの、または該ハーブ成分からなるものである。
【表3】

【0025】
特定の実施形態において、本発明は、ほぼまたは正確に表4に示す割合のハーブ成分を含むもの、本質的に該ハーブ成分からなる、または該ハーブ成分からなるハーブ混合物を提供する。
【表4】

【0026】
〜を含む、本質的に〜からなる、および〜からなるという用語は、当該技術分野で一般的に認められた意味を有する。ほぼという用語およびその変化形は、それぞれの表内の具体的な値の許容範囲が、示された値の+/−10%の範囲内であることを意味する。したがって、例えば、ほぼ10%である値とは(10+/−1)%であり得る、すなわち9〜11%の範囲であり得る。正確なという用語およびその変化形は、それぞれの表内の具体的な値の許容範囲が、示された値の+/−1%の範囲内であることを意味する。したがって、例えば、正確に10.0%である値とは(10+/−0.1)%であり得る:すなわち9.9〜10.1%の範囲であり得る。一部の実施形態において、表1〜表3に示した割合は、ほぼであり、別の一部の実施形態では、該割合は正確なものである。
【0027】
一部の実施形態において、本発明は、上記のハーブ混合物のエキスである組成物を提供する。一部の実施形態において、本発明のエキスは、ハーブ、すなわちHerba Scutellaria Barbata、Radix Sophora Subprostratae、Radix Anamarrhena、Semen Glycine Sojae、Radix Glycyrrhiza、Rhizoma Rhei、Fructus Tritici Levis、Radix Astragali、Radix Rehmania、Fructus Ligustri Lucidi、Semen Zyziphi Spinozae、Plumula Nelumbinis、Poria Cocos、Rhizoma Alismatis、Cortex Moutan Radicis、Fructus Corni、Radix Achyranthis、Concha Ostrea、Radix AsparagiおよびRadix Puerariaを含むハーブ混合物のエキスである。一部の実施形態において、該エキスは、有意な量の各ハーブ、すなわちHerba Scutellaria Barbata、Radix Sophora Subprostratae、Radix Anamarrhena、Semen Glycine Sojae、Radix Glycyrrhiza、Rhizoma Rhei、Fructus Tritici Levis、Radix Astragali、Radix Rehmania、Fructus Ligustri Lucidi、Semen Zyziphi Spinozae、Plumula Nelumbinis、Poria Cocos、Rhizoma Alismatis、Cortex Moutan Radicis、Fructus Corni、Radix Achyranthis、Concha Ostrea、Radix AsparagiおよびRadix Puerariaのエキスである。他の実施形態において、該エキスは、表2に示したハーブ混合物のエキスである。さらなる実施形態において、該エキスは、表3に示したハーブ混合物のエキスである。なおさらなる実施形態において、該エキスは、表4に示したハーブ混合物のエキスである。
【0028】
本発明の一部の実施形態において、該組成物は、ハーブ混合物の濃縮型または無水型エキスである。一部の実施形態において、該組成物は、ハーブ、すなわちHerba Scutellaria Barbata、Radix Sophora Subprostratae、Radix Anamarrhena、Semen Glycine Sojae、Radix Glycyrrhiza、Rhizoma Rhei、Fructus Tritici Levis、Radix Astragali、Radix Rehmania、Fructus Ligustri Lucidi、Semen Zyziphi Spinozae、Plumula Nelumbinis、Poria Cocos、Rhizoma Alismatis、Cortex Moutan Radicis、Fructus Corni、Radix Achyranthis、Concha Ostrea、Radix AsparagiおよびRadix Puerariaを含むハーブ混合物の無水型または濃縮型エキスである。一部の実施形態において、該組成物は、有意な量の各ハーブ、すなわちHerba Scutellaria Barbata、Radix Sophora Subprostratae、Radix Anamarrhena、Semen Glycine Sojae、Radix Glycyrrhiza、Rhizoma Rhei、Fructus Tritici Levis、Radix Astragali、Radix Rehmania、Fructus Ligustri Lucidi、Semen Zyziphi Spinozae、Plumula Nelumbinis、Poria Cocos、Rhizoma Alismatis、Cortex Moutan Radicis、Fructus Corni、Radix Achyranthis、Concha Ostrea、Radix AsparagiおよびRadix Puerariaの濃縮型または無水型エキスである。他の実施形態において、該組成物は、表2または表3または表4に示したハーブ混合物の濃縮型または無水型エキスである。
【0029】
一部の実施形態において、本発明は、前述のエキスまたは濃縮型もしくは無水型エキスの1種類以上と、1種類以上の適当な希釈剤、フレーバー剤、賦形剤または他の添加剤との組み合わせである組成物を提供する。好適な希釈剤としては、水、例えば、脱イオン水、注射用水(WFI)、濾過水などが挙げられる。他の適当な希釈剤としては、果汁、お茶、ミルク、マグネシアミルクなどが挙げられる。好適なフレーバーとしては、フルーツフレーバー、ウインターグリーン、ペパーミント、スペアミント、シナモンなどが挙げられる。他の適当な添加剤としては、食品着色料およびエタノールが挙げられる。一部の実施形態において、該組成物は、無水型エキスを、1種類以上の希釈剤、フレーバー剤または他の添加剤との組み合わせで含むものである。他の実施形態において、該組成物は、濃縮型エキスを、1種類以上の希釈剤、フレーバー剤または他の添加剤との組み合わせで含むものである。一部の特定の実施形態では、無水型エキスは、表2、表3または表4に示した混合物のうちの1種類の無水型エキスである。他の特定の実施形態において、濃縮型エキスは、表2、表3または表4に示したハーブ混合物のうちの1種類の濃縮型エキスである。
【0030】
本発明による組成物は、ハーブ、すなわちHerba Scutellaria Barbata、Radix Sophora Subprostratae、Radix Anamarrhena、Semen Glycine Sojae、Radix Glycyrrhiza、Rhizoma Rhei、Fructus Tritici Levis、Radix Astragali、Radix Rehmania、Fructus Ligustri Lucidi、Semen Zyziphi Spinozae、Plumula Nelumbinis、Poria Cocos、Rhizoma Alismatis、Cortex Moutan Radicis、Fructus Corni、Radix Achyranthis、Concha Ostrea、Radix AsparagiおよびRadix Pueraria、特に、有意な量の各ハーブの混合物を含むものであり、より詳細には、ほぼまたは正確に表2、表3または表4のうちの1つに示したとおりの各ハーブの混合物を含むものである。かかるハーブ混合物は、慣用的な様式で、すなわち、適切な量の各ハーブを計り取り、種々のハーブを組み合わせてハーブ混合物を形成することにより作製され得る。このプロセスに、混合物の摩砕または攪拌などのさらなる工程を含めてもよい。該混合物は、そのまま摂取してもよく、被検体への経口投与に適した1つ以上のカプセル内に存在させてもよい。特定の実施形態において、ハーブ混合物を、該混合物のエキスを調製することなどによって、さらに加工処理してもよい。
【0031】
本発明によるハーブ混合物のエキスは、慣用的な様式で、例えば、ハーブ混合物を1種類以上の溶媒と、エキスの調製に適した時間および条件下で合わせることなどにより調製され得る。ハーブ混合物と溶媒を、エキスの形成に適当な期間接触させた後、溶媒とハーブを濾過または遠心分離などの適当な方法によって分離する。溶媒を含む液体はエキスに相当する。次いで、このエキスは、該エキスを濃縮または脱水し(または両方)、該エキスをさらなる成分と組み合わせることなどにより、さらに加工処理され得る。
【0032】
抽出プロセスに好適な溶媒(抽出溶媒)としては、水性溶媒、例えば、純水およびエタノールの水性溶液などが挙げられる。好適な条件としては、抽出溶媒とハーブの混合物に対する加熱が挙げられる。一部の特定の実施形態では、溶媒とハーブ混合物を、沸騰するまで所与の時間加熱する。特定の実施形態では、ハーブ混合物を水と合わせ、この合わせたものを約1分より長い時間、特に、5分より長い時間煎出する。
【0033】
本発明の特定の実施形態では、上記の表5に示したハーブ混合物を水と組み合わせ、次いで、沸点まで、エキスの調製に適した時間加熱する。水を煎出ハーブから分離した後、水分を脱水によって除去し、残った残渣を本発明による組成物(無水型エキス)として回収する。次いで、この無水型エキスを、お湯で薄めてお茶として飲用にしてもよく、他のフレーバーと合わせてもよく、1つ以上のゼラチンカプセル剤に調製してもよい。
【0034】
本発明の方法は、閉経期症状が治療されるのに充分な量の本発明の組成物を摂取することを含む。「閉経期症状」は、閉経周辺期、閉経期または閉経後の1つ以上と関連している症状である。閉経期症状としては、血管運動の不安定性に副次的なのぼせおよび発汗、疲労感、イライラ感、不眠、集中力の低下、鬱、記憶力の減退、頭痛、不安感、神経質、断続的なめまい、感覚異常、動悸、頻脈、吐き気、便秘、下痢、関節痛、筋肉痛、手足の冷え、体重増加、尿失禁、膣乾燥および骨盤筋の緊張の低下が挙げられる。特定の実施形態において、該方法は、のぼせの治療を含む。
【0035】
治療という用語およびその文法上の変化形は、具体的な症状の頻度または重症度の低減を包含する。症状の頻度は、当該技術分野で認められた様式で、例えば、1種類以上の自動バイオメトリック法(血圧、脈拍数、呼吸数、呼吸容量、心電図、皮膚の抵抗力、脳波などの測定)または被検体に対して質問票に症状の頻度の記録を求めることなどによって判定され得る。また、症状の重症度も、前述のバイオメトリック法または質問票の1つ以上によって判定され得る。したがって、症状の頻度および重症度の測定は、主観的、客観的またはその両方であり得る。
【0036】
したがって、閉経期症状が治療されるのに充分な本発明の組成物の量は、閉経期症状の頻度の低減、症状の重症度の改善またはその両方に充分なハーブ混合物、ハーブ混合物のエキス、またはハーブエキスの混合物の量である。一般的に、症状の治療に必要とされる量は、被検体の年齢、体重、一般健康状態、遺伝子構造、感情面の状態、および他の要素に依存する。選択された有効量は、エストロゲンホルモン補充療法よりも有効性が高い場合もあり、低い場合もあり得る。したがって、本発明の組成物の日用量に適した量は、約0.01〜100グラムの本発明のハーブ混合物/キログラム被検体体重、より詳細には約0.05〜約50グラム/キログラム被検体体重に相当する量である。本発明によるエキスに関しては、日用量は、約1〜10,000mgの乾燥エキス/kg体重、より詳細には約2〜約5,000mg/kgの範囲である。本発明の組成物は安全であり、特に、乳癌のリスクの増大などのエストロゲン補充に関連する問題が引き起こされるリスクの低下を提示するものであると考えられるが、それでもなお、閉経期症状が低減され得る最小用量を使用するべきであることは、当業者には認識されよう。また、同様に、当業者は、所望の症状の緩和効果を得るのに必要な用量を明記した範囲内で滴定することができ、また、該範囲から上方または下方への偏差は、本発明の範囲内に許容され得ることが同様に認識されよう。
【0037】
エストロゲンは乳癌を引き起こすという納得のいく証拠にもかかわらず、観察研究では、逆説的に、アジア諸国の女性は、大量の植物性エストロゲン(フィトエストロゲン)を摂取しているにもかかわらず、乳癌の発生率が最も低いことが示されている。同様に、アジア人女性が訴える、閉経期の症状は最小限であり、卵巣機能の停止時期におけるのぼせの経験は、はるかに少ない傾向にある。このような所見により、米国の多くの閉経期女性は、乳癌発生のリスクが増大することなく、のぼせが軽減されることを期待して、大豆またはエストロゲンの代替薬としてのハーブ療法剤中に存在するフィトエストロゲンを進んで摂取するようになった。種々のエストロゲン様化合物は、乳房細胞に対して反対の効果を発揮することがあり得る。エストラジオール(E2)などのエストロゲンは乳癌を促進させるが、フィトエストロゲンは、アジアで観察されているような乳癌の低発生率の一因であり得る。この理論を裏付ける臨床データおよび観察データは相当あるが(Kurtzer M.Phytoestrogen supplement use by women.J.Nutr.2003、133:1983S−1986S)、これまでに、フィトエストロゲンが乳癌のリスクを低減させることが記録された無作為対照比較試験はない。
【実施例】
【0038】
本発明の種々の態様および利点を実証するため、以下の例示的な実施例を示した。該実施例により、本発明の特定の実施形態を説明するが、本発明の完全な範囲がこれらの実施例に限定されないことは、当業者には認識されよう。
【0039】
調製例1−MF101(IND 58,267)
【0040】
本発明の特定の実施形態において、エキスをMF101と表示し、これを以下の表5に示す。
【表5】

【0041】
次いで、乾燥エキスを、エキス溶液1リットルあたり固形エキス53megの濃度まで希釈する。この溶液を、以下の実施例1〜10を通して使用する。
【実施例1】
【0042】
実施例1−MF101のERβ特異的インビトロERE活性化
U2OS骨肉種細胞を、最小限のチミジンキナーゼ(tk)プロモータ(ERE−tk−Luc)の上流の古典的EREおよびヒトERαまたはERβの発現ベクターでコトランスフェクトした。MF101では、ERβによる用量依存的なERE−tk−Luc活性化がもたらされたが、ERαによる活性化は観察されなかった(図1A)。ERβでは、0.1μl/mlのMF101で2.5倍のERE−tk−Luc活性化がもたらされ、2.5μl/mlのMF101で20倍の最大活性化がもたらされた。MF101(2.5μl/ml)による最大活性化は、10nMのエストラジオール(E2)で観察されたものに相当した。MF101によるERE−tk−Luc活性化は、ICI、ラロキシフェンおよびタモキシフェンによってブロックされ(図1B)、これは、MF101の効果がERβによって直接媒介されることを示す。また、ERサブタイプの選択性を、EREを含む内在性ケラチン19遺伝子において調べた(Choi,I、Gudas,L.J.&Katzenellenbogen,B.S.、「Regulation of keratin 19 gene expression by estrogen in himan breast cancer and identification of the estrogen responsive gene region」、 Mol.Cell Endocrinol.164、225−37.(2000))。以前に、E2が、テトラサイクリン(tetracycyline)誘導性ERαまたはERβ細胞で安定的にトランスフェクトしたU2OS細胞においてケラチン19mRNAの用量依存的な刺激をもたらすことが示されていた(Kian Tee,M.ら、「Estradiol and Selective Estrogen Receptor Modulators Differentially Regulate Target Genes with Estrogen Receptors {alpha} and {beta}」、Mol.Biol.Cell 15、1262−1272(2004))。対照的に、MF101は、U2OS−ERβ細胞においてケラチン19mRNAを増加させる(図1C)が、U2OS−ERα細胞においては増加させなかった(図1D)。この結果は、MF101が、異種プロモータに連結させたEREまたは内在性遺伝子内に存在するEREにおいて、ERβ媒介性転写経路を選択的に誘発することを示す。
【実施例2】
【0043】
実施例2−インビトロエストロゲン受容体結合
以前に、大豆にみられるフィトエストロゲン(ゲニステインなど)は、ERβに対して、ERαと比べて7〜30倍高い親和性で結合することが示された(Barkhem,T.らDifferential response of estrogen receptor alpha and estrogen receptor beta to partial estrogen agonists/antagonists.Mol Pharmacol.54、105−12(1998)、Kuiper,G.G.らInteraction of estrogenic chemicals and phytoestrogens with estrogen receptor beta.Endocrinology 139、4252−63(1998))。図1A〜図1Dのデータは、MF101が、ERβに対してより良好に結合することにより、ERβ選択的様式で作用し得ることを示す。MF101が精製ERαおよびERβに対する結合に対してE2と競合する能力を、インビトロ結合アッセイにおいて試験した。競合結合曲線は、MF101がERβとERαに等しく結合することを示す(図2A)。この実験は、MF101のERβ選択性がERβに対する優先的結合によるものでないことを示す。別の可能性は、MF101のERβ選択性が、標的遺伝子内のEREへのMF101−ERβ複合体の選択的結合に起因しているということである。この可能性を調べるため、U2OS−ERβ細胞およびU2OS−ERα細胞において、ケラチン19遺伝子を用いてクロマチン免疫沈降(ChIP)アッセイを行った。以前に、E2処理によって、U2OS−ERα細胞およびU2OS−ERβ細胞において、それぞれERαおよびERβの漸増がもたらされることが報告された(Kian Tee,M.ら、「Estradiol and Selective Estrogen Receptor Modulators Differentially Regulate Target Genes with Estrogen Receptors {alpha} and {beta}」、Mol.Biol.Cell 15、1262−1272(2004))。対照的に、ChIPは、MF101は、ケラチン19EREにERβを漸増させたが、ERαは漸増させなかったことを示す(図2B)。したがって、ERαに対するMF101の結合は、EREへの結合が可能になるコンホメーションはもたらされない。
【実施例3】
【0044】
実施例3−MF101によるエラスターゼ阻害
ERαおよびERβのコンホメーションに対するMF101の効果をさらに調べるため、エラスターゼでの限定的タンパク質分解を行い、MF101が、E2と比べて異なるプロテアーゼ消化パターンかどうかを調べた。エラスターゼでの消化後、ERαでは、E2とMF101で相違する保護パターンが得られる(図2C)。ERαがE2と結合している場合に、ERαの最も強い保護が観察される。2つの矢印は、最も高いエラスターゼ濃度であっても、いくつかの保護断片が存在することを示す。リガンドの非存在下では(エタノール対照)、ERα保護の明白な減損がみられる。MF101と結合している場合、ERαは、対照と比べてエラスターゼに対する保護のわずかな増大を示すが、E2に結合しているERαと比べると、それほど大きな保護は生じなかった(図2D)。対照的に、ERβでのプロテアーゼ保護の結果、ERαと比べて、完全に異なるパターンの保護断片が得られる。MF101では、エタノールおよびE2と比べて相違するパターンが得られた(E2およびエタノール対照の保護断片を示す5つの矢印と、MF101試料の保護断片を示す4つの矢印を比較)。これは、MF101に結合すると、ERβは、E2と結合している場合またはホルモンなしの場合とは異なる全体コンホメーションになることを示す。ERβは、MF101と結合している場合には異なるコンホメーションを有するため、ERβの別の表面が露出し、場合によっては、補助調節タンパク質に利用可能となる。ERのコンホメーションの変化によって相違する類型のタンパク質(p160コアクチベータなど)の漸増がもたらされることがわかっているため、MF101によって、ERαおよびERβへの補助調節タンパク質の識別的漸増がもたらされるかどうかを調べた(Shang,Y.、Hu,X.、DiRenzo,J.、Lazar,M.A.&Brown、M.Cofactor dynamics and sufficiency in estrogen receptor−regulated transcription.Cell 103、843−52.(2000)、Metivier,R.らEstrogen receptor−alpha directs ordered,cyclical,and combinatorial recruitment of cofactors on a natural target promoter.Cell 115、751−63(2003)、Smith,CL.&O’Malley,B.W.、「Coregulator function:a key to understanding tissue specificity of selective receptor modulators」、Endocr.Rev.25、45−71(2004))。
【0045】
MF101が補助調節因子を内在性遺伝子に選択的に漸増させるかどうかを調べるため、U2OS−ERα細胞およびU2OS−ERβ細胞において、ケラチン19遺伝子に対してChIPアッセイを行った。MF101は、U2OS−ERβ細胞では、ケラチン19遺伝子に対してGRIP1およびCBPの漸増を誘導したが、U2OS−ERα細胞では誘導しなかった(図2B)。また、MF101は、ERβにRNAポリメラーゼIIを選択的に漸増させたが、これは、MF101がU2OS−ERβ細胞でのみケラチン19遺伝子を活性化させたという所見と整合する。この結果は、MF101のERβ選択性がEREに対する識別的結合および標的遺伝子に対する補助調節タンパク質の漸増に起因していることを示す。
【実施例4】
【0046】
実施例4−MF101はインビトロでMCF−7乳癌細胞増殖を刺激しない
のぼせのための代替エストロゲンの重要な特徴は、乳癌を促進させないことである。MF101の増殖促進特性を、ERαのみを発現するMCF−7乳癌細胞において試験した(図3A)。MCF−7細胞をMF101で7日間処理し、細胞増殖を3H−チミジン取り込みによって測定した。E2とは異なり、MF101はMCF−7細胞の細胞増殖を刺激しなかった。また、MF101は、E2によって活性化され、細胞増殖および乳癌を促進させる主要な遺伝子であるc−myc遺伝子およびサイクリンD1遺伝子も刺激しなかった(図3B)。このデータは、MF101がERβ選択的であるというさらなる証拠を示し、ERαがMCF−7細胞においてE2の増殖性効果を媒介することを示す前述の試験と整合する(Paruthiyil,S.ら、「Estrogen receptor beta inhibits human breast cancer cell proliferation and tumor formation by causing a G2 cell cycle arrest」、Cancer Res.64、423−8(2004)、An,J.、Tzagarakis−Foster,C、Scharschmidt,T.C、Lomri,N.&Leitman,D.C、「Estrogen receptor beta−selective transcriptional activity and recruitment of coregulator by phytoestrogen」、J.Biol.Chem.276、17808−14.(2001))。
【0047】
同様の実験において、乳癌細胞に対するMF101の効果をジエチルスチルベルトロール(DES)のものと比較した。図3D〜図3Fは、対照処理(図3D)およびMF101処理(図3F)癌細胞と比較した場合の乳癌に対するDESの増殖刺激効果を示す。図3Gおよび図3Hは、乳癌移植片の質量(図3G)および子宮角の質量(図3H)に対する対照、DESおよびMF101の効果を示す。この結果は、合成エストロゲンDESとは異なり、MF101は、癌細胞または正常子宮細胞のいずれの増殖も刺激しないことを示す。
【実施例5】
【0048】
実施例5−遺伝子発現マイクロアレイ
以下に概要を示す試験に基づき、本発明者らは、エストロゲンは、ERαと相互作用することにより乳癌を促進させるが、MF101に見られるフィトエストロゲンは、増殖促進遺伝子を抑制し、かつ乳房細胞のERα媒介性増殖を抑止するERβと選択的に相互作用することにより、乳癌およびのぼせなどの閉経期症状を抑制し得るのではないかという仮説を立てた。ERβ受容体は、脳や骨などの非生殖組織内により多く存在し、どのようにしてフィトエストロゲンが、血管運動症状を引き起こす中枢神経系効果を低減させ、骨量の維持を補助し得るかに役割を果たしている可能性がある。
【0049】
エストロゲン様化合物は、その臨床効果を、ステロイド受容体スーパーファミリーの構成員である2種類の相違するエストロゲン受容体と相互作用することにより誘起させる。(Evans RM.The steroid and thyroid hormone receptor superfamily、Science 1988、240:889−895、Mangelsdorf DJ、Thummel C、Beato Mら、The nuclear receptor superfamily:the second decade.Cell、83:835−839)。ERαは595アミノ酸のタンパク質であり、ERβと称される第2のERα(530アミノ酸)は10年後に確認された(Mosselman S、Polman J、Dijkema R.ER beta:identification and characterization of a novel human estrogen receptor.FEBS Lett.1996、392:49−53)。この2つの受容体の機能上の違いは、ごく最近になって研究された。ERαとERβの全体的な構造は、A/Bドメイン以外は非常に類似しており、該ドメインは、相同性が25%しか示されず、トランス作用性領域の1つを含む。DNA結合ドメインは事実上同一である(98%相同性)が、リガンド結合ドメイン(また、これは、第2のトランス作用性ドメインを含む)では、アミノ酸の55%しか保存されていない(Enmark E、Pelto−Huikko M、Grandien KらHuman estrogen receptor beta−gene structure,chromosomal localization,and expression pattern.J Clin.Endocrinol.Metab.1997、82:4258−4265)。他の試験では、組織分布、生理学的効果および転写活性がかなり異なっていることが明白に示されている。ERβの方が偏在性であり、生殖組織(卵巣および精巣など)に加えて、多くの非生殖組織(骨、脳、尿路、脈管系および前立腺など)でも発現される。ERαは、主に、子宮、肝臓、乳房および腎臓で発現される。ERαとERβの生理学的役割は異なることが、ERαまたはERβノックアウトマウスで明白に示された。ERαノックアウトマウスは、始原的な乳腺および子宮などの大きな欠陥を示し、不妊である(Hewitt SC、Korach KS.、「Oestrogen receptor knockout mice:roles for oestrogen receptors alpha and beta in reproductive tissues」、Reproduction 2003、125:143−149)。対照的に、ERβノックアウトマウスで観察された効果は、より微妙であり、低生殖能力で、同腹子の大きさが小さい、雌の皮質骨の肥厚および前立腺肥大が挙げられる。
【0050】
フィトエストロゲンは、これまでに、ステロイドホルモン受容体の結合によってエストロゲン様効果を発揮することがわかっており(Tamaya T、Sato S、Okada HH、「Possible mechanism of steroid action of the plant herb extracts glycyrrhizin,glycyrrhetinic acid,and paeoniflorin:inhibition by plant herb extracts of steroid protein binding in the rabbit」、Am.J.Obstet.Gynecol.、1986、155:1134−1139)、ごく最近、ERβに対してERαと比べて有意に高い親和性を有することがわかった(Barkhem T、Carlsson B、Nilsson Yら、「Differential response of estrogen receptor alpha and estrogen receptor beta to partial estrogen agonists/antagonists」、Mol.Pharmacol.、1998、54:105−112)。最初の実験において、イソフラボンのゲニステインは、ERβに対する強力な転写アゴニストであるが、ERαに対しては弱いアゴニストでしかないことが示された(An J、Tzagarakis−Foster C、Scharschmidt TCら、「Estrogen receptor beta−selective trtanscriptional activity and recruitment of coregulators by phytoestrogens」、J.Biol.Chem.2001、276:17808−17814)。閉経期症状のためのERサブタイプ選択的天然化合物を同定するためには、ERαまたはERβが相違する生物学的効果を発揮することを示すことが必要であった。ERαとERβは異なる標的遺伝子を調節する。これは、テトラサイクリン誘導ベクターで安定的にトランスフェクトしたヒトU2OS骨肉種細胞を用いてERαまたはERβを発現させることにより示される。ウエスタンブロッティング、免疫組織化学試験および免疫沈降試験により、U2OS−ERα細胞ではERαのみが合成されること、およびU2OS−ERβ細胞ではERβが排他的に発現されることが確認された(Kian Tee M、Rogatsky I、Tzagarakis−Foster Cら、「Estradiol and selective estrogen receptor modulators differentially regulate target genes with estrogen receptors alpha and beta.」Mol.Biol.Cell 2004、15:1262−12672)。ドキシサイクリンで18時間処理してERαまたはERβの発現を誘導した後、3H−E2結合試験により、U2OS−ERα細胞株およびU2OS−ERβ細胞株には、それぞれ、細胞1つあたり69,000個および54,000個の受容体が含まれていた。ERαおよび/またはERβによって調節される遺伝子を同定するため、U2OS−ERα細胞株およびU2OS−ERβ細胞株を、10nMのE2の非存在下または存在下、ドキシサイクリンで18時間処理した。全RNAを使用し、12,600個の既知遺伝子を含むヒトU95Av2 AffymetrixマイクロアレイとのハイブリダイゼーションのためのcRNAを調製した。未処理群と各処理群の6組の比較発現データを使用し、ERα細胞またはERβ細胞において調節される遺伝子を調べた。U2OS−ERα細胞とU2OS−ERβ細胞の両方において、合計228個が、E2によって有意に(p<0.05)活性化または抑制された(表4)。E2は、65個の遺伝子をU2OS−ERα細胞のみにおいて、および125個の遺伝子をU2OS−ERβ細胞のみにおいて調節した。E2は、32個の遺伝子をU2OS−ERα細胞において、および38個の遺伝子をU2OS−ERβ細胞において抑制した。両方の細胞株でE2によって活性化された遺伝子は34個、抑制された遺伝子は4個だけであった。この所見は、E2では、ERαとERβの両方によって調節される遺伝子は228個のうち38個(17%)だけであることを示す。E2と同様、U2OS−ERα細胞においてラロキシフェンまたはタモキシフェンによって調節される遺伝子は、U2OS−ERβ細胞において調節されるものとは相違した。驚くべきことに、タモキシフェンによって調節される遺伝子のうち、ラロキシフェンによっても調節されるのは、どちらも選択的エストロゲン受容体モジュレータ(SERM)に分類されるにもかかわらず、わずか27%である。この結果を、以下の表6にまとめる。
【表6】

【0051】
U2OS−ERα細胞株およびU2OS−ERβ細胞株におけるE2およびSERMによる識別的遺伝子調節
ドキシサイクリン誘導型U2OS−ERα細胞およびU2OS−ERβ細胞を、10nMのE2、1μMのラロキシフェンまたは1μMのタモキシフェンで18時間処理した。未処理試料とリガンド処理試料のヒトAffymetrix U95Av2遺伝子チップから得られたマイクロアレイデータを、Affymetrix Microarray Suite Version 5.0を用いて解析した。少なくとも3回の実験で対照と比べて統計学的に有意な(p<0.05)増大または減少であるシグナル変化を示す候補遺伝子を、±0.8シグナルlog比平均カットオフによってさらに選択した。ERα細胞株、ERβ細胞株およびERα+ERβ両方の細胞株における活性化された遺伝子の数、抑制された遺伝子の数およびその相対割合(括弧内)を示す。アスタリスク(*)は、ERβ細胞と比べて反対の発現パターンが示されたERα細胞においてSERMによって調節される共通遺伝子の数を示す。α−抗トリプシン、ケラチン19(K19)、WISP−2、Mda−7、NKG2CおよびNKG2Eに関するリアルタイムRT−PCRを、10nMのE2、1μMのラロキシフェンまたは1μMのタモキシフェンのいずれかで18時間処理したU2OS−ERα試料およびU2OS−ERβ試料において行った。U2OS−ERα試料およびU2OS−ERβ試料における変化倍数(括弧内)は、未処理試料に相対して計算した。
【0052】
ERαおよびERβが相違する遺伝子を調節するという観察結果は、ERαとERβが乳癌の発生において異なる役割を有し得ることを示す。乳癌におけるERαの役割を調べるため、ERαのみを発現するMCF−7細胞において、細胞増殖に対するE2の効果を試験した。E2は、ERα−MCF−7細胞において細胞数の用量依存的な増加をもたらした(An,上掲,2001)。該細胞はERβを発現しないため、この試験により、増殖性効果はERαによって媒介されることが示された。乳癌細胞の増殖に対するERβの役割を調べるため、アデノウイルス(Ad)を使用し、ERβを高割合の細胞内に送達した。MCF−7細胞を、Ad−ERβまたは該ウイルスの潜在的な非特異的効果を制御するためにAd−LacZに24時間感染させた。感染細胞をE2の非存在下または存在下で10日間培養した後、DNA合成を、インビトロでの[3H]チミジン取込みによって測定した。ERβの発現により、E2の非存在下では、50MOIのAd−LacZに感染させた細胞比較すると、MCF−7細胞の細胞増殖の50%低減がもたらされた(図5)。Ad−ERβ感染細胞では、E2により細胞増殖の抑止が70%まで増大された。感染多重度(MOI)100のAd−ERβの使用でも同様の結果が観察された。ERβによる細胞増殖の抑止は主にリガンド非依存性であるという観察結果は、ストリッピング処理された血清中の残留E2、またはERβに感染した細胞内に保持された残留E2、あるいはERβの非リガンド特性に起因している可能性がある。
【0053】
また、腫瘍形成に対するERβの発現の効果を、マウス異種移植片モデルにおいて調べた(図6)。アデノウイルスに感染させたLacZ、ERαまたはERβを発現するMCF−7細胞を最初に凝集させ、次いで、重合コラーゲンゲル中に再懸濁させ、皮下エストラジオールペレットを埋入した雌ヌードマウスの腎臓嚢下に移植した。細胞を移植してから1ヶ月後、非感染MCF−7細胞およびAd−LacZまたはAd−ERβに感染させた細胞から、同等のサイズの腫瘍が発生した。Ad−ERβに感染させたMCF−7細胞からは、有意な腫瘍は発生しなかった(右下)。Ki67増殖指数により、非感染MCF−7細胞およびAd−LacZまたはAd−ERαに感染させた細胞のほぼ70%はKi67について染色されたのに対し、Ad−ERβに感染させた細胞では5%であることがわかった(データ示さず)。
【0054】
この試験は、MCF−7細胞へのAd−ERβの導入によってマウス異種移植片内での腫瘍形成が抑制されるが、Ad−ERαの導入では抑制されないことを示す。イムノブロットにより、感染細胞において同等レベルのERα発現およびERβ発現が検出され(データ示さず)、この結果が、ERβによる補因子または転写因子の過剰発現および非特異的抑圧(squelching)のためではないようである。さらに、この抑圧が、ERβが腫瘍形成を抑制する機構である場合、Ad−ERαに感染させた細胞でも同様の結果が観察されたはずである。
【実施例6】
【0055】
実施例6−MF101はエストロゲン受容体α(ERα)と機能的に相互作用しない
MF101が、乳房および子宮の細胞に対して不要な増殖性効果を発揮することがあり得、それにより潜在的に乳癌および子宮癌のリスクを増大させるERαのアゴニストであるかどうかを調べるため、ERαをER陰性U2OS骨肉種細胞内に一過的にトランスフェクトした。該細胞内に、エストロゲン応答エレメント−チミジンキナーゼ(tk)−ルシフェラーゼ(ERE−tk−Luc)構築物も一過的にコトランスフェクトした。次いで、MF101またはエストラジオールを生理学的濃度で添加し、細胞を18時間インキュベートし、その時点でルシフェラーゼ活性を測定した。図7に見られるように、MF101はERαを活性化しない。しかしながら、エストラジオールはERαを活性化し、このトランス活性能は、純粋なエストロゲンアンタゴニストICI 182,780(ICI)によって阻害され得る。
【実施例7】
【0056】
実施例7−MF101はエストロゲン受容体β(ERβ)選択的転写活性化をもたらす
MF101のERβ媒介性効果を試験するため、ERβをU2OS骨肉種細胞内に一過的にトランスフェクトした。ERE−tk−Luc構築物も一過的にコトランスフェクトした。次いで、MF101またはエストラジオールを生理学的濃度で18時間添加し、ルシフェラーゼ活性を測定した。図8に示されるように、MF101はERβを活性化する。MF101とエストラジオールはともにERβを活性化し、この活性は、ICI 182,780によってブロックされる。結果は、エストラジオールがERαとERβのどちらとも普遍的に相互作用するが、MF101は、ERβのみと選択的に相互作用することを示す。
【実施例8】
【0057】
実施例8−MF101は乳癌細胞に対して抗増殖活性を示す
次の組の検査試験の目的は、インビトロでの乳癌細胞に対するMF101の増殖効果を解明することであった。図9は、Cy−Quant Molecular Deviseシステムを使用し、MF101がER陽性乳癌細胞に対して抗増殖活性を示すことを示す。MCF7細胞は内在性ERαを発現するが、SKBR3細胞はER陰性である。MF101は、ER陽性細胞に対しての方が大きな阻害を示す。これは、抗増殖効果がER非依存性であり、増殖刺激の徴候がないことを示す。
【実施例9】
【0058】
実施例9−MF101は骨細胞をTNFβの活性から保護し、骨粗鬆症を予防し得る
骨内では、エストロゲンは、腫瘍壊死因子β(TNFβ)などの特定のエストロゲン抑制性遺伝子を抑制し、それにより、その骨鉱化保護効果を媒介すると考えられている。骨細胞に対するMF101の潜在的効果を観察するため、ERβ(骨内での存在度が高い方のER)をU2OS骨肉種細胞内に一過的にトランスフェクトした。該細胞内に、TNFβ−tk−応答エレメント−ルシフェラーゼ構築物(TNF−RE−tk−Luc)も一過的にコトランスフェクトし、MF101またはエストラジオールを添加し、18時間後にルシフェラーゼ活性を測定した。MF101とエストラジオールはどちらも腫瘍TNFβを阻害し、該阻害はICI 182,780(ICI)によってブロックされた。図10に示したデータは、エストラジオールとMF101がどちらも閉経後女性の骨量の維持に有効であり得ることを示す。
【実施例10】
【0059】
実施例10−MF101の個々のハーブ成分のER選択性
個々のハーブのいくつかの(several of several of)ERαおよびERβの転写活性もまた評価した。本発明の目的の一つは、伝統的な中国医学アプローチを維持しながら、MF101配合物全体を試験することであるため、検査試験は、配合物全体に焦点をあてたものとした。しかしながら、一過的トランスフェクションアッセイにおいてスクリーニングした67種類のハーブのうち、ERE−tk−LucまたはTNF−RE−tk−Lucレポータを有する33種類が活性を示し、8種類がERα選択性を示したが、4種類はERβ選択性を有した。
【実施例11】
【0060】
実施例11−MF101のフェーズI臨床試験終了後の実効可能性および毒性データ
フェーズIの治験をカリフォルニア州サンフランシスコ大学において実施し、閉経期と関連しているのぼせおよび他の症状を軽減するためのMF101の安全性と実効可能性を評価した。この試験は、少なくとも56回ののぼせが報告された年齢が50歳から65歳の31名の健常な閉経後女性での7日間の対照なしの非盲検治験であった。参加者を5グラムの顆粒状のMF101で治療した(温水と混合した粉末剤として、経口摂取、1日2回で30日間)。主要転帰の測定は安全性とし、副次的転帰には、のぼせの頻度の変化ならびに血清エストラジオール、膣成熟および骨再吸収マーカーに対する効果を含めた。試験は、30日間の導入(run−in)期間の後、30日間の試験薬物での治療期間を含むものとした。表7に、解析に含めた試験参加者の数、除外した人数および除外理由をまとめる。
【表7】

【0061】
平均すると、この治験を終了した試験参加者は、30日間の治療期間で、処方されたMF101用量の87.8%を摂取した。毒性データが入手可能な25名の参加者についてNCIの一般毒性基準により測定時、等級IIIまたはIVの有害事象は報告されなかった。試験参加者によって治験担当医に報告された有害事象は合計9例であり、場合によってはまたはおそらくMF101に関連していると分類された。NCIの一般毒性基準に従い、この有害事象のうち5例は等級Iに分類され、4例は等級IIの有害事象と記録された。報告された最も一般的な毒性は、わずかな吐き気または胃の膨満感であった(25名中4名の女性)。他の5例の有害事象は、以下の理由、すなわち頭痛、嗜眠、鬱、気分の変動および血圧の上昇によるものであった。試験参加者はいずれも、報告されたいずれの副作用にも治療を必要とせず、入院もみられなかった。
【0062】
ベースラインおよび試験終了時に血液および尿検査試験を受けた22名の参加者全員を、毒性の解析に含めた。全血球算定、化学検査、肝臓パネル、または血清中もしくは尿中のエストロゲンもしくはゴナドトロピンレベルに関するいずれの検査値にも統計学的に有意な変化は認められなかった。
【0063】
この試験は、主要エンドポイントとして有効性を測定するために設計されたものではなかったが、30日間の治療後、のぼせの頻度および重症度に統計学的に有意な低減が認められた。のぼせの平均頻度は、ベースライン時では57.3回/7日間であり、治療後では44.9回であった(p=0.003)。のぼせスコア(頻度に重症度を乗算)は、ベースライン時での98.0から治療後では81.7に減少した(p=0.03)。試験を終了した22名の女性のうち、18名(82%)は、30日間の試験薬物治療後、のぼせが少なくなったが、4名(18%)だけは多くなった。ベースライン時に測定された7日間に起こったのぼせの頻度は、試験薬物治療の最後の7日間と比較すると、22%の減少がみられた(p=0.0035)。また、30日間の治療後、のぼせスコア(頻度に重症度を乗算)でも17%の減少がみられた(p=0.031)。
【0064】
まとめると、予備臨床試験データは、MF101がのぼせの治療に対して安全であり、良好なコンプライアンスで実効可能に投与され得ることを示す。MF101は、のぼせの頻度および重症度を低減させた。しかしながら、その効果は小さかった。この試験の結果を表7Aに示す。この表は、22名のうち7名の患者が40%より高い閉経期症状の低減を示したことを示す。
【表7A】

【実施例12】
【0065】
実施例12−漸増用量試験
実施例11に示したものよりも期間が長く、高用量のMF101との比較を含めた、フェーズII試験のための二重盲検プラセボ対照比較無作為臨床試験を実施する。MF101の用量は、MF101の乾燥重量で5グラムを1日2回、およびMF101の乾燥重量で10グラムを1日2回とする。試験薬物治療は、ハーブティーの苦味に起因し得る胃腸の病訴の数の低減を意図して、および液状エキスの味のまずさによる試験の中止を最小限にするため、カプセル形態内に封入する。
【0066】
結論
ERαは乳癌細胞増殖を促進するが、ERβは増殖および腫瘍形成を抑止するという観察結果に基づき、ERβ選択的エストロゲンは、乳癌を促進させないはずであり、のぼせを抑制する可能性がある。本明細書における結果は、MF101が、遺伝子の転写をERβによって、補助調節タンパク質を選択的に漸増させることにより調節することを示す。ホルモン療法におけるエストロゲンとは異なり、MF101は、MCF−7細胞の増殖を刺激せず、増殖性遺伝子、c−mycおよびサイクリンD1も活性化させず、これは、MF101が乳癌を促進させないことを示す。上記の実施例11に概要を示した試験では、MF101がなんら有害効果を誘発せず、治験を終了した22名の女性のうち7名において、40%より高いのぼせの低減をもたらした。この結果は、MF101がERβ選択的エストロゲンを含むことを示し、MF101が、のぼせを抑制するためにホルモン療法で使用されている非選択的エストロゲンの、より安全な代替薬であることと整合する。
【0067】
多くの女性は、HTは有益性よりもリスクが勝ることが示された女性の健康イニシアチブの治験の結果以来、閉経期症状のためのHTに使用される安全で有効なエストロゲン代替薬を心待ちにしている。その一方で、最近の調査により、閉経周辺期および閉経後の女性の79%が、植物性の食品サプリメント(BDS)を使用していることが報告された。BDSが広く使用されているにも関わらず、植物性物質の作用機序、有効性および安全性は、厳密には調べられていなかった。MF101は、のぼせや他の更年期症状を軽減するための伝統的な漢方薬(Traditional Chinese Medicine)(TCM)に従来より使用されされている22種類の個々のハーブを含む配合物である。本明細書における結果は、MF101が、選択的エストロゲン受容体活性を有し、のぼせを抑制するために臨床的に使用され得ることを示す。
【0068】
MF101がERβ選択的であるという所見は、女性ののぼせの治療におけるERβ役割を調べるための、またとない機会を提供する。上記に論考したように、MF101の単群の前向きフェーズ1臨床試験を、年齢が40〜60歳であり、1日に≧7回の中等度から重度ののぼせ、または1週間に≧50回の中等度から重度のののぼせを訴える、外科的に誘導された、または自然な閉経後の健常な女性において行った。この治験の最初の30日間(導入期間)に、のぼせの頻度および重症度の毎日の一日の記録を含むベースライン転帰の測定、ならびに血液検査値、血液化学、肝機能、腎機能およびホルモンの状態の検査測定値を取得した。導入期間後、女性を、1日2回で30日間、5gmの経口MF101エキス(水で再構成)で治療した。治療期間の終了時、同じ転帰の測定を繰り返した。22名の女性がこの治験を終了した。のぼせの頻度と重症度の両方において、統計学的に有意な低減がみられた。のぼせの平均頻度は、1週間あたりののぼせが、ベースライン時での57.3から治療後では44.9に減少した(p=0.003、対応のあるt検定)(データ示さず)。また、のぼせスコア(頻度に重症度を乗算)も、ベースライン時では98.0から、治療後では81.7に減少した(p=0.031、対応のあるt検定)。7名の女性は、40%より高い(greater then)のぼせの低減を報告した(表1)。このデータは、MF101が、中等度から重度の症状を有する一部の女性において、のぼせの頻度および重症度を低減させることを示す。
【0069】
前述の実施例は、MF101が、ERβ媒介性転写経路のみを誘発することを示す。驚くべきことに、MF101は、精製ERαと精製ERβに等しく結合する。この観察結果は、精製ERとのリガンド結合活性についてのみ化合物をスクリーニングすることは、ERサブタイプ特異的化合物の有効な新薬発見ストラテジーとはなり得ないことを示す。MF101のERβ選択性は、ERβがEREに結合することを可能にし、補助調節因子(GRIP1およびCBPなど)が漸増するコンホメーションを構成する自身の能力に起因していることが示された。MF101によるERβへのコアクチベータの選択的な漸増は、ERαがMCF−7乳癌細胞の細胞増殖と腫瘍形成を媒介するのに対して、ERβはER陽性乳癌細胞において腫瘍抑制因子としての機能を果たすため、臨床的に重要である(Paruthiyil,S.ら、「Estrogen receptor β inhibits human breast cancer cell proliferation and tumor formation by causing a G2 cell cycle arrest」、Cancer Res.64,423−8(2004)、Strom,A.ら、「Estrogen receptor β inhibits 17beta−estradiol−stimulated proliferation of the breast cancer cell line T47D」、Proc.Natl.Acad.Sci.USA 101,1566−71(2004))。ERαへのコアクチベータの漸増の欠如は、MF101がc−mycおよびサイクリンD1の転写を活性化せず、MCF−7細胞の増殖も刺激しなかったという観察結果の説明となり得る。
【実施例13】
【0070】
調製例13−多種類の活性物質のハイスループットLC−MS/MS定量
調製例1に開示した22種類の乾燥ハーブ材料を粉砕し、メタノール/水(80/20)溶液で30分間抽出し(室温、500rpm)、次いで、5分間(4℃、13,000rpm)遠心分離した。上清みをタンパク質沈殿用バイアル(viald)に移した。12種類のポリフェノール系化合物(ニアソール、リクイリチン、リキリチゲニン、イソリキリチゲニン、カリコシン、四環系イソフラボン、エモジン、レイン、ルテオリン、7,4’−ジヒドロキシフラボン、スクテラリンおよびスクテラレイン)を、メタノール/水(80/20)溶液中にスパイクすることにより、検量物質を作製した。内部標準(2’,4’−ジヒドロキシカルコン)を含むメタノールを、標準物質、QCおよびハーブエキスに、タンパク質沈殿のために添加した。生物学的試料調製物は、抽出時間を短くしたこと(5分)以外は同様にして取り扱った。上清み(20μL)をオンライン抽出カラム上にインジェクトした。切り替え弁を作動させ、被検物質を分析用カラムにバックフラッシュさせた。被検物質を分離し、API5000 MS/MSシステムにてターボスプレーネガティブSRMモードで定量した。
【0071】
予備結果
ハイスループットで感度のよいLC−MS/MS法による、中国漢方薬および種々の生物学的マトリクス中の多種類の生体活性物質−ポリフェノール系化合物の同時定量を開発し、異なるマトリクス、すなわちヒト血漿、ヒト尿、イヌ血漿、ラット血漿、マウス血漿および種々の比率の水溶液/メタノール溶液において確認した。
【0072】
試料調製物および抽出手順は充分に最適化した。試料の振盪時間は、生物学的試料およびハーブエキスで、それぞれ5分および30分とした(500rpm、室温)。至適遠心分離時間は、すべての試料で、13,000rpmにて15分間(4℃)であった。内部標準を含む抽出溶媒として使用したものは100%メタノールであった。抽出時の絶対回収率は>85%であった。予備結果により、血漿(ヒト、ラット、イヌ、マウス)中での5回の凍結解凍サイクルでは、変化はないことが示された。生物学的試料中の活性物質はすべて、高温環境(室温、℃)で保存した場合、少なくとも2日間(これは、分析者が充分に解析手順を遂行できる時間である)安定であった。より低温(−20、−80℃)では、数ヶ月間安定である。抽出された活性物質は、自動試料採取装置(4℃)では、2日間にわたって安定である。被検物質シグナルによるイオン抑制干渉は検出されなかった。ブランク血漿またはメタノールでの試料の100倍までの希釈は、正確度に影響しなかった。
【0073】
この方法は高感度である。0.025〜100ng/mLの範囲の線形性は、種々のマトリクスの種々の活性物質に依存した。カラムの定量下限(LLOQ)は、ほとんどの活性物質(例えば、リキリチゲニン(liquitigenin)、カリコシン、イソリキリチゲニンおよびレイン)で0.5pgであった。リクイリチン、ルテオリンおよび7,4’−ジヒドロキシフラボンは、カラム上で1pgのLLOQレベルを有する。ニアソール、スクテラリンおよびスクテラレインは、10pgのLLOQを有する。このアッセイは、所定の許容基準をすべて満たし、大規模薬物動態試験に好適である。
【0074】
実験
試料の調製および機器
タンパク質沈殿/内部標準溶液(2’,4’−ジヒドロキシカルコン、100%MeOH中)は、ストック溶液(1mg/mL)から毎月、新たに調製し、使用のために4℃で保存した(室温に6時間より長く曝露すべきでなく、抽出から次の抽出までは4℃で保存しなければならない)。この溶液は、標準物質、QCおよび試料(生物学的試料またはハーブエキス)に、タンパク質沈殿のために添加した。試料を室温で解凍後、組織試料を0.1Mのリン酸バッファー中で均質化し、終濃度を250mg/mLとした。試料は、37℃で30分間(血漿)または2時間(組織)インキュベートする。タンパク質沈殿用試薬(600μL)を試料(300μL)に添加し、回転式振盪機にて2.5分間(組織の場合は30分間)、500RPMおよび室温で混合した。次いで、試料を13,000RPMで4℃にて15分間遠心分離した。乾燥ハーブ材料を磨砕して粉末にし、次いで、メタノール/水(80/20、v/v)で30分間室温にて、回転式振盪機において30分間抽出した。13種類のポリフェノール化合物(BNER1101、BNER1103、BNER1104、BNER1105、BNER1106、BNER1108、BNER1109、BNER1112、BNER1114、BNER1115、BNAC5501、BNAC5502およびBNAC5503)を、全試験マトリクス中にスパイクすることにより検量物質を作製した。次いで、上清み(20μL)を、API5000 MS/MSと組み合わせたAgilent 1200 2D−HPLCシステムにインジェクトした。使用した移動相は、MeOH(100%)および0.088%ギ酸含有水であった。線形勾配は、40%MeOHから開始し、4分間で100%MeOHまで傾斜させた。全泳動時間は8分間であった。カラム温度は65℃に設定した。イオンはネガティブSRMモードで記録した。以下のイオン輸送を主な活性物質についてモニタリングした。BNER1101:m/z=251→93、BNER1103:m/z=417→255、BNER1104:m/z=255→135または255→119、BNER1105:m/z=283→268、BNER1106:m/z=255→119、BNER1115:m/z=253→117およびIS:m/z=239→91。
【0075】
結果および結論
ハイスループットで感度のよいLC−MS/MS法を用いた、生物学的試料および漢方薬草エキス中の多種類の生体活性ポリフェノール化合物の同時定量を開発し、種々のマトリクス、すなわちヒト血漿、ヒト尿、イヌ血漿、ラット血漿、マウス血漿、ラット肝臓および種々の比率の水溶液/メタノール溶液において確認した。このアッセイは、ヒト血漿で充分に確認された。図1は、すべての活性物質および内部標準のLC−MS/MSクロマトグラムである。
【0076】
6種類の主な活性成分の抽出効率試験では、80%より高い回収率が示された(図14)。この方法はハイスループットで感度がよく、すべての活性物質に対して広い線形性を有した。検出限界(LOD)は、BNER1101、BNER1104、BNER1105およびBNER1106では0.025ng/mL、BNER1101では0.1ng/mL、およびBNER1115では0.25ng/mLであった。LODはすべて、3:1より大きい信号雑音比に基づいたものであった。定量下限(LLOQ)は、BNER1101(0.5ng/mL)、BNER1106(0.1ng/mL)およびBNER1115(0.5ng/mL)以外のすべての活性物質で0.05ng/mLであった。LLOQの信号雑音比は8より大きかった。この方法の検量曲線は、BNER1103、BNER1104およびBNER1105では0.05から50ng/mLまで線形であり、BNER1106では0.1から50ng/mLまで線形であり、BNER1115およびBNER1101では、0.5から50ng/mLまで線形であった(すべてn=6)。線形範囲は、0.995より大きいの回帰係数(r)によって判定した。6つの生物学的マトリクスの6種類の主な活性物質の典型的な標準曲線パラメータを図12および表8に示す。
【表8】

【0077】
1日のうちでの正確度は、±10%(91.8〜108.9%)よりも良好であり、1日のうちでの精密度は14%よりも良好であった。また、このアッセイを、いくつかの生物学的マトリクス(イヌ血漿、ラット血漿、マウス血漿、ヒト尿およびラット肝臓)ならびに種々の組み合わせのMeOH/水溶媒(80/20 MeOH/H2O、50/50 MeOH/H2Oおよび100%H2O)でも確認した。この確認は、異なる分析者が異なる機器(API5000およびAPI4000 QTrap)で行った。
【0078】
該6種類の被検物質と内部標準からなるストック溶液は、室温で少なくとも6時間安定である。機器のインジェクション再現性は高く、精密度は、95%インジェクションで6%よりも良好であった。3回の凍結解凍サイクル後、活性物質はすべて、すべての濃度レベルで分解は観察されなかった(図13)。ほとんどの被検物質は、5回のサイクル後も回収率はなお高かった。BNER1106を除き(これは、5回のサイクル後、回収率はほぼ75%であった)、94%より高い回収率が得られ得る。ヒト血漿中での6種類のMF101活性物質は安定であり、低濃度レベルおよび中濃度レベルのどちらの場合も、室温で保存時、24時間以内に有意な分解は観察されなかった。
【0079】
まとめると、BNER1101、BNER1103、BNER1104、BNER1105、BNER1106、BNER1115の定量のため、およびヒト、マウス、ラットおよびイヌ血漿、ならびにヒト尿、ラット肝臓および種々の組み合わせのMeOH/水における、所定の許容基準をすべて満たしたLC/LC−MS/MSアッセイの開発および確認。
【0080】
本発明の好ましい実施形態を本明細書において示し、記載したが、かかる実施形態は単なる一例として示したものであることは、当業者に自明であろう。本明細書において本発明を逸脱することなく、数多くの変形例、変更例および置換例が当業者に想起されよう。本発明の実施において、本明細書に記載の本発明の実施形態に対する種々の択一例が使用され得ることを理解されたい。以下の特許請求の範囲が本発明の範囲を規定し、この特許請求の範囲の範囲に含まれる方法および構造ならびにその均等物は特許請求の範囲に包含されるものとする。
【0081】
本発明の好ましい実施形態を本明細書において示し、記載したが、かかる実施形態は単なる一例として示したものであることは、当業者に自明であろう。本明細書において本発明を逸脱することなく、数多くの変形例、変更例および置換例が当業者に想起されよう。本発明の実施において、本明細書に記載の本発明の実施形態に対する種々の択一例が使用され得ることを理解されたい。以下の特許請求の範囲が本発明の範囲を規定し、この特許請求の範囲の範囲に含まれる方法および構造ならびにおよびその均等物は特許請求の範囲に包含されるものとする。
【図1】

【図2】

【図3】

【技術分野】
【0001】
本出願は、植物組成物由来の多種類の生体活性物質の定量方法、1種類以上の単離分離された活性物質を含む組成物を患者に投与することを含む、閉経期の治療方法に関する。
【0002】
(関連出願の相互参照)
本出願は、2008年6月5日に出願された米国特許仮出願第61/059,255号の恩典を主張し、引用によりその全体が本明細書に組み込まれる。
【背景技術】
【0003】
閉経期は、正常な排卵サイクルが停止して正常な月経が停止した後の期間である。閉経期には、卵巣がエストラジオール(E2)を生成しなくなるため、E2生成の減少を伴う。このE2生成の減少は、体内のホルモンバランスの変化をもたらし、多くの場合、閉経期と関連するさまざまな症状が起こる。
【0004】
閉経前または更年期としても知られる閉経周辺期は、正常な排卵サイクルが徐々に月経の停止へと移行する閉経期前の期間である。排卵サイクルが長くなり、より不規則となるため、E2レベルは、最初は増大することがあり得るが、最終的には低下し、閉経期が始まる。閉経期症状は、多くの場合、E2レベルの低下を伴う。
【0005】
閉経周辺期、閉経期および閉経後の症状としては、血管運動の不安定性に副次的なのぼせおよび発汗などの身体症状が挙げられる。また、更年期の開始には、疲労感、イライラ感、不眠、集中力の低下、鬱、記憶力の減退、頭痛、不安感および神経質などの心理的および感情的症状を伴うことがあり得る。さらなる症状としては、断続的なめまい、感覚異常、動悸および頻脈ならびに吐き気、便秘、下痢、関節痛、筋肉痛、手足の冷えおよび体重増加が挙げられ得る。また、生殖器官に対する変化、尿失禁、膣乾燥、骨盤筋の緊張の低下、心血管疾患および骨粗鬆症のリスクの増大が、閉経期の始まりとともに増大する。
【0006】
のぼせは、閉経周辺期、閉経期および閉経後の多くの女性に一般的に見られ、厄介である。数十年の間、エストロゲンによるホルモン補充療法は、のぼせの標準的な治療であったが、多くの女性は、有害効果、特に乳癌の可能性に関する懸念のため、ホルモン療法(HT)を諦めていた。いくつかの最近の研究、特に、女性の健康イニシアチブ(Women’s Health Initiative)(WHI)により、HTは乳癌のリスクを増大させることがわかった。選択的エストロゲン受容体モジュレータ(「SERM」)であるラロキシフェンおよびタモキシフェンはエストロゲン受容体(ER)陽性乳癌を抑制するという観察結果は、エストロゲンが乳癌を促進させるというさらなる証拠を提供する。
【0007】
したがって、閉経期、特にのぼせなどの閉経期症状の治療のための、乳癌のリスクを増大させない治療用組成物および方法の必要性が存在する。本発明は、この必要性を満たし、また、関連する利点をもたらすものである。
【発明の概要】
【発明が解決しようとする課題】
【0008】
したがって、本明細書に記載の実施形態は、Herba Scutellaria Barbata、Radix Sophora Subprostratae、Radix Anamarrhena、Semen Glycine Sojae、Radix Glycyrrhiza、Rhizoma Rhei、Fructus Tritici Levis、Radix Astragali、Radix Rehmania、Fructus Ligustri Lucidi、Semen Zyziphi Spinozae、Plumula Nelumbinis、Poria Cocos、Rhizoma Alismatis、Cortex Moutan Radicis、Fructus Corni、Radix Achyranthis、Concha Ostrea、Radix Aspargi、Radix Pueraria、Radix Atractylodis MacrocephalaおよびHerba Epimediaの混合物のエキスの活性物質の定量方法であって、(a)前記エキスからタンパク質を沈殿させ、上清みを単離することと、(b)該上清みを抽出媒体上にインジェクトし、溶出液を該抽出媒体から収集することと、(c)(b)の溶出液をMS/MS分離および定量に供し、それにより、前記活性物質の定量を得ることとを含む方法を提供する。一部の実施形態において、前記タンパク質沈殿(a)はタンパク質分離用バイアル内で行われる。一部の実施形態において、抽出媒体は抽出カラムである。一部の実施形態において、MS/MS分離および定量は、API5000 MS/MSシステムにおいてターボスプレーネガティブSRMモードで行われる。一部の実施形態において、活性物質は、(i)ERαおよび/またはERβの存在下でのERE−tk−Lucアッセイの活性化を特徴とする、(ii)および/または活性物質がERαおよび/またはERβの存在下でのTNF−RE−Lucアッセイの活性化を特徴とする。一部の実施形態において、このプロセスによって得られる分離された活性物質を記載する。一部の実施形態において、1種類以上の前記活性物質を含む、1つ以上の閉経期症状の治療のための医薬を提供する。一部の実施形態は、1つ以上のエストロゲン関連の病状または疾患状態の治療のための医薬の調製のための記載の方法の単離分離された活性物質の使用を提供する。一部の実施形態は、開示した方法の1つによって同定、単離および/または調製される1種類以上の単離分離された活性物質を含む組成物を患者に投与することを含む、閉経期の治療方法を提供する。
【課題を解決するための手段】
【0009】
エストロゲン媒介性の病状または疾患状態の治療方法は、患者に、開示した方法の一つを特徴とする1種類以上の単離分離された活性物質を含む組成物を投与することを含む。一部の実施形態において、前記治療は少なくとも1つの閉経期症状の重症度または頻度の低減を含む。一部の実施形態において、前記閉経期症状は、のぼせである。一部の実施形態において、閉経期症状は、疲労感、イライラ感、不眠、集中力の低下、鬱、記憶力の減退、頭痛、不安感、神経質、断続的なめまい、感覚異常、動悸、頻脈、吐き気、便秘、下痢、関節痛、筋肉痛、手足の冷え、体重増加、尿失禁、膣乾燥および骨盤筋の緊張の低下からなる群より選択される。一部の実施形態において、患者に投与される前記活性物質の量は、患者の体重1kgあたり約0.1〜10mgの前記1種類以上の組成物である。
【0010】
一部の実施形態において、生物学的試料から活性物質を単離し、前記活性物質を定量する方法であって、前記活性物質が、Herba Scutellaria Barbata、Radix Sophora Subprostratae、Radix Anamarrhena、Semen Glycine Sojae、Radix Glycyrrhiza、Rhizoma Rhei、Fructus Tritici Levis、Radix Astragali、Radix Rehmania、Fructus Ligustri Lucidi、Semen Zyziphi Spinozae、Plumula Nelumbinis、Poria Cocos、Rhizoma Alismatis、Cortex Moutan Radicis、Fructus Corni、Radix Achyranthis、Concha Ostrea、Radix Aspargi、Radix Pueraria、Radix Atractylodis MacrocephalaおよびHerba Epimediaの混合物のエキス由来のエストロゲン様化合物であり、(a)前記生物学的試料からタンパク質を沈殿させ、上清みを単離することと、(b)該上清みを抽出媒体上にインジェクトし、溶出液を該抽出媒体から収集することと、(c)(b)の溶出液をMS/MS分離および定量に供し、それにより、前記活性物質の定量を得ることとを含む方法を提供する。一部の実施形態において、生物学的試料は、血液、器官または尿試料などの哺乳動物組織試料である。一部の実施形態において、生物学的試料は血液試料(例えば、血漿試料)、尿試料、肝臓試料、乳房組織試料、卵巣組織試料、子宮組織試料、外陰部組織試料、膣組織試料、頚部組織試料、ファローピウス管組織試料、子宮内膜組織試料、リンパ節組織試料および/または骨組織試料である。一部の実施形態において、哺乳動物組織試料は、ヒト血漿試料、ヒト尿試料、イヌ血漿試料、マウス血漿試料またはラット肝臓試料である。一部の実施形態において、前記タンパク質沈殿(a)はタンパク質分離用バイアル内で行われる。一部の実施形態において、抽出媒体は抽出カラムである。一部の実施形態において、MS/MS分離および定量は、API5000 MS/MSシステムにおいてターボスプレーネガティブSRMモードで行われる。一部の実施形態において、活性物質は、(i)ERαおよび/またはERβの存在下でのERE−tk−Luc活性化を特徴とする、(ii)および/または活性物質がERαおよび/またはERβの存在下でのTNF−RE−Lucアッセイの活性化を特徴とする。
【0011】
本明細書に開示する一部の実施形態は、(a)Herba Scutellaria Barbata、Radix Sophora Subprostratae、Radix Anamarrhena、Semen Glycine Sojae、Radix Glycyrrhiza、Rhizoma Rhei、Fructus Tritici Levis、Radix Astragali、Radix Rehmania、Fructus Ligustri Lucidi、Semen Zyziphi Spinozae、Plumula Nelumbinis、Poria Cocos、Rhizoma Alismatis、Cortex Moutan Radicis、Fructus Corni、Radix Achyranthis、Concha Ostrea、Radix Aspargi、Radix Pueraria、Radix Atractylodis Macro cephalaおよびHerba Epimediaを合わせ、ハーブ混合物を形成することと、(b)該ハーブ混合物を、抽出溶媒での抽出に供することと、(c)該ハーブ混合物を水から分離してエキスを形成し、任意選択で、前記エキスからタンパク質を沈殿させることと、(d)前記エキスから活性物質を分離することと、(e)前記(d)の活性物質の1種類以上を少なくとも1種類の薬学的に許容され得る成分と組み合わせ、それにより医薬を形成することとを含む、医薬の調製方法を提供する。
【0012】
一部の実施形態において、本発明は、閉経期の治療のための組成物を提供する。該組成物は、ハーブ混合物、ハーブ混合物のエキスまたはハーブエキスの混合物である。ハーブ混合物は、Herba Scutellaria Barbata、Radix Sophora Subprostratae、Radix Anamarrhena、Semen Glycine Sojae、Radix Glycyrrhiza、Rhizoma Rhei、Fructus Tritici Levis、Radix Astragali、Radix Rehmania、Fructus Ligustri Lucidi、Semen Zyziphi Spinozae、Plumula Nelumbinis、Poria Cocos、Rhizoma Alismatis、Cortex Moutan Radicis、Fructus Corni、Radix Achyranthis、Concha Ostrea、Radix AsparagiおよびRadix Puerariaを含む。該組成物は、インビトロアッセイにおいて、エストロゲン応答エレメント(ERE)を、エストロゲン受容体β(ERβ)により活性化させるが、エストロゲン受容体α(ERα)では活性化させない。
【0013】
また、本発明は、閉経期の治療方法を提供する。該方法は、被検体に、閉経期が治療されるのに充分な量の上記の組成物投与することを含む。一部の実施形態において、閉経期の治療としては、閉経期症状の重症度、頻度または重症度と頻度の低減が挙げられる。
【0014】
引用による組み込み
本明細書において挙げた刊行物および特許出願はすべて、引用により、個々の刊行物および特許出願が、引用により組み込まれて、あたかも具体的に個々に示されているのと同程度に本明細書に組み込まれる。
【図面の簡単な説明】
【0015】
本発明の新規な特徴は、特に、添付の特許請求の範囲に示したものである。本発明の原理を用いた例示的実施形態を示した以下の詳細な説明、および添付の図面を参照することにより、本発明の特徴および利点のより良好な理解が得られよう。
【図1A】ERβ発現細胞およびERα発現細胞に対するMF101の活性を比較する折れ線グラフである。MF101は、ERβでは、用量依存的なERE−tk−Luc活性化をもたらしたが、ERαでは、活性化は観察されなかった。
【図1B】E2、MF101ならびにMF101+ICI、MF101+ラロキシフェン(Ral)およびMF101+タモキシフェン(Tam)の組み合わせの効果を比較する棒グラフである。MF101によるERE−tk−Luc活性化は、ICI、RalおよびTamによってブロックされた。
【図1C】MF101の存在下で、U2OS−ERβ細胞におけるケラチン19mRNA発現の増大を示す棒グラフである。
【図1D】MF101は、U2OS−ERα細胞において、ケラチン19mRNA発現に対してほとんど効果がなかったことを示す棒グラフである。
【図2A】ERβおよびERαに対するMF101の結合を示す折れ線グラフである。
【図2B】MF101が、ケラチン19EREにERβを漸増させるが、ERαは漸増させないことを示すゲルである。
【図2C】ERαのエラスターゼ消化に対するエタノール(対照)、E2(陽性対照)およびMF101の効果を示すゲルである。MF101と結合している場合、ERαは対照と比べて、エラスターゼに対する保護のわずかな増大を示す。
【図2D】ERβのエラスターゼ消化に対するエタノール(対照)、E2(陽性対照)およびMF101の効果を示すゲルである。
【図3A】それぞれ、対照、E2およびMF101で処理した細胞における3H−チミジン取込みの違いを示す棒グラフである。一般的に、MF101は、対照と比べて、3H−チミジン取込みを大きく増大させなかった。
【図3B】細胞内で、MF101が、c−myc(図3B)遺伝子を活性化させなかったことを示す棒グラフである。
【図3C】細胞内で、MF101が、サイクリンD1(図3c)遺伝子を活性化させなかったことを示す棒グラフである。
【図3D】細胞増殖に対する対照、ジエチルスチルベルトロール(DES)およびMF101の効果を示す写真である。
【図3E】細胞増殖に対する対照、ジエチルスチルベルトロール(DES)およびMF101の効果を示す写真である。
【図3F】細胞増殖に対する対照、ジエチルスチルベルトロール(DES)およびMF101の効果を示す写真である。
【図3G】異種移植片の増殖に対する対照、DESおよびMF101の効果を示す棒グラフである。MF101は、移植片の増殖を刺激しなかったが、DESは、異種移植片の質量の相当な増加を引き起こした。
【図3H】子宮角塊の増殖に対する対照、DESおよびMF101の効果を示す棒グラフである。MF101は、子宮角増殖を刺激しなかったが、対照的に、DESは、子宮角増殖の相当な増大を刺激した。
【図4】エストラジオールあり、またはなしでのMCF細胞増殖に対するERβの効果を示す棒グラフである。
【図5】インビボ細胞増殖に対するERαおよびERβの効果を示す。
【図6】エストラジオールはERαをインビボで活性化するが、MF−101は活性化しないことを示す三次元の棒グラフである。
【図7】MF−101がERβと選択的に相互作用することを示す三次元の棒グラフである。
【図8】MF−101の抗増殖効果を示す折れ線グラフである。
【図9】MF−101が骨細胞をTNFβ活性から保護することを示す三次元の棒グラフである。
【図10】すべての活性物質と内部標準の標準的な混合物の高速液体クロマトグラムである。
【図11】6種類の主な活性物質(ヒト血漿中)の一組の典型的な標準曲線である。
【図12】低(0.5ng/mLまたは1ng/mL)、中(20ng/mL)および高(50ng/mL)濃度レベルでの、3回の凍結解凍サイクルを経た6種類の活性物質のヒト血漿中における安定性を示す。
【図13】ヒト血漿からの種々の活性物質の回収率を示す。低(BNER1103、BNER1104およびBNER1106では0.5ng/mL、BNER1101、BNER1105およびBNER1115では1ng/mL)、中(10ng/mL)および高(20ng/mL)。
【発明を実施するための形態】
【0016】
本明細書において、閉経期の治療に有用であることがわかっている諸成分の混合物から活性化合物を単離し、定量し、特性評価する方法を記載する。一部の実施形態において、本明細書に記載の方法は、本明細書においてより詳細に説明するハーブ混合物のエキスからの活性化合物(活性物質)の単離を伴う。一部の実施形態において、本明細書に記載の方法は、血漿からの活性物質の単離を伴う。エキスまたは血漿を、まず、タンパク質の沈殿および分離に供する。上清みを、沈澱したタンパク質から分離し、抽出媒体(抽出カラムなど)に適用し、適当な溶媒で溶出させる。次いで、溶出液を質量分析−質量分析分離に供し、活性物質の単離と定量の両方を行う。活性物質の活性は、ERαおよび/またはERβの一方または両方の存在下で、EREまたはTNF−REの活性化などのエストロゲン様効果の既知の試験方法によって確認され得る。活性物質を1種類以上の賦形剤と合わせ、医薬組成物を調製してもよく、これは、エストロゲン媒介性の病状または疾患状態、例えば、閉経期、骨粗鬆症、乳癌、子宮癌、卵巣癌、膣癌、外陰部の癌、頚部癌、子宮内膜癌、ファローピウス管癌など、またはリンパ系内に遊走した任意の癌の治療のために使用され得る。また、該単離および定量方法は、薬物試験の際に、生物学的組織から前記活性物質を単離および定量するため、ならびに薬物試験の際に、活性物質の薬物動態および全身分布を調べるために使用され得る。
【0017】
多くの女性は、HTは有益性よりもリスクが勝ることが示された女性の健康イニシアチブの治験の結果以来、閉経期症状のためのHTに使用される安全で有効なエストロゲン代替薬を心待ちにしている(Ettinger,B.、Grady,D.、Tosteson,A.N.、Pressman,A.&Macer、J.L.、「Effect of the Women’s Health Initiative on women’s decisions to discontinue postmenopausal hoemone therapy」、Obstet.Gynecol.102、1225−32(2003))。その一方で、最近の調査により、閉経周辺期および閉経後の女性の79%が、植物性ダイエタリーサプリメント(BDS)を使用していることが報告された(Mahady,G.B.、Parrot,J.、Lee,C.、Yun,G.S.&Dan,A.Botanical dietary supplement use in peri− and postmenopausal women.Menopause 10、65−72(2003))。BDSが広く使用されているにも関わらず、植物性物質の作用機序、有効性および安全性は、厳密には調べられていなかった。本発明は、Herba Scutellaria Barbata、Radix Sophora Subprostratae、Radix Anamarrhena、Semen Glycine Sojae、Radix Glycyrrhiza、Rhizoma Rhei、Fructus Tritici Levis、Radix Astragali、Radix Rehmania、Fructus Ligustri Lucidi、Semen Zyziphi Spinozae、Plumula Nelumbinis、Poria Cocos、Rhizoma Alismatis、Cortex Moutan Radicis、Fructus Corni、Radix Achyranthis、Concha Ostrea、Radix AsparagiおよびRadix Puerariaを含有するハーブ配合物を提供する。一部の実施形態において、該エキスは、各ハーブ、すなわちHerba Scutellaria Barbata、Radix Sophora Subprostratae、Radix Anamarrhena、Semen Glycine Sojae、Radix Glycyrrhiza、Rhizoma Rhei、Fructus Tritici Levis、Radix Astragali、Radix Rehmania、Fructus Ligustri Lucidi、Semen Zyziphi Spinozae、Plumula Nelumbinis、Poria Cocos、Rhizoma Alismatis、Cortex Moutan Radicis、Fructus Corni、Radix Achyranthis、Concha Ostrea、Radix AsparagiおよびRadix Puerariaが有意な量のエキスである。本発明の例示的な実施形態はMF101であり、これは、以下に、より詳細に説明する。MF101に含まれるハーブの多くは、更年期症状の治療のための伝統的な漢方薬草の調合薬に使用されているが、これまでの試験で、閉経期の治療のための混合物の個々の物質の有効性が確認されたことはない。本発明の組成物は、ERβ−選択的エストロゲン受容体活性を有し、したがって、閉経期の臨床的治療、特に、のぼせなどの閉経期症状の治療に充分に適している。
【0018】
本発明は、閉経期、特に、のぼせなどの閉経期症状の治療のための組成物および方法を提供する。本発明の組成物は、ハーブ混合物、ハーブ混合物のエキスまたはハーブエキスの混合物である。さらに、本発明の組成物は、U2OS骨肉種細胞アッセイにおいて、エストロゲン応答エレメント(ERE)を、エストロゲン受容体β(ERβ)により活性化するが、エストロゲン受容体α(ERα)では活性化しない。該組成物は、EREを、ERαではなくERβとの相互作用(前者のみ、エストロゲンHTの有害効果と関連している)によって活性化するため、本発明の組成物および方法は、エストロゲンホルモン療法の代わり使用され、WHIにおいて、乳癌のリスクの増大などのエストロゲン補充と関連していると確認された状態が起こりにくい
【0019】
本発明との関連において、「閉経期」は、閉経周辺期、閉経期および閉経後を含み、特に、閉経周辺期、閉経期および閉経後に伴うエストラジオール(E2)レベルの低下によって引き起こされる、または悪化する症状を含む。したがって、本発明との関連において、「閉経期の治療」は、閉経期症状の治療を意味する。例示的な閉経期症状としては、血管運動の不安定性に副次的なのぼせ、発汗、心理的および感情的症状(疲労感、イライラ感、不眠、集中力の低下、鬱、記憶力の減退、頭痛、不安感、神経質など)、断続的なめまい、感覚異常、動悸、頻脈、吐き気、便秘、下痢、関節痛、筋肉痛、手足の冷え、体重増加、尿失禁、膣乾燥、骨盤筋の緊張の低下、心血管疾患および骨粗鬆症のリスクの増大が挙げられる。
【0020】
したがって、「閉経期の治療」は、閉経周辺期、閉経期または閉経後と関連している1つ以上の症状の軽減、緩和または予防を意味し、少なくとも1つの閉経期症状の重症度または頻度の低減が挙げられる。「または/もしくは」の使用は、本明細書で用いる場合、特に記載のない限り、接続的であることを意図する。したがって、治療には、少なくとも1つの閉経期症状の重症度と頻度の両方の低減も包含される。症状の頻度および重症度の低減は完全なものであり得るという意味では、治療には、該症状の予防も包含され得る。これに関連して、閉経期の治療には、ヒト成人女性の月経の自然な停止の予防は含まれないが、閉経期と関連している少なくとも1つの症状の頻度および重症度の検出不可能なレベルまでの低減は含まれることに注意されたい。
【0021】
本発明との関連において、「閉経期の被検体」およびその文言上の変化形は、かつて初経が起こり、閉経周辺期、閉経期または閉経後である雌の成体、特にヒト成人女性をいう。婦人科学の当業者には、閉経期の始まりの診断上の特徴を確認することができ、当該技術分野で認められた臨床方法によって被検体を「閉経期の被検体」であると特定することができよう。
【0022】
本発明による組成物は、以下の各ハーブ、すなわちHerba Scutellaria Barbata、Radix Sophora Subprostratae、Radix Anamarrhena、Semen Glycine Sojae、Radix Glycyrrhiza、Rhizoma Rhei、Fructus Tritici Levis、Radix Astragali、Radix Rehmania、Fructus Ligustri Lucidi、Semen Zyziphi Spinozae、Plumula Nelumbinis、Poria Cocos、Rhizoma Alismatis、Cortex Moutan Radicis、Fructus Corni、Radix Achyranthis、Concha Ostrea、Radix AsparagiおよびRadix Puerariaを含むハーブ混合物を含むものである。一部の実施形態において、ハーブ混合物は、前述の各ハーブを有意な量で含むものである。これに関連して、有意な量は、ハーブ混合物中の全ハーブ物質の質量の約0.1重量%より多い、例えば約0.5%より多い、より詳細には約1重量%より多い量を意味する。また、本発明による組成物は、前述のハーブ混合物のエキスを含むものである。かかるエキスの作製方法は、以下に詳細に説明する。
【0023】
本発明の一部の実施形態において、ハーブ混合物は、ほぼまたは正確に表2に示した割合のハーブの混合物を含むもの、本質的に該混合物からなるもの、または該混合物からなるものである。
【表2】

【0024】
一部の実施形態において、本発明のハーブ混合物は、表3に示したほぼまたは正確な割合のハーブ成分を含むもの、本質的に該ハーブ成分からなるもの、または該ハーブ成分からなるものである。
【表3】

【0025】
特定の実施形態において、本発明は、ほぼまたは正確に表4に示す割合のハーブ成分を含むもの、本質的に該ハーブ成分からなる、または該ハーブ成分からなるハーブ混合物を提供する。
【表4】

【0026】
〜を含む、本質的に〜からなる、および〜からなるという用語は、当該技術分野で一般的に認められた意味を有する。ほぼという用語およびその変化形は、それぞれの表内の具体的な値の許容範囲が、示された値の+/−10%の範囲内であることを意味する。したがって、例えば、ほぼ10%である値とは(10+/−1)%であり得る、すなわち9〜11%の範囲であり得る。正確なという用語およびその変化形は、それぞれの表内の具体的な値の許容範囲が、示された値の+/−1%の範囲内であることを意味する。したがって、例えば、正確に10.0%である値とは(10+/−0.1)%であり得る:すなわち9.9〜10.1%の範囲であり得る。一部の実施形態において、表1〜表3に示した割合は、ほぼであり、別の一部の実施形態では、該割合は正確なものである。
【0027】
一部の実施形態において、本発明は、上記のハーブ混合物のエキスである組成物を提供する。一部の実施形態において、本発明のエキスは、ハーブ、すなわちHerba Scutellaria Barbata、Radix Sophora Subprostratae、Radix Anamarrhena、Semen Glycine Sojae、Radix Glycyrrhiza、Rhizoma Rhei、Fructus Tritici Levis、Radix Astragali、Radix Rehmania、Fructus Ligustri Lucidi、Semen Zyziphi Spinozae、Plumula Nelumbinis、Poria Cocos、Rhizoma Alismatis、Cortex Moutan Radicis、Fructus Corni、Radix Achyranthis、Concha Ostrea、Radix AsparagiおよびRadix Puerariaを含むハーブ混合物のエキスである。一部の実施形態において、該エキスは、有意な量の各ハーブ、すなわちHerba Scutellaria Barbata、Radix Sophora Subprostratae、Radix Anamarrhena、Semen Glycine Sojae、Radix Glycyrrhiza、Rhizoma Rhei、Fructus Tritici Levis、Radix Astragali、Radix Rehmania、Fructus Ligustri Lucidi、Semen Zyziphi Spinozae、Plumula Nelumbinis、Poria Cocos、Rhizoma Alismatis、Cortex Moutan Radicis、Fructus Corni、Radix Achyranthis、Concha Ostrea、Radix AsparagiおよびRadix Puerariaのエキスである。他の実施形態において、該エキスは、表2に示したハーブ混合物のエキスである。さらなる実施形態において、該エキスは、表3に示したハーブ混合物のエキスである。なおさらなる実施形態において、該エキスは、表4に示したハーブ混合物のエキスである。
【0028】
本発明の一部の実施形態において、該組成物は、ハーブ混合物の濃縮型または無水型エキスである。一部の実施形態において、該組成物は、ハーブ、すなわちHerba Scutellaria Barbata、Radix Sophora Subprostratae、Radix Anamarrhena、Semen Glycine Sojae、Radix Glycyrrhiza、Rhizoma Rhei、Fructus Tritici Levis、Radix Astragali、Radix Rehmania、Fructus Ligustri Lucidi、Semen Zyziphi Spinozae、Plumula Nelumbinis、Poria Cocos、Rhizoma Alismatis、Cortex Moutan Radicis、Fructus Corni、Radix Achyranthis、Concha Ostrea、Radix AsparagiおよびRadix Puerariaを含むハーブ混合物の無水型または濃縮型エキスである。一部の実施形態において、該組成物は、有意な量の各ハーブ、すなわちHerba Scutellaria Barbata、Radix Sophora Subprostratae、Radix Anamarrhena、Semen Glycine Sojae、Radix Glycyrrhiza、Rhizoma Rhei、Fructus Tritici Levis、Radix Astragali、Radix Rehmania、Fructus Ligustri Lucidi、Semen Zyziphi Spinozae、Plumula Nelumbinis、Poria Cocos、Rhizoma Alismatis、Cortex Moutan Radicis、Fructus Corni、Radix Achyranthis、Concha Ostrea、Radix AsparagiおよびRadix Puerariaの濃縮型または無水型エキスである。他の実施形態において、該組成物は、表2または表3または表4に示したハーブ混合物の濃縮型または無水型エキスである。
【0029】
一部の実施形態において、本発明は、前述のエキスまたは濃縮型もしくは無水型エキスの1種類以上と、1種類以上の適当な希釈剤、フレーバー剤、賦形剤または他の添加剤との組み合わせである組成物を提供する。好適な希釈剤としては、水、例えば、脱イオン水、注射用水(WFI)、濾過水などが挙げられる。他の適当な希釈剤としては、果汁、お茶、ミルク、マグネシアミルクなどが挙げられる。好適なフレーバーとしては、フルーツフレーバー、ウインターグリーン、ペパーミント、スペアミント、シナモンなどが挙げられる。他の適当な添加剤としては、食品着色料およびエタノールが挙げられる。一部の実施形態において、該組成物は、無水型エキスを、1種類以上の希釈剤、フレーバー剤または他の添加剤との組み合わせで含むものである。他の実施形態において、該組成物は、濃縮型エキスを、1種類以上の希釈剤、フレーバー剤または他の添加剤との組み合わせで含むものである。一部の特定の実施形態では、無水型エキスは、表2、表3または表4に示した混合物のうちの1種類の無水型エキスである。他の特定の実施形態において、濃縮型エキスは、表2、表3または表4に示したハーブ混合物のうちの1種類の濃縮型エキスである。
【0030】
本発明による組成物は、ハーブ、すなわちHerba Scutellaria Barbata、Radix Sophora Subprostratae、Radix Anamarrhena、Semen Glycine Sojae、Radix Glycyrrhiza、Rhizoma Rhei、Fructus Tritici Levis、Radix Astragali、Radix Rehmania、Fructus Ligustri Lucidi、Semen Zyziphi Spinozae、Plumula Nelumbinis、Poria Cocos、Rhizoma Alismatis、Cortex Moutan Radicis、Fructus Corni、Radix Achyranthis、Concha Ostrea、Radix AsparagiおよびRadix Pueraria、特に、有意な量の各ハーブの混合物を含むものであり、より詳細には、ほぼまたは正確に表2、表3または表4のうちの1つに示したとおりの各ハーブの混合物を含むものである。かかるハーブ混合物は、慣用的な様式で、すなわち、適切な量の各ハーブを計り取り、種々のハーブを組み合わせてハーブ混合物を形成することにより作製され得る。このプロセスに、混合物の摩砕または攪拌などのさらなる工程を含めてもよい。該混合物は、そのまま摂取してもよく、被検体への経口投与に適した1つ以上のカプセル内に存在させてもよい。特定の実施形態において、ハーブ混合物を、該混合物のエキスを調製することなどによって、さらに加工処理してもよい。
【0031】
本発明によるハーブ混合物のエキスは、慣用的な様式で、例えば、ハーブ混合物を1種類以上の溶媒と、エキスの調製に適した時間および条件下で合わせることなどにより調製され得る。ハーブ混合物と溶媒を、エキスの形成に適当な期間接触させた後、溶媒とハーブを濾過または遠心分離などの適当な方法によって分離する。溶媒を含む液体はエキスに相当する。次いで、このエキスは、該エキスを濃縮または脱水し(または両方)、該エキスをさらなる成分と組み合わせることなどにより、さらに加工処理され得る。
【0032】
抽出プロセスに好適な溶媒(抽出溶媒)としては、水性溶媒、例えば、純水およびエタノールの水性溶液などが挙げられる。好適な条件としては、抽出溶媒とハーブの混合物に対する加熱が挙げられる。一部の特定の実施形態では、溶媒とハーブ混合物を、沸騰するまで所与の時間加熱する。特定の実施形態では、ハーブ混合物を水と合わせ、この合わせたものを約1分より長い時間、特に、5分より長い時間煎出する。
【0033】
本発明の特定の実施形態では、上記の表5に示したハーブ混合物を水と組み合わせ、次いで、沸点まで、エキスの調製に適した時間加熱する。水を煎出ハーブから分離した後、水分を脱水によって除去し、残った残渣を本発明による組成物(無水型エキス)として回収する。次いで、この無水型エキスを、お湯で薄めてお茶として飲用にしてもよく、他のフレーバーと合わせてもよく、1つ以上のゼラチンカプセル剤に調製してもよい。
【0034】
本発明の方法は、閉経期症状が治療されるのに充分な量の本発明の組成物を摂取することを含む。「閉経期症状」は、閉経周辺期、閉経期または閉経後の1つ以上と関連している症状である。閉経期症状としては、血管運動の不安定性に副次的なのぼせおよび発汗、疲労感、イライラ感、不眠、集中力の低下、鬱、記憶力の減退、頭痛、不安感、神経質、断続的なめまい、感覚異常、動悸、頻脈、吐き気、便秘、下痢、関節痛、筋肉痛、手足の冷え、体重増加、尿失禁、膣乾燥および骨盤筋の緊張の低下が挙げられる。特定の実施形態において、該方法は、のぼせの治療を含む。
【0035】
治療という用語およびその文法上の変化形は、具体的な症状の頻度または重症度の低減を包含する。症状の頻度は、当該技術分野で認められた様式で、例えば、1種類以上の自動バイオメトリック法(血圧、脈拍数、呼吸数、呼吸容量、心電図、皮膚の抵抗力、脳波などの測定)または被検体に対して質問票に症状の頻度の記録を求めることなどによって判定され得る。また、症状の重症度も、前述のバイオメトリック法または質問票の1つ以上によって判定され得る。したがって、症状の頻度および重症度の測定は、主観的、客観的またはその両方であり得る。
【0036】
したがって、閉経期症状が治療されるのに充分な本発明の組成物の量は、閉経期症状の頻度の低減、症状の重症度の改善またはその両方に充分なハーブ混合物、ハーブ混合物のエキス、またはハーブエキスの混合物の量である。一般的に、症状の治療に必要とされる量は、被検体の年齢、体重、一般健康状態、遺伝子構造、感情面の状態、および他の要素に依存する。選択された有効量は、エストロゲンホルモン補充療法よりも有効性が高い場合もあり、低い場合もあり得る。したがって、本発明の組成物の日用量に適した量は、約0.01〜100グラムの本発明のハーブ混合物/キログラム被検体体重、より詳細には約0.05〜約50グラム/キログラム被検体体重に相当する量である。本発明によるエキスに関しては、日用量は、約1〜10,000mgの乾燥エキス/kg体重、より詳細には約2〜約5,000mg/kgの範囲である。本発明の組成物は安全であり、特に、乳癌のリスクの増大などのエストロゲン補充に関連する問題が引き起こされるリスクの低下を提示するものであると考えられるが、それでもなお、閉経期症状が低減され得る最小用量を使用するべきであることは、当業者には認識されよう。また、同様に、当業者は、所望の症状の緩和効果を得るのに必要な用量を明記した範囲内で滴定することができ、また、該範囲から上方または下方への偏差は、本発明の範囲内に許容され得ることが同様に認識されよう。
【0037】
エストロゲンは乳癌を引き起こすという納得のいく証拠にもかかわらず、観察研究では、逆説的に、アジア諸国の女性は、大量の植物性エストロゲン(フィトエストロゲン)を摂取しているにもかかわらず、乳癌の発生率が最も低いことが示されている。同様に、アジア人女性が訴える、閉経期の症状は最小限であり、卵巣機能の停止時期におけるのぼせの経験は、はるかに少ない傾向にある。このような所見により、米国の多くの閉経期女性は、乳癌発生のリスクが増大することなく、のぼせが軽減されることを期待して、大豆またはエストロゲンの代替薬としてのハーブ療法剤中に存在するフィトエストロゲンを進んで摂取するようになった。種々のエストロゲン様化合物は、乳房細胞に対して反対の効果を発揮することがあり得る。エストラジオール(E2)などのエストロゲンは乳癌を促進させるが、フィトエストロゲンは、アジアで観察されているような乳癌の低発生率の一因であり得る。この理論を裏付ける臨床データおよび観察データは相当あるが(Kurtzer M.Phytoestrogen supplement use by women.J.Nutr.2003、133:1983S−1986S)、これまでに、フィトエストロゲンが乳癌のリスクを低減させることが記録された無作為対照比較試験はない。
【実施例】
【0038】
本発明の種々の態様および利点を実証するため、以下の例示的な実施例を示した。該実施例により、本発明の特定の実施形態を説明するが、本発明の完全な範囲がこれらの実施例に限定されないことは、当業者には認識されよう。
【0039】
調製例1−MF101(IND 58,267)
【0040】
本発明の特定の実施形態において、エキスをMF101と表示し、これを以下の表5に示す。
【表5】

【0041】
次いで、乾燥エキスを、エキス溶液1リットルあたり固形エキス53megの濃度まで希釈する。この溶液を、以下の実施例1〜10を通して使用する。
【実施例1】
【0042】
実施例1−MF101のERβ特異的インビトロERE活性化
U2OS骨肉種細胞を、最小限のチミジンキナーゼ(tk)プロモータ(ERE−tk−Luc)の上流の古典的EREおよびヒトERαまたはERβの発現ベクターでコトランスフェクトした。MF101では、ERβによる用量依存的なERE−tk−Luc活性化がもたらされたが、ERαによる活性化は観察されなかった(図1A)。ERβでは、0.1μl/mlのMF101で2.5倍のERE−tk−Luc活性化がもたらされ、2.5μl/mlのMF101で20倍の最大活性化がもたらされた。MF101(2.5μl/ml)による最大活性化は、10nMのエストラジオール(E2)で観察されたものに相当した。MF101によるERE−tk−Luc活性化は、ICI、ラロキシフェンおよびタモキシフェンによってブロックされ(図1B)、これは、MF101の効果がERβによって直接媒介されることを示す。また、ERサブタイプの選択性を、EREを含む内在性ケラチン19遺伝子において調べた(Choi,I、Gudas,L.J.&Katzenellenbogen,B.S.、「Regulation of keratin 19 gene expression by estrogen in himan breast cancer and identification of the estrogen responsive gene region」、 Mol.Cell Endocrinol.164、225−37.(2000))。以前に、E2が、テトラサイクリン(tetracycyline)誘導性ERαまたはERβ細胞で安定的にトランスフェクトしたU2OS細胞においてケラチン19mRNAの用量依存的な刺激をもたらすことが示されていた(Kian Tee,M.ら、「Estradiol and Selective Estrogen Receptor Modulators Differentially Regulate Target Genes with Estrogen Receptors {alpha} and {beta}」、Mol.Biol.Cell 15、1262−1272(2004))。対照的に、MF101は、U2OS−ERβ細胞においてケラチン19mRNAを増加させる(図1C)が、U2OS−ERα細胞においては増加させなかった(図1D)。この結果は、MF101が、異種プロモータに連結させたEREまたは内在性遺伝子内に存在するEREにおいて、ERβ媒介性転写経路を選択的に誘発することを示す。
【実施例2】
【0043】
実施例2−インビトロエストロゲン受容体結合
以前に、大豆にみられるフィトエストロゲン(ゲニステインなど)は、ERβに対して、ERαと比べて7〜30倍高い親和性で結合することが示された(Barkhem,T.らDifferential response of estrogen receptor alpha and estrogen receptor beta to partial estrogen agonists/antagonists.Mol Pharmacol.54、105−12(1998)、Kuiper,G.G.らInteraction of estrogenic chemicals and phytoestrogens with estrogen receptor beta.Endocrinology 139、4252−63(1998))。図1A〜図1Dのデータは、MF101が、ERβに対してより良好に結合することにより、ERβ選択的様式で作用し得ることを示す。MF101が精製ERαおよびERβに対する結合に対してE2と競合する能力を、インビトロ結合アッセイにおいて試験した。競合結合曲線は、MF101がERβとERαに等しく結合することを示す(図2A)。この実験は、MF101のERβ選択性がERβに対する優先的結合によるものでないことを示す。別の可能性は、MF101のERβ選択性が、標的遺伝子内のEREへのMF101−ERβ複合体の選択的結合に起因しているということである。この可能性を調べるため、U2OS−ERβ細胞およびU2OS−ERα細胞において、ケラチン19遺伝子を用いてクロマチン免疫沈降(ChIP)アッセイを行った。以前に、E2処理によって、U2OS−ERα細胞およびU2OS−ERβ細胞において、それぞれERαおよびERβの漸増がもたらされることが報告された(Kian Tee,M.ら、「Estradiol and Selective Estrogen Receptor Modulators Differentially Regulate Target Genes with Estrogen Receptors {alpha} and {beta}」、Mol.Biol.Cell 15、1262−1272(2004))。対照的に、ChIPは、MF101は、ケラチン19EREにERβを漸増させたが、ERαは漸増させなかったことを示す(図2B)。したがって、ERαに対するMF101の結合は、EREへの結合が可能になるコンホメーションはもたらされない。
【実施例3】
【0044】
実施例3−MF101によるエラスターゼ阻害
ERαおよびERβのコンホメーションに対するMF101の効果をさらに調べるため、エラスターゼでの限定的タンパク質分解を行い、MF101が、E2と比べて異なるプロテアーゼ消化パターンかどうかを調べた。エラスターゼでの消化後、ERαでは、E2とMF101で相違する保護パターンが得られる(図2C)。ERαがE2と結合している場合に、ERαの最も強い保護が観察される。2つの矢印は、最も高いエラスターゼ濃度であっても、いくつかの保護断片が存在することを示す。リガンドの非存在下では(エタノール対照)、ERα保護の明白な減損がみられる。MF101と結合している場合、ERαは、対照と比べてエラスターゼに対する保護のわずかな増大を示すが、E2に結合しているERαと比べると、それほど大きな保護は生じなかった(図2D)。対照的に、ERβでのプロテアーゼ保護の結果、ERαと比べて、完全に異なるパターンの保護断片が得られる。MF101では、エタノールおよびE2と比べて相違するパターンが得られた(E2およびエタノール対照の保護断片を示す5つの矢印と、MF101試料の保護断片を示す4つの矢印を比較)。これは、MF101に結合すると、ERβは、E2と結合している場合またはホルモンなしの場合とは異なる全体コンホメーションになることを示す。ERβは、MF101と結合している場合には異なるコンホメーションを有するため、ERβの別の表面が露出し、場合によっては、補助調節タンパク質に利用可能となる。ERのコンホメーションの変化によって相違する類型のタンパク質(p160コアクチベータなど)の漸増がもたらされることがわかっているため、MF101によって、ERαおよびERβへの補助調節タンパク質の識別的漸増がもたらされるかどうかを調べた(Shang,Y.、Hu,X.、DiRenzo,J.、Lazar,M.A.&Brown、M.Cofactor dynamics and sufficiency in estrogen receptor−regulated transcription.Cell 103、843−52.(2000)、Metivier,R.らEstrogen receptor−alpha directs ordered,cyclical,and combinatorial recruitment of cofactors on a natural target promoter.Cell 115、751−63(2003)、Smith,CL.&O’Malley,B.W.、「Coregulator function:a key to understanding tissue specificity of selective receptor modulators」、Endocr.Rev.25、45−71(2004))。
【0045】
MF101が補助調節因子を内在性遺伝子に選択的に漸増させるかどうかを調べるため、U2OS−ERα細胞およびU2OS−ERβ細胞において、ケラチン19遺伝子に対してChIPアッセイを行った。MF101は、U2OS−ERβ細胞では、ケラチン19遺伝子に対してGRIP1およびCBPの漸増を誘導したが、U2OS−ERα細胞では誘導しなかった(図2B)。また、MF101は、ERβにRNAポリメラーゼIIを選択的に漸増させたが、これは、MF101がU2OS−ERβ細胞でのみケラチン19遺伝子を活性化させたという所見と整合する。この結果は、MF101のERβ選択性がEREに対する識別的結合および標的遺伝子に対する補助調節タンパク質の漸増に起因していることを示す。
【実施例4】
【0046】
実施例4−MF101はインビトロでMCF−7乳癌細胞増殖を刺激しない
のぼせのための代替エストロゲンの重要な特徴は、乳癌を促進させないことである。MF101の増殖促進特性を、ERαのみを発現するMCF−7乳癌細胞において試験した(図3A)。MCF−7細胞をMF101で7日間処理し、細胞増殖を3H−チミジン取り込みによって測定した。E2とは異なり、MF101はMCF−7細胞の細胞増殖を刺激しなかった。また、MF101は、E2によって活性化され、細胞増殖および乳癌を促進させる主要な遺伝子であるc−myc遺伝子およびサイクリンD1遺伝子も刺激しなかった(図3B)。このデータは、MF101がERβ選択的であるというさらなる証拠を示し、ERαがMCF−7細胞においてE2の増殖性効果を媒介することを示す前述の試験と整合する(Paruthiyil,S.ら、「Estrogen receptor beta inhibits human breast cancer cell proliferation and tumor formation by causing a G2 cell cycle arrest」、Cancer Res.64、423−8(2004)、An,J.、Tzagarakis−Foster,C、Scharschmidt,T.C、Lomri,N.&Leitman,D.C、「Estrogen receptor beta−selective transcriptional activity and recruitment of coregulator by phytoestrogen」、J.Biol.Chem.276、17808−14.(2001))。
【0047】
同様の実験において、乳癌細胞に対するMF101の効果をジエチルスチルベルトロール(DES)のものと比較した。図3D〜図3Fは、対照処理(図3D)およびMF101処理(図3F)癌細胞と比較した場合の乳癌に対するDESの増殖刺激効果を示す。図3Gおよび図3Hは、乳癌移植片の質量(図3G)および子宮角の質量(図3H)に対する対照、DESおよびMF101の効果を示す。この結果は、合成エストロゲンDESとは異なり、MF101は、癌細胞または正常子宮細胞のいずれの増殖も刺激しないことを示す。
【実施例5】
【0048】
実施例5−遺伝子発現マイクロアレイ
以下に概要を示す試験に基づき、本発明者らは、エストロゲンは、ERαと相互作用することにより乳癌を促進させるが、MF101に見られるフィトエストロゲンは、増殖促進遺伝子を抑制し、かつ乳房細胞のERα媒介性増殖を抑止するERβと選択的に相互作用することにより、乳癌およびのぼせなどの閉経期症状を抑制し得るのではないかという仮説を立てた。ERβ受容体は、脳や骨などの非生殖組織内により多く存在し、どのようにしてフィトエストロゲンが、血管運動症状を引き起こす中枢神経系効果を低減させ、骨量の維持を補助し得るかに役割を果たしている可能性がある。
【0049】
エストロゲン様化合物は、その臨床効果を、ステロイド受容体スーパーファミリーの構成員である2種類の相違するエストロゲン受容体と相互作用することにより誘起させる。(Evans RM.The steroid and thyroid hormone receptor superfamily、Science 1988、240:889−895、Mangelsdorf DJ、Thummel C、Beato Mら、The nuclear receptor superfamily:the second decade.Cell、83:835−839)。ERαは595アミノ酸のタンパク質であり、ERβと称される第2のERα(530アミノ酸)は10年後に確認された(Mosselman S、Polman J、Dijkema R.ER beta:identification and characterization of a novel human estrogen receptor.FEBS Lett.1996、392:49−53)。この2つの受容体の機能上の違いは、ごく最近になって研究された。ERαとERβの全体的な構造は、A/Bドメイン以外は非常に類似しており、該ドメインは、相同性が25%しか示されず、トランス作用性領域の1つを含む。DNA結合ドメインは事実上同一である(98%相同性)が、リガンド結合ドメイン(また、これは、第2のトランス作用性ドメインを含む)では、アミノ酸の55%しか保存されていない(Enmark E、Pelto−Huikko M、Grandien KらHuman estrogen receptor beta−gene structure,chromosomal localization,and expression pattern.J Clin.Endocrinol.Metab.1997、82:4258−4265)。他の試験では、組織分布、生理学的効果および転写活性がかなり異なっていることが明白に示されている。ERβの方が偏在性であり、生殖組織(卵巣および精巣など)に加えて、多くの非生殖組織(骨、脳、尿路、脈管系および前立腺など)でも発現される。ERαは、主に、子宮、肝臓、乳房および腎臓で発現される。ERαとERβの生理学的役割は異なることが、ERαまたはERβノックアウトマウスで明白に示された。ERαノックアウトマウスは、始原的な乳腺および子宮などの大きな欠陥を示し、不妊である(Hewitt SC、Korach KS.、「Oestrogen receptor knockout mice:roles for oestrogen receptors alpha and beta in reproductive tissues」、Reproduction 2003、125:143−149)。対照的に、ERβノックアウトマウスで観察された効果は、より微妙であり、低生殖能力で、同腹子の大きさが小さい、雌の皮質骨の肥厚および前立腺肥大が挙げられる。
【0050】
フィトエストロゲンは、これまでに、ステロイドホルモン受容体の結合によってエストロゲン様効果を発揮することがわかっており(Tamaya T、Sato S、Okada HH、「Possible mechanism of steroid action of the plant herb extracts glycyrrhizin,glycyrrhetinic acid,and paeoniflorin:inhibition by plant herb extracts of steroid protein binding in the rabbit」、Am.J.Obstet.Gynecol.、1986、155:1134−1139)、ごく最近、ERβに対してERαと比べて有意に高い親和性を有することがわかった(Barkhem T、Carlsson B、Nilsson Yら、「Differential response of estrogen receptor alpha and estrogen receptor beta to partial estrogen agonists/antagonists」、Mol.Pharmacol.、1998、54:105−112)。最初の実験において、イソフラボンのゲニステインは、ERβに対する強力な転写アゴニストであるが、ERαに対しては弱いアゴニストでしかないことが示された(An J、Tzagarakis−Foster C、Scharschmidt TCら、「Estrogen receptor beta−selective trtanscriptional activity and recruitment of coregulators by phytoestrogens」、J.Biol.Chem.2001、276:17808−17814)。閉経期症状のためのERサブタイプ選択的天然化合物を同定するためには、ERαまたはERβが相違する生物学的効果を発揮することを示すことが必要であった。ERαとERβは異なる標的遺伝子を調節する。これは、テトラサイクリン誘導ベクターで安定的にトランスフェクトしたヒトU2OS骨肉種細胞を用いてERαまたはERβを発現させることにより示される。ウエスタンブロッティング、免疫組織化学試験および免疫沈降試験により、U2OS−ERα細胞ではERαのみが合成されること、およびU2OS−ERβ細胞ではERβが排他的に発現されることが確認された(Kian Tee M、Rogatsky I、Tzagarakis−Foster Cら、「Estradiol and selective estrogen receptor modulators differentially regulate target genes with estrogen receptors alpha and beta.」Mol.Biol.Cell 2004、15:1262−12672)。ドキシサイクリンで18時間処理してERαまたはERβの発現を誘導した後、3H−E2結合試験により、U2OS−ERα細胞株およびU2OS−ERβ細胞株には、それぞれ、細胞1つあたり69,000個および54,000個の受容体が含まれていた。ERαおよび/またはERβによって調節される遺伝子を同定するため、U2OS−ERα細胞株およびU2OS−ERβ細胞株を、10nMのE2の非存在下または存在下、ドキシサイクリンで18時間処理した。全RNAを使用し、12,600個の既知遺伝子を含むヒトU95Av2 AffymetrixマイクロアレイとのハイブリダイゼーションのためのcRNAを調製した。未処理群と各処理群の6組の比較発現データを使用し、ERα細胞またはERβ細胞において調節される遺伝子を調べた。U2OS−ERα細胞とU2OS−ERβ細胞の両方において、合計228個が、E2によって有意に(p<0.05)活性化または抑制された(表4)。E2は、65個の遺伝子をU2OS−ERα細胞のみにおいて、および125個の遺伝子をU2OS−ERβ細胞のみにおいて調節した。E2は、32個の遺伝子をU2OS−ERα細胞において、および38個の遺伝子をU2OS−ERβ細胞において抑制した。両方の細胞株でE2によって活性化された遺伝子は34個、抑制された遺伝子は4個だけであった。この所見は、E2では、ERαとERβの両方によって調節される遺伝子は228個のうち38個(17%)だけであることを示す。E2と同様、U2OS−ERα細胞においてラロキシフェンまたはタモキシフェンによって調節される遺伝子は、U2OS−ERβ細胞において調節されるものとは相違した。驚くべきことに、タモキシフェンによって調節される遺伝子のうち、ラロキシフェンによっても調節されるのは、どちらも選択的エストロゲン受容体モジュレータ(SERM)に分類されるにもかかわらず、わずか27%である。この結果を、以下の表6にまとめる。
【表6】

【0051】
U2OS−ERα細胞株およびU2OS−ERβ細胞株におけるE2およびSERMによる識別的遺伝子調節
ドキシサイクリン誘導型U2OS−ERα細胞およびU2OS−ERβ細胞を、10nMのE2、1μMのラロキシフェンまたは1μMのタモキシフェンで18時間処理した。未処理試料とリガンド処理試料のヒトAffymetrix U95Av2遺伝子チップから得られたマイクロアレイデータを、Affymetrix Microarray Suite Version 5.0を用いて解析した。少なくとも3回の実験で対照と比べて統計学的に有意な(p<0.05)増大または減少であるシグナル変化を示す候補遺伝子を、±0.8シグナルlog比平均カットオフによってさらに選択した。ERα細胞株、ERβ細胞株およびERα+ERβ両方の細胞株における活性化された遺伝子の数、抑制された遺伝子の数およびその相対割合(括弧内)を示す。アスタリスク(*)は、ERβ細胞と比べて反対の発現パターンが示されたERα細胞においてSERMによって調節される共通遺伝子の数を示す。α−抗トリプシン、ケラチン19(K19)、WISP−2、Mda−7、NKG2CおよびNKG2Eに関するリアルタイムRT−PCRを、10nMのE2、1μMのラロキシフェンまたは1μMのタモキシフェンのいずれかで18時間処理したU2OS−ERα試料およびU2OS−ERβ試料において行った。U2OS−ERα試料およびU2OS−ERβ試料における変化倍数(括弧内)は、未処理試料に相対して計算した。
【0052】
ERαおよびERβが相違する遺伝子を調節するという観察結果は、ERαとERβが乳癌の発生において異なる役割を有し得ることを示す。乳癌におけるERαの役割を調べるため、ERαのみを発現するMCF−7細胞において、細胞増殖に対するE2の効果を試験した。E2は、ERα−MCF−7細胞において細胞数の用量依存的な増加をもたらした(An,上掲,2001)。該細胞はERβを発現しないため、この試験により、増殖性効果はERαによって媒介されることが示された。乳癌細胞の増殖に対するERβの役割を調べるため、アデノウイルス(Ad)を使用し、ERβを高割合の細胞内に送達した。MCF−7細胞を、Ad−ERβまたは該ウイルスの潜在的な非特異的効果を制御するためにAd−LacZに24時間感染させた。感染細胞をE2の非存在下または存在下で10日間培養した後、DNA合成を、インビトロでの[3H]チミジン取込みによって測定した。ERβの発現により、E2の非存在下では、50MOIのAd−LacZに感染させた細胞比較すると、MCF−7細胞の細胞増殖の50%低減がもたらされた(図5)。Ad−ERβ感染細胞では、E2により細胞増殖の抑止が70%まで増大された。感染多重度(MOI)100のAd−ERβの使用でも同様の結果が観察された。ERβによる細胞増殖の抑止は主にリガンド非依存性であるという観察結果は、ストリッピング処理された血清中の残留E2、またはERβに感染した細胞内に保持された残留E2、あるいはERβの非リガンド特性に起因している可能性がある。
【0053】
また、腫瘍形成に対するERβの発現の効果を、マウス異種移植片モデルにおいて調べた(図6)。アデノウイルスに感染させたLacZ、ERαまたはERβを発現するMCF−7細胞を最初に凝集させ、次いで、重合コラーゲンゲル中に再懸濁させ、皮下エストラジオールペレットを埋入した雌ヌードマウスの腎臓嚢下に移植した。細胞を移植してから1ヶ月後、非感染MCF−7細胞およびAd−LacZまたはAd−ERβに感染させた細胞から、同等のサイズの腫瘍が発生した。Ad−ERβに感染させたMCF−7細胞からは、有意な腫瘍は発生しなかった(右下)。Ki67増殖指数により、非感染MCF−7細胞およびAd−LacZまたはAd−ERαに感染させた細胞のほぼ70%はKi67について染色されたのに対し、Ad−ERβに感染させた細胞では5%であることがわかった(データ示さず)。
【0054】
この試験は、MCF−7細胞へのAd−ERβの導入によってマウス異種移植片内での腫瘍形成が抑制されるが、Ad−ERαの導入では抑制されないことを示す。イムノブロットにより、感染細胞において同等レベルのERα発現およびERβ発現が検出され(データ示さず)、この結果が、ERβによる補因子または転写因子の過剰発現および非特異的抑圧(squelching)のためではないようである。さらに、この抑圧が、ERβが腫瘍形成を抑制する機構である場合、Ad−ERαに感染させた細胞でも同様の結果が観察されたはずである。
【実施例6】
【0055】
実施例6−MF101はエストロゲン受容体α(ERα)と機能的に相互作用しない
MF101が、乳房および子宮の細胞に対して不要な増殖性効果を発揮することがあり得、それにより潜在的に乳癌および子宮癌のリスクを増大させるERαのアゴニストであるかどうかを調べるため、ERαをER陰性U2OS骨肉種細胞内に一過的にトランスフェクトした。該細胞内に、エストロゲン応答エレメント−チミジンキナーゼ(tk)−ルシフェラーゼ(ERE−tk−Luc)構築物も一過的にコトランスフェクトした。次いで、MF101またはエストラジオールを生理学的濃度で添加し、細胞を18時間インキュベートし、その時点でルシフェラーゼ活性を測定した。図7に見られるように、MF101はERαを活性化しない。しかしながら、エストラジオールはERαを活性化し、このトランス活性能は、純粋なエストロゲンアンタゴニストICI 182,780(ICI)によって阻害され得る。
【実施例7】
【0056】
実施例7−MF101はエストロゲン受容体β(ERβ)選択的転写活性化をもたらす
MF101のERβ媒介性効果を試験するため、ERβをU2OS骨肉種細胞内に一過的にトランスフェクトした。ERE−tk−Luc構築物も一過的にコトランスフェクトした。次いで、MF101またはエストラジオールを生理学的濃度で18時間添加し、ルシフェラーゼ活性を測定した。図8に示されるように、MF101はERβを活性化する。MF101とエストラジオールはともにERβを活性化し、この活性は、ICI 182,780によってブロックされる。結果は、エストラジオールがERαとERβのどちらとも普遍的に相互作用するが、MF101は、ERβのみと選択的に相互作用することを示す。
【実施例8】
【0057】
実施例8−MF101は乳癌細胞に対して抗増殖活性を示す
次の組の検査試験の目的は、インビトロでの乳癌細胞に対するMF101の増殖効果を解明することであった。図9は、Cy−Quant Molecular Deviseシステムを使用し、MF101がER陽性乳癌細胞に対して抗増殖活性を示すことを示す。MCF7細胞は内在性ERαを発現するが、SKBR3細胞はER陰性である。MF101は、ER陽性細胞に対しての方が大きな阻害を示す。これは、抗増殖効果がER非依存性であり、増殖刺激の徴候がないことを示す。
【実施例9】
【0058】
実施例9−MF101は骨細胞をTNFβの活性から保護し、骨粗鬆症を予防し得る
骨内では、エストロゲンは、腫瘍壊死因子β(TNFβ)などの特定のエストロゲン抑制性遺伝子を抑制し、それにより、その骨鉱化保護効果を媒介すると考えられている。骨細胞に対するMF101の潜在的効果を観察するため、ERβ(骨内での存在度が高い方のER)をU2OS骨肉種細胞内に一過的にトランスフェクトした。該細胞内に、TNFβ−tk−応答エレメント−ルシフェラーゼ構築物(TNF−RE−tk−Luc)も一過的にコトランスフェクトし、MF101またはエストラジオールを添加し、18時間後にルシフェラーゼ活性を測定した。MF101とエストラジオールはどちらも腫瘍TNFβを阻害し、該阻害はICI 182,780(ICI)によってブロックされた。図10に示したデータは、エストラジオールとMF101がどちらも閉経後女性の骨量の維持に有効であり得ることを示す。
【実施例10】
【0059】
実施例10−MF101の個々のハーブ成分のER選択性
個々のハーブのいくつかの(several of several of)ERαおよびERβの転写活性もまた評価した。本発明の目的の一つは、伝統的な中国医学アプローチを維持しながら、MF101配合物全体を試験することであるため、検査試験は、配合物全体に焦点をあてたものとした。しかしながら、一過的トランスフェクションアッセイにおいてスクリーニングした67種類のハーブのうち、ERE−tk−LucまたはTNF−RE−tk−Lucレポータを有する33種類が活性を示し、8種類がERα選択性を示したが、4種類はERβ選択性を有した。
【実施例11】
【0060】
実施例11−MF101のフェーズI臨床試験終了後の実効可能性および毒性データ
フェーズIの治験をカリフォルニア州サンフランシスコ大学において実施し、閉経期と関連しているのぼせおよび他の症状を軽減するためのMF101の安全性と実効可能性を評価した。この試験は、少なくとも56回ののぼせが報告された年齢が50歳から65歳の31名の健常な閉経後女性での7日間の対照なしの非盲検治験であった。参加者を5グラムの顆粒状のMF101で治療した(温水と混合した粉末剤として、経口摂取、1日2回で30日間)。主要転帰の測定は安全性とし、副次的転帰には、のぼせの頻度の変化ならびに血清エストラジオール、膣成熟および骨再吸収マーカーに対する効果を含めた。試験は、30日間の導入(run−in)期間の後、30日間の試験薬物での治療期間を含むものとした。表7に、解析に含めた試験参加者の数、除外した人数および除外理由をまとめる。
【表7】

【0061】
平均すると、この治験を終了した試験参加者は、30日間の治療期間で、処方されたMF101用量の87.8%を摂取した。毒性データが入手可能な25名の参加者についてNCIの一般毒性基準により測定時、等級IIIまたはIVの有害事象は報告されなかった。試験参加者によって治験担当医に報告された有害事象は合計9例であり、場合によってはまたはおそらくMF101に関連していると分類された。NCIの一般毒性基準に従い、この有害事象のうち5例は等級Iに分類され、4例は等級IIの有害事象と記録された。報告された最も一般的な毒性は、わずかな吐き気または胃の膨満感であった(25名中4名の女性)。他の5例の有害事象は、以下の理由、すなわち頭痛、嗜眠、鬱、気分の変動および血圧の上昇によるものであった。試験参加者はいずれも、報告されたいずれの副作用にも治療を必要とせず、入院もみられなかった。
【0062】
ベースラインおよび試験終了時に血液および尿検査試験を受けた22名の参加者全員を、毒性の解析に含めた。全血球算定、化学検査、肝臓パネル、または血清中もしくは尿中のエストロゲンもしくはゴナドトロピンレベルに関するいずれの検査値にも統計学的に有意な変化は認められなかった。
【0063】
この試験は、主要エンドポイントとして有効性を測定するために設計されたものではなかったが、30日間の治療後、のぼせの頻度および重症度に統計学的に有意な低減が認められた。のぼせの平均頻度は、ベースライン時では57.3回/7日間であり、治療後では44.9回であった(p=0.003)。のぼせスコア(頻度に重症度を乗算)は、ベースライン時での98.0から治療後では81.7に減少した(p=0.03)。試験を終了した22名の女性のうち、18名(82%)は、30日間の試験薬物治療後、のぼせが少なくなったが、4名(18%)だけは多くなった。ベースライン時に測定された7日間に起こったのぼせの頻度は、試験薬物治療の最後の7日間と比較すると、22%の減少がみられた(p=0.0035)。また、30日間の治療後、のぼせスコア(頻度に重症度を乗算)でも17%の減少がみられた(p=0.031)。
【0064】
まとめると、予備臨床試験データは、MF101がのぼせの治療に対して安全であり、良好なコンプライアンスで実効可能に投与され得ることを示す。MF101は、のぼせの頻度および重症度を低減させた。しかしながら、その効果は小さかった。この試験の結果を表7Aに示す。この表は、22名のうち7名の患者が40%より高い閉経期症状の低減を示したことを示す。
【表7A】

【実施例12】
【0065】
実施例12−漸増用量試験
実施例11に示したものよりも期間が長く、高用量のMF101との比較を含めた、フェーズII試験のための二重盲検プラセボ対照比較無作為臨床試験を実施する。MF101の用量は、MF101の乾燥重量で5グラムを1日2回、およびMF101の乾燥重量で10グラムを1日2回とする。試験薬物治療は、ハーブティーの苦味に起因し得る胃腸の病訴の数の低減を意図して、および液状エキスの味のまずさによる試験の中止を最小限にするため、カプセル形態内に封入する。
【0066】
結論
ERαは乳癌細胞増殖を促進するが、ERβは増殖および腫瘍形成を抑止するという観察結果に基づき、ERβ選択的エストロゲンは、乳癌を促進させないはずであり、のぼせを抑制する可能性がある。本明細書における結果は、MF101が、遺伝子の転写をERβによって、補助調節タンパク質を選択的に漸増させることにより調節することを示す。ホルモン療法におけるエストロゲンとは異なり、MF101は、MCF−7細胞の増殖を刺激せず、増殖性遺伝子、c−mycおよびサイクリンD1も活性化させず、これは、MF101が乳癌を促進させないことを示す。上記の実施例11に概要を示した試験では、MF101がなんら有害効果を誘発せず、治験を終了した22名の女性のうち7名において、40%より高いのぼせの低減をもたらした。この結果は、MF101がERβ選択的エストロゲンを含むことを示し、MF101が、のぼせを抑制するためにホルモン療法で使用されている非選択的エストロゲンの、より安全な代替薬であることと整合する。
【0067】
多くの女性は、HTは有益性よりもリスクが勝ることが示された女性の健康イニシアチブの治験の結果以来、閉経期症状のためのHTに使用される安全で有効なエストロゲン代替薬を心待ちにしている。その一方で、最近の調査により、閉経周辺期および閉経後の女性の79%が、植物性の食品サプリメント(BDS)を使用していることが報告された。BDSが広く使用されているにも関わらず、植物性物質の作用機序、有効性および安全性は、厳密には調べられていなかった。MF101は、のぼせや他の更年期症状を軽減するための伝統的な漢方薬(Traditional Chinese Medicine)(TCM)に従来より使用されされている22種類の個々のハーブを含む配合物である。本明細書における結果は、MF101が、選択的エストロゲン受容体活性を有し、のぼせを抑制するために臨床的に使用され得ることを示す。
【0068】
MF101がERβ選択的であるという所見は、女性ののぼせの治療におけるERβ役割を調べるための、またとない機会を提供する。上記に論考したように、MF101の単群の前向きフェーズ1臨床試験を、年齢が40〜60歳であり、1日に≧7回の中等度から重度ののぼせ、または1週間に≧50回の中等度から重度のののぼせを訴える、外科的に誘導された、または自然な閉経後の健常な女性において行った。この治験の最初の30日間(導入期間)に、のぼせの頻度および重症度の毎日の一日の記録を含むベースライン転帰の測定、ならびに血液検査値、血液化学、肝機能、腎機能およびホルモンの状態の検査測定値を取得した。導入期間後、女性を、1日2回で30日間、5gmの経口MF101エキス(水で再構成)で治療した。治療期間の終了時、同じ転帰の測定を繰り返した。22名の女性がこの治験を終了した。のぼせの頻度と重症度の両方において、統計学的に有意な低減がみられた。のぼせの平均頻度は、1週間あたりののぼせが、ベースライン時での57.3から治療後では44.9に減少した(p=0.003、対応のあるt検定)(データ示さず)。また、のぼせスコア(頻度に重症度を乗算)も、ベースライン時では98.0から、治療後では81.7に減少した(p=0.031、対応のあるt検定)。7名の女性は、40%より高い(greater then)のぼせの低減を報告した(表1)。このデータは、MF101が、中等度から重度の症状を有する一部の女性において、のぼせの頻度および重症度を低減させることを示す。
【0069】
前述の実施例は、MF101が、ERβ媒介性転写経路のみを誘発することを示す。驚くべきことに、MF101は、精製ERαと精製ERβに等しく結合する。この観察結果は、精製ERとのリガンド結合活性についてのみ化合物をスクリーニングすることは、ERサブタイプ特異的化合物の有効な新薬発見ストラテジーとはなり得ないことを示す。MF101のERβ選択性は、ERβがEREに結合することを可能にし、補助調節因子(GRIP1およびCBPなど)が漸増するコンホメーションを構成する自身の能力に起因していることが示された。MF101によるERβへのコアクチベータの選択的な漸増は、ERαがMCF−7乳癌細胞の細胞増殖と腫瘍形成を媒介するのに対して、ERβはER陽性乳癌細胞において腫瘍抑制因子としての機能を果たすため、臨床的に重要である(Paruthiyil,S.ら、「Estrogen receptor β inhibits human breast cancer cell proliferation and tumor formation by causing a G2 cell cycle arrest」、Cancer Res.64,423−8(2004)、Strom,A.ら、「Estrogen receptor β inhibits 17beta−estradiol−stimulated proliferation of the breast cancer cell line T47D」、Proc.Natl.Acad.Sci.USA 101,1566−71(2004))。ERαへのコアクチベータの漸増の欠如は、MF101がc−mycおよびサイクリンD1の転写を活性化せず、MCF−7細胞の増殖も刺激しなかったという観察結果の説明となり得る。
【実施例13】
【0070】
調製例13−多種類の活性物質のハイスループットLC−MS/MS定量
調製例1に開示した22種類の乾燥ハーブ材料を粉砕し、メタノール/水(80/20)溶液で30分間抽出し(室温、500rpm)、次いで、5分間(4℃、13,000rpm)遠心分離した。上清みをタンパク質沈殿用バイアル(viald)に移した。12種類のポリフェノール系化合物(ニアソール、リクイリチン、リキリチゲニン、イソリキリチゲニン、カリコシン、四環系イソフラボン、エモジン、レイン、ルテオリン、7,4’−ジヒドロキシフラボン、スクテラリンおよびスクテラレイン)を、メタノール/水(80/20)溶液中にスパイクすることにより、検量物質を作製した。内部標準(2’,4’−ジヒドロキシカルコン)を含むメタノールを、標準物質、QCおよびハーブエキスに、タンパク質沈殿のために添加した。生物学的試料調製物は、抽出時間を短くしたこと(5分)以外は同様にして取り扱った。上清み(20μL)をオンライン抽出カラム上にインジェクトした。切り替え弁を作動させ、被検物質を分析用カラムにバックフラッシュさせた。被検物質を分離し、API5000 MS/MSシステムにてターボスプレーネガティブSRMモードで定量した。
【0071】
予備結果
ハイスループットで感度のよいLC−MS/MS法による、中国漢方薬および種々の生物学的マトリクス中の多種類の生体活性物質−ポリフェノール系化合物の同時定量を開発し、異なるマトリクス、すなわちヒト血漿、ヒト尿、イヌ血漿、ラット血漿、マウス血漿および種々の比率の水溶液/メタノール溶液において確認した。
【0072】
試料調製物および抽出手順は充分に最適化した。試料の振盪時間は、生物学的試料およびハーブエキスで、それぞれ5分および30分とした(500rpm、室温)。至適遠心分離時間は、すべての試料で、13,000rpmにて15分間(4℃)であった。内部標準を含む抽出溶媒として使用したものは100%メタノールであった。抽出時の絶対回収率は>85%であった。予備結果により、血漿(ヒト、ラット、イヌ、マウス)中での5回の凍結解凍サイクルでは、変化はないことが示された。生物学的試料中の活性物質はすべて、高温環境(室温、℃)で保存した場合、少なくとも2日間(これは、分析者が充分に解析手順を遂行できる時間である)安定であった。より低温(−20、−80℃)では、数ヶ月間安定である。抽出された活性物質は、自動試料採取装置(4℃)では、2日間にわたって安定である。被検物質シグナルによるイオン抑制干渉は検出されなかった。ブランク血漿またはメタノールでの試料の100倍までの希釈は、正確度に影響しなかった。
【0073】
この方法は高感度である。0.025〜100ng/mLの範囲の線形性は、種々のマトリクスの種々の活性物質に依存した。カラムの定量下限(LLOQ)は、ほとんどの活性物質(例えば、リキリチゲニン(liquitigenin)、カリコシン、イソリキリチゲニンおよびレイン)で0.5pgであった。リクイリチン、ルテオリンおよび7,4’−ジヒドロキシフラボンは、カラム上で1pgのLLOQレベルを有する。ニアソール、スクテラリンおよびスクテラレインは、10pgのLLOQを有する。このアッセイは、所定の許容基準をすべて満たし、大規模薬物動態試験に好適である。
【0074】
実験
試料の調製および機器
タンパク質沈殿/内部標準溶液(2’,4’−ジヒドロキシカルコン、100%MeOH中)は、ストック溶液(1mg/mL)から毎月、新たに調製し、使用のために4℃で保存した(室温に6時間より長く曝露すべきでなく、抽出から次の抽出までは4℃で保存しなければならない)。この溶液は、標準物質、QCおよび試料(生物学的試料またはハーブエキス)に、タンパク質沈殿のために添加した。試料を室温で解凍後、組織試料を0.1Mのリン酸バッファー中で均質化し、終濃度を250mg/mLとした。試料は、37℃で30分間(血漿)または2時間(組織)インキュベートする。タンパク質沈殿用試薬(600μL)を試料(300μL)に添加し、回転式振盪機にて2.5分間(組織の場合は30分間)、500RPMおよび室温で混合した。次いで、試料を13,000RPMで4℃にて15分間遠心分離した。乾燥ハーブ材料を磨砕して粉末にし、次いで、メタノール/水(80/20、v/v)で30分間室温にて、回転式振盪機において30分間抽出した。13種類のポリフェノール化合物(BNER1101、BNER1103、BNER1104、BNER1105、BNER1106、BNER1108、BNER1109、BNER1112、BNER1114、BNER1115、BNAC5501、BNAC5502およびBNAC5503)を、全試験マトリクス中にスパイクすることにより検量物質を作製した。次いで、上清み(20μL)を、API5000 MS/MSと組み合わせたAgilent 1200 2D−HPLCシステムにインジェクトした。使用した移動相は、MeOH(100%)および0.088%ギ酸含有水であった。線形勾配は、40%MeOHから開始し、4分間で100%MeOHまで傾斜させた。全泳動時間は8分間であった。カラム温度は65℃に設定した。イオンはネガティブSRMモードで記録した。以下のイオン輸送を主な活性物質についてモニタリングした。BNER1101:m/z=251→93、BNER1103:m/z=417→255、BNER1104:m/z=255→135または255→119、BNER1105:m/z=283→268、BNER1106:m/z=255→119、BNER1115:m/z=253→117およびIS:m/z=239→91。
【0075】
結果および結論
ハイスループットで感度のよいLC−MS/MS法を用いた、生物学的試料および漢方薬草エキス中の多種類の生体活性ポリフェノール化合物の同時定量を開発し、種々のマトリクス、すなわちヒト血漿、ヒト尿、イヌ血漿、ラット血漿、マウス血漿、ラット肝臓および種々の比率の水溶液/メタノール溶液において確認した。このアッセイは、ヒト血漿で充分に確認された。図1は、すべての活性物質および内部標準のLC−MS/MSクロマトグラムである。
【0076】
6種類の主な活性成分の抽出効率試験では、80%より高い回収率が示された(図14)。この方法はハイスループットで感度がよく、すべての活性物質に対して広い線形性を有した。検出限界(LOD)は、BNER1101、BNER1104、BNER1105およびBNER1106では0.025ng/mL、BNER1101では0.1ng/mL、およびBNER1115では0.25ng/mLであった。LODはすべて、3:1より大きい信号雑音比に基づいたものであった。定量下限(LLOQ)は、BNER1101(0.5ng/mL)、BNER1106(0.1ng/mL)およびBNER1115(0.5ng/mL)以外のすべての活性物質で0.05ng/mLであった。LLOQの信号雑音比は8より大きかった。この方法の検量曲線は、BNER1103、BNER1104およびBNER1105では0.05から50ng/mLまで線形であり、BNER1106では0.1から50ng/mLまで線形であり、BNER1115およびBNER1101では、0.5から50ng/mLまで線形であった(すべてn=6)。線形範囲は、0.995より大きいの回帰係数(r)によって判定した。6つの生物学的マトリクスの6種類の主な活性物質の典型的な標準曲線パラメータを図12および表8に示す。
【表8】

【0077】
1日のうちでの正確度は、±10%(91.8〜108.9%)よりも良好であり、1日のうちでの精密度は14%よりも良好であった。また、このアッセイを、いくつかの生物学的マトリクス(イヌ血漿、ラット血漿、マウス血漿、ヒト尿およびラット肝臓)ならびに種々の組み合わせのMeOH/水溶媒(80/20 MeOH/H2O、50/50 MeOH/H2Oおよび100%H2O)でも確認した。この確認は、異なる分析者が異なる機器(API5000およびAPI4000 QTrap)で行った。
【0078】
該6種類の被検物質と内部標準からなるストック溶液は、室温で少なくとも6時間安定である。機器のインジェクション再現性は高く、精密度は、95%インジェクションで6%よりも良好であった。3回の凍結解凍サイクル後、活性物質はすべて、すべての濃度レベルで分解は観察されなかった(図13)。ほとんどの被検物質は、5回のサイクル後も回収率はなお高かった。BNER1106を除き(これは、5回のサイクル後、回収率はほぼ75%であった)、94%より高い回収率が得られ得る。ヒト血漿中での6種類のMF101活性物質は安定であり、低濃度レベルおよび中濃度レベルのどちらの場合も、室温で保存時、24時間以内に有意な分解は観察されなかった。
【0079】
まとめると、BNER1101、BNER1103、BNER1104、BNER1105、BNER1106、BNER1115の定量のため、およびヒト、マウス、ラットおよびイヌ血漿、ならびにヒト尿、ラット肝臓および種々の組み合わせのMeOH/水における、所定の許容基準をすべて満たしたLC/LC−MS/MSアッセイの開発および確認。
【0080】
本発明の好ましい実施形態を本明細書において示し、記載したが、かかる実施形態は単なる一例として示したものであることは、当業者に自明であろう。本明細書において本発明を逸脱することなく、数多くの変形例、変更例および置換例が当業者に想起されよう。本発明の実施において、本明細書に記載の本発明の実施形態に対する種々の択一例が使用され得ることを理解されたい。以下の特許請求の範囲が本発明の範囲を規定し、この特許請求の範囲の範囲に含まれる方法および構造ならびにその均等物は特許請求の範囲に包含されるものとする。
【0081】
本発明の好ましい実施形態を本明細書において示し、記載したが、かかる実施形態は単なる一例として示したものであることは、当業者に自明であろう。本明細書において本発明を逸脱することなく、数多くの変形例、変更例および置換例が当業者に想起されよう。本発明の実施において、本明細書に記載の本発明の実施形態に対する種々の択一例が使用され得ることを理解されたい。以下の特許請求の範囲が本発明の範囲を規定し、この特許請求の範囲の範囲に含まれる方法および構造ならびにおよびその均等物は特許請求の範囲に包含されるものとする。
【図1】

【図2】

【図3】

【特許請求の範囲】
【請求項1】
Herba Scutellaria Barbata、Radix Sophora Subprostratae、Radix Anamarrhena、Semen Glycine Sojae、Radix Glycyrrhiza、Rhizoma Rhei、Fructus Tritici Levis、Radix Astragali、Radix Rehmania、Fructus Ligustri Lucidi、Semen Zyziphi Spinozae、Plumula Nelumbinis、Poria Cocos、Rhizoma Alismatis、Cortex Moutan Radicis、Fructus Corni、Radix Achyranthis、Concha Ostrea、Radix Aspargi、Radix Pueraria、Radix Atractylodis MacrocephalaおよびHerba Epimediaの混合物のエキスの活性物質の定量方法であって、
(a)前記エキスからタンパク質を沈殿させ、上清みを単離することと、
(b)前記上清みを抽出媒体上にインジェクトし、溶出液を前記抽出媒体から収集することと、
(c)(b)の溶出液をMS/MS分離および定量に供し、それにより、前記活性物質の定量を得ることと、
を含む方法。
【請求項2】
前記タンパク質沈殿(a)がタンパク質分離用バイアル内で行われる、請求項1に記載の方法。
【請求項3】
前記抽出媒体が抽出カラムである、請求項1に記載の方法。
【請求項4】
前記MS/MS分離および定量が、API5000 MS/MSシステムにおいてターボスプレーネガティブSRMモードで行われる、請求項1に記載の方法。
【請求項5】
前記活性物質が(i)ERαおよび/またはERβの存在下でのERE−tk−Lucアッセイの活性化を特徴とする、(ii)および/または前記活性物質がERαおよび/またはERβの存在下でのTNF−RE−Lucアッセイの活性化を特徴とする、請求項1に記載の方法。
【請求項6】
請求項1から請求項5のいずれか一項に記載の単離分離された活性物質。
【請求項7】
1つ以上の閉経期症状の治療のための医薬の調製のための請求項1から請求項6のいずれか一項に記載の単離分離された前記活性物質の使用。
【請求項8】
1つ以上のエストロゲン関連の病状または疾患状態の治療のための医薬の調製のための請求項1から請求項6のいずれか一項に記載の単離分離された前記活性物質の使用。
【請求項9】
患者に、請求項1から請求項5に記載の1種類以上の単離分離された活性物質を含む組成物を投与することを含む、閉経期の治療方法。
【請求項10】
患者に、請求項1から請求項5に記載の1種類以上の単離分離された活性物質を含む組成物を投与することを含む、エストロゲン媒介性の病状または疾患状態の治療方法。
【請求項11】
前記治療が、少なくとも1つの閉経期症状の重症度または頻度の低減を含む、請求項10に記載の方法。
【請求項12】
前記閉経期症状がのぼせである、請求項11に記載の方法。
【請求項13】
前記閉経期症状が、疲労感、イライラ感、不眠、集中力の低下、鬱、記憶力の減退、頭痛、不安感、神経質、断続的なめまい、感覚異常、動悸、頻脈、吐き気、便秘、下痢、関節痛、筋肉痛、手足の冷え、体重増加、尿失禁、膣乾燥および骨盤筋の緊張の低下からなる群より選択される、請求項12に記載の方法。
【請求項14】
患者に投与される前記活性物質の量が患者の体重1kgあたり約0.1〜10mgの前記1種類以上の組成物である、請求項10に記載の閉経期症状の治療方法。
【請求項15】
生物学的試料から活性物質を単離し、前記活性物質を定量する方法であって、前記活性物質が、Herba Scutellaria Barbata、Radix Sophora Subprostratae、Radix Anamarrhena、Semen Glycine Sojae、Radix Glycyrrhiza、Rhizoma Rhei、Fructus Tritici Levis、Radix Astragali、Radix Rehmania、Fructus Ligustri Lucidi、Semen Zyziphi Spinozae、Plumula Nelumbinis、Poria Cocos、Rhizoma Alismatis、Cortex Moutan Radicis、Fructus Corni、Radix Achyranthis、Concha Ostrea、Radix Aspargi、Radix Pueraria、Radix Atractylodis MacrocephalaおよびHerba Epimediaの混合物のエキス由来のエストロゲン様化合物であり、
(a)前記生物学的試料からタンパク質を沈殿させ、上清みを単離することと、
(b)前記上清みを抽出媒体上にインジェクトし、溶出液を前記抽出媒体から収集することと、
(c)(b)の溶出液をMS/MS分離および定量に供し、それにより、前記活性物質の定量を得ることと、
を含む方法。
【請求項16】
前記生物学的試料が、血液、器官または尿試料などの哺乳動物組織試料である、請求項15に記載の方法。
【請求項17】
前記生物学的試料が、血液試料(例えば、血漿試料)、尿試料、肝臓試料、乳房組織試料、卵巣組織試料、子宮組織試料、外陰部組織試料、膣組織試料、頚部組織試料、ファローピウス管組織試料、子宮内膜組織試料、リンパ節組織試料および/または骨組織試料である、請求項16に記載の方法。
【請求項18】
前記哺乳動物組織試料が、ヒト血漿試料、ヒト尿試料、イヌ血漿試料、マウス血漿試料またはラット肝臓試料である、請求項16に記載の方法。
【請求項19】
前記タンパク質沈殿(a)がタンパク質分離用バイアル内で行われる、請求項15に記載の方法。
【請求項20】
前記抽出媒体が抽出カラムである、請求項15に記載の方法。
【請求項21】
前記MS/MS分離および定量が、API5000 MS/MSシステムにおいてターボスプレーネガティブSRMモードで行われる、請求項15に記載の方法。
【請求項22】
前記活性物質が(i)ERαおよび/またはERβの存在下でのERE−tk−Luc活性化を特徴とする、(ii)および/または活性物質がERαおよび/またはERβの存在下でのTNF−RE−Lucアッセイの活性化を特徴とする、請求項15に記載の方法。
【請求項23】
(a)Herba Scutellaria Barbata、Radix Sophora Subprostratae、Radix Anamarrhena、Semen Glycine Sojae、Radix Glycyrrhiza、Rhizoma Rhei、Fructus Tritici Levis、Radix Astragali、Radix Rehmania、Fructus Ligustri Lucidi、Semen Zyziphi Spinozae、Plumula Nelumbinis、Poria Cocos、Rhizoma Alismatis、Cortex Moutan Radicis、Fructus Corni、Radix Achyranthis、Concha Ostrea、Radix Aspargi、Radix Pueraria、Radix Atractylodis MacrocephalaおよびHerba Epimediaを組み合わせ、ハーブ混合物を形成することと、
(b)前記ハーブ混合物を、抽出溶媒での抽出に供することと、
(c)前記ハーブ混合物を水から分離してエキスを形成し、任意選択で、前記エキスからタンパク質を沈殿させることと、
(d)前記エキスから活性物質を分離することと、
(e)前記(d)の活性物質の1種類以上を少なくとも1種類の薬学的に許容され得る成分と組み合わせ、それにより医薬を形成することと、
を含む、医薬の調製方法。
【請求項24】
前記ハーブ混合物中のハーブ成分を下記の表:
【表1】

に示した割合で組み合わせる、前記請求項のいずれか一項に記載の方法。
【請求項25】
前記ハーブ混合物中のハーブ成分を下記の表:
【表2】

に示した割合で組み合わせる、前記請求項のいずれか一項に記載の方法。
【請求項26】
前記ハーブ混合物中のハーブ成分を下記の表:
【表3】

1 概算割合(全組成物に対する重量パーセント)
に示した割合で組み合わせる、前記請求項のいずれか一項に記載の方法。
【請求項27】
前記混合物が、本質的に前記表に示した割合のハーブ成分からなる、請求項26に記載の方法。
【請求項28】
(i)推定活性物質がERα結合EREおよびERβ結合EREを活性化する能力を測定することと、
(ii)推定活性物質が前記ERα結合EREおよび前記ERβ結合EREを活性化する能力を比較し、それにより、ERβ結合EREをERβ結合EREよりも高い程度で活性化する推定活性物質を活性であると判定することと、
を含む、前記請求項のいずれか一項に記載の1種類以上の活性物質の特性評価方法。
【請求項31】
前記活性物質が乳癌細胞の増殖を刺激する能力を評価することと、乳癌細胞増殖の刺激を実質的に示さない活性物質を閉経期の治療薬として選択することとをさらに含む、請求項28に記載の方法。
【請求項32】
前記閉経期の治療薬が示す乳癌細胞増殖の刺激が約10%未満である、請求項29に記載の方法。
【請求項33】
前記閉経期の治療薬が示す乳癌細胞増殖の刺激が約5%未満である、請求項30に記載の方法。
【請求項34】
前記閉経期の治療薬が、対照と比べて乳癌細胞増殖の刺激を実質的に示さない、請求項31に記載の方法。
【請求項1】
Herba Scutellaria Barbata、Radix Sophora Subprostratae、Radix Anamarrhena、Semen Glycine Sojae、Radix Glycyrrhiza、Rhizoma Rhei、Fructus Tritici Levis、Radix Astragali、Radix Rehmania、Fructus Ligustri Lucidi、Semen Zyziphi Spinozae、Plumula Nelumbinis、Poria Cocos、Rhizoma Alismatis、Cortex Moutan Radicis、Fructus Corni、Radix Achyranthis、Concha Ostrea、Radix Aspargi、Radix Pueraria、Radix Atractylodis MacrocephalaおよびHerba Epimediaの混合物のエキスの活性物質の定量方法であって、
(a)前記エキスからタンパク質を沈殿させ、上清みを単離することと、
(b)前記上清みを抽出媒体上にインジェクトし、溶出液を前記抽出媒体から収集することと、
(c)(b)の溶出液をMS/MS分離および定量に供し、それにより、前記活性物質の定量を得ることと、
を含む方法。
【請求項2】
前記タンパク質沈殿(a)がタンパク質分離用バイアル内で行われる、請求項1に記載の方法。
【請求項3】
前記抽出媒体が抽出カラムである、請求項1に記載の方法。
【請求項4】
前記MS/MS分離および定量が、API5000 MS/MSシステムにおいてターボスプレーネガティブSRMモードで行われる、請求項1に記載の方法。
【請求項5】
前記活性物質が(i)ERαおよび/またはERβの存在下でのERE−tk−Lucアッセイの活性化を特徴とする、(ii)および/または前記活性物質がERαおよび/またはERβの存在下でのTNF−RE−Lucアッセイの活性化を特徴とする、請求項1に記載の方法。
【請求項6】
請求項1から請求項5のいずれか一項に記載の単離分離された活性物質。
【請求項7】
1つ以上の閉経期症状の治療のための医薬の調製のための請求項1から請求項6のいずれか一項に記載の単離分離された前記活性物質の使用。
【請求項8】
1つ以上のエストロゲン関連の病状または疾患状態の治療のための医薬の調製のための請求項1から請求項6のいずれか一項に記載の単離分離された前記活性物質の使用。
【請求項9】
患者に、請求項1から請求項5に記載の1種類以上の単離分離された活性物質を含む組成物を投与することを含む、閉経期の治療方法。
【請求項10】
患者に、請求項1から請求項5に記載の1種類以上の単離分離された活性物質を含む組成物を投与することを含む、エストロゲン媒介性の病状または疾患状態の治療方法。
【請求項11】
前記治療が、少なくとも1つの閉経期症状の重症度または頻度の低減を含む、請求項10に記載の方法。
【請求項12】
前記閉経期症状がのぼせである、請求項11に記載の方法。
【請求項13】
前記閉経期症状が、疲労感、イライラ感、不眠、集中力の低下、鬱、記憶力の減退、頭痛、不安感、神経質、断続的なめまい、感覚異常、動悸、頻脈、吐き気、便秘、下痢、関節痛、筋肉痛、手足の冷え、体重増加、尿失禁、膣乾燥および骨盤筋の緊張の低下からなる群より選択される、請求項12に記載の方法。
【請求項14】
患者に投与される前記活性物質の量が患者の体重1kgあたり約0.1〜10mgの前記1種類以上の組成物である、請求項10に記載の閉経期症状の治療方法。
【請求項15】
生物学的試料から活性物質を単離し、前記活性物質を定量する方法であって、前記活性物質が、Herba Scutellaria Barbata、Radix Sophora Subprostratae、Radix Anamarrhena、Semen Glycine Sojae、Radix Glycyrrhiza、Rhizoma Rhei、Fructus Tritici Levis、Radix Astragali、Radix Rehmania、Fructus Ligustri Lucidi、Semen Zyziphi Spinozae、Plumula Nelumbinis、Poria Cocos、Rhizoma Alismatis、Cortex Moutan Radicis、Fructus Corni、Radix Achyranthis、Concha Ostrea、Radix Aspargi、Radix Pueraria、Radix Atractylodis MacrocephalaおよびHerba Epimediaの混合物のエキス由来のエストロゲン様化合物であり、
(a)前記生物学的試料からタンパク質を沈殿させ、上清みを単離することと、
(b)前記上清みを抽出媒体上にインジェクトし、溶出液を前記抽出媒体から収集することと、
(c)(b)の溶出液をMS/MS分離および定量に供し、それにより、前記活性物質の定量を得ることと、
を含む方法。
【請求項16】
前記生物学的試料が、血液、器官または尿試料などの哺乳動物組織試料である、請求項15に記載の方法。
【請求項17】
前記生物学的試料が、血液試料(例えば、血漿試料)、尿試料、肝臓試料、乳房組織試料、卵巣組織試料、子宮組織試料、外陰部組織試料、膣組織試料、頚部組織試料、ファローピウス管組織試料、子宮内膜組織試料、リンパ節組織試料および/または骨組織試料である、請求項16に記載の方法。
【請求項18】
前記哺乳動物組織試料が、ヒト血漿試料、ヒト尿試料、イヌ血漿試料、マウス血漿試料またはラット肝臓試料である、請求項16に記載の方法。
【請求項19】
前記タンパク質沈殿(a)がタンパク質分離用バイアル内で行われる、請求項15に記載の方法。
【請求項20】
前記抽出媒体が抽出カラムである、請求項15に記載の方法。
【請求項21】
前記MS/MS分離および定量が、API5000 MS/MSシステムにおいてターボスプレーネガティブSRMモードで行われる、請求項15に記載の方法。
【請求項22】
前記活性物質が(i)ERαおよび/またはERβの存在下でのERE−tk−Luc活性化を特徴とする、(ii)および/または活性物質がERαおよび/またはERβの存在下でのTNF−RE−Lucアッセイの活性化を特徴とする、請求項15に記載の方法。
【請求項23】
(a)Herba Scutellaria Barbata、Radix Sophora Subprostratae、Radix Anamarrhena、Semen Glycine Sojae、Radix Glycyrrhiza、Rhizoma Rhei、Fructus Tritici Levis、Radix Astragali、Radix Rehmania、Fructus Ligustri Lucidi、Semen Zyziphi Spinozae、Plumula Nelumbinis、Poria Cocos、Rhizoma Alismatis、Cortex Moutan Radicis、Fructus Corni、Radix Achyranthis、Concha Ostrea、Radix Aspargi、Radix Pueraria、Radix Atractylodis MacrocephalaおよびHerba Epimediaを組み合わせ、ハーブ混合物を形成することと、
(b)前記ハーブ混合物を、抽出溶媒での抽出に供することと、
(c)前記ハーブ混合物を水から分離してエキスを形成し、任意選択で、前記エキスからタンパク質を沈殿させることと、
(d)前記エキスから活性物質を分離することと、
(e)前記(d)の活性物質の1種類以上を少なくとも1種類の薬学的に許容され得る成分と組み合わせ、それにより医薬を形成することと、
を含む、医薬の調製方法。
【請求項24】
前記ハーブ混合物中のハーブ成分を下記の表:
【表1】

に示した割合で組み合わせる、前記請求項のいずれか一項に記載の方法。
【請求項25】
前記ハーブ混合物中のハーブ成分を下記の表:
【表2】

に示した割合で組み合わせる、前記請求項のいずれか一項に記載の方法。
【請求項26】
前記ハーブ混合物中のハーブ成分を下記の表:
【表3】

1 概算割合(全組成物に対する重量パーセント)
に示した割合で組み合わせる、前記請求項のいずれか一項に記載の方法。
【請求項27】
前記混合物が、本質的に前記表に示した割合のハーブ成分からなる、請求項26に記載の方法。
【請求項28】
(i)推定活性物質がERα結合EREおよびERβ結合EREを活性化する能力を測定することと、
(ii)推定活性物質が前記ERα結合EREおよび前記ERβ結合EREを活性化する能力を比較し、それにより、ERβ結合EREをERβ結合EREよりも高い程度で活性化する推定活性物質を活性であると判定することと、
を含む、前記請求項のいずれか一項に記載の1種類以上の活性物質の特性評価方法。
【請求項31】
前記活性物質が乳癌細胞の増殖を刺激する能力を評価することと、乳癌細胞増殖の刺激を実質的に示さない活性物質を閉経期の治療薬として選択することとをさらに含む、請求項28に記載の方法。
【請求項32】
前記閉経期の治療薬が示す乳癌細胞増殖の刺激が約10%未満である、請求項29に記載の方法。
【請求項33】
前記閉経期の治療薬が示す乳癌細胞増殖の刺激が約5%未満である、請求項30に記載の方法。
【請求項34】
前記閉経期の治療薬が、対照と比べて乳癌細胞増殖の刺激を実質的に示さない、請求項31に記載の方法。
【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】




【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【公表番号】特表2011−523713(P2011−523713A)
【公表日】平成23年8月18日(2011.8.18)
【国際特許分類】
【出願番号】特願2011−512718(P2011−512718)
【出願日】平成21年6月5日(2009.6.5)
【国際出願番号】PCT/US2009/046496
【国際公開番号】WO2009/149411
【国際公開日】平成21年12月10日(2009.12.10)
【出願人】(507200569)バイオノボ・インコーポレーテッド (24)
【Fターム(参考)】
【公表日】平成23年8月18日(2011.8.18)
【国際特許分類】
【出願日】平成21年6月5日(2009.6.5)
【国際出願番号】PCT/US2009/046496
【国際公開番号】WO2009/149411
【国際公開日】平成21年12月10日(2009.12.10)
【出願人】(507200569)バイオノボ・インコーポレーテッド (24)
【Fターム(参考)】
[ Back to top ]

