検体の監視および薬物送達のための医療デバイス
【課題】疾患マーカである生物学的検体と相互に作用することのできる生物活性因子を含むマイクロアレイと、少なくとも1つの治療薬を含み、医療デバイスを提供する。
【解決手段】該治療薬を放出することのできるリザーバと、疾患マーカである生物学的検体と生物活性因子との間の相互作用の物理的パラメータデータを取得することのできるマイクロアレイ走査デバイスを含む複数のマイクロチップと、物理的パラメータデータを検体の相互作用プロファイルと比較することのできる生体測定認識デバイスと、状況に応じてリザーバからの治療薬の放出を制御することのできる治療薬放出デバイスと、マイクロアレイ走査デバイス、生体測定認識デバイスおよび治療薬放出デバイス間の連絡を促進することのできるインターフェースデバイスと、医療デバイスに動力を供給するためのエネルギー源とを備える、摂取可能、埋め込み可能または装着可能な医療デバイスを構成する。
【解決手段】該治療薬を放出することのできるリザーバと、疾患マーカである生物学的検体と生物活性因子との間の相互作用の物理的パラメータデータを取得することのできるマイクロアレイ走査デバイスを含む複数のマイクロチップと、物理的パラメータデータを検体の相互作用プロファイルと比較することのできる生体測定認識デバイスと、状況に応じてリザーバからの治療薬の放出を制御することのできる治療薬放出デバイスと、マイクロアレイ走査デバイス、生体測定認識デバイスおよび治療薬放出デバイス間の連絡を促進することのできるインターフェースデバイスと、医療デバイスに動力を供給するためのエネルギー源とを備える、摂取可能、埋め込み可能または装着可能な医療デバイスを構成する。
【発明の詳細な説明】
【技術分野】
【0001】
(発明の背景)
(1.発明の分野)
本発明は、診断および薬物送達の分野に関する。より詳細には、本発明は、体液検体の
レベルを監視し、状況に応じて適切な治療薬を放出することのできる医療デバイスおよび
方法に関する。
【背景技術】
【0002】
(2.背景)
生体高分子の活性または薬物の濃度レベルを検出することのできる「ポイントオブケア
」デバイスは、それらが患者の検査室訪問の必要性を排除し、従って時間と費用の両方を
節約することができるため、需要が高い。現代のマイクロアレイ技術の最も価値ある側面
の1つは、疾患を招く生体高分子の機能不全、奇形または突然変異を検出する能力である
。しかしながら、そのようなアレイが摂取可能、埋め込み可能または装着可能なポイント
オブケアデバイス内に組み込まれていないために、この能力は、十分に生かされていない
。現代のマイクロアレイ技術は、機械の内部に挿入されることになるスライド上に安定化
された固定化検体の分析によるか、または生体の外部で手作業で分析した生体高分子およ
びそれらの代謝産物の特性付けに限定されている。
全血は細胞、血小板、無数の蛋白質および他の高分子を含んでいるため、血液を含むアッ
セイは一般に、これらの成分を除去するための試料の前処理を必要とする。前処理ステッ
プをポイントオブケアデバイス内に統合することは、デバイス自体にかかるコストを押し
上げ、従って、デバイスの使用を財政的に実行不可能とする。例えば、現在市販されてい
る一部のデバイスは、それらのアッセイに全血を使用しており、それらの中には、血液に
よって運ばれる検体(コレステロールがその代表である)を測定するためのBoehri
nger MannheimのReflotron(商標)システム、および電解質、一
般的化学反応、血液ガスおよび血液学を含むいくつかの集中治療用アッセイを行うiSt
at(商標)(iStat Inc.)がある。Reflotron(商標)は、酵素ま
たは他の反応性要素がテストストリップの表面上に固定化されるドライケミストリー技術
に依存している。そのアッセイは、反応が変色を引き起こし、従って存在する検体の量を
示す、熱量計による活性度アッセイである。iStat(商標)は、電気化学検出に依存
して、信号を生成する。どちらの場合にも、血液試料が別個に取られ(一般に指を刺すこ
とによって)、ついでチップ(またはiStatの場合はカートリッジ)上に配置され、
そこで反応が生じ、外部の検出装置で分析される。これらの既存の監視システムは、それ
らが通常、使用者が自身に針を刺し、かつ1つの結果を得るのに多くのステップを必要と
するので、不十分かつ不都合である。従って、血液などの体液を、繰り返し、自動的かつ
正確に監視することのできる装着可能なデバイスに対する必要性が存在する。
【0003】
ポイントオブケアデバイスは、血液、尿、大便などの全身性生体試料が疾患の存在場所
におけるわずかな分子変化に関する適切な情報を提供することができない特定の状況にお
いても有益である。そのような場合、臨床家が病気の正確な存在部位を特定することがで
きたとしても、分析用の生体試料を採取することは、患者にとっての大きなリスク、痛み
および出費となるだけである。さらに、ポイントオブケアデバイスは、治療すべき疾患が
限局性のものである場合においても、経皮的手段または経静脈的手段のような薬剤の全身
投与によって身体が全体として治療される場合には、ポイントオブケアデバイスは望まし
いであろう。この場合、薬剤は治療を意図されていない身体部分に対して望ましくない影
響があることが多いため、または身体の罹患部の治療は全身投与では達成不可能であるか
もしれない薬剤の高集積を必要とするため、全身投与は望ましくないかもしれない。例え
ば、ある患者に全身的に投与した場合、一部の薬物(例えば、癌および他の増殖性疾患を
治療するために用いられるもののような化学療法薬)は、望ましくない副作用を引き起こ
す可能性がある。従って、疾患を検出し、体内の局所部位に薬剤を投与することが望まし
いことが多い。
【0004】
従って、生体高分子の活性または薬物の濃度レベルを検出することができ、生体高分子
の活性もしくは薬物の濃度レベルの変化に応じて体内の局所部位に特定の治療薬を投与す
ることもできるポイントオブケアデバイスに対する要望がある。本明細書に引用するすべ
ての論文、広報および特許は、それらの全体が、引用により組み込まれる。さらに、20
03年9月11日に提出された特許仮出願第60/501、847号も、引用により本明
細書に組み込まれる。
【発明の開示】
【課題を解決するための手段】
【0005】
(発明の概要)
本発明の一態様は、疾患マーカである生物学的検体と相互に作用することのできる生物
活性因子を含むマイクロアレイと、少なくとも1つの治療薬を含み、かつ該治療薬を医療
デバイスから放出することのできるリザーバと、疾患マーカである生物学的検体と生物活
性因子との間の相互作用の物理的パラメータデータを取得することのできるマイクロアレ
イ走査デバイスを含む複数のマイクロチップと、物理的パラメータデータを検体の相互作
用プロファイルと比較することのできる生体測定認識デバイスと、リザーバからの治療薬
の放出を制御することのできる治療薬放出デバイスと、マイクロアレイ走査デバイス、生
体測定認識デバイスおよび治療薬放出デバイス間の連絡を促進することのできるインター
フェースデバイスと、医療デバイスに動力を供給するためのエネルギー源とを備える医療
デバイスに関する。
【0006】
本発明のこの態様の一実施形態では、本デバイスは、被膜を施されており、被膜は、チ
ャネルを有することのできる生体安定性ポリマーである。本発明のこの態様の別の実施形
態では、このポリマーは、多孔質である。
【0007】
別の実施形態では、体液は、圧力差を用いて分子をマイクロアレイに沿って移動させる
マイクロ流体路を通じて輸送される。一実施形態では、浸透圧ポンプを用いて、本デバイ
スの最上部を通して流体を前進させる。別の実施形態では、パーソナルエリアネットワー
ク技術によって伝導される体内の自然な電流によって、流体輸送に動力が供給される。
【0008】
本発明のこの態様のさらに別の実施形態では、マイクロアレイは、マイクロビーズを備
える。別の実施形態では、生物活性因子は、核酸である。さらに別の実施形態では、生物
活性因子は、ポリペプチドである。さらに別の実施形態では、生物活性因子は、免疫グロ
ブリンである。
【0009】
本発明の医療デバイスの追加の実施形態では、生物活性因子は、蛍光標識されている。
別の実施形態では、生物活性因子は、ナノ結晶で蛍光標識されている。
【0010】
さらに別の実施形態では、疾患マーカである生物学的検体は、核酸である。さらに別の
実施形態では、疾患マーカである生物学的検体は、ポリペプチドである。別の実施形態で
は、疾患マーカである生物学的検体は、免疫グロブリンである。
【0011】
さらにもう一つ別の実施形態では、複数のマイクロチップは、シリコンゲルマニウムを
含む。
【0012】
別の実施形態では、マイクロアレイ走査デバイスは、光ファイバ素子を備える。
【0013】
追加の実施形態では、検体の相互作用プロファイルは、生体測定認識デバイスに格納さ
れる。代替的実施形態では、検体の相互作用プロファイルは、本医療デバイスの外部に格
納される。
【0014】
別の実施形態では、本医療デバイスは、複数のリザーバを有する。追加の実施形態では
、インターフェースデバイスは、パーソナルエリアネットワークを備える。
【0015】
追加の実施形態では、エネルギー源は、電池である。代替的実施形態では、エネルギー
源は、パーソナルエリアネットワークによって提供される。
【0016】
本発明の別の態様は、疾患マーカである生物学的検体と相互に作用することのできる生
物活性因子を含むマイクロアレイと、少なくとも1つの治療薬を含み、かつ該少なくとも
1つの治療薬を医療デバイスから放出することのできるリザーバと、疾患マーカである生
物学的検体と生物活性因子との間の相互作用の物理的パラメータデータを取得することの
できるマイクロアレイ走査デバイスを含む複数のマイクロチップと、物理的パラメータデ
ータを検体の相互作用プロファイルと比較することのできる生体測定認識デバイスと、リ
ザーバからの治療薬の放出を制御することのできる治療薬放出デバイスと、マイクロアレ
イ走査デバイス、生体測定認識デバイスおよび治療薬放出デバイス間の連絡を促進するこ
とのできるインターフェースデバイスと、医療デバイスに動力を供給するためのエネルギ
ー源と、医療デバイスが飲み込まれ、患者の腸管を通過し、自然に排せつされることを可
能にする生体適合性を有する被膜とを備えるコーティングされた医療デバイスを患者に投
与する工程を含む、患者の体内の疾患を検出および治療する方法に関する。
【0017】
本方法の一実施形態では、被膜は、チャネルを有することのできる生体安定性ポリマー
である。別の実施形態では、ポリマーは、多孔質である。
【0018】
本方法のさらに別の実施形態では、マイクロアレイは、マイクロビーズを備える。別の
実施形態では、生物活性因子は、核酸である。さらに別の実施形態では、生物活性因子は
、ポリペプチドである。さらに別の実施形態では、生物活性因子は、免疫グロブリンであ
る。
【0019】
本発明の本方法の追加の実施形態では、生物活性因子は、蛍光標識されている。別の実
施形態では、生物活性因子は、ナノ結晶で蛍光標識されている。
【0020】
本方法のさらに別の実施形態では、疾患マーカである生物学的検体は、核酸である。さ
らに別の実施形態では、疾患マーカである生物学的検体は、ポリペプチドである。別の実
施形態では、疾患マーカである生物学的検体は、免疫グロブリンである。
【0021】
本方法のさらにもう一つ別の実施形態では、複数のマイクロチップは、シリコンゲルマ
ニウムを含む。
【0022】
本方法の別の実施形態では、マイクロアレイ走査デバイスは、光ファイバ素子を備える
。
【0023】
本方法の追加の実施形態では、検体の相互作用プロファイルは、生体測定認識デバイス
内に格納される。代替的実施形態では、検体の相互作用プロファイルは、本医療デバイス
の外部に格納される。
【0024】
本方法の別の実施形態では、複数のリザーバを用いる。
本方法の追加の実施形態では、インターフェースデバイスは、パーソナルエリアネットワ
ークを備える。
【0025】
本方法の追加の実施形態では、エネルギー源は、電池である。代替的実施形態では、エ
ネルギー源は、パーソナルエリアネットワークによって提供される。
【0026】
本方法の追加の実施形態では、連絡は、外部のコンピュータによって監視される。別の
実施形態では、外部コンピュータは、治療薬の放出を指示する。
【0027】
本発明の別の態様は、体液の試料を採取することのできる少なくとも1本のマイクロニ
ードルと、試料が貫流して該少なくとも1本のマイクロニードルと流体連絡する第1のマ
イクロチャネルと、第1のマイクロチャネルと流体連絡し、緩衝剤が貫流し、生物活性因
子を有するマイクロアレイと、生物活性因子と体液中の検体との間の相互作用を検出する
ためのマイクロアレイ走査デバイスとを含む第2のマイクロチャネルと、前記マイクロア
レイ走査デバイスと生体測定認識デバイスとの間の連絡を促進することのできるインター
フェースデバイスとを備える、体液中の検体を検出することができる医療デバイスに関す
る。
【0028】
一実施形態では、体液は、血液である。別の実施形態では、少なくとも1本のマイクロ
ニードルは、複数のマイクロニードルである。さらに別の実施形態では、マイクロニード
ルは、直径が約10ミクロンと約200ミクロンの間にある。さらに別の実施形態では、
マイクロニードルは、約100マイクロリットルの血液を採取することができる。別の実
施形態では、第1のマイクロチャネルは直径が約100マイクロメートルである。追加の
実施形態では、第2のマイクロチャネルは、直径が約100マイクロメートルである。
【0029】
またさらに別の実施形態では、第1のマイクロチャネルを貫流する体液中の検体は、第
2のマイクロチャネル内に拡散し、生物活性因子と相互に作用する。別の実施形態では、
第1のマイクロチャネルを貫流する体液中の検体は、第2のマイクロチャネル内に拡散し
、標識検体を、生物活性因子に結合している位置から競合的に転移させる。さらに別の実
施形態では、標識検体は、所定量で提供される。別の実施形態では、標識検体は、蛍光成
分で標識されている。さらに別の実施形態では、マイクロアレイは、体液中の検体を特異
的に結合する抗体の被覆を有する第2のマイクロチャネルの一部分である。さらに別の実
施形態では、マイクロアレイ走査デバイスは、全内部反射蛍光(total inter
nal reflection fluorescence; TIRF)分光計を備え
る。
【0030】
本発明のこの態様の別の実施形態では、生体測定認識デバイスは、本デバイスの外部に
配置され、連絡は、無線伝送によって行われる。別の実施形態では、検体は、インスリン
であり、生物活性因子は、インスリンに対して特異的な抗体である。さらにもう一つ別の
実施形態では、検体は、グルコースであり、生物活性因子は、グルコースに対して特異的
な抗体である。さらに別の実施形態では、本デバイスは、パッチとして皮膚上に装着され
る。
【0031】
本発明のこの態様のさらに別の実施形態では、検体は、疾患を示す。
【0032】
本発明のこの態様の別の実施形態では、本医療デバイスは、内部に治療薬を有するリザ
ーバと、生体測定認識デバイスからの指示に応じたリザーバからの治療薬放出を制御する
ことのできる治療薬放出デバイスとをさらに備える。別の実施形態では、検体は、グルコ
ースであり、治療薬は、インスリンである。さらに別の実施形態では、検体と治療薬は同
一である。
【0033】
本発明のこの態様の別の実施形態では、本医療デバイスは、少なくとも1本のマイクロ
ニードルと、第1のマイクロチャネルと、第2のチャネルとを備える少なくとも1つの使
い捨てアッセイデバイスを有し、かつ、マイクロアレイ走査デバイスとインターフェース
デバイスとを備える非使い捨てアッセイ読み取りデバイスを有する。さらに別の実施形態
では、アッセイデバイスとアッセイ読み取りデバイスとは、互いに光連絡している。また
さらにもう一つ別の実施形態では、単一のアッセイ読み取りデバイス内にはめ込まれた複
数の使い捨てアッセイデバイスがある。
【0034】
別の実施形態では、マイクロアレイは、第2のマイクロチャネルと流体接触する、生物
活性因子で機能化された単一のガラス光ファイバからなる1つのクラッディングされてい
ない部分を含む。代替的に、マイクロアレイは、第2のマイクロチャネルと流体接触し、
生物活性因子で機能化された単一のガラス光ファイバからなる、複数のクラッディングさ
れていない部分を含んでもよい。
【0035】
本発明の付加的利点は、本発明の実施に関して企図される最良の形態の単なる例として
、本発明の好ましい実施形態のみを示して説明する以下の詳細な説明から、当業者には容
易に明らかとなろう。理解されることになるように、本発明は、他の実施形態および異な
る実施形態が可能であり、そのいくつかの詳細は、種々の明白な箇所において、すべて本
発明から逸脱することなく、修正することができる。本発明は、これらの特定の詳細の一
部または全部がなくとも実施することができる。他の例では、周知の処理作業については
、本発明を不必要に分かりにくくしないために、詳細には説明してきていない。従って、
図面および説明は、本質的に、例としてみなすべきであり、限定するものとみなすべきで
はない。
【発明を実施するための最良の形態】
【0036】
(発明の詳細な説明)
その最も基本的な形態において、本発明は、体液中の検体を定性的かつ/または定量的
に検出するためのセンサとして機能する医療デバイスに関する。そのような検体は、疾患
を示す可能性を秘めているものであっても、薬物または薬物代謝産物であってもよい。さ
らに、本デバイスは、感覚の入力に応答して治療薬を放出することを可能とすることがで
きる。従って、これはさらに、持続的な診断および投薬を提供することができる。本発明
の装置は、埋め込み可能としても、摂取可能としても、パッチとして皮膚上に装着しても
よい。
【0037】
本デバイスは、生体液中の検体をサンプリングすることができる。生体液には、限定す
るものではないが、血液、血清、尿、胃液および消化液、涙液、唾液、便、精液、および
腫瘍性の組織に由来する間質液が含まれる。
【0038】
医療デバイス内に採取された体液は、マイクロアレイと接触させられ、該マイクロアレ
イが、体液中の生物学的検体をサンプリングする。流体は、医療デバイスから放出するこ
とができ、かつ特定の検体の有無に応じて放出される治療薬を含むことができる。医療デ
バイスを出入りする体液の動きは、マイクロ流体ポンプまたは浸透圧ポンプのようなポン
プによって円滑化されるのが最も好ましい。別の実施形態では、分子の輸送は、流体をマ
イクロアレイに沿って流れさせる加圧マイクロ流体路を経由して行われる。さらに別の実
施形態では、分子は、パーソナルエリアネットワーク(PAN)の送信機または圧電セン
サもしくは磁気センサによって伝導される自然な電流によって輸送される。
【0039】
埋め込み可能な実施形態に関しては、本デバイスは、カテーテル内視鏡の先端に封着す
ることができ、体内における薬物濃度のリアルタイムの分析およびモデル化が可能となる
。例えば、本デバイスは、例えば血管ステント、胃ステントまたは胆管ステントに関連付
けることができる。別の実施形態では、本デバイスは、ステントの内側に封着される。別
の実施形態では、本デバイスは、それを体内に埋め込むことを可能にするポリマーシステ
ム内、眼の背部に配置することのできるレンズ内、ガスおよび大気汚染の外部センサ内、
およびリアルタイムの監視を必要とする他の物体内に梱包される。
【0040】
一実施形態では、本デバイスは、パッチの形状をしている。図2。本デバイスは、全血
検体のモニタとして使用されることになる皮膚の外部に貼付される、粘着パッチであるの
が好ましい。血液検体は、その濃度がパッチによって監視される薬物であるのがより好ま
しい。そのような薬物は、治療域が狭く、血液中のマイクロモルの濃度中に存在する。血
液中の標的検体分子の濃度または同一性は、パッチ上で直接測定され、次いで当該情報を
内部または外部のデータ格納システムに伝送することができるのが最も好ましい。
【0041】
パッチについては、複数ではないにしても、少なくとも1本のマイクロニードルを用い
、皮膚を通じて血液を採取することを想定している。図4。マイクロニードルは、ほぼ人
毛の大きさで、一体化されたマイクロリザーバまたはキュベットを有するのが好ましい。
マイクロニードルは、無痛で皮膚を貫通し、微量の血液試料を採取する。マイクロニード
ルは、約0.01マイクロリットル〜約1マイクロリットル、好ましくは0.05マイク
ロリットル〜約0.5マイクロリットル、最も好ましくは約0.1マイクロリットル〜約
0.3マイクロリットルの毛細血管血液を採取し、それらをパッチ内のリザーバに送達す
るのがより好ましい。マイクロニードルは、シリコンを材料として製造され、直径が約1
0ミクロン〜約200ミクロン、より好ましくは約50ミクロン〜約150ミクロン、最
も好ましくは100ミクロンで、皮膚へのそれらの穿刺を実質的に無痛としているのが好
ましい。パッチは、例えば指の先端ほど詳細に調べられていない身体部位上に配置される
可能性が最も高いかもしれないので、毛細血管密度は、かなり低い可能性がある。図4に
示すように、毛細血管が確実に針で実際に突き刺されるように、血液採取用には複数の針
が用いられることになる。そのようなマイクロニードルは、Pelikan(カリフォル
ニア州パロアルト所在)および/またはKumetrix(カリフォルニア州ユニオンシ
ティー所在)によって市販されている種類のものであり、米国特許第6、503、231
号も参照されたい。
【0042】
一実施形態では、そのうちの一部が大きさならびに/または特異度に基づいた標的分子
の分離を可能にする多孔質ゲルおよびポリマーが被覆された複数のポリマー製の針を用い
る方法を想定している。ゲルには、限定するものではないが、ポリクロリメリド(pol
ychlorimeride)および多孔質ポリカーボネートエラストマーが含まれる。
【0043】
一般に、本明細書に開示するマイクロニードルを作製する際に用いることのできるマイ
クロ加工工程には、リソグラフィ、湿式化学的除去法、乾式化学的除去法、およびフォト
レジスト除去法のようなエッチング技法、シリコン熱酸化法、電気メッキならびに化学メ
ッキ、ホウ素拡散、リン拡散、ヒ素拡散、およびアンチモン拡散のような拡散工程、イオ
ン注入、蒸発(フィラメント、電子ビーム、フラッシュ、ならびにシャドウイングおよび
ステップカバレッジ)、スパッタリング、化学蒸着(CVD)、エピタキシ(気相、液相
、ならびに分子線)、電気メッキ、スクリーン印刷、およびラミネート加工のような膜蒸
着が含まれる。全体としては、Jaeger、Introduction to Mic
roelectronic Fabrication (Addison−Wesley
Publishing Co.,マサチューセッツ州レディング所在、1988年)、
Runyan他、Semiconductor Integrated Circuit
Processing Technology(Addison−Wesley Pu
blishing Co.,マサチューセッツ州レディング所在、1990年)、Pro
cessing of the IEEE Micro Electro Mechan
ical Systems Conference 1987年−1998年、Rai−
Choudhury編集、Handbook of Microlithography
,Micromachining & Microfabrication (SPIE
Optical Engineering Press、ワシントン州ベリンガム所在
、1997年)を参照されたい。代替的に、針は、シリコンウエハ内に成形し、次いで、
従来のワイヤ切断技法を用いて、ニッケル、金、チタンまたは種々の他の生体適合性を有
する金属で被覆することができる。別の実施形態では、針は、生体高分子で作製すること
ができる。マイクロニードルは、その全体が引用により本明細書に組み込まれる、Muk
erjee他、Sensors and Actuators A:Physical、
第114巻、第2号−第3号、2004年9月1日、第267頁−第275頁に記載の方
法に従って、特許請求の範囲のデバイス用に作製し、使用することができる。
【0044】
本デバイスは多くの測定結果を取得することができるが、マイクロニードルは、1回の
み使用されることも好ましい。針を挿抜し、使用済みの針を廃棄し、かつ新しい針を再搭
載する機械的アクチュエータによって、複数回の血液採取が行われるのが好ましい。超小
型ディスクドライブ(例えばIBMマイクロドライブ)用に開発され、大量生産に用いら
れている機械技術は、同様の一連の動作を有しており、かつ要求価格が低い。マイクロア
クチュエータは、半導体様のバッチ工程を用いて製造されたMEMS(マイクロ機械加工
電気機械システム)デバイスであるのが好ましい。そのようなアクチュエータには、ニッ
ケルチタニウム合金製デバイス、空気圧式デバイス、または圧電デバイスが含まれる。最
小の針は、厚さが約1ミクロン〜約10ミクロン、好ましくは約2ミクロン〜約6ミクロ
ン、最も好ましくは約4ミクロンであるが、高さは、約10ミクロン〜約100ミクロン
よりも高く、好ましくは約30ミクロン〜約60ミクロン、最も好ましくは約40ミクロ
ンである。
【0045】
代替的に、針は、十分な力および作動に必要な可動域を生成するに足るほどコイル状に
きつく巻かれた小型バネの解放がピンによって誘発される、バネソレノイドシステムで作
動される。
【0046】
一実施形態では、本発明のパッチデバイスは、複数のマイクロニードル、マイクロチャ
ネルおよびマイクロアレイ(アッセイデバイス)を有する使い捨て部品と、マイクロアレ
イ走査デバイスならびにマイクロアレイ上での検体の生物活性因子との相互作用の結果を
好ましくは無線連絡によって、例えばブルートゥース(登録商標)(アッセイ読み取りデ
バイス)(図5参照)によって生体測定認識デバイスに伝送する機能を有する非使い捨て
部品との2つの分離可能な部品を有する。この実施形態では、使用済みの使い捨て部品は
、非使い捨て部品から除去することができ、一方で、非使い捨て部分は、引き続き被検者
の身体上の所定部位にとどまる。次いで、未使用の針を備える未使用の使い捨て部品を、
すでに患者の身体の所定部位に貼付されている非使い捨て部分に付けることができる。未
使用の使い捨て部品は、先に使用された使い捨て部品と同一または異なる検体を定量的も
しくは定性的に検出することを可能とすることができる。図7。この実施形態では、使用
済み使い捨て部品のマイクロニードルが例えば血餅で詰まった時点で、未使用の使い捨て
部品を付けるのが好ましい。非使い捨て部品は、1つまたはそれ以上の使い捨て部品をも
含むことができる。この構成では、使い捨て部品の各々が、異なる検体を同時に検出する
ことができる。代替的に、使い捨て部品は各々、個別の時間帯に体液、例えば血液をサン
プリングするなどの方法で依然として順次作動され、同一の検体を検出する。この構成で
は、本デバイスは、ある時間帯にわたって使い捨て部品を1つずつ順に採用することによ
り、長時間にわたって検体を検出する。本デバイスは、12個の使い捨て部品を有し、2
時間毎に新しい使い捨て部品を採用することにより、24時間にわたって検体を検出する
ことができるのが好ましい。
【0047】
嚥下可能または埋め込み可能な実施形態では、長期間にわたる(例えば、最長1週間、
6ヶ月間、1年間またはそれより長期間)体液、組織およびこれらに類するものへの暴露
の結果として有意な劣化を被らず、従って本デバイスが腸管全体を通過することを可能に
するものを指す、「生体安定性ポリマー」を本デバイスに被覆するのが好ましい。流体は
、ポリマー内の微細孔またはチャネルを通じて本医療デバイス内に注入され、そこから放
出されるのが好ましい。図1。
【0048】
本発明のこの態様の特定の実施形態の生体安定性被膜材料は、本医療デバイス内への体
液の流入およびそれからの治療薬の放出を可能にさせるのに足る大きさの互いにつながっ
た細孔によって特徴付けられる多孔質ポリマー材料である。多孔質ポリマー材料は、少な
くとも約5ミクロン、より好ましくは少なくとも約8ミクロン、より好ましくは少なくと
も約10ミクロンの平均細孔径を特徴とするのが好ましい。多孔質構造が凍結乾燥法によ
って得られる実施形態に用いるのに適したポリマーには、ポリウレタン(ポリウレタン分
散体を含む)などの任意の適した生体安定性ポリマー、エチレンビニールアセテートポリ
マー、交差結合ゼラチンなどのヒドロゲル、デキストラン、ポリカルボン酸、セルロース
ポリマー、ゼラチン、ポリビニルピロリドン、無水マレイン酸ポリマー、アクリルラテッ
クス分散体、ポリアミド、ポリビニルアルコール、ポリエチレンオキシド、グリコサミノ
グリカン、多糖類、ポリエステル、ポリアクリルアミド、ポリエーテル、およびそれらの
混合物ならびにコポリマーが含まれる。
【0049】
本明細書において使用する用語「検体」は、体液および身体組織内に見出される、抗体
、血清蛋白、コレステロール、核酸、薬物ならびに薬物代謝産物等を指す。別の実施形態
では、検体は、生理的状態または体調を判定するための分析に望ましい生物学的状態を示
す任意の生物学的検体、マーカ、遺伝子、蛋白質、代謝産物、またはホルモンまたはそれ
らの組み合わせである。本発明のデバイスの目的は、体液中の検体を定性的および/また
は定量的に「検出」することにある。そのような検出は、定期的に実施されるのが好まし
い。これは、リアルタイムで実施されるのが最も好ましい。一実施形態では、検体は、ミ
クロモル濃度からナノモル濃度で存在し、かつ、アミノグリコシド抗生物質または抗生物
質、例えばバイコマイシンなどの高い効力を有する化学療法物質であり、検体の治療域は
狭いため、それらの分刻みの監視は、極めて望ましい。
【0050】
体内の検体レベルの持続的監視によって、本発明のデバイスは、検査者が治療上の用法
・用量を最適化し、かつ実験的薬剤用の薬物動態モデルを迅速に開発することを可能にす
る。現在では、濃度を介した監視により、標的リードの開発に加えて、迅速な標的削除ま
たは投薬計画の妥当性確認が可能となっているため、ターゲットバリデーション、リード
最適化、および化合物最適化(治療域ならびに毒性試験)は、極めて迅速かつより正確に
行うことができる。従って、第二相臨床試験および第三相臨床試験に入るか否かに関する
不確定性を低減するのに役立ち、それにより薬物開発の登録にかかる時間および総経費を
削減する。さらに、本発明のデバイスは、依然として感度の判断基準となっている、蛍光
ベースのアッセイ法における新規化合物の薬物濃度を感知する方法を提供し、かつ、新規
化合物を監視するための標的蛍光ベースの解法を新規に提供する。
【0051】
本明細書において使用する用語「疾患マーカ」は、体内に存在または欠落している体液
中および組織内に見られ、疾患と相関関係があることが分かっている検出可能な検体、例
えば抗体、血清蛋白、コレステロール、核酸、薬物および薬物代謝産物等である。特定の
生理的状態の検出を可能にする検体は、正常な健全な生理機能を示すこともできる。本明
細書においては、これらを「正常な」または「健全な」生物学的検体と呼ぶ。本発明の生
体測定認識デバイスは、1)マイクロアレイ上での疾患マーカである生物学的検体と生物
活性因子との間の相互作用および2)マイクロアレイ上での正常な生物学的検体と生物活
性因子との間の相互作用の物理的特性間の差異を認識する物理的パラメータデータに基づ
いて疾患マーカを検出するのが好ましい。疾患マーカである生物学的検体は、特定の生理
的状態、例えば感染、炎症、自己免疫性脳脊髄炎、癌等の検出を可能にする。当業者に現
在知られている疾患マーカおよび今後知られることになる疾患マーカは、本発明によって
包含される。疾患マーカの存在は、疾患の存在を示し、治療薬放出が是認される。
【0052】
疾患マーカである生物学的検体は、望ましくない増殖を行っている細胞内で過剰発現ま
たは過剰活性化した遺伝子もしくはそれらの産物とすることができる。例えば、本発明の
デバイスは、腫瘍または生検手技後に残された腔もしくは空間のような腫瘍の疑いがある
組織の内部に埋め込むことができる。本発明がそのような生物学的検体の濃度の増加また
はそのような検体、例えば疾患マーカの変位した過剰活性化形を検出した場合、細胞傷害
性物質などの治療薬の放出が是認される。これらの疾患マーカである生物学的検体は、癌
、動脈狭窄を引き起こす新生増殖、乾癬等のような望ましくない細胞増殖を示すことがで
きる。疾患マーカである生物学的検体は、組織内の遺伝子発現を解析し、それを既知の腫
瘍−遺伝子発現型と照合するか、またはそれらを正常な表現型と比較することによって検
出することができる。好ましい実施形態では、マイクロアレイは、一塩基変異多型(SN
P)、mRNAまたは酵素などの特定の蛋白質、抗体もしくは抗原を含む特定のヌクレオ
チド配列の存在、欠落または過剰存在によって定義される疾患マーカである生物学的検体
の存在を検出するために用いられる。
【0053】
一実施形態では、疾患マーカである生物学的検体は、腫瘍特異的抗原である。例えば、
そのような抗原、例えば腫瘍特異的抗原MUC−1は、癌細胞の表面上に発現するかまた
は癌細胞から放出される。核酸検出または蛋白質活性によるMUC−1発現の検出により
、治療薬としての細胞傷害性物質の放出が誘発される。
【0054】
別の例は、細胞増殖シグナルの形質導入に重要な受容体チロシンキナーゼ(RTK)に
関する。RTKは、上皮細胞増殖因子(EGF)、キナーゼとして機能してサイトゾル蛋
白質上のチロシンアミノ酸残基をリン酸化し、それにより細胞増殖を仲介する細胞内部分
のような増殖因子に対する細胞外リガンド結合領域を有する、巨大な膜貫通蛋白質である
。異なる受容体チロシンキナーゼに結合する増殖因子ファミリを基準として、様々な分類
の受容体チロシンキナーゼが知られている。受容体チロシンキナーゼのEGF−Rファミ
リのようなクラスIキナーゼには、EGF受容体、HER2−neu受容体、erbB受
容体、Xmrk受容体、DER受容体およびlet23受容体が含まれる。これらの受容
体は、乳癌、肺の扁平上皮癌、膀胱癌、食道癌、結腸癌、直腸癌または胃癌などの消化管
癌、白血病および卵巣癌、気管支癌もしくは膵臓癌などの一般的なヒト癌にしばしば存在
する。受容体チロシンキナーゼのEGFファミリに対しては、ヒト腫瘍組織がさらに検査
されるので、その広範囲に及ぶ罹患率が甲状腺癌および子宮癌などの他の癌において立証
されることになると予測される。具体的に述べれば、EGFRチロシンキナーゼの活性は
、正常細胞内ではめったに検出されないが、悪性細胞内ではより頻繁に検出可能である。
EGFRは、脳腫瘍、肺扁平上皮癌、膀胱腫瘍、胃腫瘍、乳房腫瘍、頭頸部腫瘍、食道腫
瘍、婦人科腫瘍および甲状腺腫瘍などの多くのヒト癌に過剰発現することが最近になって
明らかにされている。受容体チロシンキナーゼは、乾癬などの他の細胞増殖性疾患におい
ても重要である。EGFR障害は、通常はEGFRを発現しない細胞によるEGFR発現
、望ましくない細胞増殖、および/または妥当でないEGFRレベルの存在につながるE
GFR活性の増加によって特徴付けられるものである。EGFRは、そのリガンドEGF
およびトランスフォーミング増殖因子α(TGF−a)によって活性化されることが知ら
れている。Her2−neu蛋白質も、クラスI受容体チロシンキナーゼ(RTK)ファ
ミリのメンバである。Her2−neu蛋白質は、構造的にEGFRに関連している。こ
れらの受容体は、共通の分子構造を共有し、それらの細胞質領域内に2つのシステインが
豊富な領域を含み、かつそれらの細胞質領域内に構造的に関連する酵素領域を含む。従っ
て、核酸検出または蛋白質活性による異常に高レベルのRTK発現または信号伝達活動の
検出は、治療薬としてのRTK阻害薬もしくは細胞傷害性物質の放出の根拠とすることが
できる。
【0055】
直接または間接的に化学療法を抑制する比較的高い遺伝子の発現は、本発明の目的に対
する疾患マーカとなる。例えば、DNA修復遺伝子ERCC1の高腫瘍発現は、高度に局
所的でしかも低浸透性の濃度部位への遺伝子傷害性化学療法薬の放出の根拠となる。従っ
て、全身的に支障なく持続されることにはならないであろう濃度を達成する。さらに、高
腫瘍レベルの遺伝子DPDは、化学療法レジメンに基づいて5−FUを抑制することが知
られている。同様に、DPDの高腫瘍発現は、高度に局所的でしかも低浸透性の濃度部位
への5−FU化学療法薬の放出の根拠となる。あるいは、熟練技術者は、高レベルのDR
CC1またはDPDが化学療法に対する耐性を示すかもしれないこと、および遺伝子傷害
性物質または5−FUの使用がそれぞれ適切ではないかもしれないことも分かるであろう
。そのような場合、遺伝子傷害性物質または5−FU以外の細胞傷害性治療薬を、それぞ
れ本デバイスから放出すべきである。
【0056】
代替的に、本デバイスは、癌のような疾患を示す疾患マーカ団を検出し、治療薬のよう
な高度に局所的な濃度の細胞傷害性物質を放出するように構成することができる。
【0057】
さらに別の実施形態では、疾患マーカである生物学的検体は、炎症性腸疾患、多硬化症
、小児期発症糖尿病、乾癬、関節リウマチ等の病因論において重要な役割を果たす炎症を
示すことができる。そのような疾患は、局所的炎症のみに対処するのに、潜在的に有害な
ステロイドの規則的な大量の全身的投与が事前に必要となる。TNF−α、IL−1、I
L−8、IL−2、IL−3、MIF(IL−4、GM−CSF、INF−γ、およびT
NF−βのような生物活性因子の高度の局所集中は、炎症を示す。そのような生物活性因
子の異常に高い集中の検出は、疾患マーカの性質であり、治療薬としての抗炎症薬または
抗体の局所放出の根拠となる。
【0058】
別の実施形態では、疾患マーカである生物学的検体は、微生物による感染を示すことが
できる。従って、疾患マーカは、ウイルス蛋白または細菌蛋白質もしくは核酸あるいはそ
れらの断片を含むことができる。例えば、外毒素およびエンテロトキシンならびにTSS
T−1、または他の細菌性スーパー抗原、またはボツリヌス毒素、ジフテリア毒素、炭疽
菌防御抗原、炭疽菌浮腫因子、および炭疽菌致死因子、ならびにインフルエンザウイルス
の血球凝集素またはノイラミニダーゼのようなウイルス蛋白を含む細菌毒素のような生物
学的検体の検出は、感染を示す疾患マーカの性質であり、治療薬としての抗微生物薬また
は毒素特異的抗体の局所放出の根拠となる。
【0059】
本発明の別の態様は、マイクロアレイに関する。マイクロアレイは本発明のデバイスの
一部分であり、検体と生物活性因子との間の相互作用を促進する。その最も基本的な実施
形態では、本明細書に定義する「マイクロアレイ」は、マイクロアレイ走査デバイスが生
物活性因子と検体との間の相互作用を検出することができるように、生物活性因子によっ
て覆われるかまたはそれによって機能化された任意の表面、例えばマイクロ流体チャネル
の壁を構成することができる。図8、図10、図11。別の実施形態では、マイクロアレ
イは、多くの試験、またはアッセイを並行して行うことを可能にする、ある表面上に配列
された小型の検査場所の集合体である。この状況では、マイクロアレイは、体液および/
または組織に直接暴露され、複数の異なるアッセイを同時に処理し、1つまたはそれ以上
の生物活性因子を、1つもしくはそれ以上の生物学的検体と相互作用させる。
【0060】
例えば、固定化抗体への抗原の結合を測定し定量化する蛍光ベースのアレイバイオセン
サの機能は、4つの異なる免疫測定法、すなわち直接測定法、競合測定法、転移測定法、
サンドイッチ法を用いて実証されてきた。Sapsfordらは、平面導波路上に固定化
した2、4、6−トリニトロトルエン(TNT)に対して特異的な抗体のパターン化アレ
イを用い、異なる抗原集中部位からの信号を測定した。Anal Chem.2002年
3月1日、74(5):1061−8(その全体が引用により組み込まれる)。ワンステ
ップアッセイである直接アッセイ、競合アッセイ、転移アッセイに関しては、測定値は、
リアルタイムで取得された。用量反応曲線は、4つのすべてのアッセイ法に対して計算さ
れ、溶液中に存在する抗原の量を定量化するアレイバイオセンサの機能が実証された。
【0061】
本発明のこの態様の一実施形態では、マイクロアレイは、生物活性因子で機能化された
1本のガラス光ファイバ上の一領域である。図11。別の実施形態では、マイクロアレイ
は、各々が同一または異なる生物活性因子で機能化された複数本のガラス光ファイバを有
することができる。1つの特定の実施形態では、マイクロアレイの生物活性因子は、検体
に対して特異的な抗体などの蛋白質である。蛋白質生物活性因子をガラス光ファイバに付
着させるのには、2つの手順を用いることができる。第1の手順は、Bhatiaらによ
って開発されたものに基づいている。Analytical Biochemistry
、178 408−13参照。これは、3−メルカプトプロピルトリメトキシシランで表
面に機能化する工程を含む。それに続き、N−y−malemidobutylrylo
xysuccimideエステルの架橋剤を用いて、蛋白質生物活性因子が機能化された
表面に付着される。第2の手順は、2003年発行のBosensors and Bi
oelectronics、19 85−93にTedeschiらによって記載された
デキストランベースの方法を用いる工程を含む。この方法は、グリシジル3−(トリメト
キシシリル)プロピルエーテルを用いて、クリーンガラス上の遊離ヒドロキシル基をデキ
ストランポリマーに結合する。蛋白質生物活性因子は、その中のカルボン酸基の酸性化に
続き、デキストランマトリックスに結合される。任意選択的に、標的検体を分離する立体
膜をファイバに被覆してもよい。
【0062】
ファイバは、マイクロニードル内に直接挿入され、選択性および特異性に基づく結合事
象に対して、マイクロニードルの壁は、ポリマーゲルを被覆されているのが好ましい。
【0063】
ガラス光ファイバを用いる実施形態では、体液中の標的検体との相互作用の発生と同時
に蛍光が検出できるほど変化するように、光源を用いて、蛍光標識された生物活性因子お
よび/または検体が励起される。図11。励起用光源は、レーザモジュールとすることが
できる。光は、機能化領域、すなわちファイバのクラッディングが除去され、生物活性因
子の被覆に対して化学的に調製された領域を含む光ファイバ内に入射することができる。
図9、図11。クラッディングの欠如により、エバネッセント波がファイバの1点から発
生し、蛍光タグ付き生物活性因子、または生物活性因子に結合された、サンプリング中の
体液中に競合的に転移される検体となることを意図された蛍光タグ付き検体から蛍光を誘
発する。図8、図11。放射光は、同一のファイバを通って再入射する。ファイバ内に戻
る光は、光ファイバのスプリッタ、周囲の背景光を除去することのできる帯域通過フィル
タ、およびフォトダイオード検出器を有することのできるマイクロアレイ走査デバイスに
よって検出される。説明した構成の概略を、図11に見ることができる。
【0064】
生物活性因子は、検体薬物に特異的の結合することができる抗体とするのが好ましい。
あるいは、生物活性因子は、血清抗体に特異的に結合することのできる抗原である。この
後者の実施形態では、本発明のデバイスは、特定の免疫学的な刺激、例えばHIV感染ま
たは結核感染に応答して生成される特定の種類の抗体の産出を検出することができる。
【0065】
別の実施形態では、マイクロアレイは、1)疾患マーカである生物学的検体とマイクロ
アレイ上の生物活性因子との間の相互作用および2)正常な生物活性因子とマイクロアレ
イ上の生物活性因子との相互作用を促進する。この状況では、生物活性因子は、正常な生
物学的検体および疾患マーカである生物学的検体と識別的に相互作用する。
【0066】
マイクロアレイの実施形態では、マイクロビーズアレイが用いられる。本明細書におけ
る「ミクロスフィア」または「ビーズ」もしくは「微粒子」あるいは文法上同等のものは
、小さい個別的な粒子を意味する。ビーズの組成は、生物活性因子のクラスおよび合成の
方法によって異なることになる。適したビーズ組成には、ペプチド合成、核酸合成、およ
び有機成分合成に用いられるものが含まれ、限定するものではないが、プラスチック、セ
ラミック、ガラス、ポリスチレン、メチルスチレン、アクリルポリマー、常磁性体、トリ
アゾル、カーボングラファイト、二酸化チタン、ラテックスまたはSepharoseの
ような交差結合デキストラン、セルロース、ナイロン、交差結合ミセルおよびテフロン(
登録商標)は、すべて用いることができる。Bangs Laboratories、F
ishers Ind.が提供している「Microsphere Detection
Guide」は、参考になる手引書であり、その全体が引用により組み込まれる。ビー
ズは、球状である必要はなく、不ぞろいの微粒子を用いてもよい。さらに、ビーズは多孔
質とすることができ、そうすることにより、生物活性因子の付着またはタグの取り付けに
利用可能な表面積を増大させる。ビーズの大きさは、ナノメートル、例えば100nmか
らミリメートル、例えば1mmの範囲にわたり、約0.2ミクロン〜約約200ミクロン
のビーズが好ましく、約0.5ミクロン〜約5ミクロンのビーズが特に好ましいが、一部
の実施形態では、より小さいかまたはより大きいビーズを用いることができる。各マイク
ロ球体が生物活性因子を含むのが好ましい。
【0067】
本発明の別の態様は、「生物活性因子」に関する。本明細書において使用する場合、そ
れは、任意の分子、例えば、蛋白質、オリゴペプチド、有機小分子、多糖類、ポリヌクレ
オチド等を表し、マイクロアレイに用いられ、検体と相互に作用するか、または体液中も
しくは組織内に存在する正常な生物学的検体および疾患マーカである生物学的検体と識別
的に相互作用することができる。生物活性因子は、生物学的検体との相互作用と同時に変
化した生物活性因子に特有の特定の物理的パラメータをマイクロアレイ走査デバイスによ
って確認することができるような方法で標識することができる。
【0068】
一実施形態では、生物活性因子は、蛍光標識されており、それらの蛍光は、体液中の標
識検体との相互作用と同時に、検出できるほど変化する。代替的に、標識検体が体液中の
検体によって競合的に転移されるように、生物活性因子は、標識検体とあらかじめ関連付
けられている。いずれの場合にも、マイクロアレイの蛍光特性は、マイクロアレイ走査デ
バイスによって検出することができるような方法で、体液中の検体とのマイクロアレイの
相互作用と同時に変化する。
【0069】
検体または生物活性因子は、蛍光ナノ結晶で標識されるのが最も好ましい。ローダミン
のような有機色素に比べ、ナノ結晶は、少なくとも約20倍明るく、光退色に対して少な
くとも約100倍の安定性を有し、発光分光線幅が約三分の一の幅である。例えば、Br
uchez他、Science、281:2013−2016、ChanおよびNie、
Science、281:2016−2018(1998年)、Bawendi他、An
nuを参照されたい。Rev.Phys.Chem、41:477−496(1990年
)、および本明細書に引用する参考文献は、それらのすべてが引用により明白に組み込ま
れる。明るさ、安定性および発光帯域幅の狭さのすべてが、以下にさらに説明するような
比較的多数の異なる色(すなわち異なる大きさのナノ結晶)を用いる機能に寄与し、それ
と同時に、それらを互いに分解し、各ナノ結晶の異なった量を解明する機能を保っている
。さらに、広い励起スペクトルにより、通常の光源によって多くの異なるナノ結晶を励起
することが可能となる。
【0070】
生物活性因子は、蛋白質、特に水素結合との構造的相互作用に必要な官能基を含むこと
ができ、一般に、少なくともアミン基、カルボニル基、ヒドロキシル基またはカルボキシ
ル基を含み、これらの化学官能基のうちの少なくとも2つを含むのが好ましい。生物活性
因子は、上記の官能基のうちの1つまたはそれ以上と置換される環状炭素構造または複素
環構造および/もしくは芳香族構造または多環芳香族構造を含むことが多い。生物活性因
子は、ペプチド、核酸、糖類、脂肪酸、ステロイド、プリン、ピリミジン、それらの誘導
体、構造的類似体または組み合わせを含む生体分子の中にも見出される。特に好ましいも
のは、核酸および蛋白質である。
【0071】
本明細書において使用する「と相互に作用する」は、マイクロアレイ上での、検体と生
物活性因子のイオン結合または共有結合、蛋白結合、核酸雑種形成、磁気引力もしくは疎
水性引力または他の検出可能な会合および/もしくは定量化可能な会合を指す。「識別的
に相互作用する」は、正常な生理機能を示す生物学的検体とは異なる方法で、疾患マーカ
である生物学的検体が生物活性因子と相互に作用することになるという事実を指す。
【0072】
例えば、1)疾患マーカである生物学的検体と生物活性因子との間の相互作用および2
)正常な生物学的検体と生物活性因子との間の相互作用における物理的差異は、生物学的
検体との相互作用の前、相互作用時、相互作用後の生物活性因子の物理的特性を比較する
ことによって検出可能である。生物学的検体との相互作用直後の生物活性因子における検
出可能および/または定量化可能な変化は、用いられる生物活性因子の性質に依存する一
連の物理的パラメータによって測定可能である。例えば、検出可能および/または定量化
可能な会合は、生物学的検体との生物活性因子の結合もしくは雑種形成による蛍光強度ま
たは波長の変化によって証明することができる。
【0073】
別の実施形態では、特定の腫瘍特異的蛋白質(疾患マーカである生物学的検体)に対し
て特異的な、マイクロアレイ(生物活性因子)上での蛍光関連抗体の結合(相互作用)は
、生物活性因子の蛍光強度における検出可能な変化をもたらす。この定型的変化は、適切
な生物活性因子および標的疾患を選択しながら事前に実験に基づいて決定された、特定の
疾患マーカの存在を示す。非特異的結合は生物活性因子の蛍光を変えることができるが、
それは、実験に基づいて決定された結果と一致する予測可能かつ定型的な方法でそうする
のではなく、従って、疾患マーカである生物学的検体の存在を示すことにはならない。
【0074】
本発明の1つの特徴は、「マイクロアレイ走査デバイス」に関する。検体とマイクロア
レイの生物活性因子との間の相互作用の物理的パラメータデータは、マイクロアレイ走査
デバイスによって「読まれ」、生体認識デバイスに伝送されて、体液中における検体の存
在、欠如、または量が判定されるのが好ましい。マイクロアレイの物理的特性の変化は、
検体と生物活性因子との間の相互作用と同時に検出されるのが好ましい。代替的に、この
走査デバイスは、1)マイクロアレイ上での疾患マーカである生物学的検体と生物活性因
子との間の相互作用および2)マイクロアレイ上での正常な生物学的検体と生物活性因子
との間の相互作用の物理的特性間の差異を認識することができる。
【0075】
本明細書において言及する「物理的パラメータデータ」は、マイクロアレイ走査デバイ
スによって収集されたマイクロアレイ上での検体と生物活性因子との間の相互作用に関連
する情報を含む。物理的パラメータデータは、分析のために生体測定認識デバイスに伝送
される。走査デバイスは、生物学的検体とマイクロアレイの生物活性因子との間の相互作
用の物理的特性、例えば生体電気特性、生体磁気学特性、または生化学的特性を、その反
応に関連する1つまたはそれ以上の物理的パラメータに関するデータを収集することによ
って測定する。そのようなパラメータは、限定するものではないが、蛍光、結合強度、結
合特異性、電荷等を含むことができる。
【0076】
物理的パラメータデータは、毒性および投与量の決定のために薬理ゲノム学的データお
よび薬物動態データをそのモデル内に組み込んだバイオインフォマティクスシステム内に
格納されるか、または該システム内に格納された物理的パラメータデータのプロファイル
と比較されるのが好ましい。これによって、現在のプロセスに何年も先立つ臨床試験用デ
ータの生成が可能となるのみならず、リアルタイムでの持続的監視による、薬物の明白な
効能と実質的毒性との間における目下の不釣り合いの解消をも可能にする。継続か中止か
を決定するプロセス中に臨床試験に用いるために、サーバ上に格納された情報を通じて、
データベース上に格納されたデータに関する大規模な人口の比較研究を行うことができる
。これにより、より多くの患者が、安全な方法でより早期に臨床試験に入ることが可能と
なる。別の実施形態では、ヒト組織の研究において発見されたバイオマーカは、本デバイ
スの目標とし、癌研究における薬物の経路および有効性の判定の精度を向上させることが
できる。
【0077】
この特徴の一実施形態では、マイクロアレイは、生物活性因子と生物学的検体との間の
相互作用に関連する物理的パラメータデータの取得を可能にするために、光ファイバ素子
が特定の波長の光を放射および受信することができるように設計されている。一例では、
マイクロアレイ内の生物活性因子は、所定量の蛍光標識検体で実質的に飽和されており、
これにより、それらが体液中の非標識標的検体と相互に作用する際に、非標識検体は、体
液内におけるその濃度と釣り合う程度まで、マイクロアレイ上の標識検体を競合的に転移
させる。その結果、マイクロアレイ走査デバイスが、マイクロアレイ上における対応する
蛍光の減少を検出し、伝送することになる。
【0078】
別の例では、生物活性因子上の色素によって光がいったん吸収されてしまうと、異なる
波長および強度の一部の光が戻り、同一のファイバまたは収集用ファイバを通じて、定量
化のためにマイクロアレイ走査デバイスに伝達される。光ファイバによって伝達された光
と光吸収性色素との間の相互作用は、検体と生物活性因子との間の相互作用によって証明
された物理的特性の変化の定性的判定および定量的判定両方の光学的基準となる。それら
の全体が引用により組み込まれる米国特許第6、482、593号および第6、544、
732号を参照されたい。生体測定認識デバイスは、光受信信号データおよび蛍光受信信
号データ、すなわち物理的パラメータデータを受信し、特定の治療薬を投薬する治療薬放
出デバイスに指示を与えることができる。適したマイクロアレイ走査デバイスは、カリフ
ォルニア州サンディエゴ所在のIllumina,Inc.などのいくつかの発売元から
市販されている。
【0079】
検体と生物活性因子との間の相互作用に由来する蛍光の差異を検出する1つの可能性は
、発光分子の近傍において、検出器を用いて放射蛍光を検出する方法である。別の可能性
は、放射蛍光を結合して1本のファイバ内に入射させ、遠位端において検出器で検出する
方法である。蛍光を検出するファイバは、入射光を出力する同一のファイバとしても、蛍
光検出専用の別個のファイバとしてもよい。後者の場合には、マイクロアレイの検出用フ
ァイバは、クラッディングを取り除き、光結合用に処理を施さなければならない。結合し
てファイバ内に戻す工程は、ファイバに隣接させてレンズを用い、放射光をより正確に集
光することによって、より効率的とすることができる。先に述べたように、検出器は、C
CD,PMTを含むことができ、フォトダイオードを含むのが最も好ましい。これらの検
出器は、帯域通過フィルタの使用によって放射波長に対して選択的となる可能性が最も高
い。この検出器は、出力ファイバの遠位端に配置することができる。
【0080】
マイクロアレイ走査デバイスの一部に接続された例示的なマイクロアレイ光ガラスファ
イバを図11に示す。この図は、本デバイスのマイクロチャネル内に延びてマイクロアレ
イの一部を構成している、機能化されたクラッディングされていないファイバを描いてい
る。本発明のデバイスのマイクロアレイは、二股光ファイバシステムにすることのできる
少なくとも1本または複数本の光ファイバを含むことができる。
【0081】
この図では、光ファイバは、抗体生物活性因子で機能化され、蛍光偏光免疫測定法のそ
れに類似する転移アッセイとして機能するように構成されている。ファイバは全内部反射
(TIR)の原理を用いて光を伝播させるので、エバネッセント波は、露出した領域(す
なわち機能化領域)においてファイバに垂直に放射される。エバネッセント波は、ファイ
バの表面上に存在するなんらかの分子によって吸収されることになり、蛍光プローブ(存
在する場合)によって、ストークスシフトしたスペクトルが放射される。ファイバは、フ
ァイバスプリッタと光連絡しており、該ファイバスプリッタが、機能化されたクラッディ
ングされていないファイバ内に光が入ることを可能にし、かつ機能化されたクラッディン
グされていないファイバから戻る光をフォトダイオード検出器へ再ルーティングする。
【0082】
使い捨て部品および非使い捨て部品を有する本発明のデバイスのパッチ除去では、使い
捨て部品は、マイクロニードル、マイクロチャネルおよびマイクロアレイを有する。挿入
時、使い捨て部品のマイクロアレイの光ファイバは、パッチの非使い捨て部品のマイクロ
アレイ走査デバイスの一部を構成する、対応するファイバスプリッタおよびフォトダイオ
ード検出器と光連絡する。
【0083】
マイクロアレイ走査デバイスの別の実施形態では、マイクロアレイの蛍光の変化は、全
内部反射蛍光(TIRF)分光計を用いて、検体とのマイクロアレイの相互作用と同時に
検出される。TIRFの原理が、図9、図10に概略的に描かれている。全内部反射は、
高密度の媒体(ガラスなどの)中を伝播している光が図9に描く緩衝剤などのより低密度
の媒体を有する境界面に接触する際に生じる光学現象である。光が小角度で境界面に接触
すれば、光の一部分は、境界面を透過し(屈折し)、別の部分は、反射して高密度媒体中
に戻る。特定の角度では、すべての光が反射する。この角度は臨界角として知られており
、その値は媒体の屈折率に依存する。しかしながら、ビームのエネルギーの一部は緩衝剤
中へ短距離伝播し(数百ナノメートルであるのが好ましい)、エバネッセント波を生成す
る。このエネルギーが吸収されなければ、それはガラス中に戻り、そこでそれを検出する
ことができる。しかしながら、生物活性因子または標識検体と関連する蛍光分子がエバネ
ッセント波内に存在すれば、それは、光子を吸収して励起することができる。このように
して、極微小な励起背景光で蛍光を得ることが可能となる。
【0084】
単一のフルオロフォアからの蛍光のレベルは極めて低い(1秒当たり数百個から数千個
の光子)。しかしながら、それは、2つの方法で検出されるのが好ましい。第1の方法は
、結合したフルオロフォアが明るい点として現れることになる画像を生成することができ
る、強化されたCCDカメラを用いる方法である。代替的に、ピンホールを通して光電子
増倍管(PMT)上にフルオロフォアを映し出すことが可能であり、それによって検出さ
れた光子の数を数えることができる。そのようなマイクロアレイ走査デバイスには、Te
xas Instruments Spreeta(商標)センサに用いられているよう
な集中光学系が用いられるのが好ましい。マイクロアレイ走査デバイスには、表面プラス
モン共鳴、TIRFに類似したエバネッセント波に基づく技法を用いられるのがより好ま
しい。そのようなセンサでは、光検出器アレイと共に、分極したLED光源を用いて、反
射光の位置が測定される。
【0085】
本発明のこの態様の別の特徴は、生体測定認識デバイスに関し、該生体測定認識デバイ
スは、マイクロアレイ走査デバイスによって収集された物理的パラメータデータ、例えば
フルオロフォア画像または光子総数の解析を通して、検体の存在、欠如または量を判定す
る。検体がマイクロアレイ上で生物活性因子と相互に作用する際に、マイクロアレイ走査
デバイスが、該相互作用の物理的パラメータに関するデータを生体測定認識デバイスに伝
達し、次いで、該生体測定認識デバイスが、そのデータを既知の検体の相互作用プロファ
イルと照合し、検体の存在、欠如および/または量を判定する。
【0086】
一実施形態では、疾患マーカである生物学的検体は、定型的かつ予測可能な方法でマイ
クロアレイ上の生物活性因子と相互に作用し、該相互作用は、再生可能かつ予測可能な物
理的パラメータデータによって証明される。既知のデータを、本明細書において「検体の
相互作用プロファイル」と呼ぶ。そのようなプロファイルは、試験管内で実験に基づいて
確立されることになり、生体測定認識デバイスは、疾患マーカおよび正常検体両方の検体
の相互作用プロファイルを自由に入手することができる。生体測定認識デバイスは、マイ
クロアレイ走査デバイスから生の物理的パラメータデータを受け取り、その情報を、格納
された検体の相互作用プロファイルと比較する。生体測定認識デバイスは、疾患マーカお
よび正常検体両方の検体の相互作用プロファイルを自由に入手することができる。
【0087】
生体測定認識デバイスは、本発明の医療デバイス内に配置されるか、または外部に配置
される。マイクロアレイ走査デバイスと生体測定認識デバイスとの間の連絡は、ローカル
エリアネットワーク(LAN)によって、または無線ローカルエリアネットワーク(WL
AN)、例えばブルートゥース(登録商標)技術によって促進することができる。さらに
、生体測定認識デバイスは、検体の相互作用プロファイルを格納し、検体の相互作用プロ
ファイルの形式の入手しやすい薬物動態情報データベースを構築することもできる。
【0088】
検体の存在を検出および定量化するための特に好ましい構成では、本デバイスは、図5
に示すマイクロ流体チャネルを有するパッチである。本デバイスは、メインチャネルに流
体が流れ込む少なくとも2つの注入口を有する。試料の血液(検体を含む)が一方の注入
口に注入され、反対側の注入口には緩衝剤溶液が注入される。小径では、慣性および乱流
混合が無い状態で流れ、構造体20血液および緩衝剤は、並行する流れで流れる。マイク
ロチャネルは、直径が約50μmと約200μmの間にあるのが好ましく、約75μmと
約150μmの間にあるのがより好ましく、約100μmであるのが最も好ましい。
【0089】
制御してチャネルに流体をポンプで通す工程は、膜がマイクロニードルの作動によって
破れて加圧けん引力が生成され、それによって流体を通過させる毛細管現象または真空に
よって行われるのが好ましい。チャネルは、精密射出成形またはレーザエッチングによっ
て製造することができる。
【0090】
チャネルの大きさおよびマイクロアレイ表面の化学的性質は、測定する検体の大きさと
なるように調整することができる。追加の空気圧式ポンピングシステムおよび流体バルブ
またはマイクロ−PCRシステムならびに新規な化学的性質をさらに含め、感性を増強す
ることができる
マイクロチャネルシステムは、拡散制御結合事象が、機能化されたチャネルの表面上ま
たは光学的表面積の最適化のためにチャネルの中央に通された機能化されたファイバ上で
発生することを可能にする。これにより、表面内にわずか約1000オングストローム貫
入することによって、エバネッセント波に基づくセンサが全血などの流体から検体を検出
することが可能となる。代替的に、流れの中央に埋め込まれたファイバの場合、拡散およ
び分離は、ファイバの両側で測定を行うことができるさらにより簡素なシステムによって
可能となる。
【0091】
本発明のデバイスにおけるマイクロフルイディクス部品の製造は、ワシントン州レドモ
ンド所在のMicronics,Incが提供している技術を用いて行うことができる。
具体的には、薄膜プラスチック積層板技術により、レーザ切断による三次元マイクロ流体
デバイスの作成が可能となる。プラスチックフィルム内に形状が切り込まれ、それに続き
、適切な配向で共に層状にされ、マイクロ流体ネットワークが形成される。代替的に、チ
ャネルは、例えばソフトリソグラフィ技法(Duffy他、Anal Chem.、19
98年)を用いて、ポリジメチルシロキサン(PDMS)内に作ることができる。さらに
、チャネルは、シリコン内に直接エッチングすることができる。ひとたびチャネルが製造
されれば、次いで、生物活性因子をガラス表面に固定化することにより、それらを本デバ
イスに導入することができる。緩衝剤の流れが抗体を付着させた表面と接触するように、
ガラス表面をチャネルに結合し、チャネルの「キャップ」または上面を形成することがで
きる。代替的に、ガラス表面は、ガラス光ファイバである。光ファイバは、単一モードフ
ァイバ、または好ましくは多モードファイバのいずれかとすることができる。1本または
それ以上のファイバを、チャネルの中央に貫通させることができる。この場合、チャネル
は、中央の緩衝剤流チャネルを取り囲む2つの血流チャネルに分割することができ、拡散
は、両方向から生じることになる。
【0092】
細胞物質および高分子とは対照的に、標的検体のような分子は、拡散によって血液/緩
衝剤境界面、流体/流体境界面を通過することができる。拡散率は分子の大きさに反比例
するので、小分子薬物は、血液によって運ばれる蛋白質または細胞のいずれよりもかなり
速く拡散することになる。これにより、大きさによる分離が効果的に生じる。
【0093】
一実施形態では、チャネルは、薬物分子のみがマイクロチャネル(緩衝剤流に隣接する
)の反対壁まで拡散するように設計されている。この壁が、蛍光標識薬物分子とあらかじ
め結合された所定量の抗薬物抗体を塗布することのできる本明細書に定義するマイクロア
レイを構成する。均衡交換が生じ、これにより、壁へ拡散した非標識薬物によって、標識
薬物分子の一部が競合的に転移される(図8、図19)。交換率は濃度依存性であり、従
って、血液中の薬物濃度を測定することができる。免疫測定法として、それに対する抗体
を生成することのできる実質的にすべての検体を検出するように上記の実施形態を適合す
ることができるのを認識することは重要である。
【0094】
上記の実施形態では、生物活性因子と検出中の検体との間の相互作用は、チャネルの緩
衝剤側上で発生し、蛍光測定は、全血試料を用い、TIRF分光計で行うことができる。
従って、蛍光検出はチャネルの緩衝剤側上で行われ、該チャネルが全血試料中の蛍光成分
によって見えにくくなることはない。さらに、測定はマイクロチャネル内で行われるので
、必要となる試料はごく少量である。
【0095】
抗グルコース抗体のマイクロアレイを有する好ましい実施形態では、グルコース濃度は
、約0.01μl〜約0.4μl、好ましくは約0.05μl〜約0.3μl、最も好ま
しくは0.1μl〜0.2μlの血液試料中で測定することができる。抗バンコマイシン
抗体を有する別の好ましいパッチ実施形態では、バンコマイシン濃度は、約0.01μl
〜約0.4μl、好ましくは約0.05μl〜約0.3μl、最も好ましくは0.1μl
〜0.2μlの血液試料中で測定することができる。さらに、これらの実施形態では、約
1分よりも短い極めて迅速な測定を行うことができる。
【0096】
さらにもう一つ別の実施形態では、本デバイスは、ある検体の濃度を監視し、該検体の
濃度に応じて治療薬を放出する。検体は特定の薬物またはその薬物の代謝産物であり、治
療薬は同一の薬物であるのが好ましい。この構成は、薬物の治療域が狭い場合に特に望ま
しく、血流中または体内の特定の部位において検体の特定の濃度を維持することは重要で
ある。従って、本デバイスが血流中または体内の特定の部位における薬物またはその代謝
産物の1つの濃度の低下を検出した場合、本デバイスは、特定の量の同一の薬物を放出し
、全身的または局所的薬物濃度を調節し、所望のレベルに戻すことができる。例えば、イ
ンスリンまたはバンコマイシンなどの抗生物質は、標的検体および治療薬の両方とするこ
とができる。
【0097】
本発明は、疾患を示す検体、すなわち疾患マーカ検体の検出と同時に1つまたはそれ以
上の治療薬の局所送達することができる医療デバイスも企図している。本発明のこの態様
の別の実施形態では、本デバイスは、いくつかの疾患マーカの検出に応じて、単一の治療
薬を放出する。代替的に、本デバイスは、異なる疾患マーカの検出に適切な異なる治療薬
を放出することができる。別の実施形態では、薬物が、マイクロニードルを通して放出さ
れる。別の実施形態では、治療薬は、本デバイス内の分散媒として機能する食塩水用の区
画内に放出することができる。本発明のこの態様のさらに別の実施形態では、リポソーム
が治療薬を充填され、該リポソームに、特定の細胞型を特異的に結合する抗体が被覆され
る。この方法により、疾患マーカの検出と同時のしかるべき細胞型への多量の薬物の送達
が可能となる。
【0098】
本デバイスは、治療薬を含む1つまたはそれ以上のリザーバを含むことができる。リザ
ーバは、疾患マーカの検出と同時に生体測定認識デバイスによってそれが指示を受けるま
で治療薬を保持し、制御方式で、例えば放出すべき薬剤の放出速度および放出量に関する
指示を受信すると、治療薬を放出する。代替的に、単一の放出速度または投与量を本デバ
イス内にプログラムしてもよい。リザーバは、1つまたはそれ以上の治療薬の混合物を収
容することができる。代替的に、本システムは、1つまたはそれ以上の治療薬のいくつか
のリザーバを備えてもよい。複数のリザーバがあるのが好ましい。
【0099】
本明細書において使用する「治療薬」は、疾患を示す特定の生物学的異常、例えば疾患
マーカ検体と関連する疾患を治療するのに有益または適切な化合物を指す。本発明の治療
薬は、例えば化学療法薬のような局所的に送達されるのが好ましい製薬化合物、ステロイ
ド、DNA、RNA,二本鎖RNA(RNAインターフェースによる)およびアンチセン
スRNAを含む治療用核酸、または免疫グロブリン、増殖因子、抗炎症薬、または酵素抑
制因子等のような蛋白質を含む、疾患治療用のなんらかの治療用物質である。
【0100】
本デバイスからの治療薬の放出により、効果的な薬物の局所集中を確立することは好ま
しいかもしれない。例えば、本デバイスの摂取可能な実施形態、埋め込み可能な実施形態
では、局所濃度が同一の薬物に対して安全な全身的濃度を実質的に越える可能性があり、
従って、患者の実質的な不快症状を減らし、しかも有効性を最大化する。局所的炎症の治
療に適切なコルチコステロイドの局所放出は、本明細書に包含される。さらに、感染の治
療用の病原体特異的抗体の局所放出も、本明細書に包含される。正確な配合および投与量
は、患者の状態を考慮して、個々の臨床家が選択することができる(The Pharm
acological Basis of Therapeutics、1975年、C
h.1 p.1のFingl他参照)。
【0101】
別の実施形態では、望ましくない細胞増殖を示す生物学的検体が検出され、増殖抑制効
果を有する治療薬を局所放出するのが好ましい。例えば、シロリムス(ラパマイシン)ま
たはパクリタキセルは、新生内膜過形成時の急速な筋細胞増殖を抑制するのに極めて有効
である。
【0102】
望ましくない増殖を示す生物学的検体の存在に応答するための別の例では、5−FUベ
ースの化学療法は、単独、またはロイコボリンなどの他の化学療法薬と併用した、もしく
はウラシル、5−エチニルウラシル、ブロモビニルウラシル、チミン、ベンジロキシベン
ジルウラシル(BBU)または5−クロロ−2,4−ジヒドロキシピリジンなどのDPD
阻害薬と併用した、5−FU、その誘導体の投与を含み、本医療デバイスから放出される
。またさらに、5−FUまたはその誘導体を有する式(I)の5’−デオキシシチジン誘
導体の併用投与は、5−FUまたはその誘導体とDPD阻害薬5−エチニルウラシルとの
組み合わせと比較して、腫瘍組織選択的な化学療法薬の送達を向上させることが分かって
いる。
【0103】
また、遺伝子毒性物質は、持続的ゲノム傷害を形成するものであり、望ましくない細胞
増殖の臨床管理において化学療法薬として用いるのが好ましい。遺伝子毒性によって誘発
されるDNA損傷の細胞修復速度、および細胞分裂周期による細胞増殖速度は、遺伝子毒
性治療の成果に影響を及ぼす。多くの癌を治療するために用いられる一般分類の遺伝子毒
性化合物は、DNAアルキル化剤およびDNA挿入剤である。ソラレンは、乾癬、白斑、
真菌感染症および皮膚T 細胞性リンパ腫のような皮膚疾患の光化学療法による治療に有
益であることが知られている。Harrison’s Principles of I
nteral Medicine、第2部、Cardinal Manifestati
ons of Disease、第60章(第12版、1991年)。そのメンバがDN
Aをアルキル化するかまたはDNAに挿入される別の一般分類の遺伝子毒性化合物には、
合成によって、もしくは自然からもたらされる抗生物質が含まれる。本明細書において特
に関心があるのは、限定するものではないが、以下のアムサクリンA、C、D(またはダ
クチノマイシンとして知られる)またはF(またはKS4)、アザセリン、ブレオマイシ
ン、カルミノマイシン(Carubicin)、ダウノマイシン(ダウノルビシン)、ま
たは14−ヒドロキシダウノマイシン(アドリアマイシンもしくはドキソルビシン)、マ
イトマイシンA、BまたはC、ミトキサントロン、プリカマイシン(ミトラマイシン)等
で代表される分類の化合物を含む抗生物質である。一般的に用いられており、NDAをア
ルキル化するさらに別の一般分類の遺伝子毒性物質は、ハロエチルニトロソウレア、特に
クロロエチルニトロソウレアを含むものである。この広い分類の代表的メンバには、カル
ムスチン、クロロゾトシン、フォテムスチン、ロムスチン、ニムスチン、ラニムスチンお
よびストレプトゾトシンが含まれる。ハロエチルニトロソウレアの第1の物質は、前記の
代表的化合物の類似物または誘導体とすることができる。
【0104】
シスプラチンまたはオキサリプラチンなどの白金協調化合物によって現在抑えることが
可能な腫瘍には、髄芽細胞腫および神経芽細胞腫に加えて、睾丸癌、子宮内膜癌、子宮頸
部癌、胃癌、扁平上皮癌、副腎皮質癌ならびに小細胞肺癌が含まれる。他の細胞傷害性抗
癌治療薬には、例えば睾丸癌に対するBEP(ブレオマイシン、エトポシド、シスプラチ
ン)、膀胱癌に対するMVAC(メトトレキサート、ビンブラスチン、キソルビシン、シ
スプラチン)、非小細胞肺癌治療に対するMVP(マイトマイシンC、ビンブラスチン、
シスプラチン)が含まれる。
【0105】
そのメンバがDNAをアルキル化するさらに別の一般分類の遺伝子毒性物質には、硫黄
およびナイトロジェンマスタードが含まれる。これらの化合物は、主にグアニンのN7原
子において共有結合付加体を形成することによって、DNAに損傷を与える。この広い分
類の代表的メンバには、クロラムブシル、イホスファミド、メルファラン、メクロルエタ
ミン、novembicin、トロホスファミド等が含まれる。選択された細胞のゲノム
における特定の配列と共有結合的にまたは非共有結合的に相互作用するオリゴヌクレオチ
ドまたはそれらの類似物は、ゲノム損傷の遺伝子座として再定義された1つまたはそれ以
上のゲノム標的を選択することが望ましければ、遺伝子毒性物質として用いることもでき
る。
【0106】
そのメンバがDNAをアルキル化する別の分類の物質には、エチレンイミン、メチルメ
ラミンが含まれる。これらの分類には、例えば、アルトレタミン(ヘキサメチルメラミン
)、トリエチレンホスホルアミド(TEPA)、トリエチレンチオホスホルアミド(Th
ioTEPA)およびトリエチレンメラミンが含まれる。
【0107】
追加の分類のDNAアルキル化物質には、ブスルファンによって代表されるアルキルス
ルフォネート、ベンゾデパによって代表されるazinidines、例えばミトグアゾ
ン、ミトキサントロンおよびプロカルバジンによって代表される他の物質が含まれる。こ
れらの分類の各々には、それぞれを代表する化合物の類似物および誘導体が含まれる。
【0108】
細胞傷害性治療薬の追加例は、細胞特異的抗体活性化血清補体および/または仲介抗体
依存性細胞傷害性を有する抗体錯化剤である。細胞を結合する抗体は、毒素に共役するこ
ともできる(抗毒素)。抗毒素の細胞傷害性成分は、細胞傷害性薬物またはバクテリアも
しくは植物由来の酵素的に活性の毒素、またはそのような毒素の酵素的に活性の断片とす
ることができる。使用される酵素的に活性の毒素およびそれらの断片は、ジフテリア、ジ
フテリアの非結合性活性断片、エクソトクシン(緑膿菌から)、リシン、アブリン、モデ
クシン、α−サルシン、シナアブラギリ蛋白質、ジアンチン蛋白質、ヨウシュヤマゴボウ
蛋白質(PAPI、PAPIIおよびPAP−S)、苦瓜阻害剤、クルシン、クロチン、
サパオ ナリアオフィシナリス阻害剤、ジェロニン、ミトゲリン、レストリクトシン、フ
ェノマイシン、およびエノマイシンである。別の実施形態では、抗体は、小分子抗癌剤に
共役している。モノクローナル抗体およびそのような細胞傷害性成分は、種々の二官能性
蛋白質結合剤を用いて作られる。そのような試薬の例は、SPDP、IT、ジメチルアジ
ピ ミデイトHC1のようなイミドエステルの二官能性誘導体、スベリン酸ジサクシンイ
ミジルのような活性エステル、グルタルアルデヒドのようなアルデヒド、ビス(p−アジ
ドベンゾイル)ヘキサネジアミンのようなビス−アジド化合物、ビス−(p−ジアゾニウ
ムベンゾイル)−エチレンジアミンのようなビス−ジアゾニウム誘導体、トリレン2,6
−ジイソシアネートのようなジイソシアネート、および1,5−ジフルオロ−2,4−ジ
ニトロベンゼンのようなビス−活性フッ素化合物である。毒素の溶解部分は、抗体のFa
b断片に結合することができる。癌を治療するための細胞傷害性放射性医薬品は、放射性
同位元素を抗体に共役することによって製造することができる。本明細書において使用す
る用語「細胞傷害性成分」は、そのような同位元素を含むことを意図されている。
【0109】
一実施形態では、治療薬は、EGFRおよびHER2のような受容体チロシンキナーゼ
の阻害薬であり、哺乳類の癌のような増殖性細胞の増殖を選択的阻害薬として用いられる
。例えば、エルブスタチン、DGF受容体チロシンキナーゼ阻害剤は、ヒト癌細胞を表す
EGFRの増殖を減少させる。スチレンの種々の誘導体もチロシンキナーゼ阻害特性を有
し、抗癌剤として役に立つと言われている。2つのそのようなスチレン誘導体は、その有
効性がヌードマウスの体内に注射したヒト扁平上皮細胞癌の増殖を減衰させることによっ
て実証されているクラスIRTK阻害剤である。特定の4−アニリノキナゾリン誘導体は
、受容体チロシンキナーゼの阻害剤として有益である。これらの化合物が示す極めて密接
な構造活性相関は、キナゾリン環がアデニンポケット内に結合し、アニリノ環が隣接する
独自の親油性ポケット内に結合する、明確に定義された結合モードを示唆している。3つ
の4−アニリノキナゾリンの類似物(2つは可逆的阻害薬、1つは非可逆的阻害薬)が、
抗癌薬物として臨床的に評価されている。さらに、HER2−neu過剰発現転移性乳癌
の治療用のモノクローナル抗体trastazumab(ハーセプチン(商標))。Sc
heurle他、Anticancer Res 20:2091−2096、2000
年。
【0110】
別の実施形態では、微生物の病原体を示す生物学的検体が検出された場合、抗微生物効
果を有する治療薬を局所放出するのが好ましい。例えば、βラクタム系抗生物質、アミノ
グリコシド抗生物質、マクロライド、リンコマイシン、およびクリンダマイシンテトラサ
イクリン、キノロン類、スルホンアミド、トリメトプリム−スルファメトキサゾールおよ
び具体的には、アモキシシラン、アモキシシラン、アモキシシリン、アンピシリン、オー
グメンチン、バクトリム、ビアキシン、セクロール、セフチン、シプロ、クリンダマイシ
ン、デカドロン、ジフルカン、ドキシサイクリン、エリスロミアシン(erythrom
yacin)、エリスロマイシン、エリスロマイシン、フラジール、フロキシン、ケフレ
ックス、レボキシル、マクロビド(macrobid)、メトロニダゾール(フラジル)
、マイノシン、ミノサイクリン/ミノシン、ニザロール(nizarol)、ノルフロキ
サシン、ナイスタチン、ペニシリン、ポラロール(Polarol)、ロセフィン、サル
ファ、ストレプトマイシン、テクイン、テトラサイクリン、チニダゾール、バルトレック
ス、ビブラマイシン、ジトロマックス、またはジトロマイシンを放出するのが好ましい。
【0111】
ウイルス感染を示す生物学的検体の検出と同時に、インビラーゼのようなプロテアーゼ
阻害剤、ノルビル、ビラセプト、クリキシバン、またはフロトバセ(Frotovase
)、サキナビルもしくはアマンタジンのような他の抗ウイルス薬、リマンタジン、ザナミ
ビル、オセルタミビル、リバビリン、AZT、ディダノシン、ザルシタビン、スタブジン
、ラミブジン、ネビラピン、デラビルジン、イドクスウリジン、ビダラビン、トリフルリ
ジン、アシクロビル、ファムシクロビル、ペンシクロビル、バラシクロビル、ガンシクロ
ビル、フォスカルネット、リバビリン、アマンタジンおよびリマンタジン、シドフォビル
、インターフェロンを含む抗ウイルス化合物を放出するのが好ましい。
【0112】
別の実施形態では、炎症を示す生物学的検体が検出された場合、抗炎症効果を有する治
療薬を局所放出するのが好ましい。そのような治療薬は、プレドニゾン/プレドニゾロン
のようなステロイド、またはアスピリン、イブプロフェン、ナプロキセン、ナブメトン、
セレコクシブ、ロフェコキシブ、またはバルデコキシブのような非ステロイド系抗炎症薬
(NSAID)であるのが好ましい。そのような薬剤は、炎症性大腸炎、関節リウマチ等
のような炎症に関連する疾患の治療に特に適している。
【0113】
別の実施形態では、高血糖症を示す生物学的検体が検出された場合、本デバイスが血清
グルコース値を低下させることになる治療薬を放出するのが好ましい。例えば、本デバイ
スによって過度に高い値のグルコースが検出された場合、本デバイスは、十分な量のイン
スリンを放出し、血液中のグルコースの過度に高い値を正常に戻すことによって対処する
ことになる。
【0114】
本発明は、本医療デバイスが複数のマイクロチップを有することを想定している。マイ
クロチップは、現在利用可能な最高の処理機能を有するのが好ましい。複数のマイクロチ
ップは、すべてが互いに連絡しているのが好ましい。マイクロチップは、シリコンゲルマ
ニウムで製造されているのが最も好ましい。マイクロチップは、本医療デバイスを動作さ
せるにあたって最高の効率、速度および能力をさらに備えるために、Internati
onal Business Machines(IBM)のCMOS 9S低誘電率誘
電体絶縁高性能チップであるのがさらにより好ましい。当業者は、下記に記載する本デバ
イスは様々な数のマイクロチップ上に埋め込むことができるという事実から、本デバイス
が様々な数のマイクロチップを有することができることが容易に分かる。
【0115】
またさらに、本デバイスの各技術的構成要素は、それらを本システム内に統合する独自
の方法によって最適化されている。最近、低誘電率誘電体絶縁技術およびシリコンゲルマ
ニウム技術により、マイクロチップの処理能力をおよび効率が最大化されてきた。これら
のチップは、光連絡ネットワークに理想的であり、また、写真光学的信号方式によってデ
ータを伝達するマイクロアレイビーズ技術とそれらを組み合わせることにより、両システ
ムの背後にある能力が最適化される。
【0116】
本発明の別の特徴は、リザーバからの治療薬の放出を制御することのできる治療薬放出
デバイスに関する。例えば、生体測定認識デバイスが疾患マーカの存在を判定すると、制
御してリザーバから治療薬を放出するための信号が、治療薬放出デバイスに送信される。
すなわち、治療薬放出デバイスは、放出すべき薬物の放出速度および/または放出量に関
する指示を受け取る。一実施形態では、治療薬放出デバイスは、上記に掲載したデバイス
を含むマイクロチップの下に配置されたマイクロチップであり、治療薬の被制御放出のた
めのリザーバを含む。マイクロチップの基板は、エッチング、成形、または機械加工によ
って作製されたリザーバを含んでおり、該マイクロチップの支持体としての機能を果たし
ている。支持体として機能し、エッチング、成形、または機械加工に適し、送達されるこ
とになる分子に対して、またその周囲を取り巻く流体、例えば水、有機溶媒、血液、電解
質または他の溶液に対して不透過性である任意の材料を、基板として用いることができる
。基板材料の例には、セラミックス、半導体、および分解性高分子ならびに非分解性高分
子が含まれる。基板自体は、非毒性、無菌、かつ生体適合性を有するのが好ましい。しか
しながら、使用前に、有毒物質もしくは他の非生体適合性物質を、ポリ(エチレングリコ
ール)またはポリテトラフルオロエチレン様物質なとの生体適合性物質内にカプセル封入
してもよい。その全体が引用により組み込まれる米国特許第6、491、666号を参照
されたい。適した治療薬放出デバイスは、MicroChips(マサチューセッツ州、
ケンブリッジ所在)から入手可能である。治療薬放出デバイスは、複数のリザーバを有す
るのが好ましい。本発明のこの態様の別の実施形態では、治療薬放出デバイスは、適切な
治療薬放出状態に関して、他のデバイスまたは外部データベースに信号を送る。さらに別
の実施形態では、治療薬の放出が少量ずつ行われ、送達に先立って正しい投与量を確認す
るためのチェックポイントとして機能する単独の無線信号システムを有する追加のマイク
ロチップを治療薬が通過する間の事前処置としての役割を果たす。
【0117】
本発明の別の特徴は、マイクロアレイ走査デバイス、生体認識デバイス、および状況に
応じての治療薬放出デバイス間の連絡を促進することのできるインターフェースデバイス
に関する。インターフェースデバイスは、生体認識デバイスから検体の存在、欠如または
量に関する情報を受信し、治療薬放出デバイスに、1つもしくはそれ以上のリザーバから
治療薬あるいは薬剤の混合物を放出するための信号を送る。一実施形態では、インターフ
ェースデバイスは、無線ローカルエリアネットワーク(WLAN)用の送信機および受信
機を有する。詳細については、その全体が引用により本明細書に組み込まれる米国特許第
5、832、296号または第6、542、717号を参照されたい。別の実施形態では
、本発明は、マイクロチップ間に信号を伝送するためのパーソナルエリアネットワーク(
PAN)静電気連絡の利用を企図しており、かつ生体認識デバイスにおける解析からのそ
れぞれの信号を受信すると同時に体内に薬物を送達するために、治療薬放出用リザーバと
関連付けた治療薬放出デバイスを用いる。埋め込み可能な実施形態および摂取可能な実施
形態では、2つの隣接するPAN送信機がマイクロアレイの下に配置され、一方はマイク
ロアレイ走査デバイスに隣接し、他方は下のリザーバを制御する治療薬放出デバイスに隣
接しているのが好ましい。PAN送信機は、アレイの結果によって特定された治療薬の放
出に対して信号を送る。適切なハードウェアは、カリフォルニア州パロアルト所在のIn
terval Research Corp.から、送信機は、ニューヨーク州アーモン
ク市所在のInternational Business Machines Cor
p.から調達することができる。
【0118】
本発明のこの態様の別の実施形態では、複数のマイクロチップは、それらの情報を、ハ
ンドヘルド監視装置のような外部情報源または無線データ連絡システムによって操作され
るネットワーク本部のコンピュータに伝送する。本デバイスが糖尿病治療用のパッチであ
るさらに別の実施形態では、該パッチは、インスリン値を測定し、炭水化物値を測定する
第2のデバイスまたは汗腺のレベルもしくは数値を測定する第3のデバイスと連絡する。
検体と異なるデバイス間の相互作用および物理的パラメータデータの比較を通じたプロセ
ス制御決定によって、ある量のグルコースまたはインスリンの放出が適切であるか否かが
判定されることになり、グルコース/インスリン放出を決定する際に必須となる他の要因
の根拠となる閉ループシステムを形成している。
【0119】
一実施形態では、本発明は、本医療デバイスに動力を供給するためのエネルギー源を有
する。例えば、本デバイスは、電池によって動力を供給される。別の実施形態では、動力
源は、パーソナルエリアネットワークによって提供される。
【0120】
本発明の用途は、軍事利用から商業的利用まで多岐にわたる。例えば、本デバイスは、
リアルタイムの診断が実質的に重要となるSARSのようなウイルスに罹災した国の一般
市民が用いることができるであろう。生物テロの発生に伴い、病原体を検出する方法は、
全世界の国防省に対し、価値が高まっている。同様に、本発明は、細菌感染または他の消
化管関連疾患を検出するために、また、消化管が感染症増大の最大中心部位の1つである
ので、腸管系を通過する際における蛋白質活性の即時リアルタイム診断を行うために用い
ることができるであろう。同様に、高親和性蛋白リガンドおよび高特異性蛋白リガンドの
隔離、またはアルデヒドスライド上の関心のあるペプチドを隠蔽するBSAなどの問題に
よって現在制限されている蛋白質マイクロアレイ技術の用途は、生体内の選択的蛋白質ア
レイを用いて標的の蛋白質類に対応する抗体または薬物を投与することによって最大化す
ることができるであろう。さらに、本発明のデバイスは、薬物動態モデルを開発するため
に実験的薬剤の濃度および効果を効率的に監視する臨床試験の研究目的に特に役立つこと
ができるであろう。
【0121】
実際には、本デバイスの商業用途、医療用途、研究/教育用途、および軍事ならびに地
域奉仕/人道的用途があり得る。
【実施例】
【0122】
(実施例1:光ファイバ全内部反射蛍光バイオセンサの仕様)
光ファイバ全内部反射蛍光(TIRF)バイオセンサが構築され、本明細書に定義する
マイクロアレイおよびマイクロアレイ走査デバイスを構成する。Preininger他
(Analytica Chimica Acta、2000年、403、67−76)
を参照されたい。レーザ光は、レーザ光源から、すべてが一連の光ファイバを経由して、
フローセル型検出器へ誘導される。この光ファイバをベースとする装置の概略図を、図1
2に示す。本センサでは、入射レーザ光は、50:50の光ファイバスプリッタの出力区
間を経由して、機能化されたファイバへ誘導される。放射蛍光は、ファイバ内に再帰結合
し、レーザ光からの干渉をほとんど受けることなく、検出器に向かって伝播する。この設
計は、いくつかの利点を有する。開始から終了までのファイバ使用により、自由空間結合
による損失が排除される。ファイバが堅牢な光の輸送手段となり、従って、振動に敏感で
なく、かつ市販の光ファイバコネクタで複数本のファイバを容易に結合することができる
。従って、マイクロアレイは、1本のファイバの機能化された表面であっても、複数本の
ファイバの機能化された表面であってもよい。
【0123】
Celebre他(Measurement Science and Techno
logy、1992年、3、1166−1173)に記載された方法を用いた、入力レー
ザパワーとAtto 655フルオロフォアのファイバ特性の関数としてのフォトダイオ
ードに送達される予測出力蛍光強度(図13参照)を、下記のシステムパラメータと共に
表1に示す。
【0124】
・ 約200ng/cm2[Tedeschi他、Biosensors and B
ioelectronics、2003年、19(2)、85−93]の表面濃度
・ スペクトル特性QY=0.3ε=110、000を有するフルオロフォア Att
o 655(Sigma Aldrich)
(表1:レーザパワーとファイバ特性の関数としての蛍光出力)
【0125】
【表1】

一般的なフォトダイオード(例えばPacific Sensor part 1−6
−TO52S1)は、ピコワット範囲の信号を正確に測定する。システム内で50%損失
すると控えめに見積もっても、出力パワーが検出器の感度下限よりも2桁大きくなるよう
にバイオセンサのパラメータを調整することができるのは明らかである。
【0126】
(実施例2:統合型パッチシステム)
例示的なパッチデバイスは、バンコマイシンに対して0.1mlの血液を自動的に採取
およびサンプリングする無痛の方法を代表している。各パッチは、2つの部分、すなわち
、単回使用マイクロニードルおよびマイクロチャネルを含む使い捨て部分(アッセイデバ
イス)と、残りの光学部品、電子機器ならびに機構(アッセイ読み取りデバイス)を含む
再使用可能部分とからなる。図5、図7。
【0127】
マイクロニードルは、少量の血液を、無痛で自動的に採取する。機械的アクチュエータ
が、針を挿抜する。本発明のデバイスは、パッチが貼付された後、いくつかの測定を行う
。しかしながら、各マイクロニードルは、凝固を回避するために、1回のみ使用される。
複数回の血液採取に対する必要条件としては、針を挿抜することができるだけではなく、
使用済みの針を廃棄して新たな針を再搭載することのできる機械的アクチュエータが求め
られる。本マイクロニードルは、鋭利、堅牢で、完全に無痛の方法で皮膚の外層を貫通す
るのには、ごく短時間で十分である。それらの設計は、本デバイスの低コスト性、使い捨
て性、独立性、生体適合性に寄与している。
【0128】
針は、フォトリソグラフィー法によって、SNFで型に製造される。パッチデバイスの
「最上」のアッセイデバイス部分上のマイクロチャネルは、ファイバセンサを捕捉するの
に必要な構造体と共に、層流要素およびリザーバ要素を含む。針を通ってリザーバに流入
する血液と、チャネルを貫流する血液/緩衝剤流との2つの別個の流体流要素によってパ
ッチが作動する。図5。下記の表に、本チャネル用の設計仕様を示す。
【0129】
(表2)
【0130】
【表2】

パッチの非使い捨て部品(アッセイ読み取りデバイス)は、その上に取り付けられるこ
とになる12個の単回使用使い捨て部品(アッセイデバイス)を含む。図7。マイクロ流
体機器の注文製造品は、Micronicsから調達することができる。仕様は下記のと
おりである。
【0131】
(仕様)
【0132】
【表3】

光センサマイクロアレイ走査デバイスは、レーザにより生成されるエバネッセント波に
よって励起される生物活性因子と検体との間の相互作用に由来する蛍光に基づいて、生体
認識デバイスに電気信号を送る。光センサの頻度は、レーザのコスト、PINダイオード
のコスト、および蛍光分子のコスト間のコストトレードオフに基づいて決定される。
【0133】
非使い捨てエバネッセントセンサファイバ(アッセイ読み取りデバイス内のマイクロア
レイ走査デバイス)は、完全な単回使用アッセイデバイスを生成するための使い捨ての採
血用流体工学的サブシステム(アッセイデバイス内のマイクロアレイを含む)に取り付け
られる。本アッセイデバイスは、各アッセイ読み取りデバイス当たり6個ずつおよび12
個ずつの組みで包装される。
【0134】
統合型システムの最大サイズの試験に関しては、図14に示す身体媒体デバイスと同様
である。
【0135】
血液は、マイクロニードルを通って血液リザーバに流入する。緩衝剤と血液が、チャネ
ルを通る層流を形成する(図5、黒で示す)。ファイバの表面(黒で示す)に結合された
660nmのレーザが、フルオロフォアを励起させる。血液中の薬物がファイバ上の標識
薬物を転移させ、蛍光が減少する。読み取り装置内のファイバ端部上のセンサが、信号レ
ベルの低下を検出する。この低下が、生体測定認識デバイスの関連データベースに報告さ
れる。
【0136】
本デバイスは、櫛状構造に形成されている。12単位アッセイのモデルを図7に示す。
図では、制御用電子機器は、本デバイスの最上部に取り付けられている(アッセイ読み取
りデバイス)。作動機構は、本デバイスの底部にある(アッセイデバイス)。
【0137】
読み取り装置の端面図は、読み取り装置底部のアッセイデバイス用キャビティを示して
いる。光学的インターフェースおよび機械的インターフェースが、これら2つの部品間に
存在する。
【0138】
キャビティの最上部に沿って、マイクロニードルを皮膚内に強制挿入するために用いら
れる12個のバネがある。また、バネを解放するソレノイドもある。各バネが、12個の
使い捨て部品のうちの1つの上端を押圧する。
【0139】
アッセイデバイスのフィンガの各々の一端が、アッセイデバイス内のヒンジを形成して
おり、それにより、バネがアッセイデバイスを強制押下し、アッセイデバイスの底部を覆
う被膜の層を通過させる。
【0140】
光ファイバがヒンジの上を通過し、電子機器のプリント回路基板底部上に取り付けられ
た光スプリッタで終了する。アッセイデバイスとアッセイ読み取りデバイスとの間の境界
面は、小さい空隙である。
【0141】
12個のアッセイデバイスフィンガの1つのこの端面図がパッケージを示している。ア
ッセイデバイスは、無菌のパッチパッケージの内部にある。マイクロニードルの下には、
針が皮膚を貫いてその中に入ることができるように設計されたパッチの一部分がある。図
6に示すように、パッチは、接着剤と共に所定の位置に保持される。最後に、保護カバー
がある。パッチの最上部は、読み取り装置内への挿入を可能にするように設計されている
。光信号は、ファイバの端部とスプリッタとの間のこのシールの一部分を通過する。
【0142】
本開示では、本発明の好ましい実施形態およびその幅広い用途のほんの数例が説明され
ているだけである。本発明は、種々の他の組み合わせおよび環境において用いることがで
き、かつ本明細書に表明した発明思想の範囲内での変更または修正が可能であることを理
解すべきである。従って、例えば、当業者は、通常の域を越えない実験によって、本明細
書に記載した特定の物質および手法と等価の数多くのものを理解または確認することがで
きるであろう。そのような等価のものは、本発明の範囲内にあるものとみなされ、かつ以
下の特許請求の範囲によって包含される。
【図面の簡単な説明】
【0143】
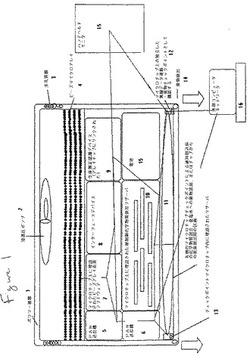
【図1】図1は、本発明の例示的な医療デバイスの概略図である。本デバイスは、本デバイスの多孔質被膜3を通る流体の動きを促進するために、生体安定性ポリマー被膜1、およびこの好ましい実施形態においては、浸透圧ポンプ2を有する。本デバイスは、疾患マーカである生物学的検体と相互に作用することのできる生物活性因子を含むマイクロアレイ4と、治療薬を含み、かつ該治療薬を本医療デバイスから放出することのできるリザーバ10と、疾患マーカである生物学的検体と生物活性因子との間の相互作用の物理的パラメータデータを取得することのできるマイクロアレイ走査デバイス7と、物理的パラメータデータを検体の相互作用プロファイルと比較することのできる生体測定認識デバイス9と、複数のリザーバおよびチェックポイント13&14からの治療薬の放出を制御することのできる治療薬放出デバイス10と、マイクロアレイ走査デバイス7、生体測定認識デバイス9および治療薬放出デバイス10間の連絡を促進することのできるインターフェースデバイス8とを含む複数のマイクロチップ5、7、8、9、6、10、12、13&14と、医療デバイスに動力を供給するためのエネルギー源15とを含む。さらに、例示的なデバイスは、パーソナルエリアネットワーク用送信機5&6およびPANとハンドヘルドコンピュータモニタ15または外部コンピュータネットワーク16との間の連絡用の伝送経路を含む。さらに、例示的なデバイスは、放出に先立つ治療薬の混合用の区画11を含む。
【図2】図2は、外部パッチの実施形態の本発明によるデバイスを示す。これは、皮膚上に装着され、かつ治療薬の放出を可能にすることができる。さらに、これは、外部ネットワークとインターフェースすることができる。
【図3】図3は、外部サーバと無線連絡する、ここではパッチ形状の複数の医療デバイスを示す。外部サーバは、生体測定認識デバイスおよび生物活性因子と検体との間の相互作用の物理的パラメータの薬物動態データベースを含むことができる。
【図4】図4(a)100マイクロメートルの直径のマイクロニードルは、おおよそ人毛の直径である。(b)シリコンマイクロニードルのアレイ。
【図5】図5(a)は、パッチの実施形態100の、本発明によるデバイスの種々の図である。例示的なパッチは、長さが2cmで幅が0.5cmである。これは、約1.5mmの厚みも有する。パッチは、複数のマイクロニードル12を含む。(b)は、パッチデバイスの内部特徴を示す。本デバイスは、マイクロニードル12からポンプで血液が送り込まれるリザーバ13、緩衝剤を含む第2のリザーバ14、緩衝剤15aと血液注入口15bとの合流点となる層流用の共通のマイクロチャネル15、および廃棄物用レセプタクル16を有する。さらに、この図は、本デバイスを、マイクロニードル、マイクロチャネルおよびマイクロアレイを有する使い捨て層100aと、使い捨て部分と光連絡する、マイクロアレイ走査デバイスならびに他の電子機器を有する非使い捨て部分100bとの2つの部品に分離可能とすることができることを示している。
【図6】図6(a)は、患者への貼付前にパッチ100を包装することができる方法を示す。パッチは、保護層17で覆うことができ、また貼付と同時にマイクロニードルが貫通することになるパッチ基部18を有することができる。基部18は、貼付前のマイクロニードルの無菌を維持するというさらなる利点を提供する。接着剤19は、被検者の皮膚へパッチを固定するのに役立つ。さらに、保護カバー20が備えられており、該保護カバー20を除去して、接着剤層19を露出させる。
【図7】図7は、複数のパッチ100を患者へ同時に貼付することができる方法を示す。その後、そのような複数のパッチを順次活性化し、長期間検体検出を行うことができる。
【図8】図8(a)2つの注入用マイクロチャネルのうちの1つの注入口15a内に血液が注入される、例示的な層流マイクロチャネル15の側面図。血液は、細胞21、種々の蛋白質25、および測定対象の検体22を含む。流体は、拡散のみによって境界面を横断する分子と並行する流れで流れる。(b)に示すように、小分子検体22のみが対壁に到達し、該対壁において、表面上で生物活性因子23に事前結合された蛍光標識検体分子24との平衡交換が生じる。この例では、生物活性因子23で被覆したチャネル壁が、マイクロアレイを構成している。
【図9】図9に、全内部反射時に発生するエバネッセント場の概念を示す。エバネッセント場は、光ビームがその中を進む媒体を越えて1波長よりも先へ広がることは決してない。
【図10】図10に、光ファイバ26によって全内部反射蛍光を利用してマイクロアレイにおいて発生する生物活性因子と検体との間の相互作用を示す蛍光の変化を検出する方法を示す。光ファイバは、多様な形状を有することができる。例えば、それは、層流チャネル15の長さに沿って平行に走ることができる。代替的に、複数のファイバがチャネル内で終了し、ファイバ自体に生物活性因子で被覆してもよい。第1のマイクロチャネル15aおよび第2のマイクロチャネル15bは、互いに流体連絡する。小分子のみが、拡散境界面を越えて、マイクロアレイ、すなわち機能化されたセンサ表面へ拡散することになる。TIRF分光計による蛍光検出は、この表面を越えて1波長よりも先へは広がらない。
【図11】図11に、マイクロアレイの一部である光ファイバ26を示す。光ファイバは、クラッディングされていない部分31およびクラッディングされていない部分27を有する。遠位のクラッディングされていない部分27は、アッセイを受けている体液中の標的検体と相互に作用する生物活性因子で機能化されている。ファイバ26の近位端は、マイクロアレイ走査デバイスの一部と光連絡している。この接触は、コネクタ28によって円滑化される。コネクタよりも先へは、入力によって光がファイバスプリッタ31へ誘導され、該ファイバスプリッタ31が、ファイバを経由して戻る光を、フォトダイオード30のような検出器へ誘導する。別に論じたように、ファイバの機能化されたクラッディングされていない27が層流マイクロチャネル15の壁の一部を構成していてもよく、複数のファイバがチャネル15内に突出していてもよい。
【図12】図12に、マイクロアレイの例示的な一部分およびTIRFセンサを用いたマイクロアレイ走査デバイスを示す。レーザ33からの入射レーザ光は、多モードファイバ26および50:50の光ファイバスプリッタ31の出力区間を経由して、機能化されたクラッディングされていないファイバ27へ誘導される。1アッセイの場合、体液中における検体の存在に起因し、かつエバネッセント波において光子エネルギーがファイバ内に結合される結果生じる競合的結合プロセスによって生物活性因子から転移された蛍光標識検体は、減少する。この光度の減少は、フォトダイオードおよび関連する増幅器によって検出される。検体22と生物活性因子23との間の相互作用の特徴を示す放射蛍光は、ファイバ内に再帰結合し、レーザ光からの干渉をほとんど受けることなく検出器30に向けて伝播する。ファイバに連結されたレーザは、660nmの光を提供する。一例では、本システムは、200μmのコア機能化ファイバおよびスプリッタ、または62.5μmのコア機能化ファイバおよびスプリッタで作動する。ファイバのコア直径は、システム全体に対して同一である。62.5μmのコアシステムまたは200μmのコアシステムのいずれかにおいて、より高次のモードのファイバ(コアの両端)が励起され、エバネッセント波エネルギーを最大化し、かつ1×2のカプラをより一様に作動させる。これは、ファイバのコア径によって異なる。
【図13】図13に、Atto 655フルオロフォアの蛍光および吸光度を示す。
【図14】図14は、ヒトの腕上に装着されたアッセイ読み取りデバイスのモデルの画像である。
【図15】図15は、0.1μl/sで流れるPBSの流れと0.02μl/minで流れる血液の流れとの2つが1つのマイクロチャネル内で集合した画像である。視覚的には、拡散境界面での各流れ間の混合はほとんど見られない。しかしながら、より高い拡散係数を有する分子は、拡散境界面を越えることになる。
【図16】図16は、細胞、ウシ血清アルブミンおよびバンコマイシンの拡散係数の画像である。
【図17】図17は、本発明の例示的なデバイスの図である。A)この図は、本デバイスを、マイクロニードル、マイクロチャネルおよびマイクロアレイを有する使い捨て層100aと、使い捨て部分と光連絡する、マイクロアレイ走査デバイスならびに他の電子機器を有する非使い捨て部分100bとの2つの部品に分離可能とすることができることを示している。B)パッチの使い捨て部分100aは、イクロニードル12からポンプで血液が送り込まれるリザーバ13、緩衝剤を含む第2のリザーバ14、緩衝剤15aと血液注入口15bとの合流点となる層流用の共通のマイクロチャネル15、および廃棄物用レセプタクル16を含む。さらに、マイクロアレイを備える光ファイバ26のクラッディングされていない部分を示す。C)は、いくつかの使い捨て部分および非使い捨て部分を共に示す。
【技術分野】
【0001】
(発明の背景)
(1.発明の分野)
本発明は、診断および薬物送達の分野に関する。より詳細には、本発明は、体液検体の
レベルを監視し、状況に応じて適切な治療薬を放出することのできる医療デバイスおよび
方法に関する。
【背景技術】
【0002】
(2.背景)
生体高分子の活性または薬物の濃度レベルを検出することのできる「ポイントオブケア
」デバイスは、それらが患者の検査室訪問の必要性を排除し、従って時間と費用の両方を
節約することができるため、需要が高い。現代のマイクロアレイ技術の最も価値ある側面
の1つは、疾患を招く生体高分子の機能不全、奇形または突然変異を検出する能力である
。しかしながら、そのようなアレイが摂取可能、埋め込み可能または装着可能なポイント
オブケアデバイス内に組み込まれていないために、この能力は、十分に生かされていない
。現代のマイクロアレイ技術は、機械の内部に挿入されることになるスライド上に安定化
された固定化検体の分析によるか、または生体の外部で手作業で分析した生体高分子およ
びそれらの代謝産物の特性付けに限定されている。
全血は細胞、血小板、無数の蛋白質および他の高分子を含んでいるため、血液を含むアッ
セイは一般に、これらの成分を除去するための試料の前処理を必要とする。前処理ステッ
プをポイントオブケアデバイス内に統合することは、デバイス自体にかかるコストを押し
上げ、従って、デバイスの使用を財政的に実行不可能とする。例えば、現在市販されてい
る一部のデバイスは、それらのアッセイに全血を使用しており、それらの中には、血液に
よって運ばれる検体(コレステロールがその代表である)を測定するためのBoehri
nger MannheimのReflotron(商標)システム、および電解質、一
般的化学反応、血液ガスおよび血液学を含むいくつかの集中治療用アッセイを行うiSt
at(商標)(iStat Inc.)がある。Reflotron(商標)は、酵素ま
たは他の反応性要素がテストストリップの表面上に固定化されるドライケミストリー技術
に依存している。そのアッセイは、反応が変色を引き起こし、従って存在する検体の量を
示す、熱量計による活性度アッセイである。iStat(商標)は、電気化学検出に依存
して、信号を生成する。どちらの場合にも、血液試料が別個に取られ(一般に指を刺すこ
とによって)、ついでチップ(またはiStatの場合はカートリッジ)上に配置され、
そこで反応が生じ、外部の検出装置で分析される。これらの既存の監視システムは、それ
らが通常、使用者が自身に針を刺し、かつ1つの結果を得るのに多くのステップを必要と
するので、不十分かつ不都合である。従って、血液などの体液を、繰り返し、自動的かつ
正確に監視することのできる装着可能なデバイスに対する必要性が存在する。
【0003】
ポイントオブケアデバイスは、血液、尿、大便などの全身性生体試料が疾患の存在場所
におけるわずかな分子変化に関する適切な情報を提供することができない特定の状況にお
いても有益である。そのような場合、臨床家が病気の正確な存在部位を特定することがで
きたとしても、分析用の生体試料を採取することは、患者にとっての大きなリスク、痛み
および出費となるだけである。さらに、ポイントオブケアデバイスは、治療すべき疾患が
限局性のものである場合においても、経皮的手段または経静脈的手段のような薬剤の全身
投与によって身体が全体として治療される場合には、ポイントオブケアデバイスは望まし
いであろう。この場合、薬剤は治療を意図されていない身体部分に対して望ましくない影
響があることが多いため、または身体の罹患部の治療は全身投与では達成不可能であるか
もしれない薬剤の高集積を必要とするため、全身投与は望ましくないかもしれない。例え
ば、ある患者に全身的に投与した場合、一部の薬物(例えば、癌および他の増殖性疾患を
治療するために用いられるもののような化学療法薬)は、望ましくない副作用を引き起こ
す可能性がある。従って、疾患を検出し、体内の局所部位に薬剤を投与することが望まし
いことが多い。
【0004】
従って、生体高分子の活性または薬物の濃度レベルを検出することができ、生体高分子
の活性もしくは薬物の濃度レベルの変化に応じて体内の局所部位に特定の治療薬を投与す
ることもできるポイントオブケアデバイスに対する要望がある。本明細書に引用するすべ
ての論文、広報および特許は、それらの全体が、引用により組み込まれる。さらに、20
03年9月11日に提出された特許仮出願第60/501、847号も、引用により本明
細書に組み込まれる。
【発明の開示】
【課題を解決するための手段】
【0005】
(発明の概要)
本発明の一態様は、疾患マーカである生物学的検体と相互に作用することのできる生物
活性因子を含むマイクロアレイと、少なくとも1つの治療薬を含み、かつ該治療薬を医療
デバイスから放出することのできるリザーバと、疾患マーカである生物学的検体と生物活
性因子との間の相互作用の物理的パラメータデータを取得することのできるマイクロアレ
イ走査デバイスを含む複数のマイクロチップと、物理的パラメータデータを検体の相互作
用プロファイルと比較することのできる生体測定認識デバイスと、リザーバからの治療薬
の放出を制御することのできる治療薬放出デバイスと、マイクロアレイ走査デバイス、生
体測定認識デバイスおよび治療薬放出デバイス間の連絡を促進することのできるインター
フェースデバイスと、医療デバイスに動力を供給するためのエネルギー源とを備える医療
デバイスに関する。
【0006】
本発明のこの態様の一実施形態では、本デバイスは、被膜を施されており、被膜は、チ
ャネルを有することのできる生体安定性ポリマーである。本発明のこの態様の別の実施形
態では、このポリマーは、多孔質である。
【0007】
別の実施形態では、体液は、圧力差を用いて分子をマイクロアレイに沿って移動させる
マイクロ流体路を通じて輸送される。一実施形態では、浸透圧ポンプを用いて、本デバイ
スの最上部を通して流体を前進させる。別の実施形態では、パーソナルエリアネットワー
ク技術によって伝導される体内の自然な電流によって、流体輸送に動力が供給される。
【0008】
本発明のこの態様のさらに別の実施形態では、マイクロアレイは、マイクロビーズを備
える。別の実施形態では、生物活性因子は、核酸である。さらに別の実施形態では、生物
活性因子は、ポリペプチドである。さらに別の実施形態では、生物活性因子は、免疫グロ
ブリンである。
【0009】
本発明の医療デバイスの追加の実施形態では、生物活性因子は、蛍光標識されている。
別の実施形態では、生物活性因子は、ナノ結晶で蛍光標識されている。
【0010】
さらに別の実施形態では、疾患マーカである生物学的検体は、核酸である。さらに別の
実施形態では、疾患マーカである生物学的検体は、ポリペプチドである。別の実施形態で
は、疾患マーカである生物学的検体は、免疫グロブリンである。
【0011】
さらにもう一つ別の実施形態では、複数のマイクロチップは、シリコンゲルマニウムを
含む。
【0012】
別の実施形態では、マイクロアレイ走査デバイスは、光ファイバ素子を備える。
【0013】
追加の実施形態では、検体の相互作用プロファイルは、生体測定認識デバイスに格納さ
れる。代替的実施形態では、検体の相互作用プロファイルは、本医療デバイスの外部に格
納される。
【0014】
別の実施形態では、本医療デバイスは、複数のリザーバを有する。追加の実施形態では
、インターフェースデバイスは、パーソナルエリアネットワークを備える。
【0015】
追加の実施形態では、エネルギー源は、電池である。代替的実施形態では、エネルギー
源は、パーソナルエリアネットワークによって提供される。
【0016】
本発明の別の態様は、疾患マーカである生物学的検体と相互に作用することのできる生
物活性因子を含むマイクロアレイと、少なくとも1つの治療薬を含み、かつ該少なくとも
1つの治療薬を医療デバイスから放出することのできるリザーバと、疾患マーカである生
物学的検体と生物活性因子との間の相互作用の物理的パラメータデータを取得することの
できるマイクロアレイ走査デバイスを含む複数のマイクロチップと、物理的パラメータデ
ータを検体の相互作用プロファイルと比較することのできる生体測定認識デバイスと、リ
ザーバからの治療薬の放出を制御することのできる治療薬放出デバイスと、マイクロアレ
イ走査デバイス、生体測定認識デバイスおよび治療薬放出デバイス間の連絡を促進するこ
とのできるインターフェースデバイスと、医療デバイスに動力を供給するためのエネルギ
ー源と、医療デバイスが飲み込まれ、患者の腸管を通過し、自然に排せつされることを可
能にする生体適合性を有する被膜とを備えるコーティングされた医療デバイスを患者に投
与する工程を含む、患者の体内の疾患を検出および治療する方法に関する。
【0017】
本方法の一実施形態では、被膜は、チャネルを有することのできる生体安定性ポリマー
である。別の実施形態では、ポリマーは、多孔質である。
【0018】
本方法のさらに別の実施形態では、マイクロアレイは、マイクロビーズを備える。別の
実施形態では、生物活性因子は、核酸である。さらに別の実施形態では、生物活性因子は
、ポリペプチドである。さらに別の実施形態では、生物活性因子は、免疫グロブリンであ
る。
【0019】
本発明の本方法の追加の実施形態では、生物活性因子は、蛍光標識されている。別の実
施形態では、生物活性因子は、ナノ結晶で蛍光標識されている。
【0020】
本方法のさらに別の実施形態では、疾患マーカである生物学的検体は、核酸である。さ
らに別の実施形態では、疾患マーカである生物学的検体は、ポリペプチドである。別の実
施形態では、疾患マーカである生物学的検体は、免疫グロブリンである。
【0021】
本方法のさらにもう一つ別の実施形態では、複数のマイクロチップは、シリコンゲルマ
ニウムを含む。
【0022】
本方法の別の実施形態では、マイクロアレイ走査デバイスは、光ファイバ素子を備える
。
【0023】
本方法の追加の実施形態では、検体の相互作用プロファイルは、生体測定認識デバイス
内に格納される。代替的実施形態では、検体の相互作用プロファイルは、本医療デバイス
の外部に格納される。
【0024】
本方法の別の実施形態では、複数のリザーバを用いる。
本方法の追加の実施形態では、インターフェースデバイスは、パーソナルエリアネットワ
ークを備える。
【0025】
本方法の追加の実施形態では、エネルギー源は、電池である。代替的実施形態では、エ
ネルギー源は、パーソナルエリアネットワークによって提供される。
【0026】
本方法の追加の実施形態では、連絡は、外部のコンピュータによって監視される。別の
実施形態では、外部コンピュータは、治療薬の放出を指示する。
【0027】
本発明の別の態様は、体液の試料を採取することのできる少なくとも1本のマイクロニ
ードルと、試料が貫流して該少なくとも1本のマイクロニードルと流体連絡する第1のマ
イクロチャネルと、第1のマイクロチャネルと流体連絡し、緩衝剤が貫流し、生物活性因
子を有するマイクロアレイと、生物活性因子と体液中の検体との間の相互作用を検出する
ためのマイクロアレイ走査デバイスとを含む第2のマイクロチャネルと、前記マイクロア
レイ走査デバイスと生体測定認識デバイスとの間の連絡を促進することのできるインター
フェースデバイスとを備える、体液中の検体を検出することができる医療デバイスに関す
る。
【0028】
一実施形態では、体液は、血液である。別の実施形態では、少なくとも1本のマイクロ
ニードルは、複数のマイクロニードルである。さらに別の実施形態では、マイクロニード
ルは、直径が約10ミクロンと約200ミクロンの間にある。さらに別の実施形態では、
マイクロニードルは、約100マイクロリットルの血液を採取することができる。別の実
施形態では、第1のマイクロチャネルは直径が約100マイクロメートルである。追加の
実施形態では、第2のマイクロチャネルは、直径が約100マイクロメートルである。
【0029】
またさらに別の実施形態では、第1のマイクロチャネルを貫流する体液中の検体は、第
2のマイクロチャネル内に拡散し、生物活性因子と相互に作用する。別の実施形態では、
第1のマイクロチャネルを貫流する体液中の検体は、第2のマイクロチャネル内に拡散し
、標識検体を、生物活性因子に結合している位置から競合的に転移させる。さらに別の実
施形態では、標識検体は、所定量で提供される。別の実施形態では、標識検体は、蛍光成
分で標識されている。さらに別の実施形態では、マイクロアレイは、体液中の検体を特異
的に結合する抗体の被覆を有する第2のマイクロチャネルの一部分である。さらに別の実
施形態では、マイクロアレイ走査デバイスは、全内部反射蛍光(total inter
nal reflection fluorescence; TIRF)分光計を備え
る。
【0030】
本発明のこの態様の別の実施形態では、生体測定認識デバイスは、本デバイスの外部に
配置され、連絡は、無線伝送によって行われる。別の実施形態では、検体は、インスリン
であり、生物活性因子は、インスリンに対して特異的な抗体である。さらにもう一つ別の
実施形態では、検体は、グルコースであり、生物活性因子は、グルコースに対して特異的
な抗体である。さらに別の実施形態では、本デバイスは、パッチとして皮膚上に装着され
る。
【0031】
本発明のこの態様のさらに別の実施形態では、検体は、疾患を示す。
【0032】
本発明のこの態様の別の実施形態では、本医療デバイスは、内部に治療薬を有するリザ
ーバと、生体測定認識デバイスからの指示に応じたリザーバからの治療薬放出を制御する
ことのできる治療薬放出デバイスとをさらに備える。別の実施形態では、検体は、グルコ
ースであり、治療薬は、インスリンである。さらに別の実施形態では、検体と治療薬は同
一である。
【0033】
本発明のこの態様の別の実施形態では、本医療デバイスは、少なくとも1本のマイクロ
ニードルと、第1のマイクロチャネルと、第2のチャネルとを備える少なくとも1つの使
い捨てアッセイデバイスを有し、かつ、マイクロアレイ走査デバイスとインターフェース
デバイスとを備える非使い捨てアッセイ読み取りデバイスを有する。さらに別の実施形態
では、アッセイデバイスとアッセイ読み取りデバイスとは、互いに光連絡している。また
さらにもう一つ別の実施形態では、単一のアッセイ読み取りデバイス内にはめ込まれた複
数の使い捨てアッセイデバイスがある。
【0034】
別の実施形態では、マイクロアレイは、第2のマイクロチャネルと流体接触する、生物
活性因子で機能化された単一のガラス光ファイバからなる1つのクラッディングされてい
ない部分を含む。代替的に、マイクロアレイは、第2のマイクロチャネルと流体接触し、
生物活性因子で機能化された単一のガラス光ファイバからなる、複数のクラッディングさ
れていない部分を含んでもよい。
【0035】
本発明の付加的利点は、本発明の実施に関して企図される最良の形態の単なる例として
、本発明の好ましい実施形態のみを示して説明する以下の詳細な説明から、当業者には容
易に明らかとなろう。理解されることになるように、本発明は、他の実施形態および異な
る実施形態が可能であり、そのいくつかの詳細は、種々の明白な箇所において、すべて本
発明から逸脱することなく、修正することができる。本発明は、これらの特定の詳細の一
部または全部がなくとも実施することができる。他の例では、周知の処理作業については
、本発明を不必要に分かりにくくしないために、詳細には説明してきていない。従って、
図面および説明は、本質的に、例としてみなすべきであり、限定するものとみなすべきで
はない。
【発明を実施するための最良の形態】
【0036】
(発明の詳細な説明)
その最も基本的な形態において、本発明は、体液中の検体を定性的かつ/または定量的
に検出するためのセンサとして機能する医療デバイスに関する。そのような検体は、疾患
を示す可能性を秘めているものであっても、薬物または薬物代謝産物であってもよい。さ
らに、本デバイスは、感覚の入力に応答して治療薬を放出することを可能とすることがで
きる。従って、これはさらに、持続的な診断および投薬を提供することができる。本発明
の装置は、埋め込み可能としても、摂取可能としても、パッチとして皮膚上に装着しても
よい。
【0037】
本デバイスは、生体液中の検体をサンプリングすることができる。生体液には、限定す
るものではないが、血液、血清、尿、胃液および消化液、涙液、唾液、便、精液、および
腫瘍性の組織に由来する間質液が含まれる。
【0038】
医療デバイス内に採取された体液は、マイクロアレイと接触させられ、該マイクロアレ
イが、体液中の生物学的検体をサンプリングする。流体は、医療デバイスから放出するこ
とができ、かつ特定の検体の有無に応じて放出される治療薬を含むことができる。医療デ
バイスを出入りする体液の動きは、マイクロ流体ポンプまたは浸透圧ポンプのようなポン
プによって円滑化されるのが最も好ましい。別の実施形態では、分子の輸送は、流体をマ
イクロアレイに沿って流れさせる加圧マイクロ流体路を経由して行われる。さらに別の実
施形態では、分子は、パーソナルエリアネットワーク(PAN)の送信機または圧電セン
サもしくは磁気センサによって伝導される自然な電流によって輸送される。
【0039】
埋め込み可能な実施形態に関しては、本デバイスは、カテーテル内視鏡の先端に封着す
ることができ、体内における薬物濃度のリアルタイムの分析およびモデル化が可能となる
。例えば、本デバイスは、例えば血管ステント、胃ステントまたは胆管ステントに関連付
けることができる。別の実施形態では、本デバイスは、ステントの内側に封着される。別
の実施形態では、本デバイスは、それを体内に埋め込むことを可能にするポリマーシステ
ム内、眼の背部に配置することのできるレンズ内、ガスおよび大気汚染の外部センサ内、
およびリアルタイムの監視を必要とする他の物体内に梱包される。
【0040】
一実施形態では、本デバイスは、パッチの形状をしている。図2。本デバイスは、全血
検体のモニタとして使用されることになる皮膚の外部に貼付される、粘着パッチであるの
が好ましい。血液検体は、その濃度がパッチによって監視される薬物であるのがより好ま
しい。そのような薬物は、治療域が狭く、血液中のマイクロモルの濃度中に存在する。血
液中の標的検体分子の濃度または同一性は、パッチ上で直接測定され、次いで当該情報を
内部または外部のデータ格納システムに伝送することができるのが最も好ましい。
【0041】
パッチについては、複数ではないにしても、少なくとも1本のマイクロニードルを用い
、皮膚を通じて血液を採取することを想定している。図4。マイクロニードルは、ほぼ人
毛の大きさで、一体化されたマイクロリザーバまたはキュベットを有するのが好ましい。
マイクロニードルは、無痛で皮膚を貫通し、微量の血液試料を採取する。マイクロニード
ルは、約0.01マイクロリットル〜約1マイクロリットル、好ましくは0.05マイク
ロリットル〜約0.5マイクロリットル、最も好ましくは約0.1マイクロリットル〜約
0.3マイクロリットルの毛細血管血液を採取し、それらをパッチ内のリザーバに送達す
るのがより好ましい。マイクロニードルは、シリコンを材料として製造され、直径が約1
0ミクロン〜約200ミクロン、より好ましくは約50ミクロン〜約150ミクロン、最
も好ましくは100ミクロンで、皮膚へのそれらの穿刺を実質的に無痛としているのが好
ましい。パッチは、例えば指の先端ほど詳細に調べられていない身体部位上に配置される
可能性が最も高いかもしれないので、毛細血管密度は、かなり低い可能性がある。図4に
示すように、毛細血管が確実に針で実際に突き刺されるように、血液採取用には複数の針
が用いられることになる。そのようなマイクロニードルは、Pelikan(カリフォル
ニア州パロアルト所在)および/またはKumetrix(カリフォルニア州ユニオンシ
ティー所在)によって市販されている種類のものであり、米国特許第6、503、231
号も参照されたい。
【0042】
一実施形態では、そのうちの一部が大きさならびに/または特異度に基づいた標的分子
の分離を可能にする多孔質ゲルおよびポリマーが被覆された複数のポリマー製の針を用い
る方法を想定している。ゲルには、限定するものではないが、ポリクロリメリド(pol
ychlorimeride)および多孔質ポリカーボネートエラストマーが含まれる。
【0043】
一般に、本明細書に開示するマイクロニードルを作製する際に用いることのできるマイ
クロ加工工程には、リソグラフィ、湿式化学的除去法、乾式化学的除去法、およびフォト
レジスト除去法のようなエッチング技法、シリコン熱酸化法、電気メッキならびに化学メ
ッキ、ホウ素拡散、リン拡散、ヒ素拡散、およびアンチモン拡散のような拡散工程、イオ
ン注入、蒸発(フィラメント、電子ビーム、フラッシュ、ならびにシャドウイングおよび
ステップカバレッジ)、スパッタリング、化学蒸着(CVD)、エピタキシ(気相、液相
、ならびに分子線)、電気メッキ、スクリーン印刷、およびラミネート加工のような膜蒸
着が含まれる。全体としては、Jaeger、Introduction to Mic
roelectronic Fabrication (Addison−Wesley
Publishing Co.,マサチューセッツ州レディング所在、1988年)、
Runyan他、Semiconductor Integrated Circuit
Processing Technology(Addison−Wesley Pu
blishing Co.,マサチューセッツ州レディング所在、1990年)、Pro
cessing of the IEEE Micro Electro Mechan
ical Systems Conference 1987年−1998年、Rai−
Choudhury編集、Handbook of Microlithography
,Micromachining & Microfabrication (SPIE
Optical Engineering Press、ワシントン州ベリンガム所在
、1997年)を参照されたい。代替的に、針は、シリコンウエハ内に成形し、次いで、
従来のワイヤ切断技法を用いて、ニッケル、金、チタンまたは種々の他の生体適合性を有
する金属で被覆することができる。別の実施形態では、針は、生体高分子で作製すること
ができる。マイクロニードルは、その全体が引用により本明細書に組み込まれる、Muk
erjee他、Sensors and Actuators A:Physical、
第114巻、第2号−第3号、2004年9月1日、第267頁−第275頁に記載の方
法に従って、特許請求の範囲のデバイス用に作製し、使用することができる。
【0044】
本デバイスは多くの測定結果を取得することができるが、マイクロニードルは、1回の
み使用されることも好ましい。針を挿抜し、使用済みの針を廃棄し、かつ新しい針を再搭
載する機械的アクチュエータによって、複数回の血液採取が行われるのが好ましい。超小
型ディスクドライブ(例えばIBMマイクロドライブ)用に開発され、大量生産に用いら
れている機械技術は、同様の一連の動作を有しており、かつ要求価格が低い。マイクロア
クチュエータは、半導体様のバッチ工程を用いて製造されたMEMS(マイクロ機械加工
電気機械システム)デバイスであるのが好ましい。そのようなアクチュエータには、ニッ
ケルチタニウム合金製デバイス、空気圧式デバイス、または圧電デバイスが含まれる。最
小の針は、厚さが約1ミクロン〜約10ミクロン、好ましくは約2ミクロン〜約6ミクロ
ン、最も好ましくは約4ミクロンであるが、高さは、約10ミクロン〜約100ミクロン
よりも高く、好ましくは約30ミクロン〜約60ミクロン、最も好ましくは約40ミクロ
ンである。
【0045】
代替的に、針は、十分な力および作動に必要な可動域を生成するに足るほどコイル状に
きつく巻かれた小型バネの解放がピンによって誘発される、バネソレノイドシステムで作
動される。
【0046】
一実施形態では、本発明のパッチデバイスは、複数のマイクロニードル、マイクロチャ
ネルおよびマイクロアレイ(アッセイデバイス)を有する使い捨て部品と、マイクロアレ
イ走査デバイスならびにマイクロアレイ上での検体の生物活性因子との相互作用の結果を
好ましくは無線連絡によって、例えばブルートゥース(登録商標)(アッセイ読み取りデ
バイス)(図5参照)によって生体測定認識デバイスに伝送する機能を有する非使い捨て
部品との2つの分離可能な部品を有する。この実施形態では、使用済みの使い捨て部品は
、非使い捨て部品から除去することができ、一方で、非使い捨て部分は、引き続き被検者
の身体上の所定部位にとどまる。次いで、未使用の針を備える未使用の使い捨て部品を、
すでに患者の身体の所定部位に貼付されている非使い捨て部分に付けることができる。未
使用の使い捨て部品は、先に使用された使い捨て部品と同一または異なる検体を定量的も
しくは定性的に検出することを可能とすることができる。図7。この実施形態では、使用
済み使い捨て部品のマイクロニードルが例えば血餅で詰まった時点で、未使用の使い捨て
部品を付けるのが好ましい。非使い捨て部品は、1つまたはそれ以上の使い捨て部品をも
含むことができる。この構成では、使い捨て部品の各々が、異なる検体を同時に検出する
ことができる。代替的に、使い捨て部品は各々、個別の時間帯に体液、例えば血液をサン
プリングするなどの方法で依然として順次作動され、同一の検体を検出する。この構成で
は、本デバイスは、ある時間帯にわたって使い捨て部品を1つずつ順に採用することによ
り、長時間にわたって検体を検出する。本デバイスは、12個の使い捨て部品を有し、2
時間毎に新しい使い捨て部品を採用することにより、24時間にわたって検体を検出する
ことができるのが好ましい。
【0047】
嚥下可能または埋め込み可能な実施形態では、長期間にわたる(例えば、最長1週間、
6ヶ月間、1年間またはそれより長期間)体液、組織およびこれらに類するものへの暴露
の結果として有意な劣化を被らず、従って本デバイスが腸管全体を通過することを可能に
するものを指す、「生体安定性ポリマー」を本デバイスに被覆するのが好ましい。流体は
、ポリマー内の微細孔またはチャネルを通じて本医療デバイス内に注入され、そこから放
出されるのが好ましい。図1。
【0048】
本発明のこの態様の特定の実施形態の生体安定性被膜材料は、本医療デバイス内への体
液の流入およびそれからの治療薬の放出を可能にさせるのに足る大きさの互いにつながっ
た細孔によって特徴付けられる多孔質ポリマー材料である。多孔質ポリマー材料は、少な
くとも約5ミクロン、より好ましくは少なくとも約8ミクロン、より好ましくは少なくと
も約10ミクロンの平均細孔径を特徴とするのが好ましい。多孔質構造が凍結乾燥法によ
って得られる実施形態に用いるのに適したポリマーには、ポリウレタン(ポリウレタン分
散体を含む)などの任意の適した生体安定性ポリマー、エチレンビニールアセテートポリ
マー、交差結合ゼラチンなどのヒドロゲル、デキストラン、ポリカルボン酸、セルロース
ポリマー、ゼラチン、ポリビニルピロリドン、無水マレイン酸ポリマー、アクリルラテッ
クス分散体、ポリアミド、ポリビニルアルコール、ポリエチレンオキシド、グリコサミノ
グリカン、多糖類、ポリエステル、ポリアクリルアミド、ポリエーテル、およびそれらの
混合物ならびにコポリマーが含まれる。
【0049】
本明細書において使用する用語「検体」は、体液および身体組織内に見出される、抗体
、血清蛋白、コレステロール、核酸、薬物ならびに薬物代謝産物等を指す。別の実施形態
では、検体は、生理的状態または体調を判定するための分析に望ましい生物学的状態を示
す任意の生物学的検体、マーカ、遺伝子、蛋白質、代謝産物、またはホルモンまたはそれ
らの組み合わせである。本発明のデバイスの目的は、体液中の検体を定性的および/また
は定量的に「検出」することにある。そのような検出は、定期的に実施されるのが好まし
い。これは、リアルタイムで実施されるのが最も好ましい。一実施形態では、検体は、ミ
クロモル濃度からナノモル濃度で存在し、かつ、アミノグリコシド抗生物質または抗生物
質、例えばバイコマイシンなどの高い効力を有する化学療法物質であり、検体の治療域は
狭いため、それらの分刻みの監視は、極めて望ましい。
【0050】
体内の検体レベルの持続的監視によって、本発明のデバイスは、検査者が治療上の用法
・用量を最適化し、かつ実験的薬剤用の薬物動態モデルを迅速に開発することを可能にす
る。現在では、濃度を介した監視により、標的リードの開発に加えて、迅速な標的削除ま
たは投薬計画の妥当性確認が可能となっているため、ターゲットバリデーション、リード
最適化、および化合物最適化(治療域ならびに毒性試験)は、極めて迅速かつより正確に
行うことができる。従って、第二相臨床試験および第三相臨床試験に入るか否かに関する
不確定性を低減するのに役立ち、それにより薬物開発の登録にかかる時間および総経費を
削減する。さらに、本発明のデバイスは、依然として感度の判断基準となっている、蛍光
ベースのアッセイ法における新規化合物の薬物濃度を感知する方法を提供し、かつ、新規
化合物を監視するための標的蛍光ベースの解法を新規に提供する。
【0051】
本明細書において使用する用語「疾患マーカ」は、体内に存在または欠落している体液
中および組織内に見られ、疾患と相関関係があることが分かっている検出可能な検体、例
えば抗体、血清蛋白、コレステロール、核酸、薬物および薬物代謝産物等である。特定の
生理的状態の検出を可能にする検体は、正常な健全な生理機能を示すこともできる。本明
細書においては、これらを「正常な」または「健全な」生物学的検体と呼ぶ。本発明の生
体測定認識デバイスは、1)マイクロアレイ上での疾患マーカである生物学的検体と生物
活性因子との間の相互作用および2)マイクロアレイ上での正常な生物学的検体と生物活
性因子との間の相互作用の物理的特性間の差異を認識する物理的パラメータデータに基づ
いて疾患マーカを検出するのが好ましい。疾患マーカである生物学的検体は、特定の生理
的状態、例えば感染、炎症、自己免疫性脳脊髄炎、癌等の検出を可能にする。当業者に現
在知られている疾患マーカおよび今後知られることになる疾患マーカは、本発明によって
包含される。疾患マーカの存在は、疾患の存在を示し、治療薬放出が是認される。
【0052】
疾患マーカである生物学的検体は、望ましくない増殖を行っている細胞内で過剰発現ま
たは過剰活性化した遺伝子もしくはそれらの産物とすることができる。例えば、本発明の
デバイスは、腫瘍または生検手技後に残された腔もしくは空間のような腫瘍の疑いがある
組織の内部に埋め込むことができる。本発明がそのような生物学的検体の濃度の増加また
はそのような検体、例えば疾患マーカの変位した過剰活性化形を検出した場合、細胞傷害
性物質などの治療薬の放出が是認される。これらの疾患マーカである生物学的検体は、癌
、動脈狭窄を引き起こす新生増殖、乾癬等のような望ましくない細胞増殖を示すことがで
きる。疾患マーカである生物学的検体は、組織内の遺伝子発現を解析し、それを既知の腫
瘍−遺伝子発現型と照合するか、またはそれらを正常な表現型と比較することによって検
出することができる。好ましい実施形態では、マイクロアレイは、一塩基変異多型(SN
P)、mRNAまたは酵素などの特定の蛋白質、抗体もしくは抗原を含む特定のヌクレオ
チド配列の存在、欠落または過剰存在によって定義される疾患マーカである生物学的検体
の存在を検出するために用いられる。
【0053】
一実施形態では、疾患マーカである生物学的検体は、腫瘍特異的抗原である。例えば、
そのような抗原、例えば腫瘍特異的抗原MUC−1は、癌細胞の表面上に発現するかまた
は癌細胞から放出される。核酸検出または蛋白質活性によるMUC−1発現の検出により
、治療薬としての細胞傷害性物質の放出が誘発される。
【0054】
別の例は、細胞増殖シグナルの形質導入に重要な受容体チロシンキナーゼ(RTK)に
関する。RTKは、上皮細胞増殖因子(EGF)、キナーゼとして機能してサイトゾル蛋
白質上のチロシンアミノ酸残基をリン酸化し、それにより細胞増殖を仲介する細胞内部分
のような増殖因子に対する細胞外リガンド結合領域を有する、巨大な膜貫通蛋白質である
。異なる受容体チロシンキナーゼに結合する増殖因子ファミリを基準として、様々な分類
の受容体チロシンキナーゼが知られている。受容体チロシンキナーゼのEGF−Rファミ
リのようなクラスIキナーゼには、EGF受容体、HER2−neu受容体、erbB受
容体、Xmrk受容体、DER受容体およびlet23受容体が含まれる。これらの受容
体は、乳癌、肺の扁平上皮癌、膀胱癌、食道癌、結腸癌、直腸癌または胃癌などの消化管
癌、白血病および卵巣癌、気管支癌もしくは膵臓癌などの一般的なヒト癌にしばしば存在
する。受容体チロシンキナーゼのEGFファミリに対しては、ヒト腫瘍組織がさらに検査
されるので、その広範囲に及ぶ罹患率が甲状腺癌および子宮癌などの他の癌において立証
されることになると予測される。具体的に述べれば、EGFRチロシンキナーゼの活性は
、正常細胞内ではめったに検出されないが、悪性細胞内ではより頻繁に検出可能である。
EGFRは、脳腫瘍、肺扁平上皮癌、膀胱腫瘍、胃腫瘍、乳房腫瘍、頭頸部腫瘍、食道腫
瘍、婦人科腫瘍および甲状腺腫瘍などの多くのヒト癌に過剰発現することが最近になって
明らかにされている。受容体チロシンキナーゼは、乾癬などの他の細胞増殖性疾患におい
ても重要である。EGFR障害は、通常はEGFRを発現しない細胞によるEGFR発現
、望ましくない細胞増殖、および/または妥当でないEGFRレベルの存在につながるE
GFR活性の増加によって特徴付けられるものである。EGFRは、そのリガンドEGF
およびトランスフォーミング増殖因子α(TGF−a)によって活性化されることが知ら
れている。Her2−neu蛋白質も、クラスI受容体チロシンキナーゼ(RTK)ファ
ミリのメンバである。Her2−neu蛋白質は、構造的にEGFRに関連している。こ
れらの受容体は、共通の分子構造を共有し、それらの細胞質領域内に2つのシステインが
豊富な領域を含み、かつそれらの細胞質領域内に構造的に関連する酵素領域を含む。従っ
て、核酸検出または蛋白質活性による異常に高レベルのRTK発現または信号伝達活動の
検出は、治療薬としてのRTK阻害薬もしくは細胞傷害性物質の放出の根拠とすることが
できる。
【0055】
直接または間接的に化学療法を抑制する比較的高い遺伝子の発現は、本発明の目的に対
する疾患マーカとなる。例えば、DNA修復遺伝子ERCC1の高腫瘍発現は、高度に局
所的でしかも低浸透性の濃度部位への遺伝子傷害性化学療法薬の放出の根拠となる。従っ
て、全身的に支障なく持続されることにはならないであろう濃度を達成する。さらに、高
腫瘍レベルの遺伝子DPDは、化学療法レジメンに基づいて5−FUを抑制することが知
られている。同様に、DPDの高腫瘍発現は、高度に局所的でしかも低浸透性の濃度部位
への5−FU化学療法薬の放出の根拠となる。あるいは、熟練技術者は、高レベルのDR
CC1またはDPDが化学療法に対する耐性を示すかもしれないこと、および遺伝子傷害
性物質または5−FUの使用がそれぞれ適切ではないかもしれないことも分かるであろう
。そのような場合、遺伝子傷害性物質または5−FU以外の細胞傷害性治療薬を、それぞ
れ本デバイスから放出すべきである。
【0056】
代替的に、本デバイスは、癌のような疾患を示す疾患マーカ団を検出し、治療薬のよう
な高度に局所的な濃度の細胞傷害性物質を放出するように構成することができる。
【0057】
さらに別の実施形態では、疾患マーカである生物学的検体は、炎症性腸疾患、多硬化症
、小児期発症糖尿病、乾癬、関節リウマチ等の病因論において重要な役割を果たす炎症を
示すことができる。そのような疾患は、局所的炎症のみに対処するのに、潜在的に有害な
ステロイドの規則的な大量の全身的投与が事前に必要となる。TNF−α、IL−1、I
L−8、IL−2、IL−3、MIF(IL−4、GM−CSF、INF−γ、およびT
NF−βのような生物活性因子の高度の局所集中は、炎症を示す。そのような生物活性因
子の異常に高い集中の検出は、疾患マーカの性質であり、治療薬としての抗炎症薬または
抗体の局所放出の根拠となる。
【0058】
別の実施形態では、疾患マーカである生物学的検体は、微生物による感染を示すことが
できる。従って、疾患マーカは、ウイルス蛋白または細菌蛋白質もしくは核酸あるいはそ
れらの断片を含むことができる。例えば、外毒素およびエンテロトキシンならびにTSS
T−1、または他の細菌性スーパー抗原、またはボツリヌス毒素、ジフテリア毒素、炭疽
菌防御抗原、炭疽菌浮腫因子、および炭疽菌致死因子、ならびにインフルエンザウイルス
の血球凝集素またはノイラミニダーゼのようなウイルス蛋白を含む細菌毒素のような生物
学的検体の検出は、感染を示す疾患マーカの性質であり、治療薬としての抗微生物薬また
は毒素特異的抗体の局所放出の根拠となる。
【0059】
本発明の別の態様は、マイクロアレイに関する。マイクロアレイは本発明のデバイスの
一部分であり、検体と生物活性因子との間の相互作用を促進する。その最も基本的な実施
形態では、本明細書に定義する「マイクロアレイ」は、マイクロアレイ走査デバイスが生
物活性因子と検体との間の相互作用を検出することができるように、生物活性因子によっ
て覆われるかまたはそれによって機能化された任意の表面、例えばマイクロ流体チャネル
の壁を構成することができる。図8、図10、図11。別の実施形態では、マイクロアレ
イは、多くの試験、またはアッセイを並行して行うことを可能にする、ある表面上に配列
された小型の検査場所の集合体である。この状況では、マイクロアレイは、体液および/
または組織に直接暴露され、複数の異なるアッセイを同時に処理し、1つまたはそれ以上
の生物活性因子を、1つもしくはそれ以上の生物学的検体と相互作用させる。
【0060】
例えば、固定化抗体への抗原の結合を測定し定量化する蛍光ベースのアレイバイオセン
サの機能は、4つの異なる免疫測定法、すなわち直接測定法、競合測定法、転移測定法、
サンドイッチ法を用いて実証されてきた。Sapsfordらは、平面導波路上に固定化
した2、4、6−トリニトロトルエン(TNT)に対して特異的な抗体のパターン化アレ
イを用い、異なる抗原集中部位からの信号を測定した。Anal Chem.2002年
3月1日、74(5):1061−8(その全体が引用により組み込まれる)。ワンステ
ップアッセイである直接アッセイ、競合アッセイ、転移アッセイに関しては、測定値は、
リアルタイムで取得された。用量反応曲線は、4つのすべてのアッセイ法に対して計算さ
れ、溶液中に存在する抗原の量を定量化するアレイバイオセンサの機能が実証された。
【0061】
本発明のこの態様の一実施形態では、マイクロアレイは、生物活性因子で機能化された
1本のガラス光ファイバ上の一領域である。図11。別の実施形態では、マイクロアレイ
は、各々が同一または異なる生物活性因子で機能化された複数本のガラス光ファイバを有
することができる。1つの特定の実施形態では、マイクロアレイの生物活性因子は、検体
に対して特異的な抗体などの蛋白質である。蛋白質生物活性因子をガラス光ファイバに付
着させるのには、2つの手順を用いることができる。第1の手順は、Bhatiaらによ
って開発されたものに基づいている。Analytical Biochemistry
、178 408−13参照。これは、3−メルカプトプロピルトリメトキシシランで表
面に機能化する工程を含む。それに続き、N−y−malemidobutylrylo
xysuccimideエステルの架橋剤を用いて、蛋白質生物活性因子が機能化された
表面に付着される。第2の手順は、2003年発行のBosensors and Bi
oelectronics、19 85−93にTedeschiらによって記載された
デキストランベースの方法を用いる工程を含む。この方法は、グリシジル3−(トリメト
キシシリル)プロピルエーテルを用いて、クリーンガラス上の遊離ヒドロキシル基をデキ
ストランポリマーに結合する。蛋白質生物活性因子は、その中のカルボン酸基の酸性化に
続き、デキストランマトリックスに結合される。任意選択的に、標的検体を分離する立体
膜をファイバに被覆してもよい。
【0062】
ファイバは、マイクロニードル内に直接挿入され、選択性および特異性に基づく結合事
象に対して、マイクロニードルの壁は、ポリマーゲルを被覆されているのが好ましい。
【0063】
ガラス光ファイバを用いる実施形態では、体液中の標的検体との相互作用の発生と同時
に蛍光が検出できるほど変化するように、光源を用いて、蛍光標識された生物活性因子お
よび/または検体が励起される。図11。励起用光源は、レーザモジュールとすることが
できる。光は、機能化領域、すなわちファイバのクラッディングが除去され、生物活性因
子の被覆に対して化学的に調製された領域を含む光ファイバ内に入射することができる。
図9、図11。クラッディングの欠如により、エバネッセント波がファイバの1点から発
生し、蛍光タグ付き生物活性因子、または生物活性因子に結合された、サンプリング中の
体液中に競合的に転移される検体となることを意図された蛍光タグ付き検体から蛍光を誘
発する。図8、図11。放射光は、同一のファイバを通って再入射する。ファイバ内に戻
る光は、光ファイバのスプリッタ、周囲の背景光を除去することのできる帯域通過フィル
タ、およびフォトダイオード検出器を有することのできるマイクロアレイ走査デバイスに
よって検出される。説明した構成の概略を、図11に見ることができる。
【0064】
生物活性因子は、検体薬物に特異的の結合することができる抗体とするのが好ましい。
あるいは、生物活性因子は、血清抗体に特異的に結合することのできる抗原である。この
後者の実施形態では、本発明のデバイスは、特定の免疫学的な刺激、例えばHIV感染ま
たは結核感染に応答して生成される特定の種類の抗体の産出を検出することができる。
【0065】
別の実施形態では、マイクロアレイは、1)疾患マーカである生物学的検体とマイクロ
アレイ上の生物活性因子との間の相互作用および2)正常な生物活性因子とマイクロアレ
イ上の生物活性因子との相互作用を促進する。この状況では、生物活性因子は、正常な生
物学的検体および疾患マーカである生物学的検体と識別的に相互作用する。
【0066】
マイクロアレイの実施形態では、マイクロビーズアレイが用いられる。本明細書におけ
る「ミクロスフィア」または「ビーズ」もしくは「微粒子」あるいは文法上同等のものは
、小さい個別的な粒子を意味する。ビーズの組成は、生物活性因子のクラスおよび合成の
方法によって異なることになる。適したビーズ組成には、ペプチド合成、核酸合成、およ
び有機成分合成に用いられるものが含まれ、限定するものではないが、プラスチック、セ
ラミック、ガラス、ポリスチレン、メチルスチレン、アクリルポリマー、常磁性体、トリ
アゾル、カーボングラファイト、二酸化チタン、ラテックスまたはSepharoseの
ような交差結合デキストラン、セルロース、ナイロン、交差結合ミセルおよびテフロン(
登録商標)は、すべて用いることができる。Bangs Laboratories、F
ishers Ind.が提供している「Microsphere Detection
Guide」は、参考になる手引書であり、その全体が引用により組み込まれる。ビー
ズは、球状である必要はなく、不ぞろいの微粒子を用いてもよい。さらに、ビーズは多孔
質とすることができ、そうすることにより、生物活性因子の付着またはタグの取り付けに
利用可能な表面積を増大させる。ビーズの大きさは、ナノメートル、例えば100nmか
らミリメートル、例えば1mmの範囲にわたり、約0.2ミクロン〜約約200ミクロン
のビーズが好ましく、約0.5ミクロン〜約5ミクロンのビーズが特に好ましいが、一部
の実施形態では、より小さいかまたはより大きいビーズを用いることができる。各マイク
ロ球体が生物活性因子を含むのが好ましい。
【0067】
本発明の別の態様は、「生物活性因子」に関する。本明細書において使用する場合、そ
れは、任意の分子、例えば、蛋白質、オリゴペプチド、有機小分子、多糖類、ポリヌクレ
オチド等を表し、マイクロアレイに用いられ、検体と相互に作用するか、または体液中も
しくは組織内に存在する正常な生物学的検体および疾患マーカである生物学的検体と識別
的に相互作用することができる。生物活性因子は、生物学的検体との相互作用と同時に変
化した生物活性因子に特有の特定の物理的パラメータをマイクロアレイ走査デバイスによ
って確認することができるような方法で標識することができる。
【0068】
一実施形態では、生物活性因子は、蛍光標識されており、それらの蛍光は、体液中の標
識検体との相互作用と同時に、検出できるほど変化する。代替的に、標識検体が体液中の
検体によって競合的に転移されるように、生物活性因子は、標識検体とあらかじめ関連付
けられている。いずれの場合にも、マイクロアレイの蛍光特性は、マイクロアレイ走査デ
バイスによって検出することができるような方法で、体液中の検体とのマイクロアレイの
相互作用と同時に変化する。
【0069】
検体または生物活性因子は、蛍光ナノ結晶で標識されるのが最も好ましい。ローダミン
のような有機色素に比べ、ナノ結晶は、少なくとも約20倍明るく、光退色に対して少な
くとも約100倍の安定性を有し、発光分光線幅が約三分の一の幅である。例えば、Br
uchez他、Science、281:2013−2016、ChanおよびNie、
Science、281:2016−2018(1998年)、Bawendi他、An
nuを参照されたい。Rev.Phys.Chem、41:477−496(1990年
)、および本明細書に引用する参考文献は、それらのすべてが引用により明白に組み込ま
れる。明るさ、安定性および発光帯域幅の狭さのすべてが、以下にさらに説明するような
比較的多数の異なる色(すなわち異なる大きさのナノ結晶)を用いる機能に寄与し、それ
と同時に、それらを互いに分解し、各ナノ結晶の異なった量を解明する機能を保っている
。さらに、広い励起スペクトルにより、通常の光源によって多くの異なるナノ結晶を励起
することが可能となる。
【0070】
生物活性因子は、蛋白質、特に水素結合との構造的相互作用に必要な官能基を含むこと
ができ、一般に、少なくともアミン基、カルボニル基、ヒドロキシル基またはカルボキシ
ル基を含み、これらの化学官能基のうちの少なくとも2つを含むのが好ましい。生物活性
因子は、上記の官能基のうちの1つまたはそれ以上と置換される環状炭素構造または複素
環構造および/もしくは芳香族構造または多環芳香族構造を含むことが多い。生物活性因
子は、ペプチド、核酸、糖類、脂肪酸、ステロイド、プリン、ピリミジン、それらの誘導
体、構造的類似体または組み合わせを含む生体分子の中にも見出される。特に好ましいも
のは、核酸および蛋白質である。
【0071】
本明細書において使用する「と相互に作用する」は、マイクロアレイ上での、検体と生
物活性因子のイオン結合または共有結合、蛋白結合、核酸雑種形成、磁気引力もしくは疎
水性引力または他の検出可能な会合および/もしくは定量化可能な会合を指す。「識別的
に相互作用する」は、正常な生理機能を示す生物学的検体とは異なる方法で、疾患マーカ
である生物学的検体が生物活性因子と相互に作用することになるという事実を指す。
【0072】
例えば、1)疾患マーカである生物学的検体と生物活性因子との間の相互作用および2
)正常な生物学的検体と生物活性因子との間の相互作用における物理的差異は、生物学的
検体との相互作用の前、相互作用時、相互作用後の生物活性因子の物理的特性を比較する
ことによって検出可能である。生物学的検体との相互作用直後の生物活性因子における検
出可能および/または定量化可能な変化は、用いられる生物活性因子の性質に依存する一
連の物理的パラメータによって測定可能である。例えば、検出可能および/または定量化
可能な会合は、生物学的検体との生物活性因子の結合もしくは雑種形成による蛍光強度ま
たは波長の変化によって証明することができる。
【0073】
別の実施形態では、特定の腫瘍特異的蛋白質(疾患マーカである生物学的検体)に対し
て特異的な、マイクロアレイ(生物活性因子)上での蛍光関連抗体の結合(相互作用)は
、生物活性因子の蛍光強度における検出可能な変化をもたらす。この定型的変化は、適切
な生物活性因子および標的疾患を選択しながら事前に実験に基づいて決定された、特定の
疾患マーカの存在を示す。非特異的結合は生物活性因子の蛍光を変えることができるが、
それは、実験に基づいて決定された結果と一致する予測可能かつ定型的な方法でそうする
のではなく、従って、疾患マーカである生物学的検体の存在を示すことにはならない。
【0074】
本発明の1つの特徴は、「マイクロアレイ走査デバイス」に関する。検体とマイクロア
レイの生物活性因子との間の相互作用の物理的パラメータデータは、マイクロアレイ走査
デバイスによって「読まれ」、生体認識デバイスに伝送されて、体液中における検体の存
在、欠如、または量が判定されるのが好ましい。マイクロアレイの物理的特性の変化は、
検体と生物活性因子との間の相互作用と同時に検出されるのが好ましい。代替的に、この
走査デバイスは、1)マイクロアレイ上での疾患マーカである生物学的検体と生物活性因
子との間の相互作用および2)マイクロアレイ上での正常な生物学的検体と生物活性因子
との間の相互作用の物理的特性間の差異を認識することができる。
【0075】
本明細書において言及する「物理的パラメータデータ」は、マイクロアレイ走査デバイ
スによって収集されたマイクロアレイ上での検体と生物活性因子との間の相互作用に関連
する情報を含む。物理的パラメータデータは、分析のために生体測定認識デバイスに伝送
される。走査デバイスは、生物学的検体とマイクロアレイの生物活性因子との間の相互作
用の物理的特性、例えば生体電気特性、生体磁気学特性、または生化学的特性を、その反
応に関連する1つまたはそれ以上の物理的パラメータに関するデータを収集することによ
って測定する。そのようなパラメータは、限定するものではないが、蛍光、結合強度、結
合特異性、電荷等を含むことができる。
【0076】
物理的パラメータデータは、毒性および投与量の決定のために薬理ゲノム学的データお
よび薬物動態データをそのモデル内に組み込んだバイオインフォマティクスシステム内に
格納されるか、または該システム内に格納された物理的パラメータデータのプロファイル
と比較されるのが好ましい。これによって、現在のプロセスに何年も先立つ臨床試験用デ
ータの生成が可能となるのみならず、リアルタイムでの持続的監視による、薬物の明白な
効能と実質的毒性との間における目下の不釣り合いの解消をも可能にする。継続か中止か
を決定するプロセス中に臨床試験に用いるために、サーバ上に格納された情報を通じて、
データベース上に格納されたデータに関する大規模な人口の比較研究を行うことができる
。これにより、より多くの患者が、安全な方法でより早期に臨床試験に入ることが可能と
なる。別の実施形態では、ヒト組織の研究において発見されたバイオマーカは、本デバイ
スの目標とし、癌研究における薬物の経路および有効性の判定の精度を向上させることが
できる。
【0077】
この特徴の一実施形態では、マイクロアレイは、生物活性因子と生物学的検体との間の
相互作用に関連する物理的パラメータデータの取得を可能にするために、光ファイバ素子
が特定の波長の光を放射および受信することができるように設計されている。一例では、
マイクロアレイ内の生物活性因子は、所定量の蛍光標識検体で実質的に飽和されており、
これにより、それらが体液中の非標識標的検体と相互に作用する際に、非標識検体は、体
液内におけるその濃度と釣り合う程度まで、マイクロアレイ上の標識検体を競合的に転移
させる。その結果、マイクロアレイ走査デバイスが、マイクロアレイ上における対応する
蛍光の減少を検出し、伝送することになる。
【0078】
別の例では、生物活性因子上の色素によって光がいったん吸収されてしまうと、異なる
波長および強度の一部の光が戻り、同一のファイバまたは収集用ファイバを通じて、定量
化のためにマイクロアレイ走査デバイスに伝達される。光ファイバによって伝達された光
と光吸収性色素との間の相互作用は、検体と生物活性因子との間の相互作用によって証明
された物理的特性の変化の定性的判定および定量的判定両方の光学的基準となる。それら
の全体が引用により組み込まれる米国特許第6、482、593号および第6、544、
732号を参照されたい。生体測定認識デバイスは、光受信信号データおよび蛍光受信信
号データ、すなわち物理的パラメータデータを受信し、特定の治療薬を投薬する治療薬放
出デバイスに指示を与えることができる。適したマイクロアレイ走査デバイスは、カリフ
ォルニア州サンディエゴ所在のIllumina,Inc.などのいくつかの発売元から
市販されている。
【0079】
検体と生物活性因子との間の相互作用に由来する蛍光の差異を検出する1つの可能性は
、発光分子の近傍において、検出器を用いて放射蛍光を検出する方法である。別の可能性
は、放射蛍光を結合して1本のファイバ内に入射させ、遠位端において検出器で検出する
方法である。蛍光を検出するファイバは、入射光を出力する同一のファイバとしても、蛍
光検出専用の別個のファイバとしてもよい。後者の場合には、マイクロアレイの検出用フ
ァイバは、クラッディングを取り除き、光結合用に処理を施さなければならない。結合し
てファイバ内に戻す工程は、ファイバに隣接させてレンズを用い、放射光をより正確に集
光することによって、より効率的とすることができる。先に述べたように、検出器は、C
CD,PMTを含むことができ、フォトダイオードを含むのが最も好ましい。これらの検
出器は、帯域通過フィルタの使用によって放射波長に対して選択的となる可能性が最も高
い。この検出器は、出力ファイバの遠位端に配置することができる。
【0080】
マイクロアレイ走査デバイスの一部に接続された例示的なマイクロアレイ光ガラスファ
イバを図11に示す。この図は、本デバイスのマイクロチャネル内に延びてマイクロアレ
イの一部を構成している、機能化されたクラッディングされていないファイバを描いてい
る。本発明のデバイスのマイクロアレイは、二股光ファイバシステムにすることのできる
少なくとも1本または複数本の光ファイバを含むことができる。
【0081】
この図では、光ファイバは、抗体生物活性因子で機能化され、蛍光偏光免疫測定法のそ
れに類似する転移アッセイとして機能するように構成されている。ファイバは全内部反射
(TIR)の原理を用いて光を伝播させるので、エバネッセント波は、露出した領域(す
なわち機能化領域)においてファイバに垂直に放射される。エバネッセント波は、ファイ
バの表面上に存在するなんらかの分子によって吸収されることになり、蛍光プローブ(存
在する場合)によって、ストークスシフトしたスペクトルが放射される。ファイバは、フ
ァイバスプリッタと光連絡しており、該ファイバスプリッタが、機能化されたクラッディ
ングされていないファイバ内に光が入ることを可能にし、かつ機能化されたクラッディン
グされていないファイバから戻る光をフォトダイオード検出器へ再ルーティングする。
【0082】
使い捨て部品および非使い捨て部品を有する本発明のデバイスのパッチ除去では、使い
捨て部品は、マイクロニードル、マイクロチャネルおよびマイクロアレイを有する。挿入
時、使い捨て部品のマイクロアレイの光ファイバは、パッチの非使い捨て部品のマイクロ
アレイ走査デバイスの一部を構成する、対応するファイバスプリッタおよびフォトダイオ
ード検出器と光連絡する。
【0083】
マイクロアレイ走査デバイスの別の実施形態では、マイクロアレイの蛍光の変化は、全
内部反射蛍光(TIRF)分光計を用いて、検体とのマイクロアレイの相互作用と同時に
検出される。TIRFの原理が、図9、図10に概略的に描かれている。全内部反射は、
高密度の媒体(ガラスなどの)中を伝播している光が図9に描く緩衝剤などのより低密度
の媒体を有する境界面に接触する際に生じる光学現象である。光が小角度で境界面に接触
すれば、光の一部分は、境界面を透過し(屈折し)、別の部分は、反射して高密度媒体中
に戻る。特定の角度では、すべての光が反射する。この角度は臨界角として知られており
、その値は媒体の屈折率に依存する。しかしながら、ビームのエネルギーの一部は緩衝剤
中へ短距離伝播し(数百ナノメートルであるのが好ましい)、エバネッセント波を生成す
る。このエネルギーが吸収されなければ、それはガラス中に戻り、そこでそれを検出する
ことができる。しかしながら、生物活性因子または標識検体と関連する蛍光分子がエバネ
ッセント波内に存在すれば、それは、光子を吸収して励起することができる。このように
して、極微小な励起背景光で蛍光を得ることが可能となる。
【0084】
単一のフルオロフォアからの蛍光のレベルは極めて低い(1秒当たり数百個から数千個
の光子)。しかしながら、それは、2つの方法で検出されるのが好ましい。第1の方法は
、結合したフルオロフォアが明るい点として現れることになる画像を生成することができ
る、強化されたCCDカメラを用いる方法である。代替的に、ピンホールを通して光電子
増倍管(PMT)上にフルオロフォアを映し出すことが可能であり、それによって検出さ
れた光子の数を数えることができる。そのようなマイクロアレイ走査デバイスには、Te
xas Instruments Spreeta(商標)センサに用いられているよう
な集中光学系が用いられるのが好ましい。マイクロアレイ走査デバイスには、表面プラス
モン共鳴、TIRFに類似したエバネッセント波に基づく技法を用いられるのがより好ま
しい。そのようなセンサでは、光検出器アレイと共に、分極したLED光源を用いて、反
射光の位置が測定される。
【0085】
本発明のこの態様の別の特徴は、生体測定認識デバイスに関し、該生体測定認識デバイ
スは、マイクロアレイ走査デバイスによって収集された物理的パラメータデータ、例えば
フルオロフォア画像または光子総数の解析を通して、検体の存在、欠如または量を判定す
る。検体がマイクロアレイ上で生物活性因子と相互に作用する際に、マイクロアレイ走査
デバイスが、該相互作用の物理的パラメータに関するデータを生体測定認識デバイスに伝
達し、次いで、該生体測定認識デバイスが、そのデータを既知の検体の相互作用プロファ
イルと照合し、検体の存在、欠如および/または量を判定する。
【0086】
一実施形態では、疾患マーカである生物学的検体は、定型的かつ予測可能な方法でマイ
クロアレイ上の生物活性因子と相互に作用し、該相互作用は、再生可能かつ予測可能な物
理的パラメータデータによって証明される。既知のデータを、本明細書において「検体の
相互作用プロファイル」と呼ぶ。そのようなプロファイルは、試験管内で実験に基づいて
確立されることになり、生体測定認識デバイスは、疾患マーカおよび正常検体両方の検体
の相互作用プロファイルを自由に入手することができる。生体測定認識デバイスは、マイ
クロアレイ走査デバイスから生の物理的パラメータデータを受け取り、その情報を、格納
された検体の相互作用プロファイルと比較する。生体測定認識デバイスは、疾患マーカお
よび正常検体両方の検体の相互作用プロファイルを自由に入手することができる。
【0087】
生体測定認識デバイスは、本発明の医療デバイス内に配置されるか、または外部に配置
される。マイクロアレイ走査デバイスと生体測定認識デバイスとの間の連絡は、ローカル
エリアネットワーク(LAN)によって、または無線ローカルエリアネットワーク(WL
AN)、例えばブルートゥース(登録商標)技術によって促進することができる。さらに
、生体測定認識デバイスは、検体の相互作用プロファイルを格納し、検体の相互作用プロ
ファイルの形式の入手しやすい薬物動態情報データベースを構築することもできる。
【0088】
検体の存在を検出および定量化するための特に好ましい構成では、本デバイスは、図5
に示すマイクロ流体チャネルを有するパッチである。本デバイスは、メインチャネルに流
体が流れ込む少なくとも2つの注入口を有する。試料の血液(検体を含む)が一方の注入
口に注入され、反対側の注入口には緩衝剤溶液が注入される。小径では、慣性および乱流
混合が無い状態で流れ、構造体20血液および緩衝剤は、並行する流れで流れる。マイク
ロチャネルは、直径が約50μmと約200μmの間にあるのが好ましく、約75μmと
約150μmの間にあるのがより好ましく、約100μmであるのが最も好ましい。
【0089】
制御してチャネルに流体をポンプで通す工程は、膜がマイクロニードルの作動によって
破れて加圧けん引力が生成され、それによって流体を通過させる毛細管現象または真空に
よって行われるのが好ましい。チャネルは、精密射出成形またはレーザエッチングによっ
て製造することができる。
【0090】
チャネルの大きさおよびマイクロアレイ表面の化学的性質は、測定する検体の大きさと
なるように調整することができる。追加の空気圧式ポンピングシステムおよび流体バルブ
またはマイクロ−PCRシステムならびに新規な化学的性質をさらに含め、感性を増強す
ることができる
マイクロチャネルシステムは、拡散制御結合事象が、機能化されたチャネルの表面上ま
たは光学的表面積の最適化のためにチャネルの中央に通された機能化されたファイバ上で
発生することを可能にする。これにより、表面内にわずか約1000オングストローム貫
入することによって、エバネッセント波に基づくセンサが全血などの流体から検体を検出
することが可能となる。代替的に、流れの中央に埋め込まれたファイバの場合、拡散およ
び分離は、ファイバの両側で測定を行うことができるさらにより簡素なシステムによって
可能となる。
【0091】
本発明のデバイスにおけるマイクロフルイディクス部品の製造は、ワシントン州レドモ
ンド所在のMicronics,Incが提供している技術を用いて行うことができる。
具体的には、薄膜プラスチック積層板技術により、レーザ切断による三次元マイクロ流体
デバイスの作成が可能となる。プラスチックフィルム内に形状が切り込まれ、それに続き
、適切な配向で共に層状にされ、マイクロ流体ネットワークが形成される。代替的に、チ
ャネルは、例えばソフトリソグラフィ技法(Duffy他、Anal Chem.、19
98年)を用いて、ポリジメチルシロキサン(PDMS)内に作ることができる。さらに
、チャネルは、シリコン内に直接エッチングすることができる。ひとたびチャネルが製造
されれば、次いで、生物活性因子をガラス表面に固定化することにより、それらを本デバ
イスに導入することができる。緩衝剤の流れが抗体を付着させた表面と接触するように、
ガラス表面をチャネルに結合し、チャネルの「キャップ」または上面を形成することがで
きる。代替的に、ガラス表面は、ガラス光ファイバである。光ファイバは、単一モードフ
ァイバ、または好ましくは多モードファイバのいずれかとすることができる。1本または
それ以上のファイバを、チャネルの中央に貫通させることができる。この場合、チャネル
は、中央の緩衝剤流チャネルを取り囲む2つの血流チャネルに分割することができ、拡散
は、両方向から生じることになる。
【0092】
細胞物質および高分子とは対照的に、標的検体のような分子は、拡散によって血液/緩
衝剤境界面、流体/流体境界面を通過することができる。拡散率は分子の大きさに反比例
するので、小分子薬物は、血液によって運ばれる蛋白質または細胞のいずれよりもかなり
速く拡散することになる。これにより、大きさによる分離が効果的に生じる。
【0093】
一実施形態では、チャネルは、薬物分子のみがマイクロチャネル(緩衝剤流に隣接する
)の反対壁まで拡散するように設計されている。この壁が、蛍光標識薬物分子とあらかじ
め結合された所定量の抗薬物抗体を塗布することのできる本明細書に定義するマイクロア
レイを構成する。均衡交換が生じ、これにより、壁へ拡散した非標識薬物によって、標識
薬物分子の一部が競合的に転移される(図8、図19)。交換率は濃度依存性であり、従
って、血液中の薬物濃度を測定することができる。免疫測定法として、それに対する抗体
を生成することのできる実質的にすべての検体を検出するように上記の実施形態を適合す
ることができるのを認識することは重要である。
【0094】
上記の実施形態では、生物活性因子と検出中の検体との間の相互作用は、チャネルの緩
衝剤側上で発生し、蛍光測定は、全血試料を用い、TIRF分光計で行うことができる。
従って、蛍光検出はチャネルの緩衝剤側上で行われ、該チャネルが全血試料中の蛍光成分
によって見えにくくなることはない。さらに、測定はマイクロチャネル内で行われるので
、必要となる試料はごく少量である。
【0095】
抗グルコース抗体のマイクロアレイを有する好ましい実施形態では、グルコース濃度は
、約0.01μl〜約0.4μl、好ましくは約0.05μl〜約0.3μl、最も好ま
しくは0.1μl〜0.2μlの血液試料中で測定することができる。抗バンコマイシン
抗体を有する別の好ましいパッチ実施形態では、バンコマイシン濃度は、約0.01μl
〜約0.4μl、好ましくは約0.05μl〜約0.3μl、最も好ましくは0.1μl
〜0.2μlの血液試料中で測定することができる。さらに、これらの実施形態では、約
1分よりも短い極めて迅速な測定を行うことができる。
【0096】
さらにもう一つ別の実施形態では、本デバイスは、ある検体の濃度を監視し、該検体の
濃度に応じて治療薬を放出する。検体は特定の薬物またはその薬物の代謝産物であり、治
療薬は同一の薬物であるのが好ましい。この構成は、薬物の治療域が狭い場合に特に望ま
しく、血流中または体内の特定の部位において検体の特定の濃度を維持することは重要で
ある。従って、本デバイスが血流中または体内の特定の部位における薬物またはその代謝
産物の1つの濃度の低下を検出した場合、本デバイスは、特定の量の同一の薬物を放出し
、全身的または局所的薬物濃度を調節し、所望のレベルに戻すことができる。例えば、イ
ンスリンまたはバンコマイシンなどの抗生物質は、標的検体および治療薬の両方とするこ
とができる。
【0097】
本発明は、疾患を示す検体、すなわち疾患マーカ検体の検出と同時に1つまたはそれ以
上の治療薬の局所送達することができる医療デバイスも企図している。本発明のこの態様
の別の実施形態では、本デバイスは、いくつかの疾患マーカの検出に応じて、単一の治療
薬を放出する。代替的に、本デバイスは、異なる疾患マーカの検出に適切な異なる治療薬
を放出することができる。別の実施形態では、薬物が、マイクロニードルを通して放出さ
れる。別の実施形態では、治療薬は、本デバイス内の分散媒として機能する食塩水用の区
画内に放出することができる。本発明のこの態様のさらに別の実施形態では、リポソーム
が治療薬を充填され、該リポソームに、特定の細胞型を特異的に結合する抗体が被覆され
る。この方法により、疾患マーカの検出と同時のしかるべき細胞型への多量の薬物の送達
が可能となる。
【0098】
本デバイスは、治療薬を含む1つまたはそれ以上のリザーバを含むことができる。リザ
ーバは、疾患マーカの検出と同時に生体測定認識デバイスによってそれが指示を受けるま
で治療薬を保持し、制御方式で、例えば放出すべき薬剤の放出速度および放出量に関する
指示を受信すると、治療薬を放出する。代替的に、単一の放出速度または投与量を本デバ
イス内にプログラムしてもよい。リザーバは、1つまたはそれ以上の治療薬の混合物を収
容することができる。代替的に、本システムは、1つまたはそれ以上の治療薬のいくつか
のリザーバを備えてもよい。複数のリザーバがあるのが好ましい。
【0099】
本明細書において使用する「治療薬」は、疾患を示す特定の生物学的異常、例えば疾患
マーカ検体と関連する疾患を治療するのに有益または適切な化合物を指す。本発明の治療
薬は、例えば化学療法薬のような局所的に送達されるのが好ましい製薬化合物、ステロイ
ド、DNA、RNA,二本鎖RNA(RNAインターフェースによる)およびアンチセン
スRNAを含む治療用核酸、または免疫グロブリン、増殖因子、抗炎症薬、または酵素抑
制因子等のような蛋白質を含む、疾患治療用のなんらかの治療用物質である。
【0100】
本デバイスからの治療薬の放出により、効果的な薬物の局所集中を確立することは好ま
しいかもしれない。例えば、本デバイスの摂取可能な実施形態、埋め込み可能な実施形態
では、局所濃度が同一の薬物に対して安全な全身的濃度を実質的に越える可能性があり、
従って、患者の実質的な不快症状を減らし、しかも有効性を最大化する。局所的炎症の治
療に適切なコルチコステロイドの局所放出は、本明細書に包含される。さらに、感染の治
療用の病原体特異的抗体の局所放出も、本明細書に包含される。正確な配合および投与量
は、患者の状態を考慮して、個々の臨床家が選択することができる(The Pharm
acological Basis of Therapeutics、1975年、C
h.1 p.1のFingl他参照)。
【0101】
別の実施形態では、望ましくない細胞増殖を示す生物学的検体が検出され、増殖抑制効
果を有する治療薬を局所放出するのが好ましい。例えば、シロリムス(ラパマイシン)ま
たはパクリタキセルは、新生内膜過形成時の急速な筋細胞増殖を抑制するのに極めて有効
である。
【0102】
望ましくない増殖を示す生物学的検体の存在に応答するための別の例では、5−FUベ
ースの化学療法は、単独、またはロイコボリンなどの他の化学療法薬と併用した、もしく
はウラシル、5−エチニルウラシル、ブロモビニルウラシル、チミン、ベンジロキシベン
ジルウラシル(BBU)または5−クロロ−2,4−ジヒドロキシピリジンなどのDPD
阻害薬と併用した、5−FU、その誘導体の投与を含み、本医療デバイスから放出される
。またさらに、5−FUまたはその誘導体を有する式(I)の5’−デオキシシチジン誘
導体の併用投与は、5−FUまたはその誘導体とDPD阻害薬5−エチニルウラシルとの
組み合わせと比較して、腫瘍組織選択的な化学療法薬の送達を向上させることが分かって
いる。
【0103】
また、遺伝子毒性物質は、持続的ゲノム傷害を形成するものであり、望ましくない細胞
増殖の臨床管理において化学療法薬として用いるのが好ましい。遺伝子毒性によって誘発
されるDNA損傷の細胞修復速度、および細胞分裂周期による細胞増殖速度は、遺伝子毒
性治療の成果に影響を及ぼす。多くの癌を治療するために用いられる一般分類の遺伝子毒
性化合物は、DNAアルキル化剤およびDNA挿入剤である。ソラレンは、乾癬、白斑、
真菌感染症および皮膚T 細胞性リンパ腫のような皮膚疾患の光化学療法による治療に有
益であることが知られている。Harrison’s Principles of I
nteral Medicine、第2部、Cardinal Manifestati
ons of Disease、第60章(第12版、1991年)。そのメンバがDN
Aをアルキル化するかまたはDNAに挿入される別の一般分類の遺伝子毒性化合物には、
合成によって、もしくは自然からもたらされる抗生物質が含まれる。本明細書において特
に関心があるのは、限定するものではないが、以下のアムサクリンA、C、D(またはダ
クチノマイシンとして知られる)またはF(またはKS4)、アザセリン、ブレオマイシ
ン、カルミノマイシン(Carubicin)、ダウノマイシン(ダウノルビシン)、ま
たは14−ヒドロキシダウノマイシン(アドリアマイシンもしくはドキソルビシン)、マ
イトマイシンA、BまたはC、ミトキサントロン、プリカマイシン(ミトラマイシン)等
で代表される分類の化合物を含む抗生物質である。一般的に用いられており、NDAをア
ルキル化するさらに別の一般分類の遺伝子毒性物質は、ハロエチルニトロソウレア、特に
クロロエチルニトロソウレアを含むものである。この広い分類の代表的メンバには、カル
ムスチン、クロロゾトシン、フォテムスチン、ロムスチン、ニムスチン、ラニムスチンお
よびストレプトゾトシンが含まれる。ハロエチルニトロソウレアの第1の物質は、前記の
代表的化合物の類似物または誘導体とすることができる。
【0104】
シスプラチンまたはオキサリプラチンなどの白金協調化合物によって現在抑えることが
可能な腫瘍には、髄芽細胞腫および神経芽細胞腫に加えて、睾丸癌、子宮内膜癌、子宮頸
部癌、胃癌、扁平上皮癌、副腎皮質癌ならびに小細胞肺癌が含まれる。他の細胞傷害性抗
癌治療薬には、例えば睾丸癌に対するBEP(ブレオマイシン、エトポシド、シスプラチ
ン)、膀胱癌に対するMVAC(メトトレキサート、ビンブラスチン、キソルビシン、シ
スプラチン)、非小細胞肺癌治療に対するMVP(マイトマイシンC、ビンブラスチン、
シスプラチン)が含まれる。
【0105】
そのメンバがDNAをアルキル化するさらに別の一般分類の遺伝子毒性物質には、硫黄
およびナイトロジェンマスタードが含まれる。これらの化合物は、主にグアニンのN7原
子において共有結合付加体を形成することによって、DNAに損傷を与える。この広い分
類の代表的メンバには、クロラムブシル、イホスファミド、メルファラン、メクロルエタ
ミン、novembicin、トロホスファミド等が含まれる。選択された細胞のゲノム
における特定の配列と共有結合的にまたは非共有結合的に相互作用するオリゴヌクレオチ
ドまたはそれらの類似物は、ゲノム損傷の遺伝子座として再定義された1つまたはそれ以
上のゲノム標的を選択することが望ましければ、遺伝子毒性物質として用いることもでき
る。
【0106】
そのメンバがDNAをアルキル化する別の分類の物質には、エチレンイミン、メチルメ
ラミンが含まれる。これらの分類には、例えば、アルトレタミン(ヘキサメチルメラミン
)、トリエチレンホスホルアミド(TEPA)、トリエチレンチオホスホルアミド(Th
ioTEPA)およびトリエチレンメラミンが含まれる。
【0107】
追加の分類のDNAアルキル化物質には、ブスルファンによって代表されるアルキルス
ルフォネート、ベンゾデパによって代表されるazinidines、例えばミトグアゾ
ン、ミトキサントロンおよびプロカルバジンによって代表される他の物質が含まれる。こ
れらの分類の各々には、それぞれを代表する化合物の類似物および誘導体が含まれる。
【0108】
細胞傷害性治療薬の追加例は、細胞特異的抗体活性化血清補体および/または仲介抗体
依存性細胞傷害性を有する抗体錯化剤である。細胞を結合する抗体は、毒素に共役するこ
ともできる(抗毒素)。抗毒素の細胞傷害性成分は、細胞傷害性薬物またはバクテリアも
しくは植物由来の酵素的に活性の毒素、またはそのような毒素の酵素的に活性の断片とす
ることができる。使用される酵素的に活性の毒素およびそれらの断片は、ジフテリア、ジ
フテリアの非結合性活性断片、エクソトクシン(緑膿菌から)、リシン、アブリン、モデ
クシン、α−サルシン、シナアブラギリ蛋白質、ジアンチン蛋白質、ヨウシュヤマゴボウ
蛋白質(PAPI、PAPIIおよびPAP−S)、苦瓜阻害剤、クルシン、クロチン、
サパオ ナリアオフィシナリス阻害剤、ジェロニン、ミトゲリン、レストリクトシン、フ
ェノマイシン、およびエノマイシンである。別の実施形態では、抗体は、小分子抗癌剤に
共役している。モノクローナル抗体およびそのような細胞傷害性成分は、種々の二官能性
蛋白質結合剤を用いて作られる。そのような試薬の例は、SPDP、IT、ジメチルアジ
ピ ミデイトHC1のようなイミドエステルの二官能性誘導体、スベリン酸ジサクシンイ
ミジルのような活性エステル、グルタルアルデヒドのようなアルデヒド、ビス(p−アジ
ドベンゾイル)ヘキサネジアミンのようなビス−アジド化合物、ビス−(p−ジアゾニウ
ムベンゾイル)−エチレンジアミンのようなビス−ジアゾニウム誘導体、トリレン2,6
−ジイソシアネートのようなジイソシアネート、および1,5−ジフルオロ−2,4−ジ
ニトロベンゼンのようなビス−活性フッ素化合物である。毒素の溶解部分は、抗体のFa
b断片に結合することができる。癌を治療するための細胞傷害性放射性医薬品は、放射性
同位元素を抗体に共役することによって製造することができる。本明細書において使用す
る用語「細胞傷害性成分」は、そのような同位元素を含むことを意図されている。
【0109】
一実施形態では、治療薬は、EGFRおよびHER2のような受容体チロシンキナーゼ
の阻害薬であり、哺乳類の癌のような増殖性細胞の増殖を選択的阻害薬として用いられる
。例えば、エルブスタチン、DGF受容体チロシンキナーゼ阻害剤は、ヒト癌細胞を表す
EGFRの増殖を減少させる。スチレンの種々の誘導体もチロシンキナーゼ阻害特性を有
し、抗癌剤として役に立つと言われている。2つのそのようなスチレン誘導体は、その有
効性がヌードマウスの体内に注射したヒト扁平上皮細胞癌の増殖を減衰させることによっ
て実証されているクラスIRTK阻害剤である。特定の4−アニリノキナゾリン誘導体は
、受容体チロシンキナーゼの阻害剤として有益である。これらの化合物が示す極めて密接
な構造活性相関は、キナゾリン環がアデニンポケット内に結合し、アニリノ環が隣接する
独自の親油性ポケット内に結合する、明確に定義された結合モードを示唆している。3つ
の4−アニリノキナゾリンの類似物(2つは可逆的阻害薬、1つは非可逆的阻害薬)が、
抗癌薬物として臨床的に評価されている。さらに、HER2−neu過剰発現転移性乳癌
の治療用のモノクローナル抗体trastazumab(ハーセプチン(商標))。Sc
heurle他、Anticancer Res 20:2091−2096、2000
年。
【0110】
別の実施形態では、微生物の病原体を示す生物学的検体が検出された場合、抗微生物効
果を有する治療薬を局所放出するのが好ましい。例えば、βラクタム系抗生物質、アミノ
グリコシド抗生物質、マクロライド、リンコマイシン、およびクリンダマイシンテトラサ
イクリン、キノロン類、スルホンアミド、トリメトプリム−スルファメトキサゾールおよ
び具体的には、アモキシシラン、アモキシシラン、アモキシシリン、アンピシリン、オー
グメンチン、バクトリム、ビアキシン、セクロール、セフチン、シプロ、クリンダマイシ
ン、デカドロン、ジフルカン、ドキシサイクリン、エリスロミアシン(erythrom
yacin)、エリスロマイシン、エリスロマイシン、フラジール、フロキシン、ケフレ
ックス、レボキシル、マクロビド(macrobid)、メトロニダゾール(フラジル)
、マイノシン、ミノサイクリン/ミノシン、ニザロール(nizarol)、ノルフロキ
サシン、ナイスタチン、ペニシリン、ポラロール(Polarol)、ロセフィン、サル
ファ、ストレプトマイシン、テクイン、テトラサイクリン、チニダゾール、バルトレック
ス、ビブラマイシン、ジトロマックス、またはジトロマイシンを放出するのが好ましい。
【0111】
ウイルス感染を示す生物学的検体の検出と同時に、インビラーゼのようなプロテアーゼ
阻害剤、ノルビル、ビラセプト、クリキシバン、またはフロトバセ(Frotovase
)、サキナビルもしくはアマンタジンのような他の抗ウイルス薬、リマンタジン、ザナミ
ビル、オセルタミビル、リバビリン、AZT、ディダノシン、ザルシタビン、スタブジン
、ラミブジン、ネビラピン、デラビルジン、イドクスウリジン、ビダラビン、トリフルリ
ジン、アシクロビル、ファムシクロビル、ペンシクロビル、バラシクロビル、ガンシクロ
ビル、フォスカルネット、リバビリン、アマンタジンおよびリマンタジン、シドフォビル
、インターフェロンを含む抗ウイルス化合物を放出するのが好ましい。
【0112】
別の実施形態では、炎症を示す生物学的検体が検出された場合、抗炎症効果を有する治
療薬を局所放出するのが好ましい。そのような治療薬は、プレドニゾン/プレドニゾロン
のようなステロイド、またはアスピリン、イブプロフェン、ナプロキセン、ナブメトン、
セレコクシブ、ロフェコキシブ、またはバルデコキシブのような非ステロイド系抗炎症薬
(NSAID)であるのが好ましい。そのような薬剤は、炎症性大腸炎、関節リウマチ等
のような炎症に関連する疾患の治療に特に適している。
【0113】
別の実施形態では、高血糖症を示す生物学的検体が検出された場合、本デバイスが血清
グルコース値を低下させることになる治療薬を放出するのが好ましい。例えば、本デバイ
スによって過度に高い値のグルコースが検出された場合、本デバイスは、十分な量のイン
スリンを放出し、血液中のグルコースの過度に高い値を正常に戻すことによって対処する
ことになる。
【0114】
本発明は、本医療デバイスが複数のマイクロチップを有することを想定している。マイ
クロチップは、現在利用可能な最高の処理機能を有するのが好ましい。複数のマイクロチ
ップは、すべてが互いに連絡しているのが好ましい。マイクロチップは、シリコンゲルマ
ニウムで製造されているのが最も好ましい。マイクロチップは、本医療デバイスを動作さ
せるにあたって最高の効率、速度および能力をさらに備えるために、Internati
onal Business Machines(IBM)のCMOS 9S低誘電率誘
電体絶縁高性能チップであるのがさらにより好ましい。当業者は、下記に記載する本デバ
イスは様々な数のマイクロチップ上に埋め込むことができるという事実から、本デバイス
が様々な数のマイクロチップを有することができることが容易に分かる。
【0115】
またさらに、本デバイスの各技術的構成要素は、それらを本システム内に統合する独自
の方法によって最適化されている。最近、低誘電率誘電体絶縁技術およびシリコンゲルマ
ニウム技術により、マイクロチップの処理能力をおよび効率が最大化されてきた。これら
のチップは、光連絡ネットワークに理想的であり、また、写真光学的信号方式によってデ
ータを伝達するマイクロアレイビーズ技術とそれらを組み合わせることにより、両システ
ムの背後にある能力が最適化される。
【0116】
本発明の別の特徴は、リザーバからの治療薬の放出を制御することのできる治療薬放出
デバイスに関する。例えば、生体測定認識デバイスが疾患マーカの存在を判定すると、制
御してリザーバから治療薬を放出するための信号が、治療薬放出デバイスに送信される。
すなわち、治療薬放出デバイスは、放出すべき薬物の放出速度および/または放出量に関
する指示を受け取る。一実施形態では、治療薬放出デバイスは、上記に掲載したデバイス
を含むマイクロチップの下に配置されたマイクロチップであり、治療薬の被制御放出のた
めのリザーバを含む。マイクロチップの基板は、エッチング、成形、または機械加工によ
って作製されたリザーバを含んでおり、該マイクロチップの支持体としての機能を果たし
ている。支持体として機能し、エッチング、成形、または機械加工に適し、送達されるこ
とになる分子に対して、またその周囲を取り巻く流体、例えば水、有機溶媒、血液、電解
質または他の溶液に対して不透過性である任意の材料を、基板として用いることができる
。基板材料の例には、セラミックス、半導体、および分解性高分子ならびに非分解性高分
子が含まれる。基板自体は、非毒性、無菌、かつ生体適合性を有するのが好ましい。しか
しながら、使用前に、有毒物質もしくは他の非生体適合性物質を、ポリ(エチレングリコ
ール)またはポリテトラフルオロエチレン様物質なとの生体適合性物質内にカプセル封入
してもよい。その全体が引用により組み込まれる米国特許第6、491、666号を参照
されたい。適した治療薬放出デバイスは、MicroChips(マサチューセッツ州、
ケンブリッジ所在)から入手可能である。治療薬放出デバイスは、複数のリザーバを有す
るのが好ましい。本発明のこの態様の別の実施形態では、治療薬放出デバイスは、適切な
治療薬放出状態に関して、他のデバイスまたは外部データベースに信号を送る。さらに別
の実施形態では、治療薬の放出が少量ずつ行われ、送達に先立って正しい投与量を確認す
るためのチェックポイントとして機能する単独の無線信号システムを有する追加のマイク
ロチップを治療薬が通過する間の事前処置としての役割を果たす。
【0117】
本発明の別の特徴は、マイクロアレイ走査デバイス、生体認識デバイス、および状況に
応じての治療薬放出デバイス間の連絡を促進することのできるインターフェースデバイス
に関する。インターフェースデバイスは、生体認識デバイスから検体の存在、欠如または
量に関する情報を受信し、治療薬放出デバイスに、1つもしくはそれ以上のリザーバから
治療薬あるいは薬剤の混合物を放出するための信号を送る。一実施形態では、インターフ
ェースデバイスは、無線ローカルエリアネットワーク(WLAN)用の送信機および受信
機を有する。詳細については、その全体が引用により本明細書に組み込まれる米国特許第
5、832、296号または第6、542、717号を参照されたい。別の実施形態では
、本発明は、マイクロチップ間に信号を伝送するためのパーソナルエリアネットワーク(
PAN)静電気連絡の利用を企図しており、かつ生体認識デバイスにおける解析からのそ
れぞれの信号を受信すると同時に体内に薬物を送達するために、治療薬放出用リザーバと
関連付けた治療薬放出デバイスを用いる。埋め込み可能な実施形態および摂取可能な実施
形態では、2つの隣接するPAN送信機がマイクロアレイの下に配置され、一方はマイク
ロアレイ走査デバイスに隣接し、他方は下のリザーバを制御する治療薬放出デバイスに隣
接しているのが好ましい。PAN送信機は、アレイの結果によって特定された治療薬の放
出に対して信号を送る。適切なハードウェアは、カリフォルニア州パロアルト所在のIn
terval Research Corp.から、送信機は、ニューヨーク州アーモン
ク市所在のInternational Business Machines Cor
p.から調達することができる。
【0118】
本発明のこの態様の別の実施形態では、複数のマイクロチップは、それらの情報を、ハ
ンドヘルド監視装置のような外部情報源または無線データ連絡システムによって操作され
るネットワーク本部のコンピュータに伝送する。本デバイスが糖尿病治療用のパッチであ
るさらに別の実施形態では、該パッチは、インスリン値を測定し、炭水化物値を測定する
第2のデバイスまたは汗腺のレベルもしくは数値を測定する第3のデバイスと連絡する。
検体と異なるデバイス間の相互作用および物理的パラメータデータの比較を通じたプロセ
ス制御決定によって、ある量のグルコースまたはインスリンの放出が適切であるか否かが
判定されることになり、グルコース/インスリン放出を決定する際に必須となる他の要因
の根拠となる閉ループシステムを形成している。
【0119】
一実施形態では、本発明は、本医療デバイスに動力を供給するためのエネルギー源を有
する。例えば、本デバイスは、電池によって動力を供給される。別の実施形態では、動力
源は、パーソナルエリアネットワークによって提供される。
【0120】
本発明の用途は、軍事利用から商業的利用まで多岐にわたる。例えば、本デバイスは、
リアルタイムの診断が実質的に重要となるSARSのようなウイルスに罹災した国の一般
市民が用いることができるであろう。生物テロの発生に伴い、病原体を検出する方法は、
全世界の国防省に対し、価値が高まっている。同様に、本発明は、細菌感染または他の消
化管関連疾患を検出するために、また、消化管が感染症増大の最大中心部位の1つである
ので、腸管系を通過する際における蛋白質活性の即時リアルタイム診断を行うために用い
ることができるであろう。同様に、高親和性蛋白リガンドおよび高特異性蛋白リガンドの
隔離、またはアルデヒドスライド上の関心のあるペプチドを隠蔽するBSAなどの問題に
よって現在制限されている蛋白質マイクロアレイ技術の用途は、生体内の選択的蛋白質ア
レイを用いて標的の蛋白質類に対応する抗体または薬物を投与することによって最大化す
ることができるであろう。さらに、本発明のデバイスは、薬物動態モデルを開発するため
に実験的薬剤の濃度および効果を効率的に監視する臨床試験の研究目的に特に役立つこと
ができるであろう。
【0121】
実際には、本デバイスの商業用途、医療用途、研究/教育用途、および軍事ならびに地
域奉仕/人道的用途があり得る。
【実施例】
【0122】
(実施例1:光ファイバ全内部反射蛍光バイオセンサの仕様)
光ファイバ全内部反射蛍光(TIRF)バイオセンサが構築され、本明細書に定義する
マイクロアレイおよびマイクロアレイ走査デバイスを構成する。Preininger他
(Analytica Chimica Acta、2000年、403、67−76)
を参照されたい。レーザ光は、レーザ光源から、すべてが一連の光ファイバを経由して、
フローセル型検出器へ誘導される。この光ファイバをベースとする装置の概略図を、図1
2に示す。本センサでは、入射レーザ光は、50:50の光ファイバスプリッタの出力区
間を経由して、機能化されたファイバへ誘導される。放射蛍光は、ファイバ内に再帰結合
し、レーザ光からの干渉をほとんど受けることなく、検出器に向かって伝播する。この設
計は、いくつかの利点を有する。開始から終了までのファイバ使用により、自由空間結合
による損失が排除される。ファイバが堅牢な光の輸送手段となり、従って、振動に敏感で
なく、かつ市販の光ファイバコネクタで複数本のファイバを容易に結合することができる
。従って、マイクロアレイは、1本のファイバの機能化された表面であっても、複数本の
ファイバの機能化された表面であってもよい。
【0123】
Celebre他(Measurement Science and Techno
logy、1992年、3、1166−1173)に記載された方法を用いた、入力レー
ザパワーとAtto 655フルオロフォアのファイバ特性の関数としてのフォトダイオ
ードに送達される予測出力蛍光強度(図13参照)を、下記のシステムパラメータと共に
表1に示す。
【0124】
・ 約200ng/cm2[Tedeschi他、Biosensors and B
ioelectronics、2003年、19(2)、85−93]の表面濃度
・ スペクトル特性QY=0.3ε=110、000を有するフルオロフォア Att
o 655(Sigma Aldrich)
(表1:レーザパワーとファイバ特性の関数としての蛍光出力)
【0125】
【表1】

一般的なフォトダイオード(例えばPacific Sensor part 1−6
−TO52S1)は、ピコワット範囲の信号を正確に測定する。システム内で50%損失
すると控えめに見積もっても、出力パワーが検出器の感度下限よりも2桁大きくなるよう
にバイオセンサのパラメータを調整することができるのは明らかである。
【0126】
(実施例2:統合型パッチシステム)
例示的なパッチデバイスは、バンコマイシンに対して0.1mlの血液を自動的に採取
およびサンプリングする無痛の方法を代表している。各パッチは、2つの部分、すなわち
、単回使用マイクロニードルおよびマイクロチャネルを含む使い捨て部分(アッセイデバ
イス)と、残りの光学部品、電子機器ならびに機構(アッセイ読み取りデバイス)を含む
再使用可能部分とからなる。図5、図7。
【0127】
マイクロニードルは、少量の血液を、無痛で自動的に採取する。機械的アクチュエータ
が、針を挿抜する。本発明のデバイスは、パッチが貼付された後、いくつかの測定を行う
。しかしながら、各マイクロニードルは、凝固を回避するために、1回のみ使用される。
複数回の血液採取に対する必要条件としては、針を挿抜することができるだけではなく、
使用済みの針を廃棄して新たな針を再搭載することのできる機械的アクチュエータが求め
られる。本マイクロニードルは、鋭利、堅牢で、完全に無痛の方法で皮膚の外層を貫通す
るのには、ごく短時間で十分である。それらの設計は、本デバイスの低コスト性、使い捨
て性、独立性、生体適合性に寄与している。
【0128】
針は、フォトリソグラフィー法によって、SNFで型に製造される。パッチデバイスの
「最上」のアッセイデバイス部分上のマイクロチャネルは、ファイバセンサを捕捉するの
に必要な構造体と共に、層流要素およびリザーバ要素を含む。針を通ってリザーバに流入
する血液と、チャネルを貫流する血液/緩衝剤流との2つの別個の流体流要素によってパ
ッチが作動する。図5。下記の表に、本チャネル用の設計仕様を示す。
【0129】
(表2)
【0130】
【表2】

パッチの非使い捨て部品(アッセイ読み取りデバイス)は、その上に取り付けられるこ
とになる12個の単回使用使い捨て部品(アッセイデバイス)を含む。図7。マイクロ流
体機器の注文製造品は、Micronicsから調達することができる。仕様は下記のと
おりである。
【0131】
(仕様)
【0132】
【表3】

光センサマイクロアレイ走査デバイスは、レーザにより生成されるエバネッセント波に
よって励起される生物活性因子と検体との間の相互作用に由来する蛍光に基づいて、生体
認識デバイスに電気信号を送る。光センサの頻度は、レーザのコスト、PINダイオード
のコスト、および蛍光分子のコスト間のコストトレードオフに基づいて決定される。
【0133】
非使い捨てエバネッセントセンサファイバ(アッセイ読み取りデバイス内のマイクロア
レイ走査デバイス)は、完全な単回使用アッセイデバイスを生成するための使い捨ての採
血用流体工学的サブシステム(アッセイデバイス内のマイクロアレイを含む)に取り付け
られる。本アッセイデバイスは、各アッセイ読み取りデバイス当たり6個ずつおよび12
個ずつの組みで包装される。
【0134】
統合型システムの最大サイズの試験に関しては、図14に示す身体媒体デバイスと同様
である。
【0135】
血液は、マイクロニードルを通って血液リザーバに流入する。緩衝剤と血液が、チャネ
ルを通る層流を形成する(図5、黒で示す)。ファイバの表面(黒で示す)に結合された
660nmのレーザが、フルオロフォアを励起させる。血液中の薬物がファイバ上の標識
薬物を転移させ、蛍光が減少する。読み取り装置内のファイバ端部上のセンサが、信号レ
ベルの低下を検出する。この低下が、生体測定認識デバイスの関連データベースに報告さ
れる。
【0136】
本デバイスは、櫛状構造に形成されている。12単位アッセイのモデルを図7に示す。
図では、制御用電子機器は、本デバイスの最上部に取り付けられている(アッセイ読み取
りデバイス)。作動機構は、本デバイスの底部にある(アッセイデバイス)。
【0137】
読み取り装置の端面図は、読み取り装置底部のアッセイデバイス用キャビティを示して
いる。光学的インターフェースおよび機械的インターフェースが、これら2つの部品間に
存在する。
【0138】
キャビティの最上部に沿って、マイクロニードルを皮膚内に強制挿入するために用いら
れる12個のバネがある。また、バネを解放するソレノイドもある。各バネが、12個の
使い捨て部品のうちの1つの上端を押圧する。
【0139】
アッセイデバイスのフィンガの各々の一端が、アッセイデバイス内のヒンジを形成して
おり、それにより、バネがアッセイデバイスを強制押下し、アッセイデバイスの底部を覆
う被膜の層を通過させる。
【0140】
光ファイバがヒンジの上を通過し、電子機器のプリント回路基板底部上に取り付けられ
た光スプリッタで終了する。アッセイデバイスとアッセイ読み取りデバイスとの間の境界
面は、小さい空隙である。
【0141】
12個のアッセイデバイスフィンガの1つのこの端面図がパッケージを示している。ア
ッセイデバイスは、無菌のパッチパッケージの内部にある。マイクロニードルの下には、
針が皮膚を貫いてその中に入ることができるように設計されたパッチの一部分がある。図
6に示すように、パッチは、接着剤と共に所定の位置に保持される。最後に、保護カバー
がある。パッチの最上部は、読み取り装置内への挿入を可能にするように設計されている
。光信号は、ファイバの端部とスプリッタとの間のこのシールの一部分を通過する。
【0142】
本開示では、本発明の好ましい実施形態およびその幅広い用途のほんの数例が説明され
ているだけである。本発明は、種々の他の組み合わせおよび環境において用いることがで
き、かつ本明細書に表明した発明思想の範囲内での変更または修正が可能であることを理
解すべきである。従って、例えば、当業者は、通常の域を越えない実験によって、本明細
書に記載した特定の物質および手法と等価の数多くのものを理解または確認することがで
きるであろう。そのような等価のものは、本発明の範囲内にあるものとみなされ、かつ以
下の特許請求の範囲によって包含される。
【図面の簡単な説明】
【0143】
【図1】図1は、本発明の例示的な医療デバイスの概略図である。本デバイスは、本デバイスの多孔質被膜3を通る流体の動きを促進するために、生体安定性ポリマー被膜1、およびこの好ましい実施形態においては、浸透圧ポンプ2を有する。本デバイスは、疾患マーカである生物学的検体と相互に作用することのできる生物活性因子を含むマイクロアレイ4と、治療薬を含み、かつ該治療薬を本医療デバイスから放出することのできるリザーバ10と、疾患マーカである生物学的検体と生物活性因子との間の相互作用の物理的パラメータデータを取得することのできるマイクロアレイ走査デバイス7と、物理的パラメータデータを検体の相互作用プロファイルと比較することのできる生体測定認識デバイス9と、複数のリザーバおよびチェックポイント13&14からの治療薬の放出を制御することのできる治療薬放出デバイス10と、マイクロアレイ走査デバイス7、生体測定認識デバイス9および治療薬放出デバイス10間の連絡を促進することのできるインターフェースデバイス8とを含む複数のマイクロチップ5、7、8、9、6、10、12、13&14と、医療デバイスに動力を供給するためのエネルギー源15とを含む。さらに、例示的なデバイスは、パーソナルエリアネットワーク用送信機5&6およびPANとハンドヘルドコンピュータモニタ15または外部コンピュータネットワーク16との間の連絡用の伝送経路を含む。さらに、例示的なデバイスは、放出に先立つ治療薬の混合用の区画11を含む。
【図2】図2は、外部パッチの実施形態の本発明によるデバイスを示す。これは、皮膚上に装着され、かつ治療薬の放出を可能にすることができる。さらに、これは、外部ネットワークとインターフェースすることができる。
【図3】図3は、外部サーバと無線連絡する、ここではパッチ形状の複数の医療デバイスを示す。外部サーバは、生体測定認識デバイスおよび生物活性因子と検体との間の相互作用の物理的パラメータの薬物動態データベースを含むことができる。
【図4】図4(a)100マイクロメートルの直径のマイクロニードルは、おおよそ人毛の直径である。(b)シリコンマイクロニードルのアレイ。
【図5】図5(a)は、パッチの実施形態100の、本発明によるデバイスの種々の図である。例示的なパッチは、長さが2cmで幅が0.5cmである。これは、約1.5mmの厚みも有する。パッチは、複数のマイクロニードル12を含む。(b)は、パッチデバイスの内部特徴を示す。本デバイスは、マイクロニードル12からポンプで血液が送り込まれるリザーバ13、緩衝剤を含む第2のリザーバ14、緩衝剤15aと血液注入口15bとの合流点となる層流用の共通のマイクロチャネル15、および廃棄物用レセプタクル16を有する。さらに、この図は、本デバイスを、マイクロニードル、マイクロチャネルおよびマイクロアレイを有する使い捨て層100aと、使い捨て部分と光連絡する、マイクロアレイ走査デバイスならびに他の電子機器を有する非使い捨て部分100bとの2つの部品に分離可能とすることができることを示している。
【図6】図6(a)は、患者への貼付前にパッチ100を包装することができる方法を示す。パッチは、保護層17で覆うことができ、また貼付と同時にマイクロニードルが貫通することになるパッチ基部18を有することができる。基部18は、貼付前のマイクロニードルの無菌を維持するというさらなる利点を提供する。接着剤19は、被検者の皮膚へパッチを固定するのに役立つ。さらに、保護カバー20が備えられており、該保護カバー20を除去して、接着剤層19を露出させる。
【図7】図7は、複数のパッチ100を患者へ同時に貼付することができる方法を示す。その後、そのような複数のパッチを順次活性化し、長期間検体検出を行うことができる。
【図8】図8(a)2つの注入用マイクロチャネルのうちの1つの注入口15a内に血液が注入される、例示的な層流マイクロチャネル15の側面図。血液は、細胞21、種々の蛋白質25、および測定対象の検体22を含む。流体は、拡散のみによって境界面を横断する分子と並行する流れで流れる。(b)に示すように、小分子検体22のみが対壁に到達し、該対壁において、表面上で生物活性因子23に事前結合された蛍光標識検体分子24との平衡交換が生じる。この例では、生物活性因子23で被覆したチャネル壁が、マイクロアレイを構成している。
【図9】図9に、全内部反射時に発生するエバネッセント場の概念を示す。エバネッセント場は、光ビームがその中を進む媒体を越えて1波長よりも先へ広がることは決してない。
【図10】図10に、光ファイバ26によって全内部反射蛍光を利用してマイクロアレイにおいて発生する生物活性因子と検体との間の相互作用を示す蛍光の変化を検出する方法を示す。光ファイバは、多様な形状を有することができる。例えば、それは、層流チャネル15の長さに沿って平行に走ることができる。代替的に、複数のファイバがチャネル内で終了し、ファイバ自体に生物活性因子で被覆してもよい。第1のマイクロチャネル15aおよび第2のマイクロチャネル15bは、互いに流体連絡する。小分子のみが、拡散境界面を越えて、マイクロアレイ、すなわち機能化されたセンサ表面へ拡散することになる。TIRF分光計による蛍光検出は、この表面を越えて1波長よりも先へは広がらない。
【図11】図11に、マイクロアレイの一部である光ファイバ26を示す。光ファイバは、クラッディングされていない部分31およびクラッディングされていない部分27を有する。遠位のクラッディングされていない部分27は、アッセイを受けている体液中の標的検体と相互に作用する生物活性因子で機能化されている。ファイバ26の近位端は、マイクロアレイ走査デバイスの一部と光連絡している。この接触は、コネクタ28によって円滑化される。コネクタよりも先へは、入力によって光がファイバスプリッタ31へ誘導され、該ファイバスプリッタ31が、ファイバを経由して戻る光を、フォトダイオード30のような検出器へ誘導する。別に論じたように、ファイバの機能化されたクラッディングされていない27が層流マイクロチャネル15の壁の一部を構成していてもよく、複数のファイバがチャネル15内に突出していてもよい。
【図12】図12に、マイクロアレイの例示的な一部分およびTIRFセンサを用いたマイクロアレイ走査デバイスを示す。レーザ33からの入射レーザ光は、多モードファイバ26および50:50の光ファイバスプリッタ31の出力区間を経由して、機能化されたクラッディングされていないファイバ27へ誘導される。1アッセイの場合、体液中における検体の存在に起因し、かつエバネッセント波において光子エネルギーがファイバ内に結合される結果生じる競合的結合プロセスによって生物活性因子から転移された蛍光標識検体は、減少する。この光度の減少は、フォトダイオードおよび関連する増幅器によって検出される。検体22と生物活性因子23との間の相互作用の特徴を示す放射蛍光は、ファイバ内に再帰結合し、レーザ光からの干渉をほとんど受けることなく検出器30に向けて伝播する。ファイバに連結されたレーザは、660nmの光を提供する。一例では、本システムは、200μmのコア機能化ファイバおよびスプリッタ、または62.5μmのコア機能化ファイバおよびスプリッタで作動する。ファイバのコア直径は、システム全体に対して同一である。62.5μmのコアシステムまたは200μmのコアシステムのいずれかにおいて、より高次のモードのファイバ(コアの両端)が励起され、エバネッセント波エネルギーを最大化し、かつ1×2のカプラをより一様に作動させる。これは、ファイバのコア径によって異なる。
【図13】図13に、Atto 655フルオロフォアの蛍光および吸光度を示す。
【図14】図14は、ヒトの腕上に装着されたアッセイ読み取りデバイスのモデルの画像である。
【図15】図15は、0.1μl/sで流れるPBSの流れと0.02μl/minで流れる血液の流れとの2つが1つのマイクロチャネル内で集合した画像である。視覚的には、拡散境界面での各流れ間の混合はほとんど見られない。しかしながら、より高い拡散係数を有する分子は、拡散境界面を越えることになる。
【図16】図16は、細胞、ウシ血清アルブミンおよびバンコマイシンの拡散係数の画像である。
【図17】図17は、本発明の例示的なデバイスの図である。A)この図は、本デバイスを、マイクロニードル、マイクロチャネルおよびマイクロアレイを有する使い捨て層100aと、使い捨て部分と光連絡する、マイクロアレイ走査デバイスならびに他の電子機器を有する非使い捨て部分100bとの2つの部品に分離可能とすることができることを示している。B)パッチの使い捨て部分100aは、イクロニードル12からポンプで血液が送り込まれるリザーバ13、緩衝剤を含む第2のリザーバ14、緩衝剤15aと血液注入口15bとの合流点となる層流用の共通のマイクロチャネル15、および廃棄物用レセプタクル16を含む。さらに、マイクロアレイを備える光ファイバ26のクラッディングされていない部分を示す。C)は、いくつかの使い捨て部分および非使い捨て部分を共に示す。
【特許請求の範囲】
【請求項1】
医療デバイスであって、
a) 疾患マーカである生物学的検体と相互作用することができる生物活性因子を含む
マイクロアレイと、
b) 少なくとも1つの治療薬を含み、かつ該医療デバイスから該少なくとも1つの治
療薬を放出することができる少なくとも1つのリザーバと、
c) 複数のマイクロチップであって、
i) 該疾患マーカである生物学的検体と該生物活性因子との間の相互作用の物理的
パラメータデータを取得することができるマイクロアレイ走査デバイスと、
ii) 該物理的パラメータデータを検体の相互作用プロファイルと比較することが
できる生体測定認識デバイスと、
iii) 該リザーバからの該治療薬の放出を制御することができる治療薬放出デバ
イスと、
iv) 該マイクロアレイ走査デバイス、該生体測定認識デバイスおよび該治療薬放
出デバイス間の連絡を促進することができるインターフェースデバイスと、
を備える複数のマイクロチップと、
d) 前記医療デバイスに動力を供給するためのエネルギー源と、
を備える、医療デバイス。
【請求項2】
前記デバイスは、生体適合性ポリマーで被覆されている、請求項1に記載の医療デバイス
。
【請求項3】
前記ポリマーは、チャネルを有する、請求項1に記載の医療デバイス。
【請求項4】
前記ポリマーは、多孔質である、請求項1に記載の医療デバイス。
【請求項5】
前記マイクロアレイは、マイクロビーズを備える、請求項1に記載の医療デバイス。
【請求項6】
前記生物活性因子は、核酸である、請求項1に記載の医療デバイス。
【請求項7】
前記生物活性因子は、ポリペプチドである、請求項1に記載の医療デバイス。
【請求項8】
前記生物活性因子は、免疫グロブリンである、請求項7に記載の医療デバイス。
【請求項9】
前記生物活性因子は、蛍光標識されている、請求項1に記載の医療デバイス。
【請求項10】
前記生物活性因子は、ナノ結晶で蛍光標識されている、請求項1に記載の医療デバイス。
【請求項11】
前記疾患マーカである生物学的検体は、核酸である、請求項1に記載の医療デバイス。
【請求項12】
前記疾患マーカである生物学的検体は、ポリペプチドである、請求項1に記載の医療デバ
イス。
【請求項13】
前記疾患マーカである生物学的検体は、免疫グロブリンである、請求項12に記載の医療
デバイス。
【請求項14】
前記複数のマイクロチップは、シリコンゲルマニウムを含む、請求項1に記載の医療デバ
イス。
【請求項15】
前記マイクロアレイ走査デバイスは、光ファイバ素子を備える、請求項1に記載の医療デ
バイス。
【請求項16】
前記検体の相互作用プロファイルは、前記生体測定認識デバイス内に格納される、請求項
1に記載の医療デバイス。
【請求項17】
前記検体の相互作用プロファイルは、前記医療デバイスの外部に格納される、請求項1に
記載の医療デバイス。
【請求項18】
複数のリザーバを有する、請求項1に記載の医療デバイス。
【請求項19】
前記インターフェースデバイスは、パーソナルエリアネットワークを備える、請求項1に
記載の医療デバイス。
【請求項20】
エネルギー源は、電池である、請求項1に記載の医療デバイス。
【請求項21】
エネルギー源は、パーソナルエリアネットワークによって提供される、請求項1に記載の
医療デバイス。
【請求項22】
患者における疾患を検出および治療する方法であって、
A) 該患者に医療デバイスを投与する工程であって、
a) 疾患マーカである生物学的検体と相互作用することができる生物活性因子を含
むマイクロアレイと、
b) 少なくとも1つの治療薬を含み、かつ該医療デバイスから該少なくとも1つの
治療薬を放出することができる少なくとも1つのリザーバと、
c) 複数のマイクロチップであって、
i) 該疾患マーカである生物学的検体と該生物活性因子との間の相互作用の物理
的パラメータデータを取得することができるマイクロアレイ走査デバイスと、
ii) 該物理的パラメータデータを検体の相互作用プロファイルと比較すること
ができる生体測定認識デバイスと、
iii) 該リザーバからの該治療薬の放出を制御することができる治療薬放出デ
バイスと、
iv) 該マイクロアレイ走査デバイス、該生体測定認識デバイスおよび該治療薬
放出デバイス間の連絡を促進することができるインターフェースデバイスと、
を含む複数のマイクロチップと、
d) 該医療デバイスに動力を供給するためのエネルギー源と、
を備える医療デバイスを投与する工程、ならびに
B) 該医療デバイスを該患者から除去する工程か、または該医療デバイスが該患者を
通過することを可能にする工程、
を包含する、方法。
【請求項23】
前記デバイスは、該デバイスが腸管を通過することを可能にする生体適合性のポリマーで
被覆されている。請求項22に記載の方法。
【請求項24】
前記ポリマーは、チャネルを有する、請求項22に記載の方法。
【請求項25】
前記ポリマーは、多孔質である、請求項22に記載の方法。
【請求項26】
前記マイクロアレイは、マイクロビーズを備える、請求項22に記載の方法。
【請求項27】
前記生物活性因子は、核酸である、請求項22に記載の方法。
【請求項28】
前記生物活性因子は、ポリペプチドである、請求項22に記載の方法。
【請求項29】
前記生物活性因子は、免疫グロブリンである、請求項28に記載の方法。
【請求項30】
前記生物活性因子は、蛍光標識されている、請求項22に記載の方法。
【請求項31】
前記生物活性因子は、ナノ結晶で蛍光標識されている、請求項22に記載の方法。
【請求項32】
前記疾患マーカ生物学的検体は、核酸である、請求項22に記載の方法。
【請求項33】
前記疾患マーカ生物学的検体は、ポリペプチドである、請求項22に記載の方法。
【請求項34】
前記疾患マーカ生物学的検体は、免疫グロブリンである、請求項33に記載の方法。
【請求項35】
前記複数のマイクロチップは、シリコンゲルマニウムを含む、請求項22に記載の方法。
【請求項36】
前記マイクロアレイ走査デバイスは、光ファイバ素子を備える、請求項22に記載の方法
。
【請求項37】
前記検体の相互作用プロファイルは、前記生体測定認識デバイス内に格納される、請求項
22に記載の方法。
【請求項38】
前記検体の相互作用プロファイルは、前記医療デバイスの外部に格納される、請求項22
に記載の方法。
【請求項39】
複数のリザーバを有する、請求項22に記載の方法。
【請求項40】
前記インターフェースデバイスは、パーソナルエリアネットワークを備える、請求項22
に記載の方法。
【請求項41】
エネルギー源は、電池である、請求項22に記載の方法。
【請求項42】
エネルギー源は、パーソナルエリアネットワークによって提供される、請求項22に記載
の方法。
【請求項43】
前記連絡は、外部コンピュータによって監視される、請求項22に記載の方法。
【請求項44】
前記外部コンピュータは、前記治療薬の放出を指示する、請求項43に記載の方法。
【請求項45】
浸透圧ポンプをさらに備える、請求項1に記載の医療デバイス。
【請求項46】
加圧マイクロ流体チャネルをさらに備える、請求項に記載の医療デバイス。
【請求項47】
体液の流れを方向付けるパーソナルエリアネットワーク送信機をさらに備える、請求項1
に記載の医療デバイス。
【請求項48】
体液中の検体を検出することができる医療デバイスであって、
A) 体液の試料を採取することができる少なくとも1本のマイクロニードルと、
B) 該少なくとも1本のマイクロニードルと流体連絡する、該試料が貫流する第
1のマイクロチャネルと、
C) 該第1のマイクロチャネルと流体連絡し、緩衝剤が通って流れる第2のマイ
クロチャネルであって、少なくとも1つの生物活性因子を有するマイクロアレイをさらに
備える、第2のマイクロチャネルと、
D) 生物活性因子と該体液中の検体との間の相互作用を検出するためのマイクロ
アレイ走査デバイスと、
E) 該マイクロアレイ走査デバイスと生体測定認識デバイスとの間の連絡を促進
することができるインターフェースデバイスと、
を備える医療デバイス。
【請求項49】
前記体液は、血液である、請求項48に記載の医療デバイス。
【請求項50】
前記少なくとも1本のマイクロニードルは、複数のマイクロニードルである、請求項48
に記載の医療デバイス。
【請求項51】
前記マイクロニードルは、直径が約10ミクロンと約200ミクロンとの間である、請求
項48に記載の医療デバイス。
【請求項52】
前記マイクロニードルは、約100マイクロリットルの血液を引くことができる、請求項
48に記載の医療デバイス。
【請求項53】
前記第1のマイクロチャネルは、直径が約100マイクロメートルである、請求項48に
記載の医療デバイス。
【請求項54】
前記第2のマイクロチャネルは、直径が約100マイクロメートルである、請求項48に
記載の医療デバイス。
【請求項55】
前記第1のマイクロチャネルを通って流れる前記体液中の前記検体が、前記第2のマイク
ロチャネル内に拡散し、かつ前記生物活性因子と相互に作用する、請求項48に記載の医
療デバイス。
【請求項56】
前記第1のマイクロチャネルを通って流れる前記体液中の前記検体は、前記第2のマイク
ロチャネル内に拡散し、標識検体を、前記生物活性因子に結合している状態から競合的に
置き換える、請求項55に記載の医療デバイス。
【請求項57】
前記標識検体は、所定量で提供される、請求項56に記載の医療デバイス。
【請求項58】
前記標識検体は、蛍光部分で標識されている、請求項56に記載の医療デバイス。
【請求項59】
前記マイクロアレイは、前記体液中の前記検体を特異的に結合する抗体の被覆を有する第
2のマイクロチャネルの一部分である、請求項48に記載の医療デバイス。
【請求項60】
前記マイクロアレイ走査デバイスは、全内部反射蛍光(TIRF)分光計を備える、請求
項48に記載の医療デバイス。
【請求項61】
前記生体測定認識デバイスは、前記デバイスの外部に配置され、かつ前記連絡は、無線伝
送による、請求項48に記載の医療デバイス。
【請求項62】
前記検体は、インスリンであり、かつ前記生物活性因子は、インスリンに対して特異的な
抗体である、請求項48に記載の医療デバイス。
【請求項63】
前記検体は、グルコースであり、かつ前記生物活性因子は、グルコースに対して特異的な
抗体である、請求項48に記載の医療デバイス。
【請求項64】
前記デバイスは、パッチとして皮膚上に装着される、請求項48に記載の医療デバイス。
【請求項65】
前記検体は、疾患を示す、請求項48に記載の医療デバイス。
【請求項66】
請求項48に記載の医療デバイスであって、さらに、
F) 中に治療薬を有するリザーバと、
G) 前記生体測定認識デバイスからの指示に応答して、リザーバからの治療薬の
放出を制御することができる治療薬放出デバイス
とを備える、医療デバイス。
【請求項67】
前記検体は、グルコースであり、かつ前記治療薬は、インスリンである、請求項66に記
載の医療デバイス。
【請求項68】
前記検体は、前記治療薬と同一である、請求項66に記載の医療デバイス。
【請求項69】
前記検体は、前記治療薬の代謝産物である、請求項66に記載の医療デバイス。
【請求項70】
請求項48に記載の医療デバイスであって、ここで、少なくとも1つの使い捨てアッセイ
デバイスは、前記少なくとも1本のマイクロニードルと、前記第1のマイクロチャネルと
、前記第2のマイクロチャネルとを備え、かつ非使い捨てアッセイ読み取りデバイスは、
前記マイクロアレイ走査デバイス、前記インターフェースデバイスを備える、医療デバイ
ス。
【請求項71】
前記アッセイデバイスとアッセイ読み取りデバイスとは、互いに光連絡している、請求項
70に記載の医療デバイス。
【請求項72】
単一のアッセイ読み取りデバイス内にはめ込まれた複数の使い捨てアッセイデバイスが存
在する、請求項70に記載の医療デバイス。
【請求項73】
前記マイクロアレイは、前記生物活性因子で機能化された単一のガラス光ファイバの、1
つのクラッディングされていない部分を含み、該単一のガラス光ファイバのクラッディン
グされていない部分は、前記第2のマイクロチャネルと流体接触している、請求項48に
記載の医療デバイス。
【請求項74】
前記マイクロアレイは、前記生物活性因子で機能化された単一のガラス光ファイバの、複
数のクラッディングされていない部分を含み、該単一のガラス光ファイバのクラッディン
グされていない部分は、前記第2のマイクロチャネルと流体接触している、請求項48に
記載の医療デバイス。
【請求項1】
医療デバイスであって、
a) 疾患マーカである生物学的検体と相互作用することができる生物活性因子を含む
マイクロアレイと、
b) 少なくとも1つの治療薬を含み、かつ該医療デバイスから該少なくとも1つの治
療薬を放出することができる少なくとも1つのリザーバと、
c) 複数のマイクロチップであって、
i) 該疾患マーカである生物学的検体と該生物活性因子との間の相互作用の物理的
パラメータデータを取得することができるマイクロアレイ走査デバイスと、
ii) 該物理的パラメータデータを検体の相互作用プロファイルと比較することが
できる生体測定認識デバイスと、
iii) 該リザーバからの該治療薬の放出を制御することができる治療薬放出デバ
イスと、
iv) 該マイクロアレイ走査デバイス、該生体測定認識デバイスおよび該治療薬放
出デバイス間の連絡を促進することができるインターフェースデバイスと、
を備える複数のマイクロチップと、
d) 前記医療デバイスに動力を供給するためのエネルギー源と、
を備える、医療デバイス。
【請求項2】
前記デバイスは、生体適合性ポリマーで被覆されている、請求項1に記載の医療デバイス
。
【請求項3】
前記ポリマーは、チャネルを有する、請求項1に記載の医療デバイス。
【請求項4】
前記ポリマーは、多孔質である、請求項1に記載の医療デバイス。
【請求項5】
前記マイクロアレイは、マイクロビーズを備える、請求項1に記載の医療デバイス。
【請求項6】
前記生物活性因子は、核酸である、請求項1に記載の医療デバイス。
【請求項7】
前記生物活性因子は、ポリペプチドである、請求項1に記載の医療デバイス。
【請求項8】
前記生物活性因子は、免疫グロブリンである、請求項7に記載の医療デバイス。
【請求項9】
前記生物活性因子は、蛍光標識されている、請求項1に記載の医療デバイス。
【請求項10】
前記生物活性因子は、ナノ結晶で蛍光標識されている、請求項1に記載の医療デバイス。
【請求項11】
前記疾患マーカである生物学的検体は、核酸である、請求項1に記載の医療デバイス。
【請求項12】
前記疾患マーカである生物学的検体は、ポリペプチドである、請求項1に記載の医療デバ
イス。
【請求項13】
前記疾患マーカである生物学的検体は、免疫グロブリンである、請求項12に記載の医療
デバイス。
【請求項14】
前記複数のマイクロチップは、シリコンゲルマニウムを含む、請求項1に記載の医療デバ
イス。
【請求項15】
前記マイクロアレイ走査デバイスは、光ファイバ素子を備える、請求項1に記載の医療デ
バイス。
【請求項16】
前記検体の相互作用プロファイルは、前記生体測定認識デバイス内に格納される、請求項
1に記載の医療デバイス。
【請求項17】
前記検体の相互作用プロファイルは、前記医療デバイスの外部に格納される、請求項1に
記載の医療デバイス。
【請求項18】
複数のリザーバを有する、請求項1に記載の医療デバイス。
【請求項19】
前記インターフェースデバイスは、パーソナルエリアネットワークを備える、請求項1に
記載の医療デバイス。
【請求項20】
エネルギー源は、電池である、請求項1に記載の医療デバイス。
【請求項21】
エネルギー源は、パーソナルエリアネットワークによって提供される、請求項1に記載の
医療デバイス。
【請求項22】
患者における疾患を検出および治療する方法であって、
A) 該患者に医療デバイスを投与する工程であって、
a) 疾患マーカである生物学的検体と相互作用することができる生物活性因子を含
むマイクロアレイと、
b) 少なくとも1つの治療薬を含み、かつ該医療デバイスから該少なくとも1つの
治療薬を放出することができる少なくとも1つのリザーバと、
c) 複数のマイクロチップであって、
i) 該疾患マーカである生物学的検体と該生物活性因子との間の相互作用の物理
的パラメータデータを取得することができるマイクロアレイ走査デバイスと、
ii) 該物理的パラメータデータを検体の相互作用プロファイルと比較すること
ができる生体測定認識デバイスと、
iii) 該リザーバからの該治療薬の放出を制御することができる治療薬放出デ
バイスと、
iv) 該マイクロアレイ走査デバイス、該生体測定認識デバイスおよび該治療薬
放出デバイス間の連絡を促進することができるインターフェースデバイスと、
を含む複数のマイクロチップと、
d) 該医療デバイスに動力を供給するためのエネルギー源と、
を備える医療デバイスを投与する工程、ならびに
B) 該医療デバイスを該患者から除去する工程か、または該医療デバイスが該患者を
通過することを可能にする工程、
を包含する、方法。
【請求項23】
前記デバイスは、該デバイスが腸管を通過することを可能にする生体適合性のポリマーで
被覆されている。請求項22に記載の方法。
【請求項24】
前記ポリマーは、チャネルを有する、請求項22に記載の方法。
【請求項25】
前記ポリマーは、多孔質である、請求項22に記載の方法。
【請求項26】
前記マイクロアレイは、マイクロビーズを備える、請求項22に記載の方法。
【請求項27】
前記生物活性因子は、核酸である、請求項22に記載の方法。
【請求項28】
前記生物活性因子は、ポリペプチドである、請求項22に記載の方法。
【請求項29】
前記生物活性因子は、免疫グロブリンである、請求項28に記載の方法。
【請求項30】
前記生物活性因子は、蛍光標識されている、請求項22に記載の方法。
【請求項31】
前記生物活性因子は、ナノ結晶で蛍光標識されている、請求項22に記載の方法。
【請求項32】
前記疾患マーカ生物学的検体は、核酸である、請求項22に記載の方法。
【請求項33】
前記疾患マーカ生物学的検体は、ポリペプチドである、請求項22に記載の方法。
【請求項34】
前記疾患マーカ生物学的検体は、免疫グロブリンである、請求項33に記載の方法。
【請求項35】
前記複数のマイクロチップは、シリコンゲルマニウムを含む、請求項22に記載の方法。
【請求項36】
前記マイクロアレイ走査デバイスは、光ファイバ素子を備える、請求項22に記載の方法
。
【請求項37】
前記検体の相互作用プロファイルは、前記生体測定認識デバイス内に格納される、請求項
22に記載の方法。
【請求項38】
前記検体の相互作用プロファイルは、前記医療デバイスの外部に格納される、請求項22
に記載の方法。
【請求項39】
複数のリザーバを有する、請求項22に記載の方法。
【請求項40】
前記インターフェースデバイスは、パーソナルエリアネットワークを備える、請求項22
に記載の方法。
【請求項41】
エネルギー源は、電池である、請求項22に記載の方法。
【請求項42】
エネルギー源は、パーソナルエリアネットワークによって提供される、請求項22に記載
の方法。
【請求項43】
前記連絡は、外部コンピュータによって監視される、請求項22に記載の方法。
【請求項44】
前記外部コンピュータは、前記治療薬の放出を指示する、請求項43に記載の方法。
【請求項45】
浸透圧ポンプをさらに備える、請求項1に記載の医療デバイス。
【請求項46】
加圧マイクロ流体チャネルをさらに備える、請求項に記載の医療デバイス。
【請求項47】
体液の流れを方向付けるパーソナルエリアネットワーク送信機をさらに備える、請求項1
に記載の医療デバイス。
【請求項48】
体液中の検体を検出することができる医療デバイスであって、
A) 体液の試料を採取することができる少なくとも1本のマイクロニードルと、
B) 該少なくとも1本のマイクロニードルと流体連絡する、該試料が貫流する第
1のマイクロチャネルと、
C) 該第1のマイクロチャネルと流体連絡し、緩衝剤が通って流れる第2のマイ
クロチャネルであって、少なくとも1つの生物活性因子を有するマイクロアレイをさらに
備える、第2のマイクロチャネルと、
D) 生物活性因子と該体液中の検体との間の相互作用を検出するためのマイクロ
アレイ走査デバイスと、
E) 該マイクロアレイ走査デバイスと生体測定認識デバイスとの間の連絡を促進
することができるインターフェースデバイスと、
を備える医療デバイス。
【請求項49】
前記体液は、血液である、請求項48に記載の医療デバイス。
【請求項50】
前記少なくとも1本のマイクロニードルは、複数のマイクロニードルである、請求項48
に記載の医療デバイス。
【請求項51】
前記マイクロニードルは、直径が約10ミクロンと約200ミクロンとの間である、請求
項48に記載の医療デバイス。
【請求項52】
前記マイクロニードルは、約100マイクロリットルの血液を引くことができる、請求項
48に記載の医療デバイス。
【請求項53】
前記第1のマイクロチャネルは、直径が約100マイクロメートルである、請求項48に
記載の医療デバイス。
【請求項54】
前記第2のマイクロチャネルは、直径が約100マイクロメートルである、請求項48に
記載の医療デバイス。
【請求項55】
前記第1のマイクロチャネルを通って流れる前記体液中の前記検体が、前記第2のマイク
ロチャネル内に拡散し、かつ前記生物活性因子と相互に作用する、請求項48に記載の医
療デバイス。
【請求項56】
前記第1のマイクロチャネルを通って流れる前記体液中の前記検体は、前記第2のマイク
ロチャネル内に拡散し、標識検体を、前記生物活性因子に結合している状態から競合的に
置き換える、請求項55に記載の医療デバイス。
【請求項57】
前記標識検体は、所定量で提供される、請求項56に記載の医療デバイス。
【請求項58】
前記標識検体は、蛍光部分で標識されている、請求項56に記載の医療デバイス。
【請求項59】
前記マイクロアレイは、前記体液中の前記検体を特異的に結合する抗体の被覆を有する第
2のマイクロチャネルの一部分である、請求項48に記載の医療デバイス。
【請求項60】
前記マイクロアレイ走査デバイスは、全内部反射蛍光(TIRF)分光計を備える、請求
項48に記載の医療デバイス。
【請求項61】
前記生体測定認識デバイスは、前記デバイスの外部に配置され、かつ前記連絡は、無線伝
送による、請求項48に記載の医療デバイス。
【請求項62】
前記検体は、インスリンであり、かつ前記生物活性因子は、インスリンに対して特異的な
抗体である、請求項48に記載の医療デバイス。
【請求項63】
前記検体は、グルコースであり、かつ前記生物活性因子は、グルコースに対して特異的な
抗体である、請求項48に記載の医療デバイス。
【請求項64】
前記デバイスは、パッチとして皮膚上に装着される、請求項48に記載の医療デバイス。
【請求項65】
前記検体は、疾患を示す、請求項48に記載の医療デバイス。
【請求項66】
請求項48に記載の医療デバイスであって、さらに、
F) 中に治療薬を有するリザーバと、
G) 前記生体測定認識デバイスからの指示に応答して、リザーバからの治療薬の
放出を制御することができる治療薬放出デバイス
とを備える、医療デバイス。
【請求項67】
前記検体は、グルコースであり、かつ前記治療薬は、インスリンである、請求項66に記
載の医療デバイス。
【請求項68】
前記検体は、前記治療薬と同一である、請求項66に記載の医療デバイス。
【請求項69】
前記検体は、前記治療薬の代謝産物である、請求項66に記載の医療デバイス。
【請求項70】
請求項48に記載の医療デバイスであって、ここで、少なくとも1つの使い捨てアッセイ
デバイスは、前記少なくとも1本のマイクロニードルと、前記第1のマイクロチャネルと
、前記第2のマイクロチャネルとを備え、かつ非使い捨てアッセイ読み取りデバイスは、
前記マイクロアレイ走査デバイス、前記インターフェースデバイスを備える、医療デバイ
ス。
【請求項71】
前記アッセイデバイスとアッセイ読み取りデバイスとは、互いに光連絡している、請求項
70に記載の医療デバイス。
【請求項72】
単一のアッセイ読み取りデバイス内にはめ込まれた複数の使い捨てアッセイデバイスが存
在する、請求項70に記載の医療デバイス。
【請求項73】
前記マイクロアレイは、前記生物活性因子で機能化された単一のガラス光ファイバの、1
つのクラッディングされていない部分を含み、該単一のガラス光ファイバのクラッディン
グされていない部分は、前記第2のマイクロチャネルと流体接触している、請求項48に
記載の医療デバイス。
【請求項74】
前記マイクロアレイは、前記生物活性因子で機能化された単一のガラス光ファイバの、複
数のクラッディングされていない部分を含み、該単一のガラス光ファイバのクラッディン
グされていない部分は、前記第2のマイクロチャネルと流体接触している、請求項48に
記載の医療デバイス。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図15】


【図16】


【図7】


【図14】


【図17】




【図2】


【図3】


【図4】


【図5】


【図6】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図15】


【図16】


【図7】


【図14】


【図17】


【公開番号】特開2013−46759(P2013−46759A)
【公開日】平成25年3月7日(2013.3.7)
【国際特許分類】
【外国語出願】
【出願番号】特願2012−179402(P2012−179402)
【出願日】平成24年8月13日(2012.8.13)
【分割の表示】特願2010−96515(P2010−96515)の分割
【原出願日】平成16年9月10日(2004.9.10)
【出願人】(506083408)セラノス, インコーポレイテッド (8)
【Fターム(参考)】
【公開日】平成25年3月7日(2013.3.7)
【国際特許分類】
【出願番号】特願2012−179402(P2012−179402)
【出願日】平成24年8月13日(2012.8.13)
【分割の表示】特願2010−96515(P2010−96515)の分割
【原出願日】平成16年9月10日(2004.9.10)
【出願人】(506083408)セラノス, インコーポレイテッド (8)
【Fターム(参考)】
[ Back to top ]

