検査方法
【課題】空中に浮遊する微生物を捕集して検査する作業を容易に且つ短時間で行うことができる検査方法を提供する。
【解決手段】捕集担体14は、生物細胞の捕集時にはゲル状であり、加熱した際に40℃以下でゾル状に相転移する高分子から成るとともに、高分子に検査用試薬が含有され、ゲル状からゾル状に相変位した際に検査用試薬が溶出される。捕集担体14は容器16に取り付けられる。捕集装置10は、捕集担体14を相転移温度に加熱する加熱手段を備える。
【解決手段】捕集担体14は、生物細胞の捕集時にはゲル状であり、加熱した際に40℃以下でゾル状に相転移する高分子から成るとともに、高分子に検査用試薬が含有され、ゲル状からゾル状に相変位した際に検査用試薬が溶出される。捕集担体14は容器16に取り付けられる。捕集装置10は、捕集担体14を相転移温度に加熱する加熱手段を備える。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は検査方法に係り、特に空中に浮遊する生物細胞をATP法により検査するための検査方法に関する。
【背景技術】
【0002】
空中に浮遊する生物細胞を検出する方法として、寒天培地を用いたコロニーカウント法や液体培地を用いた濁度測法などが知られている。これらの方法は、空中に浮遊する生物細胞を培地に捕集した後、一日から数日かけて培養し、検査を行うものである。したがって、これらの方法は、検査に長い時間がかかるという問題や、培養した微生物により安全管理が難しくなるという問題があり、食品や医薬品の製造ラインにオンラインで組み込めないという問題があった。
【0003】
近年では、これらの問題を解消する方法として、発光試薬や蛍光試薬を用いて微生物細胞の構成物を特異的に標識し、発光強度を計測して微生物を求める方法が提案されている。このうちATP法は、生きた細胞が必ず含有する化学物質ATP(アデノリン−3−リン酸)を微生物数の指標としており、生物由来の酵素であるルシフェラーゼとその基質タンパク質であるルシフェリンによる生物発光を利用する方法である。すなわち、微生物を含む試料からATPを抽出し、これにルシフェリン−ルシフェラーゼ混合液を添加して発光させることによって、発光強度からATP量を求め、微生物量に換算する方法である。このATP法によれば、数分〜数十分程度で生菌の微生物量を計測することができる。
【0004】
ATP法によって生菌の微生物量を計測する場合、まず、ATP消去剤を添加することによって、生菌の菌体外に遊離する遊離ATP(すなわち、菌体外のATPと死滅菌のATP)を取り除き、遊離ATPを分解させる。次に、生菌からATPを抽出するためにATP抽出試薬を添加し、生菌の細胞膜を分解し、生菌の菌体内のATPを溶出させる。
【0005】
次いで発光試薬を添加し、発光強度を求め、ATP量に換算する。ATP量は、微生物の種類によって異なるため、ATP量を微生物細胞数へ換算することによって、微生物量を正確に求めることができる。
【0006】
ところで、生物細胞のなかには化学物質や熱に高い耐久性をもつ胞子膜に包まれた芽胞状態のものがあり、上述したATP法を含む各種の反応が起こりにくいという問題がある。このような芽胞形成菌の問題を解消するため、発芽誘導因子を添加して発芽させてから各種の反応を行うことが提案されている。たとえば、特許文献1には、培地に発芽性因子を含有させ、発芽させることが記載されている。
【0007】
また、特許文献2、3には、芽胞状態の生物細胞に発芽誘導物質を添加して発芽させた後、殺菌を行うことが記載されている。さらに特許文献4には、発芽誘導物質を添加し、種特異的細胞胞子の検出、定量を行うことが記載されている。
【0008】
特許文献5には、細胞にアラニンを添加することによって、有芽胞細菌の芽胞の耐久性を低下させ、有芽胞細菌計量を容易にすることが記載されている。特許文献6には微生物を発芽促進剤と混合した後、遺伝子を溶出する方法が記載されている。
【0009】
このように、芽胞状態の生物細胞を反応させるには、発芽誘導物質を添加することが有効であり、上述したATP法で検査を行う場合にも、発芽誘導物質を添加することが有効な手段であると考えられる。
【特許文献1】特表2001−511356号公報
【特許文献2】特開2002−330740号公報
【特許文献3】特開2004−2229号公報
【特許文献4】特表2005−516213号公報
【特許文献5】特開2006−174751号公報
【特許文献6】特開2005−253365号公報
【発明の概要】
【発明が解決しようとする課題】
【0010】
しかしながら、ATP法の検査は、ATP消去剤、ATP抽出剤、発光試薬などの様々な試薬を添加し、反応させる必要があるため、発芽誘導物質をさらに添加することによって検査時間が長くなり、検査の手間も増えるという問題が発生する。特に上述の発芽誘導物質の反応は比較的長い時間を要するので、検査の時間が長くなり、製造ライン等にオンラインで組み込むことが困難になる。
【0011】
さらに、ATP法で検査する対象物質が空中浮遊の生物細胞の場合、その生物細胞を捕集担体に捕集した後、捕集担体から取り出す必要があるが、その作業にも時間を要するため、捕集から検査までに長時間を要するという問題がある。
【0012】
本発明はこのような事情に鑑みてなされたもので、空中に浮遊する微生物を捕集して検査する作業を容易に且つ短時間で行うことができる検査方法を提供する。
【課題を解決するための手段】
【0013】
請求項1に記載の発明は前記目的を達成するために、空中に浮遊する生物細胞が捕集されたゲル状の高分子捕集担体を加熱し、前記高分子捕集担体をゲル状からゾル状に相転移し、前記生物細胞にATP消去剤を添加し、前記生物細胞に発芽誘導因子を添加する工程を含むことを特徴とする。
【0014】
請求項2に記載の発明は請求項1の発明において、さらにATP抽出剤を添加する工程を含むことを特徴とする。ATP法のように多数の試薬が必要になる場合には、本発明を適用することによって、生物細胞の捕集から検査までの作業の手間と時間を大幅に削減することができる。
【0015】
請求項3に記載の発明は請求項2の発明において、前記ATP抽出剤が添加されたATP抽出液に発光試薬を添加する工程を含むことを特徴とする。
【0016】
請求項4に記載の発明は請求項3の発明において、前記発光試薬が添加された反応液の発光量を測定する工程を含むことを特徴とする。
【0017】
請求項5は請求項1において、前記ATP消去剤は、アピラーゼ、アルカリホスファターゼ、酸性ホスファターゼ、ヘキソキナーゼ、及び、アデノシントリホスファターゼ、アデノシンリン酸デアミナーゼからなる群より選ばれる少なくとも一種を含むことを特徴とする。
【0018】
請求項6は請求項2において、前記ATP抽出剤は、界面活性剤、トリクロロ酢酸(TCA)、トリス緩衝液、エタノール、プロテアーゼ活性を有する溶菌酵素のいずれかを含むことを特徴とする。
【0019】
請求項7に記載の発明は請求項1の発明において、前記発芽誘導因子が、アミノ酸又はL−アラニンであることを特徴とする。
【0020】
請求項8に記載の発明は請求項1の発明において、前記発芽誘導因子が、糖又はグルコースであることを特徴とする。
【発明の効果】
【0021】
本発明によれば、捕集担体を加熱することによって捕集担体がゲルからゾルに相転移し、捕集担体に捕集された生物細胞が取り出されるとともに、検査用試薬が溶出して添加される。これにより、生物細胞の捕集から検査までの作業の手間と時間を削減することができる。
【図面の簡単な説明】
【0022】
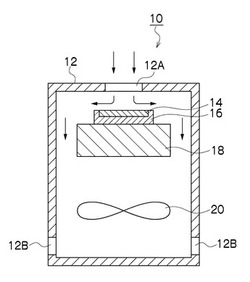
【図1】本実施の形態の捕集装置の構成を模式的に示す断面図
【図2】本実施の形態の捕集・検査方法の手順を示すフローチャート
【図3】Ala処理濃度と発光量との関係を示す図
【図4】Ala処理温度と発光量との関係を示す図
【図5】Ala処理時間と発光量との関係を示す図
【発明を実施するための形態】
【0023】
以下添付図面に従って本発明に係る検査方法の好ましい実施形態について説明する。
【0024】
まず、本発明における捕集担体が好適に使用される捕集装置について説明する。図1は捕集装置10の構成を模式的に示す断面図である。同図に示す捕集装置10はインパクタ方式の分離装置であり、主としてケーシング12、捕集担体14、容器16、支持部材18及びファン20で構成される。
【0025】
ケーシング12は中空状に形成されており、その内部空間の下部にファン20が設けられる。また、ケーシング12の天面には円形の開口部12Aが形成され、ケーシング12の側面下部には排気口12Bが形成される。したがって、ファン20を駆動することによって、開口部12Aをノズルとして外部のエアが鉛直下向きに吸引され、そのエアが排気口12Bから排気される。開口部12Aは一つ又は複数の穴より形成され、これにはパンチングプレートなどの整流板を設けてもよい。
【0026】
ケーシング12の開口部12Aの下方には、捕集担体14及び容器16が設けられる。捕集担体14はその原料の高分子を凹状の容器16の上に薄膜状に流し込むことによって、容器16と一体的に形成されている。
【0027】
捕集担体14の高分子は、捕集時にゲル状であり、加熱することによって40℃以下でゾルに転移するものが使用される。特に相転移温度が15〜37℃であり、25℃で適度な強度のゲル状であるとともに37℃の時に数分でゾル状に相転移するものが好ましい。この温度範囲で相転移させることによって、捕集した生物細胞を死滅させることなく、高分子から取り出すことができる。
【0028】
また、高分子としては、ゼラチン又はNAGAm/MBPDAを含むものが好ましい。高分子がゼラチンの場合、濃度は相転移温度に応じて1〜20重量%の間で調節するが、その濃度が低いと十分な強度のゲルが得られず、濃度が高いと相転移したゾルの粘性が高くなって濾過が困難になる。相転移温度が37℃付近の場合のゼラチンの濃度は5〜10重量%が好ましい。
【0029】
高分子には殺菌作用を有しないアルコール類、たとえば、グリセロール、エチレングリコール、プロピレングリコールを含むことが好ましい。アルコール類がグリセロールの場合、高分子に対する重量比が小さいと十分な強度のゲルを得られず、重量比が大きいと相転移したゲルの粘性が高くなって濾過が困難になるため、グリセロールは、ゼラチンの濃度5〜10重量%の場合、体積比で10〜50%含まれていることが好ましい。
【0030】
捕集担体14は、ゲル状の高分子に検査用試薬が含有されている。この検査用試薬は、高分子がゾル状に相転移した際に溶出し、添加されるようになっている。また、検査用試薬は、生物細胞の種類やその検査方法に応じて選択され、たとえば、ATP法の検査を行う場合には、ATP消去剤、発芽誘導因子、ATP抽出剤、発光試薬などが選択される。
【0031】
捕集担体14は、開口部12Aから吸引されるエアの流れに対して直交するように、すなわち、水平に配置される。したがって、開口部12Aから吸引されたエアは、捕集担体14に衝突して水平方向に流れを変え、その際にエア中の微生物等の粒子がゲル状の高分子に捕集される。
【0032】
捕集担体14及び容器16は、支持部材18によって支持される。支持部材18の外周面とケーシング12の内壁との間には隙間が形成されており、捕集担体14に衝突して水平方向に流れたエアは、その隙間を通って下方に流れ、排気口12Bから排出される。
【0033】
支持部材18の内部には、不図示のヒータが設けられている。このヒータは、捕集担体14を相転移温度まで精度良く加熱するように制御される。なお、捕集担体14の加熱手段は、ヒータに限定されるものではなく、捕集担体14を相転移温度に加熱できる装置であればよい。たとえば、捕集担体14の周囲にジャケットを装着して温水を流したり、開口部12Aから吸い込まれるエアを加熱したりするようにしてもよい。
【0034】
上記の如く構成された捕集装置10は、捕集担体14を支持部材18によって開口部12Aの下方にセットし、ファン20を駆動することによってエアをケーシング12内に吸引する。これにより、開口部12Aからエアが鉛直下方に吸引され、このエアが捕集担体14に衝突して水平方向に流れを変えるとともに、エア中に浮遊する生物細胞がゲル状の捕集担体14に捕集される。
【0035】
捕集後、捕集担体14は支持部材18のヒータ(不図示)によって高分子の相転移温度まで加熱される。これにより、ゲル状の高分子がゾル状に相転移するので、捕集担体14に捕集された生物細胞が捕集担体14から取り出され、同時に、捕集担体14に保持されていた検査用試薬が溶出され、生物細胞に添加される。これにより、生物細胞に検査用試薬を添加して反応させる作業の少なくとも一つを捕集担体14で行うことができ、後段の検査装置での作業の手間と作業を削減することができる。
【0036】
捕集担体14から取り出された生物細胞は、容器16内に回収される。したがって、回収された生物細胞を容器16ごと、後段の検査装置(不図示)にセットして検査を行うことができ、検査の作業を容易に且つ短時間で行うことができる。
【0037】
次に、本発明をATP法による生物細胞の検出に用いた場合の実施形態について説明する。なお、以下の実施形態は、ATP消去剤、発芽誘導因子、ATP抽出剤、発光試薬を添加する例で説明するが、添加する試薬はこれに限定するものではなく、必要に応じて試薬の一部を省略したり別の試薬を添加したりしてもよい。また、捕集・検査する対象の生物細胞は特に限定するものではないが、たとえばセレウス菌 Bacillus cereus、枯草菌 Bacillus spizizenii、Corynebacterium renale、Micrococcus luteus、黄色ブドウ球菌 S.aureus、表皮ブドウ球菌 S.epidermidis、Citrobacter freundii、緑膿菌 Pseudomonas aeruginosa、セラチア菌 Serratia marcescensなどがあげられる。
【0038】
(第1の実施形態)
第1の実施形態の捕集担体14には、検査用試薬としてATP消去剤と発芽誘導因子がゲル状の高分子に含有される。ATP消去剤としては、たとえば、アピラーゼ、アルカリホスファターゼ、酸性ホスファターゼ、ヘキソキナーゼ、及び、アデノシントリホスファターゼ、アデノシンリン酸デアミナーゼからなる群より選ばれる少なくとも一種が用いられる。また、発芽誘導因子としては、たとえば、アミノ酸やL−アラニンが用いられる。発芽誘導因子としてL−アラニンを用いた場合、高分子に対する濃度が低すぎると、芽胞形成菌の細胞膜を十分に破壊できないため、25mM以上が好ましい。また、濃度が高すぎると、十分な強度のゲルを形成できないため、100mM以下が好ましい。
【0039】
上述した捕集担体14の好ましい組成の一例としては、
8%(w/v)ゼラチン(和光社(077-03155))、
25%(v/v)グリセロール(関東化学社(17029-00))、
1%(v/v)ATP消去剤(キッコーマン社ルシフェールHSセット付属(60315))、
25%(v/v)リン酸バッファー(Invitrogen社(20012-027)リン酸バッファーpH7.2)、
50mM L−アラニン(関東化学社製(1007-1M)Lアラニン)、
をあげることができる。また、捕集担体14の大きさとしては、直径がφ40mm、厚さが0.8〜4mm程度のものを好適に用いることができる。
【0040】
一方、捕集装置10では、捕集担体14を加熱する加熱手段が、捕集担体14を30℃以上37℃以下の温度に30分以上維持するように制御される。加熱温度が30℃よりも低いと加熱処理時間を長くしても発芽せず、芽胞形成菌からATPを抽出することができない。また、加熱温度が40℃を超えると、対象となる菌体によっては、栄養欠乏環境で増殖活性が高くなることによる死滅や、熱そのものによる不活性化などを引き起こすおそれがある。
【0041】
次に上記の如く構成された第1の実施形態による捕集・検査方法について図2に従って説明する。
【0042】
まず、捕集担体14をセットし、ファン20(図1参照)を駆動することによって、空中に浮遊する生物細胞を捕集担体14の高分子に捕集する(ステップS1)。次に、捕集担体14を相転移温度まで加熱し、高分子をゲル状からゾル状に相転移させる(ステップS2)。これにより、捕集担体14に捕集されていた生物細胞が捕集担体14から取り出され、同時にATP消去剤と発芽誘導因子が高分子から溶出され、ATP消去剤の添加と発芽誘導因子の添加とが行われる。したがって、捕集された生物細胞が取り出されるとともに、生菌の菌体外に遊離する遊離ATPが消去され、それに遅れて、生物細胞が発芽誘導因子に接触して芽胞形成菌が発芽する。
【0043】
ATP消去剤と発芽誘導因子が添加された生物細胞は、容器16内に回収される。容器16は検査装置(不図示)にセットされ、この検査装置でATP抽出剤が添加される(ステップS3)。ATP抽出剤は、生菌の細胞膜を溶解して内部のATPを抽出させる試薬であり、たとえば界面活性剤、トリクロロ酢酸(TCA)、トリス緩衝液、エタノール、プロテアーゼ活性を有する溶菌酵素等を含むものが使用される。これにより、生物細胞の細胞膜が溶解され、その内部のATPが抽出するので、ATPの検出が可能となる。その後、発光試薬を添加し(ステップS4)、さらにその反応液を分取し、発光量を測定する(ステップS5)。発光量の測定は、たとえばルミノメータ(Berthold Detection Systems社FB12型)を用い、標準試料の発光量との対比によって測定される。測定された発光量は、ATP量に換算され、さらにそれが菌数に換算される(ステップS6)。このようにして求められた菌数は、芽胞形成菌の菌数も含まれており、菌数を正確に求めることができる。
【0044】
本実施の形態によれば、捕集担体14によって、生物細胞の捕集を行うだけでなく、捕集した生物細胞を取り出し、さらにその取り出しと同時にATP消去剤の添加と発芽誘導因子の添加を行うので、検査装置において添加する試薬の数を減らすことができる。これにより、検査にかかる作業の手間と時間を削減することができる。特に本実施の形態では、反応に時間を要する発芽誘導因子の添加を、検査装置にセットする前に行うことができるので、検査時間を大幅に短縮することができる。
【0045】
(第2の実施形態)
第2の実施形態の捕集担体14は、ゲル状の高分子にATP消去剤のみが含有されている。そして、後段の検査装置では、発芽誘導因子の添加、ATP抽出剤の添加、発光試薬の添加が順に行われ、その後に発光量が測定される。すなわち、図2のフローにおいて、ステップS2の「発芽誘導因子の添加」がステップS2とステップS3の間で行われる。
【0046】
第2の実施形態の場合、捕集担体14を加熱して高分子をゲル状からゾル状に相転移させることによって、捕集担体14から生物細胞が取り出され、同時にATP消去剤が添加される。したがって、検査装置でATP消去剤を添加する手間と時間を省くことができる。
【0047】
(第3の実施形態)
第3の実施形態の捕集担体14は、ゲル状の高分子に発芽誘導因子のみが含有されている。そして、後段の検査装置では、ATP消去剤の添加、ATP抽出剤の添加、発光試薬の添加が順に行われ、その後に発光量が測定される。すなわち、図2のフローにおいて、ステップS2の「ATP消去剤の添加」がステップS2とステップS3の間で行われる。なお、ATP消去剤の添加は、発芽誘導因子の添加を行った後、その発芽誘導因子の反応が起こる前(通常、30分以内)に行われる。
【0048】
第3の実施形態の場合、捕集担体14の高分子をゲル状からゾル状に相転移させることによって、捕集担体14から生物細胞が取り出され、同時に発芽誘導因子が添加される。したがって、検査装置で発芽誘導因子を添加する手間と時間を省くことができる。
【0049】
(第4の実施形態)
第4の実施形態の捕集担体14は、ゲル−ゾル間の相転移温度が異なる二種類の高分子が上下に積層されて構成されている。二種類の高分子のうち、上側(すなわち生物細胞を捕集する側)の高分子は、下側の高分子よりも相転移温度が低く、加熱時に先にゾルに相転移するようになっている。また、上側の高分子には、ATP消去剤と発芽誘導因子が含有されており、下側の高分子には、ATP抽出剤が含有されている。
【0050】
また、第4の実施形態における捕集装置10は、捕集担体14を加熱する加熱手段が二段階で温度を制御するように構成される。すなわち、上側の高分子の相転移温度と、下側の高分子の相転移温度とに、捕集担体14の温度を加熱できるようになっている。
【0051】
上記の如く構成された第4の実施形態では、生物細胞が捕集担体14の上側の高分子に捕集される。この生物細胞を取り出す際は、まず、捕集担体14を上側の高分子の相転移温度に加熱する。これにより、下側の高分子がゲル状態を保ったまま、上側の高分子のみがゾル状に相転移する。したがって、上側の高分子から生物細胞が取り出されるとともに、上側の高分子からATP消去剤と発芽誘導因子が溶出される。よって、遊離ATPが消去され、さらに芽胞状態の生物細胞が発芽する。ATP消去剤と発芽誘導因子が添加された生物細胞は下側の高分子の上に保持される。
【0052】
次に捕集担体14を下側の高分子の相転移温度に加熱する。これにより、下側の高分子がゾル状に相転移し、ATP抽出剤が溶出される。したがって、生物細胞にATP抽出剤が添加され、生物細胞の細胞膜が分解されて生物細胞内のATPが抽出される。
【0053】
生物細胞内から抽出されたATPに発光試薬が添加された後、発光量が測定される。
【0054】
上述した第4の実施形態によれば、相転移温度の異なる二つの高分子を積層し、各高分子に異なる試薬を含有させたので、加熱温度を制御することによって、複数の試薬を捕集担体14上で順に添加することができる。これにより、検査装置で試薬を添加する作業を省くことができ、作業の手間と時間を大幅に削減することができる。
【0055】
(第5の実施形態)
第5の実施形態の捕集担体14は、ゲル−ゾル間の相転移温度が異なる三種類の高分子が上下三層に積層されている。三種類の高分子は、上側(すなわち生物細胞を捕集する側)ほど相転移温度が低く、加熱した際に先にゾルに相転移するようになっている。また、最も上側の高分子にはATP消去剤が含有され、中間の高分子には発芽誘導因子が含有され、下側の高分子にはATP抽出剤が含有されている。
【0056】
なお、第5の実施形態における捕集装置は、捕集担体14を加熱する加熱手段が三段階で温度を制御できるようになっている。すなわち、最も上側の高分子の相転移温度と、中間の高分子の相転移温度と、最も下側の高分子の相転移温度とに温度を制御できるようになっている。
【0057】
上記の如く構成された第5の実施形態では、生物細胞が捕集担体14の上側の高分子に捕集される。この生物細胞を取り出す際は、まず、捕集担体14を上側の高分子の相転移温度に加熱する。これにより、中間の高分子と下側の高分子がゲル状態を保ったまま、上側の高分子のみがゾルに相転移する。したがって、上側の高分子から生物細胞が取り出されるとともに、上側の高分子からATP消去剤が溶出され、遊離ATPが消去される。遊離ATPが消去された生物細胞は、中間の高分子の上に保持される。
【0058】
次に、捕集担体14を中間の高分子の相転移温度に加熱する。これにより、下側の高分子がゲル状態を保ったまた、中間の高分子がゾルに相転移する。したがって、中間の高分子から発芽誘導因子が溶出されて添加され、芽胞状態の生物細胞が発芽する。
【0059】
次に、捕集担体14を下側の高分子の相転移温度に加熱する。これにより、下側の高分子がゾル状に相転移し、ATP抽出剤が溶出される。したがって、生物細胞にATP抽出剤が添加され、生物細胞の細胞膜が分解されて生物細胞内のATPが抽出される。
【0060】
生物細胞内から抽出されたATPに発光試薬が添加された後、発光量が測定される。
【0061】
上述した第5の実施形態によれば、相転移温度の異なる三つの高分子を積層するとともに、各高分子に異なる試薬を含有させたので、捕集担体の加熱温度を制御することによって、複数の試薬を捕集担体14上で順に添加することができる。これにより、検査装置で複数の試薬を添加する作業を省くことができ、検査の手間と時間を大幅に削減することができる。
【0062】
なお、上述した第4、第5の実施形態では下側の高分子の形状を中央に窪みを有する凹状に形成し、その窪み部分に上側の高分子を設けてもよい。
【0063】
なお、上述した第1〜第5の実施形態は、ATP消去剤、発芽誘導因子、ATP抽出剤を選択的に捕集担体14に含有させるようにしたが、他の試薬、たとえば発光試薬をATP抽出剤に含有させるようにしてもよい。
【0064】
また、上述した第1〜第5の実施形態は、捕集担体14に容器16を取り付けたが、これに限定するものではなく、容器16のない態様も可能である。この場合、生物細胞だけを残してゾル状の高分子を濾過することが可能なフィルタの上に捕集担体14を配置する方式などが考えられる。フィルタとしては、たとえば孔径0.45μmのポリビニリデンフロライド製のメンブレンフィルタなどを用いることができる。
【0065】
また、上述した実施形態は、空中に浮遊する生物細胞を捕集して検査する例で説明したが、本発明の用途はこれに限定するものではなく、空中に浮遊する微粒子を捕集し、検査するための捕集担体、捕集ユニット、捕集装置及び捕集・検査方法に適用することができる。
【0066】
さらに、上述した実施形態は、熱によって相転移する高分子を用いたが、他の要因によって相転移する高分子を用いてもよい。たとえば、生物細胞等に影響のない薬品によってゲルからゾルに相転移する高分子を用いてもよい。
【0067】
なお、上述した実施形態において、試薬をマイクロカプセルに内包させて高分子ゲルに分散させるようにしてもよい。
【0068】
また、上述した第4、第5の実施形態のように複数種類の高分子の層を積層する場合、上側の高分子層のなかに、そのすぐ下側の高分子層の成分を、温度感受性のマイクロカプセルとして分散・包埋ようにしてもよい。すなわち、相転移する順に第n層とした際に、第(n+1)層成分を第n層中に、温度感受性のマイクロカプセルとして分散・包埋ようにしてもよい。この場合、両者の接触面積と混合効率を向上させることができる。
【0069】
さらに、上述した第4、第5の実施形態のように複数種類の高分子の層を積層する場合、高分子層の成分を表面に固定化した磁気微粒子を、そのすぐ上側の高分子層との境界面に設置し、その上側の高分子層をゾル化した後、外部磁場により微粒子を揺動して混合、反応させるようにしてもよい。すなわち、相転移する順に第n層とした際に、第(n+1)層成分を表面に固定化した磁気微粒子を第n層との境界面に設置し、第n層をゾル化した後、外部磁場により微粒子を揺動して混合、反応させるようにしてもよい。この場合、温度条件以外の制御手段を併用することになるので、制御の精度を向上させることができる。
【実施例】
【0070】
発芽誘導因子の好ましい濃度、反応温度、反応時間を試験により求めた。この試験では、サンプルとして枯草菌芽胞を含む菌液に、L−アラニンを予め添加し、これを分取してATP消去剤を添加した。そして、30分後にATP抽出剤を添加し、その反応液を分取した後、発光測定を行った。
【0071】
この試験において、まず、L−アラニンの濃度(以下、Ala濃度)を変えて発光量を求めた。発光量は、1CFU(すなわち、培養前のサンプル中の1微生物)あたりの発光量を求めた。その結果を図3に示す。なお、発光量の単位cpsは、一秒あたりにカウントした光電子の数である。
【0072】
同図に示すように、Ala濃度が大きくなると発光量が増加し、25mM以上の時に発光量を安定させることができた。すなわち、Ala濃度が25mM以上の時に、芽胞細胞を十分に発芽させ、ATPを抽出させることができた。したがって、Ala濃度は25mM以上が好ましいことが分かる。なお、Ala濃度が大きいと、十分な強度のゲルを形成することができない。このため、Ala濃度は100mM以下が好ましい。
【0073】
次に、L−アラニンを反応させる際の温度と、発光量との関係について調べた。その結果を図4に示す。同図から分かるように、L−アラニンの反応温度が高いほど、芽胞形成菌を発芽させることができ、発光量を増やすことができた。特に30℃以上になると急激に発光量が増加した。また、図には示してないが、処理温度が40℃を超えると、徐々に死滅する菌が発生した。したがって、L−アラニンを反応させる際の温度は30℃以上40℃以下が好ましい。よって、捕集担体14を加熱して芽胞形成菌を溶出させる際の温度としては、30℃以上40℃以下が好ましい。
【0074】
次に反応温度ごとに、発光量の経時変化を調べた。その結果を図5に示す。同図に示すように、反応温度が35℃の場合には、反応時間は30分過ぎにピークを迎えた。したがって、反応温度が35℃の時、反応時間は30分以上が好ましい。
【0075】
〈参考〉
請求項1に記載の発明は前記目的を達成するために、空中に浮遊する生物細胞を捕集する捕集担体において、前記生物細胞の捕集時にはゲル状であり、加熱した際に40℃以下でゾル状に相転移する高分子から成るとともに、該高分子に検査用試薬が含有され、前記ゲル状からゾル状に相変位した際に前記検査用試薬が溶出されることを特徴とする。
【0076】
本発明によれば、捕集担体を構成する高分子が捕集時にゲル状であるので、空中に浮遊する生物細胞を効率良く捕捉することができる。また、捕集担体を加熱することにより40℃以下でゾル状に相変位するので、捕集担体に捕捉された生物細胞を死滅させることなく、捕集担体から容易に取り出すことができる。さらに、本発明によれば、ゲル状の高分子が検査用試薬を含有し、ゾル状に相変位した際に溶出するので、生物細胞を捕集担体から取り出した際に同時に、検査用試薬の添加を行うことができる。したがって、本発明によれば、捕集担体からの生物細胞の取り出し作業と、検査用試薬の添加を同時に行うことができる。このように本発明の捕集担体は、空中浮遊の生物細胞の捕集と、その生物細胞の取り出しと、検査用試薬の添加を行うことができるので、空中浮遊生物細胞の捕集から検査までを短時間で容易に行うことができる。
【0077】
請求項2に記載の発明は請求項1の発明において、前記検査用試薬は、前記捕集した生物細胞をATP法により検出するための試薬であることを特徴とする。ATP法のように多数の試薬が必要になる場合には、本発明を適用することによって、生物細胞の捕集から検査までの作業の手間と時間を大幅に削減することができる。
【0078】
請求項3に記載の発明は請求項2の発明において、前記試薬は、前記生物細胞由来以外のATPを消去するATP消去剤であることを特徴とする。本発明によれば、捕集担体をゲルからゾルに相転移させることによって生物細胞を取り出した際にATP消去剤が溶出して添加されるので、生菌の菌体外の遊離ATPを消去することができる。したがって、請求項3の発明によれば、捕集担体からの生物細胞の取り出し作業と、遊離ATPの消去作業とを同時に行うことができる。
【0079】
請求項4に記載の発明は請求項3の発明において、前記ATP消去剤は、アピラーゼ、アルカリホスファターゼ、酸性ホスファターゼ、ヘキソキナーゼ、及び、アデノシントリホスファターゼ、アデノシンリン酸デアミナーゼからなる群より選ばれる少なくとも一種を含むことを特徴とする。
【0080】
請求項5に記載の発明は請求項2の発明において、前記試薬は、前記生物細胞由来のATPを抽出するATP抽出剤を含むことを特徴とする。本発明によれば、捕集担体をゲルからゾルに相転移させて生物細胞を取り出した際にATP抽出剤が溶出して添加されるので、生菌の細胞膜を分解することができる。したがって、請求項5の発明によれば、捕集担体からの生物細胞の取り出し作業と、生菌の細胞膜の分解作業とを同時に行うことができる。
【0081】
請求項6に記載の発明は請求項5の発明において、前記ATP抽出剤は、界面活性剤、トリクロロ酢酸(TCA)、トリス緩衝液、エタノール、プロテアーゼ活性を有する溶菌酵素等を含むことを特徴とする。
【0082】
請求項7に記載の発明は請求項2の発明において、前記試薬は、芽胞形成菌の芽胞又は植物の胞子の発芽を誘発する発芽誘導因子であることを特徴とする。本発明によれば、捕集担体をゲルからゾルに相転移させて生物細胞を取り出した際に発芽誘導因子が溶出されて添加されるので、芽胞形成菌の芽胞や植物胞子の発芽を促し、ATP法の各反応が容易にできる通常の状態の細胞に変化させることができる。したがって、請求項7の発明によれば、捕集担体からの生物細胞の取り出し作業と、芽胞形成菌の細胞膜や植物細胞の胞子の発芽誘導とを同時に行うことができる。
【0083】
請求項8に記載の発明は請求項7の発明において、前記発芽誘導因子が、アミノ酸又はL−アラニンであることを特徴とする。
【0084】
請求項9に記載の発明は請求項7の発明において、前記発芽誘導因子が、糖又はグルコースであることを特徴とする。
【0085】
請求項10に記載の発明は請求項1〜9のいずれか1の発明において、前記捕集担体は、ゲル状からゾル状に相転移する相転移温度が異なる複数の高分子を積層することにより構成されることを特徴とする。本発明によれば、捕集担体が相転移温度の異なる複数の高分子を積層して構成されるので、加熱温度を制御することによって、ゲルからゾルに相転移する高分子を選択することができる。したがって、高分子ごとに検査用試薬を変えることによって、添加する検査用試薬を選択することができる。
【0086】
請求項11に記載の発明は請求項10の発明において、前記複数の高分子は三層から成り、前記生物細胞が捕集される側の高分子ほど相転移温度が低く、且つ、前記生物細胞が捕集される側から順にATP消去剤、発芽誘導因子、ATP抽出剤が含まれることを特徴とする。
【0087】
本発明によれば、捕集担体の加熱温度を上昇させた際に、生物細胞が捕集された側から順に高分子がゲルからゾルに相転移する。これにより、捕集担体に捕集された生物細胞が取り出されるとともに、ATP消去剤、発芽誘導因子、ATP抽出剤が順に溶出されて添加される。したがって、捕集担体から生物細胞を取り出す作業と、遊離ATPの消去と、芽胞形成菌等の発芽誘導と、生物細胞のATP抽出とを、一つの捕集担体で行うことができ、捕集から検査までの効率を大幅に向上させることができる。
【0088】
請求項12に記載の発明は請求項10の発明において、前記複数の高分子は二層から成り、前記生物細胞が捕集される側の高分子の相転移温度がもう一方の高分子の相転移温度よりも低く、且つ、前記生物細胞が捕集される側の高分子にATP消去剤と発芽誘導因子が含まれ、もう一方の高分子にATP抽出剤が含まれることを特徴とする。
【0089】
本発明によれば、捕集担体の加熱温度を上昇させた際に、生物細胞の捕集側から順に高分子がゲルからゾルに相転移する。これにより、捕集担体に捕集された生物細胞が取り出されるとともに、ATP消去剤と発芽誘導因子が溶出されて添加され、次いでATP抽出剤が溶出されて添加される。したがって、本発明によれば、捕集担体から生物作業を取り出す作業と、遊離ATPの消去と、芽胞形成菌等の発芽誘導と、生物細胞のATP抽出とを、一つの捕集担体で行うことができ、捕集から検査までの効率を大幅に向上させることができる。
【0090】
請求項13に記載の発明は、請求項1〜12に記載の捕集担体と、該捕集担体の前記生物細胞を捕集する側の反対側に取り付けられ、前記捕集担体に捕集された生物細胞を前記捕集担体から取り出した際に捕集するフィルタと、を備えたことを特徴とする捕集ユニットを提供する。本発明によれば、捕集担体にフィルタが設けられているので、捕集担体から取り出した生物細胞をフィルタによって捕集することができ、取り出した後の検査を容易に行うことができる。
【0091】
請求項14に記載の発明は、請求項1〜12の捕集担体又は請求項13の捕集ユニットに、生物細胞が浮遊するエアを吹き付ける吹き付け手段と、請求項1〜12の捕集担体又は請求項13の捕集ユニットを前記高分子の相転移温度に加熱する加熱手段と、を備えたことを特徴とする捕集装置を提供する。本発明によれば、加熱手段を備えているので、捕集担体から生物細胞を取り出す作業と、検査用試薬を溶出して添加する作業とを捕集装置で行うことができる。したがって、捕集装置の後段の検査装置での作業の手間と時間を削減することができる。
【0092】
請求項15に記載の発明は前記目的を達成するために、生物細胞が浮遊するエアを、ゲル状の高分子から成るとともに検査用試薬を含有する捕集担体に吹き付けることによって、前記生物細胞を前記捕集担体に捕集する捕集工程と、前記捕集担体を加熱して40℃以下でゾル状に相転移させることによって、前記捕集担体に捕集された生物細胞を前記捕集担体から取り出すとともに、ゾル状に相転移した捕集担体から検査用試薬を溶出させて前記生物細胞に添加する取出・添加工程と、を含むことを特徴とする捕集・検査方法を提供する。本発明によれば、捕集担体からの生物細胞の取り出しと、その生物細胞への検査用試薬の添加とを同時に行うことができ、作業の容易化と時間短縮化を図ることができる。
【符号の説明】
【0093】
10…捕集装置、12…ケーシング、14…捕集担体、16…容器、18…支持部材、20…ファン
【技術分野】
【0001】
本発明は検査方法に係り、特に空中に浮遊する生物細胞をATP法により検査するための検査方法に関する。
【背景技術】
【0002】
空中に浮遊する生物細胞を検出する方法として、寒天培地を用いたコロニーカウント法や液体培地を用いた濁度測法などが知られている。これらの方法は、空中に浮遊する生物細胞を培地に捕集した後、一日から数日かけて培養し、検査を行うものである。したがって、これらの方法は、検査に長い時間がかかるという問題や、培養した微生物により安全管理が難しくなるという問題があり、食品や医薬品の製造ラインにオンラインで組み込めないという問題があった。
【0003】
近年では、これらの問題を解消する方法として、発光試薬や蛍光試薬を用いて微生物細胞の構成物を特異的に標識し、発光強度を計測して微生物を求める方法が提案されている。このうちATP法は、生きた細胞が必ず含有する化学物質ATP(アデノリン−3−リン酸)を微生物数の指標としており、生物由来の酵素であるルシフェラーゼとその基質タンパク質であるルシフェリンによる生物発光を利用する方法である。すなわち、微生物を含む試料からATPを抽出し、これにルシフェリン−ルシフェラーゼ混合液を添加して発光させることによって、発光強度からATP量を求め、微生物量に換算する方法である。このATP法によれば、数分〜数十分程度で生菌の微生物量を計測することができる。
【0004】
ATP法によって生菌の微生物量を計測する場合、まず、ATP消去剤を添加することによって、生菌の菌体外に遊離する遊離ATP(すなわち、菌体外のATPと死滅菌のATP)を取り除き、遊離ATPを分解させる。次に、生菌からATPを抽出するためにATP抽出試薬を添加し、生菌の細胞膜を分解し、生菌の菌体内のATPを溶出させる。
【0005】
次いで発光試薬を添加し、発光強度を求め、ATP量に換算する。ATP量は、微生物の種類によって異なるため、ATP量を微生物細胞数へ換算することによって、微生物量を正確に求めることができる。
【0006】
ところで、生物細胞のなかには化学物質や熱に高い耐久性をもつ胞子膜に包まれた芽胞状態のものがあり、上述したATP法を含む各種の反応が起こりにくいという問題がある。このような芽胞形成菌の問題を解消するため、発芽誘導因子を添加して発芽させてから各種の反応を行うことが提案されている。たとえば、特許文献1には、培地に発芽性因子を含有させ、発芽させることが記載されている。
【0007】
また、特許文献2、3には、芽胞状態の生物細胞に発芽誘導物質を添加して発芽させた後、殺菌を行うことが記載されている。さらに特許文献4には、発芽誘導物質を添加し、種特異的細胞胞子の検出、定量を行うことが記載されている。
【0008】
特許文献5には、細胞にアラニンを添加することによって、有芽胞細菌の芽胞の耐久性を低下させ、有芽胞細菌計量を容易にすることが記載されている。特許文献6には微生物を発芽促進剤と混合した後、遺伝子を溶出する方法が記載されている。
【0009】
このように、芽胞状態の生物細胞を反応させるには、発芽誘導物質を添加することが有効であり、上述したATP法で検査を行う場合にも、発芽誘導物質を添加することが有効な手段であると考えられる。
【特許文献1】特表2001−511356号公報
【特許文献2】特開2002−330740号公報
【特許文献3】特開2004−2229号公報
【特許文献4】特表2005−516213号公報
【特許文献5】特開2006−174751号公報
【特許文献6】特開2005−253365号公報
【発明の概要】
【発明が解決しようとする課題】
【0010】
しかしながら、ATP法の検査は、ATP消去剤、ATP抽出剤、発光試薬などの様々な試薬を添加し、反応させる必要があるため、発芽誘導物質をさらに添加することによって検査時間が長くなり、検査の手間も増えるという問題が発生する。特に上述の発芽誘導物質の反応は比較的長い時間を要するので、検査の時間が長くなり、製造ライン等にオンラインで組み込むことが困難になる。
【0011】
さらに、ATP法で検査する対象物質が空中浮遊の生物細胞の場合、その生物細胞を捕集担体に捕集した後、捕集担体から取り出す必要があるが、その作業にも時間を要するため、捕集から検査までに長時間を要するという問題がある。
【0012】
本発明はこのような事情に鑑みてなされたもので、空中に浮遊する微生物を捕集して検査する作業を容易に且つ短時間で行うことができる検査方法を提供する。
【課題を解決するための手段】
【0013】
請求項1に記載の発明は前記目的を達成するために、空中に浮遊する生物細胞が捕集されたゲル状の高分子捕集担体を加熱し、前記高分子捕集担体をゲル状からゾル状に相転移し、前記生物細胞にATP消去剤を添加し、前記生物細胞に発芽誘導因子を添加する工程を含むことを特徴とする。
【0014】
請求項2に記載の発明は請求項1の発明において、さらにATP抽出剤を添加する工程を含むことを特徴とする。ATP法のように多数の試薬が必要になる場合には、本発明を適用することによって、生物細胞の捕集から検査までの作業の手間と時間を大幅に削減することができる。
【0015】
請求項3に記載の発明は請求項2の発明において、前記ATP抽出剤が添加されたATP抽出液に発光試薬を添加する工程を含むことを特徴とする。
【0016】
請求項4に記載の発明は請求項3の発明において、前記発光試薬が添加された反応液の発光量を測定する工程を含むことを特徴とする。
【0017】
請求項5は請求項1において、前記ATP消去剤は、アピラーゼ、アルカリホスファターゼ、酸性ホスファターゼ、ヘキソキナーゼ、及び、アデノシントリホスファターゼ、アデノシンリン酸デアミナーゼからなる群より選ばれる少なくとも一種を含むことを特徴とする。
【0018】
請求項6は請求項2において、前記ATP抽出剤は、界面活性剤、トリクロロ酢酸(TCA)、トリス緩衝液、エタノール、プロテアーゼ活性を有する溶菌酵素のいずれかを含むことを特徴とする。
【0019】
請求項7に記載の発明は請求項1の発明において、前記発芽誘導因子が、アミノ酸又はL−アラニンであることを特徴とする。
【0020】
請求項8に記載の発明は請求項1の発明において、前記発芽誘導因子が、糖又はグルコースであることを特徴とする。
【発明の効果】
【0021】
本発明によれば、捕集担体を加熱することによって捕集担体がゲルからゾルに相転移し、捕集担体に捕集された生物細胞が取り出されるとともに、検査用試薬が溶出して添加される。これにより、生物細胞の捕集から検査までの作業の手間と時間を削減することができる。
【図面の簡単な説明】
【0022】
【図1】本実施の形態の捕集装置の構成を模式的に示す断面図
【図2】本実施の形態の捕集・検査方法の手順を示すフローチャート
【図3】Ala処理濃度と発光量との関係を示す図
【図4】Ala処理温度と発光量との関係を示す図
【図5】Ala処理時間と発光量との関係を示す図
【発明を実施するための形態】
【0023】
以下添付図面に従って本発明に係る検査方法の好ましい実施形態について説明する。
【0024】
まず、本発明における捕集担体が好適に使用される捕集装置について説明する。図1は捕集装置10の構成を模式的に示す断面図である。同図に示す捕集装置10はインパクタ方式の分離装置であり、主としてケーシング12、捕集担体14、容器16、支持部材18及びファン20で構成される。
【0025】
ケーシング12は中空状に形成されており、その内部空間の下部にファン20が設けられる。また、ケーシング12の天面には円形の開口部12Aが形成され、ケーシング12の側面下部には排気口12Bが形成される。したがって、ファン20を駆動することによって、開口部12Aをノズルとして外部のエアが鉛直下向きに吸引され、そのエアが排気口12Bから排気される。開口部12Aは一つ又は複数の穴より形成され、これにはパンチングプレートなどの整流板を設けてもよい。
【0026】
ケーシング12の開口部12Aの下方には、捕集担体14及び容器16が設けられる。捕集担体14はその原料の高分子を凹状の容器16の上に薄膜状に流し込むことによって、容器16と一体的に形成されている。
【0027】
捕集担体14の高分子は、捕集時にゲル状であり、加熱することによって40℃以下でゾルに転移するものが使用される。特に相転移温度が15〜37℃であり、25℃で適度な強度のゲル状であるとともに37℃の時に数分でゾル状に相転移するものが好ましい。この温度範囲で相転移させることによって、捕集した生物細胞を死滅させることなく、高分子から取り出すことができる。
【0028】
また、高分子としては、ゼラチン又はNAGAm/MBPDAを含むものが好ましい。高分子がゼラチンの場合、濃度は相転移温度に応じて1〜20重量%の間で調節するが、その濃度が低いと十分な強度のゲルが得られず、濃度が高いと相転移したゾルの粘性が高くなって濾過が困難になる。相転移温度が37℃付近の場合のゼラチンの濃度は5〜10重量%が好ましい。
【0029】
高分子には殺菌作用を有しないアルコール類、たとえば、グリセロール、エチレングリコール、プロピレングリコールを含むことが好ましい。アルコール類がグリセロールの場合、高分子に対する重量比が小さいと十分な強度のゲルを得られず、重量比が大きいと相転移したゲルの粘性が高くなって濾過が困難になるため、グリセロールは、ゼラチンの濃度5〜10重量%の場合、体積比で10〜50%含まれていることが好ましい。
【0030】
捕集担体14は、ゲル状の高分子に検査用試薬が含有されている。この検査用試薬は、高分子がゾル状に相転移した際に溶出し、添加されるようになっている。また、検査用試薬は、生物細胞の種類やその検査方法に応じて選択され、たとえば、ATP法の検査を行う場合には、ATP消去剤、発芽誘導因子、ATP抽出剤、発光試薬などが選択される。
【0031】
捕集担体14は、開口部12Aから吸引されるエアの流れに対して直交するように、すなわち、水平に配置される。したがって、開口部12Aから吸引されたエアは、捕集担体14に衝突して水平方向に流れを変え、その際にエア中の微生物等の粒子がゲル状の高分子に捕集される。
【0032】
捕集担体14及び容器16は、支持部材18によって支持される。支持部材18の外周面とケーシング12の内壁との間には隙間が形成されており、捕集担体14に衝突して水平方向に流れたエアは、その隙間を通って下方に流れ、排気口12Bから排出される。
【0033】
支持部材18の内部には、不図示のヒータが設けられている。このヒータは、捕集担体14を相転移温度まで精度良く加熱するように制御される。なお、捕集担体14の加熱手段は、ヒータに限定されるものではなく、捕集担体14を相転移温度に加熱できる装置であればよい。たとえば、捕集担体14の周囲にジャケットを装着して温水を流したり、開口部12Aから吸い込まれるエアを加熱したりするようにしてもよい。
【0034】
上記の如く構成された捕集装置10は、捕集担体14を支持部材18によって開口部12Aの下方にセットし、ファン20を駆動することによってエアをケーシング12内に吸引する。これにより、開口部12Aからエアが鉛直下方に吸引され、このエアが捕集担体14に衝突して水平方向に流れを変えるとともに、エア中に浮遊する生物細胞がゲル状の捕集担体14に捕集される。
【0035】
捕集後、捕集担体14は支持部材18のヒータ(不図示)によって高分子の相転移温度まで加熱される。これにより、ゲル状の高分子がゾル状に相転移するので、捕集担体14に捕集された生物細胞が捕集担体14から取り出され、同時に、捕集担体14に保持されていた検査用試薬が溶出され、生物細胞に添加される。これにより、生物細胞に検査用試薬を添加して反応させる作業の少なくとも一つを捕集担体14で行うことができ、後段の検査装置での作業の手間と作業を削減することができる。
【0036】
捕集担体14から取り出された生物細胞は、容器16内に回収される。したがって、回収された生物細胞を容器16ごと、後段の検査装置(不図示)にセットして検査を行うことができ、検査の作業を容易に且つ短時間で行うことができる。
【0037】
次に、本発明をATP法による生物細胞の検出に用いた場合の実施形態について説明する。なお、以下の実施形態は、ATP消去剤、発芽誘導因子、ATP抽出剤、発光試薬を添加する例で説明するが、添加する試薬はこれに限定するものではなく、必要に応じて試薬の一部を省略したり別の試薬を添加したりしてもよい。また、捕集・検査する対象の生物細胞は特に限定するものではないが、たとえばセレウス菌 Bacillus cereus、枯草菌 Bacillus spizizenii、Corynebacterium renale、Micrococcus luteus、黄色ブドウ球菌 S.aureus、表皮ブドウ球菌 S.epidermidis、Citrobacter freundii、緑膿菌 Pseudomonas aeruginosa、セラチア菌 Serratia marcescensなどがあげられる。
【0038】
(第1の実施形態)
第1の実施形態の捕集担体14には、検査用試薬としてATP消去剤と発芽誘導因子がゲル状の高分子に含有される。ATP消去剤としては、たとえば、アピラーゼ、アルカリホスファターゼ、酸性ホスファターゼ、ヘキソキナーゼ、及び、アデノシントリホスファターゼ、アデノシンリン酸デアミナーゼからなる群より選ばれる少なくとも一種が用いられる。また、発芽誘導因子としては、たとえば、アミノ酸やL−アラニンが用いられる。発芽誘導因子としてL−アラニンを用いた場合、高分子に対する濃度が低すぎると、芽胞形成菌の細胞膜を十分に破壊できないため、25mM以上が好ましい。また、濃度が高すぎると、十分な強度のゲルを形成できないため、100mM以下が好ましい。
【0039】
上述した捕集担体14の好ましい組成の一例としては、
8%(w/v)ゼラチン(和光社(077-03155))、
25%(v/v)グリセロール(関東化学社(17029-00))、
1%(v/v)ATP消去剤(キッコーマン社ルシフェールHSセット付属(60315))、
25%(v/v)リン酸バッファー(Invitrogen社(20012-027)リン酸バッファーpH7.2)、
50mM L−アラニン(関東化学社製(1007-1M)Lアラニン)、
をあげることができる。また、捕集担体14の大きさとしては、直径がφ40mm、厚さが0.8〜4mm程度のものを好適に用いることができる。
【0040】
一方、捕集装置10では、捕集担体14を加熱する加熱手段が、捕集担体14を30℃以上37℃以下の温度に30分以上維持するように制御される。加熱温度が30℃よりも低いと加熱処理時間を長くしても発芽せず、芽胞形成菌からATPを抽出することができない。また、加熱温度が40℃を超えると、対象となる菌体によっては、栄養欠乏環境で増殖活性が高くなることによる死滅や、熱そのものによる不活性化などを引き起こすおそれがある。
【0041】
次に上記の如く構成された第1の実施形態による捕集・検査方法について図2に従って説明する。
【0042】
まず、捕集担体14をセットし、ファン20(図1参照)を駆動することによって、空中に浮遊する生物細胞を捕集担体14の高分子に捕集する(ステップS1)。次に、捕集担体14を相転移温度まで加熱し、高分子をゲル状からゾル状に相転移させる(ステップS2)。これにより、捕集担体14に捕集されていた生物細胞が捕集担体14から取り出され、同時にATP消去剤と発芽誘導因子が高分子から溶出され、ATP消去剤の添加と発芽誘導因子の添加とが行われる。したがって、捕集された生物細胞が取り出されるとともに、生菌の菌体外に遊離する遊離ATPが消去され、それに遅れて、生物細胞が発芽誘導因子に接触して芽胞形成菌が発芽する。
【0043】
ATP消去剤と発芽誘導因子が添加された生物細胞は、容器16内に回収される。容器16は検査装置(不図示)にセットされ、この検査装置でATP抽出剤が添加される(ステップS3)。ATP抽出剤は、生菌の細胞膜を溶解して内部のATPを抽出させる試薬であり、たとえば界面活性剤、トリクロロ酢酸(TCA)、トリス緩衝液、エタノール、プロテアーゼ活性を有する溶菌酵素等を含むものが使用される。これにより、生物細胞の細胞膜が溶解され、その内部のATPが抽出するので、ATPの検出が可能となる。その後、発光試薬を添加し(ステップS4)、さらにその反応液を分取し、発光量を測定する(ステップS5)。発光量の測定は、たとえばルミノメータ(Berthold Detection Systems社FB12型)を用い、標準試料の発光量との対比によって測定される。測定された発光量は、ATP量に換算され、さらにそれが菌数に換算される(ステップS6)。このようにして求められた菌数は、芽胞形成菌の菌数も含まれており、菌数を正確に求めることができる。
【0044】
本実施の形態によれば、捕集担体14によって、生物細胞の捕集を行うだけでなく、捕集した生物細胞を取り出し、さらにその取り出しと同時にATP消去剤の添加と発芽誘導因子の添加を行うので、検査装置において添加する試薬の数を減らすことができる。これにより、検査にかかる作業の手間と時間を削減することができる。特に本実施の形態では、反応に時間を要する発芽誘導因子の添加を、検査装置にセットする前に行うことができるので、検査時間を大幅に短縮することができる。
【0045】
(第2の実施形態)
第2の実施形態の捕集担体14は、ゲル状の高分子にATP消去剤のみが含有されている。そして、後段の検査装置では、発芽誘導因子の添加、ATP抽出剤の添加、発光試薬の添加が順に行われ、その後に発光量が測定される。すなわち、図2のフローにおいて、ステップS2の「発芽誘導因子の添加」がステップS2とステップS3の間で行われる。
【0046】
第2の実施形態の場合、捕集担体14を加熱して高分子をゲル状からゾル状に相転移させることによって、捕集担体14から生物細胞が取り出され、同時にATP消去剤が添加される。したがって、検査装置でATP消去剤を添加する手間と時間を省くことができる。
【0047】
(第3の実施形態)
第3の実施形態の捕集担体14は、ゲル状の高分子に発芽誘導因子のみが含有されている。そして、後段の検査装置では、ATP消去剤の添加、ATP抽出剤の添加、発光試薬の添加が順に行われ、その後に発光量が測定される。すなわち、図2のフローにおいて、ステップS2の「ATP消去剤の添加」がステップS2とステップS3の間で行われる。なお、ATP消去剤の添加は、発芽誘導因子の添加を行った後、その発芽誘導因子の反応が起こる前(通常、30分以内)に行われる。
【0048】
第3の実施形態の場合、捕集担体14の高分子をゲル状からゾル状に相転移させることによって、捕集担体14から生物細胞が取り出され、同時に発芽誘導因子が添加される。したがって、検査装置で発芽誘導因子を添加する手間と時間を省くことができる。
【0049】
(第4の実施形態)
第4の実施形態の捕集担体14は、ゲル−ゾル間の相転移温度が異なる二種類の高分子が上下に積層されて構成されている。二種類の高分子のうち、上側(すなわち生物細胞を捕集する側)の高分子は、下側の高分子よりも相転移温度が低く、加熱時に先にゾルに相転移するようになっている。また、上側の高分子には、ATP消去剤と発芽誘導因子が含有されており、下側の高分子には、ATP抽出剤が含有されている。
【0050】
また、第4の実施形態における捕集装置10は、捕集担体14を加熱する加熱手段が二段階で温度を制御するように構成される。すなわち、上側の高分子の相転移温度と、下側の高分子の相転移温度とに、捕集担体14の温度を加熱できるようになっている。
【0051】
上記の如く構成された第4の実施形態では、生物細胞が捕集担体14の上側の高分子に捕集される。この生物細胞を取り出す際は、まず、捕集担体14を上側の高分子の相転移温度に加熱する。これにより、下側の高分子がゲル状態を保ったまま、上側の高分子のみがゾル状に相転移する。したがって、上側の高分子から生物細胞が取り出されるとともに、上側の高分子からATP消去剤と発芽誘導因子が溶出される。よって、遊離ATPが消去され、さらに芽胞状態の生物細胞が発芽する。ATP消去剤と発芽誘導因子が添加された生物細胞は下側の高分子の上に保持される。
【0052】
次に捕集担体14を下側の高分子の相転移温度に加熱する。これにより、下側の高分子がゾル状に相転移し、ATP抽出剤が溶出される。したがって、生物細胞にATP抽出剤が添加され、生物細胞の細胞膜が分解されて生物細胞内のATPが抽出される。
【0053】
生物細胞内から抽出されたATPに発光試薬が添加された後、発光量が測定される。
【0054】
上述した第4の実施形態によれば、相転移温度の異なる二つの高分子を積層し、各高分子に異なる試薬を含有させたので、加熱温度を制御することによって、複数の試薬を捕集担体14上で順に添加することができる。これにより、検査装置で試薬を添加する作業を省くことができ、作業の手間と時間を大幅に削減することができる。
【0055】
(第5の実施形態)
第5の実施形態の捕集担体14は、ゲル−ゾル間の相転移温度が異なる三種類の高分子が上下三層に積層されている。三種類の高分子は、上側(すなわち生物細胞を捕集する側)ほど相転移温度が低く、加熱した際に先にゾルに相転移するようになっている。また、最も上側の高分子にはATP消去剤が含有され、中間の高分子には発芽誘導因子が含有され、下側の高分子にはATP抽出剤が含有されている。
【0056】
なお、第5の実施形態における捕集装置は、捕集担体14を加熱する加熱手段が三段階で温度を制御できるようになっている。すなわち、最も上側の高分子の相転移温度と、中間の高分子の相転移温度と、最も下側の高分子の相転移温度とに温度を制御できるようになっている。
【0057】
上記の如く構成された第5の実施形態では、生物細胞が捕集担体14の上側の高分子に捕集される。この生物細胞を取り出す際は、まず、捕集担体14を上側の高分子の相転移温度に加熱する。これにより、中間の高分子と下側の高分子がゲル状態を保ったまま、上側の高分子のみがゾルに相転移する。したがって、上側の高分子から生物細胞が取り出されるとともに、上側の高分子からATP消去剤が溶出され、遊離ATPが消去される。遊離ATPが消去された生物細胞は、中間の高分子の上に保持される。
【0058】
次に、捕集担体14を中間の高分子の相転移温度に加熱する。これにより、下側の高分子がゲル状態を保ったまた、中間の高分子がゾルに相転移する。したがって、中間の高分子から発芽誘導因子が溶出されて添加され、芽胞状態の生物細胞が発芽する。
【0059】
次に、捕集担体14を下側の高分子の相転移温度に加熱する。これにより、下側の高分子がゾル状に相転移し、ATP抽出剤が溶出される。したがって、生物細胞にATP抽出剤が添加され、生物細胞の細胞膜が分解されて生物細胞内のATPが抽出される。
【0060】
生物細胞内から抽出されたATPに発光試薬が添加された後、発光量が測定される。
【0061】
上述した第5の実施形態によれば、相転移温度の異なる三つの高分子を積層するとともに、各高分子に異なる試薬を含有させたので、捕集担体の加熱温度を制御することによって、複数の試薬を捕集担体14上で順に添加することができる。これにより、検査装置で複数の試薬を添加する作業を省くことができ、検査の手間と時間を大幅に削減することができる。
【0062】
なお、上述した第4、第5の実施形態では下側の高分子の形状を中央に窪みを有する凹状に形成し、その窪み部分に上側の高分子を設けてもよい。
【0063】
なお、上述した第1〜第5の実施形態は、ATP消去剤、発芽誘導因子、ATP抽出剤を選択的に捕集担体14に含有させるようにしたが、他の試薬、たとえば発光試薬をATP抽出剤に含有させるようにしてもよい。
【0064】
また、上述した第1〜第5の実施形態は、捕集担体14に容器16を取り付けたが、これに限定するものではなく、容器16のない態様も可能である。この場合、生物細胞だけを残してゾル状の高分子を濾過することが可能なフィルタの上に捕集担体14を配置する方式などが考えられる。フィルタとしては、たとえば孔径0.45μmのポリビニリデンフロライド製のメンブレンフィルタなどを用いることができる。
【0065】
また、上述した実施形態は、空中に浮遊する生物細胞を捕集して検査する例で説明したが、本発明の用途はこれに限定するものではなく、空中に浮遊する微粒子を捕集し、検査するための捕集担体、捕集ユニット、捕集装置及び捕集・検査方法に適用することができる。
【0066】
さらに、上述した実施形態は、熱によって相転移する高分子を用いたが、他の要因によって相転移する高分子を用いてもよい。たとえば、生物細胞等に影響のない薬品によってゲルからゾルに相転移する高分子を用いてもよい。
【0067】
なお、上述した実施形態において、試薬をマイクロカプセルに内包させて高分子ゲルに分散させるようにしてもよい。
【0068】
また、上述した第4、第5の実施形態のように複数種類の高分子の層を積層する場合、上側の高分子層のなかに、そのすぐ下側の高分子層の成分を、温度感受性のマイクロカプセルとして分散・包埋ようにしてもよい。すなわち、相転移する順に第n層とした際に、第(n+1)層成分を第n層中に、温度感受性のマイクロカプセルとして分散・包埋ようにしてもよい。この場合、両者の接触面積と混合効率を向上させることができる。
【0069】
さらに、上述した第4、第5の実施形態のように複数種類の高分子の層を積層する場合、高分子層の成分を表面に固定化した磁気微粒子を、そのすぐ上側の高分子層との境界面に設置し、その上側の高分子層をゾル化した後、外部磁場により微粒子を揺動して混合、反応させるようにしてもよい。すなわち、相転移する順に第n層とした際に、第(n+1)層成分を表面に固定化した磁気微粒子を第n層との境界面に設置し、第n層をゾル化した後、外部磁場により微粒子を揺動して混合、反応させるようにしてもよい。この場合、温度条件以外の制御手段を併用することになるので、制御の精度を向上させることができる。
【実施例】
【0070】
発芽誘導因子の好ましい濃度、反応温度、反応時間を試験により求めた。この試験では、サンプルとして枯草菌芽胞を含む菌液に、L−アラニンを予め添加し、これを分取してATP消去剤を添加した。そして、30分後にATP抽出剤を添加し、その反応液を分取した後、発光測定を行った。
【0071】
この試験において、まず、L−アラニンの濃度(以下、Ala濃度)を変えて発光量を求めた。発光量は、1CFU(すなわち、培養前のサンプル中の1微生物)あたりの発光量を求めた。その結果を図3に示す。なお、発光量の単位cpsは、一秒あたりにカウントした光電子の数である。
【0072】
同図に示すように、Ala濃度が大きくなると発光量が増加し、25mM以上の時に発光量を安定させることができた。すなわち、Ala濃度が25mM以上の時に、芽胞細胞を十分に発芽させ、ATPを抽出させることができた。したがって、Ala濃度は25mM以上が好ましいことが分かる。なお、Ala濃度が大きいと、十分な強度のゲルを形成することができない。このため、Ala濃度は100mM以下が好ましい。
【0073】
次に、L−アラニンを反応させる際の温度と、発光量との関係について調べた。その結果を図4に示す。同図から分かるように、L−アラニンの反応温度が高いほど、芽胞形成菌を発芽させることができ、発光量を増やすことができた。特に30℃以上になると急激に発光量が増加した。また、図には示してないが、処理温度が40℃を超えると、徐々に死滅する菌が発生した。したがって、L−アラニンを反応させる際の温度は30℃以上40℃以下が好ましい。よって、捕集担体14を加熱して芽胞形成菌を溶出させる際の温度としては、30℃以上40℃以下が好ましい。
【0074】
次に反応温度ごとに、発光量の経時変化を調べた。その結果を図5に示す。同図に示すように、反応温度が35℃の場合には、反応時間は30分過ぎにピークを迎えた。したがって、反応温度が35℃の時、反応時間は30分以上が好ましい。
【0075】
〈参考〉
請求項1に記載の発明は前記目的を達成するために、空中に浮遊する生物細胞を捕集する捕集担体において、前記生物細胞の捕集時にはゲル状であり、加熱した際に40℃以下でゾル状に相転移する高分子から成るとともに、該高分子に検査用試薬が含有され、前記ゲル状からゾル状に相変位した際に前記検査用試薬が溶出されることを特徴とする。
【0076】
本発明によれば、捕集担体を構成する高分子が捕集時にゲル状であるので、空中に浮遊する生物細胞を効率良く捕捉することができる。また、捕集担体を加熱することにより40℃以下でゾル状に相変位するので、捕集担体に捕捉された生物細胞を死滅させることなく、捕集担体から容易に取り出すことができる。さらに、本発明によれば、ゲル状の高分子が検査用試薬を含有し、ゾル状に相変位した際に溶出するので、生物細胞を捕集担体から取り出した際に同時に、検査用試薬の添加を行うことができる。したがって、本発明によれば、捕集担体からの生物細胞の取り出し作業と、検査用試薬の添加を同時に行うことができる。このように本発明の捕集担体は、空中浮遊の生物細胞の捕集と、その生物細胞の取り出しと、検査用試薬の添加を行うことができるので、空中浮遊生物細胞の捕集から検査までを短時間で容易に行うことができる。
【0077】
請求項2に記載の発明は請求項1の発明において、前記検査用試薬は、前記捕集した生物細胞をATP法により検出するための試薬であることを特徴とする。ATP法のように多数の試薬が必要になる場合には、本発明を適用することによって、生物細胞の捕集から検査までの作業の手間と時間を大幅に削減することができる。
【0078】
請求項3に記載の発明は請求項2の発明において、前記試薬は、前記生物細胞由来以外のATPを消去するATP消去剤であることを特徴とする。本発明によれば、捕集担体をゲルからゾルに相転移させることによって生物細胞を取り出した際にATP消去剤が溶出して添加されるので、生菌の菌体外の遊離ATPを消去することができる。したがって、請求項3の発明によれば、捕集担体からの生物細胞の取り出し作業と、遊離ATPの消去作業とを同時に行うことができる。
【0079】
請求項4に記載の発明は請求項3の発明において、前記ATP消去剤は、アピラーゼ、アルカリホスファターゼ、酸性ホスファターゼ、ヘキソキナーゼ、及び、アデノシントリホスファターゼ、アデノシンリン酸デアミナーゼからなる群より選ばれる少なくとも一種を含むことを特徴とする。
【0080】
請求項5に記載の発明は請求項2の発明において、前記試薬は、前記生物細胞由来のATPを抽出するATP抽出剤を含むことを特徴とする。本発明によれば、捕集担体をゲルからゾルに相転移させて生物細胞を取り出した際にATP抽出剤が溶出して添加されるので、生菌の細胞膜を分解することができる。したがって、請求項5の発明によれば、捕集担体からの生物細胞の取り出し作業と、生菌の細胞膜の分解作業とを同時に行うことができる。
【0081】
請求項6に記載の発明は請求項5の発明において、前記ATP抽出剤は、界面活性剤、トリクロロ酢酸(TCA)、トリス緩衝液、エタノール、プロテアーゼ活性を有する溶菌酵素等を含むことを特徴とする。
【0082】
請求項7に記載の発明は請求項2の発明において、前記試薬は、芽胞形成菌の芽胞又は植物の胞子の発芽を誘発する発芽誘導因子であることを特徴とする。本発明によれば、捕集担体をゲルからゾルに相転移させて生物細胞を取り出した際に発芽誘導因子が溶出されて添加されるので、芽胞形成菌の芽胞や植物胞子の発芽を促し、ATP法の各反応が容易にできる通常の状態の細胞に変化させることができる。したがって、請求項7の発明によれば、捕集担体からの生物細胞の取り出し作業と、芽胞形成菌の細胞膜や植物細胞の胞子の発芽誘導とを同時に行うことができる。
【0083】
請求項8に記載の発明は請求項7の発明において、前記発芽誘導因子が、アミノ酸又はL−アラニンであることを特徴とする。
【0084】
請求項9に記載の発明は請求項7の発明において、前記発芽誘導因子が、糖又はグルコースであることを特徴とする。
【0085】
請求項10に記載の発明は請求項1〜9のいずれか1の発明において、前記捕集担体は、ゲル状からゾル状に相転移する相転移温度が異なる複数の高分子を積層することにより構成されることを特徴とする。本発明によれば、捕集担体が相転移温度の異なる複数の高分子を積層して構成されるので、加熱温度を制御することによって、ゲルからゾルに相転移する高分子を選択することができる。したがって、高分子ごとに検査用試薬を変えることによって、添加する検査用試薬を選択することができる。
【0086】
請求項11に記載の発明は請求項10の発明において、前記複数の高分子は三層から成り、前記生物細胞が捕集される側の高分子ほど相転移温度が低く、且つ、前記生物細胞が捕集される側から順にATP消去剤、発芽誘導因子、ATP抽出剤が含まれることを特徴とする。
【0087】
本発明によれば、捕集担体の加熱温度を上昇させた際に、生物細胞が捕集された側から順に高分子がゲルからゾルに相転移する。これにより、捕集担体に捕集された生物細胞が取り出されるとともに、ATP消去剤、発芽誘導因子、ATP抽出剤が順に溶出されて添加される。したがって、捕集担体から生物細胞を取り出す作業と、遊離ATPの消去と、芽胞形成菌等の発芽誘導と、生物細胞のATP抽出とを、一つの捕集担体で行うことができ、捕集から検査までの効率を大幅に向上させることができる。
【0088】
請求項12に記載の発明は請求項10の発明において、前記複数の高分子は二層から成り、前記生物細胞が捕集される側の高分子の相転移温度がもう一方の高分子の相転移温度よりも低く、且つ、前記生物細胞が捕集される側の高分子にATP消去剤と発芽誘導因子が含まれ、もう一方の高分子にATP抽出剤が含まれることを特徴とする。
【0089】
本発明によれば、捕集担体の加熱温度を上昇させた際に、生物細胞の捕集側から順に高分子がゲルからゾルに相転移する。これにより、捕集担体に捕集された生物細胞が取り出されるとともに、ATP消去剤と発芽誘導因子が溶出されて添加され、次いでATP抽出剤が溶出されて添加される。したがって、本発明によれば、捕集担体から生物作業を取り出す作業と、遊離ATPの消去と、芽胞形成菌等の発芽誘導と、生物細胞のATP抽出とを、一つの捕集担体で行うことができ、捕集から検査までの効率を大幅に向上させることができる。
【0090】
請求項13に記載の発明は、請求項1〜12に記載の捕集担体と、該捕集担体の前記生物細胞を捕集する側の反対側に取り付けられ、前記捕集担体に捕集された生物細胞を前記捕集担体から取り出した際に捕集するフィルタと、を備えたことを特徴とする捕集ユニットを提供する。本発明によれば、捕集担体にフィルタが設けられているので、捕集担体から取り出した生物細胞をフィルタによって捕集することができ、取り出した後の検査を容易に行うことができる。
【0091】
請求項14に記載の発明は、請求項1〜12の捕集担体又は請求項13の捕集ユニットに、生物細胞が浮遊するエアを吹き付ける吹き付け手段と、請求項1〜12の捕集担体又は請求項13の捕集ユニットを前記高分子の相転移温度に加熱する加熱手段と、を備えたことを特徴とする捕集装置を提供する。本発明によれば、加熱手段を備えているので、捕集担体から生物細胞を取り出す作業と、検査用試薬を溶出して添加する作業とを捕集装置で行うことができる。したがって、捕集装置の後段の検査装置での作業の手間と時間を削減することができる。
【0092】
請求項15に記載の発明は前記目的を達成するために、生物細胞が浮遊するエアを、ゲル状の高分子から成るとともに検査用試薬を含有する捕集担体に吹き付けることによって、前記生物細胞を前記捕集担体に捕集する捕集工程と、前記捕集担体を加熱して40℃以下でゾル状に相転移させることによって、前記捕集担体に捕集された生物細胞を前記捕集担体から取り出すとともに、ゾル状に相転移した捕集担体から検査用試薬を溶出させて前記生物細胞に添加する取出・添加工程と、を含むことを特徴とする捕集・検査方法を提供する。本発明によれば、捕集担体からの生物細胞の取り出しと、その生物細胞への検査用試薬の添加とを同時に行うことができ、作業の容易化と時間短縮化を図ることができる。
【符号の説明】
【0093】
10…捕集装置、12…ケーシング、14…捕集担体、16…容器、18…支持部材、20…ファン
【特許請求の範囲】
【請求項1】
空中に浮遊する生物細胞が捕集されたゲル状の高分子捕集担体を加熱し、
前記高分子捕集担体をゲル状からゾル状に相転移し、
前記生物細胞にATP消去剤を添加し、
前記生物細胞に発芽誘導因子を添加する工程を含むことを特徴とする検査方法。
【請求項2】
さらにATP抽出剤を添加する工程を含むことを特徴とする請求項1に記載の検査方法。
【請求項3】
前記ATP抽出剤が添加されたATP抽出液に発光試薬を添加する工程を含むことを特徴とする請求項2に記載の検査方法。
【請求項4】
前記発光試薬が添加された反応液の発光量を測定する工程を含むことを特徴とする請求項3に記載の検査方法。
【請求項5】
前記ATP消去剤は、アピラーゼ、アルカリホスファターゼ、酸性ホスファターゼ、ヘキソキナーゼ、及び、アデノシントリホスファターゼ、アデノシンリン酸デアミナーゼからなる群より選ばれる少なくとも一種を含むことを特徴とする請求項1に記載の検査方法。
【請求項6】
前記ATP抽出剤は、界面活性剤、トリクロロ酢酸(TCA)、トリス緩衝液、エタノール、プロテアーゼ活性を有する溶菌酵素のいずれかを含むことを特徴とする請求項2に記載の検査方法。
【請求項7】
前記発芽誘導因子が、アミノ酸またはL−アラニンであることを特徴とする請求項1に記載の検査方法。
【請求項8】
前記発芽誘導因子が、糖またはグルコースであることを特徴とする請求項1に記載の検査方法。
【請求項1】
空中に浮遊する生物細胞が捕集されたゲル状の高分子捕集担体を加熱し、
前記高分子捕集担体をゲル状からゾル状に相転移し、
前記生物細胞にATP消去剤を添加し、
前記生物細胞に発芽誘導因子を添加する工程を含むことを特徴とする検査方法。
【請求項2】
さらにATP抽出剤を添加する工程を含むことを特徴とする請求項1に記載の検査方法。
【請求項3】
前記ATP抽出剤が添加されたATP抽出液に発光試薬を添加する工程を含むことを特徴とする請求項2に記載の検査方法。
【請求項4】
前記発光試薬が添加された反応液の発光量を測定する工程を含むことを特徴とする請求項3に記載の検査方法。
【請求項5】
前記ATP消去剤は、アピラーゼ、アルカリホスファターゼ、酸性ホスファターゼ、ヘキソキナーゼ、及び、アデノシントリホスファターゼ、アデノシンリン酸デアミナーゼからなる群より選ばれる少なくとも一種を含むことを特徴とする請求項1に記載の検査方法。
【請求項6】
前記ATP抽出剤は、界面活性剤、トリクロロ酢酸(TCA)、トリス緩衝液、エタノール、プロテアーゼ活性を有する溶菌酵素のいずれかを含むことを特徴とする請求項2に記載の検査方法。
【請求項7】
前記発芽誘導因子が、アミノ酸またはL−アラニンであることを特徴とする請求項1に記載の検査方法。
【請求項8】
前記発芽誘導因子が、糖またはグルコースであることを特徴とする請求項1に記載の検査方法。
【図1】


【図2】


【図3】


【図4】


【図5】




【図2】


【図3】


【図4】


【図5】


【公開番号】特開2012−205600(P2012−205600A)
【公開日】平成24年10月25日(2012.10.25)
【国際特許分類】
【出願番号】特願2012−171114(P2012−171114)
【出願日】平成24年8月1日(2012.8.1)
【分割の表示】特願2007−309342(P2007−309342)の分割
【原出願日】平成19年11月29日(2007.11.29)
【出願人】(000005452)株式会社日立プラントテクノロジー (1,767)
【Fターム(参考)】
【公開日】平成24年10月25日(2012.10.25)
【国際特許分類】
【出願日】平成24年8月1日(2012.8.1)
【分割の表示】特願2007−309342(P2007−309342)の分割
【原出願日】平成19年11月29日(2007.11.29)
【出願人】(000005452)株式会社日立プラントテクノロジー (1,767)
【Fターム(参考)】
[ Back to top ]

