検査用チップ
【課題】 試薬の活性を十分に高く維持したまま、試薬を検体との反応に供することを可能にする検査用チップを提供すること。
【解決手段】 検体を含有する検体液を収容するための第1のウェル2と、検体と反応する固形状の試薬5が収納されている第2のウェル3と、第1のウェル2を大気に開放するための第1の開口2aと、第2のウェル3を大気に開放するための第2の開口3aと、第1のウェル2及び第2のウェル3を接続する流路4と、が本体部1に形成されていることを特徴とする検査用チップ10。
【解決手段】 検体を含有する検体液を収容するための第1のウェル2と、検体と反応する固形状の試薬5が収納されている第2のウェル3と、第1のウェル2を大気に開放するための第1の開口2aと、第2のウェル3を大気に開放するための第2の開口3aと、第1のウェル2及び第2のウェル3を接続する流路4と、が本体部1に形成されていることを特徴とする検査用チップ10。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、検査用チップに関する。
【背景技術】
【0002】
近年、飲食料中の微生物(細菌、真菌等)を検出するために、微生物中に存在するアデノシン三リン酸(ATP)を検出することが行われている。また、DNA塩基配列を分析するために、DNAを構成するデオキシヌクレオチド三リン酸(dNTP)と、それに相補的なdNTPとの結合に伴って生成するピロリン酸をATPに変換し、このATPを検出することが行われている(例えば、下記特許文献1)。
【0003】
このようなATPの検出は、従来、検査用チップを用いて、検体液を、予め調製した試薬溶液と混合させ、ルシフェリン−ルシフェラーゼ反応に基づく発光を生じさせることによって行われていた(例えば、下記特許文献1)。
【特許文献1】特開2004−028589号公報
【発明の開示】
【発明が解決しようとする課題】
【0004】
しかしながら、ルシフェリン−ルシフェラーゼ反応で用いられる試薬はタンパク質であるルシフェラーゼを含有し、水溶液状態では劣化しやすいため、試薬溶液の調製が必要な従来の検査用チップでは、反応に供されるまでの間に試薬の活性が低下し、その分だけ発光量が低下するという問題があった。
【0005】
このような試薬の活性の低下は、従来の検査用チップを用いる限り、ルシフェラーゼに限らず、一般に、タンパク質を含有する試薬を用いて検査を行う場合には同様に問題となる。
【0006】
そこで、本発明は、試薬の活性を十分に高く維持したまま、試薬を検体との反応に供することを可能にする検査用チップを提供することを目的とする。
【課題を解決するための手段】
【0007】
上記目的を達成するために、本発明は、検体を含有する検体液を導入するための第1のウェルと、検体と反応する固形状の試薬が収納されている第2のウェルと、第1のウェルを大気に開放するための第1の開口と、第2のウェルを大気に開放するための第2の開口と、第1のウェル及び第2のウェルを接続する流路と、が本体部に形成されていることを特徴とする検査用チップを提供する。
【0008】
上記検査用チップでは、検体液を第1のウェルに導入した後、検体液を、流路に流通させて第2のウェルに収容させる。検体液が第2のウェルに収容されると、第2のウェルに収納されている固形状の試薬が検体液に溶解し、第2のウェル内で検体と反応する。第1のウェルに導入された検体液の流路への流通、及び第2のウェルへの収容は、検体液に加えられる圧力を第1及び第2の開口を通じて加減することにより行う。なお、本発明において、「検体液」とは、検体を含有する液体を意味する。
【0009】
上記検査用チップを用いれば、試薬溶液を予め調製する必要がなく、試薬が検体液に溶解すると同時に、検体と試薬との反応が開始するので、試薬の活性を十分に高く維持したまま、試薬を検体との反応に供することができる。また、試薬溶液を予め調製する必要がないので、試薬溶液の調製又は分注に伴って反応場に微生物等の不純物が混入するおそれがなくなり、それだけ高い精度で検査を行うことができる。また、試薬溶液の調製及び分注が不要なので、それだけ簡便に検査を行うことができる。
【0010】
本発明はまた、上記検査用チップにおいて、第2のウェルに収納されている試薬が、ATPの存在下に発光する発光試薬であり、微生物中のATPを抽出する固形状の抽出試薬が収納されている第3のウェルと、第3のウェルを大気に開放するための第3の開口と、が本体部に更に形成され、第3のウェルが、第1のウェル及び第2のウェルの間で流路の一部を構成している検査用チップを提供する。
【0011】
このような検査用チップ(以下、「微生物検出用チップ」という。)では、検体液を第1のウェルに導入した後、検体液を、流路に流通させて第3のウェルに収容させる。検体液が第3のウェルに収容されると、第3のウェルに収納されている固形状の抽出試薬が検体液に溶解し、第3のウェル内で微生物中のATPを抽出する。検体液が第3のウェルに収容され、ATPの抽出に十分な時間が経過した後、検体液を第3のウェル及び第2のウェルの間の流路に流通させて第2のウェルに収容させる。検体液が第2のウェルに収容されると、第2のウェルに収納されている固形状の発光試薬が検体液に溶解し、第2のウェル内で検体液中のATPと反応し、発光を生じる。第1のウェルに導入された検体液の流路への流通、及び他のウェルへの収容は、検体液に加えられる圧力を第1、第3及び第2の開口を通じて加減することにより行う。このような微生物検出用チップは、光検出器と組み合わせることによって、ATPを指標とする検体中の微生物の検出に利用することができる。なお、本発明において、「発光試薬」とは、ATPと反応して発光を生じさせる試薬を意味し、また、「抽出試薬」とは、微生物中のATPを抽出する試薬を意味する。いずれの試薬も、1種類の物質からなるものであっても、2種類以上の物質からなるものであってもよい。
【0012】
上記微生物検出用チップとしては、第1のウェル及び第3のウェルの間の流路の内壁面にATP分解酵素が固定化されているものが好ましい。このような微生物検出用チップを用いれば、検体液と抽出試薬とが混合される前に、ATP分解酵素によって微生物中のATP以外のATP(以下、「バックグラウンドATP」という。)が分解除去されるので、検体中の微生物がそれだけ高い精度で検出される。なお、本発明において、「ATP分解酵素が固定化されている」とは、ATP分解酵素が物理吸着、化学結合等により固体表面に結合しており、固体表面を水又は水溶液と接触させても、ATP分解酵素が固体表面から脱離しないことをいう。
【0013】
上記微生物検出用チップとしてはまた、ATPを増幅する固形状の増幅試薬が収納されている第4のウェルと、第4のウェルを大気に開放するための第4の開口と、が更に本体部に形成され、第4のウェルが、第3のウェル及び第2のウェルの間で流路の一部を構成しているものが好ましい。このような微生物検出用チップでは、検体液が第3のウェルに収容され、ATPの抽出に十分な時間が経過した後、検体液を第3のウェル及び第4のウェルの間の流路に流通させて第4のウェルに収容させる。検体液が第4のウェルに収容されると、第4のウェルに収納されている固形状の増幅試薬が検体液に溶解し、第4のウェル内で検体液中のATPと反応し、検体液中のATPを増幅する。検体液が第4のウェルに収容され、ATPの増幅に十分な時間が経過した後、検体液を第4のウェル及び第2のウェルの間の流路に流通させて第2のウェルに収容させる。検体液が第2のウェルに収容されると、第2のウェルに収納されている固形状の発光試薬が検体液に溶解し、第2のウェル内で検体液中のATPと反応し、発光を生じる。第1のウェルに導入された検体液の流路への流通、及び他のウェルへの収容は、検体液に加えられる圧力を第1、第3、第4及び第2の開口を通じて加減することにより行う。このような微生物検出用チップを用いれば、微生物中のATPが抽出試薬によって抽出された後、検体液と発光試薬とが混合される前に検体液中のATPが増幅されるので、検体中の微生物がそれだけ高い感度で検出される。なお、本発明において、「増幅試薬」とは、ATPを増幅させる試薬を意味し、1種類の物質からなるものであっても、2種類以上の物質からなるものであってもよい。
【0014】
上記微生物検出用チップとしてはまた、前記第2のウェル内で生じた光を反射する光反射部が、試薬を包囲するように第2のウェルの内壁面の一部に設けられているものが好ましい。このような微生物検出用チップを用いれば、光反射部で反射した光が光検出器の受光部に入射されるように光検出器を配置することによって、光検出器の受光部に入射される光の量を増加させることができるので、検体中の微生物をそれだけ高い感度で検出することができる。なお、本発明において、「光を反射する」とは、光の少なくとも一部を反射することを意味する。
【0015】
上記微生物検出用チップとしてはまた、第2の開口が、第2のウェル内で生じた光を反射する通気性の光反射膜で覆われているものが好ましい。このような微生物検出用チップを用いれば、光反射膜で反射した光が光検出器の受光部に入射されるように光検出器を配置することによって、光検出器の受光部に入射される光の量を増加させることができるので、検体中の微生物をそれだけ高い感度で検出することができる。なお、第1のウェルに導入された検体液の流路への流通、及び他のウェルへの収容は、検体液に加えられる圧力を、開口を通じて加減することにより行うので、上記光反射膜は通気性を有する必要がある。
【0016】
上記検査用チップ(上記微生物検出用チップを含む。)としては、第1の開口(第2の開口が光反射膜で覆われている場合は、第1及び第2の開口)を除くすべての開口がフィルターで覆われているものが好ましい。このような検査用チップを用いれば、第1のウェルを除くすべてのウェル内に微生物等の不純物が混入するのが防止されるので、それだけ高い精度で検査を行うことができる。
【発明の効果】
【0017】
本発明によれば、試薬の活性を十分に高く維持したまま、試薬を検体との反応に供することを可能にする検査用チップが提供される。
【発明を実施するための最良の形態】
【0018】
以下、図面を参照して本発明の好適な実施形態を説明する。なお、図面の説明においては、同一または同等の要素には同一符号を用いるものとし、重複する説明は省略する。
【0019】
(第1実施形態)
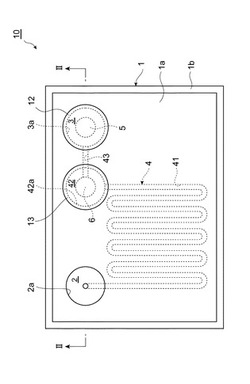
本発明の第1実施形態について、図1及び2を参照して説明する。図1は、第1実施形態に係る検査用チップの平面図である。図2は、図1のII−II線に沿った断面図である。
【0020】
第1実施形態に係る検査用チップ10は本体部1を備え、本体部1は三層の基板1a〜1cからなる。基板1a〜1cは、透光性を有する材料で構成されていればよい。そのような材料としては、ポリカーボネート(PC)、ポリエチレンテレフタレート(PET)、ポリジメチルシロキサン(PDMS)、ポリイミド、ポリスチレン(PS)、ポリメチルメタクリレート(PMMA)等の樹脂や、石英ガラス、パイレックス(登録商標)ガラス等のガラスが挙げられる。
【0021】
基板1aには、検体液導入ウェル(第1のウェル)2、発光ウェル(第2のウェル)3及び抽出ウェル(第3のウェル)42が形成されている。基板1aの表面のうち、基板1aに対して基板1bと反対側の表面には、検体液導入ウェル2を大気に開放するための検体液導入ウェル開放口(第1の開口)2aと、発光ウェル3を大気に開放するための発光ウェル開放口(第2の開口)3aと、抽出ウェル42を大気に開放するための抽出ウェル開放口(第3の開口)42aと、が形成されている。いずれのウェルも、開口の縁部から基板1b側に向かって円筒状に延びる側壁面と、その側壁面の端部に接続される底面と、によって形成されている。ここで、検体液導入ウェル2及び抽出ウェル42の底面は各々、側壁面の端部から遠ざかる方向へ窪んでいる。具体的には、上記底面は、基板1aの表面に平行な仮想平面でウェル(側壁面によって形成される円柱状の部分を除く。)を切断したときの開口の面積が、基板1aから基板1bに向かって小さくなるように、テーパ状(円錐状又は円錐台状)に形成されている。
【0022】
発光ウェル3には、固形状の発光試薬(固形状の試薬)5が収納されている。発光試薬5としては、例えば、ホタルルシフェリン、ホタルルシフェラーゼ及び2価金属イオン(Mg2+等)からなる試薬が挙げられる。ATPは、酸素及び2価金属イオンの存在下でホタルルシフェリン及びホタルルシフェラーゼと反応して、ホタルルシフェリンによる発光を生じさせる。
【0023】
抽出ウェル42には、固形状の抽出試薬6が収納されている。抽出試薬6としては、例えば、溶菌酵素(リゾチーム、キチナーゼ、キトサナーゼ等)、陽イオン界面活性剤(塩化ベンザルコニウム、塩化ベンゼトニウム、塩化セチルトリメチルアンモニウム等)、非イオン性界面活性剤(ポリオキシエチレンアルキルエーテル、ポリオキシエチレンアルキルフェニルエーテル、ポリオキシエチレンソルビタンエステル、ソルビタン脂肪酸エステル等)が挙げられる。抽出試薬6中には、溶菌酵素等に加えて、例えば、非イオン性界面活性剤、キレート剤(エチレンジアミン四酢酸等)又は糖類(スクロース、グルコース、フルクトース等)が含まれていてもよい。
【0024】
固形状の試薬は、発光試薬5及び抽出試薬6のいずれについても、酵素を含有する場合は、凍結乾燥されたものであることが好ましい。凍結乾燥された試薬は、長期(例えば、半年以上)に渡って本来の活性を維持することができる。
【0025】
発光ウェル3の円筒状の側壁面には、側壁面の全周に渡って、光反射部11が設けられ、光反射部11は固形状の発光試薬5を包囲している。光反射部11は、発光ウェル3の底面には設けられていない。また、発光ウェル開放口3aは、光反射膜12で覆われている。発光ウェル3内で生じた光のうち、側壁面又は発光ウェル開放口3aに向かう光は、光反射部11又は光反射膜12で反射され、底面から発光ウェル3の外に出る。光反射膜12は通気性を有するが、このことにより、発光ウェル3内部の加圧又は減圧が可能となっている。また、光反射膜12は、発光ウェル3内への微生物等の不純物の混入を防止するフィルターとしても機能する。光反射部11は、光を反射する材料で構成されていればよい。そのような材料としては、アルミニウム、ニッケル、チタン、クロム、金、銅、鉄等の金属が挙げられる。また、光反射膜12は、光を反射する通気性の材料で構成されていればよい。そのような材料としては、ポリテトラフルオロエチレン、ポリビニリデンフロライド等が挙げられる。なお、光反射膜12の平均孔径としては、発光ウェル3への微生物等の不純物の混入を防ぐために、0.1〜1μmが好ましい。
【0026】
抽出ウェル開放口42aは、フィルター13で覆われている。このことにより、抽出ウェル42内への微生物等の不純物の混入が防止され、また、発光ウェル3内部の加圧又は減圧が可能となっている。なお、フィルター13の平均孔径としては、抽出ウェル42への微生物等の不純物の混入を防ぐために、0.1〜1μmが好ましい。
【0027】
検体液導入ウェル2及び抽出ウェル42は流路41によって接続されている。具体的には、流路41の一端は検体液導入ウェル2のテーパ状の底面の端部に接続され、流路41の他端は抽出ウェル42の側壁面に接続されている。従って、検体液導入ウェル2内の検体液は、流路41を経て抽出ウェル42に流入することができる。また、抽出ウェル42及び発光ウェル3は流路43によって接続されている。具体的には、流路43の一端は抽出ウェル42のテーパ状の底面の端部に接続され、流路43の他端は発光ウェル3の側壁面に接続されている。従って、抽出ウェル42内の検体液は、流路43を経て発光ウェル3に流入することができる。なお、抽出ウェル42は流路41及び流路43とともに流路4を構成している。すなわち、流路4は検体液導入ウェル2及び発光ウェル3を接続している。
【0028】
また、流路41は蛇行状に形成されているので、直線状である場合と比較して、十分に長くなっている。また、流路41の内壁面には、ATP分解酵素が固定化され(図には示されていない)、流路41を流通する液体中のATPが分解除去されるようになっている。ATP分解酵素としては、アピラーゼ、アデノシンリン酸デアミナーゼ、ルシフェラーゼ等が挙げられる。
【0029】
次に、検査用チップ10を用いて検体中の微生物を検出する方法について説明する。
【0030】
まず、検体液を検体液導入ウェル2に導入する。また、受光部21aを有する光検出器21を、受光部21aが発光ウェル3に対向して基板1cの表面に接するように設置する。また、圧力ポート22及び23を、それぞれ検体液導入ウェル開放口2a及び抽出ウェル開放口42aを覆うように設置する。なお、図2では、光検出器21、受光部21a、圧力ポート22及び23が二点鎖線で示されている。
【0031】
次に、検体液導入ウェル2に導入された検体液を、検体液導入ウェル2の内部を圧力ポート22で加圧することによって、流路41に流通させて抽出ウェル42に収容させる。検体液が抽出ウェル42に収容されると、抽出ウェル42に収納されている固形状の抽出試薬6が検体液に溶解し、抽出ウェル42内で微生物中のATPが抽出される。
【0032】
最後に、ATPの抽出に十分な時間が経過した後、抽出ウェル42の内部を圧力ポート23で加圧することによって、抽出ウェル42に収容された検体液を、流路43に流通させて発光ウェル3に収容させる。このとき、検体液の逆流、及び抽出ウェル42内の圧力損失を防ぐために、同時に検体液導入ウェル2の内部を圧力ポート22で加圧する。検体液が発光ウェル3に収容されると、固形状の発光試薬5が検体液に溶解し、発光ウェル3内で検体液中のATPと反応し、発光が生じる。発光試薬5から発せられる光は受光部21aに入射され、光検出器21で検出される。こうして検体中の微生物が検出される。
【0033】
検査用チップ10を用いれば、試薬溶液を予め調製する必要がなく、試薬が検体液に溶解すると同時に、検体と試薬との反応が開始するので、試薬の活性を十分に高く維持したまま、試薬を検体との反応に供することができる。また、試薬溶液を予め調製する必要がないので、試薬溶液の調製又は分注に伴って反応場に微生物等の不純物が混入するおそれがなくなり、それだけ高い精度で微生物を検出することができる。また、試薬溶液の調製及び分注が不要なので、それだけ簡便に微生物を検出することができる。
【0034】
また、検査用チップ10では、流路41が蛇行状に形成されていて十分に長いので、検体液が流路41を流通する間に、流路41の内壁面に固定化されているATP分解酵素によって、検体液中のバックグラウンドATPがほぼ完全に分解除去される。従って、検査用チップ10を用いれば、それだけ高い精度で微生物を検出することができる。
【0035】
また、検査用チップ10では、発光試薬5から発せられる光のうち、発光ウェル3の側壁面又は発光ウェル開放口3aに向かう光が、光反射部11又は光反射膜12で反射され、発光ウェル3の底面から発光ウェル3の外側に出射された後、受光部21aに入射される。従って、検査用チップ10を用いれば、受光部21aに入射される光の量が多くなり、それだけ高い感度で微生物を検出することができる。
【0036】
また、検査用チップ10では、発光ウェル開放口3aが光反射膜12で、抽出ウェル開放口42aがフィルター13で覆われていることにより、発光ウェル3及び抽出ウェル42内への微生物等の不純物の混入が防止される。従って、検査用チップ10を用いれば、それだけ高い精度で微生物を検出することができる。
【0037】
また、検査用チップ10では、流路41が検体液導入ウェル2のテーパ状の底面の端部に接続されているので、検体液導入ウェル2に収容されている検体液を流路41に流出させる操作を行った場合、ウェル内に残存する検体液の量が十分に少なくなる。また、流路43が抽出ウェル42のテーパ状の底面の端部に接続されているので、抽出ウェル42に収容されている検体液を流路41に流出させる操作を行った場合、ウェル内に残存する検体液の量が十分に少なくなる。このように、検体液導入ウェル2及び抽出ウェル42に残存する検体液の量が十分に少なくなるので、検査用チップ10を用いれば、導入した検体液中の検体の量に対応する発光強度を高い精度で測定することができ、また、それだけ高い精度で、かつ再現性よく微生物を検出することができる。ここで、検体液導入ウェル2及び抽出ウェル42のテーパ状の底面と基板1aの表面とがなす角度は特に限定されないが、例えば30〜60度であればよい。
【0038】
また、検査用チップ10では、流路41が抽出ウェル42の側壁面に接続されているので、流路41を流通してきた検体液が、抽出ウェル42に収納されている固体状の抽出試薬6の上方から抽出ウェル42に流入し、固体状の抽出試薬6の溶解が上下両方向から進むことになる。すなわち、一方で、流路41から流出され、固体状の抽出試薬6に直接当たる検体液によって、固体状の抽出試薬6の上側部分が溶解され、他方で、抽出ウェル42に貯留する検体液によって、固体状の抽出試薬6の下側部分が溶解される。従って、検査用チップ10を用いれば、それだけ抽出試薬6の溶解速度が大きくなり、迅速に微生物を検出することができる。
【0039】
また、検体液導入ウェル2の内部を加圧して検体液を抽出ウェル42に移送する場合において、流路41が、例えば抽出ウェル42の底面に接続されていると、空気が、検体液導入ウェル2から流路41を経て、抽出ウェル42に貯留されている検体液中に導入され、検体液中に気泡が発生し、この気泡が抽出ウェル42から流路43への検体液の流出を妨げるおそれがある。これに対し、検査用チップ10では、流路41が、抽出ウェル42の側壁面に接続されているので、検体液の量を最適化することによって、上述のような検体液中における気泡の発生が防止される。すなわち、流路41が、抽出ウェル42の側壁面のうち、抽出ウェル42に収容される検体液の液面より上の部分に接続されている場合は、上述のような気泡の発生が防止される。従って、検査用チップ10を用いれば、検体液の量を最適化することによって、それだけ、検体液が円滑に抽出ウェル42から流路43を経て発光ウェル3に移送され、円滑に微生物を検出することができる。
【0040】
また、流路41が、抽出ウェル42の側壁面のうち、抽出ウェル42に収容される検体液の液面より上の部分に接続されている場合は、収容された検体液の逆流が確実に防止される。また、検体液を流路43に流出させる際には、検体液の逆流を防ぐために、検体液導入ウェル2の内部を加圧する必要がない。従って、検査用チップ10を用いれば、検体液の量を最適化することによって、それだけ高い精度で、かつ簡便に微生物を検出することができる。
【0041】
同様に、流路43が発光ウェル3の側壁面に接続されているので、固体状の発光試薬5の溶解が上下両方向から進むことになる。従って、検査用チップ10を用いれば、それだけ発光試薬5の溶解速度が大きくなり、迅速に微生物を検出することができる。
【0042】
次に、検査用チップ10の製造方法を説明する。検査用チップ10は、例えば、次のように製造することができる。
【0043】
まず、シリコンウェハ上にレジストを塗布し、流路41及び43に対応した形状にパターニング(露光、現像)した後、シリコンウェハの表面部分をエッチングする。こうしてシリコン表面に流路41及び43に対応した凸部が形成される。そして、検体液導入ウェル2、発光ウェル3及び抽出ウェル42に対応した凸部が形成された金型を用意し、レジストが除去されたシリコンウェハと金型とを、双方の凸部が向かい合うように、対向させる。その後、シリコンウェハと金型とが対向して形成された空隙に未硬化のPDMSを注入する。
【0044】
次に、PDMSを硬化(125℃、20分)させ、PDMSを剥離することにより、検体液導入ウェル2、発光ウェル3、抽出ウェル42、流路41及び43の形状を有するPDMS硬化物が得られる。PDMS硬化物は、各ウェルと流路とが接続されるように加工(穴あけ加工等)が施される。
【0045】
次に、ガラスウェハ上に別の未硬化のPDMSを塗布し、仮硬化(50℃、10分)させる。仮硬化したPDMSの上に先のPDMS硬化物を貼り合わせ、仮硬化したPDMSを硬化(125℃、20分)する。
【0046】
最後に、流路41の内壁面にATP分解酵素を固定化させる。ATP分解酵素の固定化は、例えば、次のように行うことができる。まず、流路41にATP分解酵素の溶液を流通させた後、開放部(検体液導入ウェル2、発光ウェル3及び抽出ウェル42)をすべてシールし、冷蔵庫内(約4℃)で約5時間放置する。次に、流路41にバッファーを流通させて、ATP分解酵素のうち、脱離しやすいものを取り除き、最後に、流路41の内部を空気で置換する。
【0047】
ATP分解酵素が流路41の内壁面に固定化されたかどうか、及び固定化された酵素のATP分解能を判定するには、例えば、流路41にATP溶液を流通させた後、抽出ウェル42に収容された反応済溶液を回収し、ここにホタルルシフェリン及びホタルルシフェラーゼを加えて、ルミテスターで発光量を測定すればよい。元のATP溶液に比べて発光量が減少していれば、ATP分解酵素が固定化されていると判定することができる。また、発光量の減少量の大小によって、ATP分解能を判定することができる。
【0048】
検査用チップ10は、ウェル及び流路内の検体液の温度を調節することができる恒温装置とともに用いるのが好ましい。検体と試薬との反応は発熱又は吸熱を伴うため、検体液の温度を調節しないと、温度変化により反応が不安定になるおそれがある。また、温度が変化すると、液体が膨張して不要な気泡が発生し、流路(ウェル部分を除く。)の目詰まりが生じるおそれがある。恒温装置とともに用いれば、そのようなトラブルを未然に防ぐことができる。
【0049】
(第2実施形態)
本発明の第2実施形態について、図3及び4を参照して説明する。図3は、第2実施形態に係る検査用チップの平面図である。図4は、図3のIV−IV線に沿った断面図である。
【0050】
第2実施形態に係る検査用チップ20は、基板1aに、流路43の一部を構成している増幅ウェル(第4のウェル)45が更に形成され、基板1aの表面のうち、基板1aに対して基板1bと反対側の表面に、増幅ウェル開放口(第4の開口)45aが形成され、更に、増幅ウェル45に固形状の増幅試薬7が収納されている点で、検査用チップ10と相違する。
【0051】
増幅ウェル45は、増幅ウェル開放口45aの縁部から基板1b側に向かって円筒状に延びる側壁面と、その側壁面の端部に接続される底面と、によって形成されている。ここで、増幅ウェル45の底面は、側壁面の端部から遠ざかる方向へ窪んでいる。具体的には、上記底面は、基板1aの表面に平行な仮想平面でウェル(側壁面によって形成される円柱状の部分を除く。)を切断したときの開口の面積が、基板1aから基板1bに向かって小さくなるように、テーパ状(円錐状又は円錐台状)に形成されている。
【0052】
上述したとおり、増幅ウェル45には、固形状の増幅試薬7が収納されている。増幅試薬7としては、例えば、アデノシン一リン酸(AMP)、ポリリン酸、アデニル酸キナーゼ(ADK)及びポリリン酸キナーゼ(PPK)からなる試薬が挙げられる。ATPは、アデニル酸キナーゼの存在下でAMPと反応して2分子のADPを生じ、この2分子のADPは、ポリリン酸キナーゼの存在下でポリリン酸と反応して2分子のATPを生じる。この反応を繰り返すことにより、ATPは増幅される。固形状の増幅試薬7は、酵素を含有する場合は、凍結乾燥されたものであることが好ましい。凍結乾燥された試薬は、長期(例えば、半年以上)に渡って本来の活性を維持することができる。
【0053】
また、増幅ウェル開放口45aは、フィルター14で覆われている。フィルター14は、増幅ウェル45内への微生物等の不純物の混入を防止するためのものである。フィルター14としては、フィルター13と同様のものを用いればよい。
【0054】
また、抽出ウェル42及び増幅ウェル45は流路44によって接続されている。具体的には、流路44の一端は抽出ウェル42のテーパ状の底面の端部に接続され、流路44の他端は増幅ウェル45の側壁面に接続されている。従って、抽出ウェル42内の検体液は、流路44を経て増幅ウェル45に流入することができる。また、増幅ウェル45及び発光ウェル3は流路46によって接続されている。具体的には、流路46の一端は増幅ウェル45のテーパ状の底面の端部に接続され、流路46の他端は発光ウェル3の側壁面に接続されている。従って、増幅ウェル45内の検体液は、流路46を経て発光ウェル3に流入することができる。なお、増幅ウェル45は流路44及び流路46とともに流路43を構成している。すなわち、流路43は増幅ウェル45及び発光ウェル3を接続している。
【0055】
流路41の内壁面に固定化されるATP分解酵素としては、ADP分解酵素を兼ねるものが好ましい。ここで、ATP分解酵素が「ADP分解酵素を兼ねる」とは、ATP分解酵素、すなわちATP分解酵素活性を有する物質(例えば、タンパク質)が更にADP分解酵素活性を有することを意味し、当該物質においてATP分解酵素活性部位及びADP分解酵素活性部位が異なっていてもよい。上記ATP分解酵素がADP分解酵素を兼ねれば、検体液と抽出試薬6、増幅試薬7及び発光試薬5とが混合される前に、バックグラウンドATP、及び検体液中に混入しているADP(以下、「バックグラウンドADP」という。)が分解除去される。増幅試薬7によってATPが増幅される際には、検体液中のADPがATPに変換されて増幅されるので、バックグラウンドATPに加えて、バックグラウンドADPが、検体液と増幅試薬7とが混合される前に分解除去されれば、それだけ高い精度で微生物を検出することができる。ADP分解酵素を兼ねるATP分解酵素としては、アピラーゼが挙げられる。
【0056】
次に、検査用チップ20を用いて検体中の微生物を検出する方法について説明する。
【0057】
まず、検体液を検体液導入ウェル2に導入する。また、受光部21aを有する光検出器21を、受光部21aが発光ウェル3に対向して基板1cの表面に接するように設置する。また、圧力ポート22、23及び24を、それぞれ検体液導入ウェル開放口2a、抽出ウェル開放口42a及び増幅ウェル開放口45aを覆うように設置する。なお、図4では、光検出器21、受光部21a、圧力ポート24が二点鎖線で示されている(圧力ポート22及び23は、図4には示されていない)。
【0058】
次に、検体液導入ウェル2に導入された検体液を、検体液導入ウェル2の内部を圧力ポート22で加圧することによって、流路41に流通させて抽出ウェル42に収容させる。検体液が抽出ウェル42に収容されると、抽出ウェル42に収納されている固形状の抽出試薬6が検体液に溶解し、抽出ウェル42内で微生物中のATPが抽出される。
【0059】
次に、ATPの抽出に十分な時間が経過した後、抽出ウェル42の内部を圧力ポート23で加圧することによって、抽出ウェル42に収容された検体液を、流路44に流通させて増幅ウェル45に収容させる。このとき、検体液の逆流、及び抽出ウェル42内の圧力損失を防ぐために、同時に検体液導入ウェル2の内部を圧力ポート22で加圧する。検体液が増幅ウェル45に収容されると、増幅ウェル45に収納されている固形状の増幅試薬7が検体液に溶解し、増幅ウェル45内で検体液中のATPと反応し、検体液中のATPが増幅される。
【0060】
最後に、ATPの増幅に十分な時間が経過した後、増幅ウェル45の内部を圧力ポート24で加圧することによって、増幅ウェル45に収容された検体液を、流路46に流通させて発光ウェル3に収容させる。このとき、検体液の逆流、及び増幅ウェル45内の圧力損失を防ぐために、同時に検体液導入ウェル2及び抽出ウェル42の内部をそれぞれ圧力ポート22及び23で加圧する。検体液が発光ウェル3に収容されると、発光ウェル3に収納されている固形状の発光試薬5が検体液に溶解し、発光ウェル3内で検体液中のATPと反応し、発光が生じる。発光試薬5から発せられる光は受光部21aに入射され、光検出器21で検出される。こうして検体中の微生物が検出される。
【0061】
検査用チップ20では、増幅ウェル開放口45aがフィルター14で覆われていることにより、増幅ウェル45内への微生物等の不純物の混入が防止される。従って、検査用チップ20を用いれば、それだけ高い精度で微生物を検出することができる。フィルター14としては、フィルター13と同様のものを用いればよい。
【0062】
また、検査用チップ20では、流路44が抽出ウェル42のテーパ状の底面の端部に接続されているので、抽出ウェル42に収容されている検体液を流路44に流出させる操作を行った場合、ウェル内に残存する検体液の量が十分に少なくなる。また、流路46が増幅ウェル45のテーパ状の底面の端部に接続されているので、増幅ウェル45に収容されている検体液を流路46に流出させる操作を行った場合、ウェル内に残存する検体液の量が十分に少なくなる。このように、抽出ウェル42及び増幅ウェル45に残存する検体液の量が十分に少なくなるので、検査用チップ20を用いれば、導入した検体液中の検体の量に対応する発光強度を高い精度で測定することができ、また、それだけ高い精度で、かつ再現性よく微生物を検出することができる。ここで、抽出ウェル42及び増幅ウェル45のテーパ状の底面と基板1aの表面とがなす角度は特に限定されないが、例えば30〜60度であればよい。
【0063】
また、検査用チップ20では、流路44が増幅ウェル45の側壁面に接続されているので、流路44を流通してきた検体液が、増幅ウェル45に収納されている固体状の増幅試薬7の上方から増幅ウェル45に流入し、固体状の増幅試薬7の溶解が上下両方向から進むことになる。すなわち、一方で、流路44から流出され、固体状の増幅試薬7に直接当たる検体液によって、固体状の増幅試薬7の上側部分が溶解され、他方で、増幅ウェル45に貯留する検体液によって、固体状の増幅試薬7の下側部分が溶解される。従って、検査用チップ20を用いれば、それだけ増幅試薬7の溶解速度が大きくなり、迅速に微生物を検出することができる。
【0064】
また、抽出ウェル42の内部を加圧して検体液を増幅ウェル45に移送する場合において、流路44が、例えば増幅ウェル45の底面に接続されていると、空気が、抽出ウェル42から流路44を経て、増幅ウェル45に貯留されている検体液中に導入され、検体液中に気泡が発生し、この気泡が増幅ウェル45から流路46への検体液の流出を妨げるおそれがある。これに対し、検査用チップ20では、流路44が、増幅ウェル45の側壁面に接続されているので、検体液の量を最適化することによって、上述のような検体液中における気泡の発生が防止される。すなわち、流路44が、増幅ウェル45の側壁面のうち、増幅ウェル45に収容される検体液の液面より上の部分に接続されている場合は、上述のような気泡の発生が防止される。従って、検査用チップ20を用いれば、検体液の量を最適化することによって、それだけ、検体液が円滑に増幅ウェル45から流路46を経て発光ウェル3に移送され、円滑に微生物を検出することができる。
【0065】
また、流路44が、増幅ウェル45の側壁面のうち、増幅ウェル45に収容される検体液の液面より上の部分に接続されている場合は、収容された検体液の逆流が確実に防止される。また、検体液を流路46に流出させる際には、検体液の逆流を防ぐために、検体液導入ウェル2又は抽出ウェル42の内部を加圧する必要がない。従って、検査用チップ20を用いれば、検体液の量を最適化することによって、それだけ高い精度で、かつ簡便に微生物を検出することができる。
【0066】
同様に、流路46が発光ウェル3の側壁面に接続されているので、固体状の発光試薬5の溶解が上下両方向から進むことになる。従って、検査用チップ20を用いれば、それだけ発光試薬5の溶解速度が大きくなり、迅速に微生物を検出することができる。
【0067】
また、検査用チップ20を用いれば、検体液中のバックグラウンドATPがATP分解酵素によって分解除去され、微生物中のATPが抽出試薬6によって抽出された後、検体液と発光試薬5とが混合される前に検体液中のATPが増幅されるので、それだけ高い感度で微生物を検出することができる。なお、ATP分解酵素がADP分解酵素を兼ねていれば、バックグラウンドATPに加えて、バックグラウンドADPも分解除去されるので、更に高い精度で微生物を検出することができる。
【0068】
(第3実施形態)
本発明の第3実施形態について、図5及び6を参照して説明する。図5は、第3実施形態に係る検査用チップの平面図である。図6は、図5のVI−VI線に沿った断面図である。
【0069】
第3実施形態に係る検査用チップ30は、基板1aに、流路41の一部を構成しているビーズ収納ウェル48が更に形成され、基板1aの表面のうち、基板1aに対して基板1bと反対側の表面に、ビーズ収納ウェル開放口48aが更に形成されている点でも、検査用チップ10と相違する。また、検査用チップ30は、流路41の内壁面にATP分解酵素が固定化される代わりに、ビーズ収納ウェル48に、ATP分解酵素が固定化されたビーズ8が収納されている点でも、検査用チップ10と相違する。
【0070】
ビーズ8に固定化されたATP分解酵素は、ビーズ収納ウェル48に収容された液体中のATPを分解除去するものである。ATP分解酵素としては、第1実施形態に係る検査用チップ10において流路41の内壁面に固定化されるATP分解酵素と同様のものを用いることができ、また、ADP分解酵素を兼ねるものが好ましい。
【0071】
また、ビーズ収納ウェル開放口48aは、フィルター15で覆われている。フィルター15は、ビーズ収納ウェル48内への微生物等の不純物の混入を防止するためのものである。フィルター15としては、フィルター13と同様のものを用いればよい。
【0072】
また、ビーズ収納ウェル48は、ビーズ収納ウェル開放口48aの縁部から基板1b側に向かって円筒状に延びる側壁面と、その側壁面の端部に接続される底面と、によって形成されている。ここで、ビーズ収納ウェル48の底面は、側壁面の端部から遠ざかる方向へ窪んでいる。具体的には、上記底面は、基板1aの表面に平行な仮想平面でウェル(側壁面によって形成される円柱状の部分を除く。)を切断したときの開口の面積が、基板1aから基板1bに向かって小さくなるように、テーパ状(円錐状又は円錐台状)に形成されている。
【0073】
また、検体液導入ウェル2及びビーズ収納ウェル48は流路47によって接続されている。具体的には、流路47の一端は検体液導入ウェル2のテーパ状の底面の端部に接続され、流路47の他端はビーズ収納ウェル48の側壁面に接続されている。従って、検体液導入ウェル2内の検体液は、流路47を経てビーズ収納ウェル48に流入することができる。また、ビーズ収納ウェル48及び抽出ウェル42は流路49によって接続されている。具体的には、流路49の一端はビーズ収納ウェル48のテーパ状の底面の端部に接続され、流路49の他端は抽出ウェル42の側壁面に接続されている。従って、抽出ウェル42内の検体液は、流路49を経て抽出ウェル42に流入することができる。ビーズ収納ウェル48と流路49との接続部は、フィルター16で覆われている。ここで、フィルター16は、微生物の透過を許容し、かつビーズ8の流出を防ぐものであればよい。また、ビーズ8の平均径は、微生物よりも大きいことが好ましい。このことから、ビーズ8の平均径としては10μm以上が好ましく、フィルター16の平均孔径としては10μm未満が好ましい。なお、ビーズ収納ウェル48は流路47及び流路49とともに流路41を構成している。すなわち、流路41は検体液導入ウェル2及び抽出ウェル42を接続している。
【0074】
次に、検査用チップ30を用いて検体中の微生物を検出する方法について説明する。
【0075】
まず、検体液を検体液導入ウェル2に導入する。また、受光部21aを有する光検出器21を、受光部21aが発光ウェル3に対向して基板1cの表面に接するように設置する。また、圧力ポート22、26及び23を、それぞれ検体液導入ウェル開放口2a、ビーズ収納ウェル開放口48a及び抽出ウェル開放口42aを覆うように設置する。なお、図6では、光検出器21、受光部21a、圧力ポート26及び24が二点鎖線で示されている(圧力ポート22は、図6には示されていない)。
【0076】
次に、検体液導入ウェル2に導入された検体液を、検体液導入ウェル2の内部を圧力ポート22で加圧することによって、流路47に流通させてビーズ収納ウェル48に収容させる。検体液がビーズ収納ウェル48に収容されると、検体液中のバックグラウンドATPが、ビーズ8に固定化されているATP分解酵素と反応し、ビーズ収納ウェル48内で分解される。
【0077】
次に、バックグラウンドATPの分解に十分な時間が経過した後、ビーズ収納ウェル48の内部を圧力ポート26で加圧することによって、ビーズ収納ウェル48に収容された検体液を、流路49に流通させて抽出ウェル42に収容させる。このとき、検体液の逆流、及びビーズ収納ウェル48内の圧力損失を防ぐために、同時に検体液導入ウェル2の内部を圧力ポート22で加圧する。検体液が抽出ウェル42に収容されると、抽出ウェル42に収納されている固形状の抽出試薬6が検体液に溶解し、抽出ウェル42内で微生物中のATPが抽出される。
【0078】
最後に、ATPの抽出に十分な時間が経過した後、抽出ウェル42の内部を圧力ポート23で加圧することによって、抽出ウェル42に収容された検体液を、流路43に流通させて発光ウェル3に収容させる。このとき、検体液の逆流、及び抽出ウェル42内の圧力損失を防ぐために、同時に検体液導入ウェル2及びビーズ収納ウェル48の内部をそれぞれ圧力ポート22及び26で加圧する。検体液が発光ウェル3に収容されると、固形状の発光試薬5が検体液に溶解し、発光ウェル3内で検体液中のATPと反応し、発光が生じる。発光試薬5から発せられる光は受光部21aに入射され、光検出器21で検出される。こうして検体中の微生物が検出される。
【0079】
検査用チップ30では、検体液がビーズ収納ウェル48に収容されている間に、ビーズ8に固定化されたATP分解酵素によって検体液中のバックグラウンドATPがほぼ完全に分解除去される。従って、検査用チップ30を用いれば、それだけ高い精度で微生物を検出することができる。
【0080】
また、検査用チップ30では、ビーズ収納ウェル48に、ATP分解酵素が固定化されたビーズ8が収納されているので、十分な量のATP分解酵素をチップ内に固定化するために、検査用チップ10のように流路41を蛇行状に形成する必要がない。従って、検査用チップ30では、チップに検査用チップ10と同様のバックグラウンドATP除去能力を持たせ、かつチップを検査用チップ10より小型化することができる。
【0081】
また、検査用チップ30では、ビーズ収納ウェル開放口48aがフィルター15で覆われていることにより、ビーズ収納ウェル48内への微生物等の不純物の混入が防止される。従って、検査用チップ30を用いれば、それだけ高い精度で微生物を検出することができる。
【0082】
また、検査用チップ30では、流路47が検体液導入ウェル2のテーパ状の底面の端部に接続されているので、検体液導入ウェル2に収容されている検体液を流路47に流出させる操作を行った場合、ウェル内に残存する検体液の量が十分に少なくなる。また、流路49がビーズ収納ウェル48のテーパ状の底面の端部に接続されているので、ビーズ収納ウェル48に収容されている検体液を流路49に流出させる操作を行った場合、ウェル内に残存する検体液の量が十分に少なくなる。このように、検体液導入ウェル2及びビーズ収納ウェル48に残存する検体液の量が十分に少なくなるので、検査用チップ30を用いれば、導入した検体液中の検体の量に対応する発光強度を高い精度で測定することができ、また、それだけ高い精度で、かつ再現性よく微生物を検出することができる。ここで、検体液導入ウェル2及びビーズ収納ウェル48のテーパ状の底面と基板1aの表面とがなす角度は特に限定されないが、例えば30〜60度であればよい。
【0083】
また、検査用チップ30では、流路47がビーズ収納ウェル48の側壁面に接続されているので、流路47を流通してきた検体液が、ビーズ収納ウェル48に収納されているビーズ8の上方からビーズ収納ウェル48に流入し、ビーズ8と検体液との接触が上下両方向から進むことになる。すなわち、一方で、流路47から流出され、ビーズ8に直接当たる検体液中のATPは、ビーズ8の上側部分に固定化されたATP分解酵素と反応し、他方で、増幅ウェル45に貯留する検体液中のATPは、固体状の増幅試薬7の下側部分に固定化されたATP分解酵素と反応する。従って、検査用チップ30を用いれば、それだけ、ビーズ8に固定化されたATP分解酵素と検体液中のATPとの反応速度が大きくなり、迅速に微生物を検出することができる。
【0084】
また、検体液導入ウェル2の内部を加圧して検体液をビーズ収納ウェル48に移送する場合において、流路47が、例えばビーズ収納ウェル48の底面に接続されていると、空気が、検体液導入ウェル2から流路47を経て、ビーズ収納ウェル48に貯留されている検体液中に導入され、検体液中に気泡が発生し、この気泡がビーズ収納ウェル48から流路49への検体液の流出を妨げるおそれがある。これに対し、検査用チップ30では、流路47が、ビーズ収納ウェル48の側壁面に接続されているので、検体液の量を最適化することによって、上述のような検体液中における気泡の発生が防止される。すなわち、流路47が、ビーズ収納ウェル48の側壁面のうち、ビーズ収納ウェル48に収容される検体液の液面より上の部分に接続されている場合は、上述のような気泡の発生が防止される。従って、検査用チップ30を用いれば、検体液の量を最適化することによって、それだけ、検体液が円滑にビーズ収納ウェル48から流路49を経て抽出ウェル42に移送され、円滑に微生物を検出することができる。
【0085】
また、流路47が、ビーズ収納ウェル48の側壁面のうち、ビーズ収納ウェル48に収容される検体液の液面より上の部分に接続されている場合は、収容された検体液の逆流が確実に防止される。また、検体液を流路49に流出させる際には、検体液の逆流を防ぐために、検体液導入ウェル2の内部を加圧する必要がない。従って、検査用チップ30を用いれば、検体液の量を最適化することによって、それだけ高い精度で、かつ簡便に微生物を検出することができる。
【0086】
同様に、流路43が発光ウェル3の側壁面に接続されているので、固体状の発光試薬5の溶解が上下両方向から進むことになる。従って、検査用チップ30を用いれば、それだけ発光試薬5の溶解速度が大きくなり、迅速に微生物を検出することができる。
【0087】
(第4実施形態)
本発明の第4実施形態について、図7及び8を参照して説明する。図7は、第4実施形態に係る検査用チップの平面図である。図8は、図7のVIII−VIII線に沿った断面図である。
【0088】
第4実施形態に係る検査用チップ40は、基板1aに、廃液収容ウェル51及び補助液収容ウェル52が更に形成され、基板1aの表面のうち、基板1aに対して基板1bと反対側の表面に、廃液収容ウェル開放口51a及び補助液収容ウェル開放口52aが形成されている点で、第1実施形態に係る検査用チップ10と相違する。また、検査用チップ40は、抽出ウェル42が流路4の一部を構成していない点でも、検査用チップ10と相違する。また、検査用チップ40は、流路4が蛇行状の部分を有しない点、及びすべての流路において、両端がウェルの底面に接続されている点でも、検査用チップ10と相違する。
【0089】
補助液収容ウェル52は、補助液収容ウェル開放口52aの縁部から基板1b側に向かって円筒状に延びる側壁面と、その側壁面の端部に接続される底面と、によって形成されている。ここで、補助液収容ウェル52の底面は、側壁面の端部から遠ざかる方向へ窪んでいる。具体的には、上記底面は、基板1aの表面に平行な仮想平面でウェル(側壁面によって形成される円柱状の部分を除く。)を切断したときの開口の面積が、基板1aから基板1bに向かって小さくなるように、テーパ状(円錐状又は円錐台状)に形成されている。
【0090】
また、検体液導入ウェル2及び廃液収容ウェル51は流路53によって接続されている。具体的には、流路53の一端は検体液導入ウェル2のテーパ状の底面の端部に接続され、流路53の他端は廃液収容ウェル51の側壁面に接続されている。従って、検体液導入ウェル2内の液体は、流路53を経て廃液収容ウェル51に流入することができる。検体液導入ウェル2と流路53との接続部は、フィルター17で覆われている。フィルター17は検出対象の微生物を捕捉するためのものである。このことから、フィルター17の平均孔径としては0.1〜1μmが好ましい。
【0091】
また、補助液収容ウェル52及び検体液導入ウェル2は流路54によって接続されている。具体的には、流路54の一端は補助液収容ウェル52のテーパ状の底面の端部に接続され、流路54の他端は検体液導入ウェル2の側壁面に接続されている。従って、補助液収容ウェル52内の液体は、流路54を経て検体液導入ウェル2に流入することができる。
【0092】
また、補助液収容ウェル52及び抽出ウェル42は流路55によって接続されている。具体的には、流路55の一端は補助液収容ウェル52のテーパ状の底面の端部に接続され、流路55の他端は抽出ウェル42の側壁面に接続されている。従って、補助液収容ウェル52内の液体は、流路55を経て抽出ウェル42に流入することができる。
【0093】
また、抽出ウェル42及び検体液導入ウェル2は流路56によって接続されている。具体的には、流路56の一端は抽出ウェル42のテーパ状の底面の端部に接続され、流路56の他端は検体液導入ウェル2の側壁面に接続されている。従って、抽出ウェル42内の液体は、流路56を経て検体液導入ウェル2に流入することができる。
【0094】
また、検体液導入ウェル2及び発光ウェル3は流路4によって接続されている。具体的には、流路4の一端は検体液導入ウェル2のテーパ状の底面の端部に接続され、流路4の他端は発光ウェル3の側壁面に接続されている。従って、検体液導入ウェル2内の液体は、流路4を経て発光ウェル3に流入することができる。
【0095】
次に、検査用チップ40を用いて検体中の微生物を検出する方法について説明する。
【0096】
まず、検体液を検体液導入ウェル2に導入し、補助液を補助液収容ウェル52に収容させる。ここで、補助液としては、例えば、純水、LP(ポリソルベート80、レシチン及びペプトンから構成される)希釈液等が挙げられる。補助液内に混入しているATP及び微生物は、オートクレーブ処理等により予め除去されていることが好ましい。
【0097】
また、受光部21aを有する光検出器21を、受光部21aが発光ウェル3に対向して基板1cの表面に接するように設置する。また、圧力ポートを、検体液導入ウェル開放口2a、廃液収容ウェル開放口51a、補助液収容ウェル開放口52a、抽出ウェル開放口42a及び発光ウェル開放口3aを覆うように設置する。なお、図8では、光検出器21、受光部21a、圧力ポート22、23及び27が二点鎖線で示されている(圧力ポート22、23及び27は、それぞれ検体液導入ウェル開放口2a、抽出ウェル開放口42a及び発光ウェル開放口3aを覆っている)。
【0098】
次に、検体液導入ウェル2に導入された検体液を、検体液導入ウェル2の内部を圧力ポート22で加圧することによって、流路53に流通させて廃液収容ウェル51に収容させる。このとき、他のウェルへの検体液の流入、及び検体液導入ウェル2内の圧力損失を防ぐために、同時に補助液収容ウェル52、抽出ウェル42及び発光ウェル3の内部を圧力ポートで加圧する。検体液が検体液導入ウェル2から流出し、廃液収容ウェル51に収容されると、フィルター17によって、検体液中の微生物が検体液導入ウェル2内に残存し、それ以外の成分(バックグラウンドATPを含む。)が検体液導入ウェル2から流出し、廃液収容ウェル51に収容される。
【0099】
次に、補助液収容ウェル52に収容されている補助液を、補助液収容ウェル52の内部を圧力ポートで加圧することによって、流路54に流通させて検体液導入ウェル2に収容させる。このとき、抽出ウェル42への補助液の流入を防ぐために、同時に抽出ウェル42の内部を圧力ポート23で加圧する。
【0100】
次に、検体液導入ウェル2に収容された補助液を、検体液導入ウェル2の内部を圧力ポート22で加圧することによって、流路53に流通させて廃液収容ウェル51に収容させる。このとき、他のウェルへの検体液の流入、及び検体液導入ウェル2内の圧力損失を防ぐために、同時に補助液収容ウェル52、抽出ウェル42及び発光ウェル3の内部を圧力ポートで加圧する。補助液が検体液導入ウェル2から流出し、廃液収容ウェル51に収容されると、フィルター17によって、検体液中の微生物以外の成分(バックグラウンドATPを含む。)は洗い流され、廃液収容ウェル51に収容される。
【0101】
次に、補助液収容ウェル52に収容されている補助液を、補助液収容ウェル52の内部を圧力ポートで加圧することによって、流路55に流通させて抽出ウェル42に収容させる。このとき、検体液導入ウェル2への補助液の流入を防ぐために、同時に検体液導入ウェル2の内部を圧力ポート22で加圧する。補助液が抽出ウェル42に収容されると、抽出ウェル42に収納されている固形状の抽出試薬6が補助液に溶解する。
【0102】
次に、抽出試薬6が溶解している補助液を、抽出ウェル42の内部を圧力ポート23で加圧することによって、流路56に流通させて検体液導入ウェル2に収容させる。このとき、補助液収容ウェル52への補助液の流入、及び抽出ウェル42内の圧力損失を防ぐために、同時に補助液収容ウェル52の内部を圧力ポートで加圧する。抽出試薬6が溶解している補助液が検体液導入ウェル2に収容されると、検体液導入ウェル2内で微生物中のATPが抽出される。
【0103】
最後に、ATPの抽出に十分な時間が経過した後、検体液導入ウェル2の内部を圧力ポート22で加圧することによって、検体液導入ウェル2に収容された補助液を、流路4に流通させて発光ウェル3に収容させる。このとき、他のウェルへの検体液の流入、及び検体液導入ウェル2内の圧力損失を防ぐために、同時に廃液収容ウェル51、補助液収容ウェル52及び抽出ウェル42の内部を圧力ポートで加圧する。補助液が発光ウェル3に収容されると、固形状の発光試薬5が補助液に溶解し、発光ウェル3内で補助液中のATPと反応し、発光が生じる。発光試薬5から発せられる光は受光部21aに入射され、光検出器21で検出される。こうして検体中の微生物が検出される。
【0104】
上述のように、検査用チップ40では、検体液中の微生物以外の成分(バックグラウンドATPを含む。)が、フィルター17によって、検体液導入ウェル2から洗い流され、廃液収容ウェル51に収容される。従って、検査用チップ40を用いれば、検体液中の微生物等の不純物に起因する発光を防止することができ、それだけ高い精度で微生物を検出することができる。
【0105】
また、検査用チップ40では、流路53及び4が検体液導入ウェル2のテーパ状の底面の端部に接続されているので、検体液導入ウェル2に収容されている検体液を流路53又は4に流出させる操作を行った場合、ウェル内に残存する検体液の量が十分に少なくなる。また、流路54及び55が補助液収容ウェル52のテーパ状の底面の端部に接続されているので、補助液収容ウェル52に収容されている検体液を流路54又は55に流出させる操作を行った場合、ウェル内に残存する検体液の量が十分に少なくなる。また、流路56が抽出ウェル42のテーパ状の底面の端部に接続されているので、抽出ウェル42に収容されている検体液を流路56に流出させる操作を行った場合、ウェル内に残存する検体液の量が十分に少なくなる。このように、検体液導入ウェル2、補助液収容ウェル52及び抽出ウェル42に残存する検体液の量が十分に少なくなるので、検査用チップ40を用いれば、導入した検体液中の検体の量に対応する発光強度を高い精度で測定することができ、また、それだけ高い精度で、かつ再現性よく微生物を検出することができる。ここで、検体液導入ウェル2、補助液収容ウェル52及び抽出ウェル42のテーパ状の底面と基板1aの表面とがなす角度は特に限定されないが、例えば30〜60度であればよい。
【0106】
また、検査用チップ40では、流路55及び4がそれぞれ抽出ウェル42及び発光ウェル3の側壁面に接続されているので、流路55又は4を流通してきた液体がそれぞれ、抽出ウェル42又は発光ウェル3に収納されている固体状の試薬の上方からウェルに流入し、固体状の抽出試薬6及び発光試薬5の溶解が上下両方向から進むことになる。従って、検査用チップ40を用いれば、それだけ抽出試薬6及び発光試薬5の溶解速度が大きくなり、迅速に微生物を検出することができる。
【0107】
また、検査用チップ40では、流路54及び56が各々、検体液導入ウェル2の側壁面に接続され、また、流路55が抽出ウェル42の側壁面に接続されているので、検体液及び補助液の量を最適化することによって、検体液導入ウェル2及び抽出ウェル42に貯留されている液体中における気泡の発生が防止される。従って、検査用チップ40を用いれば、検体液及び補助液の量を最適化することによって、それだけ、液体が円滑に検体液導入ウェル2から廃液収容ウェル51又は発光ウェル3へ、また、抽出ウェル42から検体液導入ウェル2へ移送され、円滑に微生物を検出することができる。
【0108】
また、検査用チップ40では、ウェルに液体が流入するための流路が、そのウェルの側壁面に接続されているので、検体液及び補助液の量を最適化することによって、収容された液体の逆流が確実に防止される。また、ウェルに収容された液体を流出させる際には、液体の逆流を防ぐために、他のウェルの内部を加圧する必要がない。従って、検査用チップ40を用いれば、検体液及び補助液の量を最適化することによって、それだけ高い精度で、かつ簡便に微生物を検出することができる。
【0109】
(第5実施形態)
本発明の第5実施形態について、図9及び10を参照して説明する。図9は、第5実施形態に係る検査用チップの平面図である。図10は、図9のX−X線に沿った断面図である。
【0110】
第5実施形態に係る検査用チップ50は、基板1aに、ATP分解ウェル57が更に形成され、基板1aの表面のうち、基板1aに対して基板1bと反対側の表面に、ATP分解ウェル開放口57aが形成され、更に、ATP分解ウェル57に固形状のATP分解酵素9が収納されている点で、第4実施形態に係る検査用チップ40と相違する。また、検査用チップ50は、廃液収容ウェル51が、流路4の途中から分岐した流路61に接続されている点でも、検査用チップ40と相違する。また、検査用チップ50は、流路4が蛇行状の部分(流路4a)を有し、この部分の内壁面に、検出対象の微生物と特異的に結合する抗体が固定化されている点でも、検査用チップ40と相違する。
【0111】
ATP分解酵素9としては、アピラーゼ、アデノシンリン酸デアミナーゼ、ルシフェラーゼ等が挙げられる。固形状のATP分解酵素9は、凍結乾燥されたものであることが好ましい。凍結乾燥された試薬は、長期(例えば、半年以上)に渡って本来の活性を維持することができる。
【0112】
また、ATP分解ウェル開放口57aは、フィルター18で覆われている。フィルター18は、ATP分解ウェル57内への微生物等の不純物の混入を防止するためのものである。フィルター18としては、フィルター13と同様のものを用いればよい。
【0113】
ATP分解ウェル57は、ATP分解ウェル開放口57aの縁部から基板1b側に向かって円筒状に延びる側壁面と、その側壁面の端部に接続される底面と、によって形成されている。ここで、ATP分解ウェル57の底面は、側壁面の端部から遠ざかる方向へ窪んでいる。具体的には、上記底面は、基板1aの表面に平行な仮想平面でウェル(側壁面によって形成される円柱状の部分を除く。)を切断したときの開口の面積が、基板1aから基板1bに向かって小さくなるように、テーパ状(円錐状又は円錐台状)に形成されている。
【0114】
また、上述のように、流路4は、その途中から分岐する流路61を介して、廃液収容ウェル51の側壁面に接続されている。流路4は、流路4と流路61との接続部に対して検体液導入ウェル2側に蛇行状に形成された流路4aと、上記接続部に対して発光ウェル3側に形成された流路4bとからなる。
【0115】
検体液導入ウェル2及び廃液収容ウェル51は、流路4a及び61によって接続されている。具体的には、流路4a及び61は各々の一端で互いに接続されており、流路4aの他端は検体液導入ウェル2のテーパ状の底面の端部に接続され、流路61の他端は廃液収容ウェル51の側壁面に接続されている。従って、検体液導入ウェル2内の液体は、流路4a及び61を経て廃液収容ウェル51に流入することができる。
【0116】
また、補助液収容ウェル52及びATP分解ウェル57は、流路58によって接続されている。具体的には、流路58の一端は補助液収容ウェル52のテーパ状の底面の端部に接続され、流路58の他端はATP分解ウェル57の側壁面に接続されている。従って、補助液収容ウェル52内の液体は、流路58を経てATP分解ウェル57に流入することができる。
【0117】
また、ATP分解ウェル57及び検体液導入ウェル2は流路59によって接続されている。具体的には、流路59の一端はATP分解ウェル57のテーパ状の底面の端部に接続され、流路59の他端は検体液導入ウェル2の側壁面に接続されている。従って、ATP分解ウェル57内の液体は、流路59を経て検体液導入ウェル2に流入することができる。
【0118】
また、抽出ウェル42及び検体液導入ウェル2は流路56によって接続されている。具体的には、流路56の一端は抽出ウェル42のテーパ状の底面の端部に接続され、流路56の他端は検体液導入ウェル2の側壁面に接続されている。従って、抽出ウェル42内の液体は、流路56を経て検体液導入ウェル2に流入することができる。
【0119】
次に、検査用チップ50を用いて検体中の微生物を検出する方法について説明する。
【0120】
まず、検体液を検体液導入ウェル2に導入し、補助液を補助液収容ウェル52に収容させる。ここで、補助液としては、例えば、純水、LP希釈液等が挙げられる。補助液内に混入しているATP及び微生物は、オートクレーブ処理により予め除去されていることが好ましい。
【0121】
また、受光部21aを有する光検出器21を、受光部21aが発光ウェル3に対向して基板1cの表面に接するように設置する。また、圧力ポートを、検体液導入ウェル開放口2a、廃液収容ウェル開放口51a、補助液収容ウェル開放口52a、ATP分解ウェル開放口57a、抽出ウェル開放口42a及び発光ウェル開放口3aを覆うように設置する。なお、図10では、光検出器21、受光部21a、圧力ポート22、28及び27が二点鎖線で示されている(圧力ポート22、28及び27は、それぞれ検体液導入ウェル開放口2a、ATP分解ウェル開放口57a及び発光ウェル開放口3aを覆っている)。
【0122】
次に、検体液導入ウェル2に導入された検体液を、検体液導入ウェル2の内部を圧力ポート22で加圧することによって、流路4a及び61に流通させて廃液収容ウェル51に収容させる。このとき、他のウェルへの検体液の流入、及び検体液導入ウェル2内の圧力損失を防ぐために、同時に補助液収容ウェル52、抽出ウェル42、ATP分解ウェル57及び発光ウェル3の内部を圧力ポートで加圧する。検体液が流路4a及び61を流通して、廃液収容ウェル51に収容されると、検体液中の検出対象の微生物のみが、流路4aに固定化された抗体に結合し、それ以外の成分(バックグラウンドATPを含む。)は廃液収容ウェル51に収容される。
【0123】
次に、補助液収容ウェル52に収容されている補助液を、補助液収容ウェル52の内部を圧力ポートで加圧することによって、流路58に流通させてATP分解ウェル57に収容させる。このとき、検体液導入ウェル2及び抽出ウェル42への補助液の流入、及び補助液収容ウェル52の圧力損失を防ぐために、同時に検体液導入ウェル2及び抽出ウェル42の内部をそれぞれ圧力ポート22及び23で加圧する。補助液がATP分解ウェル57に収容されると、ATP分解ウェル57に収納されている固形状のATP分解酵素9が補助液に溶解する。
【0124】
次に、ATP分解酵素9が溶解している補助液を、ATP分解ウェル57の内部を圧力ポート28で加圧することによって、流路59に流通させて検体液導入ウェル2に収容させる。このとき、補助液収容ウェル52への補助液の流入、及びATP分解ウェル57内の圧力損失を防ぐために、同時に補助液収容ウェル52の内部を圧力ポートで加圧する。ATP分解酵素9が溶解している補助液が検体液導入ウェル2に収容されると、検体液導入ウェル2内のバックグラウンドATPが分解される。
【0125】
次に、検体液導入ウェル2に収容された補助液を、検体液導入ウェル2の内部を圧力ポート22で加圧することによって、流路4a及び61に流通させて廃液収容ウェル51に収容させる。このとき、他のウェルへの検体液の流入、及び検体液導入ウェル2内の圧力損失を防ぐために、同時に補助液収容ウェル52、抽出ウェル42、ATP分解ウェル57及び発光ウェル3の内部を圧力ポートで加圧する。補助液が流路4a及び61を流通して、廃液収容ウェル51に収容されると、補助液中のATP分解酵素によって、流路4a及び61の内部のバックグラウンドATPが分解され、検出対象の微生物以外の成分(バックグラウンドATPを含む。)が検体液導入ウェル2、流路4a及び61から洗い流されて、廃液収容ウェル51に収容される。
【0126】
次に、補助液収容ウェル52に収容されている補助液を、補助液収容ウェル52の内部を圧力ポートで加圧することによって、流路54に流通させて検体液導入ウェル2に収容させる。このとき、抽出ウェル42及びATP分解ウェル57への補助液の流入、及び補助液収容ウェル52内の圧力損失を防ぐために、同時に抽出ウェル42及びATP分解ウェル57の内部をそれぞれ圧力ポート23及び28で加圧する。
【0127】
次に、検体液導入ウェル2に収容された補助液を、検体液導入ウェル2の内部を圧力ポート22で加圧することによって、流路4a及び61に流通させて廃液収容ウェル51に収容させる。このとき、他のウェルへの検体液の流入、及び検体液導入ウェル2内の圧力損失を防ぐために、同時に補助液収容ウェル52、抽出ウェル42、ATP分解ウェル57及び発光ウェル3の内部を圧力ポートで加圧する。補助液が流路4a及び61を流通して、廃液収容ウェル51に収容されると、補助液中の成分のうち、検出対象の微生物以外の成分(バックグラウンドATP及びATP分解酵素を含む。)が検体液導入ウェル2、流路4a及び61から更に洗い流されて、廃液収容ウェル51に収容される。
【0128】
次に、補助液収容ウェル52に収容されている補助液を、補助液収容ウェル52の内部を圧力ポートで加圧することによって、流路55に流通させて抽出ウェル42に収容させる。このとき、検体液導入ウェル2及びATP分解ウェル57への補助液の流入、及び補助液収容ウェル52内の圧力損失を防ぐために、同時に検体液導入ウェル2及びATP分解ウェル57の内部をそれぞれ圧力ポート22及び28で加圧する。補助液が抽出ウェル42に収容されると、抽出ウェル42に収納されている固形状の抽出試薬6が補助液に溶解する。
【0129】
次に、抽出試薬6が溶解している補助液を、抽出ウェル42の内部を圧力ポート23で加圧することによって、流路56に流通させて検体液導入ウェル2に収容させる。このとき、補助液収容ウェル52への補助液の流入、及び抽出ウェル42内の圧力損失を防ぐために、同時に補助液収容ウェル52の内部を圧力ポートで加圧する。
【0130】
最後に、検体液導入ウェル2に収容された補助液を、検体液導入ウェル2の内部を圧力ポート22で加圧することによって、流路4(4a及び4b)に流通させて発光ウェル3に収容させる。このとき、他のウェルへの検体液の流入、及び検体液導入ウェル2内の圧力損失を防ぐために、同時に廃液収容ウェル51、補助液収容ウェル52、ATP分解ウェル57及び抽出ウェル42の内部を圧力ポートで加圧する。抽出試薬6が溶解している補助液が流路4aを流通すると、流路4aに固定化された抗体に結合している検出対象の微生物中のATPが補助液中に抽出される。補助液が発光ウェル3に収容されると、固形状の発光試薬5が補助液に溶解し、発光ウェル3内で補助液中のATPと反応し、発光が生じる。発光試薬5から発せられる光は受光部21aに入射され、光検出器21で検出される。こうして検体中の微生物が検出される。
【0131】
検査用チップ50は、上述のように抗体を備えるものであるので、検体中の特定の微生物の検出に用いることができる。
【0132】
上述のように、検査用チップ50では、検体液及び補助液中の成分のうち、検出対象の微生物以外の成分(バックグラウンドATP及びATP分解酵素を含む。)が、検体液導入ウェル2及び流路4aから洗い流され、廃液収容ウェル51に収容される。従って、検査用チップ50を用いれば、それだけ高い精度で検出対象の微生物を検出することができる。
【0133】
また、検査用チップ50では、ATP分解ウェル開放口57aがフィルター18で覆われていることにより、ATP分解ウェル57内への微生物等の不純物の混入が防止される。従って、検査用チップ50を用いれば、それだけ高い精度で検出対象の微生物を検出することができる。
【0134】
また、検査用チップ50では、流路4aが検体液導入ウェル2のテーパ状の底面の端部に接続されているので、検体液導入ウェル2に収容されている検体液を流路4aに流出させる操作を行った場合、ウェル内に残存する検体液の量が十分に少なくなる。また、流路54、55及び58が各々、補助液収容ウェル52のテーパ状の底面の端部に接続されているので、補助液収容ウェル52に収容されている検体液を流路54、55又は58に流出させる操作を行った場合、ウェル内に残存する検体液の量が十分に少なくなる。また、流路59がATP分解ウェル57のテーパ状の底面の端部に接続されているので、ATP分解ウェル57に収容されている検体液を流路59に流出させる操作を行った場合、ウェル内に残存する検体液の量が十分に少なくなる。また、流路56が抽出ウェル42のテーパ状の底面の端部に接続されているので、抽出ウェル42に収容されている検体液を流路56に流出させる操作を行った場合、ウェル内に残存する検体液の量が十分に少なくなる。このように、検体液導入ウェル2、補助液収容ウェル52、ATP分解ウェル57及び抽出ウェル42に残存する検体液の量が十分に少なくなるので、検査用チップ50を用いれば、導入した検体液中の検体の量に対応する発光強度を高い精度で測定することができ、また、それだけ高い精度で、かつ再現性よく検出対象の微生物を検出することができる。ここで、検体液導入ウェル2、補助液収容ウェル52、ATP分解ウェル57及び抽出ウェル42のテーパ状の底面と基板1aの表面とがなす角度は特に限定されないが、例えば30〜60度であればよい。
【0135】
また、検査用チップ50では、流路58、55及び4がそれぞれATP分解ウェル57、抽出ウェル42及び発光ウェル3の側壁面に接続されているので、流路58、55又は4を流通してきた液体がそれぞれ、ATP分解ウェル57、抽出ウェル42又は発光ウェル3に収納されている固体状の試薬の上方からウェルに流入し、固体状のATP分解酵素9、抽出試薬6及び発光試薬5の溶解が上下両方向から進むことになる。従って、検査用チップ50を用いれば、それだけATP分解酵素9、抽出試薬6及び発光試薬5の溶解速度が大きくなり、迅速に検出対象の微生物を検出することができる。
【0136】
また、検査用チップ50では、流路59、54及び56が各々、検体液導入ウェル2の側壁面に接続され、また、流路58がATP分解ウェル57の側壁面に、流路55が抽出ウェル42の側壁面に接続されているので、検体液及び補助液の量を最適化することによって、検体液導入ウェル2、ATP分解ウェル57及び抽出ウェル42に貯留されている液体中における気泡の発生が防止される。従って、検査用チップ50を用いれば、検体液及び補助液の量を最適化することによって、それだけ、液体が円滑に検体液導入ウェル2から廃液収容ウェル51又は発光ウェル3へ、また、ATP分解ウェル57又は抽出ウェル42から検体液導入ウェル2へ移送され、円滑に検出対象の微生物を検出することができる。
【0137】
また、検査用チップ50では、ウェルに液体が流入するための流路が、そのウェルの側壁面に接続されているので、検体液及び補助液の量を最適化することによって、収容された液体の逆流が確実に防止される。また、ウェルに収容された液体を流出させる際には、液体の逆流を防ぐために、他のウェルの内部を加圧する必要がない。従って、検査用チップ50を用いれば、検体液及び補助液の量を最適化することによって、それだけ高い精度で、かつ簡便に検出対象の微生物を検出することができる。
【0138】
本発明は、上述の第1〜第5実施形態に限定されるものではない。
【0139】
例えば、第1及び第3〜第5実施形態に係る検査用チップ10、30、40及び50では、発光ウェル3に固形状の発光試薬5が収納されていたが、発光ウェル3には固形状の増幅発光試薬が収納されていてもよい。ここで、「増幅発光試薬」とは、ATPを増幅すると同時に、増幅されたATPと反応して発光を生じさせる試薬を意味し、そのような増幅発光試薬としては、例えば、AMP、ポリリン酸、ADK、PPK、ホタルルシフェリン、ホタルルシフェラーゼ及び2価金属イオンからなる試薬が挙げられる。
【0140】
また、第3〜第5実施形態に係る検査用チップ30、40及び50では、固形状の増幅試薬が収納されているウェルが本体部に形成されていないが、第2実施形態に係る検査用チップ20と同様に、本体部には増幅ウェル45が流路4(検査用チップ30では流路43)の一部として形成され、増幅ウェル45には固形状の増幅試薬7が収納されていてもよい。
【0141】
また、第2実施形態に係る検査用チップ20では、増幅ウェル45に固形状の増幅試薬7が収納されているが、本体部には更にもう一つの増幅ウェルが形成され、固形状の増幅試薬の一部は一方の増幅ウェルに、また、残りの一部は他方の増幅ウェルに収納されていてもよい。すなわち、増幅試薬がAMP、ポリリン酸、ADK及びPPKからなる試薬であるとすると、本体部には更にもう一つの増幅ウェルが形成され、例えば、固形状のAMP及びポリリン酸は一方の増幅ウェルに、固形状のADK及びPPKは他方の増幅ウェルに収納されていてもよい。
【0142】
また、第5実施形態に係る検査用チップ50では、流路4aが蛇行状に形成され、その内壁面に、検出対象の微生物と特異的に結合する抗体が固定化されているが、本体部にはビーズ収納ウェルが流路4(4a及び4b)の一部として形成され、ビーズ収納ウェルには、上記抗体が固定化されたビーズが収納されていてもよい。この場合、流路4は、蛇行状の部分を有していなくてもよい。
【0143】
また、第4及び第5実施形態に係る検査用チップ40及び50では、補助液収容ウェル52に接続されている流路に特別な処理が施されていないが、補助液収容ウェル52に接続されている流路にはATP分解酵素が固定化されていてもよい。また、補助液収容ウェル52と各流路との接続部はフィルター16と同様のフィルターで覆われ、補助液収容ウェル52には、ATP分解酵素が固定化されたビーズ8が収納されていてもよい。
【0144】
また、第1〜第5実施形態に係る検査用チップ10、20、30、40及び50では、ウェルの側壁面が円筒状となっているが、ウェルの側壁面の形状は四角柱等であってもよい。
【0145】
また、第1〜第5実施形態に係る検査用チップ10、20、30、40及び50では、流路が三層の基板1a〜1cのうちの基板1aに形成されているが、流路は、三層の基板1a〜1cのうちの中間層の基板1bに形成されていてもよい。また、検査用チップの本体部1は、例えば、二層の基板からなっていてもよく、流路を構成する溝は、二層の基板の両方に形成されていてもよい。
【0146】
また、第1〜第5実施形態に係る検査用チップ10、20、30、40及び50では、ウェルに液体が流入するための流路がそのウェルの側壁面に接続されているが、ウェルに液体が流入するための流路は、そのウェルの底面に接続されていてもよい。
【実施例】
【0147】
以下、実施例及び比較例に基づいて、本発明をより具体的に説明する。但し、本発明は、以下の実施例に限定されるものではない。
【0148】
(実施例1)
まず、本実施例で用いた検査用チップの構成について、図11及び12を参照して説明する。図11は、実施例1において用いられた検査用チップの平面図である。図12は、図11のXII−XII線に沿った断面図である。
【0149】
図11及び12に示されているように、実施例1において用いられた検査用チップ100は、三層の基板1a〜1cからなる本体部1を備えている。基板1a及び1bは各々、PDMS基板であり、基板1cはガラス基板である。本体部1には、検体液導入ウェル(第1のウェル)2と、発光ウェル(第2のウェル)3と、検体液導入ウェル開放口(第1の開口)2aと、発光ウェル開放口(第2に開口)3aと、検体液導入ウェル2及び発光ウェル3を接続する流路4と、が形成されている。
【0150】
検体液導入ウェル2は、検体液導入ウェル開放口2aの縁部から基板1b側に向かって円筒状に延びる側壁面と、その側壁面の端部に接続される底面と、によって形成されている。ここで、検体液導入ウェル2の底面は、側壁面の端部から遠ざかる方向へ窪んでいる。具体的には、上記底面は、基板1aの表面に平行な仮想平面でウェル(側壁面によって形成される円柱状の部分を除く。)を切断したときの開口の面積が、基板1aから基板1bに向かって小さくなるように、テーパ状(円錐状又は円錐台状)に形成されている。また、発光ウェル3は、発光ウェル開放口3aの縁部から基板1b側に向かって円筒状に延びる側壁面と、その側壁面の端部に接続される平坦な底面と、によって形成されている。また、検体液導入ウェル2及び発光ウェル3は流路4によって接続されている。具体的には、流路4の一端は検体液導入ウェル2のテーパ状の底面の端部に接続され、流路4の他端は発光ウェル3の平坦な底面に接続されている。
【0151】
発光ウェル3には、固形状の発光試薬(固形状の試薬)5が収納されている。固形状の発光試薬5は、ホタルルシフェラーゼ(和光純薬工業社製)(5ng)、ホタルルシフェリン(和光純薬工業社製)(0.3nmol)、Tris−HCl(10nmol)、MgCl2(2nmol)及びトレハロース(和光純薬工業社製)(10mg)の混合物を凍結乾燥させて得た試薬である。また、発光ウェル3の円筒状の側壁面には、側壁面の全周に渡って、アルミニウムからなる光反射部11が設けられ、光反射部11は固形状の発光試薬5を包囲している。
【0152】
こうような検査チップ100を用いて、以下のようにして、ATPと発光試薬との反応によって生じる発光量の測定を行った
【0153】
まず、1nM ATP溶液200μLをマイクロピペットで検体液導入ウェル2に導入した。また、光検出器21を、受光部21aが発光ウェル3に対向して基板1cの表面に接するように設置した。光検出器21としては、光電子増倍管(Hamamatsu Photonics、H7155)を用いた。また、圧力発生器(Naganokeiki、PC20)に接続された圧力ポート22を、検体液導入ウェル開放口2aを覆うように設置した。
【0154】
次に、圧力ポート22で検体液導入ウェル2の内部に30kPaの圧力を加えることにより、ATP溶液を、流路4を通じて発光ウェル3に収容させ、発光強度を光検出器21で測定した。
【0155】
(比較例1)
発光ウェルに試薬が収納されていないこと以外は、検査用チップ100と同様の構成及び大きさを有する検査用チップを用意し、これを用いて、以下のようにして、ATPと発光試薬との反応によって生じる発光量の測定を行った。
【0156】
まず、2nM ATP溶液100μLをマイクロピペットで検体液導入ウェルに導入した。また、実施例1と同様にして、光検出器及び圧力ポートを検査用チップに設置した。
【0157】
他方、実施例1で用いた発光試薬5と同様の組成を有する固形状の発光試薬を精製水100μLに溶解し、得られた水溶液を10分静置した。
【0158】
10分静置した水溶液を発光ウェルに導入した後、圧力ポートで検体液導入ウェルの内部に30kPaの圧力を加えることにより、ATP溶液を、流路を通じて発光ウェルに収容させ、発光強度を光検出器で測定し、試薬の活性劣化率(実施例1で測定された発光強度に対する発光強度減少率)を求めた。結果を表1に示す。
【0159】
(比較例2)
発光試薬の水溶液を30分静置したこと以外は、比較例1と同様にして、試薬の活性劣化率(実施例1で測定された発光強度に対する発光強度減少率)を求めた。結果を表1に示す。
【0160】
【表1】

【0161】
実施例1、比較例1及び2により、本発明の検査用チップを用いれば、反応時にも試薬の活性を十分に高く維持したまま検査を行うことができることが示された。また、本発明の検査用チップを用いれば、試薬溶液の調製及び分注が不要であり、それだけ検査を簡便に行うことができることが示された。
【産業上の利用可能性】
【0162】
本発明の検査用チップは、タンパク質を含有する試薬を用いて行う検査、特にルシフェリン−ルシフェラーゼ反応を用いた飲食料中の微生物(細菌、真菌等)の検出に利用することができる。
【図面の簡単な説明】
【0163】
【図1】第1実施形態に係る検査用チップの平面図である。
【図2】図1のII−II線に沿った断面図である。
【図3】第2実施形態に係る検査用チップの平面図である。
【図4】図3のIV−IV線に沿った断面図である。
【図5】第3実施形態に係る検査用チップの平面図である。
【図6】図5のVI−VI線に沿った断面図である。
【図7】第4実施形態に係る検査用チップの平面図である。
【図8】図7のVIII−VIII線に沿った断面図である。
【図9】第5実施形態に係る検査用チップの平面図である。
【図10】図9のX−X線に沿った断面図である。
【図11】実施例1において用いられた検査用チップの平面図である。
【図12】図11のXII−XII線に沿った断面図である。
【符号の説明】
【0164】
10,20,30,40,50…検査用チップ、1…本体部、1a〜1c…基板、2…検体液導入ウェル、2a…検体液導入ウェル開放口、3…発光ウェル、3a…発光ウェル開放口、4,4a,4b…流路、5…発光試薬、6…抽出試薬、7…増幅試薬、8…ビーズ、9…ATP分解酵素、11…光反射部、12…光反射膜、13〜18…フィルター、21…光検出器、21a…受光部、22〜24,26〜28…圧力ポート、41…流路、42…抽出ウェル、42a…抽出ウェル開放口、43,44…流路、45…増幅ウェル、45a…増幅ウェル開放口、46,47…流路、48…ビーズ収納ウェル、48a…ビーズ収納ウェル開放口、49…流路、51…廃液収容ウェル、51a…廃液収容ウェル開放口、52…補助液収容ウェル、52a…補助液収容ウェル開放口、53〜56…流路、57…ATP分解ウェル、57a…ATP分解ウェル開放口、58,59,61…流路、100…検査用チップ。
【技術分野】
【0001】
本発明は、検査用チップに関する。
【背景技術】
【0002】
近年、飲食料中の微生物(細菌、真菌等)を検出するために、微生物中に存在するアデノシン三リン酸(ATP)を検出することが行われている。また、DNA塩基配列を分析するために、DNAを構成するデオキシヌクレオチド三リン酸(dNTP)と、それに相補的なdNTPとの結合に伴って生成するピロリン酸をATPに変換し、このATPを検出することが行われている(例えば、下記特許文献1)。
【0003】
このようなATPの検出は、従来、検査用チップを用いて、検体液を、予め調製した試薬溶液と混合させ、ルシフェリン−ルシフェラーゼ反応に基づく発光を生じさせることによって行われていた(例えば、下記特許文献1)。
【特許文献1】特開2004−028589号公報
【発明の開示】
【発明が解決しようとする課題】
【0004】
しかしながら、ルシフェリン−ルシフェラーゼ反応で用いられる試薬はタンパク質であるルシフェラーゼを含有し、水溶液状態では劣化しやすいため、試薬溶液の調製が必要な従来の検査用チップでは、反応に供されるまでの間に試薬の活性が低下し、その分だけ発光量が低下するという問題があった。
【0005】
このような試薬の活性の低下は、従来の検査用チップを用いる限り、ルシフェラーゼに限らず、一般に、タンパク質を含有する試薬を用いて検査を行う場合には同様に問題となる。
【0006】
そこで、本発明は、試薬の活性を十分に高く維持したまま、試薬を検体との反応に供することを可能にする検査用チップを提供することを目的とする。
【課題を解決するための手段】
【0007】
上記目的を達成するために、本発明は、検体を含有する検体液を導入するための第1のウェルと、検体と反応する固形状の試薬が収納されている第2のウェルと、第1のウェルを大気に開放するための第1の開口と、第2のウェルを大気に開放するための第2の開口と、第1のウェル及び第2のウェルを接続する流路と、が本体部に形成されていることを特徴とする検査用チップを提供する。
【0008】
上記検査用チップでは、検体液を第1のウェルに導入した後、検体液を、流路に流通させて第2のウェルに収容させる。検体液が第2のウェルに収容されると、第2のウェルに収納されている固形状の試薬が検体液に溶解し、第2のウェル内で検体と反応する。第1のウェルに導入された検体液の流路への流通、及び第2のウェルへの収容は、検体液に加えられる圧力を第1及び第2の開口を通じて加減することにより行う。なお、本発明において、「検体液」とは、検体を含有する液体を意味する。
【0009】
上記検査用チップを用いれば、試薬溶液を予め調製する必要がなく、試薬が検体液に溶解すると同時に、検体と試薬との反応が開始するので、試薬の活性を十分に高く維持したまま、試薬を検体との反応に供することができる。また、試薬溶液を予め調製する必要がないので、試薬溶液の調製又は分注に伴って反応場に微生物等の不純物が混入するおそれがなくなり、それだけ高い精度で検査を行うことができる。また、試薬溶液の調製及び分注が不要なので、それだけ簡便に検査を行うことができる。
【0010】
本発明はまた、上記検査用チップにおいて、第2のウェルに収納されている試薬が、ATPの存在下に発光する発光試薬であり、微生物中のATPを抽出する固形状の抽出試薬が収納されている第3のウェルと、第3のウェルを大気に開放するための第3の開口と、が本体部に更に形成され、第3のウェルが、第1のウェル及び第2のウェルの間で流路の一部を構成している検査用チップを提供する。
【0011】
このような検査用チップ(以下、「微生物検出用チップ」という。)では、検体液を第1のウェルに導入した後、検体液を、流路に流通させて第3のウェルに収容させる。検体液が第3のウェルに収容されると、第3のウェルに収納されている固形状の抽出試薬が検体液に溶解し、第3のウェル内で微生物中のATPを抽出する。検体液が第3のウェルに収容され、ATPの抽出に十分な時間が経過した後、検体液を第3のウェル及び第2のウェルの間の流路に流通させて第2のウェルに収容させる。検体液が第2のウェルに収容されると、第2のウェルに収納されている固形状の発光試薬が検体液に溶解し、第2のウェル内で検体液中のATPと反応し、発光を生じる。第1のウェルに導入された検体液の流路への流通、及び他のウェルへの収容は、検体液に加えられる圧力を第1、第3及び第2の開口を通じて加減することにより行う。このような微生物検出用チップは、光検出器と組み合わせることによって、ATPを指標とする検体中の微生物の検出に利用することができる。なお、本発明において、「発光試薬」とは、ATPと反応して発光を生じさせる試薬を意味し、また、「抽出試薬」とは、微生物中のATPを抽出する試薬を意味する。いずれの試薬も、1種類の物質からなるものであっても、2種類以上の物質からなるものであってもよい。
【0012】
上記微生物検出用チップとしては、第1のウェル及び第3のウェルの間の流路の内壁面にATP分解酵素が固定化されているものが好ましい。このような微生物検出用チップを用いれば、検体液と抽出試薬とが混合される前に、ATP分解酵素によって微生物中のATP以外のATP(以下、「バックグラウンドATP」という。)が分解除去されるので、検体中の微生物がそれだけ高い精度で検出される。なお、本発明において、「ATP分解酵素が固定化されている」とは、ATP分解酵素が物理吸着、化学結合等により固体表面に結合しており、固体表面を水又は水溶液と接触させても、ATP分解酵素が固体表面から脱離しないことをいう。
【0013】
上記微生物検出用チップとしてはまた、ATPを増幅する固形状の増幅試薬が収納されている第4のウェルと、第4のウェルを大気に開放するための第4の開口と、が更に本体部に形成され、第4のウェルが、第3のウェル及び第2のウェルの間で流路の一部を構成しているものが好ましい。このような微生物検出用チップでは、検体液が第3のウェルに収容され、ATPの抽出に十分な時間が経過した後、検体液を第3のウェル及び第4のウェルの間の流路に流通させて第4のウェルに収容させる。検体液が第4のウェルに収容されると、第4のウェルに収納されている固形状の増幅試薬が検体液に溶解し、第4のウェル内で検体液中のATPと反応し、検体液中のATPを増幅する。検体液が第4のウェルに収容され、ATPの増幅に十分な時間が経過した後、検体液を第4のウェル及び第2のウェルの間の流路に流通させて第2のウェルに収容させる。検体液が第2のウェルに収容されると、第2のウェルに収納されている固形状の発光試薬が検体液に溶解し、第2のウェル内で検体液中のATPと反応し、発光を生じる。第1のウェルに導入された検体液の流路への流通、及び他のウェルへの収容は、検体液に加えられる圧力を第1、第3、第4及び第2の開口を通じて加減することにより行う。このような微生物検出用チップを用いれば、微生物中のATPが抽出試薬によって抽出された後、検体液と発光試薬とが混合される前に検体液中のATPが増幅されるので、検体中の微生物がそれだけ高い感度で検出される。なお、本発明において、「増幅試薬」とは、ATPを増幅させる試薬を意味し、1種類の物質からなるものであっても、2種類以上の物質からなるものであってもよい。
【0014】
上記微生物検出用チップとしてはまた、前記第2のウェル内で生じた光を反射する光反射部が、試薬を包囲するように第2のウェルの内壁面の一部に設けられているものが好ましい。このような微生物検出用チップを用いれば、光反射部で反射した光が光検出器の受光部に入射されるように光検出器を配置することによって、光検出器の受光部に入射される光の量を増加させることができるので、検体中の微生物をそれだけ高い感度で検出することができる。なお、本発明において、「光を反射する」とは、光の少なくとも一部を反射することを意味する。
【0015】
上記微生物検出用チップとしてはまた、第2の開口が、第2のウェル内で生じた光を反射する通気性の光反射膜で覆われているものが好ましい。このような微生物検出用チップを用いれば、光反射膜で反射した光が光検出器の受光部に入射されるように光検出器を配置することによって、光検出器の受光部に入射される光の量を増加させることができるので、検体中の微生物をそれだけ高い感度で検出することができる。なお、第1のウェルに導入された検体液の流路への流通、及び他のウェルへの収容は、検体液に加えられる圧力を、開口を通じて加減することにより行うので、上記光反射膜は通気性を有する必要がある。
【0016】
上記検査用チップ(上記微生物検出用チップを含む。)としては、第1の開口(第2の開口が光反射膜で覆われている場合は、第1及び第2の開口)を除くすべての開口がフィルターで覆われているものが好ましい。このような検査用チップを用いれば、第1のウェルを除くすべてのウェル内に微生物等の不純物が混入するのが防止されるので、それだけ高い精度で検査を行うことができる。
【発明の効果】
【0017】
本発明によれば、試薬の活性を十分に高く維持したまま、試薬を検体との反応に供することを可能にする検査用チップが提供される。
【発明を実施するための最良の形態】
【0018】
以下、図面を参照して本発明の好適な実施形態を説明する。なお、図面の説明においては、同一または同等の要素には同一符号を用いるものとし、重複する説明は省略する。
【0019】
(第1実施形態)
本発明の第1実施形態について、図1及び2を参照して説明する。図1は、第1実施形態に係る検査用チップの平面図である。図2は、図1のII−II線に沿った断面図である。
【0020】
第1実施形態に係る検査用チップ10は本体部1を備え、本体部1は三層の基板1a〜1cからなる。基板1a〜1cは、透光性を有する材料で構成されていればよい。そのような材料としては、ポリカーボネート(PC)、ポリエチレンテレフタレート(PET)、ポリジメチルシロキサン(PDMS)、ポリイミド、ポリスチレン(PS)、ポリメチルメタクリレート(PMMA)等の樹脂や、石英ガラス、パイレックス(登録商標)ガラス等のガラスが挙げられる。
【0021】
基板1aには、検体液導入ウェル(第1のウェル)2、発光ウェル(第2のウェル)3及び抽出ウェル(第3のウェル)42が形成されている。基板1aの表面のうち、基板1aに対して基板1bと反対側の表面には、検体液導入ウェル2を大気に開放するための検体液導入ウェル開放口(第1の開口)2aと、発光ウェル3を大気に開放するための発光ウェル開放口(第2の開口)3aと、抽出ウェル42を大気に開放するための抽出ウェル開放口(第3の開口)42aと、が形成されている。いずれのウェルも、開口の縁部から基板1b側に向かって円筒状に延びる側壁面と、その側壁面の端部に接続される底面と、によって形成されている。ここで、検体液導入ウェル2及び抽出ウェル42の底面は各々、側壁面の端部から遠ざかる方向へ窪んでいる。具体的には、上記底面は、基板1aの表面に平行な仮想平面でウェル(側壁面によって形成される円柱状の部分を除く。)を切断したときの開口の面積が、基板1aから基板1bに向かって小さくなるように、テーパ状(円錐状又は円錐台状)に形成されている。
【0022】
発光ウェル3には、固形状の発光試薬(固形状の試薬)5が収納されている。発光試薬5としては、例えば、ホタルルシフェリン、ホタルルシフェラーゼ及び2価金属イオン(Mg2+等)からなる試薬が挙げられる。ATPは、酸素及び2価金属イオンの存在下でホタルルシフェリン及びホタルルシフェラーゼと反応して、ホタルルシフェリンによる発光を生じさせる。
【0023】
抽出ウェル42には、固形状の抽出試薬6が収納されている。抽出試薬6としては、例えば、溶菌酵素(リゾチーム、キチナーゼ、キトサナーゼ等)、陽イオン界面活性剤(塩化ベンザルコニウム、塩化ベンゼトニウム、塩化セチルトリメチルアンモニウム等)、非イオン性界面活性剤(ポリオキシエチレンアルキルエーテル、ポリオキシエチレンアルキルフェニルエーテル、ポリオキシエチレンソルビタンエステル、ソルビタン脂肪酸エステル等)が挙げられる。抽出試薬6中には、溶菌酵素等に加えて、例えば、非イオン性界面活性剤、キレート剤(エチレンジアミン四酢酸等)又は糖類(スクロース、グルコース、フルクトース等)が含まれていてもよい。
【0024】
固形状の試薬は、発光試薬5及び抽出試薬6のいずれについても、酵素を含有する場合は、凍結乾燥されたものであることが好ましい。凍結乾燥された試薬は、長期(例えば、半年以上)に渡って本来の活性を維持することができる。
【0025】
発光ウェル3の円筒状の側壁面には、側壁面の全周に渡って、光反射部11が設けられ、光反射部11は固形状の発光試薬5を包囲している。光反射部11は、発光ウェル3の底面には設けられていない。また、発光ウェル開放口3aは、光反射膜12で覆われている。発光ウェル3内で生じた光のうち、側壁面又は発光ウェル開放口3aに向かう光は、光反射部11又は光反射膜12で反射され、底面から発光ウェル3の外に出る。光反射膜12は通気性を有するが、このことにより、発光ウェル3内部の加圧又は減圧が可能となっている。また、光反射膜12は、発光ウェル3内への微生物等の不純物の混入を防止するフィルターとしても機能する。光反射部11は、光を反射する材料で構成されていればよい。そのような材料としては、アルミニウム、ニッケル、チタン、クロム、金、銅、鉄等の金属が挙げられる。また、光反射膜12は、光を反射する通気性の材料で構成されていればよい。そのような材料としては、ポリテトラフルオロエチレン、ポリビニリデンフロライド等が挙げられる。なお、光反射膜12の平均孔径としては、発光ウェル3への微生物等の不純物の混入を防ぐために、0.1〜1μmが好ましい。
【0026】
抽出ウェル開放口42aは、フィルター13で覆われている。このことにより、抽出ウェル42内への微生物等の不純物の混入が防止され、また、発光ウェル3内部の加圧又は減圧が可能となっている。なお、フィルター13の平均孔径としては、抽出ウェル42への微生物等の不純物の混入を防ぐために、0.1〜1μmが好ましい。
【0027】
検体液導入ウェル2及び抽出ウェル42は流路41によって接続されている。具体的には、流路41の一端は検体液導入ウェル2のテーパ状の底面の端部に接続され、流路41の他端は抽出ウェル42の側壁面に接続されている。従って、検体液導入ウェル2内の検体液は、流路41を経て抽出ウェル42に流入することができる。また、抽出ウェル42及び発光ウェル3は流路43によって接続されている。具体的には、流路43の一端は抽出ウェル42のテーパ状の底面の端部に接続され、流路43の他端は発光ウェル3の側壁面に接続されている。従って、抽出ウェル42内の検体液は、流路43を経て発光ウェル3に流入することができる。なお、抽出ウェル42は流路41及び流路43とともに流路4を構成している。すなわち、流路4は検体液導入ウェル2及び発光ウェル3を接続している。
【0028】
また、流路41は蛇行状に形成されているので、直線状である場合と比較して、十分に長くなっている。また、流路41の内壁面には、ATP分解酵素が固定化され(図には示されていない)、流路41を流通する液体中のATPが分解除去されるようになっている。ATP分解酵素としては、アピラーゼ、アデノシンリン酸デアミナーゼ、ルシフェラーゼ等が挙げられる。
【0029】
次に、検査用チップ10を用いて検体中の微生物を検出する方法について説明する。
【0030】
まず、検体液を検体液導入ウェル2に導入する。また、受光部21aを有する光検出器21を、受光部21aが発光ウェル3に対向して基板1cの表面に接するように設置する。また、圧力ポート22及び23を、それぞれ検体液導入ウェル開放口2a及び抽出ウェル開放口42aを覆うように設置する。なお、図2では、光検出器21、受光部21a、圧力ポート22及び23が二点鎖線で示されている。
【0031】
次に、検体液導入ウェル2に導入された検体液を、検体液導入ウェル2の内部を圧力ポート22で加圧することによって、流路41に流通させて抽出ウェル42に収容させる。検体液が抽出ウェル42に収容されると、抽出ウェル42に収納されている固形状の抽出試薬6が検体液に溶解し、抽出ウェル42内で微生物中のATPが抽出される。
【0032】
最後に、ATPの抽出に十分な時間が経過した後、抽出ウェル42の内部を圧力ポート23で加圧することによって、抽出ウェル42に収容された検体液を、流路43に流通させて発光ウェル3に収容させる。このとき、検体液の逆流、及び抽出ウェル42内の圧力損失を防ぐために、同時に検体液導入ウェル2の内部を圧力ポート22で加圧する。検体液が発光ウェル3に収容されると、固形状の発光試薬5が検体液に溶解し、発光ウェル3内で検体液中のATPと反応し、発光が生じる。発光試薬5から発せられる光は受光部21aに入射され、光検出器21で検出される。こうして検体中の微生物が検出される。
【0033】
検査用チップ10を用いれば、試薬溶液を予め調製する必要がなく、試薬が検体液に溶解すると同時に、検体と試薬との反応が開始するので、試薬の活性を十分に高く維持したまま、試薬を検体との反応に供することができる。また、試薬溶液を予め調製する必要がないので、試薬溶液の調製又は分注に伴って反応場に微生物等の不純物が混入するおそれがなくなり、それだけ高い精度で微生物を検出することができる。また、試薬溶液の調製及び分注が不要なので、それだけ簡便に微生物を検出することができる。
【0034】
また、検査用チップ10では、流路41が蛇行状に形成されていて十分に長いので、検体液が流路41を流通する間に、流路41の内壁面に固定化されているATP分解酵素によって、検体液中のバックグラウンドATPがほぼ完全に分解除去される。従って、検査用チップ10を用いれば、それだけ高い精度で微生物を検出することができる。
【0035】
また、検査用チップ10では、発光試薬5から発せられる光のうち、発光ウェル3の側壁面又は発光ウェル開放口3aに向かう光が、光反射部11又は光反射膜12で反射され、発光ウェル3の底面から発光ウェル3の外側に出射された後、受光部21aに入射される。従って、検査用チップ10を用いれば、受光部21aに入射される光の量が多くなり、それだけ高い感度で微生物を検出することができる。
【0036】
また、検査用チップ10では、発光ウェル開放口3aが光反射膜12で、抽出ウェル開放口42aがフィルター13で覆われていることにより、発光ウェル3及び抽出ウェル42内への微生物等の不純物の混入が防止される。従って、検査用チップ10を用いれば、それだけ高い精度で微生物を検出することができる。
【0037】
また、検査用チップ10では、流路41が検体液導入ウェル2のテーパ状の底面の端部に接続されているので、検体液導入ウェル2に収容されている検体液を流路41に流出させる操作を行った場合、ウェル内に残存する検体液の量が十分に少なくなる。また、流路43が抽出ウェル42のテーパ状の底面の端部に接続されているので、抽出ウェル42に収容されている検体液を流路41に流出させる操作を行った場合、ウェル内に残存する検体液の量が十分に少なくなる。このように、検体液導入ウェル2及び抽出ウェル42に残存する検体液の量が十分に少なくなるので、検査用チップ10を用いれば、導入した検体液中の検体の量に対応する発光強度を高い精度で測定することができ、また、それだけ高い精度で、かつ再現性よく微生物を検出することができる。ここで、検体液導入ウェル2及び抽出ウェル42のテーパ状の底面と基板1aの表面とがなす角度は特に限定されないが、例えば30〜60度であればよい。
【0038】
また、検査用チップ10では、流路41が抽出ウェル42の側壁面に接続されているので、流路41を流通してきた検体液が、抽出ウェル42に収納されている固体状の抽出試薬6の上方から抽出ウェル42に流入し、固体状の抽出試薬6の溶解が上下両方向から進むことになる。すなわち、一方で、流路41から流出され、固体状の抽出試薬6に直接当たる検体液によって、固体状の抽出試薬6の上側部分が溶解され、他方で、抽出ウェル42に貯留する検体液によって、固体状の抽出試薬6の下側部分が溶解される。従って、検査用チップ10を用いれば、それだけ抽出試薬6の溶解速度が大きくなり、迅速に微生物を検出することができる。
【0039】
また、検体液導入ウェル2の内部を加圧して検体液を抽出ウェル42に移送する場合において、流路41が、例えば抽出ウェル42の底面に接続されていると、空気が、検体液導入ウェル2から流路41を経て、抽出ウェル42に貯留されている検体液中に導入され、検体液中に気泡が発生し、この気泡が抽出ウェル42から流路43への検体液の流出を妨げるおそれがある。これに対し、検査用チップ10では、流路41が、抽出ウェル42の側壁面に接続されているので、検体液の量を最適化することによって、上述のような検体液中における気泡の発生が防止される。すなわち、流路41が、抽出ウェル42の側壁面のうち、抽出ウェル42に収容される検体液の液面より上の部分に接続されている場合は、上述のような気泡の発生が防止される。従って、検査用チップ10を用いれば、検体液の量を最適化することによって、それだけ、検体液が円滑に抽出ウェル42から流路43を経て発光ウェル3に移送され、円滑に微生物を検出することができる。
【0040】
また、流路41が、抽出ウェル42の側壁面のうち、抽出ウェル42に収容される検体液の液面より上の部分に接続されている場合は、収容された検体液の逆流が確実に防止される。また、検体液を流路43に流出させる際には、検体液の逆流を防ぐために、検体液導入ウェル2の内部を加圧する必要がない。従って、検査用チップ10を用いれば、検体液の量を最適化することによって、それだけ高い精度で、かつ簡便に微生物を検出することができる。
【0041】
同様に、流路43が発光ウェル3の側壁面に接続されているので、固体状の発光試薬5の溶解が上下両方向から進むことになる。従って、検査用チップ10を用いれば、それだけ発光試薬5の溶解速度が大きくなり、迅速に微生物を検出することができる。
【0042】
次に、検査用チップ10の製造方法を説明する。検査用チップ10は、例えば、次のように製造することができる。
【0043】
まず、シリコンウェハ上にレジストを塗布し、流路41及び43に対応した形状にパターニング(露光、現像)した後、シリコンウェハの表面部分をエッチングする。こうしてシリコン表面に流路41及び43に対応した凸部が形成される。そして、検体液導入ウェル2、発光ウェル3及び抽出ウェル42に対応した凸部が形成された金型を用意し、レジストが除去されたシリコンウェハと金型とを、双方の凸部が向かい合うように、対向させる。その後、シリコンウェハと金型とが対向して形成された空隙に未硬化のPDMSを注入する。
【0044】
次に、PDMSを硬化(125℃、20分)させ、PDMSを剥離することにより、検体液導入ウェル2、発光ウェル3、抽出ウェル42、流路41及び43の形状を有するPDMS硬化物が得られる。PDMS硬化物は、各ウェルと流路とが接続されるように加工(穴あけ加工等)が施される。
【0045】
次に、ガラスウェハ上に別の未硬化のPDMSを塗布し、仮硬化(50℃、10分)させる。仮硬化したPDMSの上に先のPDMS硬化物を貼り合わせ、仮硬化したPDMSを硬化(125℃、20分)する。
【0046】
最後に、流路41の内壁面にATP分解酵素を固定化させる。ATP分解酵素の固定化は、例えば、次のように行うことができる。まず、流路41にATP分解酵素の溶液を流通させた後、開放部(検体液導入ウェル2、発光ウェル3及び抽出ウェル42)をすべてシールし、冷蔵庫内(約4℃)で約5時間放置する。次に、流路41にバッファーを流通させて、ATP分解酵素のうち、脱離しやすいものを取り除き、最後に、流路41の内部を空気で置換する。
【0047】
ATP分解酵素が流路41の内壁面に固定化されたかどうか、及び固定化された酵素のATP分解能を判定するには、例えば、流路41にATP溶液を流通させた後、抽出ウェル42に収容された反応済溶液を回収し、ここにホタルルシフェリン及びホタルルシフェラーゼを加えて、ルミテスターで発光量を測定すればよい。元のATP溶液に比べて発光量が減少していれば、ATP分解酵素が固定化されていると判定することができる。また、発光量の減少量の大小によって、ATP分解能を判定することができる。
【0048】
検査用チップ10は、ウェル及び流路内の検体液の温度を調節することができる恒温装置とともに用いるのが好ましい。検体と試薬との反応は発熱又は吸熱を伴うため、検体液の温度を調節しないと、温度変化により反応が不安定になるおそれがある。また、温度が変化すると、液体が膨張して不要な気泡が発生し、流路(ウェル部分を除く。)の目詰まりが生じるおそれがある。恒温装置とともに用いれば、そのようなトラブルを未然に防ぐことができる。
【0049】
(第2実施形態)
本発明の第2実施形態について、図3及び4を参照して説明する。図3は、第2実施形態に係る検査用チップの平面図である。図4は、図3のIV−IV線に沿った断面図である。
【0050】
第2実施形態に係る検査用チップ20は、基板1aに、流路43の一部を構成している増幅ウェル(第4のウェル)45が更に形成され、基板1aの表面のうち、基板1aに対して基板1bと反対側の表面に、増幅ウェル開放口(第4の開口)45aが形成され、更に、増幅ウェル45に固形状の増幅試薬7が収納されている点で、検査用チップ10と相違する。
【0051】
増幅ウェル45は、増幅ウェル開放口45aの縁部から基板1b側に向かって円筒状に延びる側壁面と、その側壁面の端部に接続される底面と、によって形成されている。ここで、増幅ウェル45の底面は、側壁面の端部から遠ざかる方向へ窪んでいる。具体的には、上記底面は、基板1aの表面に平行な仮想平面でウェル(側壁面によって形成される円柱状の部分を除く。)を切断したときの開口の面積が、基板1aから基板1bに向かって小さくなるように、テーパ状(円錐状又は円錐台状)に形成されている。
【0052】
上述したとおり、増幅ウェル45には、固形状の増幅試薬7が収納されている。増幅試薬7としては、例えば、アデノシン一リン酸(AMP)、ポリリン酸、アデニル酸キナーゼ(ADK)及びポリリン酸キナーゼ(PPK)からなる試薬が挙げられる。ATPは、アデニル酸キナーゼの存在下でAMPと反応して2分子のADPを生じ、この2分子のADPは、ポリリン酸キナーゼの存在下でポリリン酸と反応して2分子のATPを生じる。この反応を繰り返すことにより、ATPは増幅される。固形状の増幅試薬7は、酵素を含有する場合は、凍結乾燥されたものであることが好ましい。凍結乾燥された試薬は、長期(例えば、半年以上)に渡って本来の活性を維持することができる。
【0053】
また、増幅ウェル開放口45aは、フィルター14で覆われている。フィルター14は、増幅ウェル45内への微生物等の不純物の混入を防止するためのものである。フィルター14としては、フィルター13と同様のものを用いればよい。
【0054】
また、抽出ウェル42及び増幅ウェル45は流路44によって接続されている。具体的には、流路44の一端は抽出ウェル42のテーパ状の底面の端部に接続され、流路44の他端は増幅ウェル45の側壁面に接続されている。従って、抽出ウェル42内の検体液は、流路44を経て増幅ウェル45に流入することができる。また、増幅ウェル45及び発光ウェル3は流路46によって接続されている。具体的には、流路46の一端は増幅ウェル45のテーパ状の底面の端部に接続され、流路46の他端は発光ウェル3の側壁面に接続されている。従って、増幅ウェル45内の検体液は、流路46を経て発光ウェル3に流入することができる。なお、増幅ウェル45は流路44及び流路46とともに流路43を構成している。すなわち、流路43は増幅ウェル45及び発光ウェル3を接続している。
【0055】
流路41の内壁面に固定化されるATP分解酵素としては、ADP分解酵素を兼ねるものが好ましい。ここで、ATP分解酵素が「ADP分解酵素を兼ねる」とは、ATP分解酵素、すなわちATP分解酵素活性を有する物質(例えば、タンパク質)が更にADP分解酵素活性を有することを意味し、当該物質においてATP分解酵素活性部位及びADP分解酵素活性部位が異なっていてもよい。上記ATP分解酵素がADP分解酵素を兼ねれば、検体液と抽出試薬6、増幅試薬7及び発光試薬5とが混合される前に、バックグラウンドATP、及び検体液中に混入しているADP(以下、「バックグラウンドADP」という。)が分解除去される。増幅試薬7によってATPが増幅される際には、検体液中のADPがATPに変換されて増幅されるので、バックグラウンドATPに加えて、バックグラウンドADPが、検体液と増幅試薬7とが混合される前に分解除去されれば、それだけ高い精度で微生物を検出することができる。ADP分解酵素を兼ねるATP分解酵素としては、アピラーゼが挙げられる。
【0056】
次に、検査用チップ20を用いて検体中の微生物を検出する方法について説明する。
【0057】
まず、検体液を検体液導入ウェル2に導入する。また、受光部21aを有する光検出器21を、受光部21aが発光ウェル3に対向して基板1cの表面に接するように設置する。また、圧力ポート22、23及び24を、それぞれ検体液導入ウェル開放口2a、抽出ウェル開放口42a及び増幅ウェル開放口45aを覆うように設置する。なお、図4では、光検出器21、受光部21a、圧力ポート24が二点鎖線で示されている(圧力ポート22及び23は、図4には示されていない)。
【0058】
次に、検体液導入ウェル2に導入された検体液を、検体液導入ウェル2の内部を圧力ポート22で加圧することによって、流路41に流通させて抽出ウェル42に収容させる。検体液が抽出ウェル42に収容されると、抽出ウェル42に収納されている固形状の抽出試薬6が検体液に溶解し、抽出ウェル42内で微生物中のATPが抽出される。
【0059】
次に、ATPの抽出に十分な時間が経過した後、抽出ウェル42の内部を圧力ポート23で加圧することによって、抽出ウェル42に収容された検体液を、流路44に流通させて増幅ウェル45に収容させる。このとき、検体液の逆流、及び抽出ウェル42内の圧力損失を防ぐために、同時に検体液導入ウェル2の内部を圧力ポート22で加圧する。検体液が増幅ウェル45に収容されると、増幅ウェル45に収納されている固形状の増幅試薬7が検体液に溶解し、増幅ウェル45内で検体液中のATPと反応し、検体液中のATPが増幅される。
【0060】
最後に、ATPの増幅に十分な時間が経過した後、増幅ウェル45の内部を圧力ポート24で加圧することによって、増幅ウェル45に収容された検体液を、流路46に流通させて発光ウェル3に収容させる。このとき、検体液の逆流、及び増幅ウェル45内の圧力損失を防ぐために、同時に検体液導入ウェル2及び抽出ウェル42の内部をそれぞれ圧力ポート22及び23で加圧する。検体液が発光ウェル3に収容されると、発光ウェル3に収納されている固形状の発光試薬5が検体液に溶解し、発光ウェル3内で検体液中のATPと反応し、発光が生じる。発光試薬5から発せられる光は受光部21aに入射され、光検出器21で検出される。こうして検体中の微生物が検出される。
【0061】
検査用チップ20では、増幅ウェル開放口45aがフィルター14で覆われていることにより、増幅ウェル45内への微生物等の不純物の混入が防止される。従って、検査用チップ20を用いれば、それだけ高い精度で微生物を検出することができる。フィルター14としては、フィルター13と同様のものを用いればよい。
【0062】
また、検査用チップ20では、流路44が抽出ウェル42のテーパ状の底面の端部に接続されているので、抽出ウェル42に収容されている検体液を流路44に流出させる操作を行った場合、ウェル内に残存する検体液の量が十分に少なくなる。また、流路46が増幅ウェル45のテーパ状の底面の端部に接続されているので、増幅ウェル45に収容されている検体液を流路46に流出させる操作を行った場合、ウェル内に残存する検体液の量が十分に少なくなる。このように、抽出ウェル42及び増幅ウェル45に残存する検体液の量が十分に少なくなるので、検査用チップ20を用いれば、導入した検体液中の検体の量に対応する発光強度を高い精度で測定することができ、また、それだけ高い精度で、かつ再現性よく微生物を検出することができる。ここで、抽出ウェル42及び増幅ウェル45のテーパ状の底面と基板1aの表面とがなす角度は特に限定されないが、例えば30〜60度であればよい。
【0063】
また、検査用チップ20では、流路44が増幅ウェル45の側壁面に接続されているので、流路44を流通してきた検体液が、増幅ウェル45に収納されている固体状の増幅試薬7の上方から増幅ウェル45に流入し、固体状の増幅試薬7の溶解が上下両方向から進むことになる。すなわち、一方で、流路44から流出され、固体状の増幅試薬7に直接当たる検体液によって、固体状の増幅試薬7の上側部分が溶解され、他方で、増幅ウェル45に貯留する検体液によって、固体状の増幅試薬7の下側部分が溶解される。従って、検査用チップ20を用いれば、それだけ増幅試薬7の溶解速度が大きくなり、迅速に微生物を検出することができる。
【0064】
また、抽出ウェル42の内部を加圧して検体液を増幅ウェル45に移送する場合において、流路44が、例えば増幅ウェル45の底面に接続されていると、空気が、抽出ウェル42から流路44を経て、増幅ウェル45に貯留されている検体液中に導入され、検体液中に気泡が発生し、この気泡が増幅ウェル45から流路46への検体液の流出を妨げるおそれがある。これに対し、検査用チップ20では、流路44が、増幅ウェル45の側壁面に接続されているので、検体液の量を最適化することによって、上述のような検体液中における気泡の発生が防止される。すなわち、流路44が、増幅ウェル45の側壁面のうち、増幅ウェル45に収容される検体液の液面より上の部分に接続されている場合は、上述のような気泡の発生が防止される。従って、検査用チップ20を用いれば、検体液の量を最適化することによって、それだけ、検体液が円滑に増幅ウェル45から流路46を経て発光ウェル3に移送され、円滑に微生物を検出することができる。
【0065】
また、流路44が、増幅ウェル45の側壁面のうち、増幅ウェル45に収容される検体液の液面より上の部分に接続されている場合は、収容された検体液の逆流が確実に防止される。また、検体液を流路46に流出させる際には、検体液の逆流を防ぐために、検体液導入ウェル2又は抽出ウェル42の内部を加圧する必要がない。従って、検査用チップ20を用いれば、検体液の量を最適化することによって、それだけ高い精度で、かつ簡便に微生物を検出することができる。
【0066】
同様に、流路46が発光ウェル3の側壁面に接続されているので、固体状の発光試薬5の溶解が上下両方向から進むことになる。従って、検査用チップ20を用いれば、それだけ発光試薬5の溶解速度が大きくなり、迅速に微生物を検出することができる。
【0067】
また、検査用チップ20を用いれば、検体液中のバックグラウンドATPがATP分解酵素によって分解除去され、微生物中のATPが抽出試薬6によって抽出された後、検体液と発光試薬5とが混合される前に検体液中のATPが増幅されるので、それだけ高い感度で微生物を検出することができる。なお、ATP分解酵素がADP分解酵素を兼ねていれば、バックグラウンドATPに加えて、バックグラウンドADPも分解除去されるので、更に高い精度で微生物を検出することができる。
【0068】
(第3実施形態)
本発明の第3実施形態について、図5及び6を参照して説明する。図5は、第3実施形態に係る検査用チップの平面図である。図6は、図5のVI−VI線に沿った断面図である。
【0069】
第3実施形態に係る検査用チップ30は、基板1aに、流路41の一部を構成しているビーズ収納ウェル48が更に形成され、基板1aの表面のうち、基板1aに対して基板1bと反対側の表面に、ビーズ収納ウェル開放口48aが更に形成されている点でも、検査用チップ10と相違する。また、検査用チップ30は、流路41の内壁面にATP分解酵素が固定化される代わりに、ビーズ収納ウェル48に、ATP分解酵素が固定化されたビーズ8が収納されている点でも、検査用チップ10と相違する。
【0070】
ビーズ8に固定化されたATP分解酵素は、ビーズ収納ウェル48に収容された液体中のATPを分解除去するものである。ATP分解酵素としては、第1実施形態に係る検査用チップ10において流路41の内壁面に固定化されるATP分解酵素と同様のものを用いることができ、また、ADP分解酵素を兼ねるものが好ましい。
【0071】
また、ビーズ収納ウェル開放口48aは、フィルター15で覆われている。フィルター15は、ビーズ収納ウェル48内への微生物等の不純物の混入を防止するためのものである。フィルター15としては、フィルター13と同様のものを用いればよい。
【0072】
また、ビーズ収納ウェル48は、ビーズ収納ウェル開放口48aの縁部から基板1b側に向かって円筒状に延びる側壁面と、その側壁面の端部に接続される底面と、によって形成されている。ここで、ビーズ収納ウェル48の底面は、側壁面の端部から遠ざかる方向へ窪んでいる。具体的には、上記底面は、基板1aの表面に平行な仮想平面でウェル(側壁面によって形成される円柱状の部分を除く。)を切断したときの開口の面積が、基板1aから基板1bに向かって小さくなるように、テーパ状(円錐状又は円錐台状)に形成されている。
【0073】
また、検体液導入ウェル2及びビーズ収納ウェル48は流路47によって接続されている。具体的には、流路47の一端は検体液導入ウェル2のテーパ状の底面の端部に接続され、流路47の他端はビーズ収納ウェル48の側壁面に接続されている。従って、検体液導入ウェル2内の検体液は、流路47を経てビーズ収納ウェル48に流入することができる。また、ビーズ収納ウェル48及び抽出ウェル42は流路49によって接続されている。具体的には、流路49の一端はビーズ収納ウェル48のテーパ状の底面の端部に接続され、流路49の他端は抽出ウェル42の側壁面に接続されている。従って、抽出ウェル42内の検体液は、流路49を経て抽出ウェル42に流入することができる。ビーズ収納ウェル48と流路49との接続部は、フィルター16で覆われている。ここで、フィルター16は、微生物の透過を許容し、かつビーズ8の流出を防ぐものであればよい。また、ビーズ8の平均径は、微生物よりも大きいことが好ましい。このことから、ビーズ8の平均径としては10μm以上が好ましく、フィルター16の平均孔径としては10μm未満が好ましい。なお、ビーズ収納ウェル48は流路47及び流路49とともに流路41を構成している。すなわち、流路41は検体液導入ウェル2及び抽出ウェル42を接続している。
【0074】
次に、検査用チップ30を用いて検体中の微生物を検出する方法について説明する。
【0075】
まず、検体液を検体液導入ウェル2に導入する。また、受光部21aを有する光検出器21を、受光部21aが発光ウェル3に対向して基板1cの表面に接するように設置する。また、圧力ポート22、26及び23を、それぞれ検体液導入ウェル開放口2a、ビーズ収納ウェル開放口48a及び抽出ウェル開放口42aを覆うように設置する。なお、図6では、光検出器21、受光部21a、圧力ポート26及び24が二点鎖線で示されている(圧力ポート22は、図6には示されていない)。
【0076】
次に、検体液導入ウェル2に導入された検体液を、検体液導入ウェル2の内部を圧力ポート22で加圧することによって、流路47に流通させてビーズ収納ウェル48に収容させる。検体液がビーズ収納ウェル48に収容されると、検体液中のバックグラウンドATPが、ビーズ8に固定化されているATP分解酵素と反応し、ビーズ収納ウェル48内で分解される。
【0077】
次に、バックグラウンドATPの分解に十分な時間が経過した後、ビーズ収納ウェル48の内部を圧力ポート26で加圧することによって、ビーズ収納ウェル48に収容された検体液を、流路49に流通させて抽出ウェル42に収容させる。このとき、検体液の逆流、及びビーズ収納ウェル48内の圧力損失を防ぐために、同時に検体液導入ウェル2の内部を圧力ポート22で加圧する。検体液が抽出ウェル42に収容されると、抽出ウェル42に収納されている固形状の抽出試薬6が検体液に溶解し、抽出ウェル42内で微生物中のATPが抽出される。
【0078】
最後に、ATPの抽出に十分な時間が経過した後、抽出ウェル42の内部を圧力ポート23で加圧することによって、抽出ウェル42に収容された検体液を、流路43に流通させて発光ウェル3に収容させる。このとき、検体液の逆流、及び抽出ウェル42内の圧力損失を防ぐために、同時に検体液導入ウェル2及びビーズ収納ウェル48の内部をそれぞれ圧力ポート22及び26で加圧する。検体液が発光ウェル3に収容されると、固形状の発光試薬5が検体液に溶解し、発光ウェル3内で検体液中のATPと反応し、発光が生じる。発光試薬5から発せられる光は受光部21aに入射され、光検出器21で検出される。こうして検体中の微生物が検出される。
【0079】
検査用チップ30では、検体液がビーズ収納ウェル48に収容されている間に、ビーズ8に固定化されたATP分解酵素によって検体液中のバックグラウンドATPがほぼ完全に分解除去される。従って、検査用チップ30を用いれば、それだけ高い精度で微生物を検出することができる。
【0080】
また、検査用チップ30では、ビーズ収納ウェル48に、ATP分解酵素が固定化されたビーズ8が収納されているので、十分な量のATP分解酵素をチップ内に固定化するために、検査用チップ10のように流路41を蛇行状に形成する必要がない。従って、検査用チップ30では、チップに検査用チップ10と同様のバックグラウンドATP除去能力を持たせ、かつチップを検査用チップ10より小型化することができる。
【0081】
また、検査用チップ30では、ビーズ収納ウェル開放口48aがフィルター15で覆われていることにより、ビーズ収納ウェル48内への微生物等の不純物の混入が防止される。従って、検査用チップ30を用いれば、それだけ高い精度で微生物を検出することができる。
【0082】
また、検査用チップ30では、流路47が検体液導入ウェル2のテーパ状の底面の端部に接続されているので、検体液導入ウェル2に収容されている検体液を流路47に流出させる操作を行った場合、ウェル内に残存する検体液の量が十分に少なくなる。また、流路49がビーズ収納ウェル48のテーパ状の底面の端部に接続されているので、ビーズ収納ウェル48に収容されている検体液を流路49に流出させる操作を行った場合、ウェル内に残存する検体液の量が十分に少なくなる。このように、検体液導入ウェル2及びビーズ収納ウェル48に残存する検体液の量が十分に少なくなるので、検査用チップ30を用いれば、導入した検体液中の検体の量に対応する発光強度を高い精度で測定することができ、また、それだけ高い精度で、かつ再現性よく微生物を検出することができる。ここで、検体液導入ウェル2及びビーズ収納ウェル48のテーパ状の底面と基板1aの表面とがなす角度は特に限定されないが、例えば30〜60度であればよい。
【0083】
また、検査用チップ30では、流路47がビーズ収納ウェル48の側壁面に接続されているので、流路47を流通してきた検体液が、ビーズ収納ウェル48に収納されているビーズ8の上方からビーズ収納ウェル48に流入し、ビーズ8と検体液との接触が上下両方向から進むことになる。すなわち、一方で、流路47から流出され、ビーズ8に直接当たる検体液中のATPは、ビーズ8の上側部分に固定化されたATP分解酵素と反応し、他方で、増幅ウェル45に貯留する検体液中のATPは、固体状の増幅試薬7の下側部分に固定化されたATP分解酵素と反応する。従って、検査用チップ30を用いれば、それだけ、ビーズ8に固定化されたATP分解酵素と検体液中のATPとの反応速度が大きくなり、迅速に微生物を検出することができる。
【0084】
また、検体液導入ウェル2の内部を加圧して検体液をビーズ収納ウェル48に移送する場合において、流路47が、例えばビーズ収納ウェル48の底面に接続されていると、空気が、検体液導入ウェル2から流路47を経て、ビーズ収納ウェル48に貯留されている検体液中に導入され、検体液中に気泡が発生し、この気泡がビーズ収納ウェル48から流路49への検体液の流出を妨げるおそれがある。これに対し、検査用チップ30では、流路47が、ビーズ収納ウェル48の側壁面に接続されているので、検体液の量を最適化することによって、上述のような検体液中における気泡の発生が防止される。すなわち、流路47が、ビーズ収納ウェル48の側壁面のうち、ビーズ収納ウェル48に収容される検体液の液面より上の部分に接続されている場合は、上述のような気泡の発生が防止される。従って、検査用チップ30を用いれば、検体液の量を最適化することによって、それだけ、検体液が円滑にビーズ収納ウェル48から流路49を経て抽出ウェル42に移送され、円滑に微生物を検出することができる。
【0085】
また、流路47が、ビーズ収納ウェル48の側壁面のうち、ビーズ収納ウェル48に収容される検体液の液面より上の部分に接続されている場合は、収容された検体液の逆流が確実に防止される。また、検体液を流路49に流出させる際には、検体液の逆流を防ぐために、検体液導入ウェル2の内部を加圧する必要がない。従って、検査用チップ30を用いれば、検体液の量を最適化することによって、それだけ高い精度で、かつ簡便に微生物を検出することができる。
【0086】
同様に、流路43が発光ウェル3の側壁面に接続されているので、固体状の発光試薬5の溶解が上下両方向から進むことになる。従って、検査用チップ30を用いれば、それだけ発光試薬5の溶解速度が大きくなり、迅速に微生物を検出することができる。
【0087】
(第4実施形態)
本発明の第4実施形態について、図7及び8を参照して説明する。図7は、第4実施形態に係る検査用チップの平面図である。図8は、図7のVIII−VIII線に沿った断面図である。
【0088】
第4実施形態に係る検査用チップ40は、基板1aに、廃液収容ウェル51及び補助液収容ウェル52が更に形成され、基板1aの表面のうち、基板1aに対して基板1bと反対側の表面に、廃液収容ウェル開放口51a及び補助液収容ウェル開放口52aが形成されている点で、第1実施形態に係る検査用チップ10と相違する。また、検査用チップ40は、抽出ウェル42が流路4の一部を構成していない点でも、検査用チップ10と相違する。また、検査用チップ40は、流路4が蛇行状の部分を有しない点、及びすべての流路において、両端がウェルの底面に接続されている点でも、検査用チップ10と相違する。
【0089】
補助液収容ウェル52は、補助液収容ウェル開放口52aの縁部から基板1b側に向かって円筒状に延びる側壁面と、その側壁面の端部に接続される底面と、によって形成されている。ここで、補助液収容ウェル52の底面は、側壁面の端部から遠ざかる方向へ窪んでいる。具体的には、上記底面は、基板1aの表面に平行な仮想平面でウェル(側壁面によって形成される円柱状の部分を除く。)を切断したときの開口の面積が、基板1aから基板1bに向かって小さくなるように、テーパ状(円錐状又は円錐台状)に形成されている。
【0090】
また、検体液導入ウェル2及び廃液収容ウェル51は流路53によって接続されている。具体的には、流路53の一端は検体液導入ウェル2のテーパ状の底面の端部に接続され、流路53の他端は廃液収容ウェル51の側壁面に接続されている。従って、検体液導入ウェル2内の液体は、流路53を経て廃液収容ウェル51に流入することができる。検体液導入ウェル2と流路53との接続部は、フィルター17で覆われている。フィルター17は検出対象の微生物を捕捉するためのものである。このことから、フィルター17の平均孔径としては0.1〜1μmが好ましい。
【0091】
また、補助液収容ウェル52及び検体液導入ウェル2は流路54によって接続されている。具体的には、流路54の一端は補助液収容ウェル52のテーパ状の底面の端部に接続され、流路54の他端は検体液導入ウェル2の側壁面に接続されている。従って、補助液収容ウェル52内の液体は、流路54を経て検体液導入ウェル2に流入することができる。
【0092】
また、補助液収容ウェル52及び抽出ウェル42は流路55によって接続されている。具体的には、流路55の一端は補助液収容ウェル52のテーパ状の底面の端部に接続され、流路55の他端は抽出ウェル42の側壁面に接続されている。従って、補助液収容ウェル52内の液体は、流路55を経て抽出ウェル42に流入することができる。
【0093】
また、抽出ウェル42及び検体液導入ウェル2は流路56によって接続されている。具体的には、流路56の一端は抽出ウェル42のテーパ状の底面の端部に接続され、流路56の他端は検体液導入ウェル2の側壁面に接続されている。従って、抽出ウェル42内の液体は、流路56を経て検体液導入ウェル2に流入することができる。
【0094】
また、検体液導入ウェル2及び発光ウェル3は流路4によって接続されている。具体的には、流路4の一端は検体液導入ウェル2のテーパ状の底面の端部に接続され、流路4の他端は発光ウェル3の側壁面に接続されている。従って、検体液導入ウェル2内の液体は、流路4を経て発光ウェル3に流入することができる。
【0095】
次に、検査用チップ40を用いて検体中の微生物を検出する方法について説明する。
【0096】
まず、検体液を検体液導入ウェル2に導入し、補助液を補助液収容ウェル52に収容させる。ここで、補助液としては、例えば、純水、LP(ポリソルベート80、レシチン及びペプトンから構成される)希釈液等が挙げられる。補助液内に混入しているATP及び微生物は、オートクレーブ処理等により予め除去されていることが好ましい。
【0097】
また、受光部21aを有する光検出器21を、受光部21aが発光ウェル3に対向して基板1cの表面に接するように設置する。また、圧力ポートを、検体液導入ウェル開放口2a、廃液収容ウェル開放口51a、補助液収容ウェル開放口52a、抽出ウェル開放口42a及び発光ウェル開放口3aを覆うように設置する。なお、図8では、光検出器21、受光部21a、圧力ポート22、23及び27が二点鎖線で示されている(圧力ポート22、23及び27は、それぞれ検体液導入ウェル開放口2a、抽出ウェル開放口42a及び発光ウェル開放口3aを覆っている)。
【0098】
次に、検体液導入ウェル2に導入された検体液を、検体液導入ウェル2の内部を圧力ポート22で加圧することによって、流路53に流通させて廃液収容ウェル51に収容させる。このとき、他のウェルへの検体液の流入、及び検体液導入ウェル2内の圧力損失を防ぐために、同時に補助液収容ウェル52、抽出ウェル42及び発光ウェル3の内部を圧力ポートで加圧する。検体液が検体液導入ウェル2から流出し、廃液収容ウェル51に収容されると、フィルター17によって、検体液中の微生物が検体液導入ウェル2内に残存し、それ以外の成分(バックグラウンドATPを含む。)が検体液導入ウェル2から流出し、廃液収容ウェル51に収容される。
【0099】
次に、補助液収容ウェル52に収容されている補助液を、補助液収容ウェル52の内部を圧力ポートで加圧することによって、流路54に流通させて検体液導入ウェル2に収容させる。このとき、抽出ウェル42への補助液の流入を防ぐために、同時に抽出ウェル42の内部を圧力ポート23で加圧する。
【0100】
次に、検体液導入ウェル2に収容された補助液を、検体液導入ウェル2の内部を圧力ポート22で加圧することによって、流路53に流通させて廃液収容ウェル51に収容させる。このとき、他のウェルへの検体液の流入、及び検体液導入ウェル2内の圧力損失を防ぐために、同時に補助液収容ウェル52、抽出ウェル42及び発光ウェル3の内部を圧力ポートで加圧する。補助液が検体液導入ウェル2から流出し、廃液収容ウェル51に収容されると、フィルター17によって、検体液中の微生物以外の成分(バックグラウンドATPを含む。)は洗い流され、廃液収容ウェル51に収容される。
【0101】
次に、補助液収容ウェル52に収容されている補助液を、補助液収容ウェル52の内部を圧力ポートで加圧することによって、流路55に流通させて抽出ウェル42に収容させる。このとき、検体液導入ウェル2への補助液の流入を防ぐために、同時に検体液導入ウェル2の内部を圧力ポート22で加圧する。補助液が抽出ウェル42に収容されると、抽出ウェル42に収納されている固形状の抽出試薬6が補助液に溶解する。
【0102】
次に、抽出試薬6が溶解している補助液を、抽出ウェル42の内部を圧力ポート23で加圧することによって、流路56に流通させて検体液導入ウェル2に収容させる。このとき、補助液収容ウェル52への補助液の流入、及び抽出ウェル42内の圧力損失を防ぐために、同時に補助液収容ウェル52の内部を圧力ポートで加圧する。抽出試薬6が溶解している補助液が検体液導入ウェル2に収容されると、検体液導入ウェル2内で微生物中のATPが抽出される。
【0103】
最後に、ATPの抽出に十分な時間が経過した後、検体液導入ウェル2の内部を圧力ポート22で加圧することによって、検体液導入ウェル2に収容された補助液を、流路4に流通させて発光ウェル3に収容させる。このとき、他のウェルへの検体液の流入、及び検体液導入ウェル2内の圧力損失を防ぐために、同時に廃液収容ウェル51、補助液収容ウェル52及び抽出ウェル42の内部を圧力ポートで加圧する。補助液が発光ウェル3に収容されると、固形状の発光試薬5が補助液に溶解し、発光ウェル3内で補助液中のATPと反応し、発光が生じる。発光試薬5から発せられる光は受光部21aに入射され、光検出器21で検出される。こうして検体中の微生物が検出される。
【0104】
上述のように、検査用チップ40では、検体液中の微生物以外の成分(バックグラウンドATPを含む。)が、フィルター17によって、検体液導入ウェル2から洗い流され、廃液収容ウェル51に収容される。従って、検査用チップ40を用いれば、検体液中の微生物等の不純物に起因する発光を防止することができ、それだけ高い精度で微生物を検出することができる。
【0105】
また、検査用チップ40では、流路53及び4が検体液導入ウェル2のテーパ状の底面の端部に接続されているので、検体液導入ウェル2に収容されている検体液を流路53又は4に流出させる操作を行った場合、ウェル内に残存する検体液の量が十分に少なくなる。また、流路54及び55が補助液収容ウェル52のテーパ状の底面の端部に接続されているので、補助液収容ウェル52に収容されている検体液を流路54又は55に流出させる操作を行った場合、ウェル内に残存する検体液の量が十分に少なくなる。また、流路56が抽出ウェル42のテーパ状の底面の端部に接続されているので、抽出ウェル42に収容されている検体液を流路56に流出させる操作を行った場合、ウェル内に残存する検体液の量が十分に少なくなる。このように、検体液導入ウェル2、補助液収容ウェル52及び抽出ウェル42に残存する検体液の量が十分に少なくなるので、検査用チップ40を用いれば、導入した検体液中の検体の量に対応する発光強度を高い精度で測定することができ、また、それだけ高い精度で、かつ再現性よく微生物を検出することができる。ここで、検体液導入ウェル2、補助液収容ウェル52及び抽出ウェル42のテーパ状の底面と基板1aの表面とがなす角度は特に限定されないが、例えば30〜60度であればよい。
【0106】
また、検査用チップ40では、流路55及び4がそれぞれ抽出ウェル42及び発光ウェル3の側壁面に接続されているので、流路55又は4を流通してきた液体がそれぞれ、抽出ウェル42又は発光ウェル3に収納されている固体状の試薬の上方からウェルに流入し、固体状の抽出試薬6及び発光試薬5の溶解が上下両方向から進むことになる。従って、検査用チップ40を用いれば、それだけ抽出試薬6及び発光試薬5の溶解速度が大きくなり、迅速に微生物を検出することができる。
【0107】
また、検査用チップ40では、流路54及び56が各々、検体液導入ウェル2の側壁面に接続され、また、流路55が抽出ウェル42の側壁面に接続されているので、検体液及び補助液の量を最適化することによって、検体液導入ウェル2及び抽出ウェル42に貯留されている液体中における気泡の発生が防止される。従って、検査用チップ40を用いれば、検体液及び補助液の量を最適化することによって、それだけ、液体が円滑に検体液導入ウェル2から廃液収容ウェル51又は発光ウェル3へ、また、抽出ウェル42から検体液導入ウェル2へ移送され、円滑に微生物を検出することができる。
【0108】
また、検査用チップ40では、ウェルに液体が流入するための流路が、そのウェルの側壁面に接続されているので、検体液及び補助液の量を最適化することによって、収容された液体の逆流が確実に防止される。また、ウェルに収容された液体を流出させる際には、液体の逆流を防ぐために、他のウェルの内部を加圧する必要がない。従って、検査用チップ40を用いれば、検体液及び補助液の量を最適化することによって、それだけ高い精度で、かつ簡便に微生物を検出することができる。
【0109】
(第5実施形態)
本発明の第5実施形態について、図9及び10を参照して説明する。図9は、第5実施形態に係る検査用チップの平面図である。図10は、図9のX−X線に沿った断面図である。
【0110】
第5実施形態に係る検査用チップ50は、基板1aに、ATP分解ウェル57が更に形成され、基板1aの表面のうち、基板1aに対して基板1bと反対側の表面に、ATP分解ウェル開放口57aが形成され、更に、ATP分解ウェル57に固形状のATP分解酵素9が収納されている点で、第4実施形態に係る検査用チップ40と相違する。また、検査用チップ50は、廃液収容ウェル51が、流路4の途中から分岐した流路61に接続されている点でも、検査用チップ40と相違する。また、検査用チップ50は、流路4が蛇行状の部分(流路4a)を有し、この部分の内壁面に、検出対象の微生物と特異的に結合する抗体が固定化されている点でも、検査用チップ40と相違する。
【0111】
ATP分解酵素9としては、アピラーゼ、アデノシンリン酸デアミナーゼ、ルシフェラーゼ等が挙げられる。固形状のATP分解酵素9は、凍結乾燥されたものであることが好ましい。凍結乾燥された試薬は、長期(例えば、半年以上)に渡って本来の活性を維持することができる。
【0112】
また、ATP分解ウェル開放口57aは、フィルター18で覆われている。フィルター18は、ATP分解ウェル57内への微生物等の不純物の混入を防止するためのものである。フィルター18としては、フィルター13と同様のものを用いればよい。
【0113】
ATP分解ウェル57は、ATP分解ウェル開放口57aの縁部から基板1b側に向かって円筒状に延びる側壁面と、その側壁面の端部に接続される底面と、によって形成されている。ここで、ATP分解ウェル57の底面は、側壁面の端部から遠ざかる方向へ窪んでいる。具体的には、上記底面は、基板1aの表面に平行な仮想平面でウェル(側壁面によって形成される円柱状の部分を除く。)を切断したときの開口の面積が、基板1aから基板1bに向かって小さくなるように、テーパ状(円錐状又は円錐台状)に形成されている。
【0114】
また、上述のように、流路4は、その途中から分岐する流路61を介して、廃液収容ウェル51の側壁面に接続されている。流路4は、流路4と流路61との接続部に対して検体液導入ウェル2側に蛇行状に形成された流路4aと、上記接続部に対して発光ウェル3側に形成された流路4bとからなる。
【0115】
検体液導入ウェル2及び廃液収容ウェル51は、流路4a及び61によって接続されている。具体的には、流路4a及び61は各々の一端で互いに接続されており、流路4aの他端は検体液導入ウェル2のテーパ状の底面の端部に接続され、流路61の他端は廃液収容ウェル51の側壁面に接続されている。従って、検体液導入ウェル2内の液体は、流路4a及び61を経て廃液収容ウェル51に流入することができる。
【0116】
また、補助液収容ウェル52及びATP分解ウェル57は、流路58によって接続されている。具体的には、流路58の一端は補助液収容ウェル52のテーパ状の底面の端部に接続され、流路58の他端はATP分解ウェル57の側壁面に接続されている。従って、補助液収容ウェル52内の液体は、流路58を経てATP分解ウェル57に流入することができる。
【0117】
また、ATP分解ウェル57及び検体液導入ウェル2は流路59によって接続されている。具体的には、流路59の一端はATP分解ウェル57のテーパ状の底面の端部に接続され、流路59の他端は検体液導入ウェル2の側壁面に接続されている。従って、ATP分解ウェル57内の液体は、流路59を経て検体液導入ウェル2に流入することができる。
【0118】
また、抽出ウェル42及び検体液導入ウェル2は流路56によって接続されている。具体的には、流路56の一端は抽出ウェル42のテーパ状の底面の端部に接続され、流路56の他端は検体液導入ウェル2の側壁面に接続されている。従って、抽出ウェル42内の液体は、流路56を経て検体液導入ウェル2に流入することができる。
【0119】
次に、検査用チップ50を用いて検体中の微生物を検出する方法について説明する。
【0120】
まず、検体液を検体液導入ウェル2に導入し、補助液を補助液収容ウェル52に収容させる。ここで、補助液としては、例えば、純水、LP希釈液等が挙げられる。補助液内に混入しているATP及び微生物は、オートクレーブ処理により予め除去されていることが好ましい。
【0121】
また、受光部21aを有する光検出器21を、受光部21aが発光ウェル3に対向して基板1cの表面に接するように設置する。また、圧力ポートを、検体液導入ウェル開放口2a、廃液収容ウェル開放口51a、補助液収容ウェル開放口52a、ATP分解ウェル開放口57a、抽出ウェル開放口42a及び発光ウェル開放口3aを覆うように設置する。なお、図10では、光検出器21、受光部21a、圧力ポート22、28及び27が二点鎖線で示されている(圧力ポート22、28及び27は、それぞれ検体液導入ウェル開放口2a、ATP分解ウェル開放口57a及び発光ウェル開放口3aを覆っている)。
【0122】
次に、検体液導入ウェル2に導入された検体液を、検体液導入ウェル2の内部を圧力ポート22で加圧することによって、流路4a及び61に流通させて廃液収容ウェル51に収容させる。このとき、他のウェルへの検体液の流入、及び検体液導入ウェル2内の圧力損失を防ぐために、同時に補助液収容ウェル52、抽出ウェル42、ATP分解ウェル57及び発光ウェル3の内部を圧力ポートで加圧する。検体液が流路4a及び61を流通して、廃液収容ウェル51に収容されると、検体液中の検出対象の微生物のみが、流路4aに固定化された抗体に結合し、それ以外の成分(バックグラウンドATPを含む。)は廃液収容ウェル51に収容される。
【0123】
次に、補助液収容ウェル52に収容されている補助液を、補助液収容ウェル52の内部を圧力ポートで加圧することによって、流路58に流通させてATP分解ウェル57に収容させる。このとき、検体液導入ウェル2及び抽出ウェル42への補助液の流入、及び補助液収容ウェル52の圧力損失を防ぐために、同時に検体液導入ウェル2及び抽出ウェル42の内部をそれぞれ圧力ポート22及び23で加圧する。補助液がATP分解ウェル57に収容されると、ATP分解ウェル57に収納されている固形状のATP分解酵素9が補助液に溶解する。
【0124】
次に、ATP分解酵素9が溶解している補助液を、ATP分解ウェル57の内部を圧力ポート28で加圧することによって、流路59に流通させて検体液導入ウェル2に収容させる。このとき、補助液収容ウェル52への補助液の流入、及びATP分解ウェル57内の圧力損失を防ぐために、同時に補助液収容ウェル52の内部を圧力ポートで加圧する。ATP分解酵素9が溶解している補助液が検体液導入ウェル2に収容されると、検体液導入ウェル2内のバックグラウンドATPが分解される。
【0125】
次に、検体液導入ウェル2に収容された補助液を、検体液導入ウェル2の内部を圧力ポート22で加圧することによって、流路4a及び61に流通させて廃液収容ウェル51に収容させる。このとき、他のウェルへの検体液の流入、及び検体液導入ウェル2内の圧力損失を防ぐために、同時に補助液収容ウェル52、抽出ウェル42、ATP分解ウェル57及び発光ウェル3の内部を圧力ポートで加圧する。補助液が流路4a及び61を流通して、廃液収容ウェル51に収容されると、補助液中のATP分解酵素によって、流路4a及び61の内部のバックグラウンドATPが分解され、検出対象の微生物以外の成分(バックグラウンドATPを含む。)が検体液導入ウェル2、流路4a及び61から洗い流されて、廃液収容ウェル51に収容される。
【0126】
次に、補助液収容ウェル52に収容されている補助液を、補助液収容ウェル52の内部を圧力ポートで加圧することによって、流路54に流通させて検体液導入ウェル2に収容させる。このとき、抽出ウェル42及びATP分解ウェル57への補助液の流入、及び補助液収容ウェル52内の圧力損失を防ぐために、同時に抽出ウェル42及びATP分解ウェル57の内部をそれぞれ圧力ポート23及び28で加圧する。
【0127】
次に、検体液導入ウェル2に収容された補助液を、検体液導入ウェル2の内部を圧力ポート22で加圧することによって、流路4a及び61に流通させて廃液収容ウェル51に収容させる。このとき、他のウェルへの検体液の流入、及び検体液導入ウェル2内の圧力損失を防ぐために、同時に補助液収容ウェル52、抽出ウェル42、ATP分解ウェル57及び発光ウェル3の内部を圧力ポートで加圧する。補助液が流路4a及び61を流通して、廃液収容ウェル51に収容されると、補助液中の成分のうち、検出対象の微生物以外の成分(バックグラウンドATP及びATP分解酵素を含む。)が検体液導入ウェル2、流路4a及び61から更に洗い流されて、廃液収容ウェル51に収容される。
【0128】
次に、補助液収容ウェル52に収容されている補助液を、補助液収容ウェル52の内部を圧力ポートで加圧することによって、流路55に流通させて抽出ウェル42に収容させる。このとき、検体液導入ウェル2及びATP分解ウェル57への補助液の流入、及び補助液収容ウェル52内の圧力損失を防ぐために、同時に検体液導入ウェル2及びATP分解ウェル57の内部をそれぞれ圧力ポート22及び28で加圧する。補助液が抽出ウェル42に収容されると、抽出ウェル42に収納されている固形状の抽出試薬6が補助液に溶解する。
【0129】
次に、抽出試薬6が溶解している補助液を、抽出ウェル42の内部を圧力ポート23で加圧することによって、流路56に流通させて検体液導入ウェル2に収容させる。このとき、補助液収容ウェル52への補助液の流入、及び抽出ウェル42内の圧力損失を防ぐために、同時に補助液収容ウェル52の内部を圧力ポートで加圧する。
【0130】
最後に、検体液導入ウェル2に収容された補助液を、検体液導入ウェル2の内部を圧力ポート22で加圧することによって、流路4(4a及び4b)に流通させて発光ウェル3に収容させる。このとき、他のウェルへの検体液の流入、及び検体液導入ウェル2内の圧力損失を防ぐために、同時に廃液収容ウェル51、補助液収容ウェル52、ATP分解ウェル57及び抽出ウェル42の内部を圧力ポートで加圧する。抽出試薬6が溶解している補助液が流路4aを流通すると、流路4aに固定化された抗体に結合している検出対象の微生物中のATPが補助液中に抽出される。補助液が発光ウェル3に収容されると、固形状の発光試薬5が補助液に溶解し、発光ウェル3内で補助液中のATPと反応し、発光が生じる。発光試薬5から発せられる光は受光部21aに入射され、光検出器21で検出される。こうして検体中の微生物が検出される。
【0131】
検査用チップ50は、上述のように抗体を備えるものであるので、検体中の特定の微生物の検出に用いることができる。
【0132】
上述のように、検査用チップ50では、検体液及び補助液中の成分のうち、検出対象の微生物以外の成分(バックグラウンドATP及びATP分解酵素を含む。)が、検体液導入ウェル2及び流路4aから洗い流され、廃液収容ウェル51に収容される。従って、検査用チップ50を用いれば、それだけ高い精度で検出対象の微生物を検出することができる。
【0133】
また、検査用チップ50では、ATP分解ウェル開放口57aがフィルター18で覆われていることにより、ATP分解ウェル57内への微生物等の不純物の混入が防止される。従って、検査用チップ50を用いれば、それだけ高い精度で検出対象の微生物を検出することができる。
【0134】
また、検査用チップ50では、流路4aが検体液導入ウェル2のテーパ状の底面の端部に接続されているので、検体液導入ウェル2に収容されている検体液を流路4aに流出させる操作を行った場合、ウェル内に残存する検体液の量が十分に少なくなる。また、流路54、55及び58が各々、補助液収容ウェル52のテーパ状の底面の端部に接続されているので、補助液収容ウェル52に収容されている検体液を流路54、55又は58に流出させる操作を行った場合、ウェル内に残存する検体液の量が十分に少なくなる。また、流路59がATP分解ウェル57のテーパ状の底面の端部に接続されているので、ATP分解ウェル57に収容されている検体液を流路59に流出させる操作を行った場合、ウェル内に残存する検体液の量が十分に少なくなる。また、流路56が抽出ウェル42のテーパ状の底面の端部に接続されているので、抽出ウェル42に収容されている検体液を流路56に流出させる操作を行った場合、ウェル内に残存する検体液の量が十分に少なくなる。このように、検体液導入ウェル2、補助液収容ウェル52、ATP分解ウェル57及び抽出ウェル42に残存する検体液の量が十分に少なくなるので、検査用チップ50を用いれば、導入した検体液中の検体の量に対応する発光強度を高い精度で測定することができ、また、それだけ高い精度で、かつ再現性よく検出対象の微生物を検出することができる。ここで、検体液導入ウェル2、補助液収容ウェル52、ATP分解ウェル57及び抽出ウェル42のテーパ状の底面と基板1aの表面とがなす角度は特に限定されないが、例えば30〜60度であればよい。
【0135】
また、検査用チップ50では、流路58、55及び4がそれぞれATP分解ウェル57、抽出ウェル42及び発光ウェル3の側壁面に接続されているので、流路58、55又は4を流通してきた液体がそれぞれ、ATP分解ウェル57、抽出ウェル42又は発光ウェル3に収納されている固体状の試薬の上方からウェルに流入し、固体状のATP分解酵素9、抽出試薬6及び発光試薬5の溶解が上下両方向から進むことになる。従って、検査用チップ50を用いれば、それだけATP分解酵素9、抽出試薬6及び発光試薬5の溶解速度が大きくなり、迅速に検出対象の微生物を検出することができる。
【0136】
また、検査用チップ50では、流路59、54及び56が各々、検体液導入ウェル2の側壁面に接続され、また、流路58がATP分解ウェル57の側壁面に、流路55が抽出ウェル42の側壁面に接続されているので、検体液及び補助液の量を最適化することによって、検体液導入ウェル2、ATP分解ウェル57及び抽出ウェル42に貯留されている液体中における気泡の発生が防止される。従って、検査用チップ50を用いれば、検体液及び補助液の量を最適化することによって、それだけ、液体が円滑に検体液導入ウェル2から廃液収容ウェル51又は発光ウェル3へ、また、ATP分解ウェル57又は抽出ウェル42から検体液導入ウェル2へ移送され、円滑に検出対象の微生物を検出することができる。
【0137】
また、検査用チップ50では、ウェルに液体が流入するための流路が、そのウェルの側壁面に接続されているので、検体液及び補助液の量を最適化することによって、収容された液体の逆流が確実に防止される。また、ウェルに収容された液体を流出させる際には、液体の逆流を防ぐために、他のウェルの内部を加圧する必要がない。従って、検査用チップ50を用いれば、検体液及び補助液の量を最適化することによって、それだけ高い精度で、かつ簡便に検出対象の微生物を検出することができる。
【0138】
本発明は、上述の第1〜第5実施形態に限定されるものではない。
【0139】
例えば、第1及び第3〜第5実施形態に係る検査用チップ10、30、40及び50では、発光ウェル3に固形状の発光試薬5が収納されていたが、発光ウェル3には固形状の増幅発光試薬が収納されていてもよい。ここで、「増幅発光試薬」とは、ATPを増幅すると同時に、増幅されたATPと反応して発光を生じさせる試薬を意味し、そのような増幅発光試薬としては、例えば、AMP、ポリリン酸、ADK、PPK、ホタルルシフェリン、ホタルルシフェラーゼ及び2価金属イオンからなる試薬が挙げられる。
【0140】
また、第3〜第5実施形態に係る検査用チップ30、40及び50では、固形状の増幅試薬が収納されているウェルが本体部に形成されていないが、第2実施形態に係る検査用チップ20と同様に、本体部には増幅ウェル45が流路4(検査用チップ30では流路43)の一部として形成され、増幅ウェル45には固形状の増幅試薬7が収納されていてもよい。
【0141】
また、第2実施形態に係る検査用チップ20では、増幅ウェル45に固形状の増幅試薬7が収納されているが、本体部には更にもう一つの増幅ウェルが形成され、固形状の増幅試薬の一部は一方の増幅ウェルに、また、残りの一部は他方の増幅ウェルに収納されていてもよい。すなわち、増幅試薬がAMP、ポリリン酸、ADK及びPPKからなる試薬であるとすると、本体部には更にもう一つの増幅ウェルが形成され、例えば、固形状のAMP及びポリリン酸は一方の増幅ウェルに、固形状のADK及びPPKは他方の増幅ウェルに収納されていてもよい。
【0142】
また、第5実施形態に係る検査用チップ50では、流路4aが蛇行状に形成され、その内壁面に、検出対象の微生物と特異的に結合する抗体が固定化されているが、本体部にはビーズ収納ウェルが流路4(4a及び4b)の一部として形成され、ビーズ収納ウェルには、上記抗体が固定化されたビーズが収納されていてもよい。この場合、流路4は、蛇行状の部分を有していなくてもよい。
【0143】
また、第4及び第5実施形態に係る検査用チップ40及び50では、補助液収容ウェル52に接続されている流路に特別な処理が施されていないが、補助液収容ウェル52に接続されている流路にはATP分解酵素が固定化されていてもよい。また、補助液収容ウェル52と各流路との接続部はフィルター16と同様のフィルターで覆われ、補助液収容ウェル52には、ATP分解酵素が固定化されたビーズ8が収納されていてもよい。
【0144】
また、第1〜第5実施形態に係る検査用チップ10、20、30、40及び50では、ウェルの側壁面が円筒状となっているが、ウェルの側壁面の形状は四角柱等であってもよい。
【0145】
また、第1〜第5実施形態に係る検査用チップ10、20、30、40及び50では、流路が三層の基板1a〜1cのうちの基板1aに形成されているが、流路は、三層の基板1a〜1cのうちの中間層の基板1bに形成されていてもよい。また、検査用チップの本体部1は、例えば、二層の基板からなっていてもよく、流路を構成する溝は、二層の基板の両方に形成されていてもよい。
【0146】
また、第1〜第5実施形態に係る検査用チップ10、20、30、40及び50では、ウェルに液体が流入するための流路がそのウェルの側壁面に接続されているが、ウェルに液体が流入するための流路は、そのウェルの底面に接続されていてもよい。
【実施例】
【0147】
以下、実施例及び比較例に基づいて、本発明をより具体的に説明する。但し、本発明は、以下の実施例に限定されるものではない。
【0148】
(実施例1)
まず、本実施例で用いた検査用チップの構成について、図11及び12を参照して説明する。図11は、実施例1において用いられた検査用チップの平面図である。図12は、図11のXII−XII線に沿った断面図である。
【0149】
図11及び12に示されているように、実施例1において用いられた検査用チップ100は、三層の基板1a〜1cからなる本体部1を備えている。基板1a及び1bは各々、PDMS基板であり、基板1cはガラス基板である。本体部1には、検体液導入ウェル(第1のウェル)2と、発光ウェル(第2のウェル)3と、検体液導入ウェル開放口(第1の開口)2aと、発光ウェル開放口(第2に開口)3aと、検体液導入ウェル2及び発光ウェル3を接続する流路4と、が形成されている。
【0150】
検体液導入ウェル2は、検体液導入ウェル開放口2aの縁部から基板1b側に向かって円筒状に延びる側壁面と、その側壁面の端部に接続される底面と、によって形成されている。ここで、検体液導入ウェル2の底面は、側壁面の端部から遠ざかる方向へ窪んでいる。具体的には、上記底面は、基板1aの表面に平行な仮想平面でウェル(側壁面によって形成される円柱状の部分を除く。)を切断したときの開口の面積が、基板1aから基板1bに向かって小さくなるように、テーパ状(円錐状又は円錐台状)に形成されている。また、発光ウェル3は、発光ウェル開放口3aの縁部から基板1b側に向かって円筒状に延びる側壁面と、その側壁面の端部に接続される平坦な底面と、によって形成されている。また、検体液導入ウェル2及び発光ウェル3は流路4によって接続されている。具体的には、流路4の一端は検体液導入ウェル2のテーパ状の底面の端部に接続され、流路4の他端は発光ウェル3の平坦な底面に接続されている。
【0151】
発光ウェル3には、固形状の発光試薬(固形状の試薬)5が収納されている。固形状の発光試薬5は、ホタルルシフェラーゼ(和光純薬工業社製)(5ng)、ホタルルシフェリン(和光純薬工業社製)(0.3nmol)、Tris−HCl(10nmol)、MgCl2(2nmol)及びトレハロース(和光純薬工業社製)(10mg)の混合物を凍結乾燥させて得た試薬である。また、発光ウェル3の円筒状の側壁面には、側壁面の全周に渡って、アルミニウムからなる光反射部11が設けられ、光反射部11は固形状の発光試薬5を包囲している。
【0152】
こうような検査チップ100を用いて、以下のようにして、ATPと発光試薬との反応によって生じる発光量の測定を行った
【0153】
まず、1nM ATP溶液200μLをマイクロピペットで検体液導入ウェル2に導入した。また、光検出器21を、受光部21aが発光ウェル3に対向して基板1cの表面に接するように設置した。光検出器21としては、光電子増倍管(Hamamatsu Photonics、H7155)を用いた。また、圧力発生器(Naganokeiki、PC20)に接続された圧力ポート22を、検体液導入ウェル開放口2aを覆うように設置した。
【0154】
次に、圧力ポート22で検体液導入ウェル2の内部に30kPaの圧力を加えることにより、ATP溶液を、流路4を通じて発光ウェル3に収容させ、発光強度を光検出器21で測定した。
【0155】
(比較例1)
発光ウェルに試薬が収納されていないこと以外は、検査用チップ100と同様の構成及び大きさを有する検査用チップを用意し、これを用いて、以下のようにして、ATPと発光試薬との反応によって生じる発光量の測定を行った。
【0156】
まず、2nM ATP溶液100μLをマイクロピペットで検体液導入ウェルに導入した。また、実施例1と同様にして、光検出器及び圧力ポートを検査用チップに設置した。
【0157】
他方、実施例1で用いた発光試薬5と同様の組成を有する固形状の発光試薬を精製水100μLに溶解し、得られた水溶液を10分静置した。
【0158】
10分静置した水溶液を発光ウェルに導入した後、圧力ポートで検体液導入ウェルの内部に30kPaの圧力を加えることにより、ATP溶液を、流路を通じて発光ウェルに収容させ、発光強度を光検出器で測定し、試薬の活性劣化率(実施例1で測定された発光強度に対する発光強度減少率)を求めた。結果を表1に示す。
【0159】
(比較例2)
発光試薬の水溶液を30分静置したこと以外は、比較例1と同様にして、試薬の活性劣化率(実施例1で測定された発光強度に対する発光強度減少率)を求めた。結果を表1に示す。
【0160】
【表1】

【0161】
実施例1、比較例1及び2により、本発明の検査用チップを用いれば、反応時にも試薬の活性を十分に高く維持したまま検査を行うことができることが示された。また、本発明の検査用チップを用いれば、試薬溶液の調製及び分注が不要であり、それだけ検査を簡便に行うことができることが示された。
【産業上の利用可能性】
【0162】
本発明の検査用チップは、タンパク質を含有する試薬を用いて行う検査、特にルシフェリン−ルシフェラーゼ反応を用いた飲食料中の微生物(細菌、真菌等)の検出に利用することができる。
【図面の簡単な説明】
【0163】
【図1】第1実施形態に係る検査用チップの平面図である。
【図2】図1のII−II線に沿った断面図である。
【図3】第2実施形態に係る検査用チップの平面図である。
【図4】図3のIV−IV線に沿った断面図である。
【図5】第3実施形態に係る検査用チップの平面図である。
【図6】図5のVI−VI線に沿った断面図である。
【図7】第4実施形態に係る検査用チップの平面図である。
【図8】図7のVIII−VIII線に沿った断面図である。
【図9】第5実施形態に係る検査用チップの平面図である。
【図10】図9のX−X線に沿った断面図である。
【図11】実施例1において用いられた検査用チップの平面図である。
【図12】図11のXII−XII線に沿った断面図である。
【符号の説明】
【0164】
10,20,30,40,50…検査用チップ、1…本体部、1a〜1c…基板、2…検体液導入ウェル、2a…検体液導入ウェル開放口、3…発光ウェル、3a…発光ウェル開放口、4,4a,4b…流路、5…発光試薬、6…抽出試薬、7…増幅試薬、8…ビーズ、9…ATP分解酵素、11…光反射部、12…光反射膜、13〜18…フィルター、21…光検出器、21a…受光部、22〜24,26〜28…圧力ポート、41…流路、42…抽出ウェル、42a…抽出ウェル開放口、43,44…流路、45…増幅ウェル、45a…増幅ウェル開放口、46,47…流路、48…ビーズ収納ウェル、48a…ビーズ収納ウェル開放口、49…流路、51…廃液収容ウェル、51a…廃液収容ウェル開放口、52…補助液収容ウェル、52a…補助液収容ウェル開放口、53〜56…流路、57…ATP分解ウェル、57a…ATP分解ウェル開放口、58,59,61…流路、100…検査用チップ。
【特許請求の範囲】
【請求項1】
検体を含有する検体液を導入するための第1のウェルと、
前記検体と反応する固形状の試薬が収納されている第2のウェルと、
前記第1のウェルを大気に開放するための第1の開口と、
前記第2のウェルを大気に開放するための第2の開口と、
前記第1のウェル及び前記第2のウェルを接続する流路と、が本体部に形成されていることを特徴とする検査用チップ。
【請求項2】
前記第2のウェルに収納されている前記試薬が、ATPの存在下に発光する発光試薬であり、
微生物中のATPを抽出する固形状の抽出試薬が収納されている第3のウェルと、
前記第3のウェルを大気に開放するための第3の開口と、が本体部に更に形成され、
前記第3のウェルが、前記第1のウェル及び前記第2のウェルの間で前記流路の一部を構成していることを特徴とする、請求項1に記載の検査用チップ。
【請求項3】
前記第1のウェル及び前記第3のウェルの間の前記流路の内壁面にATP分解酵素が固定化されていることを特徴とする、請求項2に記載の検査用チップ。
【請求項4】
ATPを増幅する固形状の増幅試薬が収納されている第4のウェルと、
前記第4のウェルを大気に開放するための第4の開口と、が更に本体部に形成され、
前記第4のウェルが、前記第3のウェル及び前記第2のウェルの間で前記流路の一部を構成していることを特徴とする、請求項2又は3に記載の検査用チップ。
【請求項5】
前記第2のウェル内で生じた光を反射する光反射部が、前記試薬を包囲するように前記第2のウェルの内壁面の一部に設けられていることを特徴とする、請求項2〜4のいずれか一項に記載の検査用チップ。
【請求項6】
前記第1の開口を除くすべての前記開口がフィルターで覆われていることを特徴とする、請求項1〜5のいずれか一項に記載の検査用チップ。
【請求項7】
前記第2の開口が、前記第2のウェル内で生じた光を反射する通気性の光反射膜で覆われていることを特徴とする、請求項2〜5のいずれか一項に記載の検査用チップ。
【請求項8】
前記第1の開口及び前記第2の開口を除くすべての前記開口がフィルターで覆われていることを特徴とする、請求項7に記載の検査用チップ。
【請求項1】
検体を含有する検体液を導入するための第1のウェルと、
前記検体と反応する固形状の試薬が収納されている第2のウェルと、
前記第1のウェルを大気に開放するための第1の開口と、
前記第2のウェルを大気に開放するための第2の開口と、
前記第1のウェル及び前記第2のウェルを接続する流路と、が本体部に形成されていることを特徴とする検査用チップ。
【請求項2】
前記第2のウェルに収納されている前記試薬が、ATPの存在下に発光する発光試薬であり、
微生物中のATPを抽出する固形状の抽出試薬が収納されている第3のウェルと、
前記第3のウェルを大気に開放するための第3の開口と、が本体部に更に形成され、
前記第3のウェルが、前記第1のウェル及び前記第2のウェルの間で前記流路の一部を構成していることを特徴とする、請求項1に記載の検査用チップ。
【請求項3】
前記第1のウェル及び前記第3のウェルの間の前記流路の内壁面にATP分解酵素が固定化されていることを特徴とする、請求項2に記載の検査用チップ。
【請求項4】
ATPを増幅する固形状の増幅試薬が収納されている第4のウェルと、
前記第4のウェルを大気に開放するための第4の開口と、が更に本体部に形成され、
前記第4のウェルが、前記第3のウェル及び前記第2のウェルの間で前記流路の一部を構成していることを特徴とする、請求項2又は3に記載の検査用チップ。
【請求項5】
前記第2のウェル内で生じた光を反射する光反射部が、前記試薬を包囲するように前記第2のウェルの内壁面の一部に設けられていることを特徴とする、請求項2〜4のいずれか一項に記載の検査用チップ。
【請求項6】
前記第1の開口を除くすべての前記開口がフィルターで覆われていることを特徴とする、請求項1〜5のいずれか一項に記載の検査用チップ。
【請求項7】
前記第2の開口が、前記第2のウェル内で生じた光を反射する通気性の光反射膜で覆われていることを特徴とする、請求項2〜5のいずれか一項に記載の検査用チップ。
【請求項8】
前記第1の開口及び前記第2の開口を除くすべての前記開口がフィルターで覆われていることを特徴とする、請求項7に記載の検査用チップ。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【公開番号】特開2007−97444(P2007−97444A)
【公開日】平成19年4月19日(2007.4.19)
【国際特許分類】
【出願番号】特願2005−289030(P2005−289030)
【出願日】平成17年9月30日(2005.9.30)
【出願人】(502205145)株式会社物産ナノテク研究所 (101)
【Fターム(参考)】
【公開日】平成19年4月19日(2007.4.19)
【国際特許分類】
【出願日】平成17年9月30日(2005.9.30)
【出願人】(502205145)株式会社物産ナノテク研究所 (101)
【Fターム(参考)】
[ Back to top ]

