標本作成装置および標本作成方法
【課題】色素量推定に適した染色状態で標本を作成することができる標本作成装置および標本作成方法を提供すること。
【解決手段】本発明のある実施の形態において、標本作成パラメータ取得部352は、少なくとも作成対象の標本を染色する染色色素を特定可能な値を含む標本作成パラメータの値を取得する。色素量最適化処理部38は、取得された標本作成パラメータの値をもとに、作成対象の標本を染色する染色色素の最適な色素量を決定する。制御パラメータ調整部39は、決定された最適な色素量をもとに、作成対象の標本を作成する際に用いる制御パラメータの値を調整する。標本作成部5は、調整された制御パラメータの値を用いて作成対象の標本を作成する。
【解決手段】本発明のある実施の形態において、標本作成パラメータ取得部352は、少なくとも作成対象の標本を染色する染色色素を特定可能な値を含む標本作成パラメータの値を取得する。色素量最適化処理部38は、取得された標本作成パラメータの値をもとに、作成対象の標本を染色する染色色素の最適な色素量を決定する。制御パラメータ調整部39は、決定された最適な色素量をもとに、作成対象の標本を作成する際に用いる制御パラメータの値を調整する。標本作成部5は、調整された制御パラメータの値を用いて作成対象の標本を作成する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、標本を作成する標本作成装置および標本作成方法に関する。
【背景技術】
【0002】
生体組織標本、特に病理標本では、臓器摘出や針生検によって得た検体を数μm程度に薄切りして標本を作成し、様々な所見を得るために顕微鏡を用いて拡大観察することが広く行われている。中でも、光学顕微鏡を用いた透過観察は、機材が比較的安価で取り扱いが容易である上、歴史的に古くから行われてきたこともあって、最も普及している観察方法の1つである。ここで、生体から採取した検体は、光をほとんど吸収および散乱せず、無色透明に近い。このため、標本の作成に際し、染色色素による染色を施すのが一般的である(染色処理)。
【0003】
染色の手法としては種々のものが提案されており、その総数は100種類以上にも達する。これらの染色法は、大別すると、一般染色、特殊染色および免疫生体組織化学的染色(以下、「免疫染色」と呼ぶ。)の3種類に分類できる。標本に施す染色の手順は、染色法によって決まっている。
【0004】
ここで、一般染色は、病理形態学的所見を得るために実施される染色法である。例えば、青紫色のヘマトキシリンおよび赤色のエオジンの2種類の染色色素を用いるヘマトキシリン−エオジン染色(以下、「H&E染色」と呼ぶ。)がこれに該当し、病理組織学的検査において最も汎用的に用いられている。このH&E染色では、先ず、ヘマトキシリン染色液でヘマトキシリン染色を行い、色出しのための水洗処理の後、エオジン染色液でエオジン染色を行う。
【0005】
特殊染色は、一般染色を補う染色法として開発され、一般染色では識別が困難な物質を検出するための染色法として知られている。例えば、膠原線維や弾性繊維、細網線維、糖原、多糖体、組織内病原体、核酸、無機質、メラニン、細胞内顆粒、繊維素、横紋、アミロイド、神経、脂肪等を検出の対象とした染色法が知られている。特殊染色の手順は、原則として一般染色と同様であり、染色法によって染色液(試薬)が異なる。例えば、線上皮細胞を特殊染色する手法として知られるPAS染色では、シッフ試薬が用いられる。
【0006】
免疫染色は、抗原抗体反応(免疫反応)を可視化するための発色操作であり、免疫染色は正確には染色とは異なるが、抗体の特異性を利用して組織を染め分けて抗原の存在(局在)を観察可能にするものである。このため、病理組織学的検査における染色法の1つとして、一般染色や特殊染色と同様に扱われている。例えば、抗原に結合した抗体の局在を酵素反応による発色によって可視化する酵素抗体法が知られている。この酵素抗体法では、先ず、切片上の対象物(抗原)に対して特異抗体を反応させる。そして、抗原抗体反応や化学反応を適宜組み合わせることによって特異抗体と標識酵素との免疫複合体を形成し、最終的に標識酵素の発色反応によって抗原の存在(局在)を可視化する。発色反応では、例えば、DAB発色が汎用的に用いられている。
【0007】
ところで、これらの一般染色や特殊染色、免疫染色による標本の染色状態(染色の程度)は、染色(反応)に要する時間(以下、「反応時間」と呼ぶ。)や染色液(試薬や抗体の希釈液等)の生成条件等によって異なる。例えば、H&E染色では、ヘマトキシリン染色液による反応時間やその染色液の生成条件、エオジン染色液による反応時間やその染色液の生成条件等によって異なる。また、免疫染色においては、例えば酵素抗体法であれば、直接法や間接法、LSAB法、高感度ポリマー試薬法といった反応形式によって感度が異なる。
【0008】
また、標本の作成処理には、上記した染色処理の他にパラフィンブロック作成処理や薄切処理、脱パラフィン処理、封入処理等が含まれ、これらの処理の条件も染め上がりに影響を与える。
【0009】
ここで、標本は通常、医療施設に配置された臨床検査技師によって作成される。このため、臨床検査技師の経験等の個人差が影響し、標本の染色状態を均一に保つのは困難であった。また、標本自体の個体差や標本作成時の室温といった周囲の環境等によっても染色状態がばらつく場合があった。
【0010】
このような染色のばらつきを抑え、安定的に標本を作成するため、近年では、一連の標本作成処理の一部または全部を自動的に行う装置の開発が進められている(例えば、特許文献1,2を参照)。例えば、特許文献1には、生物標本の脱パラフィン、染色、カバーグラス被覆操作を自動化した自動装置が開示されている。また、特許文献2には、サンプル毎に個別に温度を監視することが可能な自動化分子病理学装置が開示されている。
【0011】
ところで、作成された標本は、臨床医によって観察・診断されるため、求められる標本の染色状態は、臨床医の好みによって異なる。このため、特許文献1,2等に開示されている自動化装置を用いれば標本作成処理の一貫した制御が実現でき、均一な染色状態の標本が安定的に作成できるものの、作成された標本の染色状態が必ずしも臨床医の望む染色状態とは限らず、診断精度の低下を招く場合があった。例えば、染色された標本の観察・診断時における臨床医のストレスに繋がり、決定的な所見が見落とされる可能性があった。
【0012】
この種の問題を解決するために、画像処理によって染色状態を定量化・標準化しようとする試みがなされている。例えば、特許文献3には、標本に固定された染色色素の相対的な量(色素量)を推定する手法や、推定した染色色素の色素量を仮想的に増減させ、増減後の色素量を用いて仮想的な標本のRGB画像を合成する手法が開示されている。色素量の増減を適切に行えば、濃く染色された標本や薄く染色された標本を、適切に染色された標本と同等の色を有する画像に補正することができる。
【0013】
【特許文献1】特表2005−527811号公報
【特許文献2】特許第3847559号公報
【特許文献3】特開2009−14355号公報
【発明の開示】
【発明が解決しようとする課題】
【0014】
しかしながら、画像処理によって標本を染色している各染色色素の色素量を推定する場合、標本の染色状態が色素量の推定精度に影響するという問題があった。例えば、濃く染色された領域では信号値のS/N比が減少し、色素量の推定精度が低下するという問題があった。ここで、複数の染色色素で染色する場合には、個々の染色色素の色素量が適切であっても、これらが重畳することで染色状態が濃すぎる事態が生じ得る。また、標本の作成工程は、検体を所定の厚さに切り出す工程(パラフィンブロック作成処理)を含むが、このときに決定される標本の厚さによっても、染色状態が濃すぎる事態が生じ得る。
【0015】
本発明は、上記に鑑みてなされたものであって、色素量推定に適した染色状態で標本を作成することができる標本作成装置および標本作成方法を提供することを目的とする。
【課題を解決するための手段】
【0016】
上記した課題を解決し、目的を達成するための、本発明のある態様にかかる標本作成装置は、生体から採取した検体を所定の染色色素で染色して標本を作成する標本作成装置であって、少なくとも作成対象の標本を染色する染色色素を特定可能な値を含む標本作成パラメータの値を取得する標本作成パラメータ取得部と、前記標本作成パラメータ取得部によって取得された標本作成パラメータの値をもとに、前記作成対象の標本を染色する染色色素の最適な色素量を決定する色素量決定部と、前記色素量決定部によって決定された色素量をもとに、前記作成対象の標本を作成する際に用いる制御パラメータの値を調整する制御パラメータ調整部と、前記制御パラメータ調整部によって調整された制御パラメータの値を用いて前記作成対象の標本を作成する標本作成部と、を備えることを特徴とする。
【0017】
この態様にかかる標本作成装置によれば、作成対象の標本を染色する染色色素を特定可能な標本作成パラメータの値をもとに作成対象の標本を染色する染色色素の最適な色素量を決定することができる。そして、決定された色素量をもとに作成対象の標本を作成する際に用いる制御パラメータの値を調整し、調整した制御パラメータの値に従って作成対象の標本を作成することができる。したがって、色素量推定に適した染色状態で標本を作成することができる。
【0018】
また、本発明の別の態様にかかる標本作成方法は、生体から採取した検体を所定の染色色素で染色して標本を作成する標本作成方法であって、少なくとも作成対象の標本を染色する染色色素を特定可能な値を含む標本作成パラメータの値を取得する標本作成パラメータ取得工程と、前記標本作成パラメータ取得工程で取得された標本作成パラメータの値をもとに、前記作成対象の標本を染色する染色色素の最適な色素量を決定する色素量決定工程と、前記色素量決定工程で決定された色素量をもとに、前記作成対象の標本を作成する際に用いる制御パラメータの値を調整する制御パラメータ調整工程と、前記制御パラメータ調整工程で調整された制御パラメータの値を用いて前記作成対象の標本を作成する標本作成工程と、を含むことを特徴とする。
【発明の効果】
【0019】
本発明によれば、色素量推定に適した染色状態で標本を作成することができる。
【発明を実施するための最良の形態】
【0020】
以下、図面を参照し、本発明の好適な実施の形態について詳細に説明する。なお、この実施の形態によって本発明が限定されるものではない。また、図面の記載において、同一部分には同一の符号を付して示している。
【0021】
(実施の形態1)
実施の形態1では、臓器摘出や針生検によって被検者の生体から採取した検体に一般染色として知られるH&E染色を施して標本を作成する場合を例にとって説明する。
【0022】
図1は、標本を作成し、観察・診断する手順の概要を説明する説明図である。先ず、被検者から採取した検体から標本を作成する(以下、作成対象の標本を「対象標本」と呼ぶ。)が、この対象標本の作成に先立ち、臨床医は、図1(a)に示すように、対象標本を作成するために必要なデータ入力を行う。臨床医がデータ入力を行うと、入力データに応じて対象標本を作成する際に用いる制御パラメータ(詳細には、後述する調整対象制御パラメータ)の値が調整され、調整された調整対象制御パラメータの値に従って、標本作成処理が自動化された装置で自動的に、あるいは臨床検査技師の作業を介して半自動的に対象標本が作成される(図1(b))。臨床検査技師は、顕微鏡を用いて作成された対象標本を観察し、その染色状態を確認する(図1(c))。
【0023】
ここで、対象標本の観察は、目視観察で行われる場合もあるが、表示装置に画面表示することによっても行なわれている。このため、このときに対象標本が撮像され、観察画像が生成されるようになっている。すなわち、標本各点の分光透過率を算出(推定)する処理や染色色素の色素量を推定する処理、推定した色素量をもとに画像の色を補正する処理等が行われ、カメラの特性や染色状態のばらつき等が補正されて表示用のRGB画像(観察画像)が合成される。臨床医は、以上のようにして得られた対象標本の観察画像を観察し、診断を行う(図1(d))。
【0024】
ここで、標本を撮像して観察画像を生成する各処理の原理について説明する。図2は、観察画像を生成する各処理の概略手順を説明する説明図である。なお、ここで説明する各処理は、公知技術を用いて実現でき、実施の形態1では、図1に示した標本の作成および観察・診断手順を実現するために適宜用いる。
【0025】
図2に示すように、観察画像を生成する際には先ず、標本を撮像する(ステップa1)。続いて、得られた画像をもとに、各画素位置(x)に対応する標本上の各点における分光透過率t^(x,λ)を算出(推定)する(ステップa3)。なお、t^は、tの上に推定値を表す記号「^(ハット)」が付いていることを示す。分光透過率t^(x,λ)の推定手法については、例えば特許文献3に開示されている技術を用いることができる。なお、分光透過率t^(x,λ)は、標本の各点における分光透過率を分光イメージング装置によって測定する構成としてもよい。
【0026】
続いて、各画素位置について算出した分光透過率を吸光度に変換し(ステップa5)、変換した吸光度をもとに標本上の各点における色素量を推定して(ステップa7)、標本の各点における色素量を取得する。
【0027】
一般に、光を透過する物質では、波長λ毎の入射光の強度I0(λ)と射出光の強度I(λ)との間に、次式(1)で表されるランベルト・ベール(Lambert-Beer)の法則が成り立つことが知られている。
【数1】

【0028】
k(λ)は波長に依存して決まる物質固有の値、dは物質の厚さをそれぞれ表す。本来色素は、標本中に分散して存在するため、厚さという概念は正確ではないが、標本が単一の色素で染色されていると仮定した場合と比較して、どの程度の量の色素が存在しているかを表す相対的な色素の量(色素量)の指標となる。以下、このランベルト・ベールの法則における物質の厚さdを、標本を構成する色素(例えば標本を染色している染色液の色素(染色色素)等)の量(色素量)として扱う。なお、色素量dに物質固有の値k(λ)を乗じた値は、一般的にその色素の吸光度または吸収強度と呼ばれる。
【0029】
標本を染色している色素が複数種類の場合、各色素に1,2,・・・nの通し番号を割り振れば、上記のランベルト・ベールの法則から、各波長λにおいて次式(2)が成立する。
【数2】

【0030】
実施の形態1では、H&E染色された標本を観察・診断対象としているため、染色色素であるヘマトキシリンおよびエオジンをそれぞれ色素H,色素Eと略記すれば、各波長λにおいて次式(3)が成立する。
【数3】

【0031】
より詳細には、これら染色色素以外の吸収成分として、標本が載置されるスライドガラスの吸収成分(Gと略記)を含むため、分光透過率t^(x)は、次式(4)によって得られる。kH(λ),kE(λ),kG(λ)は、それぞれ色素H、色素Eおよびこれらの染色色素以外の吸収成分Gに対応するk(λ)を表し、各k(λ)の値が、対応する色素(吸収成分)の分光特性に相当する。
【数4】

【0032】
なお、各k(λ)は、標本(検体)を採取した臓器や部位、標本内の組織によって異なる場合がある。このため、これらの違いに応じてk(λ)1、k(λ)2・・・のように複数のk(λ)を色素毎に用意しておき、該当するk(λ)を用いることとしてもよい。より具体的には、臓器や部位、組織毎に各色素に対応するk(λ)を用意しておき、対象標本を採取した臓器や部位、組織に応じたk(λ)を適宜選択して用いることとしてもよい。また、適用する染色法で用いる染色液によっては、その色素の分光特性が組織内の物質によって変化する場合がある。このような場合には、その色素の分光特性として、予め定められた該当する色素の分光特性k(λ)に変化分を考慮した分光特性k´(λ)を適用するようにしてもよい。
【0033】
また、色素Hおよび色素Eの染色色素以外の吸収成分としてスライドガラスの吸収成分Gについて説明したが、この他にも、標本内には、無染色時において吸収成分を持つ例えば赤血球等の組織が存在し得る。すなわち、赤血球は、染色を施さない状態であってもそれ自身特有の色を有しており、H&E染色後は、赤血球自身の色として観察される。あるいは、染色過程において変化したエオジンの色が赤血球自身の色に重畳して観察される。この赤血球の吸収成分を考慮し、上記した式(4)において、予め定められた赤血球の吸収成分についての分光特性k(λ)にその色素量を乗じた値をさらに加算し、分光透過率t^(x)を算出することとしてもよい。このようにすれば、赤血球領域の画素信号値を精度良く表示することができる。
【0034】
ここで、各画素位置(x)について求めた分光透過率をt^(x,λ)とし、分光吸光度をa^(x,λ)とすると、これらの間には、次式(5)の関係が成り立つ。なお、a^は、aの上に記号「^」が付いていることを示す。上記した式(5)によって、各画素位置(x)の吸光度を得る。
【数5】

【0035】
式(5)に式(4)を代入すると、次式(6)が得られる。
【数6】

【0036】
式(6)において未知変数を色素Hの色素量dHと色素Eの色素量dEとし、少なくとも2つの異なる波長λについて式(6)を連立させれば、これらを解くことができる。より精度を高めるために、3つ以上の異なる波長λに対して式(6)を連立させ、重回帰分析を行ってもよい。例えば、3つの波長λ1,λ2,λ3について式(6)を連立させた場合、次式(7)のように行列表記できる。
【数7】

【0037】
ここで、式(7)を次式(8)に置き換える。
【数8】

【0038】
波長方向のサンプル点数をDとすれば、A^(x)は、a^(x,λ)に対応するD行1列の行列であり、Kは、k(λ)に対応するD行3列の行列、d(x)は、画素位置(x)におけるdH,dEに対応する2行1列の行列、εは誤差に対応するD行1列の行列である。なお、A^は、Aの上に記号「^」が付いていることを示す。
【0039】
例えば、式(8)に従い、例えば最小二乗法を用いて各染色色素の色素量dH,dEを算出する。最小二乗法とは単回帰式において誤差の二乗和を最小にするようにd(x)を決定する方法であり、次式(9)で算出できる。
【数9】

【0040】
以上のようにして、色素量dH,dEを推定したならば、これらの値を調整する。具体的には先ず、色素量dH,dEそれぞれについて調整係数αH,αEを設定し、ステップa7で推定した色素量に設定した調整係数αH,αEを乗じることで色素量を調整する(ステップa9)。調整後の色素量dH*,dE*の算出式は、次式(10),(11)で表される。
【数10】

【0041】
そして、このようにして調整した色素量dH*,dE*を式(6)に代入して新たに吸光度を算出し(ステップa11)、算出した吸光度を上記した式(4)に従って分光透過率に変換する(ステップa13)。これにより、調整後の色素量dH*,dE*から各画素位置の分光透過率が得られる。続いて、各画素位置について算出した分光透過率をもとに各画素位置の画素信号値g(b)を算出し、RGB画像(観察画像)を生成する(ステップa15)。
【0042】
画像のバンドbにおける画素信号値g(b)と、対応する標本の分光透過率t(λ)との間には、カメラの応答モデル関数に基づく次式(12)の関係が成り立つ。λは波長、s(λ,b)はバンドbのカメラの分光感度特性、e(λ)は照明の分光放射特性をそれぞれ表す。bはバンドを識別する通し番号であり、通常RGBカメラの場合b=3となる。ただし、バンド数は適宜選択することができる。また、分光特性の異なるフィルタを用い、標本をマルチバンド撮像することとしてもよい。
【数11】

【0043】
実際の撮影で得られる画素信号値g(b)は、式(12)に観測ノイズを加えた次式(13)によって得られる。n(b)はバンドbにおける観測ノイズを表す。ここで、観測ノイズn(b)は、式(12)によって得られる画素信号値g(b)と、画素信号値g(b)とノイズとの相関関数と、によって得られる値の範囲でランダムに検出される。
【数12】

【0044】
ステップa15では、上記した式(12)または式(13)に従って各画素位置の画素信号値g(b)を算出し、標本の観察画像として、調整係数αH,αEに従って画像の色を補正した(対象標本の色素量を仮想的に変化させた)RGB画像を得る。なお、調整係数調整係数αH,αEを用いた色素量dH,dEの調整は適宜行うこととしてよい。すなわち、ステップa3の処理の後、得られた分光透過率をもとにステップa15の処理を行えば、画像の色を補正せずに(色素量を調整せずに)RGB画像を生成できる。
【0045】
次に、実施の形態1の標本作成装置の構成について説明する。図3は、実施の形態1の標本作成装置2を含む標本作成システム1の全体構成を説明する模式図である。図3に示すように、実施の形態1の標本作成システム1は、標本作成装置2と、観察装置6とで構成される。ここで、標本作成装置2は、制御装置3と、標本作成部5とを備え、これらの間がデータの授受可能に接続されて構成される。また、観察装置6は、標本作成装置2によって作成された標本を観察するためのものであり、例えば、対象標本の透過観察が可能な顕微鏡や、この顕微鏡による標本の観察像を撮像するカメラ等で構成される。
【0046】
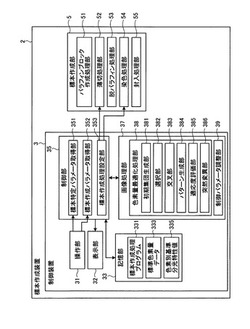
図4は、標本作成装置2の機能構成を示すブロック図である。ここで、標本作成部5は、一連の標本作成処理を全自動化した装置、あるいは標本作成処理を部分毎に自動化した装置や部分毎の標本作成処理を臨床検査技師の作業を介して半自動的に行う装置を組み合わせて構成され、所定の制御パラメータの値に従って検体を処理し、標本を作成する。例えば、実施の形態1の標本作成部5は、パラフィンブロック作成処理を行うパラフィンブロック作成処理部51と、薄切処理を行う薄切処理部52と、脱パラフィン処理を行う脱パラフィン処理部53と、染色処理を行う染色処理部54と、封入処理を行う封入処理部55とを備える。ここで、標本作成部5の具体的な装置構成は医療施設毎に異なり、採用する装置によっては、各装置が分担する処理も異なる。また、この装置構成は、標本に施す染色法によっても異なる。そして、標本作成処理のプロトコールやこのプロトコールで用いる制御パラメータについても、採用する装置の製造メーカによって異なり、医療施設側の設定によって異なる場合もある。標本作成部5の構成は、例示した構成に限定されるものではなく、標本作成処理で用いる制御パラメータも適宜設定できる。
【0047】
制御装置3は、標本作成部5に対して標本を作成するための動作指示を行うものであり、ワークステーションやパソコン等の汎用コンピュータで実現される。この制御装置3は、対象標本を作成するために必要なデータとしてユーザ(例えば臨床医)が入力した標本特定パラメータおよび標本作成パラメータの各値を取得し、取得した標本特定パラメータおよび標本作成パラメータの値に応じた最適化色素量を決定する。そして、算出した最適化色素量に従って調整対象制御パラメータの値を調整し、標本作成部5に対する動作指示を行う。
【0048】
この制御装置3は、操作部31と、表示部32と、記憶部33と、制御部35と、画像処理部37とを備える。
【0049】
操作部31は、例えば、キーボードやマウス、タッチパネル、各種スイッチ等の各種入力装置によって実現されるものであり、操作入力に応じた入力信号を制御部35に出力する。表示部32は、LCDやELディスプレイ、CRTディスプレイ等の表示装置によって実現されるものであり、制御部35から入力される表示信号をもとに各種画面を表示する。
【0050】
記憶部33は、更新記憶可能なフラッシュメモリ等のROMやRAMといった各種ICメモリ、内蔵あるいはデータ通信端子で接続されたハードディスク、CD−ROM等の情報記憶媒体およびその読取装置等によって実現されるものである。この記憶部33には、制御装置3を動作させ、この制御装置3が備える種々の機能を実現するためのプログラムや、このプログラムの実行中に使用されるデータ等が記憶される。
【0051】
実施の形態1では、記憶部33は、標本作成処理プログラム331を記憶する。標本作成処理プログラム331は、最適化色素量を決定して調整対象制御パラメータの値を調整し、標本作成部5に対する動作指示を行う処理を実現するためのプログラムである。
【0052】
また、記憶部33は、教師データ記憶部として標準色素量データ333を記憶する。標準色素量データ333は、標準的な染色状態での各染色色素の標準色素量(以下、dH_S,dE_Sと表記する。)を記憶する。この標準色素量dH_S,dE_Sは、事前に標準的な染色状態の標準標本を用意し、この標準標本について図2に示して説明したステップa1〜ステップa7の各処理を行って推定した標本各点における各染色色素の色素量であり、各点における分光透過率や吸光度とともに教師データとして記憶される。より詳細には、実施の形態1では、標本特定パラメータの値の組み合わせによって定まる全ての種類の標本について標準標本が用意され、これら標準標本それぞれについて色素量が推定される。そして、得られた標準色素量dH_S,dE_Sが、その推定過程で得られた分光透過率や吸光度とともに、該当する標本特定パラメータの値の組み合わせと対応付けられて標準色素量データ333に記憶される。なお、標準色素量データ333は、記憶部33に記憶される構成に限定されるものではなく、例えばネットワークを介して制御装置3と接続されるデータベース装置で実現し、制御装置3とは離れた別の場所に設置されて標準色素量dH_S,dE_Sのデータを記憶・管理する構成としてもよい。
【0053】
また、記憶部33は、色素別基準分光特性値335を記憶する。色素別基準分光特性値335は、標本を染色している各色素の分光特性値(k(λ))を記憶する。実施の形態1では、上記した式(4)等で用いる色素H、色素Eおよびこれらの染色色素以外の吸収成分Gにそれぞれ対応するkH(λ),kE(λ),kG(λ)の各値を記憶する。
【0054】
制御部35は、CPU等のハードウェアによって実現される。この制御部35は、操作部31から入力される入力信号、あるいは記憶部33に記憶されるプログラムやデータ等をもとに標本作成装置2を構成する各部への指示やデータの転送等を行い、標本作成装置2全体の動作を統括的に制御する。この制御部35は、標本特定パラメータ取得部351と、標本作成パラメータ取得部352と、標本作成処理設定部353とを含む。
【0055】
標本特定パラメータ取得部351は、対象標本についての標本特定パラメータの値の入力を依頼し、操作部31を介してユーザによる標本特定パラメータの値の入力を受け付ける。ここで、標本特定パラメータは、標本の種類を示す値であり、例えば検体を採取した臓器や部位、被験者の疾患名等が挙げられる。なお、標本特定パラメータ取得部351が取得する標本特定パラメータはこれに限定されるものではなく、標本に関する情報を適宜用いることができる。例えば、標本における組織の状態を標本特定パラメータとして用いてもよい。具体例としては、例えば、細胞核の個数や密度、形状等が挙げられる。これは、臨床医が対象標本内の例えば細胞核等の組織の個数や密度、形状等を観察することによって診断を行う場合を想定しており、これらの値を標本特定パラメータとして取得してもよい。
【0056】
標本作成パラメータ取得部352は、対象標本を作成する際に用いる標本作成パラメータの値の入力を依頼し、操作部31を介してユーザによる標本作成パラメータの値の入力を受け付ける。ここで、標本作成パラメータは、標本作成部5の各部が動作するために事前に決定しておくべき所定のパラメータであり、対象標本に施す染色法を含む。また、この他、パラフィンブロック作成処理部51、薄切処理部52、脱パラフィン処理部53、染色処理部54および封入処理部55が行う各処理で用いる制御パラメータを適宜含む。この標本作成パラメータ取得部352は、この標本作成パラメータの値を取得する。以下、実施の形態1では、染色処理部54が染色処理で用いる染色法および薄切処理部52が薄切処理で用いる制御パラメータの1つである標本の厚さの2つの値を標本作成パラメータとし、ユーザ操作に従って各標本作成パラメータの値を取得することとする。なお、染色法については、実施の形態1では、その値として“H&E染色”を取得した場合を想定している。ここで、染色法は、標本を染色する染色色素を特定可能な標本作成パラメータの値に相当する。すなわち、実施の形態1では、取得される染色法“H&E染色”をもとに染色色素が色素H,色素Eとして特定される。また、標本の厚さ以外の標本作成部5の各部が用いる制御パラメータについては、その値を例えば固定値とし、予め設定しておく。
【0057】
標本作成処理設定部353は、標本作成パラメータ取得部352によって取得され、または画像処理部37の制御パラメータ調整部39によって調整された制御パラメータの値を標本作成部5に通知して各部に対する動作指示を行う。これに応答し、標本作成部5は、標本作成パラメータ取得部352によって取得された制御パラメータや制御パラメータ調整部39によって調整された制御パラメータの値を用いて標本作成処理を行う。この結果、その色素量が最適化色素量となるような染色状態の対象標本が得られる。なお、実施の形態1では、標本作成パラメータ取得部352によって、染色法として“H&E染色”が取得されるとともに、標本の厚さが取得される。また、制御パラメータ調整部39によって反応時間が調整される。このため、実施の形態1では、標本作成処理設定部353は、標本作成パラメータ取得部352によって取得された標本の厚さを薄切処理部52に通知し、制御パラメータ調整部39によって調整された反応時間を染色処理部54に通知する。
【0058】
画像処理部37は、CPU等のハードウェアによって実現される。この画像処理部37は、色素量決定部としての色素量最適化処理部38と、制御パラメータ調整部39とを含む。
【0059】
色素量最適化処理部38は、色素量最適化処理を行って最適化色素量を決定する。上記したように、対象標本の観察を表示装置に画面表示することによって行う場合、標本各点の分光透過率を算出して対象標本に固定された染色色素の色素量を推定している。そして、推定した色素量を調整して画像の色を補正することによって、カメラの特性や染色状態のばらつき等が補正された観察画像(RGB画像)を合成している。ここで、色素量の推定を適切に行えば、濃く染色された標本や薄く染色された標本を、適切に染色された標本と同等の色を有する画像に補正することができる。したがって、対象標本に固定された色素量を高精度に推定することが、染色ばらつきの補正等の高精度化につながる。色素量最適化処理部38は、この色素量の推定に適した染色状態の対象標本を得るための色素量(詳細には、色素Hおよび色素Eの各染色色素それぞれの色素量)を最適化色素量として決定する。
【0060】
具体的には、色素量最適化処理部38は、公知の遺伝的アルゴリズム(GA)を用いて色素Hおよび色素Eの各染色色素の最適化色素量を決定する。遺伝的アルゴリズムは、ある世代を形成している個体の集合を基本単位とした進化型の計算を行うアルゴリズムであり、処理の概要を説明すると、先ず初期集団を生成し、初期集団の中から個体を選択する。そして、選択した個体に対して交叉や突然変異を行って次世代集団を形成する。その後、次世代集団について処理を繰り返し、最終的に適応度の高い個体を選ぶことで色素量の推定に適した最適化色素量を決定するものである。
【0061】
実施の形態1では、色素量最適化処理部38は、標準色素量データ333として記憶部33に記憶されている標準色素量dH_S,dE_Sにそれぞれ乗じる調整係数の値を組み合わせた解候補を個体として用いる。各個体は、この解候補を数値列で示した遺伝子によって特徴付けられる。図5は、ある個体の遺伝子を示す図である。図5に示すように、各個体を特徴付ける遺伝子は、染色色素毎の調整係数を表した例えば8ビットのビット列を順番に羅列したものである。実施の形態1では、染色色素は色素Hおよび色素Eの2種類であるので、各個体の遺伝子は、16ビットのビット列となる。
【0062】
この色素量最適化処理部38は、初期集団生成部381と、選択部382と、交叉部383と、パターン生成部384と、適応度評価部385と、突然変異部386とを備る。ここで、初期集団生成部381、選択部382、交叉部383および突然変異部386は、候補値生成部として最適化色素量の候補値を生成する。また、適応度評価部385は、評価部として候補値を評価する。具体的には、初期集団生成部381は、初期集団を生成する。選択部382は、選択処理を行う。交叉部383は、交叉処理を行う。パターン生成部384は、色素量パターンを生成する。適応度評価部385は、適応度を算出する。突然変異部386は、突然変異処理を行う。
【0063】
制御パラメータ調整部39は、色素量最適化処理部38によって算出された最適化色素量に従って調整対象制御パラメータの値を調整する。調整対象制御パラメータは、標本作成部5の各部が行う各処理で用いる少なくとも1つの制御パラメータを含む。なお、調整対象制御パラメータが、標本作成パラメータ取得部352による取得対象となっている場合であれば、取得した制御パラメータの値を、最適化色素量を反映させて調整した値で置き換える。
【0064】
ところで、最適化色素量を複数の制御パラメータに反映させるようにしてもよいが、このようにすると計算式が複雑化し、算出時間が増大する。また、各値の算出時に生じる算出値と色素量との関係に含まれる誤差が増幅されるため、得られた標本の染色状態が最適化色素量が表す染色状態と異なるといった問題が生じ得る。ここで、染色状態に大きく影響し、且つ簡便に設定(算出)可能な制御パラメータとして、染色処理部54が用いる染色に要する時間(反応時間)および染色液の濃度が挙げられる。これに鑑み、実施の形態1では、制御パラメータ調整部39は、反応時間を調整対象制御パラメータとする。そして、反応時間に最適化色素量を反映させてその値を調整する。なお、染色液の濃度を調整対象制御パラメータとし、最適化色素量を反映させる構成としてもよい。また、調整対象とする制御パラメータはこれに限定されるものではなく、標本の診断方法に応じて適宜選択できる。また、複数の制御パラメータを適宜組み合わせて調整対象としてもよい。ここで、反応時間は、ヘマトキシリン染色液による反応時間およびエオジン染色液による反応時間を含み、各反応時間は、対応する染色液に標本を浸す時間に相当する。また、染色液の生成条件は、例えば染色液(染色試薬)の濃度であり、実施の形態1では、ヘマトキシリン染色液の濃度およびエオジン染色液の濃度がこれに該当する。
【0065】
図6は、実施の形態1の制御装置3が行う処理手順を示すフローチャートである。なお、ここで説明する処理は、記憶部33に記憶された標本作成処理プログラム331に従って制御装置3の各部が動作することによって実現される。
【0066】
先ず、標本特定パラメータ取得部351が、ユーザ操作に従って標本特定パラメータの値を取得する(ステップb1)。例えば、標本特定パラメータ取得部351は、標本特定パラメータ入力画面を表示部32に表示して標本特定パラメータの入力依頼を通知する処理を行い、この標本特定パラメータ入力画面において標本特定パラメータの入力を受け付ける。
【0067】
図7および図8は、標本特定パラメータ入力画面の一例を示す図である。この標本特定パラメータ入力画面には、図7に示すように、臓器や部位、疾患名等の標本特定パラメータの値を入力するためのスピンボックスB11〜B13、これら各スピンボックスに対するユーザ操作を確定するOKボタンBTN11、操作をキャンセルするキャンセルボタンBTN12等が配置されている。
【0068】
各スピンボックスB11〜B13は、該当する標本特性パラメータとして設定可能な値の一覧を選択肢として提示し、選択操作を受け付けるものである。例えば、臓器を入力するためのスピンボックスB11では、図8に示すように、肝臓や腎臓、前立腺、肺等の検体が採取され得る臓器の一覧を選択肢として提示したドロップダウンリストL11が表示されるようになっており、ユーザは、このドロップダウンリストL11から対象標本について該当する臓器を選択する。なお、標本特性パラメータの取得方法は特に限定されるものではなく、例えば各標本特性パラメータの値を直接入力する構成としてもよい。また、図7や図8では各標本特定パラメータの値を個別に入力する場合を例示したが、標本特定パラメータの値の組み合わせを選択肢として提示し、この選択肢の選択によって各標本特定パラメータの値を同時に取得する構成としてもよい。
【0069】
続いて、標本作成パラメータ取得部352が、ユーザ操作に従って標本作成パラメータの値を取得する(ステップb3)。例えば、標本作成パラメータ取得部352は、標本作成パラメータ入力画面を表示部32に表示して標本作成パラメータの入力依頼を通知する処理を行い、この標本作成パラメータ入力画面において標本作成パラメータの入力を受け付ける。
【0070】
図9は、標本作成パラメータ入力画面の一例を示す図である。図9に示す標本作成パラメータ入力画面には、実施の形態1で取得対象としている染色法および標本の厚さの各制御パラメータの値を入力するためのスピンボックスB21,B22や、これら各スピンボックスに対するユーザ操作を確定するOKボタンBTN21、操作をキャンセルするキャンセルボタンBTN22等が配置されている。各スピンボックスB21,B22は、該当する制御パラメータの値として設定可能な値の一覧を選択肢として提示し、選択操作を受け付けるものであり、例えば、図8に示した標本特定パラメータの場合と同様に、ドロップダウンリストを表示して選択肢を提示する。なお、制御パラメータの取得方法は例示した手法に限定されるものではなく、例えば標本作成パラメータの値を直接入力する構成としてもよい。また、実施の形態1では標本作成パラメータを2種類(染色法および標本の厚さ)に固定しているが、ユーザによって選択可能に構成してもよい。すなわち、標本作成部5の各部が用いる制御パラメータの中から取得対象とする制御パラメータの選択操作を受け付け、ユーザが取得対象として選択した制御パラメータの値を取得する構成としてもよい。なお、ここで取得した染色法(実施の形態1ではH&E染色)によって、対象標本を染色する染色色素が色素Hおよび色素Eとして特定される。
【0071】
続いて、色素量最適化処理部38が色素量最適化処理を行い、最適化色素量を算出する(ステップb5)。図10は、色素量最適化処理の詳細な処理手順を示すフローチャートである。
【0072】
色素量最適化処理では、図10に示すように、先ず初期集団生成部381が、初期集団を生成する(ステップc1)。例えば、“0”または“1”をランダムに発生させて16ビット分のビット列を生成し、その個体の遺伝子として生成する。これを予め設定されている個体数繰り返し行い、初期集団を得る。集団を構成する個体の数は、任意に設定できる。また、ビット列は乱数によって生成する場合に限定されるものではない。例えば、予め所定の中心初期値およびこの中心初期値の周辺の値を生成する確率変数の分散を定義しておき、この確率変数に従ってビット列を生成するようにしてもよい。このようにすれば、解が中心初期値付近に存在する場合に後述する処理回数(繰り返し数)を低減でき、最適化色素量の算出処理の高速化が図れる。
【0073】
そして、初期集団を対象としたステップc3以降の処理に移る。すなわち、ステップc3では、選択部382が選択処理を行い、対象の集団から個体を2つ選択する。この選択は、例えば乱数を発生させてランダムに行う。なお、ここでは、2つの個体を選択することとした。これに対し、予め交叉確率を設定しておき、この交叉確率に従って交叉させる個体を選択することとしてもよい。
【0074】
そして、交叉部383が、選択された2つの個体を親として交叉処理を行い、これら2つの親の遺伝子を受け継ぐ新たな個体を2つ生成する(ステップc5)。この交叉処理で用いる交叉方法は、一点交叉や二点交叉、一様交叉等、適宜選択できる。例えば、一点交叉を用いる場合には、交叉点を1つランダムに決定し、各親の決定した交叉点より後の遺伝子をそれぞれ入れ替えることによって、新たな2つの個体を得る。また二点交叉を用いる場合には、交叉点を2つランダムに決定する。そして、各親の決定した2点の交叉点で挟まれる遺伝子をそれぞれ入れ替えることによって、新たな2つの個体を得る。ここでの交叉処理によって、対象の集団の個体のうち、ステップc3で選択した親の個体が生成された新たな個体で置き換えられる。
【0075】
続いて、パターン生成部384が、交叉処理後の集団を構成する各個体をもとに、色素量パターンを生成する(ステップc7)。具体的には、各個体を特徴付けている遺伝子である16ビットを前後8ビットずつに分割し、前8ビットを色素Hについての調整係数αHとし、後8ビットを色素Eについての調整係数αEとする。また、図6のステップb1で取得した標本特定パラメータおよびステップb3で取得した標本作成パラメータをもとに、標準色素量データ333から対象標本に応じた標準色素量標準色素量dH_S,dE_Sを読み出す。そして、図2のステップa9の処理手順に従い、上記した式(10),(11)を用いて読み出した標準色素量dH_S,dE_Sを調整し、調整後の色素量dH*,dE*を得る。この処理を各個体について行い、得られた色素量dH*,dE*を個体毎の色素量パターンとする。
【0076】
続いて、適応度評価部385が、適応度評価処理を行う(ステップc9)。図11は、適応度評価処理の詳細な処理手順を示すフローチャートである。図11に示すように、適応度評価処理では、図10のステップc7で生成した色素量パターンを順次処理対象パターンとし、各色素量パターンについてループAの処理を行う(ステップd1〜ステップd15)。
【0077】
先ず、適応度評価部385は、処理対象パターンの各染色色素の色素量をもとにステップd3〜ステップd11の各処理を行う。すなわち、適応度評価部385は、先ず、処理対象パターンの色素量をもとに吸光度を算出する(ステップd3)。具体的には、図2のステップa11の処理手順に従い、上記した式(6)を用いて吸光度を算出する。続いて、適応度評価部385は、算出した吸光度を分光透過率に変換する(ステップd5)。具体的には、図2のステップa13の処理手順に従い、上記した式(4)を用いて吸光度を分光透過率に変換する。そして、適応度評価部385は、図2のステップa15の処理手順に従い、先ず、上記した式(12)を用いて画素信号値を算出する(ステップd7)。続いて、適応度評価部385は、上記した式(13)を用いて所定量のノイズ(式(13)の観測ノイズn(b))を付加した画素信号値を算出する(ステップd8)。
【0078】
例えば、画素信号値と付加するノイズ量との関係(相関式)を定義したルックアップテーブル(以下、「LUT」と略記する。)を事前に生成して記憶部33に記憶しておき、このLUTを参照して画素信号値に付加するノイズ量を決定する。図12は、画素信号値とノイズ量との対応関係の一例を模式的に示した図であり、横軸を画素信号値、縦軸をノイズ量として画素信号値毎に定義されるノイズ量を示している。ここで、前述のように、ノイズ量(観測ノイズn(b))は、式(12)によって得られる画素信号値g(b)と、画素信号値g(b)とノイズとの相関関数と、によって得られる値の範囲でランダムに検出される。そこで本例では、このノイズ量(観測ノイズn(b)の値)の範囲を図12中に破線で示す画素信号値毎の分散によって定義したLUTを作成しておく。
【0079】
そして、適応度評価部385は、このLUTを参照し、今回画素信号値に付加するノイズ量を決定する。例えば、適応度評価部385は、LUTを参照してステップd8で算出した画素信号値に対応するノイズ量の誤差範囲を取得し、取得した誤差範囲に含まれる値をランダムに選出してノイズ量を決定する。
【0080】
なお、画像信号値に対するノイズ量(観測ノイズn(b))の比率から、処理対象パターンが表す各染色色素の色素量で染色された標本におけるS/N比を得ることができる。S/N値が小さいほど、画素信号値のノイズ比率が高くなる。したがって、後述するステップd9で算出(推定)される分光透過率の推定精度が低下し、結果的にステップd11で推定される色素量の推定精度が低下する。実施の形態1では、処理対象パターンの色素量と後述するステップd11で推定する色素量との差分を適応度として用い、この適応度の値を評価することとしているが、S/N値を適応度として用い、その値を評価する構成も可能である。
【0081】
その後、適応度評価部385は、図2のステップa3の処理手順に従い、ステップd8でノイズの付加された画素信号値をもとに分光透過率t^(x,λ)を再度算出(推定)する(ステップd9)。続いて、適応度評価部385は、ステップd5で変換した分光透過率から再度吸光度を算出する(ステップd10)。具体的には、図2のステップa5の処理手順に従い、上記した式(6)を用いて吸光度を算出する。続いて、適応度評価部385は、ステップd10で算出した吸光度をもとに各染色色素の色素量を推定する(ステップd11)。具体的には、図2のステップa7の処理手順に従い、上記した式(7),(9)を用いて各染色色素の色素量を推定する。
【0082】
そして、適応度評価部385は、処理対象パターンの適応度を算出する(ステップd13)。例えば、ステップd11で推定された各染色色素の色素量をもとに、処理対象パターンの色素量との差分(すなわち色素量の推定誤差)を染色色素毎に算出し、適応度とする。
【0083】
全ての色素量パターンについてループAの処理を行ったならば、適応度評価部385は、ステップd13で色素量パターン毎に算出した適応度の合計値を評価値として算出する(ステップd17)。その後図10のステップc9にリターンし、ステップc11に移行する。
【0084】
そして、ステップc11では、適応度評価部385は、ステップc9の適応度評価処理で得られた評価値を予め設定される所定の閾値を用いて閾値処理し、閾値を超えており閾値条件を満足しない場合には(ステップc11:No)、ステップc13に移行する。そして、ステップc13では、ステップc3〜ステップc11の一連の処理を行った処理回数(繰り返し数)を判定し、処理回数が予め設定されている所定の回数を超えない間は(ステップc13:No)、ステップc15に移行する。
【0085】
ステップc15では、突然変異部386が、突然変異処理を行う。具体的には、例えば予め設定される所定の確率(突然変異率)で乱数を発生させて交叉処理後の集団を構成する各個体の中から突然変異を起こさせる個体を選び、その遺伝子の数値列を変更する。例えば、選んだ個体の遺伝子のビット列から突然変異を起こさせる一部分(1ビットでもよいし複数ビットでもよい)を例えば乱数を発生させて選択し、選択した一部分のビットを反転させる。ここで、突然変異率は固定としてもよいし、図11のステップd17で算出した評価値に応じて動的に設定してもよい。例えば、評価値が低ければ(値が大きければ)、突然変異率を高く設定する。一方、評価値が高い場合には(値が小さい場合には)、突然変異率を低く設定する。これによれば、評価値が低い段階では早期に最適解に近付き易くすることができ、また、局所解に陥る事態を防止することができる。そして、最適解に近付いて評価値が高くなった段階では、突然変異によって評価値が急激に低下する事態を防止できる。
【0086】
そして、ステップc15の突然変異処理後の集団を次世代集団とし、ステップc3に戻ってこの次世代集団について処理を繰り返す。
【0087】
一方、評価値が閾値以下の場合(ステップc11:Yes)、あるいは処理回数が所定の回数を超えた場合には(ステップc13:Yes)、適応度評価部385は、例えば適応度が最も高い(適応度の値が最も小さい)色素量パターンの各染色色素の色素量を最適化色素量として決定する(ステップc17)。なお、処理回数が所定の回数を超えた場合に色素量推定処理を終了させているのは、ステップc3〜ステップc11の一連の処理を繰り返しても適応度が所定の閾値以下とならず、処理が完了しなくなることを避けるためである。その後、図6のステップb5にリターンし、ステップb7に移行する。
【0088】
そして、ステップb7では、制御パラメータ調整部39が、ステップb5で得られた最適化色素量を調整対象制御パラメータ(実施の形態1では反応時間)の値に反映させ、その値を調整する。
【0089】
例えば、反応時間と色素量との関係(相関式)を定義したLUTを事前に生成して記憶部33に記憶しておき、このLUTを参照して調整対象制御パラメータの値を調整する。ここで、LUTの生成方法について説明する。実施の形態1では、反応時間を変えて実際に作成した標本を用意して色素量を求め、反応時間と色素量との対応関係を予め設定しておく。ここで、同じ反応時間で標本を作成した場合であっても、色素量に多少のバラつきが生じる。この誤差を軽減するため、同じ反応時間で作成した複数の標本を用意する。そして、図2に示した処理手順に従い、得られた各標本の色素量を推定して反応時間毎の測定値(推定)を得る。
【0090】
図13は、反応時間毎の色素量の測定値をもとに反応時間と色素量との対応関係の一例を模式的に示した図であり、横軸を反応時間、縦軸を色素量とし、反応時間を異ならせて作成した標本の色素量を示している。前述のように、本例では、同じ反応時間で作成した複数の標本を用意しているため反応時間毎に複数の測定値が得られ、各値は、例えば図13中で破線で示すような範囲で値が分散する。この破線によって示した反応時間毎の分散は、対応する反応時間と色素量との関係に含まれる誤差とする。
【0091】
実施の形態1では、例えば、図13中に実線で示すように、反応時間毎に測定値の平均値を算出し、各反応時間に対応する色素量をその反応時間に対する1点として得る。そして、図13中に実線で示すプロット分布をテーブル化してLUTを作成し、記憶部33に記憶する。なお、このLUTは、反応時間と色素量との対応関係を定義したデータテーブルとして記憶しておく場合に限定されるものではない。例えば、測定点をもとに算出した近似曲線の関数式として記憶しておく構成としてもよい。
【0092】
制御パラメータ調整部39は、このようにして予め生成したLUTを参照し、色素Hおよび色素Eの染色液毎の反応時間を個別に算出する。例えば、最適化色素量のうち、色素Hの最適化色素量(色素量)をdH、色素Eの最適化色素量(色素量)dEとする。そして、dHの値をもとに、ヘマトキシリン染色液による反応時間SHを次式(14)に従って算出する。また、dEの値をもとに、エオジン染色液による反応時間SEを次式(15)に従って算出する。
【数13】

【0093】
ここで、最適化色素量の値がLUTに設定されていない数値の場合には、値が最も近いLUTの設定値を用いて線形変換を行い、反応時間を得る。以上のように、制御パラメータ調整部39は、式(14),(15)に従って、最適化色素量を反映させたヘマトキシリン染色液による反応時間SHおよびエオジン染色液による反応時間SEを得る。最適化色素量に対応する反応時間の算出は、上記式(14),(15)に従ってLUTを参照して行う方法に限定されるものではない。例えば、最適化色素量を変数とする変換関数を用い、反応時間を算出する構成としてもよい。
【0094】
そして、図6に示すように、標本作成処理設定部353は、ステップb3で取得された標本作成パラメータの値やステップb7で調整された調整対象制御パラメータの値を標本作成部5に通知し、標本作成部5の各部に対する動作指示を行う(ステップb9)。すなわち、実施の形態1では、標本作成処理設定部353は、ステップb3で取得された標本の厚さを薄切処理部52に通知するとともに、ステップb7で調整された反応時間を染色処理部54に通知する。
【0095】
なお、色素量最適化処理で最適化色素量として決定した色素量パターンについて図11のステップd7で算出した画素信号値をもとに、最適化色素量を表した画像を画面表示することとしてもよい。これによれば、対象標本を作成する前に臨床医等のユーザにその染め上がりを仮想的に提示することができる。
【0096】
図14は、図6に示すステップb9の動作指示に応答して標本作成部5が行う標本作成処理の処理手順を示すフローチャートである。この標本作成処理により、図6のステップb3で取得され、ステップb7で調整された制御パラメータの値を用いて対象標本が作成される。
【0097】
すなわち、図14に示すように、実施の形態1の標本作成処理では、先ず、パラフィンブロック作成処理部51がパラフィンブロック作成処理(ステップe1〜ステップe9)を行い、被験者から採取した検体からパラフィンブロックを作成する。
【0098】
具体的には先ず、パラフィンブロック作成処理部51は、採取した検体からブロックを切り出す(ステップe1)。ここで、切り出すブロックサイズは、その検体を採取(摘出)した臓器や部位、あるいは疾患名やその疾患の状態等によって異なる。このブロックサイズはパラフィンブロック作成処理部51が用いる制御パラメータであり、実施の形態1では固定値とする。例えば、予め臓器、部位、疾患名、疾患の状態の組み合わせと対応付けてブロックサイズを設定しておく。そして、図6のステップc3で取得された標本特定パラメータをもとに対象標本のブロックサイズを特定する。なお、このブロックサイズを標本作成パラメータ取得部352が取得する構成としてもよいし、制御パラメータ調整部39が調整する構成としてもよい。この場合には、取得または調整したブロックサイズの値に従ってステップe1の処理が行われる。
【0099】
実際のブロックサイズは、概ね1〔cm〕×2〔cm〕×数〔mm〕程度が標準的であるが、例えば脳の標本を作成する場合のように、1〔cm〕×数〔cm〕×数〔cm〕といった比較的大きなサイズで切り出すこともある。また、針生検等では検体から標本ブロックを採取する工程は不要であるため、次のステップe3の処理に移る。
【0100】
続くステップe3では、パラフィンブロック作成処理部51は、切り出した標本ブロックに対し、ホルマリン系固定液を用いて組織の固定を行う。ホルマリン系固定液の種類および固定時間は、パラフィンブロック作成処理部51が用いる制御パラメータであり、実施の形態1では固定値とする。ここで、ステップe1で切り出されたブロックサイズや固定する組織の種類、使用するホルマリン系固定液の種類によってホルマリンの浸透速度が異なるため、固定時間については、これらの値から決定される。通常、固定には1〜2日を要する。長時間漬け過ぎると過固定と呼ばれる状態になり、後段の染色処理において染色液によって染まり難くなる場合がある。なお、ホルマリン系固定液の種類および固定時間についても標本作成パラメータ取得部352が取得する構成としてもよいし、制御パラメータ調整部39が調整する構成としてもよい。この場合には、取得または調整したこれらの値に従ってステップe3の処理が行われる。
【0101】
続いて、パラフィンブロック作成処理部51は、アルコールを用いて脱脂・脱水する(ステップe5)。これは、生体組織に脂肪が含まれるためである。ここでの処理には2〜3日を要し、例えばアルコールの濃度を段階的(例えば3段階)に濃くしながら行う。使用するアルコール液、アルコール濃度、脱脂・脱水時間は、パラフィンブロック作成処理部51が用いる制御パラメータであり、実施の形態1では固定値とする。ただし、標本作成パラメータ取得部352が取得する構成としてもよいし、制御パラメータ調整部39が調整する構成としてもよい。この場合には、取得または調整したこれらの値に従ってステップe5の処理が行われる。
【0102】
続いて、パラフィンブロック作成処理部51は、溶けたパラフィンを組織内に浸透させて固める(脱水包埋:ステップe7)。ここでの処理には2日〜3日を要する。具体的には、無水アルコール、メタノール+クロロホルム、キシレン、パラフィンの各溶液に順次組織を浸していく。無水アルコールは仕上げの脱水のため、キシレンは脱アルコールのために使用する。各溶液および各溶液に対する浸透時間は、パラフィンブロック作成処理部51が用いる制御パラメータであり、実施の形態1では固定値とする。ただし、標本作成パラメータ取得部352が取得する構成としてもよいし、制御パラメータ調整部39が調整する構成としてもよい。この場合には、取得または調整したこれらの値に従ってステップe7の処理が行われる。この脱水包埋については、自動化装置が広く普及しており、適宜用いることができる。
【0103】
そして、パラフィンブロック作成処理部51は、溶けたパラフィンに沈め、更に冷して固めることでステップe1〜ステップe7の処理を施した標本ブロックをパラフィンで完全に覆う(パラフィン包埋:ステップe9)。浸透時間は、パラフィンブロック作成処理部51が用いる制御パラメータであり、実施の形態1では固定値とする。ただし、標本作成パラメータ取得部352が取得する構成としてもよいし、制御パラメータ調整部39が調整する構成としてもよい。この場合には、取得または調整した値に従ってステップe9の処理が行われる。このパラフィン包埋によって、本来柔らかい生体組織で構成される標本ブロックにパラフィンの強度を与え、薄切時において必要な程度の固さが実現できる。また、パラフィン包埋された標本ブロックは理想的な条件下で気密状態にできるため、半永久的に保存が可能になる。だたし、実際には完全な機密状態とはならないため、気密状態によっては状態変化が生じる。また、手術中に行う観察・診断を行いたい場合のように短時間で標本を作成する必要がある場合には、組織を凍結させることで形状を固定し、後段の薄切処理に移るようにしてもよい。
【0104】
続いて、薄切処理部52が、薄切処理を行う(ステップe11)。薄切処理部52は、例えば薄切処理が自動化された自動化装置(自動薄切装置)で構成される。ここで、所定の厚さ(標本の厚さ)は、薄切処理部52が用いる制御パラメータであり、実施の形態1では、標本作成パラメータ取得部352がユーザ操作に従って取得し、標本作成処理設定部353が薄切処理部52に通知することによって得られる。なお、制御パラメータ調整部39が調整する構成としてもよい。自動薄切装置は、通知された標本の厚さを制御パラメータとして用い、例えば、ミクロトーム(microtome)を用い、所定の厚さとなるように標本ブロックを薄くスライスする。薄切した切片は一旦水に浮かべ、その後プレパラートに掬い上げる。プレパラートに掬い上げた切片は、42℃〜43℃程度で乾燥させる。この温度は切片に皺や皸を作らないように設定する。
【0105】
続いて、脱パラフィン処理部53が、パラフィンを洗い流す(脱パラフィン:ステップe13)。薄切処理が完了すればパラフィンは不要であるから、染色の邪魔にならないようにこれを除去する。先ず、60℃程度の温度でパラフィンを融溶させる。プレパラートを立てた状態にしておけば、大部分のパラフィンは自然に流れ落ちる。ここでの処理には通常1時間程度を要するが、専用の自動化装置が知られており、適宜用いることができる。続いて、キシレンを溶剤として、残ったパラフィンを溶かす。パラフィンを溶かすことでキシレンは汚染されていくので、純度の異なる例えば3槽のキシレンプールを用意し、純度が低いキシレンプールから順次5分程度ずつ浸す。浸透時間は、脱パラフィン処理部53が用いる制御パラメータであり、実施の形態1では固定値とする。ただし、標本作成パラメータ取得部352が取得する構成としてもよいし、制御パラメータ調整部39が調整する構成としてもよい。この場合には、取得または調整した値に従ってステップe13の処理が行われる。
【0106】
続いて、脱パラフィン処理部53は、アルコール(純エタノール)を用いてキシレンを洗い流す(脱キシレン:ステップe15)。脱パラフィンの場合と同様に、キシレンを溶かすことでアルコールは汚染されていくので、純度の異なる例えば3槽のアルコールプールを用意し、純度が低いアルコールプールから順次5分程度ずつ浸す。浸透時間は、脱パラフィン処理部53が用いる制御パラメータであり、実施の形態1では固定値とする。ただし、標本作成パラメータ取得部352が取得する構成としてもよいし、制御パラメータ調整部39が調整する構成としてもよい。この場合には、取得または調整した値に従ってステップe15の処理が行われる。
【0107】
続いて、脱パラフィン処理部53は、アルコールを洗い流す(脱アルコール:ステップe17)。通常、水洗には水道水を使用し、他の染色液や溶剤に投入する前に蒸留水を潛らせる。アルコールから水への急激な変化が標本に悪影響を与えると懸念される場合等、一旦70%程度の濃度のアルコール洗浄を経由する場合もある。
【0108】
続いて、染色処理部54が染色処理(ステップe19〜ステップe27)を行い、H&E染色を施す。先ず、染色処理部54は、標本のヘマトキシリン染色を行う(ステップe19)。ヘマトキシリン染色は、蒸留水を用いて標本を洗浄した後、所定の時間(反応時間)ヘマトキシリン染色液に浸す。ここで、染色液の濃度および反応時間は、染色処理部54が用いる制御パラメータである。実施の形態1では、染色液の濃度については固定値とする。ただし、標本作成パラメータ取得部352が取得する構成としてもよいし、制御パラメータ調整部39が調整する構成としてもよい。この場合には、取得または調整した値に従ってステップe19の処理が行われる。一方、反応時間は、制御パラメータ調整部39が最適化色素量を反映させて調整した値であり、標本作成処理設定部353によって染色処理部54に通知されたヘマトキシリン染色液による反応時間である。
【0109】
続いて、染色処理部54は、ヘマトキシリン染色された標本に対して色出しのための水洗を行う(ステップe21)。通常は、時間短縮のため、1%の塩酸アルコールに浸す。ここでの処理により、細胞質等に付着した余分なヘマトキシリン染色液が除去される。水道水を用いる場合には、長時間水道水に漬け過ぎると水道水に含まれる塩素によってヘマトキシリンの色が抜けてしまうので、注意が必要である。染色は一度安定状態になるため、蒸留水中であれば長時間放置しても問題ない。ここで、塩酸アルコールの溶液濃度および水洗時間は、染色処理部54が用いる制御パラメータであり、実施の形態1では固定値とする。ただし、標本作成パラメータ取得部352が取得する構成としてもよいし、制御パラメータ調整部39が調整する構成としてもよい。この場合には、取得または調整したこれらの値に従ってステップe21の処理が行われる。
【0110】
蒸留水による洗浄後、続いて染色処理部54は、エオジン染色を行う(ステップe23)。ここでは、標本をエオジン染色液に浸す。ここで、染色液の濃度および反応時間は、染色処理部54が用いる制御パラメータである。実施の形態1では、染色液の濃度については固定値とする。ただし、標本作成パラメータ取得部352が取得する構成としてもよいし、制御パラメータ調整部39が調整する構成としてもよい。この場合には、取得または調整した値に従ってステップe23の処理が行われる。一方、反応時間は、ステップe19のヘマトキシリン染色で用いる反応時間と同様に、制御パラメータ調整部39が最適化色素量を反映させて調整した値であり、標本作成処理設定部353によって染色処理部54に通知されたエオジン染色液による反応時間である。
【0111】
続いて、染色処理部54は、エオジン染色された標本に分別脱水処理を行う(ステップe25)。通常、染色液に浸された標本は、全体に染色液を含んだ状態となる。しかし、その後適当な溶剤(洗浄液)で洗浄することで、本来染色されるべき部位以外の染色液を洗い流し、目的部位だけが染色された状態にする。この処理を分別と呼ぶ。エオジンの分別には、通常洗浄液としてアルコール(純エタノール)を用いる。アルコールで洗浄することで染色中に付着した水分も除去されるため、この場合の分別の工程は脱水の行程も兼ねている。アルコール中に標本を放置するとエオジンが溶け出してしまうので、アルコール中で10回揺する処理を4回程度行って分別を終える。ここで、洗浄液の種類および洗浄時間は染色処理部54が用いる制御パラメータであり、実施の形態1では固定値とする。ただし、標本作成パラメータ取得部352が取得する構成としてもよいし、制御パラメータ調整部39が調整する構成としてもよい。この場合には、取得または調整したこれらの値に従ってステップe25の処理が行われる。
【0112】
分別が終わった状態で放置すると標本に残留・付着したアルコール分でエオジンが落ちてしまうので、染色処理部54は、直ちに続く透徹を行う(ステップe27)。透徹は、標本をキシレンに浸す処理であり、例えば5分の浸透時間で3回程度行う。この処理は、脱アルコールと同様の処理であるが、標本の発色を良くする効果もあるため、特に透徹と呼ばれている。透徹時間は、染色処理部54が用いる制御パラメータであり、実施の形態1では固定値とする。ただし、標本作成パラメータ取得部352が取得する構成としてもよいし、制御パラメータ調整部39が調整する構成としてもよい。この場合には、取得または調整した値に従ってステップe27の処理が行われる。
【0113】
続いて、封入処理部55が、標本の封入処理を行い、標本(対象標本)を得る(ステップe29)。すなわち、プレパラートにカバーガラスを載せ、接着剤で固定する。封入包埋については、専用装置によって自動化されており、適宜用いることができる。接着剤によって完全密封されるため、得られた標本は、半永久的に保存できる。
【0114】
以上説明したように、実施の形態1によれば、対象標本の種類を示す標本特定パラメータおよび対象標本を作成する際に用いる標本作成パラメータの各値をユーザ操作に従って取得し、取得した値に応じた標準色素量dH_S,dE_Sを用いて色素量推定に適した最適化色素量を決定することができる。具体的には、遺伝的アルゴリズムを適用して集団の生成および評価を繰り返し、適応度が最も高い(すなわち色素量の推定誤差が小さい)色素量を最適化色素量として決定することができる。そして、決定した最適化色素量に従って調整対象制御パラメータの値を調整し、標本作成部5に通知して動作指示を行うことができる。この結果、標本作成部5は、標本の染色状態(染め上がり)が色素量推定に適した色素量となるように調整した調整対象制御パラメータの値を用いて対象標本を作成する。これによれば、色素量推定に適した(色素量を高精度に推定可能な)染色状態で対象標本を作成することができる。
【0115】
なお、上記した実施の形態1では、遺伝的アルゴリズムを用いて最適化色素量を決定することとしたが、この遺伝的アルゴリズムについては様々な分野で種々の改善が行われており、改善されたアルゴリズムを適用することとしてよく、高速且つ高精度に最適化色素量を決定することができる。
【0116】
また、上記した実施の形態1では、適応度として色素量の推定誤差を算出することとした。これに対し、吸光度の推定誤差や分光透過率の推定誤差を適応度として用いることとしてもよい。例えば吸光度の推定誤差を用いる場合であれば、図11のステップd3で処理対象パターンの色素量をもとに算出した吸光度と、この吸光度をステップd5で分光透過率に変換した後、ステップd10においてこの分光透過率を変換して得た吸光度との差分(吸光度の推定誤差)を算出し、適応度として用いることとしてもよい。
【0117】
また、分光透過率の推定誤差を用いる場合であれば、図11のステップd5において、ステップd3で得た吸光度を変換して得た分光透過率と、この後ステップd9で再度算出(推定)した分光透過率との差分(分光透過率の推定誤差)を算出し、適応度として用いることとしてもよい。
【0118】
また、上記した実施の形態1では、調整対象とする制御パラメータとして反応時間について詳述したが、反応時間以外の制御パラメータを調整対象としてもよい。その調整対象とする制御パラメータの値と色素量との対応関係を予め設定しておくことで上記した実施の形態1と同様に実現できる。
【0119】
例えば、標本の厚さを調整対象制御パラメータとする場合には、標本の厚さと色素量との関係(相関式)を定義したLUTを事前に生成して記憶部33に記憶しておけばよい。すなわち例えば、標本の厚さを変えて実際に作成した標本を用意して色素量を求め、上記した実施の形態1と同様の要領で、標本の厚さと色素量との対応関係を予め設定しておく。このとき、同じ標本の厚さで標本を作成した場合であっても、色素量に多少のバラつきが生じる。この誤差を軽減するため、同じ標本の厚さで作成した複数の標本を用意する。そして、図2に示した処理手順に従い、得られた各標本の色素量を推定して標本の厚さ毎の測定値(推定)を得る。
【0120】
図15は、標本の厚さ毎の色素量の測定値をもとに標本の厚さと色素量との対応関係の一例を模式的に示した図であり、横軸を標本の厚さ、縦軸を色素量とし、標本の厚さを異ならせて作成した標本の色素量を示している。この場合も、上記した実施の形態1と同様に標本の厚さ毎に複数の測定値が得られ、各値は、例えば図15中で破線で示すような範囲で値が分散する。そこで例えば、実施の形態1と同様に、図15中に実線で示すように、標本の厚さ毎に測定値の平均値を算出し、各標本の厚さに対応する色素量をその標本の厚さに対する1点として得る。そして、図15中に実線で示すプロット分布をテーブル化してLUTを作成し、記憶部33に記憶しておく。
【0121】
そして、制御パラメータ調整部39は、このようにして予め生成したLUTを参照し、標本の厚さを算出する。例えば、最適化色素量のうち、色素Eの最適化色素量(色素量)をdEとする。そして、dEの値をもとに、標本の厚さTEを次式(16)に従って算出する。
【数14】

【0122】
これにより、最適化色素量を標本の厚さに反映させて調整することができる。上記したように、標本の厚さは標本の染色状態に影響を与えるため、このようにして最適化色素量を標本の厚さに反映させて調整することによって、より高精度に色素量を推定可能な染色状態で対象標本を作成することができる。
【0123】
同様に、ヘマトキシリン染色液の濃度を調整対象制御パラメータとする場合であれば、ヘマトキシリン染色液の濃度と色素量との関係(相関式)を定義したLUTを事前に生成して記憶部33に記憶しておけばよい。すなわち例えば、ヘマトキシリン染色液の濃度を変えて実際に作成した標本を用意して色素量を求め、上記した実施の形態1と同様の要領で、ヘマトキシリン染色液の濃度と色素量との対応関係を予め設定しておく。
【0124】
図16は、ヘマトキシリン染色液の濃度毎の色素量の測定値をもとにヘマトキシリン染色液の濃度と色素量との対応関係の一例を模式的に示した図であり、横軸をヘマトキシリン染色液の濃度、縦軸を色素量とし、ヘマトキシリン染色液の濃度を異ならせて作成した標本の色素量を示している。この場合も、上記した実施の形態1と同様にヘマトキシリン染色液の濃度毎に複数の測定値が得られ、各値は、例えば図16中で破線で示すような範囲で値が分散する。そこで、実施の形態1と同様に、図16中に実線で示すように、ヘマトキシリン染色液の濃度毎に測定値の平均値を算出し、各ヘマトキシリン染色液の濃度に対応する色素量をそのヘマトキシリン染色液の濃度に対する1点として得る。そして、図16中に実線で示すプロット分布をテーブル化してLUTを作成し、記憶部33に記憶しておく。
【0125】
そして、制御パラメータ調整部39は、このようにして予め生成したLUTを参照し、ヘマトキシリン染色液の濃度を算出する。例えば、最適化色素量のうち、色素Hの最適化色素量(色素量)をdHとする。そして、dHの値をもとに、ヘマトキシリン染色液の濃度CHを次式(17)に従って算出する。
【数15】

【0126】
また、図示しないが、パラフィンブロック作成処理部51がパラフィンブロック作成処理で用いるブロックサイズ(採取した検体からブロックを切り出す際のブロックサイズ)や、標本内の組織の固定に用いるホルマリン系固定液の固定時間を調整対象制御パラメータとする場合も同様に、ブロックサイズと色素量、あるいは固定時間と色素量との関係(相関式)を定義したLUTを事前に生成して記憶部33に記憶しておけばよい。
【0127】
また、上記した実施の形態1,2では、調整対象とする制御パラメータを反応時間とし、最適化色素量の値を反映させて調整する場合について説明した。これに対し、さらに標本の厚さを加味して反応時間を調整するようにしてもよい。
【0128】
一般的なH&E染色の染色工程では、色素Hは、核を染色する。一方、色素Eは、核を含む組織のほぼ全域を染色する。なお、染色工程によっては、色素Hが組織全域を染色する場合もある。ここで、ある厚さの標本を色素Eで染色した場合に対し、その2倍の厚さの標本を色素Eで染色した場合の色素Eの色素量はほぼ2倍となる。これは、色素Eは、色素Eが組織全域(主に細胞質)を染色するためのである。すなわち、標本の厚さを2倍にした場合、標本中を占める組織のうち、色素Eによって主に染色される細胞質の体積も2倍となるためである。一方で、ある厚さの標本を色素Hで染色した場合に対し、その2倍の厚さの標本を色素Hで染色した場合の色素Hの色素量はほとんど変化しない。これは、色素Hが主に染色するのは核であり、通常では、標本の厚さを2倍にしたとしてもその標本内に別の核が存在する可能性が極めて低いためである。
【0129】
このため、標本の色素量(詳細には、色素Eの色素量)は、標本の厚さによって変わる。そこで、標本の厚さを加味して反応時間を調整することとしてもよい。例えば、上記した実施の形態1,2のように、標本の厚さを取得対象とする場合であれば、取得した標本の厚さを加味して反応時間を次式(18),(19)に従って算出することとしてもよい。この場合には、制御パラメータ決定部372は、実施の形態1で説明した反応時間と色素量との関係(相関式)を定義したLUT(図13のLUT)および標本の厚さと色素量との関係(相関式)を定義したLUT(図15のLUT)を参照し、色素Hおよび色素Eの染色液毎の反応時間を個別に算出する。例えば、最適化色素量のうち、色素Hの最適化色素量(色素量)をdH、色素Eの最適化色素量(色素量)dEとする。そして、dHの値をもとに、ヘマトキシリン染色液による反応時間SHを次式(18)に従って算出する。また、dEの値および取得した標本の厚さTの値をもとに、エオジン染色液による反応時間SEを次式(19)に従って算出する。
【数16】

【0130】
ここで、式(19)に示したエオジン染色液による反応時間SEの算出について説明する。式(19)に示すように、エオジン染色液による反応時間SEの算出では先ず、標本の厚さと色素量との関係を定義したLUT(例えば図15のLUT)に従い、標本の厚さが取得した値Tの場合の色素量を得る。標本の厚さTに対応する色素量(LUT(T))の値を得たならば、続いて、反応時間と色素量との関係を定義したLUT(例えば図13のLUT)に従い、反応時間SEを得る。具体的にはこのとき、標本の厚さTに対応する色素量(LUT(T))と反応時間SEに対応する色素量とで最終的な色素Eの色素量がdEになるように、差分値dE/LUT(T)を求める。そして、反応時間と色素量との関係を定義したLUTに従い、求めた差分値に対応する反応時間をSEとして得る。この結果、標本の厚さをTとして作成する標本において、色素Eの色素量が最適化色素量dEとなるようなエオジン染色液の反応時間SEの値を取得できる。
【0131】
なお、ここでは、標本の厚さを加味して反応時間SEの値を算出(調整)する場合について例示した。これに対し、同様の手法を適用することで、標本の厚さ以外の取得対象とする所望の制御パラメータの値を加味し、所望の調整対象制御パラメータの値を調整することができる。また、同様の手法を適用することで、複数の取得対象制御パラメータの値を加味して調整対象制御パラメータの値を調整することができる。例えば反応時間を調整するのであれば、加味する各制御パラメータの値と色素量との関係を定義したLUTをそれぞれ用意しておき、これらLUTを順次参照して最終的な色素Hおよび/または色素Eの色素量が最適化色素量dH,dEとなるように反応時間SH,SEを決定すればよい。
【0132】
また、ここでは、反応時間と色素量との関係を定義したLUTおよび標本の厚さと色素量との関係を定義したLUTを用いてエオジン染色液の反応時間SEを算出する場合を例示した。これに対し、標本の厚さ毎に個別に反応時間と色素Eの色素量との関係を定義したLUTを用意しておくこととしてもよい。この場合には、取得した標本の厚さTに応じたLUTを参照し、この参照先のLUTに従って確定された色素Eの色素量に対応する反応時間を取得すればよい。
【0133】
あるいは、パラフィンブロック作成処理部51が用いる標本内の組織の固定に用いるホルマリン系固定液の種類を加味して反応時間を調整することもできる。この場合には、使用するホルマリン系固定液の種類に応じた係数を式(14),(15)や式(18),(19)で得られる各値に乗じることで実現できる。例えばあるホルマリン系固定液Aを用いる場合の係数を“1.0”とする。一方、Aとは別のホルマリン系固定液Bを用いる場合の係数を“0.95”とする。そして、ホルマリン系固定液Aを用いる場合であれば、式(14)や式(18)に従って算出したSHの値をヘマトキシリン染色液による反応時間として得る。同様に、式(15)や式(19)に従って算出したSEの値をエオジン染色液による反応時間として得る。一方、ホルマリン系固定液Bを用いる場合には、式(14)や式(18)に従って算出したSHの値に係数“0.95”を乗じた値をヘマトキシリン染色液による反応時間として得る。エオジン染色液による反応時間も式(15)や式(19)を用いて同様に算出する。
【0134】
(実施の形態2)
上記した実施の形態1では、一般染色として知られるH&E染色を施した標本を作成する場合について説明した。これに対し、この他にも、様々な染色法が知られている。上記したように、これらの染色法は、一般染色、特殊染色および免疫染色に大別されるが、本発明は、いずれの染色法で標本を染色する場合にも適用可能である。
【0135】
例えば、特殊染色について例示すると、アザン染色、アルシアンブルー・PAS重染色、アルシアンブルー染色、エラスチカ・ワンギーソン染色(EVG染色)、オイルレッドO染色、オルセイン染色、ギムザ染色、グリメリウス染色、クリューバー・バレラ(KB)染色、グロコット染色、コッサ(Ca)反応、ゴモリのアルデヒドフクシン染色、コロイド鉄染色、コンゴー赤(DFS 4BS)染色、サフラニンO染色、ズダンIII染色、ズダン黒B染色、ダイレクトファーストスカーレット染色、チールネンゼン染色、トルイジンブルー(Tb)染色、ナフトールASDクロロアセテート法、ニッスル染色、ビクトリアブルー染色、フォイルゲン染色、ベルリンブルー(Fe)染色、ボデイアン染色、マッソン・トリクローム染色(MT染色)、マッソンフォンタナ染色、ムチカルミン染色、メチルグリーンピロニン染色、リンタングステン酸ヘマトキリシン(PTAH)染色、レンドラムの封入体染色、グラム染色、ワイゲルト染色、ワンギーソン染色、渡辺の鍍銀(Ag)染色、漂白法、好酸球染色(ルナ染色)、Kossa法、LFB染色、TRAP染色、PAM染色、PAS反応等が挙げられ、各染色法に適用できる。また、ここで挙げていない染色法についても同様に適用できる。
【0136】
これらの特殊染色に適用する場合も、上記した実施の形態1と同様に、該当する染色法で染色した標準的な標本を用意し、その染色色素毎の標準色素量dH_S,dE_Sを教師データとして記憶部に記憶しておく。また、対象標本について標本特定パラメータおよび標本作成パラメータの各値を取得する。そして、取得した値に応じた標準色素量dH_S,dE_Sを用い、実施の形態1と同様の要領で色素量最適化処理を行って各染色色素の最適化色素量を算出する。そして、得られた最適化色素量に従って調整対象制御パラメータの値を調整し、調整した値を用いて対象標本を作成する。
【0137】
標本作成パラメータや調整対象制御パラメータとする制御パラメータには、例えば適用する染色法で使用する染色液の生成条件や反応時間等が挙げられる。ここで、染色液の生成条件は、染色液の構成や濃度等である。また、この他、その染色法における標本作成処理の各工程で用いる制御パラメータを適宜調整対象制御パラメータとすることができる。ここで、特殊染色においても、その染色法における標本作成処理のプロトコールやこのプロトコールで用いる制御パラメータは、一般染色として例示したH&E染色の場合と同様に採用する装置の製造メーカによって異なり、医療施設側の設定によって異なる場合もある。本発明は何れのプロトコールを採用することとしてもよく、そのプロトコールに記載される制御パラメータを適宜標本作成パラメータや調整対象制御パラメータとしてよい。
【0138】
例えば、特殊染色のうち、多糖類を過ヨウ素酸で酸化して、生じたアルデヒド基にシッフ試薬を反応させて呈色させることにより、単純多糖類(グリコーゲン,セルロース,デキストラン)、中性または酸性粘液(グリコプロテイン,所謂上皮性粘液)、糖脂質、甲状腺コロイド、基底膜、細網繊維、赤痢アメーバ、真菌、リポフスチン等を赤紫から赤色に染め、膠原線維や繊維素を桃色に染める過ヨウ素酸シッフ反応染色(以降、PAS染色)の場合には、例えば過ヨウ素酸水の生成条件やシッフ試薬の生成条件、過ヨウ素酸水による反応時間、シッフ試薬による反応時間等が制御パラメータとして挙げられる。また、例えばシッフ試薬の生成条件としては、その組成物質や、各組成物質の混合量の組み合わせが挙げられる。
【0139】
なお、PAS染色では、過ヨウ素酸での染色の後、シッフ試薬での染色を行い、その後ヘマトキシリン染色液を用いて核の染色を行う。より詳細には、シッフ試薬での染色の後、亜硫酸水を用いて対象部位以外の染色液を洗い流す工程を行う。このため、このときに核が酸化される。ここで、ヘマトキシリン染色は酸化性染色であるため、亜硫酸水を用いた処理の影響により、その後のヘマトキシリン染色において、実施の形態1,2で説明したH&E染色でのヘマトキシリン染色と比較して核が染色され易くなる。このため、本発明をPAS染色に適用し、ヘマトキシリン染色液による反応時間を調整対象制御パラメータとする場合には、例えば、実施の形態1で説明したH&E染色の際に用いるLUTとは別の、シッフ試薬の反応時間を加味したヘマトキシリン染色液の反応時間を定義したLUTを用意し、これを用いるようにしてもよい。
【0140】
その他、例えば弾性繊維の染色法であるワイゲルト染色と膠原線維の染色であるワンギーソン染色を組み合わせた染色法であるEVG染色の場合には、レゾルシンフクシン液、鉄ヘマトキシリンおよびワンギーソン液それぞれの生成条件や反応時間が制御パラメータとして挙げられる。
【0141】
また、分子量の異なる酸性色素を用いた重染色であるMT染色の場合には、鉄ヘマトキシリン、ポンソー・キシリジン・酸フクシン・アゾフロキシン、オレンジG水溶液およびアニリン青それぞれの生成条件や反応時間が制御パラメータとして挙げられる。
【0142】
また、染色法によっては、染色した色素を不溶化するため、洗浄する前に媒染剤を用いて媒染処理を行う場合があるが、この媒染剤の生成条件や反応時間も制御パラメータとなる。
【0143】
一方、免疫染色について例示すると、例えば酵素抗体法では、直接法、間接法等が挙げられる。また、間接法については増感の有無を選択でき、増感法として、PAP法やABC法、ストレプトアビジン法、Tyramide signal amplificationシステム(TSAシステム)、LSAB法、高感度ポリマー試薬法、酵素抗体法による多重染色等が挙げられる。これらの免疫染色についても、上記した実施の形態1と同様に適用できる。ここで、免疫染色では、酵素抗体法におけるこれらの反応形式や増感法の種類が制御パラメータとなる。なお、ここで挙げていない染色法についても同様に適用できる。
【0144】
この他、標本作成パラメータや調整対象制御パラメータとする制御パラメータには、該当する染色法で使用する一次抗体や二次抗体、発色試薬の生成条件や反応時間等が挙げられる。生成条件としては、使用する化学薬品の構成や濃度が挙げられる。また、免疫染色においても、その染色法における標本作成処理のプロトコールやこのプロトコールで用いる制御パラメータは、採用する装置の製造メーカによって異なり、医療施設側の設定によって異なる場合もある。本発明は何れのプロトコールを採用することとしてもよく、そのプロトコールに記載される制御パラメータを適宜標本作成パラメータや調整対象制御パラメータとしてよい。
【0145】
図17は、免疫染色を適用した場合の標本作成処理の処理手順を示すフローチャートである。先ず、抗原の賦活化を行い、抗体の認識部位あるいは配列(エピトープ)を表出させる(ステップf1)。賦活化の手法としては、タンパク質分解酵素を用いる方法や界面活性剤を用いる方法等が知られている。続いて、切片の上にタンパク質を緩衝液に溶かした溶液を乗せ、所定時間置くこでブロッキングを行う(ステップf3)。このブロッキングは、抗体が抗原以外の分子を認識することを防ぐために行う。
【0146】
続いて、一次抗体を反応させる(ステップf5)。その後、洗浄を行った(ステップf7)後で、二次抗体を反応させる(ステップf9)。そして、洗浄の後(ステップf11)、増感するか否かを判定し、増感する場合には(ステップf13:Yes)、増感反応に移る(ステップf15)。ここでは、例えばステップf9で反応させた二次抗体の種類に応じて適宜増感反応を行う。そして、増感しない場合(ステップf13:No)、あるいはステップf15の増感反応の後、発色工程に移り、酵素に対する基質を添加して発色させる(ステップf17)。
【0147】
なお、上記した実施の形態1では、対象標本にH&E染色を施すことを前提とし、記憶部33の標準色素量データ333には、色素Hおよび色素Eの標準色素量dH_S,dE_Sが記憶されていることとして説明した。また、実施の形態2では、適用可能な他の染色法について説明した。ここで、標準色素量データ333には、実施の形態1のH&E染色や実施の形態2で例示した染色法を含む染色法毎に、その染色法に応じた染色色素毎の標準色素量を記憶しておく構成としてよい。これによれば、ユーザ操作に従って取得した標本作成パラメータの値をもとに対象標本に施す染色法を特定することによって、特定した染色法に応じた染色色素の標準色素量を標準色素量データ333から読み出して用い、最適化色素量を決定することができる。
【0148】
また、上記した実施の形態1では、事前に標準的な染色状態の標準標本を用意し、この標準標本の各点について推定した標準色素量を教師データとして用いる場合について説明した。これに対し、標準標本の各点における分光透過率や吸光度を教師データとして用いることとしてもよい。そして、最適化色素量を求める際にこれら教師データとする分光透過率や吸光度から色素量を算出し、GAを適用してこの色素量を調整することによって最適化色素量を算出することとしてもよい。
【0149】
また、作成対象とする標本は、病理検査に用いる病理標本に限らず、あらゆる生体標本を対象とすることができる。
【図面の簡単な説明】
【0150】
【図1】標本を作成し、観察・診断する手順の概要を説明する説明図である。
【図2】観察画像を生成する各処理の概略手順を説明する説明図である。
【図3】実施の形態1の標本作成装置を含む標本作成システムの全体構成を説明する模式図である。
【図4】標本作成装置の機能構成を示すブロック図である。
【図5】遺伝子の一例を示す図である。
【図6】制御装置が行う処理手順を示すフローチャートである。
【図7】標本特定パラメータ入力画面の一例を示す図である。
【図8】標本特定パラメータ入力画面の他の例を示す図である。
【図9】標本作成パラメータ入力画面の一例を示す図である。
【図10】色素量最適化処理の詳細な処理手順を示すフローチャートである。
【図11】適応度評価処理の詳細な処理手順を示すフローチャートである。
【図12】画素信号値とノイズ量との対応関係の一例を示す図である。
【図13】反応時間と色素量との対応関係の一例を示す図である。
【図14】実施の形態1における標本作成処理の処理手順を示すフローチャートである。
【図15】標本の厚さと色素量との対応関係の一例を示す図である。
【図16】ヘマトキシリン染色液の濃度と色素量との対応関係の一例を示す図である。
【図17】実施の形態2における標本作成処理の処理手順を示すフローチャートである。
【符号の説明】
【0151】
1 標本作成システム
2 標本作成装置
3 制御装置
31 操作部
32 表示部
33 記憶部
331 標本作成処理プログラム
333 標準色素量データ
335 色素別基準分光特性値
35 制御部
351 標本特定パラメータ取得部
352 標本作成パラメータ取得部
353 標本作成処理設定部
37 画像処理部
38 色素量最適化処理部
381 初期集団生成部
382 選択部
383 交叉部
384 パターン生成部
385 適応度評価部
386 突然変異部
39 制御パラメータ調整部
5 標本作成部
51 パラフィンブロック作成処理部
52 薄切処理部
53 脱パラフィン処理部
54 染色処理部
55 封入処理部
6 観察装置
【技術分野】
【0001】
本発明は、標本を作成する標本作成装置および標本作成方法に関する。
【背景技術】
【0002】
生体組織標本、特に病理標本では、臓器摘出や針生検によって得た検体を数μm程度に薄切りして標本を作成し、様々な所見を得るために顕微鏡を用いて拡大観察することが広く行われている。中でも、光学顕微鏡を用いた透過観察は、機材が比較的安価で取り扱いが容易である上、歴史的に古くから行われてきたこともあって、最も普及している観察方法の1つである。ここで、生体から採取した検体は、光をほとんど吸収および散乱せず、無色透明に近い。このため、標本の作成に際し、染色色素による染色を施すのが一般的である(染色処理)。
【0003】
染色の手法としては種々のものが提案されており、その総数は100種類以上にも達する。これらの染色法は、大別すると、一般染色、特殊染色および免疫生体組織化学的染色(以下、「免疫染色」と呼ぶ。)の3種類に分類できる。標本に施す染色の手順は、染色法によって決まっている。
【0004】
ここで、一般染色は、病理形態学的所見を得るために実施される染色法である。例えば、青紫色のヘマトキシリンおよび赤色のエオジンの2種類の染色色素を用いるヘマトキシリン−エオジン染色(以下、「H&E染色」と呼ぶ。)がこれに該当し、病理組織学的検査において最も汎用的に用いられている。このH&E染色では、先ず、ヘマトキシリン染色液でヘマトキシリン染色を行い、色出しのための水洗処理の後、エオジン染色液でエオジン染色を行う。
【0005】
特殊染色は、一般染色を補う染色法として開発され、一般染色では識別が困難な物質を検出するための染色法として知られている。例えば、膠原線維や弾性繊維、細網線維、糖原、多糖体、組織内病原体、核酸、無機質、メラニン、細胞内顆粒、繊維素、横紋、アミロイド、神経、脂肪等を検出の対象とした染色法が知られている。特殊染色の手順は、原則として一般染色と同様であり、染色法によって染色液(試薬)が異なる。例えば、線上皮細胞を特殊染色する手法として知られるPAS染色では、シッフ試薬が用いられる。
【0006】
免疫染色は、抗原抗体反応(免疫反応)を可視化するための発色操作であり、免疫染色は正確には染色とは異なるが、抗体の特異性を利用して組織を染め分けて抗原の存在(局在)を観察可能にするものである。このため、病理組織学的検査における染色法の1つとして、一般染色や特殊染色と同様に扱われている。例えば、抗原に結合した抗体の局在を酵素反応による発色によって可視化する酵素抗体法が知られている。この酵素抗体法では、先ず、切片上の対象物(抗原)に対して特異抗体を反応させる。そして、抗原抗体反応や化学反応を適宜組み合わせることによって特異抗体と標識酵素との免疫複合体を形成し、最終的に標識酵素の発色反応によって抗原の存在(局在)を可視化する。発色反応では、例えば、DAB発色が汎用的に用いられている。
【0007】
ところで、これらの一般染色や特殊染色、免疫染色による標本の染色状態(染色の程度)は、染色(反応)に要する時間(以下、「反応時間」と呼ぶ。)や染色液(試薬や抗体の希釈液等)の生成条件等によって異なる。例えば、H&E染色では、ヘマトキシリン染色液による反応時間やその染色液の生成条件、エオジン染色液による反応時間やその染色液の生成条件等によって異なる。また、免疫染色においては、例えば酵素抗体法であれば、直接法や間接法、LSAB法、高感度ポリマー試薬法といった反応形式によって感度が異なる。
【0008】
また、標本の作成処理には、上記した染色処理の他にパラフィンブロック作成処理や薄切処理、脱パラフィン処理、封入処理等が含まれ、これらの処理の条件も染め上がりに影響を与える。
【0009】
ここで、標本は通常、医療施設に配置された臨床検査技師によって作成される。このため、臨床検査技師の経験等の個人差が影響し、標本の染色状態を均一に保つのは困難であった。また、標本自体の個体差や標本作成時の室温といった周囲の環境等によっても染色状態がばらつく場合があった。
【0010】
このような染色のばらつきを抑え、安定的に標本を作成するため、近年では、一連の標本作成処理の一部または全部を自動的に行う装置の開発が進められている(例えば、特許文献1,2を参照)。例えば、特許文献1には、生物標本の脱パラフィン、染色、カバーグラス被覆操作を自動化した自動装置が開示されている。また、特許文献2には、サンプル毎に個別に温度を監視することが可能な自動化分子病理学装置が開示されている。
【0011】
ところで、作成された標本は、臨床医によって観察・診断されるため、求められる標本の染色状態は、臨床医の好みによって異なる。このため、特許文献1,2等に開示されている自動化装置を用いれば標本作成処理の一貫した制御が実現でき、均一な染色状態の標本が安定的に作成できるものの、作成された標本の染色状態が必ずしも臨床医の望む染色状態とは限らず、診断精度の低下を招く場合があった。例えば、染色された標本の観察・診断時における臨床医のストレスに繋がり、決定的な所見が見落とされる可能性があった。
【0012】
この種の問題を解決するために、画像処理によって染色状態を定量化・標準化しようとする試みがなされている。例えば、特許文献3には、標本に固定された染色色素の相対的な量(色素量)を推定する手法や、推定した染色色素の色素量を仮想的に増減させ、増減後の色素量を用いて仮想的な標本のRGB画像を合成する手法が開示されている。色素量の増減を適切に行えば、濃く染色された標本や薄く染色された標本を、適切に染色された標本と同等の色を有する画像に補正することができる。
【0013】
【特許文献1】特表2005−527811号公報
【特許文献2】特許第3847559号公報
【特許文献3】特開2009−14355号公報
【発明の開示】
【発明が解決しようとする課題】
【0014】
しかしながら、画像処理によって標本を染色している各染色色素の色素量を推定する場合、標本の染色状態が色素量の推定精度に影響するという問題があった。例えば、濃く染色された領域では信号値のS/N比が減少し、色素量の推定精度が低下するという問題があった。ここで、複数の染色色素で染色する場合には、個々の染色色素の色素量が適切であっても、これらが重畳することで染色状態が濃すぎる事態が生じ得る。また、標本の作成工程は、検体を所定の厚さに切り出す工程(パラフィンブロック作成処理)を含むが、このときに決定される標本の厚さによっても、染色状態が濃すぎる事態が生じ得る。
【0015】
本発明は、上記に鑑みてなされたものであって、色素量推定に適した染色状態で標本を作成することができる標本作成装置および標本作成方法を提供することを目的とする。
【課題を解決するための手段】
【0016】
上記した課題を解決し、目的を達成するための、本発明のある態様にかかる標本作成装置は、生体から採取した検体を所定の染色色素で染色して標本を作成する標本作成装置であって、少なくとも作成対象の標本を染色する染色色素を特定可能な値を含む標本作成パラメータの値を取得する標本作成パラメータ取得部と、前記標本作成パラメータ取得部によって取得された標本作成パラメータの値をもとに、前記作成対象の標本を染色する染色色素の最適な色素量を決定する色素量決定部と、前記色素量決定部によって決定された色素量をもとに、前記作成対象の標本を作成する際に用いる制御パラメータの値を調整する制御パラメータ調整部と、前記制御パラメータ調整部によって調整された制御パラメータの値を用いて前記作成対象の標本を作成する標本作成部と、を備えることを特徴とする。
【0017】
この態様にかかる標本作成装置によれば、作成対象の標本を染色する染色色素を特定可能な標本作成パラメータの値をもとに作成対象の標本を染色する染色色素の最適な色素量を決定することができる。そして、決定された色素量をもとに作成対象の標本を作成する際に用いる制御パラメータの値を調整し、調整した制御パラメータの値に従って作成対象の標本を作成することができる。したがって、色素量推定に適した染色状態で標本を作成することができる。
【0018】
また、本発明の別の態様にかかる標本作成方法は、生体から採取した検体を所定の染色色素で染色して標本を作成する標本作成方法であって、少なくとも作成対象の標本を染色する染色色素を特定可能な値を含む標本作成パラメータの値を取得する標本作成パラメータ取得工程と、前記標本作成パラメータ取得工程で取得された標本作成パラメータの値をもとに、前記作成対象の標本を染色する染色色素の最適な色素量を決定する色素量決定工程と、前記色素量決定工程で決定された色素量をもとに、前記作成対象の標本を作成する際に用いる制御パラメータの値を調整する制御パラメータ調整工程と、前記制御パラメータ調整工程で調整された制御パラメータの値を用いて前記作成対象の標本を作成する標本作成工程と、を含むことを特徴とする。
【発明の効果】
【0019】
本発明によれば、色素量推定に適した染色状態で標本を作成することができる。
【発明を実施するための最良の形態】
【0020】
以下、図面を参照し、本発明の好適な実施の形態について詳細に説明する。なお、この実施の形態によって本発明が限定されるものではない。また、図面の記載において、同一部分には同一の符号を付して示している。
【0021】
(実施の形態1)
実施の形態1では、臓器摘出や針生検によって被検者の生体から採取した検体に一般染色として知られるH&E染色を施して標本を作成する場合を例にとって説明する。
【0022】
図1は、標本を作成し、観察・診断する手順の概要を説明する説明図である。先ず、被検者から採取した検体から標本を作成する(以下、作成対象の標本を「対象標本」と呼ぶ。)が、この対象標本の作成に先立ち、臨床医は、図1(a)に示すように、対象標本を作成するために必要なデータ入力を行う。臨床医がデータ入力を行うと、入力データに応じて対象標本を作成する際に用いる制御パラメータ(詳細には、後述する調整対象制御パラメータ)の値が調整され、調整された調整対象制御パラメータの値に従って、標本作成処理が自動化された装置で自動的に、あるいは臨床検査技師の作業を介して半自動的に対象標本が作成される(図1(b))。臨床検査技師は、顕微鏡を用いて作成された対象標本を観察し、その染色状態を確認する(図1(c))。
【0023】
ここで、対象標本の観察は、目視観察で行われる場合もあるが、表示装置に画面表示することによっても行なわれている。このため、このときに対象標本が撮像され、観察画像が生成されるようになっている。すなわち、標本各点の分光透過率を算出(推定)する処理や染色色素の色素量を推定する処理、推定した色素量をもとに画像の色を補正する処理等が行われ、カメラの特性や染色状態のばらつき等が補正されて表示用のRGB画像(観察画像)が合成される。臨床医は、以上のようにして得られた対象標本の観察画像を観察し、診断を行う(図1(d))。
【0024】
ここで、標本を撮像して観察画像を生成する各処理の原理について説明する。図2は、観察画像を生成する各処理の概略手順を説明する説明図である。なお、ここで説明する各処理は、公知技術を用いて実現でき、実施の形態1では、図1に示した標本の作成および観察・診断手順を実現するために適宜用いる。
【0025】
図2に示すように、観察画像を生成する際には先ず、標本を撮像する(ステップa1)。続いて、得られた画像をもとに、各画素位置(x)に対応する標本上の各点における分光透過率t^(x,λ)を算出(推定)する(ステップa3)。なお、t^は、tの上に推定値を表す記号「^(ハット)」が付いていることを示す。分光透過率t^(x,λ)の推定手法については、例えば特許文献3に開示されている技術を用いることができる。なお、分光透過率t^(x,λ)は、標本の各点における分光透過率を分光イメージング装置によって測定する構成としてもよい。
【0026】
続いて、各画素位置について算出した分光透過率を吸光度に変換し(ステップa5)、変換した吸光度をもとに標本上の各点における色素量を推定して(ステップa7)、標本の各点における色素量を取得する。
【0027】
一般に、光を透過する物質では、波長λ毎の入射光の強度I0(λ)と射出光の強度I(λ)との間に、次式(1)で表されるランベルト・ベール(Lambert-Beer)の法則が成り立つことが知られている。
【数1】

【0028】
k(λ)は波長に依存して決まる物質固有の値、dは物質の厚さをそれぞれ表す。本来色素は、標本中に分散して存在するため、厚さという概念は正確ではないが、標本が単一の色素で染色されていると仮定した場合と比較して、どの程度の量の色素が存在しているかを表す相対的な色素の量(色素量)の指標となる。以下、このランベルト・ベールの法則における物質の厚さdを、標本を構成する色素(例えば標本を染色している染色液の色素(染色色素)等)の量(色素量)として扱う。なお、色素量dに物質固有の値k(λ)を乗じた値は、一般的にその色素の吸光度または吸収強度と呼ばれる。
【0029】
標本を染色している色素が複数種類の場合、各色素に1,2,・・・nの通し番号を割り振れば、上記のランベルト・ベールの法則から、各波長λにおいて次式(2)が成立する。
【数2】

【0030】
実施の形態1では、H&E染色された標本を観察・診断対象としているため、染色色素であるヘマトキシリンおよびエオジンをそれぞれ色素H,色素Eと略記すれば、各波長λにおいて次式(3)が成立する。
【数3】

【0031】
より詳細には、これら染色色素以外の吸収成分として、標本が載置されるスライドガラスの吸収成分(Gと略記)を含むため、分光透過率t^(x)は、次式(4)によって得られる。kH(λ),kE(λ),kG(λ)は、それぞれ色素H、色素Eおよびこれらの染色色素以外の吸収成分Gに対応するk(λ)を表し、各k(λ)の値が、対応する色素(吸収成分)の分光特性に相当する。
【数4】

【0032】
なお、各k(λ)は、標本(検体)を採取した臓器や部位、標本内の組織によって異なる場合がある。このため、これらの違いに応じてk(λ)1、k(λ)2・・・のように複数のk(λ)を色素毎に用意しておき、該当するk(λ)を用いることとしてもよい。より具体的には、臓器や部位、組織毎に各色素に対応するk(λ)を用意しておき、対象標本を採取した臓器や部位、組織に応じたk(λ)を適宜選択して用いることとしてもよい。また、適用する染色法で用いる染色液によっては、その色素の分光特性が組織内の物質によって変化する場合がある。このような場合には、その色素の分光特性として、予め定められた該当する色素の分光特性k(λ)に変化分を考慮した分光特性k´(λ)を適用するようにしてもよい。
【0033】
また、色素Hおよび色素Eの染色色素以外の吸収成分としてスライドガラスの吸収成分Gについて説明したが、この他にも、標本内には、無染色時において吸収成分を持つ例えば赤血球等の組織が存在し得る。すなわち、赤血球は、染色を施さない状態であってもそれ自身特有の色を有しており、H&E染色後は、赤血球自身の色として観察される。あるいは、染色過程において変化したエオジンの色が赤血球自身の色に重畳して観察される。この赤血球の吸収成分を考慮し、上記した式(4)において、予め定められた赤血球の吸収成分についての分光特性k(λ)にその色素量を乗じた値をさらに加算し、分光透過率t^(x)を算出することとしてもよい。このようにすれば、赤血球領域の画素信号値を精度良く表示することができる。
【0034】
ここで、各画素位置(x)について求めた分光透過率をt^(x,λ)とし、分光吸光度をa^(x,λ)とすると、これらの間には、次式(5)の関係が成り立つ。なお、a^は、aの上に記号「^」が付いていることを示す。上記した式(5)によって、各画素位置(x)の吸光度を得る。
【数5】

【0035】
式(5)に式(4)を代入すると、次式(6)が得られる。
【数6】

【0036】
式(6)において未知変数を色素Hの色素量dHと色素Eの色素量dEとし、少なくとも2つの異なる波長λについて式(6)を連立させれば、これらを解くことができる。より精度を高めるために、3つ以上の異なる波長λに対して式(6)を連立させ、重回帰分析を行ってもよい。例えば、3つの波長λ1,λ2,λ3について式(6)を連立させた場合、次式(7)のように行列表記できる。
【数7】

【0037】
ここで、式(7)を次式(8)に置き換える。
【数8】

【0038】
波長方向のサンプル点数をDとすれば、A^(x)は、a^(x,λ)に対応するD行1列の行列であり、Kは、k(λ)に対応するD行3列の行列、d(x)は、画素位置(x)におけるdH,dEに対応する2行1列の行列、εは誤差に対応するD行1列の行列である。なお、A^は、Aの上に記号「^」が付いていることを示す。
【0039】
例えば、式(8)に従い、例えば最小二乗法を用いて各染色色素の色素量dH,dEを算出する。最小二乗法とは単回帰式において誤差の二乗和を最小にするようにd(x)を決定する方法であり、次式(9)で算出できる。
【数9】

【0040】
以上のようにして、色素量dH,dEを推定したならば、これらの値を調整する。具体的には先ず、色素量dH,dEそれぞれについて調整係数αH,αEを設定し、ステップa7で推定した色素量に設定した調整係数αH,αEを乗じることで色素量を調整する(ステップa9)。調整後の色素量dH*,dE*の算出式は、次式(10),(11)で表される。
【数10】

【0041】
そして、このようにして調整した色素量dH*,dE*を式(6)に代入して新たに吸光度を算出し(ステップa11)、算出した吸光度を上記した式(4)に従って分光透過率に変換する(ステップa13)。これにより、調整後の色素量dH*,dE*から各画素位置の分光透過率が得られる。続いて、各画素位置について算出した分光透過率をもとに各画素位置の画素信号値g(b)を算出し、RGB画像(観察画像)を生成する(ステップa15)。
【0042】
画像のバンドbにおける画素信号値g(b)と、対応する標本の分光透過率t(λ)との間には、カメラの応答モデル関数に基づく次式(12)の関係が成り立つ。λは波長、s(λ,b)はバンドbのカメラの分光感度特性、e(λ)は照明の分光放射特性をそれぞれ表す。bはバンドを識別する通し番号であり、通常RGBカメラの場合b=3となる。ただし、バンド数は適宜選択することができる。また、分光特性の異なるフィルタを用い、標本をマルチバンド撮像することとしてもよい。
【数11】

【0043】
実際の撮影で得られる画素信号値g(b)は、式(12)に観測ノイズを加えた次式(13)によって得られる。n(b)はバンドbにおける観測ノイズを表す。ここで、観測ノイズn(b)は、式(12)によって得られる画素信号値g(b)と、画素信号値g(b)とノイズとの相関関数と、によって得られる値の範囲でランダムに検出される。
【数12】

【0044】
ステップa15では、上記した式(12)または式(13)に従って各画素位置の画素信号値g(b)を算出し、標本の観察画像として、調整係数αH,αEに従って画像の色を補正した(対象標本の色素量を仮想的に変化させた)RGB画像を得る。なお、調整係数調整係数αH,αEを用いた色素量dH,dEの調整は適宜行うこととしてよい。すなわち、ステップa3の処理の後、得られた分光透過率をもとにステップa15の処理を行えば、画像の色を補正せずに(色素量を調整せずに)RGB画像を生成できる。
【0045】
次に、実施の形態1の標本作成装置の構成について説明する。図3は、実施の形態1の標本作成装置2を含む標本作成システム1の全体構成を説明する模式図である。図3に示すように、実施の形態1の標本作成システム1は、標本作成装置2と、観察装置6とで構成される。ここで、標本作成装置2は、制御装置3と、標本作成部5とを備え、これらの間がデータの授受可能に接続されて構成される。また、観察装置6は、標本作成装置2によって作成された標本を観察するためのものであり、例えば、対象標本の透過観察が可能な顕微鏡や、この顕微鏡による標本の観察像を撮像するカメラ等で構成される。
【0046】
図4は、標本作成装置2の機能構成を示すブロック図である。ここで、標本作成部5は、一連の標本作成処理を全自動化した装置、あるいは標本作成処理を部分毎に自動化した装置や部分毎の標本作成処理を臨床検査技師の作業を介して半自動的に行う装置を組み合わせて構成され、所定の制御パラメータの値に従って検体を処理し、標本を作成する。例えば、実施の形態1の標本作成部5は、パラフィンブロック作成処理を行うパラフィンブロック作成処理部51と、薄切処理を行う薄切処理部52と、脱パラフィン処理を行う脱パラフィン処理部53と、染色処理を行う染色処理部54と、封入処理を行う封入処理部55とを備える。ここで、標本作成部5の具体的な装置構成は医療施設毎に異なり、採用する装置によっては、各装置が分担する処理も異なる。また、この装置構成は、標本に施す染色法によっても異なる。そして、標本作成処理のプロトコールやこのプロトコールで用いる制御パラメータについても、採用する装置の製造メーカによって異なり、医療施設側の設定によって異なる場合もある。標本作成部5の構成は、例示した構成に限定されるものではなく、標本作成処理で用いる制御パラメータも適宜設定できる。
【0047】
制御装置3は、標本作成部5に対して標本を作成するための動作指示を行うものであり、ワークステーションやパソコン等の汎用コンピュータで実現される。この制御装置3は、対象標本を作成するために必要なデータとしてユーザ(例えば臨床医)が入力した標本特定パラメータおよび標本作成パラメータの各値を取得し、取得した標本特定パラメータおよび標本作成パラメータの値に応じた最適化色素量を決定する。そして、算出した最適化色素量に従って調整対象制御パラメータの値を調整し、標本作成部5に対する動作指示を行う。
【0048】
この制御装置3は、操作部31と、表示部32と、記憶部33と、制御部35と、画像処理部37とを備える。
【0049】
操作部31は、例えば、キーボードやマウス、タッチパネル、各種スイッチ等の各種入力装置によって実現されるものであり、操作入力に応じた入力信号を制御部35に出力する。表示部32は、LCDやELディスプレイ、CRTディスプレイ等の表示装置によって実現されるものであり、制御部35から入力される表示信号をもとに各種画面を表示する。
【0050】
記憶部33は、更新記憶可能なフラッシュメモリ等のROMやRAMといった各種ICメモリ、内蔵あるいはデータ通信端子で接続されたハードディスク、CD−ROM等の情報記憶媒体およびその読取装置等によって実現されるものである。この記憶部33には、制御装置3を動作させ、この制御装置3が備える種々の機能を実現するためのプログラムや、このプログラムの実行中に使用されるデータ等が記憶される。
【0051】
実施の形態1では、記憶部33は、標本作成処理プログラム331を記憶する。標本作成処理プログラム331は、最適化色素量を決定して調整対象制御パラメータの値を調整し、標本作成部5に対する動作指示を行う処理を実現するためのプログラムである。
【0052】
また、記憶部33は、教師データ記憶部として標準色素量データ333を記憶する。標準色素量データ333は、標準的な染色状態での各染色色素の標準色素量(以下、dH_S,dE_Sと表記する。)を記憶する。この標準色素量dH_S,dE_Sは、事前に標準的な染色状態の標準標本を用意し、この標準標本について図2に示して説明したステップa1〜ステップa7の各処理を行って推定した標本各点における各染色色素の色素量であり、各点における分光透過率や吸光度とともに教師データとして記憶される。より詳細には、実施の形態1では、標本特定パラメータの値の組み合わせによって定まる全ての種類の標本について標準標本が用意され、これら標準標本それぞれについて色素量が推定される。そして、得られた標準色素量dH_S,dE_Sが、その推定過程で得られた分光透過率や吸光度とともに、該当する標本特定パラメータの値の組み合わせと対応付けられて標準色素量データ333に記憶される。なお、標準色素量データ333は、記憶部33に記憶される構成に限定されるものではなく、例えばネットワークを介して制御装置3と接続されるデータベース装置で実現し、制御装置3とは離れた別の場所に設置されて標準色素量dH_S,dE_Sのデータを記憶・管理する構成としてもよい。
【0053】
また、記憶部33は、色素別基準分光特性値335を記憶する。色素別基準分光特性値335は、標本を染色している各色素の分光特性値(k(λ))を記憶する。実施の形態1では、上記した式(4)等で用いる色素H、色素Eおよびこれらの染色色素以外の吸収成分Gにそれぞれ対応するkH(λ),kE(λ),kG(λ)の各値を記憶する。
【0054】
制御部35は、CPU等のハードウェアによって実現される。この制御部35は、操作部31から入力される入力信号、あるいは記憶部33に記憶されるプログラムやデータ等をもとに標本作成装置2を構成する各部への指示やデータの転送等を行い、標本作成装置2全体の動作を統括的に制御する。この制御部35は、標本特定パラメータ取得部351と、標本作成パラメータ取得部352と、標本作成処理設定部353とを含む。
【0055】
標本特定パラメータ取得部351は、対象標本についての標本特定パラメータの値の入力を依頼し、操作部31を介してユーザによる標本特定パラメータの値の入力を受け付ける。ここで、標本特定パラメータは、標本の種類を示す値であり、例えば検体を採取した臓器や部位、被験者の疾患名等が挙げられる。なお、標本特定パラメータ取得部351が取得する標本特定パラメータはこれに限定されるものではなく、標本に関する情報を適宜用いることができる。例えば、標本における組織の状態を標本特定パラメータとして用いてもよい。具体例としては、例えば、細胞核の個数や密度、形状等が挙げられる。これは、臨床医が対象標本内の例えば細胞核等の組織の個数や密度、形状等を観察することによって診断を行う場合を想定しており、これらの値を標本特定パラメータとして取得してもよい。
【0056】
標本作成パラメータ取得部352は、対象標本を作成する際に用いる標本作成パラメータの値の入力を依頼し、操作部31を介してユーザによる標本作成パラメータの値の入力を受け付ける。ここで、標本作成パラメータは、標本作成部5の各部が動作するために事前に決定しておくべき所定のパラメータであり、対象標本に施す染色法を含む。また、この他、パラフィンブロック作成処理部51、薄切処理部52、脱パラフィン処理部53、染色処理部54および封入処理部55が行う各処理で用いる制御パラメータを適宜含む。この標本作成パラメータ取得部352は、この標本作成パラメータの値を取得する。以下、実施の形態1では、染色処理部54が染色処理で用いる染色法および薄切処理部52が薄切処理で用いる制御パラメータの1つである標本の厚さの2つの値を標本作成パラメータとし、ユーザ操作に従って各標本作成パラメータの値を取得することとする。なお、染色法については、実施の形態1では、その値として“H&E染色”を取得した場合を想定している。ここで、染色法は、標本を染色する染色色素を特定可能な標本作成パラメータの値に相当する。すなわち、実施の形態1では、取得される染色法“H&E染色”をもとに染色色素が色素H,色素Eとして特定される。また、標本の厚さ以外の標本作成部5の各部が用いる制御パラメータについては、その値を例えば固定値とし、予め設定しておく。
【0057】
標本作成処理設定部353は、標本作成パラメータ取得部352によって取得され、または画像処理部37の制御パラメータ調整部39によって調整された制御パラメータの値を標本作成部5に通知して各部に対する動作指示を行う。これに応答し、標本作成部5は、標本作成パラメータ取得部352によって取得された制御パラメータや制御パラメータ調整部39によって調整された制御パラメータの値を用いて標本作成処理を行う。この結果、その色素量が最適化色素量となるような染色状態の対象標本が得られる。なお、実施の形態1では、標本作成パラメータ取得部352によって、染色法として“H&E染色”が取得されるとともに、標本の厚さが取得される。また、制御パラメータ調整部39によって反応時間が調整される。このため、実施の形態1では、標本作成処理設定部353は、標本作成パラメータ取得部352によって取得された標本の厚さを薄切処理部52に通知し、制御パラメータ調整部39によって調整された反応時間を染色処理部54に通知する。
【0058】
画像処理部37は、CPU等のハードウェアによって実現される。この画像処理部37は、色素量決定部としての色素量最適化処理部38と、制御パラメータ調整部39とを含む。
【0059】
色素量最適化処理部38は、色素量最適化処理を行って最適化色素量を決定する。上記したように、対象標本の観察を表示装置に画面表示することによって行う場合、標本各点の分光透過率を算出して対象標本に固定された染色色素の色素量を推定している。そして、推定した色素量を調整して画像の色を補正することによって、カメラの特性や染色状態のばらつき等が補正された観察画像(RGB画像)を合成している。ここで、色素量の推定を適切に行えば、濃く染色された標本や薄く染色された標本を、適切に染色された標本と同等の色を有する画像に補正することができる。したがって、対象標本に固定された色素量を高精度に推定することが、染色ばらつきの補正等の高精度化につながる。色素量最適化処理部38は、この色素量の推定に適した染色状態の対象標本を得るための色素量(詳細には、色素Hおよび色素Eの各染色色素それぞれの色素量)を最適化色素量として決定する。
【0060】
具体的には、色素量最適化処理部38は、公知の遺伝的アルゴリズム(GA)を用いて色素Hおよび色素Eの各染色色素の最適化色素量を決定する。遺伝的アルゴリズムは、ある世代を形成している個体の集合を基本単位とした進化型の計算を行うアルゴリズムであり、処理の概要を説明すると、先ず初期集団を生成し、初期集団の中から個体を選択する。そして、選択した個体に対して交叉や突然変異を行って次世代集団を形成する。その後、次世代集団について処理を繰り返し、最終的に適応度の高い個体を選ぶことで色素量の推定に適した最適化色素量を決定するものである。
【0061】
実施の形態1では、色素量最適化処理部38は、標準色素量データ333として記憶部33に記憶されている標準色素量dH_S,dE_Sにそれぞれ乗じる調整係数の値を組み合わせた解候補を個体として用いる。各個体は、この解候補を数値列で示した遺伝子によって特徴付けられる。図5は、ある個体の遺伝子を示す図である。図5に示すように、各個体を特徴付ける遺伝子は、染色色素毎の調整係数を表した例えば8ビットのビット列を順番に羅列したものである。実施の形態1では、染色色素は色素Hおよび色素Eの2種類であるので、各個体の遺伝子は、16ビットのビット列となる。
【0062】
この色素量最適化処理部38は、初期集団生成部381と、選択部382と、交叉部383と、パターン生成部384と、適応度評価部385と、突然変異部386とを備る。ここで、初期集団生成部381、選択部382、交叉部383および突然変異部386は、候補値生成部として最適化色素量の候補値を生成する。また、適応度評価部385は、評価部として候補値を評価する。具体的には、初期集団生成部381は、初期集団を生成する。選択部382は、選択処理を行う。交叉部383は、交叉処理を行う。パターン生成部384は、色素量パターンを生成する。適応度評価部385は、適応度を算出する。突然変異部386は、突然変異処理を行う。
【0063】
制御パラメータ調整部39は、色素量最適化処理部38によって算出された最適化色素量に従って調整対象制御パラメータの値を調整する。調整対象制御パラメータは、標本作成部5の各部が行う各処理で用いる少なくとも1つの制御パラメータを含む。なお、調整対象制御パラメータが、標本作成パラメータ取得部352による取得対象となっている場合であれば、取得した制御パラメータの値を、最適化色素量を反映させて調整した値で置き換える。
【0064】
ところで、最適化色素量を複数の制御パラメータに反映させるようにしてもよいが、このようにすると計算式が複雑化し、算出時間が増大する。また、各値の算出時に生じる算出値と色素量との関係に含まれる誤差が増幅されるため、得られた標本の染色状態が最適化色素量が表す染色状態と異なるといった問題が生じ得る。ここで、染色状態に大きく影響し、且つ簡便に設定(算出)可能な制御パラメータとして、染色処理部54が用いる染色に要する時間(反応時間)および染色液の濃度が挙げられる。これに鑑み、実施の形態1では、制御パラメータ調整部39は、反応時間を調整対象制御パラメータとする。そして、反応時間に最適化色素量を反映させてその値を調整する。なお、染色液の濃度を調整対象制御パラメータとし、最適化色素量を反映させる構成としてもよい。また、調整対象とする制御パラメータはこれに限定されるものではなく、標本の診断方法に応じて適宜選択できる。また、複数の制御パラメータを適宜組み合わせて調整対象としてもよい。ここで、反応時間は、ヘマトキシリン染色液による反応時間およびエオジン染色液による反応時間を含み、各反応時間は、対応する染色液に標本を浸す時間に相当する。また、染色液の生成条件は、例えば染色液(染色試薬)の濃度であり、実施の形態1では、ヘマトキシリン染色液の濃度およびエオジン染色液の濃度がこれに該当する。
【0065】
図6は、実施の形態1の制御装置3が行う処理手順を示すフローチャートである。なお、ここで説明する処理は、記憶部33に記憶された標本作成処理プログラム331に従って制御装置3の各部が動作することによって実現される。
【0066】
先ず、標本特定パラメータ取得部351が、ユーザ操作に従って標本特定パラメータの値を取得する(ステップb1)。例えば、標本特定パラメータ取得部351は、標本特定パラメータ入力画面を表示部32に表示して標本特定パラメータの入力依頼を通知する処理を行い、この標本特定パラメータ入力画面において標本特定パラメータの入力を受け付ける。
【0067】
図7および図8は、標本特定パラメータ入力画面の一例を示す図である。この標本特定パラメータ入力画面には、図7に示すように、臓器や部位、疾患名等の標本特定パラメータの値を入力するためのスピンボックスB11〜B13、これら各スピンボックスに対するユーザ操作を確定するOKボタンBTN11、操作をキャンセルするキャンセルボタンBTN12等が配置されている。
【0068】
各スピンボックスB11〜B13は、該当する標本特性パラメータとして設定可能な値の一覧を選択肢として提示し、選択操作を受け付けるものである。例えば、臓器を入力するためのスピンボックスB11では、図8に示すように、肝臓や腎臓、前立腺、肺等の検体が採取され得る臓器の一覧を選択肢として提示したドロップダウンリストL11が表示されるようになっており、ユーザは、このドロップダウンリストL11から対象標本について該当する臓器を選択する。なお、標本特性パラメータの取得方法は特に限定されるものではなく、例えば各標本特性パラメータの値を直接入力する構成としてもよい。また、図7や図8では各標本特定パラメータの値を個別に入力する場合を例示したが、標本特定パラメータの値の組み合わせを選択肢として提示し、この選択肢の選択によって各標本特定パラメータの値を同時に取得する構成としてもよい。
【0069】
続いて、標本作成パラメータ取得部352が、ユーザ操作に従って標本作成パラメータの値を取得する(ステップb3)。例えば、標本作成パラメータ取得部352は、標本作成パラメータ入力画面を表示部32に表示して標本作成パラメータの入力依頼を通知する処理を行い、この標本作成パラメータ入力画面において標本作成パラメータの入力を受け付ける。
【0070】
図9は、標本作成パラメータ入力画面の一例を示す図である。図9に示す標本作成パラメータ入力画面には、実施の形態1で取得対象としている染色法および標本の厚さの各制御パラメータの値を入力するためのスピンボックスB21,B22や、これら各スピンボックスに対するユーザ操作を確定するOKボタンBTN21、操作をキャンセルするキャンセルボタンBTN22等が配置されている。各スピンボックスB21,B22は、該当する制御パラメータの値として設定可能な値の一覧を選択肢として提示し、選択操作を受け付けるものであり、例えば、図8に示した標本特定パラメータの場合と同様に、ドロップダウンリストを表示して選択肢を提示する。なお、制御パラメータの取得方法は例示した手法に限定されるものではなく、例えば標本作成パラメータの値を直接入力する構成としてもよい。また、実施の形態1では標本作成パラメータを2種類(染色法および標本の厚さ)に固定しているが、ユーザによって選択可能に構成してもよい。すなわち、標本作成部5の各部が用いる制御パラメータの中から取得対象とする制御パラメータの選択操作を受け付け、ユーザが取得対象として選択した制御パラメータの値を取得する構成としてもよい。なお、ここで取得した染色法(実施の形態1ではH&E染色)によって、対象標本を染色する染色色素が色素Hおよび色素Eとして特定される。
【0071】
続いて、色素量最適化処理部38が色素量最適化処理を行い、最適化色素量を算出する(ステップb5)。図10は、色素量最適化処理の詳細な処理手順を示すフローチャートである。
【0072】
色素量最適化処理では、図10に示すように、先ず初期集団生成部381が、初期集団を生成する(ステップc1)。例えば、“0”または“1”をランダムに発生させて16ビット分のビット列を生成し、その個体の遺伝子として生成する。これを予め設定されている個体数繰り返し行い、初期集団を得る。集団を構成する個体の数は、任意に設定できる。また、ビット列は乱数によって生成する場合に限定されるものではない。例えば、予め所定の中心初期値およびこの中心初期値の周辺の値を生成する確率変数の分散を定義しておき、この確率変数に従ってビット列を生成するようにしてもよい。このようにすれば、解が中心初期値付近に存在する場合に後述する処理回数(繰り返し数)を低減でき、最適化色素量の算出処理の高速化が図れる。
【0073】
そして、初期集団を対象としたステップc3以降の処理に移る。すなわち、ステップc3では、選択部382が選択処理を行い、対象の集団から個体を2つ選択する。この選択は、例えば乱数を発生させてランダムに行う。なお、ここでは、2つの個体を選択することとした。これに対し、予め交叉確率を設定しておき、この交叉確率に従って交叉させる個体を選択することとしてもよい。
【0074】
そして、交叉部383が、選択された2つの個体を親として交叉処理を行い、これら2つの親の遺伝子を受け継ぐ新たな個体を2つ生成する(ステップc5)。この交叉処理で用いる交叉方法は、一点交叉や二点交叉、一様交叉等、適宜選択できる。例えば、一点交叉を用いる場合には、交叉点を1つランダムに決定し、各親の決定した交叉点より後の遺伝子をそれぞれ入れ替えることによって、新たな2つの個体を得る。また二点交叉を用いる場合には、交叉点を2つランダムに決定する。そして、各親の決定した2点の交叉点で挟まれる遺伝子をそれぞれ入れ替えることによって、新たな2つの個体を得る。ここでの交叉処理によって、対象の集団の個体のうち、ステップc3で選択した親の個体が生成された新たな個体で置き換えられる。
【0075】
続いて、パターン生成部384が、交叉処理後の集団を構成する各個体をもとに、色素量パターンを生成する(ステップc7)。具体的には、各個体を特徴付けている遺伝子である16ビットを前後8ビットずつに分割し、前8ビットを色素Hについての調整係数αHとし、後8ビットを色素Eについての調整係数αEとする。また、図6のステップb1で取得した標本特定パラメータおよびステップb3で取得した標本作成パラメータをもとに、標準色素量データ333から対象標本に応じた標準色素量標準色素量dH_S,dE_Sを読み出す。そして、図2のステップa9の処理手順に従い、上記した式(10),(11)を用いて読み出した標準色素量dH_S,dE_Sを調整し、調整後の色素量dH*,dE*を得る。この処理を各個体について行い、得られた色素量dH*,dE*を個体毎の色素量パターンとする。
【0076】
続いて、適応度評価部385が、適応度評価処理を行う(ステップc9)。図11は、適応度評価処理の詳細な処理手順を示すフローチャートである。図11に示すように、適応度評価処理では、図10のステップc7で生成した色素量パターンを順次処理対象パターンとし、各色素量パターンについてループAの処理を行う(ステップd1〜ステップd15)。
【0077】
先ず、適応度評価部385は、処理対象パターンの各染色色素の色素量をもとにステップd3〜ステップd11の各処理を行う。すなわち、適応度評価部385は、先ず、処理対象パターンの色素量をもとに吸光度を算出する(ステップd3)。具体的には、図2のステップa11の処理手順に従い、上記した式(6)を用いて吸光度を算出する。続いて、適応度評価部385は、算出した吸光度を分光透過率に変換する(ステップd5)。具体的には、図2のステップa13の処理手順に従い、上記した式(4)を用いて吸光度を分光透過率に変換する。そして、適応度評価部385は、図2のステップa15の処理手順に従い、先ず、上記した式(12)を用いて画素信号値を算出する(ステップd7)。続いて、適応度評価部385は、上記した式(13)を用いて所定量のノイズ(式(13)の観測ノイズn(b))を付加した画素信号値を算出する(ステップd8)。
【0078】
例えば、画素信号値と付加するノイズ量との関係(相関式)を定義したルックアップテーブル(以下、「LUT」と略記する。)を事前に生成して記憶部33に記憶しておき、このLUTを参照して画素信号値に付加するノイズ量を決定する。図12は、画素信号値とノイズ量との対応関係の一例を模式的に示した図であり、横軸を画素信号値、縦軸をノイズ量として画素信号値毎に定義されるノイズ量を示している。ここで、前述のように、ノイズ量(観測ノイズn(b))は、式(12)によって得られる画素信号値g(b)と、画素信号値g(b)とノイズとの相関関数と、によって得られる値の範囲でランダムに検出される。そこで本例では、このノイズ量(観測ノイズn(b)の値)の範囲を図12中に破線で示す画素信号値毎の分散によって定義したLUTを作成しておく。
【0079】
そして、適応度評価部385は、このLUTを参照し、今回画素信号値に付加するノイズ量を決定する。例えば、適応度評価部385は、LUTを参照してステップd8で算出した画素信号値に対応するノイズ量の誤差範囲を取得し、取得した誤差範囲に含まれる値をランダムに選出してノイズ量を決定する。
【0080】
なお、画像信号値に対するノイズ量(観測ノイズn(b))の比率から、処理対象パターンが表す各染色色素の色素量で染色された標本におけるS/N比を得ることができる。S/N値が小さいほど、画素信号値のノイズ比率が高くなる。したがって、後述するステップd9で算出(推定)される分光透過率の推定精度が低下し、結果的にステップd11で推定される色素量の推定精度が低下する。実施の形態1では、処理対象パターンの色素量と後述するステップd11で推定する色素量との差分を適応度として用い、この適応度の値を評価することとしているが、S/N値を適応度として用い、その値を評価する構成も可能である。
【0081】
その後、適応度評価部385は、図2のステップa3の処理手順に従い、ステップd8でノイズの付加された画素信号値をもとに分光透過率t^(x,λ)を再度算出(推定)する(ステップd9)。続いて、適応度評価部385は、ステップd5で変換した分光透過率から再度吸光度を算出する(ステップd10)。具体的には、図2のステップa5の処理手順に従い、上記した式(6)を用いて吸光度を算出する。続いて、適応度評価部385は、ステップd10で算出した吸光度をもとに各染色色素の色素量を推定する(ステップd11)。具体的には、図2のステップa7の処理手順に従い、上記した式(7),(9)を用いて各染色色素の色素量を推定する。
【0082】
そして、適応度評価部385は、処理対象パターンの適応度を算出する(ステップd13)。例えば、ステップd11で推定された各染色色素の色素量をもとに、処理対象パターンの色素量との差分(すなわち色素量の推定誤差)を染色色素毎に算出し、適応度とする。
【0083】
全ての色素量パターンについてループAの処理を行ったならば、適応度評価部385は、ステップd13で色素量パターン毎に算出した適応度の合計値を評価値として算出する(ステップd17)。その後図10のステップc9にリターンし、ステップc11に移行する。
【0084】
そして、ステップc11では、適応度評価部385は、ステップc9の適応度評価処理で得られた評価値を予め設定される所定の閾値を用いて閾値処理し、閾値を超えており閾値条件を満足しない場合には(ステップc11:No)、ステップc13に移行する。そして、ステップc13では、ステップc3〜ステップc11の一連の処理を行った処理回数(繰り返し数)を判定し、処理回数が予め設定されている所定の回数を超えない間は(ステップc13:No)、ステップc15に移行する。
【0085】
ステップc15では、突然変異部386が、突然変異処理を行う。具体的には、例えば予め設定される所定の確率(突然変異率)で乱数を発生させて交叉処理後の集団を構成する各個体の中から突然変異を起こさせる個体を選び、その遺伝子の数値列を変更する。例えば、選んだ個体の遺伝子のビット列から突然変異を起こさせる一部分(1ビットでもよいし複数ビットでもよい)を例えば乱数を発生させて選択し、選択した一部分のビットを反転させる。ここで、突然変異率は固定としてもよいし、図11のステップd17で算出した評価値に応じて動的に設定してもよい。例えば、評価値が低ければ(値が大きければ)、突然変異率を高く設定する。一方、評価値が高い場合には(値が小さい場合には)、突然変異率を低く設定する。これによれば、評価値が低い段階では早期に最適解に近付き易くすることができ、また、局所解に陥る事態を防止することができる。そして、最適解に近付いて評価値が高くなった段階では、突然変異によって評価値が急激に低下する事態を防止できる。
【0086】
そして、ステップc15の突然変異処理後の集団を次世代集団とし、ステップc3に戻ってこの次世代集団について処理を繰り返す。
【0087】
一方、評価値が閾値以下の場合(ステップc11:Yes)、あるいは処理回数が所定の回数を超えた場合には(ステップc13:Yes)、適応度評価部385は、例えば適応度が最も高い(適応度の値が最も小さい)色素量パターンの各染色色素の色素量を最適化色素量として決定する(ステップc17)。なお、処理回数が所定の回数を超えた場合に色素量推定処理を終了させているのは、ステップc3〜ステップc11の一連の処理を繰り返しても適応度が所定の閾値以下とならず、処理が完了しなくなることを避けるためである。その後、図6のステップb5にリターンし、ステップb7に移行する。
【0088】
そして、ステップb7では、制御パラメータ調整部39が、ステップb5で得られた最適化色素量を調整対象制御パラメータ(実施の形態1では反応時間)の値に反映させ、その値を調整する。
【0089】
例えば、反応時間と色素量との関係(相関式)を定義したLUTを事前に生成して記憶部33に記憶しておき、このLUTを参照して調整対象制御パラメータの値を調整する。ここで、LUTの生成方法について説明する。実施の形態1では、反応時間を変えて実際に作成した標本を用意して色素量を求め、反応時間と色素量との対応関係を予め設定しておく。ここで、同じ反応時間で標本を作成した場合であっても、色素量に多少のバラつきが生じる。この誤差を軽減するため、同じ反応時間で作成した複数の標本を用意する。そして、図2に示した処理手順に従い、得られた各標本の色素量を推定して反応時間毎の測定値(推定)を得る。
【0090】
図13は、反応時間毎の色素量の測定値をもとに反応時間と色素量との対応関係の一例を模式的に示した図であり、横軸を反応時間、縦軸を色素量とし、反応時間を異ならせて作成した標本の色素量を示している。前述のように、本例では、同じ反応時間で作成した複数の標本を用意しているため反応時間毎に複数の測定値が得られ、各値は、例えば図13中で破線で示すような範囲で値が分散する。この破線によって示した反応時間毎の分散は、対応する反応時間と色素量との関係に含まれる誤差とする。
【0091】
実施の形態1では、例えば、図13中に実線で示すように、反応時間毎に測定値の平均値を算出し、各反応時間に対応する色素量をその反応時間に対する1点として得る。そして、図13中に実線で示すプロット分布をテーブル化してLUTを作成し、記憶部33に記憶する。なお、このLUTは、反応時間と色素量との対応関係を定義したデータテーブルとして記憶しておく場合に限定されるものではない。例えば、測定点をもとに算出した近似曲線の関数式として記憶しておく構成としてもよい。
【0092】
制御パラメータ調整部39は、このようにして予め生成したLUTを参照し、色素Hおよび色素Eの染色液毎の反応時間を個別に算出する。例えば、最適化色素量のうち、色素Hの最適化色素量(色素量)をdH、色素Eの最適化色素量(色素量)dEとする。そして、dHの値をもとに、ヘマトキシリン染色液による反応時間SHを次式(14)に従って算出する。また、dEの値をもとに、エオジン染色液による反応時間SEを次式(15)に従って算出する。
【数13】

【0093】
ここで、最適化色素量の値がLUTに設定されていない数値の場合には、値が最も近いLUTの設定値を用いて線形変換を行い、反応時間を得る。以上のように、制御パラメータ調整部39は、式(14),(15)に従って、最適化色素量を反映させたヘマトキシリン染色液による反応時間SHおよびエオジン染色液による反応時間SEを得る。最適化色素量に対応する反応時間の算出は、上記式(14),(15)に従ってLUTを参照して行う方法に限定されるものではない。例えば、最適化色素量を変数とする変換関数を用い、反応時間を算出する構成としてもよい。
【0094】
そして、図6に示すように、標本作成処理設定部353は、ステップb3で取得された標本作成パラメータの値やステップb7で調整された調整対象制御パラメータの値を標本作成部5に通知し、標本作成部5の各部に対する動作指示を行う(ステップb9)。すなわち、実施の形態1では、標本作成処理設定部353は、ステップb3で取得された標本の厚さを薄切処理部52に通知するとともに、ステップb7で調整された反応時間を染色処理部54に通知する。
【0095】
なお、色素量最適化処理で最適化色素量として決定した色素量パターンについて図11のステップd7で算出した画素信号値をもとに、最適化色素量を表した画像を画面表示することとしてもよい。これによれば、対象標本を作成する前に臨床医等のユーザにその染め上がりを仮想的に提示することができる。
【0096】
図14は、図6に示すステップb9の動作指示に応答して標本作成部5が行う標本作成処理の処理手順を示すフローチャートである。この標本作成処理により、図6のステップb3で取得され、ステップb7で調整された制御パラメータの値を用いて対象標本が作成される。
【0097】
すなわち、図14に示すように、実施の形態1の標本作成処理では、先ず、パラフィンブロック作成処理部51がパラフィンブロック作成処理(ステップe1〜ステップe9)を行い、被験者から採取した検体からパラフィンブロックを作成する。
【0098】
具体的には先ず、パラフィンブロック作成処理部51は、採取した検体からブロックを切り出す(ステップe1)。ここで、切り出すブロックサイズは、その検体を採取(摘出)した臓器や部位、あるいは疾患名やその疾患の状態等によって異なる。このブロックサイズはパラフィンブロック作成処理部51が用いる制御パラメータであり、実施の形態1では固定値とする。例えば、予め臓器、部位、疾患名、疾患の状態の組み合わせと対応付けてブロックサイズを設定しておく。そして、図6のステップc3で取得された標本特定パラメータをもとに対象標本のブロックサイズを特定する。なお、このブロックサイズを標本作成パラメータ取得部352が取得する構成としてもよいし、制御パラメータ調整部39が調整する構成としてもよい。この場合には、取得または調整したブロックサイズの値に従ってステップe1の処理が行われる。
【0099】
実際のブロックサイズは、概ね1〔cm〕×2〔cm〕×数〔mm〕程度が標準的であるが、例えば脳の標本を作成する場合のように、1〔cm〕×数〔cm〕×数〔cm〕といった比較的大きなサイズで切り出すこともある。また、針生検等では検体から標本ブロックを採取する工程は不要であるため、次のステップe3の処理に移る。
【0100】
続くステップe3では、パラフィンブロック作成処理部51は、切り出した標本ブロックに対し、ホルマリン系固定液を用いて組織の固定を行う。ホルマリン系固定液の種類および固定時間は、パラフィンブロック作成処理部51が用いる制御パラメータであり、実施の形態1では固定値とする。ここで、ステップe1で切り出されたブロックサイズや固定する組織の種類、使用するホルマリン系固定液の種類によってホルマリンの浸透速度が異なるため、固定時間については、これらの値から決定される。通常、固定には1〜2日を要する。長時間漬け過ぎると過固定と呼ばれる状態になり、後段の染色処理において染色液によって染まり難くなる場合がある。なお、ホルマリン系固定液の種類および固定時間についても標本作成パラメータ取得部352が取得する構成としてもよいし、制御パラメータ調整部39が調整する構成としてもよい。この場合には、取得または調整したこれらの値に従ってステップe3の処理が行われる。
【0101】
続いて、パラフィンブロック作成処理部51は、アルコールを用いて脱脂・脱水する(ステップe5)。これは、生体組織に脂肪が含まれるためである。ここでの処理には2〜3日を要し、例えばアルコールの濃度を段階的(例えば3段階)に濃くしながら行う。使用するアルコール液、アルコール濃度、脱脂・脱水時間は、パラフィンブロック作成処理部51が用いる制御パラメータであり、実施の形態1では固定値とする。ただし、標本作成パラメータ取得部352が取得する構成としてもよいし、制御パラメータ調整部39が調整する構成としてもよい。この場合には、取得または調整したこれらの値に従ってステップe5の処理が行われる。
【0102】
続いて、パラフィンブロック作成処理部51は、溶けたパラフィンを組織内に浸透させて固める(脱水包埋:ステップe7)。ここでの処理には2日〜3日を要する。具体的には、無水アルコール、メタノール+クロロホルム、キシレン、パラフィンの各溶液に順次組織を浸していく。無水アルコールは仕上げの脱水のため、キシレンは脱アルコールのために使用する。各溶液および各溶液に対する浸透時間は、パラフィンブロック作成処理部51が用いる制御パラメータであり、実施の形態1では固定値とする。ただし、標本作成パラメータ取得部352が取得する構成としてもよいし、制御パラメータ調整部39が調整する構成としてもよい。この場合には、取得または調整したこれらの値に従ってステップe7の処理が行われる。この脱水包埋については、自動化装置が広く普及しており、適宜用いることができる。
【0103】
そして、パラフィンブロック作成処理部51は、溶けたパラフィンに沈め、更に冷して固めることでステップe1〜ステップe7の処理を施した標本ブロックをパラフィンで完全に覆う(パラフィン包埋:ステップe9)。浸透時間は、パラフィンブロック作成処理部51が用いる制御パラメータであり、実施の形態1では固定値とする。ただし、標本作成パラメータ取得部352が取得する構成としてもよいし、制御パラメータ調整部39が調整する構成としてもよい。この場合には、取得または調整した値に従ってステップe9の処理が行われる。このパラフィン包埋によって、本来柔らかい生体組織で構成される標本ブロックにパラフィンの強度を与え、薄切時において必要な程度の固さが実現できる。また、パラフィン包埋された標本ブロックは理想的な条件下で気密状態にできるため、半永久的に保存が可能になる。だたし、実際には完全な機密状態とはならないため、気密状態によっては状態変化が生じる。また、手術中に行う観察・診断を行いたい場合のように短時間で標本を作成する必要がある場合には、組織を凍結させることで形状を固定し、後段の薄切処理に移るようにしてもよい。
【0104】
続いて、薄切処理部52が、薄切処理を行う(ステップe11)。薄切処理部52は、例えば薄切処理が自動化された自動化装置(自動薄切装置)で構成される。ここで、所定の厚さ(標本の厚さ)は、薄切処理部52が用いる制御パラメータであり、実施の形態1では、標本作成パラメータ取得部352がユーザ操作に従って取得し、標本作成処理設定部353が薄切処理部52に通知することによって得られる。なお、制御パラメータ調整部39が調整する構成としてもよい。自動薄切装置は、通知された標本の厚さを制御パラメータとして用い、例えば、ミクロトーム(microtome)を用い、所定の厚さとなるように標本ブロックを薄くスライスする。薄切した切片は一旦水に浮かべ、その後プレパラートに掬い上げる。プレパラートに掬い上げた切片は、42℃〜43℃程度で乾燥させる。この温度は切片に皺や皸を作らないように設定する。
【0105】
続いて、脱パラフィン処理部53が、パラフィンを洗い流す(脱パラフィン:ステップe13)。薄切処理が完了すればパラフィンは不要であるから、染色の邪魔にならないようにこれを除去する。先ず、60℃程度の温度でパラフィンを融溶させる。プレパラートを立てた状態にしておけば、大部分のパラフィンは自然に流れ落ちる。ここでの処理には通常1時間程度を要するが、専用の自動化装置が知られており、適宜用いることができる。続いて、キシレンを溶剤として、残ったパラフィンを溶かす。パラフィンを溶かすことでキシレンは汚染されていくので、純度の異なる例えば3槽のキシレンプールを用意し、純度が低いキシレンプールから順次5分程度ずつ浸す。浸透時間は、脱パラフィン処理部53が用いる制御パラメータであり、実施の形態1では固定値とする。ただし、標本作成パラメータ取得部352が取得する構成としてもよいし、制御パラメータ調整部39が調整する構成としてもよい。この場合には、取得または調整した値に従ってステップe13の処理が行われる。
【0106】
続いて、脱パラフィン処理部53は、アルコール(純エタノール)を用いてキシレンを洗い流す(脱キシレン:ステップe15)。脱パラフィンの場合と同様に、キシレンを溶かすことでアルコールは汚染されていくので、純度の異なる例えば3槽のアルコールプールを用意し、純度が低いアルコールプールから順次5分程度ずつ浸す。浸透時間は、脱パラフィン処理部53が用いる制御パラメータであり、実施の形態1では固定値とする。ただし、標本作成パラメータ取得部352が取得する構成としてもよいし、制御パラメータ調整部39が調整する構成としてもよい。この場合には、取得または調整した値に従ってステップe15の処理が行われる。
【0107】
続いて、脱パラフィン処理部53は、アルコールを洗い流す(脱アルコール:ステップe17)。通常、水洗には水道水を使用し、他の染色液や溶剤に投入する前に蒸留水を潛らせる。アルコールから水への急激な変化が標本に悪影響を与えると懸念される場合等、一旦70%程度の濃度のアルコール洗浄を経由する場合もある。
【0108】
続いて、染色処理部54が染色処理(ステップe19〜ステップe27)を行い、H&E染色を施す。先ず、染色処理部54は、標本のヘマトキシリン染色を行う(ステップe19)。ヘマトキシリン染色は、蒸留水を用いて標本を洗浄した後、所定の時間(反応時間)ヘマトキシリン染色液に浸す。ここで、染色液の濃度および反応時間は、染色処理部54が用いる制御パラメータである。実施の形態1では、染色液の濃度については固定値とする。ただし、標本作成パラメータ取得部352が取得する構成としてもよいし、制御パラメータ調整部39が調整する構成としてもよい。この場合には、取得または調整した値に従ってステップe19の処理が行われる。一方、反応時間は、制御パラメータ調整部39が最適化色素量を反映させて調整した値であり、標本作成処理設定部353によって染色処理部54に通知されたヘマトキシリン染色液による反応時間である。
【0109】
続いて、染色処理部54は、ヘマトキシリン染色された標本に対して色出しのための水洗を行う(ステップe21)。通常は、時間短縮のため、1%の塩酸アルコールに浸す。ここでの処理により、細胞質等に付着した余分なヘマトキシリン染色液が除去される。水道水を用いる場合には、長時間水道水に漬け過ぎると水道水に含まれる塩素によってヘマトキシリンの色が抜けてしまうので、注意が必要である。染色は一度安定状態になるため、蒸留水中であれば長時間放置しても問題ない。ここで、塩酸アルコールの溶液濃度および水洗時間は、染色処理部54が用いる制御パラメータであり、実施の形態1では固定値とする。ただし、標本作成パラメータ取得部352が取得する構成としてもよいし、制御パラメータ調整部39が調整する構成としてもよい。この場合には、取得または調整したこれらの値に従ってステップe21の処理が行われる。
【0110】
蒸留水による洗浄後、続いて染色処理部54は、エオジン染色を行う(ステップe23)。ここでは、標本をエオジン染色液に浸す。ここで、染色液の濃度および反応時間は、染色処理部54が用いる制御パラメータである。実施の形態1では、染色液の濃度については固定値とする。ただし、標本作成パラメータ取得部352が取得する構成としてもよいし、制御パラメータ調整部39が調整する構成としてもよい。この場合には、取得または調整した値に従ってステップe23の処理が行われる。一方、反応時間は、ステップe19のヘマトキシリン染色で用いる反応時間と同様に、制御パラメータ調整部39が最適化色素量を反映させて調整した値であり、標本作成処理設定部353によって染色処理部54に通知されたエオジン染色液による反応時間である。
【0111】
続いて、染色処理部54は、エオジン染色された標本に分別脱水処理を行う(ステップe25)。通常、染色液に浸された標本は、全体に染色液を含んだ状態となる。しかし、その後適当な溶剤(洗浄液)で洗浄することで、本来染色されるべき部位以外の染色液を洗い流し、目的部位だけが染色された状態にする。この処理を分別と呼ぶ。エオジンの分別には、通常洗浄液としてアルコール(純エタノール)を用いる。アルコールで洗浄することで染色中に付着した水分も除去されるため、この場合の分別の工程は脱水の行程も兼ねている。アルコール中に標本を放置するとエオジンが溶け出してしまうので、アルコール中で10回揺する処理を4回程度行って分別を終える。ここで、洗浄液の種類および洗浄時間は染色処理部54が用いる制御パラメータであり、実施の形態1では固定値とする。ただし、標本作成パラメータ取得部352が取得する構成としてもよいし、制御パラメータ調整部39が調整する構成としてもよい。この場合には、取得または調整したこれらの値に従ってステップe25の処理が行われる。
【0112】
分別が終わった状態で放置すると標本に残留・付着したアルコール分でエオジンが落ちてしまうので、染色処理部54は、直ちに続く透徹を行う(ステップe27)。透徹は、標本をキシレンに浸す処理であり、例えば5分の浸透時間で3回程度行う。この処理は、脱アルコールと同様の処理であるが、標本の発色を良くする効果もあるため、特に透徹と呼ばれている。透徹時間は、染色処理部54が用いる制御パラメータであり、実施の形態1では固定値とする。ただし、標本作成パラメータ取得部352が取得する構成としてもよいし、制御パラメータ調整部39が調整する構成としてもよい。この場合には、取得または調整した値に従ってステップe27の処理が行われる。
【0113】
続いて、封入処理部55が、標本の封入処理を行い、標本(対象標本)を得る(ステップe29)。すなわち、プレパラートにカバーガラスを載せ、接着剤で固定する。封入包埋については、専用装置によって自動化されており、適宜用いることができる。接着剤によって完全密封されるため、得られた標本は、半永久的に保存できる。
【0114】
以上説明したように、実施の形態1によれば、対象標本の種類を示す標本特定パラメータおよび対象標本を作成する際に用いる標本作成パラメータの各値をユーザ操作に従って取得し、取得した値に応じた標準色素量dH_S,dE_Sを用いて色素量推定に適した最適化色素量を決定することができる。具体的には、遺伝的アルゴリズムを適用して集団の生成および評価を繰り返し、適応度が最も高い(すなわち色素量の推定誤差が小さい)色素量を最適化色素量として決定することができる。そして、決定した最適化色素量に従って調整対象制御パラメータの値を調整し、標本作成部5に通知して動作指示を行うことができる。この結果、標本作成部5は、標本の染色状態(染め上がり)が色素量推定に適した色素量となるように調整した調整対象制御パラメータの値を用いて対象標本を作成する。これによれば、色素量推定に適した(色素量を高精度に推定可能な)染色状態で対象標本を作成することができる。
【0115】
なお、上記した実施の形態1では、遺伝的アルゴリズムを用いて最適化色素量を決定することとしたが、この遺伝的アルゴリズムについては様々な分野で種々の改善が行われており、改善されたアルゴリズムを適用することとしてよく、高速且つ高精度に最適化色素量を決定することができる。
【0116】
また、上記した実施の形態1では、適応度として色素量の推定誤差を算出することとした。これに対し、吸光度の推定誤差や分光透過率の推定誤差を適応度として用いることとしてもよい。例えば吸光度の推定誤差を用いる場合であれば、図11のステップd3で処理対象パターンの色素量をもとに算出した吸光度と、この吸光度をステップd5で分光透過率に変換した後、ステップd10においてこの分光透過率を変換して得た吸光度との差分(吸光度の推定誤差)を算出し、適応度として用いることとしてもよい。
【0117】
また、分光透過率の推定誤差を用いる場合であれば、図11のステップd5において、ステップd3で得た吸光度を変換して得た分光透過率と、この後ステップd9で再度算出(推定)した分光透過率との差分(分光透過率の推定誤差)を算出し、適応度として用いることとしてもよい。
【0118】
また、上記した実施の形態1では、調整対象とする制御パラメータとして反応時間について詳述したが、反応時間以外の制御パラメータを調整対象としてもよい。その調整対象とする制御パラメータの値と色素量との対応関係を予め設定しておくことで上記した実施の形態1と同様に実現できる。
【0119】
例えば、標本の厚さを調整対象制御パラメータとする場合には、標本の厚さと色素量との関係(相関式)を定義したLUTを事前に生成して記憶部33に記憶しておけばよい。すなわち例えば、標本の厚さを変えて実際に作成した標本を用意して色素量を求め、上記した実施の形態1と同様の要領で、標本の厚さと色素量との対応関係を予め設定しておく。このとき、同じ標本の厚さで標本を作成した場合であっても、色素量に多少のバラつきが生じる。この誤差を軽減するため、同じ標本の厚さで作成した複数の標本を用意する。そして、図2に示した処理手順に従い、得られた各標本の色素量を推定して標本の厚さ毎の測定値(推定)を得る。
【0120】
図15は、標本の厚さ毎の色素量の測定値をもとに標本の厚さと色素量との対応関係の一例を模式的に示した図であり、横軸を標本の厚さ、縦軸を色素量とし、標本の厚さを異ならせて作成した標本の色素量を示している。この場合も、上記した実施の形態1と同様に標本の厚さ毎に複数の測定値が得られ、各値は、例えば図15中で破線で示すような範囲で値が分散する。そこで例えば、実施の形態1と同様に、図15中に実線で示すように、標本の厚さ毎に測定値の平均値を算出し、各標本の厚さに対応する色素量をその標本の厚さに対する1点として得る。そして、図15中に実線で示すプロット分布をテーブル化してLUTを作成し、記憶部33に記憶しておく。
【0121】
そして、制御パラメータ調整部39は、このようにして予め生成したLUTを参照し、標本の厚さを算出する。例えば、最適化色素量のうち、色素Eの最適化色素量(色素量)をdEとする。そして、dEの値をもとに、標本の厚さTEを次式(16)に従って算出する。
【数14】

【0122】
これにより、最適化色素量を標本の厚さに反映させて調整することができる。上記したように、標本の厚さは標本の染色状態に影響を与えるため、このようにして最適化色素量を標本の厚さに反映させて調整することによって、より高精度に色素量を推定可能な染色状態で対象標本を作成することができる。
【0123】
同様に、ヘマトキシリン染色液の濃度を調整対象制御パラメータとする場合であれば、ヘマトキシリン染色液の濃度と色素量との関係(相関式)を定義したLUTを事前に生成して記憶部33に記憶しておけばよい。すなわち例えば、ヘマトキシリン染色液の濃度を変えて実際に作成した標本を用意して色素量を求め、上記した実施の形態1と同様の要領で、ヘマトキシリン染色液の濃度と色素量との対応関係を予め設定しておく。
【0124】
図16は、ヘマトキシリン染色液の濃度毎の色素量の測定値をもとにヘマトキシリン染色液の濃度と色素量との対応関係の一例を模式的に示した図であり、横軸をヘマトキシリン染色液の濃度、縦軸を色素量とし、ヘマトキシリン染色液の濃度を異ならせて作成した標本の色素量を示している。この場合も、上記した実施の形態1と同様にヘマトキシリン染色液の濃度毎に複数の測定値が得られ、各値は、例えば図16中で破線で示すような範囲で値が分散する。そこで、実施の形態1と同様に、図16中に実線で示すように、ヘマトキシリン染色液の濃度毎に測定値の平均値を算出し、各ヘマトキシリン染色液の濃度に対応する色素量をそのヘマトキシリン染色液の濃度に対する1点として得る。そして、図16中に実線で示すプロット分布をテーブル化してLUTを作成し、記憶部33に記憶しておく。
【0125】
そして、制御パラメータ調整部39は、このようにして予め生成したLUTを参照し、ヘマトキシリン染色液の濃度を算出する。例えば、最適化色素量のうち、色素Hの最適化色素量(色素量)をdHとする。そして、dHの値をもとに、ヘマトキシリン染色液の濃度CHを次式(17)に従って算出する。
【数15】

【0126】
また、図示しないが、パラフィンブロック作成処理部51がパラフィンブロック作成処理で用いるブロックサイズ(採取した検体からブロックを切り出す際のブロックサイズ)や、標本内の組織の固定に用いるホルマリン系固定液の固定時間を調整対象制御パラメータとする場合も同様に、ブロックサイズと色素量、あるいは固定時間と色素量との関係(相関式)を定義したLUTを事前に生成して記憶部33に記憶しておけばよい。
【0127】
また、上記した実施の形態1,2では、調整対象とする制御パラメータを反応時間とし、最適化色素量の値を反映させて調整する場合について説明した。これに対し、さらに標本の厚さを加味して反応時間を調整するようにしてもよい。
【0128】
一般的なH&E染色の染色工程では、色素Hは、核を染色する。一方、色素Eは、核を含む組織のほぼ全域を染色する。なお、染色工程によっては、色素Hが組織全域を染色する場合もある。ここで、ある厚さの標本を色素Eで染色した場合に対し、その2倍の厚さの標本を色素Eで染色した場合の色素Eの色素量はほぼ2倍となる。これは、色素Eは、色素Eが組織全域(主に細胞質)を染色するためのである。すなわち、標本の厚さを2倍にした場合、標本中を占める組織のうち、色素Eによって主に染色される細胞質の体積も2倍となるためである。一方で、ある厚さの標本を色素Hで染色した場合に対し、その2倍の厚さの標本を色素Hで染色した場合の色素Hの色素量はほとんど変化しない。これは、色素Hが主に染色するのは核であり、通常では、標本の厚さを2倍にしたとしてもその標本内に別の核が存在する可能性が極めて低いためである。
【0129】
このため、標本の色素量(詳細には、色素Eの色素量)は、標本の厚さによって変わる。そこで、標本の厚さを加味して反応時間を調整することとしてもよい。例えば、上記した実施の形態1,2のように、標本の厚さを取得対象とする場合であれば、取得した標本の厚さを加味して反応時間を次式(18),(19)に従って算出することとしてもよい。この場合には、制御パラメータ決定部372は、実施の形態1で説明した反応時間と色素量との関係(相関式)を定義したLUT(図13のLUT)および標本の厚さと色素量との関係(相関式)を定義したLUT(図15のLUT)を参照し、色素Hおよび色素Eの染色液毎の反応時間を個別に算出する。例えば、最適化色素量のうち、色素Hの最適化色素量(色素量)をdH、色素Eの最適化色素量(色素量)dEとする。そして、dHの値をもとに、ヘマトキシリン染色液による反応時間SHを次式(18)に従って算出する。また、dEの値および取得した標本の厚さTの値をもとに、エオジン染色液による反応時間SEを次式(19)に従って算出する。
【数16】

【0130】
ここで、式(19)に示したエオジン染色液による反応時間SEの算出について説明する。式(19)に示すように、エオジン染色液による反応時間SEの算出では先ず、標本の厚さと色素量との関係を定義したLUT(例えば図15のLUT)に従い、標本の厚さが取得した値Tの場合の色素量を得る。標本の厚さTに対応する色素量(LUT(T))の値を得たならば、続いて、反応時間と色素量との関係を定義したLUT(例えば図13のLUT)に従い、反応時間SEを得る。具体的にはこのとき、標本の厚さTに対応する色素量(LUT(T))と反応時間SEに対応する色素量とで最終的な色素Eの色素量がdEになるように、差分値dE/LUT(T)を求める。そして、反応時間と色素量との関係を定義したLUTに従い、求めた差分値に対応する反応時間をSEとして得る。この結果、標本の厚さをTとして作成する標本において、色素Eの色素量が最適化色素量dEとなるようなエオジン染色液の反応時間SEの値を取得できる。
【0131】
なお、ここでは、標本の厚さを加味して反応時間SEの値を算出(調整)する場合について例示した。これに対し、同様の手法を適用することで、標本の厚さ以外の取得対象とする所望の制御パラメータの値を加味し、所望の調整対象制御パラメータの値を調整することができる。また、同様の手法を適用することで、複数の取得対象制御パラメータの値を加味して調整対象制御パラメータの値を調整することができる。例えば反応時間を調整するのであれば、加味する各制御パラメータの値と色素量との関係を定義したLUTをそれぞれ用意しておき、これらLUTを順次参照して最終的な色素Hおよび/または色素Eの色素量が最適化色素量dH,dEとなるように反応時間SH,SEを決定すればよい。
【0132】
また、ここでは、反応時間と色素量との関係を定義したLUTおよび標本の厚さと色素量との関係を定義したLUTを用いてエオジン染色液の反応時間SEを算出する場合を例示した。これに対し、標本の厚さ毎に個別に反応時間と色素Eの色素量との関係を定義したLUTを用意しておくこととしてもよい。この場合には、取得した標本の厚さTに応じたLUTを参照し、この参照先のLUTに従って確定された色素Eの色素量に対応する反応時間を取得すればよい。
【0133】
あるいは、パラフィンブロック作成処理部51が用いる標本内の組織の固定に用いるホルマリン系固定液の種類を加味して反応時間を調整することもできる。この場合には、使用するホルマリン系固定液の種類に応じた係数を式(14),(15)や式(18),(19)で得られる各値に乗じることで実現できる。例えばあるホルマリン系固定液Aを用いる場合の係数を“1.0”とする。一方、Aとは別のホルマリン系固定液Bを用いる場合の係数を“0.95”とする。そして、ホルマリン系固定液Aを用いる場合であれば、式(14)や式(18)に従って算出したSHの値をヘマトキシリン染色液による反応時間として得る。同様に、式(15)や式(19)に従って算出したSEの値をエオジン染色液による反応時間として得る。一方、ホルマリン系固定液Bを用いる場合には、式(14)や式(18)に従って算出したSHの値に係数“0.95”を乗じた値をヘマトキシリン染色液による反応時間として得る。エオジン染色液による反応時間も式(15)や式(19)を用いて同様に算出する。
【0134】
(実施の形態2)
上記した実施の形態1では、一般染色として知られるH&E染色を施した標本を作成する場合について説明した。これに対し、この他にも、様々な染色法が知られている。上記したように、これらの染色法は、一般染色、特殊染色および免疫染色に大別されるが、本発明は、いずれの染色法で標本を染色する場合にも適用可能である。
【0135】
例えば、特殊染色について例示すると、アザン染色、アルシアンブルー・PAS重染色、アルシアンブルー染色、エラスチカ・ワンギーソン染色(EVG染色)、オイルレッドO染色、オルセイン染色、ギムザ染色、グリメリウス染色、クリューバー・バレラ(KB)染色、グロコット染色、コッサ(Ca)反応、ゴモリのアルデヒドフクシン染色、コロイド鉄染色、コンゴー赤(DFS 4BS)染色、サフラニンO染色、ズダンIII染色、ズダン黒B染色、ダイレクトファーストスカーレット染色、チールネンゼン染色、トルイジンブルー(Tb)染色、ナフトールASDクロロアセテート法、ニッスル染色、ビクトリアブルー染色、フォイルゲン染色、ベルリンブルー(Fe)染色、ボデイアン染色、マッソン・トリクローム染色(MT染色)、マッソンフォンタナ染色、ムチカルミン染色、メチルグリーンピロニン染色、リンタングステン酸ヘマトキリシン(PTAH)染色、レンドラムの封入体染色、グラム染色、ワイゲルト染色、ワンギーソン染色、渡辺の鍍銀(Ag)染色、漂白法、好酸球染色(ルナ染色)、Kossa法、LFB染色、TRAP染色、PAM染色、PAS反応等が挙げられ、各染色法に適用できる。また、ここで挙げていない染色法についても同様に適用できる。
【0136】
これらの特殊染色に適用する場合も、上記した実施の形態1と同様に、該当する染色法で染色した標準的な標本を用意し、その染色色素毎の標準色素量dH_S,dE_Sを教師データとして記憶部に記憶しておく。また、対象標本について標本特定パラメータおよび標本作成パラメータの各値を取得する。そして、取得した値に応じた標準色素量dH_S,dE_Sを用い、実施の形態1と同様の要領で色素量最適化処理を行って各染色色素の最適化色素量を算出する。そして、得られた最適化色素量に従って調整対象制御パラメータの値を調整し、調整した値を用いて対象標本を作成する。
【0137】
標本作成パラメータや調整対象制御パラメータとする制御パラメータには、例えば適用する染色法で使用する染色液の生成条件や反応時間等が挙げられる。ここで、染色液の生成条件は、染色液の構成や濃度等である。また、この他、その染色法における標本作成処理の各工程で用いる制御パラメータを適宜調整対象制御パラメータとすることができる。ここで、特殊染色においても、その染色法における標本作成処理のプロトコールやこのプロトコールで用いる制御パラメータは、一般染色として例示したH&E染色の場合と同様に採用する装置の製造メーカによって異なり、医療施設側の設定によって異なる場合もある。本発明は何れのプロトコールを採用することとしてもよく、そのプロトコールに記載される制御パラメータを適宜標本作成パラメータや調整対象制御パラメータとしてよい。
【0138】
例えば、特殊染色のうち、多糖類を過ヨウ素酸で酸化して、生じたアルデヒド基にシッフ試薬を反応させて呈色させることにより、単純多糖類(グリコーゲン,セルロース,デキストラン)、中性または酸性粘液(グリコプロテイン,所謂上皮性粘液)、糖脂質、甲状腺コロイド、基底膜、細網繊維、赤痢アメーバ、真菌、リポフスチン等を赤紫から赤色に染め、膠原線維や繊維素を桃色に染める過ヨウ素酸シッフ反応染色(以降、PAS染色)の場合には、例えば過ヨウ素酸水の生成条件やシッフ試薬の生成条件、過ヨウ素酸水による反応時間、シッフ試薬による反応時間等が制御パラメータとして挙げられる。また、例えばシッフ試薬の生成条件としては、その組成物質や、各組成物質の混合量の組み合わせが挙げられる。
【0139】
なお、PAS染色では、過ヨウ素酸での染色の後、シッフ試薬での染色を行い、その後ヘマトキシリン染色液を用いて核の染色を行う。より詳細には、シッフ試薬での染色の後、亜硫酸水を用いて対象部位以外の染色液を洗い流す工程を行う。このため、このときに核が酸化される。ここで、ヘマトキシリン染色は酸化性染色であるため、亜硫酸水を用いた処理の影響により、その後のヘマトキシリン染色において、実施の形態1,2で説明したH&E染色でのヘマトキシリン染色と比較して核が染色され易くなる。このため、本発明をPAS染色に適用し、ヘマトキシリン染色液による反応時間を調整対象制御パラメータとする場合には、例えば、実施の形態1で説明したH&E染色の際に用いるLUTとは別の、シッフ試薬の反応時間を加味したヘマトキシリン染色液の反応時間を定義したLUTを用意し、これを用いるようにしてもよい。
【0140】
その他、例えば弾性繊維の染色法であるワイゲルト染色と膠原線維の染色であるワンギーソン染色を組み合わせた染色法であるEVG染色の場合には、レゾルシンフクシン液、鉄ヘマトキシリンおよびワンギーソン液それぞれの生成条件や反応時間が制御パラメータとして挙げられる。
【0141】
また、分子量の異なる酸性色素を用いた重染色であるMT染色の場合には、鉄ヘマトキシリン、ポンソー・キシリジン・酸フクシン・アゾフロキシン、オレンジG水溶液およびアニリン青それぞれの生成条件や反応時間が制御パラメータとして挙げられる。
【0142】
また、染色法によっては、染色した色素を不溶化するため、洗浄する前に媒染剤を用いて媒染処理を行う場合があるが、この媒染剤の生成条件や反応時間も制御パラメータとなる。
【0143】
一方、免疫染色について例示すると、例えば酵素抗体法では、直接法、間接法等が挙げられる。また、間接法については増感の有無を選択でき、増感法として、PAP法やABC法、ストレプトアビジン法、Tyramide signal amplificationシステム(TSAシステム)、LSAB法、高感度ポリマー試薬法、酵素抗体法による多重染色等が挙げられる。これらの免疫染色についても、上記した実施の形態1と同様に適用できる。ここで、免疫染色では、酵素抗体法におけるこれらの反応形式や増感法の種類が制御パラメータとなる。なお、ここで挙げていない染色法についても同様に適用できる。
【0144】
この他、標本作成パラメータや調整対象制御パラメータとする制御パラメータには、該当する染色法で使用する一次抗体や二次抗体、発色試薬の生成条件や反応時間等が挙げられる。生成条件としては、使用する化学薬品の構成や濃度が挙げられる。また、免疫染色においても、その染色法における標本作成処理のプロトコールやこのプロトコールで用いる制御パラメータは、採用する装置の製造メーカによって異なり、医療施設側の設定によって異なる場合もある。本発明は何れのプロトコールを採用することとしてもよく、そのプロトコールに記載される制御パラメータを適宜標本作成パラメータや調整対象制御パラメータとしてよい。
【0145】
図17は、免疫染色を適用した場合の標本作成処理の処理手順を示すフローチャートである。先ず、抗原の賦活化を行い、抗体の認識部位あるいは配列(エピトープ)を表出させる(ステップf1)。賦活化の手法としては、タンパク質分解酵素を用いる方法や界面活性剤を用いる方法等が知られている。続いて、切片の上にタンパク質を緩衝液に溶かした溶液を乗せ、所定時間置くこでブロッキングを行う(ステップf3)。このブロッキングは、抗体が抗原以外の分子を認識することを防ぐために行う。
【0146】
続いて、一次抗体を反応させる(ステップf5)。その後、洗浄を行った(ステップf7)後で、二次抗体を反応させる(ステップf9)。そして、洗浄の後(ステップf11)、増感するか否かを判定し、増感する場合には(ステップf13:Yes)、増感反応に移る(ステップf15)。ここでは、例えばステップf9で反応させた二次抗体の種類に応じて適宜増感反応を行う。そして、増感しない場合(ステップf13:No)、あるいはステップf15の増感反応の後、発色工程に移り、酵素に対する基質を添加して発色させる(ステップf17)。
【0147】
なお、上記した実施の形態1では、対象標本にH&E染色を施すことを前提とし、記憶部33の標準色素量データ333には、色素Hおよび色素Eの標準色素量dH_S,dE_Sが記憶されていることとして説明した。また、実施の形態2では、適用可能な他の染色法について説明した。ここで、標準色素量データ333には、実施の形態1のH&E染色や実施の形態2で例示した染色法を含む染色法毎に、その染色法に応じた染色色素毎の標準色素量を記憶しておく構成としてよい。これによれば、ユーザ操作に従って取得した標本作成パラメータの値をもとに対象標本に施す染色法を特定することによって、特定した染色法に応じた染色色素の標準色素量を標準色素量データ333から読み出して用い、最適化色素量を決定することができる。
【0148】
また、上記した実施の形態1では、事前に標準的な染色状態の標準標本を用意し、この標準標本の各点について推定した標準色素量を教師データとして用いる場合について説明した。これに対し、標準標本の各点における分光透過率や吸光度を教師データとして用いることとしてもよい。そして、最適化色素量を求める際にこれら教師データとする分光透過率や吸光度から色素量を算出し、GAを適用してこの色素量を調整することによって最適化色素量を算出することとしてもよい。
【0149】
また、作成対象とする標本は、病理検査に用いる病理標本に限らず、あらゆる生体標本を対象とすることができる。
【図面の簡単な説明】
【0150】
【図1】標本を作成し、観察・診断する手順の概要を説明する説明図である。
【図2】観察画像を生成する各処理の概略手順を説明する説明図である。
【図3】実施の形態1の標本作成装置を含む標本作成システムの全体構成を説明する模式図である。
【図4】標本作成装置の機能構成を示すブロック図である。
【図5】遺伝子の一例を示す図である。
【図6】制御装置が行う処理手順を示すフローチャートである。
【図7】標本特定パラメータ入力画面の一例を示す図である。
【図8】標本特定パラメータ入力画面の他の例を示す図である。
【図9】標本作成パラメータ入力画面の一例を示す図である。
【図10】色素量最適化処理の詳細な処理手順を示すフローチャートである。
【図11】適応度評価処理の詳細な処理手順を示すフローチャートである。
【図12】画素信号値とノイズ量との対応関係の一例を示す図である。
【図13】反応時間と色素量との対応関係の一例を示す図である。
【図14】実施の形態1における標本作成処理の処理手順を示すフローチャートである。
【図15】標本の厚さと色素量との対応関係の一例を示す図である。
【図16】ヘマトキシリン染色液の濃度と色素量との対応関係の一例を示す図である。
【図17】実施の形態2における標本作成処理の処理手順を示すフローチャートである。
【符号の説明】
【0151】
1 標本作成システム
2 標本作成装置
3 制御装置
31 操作部
32 表示部
33 記憶部
331 標本作成処理プログラム
333 標準色素量データ
335 色素別基準分光特性値
35 制御部
351 標本特定パラメータ取得部
352 標本作成パラメータ取得部
353 標本作成処理設定部
37 画像処理部
38 色素量最適化処理部
381 初期集団生成部
382 選択部
383 交叉部
384 パターン生成部
385 適応度評価部
386 突然変異部
39 制御パラメータ調整部
5 標本作成部
51 パラフィンブロック作成処理部
52 薄切処理部
53 脱パラフィン処理部
54 染色処理部
55 封入処理部
6 観察装置
【特許請求の範囲】
【請求項1】
生体から採取した検体を所定の染色色素で染色して標本を作成する標本作成装置であって、
少なくとも作成対象の標本を染色する染色色素を特定可能な値を含む標本作成パラメータの値を取得する標本作成パラメータ取得部と、
前記標本作成パラメータ取得部によって取得された標本作成パラメータの値をもとに、前記作成対象の標本を染色する染色色素の最適な色素量を決定する色素量決定部と、
前記色素量決定部によって決定された色素量をもとに、前記作成対象の標本を作成する際に用いる制御パラメータの値を調整する制御パラメータ調整部と、
前記制御パラメータ調整部によって調整された制御パラメータの値を用いて前記作成対象の標本を作成する標本作成部と、
を備えることを特徴とする標本作成装置。
【請求項2】
前記色素量決定部は、
前記染色色素の最適な色素量の候補値を生成する候補値生成部と、
前記候補値生成部によって生成された候補値の評価を行う評価部と、
を備え、
前記評価部による評価結果をもとに前記染色色素の最適な色素量を決定することを特徴とする請求項1に記載の標本作成装置。
【請求項3】
予め設定される標準的な分光特性値を教師データとして記憶する教師データ記憶部を備え、
前記候補値生成部は、前記標準的な分光特性値をもとに前記候補値を生成することを特徴とする請求項2に記載の標本作成装置。
【請求項4】
前記教師データ記憶部は、前記標準的な分光特性値として、前記標本の種類を示す標本特定パラメータ毎に標準的な色素量を記憶しており、
前記作成対象の標本の標本特定パラメータの値を取得する標本特定パラメータ取得部を備え、
前記候補値生成部は、前記標本特定パラメータ取得部によって取得された標本特定パラメータの値について前記教師データ記憶部に記憶されている前記標準的な色素量を用い、前記候補値を生成することを特徴とする請求項3に記載の標本作成装置。
【請求項5】
前記評価部は、前記生成された候補値から吸光度を算出し、該吸光度を分光透過率に変換した後、該分光透過率を再度吸光度に変換して色素量を推定する処理を行い、該推定した色素量と前記生成された候補値との差分をもとに前記候補値を評価することを特徴とする請求項3に記載の標本作成装置。
【請求項6】
前記評価部は、前記生成された候補値から吸光度を算出し、該吸光度を分光透過率に変換した後、該分光透過率を再度吸光度に変換する処理を行い、該再度変換された吸光度と前記生成された候補値から算出した吸光度との差分をもとに前記候補値を評価することを特徴とする請求項3に記載の標本作成装置。
【請求項7】
前記評価部は、前記生成された候補値から吸光度を算出して分光透過率に変換し、該分光透過率から画素信号値を算出した後、該画素信号値に所定量のノイズを付加して再度分光透過率を算出する処理を行い、該再度算出した分光透過率と前記生成された候補値から算出した吸光度を変換して得た分光透過率との差分をもとに前記候補値を評価することを特徴とする請求項3に記載の標本作成装置。
【請求項8】
前記作成対象の標本を染色する染色色素は複数の染色色素を含み、
前記候補値生成部は、前記複数の染色色素それぞれの最適な色素量の候補値の組み合わせを生成することを特徴とする請求項2に記載の標本作成装置。
【請求項9】
前記候補値生成部は、前記候補値を複数生成して複数の候補値から成る集団を生成するとともに、前記集団を構成する候補値のうちの所定の候補値を変化させて新たな集団を生成し、
前記評価部は、前記集団を構成する各候補値を評価し、
前記色素量決定部は、前記候補値生成部による新たな集団の生成と、前記評価部による評価との一連の処理を繰り返し実行することを特徴とする請求項2に記載の標本作成装置。
【請求項10】
生体から採取した検体を所定の染色色素で染色して標本を作成する標本作成方法であって、
少なくとも作成対象の標本を染色する染色色素を特定可能な値を含む標本作成パラメータの値を取得する標本作成パラメータ取得工程と、
前記標本作成パラメータ取得工程で取得された標本作成パラメータの値をもとに、前記作成対象の標本を染色する染色色素の最適な色素量を決定する色素量決定工程と、
前記色素量決定工程で決定された色素量をもとに、前記作成対象の標本を作成する際に用いる制御パラメータの値を調整する制御パラメータ調整工程と、
前記制御パラメータ調整工程で調整された制御パラメータの値を用いて前記作成対象の標本を作成する標本作成工程と、
を含むことを特徴とする標本作成方法。
【請求項1】
生体から採取した検体を所定の染色色素で染色して標本を作成する標本作成装置であって、
少なくとも作成対象の標本を染色する染色色素を特定可能な値を含む標本作成パラメータの値を取得する標本作成パラメータ取得部と、
前記標本作成パラメータ取得部によって取得された標本作成パラメータの値をもとに、前記作成対象の標本を染色する染色色素の最適な色素量を決定する色素量決定部と、
前記色素量決定部によって決定された色素量をもとに、前記作成対象の標本を作成する際に用いる制御パラメータの値を調整する制御パラメータ調整部と、
前記制御パラメータ調整部によって調整された制御パラメータの値を用いて前記作成対象の標本を作成する標本作成部と、
を備えることを特徴とする標本作成装置。
【請求項2】
前記色素量決定部は、
前記染色色素の最適な色素量の候補値を生成する候補値生成部と、
前記候補値生成部によって生成された候補値の評価を行う評価部と、
を備え、
前記評価部による評価結果をもとに前記染色色素の最適な色素量を決定することを特徴とする請求項1に記載の標本作成装置。
【請求項3】
予め設定される標準的な分光特性値を教師データとして記憶する教師データ記憶部を備え、
前記候補値生成部は、前記標準的な分光特性値をもとに前記候補値を生成することを特徴とする請求項2に記載の標本作成装置。
【請求項4】
前記教師データ記憶部は、前記標準的な分光特性値として、前記標本の種類を示す標本特定パラメータ毎に標準的な色素量を記憶しており、
前記作成対象の標本の標本特定パラメータの値を取得する標本特定パラメータ取得部を備え、
前記候補値生成部は、前記標本特定パラメータ取得部によって取得された標本特定パラメータの値について前記教師データ記憶部に記憶されている前記標準的な色素量を用い、前記候補値を生成することを特徴とする請求項3に記載の標本作成装置。
【請求項5】
前記評価部は、前記生成された候補値から吸光度を算出し、該吸光度を分光透過率に変換した後、該分光透過率を再度吸光度に変換して色素量を推定する処理を行い、該推定した色素量と前記生成された候補値との差分をもとに前記候補値を評価することを特徴とする請求項3に記載の標本作成装置。
【請求項6】
前記評価部は、前記生成された候補値から吸光度を算出し、該吸光度を分光透過率に変換した後、該分光透過率を再度吸光度に変換する処理を行い、該再度変換された吸光度と前記生成された候補値から算出した吸光度との差分をもとに前記候補値を評価することを特徴とする請求項3に記載の標本作成装置。
【請求項7】
前記評価部は、前記生成された候補値から吸光度を算出して分光透過率に変換し、該分光透過率から画素信号値を算出した後、該画素信号値に所定量のノイズを付加して再度分光透過率を算出する処理を行い、該再度算出した分光透過率と前記生成された候補値から算出した吸光度を変換して得た分光透過率との差分をもとに前記候補値を評価することを特徴とする請求項3に記載の標本作成装置。
【請求項8】
前記作成対象の標本を染色する染色色素は複数の染色色素を含み、
前記候補値生成部は、前記複数の染色色素それぞれの最適な色素量の候補値の組み合わせを生成することを特徴とする請求項2に記載の標本作成装置。
【請求項9】
前記候補値生成部は、前記候補値を複数生成して複数の候補値から成る集団を生成するとともに、前記集団を構成する候補値のうちの所定の候補値を変化させて新たな集団を生成し、
前記評価部は、前記集団を構成する各候補値を評価し、
前記色素量決定部は、前記候補値生成部による新たな集団の生成と、前記評価部による評価との一連の処理を繰り返し実行することを特徴とする請求項2に記載の標本作成装置。
【請求項10】
生体から採取した検体を所定の染色色素で染色して標本を作成する標本作成方法であって、
少なくとも作成対象の標本を染色する染色色素を特定可能な値を含む標本作成パラメータの値を取得する標本作成パラメータ取得工程と、
前記標本作成パラメータ取得工程で取得された標本作成パラメータの値をもとに、前記作成対象の標本を染色する染色色素の最適な色素量を決定する色素量決定工程と、
前記色素量決定工程で決定された色素量をもとに、前記作成対象の標本を作成する際に用いる制御パラメータの値を調整する制御パラメータ調整工程と、
前記制御パラメータ調整工程で調整された制御パラメータの値を用いて前記作成対象の標本を作成する標本作成工程と、
を含むことを特徴とする標本作成方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【公開番号】特開2010−261763(P2010−261763A)
【公開日】平成22年11月18日(2010.11.18)
【国際特許分類】
【出願番号】特願2009−111596(P2009−111596)
【出願日】平成21年4月30日(2009.4.30)
【出願人】(000000376)オリンパス株式会社 (11,466)
【Fターム(参考)】
【公開日】平成22年11月18日(2010.11.18)
【国際特許分類】
【出願日】平成21年4月30日(2009.4.30)
【出願人】(000000376)オリンパス株式会社 (11,466)
【Fターム(参考)】
[ Back to top ]

