標的ポリヌクレオチドの増幅効率の調節方法
【課題】標的ポリヌクレオチドを増幅する技術において、簡便に標的ポリヌクレオチドの増幅効率を調節する。
【解決手段】下記(i)〜(iii)のプライマーを用いて、PCRにより標的ポリヌクレオチドを増幅する際の、該標的ポリヌクレオチドの増幅効率を調節する方法であって、
下記(i)〜(iii)のプライマーの量比を調節することにより、標的ポリヌクレオチドの増幅効率を調節することを含む、方法、
(i)標的ポリヌクレオチドに対合する第1のプライマー、
(ii)標的ポリヌクレオチドに、第1のプライマーと競合的に対合するが、第1のプライマーよりPCRによる伸長反応が起こりにくい第2のプライマー、
(iii)第1のプライマーと対になって、標的ポリヌクレオチドを増幅可能に設計された第3のプライマー。
【解決手段】下記(i)〜(iii)のプライマーを用いて、PCRにより標的ポリヌクレオチドを増幅する際の、該標的ポリヌクレオチドの増幅効率を調節する方法であって、
下記(i)〜(iii)のプライマーの量比を調節することにより、標的ポリヌクレオチドの増幅効率を調節することを含む、方法、
(i)標的ポリヌクレオチドに対合する第1のプライマー、
(ii)標的ポリヌクレオチドに、第1のプライマーと競合的に対合するが、第1のプライマーよりPCRによる伸長反応が起こりにくい第2のプライマー、
(iii)第1のプライマーと対になって、標的ポリヌクレオチドを増幅可能に設計された第3のプライマー。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、標的ポリヌクレオチドの増幅効率を調節する方法、並びに標的ポリヌクレオチドの検出効率を調節する方法、これを用いた標的ポリヌクレオチドの検出方法に関する。また、本発明は疾患の試験方法及び診断方法にも関する。また、本発明は、標的ポリヌクレオチドの増幅に用いるプライマーセットの製造方法、標的ポリヌクレオチドの検出に用いるキットの製造方法にも関する。
【背景技術】
【0002】
アレル特異的PCR法(ASP-PCR法(Allele Specific Primer-PCR法))は、SNPs等の変異の検出に利用される方法である。典型的なアレル特異的PCR法は、変異アレルに特異的なヌクレオチドに対応するヌクレオチドを3’末端に有するプライマーと、これと対になってSNP部位を含む領域を増幅するプライマーをセットとして用い、変異アレルを含む標的ポリヌクレオチドを特異的に増幅することにより、変異アレルを検出しようとするものである(特許文献1)。
【0003】
しかしながら、上記のようなアレル特異的PCR法では、変異アレルを含む標的ポリヌクレオチドを特異的に増幅するために厳密なPCR条件の設定が必要であり、そのため高い検出感度を得ることが困難であるという問題があった(特許文献2)。
【0004】
このような問題を解決する技術として、典型的なアレル特異的PCR法の応用技術である、(i)3'末端から数えて2塩基目及び3塩基目の一方のみに前記SNP部位として野生型ヌクレオチドを有する以外は、前記標的核酸内のSNP部位を含む部分領域と同一の塩基配列を有する第1の順方向プライマーと、(ii)3'末端から数えて2塩基目及び3塩基目の一方のみに前記SNP部位として変異型ヌクレオチドを有する以外は、前記標的核酸内のSNP部位を含む部分領域と同一の塩基配列を有する第2の順方向プライマーと、(iii)前記標的核酸の相補鎖の、前記SNP部位よりも5'末端側で、前記SNP部位に対応する部位を含まない部分領域と同一の塩基配列を有する逆方向プライマーとを用いて前記標的核酸のPCR反応を行うことを特徴とする核酸増幅方法が知られている(特許文献2)。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特許第2853864号公報
【特許文献2】特開2010−35532号公報
【発明の概要】
【発明が解決しようとする課題】
【0006】
ところで、遺伝子における変異の存在又は非存在を検出することにより、該変異が関連する疾患の可能性を測定する場合には、疾患の診断に利用できる意義ある検出結果を得る目的から、種々の検出感度での前記変異の検出結果と、該変異が関連する疾患に関する臨床的知見との関係を分析し、診断に利用できる検出を行うための検出感度の基準を定めることが必要である。
【0007】
検出感度を調節するためのアプローチとして、検出の目的とする変異に応じてプライマーの設計を工夫することで、変異アレルを含む標的ポリヌクレオチドの増幅効率を調節することが、通常考えられる。しかしながら、このようなアプローチでは、プライマーの設計、プライマーの作製、増幅効率の確認の作業を繰り返すことが必要であり、多大な労力を要する場合が多い。
【0008】
そこで、本発明は、標的ポリヌクレオチドを増幅する技術において、簡便に標的ポリヌクレオチドの増幅効率を調節する技術を提供することを課題とする。
【課題を解決するための手段】
【0009】
本発明は、前記課題を解決する手段として、下記(i)〜(iii)のプライマーを用いて、PCRにより標的ポリヌクレオチドを増幅する際の、該標的ポリヌクレオチドの増幅効率を調節する方法であって、下記(i)〜(iii)のプライマーの量比を調節することにより、標的ポリヌクレオチドの増幅効率を調節することを含む、方法を提供する。
各プライマーは以下の通りである。
(i)標的ポリヌクレオチドに対合する第1のプライマー
(ii)標的ポリヌクレオチドに、第1のプライマーと競合的に対合するが、第1のプライマーよりPCRによる伸長反応が起こりにくい第2のプライマー
(iii)第1のプライマーと対になって、標的ポリヌクレオチドを増幅可能に設計された第3のプライマー
上記方法により、標的ポリヌクレオチドの増幅効率を簡便に調節することができる。
【0010】
前記プライマーの量比として、第1のプライマーと第2のプライマーの総量に対する第3のプライマーの量、第2のプライマーの量に対する第1のプライマーの量が挙げられる。このようにプライマーの量比を調節することにより、簡便に標的ポリヌクレオチドの増幅効率を調節することができる。
【0011】
また、本発明は、前記(i)〜(iii)のプライマーを用いて、PCRにより標的ポリヌクレオチドを増幅し、得られた増幅産物を用いて該標的ポリヌクレオチドを検出する際の、該標的ポリヌクレオチドの検出効率(検出感度)を調節する方法であって、本発明の増幅効率の調節方法を用いることにより、該標的ポリヌクレオチドの検出効率(検出感度)を調節する方法を提供する。
上記方法により、標的ポリヌクレオチドの検出効率を簡便に調節することができる。
【0012】
また、本発明は、上記方法で標的ポリヌクレオチドの検出効率を調節し、調節された検出効率を実現する量比の前記(i)〜(iii)のプライマーを用いてPCRを行い、得られたPCR増幅産物中の標的ポリヌクレオチドを検出することを含む、標的ポリヌクレオチドの検出方法を提供する。
上記検出方法により、適切な検出感度で簡便に、標的ポリヌクレオチドの検出を行うことができる。
【0013】
また、本発明は、上記検出方法を用いて、被験者に由来する遺伝子における変異の存在又は非存在を検出し、得られた検出結果を、該変異が検出された場合には前記被験者が該変異の存在により起こる疾患を有する可能性があるという基準と比較することにより、前記変異の存在により起こる疾患の可能性を試験することを含む、試験方法を提供する。
上記試験方法により、臨床上意義の小さい試験結果が得られる可能性を低減させることができる。
【0014】
また、本発明は、上記検出方法を用いて、被験者に由来する遺伝子における変異の存在又は非存在を検出し、得られた検出結果と、該変異の有無及び特定の医薬の効果の関係と、を比較することにより、前記被験者に対する前記特定の医薬の効果を予測することを含む、薬効の予測方法を提供する。
上記薬効の予測方法により、投薬に際し薬効を予測することができ、効果的な投薬を可能にすることが期待される。
【0015】
さらに、本発明は、上記試験方法により得られた試験結果に基づいて、疾患を診断することを含む、疾患の診断方法を提供する。
上記診断方法により、不適切な診断結果が得られる可能性を低減させることができる。
【0016】
また、本発明は、標的ポリヌクレオチドをPCRにより増幅又は検出するためのプライマーセットの製造方法を提供する。該製造方法は、上記方法を用いて標的ポリヌクレオチドの増幅効率を調節し、調節された増幅効率を実現する量比の前記(i)〜(iii)のプライマーを組み合わせることを含む。
上記製造方法により、標的ポリヌクレオチドの任意の増幅効率、検出効率を実現するプライマーセットを簡便に製造することができる。
【0017】
また、本発明は、標的ポリヌクレオチドを、PCRを用いて検出するための検出キットの製造方法を提供する。該製造方法は、上記方法を用いて標的ポリヌクレオチドの増幅効率を調節し、調節された増幅効率を実現する量比の前記(i)〜(iii)のプライマーと、標的ポリヌクレオチドに相補的な配列からなり、末端が蛍光色素で標識されハイブリダイゼーションしたときに蛍光が増加又は減少するプローブと、を組み合わせることを含む。
上記製造方法により、標的ポリヌクレオチドの任意の検出効率を実現する検出キットを簡便に製造することができる。
【0018】
また、本発明は、前記(i)〜(iii)のプライマーを含み、第1のプライマー及び第2のプライマーの総量に対する第3のプライマーの量が、モル比で1倍より大きい、プライマーセットを提供する。
また、本発明は、前記(i)〜(iii)のプライマーを含み、第1のプライマー及び第2のプライマーの総量に対する第3のプライマーの量が、モル比で1倍より小さい、プライマーセットを提供する。
【発明の効果】
【0019】
本発明は、簡便に標的ポリヌクレオチドの増幅効率を調節することを可能にする。また、本発明は、標的ポリヌクレオチドの検出効率(検出感度)を簡便に調節することを可能にする。標的ポリヌクレオチドの検出感度を適切に設定することにより、標的ポリヌクレオチドが関連する疾患の可能性の測定、疾患の診断を、より的確なものとすることができることが期待される。
【図面の簡単な説明】
【0020】
【図1】第1のプライマーと第2のプライマーの総量と、第3のプライマーとの量比が変異型プラスミド(標的ポリヌクレオチド)の検出感度に与える影響を示す図である。
【図2】第1のプライマーと第2のプライマーの総量と、第3のプライマーとの量比が変異型プラスミド(標的ポリヌクレオチド)の検出感度に与える影響を示す図である。
【図3】第1のプライマーと第2のプライマーとの量比が変異型プラスミド(標的ポリヌクレオチド)の検出感度に与える影響を示す図である。
【図4】第1のプライマーと第2のプライマーとの量比が変異型プラスミド(標的ポリヌクレオチド)の検出感度に与える影響を示す図である。
【図5A】第1のプライマーと第2のプライマーの総量と、第3のプライマーとの量比が変異型プラスミド(標的ポリヌクレオチド)の検出感度に与える影響を示す図である。量比(R/(Fwt+Fmt))はモル比で1倍。
【図5B】第1のプライマーと第2のプライマーの総量と、第3のプライマーとの量比が変異型プラスミド(標的ポリヌクレオチド)の検出感度に与える影響を示す図である。量比(R/(Fwt+Fmt))はモル比で2倍。
【図5C】第1のプライマーと第2のプライマーの総量と、第3のプライマーとの量比が変異型プラスミド(標的ポリヌクレオチド)の検出感度に与える影響を示す図である。量比(R/(Fwt+Fmt))はモル比で4倍。
【図5D】第1のプライマーと第2のプライマーの総量と、第3のプライマーとの量比が変異型プラスミド(標的ポリヌクレオチド)の検出感度に与える影響を示す図である。量比(R/(Fwt+Fmt))はモル比で8倍。
【図5E】第1のプライマーと第2のプライマーの総量と、第3のプライマーとの量比が変異型プラスミド(標的ポリヌクレオチド)の検出感度に与える影響を示す図である。量比(R/(Fwt+Fmt))はモル比で16倍。
【図6A】第1のプライマーと第2のプライマーの総量と、第3のプライマーとの量比が変異型プラスミド(標的ポリヌクレオチド)の検出感度に与える影響を示す図である。量比(R/(Fwt+Fmt))はモル比で1倍。
【図6B】第1のプライマーと第2のプライマーの総量と、第3のプライマーとの量比が変異型プラスミド(標的ポリヌクレオチド)の検出感度に与える影響を示す図である。量比(R/(Fwt+Fmt))はモル比で2倍。
【図6C】第1のプライマーと第2のプライマーの総量と、第3のプライマーとの量比が変異型プラスミド(標的ポリヌクレオチド)の検出感度に与える影響を示す図である。量比(R/(Fwt+Fmt))はモル比で4倍。
【図6D】第1のプライマーと第2のプライマーの総量と、第3のプライマーとの量比が変異型プラスミド(標的ポリヌクレオチド)の検出感度に与える影響を示す図である。量比(R/(Fwt+Fmt))はモル比で8倍。
【図6E】第1のプライマーと第2のプライマーの総量と、第3のプライマーとの量比が変異型プラスミド(標的ポリヌクレオチド)の検出感度に与える影響を示す図である。量比(R/(Fwt+Fmt))はモル比で16倍。
【図7A】第1のプライマーと第2のプライマーとの量比が変異型プラスミド(標的ポリヌクレオチド)の検出感度に与える影響を示す図である。量比(Fwt/Fmt)はモル比で1/3倍。
【図7B】第1のプライマーと第2のプライマーとの量比が変異型プラスミド(標的ポリヌクレオチド)の検出感度に与える影響を示す図である。量比(Fwt/Fmt)はモル比で1/2倍。
【図7C】第1のプライマーと第2のプライマーとの量比が変異型プラスミド(標的ポリヌクレオチド)の検出感度に与える影響を示す図である。量比(Fwt/Fmt)はモル比で1倍。
【図7D】第1のプライマーと第2のプライマーとの量比が変異型プラスミド(標的ポリヌクレオチド)の検出感度に与える影響を示す図である。量比(Fwt/Fmt)はモル比で2倍。
【図7E】第1のプライマーと第2のプライマーとの量比が変異型プラスミド(標的ポリヌクレオチド)の検出感度に与える影響を示す図である。量比(Fwt/Fmt)はモル比で3倍。
【図8A】第1のプライマーと第2のプライマーとの量比が変異型プラスミド(標的ポリヌクレオチド)の検出感度に与える影響を示す図である。量比(Fwt/Fmt)はモル比で1/4倍。
【図8B】第1のプライマーと第2のプライマーとの量比が変異型プラスミド(標的ポリヌクレオチド)の検出感度に与える影響を示す図である。量比(Fwt/Fmt)はモル比で1/2倍。
【図8C】第1のプライマーと第2のプライマーとの量比が変異型プラスミド(標的ポリヌクレオチド)の検出感度に与える影響を示す図である。量比(Fwt/Fmt)はモル比で1倍。
【図8D】第1のプライマーと第2のプライマーとの量比が変異型プラスミド(標的ポリヌクレオチド)の検出感度に与える影響を示す図である。量比(Fwt/Fmt)はモル比で2倍。
【図8E】第1のプライマーと第2のプライマーとの量比が変異型プラスミド(標的ポリヌクレオチド)の検出感度に与える影響を示す図である。量比(Fwt/Fmt)はモル比で3倍。
【発明を実施するための形態】
【0021】
本発明について、好ましい形態を例示しながら説明する。
第一の本発明は、下記(i)〜(iii)のプライマーを用いて、PCRにより標的ポリヌクレオチドを増幅する際の、該標的ポリヌクレオチドの増幅効率を調節する方法に関する。
本発明の特徴は、下記(i)〜(iii)のプライマーの量比を調節することにより、標的ポリヌクレオチドの増幅効率を調節する点にある。
各プライマーは以下の通りである。
(i)標的ポリヌクレオチドに対合する第1のプライマー
(ii)標的ポリヌクレオチドに、第1のプライマーと競合的に対合するが、第1のプライマーよりPCRによる伸長反応が起こりにくい第2のプライマー
(iii)第1のプライマーと対になって、標的ポリヌクレオチドを増幅可能に設計された第3のプライマー
【0022】
「標的ポリヌクレオチド」は、例えば、変異を含むポリヌクレオチドである。この場合の変異は、置換、欠失、挿入の何れをも含む。変異としては、例えば一塩基置換が挙げられる。本発明は、SNP部位を含むポリヌクレオチドにおける、変異アレルを含む標的ポリヌクレオチドの増幅効率を調節するのに好適である。
【0023】
第1のプライマーについて、「標的ポリヌクレオチドに対合し」の用語は、PCRにおいて、伸長反応が起こるように、PCRのアニーリング条件において標的ポリヌクレオチドにハイブリダイズすることを意味する。但し、当業者に明らかであるように、標的ポリヌクレオチドの部分領域の配列に完全に相補的である必要はない。第1のプライマーは、標的ポリヌクレオチドのセンス鎖に対合するものであっても、標的ポリヌクレオチドのアンチセンス鎖に対合するものであってもよい。第1のプライマーの設計は、標的ポリヌクレオチドの配列に応じて設計する。
【0024】
第1のプライマーは、通常、プライマーの3’末端側、例えば、3’末端から数えて1〜5番目程度の領域(以下、「3’末端領域」という場合がある。)に、標的ポリヌクレオチドに対合するヌクレオチドを配置することが挙げられる。なお、本明細書において、「3’末端から数えて1〜5番目」という場合は、3’末端を1番目として数える。このようなプライマーの設計は、当業者であれば適宜行うことができる。
【0025】
例えば、標的ポリヌクレオチドが、ヌクレオチドの置換を有する変異型ポリヌクレオチドである場合には、第1のプライマーは、置換したヌクレオチドを上記3’末端の領域に配置すればよい。
標的ポリヌクレオチドがSNP部位を含む場合には、第1のプライマーは、前記SNP部位の第1のアレル特異的ヌクレオチドに対応するヌクレオチドを3’末端から数えて1〜5番目の何れか、好ましくは1〜3番目の何れか、更に好ましくは1又は2番目の何れか、最も好ましくは、3’末端に有し、前記SNP部位を含む領域にハイブリダイズする。ここで、「第1のアレル特異的ヌクレオチドに対応するヌクレオチド」の用語は、第1のプライマーがセンス鎖にハイブリダイズするものである場合には、第1のアレル特異的ヌクレオチドに相補的なヌクレオチドを意味し、第1のプライマーがアンチセンス鎖にハイブリダイズするものである場合には、第1のアレル特異的ヌクレオチドと同一のヌクレオチドを意味する。なお、「第1のアレル特異的ヌクレオチド」は、後述する「第2のアレル特異的ヌクレオチド」との組み合わせによって規定されるものであり、例えば、第1のアレル特異的ヌクレオチドが変異ヌクレオチドであって第2のアレル特異的ヌクレオチドが野生ヌクレオチドである組み合わせ、又はその逆の組み合わせの他、第1のアレル特異的ヌク
レオチドが第1の変異ヌクレオチドであって、第2のアレル特異的ヌクレオチドが第2の変異ヌクレオチドである組み合わせが挙げられる。
【0026】
また、標的ポリヌクレオチドが、ヌクレオチドの挿入を有する変異型ポリヌクレオチドである場合も、上記置換の場合と同様に設計することができ、挿入されたヌクレオチドに対合するヌクレオチドを上記3’末端の領域に配置すればよい。
また、標的ポリヌクレオチドが、ヌクレオチドの欠失を有する変異型ポリヌクレオチドである場合は、欠失部位の前後を含む領域に対合するヌクレオチドを上記3’末端の領域に配置すればよい。
【0027】
第2のプライマーについて、「標的ポリヌクレオチドに第1のプライマーと競合的に対合する」とは、PCRのアニーリング条件において、第1のプライマーが対合する標的ポリヌクレオチドの領域に、第1のプライマーと競合しながら対合することを意味する。従って、第2のプライマーは、第1のプライマーに対して、通常60〜95%程度の相同性を有する。ここで、第2のプライマーは、第1のプライマーよりPCRによる伸長反応が起こりにくい。このような第2のプライマーの設計は、標的ポリヌクレオチドの配列、及び第1のプライマーの配列を考慮して行うことができる。一般的には、PCRの伸長方向(3’末端側)に、標的ポリヌクレオチドに対合しないヌクレオチドを配置することが挙げられる。また、第2のプライマーのTm値が第1のプライマーのTm値より小さくなるように配列を設計することが挙げられる。このようなプライマーの設計は、当業者であれば適宜行うことができる。通常、プライマーの3’末端側、例えば、3’末端から数えて1〜5番目程度の領域(以下「3’末端領域」という場合がある。)に、標的ポリヌクレオチドに対合しないヌクレオチドを配置する。例えば、標的ポリヌクレオチドが、変異を含むポリヌクレオチドである場合には、第2のプライマーは、上記3’末端領域に変異部分の配列に対合するヌクレオチドでなく、野生型の配列に対合するヌクレオチドを配置することが挙げられる。
【0028】
標的ポリヌクレオチドがSNP部位を含む場合には、第2のプライマーは、前記SNP部位の第2のアレル特異的ヌクレオチドに対応するヌクレオチドを3’末端から数えて1〜5番目の何れか、好ましくは1〜3番目の何れか、更に好ましくは1又は2番目の何れか、最も好ましくは、3’末端に有し、前記SNP部位を含む領域にハイブリダイズする。
【0029】
第3のプライマーは、第1のプライマーと対になって、標的ポリヌクレオチドを増幅可能に設計されるものである。すなわち、第1のプライマーによる伸長方向の下流の領域の、第1のプライマーが対合するポリヌクレオチド鎖の相補鎖に対合するように設計されたものである。
【0030】
各々のプライマーの長さ及びTm値は、標的ポリヌクレオチドの配列に応じて適宜設計することができる。通常は10〜40merで40〜70℃、好ましくは15〜30merで50〜60℃である。なお、Tm値は最近接塩基対(Nearest Neighbor)法により算出した値である。
【0031】
本発明の一形態では、第1のプライマーのTm値が、第2のプライマーのTm値より高い。なお、Tm値は最近接塩基対(Nearest Neighbor)法により算出した値である。この場合、第1のプライマーのTm値と、第2のプライマーのTm値の差は、好ましくは0.1〜10℃、更に好ましくは0.5〜5℃である。第1のプライマーのTm値が、第2のプライマーのTm値より高い場合には、本発明の方法により、標的ポリヌクレオチドの増幅効率を上げることが容易になる。
Tm値は、CG含有量及びヌクレオチド数から求めることができる。第1のプライマーのTm値を、第2のプライマーのTm値より高く設計する最も簡便な方法としては、第1のプライマーの長さを第2のプライマーの長さより長くする。例えば、第1のプライマーの長さを
第2のプライマーの長さより1〜10塩基程度、好ましくは2〜5塩基程度長くする方法が挙げられる。
【0032】
また、第1のプライマー5’末端と第2のプライマーの5’末端に、それぞれ、数塩基からなる異なる配列のオリゴヌクレオチドを付加することが好ましい。この付加配列は、通常1〜20塩基程度、好ましくは3〜10塩基程度の長さを有する。これは、第1のプライマーが標的ポリヌクレオチドとは異なるポリヌクレオチドにハイブリダイズし、標的ポリヌクレオチド以外のヌクレオチドを鋳型として増幅する可能性を低くし、標的ポリヌクレオチドの増幅効率の調節をより確実に行うためである。
【0033】
第一の本発明の一形態では、第1のプライマーのTm値が、第2のプライマーのTm値より高い場合に、第1のプライマー及び第2のプライマーの総量に対する第3のプライマーの量を大きくすることにより、標的ポリヌクレオチドの増幅効率を上げることができる。
【0034】
反対に、第1のプライマー及び第2のプライマーの総量に対する第3のプライマーの量を小さくすることにより、標的ポリヌクレオチドの増幅効率を下げることができる。
【0035】
すなわち、プライマー量比を前記の方法で変えることにより、標的ポリヌクレオチドの増幅効率を上げたり下げたりすることができる。
【0036】
該形態において、具体的には、第1のプライマー及び第2のプライマーの総量に対する第3のプライマーの量をモル比で1倍より大きくすることにより、標的ポリヌクレオチドの増幅効率を上げることができる。従来の、本発明と同様の系を持つPCR法(例えば特許文献2)では、フォワードプライマーとリバースプライマーの量比は、モル比で約1:1であったので、第1のプライマー及び第2のプライマーの総量に対する第3のプライマーの量をモル比で1倍より大きくすることにより、従来のPCR法での標的ポリヌクレオチドの増幅効率に比して、該標的ポリヌクレオチドの増幅効率を上げることができる。
【0037】
また、第1のプライマー及び第2のプライマーの総量に対する第3のプライマーの量をモル比で2倍より大きくすることにより、更に標的ポリヌクレオチドの増幅効率を上げることができる。また、実施例からも明らかなように、第1のプライマー及び第2のプライマーの総量に対する第3のプライマーの量をモル比で4倍より大きく、更にはモル比で8倍より大きくすることにより、更に標的ポリヌクレオチドの増幅効率を上げることができる。
【0038】
また、具体的には、第1のプライマー及び第2のプライマーの総量に対する第3のプライマーの量をモル比で1倍より小さくすることにより、標的ポリヌクレオチドの増幅効率を下げることができる。従来の、本発明と同様の系を持つPCR法(例えば特許文献2)では、フォワードプライマーとリバースプライマーの量比は、モル比で約1:1であったので、第1のプライマー及び第2のプライマーの総量に対する第3のプライマーの量をモル比で1倍より小さくすることにより、従来のPCR法での標的ポリヌクレオチドの増幅効率に比して、該標的ポリヌクレオチドの増幅効率を下げることができる。
【0039】
また、第1のプライマー及び第2のプライマーの総量に対する第3のプライマーの量をモル比で0.5倍より小さくすることにより、更に標的ポリヌクレオチドの増幅効率を下げることができる。また、第1のプライマー及び第2のプライマーの総量に対する第3のプライマーの量をモル比で0.25倍より小さく、更にはモル比で0.125倍より小さくすることにより、更に標的ポリヌクレオチドの増幅効率を下げることができる。
【0040】
第一の本発明の他の形態では、第2のプライマーの量に対する第1のプライマーの量を大きくすることにより、前記標的ポリヌクレオチドの増幅効率を上げることができる。
【0041】
反対に、第2のプライマーの量に対する第1のプライマーの量を小さくすることにより、前記標的ポリヌクレオチドの増幅効率を下げることができる。
すなわち、プライマーの量比を前記の方法で変えることにより、前記標的ポリヌクレオチドの増幅効率を上げたり下げたりすることができる。
【0042】
該形態において、具体的には、第2のプライマーの量に対する第1のプライマーの量を、モル比で1倍より大きくすることにより、前記標的ポリヌクレオチドの増幅効率を上げることができる。
なお、従来の、本発明と同様の系を持つPCR法(例えば特許文献2)では、第1のプライマーと第2のプライマーの量比は、モル比で約1:1であるので、第2のプライマーの量に対する第1のプライマーの量を、モル比で1倍より大きくすることにより、従来のPCR法での標的ポリヌクレオチドの増幅効率に比して、該標的ポリヌクレオチドの増幅効率を上げることができる。
【0043】
また、第2のプライマーの量に対する第1のプライマーの量を、モル比で2倍より大きくすることにより、更に前記標的ポリヌクレオチドの増幅効率を上げることができる。
【0044】
第2のプライマーの量に対する第1のプライマーの量の上限は、好ましくはモル比で4倍である。
【0045】
また、第2のプライマーの量に対する第1のプライマーの量を調節する形態に、上述した第1のプライマー及び第2のプライマーの総量に対する前記第3のプライマーの量を調節する形態を組み合わせる形態も好ましい。
【0046】
上記の方法により、標的ポリヌクレオチドの増幅効率を調節することにより、当該標的ポリヌクレオチドの増幅の目的に応じた増幅効率を実現するプライマー量比を決定することができる。すなわち、本発明は、上記(i)〜(iii)のプライマーを用いたPCRにより標的ポリヌクレオチドを増幅する際の、プライマー量比を決定する方法をも提供する。
このようにして決定した量比のプライマーを用いてPCRを行うことにより、標的ポリヌクレオチドの目的に応じた増幅効率を実現することができる。
すなわち、本発明は、上記方法で標的ポリヌクレオチドの増幅効率を調節し、調節された増幅効率を実現する量比の前記(i)〜(iii)のプライマーを用いてPCRを行うことを含む、標的ポリヌクレオチドの増幅方法を提供する。
【0047】
上述した第一の本発明により、PCRにおける標的ポリヌクレオチドの増幅効率を調節することができる。そして、第一の本発明を用いて、標的ポリヌクレオチドの増幅効率を調節することにより、該標的ポリヌクレオチドの検出効率(検出感度)を調節することができる。
すなわち、第二の本発明は、前記(i)〜(iii)のプライマーを用いて、PCRにより標的ポリヌクレオチドを増幅し、得られた増幅産物を用いて該標的ポリヌクレオチドを検出する際の、該標的ポリヌクレオチドの検出効率(検出感度)を調節する方法であって、本発明の増幅効率の調節方法を用いることにより、該標的ポリヌクレオチドの検出効率(検出感度)を調節する方法である。
【0048】
プライマーの量比の調節方法の形態については、第一の本発明について説明したとおりである。すなわち、上述したプライマーの量比の調節により、標的ポリヌクレオチドの増幅効率を高めるほど、該標的ポリヌクレオチドの検出感度が高くなるという関係にある。
【0049】
上記の方法により、標的ポリヌクレオチドの検出効率(検出感度)を調節することにより、当該標的ポリヌクレオチドの検出の目的に応じた検出効率を実現するプライマー量比を決定することができる。すなわち、本発明は、上記(i)〜(iii)のプライマーを用いたPCRにより標的ポリヌクレオチドを検出する際の、プライマー量比を決定する方法をも提供する。
このようにして決定した量比のプライマーを用いてPCRを行い、得られたPCR増幅産物中の標的ポリヌクレオチドを検出することにより、目的に応じた検出効率を実現することができる。
すなわち、本発明は、上記方法で標的ポリヌクレオチドの検出効率を調節し、調節された検出効率を実現する量比の前記(i)〜(iii)のプライマーを用いてPCRを行い、得られたPCR増幅産物中の標的ポリヌクレオチドを検出することを含む、標的ポリヌクレオチドの検出方法を提供する。
【0050】
標的ポリヌクレオチドを検出する方法としては、公知の方法を用いることができ、例えば、融解曲線分析(Tm解析)、シーケンシング、電気泳動などを用いることができる。中でも、融解曲線分析(Tm解析)による検出が好ましい。これは、Tm解析を行う場合には、標的ポリヌクレオチドの増幅産物を特に処理を施すことなく、増幅産物を含む反応液をそのまま解析に付すことができるためである。また、増幅とTm解析を連続的に行う機器(実施例を参照)も実用化されているので、簡便である。
【0051】
Tm解析には標的ポリヌクレオチドに相補的な配列からなり、末端が蛍光色素で標識され標的ポリヌクレオチドにハイブリダイゼーションし、二本鎖になったときに蛍光が増加又は減少するプローブ(Probe)や二本鎖DNAにインターカレートするSYBR-Green (SYBR:登録商標)や2種類の近接するプローブで蛍光共鳴エネルギー転移(FRET)を起こすHybProbeを用いることができる。末端が蛍光色素で標識され標的ポリヌクレオチドにハイブリダイゼーションし、二本鎖になったときに蛍光が減少するプローブとしては、DNAのグアニン塩基が近づくと蛍光が消光する蛍光色素を用いた蛍光DNAプローブ、いわゆるQProbe(登録商標)を用いる方法(http://unit.aist.go.jp/brf/ci/research_result/aist_today/vol08_02_p18_p19.pdf、WO2008117782)が挙げられる。このようなプローブに用いられる蛍光色素は公知であり、このようなプローブを作製する方法も公知である。ここで、「標的ポリヌクレオチドに相補的な配列」とは、上記検出方法における通常の条件において、標的ポリヌクレオチドにハイブリダイズすることができる程度に相補的であれば足り、完全に相補的である必要はない。
また、二本鎖になったときに蛍光が減少するプローブに用いられる蛍光色素としては、Invitrogen社製のPacific Blue、TAMRA、BODIPY FL等が挙げられる。プローブの長さは、検出の標的となるポリヌクレオチドに応じて適宜設計することができるが、通常は10〜40mer程度である。
【0052】
Tm解析は、反応液を段階的に昇温していく際に検出される蛍光強度を測定することで行うことができる。蛍光強度の測定は、用いる蛍光色素に応じた波長の励起光を用い発光波長の光を測定することにより行う。Tm解析における昇温は、通常0.1〜1℃/5秒のスピードである。Tm解析を行うときの反応液の組成は、プローブとその塩基配列に相補的な配列を有するポリヌクレオチドとのハイブリダイゼーションが可能であれば特に制限されないが、通常は、一価の陽イオン濃度が1.5〜50mM、pHが7〜9である。PCR等のDNAポリメラーゼを用いた増幅方法の反応液は、通常、この条件を満たすので、増幅に用いた反応液をそのままTm解析に用いることができる。
【0053】
続いて、Tm解析の結果に基づいて、標的ポリヌクレオチドを検出する。Tm解析の結果に基づく標的ポリヌクレオチドの検出は、通常の方法により行うことができる。本発明にお
いて「検出」とは、標的ポリヌクレオチドの有無の検出の他、サンプルにおける標的ポリヌクレオチドの定量、サンプルにおける標的ポリヌクレオチドとその他のポリヌクレオチドの比率の測定を含む概念である。
【0054】
また、前記検出方法を用いることで、被験者に由来する遺伝子における変異の存在又は非存在を検出することが可能となる。すなわち、第三の本発明は、前記検出方法により得られた検出結果を、該変異が検出された場合には前記被験者が該変異の存在により起こる疾患を有する可能性があるという基準と比較することにより、前記変異の存在により起こる疾患の可能性を試験することを含む、試験方法である。また、本発明は、上記の試験結果に基づいて、疾患を診断する方法も提供する。
【0055】
第四の本発明は、前記検出方法により得られた検出結果と、該変異の有無及び特定の医薬の効果の関係と、を比較することにより、前記被験者に対する前記特定の医薬の効果を予測することを含む、薬効の予測方法である。すなわち、特定の変異と特定の医薬の効果との関係が知られている場合に、特定の変異の有無を検出することにより、前記関係を参照することにより、特定の医薬の効果を予測することが可能となる。
例えば、分子標的薬ゲフィチニブはEGFR遺伝子に特定の変異(exon21のL858Rの変異等)があると奏効率が高くなることが知られている。また、分子標的薬セツキシマブはkras遺伝子のcodon12又は13の変異やbraf遺伝子のV600E変異があると薬が効かなくなることが知られている。すなわち、本発明の検出方法を用いて、EGFR遺伝子の上記変異を検出することにより、被験者に対するゲフィチニブの薬効を予測することができる。また、本発明の検出方法を用いて、kras遺伝子またはbraf遺伝子の上記変異を検出することにより、被験者に対するセツキシマブの薬効を予測することができる。
【0056】
また、本発明は、上述した(i)〜(iii)のプライマーを用いて標的ポリヌクレオチドを増幅する方法に用いるプライマーセットの製造方法を提供する。
すなわち、第五の本発明は、上述した第一の本発明を用いて標的ポリヌクレオチドの増幅効率を調節し、調節された増幅効率を実現する量比の前記プライマーを組み合わせることを含む、プライマーセットの製造方法である。
このような製造方法によれば、標的ポリヌクレオチドの増幅や検出に適したプライマーセットを提供することが可能になる。
ここで、「組み合わせる」には、前記プライマーを混合する形態のほか、使用時に混合できるように別個に含める形態などがある。
【0057】
また、本発明は、上述した(i)〜(iii)のプライマーを用いて標的ポリヌクレオチドを増幅する方法に用いるプライマーセットの設計方法を提供する。
すなわち、本発明の他の形態は、上述した第一の本発明を用いて標的ポリヌクレオチドの増幅効率を調節し、調節された増幅効率を実現するプライマー量比を決定し、プライマーセットを設計する方法である。
このような設計方法によれば、標的ポリヌクレオチドの増幅や検出に適したプライマーセットを簡便に設計することが可能になる。
【0058】
第六の本発明であるプライマーセットは、例えば、以下のような構成を取ることができる。該プライマーセットは、標的ポリヌクレオチドの増幅や検出に用いられる。
下記(i)〜(iii)のプライマーを含み、第1のプライマー及び第2のプライマーの総量に対する第3のプライマーの量が、モル比で1倍より大きい、プライマーセット、
(i)標的ポリヌクレオチドに対合する第1のプライマー
(ii)標的ポリヌクレオチドに、第1のプライマーと競合的に対合するが、第1のプライマーよりPCRによる伸長反応が起こりにくい第2のプライマー
(iii)第1のプライマーと対になって、標的ポリヌクレオチドを増幅可能に設計された
第3のプライマー。
【0059】
上記プライマーセットは、例えば、SNP部位を含む標的ポリヌクレオチドの増幅や検出に用いられる。この場合、第1のプライマーは、前記SNP部位の第1のアレル特異的ヌクレオチドに対応するヌクレオチドを3’末端から数えて1〜5番目の何れかに有し、第2のプライマーは、前記SNP部位の第2のアレル特異的ヌクレオチドに対応するヌクレオチドを3’末端から数えて1〜5番目の何れかに有する。
【0060】
その他、各プライマーの好ましい形態については、第一の本発明について説明したとおりである。一形態では、第1のプライマーのTm値は、第2のプライマーのTm値より高い。
第1のプライマー及び第2のプライマーの総量に対する第3のプライマーの量は、モル比で、好ましくは2倍より大きく、更に好ましくは4倍より大きく、より好ましくは8倍より大きい。
また、本発明は、上記(i)〜(iii)のプライマーを含み、第1のプライマー及び第2のプライマーの総量に対する第3のプライマーの量が、モル比で1倍より小さいプライマーセット、モル比で0.5倍より小さいプライマーセット、モル比で0.25倍より小さいプライマーセット、モル比で0.125倍より小さいプライマーセット等も提供する。
【0061】
第六の本発明であるプライマーセットの他の形態としては、例えば、以下のようなものが挙げられる。
下記(i)及び(ii)のプライマーを含み、第2のプライマーの量に対する第1のプライマーの量が、モル比で1倍より大きい、プライマーセット、
(i)前記標的ポリヌクレオチドに対合する第1のプライマー
(ii)前記標的ポリヌクレオチドに、第1のプライマーと競合的に対合するが、第1のプライマーよりPCRによる伸長反応が起こりにくい第2のプライマー
【0062】
第2のプライマーの量に対する第1のプライマーの量は、好ましくはモル比で2倍より大きい。第2のプライマーの量に対する第1のプライマーの量の上限は、好ましくはモル比で4倍である。
【0063】
さらに、本発明は、上述した(i)〜(iii)のプライマーを用いて標的ポリヌクレオチドを増幅し、増幅産物中の標的ポリヌクレオチドを検出する方法に用いる検出キットの製造方法を提供する。
該検出キットの製造方法は、上述した第一の本発明を用いて標的ポリヌクレオチドの増幅効率を調節し、調節された増幅効率を実現する量比の前記プライマーと、標的ポリヌクレオチドに相補的な配列からなり、末端が蛍光色素で標識されハイブリダイゼーションしたときに蛍光が増加又は減少するプローブとを組み合わせることを含む。このようなプローブについては、第一の本発明について説明したとおりである。
また、本発明は、第六の発明のプライマーセットと上記プローブを組み合わせた検出キットをも提供する。
【実施例】
【0064】
<実施例1>
配列番号1はJAK2遺伝子配列の部分配列である。配列番号1は、GenBankのAccession No. NG_009904の88381〜88680番目の配列に相当する。配列番号1に示す塩基配列のうち、18番目〜237番目からなるDNA断片をpT7Blue T-vectorのEcoR VサイトにTAクローニングで挿入し、EcoRIで線状化した。これを、野生型プラスミド(JAK2 Wt プラスミド)とした。また、配列番号1に示す塩基配列における147番目のグアニン(G)がチミン(T)に置換した配列からなるDNA断片を同様に処理し、変異型プラスミド(JAK2 V617F プラスミド)とした。サンプルは上記JAK2 Wt プラスミドとJAK2 V617F プラスミドを99:1で混合し
たものとした。
【0065】
上記サンプル104コピーを含み、表1に示すPCR反応液の各成分を、下記の濃度となるように混合したPCR反応液50μLを、全自動SNPs検査装置(商品名:i-densy (商標)、アークレイ社製)を用いて、PCR及びTm解析を行った。プライマーは、野生型JAK2プライマーFwt(3’末端が野生型ヌクレオチド、配列番号2)、変異型JAK2プライマーFmt(3’末端が変異型ヌクレオチド、配列番号3)、及びこれらと対になるJAK2プライマーR(配列番号4)を用いた。また、プローブは、3’末端が蛍光色素(TAMRA)、で標識された、二本鎖になると蛍光が減少するプローブ(配列番号5)を用いた。プライマー及びプローブの配列及び長さを表2に示す。表中、JAK2プライマーFwtとJAK2プライマーFmtの5’末端側の大文字で表すヌクレオチドからなる配列は、擬陽性を抑制するための付加配列である。
JAK2プライマーRの濃度を表3に示すように変えることで、JAK2プライマーFwtとJAK2プライマーFmtの総量とJAK2プライマーRの量比を変え、当該量比が変異型プラスミドの検出感度に与える影響を試験した。
PCR及びTm解析の条件は表4に示す通りである。また、Tm解析における励起波長及び検出波長は、それぞれ520〜555nm、585〜700nmであった。
【0066】
【表1】

【0067】
【表2】

【0068】
【表3】

【0069】
【表4】

【0070】
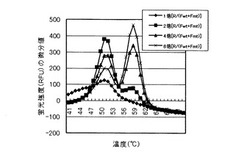
PCR及びTm解析の結果を図1に示す。図1の縦軸は蛍光強度(Relative Fluorescence Units (RFU))の微分値、横軸は温度(℃)である。51℃付近に見られるピークは、野生型プラスミドの存在に由来するピーク、59℃付近に見られるピークが、変異型プラスミドの存在に由来するピークである。
図1から判るように、JAK2プライマーFwtとJAK2プライマーFmtの総量に対するJAK2プライマーRの量(R/(Fwt+Fmt))が、2モル倍、4モル倍、8モル倍と大きくなるに従い、変異型プラスミドの存在に由来するピークが大きくなった。
これより、R/(Fwt+Fmt)が大きくなるほど変異型プラスミドの増幅効率が上がるという規則性が明らかとなった。
【0071】
<実施例2>
配列番号6はabl遺伝子配列の部分配列である。配列番号6は、GenBankのAccession No. NG_012034の158941〜159060番目の配列に相当する。配列番号6に示す塩基配列のうち、少なくとも19番目〜100番目の配列を含むDNA断片をpT7Blue T-vectorのEcoR VサイトにTAクローニングで挿入し、KpnIで線状化した。これを、野生型プラスミド(abl Wt プラスミド)とした。また、配列番号6に示す塩基配列における77番目のシトシン(C)がチミン(T)に置換した配列からなるDNA断片を同様に処理し、変異型プラスミド(abl C944T プラスミド)とした。サンプルは上記abl Wt プラスミドとabl C944T プラスミドを99:1で混合したものとした。
【0072】
上記サンプル104コピーを含み、表5に示すPCR反応液の各成分を、下記の濃度となるように混合したPCR反応液50μLを全自動SNPs検査装置(商品名:i-densy (商標)、アークレイ社製)を用いて、PCR及びTm解析を行った。プライマーは、野生型ablプライマーRwt(3’末端が野生型ヌクレオチド、配列番号8)、変異型ablプライマーRmt(3’末
端が変異型ヌクレオチド、配列番号9)、及びこれらと対になるablプライマーF(配列番号7)を用いた。また、プローブは、5’末端が蛍光色素(BODIPY FL)で標識され、3’末端がリン酸化された(表6中、“P”で示す。)、二本鎖になると蛍光が減少するプローブ(配列番号10)を用いた。プライマー及びプローブの配列及び長さを表6に示す。
ablプライマーFの濃度を表7に示すように変えることで、ablプライマーRwtとablプライマーRmtの総量とablプライマーFの量比を変え、当該量比が変異型プラスミドの検出感度に与える影響を試験した。
PCR及びTm解析の条件は表8に示す通りである。また、Tm解析における励起波長及び検出波長は、それぞれ420〜485nm、520〜555nmであった。
【0073】
【表5】

【0074】
【表6】

【0075】
【表7】

【0076】
【表8】

【0077】
PCR及びTm解析の結果を図2に示す。図2の縦軸は蛍光強度(Relative Fluorescence Units (RFU))の微分値、横軸は温度(℃)である。47℃付近に見られるピークは、野生型プラスミドの存在に由来するピーク、54℃付近に見られるピークが、変異型プラスミドの存在に由来するピークである。
図2から判るように、ablプライマーRwtとablプライマーRmtの総量に対するablプライマーFの量(F/(Rwt+Rmt))が、4モル倍、8モル倍と大きくなるに従い、変異型プラスミドの存在に由来するピークが大きくなった。
これより、F/(Rwt+Rmt)が大きくなるほど変異型プラスミドの増幅効率が上がるという規則性が明らかとなった。
【0078】
実施例1と実施例2で得られた結果から、アレル特異的な塩基を有するプライマーと、アレル非特異的なプライマーとの量比を調節することで、特定のアレル特異的な塩基を有するDNAの増幅効率を上げることができることが判った。
【0079】
<実施例3>
配列番号11はkit遺伝子配列の部分配列である。配列番号11は、GenBankのAccession No. NG_007456の75001〜75360番目の配列に相当する。配列番号11に示す塩基配列のうち、59番目〜358番目からなるDNA断片をpT7Blue T-vectorのEcoR VサイトにTAクローニングで挿入し、EcoRIで線状化した。これを、野生型プラスミド(kit Wt プラスミド)とした。また、配列番号11に示す塩基配列における228番目のアデニン(A)がチミン(T)に置換した配列からなるDNA断片を同様に処理し、変異型プラスミド(kit D617V プラスミド)とした。サンプルは上記kit Wt プラスミドとkit D617V プラスミドを99:1で混合したものとした。
【0080】
上記サンプル104コピーを含み、表9に示すPCR反応液の各成分を、下記の濃度となるように混合したPCR反応液50μLを全自動SNPs検査装置(商品名:i-densy (商標)、アークレイ社製)を用いて、PCR及びTm解析を行った。プライマーは、野生型kitプライマーFwt(3’末端が野生型ヌクレオチド、配列番号12)、変異型kitプライマーFmt(3’末端が変異型ヌクレオチド、配列番号13)、及びこれらと対になるkitプライマーR(配列番号14)を用いた。また、プローブは、5’末端が蛍光色素(TAMRA)で標識され、3'末端がリン酸化された、二本鎖になると蛍光が減少するプローブ(配列番号15)を用いた。プライマー及びプローブの配列及び長さを表10に示す。
kitプライマーFwtの濃度を表11に示すように変えることで、kitプライマーFwtとkitプライマーFmtの量比を変え、当該量比が変異型プラスミドの検出感度に与える影響を試験した。
PCR及びTm解析の条件は表12に示す通りである。また、Tm解析における励起波長及び検出波長は、それぞれ520〜555nm、585〜700nmであった。
【0081】
【表9】

【0082】
【表10】

【0083】
【表11】

【0084】
【表12】

【0085】
PCR及びTm解析の結果を図3に示す。図3の縦軸は蛍光強度(Relative Fluorescence Units (RFU))の微分値、横軸は温度(℃)である。48℃付近に見られるピークは、野生型プラスミドの存在に由来するピーク、56℃付近に見られるピークが、変異型プラスミドの存在に由来するピークである。
図3から判るように、kitプライマーFmtの量に対するkitプライマーFwtの量(Fwt/Fmt)が、2モル倍から1モル倍へと小さくなるに従い、変異型プラスミドの存在に由来するピークが大きくなった。
これより、Fwt/Fmtが小さくなるほど変異型プラスミドの増幅効率が上がるという規則性が明らかとなった。
【0086】
<実施例4>
実施例1で作製したJAK2 Wt プラスミドとJAK2 V617F プラスミドを99:1で混合したものをサンプルとし、表2に示す各種プライマー及びプローブを用いて、以下の試験を行った。
【0087】
上記サンプル104コピーを含み、表13に示すPCR反応液の各成分を、下記の濃度となるように混合したPCR反応液50μLを全自動SNPs検査装置(商品名:i-densy (商標)、アークレイ社製)を用いて、PCR及びTm解析を行った。
JAK2プライマーFmtの濃度を表14に示すように変えることで、JAK2プライマーFwtとJAK2プライマーFmtの量比を変え、当該量比が変異型プラスミドの検出感度に与える影響を試験した。
PCR及びTm解析の条件は表15に示す通りである。また、Tm解析における励起波長及び検出波長は、それぞれ520〜555nm、585〜700nmであった。
【0088】
【表13】

【0089】
【表14】

【0090】
【表15】

【0091】
PCR及びTm解析の結果を図4に示す。図4の縦軸は蛍光強度(Relative Fluorescence Units (RFU))の微分値、横軸は温度(℃)である。51℃付近に見られるピークは、野生型プラスミドの存在に由来するピーク、59℃付近に見られるピークが、変異型プラスミドの存在に由来するピークである。
図4から判るように、JAK2プライマーFmtの量に対するJAK2プライマーFwtの量(Fwt/Fmt)が、2モル倍から0.5モル倍へと小さくなるに従い、変異型プラスミドの存在に由来するピークが大きくなった。
これより、Fwt/Fmtが小さくなるほど変異型プラスミドの増幅効率が上がるという規則性が明らかとなった。
【0092】
実施例3と実施例4で得られた結果から、アレル特異的な塩基を有する複数のプライマー(第1のプライマーと第2のプライマー)の量比を調節することで、特定のアレル特異的な塩基を有するDNAの増幅効率を上げることができることが判った。
【0093】
<実施例5>
実施例3で作成したkit Wt プラスミドとkit D617V プラスミドを1:0、99:1、97:3、9:1で混合したサンプルをそれぞれWt、Mt1%、Mt3%、Mt10%のサンプルとした。本サンプルを104コピー含み、下表に示すPCR反応液の各成分を、下表の濃度となるように混合した50μLを全自動SNPs検査装置(商品名:i-densy (商標)、アークレイ社製)を用いて、PCR及びTm解析を行った。
【0094】
50μLのPCR反応液において:
1×反応バッファー
1.25U Taqポリメラーゼ
1.5mmol/L MgCl2
0.2mmol/L dNTP
0.25μmol/L kitプライマーFwt(表10)
0.25μmol/L kitプライマーFmt(表10)
0.2μmol/L kit mt プローブ(表10)
*kitプライマーR(表10)の濃度は下表参照
【0095】
【表16】

【0096】
その他の反応条件は実施例3と同じとした。
PCR及びTm解析の結果を図5に示す。図5の縦軸は蛍光強度(Relative Fluorescence Units (RFU))の微分値、横軸は温度(℃)である。48℃付近に見られるピークは、野生型プラスミドの存在に由来するピーク、56℃付近に見られるピークが、変異型プラスミドの存在に由来するピークである。
図5A〜Eから判るように、kitプライマーFwtとkitプライマーFmtの総量に対するkitプライマーRの量(R/(Fwt+Fmt))が、1モル倍(図5A)、2モル倍(図5B)、4モル倍(図5C)、8モル倍(図5D)、16モル倍(図5E)と大きくなるに従い、変異型プラスミドの存在に由来するピークが大きくなった。しかし、16モル倍の場合、野生型由来のピークがほとんど見られなくなった。
これより、R/(Fwt+Fmt)が大きくなるほど変異型プラスミドの増幅効率が上がるという規則性は明らかになったものの、16モル倍になると野生型由来のピークがほとんど見られなくなるため、反応不良との区別がつきにくくなるということが判った。
【0097】
<実施例6>
実施例1で作成したJAK2 WtプラスミドとJAK2 V617Fプラスミドを1:0、99:1、97:3、9:1で混合したサンプルをそれぞれWt、Mt1%、Mt3%、Mt10%のサンプルとした。本サンプルを104コピー含み、下表に示すPCR反応液の各成分を、下表の濃度となるように混合した50μLを全自動SNPs検査装置(商品名:i-densy (商標)、アークレイ社製)を用いて、PCR及びTm解析を行った。
【0098】
50μLのPCR反応液において:
1×反応バッファー
1.25U Taqポリメラーゼ
1.5mmol/L MgCl2
0.2mmol/L dNTP
0.25μmol/L JAK2プライマーFwt(表2)
0.25μmol/L JAK2プライマーFmt(表2)
0.2μmol/L JAK2 mt プローブ(表2)
*JAK2プライマーR(表2)の濃度は下表参照
【0099】
【表17】

【0100】
その他の反応条件は実施例1と同じとした。
PCR及びTm解析の結果を図6に示す。図6の縦軸は蛍光強度(Relative Fluorescence Units (RFU))の微分値、横軸は温度(℃)である。51℃付近に見られるピークは、野生型プラスミドの存在に由来するピーク、59℃付近に見られるピークが、変異型プラスミドの存在に由来するピークである。
図6A〜Eから判るように、JAK2プライマーFwtとJAK2プライマーFmtの総量に対するJAK2プライマーRの量(R/(Fwt+Fmt))が、1モル倍(図6A)、2モル倍(図6B)、4モル倍(図6C)、8モル倍(図6D)、16モル倍(図6E)と大きくなるに従い、変異型プラスミドの存在に由来するピークが大きくなった。
これより、R/(Fwt+Fmt)が大きくなるほど変異型プラスミドの増幅効率が上がるという規則性が明らかとなった。
【0101】
<実施例7>
実施例5で作成したWt、Mt1%、Mt3%、Mt10%のサンプルを104コピー含み、下表に示すPCR反応液の各成分を、下表の濃度となるように混合した50μLを全自動SNPs検査装置(商品名:i-densy (商標)、アークレイ社製)を用いて、PCR及びTm解析を行った。
【0102】
50μLのPCR反応液において:
1×反応バッファー
1.25U Taqポリメラーゼ
1.5mmol/L MgCl2
0.2mmol/L dNTP
1μmol/L kitプライマーR(表10)
0.2μmol/L kit mt プローブ(表10)
*kitプライマーFwt(表10)とkitプライマーFmt(表10)の濃度は下表参照
【0103】
【表18】

【0104】
その他の反応条件は実施例3と同じとした。
PCR及びTm解析の結果を図7に示す。図7の縦軸は蛍光強度(Relative Fluorescence Units (RFU))の微分値、横軸は温度(℃)である。48℃付近に見られるピークは、野生型プラスミドの存在に由来するピーク、56℃付近に見られるピークが、変異型プラスミドの存在に由来するピークである。
図7A〜Eから判るように、kitプライマーFmtの量に対するkitプライマーFwtの量(Fwt/Fmt)が、3モル倍(図7E)、2モル倍(図7D)、1モル倍(図7C)、1/2モル倍(図7B)、1/3モル倍(図7A)へと小さくなるに従い、変異型プラスミドの存在に由来するピークが大きくなった。
これより、Fwt/Fmtが小さくなるほど変異型プラスミドの増幅効率が上がるという規則性が明らかとなった。また、3モル倍の場合は野生型のピークがすべてのサンプルにおいてほとんど見られなくなることが明らかとなった。
【0105】
<実施例8>
実施例6で作成したWt、Mt1%、Mt3%、Mt10%のサンプルを104コピー含み、下表に示すPCR反応液の各成分を、下表の濃度となるように混合した50μLを全自動SNPs検査装置(商品名:i-densy (商標)、アークレイ社製)を用いて、PCR及びTm解析を行った。
【0106】
50μLのPCR反応液において:
1×反応バッファー
1.25U Taqポリメラーゼ
1.5mmol/L MgCl2
0.2mmol/L dNTP
1μmol/L JAK2プライマーR(表2)
0.2μmol/L JAk2 mt プローブ(表2)
*JAK2プライマーFwt(表2)とJAK2プライマーFmt(表2)の濃度は下表参照
【0107】
【表19】

【0108】
その他の反応条件は実施例1と同じとした。
PCR及びTm解析の結果を図8に示す。図8の縦軸は蛍光強度(Relative Fluorescence U
nits (RFU))の微分値、横軸は温度(℃)である。51℃付近に見られるピークは、野生型プラスミドの存在に由来するピーク、59℃付近に見られるピーク が、変異型プラスミドの存在に由来するピークである。
図8A〜Eから判るように、JAK2プライマーFmtの量に対するJAK2プライマーFwtの量(Fwt/Fmt)が、3モル倍(図8E)、2モル倍(図8D)、1モル倍(図8C)、1/2モル倍(図8B)、1/4モル倍(図8A)へと小さくなるに従い、変異型プラスミドの存在に由来するピークが大きくなった。
これより、Fwt/Fmtが小さくなるほど変異型プラスミドの増幅効率が上がるという規則性が明らかとなった。また、3モル倍の場合は野生型のピークがすべてのサンプルにおいてほとんど見られなくなることが明らかとなった。
【産業上の利用可能性】
【0109】
本発明は、種々の遺伝子の変異について、臨床的に利用価値のある検出感度を探るツールを提供する。
【技術分野】
【0001】
本発明は、標的ポリヌクレオチドの増幅効率を調節する方法、並びに標的ポリヌクレオチドの検出効率を調節する方法、これを用いた標的ポリヌクレオチドの検出方法に関する。また、本発明は疾患の試験方法及び診断方法にも関する。また、本発明は、標的ポリヌクレオチドの増幅に用いるプライマーセットの製造方法、標的ポリヌクレオチドの検出に用いるキットの製造方法にも関する。
【背景技術】
【0002】
アレル特異的PCR法(ASP-PCR法(Allele Specific Primer-PCR法))は、SNPs等の変異の検出に利用される方法である。典型的なアレル特異的PCR法は、変異アレルに特異的なヌクレオチドに対応するヌクレオチドを3’末端に有するプライマーと、これと対になってSNP部位を含む領域を増幅するプライマーをセットとして用い、変異アレルを含む標的ポリヌクレオチドを特異的に増幅することにより、変異アレルを検出しようとするものである(特許文献1)。
【0003】
しかしながら、上記のようなアレル特異的PCR法では、変異アレルを含む標的ポリヌクレオチドを特異的に増幅するために厳密なPCR条件の設定が必要であり、そのため高い検出感度を得ることが困難であるという問題があった(特許文献2)。
【0004】
このような問題を解決する技術として、典型的なアレル特異的PCR法の応用技術である、(i)3'末端から数えて2塩基目及び3塩基目の一方のみに前記SNP部位として野生型ヌクレオチドを有する以外は、前記標的核酸内のSNP部位を含む部分領域と同一の塩基配列を有する第1の順方向プライマーと、(ii)3'末端から数えて2塩基目及び3塩基目の一方のみに前記SNP部位として変異型ヌクレオチドを有する以外は、前記標的核酸内のSNP部位を含む部分領域と同一の塩基配列を有する第2の順方向プライマーと、(iii)前記標的核酸の相補鎖の、前記SNP部位よりも5'末端側で、前記SNP部位に対応する部位を含まない部分領域と同一の塩基配列を有する逆方向プライマーとを用いて前記標的核酸のPCR反応を行うことを特徴とする核酸増幅方法が知られている(特許文献2)。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特許第2853864号公報
【特許文献2】特開2010−35532号公報
【発明の概要】
【発明が解決しようとする課題】
【0006】
ところで、遺伝子における変異の存在又は非存在を検出することにより、該変異が関連する疾患の可能性を測定する場合には、疾患の診断に利用できる意義ある検出結果を得る目的から、種々の検出感度での前記変異の検出結果と、該変異が関連する疾患に関する臨床的知見との関係を分析し、診断に利用できる検出を行うための検出感度の基準を定めることが必要である。
【0007】
検出感度を調節するためのアプローチとして、検出の目的とする変異に応じてプライマーの設計を工夫することで、変異アレルを含む標的ポリヌクレオチドの増幅効率を調節することが、通常考えられる。しかしながら、このようなアプローチでは、プライマーの設計、プライマーの作製、増幅効率の確認の作業を繰り返すことが必要であり、多大な労力を要する場合が多い。
【0008】
そこで、本発明は、標的ポリヌクレオチドを増幅する技術において、簡便に標的ポリヌクレオチドの増幅効率を調節する技術を提供することを課題とする。
【課題を解決するための手段】
【0009】
本発明は、前記課題を解決する手段として、下記(i)〜(iii)のプライマーを用いて、PCRにより標的ポリヌクレオチドを増幅する際の、該標的ポリヌクレオチドの増幅効率を調節する方法であって、下記(i)〜(iii)のプライマーの量比を調節することにより、標的ポリヌクレオチドの増幅効率を調節することを含む、方法を提供する。
各プライマーは以下の通りである。
(i)標的ポリヌクレオチドに対合する第1のプライマー
(ii)標的ポリヌクレオチドに、第1のプライマーと競合的に対合するが、第1のプライマーよりPCRによる伸長反応が起こりにくい第2のプライマー
(iii)第1のプライマーと対になって、標的ポリヌクレオチドを増幅可能に設計された第3のプライマー
上記方法により、標的ポリヌクレオチドの増幅効率を簡便に調節することができる。
【0010】
前記プライマーの量比として、第1のプライマーと第2のプライマーの総量に対する第3のプライマーの量、第2のプライマーの量に対する第1のプライマーの量が挙げられる。このようにプライマーの量比を調節することにより、簡便に標的ポリヌクレオチドの増幅効率を調節することができる。
【0011】
また、本発明は、前記(i)〜(iii)のプライマーを用いて、PCRにより標的ポリヌクレオチドを増幅し、得られた増幅産物を用いて該標的ポリヌクレオチドを検出する際の、該標的ポリヌクレオチドの検出効率(検出感度)を調節する方法であって、本発明の増幅効率の調節方法を用いることにより、該標的ポリヌクレオチドの検出効率(検出感度)を調節する方法を提供する。
上記方法により、標的ポリヌクレオチドの検出効率を簡便に調節することができる。
【0012】
また、本発明は、上記方法で標的ポリヌクレオチドの検出効率を調節し、調節された検出効率を実現する量比の前記(i)〜(iii)のプライマーを用いてPCRを行い、得られたPCR増幅産物中の標的ポリヌクレオチドを検出することを含む、標的ポリヌクレオチドの検出方法を提供する。
上記検出方法により、適切な検出感度で簡便に、標的ポリヌクレオチドの検出を行うことができる。
【0013】
また、本発明は、上記検出方法を用いて、被験者に由来する遺伝子における変異の存在又は非存在を検出し、得られた検出結果を、該変異が検出された場合には前記被験者が該変異の存在により起こる疾患を有する可能性があるという基準と比較することにより、前記変異の存在により起こる疾患の可能性を試験することを含む、試験方法を提供する。
上記試験方法により、臨床上意義の小さい試験結果が得られる可能性を低減させることができる。
【0014】
また、本発明は、上記検出方法を用いて、被験者に由来する遺伝子における変異の存在又は非存在を検出し、得られた検出結果と、該変異の有無及び特定の医薬の効果の関係と、を比較することにより、前記被験者に対する前記特定の医薬の効果を予測することを含む、薬効の予測方法を提供する。
上記薬効の予測方法により、投薬に際し薬効を予測することができ、効果的な投薬を可能にすることが期待される。
【0015】
さらに、本発明は、上記試験方法により得られた試験結果に基づいて、疾患を診断することを含む、疾患の診断方法を提供する。
上記診断方法により、不適切な診断結果が得られる可能性を低減させることができる。
【0016】
また、本発明は、標的ポリヌクレオチドをPCRにより増幅又は検出するためのプライマーセットの製造方法を提供する。該製造方法は、上記方法を用いて標的ポリヌクレオチドの増幅効率を調節し、調節された増幅効率を実現する量比の前記(i)〜(iii)のプライマーを組み合わせることを含む。
上記製造方法により、標的ポリヌクレオチドの任意の増幅効率、検出効率を実現するプライマーセットを簡便に製造することができる。
【0017】
また、本発明は、標的ポリヌクレオチドを、PCRを用いて検出するための検出キットの製造方法を提供する。該製造方法は、上記方法を用いて標的ポリヌクレオチドの増幅効率を調節し、調節された増幅効率を実現する量比の前記(i)〜(iii)のプライマーと、標的ポリヌクレオチドに相補的な配列からなり、末端が蛍光色素で標識されハイブリダイゼーションしたときに蛍光が増加又は減少するプローブと、を組み合わせることを含む。
上記製造方法により、標的ポリヌクレオチドの任意の検出効率を実現する検出キットを簡便に製造することができる。
【0018】
また、本発明は、前記(i)〜(iii)のプライマーを含み、第1のプライマー及び第2のプライマーの総量に対する第3のプライマーの量が、モル比で1倍より大きい、プライマーセットを提供する。
また、本発明は、前記(i)〜(iii)のプライマーを含み、第1のプライマー及び第2のプライマーの総量に対する第3のプライマーの量が、モル比で1倍より小さい、プライマーセットを提供する。
【発明の効果】
【0019】
本発明は、簡便に標的ポリヌクレオチドの増幅効率を調節することを可能にする。また、本発明は、標的ポリヌクレオチドの検出効率(検出感度)を簡便に調節することを可能にする。標的ポリヌクレオチドの検出感度を適切に設定することにより、標的ポリヌクレオチドが関連する疾患の可能性の測定、疾患の診断を、より的確なものとすることができることが期待される。
【図面の簡単な説明】
【0020】
【図1】第1のプライマーと第2のプライマーの総量と、第3のプライマーとの量比が変異型プラスミド(標的ポリヌクレオチド)の検出感度に与える影響を示す図である。
【図2】第1のプライマーと第2のプライマーの総量と、第3のプライマーとの量比が変異型プラスミド(標的ポリヌクレオチド)の検出感度に与える影響を示す図である。
【図3】第1のプライマーと第2のプライマーとの量比が変異型プラスミド(標的ポリヌクレオチド)の検出感度に与える影響を示す図である。
【図4】第1のプライマーと第2のプライマーとの量比が変異型プラスミド(標的ポリヌクレオチド)の検出感度に与える影響を示す図である。
【図5A】第1のプライマーと第2のプライマーの総量と、第3のプライマーとの量比が変異型プラスミド(標的ポリヌクレオチド)の検出感度に与える影響を示す図である。量比(R/(Fwt+Fmt))はモル比で1倍。
【図5B】第1のプライマーと第2のプライマーの総量と、第3のプライマーとの量比が変異型プラスミド(標的ポリヌクレオチド)の検出感度に与える影響を示す図である。量比(R/(Fwt+Fmt))はモル比で2倍。
【図5C】第1のプライマーと第2のプライマーの総量と、第3のプライマーとの量比が変異型プラスミド(標的ポリヌクレオチド)の検出感度に与える影響を示す図である。量比(R/(Fwt+Fmt))はモル比で4倍。
【図5D】第1のプライマーと第2のプライマーの総量と、第3のプライマーとの量比が変異型プラスミド(標的ポリヌクレオチド)の検出感度に与える影響を示す図である。量比(R/(Fwt+Fmt))はモル比で8倍。
【図5E】第1のプライマーと第2のプライマーの総量と、第3のプライマーとの量比が変異型プラスミド(標的ポリヌクレオチド)の検出感度に与える影響を示す図である。量比(R/(Fwt+Fmt))はモル比で16倍。
【図6A】第1のプライマーと第2のプライマーの総量と、第3のプライマーとの量比が変異型プラスミド(標的ポリヌクレオチド)の検出感度に与える影響を示す図である。量比(R/(Fwt+Fmt))はモル比で1倍。
【図6B】第1のプライマーと第2のプライマーの総量と、第3のプライマーとの量比が変異型プラスミド(標的ポリヌクレオチド)の検出感度に与える影響を示す図である。量比(R/(Fwt+Fmt))はモル比で2倍。
【図6C】第1のプライマーと第2のプライマーの総量と、第3のプライマーとの量比が変異型プラスミド(標的ポリヌクレオチド)の検出感度に与える影響を示す図である。量比(R/(Fwt+Fmt))はモル比で4倍。
【図6D】第1のプライマーと第2のプライマーの総量と、第3のプライマーとの量比が変異型プラスミド(標的ポリヌクレオチド)の検出感度に与える影響を示す図である。量比(R/(Fwt+Fmt))はモル比で8倍。
【図6E】第1のプライマーと第2のプライマーの総量と、第3のプライマーとの量比が変異型プラスミド(標的ポリヌクレオチド)の検出感度に与える影響を示す図である。量比(R/(Fwt+Fmt))はモル比で16倍。
【図7A】第1のプライマーと第2のプライマーとの量比が変異型プラスミド(標的ポリヌクレオチド)の検出感度に与える影響を示す図である。量比(Fwt/Fmt)はモル比で1/3倍。
【図7B】第1のプライマーと第2のプライマーとの量比が変異型プラスミド(標的ポリヌクレオチド)の検出感度に与える影響を示す図である。量比(Fwt/Fmt)はモル比で1/2倍。
【図7C】第1のプライマーと第2のプライマーとの量比が変異型プラスミド(標的ポリヌクレオチド)の検出感度に与える影響を示す図である。量比(Fwt/Fmt)はモル比で1倍。
【図7D】第1のプライマーと第2のプライマーとの量比が変異型プラスミド(標的ポリヌクレオチド)の検出感度に与える影響を示す図である。量比(Fwt/Fmt)はモル比で2倍。
【図7E】第1のプライマーと第2のプライマーとの量比が変異型プラスミド(標的ポリヌクレオチド)の検出感度に与える影響を示す図である。量比(Fwt/Fmt)はモル比で3倍。
【図8A】第1のプライマーと第2のプライマーとの量比が変異型プラスミド(標的ポリヌクレオチド)の検出感度に与える影響を示す図である。量比(Fwt/Fmt)はモル比で1/4倍。
【図8B】第1のプライマーと第2のプライマーとの量比が変異型プラスミド(標的ポリヌクレオチド)の検出感度に与える影響を示す図である。量比(Fwt/Fmt)はモル比で1/2倍。
【図8C】第1のプライマーと第2のプライマーとの量比が変異型プラスミド(標的ポリヌクレオチド)の検出感度に与える影響を示す図である。量比(Fwt/Fmt)はモル比で1倍。
【図8D】第1のプライマーと第2のプライマーとの量比が変異型プラスミド(標的ポリヌクレオチド)の検出感度に与える影響を示す図である。量比(Fwt/Fmt)はモル比で2倍。
【図8E】第1のプライマーと第2のプライマーとの量比が変異型プラスミド(標的ポリヌクレオチド)の検出感度に与える影響を示す図である。量比(Fwt/Fmt)はモル比で3倍。
【発明を実施するための形態】
【0021】
本発明について、好ましい形態を例示しながら説明する。
第一の本発明は、下記(i)〜(iii)のプライマーを用いて、PCRにより標的ポリヌクレオチドを増幅する際の、該標的ポリヌクレオチドの増幅効率を調節する方法に関する。
本発明の特徴は、下記(i)〜(iii)のプライマーの量比を調節することにより、標的ポリヌクレオチドの増幅効率を調節する点にある。
各プライマーは以下の通りである。
(i)標的ポリヌクレオチドに対合する第1のプライマー
(ii)標的ポリヌクレオチドに、第1のプライマーと競合的に対合するが、第1のプライマーよりPCRによる伸長反応が起こりにくい第2のプライマー
(iii)第1のプライマーと対になって、標的ポリヌクレオチドを増幅可能に設計された第3のプライマー
【0022】
「標的ポリヌクレオチド」は、例えば、変異を含むポリヌクレオチドである。この場合の変異は、置換、欠失、挿入の何れをも含む。変異としては、例えば一塩基置換が挙げられる。本発明は、SNP部位を含むポリヌクレオチドにおける、変異アレルを含む標的ポリヌクレオチドの増幅効率を調節するのに好適である。
【0023】
第1のプライマーについて、「標的ポリヌクレオチドに対合し」の用語は、PCRにおいて、伸長反応が起こるように、PCRのアニーリング条件において標的ポリヌクレオチドにハイブリダイズすることを意味する。但し、当業者に明らかであるように、標的ポリヌクレオチドの部分領域の配列に完全に相補的である必要はない。第1のプライマーは、標的ポリヌクレオチドのセンス鎖に対合するものであっても、標的ポリヌクレオチドのアンチセンス鎖に対合するものであってもよい。第1のプライマーの設計は、標的ポリヌクレオチドの配列に応じて設計する。
【0024】
第1のプライマーは、通常、プライマーの3’末端側、例えば、3’末端から数えて1〜5番目程度の領域(以下、「3’末端領域」という場合がある。)に、標的ポリヌクレオチドに対合するヌクレオチドを配置することが挙げられる。なお、本明細書において、「3’末端から数えて1〜5番目」という場合は、3’末端を1番目として数える。このようなプライマーの設計は、当業者であれば適宜行うことができる。
【0025】
例えば、標的ポリヌクレオチドが、ヌクレオチドの置換を有する変異型ポリヌクレオチドである場合には、第1のプライマーは、置換したヌクレオチドを上記3’末端の領域に配置すればよい。
標的ポリヌクレオチドがSNP部位を含む場合には、第1のプライマーは、前記SNP部位の第1のアレル特異的ヌクレオチドに対応するヌクレオチドを3’末端から数えて1〜5番目の何れか、好ましくは1〜3番目の何れか、更に好ましくは1又は2番目の何れか、最も好ましくは、3’末端に有し、前記SNP部位を含む領域にハイブリダイズする。ここで、「第1のアレル特異的ヌクレオチドに対応するヌクレオチド」の用語は、第1のプライマーがセンス鎖にハイブリダイズするものである場合には、第1のアレル特異的ヌクレオチドに相補的なヌクレオチドを意味し、第1のプライマーがアンチセンス鎖にハイブリダイズするものである場合には、第1のアレル特異的ヌクレオチドと同一のヌクレオチドを意味する。なお、「第1のアレル特異的ヌクレオチド」は、後述する「第2のアレル特異的ヌクレオチド」との組み合わせによって規定されるものであり、例えば、第1のアレル特異的ヌクレオチドが変異ヌクレオチドであって第2のアレル特異的ヌクレオチドが野生ヌクレオチドである組み合わせ、又はその逆の組み合わせの他、第1のアレル特異的ヌク
レオチドが第1の変異ヌクレオチドであって、第2のアレル特異的ヌクレオチドが第2の変異ヌクレオチドである組み合わせが挙げられる。
【0026】
また、標的ポリヌクレオチドが、ヌクレオチドの挿入を有する変異型ポリヌクレオチドである場合も、上記置換の場合と同様に設計することができ、挿入されたヌクレオチドに対合するヌクレオチドを上記3’末端の領域に配置すればよい。
また、標的ポリヌクレオチドが、ヌクレオチドの欠失を有する変異型ポリヌクレオチドである場合は、欠失部位の前後を含む領域に対合するヌクレオチドを上記3’末端の領域に配置すればよい。
【0027】
第2のプライマーについて、「標的ポリヌクレオチドに第1のプライマーと競合的に対合する」とは、PCRのアニーリング条件において、第1のプライマーが対合する標的ポリヌクレオチドの領域に、第1のプライマーと競合しながら対合することを意味する。従って、第2のプライマーは、第1のプライマーに対して、通常60〜95%程度の相同性を有する。ここで、第2のプライマーは、第1のプライマーよりPCRによる伸長反応が起こりにくい。このような第2のプライマーの設計は、標的ポリヌクレオチドの配列、及び第1のプライマーの配列を考慮して行うことができる。一般的には、PCRの伸長方向(3’末端側)に、標的ポリヌクレオチドに対合しないヌクレオチドを配置することが挙げられる。また、第2のプライマーのTm値が第1のプライマーのTm値より小さくなるように配列を設計することが挙げられる。このようなプライマーの設計は、当業者であれば適宜行うことができる。通常、プライマーの3’末端側、例えば、3’末端から数えて1〜5番目程度の領域(以下「3’末端領域」という場合がある。)に、標的ポリヌクレオチドに対合しないヌクレオチドを配置する。例えば、標的ポリヌクレオチドが、変異を含むポリヌクレオチドである場合には、第2のプライマーは、上記3’末端領域に変異部分の配列に対合するヌクレオチドでなく、野生型の配列に対合するヌクレオチドを配置することが挙げられる。
【0028】
標的ポリヌクレオチドがSNP部位を含む場合には、第2のプライマーは、前記SNP部位の第2のアレル特異的ヌクレオチドに対応するヌクレオチドを3’末端から数えて1〜5番目の何れか、好ましくは1〜3番目の何れか、更に好ましくは1又は2番目の何れか、最も好ましくは、3’末端に有し、前記SNP部位を含む領域にハイブリダイズする。
【0029】
第3のプライマーは、第1のプライマーと対になって、標的ポリヌクレオチドを増幅可能に設計されるものである。すなわち、第1のプライマーによる伸長方向の下流の領域の、第1のプライマーが対合するポリヌクレオチド鎖の相補鎖に対合するように設計されたものである。
【0030】
各々のプライマーの長さ及びTm値は、標的ポリヌクレオチドの配列に応じて適宜設計することができる。通常は10〜40merで40〜70℃、好ましくは15〜30merで50〜60℃である。なお、Tm値は最近接塩基対(Nearest Neighbor)法により算出した値である。
【0031】
本発明の一形態では、第1のプライマーのTm値が、第2のプライマーのTm値より高い。なお、Tm値は最近接塩基対(Nearest Neighbor)法により算出した値である。この場合、第1のプライマーのTm値と、第2のプライマーのTm値の差は、好ましくは0.1〜10℃、更に好ましくは0.5〜5℃である。第1のプライマーのTm値が、第2のプライマーのTm値より高い場合には、本発明の方法により、標的ポリヌクレオチドの増幅効率を上げることが容易になる。
Tm値は、CG含有量及びヌクレオチド数から求めることができる。第1のプライマーのTm値を、第2のプライマーのTm値より高く設計する最も簡便な方法としては、第1のプライマーの長さを第2のプライマーの長さより長くする。例えば、第1のプライマーの長さを
第2のプライマーの長さより1〜10塩基程度、好ましくは2〜5塩基程度長くする方法が挙げられる。
【0032】
また、第1のプライマー5’末端と第2のプライマーの5’末端に、それぞれ、数塩基からなる異なる配列のオリゴヌクレオチドを付加することが好ましい。この付加配列は、通常1〜20塩基程度、好ましくは3〜10塩基程度の長さを有する。これは、第1のプライマーが標的ポリヌクレオチドとは異なるポリヌクレオチドにハイブリダイズし、標的ポリヌクレオチド以外のヌクレオチドを鋳型として増幅する可能性を低くし、標的ポリヌクレオチドの増幅効率の調節をより確実に行うためである。
【0033】
第一の本発明の一形態では、第1のプライマーのTm値が、第2のプライマーのTm値より高い場合に、第1のプライマー及び第2のプライマーの総量に対する第3のプライマーの量を大きくすることにより、標的ポリヌクレオチドの増幅効率を上げることができる。
【0034】
反対に、第1のプライマー及び第2のプライマーの総量に対する第3のプライマーの量を小さくすることにより、標的ポリヌクレオチドの増幅効率を下げることができる。
【0035】
すなわち、プライマー量比を前記の方法で変えることにより、標的ポリヌクレオチドの増幅効率を上げたり下げたりすることができる。
【0036】
該形態において、具体的には、第1のプライマー及び第2のプライマーの総量に対する第3のプライマーの量をモル比で1倍より大きくすることにより、標的ポリヌクレオチドの増幅効率を上げることができる。従来の、本発明と同様の系を持つPCR法(例えば特許文献2)では、フォワードプライマーとリバースプライマーの量比は、モル比で約1:1であったので、第1のプライマー及び第2のプライマーの総量に対する第3のプライマーの量をモル比で1倍より大きくすることにより、従来のPCR法での標的ポリヌクレオチドの増幅効率に比して、該標的ポリヌクレオチドの増幅効率を上げることができる。
【0037】
また、第1のプライマー及び第2のプライマーの総量に対する第3のプライマーの量をモル比で2倍より大きくすることにより、更に標的ポリヌクレオチドの増幅効率を上げることができる。また、実施例からも明らかなように、第1のプライマー及び第2のプライマーの総量に対する第3のプライマーの量をモル比で4倍より大きく、更にはモル比で8倍より大きくすることにより、更に標的ポリヌクレオチドの増幅効率を上げることができる。
【0038】
また、具体的には、第1のプライマー及び第2のプライマーの総量に対する第3のプライマーの量をモル比で1倍より小さくすることにより、標的ポリヌクレオチドの増幅効率を下げることができる。従来の、本発明と同様の系を持つPCR法(例えば特許文献2)では、フォワードプライマーとリバースプライマーの量比は、モル比で約1:1であったので、第1のプライマー及び第2のプライマーの総量に対する第3のプライマーの量をモル比で1倍より小さくすることにより、従来のPCR法での標的ポリヌクレオチドの増幅効率に比して、該標的ポリヌクレオチドの増幅効率を下げることができる。
【0039】
また、第1のプライマー及び第2のプライマーの総量に対する第3のプライマーの量をモル比で0.5倍より小さくすることにより、更に標的ポリヌクレオチドの増幅効率を下げることができる。また、第1のプライマー及び第2のプライマーの総量に対する第3のプライマーの量をモル比で0.25倍より小さく、更にはモル比で0.125倍より小さくすることにより、更に標的ポリヌクレオチドの増幅効率を下げることができる。
【0040】
第一の本発明の他の形態では、第2のプライマーの量に対する第1のプライマーの量を大きくすることにより、前記標的ポリヌクレオチドの増幅効率を上げることができる。
【0041】
反対に、第2のプライマーの量に対する第1のプライマーの量を小さくすることにより、前記標的ポリヌクレオチドの増幅効率を下げることができる。
すなわち、プライマーの量比を前記の方法で変えることにより、前記標的ポリヌクレオチドの増幅効率を上げたり下げたりすることができる。
【0042】
該形態において、具体的には、第2のプライマーの量に対する第1のプライマーの量を、モル比で1倍より大きくすることにより、前記標的ポリヌクレオチドの増幅効率を上げることができる。
なお、従来の、本発明と同様の系を持つPCR法(例えば特許文献2)では、第1のプライマーと第2のプライマーの量比は、モル比で約1:1であるので、第2のプライマーの量に対する第1のプライマーの量を、モル比で1倍より大きくすることにより、従来のPCR法での標的ポリヌクレオチドの増幅効率に比して、該標的ポリヌクレオチドの増幅効率を上げることができる。
【0043】
また、第2のプライマーの量に対する第1のプライマーの量を、モル比で2倍より大きくすることにより、更に前記標的ポリヌクレオチドの増幅効率を上げることができる。
【0044】
第2のプライマーの量に対する第1のプライマーの量の上限は、好ましくはモル比で4倍である。
【0045】
また、第2のプライマーの量に対する第1のプライマーの量を調節する形態に、上述した第1のプライマー及び第2のプライマーの総量に対する前記第3のプライマーの量を調節する形態を組み合わせる形態も好ましい。
【0046】
上記の方法により、標的ポリヌクレオチドの増幅効率を調節することにより、当該標的ポリヌクレオチドの増幅の目的に応じた増幅効率を実現するプライマー量比を決定することができる。すなわち、本発明は、上記(i)〜(iii)のプライマーを用いたPCRにより標的ポリヌクレオチドを増幅する際の、プライマー量比を決定する方法をも提供する。
このようにして決定した量比のプライマーを用いてPCRを行うことにより、標的ポリヌクレオチドの目的に応じた増幅効率を実現することができる。
すなわち、本発明は、上記方法で標的ポリヌクレオチドの増幅効率を調節し、調節された増幅効率を実現する量比の前記(i)〜(iii)のプライマーを用いてPCRを行うことを含む、標的ポリヌクレオチドの増幅方法を提供する。
【0047】
上述した第一の本発明により、PCRにおける標的ポリヌクレオチドの増幅効率を調節することができる。そして、第一の本発明を用いて、標的ポリヌクレオチドの増幅効率を調節することにより、該標的ポリヌクレオチドの検出効率(検出感度)を調節することができる。
すなわち、第二の本発明は、前記(i)〜(iii)のプライマーを用いて、PCRにより標的ポリヌクレオチドを増幅し、得られた増幅産物を用いて該標的ポリヌクレオチドを検出する際の、該標的ポリヌクレオチドの検出効率(検出感度)を調節する方法であって、本発明の増幅効率の調節方法を用いることにより、該標的ポリヌクレオチドの検出効率(検出感度)を調節する方法である。
【0048】
プライマーの量比の調節方法の形態については、第一の本発明について説明したとおりである。すなわち、上述したプライマーの量比の調節により、標的ポリヌクレオチドの増幅効率を高めるほど、該標的ポリヌクレオチドの検出感度が高くなるという関係にある。
【0049】
上記の方法により、標的ポリヌクレオチドの検出効率(検出感度)を調節することにより、当該標的ポリヌクレオチドの検出の目的に応じた検出効率を実現するプライマー量比を決定することができる。すなわち、本発明は、上記(i)〜(iii)のプライマーを用いたPCRにより標的ポリヌクレオチドを検出する際の、プライマー量比を決定する方法をも提供する。
このようにして決定した量比のプライマーを用いてPCRを行い、得られたPCR増幅産物中の標的ポリヌクレオチドを検出することにより、目的に応じた検出効率を実現することができる。
すなわち、本発明は、上記方法で標的ポリヌクレオチドの検出効率を調節し、調節された検出効率を実現する量比の前記(i)〜(iii)のプライマーを用いてPCRを行い、得られたPCR増幅産物中の標的ポリヌクレオチドを検出することを含む、標的ポリヌクレオチドの検出方法を提供する。
【0050】
標的ポリヌクレオチドを検出する方法としては、公知の方法を用いることができ、例えば、融解曲線分析(Tm解析)、シーケンシング、電気泳動などを用いることができる。中でも、融解曲線分析(Tm解析)による検出が好ましい。これは、Tm解析を行う場合には、標的ポリヌクレオチドの増幅産物を特に処理を施すことなく、増幅産物を含む反応液をそのまま解析に付すことができるためである。また、増幅とTm解析を連続的に行う機器(実施例を参照)も実用化されているので、簡便である。
【0051】
Tm解析には標的ポリヌクレオチドに相補的な配列からなり、末端が蛍光色素で標識され標的ポリヌクレオチドにハイブリダイゼーションし、二本鎖になったときに蛍光が増加又は減少するプローブ(Probe)や二本鎖DNAにインターカレートするSYBR-Green (SYBR:登録商標)や2種類の近接するプローブで蛍光共鳴エネルギー転移(FRET)を起こすHybProbeを用いることができる。末端が蛍光色素で標識され標的ポリヌクレオチドにハイブリダイゼーションし、二本鎖になったときに蛍光が減少するプローブとしては、DNAのグアニン塩基が近づくと蛍光が消光する蛍光色素を用いた蛍光DNAプローブ、いわゆるQProbe(登録商標)を用いる方法(http://unit.aist.go.jp/brf/ci/research_result/aist_today/vol08_02_p18_p19.pdf、WO2008117782)が挙げられる。このようなプローブに用いられる蛍光色素は公知であり、このようなプローブを作製する方法も公知である。ここで、「標的ポリヌクレオチドに相補的な配列」とは、上記検出方法における通常の条件において、標的ポリヌクレオチドにハイブリダイズすることができる程度に相補的であれば足り、完全に相補的である必要はない。
また、二本鎖になったときに蛍光が減少するプローブに用いられる蛍光色素としては、Invitrogen社製のPacific Blue、TAMRA、BODIPY FL等が挙げられる。プローブの長さは、検出の標的となるポリヌクレオチドに応じて適宜設計することができるが、通常は10〜40mer程度である。
【0052】
Tm解析は、反応液を段階的に昇温していく際に検出される蛍光強度を測定することで行うことができる。蛍光強度の測定は、用いる蛍光色素に応じた波長の励起光を用い発光波長の光を測定することにより行う。Tm解析における昇温は、通常0.1〜1℃/5秒のスピードである。Tm解析を行うときの反応液の組成は、プローブとその塩基配列に相補的な配列を有するポリヌクレオチドとのハイブリダイゼーションが可能であれば特に制限されないが、通常は、一価の陽イオン濃度が1.5〜50mM、pHが7〜9である。PCR等のDNAポリメラーゼを用いた増幅方法の反応液は、通常、この条件を満たすので、増幅に用いた反応液をそのままTm解析に用いることができる。
【0053】
続いて、Tm解析の結果に基づいて、標的ポリヌクレオチドを検出する。Tm解析の結果に基づく標的ポリヌクレオチドの検出は、通常の方法により行うことができる。本発明にお
いて「検出」とは、標的ポリヌクレオチドの有無の検出の他、サンプルにおける標的ポリヌクレオチドの定量、サンプルにおける標的ポリヌクレオチドとその他のポリヌクレオチドの比率の測定を含む概念である。
【0054】
また、前記検出方法を用いることで、被験者に由来する遺伝子における変異の存在又は非存在を検出することが可能となる。すなわち、第三の本発明は、前記検出方法により得られた検出結果を、該変異が検出された場合には前記被験者が該変異の存在により起こる疾患を有する可能性があるという基準と比較することにより、前記変異の存在により起こる疾患の可能性を試験することを含む、試験方法である。また、本発明は、上記の試験結果に基づいて、疾患を診断する方法も提供する。
【0055】
第四の本発明は、前記検出方法により得られた検出結果と、該変異の有無及び特定の医薬の効果の関係と、を比較することにより、前記被験者に対する前記特定の医薬の効果を予測することを含む、薬効の予測方法である。すなわち、特定の変異と特定の医薬の効果との関係が知られている場合に、特定の変異の有無を検出することにより、前記関係を参照することにより、特定の医薬の効果を予測することが可能となる。
例えば、分子標的薬ゲフィチニブはEGFR遺伝子に特定の変異(exon21のL858Rの変異等)があると奏効率が高くなることが知られている。また、分子標的薬セツキシマブはkras遺伝子のcodon12又は13の変異やbraf遺伝子のV600E変異があると薬が効かなくなることが知られている。すなわち、本発明の検出方法を用いて、EGFR遺伝子の上記変異を検出することにより、被験者に対するゲフィチニブの薬効を予測することができる。また、本発明の検出方法を用いて、kras遺伝子またはbraf遺伝子の上記変異を検出することにより、被験者に対するセツキシマブの薬効を予測することができる。
【0056】
また、本発明は、上述した(i)〜(iii)のプライマーを用いて標的ポリヌクレオチドを増幅する方法に用いるプライマーセットの製造方法を提供する。
すなわち、第五の本発明は、上述した第一の本発明を用いて標的ポリヌクレオチドの増幅効率を調節し、調節された増幅効率を実現する量比の前記プライマーを組み合わせることを含む、プライマーセットの製造方法である。
このような製造方法によれば、標的ポリヌクレオチドの増幅や検出に適したプライマーセットを提供することが可能になる。
ここで、「組み合わせる」には、前記プライマーを混合する形態のほか、使用時に混合できるように別個に含める形態などがある。
【0057】
また、本発明は、上述した(i)〜(iii)のプライマーを用いて標的ポリヌクレオチドを増幅する方法に用いるプライマーセットの設計方法を提供する。
すなわち、本発明の他の形態は、上述した第一の本発明を用いて標的ポリヌクレオチドの増幅効率を調節し、調節された増幅効率を実現するプライマー量比を決定し、プライマーセットを設計する方法である。
このような設計方法によれば、標的ポリヌクレオチドの増幅や検出に適したプライマーセットを簡便に設計することが可能になる。
【0058】
第六の本発明であるプライマーセットは、例えば、以下のような構成を取ることができる。該プライマーセットは、標的ポリヌクレオチドの増幅や検出に用いられる。
下記(i)〜(iii)のプライマーを含み、第1のプライマー及び第2のプライマーの総量に対する第3のプライマーの量が、モル比で1倍より大きい、プライマーセット、
(i)標的ポリヌクレオチドに対合する第1のプライマー
(ii)標的ポリヌクレオチドに、第1のプライマーと競合的に対合するが、第1のプライマーよりPCRによる伸長反応が起こりにくい第2のプライマー
(iii)第1のプライマーと対になって、標的ポリヌクレオチドを増幅可能に設計された
第3のプライマー。
【0059】
上記プライマーセットは、例えば、SNP部位を含む標的ポリヌクレオチドの増幅や検出に用いられる。この場合、第1のプライマーは、前記SNP部位の第1のアレル特異的ヌクレオチドに対応するヌクレオチドを3’末端から数えて1〜5番目の何れかに有し、第2のプライマーは、前記SNP部位の第2のアレル特異的ヌクレオチドに対応するヌクレオチドを3’末端から数えて1〜5番目の何れかに有する。
【0060】
その他、各プライマーの好ましい形態については、第一の本発明について説明したとおりである。一形態では、第1のプライマーのTm値は、第2のプライマーのTm値より高い。
第1のプライマー及び第2のプライマーの総量に対する第3のプライマーの量は、モル比で、好ましくは2倍より大きく、更に好ましくは4倍より大きく、より好ましくは8倍より大きい。
また、本発明は、上記(i)〜(iii)のプライマーを含み、第1のプライマー及び第2のプライマーの総量に対する第3のプライマーの量が、モル比で1倍より小さいプライマーセット、モル比で0.5倍より小さいプライマーセット、モル比で0.25倍より小さいプライマーセット、モル比で0.125倍より小さいプライマーセット等も提供する。
【0061】
第六の本発明であるプライマーセットの他の形態としては、例えば、以下のようなものが挙げられる。
下記(i)及び(ii)のプライマーを含み、第2のプライマーの量に対する第1のプライマーの量が、モル比で1倍より大きい、プライマーセット、
(i)前記標的ポリヌクレオチドに対合する第1のプライマー
(ii)前記標的ポリヌクレオチドに、第1のプライマーと競合的に対合するが、第1のプライマーよりPCRによる伸長反応が起こりにくい第2のプライマー
【0062】
第2のプライマーの量に対する第1のプライマーの量は、好ましくはモル比で2倍より大きい。第2のプライマーの量に対する第1のプライマーの量の上限は、好ましくはモル比で4倍である。
【0063】
さらに、本発明は、上述した(i)〜(iii)のプライマーを用いて標的ポリヌクレオチドを増幅し、増幅産物中の標的ポリヌクレオチドを検出する方法に用いる検出キットの製造方法を提供する。
該検出キットの製造方法は、上述した第一の本発明を用いて標的ポリヌクレオチドの増幅効率を調節し、調節された増幅効率を実現する量比の前記プライマーと、標的ポリヌクレオチドに相補的な配列からなり、末端が蛍光色素で標識されハイブリダイゼーションしたときに蛍光が増加又は減少するプローブとを組み合わせることを含む。このようなプローブについては、第一の本発明について説明したとおりである。
また、本発明は、第六の発明のプライマーセットと上記プローブを組み合わせた検出キットをも提供する。
【実施例】
【0064】
<実施例1>
配列番号1はJAK2遺伝子配列の部分配列である。配列番号1は、GenBankのAccession No. NG_009904の88381〜88680番目の配列に相当する。配列番号1に示す塩基配列のうち、18番目〜237番目からなるDNA断片をpT7Blue T-vectorのEcoR VサイトにTAクローニングで挿入し、EcoRIで線状化した。これを、野生型プラスミド(JAK2 Wt プラスミド)とした。また、配列番号1に示す塩基配列における147番目のグアニン(G)がチミン(T)に置換した配列からなるDNA断片を同様に処理し、変異型プラスミド(JAK2 V617F プラスミド)とした。サンプルは上記JAK2 Wt プラスミドとJAK2 V617F プラスミドを99:1で混合し
たものとした。
【0065】
上記サンプル104コピーを含み、表1に示すPCR反応液の各成分を、下記の濃度となるように混合したPCR反応液50μLを、全自動SNPs検査装置(商品名:i-densy (商標)、アークレイ社製)を用いて、PCR及びTm解析を行った。プライマーは、野生型JAK2プライマーFwt(3’末端が野生型ヌクレオチド、配列番号2)、変異型JAK2プライマーFmt(3’末端が変異型ヌクレオチド、配列番号3)、及びこれらと対になるJAK2プライマーR(配列番号4)を用いた。また、プローブは、3’末端が蛍光色素(TAMRA)、で標識された、二本鎖になると蛍光が減少するプローブ(配列番号5)を用いた。プライマー及びプローブの配列及び長さを表2に示す。表中、JAK2プライマーFwtとJAK2プライマーFmtの5’末端側の大文字で表すヌクレオチドからなる配列は、擬陽性を抑制するための付加配列である。
JAK2プライマーRの濃度を表3に示すように変えることで、JAK2プライマーFwtとJAK2プライマーFmtの総量とJAK2プライマーRの量比を変え、当該量比が変異型プラスミドの検出感度に与える影響を試験した。
PCR及びTm解析の条件は表4に示す通りである。また、Tm解析における励起波長及び検出波長は、それぞれ520〜555nm、585〜700nmであった。
【0066】
【表1】

【0067】
【表2】

【0068】
【表3】

【0069】
【表4】

【0070】
PCR及びTm解析の結果を図1に示す。図1の縦軸は蛍光強度(Relative Fluorescence Units (RFU))の微分値、横軸は温度(℃)である。51℃付近に見られるピークは、野生型プラスミドの存在に由来するピーク、59℃付近に見られるピークが、変異型プラスミドの存在に由来するピークである。
図1から判るように、JAK2プライマーFwtとJAK2プライマーFmtの総量に対するJAK2プライマーRの量(R/(Fwt+Fmt))が、2モル倍、4モル倍、8モル倍と大きくなるに従い、変異型プラスミドの存在に由来するピークが大きくなった。
これより、R/(Fwt+Fmt)が大きくなるほど変異型プラスミドの増幅効率が上がるという規則性が明らかとなった。
【0071】
<実施例2>
配列番号6はabl遺伝子配列の部分配列である。配列番号6は、GenBankのAccession No. NG_012034の158941〜159060番目の配列に相当する。配列番号6に示す塩基配列のうち、少なくとも19番目〜100番目の配列を含むDNA断片をpT7Blue T-vectorのEcoR VサイトにTAクローニングで挿入し、KpnIで線状化した。これを、野生型プラスミド(abl Wt プラスミド)とした。また、配列番号6に示す塩基配列における77番目のシトシン(C)がチミン(T)に置換した配列からなるDNA断片を同様に処理し、変異型プラスミド(abl C944T プラスミド)とした。サンプルは上記abl Wt プラスミドとabl C944T プラスミドを99:1で混合したものとした。
【0072】
上記サンプル104コピーを含み、表5に示すPCR反応液の各成分を、下記の濃度となるように混合したPCR反応液50μLを全自動SNPs検査装置(商品名:i-densy (商標)、アークレイ社製)を用いて、PCR及びTm解析を行った。プライマーは、野生型ablプライマーRwt(3’末端が野生型ヌクレオチド、配列番号8)、変異型ablプライマーRmt(3’末
端が変異型ヌクレオチド、配列番号9)、及びこれらと対になるablプライマーF(配列番号7)を用いた。また、プローブは、5’末端が蛍光色素(BODIPY FL)で標識され、3’末端がリン酸化された(表6中、“P”で示す。)、二本鎖になると蛍光が減少するプローブ(配列番号10)を用いた。プライマー及びプローブの配列及び長さを表6に示す。
ablプライマーFの濃度を表7に示すように変えることで、ablプライマーRwtとablプライマーRmtの総量とablプライマーFの量比を変え、当該量比が変異型プラスミドの検出感度に与える影響を試験した。
PCR及びTm解析の条件は表8に示す通りである。また、Tm解析における励起波長及び検出波長は、それぞれ420〜485nm、520〜555nmであった。
【0073】
【表5】

【0074】
【表6】

【0075】
【表7】

【0076】
【表8】

【0077】
PCR及びTm解析の結果を図2に示す。図2の縦軸は蛍光強度(Relative Fluorescence Units (RFU))の微分値、横軸は温度(℃)である。47℃付近に見られるピークは、野生型プラスミドの存在に由来するピーク、54℃付近に見られるピークが、変異型プラスミドの存在に由来するピークである。
図2から判るように、ablプライマーRwtとablプライマーRmtの総量に対するablプライマーFの量(F/(Rwt+Rmt))が、4モル倍、8モル倍と大きくなるに従い、変異型プラスミドの存在に由来するピークが大きくなった。
これより、F/(Rwt+Rmt)が大きくなるほど変異型プラスミドの増幅効率が上がるという規則性が明らかとなった。
【0078】
実施例1と実施例2で得られた結果から、アレル特異的な塩基を有するプライマーと、アレル非特異的なプライマーとの量比を調節することで、特定のアレル特異的な塩基を有するDNAの増幅効率を上げることができることが判った。
【0079】
<実施例3>
配列番号11はkit遺伝子配列の部分配列である。配列番号11は、GenBankのAccession No. NG_007456の75001〜75360番目の配列に相当する。配列番号11に示す塩基配列のうち、59番目〜358番目からなるDNA断片をpT7Blue T-vectorのEcoR VサイトにTAクローニングで挿入し、EcoRIで線状化した。これを、野生型プラスミド(kit Wt プラスミド)とした。また、配列番号11に示す塩基配列における228番目のアデニン(A)がチミン(T)に置換した配列からなるDNA断片を同様に処理し、変異型プラスミド(kit D617V プラスミド)とした。サンプルは上記kit Wt プラスミドとkit D617V プラスミドを99:1で混合したものとした。
【0080】
上記サンプル104コピーを含み、表9に示すPCR反応液の各成分を、下記の濃度となるように混合したPCR反応液50μLを全自動SNPs検査装置(商品名:i-densy (商標)、アークレイ社製)を用いて、PCR及びTm解析を行った。プライマーは、野生型kitプライマーFwt(3’末端が野生型ヌクレオチド、配列番号12)、変異型kitプライマーFmt(3’末端が変異型ヌクレオチド、配列番号13)、及びこれらと対になるkitプライマーR(配列番号14)を用いた。また、プローブは、5’末端が蛍光色素(TAMRA)で標識され、3'末端がリン酸化された、二本鎖になると蛍光が減少するプローブ(配列番号15)を用いた。プライマー及びプローブの配列及び長さを表10に示す。
kitプライマーFwtの濃度を表11に示すように変えることで、kitプライマーFwtとkitプライマーFmtの量比を変え、当該量比が変異型プラスミドの検出感度に与える影響を試験した。
PCR及びTm解析の条件は表12に示す通りである。また、Tm解析における励起波長及び検出波長は、それぞれ520〜555nm、585〜700nmであった。
【0081】
【表9】

【0082】
【表10】

【0083】
【表11】

【0084】
【表12】

【0085】
PCR及びTm解析の結果を図3に示す。図3の縦軸は蛍光強度(Relative Fluorescence Units (RFU))の微分値、横軸は温度(℃)である。48℃付近に見られるピークは、野生型プラスミドの存在に由来するピーク、56℃付近に見られるピークが、変異型プラスミドの存在に由来するピークである。
図3から判るように、kitプライマーFmtの量に対するkitプライマーFwtの量(Fwt/Fmt)が、2モル倍から1モル倍へと小さくなるに従い、変異型プラスミドの存在に由来するピークが大きくなった。
これより、Fwt/Fmtが小さくなるほど変異型プラスミドの増幅効率が上がるという規則性が明らかとなった。
【0086】
<実施例4>
実施例1で作製したJAK2 Wt プラスミドとJAK2 V617F プラスミドを99:1で混合したものをサンプルとし、表2に示す各種プライマー及びプローブを用いて、以下の試験を行った。
【0087】
上記サンプル104コピーを含み、表13に示すPCR反応液の各成分を、下記の濃度となるように混合したPCR反応液50μLを全自動SNPs検査装置(商品名:i-densy (商標)、アークレイ社製)を用いて、PCR及びTm解析を行った。
JAK2プライマーFmtの濃度を表14に示すように変えることで、JAK2プライマーFwtとJAK2プライマーFmtの量比を変え、当該量比が変異型プラスミドの検出感度に与える影響を試験した。
PCR及びTm解析の条件は表15に示す通りである。また、Tm解析における励起波長及び検出波長は、それぞれ520〜555nm、585〜700nmであった。
【0088】
【表13】

【0089】
【表14】

【0090】
【表15】

【0091】
PCR及びTm解析の結果を図4に示す。図4の縦軸は蛍光強度(Relative Fluorescence Units (RFU))の微分値、横軸は温度(℃)である。51℃付近に見られるピークは、野生型プラスミドの存在に由来するピーク、59℃付近に見られるピークが、変異型プラスミドの存在に由来するピークである。
図4から判るように、JAK2プライマーFmtの量に対するJAK2プライマーFwtの量(Fwt/Fmt)が、2モル倍から0.5モル倍へと小さくなるに従い、変異型プラスミドの存在に由来するピークが大きくなった。
これより、Fwt/Fmtが小さくなるほど変異型プラスミドの増幅効率が上がるという規則性が明らかとなった。
【0092】
実施例3と実施例4で得られた結果から、アレル特異的な塩基を有する複数のプライマー(第1のプライマーと第2のプライマー)の量比を調節することで、特定のアレル特異的な塩基を有するDNAの増幅効率を上げることができることが判った。
【0093】
<実施例5>
実施例3で作成したkit Wt プラスミドとkit D617V プラスミドを1:0、99:1、97:3、9:1で混合したサンプルをそれぞれWt、Mt1%、Mt3%、Mt10%のサンプルとした。本サンプルを104コピー含み、下表に示すPCR反応液の各成分を、下表の濃度となるように混合した50μLを全自動SNPs検査装置(商品名:i-densy (商標)、アークレイ社製)を用いて、PCR及びTm解析を行った。
【0094】
50μLのPCR反応液において:
1×反応バッファー
1.25U Taqポリメラーゼ
1.5mmol/L MgCl2
0.2mmol/L dNTP
0.25μmol/L kitプライマーFwt(表10)
0.25μmol/L kitプライマーFmt(表10)
0.2μmol/L kit mt プローブ(表10)
*kitプライマーR(表10)の濃度は下表参照
【0095】
【表16】

【0096】
その他の反応条件は実施例3と同じとした。
PCR及びTm解析の結果を図5に示す。図5の縦軸は蛍光強度(Relative Fluorescence Units (RFU))の微分値、横軸は温度(℃)である。48℃付近に見られるピークは、野生型プラスミドの存在に由来するピーク、56℃付近に見られるピークが、変異型プラスミドの存在に由来するピークである。
図5A〜Eから判るように、kitプライマーFwtとkitプライマーFmtの総量に対するkitプライマーRの量(R/(Fwt+Fmt))が、1モル倍(図5A)、2モル倍(図5B)、4モル倍(図5C)、8モル倍(図5D)、16モル倍(図5E)と大きくなるに従い、変異型プラスミドの存在に由来するピークが大きくなった。しかし、16モル倍の場合、野生型由来のピークがほとんど見られなくなった。
これより、R/(Fwt+Fmt)が大きくなるほど変異型プラスミドの増幅効率が上がるという規則性は明らかになったものの、16モル倍になると野生型由来のピークがほとんど見られなくなるため、反応不良との区別がつきにくくなるということが判った。
【0097】
<実施例6>
実施例1で作成したJAK2 WtプラスミドとJAK2 V617Fプラスミドを1:0、99:1、97:3、9:1で混合したサンプルをそれぞれWt、Mt1%、Mt3%、Mt10%のサンプルとした。本サンプルを104コピー含み、下表に示すPCR反応液の各成分を、下表の濃度となるように混合した50μLを全自動SNPs検査装置(商品名:i-densy (商標)、アークレイ社製)を用いて、PCR及びTm解析を行った。
【0098】
50μLのPCR反応液において:
1×反応バッファー
1.25U Taqポリメラーゼ
1.5mmol/L MgCl2
0.2mmol/L dNTP
0.25μmol/L JAK2プライマーFwt(表2)
0.25μmol/L JAK2プライマーFmt(表2)
0.2μmol/L JAK2 mt プローブ(表2)
*JAK2プライマーR(表2)の濃度は下表参照
【0099】
【表17】

【0100】
その他の反応条件は実施例1と同じとした。
PCR及びTm解析の結果を図6に示す。図6の縦軸は蛍光強度(Relative Fluorescence Units (RFU))の微分値、横軸は温度(℃)である。51℃付近に見られるピークは、野生型プラスミドの存在に由来するピーク、59℃付近に見られるピークが、変異型プラスミドの存在に由来するピークである。
図6A〜Eから判るように、JAK2プライマーFwtとJAK2プライマーFmtの総量に対するJAK2プライマーRの量(R/(Fwt+Fmt))が、1モル倍(図6A)、2モル倍(図6B)、4モル倍(図6C)、8モル倍(図6D)、16モル倍(図6E)と大きくなるに従い、変異型プラスミドの存在に由来するピークが大きくなった。
これより、R/(Fwt+Fmt)が大きくなるほど変異型プラスミドの増幅効率が上がるという規則性が明らかとなった。
【0101】
<実施例7>
実施例5で作成したWt、Mt1%、Mt3%、Mt10%のサンプルを104コピー含み、下表に示すPCR反応液の各成分を、下表の濃度となるように混合した50μLを全自動SNPs検査装置(商品名:i-densy (商標)、アークレイ社製)を用いて、PCR及びTm解析を行った。
【0102】
50μLのPCR反応液において:
1×反応バッファー
1.25U Taqポリメラーゼ
1.5mmol/L MgCl2
0.2mmol/L dNTP
1μmol/L kitプライマーR(表10)
0.2μmol/L kit mt プローブ(表10)
*kitプライマーFwt(表10)とkitプライマーFmt(表10)の濃度は下表参照
【0103】
【表18】

【0104】
その他の反応条件は実施例3と同じとした。
PCR及びTm解析の結果を図7に示す。図7の縦軸は蛍光強度(Relative Fluorescence Units (RFU))の微分値、横軸は温度(℃)である。48℃付近に見られるピークは、野生型プラスミドの存在に由来するピーク、56℃付近に見られるピークが、変異型プラスミドの存在に由来するピークである。
図7A〜Eから判るように、kitプライマーFmtの量に対するkitプライマーFwtの量(Fwt/Fmt)が、3モル倍(図7E)、2モル倍(図7D)、1モル倍(図7C)、1/2モル倍(図7B)、1/3モル倍(図7A)へと小さくなるに従い、変異型プラスミドの存在に由来するピークが大きくなった。
これより、Fwt/Fmtが小さくなるほど変異型プラスミドの増幅効率が上がるという規則性が明らかとなった。また、3モル倍の場合は野生型のピークがすべてのサンプルにおいてほとんど見られなくなることが明らかとなった。
【0105】
<実施例8>
実施例6で作成したWt、Mt1%、Mt3%、Mt10%のサンプルを104コピー含み、下表に示すPCR反応液の各成分を、下表の濃度となるように混合した50μLを全自動SNPs検査装置(商品名:i-densy (商標)、アークレイ社製)を用いて、PCR及びTm解析を行った。
【0106】
50μLのPCR反応液において:
1×反応バッファー
1.25U Taqポリメラーゼ
1.5mmol/L MgCl2
0.2mmol/L dNTP
1μmol/L JAK2プライマーR(表2)
0.2μmol/L JAk2 mt プローブ(表2)
*JAK2プライマーFwt(表2)とJAK2プライマーFmt(表2)の濃度は下表参照
【0107】
【表19】

【0108】
その他の反応条件は実施例1と同じとした。
PCR及びTm解析の結果を図8に示す。図8の縦軸は蛍光強度(Relative Fluorescence U
nits (RFU))の微分値、横軸は温度(℃)である。51℃付近に見られるピークは、野生型プラスミドの存在に由来するピーク、59℃付近に見られるピーク が、変異型プラスミドの存在に由来するピークである。
図8A〜Eから判るように、JAK2プライマーFmtの量に対するJAK2プライマーFwtの量(Fwt/Fmt)が、3モル倍(図8E)、2モル倍(図8D)、1モル倍(図8C)、1/2モル倍(図8B)、1/4モル倍(図8A)へと小さくなるに従い、変異型プラスミドの存在に由来するピークが大きくなった。
これより、Fwt/Fmtが小さくなるほど変異型プラスミドの増幅効率が上がるという規則性が明らかとなった。また、3モル倍の場合は野生型のピークがすべてのサンプルにおいてほとんど見られなくなることが明らかとなった。
【産業上の利用可能性】
【0109】
本発明は、種々の遺伝子の変異について、臨床的に利用価値のある検出感度を探るツールを提供する。
【特許請求の範囲】
【請求項1】
下記(i)〜(iii)のプライマーを用いて、PCRにより標的ポリヌクレオチドを増幅する際の、該標的ポリヌクレオチドの増幅効率を調節する方法であって、
下記(i)〜(iii)のプライマーの量比を調節することにより、標的ポリヌクレオチドの増幅効率を調節することを含む、方法、
(i)標的ポリヌクレオチドに対合する第1のプライマー、
(ii)標的ポリヌクレオチドに、第1のプライマーと競合的に対合するが、第1のプライマーよりPCRによる伸長反応が起こりにくい第2のプライマー、
(iii)第1のプライマーと対になって、標的ポリヌクレオチドを増幅可能に設計された第3のプライマー。
【請求項2】
第1のプライマー及び第2のプライマーの総量に対する第3のプライマーの量を調節することにより、標的ポリヌクレオチドの増幅効率を調節することを含む、請求項1に記載の方法。
【請求項3】
標的ポリヌクレオチドは、SNP部位を含み、
第1のプライマー及び第2のプライマーは前記SNP部位を含む領域にハイブリダイズし、
第1のプライマーは、前記SNP部位の第1のアレル特異的ヌクレオチドに対応するヌクレオチドを3’末端から数えて1〜5番目の何れかに有し、
第2のプライマーは、前記SNP部位の第2のアレル特異的ヌクレオチドに対応するヌクレオチドを3’末端から数えて1〜5番目の何れかに有する、請求項1又は2に記載の方法。
【請求項4】
第1のプライマーのTm値は、第2のプライマーのTm値より高い、請求項1〜3の何れか一項に記載の方法。
【請求項5】
第1のプライマー及び第2のプライマーの総量に対する第3のプライマーの量を大きくすることにより、標的ポリヌクレオチドの増幅効率を上げることを含む、請求項4に記載の方法。
【請求項6】
第1のプライマー及び第2のプライマーの総量に対する第3のプライマーの量を小さくすることにより、標的ポリヌクレオチドの増幅効率を下げることを含む、請求項4に記載の方法。
【請求項7】
第1のプライマー及び第2のプライマーの総量に対する第3のプライマーの量をモル比で1倍より大きくすることにより、第1のアレル特異的ヌクレオチドを含む標的ポリヌクレオチドの増幅効率を上げることを含む、請求項5に記載の方法。
【請求項8】
第1のプライマー及び第2のプライマーの総量に対する第3のプライマーの量をモル比で2倍より大きくすることにより、標的ポリヌクレオチドの増幅効率を上げることを含む、請求項7に記載の方法。
【請求項9】
第2のプライマーの量に対する第1のプライマーの量を大きくすることにより、前記標的ポリヌクレオチドの増幅効率を上げることを含む、請求項1〜8の何れか一項に記載の方法。
【請求項10】
前記(i)〜(iii)のプライマーを用いて、PCRにより標的ポリヌクレオチドを増幅し、得られた増幅産物を用いて該標的ポリヌクレオチドを検出する際の、該標的ポリヌクレオチ
ドの検出効率を調節する方法であって、
請求項1〜9の何れか一項に記載の方法を用いて標的ポリヌクレオチドの増幅効率を調節することにより、該標的ポリヌクレオチドの検出効率を調節することを含む、方法。
【請求項11】
請求項10に記載の方法で標的ポリヌクレオチドの検出効率を調節し、
調節された検出効率を実現する量比の前記(i)〜(iii)のプライマーを用いてPCRを行い、
得られたPCR増幅産物中の前記標的ポリヌクレオチドを検出することを含む、標的ポリヌクレオチドの検出方法。
【請求項12】
請求項11に記載の検出方法を用いて、被験者に由来する遺伝子における変異の存在又は非存在を検出し、得られた検出結果を、該変異が検出された場合には前記被験者が該変異の存在により起こる疾患を有する可能性があるという基準と比較することにより、前記変異の存在により起こる疾患の可能性を試験することを含む、試験方法。
【請求項13】
請求項11に記載の検出方法を用いて、被験者に由来する遺伝子における変異の存在又は非存在を検出し、得られた検出結果と、該変異の有無及び特定の医薬の効果の関係と、を比較することにより、前記被験者に対する前記特定の医薬の効果を予測することを含む、薬効の予測方法。
【請求項14】
請求項1〜9の何れか一項に記載の方法を用いて標的ポリヌクレオチドの増幅効率を調節し、
調節された増幅効率を実現する量比の前記(i)〜(iii)のプライマーを組み合わせることを含む、プライマーセットの製造方法。
【請求項15】
下記(i)〜(iii)のプライマーを含み、第1のプライマー及び第2のプライマーの総量に対する第3のプライマーの量が、モル比で1倍より大きい、プライマーセット、
(i)標的ポリヌクレオチドに対合する第1のプライマー
(ii)標的ポリヌクレオチドに、第1のプライマーと競合的に対合するが、第1のプライマーよりPCRによる伸長反応が起こりにくい第2のプライマー
(iii)第1のプライマーと対になって、標的ポリヌクレオチドを増幅可能に設計された第3のプライマー。
【請求項1】
下記(i)〜(iii)のプライマーを用いて、PCRにより標的ポリヌクレオチドを増幅する際の、該標的ポリヌクレオチドの増幅効率を調節する方法であって、
下記(i)〜(iii)のプライマーの量比を調節することにより、標的ポリヌクレオチドの増幅効率を調節することを含む、方法、
(i)標的ポリヌクレオチドに対合する第1のプライマー、
(ii)標的ポリヌクレオチドに、第1のプライマーと競合的に対合するが、第1のプライマーよりPCRによる伸長反応が起こりにくい第2のプライマー、
(iii)第1のプライマーと対になって、標的ポリヌクレオチドを増幅可能に設計された第3のプライマー。
【請求項2】
第1のプライマー及び第2のプライマーの総量に対する第3のプライマーの量を調節することにより、標的ポリヌクレオチドの増幅効率を調節することを含む、請求項1に記載の方法。
【請求項3】
標的ポリヌクレオチドは、SNP部位を含み、
第1のプライマー及び第2のプライマーは前記SNP部位を含む領域にハイブリダイズし、
第1のプライマーは、前記SNP部位の第1のアレル特異的ヌクレオチドに対応するヌクレオチドを3’末端から数えて1〜5番目の何れかに有し、
第2のプライマーは、前記SNP部位の第2のアレル特異的ヌクレオチドに対応するヌクレオチドを3’末端から数えて1〜5番目の何れかに有する、請求項1又は2に記載の方法。
【請求項4】
第1のプライマーのTm値は、第2のプライマーのTm値より高い、請求項1〜3の何れか一項に記載の方法。
【請求項5】
第1のプライマー及び第2のプライマーの総量に対する第3のプライマーの量を大きくすることにより、標的ポリヌクレオチドの増幅効率を上げることを含む、請求項4に記載の方法。
【請求項6】
第1のプライマー及び第2のプライマーの総量に対する第3のプライマーの量を小さくすることにより、標的ポリヌクレオチドの増幅効率を下げることを含む、請求項4に記載の方法。
【請求項7】
第1のプライマー及び第2のプライマーの総量に対する第3のプライマーの量をモル比で1倍より大きくすることにより、第1のアレル特異的ヌクレオチドを含む標的ポリヌクレオチドの増幅効率を上げることを含む、請求項5に記載の方法。
【請求項8】
第1のプライマー及び第2のプライマーの総量に対する第3のプライマーの量をモル比で2倍より大きくすることにより、標的ポリヌクレオチドの増幅効率を上げることを含む、請求項7に記載の方法。
【請求項9】
第2のプライマーの量に対する第1のプライマーの量を大きくすることにより、前記標的ポリヌクレオチドの増幅効率を上げることを含む、請求項1〜8の何れか一項に記載の方法。
【請求項10】
前記(i)〜(iii)のプライマーを用いて、PCRにより標的ポリヌクレオチドを増幅し、得られた増幅産物を用いて該標的ポリヌクレオチドを検出する際の、該標的ポリヌクレオチ
ドの検出効率を調節する方法であって、
請求項1〜9の何れか一項に記載の方法を用いて標的ポリヌクレオチドの増幅効率を調節することにより、該標的ポリヌクレオチドの検出効率を調節することを含む、方法。
【請求項11】
請求項10に記載の方法で標的ポリヌクレオチドの検出効率を調節し、
調節された検出効率を実現する量比の前記(i)〜(iii)のプライマーを用いてPCRを行い、
得られたPCR増幅産物中の前記標的ポリヌクレオチドを検出することを含む、標的ポリヌクレオチドの検出方法。
【請求項12】
請求項11に記載の検出方法を用いて、被験者に由来する遺伝子における変異の存在又は非存在を検出し、得られた検出結果を、該変異が検出された場合には前記被験者が該変異の存在により起こる疾患を有する可能性があるという基準と比較することにより、前記変異の存在により起こる疾患の可能性を試験することを含む、試験方法。
【請求項13】
請求項11に記載の検出方法を用いて、被験者に由来する遺伝子における変異の存在又は非存在を検出し、得られた検出結果と、該変異の有無及び特定の医薬の効果の関係と、を比較することにより、前記被験者に対する前記特定の医薬の効果を予測することを含む、薬効の予測方法。
【請求項14】
請求項1〜9の何れか一項に記載の方法を用いて標的ポリヌクレオチドの増幅効率を調節し、
調節された増幅効率を実現する量比の前記(i)〜(iii)のプライマーを組み合わせることを含む、プライマーセットの製造方法。
【請求項15】
下記(i)〜(iii)のプライマーを含み、第1のプライマー及び第2のプライマーの総量に対する第3のプライマーの量が、モル比で1倍より大きい、プライマーセット、
(i)標的ポリヌクレオチドに対合する第1のプライマー
(ii)標的ポリヌクレオチドに、第1のプライマーと競合的に対合するが、第1のプライマーよりPCRによる伸長反応が起こりにくい第2のプライマー
(iii)第1のプライマーと対になって、標的ポリヌクレオチドを増幅可能に設計された第3のプライマー。
【図1】


【図2】


【図3】


【図4】


【図5A】


【図5B】


【図5C】


【図5D】


【図5E】


【図6A】


【図6B】


【図6C】


【図6D】


【図6E】


【図7A】


【図7B】


【図7C】


【図7D】


【図7E】


【図8A】


【図8B】


【図8C】


【図8D】


【図8E】




【図2】


【図3】


【図4】


【図5A】


【図5B】


【図5C】


【図5D】


【図5E】


【図6A】


【図6B】


【図6C】


【図6D】


【図6E】


【図7A】


【図7B】


【図7C】


【図7D】


【図7E】


【図8A】


【図8B】


【図8C】


【図8D】


【図8E】


【公開番号】特開2011−244816(P2011−244816A)
【公開日】平成23年12月8日(2011.12.8)
【国際特許分類】
【出願番号】特願2011−101037(P2011−101037)
【出願日】平成23年4月28日(2011.4.28)
【出願人】(000141897)アークレイ株式会社 (288)
【Fターム(参考)】
【公開日】平成23年12月8日(2011.12.8)
【国際特許分類】
【出願日】平成23年4月28日(2011.4.28)
【出願人】(000141897)アークレイ株式会社 (288)
【Fターム(参考)】
[ Back to top ]

