標的ポリヌクレオチドの検出用剤及びその利用
【課題】より簡便で実用的にハイブリダイズ産物の有無を検出できる標的ポリヌクレオチドの検出用剤を提供する。
【解決手段】一つの前記標的ポリヌクレオチドに予め関連付けられた少なくとも一つのオリゴヌクレオチドプローブ4を、そのオリゴヌクレオチドプローブ4を識別するためのパターン情報を含むプローブ識別情報を伴って固相担体2上に固定して備える検出用剤10とする。オリゴヌクレオチドプローブ4を固定するパターンにプローブの識別情報を付与することで、ハイブリダイズ産物を生成したプローブの位置の照合操作を省略できる。
【解決手段】一つの前記標的ポリヌクレオチドに予め関連付けられた少なくとも一つのオリゴヌクレオチドプローブ4を、そのオリゴヌクレオチドプローブ4を識別するためのパターン情報を含むプローブ識別情報を伴って固相担体2上に固定して備える検出用剤10とする。オリゴヌクレオチドプローブ4を固定するパターンにプローブの識別情報を付与することで、ハイブリダイズ産物を生成したプローブの位置の照合操作を省略できる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、標的ポリヌクレオチドを検出するためのアレイなどの検出用剤、その製造方法及び使用に関する。
【背景技術】
【0002】
各種生物における遺伝子解析が進み、遺伝子多型、遺伝子変異など検査など、結核菌の型別及び感染症における原因菌若しくはウイルスの同定、分類等が、遺伝子情報を利用して行われている。また、遺伝子配列の決定も行われている。
【0003】
こうした遺伝子に関する検査にあたっては、通常、特定のオリゴヌクレオチドプローブを固相担体に固定したアレイなどの検出用剤を用いて行われている。より具体的には、固相担体に固定化された、予め配列を取得している標的オリゴヌクレオチドに関連付けたオリゴヌクレオチドプローブと、分析対象から取得した遺伝子試料とをハイブリダイズさせて、ハイブリダイズ産物をプローブ又は遺伝子試料に付与されたシグナル等に基づき検出することにより、標的ポリヌクレオチドを検出している。
【0004】
従来この種の方法としては、例えば、複数の検出しようとする菌の型別に必要な特異的プローブ数十種類を準備し、メンブレン上にこれらのプローブを平行線状に固定化しておき、ブロッターを用いてプローブのラインパターンと垂直になるように試料から調製したPCR産物を供給しハイブリダイズさせる方法がある。この方法では、PCR産物がビオチン標識されているため、ハイブリダイゼーション後のメンブレンをペルオキシダーゼ標識ストレプトアビジンでインキュベートする。これにより、ハイブリダイズしたPCR産物をペルオキシダーゼで標識し、ECL試薬による化学発光シグナルをX線フィルムへ感光させる。生体試料に含まれている菌の型に応じて表出される特異的プローブの配列パターンに基づき型判別が可能となる(非特許文献1)。
【0005】
さらに、標的ポリヌクレオチドの検出を容易にするため、試験紙などに、関連する2種類以上の互いに異なる生理活性物質(特異的プローブ等)を隣接して固定しておいて、これらの全部の生理活性物質においてシグナルを検出するかあるいはその一部においてシグナルを欠損するかによって、変異の有無を検出することも検討されている(特許文献1)。また、複数列×複数行のマトリックス状に複数のプローブが固定化されているときにおいて、プローブの位置を特定可能なマーカー物質も固定化しておくことも試みられている(特許文献2)。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特開2007−64927号公報
【特許文献2】特開2000−270896号公報
【非特許文献】
【0007】
【非特許文献1】Ocimum BiosolutionsのHP(FIGGENhttp://www3.ocimumbio.com/wp-content/uploads/docs/OBS_SPK_WP.pdf)
【発明の概要】
【発明が解決しようとする課題】
【0008】
通常、プローブは、いずれも、固相担体上の予め決定された特定の位置に固定されている。したがって、どのプローブにおいてハイブリダイズ産物を検出したか否かを判定するには、予め決定されている固相担体上におけるプローブの位置情報と照らし合わせる必要がある。このような照合操作は、目視で行われうる場合もあるが、一般的には、ハイブリダイゼーション反応後のアレイから画像情報を取得し、その後、専用の解析ソフトでどのプローブにおいてハイブリダイズ産物が検出されたかが判定される。
【0009】
しかしながら、上記した従来の方法では、いずれも、どの位置のプローブにおいてハイブリダイズ産物を検出したかを特定するのは困難であった。上記非特許文献1及び特許文献1では、標的ポリヌクレオチドに関連する一群のプローブの固定化領域の検出パターン認識を前提とするものであった。したがって、これらの先行技術では、個々の一つのプローブについての検出を容易することはできず、依然として面倒な照合操作を要していた。
【0010】
また、上記特許文献2に開示される方法では、個別のプローブの特定ならびに検出及び定量を容易にし信頼性を向上させるものとして有効であった。しかしながら、依然として照合操作は必要であった。
【0011】
そこで、本発明では、より簡便で実用的にハイブリダイズ産物の有無を検出できる標的ポリヌクレオチドの検出用剤を提供することを一つの目的とする。
【課題を解決するための手段】
【0012】
本発明者らは、より実用的で簡便な標的ポリヌクレオチドの検出のために、既知のプローブ個別の位置情報との照合操作を簡素化ないし省略するべく検討した。その結果、本発明者らは、個々のプローブを固定化するパターンにそのプローブの識別情報を付与することで、ハイブリダイゼーション反応後のハイブリダイズ産物を生成したプローブの位置の照合操作を省略できるという知見を得た。こうした知見によれば、以下の手段が提供される。
【0013】
(1)標的ポリヌクレオチドを検出するための検出用剤であって、
固相担体と、
前記標的ポリヌクレオチドに予め関連付けられたオリゴヌクレオチドプローブであって、パターン情報を含むプローブ識別情報を伴って、前記固相担体上に固定されるオリゴヌクレオチドプローブと、
を備える、検出用剤。
(2)前記固相担体上には、1又は2以上の前記オリゴヌクレオチドプローブを固定するための1又は2以上のフィーチャーエリアが画定されており、
前記パターン情報は、前記フィーチャーエリアのそれぞれにおいて、1又は2以上の前記オリゴヌクレオチドプローブの固定領域又はそれらの非固定領域によって特徴付けられる、(1)に記載の検出用剤。
(3)前記パターン情報は、前記フィーチャーエリアの輪郭に沿う前記固定領域によって実質的に囲繞される前記非固定領域によって特徴付けられる、(2)に記載の検出用剤。
(4)前記パターン情報は、前記固定領域又は前記非固定領域の形状に関する情報を含む、(2)又は(3)に記載の検出用剤。
(5)前記パターン情報は、前記固定領域又は前記非固定領域の大きさに関する情報を含む、(2)〜(4)のいずれかに記載の検出用剤。
(6)前記パターン情報は、前記固定領域又は前記非固定領域の模様に関する情報を含む、(2)〜(5)のいずれかに記載の検出用剤。
(7)前記パターン情報は、文字、数字、記号及び図形並びにこれらの組み合わせからなる群から選択されるシンボルを含む、(2)〜(6)のいずれかに記載の検出用剤。
(8)前記シンボルはバーコードを含む、(7)に記載の検出用剤。
(9)前記パターン情報は、目視によって識別可能な大きさを備える、(1)〜(8)のいずれかに記載の検出用剤。
(10)前記固相担体上には、1又は2以上の前記オリゴヌクレオチドプローブを固定するための1又は2以上のフィーチャーエリアが画定されており、
1つの前記フィーチャーエリア内において、2以上の前記オリゴヌクレオチドプローブの前記パターン情報が配置されている、(1)〜(9)のいずれかに記載の検出用剤。
(11)1つの前記フィーチャーエリア内において、2以上の前記オリゴヌクレオチドプローブの前記パターン情報が少なくとも部分的に重複する、(10)に記載の検出用剤。
(12)1つの前記フィーチャーエリア内において、2以上の前記オリゴヌクレオチドの前記パターン情報が相補的である、(10)に記載の検出用剤。
(13) 前記固相担体上の前記パターン情報の方向性を示す方向性情報を前記固相担体上に備える、(1)〜(12)のいずれかに記載の検出用剤。
(14) 複数個の前記オリゴヌクレオチドプローブを、これらの前記オリゴヌクレオチドプローブ毎の前記プローブ識別情報を伴って前記固相担体上に備える、(1)〜(13)のいずれかに記載の検出用剤。
(15)(1)〜(14)のいずれかに記載の検出用剤と、
前記ハイブリダイズ産物に前記プローブ識別情報を肉眼で視認可能な検出シグナルを付与可能な薬剤と、
を備える、キット。
(16)(1)〜(14)のいずれかに記載の検出用剤の製造方法であって、
前記固相担体上に、前記オリゴヌクレオチドプローブを、前記プローブ識別情報を伴って供給する工程、
を備える、製造方法。
(17)前記オリゴヌクレオチドの供給工程は、前記オリゴヌクレオチドプローブを含有する液体を、ピエゾ素子を用いて吐出して前記固相担体上に供給する工程である、(16)に記載の製造方法。
(18)標的ポリヌクレオチドの検出方法であって、
(1)〜(14)のいずれかに記載の検出用剤上の前記オリゴヌクレオチドプローブと、被験試料とについてハイブリダイゼーションを実施する工程と、
前記ハイブリダイゼーションで得られたハイブリダイズ産物が呈示する前記プローブ識別情報に基づいて前記標的ポリヌクレオチドを検出する工程と、
を備える、検出方法。
(19)前記ハイブリダイゼーション工程後、前記検出工程に先立って、前記ハイブリダイズ産物に前記プローブ識別情報を肉眼で視認可能な検出シグナルを付与する工程を、備える、(18)に記載の検出方法。
(20)前記標的ポリヌクレオチドは一塩基多型を含む、(18)は(19)に記載の検出方法。
【図面の簡単な説明】
【0014】
【図1】本発明の検出用剤の一例を示す図である。
【図2】2種以上のプローブを一つのフィーチャーエリアに固定した一例を示す図である。
【図3】一つのフィーチャーエリア内に第1〜第10までの10種のプローブを必要に応じて複数選択して固定するためのデザインの一例を示す図である。
【図4】デジタル表現された1〜0の数字の各数字からなるパターンを、8個のバー領域a〜gを用いて10種のプローブを用いて形成する場合のプローブ供給領域を示す図であり、左図は、バー領域a〜gを示し、右図は、数字とプローブを付与するバー領域を示す図である。
【図5】一つのフィーチャーエリア内で、2種のプローブをそれぞれ同時検出可能にパターン情報を形成する一例を示す図である。
【図6】本発明の検出方法の一例を示す図である。
【図7】実施例1で作製したアレイを示す図である。
【図8】実施例1で作製したアレイを用いた検出結果の一例を示す図である。
【図9】実施例1で作製したアレイを用いた検出結果の他の一例を示す図である。
【発明を実施するための形態】
【0015】
本発明は、標的ポリヌクレオチドの検出用剤及びその利用、詳しくは、標的ポリヌクレオチドの検出用剤、その製造方法及び標的ポリヌクレオチドの検出方法に関する。本発明の検出用剤では、この種の検出用剤に必要とされていたオリゴヌクレオチドプローブの位置の照合操作に替えてオリゴヌクレオチドプローブを識別するためのパターン情報を含むプローブ識別情報を取得する。プローブ識別情報は、それ自体オリゴヌクレオチドプローブを識別できるパターン情報を含んでいるため、位置照合することなく、どのオリゴヌクレオチドプローブにおいてハイブリダイズ産物が生成されたか、すなわち、どの標的オリゴヌクレオチドが検出できたかを直ちに知ることができる。この結果、前記照合操作を省略して標的オリゴヌクレオチドの検出が可能となる。
【0016】
本発明の検出用剤によれば、プローブの位置の照合操作を簡素化ないし省略できるため、画像情報の取得装置やプローブ位置照合のための専用の解析ソフトなどを簡素化ないし省略することができる。また、プローブ識別情報を目視で視認可能な大きさを有する場合には、簡易に標的ポリヌクレオチドの検出が可能となる。さらに、プローブ識別情報を、可視光等を用いて目視で視認可能である場合には、装置を備えていない検査現場において遺伝子検査等を容易に実施できるようになる。可視光による検出は、装置コストを低減できるほか、リアルタイムに発色を観察できる点が検査の迅速性に寄与している。
【0017】
本明細書において、標的ポリヌクレオチドは、ヌクレオチドの重合体を意味しており、その重合数は特に限定しない。したがって、標的ポリヌクレオチドには、数個から数十程度のヌクレオチドが連結したオリゴヌクレオチドが包含される。標的ポリヌクレオチドは、例えば、体質、遺伝病、癌などの特定疾患についての発症、疾患診断、治療予後、薬剤や治療の選択などのヒト、非ヒト動物などの生物における遺伝子上の指標となる塩基あるいは塩基配列を標的部位として含むことができる。標的ポリヌクレオチドとしては、典型的には、SNPなどの多型や先天的又は後天的変異を標的部位として含むポリヌクレオチドが挙げられる。また、病原菌やウイルスなどの微生物由来の塩基配列も標的部位として含むポリヌクレオチドが挙げられる。
【0018】
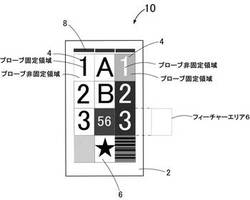
以下、本発明の実施形態について、適宜図面を参照しながら説明する。図1には、本発明の検出用剤の一例を示す。
【0019】
(標的ポリヌクレオチドの検出用剤)
本発明の標的ポリヌクレオチドの検出用剤(以下、本検出用剤という。)10は、固相担体2と、
標的ポリヌクレオチドに予め関連付けられたオリゴヌクレオチドプローブであって、パターン情報を含むプローブ識別情報を伴って、固相担体2上に固定されるオリゴヌクレオチドプローブ4と、を備えている。
【0020】
(固相担体)
固相担体2は、その材料を特に限定しないで、セラミックス、ガラス、金属、合成樹脂等を用いることができる。オリゴヌクレオチドプローブ4を固定化するための層を別途備えることもできる。固相担体2は、ダウンサイジング性、小スケールでの取り扱い性、反応性、プローブ識別情報の視認性等を考慮すると、液体の浸透性又は透過性を有することが好ましい。こうした材料としては、例えば、合成樹脂が挙げられ、典型的には、ポリエーテルスルホン、ニトロセルロース、ナイロン、ポリフッ化ビニリデンなどのポリマーを主体としたいわゆる多孔性のメンブランフィルターのほか、セルロースなどのろ紙を好ましく用いることができる。
【0021】
固相担体2の形状は、問わないで、各種形状のビーズ、シート状とすることができる。シート状であると、ハンドリング性が良く、検査データとしての保存にも有利である。さらに、シート状であると、一定の可撓性も付与しやすく、ハイブリダイゼーションの容器への充填性、収納性及び反応性に有利に寄与することができる。固相担体2の厚みとしては、0.01mm以上0.3mm以下であることが好ましい。
【0022】
より具体的には、固相担体2の形態は、平面積が150mm2以下であることが好ましい。この平面積以下であると、十分に1ml以下の液中においても固定化領域においてハイブリダイゼーションが可能である。より好ましくは、100mm2以下であり、さらに好ましくは50mm2以下である。50mm2以下であると、0.3ml以下の液中でのハイブリダイゼーションにも有効である。
【0023】
また、好ましくは、アスペクト比が1.5以上の方形状である。こうした方形状であると、チューブ状容器に収まりやすく、ハンドリングも容易である。また、チューブ状容器内で反転したりせずに、容器内において投入時の形態が保持され、予め定めた一定の方向性が確保される。さらに、方形状であると、本検出用剤10の方向性を目視で簡易に判別することができ、後述するハイブリダイゼーション工程ほか、シグナル付与工程及び検出工程に都合がよい。より好ましくはアスペクト比は20以下である。アスペクト比が20を超えるとプローブ識別情報を把握しにくくなるからであり、20以下であると複数個のプローブ識別情報を目視で識別しやすいため、検出精度を維持ないし向上させることができる。アスペクト比は好ましくは15以下であり、より好ましくは10以下であり、さらに好ましくは5以下であり、一層好ましくは3以下である。
【0024】
(オリゴヌクレオチドプローブ)
オリゴヌクレオチドプローブ(以下、単にプローブという。)4は、特に限定しないで、従来公知の手法で固相担体2上に固定されている。すなわち、共有結合他、非共有結合で固定されていてもよい。また、プローブ4は、固相担体2上に少なくとも1つ備えられる。好ましくは複数個備えられ、より好ましくは十数個以上備えられ、さらに好ましくは数十個以上備えられる。
【0025】
プローブ4は、検出する標的ポリヌクレオチドや、標的ポリヌクレオチドの検出システムに応じて適宜選択される。例えば、感染症等の感染原因菌の菌種(型)判定には、複数のプローブ4に対するハイブリダイゼーションによって検出する。変異の検出にあたっては、一つの変異に対して1又は複数のプローブ4を対応させてもよい。
【0026】
プローブ4は、標的ポリヌクレオチドに予め関連付けられている。ここで、「標的ポリヌクレオチドに予め関連付けられている」とは、標的ポリヌクレオチドと特異的にハイブリダイズする塩基配列を有しているプローブのほか、標的ポリヌクレオチドと特異的にハイブリダイズする塩基配列を有してはいないが、標的オリゴヌクレオチドを検出するための予め決定された塩基配列を有しているプローブ(ユニバーサルプローブ)ことを意味している。
【0027】
ユニバーサルプローブは、たとえば乱数から得られた所定塩基長のDNA配列に対して連続一致長、Nearest-Neighbor法による融解温度予測、ハミング距離、二次構造予測の計算を行うことにより設計される塩基配列である正規直交配列を有することができる。正規直交配列は、核酸の塩基配列であって、その融解温度が均一であるもの、即ち融解温度が一定範囲内に揃うように設計された配列であって、核酸自身が分子内(intramolecular)で構造化して、相補的な配列とのハイブリッド形成を阻害することのない配列であり、尚且つこれに相補的な塩基配列以外とは安定したハイブリッドを形成しない塩基配列を意味することができる。1つの正規直交配列群に含まれる配列は、所望の組み合わせ以外の配列間および自己配列内において反応が生じ難いか、または反応が生じない。また、正規直交配列は、PCR等において増幅させると、たとえば上述のクロスハイブリダイズのような問題に影響されずに、当該正規直交配列を有する核酸の初期量に応じた量の核酸が定量的に増幅される性質を有しうる。上記のような正規直交配列は、H.Yoshida and A.Suyama,“Solution to 3-SAT by breadth first search”,DIMACS Vl.54, 9-20(2000)に詳細が記載されている。こうした文献に基づいて正規直交配列を設計することができる。
【0028】
こうしたユニバーサルプローブを用いた場合、予め標的ポリヌクレオチドに対して特定のユニバーサルプローブを関連付けておく。このためには、ユニバーサルプローブと同一又は相補的な塩基配列を有し、かつ標的ポリヌクレオチドと相補的な塩基配列を有するプライマーやプローブを用いる。すなわち、標的ポリヌクレオチドに対して、このプライマー等とのハイブリダイゼーション反応とリガーゼ反応とを実施して、関連付けられたユニバーサルプローブの塩基配列と同一又は相補的な塩基配列を有するとともに標的ポリヌクレオチドに特異的なリガーゼ産物を取得し、このリガーゼ産物ないしこのPCR増幅産物と、固相担体2上のユニバーサルプローブとのハイブリダイゼーションを実施することとなる。リガーゼ産物等は、予め関連付けられたプローブとハイブリダイズし二重鎖ハイブリダイズ産物を生成する。なお、SNPなど変異の検出には、一つの標的ポリヌクレオチドに対して、複数のユニバーサルプローブが割り付けられることもある。この種の方法は、特開2008−306941号公報、Analytical Biochemistry, 364, 1, 2007, 78-85の他、特開2009−232778号公報、特開2009−24号公報等を参照して実施することができる。
【0029】
固相担体2上には、1又は2以上のプローブ4を固定するための1又は2以上のフィーチャーエリア6が画定されている。一つのフィーチャーエリア6は、固相担体2上において、1又は複数のプローブ4に割り当てられる領域である。すなわち、一つのフィーチャーエリア6には、1種のプローブ4が固定されていてもよいし、2種以上のプローブ4が固定されていてもよい。固相担体2上において、フィーチャーエリア6は、同一の面積及び形状となっている。フィーチャーエリア6は、例えば、平面的な固相担体2の場合、固相担体2の平坦な表面をグリッド状に区画した方形状の各区画が挙げられる。なお、フィーチャーエリア6は、方形状に限定するものではなく、円形状であってもよく、特に限定されないが、グリッドの区画内で収まる形状とすることで、同一面積及び形状のフィーチャーエリア6を形成しやすい。こうしたグリッドによって区画された領域内にあるフィーチャーエリア6に、プローブ4を固定することでプローブ4を行×列のマトリックス状に備えることとなる。フィーチャーエリア6を多数個設けるために、グリッドによって区画された内部をさらに二分割等してもよい。二分割する形態としては、方形状の区画に対角線でさらに区画してもよい。
【0030】
フィーチャーエリア6の大きさは、0.2mm2以上150mm2以下であることが好ましい。0.2mm2未満であると目視による視認性が低下しすぎ、150mm2を超えてはアレイのサイズ上問題がある。例えば、長辺が1mm〜10mmで、短辺が0.8mm〜5mm程度に設定することができる。なお、フィーチャーエリア6間には適当な間隔を置くことができる。
【0031】
フィーチャーエリア6の個数は、検出意図や検出方法の用途に応じて適宜設定される。固相担体2のサイズ等を考慮すると、特に限定しないが、2個以上200個以下であることが好ましい。200個を超えると、固相担体2のサイズ上の観点及び目視による検出判定が困難になる可能性があるからである。1又は複数のフィーチャーエリア6における目視によるシグナル検出を考慮すると、好ましくは150個以下であり、より好ましくは100個以下である。また、フィーチャーエリア6の個数は、好ましくは20個以上であり、より好ましくは40個以上である。20個以上であると、例えば、各種診断等において汎用性が高い。
【0032】
オリゴヌクレオチドプローブ4は、フィーチャーエリア6内において固定領域を少なくとも有しており、多くの場合、同時にプローブ4が固定されていない非固定領域を伴っている。
【0033】
(プローブ識別情報)
プローブ4は、それぞれそのプローブ4を識別するためのプローブ識別情報を伴って固相担体2上に固定されている。プローブ識別情報は、固相担体2上のプローブ4ごとに特徴的であって、固相担体2上の他のプローブ4のプローブ識別情報と区別可能であることが好ましい。
【0034】
(パターン情報)
プローブ識別情報は、パターン情報を含んでいる。プローブ識別情報がパターン情報を含むことで、他種多様な組み合わせを設定することができ、同一の固相担体2上に多数のプローブを配置してもそれぞれを識別することができる。例えば、プローブ識別情報が色情報のみの場合、色の多様性は低く、また多様な色を提供することも困難であり、さらに色の識別も困難である。このため、同一の固相担体2上において多数個のプローブを配置することができない。さらに、異なる発色操作や化合物を用いて異なる色を付与しなければならず、操作も煩雑でコストがかかってしまうことになる。さらに、安定した発色を確保することも困難である。なお、プローブ識別情報がパターン情報を含んでいれば、さらに色情報を含むことを排除するものではない。
【0035】
本明細書において、「プローブ4がプローブ識別情報を伴って固定されている」とは、パターン情報がフィーチャーエリア6内におけるプローブ4の固定領域、あるいは同エリア6内におけるプローブ4の非固定領域によって特徴付けられていることを意味している。
【0036】
プローブ4のプローブ識別情報がプローブ4の固定領域によって特徴付けられる場合とは、例えば、図1の左上に示すように、プローブ4の固定領域自体が、ある種の明示的なパターン情報(シンボル)(図1では数字の「1」)を形成している場合である。
【0037】
また、プローブ4のプローブ識別情報が非固定領域によって特徴付けられる場合とは、例えば、図1の右上に示すように、プローブ4の固定領域と非固定領域があるとき、非固定領域自体がある種の明示的なパターン情報(シンボル)(図1では、数字の「1」)を形成している場合(いわゆる白抜きの状態)である。このように、フィーチャーエリア6の輪郭(ここでは方形状)に沿ってフィーチャーエリア6の外周をほぼ充填するように形成された固定領域によって実質的に囲繞される非固定領域によって特徴付けられる場合、以下のメリットを奏することができる。
(1)複数のプローブ4の複数のフィーチャーエリア6の各固定領域を、フィーチャーエリア6の輪郭に一致させることができる。プローブ4間で、その固定領域の輪郭が一致しているため、プローブ4を識別するパターン情報の識別力のバラツキを低減することができる。
(2)フィーチャーエリア6内の固定領域におけるハイブリダイゼーション反応性にバラツキが生じた場合であっても、非固定領域による特徴付けが維持されやすく、パターン情報の識別力が高い(特に、パターン情報が数字の場合などが該当する。)
(3)隣り合うフィーチャーエリア6間で非固定領域で特徴付けられるパターン情報が同種であったとしても(例えば、いずれも数字であり、一方が一桁の数字で他方が二桁の数字である場合などが該当する。)、各フィーチャーエリア6における非固定領域は、それぞれの固定領域で区画化されているので、各フィーチャーエリア6のパターンをそれぞれ確実に識別できる。
【0038】
こうしたパターン情報としては、固定領域又は非固定領域の形状に関する情報のほか、これらの領域の大きさに関する情報であってもよく、これらの領域の模様に関する情報であってもよい。パターン情報が形状に関する情報の場合には、文字、数字、記号及び図形並びにこれらの組み合わせからなる群から選択されるシンボルが、フィーチャーエリア6内の固定領域又は非固定領域で特徴付けられる形態が挙げられる。シンボルとしては、シンボルは平行線状あるいはドット状等の各種のバーコードを含むことができる。
【0039】
パターン情報が大きさに関する情報の場合には、同一形状での相似体のシンボルがフィーチャーエリア6の固定領域又は非固定領域によって特徴付けられている形態が挙げられる。
【0040】
パターン情報が模様に関する情報の場合には、例えば、フィーチャーエリア6を多数個の各種形状のドット状、縦ストライプ状、横ストライプ状、斜めストライプ状、網目状等あるいはこれらの組み合わせが固定領域又は非固定領域によって特徴付けられている形態が挙げられる。
【0041】
パターン情報は、目視によって識別可能な大きさを備えることが好ましい。こうした形態であると、ハイブリダイズ産物が検出シグナルを有しているかあるいはハイブリダイズ産物に検出シグナルを付与することで、顕微鏡観察によらずにプローブ識別情報を確認できる。
【0042】
1種のプローブ4のみがフィーチャーエリア6内に固定されている場合には、当該プローブ4の固定領域及び非固定領域でパターン情報が形成される。また、2種以上のプローブ4が、それぞれ独立したパターン情報を形成して一つのフィーチャーエリア6内に固定されていてもよい。この場合、2種以上のプローブ4のパターン情報はフィーチャーエリア6内において部分的に重複していてもよいし、場合によっては完全一致していてもよい。こうすることで、一つのフィーチャーエリア6を2種以上のプローブ4を独立して使用することができ、一つのフィーチャーエリア6を異種のプローブ4のために独立して多重に有効活用できる。
【0043】
例えば、図2に示すように、一つのフィーチャーエリア6内に、第1のプローブ4を数字の「1」というパターン情報を形成して固定するとともに、他の第2のプローブ4を、数字の「2」というパターン情報を形成して固定する。この結果、一つのフィーチャーエリア6は、第1のプローブ4に対応するポリヌクレオチドが存在する被験試料と接したとき、数字の「1」を呈示し、他の第2のプローブ4に対応するポリヌクレオチドが存在する被験試料と接したとき、数字の「2」を呈示する。こうした形態によれば、例えば、2種のポリヌクレオチドのうちいずれか一方が存在するような被験試料の場合において、一つのフィーチャーエリア6で効率的に当該一方のポリヌクレオチドを検出できる。また、異種のプローブ4が異なる用途や場面を意図している場合には、一つのフィーチャーエリア6を多用途(多場面)に使用できる。この場合、一つのフィーチャーエリア6における2種以上のプローブ4のパターン情報は少なくとも部分的に重複することができる。すなわち、完全に一致するパターンであってもよいし、全く異なるパターンであってもよい。検出用剤10が異なる場面や用途に用いられるため、一つのフィーチャーエリア内において二つ以上のプローブ4に基づいて二つ以上のプローブ識別情報が提示されることがないからである。
【0044】
さらに、例えば、一つの固相担体2上に複数個のフィーチャーエリア6を備えており、これらのフィーチャーエリア6に対して、ある種の臨床検査を意図した複数個のプローブ4をそれぞれパターン情報を形成して固定する。さらに、同じ複数個のフィーチャーエリア6に対して、全く異なる種の臨床検査を意図した複数個のプローブ4をそれぞれパターン情報を形成して固定する。こうすることで、一つの本検出用剤10を、異なる用途や場面に用いることができる。
【0045】
図3に、一つのフィーチャーエリア内に第1〜第10までの10種のプローブを必要に応じて複数選択して固定するためのデザインの一例を示す。図3には、10種のプローブがそれぞれ伴うプローブ識別情報、すなわち、1〜0までの数字からなるパターン情報を示す。こうした10種のプローブがそれぞれ個別のパターン情報を形成するためには、例えば、図4の左図に示すように、これらの数字をデジタル表現可能な7個のバー領域(a〜g)で構成するものとする。そして、第1のプローブで数字の「1」を形成するとき、図4の右図に示すように、バー領域e、gに第1のプローブを固定する。同様に、第2のプローブで数字の「2」を形成するとき、前記右図に示すように、バー領域a、b、c、e、gに第2のプローブを固定する。同様に、第3のプローブ〜第10のプローブを用いて、対応する数字を形成するように対応するバー領域に各プローブを固定する。数字をパターン情報として用いることで、一つのフィーチャーエリア6を効率的に活用して複数のプローブ4、すなわち、複数のプローブ情報を内在させることができる。また、数字をパターン情報として用いることで複数のパターン情報が内在されていても、誤認なく各パターン情報を含むプローブ識別情報を識別できる。さらに、デジタル表現された数字とすることで、高い識別性を有している。さらにまた、こうした一つのフィーチャーエリア6内で複数のプローブ4を異なるパターン情報を形成して固定するには、ピエゾ素子を用いたプローブ供給手法を用いることで明瞭なパターン情報を形成できる。
【0046】
また、2種以上のプローブ4が、一つのフィーチャーエリア6内に固定されている場合として、一つのフィーチャーエリア6で同時に2種以上のプローブ4を用いた判別を実現することもできる。例えば、複数のプローブ4のうち、一部のプローブ4のみからなるパターン情報と、全てのプローブ4によって構成されるパターン情報とが、異なる形状、大きさ、模様等となって、同時にパターン情報が提示されても互いに区別可能に異なって形成される場合が挙げられる。典型的には、図5に示すように、一つのフィーチャーエリア6内に、2種のプローブ4を固定するとき、2種のプローブ4のパターン情報を相補的に形成することができる。すなわち、一つのフィーチャーエリア6内の中心部に各プローブ4につき合同の形状の直角三角形の固定領域をその斜辺が近接して対向するように形成する。この結果、第1及び第2のプローブ4のみからなるパターン情報は、斜辺が対向するように配置されたそれぞれ直角三角形のパターンであるが、二つのプローブ4のパターン情報が合体すると方形状のパターン形成することとなる。なお、個々のプローブ4のパターン情報や合体して形成するパターンについては特に限定されず、各種形態を採ることができる。
【0047】
(方向性情報)
固相担体2上には、固相担体2上のパターン情報の方向性を示す方向性情報8を備えることができる。こうした方向性情報を固相担体2上に備えることで、プローブ識別情報の識別力を高めることができる。方向性情報は、例えば、顔料インク又は染料インク等で固相担体2上に付与して形成することができる。方向性情報8の形態は特に限定しないで、バー状、ドット状等とすることができ、固相担体2における位置は、固相担体2を視認する場合の方向を特定できる形態であれば特に限定されない。方向性情報8は、例えば、固相担体2の一部(例えば、方形状のとき、上辺及び/又は下辺、角部等)に設けることができる。
【0048】
(本検出用剤の製造方法)
本検出用剤の製造方法は、固相担体2上に、プローブ4を、プローブ識別情報を伴って供給する工程を備えることができる。こうすることで、プローブ4の固定位置の照合操作を省略できる検出用剤を製造できる。
【0049】
プローブ4は、既に説明したプローブ識別情報を構成できるように固相担体2上に供給される。こうしたプローブ4の固相担体2への供給やプローブ4の固相担体2への固定化は、従来公知の手法に従い行うことができる。本検出用剤の製造方法においては、プローブ4をプローブ識別情報を伴って供給して固定するものであるため、プローブ4を含有する液体を、ピエゾ素子を用いて吐出して固相担体2に供給することが好ましい。ピエゾ素子を用いることで、微細なパターン情報であっても精度よく供給できて識別力の高いパターン情報を形成できる。
【0050】
(標的ポリヌクレオチドの検出用のキット)
本発明のキットは、本検出用剤と、本検出用剤において得られる被験試料中のDNA等とのハイブリダイズ産物にプローブ識別情報を肉眼で視認可能な検出シグナルを付与可能な薬剤と、を備えることができる。肉眼で視認可能な検出シグナルをハイブリダイズ産物に付与できれば、蛍光を検知する装置なくして簡易にプローブ識別情報を確認できる。
【0051】
こうした薬剤としては、特に限定しないが、例えば、被験試料を、蛍光色素などの標識物質あるいは標識物質と標識用化合物が結合したポリメラーゼ増幅反応の産物として調製できるプライマー又は当該プライマーを含むポリメラーゼ増幅反応キットが挙げられる。例えば、標識物質又は標識結合性物質が結合したプライマーであってもよいし、こうした結合物を持たないプライマーと、DNA鎖の伸長に伴って標識物質あるいは標識結合性物質を連結できるように構成されたヌクレオチド3リン酸セットの組み合わせであってもよいし、増幅産物に対して標識物質又は標識結合性物質を導入できる修飾用の薬剤とこのためのプライマーとの組み合わせであってもよい。最終的にハイブリダイズ産物に肉眼で視認可能な検出シグナルを付与するための手法や薬剤は、当業者において周知であり、当業者であれば、必要に応じて公知の手法や薬剤から適宜選択して用いることができる。
【0052】
(標的ポリヌクレオチドの検出方法)
本発明の標的ポリヌクレオチドの検出方法は、本検出用剤10上のプローブ4と、被験試料とについてハイブリダイゼーションを実施する工程と、ハイブリダイゼーションで得られたハイブリダイズ産物が呈示するプローブ識別情報に基づいて標的ポリヌクレオチドを検出する工程と、を備えることができる。この検出方法によれば、プローブ識別情報を用いて標的ポリヌクレオチドを検出できるため、従来のプローブ位置の照合操作を省略することができる。
【0053】
(被験試料の準備)
ハイブリダイゼーション工程に供する被験試料は、特に限定しないで、ハイブリダイゼーションの対象となる可能性のある標的ポリヌクレオチドを含んでいればよい。被験試料としては、プローブハイブリダイゼーションが適用される公知の遺伝子情報、DNAを用いた検出、検査、診断方法における被験試料を本方法に用いることができる。
【0054】
被験試料には、各種の生体由来の試料(血液、尿、痰、組織、細胞(各種の動物由来の培養動物細胞、培養植物細胞、培養微生物細胞を含む))あるいは、こうした生体試料からDNAなどのポリヌクレオチドを抽出した抽出試料、こうした生体試料の有するDNAやRNAから各種の遺伝子増幅手法による増幅試料等が含まれる。また、後述するシグナル付与工程を考慮すると、被験試料中のオリゴヌクレオチドが予め標識ないし標識可能に構成されていることが好ましい。当業者であれば、こうした被験試料を周知の技術に基づいて容易に調製することができる。
【0055】
遺伝子増幅反応としては、公知の各種の反応が利用でき、例えば、各種手法によるPCRのほか、LCR、SDA、ICAN等が挙げられる。また、被験試料中のポリヌクレオチドを標識するのにあたっては、所定の標識結合性物質が連結されたdNTPを取り込ませる方法によることができる。標識結合性物質とは、ジゴキニゲニン(DIG)などのハプテンやビオチンなどが挙げられる。例えば、当該ハプテン特異的認識抗体を用い、さらに当該認識抗体に付与した例えば、ペルオキシダーゼ等の発色性物質を検出シグナルとして用いることができる。例えば、図6に例示する以下の被験試料調製工程を実施してもよい。
【0056】
被験試料調製工程の一例は、ハイブリダイゼーション工程に用いる容器と同一容器を用いて、遺伝子増幅反応によって被験試料を調製する工程が挙げられる。同一容器を用いることで、増幅に用いた容器に対して検出用剤10を投入することでそのままハイブリダイゼーション工程を実施できる。また、こうすることで、用いる容器数を減少させ、操作を簡略化することができる。なお、遺伝子増幅反応実施後、同一容器内の遺伝子増幅反応液又はハイブリダイゼーション用の液を供給することが好ましい。そして、さらに、ハイブリダイゼーションに先立つ高温による変性工程も同一容器内でそのまま実施することがより好ましい。こうすることで、操作を簡略化し、さらに操作の迅速化、温度制御の迅速化及び高精度化も実現できる。
【0057】
(ハイブリダイゼーション工程)
ハイブリダイゼーション工程では、本検出用剤10のプローブ4と被験試料とにつきハイブリダイゼーションを実施する。ハイブリダイゼーションは、プローブ4と被験試料中の可能性ある標的ポリヌクレオチドが特異的に結合するような条件で行う。こうした温度、塩濃度及び時間等は、用いるプローブ4等の種類にもよるが、当業者であれば適宜設定することができる。
【0058】
ハイブリダイゼーション工程の実施形態は特に限定しないが、たとえば、上記した被験試料調製工程の一例の後段として、図2に例示するように、本検出用剤10毎に1ml以下の液中で実施することができる。
【0059】
ハイブリダイゼーション工程の一例では、本検出用剤10を用いて1ml以下の液中ハイブリダイゼーションを可能とする形態は、ハイブリダイゼーション容器の大きさによっても異なるが、例えば、当該容器として、先細りのあるいは寸胴状のチューブ状容器が意図されることが好ましい。すなわち、こうした容器を用いて本検出方法を実施することが好ましい。先細り状の容器の例としては、典型的には、エッペンドルフチューブ(商品名)が挙げられ、寸胴状の容器の例としては、典型的には一般的な試験管等が挙げられる。チューブ状容器は、例えば、1ml以下、0.5ml以下、0.3ml以下のハイブリダイゼーション液を充填できる容積を有することが好ましい。こうしたチューブ状容器としては、それぞれ、内径7〜9mm、典型的には8mm、深さ37〜39mm、典型的には38mm、内径5〜7mm、典型的には6mm、深さ29〜31mm、典型的には30mm及び内径4〜6mm、典型的には5mm、深さ19〜21mm、典型的には20mmのサイズを有するものが挙げられる。
【0060】
容器は、また、透明性であることが好ましい。内部の本検出用剤10のプローブ識別情報を肉眼で視認するのに都合がよいからである。また、容器は、その開口部(通常は上部)を開閉するために脱着可能な蓋を備えていてもよい。こうした蓋を備えることで、少ない液量の蒸発等を防ぐとともに、温度制御を迅速かつ容易化できる。
【0061】
ハイブリダイゼーション工程の一例では、図6に示すように、本検出用剤10を用いて、一つの本検出用剤10につき1ml以下、好ましくは、0.5ml以下、より好ましくは0.3ml以下の液中でハイブリダイゼーションを実施する。ハイブリダイゼーション工程において、被験試料中に、プローブと塩基対を形成する標的ポリヌクレオチドを有するオリゴヌクレオチドを含んでいるとき、二重鎖ハイブリダイズ産物が形成される。
【0062】
ハイブリダイゼーション工程の一例では、本検出用剤10を所定の方向でチューブ状容器に投入し、その状態を維持して実施することが好ましい。具体的には、チューブ状容器の内部形態に合わせて、本検出用剤10の長辺が容器の深さ方向に沿う状態を維持して実施することが好ましい。上記したアスペクト比の方形状シートの本検出用剤10を用いることで、市販で入手できる1〜0.3ml程度の各種形態のチューブ状容器内に安定して保持される。
【0063】
ハイブリダイゼーション工程の一例では、チューブ状容器を用いる場合、既存のPCRのための温度制御装置に適用することができる。こうした温度制御を実施することで、精度よくかつ迅速に温度制御が可能となる。ハイブリダイゼーション工程の条件は特に限定しない。通常のハイブリダイズ媒体を用いることができる。また、適度な温度に設定することができる。
【0064】
なお、後段の検出工程に先立って、過剰の被験試料を洗浄除去する洗浄工程を実施することが好ましい。洗浄工程は、ハイブリダイゼーション工程を実施した容器からハイブリダイゼーション液を除去して本検出用剤10のみを残留させた状態で、所定の温度条件で洗浄に適した液を供給して適当な時間接触させることを適数回繰り返すことによって実施できる。こうした洗浄工程を同一容器で実施することで、操作を簡略化し容器数を減らしてしかも、温度制御を迅速かつ精度よく行うことができる。
【0065】
(シグナル付与工程)
ハイブリダイゼーション工程後、前記検出工程に先立って、前記ハイブリダイズ産物に前記プローブ識別情報を検出可能な検出シグナルを付与する工程を、備えることができる。ハイブリダイズ産物が、被験試料において付与された標識物質によって既に標識されている場合においては、ハイブリダイゼーション工程後に検出工程を実施してプローブ識別情報を確認できるが、そうでない場合には、ハイブリダイズ産物からプローブ識別情報をなんらかの手段で確認できる検出シグナルを付与することが好ましい。
【0066】
シグナル付与工程は、ハイブリダイズ産物に対して各種の標識物質を付与する、又は既に標識結合性物質を備えている場合には当該標識結合物質に特異的に結合する標識物質を付与する工程である。こうした標識物質及び標識結合性物質については、既に説明したとおりである。特に、肉眼で視認可能な標識物質を付与することで、特別な検出装置を要することなく、しかもリアルタイムに発色を肉眼で観察し判定することができる。二重鎖ハイブリダイズ産物に検出シグナル付与するには、例えば、既に記載のとおり、予め被験試料中のポリヌクレオチドに対してハプテンなどのほか、ビオチンなどの標識結合性物質を付与しておくことが挙げられる。そして、本工程において、当該標識結合性物質に特異的な標識物質を付与することで、当該二次シグナルを利用して肉眼で視認可能な検出シグナルを付与することができる。すなわち、検出系としては、抗原抗体反応やビオチン−アビジン反応を利用できる。あるいは、ハイブリダイズ産物の被験試料部位に標識結合性物質に付与し、その後標識物質を付与してもよいし、ハイブリダイズ産物の被験試料部位に直接標識物質を付与するようにしてもよい。
【0067】
標識物質は、発色性の生成物を生成する酵素であることが好ましい。こうすることで、酵素反応を利用して発色性生成物を速やかにかつリアルタイムに検出することができる。この場合、標識物質は、ハプテンに特異的に結合する抗体とこうした酵素とを備えた複合体とすることができる。
【0068】
なお、抗原抗体反応やビオチン−アビジン結合のための2以上の化合物を介して最終的に標識物質をハイブリダイズ産物に結合させてもよい。
【0069】
シグナル付与工程は、図6に示すように、上記した被験試料調製工程及びハイブリダイゼーション工程の各一例の後段として行うときには、前段の工程で用いたのと同一容器内で実施することが好ましい。こうすることで、操作を簡略化して迅速性を向上させることができる。また、本検出用剤10を、同一容器に残しておくことで、本検出用剤10の容器への投入時(ハイブリダイゼーション工程時)の一定の方向性を容易に維持できる。例えば、過剰試料除去後の本検出用剤10が残留した同一容器に、標識物質を含む溶液を投入して標識反応を実施することができる。過剰の標識物質を除去洗浄後、標識物質による検出シグナルをそのまま肉眼で視認できる場合以外は、さらに、標識物質を発色させる発色反応を実施する。例えば、標識物質としてペルオキシダーゼなどの酵素を用いた場合には、過剰なペルオキシダーゼ除去後に、その基質を供給して酵素反応を生じさせる。さらに重ねて標識物質を要する場合には、洗浄及び反応工程をさらに実施する。
【0070】
(検出工程)
検出工程は、ハイブリダイゼーションで得られたハイブリダイズ産物が呈示するプローブ識別情報に基づいて標的ポリヌクレオチドを検出する工程である。この検出工程によれば、予めプローブ毎に付与されているプローブ識別情報を識別することで直ちに標的ポリヌクレオチドを特定できるため、従来のようなプローブの位置照合操作を省略することができる。上記のとおり、ハイブリダイズ産物は、被験試料調製時からあるいはハイブリダイゼーション工程後の修飾により検出シグナルが付与されているので、プローブ識別情報を呈示することができる。プローブ識別情報は、標識物質の種類に応じて、特定波長域の光を照射して検出したり、発色反応を行って検出したりすることができる。標識物質等の種類により、プローブ識別情報を肉眼にて視認できる場合には、特別な、標的ポリヌクレオチドの有無を検出する。
【0071】
検出にあたっては、既に説明した被験試料調製工程、ハイブリダイゼーション工程及びシグナル付与工程を同一容器内で行う形態においては、図6に示すように、本検出用剤10が充填されたままの容器内で行ってもよいし、本検出用剤10を容器から取り出して容器外で行ってもよい。また、シグナル付与のための液が投入されたままの状態で行っても良い。シグナル付与工程において、ハイブリダイゼーション工程に用いたのと同一容器で本検出用剤10の方向性が維持された状態とすることで、本検出用剤10における検出シグナルの検出の際に、投入時と同様である、所定の方向性でシグナルを検出できるため、標的ポリヌクレオチドの検出が容易であり確度も高いものとなる。
【0072】
検出工程は、標的ポリヌクレオチドや用途に応じて、被験試料中の複数の標的ポリヌクレオチドの組み合わせを検出する工程であってもよい。例えば、肺炎の原因菌の型判別のように、複数の遺伝子の複数の配列を検出する場合には、複数の標的ポリヌクレオチドに対応する複数のプローブ4の組み合わせが検出される。この場合、こうした組み合わせを、本検出用剤10上において得られたプローブ識別情報とから、最終的な検出対象を特定することもできる。
【実施例】
【0073】
以下、本発明を、実施例を挙げて具体的に説明するが、以下の実施例は本発明を説明するものであって、本発明の範囲を限定するものではない。
【実施例1】
【0074】
(本検出用剤(アレイ)の作製)
ポリエーテルスルホン製であって、サイズが285mm×50mm、孔径が0.5μm、厚さが0.15mのシートに、以下の表に示す塩基配列からなるDNAプローブ溶液を、特開2003−75305号公報に記載されている吐出ユニット(ピエゾ素子を用いた吐出ユニット)を用いた日本ガイシ株式会社GENESHOT(登録商標)スポッターを用いて、スポットし、以下の手順で固定化した。
【0075】
(DNAプローブ溶液)
DNAプローブ15種類を以下の表に示す塩基配列に従って合成し、Tris-EDTA bufferで溶解した水溶液を、SSC緩衝液、ブロモフェノールブルーと混合してDNAプローブ濃度が2μM〜60μMのDNAプローブ溶液を調製した。
【表1】

【0076】
(手順1)
吐出ユニット内に配置した液体注入部に、DNAプローブ溶液を注入し、シートにスポットする前に、シート上に検査スポットを行った。品質の検査は、検査スポットに対し、スポットが形成されないことはないか、スポットがいびつな形状ではないか、スポット径が設計値から10% 以上ずれていないか、サテライトと呼ばれる本スポット以外の不要なスポットが発生していないか、スポット位置がスポット径の3分の1以上ずれていないかという項目を実施した。シートの色は白色で、DNAプローブ溶液はブロモフェノールブルーによって青色に着色されているため、目視で検査を実施した。ブロモフェノールブルーは、ハイブリダイゼーション〜酵素付抗体免疫反応〜酵素発色色素沈着において、溶出し、除去される。
【0077】
(手順2)
検査スポットで不良が検出されたときは、吐出ユニット内に配置された圧電/電歪素子の駆動信号を調整して検査スポットを再度行う。駆動信号の調整は電圧値、所定電圧までの上昇時間、所定電圧値のキープ時間、電圧立ち下げ時間の変更で行った。それでも不良が検出されるときは、真空吸引することで吐出ユニットからDNAプローブ溶液を抜き取り、液体注入部にDNAプローブ溶液を再度注入して、検査スポットを行う。不良スポットが検出されなくなるまで、この操作を繰り返した。
【0078】
(手順3)
不良スポットが検出されなくなったことを確認したのち、以下の方法でDNAプローブ溶液をシートにスポットした。すなわち、1種類のDNAプローブ溶液につき、スポットのピッチを横方向(X方向)、縦方向(Y方向)ともに0.05mmで、横方向、縦方向ともにスポットを行い、横方向0.9mm、縦方向1.3mmのスクエア形状の一つのフィーチャーを形成した。固定領域のコーナーはR=0.05mmとなった。シート上を吐出ユニットが、シート長手方向(X方向)に移動しながら、シートがシート短手方向(Y方向)に移動して、非接触でスポットを行う。フィーチャーのピッチを縦方向1.5mm、横方向1mmで3列×5行の格子エリア内に15種類のDNAプローブの固定化領域を形成・配置して、複数のフィーチャーからなる1つの区画(7.3mm×2.9mm)を形成した。さらにこの区画を、縦方向13.5mmピッチ、横方向6.8mmピッチで、1シートに84個形成した。
【0079】
フィーチャー内に、DNAプローブを個別に識別できるように、プローブ識別情報として、DNAプローブ溶液を“1、2、・・・・・、A、B、・・・”の英数字と、英数字が白抜けとなるように2種類のデザインで、スポットを行った。
【0080】
(手順4)
1区画の上部に、1区画の上下を判別できるように顔料系マゼンダインクのマーカー(方向性情報)のスポットを行った。
【0081】
(手順5)
DNAプローブ溶液、マーカーのスポットが完了したのち、風乾することで、DNAプローブの固定、マーカーの固着を行った。
(手順6)
(手順1)で行う検査と同様の項目で検査を行った。
(手順7)
不良が検出されなかったシートについて、1アレイを4mm×9mmサイズに、ローラーカッターで切断することで、1シートから84個のアレイを得た。2種類のアレイを図7に示す。
【実施例2】
【0082】
本実施例では、本アレイを評価した。
【0083】
(遺伝子増幅工程)
DNAプローブに対して相補的な配列を有するように人工的に合成したDNAを、DIGラベルにより標識することで、サンプルDNAを得た。
【0084】
(変性工程)
各チューブに、ハイブリダイゼーション液として、0.5%Tween20、1%BSAのPBS溶液200μlを加えて、良く混合し、95℃に加熱したヒートブロックに5分配置後、氷水中に移して急冷した。
【0085】
(ハイブリダイゼーション工程)
各チューブに、実施例1で作製したアレイを一個ずつ、投入して、60℃に制御したヒートブロックに挿入して15分ハイブリダイゼーションを実施した。
【0086】
(洗浄工程)
ハイブリダイゼーション工程に用いた溶液を一旦除去し、チューブ内のアレイに対して新たにハイブリダイゼーション溶液200μlを添加し、60℃のヒートブロックで1分間静置状態で加熱してハイブリダイゼーション液を除去した後、さらに同様にしてハイブリダイゼーション液を交換してそれぞれ10分及び1分の洗浄を繰り返した。
【0087】
(シグナル付与工程)
抗DIG抗体酵素(ペルオキシダーゼ)含有試薬(DIG−POD、ロッシュ製)の1000倍希釈液200μlを各チューブ内のアレイに供給して、抗原抗体反応により酵素を結合させた。
【0088】
(洗浄工程)
シグナル付与工程に用いた溶液を除去し、チューブ内のアレイに対して新たにハイブリダイゼーション溶液250μlを添加し、60℃のヒートブロックで1分間静置状態で加熱してハイブリダイゼーション液を除去した後、さらに同様にしてハイブリダイゼーション液を交換してそれぞれ10分及び1分の洗浄を繰り返した。
【0089】
(基質反応工程)
洗浄後のチューブに対してペルオキシダーゼの基質溶液(Vec.Lab製、TMBキット)200μlを供給して、室温で酵素反応を行い、青色の反応生成物を生成させた。
【0090】
(検出工程)
DNAプローブ名”1”は発色パターンの数字の”1”と対応している。他にもDNAプローブ名”2”、”A”、”B”は、それぞれ発色パターンの数字の”2”並びにアルファベットの”A”及び”B”に対応している。各チューブ内で反応後、固定化領域の発色パターンを確認したところ、図8のように、それぞれの発色パターン、“1”、“2”、“A”、“B”が発色するのを確認することができた。白抜けのデザインについても、図9のように、プローブ名を白抜けの英数字で確認することができた。こうして、発色したDNAプローブの位置情報とプローブ配置図を照合することなく、DNAプローブを認識することができた。図8のように文字の部分が発色したことで、迅速かつ容易にDNAプローブを認識することができた。図9のように、文字部を白抜けとすることで、さらに認識が容易となった。
【配列表フリーテキスト】
【0091】
配列番号1〜15:プローブ
【技術分野】
【0001】
本発明は、標的ポリヌクレオチドを検出するためのアレイなどの検出用剤、その製造方法及び使用に関する。
【背景技術】
【0002】
各種生物における遺伝子解析が進み、遺伝子多型、遺伝子変異など検査など、結核菌の型別及び感染症における原因菌若しくはウイルスの同定、分類等が、遺伝子情報を利用して行われている。また、遺伝子配列の決定も行われている。
【0003】
こうした遺伝子に関する検査にあたっては、通常、特定のオリゴヌクレオチドプローブを固相担体に固定したアレイなどの検出用剤を用いて行われている。より具体的には、固相担体に固定化された、予め配列を取得している標的オリゴヌクレオチドに関連付けたオリゴヌクレオチドプローブと、分析対象から取得した遺伝子試料とをハイブリダイズさせて、ハイブリダイズ産物をプローブ又は遺伝子試料に付与されたシグナル等に基づき検出することにより、標的ポリヌクレオチドを検出している。
【0004】
従来この種の方法としては、例えば、複数の検出しようとする菌の型別に必要な特異的プローブ数十種類を準備し、メンブレン上にこれらのプローブを平行線状に固定化しておき、ブロッターを用いてプローブのラインパターンと垂直になるように試料から調製したPCR産物を供給しハイブリダイズさせる方法がある。この方法では、PCR産物がビオチン標識されているため、ハイブリダイゼーション後のメンブレンをペルオキシダーゼ標識ストレプトアビジンでインキュベートする。これにより、ハイブリダイズしたPCR産物をペルオキシダーゼで標識し、ECL試薬による化学発光シグナルをX線フィルムへ感光させる。生体試料に含まれている菌の型に応じて表出される特異的プローブの配列パターンに基づき型判別が可能となる(非特許文献1)。
【0005】
さらに、標的ポリヌクレオチドの検出を容易にするため、試験紙などに、関連する2種類以上の互いに異なる生理活性物質(特異的プローブ等)を隣接して固定しておいて、これらの全部の生理活性物質においてシグナルを検出するかあるいはその一部においてシグナルを欠損するかによって、変異の有無を検出することも検討されている(特許文献1)。また、複数列×複数行のマトリックス状に複数のプローブが固定化されているときにおいて、プローブの位置を特定可能なマーカー物質も固定化しておくことも試みられている(特許文献2)。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特開2007−64927号公報
【特許文献2】特開2000−270896号公報
【非特許文献】
【0007】
【非特許文献1】Ocimum BiosolutionsのHP(FIGGENhttp://www3.ocimumbio.com/wp-content/uploads/docs/OBS_SPK_WP.pdf)
【発明の概要】
【発明が解決しようとする課題】
【0008】
通常、プローブは、いずれも、固相担体上の予め決定された特定の位置に固定されている。したがって、どのプローブにおいてハイブリダイズ産物を検出したか否かを判定するには、予め決定されている固相担体上におけるプローブの位置情報と照らし合わせる必要がある。このような照合操作は、目視で行われうる場合もあるが、一般的には、ハイブリダイゼーション反応後のアレイから画像情報を取得し、その後、専用の解析ソフトでどのプローブにおいてハイブリダイズ産物が検出されたかが判定される。
【0009】
しかしながら、上記した従来の方法では、いずれも、どの位置のプローブにおいてハイブリダイズ産物を検出したかを特定するのは困難であった。上記非特許文献1及び特許文献1では、標的ポリヌクレオチドに関連する一群のプローブの固定化領域の検出パターン認識を前提とするものであった。したがって、これらの先行技術では、個々の一つのプローブについての検出を容易することはできず、依然として面倒な照合操作を要していた。
【0010】
また、上記特許文献2に開示される方法では、個別のプローブの特定ならびに検出及び定量を容易にし信頼性を向上させるものとして有効であった。しかしながら、依然として照合操作は必要であった。
【0011】
そこで、本発明では、より簡便で実用的にハイブリダイズ産物の有無を検出できる標的ポリヌクレオチドの検出用剤を提供することを一つの目的とする。
【課題を解決するための手段】
【0012】
本発明者らは、より実用的で簡便な標的ポリヌクレオチドの検出のために、既知のプローブ個別の位置情報との照合操作を簡素化ないし省略するべく検討した。その結果、本発明者らは、個々のプローブを固定化するパターンにそのプローブの識別情報を付与することで、ハイブリダイゼーション反応後のハイブリダイズ産物を生成したプローブの位置の照合操作を省略できるという知見を得た。こうした知見によれば、以下の手段が提供される。
【0013】
(1)標的ポリヌクレオチドを検出するための検出用剤であって、
固相担体と、
前記標的ポリヌクレオチドに予め関連付けられたオリゴヌクレオチドプローブであって、パターン情報を含むプローブ識別情報を伴って、前記固相担体上に固定されるオリゴヌクレオチドプローブと、
を備える、検出用剤。
(2)前記固相担体上には、1又は2以上の前記オリゴヌクレオチドプローブを固定するための1又は2以上のフィーチャーエリアが画定されており、
前記パターン情報は、前記フィーチャーエリアのそれぞれにおいて、1又は2以上の前記オリゴヌクレオチドプローブの固定領域又はそれらの非固定領域によって特徴付けられる、(1)に記載の検出用剤。
(3)前記パターン情報は、前記フィーチャーエリアの輪郭に沿う前記固定領域によって実質的に囲繞される前記非固定領域によって特徴付けられる、(2)に記載の検出用剤。
(4)前記パターン情報は、前記固定領域又は前記非固定領域の形状に関する情報を含む、(2)又は(3)に記載の検出用剤。
(5)前記パターン情報は、前記固定領域又は前記非固定領域の大きさに関する情報を含む、(2)〜(4)のいずれかに記載の検出用剤。
(6)前記パターン情報は、前記固定領域又は前記非固定領域の模様に関する情報を含む、(2)〜(5)のいずれかに記載の検出用剤。
(7)前記パターン情報は、文字、数字、記号及び図形並びにこれらの組み合わせからなる群から選択されるシンボルを含む、(2)〜(6)のいずれかに記載の検出用剤。
(8)前記シンボルはバーコードを含む、(7)に記載の検出用剤。
(9)前記パターン情報は、目視によって識別可能な大きさを備える、(1)〜(8)のいずれかに記載の検出用剤。
(10)前記固相担体上には、1又は2以上の前記オリゴヌクレオチドプローブを固定するための1又は2以上のフィーチャーエリアが画定されており、
1つの前記フィーチャーエリア内において、2以上の前記オリゴヌクレオチドプローブの前記パターン情報が配置されている、(1)〜(9)のいずれかに記載の検出用剤。
(11)1つの前記フィーチャーエリア内において、2以上の前記オリゴヌクレオチドプローブの前記パターン情報が少なくとも部分的に重複する、(10)に記載の検出用剤。
(12)1つの前記フィーチャーエリア内において、2以上の前記オリゴヌクレオチドの前記パターン情報が相補的である、(10)に記載の検出用剤。
(13) 前記固相担体上の前記パターン情報の方向性を示す方向性情報を前記固相担体上に備える、(1)〜(12)のいずれかに記載の検出用剤。
(14) 複数個の前記オリゴヌクレオチドプローブを、これらの前記オリゴヌクレオチドプローブ毎の前記プローブ識別情報を伴って前記固相担体上に備える、(1)〜(13)のいずれかに記載の検出用剤。
(15)(1)〜(14)のいずれかに記載の検出用剤と、
前記ハイブリダイズ産物に前記プローブ識別情報を肉眼で視認可能な検出シグナルを付与可能な薬剤と、
を備える、キット。
(16)(1)〜(14)のいずれかに記載の検出用剤の製造方法であって、
前記固相担体上に、前記オリゴヌクレオチドプローブを、前記プローブ識別情報を伴って供給する工程、
を備える、製造方法。
(17)前記オリゴヌクレオチドの供給工程は、前記オリゴヌクレオチドプローブを含有する液体を、ピエゾ素子を用いて吐出して前記固相担体上に供給する工程である、(16)に記載の製造方法。
(18)標的ポリヌクレオチドの検出方法であって、
(1)〜(14)のいずれかに記載の検出用剤上の前記オリゴヌクレオチドプローブと、被験試料とについてハイブリダイゼーションを実施する工程と、
前記ハイブリダイゼーションで得られたハイブリダイズ産物が呈示する前記プローブ識別情報に基づいて前記標的ポリヌクレオチドを検出する工程と、
を備える、検出方法。
(19)前記ハイブリダイゼーション工程後、前記検出工程に先立って、前記ハイブリダイズ産物に前記プローブ識別情報を肉眼で視認可能な検出シグナルを付与する工程を、備える、(18)に記載の検出方法。
(20)前記標的ポリヌクレオチドは一塩基多型を含む、(18)は(19)に記載の検出方法。
【図面の簡単な説明】
【0014】
【図1】本発明の検出用剤の一例を示す図である。
【図2】2種以上のプローブを一つのフィーチャーエリアに固定した一例を示す図である。
【図3】一つのフィーチャーエリア内に第1〜第10までの10種のプローブを必要に応じて複数選択して固定するためのデザインの一例を示す図である。
【図4】デジタル表現された1〜0の数字の各数字からなるパターンを、8個のバー領域a〜gを用いて10種のプローブを用いて形成する場合のプローブ供給領域を示す図であり、左図は、バー領域a〜gを示し、右図は、数字とプローブを付与するバー領域を示す図である。
【図5】一つのフィーチャーエリア内で、2種のプローブをそれぞれ同時検出可能にパターン情報を形成する一例を示す図である。
【図6】本発明の検出方法の一例を示す図である。
【図7】実施例1で作製したアレイを示す図である。
【図8】実施例1で作製したアレイを用いた検出結果の一例を示す図である。
【図9】実施例1で作製したアレイを用いた検出結果の他の一例を示す図である。
【発明を実施するための形態】
【0015】
本発明は、標的ポリヌクレオチドの検出用剤及びその利用、詳しくは、標的ポリヌクレオチドの検出用剤、その製造方法及び標的ポリヌクレオチドの検出方法に関する。本発明の検出用剤では、この種の検出用剤に必要とされていたオリゴヌクレオチドプローブの位置の照合操作に替えてオリゴヌクレオチドプローブを識別するためのパターン情報を含むプローブ識別情報を取得する。プローブ識別情報は、それ自体オリゴヌクレオチドプローブを識別できるパターン情報を含んでいるため、位置照合することなく、どのオリゴヌクレオチドプローブにおいてハイブリダイズ産物が生成されたか、すなわち、どの標的オリゴヌクレオチドが検出できたかを直ちに知ることができる。この結果、前記照合操作を省略して標的オリゴヌクレオチドの検出が可能となる。
【0016】
本発明の検出用剤によれば、プローブの位置の照合操作を簡素化ないし省略できるため、画像情報の取得装置やプローブ位置照合のための専用の解析ソフトなどを簡素化ないし省略することができる。また、プローブ識別情報を目視で視認可能な大きさを有する場合には、簡易に標的ポリヌクレオチドの検出が可能となる。さらに、プローブ識別情報を、可視光等を用いて目視で視認可能である場合には、装置を備えていない検査現場において遺伝子検査等を容易に実施できるようになる。可視光による検出は、装置コストを低減できるほか、リアルタイムに発色を観察できる点が検査の迅速性に寄与している。
【0017】
本明細書において、標的ポリヌクレオチドは、ヌクレオチドの重合体を意味しており、その重合数は特に限定しない。したがって、標的ポリヌクレオチドには、数個から数十程度のヌクレオチドが連結したオリゴヌクレオチドが包含される。標的ポリヌクレオチドは、例えば、体質、遺伝病、癌などの特定疾患についての発症、疾患診断、治療予後、薬剤や治療の選択などのヒト、非ヒト動物などの生物における遺伝子上の指標となる塩基あるいは塩基配列を標的部位として含むことができる。標的ポリヌクレオチドとしては、典型的には、SNPなどの多型や先天的又は後天的変異を標的部位として含むポリヌクレオチドが挙げられる。また、病原菌やウイルスなどの微生物由来の塩基配列も標的部位として含むポリヌクレオチドが挙げられる。
【0018】
以下、本発明の実施形態について、適宜図面を参照しながら説明する。図1には、本発明の検出用剤の一例を示す。
【0019】
(標的ポリヌクレオチドの検出用剤)
本発明の標的ポリヌクレオチドの検出用剤(以下、本検出用剤という。)10は、固相担体2と、
標的ポリヌクレオチドに予め関連付けられたオリゴヌクレオチドプローブであって、パターン情報を含むプローブ識別情報を伴って、固相担体2上に固定されるオリゴヌクレオチドプローブ4と、を備えている。
【0020】
(固相担体)
固相担体2は、その材料を特に限定しないで、セラミックス、ガラス、金属、合成樹脂等を用いることができる。オリゴヌクレオチドプローブ4を固定化するための層を別途備えることもできる。固相担体2は、ダウンサイジング性、小スケールでの取り扱い性、反応性、プローブ識別情報の視認性等を考慮すると、液体の浸透性又は透過性を有することが好ましい。こうした材料としては、例えば、合成樹脂が挙げられ、典型的には、ポリエーテルスルホン、ニトロセルロース、ナイロン、ポリフッ化ビニリデンなどのポリマーを主体としたいわゆる多孔性のメンブランフィルターのほか、セルロースなどのろ紙を好ましく用いることができる。
【0021】
固相担体2の形状は、問わないで、各種形状のビーズ、シート状とすることができる。シート状であると、ハンドリング性が良く、検査データとしての保存にも有利である。さらに、シート状であると、一定の可撓性も付与しやすく、ハイブリダイゼーションの容器への充填性、収納性及び反応性に有利に寄与することができる。固相担体2の厚みとしては、0.01mm以上0.3mm以下であることが好ましい。
【0022】
より具体的には、固相担体2の形態は、平面積が150mm2以下であることが好ましい。この平面積以下であると、十分に1ml以下の液中においても固定化領域においてハイブリダイゼーションが可能である。より好ましくは、100mm2以下であり、さらに好ましくは50mm2以下である。50mm2以下であると、0.3ml以下の液中でのハイブリダイゼーションにも有効である。
【0023】
また、好ましくは、アスペクト比が1.5以上の方形状である。こうした方形状であると、チューブ状容器に収まりやすく、ハンドリングも容易である。また、チューブ状容器内で反転したりせずに、容器内において投入時の形態が保持され、予め定めた一定の方向性が確保される。さらに、方形状であると、本検出用剤10の方向性を目視で簡易に判別することができ、後述するハイブリダイゼーション工程ほか、シグナル付与工程及び検出工程に都合がよい。より好ましくはアスペクト比は20以下である。アスペクト比が20を超えるとプローブ識別情報を把握しにくくなるからであり、20以下であると複数個のプローブ識別情報を目視で識別しやすいため、検出精度を維持ないし向上させることができる。アスペクト比は好ましくは15以下であり、より好ましくは10以下であり、さらに好ましくは5以下であり、一層好ましくは3以下である。
【0024】
(オリゴヌクレオチドプローブ)
オリゴヌクレオチドプローブ(以下、単にプローブという。)4は、特に限定しないで、従来公知の手法で固相担体2上に固定されている。すなわち、共有結合他、非共有結合で固定されていてもよい。また、プローブ4は、固相担体2上に少なくとも1つ備えられる。好ましくは複数個備えられ、より好ましくは十数個以上備えられ、さらに好ましくは数十個以上備えられる。
【0025】
プローブ4は、検出する標的ポリヌクレオチドや、標的ポリヌクレオチドの検出システムに応じて適宜選択される。例えば、感染症等の感染原因菌の菌種(型)判定には、複数のプローブ4に対するハイブリダイゼーションによって検出する。変異の検出にあたっては、一つの変異に対して1又は複数のプローブ4を対応させてもよい。
【0026】
プローブ4は、標的ポリヌクレオチドに予め関連付けられている。ここで、「標的ポリヌクレオチドに予め関連付けられている」とは、標的ポリヌクレオチドと特異的にハイブリダイズする塩基配列を有しているプローブのほか、標的ポリヌクレオチドと特異的にハイブリダイズする塩基配列を有してはいないが、標的オリゴヌクレオチドを検出するための予め決定された塩基配列を有しているプローブ(ユニバーサルプローブ)ことを意味している。
【0027】
ユニバーサルプローブは、たとえば乱数から得られた所定塩基長のDNA配列に対して連続一致長、Nearest-Neighbor法による融解温度予測、ハミング距離、二次構造予測の計算を行うことにより設計される塩基配列である正規直交配列を有することができる。正規直交配列は、核酸の塩基配列であって、その融解温度が均一であるもの、即ち融解温度が一定範囲内に揃うように設計された配列であって、核酸自身が分子内(intramolecular)で構造化して、相補的な配列とのハイブリッド形成を阻害することのない配列であり、尚且つこれに相補的な塩基配列以外とは安定したハイブリッドを形成しない塩基配列を意味することができる。1つの正規直交配列群に含まれる配列は、所望の組み合わせ以外の配列間および自己配列内において反応が生じ難いか、または反応が生じない。また、正規直交配列は、PCR等において増幅させると、たとえば上述のクロスハイブリダイズのような問題に影響されずに、当該正規直交配列を有する核酸の初期量に応じた量の核酸が定量的に増幅される性質を有しうる。上記のような正規直交配列は、H.Yoshida and A.Suyama,“Solution to 3-SAT by breadth first search”,DIMACS Vl.54, 9-20(2000)に詳細が記載されている。こうした文献に基づいて正規直交配列を設計することができる。
【0028】
こうしたユニバーサルプローブを用いた場合、予め標的ポリヌクレオチドに対して特定のユニバーサルプローブを関連付けておく。このためには、ユニバーサルプローブと同一又は相補的な塩基配列を有し、かつ標的ポリヌクレオチドと相補的な塩基配列を有するプライマーやプローブを用いる。すなわち、標的ポリヌクレオチドに対して、このプライマー等とのハイブリダイゼーション反応とリガーゼ反応とを実施して、関連付けられたユニバーサルプローブの塩基配列と同一又は相補的な塩基配列を有するとともに標的ポリヌクレオチドに特異的なリガーゼ産物を取得し、このリガーゼ産物ないしこのPCR増幅産物と、固相担体2上のユニバーサルプローブとのハイブリダイゼーションを実施することとなる。リガーゼ産物等は、予め関連付けられたプローブとハイブリダイズし二重鎖ハイブリダイズ産物を生成する。なお、SNPなど変異の検出には、一つの標的ポリヌクレオチドに対して、複数のユニバーサルプローブが割り付けられることもある。この種の方法は、特開2008−306941号公報、Analytical Biochemistry, 364, 1, 2007, 78-85の他、特開2009−232778号公報、特開2009−24号公報等を参照して実施することができる。
【0029】
固相担体2上には、1又は2以上のプローブ4を固定するための1又は2以上のフィーチャーエリア6が画定されている。一つのフィーチャーエリア6は、固相担体2上において、1又は複数のプローブ4に割り当てられる領域である。すなわち、一つのフィーチャーエリア6には、1種のプローブ4が固定されていてもよいし、2種以上のプローブ4が固定されていてもよい。固相担体2上において、フィーチャーエリア6は、同一の面積及び形状となっている。フィーチャーエリア6は、例えば、平面的な固相担体2の場合、固相担体2の平坦な表面をグリッド状に区画した方形状の各区画が挙げられる。なお、フィーチャーエリア6は、方形状に限定するものではなく、円形状であってもよく、特に限定されないが、グリッドの区画内で収まる形状とすることで、同一面積及び形状のフィーチャーエリア6を形成しやすい。こうしたグリッドによって区画された領域内にあるフィーチャーエリア6に、プローブ4を固定することでプローブ4を行×列のマトリックス状に備えることとなる。フィーチャーエリア6を多数個設けるために、グリッドによって区画された内部をさらに二分割等してもよい。二分割する形態としては、方形状の区画に対角線でさらに区画してもよい。
【0030】
フィーチャーエリア6の大きさは、0.2mm2以上150mm2以下であることが好ましい。0.2mm2未満であると目視による視認性が低下しすぎ、150mm2を超えてはアレイのサイズ上問題がある。例えば、長辺が1mm〜10mmで、短辺が0.8mm〜5mm程度に設定することができる。なお、フィーチャーエリア6間には適当な間隔を置くことができる。
【0031】
フィーチャーエリア6の個数は、検出意図や検出方法の用途に応じて適宜設定される。固相担体2のサイズ等を考慮すると、特に限定しないが、2個以上200個以下であることが好ましい。200個を超えると、固相担体2のサイズ上の観点及び目視による検出判定が困難になる可能性があるからである。1又は複数のフィーチャーエリア6における目視によるシグナル検出を考慮すると、好ましくは150個以下であり、より好ましくは100個以下である。また、フィーチャーエリア6の個数は、好ましくは20個以上であり、より好ましくは40個以上である。20個以上であると、例えば、各種診断等において汎用性が高い。
【0032】
オリゴヌクレオチドプローブ4は、フィーチャーエリア6内において固定領域を少なくとも有しており、多くの場合、同時にプローブ4が固定されていない非固定領域を伴っている。
【0033】
(プローブ識別情報)
プローブ4は、それぞれそのプローブ4を識別するためのプローブ識別情報を伴って固相担体2上に固定されている。プローブ識別情報は、固相担体2上のプローブ4ごとに特徴的であって、固相担体2上の他のプローブ4のプローブ識別情報と区別可能であることが好ましい。
【0034】
(パターン情報)
プローブ識別情報は、パターン情報を含んでいる。プローブ識別情報がパターン情報を含むことで、他種多様な組み合わせを設定することができ、同一の固相担体2上に多数のプローブを配置してもそれぞれを識別することができる。例えば、プローブ識別情報が色情報のみの場合、色の多様性は低く、また多様な色を提供することも困難であり、さらに色の識別も困難である。このため、同一の固相担体2上において多数個のプローブを配置することができない。さらに、異なる発色操作や化合物を用いて異なる色を付与しなければならず、操作も煩雑でコストがかかってしまうことになる。さらに、安定した発色を確保することも困難である。なお、プローブ識別情報がパターン情報を含んでいれば、さらに色情報を含むことを排除するものではない。
【0035】
本明細書において、「プローブ4がプローブ識別情報を伴って固定されている」とは、パターン情報がフィーチャーエリア6内におけるプローブ4の固定領域、あるいは同エリア6内におけるプローブ4の非固定領域によって特徴付けられていることを意味している。
【0036】
プローブ4のプローブ識別情報がプローブ4の固定領域によって特徴付けられる場合とは、例えば、図1の左上に示すように、プローブ4の固定領域自体が、ある種の明示的なパターン情報(シンボル)(図1では数字の「1」)を形成している場合である。
【0037】
また、プローブ4のプローブ識別情報が非固定領域によって特徴付けられる場合とは、例えば、図1の右上に示すように、プローブ4の固定領域と非固定領域があるとき、非固定領域自体がある種の明示的なパターン情報(シンボル)(図1では、数字の「1」)を形成している場合(いわゆる白抜きの状態)である。このように、フィーチャーエリア6の輪郭(ここでは方形状)に沿ってフィーチャーエリア6の外周をほぼ充填するように形成された固定領域によって実質的に囲繞される非固定領域によって特徴付けられる場合、以下のメリットを奏することができる。
(1)複数のプローブ4の複数のフィーチャーエリア6の各固定領域を、フィーチャーエリア6の輪郭に一致させることができる。プローブ4間で、その固定領域の輪郭が一致しているため、プローブ4を識別するパターン情報の識別力のバラツキを低減することができる。
(2)フィーチャーエリア6内の固定領域におけるハイブリダイゼーション反応性にバラツキが生じた場合であっても、非固定領域による特徴付けが維持されやすく、パターン情報の識別力が高い(特に、パターン情報が数字の場合などが該当する。)
(3)隣り合うフィーチャーエリア6間で非固定領域で特徴付けられるパターン情報が同種であったとしても(例えば、いずれも数字であり、一方が一桁の数字で他方が二桁の数字である場合などが該当する。)、各フィーチャーエリア6における非固定領域は、それぞれの固定領域で区画化されているので、各フィーチャーエリア6のパターンをそれぞれ確実に識別できる。
【0038】
こうしたパターン情報としては、固定領域又は非固定領域の形状に関する情報のほか、これらの領域の大きさに関する情報であってもよく、これらの領域の模様に関する情報であってもよい。パターン情報が形状に関する情報の場合には、文字、数字、記号及び図形並びにこれらの組み合わせからなる群から選択されるシンボルが、フィーチャーエリア6内の固定領域又は非固定領域で特徴付けられる形態が挙げられる。シンボルとしては、シンボルは平行線状あるいはドット状等の各種のバーコードを含むことができる。
【0039】
パターン情報が大きさに関する情報の場合には、同一形状での相似体のシンボルがフィーチャーエリア6の固定領域又は非固定領域によって特徴付けられている形態が挙げられる。
【0040】
パターン情報が模様に関する情報の場合には、例えば、フィーチャーエリア6を多数個の各種形状のドット状、縦ストライプ状、横ストライプ状、斜めストライプ状、網目状等あるいはこれらの組み合わせが固定領域又は非固定領域によって特徴付けられている形態が挙げられる。
【0041】
パターン情報は、目視によって識別可能な大きさを備えることが好ましい。こうした形態であると、ハイブリダイズ産物が検出シグナルを有しているかあるいはハイブリダイズ産物に検出シグナルを付与することで、顕微鏡観察によらずにプローブ識別情報を確認できる。
【0042】
1種のプローブ4のみがフィーチャーエリア6内に固定されている場合には、当該プローブ4の固定領域及び非固定領域でパターン情報が形成される。また、2種以上のプローブ4が、それぞれ独立したパターン情報を形成して一つのフィーチャーエリア6内に固定されていてもよい。この場合、2種以上のプローブ4のパターン情報はフィーチャーエリア6内において部分的に重複していてもよいし、場合によっては完全一致していてもよい。こうすることで、一つのフィーチャーエリア6を2種以上のプローブ4を独立して使用することができ、一つのフィーチャーエリア6を異種のプローブ4のために独立して多重に有効活用できる。
【0043】
例えば、図2に示すように、一つのフィーチャーエリア6内に、第1のプローブ4を数字の「1」というパターン情報を形成して固定するとともに、他の第2のプローブ4を、数字の「2」というパターン情報を形成して固定する。この結果、一つのフィーチャーエリア6は、第1のプローブ4に対応するポリヌクレオチドが存在する被験試料と接したとき、数字の「1」を呈示し、他の第2のプローブ4に対応するポリヌクレオチドが存在する被験試料と接したとき、数字の「2」を呈示する。こうした形態によれば、例えば、2種のポリヌクレオチドのうちいずれか一方が存在するような被験試料の場合において、一つのフィーチャーエリア6で効率的に当該一方のポリヌクレオチドを検出できる。また、異種のプローブ4が異なる用途や場面を意図している場合には、一つのフィーチャーエリア6を多用途(多場面)に使用できる。この場合、一つのフィーチャーエリア6における2種以上のプローブ4のパターン情報は少なくとも部分的に重複することができる。すなわち、完全に一致するパターンであってもよいし、全く異なるパターンであってもよい。検出用剤10が異なる場面や用途に用いられるため、一つのフィーチャーエリア内において二つ以上のプローブ4に基づいて二つ以上のプローブ識別情報が提示されることがないからである。
【0044】
さらに、例えば、一つの固相担体2上に複数個のフィーチャーエリア6を備えており、これらのフィーチャーエリア6に対して、ある種の臨床検査を意図した複数個のプローブ4をそれぞれパターン情報を形成して固定する。さらに、同じ複数個のフィーチャーエリア6に対して、全く異なる種の臨床検査を意図した複数個のプローブ4をそれぞれパターン情報を形成して固定する。こうすることで、一つの本検出用剤10を、異なる用途や場面に用いることができる。
【0045】
図3に、一つのフィーチャーエリア内に第1〜第10までの10種のプローブを必要に応じて複数選択して固定するためのデザインの一例を示す。図3には、10種のプローブがそれぞれ伴うプローブ識別情報、すなわち、1〜0までの数字からなるパターン情報を示す。こうした10種のプローブがそれぞれ個別のパターン情報を形成するためには、例えば、図4の左図に示すように、これらの数字をデジタル表現可能な7個のバー領域(a〜g)で構成するものとする。そして、第1のプローブで数字の「1」を形成するとき、図4の右図に示すように、バー領域e、gに第1のプローブを固定する。同様に、第2のプローブで数字の「2」を形成するとき、前記右図に示すように、バー領域a、b、c、e、gに第2のプローブを固定する。同様に、第3のプローブ〜第10のプローブを用いて、対応する数字を形成するように対応するバー領域に各プローブを固定する。数字をパターン情報として用いることで、一つのフィーチャーエリア6を効率的に活用して複数のプローブ4、すなわち、複数のプローブ情報を内在させることができる。また、数字をパターン情報として用いることで複数のパターン情報が内在されていても、誤認なく各パターン情報を含むプローブ識別情報を識別できる。さらに、デジタル表現された数字とすることで、高い識別性を有している。さらにまた、こうした一つのフィーチャーエリア6内で複数のプローブ4を異なるパターン情報を形成して固定するには、ピエゾ素子を用いたプローブ供給手法を用いることで明瞭なパターン情報を形成できる。
【0046】
また、2種以上のプローブ4が、一つのフィーチャーエリア6内に固定されている場合として、一つのフィーチャーエリア6で同時に2種以上のプローブ4を用いた判別を実現することもできる。例えば、複数のプローブ4のうち、一部のプローブ4のみからなるパターン情報と、全てのプローブ4によって構成されるパターン情報とが、異なる形状、大きさ、模様等となって、同時にパターン情報が提示されても互いに区別可能に異なって形成される場合が挙げられる。典型的には、図5に示すように、一つのフィーチャーエリア6内に、2種のプローブ4を固定するとき、2種のプローブ4のパターン情報を相補的に形成することができる。すなわち、一つのフィーチャーエリア6内の中心部に各プローブ4につき合同の形状の直角三角形の固定領域をその斜辺が近接して対向するように形成する。この結果、第1及び第2のプローブ4のみからなるパターン情報は、斜辺が対向するように配置されたそれぞれ直角三角形のパターンであるが、二つのプローブ4のパターン情報が合体すると方形状のパターン形成することとなる。なお、個々のプローブ4のパターン情報や合体して形成するパターンについては特に限定されず、各種形態を採ることができる。
【0047】
(方向性情報)
固相担体2上には、固相担体2上のパターン情報の方向性を示す方向性情報8を備えることができる。こうした方向性情報を固相担体2上に備えることで、プローブ識別情報の識別力を高めることができる。方向性情報は、例えば、顔料インク又は染料インク等で固相担体2上に付与して形成することができる。方向性情報8の形態は特に限定しないで、バー状、ドット状等とすることができ、固相担体2における位置は、固相担体2を視認する場合の方向を特定できる形態であれば特に限定されない。方向性情報8は、例えば、固相担体2の一部(例えば、方形状のとき、上辺及び/又は下辺、角部等)に設けることができる。
【0048】
(本検出用剤の製造方法)
本検出用剤の製造方法は、固相担体2上に、プローブ4を、プローブ識別情報を伴って供給する工程を備えることができる。こうすることで、プローブ4の固定位置の照合操作を省略できる検出用剤を製造できる。
【0049】
プローブ4は、既に説明したプローブ識別情報を構成できるように固相担体2上に供給される。こうしたプローブ4の固相担体2への供給やプローブ4の固相担体2への固定化は、従来公知の手法に従い行うことができる。本検出用剤の製造方法においては、プローブ4をプローブ識別情報を伴って供給して固定するものであるため、プローブ4を含有する液体を、ピエゾ素子を用いて吐出して固相担体2に供給することが好ましい。ピエゾ素子を用いることで、微細なパターン情報であっても精度よく供給できて識別力の高いパターン情報を形成できる。
【0050】
(標的ポリヌクレオチドの検出用のキット)
本発明のキットは、本検出用剤と、本検出用剤において得られる被験試料中のDNA等とのハイブリダイズ産物にプローブ識別情報を肉眼で視認可能な検出シグナルを付与可能な薬剤と、を備えることができる。肉眼で視認可能な検出シグナルをハイブリダイズ産物に付与できれば、蛍光を検知する装置なくして簡易にプローブ識別情報を確認できる。
【0051】
こうした薬剤としては、特に限定しないが、例えば、被験試料を、蛍光色素などの標識物質あるいは標識物質と標識用化合物が結合したポリメラーゼ増幅反応の産物として調製できるプライマー又は当該プライマーを含むポリメラーゼ増幅反応キットが挙げられる。例えば、標識物質又は標識結合性物質が結合したプライマーであってもよいし、こうした結合物を持たないプライマーと、DNA鎖の伸長に伴って標識物質あるいは標識結合性物質を連結できるように構成されたヌクレオチド3リン酸セットの組み合わせであってもよいし、増幅産物に対して標識物質又は標識結合性物質を導入できる修飾用の薬剤とこのためのプライマーとの組み合わせであってもよい。最終的にハイブリダイズ産物に肉眼で視認可能な検出シグナルを付与するための手法や薬剤は、当業者において周知であり、当業者であれば、必要に応じて公知の手法や薬剤から適宜選択して用いることができる。
【0052】
(標的ポリヌクレオチドの検出方法)
本発明の標的ポリヌクレオチドの検出方法は、本検出用剤10上のプローブ4と、被験試料とについてハイブリダイゼーションを実施する工程と、ハイブリダイゼーションで得られたハイブリダイズ産物が呈示するプローブ識別情報に基づいて標的ポリヌクレオチドを検出する工程と、を備えることができる。この検出方法によれば、プローブ識別情報を用いて標的ポリヌクレオチドを検出できるため、従来のプローブ位置の照合操作を省略することができる。
【0053】
(被験試料の準備)
ハイブリダイゼーション工程に供する被験試料は、特に限定しないで、ハイブリダイゼーションの対象となる可能性のある標的ポリヌクレオチドを含んでいればよい。被験試料としては、プローブハイブリダイゼーションが適用される公知の遺伝子情報、DNAを用いた検出、検査、診断方法における被験試料を本方法に用いることができる。
【0054】
被験試料には、各種の生体由来の試料(血液、尿、痰、組織、細胞(各種の動物由来の培養動物細胞、培養植物細胞、培養微生物細胞を含む))あるいは、こうした生体試料からDNAなどのポリヌクレオチドを抽出した抽出試料、こうした生体試料の有するDNAやRNAから各種の遺伝子増幅手法による増幅試料等が含まれる。また、後述するシグナル付与工程を考慮すると、被験試料中のオリゴヌクレオチドが予め標識ないし標識可能に構成されていることが好ましい。当業者であれば、こうした被験試料を周知の技術に基づいて容易に調製することができる。
【0055】
遺伝子増幅反応としては、公知の各種の反応が利用でき、例えば、各種手法によるPCRのほか、LCR、SDA、ICAN等が挙げられる。また、被験試料中のポリヌクレオチドを標識するのにあたっては、所定の標識結合性物質が連結されたdNTPを取り込ませる方法によることができる。標識結合性物質とは、ジゴキニゲニン(DIG)などのハプテンやビオチンなどが挙げられる。例えば、当該ハプテン特異的認識抗体を用い、さらに当該認識抗体に付与した例えば、ペルオキシダーゼ等の発色性物質を検出シグナルとして用いることができる。例えば、図6に例示する以下の被験試料調製工程を実施してもよい。
【0056】
被験試料調製工程の一例は、ハイブリダイゼーション工程に用いる容器と同一容器を用いて、遺伝子増幅反応によって被験試料を調製する工程が挙げられる。同一容器を用いることで、増幅に用いた容器に対して検出用剤10を投入することでそのままハイブリダイゼーション工程を実施できる。また、こうすることで、用いる容器数を減少させ、操作を簡略化することができる。なお、遺伝子増幅反応実施後、同一容器内の遺伝子増幅反応液又はハイブリダイゼーション用の液を供給することが好ましい。そして、さらに、ハイブリダイゼーションに先立つ高温による変性工程も同一容器内でそのまま実施することがより好ましい。こうすることで、操作を簡略化し、さらに操作の迅速化、温度制御の迅速化及び高精度化も実現できる。
【0057】
(ハイブリダイゼーション工程)
ハイブリダイゼーション工程では、本検出用剤10のプローブ4と被験試料とにつきハイブリダイゼーションを実施する。ハイブリダイゼーションは、プローブ4と被験試料中の可能性ある標的ポリヌクレオチドが特異的に結合するような条件で行う。こうした温度、塩濃度及び時間等は、用いるプローブ4等の種類にもよるが、当業者であれば適宜設定することができる。
【0058】
ハイブリダイゼーション工程の実施形態は特に限定しないが、たとえば、上記した被験試料調製工程の一例の後段として、図2に例示するように、本検出用剤10毎に1ml以下の液中で実施することができる。
【0059】
ハイブリダイゼーション工程の一例では、本検出用剤10を用いて1ml以下の液中ハイブリダイゼーションを可能とする形態は、ハイブリダイゼーション容器の大きさによっても異なるが、例えば、当該容器として、先細りのあるいは寸胴状のチューブ状容器が意図されることが好ましい。すなわち、こうした容器を用いて本検出方法を実施することが好ましい。先細り状の容器の例としては、典型的には、エッペンドルフチューブ(商品名)が挙げられ、寸胴状の容器の例としては、典型的には一般的な試験管等が挙げられる。チューブ状容器は、例えば、1ml以下、0.5ml以下、0.3ml以下のハイブリダイゼーション液を充填できる容積を有することが好ましい。こうしたチューブ状容器としては、それぞれ、内径7〜9mm、典型的には8mm、深さ37〜39mm、典型的には38mm、内径5〜7mm、典型的には6mm、深さ29〜31mm、典型的には30mm及び内径4〜6mm、典型的には5mm、深さ19〜21mm、典型的には20mmのサイズを有するものが挙げられる。
【0060】
容器は、また、透明性であることが好ましい。内部の本検出用剤10のプローブ識別情報を肉眼で視認するのに都合がよいからである。また、容器は、その開口部(通常は上部)を開閉するために脱着可能な蓋を備えていてもよい。こうした蓋を備えることで、少ない液量の蒸発等を防ぐとともに、温度制御を迅速かつ容易化できる。
【0061】
ハイブリダイゼーション工程の一例では、図6に示すように、本検出用剤10を用いて、一つの本検出用剤10につき1ml以下、好ましくは、0.5ml以下、より好ましくは0.3ml以下の液中でハイブリダイゼーションを実施する。ハイブリダイゼーション工程において、被験試料中に、プローブと塩基対を形成する標的ポリヌクレオチドを有するオリゴヌクレオチドを含んでいるとき、二重鎖ハイブリダイズ産物が形成される。
【0062】
ハイブリダイゼーション工程の一例では、本検出用剤10を所定の方向でチューブ状容器に投入し、その状態を維持して実施することが好ましい。具体的には、チューブ状容器の内部形態に合わせて、本検出用剤10の長辺が容器の深さ方向に沿う状態を維持して実施することが好ましい。上記したアスペクト比の方形状シートの本検出用剤10を用いることで、市販で入手できる1〜0.3ml程度の各種形態のチューブ状容器内に安定して保持される。
【0063】
ハイブリダイゼーション工程の一例では、チューブ状容器を用いる場合、既存のPCRのための温度制御装置に適用することができる。こうした温度制御を実施することで、精度よくかつ迅速に温度制御が可能となる。ハイブリダイゼーション工程の条件は特に限定しない。通常のハイブリダイズ媒体を用いることができる。また、適度な温度に設定することができる。
【0064】
なお、後段の検出工程に先立って、過剰の被験試料を洗浄除去する洗浄工程を実施することが好ましい。洗浄工程は、ハイブリダイゼーション工程を実施した容器からハイブリダイゼーション液を除去して本検出用剤10のみを残留させた状態で、所定の温度条件で洗浄に適した液を供給して適当な時間接触させることを適数回繰り返すことによって実施できる。こうした洗浄工程を同一容器で実施することで、操作を簡略化し容器数を減らしてしかも、温度制御を迅速かつ精度よく行うことができる。
【0065】
(シグナル付与工程)
ハイブリダイゼーション工程後、前記検出工程に先立って、前記ハイブリダイズ産物に前記プローブ識別情報を検出可能な検出シグナルを付与する工程を、備えることができる。ハイブリダイズ産物が、被験試料において付与された標識物質によって既に標識されている場合においては、ハイブリダイゼーション工程後に検出工程を実施してプローブ識別情報を確認できるが、そうでない場合には、ハイブリダイズ産物からプローブ識別情報をなんらかの手段で確認できる検出シグナルを付与することが好ましい。
【0066】
シグナル付与工程は、ハイブリダイズ産物に対して各種の標識物質を付与する、又は既に標識結合性物質を備えている場合には当該標識結合物質に特異的に結合する標識物質を付与する工程である。こうした標識物質及び標識結合性物質については、既に説明したとおりである。特に、肉眼で視認可能な標識物質を付与することで、特別な検出装置を要することなく、しかもリアルタイムに発色を肉眼で観察し判定することができる。二重鎖ハイブリダイズ産物に検出シグナル付与するには、例えば、既に記載のとおり、予め被験試料中のポリヌクレオチドに対してハプテンなどのほか、ビオチンなどの標識結合性物質を付与しておくことが挙げられる。そして、本工程において、当該標識結合性物質に特異的な標識物質を付与することで、当該二次シグナルを利用して肉眼で視認可能な検出シグナルを付与することができる。すなわち、検出系としては、抗原抗体反応やビオチン−アビジン反応を利用できる。あるいは、ハイブリダイズ産物の被験試料部位に標識結合性物質に付与し、その後標識物質を付与してもよいし、ハイブリダイズ産物の被験試料部位に直接標識物質を付与するようにしてもよい。
【0067】
標識物質は、発色性の生成物を生成する酵素であることが好ましい。こうすることで、酵素反応を利用して発色性生成物を速やかにかつリアルタイムに検出することができる。この場合、標識物質は、ハプテンに特異的に結合する抗体とこうした酵素とを備えた複合体とすることができる。
【0068】
なお、抗原抗体反応やビオチン−アビジン結合のための2以上の化合物を介して最終的に標識物質をハイブリダイズ産物に結合させてもよい。
【0069】
シグナル付与工程は、図6に示すように、上記した被験試料調製工程及びハイブリダイゼーション工程の各一例の後段として行うときには、前段の工程で用いたのと同一容器内で実施することが好ましい。こうすることで、操作を簡略化して迅速性を向上させることができる。また、本検出用剤10を、同一容器に残しておくことで、本検出用剤10の容器への投入時(ハイブリダイゼーション工程時)の一定の方向性を容易に維持できる。例えば、過剰試料除去後の本検出用剤10が残留した同一容器に、標識物質を含む溶液を投入して標識反応を実施することができる。過剰の標識物質を除去洗浄後、標識物質による検出シグナルをそのまま肉眼で視認できる場合以外は、さらに、標識物質を発色させる発色反応を実施する。例えば、標識物質としてペルオキシダーゼなどの酵素を用いた場合には、過剰なペルオキシダーゼ除去後に、その基質を供給して酵素反応を生じさせる。さらに重ねて標識物質を要する場合には、洗浄及び反応工程をさらに実施する。
【0070】
(検出工程)
検出工程は、ハイブリダイゼーションで得られたハイブリダイズ産物が呈示するプローブ識別情報に基づいて標的ポリヌクレオチドを検出する工程である。この検出工程によれば、予めプローブ毎に付与されているプローブ識別情報を識別することで直ちに標的ポリヌクレオチドを特定できるため、従来のようなプローブの位置照合操作を省略することができる。上記のとおり、ハイブリダイズ産物は、被験試料調製時からあるいはハイブリダイゼーション工程後の修飾により検出シグナルが付与されているので、プローブ識別情報を呈示することができる。プローブ識別情報は、標識物質の種類に応じて、特定波長域の光を照射して検出したり、発色反応を行って検出したりすることができる。標識物質等の種類により、プローブ識別情報を肉眼にて視認できる場合には、特別な、標的ポリヌクレオチドの有無を検出する。
【0071】
検出にあたっては、既に説明した被験試料調製工程、ハイブリダイゼーション工程及びシグナル付与工程を同一容器内で行う形態においては、図6に示すように、本検出用剤10が充填されたままの容器内で行ってもよいし、本検出用剤10を容器から取り出して容器外で行ってもよい。また、シグナル付与のための液が投入されたままの状態で行っても良い。シグナル付与工程において、ハイブリダイゼーション工程に用いたのと同一容器で本検出用剤10の方向性が維持された状態とすることで、本検出用剤10における検出シグナルの検出の際に、投入時と同様である、所定の方向性でシグナルを検出できるため、標的ポリヌクレオチドの検出が容易であり確度も高いものとなる。
【0072】
検出工程は、標的ポリヌクレオチドや用途に応じて、被験試料中の複数の標的ポリヌクレオチドの組み合わせを検出する工程であってもよい。例えば、肺炎の原因菌の型判別のように、複数の遺伝子の複数の配列を検出する場合には、複数の標的ポリヌクレオチドに対応する複数のプローブ4の組み合わせが検出される。この場合、こうした組み合わせを、本検出用剤10上において得られたプローブ識別情報とから、最終的な検出対象を特定することもできる。
【実施例】
【0073】
以下、本発明を、実施例を挙げて具体的に説明するが、以下の実施例は本発明を説明するものであって、本発明の範囲を限定するものではない。
【実施例1】
【0074】
(本検出用剤(アレイ)の作製)
ポリエーテルスルホン製であって、サイズが285mm×50mm、孔径が0.5μm、厚さが0.15mのシートに、以下の表に示す塩基配列からなるDNAプローブ溶液を、特開2003−75305号公報に記載されている吐出ユニット(ピエゾ素子を用いた吐出ユニット)を用いた日本ガイシ株式会社GENESHOT(登録商標)スポッターを用いて、スポットし、以下の手順で固定化した。
【0075】
(DNAプローブ溶液)
DNAプローブ15種類を以下の表に示す塩基配列に従って合成し、Tris-EDTA bufferで溶解した水溶液を、SSC緩衝液、ブロモフェノールブルーと混合してDNAプローブ濃度が2μM〜60μMのDNAプローブ溶液を調製した。
【表1】

【0076】
(手順1)
吐出ユニット内に配置した液体注入部に、DNAプローブ溶液を注入し、シートにスポットする前に、シート上に検査スポットを行った。品質の検査は、検査スポットに対し、スポットが形成されないことはないか、スポットがいびつな形状ではないか、スポット径が設計値から10% 以上ずれていないか、サテライトと呼ばれる本スポット以外の不要なスポットが発生していないか、スポット位置がスポット径の3分の1以上ずれていないかという項目を実施した。シートの色は白色で、DNAプローブ溶液はブロモフェノールブルーによって青色に着色されているため、目視で検査を実施した。ブロモフェノールブルーは、ハイブリダイゼーション〜酵素付抗体免疫反応〜酵素発色色素沈着において、溶出し、除去される。
【0077】
(手順2)
検査スポットで不良が検出されたときは、吐出ユニット内に配置された圧電/電歪素子の駆動信号を調整して検査スポットを再度行う。駆動信号の調整は電圧値、所定電圧までの上昇時間、所定電圧値のキープ時間、電圧立ち下げ時間の変更で行った。それでも不良が検出されるときは、真空吸引することで吐出ユニットからDNAプローブ溶液を抜き取り、液体注入部にDNAプローブ溶液を再度注入して、検査スポットを行う。不良スポットが検出されなくなるまで、この操作を繰り返した。
【0078】
(手順3)
不良スポットが検出されなくなったことを確認したのち、以下の方法でDNAプローブ溶液をシートにスポットした。すなわち、1種類のDNAプローブ溶液につき、スポットのピッチを横方向(X方向)、縦方向(Y方向)ともに0.05mmで、横方向、縦方向ともにスポットを行い、横方向0.9mm、縦方向1.3mmのスクエア形状の一つのフィーチャーを形成した。固定領域のコーナーはR=0.05mmとなった。シート上を吐出ユニットが、シート長手方向(X方向)に移動しながら、シートがシート短手方向(Y方向)に移動して、非接触でスポットを行う。フィーチャーのピッチを縦方向1.5mm、横方向1mmで3列×5行の格子エリア内に15種類のDNAプローブの固定化領域を形成・配置して、複数のフィーチャーからなる1つの区画(7.3mm×2.9mm)を形成した。さらにこの区画を、縦方向13.5mmピッチ、横方向6.8mmピッチで、1シートに84個形成した。
【0079】
フィーチャー内に、DNAプローブを個別に識別できるように、プローブ識別情報として、DNAプローブ溶液を“1、2、・・・・・、A、B、・・・”の英数字と、英数字が白抜けとなるように2種類のデザインで、スポットを行った。
【0080】
(手順4)
1区画の上部に、1区画の上下を判別できるように顔料系マゼンダインクのマーカー(方向性情報)のスポットを行った。
【0081】
(手順5)
DNAプローブ溶液、マーカーのスポットが完了したのち、風乾することで、DNAプローブの固定、マーカーの固着を行った。
(手順6)
(手順1)で行う検査と同様の項目で検査を行った。
(手順7)
不良が検出されなかったシートについて、1アレイを4mm×9mmサイズに、ローラーカッターで切断することで、1シートから84個のアレイを得た。2種類のアレイを図7に示す。
【実施例2】
【0082】
本実施例では、本アレイを評価した。
【0083】
(遺伝子増幅工程)
DNAプローブに対して相補的な配列を有するように人工的に合成したDNAを、DIGラベルにより標識することで、サンプルDNAを得た。
【0084】
(変性工程)
各チューブに、ハイブリダイゼーション液として、0.5%Tween20、1%BSAのPBS溶液200μlを加えて、良く混合し、95℃に加熱したヒートブロックに5分配置後、氷水中に移して急冷した。
【0085】
(ハイブリダイゼーション工程)
各チューブに、実施例1で作製したアレイを一個ずつ、投入して、60℃に制御したヒートブロックに挿入して15分ハイブリダイゼーションを実施した。
【0086】
(洗浄工程)
ハイブリダイゼーション工程に用いた溶液を一旦除去し、チューブ内のアレイに対して新たにハイブリダイゼーション溶液200μlを添加し、60℃のヒートブロックで1分間静置状態で加熱してハイブリダイゼーション液を除去した後、さらに同様にしてハイブリダイゼーション液を交換してそれぞれ10分及び1分の洗浄を繰り返した。
【0087】
(シグナル付与工程)
抗DIG抗体酵素(ペルオキシダーゼ)含有試薬(DIG−POD、ロッシュ製)の1000倍希釈液200μlを各チューブ内のアレイに供給して、抗原抗体反応により酵素を結合させた。
【0088】
(洗浄工程)
シグナル付与工程に用いた溶液を除去し、チューブ内のアレイに対して新たにハイブリダイゼーション溶液250μlを添加し、60℃のヒートブロックで1分間静置状態で加熱してハイブリダイゼーション液を除去した後、さらに同様にしてハイブリダイゼーション液を交換してそれぞれ10分及び1分の洗浄を繰り返した。
【0089】
(基質反応工程)
洗浄後のチューブに対してペルオキシダーゼの基質溶液(Vec.Lab製、TMBキット)200μlを供給して、室温で酵素反応を行い、青色の反応生成物を生成させた。
【0090】
(検出工程)
DNAプローブ名”1”は発色パターンの数字の”1”と対応している。他にもDNAプローブ名”2”、”A”、”B”は、それぞれ発色パターンの数字の”2”並びにアルファベットの”A”及び”B”に対応している。各チューブ内で反応後、固定化領域の発色パターンを確認したところ、図8のように、それぞれの発色パターン、“1”、“2”、“A”、“B”が発色するのを確認することができた。白抜けのデザインについても、図9のように、プローブ名を白抜けの英数字で確認することができた。こうして、発色したDNAプローブの位置情報とプローブ配置図を照合することなく、DNAプローブを認識することができた。図8のように文字の部分が発色したことで、迅速かつ容易にDNAプローブを認識することができた。図9のように、文字部を白抜けとすることで、さらに認識が容易となった。
【配列表フリーテキスト】
【0091】
配列番号1〜15:プローブ
【特許請求の範囲】
【請求項1】
標的ポリヌクレオチドを検出するための検出用剤であって、
固相担体と、
前記標的ポリヌクレオチドに予め関連付けられたオリゴヌクレオチドプローブであって、パターン情報を含むプローブ識別情報を伴って、前記固相担体上に固定されるオリゴヌクレオチドプローブと、
を備える、検出用剤。
【請求項2】
前記固相担体上には、1又は2以上の前記オリゴヌクレオチドプローブを固定するための1又は2以上のフィーチャーエリアが画定されており、
前記パターン情報は、前記フィーチャーエリアのそれぞれにおいて、1又は2以上の前記オリゴヌクレオチドプローブの固定領域又はそれらの非固定領域によって特徴付けられる、請求項1に記載の検出用剤。
【請求項3】
前記パターン情報は、前記フィーチャーエリアの輪郭に沿う前記固定領域によって実質的に囲繞される前記非固定領域によって特徴付けられる、請求項2に記載の検出用剤。
【請求項4】
前記パターン情報は、前記固定領域又は前記非固定領域の形状に関する情報を含む、請求項2又は3に記載の検出用剤。
【請求項5】
前記パターン情報は、前記固定領域又は前記非固定領域の大きさに関する情報を含む、請求項2〜4のいずれかに記載の検出用剤。
【請求項6】
前記パターン情報は、前記固定領域又は前記非固定領域の模様に関する情報を含む、請求項2〜5のいずれかに記載の検出用剤。
【請求項7】
前記パターン情報は、文字、数字、記号及び図形並びにこれらの組み合わせからなる群から選択されるシンボルを含む、請求項2〜6のいずれかに記載の検出用剤。
【請求項8】
前記シンボルはバーコードを含む、請求項7に記載の検出用剤。
【請求項9】
前記パターン情報は、目視によって識別可能な大きさを備える、請求項1〜8のいずれかに記載の検出用剤。
【請求項10】
前記固相担体上には、1又は2以上の前記オリゴヌクレオチドプローブを固定するための1又は2以上のフィーチャーエリアが画定されており、
1つの前記フィーチャーエリア内において、2以上の前記オリゴヌクレオチドプローブの前記パターン情報が配置されている、請求項1〜9のいずれかに記載の検出用剤。
【請求項11】
1つの前記フィーチャーエリア内において、2以上の前記オリゴヌクレオチドプローブの前記パターン情報が少なくとも部分的に重複する、請求項10に記載の検出用剤。
【請求項12】
1つの前記フィーチャーエリア内において、2以上の前記オリゴヌクレオチドの前記パターン情報が相補的である、請求項10に記載の検出用剤。
【請求項13】
前記固相担体上の前記パターン情報の方向性を示す方向性情報を前記固相担体上に備える、請求項1〜12のいずれかに記載の検出用剤。
【請求項14】
複数個の前記オリゴヌクレオチドプローブを、これらの前記オリゴヌクレオチドプローブ毎の前記プローブ識別情報を伴って前記固相担体上に備える、請求項1〜13のいずれかに記載の検出用剤。
【請求項15】
請求項1〜14のいずれかに記載の検出用剤と、
前記ハイブリダイズ産物に前記プローブ識別情報を肉眼で視認可能な検出シグナルを付与可能な薬剤と、
を備える、キット。
【請求項16】
請求項1〜14のいずれかに記載の検出用剤の製造方法であって、
前記固相担体上に、前記オリゴヌクレオチドプローブを、前記プローブ識別情報を伴って供給する工程、
を備える、製造方法。
【請求項17】
前記オリゴヌクレオチドの供給工程は、前記オリゴヌクレオチドプローブを含有する液体を、ピエゾ素子を用いて吐出して前記固相担体上に供給する工程である、請求項16に記載の製造方法。
【請求項18】
標的ポリヌクレオチドの検出方法であって、
請求項1〜13のいずれかに記載の検出用剤上の前記オリゴヌクレオチドプローブと、被験試料とについてハイブリダイゼーションを実施する工程と、
前記ハイブリダイゼーションで得られたハイブリダイズ産物が呈示する前記プローブ識別情報に基づいて前記標的ポリヌクレオチドを検出する工程と、
を備える、検出方法。
【請求項19】
前記ハイブリダイゼーション工程後、前記検出工程に先立って、前記ハイブリダイズ産物に前記プローブ識別情報を肉眼で視認可能な検出シグナルを付与する工程を、備える、請求項18に記載の検出方法。
【請求項20】
前記標的ポリヌクレオチドは一塩基多型を含む、請求項18又は19に記載の検出方法。
【請求項1】
標的ポリヌクレオチドを検出するための検出用剤であって、
固相担体と、
前記標的ポリヌクレオチドに予め関連付けられたオリゴヌクレオチドプローブであって、パターン情報を含むプローブ識別情報を伴って、前記固相担体上に固定されるオリゴヌクレオチドプローブと、
を備える、検出用剤。
【請求項2】
前記固相担体上には、1又は2以上の前記オリゴヌクレオチドプローブを固定するための1又は2以上のフィーチャーエリアが画定されており、
前記パターン情報は、前記フィーチャーエリアのそれぞれにおいて、1又は2以上の前記オリゴヌクレオチドプローブの固定領域又はそれらの非固定領域によって特徴付けられる、請求項1に記載の検出用剤。
【請求項3】
前記パターン情報は、前記フィーチャーエリアの輪郭に沿う前記固定領域によって実質的に囲繞される前記非固定領域によって特徴付けられる、請求項2に記載の検出用剤。
【請求項4】
前記パターン情報は、前記固定領域又は前記非固定領域の形状に関する情報を含む、請求項2又は3に記載の検出用剤。
【請求項5】
前記パターン情報は、前記固定領域又は前記非固定領域の大きさに関する情報を含む、請求項2〜4のいずれかに記載の検出用剤。
【請求項6】
前記パターン情報は、前記固定領域又は前記非固定領域の模様に関する情報を含む、請求項2〜5のいずれかに記載の検出用剤。
【請求項7】
前記パターン情報は、文字、数字、記号及び図形並びにこれらの組み合わせからなる群から選択されるシンボルを含む、請求項2〜6のいずれかに記載の検出用剤。
【請求項8】
前記シンボルはバーコードを含む、請求項7に記載の検出用剤。
【請求項9】
前記パターン情報は、目視によって識別可能な大きさを備える、請求項1〜8のいずれかに記載の検出用剤。
【請求項10】
前記固相担体上には、1又は2以上の前記オリゴヌクレオチドプローブを固定するための1又は2以上のフィーチャーエリアが画定されており、
1つの前記フィーチャーエリア内において、2以上の前記オリゴヌクレオチドプローブの前記パターン情報が配置されている、請求項1〜9のいずれかに記載の検出用剤。
【請求項11】
1つの前記フィーチャーエリア内において、2以上の前記オリゴヌクレオチドプローブの前記パターン情報が少なくとも部分的に重複する、請求項10に記載の検出用剤。
【請求項12】
1つの前記フィーチャーエリア内において、2以上の前記オリゴヌクレオチドの前記パターン情報が相補的である、請求項10に記載の検出用剤。
【請求項13】
前記固相担体上の前記パターン情報の方向性を示す方向性情報を前記固相担体上に備える、請求項1〜12のいずれかに記載の検出用剤。
【請求項14】
複数個の前記オリゴヌクレオチドプローブを、これらの前記オリゴヌクレオチドプローブ毎の前記プローブ識別情報を伴って前記固相担体上に備える、請求項1〜13のいずれかに記載の検出用剤。
【請求項15】
請求項1〜14のいずれかに記載の検出用剤と、
前記ハイブリダイズ産物に前記プローブ識別情報を肉眼で視認可能な検出シグナルを付与可能な薬剤と、
を備える、キット。
【請求項16】
請求項1〜14のいずれかに記載の検出用剤の製造方法であって、
前記固相担体上に、前記オリゴヌクレオチドプローブを、前記プローブ識別情報を伴って供給する工程、
を備える、製造方法。
【請求項17】
前記オリゴヌクレオチドの供給工程は、前記オリゴヌクレオチドプローブを含有する液体を、ピエゾ素子を用いて吐出して前記固相担体上に供給する工程である、請求項16に記載の製造方法。
【請求項18】
標的ポリヌクレオチドの検出方法であって、
請求項1〜13のいずれかに記載の検出用剤上の前記オリゴヌクレオチドプローブと、被験試料とについてハイブリダイゼーションを実施する工程と、
前記ハイブリダイゼーションで得られたハイブリダイズ産物が呈示する前記プローブ識別情報に基づいて前記標的ポリヌクレオチドを検出する工程と、
を備える、検出方法。
【請求項19】
前記ハイブリダイゼーション工程後、前記検出工程に先立って、前記ハイブリダイズ産物に前記プローブ識別情報を肉眼で視認可能な検出シグナルを付与する工程を、備える、請求項18に記載の検出方法。
【請求項20】
前記標的ポリヌクレオチドは一塩基多型を含む、請求項18又は19に記載の検出方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【公開番号】特開2013−106549(P2013−106549A)
【公開日】平成25年6月6日(2013.6.6)
【国際特許分類】
【出願番号】特願2011−253159(P2011−253159)
【出願日】平成23年11月18日(2011.11.18)
【出願人】(000004064)日本碍子株式会社 (2,325)
【Fターム(参考)】
【公開日】平成25年6月6日(2013.6.6)
【国際特許分類】
【出願日】平成23年11月18日(2011.11.18)
【出願人】(000004064)日本碍子株式会社 (2,325)
【Fターム(参考)】
[ Back to top ]

