標的核酸の検出・識別方法
【課題】少なくとも1種類の標的核酸を同時に増幅させ、目視で識別することができる標的核酸の検出・識別方法を提供することである。
【解決手段】上流側及び/又は下流側プライマーに異なる蛍光物質を標識する工程と、標的核酸の種類ごとに、標的核酸を増幅させる方法に応じた少なくとも1本の前記蛍光標識プライマーを含む標的核酸増幅用のプライマーを添加して、少なくとも1種類の標的核酸を同時に増幅させる工程と、前記増幅させた標的核酸増幅液に、前記蛍光物質を標識したプライマーと相補配列を有しクエンチャーを標識したオリゴヌクレオチドを添加させて反応させる工程と、前記反応後の標的核酸増幅液に定められた波長域の光を照射し、蛍光物質から発せられた蛍光色から増幅した標的核酸を検出・識別する工程と、を含む工程としたことで課題を解決できた。
【解決手段】上流側及び/又は下流側プライマーに異なる蛍光物質を標識する工程と、標的核酸の種類ごとに、標的核酸を増幅させる方法に応じた少なくとも1本の前記蛍光標識プライマーを含む標的核酸増幅用のプライマーを添加して、少なくとも1種類の標的核酸を同時に増幅させる工程と、前記増幅させた標的核酸増幅液に、前記蛍光物質を標識したプライマーと相補配列を有しクエンチャーを標識したオリゴヌクレオチドを添加させて反応させる工程と、前記反応後の標的核酸増幅液に定められた波長域の光を照射し、蛍光物質から発せられた蛍光色から増幅した標的核酸を検出・識別する工程と、を含む工程としたことで課題を解決できた。
【発明の詳細な説明】
【技術分野】
【0001】
本願発明は、すべての生物の細胞に含まれている核酸を迅速に、簡易に、しかも複数の核酸を同時に検出・識別する方法に関する。
【背景技術】
【0002】
近年、患者などの生体などから採取した試料中の核酸を同定するための標的核酸の検出・識別方法に関する技術が開示されている。
【0003】
例えば、標的核酸に対して、一方の末端が蛍光標識された第一プローブと、他方の末端がクエンチャーで標識された第二プローブとを同時にハイブリダイズさせ蛍光体とクエンチャーの相互作用による消光の様子を観察することにより、試料中に存在する特定の標的核酸量を調べる技術が開示され、蛍光プレートリーダーや蛍光光度計などの機器を使用して蛍光シグナルを測定している技術が開示されている(特許文献1参照。)。
【0004】
また、PCR容器内に、検出すべき標的核酸の配列に対して相補的塩基配列を有した標識プローブを含まない反応液とともにある標的核酸を注入する工程と、該標的核酸反応液の上部に、検出すべき該標的核酸の配列に対して相補的塩基配列を有した標識プローブ混合液を注入する工程と、これに蓋をして核酸増幅させる工程と、核酸増幅後に遠心して反応液と標識プローブ混合液とを混合させる工程と、混合後に標識ブローブの分析をする工程とからなる技術が開示され、標的プローブのTm値の分析が融解曲線分析で行われる技術が開示されている(特許文献2参照。)。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特開2009−159945号公報
【特許文献2】特開2005−000025号公報
【発明の概要】
【発明が解決しようとする課題】
【0006】
特許文献1に開示された技術においては、プライマーとは別に新たに第一及び第二プローブ(オリゴヌクレオチド)を設計する必要があり、また、[0020]に記載されているように、第二プローブ(オリゴヌクレオチド)を伸長させないようにリン酸化やアミノ化、あるいはダイデオキシ化などの修飾が必要になり、手間がかかるという問題があった。
【0007】
また、標的核酸が存在すると蛍光は消光し、標的核酸が存在しないと蛍光は発光したままであるので、直接目視で存在する複数の標的核酸の種類を識別することができず、蛍光プレートリーダーや蛍光光度計などの測定機器が必要となってコスト高になるという問題があった。
【0008】
特許文献2の技術は、[0033]に記載のプライマーとは別に[0034]に記載のプローブを別々に混入しなければならないという手間がかかり、核酸増幅後に遠心させるために遠心機が必要となってコスト高になり、かつ[0035]及び[0036]の記載にあるようにカローセルをリアルタイムPCR装置であるライトサイクラー(商品名)にセットし増幅させた後、遠心機に移し遠心操作をし、その後再びライトサイクラーに再セットするという手間がかかるという問題があった。
【0009】
また、[0042]に、少なくとも5種類以上の異なる核酸配列の増幅結果を同時に確認できるとの記載はあるが、この記載は5種類以上の核酸にハイブリダイズするプローブのTm値が離れている場合を意味しているのであって、Tm値が近似した場合には、[0039]に記載されている対応をしなければならないことからわかるように、Tm値による標的核酸の判別が難しいことが示されている。
【0010】
しかし、そのための対応として、[0039]にTm値が近似した場合には、蛍光色素「LCRed640(F2/F1),LCRed705(F3/F1)の2色」を変えて異なる波長で検出するようにするとの記載があるが、この方法では、Tm値が近似した2種類までの判別は可能であるが、近似した3種類以上の判別は極めて困難であるという問題があった。また、融解曲線分析を行うためのソフトウエアを組み込んだ検出機器が必要となってコスト高になるという問題もあった。
【0011】
したがって、本願発明の目的は、少なくとも1種類の標的核酸を同時に増幅させた場合であっても、どの核酸が増幅したのかを、新たに機器を必要とせず、容易に簡易に短時間で直接に、目視で識別することができる標的核酸の検出・識別方法を提供することである。
【課題を解決するための手段】
【0012】
本発明における「末端」とは、標的核酸、プライマー又はオリゴヌクレオチドの塩基配列5’側の最も端に存在する塩基、もしくは標的核酸、プライマー又はオリゴヌクレオチドの塩基配列3’側の最も端に存在する塩基を意味し、「鎖内」とは、5’末端と3’末端との間に存在する塩基を意味する。また、「上流側」とは塩基配列の領域内で5’末端側を、「下流側」とは塩基配列の領域内で3’末端側を意味する。
【0013】
本発明における「核酸」とは、DNA(デオキシリボ核酸)とRNA(リボ核酸)を意味する。
【0014】
「発明が解決しようとする課題」に記載した課題を解決するために、請求項1に記載の標的核酸の検出・識別方法の発明は、検出・識別しようする少なくとも1種類の標的核酸の種類ごとに添加する標的核酸増幅用及び/又は検出・識別用の上流側及び/又は下流側プライマーに対して検出用の異なる蛍光物質を標識する工程と、標的核酸の種類ごとに、標的核酸を増幅させる方法に応じた前記標的核酸増幅用の、少なくとも一対の前記蛍光標識された上流側及び下流側プライマー、少なくとも一対の前記蛍光標識された上流側プライマー及び蛍光標識されていない下流側プライマー、少なくとも一対の蛍光標識されていない上流側プライマー及び前記蛍光標識された下流側プライマー、少なくとも1本の前記蛍光標識された上流側又は下流側プライマー、又は、標的核酸を増幅させる蛍光標識されていないプライマー並びに標的核酸を検出・識別しようとする少なくとも1本の前記蛍光標識された上流側及び/又は下流側プライマーを添加して、少なくとも1種類の標的核酸を同時に増幅させる工程と、前記増幅させた標的核酸増幅液に、前記蛍光物質を標識したプライマーと相補配列を有するクエンチャーを標識したオリゴヌクレオチドを添加させて反応させる工程と、前記反応後の標的核酸増幅液にあらかじめ定められた波長域の光を照射し、前記照射により蛍光物質から発せられた蛍光から増幅した標的核酸を検出し、前記蛍光の色から標的核酸を識別する工程と、を含む工程からなることを特徴とする。
【0015】
請求項2に記載の標的核酸の検出・識別方法の発明は、請求項1において、前記プライマーに標識する蛍光物質が、前記プライマー配列の5’末端又は鎖内に標識されることを特徴とする。
【0016】
請求項3に記載の標的核酸の検出・識別方法の発明は、請求項1又は2において、前記オリゴヌクレオチドに標識されたクエンチャーが、前記オリゴヌクレオチドの配列の5’末端、3’末端又は鎖内に標識された、前記蛍光物質から発せられる蛍光を消光する消光物質であることを特徴とする。
【0017】
請求項4に記載の標的核酸の検出・識別方法の発明は、請求項1乃至3のいずれかにおいて、前記照射光の波長域が300〜800nmであることを特徴とする。
【0018】
請求項5に記載の標的核酸の検出・識別方法の発明は、請求項1乃至4のいずれかにおいて、少なくとも1種類の標的核酸を同時に増幅させる工程が、プライマーを用いて標的核酸を増幅させる方法であればいずれの増幅方法でもよいことを特徴とする。
【0019】
請求項6に記載の標的核酸の検出・識別方法の発明は、請求項1乃至5のいずれかにおいて、標的核酸の種類ごとに対応させる上流側及び/又は下流側プライマーそれぞれの5’末端に、標的核酸の種類ごとに異なる蛍光物質を標識させた、同じ配列からなるオリゴヌクレオチドを連結させることを特徴とする。
【0020】
請求項7に記載の標的核酸の検出・識別方法の発明は、請求項1乃至6のいずれかにおいて、複数の蛍光物質から発せられた蛍光によって目視で確認できる色が混色となっている場合に、カチオン性ポリマーを添加することによって、混色を構成している複数の蛍光物質の中で一部の意図した蛍光物質からの蛍光色を消光させることを特徴とする。
【発明の効果】
【0021】
請求項1に記載の発明は、標的核酸増幅後に、蛍光プレートリーダーや蛍光光度計などの測定機器、遠心機、電気泳動装置や融解曲線分析を行う機器などの分析機器を必要としないので、それらの機器が備わっていなくてもどこでも標的核酸を検出・識別でき、それらの機器に関する作業がなくてよいので、検出・識別作業が簡易で短時間でできるという効果を奏する。
【0022】
標的核酸増幅及び/又は検出・識別のために、プライマーを添加させるのみでよく、プライマーの他にプローブを混入させる必要がなく、またプローブが伸長しないようにリン酸化やアミノ化、あるいはダイデオキシ化などの修飾をする必要がないため、作業が容易で手間がかからないという効果を奏する。
【0023】
複数の標的核酸の包括的検出を目的とした結果、例えばTm値が近似し融解曲線分析では判別が困難な標的核酸が増幅した場合であっても、標識する蛍光物質(蛍光色)を変えることにより容易に目視で識別できるという効果を奏する。
【0024】
プライマーに標識する蛍光物質は、可視できる蛍光色を発するものであれば、すべての蛍光物質が使用可能であるという効果を奏する。
【0025】
標的核酸増幅後、蛍光標識プライマーと相補配列を持つ、クエンチャー標識オリゴヌクレオチドを加えるのみで、作業が極めて簡易である。
【0026】
請求項2に記載の発明は、請求項1の発明と同じ効果を奏する。さらに、標的核酸の5’末端でなくても、鎖内であっても標的核酸が増幅できるという効果を奏する。
【0027】
請求項3に記載の発明は、請求項1又は2の発明と同じ効果を奏する。さらに、クエンチャーがオリゴヌクレオチドの5’末端、3’末端又は鎖内であっても蛍光物質を標識したプライマーとクエンチャーを標識したオリゴヌクレオチドとがハイブリダイズし、蛍光物質とクエンチャーとが接近するため蛍光共鳴エネルギートランスファーにより蛍光物質からの蛍光が消光されるという効果を奏する。
【0028】
請求項4に記載の発明は、請求項1乃至3のいずれかの発明と同じ効果を奏する。さらに、蛍光波長が可視領域であり、標的核酸別に赤、青、緑、黄あるいは橙などの蛍光色を発光するので、目視で標的核酸を識別できるという効果を奏する。
【0029】
請求項5に記載の発明は、請求項1乃至4のいずれかの発明と同じ効果を奏する。さらに、プライマーを用いて標的核酸を増幅させる方法であればいずれの増幅方法でもよいので、本発明の実施にあたり新規に装置を購入する必要がなく、既存の装置で利用できるという効果を奏する。また、実施している核酸の増幅プロトコルをそのまま使用できる効果がある。
【0030】
請求項6に記載の発明は、請求項1乃至5のいずれかの発明と同じ効果を奏する。さらに、プライマーの5’末端に、共通の配列からなる標的核酸の種類ごとに異なる蛍光物質を標識したオリゴヌクレオチドを連結させることにより、複数種類のプライマーと相補配列を有する、クエンチャーを標識したオリゴヌクレオチドを複数種類添加させなくてもよく、プライマーに連結させた共通の配列と相補配列を有するクエンチャーを標識したオリゴヌクレオチドを添加させればよく、クエンチャー標識オリゴヌクレオチドの種類を減じることができるという効果を奏する。
【0031】
請求項7に記載の発明は、請求項1乃至6のいずれかの発明と同じ効果を奏する。さらに、複数の蛍光物質から発光した蛍光色によって混色が見られる場合に、混色を構成している複数の蛍光物質の中で一部の意図した蛍光物質からの蛍光色を消光させることによって混色になった複数の蛍光色を把握することができ、これにより複数の標的核酸を把握できるという効果を奏する。
【図面の簡単な説明】
【0032】
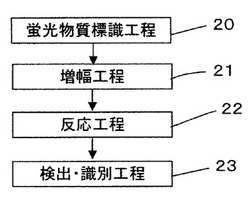
【図1】本願発明の標的核酸の検出・識別方法のフロー図である。
【図2】増幅工程において標的核酸と標的核酸増幅用のプライマーを混合させたときの原理説明図である。
【図3】増幅工程においてプライマーが標的核酸にハイブリダイズする原理説明図である。
【図4】増幅工程において標的核酸の増幅反応が進行する原理説明図である。
【図5】反応工程においてクエンチャー標識オリゴヌクレオチドが反応に使用されなかった蛍光標識プライマーとハイブリダイズする原理説明図である
【図6】検出・識別工程における原理説明図である。
【発明を実施するための形態】
【0033】
図1で本願発明の標的核酸の検出・識別方法を説明する。本願発明の標的核酸の検出・識別方法は、検出・識別しようする少なくとも1種類の標的核酸の種類ごとに添加する標的核酸増幅用及び/又は検出・識別用の上流側及び/又は下流側プライマーに対して検出用の異なる蛍光物質を標識する蛍光物質標識工程20と、標的核酸の種類ごとに、標的核酸を増幅させる方法に応じた前記標的核酸増幅用の、少なくとも一対の前記蛍光標識された上流側及び下流側プライマー、少なくとも一対の前記蛍光標識された上流側プライマー及び蛍光標識されていない下流側プライマー、少なくとも一対の蛍光標識されていない上流側プライマー及び前記蛍光標識された下流側プライマー、少なくとも1本の前記蛍光標識された上流側又は下流側プライマー、又は、標的核酸を増幅させる蛍光標識されていないプライマー並びに標的核酸を検出・識別しようとする少なくとも1本の前記蛍光標識された上流側及び/又は下流側プライマーを添加して、少なくとも1種類の標的核酸を同時に増幅させる増幅工程21と、前記増幅させた標的核酸増幅液に、前記蛍光物質を標識したプライマーと相補配列を有するクエンチャーを標識したオリゴヌクレオチドを添加させて反応させる反応工程22と、前記反応後の標的核酸増幅液にあらかじめ定められた波長域の光を照射し、前記照射により蛍光物質から発せられた蛍光から増幅した標的核酸を検出し、前記蛍光の色から標的核酸を識別する検出・識別工程23と、を含む工程からなる。
【0034】
本発明に用いる核酸増幅方法は、プライマーを用いてDNA又はRNAの標的核酸を増幅させる方法であればよく、PCR(Polymerase Chain Reaction) 、RT−PCR(Reverse Transcription-PCR) 、LCR(Ligase Chain Reaction)、SDA(Strand Displacement Amplification)、NASBA(Nucleic Acid Sequence-based Amplification)、TRC(Transcription Reverse-transcription Concerted Reaction)、LAMP(Loop-mediated Isothermal Amplification)、RT−LAMP(Reverse Transcription-LAMP)、ICAN(Isothermal and Chimeric Primer-initiated Amplification of Nucleic Acids)、RCA(Rolling Cycle Amplification)、 Smart Amp(Smart Amplification Process)、 TMA(Transcription-mediated Amplification)、TAS(Transcription Amplification System)、3SR(Self-sustained Sequence Replication System)などが挙げられる。本願発明の標的核酸の検出・識別方法は、いかなる標的核酸増幅法にも適用できる。
【0035】
まず、検出・識別しようとする少なくとも1種類の標的核酸の種類ごとの上流側及び/又は下流側プライマーそれぞれに対して検出用の異なる蛍光物質を標識する蛍光物質標識工程20である。検出しようとする少なくとも1種類の標的核酸の種類ごとの上流側及び/又は下流側プライマーを設計する。
【0036】
本発明に利用可能なプライマーは、PCR、RT−PCR、LCR、SDA、NASBA、TRC、LAMP、RT−LAMP、ICAN、TMA、RCA、Smart Amp、TAS、3SRなどの既知の核酸増幅方法により、少なくとも1種類の検出・識別したい標的核酸であるDNA又はRNAから増幅産物が得られるように設計する。プライマー鎖長は、9〜35塩基であればよく、好ましくは15〜30塩基である。
【0037】
また、増幅させる標的核酸の種類ごとに対応した、前記標的核酸の上流側及び/又は下流側プライマーの5’末端に、標的核酸の種類ごとに異なる蛍光物質を標識しかつ同じ配列からなるオリゴヌクレオチドを連結させたプライマーを設計することもできる。この場合にはクエンチャー標識オリゴヌクレオチドを最小限1種類まで減じることができる。また、オリゴヌクレオチド鎖長は、9〜50塩基であればよい。
【0038】
標的核酸の上流側及び/又は下流側プライマーに、検出・識別しようとする標的核酸の種類ごとに異なる任意の蛍光色の蛍光物質を標識する。標的核酸を目視で検出・識別するために、緑色、赤色、黄色、青色などの目視で識別しやすい色を種々の蛍光物質から選択する。なお、蛍光プレートリーダーや蛍光光度計などの機器による測定の場合には特に可視領域や目視による判別性を考慮せずに蛍光物質を選択すればよい。
【0039】
プライマーに標識する蛍光物質は、プライマー配列の5’末端又は鎖内に標識する。
【0040】
ここで、本発明に利用可能な蛍光物質は、登録商標又は商品名として、Alexa Fluorシリーズ、BODIPYシリーズ、DYシリーズ、 ATTOシリーズ、Dy Lightシリーズ、Oysterシリーズ、HiLyte Fluorシリーズ、 Pacific Blue、Marina Blue、Acridine、Edans、Coumarin、DANSYL、FAN、Oregon Green、Rhodamine Green-X、NBD-X、TET、JOE、Yakima Yellow、VIC、HEX、R6G、Cy3、TAMRA、Rhodamine Red-X、Redmond Red、ROX、Cal Red、Texas Red、LC Red 640、Cy5、Cy5.5、LC Red 705などが挙げられる。
【0041】
次に、標的核酸の種類ごとに、標的核酸を増幅させる方法に応じた前記標的核酸増幅用及び/又は検出・識別用の、少なくとも一対の前記蛍光標識された上流側及び下流側プライマー、少なくとも一対の前記蛍光標識された上流側プライマー及び蛍光標識されていない下流側プライマー、少なくとも一対の蛍光標識されていない上流側プライマー及び前記蛍光標識された下流側プライマー、少なくとも1本の前記蛍光標識された上流側又は下流側プライマー、又は標的核酸を増幅させる蛍光標識されていないプライマー並びに標的核酸を検出・識別しようとする少なくとも1本の前記蛍光標識された上流側及び/又は下流側プライマーを添加して、少なくとも1種類の標的核酸を同時に増幅させる増幅工程21である。標的核酸を増幅する方法は、PCR、RT−PCR、LCR、SDA、NASBA、TRC、LAMP、RT−LAMP、ICAN、TMA、RCA、Smart Amp、TAS、3SRなどの核酸増幅方法であればよい。
【0042】
前記標的核酸増幅方法の中から選択した標的核酸増幅方法によって、前記標的核酸を増幅させる方法に応じた前記標的核酸増幅用及び/又は検出・識別用のプライマーを添加して、少なくとも1種類の標的核酸を同時に増幅させる。
【0043】
図2は増幅工程における標的核酸と標的核酸増幅用のプライマーを混合させたときの原理の説明図である。DNA、又はRNAから逆転写反応により生成したcDNA(標的核酸A又はB)9と、標的核酸Aに対するプライマーa31と、蛍光物質a5を標識した標的核酸Aに対するプライマーa1と、標的核酸Bに対するプライマーb32と、蛍光物質b6を標識した標的核酸Bに対するプライマーb2とを混合させた直後の状況を原理的に示している。
【0044】
図3は標的核酸Aであった場合、増幅工程においてプライマーが標的核酸にハイブリダイズする原理説明図である。加熱させて熱変性させ1本鎖化したDNA、又は逆転写反応により生成した1本鎖のcDNA10に、蛍光物質a5を標識した標的核酸Aに対するプライマーa1及び/又は標的核酸Aに対するプライマーa31がハイブリダイズする。また、蛍光物質b6を標識した標的核酸Bに対するプライマーb2及び標的核酸Bに対するプライマーb32は1本鎖化したDNA、又は逆転写反応により生成した1本鎖のcDNA10とハイブリダイズしていない。
【0045】
そして、標的核酸Aにハイブリダイズしたプライマーa1及び/又はプライマーa31を起点にDNAが伸長する原理を図4に示している。図4において、例えば、1本鎖化したDNA、又は逆転写反応により生成した1本鎖のcDNA10にハイブリダイズした、蛍光物質a5を標識した標的核酸Aに対するプライマーa1及び/又は蛍光物質を標識していない標的核酸Aに対するプライマーa31を起点にDNAが伸長し、増幅した2本鎖DNA11が生成される。一方、標的核酸の増幅に使用されなかった蛍光物質b6を標識したプライマーb2、及びプライマーb32はそのままの状態で残存する。
【0046】
このことは、標的核酸が増幅した場合は、増幅した標的核酸に対応したプライマーは核酸の伸長に使用されるのに対して、標的核酸が存在しなかった場合は、存在しなかった標的核酸に対応したプライマーは未反応のまま残存することを示している。
【0047】
次に、前記増幅させた標的核酸増幅液に、前記蛍光物質を標識したプライマーと相補配列を有するクエンチャーを標識したオリゴヌクレオチドを添加させて、増幅工程で増幅に使用されなかった蛍光標識プライマーと反応させる反応工程22である。
【0048】
本発明に利用可能な消光物質であるクエンチャーは、前記蛍光物質から発せられる蛍光を消光する消光物質であればよく、登録商標又は商品名として、BHQ-0、BHQ-1、BHQ-2、BHQ-3などのBHQシリーズ、DDQシリーズ、TAMRA、Dabcylなどが挙げられる。
【0049】
前記蛍光物質の中から選択した蛍光物質を標識した、上流側及び/又は下流側プライマーと相補配列を有するオリゴヌクレオチドを準備し、前記オリゴヌクレオチドに、前記蛍光物質を消光させるのに適した、前記消光物質の中から選択したクエンチャーを標識し添加する。
【0050】
前記クエンチャーは、前記オリゴヌクレオチドの配列の5’末端、3’末端又は鎖内に標識される。
【0051】
増幅工程で標的核酸からプライマーの伸長によって生じた増幅産物である2本鎖DNAには前記クエンチャー標識オリゴヌクレオチドがハイブリダイズしないため、蛍光物質は発光したままとなる。
【0052】
一方、増幅工程で増幅に使用されなかった蛍光物質標識プライマーは、前記クエンチャー標識オリゴヌクレオチドとハイブリダイズし、蛍光物質と消光物質とが近接するので、蛍光物質から発せられた蛍光は消光する。
【0053】
図5で反応工程22を説明する。標的核酸増幅液に蛍光標識プライマーと相補配列を有するクエンチャー標識オリゴヌクレオチドを添加すると、未反応の蛍光標識プライマーはクエンチャー標識オリゴヌクレオチドとハイブリダイズする。一部標的核酸の増幅に使用されず残存した蛍光物質a5を標識したプライマーa1にはクエンチャーa7を標識したオリゴヌクレオチドa3がハイブリダイズし、標的核酸が存在せず全く増幅に使用されなかった蛍光物質b6を標識したプライマーb2にはクエンチャーb8を標識したオリゴヌクレオチドb4がハイブリダイズしている。
【0054】
一方、標的核酸の伸長反応に使用され、増幅核酸に取り込まれた蛍光標識プライマーにはクエンチャーを標識したオリゴヌクレオチドがハイブリダイズしない。図5において、増幅した2本鎖DNA11の伸長に使用された蛍光物質a5を標識した標的核酸Aに対するプライマーa1には、クエンチャーa7を標識したオリゴヌクレオチドa3がハイブリダイズされていないことが示されている。
【0055】
次に、前記反応後の標的核酸増幅液にあらかじめ定められた波長域の光を照射し、照射により蛍光物質から発せられた蛍光から増幅した標的核酸を検出し、前記蛍光の色から標的核酸を識別する検出・識別工程23である。
【0056】
まず、目視で識別できるように、照射光の波長域が300〜800nmの中から任意に選択した波長の光を照射する。図6において照射機器15から波長を設定して照射光は発せられる。
【0057】
次に、標的核酸からプライマーの伸長により増幅した産物である2本鎖DNAが生成されており、前記蛍光標識プライマーにより伸長した2本鎖DNAはクエンチャー標識オリゴヌクレオチドとハイブリダイズしないので、照射により、あらかじめ標的核酸の種類ごとに定めた蛍光色を発光する。このため、前記蛍光色を検出することにより標的核酸を識別できる。
【0058】
図6において、目視すると、クエンチャー標識オリゴヌクレオチドとハイブリダイズしなかったプライマーに標識された蛍光物質a5が発光し、その蛍光色から増幅した標的核酸を識別することができる。
【0059】
一方、存在しなかった標的核酸に対応した蛍光標識プライマーはクエンチャー標識オリゴヌクレオチドとハイブリダイズする。これにより、照射時にあらかじめ標的核酸の種類ごとに定めた蛍光色が検出されない。これによって、増幅しようとした標的核酸が存在しないことを確認することができる。
【0060】
このとき、目視で確認できる蛍光色が混色の場合には、カチオン性ポリマーを添加することによって、混色を構成している複数の蛍光物質の中で一部の意図した蛍光物質からの蛍光色を消光させることができる。カチオン性ポリマーとしては、ポリエチレンイミン、ポリアリルアミン、ポリビニルアミンなどがある。
【0061】
例えば、蛍光色が黄色の場合には、黄色単色の場合と、緑色と赤色との混色である場合があるので、このときはカチオン性ポリマーであるポリエチレンイミンを添加させることによって、混色の場合には緑色を退色させて赤色のみに変えることができる。
【0062】
これによって、蛍光色が黄色の場合に、単色の黄色を呈する標的核酸の増幅か、混色であっても緑色を呈する標的核酸と、赤色を呈する標的核酸との同時増幅かを検出し識別することができる。
【0063】
以下、実施例で本願発明を詳細に説明するが、本願発明はこれらの実施例によって制限されるものではない。
【実施例1】
【0064】
プログラムコントロールシステムPC−818A(株式会社アステック社製)を用いて、RT−マルチプレックスPCR法により、胃腸炎関連で人に感染する下痢症ウイルスであるノロウイルス遺伝子グループI、ノロウイルス遺伝子グループII、サポウイルス及びアストロウイルスの遺伝子を標的核酸として増幅させ検出する。
【0065】
標的核酸の種類ごとに、蛍光物質を標識させたプライマー及び標的核酸を増幅させるプライマー、並びに、前記蛍光標識プライマーと相補配列を有し、蛍光標識プライマーの蛍光色を消光させるクエンチャーを標識したオリゴヌクレオチドを準備する。
【0066】
その蛍光標識プライマーにおいて、標的核酸を目視で識別するために、ノロウイルス遺伝子グループIの蛍光色を緑色、ノロウイルス遺伝子グループIIの蛍光色を赤色、サポウイルスの蛍光色を黄色、アストロウイルスの蛍光色を青色の蛍光物質を、それぞれのプライマー配列の5’末端に標識した。
【0067】
前記蛍光物質を標識したプライマーと相補配列を有するオリゴヌクレオチドの配列の3’末端に消光物質であるクエンチャーを標識した。各蛍光物質に対するクエンチャーとしては、ノロウイルス遺伝子グループIの蛍光物質Alexa Fluor 488に対して消光物質BHQ-1を、ノロウイルス遺伝子グループIIの蛍光物質Alexa Fluor 594に対しては消光物質BHQ-2を、サポウイルスの蛍光物質Alexa Fluor 532に対しては消光物質BHQ-1を、アストロウイルスの蛍光物質Alexa Fluor 350に対しては消光物質BHQ-0を組み合わせた。
【0068】
上流側及び下流側プライマー、及び前記蛍光標識プライマーと相補配列を有するクエンチャー標識オリゴヌクレオチドの塩基配列を以下に示す。
【0069】
ノロウイルス遺伝子グループIの遺伝子増幅に対して使用するプライマーは、文献Kojima S,Kageyama T,Fukushi S,Hoshino FB,Shinohara M,Uchida K,Natori K,Takeda N,and Katayama K:Genogroup-specific PCR primers for detection of Norwalk-like viruses.Journal of Virological Methods 100,107-114,2002.に記載されているプライマーであるG1SKF及びG1SKRを使用した。蛍光標識プライマーと相補配列を有するクエンチャー標識オリゴヌクレオチドはG1SKF_Rを使用した。
G1SKF;5’CTGCCCGAATTYGTAAATGA 3’ 5’Alexa Fluor488標識(緑) 配列番号1
G1SKR;5’CCAACCCARCCATTRTACA 3’ 配列番号2
G1SKF_R;5’TCATTTACRAATTCGGGCAG 3’ 3’BHQ-1標識 配列番号3
【0070】
前記プライマー及びオリゴヌクレオチドの記載例を説明すると、「G1SKF ; 5’CTGCCCGAATTYGTAAATGA 3’ 5’ Alexa Fluor 488標識 (緑)」の「G1SKF」はプライマー名を示し、「5’ Alexa Fluor 488標識 (緑)」は、塩基配列の5’末端に緑色の蛍光色を発光するAlexa Fluor 488を標識することを示している。また、「G1SKF_R;5’ TCATTTACRAATTCGGGCAG 3’ 3’BHQ-1標識」の「G1SKF_R」はオリゴヌクレオチド名を示し、「3’BHQ−1標識」は3’末端に標識した消光物質を示している。
【0071】
ノロウイルス遺伝子グループIIの遺伝子増幅に対して使用するプライマーも、ノロウイルス遺伝子グループIの遺伝子増幅に使用するプライマーが記載されている文献と同じJournal of Virological Methods 100,107-114,2002.に記載されているプライマーである G2SKF及びG2SKRを使用した。蛍光標識プライマーと相補配列を有するクエンチャー標識オリゴヌクレオチドはG2SKF_Rを使用した。
G2SKF;5’CNTGGGAGGGCGATCGCAA 3’ 5’Alexa Fluor594標識(赤) 配列番号4
G2SKR;5’CCRCCNGCATRHCCRTTRTACAT 3’ 配列番号5
G2SKF_R;5’TTGCGATCGCCCTCCCANG 3’ 3’BHQ-2標識 配列番号6
【0072】
サポウイルスの遺伝子増幅に対して使用するプライマーは、文献Okada M,Shinozaki K,Ogawa T,and Kaiho I:Molecular epidemiology and phylogenetic Analysis of Sapporo-like viruses.Archives of Virology 147,1445-1451,2002.に記載されているプライマーであるSV-F21及びSV-R2を使用した。蛍光標識プライマーと相補配列を有するクエンチャー標識オリゴヌクレオチドはSV-F21_Rを使用した。
SV-F21:5’ANTAGTGTTTGARATGGAGGG 3’ 5’Alexa Fluor532標識(黄) 配列番号7
SV-R2;5’GWGGGRTCAACMCCWGGTGG 3’ 配列番号8
SV-F21_R;5’CCCTCCATYTCAAACACTANT 3’ 3’BHQ-1標識 配列番号9
【0073】
アストロウイルスの遺伝子増幅に対して使用するプライマーは、文献Sakon N,Yamazaki K,Utagawa E, Okuno Y,and Oishi I:Genomic characterization of human astrovirus type 6 Katano virus and the establishment of a rapid and effective reverse transcription-polymerase chain reaction to detect all serotypes of human astrovirus.Journal of Medical Virology 61,125-131,2000.に記載されているプライマーであるAC1’及びAC230を使用した。蛍光標識プライマーと相補配列を有するクエンチャー標識オリゴヌクレオチドはAC1’_Rを使用した。
AC1’;5’ATGGCTAGCAAGTCTGACAAG 3’ 5’Alexa Fluor350標識(青) 配列番号10
AC230;5’GGTTTTGGTCCTGTGACACC 3’ 配列番号11
AC1’_R;5’CTTGTCAGACTTGCTAGCCAT 3’ 3’BHQ-0標識 配列番号12
【0074】
水(H2O)で糞便10%乳剤を作製し、前記糞便10%乳剤よりQIAamp Viral RNA Mini Kit(キアゲン社製)を用いてRNAを抽出した。
【0075】
PCR法によって標的核酸を増幅させるために、抽出したRNAを鋳型に逆転写反応を行ってcDNA(Complementary DNA)を生成した。
【0076】
逆転写反応においては、逆転写反応試薬であるPrimeScript RT reagent Kit(タカラバイオ社製)に前記抽出RNAを用いて、以下の表1に示す組成反応液で行った。
【0077】
【表1】

【0078】
逆転写反応手順は、表1に示す反応液を、30℃で10分間保持し、その後42℃で60分間保持し、99℃で5分間保持し、その後冷却して4℃に保持した。
【0079】
次に、生成されたcDNAから標的核酸の増幅は、マルチプレックスPCR試薬であるMultiplex PCR Assay Kit(タカラバイオ社製)を用いて、以下の表2に示す組成反応液(全量50μl)でPCR反応を行った。
【0080】
【表2】

【0081】
マルチプレックスPCR反応は、表2に示す反応液を、94℃で60秒間の熱変性を行った後、次いで、94℃で30秒間の熱変性工程、57℃で90秒間のアニーリング工程、72℃で90秒間の伸長工程を40サイクル繰り返し、その後72℃で10分間保持し、標的核酸を増幅させた標的核酸増幅液を生成した。
【0082】
次に、標的核酸増幅液に、表3に示すクエンチャー標識オリゴヌクレオチドを添加し、増幅反応に使用されなかった蛍光標識プライマーとハイブリダイズさせた。
【0083】
【表3】

【0084】
次に、ハイブリダイズさせた液にトランスイルミネータ(VILBER LOURMAT社製)を用いて波長312nmの光を照射し、蛍光色を目視で確認した。増幅した標的核酸が1種類の場合には、例えばノロウイルス遺伝子グループIの遺伝子が増幅していた場合は緑色の蛍光色となり、ノロウイルス遺伝子グループIIの遺伝子が増幅していた場合は赤色の蛍光色となり、サポウイルスの遺伝子が増幅していた場合は黄色の蛍光色となり、アストロウイルスの遺伝子が増幅していた場合は青色の蛍光色となる。これらの蛍光色が目視で判別できるので簡易に増幅した標的核酸を識別することができる。
【0085】
ここで、目視で確認した蛍光色が1種類の標的核酸が増幅したときと同じ蛍光色であっても各標的核酸別の単色でなく複数の標的核酸による混色の場合があるので、その場合には一部の意図した標的核酸に対応した蛍光物質からの蛍光色を消光させることにより、蛍光色が変わるので複数の標的核酸が増幅したことを確認でき、一方蛍光色が変わらなかった場合は混色ではなく単色の1種類の標的核酸が増幅したことが確認できる。
【0086】
例えば、緑色と赤色の混色は黄色であるので、蛍光色が黄色を示した場合には、カチオン性ポリマーである1%ポリエチレンイミンを1μl添加して緑色が消光して赤色に変わるかを確認する。蛍光色が黄色のままの場合にはサポウイルスの遺伝子が増幅したことがわかり、蛍光色が赤色に変わった場合には、ノロウイルス遺伝子グループIの遺伝子及びノロウイルス遺伝子グループIIの遺伝子が増幅したことがわかる。
【実施例2】
【0087】
RT−LAMP法を使用して、ノロウイルス遺伝子グループIの遺伝子及びノロウイルス遺伝子グループIIの遺伝子を標的核酸として増幅させ検出する。
【0088】
RT−LAMP法に使用するプライマー及び増幅方法は、文献Fukuda S,Takao S,Kuwayama M,Shimazu Y,and Miyazaki K:Rapid detection of norovirus from fecal specimens by real-time reverse transcription-loop-mediated isothermal amplification assay. Journal of Clinical Microbiology 44,1376-1381,2006. 及び文献Fukuda S,Sasaki Y,Kuwayama M,and Miyazaki K:Simultaneous detection and genogroup-screening test for norovirus genogroups I and II from fecal specimens in single tube by reverse transcription-loop-mediated isothermal amplification assay. Microbiology and Immunology 51,547-550,2007.に記載されているプライマーを使用し、記載されている増幅方法で実施した。
【0089】
標的核酸の種類ごとに、蛍光物質を標識させないで標的核酸を増幅させるプライマー及び蛍光物質を標識させて標的核酸を検出・識別させるプライマー、及び、前記蛍光標識プライマーと相補配列を有し、蛍光標識プライマーの蛍光色を消光させるクエンチャーを標識したオリゴヌクレオチドを準備する。
【0090】
その蛍光標識プライマーにおいて、標的核酸を目視で識別するために、ノロウイルス遺伝子グループIは緑色を発光し、ノロウイルス遺伝子グループIIは赤色を発光する蛍光物質を、それぞれのプライマー配列の5’末端に標識した。
【0091】
前記蛍光物質を標識したプライマーと相補配列を有するオリゴヌクレオチドの配列の3’末端に消光物質であるクエンチャーを標識した。各蛍光物質に対するクエンチャーとしては、ノロウイルス遺伝子グループIの蛍光物質Alexa Fluor 488に対して消光物質BHQ-1を、ノロウイルス遺伝子グループIIの蛍光物質Alexa Fluor 594に対しては消光物質BHQ-2を組み合わせた。
【0092】
前記プライマー、及び前記蛍光標識プライマーと相補配列を有するオリゴヌクレオチドの塩基配列を以下に示す。
【0093】
ノロウイルス遺伝子グループIの遺伝子増幅用及び検出・識別用に使用したプライマーと、前記蛍光標識プライマーと相補配列を有するクエンチャー標識オリゴヌクレオチドを示す。
G1F3;5’CCRGGNTGGCARGCNATGTT 3’ 配列番号13
G1B3(GISKR);5’CCAACCCARCCATTRTACA 3’ 配列番号14
G1FIP1;5’CATTTACGAATTCGGGCAGGTTTTCGCTGGATGCGNTTCCATGA 3’ 配列番号15
G1FIP2;5’CATTTACAAAATTCGGGCAGGTTTTCGCTGGATGCGNTTCCATGA 3’ 配列番号16
G1BIP1;5’GATGGCGTCTAAGGACGCTTTTAGCTGTRTTTGCCTCTGGWAC 3’ 配列番号17
G1BIP2;5’GATGGCGTCTAAGGACGCTTTTAGCWGTATTAACCTCCGGYAC 3’ 配列番号18
G1BIP3;5’GATGGCGTCTAAGGACGCTTTTAGCTGYAYTAACCTCTGGAAC 3’ 配列番号19
G1LF1;5’AGATYGCGATCYCCTGTCCA 3’ 5’Alexa Fluor 488標識(緑) 配列番号20
G1LF2;5’AGATTGCGATCTCCTGCCCA 3’ 5’ Alexa Fluor 488標識(緑) 配列番号21
G1LF3;5’AGCTCGCGGTCTCCTGTCCA 3’ 5’ Alexa Fluor 488標識(緑) 配列番号22
G1LF_R;5’TGGRCAGGRGAYCGCRAKCT 3’ 3’BHQ-1標識 配列番号23
【0094】
ノロウイルス遺伝子グループIIの遺伝子増幅用及び検出・識別用に使用したプライマーと、前記蛍光標識プライマーと相補配列を有するクエンチャー標識オリゴヌクレオチドを示す。
G2F3;5’GGNMTGGANTTTTAYGTGCCMAG 3’ 配列番号24
G2B3(G2SKR);5’CCRCCNGCATRHCCRTTRTACAT 3’ 配列番号25
G2FIP1;5’GGGAGCMAGATTGCGATCGCTTTTGAGBCNATGTTYAGRTGGAT 3’ 配列番号26
G2FIP2;5’GGGAGCMAGATTGCGATCGCTTTTGAGCCCATGTTCAGRTGGAT 3’ 配列番号27
G2FIP3;5’GGGAGCGAGATTGCGATCGCTTTTGAGTCAATGTTYAGGTGGAT 3’ 配列番号28
G2FIP4;5’GGGAGCGAGATTGCGATCGCTTTTGAGCCYATGTTYAGGTGGAT 3’ 配列番号29
G2FIP5;5’GGGAGCMAGATTGCGATCGCTTTTGAACCWATGTTYAGGTGGAT 3’ 配列番号30
G2BIP1;5’TGTGAATGAAGATGGCGTCGTTTTCTCATTRTTRVTCTCTGGBACGAG 3’配列番号31
G2BIP2;5’TGTGAATGAAGATGGCGTCGTTTTCTCATTRTTGCYCTCTGGYACGAG 3’配列番号32
G2BIP3;5’TGTGAATGAAGATGGCGTCGTTTTCTCATTGTTGAYCTCTGGKACGAG 3’配列番号33
G2BIP4;5’TGTGAATGAAGATGGCGTCGTTTTCTCATTRTTACTTTCTGGCACGAG 3’配列番号34
G2LF1;5’GTGCTCARATCWGARAACCTC 3’ 5’Alexa Fluor 594標識(赤) 配列番号35
G2LF2;5’GTGCTGAGGTCWGARAATCTC 3’ 5’Alexa Fluor 594標識(赤) 配列番号36
G2LF3;5’GTGCTCAAATCTGAGAATCTC 3’ 5’Alexa Fluor 594標識(赤) 配列番号37
G2LF4;5’GTGCTCAAGTCTGAGAAYCTC 3’ 5’Alexa Fluor 594標識(赤) 配列番号38
G2LF_R;5’GAGRTTYTCWGAYYTSAGCAC 3’ 3’BHQ-2標識 配列番号39
【0095】
水(H2O)で糞便10%乳剤を作製し、前記糞便10%乳剤よりQIAamp Viral RNA Mini Kit(キアゲン社製)を用いてRNAを抽出した。
【0096】
次に、抽出されたRNAの増幅をRT−LAMP法によりリアルタイム濁度測定装置(テラメックス株式会社製)を用いて行った。RT−LAMP増幅試薬キット(栄研化学社製)を用いて、以下の表4に示す組成反応液に表5に示すプライマーを添加してRT−LAMP反応を行った(全量25μl)。試薬及び標的核酸を表4に、プライマーの添加量を表5に記す。
【0097】
【表4】

【0098】
【表5】

【0099】
RT−LAMP手順は、62℃で90分間保持して、標的核酸を増幅させた標的核酸増幅液を生成した。
【0100】
次に、標的核酸増幅液に、表6に示すクエンチャー標識オリゴヌクレオチドを添加し、増幅反応に使用されなかった蛍光標識プライマーとハイブリダイズさせた。
【0101】
【表6】

【0102】
次に、ハイブリダイズさせた液にトランスイルミネータ(VILBER LOURMAT社製)を用いて波長312nmの光を照射し、蛍光色を目視で確認した。蛍光色が緑色の場合は増幅した標的核酸はノロウイルス遺伝子グループIの遺伝子であり、蛍光色が赤色の場合は増幅した標的核酸はノロウイルス遺伝子グループIIの遺伝子であり、蛍光色が黄色の場合は増幅した標的核酸はノロウイルス遺伝子グループIの遺伝子及びノロウイルス遺伝子グループIIの遺伝子である。
【符号の説明】
【0103】
1 (標的核酸Aに対する)プライマーa
2 (標的核酸Bに対する)プライマーb
3 オリゴヌクレオチドa
4 オリゴヌクレオチドb
5 蛍光物質a
6 蛍光物質b
7 クエンチャーa
8 クエンチャーb
9 DNA又はRNAから逆転写反応により生成したcDNA(標的核酸A又はB)
10 1本鎖化したDNA、又は逆転写反応により生成した1本鎖のcDNA
11 増幅した2本鎖DNA
15 照射機器
20 蛍光物質標識工程
21 増幅工程
22 反応工程
23 検出・識別工程
31 (標的核酸Aに対する)プライマーa
32 (標的核酸Bに対する)プライマーb
【技術分野】
【0001】
本願発明は、すべての生物の細胞に含まれている核酸を迅速に、簡易に、しかも複数の核酸を同時に検出・識別する方法に関する。
【背景技術】
【0002】
近年、患者などの生体などから採取した試料中の核酸を同定するための標的核酸の検出・識別方法に関する技術が開示されている。
【0003】
例えば、標的核酸に対して、一方の末端が蛍光標識された第一プローブと、他方の末端がクエンチャーで標識された第二プローブとを同時にハイブリダイズさせ蛍光体とクエンチャーの相互作用による消光の様子を観察することにより、試料中に存在する特定の標的核酸量を調べる技術が開示され、蛍光プレートリーダーや蛍光光度計などの機器を使用して蛍光シグナルを測定している技術が開示されている(特許文献1参照。)。
【0004】
また、PCR容器内に、検出すべき標的核酸の配列に対して相補的塩基配列を有した標識プローブを含まない反応液とともにある標的核酸を注入する工程と、該標的核酸反応液の上部に、検出すべき該標的核酸の配列に対して相補的塩基配列を有した標識プローブ混合液を注入する工程と、これに蓋をして核酸増幅させる工程と、核酸増幅後に遠心して反応液と標識プローブ混合液とを混合させる工程と、混合後に標識ブローブの分析をする工程とからなる技術が開示され、標的プローブのTm値の分析が融解曲線分析で行われる技術が開示されている(特許文献2参照。)。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特開2009−159945号公報
【特許文献2】特開2005−000025号公報
【発明の概要】
【発明が解決しようとする課題】
【0006】
特許文献1に開示された技術においては、プライマーとは別に新たに第一及び第二プローブ(オリゴヌクレオチド)を設計する必要があり、また、[0020]に記載されているように、第二プローブ(オリゴヌクレオチド)を伸長させないようにリン酸化やアミノ化、あるいはダイデオキシ化などの修飾が必要になり、手間がかかるという問題があった。
【0007】
また、標的核酸が存在すると蛍光は消光し、標的核酸が存在しないと蛍光は発光したままであるので、直接目視で存在する複数の標的核酸の種類を識別することができず、蛍光プレートリーダーや蛍光光度計などの測定機器が必要となってコスト高になるという問題があった。
【0008】
特許文献2の技術は、[0033]に記載のプライマーとは別に[0034]に記載のプローブを別々に混入しなければならないという手間がかかり、核酸増幅後に遠心させるために遠心機が必要となってコスト高になり、かつ[0035]及び[0036]の記載にあるようにカローセルをリアルタイムPCR装置であるライトサイクラー(商品名)にセットし増幅させた後、遠心機に移し遠心操作をし、その後再びライトサイクラーに再セットするという手間がかかるという問題があった。
【0009】
また、[0042]に、少なくとも5種類以上の異なる核酸配列の増幅結果を同時に確認できるとの記載はあるが、この記載は5種類以上の核酸にハイブリダイズするプローブのTm値が離れている場合を意味しているのであって、Tm値が近似した場合には、[0039]に記載されている対応をしなければならないことからわかるように、Tm値による標的核酸の判別が難しいことが示されている。
【0010】
しかし、そのための対応として、[0039]にTm値が近似した場合には、蛍光色素「LCRed640(F2/F1),LCRed705(F3/F1)の2色」を変えて異なる波長で検出するようにするとの記載があるが、この方法では、Tm値が近似した2種類までの判別は可能であるが、近似した3種類以上の判別は極めて困難であるという問題があった。また、融解曲線分析を行うためのソフトウエアを組み込んだ検出機器が必要となってコスト高になるという問題もあった。
【0011】
したがって、本願発明の目的は、少なくとも1種類の標的核酸を同時に増幅させた場合であっても、どの核酸が増幅したのかを、新たに機器を必要とせず、容易に簡易に短時間で直接に、目視で識別することができる標的核酸の検出・識別方法を提供することである。
【課題を解決するための手段】
【0012】
本発明における「末端」とは、標的核酸、プライマー又はオリゴヌクレオチドの塩基配列5’側の最も端に存在する塩基、もしくは標的核酸、プライマー又はオリゴヌクレオチドの塩基配列3’側の最も端に存在する塩基を意味し、「鎖内」とは、5’末端と3’末端との間に存在する塩基を意味する。また、「上流側」とは塩基配列の領域内で5’末端側を、「下流側」とは塩基配列の領域内で3’末端側を意味する。
【0013】
本発明における「核酸」とは、DNA(デオキシリボ核酸)とRNA(リボ核酸)を意味する。
【0014】
「発明が解決しようとする課題」に記載した課題を解決するために、請求項1に記載の標的核酸の検出・識別方法の発明は、検出・識別しようする少なくとも1種類の標的核酸の種類ごとに添加する標的核酸増幅用及び/又は検出・識別用の上流側及び/又は下流側プライマーに対して検出用の異なる蛍光物質を標識する工程と、標的核酸の種類ごとに、標的核酸を増幅させる方法に応じた前記標的核酸増幅用の、少なくとも一対の前記蛍光標識された上流側及び下流側プライマー、少なくとも一対の前記蛍光標識された上流側プライマー及び蛍光標識されていない下流側プライマー、少なくとも一対の蛍光標識されていない上流側プライマー及び前記蛍光標識された下流側プライマー、少なくとも1本の前記蛍光標識された上流側又は下流側プライマー、又は、標的核酸を増幅させる蛍光標識されていないプライマー並びに標的核酸を検出・識別しようとする少なくとも1本の前記蛍光標識された上流側及び/又は下流側プライマーを添加して、少なくとも1種類の標的核酸を同時に増幅させる工程と、前記増幅させた標的核酸増幅液に、前記蛍光物質を標識したプライマーと相補配列を有するクエンチャーを標識したオリゴヌクレオチドを添加させて反応させる工程と、前記反応後の標的核酸増幅液にあらかじめ定められた波長域の光を照射し、前記照射により蛍光物質から発せられた蛍光から増幅した標的核酸を検出し、前記蛍光の色から標的核酸を識別する工程と、を含む工程からなることを特徴とする。
【0015】
請求項2に記載の標的核酸の検出・識別方法の発明は、請求項1において、前記プライマーに標識する蛍光物質が、前記プライマー配列の5’末端又は鎖内に標識されることを特徴とする。
【0016】
請求項3に記載の標的核酸の検出・識別方法の発明は、請求項1又は2において、前記オリゴヌクレオチドに標識されたクエンチャーが、前記オリゴヌクレオチドの配列の5’末端、3’末端又は鎖内に標識された、前記蛍光物質から発せられる蛍光を消光する消光物質であることを特徴とする。
【0017】
請求項4に記載の標的核酸の検出・識別方法の発明は、請求項1乃至3のいずれかにおいて、前記照射光の波長域が300〜800nmであることを特徴とする。
【0018】
請求項5に記載の標的核酸の検出・識別方法の発明は、請求項1乃至4のいずれかにおいて、少なくとも1種類の標的核酸を同時に増幅させる工程が、プライマーを用いて標的核酸を増幅させる方法であればいずれの増幅方法でもよいことを特徴とする。
【0019】
請求項6に記載の標的核酸の検出・識別方法の発明は、請求項1乃至5のいずれかにおいて、標的核酸の種類ごとに対応させる上流側及び/又は下流側プライマーそれぞれの5’末端に、標的核酸の種類ごとに異なる蛍光物質を標識させた、同じ配列からなるオリゴヌクレオチドを連結させることを特徴とする。
【0020】
請求項7に記載の標的核酸の検出・識別方法の発明は、請求項1乃至6のいずれかにおいて、複数の蛍光物質から発せられた蛍光によって目視で確認できる色が混色となっている場合に、カチオン性ポリマーを添加することによって、混色を構成している複数の蛍光物質の中で一部の意図した蛍光物質からの蛍光色を消光させることを特徴とする。
【発明の効果】
【0021】
請求項1に記載の発明は、標的核酸増幅後に、蛍光プレートリーダーや蛍光光度計などの測定機器、遠心機、電気泳動装置や融解曲線分析を行う機器などの分析機器を必要としないので、それらの機器が備わっていなくてもどこでも標的核酸を検出・識別でき、それらの機器に関する作業がなくてよいので、検出・識別作業が簡易で短時間でできるという効果を奏する。
【0022】
標的核酸増幅及び/又は検出・識別のために、プライマーを添加させるのみでよく、プライマーの他にプローブを混入させる必要がなく、またプローブが伸長しないようにリン酸化やアミノ化、あるいはダイデオキシ化などの修飾をする必要がないため、作業が容易で手間がかからないという効果を奏する。
【0023】
複数の標的核酸の包括的検出を目的とした結果、例えばTm値が近似し融解曲線分析では判別が困難な標的核酸が増幅した場合であっても、標識する蛍光物質(蛍光色)を変えることにより容易に目視で識別できるという効果を奏する。
【0024】
プライマーに標識する蛍光物質は、可視できる蛍光色を発するものであれば、すべての蛍光物質が使用可能であるという効果を奏する。
【0025】
標的核酸増幅後、蛍光標識プライマーと相補配列を持つ、クエンチャー標識オリゴヌクレオチドを加えるのみで、作業が極めて簡易である。
【0026】
請求項2に記載の発明は、請求項1の発明と同じ効果を奏する。さらに、標的核酸の5’末端でなくても、鎖内であっても標的核酸が増幅できるという効果を奏する。
【0027】
請求項3に記載の発明は、請求項1又は2の発明と同じ効果を奏する。さらに、クエンチャーがオリゴヌクレオチドの5’末端、3’末端又は鎖内であっても蛍光物質を標識したプライマーとクエンチャーを標識したオリゴヌクレオチドとがハイブリダイズし、蛍光物質とクエンチャーとが接近するため蛍光共鳴エネルギートランスファーにより蛍光物質からの蛍光が消光されるという効果を奏する。
【0028】
請求項4に記載の発明は、請求項1乃至3のいずれかの発明と同じ効果を奏する。さらに、蛍光波長が可視領域であり、標的核酸別に赤、青、緑、黄あるいは橙などの蛍光色を発光するので、目視で標的核酸を識別できるという効果を奏する。
【0029】
請求項5に記載の発明は、請求項1乃至4のいずれかの発明と同じ効果を奏する。さらに、プライマーを用いて標的核酸を増幅させる方法であればいずれの増幅方法でもよいので、本発明の実施にあたり新規に装置を購入する必要がなく、既存の装置で利用できるという効果を奏する。また、実施している核酸の増幅プロトコルをそのまま使用できる効果がある。
【0030】
請求項6に記載の発明は、請求項1乃至5のいずれかの発明と同じ効果を奏する。さらに、プライマーの5’末端に、共通の配列からなる標的核酸の種類ごとに異なる蛍光物質を標識したオリゴヌクレオチドを連結させることにより、複数種類のプライマーと相補配列を有する、クエンチャーを標識したオリゴヌクレオチドを複数種類添加させなくてもよく、プライマーに連結させた共通の配列と相補配列を有するクエンチャーを標識したオリゴヌクレオチドを添加させればよく、クエンチャー標識オリゴヌクレオチドの種類を減じることができるという効果を奏する。
【0031】
請求項7に記載の発明は、請求項1乃至6のいずれかの発明と同じ効果を奏する。さらに、複数の蛍光物質から発光した蛍光色によって混色が見られる場合に、混色を構成している複数の蛍光物質の中で一部の意図した蛍光物質からの蛍光色を消光させることによって混色になった複数の蛍光色を把握することができ、これにより複数の標的核酸を把握できるという効果を奏する。
【図面の簡単な説明】
【0032】
【図1】本願発明の標的核酸の検出・識別方法のフロー図である。
【図2】増幅工程において標的核酸と標的核酸増幅用のプライマーを混合させたときの原理説明図である。
【図3】増幅工程においてプライマーが標的核酸にハイブリダイズする原理説明図である。
【図4】増幅工程において標的核酸の増幅反応が進行する原理説明図である。
【図5】反応工程においてクエンチャー標識オリゴヌクレオチドが反応に使用されなかった蛍光標識プライマーとハイブリダイズする原理説明図である
【図6】検出・識別工程における原理説明図である。
【発明を実施するための形態】
【0033】
図1で本願発明の標的核酸の検出・識別方法を説明する。本願発明の標的核酸の検出・識別方法は、検出・識別しようする少なくとも1種類の標的核酸の種類ごとに添加する標的核酸増幅用及び/又は検出・識別用の上流側及び/又は下流側プライマーに対して検出用の異なる蛍光物質を標識する蛍光物質標識工程20と、標的核酸の種類ごとに、標的核酸を増幅させる方法に応じた前記標的核酸増幅用の、少なくとも一対の前記蛍光標識された上流側及び下流側プライマー、少なくとも一対の前記蛍光標識された上流側プライマー及び蛍光標識されていない下流側プライマー、少なくとも一対の蛍光標識されていない上流側プライマー及び前記蛍光標識された下流側プライマー、少なくとも1本の前記蛍光標識された上流側又は下流側プライマー、又は、標的核酸を増幅させる蛍光標識されていないプライマー並びに標的核酸を検出・識別しようとする少なくとも1本の前記蛍光標識された上流側及び/又は下流側プライマーを添加して、少なくとも1種類の標的核酸を同時に増幅させる増幅工程21と、前記増幅させた標的核酸増幅液に、前記蛍光物質を標識したプライマーと相補配列を有するクエンチャーを標識したオリゴヌクレオチドを添加させて反応させる反応工程22と、前記反応後の標的核酸増幅液にあらかじめ定められた波長域の光を照射し、前記照射により蛍光物質から発せられた蛍光から増幅した標的核酸を検出し、前記蛍光の色から標的核酸を識別する検出・識別工程23と、を含む工程からなる。
【0034】
本発明に用いる核酸増幅方法は、プライマーを用いてDNA又はRNAの標的核酸を増幅させる方法であればよく、PCR(Polymerase Chain Reaction) 、RT−PCR(Reverse Transcription-PCR) 、LCR(Ligase Chain Reaction)、SDA(Strand Displacement Amplification)、NASBA(Nucleic Acid Sequence-based Amplification)、TRC(Transcription Reverse-transcription Concerted Reaction)、LAMP(Loop-mediated Isothermal Amplification)、RT−LAMP(Reverse Transcription-LAMP)、ICAN(Isothermal and Chimeric Primer-initiated Amplification of Nucleic Acids)、RCA(Rolling Cycle Amplification)、 Smart Amp(Smart Amplification Process)、 TMA(Transcription-mediated Amplification)、TAS(Transcription Amplification System)、3SR(Self-sustained Sequence Replication System)などが挙げられる。本願発明の標的核酸の検出・識別方法は、いかなる標的核酸増幅法にも適用できる。
【0035】
まず、検出・識別しようとする少なくとも1種類の標的核酸の種類ごとの上流側及び/又は下流側プライマーそれぞれに対して検出用の異なる蛍光物質を標識する蛍光物質標識工程20である。検出しようとする少なくとも1種類の標的核酸の種類ごとの上流側及び/又は下流側プライマーを設計する。
【0036】
本発明に利用可能なプライマーは、PCR、RT−PCR、LCR、SDA、NASBA、TRC、LAMP、RT−LAMP、ICAN、TMA、RCA、Smart Amp、TAS、3SRなどの既知の核酸増幅方法により、少なくとも1種類の検出・識別したい標的核酸であるDNA又はRNAから増幅産物が得られるように設計する。プライマー鎖長は、9〜35塩基であればよく、好ましくは15〜30塩基である。
【0037】
また、増幅させる標的核酸の種類ごとに対応した、前記標的核酸の上流側及び/又は下流側プライマーの5’末端に、標的核酸の種類ごとに異なる蛍光物質を標識しかつ同じ配列からなるオリゴヌクレオチドを連結させたプライマーを設計することもできる。この場合にはクエンチャー標識オリゴヌクレオチドを最小限1種類まで減じることができる。また、オリゴヌクレオチド鎖長は、9〜50塩基であればよい。
【0038】
標的核酸の上流側及び/又は下流側プライマーに、検出・識別しようとする標的核酸の種類ごとに異なる任意の蛍光色の蛍光物質を標識する。標的核酸を目視で検出・識別するために、緑色、赤色、黄色、青色などの目視で識別しやすい色を種々の蛍光物質から選択する。なお、蛍光プレートリーダーや蛍光光度計などの機器による測定の場合には特に可視領域や目視による判別性を考慮せずに蛍光物質を選択すればよい。
【0039】
プライマーに標識する蛍光物質は、プライマー配列の5’末端又は鎖内に標識する。
【0040】
ここで、本発明に利用可能な蛍光物質は、登録商標又は商品名として、Alexa Fluorシリーズ、BODIPYシリーズ、DYシリーズ、 ATTOシリーズ、Dy Lightシリーズ、Oysterシリーズ、HiLyte Fluorシリーズ、 Pacific Blue、Marina Blue、Acridine、Edans、Coumarin、DANSYL、FAN、Oregon Green、Rhodamine Green-X、NBD-X、TET、JOE、Yakima Yellow、VIC、HEX、R6G、Cy3、TAMRA、Rhodamine Red-X、Redmond Red、ROX、Cal Red、Texas Red、LC Red 640、Cy5、Cy5.5、LC Red 705などが挙げられる。
【0041】
次に、標的核酸の種類ごとに、標的核酸を増幅させる方法に応じた前記標的核酸増幅用及び/又は検出・識別用の、少なくとも一対の前記蛍光標識された上流側及び下流側プライマー、少なくとも一対の前記蛍光標識された上流側プライマー及び蛍光標識されていない下流側プライマー、少なくとも一対の蛍光標識されていない上流側プライマー及び前記蛍光標識された下流側プライマー、少なくとも1本の前記蛍光標識された上流側又は下流側プライマー、又は標的核酸を増幅させる蛍光標識されていないプライマー並びに標的核酸を検出・識別しようとする少なくとも1本の前記蛍光標識された上流側及び/又は下流側プライマーを添加して、少なくとも1種類の標的核酸を同時に増幅させる増幅工程21である。標的核酸を増幅する方法は、PCR、RT−PCR、LCR、SDA、NASBA、TRC、LAMP、RT−LAMP、ICAN、TMA、RCA、Smart Amp、TAS、3SRなどの核酸増幅方法であればよい。
【0042】
前記標的核酸増幅方法の中から選択した標的核酸増幅方法によって、前記標的核酸を増幅させる方法に応じた前記標的核酸増幅用及び/又は検出・識別用のプライマーを添加して、少なくとも1種類の標的核酸を同時に増幅させる。
【0043】
図2は増幅工程における標的核酸と標的核酸増幅用のプライマーを混合させたときの原理の説明図である。DNA、又はRNAから逆転写反応により生成したcDNA(標的核酸A又はB)9と、標的核酸Aに対するプライマーa31と、蛍光物質a5を標識した標的核酸Aに対するプライマーa1と、標的核酸Bに対するプライマーb32と、蛍光物質b6を標識した標的核酸Bに対するプライマーb2とを混合させた直後の状況を原理的に示している。
【0044】
図3は標的核酸Aであった場合、増幅工程においてプライマーが標的核酸にハイブリダイズする原理説明図である。加熱させて熱変性させ1本鎖化したDNA、又は逆転写反応により生成した1本鎖のcDNA10に、蛍光物質a5を標識した標的核酸Aに対するプライマーa1及び/又は標的核酸Aに対するプライマーa31がハイブリダイズする。また、蛍光物質b6を標識した標的核酸Bに対するプライマーb2及び標的核酸Bに対するプライマーb32は1本鎖化したDNA、又は逆転写反応により生成した1本鎖のcDNA10とハイブリダイズしていない。
【0045】
そして、標的核酸Aにハイブリダイズしたプライマーa1及び/又はプライマーa31を起点にDNAが伸長する原理を図4に示している。図4において、例えば、1本鎖化したDNA、又は逆転写反応により生成した1本鎖のcDNA10にハイブリダイズした、蛍光物質a5を標識した標的核酸Aに対するプライマーa1及び/又は蛍光物質を標識していない標的核酸Aに対するプライマーa31を起点にDNAが伸長し、増幅した2本鎖DNA11が生成される。一方、標的核酸の増幅に使用されなかった蛍光物質b6を標識したプライマーb2、及びプライマーb32はそのままの状態で残存する。
【0046】
このことは、標的核酸が増幅した場合は、増幅した標的核酸に対応したプライマーは核酸の伸長に使用されるのに対して、標的核酸が存在しなかった場合は、存在しなかった標的核酸に対応したプライマーは未反応のまま残存することを示している。
【0047】
次に、前記増幅させた標的核酸増幅液に、前記蛍光物質を標識したプライマーと相補配列を有するクエンチャーを標識したオリゴヌクレオチドを添加させて、増幅工程で増幅に使用されなかった蛍光標識プライマーと反応させる反応工程22である。
【0048】
本発明に利用可能な消光物質であるクエンチャーは、前記蛍光物質から発せられる蛍光を消光する消光物質であればよく、登録商標又は商品名として、BHQ-0、BHQ-1、BHQ-2、BHQ-3などのBHQシリーズ、DDQシリーズ、TAMRA、Dabcylなどが挙げられる。
【0049】
前記蛍光物質の中から選択した蛍光物質を標識した、上流側及び/又は下流側プライマーと相補配列を有するオリゴヌクレオチドを準備し、前記オリゴヌクレオチドに、前記蛍光物質を消光させるのに適した、前記消光物質の中から選択したクエンチャーを標識し添加する。
【0050】
前記クエンチャーは、前記オリゴヌクレオチドの配列の5’末端、3’末端又は鎖内に標識される。
【0051】
増幅工程で標的核酸からプライマーの伸長によって生じた増幅産物である2本鎖DNAには前記クエンチャー標識オリゴヌクレオチドがハイブリダイズしないため、蛍光物質は発光したままとなる。
【0052】
一方、増幅工程で増幅に使用されなかった蛍光物質標識プライマーは、前記クエンチャー標識オリゴヌクレオチドとハイブリダイズし、蛍光物質と消光物質とが近接するので、蛍光物質から発せられた蛍光は消光する。
【0053】
図5で反応工程22を説明する。標的核酸増幅液に蛍光標識プライマーと相補配列を有するクエンチャー標識オリゴヌクレオチドを添加すると、未反応の蛍光標識プライマーはクエンチャー標識オリゴヌクレオチドとハイブリダイズする。一部標的核酸の増幅に使用されず残存した蛍光物質a5を標識したプライマーa1にはクエンチャーa7を標識したオリゴヌクレオチドa3がハイブリダイズし、標的核酸が存在せず全く増幅に使用されなかった蛍光物質b6を標識したプライマーb2にはクエンチャーb8を標識したオリゴヌクレオチドb4がハイブリダイズしている。
【0054】
一方、標的核酸の伸長反応に使用され、増幅核酸に取り込まれた蛍光標識プライマーにはクエンチャーを標識したオリゴヌクレオチドがハイブリダイズしない。図5において、増幅した2本鎖DNA11の伸長に使用された蛍光物質a5を標識した標的核酸Aに対するプライマーa1には、クエンチャーa7を標識したオリゴヌクレオチドa3がハイブリダイズされていないことが示されている。
【0055】
次に、前記反応後の標的核酸増幅液にあらかじめ定められた波長域の光を照射し、照射により蛍光物質から発せられた蛍光から増幅した標的核酸を検出し、前記蛍光の色から標的核酸を識別する検出・識別工程23である。
【0056】
まず、目視で識別できるように、照射光の波長域が300〜800nmの中から任意に選択した波長の光を照射する。図6において照射機器15から波長を設定して照射光は発せられる。
【0057】
次に、標的核酸からプライマーの伸長により増幅した産物である2本鎖DNAが生成されており、前記蛍光標識プライマーにより伸長した2本鎖DNAはクエンチャー標識オリゴヌクレオチドとハイブリダイズしないので、照射により、あらかじめ標的核酸の種類ごとに定めた蛍光色を発光する。このため、前記蛍光色を検出することにより標的核酸を識別できる。
【0058】
図6において、目視すると、クエンチャー標識オリゴヌクレオチドとハイブリダイズしなかったプライマーに標識された蛍光物質a5が発光し、その蛍光色から増幅した標的核酸を識別することができる。
【0059】
一方、存在しなかった標的核酸に対応した蛍光標識プライマーはクエンチャー標識オリゴヌクレオチドとハイブリダイズする。これにより、照射時にあらかじめ標的核酸の種類ごとに定めた蛍光色が検出されない。これによって、増幅しようとした標的核酸が存在しないことを確認することができる。
【0060】
このとき、目視で確認できる蛍光色が混色の場合には、カチオン性ポリマーを添加することによって、混色を構成している複数の蛍光物質の中で一部の意図した蛍光物質からの蛍光色を消光させることができる。カチオン性ポリマーとしては、ポリエチレンイミン、ポリアリルアミン、ポリビニルアミンなどがある。
【0061】
例えば、蛍光色が黄色の場合には、黄色単色の場合と、緑色と赤色との混色である場合があるので、このときはカチオン性ポリマーであるポリエチレンイミンを添加させることによって、混色の場合には緑色を退色させて赤色のみに変えることができる。
【0062】
これによって、蛍光色が黄色の場合に、単色の黄色を呈する標的核酸の増幅か、混色であっても緑色を呈する標的核酸と、赤色を呈する標的核酸との同時増幅かを検出し識別することができる。
【0063】
以下、実施例で本願発明を詳細に説明するが、本願発明はこれらの実施例によって制限されるものではない。
【実施例1】
【0064】
プログラムコントロールシステムPC−818A(株式会社アステック社製)を用いて、RT−マルチプレックスPCR法により、胃腸炎関連で人に感染する下痢症ウイルスであるノロウイルス遺伝子グループI、ノロウイルス遺伝子グループII、サポウイルス及びアストロウイルスの遺伝子を標的核酸として増幅させ検出する。
【0065】
標的核酸の種類ごとに、蛍光物質を標識させたプライマー及び標的核酸を増幅させるプライマー、並びに、前記蛍光標識プライマーと相補配列を有し、蛍光標識プライマーの蛍光色を消光させるクエンチャーを標識したオリゴヌクレオチドを準備する。
【0066】
その蛍光標識プライマーにおいて、標的核酸を目視で識別するために、ノロウイルス遺伝子グループIの蛍光色を緑色、ノロウイルス遺伝子グループIIの蛍光色を赤色、サポウイルスの蛍光色を黄色、アストロウイルスの蛍光色を青色の蛍光物質を、それぞれのプライマー配列の5’末端に標識した。
【0067】
前記蛍光物質を標識したプライマーと相補配列を有するオリゴヌクレオチドの配列の3’末端に消光物質であるクエンチャーを標識した。各蛍光物質に対するクエンチャーとしては、ノロウイルス遺伝子グループIの蛍光物質Alexa Fluor 488に対して消光物質BHQ-1を、ノロウイルス遺伝子グループIIの蛍光物質Alexa Fluor 594に対しては消光物質BHQ-2を、サポウイルスの蛍光物質Alexa Fluor 532に対しては消光物質BHQ-1を、アストロウイルスの蛍光物質Alexa Fluor 350に対しては消光物質BHQ-0を組み合わせた。
【0068】
上流側及び下流側プライマー、及び前記蛍光標識プライマーと相補配列を有するクエンチャー標識オリゴヌクレオチドの塩基配列を以下に示す。
【0069】
ノロウイルス遺伝子グループIの遺伝子増幅に対して使用するプライマーは、文献Kojima S,Kageyama T,Fukushi S,Hoshino FB,Shinohara M,Uchida K,Natori K,Takeda N,and Katayama K:Genogroup-specific PCR primers for detection of Norwalk-like viruses.Journal of Virological Methods 100,107-114,2002.に記載されているプライマーであるG1SKF及びG1SKRを使用した。蛍光標識プライマーと相補配列を有するクエンチャー標識オリゴヌクレオチドはG1SKF_Rを使用した。
G1SKF;5’CTGCCCGAATTYGTAAATGA 3’ 5’Alexa Fluor488標識(緑) 配列番号1
G1SKR;5’CCAACCCARCCATTRTACA 3’ 配列番号2
G1SKF_R;5’TCATTTACRAATTCGGGCAG 3’ 3’BHQ-1標識 配列番号3
【0070】
前記プライマー及びオリゴヌクレオチドの記載例を説明すると、「G1SKF ; 5’CTGCCCGAATTYGTAAATGA 3’ 5’ Alexa Fluor 488標識 (緑)」の「G1SKF」はプライマー名を示し、「5’ Alexa Fluor 488標識 (緑)」は、塩基配列の5’末端に緑色の蛍光色を発光するAlexa Fluor 488を標識することを示している。また、「G1SKF_R;5’ TCATTTACRAATTCGGGCAG 3’ 3’BHQ-1標識」の「G1SKF_R」はオリゴヌクレオチド名を示し、「3’BHQ−1標識」は3’末端に標識した消光物質を示している。
【0071】
ノロウイルス遺伝子グループIIの遺伝子増幅に対して使用するプライマーも、ノロウイルス遺伝子グループIの遺伝子増幅に使用するプライマーが記載されている文献と同じJournal of Virological Methods 100,107-114,2002.に記載されているプライマーである G2SKF及びG2SKRを使用した。蛍光標識プライマーと相補配列を有するクエンチャー標識オリゴヌクレオチドはG2SKF_Rを使用した。
G2SKF;5’CNTGGGAGGGCGATCGCAA 3’ 5’Alexa Fluor594標識(赤) 配列番号4
G2SKR;5’CCRCCNGCATRHCCRTTRTACAT 3’ 配列番号5
G2SKF_R;5’TTGCGATCGCCCTCCCANG 3’ 3’BHQ-2標識 配列番号6
【0072】
サポウイルスの遺伝子増幅に対して使用するプライマーは、文献Okada M,Shinozaki K,Ogawa T,and Kaiho I:Molecular epidemiology and phylogenetic Analysis of Sapporo-like viruses.Archives of Virology 147,1445-1451,2002.に記載されているプライマーであるSV-F21及びSV-R2を使用した。蛍光標識プライマーと相補配列を有するクエンチャー標識オリゴヌクレオチドはSV-F21_Rを使用した。
SV-F21:5’ANTAGTGTTTGARATGGAGGG 3’ 5’Alexa Fluor532標識(黄) 配列番号7
SV-R2;5’GWGGGRTCAACMCCWGGTGG 3’ 配列番号8
SV-F21_R;5’CCCTCCATYTCAAACACTANT 3’ 3’BHQ-1標識 配列番号9
【0073】
アストロウイルスの遺伝子増幅に対して使用するプライマーは、文献Sakon N,Yamazaki K,Utagawa E, Okuno Y,and Oishi I:Genomic characterization of human astrovirus type 6 Katano virus and the establishment of a rapid and effective reverse transcription-polymerase chain reaction to detect all serotypes of human astrovirus.Journal of Medical Virology 61,125-131,2000.に記載されているプライマーであるAC1’及びAC230を使用した。蛍光標識プライマーと相補配列を有するクエンチャー標識オリゴヌクレオチドはAC1’_Rを使用した。
AC1’;5’ATGGCTAGCAAGTCTGACAAG 3’ 5’Alexa Fluor350標識(青) 配列番号10
AC230;5’GGTTTTGGTCCTGTGACACC 3’ 配列番号11
AC1’_R;5’CTTGTCAGACTTGCTAGCCAT 3’ 3’BHQ-0標識 配列番号12
【0074】
水(H2O)で糞便10%乳剤を作製し、前記糞便10%乳剤よりQIAamp Viral RNA Mini Kit(キアゲン社製)を用いてRNAを抽出した。
【0075】
PCR法によって標的核酸を増幅させるために、抽出したRNAを鋳型に逆転写反応を行ってcDNA(Complementary DNA)を生成した。
【0076】
逆転写反応においては、逆転写反応試薬であるPrimeScript RT reagent Kit(タカラバイオ社製)に前記抽出RNAを用いて、以下の表1に示す組成反応液で行った。
【0077】
【表1】

【0078】
逆転写反応手順は、表1に示す反応液を、30℃で10分間保持し、その後42℃で60分間保持し、99℃で5分間保持し、その後冷却して4℃に保持した。
【0079】
次に、生成されたcDNAから標的核酸の増幅は、マルチプレックスPCR試薬であるMultiplex PCR Assay Kit(タカラバイオ社製)を用いて、以下の表2に示す組成反応液(全量50μl)でPCR反応を行った。
【0080】
【表2】

【0081】
マルチプレックスPCR反応は、表2に示す反応液を、94℃で60秒間の熱変性を行った後、次いで、94℃で30秒間の熱変性工程、57℃で90秒間のアニーリング工程、72℃で90秒間の伸長工程を40サイクル繰り返し、その後72℃で10分間保持し、標的核酸を増幅させた標的核酸増幅液を生成した。
【0082】
次に、標的核酸増幅液に、表3に示すクエンチャー標識オリゴヌクレオチドを添加し、増幅反応に使用されなかった蛍光標識プライマーとハイブリダイズさせた。
【0083】
【表3】

【0084】
次に、ハイブリダイズさせた液にトランスイルミネータ(VILBER LOURMAT社製)を用いて波長312nmの光を照射し、蛍光色を目視で確認した。増幅した標的核酸が1種類の場合には、例えばノロウイルス遺伝子グループIの遺伝子が増幅していた場合は緑色の蛍光色となり、ノロウイルス遺伝子グループIIの遺伝子が増幅していた場合は赤色の蛍光色となり、サポウイルスの遺伝子が増幅していた場合は黄色の蛍光色となり、アストロウイルスの遺伝子が増幅していた場合は青色の蛍光色となる。これらの蛍光色が目視で判別できるので簡易に増幅した標的核酸を識別することができる。
【0085】
ここで、目視で確認した蛍光色が1種類の標的核酸が増幅したときと同じ蛍光色であっても各標的核酸別の単色でなく複数の標的核酸による混色の場合があるので、その場合には一部の意図した標的核酸に対応した蛍光物質からの蛍光色を消光させることにより、蛍光色が変わるので複数の標的核酸が増幅したことを確認でき、一方蛍光色が変わらなかった場合は混色ではなく単色の1種類の標的核酸が増幅したことが確認できる。
【0086】
例えば、緑色と赤色の混色は黄色であるので、蛍光色が黄色を示した場合には、カチオン性ポリマーである1%ポリエチレンイミンを1μl添加して緑色が消光して赤色に変わるかを確認する。蛍光色が黄色のままの場合にはサポウイルスの遺伝子が増幅したことがわかり、蛍光色が赤色に変わった場合には、ノロウイルス遺伝子グループIの遺伝子及びノロウイルス遺伝子グループIIの遺伝子が増幅したことがわかる。
【実施例2】
【0087】
RT−LAMP法を使用して、ノロウイルス遺伝子グループIの遺伝子及びノロウイルス遺伝子グループIIの遺伝子を標的核酸として増幅させ検出する。
【0088】
RT−LAMP法に使用するプライマー及び増幅方法は、文献Fukuda S,Takao S,Kuwayama M,Shimazu Y,and Miyazaki K:Rapid detection of norovirus from fecal specimens by real-time reverse transcription-loop-mediated isothermal amplification assay. Journal of Clinical Microbiology 44,1376-1381,2006. 及び文献Fukuda S,Sasaki Y,Kuwayama M,and Miyazaki K:Simultaneous detection and genogroup-screening test for norovirus genogroups I and II from fecal specimens in single tube by reverse transcription-loop-mediated isothermal amplification assay. Microbiology and Immunology 51,547-550,2007.に記載されているプライマーを使用し、記載されている増幅方法で実施した。
【0089】
標的核酸の種類ごとに、蛍光物質を標識させないで標的核酸を増幅させるプライマー及び蛍光物質を標識させて標的核酸を検出・識別させるプライマー、及び、前記蛍光標識プライマーと相補配列を有し、蛍光標識プライマーの蛍光色を消光させるクエンチャーを標識したオリゴヌクレオチドを準備する。
【0090】
その蛍光標識プライマーにおいて、標的核酸を目視で識別するために、ノロウイルス遺伝子グループIは緑色を発光し、ノロウイルス遺伝子グループIIは赤色を発光する蛍光物質を、それぞれのプライマー配列の5’末端に標識した。
【0091】
前記蛍光物質を標識したプライマーと相補配列を有するオリゴヌクレオチドの配列の3’末端に消光物質であるクエンチャーを標識した。各蛍光物質に対するクエンチャーとしては、ノロウイルス遺伝子グループIの蛍光物質Alexa Fluor 488に対して消光物質BHQ-1を、ノロウイルス遺伝子グループIIの蛍光物質Alexa Fluor 594に対しては消光物質BHQ-2を組み合わせた。
【0092】
前記プライマー、及び前記蛍光標識プライマーと相補配列を有するオリゴヌクレオチドの塩基配列を以下に示す。
【0093】
ノロウイルス遺伝子グループIの遺伝子増幅用及び検出・識別用に使用したプライマーと、前記蛍光標識プライマーと相補配列を有するクエンチャー標識オリゴヌクレオチドを示す。
G1F3;5’CCRGGNTGGCARGCNATGTT 3’ 配列番号13
G1B3(GISKR);5’CCAACCCARCCATTRTACA 3’ 配列番号14
G1FIP1;5’CATTTACGAATTCGGGCAGGTTTTCGCTGGATGCGNTTCCATGA 3’ 配列番号15
G1FIP2;5’CATTTACAAAATTCGGGCAGGTTTTCGCTGGATGCGNTTCCATGA 3’ 配列番号16
G1BIP1;5’GATGGCGTCTAAGGACGCTTTTAGCTGTRTTTGCCTCTGGWAC 3’ 配列番号17
G1BIP2;5’GATGGCGTCTAAGGACGCTTTTAGCWGTATTAACCTCCGGYAC 3’ 配列番号18
G1BIP3;5’GATGGCGTCTAAGGACGCTTTTAGCTGYAYTAACCTCTGGAAC 3’ 配列番号19
G1LF1;5’AGATYGCGATCYCCTGTCCA 3’ 5’Alexa Fluor 488標識(緑) 配列番号20
G1LF2;5’AGATTGCGATCTCCTGCCCA 3’ 5’ Alexa Fluor 488標識(緑) 配列番号21
G1LF3;5’AGCTCGCGGTCTCCTGTCCA 3’ 5’ Alexa Fluor 488標識(緑) 配列番号22
G1LF_R;5’TGGRCAGGRGAYCGCRAKCT 3’ 3’BHQ-1標識 配列番号23
【0094】
ノロウイルス遺伝子グループIIの遺伝子増幅用及び検出・識別用に使用したプライマーと、前記蛍光標識プライマーと相補配列を有するクエンチャー標識オリゴヌクレオチドを示す。
G2F3;5’GGNMTGGANTTTTAYGTGCCMAG 3’ 配列番号24
G2B3(G2SKR);5’CCRCCNGCATRHCCRTTRTACAT 3’ 配列番号25
G2FIP1;5’GGGAGCMAGATTGCGATCGCTTTTGAGBCNATGTTYAGRTGGAT 3’ 配列番号26
G2FIP2;5’GGGAGCMAGATTGCGATCGCTTTTGAGCCCATGTTCAGRTGGAT 3’ 配列番号27
G2FIP3;5’GGGAGCGAGATTGCGATCGCTTTTGAGTCAATGTTYAGGTGGAT 3’ 配列番号28
G2FIP4;5’GGGAGCGAGATTGCGATCGCTTTTGAGCCYATGTTYAGGTGGAT 3’ 配列番号29
G2FIP5;5’GGGAGCMAGATTGCGATCGCTTTTGAACCWATGTTYAGGTGGAT 3’ 配列番号30
G2BIP1;5’TGTGAATGAAGATGGCGTCGTTTTCTCATTRTTRVTCTCTGGBACGAG 3’配列番号31
G2BIP2;5’TGTGAATGAAGATGGCGTCGTTTTCTCATTRTTGCYCTCTGGYACGAG 3’配列番号32
G2BIP3;5’TGTGAATGAAGATGGCGTCGTTTTCTCATTGTTGAYCTCTGGKACGAG 3’配列番号33
G2BIP4;5’TGTGAATGAAGATGGCGTCGTTTTCTCATTRTTACTTTCTGGCACGAG 3’配列番号34
G2LF1;5’GTGCTCARATCWGARAACCTC 3’ 5’Alexa Fluor 594標識(赤) 配列番号35
G2LF2;5’GTGCTGAGGTCWGARAATCTC 3’ 5’Alexa Fluor 594標識(赤) 配列番号36
G2LF3;5’GTGCTCAAATCTGAGAATCTC 3’ 5’Alexa Fluor 594標識(赤) 配列番号37
G2LF4;5’GTGCTCAAGTCTGAGAAYCTC 3’ 5’Alexa Fluor 594標識(赤) 配列番号38
G2LF_R;5’GAGRTTYTCWGAYYTSAGCAC 3’ 3’BHQ-2標識 配列番号39
【0095】
水(H2O)で糞便10%乳剤を作製し、前記糞便10%乳剤よりQIAamp Viral RNA Mini Kit(キアゲン社製)を用いてRNAを抽出した。
【0096】
次に、抽出されたRNAの増幅をRT−LAMP法によりリアルタイム濁度測定装置(テラメックス株式会社製)を用いて行った。RT−LAMP増幅試薬キット(栄研化学社製)を用いて、以下の表4に示す組成反応液に表5に示すプライマーを添加してRT−LAMP反応を行った(全量25μl)。試薬及び標的核酸を表4に、プライマーの添加量を表5に記す。
【0097】
【表4】

【0098】
【表5】

【0099】
RT−LAMP手順は、62℃で90分間保持して、標的核酸を増幅させた標的核酸増幅液を生成した。
【0100】
次に、標的核酸増幅液に、表6に示すクエンチャー標識オリゴヌクレオチドを添加し、増幅反応に使用されなかった蛍光標識プライマーとハイブリダイズさせた。
【0101】
【表6】

【0102】
次に、ハイブリダイズさせた液にトランスイルミネータ(VILBER LOURMAT社製)を用いて波長312nmの光を照射し、蛍光色を目視で確認した。蛍光色が緑色の場合は増幅した標的核酸はノロウイルス遺伝子グループIの遺伝子であり、蛍光色が赤色の場合は増幅した標的核酸はノロウイルス遺伝子グループIIの遺伝子であり、蛍光色が黄色の場合は増幅した標的核酸はノロウイルス遺伝子グループIの遺伝子及びノロウイルス遺伝子グループIIの遺伝子である。
【符号の説明】
【0103】
1 (標的核酸Aに対する)プライマーa
2 (標的核酸Bに対する)プライマーb
3 オリゴヌクレオチドa
4 オリゴヌクレオチドb
5 蛍光物質a
6 蛍光物質b
7 クエンチャーa
8 クエンチャーb
9 DNA又はRNAから逆転写反応により生成したcDNA(標的核酸A又はB)
10 1本鎖化したDNA、又は逆転写反応により生成した1本鎖のcDNA
11 増幅した2本鎖DNA
15 照射機器
20 蛍光物質標識工程
21 増幅工程
22 反応工程
23 検出・識別工程
31 (標的核酸Aに対する)プライマーa
32 (標的核酸Bに対する)プライマーb
【特許請求の範囲】
【請求項1】
検出・識別しようする少なくとも1種類の標的核酸の種類ごとに添加する標的核酸増幅用及び/又は検出・識別用の上流側及び/又は下流側プライマーに対して検出用の異なる蛍光物質を標識する工程と、標的核酸の種類ごとに、標的核酸を増幅させる方法に応じた前記標的核酸増幅用の、少なくとも一対の前記蛍光標識された上流側及び下流側プライマー、少なくとも一対の前記蛍光標識された上流側プライマー及び蛍光標識されていない下流側プライマー、少なくとも一対の蛍光標識されていない上流側プライマー及び前記蛍光標識された下流側プライマー、少なくとも1本の前記蛍光標識された上流側又は下流側プライマー、又は、標的核酸を増幅させる蛍光標識されていないプライマー並びに標的核酸を検出・識別しようとする少なくとも1本の前記蛍光標識された上流側及び/又は下流側プライマーを添加して、少なくとも1種類の標的核酸を同時に増幅させる工程と、前記増幅させた標的核酸増幅液に、前記蛍光物質を標識したプライマーと相補配列を有するクエンチャーを標識したオリゴヌクレオチドを添加させて反応させる工程と、前記反応後の標的核酸増幅液にあらかじめ定められた波長域の光を照射し、前記照射により蛍光物質から発せられた蛍光から増幅した標的核酸を検出し、前記蛍光の色から標的核酸を識別する工程と、を含む工程からなることを特徴とする標的核酸の検出・識別方法。
【請求項2】
前記プライマーに標識する蛍光物質が、前記プライマー配列の5’末端又は鎖内に標識されることを特徴とする請求項1に記載の標的核酸の検出・識別方法。
【請求項3】
前記オリゴヌクレオチドに標識されたクエンチャーが、前記オリゴヌクレオチドの配列の5’末端、3’末端又は鎖内に標識された、前記蛍光物質から発せられる蛍光を消光する消光物質であることを特徴とする請求項1又は2に記載の標的核酸の検出・識別方法。
【請求項4】
前記照射光の波長域が300〜800nmであることを特徴とする請求項1乃至3のいずれかに記載の標的核酸の検出・識別方法。
【請求項5】
少なくとも1種類の標的核酸を同時に増幅させる工程が、プライマーを用いて標的核酸を増幅させる方法であればいずれの増幅方法でもよいことを特徴とする請求項1乃至4のいずれかに記載の標的核酸の検出・識別方法。
【請求項6】
標的核酸の種類ごとに対応させる上流側及び/又は下流側プライマーそれぞれの5’末端に、標的核酸の種類ごとに異なる蛍光物質を標識させた、同じ配列からなるオリゴヌクレオチドを連結させることを特徴とする請求項1乃至5のいずれかに記載の標的核酸の検出・識別方法。
【請求項7】
複数の蛍光物質から発せられた蛍光によって目視で確認できる色が混色となっている場合に、カチオン性ポリマーを添加することによって、混色を構成している複数の蛍光物質の中で一部の意図した蛍光物質からの蛍光色を消光させることを特徴とする請求項1乃至6のいずれかに記載の標的核酸の検出・識別方法。
【請求項1】
検出・識別しようする少なくとも1種類の標的核酸の種類ごとに添加する標的核酸増幅用及び/又は検出・識別用の上流側及び/又は下流側プライマーに対して検出用の異なる蛍光物質を標識する工程と、標的核酸の種類ごとに、標的核酸を増幅させる方法に応じた前記標的核酸増幅用の、少なくとも一対の前記蛍光標識された上流側及び下流側プライマー、少なくとも一対の前記蛍光標識された上流側プライマー及び蛍光標識されていない下流側プライマー、少なくとも一対の蛍光標識されていない上流側プライマー及び前記蛍光標識された下流側プライマー、少なくとも1本の前記蛍光標識された上流側又は下流側プライマー、又は、標的核酸を増幅させる蛍光標識されていないプライマー並びに標的核酸を検出・識別しようとする少なくとも1本の前記蛍光標識された上流側及び/又は下流側プライマーを添加して、少なくとも1種類の標的核酸を同時に増幅させる工程と、前記増幅させた標的核酸増幅液に、前記蛍光物質を標識したプライマーと相補配列を有するクエンチャーを標識したオリゴヌクレオチドを添加させて反応させる工程と、前記反応後の標的核酸増幅液にあらかじめ定められた波長域の光を照射し、前記照射により蛍光物質から発せられた蛍光から増幅した標的核酸を検出し、前記蛍光の色から標的核酸を識別する工程と、を含む工程からなることを特徴とする標的核酸の検出・識別方法。
【請求項2】
前記プライマーに標識する蛍光物質が、前記プライマー配列の5’末端又は鎖内に標識されることを特徴とする請求項1に記載の標的核酸の検出・識別方法。
【請求項3】
前記オリゴヌクレオチドに標識されたクエンチャーが、前記オリゴヌクレオチドの配列の5’末端、3’末端又は鎖内に標識された、前記蛍光物質から発せられる蛍光を消光する消光物質であることを特徴とする請求項1又は2に記載の標的核酸の検出・識別方法。
【請求項4】
前記照射光の波長域が300〜800nmであることを特徴とする請求項1乃至3のいずれかに記載の標的核酸の検出・識別方法。
【請求項5】
少なくとも1種類の標的核酸を同時に増幅させる工程が、プライマーを用いて標的核酸を増幅させる方法であればいずれの増幅方法でもよいことを特徴とする請求項1乃至4のいずれかに記載の標的核酸の検出・識別方法。
【請求項6】
標的核酸の種類ごとに対応させる上流側及び/又は下流側プライマーそれぞれの5’末端に、標的核酸の種類ごとに異なる蛍光物質を標識させた、同じ配列からなるオリゴヌクレオチドを連結させることを特徴とする請求項1乃至5のいずれかに記載の標的核酸の検出・識別方法。
【請求項7】
複数の蛍光物質から発せられた蛍光によって目視で確認できる色が混色となっている場合に、カチオン性ポリマーを添加することによって、混色を構成している複数の蛍光物質の中で一部の意図した蛍光物質からの蛍光色を消光させることを特徴とする請求項1乃至6のいずれかに記載の標的核酸の検出・識別方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】




【図2】


【図3】


【図4】


【図5】


【図6】


【公開番号】特開2013−60(P2013−60A)
【公開日】平成25年1月7日(2013.1.7)
【国際特許分類】
【出願番号】特願2011−134800(P2011−134800)
【出願日】平成23年6月17日(2011.6.17)
【出願人】(591079487)広島県 (101)
【Fターム(参考)】
【公開日】平成25年1月7日(2013.1.7)
【国際特許分類】
【出願日】平成23年6月17日(2011.6.17)
【出願人】(591079487)広島県 (101)
【Fターム(参考)】
[ Back to top ]

