標的特異的非抗体タンパク質及びこの製造方法
本発明は、標的特異的非抗体タンパク質の製造方法に関し、より具体的には、非抗体タンパク質のライブラリーから標的タンパク質の標的部位と構造的相補性を有する非抗体タンパク質を選別し、選別された非抗体タンパク質と標的タンパク質との結合エネルギーを計算して、選別された非抗体タンパク質の中から安定した結合エネルギーを有する非抗体タンパク質を選別し、選定された非抗体タンパク質と標的タンパク質とが直接接触するアミノ酸残基のうち、結合エネルギーが高いアミノ酸残基を選択し、選択されたアミノ酸残基を結合エネルギーが低いアミノ酸残基に置換する段階を含む標的特異的非抗体タンパク質の製造方法に関する。さらに、本発明は、前記方法によって製造されたEGFR(Epidermal Growth Factor Receptor)ドメイン2に特異的に結合する標的特異的非抗体及びこれを含む癌治療用組成物に関する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、標的特異的非抗体タンパク質の製造方法に関し、より具体的には、非抗体タンパク質のライブラリーで標的タンパク質の標的部位と構造的な相補性を有する非抗体タンパク質を選別し、選別された非抗体タンパク質と標的タンパク質との結合エネルギーを計算して、選別された非抗体タンパク質の中から安定した結合エネルギーを有する非抗体タンパク質を選別し、選定された非抗体タンパク質と標的タンパク質とが直接接触するアミノ酸残基のうち、結合エネルギーが高いアミノ酸残基を選択し、選択されたアミノ酸残基を結合エネルギーが低いアミノ酸残基に置換する段階を含む標的特異的非抗体タンパク質の製造方法に関する。さらに、本発明は、前記方法によって製造されたEGFR(Epidermal Growth Factor Receptor)ドメイン2に特異的に結合する標的特異的非抗体及びこれを含む癌治療用組成物に関する。
【背景技術】
【0002】
疾病を治療するためのタンパク質の新薬として、従来には抗体(antibody)を使用して来た。抗体は、免疫系内の白血球のB細胞から抗原の刺激によって作られるタンパク質であって、抗原に会えると、細胞にある受容体を介して抗原を認識し、受容体を介して結合する。特に、抗体は、その属性上、特定タンパク質を特異的に認識して強く結合する特徴がある。このような性質を用いて癌などの疾病を起こす原因になるタンパク質に結合して、悪意的なタンパク質相互作用を阻む目的として使用されて来た。
【0003】
しかし、治療用抗体の場合、分子のサイズが大きく、大量生産が難しく、生産工程が長くて価格が高いという問題点によって、最近には患者オーダーメード型標的治療のための代案で非抗体タンパク質(non-antibody protein scaffold)を使用しようとする研究が活発になっている。非抗体タンパク質は、患者オーダーメード型標的治療のための新薬の一部類であって、現在の新薬市場において脚光を浴びている治療用抗体(therapeutic antibody)が有する前記限界点を克服するための代案として最近新しく注目され始めた。このような非抗体タンパク質は、抗体治療剤のように特定標的分子を選択的に認識して強く結合することによって、所望の標的分子の活性を阻害して癌、自家免疫疾患のような多くの疾病を治療するとか進行を阻むという目的を有するている。
【0004】
しかし、既存の非抗体タンパク質は、既存の抗体と同様に標的分子の構造に構わずにただ一つのスキャフォールド(scaffold)に基盤して製作されている。タンパク質などは、3次元的な構造に基盤して、レゴブロックが噛み合わせるように互いに結合するようになるので、特定標的に合う特異的なオーダーメード型タンパク質スキャフォールドを使用するのが理想的である。しかし、標的と特異的に結合できる相補的な構造を有する非抗体タンパク質を見出すことができる技術がなかったため、標的特異的な非抗体タンパク質を見出し、これを疾病治療用として用いるのに困難さがあるという問題点があった。特に、タンパク質の構造と種類は非常に多様なので、数多のタンパク質の中でどんなものが特定標的とよく結合するか否かを実験を介して確認することは不可能であるという問題点があった。
【0005】
また、一つのスキャフォールドに基盤する既存の抗体と非抗体タンパク質の場合、標的分子への結合部位が偶然に決定され、この結合部位を予めデザインすることができない。また、既存の非抗体タンパク質及び抗体が結合できる標的タンパク質の部位は、構造的に非常に制限されており、特に、標的部位が凹面(concave)の場合には、接近が基本的に不可能であった。従って、標的分子に結合するタンパク質などのうち、所望の部位に結合するタンパク質を見出すために、標的結合部位確認実験(epitope mapping)など、以後長い間の複雑な候補選択過程を経るという問題点があった。
【0006】
従って、前記のような既存の抗体や非抗体タンパク質の限界点を克服する標的に最適化されたスキャフォールドを選定して、標的分子の所望の標的部位に結合する非抗体タンパク質を論理的にデザインすることができる技術の開発が切実に要求されている。所望の標的タンパク質の所望の部位に強い結合力と特異性とを有して付く非抗体タンパク質をデザイン及び製造できる技術は、多様な標的タンパク質に幅広く適用可能な基盤技術(platform technology)であり、これは、抗体新薬やアプタマーなどにおいても未だに具現できなかった技術である。これにより、革新的な患者オーダーメード型標的治療剤開発のためにも切実に要求される技術である。
【発明の概要】
【発明が解決しようとする課題】
【0007】
本発明者らは、標的特異的非抗体タンパク質を製造する方法を見出すために、鋭意努力した結果、3次構造が決定されているタンパク質の構造ライブラリーを基盤に、与えられた標的タンパク質の所望の標的部位に対する仮想スクリーニングを介して構造相補性が最も高い最適のタンパク質スキャフォールドを選定し、標的分子との結合を妨害するアミノ酸をファージディスプレイ及びバイオパニングを用いたランダム化を行って予め決定された標的タンパク質の特定部位と最適の結合ができる標的特異的非抗体タンパク質を製造できることを確認した。ひいては、実際に坑癌標的であるEGFR(Epdermal Growth Factor Receptor)のドメイン2を標的とする非抗体タンパク質の製造及び前記標的との結合力を確認して本発明を完成した。
【課題を解決するための手段】
【0008】
本発明の一つの目的は、(a)非抗体タンパク質のライブラリーから標的タンパク質の標的部位と構造的相補性を有する非抗体タンパク質を選別する段階;(b)前記選別された非抗体タンパク質と標的タンパク質との結合エネルギーを計算する段階;(c)前記選別された非抗体タンパク質の中から安定した結合エネルギーを有する非抗体タンパク質を選別する段階;(d)選定された非抗体タンパク質と標的タンパク質とが直接接触するアミノ酸残基の中から結合エネルギーが高いアミノ酸残基を選択する段階;及び(e)前記(d)段階で選択されたアミノ酸残基を結合エネルギーが低いアミノ酸残基に置換する段階を含む、標的特異的非抗体タンパク質の製造方法を提供することである。
【0009】
本発明の他の目的は、EGFRドメイン2に特異的に結合する標的特異的非抗体タンパク質を提供することである。
【0010】
本発明のまた他の目的は、前記EGFRドメイン2に特異的に結合する標的特異的非抗体タンパク質をコードする核酸、前記核酸を含むベクター、または前記ベクターに形質転換された形質転換体を提供することである。
【0011】
本発明のまた他の目的は、EGFRドメイン2に特異的に結合する標的特異的非抗体タンパク質を含む癌治療用組成物を提供することである。
【発明の効果】
【0012】
本発明の標的特異的非抗体タンパク質の製造方法を用いる場合、既存の抗体新薬やタンパク質新薬、アプタマーなどの既存の物質へ接近が不可能であった多様な標的に適用可能なバイオ新薬の開発ができる基盤技術(platform technology)を提供することができる。従って、本発明の方法は、革新的な患者オーダーメード型標的治療剤の開発を可能にして、社会的、経済的波及効果が非常に大きいと予想される。また、本発明のEGFRドメイン2を阻害する標的特異的タンパク質は、癌治療の標的であるEGFRを新しい概念でEGFRの活性を特異的に阻害して正常細胞ではない癌細胞のみを選択的に攻撃して効率的な癌治療効果を提供することができるだろう。
【図面の簡単な説明】
【0013】
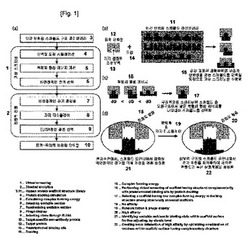
【図1】図1は、結合部位に特異的なスキャフォールドをデザインするための本発明の方法であるPELEX(Protein Engineering with Laboratory Evolution & Extensive Computaion)の概略的な方法を図示化したものである。(a)は、PELEXを2段階で示したフローチャートである。ヒトタンパク質スキャフォールド構造ライブラリーを基にして、ドッキングシミュレーションと複合体形成エネルギー計算を含む仮想スクリーニングを行う仮想スクリーニング段階と、スクリーニングされたスキャフォールドを予め決定された結合部位と結合親和力を最適化されるように方向的進化する段階から構成される。(b)は、標的タンパク質の予め決定された結合部位と相補的な様子を有するタンパク質スキャフォールドをヒトタンパク質スキャフォールド構造ライブラリーとドッキングシミュレーションを基に選別することを示した図である。大規模のタンパク質スキャフォールドライブラリーは、知られているすべてのヒトタンパク質構造を含む。(c)は、スクリーニングされたドッキング構造を使用した複合体形成エネルギー計算によって方向的進化を介した追加的な最適化のための安定した結合エネルギーを表するスキャフォールドを選択することを示した図である。(d)は、結合部位に特異的なスキャフォールドの微細調整のために、配列ランダム化とファージディスプレイを用いた方向的進化を行うことを示した図である。このような過程において、結合に非安定的な残基を標的とスキャフォールドとの間の親和度を最適化するためにランダム化した。
【図2】図2は、EGFRのアミノ酸配列を示した図である。下線で表示したアミノ酸がEGFRドメイン2部位のアミノ酸であって、166番目から309番目のアミノ酸部分である。ボックス内に表示した28個のアミノ酸残基を表面残基で結合に参与するアミノ酸の候補として選定した。
【図3】図3は、EGFRの活性メカニズムとEGFRの活性を抑制するためにデザインされたスキャフォールドの活性機転を示した図である。(a)は、自動抑制状態において、EGFRはドメイン2とドメイン4との間の分子内の相互作用によって非活性化されることを示す。この状態でドメイン2の“二量体化アーム(dimerization arm)”が遮断されている。(b)は、EGFが結合すると、ドメイン2とドメイン4との間の分子内の相互作用を除去し、領域再配置を促進して、ドメイン2を露出させてEGFRを活性化させることを示したものである。最後に、ドメイン2の“二量体化アーム”媒介の相互作用を介して同種二量体(homodimer)を形成する。(c)は、デザインされたスキャフォールドがEGFRドメイン2に結合して同種二量体になることを阻んでEGFRの活性を抑制する機作を図示化したものである。このような結合タンパク質は、活性化されたEGFRのみ認識し、自動抑制されたEGFRは認識しない。
【図4】図4は、1OZJの構造及びエネルギーを図式化したものである。(a)は、1OZJ(鎖B)の構造を図式化したものである。(b)は、1OZJ−EGFRのドッキング構造を図式化したものである。濃い色の鎖は、スキャフォールドを示したものである。曇った色の鎖は、それぞれEGFRのドメイン1、2、3、及び4を示したものである。円内の残基は、EGFRとスキャフォールドとの接触残基を示したものである。(a)のスキャフォールドの構造は、(b)でのスキャフォールド構造の同じ方向から表示した。(c)は、 EGFRとの複合体を形成するための1OZJの表面残基のエネルギー寄与を示したものである。方向的進化を介した追加的な改善のために選択された不安定な結合エネルギーを表する残基は斜線でバーを表示した。これは、追ってランダム化を介して突然変異させるアミノ酸残基を示したものである。
【図5】図5は、1OZJの非安定的な結合エネルギーを有する残基を突然変異させた時の結合親和度を表したELISA結果を示したものである。横軸は、クローン番号を示す。縦軸は、ELISA分析で得た光学密度を示す。1OZJクローンの配列ランダム化結果は表2に示した。
【図6】図6は、1OZJスキャフォールドのランダム化を介した突然変異以前の野生型スキャフォールドのアミノ酸配列(左側部分)及びDNA配列(右側部分)を示した図である。下線で表示した配列が非安定的な結合エネルギーを表する残基に突然変異させる配列である。
【図7】図7は、1OZJスキャフォールドの6番クローンのアミノ酸配列(左側部分)及びDNA配列(右側部分)を示した図である。下線で表示した配列が非安定的な結合エネルギーを表する残基に突然変異された配列である。
【図8】図8は、1OZJスキャフォールドの7番クローンのアミノ酸配列(左側部分)及びDNA配列(右側部分)を示した図である。下線で表示した配列が非安定的な結合エネルギーを表する残基に突然変異された配列である。
【図9】図9は、1OZJスキャフォールドの9番クローンのアミノ酸配列(左側部分)及びDNA配列(右側部分)を示した図である。下線で表示した配列が非安定的な結合エネルギーを表する残基に突然変異された配列である。
【発明を実施するための形態】
【0014】
前記の目的を達成するための一つの態様として、本発明は、(a)非抗体タンパク質のライブラリーから標的タンパク質の標的部位と構造的相補性を有する非抗体タンパク質を選別する段階;(b)前記選別された非抗体タンパク質と標的タンパク質との結合エネルギーを計算する段階;(c)前記選別された非抗体タンパク質の中から安定した結合エネルギーを有する非抗体タンパク質を選別する段階;(d)選定された非抗体タンパク質と標的タンパク質とが直接接触するアミノ酸残基の中から結合エネルギーが高いアミノ酸残基を選択する段階;及び(e)前記(d)段階で選択されたアミノ酸残基を結合エネルギーが低いアミノ酸残基に置換する段階を含む、標的特異的非抗体タンパク質の製造方法に関するものである。
【0015】
本発明の標的特異的非抗体タンパク質の製造方法の全体的な模式図は、図1(a)に示した通りである。本発明者らは、本発明者が開発したドッキングシミュレーション及び結合エネルギー計算による仮想スクリーニング段階、及びファージディスプレイ並びにバイオパニングを介した残基のランダム化を用いた方向的進化段階を行う本標的特異的非抗体タンパク質の製造方法をPELEX(Protein Engineering with Laboratory Evolution & Extensive Computation)と命名した。
【0016】
本発明において使用された用語“非抗体タンパク質”は、分子量10〜40kDaのサイズで既存の治療用抗体に比べて分子量が1/10以上に減ったタンパク質で目標組職への浸透が容易であり、バクテリアなどで大量生産の可能な抗体ではないタンパク質であって、分子標的治療のために使用され得る特定標的分子を選択的に認識して強く結合することによって、所望の標的分子の活性を阻害して癌、自家免疫疾患のような多くの疾病を治療するとか進行を阻むことができるタンパク質を意味する。前記“非抗体タンパク質”は、本願において、“スキャフォールド”、“スキャフォールドタンパク質”、“結合タンパク質”と混用され得る。
【0017】
本発明において使用された用語“非抗体タンパク質のライブラリー”は、ヒトが自然界でその3次構造が明らかになったすべてのタンパク質の構造体からなったタンパク質骨格の総集合体を意味し、このような集合体は、データベース上に存在するように製造することができる。非抗体タンパク質のライブラリーの製造は、PDB(Protein Data Bank)、SCOP(Structural Classification of Protein)のようなヒトタンパク質の3次構造をすべて含むデータベースを使用することができ、これに制限されるのではないが、公知の多様なヒトタンパク質の3次元構造が知られている多様なデータベースを介して非抗体タンパク質のライブラリーの製造のためのタンパク質を選択することができる。このようなデータベースには、ヒトタンパク質それぞれが有する3次元的構造に応じて類型別で複数のグループに分類されている。非抗体タンパク質ライブラリーの具体的な製造方法は次の通りである。まず、ヒトタンパク質のうちから組職浸透を容易にするために、分子量を限定して10〜40kDaの分子量を有するタンパク質のみを選択することができる。この時、それぞれのヒトタンパク質構造類型別グループから10〜40kDaの分子量を有する代表タンパク質を5個以下に選択してすべての類型のヒトタンパク質を含むと共に、電子ライブラリーの規模を縮小することによって検索速度を向上させ得る。以後には、ヒトのタンパク質のうち、非抗体タンパク質ではないタンパク質を除去するための段階として、膜タンパク質及び抗体タンパク質を除去する段階を含むことができる。膜タンパク質及び抗体タンパク質は、公知の機能が知られているタンパク質のデータベースを制限なしに使用することができ、その例として、PDBTM(Protein Data Bank of Transmembrane Proteins)のようなデータベースを用いてキーワード検索などを利用して行われることができる。以後、無差別的な結合を避けるために、10個以下の相互作用が知られているタンパク質のみを選択する段階を含むことができる。このような相互作用に関連する情報も公知のタンパク質−タンパク質相互作用情報を提供する多様なデータベースを使用することができるが、その例として、HPRD(Human Protein Reference Database)を用いてタンパク質の相互作用の数を計算することができる。その後、同種四量体(homotetramer)、同種六量体(homohexamer)などのように同時に多い相互作用を有するタンパク質を除外するために単量体(monomer)、同種二量体(homodimer)、及び同種三量体(homotrimer)のうち、いずれか一つ以上を形成できるタンパク質を選択する段階を含むことができ、これはタンパク質間の結合を計算することができる公知のデータベースを制限なしに用いて行うことができるが、その例として、SWISS−PROTデータベースを用いることができる。前記のような段階を全部経って製造された非抗体タンパク質ライブラリーは、1000個〜2000個の構造が知られている非抗体タンパク質が含まれ得る。本発明の一つの具現例によれば、小さい分子量を有しながらランダム結合の危険が少ない1261個の非抗体水溶性タンパク質から構成された非抗体タンパク質ライブラリーを製作し、これを基盤にしてドッキングシミュレーションなど仮想スクリーニングを行った。
【0018】
好ましくは、前記(a)非抗体タンパク質のライブラリーから標的タンパク質の標的d部位と構造的相補性を有する非抗体タンパク質を選別する段階;及び(b)前記選別された非抗体タンパク質と標的タンパク質との結合エネルギーを計算する段階は、順次にまたは同時に行われることができる。
【0019】
本発明における用語“標的タンパク質”とは、非抗体タンパク質が結合する目的タンパク質を意味するものであって、非抗体タンパク質の結合を介して目的しようとする用途に応じて多様に選択されることができ、癌誘発タンパク質、免疫疾患誘発タンパク質、外来感染タンパク質などが制限なしに選択されることができるが、その例として、EGFR(Epidermal Growth Factor Receptor)であり得る。
【0020】
本発明における用語“標的部位”とは、標的タンパク質の3次構造で病理的なタンパク質相互作用及び結合に直間接的に参与する部位であって、該当部位に非抗体タンパク質が強く結合して悪意的なタンパク質相互作用を阻むことができ、その例として、EGFRのドメイン2であり得る。また、本発明の非抗体タンパク質が結合できる標的タンパク質の結合面は、凹面(concave)など多様な表面に結合できるので、本発明の非抗体タンパク質の製造は、その結合する標的タンパク質の3次構造に制限がない。
【0021】
本発明における用語“EGFR(Epidermal Growth Factor Receptor)”とは、代表的な成長因子受容体であって、乳房癌、肺癌、大膓癌、腎癌、胆嚢癌、頭頸部癌、卵巣癌、前立腺癌、子宮頸部癌及び胃癌など多くの多様な癌細胞の表面に過発現されており、成長因子EGFの結合により活性化されて癌細胞の増殖、浸潤、血管生成や転移に中心的な役目を果たすEGFの受容体を意味する。現在まで多様にEGFRを選択的に阻害して癌細胞のみを選択的に攻撃する標的治療剤の開発に対する研究が活発になっていたが、本発明において標的として使用したEGFRドメイン2に対する研究はほとんどなっていなかった。
【0022】
EGFRは、ドメイン4個からなっており、リガンドであるEGFと結合後に構造的変化を経て露出したドメイン2を介して同種二量体(homodimer)を形成することによって活性化される。従って、本発明が標的とするEGFRドメイン2に強く結合する非抗体タンパク質は、リガンドであるEGFが結合されて露出したドメイン2に特異的に結合して同種二量体を形成することができないようにしてEGFRの活性を特異的に阻害することができる(図3)。従って、活性化されたEGFRのみを選択的に阻害するから正常細胞ではない癌細胞のみを選択的に攻撃して癌治療剤としての機能を行うことができるだろう。
【0023】
前記(a)非抗体タンパク質のライブラリーから標的タンパク質と構造的相補性を有する非抗体タンパク質を選別する段階は、製造された非抗体タンパク質のライブラリーにある多数の非抗体タンパク質またはスキャフォールドをスーパーコンピューターを用いて標的タンパク質と構造的に相補性があるか否かを確認する段階であって、これはドッキングシミュレーションを行って仮想で結合して達成することができる。これはスキャフォールドライブラリーにある多数のスキャフォールドをすべて標的と仮想で結合して多様な結合構造などを作って見る過程であって、ドッキングシミュレーションは、公知のプログラムを制限なしに使用することができるが、その例として、ZDOCK、PIPER、ClusPro、ICM−DISCO、RosettaDock、PatchDock、MolFitのようなプログラムであることができ、本発明の一つの具現例によれば、PatchDockを使用して構造的に相補性を有するた非抗体タンパク質を選別した。一つの標的と一つの非抗体タンパク質とが構造的相補性によって結合可能な方法は無数に多くて、PatchDockプログラムは、相補性などを基準にしてドッキング結合構造の順位を付けてくれる。この時、一つの非抗体タンパク質に対する多様な結合構造のうち、1位〜10位にある結合構造を選別して以後段階の分析に使用するようになる。好ましくは、ドッキングシミュレーション段階は、前記標的タンパク質の標的部位アミノ酸残基などのうち、既設定された個数以上結合される非抗体タンパク質を選択することができる。より好ましくは、標的タンパク質の標的部位であるEGFRドメイン2の場合、非抗体タンパク質と結合する標的残基は28個であることができ、既設定された個数は、10個であり、28個の残基のうち、10個以上の残基が結合に参与すると、ドッキング構造のうち、スキャフォールドが安定した構造でEGFRドメイン2に結合すると判断し、このようなドッキング構造を形成する非抗体タンパク質を選別することができる。このような残基の個数は、標的タンパク質或いは標的部位の種類などによって個数を多様に設定することができる。
【0024】
前記(b)段階は、前記(a)段階で選別された非抗体タンパク質と標的タンパク質との結合エネルギーを計算する段階であって、これはドッキングシミュレーションの結果、標的タンパク質の所望の部位に一定基準以上に結合がよくなる非抗体タンパク質を選択するための段階である。この時、標的部位の残基などのうち、結合される残基の数が一定個数以上の時、結合が安定的に達成され得る。
【0025】
下記の数学式1によって非抗体タンパク質と標的との結合エネルギーを計算する。このような結合エネルギーの計算は、多様な公知のプログラムで計算することができ、これに制限されるのではないが、その例として、EGAD、RossettaDesignなどを使用することができる。本発明の一つの具現例によれば、EGADプログラムを使用して結合エネルギーを計算した。
【0026】
[数学式1]
ΔGbinding=ΔGcomplex−ΔGfree
結合エネルギー(Gbinding)は、標的タンパク質と非抗体タンパク質との結合に必要なエネルギーであって、標的タンパク質と非抗体タンパク質とが結合された状態でのエネルギー(Gcomplex)と結合前の標的タンパク質と非抗体タンパク質とのそれぞれのエネルギー(Gfree)の差で示すことができる。結合エネルギーが最も低い非抗体タンパク質から順次に整列する。
【0027】
前記(c)段階は、選別された非抗体タンパク質の中で安定した結合エネルギーを有する非抗体タンパク質を選別する段階であって、結合エネルギーが低いほど標的と非抗体タンパク質との結合が安定的に達成することができ、標的に特異的に強く結合する確率が高くなる。この時、所望の個数を設定し、設定された個数の非抗体タンパク質のみを整列することが好ましい。
【0028】
前記(d)段階は、選定された非抗体タンパク質と標的タンパク質とが直接接触するアミノ酸残基のうち、結合エネルギーが高い残基を選択する段階であって、直接接触する各アミノ酸残基別結合エネルギーを計算し、各残基が結合エネルギーに寄与する程度を算出する。非安定的な結合エネルギーを有する残基を選んで追後のランダム化する段階で使用することができる。この場合、非安定的な結合エネルギーを有する表面残基の個数が多すぎると、追後のランダム化過程から無理が来ることができるので、上位スキャフォールドの間で相対的な比較を介して除外することができる。本発明の一つの具現例によれば、EGFRドメイン2とドッキングシミュレーションによって結合された非抗体タンパク質のうち、構造的相補性が高い結合エネルギーが安定したスキャフォールドとして選別された10ZJの結合に参与する各残基別結合エネルギーを計算し、結合エネルギーが高く示された残基である44Lys、107Glu、110Glu、114Asn、及び118Aspである5個の残基を非安定的な残基として選択した(図4の(c)、表2)。
【0029】
前記(e)段階は、前記(d)段階で選択された非安定的なアミノ酸残基を結合エネルギーが低いアミノ酸残基に置換する段階であって、標的タンパク質と非抗体タンパク質との間の結合する表面のアミノ酸残基のうち、結合エネルギーが高くて結合を妨害するアミノ酸残基を結合エネルギーが低いアミノ酸に置換して安定した結合ができるようにする方向的進化過程である。アミノ酸残基の置換は、公知の分子生物学方法を制限なしに使用することができるが、好ましくはファージディスプレイ及びバイオパニング過程を行って達成することができる。本発明の一つの具現例によれば、選択されたスキャフォールドである10ZJの結合に参与する各残基別結合エネルギーを計算して結合エネルギーが高く示された残基である44Lys、107 Glu、110Glu、114Asn、及び118Aspである5個のアミノ酸の置換のために、ファージディスプレイランダムライブラリーを製作した後、5回のバイオパニングを行った後、ファージELISAを介して野生型の10ZJスキャフォールドより結合力が強化されたクローンを確認した(図5)。
【0030】
本発明者は、既に知られているヒトタンパク質をほとんど全部含むタンパク質のうち、10〜40kDaの分子量を有しながらランダム結合の危険が少ない1、261個の非抗体水溶性タンパク質からなるヒトスキャフォールドライブラリーを製作した後、EGFRドメイン2に相補的な様子を有するスキャフォールドをスクリーニングするために、PatchDockプログラムを介して大規模ドッキングシミュレーションを行って上位10個の結合モデルを選択し、EGFRのドメイン2の28個の残基のうち、10個の残基が結合に参与すると、安定した結合構造として判別して、EGFRドメイン2の結合領域と最も相補的な様子を有するタンパク質スキャフォールドを見出した。選定されたスキャフォールドの各残基の結合に関与するエネルギー寄与度をEGADを介して計算し、最も安定した複合体形成エネルギーを有するスキャフォールド1OZJを選定、及び5個の非安定的な結合エネルギーを有する表面残基を選定した(表1及び図4)。その後、ファージディスプレイライブラリー製作及びバイオパニングを介して前記5個の残基を安定した結合エネルギーを有する残基に置換する実験を行った後、EGFRとの結合をファージELISAを介して確認して結合力が増加された15個のクローンを選別し(表2及び図5)、そのうち、最も結合力が強いクローン6、7及び9を選定して配列分析を介して所望の配列が変更されて結合力が強化された標的−特異的非抗体タンパク質を製造できることを確認した(図7〜図9)。
【0031】
また一つの態様として、本発明は、EGFRドメイン2に特異的に結合する標的特異的非抗体タンパク質に関するものである。
【0032】
EGFRドメイン2に特異的に結合する標的特異的非抗体タンパク質は、前記で説明したところのようであり、好ましくは前記の標的特異的非抗体タンパク質の製造方法によって製造され得る。好ましくは、前記EGFRドメイン2に特異的に結合する標的特異的非抗体タンパク質は、配列番号3、4または5のアミノ酸配列であり得る。本発明の一つの具現例によれば、EGFRドメイン2に特異的に結合する標的特異的非抗体タンパク質として選定された1OZJのうち、ファージELISAの結果、EGFRと結合力が増加したクローン6、7及び9のアミノ酸配列を分析した結果、それぞれ配列番号3、4及び5の配列を有することを確認した(表2、図5、及び図7〜図9)。
【0033】
また一つの態様として、本発明は、EGFRドメイン2に特異的に結合する標的特異的非抗体タンパク質をコードする核酸に関するものである。好ましくは、配列番号7、8または9の核酸配列であり得る。本発明の一つの具現例によれば、EGFRドメイン2に特異的に結合する標的特異的非抗体タンパク質に選定された1OZJのうち、ファージELISAの結果、EGFRと結合力が増加したクローン6、7及び9をコードする核酸配列を分析した結果、それぞれ配列番号7、8及び9の配列を有することを確認した(表2、図5、及び図7〜図9)。
【0034】
また一つの態様として、本発明は、EGFRドメイン2に特異的に結合する標的特異的非抗体タンパク質をコードする核酸を含むベクターに関するものである。本発明のベクターは、プラスミドベクター、コスミドベクター、バクテリオファージベクター及びウイルスベクターなどを含むが、これに制限されない。適した発現ベクターは、プローモーター、オペレーター、開始コドン、終結コドン、ポリアデニル化シグナル及びエンハンサーのような発現調節エレメントの他にも膜標的化または分泌のためのシグナル配列またはリーダー配列を含むことができる。ベクターのプローモーターは、構成的または誘導性であり得る。また、発現ベクターは、ベクターを含む宿主細胞を選択するための選択マーカーを含む。
【0035】
また一つの態様として、本発明は、EGFRドメイン2に特異的に結合する標的特異的非抗体タンパク質をコードする核酸を含むベクターに形質転換された形質転換体に関するものである。
【0036】
形質転換は、核酸を有機体、細胞、組職または器官に導入するどんな方法も含まれ、当分野において公知されたように、宿主細胞に応じて適した標準技術を選択して行うことができる。このような方法には、電気衝撃遺伝子伝達法(electroporation)、原形質融合、リン酸カルシウム(CaPO4)、沈澱、塩化カルシウム(CaCl2)沈澱、シリコンカーバイド繊維を用いた攪拌、アグロバクテリア媒介された形質転換、PEG、デキストラン硫酸 、リポフェクタミンなどが含まれるが、これに制限されない。宿主細胞に応じてタンパク質の発現量と数式などが異なりに示されるので、目的に最も適した宿主細胞を選択して使用すれば良い。宿主細胞としては、エシェリキア・コリ(Escherichia coli)、バチルス・スブチリス(Bacillus subtilis)、ストレプトマイセス(Streptomyces)、シュードモナス(Pseudomonas)、プロテウス・ミラビリス(Proteus mirabilis)またはスタフィロコッカス(Staphylococcus)のような原核宿主細胞があるが、これに制限されるのではない。また、真菌(例えば、アスペルギルス(Aspergillus))、酵母(例えば、ピキア・パストリス(Pichia pastoris)、サッカロマイセス・セレビシエ(Saccharomyces cerevisiae)、シゾサッカロミセス(Schizosaccharomyces)、アカパンカビ(Neurospora crassa))などのような下等真核細胞、昆虫細胞、植物細胞、哺乳動物などを含む高等真核生物来由の細胞を宿主細胞として使用することができる。
【0037】
また一つの態様として、本発明は、EGFRドメイン2に特異的に結合する標的特異的非抗体タンパク質を含む癌治療または予防用組成物に関するものである。
【0038】
本発明の癌治療または予防用組成物は、EGFRの活性化によって発生するすべての種類の癌に適用が可能であり、前記癌が発生することができる任意の動物に適用が可能である。動物は、ヒト及び霊長類だけでなく、牛、豚、羊、馬、犬及び猫などの家畜を制限なしに含む。
【0039】
本発明における用語“予防”とは、本発明の非抗体タンパク質を含む組成物投与によって癌誘発が抑制されるとか遅延されるすべての行為を意味し、“治療”とは、本発明の非抗体タンパク質を含む組成物投与によって癌症状が好転するとか有利に変更するすべての行為を意味する。治療用組成物として使用される場合、EGFRドメイン2特異的非抗体タンパク質は、既存の治療剤と直接またはリンカーなどを介して間接的にカップリング(例えば、共有結合)されて非抗体タンパク質−治療剤結合体形態で生体内へ投入して癌予防または治療に用いることができる。使用され得る治療剤は、化学治療剤、免疫治療剤、サイトカイン、ケモカイン、抗ウイルス剤、生物作用剤、酵素阻害物質などを含む。本発明のEGFRドメイン2特異的非抗体タンパク質を含む癌治療用組成物は、薬学的に許容可能な担体を更に含むことができ、担体とともに製剤化され得る。本発明における用語“薬学的に許容可能な担体”とは、生物体を刺激せず投与化合物の生物学的活性及び特性を阻害しない担体または希釈剤をいう。液状溶液で製剤化される組成物において許容される薬剤学的担体としては、滅菌及び生体に適したものであって、食塩水、滅菌数、リンゲル液、緩衝食塩水、アルブミン注射溶液、デキストロース溶液、マルトデキストリン溶液、グリセロール、エチルアルコール及びこれらの成分のうち、1成分以上を混合して使用することができ、必要に応じて抗酸化剤、緩衝液、静菌剤などの他の通常の添加剤を添加することができる。また、希釈剤、分散剤、界面活性剤、結合剤及び潤滑剤を付加的に添加して水溶液、懸濁液、乳濁液などのような注射用剤形、丸薬、カプセル、料粒または錠剤に製剤化することができる。
【0040】
本発明のEGFRドメイン2に特異的に結合する標的特異的非抗体タンパク質及び薬学的に許容可能な担体を含む坑癌組成物は、これを有効成分として含むどんな剤形でも適用可能であり、経口用または非経口用剤形で製造することができる。本発明の薬学的剤形は、口腔(oral)、直腸(rectal)、鼻腔(nasal)、局所(topical;頬及び舌下を含む)、皮下、腟(vaginal)または非経口(parenteral;筋肉内、皮下及び静脈内を含む)投与に適当なものまたは吸入(inhalation)または注入(insufflation)による投与に適当な形態を含む。
【0041】
本発明の組成物を有効成分で含む経口投与用剤形としては、例えば、錠剤、トローチ剤、ロゼンジ、水溶性または油性懸濁液、調剤粉末または料粒、エマルジョン、ハードまたはソフトカプセル、シロップまたはエリキシル剤に製剤化することができる。錠剤及びカプセルなどの剤形に製剤化するために、ラクトース、サッカロース、ソルビトール、マンニトール、澱粉、アミロペクチン、セルロースまたはゼラチンのような結合剤、リン酸二カルシウムのような賦形剤、トウモロコシ澱粉またはサツマイモ澱粉のような崩壊剤、ステアリン酸マグネシウム、ステアリン酸カルシウム、ステアリルプマル酸ナトリウムまたはポリエチレングリコールワックスのような潤滑油を含むことができ、カプセル剤形の場合、前記言及した物質の他にも脂肪油のような液体担体をさらに含むことができる。
【0042】
本発明の組成物を有効成分で含む非経口剤形としては、皮下注射、静脈注射または筋肉内注射などの注射用形態、座剤注入方式または呼吸器を介して吸入ができるようにするエアロゾル剤などスプレー用に製剤化することができる。注射用剤形に製剤化するためには、本発明の組成物を安定剤または緩衝剤とともに水で混合して溶液または懸濁液で製造し、これをアンプルまたはバイアルの単位投与用で製剤化することができる。座剤に注入するためには、ココアバターまたは他のグリセリドなどの通常の座薬ベースを含む座薬または滞留かん腸剤のような直腸投与用組成物に製剤化することができる。エアロゾル剤などのスプレー用に剤形化する場合、水分散された濃縮物または湿潤粉末が分散するように推進剤などが添加剤とともに配合され得る。
【実施例】
【0043】
以下、下記の実施例を介して本発明をより詳細に説明することにする。これらの実施例は、ただ本発明を例示するためのものであって、本発明の範囲がこれらの実施例によって制限されることとして解釈されない。
【0044】
実施例1:構造的に決定されたヒトスキャフォールドライブラリーの製作
既に知られているヒトタンパク質をほとんど全部含むヒトタンパク質スキャフォールドのライブラリー製作のために、SCOP(Structural Classification of Proteins)データベースにあるヒトタンパク質のそれぞれが有する3次元的構造に応じて類型別に複数のグループで分類されているグループから5個の代表的な構造を選択した。組織浸透を容易にするために、分子量を限定して10−40kDaの分子量を有する代表タンパク質を5個以下で選択してすべての類型のヒトタンパク質を含むと共にライブラリーの規模を縮小した。そして、本発明者らは、PDBTM(Protein Data Bank of Transmembrane Proteins)データベースの注釈を用いて膜タンパク質の構造及びキーワード検索で抗体を除外させた。無差別的な結合を避けるために、10個以下の相互作用が知られているタンパク質のみを選択した。タンパク質の相互作用の数は、HPRD(Human Protein Reference Database)で計算した。また、SWISS−PROTデータベースの‘SUBNIT’セクションを基に同種四量体(homotetramer)、同種六量体(homohexamer)などのような同時に多い相互作用を有する同種多量体(homomultimer)を除いて、単量体(monomer)、同種二量体(homodimer)または同種三量体(homotrimer)を形成して作るタンパク質を選択した。
【0045】
その結果、小さな分子量を有しながらランダム結合の危険が少ない1、261個の非抗体水溶性タンパク質から構成されたヒトタンパク質構造のスキャフォールドライブラリーを作った。
【0046】
実施例2:構造基盤仮想スクリーニング
前記実施例1で製作したヒトタンパク質スキャフォールドライブラリーを基盤に、EGFRドメイン2に相補的な様子を有するスキャフォールドをスクリーニングするために、EGFRを有して大規模ドッキングシミュレーションによる仮想スクリーニングを行った(図1の(b))。その方法は、下記のようである。タンパク質ドッキングシミュレーションの本来目的は、現存するタンパク質−タンパク質相互作用を予測することであるが、本発明では二つのタンパク質の間の相補的な様子を見出し、新しいタンパク質−タンパク質相互作用を作るための目的として使用した。
【0047】
EGFRドメイン2と相補的な構造を有するスキャフォールドをスクリーニングするために、ヒトEGFR細胞外領域(PDB id:1IVO,Ogiso H et.al,Cell.Sep 20;110(6):775-87,2002)のA鎖とライブラリー内の各スキャフォールドの間のドッキングシミュレーションをPatchDockプログラムを用いて行った(Schneidman-Duhovny,D.et al.Proteins 52,107-112 (2003),Schneidman-Duhovny,D.et al.Nucleic Acids Res 33,W363-367 (2005))。次に、各スキャフォールド−EGFRドッキング結果の中から上位10個のドッキングモデルを選択し、前記モデルなどの結合様相を分析してEGFRの何の残基が複合体形成に関与するのか確認及びEGFRドメイン2のドッキング構造を見出した。EGFRの標的部位であるドメイン2の28個の残基を既設定し、このうち、複合体形成に10個以上の残基が関与すると、ドッキング複合体のうち、スキャフォールドが安定した構造でEGFRドメイン2(配列番号1のEGFRのアミノ酸のうち、166番目から309番目の配列、図2)に結合すると判断した:229、230、239、242、244、245、246、248、249、250、251、252、253、262、263、264、265、275、278、279、280、282、283、284、285、286、303、304(配列番号1のEGFRのアミノ酸配列のうち、既設定されたアミノ酸配列である28個配列の位置、図2)。
【0048】
本発明では、二つの鎖の間のドッキング複合体形成の時、SASA(solvent accessible surface area)内で1A2より大きい変化を経る残基を結合に関与する残基であると判断した。各残基のSASAは、Naccess(http://www.bioinf.manchester.ac.kr)を用いて計算した。これを介して特定残基が結合に参与するかどうかを判断することができる。
【0049】
その結果、EGFRドメイン2の標的結合領域と最も相補的な様子を有するタンパク質スキャフォールドを見出した。
【0050】
実施例3:複合体形成エネルギー計算及び安定した結合エネルギーを有するスキャフォールドの選択
EGFRドメイン2の結合に関与するスキャフォールドEGFRドッキング複合体から選択されたものなどの中で、最も安定した複合体形成エネルギーを有する少数の主導的なスキャフォールドを追加的な最適化のためにスクリーニングした(図1の(c))。
【0051】
スキャフォールドEGFRドッキング構造の複合体形成エネルギー及びスキャフォールド内の各結合に関与する残基の寄与度をEGAD(http://egad.berkeley.edu/EGAD_manual/index.html)を用いて計算した。テンプレート(template)として、PatchDockによって生成されたドッキング構造を使用し、命令語のうち、JOBTYPE項目にcomplex_formation_energyを使用して結合エネルギーを算出した。他のすべてのオプションをデフォルト(default)値として使用した。計算結果、pseudo_DELTA_G複合体形成値を複合体形成エネルギーとして得り、level_1に表示された表面残基のdG値を非安定的な残基を選択するために収集した。この時、結合に間接的に関与するlevel_2の残基を除外した。この過程において、安定したエネルギー以外に、二つの他の基準を考慮した。第1に、適しない構造を有するスキャフォールドをマニュアル検査によって除去した。第2に、方向的進化のためのランダム配列ライブラリーを製作しやすいように非安定的な残基が一次配列で互いに近く位置したスキャフォールドを選り好みした。
【0052】
結合エネルギーの計算は、下記の数学式1によって計算した。
【0053】
[数学式1]
ΔGbinding=ΔGcomplex−ΔGfree
【0054】
結合エネルギー(Gbinding)は、標的と非抗体バインダータンパク質との結合に必要なエネルギーであって、標的と非抗体バインダータンパク質とが結合された状態でのエネルギー(Gcomplex)と、結合前の標的と非抗体バインダータンパク質のそれぞれのエネルギー(Gfree)の差を計算して複合体の場合にもっと安定するか、そうではないかを計算した。
【0055】
その結果、最も安定した複合体形成エネルギーを有する一つのスキャフォールド、1OZJ(Crystal structure of Smad3-MH1)のB鎖(図4の(a))を選択した(表1)。EGFRに対する1OZJの複合体形成エネルギーをドッキングモデルとして算出した(図4の(b))。前記スキャフォールドを濃い色で表示し、スキャフォールドの構造は、同じ方法で図4の(a)に示した。EGFRに対するスキャフォールドの接触残基は、円(sphere)で示した。
【0056】
【表1】

【0057】
その後、選択されたスキャフォールドにある各表面残基のエネルギー寄与実験を介して複合体を形成するのに非安定的なアミノ酸残基を配列ランダム化のために選択した。図4の(c)は、1OZJの各接触残基に対するエネルギー寄与をそれぞれ示した結果である。
【0058】
その結果、バーを斜線で示した1OZJの5個残基をランダム化を介した方向的進化のために選択した(44Lys、107Glu、110Glu、114Asn、118Asp、図4の(c))。
【0059】
実施例4:ランダムライブラリー製作
前記実施例3で選択したEGFR結合スキャフォールド(1OZJ)のDNA(配列番号6、図6)をGenscript(Piscataway,NJ)で合成し、結合領域の特定位置のランダム化のためにデザインしたNNKプライマーを(Genotech,Daejon,Korea)用いてランダム化した。ランダム化したスキャフォールドをSfiI(Roche,Indianapolis,IN)で切断してファージミドベクターpComb3Xにライゲイションし、electrocompetent ER2738(New England Biolabs,Beverly,MA)に形質転換させてランダムライブラリーを製作した。
【0060】
その結果、選択された1OZJの5個の非安定的な表面残基をランダム化ライブラリーの構築によって十分にランダム化した。選択された表面残基で総4×108組合せを生成した。その後、下記のファージディスプレイを基に突然変異の中で強い結合タンパク質をスクリーニングした。
【0061】
実施例5:バイオパニング(biopanning)、ファージディスプレイ及びファージ ELISA
<5−1>バイオパニング及びファージディスプレイ
EGFRに特異的な結合タンパク質を質的に向上させるために、親和度選択技術である5回のバイオパニングを下記のように行った。
本発明者らは、製造社の指示に応じてDynabead M-270 Epoxy(Dynal,Invitrogen,Carlsbad,CA)をコーティングしてブロッキングした。1.5μgEGFR(Sigma,St.Louis,MO)を1ml/mgになるようにPBS(137mM塩化ナトリウム、10mMリン酸塩、2.7mM塩化カリウム、ph7.4)をストック溶液(stock solution)で使用して5×106個のダイナビーズ(Dynabead)をパニングの各回ごとにコーティングした。EGFRにコーティングされたダイナビーズ(Dynabead)をランダム化したファージライブラリー500μlとともに2時間室温ローテータ(rotator)で培養した。結合しないファージを除去するために、ダイナビーズ(Dynabead)を0.05%Tween20を含むPBS(v/v)で一番目のバイオパニング後には1回、2及び3番目のバイオパニング後には3回、残った2回には、5回洗浄した。EGFR−コーティングされたダイナビーズ(Dynabead)に結合したファージを0.1Mグリシン−HCl(pH2.2)30μlを2回追加して溶離し、2MのTris−HCl(pH9.1)を追加して中性化させた。溶離されたファージを新鮮に成長させたER2738に感染させ、次のバイオパニングのために一晩培養した。
【0062】
<5−2>ファージELISA
各コロニーをパニング最後の週期の算出量適定プレートでランダムに選択し、1mlのスーパーブロス(super broth)(3%トリプトン、2%酵母抽出、1%3−(N−モルホリノ)プロパンスルホン酸(3-[N-Morpholino]propanesulfonic acid)[MOPS]、pH7.0)に接種した。37℃で一晩培養の後に、培養上澄液をファージELISA(enzyme-linked immunosorbant assay)を行うのに使用した。微細適定プレートウェルを4℃で一晩の間4μg/mlEGFRを含むPBSでコーティングし、37℃で1時間3%BSAを含むPBSでブロッキングした。前記プレートをファージを含む培養上澄液とともに37℃で2時間培養し、0.05%Tween−20を含むPBS(PBST)で3回洗浄した。その後、ブロッキング緩衝溶液(1:2000)で希釈されたHRP(horseradish peroxidase)と結合した抗−M13抗体(Sigma)を加え、37℃で1時間培養した。50μlTMB基質溶液(Pierce、 Rockford,IL)を各ウェルに加え、650nmでODを測定した。
【0063】
その結果、パニング過程後に、1OZJスキャフォールドから出たクローンなどのEGFRと結合力が飛躍的に増加されたことを確認した(図5)。1OZJ野生型がEGFRとの親和度を見せてくれなかったが、前記実施例3で選択した5個アミノ酸などのランダム化を経った後には15個以上の1OZJ突然変異クローンでEGFRに対する強い結合力が観察された(図5及び表2)。最も結合力が高い6、7及び9番クローンのアミノ酸配列及びDNA配列を公知の分子生物学的方法で分析した。その結果、6番クローンは、配列番号3のアミノ酸配列及び配列番号7のDNA配列を有していた(図7)。7番クローンは、配列番号4のアミノ酸配列及び配列番号9のDNA配列を有していた(図8)。9番クローンは、配列番号5のアミノ酸配列及び配列番号8のDNA配列を有していた(図9)。
【0064】
【表2】

【0065】
表2及び図5のような結果は、相補的な構造と安定した結合エネルギーの他には、互いに全く関連のないスキャフォールドタンパク質とEGFRとの間に新しい結合が実際に生成されたことを示唆する結果である。合わせて、このような結果は、本発明の方法である仮想スクリーニング及びバイオパニングを介したランダム化過程を経る標的特異的非抗体タンパク質の製造方法を用いる場合、所望の標的を予め特定し、これに結合力と特異性とを最適化した結合タンパク質を製造できることを示唆する結果である。
【技術分野】
【0001】
本発明は、標的特異的非抗体タンパク質の製造方法に関し、より具体的には、非抗体タンパク質のライブラリーで標的タンパク質の標的部位と構造的な相補性を有する非抗体タンパク質を選別し、選別された非抗体タンパク質と標的タンパク質との結合エネルギーを計算して、選別された非抗体タンパク質の中から安定した結合エネルギーを有する非抗体タンパク質を選別し、選定された非抗体タンパク質と標的タンパク質とが直接接触するアミノ酸残基のうち、結合エネルギーが高いアミノ酸残基を選択し、選択されたアミノ酸残基を結合エネルギーが低いアミノ酸残基に置換する段階を含む標的特異的非抗体タンパク質の製造方法に関する。さらに、本発明は、前記方法によって製造されたEGFR(Epidermal Growth Factor Receptor)ドメイン2に特異的に結合する標的特異的非抗体及びこれを含む癌治療用組成物に関する。
【背景技術】
【0002】
疾病を治療するためのタンパク質の新薬として、従来には抗体(antibody)を使用して来た。抗体は、免疫系内の白血球のB細胞から抗原の刺激によって作られるタンパク質であって、抗原に会えると、細胞にある受容体を介して抗原を認識し、受容体を介して結合する。特に、抗体は、その属性上、特定タンパク質を特異的に認識して強く結合する特徴がある。このような性質を用いて癌などの疾病を起こす原因になるタンパク質に結合して、悪意的なタンパク質相互作用を阻む目的として使用されて来た。
【0003】
しかし、治療用抗体の場合、分子のサイズが大きく、大量生産が難しく、生産工程が長くて価格が高いという問題点によって、最近には患者オーダーメード型標的治療のための代案で非抗体タンパク質(non-antibody protein scaffold)を使用しようとする研究が活発になっている。非抗体タンパク質は、患者オーダーメード型標的治療のための新薬の一部類であって、現在の新薬市場において脚光を浴びている治療用抗体(therapeutic antibody)が有する前記限界点を克服するための代案として最近新しく注目され始めた。このような非抗体タンパク質は、抗体治療剤のように特定標的分子を選択的に認識して強く結合することによって、所望の標的分子の活性を阻害して癌、自家免疫疾患のような多くの疾病を治療するとか進行を阻むという目的を有するている。
【0004】
しかし、既存の非抗体タンパク質は、既存の抗体と同様に標的分子の構造に構わずにただ一つのスキャフォールド(scaffold)に基盤して製作されている。タンパク質などは、3次元的な構造に基盤して、レゴブロックが噛み合わせるように互いに結合するようになるので、特定標的に合う特異的なオーダーメード型タンパク質スキャフォールドを使用するのが理想的である。しかし、標的と特異的に結合できる相補的な構造を有する非抗体タンパク質を見出すことができる技術がなかったため、標的特異的な非抗体タンパク質を見出し、これを疾病治療用として用いるのに困難さがあるという問題点があった。特に、タンパク質の構造と種類は非常に多様なので、数多のタンパク質の中でどんなものが特定標的とよく結合するか否かを実験を介して確認することは不可能であるという問題点があった。
【0005】
また、一つのスキャフォールドに基盤する既存の抗体と非抗体タンパク質の場合、標的分子への結合部位が偶然に決定され、この結合部位を予めデザインすることができない。また、既存の非抗体タンパク質及び抗体が結合できる標的タンパク質の部位は、構造的に非常に制限されており、特に、標的部位が凹面(concave)の場合には、接近が基本的に不可能であった。従って、標的分子に結合するタンパク質などのうち、所望の部位に結合するタンパク質を見出すために、標的結合部位確認実験(epitope mapping)など、以後長い間の複雑な候補選択過程を経るという問題点があった。
【0006】
従って、前記のような既存の抗体や非抗体タンパク質の限界点を克服する標的に最適化されたスキャフォールドを選定して、標的分子の所望の標的部位に結合する非抗体タンパク質を論理的にデザインすることができる技術の開発が切実に要求されている。所望の標的タンパク質の所望の部位に強い結合力と特異性とを有して付く非抗体タンパク質をデザイン及び製造できる技術は、多様な標的タンパク質に幅広く適用可能な基盤技術(platform technology)であり、これは、抗体新薬やアプタマーなどにおいても未だに具現できなかった技術である。これにより、革新的な患者オーダーメード型標的治療剤開発のためにも切実に要求される技術である。
【発明の概要】
【発明が解決しようとする課題】
【0007】
本発明者らは、標的特異的非抗体タンパク質を製造する方法を見出すために、鋭意努力した結果、3次構造が決定されているタンパク質の構造ライブラリーを基盤に、与えられた標的タンパク質の所望の標的部位に対する仮想スクリーニングを介して構造相補性が最も高い最適のタンパク質スキャフォールドを選定し、標的分子との結合を妨害するアミノ酸をファージディスプレイ及びバイオパニングを用いたランダム化を行って予め決定された標的タンパク質の特定部位と最適の結合ができる標的特異的非抗体タンパク質を製造できることを確認した。ひいては、実際に坑癌標的であるEGFR(Epdermal Growth Factor Receptor)のドメイン2を標的とする非抗体タンパク質の製造及び前記標的との結合力を確認して本発明を完成した。
【課題を解決するための手段】
【0008】
本発明の一つの目的は、(a)非抗体タンパク質のライブラリーから標的タンパク質の標的部位と構造的相補性を有する非抗体タンパク質を選別する段階;(b)前記選別された非抗体タンパク質と標的タンパク質との結合エネルギーを計算する段階;(c)前記選別された非抗体タンパク質の中から安定した結合エネルギーを有する非抗体タンパク質を選別する段階;(d)選定された非抗体タンパク質と標的タンパク質とが直接接触するアミノ酸残基の中から結合エネルギーが高いアミノ酸残基を選択する段階;及び(e)前記(d)段階で選択されたアミノ酸残基を結合エネルギーが低いアミノ酸残基に置換する段階を含む、標的特異的非抗体タンパク質の製造方法を提供することである。
【0009】
本発明の他の目的は、EGFRドメイン2に特異的に結合する標的特異的非抗体タンパク質を提供することである。
【0010】
本発明のまた他の目的は、前記EGFRドメイン2に特異的に結合する標的特異的非抗体タンパク質をコードする核酸、前記核酸を含むベクター、または前記ベクターに形質転換された形質転換体を提供することである。
【0011】
本発明のまた他の目的は、EGFRドメイン2に特異的に結合する標的特異的非抗体タンパク質を含む癌治療用組成物を提供することである。
【発明の効果】
【0012】
本発明の標的特異的非抗体タンパク質の製造方法を用いる場合、既存の抗体新薬やタンパク質新薬、アプタマーなどの既存の物質へ接近が不可能であった多様な標的に適用可能なバイオ新薬の開発ができる基盤技術(platform technology)を提供することができる。従って、本発明の方法は、革新的な患者オーダーメード型標的治療剤の開発を可能にして、社会的、経済的波及効果が非常に大きいと予想される。また、本発明のEGFRドメイン2を阻害する標的特異的タンパク質は、癌治療の標的であるEGFRを新しい概念でEGFRの活性を特異的に阻害して正常細胞ではない癌細胞のみを選択的に攻撃して効率的な癌治療効果を提供することができるだろう。
【図面の簡単な説明】
【0013】
【図1】図1は、結合部位に特異的なスキャフォールドをデザインするための本発明の方法であるPELEX(Protein Engineering with Laboratory Evolution & Extensive Computaion)の概略的な方法を図示化したものである。(a)は、PELEXを2段階で示したフローチャートである。ヒトタンパク質スキャフォールド構造ライブラリーを基にして、ドッキングシミュレーションと複合体形成エネルギー計算を含む仮想スクリーニングを行う仮想スクリーニング段階と、スクリーニングされたスキャフォールドを予め決定された結合部位と結合親和力を最適化されるように方向的進化する段階から構成される。(b)は、標的タンパク質の予め決定された結合部位と相補的な様子を有するタンパク質スキャフォールドをヒトタンパク質スキャフォールド構造ライブラリーとドッキングシミュレーションを基に選別することを示した図である。大規模のタンパク質スキャフォールドライブラリーは、知られているすべてのヒトタンパク質構造を含む。(c)は、スクリーニングされたドッキング構造を使用した複合体形成エネルギー計算によって方向的進化を介した追加的な最適化のための安定した結合エネルギーを表するスキャフォールドを選択することを示した図である。(d)は、結合部位に特異的なスキャフォールドの微細調整のために、配列ランダム化とファージディスプレイを用いた方向的進化を行うことを示した図である。このような過程において、結合に非安定的な残基を標的とスキャフォールドとの間の親和度を最適化するためにランダム化した。
【図2】図2は、EGFRのアミノ酸配列を示した図である。下線で表示したアミノ酸がEGFRドメイン2部位のアミノ酸であって、166番目から309番目のアミノ酸部分である。ボックス内に表示した28個のアミノ酸残基を表面残基で結合に参与するアミノ酸の候補として選定した。
【図3】図3は、EGFRの活性メカニズムとEGFRの活性を抑制するためにデザインされたスキャフォールドの活性機転を示した図である。(a)は、自動抑制状態において、EGFRはドメイン2とドメイン4との間の分子内の相互作用によって非活性化されることを示す。この状態でドメイン2の“二量体化アーム(dimerization arm)”が遮断されている。(b)は、EGFが結合すると、ドメイン2とドメイン4との間の分子内の相互作用を除去し、領域再配置を促進して、ドメイン2を露出させてEGFRを活性化させることを示したものである。最後に、ドメイン2の“二量体化アーム”媒介の相互作用を介して同種二量体(homodimer)を形成する。(c)は、デザインされたスキャフォールドがEGFRドメイン2に結合して同種二量体になることを阻んでEGFRの活性を抑制する機作を図示化したものである。このような結合タンパク質は、活性化されたEGFRのみ認識し、自動抑制されたEGFRは認識しない。
【図4】図4は、1OZJの構造及びエネルギーを図式化したものである。(a)は、1OZJ(鎖B)の構造を図式化したものである。(b)は、1OZJ−EGFRのドッキング構造を図式化したものである。濃い色の鎖は、スキャフォールドを示したものである。曇った色の鎖は、それぞれEGFRのドメイン1、2、3、及び4を示したものである。円内の残基は、EGFRとスキャフォールドとの接触残基を示したものである。(a)のスキャフォールドの構造は、(b)でのスキャフォールド構造の同じ方向から表示した。(c)は、 EGFRとの複合体を形成するための1OZJの表面残基のエネルギー寄与を示したものである。方向的進化を介した追加的な改善のために選択された不安定な結合エネルギーを表する残基は斜線でバーを表示した。これは、追ってランダム化を介して突然変異させるアミノ酸残基を示したものである。
【図5】図5は、1OZJの非安定的な結合エネルギーを有する残基を突然変異させた時の結合親和度を表したELISA結果を示したものである。横軸は、クローン番号を示す。縦軸は、ELISA分析で得た光学密度を示す。1OZJクローンの配列ランダム化結果は表2に示した。
【図6】図6は、1OZJスキャフォールドのランダム化を介した突然変異以前の野生型スキャフォールドのアミノ酸配列(左側部分)及びDNA配列(右側部分)を示した図である。下線で表示した配列が非安定的な結合エネルギーを表する残基に突然変異させる配列である。
【図7】図7は、1OZJスキャフォールドの6番クローンのアミノ酸配列(左側部分)及びDNA配列(右側部分)を示した図である。下線で表示した配列が非安定的な結合エネルギーを表する残基に突然変異された配列である。
【図8】図8は、1OZJスキャフォールドの7番クローンのアミノ酸配列(左側部分)及びDNA配列(右側部分)を示した図である。下線で表示した配列が非安定的な結合エネルギーを表する残基に突然変異された配列である。
【図9】図9は、1OZJスキャフォールドの9番クローンのアミノ酸配列(左側部分)及びDNA配列(右側部分)を示した図である。下線で表示した配列が非安定的な結合エネルギーを表する残基に突然変異された配列である。
【発明を実施するための形態】
【0014】
前記の目的を達成するための一つの態様として、本発明は、(a)非抗体タンパク質のライブラリーから標的タンパク質の標的部位と構造的相補性を有する非抗体タンパク質を選別する段階;(b)前記選別された非抗体タンパク質と標的タンパク質との結合エネルギーを計算する段階;(c)前記選別された非抗体タンパク質の中から安定した結合エネルギーを有する非抗体タンパク質を選別する段階;(d)選定された非抗体タンパク質と標的タンパク質とが直接接触するアミノ酸残基の中から結合エネルギーが高いアミノ酸残基を選択する段階;及び(e)前記(d)段階で選択されたアミノ酸残基を結合エネルギーが低いアミノ酸残基に置換する段階を含む、標的特異的非抗体タンパク質の製造方法に関するものである。
【0015】
本発明の標的特異的非抗体タンパク質の製造方法の全体的な模式図は、図1(a)に示した通りである。本発明者らは、本発明者が開発したドッキングシミュレーション及び結合エネルギー計算による仮想スクリーニング段階、及びファージディスプレイ並びにバイオパニングを介した残基のランダム化を用いた方向的進化段階を行う本標的特異的非抗体タンパク質の製造方法をPELEX(Protein Engineering with Laboratory Evolution & Extensive Computation)と命名した。
【0016】
本発明において使用された用語“非抗体タンパク質”は、分子量10〜40kDaのサイズで既存の治療用抗体に比べて分子量が1/10以上に減ったタンパク質で目標組職への浸透が容易であり、バクテリアなどで大量生産の可能な抗体ではないタンパク質であって、分子標的治療のために使用され得る特定標的分子を選択的に認識して強く結合することによって、所望の標的分子の活性を阻害して癌、自家免疫疾患のような多くの疾病を治療するとか進行を阻むことができるタンパク質を意味する。前記“非抗体タンパク質”は、本願において、“スキャフォールド”、“スキャフォールドタンパク質”、“結合タンパク質”と混用され得る。
【0017】
本発明において使用された用語“非抗体タンパク質のライブラリー”は、ヒトが自然界でその3次構造が明らかになったすべてのタンパク質の構造体からなったタンパク質骨格の総集合体を意味し、このような集合体は、データベース上に存在するように製造することができる。非抗体タンパク質のライブラリーの製造は、PDB(Protein Data Bank)、SCOP(Structural Classification of Protein)のようなヒトタンパク質の3次構造をすべて含むデータベースを使用することができ、これに制限されるのではないが、公知の多様なヒトタンパク質の3次元構造が知られている多様なデータベースを介して非抗体タンパク質のライブラリーの製造のためのタンパク質を選択することができる。このようなデータベースには、ヒトタンパク質それぞれが有する3次元的構造に応じて類型別で複数のグループに分類されている。非抗体タンパク質ライブラリーの具体的な製造方法は次の通りである。まず、ヒトタンパク質のうちから組職浸透を容易にするために、分子量を限定して10〜40kDaの分子量を有するタンパク質のみを選択することができる。この時、それぞれのヒトタンパク質構造類型別グループから10〜40kDaの分子量を有する代表タンパク質を5個以下に選択してすべての類型のヒトタンパク質を含むと共に、電子ライブラリーの規模を縮小することによって検索速度を向上させ得る。以後には、ヒトのタンパク質のうち、非抗体タンパク質ではないタンパク質を除去するための段階として、膜タンパク質及び抗体タンパク質を除去する段階を含むことができる。膜タンパク質及び抗体タンパク質は、公知の機能が知られているタンパク質のデータベースを制限なしに使用することができ、その例として、PDBTM(Protein Data Bank of Transmembrane Proteins)のようなデータベースを用いてキーワード検索などを利用して行われることができる。以後、無差別的な結合を避けるために、10個以下の相互作用が知られているタンパク質のみを選択する段階を含むことができる。このような相互作用に関連する情報も公知のタンパク質−タンパク質相互作用情報を提供する多様なデータベースを使用することができるが、その例として、HPRD(Human Protein Reference Database)を用いてタンパク質の相互作用の数を計算することができる。その後、同種四量体(homotetramer)、同種六量体(homohexamer)などのように同時に多い相互作用を有するタンパク質を除外するために単量体(monomer)、同種二量体(homodimer)、及び同種三量体(homotrimer)のうち、いずれか一つ以上を形成できるタンパク質を選択する段階を含むことができ、これはタンパク質間の結合を計算することができる公知のデータベースを制限なしに用いて行うことができるが、その例として、SWISS−PROTデータベースを用いることができる。前記のような段階を全部経って製造された非抗体タンパク質ライブラリーは、1000個〜2000個の構造が知られている非抗体タンパク質が含まれ得る。本発明の一つの具現例によれば、小さい分子量を有しながらランダム結合の危険が少ない1261個の非抗体水溶性タンパク質から構成された非抗体タンパク質ライブラリーを製作し、これを基盤にしてドッキングシミュレーションなど仮想スクリーニングを行った。
【0018】
好ましくは、前記(a)非抗体タンパク質のライブラリーから標的タンパク質の標的d部位と構造的相補性を有する非抗体タンパク質を選別する段階;及び(b)前記選別された非抗体タンパク質と標的タンパク質との結合エネルギーを計算する段階は、順次にまたは同時に行われることができる。
【0019】
本発明における用語“標的タンパク質”とは、非抗体タンパク質が結合する目的タンパク質を意味するものであって、非抗体タンパク質の結合を介して目的しようとする用途に応じて多様に選択されることができ、癌誘発タンパク質、免疫疾患誘発タンパク質、外来感染タンパク質などが制限なしに選択されることができるが、その例として、EGFR(Epidermal Growth Factor Receptor)であり得る。
【0020】
本発明における用語“標的部位”とは、標的タンパク質の3次構造で病理的なタンパク質相互作用及び結合に直間接的に参与する部位であって、該当部位に非抗体タンパク質が強く結合して悪意的なタンパク質相互作用を阻むことができ、その例として、EGFRのドメイン2であり得る。また、本発明の非抗体タンパク質が結合できる標的タンパク質の結合面は、凹面(concave)など多様な表面に結合できるので、本発明の非抗体タンパク質の製造は、その結合する標的タンパク質の3次構造に制限がない。
【0021】
本発明における用語“EGFR(Epidermal Growth Factor Receptor)”とは、代表的な成長因子受容体であって、乳房癌、肺癌、大膓癌、腎癌、胆嚢癌、頭頸部癌、卵巣癌、前立腺癌、子宮頸部癌及び胃癌など多くの多様な癌細胞の表面に過発現されており、成長因子EGFの結合により活性化されて癌細胞の増殖、浸潤、血管生成や転移に中心的な役目を果たすEGFの受容体を意味する。現在まで多様にEGFRを選択的に阻害して癌細胞のみを選択的に攻撃する標的治療剤の開発に対する研究が活発になっていたが、本発明において標的として使用したEGFRドメイン2に対する研究はほとんどなっていなかった。
【0022】
EGFRは、ドメイン4個からなっており、リガンドであるEGFと結合後に構造的変化を経て露出したドメイン2を介して同種二量体(homodimer)を形成することによって活性化される。従って、本発明が標的とするEGFRドメイン2に強く結合する非抗体タンパク質は、リガンドであるEGFが結合されて露出したドメイン2に特異的に結合して同種二量体を形成することができないようにしてEGFRの活性を特異的に阻害することができる(図3)。従って、活性化されたEGFRのみを選択的に阻害するから正常細胞ではない癌細胞のみを選択的に攻撃して癌治療剤としての機能を行うことができるだろう。
【0023】
前記(a)非抗体タンパク質のライブラリーから標的タンパク質と構造的相補性を有する非抗体タンパク質を選別する段階は、製造された非抗体タンパク質のライブラリーにある多数の非抗体タンパク質またはスキャフォールドをスーパーコンピューターを用いて標的タンパク質と構造的に相補性があるか否かを確認する段階であって、これはドッキングシミュレーションを行って仮想で結合して達成することができる。これはスキャフォールドライブラリーにある多数のスキャフォールドをすべて標的と仮想で結合して多様な結合構造などを作って見る過程であって、ドッキングシミュレーションは、公知のプログラムを制限なしに使用することができるが、その例として、ZDOCK、PIPER、ClusPro、ICM−DISCO、RosettaDock、PatchDock、MolFitのようなプログラムであることができ、本発明の一つの具現例によれば、PatchDockを使用して構造的に相補性を有するた非抗体タンパク質を選別した。一つの標的と一つの非抗体タンパク質とが構造的相補性によって結合可能な方法は無数に多くて、PatchDockプログラムは、相補性などを基準にしてドッキング結合構造の順位を付けてくれる。この時、一つの非抗体タンパク質に対する多様な結合構造のうち、1位〜10位にある結合構造を選別して以後段階の分析に使用するようになる。好ましくは、ドッキングシミュレーション段階は、前記標的タンパク質の標的部位アミノ酸残基などのうち、既設定された個数以上結合される非抗体タンパク質を選択することができる。より好ましくは、標的タンパク質の標的部位であるEGFRドメイン2の場合、非抗体タンパク質と結合する標的残基は28個であることができ、既設定された個数は、10個であり、28個の残基のうち、10個以上の残基が結合に参与すると、ドッキング構造のうち、スキャフォールドが安定した構造でEGFRドメイン2に結合すると判断し、このようなドッキング構造を形成する非抗体タンパク質を選別することができる。このような残基の個数は、標的タンパク質或いは標的部位の種類などによって個数を多様に設定することができる。
【0024】
前記(b)段階は、前記(a)段階で選別された非抗体タンパク質と標的タンパク質との結合エネルギーを計算する段階であって、これはドッキングシミュレーションの結果、標的タンパク質の所望の部位に一定基準以上に結合がよくなる非抗体タンパク質を選択するための段階である。この時、標的部位の残基などのうち、結合される残基の数が一定個数以上の時、結合が安定的に達成され得る。
【0025】
下記の数学式1によって非抗体タンパク質と標的との結合エネルギーを計算する。このような結合エネルギーの計算は、多様な公知のプログラムで計算することができ、これに制限されるのではないが、その例として、EGAD、RossettaDesignなどを使用することができる。本発明の一つの具現例によれば、EGADプログラムを使用して結合エネルギーを計算した。
【0026】
[数学式1]
ΔGbinding=ΔGcomplex−ΔGfree
結合エネルギー(Gbinding)は、標的タンパク質と非抗体タンパク質との結合に必要なエネルギーであって、標的タンパク質と非抗体タンパク質とが結合された状態でのエネルギー(Gcomplex)と結合前の標的タンパク質と非抗体タンパク質とのそれぞれのエネルギー(Gfree)の差で示すことができる。結合エネルギーが最も低い非抗体タンパク質から順次に整列する。
【0027】
前記(c)段階は、選別された非抗体タンパク質の中で安定した結合エネルギーを有する非抗体タンパク質を選別する段階であって、結合エネルギーが低いほど標的と非抗体タンパク質との結合が安定的に達成することができ、標的に特異的に強く結合する確率が高くなる。この時、所望の個数を設定し、設定された個数の非抗体タンパク質のみを整列することが好ましい。
【0028】
前記(d)段階は、選定された非抗体タンパク質と標的タンパク質とが直接接触するアミノ酸残基のうち、結合エネルギーが高い残基を選択する段階であって、直接接触する各アミノ酸残基別結合エネルギーを計算し、各残基が結合エネルギーに寄与する程度を算出する。非安定的な結合エネルギーを有する残基を選んで追後のランダム化する段階で使用することができる。この場合、非安定的な結合エネルギーを有する表面残基の個数が多すぎると、追後のランダム化過程から無理が来ることができるので、上位スキャフォールドの間で相対的な比較を介して除外することができる。本発明の一つの具現例によれば、EGFRドメイン2とドッキングシミュレーションによって結合された非抗体タンパク質のうち、構造的相補性が高い結合エネルギーが安定したスキャフォールドとして選別された10ZJの結合に参与する各残基別結合エネルギーを計算し、結合エネルギーが高く示された残基である44Lys、107Glu、110Glu、114Asn、及び118Aspである5個の残基を非安定的な残基として選択した(図4の(c)、表2)。
【0029】
前記(e)段階は、前記(d)段階で選択された非安定的なアミノ酸残基を結合エネルギーが低いアミノ酸残基に置換する段階であって、標的タンパク質と非抗体タンパク質との間の結合する表面のアミノ酸残基のうち、結合エネルギーが高くて結合を妨害するアミノ酸残基を結合エネルギーが低いアミノ酸に置換して安定した結合ができるようにする方向的進化過程である。アミノ酸残基の置換は、公知の分子生物学方法を制限なしに使用することができるが、好ましくはファージディスプレイ及びバイオパニング過程を行って達成することができる。本発明の一つの具現例によれば、選択されたスキャフォールドである10ZJの結合に参与する各残基別結合エネルギーを計算して結合エネルギーが高く示された残基である44Lys、107 Glu、110Glu、114Asn、及び118Aspである5個のアミノ酸の置換のために、ファージディスプレイランダムライブラリーを製作した後、5回のバイオパニングを行った後、ファージELISAを介して野生型の10ZJスキャフォールドより結合力が強化されたクローンを確認した(図5)。
【0030】
本発明者は、既に知られているヒトタンパク質をほとんど全部含むタンパク質のうち、10〜40kDaの分子量を有しながらランダム結合の危険が少ない1、261個の非抗体水溶性タンパク質からなるヒトスキャフォールドライブラリーを製作した後、EGFRドメイン2に相補的な様子を有するスキャフォールドをスクリーニングするために、PatchDockプログラムを介して大規模ドッキングシミュレーションを行って上位10個の結合モデルを選択し、EGFRのドメイン2の28個の残基のうち、10個の残基が結合に参与すると、安定した結合構造として判別して、EGFRドメイン2の結合領域と最も相補的な様子を有するタンパク質スキャフォールドを見出した。選定されたスキャフォールドの各残基の結合に関与するエネルギー寄与度をEGADを介して計算し、最も安定した複合体形成エネルギーを有するスキャフォールド1OZJを選定、及び5個の非安定的な結合エネルギーを有する表面残基を選定した(表1及び図4)。その後、ファージディスプレイライブラリー製作及びバイオパニングを介して前記5個の残基を安定した結合エネルギーを有する残基に置換する実験を行った後、EGFRとの結合をファージELISAを介して確認して結合力が増加された15個のクローンを選別し(表2及び図5)、そのうち、最も結合力が強いクローン6、7及び9を選定して配列分析を介して所望の配列が変更されて結合力が強化された標的−特異的非抗体タンパク質を製造できることを確認した(図7〜図9)。
【0031】
また一つの態様として、本発明は、EGFRドメイン2に特異的に結合する標的特異的非抗体タンパク質に関するものである。
【0032】
EGFRドメイン2に特異的に結合する標的特異的非抗体タンパク質は、前記で説明したところのようであり、好ましくは前記の標的特異的非抗体タンパク質の製造方法によって製造され得る。好ましくは、前記EGFRドメイン2に特異的に結合する標的特異的非抗体タンパク質は、配列番号3、4または5のアミノ酸配列であり得る。本発明の一つの具現例によれば、EGFRドメイン2に特異的に結合する標的特異的非抗体タンパク質として選定された1OZJのうち、ファージELISAの結果、EGFRと結合力が増加したクローン6、7及び9のアミノ酸配列を分析した結果、それぞれ配列番号3、4及び5の配列を有することを確認した(表2、図5、及び図7〜図9)。
【0033】
また一つの態様として、本発明は、EGFRドメイン2に特異的に結合する標的特異的非抗体タンパク質をコードする核酸に関するものである。好ましくは、配列番号7、8または9の核酸配列であり得る。本発明の一つの具現例によれば、EGFRドメイン2に特異的に結合する標的特異的非抗体タンパク質に選定された1OZJのうち、ファージELISAの結果、EGFRと結合力が増加したクローン6、7及び9をコードする核酸配列を分析した結果、それぞれ配列番号7、8及び9の配列を有することを確認した(表2、図5、及び図7〜図9)。
【0034】
また一つの態様として、本発明は、EGFRドメイン2に特異的に結合する標的特異的非抗体タンパク質をコードする核酸を含むベクターに関するものである。本発明のベクターは、プラスミドベクター、コスミドベクター、バクテリオファージベクター及びウイルスベクターなどを含むが、これに制限されない。適した発現ベクターは、プローモーター、オペレーター、開始コドン、終結コドン、ポリアデニル化シグナル及びエンハンサーのような発現調節エレメントの他にも膜標的化または分泌のためのシグナル配列またはリーダー配列を含むことができる。ベクターのプローモーターは、構成的または誘導性であり得る。また、発現ベクターは、ベクターを含む宿主細胞を選択するための選択マーカーを含む。
【0035】
また一つの態様として、本発明は、EGFRドメイン2に特異的に結合する標的特異的非抗体タンパク質をコードする核酸を含むベクターに形質転換された形質転換体に関するものである。
【0036】
形質転換は、核酸を有機体、細胞、組職または器官に導入するどんな方法も含まれ、当分野において公知されたように、宿主細胞に応じて適した標準技術を選択して行うことができる。このような方法には、電気衝撃遺伝子伝達法(electroporation)、原形質融合、リン酸カルシウム(CaPO4)、沈澱、塩化カルシウム(CaCl2)沈澱、シリコンカーバイド繊維を用いた攪拌、アグロバクテリア媒介された形質転換、PEG、デキストラン硫酸 、リポフェクタミンなどが含まれるが、これに制限されない。宿主細胞に応じてタンパク質の発現量と数式などが異なりに示されるので、目的に最も適した宿主細胞を選択して使用すれば良い。宿主細胞としては、エシェリキア・コリ(Escherichia coli)、バチルス・スブチリス(Bacillus subtilis)、ストレプトマイセス(Streptomyces)、シュードモナス(Pseudomonas)、プロテウス・ミラビリス(Proteus mirabilis)またはスタフィロコッカス(Staphylococcus)のような原核宿主細胞があるが、これに制限されるのではない。また、真菌(例えば、アスペルギルス(Aspergillus))、酵母(例えば、ピキア・パストリス(Pichia pastoris)、サッカロマイセス・セレビシエ(Saccharomyces cerevisiae)、シゾサッカロミセス(Schizosaccharomyces)、アカパンカビ(Neurospora crassa))などのような下等真核細胞、昆虫細胞、植物細胞、哺乳動物などを含む高等真核生物来由の細胞を宿主細胞として使用することができる。
【0037】
また一つの態様として、本発明は、EGFRドメイン2に特異的に結合する標的特異的非抗体タンパク質を含む癌治療または予防用組成物に関するものである。
【0038】
本発明の癌治療または予防用組成物は、EGFRの活性化によって発生するすべての種類の癌に適用が可能であり、前記癌が発生することができる任意の動物に適用が可能である。動物は、ヒト及び霊長類だけでなく、牛、豚、羊、馬、犬及び猫などの家畜を制限なしに含む。
【0039】
本発明における用語“予防”とは、本発明の非抗体タンパク質を含む組成物投与によって癌誘発が抑制されるとか遅延されるすべての行為を意味し、“治療”とは、本発明の非抗体タンパク質を含む組成物投与によって癌症状が好転するとか有利に変更するすべての行為を意味する。治療用組成物として使用される場合、EGFRドメイン2特異的非抗体タンパク質は、既存の治療剤と直接またはリンカーなどを介して間接的にカップリング(例えば、共有結合)されて非抗体タンパク質−治療剤結合体形態で生体内へ投入して癌予防または治療に用いることができる。使用され得る治療剤は、化学治療剤、免疫治療剤、サイトカイン、ケモカイン、抗ウイルス剤、生物作用剤、酵素阻害物質などを含む。本発明のEGFRドメイン2特異的非抗体タンパク質を含む癌治療用組成物は、薬学的に許容可能な担体を更に含むことができ、担体とともに製剤化され得る。本発明における用語“薬学的に許容可能な担体”とは、生物体を刺激せず投与化合物の生物学的活性及び特性を阻害しない担体または希釈剤をいう。液状溶液で製剤化される組成物において許容される薬剤学的担体としては、滅菌及び生体に適したものであって、食塩水、滅菌数、リンゲル液、緩衝食塩水、アルブミン注射溶液、デキストロース溶液、マルトデキストリン溶液、グリセロール、エチルアルコール及びこれらの成分のうち、1成分以上を混合して使用することができ、必要に応じて抗酸化剤、緩衝液、静菌剤などの他の通常の添加剤を添加することができる。また、希釈剤、分散剤、界面活性剤、結合剤及び潤滑剤を付加的に添加して水溶液、懸濁液、乳濁液などのような注射用剤形、丸薬、カプセル、料粒または錠剤に製剤化することができる。
【0040】
本発明のEGFRドメイン2に特異的に結合する標的特異的非抗体タンパク質及び薬学的に許容可能な担体を含む坑癌組成物は、これを有効成分として含むどんな剤形でも適用可能であり、経口用または非経口用剤形で製造することができる。本発明の薬学的剤形は、口腔(oral)、直腸(rectal)、鼻腔(nasal)、局所(topical;頬及び舌下を含む)、皮下、腟(vaginal)または非経口(parenteral;筋肉内、皮下及び静脈内を含む)投与に適当なものまたは吸入(inhalation)または注入(insufflation)による投与に適当な形態を含む。
【0041】
本発明の組成物を有効成分で含む経口投与用剤形としては、例えば、錠剤、トローチ剤、ロゼンジ、水溶性または油性懸濁液、調剤粉末または料粒、エマルジョン、ハードまたはソフトカプセル、シロップまたはエリキシル剤に製剤化することができる。錠剤及びカプセルなどの剤形に製剤化するために、ラクトース、サッカロース、ソルビトール、マンニトール、澱粉、アミロペクチン、セルロースまたはゼラチンのような結合剤、リン酸二カルシウムのような賦形剤、トウモロコシ澱粉またはサツマイモ澱粉のような崩壊剤、ステアリン酸マグネシウム、ステアリン酸カルシウム、ステアリルプマル酸ナトリウムまたはポリエチレングリコールワックスのような潤滑油を含むことができ、カプセル剤形の場合、前記言及した物質の他にも脂肪油のような液体担体をさらに含むことができる。
【0042】
本発明の組成物を有効成分で含む非経口剤形としては、皮下注射、静脈注射または筋肉内注射などの注射用形態、座剤注入方式または呼吸器を介して吸入ができるようにするエアロゾル剤などスプレー用に製剤化することができる。注射用剤形に製剤化するためには、本発明の組成物を安定剤または緩衝剤とともに水で混合して溶液または懸濁液で製造し、これをアンプルまたはバイアルの単位投与用で製剤化することができる。座剤に注入するためには、ココアバターまたは他のグリセリドなどの通常の座薬ベースを含む座薬または滞留かん腸剤のような直腸投与用組成物に製剤化することができる。エアロゾル剤などのスプレー用に剤形化する場合、水分散された濃縮物または湿潤粉末が分散するように推進剤などが添加剤とともに配合され得る。
【実施例】
【0043】
以下、下記の実施例を介して本発明をより詳細に説明することにする。これらの実施例は、ただ本発明を例示するためのものであって、本発明の範囲がこれらの実施例によって制限されることとして解釈されない。
【0044】
実施例1:構造的に決定されたヒトスキャフォールドライブラリーの製作
既に知られているヒトタンパク質をほとんど全部含むヒトタンパク質スキャフォールドのライブラリー製作のために、SCOP(Structural Classification of Proteins)データベースにあるヒトタンパク質のそれぞれが有する3次元的構造に応じて類型別に複数のグループで分類されているグループから5個の代表的な構造を選択した。組織浸透を容易にするために、分子量を限定して10−40kDaの分子量を有する代表タンパク質を5個以下で選択してすべての類型のヒトタンパク質を含むと共にライブラリーの規模を縮小した。そして、本発明者らは、PDBTM(Protein Data Bank of Transmembrane Proteins)データベースの注釈を用いて膜タンパク質の構造及びキーワード検索で抗体を除外させた。無差別的な結合を避けるために、10個以下の相互作用が知られているタンパク質のみを選択した。タンパク質の相互作用の数は、HPRD(Human Protein Reference Database)で計算した。また、SWISS−PROTデータベースの‘SUBNIT’セクションを基に同種四量体(homotetramer)、同種六量体(homohexamer)などのような同時に多い相互作用を有する同種多量体(homomultimer)を除いて、単量体(monomer)、同種二量体(homodimer)または同種三量体(homotrimer)を形成して作るタンパク質を選択した。
【0045】
その結果、小さな分子量を有しながらランダム結合の危険が少ない1、261個の非抗体水溶性タンパク質から構成されたヒトタンパク質構造のスキャフォールドライブラリーを作った。
【0046】
実施例2:構造基盤仮想スクリーニング
前記実施例1で製作したヒトタンパク質スキャフォールドライブラリーを基盤に、EGFRドメイン2に相補的な様子を有するスキャフォールドをスクリーニングするために、EGFRを有して大規模ドッキングシミュレーションによる仮想スクリーニングを行った(図1の(b))。その方法は、下記のようである。タンパク質ドッキングシミュレーションの本来目的は、現存するタンパク質−タンパク質相互作用を予測することであるが、本発明では二つのタンパク質の間の相補的な様子を見出し、新しいタンパク質−タンパク質相互作用を作るための目的として使用した。
【0047】
EGFRドメイン2と相補的な構造を有するスキャフォールドをスクリーニングするために、ヒトEGFR細胞外領域(PDB id:1IVO,Ogiso H et.al,Cell.Sep 20;110(6):775-87,2002)のA鎖とライブラリー内の各スキャフォールドの間のドッキングシミュレーションをPatchDockプログラムを用いて行った(Schneidman-Duhovny,D.et al.Proteins 52,107-112 (2003),Schneidman-Duhovny,D.et al.Nucleic Acids Res 33,W363-367 (2005))。次に、各スキャフォールド−EGFRドッキング結果の中から上位10個のドッキングモデルを選択し、前記モデルなどの結合様相を分析してEGFRの何の残基が複合体形成に関与するのか確認及びEGFRドメイン2のドッキング構造を見出した。EGFRの標的部位であるドメイン2の28個の残基を既設定し、このうち、複合体形成に10個以上の残基が関与すると、ドッキング複合体のうち、スキャフォールドが安定した構造でEGFRドメイン2(配列番号1のEGFRのアミノ酸のうち、166番目から309番目の配列、図2)に結合すると判断した:229、230、239、242、244、245、246、248、249、250、251、252、253、262、263、264、265、275、278、279、280、282、283、284、285、286、303、304(配列番号1のEGFRのアミノ酸配列のうち、既設定されたアミノ酸配列である28個配列の位置、図2)。
【0048】
本発明では、二つの鎖の間のドッキング複合体形成の時、SASA(solvent accessible surface area)内で1A2より大きい変化を経る残基を結合に関与する残基であると判断した。各残基のSASAは、Naccess(http://www.bioinf.manchester.ac.kr)を用いて計算した。これを介して特定残基が結合に参与するかどうかを判断することができる。
【0049】
その結果、EGFRドメイン2の標的結合領域と最も相補的な様子を有するタンパク質スキャフォールドを見出した。
【0050】
実施例3:複合体形成エネルギー計算及び安定した結合エネルギーを有するスキャフォールドの選択
EGFRドメイン2の結合に関与するスキャフォールドEGFRドッキング複合体から選択されたものなどの中で、最も安定した複合体形成エネルギーを有する少数の主導的なスキャフォールドを追加的な最適化のためにスクリーニングした(図1の(c))。
【0051】
スキャフォールドEGFRドッキング構造の複合体形成エネルギー及びスキャフォールド内の各結合に関与する残基の寄与度をEGAD(http://egad.berkeley.edu/EGAD_manual/index.html)を用いて計算した。テンプレート(template)として、PatchDockによって生成されたドッキング構造を使用し、命令語のうち、JOBTYPE項目にcomplex_formation_energyを使用して結合エネルギーを算出した。他のすべてのオプションをデフォルト(default)値として使用した。計算結果、pseudo_DELTA_G複合体形成値を複合体形成エネルギーとして得り、level_1に表示された表面残基のdG値を非安定的な残基を選択するために収集した。この時、結合に間接的に関与するlevel_2の残基を除外した。この過程において、安定したエネルギー以外に、二つの他の基準を考慮した。第1に、適しない構造を有するスキャフォールドをマニュアル検査によって除去した。第2に、方向的進化のためのランダム配列ライブラリーを製作しやすいように非安定的な残基が一次配列で互いに近く位置したスキャフォールドを選り好みした。
【0052】
結合エネルギーの計算は、下記の数学式1によって計算した。
【0053】
[数学式1]
ΔGbinding=ΔGcomplex−ΔGfree
【0054】
結合エネルギー(Gbinding)は、標的と非抗体バインダータンパク質との結合に必要なエネルギーであって、標的と非抗体バインダータンパク質とが結合された状態でのエネルギー(Gcomplex)と、結合前の標的と非抗体バインダータンパク質のそれぞれのエネルギー(Gfree)の差を計算して複合体の場合にもっと安定するか、そうではないかを計算した。
【0055】
その結果、最も安定した複合体形成エネルギーを有する一つのスキャフォールド、1OZJ(Crystal structure of Smad3-MH1)のB鎖(図4の(a))を選択した(表1)。EGFRに対する1OZJの複合体形成エネルギーをドッキングモデルとして算出した(図4の(b))。前記スキャフォールドを濃い色で表示し、スキャフォールドの構造は、同じ方法で図4の(a)に示した。EGFRに対するスキャフォールドの接触残基は、円(sphere)で示した。
【0056】
【表1】

【0057】
その後、選択されたスキャフォールドにある各表面残基のエネルギー寄与実験を介して複合体を形成するのに非安定的なアミノ酸残基を配列ランダム化のために選択した。図4の(c)は、1OZJの各接触残基に対するエネルギー寄与をそれぞれ示した結果である。
【0058】
その結果、バーを斜線で示した1OZJの5個残基をランダム化を介した方向的進化のために選択した(44Lys、107Glu、110Glu、114Asn、118Asp、図4の(c))。
【0059】
実施例4:ランダムライブラリー製作
前記実施例3で選択したEGFR結合スキャフォールド(1OZJ)のDNA(配列番号6、図6)をGenscript(Piscataway,NJ)で合成し、結合領域の特定位置のランダム化のためにデザインしたNNKプライマーを(Genotech,Daejon,Korea)用いてランダム化した。ランダム化したスキャフォールドをSfiI(Roche,Indianapolis,IN)で切断してファージミドベクターpComb3Xにライゲイションし、electrocompetent ER2738(New England Biolabs,Beverly,MA)に形質転換させてランダムライブラリーを製作した。
【0060】
その結果、選択された1OZJの5個の非安定的な表面残基をランダム化ライブラリーの構築によって十分にランダム化した。選択された表面残基で総4×108組合せを生成した。その後、下記のファージディスプレイを基に突然変異の中で強い結合タンパク質をスクリーニングした。
【0061】
実施例5:バイオパニング(biopanning)、ファージディスプレイ及びファージ ELISA
<5−1>バイオパニング及びファージディスプレイ
EGFRに特異的な結合タンパク質を質的に向上させるために、親和度選択技術である5回のバイオパニングを下記のように行った。
本発明者らは、製造社の指示に応じてDynabead M-270 Epoxy(Dynal,Invitrogen,Carlsbad,CA)をコーティングしてブロッキングした。1.5μgEGFR(Sigma,St.Louis,MO)を1ml/mgになるようにPBS(137mM塩化ナトリウム、10mMリン酸塩、2.7mM塩化カリウム、ph7.4)をストック溶液(stock solution)で使用して5×106個のダイナビーズ(Dynabead)をパニングの各回ごとにコーティングした。EGFRにコーティングされたダイナビーズ(Dynabead)をランダム化したファージライブラリー500μlとともに2時間室温ローテータ(rotator)で培養した。結合しないファージを除去するために、ダイナビーズ(Dynabead)を0.05%Tween20を含むPBS(v/v)で一番目のバイオパニング後には1回、2及び3番目のバイオパニング後には3回、残った2回には、5回洗浄した。EGFR−コーティングされたダイナビーズ(Dynabead)に結合したファージを0.1Mグリシン−HCl(pH2.2)30μlを2回追加して溶離し、2MのTris−HCl(pH9.1)を追加して中性化させた。溶離されたファージを新鮮に成長させたER2738に感染させ、次のバイオパニングのために一晩培養した。
【0062】
<5−2>ファージELISA
各コロニーをパニング最後の週期の算出量適定プレートでランダムに選択し、1mlのスーパーブロス(super broth)(3%トリプトン、2%酵母抽出、1%3−(N−モルホリノ)プロパンスルホン酸(3-[N-Morpholino]propanesulfonic acid)[MOPS]、pH7.0)に接種した。37℃で一晩培養の後に、培養上澄液をファージELISA(enzyme-linked immunosorbant assay)を行うのに使用した。微細適定プレートウェルを4℃で一晩の間4μg/mlEGFRを含むPBSでコーティングし、37℃で1時間3%BSAを含むPBSでブロッキングした。前記プレートをファージを含む培養上澄液とともに37℃で2時間培養し、0.05%Tween−20を含むPBS(PBST)で3回洗浄した。その後、ブロッキング緩衝溶液(1:2000)で希釈されたHRP(horseradish peroxidase)と結合した抗−M13抗体(Sigma)を加え、37℃で1時間培養した。50μlTMB基質溶液(Pierce、 Rockford,IL)を各ウェルに加え、650nmでODを測定した。
【0063】
その結果、パニング過程後に、1OZJスキャフォールドから出たクローンなどのEGFRと結合力が飛躍的に増加されたことを確認した(図5)。1OZJ野生型がEGFRとの親和度を見せてくれなかったが、前記実施例3で選択した5個アミノ酸などのランダム化を経った後には15個以上の1OZJ突然変異クローンでEGFRに対する強い結合力が観察された(図5及び表2)。最も結合力が高い6、7及び9番クローンのアミノ酸配列及びDNA配列を公知の分子生物学的方法で分析した。その結果、6番クローンは、配列番号3のアミノ酸配列及び配列番号7のDNA配列を有していた(図7)。7番クローンは、配列番号4のアミノ酸配列及び配列番号9のDNA配列を有していた(図8)。9番クローンは、配列番号5のアミノ酸配列及び配列番号8のDNA配列を有していた(図9)。
【0064】
【表2】

【0065】
表2及び図5のような結果は、相補的な構造と安定した結合エネルギーの他には、互いに全く関連のないスキャフォールドタンパク質とEGFRとの間に新しい結合が実際に生成されたことを示唆する結果である。合わせて、このような結果は、本発明の方法である仮想スクリーニング及びバイオパニングを介したランダム化過程を経る標的特異的非抗体タンパク質の製造方法を用いる場合、所望の標的を予め特定し、これに結合力と特異性とを最適化した結合タンパク質を製造できることを示唆する結果である。
【特許請求の範囲】
【請求項1】
(a)非抗体タンパク質のライブラリーから標的タンパク質の標的部位と構造的相補性を有する非抗体タンパク質とを選別する段階;
(b)前記選別された非抗体タンパク質と標的タンパク質との結合エネルギーを計算する段階;
(c)前記選別された非抗体タンパク質の中から安定した結合エネルギーを有する非抗体タンパク質を選別する段階;
(d)選定された非抗体タンパク質と標的タンパク質とが直接接触するアミノ酸残基の中から結合エネルギーが高いアミノ酸残基を選択する段階;及び
(e)前記(d)段階で選択されたアミノ酸残基を結合エネルギーが低いアミノ酸残基に置換する段階を含む、標的特異的非抗体タンパク質の製造方法。
【請求項2】
前記(a)段階及び(b)段階は、順次に、または同時に行われることができるものである、請求項1に記載の標的特異的非抗体タンパク質の製造方法。
【請求項3】
前記(a)段階の非抗体タンパク質ライブラリーは、ヒトタンパク質のうち、10〜40kDaの分子量を有し、単量体(monomer)、同種二量体(homodimer)、及び同種三量体(homotrimer)のうち、いずれか一つ以上を形成することができる非抗体タンパク質を含むものである、請求項1に記載の標的特異的非抗体タンパク質の製造方法。
【請求項4】
前記(a)段階のライブラリーは、
(i)ヒトタンパク質のうち、10〜40kDaの分子量を有するタンパク質を選択する段階;
(ii)前記(i)段階で選択されたタンパク質から膜タンパク質及び抗体タンパク質を除去する段階;
(iii)前記(ii)段階で除去して残ったタンパク質から10個以下の相互作用が知られているタンパク質を選択する段階;及び
(iv)前記(iii)段階で選択されたタンパク質に単量体(monomer)、同種二量体(homodimer)、及び同種三量体(homotrimer)のうち、いずれか一つ以上を形成することができるタンパク質を選択する段階を含む方法で製造するものである、請求項1に記載の標的特異的非抗体タンパク質の製造方法。
【請求項5】
前記(a)段階は、ドッキングシミュレーションを行って選別するものである、請求項1に記載の標的特異的非抗体タンパク質の製造方法。
【請求項6】
前記(a)段階のドッキングシミュレーションは、前記標的タンパク質のアミノ酸残基などのうち、既設定された個数以上結合される非抗体タンパク質を選択する段階である、請求項5に記載の標的特異的非抗体タンパク質の製造方法。
【請求項7】
前記(e)段階は、ファージディスプレイ及びバイオパニング(biopanning)を行ってなるものである、請求項1に記載の標的特異的非抗体タンパク質の製造方法。
【請求項8】
前記(a)段階の標的タンパク質は、EGFR(Epidermal Growth Factor Receptor)ドメイン2である、請求項1に記載の標的特異的非抗体タンパク質の製造方法。
【請求項9】
前記(a)段階は、前記標的タンパク質の残基は28個であり、前記既設定された個数は10個である、請求項8に記載の標的特異的非抗体タンパク質の製造方法。
【請求項10】
EGFRドメイン2に特異的に結合する標的特異的非抗体タンパク質。
【請求項11】
前記標的特異的非抗体タンパク質は、請求項1〜9のうち、いずれか1項の方法で製造するものである、請求項10に記載の標的特異的非抗体タンパク質。
【請求項12】
前記標的特異的非抗体タンパク質は、配列番号3、4または5のアミノ酸配列を有するものである、請求項11に記載の標的特異的非抗体タンパク質。
【請求項13】
請求項10の非抗体タンパク質をコードする核酸。
【請求項14】
前記核酸は、配列番号7、8または9の核酸配列を有するものである、請求項13に記載の核酸。
【請求項15】
請求項13の核酸を含むベクター。
【請求項16】
請求項15のベクターに形質転換された形質転換体。
【請求項17】
請求項10の非抗体タンパク質を含む癌治療用組成物。
【請求項1】
(a)非抗体タンパク質のライブラリーから標的タンパク質の標的部位と構造的相補性を有する非抗体タンパク質とを選別する段階;
(b)前記選別された非抗体タンパク質と標的タンパク質との結合エネルギーを計算する段階;
(c)前記選別された非抗体タンパク質の中から安定した結合エネルギーを有する非抗体タンパク質を選別する段階;
(d)選定された非抗体タンパク質と標的タンパク質とが直接接触するアミノ酸残基の中から結合エネルギーが高いアミノ酸残基を選択する段階;及び
(e)前記(d)段階で選択されたアミノ酸残基を結合エネルギーが低いアミノ酸残基に置換する段階を含む、標的特異的非抗体タンパク質の製造方法。
【請求項2】
前記(a)段階及び(b)段階は、順次に、または同時に行われることができるものである、請求項1に記載の標的特異的非抗体タンパク質の製造方法。
【請求項3】
前記(a)段階の非抗体タンパク質ライブラリーは、ヒトタンパク質のうち、10〜40kDaの分子量を有し、単量体(monomer)、同種二量体(homodimer)、及び同種三量体(homotrimer)のうち、いずれか一つ以上を形成することができる非抗体タンパク質を含むものである、請求項1に記載の標的特異的非抗体タンパク質の製造方法。
【請求項4】
前記(a)段階のライブラリーは、
(i)ヒトタンパク質のうち、10〜40kDaの分子量を有するタンパク質を選択する段階;
(ii)前記(i)段階で選択されたタンパク質から膜タンパク質及び抗体タンパク質を除去する段階;
(iii)前記(ii)段階で除去して残ったタンパク質から10個以下の相互作用が知られているタンパク質を選択する段階;及び
(iv)前記(iii)段階で選択されたタンパク質に単量体(monomer)、同種二量体(homodimer)、及び同種三量体(homotrimer)のうち、いずれか一つ以上を形成することができるタンパク質を選択する段階を含む方法で製造するものである、請求項1に記載の標的特異的非抗体タンパク質の製造方法。
【請求項5】
前記(a)段階は、ドッキングシミュレーションを行って選別するものである、請求項1に記載の標的特異的非抗体タンパク質の製造方法。
【請求項6】
前記(a)段階のドッキングシミュレーションは、前記標的タンパク質のアミノ酸残基などのうち、既設定された個数以上結合される非抗体タンパク質を選択する段階である、請求項5に記載の標的特異的非抗体タンパク質の製造方法。
【請求項7】
前記(e)段階は、ファージディスプレイ及びバイオパニング(biopanning)を行ってなるものである、請求項1に記載の標的特異的非抗体タンパク質の製造方法。
【請求項8】
前記(a)段階の標的タンパク質は、EGFR(Epidermal Growth Factor Receptor)ドメイン2である、請求項1に記載の標的特異的非抗体タンパク質の製造方法。
【請求項9】
前記(a)段階は、前記標的タンパク質の残基は28個であり、前記既設定された個数は10個である、請求項8に記載の標的特異的非抗体タンパク質の製造方法。
【請求項10】
EGFRドメイン2に特異的に結合する標的特異的非抗体タンパク質。
【請求項11】
前記標的特異的非抗体タンパク質は、請求項1〜9のうち、いずれか1項の方法で製造するものである、請求項10に記載の標的特異的非抗体タンパク質。
【請求項12】
前記標的特異的非抗体タンパク質は、配列番号3、4または5のアミノ酸配列を有するものである、請求項11に記載の標的特異的非抗体タンパク質。
【請求項13】
請求項10の非抗体タンパク質をコードする核酸。
【請求項14】
前記核酸は、配列番号7、8または9の核酸配列を有するものである、請求項13に記載の核酸。
【請求項15】
請求項13の核酸を含むベクター。
【請求項16】
請求項15のベクターに形質転換された形質転換体。
【請求項17】
請求項10の非抗体タンパク質を含む癌治療用組成物。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【公表番号】特表2012−523248(P2012−523248A)
【公表日】平成24年10月4日(2012.10.4)
【国際特許分類】
【出願番号】特願2012−505820(P2012−505820)
【出願日】平成22年4月14日(2010.4.14)
【国際出願番号】PCT/KR2010/002318
【国際公開番号】WO2010/120121
【国際公開日】平成22年10月21日(2010.10.21)
【出願人】(509327541)ポステク アカデミー−インダストリー ファウンデイション (3)
【氏名又は名称原語表記】POSTECH ACADEMY−INDUSTRY FOUNDATION
【住所又は居所原語表記】Pohang University of Science and Technology,San 31,Hyoja−dong,Nam−gu,Pohang−si,Gyeongsangbuk−do 790−784,Republic of Korea
【Fターム(参考)】
【公表日】平成24年10月4日(2012.10.4)
【国際特許分類】
【出願日】平成22年4月14日(2010.4.14)
【国際出願番号】PCT/KR2010/002318
【国際公開番号】WO2010/120121
【国際公開日】平成22年10月21日(2010.10.21)
【出願人】(509327541)ポステク アカデミー−インダストリー ファウンデイション (3)
【氏名又は名称原語表記】POSTECH ACADEMY−INDUSTRY FOUNDATION
【住所又は居所原語表記】Pohang University of Science and Technology,San 31,Hyoja−dong,Nam−gu,Pohang−si,Gyeongsangbuk−do 790−784,Republic of Korea
【Fターム(参考)】
[ Back to top ]

