標的細胞表面の標的分子に特異的に結合する核酸の選択法
【課題】特定の細胞に特徴的な細胞表面の標的タンパク質に特異的に結合する核酸鎖を容易に得る方法の提供。
【解決手段】特定の細胞表面の標的タンパク質に特異的に結合する核酸鎖候補を精製回収するために、細胞表面のタンパク質等に核酸鎖候補を結合させたのち、膜表面タンパク質等を分解するプロテアーゼ等のタンパク質分解酵素を作用させて、膜たんぱく質を分解することで回収することができる。
【解決手段】特定の細胞表面の標的タンパク質に特異的に結合する核酸鎖候補を精製回収するために、細胞表面のタンパク質等に核酸鎖候補を結合させたのち、膜表面タンパク質等を分解するプロテアーゼ等のタンパク質分解酵素を作用させて、膜たんぱく質を分解することで回収することができる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、標的細胞表面の標的分子に特異的に結合する核酸鎖の選択・回収法、それによる細胞培養方法に関する。
【背景技術】
【0002】
一本鎖核酸はその高次構造により、特定の標的分子に対して結合能を有することが、1990年にC. Tuerkらのグループによって報告(非特許文献1:Science, 249, 505-510 (1990))され、それらの核酸は「アプタマー」と命名された。これまでイオンや糖鎖、タンパク質、生細胞表面上の分子に親和性のあるアプタマー、さらにはタンパク質のリン酸化状態を判別するアプタマーなどが先行研究により多数報告されている。アプタマーは大別して一本鎖DNAまたは一本鎖RNAから成るが、他にもペプチドアプタマーなどが報告されている。またそれらの中には人工塩基を用いたアプタマー、ポリエチレングリコールなどの有機分子により修飾されたアプタマーなど、使用目的に合わせた修飾アプタマーも開発されている。
【0003】
これらアプタマーは、C. Tuerkらによって提案されたSELEX(Systematic Evolution of Ligands by Exponential Enrichment)という、目的の核酸分子の選別と、それら分子の増幅という2つのステップによって選択される。
【0004】
一般的には、まず、1014〜1016分子種の、両端が18〜38塩基ほどのプライマー配列に挟まれた30〜100塩基のランダム配列からなる全長が約60〜140塩基の核酸プールを準備する。次に、この核酸プールから、標的分子に親和性を有する配列を選別するが、この操作にはこれまで様々な方法が開発されている。一般に、標的分子のみを用いて親和性を有する核酸を選別する場合、最終的に得られたアプタマーの中には、非標的分子にも親和性を有する(抗体で言う“cross reactivity”)アプタマーが存在することも珍しくない。そのため、用いることが想定される多種類の分子が混合されているようなサンプルにおいて、標的分子には親和性を有するが非標的分子に親和性を有さないというアプタマーを、対向選別法(Counter Selection)によって選別することも行われている。
【0005】
その例として、2000年にScott D Seiwertらによって報告(非特許文献2:Chemistry & Biology, 7, 833-843 (2000))された、同じタンパク質のリン酸化状態を10倍の親和性の違いで識別するアプタマーがある。これは、はじめリン酸化状態のタンパク質ppERK2に結合するRNAを選別し、同時に非標的タンパク質として、リン酸化されていないタンパク質ERK2に選別されたRNAを導入して、それに結合しなかったRNAを回収する、という目的のRNAアプタマーを取得するものである。
【先行技術文献】
【非特許文献】
【0006】
【非特許文献1】Science, 249, 505-510 (1990)
【非特許文献2】Chemistry & Biology, 7, 833-843 (2000)
【発明の概要】
【発明が解決しようとする課題】
【0007】
このように、従来のSELEX法では核酸プールを標的タンパク質に結合させ回収し、(対向選別法の操作を経るならば、非標的タンパク質に適用した後に)PCRによって増幅後、核酸を再度、標的分子に結合させるという操作を行う。上記例はDNAの場合であったが、RNAの場合は、標的タンパク質に結合したRNAを回収し、(ここでも、対向選別法の操作を経るならば、非標的タンパク質に適用した後に)RT−PCRによる増幅後に、in vitro転写によってRNAプールを再生し、再度、標的分子に結合させる。通常、このプロセスを1回行っただけではアプタマーを選別することができないため、10〜20回は繰り返す必要がある。非標的分子に親和性を有する核酸を除去するための対向選別法も、各ラウンドについてその都度行わなければならないため、操作が非常に煩雑であり時間を要する方法である。
【0008】
これは、選別初期では選別予定核酸の絶対量・相対量がともに少なく、この中から選別予定の核酸のみを分離することが困難だからである。もし、この中からそれら選別予定以外の配列のみを除去できる方法が開発されれば、操作は非常に簡便なものになると考えられる。また上記先行研究では非標的タンパク質として単一タンパク質を用いているが、本件のような方法で、多種類の非標的タンパク質を用いて、それら全てに親和性を有さないが標的タンパク質にのみ親和性を有するような核酸を選別したという報告はされていない。また、この手法を特定の標的細胞表面の標的分子に結合する核酸鎖の精製手法として用いる場合には、細胞を破砕してタンパク質分子として精製する必要がある。
【0009】
したがって、本発明の目的は、上記のような複雑な手順を経ずに、かつ、細胞を破砕することなく、標的細胞表面に特異的に結合する核酸鎖を短時間で回収する方法を提案することである。
【0010】
さらに標的細胞表面に特異的に結合する核酸鎖を二種類以上用いて、異なる細胞同士の接着を制御する方法を提案することも目的としている。
【課題を解決するための手段】
【0011】
したがって、本発明は、以下を提供する。
(1)(i)標的細胞または標的細胞の集団に一本鎖核酸または一本鎖核酸プールを適用して上記標的細胞の表面に発現している標的分子に特異的に結合する一本鎖核酸を結合させる工程、
(ii)上記標的細胞の表面に発現している標的分子に特異的に結合しなかった一本鎖核酸を除去する工程、
(iii)上記標的細胞の表面に発現している標的分子の分解酵素を加えて上記標的分子を分解して、上記標的細胞の表面の標的分子に特異的に結合した一本鎖核酸を回収する工程、および
(iv)上記回収した一本鎖核酸をPCRにより増幅する工程、
を含む、標的細胞表面の標的分子に特異的に結合する核酸の選択法。
(2)さらに、
(v)上記回収した核酸の塩基配列を調べ、比較することで特異的な結合配列を決定し結合性を向上するように設計する工程、を含む、上記(1)に記載の方法。
(3)上記工程(i)〜(iv)で得られた一本鎖核酸を新たに一本鎖核酸プールとして用いて、再度、上記工程(i)〜(iv)を繰り返すことを含む、上記(1)または(2)に記載の方法。
(4)上記標的細胞の表面に発現している標的分子がタンパク質であり、上記分解酵素がタンパク質分解酵素である、上記(1)〜(3)のいずれか一項に記載の方法。
(5)上記(1)〜(4)のいずれか一項に記載の核酸選択法を使用する工程を含む、標的細胞に特異的に結合する核酸の製造方法。
(6)標的細胞の表面に発現している物質に特異的に結合する1以上の一本鎖核酸を基板上の特定の表面領域に付着させた細胞培養チップであって、上記標的細胞を上記一本鎖核酸と結合させることによって上記標的細胞を上記表面領域に固定して培養する、細胞培養チップ。
(7)上記(1)〜(4)のいずれか一項に記載の核酸選択法を使用して得られた、標的細胞毎に特異的に結合できる一本鎖核酸の一種類または二種類以上を用意する工程、および
複数の上記一本鎖核酸を直鎖状に結合させた核酸鎖を作製することで、核酸鎖を介して同じ標的細胞あるいは異なる二種類以上の標的細胞を培養基板上の特定の表面領域に接着させて、培養する工程、
を含む、細胞培養方法。
(8)上記(1)〜(4)のいずれか一項に記載の核酸選択法を使用して得られた、標的細胞毎に特異的に結合できる一本鎖核酸の一種類または二種類以上を用意する工程、
複数の上記一本鎖核酸を直鎖状に結合させた核酸鎖を作製する工程であって、上記複数の一本鎖核酸の互いの立体配置および機能を失わないように、上記複数の一本鎖核酸の間にスペーサー分子を挟み込む、工程、
を含むダブルアプタマー分子の作製方法。
(9)上記スペーサー分子が、二本鎖核酸、ポリエチレングリコール、あるいは生体不活性な分子である、上記(8)に記載の方法。
(10)上記(8)または(9)に記載のダブルアプタマー分子の製造方法によって製造されたダブルアプタマー分子で二種類以上の標的細胞をつなぎ合わせる工程、および
上記つなぎ合わされた二種類以上の標的細胞を解離させる工程、
を含む、標的細胞の連結−解離方法であって、
スペーサー分子が、制限酵素によって特異的に認識される特定の塩基配列が組み込まれた二本鎖核酸であり、
上記ダブルアプタマー分子に上記制限酵素を作用させることによって、上記二種類以上の標的細胞を解離させる、標的細胞の連結−解離方法。
(11)上記(8)または(9)に記載のダブルアプタマー分子の作製方法により作製したダブルアプタマーを介して同じ種類の細胞あるいは異なる二種類以上の細胞を接着させた後、該細胞を解離させる細胞の連結−解離方法であって、
スペーサー分子が、二本鎖核酸であり、
核酸分解酵素を作用させて上記二本鎖核酸を分解することによって、上記二種類以上の標的細胞を解離させる、細胞の連結−解離方法。
(12)上記(8)または(9)に記載のダブルアプタマーの作製方法により作製したダブルアプタマーを介してつなぎ合わされた同じ種類の細胞あるいは異なる二種類以上の細胞を培養基板上に配置する工程を含む、細胞培養方法。
(13)上記(12)に記載の細胞培養方法であって、
上記(10)または(11)に記載の標的細胞の連結−解離方法を含む、細胞培養方法。
(14)上記(1)〜(4)のいずれか一項に記載の核酸選択法を使用して得られた、標的細胞毎に特異的に結合できる一本鎖核酸の一種類または二種類以上を用意し、それらを直鎖状に結合させた核酸鎖を作製することで、シート状の細胞群を積層させる方法。
(15)上記(1)〜(4)のいずれか一項に記載の核酸選択法を使用して得られた、標的細胞毎に特異的に結合できる一本鎖核酸の一種類または二種類以上を用意し、それらを直鎖状に結合させた核酸鎖を作製することで、2つの細胞を接着させ、かつ、その後に核酸分解酵素によって接着に用いた核酸鎖を分解させる方法。
(16)上記(1)〜(4)のいずれか一項に記載の核酸選択法を使用して得られた、標的細胞毎に特異的に結合できる一本鎖核酸の一種類または二種類以上を用意し、それらを直鎖状に結合させることで、上記一種類あるいは2種類の細胞を両端に接着させる機能を有する核酸鎖。
(17)(i)予め準備した抗原を細胞表面に提示する機能を有する貪食細胞を用いて抗原となる細胞を貪食させる前に、上記貪食細胞に結合する一本鎖核酸を予め一本鎖核酸プールから排除することによって、精製された核酸プールを準備する工程、
(ii)上記貪食細胞に、標的細胞を貪食させて、標的細胞の断片を上記貪食細胞の表面に提示させる工程、
(iii)上記工程(i)において精製された核酸プールを適用して上記標的細胞を貪食した細胞の表面に提示された標的分子に特異的に結合する一本鎖DNAを結合させる工程、
(iv)上記特異的に結合しなかった一本鎖核酸を除去する工程、
(v)上記標的細胞の表面の標的分子に特異的に結合した一本鎖核酸を回収するために、分解酵素を加えて上記標的分子を分解して、結合した一本鎖核酸を回収する工程、
(vi)上記回収した一本鎖核酸をPCRにより増幅する工程、
(vii)上記、回収した核酸鎖の塩基配列を調べ、比較することで特異的な結合配列を決定し結合性を向上するように設計する工程、
を含む、標的細胞表面の標的分子に特異的に結合する核酸の選択法。
(18)上記抗原を細胞表面に提示する機能を有する貪食細胞が、マクロファージまたは樹状細胞である、上記(17)に記載の方法。
(19)上記回収した一本鎖核酸(またはアプタマー)の標的分子に対する特異的結合特性を確認するために、原子間力顕微鏡(AFM)探針先端に上記回収した一本鎖核酸のうちの1種類の塩基配列を有する一本鎖核酸を取り付けて細胞表面の標的分子との結合力を直接測定することにより力学的結合の強さを定量的に測定する工程を含む、上記(1)〜(4)および上記(17)のいずれかに記載の方法。
(20)上記回収した一本鎖核酸が標的細胞に対する結合部位を調べる際にAFM探針先端に上記回収した一本鎖核酸のうちの1種類の塩基配列を有する一本鎖核酸を取り付けて標的細胞との結合力を標的細胞表面上全体にわたり直接測定することにより細胞表面での結合力の分布の局所性を定量的に測定する工程を含む、上記(1)〜(4)および上記(17)のいずれかに記載の方法。
【0012】
本発明は、別の表現を用いれば、以下の核酸鎖選択法および核酸製造方法および細胞培養方法を提供する。
(1)(i)標的細胞のみからなる集団に一本鎖核酸プールを適用して上記標的細胞の表面に発現しているタンパク質等の標的分子に特異的に結合する一本鎖核酸を結合させる工程、
(ii)上記特異的に結合しなかった一本鎖核酸を除去する工程、
(iii)上記標的細胞の表面の標的分子に特異的に結合した一本鎖核酸を回収するために、トリプシン等のタンパク質分解酵素等を加えて上記標的分子を分解して、結合した一本鎖核酸を回収する工程、
(iv)上記回収した一本鎖核酸をPCRにより増幅する工程、
を含む、標的細胞表面の標的分子に特異的に結合する核酸の選択法。
(2)上記工程(i)〜(iv)で得られた一本鎖核酸を新たに一本鎖核酸プールとして用いて、再度、上記工程(i)〜(iv)を繰り返す工程を行って、一本鎖核酸プールの精度を段階的に高めながら、上記標的細胞に結合する一本鎖核酸の精度を高める、上記(1)記載の核酸選択法。
(3)上記(1)〜(2)のいずれか記載の核酸選択法を使用する工程を含む、標的細胞に特異的に結合する核酸の製造方法。
(4)回収した標的細胞に特異的に結合する一本鎖核酸を、細胞培養を行う基板上の特定の細胞を培養させたい領域の底面に修飾し、標的細胞をその場に固定し、培養する細胞培養チップ。
【0013】
本発明において、核酸(鎖)は、DNA(鎖)またはRNA(鎖)であり得る。なお、本明細書中、核酸と核酸鎖、DNAとDNA鎖、およびRNAとRNA鎖とは、それぞれ交換可能に(interchangeably)用いられる。
【0014】
本発明では、標的細胞のみに特異的に親和性を有する核酸を選別する。この選別過程は以下のようである。
【0015】
まず、標的となる細胞を多種の細胞が混ざった集団から選択する。次いで、核酸プールを選択した標的細胞の集団に適用し、標的細胞表面の標的分子と特異的に結合する核酸を結合させる。
【0016】
そこで、次に、標的細胞表面の分子に結合した核酸を回収するために、標的細胞表面の分子を分解し、結合した核酸を選択的に回収する。このとき、分子がタンパク質の場合は、トリプシンなどのタンパク質分解酵素を用いる。また、この段階で分子を分解するために用いる酵素は、トリプシンのように結合した核酸を分解する等の影響を何ら与えずに細胞表面の分子のみを分解するものとする。
【0017】
次いで、回収した核酸をPCR増幅することで目的とする標識細胞への結合性を有する核酸鎖を得ることができる。また、さらにこの得られた核酸鎖を、新たな核酸スープとして、同じ工程を繰り返し行うことで、また、より少ない細胞集団数で工程を行うことで、より高い精度の核酸鎖を得ることができる。また、標的細胞表面の分子を分解する酵素についても、複数の特性の異なる酵素を段階的に利用することで、細胞表面の異なる標的分子に対する核酸鎖を回収することができる。
【0018】
また、得られた核酸鎖(アプタマー)について、その塩基配列の異なるものの特性の比較を行うために、1つの塩基配列のアプタマーについて各々AFM探針先端に取り付けて、得られたアプタマーと標的細胞表面間の結合力と結合力が高まる細胞表面の部位を測定することにより、各塩基配列のアプタマーの力学的結合特性を定量的に特定することが可能であり、かつ、特定の部位への結合性能を有するより選択性の高いアプタマーを選別することができる。
【0019】
また、回収した核酸鎖を新しい細胞培養チップの底面の細胞を配置したい特定の場所の底面に修飾することで、細胞を修飾した核酸鎖の空間パターンに合わせて結合して配置することができる。この場合には、核酸鎖は、培養初期の細胞の固定に用いられ、細胞が十分に基板に結合したと考えられるところで、核酸分解酵素あるいは核酸分解酵素が含まれている血清培地を添加することで、基板底面に細胞を結合させていた核酸鎖を消失させることができる。
【0020】
上記の工程はすべてDNA鎖だけでなく、RNA鎖等の核酸鎖でも同様に行うことができる。
【0021】
標的細胞を二種類用意し、それぞれの細胞に対し特異的な結合性を有する核酸鎖を二種類用意する。それぞれの核酸鎖を二重鎖の核酸鎖で繋ぎ合せた構造を提供する。これにより、異なる二種類の細胞を作製した核酸鎖を介して人工的に接着させる。
【0022】
標的細胞を二種類用意し、それぞれの細胞に対し特異的な結合性を有する核酸鎖を二種類用意する。それぞれの核酸鎖を二重鎖のDNAあるいはポリエチレングリコールなどで繋ぎ合せた構造を提供する。
【0023】
それぞれの細胞に対し特異的な結合性を有する核酸鎖によって挟みこむ核酸鎖には特定の塩基配列のみを認識し切断できる制限酵素の認識部位を組み込むことによって、人工的に核酸鎖を切断できる。それにより、細胞の引きあわせと乖離を自在にコントロールする。
【0024】
標的細胞を二種類用意し、それぞれの細胞に対し特異的な結合性を有する核酸鎖を二種類用意する。さらにそれぞれの核酸鎖を二重鎖の核酸あるいはポリエチレングリコールなどで繋ぎ合せた構造を用意する。これを用いて、培養中の細胞に対し、異なる特定の細胞を特定の位置、あるいは層状に積層することを提供する。
【0025】
細胞毎に特異的に結合できる上記(1)〜(3)のいずれか記載の核酸選択法により得られた一本鎖核酸を一種類あるいは二種類以上用意し、それらを直鎖状に結合させた核酸鎖を作製することで、2つの細胞を接着させ、かつ、その後に核酸分解酵素によって接着に用いた核酸鎖を分解させる方法を提供する。
(i)予め準備したマクロファージ、樹状細胞等の抗原を細胞表面に提示する機能を有する貪食細胞を用いて抗原となる細胞を貪食させる前に、前記貪食細胞に結合する一本鎖核酸を予め一本鎖核酸プールから排除して、精製された核酸プールを準備する工程、
(ii)前記貪食細胞に、標的細胞を貪食させて、標的細胞の断片を前記貪食細胞の表面に提示させる工程、
(iii)前記工程(i)において精製した核酸プールを適用して前記標的細胞を貪食した細胞の表面に提示されたタンパク質等の分子に特異的に結合する一本鎖核酸を結合させる工程、
(iv)前記特異的に結合しなかった一本鎖核酸を除去する工程、
(v)前記、標的細胞の表面の分子に特異的に結合した一本鎖核酸を回収するために、トリプシン等のタンパク質分解酵素等を加えて上記分子を分解して、結合した一本鎖核酸を回収する工程、
(vi)前記、回収した一本鎖核酸をPCRにより増幅する工程、
(vii)前記、回収した核酸の塩基配列を調べ、比較することで特異的な結合配列を決定し結合性を向上するように設計する工程、
を含む、標的細胞表面の分子に特異的に結合する核酸の選択法を提供する。
【発明の効果】
【0026】
本発明によれば、精製した特定の細胞に結合する核酸鎖を短時間で簡便に得ることができる。また、精製した特定の細胞の特定の部位に結合する核酸鎖を選択的に回収することができる。また、核酸鎖を用いて、標的細胞を基板上に配置し、配置後に配置に用いた核酸鎖を除去することができる。
【図面の簡単な説明】
【0027】
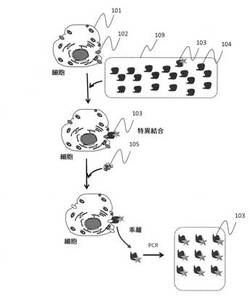
【図1】標的細胞表面の標的分子に特異的に結合する核酸鎖を精製する手法の手順を示した模式図である。
【図2】試験管を用いたバッチ処理による標的浮遊細胞表面の標的分子に特異的に結合する核酸鎖を精製する手法の手順を示した模式図である。
【図3】培養皿を用いたバッチ処理による培養皿底面に接着した標的培養細胞表面の標的分子に特異的に結合する核酸鎖を精製する手法の手順を示した模式図である。
【図4】細胞カラムを用いた標的細胞表面に結合する核酸鎖を精製するフラクションコレクター装置のしくみを示す模式図である。
【図5】本発明の方法で精製した核酸鎖を用いて標的細胞を基板上の特定の場所に固定する技術を説明する模式図である。
【図6】本発明で作製した標的細胞を二種類に対しそれぞれ特異的な結合性を有する核酸鎖を結合させたダブルアプタマーの構造を模式的に示した図である。(a)二種類用意し二重鎖の核酸で繋ぎ合せたダブルアプタマーの構造の模式図、(b)それぞれの核酸鎖が共通配列でハイブリダイゼーションできる構造体を有するダブルアプタマーの構造の模式図、(c)それぞれの認識配列をポリエチレングリコールでつないだ構造の模式図、(d)それぞれ末端にポリエチレングリコールとそれらをハイブリダイゼーションするための核酸鎖を有するダブルアプタマーの構造の模式図である。
【図7】ダブルアプタマーを用いて、異なる種類の細胞を結合させていき、人工的な生体組織を構築する工程の模式図である。
【図8】培養シャーレ上で培養している細胞の特定の細胞にダブルアプタマーを用いて別の異なる細胞をパターニング培養する工程の模式図である。
【図9】ダブルアプタマーを用いて培養中の細胞層を積層させる工程の模式図である。
【図10】異なる種類のダブルアプタマーを用いて様々な細胞を結合させる工程の模式図である。
【図11】ダブルアプタマーのスペーサー上に制限酵素認識部位を設計することで、ダブルアプタマーで一度引き寄せた細胞でも制限酵素で再度離す工程の模式図である。
【図12】マクロファージ、樹状細胞等の抗原提示型細胞の有する抗原提示機能を利用して標的細胞表面の標的分子に特異的に結合する核酸鎖を精製する手法の手順のひとつを示した模式図である。
【図13】AFMを利用して核酸鎖の標的細胞表面上結合部位とその結合力を計測する方法を示す模式図である。核酸鎖が3種類得られた場合を例示している。(a)一つ目の核酸鎖をAFM探針に取り付けて結合力測定を行う模式図、(b)二つ目の核酸鎖を取り付けた場合、(C)三つ目の場合、(d)標的細胞基板表面からのAFM探針の距離とカンチレバー変位量の関係を示したグラフである。
【図14】標的細胞の上で3種類の核酸鎖に対する標的分子の存在部位をそれぞれマップとして表した模式図である。(a)一つ目の核酸鎖をAFM探針に取り付けた場合、(b)二つ目の場合、(C)三つ目の場合である。(d)実際に神経細胞に対して、AFMによる精製を行う例のひとつである。神経細胞の軸索、樹状突起等の神経突起にひとつの先端部分にてアプタマーと細胞表面との結合を測定する事で、神経突起の先端に選択的に発現しているレセプタータンパク質と特異的に結合するアプタマーを選択することができる。
【発明を実施するための形態】
【0028】
図1は本発明の核酸選択法を説明するフロー図である。すなわち、標的細胞表面のイオンチャンネルタンパク質等の分子に特異的に結合する核酸を簡便に選別する本発明の方法の過程を示している。ここで、核酸鎖としては、DNA鎖、RNA鎖などのタンパク質分解酵素によって分解されない核酸鎖が含まれる。
【0029】
本明細書中、ある核酸があるタンパク質またはその断片に「特異的に結合する」とは、その核酸が、そのタンパク質またはその断片の特定のアミノ酸配列に対して、他の(タンパク質またはその断片の)アミノ酸配列に対する親和性よりも、実質的に高い親和性で結合することを意味する。ここで、「実質的に高い親和性」とは、当業者に利用可能な所望の測定装置または方法によって、その特定のアミノ酸配列を他のアミノ酸配列から区別して検出することが可能な程度に高い親和性を意味し、典型的には、結合定数(Ka)が少なくとも107M−1、好ましくは、少なくとも108M−1、より好ましくは、109M−1、さらにより好ましくは、1010M−1、1011M−1、1012M−1またはそれより高い、例えば、最高で1013M−1またはそれより高いものであるような結合親和性を意味する。
【0030】
図1に示すように、本発明の方法によれば、標的細胞101の表面に発現した分子102に対して特異的に結合する核酸鎖103が、結合性を有さない核酸鎖104も含まれる核酸プール(またはアプタマープール)109から選択的に抽出されることができる。実際に標的細胞101と核酸鎖103、104を反応させると、結合性を有する核酸鎖103のみが細胞表面に結合する。次のステップにおいて、トリプシン等の核酸を分解せず、タンパク質を分解する酵素で処理を行うことによって、結合しなかった核酸鎖を洗浄除去して、標的細胞表面の標的分子(核酸鎖と結合した分子)を分解させる。そうすると、標的分子の分解にあわせて、これに結合していた核酸鎖が溶液中にリリースされてくるので、これを回収してPCR増幅することで標的細胞に結合するさまざまな核酸鎖を集めることができる。
【0031】
この手順を、再度、核酸ソースとして上記手順で得られた結合能を有する核酸鎖を用いて、より多数の標的細胞を用いて繰り返し行うことで、核酸鎖の選択制を高くすることができる。また、精度を上げるためには、標的細胞の集団について、その1細胞単位での結合を計測してもよい。その場合は、細胞ごとに微妙に異なる結合核酸鎖のデータがそのまま得られるため、集団で計測したときにはわからなかった細胞ごとの結合核酸鎖の違いを評価することができる。そして、多くの細胞について、最も高い結合特性を有するものを見出すことができる。
【0032】
また、上記図1に示した手法では、直接標的細胞を用いた結合性核酸鎖の精製方法を示したが、図12に示したように、マクロファージや樹状細胞等の貪食能と貪食した細胞等の断片を抗原提示物質として細胞表面に提示する機能を利用して標的細胞の細胞表面の特徴的な抗原分子を提示させてこれと結合するアプタマーを特異的に選択する手法による精製手法もある。これは、(i)あらかじめ準備したマクロファージ、樹状細胞等の抗原を細胞表面に提示する機能を有する貪食細胞110を用いて、抗原となる細胞101を貪食させる前に、上記貪食細胞110に結合する一本鎖核酸(DNAまたはRNA)を一本鎖核酸プールから排除する工程によって、まずはマクロファージ等の貪食細胞110にもともと結合する可能性のある核酸鎖を排除した精製された核酸プール111を調製した後に、(ii)上記貪食細胞に、標的細胞101を貪食させて、標的細胞の抗原提示用の断片102を上記貪食細胞の表面に提示させる工程によって、生体の抗原提示機能を巧みに利用して、貪食細胞表面に抗原提示物質を精製することにより、(iii)上記工程(i)において精製した核酸プール111を適用して上記標的細胞を貪食した細胞の表面に提示されたタンパク質等の分子に特異的に結合する一本鎖DNA(あるいは一本鎖RNA)を結合させる工程によって標的細胞の抗原提示部位に特異的に結合するDNA鎖(あるいはRNA鎖)を上記貪食細胞表面に結合させ、さらに(iv)上記特異的に結合しなかった一本鎖DNA(あるいはRNA)を除去する洗浄工程によって十分に上記貪食細胞表面を洗浄した後に、(v)上記、標的細胞の表面の分子に特異的に結合した一本鎖DNA(あるいはRNA)を回収するために、トリプシン等のタンパク質分解酵素等を加えて上記分子を分解して、結合した一本鎖核酸を回収する工程、(vi)上記回収した1本鎖DNA(あるいはRNA)をPCRにより増幅する工程によって標的細胞の上記貪食細胞の抗原提示機能によって提示された標的細胞の標的部位に結合能を有する核酸鎖を精製することができ、さらに(vii)上記回収したDNA鎖(あるいはRNA鎖)の塩基配列を調べ、比較することで特異的な結合配列を決定し結合性を向上するように設計する工程を含む方法により、標的細胞表面の分子に特異的に結合する核酸を精製してもよい。
【0033】
この場合、たとえば貪食細胞としてマクロファージ細胞株J774.2などの細胞株を用いても良いし、個別化医療の対象とする場合には、患者由来のマクロファージや樹状細胞等の貪食細胞、あるいは患者由来のiPS細胞から分化させた貪食細胞を用いても良い。
【0034】
さらに、より精度と選択性を高めるためには、引き続き、以下に述べる工程を含む精製法を用いることができる。すなわち(I)得られた核酸鎖群の塩基配列情報をシークエンサーによって解読し、その塩基配列情報の結果についてホモロジー検索を行い、実質的な相同性(例:60%以上、70%以上、80%以上、または90%以上の同一性)を有する配列を抽出する工程、(II)標的細胞に対して混在する可能性のある別細胞に結合する塩基配列の抽出と、シークエンサーによる解読と、得られた塩基配列のホモロジー検索とを行い、実質的な相同性を有する配列を抽出する工程、(III)(I)で得られた配列から(II)で得られた配列を排除する情報処理を行って選択された塩基配列を有する核酸鎖を、標的細胞に対して特異的に結合する核酸鎖として得る工程。
【0035】
また、上記の工程(III)の結果として得られた核酸鎖について、さらに精製された膜タンパク質、糖鎖と結合を行わせて結合能を定量的に評価することで、得られた核酸鎖の標的物質についても同定することが可能である。
【0036】
より精度と選択性を高めるための方法として、精製した核酸鎖(アプタマー)について、引き続き、以下に述べる工程を含む精製法を用いることができる。すなわち(I)得られた核酸鎖群のうち各々の一種類の核酸鎖に対して、核酸の5'もしくは3'末端にアミノ基、チオール基、あるいはアビジンなどのAFM探針に結合させるための反応基を導入したものを作製する工程、(II)(I)で作製した核酸をAFM探針先端にAu-S結合、アビジン-ビオチン結合、あるいは2架性架橋剤を介した共有結合などの結合手段により固定化する工程、(III)(II)で作製した核酸固定済みAFM探針を、ひとつの標的細胞の表面で細胞に対して近づけた後に遠ざける作業を行って、細胞上の位置と関連づけて計測を繰り返す工程であって、AFM探針が標的細胞に接触後遠ざかる際に探針表面の核酸と標的細胞表面の標的分子の結合破壊に由来する破断力を計測して細胞表面でのアプタマーの結合力の空間分布を細胞形状の特性と合わせて測定する工程、(IV)(I)から(III)の工程を得られた核酸鎖群全てに対して行った後得られた核酸鎖群の中から最も結合力が強い核酸鎖の種類とその核酸鎖の細胞表面上での結合部位を同定する工程。なお、使用される反応基等は上記のものに限定されない。
【0037】
上述の図1で述べた細胞結合性の核酸鎖を精製する過程について、以下により具体的な処理について説明する。
【0038】
(実施例1)
実施例1では、浮遊細胞について、以下の手順により標的細胞に特異的に結合する核酸を得る。図2にその手順の概要を模式的に示す。
【0039】
(I)標的細胞と核酸鎖との結合
図2を参照して、
(1)試験管201内に浮遊している標的細胞101に、核酸鎖103、104を添加して、標的細胞と核酸鎖を反応させる。
【0040】
(2)細胞と反応しなかった核酸鎖は試験管から除去され、細胞に結合した核酸のみがある状況となったことを確認してから、たとえば細胞表面のタンパク質を分解するために、トリプシンなどのタンパク質分解酵素を含む細胞表面分子分解酵素105を添加する。この結果、細胞表面の分子は、それぞれの性質や核酸鎖との結合状態の違いなどによって時間的に差を持って細胞表面から溶出することとなる。また、本実施例では細胞表面分子分解酵素としてタンパク質分解酵素であるトリプシンを使ったが、糖鎖分解酵素や、他のタンパク質分解酵素を用いてもよい。このような酵素を、バッチ処理として組み合わせてシリーズで用いることで、標的細胞表面の分子の違いにあわせて異なる分子を標的とした核酸鎖の回収が可能となる。
(3)回収した一本鎖核酸をPCR増幅して回収する。
上記標的細胞に結合した核酸鎖を回収し、これをPCR反応させて増幅する。
(実施例2)
実施例2では、細胞培養皿底面に結合して培養されている細胞について、以下の手順により標的細胞に特異的に結合する核酸を得る。図3にその手順の概要を模式的に示す。
【0041】
(I)標的細胞と核酸鎖との結合
図3を参照して、
(1)細胞培養皿301内の細胞培養物に核酸鎖103、104を添加して、細胞培養物中で浮遊している標的細胞101と核酸鎖とを反応させる。
【0042】
(2)細胞と反応しなかった核酸鎖は細胞培養皿から除去され、細胞に結合した核酸のみがある状況となったことを確認してから、たとえば細胞表面のタンパク質を分解するために、トリプシンなどのタンパク質分解酵素を含む細胞表面分子分解酵素105を添加する。この結果、細胞表面の分子は、それぞれの性質や核酸鎖との結合状態の違いなどによって時間的に差を持って細胞表面から溶出することとなる。また、本実施例では細胞表面分子分解酵素としてタンパク質分解酵素であるトリプシンを使ったが、糖鎖分解酵素や、他のタンパク質分解酵素を用いてもよい。このような酵素を、バッチ処理として組み合わせてシリーズで用いることで、標的細胞表面の分子の違いにあわせて異なる分子を標的とした核酸鎖の回収が可能となる。
(3)回収した一本鎖核酸をPCR増幅して回収する。
上記標的細胞に結合した核酸鎖を回収し、これをPCR反応させて増幅する。
【0043】
本明細書中、核酸(ヌクレオチド)配列について「ハイブリダイゼーション」とは、ヌクレオチド配列同士の相補性が高い場合、二本鎖を形成することをいう。通常、二本鎖は、互いの核酸が相補的になるように設計されているが、必要に応じて(例えば、核酸を検出に使用する場合は、その目的上、問題が生じない範囲において)、その核酸中に、1または複数個(例えば、2〜5個)のミスマッチを含んでいてもよい。存在してもよいミスマッチの数は、例えば、要求される検出精度、ヌクレオチド配列(または塩基配列もしくは核酸(配列)もしくはポリヌクレオチド)の長さに応じて変化し得る。なお、核酸配列と、それがハイブリダイズする相手の核酸配列とのハイブリダイゼーション条件を適宜変更することにより、ミスマッチが存在する場合を排除したり、許容できるミスマッチの数を調整したりすることができることは当業者に周知である。
【0044】
なお、ハイブリダイゼーションのストリンジェンシーは、例えば、5×SSC、5×デンハルト溶液、0.5%(w/v)SDS、50%(w/v)ホルムアミド、50℃、のように決定され得る。ただし、本発明で用いられる核酸配列の担体への固定部分は、どの核酸配列でも共通であることから、ハイブリダイゼーションは、この固定部分の融解温度(Melting Temperature)よりは少なくとも高い温度で行うこと、また、これらの条件において、温度を上げるほど高い同一性を有する核酸が効率的に得られることは当業者に周知である。ハイブリダイゼーションのストリンジェンシーに影響する要素としては温度、核酸の濃度、核酸の長さ、イオン強度、時間、塩濃度など複数の要素が考えられ、当業者であればこれら要素を適宜選択することで同様のストリンジェンシーを実現することが可能である。
【0045】
(実施例3)
図4は、細胞カラムを用いた標的細胞表面に結合する核酸鎖を精製するフラクションコレクター装置のしくみを示す模式図である。図4に示したように、この装置は、細胞カラム401と、細胞カラムから滴下される分解産物核酸鎖103を含む水溶液を回収する試験管402のアレイと、この試験管アレイを時間経過に合わせて403の方向へ移動させる手段とを備える。
【0046】
標的細胞101を含むカラム401に標的細胞表面の分子を分解する酵素105を添加すると、カラム401内の標的細胞101に結合していた核酸鎖103は滴下され、試験管402中のフラクションの中に集められることとなる。
【0047】
(実施例4)
図5は、本発明の方法で精製した核酸鎖を用いて標的細胞を基板上の特定の場所に固定した状態を示す模式図である。図5に示したように、細胞培養観察を行う基板501の上の特異的領域に、上記手順で作った標的細胞101に結合能を有する核酸鎖103を修飾し、この結合能を有する核酸鎖103に標的細胞101が結合することで、細胞を特定の位置に固定することができる。ただし、この手順では、核酸分解酵素などが含まれていない培養溶液を使うことが好ましい。また、ここで特記すべきこととして、当初、なかなか培養のための接着が難しい浮遊状態の細胞を、基板501の表面(この場合は電極502の上)の特定の領域に接合させることができるが、細胞と基板の間の接着が十分に安定したところで、無血清培地から血清培地に変えることで基板上に修飾された核酸鎖を分解、消失させることができる。
【0048】
(実施例5)
上記のように、標的細胞に特異的に結合する核酸鎖103を2つ以上組み合わせて機能を維持しながら1つの高分子となるように結合させることで、複数の標的細胞を互いに接着結合させるアンカー(結合素子:糊の役割)として用いることができる。これを用いれば、例えば、培地培養系においては、特定の標的細胞に選択的に接着させたい細胞を接着させた後に、血清培地、あるいは核酸分解酵素(例えば、DNA分解酵素、RNA分解酵素等)を無血清培地に添加することで、結合に用いた核酸鎖は完全に分解させることができる。また、ここで用いる核酸鎖自体が細胞外で用いる生体物質であることから、生体に対しては特に有害物質とはならないため、この排除工程を省くことも可能である。
【0049】
例えば、2つの核酸鎖を結合させた例(以下、「ダブルアプタマー」と呼ぶ。)としては、図6に示したように、異なる特定の細胞を認識する核酸鎖二種類(601ならびに602)を、それらの細胞結合の機能を損なわないように結合させる20塩基長以上のスペーサー核酸(603/604、605/606)あるいは鎖長10nm以上のポリエチレングリコール607等の核酸鎖と水素結合を形成しない生体親和性の高い有機高分子(または生体不活性な分子)を用いて直鎖状に作製すれば良い。スペーサーとなる分子は、細胞認識に必要な両端の核酸鎖の立体構造がお互いに干渉しない分子または長さを有するものにする。また、スペーサーとなる核酸配列(603/604)の内部には特定の制限酵素が認識できる配列を含む。
【0050】
次に、図7を参照して、実際にダブルアプタマーを用いた細胞接着の工程について説明をする。図7では異なる2種類の標的細胞を認識する部位を有するダブルアプタマー701用いて多段階で細胞による組織を作製する工程を示している。まず、ダブルアプタマー701の2つの認識部位のうち、一方の認識部位と特異的に結合する第一標的細胞101とダブルアプタマーを反応させ、ダブルアプタマーが有する他方の認識部位と特異的に結合する第二標的細胞106と反応させて2つの細胞を接着させる。その後、しばらく培養後、核酸分解酵素703を用いて細胞に結合しているダブルアプタマーを分解する(分解した核酸鎖断片を704に示す)。その次に第二標的細胞に特異的に結合する部位と、第三標的細胞に特異的に結合する部位とを有するダブルアプタマー702を用いて、第二標的細胞106に、第三標的細胞107を結合させ、再度核酸分解酵素でダブルアプタマーを分解する。同様な工程を繰り返すことで、あらかじめプログラムされた手順によって人工的に3次元に細胞の配置、配列を1細胞レベルで制御して細胞集団の高次構造を構築することができ、最終的に空間情報を制御した組織を作製することができる。
【0051】
図8では、実際にすでに存在している組織表面あるいは細胞集団表面に対する利用の一例を示している。培養シャーレ中に培養している細胞集団101の中の特定の標的細胞106に対して、細胞106と細胞107に結合能を有する部位を有するダブルアプタマー702を用いることで、細胞集団のうちの細胞106のみに特異的に細胞107を接着することが可能である。同様に、生体中においても、細胞106をガン細胞、細胞107を樹状細胞、マクロファージ、T細胞、B細胞のいずれかとして用いれば、ガン細胞等の病巣細胞を特異的に攻撃する免疫系による治療手段として用いることもできる。ただし、この場合は、核酸鎖については分解を阻止するために核酸の糖鎖の一部を硫黄(S)に置換して核酸分解酵素によって溶解しないように加工すればよい。また、再生医療においても、ダブルアプタマーの片側の認識部位をターゲットとなる再生したい組織中の標的細胞のものとし、他方を標的細胞に接着させたい分化途上の未成熟分化細胞として、標的細胞に結合し接着することが可能である。
【0052】
図9では、培養シャーレ中に培養している単層の細胞シート上に異なる種類の細胞106をダブルアプタマーにより積層させていく手順の一例を示している。これにより、通常ではできなかった特定の細胞を細胞が有する情報を基にパターニングあるいは積層させることができる。
【0053】
図10では、特定の細胞に対して、2つの結合部位のうち1つの結合部位が異なるダブルアプタマーを用いることで、一つの標的細胞に対して様々な異種細胞を結合させることができる例を示した。
【0054】
図11では、ダブルアプタマーのスペーサー部位の塩基配列上に制限酵素で認識され、切断させる塩基配列を組み込むことにより、一度細胞同士をダブルアプタマーで引き寄せた後再度引き離すことができる。
【0055】
図13は、標的細胞と結合するいくつかの核酸鎖について、AFMを用いて結合力の比較と標的細胞に対する核酸鎖の結合部位同定を行うための概念図である。本実施例では、3種類の核酸鎖が得られた場合の例を示す。標的細胞101に結合する核酸鎖103-1、103-2、103-3に対して、AFMチップ1301の先端にある探針1302に固定化するために核酸鎖103-1、2、3の3'もしくは5'末端に反応基を導入したものを作製する。反応基の代表的なものとしてはアミノ基、チオール基、カルボキシル基、ビオチンなどであるが、この例に限らず一般に分子固定に広く用いられている反応基であればいずれのものでもよい。また、AFM探針1302の材質は代表的にはシリコン製、窒化シリコン製とそれら表面に金、銀などの薄膜を形成したものであるが、この例に限らず一般にAFM探針として用いられているものであればいずれの材質でも構わない。また、チップ先端にカーボンナノチューブ、マイクロビーズ、金属ウィスカなどを取り付けて探針として利用することもできる。核酸鎖103-1、2、3を固定化するために、必要に応じてAFM探針1302を予め化学処理することも有用である。例えば窒化シリコン製探針に対して、3-aminopropyltriethoxysilaneを反応させて探針表面にアミノ基を導入することにより、3'もしくは5'末端にカルボキシル基を導入した核酸鎖を固定化することができる。また、表面に金や銀の薄膜を形成した探針に対しては、3'もしくは5'末端にチオール基を導入した核酸鎖を固定化することができる。これらの方法により、ひとつのAFM探針1302に対して1種類の核酸鎖を固定化したものを核酸鎖103-1、2、3それぞれに対して作製する。
【0056】
次に、作製した核酸鎖固定化済みAFM探針を基板上に存在する標的細胞101に対して近づけた後に遠ざける。その方法は、一般のAFM装置システムにAFMチップを装着し、一般のAFMフォースカーブ測定と同様にAFMカンチレバー1303の反りもしくはたわみを検出しつつ、ピエゾスキャナ1306を伸縮させることにより行う。カンチレバーの反りもしくはたわみの検出は、代表的な方法としてカンチレバー背面に照射したレーザビーム1304が反射した後に照射する光検出器1305の位置の変化として知ることができるが、この方法に限定されず、カンチレバーに微小な圧電素子を組み込んで検知する方法など様々であり、いずれの方法を採用してもよい。核酸鎖103を固定化したAFM探針1302を標的細胞101に近づけて接触させた後に遠ざける際、接触部位に標的分子102が存在すると核酸鎖との間に結合が生じ、AFM 探針を標的細胞の表面から遠ざけてもすぐに結合は開裂しないため、その結果としてカンチレバーは標的細胞側にたわむ。さらに探針を標的細胞から遠ざけると、カンチレバーの復元力と核酸鎖-標的分子間の結合力が拮抗した地点で核酸鎖-標的分子間の結合が破断し、カンチレバーのたわみは復元される。図13(d)は、この一連の測定過程について横軸に標的細胞基板表面からのAFM探針の距離、縦軸にカンチレバーの変位量をプロットしたものである。核酸鎖-標的分子間の結合が破断する部位でのカンチレバー変位復元量1307にカンチレバーのバネ定数を乗算することにより、核酸鎖-標的分子間の結合力を計算することができる。
【0057】
以上の工程を標的細胞101の表面全体に行うことにより、各核酸鎖103-1、2、3に対する標的分子102(102-1、2、3(図示せず))の細胞表面上存在部位を同定することができる。図14は標的細胞101の上で核酸鎖103-1、2、3に対する標的分子の存在部位をマップとして表した模式図である。各升目は結合力測定を行った各部位に対応し、色の濃淡は観測された結合力の強弱に対応する。例えば白い升目の部位では結合力が観測されず、黒い升目では強い結合力が観測されたことに対応する。各核酸鎖103-1、2、3に対するマップ図14(a)、(b)、(c)を比較することにより、それぞれ対応する標的分子の細胞表面上存在部位がわかる。また、結合力の平均値を相互比較することにより、標的分子に対してより強固に結合する核酸鎖を特定することができる。図14の例では、核酸鎖103-1と103-2の結合部位マップが同じであるため、両核酸鎖の標的分子が同一であることがわかる。また、各升目の色の濃淡、すなわち結合力を比較すると、核酸鎖103-1が103-2に比べてより強固に結合することがわかる。さらに、核酸鎖103-3のマップは103-1、103-2と異なるため、標的となる分子の種類が異なることがわかる。図14(d)に示したように、たとえば神経細胞1401から伸長した軸索1402の先端に特異的に結合するアプタマーを、上記手法によって精製することによって、神経細胞のレセプターに特異的に結合するアプタマーの開発が可能である。たとえば、本技術と神経細胞の電気生理的計測による神経突起の特性検査を組み合わせる事で、従来、非常に困難であった微量タンパク質に対するアプタマーの精製が可能となる。
【0058】
以上の測定を1細胞の細胞表面の空間分布レベルで行うことにより、それぞれの細胞に特徴的に最も特異的かつ強固に結合する核酸鎖を同定することができる。
【0059】
以上、本発明の例示的実施形態を説明したが、種々の変更、改変、および改良が当業者に容易に想起される。上記は、本発明の原理を例示的に示したものに過ぎず、当業者であれば、本発明の範囲および精神から逸脱することなく、様々な改変を為し得る。
【産業上の利用可能性】
【0060】
本発明によれば標的細胞表面の標的分子に特異的に結合する核酸鎖を容易に得ることができるので、創薬、医療分野の研究発展に貢献することができる。
【符号の説明】
【0061】
101…標的細胞その1
102…細胞表面の標的分子
103、103-1,103-2,103-3…標的分子に結合する核酸鎖
104…標的分子に結合しない核酸鎖
105…細胞表面分子分解酵素
106…標的細胞その2
107…標的細胞その3
108…細胞その4
109…核酸プール(またはアプタマープール)
110…抗原提示型細胞
111…予め抗原提示型細胞と結合するものを排除した核酸プール(またはアプタマープール)
201、402…試験管
301…細胞培養皿
401…細胞カラム
403…フラクションコレクターの動く方向
501…ガラス基板
502…細胞電位計測電極
601…標的細胞その1に結合するアプタマー配列
602…標的細胞その2に結合するアプタマー配列
603…スペーサーDNAセンス鎖
604…スペーサーDNAアンチセンス鎖
605…二種類のアプタマーをハイブリダイゼーションさせるためのセンス鎖
606…二種類のアプタマーをハイブリダイゼーションさせるためのアンチセンス鎖
701…ダブルアプタマーその1
702…ダブルアプタマーその2
703…DNA分解酵素
704…DNA分解酵素によって消化されたアプタマー
705…ダブルアプタマーその3
706…ダブルアプタマーその4
801…アプタマーを培養皿上に結合させるための物質
901…制限酵素
1301…AFMチップ
1302…AFM探針
1303…AFMカンチレバー
1304…AFM探針の変位量を計測するためのレーザビーム
1305…光検出器
1306…ピエゾスキャナ
1307…核酸鎖と標的分子の結合が切れた際のカンチレバー変位復元量
1401…神経細胞
1402…軸索
【技術分野】
【0001】
本発明は、標的細胞表面の標的分子に特異的に結合する核酸鎖の選択・回収法、それによる細胞培養方法に関する。
【背景技術】
【0002】
一本鎖核酸はその高次構造により、特定の標的分子に対して結合能を有することが、1990年にC. Tuerkらのグループによって報告(非特許文献1:Science, 249, 505-510 (1990))され、それらの核酸は「アプタマー」と命名された。これまでイオンや糖鎖、タンパク質、生細胞表面上の分子に親和性のあるアプタマー、さらにはタンパク質のリン酸化状態を判別するアプタマーなどが先行研究により多数報告されている。アプタマーは大別して一本鎖DNAまたは一本鎖RNAから成るが、他にもペプチドアプタマーなどが報告されている。またそれらの中には人工塩基を用いたアプタマー、ポリエチレングリコールなどの有機分子により修飾されたアプタマーなど、使用目的に合わせた修飾アプタマーも開発されている。
【0003】
これらアプタマーは、C. Tuerkらによって提案されたSELEX(Systematic Evolution of Ligands by Exponential Enrichment)という、目的の核酸分子の選別と、それら分子の増幅という2つのステップによって選択される。
【0004】
一般的には、まず、1014〜1016分子種の、両端が18〜38塩基ほどのプライマー配列に挟まれた30〜100塩基のランダム配列からなる全長が約60〜140塩基の核酸プールを準備する。次に、この核酸プールから、標的分子に親和性を有する配列を選別するが、この操作にはこれまで様々な方法が開発されている。一般に、標的分子のみを用いて親和性を有する核酸を選別する場合、最終的に得られたアプタマーの中には、非標的分子にも親和性を有する(抗体で言う“cross reactivity”)アプタマーが存在することも珍しくない。そのため、用いることが想定される多種類の分子が混合されているようなサンプルにおいて、標的分子には親和性を有するが非標的分子に親和性を有さないというアプタマーを、対向選別法(Counter Selection)によって選別することも行われている。
【0005】
その例として、2000年にScott D Seiwertらによって報告(非特許文献2:Chemistry & Biology, 7, 833-843 (2000))された、同じタンパク質のリン酸化状態を10倍の親和性の違いで識別するアプタマーがある。これは、はじめリン酸化状態のタンパク質ppERK2に結合するRNAを選別し、同時に非標的タンパク質として、リン酸化されていないタンパク質ERK2に選別されたRNAを導入して、それに結合しなかったRNAを回収する、という目的のRNAアプタマーを取得するものである。
【先行技術文献】
【非特許文献】
【0006】
【非特許文献1】Science, 249, 505-510 (1990)
【非特許文献2】Chemistry & Biology, 7, 833-843 (2000)
【発明の概要】
【発明が解決しようとする課題】
【0007】
このように、従来のSELEX法では核酸プールを標的タンパク質に結合させ回収し、(対向選別法の操作を経るならば、非標的タンパク質に適用した後に)PCRによって増幅後、核酸を再度、標的分子に結合させるという操作を行う。上記例はDNAの場合であったが、RNAの場合は、標的タンパク質に結合したRNAを回収し、(ここでも、対向選別法の操作を経るならば、非標的タンパク質に適用した後に)RT−PCRによる増幅後に、in vitro転写によってRNAプールを再生し、再度、標的分子に結合させる。通常、このプロセスを1回行っただけではアプタマーを選別することができないため、10〜20回は繰り返す必要がある。非標的分子に親和性を有する核酸を除去するための対向選別法も、各ラウンドについてその都度行わなければならないため、操作が非常に煩雑であり時間を要する方法である。
【0008】
これは、選別初期では選別予定核酸の絶対量・相対量がともに少なく、この中から選別予定の核酸のみを分離することが困難だからである。もし、この中からそれら選別予定以外の配列のみを除去できる方法が開発されれば、操作は非常に簡便なものになると考えられる。また上記先行研究では非標的タンパク質として単一タンパク質を用いているが、本件のような方法で、多種類の非標的タンパク質を用いて、それら全てに親和性を有さないが標的タンパク質にのみ親和性を有するような核酸を選別したという報告はされていない。また、この手法を特定の標的細胞表面の標的分子に結合する核酸鎖の精製手法として用いる場合には、細胞を破砕してタンパク質分子として精製する必要がある。
【0009】
したがって、本発明の目的は、上記のような複雑な手順を経ずに、かつ、細胞を破砕することなく、標的細胞表面に特異的に結合する核酸鎖を短時間で回収する方法を提案することである。
【0010】
さらに標的細胞表面に特異的に結合する核酸鎖を二種類以上用いて、異なる細胞同士の接着を制御する方法を提案することも目的としている。
【課題を解決するための手段】
【0011】
したがって、本発明は、以下を提供する。
(1)(i)標的細胞または標的細胞の集団に一本鎖核酸または一本鎖核酸プールを適用して上記標的細胞の表面に発現している標的分子に特異的に結合する一本鎖核酸を結合させる工程、
(ii)上記標的細胞の表面に発現している標的分子に特異的に結合しなかった一本鎖核酸を除去する工程、
(iii)上記標的細胞の表面に発現している標的分子の分解酵素を加えて上記標的分子を分解して、上記標的細胞の表面の標的分子に特異的に結合した一本鎖核酸を回収する工程、および
(iv)上記回収した一本鎖核酸をPCRにより増幅する工程、
を含む、標的細胞表面の標的分子に特異的に結合する核酸の選択法。
(2)さらに、
(v)上記回収した核酸の塩基配列を調べ、比較することで特異的な結合配列を決定し結合性を向上するように設計する工程、を含む、上記(1)に記載の方法。
(3)上記工程(i)〜(iv)で得られた一本鎖核酸を新たに一本鎖核酸プールとして用いて、再度、上記工程(i)〜(iv)を繰り返すことを含む、上記(1)または(2)に記載の方法。
(4)上記標的細胞の表面に発現している標的分子がタンパク質であり、上記分解酵素がタンパク質分解酵素である、上記(1)〜(3)のいずれか一項に記載の方法。
(5)上記(1)〜(4)のいずれか一項に記載の核酸選択法を使用する工程を含む、標的細胞に特異的に結合する核酸の製造方法。
(6)標的細胞の表面に発現している物質に特異的に結合する1以上の一本鎖核酸を基板上の特定の表面領域に付着させた細胞培養チップであって、上記標的細胞を上記一本鎖核酸と結合させることによって上記標的細胞を上記表面領域に固定して培養する、細胞培養チップ。
(7)上記(1)〜(4)のいずれか一項に記載の核酸選択法を使用して得られた、標的細胞毎に特異的に結合できる一本鎖核酸の一種類または二種類以上を用意する工程、および
複数の上記一本鎖核酸を直鎖状に結合させた核酸鎖を作製することで、核酸鎖を介して同じ標的細胞あるいは異なる二種類以上の標的細胞を培養基板上の特定の表面領域に接着させて、培養する工程、
を含む、細胞培養方法。
(8)上記(1)〜(4)のいずれか一項に記載の核酸選択法を使用して得られた、標的細胞毎に特異的に結合できる一本鎖核酸の一種類または二種類以上を用意する工程、
複数の上記一本鎖核酸を直鎖状に結合させた核酸鎖を作製する工程であって、上記複数の一本鎖核酸の互いの立体配置および機能を失わないように、上記複数の一本鎖核酸の間にスペーサー分子を挟み込む、工程、
を含むダブルアプタマー分子の作製方法。
(9)上記スペーサー分子が、二本鎖核酸、ポリエチレングリコール、あるいは生体不活性な分子である、上記(8)に記載の方法。
(10)上記(8)または(9)に記載のダブルアプタマー分子の製造方法によって製造されたダブルアプタマー分子で二種類以上の標的細胞をつなぎ合わせる工程、および
上記つなぎ合わされた二種類以上の標的細胞を解離させる工程、
を含む、標的細胞の連結−解離方法であって、
スペーサー分子が、制限酵素によって特異的に認識される特定の塩基配列が組み込まれた二本鎖核酸であり、
上記ダブルアプタマー分子に上記制限酵素を作用させることによって、上記二種類以上の標的細胞を解離させる、標的細胞の連結−解離方法。
(11)上記(8)または(9)に記載のダブルアプタマー分子の作製方法により作製したダブルアプタマーを介して同じ種類の細胞あるいは異なる二種類以上の細胞を接着させた後、該細胞を解離させる細胞の連結−解離方法であって、
スペーサー分子が、二本鎖核酸であり、
核酸分解酵素を作用させて上記二本鎖核酸を分解することによって、上記二種類以上の標的細胞を解離させる、細胞の連結−解離方法。
(12)上記(8)または(9)に記載のダブルアプタマーの作製方法により作製したダブルアプタマーを介してつなぎ合わされた同じ種類の細胞あるいは異なる二種類以上の細胞を培養基板上に配置する工程を含む、細胞培養方法。
(13)上記(12)に記載の細胞培養方法であって、
上記(10)または(11)に記載の標的細胞の連結−解離方法を含む、細胞培養方法。
(14)上記(1)〜(4)のいずれか一項に記載の核酸選択法を使用して得られた、標的細胞毎に特異的に結合できる一本鎖核酸の一種類または二種類以上を用意し、それらを直鎖状に結合させた核酸鎖を作製することで、シート状の細胞群を積層させる方法。
(15)上記(1)〜(4)のいずれか一項に記載の核酸選択法を使用して得られた、標的細胞毎に特異的に結合できる一本鎖核酸の一種類または二種類以上を用意し、それらを直鎖状に結合させた核酸鎖を作製することで、2つの細胞を接着させ、かつ、その後に核酸分解酵素によって接着に用いた核酸鎖を分解させる方法。
(16)上記(1)〜(4)のいずれか一項に記載の核酸選択法を使用して得られた、標的細胞毎に特異的に結合できる一本鎖核酸の一種類または二種類以上を用意し、それらを直鎖状に結合させることで、上記一種類あるいは2種類の細胞を両端に接着させる機能を有する核酸鎖。
(17)(i)予め準備した抗原を細胞表面に提示する機能を有する貪食細胞を用いて抗原となる細胞を貪食させる前に、上記貪食細胞に結合する一本鎖核酸を予め一本鎖核酸プールから排除することによって、精製された核酸プールを準備する工程、
(ii)上記貪食細胞に、標的細胞を貪食させて、標的細胞の断片を上記貪食細胞の表面に提示させる工程、
(iii)上記工程(i)において精製された核酸プールを適用して上記標的細胞を貪食した細胞の表面に提示された標的分子に特異的に結合する一本鎖DNAを結合させる工程、
(iv)上記特異的に結合しなかった一本鎖核酸を除去する工程、
(v)上記標的細胞の表面の標的分子に特異的に結合した一本鎖核酸を回収するために、分解酵素を加えて上記標的分子を分解して、結合した一本鎖核酸を回収する工程、
(vi)上記回収した一本鎖核酸をPCRにより増幅する工程、
(vii)上記、回収した核酸鎖の塩基配列を調べ、比較することで特異的な結合配列を決定し結合性を向上するように設計する工程、
を含む、標的細胞表面の標的分子に特異的に結合する核酸の選択法。
(18)上記抗原を細胞表面に提示する機能を有する貪食細胞が、マクロファージまたは樹状細胞である、上記(17)に記載の方法。
(19)上記回収した一本鎖核酸(またはアプタマー)の標的分子に対する特異的結合特性を確認するために、原子間力顕微鏡(AFM)探針先端に上記回収した一本鎖核酸のうちの1種類の塩基配列を有する一本鎖核酸を取り付けて細胞表面の標的分子との結合力を直接測定することにより力学的結合の強さを定量的に測定する工程を含む、上記(1)〜(4)および上記(17)のいずれかに記載の方法。
(20)上記回収した一本鎖核酸が標的細胞に対する結合部位を調べる際にAFM探針先端に上記回収した一本鎖核酸のうちの1種類の塩基配列を有する一本鎖核酸を取り付けて標的細胞との結合力を標的細胞表面上全体にわたり直接測定することにより細胞表面での結合力の分布の局所性を定量的に測定する工程を含む、上記(1)〜(4)および上記(17)のいずれかに記載の方法。
【0012】
本発明は、別の表現を用いれば、以下の核酸鎖選択法および核酸製造方法および細胞培養方法を提供する。
(1)(i)標的細胞のみからなる集団に一本鎖核酸プールを適用して上記標的細胞の表面に発現しているタンパク質等の標的分子に特異的に結合する一本鎖核酸を結合させる工程、
(ii)上記特異的に結合しなかった一本鎖核酸を除去する工程、
(iii)上記標的細胞の表面の標的分子に特異的に結合した一本鎖核酸を回収するために、トリプシン等のタンパク質分解酵素等を加えて上記標的分子を分解して、結合した一本鎖核酸を回収する工程、
(iv)上記回収した一本鎖核酸をPCRにより増幅する工程、
を含む、標的細胞表面の標的分子に特異的に結合する核酸の選択法。
(2)上記工程(i)〜(iv)で得られた一本鎖核酸を新たに一本鎖核酸プールとして用いて、再度、上記工程(i)〜(iv)を繰り返す工程を行って、一本鎖核酸プールの精度を段階的に高めながら、上記標的細胞に結合する一本鎖核酸の精度を高める、上記(1)記載の核酸選択法。
(3)上記(1)〜(2)のいずれか記載の核酸選択法を使用する工程を含む、標的細胞に特異的に結合する核酸の製造方法。
(4)回収した標的細胞に特異的に結合する一本鎖核酸を、細胞培養を行う基板上の特定の細胞を培養させたい領域の底面に修飾し、標的細胞をその場に固定し、培養する細胞培養チップ。
【0013】
本発明において、核酸(鎖)は、DNA(鎖)またはRNA(鎖)であり得る。なお、本明細書中、核酸と核酸鎖、DNAとDNA鎖、およびRNAとRNA鎖とは、それぞれ交換可能に(interchangeably)用いられる。
【0014】
本発明では、標的細胞のみに特異的に親和性を有する核酸を選別する。この選別過程は以下のようである。
【0015】
まず、標的となる細胞を多種の細胞が混ざった集団から選択する。次いで、核酸プールを選択した標的細胞の集団に適用し、標的細胞表面の標的分子と特異的に結合する核酸を結合させる。
【0016】
そこで、次に、標的細胞表面の分子に結合した核酸を回収するために、標的細胞表面の分子を分解し、結合した核酸を選択的に回収する。このとき、分子がタンパク質の場合は、トリプシンなどのタンパク質分解酵素を用いる。また、この段階で分子を分解するために用いる酵素は、トリプシンのように結合した核酸を分解する等の影響を何ら与えずに細胞表面の分子のみを分解するものとする。
【0017】
次いで、回収した核酸をPCR増幅することで目的とする標識細胞への結合性を有する核酸鎖を得ることができる。また、さらにこの得られた核酸鎖を、新たな核酸スープとして、同じ工程を繰り返し行うことで、また、より少ない細胞集団数で工程を行うことで、より高い精度の核酸鎖を得ることができる。また、標的細胞表面の分子を分解する酵素についても、複数の特性の異なる酵素を段階的に利用することで、細胞表面の異なる標的分子に対する核酸鎖を回収することができる。
【0018】
また、得られた核酸鎖(アプタマー)について、その塩基配列の異なるものの特性の比較を行うために、1つの塩基配列のアプタマーについて各々AFM探針先端に取り付けて、得られたアプタマーと標的細胞表面間の結合力と結合力が高まる細胞表面の部位を測定することにより、各塩基配列のアプタマーの力学的結合特性を定量的に特定することが可能であり、かつ、特定の部位への結合性能を有するより選択性の高いアプタマーを選別することができる。
【0019】
また、回収した核酸鎖を新しい細胞培養チップの底面の細胞を配置したい特定の場所の底面に修飾することで、細胞を修飾した核酸鎖の空間パターンに合わせて結合して配置することができる。この場合には、核酸鎖は、培養初期の細胞の固定に用いられ、細胞が十分に基板に結合したと考えられるところで、核酸分解酵素あるいは核酸分解酵素が含まれている血清培地を添加することで、基板底面に細胞を結合させていた核酸鎖を消失させることができる。
【0020】
上記の工程はすべてDNA鎖だけでなく、RNA鎖等の核酸鎖でも同様に行うことができる。
【0021】
標的細胞を二種類用意し、それぞれの細胞に対し特異的な結合性を有する核酸鎖を二種類用意する。それぞれの核酸鎖を二重鎖の核酸鎖で繋ぎ合せた構造を提供する。これにより、異なる二種類の細胞を作製した核酸鎖を介して人工的に接着させる。
【0022】
標的細胞を二種類用意し、それぞれの細胞に対し特異的な結合性を有する核酸鎖を二種類用意する。それぞれの核酸鎖を二重鎖のDNAあるいはポリエチレングリコールなどで繋ぎ合せた構造を提供する。
【0023】
それぞれの細胞に対し特異的な結合性を有する核酸鎖によって挟みこむ核酸鎖には特定の塩基配列のみを認識し切断できる制限酵素の認識部位を組み込むことによって、人工的に核酸鎖を切断できる。それにより、細胞の引きあわせと乖離を自在にコントロールする。
【0024】
標的細胞を二種類用意し、それぞれの細胞に対し特異的な結合性を有する核酸鎖を二種類用意する。さらにそれぞれの核酸鎖を二重鎖の核酸あるいはポリエチレングリコールなどで繋ぎ合せた構造を用意する。これを用いて、培養中の細胞に対し、異なる特定の細胞を特定の位置、あるいは層状に積層することを提供する。
【0025】
細胞毎に特異的に結合できる上記(1)〜(3)のいずれか記載の核酸選択法により得られた一本鎖核酸を一種類あるいは二種類以上用意し、それらを直鎖状に結合させた核酸鎖を作製することで、2つの細胞を接着させ、かつ、その後に核酸分解酵素によって接着に用いた核酸鎖を分解させる方法を提供する。
(i)予め準備したマクロファージ、樹状細胞等の抗原を細胞表面に提示する機能を有する貪食細胞を用いて抗原となる細胞を貪食させる前に、前記貪食細胞に結合する一本鎖核酸を予め一本鎖核酸プールから排除して、精製された核酸プールを準備する工程、
(ii)前記貪食細胞に、標的細胞を貪食させて、標的細胞の断片を前記貪食細胞の表面に提示させる工程、
(iii)前記工程(i)において精製した核酸プールを適用して前記標的細胞を貪食した細胞の表面に提示されたタンパク質等の分子に特異的に結合する一本鎖核酸を結合させる工程、
(iv)前記特異的に結合しなかった一本鎖核酸を除去する工程、
(v)前記、標的細胞の表面の分子に特異的に結合した一本鎖核酸を回収するために、トリプシン等のタンパク質分解酵素等を加えて上記分子を分解して、結合した一本鎖核酸を回収する工程、
(vi)前記、回収した一本鎖核酸をPCRにより増幅する工程、
(vii)前記、回収した核酸の塩基配列を調べ、比較することで特異的な結合配列を決定し結合性を向上するように設計する工程、
を含む、標的細胞表面の分子に特異的に結合する核酸の選択法を提供する。
【発明の効果】
【0026】
本発明によれば、精製した特定の細胞に結合する核酸鎖を短時間で簡便に得ることができる。また、精製した特定の細胞の特定の部位に結合する核酸鎖を選択的に回収することができる。また、核酸鎖を用いて、標的細胞を基板上に配置し、配置後に配置に用いた核酸鎖を除去することができる。
【図面の簡単な説明】
【0027】
【図1】標的細胞表面の標的分子に特異的に結合する核酸鎖を精製する手法の手順を示した模式図である。
【図2】試験管を用いたバッチ処理による標的浮遊細胞表面の標的分子に特異的に結合する核酸鎖を精製する手法の手順を示した模式図である。
【図3】培養皿を用いたバッチ処理による培養皿底面に接着した標的培養細胞表面の標的分子に特異的に結合する核酸鎖を精製する手法の手順を示した模式図である。
【図4】細胞カラムを用いた標的細胞表面に結合する核酸鎖を精製するフラクションコレクター装置のしくみを示す模式図である。
【図5】本発明の方法で精製した核酸鎖を用いて標的細胞を基板上の特定の場所に固定する技術を説明する模式図である。
【図6】本発明で作製した標的細胞を二種類に対しそれぞれ特異的な結合性を有する核酸鎖を結合させたダブルアプタマーの構造を模式的に示した図である。(a)二種類用意し二重鎖の核酸で繋ぎ合せたダブルアプタマーの構造の模式図、(b)それぞれの核酸鎖が共通配列でハイブリダイゼーションできる構造体を有するダブルアプタマーの構造の模式図、(c)それぞれの認識配列をポリエチレングリコールでつないだ構造の模式図、(d)それぞれ末端にポリエチレングリコールとそれらをハイブリダイゼーションするための核酸鎖を有するダブルアプタマーの構造の模式図である。
【図7】ダブルアプタマーを用いて、異なる種類の細胞を結合させていき、人工的な生体組織を構築する工程の模式図である。
【図8】培養シャーレ上で培養している細胞の特定の細胞にダブルアプタマーを用いて別の異なる細胞をパターニング培養する工程の模式図である。
【図9】ダブルアプタマーを用いて培養中の細胞層を積層させる工程の模式図である。
【図10】異なる種類のダブルアプタマーを用いて様々な細胞を結合させる工程の模式図である。
【図11】ダブルアプタマーのスペーサー上に制限酵素認識部位を設計することで、ダブルアプタマーで一度引き寄せた細胞でも制限酵素で再度離す工程の模式図である。
【図12】マクロファージ、樹状細胞等の抗原提示型細胞の有する抗原提示機能を利用して標的細胞表面の標的分子に特異的に結合する核酸鎖を精製する手法の手順のひとつを示した模式図である。
【図13】AFMを利用して核酸鎖の標的細胞表面上結合部位とその結合力を計測する方法を示す模式図である。核酸鎖が3種類得られた場合を例示している。(a)一つ目の核酸鎖をAFM探針に取り付けて結合力測定を行う模式図、(b)二つ目の核酸鎖を取り付けた場合、(C)三つ目の場合、(d)標的細胞基板表面からのAFM探針の距離とカンチレバー変位量の関係を示したグラフである。
【図14】標的細胞の上で3種類の核酸鎖に対する標的分子の存在部位をそれぞれマップとして表した模式図である。(a)一つ目の核酸鎖をAFM探針に取り付けた場合、(b)二つ目の場合、(C)三つ目の場合である。(d)実際に神経細胞に対して、AFMによる精製を行う例のひとつである。神経細胞の軸索、樹状突起等の神経突起にひとつの先端部分にてアプタマーと細胞表面との結合を測定する事で、神経突起の先端に選択的に発現しているレセプタータンパク質と特異的に結合するアプタマーを選択することができる。
【発明を実施するための形態】
【0028】
図1は本発明の核酸選択法を説明するフロー図である。すなわち、標的細胞表面のイオンチャンネルタンパク質等の分子に特異的に結合する核酸を簡便に選別する本発明の方法の過程を示している。ここで、核酸鎖としては、DNA鎖、RNA鎖などのタンパク質分解酵素によって分解されない核酸鎖が含まれる。
【0029】
本明細書中、ある核酸があるタンパク質またはその断片に「特異的に結合する」とは、その核酸が、そのタンパク質またはその断片の特定のアミノ酸配列に対して、他の(タンパク質またはその断片の)アミノ酸配列に対する親和性よりも、実質的に高い親和性で結合することを意味する。ここで、「実質的に高い親和性」とは、当業者に利用可能な所望の測定装置または方法によって、その特定のアミノ酸配列を他のアミノ酸配列から区別して検出することが可能な程度に高い親和性を意味し、典型的には、結合定数(Ka)が少なくとも107M−1、好ましくは、少なくとも108M−1、より好ましくは、109M−1、さらにより好ましくは、1010M−1、1011M−1、1012M−1またはそれより高い、例えば、最高で1013M−1またはそれより高いものであるような結合親和性を意味する。
【0030】
図1に示すように、本発明の方法によれば、標的細胞101の表面に発現した分子102に対して特異的に結合する核酸鎖103が、結合性を有さない核酸鎖104も含まれる核酸プール(またはアプタマープール)109から選択的に抽出されることができる。実際に標的細胞101と核酸鎖103、104を反応させると、結合性を有する核酸鎖103のみが細胞表面に結合する。次のステップにおいて、トリプシン等の核酸を分解せず、タンパク質を分解する酵素で処理を行うことによって、結合しなかった核酸鎖を洗浄除去して、標的細胞表面の標的分子(核酸鎖と結合した分子)を分解させる。そうすると、標的分子の分解にあわせて、これに結合していた核酸鎖が溶液中にリリースされてくるので、これを回収してPCR増幅することで標的細胞に結合するさまざまな核酸鎖を集めることができる。
【0031】
この手順を、再度、核酸ソースとして上記手順で得られた結合能を有する核酸鎖を用いて、より多数の標的細胞を用いて繰り返し行うことで、核酸鎖の選択制を高くすることができる。また、精度を上げるためには、標的細胞の集団について、その1細胞単位での結合を計測してもよい。その場合は、細胞ごとに微妙に異なる結合核酸鎖のデータがそのまま得られるため、集団で計測したときにはわからなかった細胞ごとの結合核酸鎖の違いを評価することができる。そして、多くの細胞について、最も高い結合特性を有するものを見出すことができる。
【0032】
また、上記図1に示した手法では、直接標的細胞を用いた結合性核酸鎖の精製方法を示したが、図12に示したように、マクロファージや樹状細胞等の貪食能と貪食した細胞等の断片を抗原提示物質として細胞表面に提示する機能を利用して標的細胞の細胞表面の特徴的な抗原分子を提示させてこれと結合するアプタマーを特異的に選択する手法による精製手法もある。これは、(i)あらかじめ準備したマクロファージ、樹状細胞等の抗原を細胞表面に提示する機能を有する貪食細胞110を用いて、抗原となる細胞101を貪食させる前に、上記貪食細胞110に結合する一本鎖核酸(DNAまたはRNA)を一本鎖核酸プールから排除する工程によって、まずはマクロファージ等の貪食細胞110にもともと結合する可能性のある核酸鎖を排除した精製された核酸プール111を調製した後に、(ii)上記貪食細胞に、標的細胞101を貪食させて、標的細胞の抗原提示用の断片102を上記貪食細胞の表面に提示させる工程によって、生体の抗原提示機能を巧みに利用して、貪食細胞表面に抗原提示物質を精製することにより、(iii)上記工程(i)において精製した核酸プール111を適用して上記標的細胞を貪食した細胞の表面に提示されたタンパク質等の分子に特異的に結合する一本鎖DNA(あるいは一本鎖RNA)を結合させる工程によって標的細胞の抗原提示部位に特異的に結合するDNA鎖(あるいはRNA鎖)を上記貪食細胞表面に結合させ、さらに(iv)上記特異的に結合しなかった一本鎖DNA(あるいはRNA)を除去する洗浄工程によって十分に上記貪食細胞表面を洗浄した後に、(v)上記、標的細胞の表面の分子に特異的に結合した一本鎖DNA(あるいはRNA)を回収するために、トリプシン等のタンパク質分解酵素等を加えて上記分子を分解して、結合した一本鎖核酸を回収する工程、(vi)上記回収した1本鎖DNA(あるいはRNA)をPCRにより増幅する工程によって標的細胞の上記貪食細胞の抗原提示機能によって提示された標的細胞の標的部位に結合能を有する核酸鎖を精製することができ、さらに(vii)上記回収したDNA鎖(あるいはRNA鎖)の塩基配列を調べ、比較することで特異的な結合配列を決定し結合性を向上するように設計する工程を含む方法により、標的細胞表面の分子に特異的に結合する核酸を精製してもよい。
【0033】
この場合、たとえば貪食細胞としてマクロファージ細胞株J774.2などの細胞株を用いても良いし、個別化医療の対象とする場合には、患者由来のマクロファージや樹状細胞等の貪食細胞、あるいは患者由来のiPS細胞から分化させた貪食細胞を用いても良い。
【0034】
さらに、より精度と選択性を高めるためには、引き続き、以下に述べる工程を含む精製法を用いることができる。すなわち(I)得られた核酸鎖群の塩基配列情報をシークエンサーによって解読し、その塩基配列情報の結果についてホモロジー検索を行い、実質的な相同性(例:60%以上、70%以上、80%以上、または90%以上の同一性)を有する配列を抽出する工程、(II)標的細胞に対して混在する可能性のある別細胞に結合する塩基配列の抽出と、シークエンサーによる解読と、得られた塩基配列のホモロジー検索とを行い、実質的な相同性を有する配列を抽出する工程、(III)(I)で得られた配列から(II)で得られた配列を排除する情報処理を行って選択された塩基配列を有する核酸鎖を、標的細胞に対して特異的に結合する核酸鎖として得る工程。
【0035】
また、上記の工程(III)の結果として得られた核酸鎖について、さらに精製された膜タンパク質、糖鎖と結合を行わせて結合能を定量的に評価することで、得られた核酸鎖の標的物質についても同定することが可能である。
【0036】
より精度と選択性を高めるための方法として、精製した核酸鎖(アプタマー)について、引き続き、以下に述べる工程を含む精製法を用いることができる。すなわち(I)得られた核酸鎖群のうち各々の一種類の核酸鎖に対して、核酸の5'もしくは3'末端にアミノ基、チオール基、あるいはアビジンなどのAFM探針に結合させるための反応基を導入したものを作製する工程、(II)(I)で作製した核酸をAFM探針先端にAu-S結合、アビジン-ビオチン結合、あるいは2架性架橋剤を介した共有結合などの結合手段により固定化する工程、(III)(II)で作製した核酸固定済みAFM探針を、ひとつの標的細胞の表面で細胞に対して近づけた後に遠ざける作業を行って、細胞上の位置と関連づけて計測を繰り返す工程であって、AFM探針が標的細胞に接触後遠ざかる際に探針表面の核酸と標的細胞表面の標的分子の結合破壊に由来する破断力を計測して細胞表面でのアプタマーの結合力の空間分布を細胞形状の特性と合わせて測定する工程、(IV)(I)から(III)の工程を得られた核酸鎖群全てに対して行った後得られた核酸鎖群の中から最も結合力が強い核酸鎖の種類とその核酸鎖の細胞表面上での結合部位を同定する工程。なお、使用される反応基等は上記のものに限定されない。
【0037】
上述の図1で述べた細胞結合性の核酸鎖を精製する過程について、以下により具体的な処理について説明する。
【0038】
(実施例1)
実施例1では、浮遊細胞について、以下の手順により標的細胞に特異的に結合する核酸を得る。図2にその手順の概要を模式的に示す。
【0039】
(I)標的細胞と核酸鎖との結合
図2を参照して、
(1)試験管201内に浮遊している標的細胞101に、核酸鎖103、104を添加して、標的細胞と核酸鎖を反応させる。
【0040】
(2)細胞と反応しなかった核酸鎖は試験管から除去され、細胞に結合した核酸のみがある状況となったことを確認してから、たとえば細胞表面のタンパク質を分解するために、トリプシンなどのタンパク質分解酵素を含む細胞表面分子分解酵素105を添加する。この結果、細胞表面の分子は、それぞれの性質や核酸鎖との結合状態の違いなどによって時間的に差を持って細胞表面から溶出することとなる。また、本実施例では細胞表面分子分解酵素としてタンパク質分解酵素であるトリプシンを使ったが、糖鎖分解酵素や、他のタンパク質分解酵素を用いてもよい。このような酵素を、バッチ処理として組み合わせてシリーズで用いることで、標的細胞表面の分子の違いにあわせて異なる分子を標的とした核酸鎖の回収が可能となる。
(3)回収した一本鎖核酸をPCR増幅して回収する。
上記標的細胞に結合した核酸鎖を回収し、これをPCR反応させて増幅する。
(実施例2)
実施例2では、細胞培養皿底面に結合して培養されている細胞について、以下の手順により標的細胞に特異的に結合する核酸を得る。図3にその手順の概要を模式的に示す。
【0041】
(I)標的細胞と核酸鎖との結合
図3を参照して、
(1)細胞培養皿301内の細胞培養物に核酸鎖103、104を添加して、細胞培養物中で浮遊している標的細胞101と核酸鎖とを反応させる。
【0042】
(2)細胞と反応しなかった核酸鎖は細胞培養皿から除去され、細胞に結合した核酸のみがある状況となったことを確認してから、たとえば細胞表面のタンパク質を分解するために、トリプシンなどのタンパク質分解酵素を含む細胞表面分子分解酵素105を添加する。この結果、細胞表面の分子は、それぞれの性質や核酸鎖との結合状態の違いなどによって時間的に差を持って細胞表面から溶出することとなる。また、本実施例では細胞表面分子分解酵素としてタンパク質分解酵素であるトリプシンを使ったが、糖鎖分解酵素や、他のタンパク質分解酵素を用いてもよい。このような酵素を、バッチ処理として組み合わせてシリーズで用いることで、標的細胞表面の分子の違いにあわせて異なる分子を標的とした核酸鎖の回収が可能となる。
(3)回収した一本鎖核酸をPCR増幅して回収する。
上記標的細胞に結合した核酸鎖を回収し、これをPCR反応させて増幅する。
【0043】
本明細書中、核酸(ヌクレオチド)配列について「ハイブリダイゼーション」とは、ヌクレオチド配列同士の相補性が高い場合、二本鎖を形成することをいう。通常、二本鎖は、互いの核酸が相補的になるように設計されているが、必要に応じて(例えば、核酸を検出に使用する場合は、その目的上、問題が生じない範囲において)、その核酸中に、1または複数個(例えば、2〜5個)のミスマッチを含んでいてもよい。存在してもよいミスマッチの数は、例えば、要求される検出精度、ヌクレオチド配列(または塩基配列もしくは核酸(配列)もしくはポリヌクレオチド)の長さに応じて変化し得る。なお、核酸配列と、それがハイブリダイズする相手の核酸配列とのハイブリダイゼーション条件を適宜変更することにより、ミスマッチが存在する場合を排除したり、許容できるミスマッチの数を調整したりすることができることは当業者に周知である。
【0044】
なお、ハイブリダイゼーションのストリンジェンシーは、例えば、5×SSC、5×デンハルト溶液、0.5%(w/v)SDS、50%(w/v)ホルムアミド、50℃、のように決定され得る。ただし、本発明で用いられる核酸配列の担体への固定部分は、どの核酸配列でも共通であることから、ハイブリダイゼーションは、この固定部分の融解温度(Melting Temperature)よりは少なくとも高い温度で行うこと、また、これらの条件において、温度を上げるほど高い同一性を有する核酸が効率的に得られることは当業者に周知である。ハイブリダイゼーションのストリンジェンシーに影響する要素としては温度、核酸の濃度、核酸の長さ、イオン強度、時間、塩濃度など複数の要素が考えられ、当業者であればこれら要素を適宜選択することで同様のストリンジェンシーを実現することが可能である。
【0045】
(実施例3)
図4は、細胞カラムを用いた標的細胞表面に結合する核酸鎖を精製するフラクションコレクター装置のしくみを示す模式図である。図4に示したように、この装置は、細胞カラム401と、細胞カラムから滴下される分解産物核酸鎖103を含む水溶液を回収する試験管402のアレイと、この試験管アレイを時間経過に合わせて403の方向へ移動させる手段とを備える。
【0046】
標的細胞101を含むカラム401に標的細胞表面の分子を分解する酵素105を添加すると、カラム401内の標的細胞101に結合していた核酸鎖103は滴下され、試験管402中のフラクションの中に集められることとなる。
【0047】
(実施例4)
図5は、本発明の方法で精製した核酸鎖を用いて標的細胞を基板上の特定の場所に固定した状態を示す模式図である。図5に示したように、細胞培養観察を行う基板501の上の特異的領域に、上記手順で作った標的細胞101に結合能を有する核酸鎖103を修飾し、この結合能を有する核酸鎖103に標的細胞101が結合することで、細胞を特定の位置に固定することができる。ただし、この手順では、核酸分解酵素などが含まれていない培養溶液を使うことが好ましい。また、ここで特記すべきこととして、当初、なかなか培養のための接着が難しい浮遊状態の細胞を、基板501の表面(この場合は電極502の上)の特定の領域に接合させることができるが、細胞と基板の間の接着が十分に安定したところで、無血清培地から血清培地に変えることで基板上に修飾された核酸鎖を分解、消失させることができる。
【0048】
(実施例5)
上記のように、標的細胞に特異的に結合する核酸鎖103を2つ以上組み合わせて機能を維持しながら1つの高分子となるように結合させることで、複数の標的細胞を互いに接着結合させるアンカー(結合素子:糊の役割)として用いることができる。これを用いれば、例えば、培地培養系においては、特定の標的細胞に選択的に接着させたい細胞を接着させた後に、血清培地、あるいは核酸分解酵素(例えば、DNA分解酵素、RNA分解酵素等)を無血清培地に添加することで、結合に用いた核酸鎖は完全に分解させることができる。また、ここで用いる核酸鎖自体が細胞外で用いる生体物質であることから、生体に対しては特に有害物質とはならないため、この排除工程を省くことも可能である。
【0049】
例えば、2つの核酸鎖を結合させた例(以下、「ダブルアプタマー」と呼ぶ。)としては、図6に示したように、異なる特定の細胞を認識する核酸鎖二種類(601ならびに602)を、それらの細胞結合の機能を損なわないように結合させる20塩基長以上のスペーサー核酸(603/604、605/606)あるいは鎖長10nm以上のポリエチレングリコール607等の核酸鎖と水素結合を形成しない生体親和性の高い有機高分子(または生体不活性な分子)を用いて直鎖状に作製すれば良い。スペーサーとなる分子は、細胞認識に必要な両端の核酸鎖の立体構造がお互いに干渉しない分子または長さを有するものにする。また、スペーサーとなる核酸配列(603/604)の内部には特定の制限酵素が認識できる配列を含む。
【0050】
次に、図7を参照して、実際にダブルアプタマーを用いた細胞接着の工程について説明をする。図7では異なる2種類の標的細胞を認識する部位を有するダブルアプタマー701用いて多段階で細胞による組織を作製する工程を示している。まず、ダブルアプタマー701の2つの認識部位のうち、一方の認識部位と特異的に結合する第一標的細胞101とダブルアプタマーを反応させ、ダブルアプタマーが有する他方の認識部位と特異的に結合する第二標的細胞106と反応させて2つの細胞を接着させる。その後、しばらく培養後、核酸分解酵素703を用いて細胞に結合しているダブルアプタマーを分解する(分解した核酸鎖断片を704に示す)。その次に第二標的細胞に特異的に結合する部位と、第三標的細胞に特異的に結合する部位とを有するダブルアプタマー702を用いて、第二標的細胞106に、第三標的細胞107を結合させ、再度核酸分解酵素でダブルアプタマーを分解する。同様な工程を繰り返すことで、あらかじめプログラムされた手順によって人工的に3次元に細胞の配置、配列を1細胞レベルで制御して細胞集団の高次構造を構築することができ、最終的に空間情報を制御した組織を作製することができる。
【0051】
図8では、実際にすでに存在している組織表面あるいは細胞集団表面に対する利用の一例を示している。培養シャーレ中に培養している細胞集団101の中の特定の標的細胞106に対して、細胞106と細胞107に結合能を有する部位を有するダブルアプタマー702を用いることで、細胞集団のうちの細胞106のみに特異的に細胞107を接着することが可能である。同様に、生体中においても、細胞106をガン細胞、細胞107を樹状細胞、マクロファージ、T細胞、B細胞のいずれかとして用いれば、ガン細胞等の病巣細胞を特異的に攻撃する免疫系による治療手段として用いることもできる。ただし、この場合は、核酸鎖については分解を阻止するために核酸の糖鎖の一部を硫黄(S)に置換して核酸分解酵素によって溶解しないように加工すればよい。また、再生医療においても、ダブルアプタマーの片側の認識部位をターゲットとなる再生したい組織中の標的細胞のものとし、他方を標的細胞に接着させたい分化途上の未成熟分化細胞として、標的細胞に結合し接着することが可能である。
【0052】
図9では、培養シャーレ中に培養している単層の細胞シート上に異なる種類の細胞106をダブルアプタマーにより積層させていく手順の一例を示している。これにより、通常ではできなかった特定の細胞を細胞が有する情報を基にパターニングあるいは積層させることができる。
【0053】
図10では、特定の細胞に対して、2つの結合部位のうち1つの結合部位が異なるダブルアプタマーを用いることで、一つの標的細胞に対して様々な異種細胞を結合させることができる例を示した。
【0054】
図11では、ダブルアプタマーのスペーサー部位の塩基配列上に制限酵素で認識され、切断させる塩基配列を組み込むことにより、一度細胞同士をダブルアプタマーで引き寄せた後再度引き離すことができる。
【0055】
図13は、標的細胞と結合するいくつかの核酸鎖について、AFMを用いて結合力の比較と標的細胞に対する核酸鎖の結合部位同定を行うための概念図である。本実施例では、3種類の核酸鎖が得られた場合の例を示す。標的細胞101に結合する核酸鎖103-1、103-2、103-3に対して、AFMチップ1301の先端にある探針1302に固定化するために核酸鎖103-1、2、3の3'もしくは5'末端に反応基を導入したものを作製する。反応基の代表的なものとしてはアミノ基、チオール基、カルボキシル基、ビオチンなどであるが、この例に限らず一般に分子固定に広く用いられている反応基であればいずれのものでもよい。また、AFM探針1302の材質は代表的にはシリコン製、窒化シリコン製とそれら表面に金、銀などの薄膜を形成したものであるが、この例に限らず一般にAFM探針として用いられているものであればいずれの材質でも構わない。また、チップ先端にカーボンナノチューブ、マイクロビーズ、金属ウィスカなどを取り付けて探針として利用することもできる。核酸鎖103-1、2、3を固定化するために、必要に応じてAFM探針1302を予め化学処理することも有用である。例えば窒化シリコン製探針に対して、3-aminopropyltriethoxysilaneを反応させて探針表面にアミノ基を導入することにより、3'もしくは5'末端にカルボキシル基を導入した核酸鎖を固定化することができる。また、表面に金や銀の薄膜を形成した探針に対しては、3'もしくは5'末端にチオール基を導入した核酸鎖を固定化することができる。これらの方法により、ひとつのAFM探針1302に対して1種類の核酸鎖を固定化したものを核酸鎖103-1、2、3それぞれに対して作製する。
【0056】
次に、作製した核酸鎖固定化済みAFM探針を基板上に存在する標的細胞101に対して近づけた後に遠ざける。その方法は、一般のAFM装置システムにAFMチップを装着し、一般のAFMフォースカーブ測定と同様にAFMカンチレバー1303の反りもしくはたわみを検出しつつ、ピエゾスキャナ1306を伸縮させることにより行う。カンチレバーの反りもしくはたわみの検出は、代表的な方法としてカンチレバー背面に照射したレーザビーム1304が反射した後に照射する光検出器1305の位置の変化として知ることができるが、この方法に限定されず、カンチレバーに微小な圧電素子を組み込んで検知する方法など様々であり、いずれの方法を採用してもよい。核酸鎖103を固定化したAFM探針1302を標的細胞101に近づけて接触させた後に遠ざける際、接触部位に標的分子102が存在すると核酸鎖との間に結合が生じ、AFM 探針を標的細胞の表面から遠ざけてもすぐに結合は開裂しないため、その結果としてカンチレバーは標的細胞側にたわむ。さらに探針を標的細胞から遠ざけると、カンチレバーの復元力と核酸鎖-標的分子間の結合力が拮抗した地点で核酸鎖-標的分子間の結合が破断し、カンチレバーのたわみは復元される。図13(d)は、この一連の測定過程について横軸に標的細胞基板表面からのAFM探針の距離、縦軸にカンチレバーの変位量をプロットしたものである。核酸鎖-標的分子間の結合が破断する部位でのカンチレバー変位復元量1307にカンチレバーのバネ定数を乗算することにより、核酸鎖-標的分子間の結合力を計算することができる。
【0057】
以上の工程を標的細胞101の表面全体に行うことにより、各核酸鎖103-1、2、3に対する標的分子102(102-1、2、3(図示せず))の細胞表面上存在部位を同定することができる。図14は標的細胞101の上で核酸鎖103-1、2、3に対する標的分子の存在部位をマップとして表した模式図である。各升目は結合力測定を行った各部位に対応し、色の濃淡は観測された結合力の強弱に対応する。例えば白い升目の部位では結合力が観測されず、黒い升目では強い結合力が観測されたことに対応する。各核酸鎖103-1、2、3に対するマップ図14(a)、(b)、(c)を比較することにより、それぞれ対応する標的分子の細胞表面上存在部位がわかる。また、結合力の平均値を相互比較することにより、標的分子に対してより強固に結合する核酸鎖を特定することができる。図14の例では、核酸鎖103-1と103-2の結合部位マップが同じであるため、両核酸鎖の標的分子が同一であることがわかる。また、各升目の色の濃淡、すなわち結合力を比較すると、核酸鎖103-1が103-2に比べてより強固に結合することがわかる。さらに、核酸鎖103-3のマップは103-1、103-2と異なるため、標的となる分子の種類が異なることがわかる。図14(d)に示したように、たとえば神経細胞1401から伸長した軸索1402の先端に特異的に結合するアプタマーを、上記手法によって精製することによって、神経細胞のレセプターに特異的に結合するアプタマーの開発が可能である。たとえば、本技術と神経細胞の電気生理的計測による神経突起の特性検査を組み合わせる事で、従来、非常に困難であった微量タンパク質に対するアプタマーの精製が可能となる。
【0058】
以上の測定を1細胞の細胞表面の空間分布レベルで行うことにより、それぞれの細胞に特徴的に最も特異的かつ強固に結合する核酸鎖を同定することができる。
【0059】
以上、本発明の例示的実施形態を説明したが、種々の変更、改変、および改良が当業者に容易に想起される。上記は、本発明の原理を例示的に示したものに過ぎず、当業者であれば、本発明の範囲および精神から逸脱することなく、様々な改変を為し得る。
【産業上の利用可能性】
【0060】
本発明によれば標的細胞表面の標的分子に特異的に結合する核酸鎖を容易に得ることができるので、創薬、医療分野の研究発展に貢献することができる。
【符号の説明】
【0061】
101…標的細胞その1
102…細胞表面の標的分子
103、103-1,103-2,103-3…標的分子に結合する核酸鎖
104…標的分子に結合しない核酸鎖
105…細胞表面分子分解酵素
106…標的細胞その2
107…標的細胞その3
108…細胞その4
109…核酸プール(またはアプタマープール)
110…抗原提示型細胞
111…予め抗原提示型細胞と結合するものを排除した核酸プール(またはアプタマープール)
201、402…試験管
301…細胞培養皿
401…細胞カラム
403…フラクションコレクターの動く方向
501…ガラス基板
502…細胞電位計測電極
601…標的細胞その1に結合するアプタマー配列
602…標的細胞その2に結合するアプタマー配列
603…スペーサーDNAセンス鎖
604…スペーサーDNAアンチセンス鎖
605…二種類のアプタマーをハイブリダイゼーションさせるためのセンス鎖
606…二種類のアプタマーをハイブリダイゼーションさせるためのアンチセンス鎖
701…ダブルアプタマーその1
702…ダブルアプタマーその2
703…DNA分解酵素
704…DNA分解酵素によって消化されたアプタマー
705…ダブルアプタマーその3
706…ダブルアプタマーその4
801…アプタマーを培養皿上に結合させるための物質
901…制限酵素
1301…AFMチップ
1302…AFM探針
1303…AFMカンチレバー
1304…AFM探針の変位量を計測するためのレーザビーム
1305…光検出器
1306…ピエゾスキャナ
1307…核酸鎖と標的分子の結合が切れた際のカンチレバー変位復元量
1401…神経細胞
1402…軸索
【特許請求の範囲】
【請求項1】
(i)標的細胞または標的細胞の集団に一本鎖核酸または一本鎖核酸プールを適用して前記標的細胞の表面に発現している標的分子に特異的に結合する一本鎖核酸を結合させる工程、
(ii)前記標的細胞の表面に発現している標的分子に特異的に結合しなかった一本鎖核酸を除去する工程、
(iii)前記標的細胞の表面に発現している標的分子の分解酵素を加えて前記標的分子を分解して、前記標的細胞の表面の標的分子に特異的に結合した一本鎖核酸を回収する工程、および
(iv)前記回収した一本鎖核酸をPCRにより増幅する工程、
を含む、標的細胞表面の標的分子に特異的に結合する核酸の選択法。
【請求項2】
さらに、
(v)前記回収した核酸の塩基配列を調べ、比較することで特異的な結合配列を決定し結合性を向上するように設計する工程、を含む、請求項1に記載の方法。
【請求項3】
前記工程(i)〜(iv)で得られた一本鎖核酸を新たに一本鎖核酸プールとして用いて、再度、前記工程(i)〜(iv)を繰り返すことを含む、請求項1または2に記載の方法。
【請求項4】
前記標的細胞の表面に発現している標的分子がタンパク質であり、前記分解酵素がタンパク質分解酵素である、請求項1〜3のいずれか一項に記載の方法。
【請求項5】
請求項1〜4のいずれか一項に記載の核酸選択法を使用する工程を含む、標的細胞に特異的に結合する核酸の製造方法。
【請求項6】
標的細胞の表面に発現している物質に特異的に結合する1以上の一本鎖核酸を基板上の特定の表面領域に付着させた細胞培養チップであって、前記標的細胞を前記一本鎖核酸と結合させることによって前記標的細胞を前記表面領域に固定して培養する、細胞培養チップ。
【請求項7】
請求項1〜4のいずれか一項に記載の核酸選択法を使用して得られた、標的細胞毎に特異的に結合できる一本鎖核酸の一種類または二種類以上を用意する工程、および
複数の前記一本鎖核酸を直鎖状に結合させた核酸鎖を作製することで、核酸鎖を介して同じ標的細胞あるいは異なる二種類以上の標的細胞を培養基板上の特定の表面領域に接着させて、培養する工程、
を含む、細胞培養方法。
【請求項8】
請求項1〜4のいずれか一項に記載の核酸選択法を使用して得られた、標的細胞毎に特異的に結合できる一本鎖核酸の一種類または二種類以上を用意する工程、
複数の前記一本鎖核酸を直鎖状に結合させた核酸鎖を作製する工程であって、前記複数の一本鎖核酸の互いの立体配置および機能を失わないように、前記複数の一本鎖核酸の間にスペーサー分子を挟み込む、工程、
を含むダブルアプタマー分子の作製方法。
【請求項9】
前記スペーサー分子が、二本鎖核酸、ポリエチレングリコール、あるいは生体不活性な分子である、請求項8に記載の方法。
【請求項10】
請求項8または9に記載のダブルアプタマー分子の製造方法によって製造されたダブルアプタマー分子で二種類以上の標的細胞をつなぎ合わせる工程、および
前記つなぎ合わされた二種類以上の標的細胞を解離させる工程、
を含む、標的細胞の連結−解離方法であって、
スペーサー分子が、制限酵素によって特異的に認識される特定の塩基配列が組み込まれた二本鎖核酸であり、
前記ダブルアプタマー分子に前記制限酵素を作用させることによって、前記二種類以上の標的細胞を解離させる、標的細胞の連結−解離方法。
【請求項11】
請求項8または9に記載のダブルアプタマー分子の作製方法により作製したダブルアプタマーを介して同じ種類の細胞あるいは異なる二種類以上の細胞を接着させた後、該細胞を解離させる細胞の連結−解離方法であって、
スペーサー分子が、二本鎖核酸であり、
核酸分解酵素を作用させて前記二本鎖核酸を分解することによって、前記二種類以上の標的細胞を解離させる、細胞の連結−解離方法。
【請求項12】
請求項8または9に記載のダブルアプタマーの作製方法により作製したダブルアプタマーを介してつなぎ合わされた同じ種類の細胞あるいは異なる二種類以上の細胞を培養基板上に配置する工程を含む、細胞培養方法。
【請求項13】
請求項12に記載の細胞培養方法であって、
請求項10または11に記載の標的細胞の連結−解離方法を含む、細胞培養方法。
【請求項14】
請求項1〜4のいずれか一項に記載の核酸選択法を使用して得られた、標的細胞毎に特異的に結合できる一本鎖核酸の一種類または二種類以上を用意し、それらを直鎖状に結合させた核酸鎖を作製することで、シート状の細胞群を積層させる方法。
【請求項15】
請求項1〜4のいずれか一項に記載の核酸選択法を使用して得られた、標的細胞毎に特異的に結合できる一本鎖核酸の一種類または二種類以上を用意し、それらを直鎖状に結合させた核酸鎖を作製することで、2つの細胞を接着させ、かつ、その後に核酸分解酵素によって接着に用いた核酸鎖を分解させる方法。
【請求項16】
請求項1〜4のいずれか一項に記載の核酸選択法を使用して得られた、標的細胞毎に特異的に結合できる一本鎖核酸の一種類または二種類以上を用意し、それらを直鎖状に結合させることで、前記一種類あるいは2種類の細胞を両端に接着させる機能を有する核酸鎖。
【請求項17】
(i)予め準備した抗原を細胞表面に提示する機能を有する貪食細胞を用いて該抗原となる細胞を貪食させる前に、前記貪食細胞に結合する一本鎖核酸を予め一本鎖核酸プールから排除することによって、精製された核酸プールを準備する工程、
(ii)前記貪食細胞に、標的細胞を貪食させて、標的細胞の断片を前記貪食細胞の表面に提示させる工程、
(iii)前記工程(i)において精製された核酸プールを適用して前記標的細胞を貪食した細胞の表面に提示された分子に特異的に結合する一本鎖核酸を結合させる工程、
(iv)前記特異的に結合しなかった一本鎖核酸を除去する工程、
(v)前記標的細胞の表面の分子に特異的に結合した一本鎖核酸を回収するために、分解酵素を加えて前記分子を分解して、結合した一本鎖核酸を回収する工程、
(vi)前記回収した一本鎖核酸をPCRにより増幅する工程、および
(vii)前記回収した核酸の塩基配列を調べ、比較することで特異的な結合配列を決定し結合性を向上するように設計する工程、
を含む、標的細胞表面の分子に特異的に結合する核酸の選択法。
【請求項18】
前記抗原を細胞表面に提示する機能を有する貪食細胞が、マクロファージまたは樹状細胞である、請求項17に記載の方法。
【請求項19】
前記回収した一本鎖核酸の標的分子に対する特異的結合特性を確認するために、原子間力顕微鏡(AFM)探針先端に前記回収した一本鎖核酸のうちの1種類の塩基配列を有する一本鎖核酸を取り付けて細胞表面の標的分子との結合力を直接測定することにより力学的結合の強さを定量的に測定する工程を含む、請求項1〜4および請求項17のいずれかに記載の方法。
【請求項20】
前記回収した一本鎖核酸が標的細胞に対する結合部位を調べる際にAFM探針先端に前記回収した一本鎖核酸のうちの1種類の塩基配列を有する一本鎖核酸を取り付けて標的細胞との結合力を標的細胞表面上全体にわたり直接測定することにより細胞表面での結合力の分布の局所性を定量的に測定する工程を含む、請求項1〜4および請求項17のいずれかに記載の方法。
【請求項1】
(i)標的細胞または標的細胞の集団に一本鎖核酸または一本鎖核酸プールを適用して前記標的細胞の表面に発現している標的分子に特異的に結合する一本鎖核酸を結合させる工程、
(ii)前記標的細胞の表面に発現している標的分子に特異的に結合しなかった一本鎖核酸を除去する工程、
(iii)前記標的細胞の表面に発現している標的分子の分解酵素を加えて前記標的分子を分解して、前記標的細胞の表面の標的分子に特異的に結合した一本鎖核酸を回収する工程、および
(iv)前記回収した一本鎖核酸をPCRにより増幅する工程、
を含む、標的細胞表面の標的分子に特異的に結合する核酸の選択法。
【請求項2】
さらに、
(v)前記回収した核酸の塩基配列を調べ、比較することで特異的な結合配列を決定し結合性を向上するように設計する工程、を含む、請求項1に記載の方法。
【請求項3】
前記工程(i)〜(iv)で得られた一本鎖核酸を新たに一本鎖核酸プールとして用いて、再度、前記工程(i)〜(iv)を繰り返すことを含む、請求項1または2に記載の方法。
【請求項4】
前記標的細胞の表面に発現している標的分子がタンパク質であり、前記分解酵素がタンパク質分解酵素である、請求項1〜3のいずれか一項に記載の方法。
【請求項5】
請求項1〜4のいずれか一項に記載の核酸選択法を使用する工程を含む、標的細胞に特異的に結合する核酸の製造方法。
【請求項6】
標的細胞の表面に発現している物質に特異的に結合する1以上の一本鎖核酸を基板上の特定の表面領域に付着させた細胞培養チップであって、前記標的細胞を前記一本鎖核酸と結合させることによって前記標的細胞を前記表面領域に固定して培養する、細胞培養チップ。
【請求項7】
請求項1〜4のいずれか一項に記載の核酸選択法を使用して得られた、標的細胞毎に特異的に結合できる一本鎖核酸の一種類または二種類以上を用意する工程、および
複数の前記一本鎖核酸を直鎖状に結合させた核酸鎖を作製することで、核酸鎖を介して同じ標的細胞あるいは異なる二種類以上の標的細胞を培養基板上の特定の表面領域に接着させて、培養する工程、
を含む、細胞培養方法。
【請求項8】
請求項1〜4のいずれか一項に記載の核酸選択法を使用して得られた、標的細胞毎に特異的に結合できる一本鎖核酸の一種類または二種類以上を用意する工程、
複数の前記一本鎖核酸を直鎖状に結合させた核酸鎖を作製する工程であって、前記複数の一本鎖核酸の互いの立体配置および機能を失わないように、前記複数の一本鎖核酸の間にスペーサー分子を挟み込む、工程、
を含むダブルアプタマー分子の作製方法。
【請求項9】
前記スペーサー分子が、二本鎖核酸、ポリエチレングリコール、あるいは生体不活性な分子である、請求項8に記載の方法。
【請求項10】
請求項8または9に記載のダブルアプタマー分子の製造方法によって製造されたダブルアプタマー分子で二種類以上の標的細胞をつなぎ合わせる工程、および
前記つなぎ合わされた二種類以上の標的細胞を解離させる工程、
を含む、標的細胞の連結−解離方法であって、
スペーサー分子が、制限酵素によって特異的に認識される特定の塩基配列が組み込まれた二本鎖核酸であり、
前記ダブルアプタマー分子に前記制限酵素を作用させることによって、前記二種類以上の標的細胞を解離させる、標的細胞の連結−解離方法。
【請求項11】
請求項8または9に記載のダブルアプタマー分子の作製方法により作製したダブルアプタマーを介して同じ種類の細胞あるいは異なる二種類以上の細胞を接着させた後、該細胞を解離させる細胞の連結−解離方法であって、
スペーサー分子が、二本鎖核酸であり、
核酸分解酵素を作用させて前記二本鎖核酸を分解することによって、前記二種類以上の標的細胞を解離させる、細胞の連結−解離方法。
【請求項12】
請求項8または9に記載のダブルアプタマーの作製方法により作製したダブルアプタマーを介してつなぎ合わされた同じ種類の細胞あるいは異なる二種類以上の細胞を培養基板上に配置する工程を含む、細胞培養方法。
【請求項13】
請求項12に記載の細胞培養方法であって、
請求項10または11に記載の標的細胞の連結−解離方法を含む、細胞培養方法。
【請求項14】
請求項1〜4のいずれか一項に記載の核酸選択法を使用して得られた、標的細胞毎に特異的に結合できる一本鎖核酸の一種類または二種類以上を用意し、それらを直鎖状に結合させた核酸鎖を作製することで、シート状の細胞群を積層させる方法。
【請求項15】
請求項1〜4のいずれか一項に記載の核酸選択法を使用して得られた、標的細胞毎に特異的に結合できる一本鎖核酸の一種類または二種類以上を用意し、それらを直鎖状に結合させた核酸鎖を作製することで、2つの細胞を接着させ、かつ、その後に核酸分解酵素によって接着に用いた核酸鎖を分解させる方法。
【請求項16】
請求項1〜4のいずれか一項に記載の核酸選択法を使用して得られた、標的細胞毎に特異的に結合できる一本鎖核酸の一種類または二種類以上を用意し、それらを直鎖状に結合させることで、前記一種類あるいは2種類の細胞を両端に接着させる機能を有する核酸鎖。
【請求項17】
(i)予め準備した抗原を細胞表面に提示する機能を有する貪食細胞を用いて該抗原となる細胞を貪食させる前に、前記貪食細胞に結合する一本鎖核酸を予め一本鎖核酸プールから排除することによって、精製された核酸プールを準備する工程、
(ii)前記貪食細胞に、標的細胞を貪食させて、標的細胞の断片を前記貪食細胞の表面に提示させる工程、
(iii)前記工程(i)において精製された核酸プールを適用して前記標的細胞を貪食した細胞の表面に提示された分子に特異的に結合する一本鎖核酸を結合させる工程、
(iv)前記特異的に結合しなかった一本鎖核酸を除去する工程、
(v)前記標的細胞の表面の分子に特異的に結合した一本鎖核酸を回収するために、分解酵素を加えて前記分子を分解して、結合した一本鎖核酸を回収する工程、
(vi)前記回収した一本鎖核酸をPCRにより増幅する工程、および
(vii)前記回収した核酸の塩基配列を調べ、比較することで特異的な結合配列を決定し結合性を向上するように設計する工程、
を含む、標的細胞表面の分子に特異的に結合する核酸の選択法。
【請求項18】
前記抗原を細胞表面に提示する機能を有する貪食細胞が、マクロファージまたは樹状細胞である、請求項17に記載の方法。
【請求項19】
前記回収した一本鎖核酸の標的分子に対する特異的結合特性を確認するために、原子間力顕微鏡(AFM)探針先端に前記回収した一本鎖核酸のうちの1種類の塩基配列を有する一本鎖核酸を取り付けて細胞表面の標的分子との結合力を直接測定することにより力学的結合の強さを定量的に測定する工程を含む、請求項1〜4および請求項17のいずれかに記載の方法。
【請求項20】
前記回収した一本鎖核酸が標的細胞に対する結合部位を調べる際にAFM探針先端に前記回収した一本鎖核酸のうちの1種類の塩基配列を有する一本鎖核酸を取り付けて標的細胞との結合力を標的細胞表面上全体にわたり直接測定することにより細胞表面での結合力の分布の局所性を定量的に測定する工程を含む、請求項1〜4および請求項17のいずれかに記載の方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【公開番号】特開2012−196197(P2012−196197A)
【公開日】平成24年10月18日(2012.10.18)
【国際特許分類】
【出願番号】特願2011−108571(P2011−108571)
【出願日】平成23年5月13日(2011.5.13)
【出願人】(591243103)財団法人神奈川科学技術アカデミー (271)
【出願人】(504296024)一般社団法人オンチップ・セロミクス・コンソーシアム (39)
【出願人】(504179255)国立大学法人 東京医科歯科大学 (228)
【Fターム(参考)】
【公開日】平成24年10月18日(2012.10.18)
【国際特許分類】
【出願日】平成23年5月13日(2011.5.13)
【出願人】(591243103)財団法人神奈川科学技術アカデミー (271)
【出願人】(504296024)一般社団法人オンチップ・セロミクス・コンソーシアム (39)
【出願人】(504179255)国立大学法人 東京医科歯科大学 (228)
【Fターム(参考)】
[ Back to top ]

