標的細菌性細胞を感染させるためにファージを使用する低濃度の標的細菌を検出するための方法
【課題】標的細菌が特定の検出技術の検出限界未満の低濃度である場合に同標的細菌が溶液中に存在しているかどうかを決定する方法を提供すること。
【解決手段】同方法は、溶液と一定量の標識化された親バクテリオファージとを混合して溶液中に存在する標的細菌の少なくともいくらかを感染させて、溶液中に多数の標識化されていない子孫バクテリオファージを生成する工程と、特定の検出技術によって溶液を分析し、標識化されていない子孫バクテリオファージに対するバイオマーカーであって標識化された親バクテリオファージに対するいかなるバイオマーカーに対しても識別可能であり、かつ標的細菌が溶液中に存在していることを間接的に示す、バイオマーカーが存在しているかを決定する工程と、からなる。
【解決手段】同方法は、溶液と一定量の標識化された親バクテリオファージとを混合して溶液中に存在する標的細菌の少なくともいくらかを感染させて、溶液中に多数の標識化されていない子孫バクテリオファージを生成する工程と、特定の検出技術によって溶液を分析し、標識化されていない子孫バクテリオファージに対するバイオマーカーであって標識化された親バクテリオファージに対するいかなるバイオマーカーに対しても識別可能であり、かつ標的細菌が溶液中に存在していることを間接的に示す、バイオマーカーが存在しているかを決定する工程と、からなる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、標的細菌性細胞を感染させるためにバクテリオファージを使用する、液体混合物中における低濃度の標的細菌を検出するための方法に関する。
【背景技術】
【0002】
本願はその全体が本願明細書中において参照として援用される、発明の名称が「標的細菌性細胞を感染させるためにファージを使用する低濃度の標的細菌の検出方法(METHOD OF DETECTING LOW CONCENTRATIONS OF A TARGET BACTERIA THAT USES PHAGES TO INFECT TARGET BACTERIAL CELLS)」であり、かつ2002年4月12日に、Angelo J.Madonna及びKent J.Voorheesによって出願された米国仮出願第60/319,184号の権利を請求する。
【0003】
標準的な微生物学的方法は、特定の生物体の存在を試験するために基質に基づく検定法にこれまで依存してきた(Bordnerらによる、1978年)。これらの技術は高レベルの選択性を提供するものの、標的細胞の純粋な培養物を最初に生育する、又は培養するために24時間またはそれ以上を要するという必要性が障害となっている。この時間的な制約は、微生物の毒性株の存在に対して迅速な応答を提供するための有効性を非常に制限するものである。
【0004】
分子生物学の技術は、標準的な微生物試験に対する価値のある代替方法として迅速に受け入れられている。特に、血清学的方法は、標的となる微生物に対するマトリクスの宿主を評価するために広く使用されてきた(Kingsbury及びFalkow、1985年;Wyattら、1992年)。これらの試験は、最初に捕捉するために抗体を使用し、次いで複雑な生物学的混合物中において他の成分から標的微生物を分離することを中心とする。分離後、捕捉された生物は濃縮され、かつ生物学的な検体を培養する必要のない種々の異なる技術により検出される。
【0005】
免疫磁気分離法(IMS)と称される一つの最も汎用される試みは、抗体を球形の微細な常磁性ビーズに固定して、該抗体で被覆されたビーズを用いて標的微生物を液体媒体から捕捉することを含む。該ビーズは標的生物体の回復及び濃縮を促進する磁場の影響下において容易に操作される。更に、該ビーズはサイズが微小であり、かつビーズの形状であることからサンプル内に均等に分散され得、ビーズと標的との相互作用の速度が加速される。これらの好ましい特性は、検定時間を低減し、かつ分析操作の能率化を助けるとともに、より高度なサンプルのスループット及び自動化に対する適用化を更に可能とする点にある。
【0006】
IMSとともにこれまで使用されてきた下流検出法は、ELISA(Cudjoeら、1995年)、ドット・ブロット検定法(Skjerveら、1990年)、電気化学発光(Yu及びBruno、1996年)及びフローサイトメトリー(Pyleら、1999年)が含まれる。これらの試験法は満足のゆく結果を提供するものの、非標的検体との交差反応性により、擬陽性の結果にかなり影響を受けやすい二値化の応答(yes/no)を実施し、かつ与えるためには、煩雑である。マトリクス支援レーザ脱離/イオン化(MALDI)飛行時間形(TOF)質量分析(MS)と組み合わせられたIMSを用いて複雑な生物学的混合物から特定の細菌を識別するための迅速な方法が近年報告されている(Madonnaら、2001年)。この試みは、種々のマトリクスが、1時間の総分析時間以内にてサルモネラ種の存在に対して評価されることを可能にする。更に、サンプリング工程をほとんど必要としないこの発展的な方法は実施が比較的容易であり、かつ得られた分子量の情報から、標的細菌からの信号と、交差反応される構成成分からの信号とを区別することが可能である。
【0007】
MALDI−TOF−MS法は、全ての細胞性微生物を識別するための証明された技術である(Hollandら、1996年;van Barr、2000年;Madonnaら、2000年)。特に、MALDIは、蛋白質シグナルの分配を変更するマススペクトルの特徴が生成される「フィンガープリント」技術である。微生物のプロテオームにおける生来の差異により、生成されるシグネチャプロファイル(signature profiles)は、菌株のレベルまで下がって個体を識別することを可能にする(Arnold及びReilly,1998年)。一実施形態において、IMSと組み合わせられたMALDI−TOF技術は、標的細菌を含み得る液体混合物を該標的細菌に特異的な免疫磁気ビーズと短い培養時間(例えば、約20分)にて混合する工程を含む。ビーズに捕捉された任意の標的細菌は脱イオン水にて2回洗浄して再懸濁させ、かつMALDIサンプル用プローブ上に直接適用される。次いで、標的細菌−ビーズ複合体は、ごく微量のマトリクス溶液で重ねられ、室温にて乾燥される。得られた結晶塊を高強度レーザにて照射することにより、無傷細胞蛋白質の担体分離及びイオン化が促進され、該蛋白質は引き続いて、TOF質量分析計により検出される。次いで、得られたマススペクトルにおいて、標的細菌の存在を示す決定的な質量ピークをデータベースにて検索する(interrogate)。
【先行技術文献】
【特許文献】
【0008】
【特許文献1】米国特許出願公開第2004/0137430号明細書
【特許文献2】米国特許第5985596号明細書
【特許文献3】欧州特許出願公開第0439354号明細書
【特許文献4】国際公開第94/06931号パンフレット
【特許文献5】欧州特許出願公開第1300082号明細書
【特許文献6】国際公開第03/087772号パンフレット
【特許文献7】国際公開第02/061117号パンフレット
【特許文献8】国際公開第98/18962号パンフレット
【特許文献9】国際公開第93/17129号パンフレット
【特許文献10】国際公開第95/05483号パンフレット
【特許文献11】米国特許第4104126号明細書
【特許文献12】米国特許第4797363号明細書
【特許文献13】米国特許第4861709号明細書
【特許文献14】米国特許第5085982号明細書
【特許文献15】米国特許第5168037号明細書
【特許文献16】米国特許第5656424号明細書
【特許文献17】米国特許第5679510号明細書
【特許文献18】米国特許第5723330号明細書
【特許文献19】米国特許第5824468号明細書
【特許文献20】米国特許第5888725号明細書
【特許文献21】米国特許第5914240号明細書
【特許文献22】米国特許第5958675号明細書
【特許文献23】米国特許第5985596号明細書
【特許文献24】米国特許第6090541号明細書
【特許文献25】米国特許第6265169号明細書
【特許文献26】米国特許第6300061号明細書
【特許文献27】米国特許第6355445号明細書
【特許文献28】米国特許第6428976号明細書
【特許文献29】米国特許第6436652号明細書
【特許文献30】米国特許第6436661号明細書
【特許文献31】米国特許第6461833号明細書
【特許文献32】米国特許第6524809号明細書
【特許文献33】米国特許第6544729号明細書
【特許文献34】米国特許第6555312号明細書
【特許文献35】米国特許第6660437号明細書
【特許文献36】米国特許第6660470号明細書
【特許文献37】米国特許出願公開第2002/0045195号明細書
【特許文献38】米国特許出願公開第2002/0127547号明細書
【特許文献39】米国特許出願公開第2003/0027241号明細書
【非特許文献】
【0009】
【非特許文献1】トーマス(Thomas)他、「キャプシド蛋白質の直接的分析によるウィルス特性(Viral characterization by direct analysis of capsid proteins)」、アナリティカル・ケミストリー(Analytical Chemistry)、1998年9月、第90巻、第18号、p.3863−3867
【非特許文献2】エス.ダブリュ.エル.タン(S.W.L. TAN)外2名、「LC及び/又はMALDIマススペクトロメトリを使用した二つのランウィルスの迅速な同時検出法(Rapid Simultaneous Detection of Two Orchid Viruses Using LC−and/or MALDI−mass Spectrometry)」、ジャーナル・オブ・ヴィロロジカル・メソッズ(Journal of Virological Methods)、エルスビア・サイエンス・ビー.ブイ.(Elsvier Science B.V.)、2000年、第85巻、p.93−99
【非特許文献3】ダブリュ.サン(W.SUN)外2名、「(構築されたファージベースの生物学的吸着剤の効果を評価するための生物発光サルモネラ菌の使用(Use of Bioluminescent Salmonella for Assessing the Efficiency of Constructed Phage−Based Biosorbent)」、ジャーナル・オブ・インダストリアル・マイクロバイオロジー・アンド・バイオテクノロジー(Journal of Industrial Microbiology & Biotechnology)、ネイチャー・パブリッシング・グループ(Nature Publishing Group)、2000年、第25巻、p.273−275
【非特許文献4】ジー.シウズダク(G.SIUZDAK)、「マススペクトロメトリを用いたウィルスのプロービング(Probing Viruses With Mass Spectrometry)」、ジャーナル・オブ・マス・スペクトロメトリ(Journal of Mass Spectrometry)、ジョン・ウィリー・アンド・サンズ(John Wiley & Sons)社、1998年、第33巻、p.203−211
【非特許文献5】アール.ジェニソン(R.JENISON)外4名、「蛋白質又は核酸標的の迅速な検出のためのシリコンベースのバイオセンサ(Silicon−Based Biosensor for Rapid Detection of Protein or Nucleic Acid Targets)」、クリニカル・ケミストリー(Clinical Chemistry)、アメリカン・アソシエーション・フォー・クリニカル・ケミストリー(American Association for Clinical Chemistry)社、2001年10月、第47巻、第10号、p.1894−1900
【非特許文献6】アール.ジェニソン(R.JENISON)外4名、「メチシリン耐性黄色ブドウ球菌からのmecAの迅速な検出のための薄膜バイオセンサ(Thin Film Biosensor for Rapid Detection of mecA from Methicillin−resistant Staphylococcus aureus)」、クリニカル・ケミストリー(Clinical Chemistry)、アメリカン・アソシエーション・フォー・クリニカル・ケミストリー(American Association for Clinical Chemistry)社、2000年9月、第46巻、第9号、p.1501−1504
【非特許文献7】エイ.ジェイ.マドンナ(A.J.MADONNA)外2名、「マトリクス支援レーザ脱離イオン化/飛行時間形質量分析と結合された免疫磁気分離及びバクテリオファージの増殖を用いた大腸菌の検出(Detection of Escherichia coli Using Immunomagnetic Separation and Bacteriophage Amplification Coupled with Matrix−assisted laser Desorption/Ionization Time−of−Flight Mass Spectrometry)」、ラピッド・コミュニケーションズ・イン・マス・スペクトロメトリ(Rapid Communications in Mass Spectrometry)、ジョン・ウィリー・アンド・サンズ(John Wiley & Sons)社、2002年12月24日オンライン出版、第17巻、p.257−263
【発明の概要】
【発明が解決しようとする課題】
【0010】
本発明の目的は、標的細菌が特定の検出技術に対して検出限界未満の低濃度にある場合に、該標的細菌が溶液中に存在するか否かを決定するための方法を提供することにある。
【課題を解決するための手段】
【0011】
上述の目的を解決するために、請求項1に記載の発明は、標的細菌が特定の検出技術の検出限界未満の低濃度である場合に同標的細菌が溶液中に存在しているかどうかを決定するための方法であって、同方法は、溶液と、一定量の標識化された親バクテリオファージと、を混合して、同溶液中に存在する標的細菌の少なくともいくらかを感染させて、同溶液中に多数の標識化されていない子孫バクテリオファージを生成する工程と、同特定の検出技術によって同溶液を分析し、標識化されていない子孫バクテリオファージに対するバイオマーカーであって標識化された親バクテリオファージに対するいかなるバイオマーカーに対しても識別可能であり、かつ標的細菌が溶液中に存在していることを間接的に示す、バイオマーカーが存在しているかを決定する工程と、からなる方法を提供する。
【0012】
請求項2に記載の発明は、請求項1に記載の方法において、分析工程は、マススペクトル分析を実施することからなることをその要旨とする。
請求項3に記載の発明は、請求項1に記載の方法において、分析工程は、MALDI分析を実施することからなることをその要旨とする。
【0013】
請求項4に記載の発明は、請求項1に記載の方法において、分析工程は、MALDI−TOF分析を実施することからなることをその要旨とする。
請求項5に記載の発明は、請求項1に記載の方法において、分析工程は、エレクトロスプレーイオン化質量分析法を実施することからなることをその要旨とする。
【0014】
請求項6に記載の発明は、請求項1に記載の方法において、分析工程は、イオン移動度分光分析法を実施することからなることをその要旨とする。
請求項7に記載の発明は、請求項1に記載の方法において、分析工程は、光学分光分析法を実施することからなることをその要旨とする。
【0015】
請求項8に記載の発明は、請求項1に記載の方法において、分析工程は、免疫分析法を実施することからなることをその要旨とする。
請求項9に記載の発明は、請求項1に記載の方法において、分析工程は、クロマトグラフィー分析法を実施することからなることをその要旨とする。
【0016】
請求項10に記載の発明は、請求項1に記載の方法において、分析工程は、アプタマー分析法を実施することからなることをその要旨とする。
請求項11に記載の発明は、請求項1に記載の方法において、標的細菌を溶液から分離する工程を更に含むことをその要旨とする。
【0017】
請求項12に記載の発明は、請求項11に記載の方法において、分離工程は、標的細菌に対する抗体で被覆された免疫磁気ビーズを使用する工程を更に含むことをその要旨とする。
【0018】
請求項13に記載の発明は、請求項1に記載の方法において、標識化された親バクテリオファージはビオチン化バクテリオファージであることをその要旨とする。
一実施形態において、該方法は、標的細菌に対するバクテリオファージが溶液に適用されるような生物学的な増幅工程を用いることからなる(バクテリオファージは細菌を感染させ、かつ該工程において多くの子孫を生成するウィルスである。構造的に、該バクテリオファージはウィルス性核酸を被包する蛋白質の殻(キャプシド)から構成される。キャプシドは、同一蛋白質の反復するコピーから構成される。バクテリオファージは特定の細菌細胞を感染させることが可能であり、遺伝材料の増幅により、該細胞は最終的には最初のファージの数百万ものコピーを爆発的に放出する。)。溶液中に存在するバクテリオファージと任意の標的細菌は培養される。培養期間の間、該バクテリオファージは溶液中に存在する標的細菌に感染することにより増殖する。より詳細には、該バクテリオファージは、感染された標的細菌中にて、自身の非常に多くのコピーを複製する。最終的に、感染された標的細菌は溶解(lyse)され、複製されたバクテリオファージ、又は子孫(progeny)バクテリオファージは溶液中に放出される。次いで、該溶液は、該バクテリオファージに対するバイオマーカーが存在するか否かを決定するために分析され、それにより、該標的細菌が溶液中に存在することを間接的に示す。分析技術として可能なものには、MALDI−MS及びエレクトロスプレーイオン化質量分析技術のような質量分析技術が含まれる。
【0019】
バクテリオファージに対するバイオマーカーの検出により標的細菌が溶液中に存在することが指標されることを確実にするために、該バクテリオファージの濃度には、いかなる分析技術が使用された場合においてもバクテリオファージ用バイオマーカーに対する検出限界未満である溶液が適用される。これは、バクテリオファージに対するバイオマーカーが分析技術により検出される場合に、該バイオマーカーの検出可能な濃度は、溶液中に存在する標的細菌によるバクテリオファージの複製に起因することを確実にする。ある状況下において、そのような濃度のバクテリオファージの使用は、低すぎて検出のためのバクテリオファージ又はバクテリオファージ用バイオマーカーの十分な濃度を迅速に生成することができない感染の多重度(MOI)(即ち、感染しているバクテリオファージの標的細菌に対する比率)を有する。
【0020】
本方法の別の実施形態は、溶液に対して非常に高濃度のバクテリオファージを加えて、それにより高いMOIを得ることによりこの問題を解決するものである。この場合、溶液に加えられるべきバクテリオファージの濃度は、該バクテリオファージ又は該バクテリオファージのバイオマーカーを検出するためにいかなる検出技術が使用されてもその検出限界を超えるものである。結果として、該方法は、混合物中の標的細菌の感染により得られる任意の子孫バクテリオファージと区別される親バクテリオファージを溶液に適用する。識別可能な子孫バクテリオファージ又は子孫バクテリオファージの識別可能なバイオマーカーが存在する場合、標的細菌が溶液プローブ中に存在することを示す。
【0021】
一実施形態において、親バクテリオファージ(即ち、溶液中に最初に適用されるバクテリオファージ)は、使用されるいかなる分析技術も、親バクテリオファージ又は親バクテリオファージのバイオマーカーを、子孫バクテリオファージ又は子孫バクテリオファージに対するバイオマーカーと生来的に識別することが可能であるように「標識(tag)」を付与される。例えば、質量分析技術が使用される場合、親バクテリオファージは、該親バクテリオファージのマススペクトルを子孫バクテリオファージに対して変更するか、又はシフトする物質にて「標識」化され、該子孫バクテリオファージは親バクテリオファージからの「標識」を遺伝的に継承していないであろう。例えば、ビオチン化されたバクテリオファージは親バクテリオファージとして使用され得、かつ溶液中に存在する標的細菌を感染するビオチン化バクテリオファージにより生成される子孫バクテリオファージとは異なるマススペクトルを有するであろう。別の「標識」は、別の型の分析技術のために使用される。
【0022】
別の実施形態において、親バクテリオファージは分析の前に溶液中の子孫バクテリオファージから区別されることを可能とする性質を有し、それにより、分離の後に溶液中に存在するバクテリオファージの全てとはいえないにしてもほとんどが、該溶液中存在する標的細菌による親バクテリオファージの複製により得られる子孫バクテリオファージであることを確実にする。一実施形態において、溶液中に最初に適用される親バクテリオファージは、ビオチン化バクテリオファージである。ビオチン化バクテリオファージはストレプトアビジンにかなり誘引される。この誘引は、ビオチン化バクテリオファージを、混合物中に存在する標的細菌によるビオチン化バクテリオファージの複製により得られる子孫バクテリオファージから分離するために使用される。
【0023】
一実施形態において、ビオチン化バクテリオファージはストレプトアビジンで被覆されたプローブに付着される。結果として、培養期間の後に溶液からのビオチン化バクテリオファージの分離は、該溶液からプローブを除去することにより達成される。別の実施形態において、ストレプトアビジンにより被覆された磁気ビーズが溶液に適用される。該ビーズは、ビオチン化バクテリオファージを捕捉するために使用される。次いで、該ビーズは磁石を用いて溶液から分離される。更に別の実施形態において、ストレプトアビジンにて被覆されたプローブ(例えば、スライド)は、培養期間の後に溶液に適用される。ビオチン化バクテリオファージはプローブに付着し、次いで、該プローブが溶液から分離される。
【0024】
本発明の更に別の実施形態は、標的細菌が存在している可能性のある溶液が、バクテリオファージ又はバクテリオファージ用バイオマーカーの検出をより困難にするか、若しくは使用される検出技術により提供される情報の信頼性を低減する、生物学的材料を含む複合体混合物であるか、又は複合体混合物であり得ることを認識する。例えば、質量分析の検出法を使用する場合、複合体混合物は、バクテリオファージに関連するバイオマーカーが不明瞭である、別の言い方をするのであれば、低い信号対ノイズ比を有する、信号を生成するかもしれない。この可能性を解決するために、溶液中に存在している標的細菌が該溶液の残りの部分から分離される精製工程を該溶液に実施する。一実施形態において、免疫磁気分離法(IMS)は、溶液中に存在する標的細菌を該溶液の残りの部分から分離するために使用される。一つの特殊な実施形態において、磁気ビーズは標的細菌に対する抗体で被覆される。該抗体は液体混合物中に存在する標的細菌に捕捉し、次いで、該ビーズを溶液の残りの部分から分離するために磁石が使用される。次いで、ビーズ及び任意に接着する標的細菌に、生物学的増幅工程及び分析が実施される。この精製工程はまた、バクテリオファージの野生種が溶液中に存在する可能性、及びそのような種が、該溶液の精製工程を実施しなかった場合には擬陽性を発生する可能性、に取り組むものであることが理解されるべきである。
【0025】
バクテリオファージの野生種が心配ではない場合、精製工程は生物学的な増幅工程の後に実施される。この実施形態において、該精製工程は、標的細菌と溶液とを分離するよりはむしろ、バクテリオファージと溶液とを分離する工程を含む。一実施形態において、バクテリオファージに対する抗体で磁気ビーズが被覆されているIMSが使用される。該ビーズは溶液中に存在するバクテリオファージを捕捉し、次いで、該ビーズを溶液の残りの部分から分離するために磁石が使用される。
【0026】
本発明の別の実施形態において、分析工程は、標的細菌に対するバイオマーカーが存在するか否かを決定するためにMS/MS分析法を用いることを含む。MS/MS分析法の使用は、標的細菌に対するバイオマーカーの存在の信頼性の高い指標を生成する。結果として、少なくともいくらかの場合、MS/MS分析法の使用は、精製工程の必要性を不必要にする。
【0027】
更に別の実施形態において、本発明は複合体混合物中の低濃度の標的細菌を検出する方法に関する。一実施形態において、該方法は液体混合物中に存在し得る標的細菌の少なくともいくらかを単離するためにIMS工程を用いることからなる。該方法は更に、標的細菌に対する低滴定濃度又は低濃度のバクテリオファージがIMS工程によって単離された標的細菌の少なくともいくらかに適用される生物学的増幅工程を使用することを含む。バクテリオファージ及び単離された標的細胞のいくらかの混合物は培養される。少なくとも所定の濃度の標的細菌が存在する場合、バクテリオファージは、高滴定濃度又は高濃度のバクテリオファージが混合物に存在し、かつMALDI−TOF−MS分析法により検出可能であるように、培養期間の間増殖される。仮に標的細胞が全く存在しないか、又はほんのわずかしか存在しない場合、MALDI−TOF−MS分析法により理にかなって検出することのできない低濃度のバクテリオファージが混合物中に存在するであろう。培養に続いて、MALDI−TOF−MS分析法はバクテリオファージ及び標的細菌の培養された混合物において実施される。得られたマススペクトルは、バクテリオファージと関連した蛋白質が存在しているか否かを決定するために分析される。仮にバクテリオファージに対する蛋白質が検出される場合、少なくとも低濃度の標的細菌が混合物中に存在していると結論づけられる。
【0028】
本発明の方法は、細菌が成長する、又は繁殖する様式にかかわらず、低濃度の標的細菌を検出することが可能であるものと理解されるべきである。
【発明の効果】
【0029】
本発明によれば、標的細菌が特定の検出技術の検出限界未満の低濃度である場合に同標的細菌が溶液中に存在しているかどうかを決定する方法が提供された。
【図面の簡単な説明】
【0030】
【図1】本発明の一実施形態に対して、標的微生物を単離するために使用される免疫磁気ビーズを示す(抗体は縮尺に基づいて描かれていない)。
【図2】本発明の一実施形態において、標的抗原(大腸菌)を単離するために使用される免疫磁気精製工程の概略図である。
【図3】本発明の一実施形態に対するバクテリオファージ増幅工程の概略図である。
【図4】PBS中における高滴定濃度のMS2サンプルから得られる典型的なMALDI−TOFマススペクトルを示す。
【図5】(a)〜(c)は、大腸菌の濃度を減少するために、該大腸菌の存在を指標するバクテリオファージのバイオマーカーを本発明の一実施形態が如何に検出可能であったかを示す。
【発明を実施するための形態】
【0031】
本発明は、概して、標的細菌の濃度が使用されるべき特定の検出技術に対して検出限界であるか、又は可能性として検出限界付近若しくは検出限界未満であるような溶液中の標的細菌の存在を間接的に検出するためにバクテリオファージを使用する方法に関する。
【0032】
本明細書において使用されるように、「標的細菌(target bacterium)」なる用語は細菌の単数又は複数の種を参照する。場合によっては、複数の標的細菌(a plurality of target bacteirum)は標的細菌(target bacteria)として参照され得る。
【0033】
バクテリオファージは細菌を感染させるウィルスであり、かつ感染の工程において、該細菌は多くの子孫を生成する。構造的には、該バクテリオファージはウィルス性核酸を被包する蛋白質の殻(キャプシド)からなる。キャプシドは同一蛋白質の反復するコピーから構成される。バクテリオファージは特定の細菌細胞を感染可能であり、多くの子孫の増殖により、該細胞は最終的には、最初のファージの数百万ものコピーを爆発的に放出する。この感染工程は、低濃度の標的細菌細胞を検出するためのバイオマーカー増幅工程としての目的を果たすために使用されてきた。例えば、MS2バクテリオファージのキャプシドは13kDの蛋白質の180のコピーを含む。この特殊なウィルスは大腸菌の菌株を特異的に感染させ、かつ標的細菌細胞に付着後40分間の間に自身の10000乃至20000のコピーを生成可能である。本質的には、一つの大腸菌がMS2に感染し、1.8×106倍のキャプシド蛋白質の複製を生ずる。
【0034】
マトリクス支援レーザ脱離イオン化/質量分析(MALDI/TOF)により得られる結果は、増幅工程の有用性を示すために使用される。MALDI−TOF―MSは全細胞性微生物を識別するための証明された技術である(Hollandら、1996年;van Barr、2000年;Madonnaら、2000年)。特に、MALDIは、蛋白質シグナルの分配を変更するマススペクトルの特徴が生成される「フィンガープリント」技術である。微生物のプロテオームにおける生来の差異により生成されるシグネチャプロファイルは、菌株のレベルまで下降して生物体を識別することを可能にする(Arnold及びReilly,1998年)。
【0035】
標的細菌細胞からの蛋白質のMALDI信号が検出されるには弱すぎるような実験において、低レベル(低すぎてMALDIにより検出できない)の適切なファージの標的細菌細胞への添加の約30分後に、ファージキャプシド蛋白質に起因する検出可能な蛋白質MALDI信号を生成した。他の細菌種に特異的なバクテリオファージは、典型的には異なる分子量であるキャプシド蛋白質を有し、故に、異なるMALDI信号を与える。従って、該方法は多数の異なる細菌種に適用可能である。イオン移動度分光分析、光学分光分析、免疫技術、クロマトグラフィー技術及びアプタマー法のような他の検出技術も同様に実施可能である。
【0036】
一般的に、標的細菌以外の生物学的材料を含むか、又は含んでいる可能性のある複合体液体混合物中における低濃度の標的細菌を検出するための方法は、仮に少なくとも所定の濃度の標的細菌が混合物中に存在している場合、該標的細菌の識別可能な信号又は指標が生成される分析に対する液体混合物、溶液又はサンプルを生成するために該混合物又はその一部を処理する工程を含む。「溶液」及び「液体混合物」なる用語は、試験を受けるべく最初の溶液又は混合物及び、方法の適用の結果として、該最初の溶液又は混合物の一部を含む任意の溶液又は混合物を参照するものと理解されるべきである。
【0037】
一実施形態において、該方法は、低濃度の標的細菌が液体中に存在しているか否かを決定することを含む。この決定は、溶液中に存在する任意の標的細菌が低濃度にて存在することを前提とすることにより行われる。これに代えて、いかなる検出技術が使用されている場合においても検出限界を確実に超える濃度にて標的細菌が存在するか否かを決定するために検定が実施され得る。例えば、質量分析技術が使用可能である。仮に、質量分析技術が溶液中の標的細菌の存在を示す信頼のおける信号を提供する場合、更なる工程を必要としない。しかしながら、質量分析技術が溶液中の標的細菌の存在を示す信頼のおける信号を提供しない場合、標的細菌は溶液中に存在している可能性はあるが、質量分析技術の検出限界未満又は検出限界付近の濃度にて存在していると結論付けられる。この場合、標的細菌が質量分析技術の検出限界を下回る濃度にて溶液中に存在しているか否かを決定するために更なる工程が実施される。
【0038】
該方法は、混合物中に存在し得る標的細菌を捕捉し、かつ該補足された細菌のいくらかを該混合物中に存在し得る他の生物学的材料から分離することを含む精製工程からなる。捕捉された細菌のいくらかを混合物中に存在し得る他の生物学的材料から分離することにより、該混合物中に存在する他の生物学的材料に関連した引き続き生成されるマススペクトル信号の部分が減少される。一実施形態において、免疫磁気分離(IMS)法が標的細菌を捕捉及び分離するために使用される。
【0039】
該方法は更に、捕捉され、かつ分離された任意の標的細菌の少なくともいくらかを、該標的細菌に特異的であるバクテリオファージで感染させる増幅工程を受けることからなる。存在する標的細菌が少なくとも所定の濃度である場合、バクテリオファージに関連したバイオマーカーがMALDI/TOF−MSのような分析技術を用いて検出可能な地点まで、該バクテリオファージは増殖されるであろう。MALDI/TOF−MSの場合、バクテリオファージの存在を示す引き続き生成されるマススペクトル信号の一部は、増大するであろう。仮に特定の濃度未満にて標的細菌が存在している場合、バクテリオファージは、MALDI/TOF−MSを用いて生成されるマススペクトルにおいて検出可能なまでには充分に増殖されないであろう。本質において、少なくとも所定の濃度の標的細菌が混合物中に存在している場合、精製工程及び増幅工程は、バクテリオファージに関連する、引き続いて生成されるマススペクトルの一部に対して信号対ノイズ比を増大させるために提供される。
【0040】
増幅後、増幅された混合物の少なくとも一部は、標的細菌に対するバイオマーカーが存在するか否かを決定するための分析が行われる。例えば、MALDI/TOF−MS分析法は、マススペクトルを生成するために使用され得る。マススペクトルは、バクテリオファージに対する一つ以上のバイオマーカーが存在しているか否かを決定するために分析される。そのようなバイオマーカーが存在している場合、標的細菌の少なくとも所定の濃度が最初のサンプル混合物中に存在していたことの間接的な指標となる。
【0041】
精製工程の必要性は、他の生物学的材料に関連した信号の部分がフィルタ化されるか、排除されるか若しくは無視されるような状況、及び/又は増幅工程がバクテリオファージに関連したマススペクトルの部分が他の生物学的材料に関連した任意のバックグランド信号を超えるような利得を有する状況、及び/又は擬陽性になり得る可能性が低いと考えられる状況にある場合には不必要であることは理解されるべきである。更に、バクテリオファージに対するバイオマーカーが存在しているか否かを決定することを困難にするようなその他の生物学的材料の一つが、試験されるべき溶液中に存在するバクテリオファージの野生種であることも理解されるべきである。精製工程は野生型バクテリオファージの存在の問題に取り組むものである。
【0042】
仮に試験されるべき溶液又は混合物中に野生型のバクテリオファージが存在しているか、又は存在している可能性が問題とならない場合、増幅工程後に精製工程を実施することも可能である。しかしながら、この場合、バクテリオファージは溶液の残りの部分から分離される。既に明記したIMS技術が使用され得る。しかしながら、磁気ビーズは標的細菌に対する抗体よりはむしろ、バクテリオファージに対する抗体で被覆される。
【0043】
ある場合において、バクテリオファージに対するバイオマーカーがバクテリオファージに対して非常に高い特異性を有し擬陽性になることがほとんどないような、MS/MS法のような特異性の高い分析技術を用いることにより精製工程の必要性を排除することもまた可能である。現在のところ、MS/MS法の使用は、7000Da未満であるキャプシド蛋白質に限られている。
【0044】
図1を参照して、混合物中の標的細菌を捕捉して、捕捉された任意の標的細菌を該混合物中の他の生物学的材料から分離するための免疫磁気分離(IMS)技術が記載されている。マイクロサイズのビーズは、ポリマー表面にて被覆された酸化鉄のコアから構成されている。一次抗体のFeの領域に対して生成された二次抗体は、リンカーを介してポリマー表面に共有結合にて付着されている。一次抗体(標的細菌に対して生成される)は、二次抗体との強い非共有結合的な相互作用により該ビーズに付着されており、該二次抗体は、標的抗原との反応において、適切な方向にて一次抗体を保持している。
【0045】
図2を参照して、免疫磁気ビーズは分析されるべく細菌混合物又は生物学的混合物に加えられ、室温にて20分間培養される。次いで、該ビーズは磁石を用いて反応管の側方にて分離される。この方法は余分な(非標的)材料を吸引により除去可能とする。この段階において、該ビーズはPBSに再び懸濁される前に、数回洗浄される。
【0046】
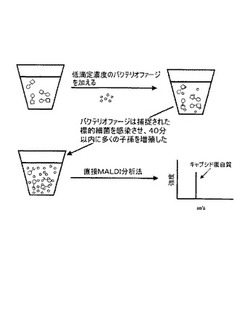
図3を参照して、ビーズ−細菌標的複合体は標的細菌に特異的な低滴定濃度のバクテリオファージ懸濁液と混合される。該滴定濃度は、ウィルスからの質量分析信号が検出不能であるように低く維持される。40分間の培養の後に、バクテリオファージは、付着、挿入、自己アセンブリ、反応環境中に放出される多くの子孫の生成により生じる細胞の溶解からなる繁殖のサイクルを完了した。該環境は次に、標的細菌が存在していることを間接的に示すバクテリオファージ用バイオマーカーが存在しているか否かを決定するために分析される。例えば、該環境は、フェルラ酸マトリクスを用いたサンドイッチサンプル調製(sandwich sample preparation)技術を用いてMALDI−TOF−MSにより分析され得る。当業者に周知の他のMALDI用マトリクスもまた使用可能である。得られたマススペクトルは、バクテリオファージキャプシド蛋白質の存在を示しており、該蛋白質は標的細菌が存在しない場合はまた存在しなかったであろう。
【0047】
混合物中にて標的細菌を捕捉し、かつ該混合物中において任意の捕捉された標的細菌を分離し、引き続いてMALDI−TOF/MS分析を行うIMS技術が、2002年4月12日に出願された、発明の名称が「ある種の細菌が混合物中に存在しているかを決定するための方法(Method for Determining if a Type of Bacteria is Present in a Mixture)」である米国特許出願第10/063346号に記載されており、該特許出願は、その全体が参照により本明細書中にて援用される。
【実施例】
【0048】
以下に記載されるように、本方法の実施形態は、大腸菌の検出限界を5.0×104細胞/mL未満に減少させるために使用された。該方法では、以下において標的−ビーズ複合体として参照される、大腸菌に対する抗体で被覆された免疫磁気ビーズを溶液から細菌を単離するために使用した。次に、標的−ビーズ複合体は、大腸菌に特異的なバクテリオファージであるMS2を含む溶液中に再懸濁した。MS2バクテリオファージの濃度は、MS2バクテリオファージのキャプシド蛋白質からのイオンシグナルが質量分析の検出限界未満となるように調整された。40分間の培養の後、溶液のアリコートが取り除かれ、13kDaのキャプシド蛋白質に対してオンプローブ(on−probe)MALDI−TOF−MS法により分析した。MS2キャプシド蛋白質に対する[M+H]+(m/z 13726)及び[M+2H]2+(m/z 6865)イオンシグナルが検出された(図4)。
【0049】
図5Aを参照して、5.0×106細胞/mLの濃度の大腸菌を含む混合物に対して本発明の方法を適用することにより、大腸菌及びMS2バクテリオファージの両方に対する蛋白質シグナルを示すマススペクトルが得られた。該方法は、大腸菌の濃度を低減するために繰り返された。具体的には、図5Bを参照して、該方法は、〜5.0×105細胞/mLの濃度の大腸菌に対して繰り返された。この場合、マススペクトルは大腸菌細胞の任意の蛋白質シグナルを明らかに示してはいないが、MS2バクテリオファージキャプシド蛋白質に対する蛋白質シグナルは示している。図5Cを参照して、該方法は、〜5.0×104細胞/mLの濃度の大腸菌に対して繰り返された。この場合、マススペクトルは大腸菌細胞の任意の蛋白質シグナルを明らかに示してはいないが、MS2バクテリオファージキャプシド蛋白質に対する蛋白質シグナルは依然として示されている。これらの結果は、大腸菌が免疫磁気ビーズに捕捉され、次いで、MS2ウィルスにより感染され、増殖可能となり、検出可能なレベルまでキャプシド蛋白質の濃度が増大可能となったことを示している。現在のところ、〜1.0×103細胞/mLであるような濃度の標的細菌を本発明の方法を用いて間接的に検出している。
【0050】
大腸菌の検出の実施例に関して実施された本発明の方法の種々の実施形態を以下に記載する。
大腸菌の調製
大腸菌は、標準的な微生物学的方法を用いて37℃にて培養しながら、トリプチカーゼ大豆培地(TSB)(ミシガン州デトロイトに所在のDifco社)にて生育した。
バクテリオファージの調製
バクテリオファージの増殖は、M.H.Adams’Bacteriophages(Interscience Publishers社、ニューヨーク、1959年)に記載されているようなアダムス寒天重層(Adams agar−overlay)法に従って実施した。簡潔に述べると、軟寒天/ホスト皮膜を、TSB中に2滴の20hrホスト(20hr host)を含んだ溶融した0.5%の寒天の2.5mL(同一の媒体)を寒天プレート(トリプチカーゼ大豆寒天,Difco社)に積層することにより調製された。軟寒天皮膜は、凍結乾燥したMS2をTSB中にて再水和することにより調製された濃縮されたMS2の懸濁液の0.5mLを積層により加える前に、硬化された。24時間後、軟寒天が寒天プレート表面からこすりとられ、25分間遠心分離(1000G)して、細胞性の堆積物と寒天とを沈殿させた。上澄み液を保存し、0.22μmのミリポアフィルタにてろ過し、4乃至8℃にて冷蔵保存した。
免疫磁気ビーズの調製
ウサギ抗大腸菌IgG抗体(カリフォルニア州、サンレアンドロに所在のCortex Biochem社)を、製造業者が示唆したプロトコルを用いて、免疫磁気ビーズ(メガビーズ(MegaBeads)、ヤギ抗ウサギIgG F(c)、Cortex Biochem社)に付着した。
免疫磁気分離(IMS)大腸菌
大腸菌は、免疫磁気ビーズを用いたアフィニティーキャプチャーにより水性懸濁液から単離された。細菌の懸濁液は、1.5mLのマイクロ遠心管(ニューヨーク州、Westburyに所在のBrinkmann Instruments社)内にて、100μLの培養液を900μLのリン酸緩衝生理食塩水(PBS,0.01MのNa2HPO4,0.15MのNaClを、HClを用いてpH7.35に滴定した)と混合することにより調製した。細胞の濃度は、ペトロフ−ハウザーカウントチャンバー(Petroff−Hauser counting chamber)(ペンシルバニア州Horshamに所在のHauser Scentific社)を用いて決定した。
【0051】
本発明の研究において開発された免疫磁気分離(IMS)法は以下の工程を含む:第一の工程において、30μLの免疫磁気ビーズを細菌サンプル溶液中に加え、連続的に振盪しながら室温にて約20分インキュベートした。第二の工程は、磁気粒子集中装置(magnetic particle concentrator)(ニューヨーク州Lake Successに所在のDynal社)を用いてサンプル管の側部に該ビーズを集め、1mLのピペットを用いて上澄み液を除去する工程を包含した。第三の工程において、磁石が除去され、該ビーズは20秒間激しく振盪しながら1mLの新たなPBS中に再懸濁して、任意の非特異的に付着する成分を洗い流した。次に、ビーズ懸濁液を新たな管に移し、第二及び第三の工程をもう一度繰り返した。第四及び最終工程において、該ビーズを磁石を用いて分離し、次に、緩衝洗浄液を廃棄するために別の容器に移し、500μLの脱イオン水中に該ビーズを再懸濁した。次に、ビーズ−大腸菌複合体を低滴定濃度(質量分析計の検出限界未満)のMS2バクテリオファージと混合し、室温にて緩やかに振盪しながら40分間培養した。次に、一定量の懸濁液を取り出し、フェルラ酸マトリクス(17%のギ酸、33%のアセトニトリル、50%の脱イオン水から構成された溶液1mL中に12.5mgのフェルラ酸)を用いたサンドウィッチ試薬調製法を用いてMS2キャプシド蛋白質を分析した。
MALDI−TOF MS
全てのマススペクトルは、ポジティブなリニアモードにて稼動するVoyager−DE STR+MALDI−TOF質量分析計(マサチューセッツ州Framinghamに所在のAB Applied Biosystems社)にて生成した。以下のパラメータが使用された:加速電圧25kV、加速電圧の92%のグリッド電圧、350nsecの遅延引き出し(extraction delay)時間及び4kDaに設定された低質量イオンゲート。レーザの強度(N2,337nm))は、イオン発生閾値より僅かに大きい値に設定され、かつ300ns毎にパスル化した。マススペクトルは、5つの異なるサンプルスポットから100のレーザショットを累積することにより、各サンプルから得られた(最終的なスペクトル=5×100レーザショットの平均)。
【0052】
バクテリオファージに対するバイオマーカーの検出により標的細菌が溶液中に存在することが示されることを確実にするために、「親」バクテリオファージの濃度には、いかなる分析技術が使用された場合においても該バクテリオファージ又は該バクテリオファージ用バイオマーカーの検出限界未満であるような溶液が適用されることが理解されるべきである。これにより、バクテリオファージ又はバクテリオファージ用バイオマーカーが該分析技術により検出され、該バクテリオファージ又はバイオマーカーの検出濃度は子孫バクテリオファージ、即ち、溶液中に存在する標的細菌による該バクテリオファージの複製により得えられるバクテリオファージ、に起因するものであることが確実となる。ある状況下において、そのような濃度の「親」バクテリオファージの使用は、低すぎて検出のためのバクテリオファージ又はバクテリオファージ用バイオマーカーの十分な濃度を迅速に生成することができない感染の多重度(MOI)(即ち、親バクテリオファージの数の標的細菌の数に対する比率)を有する。
【0053】
低MOIに関連した欠点を解決するために、十分に高濃度の「親」バクテリオファージが溶液に加えられる。この場合、溶液に加えられるべき「親」バクテリオファージの濃度は、該バクテリオファージ又は該バクテリオファージのバイオマーカーを検出するためにいかなる分析技術を使用した場合であってもその検出限界を超えているであろう。その結果、この方法にて処理された溶液の分析は、標的細胞による複製にて得られる子孫バクテリオファージよりもむしろ、溶液に加えられるべき「親」バクテリオファージを検出する。
【0054】
従って、該方法の別の実施形態は、任意の子孫バクテリオファージから区別することが可能なある濃度の「親」バクテリオファージを溶液に適用する。一実施形態において、親バクテリオファージ(即ち、最初に溶液に適用されるバクテリオファージ)は、いかなる分析技術が使用された場合であっても該親バクテリオファージ又は該親バクテリオファージのバイオマーカーを、子孫バクテリオファージ又は該子孫バクテリオファージのバイオマーカーから区別することが生来的に可能であるように「標識」化される。例えば、マススペクトル分析技術を使用した場合、親バクテリオファージは、該親バクテリオファージのマススペクトルを子孫バクテリオファージに対して変更するか、又はシフトする物質にて「標識」化され、該物質は親バクテリオファージからの「標識」を遺伝的に継承していない。例えば、ビオチン化バクテリオファージは親バクテリオファージとして使用され得、かつ溶液中に存在する標的細菌を感染させるビオチン化バクテリオファージにより生成される子孫バクテリオファージとは異なるマススペクトルを有するであろう。別の「標識」は、別の型の分析技術のために使用される。
【0055】
別の実施形態において、親バクテリオファージは分析の前に溶液中の子孫バクテリオファージから区別されることを可能とする性質を有し、それにより、分離の後に溶液中に存在するバクテリオファージの全てとはいえないにしてもほとんどが、該溶液中存在する標的細菌によって親バクテリオファージの複製により得られる子孫バクテリオファージであることを確実にする。一実施形態において、ビオチン化バクテリオファージは、溶液中に最初に適用される。ビオチン化バクテリオファージはストレプトアビジンにかなり誘引される。その結果、ビオチン化バクテリオファージを溶液から分離するために、ストレプトアビジンプローブが使用される。一実施形態において、ビオチン化バクテリオファージはストレプトアビジンで被覆されたプローブに付着され、かつ該プローブが溶液中に配置される。この場合、培養期間の後に溶液からのビオチン化バクテリオファージの分離は、該溶液からプローブを除去することにより達成される。別の実施形態において、ストレプトアビジンにより被覆された磁気ビーズが溶液に適用される。ビオチン化バクテリオファージは、溶液に該ビーズを適用する前にストレプトアビジンにて被覆された磁気ビーズに付着される。これに代えて、溶液に予め加えられたビオチン化バクテリオファージを捕捉するためにビーズが使用され、次いで磁石を用いて該溶液から該ビーズが除去される。更に別の実施形態において、ストレプトアビジンにて被覆されたプローブ(例えば、スライド)は、培養期間の後に溶液に適用される。ビオチン化バクテリオファージはプローブに付着し、次いで、該プローブが溶液から分離される。ビオチン化バクテリオファージが液体混合物から分離される様式に関係なく、少なくとも一部の溶液が、溶液中に標的細菌が存在したことを間接的に示すバクテリオファージ又はバクテリオファージ用バイオマーカーが存在するか否かを決定するために分析される。
【技術分野】
【0001】
本発明は、標的細菌性細胞を感染させるためにバクテリオファージを使用する、液体混合物中における低濃度の標的細菌を検出するための方法に関する。
【背景技術】
【0002】
本願はその全体が本願明細書中において参照として援用される、発明の名称が「標的細菌性細胞を感染させるためにファージを使用する低濃度の標的細菌の検出方法(METHOD OF DETECTING LOW CONCENTRATIONS OF A TARGET BACTERIA THAT USES PHAGES TO INFECT TARGET BACTERIAL CELLS)」であり、かつ2002年4月12日に、Angelo J.Madonna及びKent J.Voorheesによって出願された米国仮出願第60/319,184号の権利を請求する。
【0003】
標準的な微生物学的方法は、特定の生物体の存在を試験するために基質に基づく検定法にこれまで依存してきた(Bordnerらによる、1978年)。これらの技術は高レベルの選択性を提供するものの、標的細胞の純粋な培養物を最初に生育する、又は培養するために24時間またはそれ以上を要するという必要性が障害となっている。この時間的な制約は、微生物の毒性株の存在に対して迅速な応答を提供するための有効性を非常に制限するものである。
【0004】
分子生物学の技術は、標準的な微生物試験に対する価値のある代替方法として迅速に受け入れられている。特に、血清学的方法は、標的となる微生物に対するマトリクスの宿主を評価するために広く使用されてきた(Kingsbury及びFalkow、1985年;Wyattら、1992年)。これらの試験は、最初に捕捉するために抗体を使用し、次いで複雑な生物学的混合物中において他の成分から標的微生物を分離することを中心とする。分離後、捕捉された生物は濃縮され、かつ生物学的な検体を培養する必要のない種々の異なる技術により検出される。
【0005】
免疫磁気分離法(IMS)と称される一つの最も汎用される試みは、抗体を球形の微細な常磁性ビーズに固定して、該抗体で被覆されたビーズを用いて標的微生物を液体媒体から捕捉することを含む。該ビーズは標的生物体の回復及び濃縮を促進する磁場の影響下において容易に操作される。更に、該ビーズはサイズが微小であり、かつビーズの形状であることからサンプル内に均等に分散され得、ビーズと標的との相互作用の速度が加速される。これらの好ましい特性は、検定時間を低減し、かつ分析操作の能率化を助けるとともに、より高度なサンプルのスループット及び自動化に対する適用化を更に可能とする点にある。
【0006】
IMSとともにこれまで使用されてきた下流検出法は、ELISA(Cudjoeら、1995年)、ドット・ブロット検定法(Skjerveら、1990年)、電気化学発光(Yu及びBruno、1996年)及びフローサイトメトリー(Pyleら、1999年)が含まれる。これらの試験法は満足のゆく結果を提供するものの、非標的検体との交差反応性により、擬陽性の結果にかなり影響を受けやすい二値化の応答(yes/no)を実施し、かつ与えるためには、煩雑である。マトリクス支援レーザ脱離/イオン化(MALDI)飛行時間形(TOF)質量分析(MS)と組み合わせられたIMSを用いて複雑な生物学的混合物から特定の細菌を識別するための迅速な方法が近年報告されている(Madonnaら、2001年)。この試みは、種々のマトリクスが、1時間の総分析時間以内にてサルモネラ種の存在に対して評価されることを可能にする。更に、サンプリング工程をほとんど必要としないこの発展的な方法は実施が比較的容易であり、かつ得られた分子量の情報から、標的細菌からの信号と、交差反応される構成成分からの信号とを区別することが可能である。
【0007】
MALDI−TOF−MS法は、全ての細胞性微生物を識別するための証明された技術である(Hollandら、1996年;van Barr、2000年;Madonnaら、2000年)。特に、MALDIは、蛋白質シグナルの分配を変更するマススペクトルの特徴が生成される「フィンガープリント」技術である。微生物のプロテオームにおける生来の差異により、生成されるシグネチャプロファイル(signature profiles)は、菌株のレベルまで下がって個体を識別することを可能にする(Arnold及びReilly,1998年)。一実施形態において、IMSと組み合わせられたMALDI−TOF技術は、標的細菌を含み得る液体混合物を該標的細菌に特異的な免疫磁気ビーズと短い培養時間(例えば、約20分)にて混合する工程を含む。ビーズに捕捉された任意の標的細菌は脱イオン水にて2回洗浄して再懸濁させ、かつMALDIサンプル用プローブ上に直接適用される。次いで、標的細菌−ビーズ複合体は、ごく微量のマトリクス溶液で重ねられ、室温にて乾燥される。得られた結晶塊を高強度レーザにて照射することにより、無傷細胞蛋白質の担体分離及びイオン化が促進され、該蛋白質は引き続いて、TOF質量分析計により検出される。次いで、得られたマススペクトルにおいて、標的細菌の存在を示す決定的な質量ピークをデータベースにて検索する(interrogate)。
【先行技術文献】
【特許文献】
【0008】
【特許文献1】米国特許出願公開第2004/0137430号明細書
【特許文献2】米国特許第5985596号明細書
【特許文献3】欧州特許出願公開第0439354号明細書
【特許文献4】国際公開第94/06931号パンフレット
【特許文献5】欧州特許出願公開第1300082号明細書
【特許文献6】国際公開第03/087772号パンフレット
【特許文献7】国際公開第02/061117号パンフレット
【特許文献8】国際公開第98/18962号パンフレット
【特許文献9】国際公開第93/17129号パンフレット
【特許文献10】国際公開第95/05483号パンフレット
【特許文献11】米国特許第4104126号明細書
【特許文献12】米国特許第4797363号明細書
【特許文献13】米国特許第4861709号明細書
【特許文献14】米国特許第5085982号明細書
【特許文献15】米国特許第5168037号明細書
【特許文献16】米国特許第5656424号明細書
【特許文献17】米国特許第5679510号明細書
【特許文献18】米国特許第5723330号明細書
【特許文献19】米国特許第5824468号明細書
【特許文献20】米国特許第5888725号明細書
【特許文献21】米国特許第5914240号明細書
【特許文献22】米国特許第5958675号明細書
【特許文献23】米国特許第5985596号明細書
【特許文献24】米国特許第6090541号明細書
【特許文献25】米国特許第6265169号明細書
【特許文献26】米国特許第6300061号明細書
【特許文献27】米国特許第6355445号明細書
【特許文献28】米国特許第6428976号明細書
【特許文献29】米国特許第6436652号明細書
【特許文献30】米国特許第6436661号明細書
【特許文献31】米国特許第6461833号明細書
【特許文献32】米国特許第6524809号明細書
【特許文献33】米国特許第6544729号明細書
【特許文献34】米国特許第6555312号明細書
【特許文献35】米国特許第6660437号明細書
【特許文献36】米国特許第6660470号明細書
【特許文献37】米国特許出願公開第2002/0045195号明細書
【特許文献38】米国特許出願公開第2002/0127547号明細書
【特許文献39】米国特許出願公開第2003/0027241号明細書
【非特許文献】
【0009】
【非特許文献1】トーマス(Thomas)他、「キャプシド蛋白質の直接的分析によるウィルス特性(Viral characterization by direct analysis of capsid proteins)」、アナリティカル・ケミストリー(Analytical Chemistry)、1998年9月、第90巻、第18号、p.3863−3867
【非特許文献2】エス.ダブリュ.エル.タン(S.W.L. TAN)外2名、「LC及び/又はMALDIマススペクトロメトリを使用した二つのランウィルスの迅速な同時検出法(Rapid Simultaneous Detection of Two Orchid Viruses Using LC−and/or MALDI−mass Spectrometry)」、ジャーナル・オブ・ヴィロロジカル・メソッズ(Journal of Virological Methods)、エルスビア・サイエンス・ビー.ブイ.(Elsvier Science B.V.)、2000年、第85巻、p.93−99
【非特許文献3】ダブリュ.サン(W.SUN)外2名、「(構築されたファージベースの生物学的吸着剤の効果を評価するための生物発光サルモネラ菌の使用(Use of Bioluminescent Salmonella for Assessing the Efficiency of Constructed Phage−Based Biosorbent)」、ジャーナル・オブ・インダストリアル・マイクロバイオロジー・アンド・バイオテクノロジー(Journal of Industrial Microbiology & Biotechnology)、ネイチャー・パブリッシング・グループ(Nature Publishing Group)、2000年、第25巻、p.273−275
【非特許文献4】ジー.シウズダク(G.SIUZDAK)、「マススペクトロメトリを用いたウィルスのプロービング(Probing Viruses With Mass Spectrometry)」、ジャーナル・オブ・マス・スペクトロメトリ(Journal of Mass Spectrometry)、ジョン・ウィリー・アンド・サンズ(John Wiley & Sons)社、1998年、第33巻、p.203−211
【非特許文献5】アール.ジェニソン(R.JENISON)外4名、「蛋白質又は核酸標的の迅速な検出のためのシリコンベースのバイオセンサ(Silicon−Based Biosensor for Rapid Detection of Protein or Nucleic Acid Targets)」、クリニカル・ケミストリー(Clinical Chemistry)、アメリカン・アソシエーション・フォー・クリニカル・ケミストリー(American Association for Clinical Chemistry)社、2001年10月、第47巻、第10号、p.1894−1900
【非特許文献6】アール.ジェニソン(R.JENISON)外4名、「メチシリン耐性黄色ブドウ球菌からのmecAの迅速な検出のための薄膜バイオセンサ(Thin Film Biosensor for Rapid Detection of mecA from Methicillin−resistant Staphylococcus aureus)」、クリニカル・ケミストリー(Clinical Chemistry)、アメリカン・アソシエーション・フォー・クリニカル・ケミストリー(American Association for Clinical Chemistry)社、2000年9月、第46巻、第9号、p.1501−1504
【非特許文献7】エイ.ジェイ.マドンナ(A.J.MADONNA)外2名、「マトリクス支援レーザ脱離イオン化/飛行時間形質量分析と結合された免疫磁気分離及びバクテリオファージの増殖を用いた大腸菌の検出(Detection of Escherichia coli Using Immunomagnetic Separation and Bacteriophage Amplification Coupled with Matrix−assisted laser Desorption/Ionization Time−of−Flight Mass Spectrometry)」、ラピッド・コミュニケーションズ・イン・マス・スペクトロメトリ(Rapid Communications in Mass Spectrometry)、ジョン・ウィリー・アンド・サンズ(John Wiley & Sons)社、2002年12月24日オンライン出版、第17巻、p.257−263
【発明の概要】
【発明が解決しようとする課題】
【0010】
本発明の目的は、標的細菌が特定の検出技術に対して検出限界未満の低濃度にある場合に、該標的細菌が溶液中に存在するか否かを決定するための方法を提供することにある。
【課題を解決するための手段】
【0011】
上述の目的を解決するために、請求項1に記載の発明は、標的細菌が特定の検出技術の検出限界未満の低濃度である場合に同標的細菌が溶液中に存在しているかどうかを決定するための方法であって、同方法は、溶液と、一定量の標識化された親バクテリオファージと、を混合して、同溶液中に存在する標的細菌の少なくともいくらかを感染させて、同溶液中に多数の標識化されていない子孫バクテリオファージを生成する工程と、同特定の検出技術によって同溶液を分析し、標識化されていない子孫バクテリオファージに対するバイオマーカーであって標識化された親バクテリオファージに対するいかなるバイオマーカーに対しても識別可能であり、かつ標的細菌が溶液中に存在していることを間接的に示す、バイオマーカーが存在しているかを決定する工程と、からなる方法を提供する。
【0012】
請求項2に記載の発明は、請求項1に記載の方法において、分析工程は、マススペクトル分析を実施することからなることをその要旨とする。
請求項3に記載の発明は、請求項1に記載の方法において、分析工程は、MALDI分析を実施することからなることをその要旨とする。
【0013】
請求項4に記載の発明は、請求項1に記載の方法において、分析工程は、MALDI−TOF分析を実施することからなることをその要旨とする。
請求項5に記載の発明は、請求項1に記載の方法において、分析工程は、エレクトロスプレーイオン化質量分析法を実施することからなることをその要旨とする。
【0014】
請求項6に記載の発明は、請求項1に記載の方法において、分析工程は、イオン移動度分光分析法を実施することからなることをその要旨とする。
請求項7に記載の発明は、請求項1に記載の方法において、分析工程は、光学分光分析法を実施することからなることをその要旨とする。
【0015】
請求項8に記載の発明は、請求項1に記載の方法において、分析工程は、免疫分析法を実施することからなることをその要旨とする。
請求項9に記載の発明は、請求項1に記載の方法において、分析工程は、クロマトグラフィー分析法を実施することからなることをその要旨とする。
【0016】
請求項10に記載の発明は、請求項1に記載の方法において、分析工程は、アプタマー分析法を実施することからなることをその要旨とする。
請求項11に記載の発明は、請求項1に記載の方法において、標的細菌を溶液から分離する工程を更に含むことをその要旨とする。
【0017】
請求項12に記載の発明は、請求項11に記載の方法において、分離工程は、標的細菌に対する抗体で被覆された免疫磁気ビーズを使用する工程を更に含むことをその要旨とする。
【0018】
請求項13に記載の発明は、請求項1に記載の方法において、標識化された親バクテリオファージはビオチン化バクテリオファージであることをその要旨とする。
一実施形態において、該方法は、標的細菌に対するバクテリオファージが溶液に適用されるような生物学的な増幅工程を用いることからなる(バクテリオファージは細菌を感染させ、かつ該工程において多くの子孫を生成するウィルスである。構造的に、該バクテリオファージはウィルス性核酸を被包する蛋白質の殻(キャプシド)から構成される。キャプシドは、同一蛋白質の反復するコピーから構成される。バクテリオファージは特定の細菌細胞を感染させることが可能であり、遺伝材料の増幅により、該細胞は最終的には最初のファージの数百万ものコピーを爆発的に放出する。)。溶液中に存在するバクテリオファージと任意の標的細菌は培養される。培養期間の間、該バクテリオファージは溶液中に存在する標的細菌に感染することにより増殖する。より詳細には、該バクテリオファージは、感染された標的細菌中にて、自身の非常に多くのコピーを複製する。最終的に、感染された標的細菌は溶解(lyse)され、複製されたバクテリオファージ、又は子孫(progeny)バクテリオファージは溶液中に放出される。次いで、該溶液は、該バクテリオファージに対するバイオマーカーが存在するか否かを決定するために分析され、それにより、該標的細菌が溶液中に存在することを間接的に示す。分析技術として可能なものには、MALDI−MS及びエレクトロスプレーイオン化質量分析技術のような質量分析技術が含まれる。
【0019】
バクテリオファージに対するバイオマーカーの検出により標的細菌が溶液中に存在することが指標されることを確実にするために、該バクテリオファージの濃度には、いかなる分析技術が使用された場合においてもバクテリオファージ用バイオマーカーに対する検出限界未満である溶液が適用される。これは、バクテリオファージに対するバイオマーカーが分析技術により検出される場合に、該バイオマーカーの検出可能な濃度は、溶液中に存在する標的細菌によるバクテリオファージの複製に起因することを確実にする。ある状況下において、そのような濃度のバクテリオファージの使用は、低すぎて検出のためのバクテリオファージ又はバクテリオファージ用バイオマーカーの十分な濃度を迅速に生成することができない感染の多重度(MOI)(即ち、感染しているバクテリオファージの標的細菌に対する比率)を有する。
【0020】
本方法の別の実施形態は、溶液に対して非常に高濃度のバクテリオファージを加えて、それにより高いMOIを得ることによりこの問題を解決するものである。この場合、溶液に加えられるべきバクテリオファージの濃度は、該バクテリオファージ又は該バクテリオファージのバイオマーカーを検出するためにいかなる検出技術が使用されてもその検出限界を超えるものである。結果として、該方法は、混合物中の標的細菌の感染により得られる任意の子孫バクテリオファージと区別される親バクテリオファージを溶液に適用する。識別可能な子孫バクテリオファージ又は子孫バクテリオファージの識別可能なバイオマーカーが存在する場合、標的細菌が溶液プローブ中に存在することを示す。
【0021】
一実施形態において、親バクテリオファージ(即ち、溶液中に最初に適用されるバクテリオファージ)は、使用されるいかなる分析技術も、親バクテリオファージ又は親バクテリオファージのバイオマーカーを、子孫バクテリオファージ又は子孫バクテリオファージに対するバイオマーカーと生来的に識別することが可能であるように「標識(tag)」を付与される。例えば、質量分析技術が使用される場合、親バクテリオファージは、該親バクテリオファージのマススペクトルを子孫バクテリオファージに対して変更するか、又はシフトする物質にて「標識」化され、該子孫バクテリオファージは親バクテリオファージからの「標識」を遺伝的に継承していないであろう。例えば、ビオチン化されたバクテリオファージは親バクテリオファージとして使用され得、かつ溶液中に存在する標的細菌を感染するビオチン化バクテリオファージにより生成される子孫バクテリオファージとは異なるマススペクトルを有するであろう。別の「標識」は、別の型の分析技術のために使用される。
【0022】
別の実施形態において、親バクテリオファージは分析の前に溶液中の子孫バクテリオファージから区別されることを可能とする性質を有し、それにより、分離の後に溶液中に存在するバクテリオファージの全てとはいえないにしてもほとんどが、該溶液中存在する標的細菌による親バクテリオファージの複製により得られる子孫バクテリオファージであることを確実にする。一実施形態において、溶液中に最初に適用される親バクテリオファージは、ビオチン化バクテリオファージである。ビオチン化バクテリオファージはストレプトアビジンにかなり誘引される。この誘引は、ビオチン化バクテリオファージを、混合物中に存在する標的細菌によるビオチン化バクテリオファージの複製により得られる子孫バクテリオファージから分離するために使用される。
【0023】
一実施形態において、ビオチン化バクテリオファージはストレプトアビジンで被覆されたプローブに付着される。結果として、培養期間の後に溶液からのビオチン化バクテリオファージの分離は、該溶液からプローブを除去することにより達成される。別の実施形態において、ストレプトアビジンにより被覆された磁気ビーズが溶液に適用される。該ビーズは、ビオチン化バクテリオファージを捕捉するために使用される。次いで、該ビーズは磁石を用いて溶液から分離される。更に別の実施形態において、ストレプトアビジンにて被覆されたプローブ(例えば、スライド)は、培養期間の後に溶液に適用される。ビオチン化バクテリオファージはプローブに付着し、次いで、該プローブが溶液から分離される。
【0024】
本発明の更に別の実施形態は、標的細菌が存在している可能性のある溶液が、バクテリオファージ又はバクテリオファージ用バイオマーカーの検出をより困難にするか、若しくは使用される検出技術により提供される情報の信頼性を低減する、生物学的材料を含む複合体混合物であるか、又は複合体混合物であり得ることを認識する。例えば、質量分析の検出法を使用する場合、複合体混合物は、バクテリオファージに関連するバイオマーカーが不明瞭である、別の言い方をするのであれば、低い信号対ノイズ比を有する、信号を生成するかもしれない。この可能性を解決するために、溶液中に存在している標的細菌が該溶液の残りの部分から分離される精製工程を該溶液に実施する。一実施形態において、免疫磁気分離法(IMS)は、溶液中に存在する標的細菌を該溶液の残りの部分から分離するために使用される。一つの特殊な実施形態において、磁気ビーズは標的細菌に対する抗体で被覆される。該抗体は液体混合物中に存在する標的細菌に捕捉し、次いで、該ビーズを溶液の残りの部分から分離するために磁石が使用される。次いで、ビーズ及び任意に接着する標的細菌に、生物学的増幅工程及び分析が実施される。この精製工程はまた、バクテリオファージの野生種が溶液中に存在する可能性、及びそのような種が、該溶液の精製工程を実施しなかった場合には擬陽性を発生する可能性、に取り組むものであることが理解されるべきである。
【0025】
バクテリオファージの野生種が心配ではない場合、精製工程は生物学的な増幅工程の後に実施される。この実施形態において、該精製工程は、標的細菌と溶液とを分離するよりはむしろ、バクテリオファージと溶液とを分離する工程を含む。一実施形態において、バクテリオファージに対する抗体で磁気ビーズが被覆されているIMSが使用される。該ビーズは溶液中に存在するバクテリオファージを捕捉し、次いで、該ビーズを溶液の残りの部分から分離するために磁石が使用される。
【0026】
本発明の別の実施形態において、分析工程は、標的細菌に対するバイオマーカーが存在するか否かを決定するためにMS/MS分析法を用いることを含む。MS/MS分析法の使用は、標的細菌に対するバイオマーカーの存在の信頼性の高い指標を生成する。結果として、少なくともいくらかの場合、MS/MS分析法の使用は、精製工程の必要性を不必要にする。
【0027】
更に別の実施形態において、本発明は複合体混合物中の低濃度の標的細菌を検出する方法に関する。一実施形態において、該方法は液体混合物中に存在し得る標的細菌の少なくともいくらかを単離するためにIMS工程を用いることからなる。該方法は更に、標的細菌に対する低滴定濃度又は低濃度のバクテリオファージがIMS工程によって単離された標的細菌の少なくともいくらかに適用される生物学的増幅工程を使用することを含む。バクテリオファージ及び単離された標的細胞のいくらかの混合物は培養される。少なくとも所定の濃度の標的細菌が存在する場合、バクテリオファージは、高滴定濃度又は高濃度のバクテリオファージが混合物に存在し、かつMALDI−TOF−MS分析法により検出可能であるように、培養期間の間増殖される。仮に標的細胞が全く存在しないか、又はほんのわずかしか存在しない場合、MALDI−TOF−MS分析法により理にかなって検出することのできない低濃度のバクテリオファージが混合物中に存在するであろう。培養に続いて、MALDI−TOF−MS分析法はバクテリオファージ及び標的細菌の培養された混合物において実施される。得られたマススペクトルは、バクテリオファージと関連した蛋白質が存在しているか否かを決定するために分析される。仮にバクテリオファージに対する蛋白質が検出される場合、少なくとも低濃度の標的細菌が混合物中に存在していると結論づけられる。
【0028】
本発明の方法は、細菌が成長する、又は繁殖する様式にかかわらず、低濃度の標的細菌を検出することが可能であるものと理解されるべきである。
【発明の効果】
【0029】
本発明によれば、標的細菌が特定の検出技術の検出限界未満の低濃度である場合に同標的細菌が溶液中に存在しているかどうかを決定する方法が提供された。
【図面の簡単な説明】
【0030】
【図1】本発明の一実施形態に対して、標的微生物を単離するために使用される免疫磁気ビーズを示す(抗体は縮尺に基づいて描かれていない)。
【図2】本発明の一実施形態において、標的抗原(大腸菌)を単離するために使用される免疫磁気精製工程の概略図である。
【図3】本発明の一実施形態に対するバクテリオファージ増幅工程の概略図である。
【図4】PBS中における高滴定濃度のMS2サンプルから得られる典型的なMALDI−TOFマススペクトルを示す。
【図5】(a)〜(c)は、大腸菌の濃度を減少するために、該大腸菌の存在を指標するバクテリオファージのバイオマーカーを本発明の一実施形態が如何に検出可能であったかを示す。
【発明を実施するための形態】
【0031】
本発明は、概して、標的細菌の濃度が使用されるべき特定の検出技術に対して検出限界であるか、又は可能性として検出限界付近若しくは検出限界未満であるような溶液中の標的細菌の存在を間接的に検出するためにバクテリオファージを使用する方法に関する。
【0032】
本明細書において使用されるように、「標的細菌(target bacterium)」なる用語は細菌の単数又は複数の種を参照する。場合によっては、複数の標的細菌(a plurality of target bacteirum)は標的細菌(target bacteria)として参照され得る。
【0033】
バクテリオファージは細菌を感染させるウィルスであり、かつ感染の工程において、該細菌は多くの子孫を生成する。構造的には、該バクテリオファージはウィルス性核酸を被包する蛋白質の殻(キャプシド)からなる。キャプシドは同一蛋白質の反復するコピーから構成される。バクテリオファージは特定の細菌細胞を感染可能であり、多くの子孫の増殖により、該細胞は最終的には、最初のファージの数百万ものコピーを爆発的に放出する。この感染工程は、低濃度の標的細菌細胞を検出するためのバイオマーカー増幅工程としての目的を果たすために使用されてきた。例えば、MS2バクテリオファージのキャプシドは13kDの蛋白質の180のコピーを含む。この特殊なウィルスは大腸菌の菌株を特異的に感染させ、かつ標的細菌細胞に付着後40分間の間に自身の10000乃至20000のコピーを生成可能である。本質的には、一つの大腸菌がMS2に感染し、1.8×106倍のキャプシド蛋白質の複製を生ずる。
【0034】
マトリクス支援レーザ脱離イオン化/質量分析(MALDI/TOF)により得られる結果は、増幅工程の有用性を示すために使用される。MALDI−TOF―MSは全細胞性微生物を識別するための証明された技術である(Hollandら、1996年;van Barr、2000年;Madonnaら、2000年)。特に、MALDIは、蛋白質シグナルの分配を変更するマススペクトルの特徴が生成される「フィンガープリント」技術である。微生物のプロテオームにおける生来の差異により生成されるシグネチャプロファイルは、菌株のレベルまで下降して生物体を識別することを可能にする(Arnold及びReilly,1998年)。
【0035】
標的細菌細胞からの蛋白質のMALDI信号が検出されるには弱すぎるような実験において、低レベル(低すぎてMALDIにより検出できない)の適切なファージの標的細菌細胞への添加の約30分後に、ファージキャプシド蛋白質に起因する検出可能な蛋白質MALDI信号を生成した。他の細菌種に特異的なバクテリオファージは、典型的には異なる分子量であるキャプシド蛋白質を有し、故に、異なるMALDI信号を与える。従って、該方法は多数の異なる細菌種に適用可能である。イオン移動度分光分析、光学分光分析、免疫技術、クロマトグラフィー技術及びアプタマー法のような他の検出技術も同様に実施可能である。
【0036】
一般的に、標的細菌以外の生物学的材料を含むか、又は含んでいる可能性のある複合体液体混合物中における低濃度の標的細菌を検出するための方法は、仮に少なくとも所定の濃度の標的細菌が混合物中に存在している場合、該標的細菌の識別可能な信号又は指標が生成される分析に対する液体混合物、溶液又はサンプルを生成するために該混合物又はその一部を処理する工程を含む。「溶液」及び「液体混合物」なる用語は、試験を受けるべく最初の溶液又は混合物及び、方法の適用の結果として、該最初の溶液又は混合物の一部を含む任意の溶液又は混合物を参照するものと理解されるべきである。
【0037】
一実施形態において、該方法は、低濃度の標的細菌が液体中に存在しているか否かを決定することを含む。この決定は、溶液中に存在する任意の標的細菌が低濃度にて存在することを前提とすることにより行われる。これに代えて、いかなる検出技術が使用されている場合においても検出限界を確実に超える濃度にて標的細菌が存在するか否かを決定するために検定が実施され得る。例えば、質量分析技術が使用可能である。仮に、質量分析技術が溶液中の標的細菌の存在を示す信頼のおける信号を提供する場合、更なる工程を必要としない。しかしながら、質量分析技術が溶液中の標的細菌の存在を示す信頼のおける信号を提供しない場合、標的細菌は溶液中に存在している可能性はあるが、質量分析技術の検出限界未満又は検出限界付近の濃度にて存在していると結論付けられる。この場合、標的細菌が質量分析技術の検出限界を下回る濃度にて溶液中に存在しているか否かを決定するために更なる工程が実施される。
【0038】
該方法は、混合物中に存在し得る標的細菌を捕捉し、かつ該補足された細菌のいくらかを該混合物中に存在し得る他の生物学的材料から分離することを含む精製工程からなる。捕捉された細菌のいくらかを混合物中に存在し得る他の生物学的材料から分離することにより、該混合物中に存在する他の生物学的材料に関連した引き続き生成されるマススペクトル信号の部分が減少される。一実施形態において、免疫磁気分離(IMS)法が標的細菌を捕捉及び分離するために使用される。
【0039】
該方法は更に、捕捉され、かつ分離された任意の標的細菌の少なくともいくらかを、該標的細菌に特異的であるバクテリオファージで感染させる増幅工程を受けることからなる。存在する標的細菌が少なくとも所定の濃度である場合、バクテリオファージに関連したバイオマーカーがMALDI/TOF−MSのような分析技術を用いて検出可能な地点まで、該バクテリオファージは増殖されるであろう。MALDI/TOF−MSの場合、バクテリオファージの存在を示す引き続き生成されるマススペクトル信号の一部は、増大するであろう。仮に特定の濃度未満にて標的細菌が存在している場合、バクテリオファージは、MALDI/TOF−MSを用いて生成されるマススペクトルにおいて検出可能なまでには充分に増殖されないであろう。本質において、少なくとも所定の濃度の標的細菌が混合物中に存在している場合、精製工程及び増幅工程は、バクテリオファージに関連する、引き続いて生成されるマススペクトルの一部に対して信号対ノイズ比を増大させるために提供される。
【0040】
増幅後、増幅された混合物の少なくとも一部は、標的細菌に対するバイオマーカーが存在するか否かを決定するための分析が行われる。例えば、MALDI/TOF−MS分析法は、マススペクトルを生成するために使用され得る。マススペクトルは、バクテリオファージに対する一つ以上のバイオマーカーが存在しているか否かを決定するために分析される。そのようなバイオマーカーが存在している場合、標的細菌の少なくとも所定の濃度が最初のサンプル混合物中に存在していたことの間接的な指標となる。
【0041】
精製工程の必要性は、他の生物学的材料に関連した信号の部分がフィルタ化されるか、排除されるか若しくは無視されるような状況、及び/又は増幅工程がバクテリオファージに関連したマススペクトルの部分が他の生物学的材料に関連した任意のバックグランド信号を超えるような利得を有する状況、及び/又は擬陽性になり得る可能性が低いと考えられる状況にある場合には不必要であることは理解されるべきである。更に、バクテリオファージに対するバイオマーカーが存在しているか否かを決定することを困難にするようなその他の生物学的材料の一つが、試験されるべき溶液中に存在するバクテリオファージの野生種であることも理解されるべきである。精製工程は野生型バクテリオファージの存在の問題に取り組むものである。
【0042】
仮に試験されるべき溶液又は混合物中に野生型のバクテリオファージが存在しているか、又は存在している可能性が問題とならない場合、増幅工程後に精製工程を実施することも可能である。しかしながら、この場合、バクテリオファージは溶液の残りの部分から分離される。既に明記したIMS技術が使用され得る。しかしながら、磁気ビーズは標的細菌に対する抗体よりはむしろ、バクテリオファージに対する抗体で被覆される。
【0043】
ある場合において、バクテリオファージに対するバイオマーカーがバクテリオファージに対して非常に高い特異性を有し擬陽性になることがほとんどないような、MS/MS法のような特異性の高い分析技術を用いることにより精製工程の必要性を排除することもまた可能である。現在のところ、MS/MS法の使用は、7000Da未満であるキャプシド蛋白質に限られている。
【0044】
図1を参照して、混合物中の標的細菌を捕捉して、捕捉された任意の標的細菌を該混合物中の他の生物学的材料から分離するための免疫磁気分離(IMS)技術が記載されている。マイクロサイズのビーズは、ポリマー表面にて被覆された酸化鉄のコアから構成されている。一次抗体のFeの領域に対して生成された二次抗体は、リンカーを介してポリマー表面に共有結合にて付着されている。一次抗体(標的細菌に対して生成される)は、二次抗体との強い非共有結合的な相互作用により該ビーズに付着されており、該二次抗体は、標的抗原との反応において、適切な方向にて一次抗体を保持している。
【0045】
図2を参照して、免疫磁気ビーズは分析されるべく細菌混合物又は生物学的混合物に加えられ、室温にて20分間培養される。次いで、該ビーズは磁石を用いて反応管の側方にて分離される。この方法は余分な(非標的)材料を吸引により除去可能とする。この段階において、該ビーズはPBSに再び懸濁される前に、数回洗浄される。
【0046】
図3を参照して、ビーズ−細菌標的複合体は標的細菌に特異的な低滴定濃度のバクテリオファージ懸濁液と混合される。該滴定濃度は、ウィルスからの質量分析信号が検出不能であるように低く維持される。40分間の培養の後に、バクテリオファージは、付着、挿入、自己アセンブリ、反応環境中に放出される多くの子孫の生成により生じる細胞の溶解からなる繁殖のサイクルを完了した。該環境は次に、標的細菌が存在していることを間接的に示すバクテリオファージ用バイオマーカーが存在しているか否かを決定するために分析される。例えば、該環境は、フェルラ酸マトリクスを用いたサンドイッチサンプル調製(sandwich sample preparation)技術を用いてMALDI−TOF−MSにより分析され得る。当業者に周知の他のMALDI用マトリクスもまた使用可能である。得られたマススペクトルは、バクテリオファージキャプシド蛋白質の存在を示しており、該蛋白質は標的細菌が存在しない場合はまた存在しなかったであろう。
【0047】
混合物中にて標的細菌を捕捉し、かつ該混合物中において任意の捕捉された標的細菌を分離し、引き続いてMALDI−TOF/MS分析を行うIMS技術が、2002年4月12日に出願された、発明の名称が「ある種の細菌が混合物中に存在しているかを決定するための方法(Method for Determining if a Type of Bacteria is Present in a Mixture)」である米国特許出願第10/063346号に記載されており、該特許出願は、その全体が参照により本明細書中にて援用される。
【実施例】
【0048】
以下に記載されるように、本方法の実施形態は、大腸菌の検出限界を5.0×104細胞/mL未満に減少させるために使用された。該方法では、以下において標的−ビーズ複合体として参照される、大腸菌に対する抗体で被覆された免疫磁気ビーズを溶液から細菌を単離するために使用した。次に、標的−ビーズ複合体は、大腸菌に特異的なバクテリオファージであるMS2を含む溶液中に再懸濁した。MS2バクテリオファージの濃度は、MS2バクテリオファージのキャプシド蛋白質からのイオンシグナルが質量分析の検出限界未満となるように調整された。40分間の培養の後、溶液のアリコートが取り除かれ、13kDaのキャプシド蛋白質に対してオンプローブ(on−probe)MALDI−TOF−MS法により分析した。MS2キャプシド蛋白質に対する[M+H]+(m/z 13726)及び[M+2H]2+(m/z 6865)イオンシグナルが検出された(図4)。
【0049】
図5Aを参照して、5.0×106細胞/mLの濃度の大腸菌を含む混合物に対して本発明の方法を適用することにより、大腸菌及びMS2バクテリオファージの両方に対する蛋白質シグナルを示すマススペクトルが得られた。該方法は、大腸菌の濃度を低減するために繰り返された。具体的には、図5Bを参照して、該方法は、〜5.0×105細胞/mLの濃度の大腸菌に対して繰り返された。この場合、マススペクトルは大腸菌細胞の任意の蛋白質シグナルを明らかに示してはいないが、MS2バクテリオファージキャプシド蛋白質に対する蛋白質シグナルは示している。図5Cを参照して、該方法は、〜5.0×104細胞/mLの濃度の大腸菌に対して繰り返された。この場合、マススペクトルは大腸菌細胞の任意の蛋白質シグナルを明らかに示してはいないが、MS2バクテリオファージキャプシド蛋白質に対する蛋白質シグナルは依然として示されている。これらの結果は、大腸菌が免疫磁気ビーズに捕捉され、次いで、MS2ウィルスにより感染され、増殖可能となり、検出可能なレベルまでキャプシド蛋白質の濃度が増大可能となったことを示している。現在のところ、〜1.0×103細胞/mLであるような濃度の標的細菌を本発明の方法を用いて間接的に検出している。
【0050】
大腸菌の検出の実施例に関して実施された本発明の方法の種々の実施形態を以下に記載する。
大腸菌の調製
大腸菌は、標準的な微生物学的方法を用いて37℃にて培養しながら、トリプチカーゼ大豆培地(TSB)(ミシガン州デトロイトに所在のDifco社)にて生育した。
バクテリオファージの調製
バクテリオファージの増殖は、M.H.Adams’Bacteriophages(Interscience Publishers社、ニューヨーク、1959年)に記載されているようなアダムス寒天重層(Adams agar−overlay)法に従って実施した。簡潔に述べると、軟寒天/ホスト皮膜を、TSB中に2滴の20hrホスト(20hr host)を含んだ溶融した0.5%の寒天の2.5mL(同一の媒体)を寒天プレート(トリプチカーゼ大豆寒天,Difco社)に積層することにより調製された。軟寒天皮膜は、凍結乾燥したMS2をTSB中にて再水和することにより調製された濃縮されたMS2の懸濁液の0.5mLを積層により加える前に、硬化された。24時間後、軟寒天が寒天プレート表面からこすりとられ、25分間遠心分離(1000G)して、細胞性の堆積物と寒天とを沈殿させた。上澄み液を保存し、0.22μmのミリポアフィルタにてろ過し、4乃至8℃にて冷蔵保存した。
免疫磁気ビーズの調製
ウサギ抗大腸菌IgG抗体(カリフォルニア州、サンレアンドロに所在のCortex Biochem社)を、製造業者が示唆したプロトコルを用いて、免疫磁気ビーズ(メガビーズ(MegaBeads)、ヤギ抗ウサギIgG F(c)、Cortex Biochem社)に付着した。
免疫磁気分離(IMS)大腸菌
大腸菌は、免疫磁気ビーズを用いたアフィニティーキャプチャーにより水性懸濁液から単離された。細菌の懸濁液は、1.5mLのマイクロ遠心管(ニューヨーク州、Westburyに所在のBrinkmann Instruments社)内にて、100μLの培養液を900μLのリン酸緩衝生理食塩水(PBS,0.01MのNa2HPO4,0.15MのNaClを、HClを用いてpH7.35に滴定した)と混合することにより調製した。細胞の濃度は、ペトロフ−ハウザーカウントチャンバー(Petroff−Hauser counting chamber)(ペンシルバニア州Horshamに所在のHauser Scentific社)を用いて決定した。
【0051】
本発明の研究において開発された免疫磁気分離(IMS)法は以下の工程を含む:第一の工程において、30μLの免疫磁気ビーズを細菌サンプル溶液中に加え、連続的に振盪しながら室温にて約20分インキュベートした。第二の工程は、磁気粒子集中装置(magnetic particle concentrator)(ニューヨーク州Lake Successに所在のDynal社)を用いてサンプル管の側部に該ビーズを集め、1mLのピペットを用いて上澄み液を除去する工程を包含した。第三の工程において、磁石が除去され、該ビーズは20秒間激しく振盪しながら1mLの新たなPBS中に再懸濁して、任意の非特異的に付着する成分を洗い流した。次に、ビーズ懸濁液を新たな管に移し、第二及び第三の工程をもう一度繰り返した。第四及び最終工程において、該ビーズを磁石を用いて分離し、次に、緩衝洗浄液を廃棄するために別の容器に移し、500μLの脱イオン水中に該ビーズを再懸濁した。次に、ビーズ−大腸菌複合体を低滴定濃度(質量分析計の検出限界未満)のMS2バクテリオファージと混合し、室温にて緩やかに振盪しながら40分間培養した。次に、一定量の懸濁液を取り出し、フェルラ酸マトリクス(17%のギ酸、33%のアセトニトリル、50%の脱イオン水から構成された溶液1mL中に12.5mgのフェルラ酸)を用いたサンドウィッチ試薬調製法を用いてMS2キャプシド蛋白質を分析した。
MALDI−TOF MS
全てのマススペクトルは、ポジティブなリニアモードにて稼動するVoyager−DE STR+MALDI−TOF質量分析計(マサチューセッツ州Framinghamに所在のAB Applied Biosystems社)にて生成した。以下のパラメータが使用された:加速電圧25kV、加速電圧の92%のグリッド電圧、350nsecの遅延引き出し(extraction delay)時間及び4kDaに設定された低質量イオンゲート。レーザの強度(N2,337nm))は、イオン発生閾値より僅かに大きい値に設定され、かつ300ns毎にパスル化した。マススペクトルは、5つの異なるサンプルスポットから100のレーザショットを累積することにより、各サンプルから得られた(最終的なスペクトル=5×100レーザショットの平均)。
【0052】
バクテリオファージに対するバイオマーカーの検出により標的細菌が溶液中に存在することが示されることを確実にするために、「親」バクテリオファージの濃度には、いかなる分析技術が使用された場合においても該バクテリオファージ又は該バクテリオファージ用バイオマーカーの検出限界未満であるような溶液が適用されることが理解されるべきである。これにより、バクテリオファージ又はバクテリオファージ用バイオマーカーが該分析技術により検出され、該バクテリオファージ又はバイオマーカーの検出濃度は子孫バクテリオファージ、即ち、溶液中に存在する標的細菌による該バクテリオファージの複製により得えられるバクテリオファージ、に起因するものであることが確実となる。ある状況下において、そのような濃度の「親」バクテリオファージの使用は、低すぎて検出のためのバクテリオファージ又はバクテリオファージ用バイオマーカーの十分な濃度を迅速に生成することができない感染の多重度(MOI)(即ち、親バクテリオファージの数の標的細菌の数に対する比率)を有する。
【0053】
低MOIに関連した欠点を解決するために、十分に高濃度の「親」バクテリオファージが溶液に加えられる。この場合、溶液に加えられるべき「親」バクテリオファージの濃度は、該バクテリオファージ又は該バクテリオファージのバイオマーカーを検出するためにいかなる分析技術を使用した場合であってもその検出限界を超えているであろう。その結果、この方法にて処理された溶液の分析は、標的細胞による複製にて得られる子孫バクテリオファージよりもむしろ、溶液に加えられるべき「親」バクテリオファージを検出する。
【0054】
従って、該方法の別の実施形態は、任意の子孫バクテリオファージから区別することが可能なある濃度の「親」バクテリオファージを溶液に適用する。一実施形態において、親バクテリオファージ(即ち、最初に溶液に適用されるバクテリオファージ)は、いかなる分析技術が使用された場合であっても該親バクテリオファージ又は該親バクテリオファージのバイオマーカーを、子孫バクテリオファージ又は該子孫バクテリオファージのバイオマーカーから区別することが生来的に可能であるように「標識」化される。例えば、マススペクトル分析技術を使用した場合、親バクテリオファージは、該親バクテリオファージのマススペクトルを子孫バクテリオファージに対して変更するか、又はシフトする物質にて「標識」化され、該物質は親バクテリオファージからの「標識」を遺伝的に継承していない。例えば、ビオチン化バクテリオファージは親バクテリオファージとして使用され得、かつ溶液中に存在する標的細菌を感染させるビオチン化バクテリオファージにより生成される子孫バクテリオファージとは異なるマススペクトルを有するであろう。別の「標識」は、別の型の分析技術のために使用される。
【0055】
別の実施形態において、親バクテリオファージは分析の前に溶液中の子孫バクテリオファージから区別されることを可能とする性質を有し、それにより、分離の後に溶液中に存在するバクテリオファージの全てとはいえないにしてもほとんどが、該溶液中存在する標的細菌によって親バクテリオファージの複製により得られる子孫バクテリオファージであることを確実にする。一実施形態において、ビオチン化バクテリオファージは、溶液中に最初に適用される。ビオチン化バクテリオファージはストレプトアビジンにかなり誘引される。その結果、ビオチン化バクテリオファージを溶液から分離するために、ストレプトアビジンプローブが使用される。一実施形態において、ビオチン化バクテリオファージはストレプトアビジンで被覆されたプローブに付着され、かつ該プローブが溶液中に配置される。この場合、培養期間の後に溶液からのビオチン化バクテリオファージの分離は、該溶液からプローブを除去することにより達成される。別の実施形態において、ストレプトアビジンにより被覆された磁気ビーズが溶液に適用される。ビオチン化バクテリオファージは、溶液に該ビーズを適用する前にストレプトアビジンにて被覆された磁気ビーズに付着される。これに代えて、溶液に予め加えられたビオチン化バクテリオファージを捕捉するためにビーズが使用され、次いで磁石を用いて該溶液から該ビーズが除去される。更に別の実施形態において、ストレプトアビジンにて被覆されたプローブ(例えば、スライド)は、培養期間の後に溶液に適用される。ビオチン化バクテリオファージはプローブに付着し、次いで、該プローブが溶液から分離される。ビオチン化バクテリオファージが液体混合物から分離される様式に関係なく、少なくとも一部の溶液が、溶液中に標的細菌が存在したことを間接的に示すバクテリオファージ又はバクテリオファージ用バイオマーカーが存在するか否かを決定するために分析される。
【特許請求の範囲】
【請求項1】
標的細菌が特定の検出技術の検出限界未満の低濃度である場合に前記標的細菌が溶液中に存在しているかどうかを決定するための方法であって、前記方法は、
前記溶液と、一定量の標識化された親バクテリオファージと、を混合して、前記溶液中に存在する標的細菌の少なくともいくらかを感染させて、前記溶液中に多数の標識化されていない子孫バクテリオファージを生成する工程と、
前記特定の検出技術によって前記溶液を分析し、前記標識化されていない子孫バクテリオファージに対するバイオマーカーであって前記標識化された親バクテリオファージに対するいかなるバイオマーカーに対しても識別可能であり、かつ前記標的細菌が前記溶液中に存在していることを間接的に示す、バイオマーカーが存在しているかを決定する工程と、
からなる方法。
【請求項2】
前記分析工程は、マススペクトル分析を実施することからなる、請求項1に記載の方法。
【請求項3】
前記分析工程は、MALDI分析を実施することからなる、請求項1に記載の方法。
【請求項4】
前記分析工程は、MALDI−TOF分析を実施することからなる、請求項1に記載の方法。
【請求項5】
前記分析工程は、エレクトロスプレーイオン化質量分析法を実施することからなる、請求項1に記載の方法。
【請求項6】
前記分析工程は、イオン移動度分光分析法を実施することからなる請求項1に記載の方法。
【請求項7】
前記分析工程は、光学分光分析法を実施することからなる請求項1に記載の方法。
【請求項8】
前記分析工程は、免疫分析法を実施することからなる請求項1に記載の方法。
【請求項9】
前記分析工程は、クロマトグラフィー分析法を実施することからなる請求項1に記載の方法。
【請求項10】
前記分析工程は、アプタマー分析法を実施することからなる請求項1に記載の方法。
【請求項11】
前記標的細菌を前記溶液から分離する工程を更に含む請求項1に記載の方法。
【請求項12】
前記分離工程は、前記標的細菌に対する抗体で被覆された免疫磁気ビーズを使用する工程を更に含む、請求項11に記載の方法。
【請求項13】
前記標識化された親バクテリオファージはビオチン化バクテリオファージである、請求項1に記載の方法。
【請求項1】
標的細菌が特定の検出技術の検出限界未満の低濃度である場合に前記標的細菌が溶液中に存在しているかどうかを決定するための方法であって、前記方法は、
前記溶液と、一定量の標識化された親バクテリオファージと、を混合して、前記溶液中に存在する標的細菌の少なくともいくらかを感染させて、前記溶液中に多数の標識化されていない子孫バクテリオファージを生成する工程と、
前記特定の検出技術によって前記溶液を分析し、前記標識化されていない子孫バクテリオファージに対するバイオマーカーであって前記標識化された親バクテリオファージに対するいかなるバイオマーカーに対しても識別可能であり、かつ前記標的細菌が前記溶液中に存在していることを間接的に示す、バイオマーカーが存在しているかを決定する工程と、
からなる方法。
【請求項2】
前記分析工程は、マススペクトル分析を実施することからなる、請求項1に記載の方法。
【請求項3】
前記分析工程は、MALDI分析を実施することからなる、請求項1に記載の方法。
【請求項4】
前記分析工程は、MALDI−TOF分析を実施することからなる、請求項1に記載の方法。
【請求項5】
前記分析工程は、エレクトロスプレーイオン化質量分析法を実施することからなる、請求項1に記載の方法。
【請求項6】
前記分析工程は、イオン移動度分光分析法を実施することからなる請求項1に記載の方法。
【請求項7】
前記分析工程は、光学分光分析法を実施することからなる請求項1に記載の方法。
【請求項8】
前記分析工程は、免疫分析法を実施することからなる請求項1に記載の方法。
【請求項9】
前記分析工程は、クロマトグラフィー分析法を実施することからなる請求項1に記載の方法。
【請求項10】
前記分析工程は、アプタマー分析法を実施することからなる請求項1に記載の方法。
【請求項11】
前記標的細菌を前記溶液から分離する工程を更に含む請求項1に記載の方法。
【請求項12】
前記分離工程は、前記標的細菌に対する抗体で被覆された免疫磁気ビーズを使用する工程を更に含む、請求項11に記載の方法。
【請求項13】
前記標識化された親バクテリオファージはビオチン化バクテリオファージである、請求項1に記載の方法。
【図1】


【図2】


【図3】


【図4】


【図5】




【図2】


【図3】


【図4】


【図5】


【公開番号】特開2010−88456(P2010−88456A)
【公開日】平成22年4月22日(2010.4.22)
【国際特許分類】
【出願番号】特願2010−6644(P2010−6644)
【出願日】平成22年1月15日(2010.1.15)
【分割の表示】特願2003−584669(P2003−584669)の分割
【原出願日】平成15年4月10日(2003.4.10)
【出願人】(502032275)
【Fターム(参考)】
【公開日】平成22年4月22日(2010.4.22)
【国際特許分類】
【出願日】平成22年1月15日(2010.1.15)
【分割の表示】特願2003−584669(P2003−584669)の分割
【原出願日】平成15年4月10日(2003.4.10)
【出願人】(502032275)

【Fターム(参考)】
[ Back to top ]

