樹脂組成物およびその用途
【課題】ポリフェニレンエーテルなどの本来有する低誘電率、低吸水性および耐熱性を維持しつつ、感放射線性に優れ、低温で熱処理可能な樹脂組成物を提供する。
【解決手段】(A)芳香族環を有する、比誘電率が5以下の化合物と、(B)下記一般式(1)で表される架橋剤と、(C)酸発生剤とを含有する。

[式(1)中、R1はn価の炭化水素基、nは1〜4の整数、R2はそれぞれ独立に水素原子、酸の存在下により、カチオンを有する基または電子供与性基を示す。]
【解決手段】(A)芳香族環を有する、比誘電率が5以下の化合物と、(B)下記一般式(1)で表される架橋剤と、(C)酸発生剤とを含有する。

[式(1)中、R1はn価の炭化水素基、nは1〜4の整数、R2はそれぞれ独立に水素原子、酸の存在下により、カチオンを有する基または電子供与性基を示す。]
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、樹脂組成物(特にネガ型感放射線性樹脂組成物)およびその用途に関する。
【背景技術】
【0002】
近年、半導体素子の微細化および高性能化の進歩は著しいものがある。半導体素子の性能を充分発揮させるために必要な技術がパッケージ技術である。パッケージ技術およびその問題点に関しては、特許文献1の背景技術に詳しく記載されている。
【0003】
パッケージ技術に使用される層間絶縁膜や表面保護膜の次世代の用途において、これらの原料である樹脂組成物には、(1)耐熱性、(2)機械物性、(3)誘電特性および(4)感放射線性を有することが要求される。これらの物性(1)〜(4)を満足する材料としては、感光性ポリイミドや感光性ポリベンズオキサゾールが広く使われている(例えば、非特許文献1、2参照)。
【0004】
しかしながら、上述の感光性ポリイミドや感光性ポリベンズオキサゾールを用いる場合、低温で熱処理を行うという近年の要求に充分応えることができない。つまり、上述の樹脂組成物には、(5)低温で熱処理可能であることも要求される(例えば、特許文献1参照)。
【0005】
そこで、これらの問題を解決するべく、重合体、架橋剤および光酸発生剤の組合せからなる感光性樹脂組成物に関して、既にいくつかの例が提案されている(例えば、特許文献1〜5参照)。ところが、特許文献2〜5に記載の感光性組成物は、上述の物性(1)〜(5)を充分に満足するとはいえず、さらなる改善が望まれている。
【0006】
また、特許文献1には、ポリフェニレンエーテルの有用性、およびポリフェニレンエーテルとベンジルカチオン系架橋剤と酸発生剤との組合せからなる感光性樹脂組成物が記載されている。しかしながら、その架橋性は充分とはいえず、上述の物性に影響するため、さらなる改善の余地がある。なお、架橋性を発揮する二重結合を含む硬化性ポリフェニレンエーテルを特許文献6に見ることが出来るが、特許文献6には感光性についての記載はない。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】特開2009−115835号公報
【特許文献2】特開平10−316751号公報
【特許文献3】特開2000−034347号公報
【特許文献4】特開2003−207892号公報
【特許文献5】特開2004−004760号公報
【特許文献6】特公平05−008933号公報
【非特許文献】
【0008】
【非特許文献1】上田充、「感光性ポリイミド」、日本写真学会誌、日本写真学会、2003年06巻、4号、p367−375
【非特許文献2】池田章彦、水野晶好、「初歩から学ぶ感光性樹脂」、工業調査会、2002年4月10日、p125−142
【発明の概要】
【発明が解決しようとする課題】
【0009】
本発明は、上述の従来技術に存在する課題を解決しようとするものである。本発明は、芳香族環を有する化合物、特にポリフェニレンエーテルの本来有する低誘電率、低吸水性および耐熱性を維持しつつ、感放射線性に優れ、低温で熱処理可能な樹脂組成物を提供することを課題とする。また、前記樹脂組成物を用いたパターンの製造方法、硬化膜および半導体素子を提供することを課題とする。
【課題を解決するための手段】
【0010】
本発明者らは上記課題を解決するため鋭意検討を行った。その結果、芳香族環を有する、比誘電率が5以下の化合物と特定の基を有する架橋剤と酸発生剤とを用いることで、上記課題を解決できることを見出し、本発明を完成するに至った。すなわち、本発明は以下の〈1〉〜〈11〉に関する。
【0011】
〈1〉(A)芳香族環を有する、比誘電率が5以下の化合物と、(B)下記一般式(1)で表される架橋剤と、(C)酸発生剤とを含有する樹脂組成物。
【0012】
【化1】

【0013】
[式(1)中、R1は炭素数1〜40のn価の炭化水素基を示し、nは1〜4の整数を示
し、複数あるR2はそれぞれ独立に水素原子、−CH2OH、−CH2OR3(R3は炭素数
1〜4のアルキル基を示す。)、−CH2OCOR4(R4は炭素数1〜4のアルキル基ま
たはフルオロアルキル基を示す。)、−CH2OSO2R5(R5は炭化水素基を示す。)または電子供与性基を示す。但し、複数あるR2のうち少なくとも2つは、−CH2OH、−CH2OR3、−CH2OCOR4および−CH2OSO2R5から選択される基である。]
〈2〉前記化合物(A)が、ポリフェニレンエーテルである前記〈1〉に記載の樹脂組成物。
【0014】
〈3〉前記架橋剤(B)において、n=2であり、かつR1がメチレン基または炭素数
2〜20の直鎖状もしくは分岐状のアルキレン基である前記〈1〉または〈2〉に記載の樹脂組成物。
【0015】
〈4〉前記架橋剤(B)において、複数あるR2のうち少なくとも2つが−CH2OCOR4であって、かつR4が炭素数1〜4のアルキル基である前記〈1〉〜〈3〉の何れか一項に記載の樹脂組成物。
【0016】
〈5〉前記架橋剤(B)において、前記電子供与性基が、炭素数1〜10のアルキル基である前記〈1〉〜〈4〉の何れか一項に記載の樹脂組成物。
【0017】
〈6〉前記酸発生剤(C)が、感放射線性酸発生剤である前記〈1〉〜〈5〉の何れか一項に記載の樹脂組成物。
【0018】
〈7〉[1]前記〈1〉〜〈6〉の何れか一項に記載の樹脂組成物を基板上に塗布して塗膜を形成する工程、[2]前記塗膜を露光する工程、および[3]露光後の前記塗膜を現像してパターンを形成する工程を有するパターンの製造方法。
【0019】
〈8〉前記工程[3]に続いて、さらに[4]前記パターンを熱処理する工程を有する前記〈7〉に記載のパターンの製造方法。
【0020】
〈9〉前記〈7〉または〈8〉に記載のパターンの製造方法によって得られる硬化膜。
【0021】
〈10〉前記〈1〉〜〈6〉の何れか一項に記載の樹脂組成物から得られる硬化膜。
【0022】
〈11〉前記〈10〉に記載の硬化膜を有する半導体素子。
【発明の効果】
【0023】
本発明によれば、芳香族環を有する、比誘電率が5以下の化合物、特にポリフェニレンエーテルの本来有する低誘電率、低吸水性および耐熱性(ガラス転移温度、熱重量減少温度などで評価される)を維持しつつ、感放射線性(現像性、感度、解像度などで評価される)に優れ、低温で熱処理可能な樹脂組成物を提供することができる。また、本発明によれば、前記樹脂組成物を用いたパターンの製造方法、硬化膜および半導体素子を提供することができる。
【図面の簡単な説明】
【0024】
【図1】図1は架橋剤種に対してDissolution rateをプロットしたグラフである。
【図2】図2はウエハー上に形成されたパターンのSEM画像である。
【図3】図3はPEB温度に対してDissolution rateをプロットしたグラフである。
【図4】図4はPEB温度に対してDissolution rateをプロットしたグラフである。
【図5】図5はPEB時間に対してDissolution rateをプロットしたグラフである。
【図6】図6はDissolution rateの酸発生剤含有量への依存性を示すグラフである。
【図7】図7はDissolution rateの架橋剤含有量への依存性を示すグラフである。
【図8】図8は樹脂組成物の感度曲線を示すグラフである。
【発明を実施するための形態】
【0025】
以下、本発明を詳細に説明する。
【0026】
〔樹脂組成物〕
本発明の樹脂組成物は、(A)芳香族環を有する、比誘電率が5以下の化合物(以下「化合物(A)」ともいう。)と、(B)後述する式(1)で表される架橋剤(以下「架橋剤(B)」ともいう。)と、(C)酸発生剤とを含有する。また、本発明の樹脂組成物は、前記成分以外の他の成分を含有してもよい。本発明の樹脂組成物は、ネガ型感放射線性樹脂組成物として好適に用いることができる。
【0027】
《化合物(A)》
化合物(A)は、芳香族環を有する、比誘電率が5以下の化合物である。化合物(A)としては、ポリフェニレンエーテル、ポリエーテルケトン、ポリエーテルエーテルケトン、ポリエーテルイミド、ポリアミドイミド、ポリアニリン、ポリエチレンテレフタレート、ポリブチレンテレフタレート、ポリスルホン、ポリエーテルスルホン、ポリエーテルエーテルスルホン、ポリフェニレンスルフィド、ポリカーボネート、ポリアリレート、ポリヒドロキシイミド;
tert−ブチルカリックス[8]アレーンなどの環状化合物;ポリアルキルチオフェン、ポリピロール、ポリ(4−ビニルピリジン)などの複素環を有する重合体;
ヒドロキシスチレンの単独または共重合体(例:ポリヒドロキシスチレン、ヒドロキシスチレンとスチレンとのランダム共重合体やブロック共重合体、ヒドロキシスチレンとエチルビニルエーテルとのブロック共重合体)、レゾール樹脂やノボラック樹脂(例:フェノール/ホルムアルデヒド縮合ノボラック樹脂、クレゾール/ホルムアルデヒド縮合ノボラック樹脂、フェノール−ナフトール/ホルムアルデヒド縮合ノボラック樹脂)、フェノール−キシリレングリコール縮合樹脂、クレゾール−キシリレングリコール縮合樹脂、フェノール−ジシクロペンタジエン縮合樹脂などのフェノール性水酸基を有する重合体などが挙げられる。
【0028】
これらの中では、形成されるパターンの誘電率が低いため、ポリフェニレンエーテルが好ましく、下記一般式(A1)で表されるポリフェニレンエーテルが特に好ましい。
【0029】
【化2】

【0030】
上記一般式(A1)中、複数あるRはそれぞれ独立に水素原子、炭素数1〜4のアルキル基またはフェニル基であり、好ましくは炭素数1〜4のアルキル基であり、特に好ましくはメチル基である。nは10〜5000の整数である。
【0031】
ポリフェニレンエーテルは、井上俊英著、高分子先端材料 One Point 8「エンジニアリングプラスチック」高分子学会、2004に開示があるように、公知の方法によって合成することができる。
【0032】
従来、感光性ポリイミドや感光性ポリベンズオキサゾールなどの前駆体を含有する樹脂組成物を用いたパターン形成の場合、300〜350℃の高温で環化処理を行う際に、基板(例:薄厚化したシリコンウエハー)の反りが問題となっていた。一方、本発明においては耐熱性の高い化合物(A)、好ましくはポリフェニレンエーテルを用いているため、高温での環化処理が不要であり、基板の反りを低減できる。
【0033】
化合物(A)は、形成される膜の解像度・熱衝撃性・耐熱性の観点から、ゲルパーミエーションクロマトグラフィー(GPC)によるポリスチレン換算の重量平均分子量(Mw)が、好ましくは1,000〜1,000,000、より好ましくは5,000〜500,000であり;重量平均分子量(Mw)と数平均分子量(Mn)との比(Mw/Mn)が、好ましくは1〜10、より好ましくは1〜5である。なお、化合物(A)の平均分子量は後述する〔実施例〕記載の条件で測定される。
【0034】
化合物(A)は1種単独で用いてもよく、2種以上を併用してもよい。
【0035】
本発明の樹脂組成物において、化合物(A)の含有量は、固形分換算で通常は40〜98重量%、好ましくは50〜95重量%、特に好ましくは70〜90重量%である。固形分換算とは、溶媒以外の成分の合計量を100重量%とすることを意味する。
【0036】
《架橋剤(B)》
本発明の樹脂組成物は、下記一般式(1)で表される架橋剤(B)を含有する。
【0037】
【化3】

【0038】
式(1)中、R1は炭素数1〜40のn価の炭化水素基を示し、nは1〜4の整数を示し
、複数あるR2はそれぞれ独立に水素原子、−CH2OH、−CH2OR3(R3は炭素数1
〜4のアルキル基を示す。)、−CH2OCOR4(R4は炭素数1〜4のアルキル基また
はフルオロアルキル基を示す。)、−CH2OSO2R5(R5は炭化水素基を示す。)または電子供与性基を示す。
【0039】
但し、複数あるR2のうち少なくとも2つは、−CH2OH、−CH2OR3、−CH2O
COR4および−CH2OSO2R5から選択される基である。前記基は、酸の存在下に架橋反応を起こしうる基である。より詳しくは、前記基は、酸の存在下により、カチオンを有する基となり、このカチオンと上述の化合物(A)の芳香族環とが、求電子反応により結合することにより架橋反応が進行する。なお、式(1)中のR2のうち少なくとも2つが
前記基であればよく、同一の芳香族基が有するR2のうち少なくとも2つが必ずしも前記
基でなければならないわけではない。
【0040】
上記電子供与性基とは、化合物の特定の位置について、電子密度を増加させる効果を持つ基のことであり、例えば、アルキル基、ハロゲン原子、アルコキシ基、アルキルチオ基、アミノ基が挙げられる。電子供与性基は、炭素数1〜10のアルキル基であることが好ましく、炭素数1〜4のアルキル基であることがより好ましい。
【0041】
R3およびR4における上記炭素数1〜4のアルキル基としては、メチル基、エチル基、プロピル基、ブチル基などが挙げられ;電子供与性基における上記炭素数1〜10のアルキル基としては、前記例示のアルキル基に加えて、ペンチル基、ヘキシル基、ヘプチル基、オクチル基、ノニル基、デシル基などが挙げられ;R4における上記炭素数1〜4のフ
ルオロアルキル基としては、トリフルオロメチル基などが挙げられる。
【0042】
R5における上記炭化水素基としては、炭素数1〜4のアルキル基、炭素数6〜20の
アリール基などが挙げられる。前記炭素数1〜4のアルキル基としては、メチル基、エチル基、プロピル基、ブチル基などが挙げられ;前記炭素数6〜20のアリール基としては、フェニル基、ナフチル基などが挙げられる。
【0043】
式(1)中、n=2であることが好ましい。この場合、R1はメチレン基または炭素数
2〜20の直鎖状または分岐状のアルキレン基であることが好ましい。このようなアルキレン基としては、エチレン基、プロピレン基、ブチレン基、ペンチレン基、ヘキシレン基、オクチレン基などが挙げられる。
【0044】
式(1)中、複数あるR2のうち少なくとも2つは、合成の容易さ、および脱離性能に
優れることを鑑みると、−CH2OCOR4であって、かつR4が炭素数1〜4のアルキル
基であることが好ましい。
【0045】
架橋剤(B)を用いることで、低誘電率、低吸水性および耐熱性を有する化合物(A)の特性を維持しつつ、感放射線性に優れ、低温で熱処理可能な樹脂組成物が得られる。
【0046】
架橋剤(B)の中でも、下記一般式(B1)で表される架橋剤(以下「架橋剤(B1)」ともいう。)が特に好ましい。
【0047】
【化4】

【0048】
式(B1)中、R1〜R6はそれぞれ独立に水素原子、アセチル基、炭素数1〜4のアルキル基、トリフルオロアセチル基またはR−SO2−で表される基(Rは炭素数1〜4の
アルキル基、炭素数6〜20のアリール基などの炭化水素基を示す。)を示し、R1〜R6から選択される2つ以上がアセチル基であることが好ましく、R1〜R6の全てがアセチル基であることがより好ましい。R1〜R6は酸触媒の存在下において、例えばR1OH〜R6OHとなって脱離する。pKa値を比較すると、スルホン酸(−1.2程度)<トリフルオロ酢酸(−0.25程度)<酢酸(5程度)<水<メタノール(15.5程度)である。これらの中では、入手の容易さ、および脱離性能に優れることを鑑みると、酢酸が好ましい。すなわち、R1〜R6がアセチル基である架橋剤(B1)は、入手が容易であるとともに、架橋性に優れる。
【0049】
また、式(B1)中、R7〜R10はそれぞれ独立に水素原子または電子供与性基を示し
、R7〜R10から選択される1つ以上が電子供与性基であることが好ましい。R7〜R10から選択される1つ以上が電子供与性基の場合、それらの基に直結するベンゼン環の電子密度が増大し、例えば、R1OH(例:酢酸)が脱離した後のベンジルカチオンの安定化(
ベンジルカチオンの寿命の増大)が可能となるため、架橋反応の効率が向上する。
【0050】
なお、本発明において電子供与性基とは、化合物の特定の位置について、電子密度を増加させる効果を持つ基のことであり、例えば、アルキル基、ハロゲン原子、アルコキシ基、アルキルチオ基、アミノ基が挙げられる。
【0051】
式(B1)中、電子供与性基は、炭素数1〜10のアルキル基であることが好ましい。電子供与性基が炭素数1〜10のアルキル基であると、架橋剤(B1)同士で自己縮合する部位が減少または消滅するため、架橋剤(B1)同士の重合を阻止できる。このため、架橋剤(B1)を用いた場合、少ない架橋剤配合量で、パターン形成能に優れた樹脂組成物が得られ、また耐熱性などに優れたパターンが得られる。
【0052】
また、式(B1)中、R11はメチレン基または炭素数2〜20の直鎖状もしくは分岐状のアルキレン基を示す。このようにR11としてメチレン基またはアルキレン基を導入することにより、以下の理由により架橋剤としての性能が向上する。
【0053】
(a)架橋剤(B1)自体のモビリティーの増加につながり、例えばR1OH(例:酢
酸)として脱離した後のベンジルカチオンが動きやすいため、架橋反応の効率が向上する。(b)架橋剤(B1)自体が長いため、重合体(化合物(A))の分子鎖が離れていても効果的な架橋反応が可能である(分子長が小さい架橋剤と比べて、架橋剤の配合量を低減できる)。(c)柔軟なアルキル鎖(アルキレン基)および回転性のあるエーテル結合の存在により、樹脂膜の低反り性の向上が期待できる。(d)架橋後の重合体(化合物(A))のクラック発生を抑制できる。
【0054】
また、架橋剤(B1)は、ベンゼン環に結合したエーテル結合(Ar−O−R11)を有する。エーテル結合は電子供与性基として働き、例えばR1OH(例:酢酸)が脱離した
後のベンジルカチオンの安定化(ベンジルカチオンの寿命の増大)が可能となるため、架橋反応の効率が向上する。また、ベンゼン環同士がエーテル結合を介して結合しているため、分子内回転が容易であり、架橋剤自体のモビリティーが向上し、架橋反応の効率が向上する。
【0055】
式(B1)中、上記炭素数1〜4のアルキル基としては、メチル基、エチル基、プロピル基、ブチル基などが挙げられ;上記炭素数1〜10のアルキル基としては、前記例示のアルキル基に加えて、ペンチル基、ヘキシル基、ヘプチル基、オクチル基、ノニル基、デシル基などが挙げられ;上記炭素数2〜20の直鎖状または分岐状のアルキレン基としては、エチレン基、プロピレン基、ブチレン基、ペンチレン基、ヘキシレン基などが挙げられる。
【0056】
−架橋剤(B)と重合体(化合物(A))との架橋反応のメカニズムについて−
以下、架橋反応のメカニズムを、架橋剤(B1)を例にとって説明する。
【0057】
【化5】

【0058】
酸発生剤(C)由来の酸(H+)が架橋剤(B1)の酸素(非共有電子対)部位と反応
し、R3OH(例:酢酸)が脱離する。続いて、生成したベンジルカチオンと、例えば、
上記反応式中において、ポリフェニレンエーテル(A)のベンゼン環(π電子雲)やフェノール性水酸基を有する重合体(B)のフェノール性水酸基(酸素の不対電子対)やベンゼン環(π電子雲)との親電子反応が進行する。架橋剤(B1)においては、このように反応しうる酸素部位が2つ以上ある(例:−OR3、−OR4など)ため、架橋反応が可能となる。
【0059】
本発明の樹脂組成物において、架橋剤(B)の含有量は、化合物(A)100重量部に対して、通常は1〜100重量部、好ましくは2〜50重量部、特に好ましくは5〜40重量部である。架橋剤(B)の含有量が前記範囲にあると、感光性と、低誘電率・低吸水性・耐熱性とのバランスに優れる。架橋剤(B)の含有量が前記範囲を下回ると露光による硬化が不充分になるため、パターニングが困難になったり、得られる硬化物の耐熱性が低下する場合があり、前記範囲を上回ると解像性が低下する場合がある。
【0060】
−架橋剤(B)の製造方法−
次に、架橋剤(B)の製造方法を、架橋剤(B1)の製造方法を例にとって説明する。その他の架橋剤(B)も、下記方法に準じて製造することができる。架橋剤(B1)は、例えば、以下の2つの方法により製造することができる。
【0061】
《第1の方法(ルート1)》
架橋剤(B1)を製造する第1の方法は、工程i:下記式(1a)で表されるフェノール化合物と下記式(1b)で表されるハロゲン含有化合物とを反応させることにより、下記式(1c)で表される化合物を製造する工程、工程ii:下記式(1c)で表される化合物と下記式(1d)で表されるハロゲン含有化合物とを反応させることにより、下記式(1e)で表される化合物を製造する工程、工程iii:下記式(1e)で表される化合物と
下記式(1f)で表されるアルカリ金属化合物とを反応させることにより、下記式(1g)で表される化合物を製造する工程を含む。
【0062】
第1の方法によれば、架橋剤(B1)を比較的高収率で製造することができる。
【0063】
−工程i−
工程iは、下記式(1a)で表されるフェノール化合物と下記式(1b)で表されるハロゲン含有化合物とを反応させることにより、下記式(1c)で表される化合物を製造する工程である。
【0064】
【化6】

【0065】
式(1a)中、複数あるRAはそれぞれ独立に水素原子または電子供与性基(例:アルキ
ル基、ハロゲン原子、アルコキシ基、アルキルチオ基、アミノ基)を示し、少なくとも1つが電子供与性基であることが好ましく、少なくとも1つが炭素数1〜10のアルキル基であることがより好ましい。具体的には、3,5−ジメチルフェノール、3,5−ジメトキシフェノールなどが挙げられる。
【0066】
【化7】

【0067】
式(1b)中、R11はメチレン基または炭素数2〜20の直鎖状もしくは分岐状のアルキレン基を示す。Xはフッ素原子、塩素原子または臭素原子を示す。具体的には、1,6−ジブロモへキサン、1,7−ジブロモヘプタン、1,10−ジブロモデカン、1,7−ジクロロヘプタン、1,8−ジクロロオクタンなどが挙げられる。
【0068】
【化8】

【0069】
式(1c)中、複数あるRAはそれぞれ独立に水素原子または電子供与性基を示し、少な
くとも1つが電子供与性基であることが好ましく、少なくとも1つが炭素数1〜10のアルキル基であることがより好ましい。R11は上記式(1b)中のR11と同義である。
【0070】
工程iにおいて、反応に供される上記式(1a)で表されるフェノール化合物と上記式(1b)で表されるハロゲン含有化合物とのモル比(1a/1b)は、収率の観点から、通常は1〜10、好ましくは2〜5である。
【0071】
工程iにおいて、フェノキシドイオンの求核種形成用の塩基触媒として、炭酸ナトリウム、炭酸カリウムなどの炭酸塩;水酸化ナトリウム、水酸化カリウムなどのアルカリ金属水酸化物などを用いることが好ましい。塩基触媒の使用量は、上記式(1a)で表されるフェノール化合物1モルに対して、通常は1〜10モル、好ましくは1〜3モルである。
【0072】
工程iにおいて、溶媒を用いることができる。前記溶媒としては、上記式(1a)または式(1b)で表される化合物と反応せず、また反応温度条件で安定である溶媒であれば、特に制限無く用いることができる。具体的には、N,N−ジメチルホルミアミド、N,N−ジメチルアセトアミド、N−メチル−2−ピロリドン、1,3−ジメチル−2−イミダゾリジノンなどが挙げられる。反応溶液中の上記式(1a)で表されるフェノール化合物と上記式(1b)で表されるハロゲン含有化合物との合計仕込み濃度は、収率の観点から、通常は5〜70重量%である。
【0073】
工程iにおいて、反応温度は通常0〜220℃、好ましくは23〜120℃であり、反応圧力は通常1〜100気圧、好ましくは大気圧であり、反応時間は通常0.1〜100時間、好ましくは1〜30時間である。また、工程iは不活性ガス雰囲気(例:窒素雰囲気やアルゴン雰囲気)下で実施することが好ましい。
【0074】
工程iにおいて得られた上記式(1c)で表される化合物は、例えば、反応溶液に対して通常の精製作業(再沈殿、抽出、洗浄、乾燥、濾過、濃縮、結晶化など)を行うことにより、単離して、次工程iiで用いることができる。
【0075】
−工程ii−
工程iiは、上記式(1c)で表される化合物と下記式(1d)で表されるハロゲン含有化合物とを反応させることにより、下記式(1e)で表される化合物を製造する工程である。
【0076】
【化9】

【0077】
式(1d)中、RBは炭素数1〜10のアルキル基を示し、Xはフッ素原子、塩素原子ま
たは臭素原子を示す。具体的には、クロロメチルメチルエーテルなどが挙げられる。
【0078】
【化10】

【0079】
式(1e)中、RAおよびR11はそれぞれ上記式(1c)中のRAおよびR11と同義であり、Xは上記式(1d)中のXと同義である。複数あるRAは相互に同一でも異なってもよ
く、複数あるXは相互に同一でも異なってもよい。
【0080】
工程iiにおいて、反応に供される上記式(1c)で表される化合物と上記式(1d)で表されるハロゲン含有化合物とのモル比(1d/1c)は、収率の観点から、通常は6〜100、好ましくは6〜30である。
【0081】
工程iiにおいて、触媒としてSnCl4、SnBr4などの金属ハロゲン化物を用いることが好ましい。触媒の使用量は、上記式(1d)で表される化合物に対して、通常は等量(モル基準)以上である。
【0082】
工程iiにおいて、溶媒を用いることができる。前記溶媒としては、上記式(1c)または式(1d)で表される化合物と反応せず、また反応温度条件で安定である溶媒であれば、特に制限無く用いることができ、上記金属ハロゲン化物を溶解できる溶媒であればより好ましい。具体的には、ジクロロメタン、クロロホルム、四塩化炭素などが挙げられる。前記溶媒は脱水して用いることが好ましい。反応溶液中の上記式(1c)で表される化合物と上記式(1d)で表されるハロゲン含有化合物との合計仕込み濃度は、収率の観点から、通常は1〜50重量%、好ましくは1〜20重量%である。
【0083】
工程iiにおいて、反応温度は通常−30〜50℃、好ましくは−15〜35℃であり、反応圧力は通常は大気圧であり、反応時間は通常0.1〜100時間、好ましくは1〜10時間である。また、工程iiは不活性ガス雰囲気(例:窒素雰囲気、アルゴン雰囲気)下で実施することが好ましい。また、前記不活性ガスは水分を含まない方が好ましい。
【0084】
工程iiにおいて得られた上記式(1e)で表される化合物は、例えば、反応溶液に対して通常の精製作業を行うことにより、単離して、次工程iiiで用いることができる。
【0085】
−工程iii−
工程iiiは、上記式(1e)で表される化合物と下記式(1f)で表されるアルカリ金
属化合物とを反応させることにより、下記式(1g)で表される化合物を製造する工程である。
【0086】
【化11】

【0087】
式(1f)中、RCは水素原子、アセチル基、炭素数1〜4のアルキル基、トリフルオロ
アセチル基またはR−SO2−で表される基(Rは炭素数1〜4のアルキル基、炭素数6
〜20のアリール基などの炭化水素基を示す。)を示し、アセチル基であることが好ましい。Mはリチウム、ナトリウムまたはカリウムを示す。具体的には、酢酸ナトリウム、酢酸カリウムなどが挙げられる。
【0088】
【化12】

【0089】
式(1g)中、RAおよびR11はそれぞれ上記式(1c)中のRAおよびR11と同義である。RCは上記式(1f)中のRCと同義である。複数あるRAは相互に同一でも異なっても
よく、複数あるRAから選択される1つ以上が電子供与性基であることが好ましく、複数
あるRAから選択される1つ以上が炭素数1〜10のアルキル基であることがより好まし
い。複数あるRCは相互に同一でも異なってもよく、複数あるRCから選択される2つ以上がアセチル基であることが好ましく、複数あるRCの全てがアセチル基であることがより
好ましい。
【0090】
工程iiiにおいて、反応に供される上記式(1e)で表される化合物と上記式(1f)
で表されるアルカリ金属化合物とのモル比(1f/1e)は、収率の観点から、通常は6〜50、好ましくは6〜30である。
【0091】
工程iiiにおいて、溶媒を用いることができる。前記溶媒としては、上記式(1e)ま
たは式(1f)で表される化合物と反応せず、また反応温度条件で安定である溶媒であれば、特に制限無く用いることができる。具体的には、酢酸、プロピオン酸、アセトニトリルなどが挙げられる。反応溶液中の上記式(1e)で表される化合物と上記式(1f)で表されるアルカリ金属化合物との合計仕込み濃度は、収率の観点から、通常は0.1〜20重量%、好ましくは1〜10重量%である。
【0092】
工程iiiは還流条件で行うことが好ましいが、上記式(1e)または式(1f)で表さ
れる化合物の種類によっては、還流条件よりも低い温度で行うこともできる。反応圧力は通常1〜100気圧、好ましくは大気圧であり、反応時間は通常0.1〜200時間、好ましくは1〜50時間である。また、工程iiiは不活性ガス雰囲気(例:窒素雰囲気、ア
ルゴン雰囲気)下で実施することが好ましい。また、前記不活性ガスは水分を含まない方が好ましい。
【0093】
工程iiiにおいて得られた上記式(1g)で表される化合物は、例えば、反応溶液に対
して通常の精製作業を行うことにより、単離すればよい。このようにして、最終的に架橋剤(B1)が得られる。
【0094】
なお、RCが水素原子である化合物を得る場合は、RCがアセチル基である化合物から、還元剤(例えば、LiAlH4)などを用いて還元することにより得ることもできる。
【0095】
また、RCがアルキル基である化合物を得る場合は、以下の2種類の手法も挙げられる
。一つは、上記RCが水素原子である化合物を少量の硫酸などの酸触媒存在下、アルコー
ルを還流することにより高収率でRcがアルキル基である化合物を合成する方法である。
もう一つは、上記RCが水素原子である化合物を塩化水素や塩化臭素でハロゲン化した後
、ハロゲン化された化合物とアルカリ金属のアルコキシド化合物(例:ナトリウムメトキシド)とをアルコール中、室温で反応させることにより比較的高収率でRcがアルキル基
である化合物を合成する方法である。
【0096】
《第2の方法(ルート2)》
架橋剤(B1)を製造する第2の方法は、工程I:上記式(1a)で表されるフェノール化合物と、1,3,5−トリオキサン、ホルムアルデヒドおよびパラホルムアルデヒドから選択される少なくとも1種と、ハロゲン化水素酸(例:フッ酸、塩酸、臭化水素酸)とを反応させることにより、下記式(2a)で表される化合物を製造する工程、工程II:下記式(2a)で表される化合物と上記式(1f)で表されるアルカリ金属化合物とを反応させることにより、下記式(2b)で表される化合物を製造する工程、工程III:下記
式(2b)で表される化合物と上記式(1b)で表されるハロゲン含有化合物とを反応させることにより、上記式(1g)で表される化合物を製造する工程を含む。
【0097】
第2の方法によれば、比較的安価な原料化合物を使用し、かつ重金属化合物を使用することなく、架橋剤(B1)を比較的高収率で製造することができる。
【0098】
−工程I−
工程Iは、上記式(1a)で表されるフェノール化合物と、1,3,5−トリオキサン、ホルムアルデヒドおよびパラホルムアルデヒドから選択される少なくとも1種と、ハロゲン化水素酸とを反応させることにより、下記式(2a)で表される化合物を製造する工程である。
【0099】
【化13】

【0100】
式(2a)中、RAは上記式(1a)中のRAと同義である。複数あるRAは相互に同一で
も異なってもよい。Xはフッ素原子、塩素原子または臭素原子を示す。
【0101】
工程Iにおいて、1,3,5−トリオキサンを用いる場合、反応に供される上記式(1a)で表されるフェノール化合物と1,3,5−トリオキサンとのモル比(トリオキサン/1a)は、収率の観点から、通常は1〜20、好ましくは1〜5である。また、上記式(1a)で表されるフェノール化合物とハロゲン化水素酸とのモル比(ハロゲン化水素酸/1a)は、収率の観点から、通常は3〜100、好ましくは3〜30である。
【0102】
工程Iにおいて、溶媒を用いることができる。前記溶媒としては、上記式(1a)で表されるフェノール化合物や1,3,5−トリオキサン、ホルムアルデヒド、パラホルムアルデヒドなどと反応せず、また反応温度条件で安定である溶媒であれば、特に制限無く用いることができる。特に、極性の高い有機溶媒を好適に用いることができる。具体的には、N,N−ジメチルアセトアミド、N,N−ジメチルホルムアミド、酢酸、プロピオン酸などが挙げられる。反応溶液中の上記式(1a)で表されるフェノール化合物と1,3,5―トリオキサン、ホルムアルデヒドおよびパラホルムアルデヒドから選択される少なく
とも1種との合計仕込み濃度は、収率の観点から、通常は1〜80重量%、好ましくは5〜30重量%である。
【0103】
工程Iにおいて、反応温度は通常−20〜220℃、好ましくは23〜120℃であり、反応圧力は通常1〜100気圧、好ましくは大気圧であり、反応時間は通常0.1〜100時間、好ましくは1〜5時間である。
【0104】
工程Iにおいて得られた上記式(2a)で表される化合物は、例えば、反応溶液に対して通常の精製作業を行うことにより、単離して、次工程IIで用いることができる。
【0105】
−工程II−
工程IIは、上記式(2a)で表される化合物と上記式(1f)で表されるアルカリ金属化合物とを反応させることにより、下記式(2b)で表される化合物を製造する工程である。
【0106】
【化14】

【0107】
式(2b)中、RCは上記式(1f)中のRCと同義である。複数あるRCは相互に同一で
も異なってもよい。
【0108】
工程IIにおいて、反応に供される上記式(2a)で表される化合物と上記式(1f)で表されるアルカリ金属化合物とのモル比(1f/2a)は、収率の観点から、通常は3〜50、好ましくは3〜12である。
【0109】
工程IIにおいて、溶媒を用いることができる。前記溶媒としては、上記式(2a)または(1f)で表される化合物と反応せず、また反応温度条件で安定である溶媒であれば、特に制限無く用いることができる。具体的には、アセトニトリル、酢酸、プロピオン酸などが挙げられる。反応溶液中の上記式(2a)で表される化合物と上記式(1f)で表されるアルカリ金属化合物との合計仕込み濃度は、収率の観点から、通常は1〜80重量%、好ましくは5〜40重量%である。
【0110】
工程IIは還流条件で行えばよく、反応温度は通常40〜140℃、好ましくは60〜140℃であり、反応圧力は通常1〜100気圧、好ましくは大気圧であり、反応時間は通常0.1〜100時間、好ましくは1〜50時間である。
【0111】
工程IIにおいて得られた上記式(2b)で表される化合物は、例えば、反応溶液に対して通常の精製作業を行うことにより、単離して、次工程IIIで用いることができる。
【0112】
−工程III−
工程IIIは、上記式(2b)で表される化合物と上記式(1b)で表されるハロゲン含
有化合物とを反応させることにより、上記式(1g)で表される化合物を製造する工程である。
【0113】
工程IIIにおいて、反応に供される上記式(2b)で表される化合物と上記式(1b)
で表されるハロゲン含有化合物とのモル比(2b/1b)は、収率の観点から、通常は2〜10、好ましくは2〜4である。
【0114】
工程IIIにおいて、フェノキシドイオンの求核種形成用の塩基触媒として、炭酸カリウ
ム、炭酸ナトリウムなどのアルカリ金属の炭酸塩;水酸化ナトリウム、水酸化カリウムなどのアルカリ金属水酸化物などを用いてもよい。塩基触媒の使用量は、上記式(2b)で表される化合物1モルに対して、通常は1〜10モル、好ましくは1〜3モルである。
【0115】
工程IIIにおいて、溶媒を用いることができる。前記溶媒としては、上記式(2b)ま
たは(1b)で表される化合物と反応せず、また反応温度条件で安定である溶媒であれば、特に制限無く用いることができる。具体的には、N,N−ジメチルアセトアミド、N−ジメチルホルムアミド、N−メチル−2−ピロリドン、1,3−ジメチル−2−イミダゾリジノンなどが挙げられる。反応溶液中の上記式(2b)で表される化合物と上記式(1b)で表されるハロゲン含有化合物との合計仕込み濃度は、収率の観点から、通常は1〜80重量%、好ましくは5〜40重量%である。
【0116】
工程IIIにおいて、反応温度は通常0〜220℃、好ましくは23〜120℃であり、
反応圧力は通常1〜100気圧、好ましくは大気圧であり、反応時間は通常0.1〜100時間、好ましくは1〜30時間である。
【0117】
工程IIIにおいて得られた上記式(1g)で表される化合物は、例えば、反応溶液に対
して通常の精製作業を行うことにより、単離すればよい。このようにして、最終的に架橋剤(B1)が得られる。
【0118】
《酸発生剤(C)》
本発明の樹脂組成物は、酸発生剤(C)を含有する。酸発生剤(C)は特に限定されないが、放射線の照射により酸を発生する化合物である、感放射線性酸発生剤が好ましい。この酸の触媒作用により架橋剤(B)中の−CH2OH、−CH2OR3、−CH2OCOR4および−CH2OSO2R5から選択される基と化合物(A)とがアルコール脱離などを伴って反応する。これにより、本発明の樹脂組成物を用いると、ネガ型のパターンを形成することができる。
【0119】
<感放射線性酸発生剤>
感放射線性酸発生剤は、放射線(例:紫外線)の照射により酸を発生する化合物である。感放射線性酸発生剤は放射線の照射により酸を発生する化合物であれば特に限定されないが、オニウム塩化合物、ハロゲン含有化合物、ジアゾケトン化合物、スルホン化合物、スルホン酸化合物、スルホンイミド化合物、ジアゾメタン化合物、ナフタレン核またはアントラセン核を有する酸発生剤などが挙げられる。これらの中では、熱処理後の耐熱性の観点から、ナフタレン核またはアントラセン核を有する酸発生剤が好ましい。
【0120】
ナフタレン核を有する酸発生剤としては、下記式で表される化合物が挙げられる。
【0121】
【化15】

【0122】
アントラセン核を有する酸発生剤としては、下記式で表される化合物が挙げられる。
【0123】
【化16】

【0124】
【化17】

【0125】
本発明の樹脂組成物において、酸発生剤(C)の含有量は、該樹脂組成物の感度・解像度・パターン形状などを確保する観点から、化合物(A)100重量部に対して、通常は1〜100重量部、好ましくは2〜30重量部、特に好ましくは5〜20重量部である。酸発生剤(C)の含有量が前記範囲を下回ると硬化が不充分になるため耐熱性が低下する恐れがあり、前記範囲を上回ると露光光に対する透明性が低下するためパターン形状の劣化を招く恐れがある。
【0126】
《溶媒》
本発明の樹脂組成物は、その取扱い性を向上させたり、粘度や保存安定性を調節するために、溶媒を含有してもよい。前記溶媒としては、有機溶媒を用いることができる。
【0127】
上記有機溶媒としては、エチレングリコールモノメチルエーテルアセテート、エチレングリコールモノエチルエーテルアセテートなどのエチレングリコールモノアルキルエーテルアセテート類;プロピレングリコールモノメチルエーテル、プロピレングリコールモノエチルエーテル、プロピレングリコールモノプロピルエーテル、プロピレングリコールモノブチルエーテルなどのプロピレングリコールモノアルキルエーテル類;プロピレングリコールジメチルエーテル、プロピレングリコールジエチルエーテル、プロピレングリコールジプロピルエーテル、プロピレングリコールジブチルエーテルなどのプロピレングリコールジアルキルエーテル類;プロピレングリコールモノメチルエーテルアセテート、プロピレングリコールモノエチルエーテルアセテート、プロピレングリコールモノプロピルエーテルアセテート、プロピレングリコールモノブチルエーテルアセテートなどのプロピレングリコールモノアルキルエーテルアセテート類;エチルセロソルブ、ブチルセロソルブなどのセロソルブ類;ブチルカルビトールなどのカルビトール類;
乳酸メチル、乳酸エチル、乳酸n−プロピル、乳酸イソプロピルなどの乳酸エステル類;酢酸エチル、酢酸n−プロピル、酢酸イソプロピル、酢酸n−ブチル、酢酸イソブチル、酢酸n−アミル、酢酸イソアミル、プロピオン酸イソプロピル、プロピオン酸n−ブチル、プロピオン酸イソブチルなどの脂肪族カルボン酸エステル類;3−メトキシプロピオン酸メチル、3−メトキシプロピオン酸エチル、3−エトキシプロピオン酸メチル、3−エトキシプロピオン酸エチル、ピルビン酸メチル、ピルビン酸エチルなどの他のエステル類;
トルエン、キシレンなどの芳香族炭化水素類;2−ヘプタノン、3−ヘプタノン、4−ヘプタノン、シクロヘキサノンなどのケトン類;N−メチルピロリドン、N−メチルホルムアミド、N−メチルアセトアミド、N,N−ジメチルホルムアミド、N,N−ジメチルアセトアミドなどのアミド類;γ−ブチロラクンなどのラクトン類;トリクロロメタン、テトラクロロエタン、クロロベンゼンなどが挙げられる。
【0128】
これらの有機溶媒は、1種単独あるいは2種以上を混合して使用することもできる。
【0129】
これらの中では、ジェー・ブランドラップ、イー・エイチ・イマーグート著『ポリマー
ハンドブック 第3版』ウイリー インターサイエンス 1989 pVII-379〜407など
に記載されているポリフェニレンエーテルなどを溶解する有機溶媒が好ましい。例えばポリ(2,6−ジメチル−1,4−フェニレンエーテル)を溶かす有機溶媒としては、トルエン、トリクロロメタン、テトラクロロエタン、クロロベンゼンなどが挙げられる。
【0130】
上記溶媒の使用量は、樹脂組成物の用途や塗布方法に応じて適宜選択され、樹脂組成物を均一な状態にすることができれば特に制限されるものではない。上記溶媒を使用する場合、溶媒の含有量は、樹脂組成物100重量%に対して、通常は10〜97重量%、好ましくは35〜95重量%である。溶媒の含有量が前記範囲にあると、化合物(A)の溶解性が良好となり、また樹脂組成物の膜形成性が良好となる。
【0131】
《その他の成分》
本発明の樹脂組成物は、酸発生剤(C)の酸発生効率を高めるために、必要に応じて各種増感剤を含有してもよい。また、界面活性剤、接着助剤、高分子添加剤、反応性希釈剤、レベリング剤、濡れ性改良剤、可塑剤、酸化防止剤、帯電防止剤、防カビ剤、調湿剤、難燃剤などを含有してもよい。
【0132】
《樹脂組成物の調製方法》
本発明の樹脂組成物は、所定量の上記各成分を、ディゾルバー、ホモジナイザー、3本ロールミルなどの分散機を用いて分散・混合することにより調製できる。また必要に応じて、メッシュメンブランフィルターなどを用いて、樹脂組成物を濾過してもよい。
【0133】
本発明の樹脂組成物は、例えばネガ型感放射線性樹脂組成物または感光性絶縁樹脂組成物として用いることができ、感放射線性(現像性、感度、解像度などで評価される)に優れ、低温で熱処理可能である。また、その硬化物は、低誘電率、低吸水性および耐熱性(ガラス転移温度、熱重量減少温度などで評価される)に優れている。従って、本発明の樹脂組成物は、半導体素子において、多層回路基板のソルダーレジスト用や微細配線形成用材料などとして好適に使用することができる。
【0134】
〔パターンの製造方法〕
本発明の樹脂組成物の用途として、パターンの製造方法について説明する。本発明のパターンの製造方法は、[1]上述の樹脂組成物を基板上に塗布して塗膜を形成する工程(塗布工程)、[2]前記塗膜を露光する工程(露光工程)、および[3]露光後の前記塗膜を現像してパターンを形成する工程(現像工程)を有する。さらに、現像工程[3]に続いて、[4]前記パターンを熱処理する工程(熱処理工程)を有することが好ましい。
【0135】
[1]塗布工程
塗布工程では、本発明の樹脂組成物を、最終的に得られる硬化膜(パターン)の膜厚が例えば0.1〜100μmとなるように、基板上に塗布する。これをオーブンやホットプレートを用いて、例えば温度:50〜140℃、時間:10〜240秒で乾燥して溶媒を除去する。これをプリベーク(PB)と呼ぶ。このようにして基板上に塗膜を形成する。
【0136】
基板としては、シリコンウエハー、化合物半導体ウエハー、金属薄膜付きウエハー、ガラス基板、石英基板、セラミックス基板、アルミ基板などが挙げられ;塗布方法としては、ディッピング法、スプレー法、バーコート法、ロールコート法、スピンコート法、カーテンコート法、グラビア印刷法、シルクスクリーン法、インクジェット法などが挙げられる。
【0137】
[2]露光工程
露光工程では、マスクを介して、コンタクトアライナーやステッパーを用いて放射線による露光を上記塗膜に対して行う。放射線としては、X線、電子線、紫外線、可視光線などが利用できるが、波長200〜500nmの光を用いることが好ましく、i線(365nm)を用いることが特に好ましい。露光機としては、通常はコンタクトアライナーやステッパーが使用される。この後、放射線感度の向上などの目的で、任意の温度、時間の組合せ(例えば、温度:40〜250℃、時間:10〜420秒)による露光後ベーク(PEB)を施す。
【0138】
[3]現像工程
現像工程では、非露光部を現像液で溶解除去し、所望のパターンを得る。現像方法としては、スプレー、パドル、ディップまたは超音波などの方式が可能である。本発明の樹脂組成物により形成された膜を現像するために用いられる現像液は、ジェー・ブランドラップ、イー・エイチ・イマーグート著『ポリマーハンドブック 第3版』ウイリー インターサイエンス 1989pVII-379〜407などに記載されており、上記に溶媒として例示したものと同一のものが好ましく使用できる。また、化合物(A)としてフェノール性水酸基を有する重合体を用いた場合には、アルカリ現像液を用いることが好ましい。前記アルカリ現像液としては、水酸化ナトリウム、水酸化カリウム、アンモニア水、テトラメチルアンモニウムヒドロキシド、コリンなどのアルカリ性化合物を濃度が0.1〜10重量%程度となるように水に溶解させた水溶液が挙げられる。
【0139】
その後、任意に、現像によって形成したパターンをリンス液により洗浄し、現像液を除去してもよい。リンス液としては、蒸留水、メタノール、エタノール、イソプロパノール、プロピレングリコールモノメチルエーテルアセテート、プロピレングリコールモノメチルエーテルなどを単独または混合して用いる。
【0140】
[4]熱処理工程
熱処理工程では、得られたパターンを温度:180〜400℃(好ましくは180〜250℃)、時間:10〜600分で加熱して、硬化パターンを得る。このような加熱硬化反応は、ホットプレート、イナートオーブン、温度プログラムを設定できる昇温式オーブンなどを用いて行うことができる。加熱硬化させる際の雰囲気気体としては空気を用いてもよく、不活性ガス(例:窒素、アルゴン)を用いてもよい。
【0141】
〔硬化膜、半導体素子〕
本発明の硬化膜は、上述の樹脂組成物から得られ、低誘電率、低吸水性および耐熱性(ガラス転移温度、熱重量減少温度などで評価される)に優れる。硬化膜は、例えば上述のパターンの製造方法によって得ることができる。硬化膜の膜厚は、通常は0.1〜100μm、好ましくは0.1〜30μm、より好ましくは5〜30μmである。
【0142】
本発明の半導体素子は、上述の硬化膜を有する。半導体素子は、上述の硬化膜をシリコンウエハーなどの基板上に形成された保護膜やパッケージの絶縁膜として使用することにより、容易に製造することができる。
【実施例】
【0143】
以下、実施例をもとに本発明をさらに詳細に説明するが、本発明はこれら実施例に何ら限定されない。なお、以下の実施例および比較例において、特に断らない限り、「部」および「%」はそれぞれ「重量部」および「重量%」の意味で用いる。
【0144】
〔重合体の分子量測定〕
重合体の重量平均分子量(Mw)、数平均分子量(Mn)の測定条件は下記のとおり。
GPC測定装置:JASCO GULLIVER1500
カラム:ポリスチレンゲル(Pigel 5mm MIXED-CT)
展開液:トリクロロメタン
流速:1.0mL/分
標準サンプル:ポリスチレン
〔合成例1〕下記式(b1)で表される架橋剤の合成(ルート1)
以下の工程(i)〜(iii)を実施することにより、ヘキサ−1,6−イレンビス[オ
キシ−(2,4,6−トリス(アセチルオキシメチル)−3,5−ジメチルベンゼン)](以下「架橋剤b1」または「HOAD」ともいう。)を合成した。
【0145】
【化18】

【0146】
(i)ヘキサ−1,6−イレンビス(オキシ−3,5−ジメチルベンゼン)(以下「HOD」ともいう。)の合成:3,5−ジメチルフェノール(5.00g、40.9mmol)および1
,6−ジブロモへキサン(4.65g、19.0mmol)をN,N−ジメチルホルムアミド(DMF
、35mL)に溶解させた溶液に、K2CO3(99.5%、8.53g、61.4mmol)を加えた。この溶液を、窒素雰囲気下、80℃で18時間攪拌した。この反応溶液を室温まで冷却し、蒸留水(500mL)に注ぎ、明黄褐色の固体を得た。この固体を濾別し、蒸留水で洗浄した。生成物
を、n−ヘキサンを用いて再結晶し、さらに真空乾燥し、5.53gの白色固体を得た(収率89%)。
【0147】
得られた白色固体の分析結果を以下に示す。融点:69.4〜70.3℃。赤外吸収スペクトル
(cm-1、KBr法): 3014-2854 (CH3, -CH2-), 1589 (Ar), 1463, 1427 and 1390 (CH3, -CH2-), 1294 and 1076 (-O-)。1H NMR (CDCl3, δ, ppm): 1.50-1.55 (m, 4H, -CH2-), 1.75-1.85 (m, 4H, -CH2-), 2.28 (s, 12H, -CH3), 3.91-3.95 (t, 4H, -CH2O-), 6.53 (s, 4H, Ar), 6.58 (s, 2H, Ar)。元素分析 (C22H30O2): 理論値: C, 80.94; H, 9.26, 測定
値: C, 81.22; H, 9.18。以上の結果から、生成物がHODであることを確認した。
【0148】
【化19】

【0149】
(ii)ヘキサ−1,6−イレンビス[オキシ−(2,4,6−トリス(クロロメチル)−3,5−ジメチルベンゼン)](以下「HOCD」ともいう。)の合成:HOD(0.500g、1.53mmol)およびクロロメチルメチルエーテル(2.22g、2.07mL、27.6mmol)を脱水
ジクロロメタン(15mL)に溶解させた溶液を、SnCl4(7.19g、3.23mL、27.6mmol)を脱水ジクロロメタン(5mL)に溶解させた溶液に、窒素雰囲気下、氷浴(0〜5℃)で冷却しな
がら15分かけて滴下した。この反応溶液を氷浴で冷却しながら1時間攪拌し、さらに室温で7時間攪拌した。その後、未反応のSnCl4を水(100mL)で除去した。この溶液の有機層をジクロロメタンで抽出する作業を水洗とともに3回繰り返した。この有機層を蒸留水で洗浄し、硫酸マグネシウムで乾燥した。硫酸マグネシウムを濾別し、真空下で有機層を濃縮した。得られた粗生成物をシリカゲルカラムクロマトグラフィー(抽出液:ジクロロメタン)で精製し、0.730gの白色固体を得た(収率77%)。
【0150】
得られた白色固体の分析結果を以下に示す。融点:198.8〜199.5℃。赤外吸収スペクトル (cm-1、KBr法): 2921-2856 (CH3, -CH2-), 1571 (Ar), 1452 and 1384 (CH3, -CH2-),
1255 and 1087 (-O-)。1H NMR (CDCl3, δ, ppm): 1.64-1.73 (m, 4H, -CH2-), 1.94-2.03 (m, 4H, -CH2-), 2.51 (s, 12H, -CH3), 4.07-4.10 (t, 4H, -OCH2-), 4.68 (s, 4H, -CH2Cl), 4.74 (s, 8H, -CH2Cl)。元素分析 (C28H36Cl6O2): 理論値: C, 54.48; H, 5.88, 測定値: C, 54.25; H, 5.76。以上の結果から、生成物がHOCDであることを確認し
た。
【0151】
【化20】

【0152】
(iii)ヘキサ−1,6−イレンビス[オキシ−(2,4,6−トリス(アセチルオキ
シメチル)−3,5−ジメチルベンゼン)](HOAD)の合成:HOCD(0.500g、0.810mmol)およびCH3COONa(98.5%、0.81g、9.72mmol)を酢酸(AcOH、35mL)に溶解させた溶液を、窒素雰囲気下、33時間還流した。この反応溶液を室温まで冷却し、蒸留水(300mL)に注ぎ、白色固体を得た。この白色固体を濾別し、蒸留水で洗浄した。得られた
生成物を酢酸エチル/n−ヘキサン(体積比7/11)を用いて再結晶し、さらに真空乾燥し、0.570gの固体を得た(収率93%)。
【0153】
最終的に得られた固体の分析結果を以下に示す。融点:163.8〜164.5℃。赤外吸収スペクトル (cm-1、KBr法): 2931-2866 (CH3, -CH2-), 1736 (C=O), 1442 (CH3, -CH2-), 1381 (CH3), 1246 and 1026 (-O-)。1H NMR (CDCl3, δ, ppm): 1.51-1.55 (m, 4H, -CH2-),
1.80-1.89 (m, 4H, -CH2-), 2.05 (s, 12H, CH3), 2.09 (s, 6H, CH3), 2.36 (s, 12H, CH3), 3.76-3.80 (t, 4H, -OCH2-), 5.22 (s, 12H, -OCH2-)。元素分析 (C40H54O14): 理論値: C, 63.31; H, 7.17, 測定値: C, 63.31; H, 7.10。以上の分析結果から、生成物がHOADであることを確認した。
【0154】
【化21】

【0155】
〔合成例2〕架橋剤BR1の合成
下記式(BR1)で表される1,3,5−トリス(アセトキシメチル)−2,4,6−トリメチルベンゼン(以下「架橋剤BR1」または「TAB」ともいう。)は、以下のようにして合成した。
【0156】
【化22】

【0157】
(1)1,3,5−トリス(クロロメチル)−2,4,6−トリメチルベンゼン(以下「TCB」ともいう。)の合成:1,3,5−トリメチルベンゼン(1g、1.15mL、8.32mmol)およびクロロメチルメチルエーテル(6.03g、5.64mL、74.9mmol)を脱水ジクロロメ
タン(10mL)に溶解させた溶液に、SnCl4(19.5g、8.77mL、74.9mmol)を脱水ジクロロメタン(10mL)に溶解させた溶液を、窒素雰囲気下、氷浴(0〜5℃)で冷却しながら20分かけて滴下した。この反応溶液を氷浴で冷却しながら1時間攪拌し、さらに室温で5時間攪拌した。その後、未反応のSnCl4を水(100mL)で除去した。この溶液の有機層をジクロロメタンで抽出する作業を水洗とともに3回繰り返した。この有機層を蒸留水で洗浄し、硫酸マグネシウムで乾燥した。硫酸マグネシウムを濾別し、真空下で有機層を濃縮した。得られた粗生成物をカラムクロマトグラフィー(抽出液:ジクロロメタン)で精製し、2.08gの白色固体を得た(収率94%)。
【0158】
得られた白色固体の分析結果を以下に示す。融点:175.5〜176.0℃。赤外吸収スペクトル (cm-1、KBr法): 2990-2894 (CH3, -CH2-), 1567 (Ar), 1446 and 1379 (CH3, -CH2-),
1253 (-CH2Cl)。1H NMR (CDCl3, δ, ppm): 2.51 (s, 9H, -CH3), 4.70 (s, 6H, -CH2Cl)。元素分析 (C12H15Cl3): 理論値 C, 54.26; H, 5.69, 測定値: C, 54.20; H, 5.64。以上の結果から、生成物がTCBであることを確認した。
【0159】
(2)1,3,5−トリス(アセトキシメチル)−2,4,6−トリメチルベンゼン(TAB)の合成:TCB(1.49g、5.60mmol)およびCH3COONa(98.5%、3.03g、36.4mmol)を酢酸(50mL)に溶解させた溶液を、窒素雰囲気下、20時間還流した。この反応溶液を室温まで冷却し、蒸留水(300mL)に注ぎ、白色固体を得た。この白色固体を濾別し、
蒸留水で洗浄した。得られた生成物を酢酸エチル/n−ヘキサン(体積比1/7)を用いて
再結晶し、真空乾燥し、1.86gの白色針状固体を得た(収率99%)。
【0160】
最終的に得られた白色針状固体の分析結果を以下に示す。融点:155.0〜155.5℃。赤外吸収スペクトル (cm-1、KBr法): 2992-2931 (CH3, -CH2-), 1728 (C=O), 1581 (Ar), 1442 and 1377 (CH3, -CH2-), 1241 and 1034 (-O-)。1H NMR (CDCl3, δ, ppm): 2.07 (s, 9H, -COCH3), 2.40 (s, 9H, -CH3), 5.25 (s, 6H, -CH2OC=O)。元素分析 (C18H24O6): 理論値; C, 64.27; H, 7.19, 測定値: C, 64.41; H, 7.09。以上の結果から、生成物がT
ABであることを確認した。
【0161】
〔合成例3〕架橋剤BR2の合成
下記式(BR2)で表される4,4’−メチレンビス[2,6−ビス(メトキシメチル)]フェノール(以下「架橋剤BR2」または「MBMP」ともいう。)は、Journal of Polymer Science:Part A:Polymer chemistry、2008,46,4949−4958と同様の手法により合成した。
【0162】
【化23】

【0163】
[実施例1]
表1に示すとおり、化合物A1:83部、架橋剤b1:10部、酸発生剤C1:7部を、固形分濃度が6.5%となるよう溶媒D1に混合して、樹脂組成物を調製した。
【0164】
[実施例2〜5および比較例1〜3]
表1に示す組成の樹脂組成物を調製したこと以外は実施例1と同様に行った。
【0165】
【表1】

【0166】
表1中の各成分の詳細は以下のとおりである。
・化合物A1:ポリ(2,6−ジメチル−1,4−フェニレンエーテル)。シグマアルドリッチジャパン株式会社より購入したものを使用した。化合物A1のMwおよびMnは、それぞれ31500および11600であった。
・架橋剤b1:合成例1で得られた化合物(HOAD)
・架橋剤BR1:合成例2で得られた化合物(TAB)
・架橋剤BR2:合成例3で得られた化合物(MBMP)
・架橋剤BR3:ヘキサメチロールメラミン(CYMEL)
(三井サイアナミド製、商品名「サイメル303」)
・酸発生剤C1:ジフェニルヨードニウム−9,10−ジメトキシアントラセン−2−スルフォナート(略称「DIAS」、シグマアルドリッチジャパン株式会社製、下記式で表される化合物)
【0167】
【化24】

【0168】
・溶媒D1:1,1,2,2−テトラクロロエタン
〔評価1〕
上記実施例1および比較例1〜3で得られた樹脂組成物をスピンコーター(ミカサ社製「1H−D7」)にて4インチシリコンウエハーにスピンコートし、ホットプレートにて空気中でプリベーク(PB)を80℃で30秒間行い、膜厚2.4μmの塗膜を形成した。なお、膜厚はフィルム膜厚測定装置(Veeco Instruments Inc. 社製「Dektak3system」)にて測定した。
【0169】
i線(365nm)の露光波長を有するコンタクト露光機(ミカサ社製 マスクアライメント装置「M−1s」)を用いて、テストパターン付きマスクを通して、上記塗膜を300mJ/cm2の露光量で露光した。ウエハーに対して、ホットプレートにて露光後ベ
ーク(PEB)を190℃で300秒間行った。次に、ウエハーを25℃のトルエンに浸漬および静置して、現像を1秒間行った。
【0170】
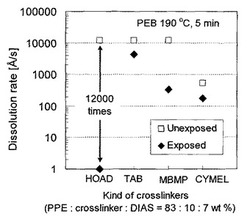
ウエハーの現像前後の厚みを測定してDissolution rate(膜の溶解速度(Å/s))を計算した。図1は、横軸:架橋剤種に対して縦軸:Dissolution rateをプロットしたグラフである(□が露光なし、◆が露光あり)。
【0171】
本発明の樹脂組成物(HOAD含有)と他の樹脂組成物(TAB、MBMP、CYMEL含有)との感光性能の比較を行った。その結果、本発明の樹脂組成物(HOAD含有)によれば効果的に未露光部・露光部の溶解速度差(12000倍程度)を得ることができ、他
の樹脂組成物より優れた性能を示した。
【0172】
また、走査型電子顕微鏡(SEM、(株)テクネックス工房製「Tiny-SEM」)により、実施例1で得られた樹脂組成物からなる、ウエハー上に形成されたパターンは、6μm/6μmのライン/スペースパターンまで解像していることがわかった。SEM画像を図2に示す。
【0173】
〔評価2〕PEB温度依存性
上記実施例1および比較例3で得られた樹脂組成物をスピンコーター(ミカサ社製「1H−D7」)にて4インチシリコンウエハーにスピンコートし、ホットプレートにて空気中でプリベーク(PB)を80℃で30秒間行い、膜厚1.2μmの塗膜を形成した。なお、膜厚はフィルム膜厚測定装置(Veeco Instruments Inc. 社製「Dektak3system」)にて測定した。
【0174】
i線(365nm)の露光波長を有するコンタクト露光機(ミカサ社製 マスクアライメント装置「M−1s」)を用いて、テストパターン付きマスクを通して、上記塗膜を300mJ/cm2の露光量で露光した。ウエハーに対して、ホットプレートにて露光後ベ
ーク(PEB)を160〜200℃(実施例1)または150〜190℃(比較例3)で300秒間行った。次に、ウエハーを25℃のトルエンに浸漬および静置して、現像を1秒間行った。
【0175】
ウエハーの現像前後の厚みを測定してDissolution rate(膜の溶解速度(Å/s))を計算した。図3(実施例1)および図4(比較例3)は、横軸:PEB温度に対して縦軸:Dissolution rateをプロットしたグラフである(□が露光なし、◆が露光あり)。その結果、実施例1で得られた樹脂組成物を用いた場合、この条件では190℃以上でPEBを行えば、未露光部と露光部との溶解速度の比率が12000倍以上となることを確認できた。
【0176】
〔評価3〕PEB時間依存性
上記実施例1で得られた樹脂組成物をスピンコーター(ミカサ社製「1H−D7」)にて4インチシリコンウエハーにスピンコートし、ホットプレートにて空気中でプリベーク(PB)を80℃で30秒間行い、膜厚1.2μmの塗膜を形成した。なお、膜厚はフィルム膜厚測定装置(Veeco Instruments Inc. 社製「Dektak3system」)にて測定した。
【0177】
i線(365nm)の露光波長を有するコンタクト露光機(ミカサ社製 マスクアライメント装置「M−1s」)を用いて、テストパターン付きマスクを通して、上記塗膜を300mJ/cm2の露光量で露光した。ウエハーに対して、ホットプレートにて露光後ベ
ーク(PEB)を190℃で0〜7分間行った。次に、ウエハーを25℃のトルエンに浸漬および静置して、現像を1秒間行った。
【0178】
ウエハーの現像前後の厚みを測定してDissolution rate(膜の溶解速度(Å/s))を計算した。図5は、横軸:PEB時間に対して縦軸:Dissolution rateをプロットしたグラフである(□が露光なし、◆が露光あり)。その結果、この条件ではPEBを5分間以上行えば、未露光部と露光部との溶解速度の比率が12000倍以上となることを確認できた。
【0179】
〔評価4〕DIAS含有量依存性
上記実施例1〜3で得られた樹脂組成物を用い、膜厚1.2μmの塗膜を形成したこと以外は評価1と同様に行った。図6は、横軸:実施例2,1,3の樹脂組成物に対して縦軸:Dissolution rateをプロットしたグラフである(□が露光なし、◆が露光あり)。その結果、この条件では樹脂組成物における固形分換算でのDIAS含有量が7重量%以上であれば、未露光部と露光部との溶解速度の比率が特に良好となることを確認した。
【0180】
〔評価5〕HOAD含有量依存性
上記実施例1,4〜5で得られた樹脂組成物を用い、膜厚1.2μmの塗膜を形成したこと以外は評価1と同様に行った。図7は、横軸:実施例4,1,5の樹脂組成物に対して縦軸:Dissolution rateをプロットしたグラフである(□が露光なし、◆が露光あり)。その結果、この条件では樹脂組成物におけるHOAD含有量が10重量%以上であれば、未露光部と露光部との溶解速度の比率が特に良好となることを確認した。
【0181】
〔評価6〕感度評価
上記実施例1で得られた樹脂組成物を用い、膜厚1.2μmの塗膜を形成し、種々の露光量で露光を行ったこと以外は評価1と同様に行った。図8は、横軸:露光量(Exposure
dose)に対して縦軸:相対膜厚(Normalized film thickness)をプロットしたグラフである。相対膜厚は、(現像後の膜厚/現像前の膜厚)×100(%)で求められる。その結果、D0.5(相対膜厚が50%になる露光量)は43mJ/cm2、γ0.5(相対膜厚が
50%である点でのグラフの接線の傾き)は11であり、本発明の樹脂組成物は感度およびコントラストに優れていることを確認した。
【0182】
〔評価7〕
ポリフェニレンエーテル(化合物A1)から得られる硬化物と実施例1の樹脂組成物から得られる硬化物との、耐熱性、吸水性および比誘電率の評価を、以下のようにして行った。
【0183】
シリコンウエハー上に実施例1の樹脂組成物を塗布し、窒素雰囲気下、220℃で1時間熱処理することにより厚さ30μmの硬化物(硬化物A)を得た。同様の手法にて、ポリフェニレンエーテル8重量%と1,1,2,2−テトラクロロエタン92重量%とを含有する樹脂組成物から、厚さ31μmの硬化物(硬化物B)を得た。
【0184】
硬化物Aおよび硬化物Bについて以下の手法にて、耐熱性(ガラス転移温度、10%重量減少温度)、吸水性および比誘電率の評価を行った。結果を表2に示す。
【0185】
−耐熱性−
DSC測定装置(Seiko製 型式:EXSTAR 6000 TG/DTA 6300)を用い、昇温速度:10℃/分、窒素雰囲気下の条件で、硬化物のガラス転移温度および10%重量減少温度の測定を行った。
【0186】
−吸水率−
上記硬化物を水中に25℃・6時間の条件で浸漬した。その後、硬化物を取り出し、ティッシュペーパーで表面に付着した水分を拭き取り、硬化物の重量を微量天秤で測定した。吸水率は下記式から算出した。
【0187】
吸水率(重量%)=(Wa−Wb)/Wb×100
Waは浸漬後の硬化物の重量を、Wbは浸漬前の硬化物の重量を示す。
【0188】
−比誘電率−
プリズムカプラー(メトリコン社製「PC−2000」、波長1320nm、室温)にて硬化物の屈折率を測定し、硬化物の1MHzにおける比誘電率を下記式にて算出した。
【0189】
ε(比誘電率)=[n(屈折率)]2
【0190】
【表2】

【0191】
300℃まで昇温したが、硬化物Aのガラス転移温度は測定されず、高い耐熱性を示した。また、硬化物Aの10%重量減少温度は硬化物Bのそれと比較して45℃程度低いものの、約400℃と充分高い耐熱性を示した。硬化物Aの吸水率は硬化物Bのそれと同様に0.05%以下であった。硬化物Aは、硬化物Bが本来有する低誘電率を維持していた。従って、本発明の樹脂組成物は、ポリフェニレンエーテルの低誘電性を損ねることなくパターニングできることが判明した。
【技術分野】
【0001】
本発明は、樹脂組成物(特にネガ型感放射線性樹脂組成物)およびその用途に関する。
【背景技術】
【0002】
近年、半導体素子の微細化および高性能化の進歩は著しいものがある。半導体素子の性能を充分発揮させるために必要な技術がパッケージ技術である。パッケージ技術およびその問題点に関しては、特許文献1の背景技術に詳しく記載されている。
【0003】
パッケージ技術に使用される層間絶縁膜や表面保護膜の次世代の用途において、これらの原料である樹脂組成物には、(1)耐熱性、(2)機械物性、(3)誘電特性および(4)感放射線性を有することが要求される。これらの物性(1)〜(4)を満足する材料としては、感光性ポリイミドや感光性ポリベンズオキサゾールが広く使われている(例えば、非特許文献1、2参照)。
【0004】
しかしながら、上述の感光性ポリイミドや感光性ポリベンズオキサゾールを用いる場合、低温で熱処理を行うという近年の要求に充分応えることができない。つまり、上述の樹脂組成物には、(5)低温で熱処理可能であることも要求される(例えば、特許文献1参照)。
【0005】
そこで、これらの問題を解決するべく、重合体、架橋剤および光酸発生剤の組合せからなる感光性樹脂組成物に関して、既にいくつかの例が提案されている(例えば、特許文献1〜5参照)。ところが、特許文献2〜5に記載の感光性組成物は、上述の物性(1)〜(5)を充分に満足するとはいえず、さらなる改善が望まれている。
【0006】
また、特許文献1には、ポリフェニレンエーテルの有用性、およびポリフェニレンエーテルとベンジルカチオン系架橋剤と酸発生剤との組合せからなる感光性樹脂組成物が記載されている。しかしながら、その架橋性は充分とはいえず、上述の物性に影響するため、さらなる改善の余地がある。なお、架橋性を発揮する二重結合を含む硬化性ポリフェニレンエーテルを特許文献6に見ることが出来るが、特許文献6には感光性についての記載はない。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】特開2009−115835号公報
【特許文献2】特開平10−316751号公報
【特許文献3】特開2000−034347号公報
【特許文献4】特開2003−207892号公報
【特許文献5】特開2004−004760号公報
【特許文献6】特公平05−008933号公報
【非特許文献】
【0008】
【非特許文献1】上田充、「感光性ポリイミド」、日本写真学会誌、日本写真学会、2003年06巻、4号、p367−375
【非特許文献2】池田章彦、水野晶好、「初歩から学ぶ感光性樹脂」、工業調査会、2002年4月10日、p125−142
【発明の概要】
【発明が解決しようとする課題】
【0009】
本発明は、上述の従来技術に存在する課題を解決しようとするものである。本発明は、芳香族環を有する化合物、特にポリフェニレンエーテルの本来有する低誘電率、低吸水性および耐熱性を維持しつつ、感放射線性に優れ、低温で熱処理可能な樹脂組成物を提供することを課題とする。また、前記樹脂組成物を用いたパターンの製造方法、硬化膜および半導体素子を提供することを課題とする。
【課題を解決するための手段】
【0010】
本発明者らは上記課題を解決するため鋭意検討を行った。その結果、芳香族環を有する、比誘電率が5以下の化合物と特定の基を有する架橋剤と酸発生剤とを用いることで、上記課題を解決できることを見出し、本発明を完成するに至った。すなわち、本発明は以下の〈1〉〜〈11〉に関する。
【0011】
〈1〉(A)芳香族環を有する、比誘電率が5以下の化合物と、(B)下記一般式(1)で表される架橋剤と、(C)酸発生剤とを含有する樹脂組成物。
【0012】
【化1】

【0013】
[式(1)中、R1は炭素数1〜40のn価の炭化水素基を示し、nは1〜4の整数を示
し、複数あるR2はそれぞれ独立に水素原子、−CH2OH、−CH2OR3(R3は炭素数
1〜4のアルキル基を示す。)、−CH2OCOR4(R4は炭素数1〜4のアルキル基ま
たはフルオロアルキル基を示す。)、−CH2OSO2R5(R5は炭化水素基を示す。)または電子供与性基を示す。但し、複数あるR2のうち少なくとも2つは、−CH2OH、−CH2OR3、−CH2OCOR4および−CH2OSO2R5から選択される基である。]
〈2〉前記化合物(A)が、ポリフェニレンエーテルである前記〈1〉に記載の樹脂組成物。
【0014】
〈3〉前記架橋剤(B)において、n=2であり、かつR1がメチレン基または炭素数
2〜20の直鎖状もしくは分岐状のアルキレン基である前記〈1〉または〈2〉に記載の樹脂組成物。
【0015】
〈4〉前記架橋剤(B)において、複数あるR2のうち少なくとも2つが−CH2OCOR4であって、かつR4が炭素数1〜4のアルキル基である前記〈1〉〜〈3〉の何れか一項に記載の樹脂組成物。
【0016】
〈5〉前記架橋剤(B)において、前記電子供与性基が、炭素数1〜10のアルキル基である前記〈1〉〜〈4〉の何れか一項に記載の樹脂組成物。
【0017】
〈6〉前記酸発生剤(C)が、感放射線性酸発生剤である前記〈1〉〜〈5〉の何れか一項に記載の樹脂組成物。
【0018】
〈7〉[1]前記〈1〉〜〈6〉の何れか一項に記載の樹脂組成物を基板上に塗布して塗膜を形成する工程、[2]前記塗膜を露光する工程、および[3]露光後の前記塗膜を現像してパターンを形成する工程を有するパターンの製造方法。
【0019】
〈8〉前記工程[3]に続いて、さらに[4]前記パターンを熱処理する工程を有する前記〈7〉に記載のパターンの製造方法。
【0020】
〈9〉前記〈7〉または〈8〉に記載のパターンの製造方法によって得られる硬化膜。
【0021】
〈10〉前記〈1〉〜〈6〉の何れか一項に記載の樹脂組成物から得られる硬化膜。
【0022】
〈11〉前記〈10〉に記載の硬化膜を有する半導体素子。
【発明の効果】
【0023】
本発明によれば、芳香族環を有する、比誘電率が5以下の化合物、特にポリフェニレンエーテルの本来有する低誘電率、低吸水性および耐熱性(ガラス転移温度、熱重量減少温度などで評価される)を維持しつつ、感放射線性(現像性、感度、解像度などで評価される)に優れ、低温で熱処理可能な樹脂組成物を提供することができる。また、本発明によれば、前記樹脂組成物を用いたパターンの製造方法、硬化膜および半導体素子を提供することができる。
【図面の簡単な説明】
【0024】
【図1】図1は架橋剤種に対してDissolution rateをプロットしたグラフである。
【図2】図2はウエハー上に形成されたパターンのSEM画像である。
【図3】図3はPEB温度に対してDissolution rateをプロットしたグラフである。
【図4】図4はPEB温度に対してDissolution rateをプロットしたグラフである。
【図5】図5はPEB時間に対してDissolution rateをプロットしたグラフである。
【図6】図6はDissolution rateの酸発生剤含有量への依存性を示すグラフである。
【図7】図7はDissolution rateの架橋剤含有量への依存性を示すグラフである。
【図8】図8は樹脂組成物の感度曲線を示すグラフである。
【発明を実施するための形態】
【0025】
以下、本発明を詳細に説明する。
【0026】
〔樹脂組成物〕
本発明の樹脂組成物は、(A)芳香族環を有する、比誘電率が5以下の化合物(以下「化合物(A)」ともいう。)と、(B)後述する式(1)で表される架橋剤(以下「架橋剤(B)」ともいう。)と、(C)酸発生剤とを含有する。また、本発明の樹脂組成物は、前記成分以外の他の成分を含有してもよい。本発明の樹脂組成物は、ネガ型感放射線性樹脂組成物として好適に用いることができる。
【0027】
《化合物(A)》
化合物(A)は、芳香族環を有する、比誘電率が5以下の化合物である。化合物(A)としては、ポリフェニレンエーテル、ポリエーテルケトン、ポリエーテルエーテルケトン、ポリエーテルイミド、ポリアミドイミド、ポリアニリン、ポリエチレンテレフタレート、ポリブチレンテレフタレート、ポリスルホン、ポリエーテルスルホン、ポリエーテルエーテルスルホン、ポリフェニレンスルフィド、ポリカーボネート、ポリアリレート、ポリヒドロキシイミド;
tert−ブチルカリックス[8]アレーンなどの環状化合物;ポリアルキルチオフェン、ポリピロール、ポリ(4−ビニルピリジン)などの複素環を有する重合体;
ヒドロキシスチレンの単独または共重合体(例:ポリヒドロキシスチレン、ヒドロキシスチレンとスチレンとのランダム共重合体やブロック共重合体、ヒドロキシスチレンとエチルビニルエーテルとのブロック共重合体)、レゾール樹脂やノボラック樹脂(例:フェノール/ホルムアルデヒド縮合ノボラック樹脂、クレゾール/ホルムアルデヒド縮合ノボラック樹脂、フェノール−ナフトール/ホルムアルデヒド縮合ノボラック樹脂)、フェノール−キシリレングリコール縮合樹脂、クレゾール−キシリレングリコール縮合樹脂、フェノール−ジシクロペンタジエン縮合樹脂などのフェノール性水酸基を有する重合体などが挙げられる。
【0028】
これらの中では、形成されるパターンの誘電率が低いため、ポリフェニレンエーテルが好ましく、下記一般式(A1)で表されるポリフェニレンエーテルが特に好ましい。
【0029】
【化2】

【0030】
上記一般式(A1)中、複数あるRはそれぞれ独立に水素原子、炭素数1〜4のアルキル基またはフェニル基であり、好ましくは炭素数1〜4のアルキル基であり、特に好ましくはメチル基である。nは10〜5000の整数である。
【0031】
ポリフェニレンエーテルは、井上俊英著、高分子先端材料 One Point 8「エンジニアリングプラスチック」高分子学会、2004に開示があるように、公知の方法によって合成することができる。
【0032】
従来、感光性ポリイミドや感光性ポリベンズオキサゾールなどの前駆体を含有する樹脂組成物を用いたパターン形成の場合、300〜350℃の高温で環化処理を行う際に、基板(例:薄厚化したシリコンウエハー)の反りが問題となっていた。一方、本発明においては耐熱性の高い化合物(A)、好ましくはポリフェニレンエーテルを用いているため、高温での環化処理が不要であり、基板の反りを低減できる。
【0033】
化合物(A)は、形成される膜の解像度・熱衝撃性・耐熱性の観点から、ゲルパーミエーションクロマトグラフィー(GPC)によるポリスチレン換算の重量平均分子量(Mw)が、好ましくは1,000〜1,000,000、より好ましくは5,000〜500,000であり;重量平均分子量(Mw)と数平均分子量(Mn)との比(Mw/Mn)が、好ましくは1〜10、より好ましくは1〜5である。なお、化合物(A)の平均分子量は後述する〔実施例〕記載の条件で測定される。
【0034】
化合物(A)は1種単独で用いてもよく、2種以上を併用してもよい。
【0035】
本発明の樹脂組成物において、化合物(A)の含有量は、固形分換算で通常は40〜98重量%、好ましくは50〜95重量%、特に好ましくは70〜90重量%である。固形分換算とは、溶媒以外の成分の合計量を100重量%とすることを意味する。
【0036】
《架橋剤(B)》
本発明の樹脂組成物は、下記一般式(1)で表される架橋剤(B)を含有する。
【0037】
【化3】

【0038】
式(1)中、R1は炭素数1〜40のn価の炭化水素基を示し、nは1〜4の整数を示し
、複数あるR2はそれぞれ独立に水素原子、−CH2OH、−CH2OR3(R3は炭素数1
〜4のアルキル基を示す。)、−CH2OCOR4(R4は炭素数1〜4のアルキル基また
はフルオロアルキル基を示す。)、−CH2OSO2R5(R5は炭化水素基を示す。)または電子供与性基を示す。
【0039】
但し、複数あるR2のうち少なくとも2つは、−CH2OH、−CH2OR3、−CH2O
COR4および−CH2OSO2R5から選択される基である。前記基は、酸の存在下に架橋反応を起こしうる基である。より詳しくは、前記基は、酸の存在下により、カチオンを有する基となり、このカチオンと上述の化合物(A)の芳香族環とが、求電子反応により結合することにより架橋反応が進行する。なお、式(1)中のR2のうち少なくとも2つが
前記基であればよく、同一の芳香族基が有するR2のうち少なくとも2つが必ずしも前記
基でなければならないわけではない。
【0040】
上記電子供与性基とは、化合物の特定の位置について、電子密度を増加させる効果を持つ基のことであり、例えば、アルキル基、ハロゲン原子、アルコキシ基、アルキルチオ基、アミノ基が挙げられる。電子供与性基は、炭素数1〜10のアルキル基であることが好ましく、炭素数1〜4のアルキル基であることがより好ましい。
【0041】
R3およびR4における上記炭素数1〜4のアルキル基としては、メチル基、エチル基、プロピル基、ブチル基などが挙げられ;電子供与性基における上記炭素数1〜10のアルキル基としては、前記例示のアルキル基に加えて、ペンチル基、ヘキシル基、ヘプチル基、オクチル基、ノニル基、デシル基などが挙げられ;R4における上記炭素数1〜4のフ
ルオロアルキル基としては、トリフルオロメチル基などが挙げられる。
【0042】
R5における上記炭化水素基としては、炭素数1〜4のアルキル基、炭素数6〜20の
アリール基などが挙げられる。前記炭素数1〜4のアルキル基としては、メチル基、エチル基、プロピル基、ブチル基などが挙げられ;前記炭素数6〜20のアリール基としては、フェニル基、ナフチル基などが挙げられる。
【0043】
式(1)中、n=2であることが好ましい。この場合、R1はメチレン基または炭素数
2〜20の直鎖状または分岐状のアルキレン基であることが好ましい。このようなアルキレン基としては、エチレン基、プロピレン基、ブチレン基、ペンチレン基、ヘキシレン基、オクチレン基などが挙げられる。
【0044】
式(1)中、複数あるR2のうち少なくとも2つは、合成の容易さ、および脱離性能に
優れることを鑑みると、−CH2OCOR4であって、かつR4が炭素数1〜4のアルキル
基であることが好ましい。
【0045】
架橋剤(B)を用いることで、低誘電率、低吸水性および耐熱性を有する化合物(A)の特性を維持しつつ、感放射線性に優れ、低温で熱処理可能な樹脂組成物が得られる。
【0046】
架橋剤(B)の中でも、下記一般式(B1)で表される架橋剤(以下「架橋剤(B1)」ともいう。)が特に好ましい。
【0047】
【化4】

【0048】
式(B1)中、R1〜R6はそれぞれ独立に水素原子、アセチル基、炭素数1〜4のアルキル基、トリフルオロアセチル基またはR−SO2−で表される基(Rは炭素数1〜4の
アルキル基、炭素数6〜20のアリール基などの炭化水素基を示す。)を示し、R1〜R6から選択される2つ以上がアセチル基であることが好ましく、R1〜R6の全てがアセチル基であることがより好ましい。R1〜R6は酸触媒の存在下において、例えばR1OH〜R6OHとなって脱離する。pKa値を比較すると、スルホン酸(−1.2程度)<トリフルオロ酢酸(−0.25程度)<酢酸(5程度)<水<メタノール(15.5程度)である。これらの中では、入手の容易さ、および脱離性能に優れることを鑑みると、酢酸が好ましい。すなわち、R1〜R6がアセチル基である架橋剤(B1)は、入手が容易であるとともに、架橋性に優れる。
【0049】
また、式(B1)中、R7〜R10はそれぞれ独立に水素原子または電子供与性基を示し
、R7〜R10から選択される1つ以上が電子供与性基であることが好ましい。R7〜R10から選択される1つ以上が電子供与性基の場合、それらの基に直結するベンゼン環の電子密度が増大し、例えば、R1OH(例:酢酸)が脱離した後のベンジルカチオンの安定化(
ベンジルカチオンの寿命の増大)が可能となるため、架橋反応の効率が向上する。
【0050】
なお、本発明において電子供与性基とは、化合物の特定の位置について、電子密度を増加させる効果を持つ基のことであり、例えば、アルキル基、ハロゲン原子、アルコキシ基、アルキルチオ基、アミノ基が挙げられる。
【0051】
式(B1)中、電子供与性基は、炭素数1〜10のアルキル基であることが好ましい。電子供与性基が炭素数1〜10のアルキル基であると、架橋剤(B1)同士で自己縮合する部位が減少または消滅するため、架橋剤(B1)同士の重合を阻止できる。このため、架橋剤(B1)を用いた場合、少ない架橋剤配合量で、パターン形成能に優れた樹脂組成物が得られ、また耐熱性などに優れたパターンが得られる。
【0052】
また、式(B1)中、R11はメチレン基または炭素数2〜20の直鎖状もしくは分岐状のアルキレン基を示す。このようにR11としてメチレン基またはアルキレン基を導入することにより、以下の理由により架橋剤としての性能が向上する。
【0053】
(a)架橋剤(B1)自体のモビリティーの増加につながり、例えばR1OH(例:酢
酸)として脱離した後のベンジルカチオンが動きやすいため、架橋反応の効率が向上する。(b)架橋剤(B1)自体が長いため、重合体(化合物(A))の分子鎖が離れていても効果的な架橋反応が可能である(分子長が小さい架橋剤と比べて、架橋剤の配合量を低減できる)。(c)柔軟なアルキル鎖(アルキレン基)および回転性のあるエーテル結合の存在により、樹脂膜の低反り性の向上が期待できる。(d)架橋後の重合体(化合物(A))のクラック発生を抑制できる。
【0054】
また、架橋剤(B1)は、ベンゼン環に結合したエーテル結合(Ar−O−R11)を有する。エーテル結合は電子供与性基として働き、例えばR1OH(例:酢酸)が脱離した
後のベンジルカチオンの安定化(ベンジルカチオンの寿命の増大)が可能となるため、架橋反応の効率が向上する。また、ベンゼン環同士がエーテル結合を介して結合しているため、分子内回転が容易であり、架橋剤自体のモビリティーが向上し、架橋反応の効率が向上する。
【0055】
式(B1)中、上記炭素数1〜4のアルキル基としては、メチル基、エチル基、プロピル基、ブチル基などが挙げられ;上記炭素数1〜10のアルキル基としては、前記例示のアルキル基に加えて、ペンチル基、ヘキシル基、ヘプチル基、オクチル基、ノニル基、デシル基などが挙げられ;上記炭素数2〜20の直鎖状または分岐状のアルキレン基としては、エチレン基、プロピレン基、ブチレン基、ペンチレン基、ヘキシレン基などが挙げられる。
【0056】
−架橋剤(B)と重合体(化合物(A))との架橋反応のメカニズムについて−
以下、架橋反応のメカニズムを、架橋剤(B1)を例にとって説明する。
【0057】
【化5】

【0058】
酸発生剤(C)由来の酸(H+)が架橋剤(B1)の酸素(非共有電子対)部位と反応
し、R3OH(例:酢酸)が脱離する。続いて、生成したベンジルカチオンと、例えば、
上記反応式中において、ポリフェニレンエーテル(A)のベンゼン環(π電子雲)やフェノール性水酸基を有する重合体(B)のフェノール性水酸基(酸素の不対電子対)やベンゼン環(π電子雲)との親電子反応が進行する。架橋剤(B1)においては、このように反応しうる酸素部位が2つ以上ある(例:−OR3、−OR4など)ため、架橋反応が可能となる。
【0059】
本発明の樹脂組成物において、架橋剤(B)の含有量は、化合物(A)100重量部に対して、通常は1〜100重量部、好ましくは2〜50重量部、特に好ましくは5〜40重量部である。架橋剤(B)の含有量が前記範囲にあると、感光性と、低誘電率・低吸水性・耐熱性とのバランスに優れる。架橋剤(B)の含有量が前記範囲を下回ると露光による硬化が不充分になるため、パターニングが困難になったり、得られる硬化物の耐熱性が低下する場合があり、前記範囲を上回ると解像性が低下する場合がある。
【0060】
−架橋剤(B)の製造方法−
次に、架橋剤(B)の製造方法を、架橋剤(B1)の製造方法を例にとって説明する。その他の架橋剤(B)も、下記方法に準じて製造することができる。架橋剤(B1)は、例えば、以下の2つの方法により製造することができる。
【0061】
《第1の方法(ルート1)》
架橋剤(B1)を製造する第1の方法は、工程i:下記式(1a)で表されるフェノール化合物と下記式(1b)で表されるハロゲン含有化合物とを反応させることにより、下記式(1c)で表される化合物を製造する工程、工程ii:下記式(1c)で表される化合物と下記式(1d)で表されるハロゲン含有化合物とを反応させることにより、下記式(1e)で表される化合物を製造する工程、工程iii:下記式(1e)で表される化合物と
下記式(1f)で表されるアルカリ金属化合物とを反応させることにより、下記式(1g)で表される化合物を製造する工程を含む。
【0062】
第1の方法によれば、架橋剤(B1)を比較的高収率で製造することができる。
【0063】
−工程i−
工程iは、下記式(1a)で表されるフェノール化合物と下記式(1b)で表されるハロゲン含有化合物とを反応させることにより、下記式(1c)で表される化合物を製造する工程である。
【0064】
【化6】

【0065】
式(1a)中、複数あるRAはそれぞれ独立に水素原子または電子供与性基(例:アルキ
ル基、ハロゲン原子、アルコキシ基、アルキルチオ基、アミノ基)を示し、少なくとも1つが電子供与性基であることが好ましく、少なくとも1つが炭素数1〜10のアルキル基であることがより好ましい。具体的には、3,5−ジメチルフェノール、3,5−ジメトキシフェノールなどが挙げられる。
【0066】
【化7】

【0067】
式(1b)中、R11はメチレン基または炭素数2〜20の直鎖状もしくは分岐状のアルキレン基を示す。Xはフッ素原子、塩素原子または臭素原子を示す。具体的には、1,6−ジブロモへキサン、1,7−ジブロモヘプタン、1,10−ジブロモデカン、1,7−ジクロロヘプタン、1,8−ジクロロオクタンなどが挙げられる。
【0068】
【化8】

【0069】
式(1c)中、複数あるRAはそれぞれ独立に水素原子または電子供与性基を示し、少な
くとも1つが電子供与性基であることが好ましく、少なくとも1つが炭素数1〜10のアルキル基であることがより好ましい。R11は上記式(1b)中のR11と同義である。
【0070】
工程iにおいて、反応に供される上記式(1a)で表されるフェノール化合物と上記式(1b)で表されるハロゲン含有化合物とのモル比(1a/1b)は、収率の観点から、通常は1〜10、好ましくは2〜5である。
【0071】
工程iにおいて、フェノキシドイオンの求核種形成用の塩基触媒として、炭酸ナトリウム、炭酸カリウムなどの炭酸塩;水酸化ナトリウム、水酸化カリウムなどのアルカリ金属水酸化物などを用いることが好ましい。塩基触媒の使用量は、上記式(1a)で表されるフェノール化合物1モルに対して、通常は1〜10モル、好ましくは1〜3モルである。
【0072】
工程iにおいて、溶媒を用いることができる。前記溶媒としては、上記式(1a)または式(1b)で表される化合物と反応せず、また反応温度条件で安定である溶媒であれば、特に制限無く用いることができる。具体的には、N,N−ジメチルホルミアミド、N,N−ジメチルアセトアミド、N−メチル−2−ピロリドン、1,3−ジメチル−2−イミダゾリジノンなどが挙げられる。反応溶液中の上記式(1a)で表されるフェノール化合物と上記式(1b)で表されるハロゲン含有化合物との合計仕込み濃度は、収率の観点から、通常は5〜70重量%である。
【0073】
工程iにおいて、反応温度は通常0〜220℃、好ましくは23〜120℃であり、反応圧力は通常1〜100気圧、好ましくは大気圧であり、反応時間は通常0.1〜100時間、好ましくは1〜30時間である。また、工程iは不活性ガス雰囲気(例:窒素雰囲気やアルゴン雰囲気)下で実施することが好ましい。
【0074】
工程iにおいて得られた上記式(1c)で表される化合物は、例えば、反応溶液に対して通常の精製作業(再沈殿、抽出、洗浄、乾燥、濾過、濃縮、結晶化など)を行うことにより、単離して、次工程iiで用いることができる。
【0075】
−工程ii−
工程iiは、上記式(1c)で表される化合物と下記式(1d)で表されるハロゲン含有化合物とを反応させることにより、下記式(1e)で表される化合物を製造する工程である。
【0076】
【化9】

【0077】
式(1d)中、RBは炭素数1〜10のアルキル基を示し、Xはフッ素原子、塩素原子ま
たは臭素原子を示す。具体的には、クロロメチルメチルエーテルなどが挙げられる。
【0078】
【化10】

【0079】
式(1e)中、RAおよびR11はそれぞれ上記式(1c)中のRAおよびR11と同義であり、Xは上記式(1d)中のXと同義である。複数あるRAは相互に同一でも異なってもよ
く、複数あるXは相互に同一でも異なってもよい。
【0080】
工程iiにおいて、反応に供される上記式(1c)で表される化合物と上記式(1d)で表されるハロゲン含有化合物とのモル比(1d/1c)は、収率の観点から、通常は6〜100、好ましくは6〜30である。
【0081】
工程iiにおいて、触媒としてSnCl4、SnBr4などの金属ハロゲン化物を用いることが好ましい。触媒の使用量は、上記式(1d)で表される化合物に対して、通常は等量(モル基準)以上である。
【0082】
工程iiにおいて、溶媒を用いることができる。前記溶媒としては、上記式(1c)または式(1d)で表される化合物と反応せず、また反応温度条件で安定である溶媒であれば、特に制限無く用いることができ、上記金属ハロゲン化物を溶解できる溶媒であればより好ましい。具体的には、ジクロロメタン、クロロホルム、四塩化炭素などが挙げられる。前記溶媒は脱水して用いることが好ましい。反応溶液中の上記式(1c)で表される化合物と上記式(1d)で表されるハロゲン含有化合物との合計仕込み濃度は、収率の観点から、通常は1〜50重量%、好ましくは1〜20重量%である。
【0083】
工程iiにおいて、反応温度は通常−30〜50℃、好ましくは−15〜35℃であり、反応圧力は通常は大気圧であり、反応時間は通常0.1〜100時間、好ましくは1〜10時間である。また、工程iiは不活性ガス雰囲気(例:窒素雰囲気、アルゴン雰囲気)下で実施することが好ましい。また、前記不活性ガスは水分を含まない方が好ましい。
【0084】
工程iiにおいて得られた上記式(1e)で表される化合物は、例えば、反応溶液に対して通常の精製作業を行うことにより、単離して、次工程iiiで用いることができる。
【0085】
−工程iii−
工程iiiは、上記式(1e)で表される化合物と下記式(1f)で表されるアルカリ金
属化合物とを反応させることにより、下記式(1g)で表される化合物を製造する工程である。
【0086】
【化11】

【0087】
式(1f)中、RCは水素原子、アセチル基、炭素数1〜4のアルキル基、トリフルオロ
アセチル基またはR−SO2−で表される基(Rは炭素数1〜4のアルキル基、炭素数6
〜20のアリール基などの炭化水素基を示す。)を示し、アセチル基であることが好ましい。Mはリチウム、ナトリウムまたはカリウムを示す。具体的には、酢酸ナトリウム、酢酸カリウムなどが挙げられる。
【0088】
【化12】

【0089】
式(1g)中、RAおよびR11はそれぞれ上記式(1c)中のRAおよびR11と同義である。RCは上記式(1f)中のRCと同義である。複数あるRAは相互に同一でも異なっても
よく、複数あるRAから選択される1つ以上が電子供与性基であることが好ましく、複数
あるRAから選択される1つ以上が炭素数1〜10のアルキル基であることがより好まし
い。複数あるRCは相互に同一でも異なってもよく、複数あるRCから選択される2つ以上がアセチル基であることが好ましく、複数あるRCの全てがアセチル基であることがより
好ましい。
【0090】
工程iiiにおいて、反応に供される上記式(1e)で表される化合物と上記式(1f)
で表されるアルカリ金属化合物とのモル比(1f/1e)は、収率の観点から、通常は6〜50、好ましくは6〜30である。
【0091】
工程iiiにおいて、溶媒を用いることができる。前記溶媒としては、上記式(1e)ま
たは式(1f)で表される化合物と反応せず、また反応温度条件で安定である溶媒であれば、特に制限無く用いることができる。具体的には、酢酸、プロピオン酸、アセトニトリルなどが挙げられる。反応溶液中の上記式(1e)で表される化合物と上記式(1f)で表されるアルカリ金属化合物との合計仕込み濃度は、収率の観点から、通常は0.1〜20重量%、好ましくは1〜10重量%である。
【0092】
工程iiiは還流条件で行うことが好ましいが、上記式(1e)または式(1f)で表さ
れる化合物の種類によっては、還流条件よりも低い温度で行うこともできる。反応圧力は通常1〜100気圧、好ましくは大気圧であり、反応時間は通常0.1〜200時間、好ましくは1〜50時間である。また、工程iiiは不活性ガス雰囲気(例:窒素雰囲気、ア
ルゴン雰囲気)下で実施することが好ましい。また、前記不活性ガスは水分を含まない方が好ましい。
【0093】
工程iiiにおいて得られた上記式(1g)で表される化合物は、例えば、反応溶液に対
して通常の精製作業を行うことにより、単離すればよい。このようにして、最終的に架橋剤(B1)が得られる。
【0094】
なお、RCが水素原子である化合物を得る場合は、RCがアセチル基である化合物から、還元剤(例えば、LiAlH4)などを用いて還元することにより得ることもできる。
【0095】
また、RCがアルキル基である化合物を得る場合は、以下の2種類の手法も挙げられる
。一つは、上記RCが水素原子である化合物を少量の硫酸などの酸触媒存在下、アルコー
ルを還流することにより高収率でRcがアルキル基である化合物を合成する方法である。
もう一つは、上記RCが水素原子である化合物を塩化水素や塩化臭素でハロゲン化した後
、ハロゲン化された化合物とアルカリ金属のアルコキシド化合物(例:ナトリウムメトキシド)とをアルコール中、室温で反応させることにより比較的高収率でRcがアルキル基
である化合物を合成する方法である。
【0096】
《第2の方法(ルート2)》
架橋剤(B1)を製造する第2の方法は、工程I:上記式(1a)で表されるフェノール化合物と、1,3,5−トリオキサン、ホルムアルデヒドおよびパラホルムアルデヒドから選択される少なくとも1種と、ハロゲン化水素酸(例:フッ酸、塩酸、臭化水素酸)とを反応させることにより、下記式(2a)で表される化合物を製造する工程、工程II:下記式(2a)で表される化合物と上記式(1f)で表されるアルカリ金属化合物とを反応させることにより、下記式(2b)で表される化合物を製造する工程、工程III:下記
式(2b)で表される化合物と上記式(1b)で表されるハロゲン含有化合物とを反応させることにより、上記式(1g)で表される化合物を製造する工程を含む。
【0097】
第2の方法によれば、比較的安価な原料化合物を使用し、かつ重金属化合物を使用することなく、架橋剤(B1)を比較的高収率で製造することができる。
【0098】
−工程I−
工程Iは、上記式(1a)で表されるフェノール化合物と、1,3,5−トリオキサン、ホルムアルデヒドおよびパラホルムアルデヒドから選択される少なくとも1種と、ハロゲン化水素酸とを反応させることにより、下記式(2a)で表される化合物を製造する工程である。
【0099】
【化13】

【0100】
式(2a)中、RAは上記式(1a)中のRAと同義である。複数あるRAは相互に同一で
も異なってもよい。Xはフッ素原子、塩素原子または臭素原子を示す。
【0101】
工程Iにおいて、1,3,5−トリオキサンを用いる場合、反応に供される上記式(1a)で表されるフェノール化合物と1,3,5−トリオキサンとのモル比(トリオキサン/1a)は、収率の観点から、通常は1〜20、好ましくは1〜5である。また、上記式(1a)で表されるフェノール化合物とハロゲン化水素酸とのモル比(ハロゲン化水素酸/1a)は、収率の観点から、通常は3〜100、好ましくは3〜30である。
【0102】
工程Iにおいて、溶媒を用いることができる。前記溶媒としては、上記式(1a)で表されるフェノール化合物や1,3,5−トリオキサン、ホルムアルデヒド、パラホルムアルデヒドなどと反応せず、また反応温度条件で安定である溶媒であれば、特に制限無く用いることができる。特に、極性の高い有機溶媒を好適に用いることができる。具体的には、N,N−ジメチルアセトアミド、N,N−ジメチルホルムアミド、酢酸、プロピオン酸などが挙げられる。反応溶液中の上記式(1a)で表されるフェノール化合物と1,3,5―トリオキサン、ホルムアルデヒドおよびパラホルムアルデヒドから選択される少なく
とも1種との合計仕込み濃度は、収率の観点から、通常は1〜80重量%、好ましくは5〜30重量%である。
【0103】
工程Iにおいて、反応温度は通常−20〜220℃、好ましくは23〜120℃であり、反応圧力は通常1〜100気圧、好ましくは大気圧であり、反応時間は通常0.1〜100時間、好ましくは1〜5時間である。
【0104】
工程Iにおいて得られた上記式(2a)で表される化合物は、例えば、反応溶液に対して通常の精製作業を行うことにより、単離して、次工程IIで用いることができる。
【0105】
−工程II−
工程IIは、上記式(2a)で表される化合物と上記式(1f)で表されるアルカリ金属化合物とを反応させることにより、下記式(2b)で表される化合物を製造する工程である。
【0106】
【化14】

【0107】
式(2b)中、RCは上記式(1f)中のRCと同義である。複数あるRCは相互に同一で
も異なってもよい。
【0108】
工程IIにおいて、反応に供される上記式(2a)で表される化合物と上記式(1f)で表されるアルカリ金属化合物とのモル比(1f/2a)は、収率の観点から、通常は3〜50、好ましくは3〜12である。
【0109】
工程IIにおいて、溶媒を用いることができる。前記溶媒としては、上記式(2a)または(1f)で表される化合物と反応せず、また反応温度条件で安定である溶媒であれば、特に制限無く用いることができる。具体的には、アセトニトリル、酢酸、プロピオン酸などが挙げられる。反応溶液中の上記式(2a)で表される化合物と上記式(1f)で表されるアルカリ金属化合物との合計仕込み濃度は、収率の観点から、通常は1〜80重量%、好ましくは5〜40重量%である。
【0110】
工程IIは還流条件で行えばよく、反応温度は通常40〜140℃、好ましくは60〜140℃であり、反応圧力は通常1〜100気圧、好ましくは大気圧であり、反応時間は通常0.1〜100時間、好ましくは1〜50時間である。
【0111】
工程IIにおいて得られた上記式(2b)で表される化合物は、例えば、反応溶液に対して通常の精製作業を行うことにより、単離して、次工程IIIで用いることができる。
【0112】
−工程III−
工程IIIは、上記式(2b)で表される化合物と上記式(1b)で表されるハロゲン含
有化合物とを反応させることにより、上記式(1g)で表される化合物を製造する工程である。
【0113】
工程IIIにおいて、反応に供される上記式(2b)で表される化合物と上記式(1b)
で表されるハロゲン含有化合物とのモル比(2b/1b)は、収率の観点から、通常は2〜10、好ましくは2〜4である。
【0114】
工程IIIにおいて、フェノキシドイオンの求核種形成用の塩基触媒として、炭酸カリウ
ム、炭酸ナトリウムなどのアルカリ金属の炭酸塩;水酸化ナトリウム、水酸化カリウムなどのアルカリ金属水酸化物などを用いてもよい。塩基触媒の使用量は、上記式(2b)で表される化合物1モルに対して、通常は1〜10モル、好ましくは1〜3モルである。
【0115】
工程IIIにおいて、溶媒を用いることができる。前記溶媒としては、上記式(2b)ま
たは(1b)で表される化合物と反応せず、また反応温度条件で安定である溶媒であれば、特に制限無く用いることができる。具体的には、N,N−ジメチルアセトアミド、N−ジメチルホルムアミド、N−メチル−2−ピロリドン、1,3−ジメチル−2−イミダゾリジノンなどが挙げられる。反応溶液中の上記式(2b)で表される化合物と上記式(1b)で表されるハロゲン含有化合物との合計仕込み濃度は、収率の観点から、通常は1〜80重量%、好ましくは5〜40重量%である。
【0116】
工程IIIにおいて、反応温度は通常0〜220℃、好ましくは23〜120℃であり、
反応圧力は通常1〜100気圧、好ましくは大気圧であり、反応時間は通常0.1〜100時間、好ましくは1〜30時間である。
【0117】
工程IIIにおいて得られた上記式(1g)で表される化合物は、例えば、反応溶液に対
して通常の精製作業を行うことにより、単離すればよい。このようにして、最終的に架橋剤(B1)が得られる。
【0118】
《酸発生剤(C)》
本発明の樹脂組成物は、酸発生剤(C)を含有する。酸発生剤(C)は特に限定されないが、放射線の照射により酸を発生する化合物である、感放射線性酸発生剤が好ましい。この酸の触媒作用により架橋剤(B)中の−CH2OH、−CH2OR3、−CH2OCOR4および−CH2OSO2R5から選択される基と化合物(A)とがアルコール脱離などを伴って反応する。これにより、本発明の樹脂組成物を用いると、ネガ型のパターンを形成することができる。
【0119】
<感放射線性酸発生剤>
感放射線性酸発生剤は、放射線(例:紫外線)の照射により酸を発生する化合物である。感放射線性酸発生剤は放射線の照射により酸を発生する化合物であれば特に限定されないが、オニウム塩化合物、ハロゲン含有化合物、ジアゾケトン化合物、スルホン化合物、スルホン酸化合物、スルホンイミド化合物、ジアゾメタン化合物、ナフタレン核またはアントラセン核を有する酸発生剤などが挙げられる。これらの中では、熱処理後の耐熱性の観点から、ナフタレン核またはアントラセン核を有する酸発生剤が好ましい。
【0120】
ナフタレン核を有する酸発生剤としては、下記式で表される化合物が挙げられる。
【0121】
【化15】

【0122】
アントラセン核を有する酸発生剤としては、下記式で表される化合物が挙げられる。
【0123】
【化16】

【0124】
【化17】

【0125】
本発明の樹脂組成物において、酸発生剤(C)の含有量は、該樹脂組成物の感度・解像度・パターン形状などを確保する観点から、化合物(A)100重量部に対して、通常は1〜100重量部、好ましくは2〜30重量部、特に好ましくは5〜20重量部である。酸発生剤(C)の含有量が前記範囲を下回ると硬化が不充分になるため耐熱性が低下する恐れがあり、前記範囲を上回ると露光光に対する透明性が低下するためパターン形状の劣化を招く恐れがある。
【0126】
《溶媒》
本発明の樹脂組成物は、その取扱い性を向上させたり、粘度や保存安定性を調節するために、溶媒を含有してもよい。前記溶媒としては、有機溶媒を用いることができる。
【0127】
上記有機溶媒としては、エチレングリコールモノメチルエーテルアセテート、エチレングリコールモノエチルエーテルアセテートなどのエチレングリコールモノアルキルエーテルアセテート類;プロピレングリコールモノメチルエーテル、プロピレングリコールモノエチルエーテル、プロピレングリコールモノプロピルエーテル、プロピレングリコールモノブチルエーテルなどのプロピレングリコールモノアルキルエーテル類;プロピレングリコールジメチルエーテル、プロピレングリコールジエチルエーテル、プロピレングリコールジプロピルエーテル、プロピレングリコールジブチルエーテルなどのプロピレングリコールジアルキルエーテル類;プロピレングリコールモノメチルエーテルアセテート、プロピレングリコールモノエチルエーテルアセテート、プロピレングリコールモノプロピルエーテルアセテート、プロピレングリコールモノブチルエーテルアセテートなどのプロピレングリコールモノアルキルエーテルアセテート類;エチルセロソルブ、ブチルセロソルブなどのセロソルブ類;ブチルカルビトールなどのカルビトール類;
乳酸メチル、乳酸エチル、乳酸n−プロピル、乳酸イソプロピルなどの乳酸エステル類;酢酸エチル、酢酸n−プロピル、酢酸イソプロピル、酢酸n−ブチル、酢酸イソブチル、酢酸n−アミル、酢酸イソアミル、プロピオン酸イソプロピル、プロピオン酸n−ブチル、プロピオン酸イソブチルなどの脂肪族カルボン酸エステル類;3−メトキシプロピオン酸メチル、3−メトキシプロピオン酸エチル、3−エトキシプロピオン酸メチル、3−エトキシプロピオン酸エチル、ピルビン酸メチル、ピルビン酸エチルなどの他のエステル類;
トルエン、キシレンなどの芳香族炭化水素類;2−ヘプタノン、3−ヘプタノン、4−ヘプタノン、シクロヘキサノンなどのケトン類;N−メチルピロリドン、N−メチルホルムアミド、N−メチルアセトアミド、N,N−ジメチルホルムアミド、N,N−ジメチルアセトアミドなどのアミド類;γ−ブチロラクンなどのラクトン類;トリクロロメタン、テトラクロロエタン、クロロベンゼンなどが挙げられる。
【0128】
これらの有機溶媒は、1種単独あるいは2種以上を混合して使用することもできる。
【0129】
これらの中では、ジェー・ブランドラップ、イー・エイチ・イマーグート著『ポリマー
ハンドブック 第3版』ウイリー インターサイエンス 1989 pVII-379〜407など
に記載されているポリフェニレンエーテルなどを溶解する有機溶媒が好ましい。例えばポリ(2,6−ジメチル−1,4−フェニレンエーテル)を溶かす有機溶媒としては、トルエン、トリクロロメタン、テトラクロロエタン、クロロベンゼンなどが挙げられる。
【0130】
上記溶媒の使用量は、樹脂組成物の用途や塗布方法に応じて適宜選択され、樹脂組成物を均一な状態にすることができれば特に制限されるものではない。上記溶媒を使用する場合、溶媒の含有量は、樹脂組成物100重量%に対して、通常は10〜97重量%、好ましくは35〜95重量%である。溶媒の含有量が前記範囲にあると、化合物(A)の溶解性が良好となり、また樹脂組成物の膜形成性が良好となる。
【0131】
《その他の成分》
本発明の樹脂組成物は、酸発生剤(C)の酸発生効率を高めるために、必要に応じて各種増感剤を含有してもよい。また、界面活性剤、接着助剤、高分子添加剤、反応性希釈剤、レベリング剤、濡れ性改良剤、可塑剤、酸化防止剤、帯電防止剤、防カビ剤、調湿剤、難燃剤などを含有してもよい。
【0132】
《樹脂組成物の調製方法》
本発明の樹脂組成物は、所定量の上記各成分を、ディゾルバー、ホモジナイザー、3本ロールミルなどの分散機を用いて分散・混合することにより調製できる。また必要に応じて、メッシュメンブランフィルターなどを用いて、樹脂組成物を濾過してもよい。
【0133】
本発明の樹脂組成物は、例えばネガ型感放射線性樹脂組成物または感光性絶縁樹脂組成物として用いることができ、感放射線性(現像性、感度、解像度などで評価される)に優れ、低温で熱処理可能である。また、その硬化物は、低誘電率、低吸水性および耐熱性(ガラス転移温度、熱重量減少温度などで評価される)に優れている。従って、本発明の樹脂組成物は、半導体素子において、多層回路基板のソルダーレジスト用や微細配線形成用材料などとして好適に使用することができる。
【0134】
〔パターンの製造方法〕
本発明の樹脂組成物の用途として、パターンの製造方法について説明する。本発明のパターンの製造方法は、[1]上述の樹脂組成物を基板上に塗布して塗膜を形成する工程(塗布工程)、[2]前記塗膜を露光する工程(露光工程)、および[3]露光後の前記塗膜を現像してパターンを形成する工程(現像工程)を有する。さらに、現像工程[3]に続いて、[4]前記パターンを熱処理する工程(熱処理工程)を有することが好ましい。
【0135】
[1]塗布工程
塗布工程では、本発明の樹脂組成物を、最終的に得られる硬化膜(パターン)の膜厚が例えば0.1〜100μmとなるように、基板上に塗布する。これをオーブンやホットプレートを用いて、例えば温度:50〜140℃、時間:10〜240秒で乾燥して溶媒を除去する。これをプリベーク(PB)と呼ぶ。このようにして基板上に塗膜を形成する。
【0136】
基板としては、シリコンウエハー、化合物半導体ウエハー、金属薄膜付きウエハー、ガラス基板、石英基板、セラミックス基板、アルミ基板などが挙げられ;塗布方法としては、ディッピング法、スプレー法、バーコート法、ロールコート法、スピンコート法、カーテンコート法、グラビア印刷法、シルクスクリーン法、インクジェット法などが挙げられる。
【0137】
[2]露光工程
露光工程では、マスクを介して、コンタクトアライナーやステッパーを用いて放射線による露光を上記塗膜に対して行う。放射線としては、X線、電子線、紫外線、可視光線などが利用できるが、波長200〜500nmの光を用いることが好ましく、i線(365nm)を用いることが特に好ましい。露光機としては、通常はコンタクトアライナーやステッパーが使用される。この後、放射線感度の向上などの目的で、任意の温度、時間の組合せ(例えば、温度:40〜250℃、時間:10〜420秒)による露光後ベーク(PEB)を施す。
【0138】
[3]現像工程
現像工程では、非露光部を現像液で溶解除去し、所望のパターンを得る。現像方法としては、スプレー、パドル、ディップまたは超音波などの方式が可能である。本発明の樹脂組成物により形成された膜を現像するために用いられる現像液は、ジェー・ブランドラップ、イー・エイチ・イマーグート著『ポリマーハンドブック 第3版』ウイリー インターサイエンス 1989pVII-379〜407などに記載されており、上記に溶媒として例示したものと同一のものが好ましく使用できる。また、化合物(A)としてフェノール性水酸基を有する重合体を用いた場合には、アルカリ現像液を用いることが好ましい。前記アルカリ現像液としては、水酸化ナトリウム、水酸化カリウム、アンモニア水、テトラメチルアンモニウムヒドロキシド、コリンなどのアルカリ性化合物を濃度が0.1〜10重量%程度となるように水に溶解させた水溶液が挙げられる。
【0139】
その後、任意に、現像によって形成したパターンをリンス液により洗浄し、現像液を除去してもよい。リンス液としては、蒸留水、メタノール、エタノール、イソプロパノール、プロピレングリコールモノメチルエーテルアセテート、プロピレングリコールモノメチルエーテルなどを単独または混合して用いる。
【0140】
[4]熱処理工程
熱処理工程では、得られたパターンを温度:180〜400℃(好ましくは180〜250℃)、時間:10〜600分で加熱して、硬化パターンを得る。このような加熱硬化反応は、ホットプレート、イナートオーブン、温度プログラムを設定できる昇温式オーブンなどを用いて行うことができる。加熱硬化させる際の雰囲気気体としては空気を用いてもよく、不活性ガス(例:窒素、アルゴン)を用いてもよい。
【0141】
〔硬化膜、半導体素子〕
本発明の硬化膜は、上述の樹脂組成物から得られ、低誘電率、低吸水性および耐熱性(ガラス転移温度、熱重量減少温度などで評価される)に優れる。硬化膜は、例えば上述のパターンの製造方法によって得ることができる。硬化膜の膜厚は、通常は0.1〜100μm、好ましくは0.1〜30μm、より好ましくは5〜30μmである。
【0142】
本発明の半導体素子は、上述の硬化膜を有する。半導体素子は、上述の硬化膜をシリコンウエハーなどの基板上に形成された保護膜やパッケージの絶縁膜として使用することにより、容易に製造することができる。
【実施例】
【0143】
以下、実施例をもとに本発明をさらに詳細に説明するが、本発明はこれら実施例に何ら限定されない。なお、以下の実施例および比較例において、特に断らない限り、「部」および「%」はそれぞれ「重量部」および「重量%」の意味で用いる。
【0144】
〔重合体の分子量測定〕
重合体の重量平均分子量(Mw)、数平均分子量(Mn)の測定条件は下記のとおり。
GPC測定装置:JASCO GULLIVER1500
カラム:ポリスチレンゲル(Pigel 5mm MIXED-CT)
展開液:トリクロロメタン
流速:1.0mL/分
標準サンプル:ポリスチレン
〔合成例1〕下記式(b1)で表される架橋剤の合成(ルート1)
以下の工程(i)〜(iii)を実施することにより、ヘキサ−1,6−イレンビス[オ
キシ−(2,4,6−トリス(アセチルオキシメチル)−3,5−ジメチルベンゼン)](以下「架橋剤b1」または「HOAD」ともいう。)を合成した。
【0145】
【化18】

【0146】
(i)ヘキサ−1,6−イレンビス(オキシ−3,5−ジメチルベンゼン)(以下「HOD」ともいう。)の合成:3,5−ジメチルフェノール(5.00g、40.9mmol)および1
,6−ジブロモへキサン(4.65g、19.0mmol)をN,N−ジメチルホルムアミド(DMF
、35mL)に溶解させた溶液に、K2CO3(99.5%、8.53g、61.4mmol)を加えた。この溶液を、窒素雰囲気下、80℃で18時間攪拌した。この反応溶液を室温まで冷却し、蒸留水(500mL)に注ぎ、明黄褐色の固体を得た。この固体を濾別し、蒸留水で洗浄した。生成物
を、n−ヘキサンを用いて再結晶し、さらに真空乾燥し、5.53gの白色固体を得た(収率89%)。
【0147】
得られた白色固体の分析結果を以下に示す。融点:69.4〜70.3℃。赤外吸収スペクトル
(cm-1、KBr法): 3014-2854 (CH3, -CH2-), 1589 (Ar), 1463, 1427 and 1390 (CH3, -CH2-), 1294 and 1076 (-O-)。1H NMR (CDCl3, δ, ppm): 1.50-1.55 (m, 4H, -CH2-), 1.75-1.85 (m, 4H, -CH2-), 2.28 (s, 12H, -CH3), 3.91-3.95 (t, 4H, -CH2O-), 6.53 (s, 4H, Ar), 6.58 (s, 2H, Ar)。元素分析 (C22H30O2): 理論値: C, 80.94; H, 9.26, 測定
値: C, 81.22; H, 9.18。以上の結果から、生成物がHODであることを確認した。
【0148】
【化19】

【0149】
(ii)ヘキサ−1,6−イレンビス[オキシ−(2,4,6−トリス(クロロメチル)−3,5−ジメチルベンゼン)](以下「HOCD」ともいう。)の合成:HOD(0.500g、1.53mmol)およびクロロメチルメチルエーテル(2.22g、2.07mL、27.6mmol)を脱水
ジクロロメタン(15mL)に溶解させた溶液を、SnCl4(7.19g、3.23mL、27.6mmol)を脱水ジクロロメタン(5mL)に溶解させた溶液に、窒素雰囲気下、氷浴(0〜5℃)で冷却しな
がら15分かけて滴下した。この反応溶液を氷浴で冷却しながら1時間攪拌し、さらに室温で7時間攪拌した。その後、未反応のSnCl4を水(100mL)で除去した。この溶液の有機層をジクロロメタンで抽出する作業を水洗とともに3回繰り返した。この有機層を蒸留水で洗浄し、硫酸マグネシウムで乾燥した。硫酸マグネシウムを濾別し、真空下で有機層を濃縮した。得られた粗生成物をシリカゲルカラムクロマトグラフィー(抽出液:ジクロロメタン)で精製し、0.730gの白色固体を得た(収率77%)。
【0150】
得られた白色固体の分析結果を以下に示す。融点:198.8〜199.5℃。赤外吸収スペクトル (cm-1、KBr法): 2921-2856 (CH3, -CH2-), 1571 (Ar), 1452 and 1384 (CH3, -CH2-),
1255 and 1087 (-O-)。1H NMR (CDCl3, δ, ppm): 1.64-1.73 (m, 4H, -CH2-), 1.94-2.03 (m, 4H, -CH2-), 2.51 (s, 12H, -CH3), 4.07-4.10 (t, 4H, -OCH2-), 4.68 (s, 4H, -CH2Cl), 4.74 (s, 8H, -CH2Cl)。元素分析 (C28H36Cl6O2): 理論値: C, 54.48; H, 5.88, 測定値: C, 54.25; H, 5.76。以上の結果から、生成物がHOCDであることを確認し
た。
【0151】
【化20】

【0152】
(iii)ヘキサ−1,6−イレンビス[オキシ−(2,4,6−トリス(アセチルオキ
シメチル)−3,5−ジメチルベンゼン)](HOAD)の合成:HOCD(0.500g、0.810mmol)およびCH3COONa(98.5%、0.81g、9.72mmol)を酢酸(AcOH、35mL)に溶解させた溶液を、窒素雰囲気下、33時間還流した。この反応溶液を室温まで冷却し、蒸留水(300mL)に注ぎ、白色固体を得た。この白色固体を濾別し、蒸留水で洗浄した。得られた
生成物を酢酸エチル/n−ヘキサン(体積比7/11)を用いて再結晶し、さらに真空乾燥し、0.570gの固体を得た(収率93%)。
【0153】
最終的に得られた固体の分析結果を以下に示す。融点:163.8〜164.5℃。赤外吸収スペクトル (cm-1、KBr法): 2931-2866 (CH3, -CH2-), 1736 (C=O), 1442 (CH3, -CH2-), 1381 (CH3), 1246 and 1026 (-O-)。1H NMR (CDCl3, δ, ppm): 1.51-1.55 (m, 4H, -CH2-),
1.80-1.89 (m, 4H, -CH2-), 2.05 (s, 12H, CH3), 2.09 (s, 6H, CH3), 2.36 (s, 12H, CH3), 3.76-3.80 (t, 4H, -OCH2-), 5.22 (s, 12H, -OCH2-)。元素分析 (C40H54O14): 理論値: C, 63.31; H, 7.17, 測定値: C, 63.31; H, 7.10。以上の分析結果から、生成物がHOADであることを確認した。
【0154】
【化21】

【0155】
〔合成例2〕架橋剤BR1の合成
下記式(BR1)で表される1,3,5−トリス(アセトキシメチル)−2,4,6−トリメチルベンゼン(以下「架橋剤BR1」または「TAB」ともいう。)は、以下のようにして合成した。
【0156】
【化22】

【0157】
(1)1,3,5−トリス(クロロメチル)−2,4,6−トリメチルベンゼン(以下「TCB」ともいう。)の合成:1,3,5−トリメチルベンゼン(1g、1.15mL、8.32mmol)およびクロロメチルメチルエーテル(6.03g、5.64mL、74.9mmol)を脱水ジクロロメ
タン(10mL)に溶解させた溶液に、SnCl4(19.5g、8.77mL、74.9mmol)を脱水ジクロロメタン(10mL)に溶解させた溶液を、窒素雰囲気下、氷浴(0〜5℃)で冷却しながら20分かけて滴下した。この反応溶液を氷浴で冷却しながら1時間攪拌し、さらに室温で5時間攪拌した。その後、未反応のSnCl4を水(100mL)で除去した。この溶液の有機層をジクロロメタンで抽出する作業を水洗とともに3回繰り返した。この有機層を蒸留水で洗浄し、硫酸マグネシウムで乾燥した。硫酸マグネシウムを濾別し、真空下で有機層を濃縮した。得られた粗生成物をカラムクロマトグラフィー(抽出液:ジクロロメタン)で精製し、2.08gの白色固体を得た(収率94%)。
【0158】
得られた白色固体の分析結果を以下に示す。融点:175.5〜176.0℃。赤外吸収スペクトル (cm-1、KBr法): 2990-2894 (CH3, -CH2-), 1567 (Ar), 1446 and 1379 (CH3, -CH2-),
1253 (-CH2Cl)。1H NMR (CDCl3, δ, ppm): 2.51 (s, 9H, -CH3), 4.70 (s, 6H, -CH2Cl)。元素分析 (C12H15Cl3): 理論値 C, 54.26; H, 5.69, 測定値: C, 54.20; H, 5.64。以上の結果から、生成物がTCBであることを確認した。
【0159】
(2)1,3,5−トリス(アセトキシメチル)−2,4,6−トリメチルベンゼン(TAB)の合成:TCB(1.49g、5.60mmol)およびCH3COONa(98.5%、3.03g、36.4mmol)を酢酸(50mL)に溶解させた溶液を、窒素雰囲気下、20時間還流した。この反応溶液を室温まで冷却し、蒸留水(300mL)に注ぎ、白色固体を得た。この白色固体を濾別し、
蒸留水で洗浄した。得られた生成物を酢酸エチル/n−ヘキサン(体積比1/7)を用いて
再結晶し、真空乾燥し、1.86gの白色針状固体を得た(収率99%)。
【0160】
最終的に得られた白色針状固体の分析結果を以下に示す。融点:155.0〜155.5℃。赤外吸収スペクトル (cm-1、KBr法): 2992-2931 (CH3, -CH2-), 1728 (C=O), 1581 (Ar), 1442 and 1377 (CH3, -CH2-), 1241 and 1034 (-O-)。1H NMR (CDCl3, δ, ppm): 2.07 (s, 9H, -COCH3), 2.40 (s, 9H, -CH3), 5.25 (s, 6H, -CH2OC=O)。元素分析 (C18H24O6): 理論値; C, 64.27; H, 7.19, 測定値: C, 64.41; H, 7.09。以上の結果から、生成物がT
ABであることを確認した。
【0161】
〔合成例3〕架橋剤BR2の合成
下記式(BR2)で表される4,4’−メチレンビス[2,6−ビス(メトキシメチル)]フェノール(以下「架橋剤BR2」または「MBMP」ともいう。)は、Journal of Polymer Science:Part A:Polymer chemistry、2008,46,4949−4958と同様の手法により合成した。
【0162】
【化23】

【0163】
[実施例1]
表1に示すとおり、化合物A1:83部、架橋剤b1:10部、酸発生剤C1:7部を、固形分濃度が6.5%となるよう溶媒D1に混合して、樹脂組成物を調製した。
【0164】
[実施例2〜5および比較例1〜3]
表1に示す組成の樹脂組成物を調製したこと以外は実施例1と同様に行った。
【0165】
【表1】

【0166】
表1中の各成分の詳細は以下のとおりである。
・化合物A1:ポリ(2,6−ジメチル−1,4−フェニレンエーテル)。シグマアルドリッチジャパン株式会社より購入したものを使用した。化合物A1のMwおよびMnは、それぞれ31500および11600であった。
・架橋剤b1:合成例1で得られた化合物(HOAD)
・架橋剤BR1:合成例2で得られた化合物(TAB)
・架橋剤BR2:合成例3で得られた化合物(MBMP)
・架橋剤BR3:ヘキサメチロールメラミン(CYMEL)
(三井サイアナミド製、商品名「サイメル303」)
・酸発生剤C1:ジフェニルヨードニウム−9,10−ジメトキシアントラセン−2−スルフォナート(略称「DIAS」、シグマアルドリッチジャパン株式会社製、下記式で表される化合物)
【0167】
【化24】

【0168】
・溶媒D1:1,1,2,2−テトラクロロエタン
〔評価1〕
上記実施例1および比較例1〜3で得られた樹脂組成物をスピンコーター(ミカサ社製「1H−D7」)にて4インチシリコンウエハーにスピンコートし、ホットプレートにて空気中でプリベーク(PB)を80℃で30秒間行い、膜厚2.4μmの塗膜を形成した。なお、膜厚はフィルム膜厚測定装置(Veeco Instruments Inc. 社製「Dektak3system」)にて測定した。
【0169】
i線(365nm)の露光波長を有するコンタクト露光機(ミカサ社製 マスクアライメント装置「M−1s」)を用いて、テストパターン付きマスクを通して、上記塗膜を300mJ/cm2の露光量で露光した。ウエハーに対して、ホットプレートにて露光後ベ
ーク(PEB)を190℃で300秒間行った。次に、ウエハーを25℃のトルエンに浸漬および静置して、現像を1秒間行った。
【0170】
ウエハーの現像前後の厚みを測定してDissolution rate(膜の溶解速度(Å/s))を計算した。図1は、横軸:架橋剤種に対して縦軸:Dissolution rateをプロットしたグラフである(□が露光なし、◆が露光あり)。
【0171】
本発明の樹脂組成物(HOAD含有)と他の樹脂組成物(TAB、MBMP、CYMEL含有)との感光性能の比較を行った。その結果、本発明の樹脂組成物(HOAD含有)によれば効果的に未露光部・露光部の溶解速度差(12000倍程度)を得ることができ、他
の樹脂組成物より優れた性能を示した。
【0172】
また、走査型電子顕微鏡(SEM、(株)テクネックス工房製「Tiny-SEM」)により、実施例1で得られた樹脂組成物からなる、ウエハー上に形成されたパターンは、6μm/6μmのライン/スペースパターンまで解像していることがわかった。SEM画像を図2に示す。
【0173】
〔評価2〕PEB温度依存性
上記実施例1および比較例3で得られた樹脂組成物をスピンコーター(ミカサ社製「1H−D7」)にて4インチシリコンウエハーにスピンコートし、ホットプレートにて空気中でプリベーク(PB)を80℃で30秒間行い、膜厚1.2μmの塗膜を形成した。なお、膜厚はフィルム膜厚測定装置(Veeco Instruments Inc. 社製「Dektak3system」)にて測定した。
【0174】
i線(365nm)の露光波長を有するコンタクト露光機(ミカサ社製 マスクアライメント装置「M−1s」)を用いて、テストパターン付きマスクを通して、上記塗膜を300mJ/cm2の露光量で露光した。ウエハーに対して、ホットプレートにて露光後ベ
ーク(PEB)を160〜200℃(実施例1)または150〜190℃(比較例3)で300秒間行った。次に、ウエハーを25℃のトルエンに浸漬および静置して、現像を1秒間行った。
【0175】
ウエハーの現像前後の厚みを測定してDissolution rate(膜の溶解速度(Å/s))を計算した。図3(実施例1)および図4(比較例3)は、横軸:PEB温度に対して縦軸:Dissolution rateをプロットしたグラフである(□が露光なし、◆が露光あり)。その結果、実施例1で得られた樹脂組成物を用いた場合、この条件では190℃以上でPEBを行えば、未露光部と露光部との溶解速度の比率が12000倍以上となることを確認できた。
【0176】
〔評価3〕PEB時間依存性
上記実施例1で得られた樹脂組成物をスピンコーター(ミカサ社製「1H−D7」)にて4インチシリコンウエハーにスピンコートし、ホットプレートにて空気中でプリベーク(PB)を80℃で30秒間行い、膜厚1.2μmの塗膜を形成した。なお、膜厚はフィルム膜厚測定装置(Veeco Instruments Inc. 社製「Dektak3system」)にて測定した。
【0177】
i線(365nm)の露光波長を有するコンタクト露光機(ミカサ社製 マスクアライメント装置「M−1s」)を用いて、テストパターン付きマスクを通して、上記塗膜を300mJ/cm2の露光量で露光した。ウエハーに対して、ホットプレートにて露光後ベ
ーク(PEB)を190℃で0〜7分間行った。次に、ウエハーを25℃のトルエンに浸漬および静置して、現像を1秒間行った。
【0178】
ウエハーの現像前後の厚みを測定してDissolution rate(膜の溶解速度(Å/s))を計算した。図5は、横軸:PEB時間に対して縦軸:Dissolution rateをプロットしたグラフである(□が露光なし、◆が露光あり)。その結果、この条件ではPEBを5分間以上行えば、未露光部と露光部との溶解速度の比率が12000倍以上となることを確認できた。
【0179】
〔評価4〕DIAS含有量依存性
上記実施例1〜3で得られた樹脂組成物を用い、膜厚1.2μmの塗膜を形成したこと以外は評価1と同様に行った。図6は、横軸:実施例2,1,3の樹脂組成物に対して縦軸:Dissolution rateをプロットしたグラフである(□が露光なし、◆が露光あり)。その結果、この条件では樹脂組成物における固形分換算でのDIAS含有量が7重量%以上であれば、未露光部と露光部との溶解速度の比率が特に良好となることを確認した。
【0180】
〔評価5〕HOAD含有量依存性
上記実施例1,4〜5で得られた樹脂組成物を用い、膜厚1.2μmの塗膜を形成したこと以外は評価1と同様に行った。図7は、横軸:実施例4,1,5の樹脂組成物に対して縦軸:Dissolution rateをプロットしたグラフである(□が露光なし、◆が露光あり)。その結果、この条件では樹脂組成物におけるHOAD含有量が10重量%以上であれば、未露光部と露光部との溶解速度の比率が特に良好となることを確認した。
【0181】
〔評価6〕感度評価
上記実施例1で得られた樹脂組成物を用い、膜厚1.2μmの塗膜を形成し、種々の露光量で露光を行ったこと以外は評価1と同様に行った。図8は、横軸:露光量(Exposure
dose)に対して縦軸:相対膜厚(Normalized film thickness)をプロットしたグラフである。相対膜厚は、(現像後の膜厚/現像前の膜厚)×100(%)で求められる。その結果、D0.5(相対膜厚が50%になる露光量)は43mJ/cm2、γ0.5(相対膜厚が
50%である点でのグラフの接線の傾き)は11であり、本発明の樹脂組成物は感度およびコントラストに優れていることを確認した。
【0182】
〔評価7〕
ポリフェニレンエーテル(化合物A1)から得られる硬化物と実施例1の樹脂組成物から得られる硬化物との、耐熱性、吸水性および比誘電率の評価を、以下のようにして行った。
【0183】
シリコンウエハー上に実施例1の樹脂組成物を塗布し、窒素雰囲気下、220℃で1時間熱処理することにより厚さ30μmの硬化物(硬化物A)を得た。同様の手法にて、ポリフェニレンエーテル8重量%と1,1,2,2−テトラクロロエタン92重量%とを含有する樹脂組成物から、厚さ31μmの硬化物(硬化物B)を得た。
【0184】
硬化物Aおよび硬化物Bについて以下の手法にて、耐熱性(ガラス転移温度、10%重量減少温度)、吸水性および比誘電率の評価を行った。結果を表2に示す。
【0185】
−耐熱性−
DSC測定装置(Seiko製 型式:EXSTAR 6000 TG/DTA 6300)を用い、昇温速度:10℃/分、窒素雰囲気下の条件で、硬化物のガラス転移温度および10%重量減少温度の測定を行った。
【0186】
−吸水率−
上記硬化物を水中に25℃・6時間の条件で浸漬した。その後、硬化物を取り出し、ティッシュペーパーで表面に付着した水分を拭き取り、硬化物の重量を微量天秤で測定した。吸水率は下記式から算出した。
【0187】
吸水率(重量%)=(Wa−Wb)/Wb×100
Waは浸漬後の硬化物の重量を、Wbは浸漬前の硬化物の重量を示す。
【0188】
−比誘電率−
プリズムカプラー(メトリコン社製「PC−2000」、波長1320nm、室温)にて硬化物の屈折率を測定し、硬化物の1MHzにおける比誘電率を下記式にて算出した。
【0189】
ε(比誘電率)=[n(屈折率)]2
【0190】
【表2】

【0191】
300℃まで昇温したが、硬化物Aのガラス転移温度は測定されず、高い耐熱性を示した。また、硬化物Aの10%重量減少温度は硬化物Bのそれと比較して45℃程度低いものの、約400℃と充分高い耐熱性を示した。硬化物Aの吸水率は硬化物Bのそれと同様に0.05%以下であった。硬化物Aは、硬化物Bが本来有する低誘電率を維持していた。従って、本発明の樹脂組成物は、ポリフェニレンエーテルの低誘電性を損ねることなくパターニングできることが判明した。
【特許請求の範囲】
【請求項1】
(A)芳香族環を有する、比誘電率が5以下の化合物と、
(B)下記一般式(1)で表される架橋剤と、
(C)酸発生剤と
を含有する樹脂組成物。
【化1】

[式(1)中、R1は炭素数1〜40のn価の炭化水素基を示し、nは1〜4の整数を示
し、複数あるR2はそれぞれ独立に水素原子、−CH2OH、−CH2OR3(R3は炭素数
1〜4のアルキル基を示す。)、−CH2OCOR4(R4は炭素数1〜4のアルキル基ま
たはフルオロアルキル基を示す。)、−CH2OSO2R5(R5は炭化水素基を示す。)または電子供与性基を示す。但し、複数あるR2のうち少なくとも2つは、−CH2OH、−CH2OR3、−CH2OCOR4および−CH2OSO2R5から選択される基である。]
【請求項2】
前記化合物(A)が、ポリフェニレンエーテルである請求項1に記載の樹脂組成物。
【請求項3】
前記架橋剤(B)において、n=2であり、かつR1がメチレン基または炭素数2〜2
0の直鎖状もしくは分岐状のアルキレン基である請求項1または2に記載の樹脂組成物。
【請求項4】
前記架橋剤(B)において、複数あるR2のうち少なくとも2つが−CH2OCOR4で
あって、かつR4が炭素数1〜4のアルキル基である請求項1〜3の何れか一項に記載の
樹脂組成物。
【請求項5】
前記架橋剤(B)において、前記電子供与性基が、炭素数1〜10のアルキル基である請求項1〜4の何れか一項に記載の樹脂組成物。
【請求項6】
前記酸発生剤(C)が、感放射線性酸発生剤である請求項1〜5の何れか一項に記載の樹脂組成物。
【請求項7】
[1]請求項1〜6の何れか一項に記載の樹脂組成物を基板上に塗布して塗膜を形成する工程、[2]前記塗膜を露光する工程、および[3]露光後の前記塗膜を現像してパターンを形成する工程を有するパターンの製造方法。
【請求項8】
前記工程[3]に続いて、さらに[4]前記パターンを熱処理する工程を有する請求項7に記載のパターンの製造方法。
【請求項9】
請求項7または8に記載のパターンの製造方法によって得られる硬化膜。
【請求項10】
請求項1〜6の何れか一項に記載の樹脂組成物から得られる硬化膜。
【請求項11】
請求項10に記載の硬化膜を有する半導体素子。
【請求項1】
(A)芳香族環を有する、比誘電率が5以下の化合物と、
(B)下記一般式(1)で表される架橋剤と、
(C)酸発生剤と
を含有する樹脂組成物。
【化1】

[式(1)中、R1は炭素数1〜40のn価の炭化水素基を示し、nは1〜4の整数を示
し、複数あるR2はそれぞれ独立に水素原子、−CH2OH、−CH2OR3(R3は炭素数
1〜4のアルキル基を示す。)、−CH2OCOR4(R4は炭素数1〜4のアルキル基ま
たはフルオロアルキル基を示す。)、−CH2OSO2R5(R5は炭化水素基を示す。)または電子供与性基を示す。但し、複数あるR2のうち少なくとも2つは、−CH2OH、−CH2OR3、−CH2OCOR4および−CH2OSO2R5から選択される基である。]
【請求項2】
前記化合物(A)が、ポリフェニレンエーテルである請求項1に記載の樹脂組成物。
【請求項3】
前記架橋剤(B)において、n=2であり、かつR1がメチレン基または炭素数2〜2
0の直鎖状もしくは分岐状のアルキレン基である請求項1または2に記載の樹脂組成物。
【請求項4】
前記架橋剤(B)において、複数あるR2のうち少なくとも2つが−CH2OCOR4で
あって、かつR4が炭素数1〜4のアルキル基である請求項1〜3の何れか一項に記載の
樹脂組成物。
【請求項5】
前記架橋剤(B)において、前記電子供与性基が、炭素数1〜10のアルキル基である請求項1〜4の何れか一項に記載の樹脂組成物。
【請求項6】
前記酸発生剤(C)が、感放射線性酸発生剤である請求項1〜5の何れか一項に記載の樹脂組成物。
【請求項7】
[1]請求項1〜6の何れか一項に記載の樹脂組成物を基板上に塗布して塗膜を形成する工程、[2]前記塗膜を露光する工程、および[3]露光後の前記塗膜を現像してパターンを形成する工程を有するパターンの製造方法。
【請求項8】
前記工程[3]に続いて、さらに[4]前記パターンを熱処理する工程を有する請求項7に記載のパターンの製造方法。
【請求項9】
請求項7または8に記載のパターンの製造方法によって得られる硬化膜。
【請求項10】
請求項1〜6の何れか一項に記載の樹脂組成物から得られる硬化膜。
【請求項11】
請求項10に記載の硬化膜を有する半導体素子。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【公開番号】特開2011−84626(P2011−84626A)
【公開日】平成23年4月28日(2011.4.28)
【国際特許分類】
【出願番号】特願2009−237422(P2009−237422)
【出願日】平成21年10月14日(2009.10.14)
【出願人】(000004178)JSR株式会社 (3,320)
【Fターム(参考)】
【公開日】平成23年4月28日(2011.4.28)
【国際特許分類】
【出願日】平成21年10月14日(2009.10.14)
【出願人】(000004178)JSR株式会社 (3,320)
【Fターム(参考)】
[ Back to top ]

