機能性物質包含微粒子を用いたバイオセンシング方法
【課題】本発明は、機能性物質包含微粒子を用いた新規なバイオセンシング方法を提供する。
【解決手段】本発明によれば、ポリマー微粒子の内部に機能性物質を封入する工程と、前記ポリマー微粒子の表面にリガンドを固定化する工程と、前記リガンドを介して前記ポリマー微粒子とターゲットを結合させる工程と、前記ターゲットに結合した前記ポリマー微粒子から前記機能性物質を溶出させる工程と、溶出した前記機能性物質の物性を定量的に測定する工程とを含み、前記物性の測定結果に基づいて前記ターゲットを定量化することを特徴とするバイオセンシング方法が提供される。本発明の方法によれば、これまでバイオセンシングにおいて利用することができなかった機能性物質をマーカーとして利用することが可能になる。
【解決手段】本発明によれば、ポリマー微粒子の内部に機能性物質を封入する工程と、前記ポリマー微粒子の表面にリガンドを固定化する工程と、前記リガンドを介して前記ポリマー微粒子とターゲットを結合させる工程と、前記ターゲットに結合した前記ポリマー微粒子から前記機能性物質を溶出させる工程と、溶出した前記機能性物質の物性を定量的に測定する工程とを含み、前記物性の測定結果に基づいて前記ターゲットを定量化することを特徴とするバイオセンシング方法が提供される。本発明の方法によれば、これまでバイオセンシングにおいて利用することができなかった機能性物質をマーカーとして利用することが可能になる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、バイオセンシング方法に関し、より詳細には、ポリマー微粒子を用いたバイオセンシング方法に関する。
【背景技術】
【0002】
現在、広く利用されている生体分子検出法の1つに、ELISA(Enzyme-Linked ImmunoSorbent Assay)法がある。ELISA法においては、目的タンパク質(抗原)に対して酵素で標識された抗体を作用させた後、当該酵素と発光試薬の反応による発光を光学的に測定することによって目的タンパク質を検出する。しかしながら、ELISA法に代表される従来のバイオアッセイは、シグナル検出までに多くの工程(時間)を要していた。
【0003】
この点につき、特開2008−127454号公報(特許文献1)は、磁性粒子を被覆するポリマー層に蛍光物質を封入することによって、蛍光標識としての機能と磁気応答性とを併せ持つ多機能型ポリマー磁性粒子を開示する。さらに、国際公開第2009/072457号(特許文献2)は、そのような蛍光物質含有ポリマー磁性粒子の表面に抗体を固定化し、これを反応場に向けて強制的に磁気誘導することによって抗体抗原反応を促進するとともに、未反応抗体を迅速に磁気回収することによって、シグナルを検出するまでに要する時間を大幅に短縮する方法を開示する。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特開2008−127454号公報(特許文献1)
【特許文献2】国際公開第2009/072457号(特許文献2)
【発明の概要】
【発明が解決しようとする課題】
【0005】
ただし、蛍光物質含有ポリマー磁性粒子を使用する従来のスキームにおいては、ポリマー層にある蛍光を測定することを前提とするため、一定以上の蛍光強度を有する蛍光物質を封入する必要があり、加えて、ポリマー内部に共存する磁性粒子(フェライト)の影響についても考慮しなければならなかった。
【0006】
これらの事情から、これまでは、ポリマー層にある蛍光物質として、フェライトによって吸収されない波長で励起され、高い強度で蛍光発光する希土類金属錯体(例えば、ユーロピウム錯体)を利用する以外に選択肢がなかったが、希土類金属錯体の励起光が紫外領域の際には、専用の紫外線照射装置が必須となり、装置コストが過大となる。
【課題を解決するための手段】
【0007】
本発明者らは、上記従来技術における課題について鋭意検討する中で、ポリマー層にある蛍光物質の蛍光を測定するという前提について今一度見直した結果、蛍光物質をポリマー磁性粒子から溶出させて直接的に定量する着想に至った。
【0008】
さらに、本発明者らは、上記着想をさらに発展させ、任意の測定系に対応した機能性物質が封入されたポリマー磁性粒子を用いる新規なバイオセンシング方法の構成に想到し、本発明に至ったのである。
【0009】
すなわち、本発明によれば、アフィニティ反応を利用したバイオセンシング方法であって、ポリマー微粒子の内部に機能性物質を封入する工程と、前記ポリマー微粒子の表面にリガンドを固定化する工程と、前記リガンドを介して前記ポリマー微粒子とターゲットを結合させる工程と、前記ターゲットに結合した前記ポリマー微粒子から前記機能性物質を溶出させる工程と、溶出した前記機能性物質の物性を定量的に測定する工程とを含み、前記物性の測定結果に基づいて前記ターゲットを定量化することを特徴とするバイオセンシング方法が提供される。
【図面の簡単な説明】
【0010】
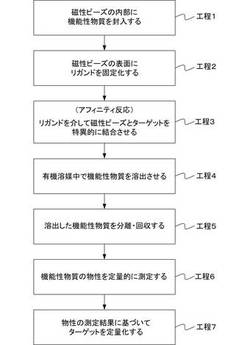
【図1】本発明のバイオセンシング方法の手順を示すフローチャート。
【図2】本発明のバイオセンシング方法の工程1および工程2を表す概念図。
【図3】本発明のバイオセンシング方法の工程3〜工程6を表す概念図。
【図4】前立腺特異抗原PSA濃度[ng/ml]と蛍光強度[cps]の関係を示す図。
【発明を実施するための形態】
【0011】
以下、本発明を図面に示した実施の形態をもって説明するが、本発明は、図面に示した実施の形態に限定されるものではない。なお、以下に参照する各図においては、共通する要素について同じ符号を用い、適宜、その説明を省略するものとする。
【0012】
図1は、本発明のバイオセンシング方法の手順を示すフローチャートであり、図2および図3は、各手順を概念的に表した図である。以下、図1〜図3に基づいて、本発明のバイオセンシング方法について説明する。
【0013】
(工程1)
工程1においては、まず、ナノサイズの粒径を持つポリマー微粒子を準備する。本発明では、溶液中の分散性に優れ、且つ、タンパク質に非特異的吸着しないポリマー微粒子を使用することが好ましい。さらに、本発明においては、内部にフェライトなどの磁性粒子を包含するポリマー微粒子を使用することが好ましい。以下、説明の便宜上、磁性粒子を包含するポリマー微粒子(以下、磁性ビーズとして参照する)を使用する実施形態をもって本発明を説明する。
【0014】
本発明の方法に使用する磁性ビーズは、例えば、本出願人が先に出願した特開2006−88131号公報に開示される下記の方法によって作製することができる。すなわち、フェライトに界面活性物質を吸着させて疎水化させた後、これにスチレンやグリシジルメタクリレート(GMA)などのラジカル付加重合が可能なモノマー液と非イオン性の親水基を有する界面活性剤とを加え、さらに適量の水を添加して混合し、ソニケーション処理等により乳化させる。このようにして調整された乳化液を60〜80℃に加熱したのち、親水性の開始剤を添加して乳化重合によりモノマーを重合させる。重合終了後、乳化粒子から界面活性剤を洗浄除去することにより、磁性ビーズの水懸濁液を得ることができる。
【0015】
なお、市販品で言えば、多摩川精機株式会社製のFGビーズ(フェライト粒子をポリGMAで被覆した粒径約200nmのポリマー磁性微粒子)を用いることができる。
【0016】
工程1においては、準備したポリマー磁性微粒子(以下、磁性ビーズとして参照する)のポリマー層に対して、以下の手順で機能性物質を封入する。本発明における機能性物質とは、定量的に測定可能な物性を持つ物質全般を意味する。
【0017】
磁性ビーズの水懸濁液を遠心分離して水を除去し、残ったペレットにメタノール等のアルコール性有機溶媒を加え分散させた後、遠心分離するという操作を数回繰り返す。こうして有機溶媒中で磁性ビーズのポリマー層を膨潤させる。続いて、膨潤した磁性ビーズを遠心分離して得られたペレットに対し、機能性物質の有機溶媒溶液を添加して分散させることで、磁性ビーズのポリマー層の内部に機能性物質が取り込まれる。なお、上記有機溶媒としてはアセトンを用いることが好ましい。
【0018】
ポリマー層への機能性物質の移行が飽和状態になった後、有機溶媒中に分散された磁性ビーズ懸濁液に対して、等量程度の純水を添加する。その後、この混合溶液から有機溶媒のみを蒸発除去すると、その内部から有機溶媒が除去され、機能性物質のみが封入された状態で磁性ビーズが収縮する。最終的に、機能性物質含有磁性ビーズが水中に分散した状態で得られる。
【0019】
(工程2)
工程2においては、機能性物質が封入されたリンカー導入済磁性ビーズの表面に対してリガンドを固定化する。本発明におけるリガンドとは、バイオセンシングに利用するアフィニティ反応において、標的分子(ターゲット)に特異的に相互作用することができる分子全般を意味する。なお、先に例示した多摩川精機株式会社製のFGビーズは、各種リンカーによって表面修飾された状態で販売されているので、このような磁性ビーズを用いれば、リンカー導入処理を省略することができる。
【0020】
(工程3)
工程3においては、標的分子(ターゲット)を含むバッファに対して、工程2でリガンドを固定化した機能性物質包含磁性ビーズを添加し、アフィニティ反応を起こさせる。図3は、本発明の方法を、抗原抗体反応を利用したサンドイッチイムノアッセイに適用した例を示す。
【0021】
機能性物質包含ビーズを用いたサンドイッチイムノアッセイの場合、抗原10(ターゲット)を含むバッファ内に抗原10に対する抗体12を固定した基板14を静置した後、当該バッファに対して、工程2でリガンドを固定化した機能性物質包含ビーズ16を添加する。この場合、機能性物質包含ビーズ16に固定化されるリガンドは抗原10に対する抗体17(抗体12とは別のエピトープを認識するもの)である。
【0022】
特に、機能性物質包含磁性ビーズを用いたサンドイッチイムノアッセイの場合、基板14の裏側に磁石20を配設し、バッファ内に磁界を発生させることで、機能性物質包含磁性ビーズ16は、抗体抗原反応の反応場となる基板14の表面近傍まで強制的に磁気誘導され、抗体12−抗原10−抗体17のサンドイッチ反応が迅速化される。その後、基板14をバッファで洗浄し、サンドイッチ反応に寄与しなかった機能性物質包含磁性ビーズ16を磁気回収すると、抗体17を介して抗原10(ターゲット)と特異的に結合した機能性物質包含磁性ビーズ16だけが基板14上に残る。
【0023】
以上、工程3について、サンドイッチイムノアッセイを例にとって説明してきたが、本発明の適用範囲は抗原抗体反応に限定されるものではなく、アフィニティ反応を利用するバイオセンシング全般に適用可能である。本発明におけるアフィニティ反応とは、上述した抗原抗体反応の他にも、核酸(DNAやRNAなど)の相補的結合、核酸とたんぱく質の特異的結合、シグナル伝達系に関わるタンパク質とその受容体タンパク質との結合やProtein A若しくはProtein Gと抗体のFc部位との結合のようなたんぱく質同士の特異的結合、酵素とその基質の特異的結合、ホルモン分子とその受容体の特異的結合、糖鎖とレクチンの特異的結合など、生体分子間(人工的に改変した生体分子との反応も含む)の特異的な反応を含み、さらに、アプタマー等を用いた人工抗体様分子と生体分子の特異的結合、薬剤若しくは薬剤候補物質と生体分子の特異的結合、アビジンとビオチンの特異的結合など、低分子化合物と生体分子(人工的に改変した生体分子との反応も含む)の間の特異的な反応を含む概念である。
【0024】
(工程4)
工程4においては、抗原10(ターゲット)に特異的に結合した機能性物質包含磁性ビーズ16に含まれる機能性物質18を溶出させる。図3に示す例の場合には、機能性物質包含磁性ビーズ16が結合した基板14を有機溶媒に浸漬し、振盪する。その結果、機能性物質包含磁性ビーズ16のポリマー層が膨潤し、内部に封入されていた機能性物質18が有機溶媒中に溶出される。
【0025】
(工程5)
工程5においては、機能性物質包含磁性ビーズ16から溶出した機能性物質18を分離・回収する。
【0026】
(工程6)
工程6においては、回収した機能性物質18の物性を適切な測定装置によって定量的に測定する。
【0027】
(工程7)
最後に、工程6における測定結果を「ターゲット量−物性値」の検量線に照らし合わせて抗原10(ターゲット)を定量する。上記検量線は、既知量のターゲットについて上述した工程3〜工程6の手順を実施した結果に基づいて事前に作成しておく。
【0028】
以上、本発明のバイオセンシング方法の手順について説明してきたが、ここで、磁性ビーズに封入する機能性物質について説明する。本発明における機能性物質は、磁性ビーズに封入することができる適切な物性を有し、且つ、定量的に測定可能な物性を持つ物質であればどのようなものであってもよく、本発明の方法は、機能性物質の種類に限定されるものではない。本発明における代表的な機能性物質として、蛍光発光の物性を持つ物質(蛍光物質)を挙げることができる。
【0029】
蛍光物質包含磁性ビーズを利用する従来のバイオセンシング法においては、ポリマー層を透過する蛍光を測定することが前提となっていたため、磁性ビーズに封入する蛍光物質の選択肢は、一定以上の高い蛍光強度を有するものに限定され、加えて、ポリマー内部に共存する磁性粒子(フェライト)によって吸収されない波長の蛍光を発光するものに限定されざるを得なかった。
【0030】
この点に関し、本発明の方法によれば、蛍光物質の選択肢の範囲は格段に広がる。すなわち、本発明では、磁性ビーズから取り出した蛍光物質の発光を直接測定するので、磁性粒子(フェライト)の影響を考慮する必要がなく、定量的な測定に必要十分な蛍光強度を有する物質であれば、如何なる蛍光物質でも使用することができる。具体的には、現在、一般的な蛍光測定装置で用いられているBODIPYなどを使用することが可能になる。
【0031】
なお、ターゲットに結合したリガンドの標識マーカーをバッファ内で検出するこれまでのスキームにおいては、標識マーカーの選択肢はある程度限られたものにならざるを得なかった。そのため、多くの場合、反応系に与える影響が少ない蛍光物質などを標識マーカーとして使用していたが、蛍光の消光などの影響を考慮して測定系を設計する必要があるため、その構成が複雑なものにならざるを得なかった。
【0032】
この点につき、本発明の方法によれば、任意の機能性物質を標識マーカーとして利用することが可能になり、これまでバイオセンシングにおいて利用されることのなかった導電性物質(物性として導電性を示す物質)などをマーカーとして利用することが可能となる。すなわち、本発明においては、磁性ビーズに対して導電性物質を封入してターゲットとアフィニティ反応を起こさせた後、磁性ビーズから溶出させた導電性物質の導電性(電流値)を測定することによって、ターゲットを定量化することができる。
【0033】
導電性物質は電気化学測定によって簡便に検出・定量化することができるため、蛍光物質などを利用する光学測定に比べれば、少ない手順と短い時間をもってアッセイ結果を得ることができる。また、導電性物質の導電性は蛍光物質の蛍光のように短時間に減衰する心配がないことから、高い精度をもって検出・測定することができる。
【0034】
さらに、電気化学測定に用いられるサイクリックボルタンメトリー(CV)装置は、蛍光測定装置に比べて小型且つ安価であり、CV測定システムを独自に開発する場合であっても、その開発コストは、蛍光などの光学測定を利用するシステムのそれに比べて格段に小さいとされている。したがって、本発明の方法において、導電性物質を採用することは、測定精度および経済面の両方において大きなメリットがあると言える。
【0035】
本発明において使用することができる導電性物質としては、フェロセン、テトラチアフルバレン(TTF)、テトラシアノキノジメタン(TCNQ)、金属錯体等を挙げることができる。
【0036】
さらに、本発明の方法に用いることができるその他の機能性物質としては、ポルフィリン、フルオレン、ペンタセン、カロチン等を挙げることができる。
【0037】
以上、本発明のバイオセンシング方法について、実施形態をもって説明してきたが、本発明は上述した実施形態に限定されるものではなく、その他、当業者が推考しうる実施態様の範囲内において、本発明の作用・効果を奏する限り、本発明の範囲に含まれるものである。
【実施例】
【0038】
以下、本発明のバイオセンシング方法について、実施例を用いてより具体的に説明を行なうが、本発明は、後述する実施例に限定されるものではない。
【0039】
(実施例1)
蛍光分子を封入した磁性ビーズを用いて既知量の前立腺特異抗原(PSA)を検出するサンドイッチイムノアッセイを実施した。
【0040】
(1)磁性ビーズへの蛍光分子の封入
磁性ビーズ(粒子径:約200nm、FGビーズ(COOHビーズ)、品番:TA8848 N1140、多摩川精機株式会社製)1.0 mgをメタノール(500 μl)、メタノール/アセトン=1/1(500 μl)、アセトン(500 μl)を順次用いて洗浄した後、蛍光分子であるDiIC18(5) solid (invitrogen製、D7757、以下Cy5として参照する)の10 mMアセトン溶液(100 μl)中に分散させた。
【0041】
上記分散液を室温にて1時間混合した後、これに超純水(900 μl)を加えてさらに混合したものを遠心分離(20℃、15,000 rpm、3分)した。その後、上澄みを除去したものに超純水(500 μl)を加えて磁性ビーズを分散させた後、遠心分離(20℃、15,000rpm、3分)するといった操作を3回繰り返した。その後、上澄みを除去し、0.1% Tween20含有50 mM HEPES溶液(500μl)を加えて磁性ビーズを分散させた後、遠心分離(20℃、15,000 rpm、3分)するといった操作を上澄みにCy5(青色)が視認できなくなるまで繰り返した。最終的に得られたCy5封入磁性ビーズを超純水(500 μl)に分散させ、4℃で保存した。
【0042】
(2)磁性ビーズ1個あたりのCy5の封入量の確認
予め、Cy5のアセトニトリル溶液を用いてCy5の量と吸光度に関する検量線を作成した。次に、上述した手順で作成したCy5封入磁性ビーズ1mgをアセトニトリル中に分散させて、磁性ビーズに封入された全てのCy5を溶出させた。具体的には、Cy5封入磁性ビーズ1mgをアセトン中に分散させてCy5を溶出させ、磁性ビーズを遠心分離後、上澄みを取るといった工程を、アセトニトリルを入れ替えて合計3回繰り返した。
【0043】
3回目に取得した上澄み液においてCy5が検出されなかったため、1、2回目の上澄み液を合わせた溶液についてCy5の吸光度を測定した。吸光度の測定値を上記検量線に照らした結果、磁性ビーズ1個あたり最大で105分子のCy5が封入されていることが分かった。
【0044】
(3)サンドイッチイムノアッセイの実施
上述した手順で作製したCy5封入磁性ビーズの表面に抗PSA抗体(Hytest製、5A6)を固定化し、これをアッセイバッファ(25 mM Tris-HCl [pH 8.0]、150 mM KCl、0.1% Tween20、1% skim milk)中に分散させて4℃で保存した。一方で、抗PSA抗体(Hytest製、1H12)を固定化した96穴マイクロプレートを用意し、アッセイバッファでブロッキング処理(4℃)した後、各ウェルに濃度[ng/ml](0、0.0006、0.006、0.6、6.0、20、60)のPSA溶液(30 μl)をセットした。続いてアッセイバッファ中に分散させた抗PSA抗体固定化Cy5封入磁性ビーズを1.0 μg(20 μl)投入した。プレートを振盪(4℃、1分)させた後、96穴対応磁気プレートをマイクロプレートの下部に置き、1分間静置した。その後、アッセイバッファ(100 μl)を用いてプレートを振盪(4℃、30秒)し、非特異的に吸着した磁性ビーズを洗浄・除去した。
【0045】
(4)蛍光分子の溶出および蛍光測定
96穴マイクロプレートにアセトニトリル(100 μl)を加えて振盪(室温、5分)し、Cy5封入磁性ビーズからCy5を溶出させて、その上澄み液をウェルごとに回収した。続いて回収した各上澄み液について蛍光強度を測定(PerkinElmer製、Wallac ARVO SX 1420)した。
【0046】
図4は、各ウェルにセットしたPSA溶液の濃度[ng/ml]と、サンドイッチイムノアッセイ後に当該ウェルから回収した上澄み液(Cy5のアセトニトリル溶液)について測定された蛍光強度[cps]の関係を示す。図4の結果から、本発明の方法によれば、0.06 ng/mlから6.0 ng/mlまでの濃度範囲でPSAを高精度に検出しうることが示された。
(実施例2)
【0047】
以下の手順で、磁性ポリマー粒子に対してフェロセンを封入した後、磁性ポリマー粒子からフェロセンを溶出させる実験を行った。
【0048】
(1)磁性ビーズへのフェロセンの封入
磁性ビーズ(粒子径:約200nm、FGビーズ(COOHビーズ)、品番:TA8848 N1140、多摩川精機株式会社製)1.0 mgをメタノール(500 μl)で2回、続いてアセトン(500 μl)で3回洗浄し、フェロセン (東京化成工業製、D0444)の100 mMアセトン溶液(60 μl)中に分散させた。
【0049】
上記分散液を40℃にて20分混合した後、磁性ビーズを遠心分離(20℃、15,000rpm、3分)した。上澄みを除去し、超純水(500 μl)を加えてビーズを分散させた後、遠心分離(20℃、15,000rpm、3分)した。その後、上澄みを除去し、0.3% Tween20含有50 mM HEPES溶液(500 μl)を加えて磁性ビーズを分散させた後、遠心分離(20℃、15,000rpm、3分)するといった操作を3回繰り返した。続いて上澄みを除去し、超純水(500 μl)を加えてビーズを分散させた後、遠心分離(20℃、15,000rpm、3分)するといった操作を3回繰り返した。最終的に得られたフェロセン封入磁性ビーズを超純水(500 μl)に分散させ、4℃で保存した。
【0050】
(2)磁性ビーズ1個あたりのフェロセンの封入量の確認
予め、フェロセンのアセトン溶液を用いてフェロセンの量と吸光度に関する検量線を作成した。次に、上述した手順で作成したフェロセン封入磁性ビーズ1mgをアセトン中に分散させて、磁性ビーズに封入された全てのフェロセンを溶出した。具体的には、フェロセン封入磁性ビーズ1mgをアセトン中に分散させてフェロセンを溶出させ、磁性ビーズを遠心分離後、上澄みを取るといった工程を、アセトンを入れ替えて合計4回繰り返した。
【0051】
4回目に取得した上澄み液においてフェロセンが検出されなかったため、1〜3回目の上澄み液を合わせた溶液についてフェロセンの吸光度を測定した。吸光度の測定値を上記検量線に照らした結果、ビーズ1mgあたり約6μmol(すなわち約1018分子((6x10-6)x(6x1023)=3.6x1018))のフェロセンがビーズに封入されていたことが分かった。ここで、フェロセン封入磁性ビーズ1mgが1011個のビーズに相当することから、磁性ビーズ1個あたりおよそ107分子のフェロセンが封入されていたことが分かった。
【0052】
(3)フェロセンの溶出およびCV測定
上述した手順で作成したフェロセン封入磁性ビーズ1mgを過塩素酸テトラブチルアンモニウムの0.1 Mアセトニトリル溶液に分散させた後、静置(室温、5分)してフェロセンを溶出させ、その後に磁性ビーズを遠心分離後、上澄みを取るといった工程を合計4回繰り返した。4回目に取得した上澄み液においてフェロセンが検出されなかったことから、1〜3回目の上澄み液を合わせた溶液をCV測定用サンプルとして得た。
【0053】
上述した手順で得たサンプルにつき、Modulab(東陽テクニカ製)を用いてCV測定を行った。なお、作用電極にはG0225白金マイクロ電極(10 μmφ、東陽テクニカ製)を、カウンター電極にはVC-3用白金カウンター電極(5 cm、BAS製)を、参照電極にはRE-7非水溶媒計参照電極(BAS製)をそれぞれ用いた。CV測定は10 mV/secの掃引速度で-0.5 V〜+0.5 Vの電圧範囲で2サイクル行った。
【0054】
過塩素酸テトラブチルアンモニウムの0.1 Mアセトニトリル溶液に溶解させたフェロセンのCV測定から、フェロセン濃度が1〜30 μMの範囲内で検量線を得た。1.0 μMのフェロセン溶液100 μlにおいて10-12Aの電流値が得られたことから、((1x10-6)x(100x10-6)x(6x1023)≒)1013分子のフェロセン≒10-12Aとなる。
【符号の説明】
【0055】
10…抗原
12…抗体
14…基板
16…機能性物質包含磁性ビーズ
17…抗体
18…機能性物質
20…磁石
【技術分野】
【0001】
本発明は、バイオセンシング方法に関し、より詳細には、ポリマー微粒子を用いたバイオセンシング方法に関する。
【背景技術】
【0002】
現在、広く利用されている生体分子検出法の1つに、ELISA(Enzyme-Linked ImmunoSorbent Assay)法がある。ELISA法においては、目的タンパク質(抗原)に対して酵素で標識された抗体を作用させた後、当該酵素と発光試薬の反応による発光を光学的に測定することによって目的タンパク質を検出する。しかしながら、ELISA法に代表される従来のバイオアッセイは、シグナル検出までに多くの工程(時間)を要していた。
【0003】
この点につき、特開2008−127454号公報(特許文献1)は、磁性粒子を被覆するポリマー層に蛍光物質を封入することによって、蛍光標識としての機能と磁気応答性とを併せ持つ多機能型ポリマー磁性粒子を開示する。さらに、国際公開第2009/072457号(特許文献2)は、そのような蛍光物質含有ポリマー磁性粒子の表面に抗体を固定化し、これを反応場に向けて強制的に磁気誘導することによって抗体抗原反応を促進するとともに、未反応抗体を迅速に磁気回収することによって、シグナルを検出するまでに要する時間を大幅に短縮する方法を開示する。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特開2008−127454号公報(特許文献1)
【特許文献2】国際公開第2009/072457号(特許文献2)
【発明の概要】
【発明が解決しようとする課題】
【0005】
ただし、蛍光物質含有ポリマー磁性粒子を使用する従来のスキームにおいては、ポリマー層にある蛍光を測定することを前提とするため、一定以上の蛍光強度を有する蛍光物質を封入する必要があり、加えて、ポリマー内部に共存する磁性粒子(フェライト)の影響についても考慮しなければならなかった。
【0006】
これらの事情から、これまでは、ポリマー層にある蛍光物質として、フェライトによって吸収されない波長で励起され、高い強度で蛍光発光する希土類金属錯体(例えば、ユーロピウム錯体)を利用する以外に選択肢がなかったが、希土類金属錯体の励起光が紫外領域の際には、専用の紫外線照射装置が必須となり、装置コストが過大となる。
【課題を解決するための手段】
【0007】
本発明者らは、上記従来技術における課題について鋭意検討する中で、ポリマー層にある蛍光物質の蛍光を測定するという前提について今一度見直した結果、蛍光物質をポリマー磁性粒子から溶出させて直接的に定量する着想に至った。
【0008】
さらに、本発明者らは、上記着想をさらに発展させ、任意の測定系に対応した機能性物質が封入されたポリマー磁性粒子を用いる新規なバイオセンシング方法の構成に想到し、本発明に至ったのである。
【0009】
すなわち、本発明によれば、アフィニティ反応を利用したバイオセンシング方法であって、ポリマー微粒子の内部に機能性物質を封入する工程と、前記ポリマー微粒子の表面にリガンドを固定化する工程と、前記リガンドを介して前記ポリマー微粒子とターゲットを結合させる工程と、前記ターゲットに結合した前記ポリマー微粒子から前記機能性物質を溶出させる工程と、溶出した前記機能性物質の物性を定量的に測定する工程とを含み、前記物性の測定結果に基づいて前記ターゲットを定量化することを特徴とするバイオセンシング方法が提供される。
【図面の簡単な説明】
【0010】
【図1】本発明のバイオセンシング方法の手順を示すフローチャート。
【図2】本発明のバイオセンシング方法の工程1および工程2を表す概念図。
【図3】本発明のバイオセンシング方法の工程3〜工程6を表す概念図。
【図4】前立腺特異抗原PSA濃度[ng/ml]と蛍光強度[cps]の関係を示す図。
【発明を実施するための形態】
【0011】
以下、本発明を図面に示した実施の形態をもって説明するが、本発明は、図面に示した実施の形態に限定されるものではない。なお、以下に参照する各図においては、共通する要素について同じ符号を用い、適宜、その説明を省略するものとする。
【0012】
図1は、本発明のバイオセンシング方法の手順を示すフローチャートであり、図2および図3は、各手順を概念的に表した図である。以下、図1〜図3に基づいて、本発明のバイオセンシング方法について説明する。
【0013】
(工程1)
工程1においては、まず、ナノサイズの粒径を持つポリマー微粒子を準備する。本発明では、溶液中の分散性に優れ、且つ、タンパク質に非特異的吸着しないポリマー微粒子を使用することが好ましい。さらに、本発明においては、内部にフェライトなどの磁性粒子を包含するポリマー微粒子を使用することが好ましい。以下、説明の便宜上、磁性粒子を包含するポリマー微粒子(以下、磁性ビーズとして参照する)を使用する実施形態をもって本発明を説明する。
【0014】
本発明の方法に使用する磁性ビーズは、例えば、本出願人が先に出願した特開2006−88131号公報に開示される下記の方法によって作製することができる。すなわち、フェライトに界面活性物質を吸着させて疎水化させた後、これにスチレンやグリシジルメタクリレート(GMA)などのラジカル付加重合が可能なモノマー液と非イオン性の親水基を有する界面活性剤とを加え、さらに適量の水を添加して混合し、ソニケーション処理等により乳化させる。このようにして調整された乳化液を60〜80℃に加熱したのち、親水性の開始剤を添加して乳化重合によりモノマーを重合させる。重合終了後、乳化粒子から界面活性剤を洗浄除去することにより、磁性ビーズの水懸濁液を得ることができる。
【0015】
なお、市販品で言えば、多摩川精機株式会社製のFGビーズ(フェライト粒子をポリGMAで被覆した粒径約200nmのポリマー磁性微粒子)を用いることができる。
【0016】
工程1においては、準備したポリマー磁性微粒子(以下、磁性ビーズとして参照する)のポリマー層に対して、以下の手順で機能性物質を封入する。本発明における機能性物質とは、定量的に測定可能な物性を持つ物質全般を意味する。
【0017】
磁性ビーズの水懸濁液を遠心分離して水を除去し、残ったペレットにメタノール等のアルコール性有機溶媒を加え分散させた後、遠心分離するという操作を数回繰り返す。こうして有機溶媒中で磁性ビーズのポリマー層を膨潤させる。続いて、膨潤した磁性ビーズを遠心分離して得られたペレットに対し、機能性物質の有機溶媒溶液を添加して分散させることで、磁性ビーズのポリマー層の内部に機能性物質が取り込まれる。なお、上記有機溶媒としてはアセトンを用いることが好ましい。
【0018】
ポリマー層への機能性物質の移行が飽和状態になった後、有機溶媒中に分散された磁性ビーズ懸濁液に対して、等量程度の純水を添加する。その後、この混合溶液から有機溶媒のみを蒸発除去すると、その内部から有機溶媒が除去され、機能性物質のみが封入された状態で磁性ビーズが収縮する。最終的に、機能性物質含有磁性ビーズが水中に分散した状態で得られる。
【0019】
(工程2)
工程2においては、機能性物質が封入されたリンカー導入済磁性ビーズの表面に対してリガンドを固定化する。本発明におけるリガンドとは、バイオセンシングに利用するアフィニティ反応において、標的分子(ターゲット)に特異的に相互作用することができる分子全般を意味する。なお、先に例示した多摩川精機株式会社製のFGビーズは、各種リンカーによって表面修飾された状態で販売されているので、このような磁性ビーズを用いれば、リンカー導入処理を省略することができる。
【0020】
(工程3)
工程3においては、標的分子(ターゲット)を含むバッファに対して、工程2でリガンドを固定化した機能性物質包含磁性ビーズを添加し、アフィニティ反応を起こさせる。図3は、本発明の方法を、抗原抗体反応を利用したサンドイッチイムノアッセイに適用した例を示す。
【0021】
機能性物質包含ビーズを用いたサンドイッチイムノアッセイの場合、抗原10(ターゲット)を含むバッファ内に抗原10に対する抗体12を固定した基板14を静置した後、当該バッファに対して、工程2でリガンドを固定化した機能性物質包含ビーズ16を添加する。この場合、機能性物質包含ビーズ16に固定化されるリガンドは抗原10に対する抗体17(抗体12とは別のエピトープを認識するもの)である。
【0022】
特に、機能性物質包含磁性ビーズを用いたサンドイッチイムノアッセイの場合、基板14の裏側に磁石20を配設し、バッファ内に磁界を発生させることで、機能性物質包含磁性ビーズ16は、抗体抗原反応の反応場となる基板14の表面近傍まで強制的に磁気誘導され、抗体12−抗原10−抗体17のサンドイッチ反応が迅速化される。その後、基板14をバッファで洗浄し、サンドイッチ反応に寄与しなかった機能性物質包含磁性ビーズ16を磁気回収すると、抗体17を介して抗原10(ターゲット)と特異的に結合した機能性物質包含磁性ビーズ16だけが基板14上に残る。
【0023】
以上、工程3について、サンドイッチイムノアッセイを例にとって説明してきたが、本発明の適用範囲は抗原抗体反応に限定されるものではなく、アフィニティ反応を利用するバイオセンシング全般に適用可能である。本発明におけるアフィニティ反応とは、上述した抗原抗体反応の他にも、核酸(DNAやRNAなど)の相補的結合、核酸とたんぱく質の特異的結合、シグナル伝達系に関わるタンパク質とその受容体タンパク質との結合やProtein A若しくはProtein Gと抗体のFc部位との結合のようなたんぱく質同士の特異的結合、酵素とその基質の特異的結合、ホルモン分子とその受容体の特異的結合、糖鎖とレクチンの特異的結合など、生体分子間(人工的に改変した生体分子との反応も含む)の特異的な反応を含み、さらに、アプタマー等を用いた人工抗体様分子と生体分子の特異的結合、薬剤若しくは薬剤候補物質と生体分子の特異的結合、アビジンとビオチンの特異的結合など、低分子化合物と生体分子(人工的に改変した生体分子との反応も含む)の間の特異的な反応を含む概念である。
【0024】
(工程4)
工程4においては、抗原10(ターゲット)に特異的に結合した機能性物質包含磁性ビーズ16に含まれる機能性物質18を溶出させる。図3に示す例の場合には、機能性物質包含磁性ビーズ16が結合した基板14を有機溶媒に浸漬し、振盪する。その結果、機能性物質包含磁性ビーズ16のポリマー層が膨潤し、内部に封入されていた機能性物質18が有機溶媒中に溶出される。
【0025】
(工程5)
工程5においては、機能性物質包含磁性ビーズ16から溶出した機能性物質18を分離・回収する。
【0026】
(工程6)
工程6においては、回収した機能性物質18の物性を適切な測定装置によって定量的に測定する。
【0027】
(工程7)
最後に、工程6における測定結果を「ターゲット量−物性値」の検量線に照らし合わせて抗原10(ターゲット)を定量する。上記検量線は、既知量のターゲットについて上述した工程3〜工程6の手順を実施した結果に基づいて事前に作成しておく。
【0028】
以上、本発明のバイオセンシング方法の手順について説明してきたが、ここで、磁性ビーズに封入する機能性物質について説明する。本発明における機能性物質は、磁性ビーズに封入することができる適切な物性を有し、且つ、定量的に測定可能な物性を持つ物質であればどのようなものであってもよく、本発明の方法は、機能性物質の種類に限定されるものではない。本発明における代表的な機能性物質として、蛍光発光の物性を持つ物質(蛍光物質)を挙げることができる。
【0029】
蛍光物質包含磁性ビーズを利用する従来のバイオセンシング法においては、ポリマー層を透過する蛍光を測定することが前提となっていたため、磁性ビーズに封入する蛍光物質の選択肢は、一定以上の高い蛍光強度を有するものに限定され、加えて、ポリマー内部に共存する磁性粒子(フェライト)によって吸収されない波長の蛍光を発光するものに限定されざるを得なかった。
【0030】
この点に関し、本発明の方法によれば、蛍光物質の選択肢の範囲は格段に広がる。すなわち、本発明では、磁性ビーズから取り出した蛍光物質の発光を直接測定するので、磁性粒子(フェライト)の影響を考慮する必要がなく、定量的な測定に必要十分な蛍光強度を有する物質であれば、如何なる蛍光物質でも使用することができる。具体的には、現在、一般的な蛍光測定装置で用いられているBODIPYなどを使用することが可能になる。
【0031】
なお、ターゲットに結合したリガンドの標識マーカーをバッファ内で検出するこれまでのスキームにおいては、標識マーカーの選択肢はある程度限られたものにならざるを得なかった。そのため、多くの場合、反応系に与える影響が少ない蛍光物質などを標識マーカーとして使用していたが、蛍光の消光などの影響を考慮して測定系を設計する必要があるため、その構成が複雑なものにならざるを得なかった。
【0032】
この点につき、本発明の方法によれば、任意の機能性物質を標識マーカーとして利用することが可能になり、これまでバイオセンシングにおいて利用されることのなかった導電性物質(物性として導電性を示す物質)などをマーカーとして利用することが可能となる。すなわち、本発明においては、磁性ビーズに対して導電性物質を封入してターゲットとアフィニティ反応を起こさせた後、磁性ビーズから溶出させた導電性物質の導電性(電流値)を測定することによって、ターゲットを定量化することができる。
【0033】
導電性物質は電気化学測定によって簡便に検出・定量化することができるため、蛍光物質などを利用する光学測定に比べれば、少ない手順と短い時間をもってアッセイ結果を得ることができる。また、導電性物質の導電性は蛍光物質の蛍光のように短時間に減衰する心配がないことから、高い精度をもって検出・測定することができる。
【0034】
さらに、電気化学測定に用いられるサイクリックボルタンメトリー(CV)装置は、蛍光測定装置に比べて小型且つ安価であり、CV測定システムを独自に開発する場合であっても、その開発コストは、蛍光などの光学測定を利用するシステムのそれに比べて格段に小さいとされている。したがって、本発明の方法において、導電性物質を採用することは、測定精度および経済面の両方において大きなメリットがあると言える。
【0035】
本発明において使用することができる導電性物質としては、フェロセン、テトラチアフルバレン(TTF)、テトラシアノキノジメタン(TCNQ)、金属錯体等を挙げることができる。
【0036】
さらに、本発明の方法に用いることができるその他の機能性物質としては、ポルフィリン、フルオレン、ペンタセン、カロチン等を挙げることができる。
【0037】
以上、本発明のバイオセンシング方法について、実施形態をもって説明してきたが、本発明は上述した実施形態に限定されるものではなく、その他、当業者が推考しうる実施態様の範囲内において、本発明の作用・効果を奏する限り、本発明の範囲に含まれるものである。
【実施例】
【0038】
以下、本発明のバイオセンシング方法について、実施例を用いてより具体的に説明を行なうが、本発明は、後述する実施例に限定されるものではない。
【0039】
(実施例1)
蛍光分子を封入した磁性ビーズを用いて既知量の前立腺特異抗原(PSA)を検出するサンドイッチイムノアッセイを実施した。
【0040】
(1)磁性ビーズへの蛍光分子の封入
磁性ビーズ(粒子径:約200nm、FGビーズ(COOHビーズ)、品番:TA8848 N1140、多摩川精機株式会社製)1.0 mgをメタノール(500 μl)、メタノール/アセトン=1/1(500 μl)、アセトン(500 μl)を順次用いて洗浄した後、蛍光分子であるDiIC18(5) solid (invitrogen製、D7757、以下Cy5として参照する)の10 mMアセトン溶液(100 μl)中に分散させた。
【0041】
上記分散液を室温にて1時間混合した後、これに超純水(900 μl)を加えてさらに混合したものを遠心分離(20℃、15,000 rpm、3分)した。その後、上澄みを除去したものに超純水(500 μl)を加えて磁性ビーズを分散させた後、遠心分離(20℃、15,000rpm、3分)するといった操作を3回繰り返した。その後、上澄みを除去し、0.1% Tween20含有50 mM HEPES溶液(500μl)を加えて磁性ビーズを分散させた後、遠心分離(20℃、15,000 rpm、3分)するといった操作を上澄みにCy5(青色)が視認できなくなるまで繰り返した。最終的に得られたCy5封入磁性ビーズを超純水(500 μl)に分散させ、4℃で保存した。
【0042】
(2)磁性ビーズ1個あたりのCy5の封入量の確認
予め、Cy5のアセトニトリル溶液を用いてCy5の量と吸光度に関する検量線を作成した。次に、上述した手順で作成したCy5封入磁性ビーズ1mgをアセトニトリル中に分散させて、磁性ビーズに封入された全てのCy5を溶出させた。具体的には、Cy5封入磁性ビーズ1mgをアセトン中に分散させてCy5を溶出させ、磁性ビーズを遠心分離後、上澄みを取るといった工程を、アセトニトリルを入れ替えて合計3回繰り返した。
【0043】
3回目に取得した上澄み液においてCy5が検出されなかったため、1、2回目の上澄み液を合わせた溶液についてCy5の吸光度を測定した。吸光度の測定値を上記検量線に照らした結果、磁性ビーズ1個あたり最大で105分子のCy5が封入されていることが分かった。
【0044】
(3)サンドイッチイムノアッセイの実施
上述した手順で作製したCy5封入磁性ビーズの表面に抗PSA抗体(Hytest製、5A6)を固定化し、これをアッセイバッファ(25 mM Tris-HCl [pH 8.0]、150 mM KCl、0.1% Tween20、1% skim milk)中に分散させて4℃で保存した。一方で、抗PSA抗体(Hytest製、1H12)を固定化した96穴マイクロプレートを用意し、アッセイバッファでブロッキング処理(4℃)した後、各ウェルに濃度[ng/ml](0、0.0006、0.006、0.6、6.0、20、60)のPSA溶液(30 μl)をセットした。続いてアッセイバッファ中に分散させた抗PSA抗体固定化Cy5封入磁性ビーズを1.0 μg(20 μl)投入した。プレートを振盪(4℃、1分)させた後、96穴対応磁気プレートをマイクロプレートの下部に置き、1分間静置した。その後、アッセイバッファ(100 μl)を用いてプレートを振盪(4℃、30秒)し、非特異的に吸着した磁性ビーズを洗浄・除去した。
【0045】
(4)蛍光分子の溶出および蛍光測定
96穴マイクロプレートにアセトニトリル(100 μl)を加えて振盪(室温、5分)し、Cy5封入磁性ビーズからCy5を溶出させて、その上澄み液をウェルごとに回収した。続いて回収した各上澄み液について蛍光強度を測定(PerkinElmer製、Wallac ARVO SX 1420)した。
【0046】
図4は、各ウェルにセットしたPSA溶液の濃度[ng/ml]と、サンドイッチイムノアッセイ後に当該ウェルから回収した上澄み液(Cy5のアセトニトリル溶液)について測定された蛍光強度[cps]の関係を示す。図4の結果から、本発明の方法によれば、0.06 ng/mlから6.0 ng/mlまでの濃度範囲でPSAを高精度に検出しうることが示された。
(実施例2)
【0047】
以下の手順で、磁性ポリマー粒子に対してフェロセンを封入した後、磁性ポリマー粒子からフェロセンを溶出させる実験を行った。
【0048】
(1)磁性ビーズへのフェロセンの封入
磁性ビーズ(粒子径:約200nm、FGビーズ(COOHビーズ)、品番:TA8848 N1140、多摩川精機株式会社製)1.0 mgをメタノール(500 μl)で2回、続いてアセトン(500 μl)で3回洗浄し、フェロセン (東京化成工業製、D0444)の100 mMアセトン溶液(60 μl)中に分散させた。
【0049】
上記分散液を40℃にて20分混合した後、磁性ビーズを遠心分離(20℃、15,000rpm、3分)した。上澄みを除去し、超純水(500 μl)を加えてビーズを分散させた後、遠心分離(20℃、15,000rpm、3分)した。その後、上澄みを除去し、0.3% Tween20含有50 mM HEPES溶液(500 μl)を加えて磁性ビーズを分散させた後、遠心分離(20℃、15,000rpm、3分)するといった操作を3回繰り返した。続いて上澄みを除去し、超純水(500 μl)を加えてビーズを分散させた後、遠心分離(20℃、15,000rpm、3分)するといった操作を3回繰り返した。最終的に得られたフェロセン封入磁性ビーズを超純水(500 μl)に分散させ、4℃で保存した。
【0050】
(2)磁性ビーズ1個あたりのフェロセンの封入量の確認
予め、フェロセンのアセトン溶液を用いてフェロセンの量と吸光度に関する検量線を作成した。次に、上述した手順で作成したフェロセン封入磁性ビーズ1mgをアセトン中に分散させて、磁性ビーズに封入された全てのフェロセンを溶出した。具体的には、フェロセン封入磁性ビーズ1mgをアセトン中に分散させてフェロセンを溶出させ、磁性ビーズを遠心分離後、上澄みを取るといった工程を、アセトンを入れ替えて合計4回繰り返した。
【0051】
4回目に取得した上澄み液においてフェロセンが検出されなかったため、1〜3回目の上澄み液を合わせた溶液についてフェロセンの吸光度を測定した。吸光度の測定値を上記検量線に照らした結果、ビーズ1mgあたり約6μmol(すなわち約1018分子((6x10-6)x(6x1023)=3.6x1018))のフェロセンがビーズに封入されていたことが分かった。ここで、フェロセン封入磁性ビーズ1mgが1011個のビーズに相当することから、磁性ビーズ1個あたりおよそ107分子のフェロセンが封入されていたことが分かった。
【0052】
(3)フェロセンの溶出およびCV測定
上述した手順で作成したフェロセン封入磁性ビーズ1mgを過塩素酸テトラブチルアンモニウムの0.1 Mアセトニトリル溶液に分散させた後、静置(室温、5分)してフェロセンを溶出させ、その後に磁性ビーズを遠心分離後、上澄みを取るといった工程を合計4回繰り返した。4回目に取得した上澄み液においてフェロセンが検出されなかったことから、1〜3回目の上澄み液を合わせた溶液をCV測定用サンプルとして得た。
【0053】
上述した手順で得たサンプルにつき、Modulab(東陽テクニカ製)を用いてCV測定を行った。なお、作用電極にはG0225白金マイクロ電極(10 μmφ、東陽テクニカ製)を、カウンター電極にはVC-3用白金カウンター電極(5 cm、BAS製)を、参照電極にはRE-7非水溶媒計参照電極(BAS製)をそれぞれ用いた。CV測定は10 mV/secの掃引速度で-0.5 V〜+0.5 Vの電圧範囲で2サイクル行った。
【0054】
過塩素酸テトラブチルアンモニウムの0.1 Mアセトニトリル溶液に溶解させたフェロセンのCV測定から、フェロセン濃度が1〜30 μMの範囲内で検量線を得た。1.0 μMのフェロセン溶液100 μlにおいて10-12Aの電流値が得られたことから、((1x10-6)x(100x10-6)x(6x1023)≒)1013分子のフェロセン≒10-12Aとなる。
【符号の説明】
【0055】
10…抗原
12…抗体
14…基板
16…機能性物質包含磁性ビーズ
17…抗体
18…機能性物質
20…磁石
【特許請求の範囲】
【請求項1】
アフィニティ反応を利用したバイオセンシング方法であって、
ポリマー微粒子の内部に機能性物質を封入する工程と、
前記ポリマー微粒子の表面にリガンドを固定化する工程と、
前記リガンドを介して前記ポリマー微粒子とターゲットを結合させる工程と、
前記ターゲットに結合した前記ポリマー微粒子から前記機能性物質を溶出させる工程と、
溶出した前記機能性物質の物性を定量的に測定する工程と
を含み、
前記物性の測定結果に基づいて前記ターゲットを定量化することを特徴とするバイオセンシング方法。
【請求項2】
前記ポリマー微粒子は、内部に磁性粒子を含む磁性微粒子である、請求項1に記載のバイオセンシング方法。
【請求項3】
前記機能性物質は、蛍光物質である、請求項1または2に記載のバイオセンシング方法。
【請求項4】
前記機能性物質は、導電性物質である、請求項1または2に記載のバイオセンシング方法。
【請求項5】
前記導電性物質は、フェロセン、テトラチアフルバレン、テトラシアノキノジメタンからなる群から選択される分子である、請求項4に記載のバイオセンシング方法。
【請求項1】
アフィニティ反応を利用したバイオセンシング方法であって、
ポリマー微粒子の内部に機能性物質を封入する工程と、
前記ポリマー微粒子の表面にリガンドを固定化する工程と、
前記リガンドを介して前記ポリマー微粒子とターゲットを結合させる工程と、
前記ターゲットに結合した前記ポリマー微粒子から前記機能性物質を溶出させる工程と、
溶出した前記機能性物質の物性を定量的に測定する工程と
を含み、
前記物性の測定結果に基づいて前記ターゲットを定量化することを特徴とするバイオセンシング方法。
【請求項2】
前記ポリマー微粒子は、内部に磁性粒子を含む磁性微粒子である、請求項1に記載のバイオセンシング方法。
【請求項3】
前記機能性物質は、蛍光物質である、請求項1または2に記載のバイオセンシング方法。
【請求項4】
前記機能性物質は、導電性物質である、請求項1または2に記載のバイオセンシング方法。
【請求項5】
前記導電性物質は、フェロセン、テトラチアフルバレン、テトラシアノキノジメタンからなる群から選択される分子である、請求項4に記載のバイオセンシング方法。
【図1】


【図2】


【図3】


【図4】




【図2】


【図3】


【図4】


【公開番号】特開2013−113735(P2013−113735A)
【公開日】平成25年6月10日(2013.6.10)
【国際特許分類】
【出願番号】特願2011−260624(P2011−260624)
【出願日】平成23年11月29日(2011.11.29)
【出願人】(304021417)国立大学法人東京工業大学 (1,821)
【Fターム(参考)】
【公開日】平成25年6月10日(2013.6.10)
【国際特許分類】
【出願日】平成23年11月29日(2011.11.29)
【出願人】(304021417)国立大学法人東京工業大学 (1,821)
【Fターム(参考)】
[ Back to top ]

