正弦波電圧を重畳印加する物質間相互作用検出装置及び方法
【課題】
物質間の相互作用を進行させる反応場において、目的の電気力学的作用を得るための電圧印加を自由に実施可能な技術を提供する。
【解決手段】
物質間の相互作用を進行させる反応場と、該反応場に臨む電極へ電圧を印加することにより、所望の電気力学的作用を前記反応場へ加えるための電圧印加手段と、を少なくとも備えており、前記電圧印加手段が、周波数が異なる二つの正弦波電圧を重畳印加してうなり(ビート)を発生する手段を備える物質間相互作用検出装置を提供する。
物質間の相互作用を進行させる反応場において、目的の電気力学的作用を得るための電圧印加を自由に実施可能な技術を提供する。
【解決手段】
物質間の相互作用を進行させる反応場と、該反応場に臨む電極へ電圧を印加することにより、所望の電気力学的作用を前記反応場へ加えるための電圧印加手段と、を少なくとも備えており、前記電圧印加手段が、周波数が異なる二つの正弦波電圧を重畳印加してうなり(ビート)を発生する手段を備える物質間相互作用検出装置を提供する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、物質間相互作用の検出技術に関する。より詳しくは、電気化学的反応による弊害を排除して電気力学的作用を利用し、物質間相互作用の検出を行う技術に関する。
【背景技術】
【0002】
近年、マイクロアレイ技術によって所定のDNAが微細配列された、いわゆるDNAチップ又はDNAマイクロアレイ(以下、本願では「DNAチップ」と総称。)と呼ばれるバイオアッセイ用の集積基板が開発され、遺伝子の変異解析、SNPs(一塩基多型)分析、遺伝子発現頻度解析、遺伝子ネットワーク解明等に利用されるようになり、さらには、創薬、臨床診断、薬理ジェノミクス、テーラーメイド医療、進化の研究、法医学その他の分野において、幅広い応用が期待されている。
【0003】
このDNAチップやタンパク質を集積したプロテインチップなどに代表されるようなセンサーチップ技術は、固層基板上に固定された検出用物質(プローブと称されることが多い。)とターゲット物質との間の特異的な相互作用を利用して、対象物の存在量を定量化する。
【0004】
DNAチップを例に挙げると、分析対象の遺伝子配列の一部をもつ一本鎖DNA断片を予め固定しておき、試料中に、そのDNA断片と相補的な配列をもつ遺伝子が存在すると、両者は特異的に結合し(即ちハイブリダイゼーション)、二本鎖DNAを形成する。この二本鎖DNAを蛍光標識法などで検出することで、その遺伝子が試料溶液中で発現しているかどうかを判定する。異なる遺伝子配列の一本鎖DNA断片を多数固定しておくことにより、一つの試料に対して、複数の遺伝子の発現解析を効率的に行い、あるいは、一つの遺伝子の発現解析に冗長性をもたせて解析の精度を上げることが可能である。
【0005】
しかしながら、上記のようなセンサーチップは、生体高分子間の自然な相互作用に依拠しており、その反応速度は、拡散による輸送過程と相互作用の反応速度定数で決められるため、反応精度は、相互作用の平衡定数で決められてしまう。したがって、試料中に、真の対象分子だけでなく、検出用物質に対して真の対象分子と同程度の親和性をもつノイズ分子が存在する場合、このノイズ分子もある程度検出用物質と結合してしまうので、センサーチップの解析精度が低下してしまう。
【0006】
この問題を解決するためのアプローチが幾つか提案されている。例えば、電気力学的効果を用いる技術がある。以下に、本発明との関連において、一般的な技術水準と位置付けられる先行技術を掲げると、まず、特許文献1には、生物試料からのmRNA転写物を増幅してアンプリコンを得て、このアンプリコンを支持体の所定位置に結合(固定)されたプローブに対して電気的にハイブリダイゼーションさせる技術が開示されている。
【0007】
また、特許文献2には、生体高分子間相互作用(この場合、DNA間のハイブリダイゼーション反応)が平衡に達した後、あやまってリガンドとハイブリダイゼーションしてしまった真の対象分子以外の分子を除去するために、輸送過程改善のための電圧とは逆の極性をもつ直流電圧を印加する方法が提案されている。
【0008】
さらに、特許文献3には、高周波交流電圧等を印加することで、ヌクレオチド鎖に分極を誘起して、不均一電場中で泳動させる(誘電泳動)ことにより、ハイブリダイゼーション効率を改善する方法などが提案されている。
【特許文献1】特表2004−524823号公報(特に、請求項1参照)。
【特許文献2】特表2002−541823号公報。
【特許文献3】特開2004−135512号公報。
【発明の開示】
【発明が解決しようとする課題】
【0009】
しかし、所望の電気力学的作用を得るべく、反応場へ電圧印加を実施する系では、電極表面での電気化学反応で発生するガス(例えば、水素、酸素、塩素など)による物質間の相互作用の阻害、作用電極表面に固定された物質の剥離現象、電極自身の溶解現象などの問題や懸念を抱えていた。このように、反応場への電圧印加には種々の制約があるので、目的の電気力学的作用に基づく効果を充分に得ることが難しかった。
【0010】
また、電極表面での電気化学的反応を防止するために、電極表面にSiO2、SiC、SiN、SiOC、SiOF、TiO2などの材料により絶縁層を形成することが有効な手段と言えるが、このような構成では、絶縁層で印加電圧が降下し、反応溶液へ目的の電圧を投入できなくなるという問題が発生してしまう。
【0011】
そこで、本発明は、物質間の相互作用を進行させる反応場において、目的の電気力学的作用を得るための電圧印加を自由に実施可能な技術を提供することを主な目的とする。
【課題を解決するための手段】
【0012】
本発明は、第一に、物質間の相互作用を進行させる反応場と、この反応場に臨む電極へ電圧を印加することにより、電気泳動や誘電泳動などの所望の電気力学的作用を前記反応場へ加えるための電圧印加手段と、を少なくとも備え、前記電圧印加手段が、周波数が異なる二つの正弦波電圧(特に、周波数が近似する二つの正弦波電圧)を重畳印加してうなり(ビート)を発生する手段を備える物質間相互作用検出装置を提供する。また、本装置の前記電圧印加手段は、例えば、半波整流によって前記うなりの周期ごとに正負の極性をカットすることが可能な電子回路を用いるようにする。
【0013】
本発明では、上記電圧印加手段のような構成を採用した結果、絶縁層での電圧降下の問題が発生しないので、投入電圧に基づく目的の電気力学的効果を確実に得ながら、電極を絶縁層で被覆した構成で、電極表面での電気化学的反応を防止することも自由に行うことができる。また、電極表面での電気化学的反応を有効に防止できるから、電極に相互作用に関与する物質を固定する構成も自由に採用できる。
【0014】
また、本発明は、第二に、所望の電気力学的作用を利用して物質間の相互作用を進行させる手順において、周波数が異なる二つの正弦波電圧を重畳印加してうなり(ビート)を発生させることによって、前記相互作用が進行する反応場での電気化学反応を抑制する物質間相互作用検出方法を提供する。
【0015】
ここで、本発明における物質間の相互作用は、物質間の非共有結合、共有結合、水素結合を含む化学的結合あるいは解離を広く包含し、例えば、核酸分子間のハイブリダイゼーション、タンパク質間の相互作用、抗原抗体反応、低分子-高分子間の相互作用などの物質間の化学的結合あるいは解離などに適用できる。なお、「ハイブリダイゼーション」は、相補的な塩基配列構造を備える間の相補鎖(二本鎖)形成反応を意味する。
【0016】
「半波整流」は、交流の片方の極性をカットする整流方式を言う。本発明では、うなり(ビート)の周期ごとに正負の極性を交互にカットするときの好適な手段として利用される。
【発明の効果】
【0017】
本発明によれば、反応場に臨設された電極表面上での不要な電気化学反応(水素、酸素、塩素等の発生)を回避できるので、所望の電圧を自由に印加できる。また、電極を絶縁層で保護した形態であっても、該絶縁層での電圧降下を発生させずに所望の電圧を反応溶液に印加できるので、目的の電気力学的効果を確実に得ることができる。
【実施例】
【0018】
以下、本発明に係わる基礎実験、並びに実施例を、添付図面を参照しながら説明する。なお、本発明は、以下に説明する実施例によって狭く解釈されることはない。
【0019】
まず、本実験は、図1に示すような構造の模擬センサーチップを用いて実施した。ベース基板1は、厚さ0.7mmのガラス基板で形成し、該ベース基板1の上には光透過性であり、かつ、導電性のITO(インジウム−スズ−オキサイド)層2を180nmの厚さに成膜した。このITO層2を作用電極として利用した。
【0020】
このITO層2の上には、反応場R1、R2を避けるように、蛍光顕微鏡観察用のクロム遮光膜3を形成し、さらに、その上方に、保護膜4として二酸化ケイ素(SiO2)をスパッタリングにより積層した。
【0021】
保護膜4の上層には、感光性ポリイミド樹脂をフォトレジスト処理することによって、円筒状(内径2mm、厚さ(深さ)5μm)の反応場R1,R2を二つ形成した。なお、一方の反応場R1は、電気的作用の効果を見るための反応場として利用し、もう一方の反応場R2は、対照区としての反応場として利用した。
【0022】
なお、両反応場R1,R2は同一基板上に搭載されているため、ほぼ同じ熱履歴を受けるが、その中心部に設けた隙間6によって物理的に絶縁されているため、電気的には完全に絶縁されている。
【0023】
図1に示した基板に、まず、イオン化蒸着法によりダイヤモンドライクカーボンを約10 nm成膜した。タングステンフィラメントで生成される熱電子を利用して、原料ガスとなるベンゼンやメタンをイオン化し、バイアス電圧によって基板上に成膜する。次に反応容器に塩素を導入し、高圧水銀灯の光を約30分照射した。
【0024】
続いて、塩素ガスを排気した後、アンモニアガスを容器に導入して、高圧水銀灯の光を約30分照射した。これにより表面にアミノ基-NH2が導入される。この基板を、1-メチル-2-ピロリドンに140mMの無水コハク酸、0.1Mの放散ナトリウム(pH 8)を添加した溶液に浸漬した。これにより表面にカルボニル基-COOHが導入される。この-COOHを以下のように活性エステル化する。0.1 Mのリン酸バッファーに0.1 MのN-エチル-N’-3-ジメチルアミノプロピルカルボジイミド塩酸塩と20 mMのN-ヒドロキシスクシンイミドを添加した溶液を作製した。これに30分浸漬した。
【0025】
上記処理された基板表面に一本鎖DNAの断片を固定した。断片の配列は、5末端から3末端方向に、CGAAGCGCTTATTCCAGAGCCCGACATGAA(計30mer)である。5’末端がNH2で終端された上記配列をもつ合成オリゴをエスペックオリゴサービス社から購入し、濃度100μMになるように純水に溶解した。その溶液10μLに、溶解液(東京鋼鈑株式会社製・Solution 6)を90μL加え、10μMのDNA溶液を調整した。次に、日本レーザー電子社製の自動スポッティング装置STAMPMAN(登録商標)を用いて、二つの反応場R1,R2の中心部にスポッティングした。
【0026】
スポッティングしたチップをガラスシャーレ上に並べ、オーブン中で80℃、1時間加熱した。この過程で、DNA断片のNH2末端と表面の活性化エステルとが反応し、DNA断片が表面に固定された。
【0027】
次に、基板をオーブンから取り出し、500mLビーカーに洗浄液(2x SSC/0.2%SDS)を150mL入れ、基板を浸漬し、100rpmで浸透しながら15分間洗浄した。予め準備しておいた90℃の不活化溶液(2x SSC)に5分間浸漬し、DNA断片のNH2末端と反応しなかった余分の活性化エステルを不活性化した。その後、流純水中で軽くリンスし、乾燥窒素ガスでブローした。完成した基板は窒素ガスボックス中で保管した。
【0028】
続いて、チップ上に固定したDNA断片と完全に相補的な配列をもつ一本鎖DNA、および、人為的に非相補的な塩基を挿入した一本鎖DNA(同じくエスペックオリゴサービス社から購入)を、濃度100μMになるように純水に溶解し、さらに5x SSC/0.5%SDS中で濃度50nMになるように調整した。このDNA断片の5’末端は蛍光色素Cy3で蛍光標識されている。
【0029】
この溶液を高精度ピペットで採取し、二つの反応場R1,R2に滴下した。滴下量は、それぞれ1.5μLである。その後、高ドープシリコンでできた上部電極(参照電極)7,7を各反応場R1,R2に被せて、加熱ステージを有するハイブリダイゼーション装置に搭載した。なお、本装置は、上部電極をピンで押さえ、片方の反応槽のWEとREとの間にのみ電圧を印加することができる装置である。
【0030】
この装置を用いて、65℃で時間を変化させてハイブリダイゼーション反応を進行させた。反応後のチップは、2x SSC/0.2%SDS中で、100rpmで浸透しながら15分間洗浄した。その後、乾燥窒素ガスでブローし、ハイブリダイゼーション反応量を蛍光顕微鏡(オリンパス社製DP70)で計測した。
【0031】
図2は、電圧印加を行った反応場R1と、電圧印加を行わなかった反応場R2のハイブリダイゼーション精度の比較を示す図面代用グラフである。グラフの横軸が非相補的塩基の数であり、縦軸がハイブリダイゼーション反応量である。なお、非相補的塩基の数が増加すると共に、急速にハイブリダイゼーション反応量が減少するチップが精度の良いチップであると言える。
【0032】
本実験での印加電圧は、15Vpp、5MHzの交流電圧である。図2に示すように、電圧を印加した反応場R1と印加しない反応場R2で、ハイブリダイゼーション反応の精度があまり変化していないことが分かった。このことから、本実験で採用したようなセンサーチップの構成では、電圧が反応場R1に対して有効に投入されていないことがわかった。
【0033】
ここで、図3に、上記基礎実験を行った系の等価電気回路を示す。
【0034】
作用電極(ITO層2)上に形成された絶縁層である保護膜4(この場合はスパッタリングで成膜したSiO2膜)の静電容量C1が、反応場R1中の溶液の静電容量C2と抵抗Rが並列合成されたものと直列に接続されている。
【0035】
このような電気回路系では、印加する高周波の周波数が低い場合、電圧は全て保護膜4に印加されるため、電圧が降下してしまい、溶液には印加されなくなってしまう。即ち、保護膜4は、反応領場R1中の溶媒(電解質溶液)と直列に接続されたキャパシタ(蓄電装置)と同様の機能を発揮してしまうので、直流、若しくは低周波交流の印加電圧は、作用電極(ITO層2)表面の保護膜4に印加されてしまい、肝心の(反応場に存在する)反応溶液部分には、印加されなくなってしまうという問題が発生する。
【0036】
なお、周波数が高くなってある閾値を越え、静電容量C1が実質的に短絡された状態になると、溶液に電圧が印加されるようになる。しかし、電気泳動や誘電泳動などの所望の電気力学的作用が閾値周波数以下で最大限に発揮される場合では、その電気力学的作用を効率的に利用することができなくなる。
【0037】
続いて、図4は、図1で示した模擬センサーチップの溶液部のインピーダンスの回路全体のインピーダンスに対する比を周波数の関数として示した図面代用グラフである(横軸は、周波数Hzである)。
【0038】
溶液に印加される電圧は、インピーダンスの回路全体のインピーダンスに対する比との積になる。ここで、反応場R1の径は2mm、深さは10μmであり(上述)、100mMのNaCl溶液で満たされた状態である。この図4に示された結果から明らかなように、保護膜4が厚くなればなるほど、より高い周波数の交流電圧を印加しなければ、溶液部に効率よく電圧を印加することができなくなることがわかる。
【0039】
従来の発想では、低周波電圧を利用したい場合、保護膜4の厚さを小さくする方法が採用できたが、一定の品質(絶縁性)を保って成膜できる膜厚には限界(下限)がある。図4には、膜厚0.1nmの場合もプロットしているが、もちろんこのような膜厚のSiO2を形成することは、実用的には困難である。
【0040】
結論として、図2の結果が示すように、有意な電気的効果が得られなかった原因は、保護膜(絶縁層SiO2)の膜厚が大き過ぎて、溶液部分に電圧が印加されていなかったためであると考えられる。
【0041】
以下、上記した基礎実験の結果と考察を踏まえて、本発明に係る実施例を説明する。
【0042】
まず、何らかの電気力学的作用を利用しようとするDNAチップなどのセンサーチップでは、その最適周波数は、利用しようとする電気力学的作用の種類によって異なる。以下で説明する実施例では、「誘電泳動」を利用した生体高分子の相互作用を検出する場合を代表例として説明するが、本発明における電気力学的作用は、誘電泳動に限定されず、電気泳動などの他の電気力学的作用であってもよい。
【0043】
なお、「誘電泳動」は、電界が一様でない場において、分子が電界の強い方へ駆動する現象であって、交流電圧をかけた場合も、かけた電圧の極性の反転につれて分極の極性も反転するので、直流の場合と同様に駆動効果が得られる(監修・林 輝、「マイクロマシンと材料技術(シーエムシー発行)」、P37〜P46・第5章・細胞およびDNAのマニピュレーション参照)。
【0044】
まず、誘電泳動を利用するためには、まず、電場によって分子内に分極を誘起する必要がある(誘電分極)。但し、対象とする分子がすでに分極していて、十分に大きな永久双極子をもっている場合は、この限りではない。
【0045】
なお、核酸分子は、液相中において電界の作用を受けると伸長又は移動することが知られている。その原理は、核酸分子の骨格をなすリン酸イオン(陰電荷)とその周辺にある水がイオン化した水素原子(陽電荷)とによってイオン曇を作っていると考えられ、これらの陰電荷及び陽電荷により生じる分極ベクトル(双極子)が、高周波高電圧の印加により全体として一方向を向き、その結果として伸長し、加えて、電気力線が一部に集中する不均一電界が印加された場合は、電気力線が集中する部位に向かって移動する(Seiichi Suzuki,Takeshi Yamanashi,Shin-ichiTazawa,Osamu Kurosawa and Masao Washizu:“Quantitative analysis on electrostatic orientation of DNA in stationary AC electric field using fluorescence anisotropy”,IEEE Transaction on Industrial Applications,Vol.34,No.1,P75-83(1998)。
【0046】
まず、図5は、DNAの分極がどの程度の周波数で起こるかを明らかにするために、2本鎖DNAの誘電分散(誘電率の周波数依存性)を示す。縦軸の値が大きいほど、誘起された分極が大きいということを意味する。これは、鮭の精子から抽出したDNAの誘電分散で、図5中の曲線1、2、および3は、それぞれ鎖長740、560、および130nmの試料に対するものである。
【0047】
このデータの詳細な解析から、DNAの誘電分極が起こる周波数は鎖長の2乗でスケーリングすることが分かる。つまり、鎖長が長いほど低い周波数で分極し、鎖長が伸びると、より高い周波数で分極するようになる。
【0048】
このスケーリング則を採用すると、30塩基対から成る2本鎖DNAは約10MHzで分極することが分かる。しかし、上記基礎実験で作用したテストチップ及び電気回路では、周波数約100MHz以下の交流電圧を用いることができない。本発明は、この矛盾点を解決するために有効である。
【0049】
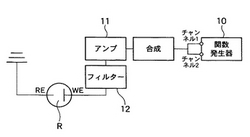
反応場へ電圧を印加するとき、通常一般では、単一の関数発生器(ファンクションジェネレーター)から正弦波を発生させ、それをアンプで増幅してチップに印加する。それに対して、本発明の電圧印加手段では、図6に示すように、2チャンネルの関数発生器10から周波数の近い正弦波を発生させ、両者を合成してからアンプ11で増幅し、続いて、半端整流フィルター12を介して、チップ上の反応場Rに印加するように工夫する。なお、図6中において、WEはその近傍で相互作用が進行する作用電極、REは該作用電極に対向配置される参照電極を示している。
【0050】
ここで、二つの周波数ω1とω2(ω1>ω2)は、図3で示した等価回路の閾値周波数より大きいものとする。さらに、両者の差(ω1−ω2)は、実際に印加したい周波数の2倍に等しいものとする。
【0051】
周波数の近似する正弦波を合成すると、以下の「数式1」で示された平均周波数の高周波電圧が、周波数の差(ω1−ω2)で変調されたうなり(ビート)が発生する。
【0052】
【数1】

【0053】
このビートは、次の「数式2」で表される。ここで、φは、チャンネル1の波のチャンネル2に対する位相差を示している。
【0054】
【数2】

【0055】
この波形は、周波数(ω1+ω2)/2で振動しているので(最初のsin項参照)、周波数は充分に高く、保護膜(絶縁層)を透過して溶液部に印加される。しかし、図5に示された誘電分散の結果から分かるように、周波数が高すぎるとDNAの誘電分極は引き起こさない。その意味では、この高周波成分は、DNA分子に電気的作用を及ぼさない(周波数が高すぎて、DNA分子は「電場を感じない」)。
【0056】
一方、高周波成分の振幅は、周波数(ω1-ω2)/2で変調されている(次のcos項参照)。この変調周波数は、所望の周波数と等しいので、実効的には、DNA分子に低周波電圧が印加されていることになる。
【0057】
実際には、ビート(うなり)の半周期中に、sin項が-1から+1までの間で振動するので、cos項が正のときは高周波の負成分を、cos項が負のときは高周波の正成分をカットしなければならない。この交流の半波整流は、最も簡単な実施形態では、回路にダイオードを挿入することによって実施できる。ダイオードは、一方向にしか電流を流さないので半波整流を実施できる。
【0058】
ただし、本発明の場合、ビートの半周期ごとに正負の極性を交互にカットする必要がある。これを実現できる電子回路は様々に考えられるが、例えば、極性が逆のダイオードを並列に並んだフィルター回路に対して、ビートの半周期と同期してスイッチングすることで、目的の波形が得られる。
【0059】
図5のデータと該データから導かれるスケーリング則に基づいて、ω1= 220MHz、ω2=200MHzとして、図6の回路形態に基づいて、重畳交流電圧を印加した。オシロスコープで観測した波形を図7に示す。
【0060】
なお、周波数は200MHz以上なので、図4から分かるように、マイクロチップに電圧が印加される。本発明では、周波数210MHzの高周波電圧が、周波数10MHzで変調されている。
【0061】
DNAなどの核酸分子は、周波数10MHzで誘電分極すると考えられるので、本発明では核酸分子の誘電分極効果を充分に期待できる。したがって、本発明を適用することにより、電極表面に保護膜が形成された場合でも、任意の周波数の電圧をDNAチップなどのマイクロチップに印加し、誘電泳動の効果を得ることができる。
【0062】
ここで、交流の片方の極性がカットされた交流が、保護膜(絶縁層)を透過できることについて説明する。
【0063】
絶縁膜のキャパシターと溶液の複素インピーダンスをZ1、Z2とすると、次の「数式3」に示すように、いかなる場合でも、印加電圧Vはインピーダンスの比に分割される。
【0064】
【数3】

【0065】
次に、印加する交流の、たとえば負の極性をカットする半波整流フィルターに相当する演算をFで定義すると、整流後の溶液にかかる電圧は、次の「数式4」で示すことができる。したがって、反応溶液にかかる電圧は、もとの電圧を半波整流したものと同じになる。即ち、交流の片方の極性がカットされた交流は、保護膜(絶縁層)を透過できる。
【0066】
【数4】

【0067】
次に、誘電泳動力は、交流の実効値の2乗の勾配(gradient)に比例する。うなり(ビート)の時間平均を取るとき、高周波成分は振動が速いので無視して、ビート項のみの時間平均を取ればよい。すると、ビートの振幅はもとの高周波の2倍なので、むしろ誘電泳動力は大きくなる。なお、誘電泳動以外の作用を用いる場合でも、電場の振幅が2倍になるとして扱ってよい。
【0068】
以上の実験結果や考察から、本発明では、電極構造にとくに関係なく、当該電極を絶縁膜で保護した形態においても、低周波電圧を(反応場の)反応溶液に印加できる。過剰の電圧印加の必要もなくなるので、電極表面での電気化学的反応の発生や電極の溶解などを確実に防止することができる。この結果、電気泳動や誘電泳動などの電気力学的作用を自在に利用して、物質間の相互作用の反応効率や精度を向上させることができる。
【0069】
また、本発明では前記電気化学反応の影響を気にすることなく、電極表面に対して相互作用に係わる物質(例えば、核酸分子)を固定できる。さらに、本発明によれば、電極および保護膜材料の選択肢が広がるので、コスト低減やチップ製造の容易化を達成できる。
【産業上の利用可能性】
【0070】
本発明は、物質間の相互作用を進行させる反応場、例えば、DNAチップやプロテインチップその他のセンサーチップの設計や製造に利用できる。より具体的には、物質間の相互作用を進行させる反応場において電気泳動や誘電泳動などの電気力学的作用を利用するときに有用である。
【図面の簡単な説明】
【0071】
【図1】基礎実験で用いた模擬センサーチップの構造を示す図(上:平面図、下:縦断面図)である。
【図2】電圧印加を行った反応場(R1)と、電圧印加を行わなかった反応場(R2)のハイブリダイゼーション精度の比較を示す図面代用グラフである。
【図3】同基礎実験を行った系の等価電気回路を示す図である。
【図4】図1で示した模擬センサーチップの溶液部のインピーダンスの回路全体のインピーダンスに対する比を周波数の関数として示した図面代用グラフである
【図5】DNAの分極がどの程度の周波数で起こるかを明らかにするために、2本鎖DNAの誘電分散(誘電率の周波数依存性)を示す図面代用グラフである。
【図6】本発明で採用可能な電気回路を示す図であって、2チャンネルのファンクションジェネレーターから周波数の近い正弦波を発生させ、両者を合成してからアンプで増幅し、続いて、半端整流フィルターを介して、チップに印加する構成の電気回路図である。
【図7】図6の回路形態に基づいて、重畳交流電圧を印加した。オシロスコープで観測した波形を示す図である。
【符号の説明】
【0072】
10 2チャンネルの関数発生器
11 アンプ(増幅器)
12 半端整流フィルター
R 反応場
RE 参照電極
WE 作用電極
【技術分野】
【0001】
本発明は、物質間相互作用の検出技術に関する。より詳しくは、電気化学的反応による弊害を排除して電気力学的作用を利用し、物質間相互作用の検出を行う技術に関する。
【背景技術】
【0002】
近年、マイクロアレイ技術によって所定のDNAが微細配列された、いわゆるDNAチップ又はDNAマイクロアレイ(以下、本願では「DNAチップ」と総称。)と呼ばれるバイオアッセイ用の集積基板が開発され、遺伝子の変異解析、SNPs(一塩基多型)分析、遺伝子発現頻度解析、遺伝子ネットワーク解明等に利用されるようになり、さらには、創薬、臨床診断、薬理ジェノミクス、テーラーメイド医療、進化の研究、法医学その他の分野において、幅広い応用が期待されている。
【0003】
このDNAチップやタンパク質を集積したプロテインチップなどに代表されるようなセンサーチップ技術は、固層基板上に固定された検出用物質(プローブと称されることが多い。)とターゲット物質との間の特異的な相互作用を利用して、対象物の存在量を定量化する。
【0004】
DNAチップを例に挙げると、分析対象の遺伝子配列の一部をもつ一本鎖DNA断片を予め固定しておき、試料中に、そのDNA断片と相補的な配列をもつ遺伝子が存在すると、両者は特異的に結合し(即ちハイブリダイゼーション)、二本鎖DNAを形成する。この二本鎖DNAを蛍光標識法などで検出することで、その遺伝子が試料溶液中で発現しているかどうかを判定する。異なる遺伝子配列の一本鎖DNA断片を多数固定しておくことにより、一つの試料に対して、複数の遺伝子の発現解析を効率的に行い、あるいは、一つの遺伝子の発現解析に冗長性をもたせて解析の精度を上げることが可能である。
【0005】
しかしながら、上記のようなセンサーチップは、生体高分子間の自然な相互作用に依拠しており、その反応速度は、拡散による輸送過程と相互作用の反応速度定数で決められるため、反応精度は、相互作用の平衡定数で決められてしまう。したがって、試料中に、真の対象分子だけでなく、検出用物質に対して真の対象分子と同程度の親和性をもつノイズ分子が存在する場合、このノイズ分子もある程度検出用物質と結合してしまうので、センサーチップの解析精度が低下してしまう。
【0006】
この問題を解決するためのアプローチが幾つか提案されている。例えば、電気力学的効果を用いる技術がある。以下に、本発明との関連において、一般的な技術水準と位置付けられる先行技術を掲げると、まず、特許文献1には、生物試料からのmRNA転写物を増幅してアンプリコンを得て、このアンプリコンを支持体の所定位置に結合(固定)されたプローブに対して電気的にハイブリダイゼーションさせる技術が開示されている。
【0007】
また、特許文献2には、生体高分子間相互作用(この場合、DNA間のハイブリダイゼーション反応)が平衡に達した後、あやまってリガンドとハイブリダイゼーションしてしまった真の対象分子以外の分子を除去するために、輸送過程改善のための電圧とは逆の極性をもつ直流電圧を印加する方法が提案されている。
【0008】
さらに、特許文献3には、高周波交流電圧等を印加することで、ヌクレオチド鎖に分極を誘起して、不均一電場中で泳動させる(誘電泳動)ことにより、ハイブリダイゼーション効率を改善する方法などが提案されている。
【特許文献1】特表2004−524823号公報(特に、請求項1参照)。
【特許文献2】特表2002−541823号公報。
【特許文献3】特開2004−135512号公報。
【発明の開示】
【発明が解決しようとする課題】
【0009】
しかし、所望の電気力学的作用を得るべく、反応場へ電圧印加を実施する系では、電極表面での電気化学反応で発生するガス(例えば、水素、酸素、塩素など)による物質間の相互作用の阻害、作用電極表面に固定された物質の剥離現象、電極自身の溶解現象などの問題や懸念を抱えていた。このように、反応場への電圧印加には種々の制約があるので、目的の電気力学的作用に基づく効果を充分に得ることが難しかった。
【0010】
また、電極表面での電気化学的反応を防止するために、電極表面にSiO2、SiC、SiN、SiOC、SiOF、TiO2などの材料により絶縁層を形成することが有効な手段と言えるが、このような構成では、絶縁層で印加電圧が降下し、反応溶液へ目的の電圧を投入できなくなるという問題が発生してしまう。
【0011】
そこで、本発明は、物質間の相互作用を進行させる反応場において、目的の電気力学的作用を得るための電圧印加を自由に実施可能な技術を提供することを主な目的とする。
【課題を解決するための手段】
【0012】
本発明は、第一に、物質間の相互作用を進行させる反応場と、この反応場に臨む電極へ電圧を印加することにより、電気泳動や誘電泳動などの所望の電気力学的作用を前記反応場へ加えるための電圧印加手段と、を少なくとも備え、前記電圧印加手段が、周波数が異なる二つの正弦波電圧(特に、周波数が近似する二つの正弦波電圧)を重畳印加してうなり(ビート)を発生する手段を備える物質間相互作用検出装置を提供する。また、本装置の前記電圧印加手段は、例えば、半波整流によって前記うなりの周期ごとに正負の極性をカットすることが可能な電子回路を用いるようにする。
【0013】
本発明では、上記電圧印加手段のような構成を採用した結果、絶縁層での電圧降下の問題が発生しないので、投入電圧に基づく目的の電気力学的効果を確実に得ながら、電極を絶縁層で被覆した構成で、電極表面での電気化学的反応を防止することも自由に行うことができる。また、電極表面での電気化学的反応を有効に防止できるから、電極に相互作用に関与する物質を固定する構成も自由に採用できる。
【0014】
また、本発明は、第二に、所望の電気力学的作用を利用して物質間の相互作用を進行させる手順において、周波数が異なる二つの正弦波電圧を重畳印加してうなり(ビート)を発生させることによって、前記相互作用が進行する反応場での電気化学反応を抑制する物質間相互作用検出方法を提供する。
【0015】
ここで、本発明における物質間の相互作用は、物質間の非共有結合、共有結合、水素結合を含む化学的結合あるいは解離を広く包含し、例えば、核酸分子間のハイブリダイゼーション、タンパク質間の相互作用、抗原抗体反応、低分子-高分子間の相互作用などの物質間の化学的結合あるいは解離などに適用できる。なお、「ハイブリダイゼーション」は、相補的な塩基配列構造を備える間の相補鎖(二本鎖)形成反応を意味する。
【0016】
「半波整流」は、交流の片方の極性をカットする整流方式を言う。本発明では、うなり(ビート)の周期ごとに正負の極性を交互にカットするときの好適な手段として利用される。
【発明の効果】
【0017】
本発明によれば、反応場に臨設された電極表面上での不要な電気化学反応(水素、酸素、塩素等の発生)を回避できるので、所望の電圧を自由に印加できる。また、電極を絶縁層で保護した形態であっても、該絶縁層での電圧降下を発生させずに所望の電圧を反応溶液に印加できるので、目的の電気力学的効果を確実に得ることができる。
【実施例】
【0018】
以下、本発明に係わる基礎実験、並びに実施例を、添付図面を参照しながら説明する。なお、本発明は、以下に説明する実施例によって狭く解釈されることはない。
【0019】
まず、本実験は、図1に示すような構造の模擬センサーチップを用いて実施した。ベース基板1は、厚さ0.7mmのガラス基板で形成し、該ベース基板1の上には光透過性であり、かつ、導電性のITO(インジウム−スズ−オキサイド)層2を180nmの厚さに成膜した。このITO層2を作用電極として利用した。
【0020】
このITO層2の上には、反応場R1、R2を避けるように、蛍光顕微鏡観察用のクロム遮光膜3を形成し、さらに、その上方に、保護膜4として二酸化ケイ素(SiO2)をスパッタリングにより積層した。
【0021】
保護膜4の上層には、感光性ポリイミド樹脂をフォトレジスト処理することによって、円筒状(内径2mm、厚さ(深さ)5μm)の反応場R1,R2を二つ形成した。なお、一方の反応場R1は、電気的作用の効果を見るための反応場として利用し、もう一方の反応場R2は、対照区としての反応場として利用した。
【0022】
なお、両反応場R1,R2は同一基板上に搭載されているため、ほぼ同じ熱履歴を受けるが、その中心部に設けた隙間6によって物理的に絶縁されているため、電気的には完全に絶縁されている。
【0023】
図1に示した基板に、まず、イオン化蒸着法によりダイヤモンドライクカーボンを約10 nm成膜した。タングステンフィラメントで生成される熱電子を利用して、原料ガスとなるベンゼンやメタンをイオン化し、バイアス電圧によって基板上に成膜する。次に反応容器に塩素を導入し、高圧水銀灯の光を約30分照射した。
【0024】
続いて、塩素ガスを排気した後、アンモニアガスを容器に導入して、高圧水銀灯の光を約30分照射した。これにより表面にアミノ基-NH2が導入される。この基板を、1-メチル-2-ピロリドンに140mMの無水コハク酸、0.1Mの放散ナトリウム(pH 8)を添加した溶液に浸漬した。これにより表面にカルボニル基-COOHが導入される。この-COOHを以下のように活性エステル化する。0.1 Mのリン酸バッファーに0.1 MのN-エチル-N’-3-ジメチルアミノプロピルカルボジイミド塩酸塩と20 mMのN-ヒドロキシスクシンイミドを添加した溶液を作製した。これに30分浸漬した。
【0025】
上記処理された基板表面に一本鎖DNAの断片を固定した。断片の配列は、5末端から3末端方向に、CGAAGCGCTTATTCCAGAGCCCGACATGAA(計30mer)である。5’末端がNH2で終端された上記配列をもつ合成オリゴをエスペックオリゴサービス社から購入し、濃度100μMになるように純水に溶解した。その溶液10μLに、溶解液(東京鋼鈑株式会社製・Solution 6)を90μL加え、10μMのDNA溶液を調整した。次に、日本レーザー電子社製の自動スポッティング装置STAMPMAN(登録商標)を用いて、二つの反応場R1,R2の中心部にスポッティングした。
【0026】
スポッティングしたチップをガラスシャーレ上に並べ、オーブン中で80℃、1時間加熱した。この過程で、DNA断片のNH2末端と表面の活性化エステルとが反応し、DNA断片が表面に固定された。
【0027】
次に、基板をオーブンから取り出し、500mLビーカーに洗浄液(2x SSC/0.2%SDS)を150mL入れ、基板を浸漬し、100rpmで浸透しながら15分間洗浄した。予め準備しておいた90℃の不活化溶液(2x SSC)に5分間浸漬し、DNA断片のNH2末端と反応しなかった余分の活性化エステルを不活性化した。その後、流純水中で軽くリンスし、乾燥窒素ガスでブローした。完成した基板は窒素ガスボックス中で保管した。
【0028】
続いて、チップ上に固定したDNA断片と完全に相補的な配列をもつ一本鎖DNA、および、人為的に非相補的な塩基を挿入した一本鎖DNA(同じくエスペックオリゴサービス社から購入)を、濃度100μMになるように純水に溶解し、さらに5x SSC/0.5%SDS中で濃度50nMになるように調整した。このDNA断片の5’末端は蛍光色素Cy3で蛍光標識されている。
【0029】
この溶液を高精度ピペットで採取し、二つの反応場R1,R2に滴下した。滴下量は、それぞれ1.5μLである。その後、高ドープシリコンでできた上部電極(参照電極)7,7を各反応場R1,R2に被せて、加熱ステージを有するハイブリダイゼーション装置に搭載した。なお、本装置は、上部電極をピンで押さえ、片方の反応槽のWEとREとの間にのみ電圧を印加することができる装置である。
【0030】
この装置を用いて、65℃で時間を変化させてハイブリダイゼーション反応を進行させた。反応後のチップは、2x SSC/0.2%SDS中で、100rpmで浸透しながら15分間洗浄した。その後、乾燥窒素ガスでブローし、ハイブリダイゼーション反応量を蛍光顕微鏡(オリンパス社製DP70)で計測した。
【0031】
図2は、電圧印加を行った反応場R1と、電圧印加を行わなかった反応場R2のハイブリダイゼーション精度の比較を示す図面代用グラフである。グラフの横軸が非相補的塩基の数であり、縦軸がハイブリダイゼーション反応量である。なお、非相補的塩基の数が増加すると共に、急速にハイブリダイゼーション反応量が減少するチップが精度の良いチップであると言える。
【0032】
本実験での印加電圧は、15Vpp、5MHzの交流電圧である。図2に示すように、電圧を印加した反応場R1と印加しない反応場R2で、ハイブリダイゼーション反応の精度があまり変化していないことが分かった。このことから、本実験で採用したようなセンサーチップの構成では、電圧が反応場R1に対して有効に投入されていないことがわかった。
【0033】
ここで、図3に、上記基礎実験を行った系の等価電気回路を示す。
【0034】
作用電極(ITO層2)上に形成された絶縁層である保護膜4(この場合はスパッタリングで成膜したSiO2膜)の静電容量C1が、反応場R1中の溶液の静電容量C2と抵抗Rが並列合成されたものと直列に接続されている。
【0035】
このような電気回路系では、印加する高周波の周波数が低い場合、電圧は全て保護膜4に印加されるため、電圧が降下してしまい、溶液には印加されなくなってしまう。即ち、保護膜4は、反応領場R1中の溶媒(電解質溶液)と直列に接続されたキャパシタ(蓄電装置)と同様の機能を発揮してしまうので、直流、若しくは低周波交流の印加電圧は、作用電極(ITO層2)表面の保護膜4に印加されてしまい、肝心の(反応場に存在する)反応溶液部分には、印加されなくなってしまうという問題が発生する。
【0036】
なお、周波数が高くなってある閾値を越え、静電容量C1が実質的に短絡された状態になると、溶液に電圧が印加されるようになる。しかし、電気泳動や誘電泳動などの所望の電気力学的作用が閾値周波数以下で最大限に発揮される場合では、その電気力学的作用を効率的に利用することができなくなる。
【0037】
続いて、図4は、図1で示した模擬センサーチップの溶液部のインピーダンスの回路全体のインピーダンスに対する比を周波数の関数として示した図面代用グラフである(横軸は、周波数Hzである)。
【0038】
溶液に印加される電圧は、インピーダンスの回路全体のインピーダンスに対する比との積になる。ここで、反応場R1の径は2mm、深さは10μmであり(上述)、100mMのNaCl溶液で満たされた状態である。この図4に示された結果から明らかなように、保護膜4が厚くなればなるほど、より高い周波数の交流電圧を印加しなければ、溶液部に効率よく電圧を印加することができなくなることがわかる。
【0039】
従来の発想では、低周波電圧を利用したい場合、保護膜4の厚さを小さくする方法が採用できたが、一定の品質(絶縁性)を保って成膜できる膜厚には限界(下限)がある。図4には、膜厚0.1nmの場合もプロットしているが、もちろんこのような膜厚のSiO2を形成することは、実用的には困難である。
【0040】
結論として、図2の結果が示すように、有意な電気的効果が得られなかった原因は、保護膜(絶縁層SiO2)の膜厚が大き過ぎて、溶液部分に電圧が印加されていなかったためであると考えられる。
【0041】
以下、上記した基礎実験の結果と考察を踏まえて、本発明に係る実施例を説明する。
【0042】
まず、何らかの電気力学的作用を利用しようとするDNAチップなどのセンサーチップでは、その最適周波数は、利用しようとする電気力学的作用の種類によって異なる。以下で説明する実施例では、「誘電泳動」を利用した生体高分子の相互作用を検出する場合を代表例として説明するが、本発明における電気力学的作用は、誘電泳動に限定されず、電気泳動などの他の電気力学的作用であってもよい。
【0043】
なお、「誘電泳動」は、電界が一様でない場において、分子が電界の強い方へ駆動する現象であって、交流電圧をかけた場合も、かけた電圧の極性の反転につれて分極の極性も反転するので、直流の場合と同様に駆動効果が得られる(監修・林 輝、「マイクロマシンと材料技術(シーエムシー発行)」、P37〜P46・第5章・細胞およびDNAのマニピュレーション参照)。
【0044】
まず、誘電泳動を利用するためには、まず、電場によって分子内に分極を誘起する必要がある(誘電分極)。但し、対象とする分子がすでに分極していて、十分に大きな永久双極子をもっている場合は、この限りではない。
【0045】
なお、核酸分子は、液相中において電界の作用を受けると伸長又は移動することが知られている。その原理は、核酸分子の骨格をなすリン酸イオン(陰電荷)とその周辺にある水がイオン化した水素原子(陽電荷)とによってイオン曇を作っていると考えられ、これらの陰電荷及び陽電荷により生じる分極ベクトル(双極子)が、高周波高電圧の印加により全体として一方向を向き、その結果として伸長し、加えて、電気力線が一部に集中する不均一電界が印加された場合は、電気力線が集中する部位に向かって移動する(Seiichi Suzuki,Takeshi Yamanashi,Shin-ichiTazawa,Osamu Kurosawa and Masao Washizu:“Quantitative analysis on electrostatic orientation of DNA in stationary AC electric field using fluorescence anisotropy”,IEEE Transaction on Industrial Applications,Vol.34,No.1,P75-83(1998)。
【0046】
まず、図5は、DNAの分極がどの程度の周波数で起こるかを明らかにするために、2本鎖DNAの誘電分散(誘電率の周波数依存性)を示す。縦軸の値が大きいほど、誘起された分極が大きいということを意味する。これは、鮭の精子から抽出したDNAの誘電分散で、図5中の曲線1、2、および3は、それぞれ鎖長740、560、および130nmの試料に対するものである。
【0047】
このデータの詳細な解析から、DNAの誘電分極が起こる周波数は鎖長の2乗でスケーリングすることが分かる。つまり、鎖長が長いほど低い周波数で分極し、鎖長が伸びると、より高い周波数で分極するようになる。
【0048】
このスケーリング則を採用すると、30塩基対から成る2本鎖DNAは約10MHzで分極することが分かる。しかし、上記基礎実験で作用したテストチップ及び電気回路では、周波数約100MHz以下の交流電圧を用いることができない。本発明は、この矛盾点を解決するために有効である。
【0049】
反応場へ電圧を印加するとき、通常一般では、単一の関数発生器(ファンクションジェネレーター)から正弦波を発生させ、それをアンプで増幅してチップに印加する。それに対して、本発明の電圧印加手段では、図6に示すように、2チャンネルの関数発生器10から周波数の近い正弦波を発生させ、両者を合成してからアンプ11で増幅し、続いて、半端整流フィルター12を介して、チップ上の反応場Rに印加するように工夫する。なお、図6中において、WEはその近傍で相互作用が進行する作用電極、REは該作用電極に対向配置される参照電極を示している。
【0050】
ここで、二つの周波数ω1とω2(ω1>ω2)は、図3で示した等価回路の閾値周波数より大きいものとする。さらに、両者の差(ω1−ω2)は、実際に印加したい周波数の2倍に等しいものとする。
【0051】
周波数の近似する正弦波を合成すると、以下の「数式1」で示された平均周波数の高周波電圧が、周波数の差(ω1−ω2)で変調されたうなり(ビート)が発生する。
【0052】
【数1】

【0053】
このビートは、次の「数式2」で表される。ここで、φは、チャンネル1の波のチャンネル2に対する位相差を示している。
【0054】
【数2】

【0055】
この波形は、周波数(ω1+ω2)/2で振動しているので(最初のsin項参照)、周波数は充分に高く、保護膜(絶縁層)を透過して溶液部に印加される。しかし、図5に示された誘電分散の結果から分かるように、周波数が高すぎるとDNAの誘電分極は引き起こさない。その意味では、この高周波成分は、DNA分子に電気的作用を及ぼさない(周波数が高すぎて、DNA分子は「電場を感じない」)。
【0056】
一方、高周波成分の振幅は、周波数(ω1-ω2)/2で変調されている(次のcos項参照)。この変調周波数は、所望の周波数と等しいので、実効的には、DNA分子に低周波電圧が印加されていることになる。
【0057】
実際には、ビート(うなり)の半周期中に、sin項が-1から+1までの間で振動するので、cos項が正のときは高周波の負成分を、cos項が負のときは高周波の正成分をカットしなければならない。この交流の半波整流は、最も簡単な実施形態では、回路にダイオードを挿入することによって実施できる。ダイオードは、一方向にしか電流を流さないので半波整流を実施できる。
【0058】
ただし、本発明の場合、ビートの半周期ごとに正負の極性を交互にカットする必要がある。これを実現できる電子回路は様々に考えられるが、例えば、極性が逆のダイオードを並列に並んだフィルター回路に対して、ビートの半周期と同期してスイッチングすることで、目的の波形が得られる。
【0059】
図5のデータと該データから導かれるスケーリング則に基づいて、ω1= 220MHz、ω2=200MHzとして、図6の回路形態に基づいて、重畳交流電圧を印加した。オシロスコープで観測した波形を図7に示す。
【0060】
なお、周波数は200MHz以上なので、図4から分かるように、マイクロチップに電圧が印加される。本発明では、周波数210MHzの高周波電圧が、周波数10MHzで変調されている。
【0061】
DNAなどの核酸分子は、周波数10MHzで誘電分極すると考えられるので、本発明では核酸分子の誘電分極効果を充分に期待できる。したがって、本発明を適用することにより、電極表面に保護膜が形成された場合でも、任意の周波数の電圧をDNAチップなどのマイクロチップに印加し、誘電泳動の効果を得ることができる。
【0062】
ここで、交流の片方の極性がカットされた交流が、保護膜(絶縁層)を透過できることについて説明する。
【0063】
絶縁膜のキャパシターと溶液の複素インピーダンスをZ1、Z2とすると、次の「数式3」に示すように、いかなる場合でも、印加電圧Vはインピーダンスの比に分割される。
【0064】
【数3】

【0065】
次に、印加する交流の、たとえば負の極性をカットする半波整流フィルターに相当する演算をFで定義すると、整流後の溶液にかかる電圧は、次の「数式4」で示すことができる。したがって、反応溶液にかかる電圧は、もとの電圧を半波整流したものと同じになる。即ち、交流の片方の極性がカットされた交流は、保護膜(絶縁層)を透過できる。
【0066】
【数4】

【0067】
次に、誘電泳動力は、交流の実効値の2乗の勾配(gradient)に比例する。うなり(ビート)の時間平均を取るとき、高周波成分は振動が速いので無視して、ビート項のみの時間平均を取ればよい。すると、ビートの振幅はもとの高周波の2倍なので、むしろ誘電泳動力は大きくなる。なお、誘電泳動以外の作用を用いる場合でも、電場の振幅が2倍になるとして扱ってよい。
【0068】
以上の実験結果や考察から、本発明では、電極構造にとくに関係なく、当該電極を絶縁膜で保護した形態においても、低周波電圧を(反応場の)反応溶液に印加できる。過剰の電圧印加の必要もなくなるので、電極表面での電気化学的反応の発生や電極の溶解などを確実に防止することができる。この結果、電気泳動や誘電泳動などの電気力学的作用を自在に利用して、物質間の相互作用の反応効率や精度を向上させることができる。
【0069】
また、本発明では前記電気化学反応の影響を気にすることなく、電極表面に対して相互作用に係わる物質(例えば、核酸分子)を固定できる。さらに、本発明によれば、電極および保護膜材料の選択肢が広がるので、コスト低減やチップ製造の容易化を達成できる。
【産業上の利用可能性】
【0070】
本発明は、物質間の相互作用を進行させる反応場、例えば、DNAチップやプロテインチップその他のセンサーチップの設計や製造に利用できる。より具体的には、物質間の相互作用を進行させる反応場において電気泳動や誘電泳動などの電気力学的作用を利用するときに有用である。
【図面の簡単な説明】
【0071】
【図1】基礎実験で用いた模擬センサーチップの構造を示す図(上:平面図、下:縦断面図)である。
【図2】電圧印加を行った反応場(R1)と、電圧印加を行わなかった反応場(R2)のハイブリダイゼーション精度の比較を示す図面代用グラフである。
【図3】同基礎実験を行った系の等価電気回路を示す図である。
【図4】図1で示した模擬センサーチップの溶液部のインピーダンスの回路全体のインピーダンスに対する比を周波数の関数として示した図面代用グラフである
【図5】DNAの分極がどの程度の周波数で起こるかを明らかにするために、2本鎖DNAの誘電分散(誘電率の周波数依存性)を示す図面代用グラフである。
【図6】本発明で採用可能な電気回路を示す図であって、2チャンネルのファンクションジェネレーターから周波数の近い正弦波を発生させ、両者を合成してからアンプで増幅し、続いて、半端整流フィルターを介して、チップに印加する構成の電気回路図である。
【図7】図6の回路形態に基づいて、重畳交流電圧を印加した。オシロスコープで観測した波形を示す図である。
【符号の説明】
【0072】
10 2チャンネルの関数発生器
11 アンプ(増幅器)
12 半端整流フィルター
R 反応場
RE 参照電極
WE 作用電極
【特許請求の範囲】
【請求項1】
物質間の相互作用を進行させる反応場と、
該反応場に臨む電極へ電圧を印加することにより、所望の電気力学的作用を前記反応場へ加えるための電圧印加手段と、を少なくとも備えており、
前記電圧印加手段が、周波数が異なる二つの正弦波電圧を重畳印加してうなり(ビート)を発生する手段を備える物質間相互作用検出装置。
【請求項2】
前記電圧印加手段は、半波整流によって前記うなりの周期ごとに正負の極性をカットすることが可能な電気回路を用いることを特徴とする請求項1記載の物質間相互作用検出装置。
【請求項3】
前記電極は、絶縁層で被覆されていることを特徴とする請求項1記載の物質間相互作用検出装置。
【請求項4】
前記電極には前記相互作用に関与する物質が固定されていることを特徴とする請求項1記載の物質間相互作用検出装置。
【請求項5】
前記電気力学的効果は、電気泳動又は誘電泳動であることを特徴とする請求項1記載の物質間相互作用検出装置。
【請求項6】
所望の電気力学的作用を利用して物質間の相互作用を進行させる手順において、
周波数が異なる二つの正弦波電圧を重畳印加してうなり(ビート)を発生させることによって、前記相互作用が進行する反応場での電気化学反応を抑制することを特徴とする物質間相互作用検出方法。
【請求項1】
物質間の相互作用を進行させる反応場と、
該反応場に臨む電極へ電圧を印加することにより、所望の電気力学的作用を前記反応場へ加えるための電圧印加手段と、を少なくとも備えており、
前記電圧印加手段が、周波数が異なる二つの正弦波電圧を重畳印加してうなり(ビート)を発生する手段を備える物質間相互作用検出装置。
【請求項2】
前記電圧印加手段は、半波整流によって前記うなりの周期ごとに正負の極性をカットすることが可能な電気回路を用いることを特徴とする請求項1記載の物質間相互作用検出装置。
【請求項3】
前記電極は、絶縁層で被覆されていることを特徴とする請求項1記載の物質間相互作用検出装置。
【請求項4】
前記電極には前記相互作用に関与する物質が固定されていることを特徴とする請求項1記載の物質間相互作用検出装置。
【請求項5】
前記電気力学的効果は、電気泳動又は誘電泳動であることを特徴とする請求項1記載の物質間相互作用検出装置。
【請求項6】
所望の電気力学的作用を利用して物質間の相互作用を進行させる手順において、
周波数が異なる二つの正弦波電圧を重畳印加してうなり(ビート)を発生させることによって、前記相互作用が進行する反応場での電気化学反応を抑制することを特徴とする物質間相互作用検出方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【公開番号】特開2006−284262(P2006−284262A)
【公開日】平成18年10月19日(2006.10.19)
【国際特許分類】
【出願番号】特願2005−102121(P2005−102121)
【出願日】平成17年3月31日(2005.3.31)
【出願人】(000002185)ソニー株式会社 (34,172)
【Fターム(参考)】
【公開日】平成18年10月19日(2006.10.19)
【国際特許分類】
【出願日】平成17年3月31日(2005.3.31)
【出願人】(000002185)ソニー株式会社 (34,172)
【Fターム(参考)】
[ Back to top ]

