正極活物質及びその製造方法、正極ならびに非水電解質二次電池
【課題】容量劣化が抑制され、サイクル特性に優れた非水電解質二次電池を与える正極活物質の製造方法、それにより得られた正極活物質、それを用いた正極及び非水電解質二次電池を提供することを課題とする。
【解決手段】オリビン構造を有する下記一般式(1)で示される正極活物質を形成するのに必要なリチウム源、M源、リン源及びX源の各所定量を溶媒に溶解させて溶液を調製する工程と、得られた溶液を環状エーテルの付与によりゲル化させる工程と、生成したゲルを焼成処理することで炭素被覆されたリチウム含有複合酸化物を得る工程を含む、一般式(1):LixMyP1-zXzO4で表される化合物(式中、Mは、Fe、Ni、Mn、Zr、Sn、Al及びYからなる群から選択される少なくとも1種の元素であり、Xは、Si及びAlから成る群から選択される少なくとも1種であり、0<x≦2、0.8≦y≦1.2、0≦z≦1の範囲である)を得ることを特徴とする正極活物質の製造方法により上記課題を解決する。
【解決手段】オリビン構造を有する下記一般式(1)で示される正極活物質を形成するのに必要なリチウム源、M源、リン源及びX源の各所定量を溶媒に溶解させて溶液を調製する工程と、得られた溶液を環状エーテルの付与によりゲル化させる工程と、生成したゲルを焼成処理することで炭素被覆されたリチウム含有複合酸化物を得る工程を含む、一般式(1):LixMyP1-zXzO4で表される化合物(式中、Mは、Fe、Ni、Mn、Zr、Sn、Al及びYからなる群から選択される少なくとも1種の元素であり、Xは、Si及びAlから成る群から選択される少なくとも1種であり、0<x≦2、0.8≦y≦1.2、0≦z≦1の範囲である)を得ることを特徴とする正極活物質の製造方法により上記課題を解決する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、正極活物質及びその製造方法、正極ならびに非水電解質二次電池に関する。更に詳しくは、本発明は、サイクル特性に優れた非水電解質二次電池を与える正極活物質及びその製造方法、それを用いた正極ならびに非水電解質二次電池に関する。
【背景技術】
【0002】
非水電解質二次電池として、リチウム二次電池が実用化されており、広く普及している。更に近年、リチウム二次電池は、ポータブル電子機器用の小型のものだけでなく、車載用や電力貯蔵用等の大容量のデバイスとしても注目されている。そのため、安全性やコスト、寿命等の要求がより高くなっている。
リチウム二次電池は、その主たる構成要素として正極、負極、電解液、セパレータ及び外装材を有する。また、上記正極は、正極活物質、導電材、集電体及びバインダー(結着剤)により構成される。
【0003】
一般に、正極活物質としては、コバルト酸リチウム(LiCoO2)に代表される層状遷移金属酸化物が用いられている。しかしながら、層状遷移金属酸化物は、満充電状態において、150℃前後の比較的低温で酸素脱離を起こし易く、当該酸素脱離により電池の熱暴走反応が起こり得る。従って、このような正極活物質を有する電池をポータブル電子機器に用いる場合、電池の発熱、発火等の事故が発生する恐れがある。
このため、構造が安定し異常時に酸素を放出せず、LiCoO2より安全なオリビン型構造を有するリチウム含有複合酸化物、例えばリン酸鉄リチウム(LiFePO4)が期待されている。リン酸鉄リチウムは、地殻存在度が低いコバルトを含まないため、比較的安価であるという利点もある。また、リン酸鉄リチウムは、層状遷移金属酸化物よりも、構造的に安定であるという利点もある。
【0004】
しかしながら、リン酸鉄リチウムを正極活物質として用いた場合、充放電の繰り返しに伴う放電容量の低下が大きく、得られる電池の寿命が短いという問題がある。これは充放電によりLiの挿入脱離に起因する正極活物質の膨張若しくは収縮が大きいため、サイクル数が増えると正極活物質が集電体や導電材から物理的に徐々に欠落し、正極活物質の構造が破壊され、充放電に寄与しない活物質が増加して、放電容量の低下が起きるためである。これに対し、固相法により得られた、リン酸鉄リチウムを基本構造とし、元素置換を行ったリチウム含有複合酸化物を正極活物質に用いることにより、正極活物質の膨張収縮を抑制する方法が検討されている(例えば、特許文献1及び2)。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特開2002−198050号公報
【特許文献2】特表2005−519451号公報
【発明の概要】
【発明が解決しようとする課題】
【0006】
しかしながら、特許文献1や2で用いられている固相法を用いて製造した場合、不純物が生成し、単一相のオリビン型構造を有するリチウム含有複合酸化物を製造するのが困難であるという問題がある。また、固相法では、焼成して得たリチウム含有複合酸化物は凝集しているため、粉砕してその粒径を制御する必要があるが、粉砕によりリチウム含有複合酸化物の結晶性が低下し、容量の低下をもたらすという問題もある。
そのため、単一相のオリビン型構造を有するリチウム含有複合酸化物を製造でき、リチウム含有複合酸化物の結晶性を低下させることなく粒径を制御できる方法が必要とされている。
そこで、本発明は、単一相のオリビン型構造を有するリチウム含有複合酸化物を製造でき、かつリチウム含有複合酸化物の結晶性を低下させることなく粒径を制御できる、リチウム含有複合酸化物の製造方法を提供することを目的とした。
【課題を解決するための手段】
【0007】
本発明者等は、オリビン型構造を有するリチウム含有複合酸化物について鋭意検討する過程で、LiFePO4の鉄元素とリン元素の一部を別の元素で置換したリチウム含有複合酸化物を正極活物質に用いると電池の寿命が向上することを見出した。
【0008】
かくして本発明によれば、オリビン構造を有する下記一般式(1)で示される正極活物質を形成するのに必要なリチウム源、M源、リン源及びX源の各所定量を溶媒に溶解させて溶液を調製する工程と、得られた溶液を環状エーテルの付与によりゲル化させる工程と、
生成したゲルを焼成処理することで炭素被覆されたリチウム含有複合酸化物を得る工程
を含む、下記一般式(1):
LixMyP1-zXzO4 (1)
で表される化合物(式中、Mは、Fe、Ni、Mn、Zr、Sn、Al及びYからなる群から選択される少なくとも1種の元素であり、Xは、Si及びAlから成る群から選択される少なくとも1種であり、0<x≦2、0.8≦y≦1.2、0≦z≦1の範囲である)を得ることを特徴とする正極活物質の製造方法が提供される。
【0009】
また、本発明によれば、上記製造方法により得られた正極活物質が提供される。
更に、本発明によれば、上記製造方法により得られた正極活物質と、導電材と、バインダーとを含むことを特徴とする正極が提供される。
また、本発明によれば、上記製造方法により得られた正極活物質を含む正極と、負極と、電解質と、セパレータとを有することを特徴とする非水電解質二次電池が提供される。
【発明の効果】
【0010】
本発明によれば、ゲル中に原料元素を均一に分散できるので、不純物の生成を抑制して単一相のオリビン型構造を有するリチウム含有複合酸化物を製造できる。また、固相法に比べ、ゲルの単位体積当たりの元素濃度が低いため、焼成時に粒子成長しにくい。更に、ゲルを粉砕することにより、ゲル同士の接触面積を小さくして、粒子成長を抑制できる。その結果、一次粒子及び二次粒子の凝集を抑制することが可能となるので、焼成後のリチウム含有複合酸化物を粉砕することなく、その粒径を制御することが可能となり、リチウム含有複合酸化物の結晶性を低下させることがない。これにより、本発明によれば、安全性とコスト面に優れ、更に電池の長寿命化の可能なリチウム二次電池用の正極活物質を提供できる
【図面の簡単な説明】
【0011】
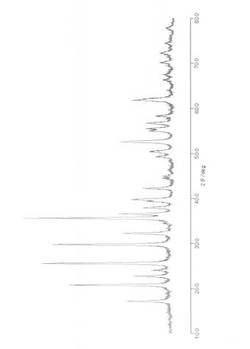
【図1】実施例1の正極活物質の粉末X線回折パターンである。
【図2】実施例2の正極活物質の粉末X線回折パターンである。
【図3】実施例3の正極活物質の粉末X線回折パターンである。
【図4】実施例4の正極活物質の粉末X線回折パターンである。
【図5】実施例5の正極活物質の粉末X線回折パターンである。
【図6】実施例6の正極活物質の粉末X線回折パターンである。
【図7】比較例1の正極活物質の粉末X線回折パターンである。
【図8】二次電池の概略断面図である。
【発明を実施するための形態】
【0012】
(1)リチウム含有複合酸化物(正極活物質)
本発明の正極活物質の製造方法では、オリビン構造を有する下記一般式(1):
LixMyP1-zXzO4 (1)
で表される化合物(式中、Mは、Fe、Ni、Mn、Zr、Sn、Al及びYからなる群から選択される少なくとも1種の元素であり、Xは、Si及びAlから成る群から選択される少なくとも1種であり、0<x≦2、0.8≦y≦1.2、0≦z≦1の範囲である)で示されるリチウム含有複合酸化物が得られる。
リチウム含有複合酸化物の具体例としては、
LixFeyP1-zO4
(0.8≦x≦1.2、0.8≦y≦1.2、z=0)、
LixNiyP1-zO4
(0.8≦x≦1.2、0.8≦y≦1.2、z=0)、
LixMnyP1-zO4
(0.8≦x≦1.2、0.8≦y≦1.2、z=0)、
Lix(Fe,Ni)yP1-zO4
(0.8≦x≦1.2、0.8≦y≦1.2、z=0)、
Lix(Fe,Mn)yP1-zO4
(0.8≦x≦1.2、0.8≦y≦1.2、z=0)、
Lix(Fe,Zr)yP1-zO4
(0.8≦x≦1.2、0.8≦y≦1.2、z=0)、
Lix(Fe,Sn)yP1-zO4
(0.8≦x≦1.2、0.8≦y≦1.2、z=0)、
Lix(Fe,Y)yP1-zO4
(0.8≦x≦1.2、0.8≦y≦1.2、z=0)、
Lix(Fe,Ni)yP1-zSizO4
(0.8≦x≦1.2、0.8≦y≦1.2、0<z≦0.5)、
Lix(Fe,Mn)yP1-zSizO4
(0.8≦x≦1.2、0.8≦y≦1.2、0<z≦0.5)、
Lix(Fe,Zr)yP1-zSizO4
(0.8≦x≦1.2、0.8≦y≦1.2、0<z≦0.5)、
Lix(Fe,Sn)yP1-zSizO4
(0.8≦x≦1.2、0.8≦y≦1.2、0<z≦0.5)、
Lix(Fe,Y)yP1-zSizO4
(0.8≦x≦1.2、0.8≦y≦1.2、0<z≦0.5)、
等を挙げることができる。Mが複数の元素から構成されている場合、それぞれの原子%の値は、M全量に対して、0原子%より多く、100原子%未満の範囲のいずれの値をも取り得る。
【0013】
正極活物質として使用する観点から、特に好ましいリチウム含有複合酸化物は、
Lix(Fe,Zr)yP1-zSizO4
(0.8≦x≦1.2、0.8≦y≦1.2、0<z≦0.5)、
Lix(Fe,Sn)yP1-zSizO4
(0.8≦x≦1.2、0.8≦y≦1.2、0<z≦0.5)、
Lix(Fe,Y)yP1-zSizO4
(0.8≦x≦1.2、0.8≦y≦1.2、0<z≦0.5)、
Lix(Fe,Ti)yP1-zSizO4
(0.8≦x≦1.2、0.8≦y≦1.2、0<z≦0.5)、
Lix(Fe,Nb)yP1-zSizO4
(0.8≦x≦1.2、0.8≦y≦1.2、0<z≦0.5)、
Lix(Fe,V)yP1-zSizO4
(0.8≦x≦1.2、0.8≦y≦1.2、0<z≦0.5)、
である。
リチウム含有複合酸化物は、通常粒子の形状で使用される。一次粒子の粒径は、リチウムイオンの挿入脱離の効率を高めるために、1μm以下、好ましくは10nm〜1μmである。一次粒子の粒径の下限は、10nm程度が挿入脱離の効率と製造コストとの兼ね合いから現実的である。なお、一次粒子の粒径は、SEMによる直接観察及びレーザー回折・散乱法による粒度分布測定装置により測定できる。
【0014】
(2)リチウム含有複合酸化物の製造方法
本発明は、上記一般式(1)のリチウム含有複合酸化物を製造する方法であり、原料物質を溶媒に溶解させる工程(以下、溶解工程という。)、得られた溶液をゲル化させる工程(以下、ゲル化工程という。)、得られたゲルを粉砕してゲルの平均粒径を0.1〜50μmとする工程(以下、粉砕工程という。)、得られたゲルを焼成する工程(以下、焼成工程という。)を少なくとも含む。なお、必要に応じて、ゲル化工程で得られたゲルから溶媒を除去する工程(以下、乾燥工程という。)や、焼成前のゲルに炭素源となる物質を混合する工程(以下、炭素源混合工程という。)を設けることもできる。
【0015】
(i)溶解工程
原料物質であるリチウム源、元素M源、リン源及び元素X源は、溶媒に溶解しうる化合物であれば特に限定されない。これら化合物は、100gの溶媒に10mmol以上溶解する化合物であることが好ましい。
【0016】
(リチウム源)
リチウム源となる物質は、一般式(1)の正極活物質の原料になり得、溶媒に可溶で、本発明の製造方法を阻害しない化合物であれば特に限定されない。リチウムの無機塩、水酸化物、有機酸塩、金属アルコキシド及びこれら塩の水和物を用いることができる。具体的には、無機塩としては、弱酸との塩(以下、弱酸塩という。)である炭酸リチウム(Li2CO3)、強酸との塩(以下、強酸塩という。)である硝酸リチウム(LiNO3)、塩化リチウム(LiCl)を挙げることができる。また、有機塩としては、弱酸塩である、酢酸リチウム(LiCH3COO)、シュウ酸リチウム(COOLi)2を挙げることができる。また、金属アルコキシドとしては、リチウムメトキシド(LiOCH3)、リチウムエトキシド(LiOC2H5)、リチウム-n-プロポキシド(LiO-n-C3H7)、リチウム-i-プロポキシド(LiO-i-C3H7)、リチウム-n-ブトキシド(LiO-n-C4H9)、リチウム-t-ブトキシド(LiO-t-C4H9)、リチウム-sec-ブトキシド(LiO-sec-C4H9)等を挙げることができる。無機塩及び有機塩については、水和物であってもよい。これらの中でも、大気雰囲気下で均一な溶液を作製しやすい、安価であるという観点から弱酸塩又は強酸塩が好ましく、その中でも酢酸リチウム又は硝酸リチウムが好ましい。なお、本発明において「均一な溶液」とは、目視観察により目視観察により沈殿物の生成が認められず、2相以上に分離していない状態をいう。
【0017】
以下、リチウム源の溶解方法について、元素Mに鉄とジルコニウム、元素Xにシリコンを用い、溶媒にエタノールを用いた場合について説明する。
リチウム源として、弱酸塩の無水物を用いる場合は、エタノールへの溶解性が低いため、鉄源の塩の水和物あるいはジルコニウム源の塩の水和物を溶解した後に溶解させることが好ましい。鉄源の塩の水和物あるいはジルコニウム源の塩の水和物を加える前に溶解させる場合は、予め水に溶解させておくことが好ましい。あるいは、弱酸塩の無水物が溶解するのに必要な量の水をエタノールへ添加しておいてもよい。弱酸塩の無水物を溶解させる水の量としては、Liのモル数の1倍〜100倍の水が好ましく、より好ましくは4倍〜20倍である。
【0018】
また、弱酸塩の無水物は、鉄源、ジルコニウム源、シリコン源との任意の組合せにおいて、任意の順番で溶解させても均一な溶液を得ることができる。得られた均一な溶液を予め反応させた後に、残りの原料を加えてもよい。弱酸塩の無水物は鉄源の塩の水和物と予め反応させておくことが好ましい。弱酸塩の無水物と鉄源の塩の水和物を予め反応させることにより、リン酸を加えた際に沈殿物ができるのを抑制できる。
また、弱酸塩の無水物はテトラメトキシシランもしくはテトラエトキシシランと予め反応させておくことが好ましく、特にテトラメトキシシランと反応させることが好ましい。このときの混合の手順としては、弱酸塩の無水物を水に溶解させた後、エタノールを加え、テトラメトキシシランもしくはテトラエトキシシランを加えることが好ましい。これらを混合した後に30℃から60℃に加熱する事で、より反応を促進できる。加熱の時間は特に限定されないが、30分から12時間程度が適当である。弱酸塩の無水物とシリコン源を予め反応させることにより、焼成後の不純物の発生やリチウム複合酸化物におけるLiサイトへのFeの置換を抑制できる。
【0019】
(元素M源)
元素M源となる物質は、一般式(1)の正極活物質の原料になり得、溶媒に可溶で、本発明の製造方法を阻害しない化合物であれば特に限定されない。元素Mの無機塩、水酸化物、有機酸塩、金属アルコキシド及びこれら塩の水和物を用いることができる。前述の通り、Mは、Fe、Ni、Mn、Zr、Sn、Al及びYからなる群から選択される少なくとも1種の元素であり、少なくともFeを含むことが好ましい。例えば、鉄源としては、無機塩として、弱酸塩である炭酸鉄(II)(Fe(CO3))、強酸塩である硝酸鉄(II)(Fe(NO3)2)、硝酸鉄(III)(Fe(NO3)3)、塩化鉄(II)(FeCl2)及び塩化鉄(III)(FeCl3)を挙げることができる。また、有機塩としては、弱酸塩である、シュウ酸鉄(II)(FeC2O4)、シュウ酸鉄(III)(Fe2(C2O4)3)、酢酸鉄(II)(Fe(CH3COO)2)及び酢酸鉄(III)(Fe(CH3COO)3)を挙げることができる。好ましくは強酸塩の水和物、その中でも硝酸鉄(III)の9水和物が好ましい。
【0020】
以下、元素M源の溶解方法について、元素Mに鉄とジルコニウム、元素Xにシリコンを用い、溶媒にエタノールを用いた場合について説明する。
強酸塩の水和物は、リチウム源、ジルコニウム源、シリコン源との任意の組合せにおいて、任意の順番に溶解させても均一な溶液を得ることができる。得られた均一な溶液を予め反応させた後に、残りの原料を加えてもよい。強酸塩の水和物はリン酸よりも先に溶媒に加えることが好ましい。強酸塩の水和物のみを予め反応させることにより、焼成後の不純物の生成を抑制できるので、強酸塩の水和物は、強酸塩の水和物のみをエタノール中に溶解させた後に、沈殿物が生じない程度に熱をかけることにより予め反応させてもよい。
【0021】
(ジルコニウム源)
また、ジルコニウム源としては、無機塩として、ジルコニウムハロゲン化物である塩化ジルコニウム(ZrCl4)、臭化ジルコニウム(ZrBr4)、ヨウ化ジルコニウム(ZrI4)、オキシジルコニウム塩である、オキシ塩化ジルコニウム(ZrOCl2)、オキシ硝酸ジルコニウム(ZrO(NO3)2)を挙げることができる。また、金属アルコキシドとしては、ジルコニウムメトキシド(Zr(OCH3)4)、ジルコニウムエトキシド(Zr(OC2H5)4)、ジルコニウム-n-プロポキシド(Zr(O-n-C3H7)4)、ジルコニウム-i-プロポキシド(Zr(O-i-C3H7)4)、ジルコニウム-n-ブトキシド(Zr(O-n-C4H8)4)、ジルコニウム-t-ブトキシド(Zr(O-t-C4H8)4)、ジルコニウム-sec-ブトキシド(Zr(O-sec-C4H8)4)等を挙げることができる。好ましくはジルコニウムハロゲン化物、その中でも塩化ジルコニウムが好ましい。
【0022】
ジルコニウムハロゲン化物は、リチウム源、鉄源、シリコン源との任意の組合せにおいて、任意の順番に溶解させても均一な溶液を得ることができる。ジルコニウムハロゲン化物を、強酸塩の水和物からなる鉄源と予め反応させておくことが好ましい。ジルコニウムハロゲン化物を強酸塩の水和物からなる鉄源と予め反応させることにより、焼成後にジルコニアやリン酸ジルコニウム等の不純物が形成するのを抑制できる。また、ジルコニウムハロゲン化物はテトラメトキシシランもしくはテトラエトキシシランと予め反応させておくことが好ましく、特にテトラメトキシシランと反応させることが好ましい。ジルコニウムハロゲン化物とシリコン源を予め反応させることにより、焼成後の不純物の発生やリチウム複合酸化物におけるLiサイトへのFeの置換を抑制できる。
【0023】
(リン源)
リン源となる物質は、一般式(1)の正極活物質の原料になり得、溶媒に可溶で、本発明の製造方法を阻害しない化合物であれば特に限定されない。具体的には、リン酸(H3PO4)、リン酸水素アンモニウム((NH4)2HPO4)、リン酸二水素アンモニウム(NH4H2PO4)等を挙げることができる。これらの中でも、リン酸が好ましい。
【0024】
以下、リン源の溶解方法について、元素Mに鉄とジルコニウム、元素Xにシリコンを用い、溶媒にエタノールを用いた場合について説明する。
リン酸は、少なくともリチウム源、鉄源及びジルコニウム源を溶解させた後で、投入する必要がある。リン酸をリチウムの弱酸塩無水物やジルコニウムハロゲン化物と混合すると、沈殿物が生成するからである。リン酸を加える際は、過剰にリン酸を加えてもよい。リン酸を過剰に加えることにより、焼成後の不純物の発生やリチウム複合酸化物におけるLiサイトへのFeの置換を抑制できる。過剰にリン酸を加える場合、化学量論比のリン酸に対して5〜20重量%の範囲で、より好ましくは5〜15重量%の範囲で過剰に加えることができる。
【0025】
(元素X源)
元素X源となる物質は、一般式(1)の正極活物質の原料になり得、溶媒に可溶で、本発明の製造方法を阻害しない化合物であれば特に限定されない。元素Xの金属アルコキシドを用いることができる。Xは、SiとAlからなる群から選択される少なくとも1種の元素であり、好ましくはSiである。例えば、シリコン源としては、テトラエトキシシラン(Si(OC2H5)4)、テトラメトキシシラン(Si(OCH3)4)、メチルトリエトキシシラン(CH3Si(OC2H5)3)、メチルトリメトキシシラン(CH3Si(OCH3)3)、エチルメトキシシラン(C2H5Si(OCH3)3)、エチルトリエトキシシラン(C2H5Si(OC2H5)3)等の種々のシリコンアルコキシドを挙げることができる。テトラエトキシシランあるいはテトラメトキシシランが好ましい。
【0026】
以下、元素X源の溶解方法について、元素Mに鉄とジルコニウム、元素Xにシリコンを用い、溶媒にエタノールを用いた場合について説明する。
シリコンアルコキシドは、リチウム源、鉄源、ジルコニウム源との任意の組合せにおいて、任意の順番に溶解させても均一な溶液を得ることができる。シリコンアルコキシドの反応を促進するため、水を加えてもよい。加える水の量としては、シリコンのモル数の1倍〜100倍、より好ましくは2倍〜20倍である。水を加えることにより加水分解が進み、反応を促進できる。シリコンアルコキシドをリン酸と予め反応させることもできる。テトラエトキシシランを用いる場合は、40℃〜80℃で反応をさせることが好ましく、より好ましくは50℃〜80℃で反応させることが好ましい。テトラメトキシシランを用いる場合は、20℃〜60℃で反応させることが好ましい。テトラメトキシシランと、リチウム源となる弱酸塩無水物を反応させる場合、(リチウム源のLiのモル数/シリコン源のSiのモル数)≧2であることが好ましい。
【0027】
(溶媒)
溶媒としては水、アルコール類、アセトン、アセトニトリル、テトラヒドロフラン、N,N−ジメチルホルムアミド、ジメチルスルホキシド、酢酸、ギ酸等が挙げられるが、上記の原料を溶解でき、本発明の製造方法を阻害しない液体であれば特に限定されるものではない。これらの中でも、安価である、取り扱いが容易であるとの観点からアルコール類が好ましい。
アルコール類であれば特に限定されるものでなく、例えば、メタノール、エタノール、n−プロパノール、i−プロパノール、n−ブタノール、sec−ブタノール、t−ブタノール、エチレングリコール、グリセリン等が挙げられ、これらの中でも、安価である、取り扱いが容易であるとの観点からメタノール及びエタノール、n−プロパノール、i−プロパノールが特に好ましい。
なお、アルコールへの溶解性が低い原料物質を溶解させるために、必要に応じて水との混合溶媒としてもよい。溶媒の量は、全原料物質を溶解できれば特に限定されない。但し、溶媒の回収コストを考慮すると、溶媒の量は、全原料物質の総モルに対して、1〜100倍のモル比の範囲、より好ましくは、2〜15倍のモル比の範囲である。
(溶解方法)
溶解工程においては、原料物質を溶解させる順番によっては沈殿物が生成して均一な溶液ができない場合がある。そのため、原料物質を溶解させる順番が重要となる。
【0028】
以下、元素Mに鉄とジルコニウム、元素Xにシリコンを用いた場合について説明する。前述のように、リン酸を弱酸塩のリチウム源、特に塩無水物やジルコニウム源と混合すると沈殿物が生成し、またジルコニウムイオンは鉄イオンの存在により安定化される。そのため、少なくともリチウム源、鉄源及びジルコニウム源を溶解させた溶媒にリン源を溶解させる必要がある。シリコン源は、リン源を溶解させる前に溶解させてもよく、あるいはリン源を溶解させた後に溶解させてもよい。
なお、本発明において、原料物質を溶解させる順番とは、溶媒に順次原料物質を投入する場合には、投入する原料物質の順番をいうが、予め複数の原料物質を溶媒に溶解させた溶液を準備し、その溶液を混合する場合には、その混合する順番をいう。
【0029】
リチウム源、鉄源及びジルコニウム源を溶解させた溶媒を調製する順番としては、ジルコニウムイオンを鉄イオンにより安定化できれば特に限定されない。ジルコニウムイオンを鉄イオンにより安定化させる方法としては、溶媒中に鉄の強酸塩水和物を溶解させた後に、ジルコニウムハロゲン化物を溶解させる方法や、溶媒中にジルコニウムハロゲン化物を溶解させた後に、鉄の強酸塩水和物を溶解させる方法や、溶媒中に鉄の強酸塩水和物とジルコニウムハロゲン化物を同時に溶解させる方法を挙げることができる。なお、鉄源とジルコニウム源の溶解の順番は特に限定されず、いずれが一方を先に溶解させても、あるいは両者を同時に溶解させてもよい。
また、リチウム源に塩無水物、例えば酢酸リチウムを用いると、溶媒中に水が含まれていないと溶解しない。そのため、リチウム源に塩無水物を用いる場合には、鉄の塩の水和物、ジルコニウムの塩の水和物を溶媒に溶解させた後に投入して、溶解させることが好ましい。
原料物質を溶媒に溶解させる際、室温以上となるように加熱してもよい。加熱温度としては、30℃〜80℃、より好ましくは30℃〜60℃である。
なお、上記の溶解工程の説明では、元素Mに鉄とジルコニウム、元素Xにシリコンを用いた例について説明したが、上記一般式(1)に含まれる元素M及びXであって、全原料物質を溶媒に均一に溶解できる組合せであれば特に限定されない。
【0030】
(ii)ゲル化工程
本工程では、溶解工程により得られた溶液をゲル化させる。
ゲル化は、Li、元素M、P及び元素Xが酸素原子を介して結合する一群の集合体となり、この集合体がゲル中で数nmから数十nmの粒径の微粒子として析出することで溶液の粘度が上昇することにより行われると発明者等は考えている。
ゲル化を促進させるために、溶液に環状エーテルを添加することが好ましい。ゲル化方法は、溶液を静置してもよく、あるいは溶液を撹拌してもよい。
環状エーテルとしては、エチレンオキシド、プロピレンオキシド、トリメチレンオキシド、cis−2,3−エポキシブタン、1,2−エポキシブタン、グリシドール、エピクロロヒドリン、エピフロロヒドリン、エピブロモヒドリン、3,3−ジメチルオキセタンからなる群から選択された少なくとも1種を用いることができる。これら環状エーテルの内、均一なゲルを製造する、安価であるとの観点からプロピレンオキシドが好ましい。環状エーテルの添加量は、溶液をゲル化できる量であれば特に限定されないが、全原料物質のモル数に対し、1〜100倍のモル数が好ましい。この範囲とすることにより、ゲル中に各原料物質をより均一に分散でき、更には粒子表面を覆う炭素の原料となりうる。また、必要に応じて、環状エーテルを添加した溶液を加熱してもよい。
【0031】
(iii)乾燥工程
本工程では、ゲル化したゲルから残留する溶媒を除去する。溶媒の除去方法としては、室温で静置する方法や、30〜80℃に加熱して溶媒を除去する方法や、ロータリーポンプ等用いたチャンバー内にゲルを設置し、減圧して溶媒を除去する方法等を用いることができる。また、溶液調製時に使用した溶媒よりも揮発性の高い溶媒や表面張力の異なる溶媒と溶媒交換を行った後に前述と同じ方法で溶媒を除去してもよい。溶媒交換に用いる溶媒としてはトルエン、ベンゼン、ヘキサン、テトラヒドロフラン、イソプロパノール及びこれらの混合溶媒を挙げることができる。また、本工程で得られたゲルを超臨界状態の二酸化炭素に浸して溶媒を抽出することで溶媒を除去することもできる。これらの除去した溶媒は工業的観点から回収して再利用することが好ましい。
【0032】
(iv)粉砕工程
得られたゲルを機械的に粉砕することで二次粒子のサイズを制御してもよい。粉砕方法は特に限定されず、必要に応じて加温、冷却及び雰囲気制御をする方法を挙げることができる。
(v)炭素源混合工程
糖類、油脂類や合成樹脂材料を、粉砕したゲルと混合してもよい。これら化合物は、焼成時に炭化することにより正極材料の表面に炭素被覆を形成し、正極材料の導電性を向上できる。炭素による被覆は、全面でもよく、一部でもよいが、良好な電極特性を得るためには、全面が均一に被覆されているのが好ましい。ここで「均一」とは、正極活物質上の被覆炭素の厚みが一定である状態を意味する。この状態は、透過型電子顕微鏡により確認できる。糖類としては、スクロース、フルクトース等を用いることができる。また、合成樹脂材料としては、ポリエーテル類としてはポリエチレングリコールやポリプロピレングリコール等のポリエーテル類や、ポリビニルアルコール、ポリアクリルアミド、カルボキシメチルセルロース、ポリ酢酸ビニル等を用いることができる。
【0033】
(vi)焼成工程
本工程では、得られたゲルを焼成することでリチウム含有複合酸化物を得る。焼成は、400〜700℃、好ましくは400〜600℃の温度範囲で、1〜24時間をかけて行う。焼成時の雰囲気は、不活性雰囲気(アルゴン、窒素、真空等の雰囲気)又は還元性雰囲気(水素含有不活性ガス、一酸化炭素等の雰囲気)を用いることができる。均一に焼成を行うため、ゲルを撹拌してもよく、焼成時にNOxやSOx、塩素等の有毒なガスが発生する場合は、除去装置を設けてもよい。
(vii)その他の工程
得られたリチウム含有複合酸化物は、必要に応じて、粉砕工程及び/又は分級工程に付すことで、所望の粒径に調製してもよい。
(viii)用途
得られたリチウム含有複合酸化物は、非水系電解質二次電池の正極活物質に使用できる。正極活物質には、上記リチウム含有複合酸化物以外に、LiCoO2、LiNiO2、LiFeO2、LiMnO2、LiMn2O4、Li2MnO3、LiCoPO4、LiNiPO4、LiMnPO4、LiFePO4等の他の酸化物が含まれていてもよい。
【0034】
(II)非水電解質二次電池
非水電解質二次電池は、正極と負極と非水電解質とセパレータとを有する。以下、各構成材料について説明する。
(a)正極
正極は、正極活物質と導電材とバインダーと集電体とを含み、例えば、活物質と導電材とバインダーとを有機溶剤と混合したスラリーを集電体に塗布する等の公知の方法によって作製できる。なお、得られたリチウム含有複合酸化物が十分に高い導電性を有する場合には、導電材は必ずしも添加する必要はない。
バインダー(結着材)としては、ポリテトラフルオロエチレン、ポリビニリデンフルオライド、ポリビニルクロライド、エチレンプロピレンジエンポリマー、スチレン−ブタジエンゴム、アクリロニトリル−ブタジエンゴム、フッ素ゴム、ポリ酢酸ビニル、ポリメチルメタクリレート、ポリエチレン、ニトロセルロース、スチレンーブタジエンゴム等を用いることができる。必要に応じてカルボキシメチルセルロース等の増粘材を使用することもできる。
【0035】
導電材としては、アセチレンブラック、カーボン、グラファイト、天然黒鉛、人造黒鉛、ニードルコークス等を用いることができる。
集電体としては、連続孔を持つ発泡(多孔質)金属、ハニカム状に形成された金属、焼結金属、エキスパンドメタル、不織布、板、箔、孔開きの板、箔等を用いることができる。
有機溶剤としては、N−メチル−2−ピロリドン、トルエン、シクロヘキサン、ジメチルホルムアミド、ジメチルアセトアミド、メチルエチルケトン、酢酸メチル、アクリル酸メチル、ジエチルトリアミン、N−N−ジメチルアミノプロピルアミン、エチレンオキシド、テトラヒドロフラン等を用いることができる。バインダーに水溶性のものを使用する場合は溶媒として水を用いることもできる。
正極の厚さは、0.01〜20mm程度が好ましい。厚すぎると導電性が低下し、薄すぎると単位面積当たりの容量が低下するので好ましくない。なお、塗布並びに乾燥によって得られた正極は、活物質の充填密度を高めるためローラープレス等により圧縮してもよい。
【0036】
(b)負極
負極は公知の方法により作製できる。具体的には、正極の作製法で説明した方法と同様にして作製できる。つまり、正極の作製法で説明した公知の結着材と公知の導電材とを負極活物質と混合した後、この混合粉末をシート状に成形し、当該成形体をステンレス、銅等の導電体網(集電体)に圧着すればよい。また、上記混合粉末を正極作製法で説明した公知の有機溶剤と混合して得られたスラリーを銅等の金属基板上に塗布することにより作製することもできる。
負極活物質としては公知の材料を用いることができる。高エネルギー密度電池を構成するためには、リチウムの挿入/脱離する電位が金属リチウムの析出/溶解電位に近いものが好ましい。その典型例は、粒子状(鱗片状、塊状、繊維状、ウィスカー状、球状、粉砕粒子状等)の天然黒鉛もしくは人造黒鉛のような炭素材料である。
【0037】
人造黒鉛としては、メソカーボンマイクロビーズ、メソフェーズピッチ粉末、等方性ピッチ粉末等を黒鉛化して得られる黒鉛が挙げられる。また、非晶質炭素を表面に付着させた黒鉛粒子も使用できる。これらの中で、天然黒鉛は、安価でかつリチウムの酸化還元電位に近く、高エネルギー密度電池が構成できるためより好ましい。
また、リチウム遷移金属酸化物、リチウム遷移金属窒化物、遷移金属酸化物、酸化シリコン等も負極活物質として使用可能である。これらの中で、Li4Ti5O12は電位の平坦性が高く、かつ充放電による体積変化が小さいためより好ましい。
【0038】
(c)非水電解質
非水電解質としては、例えば、有機電解液、ゲル状電解質、高分子固体電解質、無機固体電解質、溶融塩等を用いることができる。非水電解質を注入した後に二次電池の容器の開口部を封止する。封止の前に通電し発生したガスを取り除いてもよい。
有機電解質を構成する有機溶媒としては、プロピレンカーボネート(PC)とエチレンカーボネート(EC)、ブチレンカーボネート等の環状カーボネート類、ジメチルカーボネート(DMC)、ジエチルカーボネート(DEC)、エチルメチルカーボネート、ジプロピルカーボネート等の鎖状カーボネート類、γ−ブチロラクトン(GBL)、γ−バレロラクトン等のラクトン類、テトラヒドロフラン、2−メチルテトラヒドロフラン等のフラン類、ジエチルエーテル、1,2−ジメトキシエタン、1,2−ジエトキシエタン、エトキシメトキシエタン、ジオキサン等のエーテル類、ジメチルスルホキシド、スルホラン、メチルスルホラン、アセトニトリル、ギ酸メチル、酢酸メチル等が挙げられ、これらの1種以上を混合して用いることができる。
【0039】
また、PC、EC及びブチレンカーボネート等の環状カーボネート類は高沸点溶媒であるため、GBLとの混合する溶媒として好適である。
有機電解液を構成する電解質塩としては、ホウフッ化リチウム(LiBF4)、六フッ化リン酸リチウム(LiPF6)、トリフルオロメタンスルホン酸リチウム(LiCF3SO3)、トリフルオロ酢酸リチウム(LiCF3COO)、リチウムビス(トリフルオロメタンスルホン)イミド(LiN(CF3SO2)2)等のリチウム塩が挙げられ、これらの1種以上を混合して用いることができる。電解液の塩濃度は、0.5〜3mol/lが好適である。
【0040】
(d)セパレータ
セパレータとしては、多孔質材料又は不織布等が挙げられる。セパレータの材質としては、上述した、電解質中に含まれる有機溶媒に対して溶解したり膨潤したりしないものが好ましい。具体的には、ポリエステル系ポリマー、ポリオレフィン系ポリマー(例えば、ポリエチレン、ポリプロピレン)、エーテル系ポリマー、ガラスのような無機材料等が挙げられる。
(e)他の部材
電池容器のような他の部材についても従来公知の非水電解質二次電池に使用される各種材料を使用でき、特に制限はない。
【0041】
(f)非水電解質二次電池の製造方法
非水電解質二次電池は、例えば、正極と負極と、それらの間に挟まれたセパレータとからなる積層体を備えている。積層体は、例えば短冊状の平面形状を有していてもよい。また、円筒型や扁平型の電池を作製する場合は、積層体を巻き取ってもよい。
積層体は、その1つ又は複数が電池容器の内部に挿入される。通常、正極及び負極は電池の外部導電端子に接続される。その後に、正極、負極及びセパレータを外気より遮断するために電池容器を密閉する。
密封の方法は、円筒電池の場合、電池容器の開口部に樹脂製のパッキンを有する蓋をはめ込み、電池容器と蓋とをかしめる方法が一般的である。また、角型電池の場合、金属性の封口板と呼ばれる蓋を開口部に取りつけ、溶接を行う方法を使用できる。これらの方法以外に、結着材で密封する方法、ガスケットを介してボルトで固定する方法も使用できる。更に、金属箔に熱可塑性樹脂を貼り付けたラミネート膜で密封する方法も使用できる。なお、密封時に電解質注入用の開口部を設けてもよい。有機電解液を用いる場合、その開口部から有機電解液を注入し、その後でその開口部を封止する。封止の前に通電し発生したガスを取り除いてもよい。
【実施例】
【0042】
以下、実施例に基づいて本発明をより詳細に説明するが、本発明は以下の実施例に限定されるものではない。なお、実施例で使用した試薬等は、特に断りのない限りキシダ化学社製の特級試薬を用いた。
〔実施例1〕
まず、サンプル瓶(密閉容器)に溶媒としてエタノールを20g、鉄源としてFe(NO3)3・9H2Oを13.125mmol量りとり、鉄源が溶媒中に完全に溶解するまで撹拌した。鉄源が完全に溶解したことを確認した後、リチウム源としてLiCH3COOを15mmol量りとり、ジルコニウム源としてZrCl4を1.875mmol、シリコン源としてSi(OC2H5)4を3.750mmol量りとり、これらが溶媒中に完全に溶解し、均一になるまで撹拌した。最後にリン源としてH3PO4(85%)を11.250mmol量りとり、均一になるまで撹拌した。試料のモル比をLi:Fe:Zr:P:Si=1:0.875:0.125:0.75:0.25とした。その後、プロピレンオキシド3mlを溶液中に加えると、約2分程で溶液の温度上昇と共に、流動性を失い、ゲル化した。
次いで、サンプル瓶に蓋をして密閉状態にし、得られた溶液を温度40℃の大気雰囲気下に24時間放置してゲルを得た。得られたゲルを温度60℃の大気雰囲気下に24時間放置して溶媒を蒸発させ、その後、窒素雰囲気中、温度600℃で12時間焼成した。得られた試料をA1とする。この試料の表面には、試料100重量部に対して1.6重量部の炭素が付着していることを確認した。
【0043】
〔実施例2〕
まず、サンプル瓶に溶媒としてメタノールを20g、鉄源としてFe(NO3)3・9H2Oを15mmol量りとり、鉄源が溶媒中に完全に溶解するまで撹拌した。鉄源が完全に溶解したことを確認した後、リチウム源としてLiCH3COOを15mmol量りとり、リチウム源が完全に溶解し、均一になるまで撹拌した。その後、リン源としてH3PO4(85%)を15mmol量りとり、リン源が完全に溶解し、均一になるまで撹拌した。試料のモル比をLi:Fe:P=1:1:1:とした。その後、プロピレンオキシド(炭素源)3mlを溶液中に加えると、約1分程で溶液の温度上昇と共に、流動性を失い、ゲル化した。
次いで、サンプル瓶に蓋をして密閉状態にし、得られた溶液を温度40℃の大気雰囲気下に24時間放置してゲルを得た。得られたゲルを温度60℃の大気雰囲気下に24時間放置して溶媒を蒸発させ、その後、窒素雰囲気中、温度600℃で12時間焼成した。得られた試料をA2とする。この試料の表面には、試料100重量部に対して2.4重量部の炭素が付着していることを確認した。
【0044】
〔実施例3〕
まず、サンプル瓶に溶媒としてエタノールを20g、鉄源としてFe(NO3)3・9H2Oを11.250mmol量りとり、鉄源が溶媒中に完全に溶解するまで撹拌した。鉄源が完全に溶解したことを確認した後、リチウム源としてLiCH3COOを15mmol量りとり、ジルコニウム源としてZrCl4を3.750mmol、シリコン源としてSi(OCH3)4を7.500mmol量りとり、これらが溶媒中に完全に溶解し、均一になるまで撹拌した。その後、リン源としてH3PO4(85%)を7.500mmol量りとり、リン源が完全に溶解し、均一になるまで撹拌した。試料のモル比をLi:Fe:Zr:P:Si=1:0.75:0.25:0.5:0.5とした。その後、プロピレンオキシド(炭素源)4mlを溶液中に加えると、約1分程で溶液の温度上昇と共に、流動性を失い、ゲル化した。
次いで、サンプル瓶に蓋をして密閉状態にし、温度40℃の大気雰囲気下に24時間放置してゲルを得た。得られたゲルを温度60℃の大気雰囲気下に24時間放置して溶媒を蒸発させ、その後、粉砕したゲルと水に溶解させたスクロース(炭素源)を重量比で1:0.1で混合し、乾燥させた後、窒素雰囲気中、温度600℃で12時間焼成した。得られた試料をA3とする。この試料の表面には、試料100重量部に対して3.4重量部の炭素が付着していることを確認した。
【0045】
〔実施例4〕
まず、サンプル瓶に溶媒としてエタノールを20g、鉄源としてFe(NO3)3・9H2Oを13.500mmol量りとり、鉄源が溶媒中に完全に溶解するまで撹拌した。鉄源が完全に溶解したことを確認した後、リチウム源としてLiCH3COOを15mmol量りとり、ジルコニウム源としてZrCl4を1.500mmol、シリコン源としてSi(OC2H5)4をを3.000mmol量りとり、これらが溶媒中に完全に溶解し、均一になるまで撹拌した。その後、ポリエチレングリコール200(炭素源)を1ml溶液中に加え、30分間撹拌した後、最後にリン源としてH3PO4(85%)を12.000mmol量りとり、均一になるまで撹拌した。試料のモル比をLi:Fe:Zr:P:Si=1:0.9:0.1:0.8:0.2とした。プロピレンオキシド(炭素源)を3ml溶液中に加え、30分程撹拌するとゲル化した。
次いで、サンプル瓶に蓋をして密閉状態にし、得られた溶液を温度40℃の大気雰囲気下に24時間放置してゲルを得た。得られたゲルを温度60℃の大気雰囲気下に24時間放置して溶媒を蒸発させ、その後、窒素雰囲気中、温度600℃で12時間焼成した。得られた試料をA4とする。この試料の表面には、試料100重量部に対して4.5重量部の炭素が付着していることを確認した。
【0046】
〔実施例5〕
まず、サンプル瓶に溶媒としてイソプロパノールを26g、鉄源としてFe(NO3)3・9H2Oを12.000mmol量りとり、鉄源が溶媒中に完全に溶解するまで撹拌した。鉄源が完全に溶解したことを確認した後、リチウム源としてLiNO3を15mmol量りとり、ジルコニウム源としてZrCl4を3.000mmol、シリコン源としてSi(OC2H5)4を9.000mmol量りとり、これらが溶媒中に完全に溶解し、均一になるまで撹拌した。その後、リン源としてH3PO4(85%)を9.000mmol量りとり、リン源が完全に溶解し、均一になるまで撹拌した。試料のモル比をLi:Fe:Zr:P:Si=1:0.8:0.2:0.6:0.4とした。その後、プロピレンオキシド(炭素源)3mlを溶液中に加えると、約2分程で溶液の温度上昇と共に、流動性を失い、ゲル化した。
次いで、サンプル瓶に蓋をして密閉状態にし、得られた溶液を温度40℃の大気雰囲気下に24時間放置して茶褐色のゲルを得た。得られたゲルを温度60℃の大気雰囲気下に24時間放置して溶媒を蒸発させ、その後、窒素雰囲気中、温度600℃で12時間焼成した。得られた試料をA5とする。この試料の表面には、試料100重量部に対して1.8重量部の炭素が付着していることを確認した。
【0047】
〔実施例6〕
出発原料にリチウム源として酢酸リチウム、鉄源として硝酸鉄(III)、リン源としてリン酸を用い、これら出発原料を、モル比でLi:Fe:P=1:1:1となるように計量した。モル比でLiの26.67倍のエタノールに計量した出発原料を溶解させた。出発原料が溶解したエタノール溶液にプロピレンオキシドをエタノールと等モル添加したところ、約30秒で溶液の温度上昇と共に、流動性を失い、ゲル化した。添加後の溶液を、容器に入れて蓋をし、60℃の乾燥炉で一晩放置した後、蓋を開けた状態で更に一晩乾燥させることでゲルを得た。得られたゲルを不活性雰囲気(具体的には窒素雰囲気)中550℃で12時間焼成することで、オリビン型の単相粉末(粒径10μm)からなる正極活物質である炭素で被覆されたリチウム含有複合酸化物(LiFePO4)を得た。得られた試料をA6とする。この試料の表面には、試料100重量部に対して6.2重量部の炭素が付着していることを確認した。
【0048】
〔比較例1〕
メノウ乳鉢に、リチウム源として炭酸リチウム(Li2CO3)を15mmol、鉄源としてシュウ酸鉄二水和物(FeC2O4・2H2O)を13.125mmol、ジルコニウム源としてオキシ塩化ジルコニウム(ZrOCl2)を1.875mmol、リン源としてリン酸水素アンモニウム((NH4)2HPO4)を11.250mmol、シリコン源としてSiO2粉末を3.750mmol量りとり、均一になるまで粉砕した。試料のモル比をLi:Fe:Zr:P:Si=1:0.875:0.125:0.75:0.25とした。更に、生成予測されるLiFe0.875Zr0.125P0.750Si0.250O4の重量に対して10重量%のスクロース(炭素源)を加え、均一になるまで原料を混合粉砕した。
次いで、得られた粉末を窒素雰囲気中、温度600℃で12時間焼成した。得られた試料をB1とする。この試料の表面には、試料100重量部に対して2.3重量部の炭素が付着していることを確認した。
【0049】
(正極活物質の組成)
得られた試料A1〜A6、B1をそれぞれメノウ乳鉢で粉砕し、粉末X線解析装置(株式会社リガク製、型式:MiniFlex II)により、それぞれ図1〜7に示す粉末X線回折パターンを得た。測定条件は2θの範囲が10°〜90°、1ステップ0.02°で1ステップ当りの計測時間を3sのFTモードとした。
次に、得られた粉末X線回折パターンについて、「RIETAN-2000」(F.Izumi AND T.Ikeda, Mater. Sci. Forum, 321-324(2000)198-203)を用いて構造解析を行ったところ、それぞれ生成予測した組成の正極活物質が得られていることが確認できた。
【0050】
(二次電池の評価)
得られた試料について以下の方法で、二次電池を作成した。
試料A1〜A6及びB1をそれぞれ約1g秤量しメノウ乳鉢にて粉砕し、これに導電剤として約10重量%のアセチレンブラックと、結着剤として約10重量%のテフロン樹脂粉末とを混合した。
この混合物をN−メチル−2−ピロリドンに溶解してスラリー状にし、これを厚さ20μmのアルミニウム箔の両面にドクターブレード法で塗布した。塗布量としては約5mg/cm2となるようにした。この塗膜を乾燥した後に、プレスを行って正極を作製した。
負極活物質として、天然黒鉛粉末又はチタン酸リチウム(Li4Ti5O12)を使用した。この負極活物質に結着剤として約10重量%のテフロン樹脂粉末を混合した。負極活物質にチタン酸リチウムを使用する場合には、導電剤として10重量%のアセチレンブラックを更に混合した。この混合物をN−メチル−2−ピロリドンに溶解してスラリー状にし、これを厚さ20μmの銅箔の両面に塗布し、乾燥した後に、プレスを行って負極を作製した。
【0051】
上記のようにして作製した正極と負極をそれぞれ30mm×30mmの大きさに切り抜き、電池の電流導入端子として正極には幅3mm、長さ50mmのアルミニウム製タブを、負極には幅3mm、長さ50mm銅製タブを溶接した。
これらの正極と負極との間に多孔質ポリエチレン製のセパレータを挟んだ。得られた積層体を、電池外装として2枚の金属箔に熱可塑性樹脂を貼り付けたラミネート膜の間に挟み、周囲を熱溶着することにより密封した。なおこのラミネートには電解質注入用の開口部が設けられている。
開口部に1モル/リットルのLiPF6を溶解させた33体積%のエチレンカーボネートと67体積%のジエチルカーボネートとを電解質として含浸させた。次いで、開口部を封止して図8に示す二次電池を得た。図8は二次電池の概略断面図である。図8中、1は正極、2は負極、3はセパレータ、4は正極及び負極タブ、5はラミネートを意味する。
このように作製した電池を25℃の環境下で充放電した。充電電流は1mAとし、電池の電位が4Vに到達した時点で充電を終了させた。充電終了後1mAで放電を行い電池の電位が2.0Vに到達した時点で放電を終了した。更に1mAの電流にて充放電を繰返し、100回目の放電容量を計測し、下記の式にて容量保持率(%)を求めた。
容量保持率=100回目放電容量/初回放電容量
得られた結果を、正極活物質の原料及び製造条件と共に表1に示す。
【0052】
【表1】

【0053】
表1の結果から、正極活物質として、本発明の製造方法により得られた試料A1〜A6を用いた非水電解質二次電池は、初期放電容量及び100回目放電容量がほぼ100mAh/g以上であり、容量保持率がほぼ90%以上であり、良好なサイクル特性を有することがわかる。
一方、正極活物質として、組成の異なる試料B1を用いた非水電解質二次電池は、初期放電容量、100回目放電容量及び容量保持率において上記の非水電解質二次電池と比較して劣ることがわかる。
【符号の説明】
【0054】
1:正極
2:負極
3:セパレータ
4:正極及び負極タブ
5:ラミネート
【技術分野】
【0001】
本発明は、正極活物質及びその製造方法、正極ならびに非水電解質二次電池に関する。更に詳しくは、本発明は、サイクル特性に優れた非水電解質二次電池を与える正極活物質及びその製造方法、それを用いた正極ならびに非水電解質二次電池に関する。
【背景技術】
【0002】
非水電解質二次電池として、リチウム二次電池が実用化されており、広く普及している。更に近年、リチウム二次電池は、ポータブル電子機器用の小型のものだけでなく、車載用や電力貯蔵用等の大容量のデバイスとしても注目されている。そのため、安全性やコスト、寿命等の要求がより高くなっている。
リチウム二次電池は、その主たる構成要素として正極、負極、電解液、セパレータ及び外装材を有する。また、上記正極は、正極活物質、導電材、集電体及びバインダー(結着剤)により構成される。
【0003】
一般に、正極活物質としては、コバルト酸リチウム(LiCoO2)に代表される層状遷移金属酸化物が用いられている。しかしながら、層状遷移金属酸化物は、満充電状態において、150℃前後の比較的低温で酸素脱離を起こし易く、当該酸素脱離により電池の熱暴走反応が起こり得る。従って、このような正極活物質を有する電池をポータブル電子機器に用いる場合、電池の発熱、発火等の事故が発生する恐れがある。
このため、構造が安定し異常時に酸素を放出せず、LiCoO2より安全なオリビン型構造を有するリチウム含有複合酸化物、例えばリン酸鉄リチウム(LiFePO4)が期待されている。リン酸鉄リチウムは、地殻存在度が低いコバルトを含まないため、比較的安価であるという利点もある。また、リン酸鉄リチウムは、層状遷移金属酸化物よりも、構造的に安定であるという利点もある。
【0004】
しかしながら、リン酸鉄リチウムを正極活物質として用いた場合、充放電の繰り返しに伴う放電容量の低下が大きく、得られる電池の寿命が短いという問題がある。これは充放電によりLiの挿入脱離に起因する正極活物質の膨張若しくは収縮が大きいため、サイクル数が増えると正極活物質が集電体や導電材から物理的に徐々に欠落し、正極活物質の構造が破壊され、充放電に寄与しない活物質が増加して、放電容量の低下が起きるためである。これに対し、固相法により得られた、リン酸鉄リチウムを基本構造とし、元素置換を行ったリチウム含有複合酸化物を正極活物質に用いることにより、正極活物質の膨張収縮を抑制する方法が検討されている(例えば、特許文献1及び2)。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特開2002−198050号公報
【特許文献2】特表2005−519451号公報
【発明の概要】
【発明が解決しようとする課題】
【0006】
しかしながら、特許文献1や2で用いられている固相法を用いて製造した場合、不純物が生成し、単一相のオリビン型構造を有するリチウム含有複合酸化物を製造するのが困難であるという問題がある。また、固相法では、焼成して得たリチウム含有複合酸化物は凝集しているため、粉砕してその粒径を制御する必要があるが、粉砕によりリチウム含有複合酸化物の結晶性が低下し、容量の低下をもたらすという問題もある。
そのため、単一相のオリビン型構造を有するリチウム含有複合酸化物を製造でき、リチウム含有複合酸化物の結晶性を低下させることなく粒径を制御できる方法が必要とされている。
そこで、本発明は、単一相のオリビン型構造を有するリチウム含有複合酸化物を製造でき、かつリチウム含有複合酸化物の結晶性を低下させることなく粒径を制御できる、リチウム含有複合酸化物の製造方法を提供することを目的とした。
【課題を解決するための手段】
【0007】
本発明者等は、オリビン型構造を有するリチウム含有複合酸化物について鋭意検討する過程で、LiFePO4の鉄元素とリン元素の一部を別の元素で置換したリチウム含有複合酸化物を正極活物質に用いると電池の寿命が向上することを見出した。
【0008】
かくして本発明によれば、オリビン構造を有する下記一般式(1)で示される正極活物質を形成するのに必要なリチウム源、M源、リン源及びX源の各所定量を溶媒に溶解させて溶液を調製する工程と、得られた溶液を環状エーテルの付与によりゲル化させる工程と、
生成したゲルを焼成処理することで炭素被覆されたリチウム含有複合酸化物を得る工程
を含む、下記一般式(1):
LixMyP1-zXzO4 (1)
で表される化合物(式中、Mは、Fe、Ni、Mn、Zr、Sn、Al及びYからなる群から選択される少なくとも1種の元素であり、Xは、Si及びAlから成る群から選択される少なくとも1種であり、0<x≦2、0.8≦y≦1.2、0≦z≦1の範囲である)を得ることを特徴とする正極活物質の製造方法が提供される。
【0009】
また、本発明によれば、上記製造方法により得られた正極活物質が提供される。
更に、本発明によれば、上記製造方法により得られた正極活物質と、導電材と、バインダーとを含むことを特徴とする正極が提供される。
また、本発明によれば、上記製造方法により得られた正極活物質を含む正極と、負極と、電解質と、セパレータとを有することを特徴とする非水電解質二次電池が提供される。
【発明の効果】
【0010】
本発明によれば、ゲル中に原料元素を均一に分散できるので、不純物の生成を抑制して単一相のオリビン型構造を有するリチウム含有複合酸化物を製造できる。また、固相法に比べ、ゲルの単位体積当たりの元素濃度が低いため、焼成時に粒子成長しにくい。更に、ゲルを粉砕することにより、ゲル同士の接触面積を小さくして、粒子成長を抑制できる。その結果、一次粒子及び二次粒子の凝集を抑制することが可能となるので、焼成後のリチウム含有複合酸化物を粉砕することなく、その粒径を制御することが可能となり、リチウム含有複合酸化物の結晶性を低下させることがない。これにより、本発明によれば、安全性とコスト面に優れ、更に電池の長寿命化の可能なリチウム二次電池用の正極活物質を提供できる
【図面の簡単な説明】
【0011】
【図1】実施例1の正極活物質の粉末X線回折パターンである。
【図2】実施例2の正極活物質の粉末X線回折パターンである。
【図3】実施例3の正極活物質の粉末X線回折パターンである。
【図4】実施例4の正極活物質の粉末X線回折パターンである。
【図5】実施例5の正極活物質の粉末X線回折パターンである。
【図6】実施例6の正極活物質の粉末X線回折パターンである。
【図7】比較例1の正極活物質の粉末X線回折パターンである。
【図8】二次電池の概略断面図である。
【発明を実施するための形態】
【0012】
(1)リチウム含有複合酸化物(正極活物質)
本発明の正極活物質の製造方法では、オリビン構造を有する下記一般式(1):
LixMyP1-zXzO4 (1)
で表される化合物(式中、Mは、Fe、Ni、Mn、Zr、Sn、Al及びYからなる群から選択される少なくとも1種の元素であり、Xは、Si及びAlから成る群から選択される少なくとも1種であり、0<x≦2、0.8≦y≦1.2、0≦z≦1の範囲である)で示されるリチウム含有複合酸化物が得られる。
リチウム含有複合酸化物の具体例としては、
LixFeyP1-zO4
(0.8≦x≦1.2、0.8≦y≦1.2、z=0)、
LixNiyP1-zO4
(0.8≦x≦1.2、0.8≦y≦1.2、z=0)、
LixMnyP1-zO4
(0.8≦x≦1.2、0.8≦y≦1.2、z=0)、
Lix(Fe,Ni)yP1-zO4
(0.8≦x≦1.2、0.8≦y≦1.2、z=0)、
Lix(Fe,Mn)yP1-zO4
(0.8≦x≦1.2、0.8≦y≦1.2、z=0)、
Lix(Fe,Zr)yP1-zO4
(0.8≦x≦1.2、0.8≦y≦1.2、z=0)、
Lix(Fe,Sn)yP1-zO4
(0.8≦x≦1.2、0.8≦y≦1.2、z=0)、
Lix(Fe,Y)yP1-zO4
(0.8≦x≦1.2、0.8≦y≦1.2、z=0)、
Lix(Fe,Ni)yP1-zSizO4
(0.8≦x≦1.2、0.8≦y≦1.2、0<z≦0.5)、
Lix(Fe,Mn)yP1-zSizO4
(0.8≦x≦1.2、0.8≦y≦1.2、0<z≦0.5)、
Lix(Fe,Zr)yP1-zSizO4
(0.8≦x≦1.2、0.8≦y≦1.2、0<z≦0.5)、
Lix(Fe,Sn)yP1-zSizO4
(0.8≦x≦1.2、0.8≦y≦1.2、0<z≦0.5)、
Lix(Fe,Y)yP1-zSizO4
(0.8≦x≦1.2、0.8≦y≦1.2、0<z≦0.5)、
等を挙げることができる。Mが複数の元素から構成されている場合、それぞれの原子%の値は、M全量に対して、0原子%より多く、100原子%未満の範囲のいずれの値をも取り得る。
【0013】
正極活物質として使用する観点から、特に好ましいリチウム含有複合酸化物は、
Lix(Fe,Zr)yP1-zSizO4
(0.8≦x≦1.2、0.8≦y≦1.2、0<z≦0.5)、
Lix(Fe,Sn)yP1-zSizO4
(0.8≦x≦1.2、0.8≦y≦1.2、0<z≦0.5)、
Lix(Fe,Y)yP1-zSizO4
(0.8≦x≦1.2、0.8≦y≦1.2、0<z≦0.5)、
Lix(Fe,Ti)yP1-zSizO4
(0.8≦x≦1.2、0.8≦y≦1.2、0<z≦0.5)、
Lix(Fe,Nb)yP1-zSizO4
(0.8≦x≦1.2、0.8≦y≦1.2、0<z≦0.5)、
Lix(Fe,V)yP1-zSizO4
(0.8≦x≦1.2、0.8≦y≦1.2、0<z≦0.5)、
である。
リチウム含有複合酸化物は、通常粒子の形状で使用される。一次粒子の粒径は、リチウムイオンの挿入脱離の効率を高めるために、1μm以下、好ましくは10nm〜1μmである。一次粒子の粒径の下限は、10nm程度が挿入脱離の効率と製造コストとの兼ね合いから現実的である。なお、一次粒子の粒径は、SEMによる直接観察及びレーザー回折・散乱法による粒度分布測定装置により測定できる。
【0014】
(2)リチウム含有複合酸化物の製造方法
本発明は、上記一般式(1)のリチウム含有複合酸化物を製造する方法であり、原料物質を溶媒に溶解させる工程(以下、溶解工程という。)、得られた溶液をゲル化させる工程(以下、ゲル化工程という。)、得られたゲルを粉砕してゲルの平均粒径を0.1〜50μmとする工程(以下、粉砕工程という。)、得られたゲルを焼成する工程(以下、焼成工程という。)を少なくとも含む。なお、必要に応じて、ゲル化工程で得られたゲルから溶媒を除去する工程(以下、乾燥工程という。)や、焼成前のゲルに炭素源となる物質を混合する工程(以下、炭素源混合工程という。)を設けることもできる。
【0015】
(i)溶解工程
原料物質であるリチウム源、元素M源、リン源及び元素X源は、溶媒に溶解しうる化合物であれば特に限定されない。これら化合物は、100gの溶媒に10mmol以上溶解する化合物であることが好ましい。
【0016】
(リチウム源)
リチウム源となる物質は、一般式(1)の正極活物質の原料になり得、溶媒に可溶で、本発明の製造方法を阻害しない化合物であれば特に限定されない。リチウムの無機塩、水酸化物、有機酸塩、金属アルコキシド及びこれら塩の水和物を用いることができる。具体的には、無機塩としては、弱酸との塩(以下、弱酸塩という。)である炭酸リチウム(Li2CO3)、強酸との塩(以下、強酸塩という。)である硝酸リチウム(LiNO3)、塩化リチウム(LiCl)を挙げることができる。また、有機塩としては、弱酸塩である、酢酸リチウム(LiCH3COO)、シュウ酸リチウム(COOLi)2を挙げることができる。また、金属アルコキシドとしては、リチウムメトキシド(LiOCH3)、リチウムエトキシド(LiOC2H5)、リチウム-n-プロポキシド(LiO-n-C3H7)、リチウム-i-プロポキシド(LiO-i-C3H7)、リチウム-n-ブトキシド(LiO-n-C4H9)、リチウム-t-ブトキシド(LiO-t-C4H9)、リチウム-sec-ブトキシド(LiO-sec-C4H9)等を挙げることができる。無機塩及び有機塩については、水和物であってもよい。これらの中でも、大気雰囲気下で均一な溶液を作製しやすい、安価であるという観点から弱酸塩又は強酸塩が好ましく、その中でも酢酸リチウム又は硝酸リチウムが好ましい。なお、本発明において「均一な溶液」とは、目視観察により目視観察により沈殿物の生成が認められず、2相以上に分離していない状態をいう。
【0017】
以下、リチウム源の溶解方法について、元素Mに鉄とジルコニウム、元素Xにシリコンを用い、溶媒にエタノールを用いた場合について説明する。
リチウム源として、弱酸塩の無水物を用いる場合は、エタノールへの溶解性が低いため、鉄源の塩の水和物あるいはジルコニウム源の塩の水和物を溶解した後に溶解させることが好ましい。鉄源の塩の水和物あるいはジルコニウム源の塩の水和物を加える前に溶解させる場合は、予め水に溶解させておくことが好ましい。あるいは、弱酸塩の無水物が溶解するのに必要な量の水をエタノールへ添加しておいてもよい。弱酸塩の無水物を溶解させる水の量としては、Liのモル数の1倍〜100倍の水が好ましく、より好ましくは4倍〜20倍である。
【0018】
また、弱酸塩の無水物は、鉄源、ジルコニウム源、シリコン源との任意の組合せにおいて、任意の順番で溶解させても均一な溶液を得ることができる。得られた均一な溶液を予め反応させた後に、残りの原料を加えてもよい。弱酸塩の無水物は鉄源の塩の水和物と予め反応させておくことが好ましい。弱酸塩の無水物と鉄源の塩の水和物を予め反応させることにより、リン酸を加えた際に沈殿物ができるのを抑制できる。
また、弱酸塩の無水物はテトラメトキシシランもしくはテトラエトキシシランと予め反応させておくことが好ましく、特にテトラメトキシシランと反応させることが好ましい。このときの混合の手順としては、弱酸塩の無水物を水に溶解させた後、エタノールを加え、テトラメトキシシランもしくはテトラエトキシシランを加えることが好ましい。これらを混合した後に30℃から60℃に加熱する事で、より反応を促進できる。加熱の時間は特に限定されないが、30分から12時間程度が適当である。弱酸塩の無水物とシリコン源を予め反応させることにより、焼成後の不純物の発生やリチウム複合酸化物におけるLiサイトへのFeの置換を抑制できる。
【0019】
(元素M源)
元素M源となる物質は、一般式(1)の正極活物質の原料になり得、溶媒に可溶で、本発明の製造方法を阻害しない化合物であれば特に限定されない。元素Mの無機塩、水酸化物、有機酸塩、金属アルコキシド及びこれら塩の水和物を用いることができる。前述の通り、Mは、Fe、Ni、Mn、Zr、Sn、Al及びYからなる群から選択される少なくとも1種の元素であり、少なくともFeを含むことが好ましい。例えば、鉄源としては、無機塩として、弱酸塩である炭酸鉄(II)(Fe(CO3))、強酸塩である硝酸鉄(II)(Fe(NO3)2)、硝酸鉄(III)(Fe(NO3)3)、塩化鉄(II)(FeCl2)及び塩化鉄(III)(FeCl3)を挙げることができる。また、有機塩としては、弱酸塩である、シュウ酸鉄(II)(FeC2O4)、シュウ酸鉄(III)(Fe2(C2O4)3)、酢酸鉄(II)(Fe(CH3COO)2)及び酢酸鉄(III)(Fe(CH3COO)3)を挙げることができる。好ましくは強酸塩の水和物、その中でも硝酸鉄(III)の9水和物が好ましい。
【0020】
以下、元素M源の溶解方法について、元素Mに鉄とジルコニウム、元素Xにシリコンを用い、溶媒にエタノールを用いた場合について説明する。
強酸塩の水和物は、リチウム源、ジルコニウム源、シリコン源との任意の組合せにおいて、任意の順番に溶解させても均一な溶液を得ることができる。得られた均一な溶液を予め反応させた後に、残りの原料を加えてもよい。強酸塩の水和物はリン酸よりも先に溶媒に加えることが好ましい。強酸塩の水和物のみを予め反応させることにより、焼成後の不純物の生成を抑制できるので、強酸塩の水和物は、強酸塩の水和物のみをエタノール中に溶解させた後に、沈殿物が生じない程度に熱をかけることにより予め反応させてもよい。
【0021】
(ジルコニウム源)
また、ジルコニウム源としては、無機塩として、ジルコニウムハロゲン化物である塩化ジルコニウム(ZrCl4)、臭化ジルコニウム(ZrBr4)、ヨウ化ジルコニウム(ZrI4)、オキシジルコニウム塩である、オキシ塩化ジルコニウム(ZrOCl2)、オキシ硝酸ジルコニウム(ZrO(NO3)2)を挙げることができる。また、金属アルコキシドとしては、ジルコニウムメトキシド(Zr(OCH3)4)、ジルコニウムエトキシド(Zr(OC2H5)4)、ジルコニウム-n-プロポキシド(Zr(O-n-C3H7)4)、ジルコニウム-i-プロポキシド(Zr(O-i-C3H7)4)、ジルコニウム-n-ブトキシド(Zr(O-n-C4H8)4)、ジルコニウム-t-ブトキシド(Zr(O-t-C4H8)4)、ジルコニウム-sec-ブトキシド(Zr(O-sec-C4H8)4)等を挙げることができる。好ましくはジルコニウムハロゲン化物、その中でも塩化ジルコニウムが好ましい。
【0022】
ジルコニウムハロゲン化物は、リチウム源、鉄源、シリコン源との任意の組合せにおいて、任意の順番に溶解させても均一な溶液を得ることができる。ジルコニウムハロゲン化物を、強酸塩の水和物からなる鉄源と予め反応させておくことが好ましい。ジルコニウムハロゲン化物を強酸塩の水和物からなる鉄源と予め反応させることにより、焼成後にジルコニアやリン酸ジルコニウム等の不純物が形成するのを抑制できる。また、ジルコニウムハロゲン化物はテトラメトキシシランもしくはテトラエトキシシランと予め反応させておくことが好ましく、特にテトラメトキシシランと反応させることが好ましい。ジルコニウムハロゲン化物とシリコン源を予め反応させることにより、焼成後の不純物の発生やリチウム複合酸化物におけるLiサイトへのFeの置換を抑制できる。
【0023】
(リン源)
リン源となる物質は、一般式(1)の正極活物質の原料になり得、溶媒に可溶で、本発明の製造方法を阻害しない化合物であれば特に限定されない。具体的には、リン酸(H3PO4)、リン酸水素アンモニウム((NH4)2HPO4)、リン酸二水素アンモニウム(NH4H2PO4)等を挙げることができる。これらの中でも、リン酸が好ましい。
【0024】
以下、リン源の溶解方法について、元素Mに鉄とジルコニウム、元素Xにシリコンを用い、溶媒にエタノールを用いた場合について説明する。
リン酸は、少なくともリチウム源、鉄源及びジルコニウム源を溶解させた後で、投入する必要がある。リン酸をリチウムの弱酸塩無水物やジルコニウムハロゲン化物と混合すると、沈殿物が生成するからである。リン酸を加える際は、過剰にリン酸を加えてもよい。リン酸を過剰に加えることにより、焼成後の不純物の発生やリチウム複合酸化物におけるLiサイトへのFeの置換を抑制できる。過剰にリン酸を加える場合、化学量論比のリン酸に対して5〜20重量%の範囲で、より好ましくは5〜15重量%の範囲で過剰に加えることができる。
【0025】
(元素X源)
元素X源となる物質は、一般式(1)の正極活物質の原料になり得、溶媒に可溶で、本発明の製造方法を阻害しない化合物であれば特に限定されない。元素Xの金属アルコキシドを用いることができる。Xは、SiとAlからなる群から選択される少なくとも1種の元素であり、好ましくはSiである。例えば、シリコン源としては、テトラエトキシシラン(Si(OC2H5)4)、テトラメトキシシラン(Si(OCH3)4)、メチルトリエトキシシラン(CH3Si(OC2H5)3)、メチルトリメトキシシラン(CH3Si(OCH3)3)、エチルメトキシシラン(C2H5Si(OCH3)3)、エチルトリエトキシシラン(C2H5Si(OC2H5)3)等の種々のシリコンアルコキシドを挙げることができる。テトラエトキシシランあるいはテトラメトキシシランが好ましい。
【0026】
以下、元素X源の溶解方法について、元素Mに鉄とジルコニウム、元素Xにシリコンを用い、溶媒にエタノールを用いた場合について説明する。
シリコンアルコキシドは、リチウム源、鉄源、ジルコニウム源との任意の組合せにおいて、任意の順番に溶解させても均一な溶液を得ることができる。シリコンアルコキシドの反応を促進するため、水を加えてもよい。加える水の量としては、シリコンのモル数の1倍〜100倍、より好ましくは2倍〜20倍である。水を加えることにより加水分解が進み、反応を促進できる。シリコンアルコキシドをリン酸と予め反応させることもできる。テトラエトキシシランを用いる場合は、40℃〜80℃で反応をさせることが好ましく、より好ましくは50℃〜80℃で反応させることが好ましい。テトラメトキシシランを用いる場合は、20℃〜60℃で反応させることが好ましい。テトラメトキシシランと、リチウム源となる弱酸塩無水物を反応させる場合、(リチウム源のLiのモル数/シリコン源のSiのモル数)≧2であることが好ましい。
【0027】
(溶媒)
溶媒としては水、アルコール類、アセトン、アセトニトリル、テトラヒドロフラン、N,N−ジメチルホルムアミド、ジメチルスルホキシド、酢酸、ギ酸等が挙げられるが、上記の原料を溶解でき、本発明の製造方法を阻害しない液体であれば特に限定されるものではない。これらの中でも、安価である、取り扱いが容易であるとの観点からアルコール類が好ましい。
アルコール類であれば特に限定されるものでなく、例えば、メタノール、エタノール、n−プロパノール、i−プロパノール、n−ブタノール、sec−ブタノール、t−ブタノール、エチレングリコール、グリセリン等が挙げられ、これらの中でも、安価である、取り扱いが容易であるとの観点からメタノール及びエタノール、n−プロパノール、i−プロパノールが特に好ましい。
なお、アルコールへの溶解性が低い原料物質を溶解させるために、必要に応じて水との混合溶媒としてもよい。溶媒の量は、全原料物質を溶解できれば特に限定されない。但し、溶媒の回収コストを考慮すると、溶媒の量は、全原料物質の総モルに対して、1〜100倍のモル比の範囲、より好ましくは、2〜15倍のモル比の範囲である。
(溶解方法)
溶解工程においては、原料物質を溶解させる順番によっては沈殿物が生成して均一な溶液ができない場合がある。そのため、原料物質を溶解させる順番が重要となる。
【0028】
以下、元素Mに鉄とジルコニウム、元素Xにシリコンを用いた場合について説明する。前述のように、リン酸を弱酸塩のリチウム源、特に塩無水物やジルコニウム源と混合すると沈殿物が生成し、またジルコニウムイオンは鉄イオンの存在により安定化される。そのため、少なくともリチウム源、鉄源及びジルコニウム源を溶解させた溶媒にリン源を溶解させる必要がある。シリコン源は、リン源を溶解させる前に溶解させてもよく、あるいはリン源を溶解させた後に溶解させてもよい。
なお、本発明において、原料物質を溶解させる順番とは、溶媒に順次原料物質を投入する場合には、投入する原料物質の順番をいうが、予め複数の原料物質を溶媒に溶解させた溶液を準備し、その溶液を混合する場合には、その混合する順番をいう。
【0029】
リチウム源、鉄源及びジルコニウム源を溶解させた溶媒を調製する順番としては、ジルコニウムイオンを鉄イオンにより安定化できれば特に限定されない。ジルコニウムイオンを鉄イオンにより安定化させる方法としては、溶媒中に鉄の強酸塩水和物を溶解させた後に、ジルコニウムハロゲン化物を溶解させる方法や、溶媒中にジルコニウムハロゲン化物を溶解させた後に、鉄の強酸塩水和物を溶解させる方法や、溶媒中に鉄の強酸塩水和物とジルコニウムハロゲン化物を同時に溶解させる方法を挙げることができる。なお、鉄源とジルコニウム源の溶解の順番は特に限定されず、いずれが一方を先に溶解させても、あるいは両者を同時に溶解させてもよい。
また、リチウム源に塩無水物、例えば酢酸リチウムを用いると、溶媒中に水が含まれていないと溶解しない。そのため、リチウム源に塩無水物を用いる場合には、鉄の塩の水和物、ジルコニウムの塩の水和物を溶媒に溶解させた後に投入して、溶解させることが好ましい。
原料物質を溶媒に溶解させる際、室温以上となるように加熱してもよい。加熱温度としては、30℃〜80℃、より好ましくは30℃〜60℃である。
なお、上記の溶解工程の説明では、元素Mに鉄とジルコニウム、元素Xにシリコンを用いた例について説明したが、上記一般式(1)に含まれる元素M及びXであって、全原料物質を溶媒に均一に溶解できる組合せであれば特に限定されない。
【0030】
(ii)ゲル化工程
本工程では、溶解工程により得られた溶液をゲル化させる。
ゲル化は、Li、元素M、P及び元素Xが酸素原子を介して結合する一群の集合体となり、この集合体がゲル中で数nmから数十nmの粒径の微粒子として析出することで溶液の粘度が上昇することにより行われると発明者等は考えている。
ゲル化を促進させるために、溶液に環状エーテルを添加することが好ましい。ゲル化方法は、溶液を静置してもよく、あるいは溶液を撹拌してもよい。
環状エーテルとしては、エチレンオキシド、プロピレンオキシド、トリメチレンオキシド、cis−2,3−エポキシブタン、1,2−エポキシブタン、グリシドール、エピクロロヒドリン、エピフロロヒドリン、エピブロモヒドリン、3,3−ジメチルオキセタンからなる群から選択された少なくとも1種を用いることができる。これら環状エーテルの内、均一なゲルを製造する、安価であるとの観点からプロピレンオキシドが好ましい。環状エーテルの添加量は、溶液をゲル化できる量であれば特に限定されないが、全原料物質のモル数に対し、1〜100倍のモル数が好ましい。この範囲とすることにより、ゲル中に各原料物質をより均一に分散でき、更には粒子表面を覆う炭素の原料となりうる。また、必要に応じて、環状エーテルを添加した溶液を加熱してもよい。
【0031】
(iii)乾燥工程
本工程では、ゲル化したゲルから残留する溶媒を除去する。溶媒の除去方法としては、室温で静置する方法や、30〜80℃に加熱して溶媒を除去する方法や、ロータリーポンプ等用いたチャンバー内にゲルを設置し、減圧して溶媒を除去する方法等を用いることができる。また、溶液調製時に使用した溶媒よりも揮発性の高い溶媒や表面張力の異なる溶媒と溶媒交換を行った後に前述と同じ方法で溶媒を除去してもよい。溶媒交換に用いる溶媒としてはトルエン、ベンゼン、ヘキサン、テトラヒドロフラン、イソプロパノール及びこれらの混合溶媒を挙げることができる。また、本工程で得られたゲルを超臨界状態の二酸化炭素に浸して溶媒を抽出することで溶媒を除去することもできる。これらの除去した溶媒は工業的観点から回収して再利用することが好ましい。
【0032】
(iv)粉砕工程
得られたゲルを機械的に粉砕することで二次粒子のサイズを制御してもよい。粉砕方法は特に限定されず、必要に応じて加温、冷却及び雰囲気制御をする方法を挙げることができる。
(v)炭素源混合工程
糖類、油脂類や合成樹脂材料を、粉砕したゲルと混合してもよい。これら化合物は、焼成時に炭化することにより正極材料の表面に炭素被覆を形成し、正極材料の導電性を向上できる。炭素による被覆は、全面でもよく、一部でもよいが、良好な電極特性を得るためには、全面が均一に被覆されているのが好ましい。ここで「均一」とは、正極活物質上の被覆炭素の厚みが一定である状態を意味する。この状態は、透過型電子顕微鏡により確認できる。糖類としては、スクロース、フルクトース等を用いることができる。また、合成樹脂材料としては、ポリエーテル類としてはポリエチレングリコールやポリプロピレングリコール等のポリエーテル類や、ポリビニルアルコール、ポリアクリルアミド、カルボキシメチルセルロース、ポリ酢酸ビニル等を用いることができる。
【0033】
(vi)焼成工程
本工程では、得られたゲルを焼成することでリチウム含有複合酸化物を得る。焼成は、400〜700℃、好ましくは400〜600℃の温度範囲で、1〜24時間をかけて行う。焼成時の雰囲気は、不活性雰囲気(アルゴン、窒素、真空等の雰囲気)又は還元性雰囲気(水素含有不活性ガス、一酸化炭素等の雰囲気)を用いることができる。均一に焼成を行うため、ゲルを撹拌してもよく、焼成時にNOxやSOx、塩素等の有毒なガスが発生する場合は、除去装置を設けてもよい。
(vii)その他の工程
得られたリチウム含有複合酸化物は、必要に応じて、粉砕工程及び/又は分級工程に付すことで、所望の粒径に調製してもよい。
(viii)用途
得られたリチウム含有複合酸化物は、非水系電解質二次電池の正極活物質に使用できる。正極活物質には、上記リチウム含有複合酸化物以外に、LiCoO2、LiNiO2、LiFeO2、LiMnO2、LiMn2O4、Li2MnO3、LiCoPO4、LiNiPO4、LiMnPO4、LiFePO4等の他の酸化物が含まれていてもよい。
【0034】
(II)非水電解質二次電池
非水電解質二次電池は、正極と負極と非水電解質とセパレータとを有する。以下、各構成材料について説明する。
(a)正極
正極は、正極活物質と導電材とバインダーと集電体とを含み、例えば、活物質と導電材とバインダーとを有機溶剤と混合したスラリーを集電体に塗布する等の公知の方法によって作製できる。なお、得られたリチウム含有複合酸化物が十分に高い導電性を有する場合には、導電材は必ずしも添加する必要はない。
バインダー(結着材)としては、ポリテトラフルオロエチレン、ポリビニリデンフルオライド、ポリビニルクロライド、エチレンプロピレンジエンポリマー、スチレン−ブタジエンゴム、アクリロニトリル−ブタジエンゴム、フッ素ゴム、ポリ酢酸ビニル、ポリメチルメタクリレート、ポリエチレン、ニトロセルロース、スチレンーブタジエンゴム等を用いることができる。必要に応じてカルボキシメチルセルロース等の増粘材を使用することもできる。
【0035】
導電材としては、アセチレンブラック、カーボン、グラファイト、天然黒鉛、人造黒鉛、ニードルコークス等を用いることができる。
集電体としては、連続孔を持つ発泡(多孔質)金属、ハニカム状に形成された金属、焼結金属、エキスパンドメタル、不織布、板、箔、孔開きの板、箔等を用いることができる。
有機溶剤としては、N−メチル−2−ピロリドン、トルエン、シクロヘキサン、ジメチルホルムアミド、ジメチルアセトアミド、メチルエチルケトン、酢酸メチル、アクリル酸メチル、ジエチルトリアミン、N−N−ジメチルアミノプロピルアミン、エチレンオキシド、テトラヒドロフラン等を用いることができる。バインダーに水溶性のものを使用する場合は溶媒として水を用いることもできる。
正極の厚さは、0.01〜20mm程度が好ましい。厚すぎると導電性が低下し、薄すぎると単位面積当たりの容量が低下するので好ましくない。なお、塗布並びに乾燥によって得られた正極は、活物質の充填密度を高めるためローラープレス等により圧縮してもよい。
【0036】
(b)負極
負極は公知の方法により作製できる。具体的には、正極の作製法で説明した方法と同様にして作製できる。つまり、正極の作製法で説明した公知の結着材と公知の導電材とを負極活物質と混合した後、この混合粉末をシート状に成形し、当該成形体をステンレス、銅等の導電体網(集電体)に圧着すればよい。また、上記混合粉末を正極作製法で説明した公知の有機溶剤と混合して得られたスラリーを銅等の金属基板上に塗布することにより作製することもできる。
負極活物質としては公知の材料を用いることができる。高エネルギー密度電池を構成するためには、リチウムの挿入/脱離する電位が金属リチウムの析出/溶解電位に近いものが好ましい。その典型例は、粒子状(鱗片状、塊状、繊維状、ウィスカー状、球状、粉砕粒子状等)の天然黒鉛もしくは人造黒鉛のような炭素材料である。
【0037】
人造黒鉛としては、メソカーボンマイクロビーズ、メソフェーズピッチ粉末、等方性ピッチ粉末等を黒鉛化して得られる黒鉛が挙げられる。また、非晶質炭素を表面に付着させた黒鉛粒子も使用できる。これらの中で、天然黒鉛は、安価でかつリチウムの酸化還元電位に近く、高エネルギー密度電池が構成できるためより好ましい。
また、リチウム遷移金属酸化物、リチウム遷移金属窒化物、遷移金属酸化物、酸化シリコン等も負極活物質として使用可能である。これらの中で、Li4Ti5O12は電位の平坦性が高く、かつ充放電による体積変化が小さいためより好ましい。
【0038】
(c)非水電解質
非水電解質としては、例えば、有機電解液、ゲル状電解質、高分子固体電解質、無機固体電解質、溶融塩等を用いることができる。非水電解質を注入した後に二次電池の容器の開口部を封止する。封止の前に通電し発生したガスを取り除いてもよい。
有機電解質を構成する有機溶媒としては、プロピレンカーボネート(PC)とエチレンカーボネート(EC)、ブチレンカーボネート等の環状カーボネート類、ジメチルカーボネート(DMC)、ジエチルカーボネート(DEC)、エチルメチルカーボネート、ジプロピルカーボネート等の鎖状カーボネート類、γ−ブチロラクトン(GBL)、γ−バレロラクトン等のラクトン類、テトラヒドロフラン、2−メチルテトラヒドロフラン等のフラン類、ジエチルエーテル、1,2−ジメトキシエタン、1,2−ジエトキシエタン、エトキシメトキシエタン、ジオキサン等のエーテル類、ジメチルスルホキシド、スルホラン、メチルスルホラン、アセトニトリル、ギ酸メチル、酢酸メチル等が挙げられ、これらの1種以上を混合して用いることができる。
【0039】
また、PC、EC及びブチレンカーボネート等の環状カーボネート類は高沸点溶媒であるため、GBLとの混合する溶媒として好適である。
有機電解液を構成する電解質塩としては、ホウフッ化リチウム(LiBF4)、六フッ化リン酸リチウム(LiPF6)、トリフルオロメタンスルホン酸リチウム(LiCF3SO3)、トリフルオロ酢酸リチウム(LiCF3COO)、リチウムビス(トリフルオロメタンスルホン)イミド(LiN(CF3SO2)2)等のリチウム塩が挙げられ、これらの1種以上を混合して用いることができる。電解液の塩濃度は、0.5〜3mol/lが好適である。
【0040】
(d)セパレータ
セパレータとしては、多孔質材料又は不織布等が挙げられる。セパレータの材質としては、上述した、電解質中に含まれる有機溶媒に対して溶解したり膨潤したりしないものが好ましい。具体的には、ポリエステル系ポリマー、ポリオレフィン系ポリマー(例えば、ポリエチレン、ポリプロピレン)、エーテル系ポリマー、ガラスのような無機材料等が挙げられる。
(e)他の部材
電池容器のような他の部材についても従来公知の非水電解質二次電池に使用される各種材料を使用でき、特に制限はない。
【0041】
(f)非水電解質二次電池の製造方法
非水電解質二次電池は、例えば、正極と負極と、それらの間に挟まれたセパレータとからなる積層体を備えている。積層体は、例えば短冊状の平面形状を有していてもよい。また、円筒型や扁平型の電池を作製する場合は、積層体を巻き取ってもよい。
積層体は、その1つ又は複数が電池容器の内部に挿入される。通常、正極及び負極は電池の外部導電端子に接続される。その後に、正極、負極及びセパレータを外気より遮断するために電池容器を密閉する。
密封の方法は、円筒電池の場合、電池容器の開口部に樹脂製のパッキンを有する蓋をはめ込み、電池容器と蓋とをかしめる方法が一般的である。また、角型電池の場合、金属性の封口板と呼ばれる蓋を開口部に取りつけ、溶接を行う方法を使用できる。これらの方法以外に、結着材で密封する方法、ガスケットを介してボルトで固定する方法も使用できる。更に、金属箔に熱可塑性樹脂を貼り付けたラミネート膜で密封する方法も使用できる。なお、密封時に電解質注入用の開口部を設けてもよい。有機電解液を用いる場合、その開口部から有機電解液を注入し、その後でその開口部を封止する。封止の前に通電し発生したガスを取り除いてもよい。
【実施例】
【0042】
以下、実施例に基づいて本発明をより詳細に説明するが、本発明は以下の実施例に限定されるものではない。なお、実施例で使用した試薬等は、特に断りのない限りキシダ化学社製の特級試薬を用いた。
〔実施例1〕
まず、サンプル瓶(密閉容器)に溶媒としてエタノールを20g、鉄源としてFe(NO3)3・9H2Oを13.125mmol量りとり、鉄源が溶媒中に完全に溶解するまで撹拌した。鉄源が完全に溶解したことを確認した後、リチウム源としてLiCH3COOを15mmol量りとり、ジルコニウム源としてZrCl4を1.875mmol、シリコン源としてSi(OC2H5)4を3.750mmol量りとり、これらが溶媒中に完全に溶解し、均一になるまで撹拌した。最後にリン源としてH3PO4(85%)を11.250mmol量りとり、均一になるまで撹拌した。試料のモル比をLi:Fe:Zr:P:Si=1:0.875:0.125:0.75:0.25とした。その後、プロピレンオキシド3mlを溶液中に加えると、約2分程で溶液の温度上昇と共に、流動性を失い、ゲル化した。
次いで、サンプル瓶に蓋をして密閉状態にし、得られた溶液を温度40℃の大気雰囲気下に24時間放置してゲルを得た。得られたゲルを温度60℃の大気雰囲気下に24時間放置して溶媒を蒸発させ、その後、窒素雰囲気中、温度600℃で12時間焼成した。得られた試料をA1とする。この試料の表面には、試料100重量部に対して1.6重量部の炭素が付着していることを確認した。
【0043】
〔実施例2〕
まず、サンプル瓶に溶媒としてメタノールを20g、鉄源としてFe(NO3)3・9H2Oを15mmol量りとり、鉄源が溶媒中に完全に溶解するまで撹拌した。鉄源が完全に溶解したことを確認した後、リチウム源としてLiCH3COOを15mmol量りとり、リチウム源が完全に溶解し、均一になるまで撹拌した。その後、リン源としてH3PO4(85%)を15mmol量りとり、リン源が完全に溶解し、均一になるまで撹拌した。試料のモル比をLi:Fe:P=1:1:1:とした。その後、プロピレンオキシド(炭素源)3mlを溶液中に加えると、約1分程で溶液の温度上昇と共に、流動性を失い、ゲル化した。
次いで、サンプル瓶に蓋をして密閉状態にし、得られた溶液を温度40℃の大気雰囲気下に24時間放置してゲルを得た。得られたゲルを温度60℃の大気雰囲気下に24時間放置して溶媒を蒸発させ、その後、窒素雰囲気中、温度600℃で12時間焼成した。得られた試料をA2とする。この試料の表面には、試料100重量部に対して2.4重量部の炭素が付着していることを確認した。
【0044】
〔実施例3〕
まず、サンプル瓶に溶媒としてエタノールを20g、鉄源としてFe(NO3)3・9H2Oを11.250mmol量りとり、鉄源が溶媒中に完全に溶解するまで撹拌した。鉄源が完全に溶解したことを確認した後、リチウム源としてLiCH3COOを15mmol量りとり、ジルコニウム源としてZrCl4を3.750mmol、シリコン源としてSi(OCH3)4を7.500mmol量りとり、これらが溶媒中に完全に溶解し、均一になるまで撹拌した。その後、リン源としてH3PO4(85%)を7.500mmol量りとり、リン源が完全に溶解し、均一になるまで撹拌した。試料のモル比をLi:Fe:Zr:P:Si=1:0.75:0.25:0.5:0.5とした。その後、プロピレンオキシド(炭素源)4mlを溶液中に加えると、約1分程で溶液の温度上昇と共に、流動性を失い、ゲル化した。
次いで、サンプル瓶に蓋をして密閉状態にし、温度40℃の大気雰囲気下に24時間放置してゲルを得た。得られたゲルを温度60℃の大気雰囲気下に24時間放置して溶媒を蒸発させ、その後、粉砕したゲルと水に溶解させたスクロース(炭素源)を重量比で1:0.1で混合し、乾燥させた後、窒素雰囲気中、温度600℃で12時間焼成した。得られた試料をA3とする。この試料の表面には、試料100重量部に対して3.4重量部の炭素が付着していることを確認した。
【0045】
〔実施例4〕
まず、サンプル瓶に溶媒としてエタノールを20g、鉄源としてFe(NO3)3・9H2Oを13.500mmol量りとり、鉄源が溶媒中に完全に溶解するまで撹拌した。鉄源が完全に溶解したことを確認した後、リチウム源としてLiCH3COOを15mmol量りとり、ジルコニウム源としてZrCl4を1.500mmol、シリコン源としてSi(OC2H5)4をを3.000mmol量りとり、これらが溶媒中に完全に溶解し、均一になるまで撹拌した。その後、ポリエチレングリコール200(炭素源)を1ml溶液中に加え、30分間撹拌した後、最後にリン源としてH3PO4(85%)を12.000mmol量りとり、均一になるまで撹拌した。試料のモル比をLi:Fe:Zr:P:Si=1:0.9:0.1:0.8:0.2とした。プロピレンオキシド(炭素源)を3ml溶液中に加え、30分程撹拌するとゲル化した。
次いで、サンプル瓶に蓋をして密閉状態にし、得られた溶液を温度40℃の大気雰囲気下に24時間放置してゲルを得た。得られたゲルを温度60℃の大気雰囲気下に24時間放置して溶媒を蒸発させ、その後、窒素雰囲気中、温度600℃で12時間焼成した。得られた試料をA4とする。この試料の表面には、試料100重量部に対して4.5重量部の炭素が付着していることを確認した。
【0046】
〔実施例5〕
まず、サンプル瓶に溶媒としてイソプロパノールを26g、鉄源としてFe(NO3)3・9H2Oを12.000mmol量りとり、鉄源が溶媒中に完全に溶解するまで撹拌した。鉄源が完全に溶解したことを確認した後、リチウム源としてLiNO3を15mmol量りとり、ジルコニウム源としてZrCl4を3.000mmol、シリコン源としてSi(OC2H5)4を9.000mmol量りとり、これらが溶媒中に完全に溶解し、均一になるまで撹拌した。その後、リン源としてH3PO4(85%)を9.000mmol量りとり、リン源が完全に溶解し、均一になるまで撹拌した。試料のモル比をLi:Fe:Zr:P:Si=1:0.8:0.2:0.6:0.4とした。その後、プロピレンオキシド(炭素源)3mlを溶液中に加えると、約2分程で溶液の温度上昇と共に、流動性を失い、ゲル化した。
次いで、サンプル瓶に蓋をして密閉状態にし、得られた溶液を温度40℃の大気雰囲気下に24時間放置して茶褐色のゲルを得た。得られたゲルを温度60℃の大気雰囲気下に24時間放置して溶媒を蒸発させ、その後、窒素雰囲気中、温度600℃で12時間焼成した。得られた試料をA5とする。この試料の表面には、試料100重量部に対して1.8重量部の炭素が付着していることを確認した。
【0047】
〔実施例6〕
出発原料にリチウム源として酢酸リチウム、鉄源として硝酸鉄(III)、リン源としてリン酸を用い、これら出発原料を、モル比でLi:Fe:P=1:1:1となるように計量した。モル比でLiの26.67倍のエタノールに計量した出発原料を溶解させた。出発原料が溶解したエタノール溶液にプロピレンオキシドをエタノールと等モル添加したところ、約30秒で溶液の温度上昇と共に、流動性を失い、ゲル化した。添加後の溶液を、容器に入れて蓋をし、60℃の乾燥炉で一晩放置した後、蓋を開けた状態で更に一晩乾燥させることでゲルを得た。得られたゲルを不活性雰囲気(具体的には窒素雰囲気)中550℃で12時間焼成することで、オリビン型の単相粉末(粒径10μm)からなる正極活物質である炭素で被覆されたリチウム含有複合酸化物(LiFePO4)を得た。得られた試料をA6とする。この試料の表面には、試料100重量部に対して6.2重量部の炭素が付着していることを確認した。
【0048】
〔比較例1〕
メノウ乳鉢に、リチウム源として炭酸リチウム(Li2CO3)を15mmol、鉄源としてシュウ酸鉄二水和物(FeC2O4・2H2O)を13.125mmol、ジルコニウム源としてオキシ塩化ジルコニウム(ZrOCl2)を1.875mmol、リン源としてリン酸水素アンモニウム((NH4)2HPO4)を11.250mmol、シリコン源としてSiO2粉末を3.750mmol量りとり、均一になるまで粉砕した。試料のモル比をLi:Fe:Zr:P:Si=1:0.875:0.125:0.75:0.25とした。更に、生成予測されるLiFe0.875Zr0.125P0.750Si0.250O4の重量に対して10重量%のスクロース(炭素源)を加え、均一になるまで原料を混合粉砕した。
次いで、得られた粉末を窒素雰囲気中、温度600℃で12時間焼成した。得られた試料をB1とする。この試料の表面には、試料100重量部に対して2.3重量部の炭素が付着していることを確認した。
【0049】
(正極活物質の組成)
得られた試料A1〜A6、B1をそれぞれメノウ乳鉢で粉砕し、粉末X線解析装置(株式会社リガク製、型式:MiniFlex II)により、それぞれ図1〜7に示す粉末X線回折パターンを得た。測定条件は2θの範囲が10°〜90°、1ステップ0.02°で1ステップ当りの計測時間を3sのFTモードとした。
次に、得られた粉末X線回折パターンについて、「RIETAN-2000」(F.Izumi AND T.Ikeda, Mater. Sci. Forum, 321-324(2000)198-203)を用いて構造解析を行ったところ、それぞれ生成予測した組成の正極活物質が得られていることが確認できた。
【0050】
(二次電池の評価)
得られた試料について以下の方法で、二次電池を作成した。
試料A1〜A6及びB1をそれぞれ約1g秤量しメノウ乳鉢にて粉砕し、これに導電剤として約10重量%のアセチレンブラックと、結着剤として約10重量%のテフロン樹脂粉末とを混合した。
この混合物をN−メチル−2−ピロリドンに溶解してスラリー状にし、これを厚さ20μmのアルミニウム箔の両面にドクターブレード法で塗布した。塗布量としては約5mg/cm2となるようにした。この塗膜を乾燥した後に、プレスを行って正極を作製した。
負極活物質として、天然黒鉛粉末又はチタン酸リチウム(Li4Ti5O12)を使用した。この負極活物質に結着剤として約10重量%のテフロン樹脂粉末を混合した。負極活物質にチタン酸リチウムを使用する場合には、導電剤として10重量%のアセチレンブラックを更に混合した。この混合物をN−メチル−2−ピロリドンに溶解してスラリー状にし、これを厚さ20μmの銅箔の両面に塗布し、乾燥した後に、プレスを行って負極を作製した。
【0051】
上記のようにして作製した正極と負極をそれぞれ30mm×30mmの大きさに切り抜き、電池の電流導入端子として正極には幅3mm、長さ50mmのアルミニウム製タブを、負極には幅3mm、長さ50mm銅製タブを溶接した。
これらの正極と負極との間に多孔質ポリエチレン製のセパレータを挟んだ。得られた積層体を、電池外装として2枚の金属箔に熱可塑性樹脂を貼り付けたラミネート膜の間に挟み、周囲を熱溶着することにより密封した。なおこのラミネートには電解質注入用の開口部が設けられている。
開口部に1モル/リットルのLiPF6を溶解させた33体積%のエチレンカーボネートと67体積%のジエチルカーボネートとを電解質として含浸させた。次いで、開口部を封止して図8に示す二次電池を得た。図8は二次電池の概略断面図である。図8中、1は正極、2は負極、3はセパレータ、4は正極及び負極タブ、5はラミネートを意味する。
このように作製した電池を25℃の環境下で充放電した。充電電流は1mAとし、電池の電位が4Vに到達した時点で充電を終了させた。充電終了後1mAで放電を行い電池の電位が2.0Vに到達した時点で放電を終了した。更に1mAの電流にて充放電を繰返し、100回目の放電容量を計測し、下記の式にて容量保持率(%)を求めた。
容量保持率=100回目放電容量/初回放電容量
得られた結果を、正極活物質の原料及び製造条件と共に表1に示す。
【0052】
【表1】

【0053】
表1の結果から、正極活物質として、本発明の製造方法により得られた試料A1〜A6を用いた非水電解質二次電池は、初期放電容量及び100回目放電容量がほぼ100mAh/g以上であり、容量保持率がほぼ90%以上であり、良好なサイクル特性を有することがわかる。
一方、正極活物質として、組成の異なる試料B1を用いた非水電解質二次電池は、初期放電容量、100回目放電容量及び容量保持率において上記の非水電解質二次電池と比較して劣ることがわかる。
【符号の説明】
【0054】
1:正極
2:負極
3:セパレータ
4:正極及び負極タブ
5:ラミネート
【特許請求の範囲】
【請求項1】
オリビン構造を有する下記一般式(1)で示される正極活物質を形成するのに必要なリチウム源、M源、リン源及びX源の各所定量を溶媒に溶解させて溶液を調製する工程と、得られた溶液を環状エーテルの付与によりゲル化させる工程と、
生成したゲルを焼成処理することで炭素被覆されたリチウム含有複合酸化物を得る工程
を含む、下記一般式(1):
LixMyP1-zXzO4 (1)
で表される化合物(式中、Mは、Fe、Ni、Mn、Zr、Sn、Al及びYからなる群から選択される少なくとも1種の元素であり、Xは、Si及びAlから成る群から選択される少なくとも1種であり、0<x≦2、0.8≦y≦1.2、0≦z≦1の範囲である)を得ることを特徴とする正極活物質の製造方法。
【請求項2】
前記環状エーテルが、構造中にエポキシ基あるいはオキセタン環を含む請求項1に記載の正極活物質の製造方法。
【請求項3】
上記一般式(1)中のMがFe及びZrであり、XがSiである請求項1又は2に記載の正極活物質の製造方法。
【請求項4】
前記リチウム源が酢酸リチウム又は硝酸リチウム、前記M源が硝酸鉄九水和物、塩化ジルコニウム、前記リン源がリン酸、前記シリコン源がテトラエトキシシラン又はテトラメトキシシランである請求項1〜3のいずれか1つに記載の正極活物質の製造方法。
【請求項5】
前記溶媒が、アルコール溶媒である請求項1〜4のいずれか1つに記載の正極活物質の製造方法。
【請求項6】
前記アルコール溶媒が、メタノール、エタノール又はプロパノールである請求項5に記載の正極活物質の製造方法。
【請求項7】
前記焼成処理に付す工程が、予め前記ゲルを大気雰囲気、温度40〜70℃で1〜72時間保持して乾燥させ、次いで還元雰囲気、温度400〜800℃で1〜48時間保持することからなる請求項1〜6のいずれか1つに記載の正極活物質の製造方法。
【請求項8】
請求項1〜7のいずれか1つに記載の製造方法により得られた正極活物質。
【請求項9】
請求項1〜7のいずれか1つに記載の製造方法により得られた正極活物質と、導電材と、バインダーとを含むことを特徴とする正極。
【請求項10】
請求項1〜7のいずれか1つに記載の製造方法により得られた正極活物質を含む正極と、負極と、電解質と、セパレータとを有することを特徴とする非水電解質二次電池。
【請求項1】
オリビン構造を有する下記一般式(1)で示される正極活物質を形成するのに必要なリチウム源、M源、リン源及びX源の各所定量を溶媒に溶解させて溶液を調製する工程と、得られた溶液を環状エーテルの付与によりゲル化させる工程と、
生成したゲルを焼成処理することで炭素被覆されたリチウム含有複合酸化物を得る工程
を含む、下記一般式(1):
LixMyP1-zXzO4 (1)
で表される化合物(式中、Mは、Fe、Ni、Mn、Zr、Sn、Al及びYからなる群から選択される少なくとも1種の元素であり、Xは、Si及びAlから成る群から選択される少なくとも1種であり、0<x≦2、0.8≦y≦1.2、0≦z≦1の範囲である)を得ることを特徴とする正極活物質の製造方法。
【請求項2】
前記環状エーテルが、構造中にエポキシ基あるいはオキセタン環を含む請求項1に記載の正極活物質の製造方法。
【請求項3】
上記一般式(1)中のMがFe及びZrであり、XがSiである請求項1又は2に記載の正極活物質の製造方法。
【請求項4】
前記リチウム源が酢酸リチウム又は硝酸リチウム、前記M源が硝酸鉄九水和物、塩化ジルコニウム、前記リン源がリン酸、前記シリコン源がテトラエトキシシラン又はテトラメトキシシランである請求項1〜3のいずれか1つに記載の正極活物質の製造方法。
【請求項5】
前記溶媒が、アルコール溶媒である請求項1〜4のいずれか1つに記載の正極活物質の製造方法。
【請求項6】
前記アルコール溶媒が、メタノール、エタノール又はプロパノールである請求項5に記載の正極活物質の製造方法。
【請求項7】
前記焼成処理に付す工程が、予め前記ゲルを大気雰囲気、温度40〜70℃で1〜72時間保持して乾燥させ、次いで還元雰囲気、温度400〜800℃で1〜48時間保持することからなる請求項1〜6のいずれか1つに記載の正極活物質の製造方法。
【請求項8】
請求項1〜7のいずれか1つに記載の製造方法により得られた正極活物質。
【請求項9】
請求項1〜7のいずれか1つに記載の製造方法により得られた正極活物質と、導電材と、バインダーとを含むことを特徴とする正極。
【請求項10】
請求項1〜7のいずれか1つに記載の製造方法により得られた正極活物質を含む正極と、負極と、電解質と、セパレータとを有することを特徴とする非水電解質二次電池。
【図8】


【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】




【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【公開番号】特開2012−89342(P2012−89342A)
【公開日】平成24年5月10日(2012.5.10)
【国際特許分類】
【出願番号】特願2010−234814(P2010−234814)
【出願日】平成22年10月19日(2010.10.19)
【出願人】(000005049)シャープ株式会社 (33,933)
【出願人】(504132272)国立大学法人京都大学 (1,269)
【Fターム(参考)】
【公開日】平成24年5月10日(2012.5.10)
【国際特許分類】
【出願日】平成22年10月19日(2010.10.19)
【出願人】(000005049)シャープ株式会社 (33,933)
【出願人】(504132272)国立大学法人京都大学 (1,269)
【Fターム(参考)】
[ Back to top ]

