歯周病予防または治療用組成物
【課題】 天然由来の成分を有効成分とする、歯周病予防または治療用に有効な薬剤を含む組成物を提供すること。
【解決手段】 鶏血藤またはその抽出物を有効成分とする歯周病予防または治療用組成物。該組成物は、洗口含漱剤、歯磨き剤またはパップ剤の形態で使用され得る。また本発明は、鶏血藤またはその抽出物を有効成分とする破骨細胞の分化・延命抑制剤および活性酸素種除去剤を提供する。
【解決手段】 鶏血藤またはその抽出物を有効成分とする歯周病予防または治療用組成物。該組成物は、洗口含漱剤、歯磨き剤またはパップ剤の形態で使用され得る。また本発明は、鶏血藤またはその抽出物を有効成分とする破骨細胞の分化・延命抑制剤および活性酸素種除去剤を提供する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、歯周病予防または治療用組成物に関する。
【背景技術】
【0002】
慢性(成人性)歯周炎は、歯肉溝細菌叢を構成する常在菌のうち、主にグラム陰性嫌気性桿菌と呼ばれるグループの細菌群の増殖により、歯周組織に引き起こされる慢性感染症である。加齢とともに罹患率が上昇し、40歳代以降の多くが限局性あるいは広汎性の歯周炎に罹患していると言われている。本疾患の実体は、歯周組織の慢性化膿性炎であるが、その影響は口腔内にとどまらず、最近では虚血性疾患や糖尿病、肥満等との関連が明らかにされつつある。本疾患の予防並びに治療は、歯ブラシによる機械的清掃や、外科的処置に依存する部分が多く、予防/治療手段にさらなる向上が望まれている。
【0003】
なお、下記特許文献1には、ビンロウジ(檳榔子)、カンゾウ(甘草)、ニクズク(肉蒄)、およびヤクモソウ(益母草)のうち、少なくとも2種以上の抽出エキス及びマスティック(乳香)の抽出エキスを有効成分とする歯周病予防又は治療用組成物が開示されている。
【0004】
ポルフィロモナス・ジンジヴァーリス(Porphyromonas gingivalis(PG))は本疾患患者に高頻度かつ特徴的に検出される細菌で、強いタンパク分解活性並びに、骨吸収誘導活性の強い内毒素を持つことから、慢性歯周炎の原因菌の一つと考えられている。歯周ポケットにおける本菌の増減が慢性歯周炎の病態の変化に一致することから、本菌に対する直接的な抗菌性あるいは、歯周病の主症状の一つである骨吸収の阻害作用のある物質は、慢性歯周炎の予防や進行の抑制に有効なことが考えられる。
【特許文献1】特許第3389556号公報
【発明の開示】
【発明が解決しようとする課題】
【0005】
本発明の目的は、天然由来の成分を有効成分とする、歯周病予防または治療用に有効な薬剤を含む組成物を提供することにある。
【課題を解決するための手段】
【0006】
本発明者は、鶏血藤と呼ばれる植物が、強い破骨細胞の分化・延命抑制作用、歯周病の原因菌に対する抗菌作用、活性酸素種除去作用を有することを見出し、本発明を完成するに至った。
【0007】
すなわち本発明は、以下のとおりである。
1.鶏血藤またはその抽出物を有効成分とする歯周病予防または治療用組成物。
2.洗口含漱剤の形態で使用される、前記1に記載の歯周病予防または治療用組成物。
3.歯磨き剤の形態で使用される、前記1に記載の歯周病予防または治療用組成物。
4.パップ剤の形態で使用される、前記1に記載の歯周病予防または治療用組成物。
5.鶏血藤またはその抽出物を有効成分とする破骨細胞の分化・延命抑制剤。
6.鶏血藤またはその抽出物を有効成分とする活性酸素種除去剤。
7.鶏血藤またはその抽出物を有効成分とするインプラント周囲炎(ペリインプラントタイティス)予防または治療用組成物。
【発明の効果】
【0008】
鶏血藤は、強い破骨細胞の分化・延命抑制作用、歯周病の原因菌に対する抗菌作用、活性酸素種除去作用を有する。したがって本発明によれば歯周病予防または治療用に有効な組成物を提供することができる。
また本発明によれば、鶏血藤またはその抽出物を有効成分とする破骨細胞の分化・延命抑制剤および活性酸素種除去剤を提供することができる。
【発明を実施するための最良の形態】
【0009】
以下、本発明をさらに詳しく説明する。
本発明でいう鶏血藤は、公知の生薬であり、例えば、マメ科に属する密花豆(Spatholobus suberectus Dunn)、光葉密花豆(S. harmandii Gagnep)、紅血藤(S. sinensis Chun et T, Chen)、香花崖豆藤(Millettia dielsianaHarms)、豊城崖豆藤(M. nitida Benth. var. hirsutissima Z. Wei)、崖豆藤(M. gentiliana Level)、美麗根崖豆藤(M. speciosa Champ.)、網絡崖豆藤(M. reticulata benth)、常春油麻藤(Mucuna sempervirens Hemsl.)、白花油麻藤(M. birdwoodiana Tutcher)、褐毛藜豆(M. castanea Merr)、巴豆藤(Craspedolobium schochii Harms)、マツブサ科に属する内南五味子(Kadsura interior A.C. Smith)、異型南五味子(K. heteroclita (Roxb.) Craib)、鉄箍散(Schisandra propinqua (Wall.) Baill. var. sinensis Oliv.)を包含する。
【0010】
本発明では、鶏血藤の乾燥した茎、つる、根をそのまま用いることができ、あるいは、鶏血藤の乾燥した茎、つる、根と、適当な溶媒(例えば水または熱水)とを接触させ、得られた抽出物を用いることもできる。また、抽出物の性状もとくに制限されず、液状、軟稠エキス状、粉末状、顆粒状等のものを用いることができる。
【0011】
鶏血藤は、下記の実施例でも記載のとおり、強い破骨細胞の分化・延命抑制作用を有する。また鶏血藤は、歯周病の原因菌に対する抗菌作用および活性酸素種除去作用を有する。さらに、鶏血藤は、下記の実施例の記載から自明なように、インプラント周囲炎(ペリインプラントタイティス)(Peri-implantitis)の予防または治療用としても有効である。
【0012】
したがって本発明では、上記鶏血藤またはその抽出物を、歯周病予防または治療用組成物の有効成分として使用できる。本発明の歯周病予防または治療用組成物は、鶏血藤またはその抽出物の細粒を水で希釈して洗口含嗽剤(うがい薬)として用いたり、歯磨き剤として使用したり、あるいはパップ剤として口内等の患部に貼り付けて用いることができる。
【0013】
鶏血藤またはその抽出物を経口投与する場合、その投与量は、とくに制限されないが、乾燥物として(抽出物の場合は乾燥粉末として)、例えば成人1日あたり、5g〜20gである。
また、鶏血藤またはその抽出物を洗口含嗽剤、歯磨き剤あるいはパップ剤として用いる場合、鶏血藤またはその抽出物の含有量は、例えば2〜8質量%であるのが好ましい。
ヒトの歯肉粘膜上皮はループ状の毛細血管が豊富であり、生体との親和性の高い本発明の組成物は、該上皮から容易に吸収されると考えられる。
【0014】
本発明の歯周病予防または治療用組成物には、上記有効成分以外に、種々の添加剤を含有させることができる。例えば、抗酸化活性成分としては、コエンザイムQ10、フェルラ酸、アスタキサンチン、ビタミンE、ビタミンC、ビタミンA、BHT、BHA、NDGA、没食子酸プロピル、ポリフェノール類(タンニン類)、エリソルビン酸等が挙げられる。その他の薬効成分としては、例えば、アズレンスルホン酸ナトリウム、ε−アミノカプロン酸、アラントイン、アラントインクロルヒドロキシアルミニウム、アラントインジヒドロキシアルミニウム、エピジヒドロコレステリン、ジヒドロコレステロール、塩化ナトリウム、グリチルリチン酸、グリチルリチン酸二アンモニウム、グリチルリチン酸二ナトリウム、グリチルリチン酸三ナトリウム、グリチルリチン酸ジカリウム、グリチルリチン酸モノアンモニウム、β−グリチルレチン酸、イソプロピルメチルフェノール、塩化セチルピリジニウム、塩化デカリニウム、塩化ベンザルコニウム、塩化ベンザルコニウム液、塩酸アルキルジアミノエチルグリシン液、塩酸クロルヘキシジン、トリクロサン、アスコルビン酸、アスコルビン酸ナトリウム、塩酸ピリドキシン、酢酸dl−α−トコフェロール、ニコチン酸dl−α−トコフェロール、ゼオライト、ピロリン酸二水素ナトリウム、ピロリン酸ナトリウム、無水ピロリン酸ナトリウム、リン酸一水素ナトリウム、リン酸三ナトリウム、ポリリン酸ナトリウム、フッ化ナトリウム、モノフルオロリン酸ナトリウム、ポリエチレングリコール200、ポリエチレングリコール300、ポリエチレングリコール400、ポリエチレングリコール600、ポリエチレングリコール1000、ポリエチレングリコール1500、ポリエチレングリコール1540、ポリエチレングリコール4000、ポリエチレングリコール6000、ポリエチレングリコール20000、ポリビニルピロリドン、ポリビニルピロリドンK25、ポリビニルピロリドンK30、ポリビニルピロリドンK90、塩化リゾチーム、銅クロロフィリンナトリウム、ヒノキチオール、ポリオキシエチレンラウリルエーテル、ラウロイルサルコシンナトリウム等が挙げられる。
【0015】
湿潤剤としては、濃グリセリン、ソルビット液などが挙げられる。溶剤としては、エタノール、水、オリーブ油、ヤシ油、大豆油、綿実油、トウモロコシ油、ゴマ油、ナタネ油、落花生油、ツバキ油等の食用油などが挙げられる。増粘剤としては、キサンタンガム、カラギーナン、カルボキシメチルセルロースナトリウム、ヒドロキシエチルセルロース、ミツロウなどが挙げられる。界面活性剤としては、ショ糖脂肪酸エステル、ラウリル硫酸ナトリウム、ラウロイルサルコシンナトリウムなどが挙げられる。香味剤としては、メントール、ペパーミント油、スペアミント油、オレンジ油、レモン油、ユーカリ油、ハッカ油、アカシア油、ウイキョウ油、クエントウ油、カラムス油、ショウノウ油、ニッケイ油、ケイ皮油、ケイ葉油、バラ油、ビャクダン油、チョウジ油、ハーブ油、バナナ油、リンゴ油、サリチル酸メチル、カルボン、アネトール、リモネン等のテルペン類などの香料および調合香料が挙げられる。
【実施例】
【0016】
以下、本発明を実施例によりさらに具体的に説明する。
【0017】
(鶏血藤抽出液の調製)
鶏血藤抽出液は、1Lの水に200g(20%w/v)の鶏血藤を加え95℃で3時間加熱したものを鶏血藤20%抽出液とし、これを適宜PBSで希釈し、以下の実験に供試した。
なお、鶏血藤は密花豆Spatholobus suberectus DUNNの乾燥茎を実験に供した。
【0018】
(実施例1:Porphyromonas gingivalis ATCC 33277株(PG)感染マウス歯槽骨吸収モデルにおける鶏血藤の骨吸収抑制効果)
6週齢のC57BL/6マウス72匹を、24匹ずつ非感染コントロール群、PG感染コントロール群およびPG感染+鶏血藤投与(実験群)の3群に分け、それぞれにサルファメトキサゾールおよびトリメトプリムを含む飲料水を1週間投与し、口腔常在菌を除菌した。体内の抗菌薬を排出させるため3日間イオン交換水で飼育後、1週間に3回、1回につき約1×109個のPG菌体を含む2.5%カルボキシメチルセルロース溶液0.1mlを、PG感染コントロール群ならびに実験群に接種した。菌接種の完了と同時に、実験群には8%鶏血藤水抽出液を飲料水として供与し、その他はイオン交換水を飲料水とした。
感染終了後から1週間ごとに6週間にわたり各群から4匹ずつ抽出・屠殺し、右側頭部について当該骨格標本を作製し、上顎歯槽骨の吸収量を実体顕微鏡観察下で行った。左側頭部はギ酸ホルマリンで脱灰後、病理標本を作製し、ヘマトキシリン-エオシン染色あるいは酒石酸抵抗性酸性フォスファターゼ(TRAP)染色を行い、炎症の状態や破骨細胞の出現について検討した。
【0019】
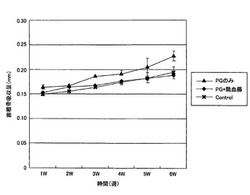
図1は、歯槽骨吸収量の経時的変化を示すグラフである。
図2は、破骨細胞出現数の経時的変化を示すグラフである。
図3は、破骨細胞数算定の算定区域を示す図であり、マウス上顎第一臼歯より第三臼歯に隣接する歯槽骨(黒線で囲まれた範囲)に出現した破骨細胞数を算定した。
図4は、マウス歯周組織のTRAP染色像である。
【0020】
図1の結果から、PG感染コントロール群では、非感染コントロール群と比べて経時的に骨の吸収量が増加し、その傾向は実験終了まで継続した。実験群では、骨吸収が非感染コントロール群と同程度まで抑制されたことから、鶏血藤の投与がPG感染による歯槽骨吸収の抑制に有効であることが示された。
また、図2の結果から、第1臼歯近心根から第3臼歯の遠心根を囲む歯槽骨面に認められた破骨細胞(osteoclast)は、PG感染コントロール群に明らかに多く、また実験経過に伴いその数は増加傾向を示したが、実験群は非感染コントロール群と相違はみられなかった。
一方、図4に示す病理標本において、非感染コントロール群、PG感染コントロール群及び実験群のいずれにも臼歯部歯間乳頭の粘膜上皮内と上皮直下にごく僅かの炎症細胞浸潤(好中球とリンパ球)が散見された。しかし、PG感染コントロール群では、非感染コントロール群に比べ歯槽骨面に吸収窩が多く認められ、実験期間の経過に伴い骨量の減少が観察された。実験群の歯槽骨には著しい変化はなく、非感染コントロール群ほぼ同様の所見であった。
【0021】
(実施例2:PGに対する鶏血藤の抗菌効果)
0.2%、2%もしくは8%鶏血藤抽出液またはPBSの5mlに、OD600=1に調整したPGのPBS懸濁液の0.05mlを加え、0分、1分、15分または60分放置した。その後、サンプルを10倍希釈し、含まれる生菌数を培養法で計測した。培養は37℃嫌気条件(15%CO2、15%H2、70%N2)下で5日間行なった。結果を図5に示す。
図5の結果から、鶏血藤抽出液にPGを混合し60分間ベンチトップで放置すると、鶏血藤を加えないコントロール対して、鶏血藤0.2%濃度で約55%、2%濃度で約15%、8%濃度で約0.1%のレベルまで生菌数の減少が検出されたことから、鶏血藤は、濃度並びに時間依存的に、PGに対して抗菌効果を示すことが明らかとなった。
【0022】
(実施例3:鶏血藤の破骨細胞の分化抑制効果)
骨髄由来の単球・マクロファージ等の破骨細胞の前駆細胞はMacrophage-Colony Stimulating Factor(M-CSF)の存在下でReceptor activator of NF-κB ligand (RANKL)の刺激により破骨細胞に分化することが知られている。マウス骨髄細胞も、M-CSF添加培地でRANKLのドナーであるMC3T3-G2/PA6細胞と共培養することで破骨細胞に分化する。そこで、破骨細胞の分化過程における鶏血藤の影響を検討する目的でマウス破骨細胞形成系に各種濃度の鶏血藤抽出液を添加し、破骨細胞の形成誘導に対する鶏血藤の影響を検討した。
【0023】
C57BL/6マウス大腿骨より採取した骨髄細胞と破骨細胞分化支持能を持つMC3T3-G2/PA6細胞を各種濃度の鶏血藤抽出液を含むビタミンD3およびデキサメサゾンを添加した10%仔牛血清添加α-Minimum essential medium(α-MEM)で7日間培養した。培養終了後、サンプルを破骨細胞マーカーである酒石酸抵抗性酸性フォスファターゼ(TRAP)で染色し、TRAP陽性で3核以上の細胞を成熟破骨細胞としてカウントし、鶏血藤添加しなかったコントロール群と各種濃度の鶏血藤を加えた実験群に観察された成熟破骨細胞数をstudent-t検定で比較した。 結果を図6に示す。
図6の結果から、培地中に鶏血藤抽出液を添加しなかったコントロール群に比べ、鶏血藤抽出液0.1%および0.01%添加群では破骨細胞数がそれぞれ約100%および50%に減少し(p<0.01)、有意な発育抑制が検出された。以上の結果は、鶏血藤抽出液は、M-CSFとRANKL依存的な骨髄細胞から破骨細胞への分化を阻害することを示している。なお、前記鶏血藤抽出液のパーセントは、培地中の鶏血藤濃度である。
【0024】
(実施例4:RANKLの破骨細胞延命作用に対する鶏血藤の抑制効果)
Receptor activator of NF-κB ligand (RANKL)やMacrophage-Colony Stimulating Factor(M-CSF)は破骨細胞の分化に必須であり、また破骨細胞の生存を延長することが知られている。破骨細胞をRANKL添加培地で培養すると、未添加培地と比べた場合に比べその寿命が大幅に延長する。一方、RANKL未添加培地中の破骨細胞は急速に死滅する。そこで、RANKLによる成熟破骨細胞生存に対する鶏血藤の影響を検討した。
【0025】
C57BL/6マウス骨髄細胞とMC3T3-G2/PA6細胞をビタミンD3(1x10-8M)、プロスタグランジンE2(1x10-7M)および10%仔牛血清を含むα-Mimimum Essential Medium (MEM)で培養、形成された破骨細胞を分離した。
その後、破骨細胞を、次の3種類の培地で48時間培養した。
1.RANKL未添加α-MEM培地
2.RANKL(200μg/ml)、M-CSF(100μg/ml)添加α-MEM
3.RANKL(200μg/ml)、M-CSF(100μg/ml)および各種濃度の鶏血藤抽出液の添加α-MEM
培養後、成熟破骨細胞マーカーである酒石酸抵抗性酸性フォスファターゼ(TRAP)の染色を行った。TRAP陽性で3核以上の細胞を生存破骨細胞としてカウントし、観察された破骨細胞数をstudent-t検定で比較した。結果を図7に示す。
図7の結果から、鶏血藤抽出液を最終濃度0.1%、0.01%、および0.001%濃度で培地に添加した実験群では、RANKL添加により寿命が延長した陽性コントロール群に比べ生存する破骨細胞数がそれぞれ約30%、40%および80%と有意に減少した(p<0.01)。これは、培養過程で細胞が死滅したことを示すものである。
【0026】
(実施例5:鶏血藤の活性酸素種除去効果)
電子スピン共鳴(ESR)法によるフリーラジカル検出:
ヒドロキシルラジカルはフェントン反応(FeSO4にH2O2添加)を用いて発生させ、また、スーパーオキサイドラジカルはhypoxanthineにXanthine oxidase添加して発生させた。発生した各フリーラジカルはラジカル補足試薬DMPOで補足した後、電子スピン共鳴(ESR)装置(JES-RE 3X X-band、日本電子)を用いて検出した(対照群)。フリーラジカル消去活性実験は、このラジカル発生系に各種生薬、またはスーパーオキサイドディスムターゼ(SOD)およびdeferoxamine(DFX)を加え、補足されたラジカルのESRシグナル強度を比較検討した。
サンプル調製法と手技:
ESRによるヒドロキシルラジカルの検出は、リン酸緩衝液(PBS, pH7.0)185μl内に10-4M FeSO4 25μl、8.8M DMPO(5.5-Dimethyl-1-Pyrriline-N-Oxide、同人化学)を15μl加えた混合液に、10-4M H2O2 (和光)25μl加えて反応させ、1分後にESRフラットセルに130μl吸引、ESRレゾネーター内に装着して測定開始した。
ヒドロキシルラジカル消去活性実験は、リン酸緩衝液(PBS, pH7.0)135μl、生薬ないしdeferoxamine (NOVARTIS) 25μl、10-4M FeSO4 25μl、8.8M DMPO (5.5-Dimethyl-1-Pyrriline-N-Oxide、同人化学)を15μl加えた混合液に、10-4M H2O2 (和光)25μl加えて反応させ、1分後にESRフラットセルに130μl吸引、ESRレゾネーター内に装着して測定開始した。
ESRによるスーパーオキサイドラジカルの検出は、リン酸緩衝液(PBS, pH7.0)135μl内に0.01U/1ml Xanthine oxidase(Roche) 25μl、0.2mM DTPA(SIGMA) 25μl、 8.8M DMPO (5.5-Dimethyl-1-Pyrriline-N-Oxide、同人化学)を15μl加えた混合液に、10-5M hypoxanthine(SIGMA)を25μl加えて反応させ、1分後にESRフラットセルに130μl吸引、ESRレゾネーター内に装着して測定開始した。
スーパーオキサイドラジカル消去活性実験におけるフリーラジカルの検出は、リン酸緩衝液(PBS, pH7.0)135μl内に0.01U/1ml Xanthine oxidase、25μl、0.2mM DTPA(SIGMA) 25μl、各種生薬ないしSOD25μl、8.8M DMPO (5.5-Dimethyl-1-Pyrriline-N-Oxide、同人化学)を15μl加えた混合液に、10-5M hypoxanthine(SIGMA)を25μl加えて反応させ、1分後にESRフラットセルに130μl吸引、ESRレゾネーター内に装着して測定開始した。
ESR装置の測定条件:
磁場変調幅;0.063 mT、掃引幅;5 mT、掃引時間;1 min、時定数;0.03 sec、マイクロ波出力;8 mW、磁場;335.5±5 mT、受信感度;7.9×10に設定した。
結果を図8〜図11に示す。
図8〜図11の結果から、鶏血藤は著しく強力な活性酸素種除去効果を示すことが分かる。なお抑制率とは、対照群に対する活性酸素種の除去割合である。
【図面の簡単な説明】
【0027】
【図1】実施例1における、歯槽骨吸収量の経時的変化を示すグラフである。
【図2】実施例1における、破骨細胞出現数の経時的変化を示すグラフである。
【図3】実施例1における、破骨細胞数算定の算定区域を示す図であり、マウス上顎第一臼歯より第三臼歯に隣接する歯槽骨(黒線で囲まれた範囲)に出現した破骨細胞数を算定した。
【図4】実施例1における、マウス歯周組織のTRAP染色像である。
【図5】実施例2における、PGに対する鶏血藤の抗菌効果を示すグラフである。
【図6】実施例3における、鶏血藤の破骨細胞の分化抑制効果を示すグラフである。
【図7】実施例4における、RANKLの破骨細胞延命作用に対する鶏血藤の抑制効果を示すグラフである。
【図8】実施例5における、鶏血藤の活性酸素種(・OH)除去効果を示すグラフである。
【図9】実施例5における、DFXの活性酸素種(・OH)除去効果を示すグラフである。
【図10】実施例5における、鶏血藤の活性酸素種(・O)除去効果を示すグラフである。
【図11】実施例5における、SODの活性酸素種(・O)除去効果を示すグラフである。
【技術分野】
【0001】
本発明は、歯周病予防または治療用組成物に関する。
【背景技術】
【0002】
慢性(成人性)歯周炎は、歯肉溝細菌叢を構成する常在菌のうち、主にグラム陰性嫌気性桿菌と呼ばれるグループの細菌群の増殖により、歯周組織に引き起こされる慢性感染症である。加齢とともに罹患率が上昇し、40歳代以降の多くが限局性あるいは広汎性の歯周炎に罹患していると言われている。本疾患の実体は、歯周組織の慢性化膿性炎であるが、その影響は口腔内にとどまらず、最近では虚血性疾患や糖尿病、肥満等との関連が明らかにされつつある。本疾患の予防並びに治療は、歯ブラシによる機械的清掃や、外科的処置に依存する部分が多く、予防/治療手段にさらなる向上が望まれている。
【0003】
なお、下記特許文献1には、ビンロウジ(檳榔子)、カンゾウ(甘草)、ニクズク(肉蒄)、およびヤクモソウ(益母草)のうち、少なくとも2種以上の抽出エキス及びマスティック(乳香)の抽出エキスを有効成分とする歯周病予防又は治療用組成物が開示されている。
【0004】
ポルフィロモナス・ジンジヴァーリス(Porphyromonas gingivalis(PG))は本疾患患者に高頻度かつ特徴的に検出される細菌で、強いタンパク分解活性並びに、骨吸収誘導活性の強い内毒素を持つことから、慢性歯周炎の原因菌の一つと考えられている。歯周ポケットにおける本菌の増減が慢性歯周炎の病態の変化に一致することから、本菌に対する直接的な抗菌性あるいは、歯周病の主症状の一つである骨吸収の阻害作用のある物質は、慢性歯周炎の予防や進行の抑制に有効なことが考えられる。
【特許文献1】特許第3389556号公報
【発明の開示】
【発明が解決しようとする課題】
【0005】
本発明の目的は、天然由来の成分を有効成分とする、歯周病予防または治療用に有効な薬剤を含む組成物を提供することにある。
【課題を解決するための手段】
【0006】
本発明者は、鶏血藤と呼ばれる植物が、強い破骨細胞の分化・延命抑制作用、歯周病の原因菌に対する抗菌作用、活性酸素種除去作用を有することを見出し、本発明を完成するに至った。
【0007】
すなわち本発明は、以下のとおりである。
1.鶏血藤またはその抽出物を有効成分とする歯周病予防または治療用組成物。
2.洗口含漱剤の形態で使用される、前記1に記載の歯周病予防または治療用組成物。
3.歯磨き剤の形態で使用される、前記1に記載の歯周病予防または治療用組成物。
4.パップ剤の形態で使用される、前記1に記載の歯周病予防または治療用組成物。
5.鶏血藤またはその抽出物を有効成分とする破骨細胞の分化・延命抑制剤。
6.鶏血藤またはその抽出物を有効成分とする活性酸素種除去剤。
7.鶏血藤またはその抽出物を有効成分とするインプラント周囲炎(ペリインプラントタイティス)予防または治療用組成物。
【発明の効果】
【0008】
鶏血藤は、強い破骨細胞の分化・延命抑制作用、歯周病の原因菌に対する抗菌作用、活性酸素種除去作用を有する。したがって本発明によれば歯周病予防または治療用に有効な組成物を提供することができる。
また本発明によれば、鶏血藤またはその抽出物を有効成分とする破骨細胞の分化・延命抑制剤および活性酸素種除去剤を提供することができる。
【発明を実施するための最良の形態】
【0009】
以下、本発明をさらに詳しく説明する。
本発明でいう鶏血藤は、公知の生薬であり、例えば、マメ科に属する密花豆(Spatholobus suberectus Dunn)、光葉密花豆(S. harmandii Gagnep)、紅血藤(S. sinensis Chun et T, Chen)、香花崖豆藤(Millettia dielsianaHarms)、豊城崖豆藤(M. nitida Benth. var. hirsutissima Z. Wei)、崖豆藤(M. gentiliana Level)、美麗根崖豆藤(M. speciosa Champ.)、網絡崖豆藤(M. reticulata benth)、常春油麻藤(Mucuna sempervirens Hemsl.)、白花油麻藤(M. birdwoodiana Tutcher)、褐毛藜豆(M. castanea Merr)、巴豆藤(Craspedolobium schochii Harms)、マツブサ科に属する内南五味子(Kadsura interior A.C. Smith)、異型南五味子(K. heteroclita (Roxb.) Craib)、鉄箍散(Schisandra propinqua (Wall.) Baill. var. sinensis Oliv.)を包含する。
【0010】
本発明では、鶏血藤の乾燥した茎、つる、根をそのまま用いることができ、あるいは、鶏血藤の乾燥した茎、つる、根と、適当な溶媒(例えば水または熱水)とを接触させ、得られた抽出物を用いることもできる。また、抽出物の性状もとくに制限されず、液状、軟稠エキス状、粉末状、顆粒状等のものを用いることができる。
【0011】
鶏血藤は、下記の実施例でも記載のとおり、強い破骨細胞の分化・延命抑制作用を有する。また鶏血藤は、歯周病の原因菌に対する抗菌作用および活性酸素種除去作用を有する。さらに、鶏血藤は、下記の実施例の記載から自明なように、インプラント周囲炎(ペリインプラントタイティス)(Peri-implantitis)の予防または治療用としても有効である。
【0012】
したがって本発明では、上記鶏血藤またはその抽出物を、歯周病予防または治療用組成物の有効成分として使用できる。本発明の歯周病予防または治療用組成物は、鶏血藤またはその抽出物の細粒を水で希釈して洗口含嗽剤(うがい薬)として用いたり、歯磨き剤として使用したり、あるいはパップ剤として口内等の患部に貼り付けて用いることができる。
【0013】
鶏血藤またはその抽出物を経口投与する場合、その投与量は、とくに制限されないが、乾燥物として(抽出物の場合は乾燥粉末として)、例えば成人1日あたり、5g〜20gである。
また、鶏血藤またはその抽出物を洗口含嗽剤、歯磨き剤あるいはパップ剤として用いる場合、鶏血藤またはその抽出物の含有量は、例えば2〜8質量%であるのが好ましい。
ヒトの歯肉粘膜上皮はループ状の毛細血管が豊富であり、生体との親和性の高い本発明の組成物は、該上皮から容易に吸収されると考えられる。
【0014】
本発明の歯周病予防または治療用組成物には、上記有効成分以外に、種々の添加剤を含有させることができる。例えば、抗酸化活性成分としては、コエンザイムQ10、フェルラ酸、アスタキサンチン、ビタミンE、ビタミンC、ビタミンA、BHT、BHA、NDGA、没食子酸プロピル、ポリフェノール類(タンニン類)、エリソルビン酸等が挙げられる。その他の薬効成分としては、例えば、アズレンスルホン酸ナトリウム、ε−アミノカプロン酸、アラントイン、アラントインクロルヒドロキシアルミニウム、アラントインジヒドロキシアルミニウム、エピジヒドロコレステリン、ジヒドロコレステロール、塩化ナトリウム、グリチルリチン酸、グリチルリチン酸二アンモニウム、グリチルリチン酸二ナトリウム、グリチルリチン酸三ナトリウム、グリチルリチン酸ジカリウム、グリチルリチン酸モノアンモニウム、β−グリチルレチン酸、イソプロピルメチルフェノール、塩化セチルピリジニウム、塩化デカリニウム、塩化ベンザルコニウム、塩化ベンザルコニウム液、塩酸アルキルジアミノエチルグリシン液、塩酸クロルヘキシジン、トリクロサン、アスコルビン酸、アスコルビン酸ナトリウム、塩酸ピリドキシン、酢酸dl−α−トコフェロール、ニコチン酸dl−α−トコフェロール、ゼオライト、ピロリン酸二水素ナトリウム、ピロリン酸ナトリウム、無水ピロリン酸ナトリウム、リン酸一水素ナトリウム、リン酸三ナトリウム、ポリリン酸ナトリウム、フッ化ナトリウム、モノフルオロリン酸ナトリウム、ポリエチレングリコール200、ポリエチレングリコール300、ポリエチレングリコール400、ポリエチレングリコール600、ポリエチレングリコール1000、ポリエチレングリコール1500、ポリエチレングリコール1540、ポリエチレングリコール4000、ポリエチレングリコール6000、ポリエチレングリコール20000、ポリビニルピロリドン、ポリビニルピロリドンK25、ポリビニルピロリドンK30、ポリビニルピロリドンK90、塩化リゾチーム、銅クロロフィリンナトリウム、ヒノキチオール、ポリオキシエチレンラウリルエーテル、ラウロイルサルコシンナトリウム等が挙げられる。
【0015】
湿潤剤としては、濃グリセリン、ソルビット液などが挙げられる。溶剤としては、エタノール、水、オリーブ油、ヤシ油、大豆油、綿実油、トウモロコシ油、ゴマ油、ナタネ油、落花生油、ツバキ油等の食用油などが挙げられる。増粘剤としては、キサンタンガム、カラギーナン、カルボキシメチルセルロースナトリウム、ヒドロキシエチルセルロース、ミツロウなどが挙げられる。界面活性剤としては、ショ糖脂肪酸エステル、ラウリル硫酸ナトリウム、ラウロイルサルコシンナトリウムなどが挙げられる。香味剤としては、メントール、ペパーミント油、スペアミント油、オレンジ油、レモン油、ユーカリ油、ハッカ油、アカシア油、ウイキョウ油、クエントウ油、カラムス油、ショウノウ油、ニッケイ油、ケイ皮油、ケイ葉油、バラ油、ビャクダン油、チョウジ油、ハーブ油、バナナ油、リンゴ油、サリチル酸メチル、カルボン、アネトール、リモネン等のテルペン類などの香料および調合香料が挙げられる。
【実施例】
【0016】
以下、本発明を実施例によりさらに具体的に説明する。
【0017】
(鶏血藤抽出液の調製)
鶏血藤抽出液は、1Lの水に200g(20%w/v)の鶏血藤を加え95℃で3時間加熱したものを鶏血藤20%抽出液とし、これを適宜PBSで希釈し、以下の実験に供試した。
なお、鶏血藤は密花豆Spatholobus suberectus DUNNの乾燥茎を実験に供した。
【0018】
(実施例1:Porphyromonas gingivalis ATCC 33277株(PG)感染マウス歯槽骨吸収モデルにおける鶏血藤の骨吸収抑制効果)
6週齢のC57BL/6マウス72匹を、24匹ずつ非感染コントロール群、PG感染コントロール群およびPG感染+鶏血藤投与(実験群)の3群に分け、それぞれにサルファメトキサゾールおよびトリメトプリムを含む飲料水を1週間投与し、口腔常在菌を除菌した。体内の抗菌薬を排出させるため3日間イオン交換水で飼育後、1週間に3回、1回につき約1×109個のPG菌体を含む2.5%カルボキシメチルセルロース溶液0.1mlを、PG感染コントロール群ならびに実験群に接種した。菌接種の完了と同時に、実験群には8%鶏血藤水抽出液を飲料水として供与し、その他はイオン交換水を飲料水とした。
感染終了後から1週間ごとに6週間にわたり各群から4匹ずつ抽出・屠殺し、右側頭部について当該骨格標本を作製し、上顎歯槽骨の吸収量を実体顕微鏡観察下で行った。左側頭部はギ酸ホルマリンで脱灰後、病理標本を作製し、ヘマトキシリン-エオシン染色あるいは酒石酸抵抗性酸性フォスファターゼ(TRAP)染色を行い、炎症の状態や破骨細胞の出現について検討した。
【0019】
図1は、歯槽骨吸収量の経時的変化を示すグラフである。
図2は、破骨細胞出現数の経時的変化を示すグラフである。
図3は、破骨細胞数算定の算定区域を示す図であり、マウス上顎第一臼歯より第三臼歯に隣接する歯槽骨(黒線で囲まれた範囲)に出現した破骨細胞数を算定した。
図4は、マウス歯周組織のTRAP染色像である。
【0020】
図1の結果から、PG感染コントロール群では、非感染コントロール群と比べて経時的に骨の吸収量が増加し、その傾向は実験終了まで継続した。実験群では、骨吸収が非感染コントロール群と同程度まで抑制されたことから、鶏血藤の投与がPG感染による歯槽骨吸収の抑制に有効であることが示された。
また、図2の結果から、第1臼歯近心根から第3臼歯の遠心根を囲む歯槽骨面に認められた破骨細胞(osteoclast)は、PG感染コントロール群に明らかに多く、また実験経過に伴いその数は増加傾向を示したが、実験群は非感染コントロール群と相違はみられなかった。
一方、図4に示す病理標本において、非感染コントロール群、PG感染コントロール群及び実験群のいずれにも臼歯部歯間乳頭の粘膜上皮内と上皮直下にごく僅かの炎症細胞浸潤(好中球とリンパ球)が散見された。しかし、PG感染コントロール群では、非感染コントロール群に比べ歯槽骨面に吸収窩が多く認められ、実験期間の経過に伴い骨量の減少が観察された。実験群の歯槽骨には著しい変化はなく、非感染コントロール群ほぼ同様の所見であった。
【0021】
(実施例2:PGに対する鶏血藤の抗菌効果)
0.2%、2%もしくは8%鶏血藤抽出液またはPBSの5mlに、OD600=1に調整したPGのPBS懸濁液の0.05mlを加え、0分、1分、15分または60分放置した。その後、サンプルを10倍希釈し、含まれる生菌数を培養法で計測した。培養は37℃嫌気条件(15%CO2、15%H2、70%N2)下で5日間行なった。結果を図5に示す。
図5の結果から、鶏血藤抽出液にPGを混合し60分間ベンチトップで放置すると、鶏血藤を加えないコントロール対して、鶏血藤0.2%濃度で約55%、2%濃度で約15%、8%濃度で約0.1%のレベルまで生菌数の減少が検出されたことから、鶏血藤は、濃度並びに時間依存的に、PGに対して抗菌効果を示すことが明らかとなった。
【0022】
(実施例3:鶏血藤の破骨細胞の分化抑制効果)
骨髄由来の単球・マクロファージ等の破骨細胞の前駆細胞はMacrophage-Colony Stimulating Factor(M-CSF)の存在下でReceptor activator of NF-κB ligand (RANKL)の刺激により破骨細胞に分化することが知られている。マウス骨髄細胞も、M-CSF添加培地でRANKLのドナーであるMC3T3-G2/PA6細胞と共培養することで破骨細胞に分化する。そこで、破骨細胞の分化過程における鶏血藤の影響を検討する目的でマウス破骨細胞形成系に各種濃度の鶏血藤抽出液を添加し、破骨細胞の形成誘導に対する鶏血藤の影響を検討した。
【0023】
C57BL/6マウス大腿骨より採取した骨髄細胞と破骨細胞分化支持能を持つMC3T3-G2/PA6細胞を各種濃度の鶏血藤抽出液を含むビタミンD3およびデキサメサゾンを添加した10%仔牛血清添加α-Minimum essential medium(α-MEM)で7日間培養した。培養終了後、サンプルを破骨細胞マーカーである酒石酸抵抗性酸性フォスファターゼ(TRAP)で染色し、TRAP陽性で3核以上の細胞を成熟破骨細胞としてカウントし、鶏血藤添加しなかったコントロール群と各種濃度の鶏血藤を加えた実験群に観察された成熟破骨細胞数をstudent-t検定で比較した。 結果を図6に示す。
図6の結果から、培地中に鶏血藤抽出液を添加しなかったコントロール群に比べ、鶏血藤抽出液0.1%および0.01%添加群では破骨細胞数がそれぞれ約100%および50%に減少し(p<0.01)、有意な発育抑制が検出された。以上の結果は、鶏血藤抽出液は、M-CSFとRANKL依存的な骨髄細胞から破骨細胞への分化を阻害することを示している。なお、前記鶏血藤抽出液のパーセントは、培地中の鶏血藤濃度である。
【0024】
(実施例4:RANKLの破骨細胞延命作用に対する鶏血藤の抑制効果)
Receptor activator of NF-κB ligand (RANKL)やMacrophage-Colony Stimulating Factor(M-CSF)は破骨細胞の分化に必須であり、また破骨細胞の生存を延長することが知られている。破骨細胞をRANKL添加培地で培養すると、未添加培地と比べた場合に比べその寿命が大幅に延長する。一方、RANKL未添加培地中の破骨細胞は急速に死滅する。そこで、RANKLによる成熟破骨細胞生存に対する鶏血藤の影響を検討した。
【0025】
C57BL/6マウス骨髄細胞とMC3T3-G2/PA6細胞をビタミンD3(1x10-8M)、プロスタグランジンE2(1x10-7M)および10%仔牛血清を含むα-Mimimum Essential Medium (MEM)で培養、形成された破骨細胞を分離した。
その後、破骨細胞を、次の3種類の培地で48時間培養した。
1.RANKL未添加α-MEM培地
2.RANKL(200μg/ml)、M-CSF(100μg/ml)添加α-MEM
3.RANKL(200μg/ml)、M-CSF(100μg/ml)および各種濃度の鶏血藤抽出液の添加α-MEM
培養後、成熟破骨細胞マーカーである酒石酸抵抗性酸性フォスファターゼ(TRAP)の染色を行った。TRAP陽性で3核以上の細胞を生存破骨細胞としてカウントし、観察された破骨細胞数をstudent-t検定で比較した。結果を図7に示す。
図7の結果から、鶏血藤抽出液を最終濃度0.1%、0.01%、および0.001%濃度で培地に添加した実験群では、RANKL添加により寿命が延長した陽性コントロール群に比べ生存する破骨細胞数がそれぞれ約30%、40%および80%と有意に減少した(p<0.01)。これは、培養過程で細胞が死滅したことを示すものである。
【0026】
(実施例5:鶏血藤の活性酸素種除去効果)
電子スピン共鳴(ESR)法によるフリーラジカル検出:
ヒドロキシルラジカルはフェントン反応(FeSO4にH2O2添加)を用いて発生させ、また、スーパーオキサイドラジカルはhypoxanthineにXanthine oxidase添加して発生させた。発生した各フリーラジカルはラジカル補足試薬DMPOで補足した後、電子スピン共鳴(ESR)装置(JES-RE 3X X-band、日本電子)を用いて検出した(対照群)。フリーラジカル消去活性実験は、このラジカル発生系に各種生薬、またはスーパーオキサイドディスムターゼ(SOD)およびdeferoxamine(DFX)を加え、補足されたラジカルのESRシグナル強度を比較検討した。
サンプル調製法と手技:
ESRによるヒドロキシルラジカルの検出は、リン酸緩衝液(PBS, pH7.0)185μl内に10-4M FeSO4 25μl、8.8M DMPO(5.5-Dimethyl-1-Pyrriline-N-Oxide、同人化学)を15μl加えた混合液に、10-4M H2O2 (和光)25μl加えて反応させ、1分後にESRフラットセルに130μl吸引、ESRレゾネーター内に装着して測定開始した。
ヒドロキシルラジカル消去活性実験は、リン酸緩衝液(PBS, pH7.0)135μl、生薬ないしdeferoxamine (NOVARTIS) 25μl、10-4M FeSO4 25μl、8.8M DMPO (5.5-Dimethyl-1-Pyrriline-N-Oxide、同人化学)を15μl加えた混合液に、10-4M H2O2 (和光)25μl加えて反応させ、1分後にESRフラットセルに130μl吸引、ESRレゾネーター内に装着して測定開始した。
ESRによるスーパーオキサイドラジカルの検出は、リン酸緩衝液(PBS, pH7.0)135μl内に0.01U/1ml Xanthine oxidase(Roche) 25μl、0.2mM DTPA(SIGMA) 25μl、 8.8M DMPO (5.5-Dimethyl-1-Pyrriline-N-Oxide、同人化学)を15μl加えた混合液に、10-5M hypoxanthine(SIGMA)を25μl加えて反応させ、1分後にESRフラットセルに130μl吸引、ESRレゾネーター内に装着して測定開始した。
スーパーオキサイドラジカル消去活性実験におけるフリーラジカルの検出は、リン酸緩衝液(PBS, pH7.0)135μl内に0.01U/1ml Xanthine oxidase、25μl、0.2mM DTPA(SIGMA) 25μl、各種生薬ないしSOD25μl、8.8M DMPO (5.5-Dimethyl-1-Pyrriline-N-Oxide、同人化学)を15μl加えた混合液に、10-5M hypoxanthine(SIGMA)を25μl加えて反応させ、1分後にESRフラットセルに130μl吸引、ESRレゾネーター内に装着して測定開始した。
ESR装置の測定条件:
磁場変調幅;0.063 mT、掃引幅;5 mT、掃引時間;1 min、時定数;0.03 sec、マイクロ波出力;8 mW、磁場;335.5±5 mT、受信感度;7.9×10に設定した。
結果を図8〜図11に示す。
図8〜図11の結果から、鶏血藤は著しく強力な活性酸素種除去効果を示すことが分かる。なお抑制率とは、対照群に対する活性酸素種の除去割合である。
【図面の簡単な説明】
【0027】
【図1】実施例1における、歯槽骨吸収量の経時的変化を示すグラフである。
【図2】実施例1における、破骨細胞出現数の経時的変化を示すグラフである。
【図3】実施例1における、破骨細胞数算定の算定区域を示す図であり、マウス上顎第一臼歯より第三臼歯に隣接する歯槽骨(黒線で囲まれた範囲)に出現した破骨細胞数を算定した。
【図4】実施例1における、マウス歯周組織のTRAP染色像である。
【図5】実施例2における、PGに対する鶏血藤の抗菌効果を示すグラフである。
【図6】実施例3における、鶏血藤の破骨細胞の分化抑制効果を示すグラフである。
【図7】実施例4における、RANKLの破骨細胞延命作用に対する鶏血藤の抑制効果を示すグラフである。
【図8】実施例5における、鶏血藤の活性酸素種(・OH)除去効果を示すグラフである。
【図9】実施例5における、DFXの活性酸素種(・OH)除去効果を示すグラフである。
【図10】実施例5における、鶏血藤の活性酸素種(・O)除去効果を示すグラフである。
【図11】実施例5における、SODの活性酸素種(・O)除去効果を示すグラフである。
【特許請求の範囲】
【請求項1】
鶏血藤またはその抽出物を有効成分とする歯周病予防または治療用組成物。
【請求項2】
洗口含漱剤の形態で使用される、請求項1に記載の歯周病予防または治療用組成物。
【請求項3】
歯磨き剤の形態で使用される、請求項1に記載の歯周病予防または治療用組成物。
【請求項4】
パップ剤の形態で使用される、請求項1に記載の歯周病予防または治療用組成物。
【請求項5】
鶏血藤またはその抽出物を有効成分とする破骨細胞の分化・延命抑制剤。
【請求項6】
鶏血藤またはその抽出物を有効成分とする活性酸素種除去剤。
【請求項7】
鶏血藤またはその抽出物を有効成分とするインプラント周囲炎(ペリインプラントタイティス)予防または治療用組成物。
【請求項1】
鶏血藤またはその抽出物を有効成分とする歯周病予防または治療用組成物。
【請求項2】
洗口含漱剤の形態で使用される、請求項1に記載の歯周病予防または治療用組成物。
【請求項3】
歯磨き剤の形態で使用される、請求項1に記載の歯周病予防または治療用組成物。
【請求項4】
パップ剤の形態で使用される、請求項1に記載の歯周病予防または治療用組成物。
【請求項5】
鶏血藤またはその抽出物を有効成分とする破骨細胞の分化・延命抑制剤。
【請求項6】
鶏血藤またはその抽出物を有効成分とする活性酸素種除去剤。
【請求項7】
鶏血藤またはその抽出物を有効成分とするインプラント周囲炎(ペリインプラントタイティス)予防または治療用組成物。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【公開番号】特開2010−138100(P2010−138100A)
【公開日】平成22年6月24日(2010.6.24)
【国際特許分類】
【出願番号】特願2008−315219(P2008−315219)
【出願日】平成20年12月11日(2008.12.11)
【出願人】(508365850)有限会社漢方歯科医学研究所 (2)
【Fターム(参考)】
【公開日】平成22年6月24日(2010.6.24)
【国際特許分類】
【出願日】平成20年12月11日(2008.12.11)
【出願人】(508365850)有限会社漢方歯科医学研究所 (2)
【Fターム(参考)】
[ Back to top ]

