殺虫性化合物
【課題】マリーゴールドの花部に含まれる殺虫活性に着目することによって新規の殺虫性化合物を提供すると共に、当該化合物を有効成分とする殺虫剤を提供する。
【解決手段】下記式を有する殺虫性化合物、及び当該殺虫性化合物単独又は当該化合物の2-3位が二重結合となった化合物の双方を有効成分とする、既存のピレスロイド系殺虫性化合物に比し、桁違いの殺虫効力を発揮し得る殺虫剤。

【解決手段】下記式を有する殺虫性化合物、及び当該殺虫性化合物単独又は当該化合物の2-3位が二重結合となった化合物の双方を有効成分とする、既存のピレスロイド系殺虫性化合物に比し、桁違いの殺虫効力を発揮し得る殺虫剤。

【発明の詳細な説明】
【技術分野】
【0001】
本発明は、蚊、ハエ等の衛生害虫に対しピレスロイド系化合物に比し、桁違いの殺虫効力を発揮し得る新規な殺虫性化合物に関するものである。
【背景技術】
【0002】
蚊、ハエ等の衛生害虫に対しノックダウンと致死効力をもち、しかも人畜にすぐれた安全性をもつ化合物は、除虫菊花に含まれるピレトリン及びピレトリンと化学構造が類似するピレスロイド系化合物を挙げることができる。
【0003】
しかしながら、前記衛生害虫は、天然ピレトリンに対しては抵抗性の発達は極めて僅かであるが、最近、合成ピレスロイド系化合物に対し、抵抗性の発達がみられ、その対策が急務となっている。
【0004】
このような状況を反映して、前記ピレスロイド系化合物においては、当該抵抗性害虫にも殺虫効力を示す化合物の研究開発が各国で進められている。その結果、人畜に対し、安全性が危惧される危険な化合物も出現するに到った。
【0005】
除虫菊は播種から開花収穫まで2年かかり、天然にのみ依存することは出来ない。このようなピレトリン及び合成ピレスロイド化合物の状況に鑑み、新たな殺虫性化合物及び当該化合物による殺虫成分の出現が模索されている。
【0006】
メキシコ原産菊科タゲテス属は一年草で、オレンジ色又はイエロー色の花弁を有すマリーゴールドは、観賞用植物として栽培されている。その根、花部、葉などには、殺菌、殺線虫、殺黴、殺虫及び昆虫忌避効果があることも知られている。
【0007】
しかしながら、これらの効果は極めて微弱で、活性成分の化学構造も不明で、実用化に至っていない。
【0008】
但し、マリーゴールドの花部及び葉に含まれている前記のような微弱な殺虫効力を有している成分に関する研究報告は1975年頃から順次行われており、色々な物質の存在が論議されているが、すべて推測にすぎず、化学上の分析は全く行われていない。
【0009】
例えば、インドのKhannaらは非特許文献1に示すように、1975年マリーゴールドの殺虫成分は除虫菊の花に含まれる殺虫成分ピレトリンと同じで、6つの化学成分を含むと発表した。
【0010】
しかしながら、アメリカ合衆国のWellsらは1993年、非特許文献2に示すように、マリーゴールドの花の抽出物から35個の化合物の存在を報告し、殺虫成分はピレトリンでなく、1個の硫黄(S)と4個の炭素(C)を含むチオフェングループであろうと報告している。
【0011】
マリーゴールドに含まれる化学物質の検索は、西ドイツ共和国のBohlmannらは、非特許文献3に示すように、1978年当時、マリーゴールド中に含まれている化合物の研究を行い、22個の化合物の存在を発表している。その中にはチオフェングループ以外に、硫黄を含まないケトン類の存在を報告している。後述する本願における化合物Bも含まれている(非特許文献3においては、前記化合物については、「Bis-trans-ocimenon」と命名されている。)。
但し、前記論文はマリーゴールドに含まれる化学物質の検索が目的で、それらの生理活性作用については全く触れていない。
【0012】
しかしながら、マリーゴールド中の化学物質につき、精緻な実験を行ったうえで、ピレスロイド系化合物のような従前の殺虫剤に比し桁違いの殺虫効力を発揮する化合物を実験によって特定する作業は、これまで全く行われていない。
【先行技術文献】
【非特許文献】
【0013】
【非特許文献1】Indian Journal Biology 13, 508 (1975)
【非特許文献2】Chromatographia Vol.35, No.3/4, 1993
【非特許文献3】Phytochemistry, 1979, Vol.18. pp. 341-343
【発明の概要】
【発明が解決しようとする課題】
【0014】
本発明は、マリーゴールドの花部に含まれる殺虫活性に着目することによって新規の殺虫性化合物を提供すると共に、当該化合物を有効成分とする殺虫剤を提供することを課題としている。
【課題を解決するための手段】
【0015】
前記課題に対応する本発明の構成は、
(1)以下の化学式を有している殺虫性化合物。
【化1】

(2)前記(1)記載の殺虫性化合物を有効成分とする殺虫剤。
(3)前記(1)記載の殺虫性化合物及び以下の化学式を有している殺虫性化合物を有効成分とする殺虫剤。
【化2】

【発明の効果】
【0016】
[化1]の殺虫性化合物及び[化2]の殺虫性化合物は、何れも殺虫効力を有している。
【0017】
のみならず、前記[化1]の殺虫性化合物又は前記[化1]の殺虫性化合物と前記[化2]の殺虫性化合物の双方を有効成分とする殺虫剤においては、天然のピレトリン、更には合成ピレスロイドを代表するdl−d−T80−アレスリンに基づくピレスロイに比し、桁違いの殺虫効力を発揮することができる。
【0018】
しかも、前記[化1]の殺虫性化合物及び前記[化2]の殺虫性化合物は、天然ピレトリンと同様、炭素(C)、水素(H)、酸素(O)の3原子から成り、各化学式からも明らかなように、人畜に対する安全性も十分予測することができ、優れた殺虫成分である。
【図面の簡単な説明】
【0019】
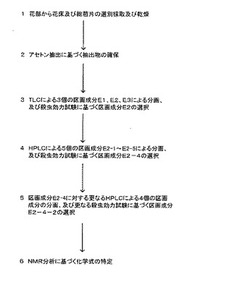
【図1】マリーゴールドの花部における花床及び総苞片を原材料として、目標とする殺虫成分を殺虫効力試験及び各種クロマトグラフィー方法(TLCとHPLC)によって純粋な殺虫成分を分画特定するに至るまでの実験経過を示す配列図。
【図2】図1の番号4に記す第1回目のHPLC(High Performance Liquid Chromatography:高速液体クロマトグラフィー、以下「HPLC」によって示す)に基づくスペクトル図(E2−1〜E2−5の5つに分画した。)。
【図3】図1の番号5に記す第2回目のHPLCに基づくスペクトル図(E2−4−1〜E2−4−4の4つに分画した。)。
【図4】NMRによって殺虫性化合物の化学式を特定する際に、NMR分析に基づく2次元スペクトルによって13C(原子量を13とする炭素の同位元素)に基づくピーク値と1H(通常の水素原子)に基づくピーク値との組合せに基づく結合基を所定の順序の下に配列している表5における表示番号に対応して、当該番号の数値に基づいて前記結合基の配列状態を特定している化学式であって、(a)は前記[化1]の殺虫剤化合物の化学式を示しており、(b)は前記[化2]の殺虫性化合物の化学式を示す。
【図5−1】局所的な位置における結合基の相違、就中当該結合基における二重結合の存否による相違にも拘らず、ピレトリンI、ジャスモリンI、シネリンI及びアレスリンが、何れも単独にて殺虫効力を有することを説明するための化学式を示す。
【図5−2】局所的な位置における結合基の相違、就中当該結合基における二重結合の存否による相違にも拘らず、ピレトリンII、ジャスモリンII、シネリンIIが何れも単独にて殺虫効力を有することを説明するための化学式を示す。
【発明を実施するための形態】
【0020】
マリーゴールドの花部を素材として、前記[化1]の殺虫性化合物(以下「化合物A」と略称する。)及び前記[化2]の殺虫性化合物(以下「化合物B」と略称する。)を特定するに至った経過につき、図1の配列図に沿って、以下のとおり具体的に説明する。
1 花部から花床及び総苞片の選別採取及び乾燥:
マリーゴールドの花部約4.5kgから花床部分及び総苞片を選別採取したうえで、乾燥することによって約450gの乾燥物を得た。
2 アセトン抽出による抽出物の確保:
前記花床及び総苞片の乾燥物を混合、粉砕して得た粉末0.9gをアセトンを溶媒として4時間ソックスレイ抽出することによって抽出物0.2gを得た。
3 TLCによる3個の区画成分E1、E2、E3による分画及び殺虫効力試験に基づく区画成分E2の選択:
前記2に基づく抽出物を下記の条件でTLC(Thin Layer Chromatography:薄層クロマトグラフィー)によって等しい保持時間間隔に即して3個の区画成分E1、E2、E3に分画した。
TLC条件
溶 剤・・・ヘキサン:ベンゼン=3:1
薄層板・・・メルク社製TLCプレート 20×20cm
シリカゲル60F254 厚さ1mm
イエバエ雌成虫を供試虫として区画成分E1、E2、E3に対する殺虫活性を下記の方法で判定した。炭酸ガスで麻酔させたハエの胸部脊板に各区画成分10μgを含むアセトン溶液を塗布し、30分後のノックダウン率と24時間後の致死率を観察した結果を表1に示す。
【表1】

表1の結果から、区画成分E2を次の工程の分析の対象として選択した。
前記殺虫効力試験について説明するに、産業上の利用可能性の項において後述するように、天然ピレトリン及びdl−d−T80−アレスリンのような典型的なピレスロイドにおいて、イエバエの成虫の殺虫に要する薬量は、アカイエカの場合の薬量に比し、約20倍前後を必要としており、逆にイエバエの殺虫が可能である場合においては、アカイエカの殺虫は当然可能という状況にある。
このような状況を考慮するならば、区画成分E2が示すイエバエに対するノックダウン率及び殺虫率は、後の5の工程においてアカイエカに対する顕著な殺虫効力によって選択されたE2−4−2の成分であって、かつ後述する6のNMR分析によって特定された化合物が寄与していることは、間違いない。
4 HPLCによる5個の区画成分E2−1〜E2−5による分画、及び殺虫効力試験に基づく区画成分E2−4の選択:
前記3の工程によって最も殺虫活性の高い区画成分E2について、以下の試験条件によってHPLC分析を行い、図2に示すようなスペクトルを得た。
【表2】

【0021】
前記スペクトルにつき、図2に示すような保持時間に沿ってスペクトルが顕著に存在する領域と存在しない領域とに即して区分した5個の区画成分E2−1〜E2−5及び天然ピレトリン並びにdl−d−T80−アレスリンによる対比試料、更にはコントロール試料(溶媒アセトンのみによる試料)につき、以下の試験条件に基づく殺虫効力試験を行った。
【表3】

【0022】
前記表3記載の殺虫効力試験によって、各試料につき、以下の殺虫効力を確認した。
【表4】

【0023】
前記表からも明らかなように、区画成分E2のうち、5個の成分は全て殺虫効力を呈したが、特に区画成分E2−4は、天然のピレトリン及びdl−d-T80−アレスリンと同程度のノックダウン及び殺虫効力を呈することが判明した。
そこで、区画成分E2−4を更なる分析試料として選択した。
5 区画成分E2−4に対する更なるHPLCによる4個の区画成分の分画、及び殺虫効力試験に基づく区画成分E2−4−2の選択:
区画成分E2−4について、更に前記4と同様に、表2の試験条件にてHPLC分析を行ったところ、図3に示すスペクトルを得た。
【0024】
前記スペクトル領域に対応して、図3に示すような保持時間に沿ってスペクトルが顕著に存在する領域と存在しない領域とに即して区分した4個の区画成分E2−4−1〜E2−4−4、及び天然ピレトリン並びにdl−d−T80−アレスリン、更にはコントロール試料に基づいて、前記4と同様に、前記表3の条件に基づく殺虫効力試験を行い、以下の結果を得た。
尚、以下の表5に示す結果は、部分的な結果であって、その余の結果については、実施例に代わる試験例において〔表7〕に即して後述するとおりである。
【表5】

【0025】
前記表からも明らかなように、区画成分E2−4に属する4個の各区画各成分のうちでは、区画成分E2−4−2の区画成分による殺虫効果が最も高い状態にある。
【0026】
因みに、10-3(mg/6.15cm2)及び10-4(mg/6.15cm2)の各濃度の場合に、区画成分E2−4−2は、天然ピレトリン及びdl−d−T80−アレスリンに比し、KT100値及び致死率において何れも優れた効果を示しているばかりか、区画成分E2−4−2は10-4(mg/6.15cm2)の濃度であっても、KT100値において、dl−d−T80−アレスリンの10-3(mg/6.15cm2)の濃度の場合と同程度のノックダウン効果が得られており、ピレスロイド系化合物に比し、明らかに低濃度の状態にて使用し得ることを裏付けている。
6 NMR分析に基づく化学式の特定:
区画成分E2−4−2につき、NMR(Nuclear Magnetic Resonance:核磁気共鳴)装置を使用して、順次化学式を特定した。
【0027】
最初に、区画成分E2−4−2をクロロホルム−d(CDCl3)に溶解したうえで、1Hと13Cの1次元NMR測定を行った。
【0028】
前記NMR測定に基づくチャートより、近似したケミカルシフトの位置に強度が異なる対のシグナルが認められることから、類縁体である2種の化合物が混在していることが判明した。
【0029】
同時に実施した、区画成分E2−4−2の液体クロマトグラフ質量分析器による分析から、混在する2種の化合物の分子量はそれぞれ[M+H]+ =303及び301の各シグナルに基づき、2種の化合物のうちの一方の分子量が302であり、他方の分子量が300であるという情報を得ることができた。
【0030】
前記1次元NMR測定のスペクトル分析におけるシグナル強度の違いから、分子量302である化合物が主たる成分であり、分子量300である化合物が従たる成分であることが判明した。
【0031】
(1)分子量が302である化合物Aの化学式を決定するに至った経過は、以下のとおりである。
【0032】
(1)−(1)1次元の13C-NMRスペクトル分析に基づいて、化合物Aの炭素数は20で、カルボニル基が2個存在すること、さらに1次元の1H-NMRスペクトルより、オレフィン領域に3個のプロトンが存在することが判明した。
これらの情報と分子量が302であることより化合物Aの分子式はC20H30O2であり、計算から導かれる不飽和度が6であることから、カルボニル基が2個、2重結合が3個の存在を考慮して、その余の構造としては、1個の環構造の存在を推認することができた。
【0033】
(1)−(2)2次元NMRの情報に基づいて、以下の順序によって化合物Aの化学構造を決定した。
近隣に位置した状態にて相互のスピン間の作用によって結合し合う水素間の情報については、COSY(Correlation Spectroscopy)測定によって、解析を行った。
次に、化合物における炭化水素の種類、具体的には、−CH3、−CH2、−CHの何れに該当するかについて、HMQC(Heteronuclear Multiple Quantum Coherence)測定に基づいて結合構造の種類を解析した。
更に、水素と炭素との結合に関する位置関係の情報については、HMBC(Heteronuclear Multiple Bond Coherence)の測定により解析を行った。
【0034】
化合物Aに関する前記各種NMR情報を総合的に解析し、化合物Aの平面構造を図4(a)と決定した。
化合物Aの位置番号とそれに対応するNMRスペクトルデータは以下の表記載のとおりである。
【表6−1】

【0035】
前記のようにして特定された化合物Aは、以下のように略式表示を行うことができる。
(CH3)2CH・CH2CO・CHCH(CH3)C6H5(CH3)CO・CH・CH・CH・(CH3)2
【0036】
(2)分子量が300である化合物Bの化学式を決定するに至った経過は、以下のとおりである。
【0037】
前記1次元NMR測定及びE2−4−2の液体クロマトグラフ質量分析器によれば、化合物Bは、化合物Aの類縁体と推測され、その違いはその分子量の差から、化合物Aより二重結合が1個多いものと考えられた。
【0038】
(2)−(1)13C-NMRスペクトル分析によれば、化合物Bには、2個のカルボニル基の炭素のうち1つが、化合物Aの場合には、201.3ppmを示すシグナルに対し、当該数値よりも高磁場である191.7ppmのシグナルを確認した。
この若干の高磁場なカルボニル基のシグナルによって化合物Aの場合とは異なり、カルボニル基の両隣の炭素がそれぞれ不飽和な状態であろうという合理的な推定を行うことができる。
【0039】
(2)−(2)このような不飽和結合を前提としたうえで、化合物Aの場合と同様に、COSY、HMQC、HMBCによる各種二次元NMRの解析に基づいて、各相関関係を参釈したところ、2位−3位の炭素が二重結合で繋がった構造であることが判明した。
【0040】
化合物Bに関する、前記各種NMR情報を総合的に解析し、化合物Bの平面構造を図4(b)と決定した。
化合物Bの位置番号とそれに対応するNMRスペクトルデータは以下の表記載のとおりである。
【表6−2】

【0041】
前記のようにして特定された化合物Bは、以下のような略式表示を行うことができる。
(CH3)2C・CHCO・CHCH(CH3)C6H5C(CH3)CO・CH・CH・CH・(CH3))2
【0042】
前記化合物A及び化合物Bの化学構造によって、表5に示されている区画成分E2−4−2が示している天然ピレトリン及びdl−d−T80−アレスリンを明らかに凌駕している殺虫効力は、結局、化合物A及び化合物Bの混合状態に基づいている。
【0043】
したがって、化合物Aの殺虫効力に関する有用性は、化合物Bとの共存によって発揮され、同様に化合物Bの殺虫効力に関する有用性もまた、化合物Aとの共存によって発揮されていることは間違いない。
【0044】
しかしながら、炭化水素及び酸素との結合からなる典型的な殺虫性化合物においては、局所的な位置における結合基によって相互に相違している殺虫性化合物の場合、就中当該結合基における二重結合の存否によって相違しているに過ぎない類縁体の場合には、共に単独にて殺虫効力を有している。
具体的に説明するに、天然ピレトリンのうち、図5−1に示すピレトリンI、ジャスモリンI、シネリンI並びに図5−2に示すピレトリンII、ジャスモリンII、シネリンIIの6成分、および図5−1に示す合成ピレスロイドアレスリンは、何れもアルコール成分側鎖炭素1位、2位、3位の位置にアリル基を有する点において共通するも、当該アルコール成分側鎖の炭素数は、アレスリンが3個、シネリンが4個、ピレトリンが5個である。
即ち、4位及び5位においてアレスリンの場合には、炭化水素を有しておらず、シネリンI、IIの場合には、メチル基を有しており、ジャスモリンI、IIの場合には、エチル基を有しており、ピレトリンI、IIの場合には、エチレン基を有している点において相違しており、特に、ピレトリンI、IIと、ジャスモリンI、IIとは4位及び5位において二重結合の存否において相違している。
しかるに、何れも単独で殺虫効力を有することは周知の事項である。
このように、典型的な炭化水素及び酸素からなる殺虫用化合物の場合に、局所的な位置における炭化水素による結合基の相違、就中当該結合基における二重結合の存否による相違にも拘らず、それぞれ単独にて殺虫効力を有するという周知の事項を考慮するならば、化合物A、化合物Bが共に単独にて殺虫効力を有することもまた、当然推認することができる。
【0045】
したがって、化合物Aを有効成分とする前記基本構成(2)の殺虫剤又は化合物A及び化合物Bを有効成分とする前記基本構成(3)の殺虫剤もまた、必然的に殺虫効力を有している。
【0046】
尚、背景技術の項において説明したように、化合物Bについては、「Bis-trans-ocimenon」という名称が付された状態にて既にマリーゴールドから抽出されかつ分析されているが、前記のような殺虫効力の確認を伴う分析による化合物Bの特定は、本発明において初めて実現されている。
〔実施例に代わる更なる効力試験〕
化合物Aと化合物Bとの混合物である区画成分E2−4−2について、表3に示す試験条件に基づき、区画成分E2−4−2、天然ピレトリン、dl−d−T80−アレスリンについて更に濃度を希釈したうえで殺虫効力試験を行ったが、その結果は、次の表に示すとおりである。
【表7】

【0047】
前記殺虫効力試験からも明らかなように、天然ピレトリン及びdl−d−T80−アレスリンの場合には、濃度10-5(mg/6.15cm2)の段階ではノックダウン状態を実現することができないのに対し、化合物A及び化合物Bの混合物の場合には、30(分)というKT100値を示すと共に、24時間後に7%の致死率を示しており、しかも更に1桁低い濃度である10-6(mg/6.15cm2)の場合であっても、KT100値において40(分)という結果を示している。
【0048】
このような試験結果においては、化合物A及び/又は化合物Bを有効成分とする殺虫剤においては、ピレスロイド系化合物を桁違いに上回る殺虫効力、具体的にはKT100値(分)を基準とした場合には、10-6(mg/6.15cm2)の濃度の場合であっても、天然ピレトリン及びdl−d−T80−アレスリンにおける10-4(mg/6.15cm2)の濃度に基づく殺虫効力の数値を上回っている以上、100倍を超える殺虫効力の可能性を明瞭に裏付けている。
【産業上の利用可能性】
【0049】
例えば、日本家庭用殺虫剤工業会が2007年3月発行することによって既に公然と知られている非特許文献である「家庭用殺虫剤とピレスロイド」の22頁の表2は、広範かつ典型的なピレスロイド系化合物におけるイエバエ、アカイエカ、チャバネゴキブリの各成虫に対する殺虫効力を対比している。
【0050】
前記対比によれば、微量滴下法によるLD50値(50%の殺虫率)を基準とした場合、ピレトリンにおいてはイエバエ成虫及びチャバネゴキブリ成虫を殺虫するためには、アカイエカ成虫に必要な薬量のそれぞれ約23.0倍及び約32.0倍の薬量を必要としており、dl−d−T80−アレスリンにおいては、イエバエ成虫及びチャバネゴキブリ成虫を殺虫するためには、アカイエカ成虫に必要な薬量に比しそれぞれ約17倍及び約103倍の薬量を必要としている。
【0051】
このようなデータに即するならば、前記殺虫効力試験のように、化合物A及び/又は化合物Bを有効成分とする殺虫剤が、アカイエカについて天然ピレトリン及びdl−d−T80−アレスリンに比し、100倍を超える殺虫効力を示すことは、当該殺虫剤がこれらのピレスロイド系殺虫剤においてアカイエカに必要な薬量を以って、ハエ類及びゴキブリ類等の広範な飛翔行動昆虫に対する殺虫効力を有し得ることを推認させるに十分である。
【0052】
このように、化合物Aを有効成分とした場合又は化合物A及び化合物Bの双方を有効成分とした場合には、これらの有効成分は、炭素(C)、水素(H)及び酸素(O)のみによって構成される有機化合物であって、人畜に対する危害を生じない一方、家庭内外において、広範な飛翔行動昆虫を対象として、ピレスロイド系化合物に比し桁違いの殺虫効力を発揮することができる殺虫剤として広く利用することが可能であることを予測させるに十分である。
【技術分野】
【0001】
本発明は、蚊、ハエ等の衛生害虫に対しピレスロイド系化合物に比し、桁違いの殺虫効力を発揮し得る新規な殺虫性化合物に関するものである。
【背景技術】
【0002】
蚊、ハエ等の衛生害虫に対しノックダウンと致死効力をもち、しかも人畜にすぐれた安全性をもつ化合物は、除虫菊花に含まれるピレトリン及びピレトリンと化学構造が類似するピレスロイド系化合物を挙げることができる。
【0003】
しかしながら、前記衛生害虫は、天然ピレトリンに対しては抵抗性の発達は極めて僅かであるが、最近、合成ピレスロイド系化合物に対し、抵抗性の発達がみられ、その対策が急務となっている。
【0004】
このような状況を反映して、前記ピレスロイド系化合物においては、当該抵抗性害虫にも殺虫効力を示す化合物の研究開発が各国で進められている。その結果、人畜に対し、安全性が危惧される危険な化合物も出現するに到った。
【0005】
除虫菊は播種から開花収穫まで2年かかり、天然にのみ依存することは出来ない。このようなピレトリン及び合成ピレスロイド化合物の状況に鑑み、新たな殺虫性化合物及び当該化合物による殺虫成分の出現が模索されている。
【0006】
メキシコ原産菊科タゲテス属は一年草で、オレンジ色又はイエロー色の花弁を有すマリーゴールドは、観賞用植物として栽培されている。その根、花部、葉などには、殺菌、殺線虫、殺黴、殺虫及び昆虫忌避効果があることも知られている。
【0007】
しかしながら、これらの効果は極めて微弱で、活性成分の化学構造も不明で、実用化に至っていない。
【0008】
但し、マリーゴールドの花部及び葉に含まれている前記のような微弱な殺虫効力を有している成分に関する研究報告は1975年頃から順次行われており、色々な物質の存在が論議されているが、すべて推測にすぎず、化学上の分析は全く行われていない。
【0009】
例えば、インドのKhannaらは非特許文献1に示すように、1975年マリーゴールドの殺虫成分は除虫菊の花に含まれる殺虫成分ピレトリンと同じで、6つの化学成分を含むと発表した。
【0010】
しかしながら、アメリカ合衆国のWellsらは1993年、非特許文献2に示すように、マリーゴールドの花の抽出物から35個の化合物の存在を報告し、殺虫成分はピレトリンでなく、1個の硫黄(S)と4個の炭素(C)を含むチオフェングループであろうと報告している。
【0011】
マリーゴールドに含まれる化学物質の検索は、西ドイツ共和国のBohlmannらは、非特許文献3に示すように、1978年当時、マリーゴールド中に含まれている化合物の研究を行い、22個の化合物の存在を発表している。その中にはチオフェングループ以外に、硫黄を含まないケトン類の存在を報告している。後述する本願における化合物Bも含まれている(非特許文献3においては、前記化合物については、「Bis-trans-ocimenon」と命名されている。)。
但し、前記論文はマリーゴールドに含まれる化学物質の検索が目的で、それらの生理活性作用については全く触れていない。
【0012】
しかしながら、マリーゴールド中の化学物質につき、精緻な実験を行ったうえで、ピレスロイド系化合物のような従前の殺虫剤に比し桁違いの殺虫効力を発揮する化合物を実験によって特定する作業は、これまで全く行われていない。
【先行技術文献】
【非特許文献】
【0013】
【非特許文献1】Indian Journal Biology 13, 508 (1975)
【非特許文献2】Chromatographia Vol.35, No.3/4, 1993
【非特許文献3】Phytochemistry, 1979, Vol.18. pp. 341-343
【発明の概要】
【発明が解決しようとする課題】
【0014】
本発明は、マリーゴールドの花部に含まれる殺虫活性に着目することによって新規の殺虫性化合物を提供すると共に、当該化合物を有効成分とする殺虫剤を提供することを課題としている。
【課題を解決するための手段】
【0015】
前記課題に対応する本発明の構成は、
(1)以下の化学式を有している殺虫性化合物。
【化1】

(2)前記(1)記載の殺虫性化合物を有効成分とする殺虫剤。
(3)前記(1)記載の殺虫性化合物及び以下の化学式を有している殺虫性化合物を有効成分とする殺虫剤。
【化2】

【発明の効果】
【0016】
[化1]の殺虫性化合物及び[化2]の殺虫性化合物は、何れも殺虫効力を有している。
【0017】
のみならず、前記[化1]の殺虫性化合物又は前記[化1]の殺虫性化合物と前記[化2]の殺虫性化合物の双方を有効成分とする殺虫剤においては、天然のピレトリン、更には合成ピレスロイドを代表するdl−d−T80−アレスリンに基づくピレスロイに比し、桁違いの殺虫効力を発揮することができる。
【0018】
しかも、前記[化1]の殺虫性化合物及び前記[化2]の殺虫性化合物は、天然ピレトリンと同様、炭素(C)、水素(H)、酸素(O)の3原子から成り、各化学式からも明らかなように、人畜に対する安全性も十分予測することができ、優れた殺虫成分である。
【図面の簡単な説明】
【0019】
【図1】マリーゴールドの花部における花床及び総苞片を原材料として、目標とする殺虫成分を殺虫効力試験及び各種クロマトグラフィー方法(TLCとHPLC)によって純粋な殺虫成分を分画特定するに至るまでの実験経過を示す配列図。
【図2】図1の番号4に記す第1回目のHPLC(High Performance Liquid Chromatography:高速液体クロマトグラフィー、以下「HPLC」によって示す)に基づくスペクトル図(E2−1〜E2−5の5つに分画した。)。
【図3】図1の番号5に記す第2回目のHPLCに基づくスペクトル図(E2−4−1〜E2−4−4の4つに分画した。)。
【図4】NMRによって殺虫性化合物の化学式を特定する際に、NMR分析に基づく2次元スペクトルによって13C(原子量を13とする炭素の同位元素)に基づくピーク値と1H(通常の水素原子)に基づくピーク値との組合せに基づく結合基を所定の順序の下に配列している表5における表示番号に対応して、当該番号の数値に基づいて前記結合基の配列状態を特定している化学式であって、(a)は前記[化1]の殺虫剤化合物の化学式を示しており、(b)は前記[化2]の殺虫性化合物の化学式を示す。
【図5−1】局所的な位置における結合基の相違、就中当該結合基における二重結合の存否による相違にも拘らず、ピレトリンI、ジャスモリンI、シネリンI及びアレスリンが、何れも単独にて殺虫効力を有することを説明するための化学式を示す。
【図5−2】局所的な位置における結合基の相違、就中当該結合基における二重結合の存否による相違にも拘らず、ピレトリンII、ジャスモリンII、シネリンIIが何れも単独にて殺虫効力を有することを説明するための化学式を示す。
【発明を実施するための形態】
【0020】
マリーゴールドの花部を素材として、前記[化1]の殺虫性化合物(以下「化合物A」と略称する。)及び前記[化2]の殺虫性化合物(以下「化合物B」と略称する。)を特定するに至った経過につき、図1の配列図に沿って、以下のとおり具体的に説明する。
1 花部から花床及び総苞片の選別採取及び乾燥:
マリーゴールドの花部約4.5kgから花床部分及び総苞片を選別採取したうえで、乾燥することによって約450gの乾燥物を得た。
2 アセトン抽出による抽出物の確保:
前記花床及び総苞片の乾燥物を混合、粉砕して得た粉末0.9gをアセトンを溶媒として4時間ソックスレイ抽出することによって抽出物0.2gを得た。
3 TLCによる3個の区画成分E1、E2、E3による分画及び殺虫効力試験に基づく区画成分E2の選択:
前記2に基づく抽出物を下記の条件でTLC(Thin Layer Chromatography:薄層クロマトグラフィー)によって等しい保持時間間隔に即して3個の区画成分E1、E2、E3に分画した。
TLC条件
溶 剤・・・ヘキサン:ベンゼン=3:1
薄層板・・・メルク社製TLCプレート 20×20cm
シリカゲル60F254 厚さ1mm
イエバエ雌成虫を供試虫として区画成分E1、E2、E3に対する殺虫活性を下記の方法で判定した。炭酸ガスで麻酔させたハエの胸部脊板に各区画成分10μgを含むアセトン溶液を塗布し、30分後のノックダウン率と24時間後の致死率を観察した結果を表1に示す。
【表1】

表1の結果から、区画成分E2を次の工程の分析の対象として選択した。
前記殺虫効力試験について説明するに、産業上の利用可能性の項において後述するように、天然ピレトリン及びdl−d−T80−アレスリンのような典型的なピレスロイドにおいて、イエバエの成虫の殺虫に要する薬量は、アカイエカの場合の薬量に比し、約20倍前後を必要としており、逆にイエバエの殺虫が可能である場合においては、アカイエカの殺虫は当然可能という状況にある。
このような状況を考慮するならば、区画成分E2が示すイエバエに対するノックダウン率及び殺虫率は、後の5の工程においてアカイエカに対する顕著な殺虫効力によって選択されたE2−4−2の成分であって、かつ後述する6のNMR分析によって特定された化合物が寄与していることは、間違いない。
4 HPLCによる5個の区画成分E2−1〜E2−5による分画、及び殺虫効力試験に基づく区画成分E2−4の選択:
前記3の工程によって最も殺虫活性の高い区画成分E2について、以下の試験条件によってHPLC分析を行い、図2に示すようなスペクトルを得た。
【表2】

【0021】
前記スペクトルにつき、図2に示すような保持時間に沿ってスペクトルが顕著に存在する領域と存在しない領域とに即して区分した5個の区画成分E2−1〜E2−5及び天然ピレトリン並びにdl−d−T80−アレスリンによる対比試料、更にはコントロール試料(溶媒アセトンのみによる試料)につき、以下の試験条件に基づく殺虫効力試験を行った。
【表3】

【0022】
前記表3記載の殺虫効力試験によって、各試料につき、以下の殺虫効力を確認した。
【表4】

【0023】
前記表からも明らかなように、区画成分E2のうち、5個の成分は全て殺虫効力を呈したが、特に区画成分E2−4は、天然のピレトリン及びdl−d-T80−アレスリンと同程度のノックダウン及び殺虫効力を呈することが判明した。
そこで、区画成分E2−4を更なる分析試料として選択した。
5 区画成分E2−4に対する更なるHPLCによる4個の区画成分の分画、及び殺虫効力試験に基づく区画成分E2−4−2の選択:
区画成分E2−4について、更に前記4と同様に、表2の試験条件にてHPLC分析を行ったところ、図3に示すスペクトルを得た。
【0024】
前記スペクトル領域に対応して、図3に示すような保持時間に沿ってスペクトルが顕著に存在する領域と存在しない領域とに即して区分した4個の区画成分E2−4−1〜E2−4−4、及び天然ピレトリン並びにdl−d−T80−アレスリン、更にはコントロール試料に基づいて、前記4と同様に、前記表3の条件に基づく殺虫効力試験を行い、以下の結果を得た。
尚、以下の表5に示す結果は、部分的な結果であって、その余の結果については、実施例に代わる試験例において〔表7〕に即して後述するとおりである。
【表5】

【0025】
前記表からも明らかなように、区画成分E2−4に属する4個の各区画各成分のうちでは、区画成分E2−4−2の区画成分による殺虫効果が最も高い状態にある。
【0026】
因みに、10-3(mg/6.15cm2)及び10-4(mg/6.15cm2)の各濃度の場合に、区画成分E2−4−2は、天然ピレトリン及びdl−d−T80−アレスリンに比し、KT100値及び致死率において何れも優れた効果を示しているばかりか、区画成分E2−4−2は10-4(mg/6.15cm2)の濃度であっても、KT100値において、dl−d−T80−アレスリンの10-3(mg/6.15cm2)の濃度の場合と同程度のノックダウン効果が得られており、ピレスロイド系化合物に比し、明らかに低濃度の状態にて使用し得ることを裏付けている。
6 NMR分析に基づく化学式の特定:
区画成分E2−4−2につき、NMR(Nuclear Magnetic Resonance:核磁気共鳴)装置を使用して、順次化学式を特定した。
【0027】
最初に、区画成分E2−4−2をクロロホルム−d(CDCl3)に溶解したうえで、1Hと13Cの1次元NMR測定を行った。
【0028】
前記NMR測定に基づくチャートより、近似したケミカルシフトの位置に強度が異なる対のシグナルが認められることから、類縁体である2種の化合物が混在していることが判明した。
【0029】
同時に実施した、区画成分E2−4−2の液体クロマトグラフ質量分析器による分析から、混在する2種の化合物の分子量はそれぞれ[M+H]+ =303及び301の各シグナルに基づき、2種の化合物のうちの一方の分子量が302であり、他方の分子量が300であるという情報を得ることができた。
【0030】
前記1次元NMR測定のスペクトル分析におけるシグナル強度の違いから、分子量302である化合物が主たる成分であり、分子量300である化合物が従たる成分であることが判明した。
【0031】
(1)分子量が302である化合物Aの化学式を決定するに至った経過は、以下のとおりである。
【0032】
(1)−(1)1次元の13C-NMRスペクトル分析に基づいて、化合物Aの炭素数は20で、カルボニル基が2個存在すること、さらに1次元の1H-NMRスペクトルより、オレフィン領域に3個のプロトンが存在することが判明した。
これらの情報と分子量が302であることより化合物Aの分子式はC20H30O2であり、計算から導かれる不飽和度が6であることから、カルボニル基が2個、2重結合が3個の存在を考慮して、その余の構造としては、1個の環構造の存在を推認することができた。
【0033】
(1)−(2)2次元NMRの情報に基づいて、以下の順序によって化合物Aの化学構造を決定した。
近隣に位置した状態にて相互のスピン間の作用によって結合し合う水素間の情報については、COSY(Correlation Spectroscopy)測定によって、解析を行った。
次に、化合物における炭化水素の種類、具体的には、−CH3、−CH2、−CHの何れに該当するかについて、HMQC(Heteronuclear Multiple Quantum Coherence)測定に基づいて結合構造の種類を解析した。
更に、水素と炭素との結合に関する位置関係の情報については、HMBC(Heteronuclear Multiple Bond Coherence)の測定により解析を行った。
【0034】
化合物Aに関する前記各種NMR情報を総合的に解析し、化合物Aの平面構造を図4(a)と決定した。
化合物Aの位置番号とそれに対応するNMRスペクトルデータは以下の表記載のとおりである。
【表6−1】

【0035】
前記のようにして特定された化合物Aは、以下のように略式表示を行うことができる。
(CH3)2CH・CH2CO・CHCH(CH3)C6H5(CH3)CO・CH・CH・CH・(CH3)2
【0036】
(2)分子量が300である化合物Bの化学式を決定するに至った経過は、以下のとおりである。
【0037】
前記1次元NMR測定及びE2−4−2の液体クロマトグラフ質量分析器によれば、化合物Bは、化合物Aの類縁体と推測され、その違いはその分子量の差から、化合物Aより二重結合が1個多いものと考えられた。
【0038】
(2)−(1)13C-NMRスペクトル分析によれば、化合物Bには、2個のカルボニル基の炭素のうち1つが、化合物Aの場合には、201.3ppmを示すシグナルに対し、当該数値よりも高磁場である191.7ppmのシグナルを確認した。
この若干の高磁場なカルボニル基のシグナルによって化合物Aの場合とは異なり、カルボニル基の両隣の炭素がそれぞれ不飽和な状態であろうという合理的な推定を行うことができる。
【0039】
(2)−(2)このような不飽和結合を前提としたうえで、化合物Aの場合と同様に、COSY、HMQC、HMBCによる各種二次元NMRの解析に基づいて、各相関関係を参釈したところ、2位−3位の炭素が二重結合で繋がった構造であることが判明した。
【0040】
化合物Bに関する、前記各種NMR情報を総合的に解析し、化合物Bの平面構造を図4(b)と決定した。
化合物Bの位置番号とそれに対応するNMRスペクトルデータは以下の表記載のとおりである。
【表6−2】

【0041】
前記のようにして特定された化合物Bは、以下のような略式表示を行うことができる。
(CH3)2C・CHCO・CHCH(CH3)C6H5C(CH3)CO・CH・CH・CH・(CH3))2
【0042】
前記化合物A及び化合物Bの化学構造によって、表5に示されている区画成分E2−4−2が示している天然ピレトリン及びdl−d−T80−アレスリンを明らかに凌駕している殺虫効力は、結局、化合物A及び化合物Bの混合状態に基づいている。
【0043】
したがって、化合物Aの殺虫効力に関する有用性は、化合物Bとの共存によって発揮され、同様に化合物Bの殺虫効力に関する有用性もまた、化合物Aとの共存によって発揮されていることは間違いない。
【0044】
しかしながら、炭化水素及び酸素との結合からなる典型的な殺虫性化合物においては、局所的な位置における結合基によって相互に相違している殺虫性化合物の場合、就中当該結合基における二重結合の存否によって相違しているに過ぎない類縁体の場合には、共に単独にて殺虫効力を有している。
具体的に説明するに、天然ピレトリンのうち、図5−1に示すピレトリンI、ジャスモリンI、シネリンI並びに図5−2に示すピレトリンII、ジャスモリンII、シネリンIIの6成分、および図5−1に示す合成ピレスロイドアレスリンは、何れもアルコール成分側鎖炭素1位、2位、3位の位置にアリル基を有する点において共通するも、当該アルコール成分側鎖の炭素数は、アレスリンが3個、シネリンが4個、ピレトリンが5個である。
即ち、4位及び5位においてアレスリンの場合には、炭化水素を有しておらず、シネリンI、IIの場合には、メチル基を有しており、ジャスモリンI、IIの場合には、エチル基を有しており、ピレトリンI、IIの場合には、エチレン基を有している点において相違しており、特に、ピレトリンI、IIと、ジャスモリンI、IIとは4位及び5位において二重結合の存否において相違している。
しかるに、何れも単独で殺虫効力を有することは周知の事項である。
このように、典型的な炭化水素及び酸素からなる殺虫用化合物の場合に、局所的な位置における炭化水素による結合基の相違、就中当該結合基における二重結合の存否による相違にも拘らず、それぞれ単独にて殺虫効力を有するという周知の事項を考慮するならば、化合物A、化合物Bが共に単独にて殺虫効力を有することもまた、当然推認することができる。
【0045】
したがって、化合物Aを有効成分とする前記基本構成(2)の殺虫剤又は化合物A及び化合物Bを有効成分とする前記基本構成(3)の殺虫剤もまた、必然的に殺虫効力を有している。
【0046】
尚、背景技術の項において説明したように、化合物Bについては、「Bis-trans-ocimenon」という名称が付された状態にて既にマリーゴールドから抽出されかつ分析されているが、前記のような殺虫効力の確認を伴う分析による化合物Bの特定は、本発明において初めて実現されている。
〔実施例に代わる更なる効力試験〕
化合物Aと化合物Bとの混合物である区画成分E2−4−2について、表3に示す試験条件に基づき、区画成分E2−4−2、天然ピレトリン、dl−d−T80−アレスリンについて更に濃度を希釈したうえで殺虫効力試験を行ったが、その結果は、次の表に示すとおりである。
【表7】

【0047】
前記殺虫効力試験からも明らかなように、天然ピレトリン及びdl−d−T80−アレスリンの場合には、濃度10-5(mg/6.15cm2)の段階ではノックダウン状態を実現することができないのに対し、化合物A及び化合物Bの混合物の場合には、30(分)というKT100値を示すと共に、24時間後に7%の致死率を示しており、しかも更に1桁低い濃度である10-6(mg/6.15cm2)の場合であっても、KT100値において40(分)という結果を示している。
【0048】
このような試験結果においては、化合物A及び/又は化合物Bを有効成分とする殺虫剤においては、ピレスロイド系化合物を桁違いに上回る殺虫効力、具体的にはKT100値(分)を基準とした場合には、10-6(mg/6.15cm2)の濃度の場合であっても、天然ピレトリン及びdl−d−T80−アレスリンにおける10-4(mg/6.15cm2)の濃度に基づく殺虫効力の数値を上回っている以上、100倍を超える殺虫効力の可能性を明瞭に裏付けている。
【産業上の利用可能性】
【0049】
例えば、日本家庭用殺虫剤工業会が2007年3月発行することによって既に公然と知られている非特許文献である「家庭用殺虫剤とピレスロイド」の22頁の表2は、広範かつ典型的なピレスロイド系化合物におけるイエバエ、アカイエカ、チャバネゴキブリの各成虫に対する殺虫効力を対比している。
【0050】
前記対比によれば、微量滴下法によるLD50値(50%の殺虫率)を基準とした場合、ピレトリンにおいてはイエバエ成虫及びチャバネゴキブリ成虫を殺虫するためには、アカイエカ成虫に必要な薬量のそれぞれ約23.0倍及び約32.0倍の薬量を必要としており、dl−d−T80−アレスリンにおいては、イエバエ成虫及びチャバネゴキブリ成虫を殺虫するためには、アカイエカ成虫に必要な薬量に比しそれぞれ約17倍及び約103倍の薬量を必要としている。
【0051】
このようなデータに即するならば、前記殺虫効力試験のように、化合物A及び/又は化合物Bを有効成分とする殺虫剤が、アカイエカについて天然ピレトリン及びdl−d−T80−アレスリンに比し、100倍を超える殺虫効力を示すことは、当該殺虫剤がこれらのピレスロイド系殺虫剤においてアカイエカに必要な薬量を以って、ハエ類及びゴキブリ類等の広範な飛翔行動昆虫に対する殺虫効力を有し得ることを推認させるに十分である。
【0052】
このように、化合物Aを有効成分とした場合又は化合物A及び化合物Bの双方を有効成分とした場合には、これらの有効成分は、炭素(C)、水素(H)及び酸素(O)のみによって構成される有機化合物であって、人畜に対する危害を生じない一方、家庭内外において、広範な飛翔行動昆虫を対象として、ピレスロイド系化合物に比し桁違いの殺虫効力を発揮することができる殺虫剤として広く利用することが可能であることを予測させるに十分である。
【特許請求の範囲】
【請求項1】
以下の化学式を有している殺虫性化合物。
【化1】

【請求項2】
請求項1記載の殺虫性化合物を有効成分とする殺虫剤。
【請求項3】
請求項1記載の殺虫性化合物及び以下の化学式を有している殺虫性化合物を有効成分とする殺虫剤。
【化2】

【請求項1】
以下の化学式を有している殺虫性化合物。
【化1】

【請求項2】
請求項1記載の殺虫性化合物を有効成分とする殺虫剤。
【請求項3】
請求項1記載の殺虫性化合物及び以下の化学式を有している殺虫性化合物を有効成分とする殺虫剤。
【化2】

【図1】


【図2】


【図3】


【図4】


【図5−1】


【図5−2】




【図2】


【図3】


【図4】


【図5−1】


【図5−2】


【公開番号】特開2012−121877(P2012−121877A)
【公開日】平成24年6月28日(2012.6.28)
【国際特許分類】
【出願番号】特願2011−140326(P2011−140326)
【出願日】平成23年6月24日(2011.6.24)
【分割の表示】特願2011−526328(P2011−526328)の分割
【原出願日】平成23年4月27日(2011.4.27)
【特許番号】特許第4911421号(P4911421)
【特許公報発行日】平成24年4月4日(2012.4.4)
【出願人】(000207584)大日本除蟲菊株式会社 (184)
【Fターム(参考)】
【公開日】平成24年6月28日(2012.6.28)
【国際特許分類】
【出願日】平成23年6月24日(2011.6.24)
【分割の表示】特願2011−526328(P2011−526328)の分割
【原出願日】平成23年4月27日(2011.4.27)
【特許番号】特許第4911421号(P4911421)
【特許公報発行日】平成24年4月4日(2012.4.4)
【出願人】(000207584)大日本除蟲菊株式会社 (184)
【Fターム(参考)】
[ Back to top ]

