毛質の評価方法
【課題】毛髪に含まれるタンパク質を同定することにより毛質を評価することが可能な毛質の評価方法を提供する。
【解決手段】毛質の評価方法は、毛髪からタンパク質を抽出する工程と、抽出されたタンパク質を、ペプチド結合加水分解酵素を用いて加水分解する工程と、加水分解されたタンパク質を、キャピラリーLC/ESI MS/MSを用いて分析し、ケラチン及び/又はケラチン関連タンパク質を同定する工程を有する。
【解決手段】毛質の評価方法は、毛髪からタンパク質を抽出する工程と、抽出されたタンパク質を、ペプチド結合加水分解酵素を用いて加水分解する工程と、加水分解されたタンパク質を、キャピラリーLC/ESI MS/MSを用いて分析し、ケラチン及び/又はケラチン関連タンパク質を同定する工程を有する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、毛質の評価方法に関する。
【背景技術】
【0002】
従来、毛髪のダメージを評価する方法としては、種々の方法が知られている。例えば、特許文献1には、毛髪に紫外光を照射し、330nm付近に蛍光極大を有するケラチン中の芳香族アミノ酸の蛍光バンドの波形及び/又は蛍光極大波長を測定して、基準値に対する波形の変化及び/又は波長シフトの度合いから毛髪の損傷・劣化を評価する方法が開示されている。特許文献2には、毛髪を、還元剤を含有する抽出溶剤を用いて抽出し、得られる蛋白質量を指標とする毛髪損傷の評価方法が開示されている。特許文献3には、毛髪を長手方向に沿って引き裂いてその引き裂き強度を求め、引き裂き強度に基づいて毛髪の損傷度を評価する方法が開示されている。特許文献4には、毛髪における酸化タンパク質のカルボニル基を特異的に蛍光標識し、その蛍光を検出することで毛髪のダメージを評価する方法が開示されている。
【0003】
また、毛髪への荷重を負荷し、そのときの荷重の大きさと毛髪の伸長との関係から微小荷重かつ微小伸長域の非フック領域の面積を求め、得られた面積に基づいてくせ毛の程度を評価する方法(特許文献5参照)が知られている。
【0004】
一方、毛髪中のヘアケラチンHa2遺伝子、ヘアケラチンHb2遺伝子、KAP5.1遺伝子(配列番号1)、KAP5.2遺伝子(配列番号2)、KAP5.3遺伝子(配列番号3)、KAP5.4遺伝子(配列番号4)及び/又はKAP5.5遺伝子(配列番号5)の発現を指標とする毛質の評価方法が知られている(特許文献6参照)。しかしながら、遺伝子の発現を指標としているため、生細胞である毛根を用いる必要があるという問題がある。
【特許文献1】特開平9−173301号公報
【特許文献2】特開2001−356125号公報
【特許文献3】特開2002−282240号公報
【特許文献4】WO2005/057211号公報
【特許文献5】特開平8−15111号公報
【特許文献6】特開2006−14721号公報
【発明の開示】
【発明が解決しようとする課題】
【0005】
本発明は、上記の従来技術が有する問題に鑑み、毛髪に含まれるタンパク質を同定することにより毛質を評価することが可能な毛質の評価方法を提供することを目的とする。
【課題を解決するための手段】
【0006】
請求項1に記載の発明は、毛質の評価方法において、毛髪からタンパク質を抽出する工程と、該抽出されたタンパク質を、ペプチド結合加水分解酵素を用いて加水分解する工程と、該加水分解されたタンパク質を、キャピラリーLC/ESI MS/MSを用いて分析し、ケラチン及び/又はケラチン関連タンパク質を同定する工程を有することを特徴とする。
【0007】
請求項2に記載の発明は、請求項1に記載の毛質の評価方法において、前記毛髪のジスルフィド結合を溶媒中で還元することにより前記タンパク質を抽出することを特徴とする。
【0008】
請求項3に記載の発明は、請求項1に記載の毛質の評価方法において、前記毛髪を水中に浸漬することにより前記タンパク質を抽出することを特徴とする。
【0009】
請求項4に記載の発明は、請求項1乃至3のいずれか一項に記載の毛質の評価方法において、前記ケラチンを同定する際に、ケラチンのトリプトファン残基の酸化の有無を分析することを特徴とする。
【0010】
請求項5に記載の発明は、請求項1乃至4のいずれか一項に記載の毛質の評価方法において、前記キャピラリーLCは、多次元のキャピラリーLCであることを特徴とする。
【発明の効果】
【0011】
本発明によれば、毛髪に含まれるタンパク質を同定することにより毛質を評価することが可能な毛質の評価方法を提供することができる。
【発明を実施するための最良の形態】
【0012】
次に、本発明を実施するための最良の形態を図面と共に説明する。
【0013】
本発明の毛質の評価方法は、毛髪からタンパク質を抽出する工程と、抽出されたタンパク質を、ペプチド結合加水分解酵素を用いて加水分解する工程と、加水分解されたタンパク質を、キャピラリーLC/ESI MS/MSを用いて分析し、ケラチン及び/又はケラチン関連タンパク質を同定する工程を有する。
【0014】
毛髪からタンパク質を抽出する方法としては、特に限定されないが、毛髪のジスルフィド結合を溶媒中で還元することにより抽出する方法、毛髪を水中に浸漬することにより抽出する方法等が挙げられる。
【0015】
本発明において、毛髪のジスルフィド結合を溶媒中で還元することによりタンパク質を抽出すると、毛髪を構成するケラチン及びケラチン関連タンパク質を分析することができる。溶媒としては、タンパク質を抽出することが可能であれば、特に限定されないが、水、リン酸緩衝液、トリスリン酸緩衝液等が挙げられる。また、毛髪のジスルフィド結合を溶媒中で還元する際に用いられる還元剤としては、特に限定されないが、ジチオエリトリトール、ジチオトレイトール、2−メルカプトエタノール、TCEP(Tris(2−carboxyethyl)phosphine hydrochloride)等が挙げられる。このとき、還元剤と共に、塩酸グアニン、尿素、ドデシル硫酸ナトリウム(SDS)等の変性剤を添加してもよい。さらに、毛髪中のジスルフィド結合を還元する際に、40.0〜99.9℃に加熱してもよい。
【0016】
毛髪から抽出されたタンパク質を加水分解するペプチド結合加水分解酵素としては、特に限定されないが、トリプシン、キモトリプシン、ペプシン、リシルエンドペプチダーゼ、V8プロテアーゼ、エンドプロテイナーゼAsp−N等が挙げられる。
【0017】
ペプチド結合加水分解酵素により加水分解されたタンパク質を、キャピラリーLC/MS/MSを用いて分析する際には、遠心分離した上清を用いることができる。なお、ケラチン及び/又はケラチン関連タンパク質を同定する際に、ケラチンのトリプトファン残基の酸化の有無を分析することにより、毛髪のダメージを評価することができる。また、ケラチン関連タンパク質を同定することにより、毛髪のくせ毛を評価することができる。
【0018】
本発明において、毛髪を水中に浸漬することによりタンパク質を抽出すると、毛髪からのケラチンの溶出量を分析することができ、その結果、毛髪のダメージを評価することができる。なお、毛髪を浸漬する水は、35.0〜80.0℃に加熱されていてもよい。また、毛髪を浸漬する際に、振とうしてもよい。
【0019】
毛髪から抽出されたタンパク質を加水分解するペプチド結合加水分解酵素としては、特に限定されないが、トリプシン、キモトリプシン、ペプシン、リシルエンドペプチダーゼ、V8プロテアーゼ、エンドプロテイナーゼAsp−N等が挙げられる。
【0020】
ペプチド結合加水分解酵素により加水分解されたタンパク質を、キャピラリーLC/MS/MSを用いて分析する際には、遠心分離した上清を用いることができる。
【0021】
なお、キャピラリーLCは、一次元及び多次元のキャピラリーLCのいずれであってもよいが、分離能を考慮すると、多次元のキャピラリーLCが好ましく、二〜三次元のキャピラリーLCが特に好ましい。また、キャピラリーLCは、イオン交換クロマトグラフィー、親水性相互作用クロマトグラフィー(HILIC)及び逆相クロマトグラフィーのいずれであってもよいが、分離能が高く、オンライン脱塩ができることから、逆相クロマトグラフィーが好ましい。このとき、試料の溶出法は、アイソクラティック溶出法及びグラジエント溶出法のいずれであってもよいが、分離能を考慮すると、グラジエント溶出法が好ましい。
【実施例】
【0022】
[実施例1]
内径100μm、長さ120mmの未充填のキャピラリーカラム(New Objective社製)のテーパー状の出口側の端部に、充填剤を保持するために、シリカ製のフリットを作製した。得られたキャピラリーカラムに、平均粒径が5μmのオクタデシル化シリカ型充填剤Aqua C18(Phenomenex社製)を、高さが100mmとなるように充填し、分析用逆相キャピラリーカラムを得た。
【0023】
内径250μm、長さ150mmの未充填のキャピラリーカラム(Agilent社製)の出口側の端部に、充填剤を保持するために、シリカ製のフリットを作製した。得られたキャピラリーカラムの出口側に、平均粒径が5μmのカチオン交換樹脂型充填剤Partisphere SCX resins(Whatman社製)と、平均粒径が5μmのアニオン交換樹脂型充填剤PolyWAX LP(PolyLC社製)を質量比2:1で混合したもの、入口側に、平均粒径が5μmのオクタデシル化シリカ型充填剤Aqua C18(Phenomenex社製)を、それぞれ高さが25mmとなるように充填し、トラップ用逆相キャピラリーカラム及びSCX−WAX混合キャピラリーカラムからなる二相型キャピラリーカラムを得た。
【0024】
なお、分析用逆相キャピラリーカラム及び二相型キャピラリーカラムを作製する際には、高圧窒素ガス及び加圧型充填容器を用いて、スラリー充填法により充填剤を充填した。
【0025】
年齢28〜41才の日本人女性(3名)由来の毛髪(直毛)からタンパク質を抽出した。具体的には、まず、毛髪を水洗した後、SDSを2質量%、ジチオエリトリトールを20mM含むリン酸緩衝液中、65℃で72時間インキュベートし、ジスルフィド結合を還元した。このとき、24時間及び48時間インキュベートした後に、マグネチックスターラーで1時間攪拌した。次に、液に対して40mMになるように、ヨードアセトアミドを添加してチオール基をアルキル化処理した後、液に対して2.5倍の体積のエタノールを添加してタンパク質を沈殿させた。これを70体積%エタノール水溶液で洗浄した後、尿素を2M、アセトニトリルを2体積%、重炭酸アンモニウムを0.1M含む水溶液に溶解させた。次に、液中の全タンパク質に対して約2質量%のトリプシンを添加して、37℃で16時間インキュベートし、タンパク質を加水分解させた。さらに、液に対して1体積%のギ酸を添加して反応を停止させた後、14000rpmで遠心分離して上清を得た。
【0026】
次に、6ステップのMudPIT型分析(二次元HPLC/ESI MS/MS)により、タンパク質を分析した。
【0027】
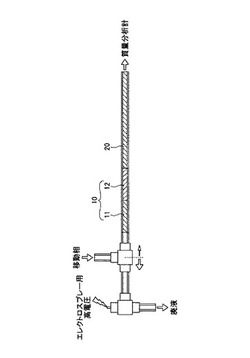
まず、ペプチドを約4μg含む上清を、加圧法により、二相型キャピラリーカラムにロードした後、試料溶液の10倍以上の体積の移動相A(水、アセトニトリル及びギ酸の体積比95:5:0.1の混合液;pH〜2.6)を用いて、洗浄、脱塩した。この二相型キャピラリーカラム10を、貫通孔型ユニオン(Upchurch Scientific社製)(不図示)を介して、分析用逆相キャピラリーカラム20と接続した(図1参照)。次に、内径が100μmのキャピラリーを配管として用いたNanospace SI−2型HPLC装置(資生堂社製)に接続した。このとき、トラップ用逆相キャピラリーカラム11は、SCX−WAX混合キャピラリーカラム12及び分析用逆相キャピラリーカラム20の上流側に配置した。
【0028】
移動相としては、移動相A、移動相B(水、アセトニトリル及びギ酸の体積比20:80:0.1の混合液)、移動相C(500mMの酢酸アンモニウムを含む移動相A;pH〜6.8)を用い、ペプチドの溶出法は、矩形状に加える移動相Cの体積%をステップ毎に漸増させた、計6ステップのグラジエント溶出法とした。
【0029】
ステップ1のグラジエントプロファイルは、5分間移動相Aを流し、次の5分間で移動相Bの比率を0体積%から15体積%まで増加させ、次の60分間で移動相Bの比率を45体積%まで増加させ、次の10分間で移動相Bの比率を75体積%まで増加させた後、この比率で5分間流すものである。
【0030】
ステップ2〜6のグラジエントプロファイルは、1分間移動相Aを流し、次の4分間移動相Cの比率をX[体積%](表1参照)として流し、次の5分間で移動相Cの比率を0体積%から15体積%まで増加させ、次の60分間で移動相Cの比率を45体積%まで増加させ、次の10分間で移動相Cの比率を75体積%まで増加させた後、この比率で5分間流すものである。以上のようにして得られたベースピーククロマトグラムを図2に示す。なお、図2(a)〜(f)は、それぞれステップ1〜6のベースピーククロマトグラムである。
【0031】
【表1】

このとき、ポンプの送液の流速を250μL/分とし、抵抗型キャピラリーによるスプリットにより、カラムの流速を300〜400nL/分に調整した。
【0032】
また、ESI MS/MSを測定する際には、イオントラップ型質量分析計LCQ−Deca(Thermo Fisher Scientific社製)を用いた。このとき、分析用逆相キャピラリーカラムから溶出されたペプチドは、スプリットすることなく、質量分析計に直接導入した。
【0033】
なお、質量電荷比(m/z)が400〜1400のフルスキャンMSスペクトル測定1回及びデータ依存型MS/MSスペクトル測定3回を、各ステップを通じて繰り返した。このとき、標準化解裂エネルギーは35%とした。また、マイクロスキャンは、MSスペクトル測定及びMS/MS測定ともに3とした。さらに、動的排除設定は、リピートカウント1、リピート期間0.50分、排除リストサイズ25、排除期間10.00分とした。
【0034】
得られたMS/MSスペクトルは、Bioworksソフトウェア(Thermo Fisher Scientific社製)上で動くSEQUESTアルゴリズムにより、非冗長ヒトデータベース(ftp://ftp.ncbi.nih.gov/blast/db/FASTA/nr.gz、2007/2/8版)に対して、検索した。なお、タンパク質の同定に必要なペプチド数は1以上とし、少なくとも片末端がトリプシンの基質特異性に適合するペプチドのみでタンパク質を同定した。また、これ以外のサーチ基準は、(1)フラグメントイオンには平均質量を使用すること、(2)システイン残基は、アルキル化が完全と仮定し+57マスユニットを加算した質量とし、メチオニン残基は、酸化・非酸化が混在していると仮定し、+16マスユニット(酸化)、+0マスユニット(非酸化)を加算した質量とすることとした。
【0035】
その結果、毛髪に含まれるケラチンは、Ha1、Ha2、Ha3、Ha4、Ha5、Ha6、Ha7、Ha8、Hb1、Hb2、Hb3、Hb5、Hb6であることがわかった。また、毛髪に含まれるケラチン関連タンパク質は、KAP3−1、KAP3−2、KAP3−3、KAP10−10、KAP11−1、KAP13−1であることがわかった。
【0036】
[実施例2]
太陽紫外光シミュレーター(ORIEL社)を用いて、年齢28〜41才の日本人女性(3名)由来の毛髪に、擬似太陽光を16時間照射した(積算946J/cm2)。得られた毛髪を用いた以外は、実施例1と同様にして、タンパク質を分析した。
【0037】
その結果、毛髪に含まれるケラチン及びケラチン関連タンパク質は、実施例1と同様であったが、ケラチンHa1及びHa3のトリプトファン残基が酸化されている点で実施例1とは異なることがわかった。
【0038】
したがって、ケラチンHa1及びHa3のトリプトファン残基の酸化の有無を分析することにより、毛髪のダメージを評価することができる。
【0039】
[実施例3]
年齢20〜40才のアフリカ人女性(3名)由来の毛髪(縮毛)を用いた以外は、実施例1と同様にして、タンパク質を分析した。
【0040】
その結果、毛髪に含まれるケラチンは、Ha1、Ha2、Ha3、Ha4、Ha5、Ha6、Ha8、Hb1、Hb2、Hb3、Hb5、Hb6であることがわかった。また、毛髪に含まれるケラチン関連タンパク質は、KAP1−9、KAP11−1、KAP13−1、KAP19−5であることがわかった。
【0041】
実施例1及び3から、直毛及び縮毛の毛髪に含まれるケラチン関連タンパク質が異なることがわかる。したがって、毛髪に含まれるケラチン関連タンパク質を同定することにより、毛質を評価することができることがわかる。
【0042】
[実施例4]
内径100μm、長さ120mmの未充填のキャピラリーカラム(New Objective社製)のテーパー状の出口側の端部に、充填剤を保持するために、シリカ製のフリットを作製した。得られたキャピラリーカラムに、平均粒径が5μmのオクタデシル化シリカ型充填剤Aqua C18(Phenomenex社製)を、高さが100mmとなるように充填し、分析用逆相キャピラリーカラムを得た。
【0043】
内径250μm、長さ150mmの未充填のキャピラリーカラム(Agilent社製)の出口側の端部に、充填剤を保持するために、シリカ製のフリットを作製した。得られたキャピラリーカラムに、平均粒径が5μmのオクタデシル化シリカ型充填剤Aqua C18(Phenomenex社製)を、高さが10mmとなるように充填し、トラップ用逆相キャピラリーカラムを得た。
【0044】
なお、分析用逆相キャピラリーカラム及びトラップ用逆相キャピラリーカラムを作製する際には、高圧窒素ガス及び加圧型充填容器を用いて、スラリー充填法により充填剤を充填した。
【0045】
年齢28〜41才の日本人女性(3名)由来の毛髪からタンパク質を抽出した。具体的には、まず、約5gの毛髪を精製水で軽くリンスした後、40℃の水中で8時間振とうした。次に、液から毛髪を取り除いて、凍結減圧乾燥機で濃縮した後、尿素を2M、アセトニトリルを2体積%、重炭酸アンモニウムを0.1M含む水溶液に溶解させた。さらに、液に対して40mMになるように、ヨードアセトアミドを添加した後、液に対して2質量%のトリプシンを添加して、37℃で16時間インキュベートし、タンパク質を加水分解させた。最後に、液に対して1体積%のギ酸を添加して反応を停止させた後、14000rpmで遠心分離して上清を得た。
【0046】
次に、1ステップのMudPIT型分析(一次元HPLC/ESI MS/MS)により、タンパク質を分析した。
【0047】
まず、ペプチドを約4μg含む上清を、加圧法によりトラップ用逆相キャピラリーカラムにロードした後、試料溶液の10倍以上の体積の移動相A(水、アセトニトリル及びギ酸の体積比95:5:0.1の混合液;pH〜2.6)を用いて、洗浄、脱塩した。このトラップ用逆相キャピラリーカラムを、貫通孔型ユニオン(Upchurch Scientific社製)を介して、分析用逆相キャピラリーカラムと接続した。次に、内径が100μmのキャピラリーを配管として用いたNanospace SI−2型HPLC装置(資生堂社製)に接続した。このとき、トラップ用逆相キャピラリーカラムは、分析用逆相キャピラリーカラムの上流側に配置した。
【0048】
移動相としては、移動相A、移動相B(水、アセトニトリル及びギ酸の体積比20:80:0.1の混合液)を用い、ペプチドの溶出法は、1ステップのグラジエント溶出法とした。
【0049】
ステップ1のグラジエントプロファイルは、5分間移動相Aを流し、次の5分間で移動相Bの比率を0体積%から15体積%まで増加させ、次の60分間で移動相Bの比率を45体積%まで増加させ、次の10分間で移動相Bの比率を75体積%まで増加させた後、この比率で5分間流すものである。
【0050】
なお、ポンプの送液の流速を250μL/分とし、抵抗型キャピラリーによるスプリットにより、カラムの流速を300〜400nL/分に調整した。
【0051】
また、ESI MS/MSを測定する際には、イオントラップ/静電型FTハイブリッド型質量分析計LTQ−Orbitrap(Thermo Fisher Scientific社製)を用いた。このとき、分析用逆相キャピラリーカラムから溶出されたペプチドは、スプリットすることなく、質量分析計に直接導入した。
【0052】
なお、高質量精度の分子量測定(<5ppm)と高速MS/MS測定を両立するパラレル検出モードとし、質量電荷比(m/z)が400〜1800のフルスキャン高質量精度MSスペクトル測定1回及びデータ依存型MS/MSスペクトル測定7回を、ステップ1を通じて繰り返した。また、マイクロスキャンは、MSスペクトル測定及びMS/MS測定ともに1とした。さらに、動的排除設定は、リピートカウント1、リピート期間0.50分、排除リストサイズ50、排除期間1.00分とした。
【0053】
得られたMS/MSスペクトルは、Bioworksソフトウェア(Thermo Fisher Scientific社製)上で動くSEQUESTアルゴリズムにより、非冗長ヒトデータベース(ftp://ftp.ncbi.nih.gov/blast/db/FASTA/nr.gz、2007/2/8版)に対して、検索した。なお、タンパク質の同定に必要なペプチド数は1以上とし、少なくとも片末端がトリプシンの基質特異性に適合するペプチドのみでタンパク質を同定した。また、これ以外のサーチ基準は、(1)データベース検索時のプリカーサー質量の許容幅を50ppmとすること、(2)サーチ時の[M+H]+の値をモノアイソトピック質量で計算すること、(3)フラグメントイオンには平均質量を使用すること、(4)システイン残基は、アルキル化が完全と仮定し+57マスユニットを加算した質量とし、メチオニン残基は、酸化・非酸化が混在していると仮定し、+16マスユニット(酸化)、+0マスユニット(非酸化)を加算した質量とすることとした。
【0054】
その結果、ケラチンHa1、Ha2、Ha3、Hb6が毛髪から流出していることがわかった。
【0055】
[実施例5]
太陽紫外光シミュレーター(ORIEL社)を用いて、年齢28〜41才の日本人女性由来の毛髪に、擬似太陽光を16時間照射した(積算946J/cm2)。得られた毛髪を用いた以外は、実施例4と同様にして、タンパク質を分析した。
【0056】
その結果、毛髪から流出しているケラチンは、実施例4と同様であった。一方、Lowry法に基づく比色法(DCプロテインアッセイキット(バイオ・ラッド ラボラトリーズ社製))により、毛髪から流出したタンパク質を定量した結果、実施例4よりも多いことがわかった。
【0057】
したがって、毛髪から流出するケラチンHa1、Ha2、Ha3、Hb6を定量することにより、毛髪のダメージを評価することができることがわかる。
【図面の簡単な説明】
【0058】
【図1】実施例1のHPLC装置を示す図である。
【図2】実施例1のベースピーククロマトグラムを示す図である。
【符号の説明】
【0059】
10 二相型キャピラリーカラム
11 トラップ用逆相キャピラリーカラム
12 SCX−WAX混合キャピラリーカラム
20 分析用逆相キャピラリーカラム
【技術分野】
【0001】
本発明は、毛質の評価方法に関する。
【背景技術】
【0002】
従来、毛髪のダメージを評価する方法としては、種々の方法が知られている。例えば、特許文献1には、毛髪に紫外光を照射し、330nm付近に蛍光極大を有するケラチン中の芳香族アミノ酸の蛍光バンドの波形及び/又は蛍光極大波長を測定して、基準値に対する波形の変化及び/又は波長シフトの度合いから毛髪の損傷・劣化を評価する方法が開示されている。特許文献2には、毛髪を、還元剤を含有する抽出溶剤を用いて抽出し、得られる蛋白質量を指標とする毛髪損傷の評価方法が開示されている。特許文献3には、毛髪を長手方向に沿って引き裂いてその引き裂き強度を求め、引き裂き強度に基づいて毛髪の損傷度を評価する方法が開示されている。特許文献4には、毛髪における酸化タンパク質のカルボニル基を特異的に蛍光標識し、その蛍光を検出することで毛髪のダメージを評価する方法が開示されている。
【0003】
また、毛髪への荷重を負荷し、そのときの荷重の大きさと毛髪の伸長との関係から微小荷重かつ微小伸長域の非フック領域の面積を求め、得られた面積に基づいてくせ毛の程度を評価する方法(特許文献5参照)が知られている。
【0004】
一方、毛髪中のヘアケラチンHa2遺伝子、ヘアケラチンHb2遺伝子、KAP5.1遺伝子(配列番号1)、KAP5.2遺伝子(配列番号2)、KAP5.3遺伝子(配列番号3)、KAP5.4遺伝子(配列番号4)及び/又はKAP5.5遺伝子(配列番号5)の発現を指標とする毛質の評価方法が知られている(特許文献6参照)。しかしながら、遺伝子の発現を指標としているため、生細胞である毛根を用いる必要があるという問題がある。
【特許文献1】特開平9−173301号公報
【特許文献2】特開2001−356125号公報
【特許文献3】特開2002−282240号公報
【特許文献4】WO2005/057211号公報
【特許文献5】特開平8−15111号公報
【特許文献6】特開2006−14721号公報
【発明の開示】
【発明が解決しようとする課題】
【0005】
本発明は、上記の従来技術が有する問題に鑑み、毛髪に含まれるタンパク質を同定することにより毛質を評価することが可能な毛質の評価方法を提供することを目的とする。
【課題を解決するための手段】
【0006】
請求項1に記載の発明は、毛質の評価方法において、毛髪からタンパク質を抽出する工程と、該抽出されたタンパク質を、ペプチド結合加水分解酵素を用いて加水分解する工程と、該加水分解されたタンパク質を、キャピラリーLC/ESI MS/MSを用いて分析し、ケラチン及び/又はケラチン関連タンパク質を同定する工程を有することを特徴とする。
【0007】
請求項2に記載の発明は、請求項1に記載の毛質の評価方法において、前記毛髪のジスルフィド結合を溶媒中で還元することにより前記タンパク質を抽出することを特徴とする。
【0008】
請求項3に記載の発明は、請求項1に記載の毛質の評価方法において、前記毛髪を水中に浸漬することにより前記タンパク質を抽出することを特徴とする。
【0009】
請求項4に記載の発明は、請求項1乃至3のいずれか一項に記載の毛質の評価方法において、前記ケラチンを同定する際に、ケラチンのトリプトファン残基の酸化の有無を分析することを特徴とする。
【0010】
請求項5に記載の発明は、請求項1乃至4のいずれか一項に記載の毛質の評価方法において、前記キャピラリーLCは、多次元のキャピラリーLCであることを特徴とする。
【発明の効果】
【0011】
本発明によれば、毛髪に含まれるタンパク質を同定することにより毛質を評価することが可能な毛質の評価方法を提供することができる。
【発明を実施するための最良の形態】
【0012】
次に、本発明を実施するための最良の形態を図面と共に説明する。
【0013】
本発明の毛質の評価方法は、毛髪からタンパク質を抽出する工程と、抽出されたタンパク質を、ペプチド結合加水分解酵素を用いて加水分解する工程と、加水分解されたタンパク質を、キャピラリーLC/ESI MS/MSを用いて分析し、ケラチン及び/又はケラチン関連タンパク質を同定する工程を有する。
【0014】
毛髪からタンパク質を抽出する方法としては、特に限定されないが、毛髪のジスルフィド結合を溶媒中で還元することにより抽出する方法、毛髪を水中に浸漬することにより抽出する方法等が挙げられる。
【0015】
本発明において、毛髪のジスルフィド結合を溶媒中で還元することによりタンパク質を抽出すると、毛髪を構成するケラチン及びケラチン関連タンパク質を分析することができる。溶媒としては、タンパク質を抽出することが可能であれば、特に限定されないが、水、リン酸緩衝液、トリスリン酸緩衝液等が挙げられる。また、毛髪のジスルフィド結合を溶媒中で還元する際に用いられる還元剤としては、特に限定されないが、ジチオエリトリトール、ジチオトレイトール、2−メルカプトエタノール、TCEP(Tris(2−carboxyethyl)phosphine hydrochloride)等が挙げられる。このとき、還元剤と共に、塩酸グアニン、尿素、ドデシル硫酸ナトリウム(SDS)等の変性剤を添加してもよい。さらに、毛髪中のジスルフィド結合を還元する際に、40.0〜99.9℃に加熱してもよい。
【0016】
毛髪から抽出されたタンパク質を加水分解するペプチド結合加水分解酵素としては、特に限定されないが、トリプシン、キモトリプシン、ペプシン、リシルエンドペプチダーゼ、V8プロテアーゼ、エンドプロテイナーゼAsp−N等が挙げられる。
【0017】
ペプチド結合加水分解酵素により加水分解されたタンパク質を、キャピラリーLC/MS/MSを用いて分析する際には、遠心分離した上清を用いることができる。なお、ケラチン及び/又はケラチン関連タンパク質を同定する際に、ケラチンのトリプトファン残基の酸化の有無を分析することにより、毛髪のダメージを評価することができる。また、ケラチン関連タンパク質を同定することにより、毛髪のくせ毛を評価することができる。
【0018】
本発明において、毛髪を水中に浸漬することによりタンパク質を抽出すると、毛髪からのケラチンの溶出量を分析することができ、その結果、毛髪のダメージを評価することができる。なお、毛髪を浸漬する水は、35.0〜80.0℃に加熱されていてもよい。また、毛髪を浸漬する際に、振とうしてもよい。
【0019】
毛髪から抽出されたタンパク質を加水分解するペプチド結合加水分解酵素としては、特に限定されないが、トリプシン、キモトリプシン、ペプシン、リシルエンドペプチダーゼ、V8プロテアーゼ、エンドプロテイナーゼAsp−N等が挙げられる。
【0020】
ペプチド結合加水分解酵素により加水分解されたタンパク質を、キャピラリーLC/MS/MSを用いて分析する際には、遠心分離した上清を用いることができる。
【0021】
なお、キャピラリーLCは、一次元及び多次元のキャピラリーLCのいずれであってもよいが、分離能を考慮すると、多次元のキャピラリーLCが好ましく、二〜三次元のキャピラリーLCが特に好ましい。また、キャピラリーLCは、イオン交換クロマトグラフィー、親水性相互作用クロマトグラフィー(HILIC)及び逆相クロマトグラフィーのいずれであってもよいが、分離能が高く、オンライン脱塩ができることから、逆相クロマトグラフィーが好ましい。このとき、試料の溶出法は、アイソクラティック溶出法及びグラジエント溶出法のいずれであってもよいが、分離能を考慮すると、グラジエント溶出法が好ましい。
【実施例】
【0022】
[実施例1]
内径100μm、長さ120mmの未充填のキャピラリーカラム(New Objective社製)のテーパー状の出口側の端部に、充填剤を保持するために、シリカ製のフリットを作製した。得られたキャピラリーカラムに、平均粒径が5μmのオクタデシル化シリカ型充填剤Aqua C18(Phenomenex社製)を、高さが100mmとなるように充填し、分析用逆相キャピラリーカラムを得た。
【0023】
内径250μm、長さ150mmの未充填のキャピラリーカラム(Agilent社製)の出口側の端部に、充填剤を保持するために、シリカ製のフリットを作製した。得られたキャピラリーカラムの出口側に、平均粒径が5μmのカチオン交換樹脂型充填剤Partisphere SCX resins(Whatman社製)と、平均粒径が5μmのアニオン交換樹脂型充填剤PolyWAX LP(PolyLC社製)を質量比2:1で混合したもの、入口側に、平均粒径が5μmのオクタデシル化シリカ型充填剤Aqua C18(Phenomenex社製)を、それぞれ高さが25mmとなるように充填し、トラップ用逆相キャピラリーカラム及びSCX−WAX混合キャピラリーカラムからなる二相型キャピラリーカラムを得た。
【0024】
なお、分析用逆相キャピラリーカラム及び二相型キャピラリーカラムを作製する際には、高圧窒素ガス及び加圧型充填容器を用いて、スラリー充填法により充填剤を充填した。
【0025】
年齢28〜41才の日本人女性(3名)由来の毛髪(直毛)からタンパク質を抽出した。具体的には、まず、毛髪を水洗した後、SDSを2質量%、ジチオエリトリトールを20mM含むリン酸緩衝液中、65℃で72時間インキュベートし、ジスルフィド結合を還元した。このとき、24時間及び48時間インキュベートした後に、マグネチックスターラーで1時間攪拌した。次に、液に対して40mMになるように、ヨードアセトアミドを添加してチオール基をアルキル化処理した後、液に対して2.5倍の体積のエタノールを添加してタンパク質を沈殿させた。これを70体積%エタノール水溶液で洗浄した後、尿素を2M、アセトニトリルを2体積%、重炭酸アンモニウムを0.1M含む水溶液に溶解させた。次に、液中の全タンパク質に対して約2質量%のトリプシンを添加して、37℃で16時間インキュベートし、タンパク質を加水分解させた。さらに、液に対して1体積%のギ酸を添加して反応を停止させた後、14000rpmで遠心分離して上清を得た。
【0026】
次に、6ステップのMudPIT型分析(二次元HPLC/ESI MS/MS)により、タンパク質を分析した。
【0027】
まず、ペプチドを約4μg含む上清を、加圧法により、二相型キャピラリーカラムにロードした後、試料溶液の10倍以上の体積の移動相A(水、アセトニトリル及びギ酸の体積比95:5:0.1の混合液;pH〜2.6)を用いて、洗浄、脱塩した。この二相型キャピラリーカラム10を、貫通孔型ユニオン(Upchurch Scientific社製)(不図示)を介して、分析用逆相キャピラリーカラム20と接続した(図1参照)。次に、内径が100μmのキャピラリーを配管として用いたNanospace SI−2型HPLC装置(資生堂社製)に接続した。このとき、トラップ用逆相キャピラリーカラム11は、SCX−WAX混合キャピラリーカラム12及び分析用逆相キャピラリーカラム20の上流側に配置した。
【0028】
移動相としては、移動相A、移動相B(水、アセトニトリル及びギ酸の体積比20:80:0.1の混合液)、移動相C(500mMの酢酸アンモニウムを含む移動相A;pH〜6.8)を用い、ペプチドの溶出法は、矩形状に加える移動相Cの体積%をステップ毎に漸増させた、計6ステップのグラジエント溶出法とした。
【0029】
ステップ1のグラジエントプロファイルは、5分間移動相Aを流し、次の5分間で移動相Bの比率を0体積%から15体積%まで増加させ、次の60分間で移動相Bの比率を45体積%まで増加させ、次の10分間で移動相Bの比率を75体積%まで増加させた後、この比率で5分間流すものである。
【0030】
ステップ2〜6のグラジエントプロファイルは、1分間移動相Aを流し、次の4分間移動相Cの比率をX[体積%](表1参照)として流し、次の5分間で移動相Cの比率を0体積%から15体積%まで増加させ、次の60分間で移動相Cの比率を45体積%まで増加させ、次の10分間で移動相Cの比率を75体積%まで増加させた後、この比率で5分間流すものである。以上のようにして得られたベースピーククロマトグラムを図2に示す。なお、図2(a)〜(f)は、それぞれステップ1〜6のベースピーククロマトグラムである。
【0031】
【表1】

このとき、ポンプの送液の流速を250μL/分とし、抵抗型キャピラリーによるスプリットにより、カラムの流速を300〜400nL/分に調整した。
【0032】
また、ESI MS/MSを測定する際には、イオントラップ型質量分析計LCQ−Deca(Thermo Fisher Scientific社製)を用いた。このとき、分析用逆相キャピラリーカラムから溶出されたペプチドは、スプリットすることなく、質量分析計に直接導入した。
【0033】
なお、質量電荷比(m/z)が400〜1400のフルスキャンMSスペクトル測定1回及びデータ依存型MS/MSスペクトル測定3回を、各ステップを通じて繰り返した。このとき、標準化解裂エネルギーは35%とした。また、マイクロスキャンは、MSスペクトル測定及びMS/MS測定ともに3とした。さらに、動的排除設定は、リピートカウント1、リピート期間0.50分、排除リストサイズ25、排除期間10.00分とした。
【0034】
得られたMS/MSスペクトルは、Bioworksソフトウェア(Thermo Fisher Scientific社製)上で動くSEQUESTアルゴリズムにより、非冗長ヒトデータベース(ftp://ftp.ncbi.nih.gov/blast/db/FASTA/nr.gz、2007/2/8版)に対して、検索した。なお、タンパク質の同定に必要なペプチド数は1以上とし、少なくとも片末端がトリプシンの基質特異性に適合するペプチドのみでタンパク質を同定した。また、これ以外のサーチ基準は、(1)フラグメントイオンには平均質量を使用すること、(2)システイン残基は、アルキル化が完全と仮定し+57マスユニットを加算した質量とし、メチオニン残基は、酸化・非酸化が混在していると仮定し、+16マスユニット(酸化)、+0マスユニット(非酸化)を加算した質量とすることとした。
【0035】
その結果、毛髪に含まれるケラチンは、Ha1、Ha2、Ha3、Ha4、Ha5、Ha6、Ha7、Ha8、Hb1、Hb2、Hb3、Hb5、Hb6であることがわかった。また、毛髪に含まれるケラチン関連タンパク質は、KAP3−1、KAP3−2、KAP3−3、KAP10−10、KAP11−1、KAP13−1であることがわかった。
【0036】
[実施例2]
太陽紫外光シミュレーター(ORIEL社)を用いて、年齢28〜41才の日本人女性(3名)由来の毛髪に、擬似太陽光を16時間照射した(積算946J/cm2)。得られた毛髪を用いた以外は、実施例1と同様にして、タンパク質を分析した。
【0037】
その結果、毛髪に含まれるケラチン及びケラチン関連タンパク質は、実施例1と同様であったが、ケラチンHa1及びHa3のトリプトファン残基が酸化されている点で実施例1とは異なることがわかった。
【0038】
したがって、ケラチンHa1及びHa3のトリプトファン残基の酸化の有無を分析することにより、毛髪のダメージを評価することができる。
【0039】
[実施例3]
年齢20〜40才のアフリカ人女性(3名)由来の毛髪(縮毛)を用いた以外は、実施例1と同様にして、タンパク質を分析した。
【0040】
その結果、毛髪に含まれるケラチンは、Ha1、Ha2、Ha3、Ha4、Ha5、Ha6、Ha8、Hb1、Hb2、Hb3、Hb5、Hb6であることがわかった。また、毛髪に含まれるケラチン関連タンパク質は、KAP1−9、KAP11−1、KAP13−1、KAP19−5であることがわかった。
【0041】
実施例1及び3から、直毛及び縮毛の毛髪に含まれるケラチン関連タンパク質が異なることがわかる。したがって、毛髪に含まれるケラチン関連タンパク質を同定することにより、毛質を評価することができることがわかる。
【0042】
[実施例4]
内径100μm、長さ120mmの未充填のキャピラリーカラム(New Objective社製)のテーパー状の出口側の端部に、充填剤を保持するために、シリカ製のフリットを作製した。得られたキャピラリーカラムに、平均粒径が5μmのオクタデシル化シリカ型充填剤Aqua C18(Phenomenex社製)を、高さが100mmとなるように充填し、分析用逆相キャピラリーカラムを得た。
【0043】
内径250μm、長さ150mmの未充填のキャピラリーカラム(Agilent社製)の出口側の端部に、充填剤を保持するために、シリカ製のフリットを作製した。得られたキャピラリーカラムに、平均粒径が5μmのオクタデシル化シリカ型充填剤Aqua C18(Phenomenex社製)を、高さが10mmとなるように充填し、トラップ用逆相キャピラリーカラムを得た。
【0044】
なお、分析用逆相キャピラリーカラム及びトラップ用逆相キャピラリーカラムを作製する際には、高圧窒素ガス及び加圧型充填容器を用いて、スラリー充填法により充填剤を充填した。
【0045】
年齢28〜41才の日本人女性(3名)由来の毛髪からタンパク質を抽出した。具体的には、まず、約5gの毛髪を精製水で軽くリンスした後、40℃の水中で8時間振とうした。次に、液から毛髪を取り除いて、凍結減圧乾燥機で濃縮した後、尿素を2M、アセトニトリルを2体積%、重炭酸アンモニウムを0.1M含む水溶液に溶解させた。さらに、液に対して40mMになるように、ヨードアセトアミドを添加した後、液に対して2質量%のトリプシンを添加して、37℃で16時間インキュベートし、タンパク質を加水分解させた。最後に、液に対して1体積%のギ酸を添加して反応を停止させた後、14000rpmで遠心分離して上清を得た。
【0046】
次に、1ステップのMudPIT型分析(一次元HPLC/ESI MS/MS)により、タンパク質を分析した。
【0047】
まず、ペプチドを約4μg含む上清を、加圧法によりトラップ用逆相キャピラリーカラムにロードした後、試料溶液の10倍以上の体積の移動相A(水、アセトニトリル及びギ酸の体積比95:5:0.1の混合液;pH〜2.6)を用いて、洗浄、脱塩した。このトラップ用逆相キャピラリーカラムを、貫通孔型ユニオン(Upchurch Scientific社製)を介して、分析用逆相キャピラリーカラムと接続した。次に、内径が100μmのキャピラリーを配管として用いたNanospace SI−2型HPLC装置(資生堂社製)に接続した。このとき、トラップ用逆相キャピラリーカラムは、分析用逆相キャピラリーカラムの上流側に配置した。
【0048】
移動相としては、移動相A、移動相B(水、アセトニトリル及びギ酸の体積比20:80:0.1の混合液)を用い、ペプチドの溶出法は、1ステップのグラジエント溶出法とした。
【0049】
ステップ1のグラジエントプロファイルは、5分間移動相Aを流し、次の5分間で移動相Bの比率を0体積%から15体積%まで増加させ、次の60分間で移動相Bの比率を45体積%まで増加させ、次の10分間で移動相Bの比率を75体積%まで増加させた後、この比率で5分間流すものである。
【0050】
なお、ポンプの送液の流速を250μL/分とし、抵抗型キャピラリーによるスプリットにより、カラムの流速を300〜400nL/分に調整した。
【0051】
また、ESI MS/MSを測定する際には、イオントラップ/静電型FTハイブリッド型質量分析計LTQ−Orbitrap(Thermo Fisher Scientific社製)を用いた。このとき、分析用逆相キャピラリーカラムから溶出されたペプチドは、スプリットすることなく、質量分析計に直接導入した。
【0052】
なお、高質量精度の分子量測定(<5ppm)と高速MS/MS測定を両立するパラレル検出モードとし、質量電荷比(m/z)が400〜1800のフルスキャン高質量精度MSスペクトル測定1回及びデータ依存型MS/MSスペクトル測定7回を、ステップ1を通じて繰り返した。また、マイクロスキャンは、MSスペクトル測定及びMS/MS測定ともに1とした。さらに、動的排除設定は、リピートカウント1、リピート期間0.50分、排除リストサイズ50、排除期間1.00分とした。
【0053】
得られたMS/MSスペクトルは、Bioworksソフトウェア(Thermo Fisher Scientific社製)上で動くSEQUESTアルゴリズムにより、非冗長ヒトデータベース(ftp://ftp.ncbi.nih.gov/blast/db/FASTA/nr.gz、2007/2/8版)に対して、検索した。なお、タンパク質の同定に必要なペプチド数は1以上とし、少なくとも片末端がトリプシンの基質特異性に適合するペプチドのみでタンパク質を同定した。また、これ以外のサーチ基準は、(1)データベース検索時のプリカーサー質量の許容幅を50ppmとすること、(2)サーチ時の[M+H]+の値をモノアイソトピック質量で計算すること、(3)フラグメントイオンには平均質量を使用すること、(4)システイン残基は、アルキル化が完全と仮定し+57マスユニットを加算した質量とし、メチオニン残基は、酸化・非酸化が混在していると仮定し、+16マスユニット(酸化)、+0マスユニット(非酸化)を加算した質量とすることとした。
【0054】
その結果、ケラチンHa1、Ha2、Ha3、Hb6が毛髪から流出していることがわかった。
【0055】
[実施例5]
太陽紫外光シミュレーター(ORIEL社)を用いて、年齢28〜41才の日本人女性由来の毛髪に、擬似太陽光を16時間照射した(積算946J/cm2)。得られた毛髪を用いた以外は、実施例4と同様にして、タンパク質を分析した。
【0056】
その結果、毛髪から流出しているケラチンは、実施例4と同様であった。一方、Lowry法に基づく比色法(DCプロテインアッセイキット(バイオ・ラッド ラボラトリーズ社製))により、毛髪から流出したタンパク質を定量した結果、実施例4よりも多いことがわかった。
【0057】
したがって、毛髪から流出するケラチンHa1、Ha2、Ha3、Hb6を定量することにより、毛髪のダメージを評価することができることがわかる。
【図面の簡単な説明】
【0058】
【図1】実施例1のHPLC装置を示す図である。
【図2】実施例1のベースピーククロマトグラムを示す図である。
【符号の説明】
【0059】
10 二相型キャピラリーカラム
11 トラップ用逆相キャピラリーカラム
12 SCX−WAX混合キャピラリーカラム
20 分析用逆相キャピラリーカラム
【特許請求の範囲】
【請求項1】
毛髪からタンパク質を抽出する工程と、
該抽出されたタンパク質を、ペプチド結合加水分解酵素を用いて加水分解する工程と、
該加水分解されたタンパク質を、キャピラリーLC/ESI MS/MSを用いて分析し、ケラチン及び/又はケラチン関連タンパク質を同定する工程を有することを特徴とする毛質の評価方法。
【請求項2】
前記毛髪のジスルフィド結合を溶媒中で還元することにより前記タンパク質を抽出することを特徴とする請求項1に記載の毛質の評価方法。
【請求項3】
前記毛髪を水中に浸漬することにより前記タンパク質を抽出することを特徴とする請求項1に記載の毛質の評価方法。
【請求項4】
前記ケラチンを同定する際に、ケラチンのトリプトファン残基の酸化の有無を分析することを特徴とする請求項1乃至3のいずれか一項に記載の毛質の評価方法。
【請求項5】
前記キャピラリーLCは、多次元のキャピラリーLCであることを特徴とする請求項1乃至4のいずれか一項に記載の毛質の評価方法。
【請求項1】
毛髪からタンパク質を抽出する工程と、
該抽出されたタンパク質を、ペプチド結合加水分解酵素を用いて加水分解する工程と、
該加水分解されたタンパク質を、キャピラリーLC/ESI MS/MSを用いて分析し、ケラチン及び/又はケラチン関連タンパク質を同定する工程を有することを特徴とする毛質の評価方法。
【請求項2】
前記毛髪のジスルフィド結合を溶媒中で還元することにより前記タンパク質を抽出することを特徴とする請求項1に記載の毛質の評価方法。
【請求項3】
前記毛髪を水中に浸漬することにより前記タンパク質を抽出することを特徴とする請求項1に記載の毛質の評価方法。
【請求項4】
前記ケラチンを同定する際に、ケラチンのトリプトファン残基の酸化の有無を分析することを特徴とする請求項1乃至3のいずれか一項に記載の毛質の評価方法。
【請求項5】
前記キャピラリーLCは、多次元のキャピラリーLCであることを特徴とする請求項1乃至4のいずれか一項に記載の毛質の評価方法。
【図1】


【図2】




【図2】


【公開番号】特開2010−112788(P2010−112788A)
【公開日】平成22年5月20日(2010.5.20)
【国際特許分類】
【出願番号】特願2008−284268(P2008−284268)
【出願日】平成20年11月5日(2008.11.5)
【出願人】(000001959)株式会社資生堂 (1,748)
【Fターム(参考)】
【公開日】平成22年5月20日(2010.5.20)
【国際特許分類】
【出願日】平成20年11月5日(2008.11.5)
【出願人】(000001959)株式会社資生堂 (1,748)
【Fターム(参考)】
[ Back to top ]

