水を濾過する膜
【課題】機能性アクアポリンを組み込んだ脂質二分子層を含む新規の水膜が開示される。
【解決手段】脂質二分子層は親水性または疎水性支持体層を含むサンドィッチ構造体内に配置される。さらに水精製装置/システムが開示され、機能性アクアポリンを含む膜を含む逆浸透濾過装置を含む。水精製方法および膜を調製する方法も開示される。さらに、本発明は、新規の、孔が形成された疎水性重合体膜を提供し、膜には導入されるアクアポリン以外の他の膜貫通タンパク質を有する脂質二分子層を含む。
【解決手段】脂質二分子層は親水性または疎水性支持体層を含むサンドィッチ構造体内に配置される。さらに水精製装置/システムが開示され、機能性アクアポリンを含む膜を含む逆浸透濾過装置を含む。水精製方法および膜を調製する方法も開示される。さらに、本発明は、新規の、孔が形成された疎水性重合体膜を提供し、膜には導入されるアクアポリン以外の他の膜貫通タンパク質を有する脂質二分子層を含む。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、純水および/またはグリセロールを濾過するのに適した機能化アクアポリンチャンネルまたは四量体を含む新規の膜、そのような膜を含む濾過装置/精製システム、ならびに超純水の製造および水性組成物からの過剰な水の抽出のために同様のものを使用する方法に関する。また、本発明は新規の疎水性重合体フィルムに関する。
【背景技術】
【0002】
人間および/または動物が摂取するのに適した精製水を得るために天然のおよび汚染された水源を浄化する様々な水処理システムおよび方法がこれまで開発されてきた。さらに、半導体工業および製薬工業における超純水に対する需要は高い。超純水の生産は水源に対してより特化したフィルタおよび化学的処理を必要とする。膜濾過、イオン交換体、サブミクロン粒子フィルタまたはナノフィルタ、紫外線およびオゾン処理など、多くの技術が使用される。生産された水は非常に純粋であり、塩、有機化合物、酸素などの溶解した気体、浮遊物、およびウイルスやバクテリアなどの微生物を含まないか、または非常に低濃度で含む。しかしながら、半導体産業における継続的な小型化などの要因のために、超純水に対する仕様はより厳しくなっている。
【0003】
従来、水は様々な利用可能な水処理装置を通じて精製または処理され、該装置は共有のおよび使用時の適用の双方に関して設計され、例えば以下の技術に基づく:有機物除去のための活性炭:紫外線消毒:硬度除去(水の軟水化)のためのイオン交換、および逆浸透(RO)またはナノ濾過(NF)などの膜の脱塩。しかしながら、ナノ濾過は水処理技術の分野では比較的新しい。NF膜は、水中に存在する硬度の原因となる二価のイオンを保持することによって、軟水を作り出す。NF膜は、ナトリウムや塩化物などの一価のイオンを高い割合で通過させ、一方で二価のイオンを高い割合で保持する。RO膜を通して水を輸送するのに必要な中程度から高い圧力を必要とする浸透圧を生成するのは一価のイオンである。したがって、水圧による駆動力が1価のイオンに由来する浸透圧の影響を克服する必要がないので、ナノフィルタ膜は、膜を通して水を輸送するのに非常に少ない圧力を要求する。概して言えば、居住用および商業用水処理用途で使用されるRO膜は、およそ98%までの溶解固形物をすべて除去し、一方でナノ濾過膜は二価イオン(硬度成分:カルシウムおよびマグネシウム)をおよそ90%まで、および一価イオン(ナトリウム塩化物)をおよそ50%まで除去する。
【0004】
膜要素(例えば:ROまたはNF)を使用する脱塩装置は、水が要素を出るときに、常に水の二つの流れを生成する:脱塩された生産水(膜を通過したもの)、および不用な塩水(膜表面を横切って流れたもの)。この不用の塩水流は、塩類および無機物の膜表面における蓄積および汚染を防ぐため、膜からそれらを洗い流すのに必要である。もしも供給水中の塩類および無機物が膜に連続的に付着する場合、溶解した物質は沈殿し、および固体膜を形成する可能性があり、膜表面を汚染する。加えて、コロイド状および粒子状の不純物も膜表面に付着して汚染の原因となる可能性がある。多くの水性不純物で、もしも膜が不可逆的に覆われ、または汚染される場合、それを洗浄することはできず、交換する必要がある。膜プロセスのこの特性は、特に、典型的には小型であり、可能な限り経済的に作られた水処理システムを使用する場所(POU)での排水の低減において重要な問題を提起する。
【0005】
イオン交換装置も「硬水」を軟化するのに使用される。イオン交換水軟化システムの問題は、いわゆる「軟水」を作るため、それが水の硬度成分(カルシウムおよびマグネシウムイオン)をナトリウムイオンと交換することによって除去することである。イオン交換媒体の再生が行なわれるとき、ナトリウム、塩化物、カルシウムおよびマグネシウムイオンが濃縮された水流は、下水道に入り、環境の廃棄物処理問題の原因となる。そのようなタイプの水精製システムの例は、米国特許第5741416号明細書、「water purification system having plural pairs of filters and an ozone contact chamber」に記述され、そのような水流中の有機不純物を酸化し、殆どのバクテリア、ウイルスおよび他の微生物を破壊するのに効果的である水精製システムを開示する。一価カチオンに選択性を有する透析膜を含むシステムも、国際公開第2004/099088号パンフレットに開示されている。
【0006】
このように、通常の家庭用の、同様に先端研究用、工業用および製薬用の双方において、化学的、生物学的および/または放射線学的不純物で汚染されたか、または汚染された可能性がある水を処理するための水精製システムに対する継続的な必要性が存在する。
【0007】
水の汚染または水の汚染のおそれは、例えば船上または僻村またはキャンプなど、非常に局所的な性質を持つことが多いので、実際の汚染場所または汚染の可能性がある場所で迅速かつ容易に配置され得る固定型または携帯型の水精製システムに対する要求が存在する。特に関連するのは、人間の摂取に適した処理された水を製造するために、実際に汚染されたまたは汚染されたおそれがある供給水、例えば海水、から有効に汚染物質を除去することができるシステムである。
【0008】
生体膜を通じてH2O分子を選択的に輸送する性能によって特徴付けられる水輸送タンパク質アクアポリンが発見され、これらのタンパク質を組み込んだ人工的な水膜(water membranes)の発明に興味が持たれた。米国特許出願第20040049230号明細書「Biomimetic membranes」は、水精製を可能にするため水輸送タンパク質がどのように膜に埋め込まれるか記述することを目的としている。記述された好ましい形態は、従来のフィルターディスクの形態を有する。そのようなディスクを作製するため、厚み5nmの合成三元ブロック共重合体およびタンパク質の単分子層はラングミュア−ブロジェットトラフを用いて25mmの市販の超濾過ディスク表面に累積される。ディスク上の単分子層はその後紫外光で架橋され重合体となって耐久性を高める。装置は、加圧した源水に膜を通過させるチャンバ内に取り付けることによって評価されてよい。しかしながら、合成三元ブロック共重合体をどのように選択すべきか指針はなく、埋め込まれたアクアポリンの実際の機能を支持する如何なるデータも存在しない。
【0009】
脂質二分子層ベシクル内部にアクアポリンタンパク質を送り込み、これらの膜を多孔質支持体上にキャストすることにより作られる水精製技術が示唆されている。James R.Swartzのホームページ:http://chemenq.stanford.edu/01About the Department/03Faculty/Swartz/swartz.html.を参照されたい。
【0010】
本発明は、高純度(例えば100%)で水を浄化することができる膜に組み込まれたアクアポリンを含む工業用水濾過膜および装置を開発することを主な目的とする。今日この課題を実行可能な既知の技術またはフィルタは存在しない。
【先行技術文献】
【特許文献】
【0011】
【特許文献1】米国特許第5741416号明細書
【特許文献2】国際公開第2004/099088号パンフレット
【特許文献3】米国特許出願第20040049230号明細書
【発明の概要】
【課題を解決するための手段】
【0012】
本発明は一つの態様において水を濾過する膜に関し、該膜は脂質ベシクル中に再構成され、ラングミュア−ブロジェット法などの方法を用いて支持体層に変換され水濾過膜を形成したアクアポリン水輸送タンパク質を使用する。
【0013】
本発明の水膜の利点として、脱塩用化学物質および可搬式脱塩フィルタの設備(水と塩を分離することができる「コーヒーフィルタ」のような装置)を必要とせずに、海水(地球の水の97−98%が海水である)を効率的に脱塩すること、半導体産業のために効率的に水を精製すること、家庭用水/飲料水を頑強に精製すること、および、例えば第3世界各国において、電気を使わずに水を精製すること、が挙げられる。
【0014】
したがって、本発明は一つの態様において、機能性アクアポリン水チャンネルを含む少なくとも一つの脂質二分子層によって分離された、少なくとも二つの透過性支持体層を有するサンドイッチ構造を含む水膜に関する。この方法において、透過性または多孔質の支持体は、水分子が支持体を通過して、支持体層の間に累積された少なくとも一つの脂質二分子層に到達することを可能にする。分散された機能性アクアポリンチャンネルを含む脂質二分子層は、反対側の多孔質支持体層へと水のみを濾過するか、またはアクアポリンがGLpFチャンネルである場合には、グリセロールも濾過し、結果的に純水で構成される濾過物を与える。好ましくは、この濾過された水は高度に精製された水である超純水(UPW)であり、イオン、粒子、有機物およびコロイドの含有量が低い。本発明の水膜は、水に対する選択性が最も高い既知の輸送チャンネルを用いた、新たな世代の逆浸透膜である。
【0015】
ここに関連して、「水膜」は、水の通過を可能にするが、他の殆どの材料または物質は同時に通過することが出来ない構造体を示す。本発明の好ましい水膜は、基本的に水に対してのみ(およびある場合にはグリセロールに対して)透過性である一方、溶質および他の溶媒は通過できない。
【0016】
第2の態様において、本発明は、一つの二分子層に構築されるとき、機能性アクアポリン水チャンネルを含む少なくとも二つの脂質単分子層を有するサンドイッチ構造体を含む水膜に関し、前記少なくとも二つの脂質単分子層が少なくとも一つの透過性支持体層によって分離される。この実施形態において、結果的に透過性支持体層は二つの脂質単分子層を分離し、該二つの脂質単分子層は支持体層が穿孔/刺し孔を含むとき、脂質二分子層を形成することが可能である。
【0017】
本発明のさらなる態様は、任意に安定化膜に封入された、本発明の水膜を含む水濾過装置に関し、精製される水溶性液体の入り口および精製された水の出口を有するハウジング内に設置される。
【0018】
本発明は、以下の段階を含む水膜を調製する方法にさらに関する。
a)アクアポリン水チャンネルを含む脂質ミクロベシクルであって、前記ミクロベシクルを少なくとも0.1%mol/mol含む脂質ミクロベシクルを得る段階と、
b)前記ベシクルを、親水性表面を有する本質的に平面状の、透過性の支持体上の平面状脂質二分子層内部に融合させ、アクアポリンタンパク質が二分子層領域の少なくとも1%を被覆する段階と、
c)任意に、段階b)を繰り返し、複数の融合二分子層を得る段階と、
d)親水性表面を有する、第2の本質的に平面状の、透過性支持体を、段階b)または段階c)で得られた脂質二分子層上に累積して、サンドイッチ構造体を得る段階と、
e)任意に、得られたサンドイッチ構造体を透過性安定化膜内に封入する段階。
【0019】
本発明は、以下の段階を含む水膜を調製する方法にも関する。
a)アクアポリン水チャンネルを含む脂質ミクロベシクルであって、前記ミクロベシクルを少なくとも0.1%mol/mol含む脂質ミクロベシクルを得る段階と、
b)前記ベシクルを、疎水性表面を有する本質的に平面状の、透過性の支持体周囲に構築された平面状脂質二分子層内部に融合させ、アクアポリンタンパク質が二分子層領域の少なくとも1%を被覆する段階と、
c)任意に、得られたサンドイッチ構造体を透過性安定化膜内に封入する段階。
【0020】
本発明は、逆浸透濾過膜として、機能性アクアポリン水チャンネルを含む水膜(例えば、本発明の水膜)を含む逆浸透水濾過装置にさらに関する。
【0021】
本発明は、尿、乳および汗/発汗などの体液から水を抽出および再生するための、機能性アクアポリン水チャンネルを含む水膜を備えた水濾過装置にさらに関する。
【0022】
加えて、本発明は、本発明の水膜を通じて天然または汚染された水源を濾過する結果得られる精製水を調製する方法に関する。前記精製水は、溶解した物質または粒子などの汚染物質を含まないことによって特徴付けられる。本発明は、機能性アクアポリンチャンネルを含む逆浸透膜を用いて水源を濾過することによって精製水を得る方法にさらに関する。
【0023】
さらに、本発明の異なる態様は、以下に詳細が記述される疎水性重合体膜に関する。
【0024】
最終的に、本発明の水膜の一般的設計は、他の目的に関する膜に適用可能であると考えられ、他の方法で本発明の水膜として設計された膜内にアクアポリンではなく他の膜貫通タンパク質が組み込まれる。そのような膜もまた本発明の一部であり、そのような膜には、ここで開示された膜と同じ膜貫通タンパク質の選択を除いた全ての態様、およびアクアポリンではなく他の膜貫通タンパク質を含む膜に必要な変更を加えて適用する膜に関するすべての開示が含まれる。
【0025】
膜貫通タンパク質は、本発明において膜に含有するのに適したアクアポリンとは異なり、例えばThe Transporter Classification Database (TCDB)に見出されるいかなる膜貫通タンパク質から選択されてよいが、これに制限されない。TCDBはhttp://www.tcdb.orgからアクセス可能である。
【0026】
TCDBにおいて本発明に含有される膜貫通タンパク質の例は以下のとおりである。
アエロリシン チャンネル形成トキシン
アグロバクテリアル ターゲット−ホスト 細胞−膜アニオンチャンネル
溶血素 チャンネル形成トキシン
アラメチシンシャンネル
アルギン酸塩排出ポーリン
アモエバポア
両親媒性ペプチドマストパラン
アミロイドb−タンパク質ペプチド
動物内向き整流性K+チャンネル
アネキシン
アポトーシス調節因子
ArpQホリン
AS−48
ATPゲートカチオンチャンネル
オートトランスポータ
バシラス サブチリス j29 ホリン
細菌タイプIII−ターゲットセルポア
殺菌剤透過性増大タンパク質(Bactericidal permeability−increasing protein)
バクテリオシン AS−48 環状ポリペプチド
バクテリオロドプシン
ベチコリン チャンネル
BIyA ホリン
ボツリヌス菌および破傷風菌毒素
ブルセラ−リゾビウム ポーリン
カンピロバクター空腸主外膜ポーリン
カチリシジンカチオンチャンネル
カチオンチャンネル形成熱ショックタンパク質70
セクロピン
チャンネル形成炭疽菌感染防御抗原
チャンネル形成セラミド
チャンネル形成コリシン
チャンネル形成コリシンV
チャンネル形成d−エンドトキシン殺虫性結晶タンパク質
チャンネル形成e−トキシン
チャンネル形成ロイコシジン細胞毒素
クラミジアポーリン
塩素チャンネル
葉緑体膜アニオンチャンネル形成体
葉緑体外膜溶質チャンネル
コレステロール結合、チオール活性化溶血毒素
クロストリジウム細胞毒素
補体タンパク質C9
錯体化ポリヒドロキシブチレート−Ca2+チャンネル
コリネバクテリアポーリン
Cphlホリン
C型ナトリウム排泄増加ペプチド
シアノバクテリアポーリン
シクロデキストリンポーリン
シトヘモリシン
細胞毒素アミリン
デフェンシン
デルマセプチン
ジフテリア毒素
ダイバージシンA
ミミズリセニン毒素
エンベロープウイルスE1チャンネル
上皮塩化物チャンネル
上皮Na+チャンネル
FadL外膜タンパク質
フソバクテリアル外膜ポーリン
ギャップ接合形成コネキシン
ギャップ接合形成イネキシン
ジェネラルバクテリアルポーリン
グルコース選択性OprBポーリン
神経伝達物質受容体のグルタミン酸塩ゲート型イオンチャンネル
gp91phox食細胞NADPH−オキシダーゼ−関連cyt b558 H+チャンネル
グラミシジンAチャンネル
H+−またはNa+−転座(translocating)細菌べん毛モータ
H+−またはNa+−転座(translocating)細菌MotABべん毛モータ/ExbBD外膜輸送
ヘリコバクター外膜ポーリン
HP1ホリン
インフルエンザウイルス マトリックス−2チャンネル
昆虫デフェンシン
細胞内塩化物チャンネル
j11ホリン
jAdhホリン
jU53ホリン
ラクタシンX
ラクチシン481
ラクトシンS
ラクトコッシン972
ラクトコッシンA
ラクトコッシンG
大コンダクタンス機械受容イオンチャンネル
ホリンS
神経伝達物質受容体のリガンドゲート型イオンチャンネル
LrgAホリン
LydAホリン
マガイニン
主要な内在性タンパク質(Major intrinsic protein)
メリッチン
金属イオン輸送体(チャンネル)
マイクロシンE492
ミトコンドリアおよび色素体ポーリン
ミコバクテリアポーリン
ニシン
非選択性カチオンチャンネル−1
非選択性カチオンチャンネル−2
ヌクレオシド特異性チャンネル形成外膜ポーリン
OmpA−OmpFポーリン
OmpGポーリン
細胞小器官塩化物チャンネル
外部バクテリア膜セクレチン
外膜補助タンパク質
外膜因子
外膜線毛アッシャーポーリン
外膜ポーリン
外膜受容体
P2ホリンTM
P21ホリンS
ペディオシン
ホスフォレマン
ピロスリン
植物デフェンシン
植物プラスモデスム
植物チオニン
プランタリシンEF
プランタリシンJK
16kDaのプラスチドアウター−エンベロープポーリン
21kDaのプラスチドアウター−エンベロープポーリン
24kDaのプラスチドアウター−エンベロープポーリン
ポリシスチンカチオンチャンネル
ポリグルタミンイオンチャンネル
孔形成エキナトキシン
孔形成ヘモリシンE
孔形成RTXトキシン
PRD1ホリンM
プリオンペプチドフラグメント
シュードモナスシリンゲHrpZターゲット−ホスト細胞膜
シュードモナスOprPポーリン
ラフィノースポーリン
ロドバクターPorCaポーリン
リアノジン−イノシトール−1,4,5−三リン酸受容体Ca2+チャンネル
サポニンチャンネル
志賀毒素Bチェーン
短鎖アミドおよび尿素ポーリン
小コンダクタンス機械受容イオンチャンネル
糖ポーリン
シリンゴマイシンチャンネル
シリンゴペプチンチャンネル
T4ホリン
T4免疫ホリン
T7ホリン
タチプレシン
トルアシンチャンネル
外膜受容体(OMR)−medi−のエナジャイザーのTonB−ExbB−ExbD/TolA−TolQ−TolR
トランジエントレセプターポテンシャルCa2+チャンネル
トライパタイトヘモリシンBL
ツーパートナー分泌ポーリン
タイプB インフルエンザウイルスNBチャンネル
尿素輸送体(チャンネル)
尿素/アミドチャンネル
空胞化シトトキシン
ビブリオキトポーリン/ナイセリアポーリン
電位開口型イオンチャンネルスーパーファミリー
鞭虫スチコソームポーリン
酵母キラートキシンK1
酵母伸展活性化カチオン選択性Ca2+チャンネル
【0027】
本発明のさらなる態様は、水溶性の物質または溶液から、例えば所望の溶質の濃度を増加するため、過剰な水を抽出する水膜の使用を含む。
【図面の簡単な説明】
【0028】
【図1】本発明の一実施形態による水膜の様々な成分を示す図であり、本発明による水膜のサンドイッチ構造を有する例における組み込まれたアクアポリン分子を有する支持された脂質二分子層を有する。
【図2】本発明の一実施形態による水膜の様々な成分を示す図であり、本発明による水膜のサンドイッチ構造を有する例における組み込まれたアクアポリン分子を有する支持された脂質二分子層を有し、アクアポリンチャンネルを含む脂質二分子層は透過性または多孔質の支持体の孔内部にある。
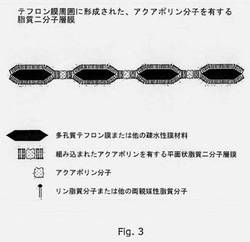
【図3】アクアポリンを含むバイオミメティック膜の設計を記述する図である。図は本発明の他の実施形態による膜の様々な成分を示し、多孔質テフロン(登録商標)膜周囲にはさまれた組み込まれたアクアポリン分子を有する支持された脂質二分子層を有する。
【図4】アクアポリンを含むバイオミメティック膜の設計を記述する図である。図は本発明の他の実施形態による膜の様々な成分を示し、多孔質テフロン(登録商標)膜周囲にはさまれた組み込まれたアクアポリン分子を有し、さらにサンドイッチ構造体に封入された支持された脂質二分子層を有する。
【図5】組み込まれたアクアポリン分子を有する封入されたサンドイッチ構造の脂質二分子層を含む水膜の様々な成分を示す図である。
【図6】本発明の他の実施形態による入口および出口を有するフィルターハウジング内に設置されたときの、本発明の封入された水膜の図である。
【図7】本発明のさらに他の実施形態による水精製システムの様々な成分を示す図である。このシステムは、未精製水の入口要素、二媒体濾過区画、水軟化区画、任意に重亜硫酸塩および苛性添加物、RO1およびR2フィルタを通る追加の精製のためのループを有するポンプに接続された逆浸透性フィルタ1および2(RO1、RO2)、UV消毒区画を有するドレインおよび貯蔵のためのタンクへの出口を備える。
【図8】タンパク質のアクアポリンおよびアクアグリセロポリン群の様々な物質を説明する。
【図9】マイカ上に形成された膜の原子間力顕微鏡像である。膜は例1において記述される手順により調製された。
【図10】本発明のらせん状に曲げられた水膜を備えたフィルタ装置を示す。
【図11】図10の線II−IIに沿った断面図である。
【図12】空気−水界面からの脂質のラングミュア−ブロジェット累積による支持された二分子層の調製を説明する図である。
【図13】ベシクル融合手順を説明する図である。ベシクルは基板に吸着し、支持されて二分子層を形成するよう破壊される。
【図14】スピン−コーティングによる支持された脂質二分子層を説明する図である。
【発明を実施するための形態】
【0029】
生きている細胞は脂質二分子層膜によって囲まれており、細胞を他の細胞および細胞外の媒体から分離する。脂質二分子層膜は基本的に水、イオン、および他の極性分子を透過しない。しかし、多くの例において、そのような物は、しばしば細胞外または細胞内信号に応答して、膜を通って迅速に、および選択的に輸送される必要がある。水輸送という作業は、アクアポリン水チャンネルタンパク質によって成される(Prestonら、1992)。アクアポリンはあらゆる形態において生命にとって非常に重要であり、バクテリアから植物、人間に至るまで、全ての有機体において見出される。アクアポリンは、迅速で高度に選択的な水輸送を促進して、結果的に細胞膜を横切る静水圧差および/または浸透圧差によって細胞がその体積および内部浸透圧を調節することを可能にする。人間におけるアクアポリンの生理学上の重要性は、おそらく腎臓において最も顕著であり、そこでは〜150−200リットルの水が毎日初期の尿から再吸収される、すなわち、水が迅速に体液から回収されなくてはならないとき、アクアポリンに促進された水輸送が起こる。腎臓においては、これはAQP1およびAQP2で示される二つのアクアポリン(11の異なるアクアポリンが人間内部において知られている)によって主に可能になる。植物においても、アクアポリンは根における水吸収に関して、および植物全体の水収支の保持に関して重要である(Agreら、1998、Borgniaら、1999)。様々な有機体および組織における水輸送の研究は、アクアポリンが非常に高い水透過率、一つのチャンネルにおいて1秒あたり〜109のH2O分子(Agre etら、1998,Borgniaら、1999)、を保持すると同時に、狭い孔を有しており、あらゆる大きな分子、イオン(塩)、およびプロトン(H3O+)、水酸化物イオン(OH−)の流れさえも防ぐことを示した。AQP1の最初の高解像度3D構造および関連するグリセロール伝導バクテリアチャンネルタンパク質アクアグリセロポリンGlpFが報告された2000および2001までに(Fuら、2000;Murataら、2000;Renら、2001;Suiら、2001)、水選択性の原因についてはほとんど分かっていなかった。
【0030】
しかしながら、実験的な構造に基づいて詳細なコンピュータモデルが提案され、高い透過率および厳密な水の選択性だけではなく、アクアポリンがプロトンの漏れも防ぐ性能も説明した(de GrootおよびGrubmuller,2001;Tajkhorshidら、2002,Jensenら、2003,Zhuら、2003,de Grootら、2003,BurykinおよびWarshel 2003,Ilanら、2004,Chakrabartiら、2004)。本質的に、アクアポリンチャンネルの構造は、チャンネル内部の静電的調整があらゆる帯電した化学種に対するアクアポリンの選択性を制御する、すなわちプロトンおよび水酸化物イオンと同様にあらゆるイオン(塩)の輸送が行なわれない一方で、水分子が一列のみ通過することを可能にする(de GrootおよびGrubmuller,2001;Tajkhorshidら、2002,Jensenら、2003,Zhuら、2003,de Grootら、2003,BurykinおよびWarshel 2003,Ilanら、2004,Chakrabartiら、2004)。簡単にいえば、これは水分子のみがアクアポリン水孔を通過することを示しているにほかならない。
【0031】
アクアポリンチャンネルの各単位が〜109H2O分子/秒、すなわち、〜4×109分子/チャンネル/秒で輸送を行なう。従って、アクアポリン1gが非常に高い圧力下で1秒あたり〜720リットルの水を輸送することができる。機能性アクアポリンチャンネルを通って濾過された、結果として得られた水は〜100%精製水であり、イオン、粒子、有機物およびコロイドを含有せず、例えば〜100%H2Oから構成される。
【0032】
ここで使用される膜タンパク質のアクアポリンファミリーは、水分子に加えてグリセロールを通すGLpFタンパク質も含む。好ましいアクアポリンはTIP、PIPまたはNIPアクアポリンなどの植物由来のものであり、例えば図8に示される。
【0033】
以下に開示される本発明の膜は水のみを通過させ、その結果逆浸透を通じて水の精製、脱塩および分子濃縮を容易にする。アクアポリンは、水溶液からのバクテリア、ウイルス、無機物、タンパク質、DNA、塩、洗浄剤、溶解した気体、さらにはプロトンを含む全ての不純物の経路を排除することで知られているが、それらの構造のためアクアポリン分子は水を輸送することができる。関連するアクアグリセロポリン(GLpF)のファミリーは、それに加えてグリセロールを輸送することができる。全てのアクアポリンはタンパク質を膜内に固定する膜貫通アルファ−ヘリカルドメイン、およびタンパク質の中央において頂点から頂点に一体となって一種の砂時計型の形態を有する、二つの高度に保存されたNPA(Asn−Pro−Ala)ループを含む。水の動きは対照的であり、どちらの方向へも進むことができることが示された。このプロセスはエネルギーを消費しないので、この事実は重要である。静水圧または浸透圧のために、水は膜を通って特定の方向へと動く。
【0034】
従って、精製水を飲用に適さない水源から得ることができ、またはもしも源水が興味の対象である化学物質を含む場合には、水は選択的に除去されることができ、投入チャンバ内に高濃度の所望の化学物質を残す。しかし、重要なことに、水に対する限定的な選択性以外の理由でもアクアポリンは本発明に適する。このタンパク質ファミリーの多くのものが、機能を失うことなく、汚染された源水の厳しい条件に耐えることができる。アクアポリンは、酸、電圧、洗浄剤、および熱に対する露出による変成または分解に耐性を有する。従って、本発明の膜は、他の膜を汚すまたは破壊する可能性がある材料で汚染された源水を精製するのに使用することができ、一貫して高温にさらされる領域で使用することができる。
【0035】
アクアポリンは突然変異が起き易い。タンパク質は、その最終形状および機能に影響する遺伝子配列に従って宿主細菌内で特異的に発現する可能性があるので、技術者はタンパク質の特性を変えるためにその遺伝子コードを容易に変更することができる。従って、タンパク質は、タンパク質の元々の機能と異なっていてよい所望の用途を満たすように設計されてよい。例えば、システインの水チャンネルの中心近傍の特定のアミノ酸残基を単純に変更することによって、製造されるアクアポリンは溶液中のあらゆる遊離水銀を結合し、妨害に起因して水の輸送が停止するだろう。その結果、膜デバイスにおいて使用されるこれらの突然変異タンパク質は、毒性物質の濃度が非常に高くなったときに単純に流れを停止することによって、水サンプル中の水銀汚染を検出することができる。
【0036】
最後に、新規のタンパク質ベース膜は製造コストが非常に低い。ウシ赤血球から得られたAQP1を有する細胞膜断片を含む脂質ミクロベシクルは、廉価なアクアポリン源である。
【0037】
他の方法では、アクアポリンは人工的に作り出された大腸菌の菌株からミリグラムの量で得られてよい。それを製造している培養液1リットルあたり約2.5mgの純粋なタンパク質が得られてよい。米国出願公開第20040049230号明細書を参照されたい。
【0038】
従って、我々は汚れた、塩を含む、または他の方法で汚染された水からの、完全に純粋な水の高効率な製造を実現するためここに生物学的成分を使用する方法および装置を開示する。本発明は、水輸送生物学的タンパク質と外部装置との統合を実行し、水精製装置の大規模な製造を可能にする製造経路に対する方向性を示す。
【0039】
本発明の第1の態様
本発明の上述の第1の態様において、水膜は機能性アクアポリン水チャンネルを含む少なくとも一つの脂質二分子層によって分離された少なくとも二つの透過性支持体層を有するサンドイッチ構造体を含む。
【0040】
本発明の第1の態様の水膜は、結果的に、表1に記載された脂質を含む膜など、両親媒性の脂質膜からなる。その結果、脂質二分子層は本質的にリン脂質、ホスホグリセリド、スフィンゴ脂質およびカルジオリピンからなる群、同様にそれらの混合物から選択される両親媒性の脂質からなり、例えば1,2−ジパルミトイル−sn−ホスファチジルコリン(DPPC)、またはリン脂質の混合物などのリン脂質である。
【0041】
他の方法では、脂質二分子層は本質的に重合可能な脂質からなるか、またはそれらを含んでよい(表1を参照)。
【0042】
このように、本発明の水膜は、多孔質支持体の上に再構成されたアクアポリン水チャンネルを含む。本発明による水膜の調製に関して親水性表面を有する有用な支持体材料は、好ましくは、マスコバイトなどのマイカ、マイカテープ、ポリスルホン、AlO2、および親水表面を有する重合体材料、例えばセルロースから選択される。支持体材料は本質的に平面状であるが、これは支持体が平面であることが好ましいことを意味するのであって、例えばらせん状に巻いたフィルタが製造されるとき必要とされるように、支持体の湾曲も許容される。この場合、例えばセルロース膜など、支持体材料が柔軟であることが好ましい。
【0043】
多孔質支持体は、好ましくはマイカなど、親水性表面を持つ本質的に平面な構造を有する材料であって、例えばエッチングによってミクロ孔またはナノ孔が形成された材料を含んでよい。従って、第1の態様の実施形態において、透過性支持体層は本質的に平面の、親水性層を含み、該親水性層はマイカまたはマイカテープを含み、層の厚みはmmからμmのスケールであって、およそ50nm未満(典型的には10−40nmの範囲)の直径を有するナノ孔が形成されている(例えばトラックエッチ技術などのエッチングによって)。マイカは、好ましくはマスコバイトである。
【0044】
透過性支持体層も、シリコーン膜、ポリスルホン、AlO2、および親水性表面を有するセルロースなどの重合体からなる群から選択される膜など、親水化膜表面を含んでよく、およそ50nm未満(典型的には10−40nmの範囲)の直径を有するナノ孔が形成されている。
【0045】
アクアポリンチャンネルを含む脂質膜は、生物学的な細胞膜の天然の構成に類似した二分子層であってよく、または脂質膜は融合した累積された脂質ベシクルの複数の二分子層からなるものであってよい。脂質は、例えばリン脂質(またはホスホグリセリド)、スフィンゴ脂質およびカルジオリピンなど、好ましくは両親媒性である。多孔質基板上に脂質層を累積するとき、アクアポリンチャンネルは好ましくは支持体材料中の予め存在する孔に隣接してまたは孔内に累積されてよい。
【0046】
本発明の好ましい実施形態において使用される透過性または多孔質支持体は、R.M.Webber,J.L.Anderson,M.S.John,Macromolecules 23(1990),1026−1034に従って調製されることが好ましく、そこでは以下のように記述されている。
【0047】
「膜はマスコバイトマイカの薄いシート、厚さ約7nm、からトラックエッチ技術によって作成された。トラックエッチされた膜で、孔はフッ化水素酸溶液でカリホルニウム252源からの視準された核分裂片によって生成されるトラックをエッチングすることによって形成される。孔の数(n)は、核分裂源に対する膜の露出時間によって制御され、一方で孔半径はエッチング時間、温度、およびフッ化水素酸水溶液バスの濃度によって決定される。孔のサイズは均一であり、膜表面に対して垂直である。孔サイズの分布が大きいことは、より大きな孔を通ってバイアスされた流れに起因して、重合体層の流体力学的厚みに関する曖昧な結果につながるため、孔サイズの均一度はこれらの膜の重要な特徴である。膜の照射部分に関する孔の断面積分率はおよそ1%であった。従って、二項式孔サイズ分布によってモデル化されたとき、単一孔の全数は96%よりも大きかった。孔は膜面に対して垂直なので、孔の長さ(1)は膜の厚みに等しかった。厚みは既知の膜寸法および重量から決定された。」
【0048】
孔の最終的な数および分布を得ることが好ましく、それは脂質層中のアクアポリンチャンネルの数および分布におよそ等しい。
【0049】
本発明の第2の態様
例えばテフロン(登録商標)フィルムなど、疎水性表面を有する多孔質支持体膜の周囲に構築された平面脂質二分子層中のアクアポリン水チャンネルを再構成することも可能であり、脂質単分子層が多孔質支持体膜の各側に構築される。多孔質支持体膜の孔中で脂質二分子層が構築され、アクアポリン水チャンネルが再構成されてよい。
【0050】
本発明の第2の態様は、少なくとも二つの脂質単分子層を有するサンドイッチ構造体を含む水膜によって構成され、一つの二分子層に構築されるとき、機能性アクアポリン水チャンネルを含み、前記少なくとも二つの脂質単分子層が少なくとも一つの透過性支持体層によって分離される。典型的には、支持体層は疎水性の孔が形成された材料を含み、該材料は脂質単分子層と接触表面を形成し、脂質二分子層は疎水性の孔が形成された材料の穿孔内に形成される。
【0051】
疎水性材料は疎水性の程度が脱イオン水と疎水性材料との間の接触角にして少なくとも100°に相当することが好ましく、接触角の測定は20℃および大気圧で実施されるが、疎水性の程度は高いことが好ましく、例えば接触角が少なくとも105°、110°、120°および120°に相当する。好ましくは、疎水性材料はパラフィルムまたはテフロン(登録商標)である。
【0052】
疎水性材料は典型的には平面であり(しかし、柔軟であって、その結果曲がってもよい)、孔は典型的には均一に分布され、疎水性材料の二つの表面間の中間の平面内で実質的に全てが実質的に同じ幾何学的形状を有する。疎水性材料中の孔の形成に関する詳細は以下に与えられる。
【0053】
「中間の平面」は、平面疎水性材料の二つの表面のどちらに対する垂直距離も同じである点からなる平面として定義される。
【0054】
疎水性材料の孔サイズは、両親媒性脂質の安定な二分子層が孔の中で形成され得ることを確実にするのみであり、従ってそれらはnm、μmまたはmmの範囲のサイズを有してよい。
【0055】
疎水性材料は、好ましくは材料において孔が形成された面積と孔が形成されていない面積との比が最大になるように孔を形成される。なぜなら、これによって水輸送をもたらすアクアポリンを有する脂質二分子層の面積を最大にするためである。孔によって構成されたパターンは、各孔間の距離のように結果的に重要である。最適なパターンは、パターン内部の各孔の間の「壁厚み」を最小にして孔を六角形に配列するものである。しかしながら、正方形のようなパターンであっても十分であると判明するかもしれない。
【0056】
したがって、本発明の第2の態様の水膜は、表1に記載される脂質を含む膜など、両親媒性脂質膜も含む。結果的に、脂質二分子層は本質的にリン脂質、ホスホグリセリド、スフィンゴ脂質およびカルジオリピンからなる群、同様にそれらの混合物から選択される両親媒性脂質からなり、例えば1,2−ジパルミトイル−sn−ホスファチジルコリン(DPPC)、またはリン脂質の混合物などのリン脂質である。第1の態様との相違は、疎水性支持体に孔が形成される領域において主に膜が二分子層を構成するのみであることであり、それに対して脂質はそれらの疎水性末端を疎水性支持体に向け、親水性末端を水性の環境に向けて組織化される。
【0057】
二分子層の調製
膜材料の固有の透過性は安定でなくてはならない。透過性の低い材料は好ましいが、しかしながら、同時に頑強であって、かつアクアポリンを組み込むことができ全体が安定で密度の高い2D濾過配列を構成しなくてはならない。支持された脂質二分子層を調製するために様々な手法が一般的に使用される。簡単な技術は、ラングミュア−ブロジェット法である。適切な有機溶媒中の脂質溶液はラングミュアトラフ内の水性副層上に展開され、有機溶媒は蒸発される。一対の可動性隔壁が脂質膜を所望の表面圧力まで横方向に圧縮するのに使用される。その後、基板は膜を通って垂直に通過し、それによって一分子の厚さの脂質層(単分子層)を基板上部に移動する(図12参照)。第2の単分子層は、基板をもう一度フィルムを通して通過させることによって移動されてよい。全部で三つの単分子層が垂直(ラングミュア−ブロジェット)累積法によって移動されるが、第4の膜は最後の層に関して水平累積、いわゆるラングミュア−シェーファー(LS)を用いて移動されてよい。この方法は様々な脂質で使用されてよい。天然の生物学的膜はしばしば非対称である。LBおよびLSのどちらも非対称二分子層の調製の可能性を提供する。これは、累積の間に副層上の脂質膜を変更することによって行なわれる。
【0058】
支持体二分子層を調製する他の方法が、ベシクル融合法である(BrianおよびMcConnell 1984)。小さな単層ベシクル(SUV)の溶液が親水化シリコンまたは新たに切断されたマイカの切片表面上に塗布される。このサンプルが低温(4℃)に置かれるとき、ベシクルは表面と融合して連続的な二分子層を形成する(図13)。いかなる理論にも束縛されることなく、ベシクルは最初基板表面に吸着し、その後融合して平坦でパンケーキのような構造体を形成し、最終的に分裂および散開して結果的に表面上に単一の二分子層をもたらすと仮定されている(ReviakineおよびBrisson 2000)。基板との融合の後、基板と直接接触するベシクルの一部分のみが支持された二分子層になることも示された(Leonenkoら、2000)。このメカニズムで、最も曲率の高い末端においてベシクルが分裂し、二分子層の上部分は基板表面へと移動して、形成され支持された二分子層のサイズを増加する可能性がある。溶液を基板上部に塗布後数分で二分子層が形成されることが報告されたが(Tokumasuら、2003)、この短い放置時間は不完全な二分子層をもたらす可能性がある。数時間または終夜放置も報告されている(Reimhultら、2003、Riniaら、2000)。
【0059】
支持された二分子層を調製するために使用することができる第3の技術はスピンコーティングである(Reimhultら、2003、SimonsenおよびBagatolli 2004)。スピンコーティングにおいて、脂質は適切な溶媒に溶解され、液滴は基板上に配置され、その後溶媒が蒸発して脂質コーティングが生成される間回転される。脂質溶液の濃度に依存して、スピンコートされた膜は一つ以上の脂質二分子層からなる。しかしながら、水和すると複数層は不安定な様子を示し、通常は表面上にただ一つの支持された二分子層が残る(図14)。この手順は容易かつ迅速であり、中間体(DPPC)および非常に高い転移温度(セラミド)を有する脂質と同様に、低融点脂質(POPC)で実行されている。有用な脂質は、例えばリン脂質および両親媒性脂質を含む。
【0060】
タンパク質またはペプチドの支持された二分子層中にさらにペプチドおよびタンパク質を組み込みたいとき、ベシクル融合法は最も応用性が高い。言及された他の手順は有機溶媒中におけるタンパク質またはペプチドの可溶化を含むためである。多くの膜タンパク質は、特にそれらが膜のどちらかの側において水溶液に露出される大きなドメインを含む場合、有機溶媒中で変性する可能性がある。従って、ペプチドまたはタンパク質をベシクル中に挿入することが好ましい。多くのペプチドおよびアクアポリンなどのタンパク質は、ベシクルの形成より前に有機溶媒中で脂質と共可溶化されることができ、ペプチドを含むベシクルはその後基板に塗布される。これは数多くのペプチド、例えばWALP(Riniaら、2000)、グラミシジン(Mouら、1996)、クラバニンA(van Kanら、2003)、およびアミロイドβタンパク質(Linら、2001)で実行されてきた。アクアポリンなどの膜タンパク質は、好ましくは他の手法によってベシクル内部に挿入される。これはここに組み込まれる2005年2月MEMPHYS−center for biomembrane physics,Physics Department,University of Southern Denmark and Dansih Polymer Centre, Riso National Laboratory, DenmarkのDanielle Kellerによる論文「Supported bilayers as models of biological membranes」イントロダクションから第4章の41−45頁においてモデルタンパク質としてシトクロムcオキシダーゼに関して記述されるように、膜タンパク質のベシクル内部への再構成のための戦略を用いて実行されてよい。
【0061】
別個の2D配列の複数層の積層体は可能であり、望ましいと考えられる。積層された配列の最終寸法は全体の頑強さおよび選択された膜材料/膜組成に固有の透過性に依存する。積層は、タンパク質が単一に、おそらく支持された脂質二分子層に自明に埋め込まれたシステムから逸脱するかもしれない。その後支持された二分子層上で一連のベシクルが崩壊する事象は、前もって必要とされるベシクルが適切なアクアポリンと再構成されるならば、複数層濾過単位装置を提供する可能性がある。積層単位装置を安定させる膜または安定させる重合体マトリックス内部へ組み込むこと、その後これらの個々の単位を綴じることは、最終的に自己組織化プロセスを通じて、全体の濾過メッシュを与えるだろう。
【0062】
本発明の態様の共通の特徴
本発明の様々な態様に関する多くの特徴がある。
【0063】
本発明による水膜の調製に関する有用なアクアポリンは、AQP1、TIP、PIP、NIP、図8を参照、および混合物およびそれらのハイブリッドである。例えば人に害を及ぼす病原性ウイルスおよびプリオンなど、不純物を含有するリスクが大幅に低減されるので、植物由来のアクアポリンは特に望ましい。加えて、植物アクアポリンは植物の自然発生物であり、過剰発現される可能性があり、植物中で生成される。
【0064】
従って、アクアポリン水チャンネルは、好ましくは、例えばGLPAチャンネル、GLPB1チャンネル、GLPB2チャンネル、GLPB3チャンネル、およびGLPY2チャンネルなどのアクアグリセロポリン(GLpF)、およびそれらの混合物およびそれらのハイブリッドからなる群から選択される。
【0065】
本発明の水膜は、好ましくは、剛直または柔軟であってよい安定化させる透過性のまたは多孔質の膜内に囲まれ、該膜は精製される水性液体から粗い粒子状物質を取り除く前置フィルタと同様に水膜を保護するはたらきをしてよい。他の方法では、またはそれに加えて、本発明の水膜はフィルターディスク上に累積されて、水フィルタを形成してよい。
【0066】
本発明の水膜を囲うため任意に使用される安定化する膜に有用な材料は、相対的に小さな孔サイズを有するミクロ多孔質シリコーン膜であり、室温近傍または約50℃以下で固化する。
【0067】
アクアポリンの再構成および脂質二分子層の形成に有用な脂質は、POPC、DPPC、セラミド、表1参照、およびそれらの混合物である。
【0068】
表1は本発明の水膜において使用される脂質二分子層の形成に有用な脂質のリストである。
【0069】
ホスファチジルコリン:
1,2−ジミリストイルホスファチジルコリン(DMPC)
1,2−ジパルミトイルホスファチジルコリン(DPPC)
1,2−ジステアロイルホスファチジルコリン(DSPC)
1,2−ジオレオイルホスファチジルコリン(DOPC)
1,2−ジミリストレオイルホスファチジルコリン
1,2−ジパルミトレオイルホスファチジルコリン
1,2−ジペトロセリノイルホスファチジルコリン
1,2−ジエライドイルホスファチジルコリン
1,2−ジリノレオイルホスファチジルコリン
1,2−ジリノレノイルホスファチジルコリン
1,2−ジエイコセノイルホスファチジルコリン
1,2−ジアラチドノイルホスファチジルコリン
1,2−ジエルコイルホスファチジルコリン
1,2−デナボノイルホスファチジルコリン(1,2−dnervonoylphosphatidylcholine)
1−パルミトイル−2−オレオイルホスファチジルコリン(POPC)
1−パルミトイル−2−リノレオイルホスファチジルコリン
1−パルミトイル−2−アラキドノイルホスファチジルコリン
1−パルミトイル−2−ドコサヘキサノイルホスファチジルコリン
1−ステアロイル−2−オレオイルホスファチジルコリン(SOPC)
1−ステアロイル−2−リノレオイルホスファチジルコリン
1−ステアロイル−2−アラキドノイルホスファチジルコリン
1−ステアロイル−2−ドコサヘキサノイルホスファチジルコリン
1−オレオイル−2−パルミトイルホスファチジルコリン
1−オレオイル−2−パルミトイルホスファチジルコリン
1−オレオイル−2−ステアロイルホスファチジルコリン
1,2−ジドコサヘキサノイルホスファチジルコリン
【0070】
ホスファチジルエタノールアミン:
1,2−ジミリストイルホスファチジルエタノールアミン(DMPE)
1,2−ジパルミトイルホスファチジルエタノールアミン(DPPE)
1,2−ジステアロイルホスファチジルエタノールアミン(DSPE)
1,2−ジオレオイルホスファチジルエタノールアミン(DOPE)
1−パルミトイル−2−オレオイルホスファチジルエタノールアミン(POPE)
1−パルミトイル−2−リノレオイルホスファチジルエタノールアミン
1−パルミトイル−2−アラキドノイルホスファチジルエタノールアミン
1−パルミトイル−2−ドコサヘキサノイルホスファチジルエタノールアミン
1−ステアロイル−2−オレオイルホスファチジルエタノールアミン(SOPE)
1−ステアロイル−2−リノレオイルホスファチジルエタノールアミン
1−ステアロイル−2−アラキドノイルホスファチジルエタノールアミン
1−ステアロイル−2−ドコサヘキサノイルホスファチジルエタノールアミン
1,2−ジエライドイルホスファチジルエタノールアミン
1,2−ジリノレオイルホスファチジルエタノールアミン
1,2−ジリノレノイルホスファチジルエタノールアミン
1,2−ジアラキドノイルホスファチジルエタノールアミン
1,2−ジドコサヘキサノイルホスファチジルエタノールアミン
1,2−ジパルミトレオイルホスファチジルエタノールアミン
【0071】
ホスファチジルグリセロール:
1,2−ジミリストイルホスファチジルグリセロール(DMPG)
1,2−ジパルミトイルホスファチジルグリセロール(DPPG)
1,2−ジステアロイルホスファチジルグリセロール(DSPG)
1,2−ジオレオイルホスファチジルグリセロール(DOPG)
1−パルミトイル−2−オレオイルホスファチジルグリセロール
1−パルミトイル−2−リノレオイルホスファチジルグリセロール
1−パルミトイル−2−アラキドノイルホスファチジルグリセロール
1−パルミトイル−2−ドコサヘキサノイルホスファチジルグリセロール
1−ステアロイル−2−オレオイルホスファチジルグリセロール(SOPG)
1−ステアロイル−2−リノレオイルホスファチジルグリセロール
1−ステアロイル−2−アラキドノイルホスファチジルグリセロール
1−ステアロイル−2−ドコサヘキサノイルホスファチジルグリセロール
【0072】
ホスファチジルセリン:
1−パルミトイル−2−オレオイルホスファチジルセリン(POPS)
1−パルミトイル−2−リノレオイルホスファチジルセリン
1−パルミトイル−2−アラキドノイルホスファチジルセリン
1−パルミトイル−2−ドコサヘキサノイルホスファチジルセリン
1−ステアロイル−2−オレオイルホスファチジルセリン(SOPS)
1−ステアロイル−2−リノレオイルホスファチジルセリン
1−ステアロイル−2−アラキドノイルホスファチジルセリン
1−ステアロイル−2−ドコサヘキサノイルホスファチジルセリン
1,2−ジミリストイルホスファチジルセリン(DMPS)
1,2−ジパルミトイルホスファチジルセリン(DPPS)
1,2−ジステアロイルホスファチジルセリン(DSPS)
1,2−ジオレオイルホスファチジルセリン(DOPS)
1,2−ジドコサヘキサノイルホスファチジルセリン
1,2−ジエルコイルホスファチジルセリン
【0073】
特別な脂質:
カルジオリピン
二極性脂質
天然脂質抽出物:
卵黄ホスファチジルコリン
ウシ心臓ホスファチジルコリン
脳ホスファチジルコリン
ウシ肝臓ホスファチジルコリン
大豆ホスファチジルコリン
大腸菌ホスファチジルエタノールアミン
ウシ心臓ホスファチジルエタノールアミン
脳ホスファチジルエタノールアミン
ウシ肝臓ホスファチジルエタノールアミン
卵ホスファチジルエタノールアミン
ウシ肝臓ホスファチジルイノシトール
大豆ホスファチジルイノシトール
脳ホスファチジルセリン
大豆ホスファチジルセリン
【0074】
重合可能脂質:
1,2−ジ−10,12−トリコサジノイル−sn−グリセロ−3−ホスホコリン(DTPC)
1,2−ジ−10,12−トリコサジノイル−sn−グリセロ−3−ホスホエタノールアミン(DTPE)
1−パルミトイル−2,10,12−トリコサジノイル−sn−グリセロ−3−ホスホエタノールアミン(PTPE)
DC8,9PC[l,2−ビス(10,12−トリコサジノイル)−sn−グリセロ−3−ホスホコリン]
diPhyPC[l,2−ジフィタノイル−sn−グリセロ−3−ホスホコリン]
【0075】
水処理システムおよび水濾過装置
本発明の一つの実施形態は従来のフィルターディスクの形態を有するが、それは機能が容易に評価されるためである。そのようなディスクを作製するために、機能性アクアポリンタンパク質を含むリン脂質膜の二分子層が、ラングミュア−ブロジェットトラフを用いて、25mmの市販の限外濾過ディスク表面上に累積される。本発明の好ましい実施形態において、従来の膜とともに水膜はらせん状に巻かれ、図10および11に参照されるように、らせん巻きROモジュールを形成する。
【0076】
フィルターディスクは入口および出口を有する密閉されたチャンバ内に設置され、例えばフィルターディスクチャンバがチューブを通じてポンプを有する水源に連結され、該ポンプが強制的に加圧された源水を膜を通して出口から排出する。純粋な水だけが膜の反対側へ通り抜けるとき、装置は機能的であると考えられ、汚染された溶質は元のチャンバ内で濃縮されている。汚染された溶液は、純粋な水がより多くの溶解粒子を有するチャンバの区画内に流れ込む自然な傾向に打ち勝つために、その結果飲用水において約10psiである水の浸透圧に打ち勝つために、加圧される必要がある。浸透性を逆にして、汚染された溶液から純粋な水を分離することが、本発明の水膜の目的である。システムのこの傾向、または浸透圧、は1平方インチあたりのポンド(psi)で表現されてよい。例えば、海水の浸透圧は360から400psiの範囲である。
【0077】
装置がこれらのタイプの圧力に耐えることを可能にするために、幾つか使用可能な方法がある。一つの方法は、非毒性かつ容易に除去可能な溶質を新鮮な水のチャンバに高濃度で添加して、チャンバ加圧に起因して逆浸透が起こっている間、膜を通る通常の浸透を促すことである。また、逆浸透に必要とされる圧力は、連続して汚染物質の濃度が低くなる、密閉され連結された段階的なチャンバで複数のアクアポリン膜を使用することによって低減される可能性がある。チャンバの各対において水を精製するのに必要とされる結果的な圧力は、逆浸透に必要な全圧力の一部である。従って、各膜は小さな圧力に耐えるのみであり、損なわれずに維持される可能性が高くなる。そこで、各チャンバ対間の濃度の差が、100%である代わりに、単に10%であるならば、上述の高い圧力の10%だけが各接続部で源水を精製するのに必要とされるだろう。純粋な水は一定の圧力および流れで最終チャンバにおいて連続的に製造されるだろう。
【0078】
アクアポリン逆浸透膜は、いくつかの異なる種類の汚染物質を有する水を単一の段階のみで精製することができる。従来の高純度システムは、精製水が製造され得る以前に、連結して使用されるため配置される水軟化剤、炭素フィルタ、イオン交換器,UVまたは化学殺菌、および二経路逆浸透膜を含んでよい幾つかの要素を必要とする。この複雑な設備は、アクアポリン膜が可能であるように、溶解された気体または150ダルトン未満の物質を源水から除去することができない。さらに、これらの部品全てのメンテナンスが必要である。UVバルブは交換およびエネルギーを必要とする。イオン交換器はそれらが充満されたら化学的に再生される必要がある。軟化剤は塩を必要とする。炭素および逆浸透カートリッジはそれらが汚れたときには交換されなくてはならない。最後に、単一段階装置は、非常に少ない空間および典型的な精製システムよりも非常に少ない重量を必要とするであろうし、この利点は可搬性の本発明のアクアポリン水膜を含む装置によって可能になる。
【0079】
アクアポリン膜は、従来のシステムと比較して迅速である。従来の高速逆浸透ユニットは1分あたり約28.4リットル(7.5ガロン)のきれいな水を製造することができる。現在の研究は、アクアポリン飽和脂質膜(0.0177mm2)を通過する水分子の動きが54μmol/secであることを示す(Pohl,P.,Saparov,S.M.,Borgnia,M.J.,およびAgre,P.,(2001),Proceedings of the National Academy of Sciences 98,p.9624−9629)。このように、理論的な1.0m2の表面積を有するアクアポリン逆浸透膜は、1分あたり純粋な水を3295リットル濾過できる可能性がある。その速度は通常の精製器と比較して116倍以上である。
【0080】
本発明は、さらなる態様において、化学的、放射線学的、生物学的、および/または粒子状の汚染物質をそこから除去するために水を処理するシステムに関し、そのようなシステムは外部水源と連結するため配置された入口を有する一体のハウジングを備えるものであって、前記一体のハウジングは内部に一つ以上の水濾過ユニットを配置されていて、該水濾過ユニットは外部水源からの水を処理して超純水流を製造するため配置された本発明の水膜を備え、そのような一体のハウジングは前記超純水をそこから排出する出口を備える。そのような処理システムの例は逆浸透濾過デバイスである。
【0081】
しかしながら、本発明の水膜を機能性アクアポリンを含む他の膜と交換することもまた可能である。例えば米国特許出願公開第2004/049230号明細書に教示されるアクアポリン含有膜である。そのような水処理システムおよびここで記載される濾過装置は、アクアポリン含有膜がどのようなものであるかに関わらず、それら自身が当然に独創的である。
【0082】
従って、本発明は塩水源から脱塩水を製造するための逆浸透水濾過装置も含み、前記脱塩水は灌漑農業のためにおよび/または可搬性の水として有用であって、最終的な逆浸透濾過膜の少なくとも一つが、本発明の膜のような機能性アクアポリン水チャンネルを含む水膜によって代替されている。同様に、本発明は原水源から超純水を製造するための逆浸透水濾過装置も含み、前記超純水は半導体産業および/または製薬産業において有用であって、最終的な逆浸透濾過膜の少なくとも一つが、機能性アクアポリン水チャンネルを含むそのような水膜によって代替されている。また、本発明は地方自治体の水産業、化学産業、飲用水産業、食品産業、電子産業、オイルおよびガス産業、精製産業、パルプおよび製紙産業、金属産業、鉱業、および電力産業において原水源から純水を製造するための逆浸透水濾過装置に関し、最終的な逆浸透濾過膜の少なくとも一つが、機能性アクアポリン水チャンネルを含むそのような水膜によって代替されている。典型的には、水の流れを駆動するために前記水膜の下流側に浸透圧が適用される。浸透圧は典型的に精製される水源と比較して大きな浸透圧を有する濃縮された溶液から生じる。
【0083】
本発明は、尿、乳および汗/発汗などの体液から抽出および回収するための水濾過装置にも関し、本発明の水膜などの機能性アクアポリン水チャンネルを含む。
【0084】
本発明の水精製システム/濾過装置は、水流を前処理し、そこから粒子状汚染物質の少なくとも一部を除去するため、水膜ユニットの上流に粒子濾過モジュールをさらに含んでよい。
【0085】
そのような粒子濾過モジュールは下流の水濾過ユニットの負荷を低減するよう機能して、水流が十分に流れるために必要とされる圧力をより低くして、それによってシステム全体のエネルギー消費およびその操作効率をよくする。
【0086】
粒子濾過モジュールは好ましくは(a)中空繊維膜セパレータ、および(b)限外濾過エレメントからなる群から選択される一つ以上の濾過エレメントを含む。複数の中空繊維膜セパレータおよび限外濾過エレメントは交互に使用されてよく、そのような特定の濾過モジュールの粒子除去性能を最大にする。
【0087】
濾過エレメントは、好ましくは、従来技術でよく知られる、タンジェンシャルフローまたはクロスフロー濾過装置を含み、濾過表面の障害を防ぐ。
【0088】
そのような粒子濾過モジュールが個々のフィルタにおいて不具合を生じる脆弱性を低減するために、および個々のフィルタの洗浄およびメンテナンスの間のシステム停止時間を低減するために、そのような粒子濾過モジュールは好ましくは複数の平行に配列された濾過エレメントを備え、それらは各々水流に対して独立した濾過経路を提供する。
【0089】
そのような粒子濾過モジュールの上流の予備的濾過が用いられることが好ましく、水流から大きな粒子(固体粒子、胞子、およびバクテリア)を濾過するように、および下流の粒子濾過モジュールにおいて使用されるフィルタの寿命を延ばすように、例えば約10μmから約20μmの範囲の多孔性を有してよい。
【0090】
そのような汚染物質除去ユニットは、水流からイオンを除去するためナノ濾過(NF)モジュールまたは逆浸透(RO)モジュールを含んでよく、ROモジュールはそのようなプロセスに従来使用されてきて効果的であることがわかっている。さらにナノ濾過はROモジュールと比較して必要とされる圧力、エネルギーおよび水消費が少ない。
【0091】
本発明の水処理システムは水力溜タンクをさらに含んでよく、システム内で均一の圧力を保持し、下流の水消費設備に対して実質的に一定の水供給を提供する目的でその内部には処理された水が流される。
【0092】
本発明の水処理システムは、水質監視モジュールをさらに含んでよく、該モジュールは処理される水流の水質の指標である一つ以上の変数(例えば、塩素濃度、pH値、伝導性、全有機炭素、溶解酸素、化学的酸素要求量、濁度および放射能を含むが、これらに制限されない)を連続的に監視し、そのような変数に関して前もって得られた値から決定されたベースライン値とそのような値とを比較し、そのようなベースライン値からの重大な偏差を同定し、前記偏差を示す出力信号を作り出す。そのような値の正確な測定を行なうために自動センサが使用されてよく、定期的に不連続な水サンプルを収集するためにサンプラーが使用されてよく、それによって偏差が起こったとき、時間枠からサンプルを分離することを可能にする。そのような偏差の原因となった水中の汚染物質を同定するために、そのようなサンプルに対して様々な分析手順がその後実行されてよい。この水質監視モジュールは、必要なときに水処理システムを起動または停止するように、および/または水質が予め決められた飲用水品質基準に達していないことを関係者に通報するようにさらに機能してよい。
【0093】
本発明の水処理システムは固定されるか、または可搬性のどちらであってもよい。それは、好ましくは、車両輸送および配置用に構築されおよび準備され、離隔された場所に水供給を提供するために使用されてよい。
【0094】
本発明のシステムは、システムの信頼性およびシステム全体の性能を高めるために、平行および/または連続的に冗長な方法で、様々な要素で構成されることができる。ここで記述されるシステムおよび実施形態は水から汚染物質を完全に除去するために機能的冗長性を使用してよいことはさらに認識される。
【0095】
このシステム/水濾過装置は水を精製するのに有用であり、上述のように、本発明は精製された水を調製する方法にも関し、前記方法は水が本発明のシステム/装置を通過することを含む。このように、得られた水は、例えばイオン、粒子、有機物およびコロイドを基本的に含まない。なぜなら、それらの部分は装置中に保持されているためである。
【0096】
本発明の疎水性膜
上記本発明の第2の態様、すなわち脂質単分子層が両側に並ぶ中間支持層に疎水性材料を含む水膜、の開示から分かるように、均一の形状およびサイズを有する孔が均一に分散された疎水性膜の形態で材料を調製することが可能である。そのような疎水性膜はそれ自体独創的である。
【0097】
従って、本発明は複数の孔を含む疎水性重合体膜にも関し、前記孔は膜内で均一に分布し、膜の二つの表面間の中間平面において実質的に全てが実質的に同じ幾何学形状である。そのような孔の各々が十分に大きな開口領域を有して、水蒸気の通過を可能にするが、液体の水の通過を防ぐよう十分小さく、例えば面積は100nm2−1mm2の範囲であり、膜はGoretex(登録商標)などの材料と同じように機能する、すなわち膜は通気性であるにもかかわらず防水である。孔のサイズおよび形状が非常によく制御されているので、本発明の膜はGoretex(登録商標)膜のような材料より優れていると考える。
【0098】
ここでの意味で用語「疎水性膜」は実質的に平面の疎水性材料を示す。平面材料に曲面形態(すなわち、材料が軸の周囲に巻かれる場合)を付与することができるように膜は典型的には柔軟であり、結果的に疎水性膜を服の繊維および他の柔軟な構造体の一部として、適切なものにする。
【0099】
孔は典型的には、μmの範囲など、nmからmmの範囲において最大の断面長さを有し、膜は典型的にはmmからμmの範囲の厚みを有する。
【0100】
典型的には、孔の幾何学的形状は円および楕円から選択される。フィルム内の孔の導入に関してレーザ装置を使用するとき、どちらの形状も容易に得られ、例えば円形の孔は静止レーザビームを用いて得られ、それに対して露出の間レーザビームに対して膜を動かすことによって(膜またはレーザビームのどちらかの動きによって)、楕円形または棒形状の孔が与えられる。好ましい実施形態において、全ての孔が同じ寸法を有する。膜材料は典型的には本発明の第2の態様の開示に関連して上述の疎水性材料から選択される。
【0101】
本発明は特定の実施形態に関して記述されてきたが、多くの変更、修正、および実施形態が可能であり、従って、そのような全ての変更、修正、および実施形態は本発明の精神および範囲の範疇にあると解釈されることは理解されるであろう。ここで引用される全ての参考文献は参照のためここに全て組み込まれる。
【0102】
本発明のさらなる態様、特徴および実施形態は、これ以降の開示および添付されるクレームからより完全に理解されるだろう。
【0103】
例1
DPPC脂質ベシクル内のAPQ−1の再構成(タンパクリポソーム)
【0104】
本発明による水膜を調製するのに以下の手順が使われてきた。
1.小さな単層ベシクルの調製(SUV)
a.乾燥DPPC脂質はミリQ水に懸濁され、1.3−1.5mMの濃度にされる。
b.懸濁液は55℃で1時間放置することによって水和され、多重層ベシクルとなる(MLV)。
c.SUVは二つの100nmポリカーボネートフィルタを通してMLV溶液を12回押し出すことによって調製される。
d.SUV溶液は55℃で保存される。
【0105】
2.BioBeadsTMの調製(ポリスチレンビーズ)
a.約4gのBioBeadsTMはミリQ水で5回すすがれる。
b.すすがれたBioBeadsTMは水を吸入しながら1時間超音波で分解される。
【0106】
3.再構成
a.適当な体積のSUV溶液がエッペンドルフ管にピペットで移される。
b.20% Triton X−100が50μl添加される。
c.Zeidel et al.(1992)によって記述された方法に従って精製されたリン酸緩衝液内の変性された形態のAQP−1(濃度0,5mg/ml)10μlが添加される。
d.最終的な体積が200μlになるまでミリQ水が添加される。
e.溶液は15分間振とうする間室温に保たれる。
f.約75mgのすすがれたBioBeadsTMが溶液に加えられ、その後30−45分間振とうされる間保温される。
g.溶液は清浄なエッペンドルフ管内部にピペットで移される。
h.段階f.−g.は3回繰り返される(合計4回のBioBeads)。
i.タンパクリポソームの準備ができる。
【0107】
図9はマスコバイト上のDPPC膜の原子間力顕微鏡(AFM)像、およびDPPC膜中の再構成されたAQP1の像を示し、再構成が目的どおりに行なわれていること、および結果として得られるベシクルの支持体二分子層が形成されていることを示す。写真中の小さな円形構造の面積は写真中で測定すると約36nm2である。これは脂質二分子層内のタンパク質の表面積とよく対応する。平均(三つの異なる領域からの異なるサイズの六つの像)では、タンパク質が表面の48%、および脂質が52%を覆っている。脂質の面積を0.5nm2と仮定すると、計算された脂質−たんぱく質比(LPR)は77である。支持された二分子層はLPRが50で調製されたタンパクリポソームのベシクル融合によって形成された。
【0108】
例2
図1によって概略説明される、水膜を得るための多孔質マスコバイト上の脂質二分子層および場合によりさらなる複数の二分子層の形成
1.マスコバイトマイカ切片(約1cm2)はテープに切断される。
2.切断直後に例1のタンパクリポソーム溶液25μlがマイカ表面に塗布される。
3.サンプルは室温(21℃)で10分間保温され、融合された二分子層を形成する。
4.サンプルは保温後ミリQ水で7回すすがれ、過剰な非結合ベシクルが除かれる。
5.最後に新たに切断されたマスコバイトマイカの第2の切片が形成された脂質二分子層の上に累積される。
【0109】
例3
大腸菌脂質抽出物ベシクルにおけるAQP−1の再構成
大腸菌全脂質抽出物のクロロホルム溶液はAvanti Polar Lipids(アラバマ州アラバスター)から入手された。溶媒(クロロホルム、エタノール、メタノール、デカン)は全てシグマ−アルドリッチ社(ミズーリ州セントルイス)から購入された。SM−2BioBeadsはBioRad Laboratories(カリフォルニア州ハーキュリーズ)から購入された。全ての調製に使用された水は超純水Milli−Q水(18.2MΩcm−1)であった。ウシ赤血球から精製されたアクアポリン−1はUniversity of AarhusのDr. Jan Enghildにより変性タンパク質の懸濁液として得られた。
【0110】
クロロホルムを脂質溶液から蒸発させ、乾燥した脂質膜は55℃で30分間100mMのKClで水和された。溶液はボルテックスされ、Lipexエクストルーダ(Northern Lipids,Vancouver,CD)内で二つの100nmポリカーボネートフィルタを12回通過させることによって小さな単層ベシクル(SUV)が形成された。再構成混合物は最終濃度1.25%(wt/vol)になるまでTriton X−100(シグマ)を添加し、その後脂質−タンパク質比(LPR)が1000:1になるまでAQP−1を添加することによって調製した。タンパクリポソームは界面活性剤を除去することによって形成された。これは疎水性BioBeads(SM−2)に吸着することによって実行された。タンパクリポソームは調製したその日か、または翌日のどちらかに使用された。溶液は実験と実験との間は40℃で保存された。
【0111】
例4
平面状の二分子層の形成および電圧固定法:イオン伝導性を増加することなく脂質二分子層内部に組み込まれたAQP−1
電圧固定法は脂質(または細胞膜)の電位Vをあらゆる所望のレベルに制御(または「固定」)する。ここで使用される方法は、二つの水溶液の間の仕切りにおいて形成された二重膜を横切る電位を測定する。AgClコート銀電極が一つのチャンバに配置され、この電圧を保持されるべき電圧(コマンド電圧と呼ばれる)と電子的に比較する。クランプ回路はその後他の電極を通じて他のチャンバに電流を戻す。この電子的フィードバック回路は、透過面が変わったときでさえ二層間の電位を所望のレベルに維持する。最も重要なことに、この装置は与えられた電圧に二層間の電位を保持するために必要とされる電流Iの同時測定を許容する。従って、電圧固定技術は膜電位がどのように膜を横切るイオン電流に影響するかを示す。この影響は電流−電圧(I/V)関係で表現される。
【0112】
平面状の二分子層は大腸菌のn−デカン溶液(2.5% wt/vol)(アラバマ州アラバスターAvanti Polar Lipids)から、実験日に調製されたバッファリングされていない0.1MKClの二つの水溶液を分離するテフロン(登録商標)仕切りの孔(直径1.3mm)を通して形成された。二層I/V実験はAxoPatch200 amplifier(カリフォルニア州サニーベール、Axon Instruments)を用いて、AgClコート銀ワイヤを電極として使用して、22℃で行なわれた。I/Vプロトコルが構築され、データはClampex 9.2ソフトウェア(カリフォルニア州サニーベール、Axon Instruments)を用いて記録された。データは、8極ベッセルフィルタ(マサチューセッツ州ヘイバリル、Frequency Devices)コーナー周波数500Hz(−3dB)において低域フィルタリングされ、16ビットAD−変換(DigiDatal332A、カリフォルニア州サニーベール、Axon Instruments)後分析のためPC(テキサス州オースチン、Dell Computers)に保存された。データはClampFit 9.2(カリフォルニア州サニーベール、Axon Instruments)およびOriginPro7.5 (マサチューセッツ州ノースハンプトン、OriginLab)を用いて分析され、表示された。
【0113】
二分子層の形成は冷光源(IntraLux 5000、Volpi、CH)を備えた実態顕微鏡(Zeiss)を用いて監視された。仕切り孔に脂質を累積した後脂質単分子層からのニュートニアン回折色は次第に消え、約10分後より厚い脂質/デカントーラスによって囲まれた透明な「黒色」脂質膜が形成された。この薄化も時間的推移においてゼロ電位IRMSにおける二層間電流の二乗平均平方根で反映されている。初期にはIRMSは約1.6pAであったが、定常値約6pAまで上がり、安定な二分子層が形成されたことを示した。二分子層の直径は約1200μmであった。二分子層の形成の後、段階的プロトコルを用いて二層間電流が得られ、電位は−100mVから+90mVまで増分10mVで段階的に変化した。各段階は1000ms継続し、各段階の間も100msであった。
【0114】
AQP−1はAQP−1含有ベシクルを二分子層形成溶液(2:1 vol/vol)に添加した後平面状二分子層に組み込まれ、同様の結果が得られた。
【0115】
AQP−1の脂質二重層に対する組み込みはイオン電流を変化させないが、対照と比較してAQP−1含有二分子層の時定数を変化させた。一次近似に対して後者の測定結果はトーラスおよび二分子層の有効誘電率における変化であると解釈されてよい。炭化水素材料に対するAQP−1タンパク質材料の誘電率が低いので、二分子層およびトーラスの双方の時定数が低くなるのであろうと思われる。
【0116】
例5
浸透勾配研究:低浸透圧性側の未攪拌層内のイオン濃度の増加をもたらす浸透勾配を与えられた脂質二分子層内部に組み込まれたAQP−1
AQP−1を含む脂質二分子層の形成の後、浸透勾配に駆動された膜を横切る水分流動が、膜近傍の未攪拌層内のK+イオン濃度の変化を測定することによって観察された。
【0117】
二連型K+電極は1.2mmODガラスキャピラリー(コーニング 120F)を用いてZeuthenの技術によって構築された。
【0118】
二つのバレルからの電極電圧はPC(Dell Computer,Austin,TX)に接続されたDUO773 Amplifier(WPI)を用いて、12ビットBioLogic 1401+ AD/DA interface(Biologic,Claix,France)を用いて記録された。
【0119】
記録は、pH7.2において20mMのトリス[ヒドロキシメチル]−アミノエタンヒドロクロリド(TRIS)(ミズーリ州セントルイス、T3253)でバッファリングされた100mMのKClを含むバック(シス)チャンバ内に配置された二連型電極で実行された。電極ホルダは水溶液表面に関して45°の角度で入るようにシスチャンバ(cis chamber)に設置され、水圧極微操作装置(David Knopf Instruments、Model 1207B)を用いて最小ステップ長0.25μmで操作された。二分子層形成および電極のおおよその位置はセクション5.3に記述した実態顕微鏡を用いて監視され、記録は脂質の累積後10−20分で始まった。二分子層−電極距離における全体的な精度は約±7μmであると判断され、絶対的な距離は二分子層と接触するときの電極電位の大きな変化によって判断された。二分子層を横切る浸透勾配は前(トランス)面にpH7.2において20mMのTRISでバッファリングされた4Mの尿素(452042V、BDH、Poole、UK)を含むKCl溶液を有することによって誘起された。
【0120】
AQP−1を組み込んだ脂質二重層が、二分子層を横切る浸透勾配の存在下で水の流れを誘起したことが観察された。
【0121】
脂質二分子層内に組み込まれたAQP−1は、浸透勾配の存在下で、バルクのK+濃度と比較して、低浸透圧性側の二分子層から20μm内部でK+イオン濃度を約8%増加させた。
【0122】
膜は4M浸透勾配を支持することができた。
【0123】
例6
本発明による膜を含むUPWシステム
【0124】
図10および11は、本発明の一つの実施形態による水精製装置を示す。図10は要素の概略的な透視断面図であり、図11は図10のII−II線に沿った断面図である。
【0125】
エレメントはエレメントの中央に配置された中空パイプ1を有し、その表面には複数の貫通孔1aが形成される。逆浸透膜2、透過された液体通路部材3、および供給液体通路部材4は、中空パイプ1の以下に記載した方法で外表面周囲に巻かれる。
【0126】
各々の逆浸透膜は全体としてバックのような形状を有し、透過された液体通路部材3がその中に配置される。バック形状の逆浸透膜2は中空パイプ1の外部表面に取り付けられ、それらの開口部2aは中空パイプ1内に形成された貫通孔1aを囲み、逆浸透膜2および透過された液体通路部材3の内部が貫通孔1aと連通するようにする。
【0127】
各供給液体通路部材4はそこに結合される逆浸透膜2の間に配置され、液体がそこを通って通過できるように構成された枠部材5は膜の両端および通路部材アセンブリに取り付けられ、それによってらせん構造になる。
【0128】
上述の要素は圧力ベッセル内に配置され、所定の圧力においてその一端(上流側)で供給液体6が供給されるように合わせられる。
【0129】
供給液体6が供給液体通路部材4に沿って流れるとき、逆浸透膜2によって逆浸透分離を受け、透過液体と溶質とに分離される。逆浸透膜2を通過し溶質濃度が低い透過液体は、貫通孔1a内部に流れ、中空パイプ1内に集まる。透過液体6aはその後要素の下流側から取り出される。
【0130】
逆浸透膜2を通過しなかった供給液体は、下流側に向かって供給液体通路部材4に沿って流れ続ける。流れる過程では、供給液体は供給液体から分離された溶質を取り込み、膜表面を離れて、高い溶質濃度を有する濃縮された液体6bになる。
【0131】
前記要素を操作するにあたって、濃度分極に起因して要素の性能が低下するなどの重大な問題がある。
【0132】
濃度分極は、例えば不純物および供給液体内に含まれる汚染物質などの付着物質が供給液体通路部材4と接触される逆浸透膜2の膜表面上で濃縮され、供給液体中の溶質および付着物質濃度が膜表面上でより高くなる現象である。結果として、浸透圧が高くなる。
【0133】
濃度分極が起こるとき、透過液体の品質は低下し、ゲルおよび薄膜など不純物が膜表面上に沈殿する。このために、逆浸透膜はその性能を発現させることができず、要素の性能は低下する。
【0134】
濃度分極の発生は、膜表面上に供給液体の乱流を作ることによって抑制することができる。例えば、乱流は、より厚みの小さい供給液体通路部材4を用いて膜表面上の供給液体の線形速度を増加することによってより簡単に発生し、濃度分極層は薄くなり得る。
【0135】
しかしながら、より厚みの小さい供給液体通路部材4を用いると、供給液体通路部材4によって画定される通路が供給液体内の、例えば不純物および微生物などの、付着物質で容易に詰まる。その結果、要素の性能は低下し、供給液体内の圧力損失は増大する。透過液体の品質および量を保持するため、供給液体の操作圧力は増加される必要があり、従って操作に電力を必要とする高圧ポンプおよび圧力パイプが与えられる必要があり、結果的に液体の製造コストを増加する。
【0136】
逆浸透膜の少なくとも一つは本発明による水膜であり、アクアポリンおよび/またはアクアグリセロポリンチャンネルを含む。
【0137】
参考文献:
1.Agre,P.,M.Bonhivers, and M.J.Borgnia. (1998). The aquaporins,blueprints for cellular plumbing systems. Journal of Biolgical Chemistry,273,14659−14662.
2.Borgnia,M.,S.Nielsen,A.Engel, and P.Agre.(1999). Cellular and molecular biology of the aquaporin water channels. Annual Review of Biochemistry,68,425−458.
3.A.A.Brian and H.M.McConnell. Allogenic stimulation of cytotoxic T cells by supported planar membranes. Proc. Natl. Acad. Sci. USA,81:6159−6163,1984.
4.Burykin and A.Warshel(2003). What really prevents proton transport through aquaporin? Charge self−energy vs. proton wire proposals, Biophysical Journal 85,3696−3706
5.Chakrabarti,N.,Tajkhorshid,E.,Roux,B. and Pommes,R.(2004). Molecular basis of pro− ton blockage in aquaporins, Structure 12,65−74
6.Dainty,J. and CR. House. 1966 . Unstirred layers in frog skin. J Physiol 182:66−78.
7.de Groot,B.L., and Grubmuller,H.(2001). Water permeation across biological membranes: mechanism and dynamics of aquaporin−1 and GIpF, Science 294,2353−2357.
8.de Groot,B.L.,Frigato,T.,Helms,V. and Grubmuller,H.(2003). The mechanism of pro− ton exclusion in the aquaporin−1 channel, Journal of Molecular Biology 333,279−293.
9.Fettiplace,R. and D.A.Haydon. 1980. Water permeability of lipid membranes. Physiol Rev 60:510−50.
10.Fu,D.,Libson,A.,Miercke,L J.,Weitzman,C,Nollert,P.,Krucinski,J., and Stroud,R.M.(2000). Structure of a glycerol−conducting channel and the basis for its selectivity, Science 290,481−6.
11.Heymann,J.B. and Engel,A.(1999). Aquaporins: Phylogeny, Structure, and Physiology of Water Channels. News Physiol. Sci.(14) p.188.
12.Ilan,B.,Tajkhorshid,E.,Schulten,K. and Voth,G.(2004). The mechanism of proton exclusion in aquaporin water channels. PROTEINS: Structure, Function, and Bioinformatics,55,223−228.
13.Jensen,M.O.,Tajkhorshid,E., and Schulten,K.(2003). Electrostatic tuning of permeation and selectivity in aquaporin water channels, Biophysical Journal 85,2884−2899.
14.Z.V.Leonenko,A.Carnini, and D.T.Cramb. Supported planar bilayer formation by vesicle fusion: the interaction of phospholipid vesicles with surfaces and the effect of gramicidin on bilayer properties usin atomic force microscopy. Biochim. Biophys. Acta, 1509:131−147,2000.
15.H.Lin,R.Bhatia, and R.LaI. Amyloid β protein forms ion channels: implications for Alzheimer’s disease pathophysiology. FASEB J., 15:2433−2444,2001.
16.Montal,M. and P.Mueller. 1972. Formation of Biomolecular Membranes from Lipid Monolayers and a Study of Their Electrial Properties. Proc. Nat. Acad. Sci. USA 69:3561−3566.
17.J.Mou,D.M.Czajkowsky, and Z.Shao. Gramicidin A aggregation in supported gel state phosphatidylcholine bilayers. Biochemistry, 35:3222−3226, 1996.
18.Murata,K.,Mitsuoka,K.,Hirai,T.,WaIz,T.,Agre,P.,Heymann,J.B.,Engel,A., and Fujiyoshi,Y.(2000). Structural determinants of water permeation through aquaporin−1, Nature 407,599−605.
19.Pohl,P.,S.M.Saparov, and Y,N.Antonenko. 1997. The effect of a transmembrane osmotic flux on the ion concentration distribution in the immediate membrane vicinity measured by microelectrodes. Biophys J 72:1711−8.
20.Preston,G.M.,P.Piazza−Carroll,W.B.Guggino, and P.Agre.(1992). Appearance of water channels in Xenopus oocytes expressing red cell CHIP28 water channel. Science,256,385−387.
21.E.Reimhult,F.Hook, and B.Kasemo. Intact vesicle adsorption and supported biomem− brane formation from vesicles in solution: Influence of surface chemistry, vesicle size, temperature, and osmotic pressure. Langmuir,19:1681−1691,2003.
22.Ren,G.,Reddy,V.S.,Cheng,A.,Melnyk,P., and Mitra,A.K.(2001).Visualization of a water−selective pore by electron crystallography in vitreous ice, Proc Natl Acad Sci USA 98,1398−1403.
23.I.Reviakine and A.Brisson. Formation of supported phospholipid bilayers from unilamellar vesicles investigated by atomic force microscopy. Langmuir,16:1806−1815,2000.
24.H.A.Rinia,R.A.Kik,R.A.Demel,M.M.E.Snel,J.A.Kiilian,J.P.J.M. van der Eerden, and B.de Kruijff. Visualization of highly ordered striated domains induced by transmembrane peptides in supported phosphatidylcholine bilayers. Biochemistry,39:5852−5858,2000.
25.Sakmann,B. and E.Neher.1995. Single channel recording 2ed. Plenum Press, New York Saparov,S.M.,D.Kozono,U.A.P.Rothe, and P.Pohl. 2001. Water and Ion Permeation of Aquaporin−1 in Planar Bilayers. J. Biol. Chem.276:31515−31520.
26.A.C.Simonsen and L.A.Bagatolli. Structure of spin−coated lipid films and domain formation in supported membranes formed by hydration.Langmuir,20:9720−9728,2004.
27.Sui,H.,Han,B.G.,Lee,J.K.,Walian,P., and Jap,B.K.(2001). Structural basis of water−specific transport through the AQPl water channel, Nature 414,872−8.
28.Tajkhorshid,E.,Nollert,P.,Jensen,M.O., Miercke,L J.,O’Connell,J.,Stroud,R.M., and Schulten,K.(2002). Control of the selectivity of the aquaporin water channel family by global orientational tuning, Science 296,525−530.
29.E.J.M.van Kan,D.N.Ganchev,M.M.E.Snel,V.Chupin,A.van der Bent, and B. de Kruijff. The peptide entibiotic clavanin A interacts strongly and specifically with lipid bilayers. Biochemistry,42:11366−11372,2003.
30.Zhu,F.,Tajkhorshid,E. and Schulten,K.(2003). Theory and simulation of water permeation in aquaporin−1. Biophysical Journal,86,50−57.
31.Zeidel,Mark L.,Suresh V.Ambudkar,Barbara L.Smith, and Peter Agre, Biochemistry 1992,31,7436−7440.
【符号の説明】
【0138】
1 中空パイプ
2 逆浸透膜
3 透過された液体通路部材
4 供給液体通路部材
5 枠部材
【技術分野】
【0001】
本発明は、純水および/またはグリセロールを濾過するのに適した機能化アクアポリンチャンネルまたは四量体を含む新規の膜、そのような膜を含む濾過装置/精製システム、ならびに超純水の製造および水性組成物からの過剰な水の抽出のために同様のものを使用する方法に関する。また、本発明は新規の疎水性重合体フィルムに関する。
【背景技術】
【0002】
人間および/または動物が摂取するのに適した精製水を得るために天然のおよび汚染された水源を浄化する様々な水処理システムおよび方法がこれまで開発されてきた。さらに、半導体工業および製薬工業における超純水に対する需要は高い。超純水の生産は水源に対してより特化したフィルタおよび化学的処理を必要とする。膜濾過、イオン交換体、サブミクロン粒子フィルタまたはナノフィルタ、紫外線およびオゾン処理など、多くの技術が使用される。生産された水は非常に純粋であり、塩、有機化合物、酸素などの溶解した気体、浮遊物、およびウイルスやバクテリアなどの微生物を含まないか、または非常に低濃度で含む。しかしながら、半導体産業における継続的な小型化などの要因のために、超純水に対する仕様はより厳しくなっている。
【0003】
従来、水は様々な利用可能な水処理装置を通じて精製または処理され、該装置は共有のおよび使用時の適用の双方に関して設計され、例えば以下の技術に基づく:有機物除去のための活性炭:紫外線消毒:硬度除去(水の軟水化)のためのイオン交換、および逆浸透(RO)またはナノ濾過(NF)などの膜の脱塩。しかしながら、ナノ濾過は水処理技術の分野では比較的新しい。NF膜は、水中に存在する硬度の原因となる二価のイオンを保持することによって、軟水を作り出す。NF膜は、ナトリウムや塩化物などの一価のイオンを高い割合で通過させ、一方で二価のイオンを高い割合で保持する。RO膜を通して水を輸送するのに必要な中程度から高い圧力を必要とする浸透圧を生成するのは一価のイオンである。したがって、水圧による駆動力が1価のイオンに由来する浸透圧の影響を克服する必要がないので、ナノフィルタ膜は、膜を通して水を輸送するのに非常に少ない圧力を要求する。概して言えば、居住用および商業用水処理用途で使用されるRO膜は、およそ98%までの溶解固形物をすべて除去し、一方でナノ濾過膜は二価イオン(硬度成分:カルシウムおよびマグネシウム)をおよそ90%まで、および一価イオン(ナトリウム塩化物)をおよそ50%まで除去する。
【0004】
膜要素(例えば:ROまたはNF)を使用する脱塩装置は、水が要素を出るときに、常に水の二つの流れを生成する:脱塩された生産水(膜を通過したもの)、および不用な塩水(膜表面を横切って流れたもの)。この不用の塩水流は、塩類および無機物の膜表面における蓄積および汚染を防ぐため、膜からそれらを洗い流すのに必要である。もしも供給水中の塩類および無機物が膜に連続的に付着する場合、溶解した物質は沈殿し、および固体膜を形成する可能性があり、膜表面を汚染する。加えて、コロイド状および粒子状の不純物も膜表面に付着して汚染の原因となる可能性がある。多くの水性不純物で、もしも膜が不可逆的に覆われ、または汚染される場合、それを洗浄することはできず、交換する必要がある。膜プロセスのこの特性は、特に、典型的には小型であり、可能な限り経済的に作られた水処理システムを使用する場所(POU)での排水の低減において重要な問題を提起する。
【0005】
イオン交換装置も「硬水」を軟化するのに使用される。イオン交換水軟化システムの問題は、いわゆる「軟水」を作るため、それが水の硬度成分(カルシウムおよびマグネシウムイオン)をナトリウムイオンと交換することによって除去することである。イオン交換媒体の再生が行なわれるとき、ナトリウム、塩化物、カルシウムおよびマグネシウムイオンが濃縮された水流は、下水道に入り、環境の廃棄物処理問題の原因となる。そのようなタイプの水精製システムの例は、米国特許第5741416号明細書、「water purification system having plural pairs of filters and an ozone contact chamber」に記述され、そのような水流中の有機不純物を酸化し、殆どのバクテリア、ウイルスおよび他の微生物を破壊するのに効果的である水精製システムを開示する。一価カチオンに選択性を有する透析膜を含むシステムも、国際公開第2004/099088号パンフレットに開示されている。
【0006】
このように、通常の家庭用の、同様に先端研究用、工業用および製薬用の双方において、化学的、生物学的および/または放射線学的不純物で汚染されたか、または汚染された可能性がある水を処理するための水精製システムに対する継続的な必要性が存在する。
【0007】
水の汚染または水の汚染のおそれは、例えば船上または僻村またはキャンプなど、非常に局所的な性質を持つことが多いので、実際の汚染場所または汚染の可能性がある場所で迅速かつ容易に配置され得る固定型または携帯型の水精製システムに対する要求が存在する。特に関連するのは、人間の摂取に適した処理された水を製造するために、実際に汚染されたまたは汚染されたおそれがある供給水、例えば海水、から有効に汚染物質を除去することができるシステムである。
【0008】
生体膜を通じてH2O分子を選択的に輸送する性能によって特徴付けられる水輸送タンパク質アクアポリンが発見され、これらのタンパク質を組み込んだ人工的な水膜(water membranes)の発明に興味が持たれた。米国特許出願第20040049230号明細書「Biomimetic membranes」は、水精製を可能にするため水輸送タンパク質がどのように膜に埋め込まれるか記述することを目的としている。記述された好ましい形態は、従来のフィルターディスクの形態を有する。そのようなディスクを作製するため、厚み5nmの合成三元ブロック共重合体およびタンパク質の単分子層はラングミュア−ブロジェットトラフを用いて25mmの市販の超濾過ディスク表面に累積される。ディスク上の単分子層はその後紫外光で架橋され重合体となって耐久性を高める。装置は、加圧した源水に膜を通過させるチャンバ内に取り付けることによって評価されてよい。しかしながら、合成三元ブロック共重合体をどのように選択すべきか指針はなく、埋め込まれたアクアポリンの実際の機能を支持する如何なるデータも存在しない。
【0009】
脂質二分子層ベシクル内部にアクアポリンタンパク質を送り込み、これらの膜を多孔質支持体上にキャストすることにより作られる水精製技術が示唆されている。James R.Swartzのホームページ:http://chemenq.stanford.edu/01About the Department/03Faculty/Swartz/swartz.html.を参照されたい。
【0010】
本発明は、高純度(例えば100%)で水を浄化することができる膜に組み込まれたアクアポリンを含む工業用水濾過膜および装置を開発することを主な目的とする。今日この課題を実行可能な既知の技術またはフィルタは存在しない。
【先行技術文献】
【特許文献】
【0011】
【特許文献1】米国特許第5741416号明細書
【特許文献2】国際公開第2004/099088号パンフレット
【特許文献3】米国特許出願第20040049230号明細書
【発明の概要】
【課題を解決するための手段】
【0012】
本発明は一つの態様において水を濾過する膜に関し、該膜は脂質ベシクル中に再構成され、ラングミュア−ブロジェット法などの方法を用いて支持体層に変換され水濾過膜を形成したアクアポリン水輸送タンパク質を使用する。
【0013】
本発明の水膜の利点として、脱塩用化学物質および可搬式脱塩フィルタの設備(水と塩を分離することができる「コーヒーフィルタ」のような装置)を必要とせずに、海水(地球の水の97−98%が海水である)を効率的に脱塩すること、半導体産業のために効率的に水を精製すること、家庭用水/飲料水を頑強に精製すること、および、例えば第3世界各国において、電気を使わずに水を精製すること、が挙げられる。
【0014】
したがって、本発明は一つの態様において、機能性アクアポリン水チャンネルを含む少なくとも一つの脂質二分子層によって分離された、少なくとも二つの透過性支持体層を有するサンドイッチ構造を含む水膜に関する。この方法において、透過性または多孔質の支持体は、水分子が支持体を通過して、支持体層の間に累積された少なくとも一つの脂質二分子層に到達することを可能にする。分散された機能性アクアポリンチャンネルを含む脂質二分子層は、反対側の多孔質支持体層へと水のみを濾過するか、またはアクアポリンがGLpFチャンネルである場合には、グリセロールも濾過し、結果的に純水で構成される濾過物を与える。好ましくは、この濾過された水は高度に精製された水である超純水(UPW)であり、イオン、粒子、有機物およびコロイドの含有量が低い。本発明の水膜は、水に対する選択性が最も高い既知の輸送チャンネルを用いた、新たな世代の逆浸透膜である。
【0015】
ここに関連して、「水膜」は、水の通過を可能にするが、他の殆どの材料または物質は同時に通過することが出来ない構造体を示す。本発明の好ましい水膜は、基本的に水に対してのみ(およびある場合にはグリセロールに対して)透過性である一方、溶質および他の溶媒は通過できない。
【0016】
第2の態様において、本発明は、一つの二分子層に構築されるとき、機能性アクアポリン水チャンネルを含む少なくとも二つの脂質単分子層を有するサンドイッチ構造体を含む水膜に関し、前記少なくとも二つの脂質単分子層が少なくとも一つの透過性支持体層によって分離される。この実施形態において、結果的に透過性支持体層は二つの脂質単分子層を分離し、該二つの脂質単分子層は支持体層が穿孔/刺し孔を含むとき、脂質二分子層を形成することが可能である。
【0017】
本発明のさらなる態様は、任意に安定化膜に封入された、本発明の水膜を含む水濾過装置に関し、精製される水溶性液体の入り口および精製された水の出口を有するハウジング内に設置される。
【0018】
本発明は、以下の段階を含む水膜を調製する方法にさらに関する。
a)アクアポリン水チャンネルを含む脂質ミクロベシクルであって、前記ミクロベシクルを少なくとも0.1%mol/mol含む脂質ミクロベシクルを得る段階と、
b)前記ベシクルを、親水性表面を有する本質的に平面状の、透過性の支持体上の平面状脂質二分子層内部に融合させ、アクアポリンタンパク質が二分子層領域の少なくとも1%を被覆する段階と、
c)任意に、段階b)を繰り返し、複数の融合二分子層を得る段階と、
d)親水性表面を有する、第2の本質的に平面状の、透過性支持体を、段階b)または段階c)で得られた脂質二分子層上に累積して、サンドイッチ構造体を得る段階と、
e)任意に、得られたサンドイッチ構造体を透過性安定化膜内に封入する段階。
【0019】
本発明は、以下の段階を含む水膜を調製する方法にも関する。
a)アクアポリン水チャンネルを含む脂質ミクロベシクルであって、前記ミクロベシクルを少なくとも0.1%mol/mol含む脂質ミクロベシクルを得る段階と、
b)前記ベシクルを、疎水性表面を有する本質的に平面状の、透過性の支持体周囲に構築された平面状脂質二分子層内部に融合させ、アクアポリンタンパク質が二分子層領域の少なくとも1%を被覆する段階と、
c)任意に、得られたサンドイッチ構造体を透過性安定化膜内に封入する段階。
【0020】
本発明は、逆浸透濾過膜として、機能性アクアポリン水チャンネルを含む水膜(例えば、本発明の水膜)を含む逆浸透水濾過装置にさらに関する。
【0021】
本発明は、尿、乳および汗/発汗などの体液から水を抽出および再生するための、機能性アクアポリン水チャンネルを含む水膜を備えた水濾過装置にさらに関する。
【0022】
加えて、本発明は、本発明の水膜を通じて天然または汚染された水源を濾過する結果得られる精製水を調製する方法に関する。前記精製水は、溶解した物質または粒子などの汚染物質を含まないことによって特徴付けられる。本発明は、機能性アクアポリンチャンネルを含む逆浸透膜を用いて水源を濾過することによって精製水を得る方法にさらに関する。
【0023】
さらに、本発明の異なる態様は、以下に詳細が記述される疎水性重合体膜に関する。
【0024】
最終的に、本発明の水膜の一般的設計は、他の目的に関する膜に適用可能であると考えられ、他の方法で本発明の水膜として設計された膜内にアクアポリンではなく他の膜貫通タンパク質が組み込まれる。そのような膜もまた本発明の一部であり、そのような膜には、ここで開示された膜と同じ膜貫通タンパク質の選択を除いた全ての態様、およびアクアポリンではなく他の膜貫通タンパク質を含む膜に必要な変更を加えて適用する膜に関するすべての開示が含まれる。
【0025】
膜貫通タンパク質は、本発明において膜に含有するのに適したアクアポリンとは異なり、例えばThe Transporter Classification Database (TCDB)に見出されるいかなる膜貫通タンパク質から選択されてよいが、これに制限されない。TCDBはhttp://www.tcdb.orgからアクセス可能である。
【0026】
TCDBにおいて本発明に含有される膜貫通タンパク質の例は以下のとおりである。
アエロリシン チャンネル形成トキシン
アグロバクテリアル ターゲット−ホスト 細胞−膜アニオンチャンネル
溶血素 チャンネル形成トキシン
アラメチシンシャンネル
アルギン酸塩排出ポーリン
アモエバポア
両親媒性ペプチドマストパラン
アミロイドb−タンパク質ペプチド
動物内向き整流性K+チャンネル
アネキシン
アポトーシス調節因子
ArpQホリン
AS−48
ATPゲートカチオンチャンネル
オートトランスポータ
バシラス サブチリス j29 ホリン
細菌タイプIII−ターゲットセルポア
殺菌剤透過性増大タンパク質(Bactericidal permeability−increasing protein)
バクテリオシン AS−48 環状ポリペプチド
バクテリオロドプシン
ベチコリン チャンネル
BIyA ホリン
ボツリヌス菌および破傷風菌毒素
ブルセラ−リゾビウム ポーリン
カンピロバクター空腸主外膜ポーリン
カチリシジンカチオンチャンネル
カチオンチャンネル形成熱ショックタンパク質70
セクロピン
チャンネル形成炭疽菌感染防御抗原
チャンネル形成セラミド
チャンネル形成コリシン
チャンネル形成コリシンV
チャンネル形成d−エンドトキシン殺虫性結晶タンパク質
チャンネル形成e−トキシン
チャンネル形成ロイコシジン細胞毒素
クラミジアポーリン
塩素チャンネル
葉緑体膜アニオンチャンネル形成体
葉緑体外膜溶質チャンネル
コレステロール結合、チオール活性化溶血毒素
クロストリジウム細胞毒素
補体タンパク質C9
錯体化ポリヒドロキシブチレート−Ca2+チャンネル
コリネバクテリアポーリン
Cphlホリン
C型ナトリウム排泄増加ペプチド
シアノバクテリアポーリン
シクロデキストリンポーリン
シトヘモリシン
細胞毒素アミリン
デフェンシン
デルマセプチン
ジフテリア毒素
ダイバージシンA
ミミズリセニン毒素
エンベロープウイルスE1チャンネル
上皮塩化物チャンネル
上皮Na+チャンネル
FadL外膜タンパク質
フソバクテリアル外膜ポーリン
ギャップ接合形成コネキシン
ギャップ接合形成イネキシン
ジェネラルバクテリアルポーリン
グルコース選択性OprBポーリン
神経伝達物質受容体のグルタミン酸塩ゲート型イオンチャンネル
gp91phox食細胞NADPH−オキシダーゼ−関連cyt b558 H+チャンネル
グラミシジンAチャンネル
H+−またはNa+−転座(translocating)細菌べん毛モータ
H+−またはNa+−転座(translocating)細菌MotABべん毛モータ/ExbBD外膜輸送
ヘリコバクター外膜ポーリン
HP1ホリン
インフルエンザウイルス マトリックス−2チャンネル
昆虫デフェンシン
細胞内塩化物チャンネル
j11ホリン
jAdhホリン
jU53ホリン
ラクタシンX
ラクチシン481
ラクトシンS
ラクトコッシン972
ラクトコッシンA
ラクトコッシンG
大コンダクタンス機械受容イオンチャンネル
ホリンS
神経伝達物質受容体のリガンドゲート型イオンチャンネル
LrgAホリン
LydAホリン
マガイニン
主要な内在性タンパク質(Major intrinsic protein)
メリッチン
金属イオン輸送体(チャンネル)
マイクロシンE492
ミトコンドリアおよび色素体ポーリン
ミコバクテリアポーリン
ニシン
非選択性カチオンチャンネル−1
非選択性カチオンチャンネル−2
ヌクレオシド特異性チャンネル形成外膜ポーリン
OmpA−OmpFポーリン
OmpGポーリン
細胞小器官塩化物チャンネル
外部バクテリア膜セクレチン
外膜補助タンパク質
外膜因子
外膜線毛アッシャーポーリン
外膜ポーリン
外膜受容体
P2ホリンTM
P21ホリンS
ペディオシン
ホスフォレマン
ピロスリン
植物デフェンシン
植物プラスモデスム
植物チオニン
プランタリシンEF
プランタリシンJK
16kDaのプラスチドアウター−エンベロープポーリン
21kDaのプラスチドアウター−エンベロープポーリン
24kDaのプラスチドアウター−エンベロープポーリン
ポリシスチンカチオンチャンネル
ポリグルタミンイオンチャンネル
孔形成エキナトキシン
孔形成ヘモリシンE
孔形成RTXトキシン
PRD1ホリンM
プリオンペプチドフラグメント
シュードモナスシリンゲHrpZターゲット−ホスト細胞膜
シュードモナスOprPポーリン
ラフィノースポーリン
ロドバクターPorCaポーリン
リアノジン−イノシトール−1,4,5−三リン酸受容体Ca2+チャンネル
サポニンチャンネル
志賀毒素Bチェーン
短鎖アミドおよび尿素ポーリン
小コンダクタンス機械受容イオンチャンネル
糖ポーリン
シリンゴマイシンチャンネル
シリンゴペプチンチャンネル
T4ホリン
T4免疫ホリン
T7ホリン
タチプレシン
トルアシンチャンネル
外膜受容体(OMR)−medi−のエナジャイザーのTonB−ExbB−ExbD/TolA−TolQ−TolR
トランジエントレセプターポテンシャルCa2+チャンネル
トライパタイトヘモリシンBL
ツーパートナー分泌ポーリン
タイプB インフルエンザウイルスNBチャンネル
尿素輸送体(チャンネル)
尿素/アミドチャンネル
空胞化シトトキシン
ビブリオキトポーリン/ナイセリアポーリン
電位開口型イオンチャンネルスーパーファミリー
鞭虫スチコソームポーリン
酵母キラートキシンK1
酵母伸展活性化カチオン選択性Ca2+チャンネル
【0027】
本発明のさらなる態様は、水溶性の物質または溶液から、例えば所望の溶質の濃度を増加するため、過剰な水を抽出する水膜の使用を含む。
【図面の簡単な説明】
【0028】
【図1】本発明の一実施形態による水膜の様々な成分を示す図であり、本発明による水膜のサンドイッチ構造を有する例における組み込まれたアクアポリン分子を有する支持された脂質二分子層を有する。
【図2】本発明の一実施形態による水膜の様々な成分を示す図であり、本発明による水膜のサンドイッチ構造を有する例における組み込まれたアクアポリン分子を有する支持された脂質二分子層を有し、アクアポリンチャンネルを含む脂質二分子層は透過性または多孔質の支持体の孔内部にある。
【図3】アクアポリンを含むバイオミメティック膜の設計を記述する図である。図は本発明の他の実施形態による膜の様々な成分を示し、多孔質テフロン(登録商標)膜周囲にはさまれた組み込まれたアクアポリン分子を有する支持された脂質二分子層を有する。
【図4】アクアポリンを含むバイオミメティック膜の設計を記述する図である。図は本発明の他の実施形態による膜の様々な成分を示し、多孔質テフロン(登録商標)膜周囲にはさまれた組み込まれたアクアポリン分子を有し、さらにサンドイッチ構造体に封入された支持された脂質二分子層を有する。
【図5】組み込まれたアクアポリン分子を有する封入されたサンドイッチ構造の脂質二分子層を含む水膜の様々な成分を示す図である。
【図6】本発明の他の実施形態による入口および出口を有するフィルターハウジング内に設置されたときの、本発明の封入された水膜の図である。
【図7】本発明のさらに他の実施形態による水精製システムの様々な成分を示す図である。このシステムは、未精製水の入口要素、二媒体濾過区画、水軟化区画、任意に重亜硫酸塩および苛性添加物、RO1およびR2フィルタを通る追加の精製のためのループを有するポンプに接続された逆浸透性フィルタ1および2(RO1、RO2)、UV消毒区画を有するドレインおよび貯蔵のためのタンクへの出口を備える。
【図8】タンパク質のアクアポリンおよびアクアグリセロポリン群の様々な物質を説明する。
【図9】マイカ上に形成された膜の原子間力顕微鏡像である。膜は例1において記述される手順により調製された。
【図10】本発明のらせん状に曲げられた水膜を備えたフィルタ装置を示す。
【図11】図10の線II−IIに沿った断面図である。
【図12】空気−水界面からの脂質のラングミュア−ブロジェット累積による支持された二分子層の調製を説明する図である。
【図13】ベシクル融合手順を説明する図である。ベシクルは基板に吸着し、支持されて二分子層を形成するよう破壊される。
【図14】スピン−コーティングによる支持された脂質二分子層を説明する図である。
【発明を実施するための形態】
【0029】
生きている細胞は脂質二分子層膜によって囲まれており、細胞を他の細胞および細胞外の媒体から分離する。脂質二分子層膜は基本的に水、イオン、および他の極性分子を透過しない。しかし、多くの例において、そのような物は、しばしば細胞外または細胞内信号に応答して、膜を通って迅速に、および選択的に輸送される必要がある。水輸送という作業は、アクアポリン水チャンネルタンパク質によって成される(Prestonら、1992)。アクアポリンはあらゆる形態において生命にとって非常に重要であり、バクテリアから植物、人間に至るまで、全ての有機体において見出される。アクアポリンは、迅速で高度に選択的な水輸送を促進して、結果的に細胞膜を横切る静水圧差および/または浸透圧差によって細胞がその体積および内部浸透圧を調節することを可能にする。人間におけるアクアポリンの生理学上の重要性は、おそらく腎臓において最も顕著であり、そこでは〜150−200リットルの水が毎日初期の尿から再吸収される、すなわち、水が迅速に体液から回収されなくてはならないとき、アクアポリンに促進された水輸送が起こる。腎臓においては、これはAQP1およびAQP2で示される二つのアクアポリン(11の異なるアクアポリンが人間内部において知られている)によって主に可能になる。植物においても、アクアポリンは根における水吸収に関して、および植物全体の水収支の保持に関して重要である(Agreら、1998、Borgniaら、1999)。様々な有機体および組織における水輸送の研究は、アクアポリンが非常に高い水透過率、一つのチャンネルにおいて1秒あたり〜109のH2O分子(Agre etら、1998,Borgniaら、1999)、を保持すると同時に、狭い孔を有しており、あらゆる大きな分子、イオン(塩)、およびプロトン(H3O+)、水酸化物イオン(OH−)の流れさえも防ぐことを示した。AQP1の最初の高解像度3D構造および関連するグリセロール伝導バクテリアチャンネルタンパク質アクアグリセロポリンGlpFが報告された2000および2001までに(Fuら、2000;Murataら、2000;Renら、2001;Suiら、2001)、水選択性の原因についてはほとんど分かっていなかった。
【0030】
しかしながら、実験的な構造に基づいて詳細なコンピュータモデルが提案され、高い透過率および厳密な水の選択性だけではなく、アクアポリンがプロトンの漏れも防ぐ性能も説明した(de GrootおよびGrubmuller,2001;Tajkhorshidら、2002,Jensenら、2003,Zhuら、2003,de Grootら、2003,BurykinおよびWarshel 2003,Ilanら、2004,Chakrabartiら、2004)。本質的に、アクアポリンチャンネルの構造は、チャンネル内部の静電的調整があらゆる帯電した化学種に対するアクアポリンの選択性を制御する、すなわちプロトンおよび水酸化物イオンと同様にあらゆるイオン(塩)の輸送が行なわれない一方で、水分子が一列のみ通過することを可能にする(de GrootおよびGrubmuller,2001;Tajkhorshidら、2002,Jensenら、2003,Zhuら、2003,de Grootら、2003,BurykinおよびWarshel 2003,Ilanら、2004,Chakrabartiら、2004)。簡単にいえば、これは水分子のみがアクアポリン水孔を通過することを示しているにほかならない。
【0031】
アクアポリンチャンネルの各単位が〜109H2O分子/秒、すなわち、〜4×109分子/チャンネル/秒で輸送を行なう。従って、アクアポリン1gが非常に高い圧力下で1秒あたり〜720リットルの水を輸送することができる。機能性アクアポリンチャンネルを通って濾過された、結果として得られた水は〜100%精製水であり、イオン、粒子、有機物およびコロイドを含有せず、例えば〜100%H2Oから構成される。
【0032】
ここで使用される膜タンパク質のアクアポリンファミリーは、水分子に加えてグリセロールを通すGLpFタンパク質も含む。好ましいアクアポリンはTIP、PIPまたはNIPアクアポリンなどの植物由来のものであり、例えば図8に示される。
【0033】
以下に開示される本発明の膜は水のみを通過させ、その結果逆浸透を通じて水の精製、脱塩および分子濃縮を容易にする。アクアポリンは、水溶液からのバクテリア、ウイルス、無機物、タンパク質、DNA、塩、洗浄剤、溶解した気体、さらにはプロトンを含む全ての不純物の経路を排除することで知られているが、それらの構造のためアクアポリン分子は水を輸送することができる。関連するアクアグリセロポリン(GLpF)のファミリーは、それに加えてグリセロールを輸送することができる。全てのアクアポリンはタンパク質を膜内に固定する膜貫通アルファ−ヘリカルドメイン、およびタンパク質の中央において頂点から頂点に一体となって一種の砂時計型の形態を有する、二つの高度に保存されたNPA(Asn−Pro−Ala)ループを含む。水の動きは対照的であり、どちらの方向へも進むことができることが示された。このプロセスはエネルギーを消費しないので、この事実は重要である。静水圧または浸透圧のために、水は膜を通って特定の方向へと動く。
【0034】
従って、精製水を飲用に適さない水源から得ることができ、またはもしも源水が興味の対象である化学物質を含む場合には、水は選択的に除去されることができ、投入チャンバ内に高濃度の所望の化学物質を残す。しかし、重要なことに、水に対する限定的な選択性以外の理由でもアクアポリンは本発明に適する。このタンパク質ファミリーの多くのものが、機能を失うことなく、汚染された源水の厳しい条件に耐えることができる。アクアポリンは、酸、電圧、洗浄剤、および熱に対する露出による変成または分解に耐性を有する。従って、本発明の膜は、他の膜を汚すまたは破壊する可能性がある材料で汚染された源水を精製するのに使用することができ、一貫して高温にさらされる領域で使用することができる。
【0035】
アクアポリンは突然変異が起き易い。タンパク質は、その最終形状および機能に影響する遺伝子配列に従って宿主細菌内で特異的に発現する可能性があるので、技術者はタンパク質の特性を変えるためにその遺伝子コードを容易に変更することができる。従って、タンパク質は、タンパク質の元々の機能と異なっていてよい所望の用途を満たすように設計されてよい。例えば、システインの水チャンネルの中心近傍の特定のアミノ酸残基を単純に変更することによって、製造されるアクアポリンは溶液中のあらゆる遊離水銀を結合し、妨害に起因して水の輸送が停止するだろう。その結果、膜デバイスにおいて使用されるこれらの突然変異タンパク質は、毒性物質の濃度が非常に高くなったときに単純に流れを停止することによって、水サンプル中の水銀汚染を検出することができる。
【0036】
最後に、新規のタンパク質ベース膜は製造コストが非常に低い。ウシ赤血球から得られたAQP1を有する細胞膜断片を含む脂質ミクロベシクルは、廉価なアクアポリン源である。
【0037】
他の方法では、アクアポリンは人工的に作り出された大腸菌の菌株からミリグラムの量で得られてよい。それを製造している培養液1リットルあたり約2.5mgの純粋なタンパク質が得られてよい。米国出願公開第20040049230号明細書を参照されたい。
【0038】
従って、我々は汚れた、塩を含む、または他の方法で汚染された水からの、完全に純粋な水の高効率な製造を実現するためここに生物学的成分を使用する方法および装置を開示する。本発明は、水輸送生物学的タンパク質と外部装置との統合を実行し、水精製装置の大規模な製造を可能にする製造経路に対する方向性を示す。
【0039】
本発明の第1の態様
本発明の上述の第1の態様において、水膜は機能性アクアポリン水チャンネルを含む少なくとも一つの脂質二分子層によって分離された少なくとも二つの透過性支持体層を有するサンドイッチ構造体を含む。
【0040】
本発明の第1の態様の水膜は、結果的に、表1に記載された脂質を含む膜など、両親媒性の脂質膜からなる。その結果、脂質二分子層は本質的にリン脂質、ホスホグリセリド、スフィンゴ脂質およびカルジオリピンからなる群、同様にそれらの混合物から選択される両親媒性の脂質からなり、例えば1,2−ジパルミトイル−sn−ホスファチジルコリン(DPPC)、またはリン脂質の混合物などのリン脂質である。
【0041】
他の方法では、脂質二分子層は本質的に重合可能な脂質からなるか、またはそれらを含んでよい(表1を参照)。
【0042】
このように、本発明の水膜は、多孔質支持体の上に再構成されたアクアポリン水チャンネルを含む。本発明による水膜の調製に関して親水性表面を有する有用な支持体材料は、好ましくは、マスコバイトなどのマイカ、マイカテープ、ポリスルホン、AlO2、および親水表面を有する重合体材料、例えばセルロースから選択される。支持体材料は本質的に平面状であるが、これは支持体が平面であることが好ましいことを意味するのであって、例えばらせん状に巻いたフィルタが製造されるとき必要とされるように、支持体の湾曲も許容される。この場合、例えばセルロース膜など、支持体材料が柔軟であることが好ましい。
【0043】
多孔質支持体は、好ましくはマイカなど、親水性表面を持つ本質的に平面な構造を有する材料であって、例えばエッチングによってミクロ孔またはナノ孔が形成された材料を含んでよい。従って、第1の態様の実施形態において、透過性支持体層は本質的に平面の、親水性層を含み、該親水性層はマイカまたはマイカテープを含み、層の厚みはmmからμmのスケールであって、およそ50nm未満(典型的には10−40nmの範囲)の直径を有するナノ孔が形成されている(例えばトラックエッチ技術などのエッチングによって)。マイカは、好ましくはマスコバイトである。
【0044】
透過性支持体層も、シリコーン膜、ポリスルホン、AlO2、および親水性表面を有するセルロースなどの重合体からなる群から選択される膜など、親水化膜表面を含んでよく、およそ50nm未満(典型的には10−40nmの範囲)の直径を有するナノ孔が形成されている。
【0045】
アクアポリンチャンネルを含む脂質膜は、生物学的な細胞膜の天然の構成に類似した二分子層であってよく、または脂質膜は融合した累積された脂質ベシクルの複数の二分子層からなるものであってよい。脂質は、例えばリン脂質(またはホスホグリセリド)、スフィンゴ脂質およびカルジオリピンなど、好ましくは両親媒性である。多孔質基板上に脂質層を累積するとき、アクアポリンチャンネルは好ましくは支持体材料中の予め存在する孔に隣接してまたは孔内に累積されてよい。
【0046】
本発明の好ましい実施形態において使用される透過性または多孔質支持体は、R.M.Webber,J.L.Anderson,M.S.John,Macromolecules 23(1990),1026−1034に従って調製されることが好ましく、そこでは以下のように記述されている。
【0047】
「膜はマスコバイトマイカの薄いシート、厚さ約7nm、からトラックエッチ技術によって作成された。トラックエッチされた膜で、孔はフッ化水素酸溶液でカリホルニウム252源からの視準された核分裂片によって生成されるトラックをエッチングすることによって形成される。孔の数(n)は、核分裂源に対する膜の露出時間によって制御され、一方で孔半径はエッチング時間、温度、およびフッ化水素酸水溶液バスの濃度によって決定される。孔のサイズは均一であり、膜表面に対して垂直である。孔サイズの分布が大きいことは、より大きな孔を通ってバイアスされた流れに起因して、重合体層の流体力学的厚みに関する曖昧な結果につながるため、孔サイズの均一度はこれらの膜の重要な特徴である。膜の照射部分に関する孔の断面積分率はおよそ1%であった。従って、二項式孔サイズ分布によってモデル化されたとき、単一孔の全数は96%よりも大きかった。孔は膜面に対して垂直なので、孔の長さ(1)は膜の厚みに等しかった。厚みは既知の膜寸法および重量から決定された。」
【0048】
孔の最終的な数および分布を得ることが好ましく、それは脂質層中のアクアポリンチャンネルの数および分布におよそ等しい。
【0049】
本発明の第2の態様
例えばテフロン(登録商標)フィルムなど、疎水性表面を有する多孔質支持体膜の周囲に構築された平面脂質二分子層中のアクアポリン水チャンネルを再構成することも可能であり、脂質単分子層が多孔質支持体膜の各側に構築される。多孔質支持体膜の孔中で脂質二分子層が構築され、アクアポリン水チャンネルが再構成されてよい。
【0050】
本発明の第2の態様は、少なくとも二つの脂質単分子層を有するサンドイッチ構造体を含む水膜によって構成され、一つの二分子層に構築されるとき、機能性アクアポリン水チャンネルを含み、前記少なくとも二つの脂質単分子層が少なくとも一つの透過性支持体層によって分離される。典型的には、支持体層は疎水性の孔が形成された材料を含み、該材料は脂質単分子層と接触表面を形成し、脂質二分子層は疎水性の孔が形成された材料の穿孔内に形成される。
【0051】
疎水性材料は疎水性の程度が脱イオン水と疎水性材料との間の接触角にして少なくとも100°に相当することが好ましく、接触角の測定は20℃および大気圧で実施されるが、疎水性の程度は高いことが好ましく、例えば接触角が少なくとも105°、110°、120°および120°に相当する。好ましくは、疎水性材料はパラフィルムまたはテフロン(登録商標)である。
【0052】
疎水性材料は典型的には平面であり(しかし、柔軟であって、その結果曲がってもよい)、孔は典型的には均一に分布され、疎水性材料の二つの表面間の中間の平面内で実質的に全てが実質的に同じ幾何学的形状を有する。疎水性材料中の孔の形成に関する詳細は以下に与えられる。
【0053】
「中間の平面」は、平面疎水性材料の二つの表面のどちらに対する垂直距離も同じである点からなる平面として定義される。
【0054】
疎水性材料の孔サイズは、両親媒性脂質の安定な二分子層が孔の中で形成され得ることを確実にするのみであり、従ってそれらはnm、μmまたはmmの範囲のサイズを有してよい。
【0055】
疎水性材料は、好ましくは材料において孔が形成された面積と孔が形成されていない面積との比が最大になるように孔を形成される。なぜなら、これによって水輸送をもたらすアクアポリンを有する脂質二分子層の面積を最大にするためである。孔によって構成されたパターンは、各孔間の距離のように結果的に重要である。最適なパターンは、パターン内部の各孔の間の「壁厚み」を最小にして孔を六角形に配列するものである。しかしながら、正方形のようなパターンであっても十分であると判明するかもしれない。
【0056】
したがって、本発明の第2の態様の水膜は、表1に記載される脂質を含む膜など、両親媒性脂質膜も含む。結果的に、脂質二分子層は本質的にリン脂質、ホスホグリセリド、スフィンゴ脂質およびカルジオリピンからなる群、同様にそれらの混合物から選択される両親媒性脂質からなり、例えば1,2−ジパルミトイル−sn−ホスファチジルコリン(DPPC)、またはリン脂質の混合物などのリン脂質である。第1の態様との相違は、疎水性支持体に孔が形成される領域において主に膜が二分子層を構成するのみであることであり、それに対して脂質はそれらの疎水性末端を疎水性支持体に向け、親水性末端を水性の環境に向けて組織化される。
【0057】
二分子層の調製
膜材料の固有の透過性は安定でなくてはならない。透過性の低い材料は好ましいが、しかしながら、同時に頑強であって、かつアクアポリンを組み込むことができ全体が安定で密度の高い2D濾過配列を構成しなくてはならない。支持された脂質二分子層を調製するために様々な手法が一般的に使用される。簡単な技術は、ラングミュア−ブロジェット法である。適切な有機溶媒中の脂質溶液はラングミュアトラフ内の水性副層上に展開され、有機溶媒は蒸発される。一対の可動性隔壁が脂質膜を所望の表面圧力まで横方向に圧縮するのに使用される。その後、基板は膜を通って垂直に通過し、それによって一分子の厚さの脂質層(単分子層)を基板上部に移動する(図12参照)。第2の単分子層は、基板をもう一度フィルムを通して通過させることによって移動されてよい。全部で三つの単分子層が垂直(ラングミュア−ブロジェット)累積法によって移動されるが、第4の膜は最後の層に関して水平累積、いわゆるラングミュア−シェーファー(LS)を用いて移動されてよい。この方法は様々な脂質で使用されてよい。天然の生物学的膜はしばしば非対称である。LBおよびLSのどちらも非対称二分子層の調製の可能性を提供する。これは、累積の間に副層上の脂質膜を変更することによって行なわれる。
【0058】
支持体二分子層を調製する他の方法が、ベシクル融合法である(BrianおよびMcConnell 1984)。小さな単層ベシクル(SUV)の溶液が親水化シリコンまたは新たに切断されたマイカの切片表面上に塗布される。このサンプルが低温(4℃)に置かれるとき、ベシクルは表面と融合して連続的な二分子層を形成する(図13)。いかなる理論にも束縛されることなく、ベシクルは最初基板表面に吸着し、その後融合して平坦でパンケーキのような構造体を形成し、最終的に分裂および散開して結果的に表面上に単一の二分子層をもたらすと仮定されている(ReviakineおよびBrisson 2000)。基板との融合の後、基板と直接接触するベシクルの一部分のみが支持された二分子層になることも示された(Leonenkoら、2000)。このメカニズムで、最も曲率の高い末端においてベシクルが分裂し、二分子層の上部分は基板表面へと移動して、形成され支持された二分子層のサイズを増加する可能性がある。溶液を基板上部に塗布後数分で二分子層が形成されることが報告されたが(Tokumasuら、2003)、この短い放置時間は不完全な二分子層をもたらす可能性がある。数時間または終夜放置も報告されている(Reimhultら、2003、Riniaら、2000)。
【0059】
支持された二分子層を調製するために使用することができる第3の技術はスピンコーティングである(Reimhultら、2003、SimonsenおよびBagatolli 2004)。スピンコーティングにおいて、脂質は適切な溶媒に溶解され、液滴は基板上に配置され、その後溶媒が蒸発して脂質コーティングが生成される間回転される。脂質溶液の濃度に依存して、スピンコートされた膜は一つ以上の脂質二分子層からなる。しかしながら、水和すると複数層は不安定な様子を示し、通常は表面上にただ一つの支持された二分子層が残る(図14)。この手順は容易かつ迅速であり、中間体(DPPC)および非常に高い転移温度(セラミド)を有する脂質と同様に、低融点脂質(POPC)で実行されている。有用な脂質は、例えばリン脂質および両親媒性脂質を含む。
【0060】
タンパク質またはペプチドの支持された二分子層中にさらにペプチドおよびタンパク質を組み込みたいとき、ベシクル融合法は最も応用性が高い。言及された他の手順は有機溶媒中におけるタンパク質またはペプチドの可溶化を含むためである。多くの膜タンパク質は、特にそれらが膜のどちらかの側において水溶液に露出される大きなドメインを含む場合、有機溶媒中で変性する可能性がある。従って、ペプチドまたはタンパク質をベシクル中に挿入することが好ましい。多くのペプチドおよびアクアポリンなどのタンパク質は、ベシクルの形成より前に有機溶媒中で脂質と共可溶化されることができ、ペプチドを含むベシクルはその後基板に塗布される。これは数多くのペプチド、例えばWALP(Riniaら、2000)、グラミシジン(Mouら、1996)、クラバニンA(van Kanら、2003)、およびアミロイドβタンパク質(Linら、2001)で実行されてきた。アクアポリンなどの膜タンパク質は、好ましくは他の手法によってベシクル内部に挿入される。これはここに組み込まれる2005年2月MEMPHYS−center for biomembrane physics,Physics Department,University of Southern Denmark and Dansih Polymer Centre, Riso National Laboratory, DenmarkのDanielle Kellerによる論文「Supported bilayers as models of biological membranes」イントロダクションから第4章の41−45頁においてモデルタンパク質としてシトクロムcオキシダーゼに関して記述されるように、膜タンパク質のベシクル内部への再構成のための戦略を用いて実行されてよい。
【0061】
別個の2D配列の複数層の積層体は可能であり、望ましいと考えられる。積層された配列の最終寸法は全体の頑強さおよび選択された膜材料/膜組成に固有の透過性に依存する。積層は、タンパク質が単一に、おそらく支持された脂質二分子層に自明に埋め込まれたシステムから逸脱するかもしれない。その後支持された二分子層上で一連のベシクルが崩壊する事象は、前もって必要とされるベシクルが適切なアクアポリンと再構成されるならば、複数層濾過単位装置を提供する可能性がある。積層単位装置を安定させる膜または安定させる重合体マトリックス内部へ組み込むこと、その後これらの個々の単位を綴じることは、最終的に自己組織化プロセスを通じて、全体の濾過メッシュを与えるだろう。
【0062】
本発明の態様の共通の特徴
本発明の様々な態様に関する多くの特徴がある。
【0063】
本発明による水膜の調製に関する有用なアクアポリンは、AQP1、TIP、PIP、NIP、図8を参照、および混合物およびそれらのハイブリッドである。例えば人に害を及ぼす病原性ウイルスおよびプリオンなど、不純物を含有するリスクが大幅に低減されるので、植物由来のアクアポリンは特に望ましい。加えて、植物アクアポリンは植物の自然発生物であり、過剰発現される可能性があり、植物中で生成される。
【0064】
従って、アクアポリン水チャンネルは、好ましくは、例えばGLPAチャンネル、GLPB1チャンネル、GLPB2チャンネル、GLPB3チャンネル、およびGLPY2チャンネルなどのアクアグリセロポリン(GLpF)、およびそれらの混合物およびそれらのハイブリッドからなる群から選択される。
【0065】
本発明の水膜は、好ましくは、剛直または柔軟であってよい安定化させる透過性のまたは多孔質の膜内に囲まれ、該膜は精製される水性液体から粗い粒子状物質を取り除く前置フィルタと同様に水膜を保護するはたらきをしてよい。他の方法では、またはそれに加えて、本発明の水膜はフィルターディスク上に累積されて、水フィルタを形成してよい。
【0066】
本発明の水膜を囲うため任意に使用される安定化する膜に有用な材料は、相対的に小さな孔サイズを有するミクロ多孔質シリコーン膜であり、室温近傍または約50℃以下で固化する。
【0067】
アクアポリンの再構成および脂質二分子層の形成に有用な脂質は、POPC、DPPC、セラミド、表1参照、およびそれらの混合物である。
【0068】
表1は本発明の水膜において使用される脂質二分子層の形成に有用な脂質のリストである。
【0069】
ホスファチジルコリン:
1,2−ジミリストイルホスファチジルコリン(DMPC)
1,2−ジパルミトイルホスファチジルコリン(DPPC)
1,2−ジステアロイルホスファチジルコリン(DSPC)
1,2−ジオレオイルホスファチジルコリン(DOPC)
1,2−ジミリストレオイルホスファチジルコリン
1,2−ジパルミトレオイルホスファチジルコリン
1,2−ジペトロセリノイルホスファチジルコリン
1,2−ジエライドイルホスファチジルコリン
1,2−ジリノレオイルホスファチジルコリン
1,2−ジリノレノイルホスファチジルコリン
1,2−ジエイコセノイルホスファチジルコリン
1,2−ジアラチドノイルホスファチジルコリン
1,2−ジエルコイルホスファチジルコリン
1,2−デナボノイルホスファチジルコリン(1,2−dnervonoylphosphatidylcholine)
1−パルミトイル−2−オレオイルホスファチジルコリン(POPC)
1−パルミトイル−2−リノレオイルホスファチジルコリン
1−パルミトイル−2−アラキドノイルホスファチジルコリン
1−パルミトイル−2−ドコサヘキサノイルホスファチジルコリン
1−ステアロイル−2−オレオイルホスファチジルコリン(SOPC)
1−ステアロイル−2−リノレオイルホスファチジルコリン
1−ステアロイル−2−アラキドノイルホスファチジルコリン
1−ステアロイル−2−ドコサヘキサノイルホスファチジルコリン
1−オレオイル−2−パルミトイルホスファチジルコリン
1−オレオイル−2−パルミトイルホスファチジルコリン
1−オレオイル−2−ステアロイルホスファチジルコリン
1,2−ジドコサヘキサノイルホスファチジルコリン
【0070】
ホスファチジルエタノールアミン:
1,2−ジミリストイルホスファチジルエタノールアミン(DMPE)
1,2−ジパルミトイルホスファチジルエタノールアミン(DPPE)
1,2−ジステアロイルホスファチジルエタノールアミン(DSPE)
1,2−ジオレオイルホスファチジルエタノールアミン(DOPE)
1−パルミトイル−2−オレオイルホスファチジルエタノールアミン(POPE)
1−パルミトイル−2−リノレオイルホスファチジルエタノールアミン
1−パルミトイル−2−アラキドノイルホスファチジルエタノールアミン
1−パルミトイル−2−ドコサヘキサノイルホスファチジルエタノールアミン
1−ステアロイル−2−オレオイルホスファチジルエタノールアミン(SOPE)
1−ステアロイル−2−リノレオイルホスファチジルエタノールアミン
1−ステアロイル−2−アラキドノイルホスファチジルエタノールアミン
1−ステアロイル−2−ドコサヘキサノイルホスファチジルエタノールアミン
1,2−ジエライドイルホスファチジルエタノールアミン
1,2−ジリノレオイルホスファチジルエタノールアミン
1,2−ジリノレノイルホスファチジルエタノールアミン
1,2−ジアラキドノイルホスファチジルエタノールアミン
1,2−ジドコサヘキサノイルホスファチジルエタノールアミン
1,2−ジパルミトレオイルホスファチジルエタノールアミン
【0071】
ホスファチジルグリセロール:
1,2−ジミリストイルホスファチジルグリセロール(DMPG)
1,2−ジパルミトイルホスファチジルグリセロール(DPPG)
1,2−ジステアロイルホスファチジルグリセロール(DSPG)
1,2−ジオレオイルホスファチジルグリセロール(DOPG)
1−パルミトイル−2−オレオイルホスファチジルグリセロール
1−パルミトイル−2−リノレオイルホスファチジルグリセロール
1−パルミトイル−2−アラキドノイルホスファチジルグリセロール
1−パルミトイル−2−ドコサヘキサノイルホスファチジルグリセロール
1−ステアロイル−2−オレオイルホスファチジルグリセロール(SOPG)
1−ステアロイル−2−リノレオイルホスファチジルグリセロール
1−ステアロイル−2−アラキドノイルホスファチジルグリセロール
1−ステアロイル−2−ドコサヘキサノイルホスファチジルグリセロール
【0072】
ホスファチジルセリン:
1−パルミトイル−2−オレオイルホスファチジルセリン(POPS)
1−パルミトイル−2−リノレオイルホスファチジルセリン
1−パルミトイル−2−アラキドノイルホスファチジルセリン
1−パルミトイル−2−ドコサヘキサノイルホスファチジルセリン
1−ステアロイル−2−オレオイルホスファチジルセリン(SOPS)
1−ステアロイル−2−リノレオイルホスファチジルセリン
1−ステアロイル−2−アラキドノイルホスファチジルセリン
1−ステアロイル−2−ドコサヘキサノイルホスファチジルセリン
1,2−ジミリストイルホスファチジルセリン(DMPS)
1,2−ジパルミトイルホスファチジルセリン(DPPS)
1,2−ジステアロイルホスファチジルセリン(DSPS)
1,2−ジオレオイルホスファチジルセリン(DOPS)
1,2−ジドコサヘキサノイルホスファチジルセリン
1,2−ジエルコイルホスファチジルセリン
【0073】
特別な脂質:
カルジオリピン
二極性脂質
天然脂質抽出物:
卵黄ホスファチジルコリン
ウシ心臓ホスファチジルコリン
脳ホスファチジルコリン
ウシ肝臓ホスファチジルコリン
大豆ホスファチジルコリン
大腸菌ホスファチジルエタノールアミン
ウシ心臓ホスファチジルエタノールアミン
脳ホスファチジルエタノールアミン
ウシ肝臓ホスファチジルエタノールアミン
卵ホスファチジルエタノールアミン
ウシ肝臓ホスファチジルイノシトール
大豆ホスファチジルイノシトール
脳ホスファチジルセリン
大豆ホスファチジルセリン
【0074】
重合可能脂質:
1,2−ジ−10,12−トリコサジノイル−sn−グリセロ−3−ホスホコリン(DTPC)
1,2−ジ−10,12−トリコサジノイル−sn−グリセロ−3−ホスホエタノールアミン(DTPE)
1−パルミトイル−2,10,12−トリコサジノイル−sn−グリセロ−3−ホスホエタノールアミン(PTPE)
DC8,9PC[l,2−ビス(10,12−トリコサジノイル)−sn−グリセロ−3−ホスホコリン]
diPhyPC[l,2−ジフィタノイル−sn−グリセロ−3−ホスホコリン]
【0075】
水処理システムおよび水濾過装置
本発明の一つの実施形態は従来のフィルターディスクの形態を有するが、それは機能が容易に評価されるためである。そのようなディスクを作製するために、機能性アクアポリンタンパク質を含むリン脂質膜の二分子層が、ラングミュア−ブロジェットトラフを用いて、25mmの市販の限外濾過ディスク表面上に累積される。本発明の好ましい実施形態において、従来の膜とともに水膜はらせん状に巻かれ、図10および11に参照されるように、らせん巻きROモジュールを形成する。
【0076】
フィルターディスクは入口および出口を有する密閉されたチャンバ内に設置され、例えばフィルターディスクチャンバがチューブを通じてポンプを有する水源に連結され、該ポンプが強制的に加圧された源水を膜を通して出口から排出する。純粋な水だけが膜の反対側へ通り抜けるとき、装置は機能的であると考えられ、汚染された溶質は元のチャンバ内で濃縮されている。汚染された溶液は、純粋な水がより多くの溶解粒子を有するチャンバの区画内に流れ込む自然な傾向に打ち勝つために、その結果飲用水において約10psiである水の浸透圧に打ち勝つために、加圧される必要がある。浸透性を逆にして、汚染された溶液から純粋な水を分離することが、本発明の水膜の目的である。システムのこの傾向、または浸透圧、は1平方インチあたりのポンド(psi)で表現されてよい。例えば、海水の浸透圧は360から400psiの範囲である。
【0077】
装置がこれらのタイプの圧力に耐えることを可能にするために、幾つか使用可能な方法がある。一つの方法は、非毒性かつ容易に除去可能な溶質を新鮮な水のチャンバに高濃度で添加して、チャンバ加圧に起因して逆浸透が起こっている間、膜を通る通常の浸透を促すことである。また、逆浸透に必要とされる圧力は、連続して汚染物質の濃度が低くなる、密閉され連結された段階的なチャンバで複数のアクアポリン膜を使用することによって低減される可能性がある。チャンバの各対において水を精製するのに必要とされる結果的な圧力は、逆浸透に必要な全圧力の一部である。従って、各膜は小さな圧力に耐えるのみであり、損なわれずに維持される可能性が高くなる。そこで、各チャンバ対間の濃度の差が、100%である代わりに、単に10%であるならば、上述の高い圧力の10%だけが各接続部で源水を精製するのに必要とされるだろう。純粋な水は一定の圧力および流れで最終チャンバにおいて連続的に製造されるだろう。
【0078】
アクアポリン逆浸透膜は、いくつかの異なる種類の汚染物質を有する水を単一の段階のみで精製することができる。従来の高純度システムは、精製水が製造され得る以前に、連結して使用されるため配置される水軟化剤、炭素フィルタ、イオン交換器,UVまたは化学殺菌、および二経路逆浸透膜を含んでよい幾つかの要素を必要とする。この複雑な設備は、アクアポリン膜が可能であるように、溶解された気体または150ダルトン未満の物質を源水から除去することができない。さらに、これらの部品全てのメンテナンスが必要である。UVバルブは交換およびエネルギーを必要とする。イオン交換器はそれらが充満されたら化学的に再生される必要がある。軟化剤は塩を必要とする。炭素および逆浸透カートリッジはそれらが汚れたときには交換されなくてはならない。最後に、単一段階装置は、非常に少ない空間および典型的な精製システムよりも非常に少ない重量を必要とするであろうし、この利点は可搬性の本発明のアクアポリン水膜を含む装置によって可能になる。
【0079】
アクアポリン膜は、従来のシステムと比較して迅速である。従来の高速逆浸透ユニットは1分あたり約28.4リットル(7.5ガロン)のきれいな水を製造することができる。現在の研究は、アクアポリン飽和脂質膜(0.0177mm2)を通過する水分子の動きが54μmol/secであることを示す(Pohl,P.,Saparov,S.M.,Borgnia,M.J.,およびAgre,P.,(2001),Proceedings of the National Academy of Sciences 98,p.9624−9629)。このように、理論的な1.0m2の表面積を有するアクアポリン逆浸透膜は、1分あたり純粋な水を3295リットル濾過できる可能性がある。その速度は通常の精製器と比較して116倍以上である。
【0080】
本発明は、さらなる態様において、化学的、放射線学的、生物学的、および/または粒子状の汚染物質をそこから除去するために水を処理するシステムに関し、そのようなシステムは外部水源と連結するため配置された入口を有する一体のハウジングを備えるものであって、前記一体のハウジングは内部に一つ以上の水濾過ユニットを配置されていて、該水濾過ユニットは外部水源からの水を処理して超純水流を製造するため配置された本発明の水膜を備え、そのような一体のハウジングは前記超純水をそこから排出する出口を備える。そのような処理システムの例は逆浸透濾過デバイスである。
【0081】
しかしながら、本発明の水膜を機能性アクアポリンを含む他の膜と交換することもまた可能である。例えば米国特許出願公開第2004/049230号明細書に教示されるアクアポリン含有膜である。そのような水処理システムおよびここで記載される濾過装置は、アクアポリン含有膜がどのようなものであるかに関わらず、それら自身が当然に独創的である。
【0082】
従って、本発明は塩水源から脱塩水を製造するための逆浸透水濾過装置も含み、前記脱塩水は灌漑農業のためにおよび/または可搬性の水として有用であって、最終的な逆浸透濾過膜の少なくとも一つが、本発明の膜のような機能性アクアポリン水チャンネルを含む水膜によって代替されている。同様に、本発明は原水源から超純水を製造するための逆浸透水濾過装置も含み、前記超純水は半導体産業および/または製薬産業において有用であって、最終的な逆浸透濾過膜の少なくとも一つが、機能性アクアポリン水チャンネルを含むそのような水膜によって代替されている。また、本発明は地方自治体の水産業、化学産業、飲用水産業、食品産業、電子産業、オイルおよびガス産業、精製産業、パルプおよび製紙産業、金属産業、鉱業、および電力産業において原水源から純水を製造するための逆浸透水濾過装置に関し、最終的な逆浸透濾過膜の少なくとも一つが、機能性アクアポリン水チャンネルを含むそのような水膜によって代替されている。典型的には、水の流れを駆動するために前記水膜の下流側に浸透圧が適用される。浸透圧は典型的に精製される水源と比較して大きな浸透圧を有する濃縮された溶液から生じる。
【0083】
本発明は、尿、乳および汗/発汗などの体液から抽出および回収するための水濾過装置にも関し、本発明の水膜などの機能性アクアポリン水チャンネルを含む。
【0084】
本発明の水精製システム/濾過装置は、水流を前処理し、そこから粒子状汚染物質の少なくとも一部を除去するため、水膜ユニットの上流に粒子濾過モジュールをさらに含んでよい。
【0085】
そのような粒子濾過モジュールは下流の水濾過ユニットの負荷を低減するよう機能して、水流が十分に流れるために必要とされる圧力をより低くして、それによってシステム全体のエネルギー消費およびその操作効率をよくする。
【0086】
粒子濾過モジュールは好ましくは(a)中空繊維膜セパレータ、および(b)限外濾過エレメントからなる群から選択される一つ以上の濾過エレメントを含む。複数の中空繊維膜セパレータおよび限外濾過エレメントは交互に使用されてよく、そのような特定の濾過モジュールの粒子除去性能を最大にする。
【0087】
濾過エレメントは、好ましくは、従来技術でよく知られる、タンジェンシャルフローまたはクロスフロー濾過装置を含み、濾過表面の障害を防ぐ。
【0088】
そのような粒子濾過モジュールが個々のフィルタにおいて不具合を生じる脆弱性を低減するために、および個々のフィルタの洗浄およびメンテナンスの間のシステム停止時間を低減するために、そのような粒子濾過モジュールは好ましくは複数の平行に配列された濾過エレメントを備え、それらは各々水流に対して独立した濾過経路を提供する。
【0089】
そのような粒子濾過モジュールの上流の予備的濾過が用いられることが好ましく、水流から大きな粒子(固体粒子、胞子、およびバクテリア)を濾過するように、および下流の粒子濾過モジュールにおいて使用されるフィルタの寿命を延ばすように、例えば約10μmから約20μmの範囲の多孔性を有してよい。
【0090】
そのような汚染物質除去ユニットは、水流からイオンを除去するためナノ濾過(NF)モジュールまたは逆浸透(RO)モジュールを含んでよく、ROモジュールはそのようなプロセスに従来使用されてきて効果的であることがわかっている。さらにナノ濾過はROモジュールと比較して必要とされる圧力、エネルギーおよび水消費が少ない。
【0091】
本発明の水処理システムは水力溜タンクをさらに含んでよく、システム内で均一の圧力を保持し、下流の水消費設備に対して実質的に一定の水供給を提供する目的でその内部には処理された水が流される。
【0092】
本発明の水処理システムは、水質監視モジュールをさらに含んでよく、該モジュールは処理される水流の水質の指標である一つ以上の変数(例えば、塩素濃度、pH値、伝導性、全有機炭素、溶解酸素、化学的酸素要求量、濁度および放射能を含むが、これらに制限されない)を連続的に監視し、そのような変数に関して前もって得られた値から決定されたベースライン値とそのような値とを比較し、そのようなベースライン値からの重大な偏差を同定し、前記偏差を示す出力信号を作り出す。そのような値の正確な測定を行なうために自動センサが使用されてよく、定期的に不連続な水サンプルを収集するためにサンプラーが使用されてよく、それによって偏差が起こったとき、時間枠からサンプルを分離することを可能にする。そのような偏差の原因となった水中の汚染物質を同定するために、そのようなサンプルに対して様々な分析手順がその後実行されてよい。この水質監視モジュールは、必要なときに水処理システムを起動または停止するように、および/または水質が予め決められた飲用水品質基準に達していないことを関係者に通報するようにさらに機能してよい。
【0093】
本発明の水処理システムは固定されるか、または可搬性のどちらであってもよい。それは、好ましくは、車両輸送および配置用に構築されおよび準備され、離隔された場所に水供給を提供するために使用されてよい。
【0094】
本発明のシステムは、システムの信頼性およびシステム全体の性能を高めるために、平行および/または連続的に冗長な方法で、様々な要素で構成されることができる。ここで記述されるシステムおよび実施形態は水から汚染物質を完全に除去するために機能的冗長性を使用してよいことはさらに認識される。
【0095】
このシステム/水濾過装置は水を精製するのに有用であり、上述のように、本発明は精製された水を調製する方法にも関し、前記方法は水が本発明のシステム/装置を通過することを含む。このように、得られた水は、例えばイオン、粒子、有機物およびコロイドを基本的に含まない。なぜなら、それらの部分は装置中に保持されているためである。
【0096】
本発明の疎水性膜
上記本発明の第2の態様、すなわち脂質単分子層が両側に並ぶ中間支持層に疎水性材料を含む水膜、の開示から分かるように、均一の形状およびサイズを有する孔が均一に分散された疎水性膜の形態で材料を調製することが可能である。そのような疎水性膜はそれ自体独創的である。
【0097】
従って、本発明は複数の孔を含む疎水性重合体膜にも関し、前記孔は膜内で均一に分布し、膜の二つの表面間の中間平面において実質的に全てが実質的に同じ幾何学形状である。そのような孔の各々が十分に大きな開口領域を有して、水蒸気の通過を可能にするが、液体の水の通過を防ぐよう十分小さく、例えば面積は100nm2−1mm2の範囲であり、膜はGoretex(登録商標)などの材料と同じように機能する、すなわち膜は通気性であるにもかかわらず防水である。孔のサイズおよび形状が非常によく制御されているので、本発明の膜はGoretex(登録商標)膜のような材料より優れていると考える。
【0098】
ここでの意味で用語「疎水性膜」は実質的に平面の疎水性材料を示す。平面材料に曲面形態(すなわち、材料が軸の周囲に巻かれる場合)を付与することができるように膜は典型的には柔軟であり、結果的に疎水性膜を服の繊維および他の柔軟な構造体の一部として、適切なものにする。
【0099】
孔は典型的には、μmの範囲など、nmからmmの範囲において最大の断面長さを有し、膜は典型的にはmmからμmの範囲の厚みを有する。
【0100】
典型的には、孔の幾何学的形状は円および楕円から選択される。フィルム内の孔の導入に関してレーザ装置を使用するとき、どちらの形状も容易に得られ、例えば円形の孔は静止レーザビームを用いて得られ、それに対して露出の間レーザビームに対して膜を動かすことによって(膜またはレーザビームのどちらかの動きによって)、楕円形または棒形状の孔が与えられる。好ましい実施形態において、全ての孔が同じ寸法を有する。膜材料は典型的には本発明の第2の態様の開示に関連して上述の疎水性材料から選択される。
【0101】
本発明は特定の実施形態に関して記述されてきたが、多くの変更、修正、および実施形態が可能であり、従って、そのような全ての変更、修正、および実施形態は本発明の精神および範囲の範疇にあると解釈されることは理解されるであろう。ここで引用される全ての参考文献は参照のためここに全て組み込まれる。
【0102】
本発明のさらなる態様、特徴および実施形態は、これ以降の開示および添付されるクレームからより完全に理解されるだろう。
【0103】
例1
DPPC脂質ベシクル内のAPQ−1の再構成(タンパクリポソーム)
【0104】
本発明による水膜を調製するのに以下の手順が使われてきた。
1.小さな単層ベシクルの調製(SUV)
a.乾燥DPPC脂質はミリQ水に懸濁され、1.3−1.5mMの濃度にされる。
b.懸濁液は55℃で1時間放置することによって水和され、多重層ベシクルとなる(MLV)。
c.SUVは二つの100nmポリカーボネートフィルタを通してMLV溶液を12回押し出すことによって調製される。
d.SUV溶液は55℃で保存される。
【0105】
2.BioBeadsTMの調製(ポリスチレンビーズ)
a.約4gのBioBeadsTMはミリQ水で5回すすがれる。
b.すすがれたBioBeadsTMは水を吸入しながら1時間超音波で分解される。
【0106】
3.再構成
a.適当な体積のSUV溶液がエッペンドルフ管にピペットで移される。
b.20% Triton X−100が50μl添加される。
c.Zeidel et al.(1992)によって記述された方法に従って精製されたリン酸緩衝液内の変性された形態のAQP−1(濃度0,5mg/ml)10μlが添加される。
d.最終的な体積が200μlになるまでミリQ水が添加される。
e.溶液は15分間振とうする間室温に保たれる。
f.約75mgのすすがれたBioBeadsTMが溶液に加えられ、その後30−45分間振とうされる間保温される。
g.溶液は清浄なエッペンドルフ管内部にピペットで移される。
h.段階f.−g.は3回繰り返される(合計4回のBioBeads)。
i.タンパクリポソームの準備ができる。
【0107】
図9はマスコバイト上のDPPC膜の原子間力顕微鏡(AFM)像、およびDPPC膜中の再構成されたAQP1の像を示し、再構成が目的どおりに行なわれていること、および結果として得られるベシクルの支持体二分子層が形成されていることを示す。写真中の小さな円形構造の面積は写真中で測定すると約36nm2である。これは脂質二分子層内のタンパク質の表面積とよく対応する。平均(三つの異なる領域からの異なるサイズの六つの像)では、タンパク質が表面の48%、および脂質が52%を覆っている。脂質の面積を0.5nm2と仮定すると、計算された脂質−たんぱく質比(LPR)は77である。支持された二分子層はLPRが50で調製されたタンパクリポソームのベシクル融合によって形成された。
【0108】
例2
図1によって概略説明される、水膜を得るための多孔質マスコバイト上の脂質二分子層および場合によりさらなる複数の二分子層の形成
1.マスコバイトマイカ切片(約1cm2)はテープに切断される。
2.切断直後に例1のタンパクリポソーム溶液25μlがマイカ表面に塗布される。
3.サンプルは室温(21℃)で10分間保温され、融合された二分子層を形成する。
4.サンプルは保温後ミリQ水で7回すすがれ、過剰な非結合ベシクルが除かれる。
5.最後に新たに切断されたマスコバイトマイカの第2の切片が形成された脂質二分子層の上に累積される。
【0109】
例3
大腸菌脂質抽出物ベシクルにおけるAQP−1の再構成
大腸菌全脂質抽出物のクロロホルム溶液はAvanti Polar Lipids(アラバマ州アラバスター)から入手された。溶媒(クロロホルム、エタノール、メタノール、デカン)は全てシグマ−アルドリッチ社(ミズーリ州セントルイス)から購入された。SM−2BioBeadsはBioRad Laboratories(カリフォルニア州ハーキュリーズ)から購入された。全ての調製に使用された水は超純水Milli−Q水(18.2MΩcm−1)であった。ウシ赤血球から精製されたアクアポリン−1はUniversity of AarhusのDr. Jan Enghildにより変性タンパク質の懸濁液として得られた。
【0110】
クロロホルムを脂質溶液から蒸発させ、乾燥した脂質膜は55℃で30分間100mMのKClで水和された。溶液はボルテックスされ、Lipexエクストルーダ(Northern Lipids,Vancouver,CD)内で二つの100nmポリカーボネートフィルタを12回通過させることによって小さな単層ベシクル(SUV)が形成された。再構成混合物は最終濃度1.25%(wt/vol)になるまでTriton X−100(シグマ)を添加し、その後脂質−タンパク質比(LPR)が1000:1になるまでAQP−1を添加することによって調製した。タンパクリポソームは界面活性剤を除去することによって形成された。これは疎水性BioBeads(SM−2)に吸着することによって実行された。タンパクリポソームは調製したその日か、または翌日のどちらかに使用された。溶液は実験と実験との間は40℃で保存された。
【0111】
例4
平面状の二分子層の形成および電圧固定法:イオン伝導性を増加することなく脂質二分子層内部に組み込まれたAQP−1
電圧固定法は脂質(または細胞膜)の電位Vをあらゆる所望のレベルに制御(または「固定」)する。ここで使用される方法は、二つの水溶液の間の仕切りにおいて形成された二重膜を横切る電位を測定する。AgClコート銀電極が一つのチャンバに配置され、この電圧を保持されるべき電圧(コマンド電圧と呼ばれる)と電子的に比較する。クランプ回路はその後他の電極を通じて他のチャンバに電流を戻す。この電子的フィードバック回路は、透過面が変わったときでさえ二層間の電位を所望のレベルに維持する。最も重要なことに、この装置は与えられた電圧に二層間の電位を保持するために必要とされる電流Iの同時測定を許容する。従って、電圧固定技術は膜電位がどのように膜を横切るイオン電流に影響するかを示す。この影響は電流−電圧(I/V)関係で表現される。
【0112】
平面状の二分子層は大腸菌のn−デカン溶液(2.5% wt/vol)(アラバマ州アラバスターAvanti Polar Lipids)から、実験日に調製されたバッファリングされていない0.1MKClの二つの水溶液を分離するテフロン(登録商標)仕切りの孔(直径1.3mm)を通して形成された。二層I/V実験はAxoPatch200 amplifier(カリフォルニア州サニーベール、Axon Instruments)を用いて、AgClコート銀ワイヤを電極として使用して、22℃で行なわれた。I/Vプロトコルが構築され、データはClampex 9.2ソフトウェア(カリフォルニア州サニーベール、Axon Instruments)を用いて記録された。データは、8極ベッセルフィルタ(マサチューセッツ州ヘイバリル、Frequency Devices)コーナー周波数500Hz(−3dB)において低域フィルタリングされ、16ビットAD−変換(DigiDatal332A、カリフォルニア州サニーベール、Axon Instruments)後分析のためPC(テキサス州オースチン、Dell Computers)に保存された。データはClampFit 9.2(カリフォルニア州サニーベール、Axon Instruments)およびOriginPro7.5 (マサチューセッツ州ノースハンプトン、OriginLab)を用いて分析され、表示された。
【0113】
二分子層の形成は冷光源(IntraLux 5000、Volpi、CH)を備えた実態顕微鏡(Zeiss)を用いて監視された。仕切り孔に脂質を累積した後脂質単分子層からのニュートニアン回折色は次第に消え、約10分後より厚い脂質/デカントーラスによって囲まれた透明な「黒色」脂質膜が形成された。この薄化も時間的推移においてゼロ電位IRMSにおける二層間電流の二乗平均平方根で反映されている。初期にはIRMSは約1.6pAであったが、定常値約6pAまで上がり、安定な二分子層が形成されたことを示した。二分子層の直径は約1200μmであった。二分子層の形成の後、段階的プロトコルを用いて二層間電流が得られ、電位は−100mVから+90mVまで増分10mVで段階的に変化した。各段階は1000ms継続し、各段階の間も100msであった。
【0114】
AQP−1はAQP−1含有ベシクルを二分子層形成溶液(2:1 vol/vol)に添加した後平面状二分子層に組み込まれ、同様の結果が得られた。
【0115】
AQP−1の脂質二重層に対する組み込みはイオン電流を変化させないが、対照と比較してAQP−1含有二分子層の時定数を変化させた。一次近似に対して後者の測定結果はトーラスおよび二分子層の有効誘電率における変化であると解釈されてよい。炭化水素材料に対するAQP−1タンパク質材料の誘電率が低いので、二分子層およびトーラスの双方の時定数が低くなるのであろうと思われる。
【0116】
例5
浸透勾配研究:低浸透圧性側の未攪拌層内のイオン濃度の増加をもたらす浸透勾配を与えられた脂質二分子層内部に組み込まれたAQP−1
AQP−1を含む脂質二分子層の形成の後、浸透勾配に駆動された膜を横切る水分流動が、膜近傍の未攪拌層内のK+イオン濃度の変化を測定することによって観察された。
【0117】
二連型K+電極は1.2mmODガラスキャピラリー(コーニング 120F)を用いてZeuthenの技術によって構築された。
【0118】
二つのバレルからの電極電圧はPC(Dell Computer,Austin,TX)に接続されたDUO773 Amplifier(WPI)を用いて、12ビットBioLogic 1401+ AD/DA interface(Biologic,Claix,France)を用いて記録された。
【0119】
記録は、pH7.2において20mMのトリス[ヒドロキシメチル]−アミノエタンヒドロクロリド(TRIS)(ミズーリ州セントルイス、T3253)でバッファリングされた100mMのKClを含むバック(シス)チャンバ内に配置された二連型電極で実行された。電極ホルダは水溶液表面に関して45°の角度で入るようにシスチャンバ(cis chamber)に設置され、水圧極微操作装置(David Knopf Instruments、Model 1207B)を用いて最小ステップ長0.25μmで操作された。二分子層形成および電極のおおよその位置はセクション5.3に記述した実態顕微鏡を用いて監視され、記録は脂質の累積後10−20分で始まった。二分子層−電極距離における全体的な精度は約±7μmであると判断され、絶対的な距離は二分子層と接触するときの電極電位の大きな変化によって判断された。二分子層を横切る浸透勾配は前(トランス)面にpH7.2において20mMのTRISでバッファリングされた4Mの尿素(452042V、BDH、Poole、UK)を含むKCl溶液を有することによって誘起された。
【0120】
AQP−1を組み込んだ脂質二重層が、二分子層を横切る浸透勾配の存在下で水の流れを誘起したことが観察された。
【0121】
脂質二分子層内に組み込まれたAQP−1は、浸透勾配の存在下で、バルクのK+濃度と比較して、低浸透圧性側の二分子層から20μm内部でK+イオン濃度を約8%増加させた。
【0122】
膜は4M浸透勾配を支持することができた。
【0123】
例6
本発明による膜を含むUPWシステム
【0124】
図10および11は、本発明の一つの実施形態による水精製装置を示す。図10は要素の概略的な透視断面図であり、図11は図10のII−II線に沿った断面図である。
【0125】
エレメントはエレメントの中央に配置された中空パイプ1を有し、その表面には複数の貫通孔1aが形成される。逆浸透膜2、透過された液体通路部材3、および供給液体通路部材4は、中空パイプ1の以下に記載した方法で外表面周囲に巻かれる。
【0126】
各々の逆浸透膜は全体としてバックのような形状を有し、透過された液体通路部材3がその中に配置される。バック形状の逆浸透膜2は中空パイプ1の外部表面に取り付けられ、それらの開口部2aは中空パイプ1内に形成された貫通孔1aを囲み、逆浸透膜2および透過された液体通路部材3の内部が貫通孔1aと連通するようにする。
【0127】
各供給液体通路部材4はそこに結合される逆浸透膜2の間に配置され、液体がそこを通って通過できるように構成された枠部材5は膜の両端および通路部材アセンブリに取り付けられ、それによってらせん構造になる。
【0128】
上述の要素は圧力ベッセル内に配置され、所定の圧力においてその一端(上流側)で供給液体6が供給されるように合わせられる。
【0129】
供給液体6が供給液体通路部材4に沿って流れるとき、逆浸透膜2によって逆浸透分離を受け、透過液体と溶質とに分離される。逆浸透膜2を通過し溶質濃度が低い透過液体は、貫通孔1a内部に流れ、中空パイプ1内に集まる。透過液体6aはその後要素の下流側から取り出される。
【0130】
逆浸透膜2を通過しなかった供給液体は、下流側に向かって供給液体通路部材4に沿って流れ続ける。流れる過程では、供給液体は供給液体から分離された溶質を取り込み、膜表面を離れて、高い溶質濃度を有する濃縮された液体6bになる。
【0131】
前記要素を操作するにあたって、濃度分極に起因して要素の性能が低下するなどの重大な問題がある。
【0132】
濃度分極は、例えば不純物および供給液体内に含まれる汚染物質などの付着物質が供給液体通路部材4と接触される逆浸透膜2の膜表面上で濃縮され、供給液体中の溶質および付着物質濃度が膜表面上でより高くなる現象である。結果として、浸透圧が高くなる。
【0133】
濃度分極が起こるとき、透過液体の品質は低下し、ゲルおよび薄膜など不純物が膜表面上に沈殿する。このために、逆浸透膜はその性能を発現させることができず、要素の性能は低下する。
【0134】
濃度分極の発生は、膜表面上に供給液体の乱流を作ることによって抑制することができる。例えば、乱流は、より厚みの小さい供給液体通路部材4を用いて膜表面上の供給液体の線形速度を増加することによってより簡単に発生し、濃度分極層は薄くなり得る。
【0135】
しかしながら、より厚みの小さい供給液体通路部材4を用いると、供給液体通路部材4によって画定される通路が供給液体内の、例えば不純物および微生物などの、付着物質で容易に詰まる。その結果、要素の性能は低下し、供給液体内の圧力損失は増大する。透過液体の品質および量を保持するため、供給液体の操作圧力は増加される必要があり、従って操作に電力を必要とする高圧ポンプおよび圧力パイプが与えられる必要があり、結果的に液体の製造コストを増加する。
【0136】
逆浸透膜の少なくとも一つは本発明による水膜であり、アクアポリンおよび/またはアクアグリセロポリンチャンネルを含む。
【0137】
参考文献:
1.Agre,P.,M.Bonhivers, and M.J.Borgnia. (1998). The aquaporins,blueprints for cellular plumbing systems. Journal of Biolgical Chemistry,273,14659−14662.
2.Borgnia,M.,S.Nielsen,A.Engel, and P.Agre.(1999). Cellular and molecular biology of the aquaporin water channels. Annual Review of Biochemistry,68,425−458.
3.A.A.Brian and H.M.McConnell. Allogenic stimulation of cytotoxic T cells by supported planar membranes. Proc. Natl. Acad. Sci. USA,81:6159−6163,1984.
4.Burykin and A.Warshel(2003). What really prevents proton transport through aquaporin? Charge self−energy vs. proton wire proposals, Biophysical Journal 85,3696−3706
5.Chakrabarti,N.,Tajkhorshid,E.,Roux,B. and Pommes,R.(2004). Molecular basis of pro− ton blockage in aquaporins, Structure 12,65−74
6.Dainty,J. and CR. House. 1966 . Unstirred layers in frog skin. J Physiol 182:66−78.
7.de Groot,B.L., and Grubmuller,H.(2001). Water permeation across biological membranes: mechanism and dynamics of aquaporin−1 and GIpF, Science 294,2353−2357.
8.de Groot,B.L.,Frigato,T.,Helms,V. and Grubmuller,H.(2003). The mechanism of pro− ton exclusion in the aquaporin−1 channel, Journal of Molecular Biology 333,279−293.
9.Fettiplace,R. and D.A.Haydon. 1980. Water permeability of lipid membranes. Physiol Rev 60:510−50.
10.Fu,D.,Libson,A.,Miercke,L J.,Weitzman,C,Nollert,P.,Krucinski,J., and Stroud,R.M.(2000). Structure of a glycerol−conducting channel and the basis for its selectivity, Science 290,481−6.
11.Heymann,J.B. and Engel,A.(1999). Aquaporins: Phylogeny, Structure, and Physiology of Water Channels. News Physiol. Sci.(14) p.188.
12.Ilan,B.,Tajkhorshid,E.,Schulten,K. and Voth,G.(2004). The mechanism of proton exclusion in aquaporin water channels. PROTEINS: Structure, Function, and Bioinformatics,55,223−228.
13.Jensen,M.O.,Tajkhorshid,E., and Schulten,K.(2003). Electrostatic tuning of permeation and selectivity in aquaporin water channels, Biophysical Journal 85,2884−2899.
14.Z.V.Leonenko,A.Carnini, and D.T.Cramb. Supported planar bilayer formation by vesicle fusion: the interaction of phospholipid vesicles with surfaces and the effect of gramicidin on bilayer properties usin atomic force microscopy. Biochim. Biophys. Acta, 1509:131−147,2000.
15.H.Lin,R.Bhatia, and R.LaI. Amyloid β protein forms ion channels: implications for Alzheimer’s disease pathophysiology. FASEB J., 15:2433−2444,2001.
16.Montal,M. and P.Mueller. 1972. Formation of Biomolecular Membranes from Lipid Monolayers and a Study of Their Electrial Properties. Proc. Nat. Acad. Sci. USA 69:3561−3566.
17.J.Mou,D.M.Czajkowsky, and Z.Shao. Gramicidin A aggregation in supported gel state phosphatidylcholine bilayers. Biochemistry, 35:3222−3226, 1996.
18.Murata,K.,Mitsuoka,K.,Hirai,T.,WaIz,T.,Agre,P.,Heymann,J.B.,Engel,A., and Fujiyoshi,Y.(2000). Structural determinants of water permeation through aquaporin−1, Nature 407,599−605.
19.Pohl,P.,S.M.Saparov, and Y,N.Antonenko. 1997. The effect of a transmembrane osmotic flux on the ion concentration distribution in the immediate membrane vicinity measured by microelectrodes. Biophys J 72:1711−8.
20.Preston,G.M.,P.Piazza−Carroll,W.B.Guggino, and P.Agre.(1992). Appearance of water channels in Xenopus oocytes expressing red cell CHIP28 water channel. Science,256,385−387.
21.E.Reimhult,F.Hook, and B.Kasemo. Intact vesicle adsorption and supported biomem− brane formation from vesicles in solution: Influence of surface chemistry, vesicle size, temperature, and osmotic pressure. Langmuir,19:1681−1691,2003.
22.Ren,G.,Reddy,V.S.,Cheng,A.,Melnyk,P., and Mitra,A.K.(2001).Visualization of a water−selective pore by electron crystallography in vitreous ice, Proc Natl Acad Sci USA 98,1398−1403.
23.I.Reviakine and A.Brisson. Formation of supported phospholipid bilayers from unilamellar vesicles investigated by atomic force microscopy. Langmuir,16:1806−1815,2000.
24.H.A.Rinia,R.A.Kik,R.A.Demel,M.M.E.Snel,J.A.Kiilian,J.P.J.M. van der Eerden, and B.de Kruijff. Visualization of highly ordered striated domains induced by transmembrane peptides in supported phosphatidylcholine bilayers. Biochemistry,39:5852−5858,2000.
25.Sakmann,B. and E.Neher.1995. Single channel recording 2ed. Plenum Press, New York Saparov,S.M.,D.Kozono,U.A.P.Rothe, and P.Pohl. 2001. Water and Ion Permeation of Aquaporin−1 in Planar Bilayers. J. Biol. Chem.276:31515−31520.
26.A.C.Simonsen and L.A.Bagatolli. Structure of spin−coated lipid films and domain formation in supported membranes formed by hydration.Langmuir,20:9720−9728,2004.
27.Sui,H.,Han,B.G.,Lee,J.K.,Walian,P., and Jap,B.K.(2001). Structural basis of water−specific transport through the AQPl water channel, Nature 414,872−8.
28.Tajkhorshid,E.,Nollert,P.,Jensen,M.O., Miercke,L J.,O’Connell,J.,Stroud,R.M., and Schulten,K.(2002). Control of the selectivity of the aquaporin water channel family by global orientational tuning, Science 296,525−530.
29.E.J.M.van Kan,D.N.Ganchev,M.M.E.Snel,V.Chupin,A.van der Bent, and B. de Kruijff. The peptide entibiotic clavanin A interacts strongly and specifically with lipid bilayers. Biochemistry,42:11366−11372,2003.
30.Zhu,F.,Tajkhorshid,E. and Schulten,K.(2003). Theory and simulation of water permeation in aquaporin−1. Biophysical Journal,86,50−57.
31.Zeidel,Mark L.,Suresh V.Ambudkar,Barbara L.Smith, and Peter Agre, Biochemistry 1992,31,7436−7440.
【符号の説明】
【0138】
1 中空パイプ
2 逆浸透膜
3 透過された液体通路部材
4 供給液体通路部材
5 枠部材
【特許請求の範囲】
【請求項1】
脂質ベシクル中に再構成され、支持体層に変換され水濾過膜を形成したアクアポリン水輸送タンパク質を含む、水を濾過するための膜。
【請求項2】
前記アクアポリンが、植物由来である、またはそれらの混合物およびそれらのハイブリッドである、請求項1に記載の水を濾過するための膜。
【請求項3】
前記植物アクアポリンが、TIP、PIPまたはNIPアクアポリン、またはそれらの混合物およびそれらのハイブリッドである、請求項2に記載の水を濾過するための膜。
【請求項4】
前記アクアポリン水チャンネルが、アクアグリセロポリン(GLpF)、またはそれらの混合物およびそれらのハイブリッドである、請求項1に記載の水を濾過するための膜。
【請求項5】
前記アクアグリセロポリン(GLpF)は、GLPAチャンネル、GLPB1チャンネル、GLPB2チャンネル、GLPB3チャンネル、またはGLPY2チャンネル、またはそれらの混合物およびそれらのハイブリッドである、請求項4に記載の水を濾過するための膜。
【請求項6】
前記アクアポリンが突然変異タンパク質である、請求項1から5の何れか一項に記載の水を濾過するための膜。
【請求項7】
前記支持体層が、マイカ、マイカテープ、ポリスルホン、AlO2、またはセルロースなどの重合体から選択される材料を含む、親水性膜表面を備える、請求項1から6の何れか一項に記載の水を濾過するための膜。
【請求項8】
水溶性の物質または溶液から水を抽出するための、請求項1から7の何れか一項に記載の水を濾過するための膜の使用。
【請求項9】
前記水溶性の物質または溶液に溶解された溶質の濃度を増加する、請求項8に記載の使用。
【請求項10】
請求項1から7の何れか一項に記載の水を濾過するための膜を通じた水溶液の濾過を含み、イオン、粒子、有機物および/またはコロイドを保持し、それによって濾過物は本質的にイオン、粒子、有機物およびコロイドを含まない水である、超純水濾過物を調製する方法。
【請求項11】
浸透圧が前記水を濾過するための膜の下流側に適用されている、請求項10に記載の方法。
【請求項12】
前記浸透圧が精製される水源よりも高い浸透圧を有する濃縮された溶液に由来する、請求項11に記載の方法。
【請求項13】
非毒性かつ容易に除去可能な溶質を新鮮な水のチャンバに高濃度で添加して膜を通る通常の浸透を促す、請求項12に記載の方法。
【請求項14】
尿、乳および汗/発汗などの体液から水を抽出および再生するための水濾過装置であって、機能性アクアポリン水チャンネルを含む請求項1から7の何れか一項に記載の水を濾過するための膜を備えた水濾過装置。
【請求項15】
支持された二分子層上に一連の崩壊するベシクルにより形成された別個の2D配列の複数層の積層体を含み、前記ベシクルが適切なアクアポリンと再構成される、請求項1から7の何れか一項に記載の水を濾過するための膜を含む水濾過単位装置。
【請求項16】
積層単位装置が、安定させる膜または安定させる重合体マトリックス内部に組み込まれている、請求項15に記載の単位装置を含む水濾過メッシュ。
【請求項17】
前記別個の単位が自己組織化プロセスを通じてその後綴じられる、請求項16に記載の水濾過メッシュ。
【請求項1】
脂質ベシクル中に再構成され、支持体層に変換され水濾過膜を形成したアクアポリン水輸送タンパク質を含む、水を濾過するための膜。
【請求項2】
前記アクアポリンが、植物由来である、またはそれらの混合物およびそれらのハイブリッドである、請求項1に記載の水を濾過するための膜。
【請求項3】
前記植物アクアポリンが、TIP、PIPまたはNIPアクアポリン、またはそれらの混合物およびそれらのハイブリッドである、請求項2に記載の水を濾過するための膜。
【請求項4】
前記アクアポリン水チャンネルが、アクアグリセロポリン(GLpF)、またはそれらの混合物およびそれらのハイブリッドである、請求項1に記載の水を濾過するための膜。
【請求項5】
前記アクアグリセロポリン(GLpF)は、GLPAチャンネル、GLPB1チャンネル、GLPB2チャンネル、GLPB3チャンネル、またはGLPY2チャンネル、またはそれらの混合物およびそれらのハイブリッドである、請求項4に記載の水を濾過するための膜。
【請求項6】
前記アクアポリンが突然変異タンパク質である、請求項1から5の何れか一項に記載の水を濾過するための膜。
【請求項7】
前記支持体層が、マイカ、マイカテープ、ポリスルホン、AlO2、またはセルロースなどの重合体から選択される材料を含む、親水性膜表面を備える、請求項1から6の何れか一項に記載の水を濾過するための膜。
【請求項8】
水溶性の物質または溶液から水を抽出するための、請求項1から7の何れか一項に記載の水を濾過するための膜の使用。
【請求項9】
前記水溶性の物質または溶液に溶解された溶質の濃度を増加する、請求項8に記載の使用。
【請求項10】
請求項1から7の何れか一項に記載の水を濾過するための膜を通じた水溶液の濾過を含み、イオン、粒子、有機物および/またはコロイドを保持し、それによって濾過物は本質的にイオン、粒子、有機物およびコロイドを含まない水である、超純水濾過物を調製する方法。
【請求項11】
浸透圧が前記水を濾過するための膜の下流側に適用されている、請求項10に記載の方法。
【請求項12】
前記浸透圧が精製される水源よりも高い浸透圧を有する濃縮された溶液に由来する、請求項11に記載の方法。
【請求項13】
非毒性かつ容易に除去可能な溶質を新鮮な水のチャンバに高濃度で添加して膜を通る通常の浸透を促す、請求項12に記載の方法。
【請求項14】
尿、乳および汗/発汗などの体液から水を抽出および再生するための水濾過装置であって、機能性アクアポリン水チャンネルを含む請求項1から7の何れか一項に記載の水を濾過するための膜を備えた水濾過装置。
【請求項15】
支持された二分子層上に一連の崩壊するベシクルにより形成された別個の2D配列の複数層の積層体を含み、前記ベシクルが適切なアクアポリンと再構成される、請求項1から7の何れか一項に記載の水を濾過するための膜を含む水濾過単位装置。
【請求項16】
積層単位装置が、安定させる膜または安定させる重合体マトリックス内部に組み込まれている、請求項15に記載の単位装置を含む水濾過メッシュ。
【請求項17】
前記別個の単位が自己組織化プロセスを通じてその後綴じられる、請求項16に記載の水濾過メッシュ。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【公開番号】特開2012−192408(P2012−192408A)
【公開日】平成24年10月11日(2012.10.11)
【国際特許分類】
【出願番号】特願2012−132624(P2012−132624)
【出願日】平成24年6月12日(2012.6.12)
【分割の表示】特願2008−511564(P2008−511564)の分割
【原出願日】平成18年5月19日(2006.5.19)
【出願人】(507382832)
【Fターム(参考)】
【公開日】平成24年10月11日(2012.10.11)
【国際特許分類】
【出願日】平成24年6月12日(2012.6.12)
【分割の表示】特願2008−511564(P2008−511564)の分割
【原出願日】平成18年5月19日(2006.5.19)
【出願人】(507382832)

【Fターム(参考)】
[ Back to top ]

