水性活性金属電気化学セルならびにシステム
【解決手段】本発明は、活性金属アノードと水性カソード/電解質系とを備えるアルカリ金属(等の活性金属)電池セルや電気化学セルに関する。電池セルは、アルカリ金属アノードに隣接して高イオン伝導性保護膜を備え、この高イオン伝導性保護膜により、溶媒環境、電解質処理環境、および/あるいは、カソード環境からアルカリ金属アノードを隔てる(分離する)と共に、これらの環境に対するイオンの出入りを可能にする。このように、電池セルや電気化学セルの他の構成成分からアノードを分離することにより、アノードと共に用いる溶媒、電解質、カソード材の選択の幅を無限に広げることができる。また、アノードの安定性やアノード性能に影響を及ぼすことなく、電解質あるいはカソード側溶媒系を最適化することも可能になる。特に、リチウム/水セル、リチウム/空気セル、リチウム/金属水素化物セル、セル構成成分、セル構造、ならびに、製造方法を開示する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、活性金属電気化学装置に関し、さらに詳しくは、空気、水分、電池セルの他の構成成分との反応の悪影響から活性金属を保護するイオン伝導性膜を備える活性金属電極構造により構成される水性活性金属(例えば、リチウム)電池セル、並びに、電池セルの製造方法、電池セルの利用法に関する。
【背景技術】
【0002】
リチウム等の低当量アルカリ金属は、電池の電極材として特に有用である。リチウム電池は、従来のニッケル電池やカドミウム電池と比較して単位容積あたりの出力エネルギー量が大きい。ただ、残念ながら、再充電可能な金属リチウム電池の商品化はいまだに成功していない。
【0003】
再充電可能な金属リチウム電池が商品化できない主な理由は、セルの充放電サイクルの問題にある。充放電サイクルを繰り返すと、金属リチウム電極から生じるリチウム「樹状突起」が次第に成長し、電解質を突き抜け、ついには、陽極に達する。これにより、電池内で内部ショートが起こるため、金属リチウム電池はほんの数サイクルで使用不能になってしまう。また、充放電サイクルを繰り返すと、リチウム電極上に「苔状」堆積物が積層し、陰極から遊離して、電池性能を悪化させる原因となる。
【0004】
電解質溶液系におけるリチウムの充放電サイクル挙動を改善するために、リチウム陰極の電解質側を「保護層」で被覆する構造が提案されている。保護層は、リチウムイオンを伝導すると同時に、リチウム電極表面が容積の大きな電解質に接するのを防ぐ必要がある。これまでにも、保護層を形成するために様々な手法が提案されたが、いずれも成功に至っていない。
【0005】
例えば、金属リチウムとリチウムに接する電解質中の化合物とをin situ(その場で)反応させることにより金属リチウム保護層を形成する手法が提案されている。この手法では、多くの場合、電池を組み立てた後、化学反応を制御して、膜をin situ(その場で)形成する。形成された膜は、通常、多孔質であるため、電解質の一部が裸の金属リチウム表面まで浸透してしまい、リチウム電極を充分に保護することができない。
【0006】
さらに、種々の成形リチウム保護膜が提案されている。例えば、(1994年5月24日にBatesに交付された)米国特許第5,314,765号には、リチウムリン酸窒化物(LiPON)等をスパッタリングすることにより形成した薄膜を含むリチウム電極をex situ(外部で)製造する方法が開示されている。LiPONは、(リチウムイオンを伝導させる)ガラス性単一イオン伝導体であり、シリコン上で製造され、集積回路の電源として用いられる固体リチウムマイクロ電池用の電解質として研究されてきた(すべてBatesらに交付された米国特許第5,597,660号、5,567,210号、5,338,625号、5,512,147号参照)。
【0007】
また、本発明の出願人らの研究所では、活性金属電池の電極内でLiPON等のガラス性あるいは非晶質保護層を用いる技術が開発されてきた(例えば、すべてPolyPlus Battery社を出願人とする2000年2月15日交付済み米国特許第6,025,094号、2002年6月11日交付済み米国特許第6,402,795号、2001年4月10日交付済み米国特許第6,214,061号、2002年7月2日交付済み米国特許第6,413,284号参照)。
【0008】
水性環境中でリチウムアノードを用いる場合には、従来、濃縮KOH水溶液等の高塩基性条件にして、リチウム電極の腐食速度を遅くするか、あるいは、リチウム電極をポリマーで被覆して、水のリチウム電極表面への拡散を妨げる手法が採られてきた。しかし、いずれの場合でも、アルカリ金属電極と水との反応が生じていた。水の絶縁破壊電圧が1.2Vである一方、リチウム/水セルの電圧は約3.0Vであるため、金属リチウムアノードと組み合わせて、水性カソードあるいは水性電解質を用いることは不可能だとされてきた。金属リチウムと水溶液が直接接触することにより、激しい寄生反応が起こり、リチウム電極が腐食してしまう。このため、金属リチウム電池分野の研究は、有用な非水性(有機物)電解質系の開発に焦点がしぼられていた。
【発明の開示】
【課題を解決するための手段】
【0009】
本発明は、活性金属アノードと水性カソード/電解質系とを備えるアルカリ(あるいは他の活性)金属電池セルならびに電気化学セルに関する。電池セルの陰極(アノード)側は、アルカリ金属アノードに隣接して、高いイオン伝導度(少なくとも約10-7S/cm以上、望ましくは10-6S/cm以上、例えば、10-5S/cmから10-4S/cm以上、さらに望ましくは10-3S/cm以上)を有する保護膜を備える。この保護膜は、リチウム等の活性金属に対して高腐食性の環境を含む、溶媒環境、電解質処理環境、および/あるいは、カソード環境から、アルカリ金属電極を隔てる(分離する)役割を果たす。さらに、腐食性環境を含むこれらの環境へのイオンの出入りを可能にする。保護膜は、片側の面が、(リチウム等の)活性金属に対して化学的に適合性のある成分から形成され、もう片側の面が、リチウム等の活性金属に対して高腐食性の成分を含む様々な成分から形成され、両方の側面間のイオン移動を可能にするように構成される。このように、活性金属電極を保護することにより、電池セル等の電気化学装置の他の構成要素の材料選択の自由度をあげることができる。電池セルや電気化学セルの他の構成要素からアノードを分離することにより、アノードと共に用いる溶媒、電解質、カソード材の選択の幅を無限に広げることができる。また、アノードの安定性やアノード性能に影響を及ぼすことなく、電解質あるいはカソード側溶媒系を最適化することも可能になる。
【0010】
このような被保護活性金属アノードは、様々な電解質ならびにカソード材と共に用いることができる。利用可能な電解質およびカソード材は、例えば、2000年2月15日交付済み米国特許第6,025,094号、2002年6月11日交付済み米国特許第6,402,795号、2001年4月10日交付済み米国特許第6,214,061号、2002年7月2日交付済み米国特許第6,413,284号、2003年10月14日出願済み米国特許出願第10/686,189号(各特許ならびに特許出願内容を本発明の参考文献として組み込む)等、PolyPlus Battery社の特許に記載されるリチウム‐イオウ電池システムで用いられるようなリチウム金属系で安定な材料でもよく、また、空気、イオン性(プロトン性)溶液、水性電解質、溶融塩、イオン性溶液等のリチウム腐食性材料でもよい。さらに、高温から低温、高放電率から低放電率等、作動条件や放電率も限定されない。ただし、リチウムアノードの腐食やアノードに対する電解質適合性は本発明の論点ではない。本発明を好適に適用可能な電池セルとしては、リチウム‐空気セル、リチウム‐水性電解質セル、リチウム‐海/塩水セルが挙げられる。また、後述するように、その他の新規で有用な電気化学装置に本発明を適用することも可能である。さらに、複層保護膜を用いることにより、リチウムに対して非常に反応性の高い材料、例えば、リチウム/フッ素電池に対してPbSnF4をカソード材に用いることも可能である。
【0011】
本発明は、高イオン伝導性膜を用いることにより、活性金属電気化学セルの活性金属アノードとカソード側とを隔てる。この高イオン伝導性膜は、活性金属陰極(アノード)構造、並びに、バッテリや燃料電池を含む電気化学装置・構成部品に組み込むことができ、活性金属イオンに対する伝導性が高い一方、他の物質に対しては不浸透性である。また、膜は、その片側面がアノードの活性金属(例えば、リチウム)に対して化学的に安定である一方、もう一方の片側面は、カソードや、有機電解質、水溶液電解質等の固相電解質あるいは液相電解質など他の電池セル構成要素や、周辺環境条件に対して安定である。さらに、膜を用いることにより、他の電池構成要素との反応の悪影響や周辺環境条件から活性金属アノードを保護し、アノードとカソードの化学的環境を分離することができ、その結果、アノードや逆にカソードに悪影響を及ぼすことなく、カソード側の溶媒や電解質にアノードに対して適合性のない材料を用いることを可能にする。この構成により、活性金属電気化学セルに利用可能な材料の幅が広がり、セルの製造が容易になる。また、高いイオン伝導性を持つ膜を組み込むことにより、電気化学セルの性能を高めることも可能である。
【0012】
周知のように、リチウム金属は水と激しく反応し、酸性水溶液とはさらに激しく反応する。しかし、LiPON(Ag)/OHARAガラスセラミック複合体で保護したリチウム電極を備える本発明のセルは、問題なく酸性水溶液中に浸漬可能である。Ag/AgCl参照電極ならびに通常の水素電極に対して、熱力学的開路電位が測定され、リチウムが水性電解質中に放出されると、Pt対極で水素放出が起こるが、リチウム電極では腐食も化学反応も生じていない。また、上記のような被保護リチウム電極はLiOH水溶液浴中に浸漬可能であり、水性電解質中で可逆的にサイクル可能である。水性環境中で金属リチウムが急速に腐食されることは知られているが、上記のような実験結果は知られていない。このような結果を踏まえることにより、リチウム/水電池やリチウム/空気電池など、数多くの独創的な電池システムの開発が可能になる。今までにも、このような電池システムの研究はなされてきたが、保護されていない金属リチウム電極を用いたものだった。保護されていない金属リチウム電極は水中で急速に腐食するため、このような電極を用いて形成された電池は寿命が非常に短く、安全性にも問題があり、市場価値が低かった。本発明の被保護リチウム電極を用いると、腐食も水性電解質との化学反応も生じず、市場価値の高い電池の製造が可能になる。
【0013】
本発明は、水性活性金属電池セルに関し、第一表面と第二表面とを有する活性金属アノードと、電子伝導性成分と、イオン伝導性成分と、電気化学的活性成分とを含むカソード構造体を備える。ここで、少なくとも一つのカソード構造体成分が水性構成成分である。さらに、イオン伝導性保護膜がアノードの第一表面上に形成される。イオン伝導性保護膜は、一ないし複数の成分から形成され、アノードの活性金属に対して化学的適合性があり、かつ、アノードに接する第一表面と、実質的に不浸透性であり、カソード構造体に対して化学的適合性があり、かつ、カソード構造体に接する第二表面とを与えるように構成される。
【0014】
本発明に従うセルの例としては、リチウム/水電池セル、リチウム/空気電池セル、リチウム/金属水素化物電池セル、種々の電気化学的セルが挙げられる。
【0015】
本発明は、さらに、種々のセル並びにセル構成成分の製造方法、セル構成成分、ならびに、セル構造を提供するものである。
【0016】
本発明の上記並びにその他の特徴は、以下の詳細な説明でさらに言及され、例示されるであろう。
【発明を実施するための最良の形態】
【0017】
以下、本発明の好適な実施例を、添付の図面に基づいて詳細に説明する。ただし、これらの実施例は、単に本発明を例示するものにすぎず、なんら本発明を限定するものではない。本発明は、そのクレームの趣旨を逸脱しない範囲内で、種々の態様で実現可能であり、様々に変更、修正可能である。本発明の理解を助けるために、以下、実施例の詳細な特徴を説明するが、これらの詳細な特徴の一部あるいは全部を省いた形で本発明を実施することも可能である。また、本発明の論点がぼけないように、周知の処理工程については詳細な説明を省く。
【0018】
本明細書ならびにクレームにおいて、「備える」「方法は〜備える」「装置は〜備える」等の表現を単数冠詞の名詞と共に用いる場合、特に明記しない限り、その名詞を単数に限定するものではなく、複数も含むこととする。また、特に明記しない限り、本明細書ならびにクレームで用いる科学技術用語は、本発明分野の当業者が通常理解する意味で用いられるものとする。
【0019】
緒言
本発明は、活性金属アノードと水性カソード/電解質系とを備えるアルカリ金属(等の活性金属)電池セルならびに電気化学セルに関する。電池セルの陰極(アノード)側は、アルカリ金属アノードに隣接して、高いイオン伝導度(少なくとも約10-7S/cm以上、望ましくは10-6S/cm以上、例えば、10-5S/cmから10-4S/cm以上、さらに望ましくは10-3S/cm以上)を有する保護膜を備える。この保護膜は、リチウム等の活性金属に対して高腐食性の環境を含む、溶媒環境、電解質処理環境、および/あるいは、カソード環境から、アルカリ金属電極を隔てる(分離する)役割を果たす。さらに、腐食性環境を含むこれらの環境へのイオンの出入りを可能にする。保護膜は、片側の面が、(リチウム等の)活性金属に対して化学的に適合性のある成分から形成され、もう片側の面が、リチウム等の活性金属に対して高腐食性の成分を含む様々な成分から形成され、両方の側面間のイオン移動を可能にするように構成される。このように、活性金属電極を保護することにより、電池セル等の電気化学装置の他の構成要素の材料選択の自由度をあげることができる。電池セルや電気化学セルの他の構成要素からアノードを分離することにより、アノードと共に用いる溶媒、電解質、カソード材の選択の幅を無限に広げることができる。また、アノードの安定性やアノード性能に影響を及ぼすことなく、電解質あるいはカソード側溶媒系を最適化することも可能になる。
【0020】
このような被保護活性金属アノードは、様々な電解質ならびにカソード材と共に用いることができる。利用可能な電解質およびカソード材は、例えば、2000年2月15日交付済み米国特許第6,025,094号、2002年6月11日交付済み米国特許第6,402,795号、2001年4月10日交付済み米国特許第6,214,061号、2002年7月2日交付済み米国特許第6,413,284号、2003年10月14日出願済み米国特許出願第10/686,189号(各特許ならびに特許出願内容を本発明の参考文献として組み込む)等、PolyPlus Battery社の特許に記載されるリチウム‐イオウ電池システムで用いられるようなリチウム金属系で安定な材料でもよく、また、空気、イオン性(プロトン性)溶液、水性電解質、溶融塩、イオン性溶液等のリチウム腐食性材料でもよい。さらに、高温から低温、高放電率から低放電率等、作動条件や放電率も限定されない。ただし、リチウムアノードの腐食やアノードに対する電解質適合性は本発明の論点ではない。本発明を好適に適用可能な電池セルとしては、リチウム‐空気セル、リチウム‐水性電解質セル、リチウム‐海/塩水セルが挙げられる。また、後述するように、その他の新規で有用な電気化学装置に本発明を適用することも可能である。さらに、複層保護膜を用いることにより、リチウムに対して非常に反応性の高い材料、例えば、リチウム/フッ素電池に対してPbSnF4をカソード材に用いることも可能である。
【0021】
本発明は、高イオン伝導性膜を用いることにより、活性金属電気化学セルの活性金属アノードとカソード側とを隔てる。この高イオン伝導性膜は、活性金属陰極(アノード)構造、並びに、バッテリや燃料電池を含む電気化学装置・構成部品に組み込むことができ、活性金属イオンに対する伝導性が高い一方、他の物質に対しては不浸透性である。また、膜は、その片側面がアノードの活性金属(例えば、リチウム)に対して化学的に安定である一方、もう一方の片側面は、カソードや、有機電解質、水溶液電解質等の固相電解質あるいは液相電解質など他の電池セル構成要素や、周辺環境条件に対して安定である。さらに、膜を用いることにより、他の電池構成要素との反応の悪影響や周辺環境条件から活性金属アノードを保護し、アノードとカソードの化学的環境を分離することができ、その結果、アノードや逆にカソードに悪影響を及ぼすことなく、カソード側の溶媒や電解質にアノードに対して適合性のない材料を用いることを可能にする。この構成により、活性金属電気化学セルに利用可能な材料の幅が広がり、セルの製造が容易になる。また、高いイオン伝導性を持つ膜を組み込むことにより、電気化学セルの性能を高めることも可能である。
【0022】
膜は、任意の適切な組成を持つように構成されるが、アノード環境とカソード環境の両方に対して化学的適合性のある一体材から形成してもよいし、異なった化学的適合性を持つ少なくとも2つの異なった成分から成る複合材から形成してもよい。後者の場合、1つの成分がアノード環境に対して化学的適合性を持ち、もう1つの成分がカソード環境に対して化学的適合性を持つ。
【0023】
複合膜の場合、異なった化学的適合性の要件を満たす少なくとも2つの異なった材料成分から構成される。複合膜は、異なった化学的適合性の要件を満たす別々の材料層を積層することにより形成してもよく、また、このような材料層が段階的に移行するように構成してもよい。ここで、「化学的適合性」(あるいは「化学的に適合」という表現は、他の電池セル構成成分と接触した場合に、これと反応して、電池セルの作動、製造条件、処理条件、保管条件に悪影響を及ぼすような生成物を生じないことを意味している。
【0024】
複合膜の第一成分層は、イオン伝導性を持ち、活性金属電極材に対して化学的適合性を持つ。化学的適合性を持つ成分は、化学的に安定であり、活性金属電極材と接触した場合に実質的に反応しない成分である。活性金属は、周辺環境条件に対して高い反応性を有し、電極として用いる場合には、障壁層を形成することが望ましい。活性金属には、(リチウム、ナトリウム、カリウム等の)アルカリ金属、(カルシウム、マグネシウム等の)アルカリ土類金属、(亜鉛等)ある種の遷移金属、これら金属の2種類以上の合金が含まれる。利用可能な活性金属の例としては、(Li、Na、K等の)アルカリ金属、(Ca、Mg、Ba等の)アルカリ土類金属、Ca、Mg、Sn、Ag、Zn、Bi、Al、Cd、Ga、Inを用いた二元あるいは三元アルカリ金属合金が挙げられる。望ましい合金としては、リチウムアルミニウム合金、リチウム珪素合金、リチウム錫合金、リチウム銀合金、(Na4Pb等の)ナトリウム鉛合金であり、活性金属電極の材料としてリチウムを使うことが望ましい。また、化学的適合性を持つ成分は、酸化剤の存在下で化学的に安定であり、活性金属電極材と接触した場合に反応して、活性金属電極材に対して化学的に安定で、(第一層の成分として)望ましいイオン伝導性を有する生成物を生じるような材料でもよい。以下、このような反応性材料を「原」材料と称する場合がある。
【0025】
複合膜の第二成分層は、イオン伝導性を除き実質的に不浸透性であり、第一成分に対して化学的適合性を有する。「実質的に不浸透な成分」という表現は、電極材に損傷を与える可能性のある電池電解質や溶媒、その他電池構成材に対して充分な障壁として作用し、電極性能を低下させるような損傷を防ぐ成分を意味する。即ち、このような成分は、膨潤性がなく、空気、水分、電解質等が第一成分まで透過するようないかなる孔、傷、通路も持たない。第二成分層は、周囲の水分、二酸化炭素、酸素等に不浸透であり、通常のリチウム電極処理に求められるような厳密な乾燥条件を必要とせず、周辺環境条件下で密閉リチウム合金電極の処理を可能にするようなものが望ましい。本発明の複合保護膜がリチウム等の活性金属に対して高い保護性能を有するため、電極及び電極/電解質複合体が電池外部で非常に長い貯蔵寿命を持つことが期待される。即ち、本発明の構成は、陰極を含む電池のみならず、未使用の陰極並びに電極/電解質積層体にも適用可能である。このような陰極並びに電極/電解質積層体は、シート状、ロール状、スタック構造等、任意の構造で提供可能である。さらに、他の電池構成要素と一体化させて、電池を製造することも可能である。本発明の電池は安定性が高いため、容易に製造可能である。
【0026】
本発明の複合保護膜は、上述したような積層構造を有する複合保護膜に限定されるものではなく、機能勾配を有する層として形成してもよい。
【0027】
第一成分、第二成分は、本質的にイオン伝導性を持ち、そのイオン伝導性が液体電解質等の媒体の存在に左右されるものではない。
【0028】
上述したような特性を獲得するため、あるいは、電極の安定性や性能を向上させるために、さらに他の層を追加で持つように複合膜を構成してもよい。複合膜のすべての層は、少なくとも約10-7S/cm以上、望ましくは10-6S/cm以上、例えば、10-5S/cmから10-4S/cm以上、さらに望ましくは10-3S/cm以上という高いイオン伝導度を有し、複層構造体からなる保護膜は、少なくとも10-7S/cm以上、望ましくは10-3S/cm以上の高い総イオン伝導度を持つ。
【0029】
保護膜並びにその構造
図1は、リチウム/水電池セル、リチウム/空気電池セル、リチウム/金属水素化物電池セル等の水性活性金属電池セル120に用いられる、本発明のイオン伝導性保護膜を示す概念図である。保護膜100は、イオン伝導性があり、(リチウム等の)活性金属電極(アノード)106に対して化学的適合性がある第一側面と、実質的に不浸透性であり、イオン伝導性があり、かつ、カソード構造体110に対して化学的適合性がある第二側面とを有する。カソード構造体110は、電子伝導性成分と、イオン伝導性成分と、電気化学的活性成分とを有し、少なくとも一つのカソード構造体成分が水性構成成分である、あるいは、水性構成成分を含む。保護膜は、少なくとも10-7S/cm以上、望ましくは10-6S/cm以上、例えば、10-5S/cmから10-4S/cm以上、さらに望ましくは10-3S/cm以上のイオン伝導性を有する。保護膜の第一側面に接する活性金属アノード106は、一般に不活性で活性金属と合金を形成しない、銅等の伝導性金属で形成される集電板108に接続される。特に図示していないが、電子伝導性成分、例えば、リチウム/水セルやリチウム/空気セルでは多孔質の電子伝導性触媒支持体が、保護膜に隣接してカソード側に形成され、(カソード側集電板112を介して)アノード側から電子を移送させ、カソード側活性成分の電解還元を促進する。
【0030】
保護膜は、アノード側と電解質及び/あるいはカソード側とで異なった化学的適合性を有する側面を形成する二つ以上の成分からなる複合体として構成するものでもよい。複合体は、イオン伝導性があり、活性金属電極材に対して化学的適合性がある物質からなる第一層と、実質的に不浸透性であり、イオン伝導性があり、第一層の成分とカソード/電解質環境の両方に化学的適合性がある物質からなる第二層とを備える。
【0031】
以下に説明するように、本発明の保護膜の構造により、アノードと組み合わせられる電解質および/あるいはカソードには、これに限定されるものではないが、本発明の参考文献であるPolyPlus Battery社の特許に記載される物質を含む多種多様な物質を用いることができる。
【0032】
図2Aは、本発明の一実施例として、保護膜複合体セパレータを示す。セパレータ200は、異なった化学適合性を有する材料からなる複数の層の積層体である。第一成分層あるいは前駆物質層202は、イオン伝導性と、活性金属に対する化学的適合性とを有する。多くの場合、第一成分は、(空気、水分等)酸化剤とは化学的に適合性がない。活性金属に接する第一層は、その全体あるいは一部を、活性金属窒化物、活性金属リン化物、活性金属ハロゲン化物、あるいは活性金属リン酸窒化物ガラスから形成するようにしてもよい。例えば、Li3N、Li3P、LiI、LiBr、LiCl、LiF等を用いることができる。また、酸化剤に対して化学的適合性があるLiPONを用いることもできる。第一成分層の厚さは、望ましくは、約0.1ないし5ミクロン、さらに望ましくは0.2ないし1ミクロン、例えば、0.25ミクロンである。
【0033】
また、上述したように、第一成分を、活性金属に対して化学的適合性があり反応性に富む前駆物質としてもよい。前駆物質が活性金属電極材に接触することにより、活性金属電極材に対して化学的に安定で、かつ、(第一層成分として)望ましいイオン伝導性を有する生成物を生じる。前駆物質の好適な例としては、金属窒化物、赤リン、窒素・リン含有有機物質(例えば、アミン、ホスフィン、ボラジン(B3N3H6)、トリアジン(C3N3H3))、ハロゲン化物が挙げられる。特に望ましくは、P(赤リン)、Cu3N、SnNx、Zn3N2、FeNx、CoNx、窒化アルミニウム(Al3N)窒化珪素(Si3N4)I2、Br2、Cl2、F2である。このような前駆物質を(Li等の)活性金属と反応させることにより、上述したようなリチウム窒化物、リン化物、ハロゲン化物等のリチウム金属塩が形成される。このような第一成分層の前駆物質としては、(水分と周辺大気に通常存在する他の物質を含む)空気中で化学的に安定であり、取り扱い、製造が容易なものでもよい。このような物質としては、金属窒化物、例えば、Cu3Nが挙げられる。
【0034】
また、活性金属に適合する層に、ポリマー成分を加え、その物性を改良するような構成も望ましい。例えば、ポリ(2−ビニルピリジン)−ヨウ素(P2VP-I2)、ポリエチレン‐ヨウ素等のポリマー‐ヨウ素錯体やテトラアルキルアンモニウム‐ヨウ素錯体をリチウムと反応させて、純粋なLiIよりも非常に高いイオン伝導性を有するLiI複合層を形成するようにしてもよい。
【0035】
第一成分層は、少なくとも10-7S/cm以上、望ましくは10-5S/cm以上、さらに望ましくは10-3S/cm以上という高いイオン伝導度を持つ。
【0036】
第一成分層あるいは前駆物質層202と隣接して第二層204が形成される。第二層204は、実質的に不浸透性であり、イオン伝導性があり、第一成分層あるいは前駆物質層202に対して化学的適合性があり、さらに、アノードの活性金属に対して通常腐食性のある環境に対して化学的適合性がある。第二層204の成分としては、(D.P. Button et al., Solid State Ionics, Vols. 9-10, Part 1, 585-592(1983年12月)に記載されるような)リンガラス、酸化物ガラス、リン酸窒化物ガラス、イオウガラス、酸化物/硫化物ガラス、セレン化物ガラス、ガリウムガラス、ゲルマニウムガラス、ボラサイトガラス等のガラス性あるいは非晶質金属イオン伝導体や、リチウムβアルミナ、ナトリウムβアルミナ、リチウム超イオン伝導体(LISICON)、ナトリウム超イオン伝導体(NASICON)等のセラミック活性金属イオン伝導体や、ガラス‐セラミック活性金属イオン伝導体が用いられる。例えば、LiPON、Li3PO4、Li2S.SiS2、Li2S.GeS2.Ga2S3、Li2O.11Al2O3、Na2O.11Al2O3、(Na,Li)1+xTi2-xAlx(PO4)3(0.6≦x≦0.9)や、結晶学的関連構造であるNa3Zr2Si2PO12、Li3Zr2Si2PO12、Na5ZrP3O12、Na5TiP3O12、Na3Fe2P3O12、Na4NbP3O12、Li5ZrP3O12、Li5TiP3O12、Li3Fe2P3O12、Li4NbP3O12、さらに、これらを組み合わせたものや焼結あるいは溶融したものを用いることができる。セラミック活性金属イオン伝導体の望ましい例は、例えば、本発明に参照文献としてその全体を組み込む米国特許第4,985,317号(Adachiら)に記載される。
【0037】
保護膜複合体の第二層のガラスセラミック材としては、以下の組成で、Li1+x(M,Al,Ga)x(Ge1-yTiy)2-x(PO4)3(ここで、X≦0.8と0≦Y≦1.0とを満たし、MがNd、Sm、Eu、Gd、Tb、Dy、Ho、Er、Tm、Ybからなる群から選択される元素)および/あるいはLi1+x+yQxTi2-xSiyP3-yO12(ここで0<X≦0.4 と0<Y≦0.6とを満たし、QがAlあるいはGaである)からなる主要結晶質相を含むリチウムイオン伝導性ガラスセラミック材が特に好適である。
組成 mol%
P2O5 26-55%
SiO2 0-15%
GeO2+TiO2 25-50%
内 GeO2 0-50%
TiO2 0-50%
ZrO2 0-10%
M2O3 0<10%
Al2O3 0-15%
Ga2O3 0-15%
Li2O 3-25%
ガラスセラミック材は、原料を溶融して、溶融した原料をガラスに成型し、ガラスに熱処理を施すことにより得られる。このような材料は、例えば、日本の株式会社オハラから市販され、詳しくは、本発明に参照文献として組み込まれる米国特許第5,702,995号、6,030,909号、6,315,881号、6,485,622号に記載される。
【0038】
これらのガラス材、セラミック材、ガラス‐セラミック材は高い伝導性(約10-7S/cmから10-3S/cmの範囲、あるいはそれ以上のイオン伝導度)を持ち、保護されるリチウムアノードの性能を高め、オーム抵抗に大きな影響を及ぼすことなく、比較的厚い膜の形成を可能にする。
【0039】
第一層、第二層ともにさらに別の成分を加えるようにしてもよい。活性金属適合性成分層(第一層)にポリマー成分を加え、その物性を改良するようにしてもよい。例えば、ポリ(2−ビニルピリジン)−ヨウ素(P2VP-I2)、ポリエチレン‐ヨウ素等のポリマー‐ヨウ素錯体やテトラアルキルアンモニウム‐ヨウ素錯体をリチウムと反応させて、純粋なLiIよりも非常に高いイオン伝導度を有するLiI含有層を形成するようにしてもよい。さらに、第一層の効果を高める成分、例えば、(蒸着中の)リチウム蒸気が第一層成分として用いられるLiPONと反応しないように(Ag等の)薄い加湿層を設けるようにしてもよい。
【0040】
これらの層は、(電子線蒸着等の)蒸着手法、Li3Nや(LiPON等の)イオン伝導性ガラスのような材料層のプラズマ溶射等の熱溶射手法など、様々な手法で形成可能である。また、上述したように、一ないし複数の前駆物質と活性金属電極との無害な反応により、活性金属電極に隣接する層をin situ(その場で)形成するようにしてもよい。例えば、Cu3NをLiアノード表面に接触させることによりLiアノード上にLi3N層を形成するようにしてもよいし、赤リンをLiアノード表面に接触させることにより、Liアノード上にLi3Pを形成するようにしてもよい。
【0041】
上記した組成、成分、製造法に関しては、Ionically Conductive Composites for Protection of Anodes and Electrolytes(アノードと電解質保護のためのイオン伝導性組成物)のタイトルで2002年10月15日出願の米国仮特許出願番号60/418,899号、Ionically Conductive Composites for Protection of Active Metal Anodes(活性金属アノード保護のためのイオン伝導性組成物)のタイトルで2003年10月14日出願の対応米国特許出願番号10/686,189号(代理人整理番号No.PLUSP027)、並びに、Ionically Conductive Composites for Protection of Active Metal Anodes(活性金属アノード保護のためのイオン伝導性組成物)のタイトルで2003年12月5日出願の米国特許出願番号10/731,771号(代理人整理番号No.PLUSP027X1)に記載されている。これらの出願全体を参照文献として、本発明に組み入れる。
【0042】
保護膜複合体には、本質的に高いイオン伝導度が求められる。複合体のイオン伝導度は、少なくとも約10-7S/cm以上、望ましくは10-6S/cmから10-5S/cm以上、さらに望ましくは10-4S/cmから10-3S/cm以上である。第一成分層は、セパレータで隔てる必要があるアノードの活性金属等、隣接する成分や層に第二成分層が接することがないように充分な厚さに形成される必要がある。例えば、第一成分層の厚さは、約0.1ないし5ミクロン、望ましくは、0.2ないし1ミクロン、例えば、約0.25ミクロンである。
【0043】
第二成分層の厚さは、0.1ないし1000ミクロン、望ましくは1ないし500ミクロン、さらに望ましくは10ないし100ミクロン、例えば20ミクロンである。第二成分層のイオン伝導度が約10-7S/cmの場合、厚さは約0.25ないし1ミクロン、イオン伝導度が約10-4S/cmから10-3S/cmの場合には、厚さは約10ないし1000ミクロンが望ましい。
【0044】
第一成分層が、Cu3NやLiPON等の空気中で化学的に安定な前駆物質で形成されている場合には、電池セルに組み込む前の保護膜複合体セパレータを、劣化させることなく、通常の大気条件で取り扱い・貯蔵可能である。セパレータを電池セルに組み込むと、前駆物質層202が(リチウム等の)活性金属電極に接し、前駆物質が活性金属と反応して、活性金属電極材に対して化学的に適合性のあるイオン伝導性成分層を形成する。一方、第二成分層は、カソードと集電板が接続される、あるいは、接続された電解質に接する。あるいは、第二成分層が電池セルの唯一の電解質として作用するような構造でもよい。いずれの構成でも、保護膜複合体の二つの層を組み合わせることにより、活性金属電極と電解質および/あるいはカソードとの間で有害な反応が起こらないように保護する。
【0045】
本発明の保護膜複合体は、積層体構造に限られず、図2Bに示すような組成勾配あるいは機能勾配を持つ勾配体構造でもよい。高周波スパッタリング、電子線蒸着、熱溶射、プラズマ溶射のような適当な蒸着手法を用いて、複数の材料源から勾配膜を形成することができる。すなわち、異なった組成及び機能を持つ複数の層の間に形成されるはっきりした界面の代わりに、一つの層から別の層へと徐々に移り変わっていく。上述の独立層積層体と同様、結果として得られる二元機能適合性でありイオン伝導性の複合体220は、片側面214がリチウム等の活性金属に対して安定であり(第一成分)、もう片側面216が実質的に不浸透性で、周辺環境に対して、さらに電池セルに組み込んだ状態ではカソードや他の電池セル成分に対して、安定である(第二成分)。複合体の第一成分と第二成分との比は、必要なイオン伝導性や機械的強度により大きく変動する。必須条件ではないが、多くの例では、第二成分のほうが多い。第一成分と第二成分の比としては、例えば、1:1000あるいは1:500が望ましく、第二成分のほうが第一成分よりも強度が高くイオン伝導度が高い場合には、例えば、1:200が望ましい(例:LiPONが2000Åに対して、ガラスセラミックが20ないし30ミクロン)。複合体内での第一成分と第二成分間の遷移層は、いかなる厚さでもよく、比較的短いものから、長いもの、中間のものと、任意に設定可能である。また、電極やセルに用いるなど、独立層積層体構造の保護膜複合体と同様、勾配体構造の保護膜複合体も様々な構成で利用可能である。
【0046】
図3Aに、本発明の一実施例として、積層体構造の保護膜複合体を備える被覆アノード構造体を示す。アノード構造体300は、リチウム等の活性金属電極308と、電極308に接続された、例えば銅製の集電板310と、保護膜複合体302とを備える。保護膜複合体302は、イオン伝導性があり、活性金属電極材に対して化学的適合性があるが、電解質や(空気等の)酸化剤に対しては化学的適合性がない成分からなる第一層304を備える。例えば、活性金属に接する第一層は、その一部あるいは全部が、活性金属窒化物、活性金属リン化物、活性金属ハロゲン化物から形成されるものでもよい。例えば、Li3N、Li3P、LiI、LiBr、LiCl、LiF等を用いることができる。第一成分層の厚さは約0.1ないし5ミクロンが望ましく、さらに望ましくは0.2ないし1ミクロン、例えば、約0.25ミクロンである。
【0047】
活性金属電極材(例えば、リチウム)に第一層の材料を積層するようにしてもよいし、あるいは、金属窒化物、金属リン化物、金属ハロゲン化物、赤リン、ヨウ素等の前駆物質をリチウムに接触させることにより、in situ(その場で)第一層を形成するようにしてもよい。第一層のin situ(その場)形成の場合には、例えば、以下のような反応で前駆物質(P、Cu3N、PbI2)をリチウム化合物に変換する。
1.3Li + P = Li3P(前駆物質からリチウムイオン伝導体を形成する反応)
2(a).3Li + Cu3N = Li3n + 3Cu(リチウムイオン伝導体‐金属複合体を形成する反応)
2(b).2Li + PbI2 = 2LiI + Pb(リチウムイオン伝導体‐金属複合体を形成する反応)
【0048】
このようなin situ(その場)変換により形成される第一層複合成分は、電子伝導性金属粒子を含み、本発明の保護膜複合体の第一層成分の要件を満たし、本発明の要旨の範囲に入る。
【0049】
保護膜複合体の第二層306は、実質的に不浸透性で、イオン伝導性があり、第一成分あるいはその前駆物質に対して化学的適合性がある成分から形成される。第二層の成分としては、リンガラス、酸化物ガラス、リン酸窒化物ガラス、イオウガラス、酸化物/硫化物ガラス、セレン化物ガラス、ガリウムガラス、ゲルマニウムガラス、ボラサイトガラス等のガラス性あるいは非晶質金属イオン伝導体や、リチウムβアルミナ、ナトリウムβアルミナ、リチウム超イオン伝導体(LISICON)、ナトリウム超イオン伝導体(NASICON)等のセラミック活性金属イオン伝導体や、ガラス‐セラミック活性金属イオン伝導体が用いられる。例えば、LiPON、Li3PO4、Li2S.SiS2、Li2S.GeS2.Ga2S3、Li2O.11Al2O3、Na2O.11Al2O3、(Na,Li)1+xTi2-xAlx(PO4)3(0.6≦x≦0.9)や、結晶学的関連構造であるNa3Zr2Si2PO12、Li3Zr2Si2PO12、Na5ZrP3O12、Na5TiP3O12、Na3Fe2P3O12、Na4NbP3O12、Li5ZrP3O12、Li5TiP3O12、Li3Fe2P3O12、Li4NbP3O12、さらに、これらを組み合わせたものや焼結あるいは溶融したものを用いることができる。セラミック活性金属イオン伝導体の望ましい例は、例えば、本発明に参照文献としてその全体を組み込む米国特許第4,985,317号(Adachiら)に記載される。また、ガラスセラミック活性金属イオン伝導体の望ましい例は、例えば、本発明に参照文献として組み込まれる米国特許第5,702,995号、6,030,909号、6,315,881号、6,485,622号に記載され、日本の株式会社オハラから入手可能である。
【0050】
複合体のイオン伝導度は、少なくとも約10-7S/cm以上、望ましくは10-6S/cm以上、例えば、10-5S/cmから10-4S/cm以上、さらに望ましくは10-3S/cm以上である。第二成分層の厚さは、0.1ないし1000ミクロン、望ましくは1ないし500ミクロン、さらに望ましくは10ないし100ミクロン、例えば20ミクロンである。第二成分層のイオン伝導度が約10-7S/cmの場合、厚さは約0.25ないし1ミクロン、イオン伝導度が約10-4S/cmから10-3S/cmの場合には、厚さは約10ないし1000ミクロンが望ましい。
【0051】
上記のようなアノード構造体を水あるいは空気カソードと組み合わせて電池セルを形成すると、第一層304は(リチウム等の)活性金属アノードに隣接し、第二層306はカソード材並びにカソードに連結される水性電解質に隣接する。後述するように、電池セルは、さらに、セル内でのカソード反応が促進されるように、多孔質の電子伝導性触媒支持構造を備える。
【0052】
図2A、図2Bを参照して保護膜セパレータ構造として上述したように、本発明の保護膜複合体の構造は、積層体構造に限られず、図3Bに示すような組成勾配および機能勾配を持つ勾配体構造とすることもできる。高周波スパッタリング、電子線蒸着、熱溶射、プラズマ溶射のような適当な蒸着手法を用いて、複数の材料源から勾配膜を形成することができる。すなわち、異なった組成及び機能を持つ複数の層の間に形成されるはっきりした界面の代わりに、一つの層から別の層へと徐々に移り変わっていく。上述の独立層積層体と同様、結果として得られる二元機能適合性でありイオン伝導性の複合体320は、片側面314がリチウム等の活性金属に対して安定であり(第一成分)、もう片側面316が実質的に不浸透性で、カソード、他の電池セル成分、望ましくは、さらに周辺大気に対して安定である(第二成分)。
【0053】
図2Bに示す勾配体構造のセパレータで説明したように、複合体の第一成分と第二成分との比は、必要なイオン伝導性や機械的強度により大きく変動する。必須条件ではないが、多くの例では、第二成分のほうが多い。第一成分と第二成分の比としては、例えば、1:1000あるいは1:500が望ましく、第二成分のほうが第一成分よりも強度が高くイオン伝導度が高い場合には、例えば、1:200が望ましい(例:LiPONが2000Åに対して、ガラスセラミックが20ないし30ミクロン)。複合体内での第一成分と第二成分間の遷移層は、いかなる厚さでもよく、比較的短いものから、長いもの、中間のものと、任意に設定可能である。
【0054】
第一成分層および第二成分層を遷移層及び/あるいは湿潤層等、他の材料で被覆するようにしてもよい。例えば、(株式会社オハラから市販されている)ガラスセラミック板をLiPON層、さらに、銀(Ag)薄膜層で被覆するようにしてもよい。この被覆構造体上でリチウムを蒸散させると、AgがAg-Liに変換され、少なくともその一部は大量の蒸着リチウム内に拡散し、リチウム電極を保護する。Agの薄膜は、高温リチウム(気相)が第一成分層のLiPONに接触して有害な反応が起こるのを防ぐ。蒸着後の固相リチウムはLiPONに対して安定である。このような遷移/湿潤層(例えば、Sn)と第一成分層とを組み合わせることにより、所望の特性を得ることができる。
【0055】
本発明の保護膜は、蒸着、蒸散等、様々な方法で形成可能である。本発明の保護膜複合体は、第一層成分あるいはその前駆物質を第二層成分上に(電子線蒸着等)蒸着あるいは蒸散することにより形成可能である。また、詳細には後述するが、活性金属電極あるいは活性金属材と一つあるいは複数の前駆物質とを悪影響のない形で反応させることにより、(リチウム箔等の)金属リチウムに前駆物質を直接接触させることにより、あるいは、第二層成分を介して前駆物質をリチウムメッキすることにより、第一層をin situ(その場で)形成するようにしてもよい。また、後述するように、第二成分層をさらに第一成分層上に形成するようにしてもよい。
【0056】
図4Aに、本発明の保護膜複合体を形成する第一の方法を示す。この方法では、高イオン伝導性で活性金属に対して化学的適合性がある成分からなる第一層を、実質的に不浸透性でイオン伝導性がある成分、例えば、LiPON等の高イオン伝導性ガラス材あるいはガラスセラミック材、または、上述のガラスセラミック材からなる第二層上に直接蒸着する。この場合には、高周波スパッタリング、電子線蒸着、熱蒸着、反応性熱/電子線蒸着等、種々の手法を用いることができる。図示した例では、窒素プラズマ中でリチウムを蒸散させることにより、上述したガラスセラミック材等のガラスセラミック材の表面にリチウム窒化物(Li3N)層を形成する。次に、Li3N層上に金属リチウムを蒸着する。Li3N層は、金属リチウム電極を第二成分層から隔てる一方で、リチウム電極からガラス材にLiイオンを透過させる。活性金属や第一層成分、第二層成分は図示した例に限られることはなく、様々な金属、成分を用いることができる。
【0057】
図4Bに、本発明の保護膜複合体を形成する第二の方法を示す。この方法では、第二成分層上に前駆物質層を形成した後、イオン伝導性と化学的適合性がある第一成分層をin situ(その場で)形成する。図示した例では、上述したようなガラスセラミック材からなるガラスセラミック層の表面を、活性金属(この場合は、リチウム)リン化物を形成する前駆物質である赤リンで被覆する。次に、リンの被覆層上に、金属リチウム層を蒸着させる。3Li+P=Li3Pの反応式で表されるリチウムとリンとの反応によりLi3Pが形成される。Li3Pは、イオン伝導性物質であり、リチウムアノードとガラスセラミック材の両方に対して化学的適合性を持つ。このような構成により、ガラスセラミック材等の第二層成分は、リチウム電極と直接に接することはない。この方法でも、活性金属や第一層成分、第二層成分は図示した例に限られることはなく、様々な金属、成分を用いることができる。例えば、前駆物質としてCu3Nを用いて、(ガラスセラミック材等の)第二成分層上にCu3Nの薄膜を形成し、リチウムアノードと接触させ、3Li+Cu3N=Li3N+3Cuの反応式に従って第一成分層を形成するようにしてもよい。あるいは、前駆物質として鉛ヨウ化物を用いて、ポリマイ電解質上に鉛ヨウ化物の薄膜を形成し、リチウムアノードと接触させ、2Li+PbI2=2LiI+Pbの反応式に従って第一成分層を形成するようにしてもよい。
【0058】
また、図5に示すように、本発明の保護膜複合体が組成勾配および機能勾配を持つように、一つの層から別の層へと徐々に移り変わる遷移層を形成してもよい。例えば、Li3N、Cu3N、Li3P、LiPON等、適当な第一成分蒸着用スプレーヘッドと株式会社オハラから市販されるガラスセラミック材等の第二成分蒸着用のスプレーヘッドの2つのスプレーヘッドを用いてプラズマ溶射を行う。まず、スプレーヘッドからプラズマを照射して100%のガラスセラミック材層を形成し、徐々にプラズマの照射量を減らす一方、もう一つのプラズマ源からの照射量を増大させる。この結果、100%のガラスセラミック材層から100%のLiPON、Li3N等の第一成分層に連続的に移り変わる勾配層が形成される。得られた保護膜複合体の片側面は(リチウム、ナトリウム等の)活性金属に対して安定であり、もう片側面は実質的に不浸透性で、カソード、他の電池セル成分、望ましくはさらに周辺条件に対して安定である。プラズマ溶射の代わりに、電子線蒸着あるいは熱溶射を行うようにしてもよい。当業者には自明のように、本発明の保護膜複合体の勾配構造は、与えられたパラメータに従い、様々な手法で形成可能である。
【0059】
保護膜複合体の勾配構造の内(活性金属に安定な)第一成分層側にリチウムを蒸着等、上述した方法で付着させることにより、アノードの保護構造を形成することができる。さらに、リチウムを蒸着させる前に、保護膜複合体の勾配構造の内リチウムに安定な側上にSn、Ag、Al等の接着層を形成することも望ましい。
【0060】
図4A、図4B、図5を参照して上述した方法のいずれにおいても、第一成分層あるいは前駆物質層上にリチウム層(活性金属層)を形成する代わりに、保護膜複合体の第一成分層あるいは前駆物質層をリチウムに接触させて、金属リチウムを保護膜の層間物質あるいは前駆物質に結合させるようにしてもよい。例えば、押し出されたリチウム金属箔に層間物質あるいは前駆物質を直接接触させるようにしてもよい。
【0061】
また、錫層を含む銅材等、加湿層を含む適当な基材を、第一層成分あるいは前駆物質、例えば、Cu3Nで被覆するようにしてもよい。これをさらに、(イオン)伝導性ガラス等の第二層成分で被覆するようにしてもよい。第一層成分及び第二層成分を介して、リチウム(活性金属)で錫電極をメッキすることにより活性金属電極を形成するようにしてもよい。このメッキ工程により、前駆物質であるCu3NもLi3Nに変換され、リチウム金属電極上に本発明の保護膜複合体が形成される。このような活性金属メッキ方法の詳細は、本発明の引用文献として組み込まれた、同一出願人による米国特許第6,402,795号に記載されている。
【0062】
上述の製造法に関して注意するべきことは、市販されているリチウム箔は通常押し出し成形されており、このため表面には無数の傷があり、高周波スパッタリング、熱蒸着、電子線蒸着等の視線蒸着手法では到達不能なほど深く凹んだ部分も多いということである。また、リチウム等の活性金属は薄膜蒸着環境に対して反応性が高いため、蒸着工程で表面がさらに劣化する危険性があることにも留意が必要である。この結果、活性金属電極の表面上に蒸着された膜には亀裂や孔が生じることになる。そこで、製造工程を逆にすることにより、この問題を解決する。すなわち、リチウム上に保護膜を蒸着させるのではなく、保護膜上にリチウムを蒸着させればよい。溶融鋳造法、切断研磨法など、滑らかな表面を形成するための周知の様々な手法のいずれかを用いて、滑らかな表面を持つガラス膜あるいはガラスセラミック膜を形成する(リチウムは柔らかい金属なので研磨は不可能である)。一層あるいは複数層の滑らかで亀裂のない膜をこの滑らかな表面上に蒸着形成する。その後、滑らかな表面上に活性金属を蒸着することにより、滑らかで亀裂のない活性金属‐保護膜界面を形成することができる。あるいは、Ag等の遷移接着層を保護膜上に蒸着し、押し出し成形されたリチウム箔をAg層に対して圧着することにより、リチウム箔と膜とを接合するようにしてもよい。
【0063】
また、前記したように、第一層が別の成分をさらに含むように構成してもよい。第一層にポリマー成分を加え、その物性を改良するようにしてもよい。例えば、ポリ(2−ビニルピリジン)−ヨウ素(P2VP-I2)、ポリエチレン‐ヨウ素等のポリマー‐ヨウ素錯体やテトラアルキルアンモニウム‐ヨウ素錯体をリチウムと反応させて、活性金属と第二層成分の両方に対して化学的適合性のあるイオン伝導性LiI含有層を形成するようにしてもよい。ポリマーヨウ素電荷移動錯体を用いることにより、純粋なLiIよりも非常に高いイオン伝導度を有し、LiIとポリマーとを含有する複合体層を形成することができる。同様に、臭素錯体等、他のハロゲン錯体を用いることもできる。
【0064】
図6Aにポリマー含有構造の一例を示す。この実施例では、ポリマー層とヨウ素層を第二成分層表面に被覆して、反応させ、ポリマーヨウ素錯体を形成する。
【0065】
この例では、ブラッシング、浸漬、あるいは、スプレー等により、(伝導性ガラス等の)第二成分層上にポリマー薄膜を形成する。例えば、(0.5ないし2.0ミクロン、より好ましくは0.1ないし0.5ミクロンの)薄いP2VP層で伝導性ガラス層を被覆する。
【0066】
次に、ドライボックスあるいはドライルーム内に設置した反応器内で(約20ないし25°Cの)室温でヨウ素結晶を昇華することによりヨウ素膜を形成する。昇華ヨウ素層は(0.05ないし0.1ミクロンと)非常に薄く形成可能であり、昇華率は、温度あるいは基材とヨウ素源との間の距離を変更することにより調節可能である。
【0067】
あるいは、アセトニトリルやn-ヘプタン等の有機溶媒に高濃度でヨウ素を溶かし(例えば、50ないし100g/l)、浸漬、スプレー、ブラッシング等により伝導性ガラス表面をヨウ素の溶解液で被覆するようにしてもよい。この場合には、被覆処理の距離及びヨウ素濃度を変更することにより処理条件を簡単に変えることができる。この手法で用いられるヨウ素源の例としては、LiアノードおよびLiI含有固体電解質と共に構成される固体電池のカソード材として知られている、AgI、PbI2等の金属ヨウ素化物が挙げられる。
【0068】
最後に、ポリマーヨウ素錯体で被覆された伝導性ガラス(第二層成分)にリチウムを蒸着する、あるいはリチウムを圧着することにより、伝導性ガラス上に形成されたポリマーヨウ素錯体にリチウム(活性金属)を接触させる。この結果、Liアノード上にLiIを含有する保護膜複合体が形成される。
【0069】
図6Bにポリマー含有構造の別の例を示す。この例では、上述した手法により、Liと反応してLiI層(A)を形成可能なヨウ素の薄膜で伝導性ガラス(第二層成分)表面上を被覆する。
【0070】
上述した手法によりリチウム箔等の活性金属層をポリマー(B)の薄膜で被覆する。その後、ポリマー層がヨウ素層に接するように、伝導性ガラスと活性金属層を組み付ける。ヨウ素がポリマーと反応することにより、インピーダンスが減少した、LiI含有保護膜複合体が形成される。
【0071】
完全形成された保護膜と上述した周辺環境に安定な前駆物質を含む電池セパレータとにより保護されたアノード構造体は、電池セルに組み込むまで、通常の周辺大気条件下で、劣化することなく、取り扱い・貯蔵可能である。
【0072】
活性金属水性セル
上述したように活性金属アノードを保護することにより、リチウム/水セル、リチウム/空気セル、リチウム/金属水素化物セルのように、カソードに水性構成成分を含む活性金属電池セルや電気化学セルを構成することができる。このようなセルは、一般的に、電子伝導性成分と、イオン伝導性成分と、電気化学的活性成分とを含むカソード構造体を備える。ここで、カソード構造体成分の少なくとも一つは、水性組成あるいは水性構成成分を有する。これらのセルは、従来のセルに比べて飛躍的に性能が強化されている。後述するように、このようなセルは、種々の態様で適用、実現可能である。このようなセルは、それぞれ異なる電気化学反応に従って作動し、カソード構造体の電気化学的活性成分を(液体、気体、固体等)様々な状態から選択可能であるが、いずれのセルも、カソード構造体内にLiイオン輸送のための水性構成成分を備えるという共通の特徴を備える。保護膜によりアノードとカソードを隔てる構造により、このような強力な新型電池セル、電気化学セルを製造することが可能になる。
【0073】
活性金属/水セル
本発明は、新しい活性金属/水電池セルや活性金属/水電気化学セルを提供する。本発明のセルは、リチウム(Li)や他のアルカリ金属等の活性金属アノードと、保護膜と、水や過酸化物水溶液等の電気化学的に活性な水性成分を含むカソード構造体とを備える。このようなセルのアノード側の構造については、前述した。このセルでは、保護膜により被覆されていない活性金属電極部分は、すべて、(銅等の)集電板材、Oリングシール、クリンプシール、ポリマーあるいはエポキシ封止材、あるいはこれらの組合せにより、水性カソード環境から切り離す必要がある。
【0074】
このようなセルのカソード側には、電子伝導性成分と、イオン伝導性成分と、電気化学的に活性な水性成分とを含むカソード構造体が形成される。電気化学的に活性な水性成分は、多くの場合、イオン伝導性も持つため、一つの溶液で電気化学的活性成分とイオン伝導性成分の両方の作用をすることも多い。以下に例を挙げて説明するように、セルは、アノードと電気的に接続される電子伝導性支持体を備え、電子の移動によりカソード材(例えば、リチウム/水セルではH2O)を還元する。電子伝導性支持体は、通常、多孔質であるため流体を透過させ、また、(NiやPt等の)触媒活性を持つか触媒処理されることにより、カソード材還元の触媒として働く。適当なイオン伝導性を有する水性電解質が電子伝導性支持体に接することにより、電子伝導性支持体内をイオンが移動して、酸化還元反応が生じる。
【0075】
電子伝導性支持体をパーフルオロスルホン酸ポリマー膜(例えば、du Pont社のNafion)等のアイオノマーで処理することにより電気化学的活性がある水性成分の許容範囲をイオン伝導性が低い、あるいは、まったくイオン伝導性を持たない水性成分にまで広げることが可能になる。また、Nafion等のアイオノマーで処理することにより、ポリマー鎖に電子伝導性成分の塩を化学的に結合させ、流水式構造やオープンセル構造でも消失してしまうことがない。
【0076】
電池セルは一次電池でも二次電池でもよい。一次電池の場合には、セルのカソード側が周辺環境に対して開放されており、セルのカソード側から酸化リチウムが周辺環境中に分散してしまう可能性がある。このようなセルの構造を「オープンセル構造」と称する。例えば、電気化学的活性とイオン伝導性を持つ成分として海水を用いる海上用セルが、オープンセル構造である。二次電池の場合には、セルのカソード側に酸化リチウムが貯留され、適当な電位がセルに加えられると、保護膜を通してLiイオンを逆方向に移送することにより、アノードを再充電することが可能になる。このようなセルの構造を「クローズドセル構造」と称する。クローズドセル構造では、カソードで生成される水素を放出する必要があるが、電池セルで用いられる適切な通気構造に関しては当該分野で周知である。
【0077】
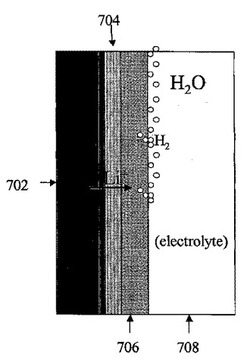
図1に概略構造を示すような本発明の活性金属/水電池セルの一例として、リチウム/水電池セルが挙げられる。図7に、本発明に従うリチウム/水電池セルの一例を示す。この例では、電池セル700がリチウム陰極(アノード)702を備えるが、他のアルカリ金属等の活性金属でアノードを形成することも可能である。金属リチウム電極702は、リチウムイオン伝導性保護膜704に接合される。接合には、本明細書で言及し、本発明の参照文献として組み込まれる特許出願に記載された、いかなる手法を用いてもよく、必要に応じて、Agや他の適当な合金形成金属の薄膜を接着層として利用してもよい。セルは、さらに、多孔質で電子伝導性のある触媒支持体706と、(水等の)電気化学的活性成分と水性電解質708とを含むカソード構造体を備える。海水やLiCl、LiBr、LiI、NH4Cl、NH4Br等の水溶液を電気化学的活性成分とイオン伝導性成分の両方として用いるようにしてもよいし、後述するようにアイオノマーを用いる場合には、塩をほとんど、あるいは、まったく含まないようにしてもよい。また、保護膜704と多孔質電子伝導性触媒支持体706との間にさらにセパレータを配置するようにしてもよい。このセパレータは、多孔質電子伝導性触媒支持体706の粗い表面により保護膜704が損傷を受けるのを防ぎ、水性カソード活性材/電解質の流体貯留所として機能する。セパレータを、ポリエチレン、ポリプロピレン等のポリオレフィンで形成するようにしてもよく、例えば、GELGARDセパレータを用いることができる。セル内の電気化学的活性成分(水)とイオン伝導性成分(水性電解質)は混合されて一つの溶液を形成していてもよく、図でも一つの部材708として示している。
【0078】
上述したように、セルの保護膜のカソード側には、電子伝導性成分と、水性及び/あるいはアイオノマー性イオン伝導性成分と、電気化学的に活性な水性成分とを含むカソード構造体が配置される。図示した構造では、これらの成分を水性電解質708および多孔質電子伝導性触媒支持体706として表している。リチウム/水電池では、電気化学的活性成分は水である。なんら限定されるものではないが、アノードからのLiイオンと水との間では、以下のような電気化学反応が起こっていると考えられる。
Li + H2O = LiOH + 1/2H2
この反応により、Li1モルと水1モルから、LiOH1モルと水素ガス0.5モルが生成される。
【0079】
セルの水性電解質は、LiイオンとLiイオンに結合した陰イオン輸送(伝導)のイオンキャリアとして働く。上述したように、電気化学的活性成分(水)とイオン伝導性成分(水性電解質)は混合されて一つの溶液を形成していてもよいが、これらの成分は、概念的には電池セルの異なった構成要素である。本発明のリチウム/水電池セルに適した電解質は、適度なイオン伝導性を有する水性電解質ならどのようなものでもよい。好適な電解質としては、HCl、H2SO4、H3PO4等の強酸、酢酸/酢酸リチウム等の弱酸、LiOH等の塩基、海水、LiCl、LiBr、LiI等の中性物質、NH4Cl、NH4Br等の両性物質が挙げられる。
【0080】
電解質として海水を用いることにより、高いエネルギー密度を有する海上用電池セルを構成することが可能になる。未使用の状態では、セル構造体は、被保護アノードと、多孔質の電子伝導性支持体(電子伝導性成分)とから構成されている。セルを使用する際には、電気化学的活性成分とイオン伝導性成分として働く海水にセル構造体を浸す。電気化学的活性成分とイオン伝導性成分は周辺環境中の海水によって与えられるため、セルの使用前に電池セルの一部として構成する必要はなく、セルのエネルギー密度算出に含める必要もない。カソード側の反応生成物は貯蔵されないために、このようなセルを「オープンセル」と称する。すなわち、このようなセルは一次電池になる。
【0081】
本発明は、リチウム/水セルとしても実現可能である。上記したように、適切な再充電電位がセルに加えられた際に、保護膜を通してLiイオンを逆方向に移動させ、セルのカソード側に貯蔵されるカソード反応生成物を用いてアノードを再充電する。このようなセルを「クローズドセル」と称する。
【0082】
また、先に言及し、詳細には後述するように、多孔質の電子伝導性触媒支持体をアイオノマーで被覆することにより、電気化学的活性成分に必要とされるイオン伝導度が減少する、あるいは、ゼロになる。
【0083】
リチウム/水セル内で生じる電気化学反応は、カソードの電気化学的活性成分を還元する酸化還元反応である。リチウム/水セルでは、電子伝導性触媒支持体が酸化還元反応を促進する。上述したように、これに限定されるものではないが、リチウム/水セル内では、以下のセル反応が生じていると考えられる。
Li + H2O = LiOH + 1/2H2
すなわち、アノードとカソードでは、以下の半電池反応が進むと考えられる。
アノード:Li = Li+ +e-
カソード:e- + H2O = OH- +1/2H2
【0084】
リチウム/水セルのカソード触媒は、水への電子移送を促進し、水素と水酸化物イオンを生成する。この反応に一般的に用いられる触媒は安価な金属ニッケルである。Pt、Pd、Ru、Au等の貴金属にも同様な触媒作用があるが、高価である。
【0085】
本発明のリチウム/水(活性金属)電池の範疇には、被保護Liアノードと、活性カソード材(電気化学的活性成分)として利用可能な水溶性の気体及び/あるいは固体酸化剤からなる水性電解質と、を備える電池も入る。水よりも強い酸化剤である水溶性化合物を用いることにより、リチウム/水電池に比べて、電池エネルギーを著しく増大させることが可能になる。このようなセルでは、放電反応時に、カソード表面で電気化学的な水素放出が生じる。利用可能な気体酸化剤の例としては、O2、SO2、NO2が挙げられる。また、NaNO2、KNO2等の亜硝酸金属、Na2SO3やK2SO3等の亜硫酸金属も水よりも強い酸化剤であり、高濃度で容易に水に溶解可能である。他に、水溶性の無機酸化剤として、リチウム、ナトリウム、カリウムの過酸化物や過酸化水素H2O2が挙げられる。
【0086】
酸化剤として過酸化水素を用いることは特に有用である。本発明の電池セルでは、過酸化水素は、少なくとも2種類の作用を果たす。一つ目の作用は、カソード表面上での過酸化水素の化学分解である。これにより、活性カソード材として利用可能な酸素ガスが生成される。二番目の作用はもっと有用であると考えられるが、カソード表面上での過酸化水素の直接的な電解還元である。過酸化水素は、原則として、塩基性溶液中でも酸性溶液中でも還元可能であるが、酸性溶液中での過酸化水素還元を利用する電池の場合に、最も高いエネルギー密度が得られる。過酸化水素を用いたリチウムアノード型セルのエネルギー密度は、(標準的な条件で)E0=4.82Vであり、これはリチウム/水セルのエネルギー密度E0=3.05Vよりも有意に高い。ただし、酸も過酸化水素も裸のリチウムに対する反応性が非常に高いため、リチウムアノードを保護しないと実用的なセルを作ることはできない。
【0087】
過酸化水素を溶解したリチウム/水セルで過酸化水素を流動させることにより、カソード表面における過酸化水素の還元効率、特に高放電率時の還元効率を高めることができる。この場合、過酸化水素は、カソード表面に連続的に供給される燃料となる。被保護Liアノードを持つ海上用高エネルギー密度セルでは、海水に溶解され、連続的にセル内を流動する過酸化水素を利用することができる。
【0088】
活性金属/空気電池セル
本発明に従う水性活性金属セルの別の例としては、活性金属/空気電池セルがある。活性金属/空気電池セルは、リチウム(Li)や他のアルカリ金属等の活性金属アノードと、保護膜と、電気化学的活性成分として空気を含むカソード構造体とを備える。なんら限定されるものではないが、アノードからのLiイオンと空気との間では、以下のような電気化学反応が起こっていると考えられる。
Li + 1/2H2O + 1/4O2 = LiOH
Li + 1/4O2 = 1/2Li2O
Li + 1/2O2 = 1/2Li2O2
すなわち、空気中の水分(H2O)と酸素の両方電気化学反応に関与している。
【0089】
活性金属/空気電池セルのアノード側構造は、水性活性金属セルに関して説明したものと同様である。このセルでも、保護膜により被覆されていない活性金属電極部分は、すべて、(銅等の)集電板材、Oリングシール、クリンプシール、ポリマーあるいはエポキシ封止材、あるいはこれらの組合せにより、空気カソード環境から切り離す必要がある。
【0090】
このようなセルのカソード側には、電子伝導性成分と、イオン伝導性成分と、電気化学的活性成分として空気を含むカソード構造体が形成される。セルの電気化学的活性成分である空気は水分を含み、この水が上記の電気化学反応に供される。以下に例を挙げて説明するように、セルは、アノードと電気的に接続される電子伝導性支持体を備え、電子の移動によりカソード活性材である空気を還元する。電子伝導性支持体は、通常、多孔質であるため流体(空気)を透過させ、また、触媒活性を持つか触媒処理されることにより、カソード活性材還元の触媒として働く。適当なイオン伝導性を有する水性電解質あるいはアイオノマーが電子伝導性支持体に接することにより、電子伝導性支持体内部をイオンが移動して、酸化還元反応が生じる。
【0091】
本発明のリチウム/空気電池セルの一例を図8に示す。図示した例では、セル800は、リチウム等の活性金属陰極(アノード)808と、アノード808に接合される銅等の集電板810と、保護膜積層複合体802とを備える。上述したように、保護膜積層複合体802は、イオン伝導性があり、活性金属電極材に対して化学的適合性を持つ成分からなる第一層804と、実質的に不浸透性で、イオン伝導性があり、第一成分と水性環境の両方に化学的適合性を持つ成分からなる第二層806とを備える。セルは、さらに、電子伝導性成分と、水性及び/あるいはアイオノマー性イオン伝導性成分と、電気化学的活性成分として空気とを含むカソード構造体(以下、「空気極」とも呼ぶ)812を備える。リチウム/水セルと同様に、保護膜802とカソード構造体812との間にさらにセパレータを配置するようにしてもよい。このセパレータは、多孔質の電子伝導性触媒支持体であるカソード構造体812の粗い表面により保護膜802が損傷を受けるのを防ぐ。酸性電解質を含むリチウム/空気電池の場合には、セパレータにより、セル放電反応で電解質が塩基性溶液に変換される以前のセル容量を増大させ、大気中のCO2に対する反応性(炭酸化反応)を高める。セパレータを、ポリエチレン、ポリプロピレン等のポリオレフィンで形成するようにしてもよく、例えば、GELGARDセパレータを用いることができる。
【0092】
カソード構造体812は、多孔質電子伝導体等の電子伝導性成分と、少なくとも水性構成成分であるイオン伝導性成分と、電気化学的活性成分として空気とを含む。カソード構造体は、亜鉛/空気電池等の金属/空気電池やPEM燃料電池等の低温燃料電池で通常用いられるものなど、適当な空気極であればよい。亜鉛/空気電池を初めとする金属/空気電池で用いられる空気極に関しては、「Handbook of Batteries」(電池ハンドブック) (Linden and T. B. Reddy, McGraw-Hill, NY, 3版)等、多くの文献に記載されているように、通常、空気拡散膜、疎水性テフロン層、触媒層、Niスクリーン等の電子伝導性金属成分/集電板を含む複数の層からなる層状構造を有する。触媒層には、水性及び/あるいはアイオノマー性イオン伝導性成分/電解質が含まれる。水性電解質は、例えば、水に溶解させたKOHである。アイオノマー性電解質は、例えば、パーフルオロスルホン酸ポリマー膜(例えば、du Pont社のNafion)等の水和(水)リチウムイオン伝導性ポリマーである。空気拡散膜は、空気(酸素)の流量を調整する。疎水性層は、セルの電解質が空気拡散膜に侵入するのを防ぐ。疎水性層には、通常、カーボン粒子とテフロン粒子とが含まれる。触媒層には、通常、表面積の大きなカーボンと酸素ガスの還元を促進する触媒とが含まれる。市販されているカソードの大部分では、MnO2等の金属酸化物が酸素還元用の触媒として用いられている。また、コバルトフタロシアニン等の大員環金属化合物やプラチナ、プラチナ/ルテニウム合金等、高分散貴金属も触媒として用いることができる。空気極構造体は、活性金属電極から化学的に分離されているため、アノード活性材に対する反応性により空気極の化学組成が限定されることはない。すなわち、保護されていない金属電極を攻撃する可能性のある材料を高性能空気極に用いた設計も可能になる。
【0093】
金属/空気電池では、周辺環境からカソードの活性反応物質を取り入れるため、容積エネルギー密度や重量エネルギー密度が非常に高い。金属/空気電池は、エネルギー密度が高いため、重量やサイズが大きな問題となるような場合に特に有用である。従来の金属/空気電池では、寄生反応が起こり、金属電極が腐食して水素が生じていた。電解質にKOHを加えることで、アノードの腐食反応を最小限に抑えることができるが、その一方で、空気極側で空気中のCO2がK2CO3に変換され、堆積物が生じるために、セルの劣化が早くなるという問題を引き起こす。本発明のセル構造では、活性金属電極を水性電解質から分離することで、アノードの腐食を防ぎ、上記のような問題を解決する。本発明のセルでは、アノードが電解質溶液内で腐食することなく、電解質溶液から分離されているため、中性電解質(LiCl)、塩基性電解質(KOH)、酸性電解質(NH4Cl、HCl等)のいずれを用いた空気極も形成可能である。なんら限られるものではないが、酸性電解質の場合には、以下に示すセル反応が生じ、塩化リチウムが形成されると考えられる。このようなセルでは、空気極は空気中からCO2を取り込まず、K2CO3が形成されない。
Li + 1/2O2 + NH4Cl = LiCl + NH3
本発明の活性金属/空気電池では、水性電解質が金属アノードに接しないため、金属アノードの腐食が起こらず、中性あるいは酸性の電解質が利用可能になる。
【0094】
本発明のリチウム/空気セルは、一次電池としても二次電池としても構成可能である。
【0095】
活性金属/金属水素化物電池セル
本発明に従う、被保護アノードと、水性成分を含むカソード構造とを備える水性活性金属電池セルの別の例として、図9に示すリチウム(活性金属)/金属水素化物電池セルがある。リチウム/金属水素化物電池では、電解質として適した水溶液中で、被保護リチウムアノードを充放電することができる。このセルで好適に用いられる電解質は、プロトン源となるものであり、HCl、HBr、NH4Cl、NH4Br等の塩化物酸や臭化物酸、それらの塩を初めとするハロゲン化物酸やその塩の水溶液が例として挙げられる。
【0096】
放電時には、アノードから放出されたリチウムイオンがイオン伝導性保護膜を通り水性電解質に到達する。プロトンが還元されて水素化イオンが形成され、金属合金陽極(カソード)の一部となる。したがって、セルのカソード側では、電子伝導性成分(金属合金)、イオン伝導性成分(水性電解質)、および、電気化学的活性成分(プロトン/金属合金)を含むカソード構造体が配置される。これは、ニッケル/金属水素化物(Ni/MH)電池で用いられる周知の金属水素化物に類似の構造である。ただし、電解質中の酸は消費され、リチウム塩に変換される。このようなセルを一次電池として構成することも可能であるが、通常は、材料コストを考えて、(再充電可能な)二次電池として構成される。二次電池の再充電時には、リチウムイオンが保護膜を通ってリチウム電極まで移送され、金属リチウムに還元される。その一方で、金属水素化物が酸化されてプロトンを放出し、酸電解質を再生する。このようなセルは、陽極と陰極の可逆性が非常に高く、サイクル寿命が長い。
【0097】
なんら限定されるものではないが、本発明のリチウム/金属水素化物セルでは以下の半電池反応ならびに全電池反応が生じていると考えられる。
アノード: Li = Li+ + e-
カソード: HCl + M + e- = MH + Cl-
電池反応: Li + HCl + M = LiCl + MH
金属水素化物合金は当業者に周知のものであり、通常は、AB5(性能向上のために部分的に置換されたLaNi5やLaCo5)で表される希土類合金(ミッシュメタル)や(ZrNi2等)チタンやジルコニウムを含むAB2合金から選択される。金属水素化物電極は、ポリマー結合活性水素貯蔵合金で被覆された穴あきニッケル箔あるいはグリッドを有する高多孔性構造体として形成される。金属水素化物電極は、商業ベースでは、ニッケル/金属水素化物(Ni/MH)電池に用いられる。市販の電池では、アルカリ電解質が用いられるため、アルカリ条件下での性能を向上させるように水素化物合金が修飾されている。Ni/MH電池において、電解質が酸性の場合には、酸性電解質におけるサイクル特性が向上するようにAB5あるいはAB2合金の組成を変更するようにしてもよい。
【0098】
リチウム/水電池および燃料電池用の水素発生装置
本発明に従い、活性金属電極上に保護層を設けることにより、ごく少量の腐食電流を生じる活性金属/水電池を構成することが可能になる。Li/水電池は、8450Wh/kgという非常に高い理論エネルギー密度を持ち、Li + H2O = LiOH + 1/2H2というセル反応が起こる。セル反応により生じた水素は通常無駄になるが、本発明のセル構造では、室温燃料電池用の燃料として用いられる。この場合、生成された水素を燃料電池に直接供給することも可能であるし、後から燃料電池で利用するために、金属水素化物合金に貯蔵することも可能である。少なくともMillenium Cell社(http://www.milleniumcell.com/news/tech.html)では、水と水素化ホウ素ナトリウムとの反応を利用して水素を生成している。しかし、この反応には触媒が必要であり、NaBH4と水との化学反応で生じたエネルギーは熱として消失してしまう。
NaBH4 + 2H2O R 4H2 + NaBO2
この反応を燃料電池反応H2 + O2 = H2Oと組み合わせることにより、燃料電池で以下の反応が起こると考えられる。
NaBH4 + 2O2 R 2H2O + NaBO2
この系のエネルギー密度は、反応物質であるNaBH4の当量から計算できる(38/4 =9.5グラム当量)。セル電圧は約1であり、この系の比エネルギーは2820Wh/kgであるため、NaBH4の重量エネルギー密度は2820mAh/kgになる。最終生成物NaBO2に基づいて計算されるエネルギー密度はもっと低く、約1620 Wh/kgである。
【0099】
リチウム/水セルの場合、次の電気化学反応により水素が生成されると考えられる。
Li + H2O = LiOH + 1/2H2
この化学反応のエネルギーは、セル当たり3ボルトの電気エネルギーに変換され、燃料電池内で水素が水に変換される。すなわち、セル全体では以下の反応が起こっていると考えられる。
Li + 1/2H2O + 1/4O2 = LiOH
ここで、理論的には、すべての化学エネルギーが電気エネルギーに変換される。11,500Wh/kg(NaBH4の4倍)に対応する約3ボルトの電池電位では、リチウムアノードに基づくエネルギー密度は3830mAh/kgになる。反応に必要な水の重量を含めると、エネルギー密度は5030 Wh/kgになる。生成物であるLiOHの重量に基づくエネルギー密度は3500 Wh/kgであり、これは、NaBO2系のエネルギー密度の2倍である。ここで、水と金属リチウムとの反応から水素を生成する系も考慮に入れる。Li/H2O反応エネルギーの大部分は熱として失われ、(Li/H2Oの3に対して)実際には1未満であるH2/O2系のセル電位にエネルギー密度が基づくため、エネルギー密度は1/3に減少する。図10に示す本発明の実施例では、Li/水電池にかかる負荷を調整することにより、水素の生成を制御する。保護膜の存在によりLi/水電池は貯蔵寿命が長く、また、セルから放出される水素は既に加湿された状態でH2/空気型燃料電池に供給される。
【0100】
Li/水セルおよびLi/空気セル用の電子伝導性触媒支持体構造
本発明のLi/水セルおよびLi/空気セルでは、充分に高い多孔性を持ち、電気化学的活性成分の大量移送を制限することなく表面積を最大にした、電子伝導性触媒支持体構造を用いることができる。多孔質の支持体材料としては、もともと電子伝導性を持つ材料も、(被覆等の)処理により電子伝導性を獲得した材料も用いることができる。(イオン伝導性はあるかもしれないが)もともと電子伝導性ではない多孔質の支持体材料としては、アルミナ、シリカ、ガラス、セラミック、ガラスセラミック、および、耐水性ポリマーが挙げられる。絶縁性支持体の場合には、電流を通すように金属メッキされる。絶縁性支持体の金属メッキは周知の無電解メッキ法により行われる。触媒と還元剤を絶縁体表面上に吸着させた後、絶縁体を金属イオンの溶液に浸すと、当業者に周知のように、金属イオンが還元され、絶縁体表面に金属が析出する。この金属メッキには、銅やニッケルが通常用いられるが、触媒特性からいうと、(特にLi/水セルでは)ニッケルが好ましい。
【0101】
ガラス、セラミック、ガラスセラミック支持体は、不活性材料か、あるいは、保護膜に適したイオン伝導性材料から形成されることが望ましい。ガラス、セラミック、あるいはガラスセラミック粉末/ポリマー結合剤/溶媒の混合物をテープキャスト成形あるいは押し出し成形することにより、多孔質支持体を形成するようにしてもよい。また、テープキャスト成形あるいは押し出し成形により、多孔質支持体上に、より微細なガラス、セラミック、あるいはガラスセラミック粉末の第二層をさらに形成するようにしてもよい。この二層構造体を焼成することにより、粗支持体層は多孔性を保持する一方、薄層は完全に緻密化して、保護膜支持体が完成する。あるいは、支持体層を予備焼成した後、薄層をテープキャスト成形あるいは押し出し成形で形成し、さらに全体を焼成することにより高密度化するようにしてもよい。
【0102】
保護膜のガラス、セラミック、あるいはガラスセラミック層は、プラズマ溶射、真空プラズマ溶射、熱溶射等の溶射法で形成することも可能である。また、Jie Fu, J. Amer. Ceramic. Soc., 80[7] p.1901-1903 (1997)、並びに、先に引用され参照文献として本発明に組み込まれた株式会社オハラに交付された特許に記載されるように、このような固体支持体のイオン伝導性を向上させるために、ガラス、セラミック、ガラスセラミック層に熱処理を施すようにしてもよい。この形成方法では、粉末状の膜材料をプラズマトーチノズルに供給し、溶融微細液滴としてノズルから噴霧するようにしてもよい。溶融液滴は基材に対して噴霧され固まる。このようにして、駆動パラメータに応じて選択された高密度あるいは多孔質の基材上にガラス、セラミック、あるいはガラスセラミック層を直接蒸着し、高密度層あるいは多孔質層を形成するようにしてもよい。
【0103】
ポリマー支持体としては、ポリエチレン、ポリプロピレン、ケブラー、ナイロン等が望ましい。例えば、ガラスセラミック薄層をテープキャスト成形した後焼成して高密度にする。次に、ポリマー/結合剤/溶媒層をテープキャスト成形することにより、ガラスセラミック層にポリマー支持体を蒸着した後、乾燥させる。
【0104】
もともと電子伝導性を持つ支持体としては、共焼成したあるいは予備焼成した金属が望ましい。例えば、テープキャスト成形あるいは押し出し成形により多孔質ステンレス鋼支持体を作製し、この多孔質支持体上にテープキャスト法でガラスあるいはガラスセラミックの薄層を蒸着させる。次に、二層構造体を、空気中900°C未満の低温条件で焼成することにより、あるいは、(水素炉等の)減圧条件下でもっと高温で焼成することにより、焼結工程におけるステンレス鋼支持体の酸化を最小限に抑える。あるいは、多孔質ニッケル支持体を上述した方法で作製してもよい。ただし、この場合には、NiのNiOへの酸化を防ぐために減圧条件下での焼成が必須となる。あるいは、多孔質支持体を予備招請することにより、所望の多孔性が得られるようにしてもよい。テープキャスト、エアロゾル噴霧、電気泳動析出等の手法で、多孔質支持体上にガラスセラミックの第二層を形成する。基材は予備焼結されているため、焼成工程では焼結せず、第二層が非焼結基材に拘束された状態で焼結される。第二層はガラス成分からなり、焼成中に流動可能なため、このような拘束は問題とならない。
【0105】
非触媒性の多孔質支持体の場合には、触媒を含浸させることにより、水の還元を促進して、アノードから放出されて保護層を透過するLiイオンとの反応を促進する。
【0106】
ニッケル支持体の場合には、ニッケル表面に水の還元を触媒する作用があるため、触媒の含浸は通常不要である。
【0107】
セル製造、成分、ならびに構成例
セル製造に用いる蒸着法
図11に、本発明の一実施例として、プラズマ溶射等の蒸着手法を用いる、薄層Li/水あるいはLi/空気電池の製造工程を示す。多孔質伝導性ニッケル触媒支持体上に保護膜複合積層体を形成し、次に、保護膜上に金属リチウムを蒸着させる。プラズマ溶射法は、基材を比較的低温で維持可能な利点がある。例えば、約500°C未満という低温条件で多孔質ニッケル支持体を維持しても、NiがNiOに酸化されるのを防ぐことができる。次に、プラズマ溶射により、多孔質ニッケル支持体をガラスあるいはガラスセラミックの薄膜で被覆し、続いて、リチウム適合性のあるLiPON層あるいはCu3N等その他適切な成分を電子線蒸着、高周波スパッタリング、CVD、プラズマ溶射等の適当な方法でガラス薄膜上に蒸着させる。さらに、リチウム適合性層上に、Agを真空蒸着することにより、薄い遷移被膜を形成するようにしてもよい。その後、リチウム電極を蒸着してLi/Ag/LiPON/Ni接合体を形成する。あるいは、リチウム電極を機械的に圧着して接合体を形成するようにしてもよい。
【0108】
最後に、必要に応じて、接合体を海水中あるいは電解質水溶液中に含浸させる等の方法で、多孔質電子伝導性支持体に水や電解質をさらに加えて、セルを完成させる。実際の電池セルでは、エラストマーあるいはエポキシ樹脂からなる溶接シーリング材を用いて、海水環境から金属リチウム電極を分離する。
【0109】
電子伝導性触媒支持体をパーフルオロスルホン酸ポリマー膜(例えば、du Pont社のNafion)等のアイオノマーで処理することにより、用いる電解質の許容範囲をもともとのイオン伝導性が低い、あるいは、まったくイオン伝導性を持たない電解質にまで広げることが可能になる。
【0110】
また、多孔質電子伝導性触媒支持体を金属フレームで構造補強して、剛性と強度を高めるようにしてもよい。フレームは、ステンレス鋼やアルミニウム等任意の適当な金属で構成されていればよい。図12Bならびに図12Dに図示するように、フレームをグリッド状に配置するようにしてもよい。
【0111】
保護膜支持構造体およびその製造
薄い保護膜を用いることには、材料コストの削減、重量削減、その結果としてのエネルギー密度向上、膜のイオン透過促進等、様々な利点がある。水性リチウムセルに用いる保護膜層を可能な限り薄くするために、テープキャスト成形等の適当な手法でイオン伝導性ガラスセラミック等の薄層を形成する。テープキャスト成形により数ミクロンから数十ミクロンの厚さの膜を形成する手法は、当該分野で周知の技術であり、このような薄層は、多層セラミックコンデンサで普通に用いられている。イオン伝導性ガラスセラミック材をテープキャスト成形した後、焼成して高密度にする。この時点では、10ないし50ミクロンの薄層は、まだ、もろく壊れやすい。
【0112】
ソニー株式会社およびSchott Glass社により提案され、Schott Glass社ウェブサイト(http://www.schott.com/english)からダウンロード可能で本発明に参照文献として組み込まれる、T.Kessler, H. Wegener, T.Togawa, M.Hayashi, and T. Kakizaki, 'Large Microsheet Glass for 40-in. Class PALC Displays', 1997, FMC2-3に記載の「ドローダウン」法で、ガラスあるいはガラスセラミック薄膜を形成するようにしてもよい。簡単に説明すれば、ガラスを溶融状態で引っ張り、薄いガラスリボンを形成する。ガラス板の冷却速度が結晶化速度を上回れば、ガラスは非晶質になる。ナシコン型のガラスでは、多くの場合、高い伝導性を得るためには結晶相の存在が必要不可欠であるため、ガラス薄板を熱処理することにより、伝導相を結晶化すると共に「ガラスセラミック」を形成して、ガラス固体膜のイオン伝導性を向上させる。この結晶化手法に関しては、先に引用され参照文献として本発明に組み込まれたJie Fu, J. Amer. Ceramic. Soc., 80[7] p.1901-1903 (1997)、並びに、株式会社オハラに交付された特許に詳述されている。結晶化(非晶質の失透)により表面が粗くなる可能性があるので、必要に応じて、熱処理条件を最適化して細粒の形成を促進させるか、あるいは、化学または機械研磨で表面仕上げをする。
【0113】
次に、いずれかの手法で形成されたガラスセラミック薄膜を、エポキシ、エラストマー、および/あるいは、セラミック接着剤等で接着することにより、あるいは、オーブンで焼成することにより、(金属製あるいは金属メッキされた)多孔質電子伝導性支持体に接合する。この製造法の例を図12Aないし図12Eに示す。金属フレームの開口部には多孔質電子伝導性触媒支持材が充填され、Li/水の酸化還元反応を促進する。このようにして、多孔質で水還元の触媒作用を持つ金属フレームと電子伝導性支持材とで、ガラスセラミック薄層を支持する。
【0114】
あるいは、発泡ニッケル等の多孔質電子伝導性触媒支持材を、直接、ガラスセラミック保護薄膜成分に接合するようにしてもよい。このガラスセラミック‐多孔質電子伝導性触媒支持材接合体を金属フレームに載置する、あるいは、接着する。このような構造を図12Eに示すように対称に形成することにより、構造体の強度を向上させ、空気極面積を最大にすることができる。
【0115】
あるいは、「ワッフル」型成型によりガラスにグリッドパターンを形成することにより、ガラス膜自体の強度を高めるようにしてもよい。溶融ガラスを適当な型に注入あるいは押圧して、ガラスに補強用の隆線を形成すると同時に、隆線間の膜厚は薄いままにする。必要があれば、この「ワッフル」構造に熱処理を施して、ガラス固体膜のイオン伝導性を向上させる。この「ワッフル」型に成形された固体電解質を多孔質ニッケル電極に接合するようにしてもよい。
【0116】
弾性シーリング
図13に、複数のガラス、セラミック、あるいは、ガラスセラミック製のイオン伝導性保護シートを弾性シーリング剤で接合して保護膜アレイを形成した構造を示す。複数のシート間のシーリング剤が弾性を持つため、アレイには多少の自由度がある。各保護シートの一面に、先に多孔質電子伝導性触媒基材を接合しておき、アレイ形成後に、各保護シートの反対側の面にリチウム(活性金属)を蒸着させてアノードを形成して、セルの固相部分を完成させるようにしてもよい(カソード/電解質部分は液相である)。あるいは、セルの固相部分を完成した後に、図13に示すように接合してアレイ構造を形成してもよい。
【0117】
管状構造
図14に、本発明のLi/水あるいはLi/空気セルを管状に成形した構造を示す。例えば、多孔質ニッケルチューブを支持体として用いて、チューブの外側面(A)あるいは内側面(B)に適当な手法でイオン伝導性ガラス、セラミック、あるいは、ガラスセラミック層を蒸着させる。チューブの端は閉じていても、開放していてもかまわない。例えば、開放端を持つチューブを用いて、チューブの外側面にイオン伝導性ガラスセラミック材をプラズマ蒸着し、続いて、リチウム適合性がある第一成分(例えば、LiPON)層、接着層(例えば、Ag)、リチウム電極、銅箔を順に蒸着して、開放端を封入する。このチューブを海水に浮遊させて、高エネルギー密度電池として用いることができる。リチウムがチューブの外側面に位置するか、あるいは、芯材としてチューブの内側に位置するかにより、海水(あるいはLi/空気セルの場合には空気)がチューブの中心あるいはチューブの周囲を流動する。
【0118】
毛細管状構造
図15に、本発明のLi/水あるいはLi/空気セルを毛細管状に成形した構造を示す。まず、保護膜材料を吹いて、細径のガラス、セラミック、あるいは、ガラスセラミック毛細管を作製する。毛細管の内側面(あるいは外側面)をリチウム適合性のある第一成分材(例えば、LiPON(Ag))で被覆した後、溶融したリチウムを毛細管に流入させ、大きな表面積を持つ被保護アノードファイバーを形成する。次に、個々のファイバーを多孔質電子伝導性触媒支持材で被覆する。ファイバーの容積に対する表面積の比が大きいため、効率を高めることができる。このようなファイバーを平行に多数接合することにより、高出力リチウム/水電池を作製する。さらに、このような平行接合体を直列に組み合わせて、高電圧−高出力電池が形成される。
【0119】
他の構成例
本発明の再充電可能な水性リチウム電池種々の他の構成で実現可能である。以下に構成例をいくつか挙げる。
【0120】
リチウム‐ニッケル電池
ニッケル電極NiOOHは当業者に周知で、再充電可能な市販ニッケル‐カドミウム電池に長年用いられており、最近では、再充電可能なニッケル‐金属水素化物電池にも用いられている。
アノード反応:Li = Li+ + e-
カソード反応:NiOOH + H2O + e- = Ni(OH)2 + OH-
全電池反応: Li + NiOOH + H2O = Ni(OH)2 + LiOH
ニッケル電極は高い可逆性を持ち、被保護LiアノードとNiOOHカソードとを組み合わせることにより、高いエネルギー密度を持ち、サイクル寿命の長い電池を製造できる。
【0121】
リチウム‐銀電池
銀電極AgOは、軍隊で広く使われている高速電池であるAg/Zn電池に用いられている。
アノード反応:Li = Li+ + e-
カソード反応:AgO + H2O + 2e- = Ag + 2OH-
全電池反応: 4Li + 2AgO + 2H2O = 4LiOH + 2Ag
リチウムアノードと銀カソードとを組み合わせることにより、高速再充電可能な電池を製造できる。
【0122】
さらに、被保護リチウムアノードと酸化鉄、酸化鉛、酸化マンガン等の遷移金属酸化物とを組み合わせることにより、本発明を種々の新しい水性電池の形態で実現可能である。
【0123】
実施例
以下、本発明のリチウム/水電池セルの特性、利点、効果等を実施例に基づいて詳細に説明する。ただし、これらの実施例は本発明を例示し詳細に説明するためのものであり、本発明をなんら限定するものではない。
【0124】
実施例1:Li/水セル
電解質とカソード(水)の水性環境に対して、株式会社オハラから市販されているイオン伝導性ガラスセラミック材を保護膜の外側層(複合体の第二層)として用いて、種々の実験を行った。金属酸化物‐リチウム伝導体は水性環境で安定な一方、金属リチウムに対しては不安定である。OHARAプレート材を金属リチウムから保護するために、LiPONで被膜した。OHARAプレート材は、厚さ0.3から1mmの範囲のものを使用した。LiPON被膜は、厚さ0.1ないし0.5ミクロンとし、高周波スパッタリングによりOHARAプレート材上に蒸着させた。
【0125】
熱蒸散したリチウムがLiPON膜と反応しないように、LiPON層上に真空蒸着によりAgの薄い被膜を形成した。Ag膜の厚さは、200ないし1000Åとした。Liの真空蒸着工程では、LiPONが高い反応性を持つ気相Liと反応する可能性がある。Ag、Al、Sn等のLi合金形成金属の薄膜をガラスセラミック表面に真空蒸着することにより、PiPON表面がLiと反応するのを防ぐことができる。この金属層の厚さは、50ないし10000Å、望ましくは100ないし1000Åとする。Liとの反応から第一成分層を保護する機能に加えて、Li合金形成金属層はさらに以下の二つの機能を果たす。第一成分層形成後に、被処理材を真空下から周辺大気あるいはドライルーム大気を通して、Li蒸着のために他の処理室に移す必要がある場合、金属層は、第一層成分が大気中の成分と反応しないように保護する役割を果たす。さらに、Li合金形成金属はLiと第一層成分とを反応結合させる結合層の役割を果たす。この構造体上でリチウムを蒸散させた場合、AgがAg-Liに変換され、少なくともその一部が大量の蒸着リチウム内に拡散する。
【0126】
Ag層形成後、Ag層上に金属リチウムを約5ミクロンの厚さに蒸着して、Li(Ag)/LiPON/OHARA構造の被保護リチウム電極を形成した。被保護リチウム電極の例を図16に示す。OHARAプレート材が水性環境に晒されるように、Oリングを用いて被保護電極を電気化学セルに取り付けた。この例では、水性環境を0.5M HCl + 1.0M LiCl電解質とした。完成したバッテリ回路では、プラチナ対極が水素還元を促進し、Ag/AgCl参照電極がセル内のLiアノードとPtカソードの電位を制御する役割を果たす。測定値を標準水素電極(SHE)電位に換算した。水中のLi/Li+とH2/H+との熱力学的電位差と密接に関係する開路電位(OCP)の測定値は、3.05ボルトであった(図17参照)。水中では金属リチウムが激しく腐食し、その結果、Li電極電位が正方向に大きくシフトするため、通常の条件下では、この開路電位を観測することができない。さらに、酸性の水性環境下において被保護リチウム電極が反応していることを示すような視覚的証拠、例えば、気体発生および/あるいはリチウム溶解などの現象は見られなかった。回路を閉鎖すると、Pt電極側で直ちに水素発生が見られた。これは、セル内で2Li = 2Li+ + 2e-および2H+ + 2e- = H2の電極反応がアノードとカソードで起こっていることを示すものである。アノード側でのリチウム溶解とカソード側での水素発生の電気化学反応をそれぞれ示す時間電位曲線を図17および図18に示す。これらの結果から、リチウム/水電池が大きな腐食電流を与えることなく作動することが実証された。
【0127】
Li(Ag)/LiPON/OHARA電極を4M LiOH電解質を含む水性セルで用いて、同様の実験を行った。このセルでも、リチウムは、熱力学的電位に近い正確なOCP値を示した(図19参照)。このセルでもPtを対極に用いて放電を行ったところ、電池回路を閉じると直ちに水素の発生が見られた。Li/水電池回路に小さな発光ダイオード(LED)を接続すると、回路を閉じると同時にLEDが発光した。この電池は高い可逆サイクル特性を有し(図20参照)、セル充電の間に、水性環境による金属リチウムのメッキ現象が観察された。1.0ないし15 mA/cm2の電流を用いてサイクル実験を行った。図21に示すように、サイクル実験で電流変動を大きくしても、アノード保護膜は崩壊せず、非可逆的なセル挙動の変化は見られなかった。この結果から、高い効率で水性電解質による金属リチウムのメッキが行われることが実証された。
【0128】
実施例2:Li/海水セル
実施例1のセルと同様の方法で、リチウム/海水(塩水)セルを作製した。この実験では、「海水」を電解質として含むセルにLi(Ag)/LiPON/OHARA構造の被保護アノードを用いた。Aquarium Systems社製のInstant Ocean(インスタントオーシャン)35 pptを用いて海水を調製した。用いた海水の伝導度は、4.5 10-2S/cmであった。図22A、図22Bに、それぞれ、放電率0.2 mA/cm2と放電率0.5 mA/cm2の場合の放電曲線(時間電位曲線)を示す。この結果から、作製されたセルが、安定した放電電圧やその他望ましいセル性能を有していることがわかる。未保護のLiアノードを用いて海水中で行われた実験では、Liの利用効率は大変低く、この実施例と同様の低レベルから中程度レベルの電流密度では、海水中のLi腐食率が非常に高い(19 A/cm2以上)ため電池の使用が不可能であった。
【0129】
実施例3:大容量アノードを用いたLi/海水セル
PtワイヤカソードとLi(Ag)/LiPON/ガラスセラミック(株式会社オハラ製)構造の大容量被保護アノードとを備えるリチウム/海水(塩水)セルを作製した。OHARAプレート上のLiPONをAg層で蒸着被覆した後、Ag層に50mmの厚さのLi箔(Cyprus Foote Mineral社)を圧着して、厚い被保護Liアノードを製造した。圧着には、ドライルームに設置されたCarver油圧プレス機を用いた。加圧圧力は800 kg/cm2で加圧時間は10分間とした。Ag層に圧着する直前にTyvek布でLi箔表面を磨いた。Ag層はLi箔と反応して、強い反応性結合を生じた。海水電解質の組成は実施例2と同じとした。
【0130】
図23に放電率が0.3 mA/cm2の場合の放電曲線(時間電位曲線)を示す。セルは長時間放電を続けた。2.0Vの遮断電圧に対する放電容量は、20mmを超えるLi層の厚さに対応する。保護層を破壊することなく、Liアノード/水性電解質の界面をこの量のLiが通過可能である。
【0131】
実施例4:溶解酸化剤として過酸化水素を含む水性電解質と被保護Li電極とを備えるセル
先の実施例で用いたものと同様のLi(Ag)/LiPON/OHARAプレート構造の被保護アノードを用いて、リチウム/過酸化水素セルを作製した。リン酸(H3PO4)の1M水溶液に5重量%の過酸化水素(H2O2)を加えたものを電解質として用いた。セル中の電解質の容積は500mlであった。カーボンファイバー紙(厚さ35mm:Lydall Technical Papers社製, Rochester, NY)の両面を約3mmの厚さのAu層で真空メッキすることにより、過酸化水素還元作用のある金カソードを形成した。
【0132】
図24に放電率が0.3 mA/cm2の場合の放電曲線(時間電位曲線)を示す。セルの開路電位(OCP)値は4.0Vに近く、約3.6Vのレベルでほぼ一定の放電電位を示した。
【0133】
理論的には、酸性媒体中でのLi/H2O2の全セル反応は以下のようになる。
2Li + H2O2 = 2Li+ + 2H2O E0 = 4.82 V (標準的な条件下)
カソード表面で過酸化水素のOCPの実測値は理論値よりも低かったが、これはカソード表面で過酸化水素が水と酸素に分解したことに起因する。カソード表面では、過酸化水素のみならず、分解により生じた酸素も還元され、この結果、OCP値と閉セル電位が減少する。カソード構造の改良とセル内での過酸化水素溶解電解質の流動とにより、総合的なセル特性が著しく向上した。また、実験結果から、被保護Liアノードと水溶性の強酸化剤の使用により、低レベルから中程度レベルの電流密度で非常に高いLi利用効率を持つ高エネルギー電源を作製可能であることがわかる。
【0134】
Li/H2O2セルでH2O2を含む酸性電解質が未保護Liアノードに直接接触すると、Liの腐食が非常に高い割合で起こり、Liの利用効率が下がるため、未保護Liアノードを使用することはできない。
【0135】
実施例5:中性電解質を含むLi/空気セル
プロトン性腐食環境に対して、株式会社オハラから市販されているイオン伝導性ガラスセラミック材を保護膜の外側層(複合体の第二層)として用いて、種々の実験を行った。金属酸化物‐リチウム伝導体は水性環境で安定な一方、金属リチウムに対しては不安定である。OHARAプレート材を金属リチウムから保護するために、LiPON、Cu3N、SnNx、Li3N、Li3P、金属ハロゲン化物等、種々の化合物を用いることができる。この実験では、OHARAプレート材をLiとの反応から守るために、LiPONを用いた。OHARAプレート材は、厚さ0.2から0.3mmの範囲のものを使用した。LiPON被膜は、厚さ0.2ないし0.9ミクロンとし、高周波スパッタリングによりOHARAプレート材上に蒸着させた。
【0136】
熱蒸散したリチウムがLiPON膜と反応しないように、LiPON層上にAgの薄膜をスパッタリングにより蒸着した。Ag膜の厚さは、200ないし1000Åとした。Liの真空蒸着工程では、LiPONが高い反応性を持つ気相Liと反応する可能性がある。Ag、Al、Sn等のLi合金形成金属の薄膜をガラスセラミック表面に真空蒸着することにより、PiPON表面がLiと反応するのを防ぐことができる。この金属層の厚さは、50ないし10000Å、望ましくは100ないし1000Åとする。
【0137】
Ag層形成後、Ag層上に金属リチウムを約5ミクロンの厚さに蒸着して、Li(Ag)/LiPON/OHARA構造の被保護アノードを形成した。OHARAプレート材が水性電解質環境に晒されるように、Oリングを用いて被保護アノードを電気化学セルに取り付けた。
【0138】
被保護アノードを備えるこのLi/空気セルでは、0.5M NH4Cl + 0.5M LiClを電解質として用いた。Zircar Products社のジルコニア布をOHARAプレート材上に載置した後、電解質で満たした。電解質の容積は約0.2mlであった。この実験用Li/空気セルのカソードとして、市販のZn/空気電池用に形成された空気極を用いた。
【0139】
このセルの開路電位は3.25Vであった。図25に放電率が0.3 mA/cm2の場合の放電曲線(時間電位曲線)を示す。セルは、ほぼ1.0時間の間、約3.1Vの放電電圧を示した(約3.0 mAh/cm2)。この結果から、被保護Liアノードと、既存の金属/空気電池で通常用いられるKOHを含まない電解質とを備えるLi/空気セルが高いセル性能を持っていることがわかる。KOHは(亜鉛等の)金属の腐食を遅くする一方で、望ましくない炭化を引き起こすCO2をセル内に導入する。この結果、従来の金属/空気電池では貯蔵寿命が限られていた。一方、実験に用いられている、この実施例のLi/空気セルは、既存の金属/空気電池で通常見られる電解質炭化に伴う悪影響を受けることがない。
【0140】
実施例6:大容量アノードを備えるLi/空気セル
実施例5と同じ空気カソードとLi(Ag)/LiPON/OHARAプレート構造の大容量被保護アノードとを用いて、リチウム/空気セルを作製した。被保護アノードを備えるこのLi/空気セルでは、0.5M LiOHを電解質として用いた。OHARAプレート上のLiPONをAg層で蒸着被覆した後、Ag層に120mmの厚さのLi箔(Cyprus Foote Mineral社)を圧着して、厚い被保護Liアノードを製造した。圧着には、ドライルームに設置されたCarver油圧プレス機を用いた。加圧圧力は800 kg/cm2で加圧時間は10分間とした。Ag層に圧着する直前にTyvek布でLi箔表面を磨いた。Ag層はLi箔と反応して、強い反応性結合を生じた。
【0141】
図26に放電率が0.3 mA/cm2の場合の放電曲線(時間電位曲線)を示す。セルは、2.9Vという高い平均放電電圧で長時間放電を続けた。2.5Vの遮断電圧に対する放電容量は、10 mAh/cm2を超えていた。49mmを超えるLi層の厚さに対応する大量のLiが、保護層を破壊することなく、Liアノード/水性電解質の界面を通過可能である。
【0142】
実施例7:被保護Liアノードを備えるLi/空気セルのサイクリング特性
プロトン性腐食環境に対して、株式会社オハラから市販されているイオン伝導性ガラスセラミック材を保護膜積層複合体の外側層(第二層)として用いて、種々の実験を行った。金属酸化物‐リチウム伝導体は水性環境で安定な一方、金属リチウムに対しては不安定である。OHARAプレート材を金属リチウムから保護するために、LiPON、Cu3N、SnNx、Li3N、Li3P、金属ハロゲン化物等、種々の化合物を用いることができる。この実験では、OHARAプレート材をLiとの反応から守るために、LiPONを用いた。OHARAプレート材は、厚さ0.2から0.3mmの範囲のものを使用した。LiPON被膜は、厚さ0.2ないし0.9ミクロンとし、高周波スパッタリングによりOHARAプレート材上に蒸着させた。
【0143】
熱蒸散したリチウムがLiPON膜と反応しないように、LiPON層上にAgの薄膜をスパッタリングにより蒸着した。Ag膜の厚さは、200ないし1000Åとした。Liの真空蒸着工程では、LiPONが高い反応性を持つ気相Liと反応する可能性がある。Ag、Al、Sn等のLi合金形成金属の薄膜をガラスセラミック表面に真空蒸着することにより、PiPON表面がLiと反応するのを防ぐことができる。この金属層の厚さは、50ないし10000Å、望ましくは100ないし1000Åとする。Liとの反応から第一成分層を保護する機能に加えて、Li合金形成金属層はさらに以下の二つの機能を果たす。第一成分層形成後に、被処理材を真空下から周辺大気あるいはドライルーム大気を通して、Li蒸着のために他の処理室に移す必要がある場合、金属層は、第一層成分が大気中の成分と反応しないように保護する役割を果たす。さらに、Li合金形成金属はLiと第一層成分とを反応結合させる結合層の役割を果たす。この構造体上でリチウムを蒸散させた場合、AgがAg-Liに変換され、少なくともその一部が大量の蒸着リチウム内に拡散する。
【0144】
Ag層形成後、Ag層上に金属リチウムを約5ミクロンの厚さに蒸着して、Li(Ag)/LiPON/OHARA構造の被保護アノードを形成した。OHARAプレート材が水性電解質環境に晒されるように、Oリングを用いて被保護アノードを電気化学セルに取り付けた。
【0145】
被保護アノードを備えるこのLi/空気セルでは、1M LiOHを電解質として用いた。電解質の容積は約0.2mlであった。この実験用Li/空気セルのカソードとして、市販のZn/空気電池用に形成された空気極を用いた。
【0146】
図27に放電/充電率が1.0 mA/cm2の場合の放電/充電時間電位曲線を示す。各サイクルの放電時間と充電時間は、それぞれ3分間とした。この実験に用いた空気極は1度だけの放電用に設計されたものであるが、電極の分極が著しく増加することなく、10サイクルの放電/充電を繰り返すことができた。この結果から、被保護Liアノードを備える本発明のLi/空気セルが可逆的に働くことがわかる。
【0147】
結語
以上、本発明の理解を深める目的で、実施例に基づいて本発明を説明したが、クレームの要旨の範囲内で様々に変更、修正、変形可能である。特に、リチウム金属アノードに主に言及しながら本発明を説明したが、アノードは、ナトリウム等の他のアルカリ金属を初めとするいかなる活性金属で形成されていてもよい。本発明の工程や組成もいかようにも変更可能である。従って、上記の実施例は単に例示に過ぎず、何ら発明を限定するものではなく、本発明はこれらの詳細な説明に幻影されるものではない。
【0148】
また、本明細書で引用した引例はすべて、あらゆる目的で、本発明に参照文献として組み込まれる。
【図面の簡単な説明】
【0149】
【図1】イオン伝導性保護膜を備える本発明の活性金属電池セルを示す概略図である。
【図2A】イオン伝導性保護膜セパレータを示す概略図である。
【図2B】イオン伝導性保護膜セパレータを示す概略図である。
【図3A】積層体構造のイオン伝導性保護膜複合体を備える本発明の活性金属アノード構造を示す概略図である。
【図3B】勾配体構造のイオン伝導性保護膜複合体を備える本発明の活性金属アノード構造を示す概略図である。
【図4A】イオン伝導性保護膜を備える本発明の電気化学装置構造の製造工程を示す概略図である。
【図4B】イオン伝導性保護膜を備える本発明の電気化学装置構造の製造工程を示す概略図である。
【図5】イオン伝導性保護膜を備える本発明の電気化学装置構造の製造工程を示す概略図である。
【図6A】イオン伝導性保護膜を備える本発明の電気化学装置構造の製造工程を示す概略図である。
【図6B】イオン伝導性保護膜を備える本発明の電気化学装置構造の製造工程を示す概略図である。
【図7】本発明の一態様としてリチウム/水電池セルを示す図である。
【図8】本発明の別の態様としてリチウム/空気電池セルを示す図である。
【図9】本発明のさらに別の態様としてリチウム/金属水素化物電池セルを示す図である。
【図10】本発明の一実施例として、リチウム/水電池と燃料電池用の水素発生装置を示す図である。
【図11】本発明の一実施例として、プラズマ溶射や蒸着技法を用いて、薄層リチウム/水あるいはリチウム/空気電池を製造する工程を示す図である。
【図12A】本発明の一実施例として、活性金属水性セルに好適に利用可能な、電子伝導性多孔質支持体に付着される薄ガラス保護膜あるいは薄ガラスセラミック保護膜を製造する工程を示す図である。
【図12B】本発明の一実施例として、活性金属水性セルに好適に利用可能な、電子伝導性多孔質支持体に付着される薄ガラス保護膜あるいは薄ガラスセラミック保護膜を製造する工程を示す図である。
【図12C】本発明の一実施例として、活性金属水性セルに好適に利用可能な、電子伝導性多孔質支持体に付着される薄ガラス保護膜あるいは薄ガラスセラミック保護膜を製造する工程を示す図である。
【図12D】本発明の一実施例として、活性金属水性セルに好適に利用可能な、電子伝導性多孔質支持体に付着される薄ガラス保護膜あるいは薄ガラスセラミック保護膜を製造する工程を示す図である。
【図12E】本発明の一実施例として、活性金属水性セルに好適に利用可能な、電子伝導性多孔質支持体に付着される薄ガラス保護膜あるいは薄ガラスセラミック保護膜を製造する工程を示す図である。
【図13】本発明の一実施例として、弾性シーリング剤を用いて、複数のガラス製、セラミック製、あるいはガラスセラミック製のイオン伝導性保護膜板を接着する工程を示す図である。
【図14】本発明のリチウム/水セルあるいはリチウム/空気セルの管状構造体を示す図である。
【図15】本発明のリチウム/水セルあるいはリチウム/空気セルの毛細管状構造体を示す図である。
【図16】実施例1のセルに用いられる被保護リチウム電極を示す図である。
【図17】本発明に従い製造された、アノード、イオン伝導性保護膜、水性カソードを備える様々なセルの性能を測定したデータを示すグラフである。
【図18】本発明に従い製造された、アノード、イオン伝導性保護膜、水性カソードを備える様々なセルの性能を測定したデータを示すグラフである。
【図19】本発明に従い製造された、アノード、イオン伝導性保護膜、水性カソードを備える様々なセルの性能を測定したデータを示すグラフである。
【図20】本発明に従い製造された、アノード、イオン伝導性保護膜、水性カソードを備える様々なセルの性能を測定したデータを示すグラフである。
【図21】本発明に従い製造された、アノード、イオン伝導性保護膜、水性カソードを備える様々なセルの性能を測定したデータを示すグラフである。
【図22A】本発明に従い製造された、アノード、イオン伝導性保護膜、水性カソードを備える様々なセルの性能を測定したデータを示すグラフである。
【図22B】本発明に従い製造された、アノード、イオン伝導性保護膜、水性カソードを備える様々なセルの性能を測定したデータを示すグラフである。
【図23】本発明に従い製造された、アノード、イオン伝導性保護膜、水性カソードを備える様々なセルの性能を測定したデータを示すグラフである。
【図24】本発明に従い製造された、アノード、イオン伝導性保護膜、水性カソードを備える様々なセルの性能を測定したデータを示すグラフである。
【図25】本発明に従い製造された、アノード、イオン伝導性保護膜、水性カソードを備える様々なセルの性能を測定したデータを示すグラフである。
【図26】本発明に従い製造された、アノード、イオン伝導性保護膜、水性カソードを備える様々なセルの性能を測定したデータを示すグラフである。
【図27】本発明に従い製造された、アノード、イオン伝導性保護膜、水性カソードを備える様々なセルの性能を測定したデータを示すグラフである。
【技術分野】
【0001】
本発明は、活性金属電気化学装置に関し、さらに詳しくは、空気、水分、電池セルの他の構成成分との反応の悪影響から活性金属を保護するイオン伝導性膜を備える活性金属電極構造により構成される水性活性金属(例えば、リチウム)電池セル、並びに、電池セルの製造方法、電池セルの利用法に関する。
【背景技術】
【0002】
リチウム等の低当量アルカリ金属は、電池の電極材として特に有用である。リチウム電池は、従来のニッケル電池やカドミウム電池と比較して単位容積あたりの出力エネルギー量が大きい。ただ、残念ながら、再充電可能な金属リチウム電池の商品化はいまだに成功していない。
【0003】
再充電可能な金属リチウム電池が商品化できない主な理由は、セルの充放電サイクルの問題にある。充放電サイクルを繰り返すと、金属リチウム電極から生じるリチウム「樹状突起」が次第に成長し、電解質を突き抜け、ついには、陽極に達する。これにより、電池内で内部ショートが起こるため、金属リチウム電池はほんの数サイクルで使用不能になってしまう。また、充放電サイクルを繰り返すと、リチウム電極上に「苔状」堆積物が積層し、陰極から遊離して、電池性能を悪化させる原因となる。
【0004】
電解質溶液系におけるリチウムの充放電サイクル挙動を改善するために、リチウム陰極の電解質側を「保護層」で被覆する構造が提案されている。保護層は、リチウムイオンを伝導すると同時に、リチウム電極表面が容積の大きな電解質に接するのを防ぐ必要がある。これまでにも、保護層を形成するために様々な手法が提案されたが、いずれも成功に至っていない。
【0005】
例えば、金属リチウムとリチウムに接する電解質中の化合物とをin situ(その場で)反応させることにより金属リチウム保護層を形成する手法が提案されている。この手法では、多くの場合、電池を組み立てた後、化学反応を制御して、膜をin situ(その場で)形成する。形成された膜は、通常、多孔質であるため、電解質の一部が裸の金属リチウム表面まで浸透してしまい、リチウム電極を充分に保護することができない。
【0006】
さらに、種々の成形リチウム保護膜が提案されている。例えば、(1994年5月24日にBatesに交付された)米国特許第5,314,765号には、リチウムリン酸窒化物(LiPON)等をスパッタリングすることにより形成した薄膜を含むリチウム電極をex situ(外部で)製造する方法が開示されている。LiPONは、(リチウムイオンを伝導させる)ガラス性単一イオン伝導体であり、シリコン上で製造され、集積回路の電源として用いられる固体リチウムマイクロ電池用の電解質として研究されてきた(すべてBatesらに交付された米国特許第5,597,660号、5,567,210号、5,338,625号、5,512,147号参照)。
【0007】
また、本発明の出願人らの研究所では、活性金属電池の電極内でLiPON等のガラス性あるいは非晶質保護層を用いる技術が開発されてきた(例えば、すべてPolyPlus Battery社を出願人とする2000年2月15日交付済み米国特許第6,025,094号、2002年6月11日交付済み米国特許第6,402,795号、2001年4月10日交付済み米国特許第6,214,061号、2002年7月2日交付済み米国特許第6,413,284号参照)。
【0008】
水性環境中でリチウムアノードを用いる場合には、従来、濃縮KOH水溶液等の高塩基性条件にして、リチウム電極の腐食速度を遅くするか、あるいは、リチウム電極をポリマーで被覆して、水のリチウム電極表面への拡散を妨げる手法が採られてきた。しかし、いずれの場合でも、アルカリ金属電極と水との反応が生じていた。水の絶縁破壊電圧が1.2Vである一方、リチウム/水セルの電圧は約3.0Vであるため、金属リチウムアノードと組み合わせて、水性カソードあるいは水性電解質を用いることは不可能だとされてきた。金属リチウムと水溶液が直接接触することにより、激しい寄生反応が起こり、リチウム電極が腐食してしまう。このため、金属リチウム電池分野の研究は、有用な非水性(有機物)電解質系の開発に焦点がしぼられていた。
【発明の開示】
【課題を解決するための手段】
【0009】
本発明は、活性金属アノードと水性カソード/電解質系とを備えるアルカリ(あるいは他の活性)金属電池セルならびに電気化学セルに関する。電池セルの陰極(アノード)側は、アルカリ金属アノードに隣接して、高いイオン伝導度(少なくとも約10-7S/cm以上、望ましくは10-6S/cm以上、例えば、10-5S/cmから10-4S/cm以上、さらに望ましくは10-3S/cm以上)を有する保護膜を備える。この保護膜は、リチウム等の活性金属に対して高腐食性の環境を含む、溶媒環境、電解質処理環境、および/あるいは、カソード環境から、アルカリ金属電極を隔てる(分離する)役割を果たす。さらに、腐食性環境を含むこれらの環境へのイオンの出入りを可能にする。保護膜は、片側の面が、(リチウム等の)活性金属に対して化学的に適合性のある成分から形成され、もう片側の面が、リチウム等の活性金属に対して高腐食性の成分を含む様々な成分から形成され、両方の側面間のイオン移動を可能にするように構成される。このように、活性金属電極を保護することにより、電池セル等の電気化学装置の他の構成要素の材料選択の自由度をあげることができる。電池セルや電気化学セルの他の構成要素からアノードを分離することにより、アノードと共に用いる溶媒、電解質、カソード材の選択の幅を無限に広げることができる。また、アノードの安定性やアノード性能に影響を及ぼすことなく、電解質あるいはカソード側溶媒系を最適化することも可能になる。
【0010】
このような被保護活性金属アノードは、様々な電解質ならびにカソード材と共に用いることができる。利用可能な電解質およびカソード材は、例えば、2000年2月15日交付済み米国特許第6,025,094号、2002年6月11日交付済み米国特許第6,402,795号、2001年4月10日交付済み米国特許第6,214,061号、2002年7月2日交付済み米国特許第6,413,284号、2003年10月14日出願済み米国特許出願第10/686,189号(各特許ならびに特許出願内容を本発明の参考文献として組み込む)等、PolyPlus Battery社の特許に記載されるリチウム‐イオウ電池システムで用いられるようなリチウム金属系で安定な材料でもよく、また、空気、イオン性(プロトン性)溶液、水性電解質、溶融塩、イオン性溶液等のリチウム腐食性材料でもよい。さらに、高温から低温、高放電率から低放電率等、作動条件や放電率も限定されない。ただし、リチウムアノードの腐食やアノードに対する電解質適合性は本発明の論点ではない。本発明を好適に適用可能な電池セルとしては、リチウム‐空気セル、リチウム‐水性電解質セル、リチウム‐海/塩水セルが挙げられる。また、後述するように、その他の新規で有用な電気化学装置に本発明を適用することも可能である。さらに、複層保護膜を用いることにより、リチウムに対して非常に反応性の高い材料、例えば、リチウム/フッ素電池に対してPbSnF4をカソード材に用いることも可能である。
【0011】
本発明は、高イオン伝導性膜を用いることにより、活性金属電気化学セルの活性金属アノードとカソード側とを隔てる。この高イオン伝導性膜は、活性金属陰極(アノード)構造、並びに、バッテリや燃料電池を含む電気化学装置・構成部品に組み込むことができ、活性金属イオンに対する伝導性が高い一方、他の物質に対しては不浸透性である。また、膜は、その片側面がアノードの活性金属(例えば、リチウム)に対して化学的に安定である一方、もう一方の片側面は、カソードや、有機電解質、水溶液電解質等の固相電解質あるいは液相電解質など他の電池セル構成要素や、周辺環境条件に対して安定である。さらに、膜を用いることにより、他の電池構成要素との反応の悪影響や周辺環境条件から活性金属アノードを保護し、アノードとカソードの化学的環境を分離することができ、その結果、アノードや逆にカソードに悪影響を及ぼすことなく、カソード側の溶媒や電解質にアノードに対して適合性のない材料を用いることを可能にする。この構成により、活性金属電気化学セルに利用可能な材料の幅が広がり、セルの製造が容易になる。また、高いイオン伝導性を持つ膜を組み込むことにより、電気化学セルの性能を高めることも可能である。
【0012】
周知のように、リチウム金属は水と激しく反応し、酸性水溶液とはさらに激しく反応する。しかし、LiPON(Ag)/OHARAガラスセラミック複合体で保護したリチウム電極を備える本発明のセルは、問題なく酸性水溶液中に浸漬可能である。Ag/AgCl参照電極ならびに通常の水素電極に対して、熱力学的開路電位が測定され、リチウムが水性電解質中に放出されると、Pt対極で水素放出が起こるが、リチウム電極では腐食も化学反応も生じていない。また、上記のような被保護リチウム電極はLiOH水溶液浴中に浸漬可能であり、水性電解質中で可逆的にサイクル可能である。水性環境中で金属リチウムが急速に腐食されることは知られているが、上記のような実験結果は知られていない。このような結果を踏まえることにより、リチウム/水電池やリチウム/空気電池など、数多くの独創的な電池システムの開発が可能になる。今までにも、このような電池システムの研究はなされてきたが、保護されていない金属リチウム電極を用いたものだった。保護されていない金属リチウム電極は水中で急速に腐食するため、このような電極を用いて形成された電池は寿命が非常に短く、安全性にも問題があり、市場価値が低かった。本発明の被保護リチウム電極を用いると、腐食も水性電解質との化学反応も生じず、市場価値の高い電池の製造が可能になる。
【0013】
本発明は、水性活性金属電池セルに関し、第一表面と第二表面とを有する活性金属アノードと、電子伝導性成分と、イオン伝導性成分と、電気化学的活性成分とを含むカソード構造体を備える。ここで、少なくとも一つのカソード構造体成分が水性構成成分である。さらに、イオン伝導性保護膜がアノードの第一表面上に形成される。イオン伝導性保護膜は、一ないし複数の成分から形成され、アノードの活性金属に対して化学的適合性があり、かつ、アノードに接する第一表面と、実質的に不浸透性であり、カソード構造体に対して化学的適合性があり、かつ、カソード構造体に接する第二表面とを与えるように構成される。
【0014】
本発明に従うセルの例としては、リチウム/水電池セル、リチウム/空気電池セル、リチウム/金属水素化物電池セル、種々の電気化学的セルが挙げられる。
【0015】
本発明は、さらに、種々のセル並びにセル構成成分の製造方法、セル構成成分、ならびに、セル構造を提供するものである。
【0016】
本発明の上記並びにその他の特徴は、以下の詳細な説明でさらに言及され、例示されるであろう。
【発明を実施するための最良の形態】
【0017】
以下、本発明の好適な実施例を、添付の図面に基づいて詳細に説明する。ただし、これらの実施例は、単に本発明を例示するものにすぎず、なんら本発明を限定するものではない。本発明は、そのクレームの趣旨を逸脱しない範囲内で、種々の態様で実現可能であり、様々に変更、修正可能である。本発明の理解を助けるために、以下、実施例の詳細な特徴を説明するが、これらの詳細な特徴の一部あるいは全部を省いた形で本発明を実施することも可能である。また、本発明の論点がぼけないように、周知の処理工程については詳細な説明を省く。
【0018】
本明細書ならびにクレームにおいて、「備える」「方法は〜備える」「装置は〜備える」等の表現を単数冠詞の名詞と共に用いる場合、特に明記しない限り、その名詞を単数に限定するものではなく、複数も含むこととする。また、特に明記しない限り、本明細書ならびにクレームで用いる科学技術用語は、本発明分野の当業者が通常理解する意味で用いられるものとする。
【0019】
緒言
本発明は、活性金属アノードと水性カソード/電解質系とを備えるアルカリ金属(等の活性金属)電池セルならびに電気化学セルに関する。電池セルの陰極(アノード)側は、アルカリ金属アノードに隣接して、高いイオン伝導度(少なくとも約10-7S/cm以上、望ましくは10-6S/cm以上、例えば、10-5S/cmから10-4S/cm以上、さらに望ましくは10-3S/cm以上)を有する保護膜を備える。この保護膜は、リチウム等の活性金属に対して高腐食性の環境を含む、溶媒環境、電解質処理環境、および/あるいは、カソード環境から、アルカリ金属電極を隔てる(分離する)役割を果たす。さらに、腐食性環境を含むこれらの環境へのイオンの出入りを可能にする。保護膜は、片側の面が、(リチウム等の)活性金属に対して化学的に適合性のある成分から形成され、もう片側の面が、リチウム等の活性金属に対して高腐食性の成分を含む様々な成分から形成され、両方の側面間のイオン移動を可能にするように構成される。このように、活性金属電極を保護することにより、電池セル等の電気化学装置の他の構成要素の材料選択の自由度をあげることができる。電池セルや電気化学セルの他の構成要素からアノードを分離することにより、アノードと共に用いる溶媒、電解質、カソード材の選択の幅を無限に広げることができる。また、アノードの安定性やアノード性能に影響を及ぼすことなく、電解質あるいはカソード側溶媒系を最適化することも可能になる。
【0020】
このような被保護活性金属アノードは、様々な電解質ならびにカソード材と共に用いることができる。利用可能な電解質およびカソード材は、例えば、2000年2月15日交付済み米国特許第6,025,094号、2002年6月11日交付済み米国特許第6,402,795号、2001年4月10日交付済み米国特許第6,214,061号、2002年7月2日交付済み米国特許第6,413,284号、2003年10月14日出願済み米国特許出願第10/686,189号(各特許ならびに特許出願内容を本発明の参考文献として組み込む)等、PolyPlus Battery社の特許に記載されるリチウム‐イオウ電池システムで用いられるようなリチウム金属系で安定な材料でもよく、また、空気、イオン性(プロトン性)溶液、水性電解質、溶融塩、イオン性溶液等のリチウム腐食性材料でもよい。さらに、高温から低温、高放電率から低放電率等、作動条件や放電率も限定されない。ただし、リチウムアノードの腐食やアノードに対する電解質適合性は本発明の論点ではない。本発明を好適に適用可能な電池セルとしては、リチウム‐空気セル、リチウム‐水性電解質セル、リチウム‐海/塩水セルが挙げられる。また、後述するように、その他の新規で有用な電気化学装置に本発明を適用することも可能である。さらに、複層保護膜を用いることにより、リチウムに対して非常に反応性の高い材料、例えば、リチウム/フッ素電池に対してPbSnF4をカソード材に用いることも可能である。
【0021】
本発明は、高イオン伝導性膜を用いることにより、活性金属電気化学セルの活性金属アノードとカソード側とを隔てる。この高イオン伝導性膜は、活性金属陰極(アノード)構造、並びに、バッテリや燃料電池を含む電気化学装置・構成部品に組み込むことができ、活性金属イオンに対する伝導性が高い一方、他の物質に対しては不浸透性である。また、膜は、その片側面がアノードの活性金属(例えば、リチウム)に対して化学的に安定である一方、もう一方の片側面は、カソードや、有機電解質、水溶液電解質等の固相電解質あるいは液相電解質など他の電池セル構成要素や、周辺環境条件に対して安定である。さらに、膜を用いることにより、他の電池構成要素との反応の悪影響や周辺環境条件から活性金属アノードを保護し、アノードとカソードの化学的環境を分離することができ、その結果、アノードや逆にカソードに悪影響を及ぼすことなく、カソード側の溶媒や電解質にアノードに対して適合性のない材料を用いることを可能にする。この構成により、活性金属電気化学セルに利用可能な材料の幅が広がり、セルの製造が容易になる。また、高いイオン伝導性を持つ膜を組み込むことにより、電気化学セルの性能を高めることも可能である。
【0022】
膜は、任意の適切な組成を持つように構成されるが、アノード環境とカソード環境の両方に対して化学的適合性のある一体材から形成してもよいし、異なった化学的適合性を持つ少なくとも2つの異なった成分から成る複合材から形成してもよい。後者の場合、1つの成分がアノード環境に対して化学的適合性を持ち、もう1つの成分がカソード環境に対して化学的適合性を持つ。
【0023】
複合膜の場合、異なった化学的適合性の要件を満たす少なくとも2つの異なった材料成分から構成される。複合膜は、異なった化学的適合性の要件を満たす別々の材料層を積層することにより形成してもよく、また、このような材料層が段階的に移行するように構成してもよい。ここで、「化学的適合性」(あるいは「化学的に適合」という表現は、他の電池セル構成成分と接触した場合に、これと反応して、電池セルの作動、製造条件、処理条件、保管条件に悪影響を及ぼすような生成物を生じないことを意味している。
【0024】
複合膜の第一成分層は、イオン伝導性を持ち、活性金属電極材に対して化学的適合性を持つ。化学的適合性を持つ成分は、化学的に安定であり、活性金属電極材と接触した場合に実質的に反応しない成分である。活性金属は、周辺環境条件に対して高い反応性を有し、電極として用いる場合には、障壁層を形成することが望ましい。活性金属には、(リチウム、ナトリウム、カリウム等の)アルカリ金属、(カルシウム、マグネシウム等の)アルカリ土類金属、(亜鉛等)ある種の遷移金属、これら金属の2種類以上の合金が含まれる。利用可能な活性金属の例としては、(Li、Na、K等の)アルカリ金属、(Ca、Mg、Ba等の)アルカリ土類金属、Ca、Mg、Sn、Ag、Zn、Bi、Al、Cd、Ga、Inを用いた二元あるいは三元アルカリ金属合金が挙げられる。望ましい合金としては、リチウムアルミニウム合金、リチウム珪素合金、リチウム錫合金、リチウム銀合金、(Na4Pb等の)ナトリウム鉛合金であり、活性金属電極の材料としてリチウムを使うことが望ましい。また、化学的適合性を持つ成分は、酸化剤の存在下で化学的に安定であり、活性金属電極材と接触した場合に反応して、活性金属電極材に対して化学的に安定で、(第一層の成分として)望ましいイオン伝導性を有する生成物を生じるような材料でもよい。以下、このような反応性材料を「原」材料と称する場合がある。
【0025】
複合膜の第二成分層は、イオン伝導性を除き実質的に不浸透性であり、第一成分に対して化学的適合性を有する。「実質的に不浸透な成分」という表現は、電極材に損傷を与える可能性のある電池電解質や溶媒、その他電池構成材に対して充分な障壁として作用し、電極性能を低下させるような損傷を防ぐ成分を意味する。即ち、このような成分は、膨潤性がなく、空気、水分、電解質等が第一成分まで透過するようないかなる孔、傷、通路も持たない。第二成分層は、周囲の水分、二酸化炭素、酸素等に不浸透であり、通常のリチウム電極処理に求められるような厳密な乾燥条件を必要とせず、周辺環境条件下で密閉リチウム合金電極の処理を可能にするようなものが望ましい。本発明の複合保護膜がリチウム等の活性金属に対して高い保護性能を有するため、電極及び電極/電解質複合体が電池外部で非常に長い貯蔵寿命を持つことが期待される。即ち、本発明の構成は、陰極を含む電池のみならず、未使用の陰極並びに電極/電解質積層体にも適用可能である。このような陰極並びに電極/電解質積層体は、シート状、ロール状、スタック構造等、任意の構造で提供可能である。さらに、他の電池構成要素と一体化させて、電池を製造することも可能である。本発明の電池は安定性が高いため、容易に製造可能である。
【0026】
本発明の複合保護膜は、上述したような積層構造を有する複合保護膜に限定されるものではなく、機能勾配を有する層として形成してもよい。
【0027】
第一成分、第二成分は、本質的にイオン伝導性を持ち、そのイオン伝導性が液体電解質等の媒体の存在に左右されるものではない。
【0028】
上述したような特性を獲得するため、あるいは、電極の安定性や性能を向上させるために、さらに他の層を追加で持つように複合膜を構成してもよい。複合膜のすべての層は、少なくとも約10-7S/cm以上、望ましくは10-6S/cm以上、例えば、10-5S/cmから10-4S/cm以上、さらに望ましくは10-3S/cm以上という高いイオン伝導度を有し、複層構造体からなる保護膜は、少なくとも10-7S/cm以上、望ましくは10-3S/cm以上の高い総イオン伝導度を持つ。
【0029】
保護膜並びにその構造
図1は、リチウム/水電池セル、リチウム/空気電池セル、リチウム/金属水素化物電池セル等の水性活性金属電池セル120に用いられる、本発明のイオン伝導性保護膜を示す概念図である。保護膜100は、イオン伝導性があり、(リチウム等の)活性金属電極(アノード)106に対して化学的適合性がある第一側面と、実質的に不浸透性であり、イオン伝導性があり、かつ、カソード構造体110に対して化学的適合性がある第二側面とを有する。カソード構造体110は、電子伝導性成分と、イオン伝導性成分と、電気化学的活性成分とを有し、少なくとも一つのカソード構造体成分が水性構成成分である、あるいは、水性構成成分を含む。保護膜は、少なくとも10-7S/cm以上、望ましくは10-6S/cm以上、例えば、10-5S/cmから10-4S/cm以上、さらに望ましくは10-3S/cm以上のイオン伝導性を有する。保護膜の第一側面に接する活性金属アノード106は、一般に不活性で活性金属と合金を形成しない、銅等の伝導性金属で形成される集電板108に接続される。特に図示していないが、電子伝導性成分、例えば、リチウム/水セルやリチウム/空気セルでは多孔質の電子伝導性触媒支持体が、保護膜に隣接してカソード側に形成され、(カソード側集電板112を介して)アノード側から電子を移送させ、カソード側活性成分の電解還元を促進する。
【0030】
保護膜は、アノード側と電解質及び/あるいはカソード側とで異なった化学的適合性を有する側面を形成する二つ以上の成分からなる複合体として構成するものでもよい。複合体は、イオン伝導性があり、活性金属電極材に対して化学的適合性がある物質からなる第一層と、実質的に不浸透性であり、イオン伝導性があり、第一層の成分とカソード/電解質環境の両方に化学的適合性がある物質からなる第二層とを備える。
【0031】
以下に説明するように、本発明の保護膜の構造により、アノードと組み合わせられる電解質および/あるいはカソードには、これに限定されるものではないが、本発明の参考文献であるPolyPlus Battery社の特許に記載される物質を含む多種多様な物質を用いることができる。
【0032】
図2Aは、本発明の一実施例として、保護膜複合体セパレータを示す。セパレータ200は、異なった化学適合性を有する材料からなる複数の層の積層体である。第一成分層あるいは前駆物質層202は、イオン伝導性と、活性金属に対する化学的適合性とを有する。多くの場合、第一成分は、(空気、水分等)酸化剤とは化学的に適合性がない。活性金属に接する第一層は、その全体あるいは一部を、活性金属窒化物、活性金属リン化物、活性金属ハロゲン化物、あるいは活性金属リン酸窒化物ガラスから形成するようにしてもよい。例えば、Li3N、Li3P、LiI、LiBr、LiCl、LiF等を用いることができる。また、酸化剤に対して化学的適合性があるLiPONを用いることもできる。第一成分層の厚さは、望ましくは、約0.1ないし5ミクロン、さらに望ましくは0.2ないし1ミクロン、例えば、0.25ミクロンである。
【0033】
また、上述したように、第一成分を、活性金属に対して化学的適合性があり反応性に富む前駆物質としてもよい。前駆物質が活性金属電極材に接触することにより、活性金属電極材に対して化学的に安定で、かつ、(第一層成分として)望ましいイオン伝導性を有する生成物を生じる。前駆物質の好適な例としては、金属窒化物、赤リン、窒素・リン含有有機物質(例えば、アミン、ホスフィン、ボラジン(B3N3H6)、トリアジン(C3N3H3))、ハロゲン化物が挙げられる。特に望ましくは、P(赤リン)、Cu3N、SnNx、Zn3N2、FeNx、CoNx、窒化アルミニウム(Al3N)窒化珪素(Si3N4)I2、Br2、Cl2、F2である。このような前駆物質を(Li等の)活性金属と反応させることにより、上述したようなリチウム窒化物、リン化物、ハロゲン化物等のリチウム金属塩が形成される。このような第一成分層の前駆物質としては、(水分と周辺大気に通常存在する他の物質を含む)空気中で化学的に安定であり、取り扱い、製造が容易なものでもよい。このような物質としては、金属窒化物、例えば、Cu3Nが挙げられる。
【0034】
また、活性金属に適合する層に、ポリマー成分を加え、その物性を改良するような構成も望ましい。例えば、ポリ(2−ビニルピリジン)−ヨウ素(P2VP-I2)、ポリエチレン‐ヨウ素等のポリマー‐ヨウ素錯体やテトラアルキルアンモニウム‐ヨウ素錯体をリチウムと反応させて、純粋なLiIよりも非常に高いイオン伝導性を有するLiI複合層を形成するようにしてもよい。
【0035】
第一成分層は、少なくとも10-7S/cm以上、望ましくは10-5S/cm以上、さらに望ましくは10-3S/cm以上という高いイオン伝導度を持つ。
【0036】
第一成分層あるいは前駆物質層202と隣接して第二層204が形成される。第二層204は、実質的に不浸透性であり、イオン伝導性があり、第一成分層あるいは前駆物質層202に対して化学的適合性があり、さらに、アノードの活性金属に対して通常腐食性のある環境に対して化学的適合性がある。第二層204の成分としては、(D.P. Button et al., Solid State Ionics, Vols. 9-10, Part 1, 585-592(1983年12月)に記載されるような)リンガラス、酸化物ガラス、リン酸窒化物ガラス、イオウガラス、酸化物/硫化物ガラス、セレン化物ガラス、ガリウムガラス、ゲルマニウムガラス、ボラサイトガラス等のガラス性あるいは非晶質金属イオン伝導体や、リチウムβアルミナ、ナトリウムβアルミナ、リチウム超イオン伝導体(LISICON)、ナトリウム超イオン伝導体(NASICON)等のセラミック活性金属イオン伝導体や、ガラス‐セラミック活性金属イオン伝導体が用いられる。例えば、LiPON、Li3PO4、Li2S.SiS2、Li2S.GeS2.Ga2S3、Li2O.11Al2O3、Na2O.11Al2O3、(Na,Li)1+xTi2-xAlx(PO4)3(0.6≦x≦0.9)や、結晶学的関連構造であるNa3Zr2Si2PO12、Li3Zr2Si2PO12、Na5ZrP3O12、Na5TiP3O12、Na3Fe2P3O12、Na4NbP3O12、Li5ZrP3O12、Li5TiP3O12、Li3Fe2P3O12、Li4NbP3O12、さらに、これらを組み合わせたものや焼結あるいは溶融したものを用いることができる。セラミック活性金属イオン伝導体の望ましい例は、例えば、本発明に参照文献としてその全体を組み込む米国特許第4,985,317号(Adachiら)に記載される。
【0037】
保護膜複合体の第二層のガラスセラミック材としては、以下の組成で、Li1+x(M,Al,Ga)x(Ge1-yTiy)2-x(PO4)3(ここで、X≦0.8と0≦Y≦1.0とを満たし、MがNd、Sm、Eu、Gd、Tb、Dy、Ho、Er、Tm、Ybからなる群から選択される元素)および/あるいはLi1+x+yQxTi2-xSiyP3-yO12(ここで0<X≦0.4 と0<Y≦0.6とを満たし、QがAlあるいはGaである)からなる主要結晶質相を含むリチウムイオン伝導性ガラスセラミック材が特に好適である。
組成 mol%
P2O5 26-55%
SiO2 0-15%
GeO2+TiO2 25-50%
内 GeO2 0-50%
TiO2 0-50%
ZrO2 0-10%
M2O3 0<10%
Al2O3 0-15%
Ga2O3 0-15%
Li2O 3-25%
ガラスセラミック材は、原料を溶融して、溶融した原料をガラスに成型し、ガラスに熱処理を施すことにより得られる。このような材料は、例えば、日本の株式会社オハラから市販され、詳しくは、本発明に参照文献として組み込まれる米国特許第5,702,995号、6,030,909号、6,315,881号、6,485,622号に記載される。
【0038】
これらのガラス材、セラミック材、ガラス‐セラミック材は高い伝導性(約10-7S/cmから10-3S/cmの範囲、あるいはそれ以上のイオン伝導度)を持ち、保護されるリチウムアノードの性能を高め、オーム抵抗に大きな影響を及ぼすことなく、比較的厚い膜の形成を可能にする。
【0039】
第一層、第二層ともにさらに別の成分を加えるようにしてもよい。活性金属適合性成分層(第一層)にポリマー成分を加え、その物性を改良するようにしてもよい。例えば、ポリ(2−ビニルピリジン)−ヨウ素(P2VP-I2)、ポリエチレン‐ヨウ素等のポリマー‐ヨウ素錯体やテトラアルキルアンモニウム‐ヨウ素錯体をリチウムと反応させて、純粋なLiIよりも非常に高いイオン伝導度を有するLiI含有層を形成するようにしてもよい。さらに、第一層の効果を高める成分、例えば、(蒸着中の)リチウム蒸気が第一層成分として用いられるLiPONと反応しないように(Ag等の)薄い加湿層を設けるようにしてもよい。
【0040】
これらの層は、(電子線蒸着等の)蒸着手法、Li3Nや(LiPON等の)イオン伝導性ガラスのような材料層のプラズマ溶射等の熱溶射手法など、様々な手法で形成可能である。また、上述したように、一ないし複数の前駆物質と活性金属電極との無害な反応により、活性金属電極に隣接する層をin situ(その場で)形成するようにしてもよい。例えば、Cu3NをLiアノード表面に接触させることによりLiアノード上にLi3N層を形成するようにしてもよいし、赤リンをLiアノード表面に接触させることにより、Liアノード上にLi3Pを形成するようにしてもよい。
【0041】
上記した組成、成分、製造法に関しては、Ionically Conductive Composites for Protection of Anodes and Electrolytes(アノードと電解質保護のためのイオン伝導性組成物)のタイトルで2002年10月15日出願の米国仮特許出願番号60/418,899号、Ionically Conductive Composites for Protection of Active Metal Anodes(活性金属アノード保護のためのイオン伝導性組成物)のタイトルで2003年10月14日出願の対応米国特許出願番号10/686,189号(代理人整理番号No.PLUSP027)、並びに、Ionically Conductive Composites for Protection of Active Metal Anodes(活性金属アノード保護のためのイオン伝導性組成物)のタイトルで2003年12月5日出願の米国特許出願番号10/731,771号(代理人整理番号No.PLUSP027X1)に記載されている。これらの出願全体を参照文献として、本発明に組み入れる。
【0042】
保護膜複合体には、本質的に高いイオン伝導度が求められる。複合体のイオン伝導度は、少なくとも約10-7S/cm以上、望ましくは10-6S/cmから10-5S/cm以上、さらに望ましくは10-4S/cmから10-3S/cm以上である。第一成分層は、セパレータで隔てる必要があるアノードの活性金属等、隣接する成分や層に第二成分層が接することがないように充分な厚さに形成される必要がある。例えば、第一成分層の厚さは、約0.1ないし5ミクロン、望ましくは、0.2ないし1ミクロン、例えば、約0.25ミクロンである。
【0043】
第二成分層の厚さは、0.1ないし1000ミクロン、望ましくは1ないし500ミクロン、さらに望ましくは10ないし100ミクロン、例えば20ミクロンである。第二成分層のイオン伝導度が約10-7S/cmの場合、厚さは約0.25ないし1ミクロン、イオン伝導度が約10-4S/cmから10-3S/cmの場合には、厚さは約10ないし1000ミクロンが望ましい。
【0044】
第一成分層が、Cu3NやLiPON等の空気中で化学的に安定な前駆物質で形成されている場合には、電池セルに組み込む前の保護膜複合体セパレータを、劣化させることなく、通常の大気条件で取り扱い・貯蔵可能である。セパレータを電池セルに組み込むと、前駆物質層202が(リチウム等の)活性金属電極に接し、前駆物質が活性金属と反応して、活性金属電極材に対して化学的に適合性のあるイオン伝導性成分層を形成する。一方、第二成分層は、カソードと集電板が接続される、あるいは、接続された電解質に接する。あるいは、第二成分層が電池セルの唯一の電解質として作用するような構造でもよい。いずれの構成でも、保護膜複合体の二つの層を組み合わせることにより、活性金属電極と電解質および/あるいはカソードとの間で有害な反応が起こらないように保護する。
【0045】
本発明の保護膜複合体は、積層体構造に限られず、図2Bに示すような組成勾配あるいは機能勾配を持つ勾配体構造でもよい。高周波スパッタリング、電子線蒸着、熱溶射、プラズマ溶射のような適当な蒸着手法を用いて、複数の材料源から勾配膜を形成することができる。すなわち、異なった組成及び機能を持つ複数の層の間に形成されるはっきりした界面の代わりに、一つの層から別の層へと徐々に移り変わっていく。上述の独立層積層体と同様、結果として得られる二元機能適合性でありイオン伝導性の複合体220は、片側面214がリチウム等の活性金属に対して安定であり(第一成分)、もう片側面216が実質的に不浸透性で、周辺環境に対して、さらに電池セルに組み込んだ状態ではカソードや他の電池セル成分に対して、安定である(第二成分)。複合体の第一成分と第二成分との比は、必要なイオン伝導性や機械的強度により大きく変動する。必須条件ではないが、多くの例では、第二成分のほうが多い。第一成分と第二成分の比としては、例えば、1:1000あるいは1:500が望ましく、第二成分のほうが第一成分よりも強度が高くイオン伝導度が高い場合には、例えば、1:200が望ましい(例:LiPONが2000Åに対して、ガラスセラミックが20ないし30ミクロン)。複合体内での第一成分と第二成分間の遷移層は、いかなる厚さでもよく、比較的短いものから、長いもの、中間のものと、任意に設定可能である。また、電極やセルに用いるなど、独立層積層体構造の保護膜複合体と同様、勾配体構造の保護膜複合体も様々な構成で利用可能である。
【0046】
図3Aに、本発明の一実施例として、積層体構造の保護膜複合体を備える被覆アノード構造体を示す。アノード構造体300は、リチウム等の活性金属電極308と、電極308に接続された、例えば銅製の集電板310と、保護膜複合体302とを備える。保護膜複合体302は、イオン伝導性があり、活性金属電極材に対して化学的適合性があるが、電解質や(空気等の)酸化剤に対しては化学的適合性がない成分からなる第一層304を備える。例えば、活性金属に接する第一層は、その一部あるいは全部が、活性金属窒化物、活性金属リン化物、活性金属ハロゲン化物から形成されるものでもよい。例えば、Li3N、Li3P、LiI、LiBr、LiCl、LiF等を用いることができる。第一成分層の厚さは約0.1ないし5ミクロンが望ましく、さらに望ましくは0.2ないし1ミクロン、例えば、約0.25ミクロンである。
【0047】
活性金属電極材(例えば、リチウム)に第一層の材料を積層するようにしてもよいし、あるいは、金属窒化物、金属リン化物、金属ハロゲン化物、赤リン、ヨウ素等の前駆物質をリチウムに接触させることにより、in situ(その場で)第一層を形成するようにしてもよい。第一層のin situ(その場)形成の場合には、例えば、以下のような反応で前駆物質(P、Cu3N、PbI2)をリチウム化合物に変換する。
1.3Li + P = Li3P(前駆物質からリチウムイオン伝導体を形成する反応)
2(a).3Li + Cu3N = Li3n + 3Cu(リチウムイオン伝導体‐金属複合体を形成する反応)
2(b).2Li + PbI2 = 2LiI + Pb(リチウムイオン伝導体‐金属複合体を形成する反応)
【0048】
このようなin situ(その場)変換により形成される第一層複合成分は、電子伝導性金属粒子を含み、本発明の保護膜複合体の第一層成分の要件を満たし、本発明の要旨の範囲に入る。
【0049】
保護膜複合体の第二層306は、実質的に不浸透性で、イオン伝導性があり、第一成分あるいはその前駆物質に対して化学的適合性がある成分から形成される。第二層の成分としては、リンガラス、酸化物ガラス、リン酸窒化物ガラス、イオウガラス、酸化物/硫化物ガラス、セレン化物ガラス、ガリウムガラス、ゲルマニウムガラス、ボラサイトガラス等のガラス性あるいは非晶質金属イオン伝導体や、リチウムβアルミナ、ナトリウムβアルミナ、リチウム超イオン伝導体(LISICON)、ナトリウム超イオン伝導体(NASICON)等のセラミック活性金属イオン伝導体や、ガラス‐セラミック活性金属イオン伝導体が用いられる。例えば、LiPON、Li3PO4、Li2S.SiS2、Li2S.GeS2.Ga2S3、Li2O.11Al2O3、Na2O.11Al2O3、(Na,Li)1+xTi2-xAlx(PO4)3(0.6≦x≦0.9)や、結晶学的関連構造であるNa3Zr2Si2PO12、Li3Zr2Si2PO12、Na5ZrP3O12、Na5TiP3O12、Na3Fe2P3O12、Na4NbP3O12、Li5ZrP3O12、Li5TiP3O12、Li3Fe2P3O12、Li4NbP3O12、さらに、これらを組み合わせたものや焼結あるいは溶融したものを用いることができる。セラミック活性金属イオン伝導体の望ましい例は、例えば、本発明に参照文献としてその全体を組み込む米国特許第4,985,317号(Adachiら)に記載される。また、ガラスセラミック活性金属イオン伝導体の望ましい例は、例えば、本発明に参照文献として組み込まれる米国特許第5,702,995号、6,030,909号、6,315,881号、6,485,622号に記載され、日本の株式会社オハラから入手可能である。
【0050】
複合体のイオン伝導度は、少なくとも約10-7S/cm以上、望ましくは10-6S/cm以上、例えば、10-5S/cmから10-4S/cm以上、さらに望ましくは10-3S/cm以上である。第二成分層の厚さは、0.1ないし1000ミクロン、望ましくは1ないし500ミクロン、さらに望ましくは10ないし100ミクロン、例えば20ミクロンである。第二成分層のイオン伝導度が約10-7S/cmの場合、厚さは約0.25ないし1ミクロン、イオン伝導度が約10-4S/cmから10-3S/cmの場合には、厚さは約10ないし1000ミクロンが望ましい。
【0051】
上記のようなアノード構造体を水あるいは空気カソードと組み合わせて電池セルを形成すると、第一層304は(リチウム等の)活性金属アノードに隣接し、第二層306はカソード材並びにカソードに連結される水性電解質に隣接する。後述するように、電池セルは、さらに、セル内でのカソード反応が促進されるように、多孔質の電子伝導性触媒支持構造を備える。
【0052】
図2A、図2Bを参照して保護膜セパレータ構造として上述したように、本発明の保護膜複合体の構造は、積層体構造に限られず、図3Bに示すような組成勾配および機能勾配を持つ勾配体構造とすることもできる。高周波スパッタリング、電子線蒸着、熱溶射、プラズマ溶射のような適当な蒸着手法を用いて、複数の材料源から勾配膜を形成することができる。すなわち、異なった組成及び機能を持つ複数の層の間に形成されるはっきりした界面の代わりに、一つの層から別の層へと徐々に移り変わっていく。上述の独立層積層体と同様、結果として得られる二元機能適合性でありイオン伝導性の複合体320は、片側面314がリチウム等の活性金属に対して安定であり(第一成分)、もう片側面316が実質的に不浸透性で、カソード、他の電池セル成分、望ましくは、さらに周辺大気に対して安定である(第二成分)。
【0053】
図2Bに示す勾配体構造のセパレータで説明したように、複合体の第一成分と第二成分との比は、必要なイオン伝導性や機械的強度により大きく変動する。必須条件ではないが、多くの例では、第二成分のほうが多い。第一成分と第二成分の比としては、例えば、1:1000あるいは1:500が望ましく、第二成分のほうが第一成分よりも強度が高くイオン伝導度が高い場合には、例えば、1:200が望ましい(例:LiPONが2000Åに対して、ガラスセラミックが20ないし30ミクロン)。複合体内での第一成分と第二成分間の遷移層は、いかなる厚さでもよく、比較的短いものから、長いもの、中間のものと、任意に設定可能である。
【0054】
第一成分層および第二成分層を遷移層及び/あるいは湿潤層等、他の材料で被覆するようにしてもよい。例えば、(株式会社オハラから市販されている)ガラスセラミック板をLiPON層、さらに、銀(Ag)薄膜層で被覆するようにしてもよい。この被覆構造体上でリチウムを蒸散させると、AgがAg-Liに変換され、少なくともその一部は大量の蒸着リチウム内に拡散し、リチウム電極を保護する。Agの薄膜は、高温リチウム(気相)が第一成分層のLiPONに接触して有害な反応が起こるのを防ぐ。蒸着後の固相リチウムはLiPONに対して安定である。このような遷移/湿潤層(例えば、Sn)と第一成分層とを組み合わせることにより、所望の特性を得ることができる。
【0055】
本発明の保護膜は、蒸着、蒸散等、様々な方法で形成可能である。本発明の保護膜複合体は、第一層成分あるいはその前駆物質を第二層成分上に(電子線蒸着等)蒸着あるいは蒸散することにより形成可能である。また、詳細には後述するが、活性金属電極あるいは活性金属材と一つあるいは複数の前駆物質とを悪影響のない形で反応させることにより、(リチウム箔等の)金属リチウムに前駆物質を直接接触させることにより、あるいは、第二層成分を介して前駆物質をリチウムメッキすることにより、第一層をin situ(その場で)形成するようにしてもよい。また、後述するように、第二成分層をさらに第一成分層上に形成するようにしてもよい。
【0056】
図4Aに、本発明の保護膜複合体を形成する第一の方法を示す。この方法では、高イオン伝導性で活性金属に対して化学的適合性がある成分からなる第一層を、実質的に不浸透性でイオン伝導性がある成分、例えば、LiPON等の高イオン伝導性ガラス材あるいはガラスセラミック材、または、上述のガラスセラミック材からなる第二層上に直接蒸着する。この場合には、高周波スパッタリング、電子線蒸着、熱蒸着、反応性熱/電子線蒸着等、種々の手法を用いることができる。図示した例では、窒素プラズマ中でリチウムを蒸散させることにより、上述したガラスセラミック材等のガラスセラミック材の表面にリチウム窒化物(Li3N)層を形成する。次に、Li3N層上に金属リチウムを蒸着する。Li3N層は、金属リチウム電極を第二成分層から隔てる一方で、リチウム電極からガラス材にLiイオンを透過させる。活性金属や第一層成分、第二層成分は図示した例に限られることはなく、様々な金属、成分を用いることができる。
【0057】
図4Bに、本発明の保護膜複合体を形成する第二の方法を示す。この方法では、第二成分層上に前駆物質層を形成した後、イオン伝導性と化学的適合性がある第一成分層をin situ(その場で)形成する。図示した例では、上述したようなガラスセラミック材からなるガラスセラミック層の表面を、活性金属(この場合は、リチウム)リン化物を形成する前駆物質である赤リンで被覆する。次に、リンの被覆層上に、金属リチウム層を蒸着させる。3Li+P=Li3Pの反応式で表されるリチウムとリンとの反応によりLi3Pが形成される。Li3Pは、イオン伝導性物質であり、リチウムアノードとガラスセラミック材の両方に対して化学的適合性を持つ。このような構成により、ガラスセラミック材等の第二層成分は、リチウム電極と直接に接することはない。この方法でも、活性金属や第一層成分、第二層成分は図示した例に限られることはなく、様々な金属、成分を用いることができる。例えば、前駆物質としてCu3Nを用いて、(ガラスセラミック材等の)第二成分層上にCu3Nの薄膜を形成し、リチウムアノードと接触させ、3Li+Cu3N=Li3N+3Cuの反応式に従って第一成分層を形成するようにしてもよい。あるいは、前駆物質として鉛ヨウ化物を用いて、ポリマイ電解質上に鉛ヨウ化物の薄膜を形成し、リチウムアノードと接触させ、2Li+PbI2=2LiI+Pbの反応式に従って第一成分層を形成するようにしてもよい。
【0058】
また、図5に示すように、本発明の保護膜複合体が組成勾配および機能勾配を持つように、一つの層から別の層へと徐々に移り変わる遷移層を形成してもよい。例えば、Li3N、Cu3N、Li3P、LiPON等、適当な第一成分蒸着用スプレーヘッドと株式会社オハラから市販されるガラスセラミック材等の第二成分蒸着用のスプレーヘッドの2つのスプレーヘッドを用いてプラズマ溶射を行う。まず、スプレーヘッドからプラズマを照射して100%のガラスセラミック材層を形成し、徐々にプラズマの照射量を減らす一方、もう一つのプラズマ源からの照射量を増大させる。この結果、100%のガラスセラミック材層から100%のLiPON、Li3N等の第一成分層に連続的に移り変わる勾配層が形成される。得られた保護膜複合体の片側面は(リチウム、ナトリウム等の)活性金属に対して安定であり、もう片側面は実質的に不浸透性で、カソード、他の電池セル成分、望ましくはさらに周辺条件に対して安定である。プラズマ溶射の代わりに、電子線蒸着あるいは熱溶射を行うようにしてもよい。当業者には自明のように、本発明の保護膜複合体の勾配構造は、与えられたパラメータに従い、様々な手法で形成可能である。
【0059】
保護膜複合体の勾配構造の内(活性金属に安定な)第一成分層側にリチウムを蒸着等、上述した方法で付着させることにより、アノードの保護構造を形成することができる。さらに、リチウムを蒸着させる前に、保護膜複合体の勾配構造の内リチウムに安定な側上にSn、Ag、Al等の接着層を形成することも望ましい。
【0060】
図4A、図4B、図5を参照して上述した方法のいずれにおいても、第一成分層あるいは前駆物質層上にリチウム層(活性金属層)を形成する代わりに、保護膜複合体の第一成分層あるいは前駆物質層をリチウムに接触させて、金属リチウムを保護膜の層間物質あるいは前駆物質に結合させるようにしてもよい。例えば、押し出されたリチウム金属箔に層間物質あるいは前駆物質を直接接触させるようにしてもよい。
【0061】
また、錫層を含む銅材等、加湿層を含む適当な基材を、第一層成分あるいは前駆物質、例えば、Cu3Nで被覆するようにしてもよい。これをさらに、(イオン)伝導性ガラス等の第二層成分で被覆するようにしてもよい。第一層成分及び第二層成分を介して、リチウム(活性金属)で錫電極をメッキすることにより活性金属電極を形成するようにしてもよい。このメッキ工程により、前駆物質であるCu3NもLi3Nに変換され、リチウム金属電極上に本発明の保護膜複合体が形成される。このような活性金属メッキ方法の詳細は、本発明の引用文献として組み込まれた、同一出願人による米国特許第6,402,795号に記載されている。
【0062】
上述の製造法に関して注意するべきことは、市販されているリチウム箔は通常押し出し成形されており、このため表面には無数の傷があり、高周波スパッタリング、熱蒸着、電子線蒸着等の視線蒸着手法では到達不能なほど深く凹んだ部分も多いということである。また、リチウム等の活性金属は薄膜蒸着環境に対して反応性が高いため、蒸着工程で表面がさらに劣化する危険性があることにも留意が必要である。この結果、活性金属電極の表面上に蒸着された膜には亀裂や孔が生じることになる。そこで、製造工程を逆にすることにより、この問題を解決する。すなわち、リチウム上に保護膜を蒸着させるのではなく、保護膜上にリチウムを蒸着させればよい。溶融鋳造法、切断研磨法など、滑らかな表面を形成するための周知の様々な手法のいずれかを用いて、滑らかな表面を持つガラス膜あるいはガラスセラミック膜を形成する(リチウムは柔らかい金属なので研磨は不可能である)。一層あるいは複数層の滑らかで亀裂のない膜をこの滑らかな表面上に蒸着形成する。その後、滑らかな表面上に活性金属を蒸着することにより、滑らかで亀裂のない活性金属‐保護膜界面を形成することができる。あるいは、Ag等の遷移接着層を保護膜上に蒸着し、押し出し成形されたリチウム箔をAg層に対して圧着することにより、リチウム箔と膜とを接合するようにしてもよい。
【0063】
また、前記したように、第一層が別の成分をさらに含むように構成してもよい。第一層にポリマー成分を加え、その物性を改良するようにしてもよい。例えば、ポリ(2−ビニルピリジン)−ヨウ素(P2VP-I2)、ポリエチレン‐ヨウ素等のポリマー‐ヨウ素錯体やテトラアルキルアンモニウム‐ヨウ素錯体をリチウムと反応させて、活性金属と第二層成分の両方に対して化学的適合性のあるイオン伝導性LiI含有層を形成するようにしてもよい。ポリマーヨウ素電荷移動錯体を用いることにより、純粋なLiIよりも非常に高いイオン伝導度を有し、LiIとポリマーとを含有する複合体層を形成することができる。同様に、臭素錯体等、他のハロゲン錯体を用いることもできる。
【0064】
図6Aにポリマー含有構造の一例を示す。この実施例では、ポリマー層とヨウ素層を第二成分層表面に被覆して、反応させ、ポリマーヨウ素錯体を形成する。
【0065】
この例では、ブラッシング、浸漬、あるいは、スプレー等により、(伝導性ガラス等の)第二成分層上にポリマー薄膜を形成する。例えば、(0.5ないし2.0ミクロン、より好ましくは0.1ないし0.5ミクロンの)薄いP2VP層で伝導性ガラス層を被覆する。
【0066】
次に、ドライボックスあるいはドライルーム内に設置した反応器内で(約20ないし25°Cの)室温でヨウ素結晶を昇華することによりヨウ素膜を形成する。昇華ヨウ素層は(0.05ないし0.1ミクロンと)非常に薄く形成可能であり、昇華率は、温度あるいは基材とヨウ素源との間の距離を変更することにより調節可能である。
【0067】
あるいは、アセトニトリルやn-ヘプタン等の有機溶媒に高濃度でヨウ素を溶かし(例えば、50ないし100g/l)、浸漬、スプレー、ブラッシング等により伝導性ガラス表面をヨウ素の溶解液で被覆するようにしてもよい。この場合には、被覆処理の距離及びヨウ素濃度を変更することにより処理条件を簡単に変えることができる。この手法で用いられるヨウ素源の例としては、LiアノードおよびLiI含有固体電解質と共に構成される固体電池のカソード材として知られている、AgI、PbI2等の金属ヨウ素化物が挙げられる。
【0068】
最後に、ポリマーヨウ素錯体で被覆された伝導性ガラス(第二層成分)にリチウムを蒸着する、あるいはリチウムを圧着することにより、伝導性ガラス上に形成されたポリマーヨウ素錯体にリチウム(活性金属)を接触させる。この結果、Liアノード上にLiIを含有する保護膜複合体が形成される。
【0069】
図6Bにポリマー含有構造の別の例を示す。この例では、上述した手法により、Liと反応してLiI層(A)を形成可能なヨウ素の薄膜で伝導性ガラス(第二層成分)表面上を被覆する。
【0070】
上述した手法によりリチウム箔等の活性金属層をポリマー(B)の薄膜で被覆する。その後、ポリマー層がヨウ素層に接するように、伝導性ガラスと活性金属層を組み付ける。ヨウ素がポリマーと反応することにより、インピーダンスが減少した、LiI含有保護膜複合体が形成される。
【0071】
完全形成された保護膜と上述した周辺環境に安定な前駆物質を含む電池セパレータとにより保護されたアノード構造体は、電池セルに組み込むまで、通常の周辺大気条件下で、劣化することなく、取り扱い・貯蔵可能である。
【0072】
活性金属水性セル
上述したように活性金属アノードを保護することにより、リチウム/水セル、リチウム/空気セル、リチウム/金属水素化物セルのように、カソードに水性構成成分を含む活性金属電池セルや電気化学セルを構成することができる。このようなセルは、一般的に、電子伝導性成分と、イオン伝導性成分と、電気化学的活性成分とを含むカソード構造体を備える。ここで、カソード構造体成分の少なくとも一つは、水性組成あるいは水性構成成分を有する。これらのセルは、従来のセルに比べて飛躍的に性能が強化されている。後述するように、このようなセルは、種々の態様で適用、実現可能である。このようなセルは、それぞれ異なる電気化学反応に従って作動し、カソード構造体の電気化学的活性成分を(液体、気体、固体等)様々な状態から選択可能であるが、いずれのセルも、カソード構造体内にLiイオン輸送のための水性構成成分を備えるという共通の特徴を備える。保護膜によりアノードとカソードを隔てる構造により、このような強力な新型電池セル、電気化学セルを製造することが可能になる。
【0073】
活性金属/水セル
本発明は、新しい活性金属/水電池セルや活性金属/水電気化学セルを提供する。本発明のセルは、リチウム(Li)や他のアルカリ金属等の活性金属アノードと、保護膜と、水や過酸化物水溶液等の電気化学的に活性な水性成分を含むカソード構造体とを備える。このようなセルのアノード側の構造については、前述した。このセルでは、保護膜により被覆されていない活性金属電極部分は、すべて、(銅等の)集電板材、Oリングシール、クリンプシール、ポリマーあるいはエポキシ封止材、あるいはこれらの組合せにより、水性カソード環境から切り離す必要がある。
【0074】
このようなセルのカソード側には、電子伝導性成分と、イオン伝導性成分と、電気化学的に活性な水性成分とを含むカソード構造体が形成される。電気化学的に活性な水性成分は、多くの場合、イオン伝導性も持つため、一つの溶液で電気化学的活性成分とイオン伝導性成分の両方の作用をすることも多い。以下に例を挙げて説明するように、セルは、アノードと電気的に接続される電子伝導性支持体を備え、電子の移動によりカソード材(例えば、リチウム/水セルではH2O)を還元する。電子伝導性支持体は、通常、多孔質であるため流体を透過させ、また、(NiやPt等の)触媒活性を持つか触媒処理されることにより、カソード材還元の触媒として働く。適当なイオン伝導性を有する水性電解質が電子伝導性支持体に接することにより、電子伝導性支持体内をイオンが移動して、酸化還元反応が生じる。
【0075】
電子伝導性支持体をパーフルオロスルホン酸ポリマー膜(例えば、du Pont社のNafion)等のアイオノマーで処理することにより電気化学的活性がある水性成分の許容範囲をイオン伝導性が低い、あるいは、まったくイオン伝導性を持たない水性成分にまで広げることが可能になる。また、Nafion等のアイオノマーで処理することにより、ポリマー鎖に電子伝導性成分の塩を化学的に結合させ、流水式構造やオープンセル構造でも消失してしまうことがない。
【0076】
電池セルは一次電池でも二次電池でもよい。一次電池の場合には、セルのカソード側が周辺環境に対して開放されており、セルのカソード側から酸化リチウムが周辺環境中に分散してしまう可能性がある。このようなセルの構造を「オープンセル構造」と称する。例えば、電気化学的活性とイオン伝導性を持つ成分として海水を用いる海上用セルが、オープンセル構造である。二次電池の場合には、セルのカソード側に酸化リチウムが貯留され、適当な電位がセルに加えられると、保護膜を通してLiイオンを逆方向に移送することにより、アノードを再充電することが可能になる。このようなセルの構造を「クローズドセル構造」と称する。クローズドセル構造では、カソードで生成される水素を放出する必要があるが、電池セルで用いられる適切な通気構造に関しては当該分野で周知である。
【0077】
図1に概略構造を示すような本発明の活性金属/水電池セルの一例として、リチウム/水電池セルが挙げられる。図7に、本発明に従うリチウム/水電池セルの一例を示す。この例では、電池セル700がリチウム陰極(アノード)702を備えるが、他のアルカリ金属等の活性金属でアノードを形成することも可能である。金属リチウム電極702は、リチウムイオン伝導性保護膜704に接合される。接合には、本明細書で言及し、本発明の参照文献として組み込まれる特許出願に記載された、いかなる手法を用いてもよく、必要に応じて、Agや他の適当な合金形成金属の薄膜を接着層として利用してもよい。セルは、さらに、多孔質で電子伝導性のある触媒支持体706と、(水等の)電気化学的活性成分と水性電解質708とを含むカソード構造体を備える。海水やLiCl、LiBr、LiI、NH4Cl、NH4Br等の水溶液を電気化学的活性成分とイオン伝導性成分の両方として用いるようにしてもよいし、後述するようにアイオノマーを用いる場合には、塩をほとんど、あるいは、まったく含まないようにしてもよい。また、保護膜704と多孔質電子伝導性触媒支持体706との間にさらにセパレータを配置するようにしてもよい。このセパレータは、多孔質電子伝導性触媒支持体706の粗い表面により保護膜704が損傷を受けるのを防ぎ、水性カソード活性材/電解質の流体貯留所として機能する。セパレータを、ポリエチレン、ポリプロピレン等のポリオレフィンで形成するようにしてもよく、例えば、GELGARDセパレータを用いることができる。セル内の電気化学的活性成分(水)とイオン伝導性成分(水性電解質)は混合されて一つの溶液を形成していてもよく、図でも一つの部材708として示している。
【0078】
上述したように、セルの保護膜のカソード側には、電子伝導性成分と、水性及び/あるいはアイオノマー性イオン伝導性成分と、電気化学的に活性な水性成分とを含むカソード構造体が配置される。図示した構造では、これらの成分を水性電解質708および多孔質電子伝導性触媒支持体706として表している。リチウム/水電池では、電気化学的活性成分は水である。なんら限定されるものではないが、アノードからのLiイオンと水との間では、以下のような電気化学反応が起こっていると考えられる。
Li + H2O = LiOH + 1/2H2
この反応により、Li1モルと水1モルから、LiOH1モルと水素ガス0.5モルが生成される。
【0079】
セルの水性電解質は、LiイオンとLiイオンに結合した陰イオン輸送(伝導)のイオンキャリアとして働く。上述したように、電気化学的活性成分(水)とイオン伝導性成分(水性電解質)は混合されて一つの溶液を形成していてもよいが、これらの成分は、概念的には電池セルの異なった構成要素である。本発明のリチウム/水電池セルに適した電解質は、適度なイオン伝導性を有する水性電解質ならどのようなものでもよい。好適な電解質としては、HCl、H2SO4、H3PO4等の強酸、酢酸/酢酸リチウム等の弱酸、LiOH等の塩基、海水、LiCl、LiBr、LiI等の中性物質、NH4Cl、NH4Br等の両性物質が挙げられる。
【0080】
電解質として海水を用いることにより、高いエネルギー密度を有する海上用電池セルを構成することが可能になる。未使用の状態では、セル構造体は、被保護アノードと、多孔質の電子伝導性支持体(電子伝導性成分)とから構成されている。セルを使用する際には、電気化学的活性成分とイオン伝導性成分として働く海水にセル構造体を浸す。電気化学的活性成分とイオン伝導性成分は周辺環境中の海水によって与えられるため、セルの使用前に電池セルの一部として構成する必要はなく、セルのエネルギー密度算出に含める必要もない。カソード側の反応生成物は貯蔵されないために、このようなセルを「オープンセル」と称する。すなわち、このようなセルは一次電池になる。
【0081】
本発明は、リチウム/水セルとしても実現可能である。上記したように、適切な再充電電位がセルに加えられた際に、保護膜を通してLiイオンを逆方向に移動させ、セルのカソード側に貯蔵されるカソード反応生成物を用いてアノードを再充電する。このようなセルを「クローズドセル」と称する。
【0082】
また、先に言及し、詳細には後述するように、多孔質の電子伝導性触媒支持体をアイオノマーで被覆することにより、電気化学的活性成分に必要とされるイオン伝導度が減少する、あるいは、ゼロになる。
【0083】
リチウム/水セル内で生じる電気化学反応は、カソードの電気化学的活性成分を還元する酸化還元反応である。リチウム/水セルでは、電子伝導性触媒支持体が酸化還元反応を促進する。上述したように、これに限定されるものではないが、リチウム/水セル内では、以下のセル反応が生じていると考えられる。
Li + H2O = LiOH + 1/2H2
すなわち、アノードとカソードでは、以下の半電池反応が進むと考えられる。
アノード:Li = Li+ +e-
カソード:e- + H2O = OH- +1/2H2
【0084】
リチウム/水セルのカソード触媒は、水への電子移送を促進し、水素と水酸化物イオンを生成する。この反応に一般的に用いられる触媒は安価な金属ニッケルである。Pt、Pd、Ru、Au等の貴金属にも同様な触媒作用があるが、高価である。
【0085】
本発明のリチウム/水(活性金属)電池の範疇には、被保護Liアノードと、活性カソード材(電気化学的活性成分)として利用可能な水溶性の気体及び/あるいは固体酸化剤からなる水性電解質と、を備える電池も入る。水よりも強い酸化剤である水溶性化合物を用いることにより、リチウム/水電池に比べて、電池エネルギーを著しく増大させることが可能になる。このようなセルでは、放電反応時に、カソード表面で電気化学的な水素放出が生じる。利用可能な気体酸化剤の例としては、O2、SO2、NO2が挙げられる。また、NaNO2、KNO2等の亜硝酸金属、Na2SO3やK2SO3等の亜硫酸金属も水よりも強い酸化剤であり、高濃度で容易に水に溶解可能である。他に、水溶性の無機酸化剤として、リチウム、ナトリウム、カリウムの過酸化物や過酸化水素H2O2が挙げられる。
【0086】
酸化剤として過酸化水素を用いることは特に有用である。本発明の電池セルでは、過酸化水素は、少なくとも2種類の作用を果たす。一つ目の作用は、カソード表面上での過酸化水素の化学分解である。これにより、活性カソード材として利用可能な酸素ガスが生成される。二番目の作用はもっと有用であると考えられるが、カソード表面上での過酸化水素の直接的な電解還元である。過酸化水素は、原則として、塩基性溶液中でも酸性溶液中でも還元可能であるが、酸性溶液中での過酸化水素還元を利用する電池の場合に、最も高いエネルギー密度が得られる。過酸化水素を用いたリチウムアノード型セルのエネルギー密度は、(標準的な条件で)E0=4.82Vであり、これはリチウム/水セルのエネルギー密度E0=3.05Vよりも有意に高い。ただし、酸も過酸化水素も裸のリチウムに対する反応性が非常に高いため、リチウムアノードを保護しないと実用的なセルを作ることはできない。
【0087】
過酸化水素を溶解したリチウム/水セルで過酸化水素を流動させることにより、カソード表面における過酸化水素の還元効率、特に高放電率時の還元効率を高めることができる。この場合、過酸化水素は、カソード表面に連続的に供給される燃料となる。被保護Liアノードを持つ海上用高エネルギー密度セルでは、海水に溶解され、連続的にセル内を流動する過酸化水素を利用することができる。
【0088】
活性金属/空気電池セル
本発明に従う水性活性金属セルの別の例としては、活性金属/空気電池セルがある。活性金属/空気電池セルは、リチウム(Li)や他のアルカリ金属等の活性金属アノードと、保護膜と、電気化学的活性成分として空気を含むカソード構造体とを備える。なんら限定されるものではないが、アノードからのLiイオンと空気との間では、以下のような電気化学反応が起こっていると考えられる。
Li + 1/2H2O + 1/4O2 = LiOH
Li + 1/4O2 = 1/2Li2O
Li + 1/2O2 = 1/2Li2O2
すなわち、空気中の水分(H2O)と酸素の両方電気化学反応に関与している。
【0089】
活性金属/空気電池セルのアノード側構造は、水性活性金属セルに関して説明したものと同様である。このセルでも、保護膜により被覆されていない活性金属電極部分は、すべて、(銅等の)集電板材、Oリングシール、クリンプシール、ポリマーあるいはエポキシ封止材、あるいはこれらの組合せにより、空気カソード環境から切り離す必要がある。
【0090】
このようなセルのカソード側には、電子伝導性成分と、イオン伝導性成分と、電気化学的活性成分として空気を含むカソード構造体が形成される。セルの電気化学的活性成分である空気は水分を含み、この水が上記の電気化学反応に供される。以下に例を挙げて説明するように、セルは、アノードと電気的に接続される電子伝導性支持体を備え、電子の移動によりカソード活性材である空気を還元する。電子伝導性支持体は、通常、多孔質であるため流体(空気)を透過させ、また、触媒活性を持つか触媒処理されることにより、カソード活性材還元の触媒として働く。適当なイオン伝導性を有する水性電解質あるいはアイオノマーが電子伝導性支持体に接することにより、電子伝導性支持体内部をイオンが移動して、酸化還元反応が生じる。
【0091】
本発明のリチウム/空気電池セルの一例を図8に示す。図示した例では、セル800は、リチウム等の活性金属陰極(アノード)808と、アノード808に接合される銅等の集電板810と、保護膜積層複合体802とを備える。上述したように、保護膜積層複合体802は、イオン伝導性があり、活性金属電極材に対して化学的適合性を持つ成分からなる第一層804と、実質的に不浸透性で、イオン伝導性があり、第一成分と水性環境の両方に化学的適合性を持つ成分からなる第二層806とを備える。セルは、さらに、電子伝導性成分と、水性及び/あるいはアイオノマー性イオン伝導性成分と、電気化学的活性成分として空気とを含むカソード構造体(以下、「空気極」とも呼ぶ)812を備える。リチウム/水セルと同様に、保護膜802とカソード構造体812との間にさらにセパレータを配置するようにしてもよい。このセパレータは、多孔質の電子伝導性触媒支持体であるカソード構造体812の粗い表面により保護膜802が損傷を受けるのを防ぐ。酸性電解質を含むリチウム/空気電池の場合には、セパレータにより、セル放電反応で電解質が塩基性溶液に変換される以前のセル容量を増大させ、大気中のCO2に対する反応性(炭酸化反応)を高める。セパレータを、ポリエチレン、ポリプロピレン等のポリオレフィンで形成するようにしてもよく、例えば、GELGARDセパレータを用いることができる。
【0092】
カソード構造体812は、多孔質電子伝導体等の電子伝導性成分と、少なくとも水性構成成分であるイオン伝導性成分と、電気化学的活性成分として空気とを含む。カソード構造体は、亜鉛/空気電池等の金属/空気電池やPEM燃料電池等の低温燃料電池で通常用いられるものなど、適当な空気極であればよい。亜鉛/空気電池を初めとする金属/空気電池で用いられる空気極に関しては、「Handbook of Batteries」(電池ハンドブック) (Linden and T. B. Reddy, McGraw-Hill, NY, 3版)等、多くの文献に記載されているように、通常、空気拡散膜、疎水性テフロン層、触媒層、Niスクリーン等の電子伝導性金属成分/集電板を含む複数の層からなる層状構造を有する。触媒層には、水性及び/あるいはアイオノマー性イオン伝導性成分/電解質が含まれる。水性電解質は、例えば、水に溶解させたKOHである。アイオノマー性電解質は、例えば、パーフルオロスルホン酸ポリマー膜(例えば、du Pont社のNafion)等の水和(水)リチウムイオン伝導性ポリマーである。空気拡散膜は、空気(酸素)の流量を調整する。疎水性層は、セルの電解質が空気拡散膜に侵入するのを防ぐ。疎水性層には、通常、カーボン粒子とテフロン粒子とが含まれる。触媒層には、通常、表面積の大きなカーボンと酸素ガスの還元を促進する触媒とが含まれる。市販されているカソードの大部分では、MnO2等の金属酸化物が酸素還元用の触媒として用いられている。また、コバルトフタロシアニン等の大員環金属化合物やプラチナ、プラチナ/ルテニウム合金等、高分散貴金属も触媒として用いることができる。空気極構造体は、活性金属電極から化学的に分離されているため、アノード活性材に対する反応性により空気極の化学組成が限定されることはない。すなわち、保護されていない金属電極を攻撃する可能性のある材料を高性能空気極に用いた設計も可能になる。
【0093】
金属/空気電池では、周辺環境からカソードの活性反応物質を取り入れるため、容積エネルギー密度や重量エネルギー密度が非常に高い。金属/空気電池は、エネルギー密度が高いため、重量やサイズが大きな問題となるような場合に特に有用である。従来の金属/空気電池では、寄生反応が起こり、金属電極が腐食して水素が生じていた。電解質にKOHを加えることで、アノードの腐食反応を最小限に抑えることができるが、その一方で、空気極側で空気中のCO2がK2CO3に変換され、堆積物が生じるために、セルの劣化が早くなるという問題を引き起こす。本発明のセル構造では、活性金属電極を水性電解質から分離することで、アノードの腐食を防ぎ、上記のような問題を解決する。本発明のセルでは、アノードが電解質溶液内で腐食することなく、電解質溶液から分離されているため、中性電解質(LiCl)、塩基性電解質(KOH)、酸性電解質(NH4Cl、HCl等)のいずれを用いた空気極も形成可能である。なんら限られるものではないが、酸性電解質の場合には、以下に示すセル反応が生じ、塩化リチウムが形成されると考えられる。このようなセルでは、空気極は空気中からCO2を取り込まず、K2CO3が形成されない。
Li + 1/2O2 + NH4Cl = LiCl + NH3
本発明の活性金属/空気電池では、水性電解質が金属アノードに接しないため、金属アノードの腐食が起こらず、中性あるいは酸性の電解質が利用可能になる。
【0094】
本発明のリチウム/空気セルは、一次電池としても二次電池としても構成可能である。
【0095】
活性金属/金属水素化物電池セル
本発明に従う、被保護アノードと、水性成分を含むカソード構造とを備える水性活性金属電池セルの別の例として、図9に示すリチウム(活性金属)/金属水素化物電池セルがある。リチウム/金属水素化物電池では、電解質として適した水溶液中で、被保護リチウムアノードを充放電することができる。このセルで好適に用いられる電解質は、プロトン源となるものであり、HCl、HBr、NH4Cl、NH4Br等の塩化物酸や臭化物酸、それらの塩を初めとするハロゲン化物酸やその塩の水溶液が例として挙げられる。
【0096】
放電時には、アノードから放出されたリチウムイオンがイオン伝導性保護膜を通り水性電解質に到達する。プロトンが還元されて水素化イオンが形成され、金属合金陽極(カソード)の一部となる。したがって、セルのカソード側では、電子伝導性成分(金属合金)、イオン伝導性成分(水性電解質)、および、電気化学的活性成分(プロトン/金属合金)を含むカソード構造体が配置される。これは、ニッケル/金属水素化物(Ni/MH)電池で用いられる周知の金属水素化物に類似の構造である。ただし、電解質中の酸は消費され、リチウム塩に変換される。このようなセルを一次電池として構成することも可能であるが、通常は、材料コストを考えて、(再充電可能な)二次電池として構成される。二次電池の再充電時には、リチウムイオンが保護膜を通ってリチウム電極まで移送され、金属リチウムに還元される。その一方で、金属水素化物が酸化されてプロトンを放出し、酸電解質を再生する。このようなセルは、陽極と陰極の可逆性が非常に高く、サイクル寿命が長い。
【0097】
なんら限定されるものではないが、本発明のリチウム/金属水素化物セルでは以下の半電池反応ならびに全電池反応が生じていると考えられる。
アノード: Li = Li+ + e-
カソード: HCl + M + e- = MH + Cl-
電池反応: Li + HCl + M = LiCl + MH
金属水素化物合金は当業者に周知のものであり、通常は、AB5(性能向上のために部分的に置換されたLaNi5やLaCo5)で表される希土類合金(ミッシュメタル)や(ZrNi2等)チタンやジルコニウムを含むAB2合金から選択される。金属水素化物電極は、ポリマー結合活性水素貯蔵合金で被覆された穴あきニッケル箔あるいはグリッドを有する高多孔性構造体として形成される。金属水素化物電極は、商業ベースでは、ニッケル/金属水素化物(Ni/MH)電池に用いられる。市販の電池では、アルカリ電解質が用いられるため、アルカリ条件下での性能を向上させるように水素化物合金が修飾されている。Ni/MH電池において、電解質が酸性の場合には、酸性電解質におけるサイクル特性が向上するようにAB5あるいはAB2合金の組成を変更するようにしてもよい。
【0098】
リチウム/水電池および燃料電池用の水素発生装置
本発明に従い、活性金属電極上に保護層を設けることにより、ごく少量の腐食電流を生じる活性金属/水電池を構成することが可能になる。Li/水電池は、8450Wh/kgという非常に高い理論エネルギー密度を持ち、Li + H2O = LiOH + 1/2H2というセル反応が起こる。セル反応により生じた水素は通常無駄になるが、本発明のセル構造では、室温燃料電池用の燃料として用いられる。この場合、生成された水素を燃料電池に直接供給することも可能であるし、後から燃料電池で利用するために、金属水素化物合金に貯蔵することも可能である。少なくともMillenium Cell社(http://www.milleniumcell.com/news/tech.html)では、水と水素化ホウ素ナトリウムとの反応を利用して水素を生成している。しかし、この反応には触媒が必要であり、NaBH4と水との化学反応で生じたエネルギーは熱として消失してしまう。
NaBH4 + 2H2O R 4H2 + NaBO2
この反応を燃料電池反応H2 + O2 = H2Oと組み合わせることにより、燃料電池で以下の反応が起こると考えられる。
NaBH4 + 2O2 R 2H2O + NaBO2
この系のエネルギー密度は、反応物質であるNaBH4の当量から計算できる(38/4 =9.5グラム当量)。セル電圧は約1であり、この系の比エネルギーは2820Wh/kgであるため、NaBH4の重量エネルギー密度は2820mAh/kgになる。最終生成物NaBO2に基づいて計算されるエネルギー密度はもっと低く、約1620 Wh/kgである。
【0099】
リチウム/水セルの場合、次の電気化学反応により水素が生成されると考えられる。
Li + H2O = LiOH + 1/2H2
この化学反応のエネルギーは、セル当たり3ボルトの電気エネルギーに変換され、燃料電池内で水素が水に変換される。すなわち、セル全体では以下の反応が起こっていると考えられる。
Li + 1/2H2O + 1/4O2 = LiOH
ここで、理論的には、すべての化学エネルギーが電気エネルギーに変換される。11,500Wh/kg(NaBH4の4倍)に対応する約3ボルトの電池電位では、リチウムアノードに基づくエネルギー密度は3830mAh/kgになる。反応に必要な水の重量を含めると、エネルギー密度は5030 Wh/kgになる。生成物であるLiOHの重量に基づくエネルギー密度は3500 Wh/kgであり、これは、NaBO2系のエネルギー密度の2倍である。ここで、水と金属リチウムとの反応から水素を生成する系も考慮に入れる。Li/H2O反応エネルギーの大部分は熱として失われ、(Li/H2Oの3に対して)実際には1未満であるH2/O2系のセル電位にエネルギー密度が基づくため、エネルギー密度は1/3に減少する。図10に示す本発明の実施例では、Li/水電池にかかる負荷を調整することにより、水素の生成を制御する。保護膜の存在によりLi/水電池は貯蔵寿命が長く、また、セルから放出される水素は既に加湿された状態でH2/空気型燃料電池に供給される。
【0100】
Li/水セルおよびLi/空気セル用の電子伝導性触媒支持体構造
本発明のLi/水セルおよびLi/空気セルでは、充分に高い多孔性を持ち、電気化学的活性成分の大量移送を制限することなく表面積を最大にした、電子伝導性触媒支持体構造を用いることができる。多孔質の支持体材料としては、もともと電子伝導性を持つ材料も、(被覆等の)処理により電子伝導性を獲得した材料も用いることができる。(イオン伝導性はあるかもしれないが)もともと電子伝導性ではない多孔質の支持体材料としては、アルミナ、シリカ、ガラス、セラミック、ガラスセラミック、および、耐水性ポリマーが挙げられる。絶縁性支持体の場合には、電流を通すように金属メッキされる。絶縁性支持体の金属メッキは周知の無電解メッキ法により行われる。触媒と還元剤を絶縁体表面上に吸着させた後、絶縁体を金属イオンの溶液に浸すと、当業者に周知のように、金属イオンが還元され、絶縁体表面に金属が析出する。この金属メッキには、銅やニッケルが通常用いられるが、触媒特性からいうと、(特にLi/水セルでは)ニッケルが好ましい。
【0101】
ガラス、セラミック、ガラスセラミック支持体は、不活性材料か、あるいは、保護膜に適したイオン伝導性材料から形成されることが望ましい。ガラス、セラミック、あるいはガラスセラミック粉末/ポリマー結合剤/溶媒の混合物をテープキャスト成形あるいは押し出し成形することにより、多孔質支持体を形成するようにしてもよい。また、テープキャスト成形あるいは押し出し成形により、多孔質支持体上に、より微細なガラス、セラミック、あるいはガラスセラミック粉末の第二層をさらに形成するようにしてもよい。この二層構造体を焼成することにより、粗支持体層は多孔性を保持する一方、薄層は完全に緻密化して、保護膜支持体が完成する。あるいは、支持体層を予備焼成した後、薄層をテープキャスト成形あるいは押し出し成形で形成し、さらに全体を焼成することにより高密度化するようにしてもよい。
【0102】
保護膜のガラス、セラミック、あるいはガラスセラミック層は、プラズマ溶射、真空プラズマ溶射、熱溶射等の溶射法で形成することも可能である。また、Jie Fu, J. Amer. Ceramic. Soc., 80[7] p.1901-1903 (1997)、並びに、先に引用され参照文献として本発明に組み込まれた株式会社オハラに交付された特許に記載されるように、このような固体支持体のイオン伝導性を向上させるために、ガラス、セラミック、ガラスセラミック層に熱処理を施すようにしてもよい。この形成方法では、粉末状の膜材料をプラズマトーチノズルに供給し、溶融微細液滴としてノズルから噴霧するようにしてもよい。溶融液滴は基材に対して噴霧され固まる。このようにして、駆動パラメータに応じて選択された高密度あるいは多孔質の基材上にガラス、セラミック、あるいはガラスセラミック層を直接蒸着し、高密度層あるいは多孔質層を形成するようにしてもよい。
【0103】
ポリマー支持体としては、ポリエチレン、ポリプロピレン、ケブラー、ナイロン等が望ましい。例えば、ガラスセラミック薄層をテープキャスト成形した後焼成して高密度にする。次に、ポリマー/結合剤/溶媒層をテープキャスト成形することにより、ガラスセラミック層にポリマー支持体を蒸着した後、乾燥させる。
【0104】
もともと電子伝導性を持つ支持体としては、共焼成したあるいは予備焼成した金属が望ましい。例えば、テープキャスト成形あるいは押し出し成形により多孔質ステンレス鋼支持体を作製し、この多孔質支持体上にテープキャスト法でガラスあるいはガラスセラミックの薄層を蒸着させる。次に、二層構造体を、空気中900°C未満の低温条件で焼成することにより、あるいは、(水素炉等の)減圧条件下でもっと高温で焼成することにより、焼結工程におけるステンレス鋼支持体の酸化を最小限に抑える。あるいは、多孔質ニッケル支持体を上述した方法で作製してもよい。ただし、この場合には、NiのNiOへの酸化を防ぐために減圧条件下での焼成が必須となる。あるいは、多孔質支持体を予備招請することにより、所望の多孔性が得られるようにしてもよい。テープキャスト、エアロゾル噴霧、電気泳動析出等の手法で、多孔質支持体上にガラスセラミックの第二層を形成する。基材は予備焼結されているため、焼成工程では焼結せず、第二層が非焼結基材に拘束された状態で焼結される。第二層はガラス成分からなり、焼成中に流動可能なため、このような拘束は問題とならない。
【0105】
非触媒性の多孔質支持体の場合には、触媒を含浸させることにより、水の還元を促進して、アノードから放出されて保護層を透過するLiイオンとの反応を促進する。
【0106】
ニッケル支持体の場合には、ニッケル表面に水の還元を触媒する作用があるため、触媒の含浸は通常不要である。
【0107】
セル製造、成分、ならびに構成例
セル製造に用いる蒸着法
図11に、本発明の一実施例として、プラズマ溶射等の蒸着手法を用いる、薄層Li/水あるいはLi/空気電池の製造工程を示す。多孔質伝導性ニッケル触媒支持体上に保護膜複合積層体を形成し、次に、保護膜上に金属リチウムを蒸着させる。プラズマ溶射法は、基材を比較的低温で維持可能な利点がある。例えば、約500°C未満という低温条件で多孔質ニッケル支持体を維持しても、NiがNiOに酸化されるのを防ぐことができる。次に、プラズマ溶射により、多孔質ニッケル支持体をガラスあるいはガラスセラミックの薄膜で被覆し、続いて、リチウム適合性のあるLiPON層あるいはCu3N等その他適切な成分を電子線蒸着、高周波スパッタリング、CVD、プラズマ溶射等の適当な方法でガラス薄膜上に蒸着させる。さらに、リチウム適合性層上に、Agを真空蒸着することにより、薄い遷移被膜を形成するようにしてもよい。その後、リチウム電極を蒸着してLi/Ag/LiPON/Ni接合体を形成する。あるいは、リチウム電極を機械的に圧着して接合体を形成するようにしてもよい。
【0108】
最後に、必要に応じて、接合体を海水中あるいは電解質水溶液中に含浸させる等の方法で、多孔質電子伝導性支持体に水や電解質をさらに加えて、セルを完成させる。実際の電池セルでは、エラストマーあるいはエポキシ樹脂からなる溶接シーリング材を用いて、海水環境から金属リチウム電極を分離する。
【0109】
電子伝導性触媒支持体をパーフルオロスルホン酸ポリマー膜(例えば、du Pont社のNafion)等のアイオノマーで処理することにより、用いる電解質の許容範囲をもともとのイオン伝導性が低い、あるいは、まったくイオン伝導性を持たない電解質にまで広げることが可能になる。
【0110】
また、多孔質電子伝導性触媒支持体を金属フレームで構造補強して、剛性と強度を高めるようにしてもよい。フレームは、ステンレス鋼やアルミニウム等任意の適当な金属で構成されていればよい。図12Bならびに図12Dに図示するように、フレームをグリッド状に配置するようにしてもよい。
【0111】
保護膜支持構造体およびその製造
薄い保護膜を用いることには、材料コストの削減、重量削減、その結果としてのエネルギー密度向上、膜のイオン透過促進等、様々な利点がある。水性リチウムセルに用いる保護膜層を可能な限り薄くするために、テープキャスト成形等の適当な手法でイオン伝導性ガラスセラミック等の薄層を形成する。テープキャスト成形により数ミクロンから数十ミクロンの厚さの膜を形成する手法は、当該分野で周知の技術であり、このような薄層は、多層セラミックコンデンサで普通に用いられている。イオン伝導性ガラスセラミック材をテープキャスト成形した後、焼成して高密度にする。この時点では、10ないし50ミクロンの薄層は、まだ、もろく壊れやすい。
【0112】
ソニー株式会社およびSchott Glass社により提案され、Schott Glass社ウェブサイト(http://www.schott.com/english)からダウンロード可能で本発明に参照文献として組み込まれる、T.Kessler, H. Wegener, T.Togawa, M.Hayashi, and T. Kakizaki, 'Large Microsheet Glass for 40-in. Class PALC Displays', 1997, FMC2-3に記載の「ドローダウン」法で、ガラスあるいはガラスセラミック薄膜を形成するようにしてもよい。簡単に説明すれば、ガラスを溶融状態で引っ張り、薄いガラスリボンを形成する。ガラス板の冷却速度が結晶化速度を上回れば、ガラスは非晶質になる。ナシコン型のガラスでは、多くの場合、高い伝導性を得るためには結晶相の存在が必要不可欠であるため、ガラス薄板を熱処理することにより、伝導相を結晶化すると共に「ガラスセラミック」を形成して、ガラス固体膜のイオン伝導性を向上させる。この結晶化手法に関しては、先に引用され参照文献として本発明に組み込まれたJie Fu, J. Amer. Ceramic. Soc., 80[7] p.1901-1903 (1997)、並びに、株式会社オハラに交付された特許に詳述されている。結晶化(非晶質の失透)により表面が粗くなる可能性があるので、必要に応じて、熱処理条件を最適化して細粒の形成を促進させるか、あるいは、化学または機械研磨で表面仕上げをする。
【0113】
次に、いずれかの手法で形成されたガラスセラミック薄膜を、エポキシ、エラストマー、および/あるいは、セラミック接着剤等で接着することにより、あるいは、オーブンで焼成することにより、(金属製あるいは金属メッキされた)多孔質電子伝導性支持体に接合する。この製造法の例を図12Aないし図12Eに示す。金属フレームの開口部には多孔質電子伝導性触媒支持材が充填され、Li/水の酸化還元反応を促進する。このようにして、多孔質で水還元の触媒作用を持つ金属フレームと電子伝導性支持材とで、ガラスセラミック薄層を支持する。
【0114】
あるいは、発泡ニッケル等の多孔質電子伝導性触媒支持材を、直接、ガラスセラミック保護薄膜成分に接合するようにしてもよい。このガラスセラミック‐多孔質電子伝導性触媒支持材接合体を金属フレームに載置する、あるいは、接着する。このような構造を図12Eに示すように対称に形成することにより、構造体の強度を向上させ、空気極面積を最大にすることができる。
【0115】
あるいは、「ワッフル」型成型によりガラスにグリッドパターンを形成することにより、ガラス膜自体の強度を高めるようにしてもよい。溶融ガラスを適当な型に注入あるいは押圧して、ガラスに補強用の隆線を形成すると同時に、隆線間の膜厚は薄いままにする。必要があれば、この「ワッフル」構造に熱処理を施して、ガラス固体膜のイオン伝導性を向上させる。この「ワッフル」型に成形された固体電解質を多孔質ニッケル電極に接合するようにしてもよい。
【0116】
弾性シーリング
図13に、複数のガラス、セラミック、あるいは、ガラスセラミック製のイオン伝導性保護シートを弾性シーリング剤で接合して保護膜アレイを形成した構造を示す。複数のシート間のシーリング剤が弾性を持つため、アレイには多少の自由度がある。各保護シートの一面に、先に多孔質電子伝導性触媒基材を接合しておき、アレイ形成後に、各保護シートの反対側の面にリチウム(活性金属)を蒸着させてアノードを形成して、セルの固相部分を完成させるようにしてもよい(カソード/電解質部分は液相である)。あるいは、セルの固相部分を完成した後に、図13に示すように接合してアレイ構造を形成してもよい。
【0117】
管状構造
図14に、本発明のLi/水あるいはLi/空気セルを管状に成形した構造を示す。例えば、多孔質ニッケルチューブを支持体として用いて、チューブの外側面(A)あるいは内側面(B)に適当な手法でイオン伝導性ガラス、セラミック、あるいは、ガラスセラミック層を蒸着させる。チューブの端は閉じていても、開放していてもかまわない。例えば、開放端を持つチューブを用いて、チューブの外側面にイオン伝導性ガラスセラミック材をプラズマ蒸着し、続いて、リチウム適合性がある第一成分(例えば、LiPON)層、接着層(例えば、Ag)、リチウム電極、銅箔を順に蒸着して、開放端を封入する。このチューブを海水に浮遊させて、高エネルギー密度電池として用いることができる。リチウムがチューブの外側面に位置するか、あるいは、芯材としてチューブの内側に位置するかにより、海水(あるいはLi/空気セルの場合には空気)がチューブの中心あるいはチューブの周囲を流動する。
【0118】
毛細管状構造
図15に、本発明のLi/水あるいはLi/空気セルを毛細管状に成形した構造を示す。まず、保護膜材料を吹いて、細径のガラス、セラミック、あるいは、ガラスセラミック毛細管を作製する。毛細管の内側面(あるいは外側面)をリチウム適合性のある第一成分材(例えば、LiPON(Ag))で被覆した後、溶融したリチウムを毛細管に流入させ、大きな表面積を持つ被保護アノードファイバーを形成する。次に、個々のファイバーを多孔質電子伝導性触媒支持材で被覆する。ファイバーの容積に対する表面積の比が大きいため、効率を高めることができる。このようなファイバーを平行に多数接合することにより、高出力リチウム/水電池を作製する。さらに、このような平行接合体を直列に組み合わせて、高電圧−高出力電池が形成される。
【0119】
他の構成例
本発明の再充電可能な水性リチウム電池種々の他の構成で実現可能である。以下に構成例をいくつか挙げる。
【0120】
リチウム‐ニッケル電池
ニッケル電極NiOOHは当業者に周知で、再充電可能な市販ニッケル‐カドミウム電池に長年用いられており、最近では、再充電可能なニッケル‐金属水素化物電池にも用いられている。
アノード反応:Li = Li+ + e-
カソード反応:NiOOH + H2O + e- = Ni(OH)2 + OH-
全電池反応: Li + NiOOH + H2O = Ni(OH)2 + LiOH
ニッケル電極は高い可逆性を持ち、被保護LiアノードとNiOOHカソードとを組み合わせることにより、高いエネルギー密度を持ち、サイクル寿命の長い電池を製造できる。
【0121】
リチウム‐銀電池
銀電極AgOは、軍隊で広く使われている高速電池であるAg/Zn電池に用いられている。
アノード反応:Li = Li+ + e-
カソード反応:AgO + H2O + 2e- = Ag + 2OH-
全電池反応: 4Li + 2AgO + 2H2O = 4LiOH + 2Ag
リチウムアノードと銀カソードとを組み合わせることにより、高速再充電可能な電池を製造できる。
【0122】
さらに、被保護リチウムアノードと酸化鉄、酸化鉛、酸化マンガン等の遷移金属酸化物とを組み合わせることにより、本発明を種々の新しい水性電池の形態で実現可能である。
【0123】
実施例
以下、本発明のリチウム/水電池セルの特性、利点、効果等を実施例に基づいて詳細に説明する。ただし、これらの実施例は本発明を例示し詳細に説明するためのものであり、本発明をなんら限定するものではない。
【0124】
実施例1:Li/水セル
電解質とカソード(水)の水性環境に対して、株式会社オハラから市販されているイオン伝導性ガラスセラミック材を保護膜の外側層(複合体の第二層)として用いて、種々の実験を行った。金属酸化物‐リチウム伝導体は水性環境で安定な一方、金属リチウムに対しては不安定である。OHARAプレート材を金属リチウムから保護するために、LiPONで被膜した。OHARAプレート材は、厚さ0.3から1mmの範囲のものを使用した。LiPON被膜は、厚さ0.1ないし0.5ミクロンとし、高周波スパッタリングによりOHARAプレート材上に蒸着させた。
【0125】
熱蒸散したリチウムがLiPON膜と反応しないように、LiPON層上に真空蒸着によりAgの薄い被膜を形成した。Ag膜の厚さは、200ないし1000Åとした。Liの真空蒸着工程では、LiPONが高い反応性を持つ気相Liと反応する可能性がある。Ag、Al、Sn等のLi合金形成金属の薄膜をガラスセラミック表面に真空蒸着することにより、PiPON表面がLiと反応するのを防ぐことができる。この金属層の厚さは、50ないし10000Å、望ましくは100ないし1000Åとする。Liとの反応から第一成分層を保護する機能に加えて、Li合金形成金属層はさらに以下の二つの機能を果たす。第一成分層形成後に、被処理材を真空下から周辺大気あるいはドライルーム大気を通して、Li蒸着のために他の処理室に移す必要がある場合、金属層は、第一層成分が大気中の成分と反応しないように保護する役割を果たす。さらに、Li合金形成金属はLiと第一層成分とを反応結合させる結合層の役割を果たす。この構造体上でリチウムを蒸散させた場合、AgがAg-Liに変換され、少なくともその一部が大量の蒸着リチウム内に拡散する。
【0126】
Ag層形成後、Ag層上に金属リチウムを約5ミクロンの厚さに蒸着して、Li(Ag)/LiPON/OHARA構造の被保護リチウム電極を形成した。被保護リチウム電極の例を図16に示す。OHARAプレート材が水性環境に晒されるように、Oリングを用いて被保護電極を電気化学セルに取り付けた。この例では、水性環境を0.5M HCl + 1.0M LiCl電解質とした。完成したバッテリ回路では、プラチナ対極が水素還元を促進し、Ag/AgCl参照電極がセル内のLiアノードとPtカソードの電位を制御する役割を果たす。測定値を標準水素電極(SHE)電位に換算した。水中のLi/Li+とH2/H+との熱力学的電位差と密接に関係する開路電位(OCP)の測定値は、3.05ボルトであった(図17参照)。水中では金属リチウムが激しく腐食し、その結果、Li電極電位が正方向に大きくシフトするため、通常の条件下では、この開路電位を観測することができない。さらに、酸性の水性環境下において被保護リチウム電極が反応していることを示すような視覚的証拠、例えば、気体発生および/あるいはリチウム溶解などの現象は見られなかった。回路を閉鎖すると、Pt電極側で直ちに水素発生が見られた。これは、セル内で2Li = 2Li+ + 2e-および2H+ + 2e- = H2の電極反応がアノードとカソードで起こっていることを示すものである。アノード側でのリチウム溶解とカソード側での水素発生の電気化学反応をそれぞれ示す時間電位曲線を図17および図18に示す。これらの結果から、リチウム/水電池が大きな腐食電流を与えることなく作動することが実証された。
【0127】
Li(Ag)/LiPON/OHARA電極を4M LiOH電解質を含む水性セルで用いて、同様の実験を行った。このセルでも、リチウムは、熱力学的電位に近い正確なOCP値を示した(図19参照)。このセルでもPtを対極に用いて放電を行ったところ、電池回路を閉じると直ちに水素の発生が見られた。Li/水電池回路に小さな発光ダイオード(LED)を接続すると、回路を閉じると同時にLEDが発光した。この電池は高い可逆サイクル特性を有し(図20参照)、セル充電の間に、水性環境による金属リチウムのメッキ現象が観察された。1.0ないし15 mA/cm2の電流を用いてサイクル実験を行った。図21に示すように、サイクル実験で電流変動を大きくしても、アノード保護膜は崩壊せず、非可逆的なセル挙動の変化は見られなかった。この結果から、高い効率で水性電解質による金属リチウムのメッキが行われることが実証された。
【0128】
実施例2:Li/海水セル
実施例1のセルと同様の方法で、リチウム/海水(塩水)セルを作製した。この実験では、「海水」を電解質として含むセルにLi(Ag)/LiPON/OHARA構造の被保護アノードを用いた。Aquarium Systems社製のInstant Ocean(インスタントオーシャン)35 pptを用いて海水を調製した。用いた海水の伝導度は、4.5 10-2S/cmであった。図22A、図22Bに、それぞれ、放電率0.2 mA/cm2と放電率0.5 mA/cm2の場合の放電曲線(時間電位曲線)を示す。この結果から、作製されたセルが、安定した放電電圧やその他望ましいセル性能を有していることがわかる。未保護のLiアノードを用いて海水中で行われた実験では、Liの利用効率は大変低く、この実施例と同様の低レベルから中程度レベルの電流密度では、海水中のLi腐食率が非常に高い(19 A/cm2以上)ため電池の使用が不可能であった。
【0129】
実施例3:大容量アノードを用いたLi/海水セル
PtワイヤカソードとLi(Ag)/LiPON/ガラスセラミック(株式会社オハラ製)構造の大容量被保護アノードとを備えるリチウム/海水(塩水)セルを作製した。OHARAプレート上のLiPONをAg層で蒸着被覆した後、Ag層に50mmの厚さのLi箔(Cyprus Foote Mineral社)を圧着して、厚い被保護Liアノードを製造した。圧着には、ドライルームに設置されたCarver油圧プレス機を用いた。加圧圧力は800 kg/cm2で加圧時間は10分間とした。Ag層に圧着する直前にTyvek布でLi箔表面を磨いた。Ag層はLi箔と反応して、強い反応性結合を生じた。海水電解質の組成は実施例2と同じとした。
【0130】
図23に放電率が0.3 mA/cm2の場合の放電曲線(時間電位曲線)を示す。セルは長時間放電を続けた。2.0Vの遮断電圧に対する放電容量は、20mmを超えるLi層の厚さに対応する。保護層を破壊することなく、Liアノード/水性電解質の界面をこの量のLiが通過可能である。
【0131】
実施例4:溶解酸化剤として過酸化水素を含む水性電解質と被保護Li電極とを備えるセル
先の実施例で用いたものと同様のLi(Ag)/LiPON/OHARAプレート構造の被保護アノードを用いて、リチウム/過酸化水素セルを作製した。リン酸(H3PO4)の1M水溶液に5重量%の過酸化水素(H2O2)を加えたものを電解質として用いた。セル中の電解質の容積は500mlであった。カーボンファイバー紙(厚さ35mm:Lydall Technical Papers社製, Rochester, NY)の両面を約3mmの厚さのAu層で真空メッキすることにより、過酸化水素還元作用のある金カソードを形成した。
【0132】
図24に放電率が0.3 mA/cm2の場合の放電曲線(時間電位曲線)を示す。セルの開路電位(OCP)値は4.0Vに近く、約3.6Vのレベルでほぼ一定の放電電位を示した。
【0133】
理論的には、酸性媒体中でのLi/H2O2の全セル反応は以下のようになる。
2Li + H2O2 = 2Li+ + 2H2O E0 = 4.82 V (標準的な条件下)
カソード表面で過酸化水素のOCPの実測値は理論値よりも低かったが、これはカソード表面で過酸化水素が水と酸素に分解したことに起因する。カソード表面では、過酸化水素のみならず、分解により生じた酸素も還元され、この結果、OCP値と閉セル電位が減少する。カソード構造の改良とセル内での過酸化水素溶解電解質の流動とにより、総合的なセル特性が著しく向上した。また、実験結果から、被保護Liアノードと水溶性の強酸化剤の使用により、低レベルから中程度レベルの電流密度で非常に高いLi利用効率を持つ高エネルギー電源を作製可能であることがわかる。
【0134】
Li/H2O2セルでH2O2を含む酸性電解質が未保護Liアノードに直接接触すると、Liの腐食が非常に高い割合で起こり、Liの利用効率が下がるため、未保護Liアノードを使用することはできない。
【0135】
実施例5:中性電解質を含むLi/空気セル
プロトン性腐食環境に対して、株式会社オハラから市販されているイオン伝導性ガラスセラミック材を保護膜の外側層(複合体の第二層)として用いて、種々の実験を行った。金属酸化物‐リチウム伝導体は水性環境で安定な一方、金属リチウムに対しては不安定である。OHARAプレート材を金属リチウムから保護するために、LiPON、Cu3N、SnNx、Li3N、Li3P、金属ハロゲン化物等、種々の化合物を用いることができる。この実験では、OHARAプレート材をLiとの反応から守るために、LiPONを用いた。OHARAプレート材は、厚さ0.2から0.3mmの範囲のものを使用した。LiPON被膜は、厚さ0.2ないし0.9ミクロンとし、高周波スパッタリングによりOHARAプレート材上に蒸着させた。
【0136】
熱蒸散したリチウムがLiPON膜と反応しないように、LiPON層上にAgの薄膜をスパッタリングにより蒸着した。Ag膜の厚さは、200ないし1000Åとした。Liの真空蒸着工程では、LiPONが高い反応性を持つ気相Liと反応する可能性がある。Ag、Al、Sn等のLi合金形成金属の薄膜をガラスセラミック表面に真空蒸着することにより、PiPON表面がLiと反応するのを防ぐことができる。この金属層の厚さは、50ないし10000Å、望ましくは100ないし1000Åとする。
【0137】
Ag層形成後、Ag層上に金属リチウムを約5ミクロンの厚さに蒸着して、Li(Ag)/LiPON/OHARA構造の被保護アノードを形成した。OHARAプレート材が水性電解質環境に晒されるように、Oリングを用いて被保護アノードを電気化学セルに取り付けた。
【0138】
被保護アノードを備えるこのLi/空気セルでは、0.5M NH4Cl + 0.5M LiClを電解質として用いた。Zircar Products社のジルコニア布をOHARAプレート材上に載置した後、電解質で満たした。電解質の容積は約0.2mlであった。この実験用Li/空気セルのカソードとして、市販のZn/空気電池用に形成された空気極を用いた。
【0139】
このセルの開路電位は3.25Vであった。図25に放電率が0.3 mA/cm2の場合の放電曲線(時間電位曲線)を示す。セルは、ほぼ1.0時間の間、約3.1Vの放電電圧を示した(約3.0 mAh/cm2)。この結果から、被保護Liアノードと、既存の金属/空気電池で通常用いられるKOHを含まない電解質とを備えるLi/空気セルが高いセル性能を持っていることがわかる。KOHは(亜鉛等の)金属の腐食を遅くする一方で、望ましくない炭化を引き起こすCO2をセル内に導入する。この結果、従来の金属/空気電池では貯蔵寿命が限られていた。一方、実験に用いられている、この実施例のLi/空気セルは、既存の金属/空気電池で通常見られる電解質炭化に伴う悪影響を受けることがない。
【0140】
実施例6:大容量アノードを備えるLi/空気セル
実施例5と同じ空気カソードとLi(Ag)/LiPON/OHARAプレート構造の大容量被保護アノードとを用いて、リチウム/空気セルを作製した。被保護アノードを備えるこのLi/空気セルでは、0.5M LiOHを電解質として用いた。OHARAプレート上のLiPONをAg層で蒸着被覆した後、Ag層に120mmの厚さのLi箔(Cyprus Foote Mineral社)を圧着して、厚い被保護Liアノードを製造した。圧着には、ドライルームに設置されたCarver油圧プレス機を用いた。加圧圧力は800 kg/cm2で加圧時間は10分間とした。Ag層に圧着する直前にTyvek布でLi箔表面を磨いた。Ag層はLi箔と反応して、強い反応性結合を生じた。
【0141】
図26に放電率が0.3 mA/cm2の場合の放電曲線(時間電位曲線)を示す。セルは、2.9Vという高い平均放電電圧で長時間放電を続けた。2.5Vの遮断電圧に対する放電容量は、10 mAh/cm2を超えていた。49mmを超えるLi層の厚さに対応する大量のLiが、保護層を破壊することなく、Liアノード/水性電解質の界面を通過可能である。
【0142】
実施例7:被保護Liアノードを備えるLi/空気セルのサイクリング特性
プロトン性腐食環境に対して、株式会社オハラから市販されているイオン伝導性ガラスセラミック材を保護膜積層複合体の外側層(第二層)として用いて、種々の実験を行った。金属酸化物‐リチウム伝導体は水性環境で安定な一方、金属リチウムに対しては不安定である。OHARAプレート材を金属リチウムから保護するために、LiPON、Cu3N、SnNx、Li3N、Li3P、金属ハロゲン化物等、種々の化合物を用いることができる。この実験では、OHARAプレート材をLiとの反応から守るために、LiPONを用いた。OHARAプレート材は、厚さ0.2から0.3mmの範囲のものを使用した。LiPON被膜は、厚さ0.2ないし0.9ミクロンとし、高周波スパッタリングによりOHARAプレート材上に蒸着させた。
【0143】
熱蒸散したリチウムがLiPON膜と反応しないように、LiPON層上にAgの薄膜をスパッタリングにより蒸着した。Ag膜の厚さは、200ないし1000Åとした。Liの真空蒸着工程では、LiPONが高い反応性を持つ気相Liと反応する可能性がある。Ag、Al、Sn等のLi合金形成金属の薄膜をガラスセラミック表面に真空蒸着することにより、PiPON表面がLiと反応するのを防ぐことができる。この金属層の厚さは、50ないし10000Å、望ましくは100ないし1000Åとする。Liとの反応から第一成分層を保護する機能に加えて、Li合金形成金属層はさらに以下の二つの機能を果たす。第一成分層形成後に、被処理材を真空下から周辺大気あるいはドライルーム大気を通して、Li蒸着のために他の処理室に移す必要がある場合、金属層は、第一層成分が大気中の成分と反応しないように保護する役割を果たす。さらに、Li合金形成金属はLiと第一層成分とを反応結合させる結合層の役割を果たす。この構造体上でリチウムを蒸散させた場合、AgがAg-Liに変換され、少なくともその一部が大量の蒸着リチウム内に拡散する。
【0144】
Ag層形成後、Ag層上に金属リチウムを約5ミクロンの厚さに蒸着して、Li(Ag)/LiPON/OHARA構造の被保護アノードを形成した。OHARAプレート材が水性電解質環境に晒されるように、Oリングを用いて被保護アノードを電気化学セルに取り付けた。
【0145】
被保護アノードを備えるこのLi/空気セルでは、1M LiOHを電解質として用いた。電解質の容積は約0.2mlであった。この実験用Li/空気セルのカソードとして、市販のZn/空気電池用に形成された空気極を用いた。
【0146】
図27に放電/充電率が1.0 mA/cm2の場合の放電/充電時間電位曲線を示す。各サイクルの放電時間と充電時間は、それぞれ3分間とした。この実験に用いた空気極は1度だけの放電用に設計されたものであるが、電極の分極が著しく増加することなく、10サイクルの放電/充電を繰り返すことができた。この結果から、被保護Liアノードを備える本発明のLi/空気セルが可逆的に働くことがわかる。
【0147】
結語
以上、本発明の理解を深める目的で、実施例に基づいて本発明を説明したが、クレームの要旨の範囲内で様々に変更、修正、変形可能である。特に、リチウム金属アノードに主に言及しながら本発明を説明したが、アノードは、ナトリウム等の他のアルカリ金属を初めとするいかなる活性金属で形成されていてもよい。本発明の工程や組成もいかようにも変更可能である。従って、上記の実施例は単に例示に過ぎず、何ら発明を限定するものではなく、本発明はこれらの詳細な説明に幻影されるものではない。
【0148】
また、本明細書で引用した引例はすべて、あらゆる目的で、本発明に参照文献として組み込まれる。
【図面の簡単な説明】
【0149】
【図1】イオン伝導性保護膜を備える本発明の活性金属電池セルを示す概略図である。
【図2A】イオン伝導性保護膜セパレータを示す概略図である。
【図2B】イオン伝導性保護膜セパレータを示す概略図である。
【図3A】積層体構造のイオン伝導性保護膜複合体を備える本発明の活性金属アノード構造を示す概略図である。
【図3B】勾配体構造のイオン伝導性保護膜複合体を備える本発明の活性金属アノード構造を示す概略図である。
【図4A】イオン伝導性保護膜を備える本発明の電気化学装置構造の製造工程を示す概略図である。
【図4B】イオン伝導性保護膜を備える本発明の電気化学装置構造の製造工程を示す概略図である。
【図5】イオン伝導性保護膜を備える本発明の電気化学装置構造の製造工程を示す概略図である。
【図6A】イオン伝導性保護膜を備える本発明の電気化学装置構造の製造工程を示す概略図である。
【図6B】イオン伝導性保護膜を備える本発明の電気化学装置構造の製造工程を示す概略図である。
【図7】本発明の一態様としてリチウム/水電池セルを示す図である。
【図8】本発明の別の態様としてリチウム/空気電池セルを示す図である。
【図9】本発明のさらに別の態様としてリチウム/金属水素化物電池セルを示す図である。
【図10】本発明の一実施例として、リチウム/水電池と燃料電池用の水素発生装置を示す図である。
【図11】本発明の一実施例として、プラズマ溶射や蒸着技法を用いて、薄層リチウム/水あるいはリチウム/空気電池を製造する工程を示す図である。
【図12A】本発明の一実施例として、活性金属水性セルに好適に利用可能な、電子伝導性多孔質支持体に付着される薄ガラス保護膜あるいは薄ガラスセラミック保護膜を製造する工程を示す図である。
【図12B】本発明の一実施例として、活性金属水性セルに好適に利用可能な、電子伝導性多孔質支持体に付着される薄ガラス保護膜あるいは薄ガラスセラミック保護膜を製造する工程を示す図である。
【図12C】本発明の一実施例として、活性金属水性セルに好適に利用可能な、電子伝導性多孔質支持体に付着される薄ガラス保護膜あるいは薄ガラスセラミック保護膜を製造する工程を示す図である。
【図12D】本発明の一実施例として、活性金属水性セルに好適に利用可能な、電子伝導性多孔質支持体に付着される薄ガラス保護膜あるいは薄ガラスセラミック保護膜を製造する工程を示す図である。
【図12E】本発明の一実施例として、活性金属水性セルに好適に利用可能な、電子伝導性多孔質支持体に付着される薄ガラス保護膜あるいは薄ガラスセラミック保護膜を製造する工程を示す図である。
【図13】本発明の一実施例として、弾性シーリング剤を用いて、複数のガラス製、セラミック製、あるいはガラスセラミック製のイオン伝導性保護膜板を接着する工程を示す図である。
【図14】本発明のリチウム/水セルあるいはリチウム/空気セルの管状構造体を示す図である。
【図15】本発明のリチウム/水セルあるいはリチウム/空気セルの毛細管状構造体を示す図である。
【図16】実施例1のセルに用いられる被保護リチウム電極を示す図である。
【図17】本発明に従い製造された、アノード、イオン伝導性保護膜、水性カソードを備える様々なセルの性能を測定したデータを示すグラフである。
【図18】本発明に従い製造された、アノード、イオン伝導性保護膜、水性カソードを備える様々なセルの性能を測定したデータを示すグラフである。
【図19】本発明に従い製造された、アノード、イオン伝導性保護膜、水性カソードを備える様々なセルの性能を測定したデータを示すグラフである。
【図20】本発明に従い製造された、アノード、イオン伝導性保護膜、水性カソードを備える様々なセルの性能を測定したデータを示すグラフである。
【図21】本発明に従い製造された、アノード、イオン伝導性保護膜、水性カソードを備える様々なセルの性能を測定したデータを示すグラフである。
【図22A】本発明に従い製造された、アノード、イオン伝導性保護膜、水性カソードを備える様々なセルの性能を測定したデータを示すグラフである。
【図22B】本発明に従い製造された、アノード、イオン伝導性保護膜、水性カソードを備える様々なセルの性能を測定したデータを示すグラフである。
【図23】本発明に従い製造された、アノード、イオン伝導性保護膜、水性カソードを備える様々なセルの性能を測定したデータを示すグラフである。
【図24】本発明に従い製造された、アノード、イオン伝導性保護膜、水性カソードを備える様々なセルの性能を測定したデータを示すグラフである。
【図25】本発明に従い製造された、アノード、イオン伝導性保護膜、水性カソードを備える様々なセルの性能を測定したデータを示すグラフである。
【図26】本発明に従い製造された、アノード、イオン伝導性保護膜、水性カソードを備える様々なセルの性能を測定したデータを示すグラフである。
【図27】本発明に従い製造された、アノード、イオン伝導性保護膜、水性カソードを備える様々なセルの性能を測定したデータを示すグラフである。
【特許請求の範囲】
【請求項1】
電池セルであって、
第一表面と第二表面とを有する活性金属アノードと、
電子伝導性成分と、イオン伝導性成分と、電気化学的活性成分とを含むカソード構造体であって、少なくとも一つのカソード構造体成分が水性構成成分を含むカソード構造体と、
前記アノードの第一表面上に形成されるイオン伝導性保護膜であって、一または複数の材料から形成され、前記アノードの活性金属に対して化学的適合性を有し、かつ、前記アノードに接する第一表面と、実質的に不浸透性であり、前記カソード構造体に対して化学的適合性を有し、かつ、前記カソード構造体に接する第二表面とを与えるように構成されるイオン伝導性保護膜と、
を備える電池セル。
【請求項2】
請求項1記載のセルにおいて、前記カソード構造体は電気化学的に活性な水性成分を含む、セル。
【請求項3】
請求項2記載のセルにおいて、前記電気化学的に活性な水性成分は水である、セル。
【請求項4】
請求項2記載のセルにおいて、前記電気化学的に活性な水性成分は気体酸化剤、液体酸化剤、固体酸化剤、並びに前記各酸化剤の組み合わせからなる群から選択される水溶性酸化剤を含む、セル。
【請求項5】
請求項4記載のセルにおいて、前記水溶性気体酸化剤はO2、SO2、NO2からなる群から選択され、前記水溶性固体酸化剤はNaNO2、KNO2、Na2SO3、K2SO3からなる群から選択される、セル。
【請求項6】
請求項4記載のセルにおいて、前記水溶性酸化剤は過酸化物である、セル。
【請求項7】
請求項6記載のセルにおいて、前記水溶性酸化剤は過酸化水素である、セル。
【請求項8】
請求項1記載のセルにおいて、前記イオン伝導性成分と前記電気化学的活性成分とは水性電解質から構成される、セル。
【請求項9】
請求項8記載のセルにおいて、前記水性電解質は、強酸溶液、弱酸溶液、塩基性溶液、中性溶液、両性溶液、過酸化物溶液、並びに、前記各溶液の組み合わせからなる群から選択される、セル。
【請求項10】
請求項8記載のセルにおいて、前記水性電解質は、HCl、H2SO4、H3PO4、酢酸/酢酸Li、LiOH、海水、LiCl、LiBr、LiI、NH4Cl、NH4Br、過酸化水素、並びに前記各化合物の組み合わせからなる群から選択される成分を含む、セル。
【請求項11】
請求項10記載のセルにおいて、前記水性電解質は海水である、セル。
【請求項12】
請求項10記載のセルにおいて、前記水性電解質は海水と過酸化水素とを含む、セル。
【請求項13】
請求項9記載のセルにおいて、前記水性電解質は酸性過酸化物溶液を含む、セル。
【請求項14】
請求項9記載のセルにおいて、前記水性電解質に溶解した過酸化水素は前記セル内を流動する、セル。
【請求項15】
請求項2記載のセルにおいて、前記カソード構造体の電子伝導性成分は多孔質触媒支持材である、セル。
【請求項16】
請求項15記載のセルにおいて、前記多孔質電子伝導性触媒支持材は補強される、セル。
【請求項17】
請求項15記載のセルにおいて、前記多孔質電子伝導性触媒支持材はニッケルを含む、セル。
【請求項18】
請求項15記載のセルにおいて、前記多孔質電子伝導性触媒支持材は減水触媒を浸み込ませた不活性材料を含む、セル。
【請求項19】
請求項15記載のセルにおいて、前記多孔質電子伝導性触媒支持材はアイオノマーで処理される、セル。
【請求項20】
請求項2記載のセルにおいて、前記セルは少なくとも2V のオープンセル電圧を有する、セル。
【請求項21】
請求項12記載のセルにおいて、前記セルは少なくとも3.5Vのフラット放電電位を有する、セル。
【請求項22】
請求項14記載のセルはさらに、前記保護膜と前記カソード構造体との間に配置されるセパレータを備える、セル。
【請求項23】
請求項1記載のセルはさらに、電池セル酸化還元反応において前記カソード構造体から放出される水素を集めるPEM H2/O2燃料電池を備える、セル。
【請求項24】
請求項1記載のセルにおいて、前記カソード構造体の電気化学的活性成分は空気を含む、セル。
【請求項25】
請求項24記載のセルにおいて、前記空気は水分を含む、セル。
【請求項26】
請求項25記載のセルにおいて、前記イオン伝導性成分が水性構成成分を含む、セル。
【請求項27】
請求項26記載のセルにおいて、前記イオン伝導性成分はさらにアイオノマーを含む、セル。
【請求項28】
請求項26記載のセルにおいて、前記イオン伝導性成分は中性あるいは酸性の水性電解質を含む、セル。
【請求項29】
請求項28記載のセルにおいて、前記水性電解質はLiClを含む、セル。
【請求項30】
請求項28記載のセルにおいて、前記水性電解質はNH4ClおよびHClのいずれか一つを含む、セル。
【請求項31】
請求項24記載のセルにおいて、前記カソード構造体は空気拡散膜と、疎水性ポリマー層と、酸素還元触媒と、電解質と、電子伝導性成分/電流集電層とを備える、セル。
【請求項32】
請求項24記載のセルにおいて、前記電子伝導性成分/電流集電層は多孔質ニッケル材料を含む、セル。
【請求項33】
請求項24記載のセルにおいて、前記セルは少なくとも3V のオープンセル電圧を有する、セル。
【請求項34】
請求項24記載のセルにおいて、前記セルは少なくとも25時間、放電率0.3mA/cm2で約2.9Vのフラット放電電位を有する、セル。
【請求項35】
請求項24記載のセルにおいて、前記セルが少なくとも10mAh/cm2の放電能力を有する、セル。
【請求項36】
請求項32記載のセルはさらに、前記保護膜と前記カソード構造体との間に配置されるセパレータを備える、セル。
【請求項37】
請求項1記載のセルにおいて、前記カソード構造体の電気化学的活性成分は金属水素化物合金を含む、セル。
【請求項38】
請求項37記載のセルにおいて、前記カソード構造体のイオン伝導性成分は水性電解質を含む、セル。
【請求項39】
請求項38記載のセルにおいて、前記水性電解質は酸性である、セル。
【請求項40】
請求項39記載のセルにおいて、前記水性電解質はハロゲン化物酸あるいはハロゲン化物酸塩である、セル。
【請求項41】
請求項40記載のセルにおいて、前記水性電解質は塩化物酸、臭化物酸、塩化物酸塩、あるいは臭化物酸塩を含む、セル。
【請求項42】
請求項41記載のセルにおいて、前記水性電解質はHCl、HBr、NH4Cl、NH4Brのいずれか一つを含む。
【請求項43】
請求項37記載のセルでにおいて、前記金属水素化物合金はAB5合金およびAB2合金のいずれかを含む、セル。
【請求項44】
前記いずれかの請求項記載のセルにおいて、活性金属はリチウムである、セル。
【請求項45】
請求項44記載のセルにおいて、前記カソード構造体は水性電気化学的活性成分を含む、セル。
【請求項46】
請求項44記載のセルにおいて、前記カソード構造体の電気化学的活性成分は空気を含む、セル。
【請求項47】
請求項44記載のセルにおいて、前記カソード構造体の電気化学的活性成分は金属水素化物合金を含む、セル。
【請求項48】
前記いずれかの請求項記載のセルにおいて、前記保護膜のイオン伝導度は少なくとも10-7S/cmである、セル。
【請求項49】
前記いずれかの請求項記載のセルであって、前記保護膜のイオン伝導度は少なくとも10-5S/cmである、セル。
【請求項50】
前記いずれかの請求項記載のセルにおいて、前記イオン伝導性保護膜は複合体から構成され、前記複合体は、
前記アノードと接し、イオン伝導性を有すると共に前記アノードの活性金属に対する化学的適合性を有する第一材料成分と、
前記第一材料成分と接し、実質的に不浸透性であり、イオン伝導性を有すると共に前記第一材料成分と前記カソード構造体に対する化学的適合性を有する第二材料成分とを備える、セル。
【請求項51】
請求項50記載のセルにおいて、前記保護膜の複合体は積層体である、セル。
【請求項52】
請求項50記載のセルにおいて、前記保護膜の複合体は勾配体である、セル。
【請求項53】
請求項50記載のセルにおいて、前記陰極の活性金属はリチウムあるいはリチウム合金である、セル。
【請求項54】
請求項50記載のセルにおいて、前記第一材料成分は活性金属窒化物、活性金属リン化物、活性金属ハロゲン化物、活性金属リン酸窒化物ガラスからなる群から選択される材料を含む、セル。
【請求項55】
請求項50記載のセルにおいて、前記第一材料成分はLi3N、Li3P、LiI、LiBr、LiCl、LiF、LiPONからなる群から選択される材料を含む、セル。
【請求項56】
請求項50記載のセルにおいて、前記第二材料成分あガラス質あるいは非晶質金属イオン伝導体、セラミック活性金属イオン伝導体、ガラス−セラミック活性金属イオン伝導体からなる群から選択される材料を含む、セル。
【請求項57】
請求項50記載のセルにおいて、前記第二材料成分は以下の組成のガラス−セラミックイオン伝導体であり、Li1+x(M,Al,Ga)x(Ge1-yTiy)2-x(PO4)3(ここで、X≦0.8と0≦Y≦1.0とを満たし、MがNd、Sm、Eu、Gd、Tb、Dy、Ho、Er、Tm、Ybからなる群から選択される元素)および/あるいはLi1+x+yQxTi2-xSiyP3-yO12(ここで0<X≦0.4 と0<Y≦0.6とを満たし、QがAlあるいはGaである)からなる主要結晶質相を含む、セル。
組成 mol%
P2O5 26-55%
SiO2 0-15%
GeO2+TiO2 25-50%
内 GeO2 0-50%
TiO2 0-50%
ZrO2 0-10%
M2O3 0<10%
Al2O3 0-15%
Ga2O3 0-15%
Li2O 3-25%
【請求項58】
前記いずれかの請求項に記載のセルであって、前記セルが一次電池である、セル。
【請求項59】
前記いずれかの請求項に記載のセルであって、前記セルが充電式電池である、セル。
【請求項60】
前記いずれかの請求項に記載のセルであって、前記セルが平面構造を有する、セル。
【請求項61】
請求項60記載のセルにおいて、前記セルは弾性シーリング材により同様のセルの任意の配列に接合される、セル。
【請求項62】
請求項1から請求項59のいずれかに記載のセルにおいて、前記セルが管状構造を有する、セル。
【請求項63】
請求項1から請求項59のいずれかに記載のセルにおいて、前記セルが毛細管状構造を有する、セル。
【請求項64】
請求項1記載のセルにおいて、前記活性金属はリチウムであり、前記カソード構造体はイオン伝導性を有する水性成分と電気化学的活性を有する遷移金属酸化物成分とを含む、セル。
【請求項65】
請求項64記載のセルにおいて、前記遷移金属酸化物はNiOOH、AgO、鉄酸化物、鉛酸化物、マンガン酸化物からなる群から選択される、セル。
【請求項66】
請求項50記載のセルにおいて、前記第二材料成分は以下の組成のセラミックイオン伝導体であり、Li1+x(M,Al,Ga)x(Ge1-yTiy)2-x(PO4)3(ここで、X≦0.8と0≦Y≦1.0とを満たし、MがNd、Sm、Eu、Gd、Tb、Dy、Ho、Er、Tm、Ybからなる群から選択される元素)および/あるいはLi1+x+yQxTi2-xSiyP3-yO12(ここで0<X≦0.4 と0<Y≦0.6とを満たし、QがAlあるいはGaである)からなる主要結晶質相を含む、セル。
組成 mol%
P2O5 26-55%
SiO2 0-15%
GeO2+TiO2 25-50%
内 GeO2 0-50%
TiO2 0-50%
ZrO2 0-10%
M2O3 0<10%
Al2O3 0-15%
Ga2O3 0-15%
Li2O 3-25%
【請求項67】
電気化学セルであって、
第一表面と第二表面とを有する活性金属アノードと、
多孔質の電子伝導性触媒支持体と、
前記アノードの第一表面上に形成されるイオン伝導性保護膜であって、前記アノードの活性金属に対して化学的適合性を有する第一表面と、実質的に不浸透性であり、前記電子伝導性触媒支持体に対して化学的適合性を有する第二表面と、水性環境とを与えるように構成される一ないし複数の材料を含むイオン伝導性保護膜と、
を備える電気化学セル。
【請求項68】
電気化学セル構造の製造方法であり、
活性金属アノードと、電子伝導性成分とを含むカソード構造体とを組み立てる工程を備え、
前記活性金属アノードと前記カソード構造体との間に保護膜を配置し、前記保護膜は、イオン伝導性を有すると共に活性金属に対して化学的適合性を有する第一表面と、実施的に不浸透性であり、イオン伝導性を有すると共に前記カソード構造体に対して化学的適合性を有する第二表面とを有し、
活性金属材料を前記保護膜の第一表面に塗布することにより、前記活性金属アノードを形成する、製造方法。
【請求項69】
請求項68記載の製造方法において、前記カソード構造体の電子伝導性成分は多孔質ニッケル板である、製造方法。
【請求項70】
請求項68または請求項69に記載の製造方法において、前記カソード構造体は、さらに、イオン伝導性成分と、電気化学的活性成分とを備え、少なくとも一つのカソード構造体成分は水性構成成分であり、前記電気化学セル構造は電池セルである、製造方法。
【請求項1】
電池セルであって、
第一表面と第二表面とを有する活性金属アノードと、
電子伝導性成分と、イオン伝導性成分と、電気化学的活性成分とを含むカソード構造体であって、少なくとも一つのカソード構造体成分が水性構成成分を含むカソード構造体と、
前記アノードの第一表面上に形成されるイオン伝導性保護膜であって、一または複数の材料から形成され、前記アノードの活性金属に対して化学的適合性を有し、かつ、前記アノードに接する第一表面と、実質的に不浸透性であり、前記カソード構造体に対して化学的適合性を有し、かつ、前記カソード構造体に接する第二表面とを与えるように構成されるイオン伝導性保護膜と、
を備える電池セル。
【請求項2】
請求項1記載のセルにおいて、前記カソード構造体は電気化学的に活性な水性成分を含む、セル。
【請求項3】
請求項2記載のセルにおいて、前記電気化学的に活性な水性成分は水である、セル。
【請求項4】
請求項2記載のセルにおいて、前記電気化学的に活性な水性成分は気体酸化剤、液体酸化剤、固体酸化剤、並びに前記各酸化剤の組み合わせからなる群から選択される水溶性酸化剤を含む、セル。
【請求項5】
請求項4記載のセルにおいて、前記水溶性気体酸化剤はO2、SO2、NO2からなる群から選択され、前記水溶性固体酸化剤はNaNO2、KNO2、Na2SO3、K2SO3からなる群から選択される、セル。
【請求項6】
請求項4記載のセルにおいて、前記水溶性酸化剤は過酸化物である、セル。
【請求項7】
請求項6記載のセルにおいて、前記水溶性酸化剤は過酸化水素である、セル。
【請求項8】
請求項1記載のセルにおいて、前記イオン伝導性成分と前記電気化学的活性成分とは水性電解質から構成される、セル。
【請求項9】
請求項8記載のセルにおいて、前記水性電解質は、強酸溶液、弱酸溶液、塩基性溶液、中性溶液、両性溶液、過酸化物溶液、並びに、前記各溶液の組み合わせからなる群から選択される、セル。
【請求項10】
請求項8記載のセルにおいて、前記水性電解質は、HCl、H2SO4、H3PO4、酢酸/酢酸Li、LiOH、海水、LiCl、LiBr、LiI、NH4Cl、NH4Br、過酸化水素、並びに前記各化合物の組み合わせからなる群から選択される成分を含む、セル。
【請求項11】
請求項10記載のセルにおいて、前記水性電解質は海水である、セル。
【請求項12】
請求項10記載のセルにおいて、前記水性電解質は海水と過酸化水素とを含む、セル。
【請求項13】
請求項9記載のセルにおいて、前記水性電解質は酸性過酸化物溶液を含む、セル。
【請求項14】
請求項9記載のセルにおいて、前記水性電解質に溶解した過酸化水素は前記セル内を流動する、セル。
【請求項15】
請求項2記載のセルにおいて、前記カソード構造体の電子伝導性成分は多孔質触媒支持材である、セル。
【請求項16】
請求項15記載のセルにおいて、前記多孔質電子伝導性触媒支持材は補強される、セル。
【請求項17】
請求項15記載のセルにおいて、前記多孔質電子伝導性触媒支持材はニッケルを含む、セル。
【請求項18】
請求項15記載のセルにおいて、前記多孔質電子伝導性触媒支持材は減水触媒を浸み込ませた不活性材料を含む、セル。
【請求項19】
請求項15記載のセルにおいて、前記多孔質電子伝導性触媒支持材はアイオノマーで処理される、セル。
【請求項20】
請求項2記載のセルにおいて、前記セルは少なくとも2V のオープンセル電圧を有する、セル。
【請求項21】
請求項12記載のセルにおいて、前記セルは少なくとも3.5Vのフラット放電電位を有する、セル。
【請求項22】
請求項14記載のセルはさらに、前記保護膜と前記カソード構造体との間に配置されるセパレータを備える、セル。
【請求項23】
請求項1記載のセルはさらに、電池セル酸化還元反応において前記カソード構造体から放出される水素を集めるPEM H2/O2燃料電池を備える、セル。
【請求項24】
請求項1記載のセルにおいて、前記カソード構造体の電気化学的活性成分は空気を含む、セル。
【請求項25】
請求項24記載のセルにおいて、前記空気は水分を含む、セル。
【請求項26】
請求項25記載のセルにおいて、前記イオン伝導性成分が水性構成成分を含む、セル。
【請求項27】
請求項26記載のセルにおいて、前記イオン伝導性成分はさらにアイオノマーを含む、セル。
【請求項28】
請求項26記載のセルにおいて、前記イオン伝導性成分は中性あるいは酸性の水性電解質を含む、セル。
【請求項29】
請求項28記載のセルにおいて、前記水性電解質はLiClを含む、セル。
【請求項30】
請求項28記載のセルにおいて、前記水性電解質はNH4ClおよびHClのいずれか一つを含む、セル。
【請求項31】
請求項24記載のセルにおいて、前記カソード構造体は空気拡散膜と、疎水性ポリマー層と、酸素還元触媒と、電解質と、電子伝導性成分/電流集電層とを備える、セル。
【請求項32】
請求項24記載のセルにおいて、前記電子伝導性成分/電流集電層は多孔質ニッケル材料を含む、セル。
【請求項33】
請求項24記載のセルにおいて、前記セルは少なくとも3V のオープンセル電圧を有する、セル。
【請求項34】
請求項24記載のセルにおいて、前記セルは少なくとも25時間、放電率0.3mA/cm2で約2.9Vのフラット放電電位を有する、セル。
【請求項35】
請求項24記載のセルにおいて、前記セルが少なくとも10mAh/cm2の放電能力を有する、セル。
【請求項36】
請求項32記載のセルはさらに、前記保護膜と前記カソード構造体との間に配置されるセパレータを備える、セル。
【請求項37】
請求項1記載のセルにおいて、前記カソード構造体の電気化学的活性成分は金属水素化物合金を含む、セル。
【請求項38】
請求項37記載のセルにおいて、前記カソード構造体のイオン伝導性成分は水性電解質を含む、セル。
【請求項39】
請求項38記載のセルにおいて、前記水性電解質は酸性である、セル。
【請求項40】
請求項39記載のセルにおいて、前記水性電解質はハロゲン化物酸あるいはハロゲン化物酸塩である、セル。
【請求項41】
請求項40記載のセルにおいて、前記水性電解質は塩化物酸、臭化物酸、塩化物酸塩、あるいは臭化物酸塩を含む、セル。
【請求項42】
請求項41記載のセルにおいて、前記水性電解質はHCl、HBr、NH4Cl、NH4Brのいずれか一つを含む。
【請求項43】
請求項37記載のセルでにおいて、前記金属水素化物合金はAB5合金およびAB2合金のいずれかを含む、セル。
【請求項44】
前記いずれかの請求項記載のセルにおいて、活性金属はリチウムである、セル。
【請求項45】
請求項44記載のセルにおいて、前記カソード構造体は水性電気化学的活性成分を含む、セル。
【請求項46】
請求項44記載のセルにおいて、前記カソード構造体の電気化学的活性成分は空気を含む、セル。
【請求項47】
請求項44記載のセルにおいて、前記カソード構造体の電気化学的活性成分は金属水素化物合金を含む、セル。
【請求項48】
前記いずれかの請求項記載のセルにおいて、前記保護膜のイオン伝導度は少なくとも10-7S/cmである、セル。
【請求項49】
前記いずれかの請求項記載のセルであって、前記保護膜のイオン伝導度は少なくとも10-5S/cmである、セル。
【請求項50】
前記いずれかの請求項記載のセルにおいて、前記イオン伝導性保護膜は複合体から構成され、前記複合体は、
前記アノードと接し、イオン伝導性を有すると共に前記アノードの活性金属に対する化学的適合性を有する第一材料成分と、
前記第一材料成分と接し、実質的に不浸透性であり、イオン伝導性を有すると共に前記第一材料成分と前記カソード構造体に対する化学的適合性を有する第二材料成分とを備える、セル。
【請求項51】
請求項50記載のセルにおいて、前記保護膜の複合体は積層体である、セル。
【請求項52】
請求項50記載のセルにおいて、前記保護膜の複合体は勾配体である、セル。
【請求項53】
請求項50記載のセルにおいて、前記陰極の活性金属はリチウムあるいはリチウム合金である、セル。
【請求項54】
請求項50記載のセルにおいて、前記第一材料成分は活性金属窒化物、活性金属リン化物、活性金属ハロゲン化物、活性金属リン酸窒化物ガラスからなる群から選択される材料を含む、セル。
【請求項55】
請求項50記載のセルにおいて、前記第一材料成分はLi3N、Li3P、LiI、LiBr、LiCl、LiF、LiPONからなる群から選択される材料を含む、セル。
【請求項56】
請求項50記載のセルにおいて、前記第二材料成分あガラス質あるいは非晶質金属イオン伝導体、セラミック活性金属イオン伝導体、ガラス−セラミック活性金属イオン伝導体からなる群から選択される材料を含む、セル。
【請求項57】
請求項50記載のセルにおいて、前記第二材料成分は以下の組成のガラス−セラミックイオン伝導体であり、Li1+x(M,Al,Ga)x(Ge1-yTiy)2-x(PO4)3(ここで、X≦0.8と0≦Y≦1.0とを満たし、MがNd、Sm、Eu、Gd、Tb、Dy、Ho、Er、Tm、Ybからなる群から選択される元素)および/あるいはLi1+x+yQxTi2-xSiyP3-yO12(ここで0<X≦0.4 と0<Y≦0.6とを満たし、QがAlあるいはGaである)からなる主要結晶質相を含む、セル。
組成 mol%
P2O5 26-55%
SiO2 0-15%
GeO2+TiO2 25-50%
内 GeO2 0-50%
TiO2 0-50%
ZrO2 0-10%
M2O3 0<10%
Al2O3 0-15%
Ga2O3 0-15%
Li2O 3-25%
【請求項58】
前記いずれかの請求項に記載のセルであって、前記セルが一次電池である、セル。
【請求項59】
前記いずれかの請求項に記載のセルであって、前記セルが充電式電池である、セル。
【請求項60】
前記いずれかの請求項に記載のセルであって、前記セルが平面構造を有する、セル。
【請求項61】
請求項60記載のセルにおいて、前記セルは弾性シーリング材により同様のセルの任意の配列に接合される、セル。
【請求項62】
請求項1から請求項59のいずれかに記載のセルにおいて、前記セルが管状構造を有する、セル。
【請求項63】
請求項1から請求項59のいずれかに記載のセルにおいて、前記セルが毛細管状構造を有する、セル。
【請求項64】
請求項1記載のセルにおいて、前記活性金属はリチウムであり、前記カソード構造体はイオン伝導性を有する水性成分と電気化学的活性を有する遷移金属酸化物成分とを含む、セル。
【請求項65】
請求項64記載のセルにおいて、前記遷移金属酸化物はNiOOH、AgO、鉄酸化物、鉛酸化物、マンガン酸化物からなる群から選択される、セル。
【請求項66】
請求項50記載のセルにおいて、前記第二材料成分は以下の組成のセラミックイオン伝導体であり、Li1+x(M,Al,Ga)x(Ge1-yTiy)2-x(PO4)3(ここで、X≦0.8と0≦Y≦1.0とを満たし、MがNd、Sm、Eu、Gd、Tb、Dy、Ho、Er、Tm、Ybからなる群から選択される元素)および/あるいはLi1+x+yQxTi2-xSiyP3-yO12(ここで0<X≦0.4 と0<Y≦0.6とを満たし、QがAlあるいはGaである)からなる主要結晶質相を含む、セル。
組成 mol%
P2O5 26-55%
SiO2 0-15%
GeO2+TiO2 25-50%
内 GeO2 0-50%
TiO2 0-50%
ZrO2 0-10%
M2O3 0<10%
Al2O3 0-15%
Ga2O3 0-15%
Li2O 3-25%
【請求項67】
電気化学セルであって、
第一表面と第二表面とを有する活性金属アノードと、
多孔質の電子伝導性触媒支持体と、
前記アノードの第一表面上に形成されるイオン伝導性保護膜であって、前記アノードの活性金属に対して化学的適合性を有する第一表面と、実質的に不浸透性であり、前記電子伝導性触媒支持体に対して化学的適合性を有する第二表面と、水性環境とを与えるように構成される一ないし複数の材料を含むイオン伝導性保護膜と、
を備える電気化学セル。
【請求項68】
電気化学セル構造の製造方法であり、
活性金属アノードと、電子伝導性成分とを含むカソード構造体とを組み立てる工程を備え、
前記活性金属アノードと前記カソード構造体との間に保護膜を配置し、前記保護膜は、イオン伝導性を有すると共に活性金属に対して化学的適合性を有する第一表面と、実施的に不浸透性であり、イオン伝導性を有すると共に前記カソード構造体に対して化学的適合性を有する第二表面とを有し、
活性金属材料を前記保護膜の第一表面に塗布することにより、前記活性金属アノードを形成する、製造方法。
【請求項69】
請求項68記載の製造方法において、前記カソード構造体の電子伝導性成分は多孔質ニッケル板である、製造方法。
【請求項70】
請求項68または請求項69に記載の製造方法において、前記カソード構造体は、さらに、イオン伝導性成分と、電気化学的活性成分とを備え、少なくとも一つのカソード構造体成分は水性構成成分であり、前記電気化学セル構造は電池セルである、製造方法。
【図1】


【図2A】


【図2B】


【図3A】


【図3B】


【図4A】


【図4B】


【図5】


【図6A】


【図6B】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12A】


【図12B】


【図12C】


【図12D】


【図12E】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22A】


【図22B】


【図23】


【図24】


【図25】


【図26】


【図27】




【図2A】


【図2B】


【図3A】


【図3B】


【図4A】


【図4B】


【図5】


【図6A】


【図6B】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12A】


【図12B】


【図12C】


【図12D】


【図12E】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22A】


【図22B】


【図23】


【図24】


【図25】


【図26】


【図27】


【公表番号】特表2007−513464(P2007−513464A)
【公表日】平成19年5月24日(2007.5.24)
【国際特許分類】
【出願番号】特願2006−535572(P2006−535572)
【出願日】平成16年10月8日(2004.10.8)
【国際出願番号】PCT/US2004/033424
【国際公開番号】WO2005/038953
【国際公開日】平成17年4月28日(2005.4.28)
【公序良俗違反の表示】
(特許庁注:以下のものは登録商標)
1.テフロン
【出願人】(500163551)ポリプラス バッテリー カンパニー (5)
【氏名又は名称原語表記】PolyPlus Battery Company
【Fターム(参考)】
【公表日】平成19年5月24日(2007.5.24)
【国際特許分類】
【出願日】平成16年10月8日(2004.10.8)
【国際出願番号】PCT/US2004/033424
【国際公開番号】WO2005/038953
【国際公開日】平成17年4月28日(2005.4.28)
【公序良俗違反の表示】
(特許庁注:以下のものは登録商標)
1.テフロン
【出願人】(500163551)ポリプラス バッテリー カンパニー (5)
【氏名又は名称原語表記】PolyPlus Battery Company
【Fターム(参考)】
[ Back to top ]

