水溶性テトラゾリウム塩
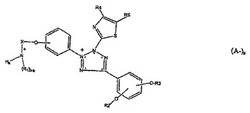
水溶液中への溶解度が上昇したチアゾリルテトラゾリウム塩は、アルキルアンモニウムアルコキシ置換基、好ましくはトリメチルアンモニウムプロポキシ基置換基、を、テトラゾリウム環に結合したフェニル環上に有する。水溶液中への溶解度が上昇したチアゾリルテトラゾリウム塩は、アルキルアンモニウムアルコキシ置換基、好ましくはトリメチルアンモニウムプロポキシ基置換基、を、たとえば、以下の式(A-)aに示される一般式の化合物であるテトラゾリウム環に結合したフェニル環上に有する。
【発明の詳細な説明】
【発明の詳細な説明】
【0001】
発明の属する分野
[0001] 本発明は、医学目的のための生物学的サンプルの解析に関する。
【0002】
発明の背景
[0002] 生物学的サンプルの解析は、しばしば、色がサンプル中の分析物の量に比例して発色される方法に関する。たとえば、酵素を使用して、目的とする分析物を酸化し、そして反応の程度が、指示薬化合物の色の変化により示される。本明細書中で特に興味深いことは、指示薬として使用されるテトラゾリウム塩のファミリーである。そのような塩は、還元されて、基質を還元することによりホルマザン色素となる。分析物を測定するため、酵素(たとえば、NAD-依存性デヒドロゲナーゼ酵素)が分析物を酸化して、還元型(たとえば、NADH)を形成し、それがテトラゾリウム塩と反応して、発色ホルマザンを生成する。メディエータは、反応を促進するために必要とされる可能性がある。分析物反応により生成されるNADHの量が生成されるホルマザンの量に比例するため、分析物の量を形成された色により間接的に測定することができる。
【0003】
[0003] テトラゾリウム塩は、様々な用途において使用されてきた。しかしながら、特に、それらは、様々な生体液(たとえば血液、尿、血漿、および血清)中の分析物を測定するための医学分野において使用された。これらの指示薬はしばしば、液体サンプルと接触させる場合に、目的とする分析物と反応し、そして存在する分析物の量を示す色を呈示する、試験ストリップ上に配置された試薬システムにより使用される。いくつかの事例においては、色の変化をカラーチャートを参照することにより視覚的に読みとることができるが、より正確な読みとり値は、分光光度法の目的のために設計された装置により、分光光度的に行うことができる。典型的には、光が試験ストリップに対して向けられ、そして反射光を測定して、ストリップ上の色の変化の効果を決定する。
【0004】
[0004] テトラゾリウム塩は、サンプル中の基質(たとえば、全血中のヘモグロビン)による干渉を回避する波長で、光を吸収するホルマザンを生成しなければならない。結果的に、光源として使用されるLEDにより生成される光などの約640 nmの波長を有する光を吸収するホルマザンを生成する、チアゾリルテトラゾリウム塩のファミリーが開発された。LEDは、わずか±約5 nmしか変化しない狭い範囲の波長を生成する。そのようなチアゾリルテトラゾリウム塩は、たとえば、U.S.特許番号5,126,275;5,322,680;5,300,637;および5,290,536などの、いくつかのU.S.特許に開示される。
【0005】
[0005] ほとんどの生物学的サンプルは、天然で水溶性であり、そのため、指示薬がサンプル中に可溶性であることが望ましい。しかしながら、テトラゾリウム塩の多くは、それほど可溶性ではない。テトラゾリウム塩のある供給業者の一つであるDojindo Laboratoriesは、指示薬分子に対してスルホン酸基を付加することにより、より可溶性にした指示薬の製品ラインを持っている。U.S.特許番号6,063,587および日本公開特許公報JP58113181 A2およびJP58113182 A2を参照。そのテトラゾリウム塩指示薬のWSTシリーズはしばしば、解析的方法を開示する特許において言及される。一例は、U.S.特許番号6,586,199に見いだされる。WSTシリーズのテトラゾリウム塩の可溶性は、約10 mg/水mLと報告されている。可溶性はまた、U.S.特許5, 250,695に開示されるテトラゾリウム塩の特定のスルホネートおよびホスホネート対イオンを使用すると、上昇させることができる。
【0006】
[0006] テトラゾリウム塩指示薬を開示するその他の特許には、EP0476455 B1;US 2004/0132004 A1;WO 98/37157;U.S.特許6,183,878 B1;U.S.特許6,207,292 B1;U.S. 特許6,277,307 B1;DE 21 47 466;U.S. 特許5,185,450;U.S. 特許5,196,314;が含まれる。
【0007】
[0007] 本発明の発明者らは、LEDによりもたらされる入射光に反応して、600〜640 nmの範囲で、そのホルマザンからから相対的に平坦なスペクトル感度を提供する能力を有したまま、チアゾリルテトラゾリウム塩の可溶性を向上させようとした。以下の本発明の記載にも示される様に、彼らは、所望のスペクトル感度を維持しながら、より高い可溶性を有するチアゾリルテトラゾリウム塩を提供することに成功した。
【0008】
発明の概要
[0008] 本発明には、新規チアゾリルテトラゾリウム塩が含まれる。いくつかは、特許にかかる関連するチアゾリルテトラゾリウム塩よりも、より高い水溶性を有していることが乱された。可溶性を向上させることは、生物学的サンプル中の分析物(たとえば、血液サンプル中のグルコース)を測定するために使用される試験ストリップに対して、それらをより容易に適応させる。テトラゾリウム塩は、可溶性を高めるアルキルアンモニウムアルコキシ置換基を有することにより特徴づけられる。一態様に従って、テトラゾリウム塩は、以下の式により定義される:
【0009】
【化1】

【0010】
式中:
A=対イオン
X=1〜6 Cアルキルまたはヘテロアルキル
a=1〜3
b=0〜3
R1=1〜6 Cアルキル
R2およびR3の一方がアルキルであり、そして他方がXN+Hb(R1)3-bであるか、R2およびR3がメチレンジオキシ基を形成し、
R4またはR5の一方がハロゲンであり、そして他方がハロゲン置換1〜6 Cアルキルであるか、R4およびR5の一方または両方がXN+Hb(R1)3-bであるか、または
R4およびR5は一緒になって、芳香環またはヘテロ芳香環、または置換芳香環または置換ヘテロ芳香環を形成する。
【0011】
[0009] 上記に示した式は、新規のチアゾリルテトラゾリウム塩を示す。すなわち、それらは、2窒素位でテトラゾリウム環に結合するチアゾール環を含有する。さらに、それらのそれぞれは、3窒素位で結合するフェニル環を有し、そしてテトラゾリウム環の5位で結合される別のフェニル環を有する。本明細書中においてHTC-045と表記される特許にかかるチアゾリルテトラゾリウム塩と比較して高い可溶性が、1またはそれ以上のアルキルアンモニウムアルコキシ基をチアゾリルテトラゾリウム塩に結合させることにより達成される。アルキルアンモニウムアルコキシ基は、R4および/またはR5としてのチアゾリル環に対して結合してもよく、またはR4およびR5により形成される芳香環またはヘテロ芳香環上で置換されてもよい。好ましい態様において、アルキルアンモニウムアルコキシ基は、テトラゾリウム環に対して結合したフェニル環上の置換基である。より好ましい態様において、アルキルアンモニウムアルコキシ基は、トリアルキルアンモニウムプロポキシである、ベンゾチアゾリルテトラゾリウム塩は、高い溶解度を有する好ましい化合物である。
【0012】
[00010] 本発明の別の側面において、チアゾリルテトラゾリウム塩を、発色指示薬として使用して、酵素を使用して分析物を酸化する生物学的サンプルの解析において、たとえば血液のグルコース含量の測定において、還元性基質(たとえば、NADH)の存在を検出する。
【0013】
好ましい態様の記載
定義
以下の定義は、本発明のチアゾリルテトラゾリウム塩の置換基に対して適用される。
“1〜6 C” - 1〜6個の炭素原子を有する基を意味する。
“アルキル” - 一般式がCnH2n+1である直鎖または分岐鎖炭化水素基を意味する。
“ヘテロアルキル” - 隣接する炭素原子に結合するヘテロ原子を含有する、直鎖および分岐鎖炭化水素基を意味する。
“アルコキシ” - 基-OR〔式中、Rはアルキルである〕を意味する。
“メチレンジオキシ” - 式-O-CH2-O-の二価の基を意味する。
“ハロゲン” - フッ素、塩素、ヨウ素、および臭素を意味する。
【0014】
“ハロゲン置換1〜6 Cアルキル” - 一般式CnH2n-1Y2〔式中Yはハロゲンである〕を有する、直鎖または分岐鎖の基を意味する。
“芳香環” - ベンゼン環またはナフタレン環を意味する。
“ヘテロ芳香環” - ピリジン環またはキノリン環を意味する。
“対イオン” - テトラゾリウム塩(たとえば、ニトレート、ホスフェート、ハイドロゲン・ホスフェート、ダイハイドロゲン・ホスフェート、ハイドロゲン・サルフェート、サルフェート、ハイドロゲン・カーボネート、カーボネート、メタンスルホネート、フルオロホウ酸、臭化物、塩化物、ヨウ化物、またはこれらの組み合わせ)を調製する際に使用される試薬に由来するイオン基を意味する。
“tet塩” - テトラゾリウム塩の略語を意味する。
【0015】
チアゾリルテトラゾリウム塩
[00016] U.S.特許5,126,275中に開示されるように、チアゾリルテトラゾリウム塩由来のホルマザンは、約600〜650 nmより高い広範囲のプラトーを示す反射スペクトルを有することにより特徴づけられ、それはLEDを光源として使用する装置において有用である。サンプルを、サンプル中に存在する分析物の量を示す色を生成する反応システムと接触させる。被検領域から戻ってくるを検出し、そして光分析物含量と相関させた。一つの重要な例において、NADの存在下におけるグルコースデヒドロゲナーゼは、血液サンプル中のグルコースの酸化を触媒する。還元されたNADHは、テトラゾリウム塩のホルマザンへの還元を触媒する、ジアホラーゼなどの酵素メディエータにより、再酸化される。生成される色の変化は、グルコースの酸化から生成されるNADHの量に対して比例し、そしてサンプル中に存在するグルコースの量に間接的に比例する。チアゾリルテトラゾリウム塩から発色ホルマザンへの変換に由来する色の変化は、それを光源に対して暴露することにより測定することができる。発色試験領域から戻ってくる光が検出され、そして適切なアルゴリズムにより、サンプル中の分析物の量に変換される。NAD-NADHに関してここで記載されたが、本発明のテトラゾリウム塩は、その他の補因子(たとえば、PQQおよびFAD)を有するデヒドロゲナーゼ酵素とともにそれらを使用することを含む、幅広い用途を有する。
【0016】
[00017] チアゾリルテトラゾリウム塩およびそれらの対応するホルマザンが、分析物を検出するために使用される試験ストリップに適用される反応混合物中に可溶性でなければならないため、600〜640 nmの範囲において相対的に平坦な反射スペクトルを有するホルマザンを提供するそれらの能力を維持しながら、チアゾールテトラゾリウム塩の溶解性を向上させることが、本発明者らの目的であった。本発明の発明者らは、それらの目的を果たす化合物を含む、新規のチアゾリルテトラゾリウム塩のファミリーを見いだした。これらの塩は、以下の一般式により示される:
【0017】
【化2】

【0018】
式中:
A=対イオン
X=1〜6 Cアルキルまたはヘテロアルキル
a=1〜3
b=0〜3
R1=1〜6 Cアルキル
R2およびR3の一方がアルキルであり、そして他方がXN+Hb(R1)3-bであるか、またはR2およびR3がメチレンジオキシ基を形成する
R4またはR5の一方がハロゲンであり、そして他方がハロゲン置換1〜6 Cアルキルであるか、R4およびR5の一方または両方がXN+Hb(R1)3-bであるか、または
R4およびR5が一緒になって芳香環またはヘテロ芳香環を形成するか、または置換芳香環または置換ヘテロ芳香環を形成する。
【0019】
[00018] 本発明のテトラゾリウム塩は、特に興味深い以下の式中に示される様な、置換チアゾリルテトラゾリウム塩および置換ベンゾチアゾリルテトラゾリウム塩に分離されてもよい。
【0020】
【化3】

【0021】
式中:
A=対イオン
X=1〜6 Cアルキル
a=1〜3
b=0〜3
R1=1〜3 Cアルキル
R2およびR3の一方が1〜4 Cアルキルであり、そして他方がXN+Hb(R1)3-bであるか、またはR2およびR3がメチレンジオキシ基として一緒になる
R4=CHF2
R5=ハロゲンである。
【0022】
【化4】

【0023】
A=対イオン
X=1〜6 Cアルキル
a=1〜3
b=0〜3
R1=1〜3 Cアルキル
R2およびR3の一方が1〜4 Cアルキルであり、そして他方がXN+Hb(R1)3-bであるか、またはR2およびR3がメチレンジオキシ基として一緒になる
R4およびR5がH3であるか、またはR4およびR5が一緒になって芳香環を形成する
R6=1〜4 Cアルコキシ、水素、またはハロゲンである。
【0024】
[00019] これらの化合物(IおよびII)の溶解性は、以下の実施例において示される。チアゾリルテトラゾリウム塩の溶解性を高めることは、試験結果を得るために必要とされる時間を短縮し、そして高い分析物レベルでよりよい直線性をもたらす。同様に、水溶性が上昇すると、1試薬混合物(one-reagent mixture)を製剤化することが容易になり、それによりより簡単にそして安価に製造することができる。
【0025】
本発明のテトラゾリウム塩の製造方法
[00020] U.S.特許5,126,275において、チアゾリルテトラゾリウム塩を製造する方法が記載される。この方法は、ヒドラゾンをジアゾ化アニリンと反応させて、ホルマザンを生成し、それがその後酸化されてテトラゾリウム塩となることが関連している。本発明の化合物を生成するための記載された新たな方法は、化合物IおよびIIの好ましいテトラゾリウム塩中に、1つの極性基(スキーム1)または2つの極性基(スキーム2)を導入する様に開発された。図1および2は、これら2種類の方法を記載する。以下の実施例は、この発明をさらに説明する。
【0026】
[00021] スキーム1を使用して、テトラゾリウム環の5位のフェニル置換基が、メチレンジオキシ置換基を有する、テトラゾリウム塩を生成する。スキーム1において、トリメチルアンモニウムプロポキシ基が、テトラゾリウム環の3位でフェニル置換基上で置換される。スキーム1において、O-ニトロフェノールを3-ブロモプロピルトリメチルアンモニウム臭化物と反応させて、3-(2-ニトロフェノキシ)プロピルトリメチルアンモニウム臭化物を形成し、その後それに水素添加して、等量のアニリンとする。その化合物とメチレンジオキシ置換基による置換チアゾリル環およびフェニル環を含有するヒドラジンとの反応により、ホルマザンが得られる。次いで、ホルマザンが酸化されて、テトラゾリウム塩になる。ヒドラジンは、置換ベンズアルデヒドのテトラゾリウム塩のための所望の置換基を含有する置換ヒドラジンとの反応から形成される。
【0027】
[00022] スキーム2を使用して、テトラゾリウム環の5位のフェニル置換基が、3位または4位のいずれか(または両方)で置換されたトリメチルアンモニウムプロポキシ基を有する、テトラゾリウム塩を生成する。スキーム1におけるように、トリメチルアンモニウムプロポキシ基が、テトラゾリウム環の3位でフェニル置換基上に置換される。スキーム2において、4-ヒドロキシ-3メトキシベンズアルデヒドを3-ブロモプロピルトリメチルアンモニウム臭化物と反応させて、トリメチルアンモニウムプロポキシ基をベンズアルデヒドに付加する。生成物を置換ヒドラジンと反応させて、ヒドラゾンを生成する。ヒドラジンをスキーム1の第一工程において生成された3-(2-アミノフェノキシ)プロピルトリメチルアンモニウム臭化物と反応させて、ホルマザンを生成し、これがテトラゾリウム塩に変換される。
【0028】
[00023] 以下の結果において、溶解性は、テトラゾリウム塩に結合する対イオンにより影響されるようであることが示される。対イオンは、プロセスにおいて使用される試薬に由来し、そして好ましい対イオンを提供する様に様々であってもよい。あるいは、対イオンを、たとえばイオン交換法により、置換することができる。
【0029】
[00024] 以下の限定的ではない例において、各工程の生成物を分光光度法により同定し、そしてその結果を各生成物について呈示した。
【実施例】
【0030】
実施例1
5-ベンゾ[1,3ジオキソル-5-イル]-3-[2-(3-トリメチルアンモニウム)プロポキシ-フェニル]-2-(5-クロロ-4-ジフルオロメチル-チアゾール-2-イル)-2 H-テトラゾリウムブロモ亜硝酸塩の調製
[00025] スキーム1において示される様に、o-ニトロフェノールを3-ブロモプロピルトリメチルアンモニウム臭化物と反応させて、3-(2-ニトロフェノキシ)プロピルトリメチルアンモニウム臭化物を形成し、次いで、それに水素付加をして等量のアニリンとする。アニリンをメチレンジオキシ置換基を有する置換チアゾリル環およびフェニル環を含有するヒドラジンと反応させ、ホルマザンを生成する。次いで、ホルマザンを酸化してテトラゾリウム塩とする。このプロセスは、以下の実施例においてより完全に記載される:窒素下、乾燥した250 mLの一口丸底フラスコ中、DMF(150 mL)中のo-ニトロフェノールの黄色溶液に対して(Aldrich、6.3 g、45 mmol)、炭酸カリウムを添加した(6.6 g、48 mmol)。混合物は、オレンジ色に変わった。10分間攪拌した後、3-ブロモプロピルトリメチルアンモニウム臭化物(Aldrich、12.9 g、45 mmol)を添加した。得られた混合物を125℃にて3時間加熱した。反応混合物を室温まで冷却した後、基を濾過し、そして沈殿物をDMFを用いて洗浄した(2×20 mL)。濾過物をゆっくりとEtOAc(750 mL)に対して添加し、沈殿物を形成させた。得られた混合物を30分間攪拌させた。沈殿物を濾過し、そしてEtOAc:DMF、5:1の溶液で洗浄し(3×100 mL)、次いでEtOAc(100 mL)およびヘキサン(100 mL)で洗浄した。淡黄色固体を5分間風乾した後、生成物をEtOAc:DMF、10:1の溶液(550 mL)に対して添加し、そして1時間攪拌した。固体を濾過し、EtOAc(100 mL)およびヘキサン(100 mL)で洗浄した。得られた固体を濾過して、以下の特性により特定される、淡いベージュ色の生成物を得た(14.54 g、>100%)、mp(178℃〜181℃)。
【0031】
【化5】

【0032】
[00026] 3-(2-ニトロフェノキシ)プロピルトリメチルアンモニウム臭化物(7 g、21.94 mmol)、10%Pd/C(725 mg)、MeOH(70 mL)および水(70 mL)のスラリーを、35 psiで2.5時間、Parr Hydrogenation装置中で水素添加した。30分後、圧力が22 psiまで低下した。得られた混合物を、521セライトのバッドを通して濾過した。黒色の触媒/セライトのパッドを、MeOH(2×10 mL)で洗浄した。濾過物を、減圧下、40〜45℃でロータリーエバポレータで濃縮した。これ以上の留出物が形成されない場合に、淡桃色の溶液を、別のフラスコに移し、そして凍結乾燥により2日間濃縮し、以下のスペクトル特性により特定される、淡いベージュ色のアニリン誘導体(5.92 g、93%)を得た。
【0033】
【化6】

【0034】
[00027] 氷浴中の水(80 ml)中、上述のアニリン誘導体の溶液(7.7 g、26.64 mmol)に対して、濃HCl(7.2 ml)を滴加した。溶液を5分間攪拌した後、水(16 mL)中、亜硝酸ナトリウム(2.2 g、32 mmol)の溶液を滴加した。溶液の色は、淡褐色から黄金に変化した。得られた溶液をwas stirred 30分間攪拌した。ピリジン(400 mL)中、ヒドラジンの溶液(Bayer、9.8 g、27.98 mmol)を、機械的スターラーおよびジャケット付加漏斗(jacketed addition funnel)を装備した3つ口の2リットルフラスコ中で、塩/氷/水浴(-15℃〜-20℃)中、攪拌した。ここで作製されたジアゾ溶液を、氷/水で充たされたジャケット付加漏斗(jacket addition funnel)を介して、ヒドラジン溶液に対して滴加された。最初の数滴の後、反応色は、黄色から濃青色へと変化した。1/3を添加した後、濃青色の反応混合物は非常に粘性になった。添加が完了した際、混合物を30分間攪拌した。次いで、反応物を、氷/水浴を介して3〜5℃に暖めた。反応物を1時間攪拌した。混合物を、MeOH(500 mL)を有する2リットルの丸底フラスコに移した。混合物を濃縮し、ロータリーエバポレータで、減圧条件下、45℃にて、さらなる留出物が形成されなくなるまで濃縮した。MeOH(500 mL)を再び添加し、そして混合物を濃縮した。このプロセスを繰り返した。得られた固体を減圧下で一晩乾燥させた。次いで、フラスコをMeOH(100 mL)ですすぎ、そしてEtOAc(500 mL)で希釈した。このスラリーを、氷/水浴中で30分間攪拌した。生成物を濾過し、そしてEtOAc(100 mL)、冷MeOH(50 mL)、EtOAc(150 mL)およびヘキサン(150 mL)で洗浄した。得られた濃青色の生成物をアンバーボトルに移し、そして減圧下にて乾燥させ、以下のスペクトル特性により特定される、所望のホルマザン(13、11.3 g、67%)を得た。
【0035】
【化7】

【0036】
[00028] 上記のホルマザン(2.16 g、3.4 mmol)、水(1.4 mL)およびTHF(40 mL)の混合物に対して、メタンスルホン酸(0.68 mL、10.24 mmol)を添加した。混合物を5分間攪拌した。次いで、亜硝酸ナトリウム(720 mg、10.24 mmol)を一度に添加した。混合物を3日間攪拌した。このスラリーの色は、濃青色からオレンジ色に変化した。オレンジ色の沈殿物を濾過し、そしてTHF(2×10 mL)で洗浄した。生成物を減圧下にて一晩乾燥させた。次いで、固体をMeOH(80 mL)でスラリー状にし、濾過し、そして残渣をMeOH(2×5 mL)で洗浄した。濾過物をロータリーエバポレータで減圧下、40℃にて濃縮した。得られた生成物を2日間、減圧下にて乾燥させ、以下のスペクトル特性により特定される、オレンジ色のtet塩(2.86 g>100%)をえた。
【0037】
【化8】

【0038】
実施例2
5-ベンゾ[1,3ジオキソル-5-イル]-3-[2-(3-トリメチルアンモニウム)プロポキシ-フェニル]-2-(5-クロロ-4-ジフルオロメチル-チアゾール-2-イル)2 H-テトラゾリウムブロモテトラフルオロボレート塩の調製
[00029] 同一のホルマザンを有する48%テトラヒドロフルオロホウ酸を使用して、所望のオレンジ色のテトラゾリウム塩を得ること以外は、塩を、実施例1に示す様に調製した。
【0039】
【化9】

【0040】
実施例3
5-ベンゾ[1,3ジオキソル-5-イル]-3-[2-(3-ジメチル水素アンモニウム)プロポキシ-フェニル]-2-(5-クロロ-4-ジフルオロメチル-チアゾール-2-イル)-2 H-テトラゾリウムブロモ亜硝酸塩の調製
[00030] 窒素下の乾燥した100 mLの一つ口丸底フラスコ中、DMF(50 mL)中のo-ニトロフェノール(Aldrich、2.1 g、45 mmol)の黄色溶液に対して、炭酸カリウム(4.4 g、32 mmol)を添加した。混合物はオレンジ色に変化した。10分間攪拌した後、3-クロロプロピルジメチルアンモニウム塩化水素(Aldrich、2.4 g、16.5 mmol)を添加した。得られた混合物を125℃で1日加熱した。反応混合物を室温まで冷却した後、残渣を濾過し、そして沈殿物をMeOH(2×10 mL)で洗浄した。濾過物を、5 mLとなるまで、減圧下にて40℃で、濃縮した。次いで、EtOAc(100 mL)を添加した。沈殿物が形成され、そして濾過された。水(100 mL)およびEtOAc(150 mL)を濾過物に対して添加し、レイヤーを混合しそして分離した。水層をEtOAc(3×25 mL)で抽出した。あわせたEtOAc抽出物を飽和食塩水(25 mL)で洗浄し、硫酸マグネシウム(5 g)上で乾燥させ、濾過し、そして濃縮して、黄色油状物(2.55 g、81%)を得た。
【0041】
【化10】

【0042】
[00031] アルキル化ニトロフェノールを実施例1と同様にして処理し、所望のtet塩を得た。
【0043】
【化11】

【0044】
実施例4
5-ベンゾ[1,3ジオキソル-5-イル]-3-[2-(3-トリメチルアンモニウム)プロポキシ-フェニル]-2(ベンゾチアゾール-2-イル)-2 H-テトラゾリウムブロモ亜硝酸塩の調製
[00032] ピペロナール-ベンゾチアゾール-2-イルヒドラジンを、実施例1と同様に3-(2-アミノフェノキシ)プロピルトリメチルアンモニウム臭化物と反応させ、ホルマザンを作製し、それを次いで対応するテトラゾリウム塩に変換した。
【0045】
[00033] ピペロナールベンゾチアゾール-2-イルヒドラジン(Bayer、2.5 g、10.5 mmol)を、実施例1由来のアニリン誘導体(2.85 g、9.6 mmol)と、実施例1においてホルマザンを作製する際に使用した条件と同様の条件下で反応させ、以下のスペクトル特性により特定される、暗紫色固体(4.7 g、82%)を得た。
【0046】
【化12】

【0047】
[00034] 上述のホルマザン(600 mg、1.01 mmol)を、実施例1と同一の条件下にて、テトラゾリウム塩に変換した(870 mg、>100%)。テトラゾリウム塩は、以下のスペクトル特性により特定された。
【0048】
【化13】

【0049】
実施例5
5-ベンゾ[1.3ジオキソル-5-イル]-3-[2-(3-トリメチルアンモニウム)プロポキシ-フェニル1-2-(6-メトキシナフチルチアゾール-2-イル)-2 H-テトラゾリウムブロモ亜硝酸塩の調製
[00035] 6-メトキシ-2-ヒドラジノ-ナフチルチアゾールを、実施例4における2-ヒドラジノ-ベンゾチアゾールの代わりに使用して、適切なヒドラゾンを作製した。次いで、ヒドラジンを同一の条件に供して、所望のホルマザン(44%全体)を得た。
【0050】
【化14】

【0051】
[00036] 氷/塩/水浴中の酢酸(5 mL)およびテトラヒドロフラン(5 mL)の溶液に対して、亜硝酸ナトリウム(143 mg、2.08 mmol)を添加した。10分間攪拌した後、上述のホルマザン(340 mg、.051 mmol)を添加した。1時間後、反応物を室温まで暖め、そして一晩攪拌した。暗えび茶色(dark maroon)混合物を濾過し、そして固体を酢酸(3×5 mL)、酢酸エチル(2×10 mL)、およびヘキサン(10 mL)で洗浄した。濾過物をロータリーエバポレータで30℃で濃縮し、次いで減圧下にて一晩乾燥させた。残渣を酢酸エチル(15 mL)でスラリー化し、落ち着かせてからデカントした。このプロセスを繰り返した。次いで、ヘキサン(10 mL)を添加した。生成物を濾過し、そして乾燥させて、所望のえび茶色(maroon)のtet塩を得た(260 mg、75%)。
【0052】
【化15】

【0053】
実施例6
5-[4-(3-トリメチルアンモニウム)プロポキシ-3-メトキシ-フェニル]-3-[2-(3-トリメチルアンモニウム)プロポキシ-フェニル]-2-(5-クロロ-4-ジフルオロメチル-チアゾール-2-イル)-2 H-テトラゾリウムジブロモ亜硝酸塩の調製
[00037] 4-ヒドロキシ-3-メトキシベンズアルデヒドを、3-ブロモプロピルトリメチルアンモニウム臭化物と反応させて、別のトリメチルアンモニウムプロポキシ置換基を導入した。生成物を5-クロロ-4-ジフルオロメチル-2-ヒドラジノ-チアゾールと反応させて、ヒドラゾンを生成した。ヒドラジンを実施例1に記載したのと同様に、3-(2-アミノフェノキシ)プロピルトリメチルアンモニウム臭化物と反応させて、ホルマザンを生成し、それを対応するテトラゾリウム塩に変換する。4-ヒドロキシ3メトキシ-ベンズアルデヒド(Vanillin、Aldrich、4.56 g、30 mmol)を、実施例1において使用した条件と同一の条件下で、3-ブロモプロピルトリメチルアンモニウム臭化物(8.8 g、34 mmol)でアルキル化し、以下のスペクトル特性により特定される、オフホワイトの生成物(9.73 g、97%)を調製した。
【0054】
【化16】

【0055】
[00038] 上述のアルキル化ベンズアルデヒド(6.8 g、20.5 mmol)および5-クロロ-4-ジフルオロメチル-2-ヒドラジノ-チアゾール(Bayer、3.72 g、18.6 mmol)のMeOH(60 mL)中スラリーに対して、酢酸(0.55 mL)を添加した。このスラリーは5分後にほぼ溶解した。得られた混合物を80℃で一晩加熱した。反応物を室温まで冷却した後、溶液をEtOAc(650 mL)に対してゆっくりと添加した。淡灰色の沈殿物が形成された。混合物を30分間攪拌した。固体を濾過し、そしてEtOAcおよびヘキサンで洗浄した。淡灰色の生成物を別のボトルに移し、そして減圧下で一晩乾燥させて、以下の特性により特定される、所望のヒドラジン(8.7 g、87%)を得た。
【0056】
【化17】

【0057】
[00039] 上述のヒドラジン(7.08 g、13.86 mmol)を、実施例1由来のアニリン誘導体(6 g、20.76 mmol)と、実施例1と同様の条件下で反応させ、以下のスペクトル特性により特定される、濃青色のホルマザン(8.56 g、76%)を得た。
【0058】
【化18】

【0059】
[00040] 上述のホルマザン(2.44 g、3 mmol)を、反応混合物を40℃で15時間加熱したことを除き、実施例1において使用された条件と同様の条件下で、テトラゾリウム塩に変換した。生成物は、以下のスペクトル特性により特定される。
【0060】
【化19】

【0061】
実施例7
5-[4-(3-トリメチルアンモニウム)プロポキシ-3-メトキシ-フェニル])-3-[2-(3-トリメチルアンモニウム)プロポキシ-フェニル]-2-(6-エトキシ-ベンゾチアゾール-2イル)-2 H-テトラゾリウムジブロモ亜硝酸塩の調製
[00041] 6-エトキシ-2-ヒドラジノ-ベンゾチアゾールを、実施例6において作製したアルキル化ベンズアルデヒドと反応させて、ヒドラゾンを形成し、それを次いで、実施例1において作製した置換アニリンと反応させて、ホルマザンを作製した。ホルマザンは、対応するテトラゾリウム塩へと変換された。
【0062】
[00042] 6-エトキシ-2-ヒドラジノ-ベンゾチアゾール(Acros、4.62 g、22 mmol)を、4-(3-トリメチルアンモニウムプロポキシ)-3-メトキシ-ベンズアルデヒドと実施例6における条件と同様の条件下で反応させ、以下の特性により特定される、淡灰色生成物(10.23 g、95%)を得た。
【0063】
【化20】

【0064】
[00043] 上記の様にして調製されたヒドラジン(3.6 g、6.93 mmol)を、実施例1に由来するアニリン(3 g、10.38 mmol)と、溶媒としてピリジンとDMFの3:1混合物を使用した以外は、実施例1において使用された条件と同様の条件下にて反応させ、ホルマザンを調製し、以下のスペクトル特性により特定される、所望の濃青色生成物(3.8 g、66%)を得た。
【0065】
【化21】

【0066】
[00044] 上述のホルマザン(1.24 g、1.5 mmol)を、実施例1において使用された条件と同様の条件下で、テトラゾリウム塩へと変換した(2 g、>100%)。生成物は、以下のスペクトル特性により特定された。
【0067】
【化22】

【0068】
実施例8
5-[4-(3-トリメチルアンモニウム)プロポキシ-3-メトキシ-フェニル]-3-[2-(3-トリメチルアンモニウム)プロポキシ-フェニル]-2-(6-ブロモ-ベンゾチアゾール-2-イル)-2 H-テトラゾリウムジブロモ亜硝酸塩の調製
[00045] 6-ブロモ-2-ヒドラジノ-ベンゾチアゾールを、実施例8における6-エトキシ-2-ヒドラジノ-ベンゾチアゾールの代わりに使用して、適切なヒドラゾンを作製した。次いで、ヒドラジンを同一の条件に供して、所望のホルマザン(44%全体)を得た。
【0069】
【化23】

【0070】
[00046] ホルマザン(322 mg、0.375 mmol)を、反応物を40℃で一晩加熱して、所望のテトラゾリウム塩(478 mg、>100%)を得たこと以外は、実施例8における条件と同一の条件に供し、テトラゾリウム塩を形成した。
【0071】
【化24】

【0072】
実施例9
5-[4-(3-トリメチルアンモニウム)プロポキシ-3-メトキシ-フェニル]-3-[2-(3-トリメチルアンモニウム)プロポキシ-フェニル]-2-(6-エトキシ-ベンゾチアゾール-2-イル)-2 H-テトラゾリウムトリ臭化物塩の調製
[00047] アセトニトリル(15 mL)中のホルマザン(実施例7由来、1.18 gr、1.43 mmol)のスラリーに対して、n-ブロモスクシンイミド(300 mg、1.69 mmol)を室温で添加した。1時間後、すべてが溶解した。3時間後、オレンジ色の沈殿物が形成された。反応物を一晩攪拌した。沈殿物を濾過し、そしてアセトニトリル(3×5 mL)で洗浄した。得られたオレンジ色の生成物を、減圧下にて一晩乾燥させた(1.07 g、83%)。
【0073】
【化25】

【0074】
[00048] 実施例1〜9において作製されたテトラゾリウム塩の溶解性を、0.2 Mホスフェートバッファー、pH約7.5、室温、を、化合物が溶解するまで、既知量の各化合物に添加することにより、測定した。結果を、表1に示す。ここで、これらを、WST-4(Dojindo Laboratoriesのチアゾリルテトラゾリウム塩)、HTC-045(Bayer Corp.のチアゾリルテトラゾリウム塩)および修飾HTC-045〔式中、メトキシ基を3-スルホン酸プロポキシ基により置換した〕を用いて比較する(図3を参照)。
【0075】
[00049]
【0076】
【表1】

【0077】
[00050] トリアルキルアンモニウムプロポキシ置換基をチアゾリルテトラゾリウム塩に対して付加することにより、テトラゾリウム塩の溶解性の向上が得られたが、この向上は、従来技術に基づいても容易には予想されなかった。従来技術は、3-スルホン酸プロポキシ基を分子中に付加することにより、分子の水溶性が亢進されると予想していた。分子中へのスルホン酸基の導入は、Dojindo Laboratoriesにより使用された。しかしながら、3-スルホン酸プロポキシ基のテトラゾリウム環に結合したフェニル基上のメトキシ基への置換(修飾HTC-045、図3を参照)は、HTC-045(21 mM)よりもより低い8 mMの溶解性をもたらした。このように、我々の分子構造においては、この現象は事実ではなかった。我々は、異なる極性基が、水溶性を向上させることを見いだした。しかしながら、その他の予想されなかった効果が、いかに検討したように見いだされた。
【0078】
[00051] トリメチルアンモニウムプロポキシ基のメトキシ基への置換により、溶解性が21 mM(HTC-045)から33 mM(実施例1)へと上昇し、そして第二のトリメチルアンモニウムプロポキシの置換により(実施例6)実質的に溶解性を181 mMまで上昇させた。しかしながら、溶解性は、テトラフルオロホウ酸対イオンを、ニトレートと置換した場合に、実質的に低下した(実施例2を実施例1と比較)。トリメチルアンモニウムプロポキシ基を修飾してジメチルアンモニウムプロポキシ基にした場合の実施例1におけるテトラゾリウム塩の溶解性は、実施例3に記載された。
【0079】
[00052] 2つのトリメチルアンモニウムプロポキシ基を付加することにより得られる溶解性の実質的な増加(実施例6)は、実施例4においても予期せず見いだされた(167 mM)。実施例4では、ただ一つのトリメチルアンモニウムプロポキシ基が含まれたが、置換チアゾリル基は非置換ベンゾチアゾリル基により置換されていた。しかしながら、置換ナフチルチアゾリル基を使用した場合の実施例5において示されるチアゾリル基のさらなる付加が、低い溶解性(5 mM)を有することが見いだされた。実施例7において示される別の予期せぬ結果において、2つのトリメチルアンモニウム基およびベンゾチアゾリル基の付加は、両方とも溶解性を顕著に増大したが、補完作用は何も有さない様であった。実施例7は、167 mMの溶解性を有していた。
【0080】
[00053] 溶解性の別の実質的な増大は、実施例7のベンゾチアゾリル基のエトキシ基を、実施例8においてブロモ基により置換した場合に得られた。溶解性は、169 mMから本明細書で示された最高値である290 mMに上昇した。実施例7の対イオン、ニトレートイオン、が実施例9において臭化物イオンにより置換された場合に、同様の結果が見いだされた。溶解性は、169 mMから260 mMに上昇した。臭素が含まれることが、テトラゾリウム塩のこのファミリーの溶解性を向上させる有効な手段である様である。
【0081】
[00054] 調製されそして溶解性について試験された化合物は、いくらか異なるスペクトル特性を有した。テトラゾリウム塩から形成され、そして表1において溶解性について試験された各ホルマザンの吸収スペクトルは、Hewlett Packard Model 8453ダイオード-アレイUV-可視化分光光度計を用いて測定された。100μMのテトラゾリウム塩溶液を、100 mMリン酸カリウムバッファー中で調製した。ホルマザンのスペクトルは、5倍過剰量のアスコルビン酸塩を添加して、tet塩をそれらのホルマザンへと変換した後に、測定した。結果は、図5aおよびbに提示する。
【0082】
[00055] 以前に記載したように、チアゾリルテトラゾリウム塩由来のホルマザンは、約640 nMの波長で光を吸収するようになっており、そして平坦な反応が望まれる。図5aおよびbの両方において、HTC-045の吸収とWST-4の吸収を比較のためにプロットした。WST-4は、約560 nMの範囲においてピーク吸収を示す一方、HTC-045は、約460 nM〜660 nMのあいだで、比較的平坦な吸収を示す。しかしながら、その溶解性は、WST-4よりも低い。トリメチルアンモニウムプロポキシ基を付加することにより、スペクトル曲線が変化した。実施例1、2、3、4、6、7、および8は、HTC-045よりも低い吸光度を有しており、しかしながら曲線は、示される範囲全体で比較的平坦であった。ナフチルチアゾリル基を含む実施例5のtet塩は、溶解性が低かっただけではなく、波長曲線に対して上昇する吸光度を示し、HTC-045または実施例1、2、3、4、6、7、および8の修飾化合物に匹敵する平坦な領域は示さない様である。実施例9は、400〜640 nMの間で、比較的平坦な反応を有し、同時に高い溶解性を有するスペクトル曲線を示した。
【0083】
[00056] 理想的には、テトラゾリウム塩は、幅広い範囲の波長で高い吸光度を有するホルマザンを得るべきであり、それにより、分析物が反応する際に発色される色を、容易にそして確実に、測定することができる。そのため、相対的に平坦な曲線がもっとも望ましい。試験されたtet塩から得られたホルマザンの溶解性から見ることができるように、おそらくは実施例5以外のこれらのすべては、有用な指示薬としての見込みを示す。実施例5のテトラゾリウム塩は新規の化合物であり、そして指示薬として使用することができたが、しかしより均質なスペクトル曲線およびより高い溶解性を有する化合物よりも好ましい訳ではなかった。
【0084】
テトラゾリウム塩の使用
[00057] テトラゾリウム塩が多くの用途のために有用な指示薬である一方、それらは生物学的サンプル中の分析物を測定するために使用される試験ストリップにおいて使用される場合に、特に有益である。一つの重要な用途は、血液のグルコース含量を測定する際の用途である。
【0085】
[00058] 試験ストリップは、典型的には、キャリアおよび試薬組成物を含む。試薬(たとえば、グルコースデヒドロゲナーゼ)および補因子(たとえば、NADまたはPQQ)は、生物学的サンプル中の分析物(たとえば、グルコース)と反応し、メディエータ(たとえば、PMSまたは酵素ジアホラーゼ)は、チアゾリルテトラゾリウム塩を還元して、その対応する色のホルマザンとする。得られた色は、通常は、その目的のために設計された測定装置においてもっとも正確に測定される。光源(たとえば、LED)は、試験ストリップ上に入射光を供給する。試験ストリップから反射された光を、光検出器で測定し、そして反応された分析物の量と相関させる。
【0086】
[00059] 本発明のチアゾリルテトラゾリウム指示薬は、U.S.特許5,126,275およびそれよりも前に言及されたその他の文献において開示された指示薬から利用可能である、幅広いスペクトルをもたらす。しかしながら、実施例において示される様に、新規のチアゾリルテトラゾリウム指示薬の多くは、HTC-045と比較して溶解性が向上しており、それによりより迅速な試験時間およびより正確な結果がもたらされる。
【0087】
本発明は、以下の代替態様にまとめられる。
[00060] 代替実施形態A
以下の式:
【0088】
【化26】

【0089】
〔式中:
A=対イオンであり、
a=1〜3であり、
b=0〜3であり、
X=1〜6 Cアルキルまたはヘテロアルキルであり、
R1=1〜6 Cアルキルであり、
R2およびR3の一方がアルキルであり、そして他方がXN+Hb(R1)3-bであるか、またはR2およびR3がメチレンジオキシ基を形成し、
R4およびR5の一方がハロゲンであり、そして他方がハロゲン置換1〜6 Cアルキルであるか、R4およびR5の一方または両方がXN+Hb(R1)3-bであるか、またはR4およびR5が一緒になって芳香環またはヘテロ芳香環、または置換芳香環または置換ヘテロ芳香環を形成する〕
を有する、化合物。
【0090】
[00061] 代替実施形態B
以下の式:
【0091】
【化27】

【0092】
〔式中:
A=対イオンであり、
X=1〜6 Cアルキルであり、
a=1〜3であり、
b=0〜3であり、
R1=1〜3 Cアルキルであり、
R2およびR3の一方が1〜4 Cアルキルであり、そして他方がXN+Hb(R1)3-bであるか、またはR2およびR3がメチレンジオキシ基を形成し、
R4=CHF2であり
R5=ハロゲンである〕
を有する、代替実施形態Aに記載の化合物。
【0093】
[00062] 代替実施形態C
式中、
Xがプロピルであり、
bがゼロであり、
R1がメチルであり、
R2およびR3がメチレンジオキシ基を形成し、
R4がCHF2であり、
R5がClである、
代替実施形態Bに記載の化合物。
【0094】
[00063] 代替実施形態D
式中、
Xがプロピルであり、
bが1であり、
R1がメチルであり、
R2およびR3がメチレンジオキシ基を形成し、
R4がCHF2であり、
R5がClである、
代替実施形態Bに記載の化合物。
【0095】
[00064] 代替実施形態E
式中、
Xがプロピルであり、
bがゼロであり、
R1がメチルであり、
R2がトリメチルアンモニウムプロピルであり、
R3がメトキシであり、
R4がCHF2であり、
R5がClである、
代替実施形態Bに記載の化合物。
【0096】
[00065] 代替実施形態F
以下の式
【0097】
【化28】

【0098】
〔式中:
a=1〜3であり、
A=対イオンであり、
X=1〜6 Cアルキルであり、
b=0〜3であり、
R1=1〜3 Cアルキルであり、
R2およびR3の一方がアルキルであり、そして他方がXN+Hb(R1)3-bであるか、またはR2およびR3がメチレンジオキシ基を形成し、
R4およびR5の一方がハロゲンであり、そして他方がハロゲン置換1〜6 Cアルキルであるか、またはR4およびR5が水素であり、
R6=1〜4 Cアルコキシ、水素、またはハロゲンである〕
を有する、代替実施形態Aに記載の化合物。
【0099】
[00066] 代替実施形態G
式中、
Xがプロピルであり、
bがゼロであり、
R1がメチルであり、
R2がトリメチルアンモニウムプロピルであり、
R3がメトキシであり、
R4、R5、およびR6が水素である、
代替実施形態Fに記載の化合物。
【0100】
[00067] 代替実施形態H
式中、
Xがプロピルであり、
R1がメチルであり、
bがゼロであり、
R2がトリメチルアンモニウムプロピルであり、
R3がメチルであり、
R4およびR5が芳香環を形成し、
R6がメトキシである、
代替実施形態Fに記載の化合物。
【0101】
[00068] 代替実施形態I
式中、
Xがプロピルであり、
bがゼロであり、
R1がメチルであり、
R2がトリメチルアンモニウムプロピルであり、
R3がメチルであり、
R4およびR5が水素であり、
R6がエトキシである、
代替実施形態Fに記載の化合物。
【0102】
[00069] 代替実施形態J
式中、
Xがプロピルであり、
bがゼロであり、
R1がメチルであり、
R2がトリメチルアンモニウムプロピルであり、
R3がメチルであり、
R4およびR5が水素であり、
R6がブロムである、
代替実施形態Fに記載の化合物。
【0103】
[00070] 代替実施形態K
少なくとも1つの対イオンが、ニトレート、ホスフェート、ハイドロゲン・ホスフェート、ダイハイドロゲン・ホスフェート、ハイドロゲン・サルフェート、サルフェート、ハイドロゲン・カーボネート、カーボネート、メタンスルホネート、フルオロボレート、臭化物、塩化物、ヨウ化物、またはこれらの組み合わせである、代替実施形態Aに記載の化合物。
【0104】
[00071] 代替プロセスL
以下の式
【0105】
【化29】

【0106】
〔式中:
A=対イオンであり、
a=1〜3であり、
b=0〜3であり、
X=1〜6 Cアルキルまたはヘテロアルキルであり、
R1=1〜6 Cアルキルであり、
R2およびR3の一方がアルキルであり、もう一方がXN+Hb(R1)3-bであるか、またはR2およびR3がメチレンジオキシ基を形成し、
R4およびR5の一方がハロゲンであり、もう一方がハロゲン置換1〜6 Cアルキルであるか、R4およびR5の一方または両方がXN+Hb(R1)3-bであるか、またはR4およびR5が一緒になって芳香環またはヘテロ芳香環または置換芳香環または置換ヘテロ芳香環を形成する〕
を有するテトラゾリウム塩を指示薬として提供すること;そして
生体液中の分析物の濃度を、指示薬としてのテトラゾリウム塩を用いて決定すること;
を含む、生体液中に含有される、反応に際して比例する色の変化を生成する様に構成される分析物を測定する方法。
【0107】
[00072] 代替プロセスM
分析物がグルコースである、代替プロセスLに記載の方法。
[00073] 代替プロセスN
生体液が全血液である、代替プロセスMに記載の方法。
【0108】
[00074] 代替プロセスO
テトラゾリウム塩が以下の式:
【0109】
【化30】

【0110】
〔式中:
A=対イオンであり、
X=1〜6 Cアルキルであり、
a=1〜3であり、
b=0〜3であり、
R1=1〜3 Cアルキルであり、
R2およびR3の一方が1〜4 Cアルキルであり、そして他方がXN+Hb(R1)3-bであるか、またはR2およびR3がメチレンジオキシ基を形成し、
R4=CHF2であり、
R5=ハロゲンである〕
を有する、代替プロセスMに記載の方法。
【0111】
[00075] 代替プロセスP
Xがプロピルであり、
bがゼロであり、
R1がメチルであり、
R2およびR3がメチレンジオキシ基を形成し、
R4がCHF2であり、
R5がClである、
代替プロセスOに記載の方法。
【0112】
[00076] 代替プロセスQ
Xがプロピルであり、
bが1であり、
R1がメチルであり、
R2およびR3がメチレンジオキシ基を形成し、
R4がCHF2であり、
R5がClである、
代替プロセスOに記載の方法。
【0113】
[00077] 代替プロセスR
Xがプロピルであり、
bがゼロであり、
R1がメチルであり、
R2がトリメチルアンモニウムプロピルであり、
R3がメトキシであり、
R4がCHF2であり、
R5がClである、
代替プロセスOに記載の方法。
【0114】
[00078] 代替プロセスS
以下の式
【0115】
【化31】

【0116】
〔式中:
a=1〜3であり、
A=対イオンであり、
X=1〜6 Cアルキルであり、
b=0〜3であり、
R1=1〜3 Cアルキルであり、
R2およびR3の一方がアルキルであり、そして他方がXN+Hb(R1)3-bであるか、またはR2およびR3がメチレンジオキシ基を形成し、
R4およびR5の一方がハロゲンであり、そして他方がハロゲン置換1〜6 Cアルキルであるか、またはR4およびR5が水素であり、
R6=1〜4 Cアルコキシ、水素、またはハロゲンである〕
を有する、代替プロセスLに記載の方法。
【0117】
[00079] 代替プロセスT
Xがプロピルであり、
bがゼロであり、
R1がメチルであり、
R2がトリメチルアンモニウムプロピルであり、
R3がメトキシであり、
R4、R5、およびR6が水素である、
代替プロセスSに記載の方法。
【0118】
[00080] 代替プロセスU
Xがプロピルであり、
R1がメチルであり、
bがゼロであり、
R2がトリメチルアンモニウムプロピルであり、
R3がメチルであり、
R4およびR5が芳香環を形成し、
R6がメトキシである、
代替プロセスSに記載の方法。
【0119】
[00081] 代替プロセスV
Xがプロピルであり、
bがゼロであり、
R1がメチルであり、
R2がトリメチルアンモニウムプロピルであり、
R3がメチルであり、
R4およびR5が水素であり、
R6がエトキシである、
代替プロセスSに記載の方法。
【0120】
[00082] 代替プロセスW
Xがプロピルであり、
bがゼロであり、
R1がメチルであり、
R2がトリメチルアンモニウムプロピルであり、
R3がメチルであり、
R4およびR5が水素であり、
R6が臭素である、
代替プロセスSに記載の方法。
【0121】
[00083] 代替プロセスX
少なくとも1つの対イオンが、ニトレート、ホスフェート、ハイドロゲン・ホスフェート、ダイハイドロゲン・ホスフェート、ハイドロゲン・サルフェート、サルフェート、ハイドロゲン・カーボネート、カーボネート、メタンスルホネート、フルオロボレート、臭化物、塩化物、ヨウ化物、またはこれらの組み合わせである、代替プロセスLに記載の方法。
【0122】
[00084] 代替プロセスY
少なくとも1つの置換基としてのトリアルキルアンモニウムアルコキシ基を、チアゾリルテトラゾリウム塩に対して付加することを含む、テトラゾリウム環の第3の窒素原子で結合したチアゾリル基を有するチアゾリルテトラゾリウム塩の可溶性を増大させる方法。
【0123】
[00085] 代替プロセスZ
チアゾリルテトラゾリウム塩が、テトラゾリウム環の第3の窒素原子および炭素原子において、フェニル置換基を有する、代替プロセスYに記載の方法。
【0124】
[00086] 代替プロセスAA
少なくとも1つのトリアルキルアンモニウムアルコキシ基が、トリメチルアンモニウムプロポキシ基である、代替プロセスZに記載の方法。
【0125】
[00087] 代替プロセスBB
少なくとも1つのトリアルキルアンモニウムアルコキシ基が、フェニル基の置換基である、代替プロセスZに記載の方法。
【0126】
[00088] 代替プロセスCC
少なくとも1つのトリアルキルアンモニウムアルコキシ基が、両方のフェニル置換基の置換基である、代替プロセスZに記載の方法。
【0127】
[00089] 代替プロセスDD
チアゾリル基が、ベンゾチアゾリル基である、代替プロセスZに記載の方法。
[00090] 代替プロセスEE
チアゾリルテトラゾリウム塩が、ニトレート、ホスフェート、ハイドロゲン・ホスフェート、ダイハイドロゲン・ホスフェート、ハイドロゲン・サルフェート、サルフェート、ハイドロゲン・カーボネート、カーボネート、メタンスルホネート、フルオロボレート、臭化物、塩化物、ヨウ化物、またはこれらの組み合わせの対イオンを有する、代替プロセスZに記載の方法。
【0128】
[00091] 代替プロセスFF
対イオンが、ブロモニトレート、ジブロモニトレート、またはトリ臭化物である、代替プロセスEEに記載の方法。
【図面の簡単な説明】
【0129】
【図1】[00011] 図1は、実施例の化合物を調製する第一の方法の図である。
【図2】[00012] 図2は、実施例の化合物を調製する第二の方法の図である。
【図3】[00013] 図3は、実施例において報告された比較化合物を示す。
【図4】[00014] 図4a〜bは、実施例において作製された本願発明の化合物を示す。
【図5a】[00015] 図5aおよび図5bは、テトラゾリウム塩の吸光度対光の波長のプロットである。
【図5b】[00015] 図5aおよび図5bは、テトラゾリウム塩の吸光度対光の波長のプロットである。
【発明の詳細な説明】
【0001】
発明の属する分野
[0001] 本発明は、医学目的のための生物学的サンプルの解析に関する。
【0002】
発明の背景
[0002] 生物学的サンプルの解析は、しばしば、色がサンプル中の分析物の量に比例して発色される方法に関する。たとえば、酵素を使用して、目的とする分析物を酸化し、そして反応の程度が、指示薬化合物の色の変化により示される。本明細書中で特に興味深いことは、指示薬として使用されるテトラゾリウム塩のファミリーである。そのような塩は、還元されて、基質を還元することによりホルマザン色素となる。分析物を測定するため、酵素(たとえば、NAD-依存性デヒドロゲナーゼ酵素)が分析物を酸化して、還元型(たとえば、NADH)を形成し、それがテトラゾリウム塩と反応して、発色ホルマザンを生成する。メディエータは、反応を促進するために必要とされる可能性がある。分析物反応により生成されるNADHの量が生成されるホルマザンの量に比例するため、分析物の量を形成された色により間接的に測定することができる。
【0003】
[0003] テトラゾリウム塩は、様々な用途において使用されてきた。しかしながら、特に、それらは、様々な生体液(たとえば血液、尿、血漿、および血清)中の分析物を測定するための医学分野において使用された。これらの指示薬はしばしば、液体サンプルと接触させる場合に、目的とする分析物と反応し、そして存在する分析物の量を示す色を呈示する、試験ストリップ上に配置された試薬システムにより使用される。いくつかの事例においては、色の変化をカラーチャートを参照することにより視覚的に読みとることができるが、より正確な読みとり値は、分光光度法の目的のために設計された装置により、分光光度的に行うことができる。典型的には、光が試験ストリップに対して向けられ、そして反射光を測定して、ストリップ上の色の変化の効果を決定する。
【0004】
[0004] テトラゾリウム塩は、サンプル中の基質(たとえば、全血中のヘモグロビン)による干渉を回避する波長で、光を吸収するホルマザンを生成しなければならない。結果的に、光源として使用されるLEDにより生成される光などの約640 nmの波長を有する光を吸収するホルマザンを生成する、チアゾリルテトラゾリウム塩のファミリーが開発された。LEDは、わずか±約5 nmしか変化しない狭い範囲の波長を生成する。そのようなチアゾリルテトラゾリウム塩は、たとえば、U.S.特許番号5,126,275;5,322,680;5,300,637;および5,290,536などの、いくつかのU.S.特許に開示される。
【0005】
[0005] ほとんどの生物学的サンプルは、天然で水溶性であり、そのため、指示薬がサンプル中に可溶性であることが望ましい。しかしながら、テトラゾリウム塩の多くは、それほど可溶性ではない。テトラゾリウム塩のある供給業者の一つであるDojindo Laboratoriesは、指示薬分子に対してスルホン酸基を付加することにより、より可溶性にした指示薬の製品ラインを持っている。U.S.特許番号6,063,587および日本公開特許公報JP58113181 A2およびJP58113182 A2を参照。そのテトラゾリウム塩指示薬のWSTシリーズはしばしば、解析的方法を開示する特許において言及される。一例は、U.S.特許番号6,586,199に見いだされる。WSTシリーズのテトラゾリウム塩の可溶性は、約10 mg/水mLと報告されている。可溶性はまた、U.S.特許5, 250,695に開示されるテトラゾリウム塩の特定のスルホネートおよびホスホネート対イオンを使用すると、上昇させることができる。
【0006】
[0006] テトラゾリウム塩指示薬を開示するその他の特許には、EP0476455 B1;US 2004/0132004 A1;WO 98/37157;U.S.特許6,183,878 B1;U.S.特許6,207,292 B1;U.S. 特許6,277,307 B1;DE 21 47 466;U.S. 特許5,185,450;U.S. 特許5,196,314;が含まれる。
【0007】
[0007] 本発明の発明者らは、LEDによりもたらされる入射光に反応して、600〜640 nmの範囲で、そのホルマザンからから相対的に平坦なスペクトル感度を提供する能力を有したまま、チアゾリルテトラゾリウム塩の可溶性を向上させようとした。以下の本発明の記載にも示される様に、彼らは、所望のスペクトル感度を維持しながら、より高い可溶性を有するチアゾリルテトラゾリウム塩を提供することに成功した。
【0008】
発明の概要
[0008] 本発明には、新規チアゾリルテトラゾリウム塩が含まれる。いくつかは、特許にかかる関連するチアゾリルテトラゾリウム塩よりも、より高い水溶性を有していることが乱された。可溶性を向上させることは、生物学的サンプル中の分析物(たとえば、血液サンプル中のグルコース)を測定するために使用される試験ストリップに対して、それらをより容易に適応させる。テトラゾリウム塩は、可溶性を高めるアルキルアンモニウムアルコキシ置換基を有することにより特徴づけられる。一態様に従って、テトラゾリウム塩は、以下の式により定義される:
【0009】
【化1】

【0010】
式中:
A=対イオン
X=1〜6 Cアルキルまたはヘテロアルキル
a=1〜3
b=0〜3
R1=1〜6 Cアルキル
R2およびR3の一方がアルキルであり、そして他方がXN+Hb(R1)3-bであるか、R2およびR3がメチレンジオキシ基を形成し、
R4またはR5の一方がハロゲンであり、そして他方がハロゲン置換1〜6 Cアルキルであるか、R4およびR5の一方または両方がXN+Hb(R1)3-bであるか、または
R4およびR5は一緒になって、芳香環またはヘテロ芳香環、または置換芳香環または置換ヘテロ芳香環を形成する。
【0011】
[0009] 上記に示した式は、新規のチアゾリルテトラゾリウム塩を示す。すなわち、それらは、2窒素位でテトラゾリウム環に結合するチアゾール環を含有する。さらに、それらのそれぞれは、3窒素位で結合するフェニル環を有し、そしてテトラゾリウム環の5位で結合される別のフェニル環を有する。本明細書中においてHTC-045と表記される特許にかかるチアゾリルテトラゾリウム塩と比較して高い可溶性が、1またはそれ以上のアルキルアンモニウムアルコキシ基をチアゾリルテトラゾリウム塩に結合させることにより達成される。アルキルアンモニウムアルコキシ基は、R4および/またはR5としてのチアゾリル環に対して結合してもよく、またはR4およびR5により形成される芳香環またはヘテロ芳香環上で置換されてもよい。好ましい態様において、アルキルアンモニウムアルコキシ基は、テトラゾリウム環に対して結合したフェニル環上の置換基である。より好ましい態様において、アルキルアンモニウムアルコキシ基は、トリアルキルアンモニウムプロポキシである、ベンゾチアゾリルテトラゾリウム塩は、高い溶解度を有する好ましい化合物である。
【0012】
[00010] 本発明の別の側面において、チアゾリルテトラゾリウム塩を、発色指示薬として使用して、酵素を使用して分析物を酸化する生物学的サンプルの解析において、たとえば血液のグルコース含量の測定において、還元性基質(たとえば、NADH)の存在を検出する。
【0013】
好ましい態様の記載
定義
以下の定義は、本発明のチアゾリルテトラゾリウム塩の置換基に対して適用される。
“1〜6 C” - 1〜6個の炭素原子を有する基を意味する。
“アルキル” - 一般式がCnH2n+1である直鎖または分岐鎖炭化水素基を意味する。
“ヘテロアルキル” - 隣接する炭素原子に結合するヘテロ原子を含有する、直鎖および分岐鎖炭化水素基を意味する。
“アルコキシ” - 基-OR〔式中、Rはアルキルである〕を意味する。
“メチレンジオキシ” - 式-O-CH2-O-の二価の基を意味する。
“ハロゲン” - フッ素、塩素、ヨウ素、および臭素を意味する。
【0014】
“ハロゲン置換1〜6 Cアルキル” - 一般式CnH2n-1Y2〔式中Yはハロゲンである〕を有する、直鎖または分岐鎖の基を意味する。
“芳香環” - ベンゼン環またはナフタレン環を意味する。
“ヘテロ芳香環” - ピリジン環またはキノリン環を意味する。
“対イオン” - テトラゾリウム塩(たとえば、ニトレート、ホスフェート、ハイドロゲン・ホスフェート、ダイハイドロゲン・ホスフェート、ハイドロゲン・サルフェート、サルフェート、ハイドロゲン・カーボネート、カーボネート、メタンスルホネート、フルオロホウ酸、臭化物、塩化物、ヨウ化物、またはこれらの組み合わせ)を調製する際に使用される試薬に由来するイオン基を意味する。
“tet塩” - テトラゾリウム塩の略語を意味する。
【0015】
チアゾリルテトラゾリウム塩
[00016] U.S.特許5,126,275中に開示されるように、チアゾリルテトラゾリウム塩由来のホルマザンは、約600〜650 nmより高い広範囲のプラトーを示す反射スペクトルを有することにより特徴づけられ、それはLEDを光源として使用する装置において有用である。サンプルを、サンプル中に存在する分析物の量を示す色を生成する反応システムと接触させる。被検領域から戻ってくるを検出し、そして光分析物含量と相関させた。一つの重要な例において、NADの存在下におけるグルコースデヒドロゲナーゼは、血液サンプル中のグルコースの酸化を触媒する。還元されたNADHは、テトラゾリウム塩のホルマザンへの還元を触媒する、ジアホラーゼなどの酵素メディエータにより、再酸化される。生成される色の変化は、グルコースの酸化から生成されるNADHの量に対して比例し、そしてサンプル中に存在するグルコースの量に間接的に比例する。チアゾリルテトラゾリウム塩から発色ホルマザンへの変換に由来する色の変化は、それを光源に対して暴露することにより測定することができる。発色試験領域から戻ってくる光が検出され、そして適切なアルゴリズムにより、サンプル中の分析物の量に変換される。NAD-NADHに関してここで記載されたが、本発明のテトラゾリウム塩は、その他の補因子(たとえば、PQQおよびFAD)を有するデヒドロゲナーゼ酵素とともにそれらを使用することを含む、幅広い用途を有する。
【0016】
[00017] チアゾリルテトラゾリウム塩およびそれらの対応するホルマザンが、分析物を検出するために使用される試験ストリップに適用される反応混合物中に可溶性でなければならないため、600〜640 nmの範囲において相対的に平坦な反射スペクトルを有するホルマザンを提供するそれらの能力を維持しながら、チアゾールテトラゾリウム塩の溶解性を向上させることが、本発明者らの目的であった。本発明の発明者らは、それらの目的を果たす化合物を含む、新規のチアゾリルテトラゾリウム塩のファミリーを見いだした。これらの塩は、以下の一般式により示される:
【0017】
【化2】

【0018】
式中:
A=対イオン
X=1〜6 Cアルキルまたはヘテロアルキル
a=1〜3
b=0〜3
R1=1〜6 Cアルキル
R2およびR3の一方がアルキルであり、そして他方がXN+Hb(R1)3-bであるか、またはR2およびR3がメチレンジオキシ基を形成する
R4またはR5の一方がハロゲンであり、そして他方がハロゲン置換1〜6 Cアルキルであるか、R4およびR5の一方または両方がXN+Hb(R1)3-bであるか、または
R4およびR5が一緒になって芳香環またはヘテロ芳香環を形成するか、または置換芳香環または置換ヘテロ芳香環を形成する。
【0019】
[00018] 本発明のテトラゾリウム塩は、特に興味深い以下の式中に示される様な、置換チアゾリルテトラゾリウム塩および置換ベンゾチアゾリルテトラゾリウム塩に分離されてもよい。
【0020】
【化3】

【0021】
式中:
A=対イオン
X=1〜6 Cアルキル
a=1〜3
b=0〜3
R1=1〜3 Cアルキル
R2およびR3の一方が1〜4 Cアルキルであり、そして他方がXN+Hb(R1)3-bであるか、またはR2およびR3がメチレンジオキシ基として一緒になる
R4=CHF2
R5=ハロゲンである。
【0022】
【化4】

【0023】
A=対イオン
X=1〜6 Cアルキル
a=1〜3
b=0〜3
R1=1〜3 Cアルキル
R2およびR3の一方が1〜4 Cアルキルであり、そして他方がXN+Hb(R1)3-bであるか、またはR2およびR3がメチレンジオキシ基として一緒になる
R4およびR5がH3であるか、またはR4およびR5が一緒になって芳香環を形成する
R6=1〜4 Cアルコキシ、水素、またはハロゲンである。
【0024】
[00019] これらの化合物(IおよびII)の溶解性は、以下の実施例において示される。チアゾリルテトラゾリウム塩の溶解性を高めることは、試験結果を得るために必要とされる時間を短縮し、そして高い分析物レベルでよりよい直線性をもたらす。同様に、水溶性が上昇すると、1試薬混合物(one-reagent mixture)を製剤化することが容易になり、それによりより簡単にそして安価に製造することができる。
【0025】
本発明のテトラゾリウム塩の製造方法
[00020] U.S.特許5,126,275において、チアゾリルテトラゾリウム塩を製造する方法が記載される。この方法は、ヒドラゾンをジアゾ化アニリンと反応させて、ホルマザンを生成し、それがその後酸化されてテトラゾリウム塩となることが関連している。本発明の化合物を生成するための記載された新たな方法は、化合物IおよびIIの好ましいテトラゾリウム塩中に、1つの極性基(スキーム1)または2つの極性基(スキーム2)を導入する様に開発された。図1および2は、これら2種類の方法を記載する。以下の実施例は、この発明をさらに説明する。
【0026】
[00021] スキーム1を使用して、テトラゾリウム環の5位のフェニル置換基が、メチレンジオキシ置換基を有する、テトラゾリウム塩を生成する。スキーム1において、トリメチルアンモニウムプロポキシ基が、テトラゾリウム環の3位でフェニル置換基上で置換される。スキーム1において、O-ニトロフェノールを3-ブロモプロピルトリメチルアンモニウム臭化物と反応させて、3-(2-ニトロフェノキシ)プロピルトリメチルアンモニウム臭化物を形成し、その後それに水素添加して、等量のアニリンとする。その化合物とメチレンジオキシ置換基による置換チアゾリル環およびフェニル環を含有するヒドラジンとの反応により、ホルマザンが得られる。次いで、ホルマザンが酸化されて、テトラゾリウム塩になる。ヒドラジンは、置換ベンズアルデヒドのテトラゾリウム塩のための所望の置換基を含有する置換ヒドラジンとの反応から形成される。
【0027】
[00022] スキーム2を使用して、テトラゾリウム環の5位のフェニル置換基が、3位または4位のいずれか(または両方)で置換されたトリメチルアンモニウムプロポキシ基を有する、テトラゾリウム塩を生成する。スキーム1におけるように、トリメチルアンモニウムプロポキシ基が、テトラゾリウム環の3位でフェニル置換基上に置換される。スキーム2において、4-ヒドロキシ-3メトキシベンズアルデヒドを3-ブロモプロピルトリメチルアンモニウム臭化物と反応させて、トリメチルアンモニウムプロポキシ基をベンズアルデヒドに付加する。生成物を置換ヒドラジンと反応させて、ヒドラゾンを生成する。ヒドラジンをスキーム1の第一工程において生成された3-(2-アミノフェノキシ)プロピルトリメチルアンモニウム臭化物と反応させて、ホルマザンを生成し、これがテトラゾリウム塩に変換される。
【0028】
[00023] 以下の結果において、溶解性は、テトラゾリウム塩に結合する対イオンにより影響されるようであることが示される。対イオンは、プロセスにおいて使用される試薬に由来し、そして好ましい対イオンを提供する様に様々であってもよい。あるいは、対イオンを、たとえばイオン交換法により、置換することができる。
【0029】
[00024] 以下の限定的ではない例において、各工程の生成物を分光光度法により同定し、そしてその結果を各生成物について呈示した。
【実施例】
【0030】
実施例1
5-ベンゾ[1,3ジオキソル-5-イル]-3-[2-(3-トリメチルアンモニウム)プロポキシ-フェニル]-2-(5-クロロ-4-ジフルオロメチル-チアゾール-2-イル)-2 H-テトラゾリウムブロモ亜硝酸塩の調製
[00025] スキーム1において示される様に、o-ニトロフェノールを3-ブロモプロピルトリメチルアンモニウム臭化物と反応させて、3-(2-ニトロフェノキシ)プロピルトリメチルアンモニウム臭化物を形成し、次いで、それに水素付加をして等量のアニリンとする。アニリンをメチレンジオキシ置換基を有する置換チアゾリル環およびフェニル環を含有するヒドラジンと反応させ、ホルマザンを生成する。次いで、ホルマザンを酸化してテトラゾリウム塩とする。このプロセスは、以下の実施例においてより完全に記載される:窒素下、乾燥した250 mLの一口丸底フラスコ中、DMF(150 mL)中のo-ニトロフェノールの黄色溶液に対して(Aldrich、6.3 g、45 mmol)、炭酸カリウムを添加した(6.6 g、48 mmol)。混合物は、オレンジ色に変わった。10分間攪拌した後、3-ブロモプロピルトリメチルアンモニウム臭化物(Aldrich、12.9 g、45 mmol)を添加した。得られた混合物を125℃にて3時間加熱した。反応混合物を室温まで冷却した後、基を濾過し、そして沈殿物をDMFを用いて洗浄した(2×20 mL)。濾過物をゆっくりとEtOAc(750 mL)に対して添加し、沈殿物を形成させた。得られた混合物を30分間攪拌させた。沈殿物を濾過し、そしてEtOAc:DMF、5:1の溶液で洗浄し(3×100 mL)、次いでEtOAc(100 mL)およびヘキサン(100 mL)で洗浄した。淡黄色固体を5分間風乾した後、生成物をEtOAc:DMF、10:1の溶液(550 mL)に対して添加し、そして1時間攪拌した。固体を濾過し、EtOAc(100 mL)およびヘキサン(100 mL)で洗浄した。得られた固体を濾過して、以下の特性により特定される、淡いベージュ色の生成物を得た(14.54 g、>100%)、mp(178℃〜181℃)。
【0031】
【化5】

【0032】
[00026] 3-(2-ニトロフェノキシ)プロピルトリメチルアンモニウム臭化物(7 g、21.94 mmol)、10%Pd/C(725 mg)、MeOH(70 mL)および水(70 mL)のスラリーを、35 psiで2.5時間、Parr Hydrogenation装置中で水素添加した。30分後、圧力が22 psiまで低下した。得られた混合物を、521セライトのバッドを通して濾過した。黒色の触媒/セライトのパッドを、MeOH(2×10 mL)で洗浄した。濾過物を、減圧下、40〜45℃でロータリーエバポレータで濃縮した。これ以上の留出物が形成されない場合に、淡桃色の溶液を、別のフラスコに移し、そして凍結乾燥により2日間濃縮し、以下のスペクトル特性により特定される、淡いベージュ色のアニリン誘導体(5.92 g、93%)を得た。
【0033】
【化6】

【0034】
[00027] 氷浴中の水(80 ml)中、上述のアニリン誘導体の溶液(7.7 g、26.64 mmol)に対して、濃HCl(7.2 ml)を滴加した。溶液を5分間攪拌した後、水(16 mL)中、亜硝酸ナトリウム(2.2 g、32 mmol)の溶液を滴加した。溶液の色は、淡褐色から黄金に変化した。得られた溶液をwas stirred 30分間攪拌した。ピリジン(400 mL)中、ヒドラジンの溶液(Bayer、9.8 g、27.98 mmol)を、機械的スターラーおよびジャケット付加漏斗(jacketed addition funnel)を装備した3つ口の2リットルフラスコ中で、塩/氷/水浴(-15℃〜-20℃)中、攪拌した。ここで作製されたジアゾ溶液を、氷/水で充たされたジャケット付加漏斗(jacket addition funnel)を介して、ヒドラジン溶液に対して滴加された。最初の数滴の後、反応色は、黄色から濃青色へと変化した。1/3を添加した後、濃青色の反応混合物は非常に粘性になった。添加が完了した際、混合物を30分間攪拌した。次いで、反応物を、氷/水浴を介して3〜5℃に暖めた。反応物を1時間攪拌した。混合物を、MeOH(500 mL)を有する2リットルの丸底フラスコに移した。混合物を濃縮し、ロータリーエバポレータで、減圧条件下、45℃にて、さらなる留出物が形成されなくなるまで濃縮した。MeOH(500 mL)を再び添加し、そして混合物を濃縮した。このプロセスを繰り返した。得られた固体を減圧下で一晩乾燥させた。次いで、フラスコをMeOH(100 mL)ですすぎ、そしてEtOAc(500 mL)で希釈した。このスラリーを、氷/水浴中で30分間攪拌した。生成物を濾過し、そしてEtOAc(100 mL)、冷MeOH(50 mL)、EtOAc(150 mL)およびヘキサン(150 mL)で洗浄した。得られた濃青色の生成物をアンバーボトルに移し、そして減圧下にて乾燥させ、以下のスペクトル特性により特定される、所望のホルマザン(13、11.3 g、67%)を得た。
【0035】
【化7】

【0036】
[00028] 上記のホルマザン(2.16 g、3.4 mmol)、水(1.4 mL)およびTHF(40 mL)の混合物に対して、メタンスルホン酸(0.68 mL、10.24 mmol)を添加した。混合物を5分間攪拌した。次いで、亜硝酸ナトリウム(720 mg、10.24 mmol)を一度に添加した。混合物を3日間攪拌した。このスラリーの色は、濃青色からオレンジ色に変化した。オレンジ色の沈殿物を濾過し、そしてTHF(2×10 mL)で洗浄した。生成物を減圧下にて一晩乾燥させた。次いで、固体をMeOH(80 mL)でスラリー状にし、濾過し、そして残渣をMeOH(2×5 mL)で洗浄した。濾過物をロータリーエバポレータで減圧下、40℃にて濃縮した。得られた生成物を2日間、減圧下にて乾燥させ、以下のスペクトル特性により特定される、オレンジ色のtet塩(2.86 g>100%)をえた。
【0037】
【化8】

【0038】
実施例2
5-ベンゾ[1,3ジオキソル-5-イル]-3-[2-(3-トリメチルアンモニウム)プロポキシ-フェニル]-2-(5-クロロ-4-ジフルオロメチル-チアゾール-2-イル)2 H-テトラゾリウムブロモテトラフルオロボレート塩の調製
[00029] 同一のホルマザンを有する48%テトラヒドロフルオロホウ酸を使用して、所望のオレンジ色のテトラゾリウム塩を得ること以外は、塩を、実施例1に示す様に調製した。
【0039】
【化9】

【0040】
実施例3
5-ベンゾ[1,3ジオキソル-5-イル]-3-[2-(3-ジメチル水素アンモニウム)プロポキシ-フェニル]-2-(5-クロロ-4-ジフルオロメチル-チアゾール-2-イル)-2 H-テトラゾリウムブロモ亜硝酸塩の調製
[00030] 窒素下の乾燥した100 mLの一つ口丸底フラスコ中、DMF(50 mL)中のo-ニトロフェノール(Aldrich、2.1 g、45 mmol)の黄色溶液に対して、炭酸カリウム(4.4 g、32 mmol)を添加した。混合物はオレンジ色に変化した。10分間攪拌した後、3-クロロプロピルジメチルアンモニウム塩化水素(Aldrich、2.4 g、16.5 mmol)を添加した。得られた混合物を125℃で1日加熱した。反応混合物を室温まで冷却した後、残渣を濾過し、そして沈殿物をMeOH(2×10 mL)で洗浄した。濾過物を、5 mLとなるまで、減圧下にて40℃で、濃縮した。次いで、EtOAc(100 mL)を添加した。沈殿物が形成され、そして濾過された。水(100 mL)およびEtOAc(150 mL)を濾過物に対して添加し、レイヤーを混合しそして分離した。水層をEtOAc(3×25 mL)で抽出した。あわせたEtOAc抽出物を飽和食塩水(25 mL)で洗浄し、硫酸マグネシウム(5 g)上で乾燥させ、濾過し、そして濃縮して、黄色油状物(2.55 g、81%)を得た。
【0041】
【化10】

【0042】
[00031] アルキル化ニトロフェノールを実施例1と同様にして処理し、所望のtet塩を得た。
【0043】
【化11】

【0044】
実施例4
5-ベンゾ[1,3ジオキソル-5-イル]-3-[2-(3-トリメチルアンモニウム)プロポキシ-フェニル]-2(ベンゾチアゾール-2-イル)-2 H-テトラゾリウムブロモ亜硝酸塩の調製
[00032] ピペロナール-ベンゾチアゾール-2-イルヒドラジンを、実施例1と同様に3-(2-アミノフェノキシ)プロピルトリメチルアンモニウム臭化物と反応させ、ホルマザンを作製し、それを次いで対応するテトラゾリウム塩に変換した。
【0045】
[00033] ピペロナールベンゾチアゾール-2-イルヒドラジン(Bayer、2.5 g、10.5 mmol)を、実施例1由来のアニリン誘導体(2.85 g、9.6 mmol)と、実施例1においてホルマザンを作製する際に使用した条件と同様の条件下で反応させ、以下のスペクトル特性により特定される、暗紫色固体(4.7 g、82%)を得た。
【0046】
【化12】

【0047】
[00034] 上述のホルマザン(600 mg、1.01 mmol)を、実施例1と同一の条件下にて、テトラゾリウム塩に変換した(870 mg、>100%)。テトラゾリウム塩は、以下のスペクトル特性により特定された。
【0048】
【化13】

【0049】
実施例5
5-ベンゾ[1.3ジオキソル-5-イル]-3-[2-(3-トリメチルアンモニウム)プロポキシ-フェニル1-2-(6-メトキシナフチルチアゾール-2-イル)-2 H-テトラゾリウムブロモ亜硝酸塩の調製
[00035] 6-メトキシ-2-ヒドラジノ-ナフチルチアゾールを、実施例4における2-ヒドラジノ-ベンゾチアゾールの代わりに使用して、適切なヒドラゾンを作製した。次いで、ヒドラジンを同一の条件に供して、所望のホルマザン(44%全体)を得た。
【0050】
【化14】

【0051】
[00036] 氷/塩/水浴中の酢酸(5 mL)およびテトラヒドロフラン(5 mL)の溶液に対して、亜硝酸ナトリウム(143 mg、2.08 mmol)を添加した。10分間攪拌した後、上述のホルマザン(340 mg、.051 mmol)を添加した。1時間後、反応物を室温まで暖め、そして一晩攪拌した。暗えび茶色(dark maroon)混合物を濾過し、そして固体を酢酸(3×5 mL)、酢酸エチル(2×10 mL)、およびヘキサン(10 mL)で洗浄した。濾過物をロータリーエバポレータで30℃で濃縮し、次いで減圧下にて一晩乾燥させた。残渣を酢酸エチル(15 mL)でスラリー化し、落ち着かせてからデカントした。このプロセスを繰り返した。次いで、ヘキサン(10 mL)を添加した。生成物を濾過し、そして乾燥させて、所望のえび茶色(maroon)のtet塩を得た(260 mg、75%)。
【0052】
【化15】

【0053】
実施例6
5-[4-(3-トリメチルアンモニウム)プロポキシ-3-メトキシ-フェニル]-3-[2-(3-トリメチルアンモニウム)プロポキシ-フェニル]-2-(5-クロロ-4-ジフルオロメチル-チアゾール-2-イル)-2 H-テトラゾリウムジブロモ亜硝酸塩の調製
[00037] 4-ヒドロキシ-3-メトキシベンズアルデヒドを、3-ブロモプロピルトリメチルアンモニウム臭化物と反応させて、別のトリメチルアンモニウムプロポキシ置換基を導入した。生成物を5-クロロ-4-ジフルオロメチル-2-ヒドラジノ-チアゾールと反応させて、ヒドラゾンを生成した。ヒドラジンを実施例1に記載したのと同様に、3-(2-アミノフェノキシ)プロピルトリメチルアンモニウム臭化物と反応させて、ホルマザンを生成し、それを対応するテトラゾリウム塩に変換する。4-ヒドロキシ3メトキシ-ベンズアルデヒド(Vanillin、Aldrich、4.56 g、30 mmol)を、実施例1において使用した条件と同一の条件下で、3-ブロモプロピルトリメチルアンモニウム臭化物(8.8 g、34 mmol)でアルキル化し、以下のスペクトル特性により特定される、オフホワイトの生成物(9.73 g、97%)を調製した。
【0054】
【化16】

【0055】
[00038] 上述のアルキル化ベンズアルデヒド(6.8 g、20.5 mmol)および5-クロロ-4-ジフルオロメチル-2-ヒドラジノ-チアゾール(Bayer、3.72 g、18.6 mmol)のMeOH(60 mL)中スラリーに対して、酢酸(0.55 mL)を添加した。このスラリーは5分後にほぼ溶解した。得られた混合物を80℃で一晩加熱した。反応物を室温まで冷却した後、溶液をEtOAc(650 mL)に対してゆっくりと添加した。淡灰色の沈殿物が形成された。混合物を30分間攪拌した。固体を濾過し、そしてEtOAcおよびヘキサンで洗浄した。淡灰色の生成物を別のボトルに移し、そして減圧下で一晩乾燥させて、以下の特性により特定される、所望のヒドラジン(8.7 g、87%)を得た。
【0056】
【化17】

【0057】
[00039] 上述のヒドラジン(7.08 g、13.86 mmol)を、実施例1由来のアニリン誘導体(6 g、20.76 mmol)と、実施例1と同様の条件下で反応させ、以下のスペクトル特性により特定される、濃青色のホルマザン(8.56 g、76%)を得た。
【0058】
【化18】

【0059】
[00040] 上述のホルマザン(2.44 g、3 mmol)を、反応混合物を40℃で15時間加熱したことを除き、実施例1において使用された条件と同様の条件下で、テトラゾリウム塩に変換した。生成物は、以下のスペクトル特性により特定される。
【0060】
【化19】

【0061】
実施例7
5-[4-(3-トリメチルアンモニウム)プロポキシ-3-メトキシ-フェニル])-3-[2-(3-トリメチルアンモニウム)プロポキシ-フェニル]-2-(6-エトキシ-ベンゾチアゾール-2イル)-2 H-テトラゾリウムジブロモ亜硝酸塩の調製
[00041] 6-エトキシ-2-ヒドラジノ-ベンゾチアゾールを、実施例6において作製したアルキル化ベンズアルデヒドと反応させて、ヒドラゾンを形成し、それを次いで、実施例1において作製した置換アニリンと反応させて、ホルマザンを作製した。ホルマザンは、対応するテトラゾリウム塩へと変換された。
【0062】
[00042] 6-エトキシ-2-ヒドラジノ-ベンゾチアゾール(Acros、4.62 g、22 mmol)を、4-(3-トリメチルアンモニウムプロポキシ)-3-メトキシ-ベンズアルデヒドと実施例6における条件と同様の条件下で反応させ、以下の特性により特定される、淡灰色生成物(10.23 g、95%)を得た。
【0063】
【化20】

【0064】
[00043] 上記の様にして調製されたヒドラジン(3.6 g、6.93 mmol)を、実施例1に由来するアニリン(3 g、10.38 mmol)と、溶媒としてピリジンとDMFの3:1混合物を使用した以外は、実施例1において使用された条件と同様の条件下にて反応させ、ホルマザンを調製し、以下のスペクトル特性により特定される、所望の濃青色生成物(3.8 g、66%)を得た。
【0065】
【化21】

【0066】
[00044] 上述のホルマザン(1.24 g、1.5 mmol)を、実施例1において使用された条件と同様の条件下で、テトラゾリウム塩へと変換した(2 g、>100%)。生成物は、以下のスペクトル特性により特定された。
【0067】
【化22】

【0068】
実施例8
5-[4-(3-トリメチルアンモニウム)プロポキシ-3-メトキシ-フェニル]-3-[2-(3-トリメチルアンモニウム)プロポキシ-フェニル]-2-(6-ブロモ-ベンゾチアゾール-2-イル)-2 H-テトラゾリウムジブロモ亜硝酸塩の調製
[00045] 6-ブロモ-2-ヒドラジノ-ベンゾチアゾールを、実施例8における6-エトキシ-2-ヒドラジノ-ベンゾチアゾールの代わりに使用して、適切なヒドラゾンを作製した。次いで、ヒドラジンを同一の条件に供して、所望のホルマザン(44%全体)を得た。
【0069】
【化23】

【0070】
[00046] ホルマザン(322 mg、0.375 mmol)を、反応物を40℃で一晩加熱して、所望のテトラゾリウム塩(478 mg、>100%)を得たこと以外は、実施例8における条件と同一の条件に供し、テトラゾリウム塩を形成した。
【0071】
【化24】

【0072】
実施例9
5-[4-(3-トリメチルアンモニウム)プロポキシ-3-メトキシ-フェニル]-3-[2-(3-トリメチルアンモニウム)プロポキシ-フェニル]-2-(6-エトキシ-ベンゾチアゾール-2-イル)-2 H-テトラゾリウムトリ臭化物塩の調製
[00047] アセトニトリル(15 mL)中のホルマザン(実施例7由来、1.18 gr、1.43 mmol)のスラリーに対して、n-ブロモスクシンイミド(300 mg、1.69 mmol)を室温で添加した。1時間後、すべてが溶解した。3時間後、オレンジ色の沈殿物が形成された。反応物を一晩攪拌した。沈殿物を濾過し、そしてアセトニトリル(3×5 mL)で洗浄した。得られたオレンジ色の生成物を、減圧下にて一晩乾燥させた(1.07 g、83%)。
【0073】
【化25】

【0074】
[00048] 実施例1〜9において作製されたテトラゾリウム塩の溶解性を、0.2 Mホスフェートバッファー、pH約7.5、室温、を、化合物が溶解するまで、既知量の各化合物に添加することにより、測定した。結果を、表1に示す。ここで、これらを、WST-4(Dojindo Laboratoriesのチアゾリルテトラゾリウム塩)、HTC-045(Bayer Corp.のチアゾリルテトラゾリウム塩)および修飾HTC-045〔式中、メトキシ基を3-スルホン酸プロポキシ基により置換した〕を用いて比較する(図3を参照)。
【0075】
[00049]
【0076】
【表1】

【0077】
[00050] トリアルキルアンモニウムプロポキシ置換基をチアゾリルテトラゾリウム塩に対して付加することにより、テトラゾリウム塩の溶解性の向上が得られたが、この向上は、従来技術に基づいても容易には予想されなかった。従来技術は、3-スルホン酸プロポキシ基を分子中に付加することにより、分子の水溶性が亢進されると予想していた。分子中へのスルホン酸基の導入は、Dojindo Laboratoriesにより使用された。しかしながら、3-スルホン酸プロポキシ基のテトラゾリウム環に結合したフェニル基上のメトキシ基への置換(修飾HTC-045、図3を参照)は、HTC-045(21 mM)よりもより低い8 mMの溶解性をもたらした。このように、我々の分子構造においては、この現象は事実ではなかった。我々は、異なる極性基が、水溶性を向上させることを見いだした。しかしながら、その他の予想されなかった効果が、いかに検討したように見いだされた。
【0078】
[00051] トリメチルアンモニウムプロポキシ基のメトキシ基への置換により、溶解性が21 mM(HTC-045)から33 mM(実施例1)へと上昇し、そして第二のトリメチルアンモニウムプロポキシの置換により(実施例6)実質的に溶解性を181 mMまで上昇させた。しかしながら、溶解性は、テトラフルオロホウ酸対イオンを、ニトレートと置換した場合に、実質的に低下した(実施例2を実施例1と比較)。トリメチルアンモニウムプロポキシ基を修飾してジメチルアンモニウムプロポキシ基にした場合の実施例1におけるテトラゾリウム塩の溶解性は、実施例3に記載された。
【0079】
[00052] 2つのトリメチルアンモニウムプロポキシ基を付加することにより得られる溶解性の実質的な増加(実施例6)は、実施例4においても予期せず見いだされた(167 mM)。実施例4では、ただ一つのトリメチルアンモニウムプロポキシ基が含まれたが、置換チアゾリル基は非置換ベンゾチアゾリル基により置換されていた。しかしながら、置換ナフチルチアゾリル基を使用した場合の実施例5において示されるチアゾリル基のさらなる付加が、低い溶解性(5 mM)を有することが見いだされた。実施例7において示される別の予期せぬ結果において、2つのトリメチルアンモニウム基およびベンゾチアゾリル基の付加は、両方とも溶解性を顕著に増大したが、補完作用は何も有さない様であった。実施例7は、167 mMの溶解性を有していた。
【0080】
[00053] 溶解性の別の実質的な増大は、実施例7のベンゾチアゾリル基のエトキシ基を、実施例8においてブロモ基により置換した場合に得られた。溶解性は、169 mMから本明細書で示された最高値である290 mMに上昇した。実施例7の対イオン、ニトレートイオン、が実施例9において臭化物イオンにより置換された場合に、同様の結果が見いだされた。溶解性は、169 mMから260 mMに上昇した。臭素が含まれることが、テトラゾリウム塩のこのファミリーの溶解性を向上させる有効な手段である様である。
【0081】
[00054] 調製されそして溶解性について試験された化合物は、いくらか異なるスペクトル特性を有した。テトラゾリウム塩から形成され、そして表1において溶解性について試験された各ホルマザンの吸収スペクトルは、Hewlett Packard Model 8453ダイオード-アレイUV-可視化分光光度計を用いて測定された。100μMのテトラゾリウム塩溶液を、100 mMリン酸カリウムバッファー中で調製した。ホルマザンのスペクトルは、5倍過剰量のアスコルビン酸塩を添加して、tet塩をそれらのホルマザンへと変換した後に、測定した。結果は、図5aおよびbに提示する。
【0082】
[00055] 以前に記載したように、チアゾリルテトラゾリウム塩由来のホルマザンは、約640 nMの波長で光を吸収するようになっており、そして平坦な反応が望まれる。図5aおよびbの両方において、HTC-045の吸収とWST-4の吸収を比較のためにプロットした。WST-4は、約560 nMの範囲においてピーク吸収を示す一方、HTC-045は、約460 nM〜660 nMのあいだで、比較的平坦な吸収を示す。しかしながら、その溶解性は、WST-4よりも低い。トリメチルアンモニウムプロポキシ基を付加することにより、スペクトル曲線が変化した。実施例1、2、3、4、6、7、および8は、HTC-045よりも低い吸光度を有しており、しかしながら曲線は、示される範囲全体で比較的平坦であった。ナフチルチアゾリル基を含む実施例5のtet塩は、溶解性が低かっただけではなく、波長曲線に対して上昇する吸光度を示し、HTC-045または実施例1、2、3、4、6、7、および8の修飾化合物に匹敵する平坦な領域は示さない様である。実施例9は、400〜640 nMの間で、比較的平坦な反応を有し、同時に高い溶解性を有するスペクトル曲線を示した。
【0083】
[00056] 理想的には、テトラゾリウム塩は、幅広い範囲の波長で高い吸光度を有するホルマザンを得るべきであり、それにより、分析物が反応する際に発色される色を、容易にそして確実に、測定することができる。そのため、相対的に平坦な曲線がもっとも望ましい。試験されたtet塩から得られたホルマザンの溶解性から見ることができるように、おそらくは実施例5以外のこれらのすべては、有用な指示薬としての見込みを示す。実施例5のテトラゾリウム塩は新規の化合物であり、そして指示薬として使用することができたが、しかしより均質なスペクトル曲線およびより高い溶解性を有する化合物よりも好ましい訳ではなかった。
【0084】
テトラゾリウム塩の使用
[00057] テトラゾリウム塩が多くの用途のために有用な指示薬である一方、それらは生物学的サンプル中の分析物を測定するために使用される試験ストリップにおいて使用される場合に、特に有益である。一つの重要な用途は、血液のグルコース含量を測定する際の用途である。
【0085】
[00058] 試験ストリップは、典型的には、キャリアおよび試薬組成物を含む。試薬(たとえば、グルコースデヒドロゲナーゼ)および補因子(たとえば、NADまたはPQQ)は、生物学的サンプル中の分析物(たとえば、グルコース)と反応し、メディエータ(たとえば、PMSまたは酵素ジアホラーゼ)は、チアゾリルテトラゾリウム塩を還元して、その対応する色のホルマザンとする。得られた色は、通常は、その目的のために設計された測定装置においてもっとも正確に測定される。光源(たとえば、LED)は、試験ストリップ上に入射光を供給する。試験ストリップから反射された光を、光検出器で測定し、そして反応された分析物の量と相関させる。
【0086】
[00059] 本発明のチアゾリルテトラゾリウム指示薬は、U.S.特許5,126,275およびそれよりも前に言及されたその他の文献において開示された指示薬から利用可能である、幅広いスペクトルをもたらす。しかしながら、実施例において示される様に、新規のチアゾリルテトラゾリウム指示薬の多くは、HTC-045と比較して溶解性が向上しており、それによりより迅速な試験時間およびより正確な結果がもたらされる。
【0087】
本発明は、以下の代替態様にまとめられる。
[00060] 代替実施形態A
以下の式:
【0088】
【化26】

【0089】
〔式中:
A=対イオンであり、
a=1〜3であり、
b=0〜3であり、
X=1〜6 Cアルキルまたはヘテロアルキルであり、
R1=1〜6 Cアルキルであり、
R2およびR3の一方がアルキルであり、そして他方がXN+Hb(R1)3-bであるか、またはR2およびR3がメチレンジオキシ基を形成し、
R4およびR5の一方がハロゲンであり、そして他方がハロゲン置換1〜6 Cアルキルであるか、R4およびR5の一方または両方がXN+Hb(R1)3-bであるか、またはR4およびR5が一緒になって芳香環またはヘテロ芳香環、または置換芳香環または置換ヘテロ芳香環を形成する〕
を有する、化合物。
【0090】
[00061] 代替実施形態B
以下の式:
【0091】
【化27】

【0092】
〔式中:
A=対イオンであり、
X=1〜6 Cアルキルであり、
a=1〜3であり、
b=0〜3であり、
R1=1〜3 Cアルキルであり、
R2およびR3の一方が1〜4 Cアルキルであり、そして他方がXN+Hb(R1)3-bであるか、またはR2およびR3がメチレンジオキシ基を形成し、
R4=CHF2であり
R5=ハロゲンである〕
を有する、代替実施形態Aに記載の化合物。
【0093】
[00062] 代替実施形態C
式中、
Xがプロピルであり、
bがゼロであり、
R1がメチルであり、
R2およびR3がメチレンジオキシ基を形成し、
R4がCHF2であり、
R5がClである、
代替実施形態Bに記載の化合物。
【0094】
[00063] 代替実施形態D
式中、
Xがプロピルであり、
bが1であり、
R1がメチルであり、
R2およびR3がメチレンジオキシ基を形成し、
R4がCHF2であり、
R5がClである、
代替実施形態Bに記載の化合物。
【0095】
[00064] 代替実施形態E
式中、
Xがプロピルであり、
bがゼロであり、
R1がメチルであり、
R2がトリメチルアンモニウムプロピルであり、
R3がメトキシであり、
R4がCHF2であり、
R5がClである、
代替実施形態Bに記載の化合物。
【0096】
[00065] 代替実施形態F
以下の式
【0097】
【化28】

【0098】
〔式中:
a=1〜3であり、
A=対イオンであり、
X=1〜6 Cアルキルであり、
b=0〜3であり、
R1=1〜3 Cアルキルであり、
R2およびR3の一方がアルキルであり、そして他方がXN+Hb(R1)3-bであるか、またはR2およびR3がメチレンジオキシ基を形成し、
R4およびR5の一方がハロゲンであり、そして他方がハロゲン置換1〜6 Cアルキルであるか、またはR4およびR5が水素であり、
R6=1〜4 Cアルコキシ、水素、またはハロゲンである〕
を有する、代替実施形態Aに記載の化合物。
【0099】
[00066] 代替実施形態G
式中、
Xがプロピルであり、
bがゼロであり、
R1がメチルであり、
R2がトリメチルアンモニウムプロピルであり、
R3がメトキシであり、
R4、R5、およびR6が水素である、
代替実施形態Fに記載の化合物。
【0100】
[00067] 代替実施形態H
式中、
Xがプロピルであり、
R1がメチルであり、
bがゼロであり、
R2がトリメチルアンモニウムプロピルであり、
R3がメチルであり、
R4およびR5が芳香環を形成し、
R6がメトキシである、
代替実施形態Fに記載の化合物。
【0101】
[00068] 代替実施形態I
式中、
Xがプロピルであり、
bがゼロであり、
R1がメチルであり、
R2がトリメチルアンモニウムプロピルであり、
R3がメチルであり、
R4およびR5が水素であり、
R6がエトキシである、
代替実施形態Fに記載の化合物。
【0102】
[00069] 代替実施形態J
式中、
Xがプロピルであり、
bがゼロであり、
R1がメチルであり、
R2がトリメチルアンモニウムプロピルであり、
R3がメチルであり、
R4およびR5が水素であり、
R6がブロムである、
代替実施形態Fに記載の化合物。
【0103】
[00070] 代替実施形態K
少なくとも1つの対イオンが、ニトレート、ホスフェート、ハイドロゲン・ホスフェート、ダイハイドロゲン・ホスフェート、ハイドロゲン・サルフェート、サルフェート、ハイドロゲン・カーボネート、カーボネート、メタンスルホネート、フルオロボレート、臭化物、塩化物、ヨウ化物、またはこれらの組み合わせである、代替実施形態Aに記載の化合物。
【0104】
[00071] 代替プロセスL
以下の式
【0105】
【化29】

【0106】
〔式中:
A=対イオンであり、
a=1〜3であり、
b=0〜3であり、
X=1〜6 Cアルキルまたはヘテロアルキルであり、
R1=1〜6 Cアルキルであり、
R2およびR3の一方がアルキルであり、もう一方がXN+Hb(R1)3-bであるか、またはR2およびR3がメチレンジオキシ基を形成し、
R4およびR5の一方がハロゲンであり、もう一方がハロゲン置換1〜6 Cアルキルであるか、R4およびR5の一方または両方がXN+Hb(R1)3-bであるか、またはR4およびR5が一緒になって芳香環またはヘテロ芳香環または置換芳香環または置換ヘテロ芳香環を形成する〕
を有するテトラゾリウム塩を指示薬として提供すること;そして
生体液中の分析物の濃度を、指示薬としてのテトラゾリウム塩を用いて決定すること;
を含む、生体液中に含有される、反応に際して比例する色の変化を生成する様に構成される分析物を測定する方法。
【0107】
[00072] 代替プロセスM
分析物がグルコースである、代替プロセスLに記載の方法。
[00073] 代替プロセスN
生体液が全血液である、代替プロセスMに記載の方法。
【0108】
[00074] 代替プロセスO
テトラゾリウム塩が以下の式:
【0109】
【化30】

【0110】
〔式中:
A=対イオンであり、
X=1〜6 Cアルキルであり、
a=1〜3であり、
b=0〜3であり、
R1=1〜3 Cアルキルであり、
R2およびR3の一方が1〜4 Cアルキルであり、そして他方がXN+Hb(R1)3-bであるか、またはR2およびR3がメチレンジオキシ基を形成し、
R4=CHF2であり、
R5=ハロゲンである〕
を有する、代替プロセスMに記載の方法。
【0111】
[00075] 代替プロセスP
Xがプロピルであり、
bがゼロであり、
R1がメチルであり、
R2およびR3がメチレンジオキシ基を形成し、
R4がCHF2であり、
R5がClである、
代替プロセスOに記載の方法。
【0112】
[00076] 代替プロセスQ
Xがプロピルであり、
bが1であり、
R1がメチルであり、
R2およびR3がメチレンジオキシ基を形成し、
R4がCHF2であり、
R5がClである、
代替プロセスOに記載の方法。
【0113】
[00077] 代替プロセスR
Xがプロピルであり、
bがゼロであり、
R1がメチルであり、
R2がトリメチルアンモニウムプロピルであり、
R3がメトキシであり、
R4がCHF2であり、
R5がClである、
代替プロセスOに記載の方法。
【0114】
[00078] 代替プロセスS
以下の式
【0115】
【化31】

【0116】
〔式中:
a=1〜3であり、
A=対イオンであり、
X=1〜6 Cアルキルであり、
b=0〜3であり、
R1=1〜3 Cアルキルであり、
R2およびR3の一方がアルキルであり、そして他方がXN+Hb(R1)3-bであるか、またはR2およびR3がメチレンジオキシ基を形成し、
R4およびR5の一方がハロゲンであり、そして他方がハロゲン置換1〜6 Cアルキルであるか、またはR4およびR5が水素であり、
R6=1〜4 Cアルコキシ、水素、またはハロゲンである〕
を有する、代替プロセスLに記載の方法。
【0117】
[00079] 代替プロセスT
Xがプロピルであり、
bがゼロであり、
R1がメチルであり、
R2がトリメチルアンモニウムプロピルであり、
R3がメトキシであり、
R4、R5、およびR6が水素である、
代替プロセスSに記載の方法。
【0118】
[00080] 代替プロセスU
Xがプロピルであり、
R1がメチルであり、
bがゼロであり、
R2がトリメチルアンモニウムプロピルであり、
R3がメチルであり、
R4およびR5が芳香環を形成し、
R6がメトキシである、
代替プロセスSに記載の方法。
【0119】
[00081] 代替プロセスV
Xがプロピルであり、
bがゼロであり、
R1がメチルであり、
R2がトリメチルアンモニウムプロピルであり、
R3がメチルであり、
R4およびR5が水素であり、
R6がエトキシである、
代替プロセスSに記載の方法。
【0120】
[00082] 代替プロセスW
Xがプロピルであり、
bがゼロであり、
R1がメチルであり、
R2がトリメチルアンモニウムプロピルであり、
R3がメチルであり、
R4およびR5が水素であり、
R6が臭素である、
代替プロセスSに記載の方法。
【0121】
[00083] 代替プロセスX
少なくとも1つの対イオンが、ニトレート、ホスフェート、ハイドロゲン・ホスフェート、ダイハイドロゲン・ホスフェート、ハイドロゲン・サルフェート、サルフェート、ハイドロゲン・カーボネート、カーボネート、メタンスルホネート、フルオロボレート、臭化物、塩化物、ヨウ化物、またはこれらの組み合わせである、代替プロセスLに記載の方法。
【0122】
[00084] 代替プロセスY
少なくとも1つの置換基としてのトリアルキルアンモニウムアルコキシ基を、チアゾリルテトラゾリウム塩に対して付加することを含む、テトラゾリウム環の第3の窒素原子で結合したチアゾリル基を有するチアゾリルテトラゾリウム塩の可溶性を増大させる方法。
【0123】
[00085] 代替プロセスZ
チアゾリルテトラゾリウム塩が、テトラゾリウム環の第3の窒素原子および炭素原子において、フェニル置換基を有する、代替プロセスYに記載の方法。
【0124】
[00086] 代替プロセスAA
少なくとも1つのトリアルキルアンモニウムアルコキシ基が、トリメチルアンモニウムプロポキシ基である、代替プロセスZに記載の方法。
【0125】
[00087] 代替プロセスBB
少なくとも1つのトリアルキルアンモニウムアルコキシ基が、フェニル基の置換基である、代替プロセスZに記載の方法。
【0126】
[00088] 代替プロセスCC
少なくとも1つのトリアルキルアンモニウムアルコキシ基が、両方のフェニル置換基の置換基である、代替プロセスZに記載の方法。
【0127】
[00089] 代替プロセスDD
チアゾリル基が、ベンゾチアゾリル基である、代替プロセスZに記載の方法。
[00090] 代替プロセスEE
チアゾリルテトラゾリウム塩が、ニトレート、ホスフェート、ハイドロゲン・ホスフェート、ダイハイドロゲン・ホスフェート、ハイドロゲン・サルフェート、サルフェート、ハイドロゲン・カーボネート、カーボネート、メタンスルホネート、フルオロボレート、臭化物、塩化物、ヨウ化物、またはこれらの組み合わせの対イオンを有する、代替プロセスZに記載の方法。
【0128】
[00091] 代替プロセスFF
対イオンが、ブロモニトレート、ジブロモニトレート、またはトリ臭化物である、代替プロセスEEに記載の方法。
【図面の簡単な説明】
【0129】
【図1】[00011] 図1は、実施例の化合物を調製する第一の方法の図である。
【図2】[00012] 図2は、実施例の化合物を調製する第二の方法の図である。
【図3】[00013] 図3は、実施例において報告された比較化合物を示す。
【図4】[00014] 図4a〜bは、実施例において作製された本願発明の化合物を示す。
【図5a】[00015] 図5aおよび図5bは、テトラゾリウム塩の吸光度対光の波長のプロットである。
【図5b】[00015] 図5aおよび図5bは、テトラゾリウム塩の吸光度対光の波長のプロットである。
【特許請求の範囲】
【請求項1】
以下の式:
【化1】

〔式中:
A=対イオンであり、
a=1-3であり、
b=0-3であり、
X=1-6 Cアルキルまたはヘテロアルキルであり、
R1=1-6 Cアルキルであり、
R2およびR3の一方がアルキルであり、そして他方がXN+Hb(R1)3-bであるか、またはR2およびR3がメチレンジオキシ基を形成し、
R4およびR5の一方がハロゲンであり、そして他方がハロゲン置換1-6 Cアルキルであるか、R4およびR5の一方または両方がXN+Hb(R1)3-bであるか、またはR4およびR5が一緒になって芳香環またはヘテロ芳香環、または置換芳香環または置換ヘテロ芳香環を形成する〕
を有する、化合物。
【請求項2】
以下の式:
【化2】

〔式中:
A=対イオンであり、
X=1-6 Cアルキルであり、
a=1-3であり、
b=0-3であり、
R1=1-3 Cアルキルであり、
R2およびR3の一方が1-4 Cアルキルであり、そして他方がXN+Hb(R1)3-bであるか、またはR2およびR3がメチレンジオキシ基を形成し、
R4=CHF2であり
R5=ハロゲンである〕
を有する、請求項1に記載の化合物。
【請求項3】
式中、
Xがプロピルであり、
bがゼロであり、
R1がメチルであり、
R2およびR3がメチレンジオキシ基を形成し、
R4がCHF2であり、
R5がClである、
請求項2に記載の化合物。
【請求項4】
式中、
Xがプロピルであり、
bが1であり、
R1がメチルであり、
R2およびR3がメチレンジオキシ基を形成し、
R4がCHF2であり、
R5がClである、
請求項2に記載の化合物。
【請求項5】
式中、
Xがプロピルであり、
bがゼロであり、
R1がメチルであり、
R2がトリメチルアンモニウムプロピルであり、
R3がメトキシであり、
R4がCHF2であり、
R5がClである、
請求項2に記載の化合物。
【請求項6】
以下の式
【化3】

〔式中:
a=1〜3であり、
A=対イオンであり、
X=1〜6 Cアルキルであり、
b=0〜3であり、
R1=1〜3 Cアルキルであり、
R2およびR3の一方がアルキルであり、そして他方がXN+Hb(R1)3-bであるか、またはR2およびR3がメチレンジオキシ基を形成し、
R4およびR5の一方がハロゲンであり、そして他方がハロゲン置換1〜6 Cアルキルであるか、またはR4およびR5が水素であり、
R6=1〜4 Cアルコキシ、水素、またはハロゲンである〕
を有する、請求項1に記載の化合物。
【請求項7】
式中、
Xがプロピルであり、
bがゼロであり、
R1がメチルであり、
R2がトリメチルアンモニウムプロピルであり、
R3がメトキシであり、
R4、R5、およびR6が水素である、
請求項6に記載の化合物。
【請求項8】
式中、
Xがプロピルであり、
R1がメチルであり、
bがゼロであり、
R2がトリメチルアンモニウムプロピルであり、
R3がメチルであり、
R4およびR5が芳香環を形成し、
R6がメトキシである、
請求項6に記載の化合物。
【請求項9】
式中、
Xがプロピルであり、
bがゼロであり、
R1がメチルであり、
R2がトリメチルアンモニウムプロピルであり、
R3がメチルであり、
R4およびR5が水素であり、
R6がエトキシである、
請求項6に記載の化合物。
【請求項10】
式中、
Xがプロピルであり、
bがゼロであり、
R1がメチルであり、
R2がトリメチルアンモニウムプロピルであり、
R3がメチルであり、
R4およびR5が水素であり、
R6がブロムである、
請求項6に記載の化合物。
【請求項11】
少なくとも1つの対イオンが、ニトレート、ホスフェート、ハイドロゲン・ホスフェート、ダイハイドロゲン・ホスフェート、ハイドロゲン・サルフェート、サルフェート、ハイドロゲン・カーボネート、カーボネート、メタンスルホネート、フルオロボレート、臭化物、塩化物、ヨウ化物、またはこれらの組み合わせである、請求項1に記載の化合物。
【請求項12】
以下の式
【化4】

〔式中:
A=対イオンであり、
a=1〜3であり、
b=0〜3であり、
X=1〜6 Cアルキルまたはヘテロアルキルであり、
R1=1〜6 Cアルキルであり、
R2およびR3の一方がアルキルであり、もう一方がXN+Hb(R1)3-bであるか、またはR2およびR3がメチレンジオキシ基を形成し、
R4およびR5の一方がハロゲンであり、もう一方がハロゲン置換1〜6 Cアルキルであるか、R4およびR5の一方または両方がXN+Hb(R1)3-bであるか、またはR4およびR5が一緒になって芳香環またはヘテロ芳香環または置換芳香環または置換ヘテロ芳香環を形成する〕
を有するテトラゾリウム塩を指示薬として提供すること;そして
生体液中の分析物の濃度を、指示薬としてのテトラゾリウム塩を用いて決定すること;
を含む、生体液中に含有される、反応に際して比例する色の変化を生成する様に構成される分析物を測定する方法。
【請求項13】
分析物がグルコースである、請求項12に記載の方法。
【請求項14】
生体液が全血液である、請求項13に記載の方法。
【請求項15】
テトラゾリウム塩が以下の式:
【化5】

〔式中:
A=対イオンであり、
X=1〜6 Cアルキルであり、
a=1〜3であり、
b=0〜3であり、
R1=1〜3 Cアルキルであり、
R2およびR3の一方が1〜4 Cアルキルであり、そして他方がXN+Hb(R1)3-bであるか、またはR2およびR3がメチレンジオキシ基を形成し、
R4=CHF2であり、
R5=ハロゲンである〕
を有する、請求項13に記載の方法。
【請求項16】
Xがプロピルであり、
bがゼロであり、
R1がメチルであり、
R2およびR3がメチレンジオキシ基を形成し、
R4がCHF2であり、
R5がClである、
請求項15に記載の方法。
【請求項17】
Xがプロピルであり、
bが1であり、
R1がメチルであり、
R2およびR3がメチレンジオキシ基を形成し、
R4がCHF2であり、
R5がClである、
請求項15に記載の方法。
【請求項18】
Xがプロピルであり、
bがゼロであり、
R1がメチルであり、
R2がトリメチルアンモニウムプロピルであり、
R3がメトキシであり、
R4がCHF2であり、
R5がClである、
請求項15に記載の方法。
【請求項19】
以下の式
【化6】

〔式中:
a=1〜3であり、
A=対イオンであり、
X=1〜6 Cアルキルであり、
b=0〜3であり、
R1=1〜3 Cアルキルであり、
R2およびR3の一方がアルキルであり、そして他方がXN+Hb(R1)3-bであるか、またはR2およびR3がメチレンジオキシ基を形成し、
R4およびR5の一方がハロゲンであり、そして他方がハロゲン置換1〜6 Cアルキルであるか、またはR4およびR5が水素であり、
R6=1〜4 Cアルコキシ、水素、またはハロゲンである〕
を有する、請求項12に記載の方法。
【請求項20】
Xがプロピルであり、
bがゼロであり、
R1がメチルであり、
R2がトリメチルアンモニウムプロピルであり、
R3がメトキシであり、
R4、R5、およびR6が水素である、
請求項19に記載の方法。
【請求項21】
Xがプロピルであり、
R1がメチルであり、
bがゼロであり、
R2がトリメチルアンモニウムプロピルであり、
R3がメチルであり、
R4およびR5が芳香環を形成し、
R6がメトキシである、
請求項19に記載の方法。
【請求項22】
Xがプロピルであり、
bがゼロであり、
R1がメチルであり、
R2がトリメチルアンモニウムプロピルであり、
R3がメチルであり、
R4およびR5が水素であり、
R6がエトキシである、
請求項19に記載の方法。
【請求項23】
Xがプロピルであり、
bがゼロであり、
R1がメチルであり、
R2がトリメチルアンモニウムプロピルであり、
R3がメチルであり、
R4およびR5が水素であり、
R6が臭素である、
請求項19に記載の方法。
【請求項24】
少なくとも1つの対イオンが、ニトレート、ホスフェート、ハイドロゲン・ホスフェート、ダイハイドロゲン・ホスフェート、ハイドロゲン・サルフェート、サルフェート、ハイドロゲン・カーボネート、カーボネート、メタンスルホネート、フルオロボレート、臭化物、塩化物、ヨウ化物、またはこれらの組み合わせである、請求項12に記載の方法。
【請求項25】
少なくとも1つの置換基としてのトリアルキルアンモニウムアルコキシ基を、チアゾリルテトラゾリウム塩に対して付加することを含む、テトラゾリウム環の第3の窒素原子で結合したチアゾリル基を有するチアゾリルテトラゾリウム塩の可溶性を増大させる方法。
【請求項26】
チアゾリルテトラゾリウム塩が、テトラゾリウム環の第3の窒素原子および炭素原子において、フェニル置換基を有する、請求項25に記載の方法。
【請求項27】
少なくとも1つのトリアルキルアンモニウムアルコキシ基が、トリメチルアンモニウムプロポキシ基である、請求項26に記載の方法。
【請求項28】
少なくとも1つのトリアルキルアンモニウムアルコキシ基が、フェニル基の置換基である、請求項26に記載の方法。
【請求項29】
少なくとも1つのトリアルキルアンモニウムアルコキシ基が、両方のフェニル置換基の置換基である、請求項26に記載の方法。
【請求項30】
チアゾリル基が、ベンゾチアゾリル基である、請求項25に記載の方法。
【請求項31】
チアゾリルテトラゾリウム塩が、ニトレート、ホスフェート、ハイドロゲン・ホスフェート、ダイハイドロゲン・ホスフェート、ハイドロゲン・サルフェート、サルフェート、ハイドロゲン・カーボネート、カーボネート、メタンスルホネート、フルオロボレート、臭化物、塩化物、ヨウ化物、またはこれらの組み合わせの対イオンを有する、請求項25に記載の方法。
【請求項32】
対イオンが、ブロモニトレート、ジブロモニトレート、またはトリ臭化物である、請求項31に記載の方法。
【請求項1】
以下の式:
【化1】

〔式中:
A=対イオンであり、
a=1-3であり、
b=0-3であり、
X=1-6 Cアルキルまたはヘテロアルキルであり、
R1=1-6 Cアルキルであり、
R2およびR3の一方がアルキルであり、そして他方がXN+Hb(R1)3-bであるか、またはR2およびR3がメチレンジオキシ基を形成し、
R4およびR5の一方がハロゲンであり、そして他方がハロゲン置換1-6 Cアルキルであるか、R4およびR5の一方または両方がXN+Hb(R1)3-bであるか、またはR4およびR5が一緒になって芳香環またはヘテロ芳香環、または置換芳香環または置換ヘテロ芳香環を形成する〕
を有する、化合物。
【請求項2】
以下の式:
【化2】

〔式中:
A=対イオンであり、
X=1-6 Cアルキルであり、
a=1-3であり、
b=0-3であり、
R1=1-3 Cアルキルであり、
R2およびR3の一方が1-4 Cアルキルであり、そして他方がXN+Hb(R1)3-bであるか、またはR2およびR3がメチレンジオキシ基を形成し、
R4=CHF2であり
R5=ハロゲンである〕
を有する、請求項1に記載の化合物。
【請求項3】
式中、
Xがプロピルであり、
bがゼロであり、
R1がメチルであり、
R2およびR3がメチレンジオキシ基を形成し、
R4がCHF2であり、
R5がClである、
請求項2に記載の化合物。
【請求項4】
式中、
Xがプロピルであり、
bが1であり、
R1がメチルであり、
R2およびR3がメチレンジオキシ基を形成し、
R4がCHF2であり、
R5がClである、
請求項2に記載の化合物。
【請求項5】
式中、
Xがプロピルであり、
bがゼロであり、
R1がメチルであり、
R2がトリメチルアンモニウムプロピルであり、
R3がメトキシであり、
R4がCHF2であり、
R5がClである、
請求項2に記載の化合物。
【請求項6】
以下の式
【化3】

〔式中:
a=1〜3であり、
A=対イオンであり、
X=1〜6 Cアルキルであり、
b=0〜3であり、
R1=1〜3 Cアルキルであり、
R2およびR3の一方がアルキルであり、そして他方がXN+Hb(R1)3-bであるか、またはR2およびR3がメチレンジオキシ基を形成し、
R4およびR5の一方がハロゲンであり、そして他方がハロゲン置換1〜6 Cアルキルであるか、またはR4およびR5が水素であり、
R6=1〜4 Cアルコキシ、水素、またはハロゲンである〕
を有する、請求項1に記載の化合物。
【請求項7】
式中、
Xがプロピルであり、
bがゼロであり、
R1がメチルであり、
R2がトリメチルアンモニウムプロピルであり、
R3がメトキシであり、
R4、R5、およびR6が水素である、
請求項6に記載の化合物。
【請求項8】
式中、
Xがプロピルであり、
R1がメチルであり、
bがゼロであり、
R2がトリメチルアンモニウムプロピルであり、
R3がメチルであり、
R4およびR5が芳香環を形成し、
R6がメトキシである、
請求項6に記載の化合物。
【請求項9】
式中、
Xがプロピルであり、
bがゼロであり、
R1がメチルであり、
R2がトリメチルアンモニウムプロピルであり、
R3がメチルであり、
R4およびR5が水素であり、
R6がエトキシである、
請求項6に記載の化合物。
【請求項10】
式中、
Xがプロピルであり、
bがゼロであり、
R1がメチルであり、
R2がトリメチルアンモニウムプロピルであり、
R3がメチルであり、
R4およびR5が水素であり、
R6がブロムである、
請求項6に記載の化合物。
【請求項11】
少なくとも1つの対イオンが、ニトレート、ホスフェート、ハイドロゲン・ホスフェート、ダイハイドロゲン・ホスフェート、ハイドロゲン・サルフェート、サルフェート、ハイドロゲン・カーボネート、カーボネート、メタンスルホネート、フルオロボレート、臭化物、塩化物、ヨウ化物、またはこれらの組み合わせである、請求項1に記載の化合物。
【請求項12】
以下の式
【化4】

〔式中:
A=対イオンであり、
a=1〜3であり、
b=0〜3であり、
X=1〜6 Cアルキルまたはヘテロアルキルであり、
R1=1〜6 Cアルキルであり、
R2およびR3の一方がアルキルであり、もう一方がXN+Hb(R1)3-bであるか、またはR2およびR3がメチレンジオキシ基を形成し、
R4およびR5の一方がハロゲンであり、もう一方がハロゲン置換1〜6 Cアルキルであるか、R4およびR5の一方または両方がXN+Hb(R1)3-bであるか、またはR4およびR5が一緒になって芳香環またはヘテロ芳香環または置換芳香環または置換ヘテロ芳香環を形成する〕
を有するテトラゾリウム塩を指示薬として提供すること;そして
生体液中の分析物の濃度を、指示薬としてのテトラゾリウム塩を用いて決定すること;
を含む、生体液中に含有される、反応に際して比例する色の変化を生成する様に構成される分析物を測定する方法。
【請求項13】
分析物がグルコースである、請求項12に記載の方法。
【請求項14】
生体液が全血液である、請求項13に記載の方法。
【請求項15】
テトラゾリウム塩が以下の式:
【化5】

〔式中:
A=対イオンであり、
X=1〜6 Cアルキルであり、
a=1〜3であり、
b=0〜3であり、
R1=1〜3 Cアルキルであり、
R2およびR3の一方が1〜4 Cアルキルであり、そして他方がXN+Hb(R1)3-bであるか、またはR2およびR3がメチレンジオキシ基を形成し、
R4=CHF2であり、
R5=ハロゲンである〕
を有する、請求項13に記載の方法。
【請求項16】
Xがプロピルであり、
bがゼロであり、
R1がメチルであり、
R2およびR3がメチレンジオキシ基を形成し、
R4がCHF2であり、
R5がClである、
請求項15に記載の方法。
【請求項17】
Xがプロピルであり、
bが1であり、
R1がメチルであり、
R2およびR3がメチレンジオキシ基を形成し、
R4がCHF2であり、
R5がClである、
請求項15に記載の方法。
【請求項18】
Xがプロピルであり、
bがゼロであり、
R1がメチルであり、
R2がトリメチルアンモニウムプロピルであり、
R3がメトキシであり、
R4がCHF2であり、
R5がClである、
請求項15に記載の方法。
【請求項19】
以下の式
【化6】

〔式中:
a=1〜3であり、
A=対イオンであり、
X=1〜6 Cアルキルであり、
b=0〜3であり、
R1=1〜3 Cアルキルであり、
R2およびR3の一方がアルキルであり、そして他方がXN+Hb(R1)3-bであるか、またはR2およびR3がメチレンジオキシ基を形成し、
R4およびR5の一方がハロゲンであり、そして他方がハロゲン置換1〜6 Cアルキルであるか、またはR4およびR5が水素であり、
R6=1〜4 Cアルコキシ、水素、またはハロゲンである〕
を有する、請求項12に記載の方法。
【請求項20】
Xがプロピルであり、
bがゼロであり、
R1がメチルであり、
R2がトリメチルアンモニウムプロピルであり、
R3がメトキシであり、
R4、R5、およびR6が水素である、
請求項19に記載の方法。
【請求項21】
Xがプロピルであり、
R1がメチルであり、
bがゼロであり、
R2がトリメチルアンモニウムプロピルであり、
R3がメチルであり、
R4およびR5が芳香環を形成し、
R6がメトキシである、
請求項19に記載の方法。
【請求項22】
Xがプロピルであり、
bがゼロであり、
R1がメチルであり、
R2がトリメチルアンモニウムプロピルであり、
R3がメチルであり、
R4およびR5が水素であり、
R6がエトキシである、
請求項19に記載の方法。
【請求項23】
Xがプロピルであり、
bがゼロであり、
R1がメチルであり、
R2がトリメチルアンモニウムプロピルであり、
R3がメチルであり、
R4およびR5が水素であり、
R6が臭素である、
請求項19に記載の方法。
【請求項24】
少なくとも1つの対イオンが、ニトレート、ホスフェート、ハイドロゲン・ホスフェート、ダイハイドロゲン・ホスフェート、ハイドロゲン・サルフェート、サルフェート、ハイドロゲン・カーボネート、カーボネート、メタンスルホネート、フルオロボレート、臭化物、塩化物、ヨウ化物、またはこれらの組み合わせである、請求項12に記載の方法。
【請求項25】
少なくとも1つの置換基としてのトリアルキルアンモニウムアルコキシ基を、チアゾリルテトラゾリウム塩に対して付加することを含む、テトラゾリウム環の第3の窒素原子で結合したチアゾリル基を有するチアゾリルテトラゾリウム塩の可溶性を増大させる方法。
【請求項26】
チアゾリルテトラゾリウム塩が、テトラゾリウム環の第3の窒素原子および炭素原子において、フェニル置換基を有する、請求項25に記載の方法。
【請求項27】
少なくとも1つのトリアルキルアンモニウムアルコキシ基が、トリメチルアンモニウムプロポキシ基である、請求項26に記載の方法。
【請求項28】
少なくとも1つのトリアルキルアンモニウムアルコキシ基が、フェニル基の置換基である、請求項26に記載の方法。
【請求項29】
少なくとも1つのトリアルキルアンモニウムアルコキシ基が、両方のフェニル置換基の置換基である、請求項26に記載の方法。
【請求項30】
チアゾリル基が、ベンゾチアゾリル基である、請求項25に記載の方法。
【請求項31】
チアゾリルテトラゾリウム塩が、ニトレート、ホスフェート、ハイドロゲン・ホスフェート、ダイハイドロゲン・ホスフェート、ハイドロゲン・サルフェート、サルフェート、ハイドロゲン・カーボネート、カーボネート、メタンスルホネート、フルオロボレート、臭化物、塩化物、ヨウ化物、またはこれらの組み合わせの対イオンを有する、請求項25に記載の方法。
【請求項32】
対イオンが、ブロモニトレート、ジブロモニトレート、またはトリ臭化物である、請求項31に記載の方法。
【図1】


【図2】


【図3】


【図4a】


【図4b】


【図5a】


【図5b】




【図2】


【図3】


【図4a】


【図4b】


【図5a】


【図5b】


【公表番号】特表2008−526990(P2008−526990A)
【公表日】平成20年7月24日(2008.7.24)
【国際特許分類】
【出願番号】特願2007−551415(P2007−551415)
【出願日】平成18年1月13日(2006.1.13)
【国際出願番号】PCT/US2006/001307
【国際公開番号】WO2006/076619
【国際公開日】平成18年7月20日(2006.7.20)
【出願人】(503106111)バイエル・ヘルスケア・エルエルシー (154)
【Fターム(参考)】
【公表日】平成20年7月24日(2008.7.24)
【国際特許分類】
【出願日】平成18年1月13日(2006.1.13)
【国際出願番号】PCT/US2006/001307
【国際公開番号】WO2006/076619
【国際公開日】平成18年7月20日(2006.7.20)
【出願人】(503106111)バイエル・ヘルスケア・エルエルシー (154)
【Fターム(参考)】
[ Back to top ]

