水系リチウム二次電池用負極活物質及びその製造方法、並びに水系リチウム二次電池
【課題】大きな放電容量を発揮できると共に、充放電サイクル特性に優れた水系リチウム二次電池用負極活物質及びその製造方法、並びに水系リチウム二次電池を提供すること。
【解決手段】リチウム塩を水に溶解してなる水溶液電解液を有する水系リチウム二次電池1用の負極活物質及びその製造方法である。また、その負極活物質を負極3に含有する水系リチウム二次電池1である。負極活物質は、リチウムバナジウム酸化物LiV2O5を主成分とする。その製造方法においては、混合工程と焼成工程と熱処理工程とを行う。混合工程においては、リチウム源と、バナジウム源とを、焼成後にLiV2O5となるような化学量論比にしたがって混合して混合物を得る。焼成工程においては、混合物を還元雰囲気下で温度400〜900℃にて加熱して焼成物を得る。熱処理工程においては、焼成物をCO2ガス中で温度500℃〜800℃にて加熱する。
【解決手段】リチウム塩を水に溶解してなる水溶液電解液を有する水系リチウム二次電池1用の負極活物質及びその製造方法である。また、その負極活物質を負極3に含有する水系リチウム二次電池1である。負極活物質は、リチウムバナジウム酸化物LiV2O5を主成分とする。その製造方法においては、混合工程と焼成工程と熱処理工程とを行う。混合工程においては、リチウム源と、バナジウム源とを、焼成後にLiV2O5となるような化学量論比にしたがって混合して混合物を得る。焼成工程においては、混合物を還元雰囲気下で温度400〜900℃にて加熱して焼成物を得る。熱処理工程においては、焼成物をCO2ガス中で温度500℃〜800℃にて加熱する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、水溶液からなる電解液を有する水系リチウム二次電池用の負極活物質及びその製造方法、並びに該負極活物質を用いた水系リチウム二次電池に関する。
【背景技術】
【0002】
電解液の溶媒として有機系溶媒を用いた非水系のリチウム二次電池は、高電圧でエネルギー密度が高く、また小型・軽量化が図れることから、パソコンや携帯電話等の携帯情報端末等を中心に情報通信機器の分野で実用が進み、広く一般に普及するに至っている。また他の分野では、環境問題、資源問題から電気自動車の開発が急がれる中、このようなリチウム二次電池を電気自動車用電源として用いることが検討されている。
【0003】
一般に、非水系のリチウム二次電池は、正極活物質としてリチウム遷移金属複合酸化物を、負極活物質として炭素材料を用い、電解液として有機溶媒にリチウム塩を溶解した非水電解液を用いて構成されている。
具体的には、正極活物質としては、例えばLiCoO2、LiNiO2、及びLiMn2O4等が用いられており、これらの活物質は、金属Liに対して3.5〜4.3Vの電位範囲で使用される。また、負極活物質としては炭素材料等が用いられており、1〜0.1V程度の電位範囲で使用される。非水系のリチウム二次電池においては、このような正極活物質と負極活物質とを組み合わせて、単セルにおいて3〜4V級の高い起電力を発揮できる。
【0004】
しかし、非水系のリチウム二次電池には、次のような問題が指摘されている。
即ち、非水系のリチウム二次電池は、電解液として有機溶媒等の非水系電解液を含有しているため、常に引火や爆発の危険性を有している。過充電状態や高温環境下にさらされた状態においては、特にその危険性が高い。
二次電池は、エネルギーを電気化学的に蓄え放出する装置であるため、電気化学的に蓄えたエネルギーが、例えば正極と負極との短絡等の何らかのきっかけで、急激に熱エネルギーに変換されてしまったときに、内部に可燃性の有機溶媒がある場合には、引火、爆発を引き起こすおこすおそれがある。
このような問題は、特に電気自動車やハイブリッド車等のように大型の電池を必要とする用途においては致命的である。また、自動車用電源として用いると、使用温度や充放電サイクルの面でも過酷な条件で使用されることとなり、引火や爆発の危険性がより高くなると考えられている。
【0005】
ところで、非水系のリチウム二次電池は、電解液に水を使用しないため、水の電気分解反応に縛られることがなく、約4Vという高電圧の起電力を発揮することができる。その反面、電池内に水分が存在すれば、電気分解に伴ってガスが発生したり、リチウムとの反応により充放電サイクル特性が低下したり、また、副反応により充放電効率が低下したり、電池構成材料が腐食したりする等という様々な問題を引き起こすおそれがある。
そのため、非水系のリチウム二次電池においては、その製造工程において徹底したドライ環境を維持する必要があり、水分を完全に除去するために特殊な設備と多大な労力を要している。そのため、製造コストが高くなってしまうという問題がある。この観点からも、特に電気自動車用の二次電池をにらんだ将来の量産化に対応し難いという問題があった。
【0006】
一方、電解液として水溶液を用いた水系リチウム二次電池がある。この水系リチウム二次電池は、上述の非水系リチウム二次電池が有する問題に対して非常に有利であると予測される。
即ち、水系リチウム二次電池は、電解液に有機溶媒を含有していないため、基本的には燃えることはない。また、製造工程においてドライ環境を必要としないため、製造にかかるコストを大幅に減少することができる。さらに、一般的に水溶液電解液は非水系電解液に比べて導電性が高いため、水系リチウム二次電池は、非水系のリチウム二次電池に比べて内部抵抗が低くなるという利点がある。
しかしその反面、水系リチウム二次電池は、水の電気分解反応が起こらない電位範囲での使用が求められるため、非水系のリチウム二次電池と比較して起電力が小さくなる。
【0007】
このように、水系リチウム二次電池においては、高電圧即ち高エネルギー密度を犠牲として、安全性、コスト、及び低内部抵抗が確保される。そのため、水系リチウム二次電池は、高エネルギー密度、即ち軽くて小さいことを重視する携帯機器等の用途には向かないが、比較的コストを重視し、大型の電池が必要とされる電気自動車やハイブリッド電気自動車、ひいては家庭用分散電源等の用途に適することが予想されている。
【0008】
水系リチウム二次電池を構成する上で重要なことは、水溶液中で安定で、かつ水の電気分解により酸素や水素を発生しない電位範囲において、可逆的に大量のリチウムを吸蔵及び脱離できる活物質、つまり特定の電位範囲において大きな容量を発揮できる活物質を用いる点にある。
また、電解液としては、中性からアルカリ性の電解液を用いることが望まれている。活物質として主として用いられるLi含有酸化物は、一般に酸性の水溶液中における安定性に乏しく、また、酸性電解液中の多量のH+イオンは、純粋なLi+イオンのロッキングチェア反応を阻害するおそれがあるからである。
【0009】
中性、即ちpH=7の電解液を用いた場合には、水の分解電圧は、水素発生電位が2.62V、酸素発生電位が3.85Vである。また、強アルカリ性、即ちpH=14の電解液を用いた場合には、水の分解電圧は水素発生電位が2.21V、酸素発生電位が3.44Vである。水系リチウム二次電池においては、負極が水素発生電位以下の電位にさらされた場合には水素の発生が起こるおそれがあり、正極が酸素発生電位以上の電位にさらされた場合には酸素の発生が起こるおそれがある。現実にはガス発生過電圧があるため、多少は範囲外の電位まで使用できるが、水系リチウム二次電池用の活物質としては、できる限りこの範囲内に多くの充放電容量を有するものが望まれている。
【0010】
これまでに、水系リチウム二次電池としては、Li−Mn酸化物、Li−Ni酸化物、Li−Co酸化物、鉄リン酸リチウム等を正極活物質として含有し、Li−Mn酸化物、VO2、LiV3O8、Fe酸化物、Feの酸化水酸化物等を負極活物質として含有するものが提案されている(特許文献1及び2参照)。
【0011】
しかしながら、このような活物質は、放電容量や水溶液電解液中での安定性が未だ不充分であった。そのため、従来の水系リチウム二次電池は、容量が小さく、充放電を繰り返し行うことにより容量劣化が起こりやすいという問題があった。それ故、現状の水系リチウム二次電池は、未だアイデア段階を抜けておらず、従来の非水系のリチウム二次電池等に取って代わる程の実用性を備えるには至っていない。
【0012】
【特許文献1】特表平9−508490号公報
【特許文献2】特開2002−110221号公報
【発明の開示】
【発明が解決しようとする課題】
【0013】
本発明はかかる従来の問題点に鑑みてなされたものであって、大きな放電容量を発揮できると共に、充放電サイクル特性に優れた水系リチウム二次電池用負極活物質及びその製造方法、並びに水系リチウム二次電池を提供しようとするものである。
【課題を解決するための手段】
【0014】
第1の発明は、リチウム塩を水に溶解してなる水溶液電解液を有する水系リチウム二次電池用の負極活物質であって、
該負極活物質は、リチウムバナジウム酸化物LiV2O5を主成分とすることを特徴とする水系リチウム二次電池用負極活物質にある(請求項1)。
【0015】
上記水系リチウム二次電池用負極活物質は、リチウムバナジウム酸化物LiV2O5を主成分としている。該主成分のリチウムバナジウム酸化物LiV2O5は、Li/Li+電極基準、開回路電圧で2.5V付近に比較的平坦な電位を有する。そのため、リチウムバナジウム酸化物LiV2O5においては、水の分解電圧範囲内でその容量のほとんどすべてを取り出すことができる。それ故、リチウムバナジウム酸化物LiV2O5は、水系リチウム二次電池の負極活物質として最適であり、LiV2O5を主成分とする上記水系リチウム二次電池用負極活物質は、大きな放電容量を発揮することができる。
【0016】
上記水系リチウム二次電池用負極活物質が上述のごとく大きな容量を発揮できる理由としては、次のように考えられる。
即ち、上記水系リチウム二次電池用負極活物質の主成分であるリチウムバナジウム酸化物LiV2O5は、そのバナジウム(V)の価数が4.5価となっており、従来負極活物質として用いられていたLiV3O8等のようにVが5価となる酸化物に比べて価数が低い。このように、上記水系リチウム二次電池用負極活物質は、従来用いられていたリチウムバナジウム酸化物よりもバナジウムの価数の低いLiV2O5を主成分とするため、水系リチウム二次電池用の負極活物質として好適な電位範囲に多くの容量を発揮できると推定される。
【0017】
また、上記主成分は、水溶液中においても安定であると共に、リチウムの挿入・脱離に伴ってバナジウムが溶出したりすることもない。そのため、上記水系リチウム二次電池用負極活物質は、リチウムの挿入・脱離反応という可逆的な反応を安定に行うことができる。それ故、上記水系リチウム二次電池用負極活物質においては、充放電を繰り返し行っても容量の劣化が起こり難く、充放電サイクル特性に優れている。
【0018】
このように、上記第1の発明によれば、大きな放電容量を発揮できると共に、充放電サイクル特性に優れた水系リチウム二次電池用負極活物質を提供することができる。
【0019】
第2の発明は、リチウム塩を水に溶解してなる水溶液電解液を有する水系リチウム二次電池用の負極活物質の製造方法であって、
リチウム源と、バナジウム源とを、焼成後にLiV2O5となるような化学量論比にしたがって混合して混合物を得る混合工程と、
上記混合物を還元雰囲気下で温度400〜900℃にて加熱して焼成物を得る焼成工程と、
上記焼成物をCO2ガス中で温度500℃〜800℃にて加熱してLiV2O5を主成分とする水系リチウム二次電池用負極活物質を得る熱処理工程とを有することを特徴とする水系リチウム二次電池用負極活物質の製造方法にある(請求項3)。
【0020】
上記第2の発明においては、上記混合工程と、上記焼成工程と、上記熱処理工程とを行うことにより、LiV2O5を主成分とする水系リチウム二次電池用負極活物質を製造する。
上記混合工程においては、リチウム源と、バナジウム源とを焼成後にLiV2O5となるような化学量論比にしたがって混合して混合物を得る。
【0021】
次いで、上記焼成工程においては、上記混合物を還元雰囲気下で温度400〜900℃にて加熱して焼成物を得る。さらに、上記熱処理工程においては、上記焼成物をCO2ガス中で温度500℃〜800℃にて加熱する。
このように、上記焼成工程において還元雰囲気で上記混合物を上記特定の温度範囲で加熱し、上記熱処理工程においてはCO2ガス中で上記焼成物を上記特定の温度範囲で加熱することにより、上記熱処理工程において上記焼成物を穏やかな酸化条件下で加熱することができる。その結果、LiV2O5を主成分とする上記水系リチウム二次電池用負極活物質を得ることができる。
ここで、LiV2O5の合成に必要な酸素は、上記リチウム源、バナジウム源、及びCO2ガスの分解等により得ることができる。上記リチウム源、バナジウム源としては、例えばリチウム又はバナジウムの酸化物、水酸化物、硝酸塩、炭酸塩等がある。
【0022】
上記第2の発明の製造方法により得られる上記水系リチウム二次電池用負極活物質は、上記第1の発明の負極活物質と同様に、LiV2O5を主成分とする。
そのため、本発明の製造方法により得られる上記水系リチウム二次電池用負極活物質は、優れた放電容量を発揮できると共に、充放電サイクル特性に優れたものとなる。
【0023】
第3の発明は、正極と、負極と、リチウム塩を水に溶解してなる水溶液電解液とを有する水系リチウム二次電池において、
上記負極は、上記第1の発明の上記水系リチウム二次電池用負極活物質を含有することを特徴とする水系リチウム二次電池にある(請求項4)。
【0024】
また、第4の発明は、正極と、負極と、リチウム塩を水に溶解してなる水溶液電解液とを有する水系リチウム二次電池において、
上記負極は、上記第2の発明の製造方法によって得られる上記水系リチウム二次電池用負極活物質を含有することを特徴とする水系リチウム二次電池にある(請求項5)。
【0025】
上記第3の発明の水系リチウム二次電池においては、上記第1の発明の水系リチウム二次電池用負極活物質を負極に含有している。
また、上記第4の発明の水系リチウム二次電池においては、上記第2の発明の製造方法によって得られる水系リチウム二次電池用正極活物質を負極に含有している。
即ち、上記第3及び上記第4の発明の水系リチウム二次電池は、LiV2O5を主成分とする上記負極活物質を負極に含有している。
【0026】
そのため、上記第3及び上記第4の発明のリチウム二次電池は、上述のごとくLiV2O5を主成分とする上記負極活物質が有する特性を生かして、大きな放電容量を発揮できると共に、優れた充放電サイクル特性を示すことができる。
【発明を実施するための最良の形態】
【0027】
次に、本発明の実施の形態について説明する。
上記水系リチウム二次電池用負極活物質は、リチウムバナジウム酸化物LiV2O5を主成分とする。
該リチウムバナジウム酸化物LiV2O5は、例えばγ型、ε型、δ型等の相からなるものがある。
【0028】
好ましくは、上記主成分としてのリチウムバナジウム酸化物は、γ−LiV2O5であることがよい(請求項2)。
この場合には、上記水系リチウム二次電池用負極活物質の電位が水系リチウム二次電池の活物質としてより好適なものとなり、放電容量をより向上させることができる。またこの場合には、例えば中性〜アルカリ性水溶液における上記水系リチウム二次電池用負極活物質の安定性がより向上し、リチウムの挿入・脱離反応という可逆的な反応をより安定に行うことができる。そのためこの場合には、充放電サイクル特性をより向上させることができる。
【0029】
上記水系リチウム二次電池用負極活物質は、混合工程と焼成工程と熱処理工程とを行うことにより製造することができる。
上記混合工程においては、リチウム源と、バナジウム源とを、焼成後にLiV2O5となるような化学量論比にしたがって混合して混合物を得る。上記リチウム源及び上記バナジウム源の内少なくとも一方は、酸化物である。
【0030】
上記リチウム源としては、例えば炭酸リチウム(Li2CO3)、硝酸リチウム(LiNO3)、水酸化リチウム(LiOH)、塩化リチウム(LiCl)、硫酸リチウム(Li2SO4)、及び酸化リチウム(Li2O)等がある。上記リチウム源としては、これらの化合物から選ばれる1種以上を用いることができる。
上記バナジウム源としては、例えば五酸化バナジウム(V2O5)、三二酸化バナジウム(V2O3)、二酸化バナジウム(VO2)、酸化バナジウム(VO)、及び酸化硫酸バナジウム(VOSO4)等がある。上記バナジウム源としては、これらの化合物から選ばれる1種以上を用いることができる。
【0031】
また、上記焼成工程においては、上記混合物を還元雰囲気下で温度400〜900℃にて加熱して焼成物を得る。
上記焼成工程における加熱温度が400℃未満の場合には、リチウム源とバナジウム源との反応が充分に進行しないおそれがある。一方、900℃を超える場合には、粒成長が著しく、電池材料に適さなくなるおそれがある。
【0032】
上記熱処理工程においては、上記焼成物をCO2ガス中で温度500℃〜800℃にて加熱してLiV2O5を主成分とする水系リチウム二次電池用負極活物質を得る。
上記熱処理工程における加熱温度が500℃未満の場合には、酸化が充分に進行しないおそれがある。一方、800℃を超える場合には、著しい粒成長が起こり、電池材料に適さなくおそれがある。
【0033】
次に、上記水系リチウム二次電池は、正極と、負極と、リチウム塩を水に溶解してなる水溶液電解液とを有する。
上記水系リチウム二次電池においては、例えば、リチウムを吸蔵・放出する正極及び負極と、これらの間に狭装されるセパレータと、正極及び負極間でリチウムを移動させる水溶液電解液等を主要構成要素として構成することができる。
上記負極は、リチウムバナジウム酸化物LiV2O5を主成分とする上記水系リチウム二次電池用負極活物質を含有する。負極は、例えば上記水系リチウム二次電池用負極活物質に導電材及び結着材を混合し、必要に応じて適当な溶剤を加えてペースト状の負極合材としたものを成形し、必要に応じて電極密度を高めるべく圧縮して形成することができる。
導電材は、負極の電気伝導性を確保するためのものであり、例えばカーボンブラック、アセチレンブラック、黒鉛等の炭素物質粉末状体の1種又は2種以上を混合したものを用いることができる。
【0034】
結着材は、活物質粒子及び導電材粒子を繋ぎ止める役割を果たすものであり、例えばポリテトラフルオロエチレン、ポリフッ化ビニリデン、フッ素ゴム等の含フッ素樹脂、或いはポリプロピレン、ポリエチレン、ポリエチレンテレフタレート等の熱可塑性樹脂、もしくはポリアクリロニトリル系高分子等を用いることができる。
これら活物質、導電材、結着材を分散させる溶剤としては、例えばN−メチル−2−ピロリドン等の有機溶剤を用いることができる。
【0035】
また、正極は、上記負極の場合と同様に、例えば正極活物質に導電材や結着材を混合し、必要に応じて適当な溶媒を加えてペースト状にした正極合材を成形し、その後必要に応じてプレスして形成することができる。
正極活物質としては、上記負極活物質よりもリチウムの吸蔵・脱離電位が高い物質を主成分とするものを用いることができる。
具体的には、上記正極活物質としては、例えばオリビン構造のリン酸鉄リチウム(LiFePO4)、マンガン酸リチウム(LiMn2O4)、Li(Ni,Co)O2、Li(Ni,Co,Mn)O2、及びLi(Ni,Mn)O2等がある。
【0036】
また、正極及び負極間でリチウムを移動させる上記水溶液電解液は、リチウム塩を水に溶解してなるものである。
このようなリチウム塩としては、例えばLiNO3、LiOH、LiCl、及びLi2S等がある。これらのリチウム塩は、それぞれ単独で用いることもできるが、2種以上を併用することもできる。
【0037】
また、上記水溶液電解液のpHは、6〜10であることが好ましい(請求項6)。
上記水溶液電解液のpHが6未満の場合には、上記水系リチウム二次電池用負極活物質の上記主成分が不安定となり、電池の容量や充放電サイクル特性が劣化するおそれがある。一方、pHが10を超える場合には、水の電気分解電位、即ち水素発生電位及び酸素発生電位がそれぞれ2.21V及び3.44Vまで低下する。そのため、正極や負極で酸素や水素が発生し易くなるおそれがある。
【0038】
また、正極及び負極に狭装させるセパレータは、正極と負極とを分離し電解液を保持するものであり、例えばセルロース、ポリエチレン、及びポリプロピレン等の薄い微多孔膜を用いることができる。
【0039】
また、上記水系リチウム二次電池の形状としては、例えばコイン型、円筒型、角型等がある。正極、負極、セパレータ及び水溶液電解液等を収容する電池ケースとしては、これらの形状に対応したものを用いることができる。
【実施例】
【0040】
(実施例1)
次に、本発明の実施例につき、図1及び図2を用いて説明する。
本例は、水系リチウム二次電池用の負極活物質を作製すると共に、該負極活物質を用いて水系リチウム二次電池を作製し、その放電容量及び充放電サイクル特性を評価する例である。
【0041】
本例の水系リチウム二次電池用負極活物質は、リチウムバナジウム酸化物LiV2O5を主成分とする。本例においては、特にγ型のリチウムバナジウム酸化物LiV2O5、即ちγ−LiV2O5を主成分とする。
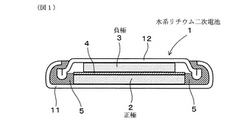
図1に示すごとく、本例の水系リチウム二次電池1は、正極2と、負極3と、リチウム塩を水に溶解してなる水溶液電解液とを有する。負極3は、上記のごとく、γ−LiV2O5を主成分とする水系リチウム二次電池用負極活物質を含有する。
また、正極2は、γ−LiV2O5よりもリチウムの吸蔵・脱離電位が低い物質であるオリビン構造のLiFePO4を主成分とする正極活物質を含有する。水溶液電解液は、リチウム塩としてのLiNO3を水に溶解してなる。
【0042】
水系リチウム二次電池1においては、CR2016型の電池ケース11中に、正極2及び負極3と共に、これらの間に狭装させた状態でセパレータ4が配置されている。また、電池ケース11内には、水溶液電解液が注入されている。電池ケース11内の端部には、ガスケット5が配置されており、電池ケース11は封口板12により密閉されている。
【0043】
次に、本例の水系リチウム二次電池の作製方法につき、説明する。
水系リチウム二次電池の作製にあたっては、まず、下記のようにして、水系リチウム二次電池用負極活物質を作製した。
本例の水系リチウム二次電池用負極活物質の製造方法においては、混合工程と、焼成工程と、熱処理工程とを行う。
混合工程においては、リチウム源と、バナジウム源とを、焼成後にLiV2O5となるような化学量論比にしたがって混合して混合物を得る。焼成工程においては、混合物を還元雰囲気下で温度600℃にて加熱して焼成物を得る。熱処理工程においては、焼成物をCO2ガス中で温度680℃にて加熱してγ−LiV2O5を主成分とする水系リチウム二次電池用負極活物質を得る。
【0044】
具体的には、まず、Li源として炭酸リチウム(Li2CO3)を準備し、V源として五酸化バナジウム(V2O5)を準備した。この炭酸リチウムと五酸化バナジウムとを、熱処理工程後にLiV2O5となるような化学量論比、即ちLi2CO3とV2O5とがモル比で1:2となるような化学量論比にて混合して混合物を得た(混合工程)。なお、混合は、自動乳鉢で120分間行った。
【0045】
次いで、混合物をプレス成形し、この混合物の成形体をArとH2との混合ガス気流中、即ち還元雰囲気下において温度600℃で8時間加熱し、焼成物を得た(焼成工程)。なお、ArとH2との混合ガスとしては、Arを約97体積%、H2を約3体積%含む混合ガスを用いた。
次に、焼成物を自動乳鉢で20分間混合し、CO2ガス中において、温度680℃で20時間焼成した(熱処理工程)。このようにして、γ−LiV2O5を合成し、これを水系リチウム二次電池用負極活物質とした。
【0046】
次に、以下のようにして、正極活物質として、オリビン構造のLiFePO4を固相反応法を用いて合成した。
即ち、まず、原料として、シュウ酸鉄・二水和物(FeC2O4・2H2O)、リン酸水素二アンモニウム((NH4)2HPO4)、及び水酸化リチウム(LiOH・H2O)を準備した。これらの原料をLiFePO4となるような化学量論比、即ち、FeC2O4・2H2Oと(NH4)2HPO4とLiOH・H2Oとをモル比で1:1:1となるように混合し、自動乳鉢を用いて30分間混合した。
【0047】
次いで、混合物をアルゴン雰気流中において、温度350℃で5時間仮焼した。得られた仮焼物を自動乳鉢で30分間混合し、さらにアルゴン雰気流中において温度650℃で6時間焼成した。
このようにして、オリビン構造のLiFePO4を合成し、これを正極活物質とした。
【0048】
次に、上記のようにして作製した正極活物質及び負極活物質を用いて、水系リチウム二次電池を作製する。
具体的には、まず、負極活物質としてのγ−LiV2O5を70重量部、導電剤としてのカーボンブラックを25重量部、及び結着材としてのポリテトラフルオロエチレン(PTFE)を5重量部混合し、負極合材を作製した。
また、正極活物質としてのLiFePO4を70重量部、導電剤としてのカーボンブラックを25重量部、及び結着材としてのポリテトラフルオロエチレン(PTFE)を5重量部混合し、正極合材を作製した。
【0049】
次に、図1に示すごとく、CR2016型のコインセル用の電池ケース11を準備し、予め電池ケース11の内側に溶接したSUSメッシュ上に負極合材15mgを約0.6ton/cm2で圧着して負極3を形成した。この負極3と同様にして、SUSメッシュ上に正極合材10mgを約0.6ton/cm2で圧着して負極3を形成した。
正極2及び負極3は、厚さ25μmのセルロース系のセパレータ4を介して、電池ケース11内に配置した。
【0050】
次いで、電池ケース11内にガスケット5を配置し、さらに電池ケース11内に水溶液電解液を適量注入し含浸させた。本例においては、水溶液電解液としては、LiNO3の飽和水溶液(pH≒7)を用いた。
次に、電池ケース11の開口部に封口板12を配置し、電池ケース11の端部をかしめ加工することにより、電池ケース11を密封して、水系リチウム二次電池1を作製した。これを電池Eとする。
【0051】
また、本例においては、上記にて作製した電池Eの優れた特性を明らかにするため、負極にLiV3O8を負極活物質として含有する水系リチウム二次電池(電池C)を作製した。
【0052】
電池Cの作製にあたっては、まず、以下のようにして負極活物質としてのLiV3O8を合成した。
即ち、まず、炭酸リチウム(Li2CO3)と、五酸化バナジウム(V2O5)とを準備した。これらをLiV3O8となるような化学量論比、即ちLi2CO3とV2O5とをモル比で1:3となるように混合し、自動乳鉢で20分間混合した。次いで、混合物をアルゴン気流中で、700℃まで昇温させて12時間保持した。その後、炉冷し、LiV3O8を作製した。これを電池Cの負極活物質とする。
【0053】
次いで、上記電池Eの場合と同様にして、正極活物質としてのLiFePO4を準備した。
さらに、上記電池Eの場合と同様にして、コインセル用の電池ケースを準備し、該電池ケース内に正極及び負極を形成すると共に、ガスケットを配置し、水溶液電解液を適量注入し含浸させた後、電池ケース11密封して、水系リチウム二次電池を作製した。これを電池Cとする。
即ち、電池Cは、負極活物質としてLiV3O8を含有する点を除いては、上記電池Eと同様のものである。
【0054】
次に、上記のようにして作製した2種類の水系リチウム二次電池(電池E及び電池C)について、充放電サイクル特性を調べた(充放電サイクル試験)。
充放電サイクル試験は、各電池について、温度60℃の条件下で、電流密度0.5mA/cm2の定電流にて電池電圧1.4Vまで充電し、その後電流密度0.5mA/cm2の定電流にて電池電圧0.1Vまで放電する充放電を1サイクルとし、このサイクルを30サイクル繰り返すことにより行った。各充放電サイクルにおいては、1.4Vまで充電した後、及び0.1Vまで放電した後に、充電休止時間及び放電休止時間をそれぞれ1分間ずつ設けた。そして、各サイクル毎に、各電池(電池E及び電池C)の放電容量を測定した。その結果を図2に示す。
【0055】
なお、放電容量は、各サイクル毎の放電電流値(mA)を測定し、この放電電流値に放電に要した時間(hr)を乗じて得られた値を、電池内の正極活物質の重量(g)で除することにより算出した。
また、図2において、横軸はサイクル数(回)を示し、縦軸は放電容量(mAh/g)を示すものである。同図には、負極活物質としてγ−LiV2O5を用いて構成した電池を電池Eとし、LiV3O8を用いて構成した電池を電池Cとして表した。
【0056】
図2から知られるごとく、負極活物質としてγ−LiV2O5を含有する電池Eは、負極活物質として従来から用いられているLiV3O8を含有する電池Cに比べて、大きな放電容量を発揮できることがわかる。電池Eは、電池Cに比べて、30サイクルの充放電の内、どのサイクルにおいてもより大きな放電容量を発揮できることがわかる。また、電池Eにおいては、充放電サイクルによる放電容量の低下率は電池Cとほぼ同等であるが、初期放電容量の大きさから、充放電サイクルを繰り返した後においても電池Cに比べて大きな放電容量を発揮できることがわかる。
【0057】
このように、本例の電池Eは、従来の水系リチウム二次電池に比べて、大きな容量を発揮できると共に、優れた充放電サイクル特性を発揮できることがわかる。
【図面の簡単な説明】
【0058】
【図1】実施例1にかかる、水系リチウム二次電池の構成を示す説明図。
【図2】実施例1にかかかる、2種類の水系リチウム二次電池(電池E及び電池C)の充放電サイクル特性を示す線図。
【符号の説明】
【0059】
1 水系リチウム二次電池
2 正極
3 負極
【技術分野】
【0001】
本発明は、水溶液からなる電解液を有する水系リチウム二次電池用の負極活物質及びその製造方法、並びに該負極活物質を用いた水系リチウム二次電池に関する。
【背景技術】
【0002】
電解液の溶媒として有機系溶媒を用いた非水系のリチウム二次電池は、高電圧でエネルギー密度が高く、また小型・軽量化が図れることから、パソコンや携帯電話等の携帯情報端末等を中心に情報通信機器の分野で実用が進み、広く一般に普及するに至っている。また他の分野では、環境問題、資源問題から電気自動車の開発が急がれる中、このようなリチウム二次電池を電気自動車用電源として用いることが検討されている。
【0003】
一般に、非水系のリチウム二次電池は、正極活物質としてリチウム遷移金属複合酸化物を、負極活物質として炭素材料を用い、電解液として有機溶媒にリチウム塩を溶解した非水電解液を用いて構成されている。
具体的には、正極活物質としては、例えばLiCoO2、LiNiO2、及びLiMn2O4等が用いられており、これらの活物質は、金属Liに対して3.5〜4.3Vの電位範囲で使用される。また、負極活物質としては炭素材料等が用いられており、1〜0.1V程度の電位範囲で使用される。非水系のリチウム二次電池においては、このような正極活物質と負極活物質とを組み合わせて、単セルにおいて3〜4V級の高い起電力を発揮できる。
【0004】
しかし、非水系のリチウム二次電池には、次のような問題が指摘されている。
即ち、非水系のリチウム二次電池は、電解液として有機溶媒等の非水系電解液を含有しているため、常に引火や爆発の危険性を有している。過充電状態や高温環境下にさらされた状態においては、特にその危険性が高い。
二次電池は、エネルギーを電気化学的に蓄え放出する装置であるため、電気化学的に蓄えたエネルギーが、例えば正極と負極との短絡等の何らかのきっかけで、急激に熱エネルギーに変換されてしまったときに、内部に可燃性の有機溶媒がある場合には、引火、爆発を引き起こすおこすおそれがある。
このような問題は、特に電気自動車やハイブリッド車等のように大型の電池を必要とする用途においては致命的である。また、自動車用電源として用いると、使用温度や充放電サイクルの面でも過酷な条件で使用されることとなり、引火や爆発の危険性がより高くなると考えられている。
【0005】
ところで、非水系のリチウム二次電池は、電解液に水を使用しないため、水の電気分解反応に縛られることがなく、約4Vという高電圧の起電力を発揮することができる。その反面、電池内に水分が存在すれば、電気分解に伴ってガスが発生したり、リチウムとの反応により充放電サイクル特性が低下したり、また、副反応により充放電効率が低下したり、電池構成材料が腐食したりする等という様々な問題を引き起こすおそれがある。
そのため、非水系のリチウム二次電池においては、その製造工程において徹底したドライ環境を維持する必要があり、水分を完全に除去するために特殊な設備と多大な労力を要している。そのため、製造コストが高くなってしまうという問題がある。この観点からも、特に電気自動車用の二次電池をにらんだ将来の量産化に対応し難いという問題があった。
【0006】
一方、電解液として水溶液を用いた水系リチウム二次電池がある。この水系リチウム二次電池は、上述の非水系リチウム二次電池が有する問題に対して非常に有利であると予測される。
即ち、水系リチウム二次電池は、電解液に有機溶媒を含有していないため、基本的には燃えることはない。また、製造工程においてドライ環境を必要としないため、製造にかかるコストを大幅に減少することができる。さらに、一般的に水溶液電解液は非水系電解液に比べて導電性が高いため、水系リチウム二次電池は、非水系のリチウム二次電池に比べて内部抵抗が低くなるという利点がある。
しかしその反面、水系リチウム二次電池は、水の電気分解反応が起こらない電位範囲での使用が求められるため、非水系のリチウム二次電池と比較して起電力が小さくなる。
【0007】
このように、水系リチウム二次電池においては、高電圧即ち高エネルギー密度を犠牲として、安全性、コスト、及び低内部抵抗が確保される。そのため、水系リチウム二次電池は、高エネルギー密度、即ち軽くて小さいことを重視する携帯機器等の用途には向かないが、比較的コストを重視し、大型の電池が必要とされる電気自動車やハイブリッド電気自動車、ひいては家庭用分散電源等の用途に適することが予想されている。
【0008】
水系リチウム二次電池を構成する上で重要なことは、水溶液中で安定で、かつ水の電気分解により酸素や水素を発生しない電位範囲において、可逆的に大量のリチウムを吸蔵及び脱離できる活物質、つまり特定の電位範囲において大きな容量を発揮できる活物質を用いる点にある。
また、電解液としては、中性からアルカリ性の電解液を用いることが望まれている。活物質として主として用いられるLi含有酸化物は、一般に酸性の水溶液中における安定性に乏しく、また、酸性電解液中の多量のH+イオンは、純粋なLi+イオンのロッキングチェア反応を阻害するおそれがあるからである。
【0009】
中性、即ちpH=7の電解液を用いた場合には、水の分解電圧は、水素発生電位が2.62V、酸素発生電位が3.85Vである。また、強アルカリ性、即ちpH=14の電解液を用いた場合には、水の分解電圧は水素発生電位が2.21V、酸素発生電位が3.44Vである。水系リチウム二次電池においては、負極が水素発生電位以下の電位にさらされた場合には水素の発生が起こるおそれがあり、正極が酸素発生電位以上の電位にさらされた場合には酸素の発生が起こるおそれがある。現実にはガス発生過電圧があるため、多少は範囲外の電位まで使用できるが、水系リチウム二次電池用の活物質としては、できる限りこの範囲内に多くの充放電容量を有するものが望まれている。
【0010】
これまでに、水系リチウム二次電池としては、Li−Mn酸化物、Li−Ni酸化物、Li−Co酸化物、鉄リン酸リチウム等を正極活物質として含有し、Li−Mn酸化物、VO2、LiV3O8、Fe酸化物、Feの酸化水酸化物等を負極活物質として含有するものが提案されている(特許文献1及び2参照)。
【0011】
しかしながら、このような活物質は、放電容量や水溶液電解液中での安定性が未だ不充分であった。そのため、従来の水系リチウム二次電池は、容量が小さく、充放電を繰り返し行うことにより容量劣化が起こりやすいという問題があった。それ故、現状の水系リチウム二次電池は、未だアイデア段階を抜けておらず、従来の非水系のリチウム二次電池等に取って代わる程の実用性を備えるには至っていない。
【0012】
【特許文献1】特表平9−508490号公報
【特許文献2】特開2002−110221号公報
【発明の開示】
【発明が解決しようとする課題】
【0013】
本発明はかかる従来の問題点に鑑みてなされたものであって、大きな放電容量を発揮できると共に、充放電サイクル特性に優れた水系リチウム二次電池用負極活物質及びその製造方法、並びに水系リチウム二次電池を提供しようとするものである。
【課題を解決するための手段】
【0014】
第1の発明は、リチウム塩を水に溶解してなる水溶液電解液を有する水系リチウム二次電池用の負極活物質であって、
該負極活物質は、リチウムバナジウム酸化物LiV2O5を主成分とすることを特徴とする水系リチウム二次電池用負極活物質にある(請求項1)。
【0015】
上記水系リチウム二次電池用負極活物質は、リチウムバナジウム酸化物LiV2O5を主成分としている。該主成分のリチウムバナジウム酸化物LiV2O5は、Li/Li+電極基準、開回路電圧で2.5V付近に比較的平坦な電位を有する。そのため、リチウムバナジウム酸化物LiV2O5においては、水の分解電圧範囲内でその容量のほとんどすべてを取り出すことができる。それ故、リチウムバナジウム酸化物LiV2O5は、水系リチウム二次電池の負極活物質として最適であり、LiV2O5を主成分とする上記水系リチウム二次電池用負極活物質は、大きな放電容量を発揮することができる。
【0016】
上記水系リチウム二次電池用負極活物質が上述のごとく大きな容量を発揮できる理由としては、次のように考えられる。
即ち、上記水系リチウム二次電池用負極活物質の主成分であるリチウムバナジウム酸化物LiV2O5は、そのバナジウム(V)の価数が4.5価となっており、従来負極活物質として用いられていたLiV3O8等のようにVが5価となる酸化物に比べて価数が低い。このように、上記水系リチウム二次電池用負極活物質は、従来用いられていたリチウムバナジウム酸化物よりもバナジウムの価数の低いLiV2O5を主成分とするため、水系リチウム二次電池用の負極活物質として好適な電位範囲に多くの容量を発揮できると推定される。
【0017】
また、上記主成分は、水溶液中においても安定であると共に、リチウムの挿入・脱離に伴ってバナジウムが溶出したりすることもない。そのため、上記水系リチウム二次電池用負極活物質は、リチウムの挿入・脱離反応という可逆的な反応を安定に行うことができる。それ故、上記水系リチウム二次電池用負極活物質においては、充放電を繰り返し行っても容量の劣化が起こり難く、充放電サイクル特性に優れている。
【0018】
このように、上記第1の発明によれば、大きな放電容量を発揮できると共に、充放電サイクル特性に優れた水系リチウム二次電池用負極活物質を提供することができる。
【0019】
第2の発明は、リチウム塩を水に溶解してなる水溶液電解液を有する水系リチウム二次電池用の負極活物質の製造方法であって、
リチウム源と、バナジウム源とを、焼成後にLiV2O5となるような化学量論比にしたがって混合して混合物を得る混合工程と、
上記混合物を還元雰囲気下で温度400〜900℃にて加熱して焼成物を得る焼成工程と、
上記焼成物をCO2ガス中で温度500℃〜800℃にて加熱してLiV2O5を主成分とする水系リチウム二次電池用負極活物質を得る熱処理工程とを有することを特徴とする水系リチウム二次電池用負極活物質の製造方法にある(請求項3)。
【0020】
上記第2の発明においては、上記混合工程と、上記焼成工程と、上記熱処理工程とを行うことにより、LiV2O5を主成分とする水系リチウム二次電池用負極活物質を製造する。
上記混合工程においては、リチウム源と、バナジウム源とを焼成後にLiV2O5となるような化学量論比にしたがって混合して混合物を得る。
【0021】
次いで、上記焼成工程においては、上記混合物を還元雰囲気下で温度400〜900℃にて加熱して焼成物を得る。さらに、上記熱処理工程においては、上記焼成物をCO2ガス中で温度500℃〜800℃にて加熱する。
このように、上記焼成工程において還元雰囲気で上記混合物を上記特定の温度範囲で加熱し、上記熱処理工程においてはCO2ガス中で上記焼成物を上記特定の温度範囲で加熱することにより、上記熱処理工程において上記焼成物を穏やかな酸化条件下で加熱することができる。その結果、LiV2O5を主成分とする上記水系リチウム二次電池用負極活物質を得ることができる。
ここで、LiV2O5の合成に必要な酸素は、上記リチウム源、バナジウム源、及びCO2ガスの分解等により得ることができる。上記リチウム源、バナジウム源としては、例えばリチウム又はバナジウムの酸化物、水酸化物、硝酸塩、炭酸塩等がある。
【0022】
上記第2の発明の製造方法により得られる上記水系リチウム二次電池用負極活物質は、上記第1の発明の負極活物質と同様に、LiV2O5を主成分とする。
そのため、本発明の製造方法により得られる上記水系リチウム二次電池用負極活物質は、優れた放電容量を発揮できると共に、充放電サイクル特性に優れたものとなる。
【0023】
第3の発明は、正極と、負極と、リチウム塩を水に溶解してなる水溶液電解液とを有する水系リチウム二次電池において、
上記負極は、上記第1の発明の上記水系リチウム二次電池用負極活物質を含有することを特徴とする水系リチウム二次電池にある(請求項4)。
【0024】
また、第4の発明は、正極と、負極と、リチウム塩を水に溶解してなる水溶液電解液とを有する水系リチウム二次電池において、
上記負極は、上記第2の発明の製造方法によって得られる上記水系リチウム二次電池用負極活物質を含有することを特徴とする水系リチウム二次電池にある(請求項5)。
【0025】
上記第3の発明の水系リチウム二次電池においては、上記第1の発明の水系リチウム二次電池用負極活物質を負極に含有している。
また、上記第4の発明の水系リチウム二次電池においては、上記第2の発明の製造方法によって得られる水系リチウム二次電池用正極活物質を負極に含有している。
即ち、上記第3及び上記第4の発明の水系リチウム二次電池は、LiV2O5を主成分とする上記負極活物質を負極に含有している。
【0026】
そのため、上記第3及び上記第4の発明のリチウム二次電池は、上述のごとくLiV2O5を主成分とする上記負極活物質が有する特性を生かして、大きな放電容量を発揮できると共に、優れた充放電サイクル特性を示すことができる。
【発明を実施するための最良の形態】
【0027】
次に、本発明の実施の形態について説明する。
上記水系リチウム二次電池用負極活物質は、リチウムバナジウム酸化物LiV2O5を主成分とする。
該リチウムバナジウム酸化物LiV2O5は、例えばγ型、ε型、δ型等の相からなるものがある。
【0028】
好ましくは、上記主成分としてのリチウムバナジウム酸化物は、γ−LiV2O5であることがよい(請求項2)。
この場合には、上記水系リチウム二次電池用負極活物質の電位が水系リチウム二次電池の活物質としてより好適なものとなり、放電容量をより向上させることができる。またこの場合には、例えば中性〜アルカリ性水溶液における上記水系リチウム二次電池用負極活物質の安定性がより向上し、リチウムの挿入・脱離反応という可逆的な反応をより安定に行うことができる。そのためこの場合には、充放電サイクル特性をより向上させることができる。
【0029】
上記水系リチウム二次電池用負極活物質は、混合工程と焼成工程と熱処理工程とを行うことにより製造することができる。
上記混合工程においては、リチウム源と、バナジウム源とを、焼成後にLiV2O5となるような化学量論比にしたがって混合して混合物を得る。上記リチウム源及び上記バナジウム源の内少なくとも一方は、酸化物である。
【0030】
上記リチウム源としては、例えば炭酸リチウム(Li2CO3)、硝酸リチウム(LiNO3)、水酸化リチウム(LiOH)、塩化リチウム(LiCl)、硫酸リチウム(Li2SO4)、及び酸化リチウム(Li2O)等がある。上記リチウム源としては、これらの化合物から選ばれる1種以上を用いることができる。
上記バナジウム源としては、例えば五酸化バナジウム(V2O5)、三二酸化バナジウム(V2O3)、二酸化バナジウム(VO2)、酸化バナジウム(VO)、及び酸化硫酸バナジウム(VOSO4)等がある。上記バナジウム源としては、これらの化合物から選ばれる1種以上を用いることができる。
【0031】
また、上記焼成工程においては、上記混合物を還元雰囲気下で温度400〜900℃にて加熱して焼成物を得る。
上記焼成工程における加熱温度が400℃未満の場合には、リチウム源とバナジウム源との反応が充分に進行しないおそれがある。一方、900℃を超える場合には、粒成長が著しく、電池材料に適さなくなるおそれがある。
【0032】
上記熱処理工程においては、上記焼成物をCO2ガス中で温度500℃〜800℃にて加熱してLiV2O5を主成分とする水系リチウム二次電池用負極活物質を得る。
上記熱処理工程における加熱温度が500℃未満の場合には、酸化が充分に進行しないおそれがある。一方、800℃を超える場合には、著しい粒成長が起こり、電池材料に適さなくおそれがある。
【0033】
次に、上記水系リチウム二次電池は、正極と、負極と、リチウム塩を水に溶解してなる水溶液電解液とを有する。
上記水系リチウム二次電池においては、例えば、リチウムを吸蔵・放出する正極及び負極と、これらの間に狭装されるセパレータと、正極及び負極間でリチウムを移動させる水溶液電解液等を主要構成要素として構成することができる。
上記負極は、リチウムバナジウム酸化物LiV2O5を主成分とする上記水系リチウム二次電池用負極活物質を含有する。負極は、例えば上記水系リチウム二次電池用負極活物質に導電材及び結着材を混合し、必要に応じて適当な溶剤を加えてペースト状の負極合材としたものを成形し、必要に応じて電極密度を高めるべく圧縮して形成することができる。
導電材は、負極の電気伝導性を確保するためのものであり、例えばカーボンブラック、アセチレンブラック、黒鉛等の炭素物質粉末状体の1種又は2種以上を混合したものを用いることができる。
【0034】
結着材は、活物質粒子及び導電材粒子を繋ぎ止める役割を果たすものであり、例えばポリテトラフルオロエチレン、ポリフッ化ビニリデン、フッ素ゴム等の含フッ素樹脂、或いはポリプロピレン、ポリエチレン、ポリエチレンテレフタレート等の熱可塑性樹脂、もしくはポリアクリロニトリル系高分子等を用いることができる。
これら活物質、導電材、結着材を分散させる溶剤としては、例えばN−メチル−2−ピロリドン等の有機溶剤を用いることができる。
【0035】
また、正極は、上記負極の場合と同様に、例えば正極活物質に導電材や結着材を混合し、必要に応じて適当な溶媒を加えてペースト状にした正極合材を成形し、その後必要に応じてプレスして形成することができる。
正極活物質としては、上記負極活物質よりもリチウムの吸蔵・脱離電位が高い物質を主成分とするものを用いることができる。
具体的には、上記正極活物質としては、例えばオリビン構造のリン酸鉄リチウム(LiFePO4)、マンガン酸リチウム(LiMn2O4)、Li(Ni,Co)O2、Li(Ni,Co,Mn)O2、及びLi(Ni,Mn)O2等がある。
【0036】
また、正極及び負極間でリチウムを移動させる上記水溶液電解液は、リチウム塩を水に溶解してなるものである。
このようなリチウム塩としては、例えばLiNO3、LiOH、LiCl、及びLi2S等がある。これらのリチウム塩は、それぞれ単独で用いることもできるが、2種以上を併用することもできる。
【0037】
また、上記水溶液電解液のpHは、6〜10であることが好ましい(請求項6)。
上記水溶液電解液のpHが6未満の場合には、上記水系リチウム二次電池用負極活物質の上記主成分が不安定となり、電池の容量や充放電サイクル特性が劣化するおそれがある。一方、pHが10を超える場合には、水の電気分解電位、即ち水素発生電位及び酸素発生電位がそれぞれ2.21V及び3.44Vまで低下する。そのため、正極や負極で酸素や水素が発生し易くなるおそれがある。
【0038】
また、正極及び負極に狭装させるセパレータは、正極と負極とを分離し電解液を保持するものであり、例えばセルロース、ポリエチレン、及びポリプロピレン等の薄い微多孔膜を用いることができる。
【0039】
また、上記水系リチウム二次電池の形状としては、例えばコイン型、円筒型、角型等がある。正極、負極、セパレータ及び水溶液電解液等を収容する電池ケースとしては、これらの形状に対応したものを用いることができる。
【実施例】
【0040】
(実施例1)
次に、本発明の実施例につき、図1及び図2を用いて説明する。
本例は、水系リチウム二次電池用の負極活物質を作製すると共に、該負極活物質を用いて水系リチウム二次電池を作製し、その放電容量及び充放電サイクル特性を評価する例である。
【0041】
本例の水系リチウム二次電池用負極活物質は、リチウムバナジウム酸化物LiV2O5を主成分とする。本例においては、特にγ型のリチウムバナジウム酸化物LiV2O5、即ちγ−LiV2O5を主成分とする。
図1に示すごとく、本例の水系リチウム二次電池1は、正極2と、負極3と、リチウム塩を水に溶解してなる水溶液電解液とを有する。負極3は、上記のごとく、γ−LiV2O5を主成分とする水系リチウム二次電池用負極活物質を含有する。
また、正極2は、γ−LiV2O5よりもリチウムの吸蔵・脱離電位が低い物質であるオリビン構造のLiFePO4を主成分とする正極活物質を含有する。水溶液電解液は、リチウム塩としてのLiNO3を水に溶解してなる。
【0042】
水系リチウム二次電池1においては、CR2016型の電池ケース11中に、正極2及び負極3と共に、これらの間に狭装させた状態でセパレータ4が配置されている。また、電池ケース11内には、水溶液電解液が注入されている。電池ケース11内の端部には、ガスケット5が配置されており、電池ケース11は封口板12により密閉されている。
【0043】
次に、本例の水系リチウム二次電池の作製方法につき、説明する。
水系リチウム二次電池の作製にあたっては、まず、下記のようにして、水系リチウム二次電池用負極活物質を作製した。
本例の水系リチウム二次電池用負極活物質の製造方法においては、混合工程と、焼成工程と、熱処理工程とを行う。
混合工程においては、リチウム源と、バナジウム源とを、焼成後にLiV2O5となるような化学量論比にしたがって混合して混合物を得る。焼成工程においては、混合物を還元雰囲気下で温度600℃にて加熱して焼成物を得る。熱処理工程においては、焼成物をCO2ガス中で温度680℃にて加熱してγ−LiV2O5を主成分とする水系リチウム二次電池用負極活物質を得る。
【0044】
具体的には、まず、Li源として炭酸リチウム(Li2CO3)を準備し、V源として五酸化バナジウム(V2O5)を準備した。この炭酸リチウムと五酸化バナジウムとを、熱処理工程後にLiV2O5となるような化学量論比、即ちLi2CO3とV2O5とがモル比で1:2となるような化学量論比にて混合して混合物を得た(混合工程)。なお、混合は、自動乳鉢で120分間行った。
【0045】
次いで、混合物をプレス成形し、この混合物の成形体をArとH2との混合ガス気流中、即ち還元雰囲気下において温度600℃で8時間加熱し、焼成物を得た(焼成工程)。なお、ArとH2との混合ガスとしては、Arを約97体積%、H2を約3体積%含む混合ガスを用いた。
次に、焼成物を自動乳鉢で20分間混合し、CO2ガス中において、温度680℃で20時間焼成した(熱処理工程)。このようにして、γ−LiV2O5を合成し、これを水系リチウム二次電池用負極活物質とした。
【0046】
次に、以下のようにして、正極活物質として、オリビン構造のLiFePO4を固相反応法を用いて合成した。
即ち、まず、原料として、シュウ酸鉄・二水和物(FeC2O4・2H2O)、リン酸水素二アンモニウム((NH4)2HPO4)、及び水酸化リチウム(LiOH・H2O)を準備した。これらの原料をLiFePO4となるような化学量論比、即ち、FeC2O4・2H2Oと(NH4)2HPO4とLiOH・H2Oとをモル比で1:1:1となるように混合し、自動乳鉢を用いて30分間混合した。
【0047】
次いで、混合物をアルゴン雰気流中において、温度350℃で5時間仮焼した。得られた仮焼物を自動乳鉢で30分間混合し、さらにアルゴン雰気流中において温度650℃で6時間焼成した。
このようにして、オリビン構造のLiFePO4を合成し、これを正極活物質とした。
【0048】
次に、上記のようにして作製した正極活物質及び負極活物質を用いて、水系リチウム二次電池を作製する。
具体的には、まず、負極活物質としてのγ−LiV2O5を70重量部、導電剤としてのカーボンブラックを25重量部、及び結着材としてのポリテトラフルオロエチレン(PTFE)を5重量部混合し、負極合材を作製した。
また、正極活物質としてのLiFePO4を70重量部、導電剤としてのカーボンブラックを25重量部、及び結着材としてのポリテトラフルオロエチレン(PTFE)を5重量部混合し、正極合材を作製した。
【0049】
次に、図1に示すごとく、CR2016型のコインセル用の電池ケース11を準備し、予め電池ケース11の内側に溶接したSUSメッシュ上に負極合材15mgを約0.6ton/cm2で圧着して負極3を形成した。この負極3と同様にして、SUSメッシュ上に正極合材10mgを約0.6ton/cm2で圧着して負極3を形成した。
正極2及び負極3は、厚さ25μmのセルロース系のセパレータ4を介して、電池ケース11内に配置した。
【0050】
次いで、電池ケース11内にガスケット5を配置し、さらに電池ケース11内に水溶液電解液を適量注入し含浸させた。本例においては、水溶液電解液としては、LiNO3の飽和水溶液(pH≒7)を用いた。
次に、電池ケース11の開口部に封口板12を配置し、電池ケース11の端部をかしめ加工することにより、電池ケース11を密封して、水系リチウム二次電池1を作製した。これを電池Eとする。
【0051】
また、本例においては、上記にて作製した電池Eの優れた特性を明らかにするため、負極にLiV3O8を負極活物質として含有する水系リチウム二次電池(電池C)を作製した。
【0052】
電池Cの作製にあたっては、まず、以下のようにして負極活物質としてのLiV3O8を合成した。
即ち、まず、炭酸リチウム(Li2CO3)と、五酸化バナジウム(V2O5)とを準備した。これらをLiV3O8となるような化学量論比、即ちLi2CO3とV2O5とをモル比で1:3となるように混合し、自動乳鉢で20分間混合した。次いで、混合物をアルゴン気流中で、700℃まで昇温させて12時間保持した。その後、炉冷し、LiV3O8を作製した。これを電池Cの負極活物質とする。
【0053】
次いで、上記電池Eの場合と同様にして、正極活物質としてのLiFePO4を準備した。
さらに、上記電池Eの場合と同様にして、コインセル用の電池ケースを準備し、該電池ケース内に正極及び負極を形成すると共に、ガスケットを配置し、水溶液電解液を適量注入し含浸させた後、電池ケース11密封して、水系リチウム二次電池を作製した。これを電池Cとする。
即ち、電池Cは、負極活物質としてLiV3O8を含有する点を除いては、上記電池Eと同様のものである。
【0054】
次に、上記のようにして作製した2種類の水系リチウム二次電池(電池E及び電池C)について、充放電サイクル特性を調べた(充放電サイクル試験)。
充放電サイクル試験は、各電池について、温度60℃の条件下で、電流密度0.5mA/cm2の定電流にて電池電圧1.4Vまで充電し、その後電流密度0.5mA/cm2の定電流にて電池電圧0.1Vまで放電する充放電を1サイクルとし、このサイクルを30サイクル繰り返すことにより行った。各充放電サイクルにおいては、1.4Vまで充電した後、及び0.1Vまで放電した後に、充電休止時間及び放電休止時間をそれぞれ1分間ずつ設けた。そして、各サイクル毎に、各電池(電池E及び電池C)の放電容量を測定した。その結果を図2に示す。
【0055】
なお、放電容量は、各サイクル毎の放電電流値(mA)を測定し、この放電電流値に放電に要した時間(hr)を乗じて得られた値を、電池内の正極活物質の重量(g)で除することにより算出した。
また、図2において、横軸はサイクル数(回)を示し、縦軸は放電容量(mAh/g)を示すものである。同図には、負極活物質としてγ−LiV2O5を用いて構成した電池を電池Eとし、LiV3O8を用いて構成した電池を電池Cとして表した。
【0056】
図2から知られるごとく、負極活物質としてγ−LiV2O5を含有する電池Eは、負極活物質として従来から用いられているLiV3O8を含有する電池Cに比べて、大きな放電容量を発揮できることがわかる。電池Eは、電池Cに比べて、30サイクルの充放電の内、どのサイクルにおいてもより大きな放電容量を発揮できることがわかる。また、電池Eにおいては、充放電サイクルによる放電容量の低下率は電池Cとほぼ同等であるが、初期放電容量の大きさから、充放電サイクルを繰り返した後においても電池Cに比べて大きな放電容量を発揮できることがわかる。
【0057】
このように、本例の電池Eは、従来の水系リチウム二次電池に比べて、大きな容量を発揮できると共に、優れた充放電サイクル特性を発揮できることがわかる。
【図面の簡単な説明】
【0058】
【図1】実施例1にかかる、水系リチウム二次電池の構成を示す説明図。
【図2】実施例1にかかかる、2種類の水系リチウム二次電池(電池E及び電池C)の充放電サイクル特性を示す線図。
【符号の説明】
【0059】
1 水系リチウム二次電池
2 正極
3 負極
【特許請求の範囲】
【請求項1】
リチウム塩を水に溶解してなる水溶液電解液を有する水系リチウム二次電池用の負極活物質であって、
該負極活物質は、リチウムバナジウム酸化物LiV2O5を主成分とすることを特徴とする水系リチウム二次電池用負極活物質。
【請求項2】
請求項1において、上記主成分としてのリチウムバナジウム酸化物は、γ−LiV2O5であることを特徴とする水系リチウム二次電池用負極活物質。
【請求項3】
リチウム塩を水に溶解してなる水溶液電解液を有する水系リチウム二次電池用の負極活物質の製造方法であって、
リチウム源と、バナジウム源とを、焼成後にLiV2O5となるような化学量論比にしたがって混合して混合物を得る混合工程と、
上記混合物を還元雰囲気下で温度400〜900℃にて加熱して焼成物を得る焼成工程と、
上記焼成物をCO2ガス中で温度500℃〜800℃にて加熱してLiV2O5を主成分とする水系リチウム二次電池用負極活物質を得る熱処理工程とを有することを特徴とする水系リチウム二次電池用負極活物質の製造方法。
【請求項4】
正極と、負極と、リチウム塩を水に溶解してなる水溶液電解液とを有する水系リチウム二次電池において、
上記負極は、請求項1又は2に記載の上記水系リチウム二次電池用負極活物質を含有することを特徴とする水系リチウム二次電池。
【請求項5】
正極と、負極と、リチウム塩を水に溶解してなる水溶液電解液とを有する水系リチウム二次電池において、
上記負極は、請求項3に記載の製造方法によって得られる上記水系リチウム二次電池用負極活物質を含有することを特徴とする水系リチウム二次電池。
【請求項6】
請求項4又は5において、上記水溶液電解液のpHは、6〜10であることを特徴とする水系リチウム二次電池。
【請求項1】
リチウム塩を水に溶解してなる水溶液電解液を有する水系リチウム二次電池用の負極活物質であって、
該負極活物質は、リチウムバナジウム酸化物LiV2O5を主成分とすることを特徴とする水系リチウム二次電池用負極活物質。
【請求項2】
請求項1において、上記主成分としてのリチウムバナジウム酸化物は、γ−LiV2O5であることを特徴とする水系リチウム二次電池用負極活物質。
【請求項3】
リチウム塩を水に溶解してなる水溶液電解液を有する水系リチウム二次電池用の負極活物質の製造方法であって、
リチウム源と、バナジウム源とを、焼成後にLiV2O5となるような化学量論比にしたがって混合して混合物を得る混合工程と、
上記混合物を還元雰囲気下で温度400〜900℃にて加熱して焼成物を得る焼成工程と、
上記焼成物をCO2ガス中で温度500℃〜800℃にて加熱してLiV2O5を主成分とする水系リチウム二次電池用負極活物質を得る熱処理工程とを有することを特徴とする水系リチウム二次電池用負極活物質の製造方法。
【請求項4】
正極と、負極と、リチウム塩を水に溶解してなる水溶液電解液とを有する水系リチウム二次電池において、
上記負極は、請求項1又は2に記載の上記水系リチウム二次電池用負極活物質を含有することを特徴とする水系リチウム二次電池。
【請求項5】
正極と、負極と、リチウム塩を水に溶解してなる水溶液電解液とを有する水系リチウム二次電池において、
上記負極は、請求項3に記載の製造方法によって得られる上記水系リチウム二次電池用負極活物質を含有することを特徴とする水系リチウム二次電池。
【請求項6】
請求項4又は5において、上記水溶液電解液のpHは、6〜10であることを特徴とする水系リチウム二次電池。
【図1】


【図2】




【図2】


【公開番号】特開2006−66085(P2006−66085A)
【公開日】平成18年3月9日(2006.3.9)
【国際特許分類】
【出願番号】特願2004−243859(P2004−243859)
【出願日】平成16年8月24日(2004.8.24)
【出願人】(000003609)株式会社豊田中央研究所 (4,200)
【Fターム(参考)】
【公開日】平成18年3月9日(2006.3.9)
【国際特許分類】
【出願日】平成16年8月24日(2004.8.24)
【出願人】(000003609)株式会社豊田中央研究所 (4,200)
【Fターム(参考)】
[ Back to top ]

