水素化金属の析出及び水素の製造方法
【課題】
エネルギー資源の海外依存度を減らし、CO2の排出量を減らし、国内に在る資源を最大限に活用して、石油や石炭のように長期保存や長距離輸送が可能な代替燃料を製造するために、海洋塩や石灰石等の天然資源あるいは産業廃棄物の鉄鋼スラグ等から、水素発生と貯蔵を同時に満たす固体燃料としての水素化金属を、風力や太陽エネルギーから得た電力を用いて製造し、需要に応じて供給して産業の発展に寄与すること。
【解決手段】
国内外から普遍的に自然状態で存在している海水、塩湖水、温泉水、石灰岩等から究極のエネルギー源から水素を需要量に応じて得るために、上記資源の源泉から採取した金属類から各種金属塩の溶融塩を生成させ、溶融塩電気分解により、陰極に析出する金属に水素を吸蔵させて、水素化金属を製造し、水素生産施設で、水と反応させて、吸蔵させた水素と、当該金属が水と反応して出す水素とを同時に得ることにより2倍の水素を得る。
エネルギー資源の海外依存度を減らし、CO2の排出量を減らし、国内に在る資源を最大限に活用して、石油や石炭のように長期保存や長距離輸送が可能な代替燃料を製造するために、海洋塩や石灰石等の天然資源あるいは産業廃棄物の鉄鋼スラグ等から、水素発生と貯蔵を同時に満たす固体燃料としての水素化金属を、風力や太陽エネルギーから得た電力を用いて製造し、需要に応じて供給して産業の発展に寄与すること。
【解決手段】
国内外から普遍的に自然状態で存在している海水、塩湖水、温泉水、石灰岩等から究極のエネルギー源から水素を需要量に応じて得るために、上記資源の源泉から採取した金属類から各種金属塩の溶融塩を生成させ、溶融塩電気分解により、陰極に析出する金属に水素を吸蔵させて、水素化金属を製造し、水素生産施設で、水と反応させて、吸蔵させた水素と、当該金属が水と反応して出す水素とを同時に得ることにより2倍の水素を得る。
【発明の詳細な説明】
【技術分野】
【0001】
本発明の第一の目的は、海洋塩、塩湖塩、岩塩、結晶化塩、温泉水含有塩、鉱泉含有塩、石灰石(炭酸カルシウムを主成分とする石灰石、大理石、方解石、石灰藻、石灰華)および/又は、ボーキサイト等の天然資源又は産業廃棄物(スラグ、貝殻、甲殻類)等から水素化金属を製造し、或いは産業廃棄物の中の溶鉱炉スラグや燃殻としての石灰などを構成する周期律表の1族、2族、13族、14族等の主に卑金属元素類の塩化物、水酸化物、酸化物、硫酸塩、炭酸塩などの単独塩又は複合塩および/又は貝殻を溶融塩電気分解により陰極に当該金属類を析出させ、或いは当該金属がイオンの状態で、それらと水素ガスとを当該水素化金属の融点以下の温度雰囲気で反応させ、水素化金属を生成させ、若しくは、調達した各種単体金属を水素ガスと反応させ、生成した水素化金属を油中に保管させると同時に当該水素化金属に水とを接触させて必要に応じて水素を製造し、燃料用に提供すると同時に、残渣として析出する水酸化金属は脱水することにより、1族元素は溶融塩電気分解用の原料としてリサイクルにより再度供給し、2族元素の水酸化金属は融点以上で水を放出して酸化金属になるため、2族金属元素塩化物を直接溶融塩電気分解するか或いは溶媒としての2族元素塩化物と溶質としての2族元素酸化物から成る混合塩を溶融塩電気分解して陰極に当該金属類を析出させ、或いは当該金属がイオンの状態で、それらと水素ガスとを当該水素化金属の融点以下の温度雰囲気で反応させ、水素化金属を生成させ、若しくは、調達した各種単体金属を水素ガスと反応させ、生成した水素化金属を油中に安全に保管させ、水素の需要に応じて水と接触させることにより、水素燃料を製造させるサイクルを維持させようとするものに関する。又、上記地球上に偏存無く、かつ極自然に存在する天然資源や産業廃棄物から産業上必要とする各種金属類を獲得することも目的とする。
【0002】
本発明の第二の目的は、(0001)に記載の天然資源から各種金属の単体、各種水素化金属の製造および副生成物から更に、産業上必要とする無機工業化学の原料の製造に必要とする動力源、電力源をエネルギーとして獲得するのに太陽光、風力、波力、重力・浮力、地熱等の自然から調達することに注力させ、又、無機工業化学の原料を海洋塩、塩湖塩、岩塩、結晶化塩、温泉水含有塩、鉱泉含有塩、石灰石、ボーキサイト等の天然資源或いは産業廃棄物の中の溶鉱炉スラグ等を廃棄物から調達することを心がけ、反応生成後の各種製造物は水素燃料サイクルを循環させることにより省エネ効果を具現化させ、発熱・吸熱による反応後に発生するCO2排出を極力無くし、かつ、水素化金属の加水分解又は、水素化アルミニウムの熱分解により水素燃料を得ると同時に反応後の副生成物である金属水酸化物或いは金属をはじめとする無機化学工業の主要原料を生成させることにあり、更に、反応後の無駄な副生成物を繰り返し溶融塩電気分解し、資源のリサイクルにより、資源の有効活用を図り、無駄を無くすことにある。
【背景技術】
【0003】
小資源国日本がエネルギー源としての石油の調達は海外に依存していることに論を挟む余地はない。炭素を含む化石燃料を燃焼させるとCO2を排出するが、燃焼によるCO2排出を抑制する方策と手段として水素の実用化を早急に実現させ、化石燃料と併用させることが望まれる。我が国のCO2排出量は、非特許文献1(産業関連表による環境負荷原単位データブック/独立行政法人国立環境研究所 地球環境センター/2002年9月)によると、年間約11億トン。その内、約29%の3.2億トンが電力・ガス・熱供給部門、約18%の2億トンが運輸部門、約12%の1.3億トンが鉄鋼部門、約7%の0.8億トンが石灰石を原料とするセメント工業を主体とする窯業・土石製品製造部門である。これら4部門だけで我が国の総CO2排出量の66%を占める。そこで先ず考えねばならないことが、第一番目の電力・ガス・熱供給部門と2番目の運輸部門の石油から水素エネルギーへの変換である。これには国内から調達可能で無尽蔵とも謂える海洋塩、温泉水含有塩、鉱泉含有塩、石灰石など、或いは世界中に偏在無く無尽蔵に分布する塩湖塩や岩塩等の天然資源。これら天然資源を太陽光、風力、波力、重力・浮力、地熱等の自然エネルギーで得られた電力で溶融塩電気分解して、水素化金属を製造することが可能である。
一方、第3番目の鉄鋼部門および第4番目のセメント部門では、石灰石を焼いて生石灰を作る工程が不可欠であり、この工程でのCO2の発生を省略することは出来ない。更に、考えねばならないことは、この石灰石こそ我が国で数少ない自給率100%の資源である。そこで本発明では、この石灰石の主成分たる炭酸カルシウムCaCO3のカルシウCaを水素発生金属として活用すると同時に、鉄鋼製造過程で出る廃棄物としての約30%に及ぶ高温スラグをも水素エネルギーに変換することである。このようにクリーンエネルギーとしての水素を持続的に得られれば今後の地球環境負荷低減と経済活動の二律背反的な課題に対しての解決策を提供することが可能となる。
【0004】
更に、生産工程、輸送過程、消費過程における経済活動を主とした人間の営みには、電力源、動力源を獲得するためのエネルギー源としては石油系化石燃料等々から賄われ、CO2の発生を皆無にすることは困難である。そこで本発明では、この点も勘案し、極力、自然界に数多にしかも平等に存在している天然物を原資にし、しかも水素、各種金属類の製造に必要とする電力源獲得は、風力発電、太陽光発電、波力発電、地熱発電、重力・浮力発電等々の自然法則を利用したものから獲得し、エネルギーの使用後、大気開放されても環境負荷が掛からず、かつ、水素を製造、輸送、貯蔵する過程において極力、常温、常圧に近いエネルギー消費で目的を達成させる方式を選択した。
【0005】
従来、水素は水の電気分解による製法が一般的であるが、その貯蔵や輸送には重いボンベが必要である。このためボンベの軽量化や水素ガスの液化或いは水素吸蔵合金などの開発が進められている。一方、需要に応じ、短時間に大量に水素を必要とする発電所や都市ガス或いは燃料電池充電工場などの施設では、固体水素が相応しい。この固体水素の代替として、水よりも軽い電力貯蔵固体として海水や岩塩から金属ナトリウムを製造し、これを石油中に保存して、電力消費地の火力発電所に輸送し、水を注いで発生させた水素で発電し、副産物の苛性ソーダはソーダ工業の原料として供給するか、或いは再度溶融塩電気分解して金属ナトリウムを再製して、ナトリウム燃料サイクル(水素燃料サイクル)として、苛性ソーダの熔融塩電気分解を繰り返す再処理システムとして、金属ナトリウムが水よりも軽い電力貯蔵固体として、枯渇の心配が全く無く、CO2も出さず、放射能も出さない化石燃料の代替エネルギーであることを特許文献1(国際出願番号:PCT/JP2008/058500、国際公開番号:WO/2008/142995)に開示している。
【0006】
一方、金属ナトリウムの加水分解では1/2モルの水素しか発生しないが、それに対して水素化ナトリウム(NaH)の加水分解では理論的には1モルの水素を発生させることと、水素化ナトリウム(NaH)の製造方法は電気化学的に電気炉内で原料の水酸化ナトリウムから酸素固体電解質電極を用い、直接NaHを製造する方法が特許文献2(特開2007-223839)に開示されている。又、水素化金属を燃料電池の燃料源として用いる方法として、特許文献3(特開2003-229134)には水素化金属としてNaH、NaBH4、KBH4、LiAlH4、KHが開示されている。更に、特許文献4(特開2003-234115)には水素化金属としてLiH、CaH2、BaH2、MgH2が開示されている。これらはすべて、比較的低温度の反応で水素を得、しかも水素燃料サイクルを形成させて持続的に所望する水素燃料を得ることと、出発原料となる金属類や水は自然状態のものから得ることを目的としているために環境負荷を少なくし、持続的社会を目指す人類の経済活動に貢献するものである。
【0007】
更に、本発明の目的は、産業上利用可能な金属類を、海洋塩、塩湖塩、岩塩、結晶化塩、温泉水含有塩、鉱泉含有塩、石灰石、ボーキサイト等の天然資源或いは産業廃棄物の中の溶鉱炉スラグや燃殻としての石灰などを得ることを目的とするために、喩え万一、資源外交問題で石油・金属資源供給国との間で不慮の経済摩擦が発生した場合にも備えて、国内で調達できることを目的とすると同時に水素エネルギー社会の到来を踏まえて安全に、持続的に水素の供給・輸送・保管を可能にすることを目的とするものである。
【0008】
又、工業規模で水素を多量に得るための水素発生装置(タンク)の構造、水素の生産現場から消費地への水素ローリ車による安全移送、水素ステーションでの内燃機関用の動力源獲得のために補給する際に、需要量に応じた給水素量をオンディマンドで製造可能とするように、補給基地としての製造・貯蔵・保管等々、地球温暖化対策としてやがて到来するであろう水素社会を睥睨しての課題点の解決策を提供することも目的とする。
【0009】
上記記載による本発明の目的を達成させるためには、最終手段的には、アルカリ金属、アルカリ土類金属を含有する海洋塩、塩湖塩、岩塩、結晶化塩、温泉水含有塩、鉱泉含有塩、石灰石、或いは周期律表第13族元素のアルミニウムを含有する粘土やボーキサイト等の天然資源或いは産業廃棄物の中の溶鉱炉スラグや燃殻としての石灰などを溶融状態で電気分解により、各種金属類を陰極で単離させた後、水素ガスと反応させて各種水素化金属を生成する方法と、各種溶融塩の電気分解過程で陰極から出る水素イオンと陰極近傍の被析出金属イオンを結合させて直接水素化金属を採取することを目的とするために膨大な実施例のデータと時間が必要になるために、本発明の実施例は、比較的簡単に、しかも確実性のある取得可能な方法に限定して実施例とすることにし、他の多くの必要とされる実施例データは公知のデータ、非特許文献等に記載されている事象に基づき、理論的に可能性ありとの見解に基づき記載した。
【0010】
本発明を実施するための出発物質の原料は自然状態で存在している海洋塩、塩湖塩、岩塩、結晶化塩、温泉水含有塩、鉱泉含有塩、石灰石等であるが、非特許文献2(『“風力よ”エタノール化からトウモロコシを救え<風力発電による海洋資源回収と洋上工場>/パワー社出版』)15ページに示してあるように、海水1リットル中に35gの塩分を含み、その中にアルカリ金属としてNa(10.8g), K(0.38g), Li(0.002g)、アルカリ土類金属はMg(1.3g), Ca(0.4g), Sr(0.01g), Ba(0.0002g)、13族のAlは(0.0002g)である。非特許文献3(石垣島の自然岩塩:http://www.binchoutan.com/ishigaki.html)には、製品100g中に、Na(32g), Mg(1.2g), Ca(0.53g), K(0.42g)である。塩湖塩としては世界最大の南米・ボリビアのウユニ塩湖の塩(100g)の成分はNa(38.7g), Ca(0.34g), K(0.03g), Mg(0.03g), Fe(0.0004g)である。岩塩としてはモンゴル岩塩(100g)の成分は Na(37.86g), Mg(0.1g), Ca(0.08g), K(0.03g), 水分(2.94g)である。温泉水の内、成分比として塩類が多いのは、兵庫県有馬温泉では1リットル中に海水の2倍に匹敵する71gの塩類からなり、その成分比はNa(20g), K(5g), Ca(3.4g), Sr(0.6g), Li(0.5g), Ba(0.5)gと非常に多くのミネラルが含有されている。我が国で最もアルミニウムイオンが多い温泉は蔵王温泉で、1リットル中には6.7gの塩類からなり、金属イオンで最も多いのがAl(0.3g)で次がCa(0.11g), Fe(0.09g), Na(0.076g), Mg(0.072g), K(0.06g)である。2番目が秋田県玉川温泉で、1リットル中には6.6gの塩類からなり、金属イオンで最も多いのがAl(0.28g)で次がFe(0.16g), Ca(0.16g), Na(0.066g), Mg(0.053g), K(0.034g)である。最もカルシウムが多いのは静岡県駿河健康ランドで、1リットル中には25gの塩類からなり、金属イオンで最も多いのがCa(4.6g)で次がNa(1.9g), Mg(1.8g), K(0.61g)である。勿論岩塩など水が無いものは、金属を取り出すには有利であるが、海水、温泉水或いは鉱泉のように95%以上が水の場合でも、淡水化により真水を、陰イオンから塩酸や硫酸を製造すれば、その副産物だけでも採算に合う。海水から金属を取り出すプロセスにおいて、副産物として出る、真水、硫酸、塩酸も従来大電力を要して生産していたものであり、この副産物だけでも採算性があることが、特許文献1(国際出願番号:PCT/JP2008/058500、国際公開番号:WO/2008/142995)および非特許文献2(『“風力よ”エタノール化からトウモロコシを救え<風力発電による海洋資源回収と洋上工場>/パワー社出版』)、非特許文献4(『Climate Change and Sustainable Development, Edited by Ruth A. Reck, Chapter 19“Wind Power and Seawater Save Corn from Ethanol Production: A Marine resources recovery and Offshore Integrated Plant for Sodium Fuel, Fresh Water, Ethanol, Vegetable, and Fish Production with Wind Energy and Seawater, p215-221,By Masataka Murahara / Linton Atlantic Books, Ltd, Feb. 2010』)に開示されている。
石灰岩の主成分は、炭酸カルシウム(CaCO3)で、少量の酸化マグネシウム(MgO)、シリカ(SiO2)、酸化アルミニウム(Al2O3)、酸化鉄(Fe2O3)を含む。非特許文献5(石灰石・ドロマイトとは/ http://www.yoshizawa.co.jp/company/index.html)によると石灰石の起源は海底のサンゴで、海中のCO2を取り込み石灰質の殻を作り、これが堆積したのが石灰石で、従って純粋な炭酸カルシウム(CaCO3)の化学成分は炭酸カルシウム(CaO):56.03%、二酸化炭素(CO2):43.9%である。我が国では年間1億7千トンが生産され、その殆どが露天掘りで、採掘費が安く、数少ない自給率100%の資源である。石灰石の用途はセメント原料や製鉄(生石灰(CaO)は鉄鉱石やコークスなどの原料に含まれる不純物を除去)に使われることが開示されている。又本発明の水素化カルシウム(CaH2)も生石灰(CaO)を使う。従って、これらの用途のために、多くの石灰石は熱分解して生石灰(CaO)として使う。そのため多量のCO2を発生させなければ成らないが、この石灰石熱分解プロセスは発電所や自動車のガソリン内燃機関と異なり酸素を用いない。現在、火力発電所などで純粋なCO2を回収するために、空気を用いず、空気から分離した酸素を使い、燃焼後のCO2を液化して深海底に埋設することが進められている。しかしこの石灰石の熱分解で得られるCO2は純粋なので、このまま液化することが出来る。又、この液化CO2を深海底の鉱物資源掘削運搬用浮力源や内燃機関の動力源として利用することが本発明者らによって特許文献5(深海資源採掘・回収統合洋上工場/特願2009-22119)に開示されている。このようにプロセス過程で排出するCO2も有効利用して大気に放出することなく石灰石を用いれば、我が国はもとより世界中に広く分布し、採掘が容易で、かつ採掘岩に約39%内外のカルシウム(Ca)を含有するエネルギー資源は他に無いと考える。この含有率39%は塩中に約38%の金属ナトリウムを含有する岩塩と肩を並べるものである。しかも、地表から深さ18 Kmの範囲の岩石圏(火成岩95%、頁岩4%、砂岩0.75%、石灰石0.25%)の中で0.25%を占める石灰石は、世界中に偏存無く広く分布し、かつ、クラーク数によると、カルシウム(Ca)は3.39%で5番目(1番:酸素/49.5%、2番:ケイ素/25.8%、3番:アルミニウム/7.56%、4番目:鉄/4.7%、5番目:カルシウム/3.39%、6番目:ナトリウム/2.63%、7番目:カリウム/2.4%、8番目:マグネシウム/1.93%)である。このクラーク数で1番目の酸素は殆どの金属の酸化物であるため、地表上で最も多い金属元素はケイ素(Si)である。従って豊富なエネルギー資源はケイ素(Si)である。これら周期律表14族元素(C,Si,Ge,Sn,Pb)の水素化金属は融点が低く、常温ではすべて気体であり、しかも酸素とは激しく反応する。このため、エネルギー源としては申し分ない。ところが燃焼後生成する酸化物はCO2 やSiO2のように超安定でその還元には大量のエネルギーが必要である。しかし、水素を燃焼させて得られる水(H2O)はその状態で、種々の物質の溶媒として或いは生物の成長エネルギーとして、或いは電気や光により簡単に還元が出来るなど、第14族元素の水素化物と比較すると経済的である。3番目のアルミニウム(Al)は、第13族元素(B, Al, Ga, In, TI) に属すが、アルミニウム以外は水素化金属の融点が低く、常温で気体であり毒性が強く、かつ酸素や水蒸気と激しく反応するためエネルギー源としては相応しくないと考える。ただし水素化アルミニウム(AlH3)だけは融点が150℃と高い。このように比較的融点が高い水素化金属の中に在って、融点が200℃以下の物質はRbの170℃、Alの150℃、Csの140℃、Beの125℃である。これら低融点材料の中で最も資源として豊富なものがアルミニウムであり、しかも水素化アルミニウム(AlH3)の比重は1.49と軽く、かつ融点が193℃、沸点が182℃と低いため昇華現象を回避すれば低温度での溶融塩電気分解が可能である。とくに水素化アルミニウム(AlH3)の融点150℃付近は、回転機、摩擦熱、或いはエンジンの発熱で水素を吐き出すことが出来るため自動車用エネルギーとして利用できる。5番目のカルシウム(Ca)と8番目のマグネシウム(Mg)などの第2族元素(Be, Mg, Ca, Sr, Ba, Ra)の金属単体表面は酸素雰囲気で酸化皮膜が形成される水との直接反応を阻害する。ベリリウム(Be)は100℃でも反応しない。マグネシウム(Mg)は水では反応せず熱水で反応する。カルシウム(Ca)は水と作用させると常温では水酸化カルシウムの保護膜を作るため、反応は緩やかで、熱すると激しく反応して水素を生成する。ラジウム(Ra)は反応性に富むが、ストロンチウム(Sr)やバリウム(Ba)はカルシウム(Ca)に似ている。しかるに第2族元素の水との直接反応で水素を発生させることは効率が低いが、水素化物にすれば常温で激しく水と反応して水素を発生する。更に、金属カルシウムを水と反応させた時には1モルの水素(H)を生成する(Ca + 2H2O →H2 + Ca(OH)2)。ところが水素化ナトリウム(CaH2)の場合には2モルの水素)を生成する((CaH2 + 2H2O → 2H2+ Ca(OH)2)。従って水素化カルシウム(CaH2)は、水素(H2)発生物質として有望である。クラーク数8番目のマグネシウム(Mg)、19番目のバリウム(Ba)、22番目のストロンチウム(Sr)およびそれ以下のベリリウム(Be)についても同様で水素化物にすると水との反応性が向上し、水素発生効率が上昇する。
第6番目のナトリウム(Na)は海水、塩湖、岩塩などに多く含まれているため、最も有望な金属である。この金属ナトリウムは、第1族元素(Li, Na, K, Rb, Cs, Fr)はアルカリ金属として最も反応性に富み、かつ水を注ぐと激しく反応して水素を発生する。しかし、大気中でも水分と反応して爆発するなど、取り扱いに注意が必要である。一般に金属ナトリウムは軽油などの油の中に保存するが、水素化ナトリウム(NaH)にパラフィンをコーティングするぐらいで安全に使用できる。更に、金属ナトリウムを水と反応させた時には0.5モルの水素(H)を生成する(Na+ H2O →1/2H2 + NaOH)。ところが水素化ナトリウム(NaH)の場合には1モル(2倍の水素)を生成する(NaH + H2O → H2 + NaOH)。従って水素化ナトリウム(NaH)は、水素(H2)発生物質として有望である。クラーク数7目のカリウム(K)、18番目のルビジウム(Rb)、更に、少ないセシウム(Cs)やリチウム(Li) についても同様で水素化物にすると水との反応性が向上し、水素発生効率が上昇する。このように、国内にある豊富な資源を原料として水素化を狙うことも今後の有力な代替エネルギー候補と成り得る。
【0011】
上記記載の海洋塩、塩湖塩、岩塩、結晶化塩、温泉水含有塩、鉱泉含有塩、石灰石、ボーキサイト等の天然資源或いは産業廃棄物の中の溶鉱炉スラグや燃殻としての石灰などの複合塩を出発原料とするのが目的であるが、各種金属の水素化物を得ることを一義的に考え、そのために各種金属毎の塩化物、水酸化物又は酸化物を、夫々単塩毎の溶融塩電気分解から始め、順次それら複数の塩を組み合わせた複合塩を溶融塩電気分解する。一般に溶融塩はイオン導電により高い導電率を示す。非特許文献6(高橋武彦著電気化学概論 223頁 /1991年2月20日 新版刷)には、導電率はイオン性が小さいほど高く、陽イオンが同じならばCl-> Br- >I- の順に、又陰イオンが同じならばLi+> Na+ > K+ > Rb+ >Se+ の順に低くなる。従って、溶融塩を金属製造などの工業分野から考える場合には、その導電率ができるだけ高く、又、できるだけ低い温度で使用できることが望ましいと記載されている。非特許文献7(伊藤康彦編 溶融塩の応用 16頁/ 2003年7月31日)には、ダウンズ法による金属ナトリウム製造において、NaClの融点は803℃と高く、実用化するには、融点の低下が望まれる。このためCaCl2-NaCl系溶融塩の相平衡効果を用い、混合溶融塩を用いることにより、電解浴の融点を下げることが記載されている。非特許文献8(電気化学便覧 第5版:丸善株式会社 平成13年6月30日発行)の125頁には2成分系および3成分系の共融混合物の組成と融点が降下することについて記載されている。更に、特許文献6の224頁には溶融塩の電解では、溶質の分解電圧が溶媒の分解電圧より高ければ溶質の電解は不可能であれば、単一塩の溶融体では溶媒が無いので、その塩の分解電圧に達しさえすれば電解が可能であると記載されている。そこで、非特許文献9(理科年表:丸善株式会社 平成15年版)や非特許文献10(実験化学ガイドブック:丸善株式会社 昭和59年6月15日発行)、非特許文献11(化学便覧 基礎編 I、II 改訂3版:丸善株式会社 昭和59年6月15日発行)、非特許文献8(電気化学便覧 第5版:丸善株式会社 平成13年6月30日発行)などから本発明遂行に必要とする金属および金属化合物の物理的定数を典型元素の中から周期律表の第1族,2族,13族元素および他の金属と比較して融点が低いため溶融塩の融点を下げる効果を期待して、遷移元素で第12族元素の亜鉛(Zn)を選び、それらについて調べると、各金属の比重は、Li(0.54) >K(0.86) >Na(0.97) >Rb(1.53) >Ca(1.55) >Mg(1.74) >Be(1.85) >Cs(1.87) >Sr(2.60) >Al(2.69) >Ba(3.5)とLiが最も軽い。金属の融点は、Al(182)<Zn(283)<
Be(405)<Li(605)<Cs(645)<Mg(714)<Rb(718)<K(770)<Ca(772)<Na(801)<Sr(875)<
Ba(925)の順に高くなる。塩化物の融点は、Al(193)<Be(405) <Li(605) <Li(605) <Cs(645)<Mg(714)<Rb(718)<K(770)<Ca(772)<Na(801)<Sr(875)<Ba(925)の順に高くる。水酸化物の融点は、Zn(125℃)< Cs(272) < Zn(125℃)<Cs(272) <Al(300)<Rb(301)<
Na(318)<Ba(325)<Mg(350)<K(360)<Sr(375)<Li(450)<Ca(580)の順に高くなる。水素化物は、Be(125℃)<Cs(140)<Al(150)<Mg(287)< Rb(300) <K(417)<Ca(600)< Li(680)<
Na(800)<Ba(1675) の順に高くなる。酸化物の融点は、Na(1275)<Li(1570)Ba(1918)<
Zn(1975)<Al(2054)< Sr(2430)<Be(2530)<Ca(2572)<Mg(2800) の順に高くなる。硫酸塩の融点は、Na(1275)<Li(1570)Ba(1918)<Ca(1450)<Ba(1580)<Sr(1605)の順に高くなる(単位は℃)。又、Pt, Pd, Ti, V, Fe, Mn, La などの遷移元素は水素が吸蔵され易いことが一般に知られている。これら遷移金属元素の中でTi, Fe, Mn などの元素化合物は本発明の溶融塩の中に含める。とくに低い温度で溶融塩電気分解を行うために、溶媒として高い導電率を有し、かつ溶質よりも分解電圧が高い溶媒を選択することが必要である。このために溶融電解塩の溶質としては、塩化カルシウム(CaCl2)或いは塩化バリウム(BaCl2)が適している。とくに本発明においては、水素化カルシウム(CaH2)は有力な代替エネルギー源である。しかし塩化カルシウム(CaCl2)は分解電圧が高いためCaの析出には大電力が必要である。ところが、非特許文献12(鈴木亮輔 「溶融塩化カルシウム中でのCaO電解を利用した酸化物の還元」平成21年度溶融塩賞受賞記念論文)には、塩化カルシウム(CaCl2)の中に生石灰(CaO)を溶融させると、CaOの理論分解電圧(約2.6V)がCaCl2の理論分解電圧(約3.2V)よりも低いので、この電圧を印加すればCaCl2の中でCaOのみを電気分解して、Caを得、これで酸化チタン(TiO2)を還元することが可能であると示唆している。このように溶融塩電気分解においては、溶媒と溶質を如何に選択するかが、実用化の鍵を握ると考える。本発明では、これら溶融塩を電気分解する過程で陰極又は陰極近傍で水素と反応させ、水素化金属を生成することに尽きる。一方、陽極では塩素、酸素、二酸化炭素、亜硫酸ガスなどを採取して、化学工業用塩酸や硫酸として或いは酸素は燃焼用として供給する。上記の手段により得られた金属の水素化物は比較的安定な化合物であるが、出来る限り油中で保管・移送・管理し、オンディマンド(On Demand)で水素の需要量に応じて水と接触させて燃料用途としての水素を得る。本発明を実施させるための原材料となる水素化金属類は、市販のものを調達することにより得ることも吝かではない。
【0012】
陸上の固鉱物資源から水素化金属を得るには、鉱脈が豊かであれば経済的である。水素化アルミニウム(AlH3)はボーキサイト、水素化ナトリウム(NaH)は岩塩、水素化カルシウム(CaH2)は石灰石から製造する。ボーキサイトや岩塩は地域に偏存する。ところが石灰石は世界中の地表や海岸の浅瀬や海底に広く分布する。この石灰岩の自給率が100%に近い我が国にとっては打って付けなエネルギー資源である。又、国外においても同様である。バルト海中央に位置するスエーデンのゴットランド島は、風が強く、古くから自然エネルギーに頼った生活様式が根付き、持続可能社会(Sustainable Society)の発想を生んだ場所でもある。島の内部や海岸或いは海上の至る所に風車が電力を生産し、その一部は海底ケーブルで送電し、本土のスエーデン国鉄の特急列車(X2000)を動かしている。このバルト海は水深が浅く、しかも塩分濃度は世界の海水の塩分濃度3%の1/3の1%と低い。しかし地下水が豊富であるため、海水の淡水化も必要が無く、海水から金属ナトリウムを回収する方法には消極的であった。ところがこの島の成因は石灰石である。至る所に露天掘りの石灰石鉱山が在り、その周囲にはセメント工場が多い。本発明は、この石灰石と風力発電を代替エネルギー資源にしようとする発想から生まれたものである。
【0013】
炭酸カルシウム(CaCO3)を主成分とする石灰石から水素化カルシウム(CaH2)を得るには、先ず、CaCO3を熱分解して、酸化カルシウムと二酸化炭素(CO2)を得る(CaCO3→CaO+CO2)。この場合、二酸化炭素(CO2)は、地球温暖化の要因ガスになるので、別途、二酸化炭素(CO2)を利用した内燃機関用の動力源とするために、液化炭酸ガス若しくはドライアイスにして貯蔵する。一方、溶質としての酸化カルシウム(CaO)は、溶融状態にある溶媒としての塩化カルシウム(CaCl2)に良く溶け、しかも塩化カルシウム(CaCl2)よりも酸化カルシウム(CaO)の方が電解電圧が低いので、酸化カルシウム(CaO)が先に電解され、陰極にカルシウム(Ca)が析出される。ここで、陰極内部或いは周囲から水素ガスを送って水素化カルシウムCaH2を生成させる。ここで陰極にはセラミック製水素電解質電極を用い、水素ガスを満たし、セラミック製電解質に接した金属電極を陰極として、イオン化された水素をセラミック製電解質電極を隔てて当該電解質近傍の溶融塩側の金属イオンと反応して水素化金属を形成させる。ここで金属イオンがカルシウムの場合は水素化カルシウム(CaH2)が生成する。この水素化カルシウム(CaH2)の比重(1.91)より重く、塩化カルシウム(CaCl2)の比重(2.15)より軽いため、最終的には水素化カルシウム(CaH2)は最上部に浮き回収される。このときの反応温度は600℃以下であることは勿論のことである。これにより、水素化カルシウムCa(H2)燃料として供給が可能となる。石灰石中には約56%の炭酸カルシウム(CaCO3)が含まれているが、更に、多い95〜98%以上含まれているのが貝殻である。この貝殻は石灰岩のような鉄分やアルミニウムなどの不純物は全く無く至って純粋な炭酸カルシウムである。例えば帆立貝を例に取ると、国内では年間21万トンが廃棄物として出るが、現在薬品などへの利用が考えられている。この貝殻も、水素化カルシウム(CaH2)製造として有望である。更に、骨や甲殻類の主成分は約58%が燐酸カルシウム(CaPO3)だが、燐を含むため公害にもなりかねないが、燐分の肥料化などをすれば、これも有望なエネルギー資源であると考える。
【0014】
製鉄の原料は、鉄鉱石、コークス、石灰石である。このプロセスには大量の熱エネルギーが投入される。コークス炉で石炭やプラスチックを燃やして製造したコークスと焼結した鉄鉱石と石灰石とを高炉中で燃やし、溶鉄を作り、これを転炉に送り、酸化剤を用い、余分な炭素や不純物を取り除くために加熱溶融した後、鋳造圧延工程を経て鉄鋼製品が出来上がる。コークス炉の副産物にコークス炉ガスが有るが、その中の56%が水素ガスである。非特許文献13(鉄鋼廃熱有効利用研究会の概要:環境・エネルギー工学部会/(社)日本鉄鋼協会:http://www.isij.or.jp/Bukai/Gakujutsu/Eco/study_01.htm)によると、各部所の廃熱温度は高炉ガス:150℃、コークス炉ガス:250℃、焼結炉ガス:400℃、転炉ガス:1500℃、高炉スラグ:1500℃、転炉スラグ:1550℃である。この高炉スラグや転炉スラグの廃熱は未使用であると記載されている。非特許文献14(鉄鋼スラグとは:株式会社 テツゲン:http://www.tetsugen.co.jp/slag.htm)によると、鉄鋼スラグの成分は、生石灰(CaO)が最も多く、高炉スラグで(CaO:41.7%, SiO2:33.8%, Al2O3:13.5%, MgO:7.4%, S:0.8%, Fe: 0.4%, MnO:0.3%)、転炉スラグで(CaO:45.8%, SiO2:11.0%, Al2O3:1.9%, MgO:6.5%, S:0.06%, Fe: 17.4%, MnO:5.3% )である。これら1500℃内外のスラグは、大型高炉では100〜150t/hの速度で連続的に排出され、大気中冷却や水冷して、コンクリート用骨材、セメント、道路補修用路盤剤、地盤改良剤、肥料などに使われている。しかし、熱回収は殆ど行われていない。非特許文献15(日本国勢図絵 第5版 2007/2008)表19-8によると2005年の我が国の銑鉄生産高が8,300万トンであるから、排出されるスラグは、約2,400万トン(鉄鋼の30%がスラグ)と莫大な量である。しかも、1,500℃に及ぶ未使用の廃熱となる。
そこで本発明では、塩化カルシウム(CaCl2)や塩化バリウム(BaCl2)の単塩又は複合塩に高温スラグを投入して混合溶融塩を作り、これを溶融塩電気分解して、金属カルシウム(Ca)を製造し、250〜300℃内外でコークス炉から得られた副産物の水素ガス(H2)と反応させて、水素化カルシウム(CaH2)を製造する。或いは、塩化カルシウム(CaCl2)や塩化バリウム(BaCl2) 或いは塩化カリウム(KCl)の組み合わせによる複合塩に高温スラグを投入して混合溶融塩を作り、600℃以下で溶融塩電気分解を行い、陰極内部或いは周囲から、コークス炉から得られた副産物の水素ガスを送って水素化カルシウムCaH2を生成する。この水素化カルシウムCaH2の比重(1.91)より重く、塩化カルシウム(CaCl2)の比重(2.15)より軽いため、最終的には水素化カルシウム(CaH2)は最上部で回収することができる。ここで、陰極内部或いは周囲から水素ガスを送って水素化カルシウムCaH2を生成させる。ここで陰極にはセラミック製水素電解質電極を用い、水素ガスを満たし、セラミック製電解質に接した金属電極を陰極として、イオン化された水素をセラミック製電解質電極を隔てて当該電解質近傍の溶融塩側の金属イオンと反応して水素化金属を形成させる。
特に、溶融塩の溶媒と溶質の複数種が含有するような場合、溶融温度も変化する。この場合、析出物に応じて溶媒を増やしたり減らしたりして処理する。又、溶融塩は温度によって導電率が異なる。その理由として、自由電子(熱電子)の運動に基因するからである。従って、溶融塩温度が低い場合でも、自由電子の動きが活発になれば、電流が流れ、電気分解の進行速度が速められると考えられる。これを実現するために磁場を掛け、陰極から陽極への電子の動きを加速すると、低温でも反応速度が速まると考えられる。
一般的に、電子の加速は気体放電の中で論じられているが、本発明は溶融塩のような液体中に磁場を掛けることにより、電子が加速される可能性がある。
【0015】
水素化金属は水分や水蒸気と反応して水素を発生する。水素化金属は金属よりも安全であると共に“禁水”であり、消防法:危険物第3類であるが、危険等級は金属ナトリウムはI、水素化ナトリウムはIIと取り扱いは楽である、
そのため、油の中に保管するが、製造工程も油で保護されれば、安全作業に繋がる。沸点が高い油は、軽油(引火点:130℃以下、沸点:180〜350℃)、一般に絶縁オイルや熱媒体油は引火点や沸点が高く、市販のものでは400℃まで気相および液相循環ができる。シリコーンオイルでは引火点が300℃である。又、引火点350℃のものもある。一方、水素化金属の融点が300℃以下の物は、Mg(287℃)> Rb(170)> Al(150) > Cs(140)> Be(125)である。ここで、エネルギー資源として利用価値が高いのは、アルミニウム(Al)とマグネシウム(Mg)である。マグネシウムの融点は651℃、塩化マグネシウム(MgCl2)は714℃、酸化マグネシウム(MgO)は2,800℃と、融点287℃の水素化マグネシウム(MgH2)よりも高く、しかも現時点では、混合塩により、溶融塩電気分解雰囲気を287℃以下にすることは難しい。そのため金属マグネシウム(Mg)を高温で水素ガスと反応させる以外に方法は無い。
一方金属アルミニウム(Al)は融点が660℃、塩化アルミニウム(AlCl3)は193℃、酸化アルミニウム(Al2O3)は2,054℃であり、何れの温度も水素化アルミニウム(AlH3)の融点150℃より高い。更に、注意しないとならないことは、塩化アルミニウム(AlCl3)の沸点が182℃と融点より低い。これは溶融溶液に成る前に昇華してしまうことを意味する。したがって、溶融塩電気分解は182℃以下の温度で実施しなければならない。幸いなことに、非特許文献8(電気化学便覧 第5版:丸善株式会社 平成13年6月30日発行)の124-125頁には、塩化アルミにウム(AlCl3)の複合塩は50℃まで溶融塩温度を降下することができることが示されている。しかも、水素化アルミニウム(AlH3)の比重は1.49であり、塩化アルミニウム(AlCl3)の比重が2.47、絶縁油或いは軽油の比重(0.8)であるため、生成した水素化アルミニウム(AlH3)は溶融塩の上に浮き、その上部を油が覆うことになり、目的製品を全く大気に触れさせないで回収することができる。ここの低温溶融塩を電気分解過程で陰極又は陰極近傍で水素と反応させ、水素化アルミニウム(AlH3)を生成することが可能である。もともと金属アルミニウム(Al)の比重は2.69と鉄(Fe)の7.44に比べて軽いため、車載用水素源として相応しい。従来水素自動車は、水素貯蔵用に重い製鉄製ボンベを必要とした。しかし、本発明のように水素発生源に水素化アルミニウム(AlH3)を用いれば、ボンベは不必要であり、かつ自動車の回転機、摩擦熱、或いはエンジンの発熱など150℃の温度で水素を吐き出し、金属アルミニウム(Al)になるため、スタンドで回収すれば、金属アルミニウムの原料として利用できるし、再度溶融塩電気分解により陽極で得られる塩素と、或いは水素か水と反応させて生成した塩化水素や塩酸と反応させて塩化アルミニウム(AlCl3)に戻した後、溶融塩電気分解を行う、水素燃料サイクルが可能である。
【0016】
将来、水素社会の到来が具体化になった場合、工業規模で水素を大量に製造させる水素製造装置内若しくは水素運搬用車両(ローリー)搭載タンク内、水素補給基地としての水素ステーションの地上若しくは地下タンク内で水素を生成させる基材となる水素化金属を安全に保管、運搬せしむるに装置に電気回路としての等価回路の原理を採用した。等価回路とは、抵抗やコンデンサー、リアクトルに置換えた回路のことで、抵抗体として金属の塩化物に置き換え、コンデンサーの役割として、灯油、軽油、潤滑油(比較的誘電率の高い誘電体、絶縁油、熱媒体油等の油種)を採用するならば、等価回路を形成させることが可能で、火災発生等の非常時には、火災感知器・火災警報装置とも連動させることが可能となる。しかしながら、灯油、軽油等の比較的引火点の低い油種を採用した場合は、上記各装置内は空気と遮断させることが必要である。又、潤滑油を採用する場合でも、熱分解温度が300℃以上の油種を採用することが望まれる。
更に、水素発生装置、水素輸送装置、水素保管装置内部で等価回路を形成させ、これにより、更にキャパシタおよび水素の吸着能力を増やすためには、特許文献6(特願2004-381984, 特開2005-203365)に開示されているように活性炭素の力を得るために各装置内の触媒としての遷移金属に担持させるか、塗布させることにより、更に、キャパシタを増加させることが期待できる。
【0017】
この等価回路(R-C回路)に通電すれば、各種溶融塩の電気分解が可能となり、所望する金属が析出され、獲得することが出来る。取り分け、ナトリウム(Na)等の爆発の危険性のある金属を油中で保管させることは、爆発する危険性から回避できると同時に各種水素化金属の化合物として、安全に貯蔵、保管、運搬が可能となり、水素の需要時にOn Demand で必要量の水素を発生させ水素燃料としての供給が可能であり、水素化社会の経済活動、産業の発達および地球環境への温暖化低減に寄与されることが現実のものとなる。
更に、石油系鉱物油を採用することにより、水素製造装置内部、水素輸送装置内部および水素貯蔵装置内部の壁面に用いるステンレス、鉄、アルミニウム等の金属鋼材に対し、防錆効果を発揮させ、腐食への対策手段にもなる。
【0018】
又、上記水素の製造装置、輸送装置、保管装置は、電気的に等価回路を形成させているために、温度センサー、圧力センサー、光センサー、超音波センサー等、非特許文献17と回路構成が可能となり、各装置内部での反応の進行具合をモニタリングにより制御させ、非常時には、アラームにより警報を発し、反応を停止させ、事故を未然に防止することが可能となる。
【先行技術文献】
【特許文献】
【0019】
【特許文献1】(国際出願番号:PCT/JP2008/058500、国際公開番号:WO/2008/142995)
【特許文献2】特願2006-46287 (特開2007-223839)
【特許文献3】特開2003-229134
【特許文献4】特開2003-234115
【特許文献5】特願2009-22119「深海資源採掘・回収統合洋上工場」
【特許文献6】特願 2002-107806,特開2003-306301
【特許文献7】特願2004-168549,特開2005-343771
【非特許文献】
【0020】
【非特許文献1】産業関連表による環境負荷原単位データブック/独立行政法人国立環境研究所 地球環境センター/2002年9月
【非特許文献2】村原正隆・関和市 著『“風力よ”エタノール化からトウモロコシを救え<風力発電による海洋資源回収と洋上工場>/パワー社出版』
【非特許文献3】石垣島の自然岩塩:http://www.binchoutan.com/ishigaki.html
【非特許文献4】『Climate Change and Sustainable Development, Edited by Ruth A. Reck, Chapter 19“Wind Power and Seawater Save Corn from Ethanol Production: A Marine resources recovery and Offshore Integrated Plant for Sodium Fuel, Fresh Water, Ethanol, Vegetable, and Fish Production with Wind Energy and Seawater, p215-221,By Masataka Murahara / Linton Atlantic Books, Ltd, Feb. 2010』
【非特許文献5】石灰石・ドロマイトとは/ http://www.yoshizawa.co.jp/company/index.html)
【非特許文献6】高橋武彦著 電気化学概論 223頁/ 1991年2月20日 新版刷
【非特許文献7】伊藤靖彦編 溶融塩の応用―エネルギー・環境技術への展開223頁、―株式会社アイピーシー、2003年7月31日発刊
【非特許文献8】電気化学便覧 第5版:丸善株式会社 平成13年6月30日発行
【非特許文献9】理科年表:丸善株式会社 平成15年版
【非特許文献10】実験化学ガイドブック:丸善株式会社 昭和59年6月15日発行
【非特許文献11】化学便覧 基礎編 I、II 改訂3版:丸善株式会社 昭和59年6月15日発行
【非特許文献12】鈴木亮輔 「溶融塩化カルシウム中でのCaO電解を利用した酸化物の還元」平成21年度溶融塩賞受賞記念論文
【非特許文献13】鉄鋼廃熱有効利用研究会の概要:環境・エネルギー工学部会/(社)日本鉄鋼協会:http://www.isij.or.jp/Bukai/Gakujutsu/Eco/study_01.htm)
【非特許文献14】鉄鋼スラグとは:株式会社 テツゲン:http://www.tetsugen.co.jp/slag.htm)
【非特許文献15】日本国勢図絵 第5版 2007/2008)
【非特許文献16】国際特許流通セミナー2010,配布資料 平成22年1月25日、EPO「未来予測」−知財制度の行方− 藤野仁三
【非特許文献17】センサーのすべて 谷腰欣司著 電波新聞社1998年10月20日発行
【非特許文献18】水素とイワタニ 岩谷瓦斯ホーム・ページ
【発明の概要】
【発明が解決しようとする課題】
【0021】
従来、水素の製法は、水を電気分解する方法、石油等のガス状炭化水素化合物からニッケルや酸化鉄を触媒にして加熱分解する方法、溶鉱炉のコークスを製造する過程で副産物として発生させる方法等がある。これらの水素ガスを需要に応じ、必要量だけを供給するシステムが必要である。その手段としては、製造した水素ガスをボンベに貯蔵したり、液化した後高圧ボンベに貯蔵したり、水素吸蔵合金に吸蔵させた後、交通手段を用い消費地に輸送したり、パイプラインで直接輸送する方法が考えられている。しかし、水素自身は軽いが輸送するには容器類が重い。水素吸蔵合金に至っては寿命が短く重い。気体である以上輸送時のガス漏れなどが心配である。水素を石油や石炭の代替エネルギーとして普及させるためには、石炭や石油のように安全で長期間の貯蔵と長距離輸送を可能にしなければならない。
【課題を解決するための手段】
【0022】
従って、本発明は前述した課題点を解決する手段として、代替燃料が安全な長期間貯蔵と長距離輸送を可能にし、二酸化炭素CO2や放射能を出さず、かつ地域に偏存せず無尽蔵に在る天然資源或いは工業廃棄物を材料として水素を製造し、その製造工程においても二酸化炭素を極力発生させないこと、水素の製造工程において副生成物は地球環境を損なうものでなく、極力資源化でき、水素燃料サイクルを実現させるものであり、しかもを産業上利用可能であるもの、水素を発生させる原材料および水素を発生させるために反応に必要とする金属等の物質は、海水、塩湖水(塩分)、温泉水、石灰石等国内に普遍に存在している天然物を利用することにある。
【0023】
更に、本発明では、上記の趣旨を基本とし、海洋塩、塩湖塩、岩塩、結晶化塩、温泉水含有塩、鉱泉含有塩、石灰石、ボーキサイトなどを構成する周期律表の1族、2族、13族、14族等の主に卑金属元素類の塩化物、水酸化物、酸化物、硫酸塩、炭酸塩などを構成する元素のうち、クラーク数で地球上での賦存量が多い鉱物資源や産業廃棄物の中の溶鉱炉スラグ或いは廃棄された貝殻や甲殻類を原料として用い、これらから水素化金属を製造するための電力を太陽光、風力、波力、重力・浮力、地熱等の自然エネルギーから調達し、かつ、熱エネルギーの一部は溶鉱炉の廃熱を利用するものとする。
【0024】
従って、上記金属の塩化物、水酸化物、酸化物、硫酸塩、炭酸塩などを溶融塩電解することからはじめる訳だが、当該金属がイオンの状態のままで、それらと水素ガスとを当該水素化金属の融点以下の温度雰囲気で反応させ、水素化金属を生成させ、若しくは、調達した各種単体金属を水素ガスと反応させ、生成した水素化金属を油中に保管させると同時に当該水素化金属に水を接触反応させ、必要に応じて水素を製造し、燃料用に提供すると同時に、残渣として析出する水酸化金属は脱水することにより、1族元素は溶融塩電気分解用の原料としてリサイクルにより再度供給し、2族元素の水素化金属は融点以上で水を放出して酸化金属になるため、2族金属元素塩化物を直接溶融塩電気分解するか、或いは溶媒としての2族元素塩化物と溶質としての2族元素酸化物から成る混合塩を溶融塩電気分解して陰極に当該金属類を析出させ、或いは当該金属がイオンの状態のままで、それらと水素ガスとを当該水素化金属の融点以下の温度雰囲気で反応させ、水素化金属を生成させ、若しくは、調達した各種単体金属を水素ガスと反応させ、生成した水素化金属を油中に安全に保管させ、需要に応じて水と接触させることにより、水素燃料を製造させるサイクルを維持させようとするものである。又、上記地球上に偏存無く、かつ極自然に存在する天然資源や産業廃棄物から産業上必要とする各種金属類を獲得することも目的とする。
【0025】
金属の塩化物を溶融塩電気分解すると陰極に各金属が析出し、陽極には塩素ガス(Cl)が生成される。陽極に生成された塩素ガスと熱水を反応させることにより、塩酸と酸素が自然生成される(2NaCl → 2Na+Cl2 , 2Cl2+ 2H2O → 4HCl+O2)。或いは、生成した塩素ガスに、高温下で水素ガスを流し、塩化水素を生成させ、それを水に吸収させて塩酸を得る方法(Cl2+ H2 →2HCl )もあるが、コスト的には塩素ガスと熱水とを反応させる方が有利である。又、ここで得られた塩酸を濃縮して濃塩酸を得るには、特許文献5(特願2009-22119「深海資源採掘・回収統合洋上工場」)に示されているように高速気流により発生する気圧差を利用して水分を蒸発させ、塩酸を濃縮する方法がある。
【0026】
ナトリウム(Na)は海水、塩湖、岩塩などに多く含まれているため、最も有望な金属である。この金属ナトリウムは、第1族元素(Li, Na, K, Rb, Cs, Fr)はアルカリ金属として最も反応性に富み、かつ水を注ぐと激しく反応して水素を発生する。しかし、大気中でも水分と反応して爆発するなど、取り扱いに注意が必要である。一般に金属ナトリウム(Na)と水素化ナトリウム(NaH)の安全性を比較すると、ともに水と激しく反応し、消防法では共に「禁水」薬品であり、危険物第3類である。ただし、危険等級は金属ナトリウムの等級Iに対し、水素化ナトリウムは等級IIと低く、比較的安全であり、取り扱いが楽である。しかるに、一般には、金属ナトリウムが灯油に保存されているが、水素化ナトリウム(NaH)は粒子がパラフィンでコーティングされているぐらいで、比較的安全に使用できる。更に、金属ナトリウムを水と反応させた時には0.5モルの水素(H)を生成する(Na+ H2O →1/2H2 + NaOH)。ところが水素化ナトリウム(NaH)の場合には1モル(2倍の水素)を生成する(NaH + H2O → H2 + NaOH)。従って水素化ナトリウム(NaH)は、水素(H2)発生物質として有望である。このようにナトリウム(Na)は、油中で保管しないと不安定で、条件によっては爆発の危険性もあるが、一端水素化させ、水素化ナトリウム(NaH)にすると、融点が800℃になり、安全にかつ、長期間の保管にも耐え、必要時に水と反応させて水素を発生させるのに好適に用いられるようになる。
【0027】
カルシウム(Ca)やマグネシウム(Mg)などの第2族元素(Be, Mg, Ca, Sr, Ba, Ra)の金属単体表面は酸素雰囲気で酸化皮膜が形成される水との直接反応を阻害する。ベリリウム(Be)は100℃でも反応しない。マグネシウム(Mg)は水では反応せず熱水で反応する。カルシウム(Ca)は水と作用させると常温では水酸化カルシウムの保護膜を作るため、反応は緩やかで、熱すると激しく反応するようになり水素を生成する。ラジウム(Ra)は反応性に富むが、ストロンチウム(Sr)やバリウム(Ba)はカルシウム(Ca)に似ている。しかるに第2族元素の水との直接反応で水素を発生させることは効率が低いが、水素化物にすれば常温で激しく水と反応して水素を発生するようになる。更に、金属カルシウムを水と反応させた時と比較して、水素化ナトリウムの場合には2倍の水素を生成する。しかも従って水素化カルシウム(CaH2)は、水素(H2)発生物質として有望である。クラーク数8番目のマグネシウム(Mg)、19番目のバリウム(Ba)、22番目のストロンチウム(Sr)およびそれ以下のベリリウム(Be)についても同様で水素化物にすると水との反応性が向上し、水素発生効率が上昇する。消防法では水素化ナトリウムと同じ「禁水」薬品であり、危険物第3類、険等級はIIに分類され、比較的安全であり、取り扱いが楽である。しかるに、水素化ナトリウム(NaH)同様に粒子はパラフィンでコーティングされて市販されており、比較的安全に使用できる。
【0028】
この周期律表第2族に属するカルシウム(Ca)は、国内に普遍的に存在する、炭酸カルシウム(CaCO3)を主成分とする石灰石から得られる。このカルシウム(Ca)に水素を貯蔵し、水素化カルシウム(CaH2)を製造し、これを水素燃料として用いることは、資源小国日本にとって有望な技術と考える。この石灰石中の炭酸カルシウム(CaCO3)の純度は、従来の鉱物資源に比べて50%以上と高く、我が国に限らず世界中の陸地や海岸周囲で採掘できるため、持続可能社会を構築のためには打って付けな資源であると考える。炭酸カルシウム(CaCO3)を主成分とする石灰石から水素化カルシウム(CaH2)を得るには、先ず、CaCO3を熱分解して、酸化カルシウムと二酸化炭素を得る。化学反応式は、CaCO3→CaO+CO2である。この場合、二酸化炭素(CO2)は、地球温暖化の要因ガスになるので、別途、二酸化炭素(CO2)を利用した内燃機関用の動力源とするために、液化炭酸ガス若しくはドライアイスにして貯蔵させる。一方、酸化カルシウム(CaO)は、塩化カルシウム(CaCl2)又は塩化バリウム(BaCl2)の単独又は複合塩を溶媒とした溶融塩電解液の中に溶質として溶かし、電解電圧の低い酸化カルシウム(CaO)が、先ず選択的に溶融塩電気分解され、陰極周囲にカルシウムイオン(Ca++)が析出される。そこで、陰極内部或いは周囲から水素ガスを送って水素化カルシウム(CaH2)を生成させる。水素化カルシウムは、比重が1.91と比較的軽く、かつ、温度を600℃以下に保てば、水素を放出しないので保管が楽である。幸いなことに、常温で水と激しく反応して水素(H2)を発生させるので、燃料としての供給が可能となる。
【0029】
周期律表第13族に属し、軽金属として社会生活に欠かせない金属アルミニウムの塩化物は他の金属には見られない低温度溶融塩である。しかるに、塩化アルミニウム(AlCl3)を出発原料にして溶融塩電解をさせることにより水素燃料サイクルを考えることができる。塩化アルミニウム(AlCl3)の融点は、193℃であり、沸点が182℃であるために水素ガス又は油圧を利用して圧力をかけると陽極では、塩素ガス(Cl2)が発生し、水に吸収させて塩酸をつくり、陰極では、水素化アルミニウム(AlH3)が生成され、これを150℃以上で過熱すると体積で3倍の水素が発生する。これは、水素燃料サイクルを応用した内燃機関用・外燃機関用の将来の動力源として提供の可能性があり、とりわけ、潤滑油や軽油の中に或いはワックス等でコーティングされた水素吸蔵アルミニウム燃料(水素化アルミニウム)は、弁当箱のようなパッケージ容器商品として、水素燃料補給基地(水素スティーション等)で、ガス欠の際の交換、取り付け部品として利用でき、内燃機関の廃熱で、軽油或いはワックスと共に加温すれば、水素を吐き出し、水素燃料としてシリンダーに供給できる。更に、潤滑油等は大気中の湿気や水との接触を防止する効果を持つと同時に等価回路を形成させるコンデンサーの役割も演じ、緊急時を知らせる警報回路の構成が可能となる。又、水素を吐き出して、水素吸蔵金属の役目を終えアルミニウムは、水素燃料補給基地(水素スティーション等)で回収することにより、リサイクルが何度でも可能となる。
【0030】
溶融塩を電気分解するには高い導電率が要求される。この溶融塩の電気的性質は、非特許文献6(高橋武彦著 電気化学概論 1991年2月20日 新版刷)222頁に示されているように、例えば塩化ナトリウム(NaCl)の伝導率κ(S/cm)は、18℃、10%の水溶液でκ=0.121(S/cm)、700℃における固体時でκ=0.000087(S/cm)であるが、融点の801℃を超えると、結晶のイオン配列が乱れ、空孔が増大し、水溶液の10倍以上の導電率を示すようになり、850℃でκ=3.5(S/cm)であり、分極電圧はV=2.5Vである。この導電率は、非特許文献11(化学便覧 基礎編 I、II 改訂3版:丸善株式会社 昭和59年6月15日発行)II−461,462頁に示されるように、塩の種類によって大きく異なり、例えば塩化アルミニウム(AlCl3)では200℃でκ=.00000056(S/cm)であるが、塩化カルシウム(CaCl2)では800℃でκ=2.1(S/cm)、塩化バリウム(BaCl2)では1000℃でκ=2.17(S/cm)、塩化カリウム(KCl) では800℃でκ=2.24(S/cm)、塩化リチウム(LiCl) では800℃でκ=6.61(S/cm)である。更に、これらの塩類を混合すると、融点は下がり、かつ導電率も大きく変わる。このため効果的に溶融塩電気分解を行うためには、導電率を高くし、かつ融点を低くしなければならない。更に、電気分解したい溶質の分解電圧に達すれば、電気分解が行われるから、目的溶質よりも分解電圧が高く、しかも融点が低くなるように塩類を組み合わせた溶媒を処方すれば、目的金属を選択的に析出させることが可能である。
【0031】
溶融塩電気分解槽としては、陰極に目的金属を析出させ、陽極に塩化物の場合は塩素ガス、水酸化物や酸化物の場合は酸素ガスを析出させる。例えば水酸化ナトリウム(NaOH)を溶融塩として電気分解するCastner法によると、陰極で金属ナトリウムが析出し、陽極では水が生成する。この反応雰囲気温度320℃において、水酸化ナトリウムの分解電圧は約2.2Vであるが、水の電気分解電圧が約1.4Vであるから、水も電解されるため、電解効率は50%以下であると、非特許文献6(高橋武彦著 電気化学概論 1991年2月20日 新版刷)238頁に記載されている。幸いなことに、この電解効率を100%にする提案が、非特許文献7(伊藤靖彦編 溶融塩の応用―エネルギー・環境技術への展開、株式会社アイピーシー、2003年7月31日発刊)21,22頁に、β−アルミナ隔膜法として記載されており、ナトリウムイオン選択透過性固体電解質 β−アルミナを隔膜として陽極室側に置かれた水酸化ナトリウムを電気分解し、溶融ナトリウムを陰極として陰極室に金属ナトリウムを析出させることにより反応温度が350℃と低く、しかも電流効率100%が可能であると記載されている。更に、、同じ装置を用い、塩化亜鉛(ZnCl2)を60%と塩化ナトリウム(NaCl)を40%の混合溶融塩にすると330〜350℃で塩化ナトリウムの電気分解が可能で、電流効率は、ほぼ100%で高純度金属ナトリウムが得られことが示されている。イットリア安定化ジルコニア、スカンジア安定化ジルコニア等のセラミック固体電解質を用いて水酸化ナトリウム(NaOH)から酸素を引き抜く方法及び装置として、ジルコニア系セラミックスから成る電解るつぼの中に水酸化ナトリウムを仕込み、固体電解質の内外面に、電圧印加のための白金メッキされた電極が備えられ、そこに約2.2Vの電圧を印加して、溶融塩温度を320℃以上450℃以下に保ちながら電気分解を行い水素化ナトリウムを製造する方法と装置が、特許文献2(電気化学的水素化ナトリウム製造方法及び装置(特願2006-46287/特開2007-223839)に開示されている。これらのように、イオン選択透過性固体電解質を隔離膜兼電極として用いれば電流効率の向上が可能であると考える。
【0032】
請求項1に記載の発明は、地球上に偏存無く、しかも豊富に在る資源から、例えば、海洋塩、塩湖塩、岩塩、結晶化塩、温泉水含有塩、鉱泉含有塩、石灰石(炭酸カルシウムをを主成分とする石灰石、大理石、方解石、石灰藻、石灰華)および/又は、ボーキサイト等の天然資源又は産業廃棄物(スラグ、貝殻、甲殻類)等から水素化金属を製造し、それから化石燃料の代替燃料としての水素を得る手段に言及したものであり、それら製造された水素化金属が、常温で安定、かつ安全で、長期保存と長距離輸送が可能であるある条件を満たすことが必須条件である。そのために、地表に存在度が高い元素順に元素をランク付けした、クラーク数を基に金属元素を特定し、かつ、それら金属元素の水素化物が常温で固体であり、毒性が無い物に限定した。その結果、周期律表第1族元素のアルカリ金属族、第2属のアルカリ土類金属族、第13族のアルミニウム族などの所謂、卑金属元素を特定した。しかし、第13族に属するホウ素、ガリウム、インジウム、タリウム等は水素化物が常温で気体でありかつ毒性があるので、第13族元素はアルミニウムのみとする。更に、水素化金属を製造するに際して、これら金属原子やイオンと水素を反応させる条件として、当該水素化金属の融点以下の温度雰囲気で反応させることが必要である。本発明では、不純物が殆ど無い該当金属元素を水素化して水素化物を製造することは当然できるが、エネルギー源として使用するためには、低純度を良としたい。そこで溶融塩の原料として、海洋塩、塩湖塩、岩塩、結晶化塩、温泉水含有塩、鉱泉含有塩の中の塩化塩、水酸化塩、酸化塩および/又は炭酸塩や硫酸塩の夫々の単独塩および/又は複合塩を溶融塩電気分解法により電解電圧の低い順に電極陰極部に単体金属を順次析出させた後、当該水素化金属の融点以下の温度範囲で水素ガスと反応させ、該電極陰極部に水素化金属を生成させるか、又は電極陰極部に単体金属を順次析出させた後、その析出金属を水素ガスと共に外部加熱可能な反応管に入れ、水素ガスを流しながら当該水素化金属の融点以下の温度範囲で水素化反応を行い水素化金属を製造する。
他方、石灰石、大理石、ドロマイト、方解石、石灰藻、石灰華などの炭酸カルシウム(CaCO3)或いは石膏などの硫酸カルシウム(CaSO4)等の天然資源および/又は産業廃棄物としての鉄鋼スラグ、或いは食品廃棄物の貝殻や甲殻類などから得られる酸化カルシウム(CaO)を溶質として、塩化カルシウム(CaCl2)や塩化バリウム(BaCl2)或いは塩化カリウム(KCl)等の単独塩又は複合塩を溶媒とした混合溶融塩を電気分解して、電極陰極部にカルシウム(Ca)を析出させた後、当該水素化金属の融点以下の温度範囲で水素ガスと反応させ、該電極陰極部に水素化金属を生成させるか、又は電極陰極部に単体金属を順次析出させた後、その析出金属を水素ガスと共に外部加熱可能な反応管に入れ、水素ガスを流しながら当該水素化金属の融点以下の温度範囲で水素化反応を行い、水素化金属を製造する。
一般には、金属アルミニウムは、ボーキサイトを溶融塩電気分解して製造しているが、低温で溶融塩電気分解が可能になれば、金属アルミニウムの価格は下がる。ここで、塩化アルミニウム(AlCl3)の沸点が182℃であるから、溶質としての塩化アルミニウムを溶媒として塩化ナトリウムを混合した溶融塩を処方すれば電解温度を120℃まで下げることが可能である。この混合溶融塩を電気分解して、電極陰極部にアルミニウム(Al)を析出させた後、当該水素化金属の融点以下の150℃以下で水素ガスと反応させ、該電極陰極部に水素化金属を生成させるか、又は電極陰極部に単体金属を順次析出させた後、その析出金属を水素ガスと共に外部加熱可能な反応管に入れ、水素ガスを流しながら当該水素化金属の融点以下の温度範囲で水素化反応を行い、水素アルミニウムを製造する。この水素化金属を石油系鉱物油中に浸漬・保管させ、水素の需要時に需要量に応じ供給可能ならしめるために当該水素化金の単体或いは複合体に真水、海水、工業用水、地下水、河川水、湖沼水、蒸留水、水道水、温泉水、鉱泉水、雨水などの水を反応させて水素を製造する。この溶融塩電気分解に必要な電力は、風力発電、太陽光発電、波力発電、地熱発電、重力・浮力発電等々の自然法則を利用したものから獲得し、エネルギーの使用後、大気開放されても環境負荷の掛からない方式を選択している。
【0033】
請求項2に記載の発明は、溶融塩電気分解を行うに際し、反応雰囲気温度を低温にし、かつ効率良く水素化金属の収量を増加させるために、電解槽中に介在させている溶融塩と接触配置されているセラミック製固体電解質隔膜電極の溶融塩と反対側に陰極としての白金やニッケルなどの金属電極を密着させた構造および/又はセラミック製固体電解質隔膜電極の溶融塩側に陰極としての白金やニッケルなどの金属電極を密着させた構造とし、溶融塩の反対側から大気圧以上で、かつセラミック製固体電解質隔膜が破壊しない範囲の圧力の水素ガスを、セラミック製固体電解質隔膜を通して、溶融塩中の金属イオンに供給することにより、溶融塩中の各種金属イオンと容易に反応を促進させ水素化金属を生成し、水素と結合したことにより、溶融塩よりも融点が高くなり、かつ比重が小さくなった固体の水素化金属は溶融塩の上に浮上して製品として回収される。
更に、当該電解槽中に介在させている溶融塩と接触配置されているセラミック製固体電解質隔膜電極の溶融塩と反対側に陰極としての白金やニッケルなどの金属電極を密着させた構造又溶融塩の反対側から大気圧以上で、かつセラミック製固体電解質隔膜が破壊しない範囲の圧力の水素ガスに別途電解槽中に設けた電解電極から電圧を印加させることにより、電子を供与させ、水素のマイナスイオン(H-)を生成させることにより、陰極に析出している各種金属イオンと該水素のマイナスイオン(H-)とが容易に反応し、水素化金属が生成される収率を増加されることが期待される。
【0034】
請求項3に記載の発明は、水素燃料製造サイクルを形成させるものである。従来化石燃料の廃棄物は二酸化炭素や石炭灰のように燃料として再利用ができなかった。ところが核燃料は再処理が行えるため核燃料サイクルが成立する。しかしこの核燃料サイクルでも高レベル放射能廃棄物が出る。しかし本発明の水素燃料製造サイクルは、水素化金属に水を反応させ、エネルギー源の水素を供給した後の廃棄物は全て安全な金属の水酸化物である。しかも第1族元素の水酸化物ならば低い温度で直接溶融塩電気分解を繰り返して水素化金属を生産できる。第2族元素にあっては、水酸化物は夫々の融点水を放出して酸化金属になるため、最終的には金属酸化物を溶質とした溶融塩電気分解に他ならないが、塩化カルシウム(CaCl2)や塩化バリウム(BaCl2)の単塩又は複合塩を溶媒としてそれらの混合塩を電気分解して更に、水素化すれば再度水素化金属が製造される。しかも再処理時の水酸化金属には外部からの不純物が入り込まないので、電力効率は高く、再処理のための原料供給は溶融塩電気分解のための電力のみで、天然資源の供給は殆ど不必要である。この再処理に必要な電力は、風力発電、太陽光発電、波力発電、地熱発電、重力・浮力発電等々の自然法則を利用したものから獲得する。
【0035】
請求項4記載の発明は、水素の製造装置、水素の輸送装置、水素の貯蔵装置の内壁は好ましくは、d軌道および、f軌道に電子を持つ遷移金属元素を採用することが望まれる。遷移金属元素は融点が高く、密度も高く、水素の吸蔵及び放出能力があるからだ。しかしながら水素の吸蔵、放出を繰り返すことにより、脆性となり、長期間の耐用には課題があるので、長期間に亘る使用の場合には、ステンレス、アルミニウム、鉄等の合金を採用する。更に、上記各装置内には、短期間の使用に対しては、多段型の複数のプレートを設け、各プレートは、遷移金属元素により構成させ、水素の吸蔵及び放出能力をより増幅させる構造体とする。
上記の夫々の装置は同じ構造体にすることが可能で、各装置内では金属水素化物に水と接触反応させることにより、必要に応じて水素を発生させ、その発生した水素圧でもつて加圧されて発熱反応を伴い遷移金属に水素を吸蔵させ、各装置内で発生した水素を取り出して使用する場合は、各装置内の水素圧力が低下し、減圧されるので遷移金属に吸蔵されていた水素が吸熱反応を伴って放出され、効率よく水素を得ることが可能となる構造体である。従って、将来、水素自動車の時代が到来し、水素燃料タンクにもこの構造体の採用が期待されるが、水素を吸蔵する光触媒の研究も行われている。
水素は、燃料として用いる場合、単位重量当りガソリンの約2.7倍の発熱量が得られが、取り扱い如何によっては爆発の危険性があるので、水素燃料使用分野の発展の阻害要因にされて来たが、考え方によっては爆発範囲が非常に広く、着火エネルギーが非常に小さいという相反する性質を安全に利用することが可能ならば、燃焼により、二酸化炭素は排出せずに、水が生成されるので地球温暖化対策に適した燃料となりうる。
そのために本各装置には、図7に示すように、爆発限界を感知させ、装置内が危険範囲の状態に達した場合は温度センサー、圧力センサーによりアラームで知らしめ、即、反応を停止、制御させる回路が制御盤として組み込まれていると同時に内部の反応状況をモニタリングする回路も組み込まれている。
又、上記各装置内は、電気絶縁油、耐熱性の熱媒体油、誘電率の高い潤滑油中に金属の水素化物が浸漬されており、これら潤滑油には、防錆効果は無論、キャパシタの役割を有し、金属水素化物は抵抗体となるので電気回路的には等価回路を形成させることが可能となり、各装置を電気回路部品の一部と看做せば将来、様々な目的に応じた回路を構成させることが可能となる。
一例として、装置内で発生させた水素と酸素ボンベからの酸素とで燃料電池を作り、制御装置を可動させる電源として用いることも可能となるが、水素を製造していないときは、燃料電池は作動不可となるのでこのような場合、バツテリーによる電源を採用する。
【0036】
水素製造装置、水素輸送装置、水素貯蔵装置としての形状は、球形、円錐形、直方体、台形状等設置場所に固定させた構造体で地上若しくは地下に静置させることが可能で、或いは車両搭載により、水素の輸送に供する場合は、移動体の形状に適合させて搭載、移動可能とした構造体で、垂直(縦型)、水平(横型)、傾斜させて設置しても差し支えない構造体とする。
【0037】
水素製造装置、水素輸送装置、水素貯蔵装置は、法律としての消防法、高圧ガス保安法等、又、省令としての一般高圧ガス保安規則、容器保安規則、特定設備検査規則、コンビナート等保安規則等に適合させたものであることが求められる。
【0038】
一方、燃料用の水素は燃焼により、二酸化炭素CO2は発生せず、水を生成させるということで地球環境上は理想的なエネルギー源となり、単位重量当りの発熱量もガソリンの約2.7倍と莫大な燃焼エネルギーが得られるが、他方、取り扱いを誤ると大事故に繋がる危険性も秘めている。特に、水素と酸素の混合比がで2:1になると最も爆発力が大きく、爆鳴気を伴う。沸点が、1気圧で-252.9℃で空気中での爆発範囲が4.0〜75.0Vol%と非常に広く、着火エネルギーが極めて小さい。酸素中での爆発範囲が4.65〜93.9Vol%wであり、又、無色、無味、無臭、無毒の気体であるが、漏洩に対する対策、取り扱い安全に対する対策等が今後の課題となる。[非特許文献18]
【0039】
水素化金属と水を接触、反応させて水素を得る際に、用いる水は、水道水、地下水、工業用水、温泉水、鉱泉水、蒸留水、河川水、湖沼水、雨水等で差し支えないが、比較的不純物の少ない、汚染されていない水を使用することが望ましい。
【0040】
本発明に基づく、水素製造装置、水素輸送装置、水素貯蔵装置の各内部での反応条件の制御法は、一般的に行われているシーケンス制御方式、フィードバック制御方式何れも適用が可能であり、制御目的は、発生する水素の量を反応温度、圧力により制御させるものであり、爆発を未然に防止することを目的とする。そのためには、水素化金属物と接触、反応に必要とする水の注入量をバルブ開閉度合いを調整させて制御させるもので、
水は少しずつ滴下させることにより、瞬間的に水素ガスが多量に発生し、発熱を伴って生成された水素圧が爆発限界を超えそうな場合は、水素取り出し口を開放させて、一時的に水素ボンベに貯蔵させ、各装置内での水素の量を調整させる制御方式である。
又、静電気による爆発防止装置も具備させることが要求される。
【0041】
本発明による各装置内の爆発限界を感知、反応を即座に停止させ、事故を未然に防止する手段として、図7に示す反応制御回路システムが各装置に具備されている。
予め設定された危険限界値(爆発限界値)とする水素圧力、装置内部温度を夫々圧力センサー、温度センサーが感知し、入力信号として制御盤であるプログラマブルコントローラーに入る。
自動制御方式は、シーケンサー制御方式、フィードバック制御方式何れにも適用可能で、コントローラーからの制御出力信号は、パルスモーターにより、水注入量調整弁及び/又は水素取り出し弁の開閉度を調整させて、各装置内の水素圧を安全圏内に保持するようにフィードバック制御信号として、各装置内部に入る。
別途各装置内部に具備させた各センサー、非特許文献17、取り分け圧力センサーと温度センサーにより、予め設定された爆発限界値に達した時の圧力と温度信号が入力信号としてコントローラーに入り、水素ガスの生成量を調整するように反応を制御するシステムである。尚、各装置内の反応状況を感知させるための圧力計、温度計を適宜必要とする箇所に接続させる。
【0042】
水素製造装置、水素輸送装置、水素貯蔵装置の各内部には多段式に反応プレートを複数重層させ、各反応プレートは水素吸蔵および放出が可能な遷移金属類を採用する場合は、各反応プレートには水素分子が通過できる程度の大きさ(4×6Å以上有れば十分)を有する細孔、空隙を設ける。
多段式水素吸蔵スティックによる水素を長時間放出させる特許には、特許文献7、特願2004-168549,特開2005-343771がある。
【発明の効果】
【0043】
本発明による水素の製法によると、生成反応に必要とする電力等のエネルギー源の確保は、風力、波力等の自然エネルギー源から賄い、かつ、各装置内では、発生した水素と別経路から入力された酸素とで燃料電池を構成させることにより電力源が確保され、水素燃料サイクルによる循環型システムが形成される。
更に、本発明によると水素および元素の周期律表でアルカリ金属、アルカリ土類金属に族する各金属の単体を得る出発物質となる基材を海水、塩湖、岩塩、温泉水、石灰岩等の自然、天然物に依存させていることと、電気分解に必要とする電力を極力自然エネルギー源から賄うために、小資源国であり、海洋に囲まれている日本としては、地球温暖化を低減させながら経済活動の営みを持続的に継続させて行くことを可能ならしめる。更に、天然物から得られた金属の塩化物は溶融塩電解により、水素と反応させ、水素化金属を獲得し、油中で保管・管理させ、水素の需要時には水素化金属に水と接触反応させて水素が容易に得られる。上記金属および水素化金属は別途市販のものを入手することにより水素を得ることも可能である。
【0044】
又、必要に応じて、各種水素化金属化合物を選択的に入手して、水素を得るための出発物質とすることができ、各種水素金属化合物と水との接触反応により、需要(On Demand)に応じた水素を製造させることが出来る。
更に、本発明による水素の製造は、来るべき水素社会の到来を睥睨して、水素製造装置と水素輸送装置及び水素貯蔵装置を同一の反応容器としての構造体を採用したために、設置場所、移送場所、貯蔵場所が適宜変更可能で、水素燃料による電力の供給、水素自動車等の内燃機関への水素燃料の補給・充填基地としての水素ステーションでの水素燃料の充填をパッケージで実施させることが可能で、水素燃料を必要とする場合、何時、何処でも、誰でもがとの情報交換可能なユビキタス社会に適合させるべく、水素も利用することを可能ならしめるようにしたものである。
【発明を実施するための最良の形態】
【0045】
以下、本発明の効果的な実施の形態を図1〜図7に基づいて詳細に説明する。
【0046】
図1は、各種金属元素と夫々の金属塩の融点を示す図である。1は金属元素の融点。2は金属塩化物(塩化金属)の融点。3は金属水酸化物(水酸化金属)の融点。4は金属酸化物(酸化金属)の融点。5は金属水素化物(水素化金属)の融点である。本発明で最も重要なことは、水素化金属5の融点以下で、水素化反応や溶融塩電気分解を行うことである。もし水素化金属5の融点以上の場合には、一旦金属元素を析出させた後に、水素化金属の融点以下の温度で水素ガスとの反応を行わねばならない。したがって、各金属塩の融点が低い化合物を探すことである。概して金属酸化物4は融点が高い。これに反し、水酸化物3は融点が低い。しかし、周期律第1族元素のLi,K,Naは融点が低いため金属水酸化物で溶融塩を作り、直接溶融塩電気分解ができる。しかし第2族のCa,Mg,Sr,Baなどは夫々の融点で水分子を放出して金属酸化物4に変化してしまうため、実質的には金属酸化物4を溶融して電気分解を行なうことになる。幸いなことに、金属塩化物2は比較的融点が低く、しかも導電率が高く、金属酸化物4の溶媒になり、複合塩を形成し、融点を下げる効果が期待される。とくに、本発明の出発原料が、海洋塩、塩湖塩、岩塩、結晶化塩、温泉水含有塩、鉱泉含有塩であり、これらの中の塩類は塩化物が大半を占めているため、これらの塩を電気分解する。炭酸カルシウムや酸化カルシウムの主成分は石灰石や鉄鋼スラグであるから、これら溶質としての酸化カルシウムと溶媒としての金属塩化物2の複合溶融塩を電気分解し、かつ水素と反応させて水素化金属を製造する。第3族のAlは塩化物2である塩化アルミニウムの融点が水素化金属5である水素化アルミニウムよりも融点が低いので水素化金属を作ることができる。
【0047】
図2は、各複合塩と融点の関係を示す図である。本発明で重要なことは水素化金属5よりも溶融塩の温度を低くすることである。したがって夫々の水素化金属(点線矢印で示す)の融点よりも溶融塩を低くする複数塩の処方が必要である。6は、金属アルミニウムの塩類の組み合わせ複合塩と水素化アルミニウムの融点6に示すように、金属アルミニウム塩類の組み合わせ塩では水素化アルミニウムの融点(150℃)よりも低い溶融塩を作ることができる。7は、金属マグネシウム塩類の組み合わせと水素化マグネシウムの融点7である。これらの組み合わせ塩の融点は全て287℃以上であるので、電気分解中での水素化反応は困難であり、この場合は電気分解で金属マグネシウムを析出させた後に、低い温度で水素化する方法を採用する。8は、金属ナトリウム塩類の組み合わせと水素化ナトリウム融点8を示す。これらの金属ナトリウム塩類の組み合わせ塩はすべて水素化ナトリウムの融点(800℃)よりも低いので水素化ナトリウムを生成するのは楽である。9は、金属カルシウム塩類の組み合わせと水素化カルシウム融点9を示す。これらの金属カルシウム塩類の組み合わせ塩は水素化カルシウムの融点(600℃)よりも低い処方があるので水素化カルシウムを生成するのは楽である。10は、金属リチウム塩類の組み合わせと水素化リチウム融点10を示す。これらの金属リチウム塩類の組み合わせ塩は水素化リチウムの融点(680℃)よりも全て低いので水素化リチウムを生成するのは楽である。11は、金属カリウム塩類の組み合わせと水素化カリウム融点11を示す。これらの金属カリウム塩類の組み合わせ塩は水素化カリウムの融点(417℃)よりも低い処方が多々あるので水素化カリウムを生成するのは楽である。12は、金属バリウム塩類の組み合わせと水素化バリウム融点12を示す。これらの金属バリウム塩類の組み合わせ塩は水素化バリウムの融点(1675℃)よりも全て低いので水素化リチウムを生成するのは楽である。この他にも、複合塩の処方の組み合わせ次第では、さらに融点を下げることが可能であると考える。
【0048】
図3は、溶融塩の種類と雰囲気温度に於ける電気伝導率の関係を示す図である。図2の6に示したように金属アルミニウムは溶融塩温度を最も低くする溶融塩であるが、この図から明らかなように、電気伝導率は10万分の1と他の塩化物に比べて極端に低い。しかし、電気伝導率の高いLiCl,CaCl2, BaCl2、NaCl, PbCl2等の溶媒を用いて混合塩を処方すればさらに伝導率を上げることができる。
【0049】
図4は、溶融塩の種類と雰囲気温度に於ける分解電圧の関係を示す図である。この図からわかるように溶融塩の温度が高くなると電気分解の分解電圧が低くなる。このため温度を高くした方が印加電圧は下がり、陰極からの金属の析出率を上げる。図2の6に示したように金属アルミニウムは溶融塩温度を最も低くする溶融塩であるが、この図から明らかなように、電気伝導率は10万分の1と他の塩化物に比べて極端に低い。しかし、電気伝導率の高いLiCl,CaCl2, BaCl2、NaCl, PbCl2等の溶媒を用いて混合塩を処方すればさらに伝導率を上げることができる。この図を見てわかるように、各種金属塩化物の分解電圧が異なることを利用すれば、当該複合塩の中に混合された夫々の塩の分解電圧に差があるから、たとえばBaCl2の中にNaClを入れて650℃で電気分解したとすると、BaCl2の電解電圧が3.71Vであり、NaClの電解電圧が3.36Vであるため電圧差が0.35Vあるため、3.71V以下の電圧で電気分解すれば、金属バリウム(Ba)は析出せず、金属ナトリウム(Na)のみが析出する。しかるに、電解電圧が高い塩化バリウム(BaCl2)や塩化カルシウム(CaCl2)を溶融塩溶媒に用い、これにこの図には記載していないが、酸化金属を溶質として混入させると、例えばCaCl2よりもCaOの方が電解電圧が低いので、さらに電圧差が広がり、金属カルシウム(Ca)を析出する。他の金属においても、一般に、酸化物の方が塩化物よりも電解電圧が低いので電圧差を利用して金属を析出させることができる。とくに複合塩では、夫々の金属の分解電圧が異なるから、電解電圧を低い側から高い側に段階的に昇げて行けば、その電圧(電位差)に応じて異なった金属を選択的に析出することができる。さらに電極近傍で水素と反応させれば、夫々の水素化金属が単体で、あるいは複合体で製造することができる。とくに、海洋塩や岩塩など異なる金属塩が混入している。石灰岩や鉄鋼スラグも純粋な物は無い。これらの自然から得られる資源や産業廃棄物をあまり純度を上げること無く、不純物と共に溶融塩電気分解することも可能であることが本発明の趣旨でもある。以上のように、効果的な溶融塩電気分解を行うためには、導電率を高くし、かつ融点を低くし、さらに、電解電圧に達すれば、電気分解が行われるから、目的とする溶質よりも分解電圧が高く、しかも融点が低くなるような塩類を組み合わせた溶媒を処方し、かつ電解電圧を低い側から順次昇らせて行くことにより、金属の分別回収が可能となる。この電解電圧の差を利用して複合塩から目的金属を選択的に析出させることが可能である。
【0050】
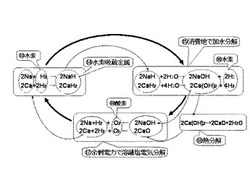
図5は、水酸化ナトリウム・水酸化カルシウムの溶融塩電気分解による水素吸蔵金属の製造と加水分解による水素燃料製造サイクルの概略図である。水素燃料製造サイクルを形成させる目的で、塩化ナトリウムや水酸化ナトリウム又は塩化カルシウムや酸化カルシウムを溶融塩電気分解して得られた金属と別系統から供給した水素13を反応させて、水素吸蔵金属14である水素化ナトリウム(NaH)や水素化カルシウム(CaH2)を製造し、これを14の消費地で加水分解15を行い、水素16を生成し水素燃焼発電や燃料電池用に供給する。ここで生成される副産物の水酸化ナトリウム(NaOH)は自然エネルギーや余剰電力で溶融塩電気分解17を行う。同様に水酸化カルシウム(Ca(OH)2)は熱分解18を経て変化した酸化カルシウム(CaO)は自然エネルギーや余剰電力で溶融塩電気分解17を行う。この再度の溶融塩電気分解により陽極から酸素19が放出され、これも燃料用に供される。このように各種金属の水酸化物を再度溶融塩電気分解して、水素化金属の生成を繰り返す水素燃料サイクルである。
【0051】
図6は、セラミック製水素電解質隔膜電極を用いた水素化金属製造装置略図である。
溶融塩電気分解を行うに際し、反応雰囲気温度を低温にし、水素化金属の収率を増加させるに際し、電解槽20 はヒーター21で加熱され、中央部にはパイプ状のセラミック製電解質隔膜電極22を備え、内壁は陽極(カーボン製)23 密着させ、陰極としてはセラミック製水素電解質隔膜電極24 を備え、両電極間に金属溶融塩(溶質+溶媒)25 を満たし、セラミック製水素電解質隔膜電極24 の外壁に陰極(白金製)26 を備え、電流を電極間に流し溶融塩電気分解を行う。例えば溶融塩が金属塩化物の場合はセラミック製電解質隔膜電極 22 の内側に塩素ガス27 が析出するからこれに水28 を流し、高温化で塩酸29 を製造する。ここで水を流さず塩素ガスのまま回収することもできる。一方陰極ではセラミック製水素電解質隔膜電極24 の陰極26 側から水素ガス13 を圧入し、セラミック製水素電解質隔膜電極24 を透過した水素と周囲の金属イオンと反応して、水素化金属30 を生成し、溶融塩よりも比重が軽くなり、かつ高融点に変身した水素化金属30 は水素化金属取り出し口31 から回収される。尚反応温度が低い場合には油32 を用いるが、高温時にはガスシールなどを考える。このように
セラミック製水素電解質隔膜電極の溶融塩と反対側に金属性陰極を密着させた電極構造および/又は溶融塩側に金属性陰極側から水素ガスを溶融塩中の金属イオンに供給して、各種金属イオンと容易に反応を促進させることができる。
【0052】
図7は、請求項4記載の水素の製造装置、水素の輸送/移送装置および水素の貯蔵装置の一例を概略図として図示したものであり、反応の制御機構、制御回路の構成および各装置類は現行の化学反応装置を改良することにより調達可能とするために簡易型構造体としたものである。反応装置36、輸送送装置36および貯蔵装置36夫々の用途として兼用可能とした装置で、予め、装置内には石油系鉱物油が充填されており、所望する量の水素を得る場合は、化学量論的に反応が完結するように水素化金属を秤量し、油中に懸濁させる。給水タンク33流量調節弁34を開閉させ、少しずつ装置内に水を滴下させる。水素化金属と水は常温、常圧で反応させ、水素ガスが発生し、装置内の上部に充満してくる。水素ガス圧が予め設定した規定値に達すると、圧力センサーおよび温度センサー38とが感知、連動して、入力信号39となり、制御盤40から制御出力信号41として、駆動機構のパスルモータ42に伝達され、流量調節弁34と連動し、装置内を常に爆発限界を超えないように流量調節弁の開度を制御して水素ボンベ35に水素ガスを充填させる。反応終了後は、金属の水酸化物が副生成物として得られるが、取出口37から採取する。
爆発限界に達しそうな緊急時の場合は、流量調節弁34を閉じて給水タンクから滴下する水を停止させると同時に、警報回路によりアラームを発する。
【実施例1】
【0053】
上部が細口の500mlの三角フラスコに予め、家庭用灯油20mlを入れ、市販の水素化ナトリウムNaHの粉末を200mgを秤量して、灯油中に懸濁、沈降させた。三角フラスコの口からスポイトで20ccの水道水を徐々に滴下させ、NaHと水を接触反応させて約0.12リットルの水素を常温で発生させた。水素ガスの泡により、灯油と水の層が白濁することにより水素ガスの生成を確認したと同時に、フェノールフタレンを滴下させ、フラスコ下部が赤色に変色したことにより、水素化ナトリウム(NaOH)が副生成物として生成されていることと、NaHからの水素の生成反応が終了し、灯油層から白濁が消え、透明になったことを確認した。
【実施例2】
【0054】
上部が細口の500mlの三角フラスコに予め、家庭用灯油20mlを入れ、市販の水素化カルシウムCaH2の粉末を200mgを秤量して、灯油中に懸濁、沈降させた。三角フラスコの口からスポイトで20ccの水道水を徐々に滴下させ、CaH2と水を接触反応させ、水素化カルシウムCaH2 約0.42リットルの水素を常温で発生させた。水素ガスの泡により、灯油と水の層が白濁することにより水素ガスの生成を確認したと同時に、フラスコの底部に水酸化カルシウムCaOH2の白色沈殿物が生成されていることを確認したと同時に、CaH2からの水素の生成反応が終了し、灯油層から白濁が消え、透明になったことも確認した。
【実施例3】
【0055】
モンゴル産塩 (NaCl,CaCl2,MgCl2の複合塩) 10gをアルミナ製磁性ルツボ内に秤量し、塩の中に熱電対及び対のカーボン電極を付設させ、電気炉の温度を室温から徐々に上げ、900℃まで加熱を続けた。700℃までは伝導率κ=0.0001 (S/cm) であったが、800℃ぐらいから急に伝導率が高くなり始め、850℃でκ=3.4 (S/cm)、950℃でκ=4.0 (S/cm)であった。電気炉として、1300Furnace,Barnstead International Model No.FB1314M,100V,10.6A,1060W,50/60HZ Phase1.Serial No.1256040370950.を用いた。又、マントルヒーターとして、150W,100V,Type 5-01,Max;450℃のものを用いた。
【産業上の利用可能性】
【0056】
従来、エネルギー源として頼っていた石炭、石油、天然ガス等の化石燃料の主成分は炭化水素系であるために、燃焼により副生成物として、炭酸ガスCO2を生成させる。更に、石油に至っては国内資源で需要量を調達させるには殆ど不可能と言っても差し支えない。又、中東等の石油産油国に依存して行くには、政情不安定その他の要因により安定的に確保できる保証はないし、石油の埋蔵量に限度があるならば、今後の長期間に亘る資源確保も保証の限りではない。
一方、原子力エネルギーに頼る傾向もあるが、放射能漏れなどの万一の事故に対する不安が付き纏う。
従って、本発明の第一の特徴は、国内外に普遍的に存在している海水、塩湖水、塩田、温泉水、石灰岩等の天然、自然物を原資と看做し、それらから地球環境を損なうことの無い、特に、地球温暖化に比較的影響の少ないクリーンエネルギーとしての水素を得ることを第一義的な目的としたものである。
水素燃料は、内燃機関等の輸送手段の動力源になり得るし、発電、家庭用燃料等基本的エネルギーとして利用が可能である。米国でも大統領が2022年を目途に水素ベースの輸送手段の開発を呼びかけている。非特許文献16
【0057】
本発明の第二の特徴は、産業の発展に欠かせない金属類で、特に、昨今の半導体産業に欠かせないレアーメタルを得る手段として、海水若しくは海底から自然エネルギーを極力利用して金属類を析出、分離して目的とする各種金属類を得ることを目的としている。取り分け、海水に比較的多く含まれる塩化ナトリウムNaCl(塩)や他の金属の塩化物から、水素化ナトリウムや水素化金属物を生成させ、(On Demand)に応じて、任意の場所で水と水素化金属を接触反応させ、比較的簡単に必要量の水素燃料を獲得することを目的とする。
更に、素化金属に水と接触反応させて水素を発生させた後の副生成物としての各金属の水酸化物は、例えば、水酸化ナトリウムNaOHは、カセイソーダとして無機化学工業の出発物質として利用可能であり、水素燃料サイクルを循環させて、資源の無駄の無い有効活用法を提供することにある。
【図面の簡単な説明】
【0058】
【図1】各種金属元素と夫々の金属塩の融点を示す図である。
【図2】各複合塩と融点の関係を示す図である。
【図3】溶融塩の種類と雰囲気温度に於ける電気伝導率の関係を示す図である。
【図4】溶融塩の種類と雰囲気温度に於ける分解電圧の関係を示す図である。
【図5】水酸化ナトリウム・水酸化カルシウムの溶融塩電気分解による水素吸蔵金属の製造と加水分解による水素燃料製造サイクルの概略図である。
【図6】セラミック製水素電解質隔膜電極を用いた水素化金属製造装置略図である。
【図7】水素の製造装置、水素の輸送装置および水素の貯蔵装置の概略図である。
【0059】
1 金属元素の融点
2 金属塩化物(塩化金属)の融点
3 金属水酸化物(水酸化金属)の融点
4 金属酸化物(酸化金属)の融点
5 金属水素化物(水素化金属)の融点
6 金属アルミニウムの塩類の組み合わせ複合塩と水素化アルミニウムの融点
7 金属マグネシウム塩類の組み合わせと水素化マグネシウムの融点
8 金属ナトリウム塩類の組み合わせと水素化ナトリウム融点
9 金属カルシウム塩類の組み合わせと水素化カルシウム融点
10 金属リチウム塩類の組み合わせと水素化リチウム融点
11 金属カリウム塩類の組み合わせと水素化カリウム融点
12 金属バリウム塩類の組み合わせと水素化バリウム融点
13 水素(供給される水素)
14 水素吸蔵金属
15 消費地で加水分解
16 水素(製造する水素)
17 自然エネルギーや余剰電力で溶融塩電気分解
18 熱分解
19 酸素(製造する酸素)
20 電解槽
21 ヒーター
22 セラミック製電解質隔膜電極
23 陽極(カーボン製)
24 セラミック製水素電解質隔膜電極
25 金属溶融塩(溶質+溶媒)
26 陰極(白金製)
27 塩素ガス
28 水
29 塩酸(製造)
30 水素化金属
31 水素化金属取り出し口
32 油
33 給水タンク
34 流量調節弁
35 水素ボンベ
36 反応装置・送装置・蔵装置
37 取出口
38 圧力センサーおよび温度センサー
39 入力信号
40 制御盤
41 制御出力信号
42 パスルモータ
【技術分野】
【0001】
本発明の第一の目的は、海洋塩、塩湖塩、岩塩、結晶化塩、温泉水含有塩、鉱泉含有塩、石灰石(炭酸カルシウムを主成分とする石灰石、大理石、方解石、石灰藻、石灰華)および/又は、ボーキサイト等の天然資源又は産業廃棄物(スラグ、貝殻、甲殻類)等から水素化金属を製造し、或いは産業廃棄物の中の溶鉱炉スラグや燃殻としての石灰などを構成する周期律表の1族、2族、13族、14族等の主に卑金属元素類の塩化物、水酸化物、酸化物、硫酸塩、炭酸塩などの単独塩又は複合塩および/又は貝殻を溶融塩電気分解により陰極に当該金属類を析出させ、或いは当該金属がイオンの状態で、それらと水素ガスとを当該水素化金属の融点以下の温度雰囲気で反応させ、水素化金属を生成させ、若しくは、調達した各種単体金属を水素ガスと反応させ、生成した水素化金属を油中に保管させると同時に当該水素化金属に水とを接触させて必要に応じて水素を製造し、燃料用に提供すると同時に、残渣として析出する水酸化金属は脱水することにより、1族元素は溶融塩電気分解用の原料としてリサイクルにより再度供給し、2族元素の水酸化金属は融点以上で水を放出して酸化金属になるため、2族金属元素塩化物を直接溶融塩電気分解するか或いは溶媒としての2族元素塩化物と溶質としての2族元素酸化物から成る混合塩を溶融塩電気分解して陰極に当該金属類を析出させ、或いは当該金属がイオンの状態で、それらと水素ガスとを当該水素化金属の融点以下の温度雰囲気で反応させ、水素化金属を生成させ、若しくは、調達した各種単体金属を水素ガスと反応させ、生成した水素化金属を油中に安全に保管させ、水素の需要に応じて水と接触させることにより、水素燃料を製造させるサイクルを維持させようとするものに関する。又、上記地球上に偏存無く、かつ極自然に存在する天然資源や産業廃棄物から産業上必要とする各種金属類を獲得することも目的とする。
【0002】
本発明の第二の目的は、(0001)に記載の天然資源から各種金属の単体、各種水素化金属の製造および副生成物から更に、産業上必要とする無機工業化学の原料の製造に必要とする動力源、電力源をエネルギーとして獲得するのに太陽光、風力、波力、重力・浮力、地熱等の自然から調達することに注力させ、又、無機工業化学の原料を海洋塩、塩湖塩、岩塩、結晶化塩、温泉水含有塩、鉱泉含有塩、石灰石、ボーキサイト等の天然資源或いは産業廃棄物の中の溶鉱炉スラグ等を廃棄物から調達することを心がけ、反応生成後の各種製造物は水素燃料サイクルを循環させることにより省エネ効果を具現化させ、発熱・吸熱による反応後に発生するCO2排出を極力無くし、かつ、水素化金属の加水分解又は、水素化アルミニウムの熱分解により水素燃料を得ると同時に反応後の副生成物である金属水酸化物或いは金属をはじめとする無機化学工業の主要原料を生成させることにあり、更に、反応後の無駄な副生成物を繰り返し溶融塩電気分解し、資源のリサイクルにより、資源の有効活用を図り、無駄を無くすことにある。
【背景技術】
【0003】
小資源国日本がエネルギー源としての石油の調達は海外に依存していることに論を挟む余地はない。炭素を含む化石燃料を燃焼させるとCO2を排出するが、燃焼によるCO2排出を抑制する方策と手段として水素の実用化を早急に実現させ、化石燃料と併用させることが望まれる。我が国のCO2排出量は、非特許文献1(産業関連表による環境負荷原単位データブック/独立行政法人国立環境研究所 地球環境センター/2002年9月)によると、年間約11億トン。その内、約29%の3.2億トンが電力・ガス・熱供給部門、約18%の2億トンが運輸部門、約12%の1.3億トンが鉄鋼部門、約7%の0.8億トンが石灰石を原料とするセメント工業を主体とする窯業・土石製品製造部門である。これら4部門だけで我が国の総CO2排出量の66%を占める。そこで先ず考えねばならないことが、第一番目の電力・ガス・熱供給部門と2番目の運輸部門の石油から水素エネルギーへの変換である。これには国内から調達可能で無尽蔵とも謂える海洋塩、温泉水含有塩、鉱泉含有塩、石灰石など、或いは世界中に偏在無く無尽蔵に分布する塩湖塩や岩塩等の天然資源。これら天然資源を太陽光、風力、波力、重力・浮力、地熱等の自然エネルギーで得られた電力で溶融塩電気分解して、水素化金属を製造することが可能である。
一方、第3番目の鉄鋼部門および第4番目のセメント部門では、石灰石を焼いて生石灰を作る工程が不可欠であり、この工程でのCO2の発生を省略することは出来ない。更に、考えねばならないことは、この石灰石こそ我が国で数少ない自給率100%の資源である。そこで本発明では、この石灰石の主成分たる炭酸カルシウムCaCO3のカルシウCaを水素発生金属として活用すると同時に、鉄鋼製造過程で出る廃棄物としての約30%に及ぶ高温スラグをも水素エネルギーに変換することである。このようにクリーンエネルギーとしての水素を持続的に得られれば今後の地球環境負荷低減と経済活動の二律背反的な課題に対しての解決策を提供することが可能となる。
【0004】
更に、生産工程、輸送過程、消費過程における経済活動を主とした人間の営みには、電力源、動力源を獲得するためのエネルギー源としては石油系化石燃料等々から賄われ、CO2の発生を皆無にすることは困難である。そこで本発明では、この点も勘案し、極力、自然界に数多にしかも平等に存在している天然物を原資にし、しかも水素、各種金属類の製造に必要とする電力源獲得は、風力発電、太陽光発電、波力発電、地熱発電、重力・浮力発電等々の自然法則を利用したものから獲得し、エネルギーの使用後、大気開放されても環境負荷が掛からず、かつ、水素を製造、輸送、貯蔵する過程において極力、常温、常圧に近いエネルギー消費で目的を達成させる方式を選択した。
【0005】
従来、水素は水の電気分解による製法が一般的であるが、その貯蔵や輸送には重いボンベが必要である。このためボンベの軽量化や水素ガスの液化或いは水素吸蔵合金などの開発が進められている。一方、需要に応じ、短時間に大量に水素を必要とする発電所や都市ガス或いは燃料電池充電工場などの施設では、固体水素が相応しい。この固体水素の代替として、水よりも軽い電力貯蔵固体として海水や岩塩から金属ナトリウムを製造し、これを石油中に保存して、電力消費地の火力発電所に輸送し、水を注いで発生させた水素で発電し、副産物の苛性ソーダはソーダ工業の原料として供給するか、或いは再度溶融塩電気分解して金属ナトリウムを再製して、ナトリウム燃料サイクル(水素燃料サイクル)として、苛性ソーダの熔融塩電気分解を繰り返す再処理システムとして、金属ナトリウムが水よりも軽い電力貯蔵固体として、枯渇の心配が全く無く、CO2も出さず、放射能も出さない化石燃料の代替エネルギーであることを特許文献1(国際出願番号:PCT/JP2008/058500、国際公開番号:WO/2008/142995)に開示している。
【0006】
一方、金属ナトリウムの加水分解では1/2モルの水素しか発生しないが、それに対して水素化ナトリウム(NaH)の加水分解では理論的には1モルの水素を発生させることと、水素化ナトリウム(NaH)の製造方法は電気化学的に電気炉内で原料の水酸化ナトリウムから酸素固体電解質電極を用い、直接NaHを製造する方法が特許文献2(特開2007-223839)に開示されている。又、水素化金属を燃料電池の燃料源として用いる方法として、特許文献3(特開2003-229134)には水素化金属としてNaH、NaBH4、KBH4、LiAlH4、KHが開示されている。更に、特許文献4(特開2003-234115)には水素化金属としてLiH、CaH2、BaH2、MgH2が開示されている。これらはすべて、比較的低温度の反応で水素を得、しかも水素燃料サイクルを形成させて持続的に所望する水素燃料を得ることと、出発原料となる金属類や水は自然状態のものから得ることを目的としているために環境負荷を少なくし、持続的社会を目指す人類の経済活動に貢献するものである。
【0007】
更に、本発明の目的は、産業上利用可能な金属類を、海洋塩、塩湖塩、岩塩、結晶化塩、温泉水含有塩、鉱泉含有塩、石灰石、ボーキサイト等の天然資源或いは産業廃棄物の中の溶鉱炉スラグや燃殻としての石灰などを得ることを目的とするために、喩え万一、資源外交問題で石油・金属資源供給国との間で不慮の経済摩擦が発生した場合にも備えて、国内で調達できることを目的とすると同時に水素エネルギー社会の到来を踏まえて安全に、持続的に水素の供給・輸送・保管を可能にすることを目的とするものである。
【0008】
又、工業規模で水素を多量に得るための水素発生装置(タンク)の構造、水素の生産現場から消費地への水素ローリ車による安全移送、水素ステーションでの内燃機関用の動力源獲得のために補給する際に、需要量に応じた給水素量をオンディマンドで製造可能とするように、補給基地としての製造・貯蔵・保管等々、地球温暖化対策としてやがて到来するであろう水素社会を睥睨しての課題点の解決策を提供することも目的とする。
【0009】
上記記載による本発明の目的を達成させるためには、最終手段的には、アルカリ金属、アルカリ土類金属を含有する海洋塩、塩湖塩、岩塩、結晶化塩、温泉水含有塩、鉱泉含有塩、石灰石、或いは周期律表第13族元素のアルミニウムを含有する粘土やボーキサイト等の天然資源或いは産業廃棄物の中の溶鉱炉スラグや燃殻としての石灰などを溶融状態で電気分解により、各種金属類を陰極で単離させた後、水素ガスと反応させて各種水素化金属を生成する方法と、各種溶融塩の電気分解過程で陰極から出る水素イオンと陰極近傍の被析出金属イオンを結合させて直接水素化金属を採取することを目的とするために膨大な実施例のデータと時間が必要になるために、本発明の実施例は、比較的簡単に、しかも確実性のある取得可能な方法に限定して実施例とすることにし、他の多くの必要とされる実施例データは公知のデータ、非特許文献等に記載されている事象に基づき、理論的に可能性ありとの見解に基づき記載した。
【0010】
本発明を実施するための出発物質の原料は自然状態で存在している海洋塩、塩湖塩、岩塩、結晶化塩、温泉水含有塩、鉱泉含有塩、石灰石等であるが、非特許文献2(『“風力よ”エタノール化からトウモロコシを救え<風力発電による海洋資源回収と洋上工場>/パワー社出版』)15ページに示してあるように、海水1リットル中に35gの塩分を含み、その中にアルカリ金属としてNa(10.8g), K(0.38g), Li(0.002g)、アルカリ土類金属はMg(1.3g), Ca(0.4g), Sr(0.01g), Ba(0.0002g)、13族のAlは(0.0002g)である。非特許文献3(石垣島の自然岩塩:http://www.binchoutan.com/ishigaki.html)には、製品100g中に、Na(32g), Mg(1.2g), Ca(0.53g), K(0.42g)である。塩湖塩としては世界最大の南米・ボリビアのウユニ塩湖の塩(100g)の成分はNa(38.7g), Ca(0.34g), K(0.03g), Mg(0.03g), Fe(0.0004g)である。岩塩としてはモンゴル岩塩(100g)の成分は Na(37.86g), Mg(0.1g), Ca(0.08g), K(0.03g), 水分(2.94g)である。温泉水の内、成分比として塩類が多いのは、兵庫県有馬温泉では1リットル中に海水の2倍に匹敵する71gの塩類からなり、その成分比はNa(20g), K(5g), Ca(3.4g), Sr(0.6g), Li(0.5g), Ba(0.5)gと非常に多くのミネラルが含有されている。我が国で最もアルミニウムイオンが多い温泉は蔵王温泉で、1リットル中には6.7gの塩類からなり、金属イオンで最も多いのがAl(0.3g)で次がCa(0.11g), Fe(0.09g), Na(0.076g), Mg(0.072g), K(0.06g)である。2番目が秋田県玉川温泉で、1リットル中には6.6gの塩類からなり、金属イオンで最も多いのがAl(0.28g)で次がFe(0.16g), Ca(0.16g), Na(0.066g), Mg(0.053g), K(0.034g)である。最もカルシウムが多いのは静岡県駿河健康ランドで、1リットル中には25gの塩類からなり、金属イオンで最も多いのがCa(4.6g)で次がNa(1.9g), Mg(1.8g), K(0.61g)である。勿論岩塩など水が無いものは、金属を取り出すには有利であるが、海水、温泉水或いは鉱泉のように95%以上が水の場合でも、淡水化により真水を、陰イオンから塩酸や硫酸を製造すれば、その副産物だけでも採算に合う。海水から金属を取り出すプロセスにおいて、副産物として出る、真水、硫酸、塩酸も従来大電力を要して生産していたものであり、この副産物だけでも採算性があることが、特許文献1(国際出願番号:PCT/JP2008/058500、国際公開番号:WO/2008/142995)および非特許文献2(『“風力よ”エタノール化からトウモロコシを救え<風力発電による海洋資源回収と洋上工場>/パワー社出版』)、非特許文献4(『Climate Change and Sustainable Development, Edited by Ruth A. Reck, Chapter 19“Wind Power and Seawater Save Corn from Ethanol Production: A Marine resources recovery and Offshore Integrated Plant for Sodium Fuel, Fresh Water, Ethanol, Vegetable, and Fish Production with Wind Energy and Seawater, p215-221,By Masataka Murahara / Linton Atlantic Books, Ltd, Feb. 2010』)に開示されている。
石灰岩の主成分は、炭酸カルシウム(CaCO3)で、少量の酸化マグネシウム(MgO)、シリカ(SiO2)、酸化アルミニウム(Al2O3)、酸化鉄(Fe2O3)を含む。非特許文献5(石灰石・ドロマイトとは/ http://www.yoshizawa.co.jp/company/index.html)によると石灰石の起源は海底のサンゴで、海中のCO2を取り込み石灰質の殻を作り、これが堆積したのが石灰石で、従って純粋な炭酸カルシウム(CaCO3)の化学成分は炭酸カルシウム(CaO):56.03%、二酸化炭素(CO2):43.9%である。我が国では年間1億7千トンが生産され、その殆どが露天掘りで、採掘費が安く、数少ない自給率100%の資源である。石灰石の用途はセメント原料や製鉄(生石灰(CaO)は鉄鉱石やコークスなどの原料に含まれる不純物を除去)に使われることが開示されている。又本発明の水素化カルシウム(CaH2)も生石灰(CaO)を使う。従って、これらの用途のために、多くの石灰石は熱分解して生石灰(CaO)として使う。そのため多量のCO2を発生させなければ成らないが、この石灰石熱分解プロセスは発電所や自動車のガソリン内燃機関と異なり酸素を用いない。現在、火力発電所などで純粋なCO2を回収するために、空気を用いず、空気から分離した酸素を使い、燃焼後のCO2を液化して深海底に埋設することが進められている。しかしこの石灰石の熱分解で得られるCO2は純粋なので、このまま液化することが出来る。又、この液化CO2を深海底の鉱物資源掘削運搬用浮力源や内燃機関の動力源として利用することが本発明者らによって特許文献5(深海資源採掘・回収統合洋上工場/特願2009-22119)に開示されている。このようにプロセス過程で排出するCO2も有効利用して大気に放出することなく石灰石を用いれば、我が国はもとより世界中に広く分布し、採掘が容易で、かつ採掘岩に約39%内外のカルシウム(Ca)を含有するエネルギー資源は他に無いと考える。この含有率39%は塩中に約38%の金属ナトリウムを含有する岩塩と肩を並べるものである。しかも、地表から深さ18 Kmの範囲の岩石圏(火成岩95%、頁岩4%、砂岩0.75%、石灰石0.25%)の中で0.25%を占める石灰石は、世界中に偏存無く広く分布し、かつ、クラーク数によると、カルシウム(Ca)は3.39%で5番目(1番:酸素/49.5%、2番:ケイ素/25.8%、3番:アルミニウム/7.56%、4番目:鉄/4.7%、5番目:カルシウム/3.39%、6番目:ナトリウム/2.63%、7番目:カリウム/2.4%、8番目:マグネシウム/1.93%)である。このクラーク数で1番目の酸素は殆どの金属の酸化物であるため、地表上で最も多い金属元素はケイ素(Si)である。従って豊富なエネルギー資源はケイ素(Si)である。これら周期律表14族元素(C,Si,Ge,Sn,Pb)の水素化金属は融点が低く、常温ではすべて気体であり、しかも酸素とは激しく反応する。このため、エネルギー源としては申し分ない。ところが燃焼後生成する酸化物はCO2 やSiO2のように超安定でその還元には大量のエネルギーが必要である。しかし、水素を燃焼させて得られる水(H2O)はその状態で、種々の物質の溶媒として或いは生物の成長エネルギーとして、或いは電気や光により簡単に還元が出来るなど、第14族元素の水素化物と比較すると経済的である。3番目のアルミニウム(Al)は、第13族元素(B, Al, Ga, In, TI) に属すが、アルミニウム以外は水素化金属の融点が低く、常温で気体であり毒性が強く、かつ酸素や水蒸気と激しく反応するためエネルギー源としては相応しくないと考える。ただし水素化アルミニウム(AlH3)だけは融点が150℃と高い。このように比較的融点が高い水素化金属の中に在って、融点が200℃以下の物質はRbの170℃、Alの150℃、Csの140℃、Beの125℃である。これら低融点材料の中で最も資源として豊富なものがアルミニウムであり、しかも水素化アルミニウム(AlH3)の比重は1.49と軽く、かつ融点が193℃、沸点が182℃と低いため昇華現象を回避すれば低温度での溶融塩電気分解が可能である。とくに水素化アルミニウム(AlH3)の融点150℃付近は、回転機、摩擦熱、或いはエンジンの発熱で水素を吐き出すことが出来るため自動車用エネルギーとして利用できる。5番目のカルシウム(Ca)と8番目のマグネシウム(Mg)などの第2族元素(Be, Mg, Ca, Sr, Ba, Ra)の金属単体表面は酸素雰囲気で酸化皮膜が形成される水との直接反応を阻害する。ベリリウム(Be)は100℃でも反応しない。マグネシウム(Mg)は水では反応せず熱水で反応する。カルシウム(Ca)は水と作用させると常温では水酸化カルシウムの保護膜を作るため、反応は緩やかで、熱すると激しく反応して水素を生成する。ラジウム(Ra)は反応性に富むが、ストロンチウム(Sr)やバリウム(Ba)はカルシウム(Ca)に似ている。しかるに第2族元素の水との直接反応で水素を発生させることは効率が低いが、水素化物にすれば常温で激しく水と反応して水素を発生する。更に、金属カルシウムを水と反応させた時には1モルの水素(H)を生成する(Ca + 2H2O →H2 + Ca(OH)2)。ところが水素化ナトリウム(CaH2)の場合には2モルの水素)を生成する((CaH2 + 2H2O → 2H2+ Ca(OH)2)。従って水素化カルシウム(CaH2)は、水素(H2)発生物質として有望である。クラーク数8番目のマグネシウム(Mg)、19番目のバリウム(Ba)、22番目のストロンチウム(Sr)およびそれ以下のベリリウム(Be)についても同様で水素化物にすると水との反応性が向上し、水素発生効率が上昇する。
第6番目のナトリウム(Na)は海水、塩湖、岩塩などに多く含まれているため、最も有望な金属である。この金属ナトリウムは、第1族元素(Li, Na, K, Rb, Cs, Fr)はアルカリ金属として最も反応性に富み、かつ水を注ぐと激しく反応して水素を発生する。しかし、大気中でも水分と反応して爆発するなど、取り扱いに注意が必要である。一般に金属ナトリウムは軽油などの油の中に保存するが、水素化ナトリウム(NaH)にパラフィンをコーティングするぐらいで安全に使用できる。更に、金属ナトリウムを水と反応させた時には0.5モルの水素(H)を生成する(Na+ H2O →1/2H2 + NaOH)。ところが水素化ナトリウム(NaH)の場合には1モル(2倍の水素)を生成する(NaH + H2O → H2 + NaOH)。従って水素化ナトリウム(NaH)は、水素(H2)発生物質として有望である。クラーク数7目のカリウム(K)、18番目のルビジウム(Rb)、更に、少ないセシウム(Cs)やリチウム(Li) についても同様で水素化物にすると水との反応性が向上し、水素発生効率が上昇する。このように、国内にある豊富な資源を原料として水素化を狙うことも今後の有力な代替エネルギー候補と成り得る。
【0011】
上記記載の海洋塩、塩湖塩、岩塩、結晶化塩、温泉水含有塩、鉱泉含有塩、石灰石、ボーキサイト等の天然資源或いは産業廃棄物の中の溶鉱炉スラグや燃殻としての石灰などの複合塩を出発原料とするのが目的であるが、各種金属の水素化物を得ることを一義的に考え、そのために各種金属毎の塩化物、水酸化物又は酸化物を、夫々単塩毎の溶融塩電気分解から始め、順次それら複数の塩を組み合わせた複合塩を溶融塩電気分解する。一般に溶融塩はイオン導電により高い導電率を示す。非特許文献6(高橋武彦著電気化学概論 223頁 /1991年2月20日 新版刷)には、導電率はイオン性が小さいほど高く、陽イオンが同じならばCl-> Br- >I- の順に、又陰イオンが同じならばLi+> Na+ > K+ > Rb+ >Se+ の順に低くなる。従って、溶融塩を金属製造などの工業分野から考える場合には、その導電率ができるだけ高く、又、できるだけ低い温度で使用できることが望ましいと記載されている。非特許文献7(伊藤康彦編 溶融塩の応用 16頁/ 2003年7月31日)には、ダウンズ法による金属ナトリウム製造において、NaClの融点は803℃と高く、実用化するには、融点の低下が望まれる。このためCaCl2-NaCl系溶融塩の相平衡効果を用い、混合溶融塩を用いることにより、電解浴の融点を下げることが記載されている。非特許文献8(電気化学便覧 第5版:丸善株式会社 平成13年6月30日発行)の125頁には2成分系および3成分系の共融混合物の組成と融点が降下することについて記載されている。更に、特許文献6の224頁には溶融塩の電解では、溶質の分解電圧が溶媒の分解電圧より高ければ溶質の電解は不可能であれば、単一塩の溶融体では溶媒が無いので、その塩の分解電圧に達しさえすれば電解が可能であると記載されている。そこで、非特許文献9(理科年表:丸善株式会社 平成15年版)や非特許文献10(実験化学ガイドブック:丸善株式会社 昭和59年6月15日発行)、非特許文献11(化学便覧 基礎編 I、II 改訂3版:丸善株式会社 昭和59年6月15日発行)、非特許文献8(電気化学便覧 第5版:丸善株式会社 平成13年6月30日発行)などから本発明遂行に必要とする金属および金属化合物の物理的定数を典型元素の中から周期律表の第1族,2族,13族元素および他の金属と比較して融点が低いため溶融塩の融点を下げる効果を期待して、遷移元素で第12族元素の亜鉛(Zn)を選び、それらについて調べると、各金属の比重は、Li(0.54) >K(0.86) >Na(0.97) >Rb(1.53) >Ca(1.55) >Mg(1.74) >Be(1.85) >Cs(1.87) >Sr(2.60) >Al(2.69) >Ba(3.5)とLiが最も軽い。金属の融点は、Al(182)<Zn(283)<
Be(405)<Li(605)<Cs(645)<Mg(714)<Rb(718)<K(770)<Ca(772)<Na(801)<Sr(875)<
Ba(925)の順に高くなる。塩化物の融点は、Al(193)<Be(405) <Li(605) <Li(605) <Cs(645)<Mg(714)<Rb(718)<K(770)<Ca(772)<Na(801)<Sr(875)<Ba(925)の順に高くる。水酸化物の融点は、Zn(125℃)< Cs(272) < Zn(125℃)<Cs(272) <Al(300)<Rb(301)<
Na(318)<Ba(325)<Mg(350)<K(360)<Sr(375)<Li(450)<Ca(580)の順に高くなる。水素化物は、Be(125℃)<Cs(140)<Al(150)<Mg(287)< Rb(300) <K(417)<Ca(600)< Li(680)<
Na(800)<Ba(1675) の順に高くなる。酸化物の融点は、Na(1275)<Li(1570)Ba(1918)<
Zn(1975)<Al(2054)< Sr(2430)<Be(2530)<Ca(2572)<Mg(2800) の順に高くなる。硫酸塩の融点は、Na(1275)<Li(1570)Ba(1918)<Ca(1450)<Ba(1580)<Sr(1605)の順に高くなる(単位は℃)。又、Pt, Pd, Ti, V, Fe, Mn, La などの遷移元素は水素が吸蔵され易いことが一般に知られている。これら遷移金属元素の中でTi, Fe, Mn などの元素化合物は本発明の溶融塩の中に含める。とくに低い温度で溶融塩電気分解を行うために、溶媒として高い導電率を有し、かつ溶質よりも分解電圧が高い溶媒を選択することが必要である。このために溶融電解塩の溶質としては、塩化カルシウム(CaCl2)或いは塩化バリウム(BaCl2)が適している。とくに本発明においては、水素化カルシウム(CaH2)は有力な代替エネルギー源である。しかし塩化カルシウム(CaCl2)は分解電圧が高いためCaの析出には大電力が必要である。ところが、非特許文献12(鈴木亮輔 「溶融塩化カルシウム中でのCaO電解を利用した酸化物の還元」平成21年度溶融塩賞受賞記念論文)には、塩化カルシウム(CaCl2)の中に生石灰(CaO)を溶融させると、CaOの理論分解電圧(約2.6V)がCaCl2の理論分解電圧(約3.2V)よりも低いので、この電圧を印加すればCaCl2の中でCaOのみを電気分解して、Caを得、これで酸化チタン(TiO2)を還元することが可能であると示唆している。このように溶融塩電気分解においては、溶媒と溶質を如何に選択するかが、実用化の鍵を握ると考える。本発明では、これら溶融塩を電気分解する過程で陰極又は陰極近傍で水素と反応させ、水素化金属を生成することに尽きる。一方、陽極では塩素、酸素、二酸化炭素、亜硫酸ガスなどを採取して、化学工業用塩酸や硫酸として或いは酸素は燃焼用として供給する。上記の手段により得られた金属の水素化物は比較的安定な化合物であるが、出来る限り油中で保管・移送・管理し、オンディマンド(On Demand)で水素の需要量に応じて水と接触させて燃料用途としての水素を得る。本発明を実施させるための原材料となる水素化金属類は、市販のものを調達することにより得ることも吝かではない。
【0012】
陸上の固鉱物資源から水素化金属を得るには、鉱脈が豊かであれば経済的である。水素化アルミニウム(AlH3)はボーキサイト、水素化ナトリウム(NaH)は岩塩、水素化カルシウム(CaH2)は石灰石から製造する。ボーキサイトや岩塩は地域に偏存する。ところが石灰石は世界中の地表や海岸の浅瀬や海底に広く分布する。この石灰岩の自給率が100%に近い我が国にとっては打って付けなエネルギー資源である。又、国外においても同様である。バルト海中央に位置するスエーデンのゴットランド島は、風が強く、古くから自然エネルギーに頼った生活様式が根付き、持続可能社会(Sustainable Society)の発想を生んだ場所でもある。島の内部や海岸或いは海上の至る所に風車が電力を生産し、その一部は海底ケーブルで送電し、本土のスエーデン国鉄の特急列車(X2000)を動かしている。このバルト海は水深が浅く、しかも塩分濃度は世界の海水の塩分濃度3%の1/3の1%と低い。しかし地下水が豊富であるため、海水の淡水化も必要が無く、海水から金属ナトリウムを回収する方法には消極的であった。ところがこの島の成因は石灰石である。至る所に露天掘りの石灰石鉱山が在り、その周囲にはセメント工場が多い。本発明は、この石灰石と風力発電を代替エネルギー資源にしようとする発想から生まれたものである。
【0013】
炭酸カルシウム(CaCO3)を主成分とする石灰石から水素化カルシウム(CaH2)を得るには、先ず、CaCO3を熱分解して、酸化カルシウムと二酸化炭素(CO2)を得る(CaCO3→CaO+CO2)。この場合、二酸化炭素(CO2)は、地球温暖化の要因ガスになるので、別途、二酸化炭素(CO2)を利用した内燃機関用の動力源とするために、液化炭酸ガス若しくはドライアイスにして貯蔵する。一方、溶質としての酸化カルシウム(CaO)は、溶融状態にある溶媒としての塩化カルシウム(CaCl2)に良く溶け、しかも塩化カルシウム(CaCl2)よりも酸化カルシウム(CaO)の方が電解電圧が低いので、酸化カルシウム(CaO)が先に電解され、陰極にカルシウム(Ca)が析出される。ここで、陰極内部或いは周囲から水素ガスを送って水素化カルシウムCaH2を生成させる。ここで陰極にはセラミック製水素電解質電極を用い、水素ガスを満たし、セラミック製電解質に接した金属電極を陰極として、イオン化された水素をセラミック製電解質電極を隔てて当該電解質近傍の溶融塩側の金属イオンと反応して水素化金属を形成させる。ここで金属イオンがカルシウムの場合は水素化カルシウム(CaH2)が生成する。この水素化カルシウム(CaH2)の比重(1.91)より重く、塩化カルシウム(CaCl2)の比重(2.15)より軽いため、最終的には水素化カルシウム(CaH2)は最上部に浮き回収される。このときの反応温度は600℃以下であることは勿論のことである。これにより、水素化カルシウムCa(H2)燃料として供給が可能となる。石灰石中には約56%の炭酸カルシウム(CaCO3)が含まれているが、更に、多い95〜98%以上含まれているのが貝殻である。この貝殻は石灰岩のような鉄分やアルミニウムなどの不純物は全く無く至って純粋な炭酸カルシウムである。例えば帆立貝を例に取ると、国内では年間21万トンが廃棄物として出るが、現在薬品などへの利用が考えられている。この貝殻も、水素化カルシウム(CaH2)製造として有望である。更に、骨や甲殻類の主成分は約58%が燐酸カルシウム(CaPO3)だが、燐を含むため公害にもなりかねないが、燐分の肥料化などをすれば、これも有望なエネルギー資源であると考える。
【0014】
製鉄の原料は、鉄鉱石、コークス、石灰石である。このプロセスには大量の熱エネルギーが投入される。コークス炉で石炭やプラスチックを燃やして製造したコークスと焼結した鉄鉱石と石灰石とを高炉中で燃やし、溶鉄を作り、これを転炉に送り、酸化剤を用い、余分な炭素や不純物を取り除くために加熱溶融した後、鋳造圧延工程を経て鉄鋼製品が出来上がる。コークス炉の副産物にコークス炉ガスが有るが、その中の56%が水素ガスである。非特許文献13(鉄鋼廃熱有効利用研究会の概要:環境・エネルギー工学部会/(社)日本鉄鋼協会:http://www.isij.or.jp/Bukai/Gakujutsu/Eco/study_01.htm)によると、各部所の廃熱温度は高炉ガス:150℃、コークス炉ガス:250℃、焼結炉ガス:400℃、転炉ガス:1500℃、高炉スラグ:1500℃、転炉スラグ:1550℃である。この高炉スラグや転炉スラグの廃熱は未使用であると記載されている。非特許文献14(鉄鋼スラグとは:株式会社 テツゲン:http://www.tetsugen.co.jp/slag.htm)によると、鉄鋼スラグの成分は、生石灰(CaO)が最も多く、高炉スラグで(CaO:41.7%, SiO2:33.8%, Al2O3:13.5%, MgO:7.4%, S:0.8%, Fe: 0.4%, MnO:0.3%)、転炉スラグで(CaO:45.8%, SiO2:11.0%, Al2O3:1.9%, MgO:6.5%, S:0.06%, Fe: 17.4%, MnO:5.3% )である。これら1500℃内外のスラグは、大型高炉では100〜150t/hの速度で連続的に排出され、大気中冷却や水冷して、コンクリート用骨材、セメント、道路補修用路盤剤、地盤改良剤、肥料などに使われている。しかし、熱回収は殆ど行われていない。非特許文献15(日本国勢図絵 第5版 2007/2008)表19-8によると2005年の我が国の銑鉄生産高が8,300万トンであるから、排出されるスラグは、約2,400万トン(鉄鋼の30%がスラグ)と莫大な量である。しかも、1,500℃に及ぶ未使用の廃熱となる。
そこで本発明では、塩化カルシウム(CaCl2)や塩化バリウム(BaCl2)の単塩又は複合塩に高温スラグを投入して混合溶融塩を作り、これを溶融塩電気分解して、金属カルシウム(Ca)を製造し、250〜300℃内外でコークス炉から得られた副産物の水素ガス(H2)と反応させて、水素化カルシウム(CaH2)を製造する。或いは、塩化カルシウム(CaCl2)や塩化バリウム(BaCl2) 或いは塩化カリウム(KCl)の組み合わせによる複合塩に高温スラグを投入して混合溶融塩を作り、600℃以下で溶融塩電気分解を行い、陰極内部或いは周囲から、コークス炉から得られた副産物の水素ガスを送って水素化カルシウムCaH2を生成する。この水素化カルシウムCaH2の比重(1.91)より重く、塩化カルシウム(CaCl2)の比重(2.15)より軽いため、最終的には水素化カルシウム(CaH2)は最上部で回収することができる。ここで、陰極内部或いは周囲から水素ガスを送って水素化カルシウムCaH2を生成させる。ここで陰極にはセラミック製水素電解質電極を用い、水素ガスを満たし、セラミック製電解質に接した金属電極を陰極として、イオン化された水素をセラミック製電解質電極を隔てて当該電解質近傍の溶融塩側の金属イオンと反応して水素化金属を形成させる。
特に、溶融塩の溶媒と溶質の複数種が含有するような場合、溶融温度も変化する。この場合、析出物に応じて溶媒を増やしたり減らしたりして処理する。又、溶融塩は温度によって導電率が異なる。その理由として、自由電子(熱電子)の運動に基因するからである。従って、溶融塩温度が低い場合でも、自由電子の動きが活発になれば、電流が流れ、電気分解の進行速度が速められると考えられる。これを実現するために磁場を掛け、陰極から陽極への電子の動きを加速すると、低温でも反応速度が速まると考えられる。
一般的に、電子の加速は気体放電の中で論じられているが、本発明は溶融塩のような液体中に磁場を掛けることにより、電子が加速される可能性がある。
【0015】
水素化金属は水分や水蒸気と反応して水素を発生する。水素化金属は金属よりも安全であると共に“禁水”であり、消防法:危険物第3類であるが、危険等級は金属ナトリウムはI、水素化ナトリウムはIIと取り扱いは楽である、
そのため、油の中に保管するが、製造工程も油で保護されれば、安全作業に繋がる。沸点が高い油は、軽油(引火点:130℃以下、沸点:180〜350℃)、一般に絶縁オイルや熱媒体油は引火点や沸点が高く、市販のものでは400℃まで気相および液相循環ができる。シリコーンオイルでは引火点が300℃である。又、引火点350℃のものもある。一方、水素化金属の融点が300℃以下の物は、Mg(287℃)> Rb(170)> Al(150) > Cs(140)> Be(125)である。ここで、エネルギー資源として利用価値が高いのは、アルミニウム(Al)とマグネシウム(Mg)である。マグネシウムの融点は651℃、塩化マグネシウム(MgCl2)は714℃、酸化マグネシウム(MgO)は2,800℃と、融点287℃の水素化マグネシウム(MgH2)よりも高く、しかも現時点では、混合塩により、溶融塩電気分解雰囲気を287℃以下にすることは難しい。そのため金属マグネシウム(Mg)を高温で水素ガスと反応させる以外に方法は無い。
一方金属アルミニウム(Al)は融点が660℃、塩化アルミニウム(AlCl3)は193℃、酸化アルミニウム(Al2O3)は2,054℃であり、何れの温度も水素化アルミニウム(AlH3)の融点150℃より高い。更に、注意しないとならないことは、塩化アルミニウム(AlCl3)の沸点が182℃と融点より低い。これは溶融溶液に成る前に昇華してしまうことを意味する。したがって、溶融塩電気分解は182℃以下の温度で実施しなければならない。幸いなことに、非特許文献8(電気化学便覧 第5版:丸善株式会社 平成13年6月30日発行)の124-125頁には、塩化アルミにウム(AlCl3)の複合塩は50℃まで溶融塩温度を降下することができることが示されている。しかも、水素化アルミニウム(AlH3)の比重は1.49であり、塩化アルミニウム(AlCl3)の比重が2.47、絶縁油或いは軽油の比重(0.8)であるため、生成した水素化アルミニウム(AlH3)は溶融塩の上に浮き、その上部を油が覆うことになり、目的製品を全く大気に触れさせないで回収することができる。ここの低温溶融塩を電気分解過程で陰極又は陰極近傍で水素と反応させ、水素化アルミニウム(AlH3)を生成することが可能である。もともと金属アルミニウム(Al)の比重は2.69と鉄(Fe)の7.44に比べて軽いため、車載用水素源として相応しい。従来水素自動車は、水素貯蔵用に重い製鉄製ボンベを必要とした。しかし、本発明のように水素発生源に水素化アルミニウム(AlH3)を用いれば、ボンベは不必要であり、かつ自動車の回転機、摩擦熱、或いはエンジンの発熱など150℃の温度で水素を吐き出し、金属アルミニウム(Al)になるため、スタンドで回収すれば、金属アルミニウムの原料として利用できるし、再度溶融塩電気分解により陽極で得られる塩素と、或いは水素か水と反応させて生成した塩化水素や塩酸と反応させて塩化アルミニウム(AlCl3)に戻した後、溶融塩電気分解を行う、水素燃料サイクルが可能である。
【0016】
将来、水素社会の到来が具体化になった場合、工業規模で水素を大量に製造させる水素製造装置内若しくは水素運搬用車両(ローリー)搭載タンク内、水素補給基地としての水素ステーションの地上若しくは地下タンク内で水素を生成させる基材となる水素化金属を安全に保管、運搬せしむるに装置に電気回路としての等価回路の原理を採用した。等価回路とは、抵抗やコンデンサー、リアクトルに置換えた回路のことで、抵抗体として金属の塩化物に置き換え、コンデンサーの役割として、灯油、軽油、潤滑油(比較的誘電率の高い誘電体、絶縁油、熱媒体油等の油種)を採用するならば、等価回路を形成させることが可能で、火災発生等の非常時には、火災感知器・火災警報装置とも連動させることが可能となる。しかしながら、灯油、軽油等の比較的引火点の低い油種を採用した場合は、上記各装置内は空気と遮断させることが必要である。又、潤滑油を採用する場合でも、熱分解温度が300℃以上の油種を採用することが望まれる。
更に、水素発生装置、水素輸送装置、水素保管装置内部で等価回路を形成させ、これにより、更にキャパシタおよび水素の吸着能力を増やすためには、特許文献6(特願2004-381984, 特開2005-203365)に開示されているように活性炭素の力を得るために各装置内の触媒としての遷移金属に担持させるか、塗布させることにより、更に、キャパシタを増加させることが期待できる。
【0017】
この等価回路(R-C回路)に通電すれば、各種溶融塩の電気分解が可能となり、所望する金属が析出され、獲得することが出来る。取り分け、ナトリウム(Na)等の爆発の危険性のある金属を油中で保管させることは、爆発する危険性から回避できると同時に各種水素化金属の化合物として、安全に貯蔵、保管、運搬が可能となり、水素の需要時にOn Demand で必要量の水素を発生させ水素燃料としての供給が可能であり、水素化社会の経済活動、産業の発達および地球環境への温暖化低減に寄与されることが現実のものとなる。
更に、石油系鉱物油を採用することにより、水素製造装置内部、水素輸送装置内部および水素貯蔵装置内部の壁面に用いるステンレス、鉄、アルミニウム等の金属鋼材に対し、防錆効果を発揮させ、腐食への対策手段にもなる。
【0018】
又、上記水素の製造装置、輸送装置、保管装置は、電気的に等価回路を形成させているために、温度センサー、圧力センサー、光センサー、超音波センサー等、非特許文献17と回路構成が可能となり、各装置内部での反応の進行具合をモニタリングにより制御させ、非常時には、アラームにより警報を発し、反応を停止させ、事故を未然に防止することが可能となる。
【先行技術文献】
【特許文献】
【0019】
【特許文献1】(国際出願番号:PCT/JP2008/058500、国際公開番号:WO/2008/142995)
【特許文献2】特願2006-46287 (特開2007-223839)
【特許文献3】特開2003-229134
【特許文献4】特開2003-234115
【特許文献5】特願2009-22119「深海資源採掘・回収統合洋上工場」
【特許文献6】特願 2002-107806,特開2003-306301
【特許文献7】特願2004-168549,特開2005-343771
【非特許文献】
【0020】
【非特許文献1】産業関連表による環境負荷原単位データブック/独立行政法人国立環境研究所 地球環境センター/2002年9月
【非特許文献2】村原正隆・関和市 著『“風力よ”エタノール化からトウモロコシを救え<風力発電による海洋資源回収と洋上工場>/パワー社出版』
【非特許文献3】石垣島の自然岩塩:http://www.binchoutan.com/ishigaki.html
【非特許文献4】『Climate Change and Sustainable Development, Edited by Ruth A. Reck, Chapter 19“Wind Power and Seawater Save Corn from Ethanol Production: A Marine resources recovery and Offshore Integrated Plant for Sodium Fuel, Fresh Water, Ethanol, Vegetable, and Fish Production with Wind Energy and Seawater, p215-221,By Masataka Murahara / Linton Atlantic Books, Ltd, Feb. 2010』
【非特許文献5】石灰石・ドロマイトとは/ http://www.yoshizawa.co.jp/company/index.html)
【非特許文献6】高橋武彦著 電気化学概論 223頁/ 1991年2月20日 新版刷
【非特許文献7】伊藤靖彦編 溶融塩の応用―エネルギー・環境技術への展開223頁、―株式会社アイピーシー、2003年7月31日発刊
【非特許文献8】電気化学便覧 第5版:丸善株式会社 平成13年6月30日発行
【非特許文献9】理科年表:丸善株式会社 平成15年版
【非特許文献10】実験化学ガイドブック:丸善株式会社 昭和59年6月15日発行
【非特許文献11】化学便覧 基礎編 I、II 改訂3版:丸善株式会社 昭和59年6月15日発行
【非特許文献12】鈴木亮輔 「溶融塩化カルシウム中でのCaO電解を利用した酸化物の還元」平成21年度溶融塩賞受賞記念論文
【非特許文献13】鉄鋼廃熱有効利用研究会の概要:環境・エネルギー工学部会/(社)日本鉄鋼協会:http://www.isij.or.jp/Bukai/Gakujutsu/Eco/study_01.htm)
【非特許文献14】鉄鋼スラグとは:株式会社 テツゲン:http://www.tetsugen.co.jp/slag.htm)
【非特許文献15】日本国勢図絵 第5版 2007/2008)
【非特許文献16】国際特許流通セミナー2010,配布資料 平成22年1月25日、EPO「未来予測」−知財制度の行方− 藤野仁三
【非特許文献17】センサーのすべて 谷腰欣司著 電波新聞社1998年10月20日発行
【非特許文献18】水素とイワタニ 岩谷瓦斯ホーム・ページ
【発明の概要】
【発明が解決しようとする課題】
【0021】
従来、水素の製法は、水を電気分解する方法、石油等のガス状炭化水素化合物からニッケルや酸化鉄を触媒にして加熱分解する方法、溶鉱炉のコークスを製造する過程で副産物として発生させる方法等がある。これらの水素ガスを需要に応じ、必要量だけを供給するシステムが必要である。その手段としては、製造した水素ガスをボンベに貯蔵したり、液化した後高圧ボンベに貯蔵したり、水素吸蔵合金に吸蔵させた後、交通手段を用い消費地に輸送したり、パイプラインで直接輸送する方法が考えられている。しかし、水素自身は軽いが輸送するには容器類が重い。水素吸蔵合金に至っては寿命が短く重い。気体である以上輸送時のガス漏れなどが心配である。水素を石油や石炭の代替エネルギーとして普及させるためには、石炭や石油のように安全で長期間の貯蔵と長距離輸送を可能にしなければならない。
【課題を解決するための手段】
【0022】
従って、本発明は前述した課題点を解決する手段として、代替燃料が安全な長期間貯蔵と長距離輸送を可能にし、二酸化炭素CO2や放射能を出さず、かつ地域に偏存せず無尽蔵に在る天然資源或いは工業廃棄物を材料として水素を製造し、その製造工程においても二酸化炭素を極力発生させないこと、水素の製造工程において副生成物は地球環境を損なうものでなく、極力資源化でき、水素燃料サイクルを実現させるものであり、しかもを産業上利用可能であるもの、水素を発生させる原材料および水素を発生させるために反応に必要とする金属等の物質は、海水、塩湖水(塩分)、温泉水、石灰石等国内に普遍に存在している天然物を利用することにある。
【0023】
更に、本発明では、上記の趣旨を基本とし、海洋塩、塩湖塩、岩塩、結晶化塩、温泉水含有塩、鉱泉含有塩、石灰石、ボーキサイトなどを構成する周期律表の1族、2族、13族、14族等の主に卑金属元素類の塩化物、水酸化物、酸化物、硫酸塩、炭酸塩などを構成する元素のうち、クラーク数で地球上での賦存量が多い鉱物資源や産業廃棄物の中の溶鉱炉スラグ或いは廃棄された貝殻や甲殻類を原料として用い、これらから水素化金属を製造するための電力を太陽光、風力、波力、重力・浮力、地熱等の自然エネルギーから調達し、かつ、熱エネルギーの一部は溶鉱炉の廃熱を利用するものとする。
【0024】
従って、上記金属の塩化物、水酸化物、酸化物、硫酸塩、炭酸塩などを溶融塩電解することからはじめる訳だが、当該金属がイオンの状態のままで、それらと水素ガスとを当該水素化金属の融点以下の温度雰囲気で反応させ、水素化金属を生成させ、若しくは、調達した各種単体金属を水素ガスと反応させ、生成した水素化金属を油中に保管させると同時に当該水素化金属に水を接触反応させ、必要に応じて水素を製造し、燃料用に提供すると同時に、残渣として析出する水酸化金属は脱水することにより、1族元素は溶融塩電気分解用の原料としてリサイクルにより再度供給し、2族元素の水素化金属は融点以上で水を放出して酸化金属になるため、2族金属元素塩化物を直接溶融塩電気分解するか、或いは溶媒としての2族元素塩化物と溶質としての2族元素酸化物から成る混合塩を溶融塩電気分解して陰極に当該金属類を析出させ、或いは当該金属がイオンの状態のままで、それらと水素ガスとを当該水素化金属の融点以下の温度雰囲気で反応させ、水素化金属を生成させ、若しくは、調達した各種単体金属を水素ガスと反応させ、生成した水素化金属を油中に安全に保管させ、需要に応じて水と接触させることにより、水素燃料を製造させるサイクルを維持させようとするものである。又、上記地球上に偏存無く、かつ極自然に存在する天然資源や産業廃棄物から産業上必要とする各種金属類を獲得することも目的とする。
【0025】
金属の塩化物を溶融塩電気分解すると陰極に各金属が析出し、陽極には塩素ガス(Cl)が生成される。陽極に生成された塩素ガスと熱水を反応させることにより、塩酸と酸素が自然生成される(2NaCl → 2Na+Cl2 , 2Cl2+ 2H2O → 4HCl+O2)。或いは、生成した塩素ガスに、高温下で水素ガスを流し、塩化水素を生成させ、それを水に吸収させて塩酸を得る方法(Cl2+ H2 →2HCl )もあるが、コスト的には塩素ガスと熱水とを反応させる方が有利である。又、ここで得られた塩酸を濃縮して濃塩酸を得るには、特許文献5(特願2009-22119「深海資源採掘・回収統合洋上工場」)に示されているように高速気流により発生する気圧差を利用して水分を蒸発させ、塩酸を濃縮する方法がある。
【0026】
ナトリウム(Na)は海水、塩湖、岩塩などに多く含まれているため、最も有望な金属である。この金属ナトリウムは、第1族元素(Li, Na, K, Rb, Cs, Fr)はアルカリ金属として最も反応性に富み、かつ水を注ぐと激しく反応して水素を発生する。しかし、大気中でも水分と反応して爆発するなど、取り扱いに注意が必要である。一般に金属ナトリウム(Na)と水素化ナトリウム(NaH)の安全性を比較すると、ともに水と激しく反応し、消防法では共に「禁水」薬品であり、危険物第3類である。ただし、危険等級は金属ナトリウムの等級Iに対し、水素化ナトリウムは等級IIと低く、比較的安全であり、取り扱いが楽である。しかるに、一般には、金属ナトリウムが灯油に保存されているが、水素化ナトリウム(NaH)は粒子がパラフィンでコーティングされているぐらいで、比較的安全に使用できる。更に、金属ナトリウムを水と反応させた時には0.5モルの水素(H)を生成する(Na+ H2O →1/2H2 + NaOH)。ところが水素化ナトリウム(NaH)の場合には1モル(2倍の水素)を生成する(NaH + H2O → H2 + NaOH)。従って水素化ナトリウム(NaH)は、水素(H2)発生物質として有望である。このようにナトリウム(Na)は、油中で保管しないと不安定で、条件によっては爆発の危険性もあるが、一端水素化させ、水素化ナトリウム(NaH)にすると、融点が800℃になり、安全にかつ、長期間の保管にも耐え、必要時に水と反応させて水素を発生させるのに好適に用いられるようになる。
【0027】
カルシウム(Ca)やマグネシウム(Mg)などの第2族元素(Be, Mg, Ca, Sr, Ba, Ra)の金属単体表面は酸素雰囲気で酸化皮膜が形成される水との直接反応を阻害する。ベリリウム(Be)は100℃でも反応しない。マグネシウム(Mg)は水では反応せず熱水で反応する。カルシウム(Ca)は水と作用させると常温では水酸化カルシウムの保護膜を作るため、反応は緩やかで、熱すると激しく反応するようになり水素を生成する。ラジウム(Ra)は反応性に富むが、ストロンチウム(Sr)やバリウム(Ba)はカルシウム(Ca)に似ている。しかるに第2族元素の水との直接反応で水素を発生させることは効率が低いが、水素化物にすれば常温で激しく水と反応して水素を発生するようになる。更に、金属カルシウムを水と反応させた時と比較して、水素化ナトリウムの場合には2倍の水素を生成する。しかも従って水素化カルシウム(CaH2)は、水素(H2)発生物質として有望である。クラーク数8番目のマグネシウム(Mg)、19番目のバリウム(Ba)、22番目のストロンチウム(Sr)およびそれ以下のベリリウム(Be)についても同様で水素化物にすると水との反応性が向上し、水素発生効率が上昇する。消防法では水素化ナトリウムと同じ「禁水」薬品であり、危険物第3類、険等級はIIに分類され、比較的安全であり、取り扱いが楽である。しかるに、水素化ナトリウム(NaH)同様に粒子はパラフィンでコーティングされて市販されており、比較的安全に使用できる。
【0028】
この周期律表第2族に属するカルシウム(Ca)は、国内に普遍的に存在する、炭酸カルシウム(CaCO3)を主成分とする石灰石から得られる。このカルシウム(Ca)に水素を貯蔵し、水素化カルシウム(CaH2)を製造し、これを水素燃料として用いることは、資源小国日本にとって有望な技術と考える。この石灰石中の炭酸カルシウム(CaCO3)の純度は、従来の鉱物資源に比べて50%以上と高く、我が国に限らず世界中の陸地や海岸周囲で採掘できるため、持続可能社会を構築のためには打って付けな資源であると考える。炭酸カルシウム(CaCO3)を主成分とする石灰石から水素化カルシウム(CaH2)を得るには、先ず、CaCO3を熱分解して、酸化カルシウムと二酸化炭素を得る。化学反応式は、CaCO3→CaO+CO2である。この場合、二酸化炭素(CO2)は、地球温暖化の要因ガスになるので、別途、二酸化炭素(CO2)を利用した内燃機関用の動力源とするために、液化炭酸ガス若しくはドライアイスにして貯蔵させる。一方、酸化カルシウム(CaO)は、塩化カルシウム(CaCl2)又は塩化バリウム(BaCl2)の単独又は複合塩を溶媒とした溶融塩電解液の中に溶質として溶かし、電解電圧の低い酸化カルシウム(CaO)が、先ず選択的に溶融塩電気分解され、陰極周囲にカルシウムイオン(Ca++)が析出される。そこで、陰極内部或いは周囲から水素ガスを送って水素化カルシウム(CaH2)を生成させる。水素化カルシウムは、比重が1.91と比較的軽く、かつ、温度を600℃以下に保てば、水素を放出しないので保管が楽である。幸いなことに、常温で水と激しく反応して水素(H2)を発生させるので、燃料としての供給が可能となる。
【0029】
周期律表第13族に属し、軽金属として社会生活に欠かせない金属アルミニウムの塩化物は他の金属には見られない低温度溶融塩である。しかるに、塩化アルミニウム(AlCl3)を出発原料にして溶融塩電解をさせることにより水素燃料サイクルを考えることができる。塩化アルミニウム(AlCl3)の融点は、193℃であり、沸点が182℃であるために水素ガス又は油圧を利用して圧力をかけると陽極では、塩素ガス(Cl2)が発生し、水に吸収させて塩酸をつくり、陰極では、水素化アルミニウム(AlH3)が生成され、これを150℃以上で過熱すると体積で3倍の水素が発生する。これは、水素燃料サイクルを応用した内燃機関用・外燃機関用の将来の動力源として提供の可能性があり、とりわけ、潤滑油や軽油の中に或いはワックス等でコーティングされた水素吸蔵アルミニウム燃料(水素化アルミニウム)は、弁当箱のようなパッケージ容器商品として、水素燃料補給基地(水素スティーション等)で、ガス欠の際の交換、取り付け部品として利用でき、内燃機関の廃熱で、軽油或いはワックスと共に加温すれば、水素を吐き出し、水素燃料としてシリンダーに供給できる。更に、潤滑油等は大気中の湿気や水との接触を防止する効果を持つと同時に等価回路を形成させるコンデンサーの役割も演じ、緊急時を知らせる警報回路の構成が可能となる。又、水素を吐き出して、水素吸蔵金属の役目を終えアルミニウムは、水素燃料補給基地(水素スティーション等)で回収することにより、リサイクルが何度でも可能となる。
【0030】
溶融塩を電気分解するには高い導電率が要求される。この溶融塩の電気的性質は、非特許文献6(高橋武彦著 電気化学概論 1991年2月20日 新版刷)222頁に示されているように、例えば塩化ナトリウム(NaCl)の伝導率κ(S/cm)は、18℃、10%の水溶液でκ=0.121(S/cm)、700℃における固体時でκ=0.000087(S/cm)であるが、融点の801℃を超えると、結晶のイオン配列が乱れ、空孔が増大し、水溶液の10倍以上の導電率を示すようになり、850℃でκ=3.5(S/cm)であり、分極電圧はV=2.5Vである。この導電率は、非特許文献11(化学便覧 基礎編 I、II 改訂3版:丸善株式会社 昭和59年6月15日発行)II−461,462頁に示されるように、塩の種類によって大きく異なり、例えば塩化アルミニウム(AlCl3)では200℃でκ=.00000056(S/cm)であるが、塩化カルシウム(CaCl2)では800℃でκ=2.1(S/cm)、塩化バリウム(BaCl2)では1000℃でκ=2.17(S/cm)、塩化カリウム(KCl) では800℃でκ=2.24(S/cm)、塩化リチウム(LiCl) では800℃でκ=6.61(S/cm)である。更に、これらの塩類を混合すると、融点は下がり、かつ導電率も大きく変わる。このため効果的に溶融塩電気分解を行うためには、導電率を高くし、かつ融点を低くしなければならない。更に、電気分解したい溶質の分解電圧に達すれば、電気分解が行われるから、目的溶質よりも分解電圧が高く、しかも融点が低くなるように塩類を組み合わせた溶媒を処方すれば、目的金属を選択的に析出させることが可能である。
【0031】
溶融塩電気分解槽としては、陰極に目的金属を析出させ、陽極に塩化物の場合は塩素ガス、水酸化物や酸化物の場合は酸素ガスを析出させる。例えば水酸化ナトリウム(NaOH)を溶融塩として電気分解するCastner法によると、陰極で金属ナトリウムが析出し、陽極では水が生成する。この反応雰囲気温度320℃において、水酸化ナトリウムの分解電圧は約2.2Vであるが、水の電気分解電圧が約1.4Vであるから、水も電解されるため、電解効率は50%以下であると、非特許文献6(高橋武彦著 電気化学概論 1991年2月20日 新版刷)238頁に記載されている。幸いなことに、この電解効率を100%にする提案が、非特許文献7(伊藤靖彦編 溶融塩の応用―エネルギー・環境技術への展開、株式会社アイピーシー、2003年7月31日発刊)21,22頁に、β−アルミナ隔膜法として記載されており、ナトリウムイオン選択透過性固体電解質 β−アルミナを隔膜として陽極室側に置かれた水酸化ナトリウムを電気分解し、溶融ナトリウムを陰極として陰極室に金属ナトリウムを析出させることにより反応温度が350℃と低く、しかも電流効率100%が可能であると記載されている。更に、、同じ装置を用い、塩化亜鉛(ZnCl2)を60%と塩化ナトリウム(NaCl)を40%の混合溶融塩にすると330〜350℃で塩化ナトリウムの電気分解が可能で、電流効率は、ほぼ100%で高純度金属ナトリウムが得られことが示されている。イットリア安定化ジルコニア、スカンジア安定化ジルコニア等のセラミック固体電解質を用いて水酸化ナトリウム(NaOH)から酸素を引き抜く方法及び装置として、ジルコニア系セラミックスから成る電解るつぼの中に水酸化ナトリウムを仕込み、固体電解質の内外面に、電圧印加のための白金メッキされた電極が備えられ、そこに約2.2Vの電圧を印加して、溶融塩温度を320℃以上450℃以下に保ちながら電気分解を行い水素化ナトリウムを製造する方法と装置が、特許文献2(電気化学的水素化ナトリウム製造方法及び装置(特願2006-46287/特開2007-223839)に開示されている。これらのように、イオン選択透過性固体電解質を隔離膜兼電極として用いれば電流効率の向上が可能であると考える。
【0032】
請求項1に記載の発明は、地球上に偏存無く、しかも豊富に在る資源から、例えば、海洋塩、塩湖塩、岩塩、結晶化塩、温泉水含有塩、鉱泉含有塩、石灰石(炭酸カルシウムをを主成分とする石灰石、大理石、方解石、石灰藻、石灰華)および/又は、ボーキサイト等の天然資源又は産業廃棄物(スラグ、貝殻、甲殻類)等から水素化金属を製造し、それから化石燃料の代替燃料としての水素を得る手段に言及したものであり、それら製造された水素化金属が、常温で安定、かつ安全で、長期保存と長距離輸送が可能であるある条件を満たすことが必須条件である。そのために、地表に存在度が高い元素順に元素をランク付けした、クラーク数を基に金属元素を特定し、かつ、それら金属元素の水素化物が常温で固体であり、毒性が無い物に限定した。その結果、周期律表第1族元素のアルカリ金属族、第2属のアルカリ土類金属族、第13族のアルミニウム族などの所謂、卑金属元素を特定した。しかし、第13族に属するホウ素、ガリウム、インジウム、タリウム等は水素化物が常温で気体でありかつ毒性があるので、第13族元素はアルミニウムのみとする。更に、水素化金属を製造するに際して、これら金属原子やイオンと水素を反応させる条件として、当該水素化金属の融点以下の温度雰囲気で反応させることが必要である。本発明では、不純物が殆ど無い該当金属元素を水素化して水素化物を製造することは当然できるが、エネルギー源として使用するためには、低純度を良としたい。そこで溶融塩の原料として、海洋塩、塩湖塩、岩塩、結晶化塩、温泉水含有塩、鉱泉含有塩の中の塩化塩、水酸化塩、酸化塩および/又は炭酸塩や硫酸塩の夫々の単独塩および/又は複合塩を溶融塩電気分解法により電解電圧の低い順に電極陰極部に単体金属を順次析出させた後、当該水素化金属の融点以下の温度範囲で水素ガスと反応させ、該電極陰極部に水素化金属を生成させるか、又は電極陰極部に単体金属を順次析出させた後、その析出金属を水素ガスと共に外部加熱可能な反応管に入れ、水素ガスを流しながら当該水素化金属の融点以下の温度範囲で水素化反応を行い水素化金属を製造する。
他方、石灰石、大理石、ドロマイト、方解石、石灰藻、石灰華などの炭酸カルシウム(CaCO3)或いは石膏などの硫酸カルシウム(CaSO4)等の天然資源および/又は産業廃棄物としての鉄鋼スラグ、或いは食品廃棄物の貝殻や甲殻類などから得られる酸化カルシウム(CaO)を溶質として、塩化カルシウム(CaCl2)や塩化バリウム(BaCl2)或いは塩化カリウム(KCl)等の単独塩又は複合塩を溶媒とした混合溶融塩を電気分解して、電極陰極部にカルシウム(Ca)を析出させた後、当該水素化金属の融点以下の温度範囲で水素ガスと反応させ、該電極陰極部に水素化金属を生成させるか、又は電極陰極部に単体金属を順次析出させた後、その析出金属を水素ガスと共に外部加熱可能な反応管に入れ、水素ガスを流しながら当該水素化金属の融点以下の温度範囲で水素化反応を行い、水素化金属を製造する。
一般には、金属アルミニウムは、ボーキサイトを溶融塩電気分解して製造しているが、低温で溶融塩電気分解が可能になれば、金属アルミニウムの価格は下がる。ここで、塩化アルミニウム(AlCl3)の沸点が182℃であるから、溶質としての塩化アルミニウムを溶媒として塩化ナトリウムを混合した溶融塩を処方すれば電解温度を120℃まで下げることが可能である。この混合溶融塩を電気分解して、電極陰極部にアルミニウム(Al)を析出させた後、当該水素化金属の融点以下の150℃以下で水素ガスと反応させ、該電極陰極部に水素化金属を生成させるか、又は電極陰極部に単体金属を順次析出させた後、その析出金属を水素ガスと共に外部加熱可能な反応管に入れ、水素ガスを流しながら当該水素化金属の融点以下の温度範囲で水素化反応を行い、水素アルミニウムを製造する。この水素化金属を石油系鉱物油中に浸漬・保管させ、水素の需要時に需要量に応じ供給可能ならしめるために当該水素化金の単体或いは複合体に真水、海水、工業用水、地下水、河川水、湖沼水、蒸留水、水道水、温泉水、鉱泉水、雨水などの水を反応させて水素を製造する。この溶融塩電気分解に必要な電力は、風力発電、太陽光発電、波力発電、地熱発電、重力・浮力発電等々の自然法則を利用したものから獲得し、エネルギーの使用後、大気開放されても環境負荷の掛からない方式を選択している。
【0033】
請求項2に記載の発明は、溶融塩電気分解を行うに際し、反応雰囲気温度を低温にし、かつ効率良く水素化金属の収量を増加させるために、電解槽中に介在させている溶融塩と接触配置されているセラミック製固体電解質隔膜電極の溶融塩と反対側に陰極としての白金やニッケルなどの金属電極を密着させた構造および/又はセラミック製固体電解質隔膜電極の溶融塩側に陰極としての白金やニッケルなどの金属電極を密着させた構造とし、溶融塩の反対側から大気圧以上で、かつセラミック製固体電解質隔膜が破壊しない範囲の圧力の水素ガスを、セラミック製固体電解質隔膜を通して、溶融塩中の金属イオンに供給することにより、溶融塩中の各種金属イオンと容易に反応を促進させ水素化金属を生成し、水素と結合したことにより、溶融塩よりも融点が高くなり、かつ比重が小さくなった固体の水素化金属は溶融塩の上に浮上して製品として回収される。
更に、当該電解槽中に介在させている溶融塩と接触配置されているセラミック製固体電解質隔膜電極の溶融塩と反対側に陰極としての白金やニッケルなどの金属電極を密着させた構造又溶融塩の反対側から大気圧以上で、かつセラミック製固体電解質隔膜が破壊しない範囲の圧力の水素ガスに別途電解槽中に設けた電解電極から電圧を印加させることにより、電子を供与させ、水素のマイナスイオン(H-)を生成させることにより、陰極に析出している各種金属イオンと該水素のマイナスイオン(H-)とが容易に反応し、水素化金属が生成される収率を増加されることが期待される。
【0034】
請求項3に記載の発明は、水素燃料製造サイクルを形成させるものである。従来化石燃料の廃棄物は二酸化炭素や石炭灰のように燃料として再利用ができなかった。ところが核燃料は再処理が行えるため核燃料サイクルが成立する。しかしこの核燃料サイクルでも高レベル放射能廃棄物が出る。しかし本発明の水素燃料製造サイクルは、水素化金属に水を反応させ、エネルギー源の水素を供給した後の廃棄物は全て安全な金属の水酸化物である。しかも第1族元素の水酸化物ならば低い温度で直接溶融塩電気分解を繰り返して水素化金属を生産できる。第2族元素にあっては、水酸化物は夫々の融点水を放出して酸化金属になるため、最終的には金属酸化物を溶質とした溶融塩電気分解に他ならないが、塩化カルシウム(CaCl2)や塩化バリウム(BaCl2)の単塩又は複合塩を溶媒としてそれらの混合塩を電気分解して更に、水素化すれば再度水素化金属が製造される。しかも再処理時の水酸化金属には外部からの不純物が入り込まないので、電力効率は高く、再処理のための原料供給は溶融塩電気分解のための電力のみで、天然資源の供給は殆ど不必要である。この再処理に必要な電力は、風力発電、太陽光発電、波力発電、地熱発電、重力・浮力発電等々の自然法則を利用したものから獲得する。
【0035】
請求項4記載の発明は、水素の製造装置、水素の輸送装置、水素の貯蔵装置の内壁は好ましくは、d軌道および、f軌道に電子を持つ遷移金属元素を採用することが望まれる。遷移金属元素は融点が高く、密度も高く、水素の吸蔵及び放出能力があるからだ。しかしながら水素の吸蔵、放出を繰り返すことにより、脆性となり、長期間の耐用には課題があるので、長期間に亘る使用の場合には、ステンレス、アルミニウム、鉄等の合金を採用する。更に、上記各装置内には、短期間の使用に対しては、多段型の複数のプレートを設け、各プレートは、遷移金属元素により構成させ、水素の吸蔵及び放出能力をより増幅させる構造体とする。
上記の夫々の装置は同じ構造体にすることが可能で、各装置内では金属水素化物に水と接触反応させることにより、必要に応じて水素を発生させ、その発生した水素圧でもつて加圧されて発熱反応を伴い遷移金属に水素を吸蔵させ、各装置内で発生した水素を取り出して使用する場合は、各装置内の水素圧力が低下し、減圧されるので遷移金属に吸蔵されていた水素が吸熱反応を伴って放出され、効率よく水素を得ることが可能となる構造体である。従って、将来、水素自動車の時代が到来し、水素燃料タンクにもこの構造体の採用が期待されるが、水素を吸蔵する光触媒の研究も行われている。
水素は、燃料として用いる場合、単位重量当りガソリンの約2.7倍の発熱量が得られが、取り扱い如何によっては爆発の危険性があるので、水素燃料使用分野の発展の阻害要因にされて来たが、考え方によっては爆発範囲が非常に広く、着火エネルギーが非常に小さいという相反する性質を安全に利用することが可能ならば、燃焼により、二酸化炭素は排出せずに、水が生成されるので地球温暖化対策に適した燃料となりうる。
そのために本各装置には、図7に示すように、爆発限界を感知させ、装置内が危険範囲の状態に達した場合は温度センサー、圧力センサーによりアラームで知らしめ、即、反応を停止、制御させる回路が制御盤として組み込まれていると同時に内部の反応状況をモニタリングする回路も組み込まれている。
又、上記各装置内は、電気絶縁油、耐熱性の熱媒体油、誘電率の高い潤滑油中に金属の水素化物が浸漬されており、これら潤滑油には、防錆効果は無論、キャパシタの役割を有し、金属水素化物は抵抗体となるので電気回路的には等価回路を形成させることが可能となり、各装置を電気回路部品の一部と看做せば将来、様々な目的に応じた回路を構成させることが可能となる。
一例として、装置内で発生させた水素と酸素ボンベからの酸素とで燃料電池を作り、制御装置を可動させる電源として用いることも可能となるが、水素を製造していないときは、燃料電池は作動不可となるのでこのような場合、バツテリーによる電源を採用する。
【0036】
水素製造装置、水素輸送装置、水素貯蔵装置としての形状は、球形、円錐形、直方体、台形状等設置場所に固定させた構造体で地上若しくは地下に静置させることが可能で、或いは車両搭載により、水素の輸送に供する場合は、移動体の形状に適合させて搭載、移動可能とした構造体で、垂直(縦型)、水平(横型)、傾斜させて設置しても差し支えない構造体とする。
【0037】
水素製造装置、水素輸送装置、水素貯蔵装置は、法律としての消防法、高圧ガス保安法等、又、省令としての一般高圧ガス保安規則、容器保安規則、特定設備検査規則、コンビナート等保安規則等に適合させたものであることが求められる。
【0038】
一方、燃料用の水素は燃焼により、二酸化炭素CO2は発生せず、水を生成させるということで地球環境上は理想的なエネルギー源となり、単位重量当りの発熱量もガソリンの約2.7倍と莫大な燃焼エネルギーが得られるが、他方、取り扱いを誤ると大事故に繋がる危険性も秘めている。特に、水素と酸素の混合比がで2:1になると最も爆発力が大きく、爆鳴気を伴う。沸点が、1気圧で-252.9℃で空気中での爆発範囲が4.0〜75.0Vol%と非常に広く、着火エネルギーが極めて小さい。酸素中での爆発範囲が4.65〜93.9Vol%wであり、又、無色、無味、無臭、無毒の気体であるが、漏洩に対する対策、取り扱い安全に対する対策等が今後の課題となる。[非特許文献18]
【0039】
水素化金属と水を接触、反応させて水素を得る際に、用いる水は、水道水、地下水、工業用水、温泉水、鉱泉水、蒸留水、河川水、湖沼水、雨水等で差し支えないが、比較的不純物の少ない、汚染されていない水を使用することが望ましい。
【0040】
本発明に基づく、水素製造装置、水素輸送装置、水素貯蔵装置の各内部での反応条件の制御法は、一般的に行われているシーケンス制御方式、フィードバック制御方式何れも適用が可能であり、制御目的は、発生する水素の量を反応温度、圧力により制御させるものであり、爆発を未然に防止することを目的とする。そのためには、水素化金属物と接触、反応に必要とする水の注入量をバルブ開閉度合いを調整させて制御させるもので、
水は少しずつ滴下させることにより、瞬間的に水素ガスが多量に発生し、発熱を伴って生成された水素圧が爆発限界を超えそうな場合は、水素取り出し口を開放させて、一時的に水素ボンベに貯蔵させ、各装置内での水素の量を調整させる制御方式である。
又、静電気による爆発防止装置も具備させることが要求される。
【0041】
本発明による各装置内の爆発限界を感知、反応を即座に停止させ、事故を未然に防止する手段として、図7に示す反応制御回路システムが各装置に具備されている。
予め設定された危険限界値(爆発限界値)とする水素圧力、装置内部温度を夫々圧力センサー、温度センサーが感知し、入力信号として制御盤であるプログラマブルコントローラーに入る。
自動制御方式は、シーケンサー制御方式、フィードバック制御方式何れにも適用可能で、コントローラーからの制御出力信号は、パルスモーターにより、水注入量調整弁及び/又は水素取り出し弁の開閉度を調整させて、各装置内の水素圧を安全圏内に保持するようにフィードバック制御信号として、各装置内部に入る。
別途各装置内部に具備させた各センサー、非特許文献17、取り分け圧力センサーと温度センサーにより、予め設定された爆発限界値に達した時の圧力と温度信号が入力信号としてコントローラーに入り、水素ガスの生成量を調整するように反応を制御するシステムである。尚、各装置内の反応状況を感知させるための圧力計、温度計を適宜必要とする箇所に接続させる。
【0042】
水素製造装置、水素輸送装置、水素貯蔵装置の各内部には多段式に反応プレートを複数重層させ、各反応プレートは水素吸蔵および放出が可能な遷移金属類を採用する場合は、各反応プレートには水素分子が通過できる程度の大きさ(4×6Å以上有れば十分)を有する細孔、空隙を設ける。
多段式水素吸蔵スティックによる水素を長時間放出させる特許には、特許文献7、特願2004-168549,特開2005-343771がある。
【発明の効果】
【0043】
本発明による水素の製法によると、生成反応に必要とする電力等のエネルギー源の確保は、風力、波力等の自然エネルギー源から賄い、かつ、各装置内では、発生した水素と別経路から入力された酸素とで燃料電池を構成させることにより電力源が確保され、水素燃料サイクルによる循環型システムが形成される。
更に、本発明によると水素および元素の周期律表でアルカリ金属、アルカリ土類金属に族する各金属の単体を得る出発物質となる基材を海水、塩湖、岩塩、温泉水、石灰岩等の自然、天然物に依存させていることと、電気分解に必要とする電力を極力自然エネルギー源から賄うために、小資源国であり、海洋に囲まれている日本としては、地球温暖化を低減させながら経済活動の営みを持続的に継続させて行くことを可能ならしめる。更に、天然物から得られた金属の塩化物は溶融塩電解により、水素と反応させ、水素化金属を獲得し、油中で保管・管理させ、水素の需要時には水素化金属に水と接触反応させて水素が容易に得られる。上記金属および水素化金属は別途市販のものを入手することにより水素を得ることも可能である。
【0044】
又、必要に応じて、各種水素化金属化合物を選択的に入手して、水素を得るための出発物質とすることができ、各種水素金属化合物と水との接触反応により、需要(On Demand)に応じた水素を製造させることが出来る。
更に、本発明による水素の製造は、来るべき水素社会の到来を睥睨して、水素製造装置と水素輸送装置及び水素貯蔵装置を同一の反応容器としての構造体を採用したために、設置場所、移送場所、貯蔵場所が適宜変更可能で、水素燃料による電力の供給、水素自動車等の内燃機関への水素燃料の補給・充填基地としての水素ステーションでの水素燃料の充填をパッケージで実施させることが可能で、水素燃料を必要とする場合、何時、何処でも、誰でもがとの情報交換可能なユビキタス社会に適合させるべく、水素も利用することを可能ならしめるようにしたものである。
【発明を実施するための最良の形態】
【0045】
以下、本発明の効果的な実施の形態を図1〜図7に基づいて詳細に説明する。
【0046】
図1は、各種金属元素と夫々の金属塩の融点を示す図である。1は金属元素の融点。2は金属塩化物(塩化金属)の融点。3は金属水酸化物(水酸化金属)の融点。4は金属酸化物(酸化金属)の融点。5は金属水素化物(水素化金属)の融点である。本発明で最も重要なことは、水素化金属5の融点以下で、水素化反応や溶融塩電気分解を行うことである。もし水素化金属5の融点以上の場合には、一旦金属元素を析出させた後に、水素化金属の融点以下の温度で水素ガスとの反応を行わねばならない。したがって、各金属塩の融点が低い化合物を探すことである。概して金属酸化物4は融点が高い。これに反し、水酸化物3は融点が低い。しかし、周期律第1族元素のLi,K,Naは融点が低いため金属水酸化物で溶融塩を作り、直接溶融塩電気分解ができる。しかし第2族のCa,Mg,Sr,Baなどは夫々の融点で水分子を放出して金属酸化物4に変化してしまうため、実質的には金属酸化物4を溶融して電気分解を行なうことになる。幸いなことに、金属塩化物2は比較的融点が低く、しかも導電率が高く、金属酸化物4の溶媒になり、複合塩を形成し、融点を下げる効果が期待される。とくに、本発明の出発原料が、海洋塩、塩湖塩、岩塩、結晶化塩、温泉水含有塩、鉱泉含有塩であり、これらの中の塩類は塩化物が大半を占めているため、これらの塩を電気分解する。炭酸カルシウムや酸化カルシウムの主成分は石灰石や鉄鋼スラグであるから、これら溶質としての酸化カルシウムと溶媒としての金属塩化物2の複合溶融塩を電気分解し、かつ水素と反応させて水素化金属を製造する。第3族のAlは塩化物2である塩化アルミニウムの融点が水素化金属5である水素化アルミニウムよりも融点が低いので水素化金属を作ることができる。
【0047】
図2は、各複合塩と融点の関係を示す図である。本発明で重要なことは水素化金属5よりも溶融塩の温度を低くすることである。したがって夫々の水素化金属(点線矢印で示す)の融点よりも溶融塩を低くする複数塩の処方が必要である。6は、金属アルミニウムの塩類の組み合わせ複合塩と水素化アルミニウムの融点6に示すように、金属アルミニウム塩類の組み合わせ塩では水素化アルミニウムの融点(150℃)よりも低い溶融塩を作ることができる。7は、金属マグネシウム塩類の組み合わせと水素化マグネシウムの融点7である。これらの組み合わせ塩の融点は全て287℃以上であるので、電気分解中での水素化反応は困難であり、この場合は電気分解で金属マグネシウムを析出させた後に、低い温度で水素化する方法を採用する。8は、金属ナトリウム塩類の組み合わせと水素化ナトリウム融点8を示す。これらの金属ナトリウム塩類の組み合わせ塩はすべて水素化ナトリウムの融点(800℃)よりも低いので水素化ナトリウムを生成するのは楽である。9は、金属カルシウム塩類の組み合わせと水素化カルシウム融点9を示す。これらの金属カルシウム塩類の組み合わせ塩は水素化カルシウムの融点(600℃)よりも低い処方があるので水素化カルシウムを生成するのは楽である。10は、金属リチウム塩類の組み合わせと水素化リチウム融点10を示す。これらの金属リチウム塩類の組み合わせ塩は水素化リチウムの融点(680℃)よりも全て低いので水素化リチウムを生成するのは楽である。11は、金属カリウム塩類の組み合わせと水素化カリウム融点11を示す。これらの金属カリウム塩類の組み合わせ塩は水素化カリウムの融点(417℃)よりも低い処方が多々あるので水素化カリウムを生成するのは楽である。12は、金属バリウム塩類の組み合わせと水素化バリウム融点12を示す。これらの金属バリウム塩類の組み合わせ塩は水素化バリウムの融点(1675℃)よりも全て低いので水素化リチウムを生成するのは楽である。この他にも、複合塩の処方の組み合わせ次第では、さらに融点を下げることが可能であると考える。
【0048】
図3は、溶融塩の種類と雰囲気温度に於ける電気伝導率の関係を示す図である。図2の6に示したように金属アルミニウムは溶融塩温度を最も低くする溶融塩であるが、この図から明らかなように、電気伝導率は10万分の1と他の塩化物に比べて極端に低い。しかし、電気伝導率の高いLiCl,CaCl2, BaCl2、NaCl, PbCl2等の溶媒を用いて混合塩を処方すればさらに伝導率を上げることができる。
【0049】
図4は、溶融塩の種類と雰囲気温度に於ける分解電圧の関係を示す図である。この図からわかるように溶融塩の温度が高くなると電気分解の分解電圧が低くなる。このため温度を高くした方が印加電圧は下がり、陰極からの金属の析出率を上げる。図2の6に示したように金属アルミニウムは溶融塩温度を最も低くする溶融塩であるが、この図から明らかなように、電気伝導率は10万分の1と他の塩化物に比べて極端に低い。しかし、電気伝導率の高いLiCl,CaCl2, BaCl2、NaCl, PbCl2等の溶媒を用いて混合塩を処方すればさらに伝導率を上げることができる。この図を見てわかるように、各種金属塩化物の分解電圧が異なることを利用すれば、当該複合塩の中に混合された夫々の塩の分解電圧に差があるから、たとえばBaCl2の中にNaClを入れて650℃で電気分解したとすると、BaCl2の電解電圧が3.71Vであり、NaClの電解電圧が3.36Vであるため電圧差が0.35Vあるため、3.71V以下の電圧で電気分解すれば、金属バリウム(Ba)は析出せず、金属ナトリウム(Na)のみが析出する。しかるに、電解電圧が高い塩化バリウム(BaCl2)や塩化カルシウム(CaCl2)を溶融塩溶媒に用い、これにこの図には記載していないが、酸化金属を溶質として混入させると、例えばCaCl2よりもCaOの方が電解電圧が低いので、さらに電圧差が広がり、金属カルシウム(Ca)を析出する。他の金属においても、一般に、酸化物の方が塩化物よりも電解電圧が低いので電圧差を利用して金属を析出させることができる。とくに複合塩では、夫々の金属の分解電圧が異なるから、電解電圧を低い側から高い側に段階的に昇げて行けば、その電圧(電位差)に応じて異なった金属を選択的に析出することができる。さらに電極近傍で水素と反応させれば、夫々の水素化金属が単体で、あるいは複合体で製造することができる。とくに、海洋塩や岩塩など異なる金属塩が混入している。石灰岩や鉄鋼スラグも純粋な物は無い。これらの自然から得られる資源や産業廃棄物をあまり純度を上げること無く、不純物と共に溶融塩電気分解することも可能であることが本発明の趣旨でもある。以上のように、効果的な溶融塩電気分解を行うためには、導電率を高くし、かつ融点を低くし、さらに、電解電圧に達すれば、電気分解が行われるから、目的とする溶質よりも分解電圧が高く、しかも融点が低くなるような塩類を組み合わせた溶媒を処方し、かつ電解電圧を低い側から順次昇らせて行くことにより、金属の分別回収が可能となる。この電解電圧の差を利用して複合塩から目的金属を選択的に析出させることが可能である。
【0050】
図5は、水酸化ナトリウム・水酸化カルシウムの溶融塩電気分解による水素吸蔵金属の製造と加水分解による水素燃料製造サイクルの概略図である。水素燃料製造サイクルを形成させる目的で、塩化ナトリウムや水酸化ナトリウム又は塩化カルシウムや酸化カルシウムを溶融塩電気分解して得られた金属と別系統から供給した水素13を反応させて、水素吸蔵金属14である水素化ナトリウム(NaH)や水素化カルシウム(CaH2)を製造し、これを14の消費地で加水分解15を行い、水素16を生成し水素燃焼発電や燃料電池用に供給する。ここで生成される副産物の水酸化ナトリウム(NaOH)は自然エネルギーや余剰電力で溶融塩電気分解17を行う。同様に水酸化カルシウム(Ca(OH)2)は熱分解18を経て変化した酸化カルシウム(CaO)は自然エネルギーや余剰電力で溶融塩電気分解17を行う。この再度の溶融塩電気分解により陽極から酸素19が放出され、これも燃料用に供される。このように各種金属の水酸化物を再度溶融塩電気分解して、水素化金属の生成を繰り返す水素燃料サイクルである。
【0051】
図6は、セラミック製水素電解質隔膜電極を用いた水素化金属製造装置略図である。
溶融塩電気分解を行うに際し、反応雰囲気温度を低温にし、水素化金属の収率を増加させるに際し、電解槽20 はヒーター21で加熱され、中央部にはパイプ状のセラミック製電解質隔膜電極22を備え、内壁は陽極(カーボン製)23 密着させ、陰極としてはセラミック製水素電解質隔膜電極24 を備え、両電極間に金属溶融塩(溶質+溶媒)25 を満たし、セラミック製水素電解質隔膜電極24 の外壁に陰極(白金製)26 を備え、電流を電極間に流し溶融塩電気分解を行う。例えば溶融塩が金属塩化物の場合はセラミック製電解質隔膜電極 22 の内側に塩素ガス27 が析出するからこれに水28 を流し、高温化で塩酸29 を製造する。ここで水を流さず塩素ガスのまま回収することもできる。一方陰極ではセラミック製水素電解質隔膜電極24 の陰極26 側から水素ガス13 を圧入し、セラミック製水素電解質隔膜電極24 を透過した水素と周囲の金属イオンと反応して、水素化金属30 を生成し、溶融塩よりも比重が軽くなり、かつ高融点に変身した水素化金属30 は水素化金属取り出し口31 から回収される。尚反応温度が低い場合には油32 を用いるが、高温時にはガスシールなどを考える。このように
セラミック製水素電解質隔膜電極の溶融塩と反対側に金属性陰極を密着させた電極構造および/又は溶融塩側に金属性陰極側から水素ガスを溶融塩中の金属イオンに供給して、各種金属イオンと容易に反応を促進させることができる。
【0052】
図7は、請求項4記載の水素の製造装置、水素の輸送/移送装置および水素の貯蔵装置の一例を概略図として図示したものであり、反応の制御機構、制御回路の構成および各装置類は現行の化学反応装置を改良することにより調達可能とするために簡易型構造体としたものである。反応装置36、輸送送装置36および貯蔵装置36夫々の用途として兼用可能とした装置で、予め、装置内には石油系鉱物油が充填されており、所望する量の水素を得る場合は、化学量論的に反応が完結するように水素化金属を秤量し、油中に懸濁させる。給水タンク33流量調節弁34を開閉させ、少しずつ装置内に水を滴下させる。水素化金属と水は常温、常圧で反応させ、水素ガスが発生し、装置内の上部に充満してくる。水素ガス圧が予め設定した規定値に達すると、圧力センサーおよび温度センサー38とが感知、連動して、入力信号39となり、制御盤40から制御出力信号41として、駆動機構のパスルモータ42に伝達され、流量調節弁34と連動し、装置内を常に爆発限界を超えないように流量調節弁の開度を制御して水素ボンベ35に水素ガスを充填させる。反応終了後は、金属の水酸化物が副生成物として得られるが、取出口37から採取する。
爆発限界に達しそうな緊急時の場合は、流量調節弁34を閉じて給水タンクから滴下する水を停止させると同時に、警報回路によりアラームを発する。
【実施例1】
【0053】
上部が細口の500mlの三角フラスコに予め、家庭用灯油20mlを入れ、市販の水素化ナトリウムNaHの粉末を200mgを秤量して、灯油中に懸濁、沈降させた。三角フラスコの口からスポイトで20ccの水道水を徐々に滴下させ、NaHと水を接触反応させて約0.12リットルの水素を常温で発生させた。水素ガスの泡により、灯油と水の層が白濁することにより水素ガスの生成を確認したと同時に、フェノールフタレンを滴下させ、フラスコ下部が赤色に変色したことにより、水素化ナトリウム(NaOH)が副生成物として生成されていることと、NaHからの水素の生成反応が終了し、灯油層から白濁が消え、透明になったことを確認した。
【実施例2】
【0054】
上部が細口の500mlの三角フラスコに予め、家庭用灯油20mlを入れ、市販の水素化カルシウムCaH2の粉末を200mgを秤量して、灯油中に懸濁、沈降させた。三角フラスコの口からスポイトで20ccの水道水を徐々に滴下させ、CaH2と水を接触反応させ、水素化カルシウムCaH2 約0.42リットルの水素を常温で発生させた。水素ガスの泡により、灯油と水の層が白濁することにより水素ガスの生成を確認したと同時に、フラスコの底部に水酸化カルシウムCaOH2の白色沈殿物が生成されていることを確認したと同時に、CaH2からの水素の生成反応が終了し、灯油層から白濁が消え、透明になったことも確認した。
【実施例3】
【0055】
モンゴル産塩 (NaCl,CaCl2,MgCl2の複合塩) 10gをアルミナ製磁性ルツボ内に秤量し、塩の中に熱電対及び対のカーボン電極を付設させ、電気炉の温度を室温から徐々に上げ、900℃まで加熱を続けた。700℃までは伝導率κ=0.0001 (S/cm) であったが、800℃ぐらいから急に伝導率が高くなり始め、850℃でκ=3.4 (S/cm)、950℃でκ=4.0 (S/cm)であった。電気炉として、1300Furnace,Barnstead International Model No.FB1314M,100V,10.6A,1060W,50/60HZ Phase1.Serial No.1256040370950.を用いた。又、マントルヒーターとして、150W,100V,Type 5-01,Max;450℃のものを用いた。
【産業上の利用可能性】
【0056】
従来、エネルギー源として頼っていた石炭、石油、天然ガス等の化石燃料の主成分は炭化水素系であるために、燃焼により副生成物として、炭酸ガスCO2を生成させる。更に、石油に至っては国内資源で需要量を調達させるには殆ど不可能と言っても差し支えない。又、中東等の石油産油国に依存して行くには、政情不安定その他の要因により安定的に確保できる保証はないし、石油の埋蔵量に限度があるならば、今後の長期間に亘る資源確保も保証の限りではない。
一方、原子力エネルギーに頼る傾向もあるが、放射能漏れなどの万一の事故に対する不安が付き纏う。
従って、本発明の第一の特徴は、国内外に普遍的に存在している海水、塩湖水、塩田、温泉水、石灰岩等の天然、自然物を原資と看做し、それらから地球環境を損なうことの無い、特に、地球温暖化に比較的影響の少ないクリーンエネルギーとしての水素を得ることを第一義的な目的としたものである。
水素燃料は、内燃機関等の輸送手段の動力源になり得るし、発電、家庭用燃料等基本的エネルギーとして利用が可能である。米国でも大統領が2022年を目途に水素ベースの輸送手段の開発を呼びかけている。非特許文献16
【0057】
本発明の第二の特徴は、産業の発展に欠かせない金属類で、特に、昨今の半導体産業に欠かせないレアーメタルを得る手段として、海水若しくは海底から自然エネルギーを極力利用して金属類を析出、分離して目的とする各種金属類を得ることを目的としている。取り分け、海水に比較的多く含まれる塩化ナトリウムNaCl(塩)や他の金属の塩化物から、水素化ナトリウムや水素化金属物を生成させ、(On Demand)に応じて、任意の場所で水と水素化金属を接触反応させ、比較的簡単に必要量の水素燃料を獲得することを目的とする。
更に、素化金属に水と接触反応させて水素を発生させた後の副生成物としての各金属の水酸化物は、例えば、水酸化ナトリウムNaOHは、カセイソーダとして無機化学工業の出発物質として利用可能であり、水素燃料サイクルを循環させて、資源の無駄の無い有効活用法を提供することにある。
【図面の簡単な説明】
【0058】
【図1】各種金属元素と夫々の金属塩の融点を示す図である。
【図2】各複合塩と融点の関係を示す図である。
【図3】溶融塩の種類と雰囲気温度に於ける電気伝導率の関係を示す図である。
【図4】溶融塩の種類と雰囲気温度に於ける分解電圧の関係を示す図である。
【図5】水酸化ナトリウム・水酸化カルシウムの溶融塩電気分解による水素吸蔵金属の製造と加水分解による水素燃料製造サイクルの概略図である。
【図6】セラミック製水素電解質隔膜電極を用いた水素化金属製造装置略図である。
【図7】水素の製造装置、水素の輸送装置および水素の貯蔵装置の概略図である。
【0059】
1 金属元素の融点
2 金属塩化物(塩化金属)の融点
3 金属水酸化物(水酸化金属)の融点
4 金属酸化物(酸化金属)の融点
5 金属水素化物(水素化金属)の融点
6 金属アルミニウムの塩類の組み合わせ複合塩と水素化アルミニウムの融点
7 金属マグネシウム塩類の組み合わせと水素化マグネシウムの融点
8 金属ナトリウム塩類の組み合わせと水素化ナトリウム融点
9 金属カルシウム塩類の組み合わせと水素化カルシウム融点
10 金属リチウム塩類の組み合わせと水素化リチウム融点
11 金属カリウム塩類の組み合わせと水素化カリウム融点
12 金属バリウム塩類の組み合わせと水素化バリウム融点
13 水素(供給される水素)
14 水素吸蔵金属
15 消費地で加水分解
16 水素(製造する水素)
17 自然エネルギーや余剰電力で溶融塩電気分解
18 熱分解
19 酸素(製造する酸素)
20 電解槽
21 ヒーター
22 セラミック製電解質隔膜電極
23 陽極(カーボン製)
24 セラミック製水素電解質隔膜電極
25 金属溶融塩(溶質+溶媒)
26 陰極(白金製)
27 塩素ガス
28 水
29 塩酸(製造)
30 水素化金属
31 水素化金属取り出し口
32 油
33 給水タンク
34 流量調節弁
35 水素ボンベ
36 反応装置・送装置・蔵装置
37 取出口
38 圧力センサーおよび温度センサー
39 入力信号
40 制御盤
41 制御出力信号
42 パスルモータ
【特許請求の範囲】
【請求項1】
水素化金属から水素を得るに際し、海洋塩、塩湖塩、岩塩、結晶化塩、温泉水含有塩、鉱泉含有塩、石灰石又はボーキサイト等の天然資源又は産業廃棄物等から再生された金属元素の塩化塩、水酸化塩、酸化塩又は炭酸塩や硫酸塩の夫々の単独塩又は複合塩を溶融塩電気分解法により電解電圧の低い順に電極陰極部に単体金属として、順次析出させ、当該水素化金属の融点以下の温度範囲で水素ガスと反応させ、該電極陰極部に水素化金属を生成させ、若しくは別途調達した当該水素化金属を石油系鉱物油中に浸漬・保管させ、水素の需要時に需要量に応じて供給可能ならしめるに当該水素化金属と水とを反応させ水素を製造することを特徴とする水素化金属から水素を製造する方法。
【請求項2】
溶融塩電気分解を行うに際し、反応雰囲気温度を低温にし、水素化金属の収率を増加させるに際し、電解槽中に介在している溶融塩に接触し、配置されているセラミック製水素電解質隔膜電極の溶融塩と反対側に金属性陰極を密着させた電極構造および/又は溶融塩側に金属性陰極を密着させた電極構造を有し、溶融塩と反対側の該セラミックス製水素電解質角膜側から水素ガスを溶融塩中の金属イオンに供給して、各種金属イオンと容易に反応を促進させることを特徴とする電解電極による請求項1記載の水素化金属の製造方法。
【請求項3】
水素燃料製造サイクルを形成させる目的で、前記請求項1及び請求項2により得られた副産物としての各種金属の水酸化物を再度溶融塩電気分解して、水素化金属の生成を繰り返すことを特徴とする請求項1及び請求項2記載の水素化金属から水素を製造する方法。
【請求項4】
装置内に水素化金属の粉末を石油系鉱物油中に浸漬させ、水素需要時には、当該装置と接続、具備させた水注入口より水を滴下させ、前記水素化金属と水とを接触反応させることにより水素を生成させ、得られた水素を回収可能とする機能を有する装置であることを特徴とする請求項1および請求項3に記載の水素の製造、輸送および貯蔵装置。
【請求項1】
水素化金属から水素を得るに際し、海洋塩、塩湖塩、岩塩、結晶化塩、温泉水含有塩、鉱泉含有塩、石灰石又はボーキサイト等の天然資源又は産業廃棄物等から再生された金属元素の塩化塩、水酸化塩、酸化塩又は炭酸塩や硫酸塩の夫々の単独塩又は複合塩を溶融塩電気分解法により電解電圧の低い順に電極陰極部に単体金属として、順次析出させ、当該水素化金属の融点以下の温度範囲で水素ガスと反応させ、該電極陰極部に水素化金属を生成させ、若しくは別途調達した当該水素化金属を石油系鉱物油中に浸漬・保管させ、水素の需要時に需要量に応じて供給可能ならしめるに当該水素化金属と水とを反応させ水素を製造することを特徴とする水素化金属から水素を製造する方法。
【請求項2】
溶融塩電気分解を行うに際し、反応雰囲気温度を低温にし、水素化金属の収率を増加させるに際し、電解槽中に介在している溶融塩に接触し、配置されているセラミック製水素電解質隔膜電極の溶融塩と反対側に金属性陰極を密着させた電極構造および/又は溶融塩側に金属性陰極を密着させた電極構造を有し、溶融塩と反対側の該セラミックス製水素電解質角膜側から水素ガスを溶融塩中の金属イオンに供給して、各種金属イオンと容易に反応を促進させることを特徴とする電解電極による請求項1記載の水素化金属の製造方法。
【請求項3】
水素燃料製造サイクルを形成させる目的で、前記請求項1及び請求項2により得られた副産物としての各種金属の水酸化物を再度溶融塩電気分解して、水素化金属の生成を繰り返すことを特徴とする請求項1及び請求項2記載の水素化金属から水素を製造する方法。
【請求項4】
装置内に水素化金属の粉末を石油系鉱物油中に浸漬させ、水素需要時には、当該装置と接続、具備させた水注入口より水を滴下させ、前記水素化金属と水とを接触反応させることにより水素を生成させ、得られた水素を回収可能とする機能を有する装置であることを特徴とする請求項1および請求項3に記載の水素の製造、輸送および貯蔵装置。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【公開番号】特開2011−184260(P2011−184260A)
【公開日】平成23年9月22日(2011.9.22)
【国際特許分類】
【出願番号】特願2010−52874(P2010−52874)
【出願日】平成22年3月10日(2010.3.10)
【出願人】(308026724)株式会社エム光・エネルギー開発研究所 (10)
【Fターム(参考)】
【公開日】平成23年9月22日(2011.9.22)
【国際特許分類】
【出願日】平成22年3月10日(2010.3.10)
【出願人】(308026724)株式会社エム光・エネルギー開発研究所 (10)
【Fターム(参考)】
[ Back to top ]

