水素発生剤、その製造方法及び水素発生方法
【課題】安価なカルシウムを使用でき、樹脂母材による反応制御が反応後期まで継続し、しかも十分高い反応率が得られる水素発生剤、その製造方法、及び水素発生方法を提供する。
【解決手段】熱硬化性樹脂の母材中にカルシウムを含有する水素発生剤、並びに、未硬化の熱硬化性樹脂とカルシウムとを含有する混合物を硬化させる工程を含む水素発生剤の製造方法。
【解決手段】熱硬化性樹脂の母材中にカルシウムを含有する水素発生剤、並びに、未硬化の熱硬化性樹脂とカルシウムとを含有する混合物を硬化させる工程を含む水素発生剤の製造方法。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、水分等の反応液と反応して水素ガスを発生させる金属を含有する水素発生剤、その製造方法、及び水素発生方法に関し、特に燃料電池に水素を供給するための技術として有用である。
【背景技術】
【0002】
従来、水を供給して水素ガスを発生させる水素発生剤としては、鉄、アルミニウム等の金属を主成分とするものや、水素化マグネシウムや水素化カルシウム等の水素化金属化合物を主成分とするものが知られている(例えば、特許文献1参照)。なかでも、水素化カルシウムのような高反応性の主成分とする水素発生剤を用いる場合、水分との反応速度が急峻であるため、水分を液体(水)で供給すると水素ガスが初期に爆発的に発生するという問題があった。
【0003】
そこで、特許文献2には、水素化金属と水分との反応速度を適度にコントロールする目的で、水素化金属が水溶性樹脂等の固体状水溶性化合物に包埋されてなる水素発生剤が開示されている。しかし、この水素発生剤では、反応性のより高い水素発生物質(例えばカルシウム)を用いる場合には、水との接触により母材が溶解する結果、十分な反応制御が行えず、水素が爆発的に発生するという問題があった。また、カルシウム等の金属と比較して、より高価な水素化金属等を用いる必要があるという問題があった。
【0004】
そこで、特許文献3には、反応熱による温度変化による影響を小さくする目的で、低温で親水性を呈し高温で疎水性を呈するアクリル系樹脂(熱可塑性樹脂)と、アルミニウム又はカルシウム等とを含有する水素発生剤が提案されている。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特開2003−314792号公報
【特許文献2】国際公開WO2007/055146号公報
【特許文献3】特開2009−1432号公報
【発明の概要】
【発明が解決しようとする課題】
【0006】
しかしながら、特許文献3の水素発生剤では、初期に熱可塑性樹脂が溶解してしまうため、その後に熱可塑性樹脂が凝集効果を発現しても、反応性の高い水素発生物質を用いる場合には、十分な反応制御が行えないという問題があった。このため、特許文献3の実施例においては、アルミニウムのような低い反応性の水素発生物質のみが使用されており、カルシウムの例は存在しない。
【0007】
そこで、本発明の目的は、安価なカルシウムを使用でき、樹脂母材による反応制御が反応後期まで継続し、しかも十分高い反応率が得られる水素発生剤、その製造方法、及び水素発生方法を提供することにある。
【課題を解決するための手段】
【0008】
本発明者らは、上記目的を達成すべく鋭意研究したところ、カルシウムと熱硬化性樹脂との組合せによって、樹脂母材による反応制御が反応後期まで継続し、しかも十分高い反応率が得られることを見出し、本発明を完成するに至った。
【0009】
即ち、本発明の水素発生剤は、熱硬化性樹脂の母材中にカルシウムを含有することを特徴とする。本発明の水素発生剤によると、熱硬化性樹脂の母材中にカルシウムを含有するため、樹脂母材による反応制御が反応後期まで継続し、しかも十分高い反応率が得られるようになる。
【0010】
高い反応率が得られる理由の詳細は明らかではないが、反応前後のカルシウムの形状の観察結果に基づき、次のように予測される。カルシウムの場合には樹脂との濡れ性が低いため、これが成形体の表面に露出し易くなり(例えば図1参照)、初期の反応が生じ易くなる。また、熱硬化性樹脂を用いる場合、発熱反応で昇温しても樹脂の形状が保持されるため、反応中にカルシウムに応力が生じて、カルシウムが割れやすくなり(例えば図5参照)、カルシウム全体が反応し易くなる。これに対して、熱可塑性樹脂の場合、発熱反応で樹脂が変形し易く反応中にカルシウムの割れが生じにくく、内部まで反応が進行しにくい(例えば図6参照)。その結果、本発明では、安価なカルシウムを使用でき、樹脂母材による反応制御が反応後期まで継続し、しかも十分高い反応率が得られる水素発生剤となる。
【0011】
上記において、前記カルシウムの平均粒子径が10〜500μmであることが好ましい。市販のカルシウムは、粒子径が数ミリと大きくなるが、粉砕等を行って、上記の範囲の平均粒子径のカルシウムを使用することによって、反応が理論反応量に近い状態まで継続して、より高い反応率が得られる。
【0012】
本発明の水素発生剤は、更に、水素化金属を含有することが好ましい。カルシウムは初期の反応が生じ易く、反応熱が大きいため、水素化金属による反応を促進して、低温における反応速度を高めることができる。また、水素化金属を併用することで、水素化金属からの重量(モル量)あたりの水素発生量が大きくなり、全体として重量(モル量)あたりの水素発生量を高めることができる。
【0013】
一方、本発明の水素発生剤の製造方法は、未硬化の熱硬化性樹脂とカルシウムとを含有する混合物を硬化させる工程を含むことを特徴とする。本発明の水素発生剤の製造方法によると、安価なカルシウムを使用でき、樹脂母材による反応制御が反応後期まで継続し、しかも十分高い反応率が得られる水素発生剤を、簡易な方法により製造することができる。
【0014】
その際、前記混合物を硬化させる工程が、加圧下で行われることが好ましい。大気圧下で行う場合、空孔が生じて体積効率が低下する傾向があるが、加圧下で行うことによって、空孔の発生を低減して体積効率を向上させることができる。また、加圧より空孔率を制御することができ、これによって反応速度を制御して水素発生速度を制御することができる。
【0015】
他方、本発明の水素発生方法は、上記いずれかに記載の水素発生剤と反応液とを接触させて水素を発生させることを特徴とする。本発明の水素発生方法によると、安価な水素発生剤を用いて、反応液と接触させるだけで適度な水素発生が可能であり、しかも樹脂母材による反応制御が反応後期まで継続しながらも、十分高い反応率が得られる。
【図面の簡単な説明】
【0016】
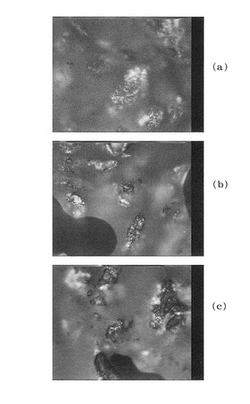
【図1】試験例2で得られたカルシウムを含有する成形体の表面を光学顕微鏡(500倍)で観察した写真であり、(a)は0MPaでの成形体、(b)は10MPaでの成形体、(c)は20MPaでの成形体
【図2】試験例2で得られた水素化カルシウムを含有する成形体の表面を光学顕微鏡(500倍)で観察した写真であり、(a)は0MPaでの成形体、(b)は10MPaでの成形体、(c)は20MPaでの成形体
【図3】実施例1における成形体の反応前の断面を示す走査型電子顕微鏡(SEM)写真であり、(a)〜(c)は倍率を変えたものである
【図4】実施例1および比較例1における水素発生速度(a)と水素発生総量(b)とを示すグラフ
【図5】実施例1における成形体の反応後の断面を示す走査型電子顕微鏡(SEM)写真であり、(a)〜(c)は倍率を変えたものである
【図6】比較例1における成形体の反応後の断面を示す走査型電子顕微鏡(SEM)写真であり、(a)〜(c)は倍率を変えたものである
【図7】実施例2における成形体の反応前の断面を示す走査型電子顕微鏡(SEM)写真であり、(a)〜(c)は倍率を変えたものである
【図8】実施例2における水素発生速度を示すグラフ
【図9】実施例3〜4における水素発生速度を示すグラフ
【図10】実施例5〜6における水素発生速度を示すグラフ
【図11】実施例7における水素発生速度(a)と水素発生総量(b)とを示すグラフ
【図12】実施例8における水素発生速度(a)と水素発生総量(b)とを示すグラフ
【図13】実施例9〜10における水素発生速度(a)と水素発生総量(b)とを示すグラフ
【発明を実施するための形態】
【0017】
本発明の水素発生剤は、熱硬化性樹脂の母材中にカルシウムを含有するものである。つまり、カルシウムが熱硬化性樹脂のマトリックス中に分散又は埋設された状態となる。これにより、カルシウムの反応性が抑制され、水との反応の際の取り扱い性が改善される。
【0018】
本発明では、表面付近に存在するカルシウムの一部が、熱硬化性樹脂の表面から露出していることが好ましい。例えば水素化カルシウムを熱硬化性樹脂に分散させる場合、両者の親和性が一般に良好なため、水素化カルシウムは、熱硬化性樹脂の表面から露出しない(殆ど露出しない)構造となる。このため、初期の反応速度を高めるために、表面を研磨することが望ましかった。これに対して、カルシウムを熱硬化性樹脂に分散させる場合、両者の親和性が一般に悪いため、表面付近に存在するカルシウムの一部が熱硬化性樹脂の表面から露出した構造となることが判明した。このため、初期の反応速度が高くなり、表面を研磨する必要がなくなり、製造工程が簡易になり工業的に望ましい水素発生剤となる。
【0019】
カルシウムの含有量は、反応制御による効果や、保形性(強度)および製造性を維持しつつ、反応速度を一定以上にする観点から、水素発生剤中、5〜80重量%が好ましく、10〜75重量%であることが好ましく、20〜70重量%がより好ましい。水素発生速度は、カルシウムの含有量と大きく関係しており、5〜30重量%の場合には、水素発生速度が低く(微量)なり、100時間以上水素発生を継続させることができる。また、60〜80重量%の場合には、水素発生速度が高く(多量)なり、1時間以内で水素発生を完結させることができる。カルシウムの含有量が30重量%を超え60重量%未満の場合には、上記の中間の水素発生速度と水素発生時間が実現できる。
【0020】
カルシウムは粒状であることが好ましく、粉砕品であることがより好ましい。粒状のカルシウムの平均粒子径は、樹脂中への分散性、反応速度、反応率などの観点から、10〜500μmが好ましく、20〜300μmがより好ましく、30〜150μmが更に好ましい。
【0021】
本発明の水素発生剤には、他の水素発生物質を含有させることも可能である。他の水素発生物質としては、水素化カルシウム、水素化リチウム、水素化カリウム、水素化リチウムアルミニウム、水素化アルミニウムナトリウム、又は水素化マグネシウムなどの水素化金属、アルミニウム、鉄、マグネシウム等の金属、水素化ホウ素化合物等の金属水素錯化合物などを含有してもよい。水素化金属化合物、金属、金属水素錯化合物は、何れかを複数組み合わせて使用することもでき、また、それぞれを組み合わせて使用することも可能である。
【0022】
本発明では、特に水素化カルシウム(CaH2)を併用することが好ましい。水素化カルシウムを併用する場合、その含有量は、カルシウムを含む水素発生物質中に、10〜90重量%であることが好ましく、20〜80重量%がより好ましい。特に、初期の反応性を高めつつ、水素発生密度を向上させる観点から、カルシウム/水素化カルシウムの比は、5/5〜0.05/0.95が好ましく、3/7〜1/9がより好ましい。
【0023】
粒状の水素化カルシウムの平均粒子径は、樹脂中への分散性や反応を適度に制御する観点から、1〜100μmが好ましく、6〜30μmがより好ましく、8〜10μmが更に好ましい。
【0024】
水素化カルシウム以外の水素発生物質の平均粒径も水素化カルシウムと同様であることが好ましい。水素化カルシウム以外の他の水素発生物質の含有量は、水素発生剤中、0〜20重量%が好ましく、0〜10重量%がより好ましく、0〜5重量%が更に好ましい。
【0025】
熱硬化性樹脂としては、エポキシ樹脂、不飽和ポリエステル樹脂、フェノール樹脂、アミノ樹脂、ポリウレタン樹脂、シリコーン樹脂、または熱硬化性ポリイミド樹脂等が挙げられる。なかでも、樹脂母材中で水等が拡散し易く、製造が容易になるなど観点から、エポキシ樹脂が好ましい。熱硬化性樹脂を硬化させる際には、必要に応じて硬化剤や硬化促進剤などが適宜併用される。
【0026】
熱硬化性樹脂の吸水性が大きいほど、樹脂母材中で水等が拡散し易くなり、水素発生速度が大きくなる。このため、下記の測定方法で求められる吸水率が0.1%以上であることが好ましく、0.2%以上がより好ましく、0.4%以上が更に好ましい。ここで、吸水率は、直径7mmの円柱状の成形体(1g)を室温で62時間水に浸漬して、その前後における重量変化を浸漬前の成形体の重量で除して百分率を求めたものである。
【0027】
熱硬化性樹脂の含有量は、反応制御による効果や、保形性(強度)および製造性を維持しつつ、反応速度を一定以上にする観点から、水素発生剤中、20〜95重量%が好ましく、25〜90重量%が好ましく、30〜80重量%がより好ましい。
【0028】
本発明の水素発生剤には、上記の成分以外の任意成分として、触媒、充填材、などのその他の成分を含有してもよい。触媒としては、水素発生剤用の金属触媒の他、水酸化ナトリウム、水酸化カリウム、水酸化カルシウムなどのアルカリ化合物も有効である。
【0029】
本発明の水素発生剤は、多孔質化された構造でもよく、実質的に中実の構造でもよいが、空孔率(空孔率(%)=空孔体積/全体積×100)が高いほど、水素発生速度が大きくなる。つまり、本発明の水素発生剤は、水素発生速度を高める観点から、空孔率(%)が1%以上が好ましく、2%以上がより好ましく、5%以上が更に好ましい。逆に、体積効率を高めながら、長時間安定した水素発生速度を維持する観点から、空孔率が小さいほど好ましい。通常このような空孔が少ない構造では、反応が内部に進行し難いが、本発明では、カルシウムを使用することで、このような低い空孔率でも反応を進行させることができ、体積効率を高めることができる。
【0030】
なお、カルシウムは、樹脂との混合又は反応の際に、水素を発生して空孔が生じる場合があるが、加圧下で反応硬化を行うことで、空孔率を制御したり、実質的に中実の構造を得ることができる。
【0031】
本発明の水素発生剤は、シート状、粒状(粉砕物)、塊状(成形体)など何れの形状でもよいが、反応速度を制御する観点から、シート状、板状、柱状などが好ましい。粉砕を行う場合、その粒径は、1〜10mmが好ましく、2〜5mmがより好ましい。
【0032】
本発明の水素発生剤は、本発明の製造方法、即ち、未硬化の熱硬化性樹脂とカルシウムとを含有する混合物を硬化させる工程を含む製法により製造されることが好ましい。混合物には、前述した他の成分や硬化剤などの成分を含有させることができる。
【0033】
本発明では、反応性を調整する上で、混合物を硬化させる工程が、加圧下で行われることが好ましい。加圧を行う場合の加圧条件としては、製造装置や製造コストを考慮しつつ、水素発生剤の空孔率を下げる観点から、1〜100MPaが好ましく、2〜50MPaがより好ましく、5〜30MPaが更に好ましい。加圧にはプレス成形用の金型等を使用することができる。
【0034】
本発明の水素発生方法は、以上のような水素発生剤と反応液とを接触させて水素を発生させるものである。反応液としては、水、酸水溶液、アルカリ水溶液などが挙げられる。供給する反応液の温度は、室温でもよいが、30〜80℃に加熱することも可能である。
【0035】
本発明では、水素発生剤と一部が接触した吸水体を介して、反応液が水素発生剤に供給される方法が、反応の制御を行う上で好ましい。吸水体としては、濾紙、吸水性シート、フェルト、脱脂綿、吸水性樹脂などが挙げられる。
【0036】
反応液の供給は、発生させる水素ガスの量に応じて供給量を調整することも可能であるが、本発明では過剰供給を行っても、反応速度が制御されているため、適度な発生速度で水素発生が可能である。
【0037】
従って、本発明の水素発生方法では、過剰な反応液中に水素発生剤を浸漬する方法により、適度な発生速度で水素発生が可能である。また、反応液中への浸漬量を変えることで、水素発生速度を調整することも可能である。その他、水素発生剤の表面の一部を、反応液の非透過性材料で覆うことにより、水素発生速度を調整することも可能である。
【0038】
本発明の水素発生剤は、水素発生装置の装置構造を簡易化できるため、特に形態機器用の燃料電池の水素供給装置に使用する場合に有効である。
【実施例】
【0039】
以下、本発明の構成と効果を具体的に示す実施例等について説明する。なお、実施例等における評価項目は下記のようにして測定を行った。
【0040】
(1)平均粒径
走査型電子顕微鏡(SEM)を用いて撮影した写真から、平均的な粒子径を有するものを選び出し、その長径と短径とを平均して求めた。
【0041】
(2)空孔率
実際に測定したサンプルの体積と、実際に測定したサンプルの質量を材料自身の密度で除して算出した体積との差として空孔体積を算出し、次式により空孔率(%)を求めた。空孔率(%)=空孔体積/全体積×100
試験例1(吸水率の測定)
実施例1のエポキシ樹脂及び比較例1の熱可塑性樹脂を用いて、直径7mmの円柱状の成形体(1g)を作製した。これを室温で62時間水に浸漬して、その前後における重量変化を浸漬前の成形体の重量で除して百分率を求めることで、吸水率を算出した。その結果、実施例1のエポキシ樹脂が、0.43%であり、比較例1の熱可塑性樹脂が0.00%(測定限界以下)であった。
【0042】
試験例2(表面状態の観察)
未硬化のエポキシ樹脂(ジャパンエポキシレジン(株)製、jER802)1.127gにCa(米山薬品工業社製、粉砕品、平均粒径70μm)1.2gを添加して撹拌後、更にジシアンジアミド系硬化剤(ジャパンエポキシレジン(株)製、DICY7)0.069g、変性脂肪族(3級アミン)硬化促進剤(ジャパンエポキシレジン(株)製、3010、トリスジメチルアミノメチルフェノール)0.0123gを添加して撹拌した。フラットな金属板の表面に金属枠材を置き、前記の混合物を金属枠材の内側(9.6mm×34mm)に塗布して、金属枠材の上面からフラットな金属板でプレス圧をかけ(図1の(a)では0MPa、(b)では10MPa、(c)では20MPa)、乾燥機(125℃設定)にて約60分間加熱硬化させた。得られた硬化物は、厚みが1.8mm、Caの含有量が50重量%であった。この成形体(反応前)の表面を光学顕微鏡(500倍)で観察すると、図1(a)〜(c)に示すように、Caの粒子の一部が樹脂表面から露出していた。
【0043】
一方、Caに変えて、CaH2(和光純薬社製、平均粒径10μm)を用いたこと以外は、上記と同様にして、CaH2の含有量が50重量%の成形体を作製した。この成形体(反応前)の表面を光学顕微鏡(500倍)で観察すると、図2(a)〜(c)に示すように、CaH2の粒子は樹脂表面から露出していなかった。
【0044】
実施例1
未硬化のエポキシ樹脂(ジャパンエポキシレジン(株)製、jER802)1.127gにCa(米山薬品工業社製、粉砕品、平均粒径70μm)0.3gを添加して撹拌後、更にジシアンジアミド系硬化剤(ジャパンエポキシレジン(株)製、DICY7)0.069g、変性脂肪族(3級アミン)硬化促進剤(ジャパンエポキシレジン(株)製、3010、トリスジメチルアミノメチルフェノール)0.0123gを添加して撹拌した。フラットな金属板の表面に金属枠材を置き、前記の混合物を金属枠材の内側(9.6mm×34mm)に塗布して、金属枠材の上面からフラットな金属板でプレス圧(20MPa)をかけ、乾燥機(125℃設定)にて約60分間加熱硬化させた。得られた硬化物は、厚みが1.8mm、Caの含有量が20重量%であり、空孔率0%であった。この成形体(反応前)は、図3に示すように、走査型電子顕微鏡(SEM)で観察すると、殆ど空孔が観察できない実質的に中実の成形体であり、Caの粒子には割れが生じていなかった。
【0045】
この成形体を水中に浸漬し、水上置換法により水素ガスの発生量を計測した。その結果を図4(a)〜(b)に示す。水素発生挙動としては、水中への浸漬直後から水素発生が始まり、約0.015cc/分の水素発生流速が約150時間継続し、最終的に理論水素発生量の90%の水素が発生した。反応後の成形体は、図5に示すように、走査型電子顕微鏡(SEM)で観察すると、中実の成形体が維持された状態であったが、Caの粒子には多数の大きな割れが生じていた。
【0046】
比較例1(熱可塑性樹脂の場合)
熱可塑性樹脂(パオックコーポレーション社製、ホットメルト接着用、20H−NA、エチレン酢酸ビニル共重合体60重量%+石油樹脂40重量%)1.2gを加熱溶融したものにCa(米山薬品工業社製、粉砕品、平均粒径70μm)0.3gを添加して140℃に加熱しながら混合した。フラットな金属板の表面に金属枠材を置き、前記の混合物を金属枠材の内側(20mm×20mm)に塗布して、金属枠材の上面からフラットな金属板でプレス圧(20MPa)をかけ、冷却固化させた。得られた硬化物は、厚みが0.5mm、Caの含有量が20重量%であり、空孔率0%であった。この成形体(反応前)は、走査型電子顕微鏡(SEM)で観察すると、殆ど空孔が観察できない実質的に中実の成形体であり、Caの粒子には割れが生じていなかった。
【0047】
この成形体を水中に浸漬し、水上置換法により水素ガスの発生量を計測した。その結果を図4(a)〜(b)に示す。水素発生挙動としては、水中への浸漬直後から水素発生が始まったが、約0.005cc/分の水素発生流速が約150時間継続し、最終的に理論水素発生量の25%の水素がのみ発生した。反応後の成形体は、図6に示すように、走査型電子顕微鏡(SEM)で観察すると、中実の成形体が維持された状態であったが、Caの粒子には小さな割れのみが生じていた。
【0048】
実施例2(含有量を変えた試験)
実施例1において、Caの含有量を70重量%に変えたことと、濾紙を全面に当てて、容器に入れた水2.5ccを供給(消費量は約0.5cc)したこと以外は、実施例1と同様にして、混合物を硬化させた成形体を作製し、水素発生反応を行った。この成形体(反応前)は、図7に示すように、走査型電子顕微鏡(SEM)で観察すると、殆ど空孔が観察できない実質的に中実の成形体であり、Caの粒子には割れが生じていなかった。
【0049】
また、水素ガスの発生量を計測した結果を図8に示す。水素発生挙動としては、水中への浸漬直後から水素発生が始まり、約10cc/分の水素発生流速が約35分間継続し、最終的に理論水素発生量の100%の水素が発生した。反応後の成形体は、走査型電子顕微鏡(SEM)で観察すると、Caの粒子には多数の大きな割れが生じていた。
【0050】
実施例3〜4(プレス圧を変えた試験)
実施例1において、Caの含有量を75重量%に変えたことと、プレス圧を変えて(2MPa及び20MPa)10mm×43mm×4.3mmの成形体を作製したこと以外は、実施例1と同様にして、混合物を硬化させた成形体を作製し、水素発生反応を行った。プレス圧2MPaで得られた成形体(実施例3)の空孔率は15%であり、20MPaで得られた成形体(実施例4)の空孔率は0%であった。
【0051】
また、水素ガスの発生量を計測した結果を図9に示す。水素発生挙動としては、プレス圧が小さく空孔率が高い実施例3の方が、水素発生流量が大きく、120分経過時の反応率も高かった。
【0052】
実施例5〜6(Ca+CaH2の混合系による試験)
実施例1において、Ca単独使用に変えて、Ca0.17gとCaH2(和光純薬社製、平均粒径10μm)1.55gを用いて総含有量を75重量%に変えたことと、プレス圧を変えて(2MPa及び20MPa)10mm×43mm×4.3mmの成形体を作製したこと以外は、実施例1と同様にして、混合物を硬化させた成形体を作製し、水素発生反応を行った。プレス圧2MPaで得られた成形体(実施例5)の空孔率は0%であり、20MPaで得られた成形体(実施例6)の空孔率は0%であった。
【0053】
また、水素ガスの発生量を計測した結果を図10に示す。水素発生挙動としては、プレス圧が小さく空孔率が高い実施例5の方が、水素発生流量が大きく、120分経過時の反応率も高かった。また、実施例3〜4と比較すると、CaH2を混合することによって、水素発生流量が大きくなり、120分経過時の反応率も高くなった。
【0054】
実施例7(低温での水素発生試験)
実施例5で得られた成形体を用いて、低温(10℃)で水素発生反応を行った。その際の水素発生挙動を室温で行った結果と併せて図11に示す。その結果、CaH2を単独で樹脂に混合した場合、低温(10℃)で水素発生反応が殆ど生じないのに対して、Ca+CaH2の混合系では、低温(10℃)でも水素発生反応が好適に生じることが分かった。
【0055】
実施例8(含有量を変えた試験)
実施例1において、Caの含有量を50重量%に変えたことと、濾紙を全面に当てて、容器に入れた水2.5ccを供給(消費量は約0.5cc)したこと以外は、実施例1と同様にして、混合物を硬化させた成形体を作製し、水素発生反応を行った。なお、成形体のプレス圧力を、0MPa、10MPa、および20MPaに変化させた結果、空孔率がそれぞれ4%、0%、0%となった。水素ガスの発生量を計測した結果を図12に示す。水素発生挙動としては、プレス圧が小さく空孔率が高いものほど、水素発生流量が大きく、90分経過時の反応率も高かった。
【0056】
比較例2(熱可塑性樹脂の場合)
比較例1において、Caの含有量を50重量%に変えたこと以外は、比較例1と同様にして、成形体を作製し、水素発生反応を行った。水素発生挙動としては、60時間経過時において反応率が5%であった。
【0057】
実施例9(Ca+CaH2の混合系による試験)
実施例1において、Ca単独使用に変えて、Ca0.18gとCaH2(和光純薬社製、平均粒径10μm)0.18gを用いて総含有量を50重量%に変えたことと、プレス圧を変えて(10MPa)成形体を作製したこと以外は、実施例1と同様にして、混合物を硬化させた成形体を作製し、水素発生反応を行った。得られた成形体の空孔率は0%であった。
【0058】
また、水素ガスの発生量を計測した結果を図13に示す。水素発生挙動としては、実施例8と比較すると、CaH2を混合することによって、水素発生流量が大きくなり、120分経過時の反応率も高くなった。
【0059】
実施例10(Ca+CaH2の混合系による試験)
実施例1において、Ca単独使用に変えて、Ca0.265gとCaH2(和光純薬社製、平均粒径10μm)0.265gを用いて総含有量を60重量%に変えたことと、プレス圧を変えて(10MPa)成形体を作製したこと以外は、実施例1と同様にして、混合物を硬化させた成形体を作製し、水素発生反応を行った。得られた成形体の空孔率は0%であった。
【0060】
また、水素ガスの発生量を計測した結果を図13に併せて示す。水素発生挙動としては、実施例8と比較すると、CaH2を混合することによって、水素発生流量が大きくなり、120分経過時の反応率も高くなった。
【技術分野】
【0001】
本発明は、水分等の反応液と反応して水素ガスを発生させる金属を含有する水素発生剤、その製造方法、及び水素発生方法に関し、特に燃料電池に水素を供給するための技術として有用である。
【背景技術】
【0002】
従来、水を供給して水素ガスを発生させる水素発生剤としては、鉄、アルミニウム等の金属を主成分とするものや、水素化マグネシウムや水素化カルシウム等の水素化金属化合物を主成分とするものが知られている(例えば、特許文献1参照)。なかでも、水素化カルシウムのような高反応性の主成分とする水素発生剤を用いる場合、水分との反応速度が急峻であるため、水分を液体(水)で供給すると水素ガスが初期に爆発的に発生するという問題があった。
【0003】
そこで、特許文献2には、水素化金属と水分との反応速度を適度にコントロールする目的で、水素化金属が水溶性樹脂等の固体状水溶性化合物に包埋されてなる水素発生剤が開示されている。しかし、この水素発生剤では、反応性のより高い水素発生物質(例えばカルシウム)を用いる場合には、水との接触により母材が溶解する結果、十分な反応制御が行えず、水素が爆発的に発生するという問題があった。また、カルシウム等の金属と比較して、より高価な水素化金属等を用いる必要があるという問題があった。
【0004】
そこで、特許文献3には、反応熱による温度変化による影響を小さくする目的で、低温で親水性を呈し高温で疎水性を呈するアクリル系樹脂(熱可塑性樹脂)と、アルミニウム又はカルシウム等とを含有する水素発生剤が提案されている。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特開2003−314792号公報
【特許文献2】国際公開WO2007/055146号公報
【特許文献3】特開2009−1432号公報
【発明の概要】
【発明が解決しようとする課題】
【0006】
しかしながら、特許文献3の水素発生剤では、初期に熱可塑性樹脂が溶解してしまうため、その後に熱可塑性樹脂が凝集効果を発現しても、反応性の高い水素発生物質を用いる場合には、十分な反応制御が行えないという問題があった。このため、特許文献3の実施例においては、アルミニウムのような低い反応性の水素発生物質のみが使用されており、カルシウムの例は存在しない。
【0007】
そこで、本発明の目的は、安価なカルシウムを使用でき、樹脂母材による反応制御が反応後期まで継続し、しかも十分高い反応率が得られる水素発生剤、その製造方法、及び水素発生方法を提供することにある。
【課題を解決するための手段】
【0008】
本発明者らは、上記目的を達成すべく鋭意研究したところ、カルシウムと熱硬化性樹脂との組合せによって、樹脂母材による反応制御が反応後期まで継続し、しかも十分高い反応率が得られることを見出し、本発明を完成するに至った。
【0009】
即ち、本発明の水素発生剤は、熱硬化性樹脂の母材中にカルシウムを含有することを特徴とする。本発明の水素発生剤によると、熱硬化性樹脂の母材中にカルシウムを含有するため、樹脂母材による反応制御が反応後期まで継続し、しかも十分高い反応率が得られるようになる。
【0010】
高い反応率が得られる理由の詳細は明らかではないが、反応前後のカルシウムの形状の観察結果に基づき、次のように予測される。カルシウムの場合には樹脂との濡れ性が低いため、これが成形体の表面に露出し易くなり(例えば図1参照)、初期の反応が生じ易くなる。また、熱硬化性樹脂を用いる場合、発熱反応で昇温しても樹脂の形状が保持されるため、反応中にカルシウムに応力が生じて、カルシウムが割れやすくなり(例えば図5参照)、カルシウム全体が反応し易くなる。これに対して、熱可塑性樹脂の場合、発熱反応で樹脂が変形し易く反応中にカルシウムの割れが生じにくく、内部まで反応が進行しにくい(例えば図6参照)。その結果、本発明では、安価なカルシウムを使用でき、樹脂母材による反応制御が反応後期まで継続し、しかも十分高い反応率が得られる水素発生剤となる。
【0011】
上記において、前記カルシウムの平均粒子径が10〜500μmであることが好ましい。市販のカルシウムは、粒子径が数ミリと大きくなるが、粉砕等を行って、上記の範囲の平均粒子径のカルシウムを使用することによって、反応が理論反応量に近い状態まで継続して、より高い反応率が得られる。
【0012】
本発明の水素発生剤は、更に、水素化金属を含有することが好ましい。カルシウムは初期の反応が生じ易く、反応熱が大きいため、水素化金属による反応を促進して、低温における反応速度を高めることができる。また、水素化金属を併用することで、水素化金属からの重量(モル量)あたりの水素発生量が大きくなり、全体として重量(モル量)あたりの水素発生量を高めることができる。
【0013】
一方、本発明の水素発生剤の製造方法は、未硬化の熱硬化性樹脂とカルシウムとを含有する混合物を硬化させる工程を含むことを特徴とする。本発明の水素発生剤の製造方法によると、安価なカルシウムを使用でき、樹脂母材による反応制御が反応後期まで継続し、しかも十分高い反応率が得られる水素発生剤を、簡易な方法により製造することができる。
【0014】
その際、前記混合物を硬化させる工程が、加圧下で行われることが好ましい。大気圧下で行う場合、空孔が生じて体積効率が低下する傾向があるが、加圧下で行うことによって、空孔の発生を低減して体積効率を向上させることができる。また、加圧より空孔率を制御することができ、これによって反応速度を制御して水素発生速度を制御することができる。
【0015】
他方、本発明の水素発生方法は、上記いずれかに記載の水素発生剤と反応液とを接触させて水素を発生させることを特徴とする。本発明の水素発生方法によると、安価な水素発生剤を用いて、反応液と接触させるだけで適度な水素発生が可能であり、しかも樹脂母材による反応制御が反応後期まで継続しながらも、十分高い反応率が得られる。
【図面の簡単な説明】
【0016】
【図1】試験例2で得られたカルシウムを含有する成形体の表面を光学顕微鏡(500倍)で観察した写真であり、(a)は0MPaでの成形体、(b)は10MPaでの成形体、(c)は20MPaでの成形体
【図2】試験例2で得られた水素化カルシウムを含有する成形体の表面を光学顕微鏡(500倍)で観察した写真であり、(a)は0MPaでの成形体、(b)は10MPaでの成形体、(c)は20MPaでの成形体
【図3】実施例1における成形体の反応前の断面を示す走査型電子顕微鏡(SEM)写真であり、(a)〜(c)は倍率を変えたものである
【図4】実施例1および比較例1における水素発生速度(a)と水素発生総量(b)とを示すグラフ
【図5】実施例1における成形体の反応後の断面を示す走査型電子顕微鏡(SEM)写真であり、(a)〜(c)は倍率を変えたものである
【図6】比較例1における成形体の反応後の断面を示す走査型電子顕微鏡(SEM)写真であり、(a)〜(c)は倍率を変えたものである
【図7】実施例2における成形体の反応前の断面を示す走査型電子顕微鏡(SEM)写真であり、(a)〜(c)は倍率を変えたものである
【図8】実施例2における水素発生速度を示すグラフ
【図9】実施例3〜4における水素発生速度を示すグラフ
【図10】実施例5〜6における水素発生速度を示すグラフ
【図11】実施例7における水素発生速度(a)と水素発生総量(b)とを示すグラフ
【図12】実施例8における水素発生速度(a)と水素発生総量(b)とを示すグラフ
【図13】実施例9〜10における水素発生速度(a)と水素発生総量(b)とを示すグラフ
【発明を実施するための形態】
【0017】
本発明の水素発生剤は、熱硬化性樹脂の母材中にカルシウムを含有するものである。つまり、カルシウムが熱硬化性樹脂のマトリックス中に分散又は埋設された状態となる。これにより、カルシウムの反応性が抑制され、水との反応の際の取り扱い性が改善される。
【0018】
本発明では、表面付近に存在するカルシウムの一部が、熱硬化性樹脂の表面から露出していることが好ましい。例えば水素化カルシウムを熱硬化性樹脂に分散させる場合、両者の親和性が一般に良好なため、水素化カルシウムは、熱硬化性樹脂の表面から露出しない(殆ど露出しない)構造となる。このため、初期の反応速度を高めるために、表面を研磨することが望ましかった。これに対して、カルシウムを熱硬化性樹脂に分散させる場合、両者の親和性が一般に悪いため、表面付近に存在するカルシウムの一部が熱硬化性樹脂の表面から露出した構造となることが判明した。このため、初期の反応速度が高くなり、表面を研磨する必要がなくなり、製造工程が簡易になり工業的に望ましい水素発生剤となる。
【0019】
カルシウムの含有量は、反応制御による効果や、保形性(強度)および製造性を維持しつつ、反応速度を一定以上にする観点から、水素発生剤中、5〜80重量%が好ましく、10〜75重量%であることが好ましく、20〜70重量%がより好ましい。水素発生速度は、カルシウムの含有量と大きく関係しており、5〜30重量%の場合には、水素発生速度が低く(微量)なり、100時間以上水素発生を継続させることができる。また、60〜80重量%の場合には、水素発生速度が高く(多量)なり、1時間以内で水素発生を完結させることができる。カルシウムの含有量が30重量%を超え60重量%未満の場合には、上記の中間の水素発生速度と水素発生時間が実現できる。
【0020】
カルシウムは粒状であることが好ましく、粉砕品であることがより好ましい。粒状のカルシウムの平均粒子径は、樹脂中への分散性、反応速度、反応率などの観点から、10〜500μmが好ましく、20〜300μmがより好ましく、30〜150μmが更に好ましい。
【0021】
本発明の水素発生剤には、他の水素発生物質を含有させることも可能である。他の水素発生物質としては、水素化カルシウム、水素化リチウム、水素化カリウム、水素化リチウムアルミニウム、水素化アルミニウムナトリウム、又は水素化マグネシウムなどの水素化金属、アルミニウム、鉄、マグネシウム等の金属、水素化ホウ素化合物等の金属水素錯化合物などを含有してもよい。水素化金属化合物、金属、金属水素錯化合物は、何れかを複数組み合わせて使用することもでき、また、それぞれを組み合わせて使用することも可能である。
【0022】
本発明では、特に水素化カルシウム(CaH2)を併用することが好ましい。水素化カルシウムを併用する場合、その含有量は、カルシウムを含む水素発生物質中に、10〜90重量%であることが好ましく、20〜80重量%がより好ましい。特に、初期の反応性を高めつつ、水素発生密度を向上させる観点から、カルシウム/水素化カルシウムの比は、5/5〜0.05/0.95が好ましく、3/7〜1/9がより好ましい。
【0023】
粒状の水素化カルシウムの平均粒子径は、樹脂中への分散性や反応を適度に制御する観点から、1〜100μmが好ましく、6〜30μmがより好ましく、8〜10μmが更に好ましい。
【0024】
水素化カルシウム以外の水素発生物質の平均粒径も水素化カルシウムと同様であることが好ましい。水素化カルシウム以外の他の水素発生物質の含有量は、水素発生剤中、0〜20重量%が好ましく、0〜10重量%がより好ましく、0〜5重量%が更に好ましい。
【0025】
熱硬化性樹脂としては、エポキシ樹脂、不飽和ポリエステル樹脂、フェノール樹脂、アミノ樹脂、ポリウレタン樹脂、シリコーン樹脂、または熱硬化性ポリイミド樹脂等が挙げられる。なかでも、樹脂母材中で水等が拡散し易く、製造が容易になるなど観点から、エポキシ樹脂が好ましい。熱硬化性樹脂を硬化させる際には、必要に応じて硬化剤や硬化促進剤などが適宜併用される。
【0026】
熱硬化性樹脂の吸水性が大きいほど、樹脂母材中で水等が拡散し易くなり、水素発生速度が大きくなる。このため、下記の測定方法で求められる吸水率が0.1%以上であることが好ましく、0.2%以上がより好ましく、0.4%以上が更に好ましい。ここで、吸水率は、直径7mmの円柱状の成形体(1g)を室温で62時間水に浸漬して、その前後における重量変化を浸漬前の成形体の重量で除して百分率を求めたものである。
【0027】
熱硬化性樹脂の含有量は、反応制御による効果や、保形性(強度)および製造性を維持しつつ、反応速度を一定以上にする観点から、水素発生剤中、20〜95重量%が好ましく、25〜90重量%が好ましく、30〜80重量%がより好ましい。
【0028】
本発明の水素発生剤には、上記の成分以外の任意成分として、触媒、充填材、などのその他の成分を含有してもよい。触媒としては、水素発生剤用の金属触媒の他、水酸化ナトリウム、水酸化カリウム、水酸化カルシウムなどのアルカリ化合物も有効である。
【0029】
本発明の水素発生剤は、多孔質化された構造でもよく、実質的に中実の構造でもよいが、空孔率(空孔率(%)=空孔体積/全体積×100)が高いほど、水素発生速度が大きくなる。つまり、本発明の水素発生剤は、水素発生速度を高める観点から、空孔率(%)が1%以上が好ましく、2%以上がより好ましく、5%以上が更に好ましい。逆に、体積効率を高めながら、長時間安定した水素発生速度を維持する観点から、空孔率が小さいほど好ましい。通常このような空孔が少ない構造では、反応が内部に進行し難いが、本発明では、カルシウムを使用することで、このような低い空孔率でも反応を進行させることができ、体積効率を高めることができる。
【0030】
なお、カルシウムは、樹脂との混合又は反応の際に、水素を発生して空孔が生じる場合があるが、加圧下で反応硬化を行うことで、空孔率を制御したり、実質的に中実の構造を得ることができる。
【0031】
本発明の水素発生剤は、シート状、粒状(粉砕物)、塊状(成形体)など何れの形状でもよいが、反応速度を制御する観点から、シート状、板状、柱状などが好ましい。粉砕を行う場合、その粒径は、1〜10mmが好ましく、2〜5mmがより好ましい。
【0032】
本発明の水素発生剤は、本発明の製造方法、即ち、未硬化の熱硬化性樹脂とカルシウムとを含有する混合物を硬化させる工程を含む製法により製造されることが好ましい。混合物には、前述した他の成分や硬化剤などの成分を含有させることができる。
【0033】
本発明では、反応性を調整する上で、混合物を硬化させる工程が、加圧下で行われることが好ましい。加圧を行う場合の加圧条件としては、製造装置や製造コストを考慮しつつ、水素発生剤の空孔率を下げる観点から、1〜100MPaが好ましく、2〜50MPaがより好ましく、5〜30MPaが更に好ましい。加圧にはプレス成形用の金型等を使用することができる。
【0034】
本発明の水素発生方法は、以上のような水素発生剤と反応液とを接触させて水素を発生させるものである。反応液としては、水、酸水溶液、アルカリ水溶液などが挙げられる。供給する反応液の温度は、室温でもよいが、30〜80℃に加熱することも可能である。
【0035】
本発明では、水素発生剤と一部が接触した吸水体を介して、反応液が水素発生剤に供給される方法が、反応の制御を行う上で好ましい。吸水体としては、濾紙、吸水性シート、フェルト、脱脂綿、吸水性樹脂などが挙げられる。
【0036】
反応液の供給は、発生させる水素ガスの量に応じて供給量を調整することも可能であるが、本発明では過剰供給を行っても、反応速度が制御されているため、適度な発生速度で水素発生が可能である。
【0037】
従って、本発明の水素発生方法では、過剰な反応液中に水素発生剤を浸漬する方法により、適度な発生速度で水素発生が可能である。また、反応液中への浸漬量を変えることで、水素発生速度を調整することも可能である。その他、水素発生剤の表面の一部を、反応液の非透過性材料で覆うことにより、水素発生速度を調整することも可能である。
【0038】
本発明の水素発生剤は、水素発生装置の装置構造を簡易化できるため、特に形態機器用の燃料電池の水素供給装置に使用する場合に有効である。
【実施例】
【0039】
以下、本発明の構成と効果を具体的に示す実施例等について説明する。なお、実施例等における評価項目は下記のようにして測定を行った。
【0040】
(1)平均粒径
走査型電子顕微鏡(SEM)を用いて撮影した写真から、平均的な粒子径を有するものを選び出し、その長径と短径とを平均して求めた。
【0041】
(2)空孔率
実際に測定したサンプルの体積と、実際に測定したサンプルの質量を材料自身の密度で除して算出した体積との差として空孔体積を算出し、次式により空孔率(%)を求めた。空孔率(%)=空孔体積/全体積×100
試験例1(吸水率の測定)
実施例1のエポキシ樹脂及び比較例1の熱可塑性樹脂を用いて、直径7mmの円柱状の成形体(1g)を作製した。これを室温で62時間水に浸漬して、その前後における重量変化を浸漬前の成形体の重量で除して百分率を求めることで、吸水率を算出した。その結果、実施例1のエポキシ樹脂が、0.43%であり、比較例1の熱可塑性樹脂が0.00%(測定限界以下)であった。
【0042】
試験例2(表面状態の観察)
未硬化のエポキシ樹脂(ジャパンエポキシレジン(株)製、jER802)1.127gにCa(米山薬品工業社製、粉砕品、平均粒径70μm)1.2gを添加して撹拌後、更にジシアンジアミド系硬化剤(ジャパンエポキシレジン(株)製、DICY7)0.069g、変性脂肪族(3級アミン)硬化促進剤(ジャパンエポキシレジン(株)製、3010、トリスジメチルアミノメチルフェノール)0.0123gを添加して撹拌した。フラットな金属板の表面に金属枠材を置き、前記の混合物を金属枠材の内側(9.6mm×34mm)に塗布して、金属枠材の上面からフラットな金属板でプレス圧をかけ(図1の(a)では0MPa、(b)では10MPa、(c)では20MPa)、乾燥機(125℃設定)にて約60分間加熱硬化させた。得られた硬化物は、厚みが1.8mm、Caの含有量が50重量%であった。この成形体(反応前)の表面を光学顕微鏡(500倍)で観察すると、図1(a)〜(c)に示すように、Caの粒子の一部が樹脂表面から露出していた。
【0043】
一方、Caに変えて、CaH2(和光純薬社製、平均粒径10μm)を用いたこと以外は、上記と同様にして、CaH2の含有量が50重量%の成形体を作製した。この成形体(反応前)の表面を光学顕微鏡(500倍)で観察すると、図2(a)〜(c)に示すように、CaH2の粒子は樹脂表面から露出していなかった。
【0044】
実施例1
未硬化のエポキシ樹脂(ジャパンエポキシレジン(株)製、jER802)1.127gにCa(米山薬品工業社製、粉砕品、平均粒径70μm)0.3gを添加して撹拌後、更にジシアンジアミド系硬化剤(ジャパンエポキシレジン(株)製、DICY7)0.069g、変性脂肪族(3級アミン)硬化促進剤(ジャパンエポキシレジン(株)製、3010、トリスジメチルアミノメチルフェノール)0.0123gを添加して撹拌した。フラットな金属板の表面に金属枠材を置き、前記の混合物を金属枠材の内側(9.6mm×34mm)に塗布して、金属枠材の上面からフラットな金属板でプレス圧(20MPa)をかけ、乾燥機(125℃設定)にて約60分間加熱硬化させた。得られた硬化物は、厚みが1.8mm、Caの含有量が20重量%であり、空孔率0%であった。この成形体(反応前)は、図3に示すように、走査型電子顕微鏡(SEM)で観察すると、殆ど空孔が観察できない実質的に中実の成形体であり、Caの粒子には割れが生じていなかった。
【0045】
この成形体を水中に浸漬し、水上置換法により水素ガスの発生量を計測した。その結果を図4(a)〜(b)に示す。水素発生挙動としては、水中への浸漬直後から水素発生が始まり、約0.015cc/分の水素発生流速が約150時間継続し、最終的に理論水素発生量の90%の水素が発生した。反応後の成形体は、図5に示すように、走査型電子顕微鏡(SEM)で観察すると、中実の成形体が維持された状態であったが、Caの粒子には多数の大きな割れが生じていた。
【0046】
比較例1(熱可塑性樹脂の場合)
熱可塑性樹脂(パオックコーポレーション社製、ホットメルト接着用、20H−NA、エチレン酢酸ビニル共重合体60重量%+石油樹脂40重量%)1.2gを加熱溶融したものにCa(米山薬品工業社製、粉砕品、平均粒径70μm)0.3gを添加して140℃に加熱しながら混合した。フラットな金属板の表面に金属枠材を置き、前記の混合物を金属枠材の内側(20mm×20mm)に塗布して、金属枠材の上面からフラットな金属板でプレス圧(20MPa)をかけ、冷却固化させた。得られた硬化物は、厚みが0.5mm、Caの含有量が20重量%であり、空孔率0%であった。この成形体(反応前)は、走査型電子顕微鏡(SEM)で観察すると、殆ど空孔が観察できない実質的に中実の成形体であり、Caの粒子には割れが生じていなかった。
【0047】
この成形体を水中に浸漬し、水上置換法により水素ガスの発生量を計測した。その結果を図4(a)〜(b)に示す。水素発生挙動としては、水中への浸漬直後から水素発生が始まったが、約0.005cc/分の水素発生流速が約150時間継続し、最終的に理論水素発生量の25%の水素がのみ発生した。反応後の成形体は、図6に示すように、走査型電子顕微鏡(SEM)で観察すると、中実の成形体が維持された状態であったが、Caの粒子には小さな割れのみが生じていた。
【0048】
実施例2(含有量を変えた試験)
実施例1において、Caの含有量を70重量%に変えたことと、濾紙を全面に当てて、容器に入れた水2.5ccを供給(消費量は約0.5cc)したこと以外は、実施例1と同様にして、混合物を硬化させた成形体を作製し、水素発生反応を行った。この成形体(反応前)は、図7に示すように、走査型電子顕微鏡(SEM)で観察すると、殆ど空孔が観察できない実質的に中実の成形体であり、Caの粒子には割れが生じていなかった。
【0049】
また、水素ガスの発生量を計測した結果を図8に示す。水素発生挙動としては、水中への浸漬直後から水素発生が始まり、約10cc/分の水素発生流速が約35分間継続し、最終的に理論水素発生量の100%の水素が発生した。反応後の成形体は、走査型電子顕微鏡(SEM)で観察すると、Caの粒子には多数の大きな割れが生じていた。
【0050】
実施例3〜4(プレス圧を変えた試験)
実施例1において、Caの含有量を75重量%に変えたことと、プレス圧を変えて(2MPa及び20MPa)10mm×43mm×4.3mmの成形体を作製したこと以外は、実施例1と同様にして、混合物を硬化させた成形体を作製し、水素発生反応を行った。プレス圧2MPaで得られた成形体(実施例3)の空孔率は15%であり、20MPaで得られた成形体(実施例4)の空孔率は0%であった。
【0051】
また、水素ガスの発生量を計測した結果を図9に示す。水素発生挙動としては、プレス圧が小さく空孔率が高い実施例3の方が、水素発生流量が大きく、120分経過時の反応率も高かった。
【0052】
実施例5〜6(Ca+CaH2の混合系による試験)
実施例1において、Ca単独使用に変えて、Ca0.17gとCaH2(和光純薬社製、平均粒径10μm)1.55gを用いて総含有量を75重量%に変えたことと、プレス圧を変えて(2MPa及び20MPa)10mm×43mm×4.3mmの成形体を作製したこと以外は、実施例1と同様にして、混合物を硬化させた成形体を作製し、水素発生反応を行った。プレス圧2MPaで得られた成形体(実施例5)の空孔率は0%であり、20MPaで得られた成形体(実施例6)の空孔率は0%であった。
【0053】
また、水素ガスの発生量を計測した結果を図10に示す。水素発生挙動としては、プレス圧が小さく空孔率が高い実施例5の方が、水素発生流量が大きく、120分経過時の反応率も高かった。また、実施例3〜4と比較すると、CaH2を混合することによって、水素発生流量が大きくなり、120分経過時の反応率も高くなった。
【0054】
実施例7(低温での水素発生試験)
実施例5で得られた成形体を用いて、低温(10℃)で水素発生反応を行った。その際の水素発生挙動を室温で行った結果と併せて図11に示す。その結果、CaH2を単独で樹脂に混合した場合、低温(10℃)で水素発生反応が殆ど生じないのに対して、Ca+CaH2の混合系では、低温(10℃)でも水素発生反応が好適に生じることが分かった。
【0055】
実施例8(含有量を変えた試験)
実施例1において、Caの含有量を50重量%に変えたことと、濾紙を全面に当てて、容器に入れた水2.5ccを供給(消費量は約0.5cc)したこと以外は、実施例1と同様にして、混合物を硬化させた成形体を作製し、水素発生反応を行った。なお、成形体のプレス圧力を、0MPa、10MPa、および20MPaに変化させた結果、空孔率がそれぞれ4%、0%、0%となった。水素ガスの発生量を計測した結果を図12に示す。水素発生挙動としては、プレス圧が小さく空孔率が高いものほど、水素発生流量が大きく、90分経過時の反応率も高かった。
【0056】
比較例2(熱可塑性樹脂の場合)
比較例1において、Caの含有量を50重量%に変えたこと以外は、比較例1と同様にして、成形体を作製し、水素発生反応を行った。水素発生挙動としては、60時間経過時において反応率が5%であった。
【0057】
実施例9(Ca+CaH2の混合系による試験)
実施例1において、Ca単独使用に変えて、Ca0.18gとCaH2(和光純薬社製、平均粒径10μm)0.18gを用いて総含有量を50重量%に変えたことと、プレス圧を変えて(10MPa)成形体を作製したこと以外は、実施例1と同様にして、混合物を硬化させた成形体を作製し、水素発生反応を行った。得られた成形体の空孔率は0%であった。
【0058】
また、水素ガスの発生量を計測した結果を図13に示す。水素発生挙動としては、実施例8と比較すると、CaH2を混合することによって、水素発生流量が大きくなり、120分経過時の反応率も高くなった。
【0059】
実施例10(Ca+CaH2の混合系による試験)
実施例1において、Ca単独使用に変えて、Ca0.265gとCaH2(和光純薬社製、平均粒径10μm)0.265gを用いて総含有量を60重量%に変えたことと、プレス圧を変えて(10MPa)成形体を作製したこと以外は、実施例1と同様にして、混合物を硬化させた成形体を作製し、水素発生反応を行った。得られた成形体の空孔率は0%であった。
【0060】
また、水素ガスの発生量を計測した結果を図13に併せて示す。水素発生挙動としては、実施例8と比較すると、CaH2を混合することによって、水素発生流量が大きくなり、120分経過時の反応率も高くなった。
【特許請求の範囲】
【請求項1】
熱硬化性樹脂の母材中にカルシウムを含有する水素発生剤。
【請求項2】
前記カルシウムの平均粒子径が10〜500μmである請求項1に記載の水素発生剤。
【請求項3】
更に、水素化金属を含有する請求項1又は2に記載の水素発生剤。
【請求項4】
未硬化の熱硬化性樹脂とカルシウムとを含有する混合物を硬化させる工程を含む水素発生剤の製造方法。
【請求項5】
前記混合物を硬化させる工程が、加圧下で行われる請求項4に記載の水素発生剤の製造方法。
【請求項6】
請求項1〜3いずれかに記載の水素発生剤と反応液とを接触させて水素を発生させる水素発生方法。
【請求項1】
熱硬化性樹脂の母材中にカルシウムを含有する水素発生剤。
【請求項2】
前記カルシウムの平均粒子径が10〜500μmである請求項1に記載の水素発生剤。
【請求項3】
更に、水素化金属を含有する請求項1又は2に記載の水素発生剤。
【請求項4】
未硬化の熱硬化性樹脂とカルシウムとを含有する混合物を硬化させる工程を含む水素発生剤の製造方法。
【請求項5】
前記混合物を硬化させる工程が、加圧下で行われる請求項4に記載の水素発生剤の製造方法。
【請求項6】
請求項1〜3いずれかに記載の水素発生剤と反応液とを接触させて水素を発生させる水素発生方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【公開番号】特開2011−32148(P2011−32148A)
【公開日】平成23年2月17日(2011.2.17)
【国際特許分類】
【出願番号】特願2009−182684(P2009−182684)
【出願日】平成21年8月5日(2009.8.5)
【出願人】(506239784)アクアフェアリー株式会社 (40)
【Fターム(参考)】
【公開日】平成23年2月17日(2011.2.17)
【国際特許分類】
【出願日】平成21年8月5日(2009.8.5)
【出願人】(506239784)アクアフェアリー株式会社 (40)
【Fターム(参考)】
[ Back to top ]

