水素発生材料、その製造方法、水素の製造方法および水素製造装置
【課題】大気中でも安定した水素発生材料等を提供する。
【解決手段】その表面が徐酸化処理されたMgナノ粒子を含み、該徐酸化処理されたMgナノ粒子が水と反応して水素を発生する水素発生材料。該Mgナノ粒子の比表面積が70m2/g未満3m2/g超である上記水素発生材料。標準電極電位がMgよりも正方向に大きな金属の粉末を更に含む上記水素発生材料。少なくとも以下のステップ(ア)および(イ)の工程を備えた上記の水素発生材料の製造方法。
(ア)Mg金属塊を水素、窒素、Arまたは、これらの混合ガス雰囲気中でアーク溶解してMgナノ粒子を得る工程。
(イ)前記Mgナノ粒子の表面を徐酸化処理する工程。
【解決手段】その表面が徐酸化処理されたMgナノ粒子を含み、該徐酸化処理されたMgナノ粒子が水と反応して水素を発生する水素発生材料。該Mgナノ粒子の比表面積が70m2/g未満3m2/g超である上記水素発生材料。標準電極電位がMgよりも正方向に大きな金属の粉末を更に含む上記水素発生材料。少なくとも以下のステップ(ア)および(イ)の工程を備えた上記の水素発生材料の製造方法。
(ア)Mg金属塊を水素、窒素、Arまたは、これらの混合ガス雰囲気中でアーク溶解してMgナノ粒子を得る工程。
(イ)前記Mgナノ粒子の表面を徐酸化処理する工程。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、水と反応して水素を発生する水素発生材料、その製造方法、並びにこの水素発生材料を使用した水素
の製造方法および装置に関する。
【背景技術】
【0002】
水素発生材料はこれまでに盛に研究されており、たとえば、特許文献1に係るものは、Al、Mgおよびそれらの合金からなる材料がアトマイズ法から作製された粒子であり、かつ、これら粒子に発熱材料(Al2O3、CaO)を30質量%以下の割合で添加した混合物(Al、Mg金属と酸化物)が水と反応して水素を発生する方法が示されているが、これらは発熱作用を伴うものであり、その水素発生速度も十分なものではなかった。
また、特許文献2には特許文献1の元になる手法が記述されており、上述の材料はAlおよびAl合金とその界面に接する金属酸化物を有する複合材料である旨の記載がある。
この特許文献2の複合材料の製造法は、市販のAl粉末(粒径:3μm)と市販のAl(OH)3を混合(任意の割合)し、加圧(120MPa)、600℃で焼結するものである。
特許文献3には、Mg−Li合金をアンモニュウム塩溶液に接触させ、水素を発生させる方法が示されているが、この合金を純水と反応させて水素を発生させた事例はない。
特許文献4は、金属Mg粒子(粒径:10μm)と酸化物粒子(TiO2、SiO2、Al2O3、粒径:1〜10μm)を混合し機械的エネルギーを付与して得た生成物を使用し、水と反応させ水素を発生させる方法であり、金属Mg単独ではない混合粒子である。現在、10μm以下のMg粒子は市販されていない。その理由は粉砕で作製されたMg粉を篩分けする時に発火、爆発などの危険を伴うためと言われている。
特許文献5、6は水素化Mg(MgH2)のミクロンサイズ(5〜500μm)の粉と水との反応による水素ガスの発生法を採用している。しかしながらMgH2を作製するためには高温(350〜500℃)および高圧(10〜60気圧)の水素ガス中で処理する操作が必要である。また水との反応で水素を発生し易くするためには、発熱材と称する材料(Al、CaO、Cなど)を20%程度添加混合しなければならないため、水素化Mgの量が減少し、水素発生組成物の単位重量当りの水素発生量である水素発生効率が低下するなどの問題がある。
特許文献7はMgH2に強烈な機械的エネルギーを与え、ナノ結晶状態のものが水との反応で水素を発生するとしているが、材料はナノ粒子ではない。このような材料を造るためには高エネルギーを必要とする。
特許文献8はボールミリングなどの処理によりナノ材料を作製するとしているが、本質的には特許文献7と同一の部類に入るものである。
クリーンエネルギーとして注目されている水素であるが、以上のような従来技術の下では、水素発生材料を作製するためには煩雑な操作と高エネルギー付与が要求されるかまたは水素吸蔵合金若しくは高圧タンク等により貯蔵したりする他は、容易に入手する方法がなかった。
【先行技術文献】
【特許文献】
【0003】
【特許文献1】特許第4104016号
【特許文献2】特許第4054877号
【特許文献3】特開2004−269310
【特許文献4】特開2008−156148
【特許文献5】特開2008−37683
【特許文献6】特開2008−37683
【特許文献7】特表2003−527281
【特許文献8】国際公開番号WO2006/011620
【発明の概要】
【発明が解決しようとする課題】
【0004】
本発明はこのような実情に鑑みてなされたものであり、大気中でも安定した水素発生材料を提供することを課題とする。
【課題を解決するための手段】
【0005】
本発明の一態様によれば、その表面が徐酸化処理されたMgナノ粒子を含み、該徐酸化処理されたMgナノ粒子が水と反応して水素を発生する水素発生材料が与えられる。
この場合、前記Mgナノ粒子の比表面積は70m2/g未満3m2/g超であってよい。
また、前記水素発生材料は標準電極電位がMgよりも正方向に大きな金属の粉末を含んでよい。このような金属としては、Ag、CuおよびFeから選ばれた少なくとも一種の金属などが挙げられる。
前記水素発生材料は所定形状に成形してよい。
前記所定形状は粒状またはペレット状であってよい。
前記水素発生材料は液体中に分散してよい。
前記液体は無水アルコールであってよい。
本発明の他の一態様によれば、少なくとも以下のステップ(ア)および(イ)の工程を備えた前期水素発生材料の製造方法が与えられる。
本発明の更に他の一態様によれば、前記水素発生材料と水と反応させて水素を発生させる水素の製造方法が与えられる。この場合、前記水素発生材料を水中に投下させて反応させても、あるいは水素発生材料に水を滴下して反応させてもよい。
本発明の更に他の一態様によれば、水を貯留する水素発生槽と、この水素発生槽に前記水素発生材料を投下する発生材料貯留槽とを設けた水素製造装置が与えられる。
本発明の更に他の一態様によれば、前記水素発生材料からなる水透過性の発生床を収容する水素発生槽と、水供給手段と、前記水素発生槽内に設けられ、前記水供給手段からの水を前記発生床に向けて滴下する滴下口とを設けた水素発生装置が与えられる。
前記水供給手段と前記滴下口の間に滴下量調整器を設けてよい。
【発明の効果】
【0006】
この発明は前記特異な構成を採用したことのより、Mgのナノ粒子でありながら大気中において安定するのみならず、従来にはない高速での水素発生を実現することができる。
この結果、水素吸蔵合金若しくは高圧タンクを用いることのない、水素製造とその使用をその場で実現し得ることが可能となる。
【図面の簡単な説明】
【0007】
【図1】この発明の水素発生材料を得るために使用したMgナノ粒子製造装置の概略図である。
【図2】Mg粉末1、2、3の走査型電子顕微鏡写真である。
【図3】Mg粉末1、2、3の粉末X線回折図である。
【図4】ガスクロ方式による水素発生量測定を説明する図である。
【図5】水上置換法による水素発生量測定を説明する図である。
【図6】Mg粉末1、2、3の水素発生量の変化(長時間)を示すグラフである。
【図7】Mg粉末1、2、3の水素発生量の変化(短時間)を示すグラフである。
【図8】Mg粉末1と水を反応させた後の走査型電子顕微鏡写真である。
【図9】Mg粉末1と水を反応させた後の粉末X線回折図である。
【図10】水温と水素発生量の関係を示した図である。
【図11】水素発生用反応器の概略図である。
【図12】大量の水の中にMg粉末を投入した場合(ガスクロ方式)とMg粉末に水を滴下した場合(圧力測定方式)の水素発生量を比較した図である。
【図13】各種Mg粉末ペレットからの水素発生量を比較した図である。
【図14】水素発生の様子の時間変化を示す一連の写真である。
【図15】水素発生方法を実施するための装置の概略図である。
【図16】別の水素発生方法を実施するための装置の概略図である。
【発明を実施するための形態】
【0008】
本願発明者はこれまでアーク水素、窒素プラズマによる金属、合金、セラミクスのナノ粒子化の研究を行ってきた(日本金属学会誌 第53巻 第10号1062−1067
)。その研究の一つに、金属をナノ粒子にすると極めて活性で、大気中に取り出すと空気と反応して燃焼してしまうことへの対策がある。このような活性な金属ナノ粒子を大気中に取り出すためには、その表面に薄い酸化被膜を形成させると燃焼することなく安全に大気中に取り出すことが出来る。その手段として、活性な金属ナノ粒子を酸素濃度の低い雰囲気中でゆっくり酸化(徐酸化)させると良いことを確認した(日本金属学会誌 第60巻 第3号318−323)。
一方、本発明者は、活性な金属ナノ粒子であれば、徐酸化処理を行う代わりに水と反応させても、殆どの金属ナノ粒子は水と反応し、水素を発生することを確認した。この方法では、ナノ粒子金属と水さえあればその場での水素の製造が可能となるので、極めて簡便に水素が製造されると考えられた。
しかしながら、その後の本発明者らの検討によれば、この方法は実際にはグローブボックスの中での操作を余儀なくされるため、その製造管理体制が煩雑となるといった難点があることが判明した。そこで本願発明者らは更に検討を進め、徐酸化した種々の金属ナノ粒子の大気中で水との反応の有無を調べたところ、その中でMgナノ粒子だけが水と激しく反応し水素を発生する現象を知見した。
本発明は、このような知見に基づくものである。
【0009】
本発明の水素発生材料の構成成分であるMg金属ナノ粒子は種々の方法で製造することができ、たとえば、次のような方法で製造される
1)Mg金属塊を水素または水素を含むAr雰囲気中でアーク溶解する方法
2)Mg金属塊を窒素または窒素を含むAr雰囲気中でアーク溶解する方法
3)Mg金属塊をAr雰囲気中でアーク溶解する方法
上記3つの方法のうち、今回は1)と2)を実施例で採用した。なお、3)の方法ももちろん使用可能である。
1)は本発明者らの昭和50年代に開発した技術(特許第1146170、特許第1476623)に基づく方法である。
上記方法1)と2)は本発明者らにより各種材料(金属、合金、セラミックス)のナノ粒子化に適応されてきた。
特に1)の方法では水素を使用するが、水素の役割は材料からの蒸発速度、すなわち、対象材料のナノ粒子化生成速度を飛躍的に増大する効果がある。さらに、水素は消耗されることはなく、ナノ粒子生成の触媒的作用を有するものである。
上記方法2)では窒素を使用する。窒素の役割は水素と同様に材料からの蒸発速度、すなわち、対象材料のナノ粒子化生成速度を飛躍的に増大する効果がある。さらに、窒素は消耗されることはなく、ナノ粒子生成の触媒的作用を有するものであるが、この方法をMgのナノ粒子化に適用した報告は現時点では皆無(特許、非特許文献など含め)である。
【0010】
ちなみに、現在、Mgナノ粒子は市販されていない。その理由は粉砕で作製されたMg粉を篩分けする時に発火、爆発などの危険を伴うためと言われている。
上記方法1)および2)で作製したMgナノ粒子は極めて活性であり、生成直後のMgナノ粒子は大気中に取り出すと空気と反応し燃焼してしまう。
【0011】
本発明においてはMgナノ粒子と水との反応は通常は大気中で行うため、Mgナノ粒子表面を安定化しなければならない。
その安定化手段として本発明においては徐酸化処理を採用する。本発明で採用される徐酸化処理とは、表面活性な金属ナノ粒子を低濃度の酸素雰囲気中でゆっくり酸化させる処理である。
金属ナノ粒子の表面が酸化被膜で覆われていない清浄な場合、このような金属ナノ粒子の粉は大気に触れると発火燃焼し金属酸化物になってしまう。これは大気中の濃い濃度の酸素と接触するため急速な酸化による発熱が起こり酸化が促進され、発火燃焼するものである。この現象を防ぐためには、徐酸化処理、すなわち大気中の酸素濃度よりも酸素濃度の低い雰囲気中に金属ナノ粒子の粉を置くことにより、酸化をゆっくりと進行させて、ナノ粒子の表面層(100nm粒子の場合その表面層が数nm)を酸化させると安定化する。このようにして安定化した金属ナノ粒子は大気中に取り出しても燃焼しない。
本発明では、Mgナノ粒子表面を、たとえば1%O2−Ar雰囲気中に数時間以上放置して徐酸化処理を行い、その表面に薄い酸化被膜を形成させて、Mgナノ粒子を安定化させる。
なお、この徐酸化処理自体は、従来よりこの種の粒子に施されている慣用の技術であり、上記の方法以外にも種々の汎用手段を用いることができる。
【0012】
本発明の水素発生材料は、少なくとも以下の工程(ア)および工程(イ)により製造することができる。
(ア)Mg金属塊を水素、窒素、Arまたは、これらの混合ガス雰囲気中でアーク溶解してMgナノ粒子を得る工程。
(イ)前記Mgナノ粒子の表面を徐酸化処理する工程
本発明の水素発生材料は、その表面が徐酸化処理されたMgナノ粒子を含むことを特徴とするものであるが、作用標準電極電位がMgより正方向に大きい金属たとえばAg、Fe、Cuなどを含有させると、水素の発生が促進されるので、これらの金属を含有させておくことが好ましい。
本発明の水素発生材料を用いて水素を製造するには、上記水素発生材料と水を反応させて水素を発生させればよい。この場合、前記水素発生材料を水中に投下させて反応させても、あるいは水素発生材料に水を滴下して反応させてもよい。
実施例に示すように、水中に当該水素発生材料(Mg粉末)を投入して、水中から水素を発生させる方法が、定常的な発生を行わせるのに有効である。
本発明の水素製造装置としては、種々のものがあるが、たとえば、「水を貯留する水素発生槽と、この水素発生槽に上記水素発生材料を投下する水素発生材料貯留槽とを設けた水素製造装置」や「上記水素発生材料からなる水透過性の水素発生床を収容する水素発生槽と、
水供給手段と、前記水素発生槽内に設けられ、前記水供給手段からの水を前記発生床に向けて滴下する滴下口とを設けた水素製造装置。」が好ましく使用される。
具体的には、図15に示すような装置によるのが適切である。図15の装置は、一部に水素排出管(B)を設けた密閉容器(C)である水素発生槽内に水(W)を貯留し、前記密閉容器(C)に落下口を開いた粒子(P)の貯蔵タンク(T)を設け、この貯蔵タンク(T)の調整弁(Ta)により、粒子(P)の前記水(W)への投入量を調整し、排出管(B)からの水素の排出量を調整するようにしてある。この構成は水素発生を連続して行わせるのに有効である。
また、図16に示すように、水素発生槽内に水素発生材料を水透過性となるように詰めて発生床(PB)を構成し、水タンク(14)の調整弁(14a)により調整した適量の水(W)を、この発生床(PB)上に滴下することで、水(W)は、その量に比べ圧倒的に多いMg粒子により急速に処理されることとなる。こちらの構成は使用状況に対応して水素発生量を調整するのに有効である。
この結果、必要な量の水素を適宜発生させる場合には、水の供給量を調整することで、発生する水素量を短期に増減することができる。
【実施例】
【0013】
(実施例1)
(Mg粉末1)
本実施例に使用したMgナノ粒子は図1に示すナノ粒子作製装置により作製した。
Mg粉末の作製手順は以下の通りであった。
Mg塊(4)(純度99.9%)約20グラムをナノ粒子製造装置(直流アーク溶解炉の一種)に入れ、装置内をロータリーポンプ(10)により排気し、水素とアルゴンの混合ガス(10%H2−Ar)を導入して全圧力を90KPa程度とした。次にMg塊(4)を直流アーク溶解(150A、40V程度、正極性)した。Mg溶解と同時にMgが蒸発・凝縮し、Mgナノ粒子が生成した。生成Mgナノ粒子は混合ガス気流に乗って、グローブボックス(9)内に設置されたフィルター捕集器(7)で回収された。
アーク放電の停止と同時にMgナノ粒子の生成も停止した。
【0014】
上記の方法で作製したMgナノ粒子と水との反応は大気圧中で行うため、Mgナノ粒子表面を安定化しなければならない。その安定化処理として徐酸化処理を行った、すなわち粒子表面に薄い酸化被膜を形成させるために1%O2−Ar雰囲気中に数時間以上放置し、安定化した。
安定化処理したMg粉末1を大気中に取り出し、水との反応に使用した。
この方法で得られたMgナノ粒子のSEM写真を図2の上段「粉末1」に示す。この写真より、粒径は20nm〜1000nm(1μm)であることがわかる。
また比表面積の測定値は13m2/gであり、それから換算される平均粒径は265nmである。
XRD測定結果を図3の上段「Mg粉末1」に示す。これに示すように、得られたMgナノ粒子には水素化物は検出されなかった。
【0015】
(Mg粉末2)
Mg粉末2も図1に示すナノ粒子作製装置を使用して作製した。
Mg塊(4)約20グラムをナノ粒子製造装置(直流アーク溶解炉の一種)に入れ、装置内をロータリーポンプ(10)により排気し、窒素とアルゴンの混合ガス(20%N2−Ar)を導入して全圧力を90KPa程度とした。次にMg塊(4)を直流アーク溶解(150A、40V程度、正極性)した。Mg溶解と同時にMgが蒸発・凝縮し、Mgナノ粒子が生成した。生成Mgナノ粒子は混合ガス気流に乗ってグローブボックス(9)に到達し、その内部に設置されたフィルター捕集器(7)で回収された。
アーク放電の停止と同時にMgナノ粒子の生成も停止した。
【0016】
上記の方法で作製し、Mgナノ粒子と水との反応は大気圧中で行うため、Mgナノ粒子表面を安定化しなければならない。その安定化手段として徐酸化処理を行った。すなわち粒子表面に薄い酸化被膜を形成させるために1%O2−Ar雰囲気中に数時間以上放置し、安定化した。
安定化処理したMg粉末2を大気中に取り出し、水との反応に使用した。
この方法で得られたMgナノ粒子のSEM写真を図2の中段「粉末2」に示す。これより粒径は20nm〜1000nmであることがわかる。
また比表面積の測定値は6m2/gであり、それから換算される平均粒径は570nmである。
XRD測定結果を図3の中段「Mg粉末2」に示す。これに示すように、得られたMg粒子には窒化物は検出されなかった。
【0017】
(Mg粉末3)
本発明で使用したMg粉末1およびMg粉末2と比較するために、市販Mg粉末3(株式会社高純度化学製、粒径:180μm pass)を使用した。
Mg粉末3は油中に保存されたものを取り出し、エタノールで洗浄して乾燥したものを使用した。
比表面積の測定値は0.96m2/gであり、それから換算される平均粒径は18μmである。この粒子のSEM写真を図2下段「粉末3」に示し、併せてXRDの測定結果を図3下段「Mg粉末3」に示す。
以上の内容を表1にまとめて示す。
【0018】
【表1】

【0019】
(実施例2)
以下ではこれらのMg粉末と水を反応させて水素を発生させた。その際に発生する水素の量の測定に当たって、以下の方法を採用した。
A.一定容積中の水素ガス濃度変化から測定する方法(ガスクロ方式)
十分な量の水(25℃)にMg粉末を投入した時に発生する水素ガスをガスクロマトグラフ装置に一定時間ごとに採取し水素ガス濃度変化を測定した。図4に示すような反応容器とガスクロマトグラフ装置を連結した装置を作製した。反応容器内には予めMg粉末(100mg)をセットし反応容器上部より約50mlの水を注入し、水素ガスを発生させた。この場合、Mg100mgに対する水素発生に必要な化学量論的な水量は0.15mlであるから、これよりも遥かに多い50ml水量とした。
B.水上置換法による発生水素ガス測定法
十分な水量(100ml)中にMg(100mg)粉末1)および2)を投入すると、投入、数十秒後から水と反応し水素を激しく発生するので、短時間(数秒から10分以内)の水素発生量の測定には水上置換法を採用した。水上置換法の概略図を図5に示す。
すなわち、十分な水量中にMg粉末を投入した場合、投入から短時間の間の水素発生量は水上置換法で、またそれから先の長時間領域ではガスクロ方式で測定を行った。以下では一々このような2段階測定を説明するのは煩雑であるので、測定方法の表記に当たってはガスクロ方式で代表させて記載した。
なお、Mg粉末3)は粒径が大きいため短時間(数秒から10分以内)では水素発生は確認出来なかった。
C.圧力測定方式
Mg粉末に水を滴下して水素を発生させた場合には、図11に示すように、密閉容器内での圧力上昇から水素発生量を求める圧力測定方式を採用した。
【0020】
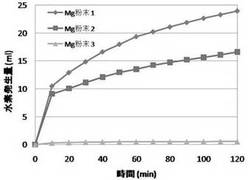
Mg粉末1、Mg粉末2およびMg粉末3(各々100mg)による水素発生量と時間の関係を図6および図7に示す。図6は長時間(30時間以上)に渡る水素発生量変化を、図7は発生初期の短時間の水素発生量変化を示す。表2に水素発生量と時間の関係を示す。
図6、図7より、本発明によるMg粉末1、2による水素発生量は市販Mg粉末3の30倍以上であることが判明した。なお、本願に言う「水素発生量」とは、別途明示していない限り、水素発生開始からの累積値のことである。
【0021】
【表2】

【0022】
Mg粉末1と水との反応前における粒子形態は、図2上段「Mg粉末1」に示したように、Mg特有の最密6方晶形態である。水と反応後の粉末のSEM写真を図8に、また水と反応後の粉末のXRD回折図を図9に示す。これより、水と反応後にはMgは水酸化マグネシュームMg(OH)2に変化したことがわかる。また、図2中段「Mg粉末2」に示すように、Mg粉末2と水との反応前におけるMg粉末2の粒子形態も、Mg特有の最密6方晶形態であり、水と反応後の粉末は、XRD回折図から、Mg粉末1と同様に水酸化マグネシュームMg(OH)2に変化したものであることを確認した。
【0023】
一方、Mg粉末1、2と水との反応で水素発生後の水溶液は弱アルカリ性を示した。従って、Mg粉末と水が反応して水素を発生する反応は次式で示される。
Mg+2H2O=Mg(OH)2+H2 (1)
【0024】
(1)式の反応が室温で速やかに進行し、1モルのMgから1モルの水素が生成される。
(1)式の反応の場合、MgからMg(OH)2を生成するための反応は熱化学のデータから発熱反応である。しかしながら、Mgと水の反応に当たって、本実施例では十分な量の水の中にMgを投入したので水温が上がるまでには至らなかった。水温が上がると反応速度が増大することが予想される。そこで、水温を25,40,60,70℃に保持した水中(100ml)にMg粉末2を100mg投入した時の水素ガスの発生を時間(秒)に対してプロットしたものを図10に示す。同図より、温度上昇とともに水素ガスの発生が増大することが分かる。
【0025】
(実施例3)
一定容積中の圧力変化から測定する方法
上述の実施例では十分な量の水にMg粉末を投入した時の水素発生量を時間に対して測定した。これに対してMg粉末と水との量的割合を変化させた場合、特にMgに対して少量の水との反応を想定すると、水素発生時には発熱反応を伴うので、当然試料(Mg)の温度が上昇し、水とMgの反応は加速され水素発生速度が増大すると考えられる。そこで図11に示すような反応容器と圧力測定機を連結した装置を作製した。反応容器内には予めMgナノ粒子試料をセットし、注入器を介して連結した水貯めから、任意量の水が滴下される構成になっている。
Mg粉末1(100mg)を図11に示す反応容器に入れ、水(蒸留水)を2.8ml滴下した時の水素発生量と時間の関係を図12および表3(圧力測定方式)に示す。
図12および表3から、水を滴下してから10分経過後の水素発生量は19.5mlである。一方大量の水中からの発生量(ガスクロ方式)は10.5mlである。この両者の比較から反応初期時間における水素発生速度は図11の圧力測定方式(すなわち、Mg粉末試料100mgに蒸留水2.8mlを滴下)の方が大きい値を示している。この原因は発熱反応による影響のためと考えられる。
【0026】
【表3】

【0027】
以上の結果を総合すると、水素発生材料の粒径範囲は1000nm(1μm)以下50nm以上が望ましい。理由は以下の通りである。
理由1:Mg金属粒子の大小にかかわらず反応層膜厚が同一であると仮定すれば、粒径が小さいほど水素発生量が大きくなる。例えば1g、粒径250nmおよび20000nm(20μm)の粒子を比較した場合、それら粒子表面から10nmの深さまで反応したとすると、発生する水素量は204ml/gと2.7ml/gと計算される。このように粒径の差が水素発生量(同一時間)に大きく影響するので、粒径の上限としては1μm程度である。粒径の下限については、本粒子は安定化処理による酸化層があり、その厚さは大約5〜10nmであることを考慮する必要がある。粒径が10nm粒子では水と反応しない酸化物層が大半を占めることになる。よって、粒径の下限は50nmとする。
理由2:Mg粒子は本願で使用した水素あるいは窒素とアルゴンの混合雰囲気でアーク放電によって極めて効率良く作製出来るが、作製されたMg粒子は粒径範囲が1000nm以下(3m2/g超)50nm以上(70m2/g未満)の混合粒子となる。
水素発生材料のより好ましい粒径範囲は、比表面積で表示した場合、4m2/g以上50m2/g以下である。
ただし、酸素を含まない雰囲気であればこの限りでなく、粒子構成の最少単位まで可能である。
【0028】
(実施例4)
実施例2において、Mg粉に代えて圧粉成形したMgペレットを用いた以外は同様の実験を行った。水との接触が良好となり、ペレットから水素が効率よく発生した。
また、Mgよりも比重の大きい金属粉とMg粉を混合した圧粉成形体ペレットを水との反応に使用したところ、ペレット内に閉じ込められたMg粒子は水中に分散することなく、水と反応し集中的にペレットから水素を効率的に発生することが出来た。
なお、Mg粉と相手金属粉と組み合わせにより、水素発生の仕方に変化があることが判明した。
Mg粉末2とMg粉末3に対して相手金属粉としてはAg(銀)、Cu(銅)、Fe(鉄)の3種類を選び、計6種類の組み合わせによるペレットを作製して水との反応による水素の発生状態をテストした。
表4に混合粉材料、Mg粉末粒径、Mg割合および各時間における水素発生量との関係を示す。
図13には各Mg粒子とAg、Cu、Fe混合による時間に対する水素発生量の変化を示す。
以上の結果より、各時間に対する水素発生量は大きく2つのグループに分けられる。水素発生量の大きいグループはMgナノ粒子含有金属粉、水素発生量の小さいグループはMg微粉(20μm)である。両グループ共に、相手金属粉としてAgとの組み合わせが最も水素発生量が大きく、Fe、Cuの順に小さくなる。
この原因が定かではないが、Mg粉と混合した金属粉との間で一種の局部電池が構成された電気化学的挙動によるものであると推定している。したがって、標準電極電位がMgより正方向に大きい金属であれば、Ag、Fe、Cuに限らず、水素発生を促進する作用を有するものと考えている。
【0029】
【表4】

【0030】
(実施例5)
実施例4により、MgとAgとの組み合わせが最も水素が発生し易いことが判明した。
この形態によれば、Mgナノ粒子を簡単にかつ安全に携帯できれば、必要な時に水さえあれば水素を取り出すことが出来る。Mgナノ粒子とAgの配合割合は自由だが、この混合粉の成形体ペレットが簡単に崩れないことが必要である。
ここに一例として、Ag45mg、Mg5mgの成形体(直径3mm)を10mlの水の入ったガラスセルに投下した時の水素の発生の様子のビデオの駒写真を図14に示す。
Mgナノ粒子が微量であっても極めて容易に、10分以内の短時間で水素水となる。
Mgナノ粒子を閉じ込めた金属圧粉体(Ag、Fe、Cu)は持ち運びが出来、必要な時に水、飲料用水溶液(飲料水、ジュース、酒などの水溶液)に投入して水素水を作製できる。
水素放出をし終わった混合成形体は多孔質でありAgベース貴金属の場合には装飾品として使用可能である。
この様なMgナノ粒子を含有した成形体は一種の水素の缶詰のようなものであり、携帯可能となり、移動先で水さえあれば水素ガスを容易に得ることが出来、燃料電池を稼働させることが出来る。水素を発生させた水は還元水素水として利用できる。
【0031】
(実施例6)
以下に、前記Mg粉末1とMg粉末2のようなナノ粒子を用いた、水素発生の制御技術に関して、図15、図16を参照して以下に説明する。
前記Mg粉末1とMg粉末2のような本発明によるMg粒子は、生成当初は綿または油煙のようなもので、その自重により、容易に落下するようなものではない。この生成当初の粒子は、圧密成型することにより、自律保形性を持った自由な形状に成型できるのみならず、空隙率が40%前後となり、さらに、一般に行われている圧密成型時の加圧力では、この空隙率は10%以下に小さくすることは不可能であった。
この空隙率は、水を浸透させるのに十分なものであるから、この圧密成型したものに、水を投与すると、急速に吸収されて水素を発生させることができた。
このような知見に基づき、図15に示す装置では、粒子(P)を、必要とする水素発生量の最小単位(発生水素の用途や装置の稼働環境によって異なる)に合わせた体積で、顆粒状、ペレット状に圧密成型したものを第一例の水素発生剤と呼ぶ。
また、生成当初のMg粒子を無水アルコールに分散させると、媒質との間では無反応であったが、その濃度により液状から固形状に至るまでの間に性状を調整することができた。さらにこの分散体に水を投与すると、水は分散体に急速に吸収されて、水素を発生した。
このような性質を利用して、液状、半固形状若しくは固形状の分散体としたものを第二例の水素発生剤と呼ぶ。
【0032】
図15の調整弁(Ta)は、前記両例の性状に合わせた従来公知の弁を総称したものである。
具体的には、第一例の水素発生剤の一種である圧密粒子又は第二例の水素発生剤の一種である低粘度の液状体を使用する場合には、調整弁(Ta)は、水素発生剤が自重で落下する量を調整できる開閉弁とするのが適切である。
また、第二例の水素発生剤の一種である高粘度液体状、半固形状若しくは固形状のものでは、調整弁(Ta)ha,スクリューフィーダのように、このような水素発生剤を強制的に送り出す機能をもった装置とするのが適切である。
このようにすることで、必要な量の水素を適宜発生させることが可能となる。
【0033】
また、図16における発生床(PB)は、第一例の水素発生剤の一種である圧密成型体を利用したり、第二例の水素発生剤の一種である固形状分散体を利用する場合は、これらの水素発生剤をその密閉容器(C)内の設置場所に合わせた形状に予め成型して用いることができる。
また、第一例の水素発生剤の一種である粒状体や第二例の水素発生剤の一種である固形状分散体を粒状にしたもの、あるいは第二例の水素発生剤の一種である液状体又は半固形状体などの、流動性をもたせた水素発生剤を使用する場合は、密閉容器(C)内に供給することで、発生床(PB)を形成することができる。
前記図15、図16の何れの形態においても、使用済みのMg粒子を密閉容器(C)から取り出す必要があるので、その形態に合わせ、取り出すことができるように開閉口(図外)が設けてある。
粒子(P)又は流動性を持たせた発生床(PB)を用いるときはドレン配管を用いることでこれを達成できるが、水素発生剤を密閉容器(C)内の設置場所に合わせた形状に成型したものでは、当該容器(C)を上下に分断して開口する構造として、その形状を崩さずに取り出し得るような構造とするのが、取り出し作業を迅速、簡便に行う上で望ましい。
また、この後者の構造は、水素発生反応により、粒子(P)の性状が変化して、当初保有していた流動性が失われる可能性のある場合にも利用することができる。
【0034】
また、発生した水素が、全量使用されるとは限らないので、密閉容器(C)に溜まった水素が過剰な高圧とならないように、所定圧力を超えた水素が貯留された場合に、その水素を徐々に外部に放出しながら燃焼する安全機構を追加することも、実用上は有効なものとなる。
【0035】
また、前記水素排出管(B)には、前記密閉容器(C)内の圧力が外圧以上に高くならないと開かない一方弁(図示せず)や圧力感知機能の付いた開閉弁を設置して、前記密閉容器(C)内に外気が流入しないようにし、前記密閉容器(C)内で不測に水素−酸素反応が生じないようにすることも、実用上は有用である。
なお、前記開放型の開口を形成した密封容器(C)では、解放の度に内部の酸素を除去する作業が必要となる。
【符号の説明】
【0036】
1、1’ 反応ガス導入部
2 電極(−)
3 アークプラズマ
4 Mg塊(原料)
5 水冷ハース
6 反応室
7 フィルター
8 循環ポンプ
9 グローブボックス
10 ロータリーポンプ
14 水タンク
14a 調整弁
B 水素排出管
C 密閉容器
P 粒子
PB 発生床
T 貯蔵タンク
Ta 調整弁
W 水
【技術分野】
【0001】
本発明は、水と反応して水素を発生する水素発生材料、その製造方法、並びにこの水素発生材料を使用した水素
の製造方法および装置に関する。
【背景技術】
【0002】
水素発生材料はこれまでに盛に研究されており、たとえば、特許文献1に係るものは、Al、Mgおよびそれらの合金からなる材料がアトマイズ法から作製された粒子であり、かつ、これら粒子に発熱材料(Al2O3、CaO)を30質量%以下の割合で添加した混合物(Al、Mg金属と酸化物)が水と反応して水素を発生する方法が示されているが、これらは発熱作用を伴うものであり、その水素発生速度も十分なものではなかった。
また、特許文献2には特許文献1の元になる手法が記述されており、上述の材料はAlおよびAl合金とその界面に接する金属酸化物を有する複合材料である旨の記載がある。
この特許文献2の複合材料の製造法は、市販のAl粉末(粒径:3μm)と市販のAl(OH)3を混合(任意の割合)し、加圧(120MPa)、600℃で焼結するものである。
特許文献3には、Mg−Li合金をアンモニュウム塩溶液に接触させ、水素を発生させる方法が示されているが、この合金を純水と反応させて水素を発生させた事例はない。
特許文献4は、金属Mg粒子(粒径:10μm)と酸化物粒子(TiO2、SiO2、Al2O3、粒径:1〜10μm)を混合し機械的エネルギーを付与して得た生成物を使用し、水と反応させ水素を発生させる方法であり、金属Mg単独ではない混合粒子である。現在、10μm以下のMg粒子は市販されていない。その理由は粉砕で作製されたMg粉を篩分けする時に発火、爆発などの危険を伴うためと言われている。
特許文献5、6は水素化Mg(MgH2)のミクロンサイズ(5〜500μm)の粉と水との反応による水素ガスの発生法を採用している。しかしながらMgH2を作製するためには高温(350〜500℃)および高圧(10〜60気圧)の水素ガス中で処理する操作が必要である。また水との反応で水素を発生し易くするためには、発熱材と称する材料(Al、CaO、Cなど)を20%程度添加混合しなければならないため、水素化Mgの量が減少し、水素発生組成物の単位重量当りの水素発生量である水素発生効率が低下するなどの問題がある。
特許文献7はMgH2に強烈な機械的エネルギーを与え、ナノ結晶状態のものが水との反応で水素を発生するとしているが、材料はナノ粒子ではない。このような材料を造るためには高エネルギーを必要とする。
特許文献8はボールミリングなどの処理によりナノ材料を作製するとしているが、本質的には特許文献7と同一の部類に入るものである。
クリーンエネルギーとして注目されている水素であるが、以上のような従来技術の下では、水素発生材料を作製するためには煩雑な操作と高エネルギー付与が要求されるかまたは水素吸蔵合金若しくは高圧タンク等により貯蔵したりする他は、容易に入手する方法がなかった。
【先行技術文献】
【特許文献】
【0003】
【特許文献1】特許第4104016号
【特許文献2】特許第4054877号
【特許文献3】特開2004−269310
【特許文献4】特開2008−156148
【特許文献5】特開2008−37683
【特許文献6】特開2008−37683
【特許文献7】特表2003−527281
【特許文献8】国際公開番号WO2006/011620
【発明の概要】
【発明が解決しようとする課題】
【0004】
本発明はこのような実情に鑑みてなされたものであり、大気中でも安定した水素発生材料を提供することを課題とする。
【課題を解決するための手段】
【0005】
本発明の一態様によれば、その表面が徐酸化処理されたMgナノ粒子を含み、該徐酸化処理されたMgナノ粒子が水と反応して水素を発生する水素発生材料が与えられる。
この場合、前記Mgナノ粒子の比表面積は70m2/g未満3m2/g超であってよい。
また、前記水素発生材料は標準電極電位がMgよりも正方向に大きな金属の粉末を含んでよい。このような金属としては、Ag、CuおよびFeから選ばれた少なくとも一種の金属などが挙げられる。
前記水素発生材料は所定形状に成形してよい。
前記所定形状は粒状またはペレット状であってよい。
前記水素発生材料は液体中に分散してよい。
前記液体は無水アルコールであってよい。
本発明の他の一態様によれば、少なくとも以下のステップ(ア)および(イ)の工程を備えた前期水素発生材料の製造方法が与えられる。
本発明の更に他の一態様によれば、前記水素発生材料と水と反応させて水素を発生させる水素の製造方法が与えられる。この場合、前記水素発生材料を水中に投下させて反応させても、あるいは水素発生材料に水を滴下して反応させてもよい。
本発明の更に他の一態様によれば、水を貯留する水素発生槽と、この水素発生槽に前記水素発生材料を投下する発生材料貯留槽とを設けた水素製造装置が与えられる。
本発明の更に他の一態様によれば、前記水素発生材料からなる水透過性の発生床を収容する水素発生槽と、水供給手段と、前記水素発生槽内に設けられ、前記水供給手段からの水を前記発生床に向けて滴下する滴下口とを設けた水素発生装置が与えられる。
前記水供給手段と前記滴下口の間に滴下量調整器を設けてよい。
【発明の効果】
【0006】
この発明は前記特異な構成を採用したことのより、Mgのナノ粒子でありながら大気中において安定するのみならず、従来にはない高速での水素発生を実現することができる。
この結果、水素吸蔵合金若しくは高圧タンクを用いることのない、水素製造とその使用をその場で実現し得ることが可能となる。
【図面の簡単な説明】
【0007】
【図1】この発明の水素発生材料を得るために使用したMgナノ粒子製造装置の概略図である。
【図2】Mg粉末1、2、3の走査型電子顕微鏡写真である。
【図3】Mg粉末1、2、3の粉末X線回折図である。
【図4】ガスクロ方式による水素発生量測定を説明する図である。
【図5】水上置換法による水素発生量測定を説明する図である。
【図6】Mg粉末1、2、3の水素発生量の変化(長時間)を示すグラフである。
【図7】Mg粉末1、2、3の水素発生量の変化(短時間)を示すグラフである。
【図8】Mg粉末1と水を反応させた後の走査型電子顕微鏡写真である。
【図9】Mg粉末1と水を反応させた後の粉末X線回折図である。
【図10】水温と水素発生量の関係を示した図である。
【図11】水素発生用反応器の概略図である。
【図12】大量の水の中にMg粉末を投入した場合(ガスクロ方式)とMg粉末に水を滴下した場合(圧力測定方式)の水素発生量を比較した図である。
【図13】各種Mg粉末ペレットからの水素発生量を比較した図である。
【図14】水素発生の様子の時間変化を示す一連の写真である。
【図15】水素発生方法を実施するための装置の概略図である。
【図16】別の水素発生方法を実施するための装置の概略図である。
【発明を実施するための形態】
【0008】
本願発明者はこれまでアーク水素、窒素プラズマによる金属、合金、セラミクスのナノ粒子化の研究を行ってきた(日本金属学会誌 第53巻 第10号1062−1067
)。その研究の一つに、金属をナノ粒子にすると極めて活性で、大気中に取り出すと空気と反応して燃焼してしまうことへの対策がある。このような活性な金属ナノ粒子を大気中に取り出すためには、その表面に薄い酸化被膜を形成させると燃焼することなく安全に大気中に取り出すことが出来る。その手段として、活性な金属ナノ粒子を酸素濃度の低い雰囲気中でゆっくり酸化(徐酸化)させると良いことを確認した(日本金属学会誌 第60巻 第3号318−323)。
一方、本発明者は、活性な金属ナノ粒子であれば、徐酸化処理を行う代わりに水と反応させても、殆どの金属ナノ粒子は水と反応し、水素を発生することを確認した。この方法では、ナノ粒子金属と水さえあればその場での水素の製造が可能となるので、極めて簡便に水素が製造されると考えられた。
しかしながら、その後の本発明者らの検討によれば、この方法は実際にはグローブボックスの中での操作を余儀なくされるため、その製造管理体制が煩雑となるといった難点があることが判明した。そこで本願発明者らは更に検討を進め、徐酸化した種々の金属ナノ粒子の大気中で水との反応の有無を調べたところ、その中でMgナノ粒子だけが水と激しく反応し水素を発生する現象を知見した。
本発明は、このような知見に基づくものである。
【0009】
本発明の水素発生材料の構成成分であるMg金属ナノ粒子は種々の方法で製造することができ、たとえば、次のような方法で製造される
1)Mg金属塊を水素または水素を含むAr雰囲気中でアーク溶解する方法
2)Mg金属塊を窒素または窒素を含むAr雰囲気中でアーク溶解する方法
3)Mg金属塊をAr雰囲気中でアーク溶解する方法
上記3つの方法のうち、今回は1)と2)を実施例で採用した。なお、3)の方法ももちろん使用可能である。
1)は本発明者らの昭和50年代に開発した技術(特許第1146170、特許第1476623)に基づく方法である。
上記方法1)と2)は本発明者らにより各種材料(金属、合金、セラミックス)のナノ粒子化に適応されてきた。
特に1)の方法では水素を使用するが、水素の役割は材料からの蒸発速度、すなわち、対象材料のナノ粒子化生成速度を飛躍的に増大する効果がある。さらに、水素は消耗されることはなく、ナノ粒子生成の触媒的作用を有するものである。
上記方法2)では窒素を使用する。窒素の役割は水素と同様に材料からの蒸発速度、すなわち、対象材料のナノ粒子化生成速度を飛躍的に増大する効果がある。さらに、窒素は消耗されることはなく、ナノ粒子生成の触媒的作用を有するものであるが、この方法をMgのナノ粒子化に適用した報告は現時点では皆無(特許、非特許文献など含め)である。
【0010】
ちなみに、現在、Mgナノ粒子は市販されていない。その理由は粉砕で作製されたMg粉を篩分けする時に発火、爆発などの危険を伴うためと言われている。
上記方法1)および2)で作製したMgナノ粒子は極めて活性であり、生成直後のMgナノ粒子は大気中に取り出すと空気と反応し燃焼してしまう。
【0011】
本発明においてはMgナノ粒子と水との反応は通常は大気中で行うため、Mgナノ粒子表面を安定化しなければならない。
その安定化手段として本発明においては徐酸化処理を採用する。本発明で採用される徐酸化処理とは、表面活性な金属ナノ粒子を低濃度の酸素雰囲気中でゆっくり酸化させる処理である。
金属ナノ粒子の表面が酸化被膜で覆われていない清浄な場合、このような金属ナノ粒子の粉は大気に触れると発火燃焼し金属酸化物になってしまう。これは大気中の濃い濃度の酸素と接触するため急速な酸化による発熱が起こり酸化が促進され、発火燃焼するものである。この現象を防ぐためには、徐酸化処理、すなわち大気中の酸素濃度よりも酸素濃度の低い雰囲気中に金属ナノ粒子の粉を置くことにより、酸化をゆっくりと進行させて、ナノ粒子の表面層(100nm粒子の場合その表面層が数nm)を酸化させると安定化する。このようにして安定化した金属ナノ粒子は大気中に取り出しても燃焼しない。
本発明では、Mgナノ粒子表面を、たとえば1%O2−Ar雰囲気中に数時間以上放置して徐酸化処理を行い、その表面に薄い酸化被膜を形成させて、Mgナノ粒子を安定化させる。
なお、この徐酸化処理自体は、従来よりこの種の粒子に施されている慣用の技術であり、上記の方法以外にも種々の汎用手段を用いることができる。
【0012】
本発明の水素発生材料は、少なくとも以下の工程(ア)および工程(イ)により製造することができる。
(ア)Mg金属塊を水素、窒素、Arまたは、これらの混合ガス雰囲気中でアーク溶解してMgナノ粒子を得る工程。
(イ)前記Mgナノ粒子の表面を徐酸化処理する工程
本発明の水素発生材料は、その表面が徐酸化処理されたMgナノ粒子を含むことを特徴とするものであるが、作用標準電極電位がMgより正方向に大きい金属たとえばAg、Fe、Cuなどを含有させると、水素の発生が促進されるので、これらの金属を含有させておくことが好ましい。
本発明の水素発生材料を用いて水素を製造するには、上記水素発生材料と水を反応させて水素を発生させればよい。この場合、前記水素発生材料を水中に投下させて反応させても、あるいは水素発生材料に水を滴下して反応させてもよい。
実施例に示すように、水中に当該水素発生材料(Mg粉末)を投入して、水中から水素を発生させる方法が、定常的な発生を行わせるのに有効である。
本発明の水素製造装置としては、種々のものがあるが、たとえば、「水を貯留する水素発生槽と、この水素発生槽に上記水素発生材料を投下する水素発生材料貯留槽とを設けた水素製造装置」や「上記水素発生材料からなる水透過性の水素発生床を収容する水素発生槽と、
水供給手段と、前記水素発生槽内に設けられ、前記水供給手段からの水を前記発生床に向けて滴下する滴下口とを設けた水素製造装置。」が好ましく使用される。
具体的には、図15に示すような装置によるのが適切である。図15の装置は、一部に水素排出管(B)を設けた密閉容器(C)である水素発生槽内に水(W)を貯留し、前記密閉容器(C)に落下口を開いた粒子(P)の貯蔵タンク(T)を設け、この貯蔵タンク(T)の調整弁(Ta)により、粒子(P)の前記水(W)への投入量を調整し、排出管(B)からの水素の排出量を調整するようにしてある。この構成は水素発生を連続して行わせるのに有効である。
また、図16に示すように、水素発生槽内に水素発生材料を水透過性となるように詰めて発生床(PB)を構成し、水タンク(14)の調整弁(14a)により調整した適量の水(W)を、この発生床(PB)上に滴下することで、水(W)は、その量に比べ圧倒的に多いMg粒子により急速に処理されることとなる。こちらの構成は使用状況に対応して水素発生量を調整するのに有効である。
この結果、必要な量の水素を適宜発生させる場合には、水の供給量を調整することで、発生する水素量を短期に増減することができる。
【実施例】
【0013】
(実施例1)
(Mg粉末1)
本実施例に使用したMgナノ粒子は図1に示すナノ粒子作製装置により作製した。
Mg粉末の作製手順は以下の通りであった。
Mg塊(4)(純度99.9%)約20グラムをナノ粒子製造装置(直流アーク溶解炉の一種)に入れ、装置内をロータリーポンプ(10)により排気し、水素とアルゴンの混合ガス(10%H2−Ar)を導入して全圧力を90KPa程度とした。次にMg塊(4)を直流アーク溶解(150A、40V程度、正極性)した。Mg溶解と同時にMgが蒸発・凝縮し、Mgナノ粒子が生成した。生成Mgナノ粒子は混合ガス気流に乗って、グローブボックス(9)内に設置されたフィルター捕集器(7)で回収された。
アーク放電の停止と同時にMgナノ粒子の生成も停止した。
【0014】
上記の方法で作製したMgナノ粒子と水との反応は大気圧中で行うため、Mgナノ粒子表面を安定化しなければならない。その安定化処理として徐酸化処理を行った、すなわち粒子表面に薄い酸化被膜を形成させるために1%O2−Ar雰囲気中に数時間以上放置し、安定化した。
安定化処理したMg粉末1を大気中に取り出し、水との反応に使用した。
この方法で得られたMgナノ粒子のSEM写真を図2の上段「粉末1」に示す。この写真より、粒径は20nm〜1000nm(1μm)であることがわかる。
また比表面積の測定値は13m2/gであり、それから換算される平均粒径は265nmである。
XRD測定結果を図3の上段「Mg粉末1」に示す。これに示すように、得られたMgナノ粒子には水素化物は検出されなかった。
【0015】
(Mg粉末2)
Mg粉末2も図1に示すナノ粒子作製装置を使用して作製した。
Mg塊(4)約20グラムをナノ粒子製造装置(直流アーク溶解炉の一種)に入れ、装置内をロータリーポンプ(10)により排気し、窒素とアルゴンの混合ガス(20%N2−Ar)を導入して全圧力を90KPa程度とした。次にMg塊(4)を直流アーク溶解(150A、40V程度、正極性)した。Mg溶解と同時にMgが蒸発・凝縮し、Mgナノ粒子が生成した。生成Mgナノ粒子は混合ガス気流に乗ってグローブボックス(9)に到達し、その内部に設置されたフィルター捕集器(7)で回収された。
アーク放電の停止と同時にMgナノ粒子の生成も停止した。
【0016】
上記の方法で作製し、Mgナノ粒子と水との反応は大気圧中で行うため、Mgナノ粒子表面を安定化しなければならない。その安定化手段として徐酸化処理を行った。すなわち粒子表面に薄い酸化被膜を形成させるために1%O2−Ar雰囲気中に数時間以上放置し、安定化した。
安定化処理したMg粉末2を大気中に取り出し、水との反応に使用した。
この方法で得られたMgナノ粒子のSEM写真を図2の中段「粉末2」に示す。これより粒径は20nm〜1000nmであることがわかる。
また比表面積の測定値は6m2/gであり、それから換算される平均粒径は570nmである。
XRD測定結果を図3の中段「Mg粉末2」に示す。これに示すように、得られたMg粒子には窒化物は検出されなかった。
【0017】
(Mg粉末3)
本発明で使用したMg粉末1およびMg粉末2と比較するために、市販Mg粉末3(株式会社高純度化学製、粒径:180μm pass)を使用した。
Mg粉末3は油中に保存されたものを取り出し、エタノールで洗浄して乾燥したものを使用した。
比表面積の測定値は0.96m2/gであり、それから換算される平均粒径は18μmである。この粒子のSEM写真を図2下段「粉末3」に示し、併せてXRDの測定結果を図3下段「Mg粉末3」に示す。
以上の内容を表1にまとめて示す。
【0018】
【表1】

【0019】
(実施例2)
以下ではこれらのMg粉末と水を反応させて水素を発生させた。その際に発生する水素の量の測定に当たって、以下の方法を採用した。
A.一定容積中の水素ガス濃度変化から測定する方法(ガスクロ方式)
十分な量の水(25℃)にMg粉末を投入した時に発生する水素ガスをガスクロマトグラフ装置に一定時間ごとに採取し水素ガス濃度変化を測定した。図4に示すような反応容器とガスクロマトグラフ装置を連結した装置を作製した。反応容器内には予めMg粉末(100mg)をセットし反応容器上部より約50mlの水を注入し、水素ガスを発生させた。この場合、Mg100mgに対する水素発生に必要な化学量論的な水量は0.15mlであるから、これよりも遥かに多い50ml水量とした。
B.水上置換法による発生水素ガス測定法
十分な水量(100ml)中にMg(100mg)粉末1)および2)を投入すると、投入、数十秒後から水と反応し水素を激しく発生するので、短時間(数秒から10分以内)の水素発生量の測定には水上置換法を採用した。水上置換法の概略図を図5に示す。
すなわち、十分な水量中にMg粉末を投入した場合、投入から短時間の間の水素発生量は水上置換法で、またそれから先の長時間領域ではガスクロ方式で測定を行った。以下では一々このような2段階測定を説明するのは煩雑であるので、測定方法の表記に当たってはガスクロ方式で代表させて記載した。
なお、Mg粉末3)は粒径が大きいため短時間(数秒から10分以内)では水素発生は確認出来なかった。
C.圧力測定方式
Mg粉末に水を滴下して水素を発生させた場合には、図11に示すように、密閉容器内での圧力上昇から水素発生量を求める圧力測定方式を採用した。
【0020】
Mg粉末1、Mg粉末2およびMg粉末3(各々100mg)による水素発生量と時間の関係を図6および図7に示す。図6は長時間(30時間以上)に渡る水素発生量変化を、図7は発生初期の短時間の水素発生量変化を示す。表2に水素発生量と時間の関係を示す。
図6、図7より、本発明によるMg粉末1、2による水素発生量は市販Mg粉末3の30倍以上であることが判明した。なお、本願に言う「水素発生量」とは、別途明示していない限り、水素発生開始からの累積値のことである。
【0021】
【表2】

【0022】
Mg粉末1と水との反応前における粒子形態は、図2上段「Mg粉末1」に示したように、Mg特有の最密6方晶形態である。水と反応後の粉末のSEM写真を図8に、また水と反応後の粉末のXRD回折図を図9に示す。これより、水と反応後にはMgは水酸化マグネシュームMg(OH)2に変化したことがわかる。また、図2中段「Mg粉末2」に示すように、Mg粉末2と水との反応前におけるMg粉末2の粒子形態も、Mg特有の最密6方晶形態であり、水と反応後の粉末は、XRD回折図から、Mg粉末1と同様に水酸化マグネシュームMg(OH)2に変化したものであることを確認した。
【0023】
一方、Mg粉末1、2と水との反応で水素発生後の水溶液は弱アルカリ性を示した。従って、Mg粉末と水が反応して水素を発生する反応は次式で示される。
Mg+2H2O=Mg(OH)2+H2 (1)
【0024】
(1)式の反応が室温で速やかに進行し、1モルのMgから1モルの水素が生成される。
(1)式の反応の場合、MgからMg(OH)2を生成するための反応は熱化学のデータから発熱反応である。しかしながら、Mgと水の反応に当たって、本実施例では十分な量の水の中にMgを投入したので水温が上がるまでには至らなかった。水温が上がると反応速度が増大することが予想される。そこで、水温を25,40,60,70℃に保持した水中(100ml)にMg粉末2を100mg投入した時の水素ガスの発生を時間(秒)に対してプロットしたものを図10に示す。同図より、温度上昇とともに水素ガスの発生が増大することが分かる。
【0025】
(実施例3)
一定容積中の圧力変化から測定する方法
上述の実施例では十分な量の水にMg粉末を投入した時の水素発生量を時間に対して測定した。これに対してMg粉末と水との量的割合を変化させた場合、特にMgに対して少量の水との反応を想定すると、水素発生時には発熱反応を伴うので、当然試料(Mg)の温度が上昇し、水とMgの反応は加速され水素発生速度が増大すると考えられる。そこで図11に示すような反応容器と圧力測定機を連結した装置を作製した。反応容器内には予めMgナノ粒子試料をセットし、注入器を介して連結した水貯めから、任意量の水が滴下される構成になっている。
Mg粉末1(100mg)を図11に示す反応容器に入れ、水(蒸留水)を2.8ml滴下した時の水素発生量と時間の関係を図12および表3(圧力測定方式)に示す。
図12および表3から、水を滴下してから10分経過後の水素発生量は19.5mlである。一方大量の水中からの発生量(ガスクロ方式)は10.5mlである。この両者の比較から反応初期時間における水素発生速度は図11の圧力測定方式(すなわち、Mg粉末試料100mgに蒸留水2.8mlを滴下)の方が大きい値を示している。この原因は発熱反応による影響のためと考えられる。
【0026】
【表3】

【0027】
以上の結果を総合すると、水素発生材料の粒径範囲は1000nm(1μm)以下50nm以上が望ましい。理由は以下の通りである。
理由1:Mg金属粒子の大小にかかわらず反応層膜厚が同一であると仮定すれば、粒径が小さいほど水素発生量が大きくなる。例えば1g、粒径250nmおよび20000nm(20μm)の粒子を比較した場合、それら粒子表面から10nmの深さまで反応したとすると、発生する水素量は204ml/gと2.7ml/gと計算される。このように粒径の差が水素発生量(同一時間)に大きく影響するので、粒径の上限としては1μm程度である。粒径の下限については、本粒子は安定化処理による酸化層があり、その厚さは大約5〜10nmであることを考慮する必要がある。粒径が10nm粒子では水と反応しない酸化物層が大半を占めることになる。よって、粒径の下限は50nmとする。
理由2:Mg粒子は本願で使用した水素あるいは窒素とアルゴンの混合雰囲気でアーク放電によって極めて効率良く作製出来るが、作製されたMg粒子は粒径範囲が1000nm以下(3m2/g超)50nm以上(70m2/g未満)の混合粒子となる。
水素発生材料のより好ましい粒径範囲は、比表面積で表示した場合、4m2/g以上50m2/g以下である。
ただし、酸素を含まない雰囲気であればこの限りでなく、粒子構成の最少単位まで可能である。
【0028】
(実施例4)
実施例2において、Mg粉に代えて圧粉成形したMgペレットを用いた以外は同様の実験を行った。水との接触が良好となり、ペレットから水素が効率よく発生した。
また、Mgよりも比重の大きい金属粉とMg粉を混合した圧粉成形体ペレットを水との反応に使用したところ、ペレット内に閉じ込められたMg粒子は水中に分散することなく、水と反応し集中的にペレットから水素を効率的に発生することが出来た。
なお、Mg粉と相手金属粉と組み合わせにより、水素発生の仕方に変化があることが判明した。
Mg粉末2とMg粉末3に対して相手金属粉としてはAg(銀)、Cu(銅)、Fe(鉄)の3種類を選び、計6種類の組み合わせによるペレットを作製して水との反応による水素の発生状態をテストした。
表4に混合粉材料、Mg粉末粒径、Mg割合および各時間における水素発生量との関係を示す。
図13には各Mg粒子とAg、Cu、Fe混合による時間に対する水素発生量の変化を示す。
以上の結果より、各時間に対する水素発生量は大きく2つのグループに分けられる。水素発生量の大きいグループはMgナノ粒子含有金属粉、水素発生量の小さいグループはMg微粉(20μm)である。両グループ共に、相手金属粉としてAgとの組み合わせが最も水素発生量が大きく、Fe、Cuの順に小さくなる。
この原因が定かではないが、Mg粉と混合した金属粉との間で一種の局部電池が構成された電気化学的挙動によるものであると推定している。したがって、標準電極電位がMgより正方向に大きい金属であれば、Ag、Fe、Cuに限らず、水素発生を促進する作用を有するものと考えている。
【0029】
【表4】

【0030】
(実施例5)
実施例4により、MgとAgとの組み合わせが最も水素が発生し易いことが判明した。
この形態によれば、Mgナノ粒子を簡単にかつ安全に携帯できれば、必要な時に水さえあれば水素を取り出すことが出来る。Mgナノ粒子とAgの配合割合は自由だが、この混合粉の成形体ペレットが簡単に崩れないことが必要である。
ここに一例として、Ag45mg、Mg5mgの成形体(直径3mm)を10mlの水の入ったガラスセルに投下した時の水素の発生の様子のビデオの駒写真を図14に示す。
Mgナノ粒子が微量であっても極めて容易に、10分以内の短時間で水素水となる。
Mgナノ粒子を閉じ込めた金属圧粉体(Ag、Fe、Cu)は持ち運びが出来、必要な時に水、飲料用水溶液(飲料水、ジュース、酒などの水溶液)に投入して水素水を作製できる。
水素放出をし終わった混合成形体は多孔質でありAgベース貴金属の場合には装飾品として使用可能である。
この様なMgナノ粒子を含有した成形体は一種の水素の缶詰のようなものであり、携帯可能となり、移動先で水さえあれば水素ガスを容易に得ることが出来、燃料電池を稼働させることが出来る。水素を発生させた水は還元水素水として利用できる。
【0031】
(実施例6)
以下に、前記Mg粉末1とMg粉末2のようなナノ粒子を用いた、水素発生の制御技術に関して、図15、図16を参照して以下に説明する。
前記Mg粉末1とMg粉末2のような本発明によるMg粒子は、生成当初は綿または油煙のようなもので、その自重により、容易に落下するようなものではない。この生成当初の粒子は、圧密成型することにより、自律保形性を持った自由な形状に成型できるのみならず、空隙率が40%前後となり、さらに、一般に行われている圧密成型時の加圧力では、この空隙率は10%以下に小さくすることは不可能であった。
この空隙率は、水を浸透させるのに十分なものであるから、この圧密成型したものに、水を投与すると、急速に吸収されて水素を発生させることができた。
このような知見に基づき、図15に示す装置では、粒子(P)を、必要とする水素発生量の最小単位(発生水素の用途や装置の稼働環境によって異なる)に合わせた体積で、顆粒状、ペレット状に圧密成型したものを第一例の水素発生剤と呼ぶ。
また、生成当初のMg粒子を無水アルコールに分散させると、媒質との間では無反応であったが、その濃度により液状から固形状に至るまでの間に性状を調整することができた。さらにこの分散体に水を投与すると、水は分散体に急速に吸収されて、水素を発生した。
このような性質を利用して、液状、半固形状若しくは固形状の分散体としたものを第二例の水素発生剤と呼ぶ。
【0032】
図15の調整弁(Ta)は、前記両例の性状に合わせた従来公知の弁を総称したものである。
具体的には、第一例の水素発生剤の一種である圧密粒子又は第二例の水素発生剤の一種である低粘度の液状体を使用する場合には、調整弁(Ta)は、水素発生剤が自重で落下する量を調整できる開閉弁とするのが適切である。
また、第二例の水素発生剤の一種である高粘度液体状、半固形状若しくは固形状のものでは、調整弁(Ta)ha,スクリューフィーダのように、このような水素発生剤を強制的に送り出す機能をもった装置とするのが適切である。
このようにすることで、必要な量の水素を適宜発生させることが可能となる。
【0033】
また、図16における発生床(PB)は、第一例の水素発生剤の一種である圧密成型体を利用したり、第二例の水素発生剤の一種である固形状分散体を利用する場合は、これらの水素発生剤をその密閉容器(C)内の設置場所に合わせた形状に予め成型して用いることができる。
また、第一例の水素発生剤の一種である粒状体や第二例の水素発生剤の一種である固形状分散体を粒状にしたもの、あるいは第二例の水素発生剤の一種である液状体又は半固形状体などの、流動性をもたせた水素発生剤を使用する場合は、密閉容器(C)内に供給することで、発生床(PB)を形成することができる。
前記図15、図16の何れの形態においても、使用済みのMg粒子を密閉容器(C)から取り出す必要があるので、その形態に合わせ、取り出すことができるように開閉口(図外)が設けてある。
粒子(P)又は流動性を持たせた発生床(PB)を用いるときはドレン配管を用いることでこれを達成できるが、水素発生剤を密閉容器(C)内の設置場所に合わせた形状に成型したものでは、当該容器(C)を上下に分断して開口する構造として、その形状を崩さずに取り出し得るような構造とするのが、取り出し作業を迅速、簡便に行う上で望ましい。
また、この後者の構造は、水素発生反応により、粒子(P)の性状が変化して、当初保有していた流動性が失われる可能性のある場合にも利用することができる。
【0034】
また、発生した水素が、全量使用されるとは限らないので、密閉容器(C)に溜まった水素が過剰な高圧とならないように、所定圧力を超えた水素が貯留された場合に、その水素を徐々に外部に放出しながら燃焼する安全機構を追加することも、実用上は有効なものとなる。
【0035】
また、前記水素排出管(B)には、前記密閉容器(C)内の圧力が外圧以上に高くならないと開かない一方弁(図示せず)や圧力感知機能の付いた開閉弁を設置して、前記密閉容器(C)内に外気が流入しないようにし、前記密閉容器(C)内で不測に水素−酸素反応が生じないようにすることも、実用上は有用である。
なお、前記開放型の開口を形成した密封容器(C)では、解放の度に内部の酸素を除去する作業が必要となる。
【符号の説明】
【0036】
1、1’ 反応ガス導入部
2 電極(−)
3 アークプラズマ
4 Mg塊(原料)
5 水冷ハース
6 反応室
7 フィルター
8 循環ポンプ
9 グローブボックス
10 ロータリーポンプ
14 水タンク
14a 調整弁
B 水素排出管
C 密閉容器
P 粒子
PB 発生床
T 貯蔵タンク
Ta 調整弁
W 水
【特許請求の範囲】
【請求項1】
表面が徐酸化処理されたMgナノ粒子を含み、該徐酸化処理されたMgナノ粒子が水と反応して水素を発生する水素発生材料。
【請求項2】
Mgナノ粒子の比表面積が70m2/g未満3m2/g超であることを特徴とする請求項1に記載の水素発生材料。
【請求項3】
標準電極電位がMgよりも正方向に大きな金属の粉末を含むことを特徴とする請求項1または請求項2に記載の水素発生材料。
【請求項4】
標準電極電位がMgよりも正方向に大きな金属が、Ag、CuおよびFeから選ばれた少なくと一種の金属であることを特徴とする請求項3に記載の水素発生材料。
【請求項5】
所定形状に成形した、請求項1から請求項4の何れかに記載の水素発生材料。
【請求項6】
所定形状は粒状またはペレット状である、請求項5に記載の水素発生材料。
【請求項7】
液体中に分散した、請求項1から請求項6の何れかに記載の水素発生材料。
【請求項8】
液体は無水アルコールである、請求項7に記載の水素発生材料。
【請求項9】
少なくとも以下のステップ(ア)および(イ)の工程を備えたことを特徴とする請求項1から請求項8の何れかに記載の水素発生材料の製造方法。
(ア)Mg金属塊を水素、窒素、Arまたは、これらの混合ガス雰囲気中でアーク溶解してMgナノ粒子を得る工程。
(イ)前記Mgナノ粒子の表面を徐酸化処理する工程。
【請求項10】
請求項1から請求項8何れかに記載の水素発生材料と水を反応させて水素を発生させることを特徴とする水素の製造方法。
【請求項11】
水素発生材料を水中に投下させることを特徴とする請求項10に記載の水素の製造方法。
【請求項12】
水素発生材料に水を滴下することを特徴とする請求項10に記載の水素の製造方法。
【請求項13】
水を貯留する水素発生槽と、この水素発生槽に請求項1から請求項8の何れかに記載の水素発生材料を投下する水素発生材料貯留槽とを設けたことを特徴とする水素製造装置。
【請求項14】
請求項1から請求項8の何れかに記載の水素発生材料からなる水透過性の水素発生床を収容する水素発生槽と、
水供給手段と、
前記水素発生槽内に設けられ、前記水供給手段からの水を前記発生床に向けて滴下する滴下口と
を設けたことを特徴とする水素製造装置。
【請求項15】
前記水供給手段と前記滴下口の間に滴下量調整器を設けた、請求項14に記載の水素製造装置。
【請求項1】
表面が徐酸化処理されたMgナノ粒子を含み、該徐酸化処理されたMgナノ粒子が水と反応して水素を発生する水素発生材料。
【請求項2】
Mgナノ粒子の比表面積が70m2/g未満3m2/g超であることを特徴とする請求項1に記載の水素発生材料。
【請求項3】
標準電極電位がMgよりも正方向に大きな金属の粉末を含むことを特徴とする請求項1または請求項2に記載の水素発生材料。
【請求項4】
標準電極電位がMgよりも正方向に大きな金属が、Ag、CuおよびFeから選ばれた少なくと一種の金属であることを特徴とする請求項3に記載の水素発生材料。
【請求項5】
所定形状に成形した、請求項1から請求項4の何れかに記載の水素発生材料。
【請求項6】
所定形状は粒状またはペレット状である、請求項5に記載の水素発生材料。
【請求項7】
液体中に分散した、請求項1から請求項6の何れかに記載の水素発生材料。
【請求項8】
液体は無水アルコールである、請求項7に記載の水素発生材料。
【請求項9】
少なくとも以下のステップ(ア)および(イ)の工程を備えたことを特徴とする請求項1から請求項8の何れかに記載の水素発生材料の製造方法。
(ア)Mg金属塊を水素、窒素、Arまたは、これらの混合ガス雰囲気中でアーク溶解してMgナノ粒子を得る工程。
(イ)前記Mgナノ粒子の表面を徐酸化処理する工程。
【請求項10】
請求項1から請求項8何れかに記載の水素発生材料と水を反応させて水素を発生させることを特徴とする水素の製造方法。
【請求項11】
水素発生材料を水中に投下させることを特徴とする請求項10に記載の水素の製造方法。
【請求項12】
水素発生材料に水を滴下することを特徴とする請求項10に記載の水素の製造方法。
【請求項13】
水を貯留する水素発生槽と、この水素発生槽に請求項1から請求項8の何れかに記載の水素発生材料を投下する水素発生材料貯留槽とを設けたことを特徴とする水素製造装置。
【請求項14】
請求項1から請求項8の何れかに記載の水素発生材料からなる水透過性の水素発生床を収容する水素発生槽と、
水供給手段と、
前記水素発生槽内に設けられ、前記水供給手段からの水を前記発生床に向けて滴下する滴下口と
を設けたことを特徴とする水素製造装置。
【請求項15】
前記水供給手段と前記滴下口の間に滴下量調整器を設けた、請求項14に記載の水素製造装置。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【公開番号】特開2011−225416(P2011−225416A)
【公開日】平成23年11月10日(2011.11.10)
【国際特許分類】
【出願番号】特願2010−118582(P2010−118582)
【出願日】平成22年5月24日(2010.5.24)
【出願人】(301023238)独立行政法人物質・材料研究機構 (1,333)
【Fターム(参考)】
【公開日】平成23年11月10日(2011.11.10)
【国際特許分類】
【出願日】平成22年5月24日(2010.5.24)
【出願人】(301023238)独立行政法人物質・材料研究機構 (1,333)
【Fターム(参考)】
[ Back to top ]

