水素製造方法
【課題】低コストで、水素発生量が従来より多く、しかも安定して長期間にわたって得ることができる水素製造方法を得ることができる。
【解決手段】反応管11の内部に金属酸化物13を加熱機構14をもつガス流路中に取り付け、水素吸蔵(還元)時には、2個の水素ボンベ16の一方を混合器18に導入し、水素ボンベ16の他方を水タンク20にバブリングさせた後混合器18に導入して、混合器18において水素と水とが所定の割合で混合された混合ガスを得、この混合ガスを、電磁弁15を介して反応管11入口に一定の流量で流す。水素放出(酸化)時には、反応管11入口に設けた電磁弁19を介して水を、窒素ボンベ17から窒素ガスを水タンク20にバブリングすることにより供給する。
【解決手段】反応管11の内部に金属酸化物13を加熱機構14をもつガス流路中に取り付け、水素吸蔵(還元)時には、2個の水素ボンベ16の一方を混合器18に導入し、水素ボンベ16の他方を水タンク20にバブリングさせた後混合器18に導入して、混合器18において水素と水とが所定の割合で混合された混合ガスを得、この混合ガスを、電磁弁15を介して反応管11入口に一定の流量で流す。水素放出(酸化)時には、反応管11入口に設けた電磁弁19を介して水を、窒素ボンベ17から窒素ガスを水タンク20にバブリングすることにより供給する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、金属の微粒子と水との反応によって水素を発生させる水素製造方法に関するものである。
【背景技術】
【0002】
金属を還元剤として水を酸化することで水素を発生させる水素製造方法においては、金属−金属酸化物間で酸化還元反応が進行する。上記金属又は金属酸化物としては、反応活性を高めるために粒径が1μm以下の、サイズの小さな粒子が使用され、二次的な粒子の形状としては、取り扱いの容易さから、粉末状、顆粒状、ペレット状、球状又はハニカムなどの形状が使用される。
例えば、コストパフォーマンスの点でも有利な、鉄−酸化鉄系を用いた水素製造方法においては、下記反応式(1)に示す酸化鉄が水素で還元される還元反応と、反応式(2)に示す鉄が水で酸化される酸化反応とを交互に繰り返して施すことで水素が製造される。
【0003】
Fe3O4 + 4H2 → 3Fe + 4H2O ・・(1)
3Fe + 4H2O → Fe3O4 + 4H2 ・・(2)
【0004】
上記鉄又は鉄酸化物を水素発生媒体(酸化還元材料)とする酸化還元反応には熱力学的に数百℃、さらに効率よく反応を進めるためには、350〜500℃程度の高温を必要とするため、酸化還元反応を繰り返すことにより鉄粒子が焼結し、一次粒子間のガスの移動が悪くなって反応が進まず、水素放出の繰り返し特性が著しく低下することが知られている。
そこで、酸化還元の繰り返しによる水素発生媒体(酸化還元材料)の耐久性を向上させるために、鉄又は酸化鉄にTi、Zr、V、Nb、Cr、Mo、Al、Ga等の鉄以外の金属を添加したものを水素発生媒体(酸化還元材料)として用いた水素製造方法が開示されている(例えば特許文献1参照)。
また、水素を発生させる酸化反応時に、水又は水蒸気を、例えば5〜60秒の供給と5〜60秒の停止を繰り返して、断続的に供給することにより、一定量の水素発生量を安定して長時間維持しようとする水素発生方法が開示されている(例えば特許文献2参照)。
【0005】
【特許文献1】国際公開第02/081368号パンフレット(第2頁)
【特許文献2】特開2006−104017号公報(第1頁)
【発明の開示】
【発明が解決しようとする課題】
【0006】
特許文献1に示す水素製造方法では、材料の観点から金属の焼結を抑制する方法を検討したものであって、鉄又は鉄酸化物に酸化還元に寄与しない鉄以外の金属を添加するため、実質的に酸化還元反応に有効な鉄の量が減少し、水素発生量が少なくなくなることや、所定の元素を金属に均質に分散した材料を調製するのに多くのコストが必要となる課題があった。
また、特許文献2の水素発生方法では、酸化反応における水の供給を調整するだけで、還元工程において生じる焼結には対応していないので、長期間にわたって水素を安定して発生できないという課題があった。
【0007】
本発明は、かかる課題を解決するためになされたものであり、低コストで、水素発生量が従来より多く、しかも安定して長期間にわたって得ることができる水素製造方法を得ることを目的とする。
【課題を解決するための手段】
【0008】
本発明に係る水素製造方法は、水素と水との混合ガスと、金属酸化物とを反応させて上記金属酸化物を還元する還元工程を備えた方法である。
【発明の効果】
【0009】
還元工程において、水素と水との混合ガスを用い、還元に用いる水素に水を加えて酸化還元反応の平衡状態をずらし、一定の割合の鉄が酸化物となるようにし、二次粒子表面で還元反応が100%進行することを防止する。それにより、還元反応中に生じる鉄−酸化鉄系二次粒子の焼結を防止し、酸化と還元の繰り返しによる金属又は金属酸化物の焼結を抑制することができ水素発生の繰り返し特性が改善する。
【発明を実施するための最良の形態】
【0010】
実施の形態1.
本発明の実施の形態1の水素製造方法を、鉄―酸化鉄系の例をとって具体的に説明するがこれに限定されず、鉄以外にも、コバルト、ニッケル又は上記鉄族金属に他の金属を添加したもの、並びにその酸化物でも同様の効果が得られる。
鉄−酸化鉄系での水素製造方法においては、上記反応式(1)に示す還元反応と反応式(2)に示す酸化反応とが、高温で繰り返されるため鉄粒子が焼結するが、焼結による特性劣化の問題は、高い反応性を確保しようとして粒径1μm以下の、サイズの小さな鉄の一次粒子を使用するとより深刻となる。
ここで、一次粒子というのは1μm以下の空隙のない粒子を、二次粒子とは一次粒子の凝集体としての粒子を意味し、二次粒子には一次粒子間に存在する空隙を細孔として有する。
つまり、微小サイズの鉄の二次粒子の還元反応を考えると、二次粒子の焼結現象は二次粒子全体で均一に進行するわけではなく、水素ガスが接触しやすい二次粒子の表面近傍が短時間で金属まで還元され、それに伴って焼結が進むが、水素ガスが接触しづらい二次粒子内部は還元に時間がかかるため、二次粒子の内部と表面との還元度、つまり、焼結の度合いに差が生じる。
そのため、水素ガスだけを流した場合は、二次粒子表面は過度に水素ガスで還元された金属鉄の状態となり、隣接する鉄の一次粒子間での焼結が進行して有効な比表面積が低下する。それに伴い、反応式(1)に示すように還元反応時には水が発生するが、特に、二次粒子内部で生じた水は、先に還元され焼結した二次粒子の表面がバリアとなって外部に十分に排出されず、二次粒子の内部はまだ十分に還元されていないにもかかわらず、二次粒子の表面は次々と流れてくる水素ガスによって過還元され、その結果、鉄又は酸化鉄当たりの水素発生量が期待したほど得られないことになる。さらに、二次粒子内部まで即座にかつ完全に還元されるわけではないので、水素吸蔵速度(還元速度)も大きくはならず、還元に長時間を要し、単位時間当たりに必要な水素ガス吸蔵の効率(還元効率)が悪くなる。
【0011】
そこで、本実施の形態において、鉄−酸化鉄系における酸化還元の素反応工程と酸化還元に伴う一次粒子間の焼結とがどのように関係するかを検討したところ、水素によって酸化鉄を金属鉄に還元する還元工程が焼結に大きな影響を与え、還元工程を制御することにより水素発生の繰り返し特性が著しく改善されることを見出した。
従来の水素の製造では、酸化鉄を金属に還元する工程においては、純水素(他成分が何も含まれない水素)を使用するのが常である。水素による還元反応を効率的に進めるため、還元反応を阻害する水はできるだけ除去すべく、水素を乾燥剤などに通過させて露点を下げる努力が行われてきた。又酸化鉄の還元効率を考慮すると、純水素を使用することが最も効率がよいことは言うまでもない。
しかし、本実施の形態の水素の製造においては、還元工程において、水素と水とを混合した混合ガスを用いることにより、酸化還元反応の平衡状態をずらし、一定の割合の鉄が酸化物となるようにして、二次粒子表面で還元反応が100%進行しないようにする。それにより、還元工程で生じる鉄の二次粒子の焼結が防止され、酸化工程と還元工程との繰り返しによる金属又は金属酸化物の焼結が防止されて、水素放出の繰り返し特性が改善される。
【0012】
本実施の形態の還元工程において、反応式(1)に示すように、鉄(Fe)と水とが反応して、二次粒子表面で還元反応を100%進行させるには、反応式(1)において、酸化鉄(Fe3O4)と化学量論的に反応するモル量の水素を用いる必要がある。以下、反応式(1)において、酸化鉄(Fe3O4)と化学量論的に反応する水素のモル量を「化学量論的な水素のモル量」と記載する。
それに対して、還元工程において、上記混合ガスにおける水の割合が、例えば上記化学量論的な水素のモル量の10分の1、つまり、10mol%である場合は、下記反応式(3)で示される酸化反応が生じ、一定の割合の鉄が酸化物となるので、
0.3Fe + 0.4H2O → 0.1Fe3O4 + 0.4H2 ・・(3) 還元工程におけるトータルの反応は下記反応式(4)となり、二次粒子表面で還元反応が100%進行するのが抑制される。
0.9Fe3O4 + 3.6H2 → 2.7Fe + 3.6H2O ・・(4)
【0013】
なお、本実施の形態の還元工程において、上記混合ガスにおける水の割合が、上記化学量論的な水素のモル量に対して、3mol%以上、20mol%以下で調整されるのが望ましい。3mol%未満では供給される水の量が不足して、還元時の一次粒子間の焼結が抑制され難く、期待された効果が得難い。また、20mol%を越える水の量では逆反応が進みすぎて部分的にしか還元されない可能性があり、他の水素貯蔵方式のひとつである水素貯蔵合金の水素貯蔵量程度しか(最大水素貯蔵量2.1wt%以下)達成できなくなり、酸化鉄による水素製造のメリットである優れた水素発生量の実現が困難となる。
【0014】
また、本実施の形態において、還元工程と酸化工程とを可逆的に繰り返して施されるが、焼結を抑制するために、還元工程において施される逆反応(酸化反応)は必ずしも一定の反応速度である必要はなく、むしろ、二次粒子の表面が還元される還元反応の初期段階で逆反応の速度が大きいことが望ましい。そのため、還元工程において、還元開始直後には水の量の割合を増やしておき、二次粒子表面の焼結がある程度抑制された後に水の量を漸次減らしていくことで、トータルとして十分な水素発生量を確保できる。具体的には、本実施の形態において、上記還元工程と酸化工程とが繰り返されるので、上記還元工程の繰り返し回数が増えるに従って上記混合ガス中の水の割合を少なくすることにより対応することができる。なお、還元反応の進行に伴う水の量の変化は、鉄−酸化鉄系粒子の量や、鉄−酸化鉄系粒が充填される反応器の空隙割合などで決まる。
【実施例】
【0015】
実施例1.
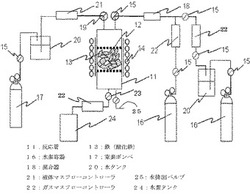
図1は、本実施の形態に用いる水素製造装置の構成図であり、内径20mmのSUS製反応管11の内部に設置された2枚のSUSメッシュ12の間に粒状の金属酸化物13を設置し、これを加熱機構14をもつガス流路中に取り付ける。水素吸蔵(還元)時には、2個の水素ボンベ16からのガスラインの一方をガスマスコントローラ22を経由して直接混合器18に導入し、水素ボンベ16からのガスラインの他方を水タンク20にバブリングさせた後、ガスマスフローコントローラ22を経由して混合器18に導入して、混合器18において水素と水とが所定の割合で混合された混合ガスを得、電磁弁15を介して反応管11入口に一定の流量で流す。還元反応で生成した水(水蒸気)は、水(水蒸気)排出バルブ25を介して反応管11の外に排出される。
【0016】
また、水素放出(酸化)時には、反応管11入口に設けた電磁弁19を介して水を、窒素ボンベ17から窒素ガスを水タンク20にバブリングすることにより供給する。このとき、液体マスフローコントローラ21を経由して、一定の速度で水を反応管11に供給する。ただし、反応管11は高温に加熱されているので、送りこまれた水はただちに水蒸気となる。一方、反応管11出口には、放出される水素量を測定するガスマスフローコントローラ22を設置し、電磁弁23を介して水素容器24に発生した水素ガスを導くことができる。
【0017】
ムライト製磁性るつぼの中に、α−Fe2O3{純度99.9%:和光純薬製(株)製}8gを入れ、軽くタッピングした後、500℃で5時間大気中で加熱した。次に、加熱後の酸化鉄粉末を50メッシュと200メッシュのふるいに順次通過させて、二次粒子径が100μm程度の粒状の凝集酸化物を回収した。
上記凝集酸化物8gを入れた反応管の周囲を400℃に加熱しながら、水素−水混合ガス(水素:水=90:10[mol])を50sccmの流量で流し、60分放置してα−Fe2O3を金属鉄まで還元する(1回目の還元)。
なお、混合ガス中に含まれる水の量はあらかじめ露点計{パナメトリック(株)製}で測定し、水素ガスと水素を水タンクにバブリングさせたガスの混合比を変えることで、混合ガス中の水の量を所望の値にコントロールする。
次に、ガス流路を切り替え、400℃に加熱した反応管に水を0.05cc/minの一定速度で、水素発生速度がゼロになるまで30min間注入した(1回目の酸化)。このとき金属鉄は、Fe3O4まで酸化できることになる。ここで熱力学上、400℃ではFe2O3までは再び酸化しないことが知られている。実際に金属鉄は外観上黒くなっており、これはFe3O4の特徴であり、Fe2O3(赤色)とは異なることを確認した。
なお、反応器出口からでてくる水素の量を時間毎に測定して、トータル水素発生量、および、水素発生速度をモニターする。
【0018】
次に、水素発生速度がゼロになったところで、電磁弁を切り替え、400℃に加熱された反応管に、水素−水混合ガス(水素:水=90:10[mol])を50sccmの流量で、反応管出口のマスフローコントローラの混合ガス流量が50sccmになり、導入した混合ガスが破過するまで、30min間導入する(2回目以降の還元)。
次に、再び電磁弁を切り替え、400℃に加熱した反応管に0.05cc/minの一定速度で水を注入する(2回目以降の酸化)。
上記のようにして水素の吸蔵と放出を繰り返し、1回、100回、1000回酸化後の水素発生量を鉄重量あたりに発生した重量%で測定し結果を表1に示す。理論最大発生量は4.8wt%である。
なお、本実施例において、1000回酸化後、反応管内の酸化物には、焼結はみられず、黒灰色に変化していた。
【0019】
【表1】

【0020】
実施例2.
還元工程において用いる水素−水混合ガスの組成をモル比で、水素:水=97:3とする以外は、実施例1と同様の方法で水素の吸蔵と放出を繰り返し、結果を表1に示す。1000回酸化後、反応管から酸化物を取り出したところ、初期投入時の二次粒子の形態がそのまま維持され、焼結はみられず、黒灰色に変化していた。
【0021】
実施例3.
還元工程において用いる水素−水混合ガスの組成をモル比で、水素:水=80:20とする以外は、実施例1と同様の方法で水素の吸蔵と放出を繰り返し、結果を表1に示す。1000回酸化後、反応管から酸化物を取り出したところ、初期投入時の二次粒子の形態がそのまま維持され、焼結はみられず、黒灰色に変化していた。
【0022】
実施例4.
還元工程において用いる水素−水混合ガスの組成をモル比で、水素:水=70:30とする以外は、実施例1と同様の方法で水素の吸蔵と放出を繰り返し、結果を発生した水素の全量とともに表1に示す。1000回酸化後、反応管から酸化物を取り出したところ、初期投入時の二次粒子の形態がそのまま維持され、焼結はみられず、黒灰色に変化していた。
【0023】
実施例5.
1回目の還元工程において用いる水素−水混合ガスの組成をモル比で、水素:水=70:30とし、その後の還元に用いる水素−水混合ガスの組成を、還元工程の繰り返し回数毎に混合ガスにおける水を0.01mol%ずつ減少させ、水素を0.01mol%ずつ増加させて、混合ガスにおける混合割合を変えて、混合ガスの組成をモル比で、水素:水=95:5となるまで変化させること以外は、実施例1と同様の方法で水素の吸蔵と放出を繰り返し、結果を発生した水素の全量とともに表1に示す。1000回酸化後、反応管から酸化物を取り出したところ、初期投入時の二次粒子の形態がそのまま維持され、焼結はみられず、黒灰色に変化していた。
【0024】
実施例6.
還元工程において、1回目〜30回目の還元に用いる水素−水混合ガスの組成をモル比で、水素:水=70:30とし、31回目〜100回目の還元に用いる水素−水混合ガスの組成をモル比で、水素:水=80:20とし、その後の還元に用いる水素−水混合ガスの組成をモル比で、水素:水=90:10とすること以外は実施例1と同様の方法で水素の吸蔵と放出を繰り返し、結果を水素の全量とともに表1に示す。1000回酸化後、反応管から酸化物を取り出したところ、初期投入時の二次粒子の形態がそのまま維持されており、焼結はみられず、黒灰色に変化していた。
【0025】
比較例1.
還元工程において、水を含まない水素を使用すること以外は実施例1と同様の方法で水素の吸蔵と放出を繰り返し、結果を表1に示す。1000回酸化後、反応管から酸化物取り出したところ、初期投入時の粒状サンプルが焼結してシュリンクしており、数mm程度の黒灰色の塊状形状となっていた。
【0026】
実施例7.
還元工程において用いる水素−水混合ガスの組成をモル比で、水素:水=99:1とする以外は、実施例1と同様の方法で水素の吸蔵と放出を繰り返し、結果を表1に示す。1000回酸化後、反応管から酸化物を取り出したところ、初期投入時の粒状サンプルに一部焼結が見られ、焼結が始まっていることが確認できた。
【0027】
実施例8.
還元工程において用いる水素−水混合ガスの組成をモル比で、水素:水=60:40とする以外は、実施例1と同様の方法で水素の吸蔵と放出を繰り返し、結果を表1に示す。1000回酸化後、反応管から酸化物を取り出したところ、サンプルは焼結していないものの、反応管に入れた凝集体とほぼ同じ大きさではあるが、黒灰色(Fe3O4)の一部に赤色(α−Fe2O3)部分が残存しており、一部還元反応が進んでいないことが確認できた。
【0028】
また、図2は、表1に基づいて得られたものであり、本発明の実施例の水素製造方法の還元工程において、混合ガスにおける水の割合(化学量論的水素のモル量に対する水のモル量[mol%])と、水素の発生量(鉄重量当たりの重量%)との関係を示す特性図で、図中、1、100、1000は、各々1回、100回、1000回繰り返し酸化工程を施した後の上記特性である。
図2に示すように、還元工程において、水を含有しない水素だけで反応を行ったもの(比較例1)は1サイクルにおける水素発生量はほぼ理論値である4.8wt%となり、実施例1〜8に比べて初期の水素発生量は多いが、100サイクル後では水素発生量は実施例1〜8に比べて少なくなり、1000サイクルではさらに少なくなっている。これは水素のみで還元することでサイクルが進むにつれて酸化鉄粒子が強く焼結してしまったことに由来する。
また、混合ガスにおける水の割合が1mol%でやや改善がみられ、3mol%になると、100サイクル、1000サイクルにおいて、水素発生量の増加が顕著となることが示されている。このことから、混合ガスにおける水の割合は3mol%以上であるのが望ましい。このように混合ガスにおける水の割合が増すことで、サイクル特性は著しく改善されるが、図2に示すように、混合ガスにおける水の割合が20mol%を越えると、1サイクル、100サイクル、1000サイクルの各サイクル後の水素発生量の差がほとんどなくなり、水素発生量の経時減少が見られなくなる。しかも、水素発生量の絶対値は化学量論的水素のモル量に対する水のモル量が多くなった分、減少するため、準備した酸化鉄の量に対して十分な水素発生量が得られない結果となるため、化学量論的水素のモル量における水のモル量20%以下であることが望ましい。
【図面の簡単な説明】
【0029】
【図1】本発明の実施の形態1に用いる水素製造装置の構成図である。
【図2】本発明の実施例の水素製造方法において、混合ガスにおける水の割合(mol%)と、鉄重量に対する水素の発生量(wt%)との関係を示す特性図である。
【符号の説明】
【0030】
11 反応管、13 鉄(酸化鉄)、16 水素ボンベ、17 窒素ボンベ、18 混合器、20 水タンク、21 液体マスフローコントローラ、22 ガスマスフローコントローラ、24 水素容器、25 水(水蒸気)排出バルブ。
【技術分野】
【0001】
本発明は、金属の微粒子と水との反応によって水素を発生させる水素製造方法に関するものである。
【背景技術】
【0002】
金属を還元剤として水を酸化することで水素を発生させる水素製造方法においては、金属−金属酸化物間で酸化還元反応が進行する。上記金属又は金属酸化物としては、反応活性を高めるために粒径が1μm以下の、サイズの小さな粒子が使用され、二次的な粒子の形状としては、取り扱いの容易さから、粉末状、顆粒状、ペレット状、球状又はハニカムなどの形状が使用される。
例えば、コストパフォーマンスの点でも有利な、鉄−酸化鉄系を用いた水素製造方法においては、下記反応式(1)に示す酸化鉄が水素で還元される還元反応と、反応式(2)に示す鉄が水で酸化される酸化反応とを交互に繰り返して施すことで水素が製造される。
【0003】
Fe3O4 + 4H2 → 3Fe + 4H2O ・・(1)
3Fe + 4H2O → Fe3O4 + 4H2 ・・(2)
【0004】
上記鉄又は鉄酸化物を水素発生媒体(酸化還元材料)とする酸化還元反応には熱力学的に数百℃、さらに効率よく反応を進めるためには、350〜500℃程度の高温を必要とするため、酸化還元反応を繰り返すことにより鉄粒子が焼結し、一次粒子間のガスの移動が悪くなって反応が進まず、水素放出の繰り返し特性が著しく低下することが知られている。
そこで、酸化還元の繰り返しによる水素発生媒体(酸化還元材料)の耐久性を向上させるために、鉄又は酸化鉄にTi、Zr、V、Nb、Cr、Mo、Al、Ga等の鉄以外の金属を添加したものを水素発生媒体(酸化還元材料)として用いた水素製造方法が開示されている(例えば特許文献1参照)。
また、水素を発生させる酸化反応時に、水又は水蒸気を、例えば5〜60秒の供給と5〜60秒の停止を繰り返して、断続的に供給することにより、一定量の水素発生量を安定して長時間維持しようとする水素発生方法が開示されている(例えば特許文献2参照)。
【0005】
【特許文献1】国際公開第02/081368号パンフレット(第2頁)
【特許文献2】特開2006−104017号公報(第1頁)
【発明の開示】
【発明が解決しようとする課題】
【0006】
特許文献1に示す水素製造方法では、材料の観点から金属の焼結を抑制する方法を検討したものであって、鉄又は鉄酸化物に酸化還元に寄与しない鉄以外の金属を添加するため、実質的に酸化還元反応に有効な鉄の量が減少し、水素発生量が少なくなくなることや、所定の元素を金属に均質に分散した材料を調製するのに多くのコストが必要となる課題があった。
また、特許文献2の水素発生方法では、酸化反応における水の供給を調整するだけで、還元工程において生じる焼結には対応していないので、長期間にわたって水素を安定して発生できないという課題があった。
【0007】
本発明は、かかる課題を解決するためになされたものであり、低コストで、水素発生量が従来より多く、しかも安定して長期間にわたって得ることができる水素製造方法を得ることを目的とする。
【課題を解決するための手段】
【0008】
本発明に係る水素製造方法は、水素と水との混合ガスと、金属酸化物とを反応させて上記金属酸化物を還元する還元工程を備えた方法である。
【発明の効果】
【0009】
還元工程において、水素と水との混合ガスを用い、還元に用いる水素に水を加えて酸化還元反応の平衡状態をずらし、一定の割合の鉄が酸化物となるようにし、二次粒子表面で還元反応が100%進行することを防止する。それにより、還元反応中に生じる鉄−酸化鉄系二次粒子の焼結を防止し、酸化と還元の繰り返しによる金属又は金属酸化物の焼結を抑制することができ水素発生の繰り返し特性が改善する。
【発明を実施するための最良の形態】
【0010】
実施の形態1.
本発明の実施の形態1の水素製造方法を、鉄―酸化鉄系の例をとって具体的に説明するがこれに限定されず、鉄以外にも、コバルト、ニッケル又は上記鉄族金属に他の金属を添加したもの、並びにその酸化物でも同様の効果が得られる。
鉄−酸化鉄系での水素製造方法においては、上記反応式(1)に示す還元反応と反応式(2)に示す酸化反応とが、高温で繰り返されるため鉄粒子が焼結するが、焼結による特性劣化の問題は、高い反応性を確保しようとして粒径1μm以下の、サイズの小さな鉄の一次粒子を使用するとより深刻となる。
ここで、一次粒子というのは1μm以下の空隙のない粒子を、二次粒子とは一次粒子の凝集体としての粒子を意味し、二次粒子には一次粒子間に存在する空隙を細孔として有する。
つまり、微小サイズの鉄の二次粒子の還元反応を考えると、二次粒子の焼結現象は二次粒子全体で均一に進行するわけではなく、水素ガスが接触しやすい二次粒子の表面近傍が短時間で金属まで還元され、それに伴って焼結が進むが、水素ガスが接触しづらい二次粒子内部は還元に時間がかかるため、二次粒子の内部と表面との還元度、つまり、焼結の度合いに差が生じる。
そのため、水素ガスだけを流した場合は、二次粒子表面は過度に水素ガスで還元された金属鉄の状態となり、隣接する鉄の一次粒子間での焼結が進行して有効な比表面積が低下する。それに伴い、反応式(1)に示すように還元反応時には水が発生するが、特に、二次粒子内部で生じた水は、先に還元され焼結した二次粒子の表面がバリアとなって外部に十分に排出されず、二次粒子の内部はまだ十分に還元されていないにもかかわらず、二次粒子の表面は次々と流れてくる水素ガスによって過還元され、その結果、鉄又は酸化鉄当たりの水素発生量が期待したほど得られないことになる。さらに、二次粒子内部まで即座にかつ完全に還元されるわけではないので、水素吸蔵速度(還元速度)も大きくはならず、還元に長時間を要し、単位時間当たりに必要な水素ガス吸蔵の効率(還元効率)が悪くなる。
【0011】
そこで、本実施の形態において、鉄−酸化鉄系における酸化還元の素反応工程と酸化還元に伴う一次粒子間の焼結とがどのように関係するかを検討したところ、水素によって酸化鉄を金属鉄に還元する還元工程が焼結に大きな影響を与え、還元工程を制御することにより水素発生の繰り返し特性が著しく改善されることを見出した。
従来の水素の製造では、酸化鉄を金属に還元する工程においては、純水素(他成分が何も含まれない水素)を使用するのが常である。水素による還元反応を効率的に進めるため、還元反応を阻害する水はできるだけ除去すべく、水素を乾燥剤などに通過させて露点を下げる努力が行われてきた。又酸化鉄の還元効率を考慮すると、純水素を使用することが最も効率がよいことは言うまでもない。
しかし、本実施の形態の水素の製造においては、還元工程において、水素と水とを混合した混合ガスを用いることにより、酸化還元反応の平衡状態をずらし、一定の割合の鉄が酸化物となるようにして、二次粒子表面で還元反応が100%進行しないようにする。それにより、還元工程で生じる鉄の二次粒子の焼結が防止され、酸化工程と還元工程との繰り返しによる金属又は金属酸化物の焼結が防止されて、水素放出の繰り返し特性が改善される。
【0012】
本実施の形態の還元工程において、反応式(1)に示すように、鉄(Fe)と水とが反応して、二次粒子表面で還元反応を100%進行させるには、反応式(1)において、酸化鉄(Fe3O4)と化学量論的に反応するモル量の水素を用いる必要がある。以下、反応式(1)において、酸化鉄(Fe3O4)と化学量論的に反応する水素のモル量を「化学量論的な水素のモル量」と記載する。
それに対して、還元工程において、上記混合ガスにおける水の割合が、例えば上記化学量論的な水素のモル量の10分の1、つまり、10mol%である場合は、下記反応式(3)で示される酸化反応が生じ、一定の割合の鉄が酸化物となるので、
0.3Fe + 0.4H2O → 0.1Fe3O4 + 0.4H2 ・・(3) 還元工程におけるトータルの反応は下記反応式(4)となり、二次粒子表面で還元反応が100%進行するのが抑制される。
0.9Fe3O4 + 3.6H2 → 2.7Fe + 3.6H2O ・・(4)
【0013】
なお、本実施の形態の還元工程において、上記混合ガスにおける水の割合が、上記化学量論的な水素のモル量に対して、3mol%以上、20mol%以下で調整されるのが望ましい。3mol%未満では供給される水の量が不足して、還元時の一次粒子間の焼結が抑制され難く、期待された効果が得難い。また、20mol%を越える水の量では逆反応が進みすぎて部分的にしか還元されない可能性があり、他の水素貯蔵方式のひとつである水素貯蔵合金の水素貯蔵量程度しか(最大水素貯蔵量2.1wt%以下)達成できなくなり、酸化鉄による水素製造のメリットである優れた水素発生量の実現が困難となる。
【0014】
また、本実施の形態において、還元工程と酸化工程とを可逆的に繰り返して施されるが、焼結を抑制するために、還元工程において施される逆反応(酸化反応)は必ずしも一定の反応速度である必要はなく、むしろ、二次粒子の表面が還元される還元反応の初期段階で逆反応の速度が大きいことが望ましい。そのため、還元工程において、還元開始直後には水の量の割合を増やしておき、二次粒子表面の焼結がある程度抑制された後に水の量を漸次減らしていくことで、トータルとして十分な水素発生量を確保できる。具体的には、本実施の形態において、上記還元工程と酸化工程とが繰り返されるので、上記還元工程の繰り返し回数が増えるに従って上記混合ガス中の水の割合を少なくすることにより対応することができる。なお、還元反応の進行に伴う水の量の変化は、鉄−酸化鉄系粒子の量や、鉄−酸化鉄系粒が充填される反応器の空隙割合などで決まる。
【実施例】
【0015】
実施例1.
図1は、本実施の形態に用いる水素製造装置の構成図であり、内径20mmのSUS製反応管11の内部に設置された2枚のSUSメッシュ12の間に粒状の金属酸化物13を設置し、これを加熱機構14をもつガス流路中に取り付ける。水素吸蔵(還元)時には、2個の水素ボンベ16からのガスラインの一方をガスマスコントローラ22を経由して直接混合器18に導入し、水素ボンベ16からのガスラインの他方を水タンク20にバブリングさせた後、ガスマスフローコントローラ22を経由して混合器18に導入して、混合器18において水素と水とが所定の割合で混合された混合ガスを得、電磁弁15を介して反応管11入口に一定の流量で流す。還元反応で生成した水(水蒸気)は、水(水蒸気)排出バルブ25を介して反応管11の外に排出される。
【0016】
また、水素放出(酸化)時には、反応管11入口に設けた電磁弁19を介して水を、窒素ボンベ17から窒素ガスを水タンク20にバブリングすることにより供給する。このとき、液体マスフローコントローラ21を経由して、一定の速度で水を反応管11に供給する。ただし、反応管11は高温に加熱されているので、送りこまれた水はただちに水蒸気となる。一方、反応管11出口には、放出される水素量を測定するガスマスフローコントローラ22を設置し、電磁弁23を介して水素容器24に発生した水素ガスを導くことができる。
【0017】
ムライト製磁性るつぼの中に、α−Fe2O3{純度99.9%:和光純薬製(株)製}8gを入れ、軽くタッピングした後、500℃で5時間大気中で加熱した。次に、加熱後の酸化鉄粉末を50メッシュと200メッシュのふるいに順次通過させて、二次粒子径が100μm程度の粒状の凝集酸化物を回収した。
上記凝集酸化物8gを入れた反応管の周囲を400℃に加熱しながら、水素−水混合ガス(水素:水=90:10[mol])を50sccmの流量で流し、60分放置してα−Fe2O3を金属鉄まで還元する(1回目の還元)。
なお、混合ガス中に含まれる水の量はあらかじめ露点計{パナメトリック(株)製}で測定し、水素ガスと水素を水タンクにバブリングさせたガスの混合比を変えることで、混合ガス中の水の量を所望の値にコントロールする。
次に、ガス流路を切り替え、400℃に加熱した反応管に水を0.05cc/minの一定速度で、水素発生速度がゼロになるまで30min間注入した(1回目の酸化)。このとき金属鉄は、Fe3O4まで酸化できることになる。ここで熱力学上、400℃ではFe2O3までは再び酸化しないことが知られている。実際に金属鉄は外観上黒くなっており、これはFe3O4の特徴であり、Fe2O3(赤色)とは異なることを確認した。
なお、反応器出口からでてくる水素の量を時間毎に測定して、トータル水素発生量、および、水素発生速度をモニターする。
【0018】
次に、水素発生速度がゼロになったところで、電磁弁を切り替え、400℃に加熱された反応管に、水素−水混合ガス(水素:水=90:10[mol])を50sccmの流量で、反応管出口のマスフローコントローラの混合ガス流量が50sccmになり、導入した混合ガスが破過するまで、30min間導入する(2回目以降の還元)。
次に、再び電磁弁を切り替え、400℃に加熱した反応管に0.05cc/minの一定速度で水を注入する(2回目以降の酸化)。
上記のようにして水素の吸蔵と放出を繰り返し、1回、100回、1000回酸化後の水素発生量を鉄重量あたりに発生した重量%で測定し結果を表1に示す。理論最大発生量は4.8wt%である。
なお、本実施例において、1000回酸化後、反応管内の酸化物には、焼結はみられず、黒灰色に変化していた。
【0019】
【表1】

【0020】
実施例2.
還元工程において用いる水素−水混合ガスの組成をモル比で、水素:水=97:3とする以外は、実施例1と同様の方法で水素の吸蔵と放出を繰り返し、結果を表1に示す。1000回酸化後、反応管から酸化物を取り出したところ、初期投入時の二次粒子の形態がそのまま維持され、焼結はみられず、黒灰色に変化していた。
【0021】
実施例3.
還元工程において用いる水素−水混合ガスの組成をモル比で、水素:水=80:20とする以外は、実施例1と同様の方法で水素の吸蔵と放出を繰り返し、結果を表1に示す。1000回酸化後、反応管から酸化物を取り出したところ、初期投入時の二次粒子の形態がそのまま維持され、焼結はみられず、黒灰色に変化していた。
【0022】
実施例4.
還元工程において用いる水素−水混合ガスの組成をモル比で、水素:水=70:30とする以外は、実施例1と同様の方法で水素の吸蔵と放出を繰り返し、結果を発生した水素の全量とともに表1に示す。1000回酸化後、反応管から酸化物を取り出したところ、初期投入時の二次粒子の形態がそのまま維持され、焼結はみられず、黒灰色に変化していた。
【0023】
実施例5.
1回目の還元工程において用いる水素−水混合ガスの組成をモル比で、水素:水=70:30とし、その後の還元に用いる水素−水混合ガスの組成を、還元工程の繰り返し回数毎に混合ガスにおける水を0.01mol%ずつ減少させ、水素を0.01mol%ずつ増加させて、混合ガスにおける混合割合を変えて、混合ガスの組成をモル比で、水素:水=95:5となるまで変化させること以外は、実施例1と同様の方法で水素の吸蔵と放出を繰り返し、結果を発生した水素の全量とともに表1に示す。1000回酸化後、反応管から酸化物を取り出したところ、初期投入時の二次粒子の形態がそのまま維持され、焼結はみられず、黒灰色に変化していた。
【0024】
実施例6.
還元工程において、1回目〜30回目の還元に用いる水素−水混合ガスの組成をモル比で、水素:水=70:30とし、31回目〜100回目の還元に用いる水素−水混合ガスの組成をモル比で、水素:水=80:20とし、その後の還元に用いる水素−水混合ガスの組成をモル比で、水素:水=90:10とすること以外は実施例1と同様の方法で水素の吸蔵と放出を繰り返し、結果を水素の全量とともに表1に示す。1000回酸化後、反応管から酸化物を取り出したところ、初期投入時の二次粒子の形態がそのまま維持されており、焼結はみられず、黒灰色に変化していた。
【0025】
比較例1.
還元工程において、水を含まない水素を使用すること以外は実施例1と同様の方法で水素の吸蔵と放出を繰り返し、結果を表1に示す。1000回酸化後、反応管から酸化物取り出したところ、初期投入時の粒状サンプルが焼結してシュリンクしており、数mm程度の黒灰色の塊状形状となっていた。
【0026】
実施例7.
還元工程において用いる水素−水混合ガスの組成をモル比で、水素:水=99:1とする以外は、実施例1と同様の方法で水素の吸蔵と放出を繰り返し、結果を表1に示す。1000回酸化後、反応管から酸化物を取り出したところ、初期投入時の粒状サンプルに一部焼結が見られ、焼結が始まっていることが確認できた。
【0027】
実施例8.
還元工程において用いる水素−水混合ガスの組成をモル比で、水素:水=60:40とする以外は、実施例1と同様の方法で水素の吸蔵と放出を繰り返し、結果を表1に示す。1000回酸化後、反応管から酸化物を取り出したところ、サンプルは焼結していないものの、反応管に入れた凝集体とほぼ同じ大きさではあるが、黒灰色(Fe3O4)の一部に赤色(α−Fe2O3)部分が残存しており、一部還元反応が進んでいないことが確認できた。
【0028】
また、図2は、表1に基づいて得られたものであり、本発明の実施例の水素製造方法の還元工程において、混合ガスにおける水の割合(化学量論的水素のモル量に対する水のモル量[mol%])と、水素の発生量(鉄重量当たりの重量%)との関係を示す特性図で、図中、1、100、1000は、各々1回、100回、1000回繰り返し酸化工程を施した後の上記特性である。
図2に示すように、還元工程において、水を含有しない水素だけで反応を行ったもの(比較例1)は1サイクルにおける水素発生量はほぼ理論値である4.8wt%となり、実施例1〜8に比べて初期の水素発生量は多いが、100サイクル後では水素発生量は実施例1〜8に比べて少なくなり、1000サイクルではさらに少なくなっている。これは水素のみで還元することでサイクルが進むにつれて酸化鉄粒子が強く焼結してしまったことに由来する。
また、混合ガスにおける水の割合が1mol%でやや改善がみられ、3mol%になると、100サイクル、1000サイクルにおいて、水素発生量の増加が顕著となることが示されている。このことから、混合ガスにおける水の割合は3mol%以上であるのが望ましい。このように混合ガスにおける水の割合が増すことで、サイクル特性は著しく改善されるが、図2に示すように、混合ガスにおける水の割合が20mol%を越えると、1サイクル、100サイクル、1000サイクルの各サイクル後の水素発生量の差がほとんどなくなり、水素発生量の経時減少が見られなくなる。しかも、水素発生量の絶対値は化学量論的水素のモル量に対する水のモル量が多くなった分、減少するため、準備した酸化鉄の量に対して十分な水素発生量が得られない結果となるため、化学量論的水素のモル量における水のモル量20%以下であることが望ましい。
【図面の簡単な説明】
【0029】
【図1】本発明の実施の形態1に用いる水素製造装置の構成図である。
【図2】本発明の実施例の水素製造方法において、混合ガスにおける水の割合(mol%)と、鉄重量に対する水素の発生量(wt%)との関係を示す特性図である。
【符号の説明】
【0030】
11 反応管、13 鉄(酸化鉄)、16 水素ボンベ、17 窒素ボンベ、18 混合器、20 水タンク、21 液体マスフローコントローラ、22 ガスマスフローコントローラ、24 水素容器、25 水(水蒸気)排出バルブ。
【特許請求の範囲】
【請求項1】
水素と水との混合ガスと、金属酸化物とを反応させて上記金属酸化物を還元する還元工程を備えたことを特徴とする水素製造方法。
【請求項2】
水素と水との混合ガスと、金属酸化物とを反応させて上記金属酸化物を還元する還元工程と、金属と水とを反応させて、上記金属を酸化して水素を発生させる酸化工程とを繰り返して施し、上記還元工程の繰り返し回数が増えるに従って、上記還元工程における混合ガス中の水の割合を少なくすることを特徴とする水素製造方法。
【請求項3】
混合ガスにおける水の割合が、還元工程の還元反応において、金属酸化物と化学量論的に反応する水素のモル量に対して、3mol%以上20mol%以下であることを特徴とする請求項1または請求項2に記載の水素製造方法。
【請求項4】
金属酸化物は酸化鉄であることを特徴とする請求項1または請求項2に記載の水素製造方法。
【請求項5】
金属又は金属酸化物の平均粒子径が1μm以下であることを特徴とする請求項1または請求項2に記載の水素製造方法。
【請求項1】
水素と水との混合ガスと、金属酸化物とを反応させて上記金属酸化物を還元する還元工程を備えたことを特徴とする水素製造方法。
【請求項2】
水素と水との混合ガスと、金属酸化物とを反応させて上記金属酸化物を還元する還元工程と、金属と水とを反応させて、上記金属を酸化して水素を発生させる酸化工程とを繰り返して施し、上記還元工程の繰り返し回数が増えるに従って、上記還元工程における混合ガス中の水の割合を少なくすることを特徴とする水素製造方法。
【請求項3】
混合ガスにおける水の割合が、還元工程の還元反応において、金属酸化物と化学量論的に反応する水素のモル量に対して、3mol%以上20mol%以下であることを特徴とする請求項1または請求項2に記載の水素製造方法。
【請求項4】
金属酸化物は酸化鉄であることを特徴とする請求項1または請求項2に記載の水素製造方法。
【請求項5】
金属又は金属酸化物の平均粒子径が1μm以下であることを特徴とする請求項1または請求項2に記載の水素製造方法。
【図1】


【図2】




【図2】


【公開番号】特開2008−150255(P2008−150255A)
【公開日】平成20年7月3日(2008.7.3)
【国際特許分類】
【出願番号】特願2006−341474(P2006−341474)
【出願日】平成18年12月19日(2006.12.19)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 平成18年9月26日 触媒学会発行の「第98回触媒討論会 討論会A予稿集」に発表
【出願人】(000006013)三菱電機株式会社 (33,312)
【出願人】(304021417)国立大学法人東京工業大学 (1,821)
【Fターム(参考)】
【公開日】平成20年7月3日(2008.7.3)
【国際特許分類】
【出願日】平成18年12月19日(2006.12.19)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 平成18年9月26日 触媒学会発行の「第98回触媒討論会 討論会A予稿集」に発表
【出願人】(000006013)三菱電機株式会社 (33,312)
【出願人】(304021417)国立大学法人東京工業大学 (1,821)
【Fターム(参考)】
[ Back to top ]

