水素製造方法
【課題】低コストで、長期間、多量の、しかも安定した水素発生と酸化(貯蔵)とが可能である水素製造方法を得ることができる。
【解決手段】還元工程においては、鉄材13を含有する反応管11に水素16を導入し、液体マスフローメータ25により発生した水の総重量を読み取り過還元になる手前で酸化環境に切り替える。酸化工程においては、鉄材13を含有する反応管11に水を注入し、ガスマスフローメータ28により発生する水素ガスの総流量を読み取り、水分が過剰に投入される手前で還元環境に切り替える。
【解決手段】還元工程においては、鉄材13を含有する反応管11に水素16を導入し、液体マスフローメータ25により発生した水の総重量を読み取り過還元になる手前で酸化環境に切り替える。酸化工程においては、鉄材13を含有する反応管11に水を注入し、ガスマスフローメータ28により発生する水素ガスの総流量を読み取り、水分が過剰に投入される手前で還元環境に切り替える。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、特に鉄等の微粒子と水との反応によって水素を発生させる水素製造方法に関するものである。
【背景技術】
【0002】
鉄−酸化鉄系を用いた水素製造方法は、下記反応式(1)に示す酸化鉄が水素で還元される還元反応と、反応式(2)に示す金属鉄が水で酸化される酸化反応とを交互に繰り返して施すものであり、反応活性を高めるために粒径1μm以下の、サイズの小さな粒子が使用され、二次的な粒子の形状としては、取り扱いの容易さから、粉末状、顆粒状、ペレット状、球状又はハニカムなどの形状が使用される。
【0003】
Fe3O4 + 4H2 → 3Fe + 4H2O ・・(1)
3Fe + 4H2O → Fe3O4 + 4H2 ・・(2)
【0004】
上記鉄−酸化鉄を水素発生媒体(酸化還元材料)とする酸化還元反応には熱力学的に数百℃、さらに効率よく反応を進めるためには、350〜500℃程度の高温を必要とするため、還元反応を繰り返すことにより鉄粒子が焼結し、一次粒子間のガスの移動が悪くなって反応が進まず、水素発生の繰り返し特性が著しく低下することが知られている。
そこで、還元反応時の焼結を抑制し、耐久性を向上させるためのものとして、鉄又は酸化鉄にTi、Zr、V、Nb、Cr、Mo、Al、Ga等の鉄以外の金属を、0.5〜30mol%、より好ましくは0.5〜15mol%添加したものを水素発生媒体(酸化還元材料)として用いた水素製造方法が開示されている(例えば特許文献1参照)。
また、水素を発生させる酸化反応時に、水又は水蒸気を、例えば5〜60秒の供給と5〜60秒の停止を繰り返して、断続的に供給することにより、一定量の水素発生量を安定して長時間維持しようとする水素発生方法が開示されている(例えば特許文献2参照)。
【0005】
【特許文献1】国際公開第02/081368号パンフレット(第2頁)
【特許文献2】特開2006−104017号公報(第1頁)
【発明の開示】
【発明が解決しようとする課題】
【0006】
特許文献1に示す水素製造方法では、水素発生媒体(酸化還元材料)として鉄又は酸化鉄に鉄以外の金属を添加するため、実質的に酸化還元反応に寄与できる有効な鉄の量が減少し、単位重量当たりの水素発生量が低下するという課題があった。また、鉄又は酸化鉄以外の元素は、水素発生媒体に均質に分散して添加され合金化される必要があり、水素発生媒体の調製のために大幅にコストがアップするという課題があった。
また、特許文献1において、閉鎖型ガス循環系反応装置における水素ガスの圧力により、還元のために使われる水素の消費量や水素の発生量を測定して水素発生媒体の還元度を見積もり、所定の還元度において酸化反応と還元反応を終了させている。しかし、系内の圧力を測定することにより還元度を検出するため、測定値が温度など周囲環境の影響を受けて大きく変化し易やすく再現性が悪く、系内の圧力変化を精度良く測定したり、制御することが困難であり、又、耐圧性を有する装置が必要でコストが増大するという課題があった。
また、特許文献2の水素発生方法では、酸化反応における水の供給を、短時間で周期的に繰り返すことにより調整するだけで、水分の過剰投入に対しては何ら対応されていないので、過剰な水分投入により、元来必要とされる以上の、鉄又は酸化鉄の乾燥のための加熱や乾燥剤が用いられ、熱的ロスが生じると共にコスト上不利になる。また、鉄又は酸化鉄中の水分残存量のばらつきはそのまま還元反応のばらつきへも波及し、安定した水素製造が困難になるという課題があった。
【0007】
本発明は、かかる課題を解決するためになされたものであり、低コストで、長期間、多量の、しかも安定した水素発生と酸化(貯蔵)とが可能な水素製造方法を得ることを目的とする。
【課題を解決するための手段】
【0008】
本発明に係る水素製造方法は、金属材と水とを反応させて上記金属材を酸化し、水素を発生させる酸化工程と、金属材と水素とを反応させて上記金属材を還元する還元工程とを交互に繰り返す水素製造方法であって、上記酸化工程および還元工程において、上記金属材の酸化状態を測定し、測定された上記金属材の酸化状態に基づいて、上記還元工程と酸化工程と間の切り替えを施すことを特徴とする方法である。
【発明の効果】
【0009】
還元工程および酸化工程における金属材(金属又は金属酸化物)の酸化状態に基づいて、還元工程と酸化工程との間を、過還元や水分が過剰投入される前に切り替えることができるので、還元工程における過還元による焼結や、酸化工程における水分の過剰投入を防止でき、酸化還元反応を繰り返した後でも、多量の、しかも安定した水素の発生と貯蔵とが可能である。
【発明を実施するための最良の形態】
【0010】
実施の形態1.
従来の鉄−酸化鉄系での水素製造方法においては、還元工程においては、水素又は水素と窒素の混合ガス中で、反応式(1)に示す還元反応が、酸化工程においては、水又は水蒸気中で、反応式(2)に示す酸化反応が、それぞれ予備評価から決めた温度で一定時間毎に、交互に繰り返し施される。
しかし、上記還元工程および酸化工程が繰り返されるに従って、鉄材の焼結状態、水分残存量、粒径分布等が変化するために、上記各工程を、予備評価で決められた一定の温度と時間とで施しても、水素の発生速度(量)や貯蔵速度(量)は毎回ばらつくことになる。
つまり、鉄材の状態は反応が繰り返されることにより変化するものであるのに、一定温度、一定時間で還元工程や酸化工程が施されると、所定の時間までに既に必要な還元反応又は酸化反応が終了しているにも係わらず、余分の水素や水分が供給されて、過還元や水分過多の状態となり、鉄粒子の焼結、熱ロス又は反応ばらつきが生じ、酸化還元反応の繰り返しが100回以上のレベルに達すると水素の発生および貯蔵速度(量)が著しく低下することになる。これは、繰り返される酸化還元の反応の環境が、毎回のそれぞれの反応に供される鉄材の酸化状態に基づいて設定されていないからである。
本実施の形態においては、酸化還元反応によって変化する金属材の状態(酸化状態)を定量的に測定し、上記酸化状態によって還元工程および酸化工程間を、過還元又は水分過多となる前に、随時切り替えることを可能とする。なお、上記酸化状態を、酸化還元反応において発生又は消費される成分量を、測定値が周囲環境の影響を受けにくい、重量又はガス総流量を用いて検出すると精度が向上するため好ましい。
【0011】
本実施の形態においては、金属材として、金属鉄および酸化鉄の少なくとも一方を含有する鉄材を用い、上記還元工程と酸化工程間での切り替えを、上記鉄材の酸化状態をバロメータとして行うが、鉄材の酸化状態を下記のように定義する平均酸化数として算出する。
図1は、本実施の形態の還元工程における、鉄材の平均酸化数を算出する方法を説明する模式図で、反応式(1)で示される還元反応に対応して示す。
図1に示すように、鉄材が全て酸化鉄(Fe3O4)で構成されている時、鉄材の平均酸化数を8/3と定義する。また、1モルの鉄材(Fe3O4)と4モルの水素が反応すると4モルの水が発生し、鉄材(Fe3O4)の全てが金属鉄(Fe0)となり、全て金属鉄となった鉄材の平均酸化数を0と定義する。つまり、反応式(1)に示す反応が化学量論的に進行すると、鉄材の平均酸化数は8/3から0に変化することになる。
【0012】
実施の形態2.
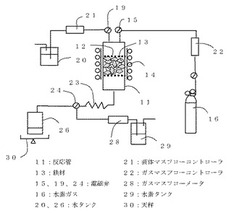
図2は、本発明の実施の形態2に用いる水素製造装置の構成図であり、加熱機構14を備えた反応管11の内部に2枚のSUSメッシュ12が設けられ、メッシュ12間に鉄材13としての粒状の酸化鉄(Fe3O4)を設置してガス流路中に取り入れている。
上記のように鉄材を設置した水素製造装置を用いた水素製造方法において、水素貯蔵時(還元工程)においては、反応管11入口の電磁弁15を介して、水素ガス16をガスマスフローコントローラ22を通過させて反応管11へ一定の流量で流す。水素ガスは、加熱機構14で所定温度に加熱された反応管11内で加熱され、メッシュ12を通って鉄材13と接触し、反応式(1)に従って水素が貯蔵され水蒸気が発生する。水蒸気は放熱コイル23内で冷却されて水となり、電磁弁24を介して水タンク26に導かれる。なお、発生した水蒸気量は結露させた水の総重量を天秤30で測定する。
また、水素貯蔵量は、導入された水素ガス総流量と反応管11で反応しきれずに排出された水素ガス総流量(ガスマスフローメータ28で測定)との差から測定する。
【0013】
一方、水素発生時(酸化工程)においては、反応管11入口には電磁弁19を介して、水タンク20から液体マスフローコントローラ21を通過させて一定の速度で水を供給する。ここで、反応管11は、水が水蒸気になるのに十分な温度(100℃以上)に加熱機構14で加熱されており、反応管11に送りこまれた水はただちに水蒸気となる。一方、発生した水素ガスを反応管11出口からガスマスフローメータ28を介して水素タンク29に導き、ガスマスフローメータ28により発生した水素ガス総流量を測定する。
また、図示はしていないが、本実施の形態の水素製造装置の反応管11にロードセルを取付けることにより、鉄材の重量を測定することができる。
【0014】
還元工程における鉄材の平均酸化数の算出方法1(水の総重量による算出方法)
還元工程において、発生した水の総重量を測定することによる鉄材の平均酸化数の算出方法を説明する。
還元工程における反応は化学量論的には反応式(1)に従って進行し、投入した鉄材が全て酸化鉄(Fe3O4)で、その量がXモルであるとする。
図1に示すように、反応開始から生成した水の総重量がaR1グラムであるとすると、そのモル量AR1は、AR1モル=aR1グラム/18グラムとなるので、XモルのFe3O4の内、金属鉄に変化したのはAR1×3/4モルとなる。ここで、下付き文字の「R1」は1回目の還元(Reduction)工程、後述する下付き文字の「O1」は1回目の酸化(Oxidation)工程での測定値であることを示す。
XモルのFe3O4が全て反応すると3Xモルの金属鉄(Fe0)となり、平均酸化数は8/3から0になる。ここで、生成した水の総モル量であるAR1に対して、AR1×3/4モルの金属鉄が生成しているので、XモルのFe3O4の内、aR1グラムの水を生成する時点までに還元された分は3Xモルに対するAR1×3/4モルとなり、減少した鉄材の平均酸化数は(8/3)×{AR1/(4X)}となる。これは上記鉄材において、還元反応により減少した分の平均酸化数であるので、結局、この時点での鉄材の平均酸化数ZR1は下式で示される。
ZR1=8/3×[1−{AR1/(4X)}]
以上により、水素貯蔵時(還元工程)の反応では、生成した水の総重量を測定することによって、鉄材の平均酸化数を決定することができる。
【0015】
還元工程における鉄材の平均酸化数の算出方法2(水素ガス総流量による算出方法)
還元工程において、貯蔵された水素ガスの総流量を測定することによる鉄材の平均酸化数の算出方法を説明する。
図1に示すように、還元工程における反応は化学量論的には反応式(1)に従って進行し、投入した鉄材が全て酸化鉄(Fe3O4)で、その量がXモルであるとする。
水素ガスの流量は、ガスマスフローメーターにより標準状態流量[以下、sccm{standard cc/min、1atm(大気圧1,013hPa)、0℃}と示す。]として測定され、還元反応において貯蔵された水素ガスの総流量bR1(sccm)は、導入水素総流量と排出水素総流量との差から求め、これより貯蔵された水素のモル量BR1を算出する。
図1に示すように、還元反応において貯蔵された水素と生成した水のモル量とは同じであるので、反応式(1)に示されるように、水素のモル量BR1は、生成した水のモル量AR1と同じとなり、上記と同様にして、BR1(=AR1)モルの水素が貯蔵された時点での鉄材の平均酸化数ZR1は下式で示される。
ZR1=8/3×[1−{BR1/(4X)}]
以上により、還元工程において、水素の貯蔵量からその場で鉄材の平均酸化数を測定できる。
【0016】
還元工程における鉄材の平均酸化数の算出方法3(鉄材の重量による算出方法)
還元工程において、減少した鉄材の重量による鉄材の平均酸化数の算出方法を説明する。図4は、本実施の形態における、鉄材の平均酸化数を算出する方法を説明する模式図で、反応式(1)で示される還元反応に対応して示す。
還元工程における反応は化学量論的には反応式(1)に従って進行し、投入した鉄材が全て酸化鉄(Fe3O4)で、その量がXモルであるとする。
図4に示すように、還元工程における反応の開始から鉄材の重量を測定し、鉄材がcR1グラム減少したとすると、その重量減少分は還元により鉄材から除去された酸素と考えられるので、減少した酸素原子モル量CR1はCR1=cR1グラム/16グラムとなる。
これから、Xモル中のFe3O4に含まれる酸素原子モル(4Xモル)の内の、CR1モルが還元されたことになるから、還元後は、(4X−CR1)モルの酸素が鉄と結びついてFe3O4となっていることになるので、鉄材がcR1グラム減少した時点での鉄材の平均酸化数ZR1は下式で示される。
ZR1=8/3×{(4X−CR1)/(4X)}
以上により、還元工程における反応は、鉄材の重量からその場で鉄材の平均酸化数を測定できる。
【0017】
酸化工程における鉄材料の平均酸化数の算出方法4(水素ガス総流量による算出方法)
酸化工程において、発生した水素の総流量を測定することによる鉄材の平均酸化数の算出方法を説明する。
図3は、本実施の形態の酸化工程における、鉄材の平均酸化数を算出する方法を説明する模式図で、反応式(2)で示される酸化反応に対応して示す。
酸化工程における反応は化学量論的には反応式(2)に従って進行し、鉄材が全て金属鉄(Fe0)で、その量がYモルであるとする。
図3に示すように、酸化反応は化学量論的には反応式(2)に従って進行し、ガスマスフローメーターにより測定された標準状態流量(sccm)として、酸化工程における反応開始からの水素ガス総流量dO1(sccm)を求め、この発生した水素ガスのモル量をDO1とする。ここで、DO1モルの水素を発生したのであるから、発生した酸化鉄(Fe3O4)はDO1/4モルとなる。Yモルの金属鉄(Fe0)が全て反応するとY/3モルの酸化鉄(Fe3O4)が生成して、鉄材の平均酸化数は0から8/3になるのであるから、今、DO1/4モルの酸化鉄が生成しているということは、酸化された金属鉄(Fe0)はY/3モルに対するDO1/4モルとなり、増加した鉄材の平均酸化数は(8/3)×{3DO1/(4Y)}となり、結局、発生した水素ガスの総流量がdO1(sccm)である時点での鉄材の平均酸化数ZO1は下式で示される。
ZO1=(8/3)×{3BO1/(4Y)}
以上により、酸化工程における水素の発生量からその場で、鉄材の平均酸化数を測定できる。
【0018】
酸化工程における鉄材の平均酸化数の算出方法5(鉄材の重量変化による算出方法)
酸化工程において、増加した鉄材の重量を測定することによる鉄材の平均酸化数の算出方法を説明する。
酸化工程における反応は化学量論的には反応式(2)に従って進行し、投入した鉄材が全て金属鉄(Fe0)で、その量がYモルであるとする。
図3に示すように、酸化反応は化学量論的には反応式(2)に従って進行し、酸化工程における反応開始からの鉄材の増加量がeO1グラムであるとすると、その重量増加分は鉄材の金属鉄が酸化鉄に酸化された分であると考えられるので、増加した酸素原子モル量EO1はEO1=eO1グラム/16グラムとなる。
これから、Yモル金属鉄(Fe0)の一部とEO1モル分の酸素原子が結合してFe3O4となるので、鉄材がeO1グラム増加した時点での鉄材の平均酸化数ZO1は下式で示される。
ZO1=(8/3)×{3EO1/(4Y)}
以上により、酸化工程における鉄材の重量変化から鉄材の平均酸化数を測定できる。
【0019】
上記鉄材の平均酸化数の算出方法1〜5は、還元工程において用いられる鉄材が全て酸化鉄(Fe3O4)で、これが全て金属鉄(Fe0)となり、また、酸化工程において用いられる鉄材が全て金属鉄(Fe0)で、これが全て酸化鉄(Fe3O4)となるとして得られた方法である。
1回目の還元工程においては、上記算出方法により鉄材の平均酸化数を算出することができるが、本実施の形態の水素製造方法では、上記還元工程と酸化工程とが繰り返し施されるのであり、2回目以降の還元工程に用いられる鉄材が全て酸化鉄(Fe3O4)であり、酸化工程において用いられる鉄材が全て金属鉄(Fe0)であるとは限らない。
例えば、1回目の還元工程を経て、次の酸化工程で用いられる鉄材は、全てが金属鉄(Fe0)ではなく、平均酸化数ZR1の鉄材である。
以下、還元工程と酸化工程が交互に繰り返される場合の鉄材の平均酸化数の算出方法について詳細に説明する。
【0020】
還元工程と酸化工程が交互に繰り返される場合の鉄材の平均酸化数の算出方法
上記算出方法により、1回目の還元工程においては、鉄材の平均酸化数はZR1と算出される。1回目の酸化工程は、上記1回目の還元工程に引き続いて生じ、2回目の還元工程は1回目の酸化工程に引き続いて生じる。そのため、酸化工程(または還元工程)における平均酸化数の算出は、その直前の還元工程(または酸化工程)で発生した金属鉄Fe0(またはFe3O4)の量、すなわち、上記Y(またはX)の値をその直前で算出された平均酸化数ZR1(またはZO1)を基に算出しておく必要がある。
【0021】
次に、還元工程と酸化工程が交互に繰り返される場合の鉄材の平均酸化数の算出方法について説明する。本実施の形態においては、生成する水の総重量による算出方法1を用いて還元工程での鉄材の平均酸化数を算出し、発生する水素ガス総流量による算出方法4を用いて酸化工程での鉄材の平均酸化数を算出した。
初期投入した鉄材の全てが酸化鉄(Fe3O4)でその量がXモルであると、1回目の還元工程において、鉄材の平均酸化数がZR1と示され、1回目の酸化工程開始時の金属鉄(Fe0)のモル量であるYO1は下式で示される。
YO1=3X−{ZR1/(8/3)×3X}
=3X×[1−{ZR1/(8/3)}]
DO1モルの水素発生を伴う1回目の酸化工程時の平均酸化数ZO1は、前式に代入して、
ZO1=(8/3)/[3DO1/{4×3X×(1−(ZR1/(8/3))}] =4X(8−3ZR1)/(3DO1)
となる。
上記のように、1回目の還元工程から続いて施された酸化工程による、鉄材の平均酸化数の変化は、1回目の還元工程が施された後の平均酸化数ZR1と1回目の酸化工程で測定された水素発生量DO1モルを使って算出することができる。
【0022】
また2回目の還元工程のスタート時点での鉄材は、平均酸化数ZO1で示される酸化状態であり、この酸化状態の鉄材に対して還元反応が生じるため、2回目の還元工程における反応開始時のFe3O4のモル量XR2は、
XR2=X×{ZO1/(8/3)}
となるので、2回目の還元工程における平均酸化数ZR2は、2回目の還元工程時に発生した水のモル量AR2を用いて、
ZR2=8/3×[1−{AR1/(4X×(ZO1/(8/3))}]
=(8/3)×{1−(2AR1)/(3XZO1)}
となる。
上記のように、1回目の酸化工程から続いて施された2回目の還元工程による、鉄材の平均酸化数の変化は、1回目の酸化工程が施された後の平均酸化数ZO1と2回目の還元化工程で測定された水素発生量AR1モルを使って算出することができる。
【0023】
上記のように、還元工程と酸化工程が繰り返して施される場合には、N回目の繰り返し反応に伴う平均酸化数は、(N−1)回目の平均酸化数を用いて示すことができる。すなわち、N回目の還元工程後の平均酸化数ZRNは、例えば、N回目の還元工程で生成した水のモル量ARN[モル]を使って、
ZRN=(8/3)×{1−(2ARN)/(3XZO(N−1))}と示され、N回目の酸化工程後の平均酸化数ZONは、例えば、N回目の酸化工程で得られた測定量AON[モル]を使って、
ZON=4X(8−3ZR(N−1))/(3BON)
と示される。
【0024】
実施の形態3.
図2に示す水素製造装置における、反応管11に原料となる酸化鉄(α−Fe2O3)を入れて、400℃で周囲を加熱しながら水素ガスを50sccmの流量で流し、60分間放置した。これにより、α−Fe2O3が金属鉄まで還元されたことを外観から確認した。このとき、理論上金属の酸化数は3から0まで変化したことになる。
次に、還元反応環境から、400℃に加熱した反応管に0.05cc/minの一定速度で水を注入して酸化環境に切り替え、水素発生量が0になるまで十分反応させた。このとき反応式(2)に従ってFe(価数0)は、水素を発生しながらFe3O4(価数8/3)まで酸化できる。ここで熱力学上、400℃ではFe2O3(価数3)までは再び酸化しないことが知られている。外観上黒くなっており、これはFe3O4の特徴であり、Fe2O3(赤色)とは異なることを確認した。
以上までを“慣らし運転”として、繰り返し運転のサイクル数には含めないものとし、上記慣らし運転後、以下の運転条件1に従って、還元工程と酸化工程を切り替えて繰り返し、酸化工程を、1回、100回、1000回施した後の水素ガス総流量を測定し、金属鉄あたりの水素発生量(wt%)として表1に示す。
【0025】
■運転条件1
(還元工程):400℃に加熱された反応管に水素を50sccmの流量で導入し、5秒毎にガスマスフローコントローラ22の値から水素ガス総流量を読み取り、上記算出方法2により鉄材の平均酸化数に換算して、鉄材の平均酸化数が0になる手前で酸化反応環境に切り替える。
(酸化工程):上記還元工程後、電磁弁を切り替え、390℃に加熱した反応管に0.05cc/minの一定速度で水を注入し、5秒毎にガスフローメータ28の値から水素ガス総流量を読み取り、上記算出方法4により鉄材の平均酸化数に換算して鉄材の平均酸化数が8/3になる手前で還元反応環境に切り替える。
【0026】
上記反応式(1)に示す還元反応が100%進行して鉄材が全て金属鉄になった状態では鉄材の平均酸化数が0となるが、実質的には測定値が「0」となる瞬間に切り替えることは困難であり、測定値が「0」となった時点では、反応が100%進行して全てが金属鉄となっているのに水素が供給されている状態、即ち過還元の状態となるので、本明細書において、平均酸化数が0と測定された鉄材の状態は、上記過還元の状態を指す。そこで、本実施の形態における鉄材の平均酸化数が0になる手前とは、反応が100%進行して全て金属鉄になる直前を意味し、実施の形態においては、鉄材の平均酸化数が0.01で切り替えることにより対応している。
また、上記反応式(2)に示す酸化反応が100%進行して鉄材が全て酸化鉄になった状態では、鉄材の平均酸化数は8/3となる。しかし、実質的には、測定値が8/3となる瞬間に切り替えることは困難であり、測定値が「8/3」となった時点では、反応が100%進行して全てが酸化鉄となっているのに水が供給されている状態、即ち水分過多の状態となり、本明細書において、平均酸化数8/3と測定された鉄材の状態は、上記水分過多の状態を指す。そこで、本実施の形態における鉄材の平均酸化数が8/3になる手前とは、反応が100%進行して全て酸化鉄になる直前を意味し、具体的には、実施の形態においては、鉄材の平均酸化数が2.66で切り替えることにより対応している。
【0027】
比較例1.
実施の形態3と同様に慣らし運転を行った後、以下の運転条件2に従って、還元工程と酸化工程を切り替えて繰り返し、酸化工程を1回、100回、1000回施した後の水素ガス総流量を測定し、金属鉄重量あたりの水素発生量として(wt%)として表1に示す。
【0028】
■運転条件2
(還元工程):400℃に加熱された反応管に水素を50sccmの流量で導入する。40分程度で水素発生速度が0になり、反応管出口のガスマスフローメータ28のガス流量が50sccmになり、導入した水素ガスが破過することを確認した。これに基づき、400℃に加熱された反応管に水素を50sccmの流量で導入し40分間流す。
(酸化工程):上記還元工程後、電磁弁を切り替え、390℃に加熱した反応管に0.05cc/minの一定速度で水を注入すると水素が発生するが、30分程度でほとんど水素発生速度が0になることを確認した。これにより、390℃に加熱された反応管に水を0.05cc/minの速度で30分間流す。
【0029】
【表1】

【0030】
表1に示されるように、実施の形態3のように、鉄の平均酸化数が、鉄材の全てが金属鉄になり、鉄材の平均酸化数が0になる直前から、鉄材の全てが酸化鉄になり、鉄材の平均酸化数が8/3になる直前の間である、0を超え8/3未満の間で毎回酸化と還元を繰り返し運転したものは、一定の温度、一定時間(例えば、還元工程40分間、酸化工程30分間)ごとに運転を切り替えた比較例1と比較して、繰り返しによる水素発生量の低下が著しく抑制され、1回目の水素発生量に対する、所定サイクル数後の水素発生量の比(=低下抑制率と定義する。)が大きいことがわかる。
また、還元工程および酸化工程での温度や時間の条件を変化させて、実施の形態3又は比較例1と同様にして水素の発生量を測定したが、いずれの場合にも、鉄材の平均酸化数が0を超え8/3未満の間で毎回酸化と還元を繰り返し運転したものの方が、上記低下抑制率が大きいことが確認された。
【0031】
実施の形態4.
実施の形態3に用いた水素製造装置の反応管11に1グラム(実施の形態4−1)、10グラム(実施の形態4−2)又は100グラム(実施の形態4−3)の鉄材(α−Fe2O3)を入れて、実施の形態3と同様にして慣らし運転を行い、上記慣らし運転後、以下の運転条件3に従って、還元工程と酸化工程を切り替えて繰り返し、酸化工程を1回、100回、1000回施した後の水素ガス総流量を測定し、金属鉄あたりの水素発生量(wt%)として表2に示す。
【0032】
■運転条件3
(還元工程):380℃に加熱された反応管に水素を80sccmの流量で導入し、5秒毎にガスマスフローコントローラ22とガスマスフローメータ28とで導入水素量と排出水素量とを測定し、その差から算出方法2により算出した鉄材の平均酸化数が0となる手前で、酸化反応環境に切り替える。
(酸化工程):375℃に加熱された反応管に0.15cc/minの一定速度で水を注入し、5秒毎にガスフローメータ28の値から算出方法4により算出した鉄材の平均酸化数が8/3になる手前で還元反応環境に切り替える。
【0033】
実施の形態5.
実施の形態3に用いた水素製造装置の反応器11にロードセルを取付け、鉄材13の重量変化をその場で測定可能となるように装置を改造した。
上記ロードセルを取付けた反応管11に1グラム(実施の形態5−1)、10グラム(実施の形態5−2)又は100グラム(実施の形態5−3)の鉄材(α−Fe2O3)を入れて、実施の形態3と同様にして慣らし運転を行い、上記慣らし運転後、以下の運転条件4に従って、還元工程と酸化工程を切り替えて繰り返し、酸化工程を1回、100回、1000回施した後の水素ガス総流量を測定した。金属鉄重量あたりの水素発生量(wt%)として表2に示す。
【0034】
■運転条件4
(還元工程):380℃に加熱された反応管に水素を80sccmの流量で導入し、5秒毎にロードセルで測定する鉄材の重量変化から、算出方法3により算出した鉄材の平均酸化数が0となる手前で酸化反応環境に切り替える。
(酸化工程):375℃に加熱された反応管に0.15cc/minの一定速度で水を注入し、5秒毎にロードセルで測定している鉄材の重量変化から算出方法5により算出した鉄材の平均酸化数が8/3となる手前で還元反応環境に切り替える。
【0035】
比較例2〜4.
実施の形態5に用いたロードセルを取付けた反応管11に1グラム(比較例2)、10グラム(比較例3)又は100グラム(比較例4)の鉄材(α−Fe2O3)を入れて、実施の形態3と同様にして慣らし運転を行い、上記慣らし運転後、以下の運転条件5に従って、還元工程と酸化工程を切り替えて繰り返し、酸化工程を1回、100回、1000回施した後の水素ガス総流量を測定し、金属鉄あたりの水素発生量(wt%)として表2に示す。
【0036】
■運転条件5
(還元工程):380℃に加熱された反応管に水素を80sccmの流量で導入し、酸化鉄の重量が1グラム(比較例2)の場合は75分、10グラム(比較例3)の場合は78分、100グラム(比較例4)の場合は85分ほど経過すると水素発生速度が0になり、ガスマスフローメータ28のガス流量が80sccmになり、導入水素ガスが破過することを確認した。これに基づき、380℃に加熱された反応管に水素を80sccmの流量で導入し、酸化鉄の重量が1グラムの場合は75分間、10グラムの場合は78分間、100グラムの場合は85分間加熱する。
(酸化工程):上記還元反応後電磁弁を切り替え、375℃に加熱した反応管に0.15cc/minの一定速度で水を注した。水素が発生するが、1グラム(比較例2)の場合は65分、10グラム(比較例3)の場合は70分、100グラム(比較例4)の場合は80分ほど経過するとほとんど水素発生速度が0になることを確認した。これより、375℃に加熱した反応管に水を0.15cc/minで導入し、酸化鉄が1グラムの場合は65分間、10グラムの場合は70分間、100グラムの場合は80分間加熱する。
【0037】
【表2】

【0038】
表2に示すように、実施の形態4−1〜3、実施の形態5−1〜3は、同一温度で、一定時間ごとに運転を切り替えた比較例2〜4と比較して、低下抑制率が大きく、繰り返しによる水素発生量の低下が著しく抑制されるのがわかる。
【0039】
また、上記実施の形態4と実施の形態5に示されるように、還元工程および酸化工程間の切り替えを、運転条件4(算出方法3、5)で得られた鉄材の平均酸化数に基づき施した場合と、運転条件3(算出方法2、4)で得られた鉄材の平均酸化数に基づき施した場合とにおいて、鉄材の平均酸化数が0を超え8/3未満の間で毎回酸化と還元を繰り返し運転したものが優れているという、同様の結果が得られることがわかる。
【0040】
実施の形態6.
実施の形態3と同様にして慣らし運転を行い、上記慣らし運転後、以下の運転条件6に従って、還元工程と酸化工程を切り替えて繰り返し、酸化工程を1回、1000回施した後の水素ガス総流量を測定し、金属鉄あたりの水素発生量(wt%)として、又これらの比(=1000回目の発生水素量/1回目の発生水素量(%)=低下抑制率)を算出して表3に示す。また、還元工程から酸化工程への切り替え時の鉄材の平均酸化数と、1回目と1000回目の酸化後の水素発生量の比(低下抑制率)および1回目の酸化後の水素発生量との関係を図5に示す。
【0041】
■運転条件6
(還元工程):390℃に加熱された反応管に水素を60sccmの流量で導入し、5秒毎にガスマスフローコントローラ22とガスマスフローメータ28とでそれぞれ導入水素量と排出水素量を測定し、その差から算出方法2により算出した鉄材の平均酸化数が、0(比較例5)、0.01(実施の形態6−1)、0.05(実施の形態6−2)、0.10(実施の形態6−3)、0.25(実施の形態6−4)、0.50(実施の形態6−5)、0.75(実施の形態6−6)、1.00(実施の形態6−7)となったところで酸化反応環境に切り替える。
(酸化工程):385℃に加熱された反応管に0.15cc/minの一定速度で水を注入し、5秒毎にガスマスフローメータ28の値から水素ガス総流量を読み取り、算出方法4により算出した鉄材の平均酸化数が2.65の値になったところで還元反応環境に切り替える。
【0042】
【表3】

【0043】
表3と図5に示すように、比較例5は、還元から酸化に切り替える時の鉄材の平均酸化数が0で、酸化から還元に切り替える時の鉄材の平均酸化数が2.65であり、1回目の酸化後の水素発生量は4.3wt%となったが、1000回目の繰り返しにより、1000回目の酸化後の水素発生量は1.6wt%と大きく低下した。
一方、本実施の形態6−1〜7は、酸化から還元に切り替える時の鉄材の平均酸化数が2.65で、還元から酸化に切り替える時の鉄材の平均酸化数が0.01以上であると、比較例5に比べて、低下抑制率が向上し、1000回の繰り返しによる水素発生速度の低下が大きく抑制される。また、還元から酸化に切り替える時の鉄材の平均酸化数が0.3以上で水素発生の低下抑制効果が顕著に現れるが、大きすぎると1回目から水素の発生量が少なくなり工業的に不利となる。また、水素貯蔵合金の水素貯蔵量が金属鉄重量あたり2wt%程度であることを考えると、還元から酸化に切り替える時の鉄材の平均酸化数は0.8以下であることが望ましい。
以上より、還元から酸化に切り替える時の鉄材の平均酸化数は0.01以上が望ましく、0.3以上、0.8以下がより望ましいことが示される。
さらに、酸化から還元に切り替える時のFe材の平均酸化数を2.00、2.25、2.40、2.55又は2.66にして、本実施の形態と同様の評価を実施したところ、本実施の形態と同様の効果を確認した。
【0044】
実施の形態7.
実施の形態3と同様にして慣らし運転を行い、上記慣らし運転後、以下の運転条件7に従って、還元工程と酸化工程を切り替えて繰り返し、酸化工程を1回、1000回施した後の水素発生量を測定し、金属鉄重量あたりの水素発生量(wt%)として、これらの比(=1000回目の発生水素量/1回目の発生水素量(%)=低下抑制率)を算出して表4に示す。また、還元工程から酸化工程への切り替え時の鉄材の平均酸化数と、1回目と1000回目の酸化後の水素発生量の比(低下抑制率)および1回目の酸化後の水素発生量との関係を図6に示す。
【0045】
■運転条件7
(還元工程):390℃に加熱された反応管に水素を60sccmの流量で導入し、5秒毎に導入水素量と、ガスマスフローメータ28で排出水素量を測定し、その差から算出方法2により算出した鉄材の平均酸化数が0.50となったところで酸化反応環境に切り替える。
(酸化工程):385℃に加熱された反応管に0.15cc/minの一定速度で水を注入し、5秒毎にガスマスフローメータ28の値から水素ガス総流量を読み取り、算出方法4により算出した鉄材の平均酸化数が、1.50(実施の形態7−1)、1.75(実施の形態7−2)、2.00(実施の形態7−3)、2.25(実施の形態7−4)、2.50(実施の形態7−5)、2.65(実施の形態7−6)、2.67(比較例6)の値になったところで還元反応環境に切り替える。
【0046】
【表4】

【0047】
表4と図6に示すように、比較例6は、酸化から還元に切り替える時の鉄材の平均酸化数が2.67であり、水素発生の低下抑制率が大きく低下するが、本実施の形態7−1〜6は、酸化から還元に切り替える時の鉄材の平均酸化数が8/3未満であり、低下抑制率が向上し、2.50以下とすることでより顕著となることがわかる。
しかし酸化から還元に切り替える時の鉄材の平均酸化数を小さくしすぎると発生水素量が小さくなり、工業的に不利となる。水素貯蔵合金に対する優位を維持するためには、2.00以上が望ましい。
なお、同様の評価を還元から酸化に切り替える時の鉄材の平均酸化数を0.01、0.10、0.25、0.75又は1.00の場合についても実施したが、同様の効果を確認した。
【0048】
上記のように、上記実施の形態に示す試料の重量、体積、形状、雰囲気ガス圧、ガスの流量および加熱温度等の反応条件により、本発明を説明したが、本発明に係わる鉄材の平均酸化数は、上記各反応条件を反映したものであるので、他の各反応条件でも同様の効果が得られることは明白である。
さらに試料の平均結晶粒径が小さいほど顕著に効果が得られることは、容易に類推できる。
【図面の簡単な説明】
【0049】
【図1】本発明の実施の形態1における、鉄材の平均酸化数を算出する方法を説明する模式図である。
【図2】本発明の実施の形態2に用いる水素製造装置の構成図である。
【図3】本発明の実施の形態2における、鉄材の平均酸化数を算出する方法を説明する模式図である。
【図4】本発明の実施の形態4における、鉄材の平均酸化数を算出する方法を説明する模式図である。
【図5】本発明の実施の形態6における、還元工程から酸化工程へ切り替えた鉄材の平均酸化数と、1回目と1000回目の酸化後の水素発生量の比および1回目の酸化後の水素発生量との関係を示す図である。
【図6】本発明の実施の形態7における、還元工程から酸化工程へ切り替えた鉄材の平均酸化数と、1回目と1000回目の酸化後の水素発生量の比および1回目の酸化後の水素発生量との関係を示す図である。本発明の実施の形態1に用いる水素製造装置の構成図である。
【符号の説明】
【0050】
11 反応管、13 鉄材、15、19、24 電磁弁、16 水素ガス、20、26 水タンク、21 液体マスフローコントローラ、22 ガスマスフローコントローラ、28 ガスマスフローメーター、29 水素タンク、30 天秤。
【技術分野】
【0001】
本発明は、特に鉄等の微粒子と水との反応によって水素を発生させる水素製造方法に関するものである。
【背景技術】
【0002】
鉄−酸化鉄系を用いた水素製造方法は、下記反応式(1)に示す酸化鉄が水素で還元される還元反応と、反応式(2)に示す金属鉄が水で酸化される酸化反応とを交互に繰り返して施すものであり、反応活性を高めるために粒径1μm以下の、サイズの小さな粒子が使用され、二次的な粒子の形状としては、取り扱いの容易さから、粉末状、顆粒状、ペレット状、球状又はハニカムなどの形状が使用される。
【0003】
Fe3O4 + 4H2 → 3Fe + 4H2O ・・(1)
3Fe + 4H2O → Fe3O4 + 4H2 ・・(2)
【0004】
上記鉄−酸化鉄を水素発生媒体(酸化還元材料)とする酸化還元反応には熱力学的に数百℃、さらに効率よく反応を進めるためには、350〜500℃程度の高温を必要とするため、還元反応を繰り返すことにより鉄粒子が焼結し、一次粒子間のガスの移動が悪くなって反応が進まず、水素発生の繰り返し特性が著しく低下することが知られている。
そこで、還元反応時の焼結を抑制し、耐久性を向上させるためのものとして、鉄又は酸化鉄にTi、Zr、V、Nb、Cr、Mo、Al、Ga等の鉄以外の金属を、0.5〜30mol%、より好ましくは0.5〜15mol%添加したものを水素発生媒体(酸化還元材料)として用いた水素製造方法が開示されている(例えば特許文献1参照)。
また、水素を発生させる酸化反応時に、水又は水蒸気を、例えば5〜60秒の供給と5〜60秒の停止を繰り返して、断続的に供給することにより、一定量の水素発生量を安定して長時間維持しようとする水素発生方法が開示されている(例えば特許文献2参照)。
【0005】
【特許文献1】国際公開第02/081368号パンフレット(第2頁)
【特許文献2】特開2006−104017号公報(第1頁)
【発明の開示】
【発明が解決しようとする課題】
【0006】
特許文献1に示す水素製造方法では、水素発生媒体(酸化還元材料)として鉄又は酸化鉄に鉄以外の金属を添加するため、実質的に酸化還元反応に寄与できる有効な鉄の量が減少し、単位重量当たりの水素発生量が低下するという課題があった。また、鉄又は酸化鉄以外の元素は、水素発生媒体に均質に分散して添加され合金化される必要があり、水素発生媒体の調製のために大幅にコストがアップするという課題があった。
また、特許文献1において、閉鎖型ガス循環系反応装置における水素ガスの圧力により、還元のために使われる水素の消費量や水素の発生量を測定して水素発生媒体の還元度を見積もり、所定の還元度において酸化反応と還元反応を終了させている。しかし、系内の圧力を測定することにより還元度を検出するため、測定値が温度など周囲環境の影響を受けて大きく変化し易やすく再現性が悪く、系内の圧力変化を精度良く測定したり、制御することが困難であり、又、耐圧性を有する装置が必要でコストが増大するという課題があった。
また、特許文献2の水素発生方法では、酸化反応における水の供給を、短時間で周期的に繰り返すことにより調整するだけで、水分の過剰投入に対しては何ら対応されていないので、過剰な水分投入により、元来必要とされる以上の、鉄又は酸化鉄の乾燥のための加熱や乾燥剤が用いられ、熱的ロスが生じると共にコスト上不利になる。また、鉄又は酸化鉄中の水分残存量のばらつきはそのまま還元反応のばらつきへも波及し、安定した水素製造が困難になるという課題があった。
【0007】
本発明は、かかる課題を解決するためになされたものであり、低コストで、長期間、多量の、しかも安定した水素発生と酸化(貯蔵)とが可能な水素製造方法を得ることを目的とする。
【課題を解決するための手段】
【0008】
本発明に係る水素製造方法は、金属材と水とを反応させて上記金属材を酸化し、水素を発生させる酸化工程と、金属材と水素とを反応させて上記金属材を還元する還元工程とを交互に繰り返す水素製造方法であって、上記酸化工程および還元工程において、上記金属材の酸化状態を測定し、測定された上記金属材の酸化状態に基づいて、上記還元工程と酸化工程と間の切り替えを施すことを特徴とする方法である。
【発明の効果】
【0009】
還元工程および酸化工程における金属材(金属又は金属酸化物)の酸化状態に基づいて、還元工程と酸化工程との間を、過還元や水分が過剰投入される前に切り替えることができるので、還元工程における過還元による焼結や、酸化工程における水分の過剰投入を防止でき、酸化還元反応を繰り返した後でも、多量の、しかも安定した水素の発生と貯蔵とが可能である。
【発明を実施するための最良の形態】
【0010】
実施の形態1.
従来の鉄−酸化鉄系での水素製造方法においては、還元工程においては、水素又は水素と窒素の混合ガス中で、反応式(1)に示す還元反応が、酸化工程においては、水又は水蒸気中で、反応式(2)に示す酸化反応が、それぞれ予備評価から決めた温度で一定時間毎に、交互に繰り返し施される。
しかし、上記還元工程および酸化工程が繰り返されるに従って、鉄材の焼結状態、水分残存量、粒径分布等が変化するために、上記各工程を、予備評価で決められた一定の温度と時間とで施しても、水素の発生速度(量)や貯蔵速度(量)は毎回ばらつくことになる。
つまり、鉄材の状態は反応が繰り返されることにより変化するものであるのに、一定温度、一定時間で還元工程や酸化工程が施されると、所定の時間までに既に必要な還元反応又は酸化反応が終了しているにも係わらず、余分の水素や水分が供給されて、過還元や水分過多の状態となり、鉄粒子の焼結、熱ロス又は反応ばらつきが生じ、酸化還元反応の繰り返しが100回以上のレベルに達すると水素の発生および貯蔵速度(量)が著しく低下することになる。これは、繰り返される酸化還元の反応の環境が、毎回のそれぞれの反応に供される鉄材の酸化状態に基づいて設定されていないからである。
本実施の形態においては、酸化還元反応によって変化する金属材の状態(酸化状態)を定量的に測定し、上記酸化状態によって還元工程および酸化工程間を、過還元又は水分過多となる前に、随時切り替えることを可能とする。なお、上記酸化状態を、酸化還元反応において発生又は消費される成分量を、測定値が周囲環境の影響を受けにくい、重量又はガス総流量を用いて検出すると精度が向上するため好ましい。
【0011】
本実施の形態においては、金属材として、金属鉄および酸化鉄の少なくとも一方を含有する鉄材を用い、上記還元工程と酸化工程間での切り替えを、上記鉄材の酸化状態をバロメータとして行うが、鉄材の酸化状態を下記のように定義する平均酸化数として算出する。
図1は、本実施の形態の還元工程における、鉄材の平均酸化数を算出する方法を説明する模式図で、反応式(1)で示される還元反応に対応して示す。
図1に示すように、鉄材が全て酸化鉄(Fe3O4)で構成されている時、鉄材の平均酸化数を8/3と定義する。また、1モルの鉄材(Fe3O4)と4モルの水素が反応すると4モルの水が発生し、鉄材(Fe3O4)の全てが金属鉄(Fe0)となり、全て金属鉄となった鉄材の平均酸化数を0と定義する。つまり、反応式(1)に示す反応が化学量論的に進行すると、鉄材の平均酸化数は8/3から0に変化することになる。
【0012】
実施の形態2.
図2は、本発明の実施の形態2に用いる水素製造装置の構成図であり、加熱機構14を備えた反応管11の内部に2枚のSUSメッシュ12が設けられ、メッシュ12間に鉄材13としての粒状の酸化鉄(Fe3O4)を設置してガス流路中に取り入れている。
上記のように鉄材を設置した水素製造装置を用いた水素製造方法において、水素貯蔵時(還元工程)においては、反応管11入口の電磁弁15を介して、水素ガス16をガスマスフローコントローラ22を通過させて反応管11へ一定の流量で流す。水素ガスは、加熱機構14で所定温度に加熱された反応管11内で加熱され、メッシュ12を通って鉄材13と接触し、反応式(1)に従って水素が貯蔵され水蒸気が発生する。水蒸気は放熱コイル23内で冷却されて水となり、電磁弁24を介して水タンク26に導かれる。なお、発生した水蒸気量は結露させた水の総重量を天秤30で測定する。
また、水素貯蔵量は、導入された水素ガス総流量と反応管11で反応しきれずに排出された水素ガス総流量(ガスマスフローメータ28で測定)との差から測定する。
【0013】
一方、水素発生時(酸化工程)においては、反応管11入口には電磁弁19を介して、水タンク20から液体マスフローコントローラ21を通過させて一定の速度で水を供給する。ここで、反応管11は、水が水蒸気になるのに十分な温度(100℃以上)に加熱機構14で加熱されており、反応管11に送りこまれた水はただちに水蒸気となる。一方、発生した水素ガスを反応管11出口からガスマスフローメータ28を介して水素タンク29に導き、ガスマスフローメータ28により発生した水素ガス総流量を測定する。
また、図示はしていないが、本実施の形態の水素製造装置の反応管11にロードセルを取付けることにより、鉄材の重量を測定することができる。
【0014】
還元工程における鉄材の平均酸化数の算出方法1(水の総重量による算出方法)
還元工程において、発生した水の総重量を測定することによる鉄材の平均酸化数の算出方法を説明する。
還元工程における反応は化学量論的には反応式(1)に従って進行し、投入した鉄材が全て酸化鉄(Fe3O4)で、その量がXモルであるとする。
図1に示すように、反応開始から生成した水の総重量がaR1グラムであるとすると、そのモル量AR1は、AR1モル=aR1グラム/18グラムとなるので、XモルのFe3O4の内、金属鉄に変化したのはAR1×3/4モルとなる。ここで、下付き文字の「R1」は1回目の還元(Reduction)工程、後述する下付き文字の「O1」は1回目の酸化(Oxidation)工程での測定値であることを示す。
XモルのFe3O4が全て反応すると3Xモルの金属鉄(Fe0)となり、平均酸化数は8/3から0になる。ここで、生成した水の総モル量であるAR1に対して、AR1×3/4モルの金属鉄が生成しているので、XモルのFe3O4の内、aR1グラムの水を生成する時点までに還元された分は3Xモルに対するAR1×3/4モルとなり、減少した鉄材の平均酸化数は(8/3)×{AR1/(4X)}となる。これは上記鉄材において、還元反応により減少した分の平均酸化数であるので、結局、この時点での鉄材の平均酸化数ZR1は下式で示される。
ZR1=8/3×[1−{AR1/(4X)}]
以上により、水素貯蔵時(還元工程)の反応では、生成した水の総重量を測定することによって、鉄材の平均酸化数を決定することができる。
【0015】
還元工程における鉄材の平均酸化数の算出方法2(水素ガス総流量による算出方法)
還元工程において、貯蔵された水素ガスの総流量を測定することによる鉄材の平均酸化数の算出方法を説明する。
図1に示すように、還元工程における反応は化学量論的には反応式(1)に従って進行し、投入した鉄材が全て酸化鉄(Fe3O4)で、その量がXモルであるとする。
水素ガスの流量は、ガスマスフローメーターにより標準状態流量[以下、sccm{standard cc/min、1atm(大気圧1,013hPa)、0℃}と示す。]として測定され、還元反応において貯蔵された水素ガスの総流量bR1(sccm)は、導入水素総流量と排出水素総流量との差から求め、これより貯蔵された水素のモル量BR1を算出する。
図1に示すように、還元反応において貯蔵された水素と生成した水のモル量とは同じであるので、反応式(1)に示されるように、水素のモル量BR1は、生成した水のモル量AR1と同じとなり、上記と同様にして、BR1(=AR1)モルの水素が貯蔵された時点での鉄材の平均酸化数ZR1は下式で示される。
ZR1=8/3×[1−{BR1/(4X)}]
以上により、還元工程において、水素の貯蔵量からその場で鉄材の平均酸化数を測定できる。
【0016】
還元工程における鉄材の平均酸化数の算出方法3(鉄材の重量による算出方法)
還元工程において、減少した鉄材の重量による鉄材の平均酸化数の算出方法を説明する。図4は、本実施の形態における、鉄材の平均酸化数を算出する方法を説明する模式図で、反応式(1)で示される還元反応に対応して示す。
還元工程における反応は化学量論的には反応式(1)に従って進行し、投入した鉄材が全て酸化鉄(Fe3O4)で、その量がXモルであるとする。
図4に示すように、還元工程における反応の開始から鉄材の重量を測定し、鉄材がcR1グラム減少したとすると、その重量減少分は還元により鉄材から除去された酸素と考えられるので、減少した酸素原子モル量CR1はCR1=cR1グラム/16グラムとなる。
これから、Xモル中のFe3O4に含まれる酸素原子モル(4Xモル)の内の、CR1モルが還元されたことになるから、還元後は、(4X−CR1)モルの酸素が鉄と結びついてFe3O4となっていることになるので、鉄材がcR1グラム減少した時点での鉄材の平均酸化数ZR1は下式で示される。
ZR1=8/3×{(4X−CR1)/(4X)}
以上により、還元工程における反応は、鉄材の重量からその場で鉄材の平均酸化数を測定できる。
【0017】
酸化工程における鉄材料の平均酸化数の算出方法4(水素ガス総流量による算出方法)
酸化工程において、発生した水素の総流量を測定することによる鉄材の平均酸化数の算出方法を説明する。
図3は、本実施の形態の酸化工程における、鉄材の平均酸化数を算出する方法を説明する模式図で、反応式(2)で示される酸化反応に対応して示す。
酸化工程における反応は化学量論的には反応式(2)に従って進行し、鉄材が全て金属鉄(Fe0)で、その量がYモルであるとする。
図3に示すように、酸化反応は化学量論的には反応式(2)に従って進行し、ガスマスフローメーターにより測定された標準状態流量(sccm)として、酸化工程における反応開始からの水素ガス総流量dO1(sccm)を求め、この発生した水素ガスのモル量をDO1とする。ここで、DO1モルの水素を発生したのであるから、発生した酸化鉄(Fe3O4)はDO1/4モルとなる。Yモルの金属鉄(Fe0)が全て反応するとY/3モルの酸化鉄(Fe3O4)が生成して、鉄材の平均酸化数は0から8/3になるのであるから、今、DO1/4モルの酸化鉄が生成しているということは、酸化された金属鉄(Fe0)はY/3モルに対するDO1/4モルとなり、増加した鉄材の平均酸化数は(8/3)×{3DO1/(4Y)}となり、結局、発生した水素ガスの総流量がdO1(sccm)である時点での鉄材の平均酸化数ZO1は下式で示される。
ZO1=(8/3)×{3BO1/(4Y)}
以上により、酸化工程における水素の発生量からその場で、鉄材の平均酸化数を測定できる。
【0018】
酸化工程における鉄材の平均酸化数の算出方法5(鉄材の重量変化による算出方法)
酸化工程において、増加した鉄材の重量を測定することによる鉄材の平均酸化数の算出方法を説明する。
酸化工程における反応は化学量論的には反応式(2)に従って進行し、投入した鉄材が全て金属鉄(Fe0)で、その量がYモルであるとする。
図3に示すように、酸化反応は化学量論的には反応式(2)に従って進行し、酸化工程における反応開始からの鉄材の増加量がeO1グラムであるとすると、その重量増加分は鉄材の金属鉄が酸化鉄に酸化された分であると考えられるので、増加した酸素原子モル量EO1はEO1=eO1グラム/16グラムとなる。
これから、Yモル金属鉄(Fe0)の一部とEO1モル分の酸素原子が結合してFe3O4となるので、鉄材がeO1グラム増加した時点での鉄材の平均酸化数ZO1は下式で示される。
ZO1=(8/3)×{3EO1/(4Y)}
以上により、酸化工程における鉄材の重量変化から鉄材の平均酸化数を測定できる。
【0019】
上記鉄材の平均酸化数の算出方法1〜5は、還元工程において用いられる鉄材が全て酸化鉄(Fe3O4)で、これが全て金属鉄(Fe0)となり、また、酸化工程において用いられる鉄材が全て金属鉄(Fe0)で、これが全て酸化鉄(Fe3O4)となるとして得られた方法である。
1回目の還元工程においては、上記算出方法により鉄材の平均酸化数を算出することができるが、本実施の形態の水素製造方法では、上記還元工程と酸化工程とが繰り返し施されるのであり、2回目以降の還元工程に用いられる鉄材が全て酸化鉄(Fe3O4)であり、酸化工程において用いられる鉄材が全て金属鉄(Fe0)であるとは限らない。
例えば、1回目の還元工程を経て、次の酸化工程で用いられる鉄材は、全てが金属鉄(Fe0)ではなく、平均酸化数ZR1の鉄材である。
以下、還元工程と酸化工程が交互に繰り返される場合の鉄材の平均酸化数の算出方法について詳細に説明する。
【0020】
還元工程と酸化工程が交互に繰り返される場合の鉄材の平均酸化数の算出方法
上記算出方法により、1回目の還元工程においては、鉄材の平均酸化数はZR1と算出される。1回目の酸化工程は、上記1回目の還元工程に引き続いて生じ、2回目の還元工程は1回目の酸化工程に引き続いて生じる。そのため、酸化工程(または還元工程)における平均酸化数の算出は、その直前の還元工程(または酸化工程)で発生した金属鉄Fe0(またはFe3O4)の量、すなわち、上記Y(またはX)の値をその直前で算出された平均酸化数ZR1(またはZO1)を基に算出しておく必要がある。
【0021】
次に、還元工程と酸化工程が交互に繰り返される場合の鉄材の平均酸化数の算出方法について説明する。本実施の形態においては、生成する水の総重量による算出方法1を用いて還元工程での鉄材の平均酸化数を算出し、発生する水素ガス総流量による算出方法4を用いて酸化工程での鉄材の平均酸化数を算出した。
初期投入した鉄材の全てが酸化鉄(Fe3O4)でその量がXモルであると、1回目の還元工程において、鉄材の平均酸化数がZR1と示され、1回目の酸化工程開始時の金属鉄(Fe0)のモル量であるYO1は下式で示される。
YO1=3X−{ZR1/(8/3)×3X}
=3X×[1−{ZR1/(8/3)}]
DO1モルの水素発生を伴う1回目の酸化工程時の平均酸化数ZO1は、前式に代入して、
ZO1=(8/3)/[3DO1/{4×3X×(1−(ZR1/(8/3))}] =4X(8−3ZR1)/(3DO1)
となる。
上記のように、1回目の還元工程から続いて施された酸化工程による、鉄材の平均酸化数の変化は、1回目の還元工程が施された後の平均酸化数ZR1と1回目の酸化工程で測定された水素発生量DO1モルを使って算出することができる。
【0022】
また2回目の還元工程のスタート時点での鉄材は、平均酸化数ZO1で示される酸化状態であり、この酸化状態の鉄材に対して還元反応が生じるため、2回目の還元工程における反応開始時のFe3O4のモル量XR2は、
XR2=X×{ZO1/(8/3)}
となるので、2回目の還元工程における平均酸化数ZR2は、2回目の還元工程時に発生した水のモル量AR2を用いて、
ZR2=8/3×[1−{AR1/(4X×(ZO1/(8/3))}]
=(8/3)×{1−(2AR1)/(3XZO1)}
となる。
上記のように、1回目の酸化工程から続いて施された2回目の還元工程による、鉄材の平均酸化数の変化は、1回目の酸化工程が施された後の平均酸化数ZO1と2回目の還元化工程で測定された水素発生量AR1モルを使って算出することができる。
【0023】
上記のように、還元工程と酸化工程が繰り返して施される場合には、N回目の繰り返し反応に伴う平均酸化数は、(N−1)回目の平均酸化数を用いて示すことができる。すなわち、N回目の還元工程後の平均酸化数ZRNは、例えば、N回目の還元工程で生成した水のモル量ARN[モル]を使って、
ZRN=(8/3)×{1−(2ARN)/(3XZO(N−1))}と示され、N回目の酸化工程後の平均酸化数ZONは、例えば、N回目の酸化工程で得られた測定量AON[モル]を使って、
ZON=4X(8−3ZR(N−1))/(3BON)
と示される。
【0024】
実施の形態3.
図2に示す水素製造装置における、反応管11に原料となる酸化鉄(α−Fe2O3)を入れて、400℃で周囲を加熱しながら水素ガスを50sccmの流量で流し、60分間放置した。これにより、α−Fe2O3が金属鉄まで還元されたことを外観から確認した。このとき、理論上金属の酸化数は3から0まで変化したことになる。
次に、還元反応環境から、400℃に加熱した反応管に0.05cc/minの一定速度で水を注入して酸化環境に切り替え、水素発生量が0になるまで十分反応させた。このとき反応式(2)に従ってFe(価数0)は、水素を発生しながらFe3O4(価数8/3)まで酸化できる。ここで熱力学上、400℃ではFe2O3(価数3)までは再び酸化しないことが知られている。外観上黒くなっており、これはFe3O4の特徴であり、Fe2O3(赤色)とは異なることを確認した。
以上までを“慣らし運転”として、繰り返し運転のサイクル数には含めないものとし、上記慣らし運転後、以下の運転条件1に従って、還元工程と酸化工程を切り替えて繰り返し、酸化工程を、1回、100回、1000回施した後の水素ガス総流量を測定し、金属鉄あたりの水素発生量(wt%)として表1に示す。
【0025】
■運転条件1
(還元工程):400℃に加熱された反応管に水素を50sccmの流量で導入し、5秒毎にガスマスフローコントローラ22の値から水素ガス総流量を読み取り、上記算出方法2により鉄材の平均酸化数に換算して、鉄材の平均酸化数が0になる手前で酸化反応環境に切り替える。
(酸化工程):上記還元工程後、電磁弁を切り替え、390℃に加熱した反応管に0.05cc/minの一定速度で水を注入し、5秒毎にガスフローメータ28の値から水素ガス総流量を読み取り、上記算出方法4により鉄材の平均酸化数に換算して鉄材の平均酸化数が8/3になる手前で還元反応環境に切り替える。
【0026】
上記反応式(1)に示す還元反応が100%進行して鉄材が全て金属鉄になった状態では鉄材の平均酸化数が0となるが、実質的には測定値が「0」となる瞬間に切り替えることは困難であり、測定値が「0」となった時点では、反応が100%進行して全てが金属鉄となっているのに水素が供給されている状態、即ち過還元の状態となるので、本明細書において、平均酸化数が0と測定された鉄材の状態は、上記過還元の状態を指す。そこで、本実施の形態における鉄材の平均酸化数が0になる手前とは、反応が100%進行して全て金属鉄になる直前を意味し、実施の形態においては、鉄材の平均酸化数が0.01で切り替えることにより対応している。
また、上記反応式(2)に示す酸化反応が100%進行して鉄材が全て酸化鉄になった状態では、鉄材の平均酸化数は8/3となる。しかし、実質的には、測定値が8/3となる瞬間に切り替えることは困難であり、測定値が「8/3」となった時点では、反応が100%進行して全てが酸化鉄となっているのに水が供給されている状態、即ち水分過多の状態となり、本明細書において、平均酸化数8/3と測定された鉄材の状態は、上記水分過多の状態を指す。そこで、本実施の形態における鉄材の平均酸化数が8/3になる手前とは、反応が100%進行して全て酸化鉄になる直前を意味し、具体的には、実施の形態においては、鉄材の平均酸化数が2.66で切り替えることにより対応している。
【0027】
比較例1.
実施の形態3と同様に慣らし運転を行った後、以下の運転条件2に従って、還元工程と酸化工程を切り替えて繰り返し、酸化工程を1回、100回、1000回施した後の水素ガス総流量を測定し、金属鉄重量あたりの水素発生量として(wt%)として表1に示す。
【0028】
■運転条件2
(還元工程):400℃に加熱された反応管に水素を50sccmの流量で導入する。40分程度で水素発生速度が0になり、反応管出口のガスマスフローメータ28のガス流量が50sccmになり、導入した水素ガスが破過することを確認した。これに基づき、400℃に加熱された反応管に水素を50sccmの流量で導入し40分間流す。
(酸化工程):上記還元工程後、電磁弁を切り替え、390℃に加熱した反応管に0.05cc/minの一定速度で水を注入すると水素が発生するが、30分程度でほとんど水素発生速度が0になることを確認した。これにより、390℃に加熱された反応管に水を0.05cc/minの速度で30分間流す。
【0029】
【表1】

【0030】
表1に示されるように、実施の形態3のように、鉄の平均酸化数が、鉄材の全てが金属鉄になり、鉄材の平均酸化数が0になる直前から、鉄材の全てが酸化鉄になり、鉄材の平均酸化数が8/3になる直前の間である、0を超え8/3未満の間で毎回酸化と還元を繰り返し運転したものは、一定の温度、一定時間(例えば、還元工程40分間、酸化工程30分間)ごとに運転を切り替えた比較例1と比較して、繰り返しによる水素発生量の低下が著しく抑制され、1回目の水素発生量に対する、所定サイクル数後の水素発生量の比(=低下抑制率と定義する。)が大きいことがわかる。
また、還元工程および酸化工程での温度や時間の条件を変化させて、実施の形態3又は比較例1と同様にして水素の発生量を測定したが、いずれの場合にも、鉄材の平均酸化数が0を超え8/3未満の間で毎回酸化と還元を繰り返し運転したものの方が、上記低下抑制率が大きいことが確認された。
【0031】
実施の形態4.
実施の形態3に用いた水素製造装置の反応管11に1グラム(実施の形態4−1)、10グラム(実施の形態4−2)又は100グラム(実施の形態4−3)の鉄材(α−Fe2O3)を入れて、実施の形態3と同様にして慣らし運転を行い、上記慣らし運転後、以下の運転条件3に従って、還元工程と酸化工程を切り替えて繰り返し、酸化工程を1回、100回、1000回施した後の水素ガス総流量を測定し、金属鉄あたりの水素発生量(wt%)として表2に示す。
【0032】
■運転条件3
(還元工程):380℃に加熱された反応管に水素を80sccmの流量で導入し、5秒毎にガスマスフローコントローラ22とガスマスフローメータ28とで導入水素量と排出水素量とを測定し、その差から算出方法2により算出した鉄材の平均酸化数が0となる手前で、酸化反応環境に切り替える。
(酸化工程):375℃に加熱された反応管に0.15cc/minの一定速度で水を注入し、5秒毎にガスフローメータ28の値から算出方法4により算出した鉄材の平均酸化数が8/3になる手前で還元反応環境に切り替える。
【0033】
実施の形態5.
実施の形態3に用いた水素製造装置の反応器11にロードセルを取付け、鉄材13の重量変化をその場で測定可能となるように装置を改造した。
上記ロードセルを取付けた反応管11に1グラム(実施の形態5−1)、10グラム(実施の形態5−2)又は100グラム(実施の形態5−3)の鉄材(α−Fe2O3)を入れて、実施の形態3と同様にして慣らし運転を行い、上記慣らし運転後、以下の運転条件4に従って、還元工程と酸化工程を切り替えて繰り返し、酸化工程を1回、100回、1000回施した後の水素ガス総流量を測定した。金属鉄重量あたりの水素発生量(wt%)として表2に示す。
【0034】
■運転条件4
(還元工程):380℃に加熱された反応管に水素を80sccmの流量で導入し、5秒毎にロードセルで測定する鉄材の重量変化から、算出方法3により算出した鉄材の平均酸化数が0となる手前で酸化反応環境に切り替える。
(酸化工程):375℃に加熱された反応管に0.15cc/minの一定速度で水を注入し、5秒毎にロードセルで測定している鉄材の重量変化から算出方法5により算出した鉄材の平均酸化数が8/3となる手前で還元反応環境に切り替える。
【0035】
比較例2〜4.
実施の形態5に用いたロードセルを取付けた反応管11に1グラム(比較例2)、10グラム(比較例3)又は100グラム(比較例4)の鉄材(α−Fe2O3)を入れて、実施の形態3と同様にして慣らし運転を行い、上記慣らし運転後、以下の運転条件5に従って、還元工程と酸化工程を切り替えて繰り返し、酸化工程を1回、100回、1000回施した後の水素ガス総流量を測定し、金属鉄あたりの水素発生量(wt%)として表2に示す。
【0036】
■運転条件5
(還元工程):380℃に加熱された反応管に水素を80sccmの流量で導入し、酸化鉄の重量が1グラム(比較例2)の場合は75分、10グラム(比較例3)の場合は78分、100グラム(比較例4)の場合は85分ほど経過すると水素発生速度が0になり、ガスマスフローメータ28のガス流量が80sccmになり、導入水素ガスが破過することを確認した。これに基づき、380℃に加熱された反応管に水素を80sccmの流量で導入し、酸化鉄の重量が1グラムの場合は75分間、10グラムの場合は78分間、100グラムの場合は85分間加熱する。
(酸化工程):上記還元反応後電磁弁を切り替え、375℃に加熱した反応管に0.15cc/minの一定速度で水を注した。水素が発生するが、1グラム(比較例2)の場合は65分、10グラム(比較例3)の場合は70分、100グラム(比較例4)の場合は80分ほど経過するとほとんど水素発生速度が0になることを確認した。これより、375℃に加熱した反応管に水を0.15cc/minで導入し、酸化鉄が1グラムの場合は65分間、10グラムの場合は70分間、100グラムの場合は80分間加熱する。
【0037】
【表2】

【0038】
表2に示すように、実施の形態4−1〜3、実施の形態5−1〜3は、同一温度で、一定時間ごとに運転を切り替えた比較例2〜4と比較して、低下抑制率が大きく、繰り返しによる水素発生量の低下が著しく抑制されるのがわかる。
【0039】
また、上記実施の形態4と実施の形態5に示されるように、還元工程および酸化工程間の切り替えを、運転条件4(算出方法3、5)で得られた鉄材の平均酸化数に基づき施した場合と、運転条件3(算出方法2、4)で得られた鉄材の平均酸化数に基づき施した場合とにおいて、鉄材の平均酸化数が0を超え8/3未満の間で毎回酸化と還元を繰り返し運転したものが優れているという、同様の結果が得られることがわかる。
【0040】
実施の形態6.
実施の形態3と同様にして慣らし運転を行い、上記慣らし運転後、以下の運転条件6に従って、還元工程と酸化工程を切り替えて繰り返し、酸化工程を1回、1000回施した後の水素ガス総流量を測定し、金属鉄あたりの水素発生量(wt%)として、又これらの比(=1000回目の発生水素量/1回目の発生水素量(%)=低下抑制率)を算出して表3に示す。また、還元工程から酸化工程への切り替え時の鉄材の平均酸化数と、1回目と1000回目の酸化後の水素発生量の比(低下抑制率)および1回目の酸化後の水素発生量との関係を図5に示す。
【0041】
■運転条件6
(還元工程):390℃に加熱された反応管に水素を60sccmの流量で導入し、5秒毎にガスマスフローコントローラ22とガスマスフローメータ28とでそれぞれ導入水素量と排出水素量を測定し、その差から算出方法2により算出した鉄材の平均酸化数が、0(比較例5)、0.01(実施の形態6−1)、0.05(実施の形態6−2)、0.10(実施の形態6−3)、0.25(実施の形態6−4)、0.50(実施の形態6−5)、0.75(実施の形態6−6)、1.00(実施の形態6−7)となったところで酸化反応環境に切り替える。
(酸化工程):385℃に加熱された反応管に0.15cc/minの一定速度で水を注入し、5秒毎にガスマスフローメータ28の値から水素ガス総流量を読み取り、算出方法4により算出した鉄材の平均酸化数が2.65の値になったところで還元反応環境に切り替える。
【0042】
【表3】

【0043】
表3と図5に示すように、比較例5は、還元から酸化に切り替える時の鉄材の平均酸化数が0で、酸化から還元に切り替える時の鉄材の平均酸化数が2.65であり、1回目の酸化後の水素発生量は4.3wt%となったが、1000回目の繰り返しにより、1000回目の酸化後の水素発生量は1.6wt%と大きく低下した。
一方、本実施の形態6−1〜7は、酸化から還元に切り替える時の鉄材の平均酸化数が2.65で、還元から酸化に切り替える時の鉄材の平均酸化数が0.01以上であると、比較例5に比べて、低下抑制率が向上し、1000回の繰り返しによる水素発生速度の低下が大きく抑制される。また、還元から酸化に切り替える時の鉄材の平均酸化数が0.3以上で水素発生の低下抑制効果が顕著に現れるが、大きすぎると1回目から水素の発生量が少なくなり工業的に不利となる。また、水素貯蔵合金の水素貯蔵量が金属鉄重量あたり2wt%程度であることを考えると、還元から酸化に切り替える時の鉄材の平均酸化数は0.8以下であることが望ましい。
以上より、還元から酸化に切り替える時の鉄材の平均酸化数は0.01以上が望ましく、0.3以上、0.8以下がより望ましいことが示される。
さらに、酸化から還元に切り替える時のFe材の平均酸化数を2.00、2.25、2.40、2.55又は2.66にして、本実施の形態と同様の評価を実施したところ、本実施の形態と同様の効果を確認した。
【0044】
実施の形態7.
実施の形態3と同様にして慣らし運転を行い、上記慣らし運転後、以下の運転条件7に従って、還元工程と酸化工程を切り替えて繰り返し、酸化工程を1回、1000回施した後の水素発生量を測定し、金属鉄重量あたりの水素発生量(wt%)として、これらの比(=1000回目の発生水素量/1回目の発生水素量(%)=低下抑制率)を算出して表4に示す。また、還元工程から酸化工程への切り替え時の鉄材の平均酸化数と、1回目と1000回目の酸化後の水素発生量の比(低下抑制率)および1回目の酸化後の水素発生量との関係を図6に示す。
【0045】
■運転条件7
(還元工程):390℃に加熱された反応管に水素を60sccmの流量で導入し、5秒毎に導入水素量と、ガスマスフローメータ28で排出水素量を測定し、その差から算出方法2により算出した鉄材の平均酸化数が0.50となったところで酸化反応環境に切り替える。
(酸化工程):385℃に加熱された反応管に0.15cc/minの一定速度で水を注入し、5秒毎にガスマスフローメータ28の値から水素ガス総流量を読み取り、算出方法4により算出した鉄材の平均酸化数が、1.50(実施の形態7−1)、1.75(実施の形態7−2)、2.00(実施の形態7−3)、2.25(実施の形態7−4)、2.50(実施の形態7−5)、2.65(実施の形態7−6)、2.67(比較例6)の値になったところで還元反応環境に切り替える。
【0046】
【表4】

【0047】
表4と図6に示すように、比較例6は、酸化から還元に切り替える時の鉄材の平均酸化数が2.67であり、水素発生の低下抑制率が大きく低下するが、本実施の形態7−1〜6は、酸化から還元に切り替える時の鉄材の平均酸化数が8/3未満であり、低下抑制率が向上し、2.50以下とすることでより顕著となることがわかる。
しかし酸化から還元に切り替える時の鉄材の平均酸化数を小さくしすぎると発生水素量が小さくなり、工業的に不利となる。水素貯蔵合金に対する優位を維持するためには、2.00以上が望ましい。
なお、同様の評価を還元から酸化に切り替える時の鉄材の平均酸化数を0.01、0.10、0.25、0.75又は1.00の場合についても実施したが、同様の効果を確認した。
【0048】
上記のように、上記実施の形態に示す試料の重量、体積、形状、雰囲気ガス圧、ガスの流量および加熱温度等の反応条件により、本発明を説明したが、本発明に係わる鉄材の平均酸化数は、上記各反応条件を反映したものであるので、他の各反応条件でも同様の効果が得られることは明白である。
さらに試料の平均結晶粒径が小さいほど顕著に効果が得られることは、容易に類推できる。
【図面の簡単な説明】
【0049】
【図1】本発明の実施の形態1における、鉄材の平均酸化数を算出する方法を説明する模式図である。
【図2】本発明の実施の形態2に用いる水素製造装置の構成図である。
【図3】本発明の実施の形態2における、鉄材の平均酸化数を算出する方法を説明する模式図である。
【図4】本発明の実施の形態4における、鉄材の平均酸化数を算出する方法を説明する模式図である。
【図5】本発明の実施の形態6における、還元工程から酸化工程へ切り替えた鉄材の平均酸化数と、1回目と1000回目の酸化後の水素発生量の比および1回目の酸化後の水素発生量との関係を示す図である。
【図6】本発明の実施の形態7における、還元工程から酸化工程へ切り替えた鉄材の平均酸化数と、1回目と1000回目の酸化後の水素発生量の比および1回目の酸化後の水素発生量との関係を示す図である。本発明の実施の形態1に用いる水素製造装置の構成図である。
【符号の説明】
【0050】
11 反応管、13 鉄材、15、19、24 電磁弁、16 水素ガス、20、26 水タンク、21 液体マスフローコントローラ、22 ガスマスフローコントローラ、28 ガスマスフローメーター、29 水素タンク、30 天秤。
【特許請求の範囲】
【請求項1】
金属材と水とを反応させて上記金属材を酸化し、水素を発生させる酸化工程と、金属材と水素とを反応させて上記金属材を還元する還元工程とを交互に繰り返す水素製造方法であって、上記酸化工程および還元工程において、上記金属材の酸化状態を測定し、測定された上記金属材の酸化状態に基づいて、上記還元工程と酸化工程との切り替えを施すことを特徴とする水素製造方法。
【請求項2】
金属材が、金属鉄および酸化鉄の少なくとも一方を含有する鉄材であり、酸化工程または還元工程における上記鉄材の酸化状態を、上記鉄材における金属鉄と酸化鉄の割合を基に検出することを特徴とする請求項1に記載の水素製造方法。
【請求項3】
還元工程において、所定の時間経過後の鉄材の酸化状態は、上記還元工程において上記所定の時間までに発生した水の総重量を測定することにより検出することを特徴とする請求項2に記載の水素製造方法。
【請求項4】
還元工程において、所定の時間経過後の鉄材の酸化状態は、上記還元工程において上記所定の時間までに貯蔵された水素の総流量を測定することにより検出することを特徴とする請求項2に記載の水素製造方法。
【請求項5】
還元工程において、所定の時間経過後の鉄材の酸化状態は、上記還元工程において上記所定の時間までに減少した鉄材の重量を測定することにより検出することを特徴とする請求項2に記載の水素製造方法。
【請求項6】
酸化工程において、所定の時間経過後の鉄材の酸化状態は、上記酸化工程において上記所定の時間までに発生した水素の総流量を測定することにより検出することを特徴とする請求項2に記載の水素製造方法。
【請求項7】
酸化工程において、所定の時間経過後の鉄材の酸化状態は、上記酸化元工程において上記所定の時間までに増加した鉄材の重量を測定することにより検出することを特徴とする請求項2に記載の水素製造方法。
【請求項1】
金属材と水とを反応させて上記金属材を酸化し、水素を発生させる酸化工程と、金属材と水素とを反応させて上記金属材を還元する還元工程とを交互に繰り返す水素製造方法であって、上記酸化工程および還元工程において、上記金属材の酸化状態を測定し、測定された上記金属材の酸化状態に基づいて、上記還元工程と酸化工程との切り替えを施すことを特徴とする水素製造方法。
【請求項2】
金属材が、金属鉄および酸化鉄の少なくとも一方を含有する鉄材であり、酸化工程または還元工程における上記鉄材の酸化状態を、上記鉄材における金属鉄と酸化鉄の割合を基に検出することを特徴とする請求項1に記載の水素製造方法。
【請求項3】
還元工程において、所定の時間経過後の鉄材の酸化状態は、上記還元工程において上記所定の時間までに発生した水の総重量を測定することにより検出することを特徴とする請求項2に記載の水素製造方法。
【請求項4】
還元工程において、所定の時間経過後の鉄材の酸化状態は、上記還元工程において上記所定の時間までに貯蔵された水素の総流量を測定することにより検出することを特徴とする請求項2に記載の水素製造方法。
【請求項5】
還元工程において、所定の時間経過後の鉄材の酸化状態は、上記還元工程において上記所定の時間までに減少した鉄材の重量を測定することにより検出することを特徴とする請求項2に記載の水素製造方法。
【請求項6】
酸化工程において、所定の時間経過後の鉄材の酸化状態は、上記酸化工程において上記所定の時間までに発生した水素の総流量を測定することにより検出することを特徴とする請求項2に記載の水素製造方法。
【請求項7】
酸化工程において、所定の時間経過後の鉄材の酸化状態は、上記酸化元工程において上記所定の時間までに増加した鉄材の重量を測定することにより検出することを特徴とする請求項2に記載の水素製造方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】




【図2】


【図3】


【図4】


【図5】


【図6】


【公開番号】特開2008−150256(P2008−150256A)
【公開日】平成20年7月3日(2008.7.3)
【国際特許分類】
【出願番号】特願2006−341475(P2006−341475)
【出願日】平成18年12月19日(2006.12.19)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 平成18年9月26日 触媒学会発行の「第98回触媒討論会 討論会A予稿集」に発表
【出願人】(000006013)三菱電機株式会社 (33,312)
【出願人】(304021417)国立大学法人東京工業大学 (1,821)
【Fターム(参考)】
【公開日】平成20年7月3日(2008.7.3)
【国際特許分類】
【出願日】平成18年12月19日(2006.12.19)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 平成18年9月26日 触媒学会発行の「第98回触媒討論会 討論会A予稿集」に発表
【出願人】(000006013)三菱電機株式会社 (33,312)
【出願人】(304021417)国立大学法人東京工業大学 (1,821)
【Fターム(参考)】
[ Back to top ]

