汎用収集用保存液
【課題】形態学的分析および生化学的分析の両方による分析を目的として、細胞または組織を保存するための方法および保存液の提供。
【解決手段】細胞学的アッセイ、分子アッセイまたはその両方を用いた疾患の存在または進行の評価のために、単一の少量の患者標本から単離した細胞およびその内容物を都合良く収集して保存する。細胞収集のための新規な普遍的収集培地により、単一の標本中に保存された細胞に対して細胞学的分析および直接的な分子分析を行うことが初めて可能となる。ヒトの状態を評価することを目的として細胞を分析するための新規な方法。
【解決手段】細胞学的アッセイ、分子アッセイまたはその両方を用いた疾患の存在または進行の評価のために、単一の少量の患者標本から単離した細胞およびその内容物を都合良く収集して保存する。細胞収集のための新規な普遍的収集培地により、単一の標本中に保存された細胞に対して細胞学的分析および直接的な分子分析を行うことが初めて可能となる。ヒトの状態を評価することを目的として細胞を分析するための新規な方法。
【発明の詳細な説明】
【技術分野】
【0001】
発明の分野
本発明は一般に細胞学的アッセイおよび分子アッセイの分野に関し、特に細胞学的アッセイおよび分子アッセイを用いた状態評価のためのアッセイの領域に関する。
【背景技術】
【0002】
発明の背景
ヒトの状態の検出および診断は、疾患の治療のために明らかに重要である。疾患の特徴は数多く同定されており、その多くがそれらの診断のために用いられている。多くの疾患では、罹患した細胞の状態の変化が先行し、それが特徴となる。このような変化には、感染細胞におけるウイルス遺伝子の発現、罹患細胞における遺伝子の発現パターンの変化、および細胞形態の変化が含まれうる。このような細胞状態の評価は、疾患の検出、診断およびモニタリングに役立つ。
【0003】
通常、1つまたは複数の感染症、例えばヒトパピローマウイルスまたは単純ヘルペスウイルスに感染したことが疑われる患者に対しては、分析のために患者から細胞標本を採取する。このような標本は一般に、疾患に主に冒された部位から採取した拭き取り標本(swipe)または細胞擦過標本の形態にある。これらの拭き取り標本では通常、正常細胞と罹患細胞の混合物が収集されるが、細胞の総数は極めて限られている。収集した細胞は、さらに分析を行うためにスライドガラス上に塗沫することが慣習的である。生化学的分析については、細胞学的分析を犠牲にして行われるか、インサイチューハイブリダイゼーションなどの定性的な方法によって行われた。
【0004】
通常、従来の細胞診のために採取した子宮頸部標本は形態学的分析のためにスライドガラス上に塗沫される。この標本から細胞診によって疾患の可能性が特定された場合には、患者は、再度の細胞診および/または遺伝子分析のため、ならびにDNA、RNAまたはタンパク質などの他の分子検査のための第2の標本を得るために再びコルポスコピーを受けなければならない。最近では、形態学用に増強された細胞診用の液体保存液が市場に登場している。これらの保存液はHPV DNAなどに関する分子検査に適用しうることが判明しているが、細胞は通常10ml〜20mlの保存液中に収集され、それによってDNA、RNAおよび他のアッセイ可能な生体分子が過度に希釈されるため、分子検査は理想的でなくなる。さらに、現行の保存用試薬は細胞の形態を維持するものの、これらの試薬はDNAおよびRNAの分解を許容するため、保存を行うと定量的分析は困難または不可能になる。
【0005】
このため、今日の分析では、細胞形態および定量的遺伝分析の評価を行うために少なくとも2つの標本を患者から入手する必要がある。現行の細胞診断法では大量の保存液を用いるため、DNA、RNAおよび他のアッセイ可能な生体分子が過度に希釈される。さらに、現行の保存用試薬は細胞の形態を維持するものの、これらの試薬はDNA、RNAおよびタンパク質などの個々の生体分子の分解を許容するため、定量的分析は不可能になる。
【0006】
形態学的分析および生化学的分析の両方による分析を目的として、細胞または組織を保存するための方法および保存液を設計することには、問題が伴うことが過去に判明している。例えば、形態学的分析のために細胞または組織を固定すると、生化学的分析を行う能力が損なわれる。細胞RNAの保存は、DNA分析および形態学的分析を犠牲にして行われてきた。同じく、細胞DNAの保存は、RNA分析および形態学的分析を犠牲にして行われてきた。
【0007】
本発明の1つの目的は、検出しようとする疾患とは関係なく、単一の標本から、細胞形態を同定するため、ならびにDNA、RNAおよび他の生体分子を量的に保存するための一般的収集用保存液を提供することである。
【0008】
本発明のもう1つの目的は、標本中に得られる細胞の数が限られている細胞標本における細胞形態および核酸、脂質、糖質またはタンパク質を保存するための汎用細胞収集用保存液を提供することである。
【0009】
本発明のもう1つの目的は、関心対象の生体分子の溶液系における直接分析のための組成物および方法を提供することである。本発明の方法および組成物は、インサイチューハイブリダイゼーションなどの非溶液系での方法、または分析の前に関心対象の生体分子を他の細胞成分から分離する必要のある非直接的な方法において生じる問題を解決する。
【発明の概要】
【0010】
発明の概要
本発明は細胞疾患の検出、分析およびモニタリングに関する。細胞標本における細胞形態および定量分析用の細胞生体分子の両方が保たれ、このため単一の患者標本から多数のアッセイを行えるような、新たな細胞収集用保存液を開示する。細胞の状態は、細胞標本を少容量収集するための装置を用いて評価することができる。
【0011】
本発明の1つの態様は、細胞形態を検査すること、および特定のDNA配列を検出すること、または細胞状態に関与する複数の遺伝子の発現レベルを測定し、それらの発現を相互もしくは参照遺伝子に対して比較して、細胞における疾患の状態の指標として特定の比を得ることを含む。本方法は、細胞形態または特定の生体分子のレベルもしくは構造の変化を引き起こすヒトの任意の状態の発症または進行を検出および/またはモニタリングするために用いることができる。例えば、本発明は、細胞の状態によって示される、特定の疾患に対する素因を評価するため、または疾患の病期もしくはリスクを評価するために用いることができる。また、示された細胞状態に基づいて適切な治療法を特定することにより、または治療を行った細胞の状態にみられる変化を示すことにより、これを疾患に対する治療法の有効性の誘導または評価のために用いることもできる。
【0012】
本発明の他の態様においては、汎用細胞収集用保存液を開示する。本保存液は、少容量における細胞形態および生体分子の同時保存を可能とする。このような細胞標本を収集するための装置も本発明の態様である。
【0013】
本発明のさらにもう1つの態様では、溶液相における細胞形態および生化学的分析によって標本を分析する方法および組成物を提供する。生化学的分析は定量的または定性的なものであり、RNA、DNA、タンパク質、糖質またはそれらの任意の組み合わせを直接分析する。
【図面の簡単な説明】
【0014】
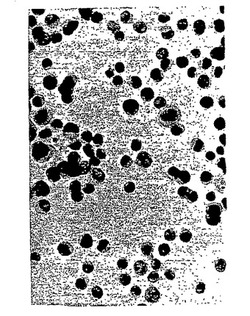
【図1】UCM 127、ベースライン(室温で12時間)。CaSki細胞。倍率200倍。パパニコロー染色。
【図2】UCM 127、室温で3週間。CaSki細胞。倍率200倍。パパニコロー染色。
【図3】UCM 127、室温で6週間。CaSki細胞。倍率200倍。H&E染色。
【図4】UCM 128、(室温で12週間)。CaSki細胞。倍率200倍。パパニコロー染色。
【図5】UCM 128、室温で3週間。CaSki細胞。倍率200倍。パパニコロー染色。
【図6】UCM 128、室温で6週間。CaSki細胞。倍率400倍。H&E染色。
【図7】UCM 130、ベースライン(室温で12週間)。CaSki細胞。倍率200倍。H&E染色。
【図8】UCM 130、室温で3週間。CaSki細胞。倍率200倍。パパニコロー染色。
【図9】UCM 130、室温で6週間。CaSki細胞。倍率400倍。H&E染色。
【図10】PreservCyt(134)、ベースライン(室温で12週間)。CaSki細胞。倍率200倍。H&E染色。
【図11】PreservCyt(134)、室温で3週間。CaSki細胞。倍率200倍。H&E染色。
【図12】PreservCyt(134)、室温で6週間。CaSki細胞。倍率400倍。H&E染色。
【図13】CytoRich(135)、ベースライン(室温で12週間)。CaSki細胞。倍率200倍。パパニコロー染色。
【図14】CytoRich(135)、室温で3週間。CaSki細胞。倍率200倍。パパニコロー染色。
【図15】CytoRich(135)、室温で6週間。CaSki細胞。倍率400倍。H&E染色。
【図16】UCM 141、室温で6週間。CaSki細胞。倍率400倍。H&E染色。
【図17】UCM 149、室温で6週間。CaSki細胞。倍率400倍。H&E染色。
【図18】UCM 141、室温でのベースライン。正常上皮細胞およびCaSki細胞。倍率200倍。
【図19】UCM 141、4℃でのベースライン。正常上皮細胞およびCaSki細胞。倍率200倍。
【図20】UCM 141、室温で10日間。正常上皮細胞およびCaSki細胞。倍率200倍。
【図21】UCM 141、4℃で10日間。正常上皮細胞およびCaSki細胞。倍率200倍。
【図22】UCM 141、室温で10日間。正常上皮細胞およびCaSki細胞。倍率200倍。
【図23】UCM 141、4℃で10日間。正常上皮細胞およびCaSki細胞。倍率200倍。
【図24】UCM 149、室温でのベースライン。正常上皮細胞およびCaSki細胞。倍率200倍。
【図25】UCM 149、4℃でのベースライン。正常上皮細胞およびCaSki細胞。倍率200倍。
【図26】UCM 149、室温で10日間。正常上皮細胞およびCaSki細胞。倍率200倍。
【図27】UCM 149、4℃で10日間。正常上皮細胞およびCaSki細胞。倍率200倍。
【図28】UCM 149、室温で3週間。正常上皮細胞およびCaSki細胞。倍率200倍。
【図29】UCM 149、4℃で3週間。正常上皮細胞およびCaSki細胞。倍率200倍。
【図30】PreservCyt、室温でのベースライン。正常上皮細胞およびCaSki細胞。倍率200倍。
【図31】PreservCyt、4℃でのベースライン。正常上皮細胞およびCaSki細胞。倍率200倍。
【図32】PreservCyt、室温で10日間。正常上皮細胞およびCaSki細胞。倍率200倍。
【図33】PreservCyt、4℃で10日間。正常上皮細胞およびCaSki細胞。倍率200倍。
【図34】PreservCyt、室温で3週間。正常上皮細胞およびCaSki細胞。倍率200倍。
【図35】PreservCyt、4℃で3週間。正常上皮細胞およびCaSki細胞。倍率200倍。
【図36】CytoRich、室温でのベースライン。正常上皮細胞およびCaSki細胞。倍率200倍。
【図37】CytoRich、4℃でのベースライン。正常上皮細胞およびCaSki細胞。倍率200倍。
【図38】CytoRich、室温で10日間。正常上皮細胞およびCaSki細胞。倍率200倍。
【図39】CytoRich、4℃で10日間。正常上皮細胞およびCaSki細胞。倍率200倍。
【図40】CytoRich、室温で3週間。正常上皮細胞およびCaSki細胞。倍率200倍。
【図41】CytoRich、4℃で3週間。正常上皮細胞およびCaSki細胞。倍率200倍。
【図42】従来のパパニコロー塗沫標本(保管標本)。倍率120倍。
【発明を実施するための形態】
【0015】
発明の詳細な説明
本発明は、細胞学的アッセイ、分子アッセイまたはその両方を用いた疾患の存在または進行の評価のために、単一の少量の患者標本から単離した細胞およびその内容物を都合良く収集して保存することを可能にする、汎用細胞収集用保存液に関する。
【0016】
本発明の汎用細胞収集用保存液は、定性分析または定量分析のための細胞標本における細胞形態を保存し、高分子を保存する。開示する細胞収集用保存液の1つの有用な形態は、細胞内の核酸を保存する。このような保存は冷凍した標本に限られる可能性がある。または、保存した標本を常温で維持しうる可能性もある。種々の形態の汎用収集用保存液により、標本が数日間もしくは数週間、またはそれ以上にわたって保存される。汎用細胞収集用保存液は任意の目的のために細胞標本を収集するのに用いることができ、何らかの特定のアッセイ法による使用には限定されない。汎用収集用保存液のいくつかの形態は、等張緩衝食塩液、またはメタノール、エタノールもしくは類似のアルコールなどのアルコール溶液、RNasinなどのRNase阻害剤、およびペプスタチンなどのプロテアーゼ阻害剤を含む。数多くのさまざまなヌクレアーゼ阻害剤が当技術分野で知られており、これには例えば、バナジン酸複合体、キレート剤および界面活性剤を基剤とする化合物のほか、RNasinなどの特異的阻害剤が含まれる。あらゆる既知のヌクレアーゼ阻害剤および/またはプロテアーゼ阻害剤を、標本中の特定の関心対象の分子を保存するために汎用収集用保存液の成分として本発明に用いることができる。
【0017】
本発明の製剤(formulation)は、単一の標本に含まれる細胞に対して細胞学的アッセイおよび分子分析を行うための手段を初めて提供する。細胞を患者から入手し、本発明のUCM中に貯蔵する。この単一の標本から、細胞を抽出して細胞学的検査を行い、細胞DNAを定性的もしくは定量的に検査する、細胞RNAを定性的もしくは定量的に検査する、または分析の任意の組み合わせを行う。異なる分析を同時に行うか、または例えば、細胞学的分析の結果を得た後、それから数日、数週間もしくはさらには数カ月後に細胞を分子分析に供する。その反対に、例えば自動スクリーニングによる、UCM中に含まれる細胞の分子分析の後、それから数日、数週間もしくはさらには数カ月後に標本を細胞学的分析のために回収する。
【0018】
本発明の1つの態様において、本発明の汎用収集用保存液(UCM)製剤は、1つまたは複数のアルコール、架橋剤ならびにRNA、DNAおよびタンパク質の分解を抑制する薬剤の混合物などの保存剤を含む、緩衝化された水性溶液である。抗菌薬の添加により、UCM製剤の用途はさらに拡張される。
【0019】
UCMの製剤化にはほとんどあらゆる非粘性アルコールが使用可能であり、例えば、C1〜C10アルコールまたはそれらの組み合わせを用いることができる。好ましいアルコールには、メタノール、エタノール、プロパノール、ブタノールおよびペンタノールが含まれる。エタノールおよびn-ブタノールが最も好ましい。アルコールは製剤のかなりの割合を占めることができる。例えば、アルコール成分がUCM製剤の約1%〜約75%を占めることができる。UCM製剤中では約1%〜約50%の範囲のアルコールがより好ましく、約5%〜約30%の範囲のアルコールがより好ましい。約5%〜約15%の範囲のアルコールもまた好ましい。
【0020】
UCM製剤のpHの範囲は、細胞の細胞生化学的および形態学的な完全性を維持するために重要である。本発明のUCMの製剤化には約2.5〜約6の範囲のpHを用いる。より好ましいのは約3〜約5の範囲のpHであり、最も好ましいのは約3.5〜約4.5の範囲のpHである。UCMのpHを一定値に維持するためには緩衝剤を用いる。指定pH範囲における緩衝能を有する任意の緩衝剤を本発明のUCMに用いることができる。緩衝成分の非制限的な例には、グリシン、マレイン酸、リン酸、酒石酸、クエン酸、蟻酸または酢酸などが含まれる。
【0021】
本発明の架橋剤は、UCM製剤の約1%〜約25%を占める。架橋剤が約1%〜約15%または約1%〜約10%を占めることが好ましい。架橋剤がUCM製剤の約1%〜約5%を占めることが最も好ましい。架橋剤(固定剤としても知られる)は当技術分野で周知であり(例えば、「ステッドマン医学大辞典(Stedman's Medical Dictionary)」、第25版、Williams & Wilkins、Baltimore MD 1990、592ページを参照)、UCM製剤におけるそれらの使用は本発明に鑑みて当業者には直ちに明らかになると思われる。UCM製剤に用いるための架橋剤の非制限的な例には、ホルムアルデヒド、グルタルアルデヒドなどのアルデヒドが含まれる。好ましい架橋剤はグルタルアルデヒド亜硫酸水素塩である。
【0022】
固定剤は、ステッドマン(Stedman's)によれば「固定、結合または硬化もしくは安定化に役立つ」ものと定義されている。これらは、「通常、タンパク質成分を変性および沈殿させること、または架橋させることにより、組織の肉眼的・組織学的検体または個々の細胞の保存に用いられる」物質である。本発明に従って用いられるこのような固定剤の非制限的な例は、ポリ(エチレングリコール)およびポリ(エチレンオキシド)などの重合体である。ポリ(エチレングリコール)が好ましく、分子量が約600〜約4,600の範囲のポリ(エチレングリコール)(「PEG」)がより好ましい。分子量が1500であるPEG(「PEG-1500」)が最も好ましい。固定剤は、本発明の目的に関しては架橋剤と同等の様式で作用し、架橋剤に関して上に述べた通りに製剤化される。
【0023】
RNA、DNAおよび/またはタンパク質の分解を抑制しうる薬剤は当技術分野で周知である。これらは酵素の阻害もしくは金属イオンの隔絶またはその両方によって作用しうる。RNasinもしくはペプスタチンなどのヌクレアーゼ阻害剤またはプロテアーゼ阻害剤、またはキレート剤を本発明に従って用いることができる。RNA、DNAおよび/またはタンパク質の分解を抑制するのに好ましい薬剤はキレート剤である。キレート剤は当技術分野で周知であり(例えば、「生化学研究用データ(Data For Biochemical Research)」、第3版、Rex M. C. Dawsonら、Oxford University Press 1986、第17章)、金属イオンおよび酵素による生体高分子の分解をいずれも減弱させることが知られている。本発明に用いるためのキレート剤の非制限的な例には、ムレキシド、クロモトロプ酸、1-(1-ヒドロキシ-2-ナフチルアゾ)-2-ヒドロキシ-5-ニトロナフタレン-4-スルホン酸、EDTA(エチレンジアミン四酢酸)、o-フェナントロリン、チオ尿素などが含まれる。好ましいキレート剤はEDTAである。
【0024】
本発明に用いるための抗菌薬は当技術分野で周知のものである。抗菌薬の非制限的な例には、アミノグリコシド、β-ラクタム系抗生物質、セファロスポリン系抗生物質、マクロライド系抗生物質、ペニシリン系抗生物質、アジドなどである。好ましい抗菌薬はアジ化ナトリウムである。
【0025】
この汎用収集用保存液を、関心対象の細胞状態と関係のある種々の特徴に関する2つまたはそれ以上のアッセイの組み合わせに対して用いることができる。本明細書で用いる場合、1つまたは複数のアッセイとは、その結果を他の特徴に関するこのような測定と組み合わせることによって、1つまたは複数の疾患に感染していると疑われる細胞の全体的評価が得られるような、特定の特徴の検出または測定のことを指す。これらのアッセイには、例えば、その存在またはレベルから、疾患の存在または進行に関する固有の指標が得られるような、特定のRNAまたはDNAまたはタンパク質または糖質の構造に関する形態学的分析および定量化の組み合わせが含まれうる。
【0026】
この汎用収集用保存液は、任意の望ましい細胞標本を収集するために用いることができる。細胞標本は擦過、生検または洗浄を含む任意の適した様式で任意の適した源から収集する。さまざまな細胞収集法が知られており、任意のものを本発明に用いることができる。一般に、細胞標本用の細胞の源は、関心対象の細胞状態に冒されることが知られている、またはその可能性が高い組織に基づいて選択する。
【0027】
本発明に用いるための細胞標本は、液体保存液中に収集して貯蔵することができる。有用な細胞収集用保存液の例には、PreservCyt(登録商標)(Cytyc)およびCytoRich(商標)(Autocyte)がある。これらの保存液は細胞診標本の収集のために開発されたが、本明細書の記載の通りに変更すると分子アッセイによる使用に適合化することができる。
【0028】
核酸検出には一般に、アッセイを標本収集の直後に行わない場合には、アッセイを行う前に核酸分解を防止しうる試薬を用いることが有益である。有用な保存液は、核酸(RNAおよびDNAの両方)およびタンパク質に対する安定化剤を有するとともに細胞形態を保存する、本発明の汎用収集用保存液などの、保存剤をベースとする収集用保存液である。
【0029】
本発明に関して有用な1つの方法は、疾病状態に関与する遺伝子の発現レベルを測定する段階、および、細胞における疾患の状態の指標としてそれらの発現を相互または参照遺伝子に対して比較する段階を含む。疾病状態の評価の正確性および信頼性を高めるために、このような測定を他のアッセイと組み合わせることが可能である。本発明は、細胞の状態によって示される疾患の病期を評価するために用いることができる。また、示された疾病状態に基づいて適切な治療法を特定することにより、または治療を行った細胞の状態にみられる変化を示すことにより、本態様を疾患に対する治療法の有効性を示すために用いることもできる。細胞標本における細胞形態および細胞生体分子を保存し、同一標本に対して多数のアッセイを行えるようにするための細胞収集用保存液も開示する。
【0030】
多くの疾患および他のヒトの状態は、特異的な細胞表現型および遺伝子発現パターンを特徴とする。このような疾患および状態は、特異的な細胞形態または特定の生体分子のレベルもしくは構造を評価することにより、同定および/またはモニタリングが可能である。例えば、新生物細胞および癌細胞は一般に、ある種の特有の形態および成長特性を呈する。遺伝子変異および遺伝子発現パターンなどの分子的特徴も、疾患進行の優れた指標である。ウイルスに感染した細胞は、ウイルス遺伝子の発現を含む、異なる形態および遺伝子発現パターンを示すことがある。本発明を用いると、細胞形態および/または遺伝子発現の変化などの細胞状態の特徴を、患者標本から決定することができる。
【0031】
検出しようとする特徴は、細胞標本中に存在することが疑われる関心対象の細胞状態および疾患に対して特異的なものである。このような特徴は一般に、細胞学的特徴および分子的特徴の2種類に分けることができる。本明細書で用いる細胞学的特徴とは、例えば、全体的な細胞の形状ならびに細胞およびそのオルガネラの外観などの特徴のことである。多くの新生物細胞および癌細胞の一次的な同定および分類は、伝統的に細胞学的特徴を用いて行われてきた。細胞学的特徴の同定は一般に時間がかかり、比較的高いレベルの熟練を要する上、自動化は一般に容易でない。本明細書で用いる分子的特徴とは、タンパク質、核酸、糖質および代謝産物などの特定の分子種の存在および/または非存在のことである。このような分子的特徴は一般に、関心対象の特定の分子の検出および/または定量化によって同定される。
【0032】
本発明により、細胞学的および分子的な特徴の両方を少量の患者標本から分析することが可能となる。アッセイされる特徴には、疾患の直接的な原因または結果ではないものの、ある種の疾患および細胞状態と関係のある追加マーカーまたは代用マーカーが含まれうる。このような追加マーカーの例には、多型マーカー、女性の子宮頸癌の素因となるB7などのヒト白血球抗原(HLA)、癌遺伝子、p53変異、BRCA1/2変異、他の癌マーカー、癌抑制因子、サイトカイン、増殖因子受容体およびホルモンが含まれる。このようなマーカーは、状態または疾患に特異的な特徴を呈する細胞に存在するものでも存在しないものでもよく、このような有無は、例えば、疾病状態の重症度が比較的高いまたは低いという指標になりうる。これらのマーカーを本開示の方法と併用して、異常スコアの数または定量的マーカーの変化の大きさに応じて、新生物疾患のリスクが比較的高いことまたは低いことを推定することができる。
【0033】
本発明を用いて評価を行う疾病状態の例には、自己免疫疾患、新生物および癌が非制限的に含まれる。関心対象となるその他の疾病状態には、HPV感染症、子宮頸部上皮内腫瘍(CIN)および癌、意義不明の(undetermined significance)異型扁平上皮細胞(ASCUS)、いぼ(warts)、疣贅状表皮発育異常症および他の皮膚疾患、喉頭パピローマ、口腔パピローマ、結膜パピローマを含むHPVに基づく疾患、ならびに前立腺肥大および前立腺癌を含む前立腺疾患、クラミジア、ならびにHIVおよびヘルペスなどのウイルス感染症が含まれる。
【0034】
本明細書で用いる用語としての細胞標本とは、主として、患者からの細胞の収集物のことである。細胞の入手方法の一つは非侵襲的な手段によるものであり、これは本明細書において、患者に対して穿刺を行わずに入手することと定義される。非侵襲的な手段の例には、例えば、尿から、または鼻、上皮、子宮頸部もしくは他の細胞表面の擦過によって入手した細胞標本がある。細胞標本を入手するための他の方法は、針生検または組織生検によるものである。細胞は10ml未満の容積中に収集される。より好ましくは、細胞は約5ml未満の容積中に収集され、最も好ましくは細胞は約2ml未満の容積中に収集される。
【0035】
本発明の保存液および装置による多数のアッセイの組み合わせを用いてもよく、これを単一の標本の使用および収集から行うことができる。アッセイの組み合わせの重要な局面は、必要なアッセイ特異的な処理段階の数を最小限に抑えながら、単一の細胞標本を種類の異なる多数のアッセイに用いることを可能にする、汎用細胞収集用保存液を用いる点である。例えば、細胞学的特徴をアッセイするための細胞を大容量の液体中に収集することが一般的であり、このために分子的特徴の大部分のアッセイにとっては細胞標本が過度に希釈される。先行技術の方法では、細胞学的アッセイおよび分子分析の両方に対する直接的な方法は得られない。先行技術の方法は分離濃縮段階などの余分な段階を要し、これは不便である上、細胞の分子成分の多くの分解を引き起こす可能性がある。一方、細胞診用の細胞標本は細胞形態を保つように最適化されているが、一般に核酸は同じようには保存されず、このため、標本を多くの分子アッセイに用いることができなくなる。
【0036】
本発明の方法に用いるための細胞標本は、行おうとするアッセイに合った任意の様式で固定されうるまたは処理されうる。例えば、細胞学的アッセイおよび分子アッセイの両方を、スライドガラスなどの固体基質上に固定した細胞を用いて行うことができる。しかし、分子アッセイは溶液中で行うことが好ましい。一般に、行うアッセイの必要条件により、用いるべき標本処理が決まる。
【0037】
上記のタイプの比較を、多くの異なる遺伝子および疾病状態に対して用いることもできる。すなわち、関心対象の遺伝子の発現レベルの測定値を、例えば、異なる細胞標本(同じ源からのより早期の細胞標本、または適切な参照細胞など)における同じ種類の遺伝子の発現レベルと、同じもしくは異なる細胞標本における異なる種類の遺伝子の発現レベルと、同じ細胞標本における参照遺伝子の発現レベルと、または参照細胞における参照遺伝子の発現レベルと、比較することができる。
【0038】
関心対象の遺伝子の発現は、任意の適した方法を用いて評価されうる。例えば、RNAはハイブリダイゼーション法、増幅法またはシークエンシング法を用いて検出されうり、タンパク質は糖質と同じように特異抗体を用いて検出可能されうる。発現産物の検出による遺伝子発現の特異的検出のための技法は数多く知られており、本開示のUCMとともに用いることができる。関心対象の遺伝子の発現レベルの検出および測定のための技法の一つは、関心対象の遺伝子から転写されたRNAの検出である。最も信頼性の高い比較を行うためには、比較しようとする発現レベルを同じ技法を用いて測定し、同じ様式で行う必要がある。
【0039】
細胞標本中の関心対象の遺伝子の発現レベルを測定するための有用な方法には、ダイジーン(Digene)社により国際公開公報第93/10263号に記載されたハイブリッドキャプチャー法(hybrid capture technique)(Nuovo、1997)により記載されたPCRインサイチューハイブリダイゼーション法、分枝状DNAアッセイ(Chernoff(1997))、転写媒介性増幅(TMA)(Stoflet(1988)、ならびに、ポリメラーゼ連鎖反応(PCR)、リガーゼ連鎖反応(LCR)、自律的配列複製(3SR)、核酸配列に基づく増幅(NASBA)、鎖置換増幅(SDA)およびQβレプリカーゼによる増幅(BirkenmeyerおよびMushahwar(1991);Landegren(1993))が含まれる。遺伝子発現産物の検出および測定のためのアッセイはさまざまなものが知られており、UCM中に収集した標本を用いた関心対象の遺伝子の発現レベルの決定のために適合化することができる。
【0040】
本発明は、これまでは行えなかった細胞の分析法を提供する。例えば、癌細胞および癌でない細胞の組み合わせを本発明による汎用収集用保存液中に入れた。4℃または室温で12時間、10日間、3週間および6週間にわたって貯蔵した後に、細胞の形態を検査した。スライドガラスは、パパニコロー染色およびヘマトキシリン・エオジン(H&E)などの当技術分野で周知の手順を用いる染色によって調製した。スライドガラスを光学顕微鏡で検査したところ、癌細胞に特徴的なすべての特徴が認められ、すべての場合に良好に保たれていた。スライドガラス上には、不規則な顆粒状のクロマチンを伴う通常は卵形の大きな高色素性の核、乏しい細胞質、多核細胞、核小体の存在および分裂像が認められた。加えて、スライドガラス上の細胞の分散は良好であり、細胞の集塊化は認められなかった。いずれの種類の細胞(正常および癌)とも、核および細胞質の形態は明確かつ鮮明であった。核は良好に染色され、正常細胞には細胞の成熟度に応じて異なる色調の細胞質が認められた。
【0041】
本発明の1つの態様では、溶液系での手順によって直接RNAが分析される。マイクロタイタープレートのウェル内に含まれる細胞に対してタンパク質分解酵素を添加することにより、細胞をまず溶解した。本発明に用いるための酵素の非制限的な例にはプロテイナーゼKまたはプロナーゼが含まれる。細胞を界面活性剤による溶解もしくは浸透圧溶解またはフレンチプレスに供することもできる。インキュベーションの後に、ビオチン化したDNAプローブを各ウェルに添加した。ストレプトアビジンでコーティングしたマイクロプレートに移すことにより、RNA:DNAハイブリッドを固相上に捕捉した。RNA:DNAハイブリッドに対するアルカリホスファターゼ結合抗体をハイブリダイゼーション用マイクロプレート内の各ウェルに添加し、CDP-Star(商標)などの化学発光試薬をエメラルドII(Emerald II)(Tropix)とともに各ウェルに添加することによってシグナルを発生させた。シグナルをマイクロプレートから読み取った。マイクロタイタープレートを抗RNA:DNAハイブリッド抗体でコートし、プローブを非標識RNAプローブとした点を除き、溶液系でのDNA分析をRNA分析と同様に行った。
【0042】
本発明は、試薬ならびに標本の収集および操作用の材料などの、本方法のために必要な材料の1つまたは複数を含むキットを用いて便利に行うことができる。例えば、本キットは、標本保存用の試薬、DNA配列、RNA配列および/または1つもしくは複数のDNA配列発現産物(mRNAまたはタンパク質)の特異的検出のための試薬、ならびにおよび標本操作用の容器を含みうる。DNA配列および/またはRNA配列の検出のために有用な試薬は、それらの配列に対する核酸プローブまたはタンパク質核酸プローブである。DNA配列の発現産物(タンパク質)の検出のために有用な試薬は抗体である。癌細胞に付随する異常糖鎖抗原を抗体によって検出することもできる。キットが、対照用の標本もしくは試薬、または本開示のアッセイと組み合わせる他のアッセイを行うための試薬および材料も含んでもよい。
【0043】
本発明は、本方法に適合させた装置を用いて実施しうる。同様のアッセイを行うための装置はさまざまなものが知られ、用いられており、本開示のUCM製剤、アッセイおよび方法と用いるために適合化することができる。例えば、標本のアッセイおよびアッセイにおける標本の操作のすべてまたは一部を自動化するための装置が知られている。
【0044】
本開示の方法のすべてまたは一部を、特殊用途コンピュータプログラムを用いて制御または管理することができる。本開示の方法によって収集したデータ、および組み合わせて用いた任意の他のアッセイによるデータを、特殊用途コンピュータプログラムを用いてまとめ、解析して、種々の形式で種々の目的用に出力することができる。このようなプログラムは、他の患者またはデータ管理用のコンピュータプログラムとともに用いること、またはその中に組み込むことが可能である。このようなプログラムの有用性は、組み合わせる測定および評価の数、ならびに各種の測定の全体的評価に対する相対的重要性が増大するほど増す。本開示の方法とともに用いるためのコンピュータプログラムは、汎用コンピュータ上で用いること、本開示の方法を制御するための特殊用途コンピュータもしくはコンピュータ化装置に組み入れること、またはその両方が可能である。
【実施例】
【0045】
以下の実施例は、本発明の実施のさまざまな局面を例示するためのものであり、いかなる形でも発明を制限するものではない。
【0046】
製剤
製剤127
20%エタノール
0.05%NaN3
5mM EDTA
2.5%グルタルアルデヒド-亜硫酸水素ナトリウム(G-S-B)
0.2M NaOAc-HOAc
pH 3.7
製剤128
20%エタノール
0.05%NaN3
5mM EDTA
2.5%グルタルアルデヒド-亜硫酸水素ナトリウム(G-S-B)
0.2M NaOAc-HOAc
pH 4.1
製剤130
7%ブタノール
0.05%NaN3
5mM EDTA
2.5%グルタルアルデヒド-亜硫酸水素ナトリウム(G-S-B)
0.2M NaOAc-HOAc
pH 3.7
製剤134
PreservCyt(登録商標)(Cytyc Corporation)
緩衝化メタノールを含む
細胞診標本の貯蔵限界:4℃〜37℃で3週間
製剤135
CytoRich(商標)(AutoCyte Corporation)
24%未満のアルコールを含む
15℃〜30℃で貯蔵
製剤141
20%エタノール
0.05%NaN3
5mM EDTA
2.5%グルタルアルデヒド-亜硫酸水素ナトリウム(G-S-B)
0.2M NaOAc-HOAc
pH 4.4
製剤149
10%ブタノール
0.05%NaN3
5mM EDTA
2.5%グルタルアルデヒド-亜硫酸水素ナトリウム(G-S-B)
0.2M NaOAc-HOAc
pH 4.4
製剤167
9%ブタノール
0.05%NaN3
5mM EDTA
2%PEG-1500
10mM NaOAc-HOAc
pH 4.5
【0047】
実施例1:核酸分析のための一般的な方法
核酸に関するアッセイは原則として、ダイジーン(Digene)社により国際公開公報第93/10263号に記載されたダイジーン・ハイブリッドキャプチャーHIVテスト(Digene Hybrid Capture HIV Test)によってHIV RNAを検出するための方法に従って行う。簡潔に述べると、可溶化の後に、50μlのプローブ混合液(DNAビオチン化プローブを含む)を各ウェルに添加した。プレートを密封し、ハイブリダイゼーションが起こるように65℃で1.5時間インキュベートした。ハイブリダイゼーションの後に、ストレプトアビジンでコーティングしたマイクロプレートに標本を移し、25μLの抗ハイブリッド抗体を各ウェルに添加した。プレートを室温にて1100RPMで1時間攪拌した。ウェルを65℃の洗浄バッファーで6回洗浄し、続いて蒸留水を用いて1回洗浄した。100μlの化学発光性基質を各ウェルに添加し、プレートを室温で30分間インキュベートした。続いてプレートの読み取りをDML 2000照度計で行った。データはシグナル・ノイズ比として表した。較正曲線を用いて、各検体から生じた化学発光シグナルを細胞1個当たりのmRNAコピー数に換算した。
【0048】
実施例2:形態学的分析のための一般的な方法
HPV 16陽性の癌細胞(CaSki)をUCM 127、128、141、130、149中、および2種類の市販の固定剤であるPreservCyt(Cytyc Corp.)およびCytoRich(AutoCyte)中に置いた。続いて標本を常温で貯蔵した。ベースライン用のスライドガラスは、12時間貯蔵した後に作製した。続いてスライドガラスを3週間後および6週間後にも作製した。さらに、UCM 141および149からも室温で6週間後にスライドガラスを作製した。スライドガラスは、細胞懸濁液200μlをポリカーボネート製フィルターに滴下することによって調製された。続いてフィルターをスライドガラス上に置き、ブロッティングを行った。フィルターを取り除き、スライドガラスを95%エタノール中で5分間固定した。スライドガラスを慣用的パパニコロー染色およびヘマトキシリン・エオジン(H&E)によって染色した。スライドガラスを光学顕微鏡により、さまざまな倍率を用いて評価し、カラー写真の形式で記録を行った。さらに、正常ヒト子宮頸部細胞およびCaSki細胞の混合物を用いて、より小規模の試験も行った。この混合物を2種類のUCM製剤141および149の中、ならびにPreservCytおよびCytoRich対照の中に置いた。各標本を2本のチューブに分け、室温および4℃に置いた。12時間(ベースライン)、10日間および3週間貯蔵した後に、スライドガラスを作製し、パパニコロー染色によって染色した。形態試験に関しては以下の特徴を評価した:細胞の分散、細胞の形状、核の形状、クロマチンのパターンおよび染色強度、核/細胞質比、核小体の存在、細胞質の形状および染色の色調。図1〜図24は、室温で12時間、3週間および6週間貯蔵した、種々のUCM中ならびにPreservCytおよびCytoRich対照中に貯蔵したCaSki細胞の形態を示している。3週間後および6週間後には、検討したすべての固定剤において、CaSki細胞(癌細胞)に特徴的なすべての特徴が認められ、良好に保たれていた:すなわち、不規則な顆粒状のクロマチンを伴う通常は卵形の大きな高色素性の核、乏しい細胞質、多核細胞、核小体の存在および分裂像。加えて、検討したすべての保存液において、スライドガラス上の細胞の分散は良好であり、細胞の集塊化は認められなかった。
【0049】
図25〜図72は、CaSki細胞と混合され、UCM 141、149ならびにPreservCytおよびCytoRich対照中に室温および4℃で12時間、10日間および3週間にわたり貯蔵された正常ヒト子宮頸部細胞の形態を示している。これらのスライドガラスの評価により、UCMならびにPreservCytおよびCytoRich対照において、形態が良好に保たれたことが示された。4℃および室温で3週間おいた場合には、いずれの種類の細胞(正常子宮頸部細胞およびCaSki細胞)も明確かつ鮮明な形状を示した(核および細胞質とも)。核は良好に染色され、正常細胞には細胞の成熟度に応じて異なる色調の細胞質が認められた。
【0050】
図73〜図75は、貯蔵してスライドガラス上に固定した標本の形態および染色を比較用に示す目的で、保管してある慣用的パパニコロー塗沫標本(Pap smears)を撮影したものである。
【0051】
実施例3:HC II HPV DNAアッセイの結果
UCM製剤127、128、130およびSTM(商標)(Digene)対照の検査を、ハイブリッドキャプチャーII HPV DNAテスト(Hybrid Capture II HPV DNA Test)を用いて行った。標準的なHC II HPVテストキット(Digeneカタログ番号5101-1096)を用いた。各収集用保存液(1mL)に0.8×106個のCaSki細胞(〜500コピー/細胞)を加えた。CaSki細胞のこの濃度を選択した理由は、適切な臨床検査材料が通常、約1×106個の細胞を含むことによる。続いて、CaSki細胞の同じ貯蔵物を形態学的検討ならびにDNAおよびRNAの検査に用いた。添付文書に記載された通り、標準的な容積である50μlを用い、標本の調製には何ら変更を加えなかった。同様のSTM標本を調製した。同じ数のCaSki細胞を1mLのダイジーン標本移行保存液(Digene Sample Transport Medium)(STM-この保存液はHPV検査に現在用いられている保存液である。これはDNAおよびRNAを保つが、細胞形態は保存されない)。HC II HPV検査は、第「0」日(ベースライン)ならびに室温で1週間および6週間貯蔵した後に行った。表1は、ベースライン時ならびに1週間後および6週間後に各保存液から得られた結果をS/N比として表した上で示している。
【0052】
UCM製剤127および128は、STM対照のベースラインでのS/N比に匹敵する最も高いS/N比を示し、室温で6週間貯蔵した後にもこれらの値を保った。ベースラインで得たUM 130のS/N比は、UCM 127および128よりも幾分低かった。UCM 130は6週間後もそのシグナルを保った。
【0053】
(表1) ベースライン時ならびに室温で1週間および6週間貯蔵した後に、UCM 127、128、130およびSTMに関して得られたシグナル対ノイズ比

【0054】
より小規模の形態的検討に用いた製剤UCM 141および149を、ベースライン時およびその後室温で1週間、2週間および4週間貯蔵した後に、HC II HPV DNAアッセイで検査した。CaSki細胞(1.5×106個)をこれらの保存液に加え、50μlを各アッセイごとに用いた。表2にS/N比を示した。どちらの製剤も、室温で4週間貯蔵した後に最初のシグナルを100%近く保っていた(UCM 141で98.4%、UCM 149で97.3%)。
【0055】
(表2) ベースライン時ならびに室温で1週間、2週間および4週間貯蔵した後に製剤UC 141および149に関して得られたS/N比

【0056】
さらに、PreservCytおよびCytoRich中に貯蔵した標本も本実施例のプロトコールに従って検討した。PreservCyt保存液およびCytoRich保存液にはいずれも、満足の行く分析を行えるDNAを提供する能力はないことが明らかになった。
【0057】
実施例4:HC II RNAアッセイの結果
すべての製剤のアリコート(CaSki細胞0.8×106個)を室温ではなく4℃で貯蔵し、HC II HPV RNAアッセイにて検査した。この試験に用いた試行的なRNAアッセイには、HPV 16E6/E7 RNAに対して特異的なビオチン化一本鎖DNAプローブを用いた。UCM製剤127、128および130の検査は、ベースライン時ならびに4℃で1週間および6週間貯蔵した後に行った。UCM製剤141および149の検査は、ベースライン時ならびに4℃で1週間、2週間および6週間貯蔵した後に行った。表3および4にその結果を示す。
【0058】
(表3) ベースライン時ならびに4℃で1週間および6週間貯蔵した後の、HC II RNAアッセイにおいてUCM 127、128および130に関して得られた結果

【0059】
検討したUCM製剤はすべて、ベースライン時の検査ではS/N比が同程度であった。UCM 127、128および130は、4℃で6週間貯蔵された後にも、ベースライン時の結果と比較して100%のシグナルを保った。UCM製剤141および149中の細胞内のRNAはいずれも4℃で4週間にわたり安定であるように思われ、ベースライン時の結果に近いS/N比が得られた(UCM 141で108%、UCM 149で89%)。
【0060】
(表4) ベースライン時ならびに4℃で1週間、2週間および6週間貯蔵した後の、HC II RNAアッセイにおいてUCM 141および149に関して得られた結果

【0061】
さらに、PreservCytおよびCytoRich中に貯蔵した標本も本実施例のプロトコールに従って検討した。PreservCyt保存液およびCytoRich保存液にはいずれも、満足の行く分析を行えるDNAを提供する能力はないことが明らかになった。
【0062】
本明細書中に引用した刊行物、および引用された材料は、参照として明確に組み入れられる。
【0063】
当業者は、定型的な範囲の実験により、本明細書に記載された特定の態様の多くの等価物を認識する、または確認しうると考えられる。このような等価物は添付の特許請求の範囲に含まれることが意図されている。
【0064】
参照

【技術分野】
【0001】
発明の分野
本発明は一般に細胞学的アッセイおよび分子アッセイの分野に関し、特に細胞学的アッセイおよび分子アッセイを用いた状態評価のためのアッセイの領域に関する。
【背景技術】
【0002】
発明の背景
ヒトの状態の検出および診断は、疾患の治療のために明らかに重要である。疾患の特徴は数多く同定されており、その多くがそれらの診断のために用いられている。多くの疾患では、罹患した細胞の状態の変化が先行し、それが特徴となる。このような変化には、感染細胞におけるウイルス遺伝子の発現、罹患細胞における遺伝子の発現パターンの変化、および細胞形態の変化が含まれうる。このような細胞状態の評価は、疾患の検出、診断およびモニタリングに役立つ。
【0003】
通常、1つまたは複数の感染症、例えばヒトパピローマウイルスまたは単純ヘルペスウイルスに感染したことが疑われる患者に対しては、分析のために患者から細胞標本を採取する。このような標本は一般に、疾患に主に冒された部位から採取した拭き取り標本(swipe)または細胞擦過標本の形態にある。これらの拭き取り標本では通常、正常細胞と罹患細胞の混合物が収集されるが、細胞の総数は極めて限られている。収集した細胞は、さらに分析を行うためにスライドガラス上に塗沫することが慣習的である。生化学的分析については、細胞学的分析を犠牲にして行われるか、インサイチューハイブリダイゼーションなどの定性的な方法によって行われた。
【0004】
通常、従来の細胞診のために採取した子宮頸部標本は形態学的分析のためにスライドガラス上に塗沫される。この標本から細胞診によって疾患の可能性が特定された場合には、患者は、再度の細胞診および/または遺伝子分析のため、ならびにDNA、RNAまたはタンパク質などの他の分子検査のための第2の標本を得るために再びコルポスコピーを受けなければならない。最近では、形態学用に増強された細胞診用の液体保存液が市場に登場している。これらの保存液はHPV DNAなどに関する分子検査に適用しうることが判明しているが、細胞は通常10ml〜20mlの保存液中に収集され、それによってDNA、RNAおよび他のアッセイ可能な生体分子が過度に希釈されるため、分子検査は理想的でなくなる。さらに、現行の保存用試薬は細胞の形態を維持するものの、これらの試薬はDNAおよびRNAの分解を許容するため、保存を行うと定量的分析は困難または不可能になる。
【0005】
このため、今日の分析では、細胞形態および定量的遺伝分析の評価を行うために少なくとも2つの標本を患者から入手する必要がある。現行の細胞診断法では大量の保存液を用いるため、DNA、RNAおよび他のアッセイ可能な生体分子が過度に希釈される。さらに、現行の保存用試薬は細胞の形態を維持するものの、これらの試薬はDNA、RNAおよびタンパク質などの個々の生体分子の分解を許容するため、定量的分析は不可能になる。
【0006】
形態学的分析および生化学的分析の両方による分析を目的として、細胞または組織を保存するための方法および保存液を設計することには、問題が伴うことが過去に判明している。例えば、形態学的分析のために細胞または組織を固定すると、生化学的分析を行う能力が損なわれる。細胞RNAの保存は、DNA分析および形態学的分析を犠牲にして行われてきた。同じく、細胞DNAの保存は、RNA分析および形態学的分析を犠牲にして行われてきた。
【0007】
本発明の1つの目的は、検出しようとする疾患とは関係なく、単一の標本から、細胞形態を同定するため、ならびにDNA、RNAおよび他の生体分子を量的に保存するための一般的収集用保存液を提供することである。
【0008】
本発明のもう1つの目的は、標本中に得られる細胞の数が限られている細胞標本における細胞形態および核酸、脂質、糖質またはタンパク質を保存するための汎用細胞収集用保存液を提供することである。
【0009】
本発明のもう1つの目的は、関心対象の生体分子の溶液系における直接分析のための組成物および方法を提供することである。本発明の方法および組成物は、インサイチューハイブリダイゼーションなどの非溶液系での方法、または分析の前に関心対象の生体分子を他の細胞成分から分離する必要のある非直接的な方法において生じる問題を解決する。
【発明の概要】
【0010】
発明の概要
本発明は細胞疾患の検出、分析およびモニタリングに関する。細胞標本における細胞形態および定量分析用の細胞生体分子の両方が保たれ、このため単一の患者標本から多数のアッセイを行えるような、新たな細胞収集用保存液を開示する。細胞の状態は、細胞標本を少容量収集するための装置を用いて評価することができる。
【0011】
本発明の1つの態様は、細胞形態を検査すること、および特定のDNA配列を検出すること、または細胞状態に関与する複数の遺伝子の発現レベルを測定し、それらの発現を相互もしくは参照遺伝子に対して比較して、細胞における疾患の状態の指標として特定の比を得ることを含む。本方法は、細胞形態または特定の生体分子のレベルもしくは構造の変化を引き起こすヒトの任意の状態の発症または進行を検出および/またはモニタリングするために用いることができる。例えば、本発明は、細胞の状態によって示される、特定の疾患に対する素因を評価するため、または疾患の病期もしくはリスクを評価するために用いることができる。また、示された細胞状態に基づいて適切な治療法を特定することにより、または治療を行った細胞の状態にみられる変化を示すことにより、これを疾患に対する治療法の有効性の誘導または評価のために用いることもできる。
【0012】
本発明の他の態様においては、汎用細胞収集用保存液を開示する。本保存液は、少容量における細胞形態および生体分子の同時保存を可能とする。このような細胞標本を収集するための装置も本発明の態様である。
【0013】
本発明のさらにもう1つの態様では、溶液相における細胞形態および生化学的分析によって標本を分析する方法および組成物を提供する。生化学的分析は定量的または定性的なものであり、RNA、DNA、タンパク質、糖質またはそれらの任意の組み合わせを直接分析する。
【図面の簡単な説明】
【0014】
【図1】UCM 127、ベースライン(室温で12時間)。CaSki細胞。倍率200倍。パパニコロー染色。
【図2】UCM 127、室温で3週間。CaSki細胞。倍率200倍。パパニコロー染色。
【図3】UCM 127、室温で6週間。CaSki細胞。倍率200倍。H&E染色。
【図4】UCM 128、(室温で12週間)。CaSki細胞。倍率200倍。パパニコロー染色。
【図5】UCM 128、室温で3週間。CaSki細胞。倍率200倍。パパニコロー染色。
【図6】UCM 128、室温で6週間。CaSki細胞。倍率400倍。H&E染色。
【図7】UCM 130、ベースライン(室温で12週間)。CaSki細胞。倍率200倍。H&E染色。
【図8】UCM 130、室温で3週間。CaSki細胞。倍率200倍。パパニコロー染色。
【図9】UCM 130、室温で6週間。CaSki細胞。倍率400倍。H&E染色。
【図10】PreservCyt(134)、ベースライン(室温で12週間)。CaSki細胞。倍率200倍。H&E染色。
【図11】PreservCyt(134)、室温で3週間。CaSki細胞。倍率200倍。H&E染色。
【図12】PreservCyt(134)、室温で6週間。CaSki細胞。倍率400倍。H&E染色。
【図13】CytoRich(135)、ベースライン(室温で12週間)。CaSki細胞。倍率200倍。パパニコロー染色。
【図14】CytoRich(135)、室温で3週間。CaSki細胞。倍率200倍。パパニコロー染色。
【図15】CytoRich(135)、室温で6週間。CaSki細胞。倍率400倍。H&E染色。
【図16】UCM 141、室温で6週間。CaSki細胞。倍率400倍。H&E染色。
【図17】UCM 149、室温で6週間。CaSki細胞。倍率400倍。H&E染色。
【図18】UCM 141、室温でのベースライン。正常上皮細胞およびCaSki細胞。倍率200倍。
【図19】UCM 141、4℃でのベースライン。正常上皮細胞およびCaSki細胞。倍率200倍。
【図20】UCM 141、室温で10日間。正常上皮細胞およびCaSki細胞。倍率200倍。
【図21】UCM 141、4℃で10日間。正常上皮細胞およびCaSki細胞。倍率200倍。
【図22】UCM 141、室温で10日間。正常上皮細胞およびCaSki細胞。倍率200倍。
【図23】UCM 141、4℃で10日間。正常上皮細胞およびCaSki細胞。倍率200倍。
【図24】UCM 149、室温でのベースライン。正常上皮細胞およびCaSki細胞。倍率200倍。
【図25】UCM 149、4℃でのベースライン。正常上皮細胞およびCaSki細胞。倍率200倍。
【図26】UCM 149、室温で10日間。正常上皮細胞およびCaSki細胞。倍率200倍。
【図27】UCM 149、4℃で10日間。正常上皮細胞およびCaSki細胞。倍率200倍。
【図28】UCM 149、室温で3週間。正常上皮細胞およびCaSki細胞。倍率200倍。
【図29】UCM 149、4℃で3週間。正常上皮細胞およびCaSki細胞。倍率200倍。
【図30】PreservCyt、室温でのベースライン。正常上皮細胞およびCaSki細胞。倍率200倍。
【図31】PreservCyt、4℃でのベースライン。正常上皮細胞およびCaSki細胞。倍率200倍。
【図32】PreservCyt、室温で10日間。正常上皮細胞およびCaSki細胞。倍率200倍。
【図33】PreservCyt、4℃で10日間。正常上皮細胞およびCaSki細胞。倍率200倍。
【図34】PreservCyt、室温で3週間。正常上皮細胞およびCaSki細胞。倍率200倍。
【図35】PreservCyt、4℃で3週間。正常上皮細胞およびCaSki細胞。倍率200倍。
【図36】CytoRich、室温でのベースライン。正常上皮細胞およびCaSki細胞。倍率200倍。
【図37】CytoRich、4℃でのベースライン。正常上皮細胞およびCaSki細胞。倍率200倍。
【図38】CytoRich、室温で10日間。正常上皮細胞およびCaSki細胞。倍率200倍。
【図39】CytoRich、4℃で10日間。正常上皮細胞およびCaSki細胞。倍率200倍。
【図40】CytoRich、室温で3週間。正常上皮細胞およびCaSki細胞。倍率200倍。
【図41】CytoRich、4℃で3週間。正常上皮細胞およびCaSki細胞。倍率200倍。
【図42】従来のパパニコロー塗沫標本(保管標本)。倍率120倍。
【発明を実施するための形態】
【0015】
発明の詳細な説明
本発明は、細胞学的アッセイ、分子アッセイまたはその両方を用いた疾患の存在または進行の評価のために、単一の少量の患者標本から単離した細胞およびその内容物を都合良く収集して保存することを可能にする、汎用細胞収集用保存液に関する。
【0016】
本発明の汎用細胞収集用保存液は、定性分析または定量分析のための細胞標本における細胞形態を保存し、高分子を保存する。開示する細胞収集用保存液の1つの有用な形態は、細胞内の核酸を保存する。このような保存は冷凍した標本に限られる可能性がある。または、保存した標本を常温で維持しうる可能性もある。種々の形態の汎用収集用保存液により、標本が数日間もしくは数週間、またはそれ以上にわたって保存される。汎用細胞収集用保存液は任意の目的のために細胞標本を収集するのに用いることができ、何らかの特定のアッセイ法による使用には限定されない。汎用収集用保存液のいくつかの形態は、等張緩衝食塩液、またはメタノール、エタノールもしくは類似のアルコールなどのアルコール溶液、RNasinなどのRNase阻害剤、およびペプスタチンなどのプロテアーゼ阻害剤を含む。数多くのさまざまなヌクレアーゼ阻害剤が当技術分野で知られており、これには例えば、バナジン酸複合体、キレート剤および界面活性剤を基剤とする化合物のほか、RNasinなどの特異的阻害剤が含まれる。あらゆる既知のヌクレアーゼ阻害剤および/またはプロテアーゼ阻害剤を、標本中の特定の関心対象の分子を保存するために汎用収集用保存液の成分として本発明に用いることができる。
【0017】
本発明の製剤(formulation)は、単一の標本に含まれる細胞に対して細胞学的アッセイおよび分子分析を行うための手段を初めて提供する。細胞を患者から入手し、本発明のUCM中に貯蔵する。この単一の標本から、細胞を抽出して細胞学的検査を行い、細胞DNAを定性的もしくは定量的に検査する、細胞RNAを定性的もしくは定量的に検査する、または分析の任意の組み合わせを行う。異なる分析を同時に行うか、または例えば、細胞学的分析の結果を得た後、それから数日、数週間もしくはさらには数カ月後に細胞を分子分析に供する。その反対に、例えば自動スクリーニングによる、UCM中に含まれる細胞の分子分析の後、それから数日、数週間もしくはさらには数カ月後に標本を細胞学的分析のために回収する。
【0018】
本発明の1つの態様において、本発明の汎用収集用保存液(UCM)製剤は、1つまたは複数のアルコール、架橋剤ならびにRNA、DNAおよびタンパク質の分解を抑制する薬剤の混合物などの保存剤を含む、緩衝化された水性溶液である。抗菌薬の添加により、UCM製剤の用途はさらに拡張される。
【0019】
UCMの製剤化にはほとんどあらゆる非粘性アルコールが使用可能であり、例えば、C1〜C10アルコールまたはそれらの組み合わせを用いることができる。好ましいアルコールには、メタノール、エタノール、プロパノール、ブタノールおよびペンタノールが含まれる。エタノールおよびn-ブタノールが最も好ましい。アルコールは製剤のかなりの割合を占めることができる。例えば、アルコール成分がUCM製剤の約1%〜約75%を占めることができる。UCM製剤中では約1%〜約50%の範囲のアルコールがより好ましく、約5%〜約30%の範囲のアルコールがより好ましい。約5%〜約15%の範囲のアルコールもまた好ましい。
【0020】
UCM製剤のpHの範囲は、細胞の細胞生化学的および形態学的な完全性を維持するために重要である。本発明のUCMの製剤化には約2.5〜約6の範囲のpHを用いる。より好ましいのは約3〜約5の範囲のpHであり、最も好ましいのは約3.5〜約4.5の範囲のpHである。UCMのpHを一定値に維持するためには緩衝剤を用いる。指定pH範囲における緩衝能を有する任意の緩衝剤を本発明のUCMに用いることができる。緩衝成分の非制限的な例には、グリシン、マレイン酸、リン酸、酒石酸、クエン酸、蟻酸または酢酸などが含まれる。
【0021】
本発明の架橋剤は、UCM製剤の約1%〜約25%を占める。架橋剤が約1%〜約15%または約1%〜約10%を占めることが好ましい。架橋剤がUCM製剤の約1%〜約5%を占めることが最も好ましい。架橋剤(固定剤としても知られる)は当技術分野で周知であり(例えば、「ステッドマン医学大辞典(Stedman's Medical Dictionary)」、第25版、Williams & Wilkins、Baltimore MD 1990、592ページを参照)、UCM製剤におけるそれらの使用は本発明に鑑みて当業者には直ちに明らかになると思われる。UCM製剤に用いるための架橋剤の非制限的な例には、ホルムアルデヒド、グルタルアルデヒドなどのアルデヒドが含まれる。好ましい架橋剤はグルタルアルデヒド亜硫酸水素塩である。
【0022】
固定剤は、ステッドマン(Stedman's)によれば「固定、結合または硬化もしくは安定化に役立つ」ものと定義されている。これらは、「通常、タンパク質成分を変性および沈殿させること、または架橋させることにより、組織の肉眼的・組織学的検体または個々の細胞の保存に用いられる」物質である。本発明に従って用いられるこのような固定剤の非制限的な例は、ポリ(エチレングリコール)およびポリ(エチレンオキシド)などの重合体である。ポリ(エチレングリコール)が好ましく、分子量が約600〜約4,600の範囲のポリ(エチレングリコール)(「PEG」)がより好ましい。分子量が1500であるPEG(「PEG-1500」)が最も好ましい。固定剤は、本発明の目的に関しては架橋剤と同等の様式で作用し、架橋剤に関して上に述べた通りに製剤化される。
【0023】
RNA、DNAおよび/またはタンパク質の分解を抑制しうる薬剤は当技術分野で周知である。これらは酵素の阻害もしくは金属イオンの隔絶またはその両方によって作用しうる。RNasinもしくはペプスタチンなどのヌクレアーゼ阻害剤またはプロテアーゼ阻害剤、またはキレート剤を本発明に従って用いることができる。RNA、DNAおよび/またはタンパク質の分解を抑制するのに好ましい薬剤はキレート剤である。キレート剤は当技術分野で周知であり(例えば、「生化学研究用データ(Data For Biochemical Research)」、第3版、Rex M. C. Dawsonら、Oxford University Press 1986、第17章)、金属イオンおよび酵素による生体高分子の分解をいずれも減弱させることが知られている。本発明に用いるためのキレート剤の非制限的な例には、ムレキシド、クロモトロプ酸、1-(1-ヒドロキシ-2-ナフチルアゾ)-2-ヒドロキシ-5-ニトロナフタレン-4-スルホン酸、EDTA(エチレンジアミン四酢酸)、o-フェナントロリン、チオ尿素などが含まれる。好ましいキレート剤はEDTAである。
【0024】
本発明に用いるための抗菌薬は当技術分野で周知のものである。抗菌薬の非制限的な例には、アミノグリコシド、β-ラクタム系抗生物質、セファロスポリン系抗生物質、マクロライド系抗生物質、ペニシリン系抗生物質、アジドなどである。好ましい抗菌薬はアジ化ナトリウムである。
【0025】
この汎用収集用保存液を、関心対象の細胞状態と関係のある種々の特徴に関する2つまたはそれ以上のアッセイの組み合わせに対して用いることができる。本明細書で用いる場合、1つまたは複数のアッセイとは、その結果を他の特徴に関するこのような測定と組み合わせることによって、1つまたは複数の疾患に感染していると疑われる細胞の全体的評価が得られるような、特定の特徴の検出または測定のことを指す。これらのアッセイには、例えば、その存在またはレベルから、疾患の存在または進行に関する固有の指標が得られるような、特定のRNAまたはDNAまたはタンパク質または糖質の構造に関する形態学的分析および定量化の組み合わせが含まれうる。
【0026】
この汎用収集用保存液は、任意の望ましい細胞標本を収集するために用いることができる。細胞標本は擦過、生検または洗浄を含む任意の適した様式で任意の適した源から収集する。さまざまな細胞収集法が知られており、任意のものを本発明に用いることができる。一般に、細胞標本用の細胞の源は、関心対象の細胞状態に冒されることが知られている、またはその可能性が高い組織に基づいて選択する。
【0027】
本発明に用いるための細胞標本は、液体保存液中に収集して貯蔵することができる。有用な細胞収集用保存液の例には、PreservCyt(登録商標)(Cytyc)およびCytoRich(商標)(Autocyte)がある。これらの保存液は細胞診標本の収集のために開発されたが、本明細書の記載の通りに変更すると分子アッセイによる使用に適合化することができる。
【0028】
核酸検出には一般に、アッセイを標本収集の直後に行わない場合には、アッセイを行う前に核酸分解を防止しうる試薬を用いることが有益である。有用な保存液は、核酸(RNAおよびDNAの両方)およびタンパク質に対する安定化剤を有するとともに細胞形態を保存する、本発明の汎用収集用保存液などの、保存剤をベースとする収集用保存液である。
【0029】
本発明に関して有用な1つの方法は、疾病状態に関与する遺伝子の発現レベルを測定する段階、および、細胞における疾患の状態の指標としてそれらの発現を相互または参照遺伝子に対して比較する段階を含む。疾病状態の評価の正確性および信頼性を高めるために、このような測定を他のアッセイと組み合わせることが可能である。本発明は、細胞の状態によって示される疾患の病期を評価するために用いることができる。また、示された疾病状態に基づいて適切な治療法を特定することにより、または治療を行った細胞の状態にみられる変化を示すことにより、本態様を疾患に対する治療法の有効性を示すために用いることもできる。細胞標本における細胞形態および細胞生体分子を保存し、同一標本に対して多数のアッセイを行えるようにするための細胞収集用保存液も開示する。
【0030】
多くの疾患および他のヒトの状態は、特異的な細胞表現型および遺伝子発現パターンを特徴とする。このような疾患および状態は、特異的な細胞形態または特定の生体分子のレベルもしくは構造を評価することにより、同定および/またはモニタリングが可能である。例えば、新生物細胞および癌細胞は一般に、ある種の特有の形態および成長特性を呈する。遺伝子変異および遺伝子発現パターンなどの分子的特徴も、疾患進行の優れた指標である。ウイルスに感染した細胞は、ウイルス遺伝子の発現を含む、異なる形態および遺伝子発現パターンを示すことがある。本発明を用いると、細胞形態および/または遺伝子発現の変化などの細胞状態の特徴を、患者標本から決定することができる。
【0031】
検出しようとする特徴は、細胞標本中に存在することが疑われる関心対象の細胞状態および疾患に対して特異的なものである。このような特徴は一般に、細胞学的特徴および分子的特徴の2種類に分けることができる。本明細書で用いる細胞学的特徴とは、例えば、全体的な細胞の形状ならびに細胞およびそのオルガネラの外観などの特徴のことである。多くの新生物細胞および癌細胞の一次的な同定および分類は、伝統的に細胞学的特徴を用いて行われてきた。細胞学的特徴の同定は一般に時間がかかり、比較的高いレベルの熟練を要する上、自動化は一般に容易でない。本明細書で用いる分子的特徴とは、タンパク質、核酸、糖質および代謝産物などの特定の分子種の存在および/または非存在のことである。このような分子的特徴は一般に、関心対象の特定の分子の検出および/または定量化によって同定される。
【0032】
本発明により、細胞学的および分子的な特徴の両方を少量の患者標本から分析することが可能となる。アッセイされる特徴には、疾患の直接的な原因または結果ではないものの、ある種の疾患および細胞状態と関係のある追加マーカーまたは代用マーカーが含まれうる。このような追加マーカーの例には、多型マーカー、女性の子宮頸癌の素因となるB7などのヒト白血球抗原(HLA)、癌遺伝子、p53変異、BRCA1/2変異、他の癌マーカー、癌抑制因子、サイトカイン、増殖因子受容体およびホルモンが含まれる。このようなマーカーは、状態または疾患に特異的な特徴を呈する細胞に存在するものでも存在しないものでもよく、このような有無は、例えば、疾病状態の重症度が比較的高いまたは低いという指標になりうる。これらのマーカーを本開示の方法と併用して、異常スコアの数または定量的マーカーの変化の大きさに応じて、新生物疾患のリスクが比較的高いことまたは低いことを推定することができる。
【0033】
本発明を用いて評価を行う疾病状態の例には、自己免疫疾患、新生物および癌が非制限的に含まれる。関心対象となるその他の疾病状態には、HPV感染症、子宮頸部上皮内腫瘍(CIN)および癌、意義不明の(undetermined significance)異型扁平上皮細胞(ASCUS)、いぼ(warts)、疣贅状表皮発育異常症および他の皮膚疾患、喉頭パピローマ、口腔パピローマ、結膜パピローマを含むHPVに基づく疾患、ならびに前立腺肥大および前立腺癌を含む前立腺疾患、クラミジア、ならびにHIVおよびヘルペスなどのウイルス感染症が含まれる。
【0034】
本明細書で用いる用語としての細胞標本とは、主として、患者からの細胞の収集物のことである。細胞の入手方法の一つは非侵襲的な手段によるものであり、これは本明細書において、患者に対して穿刺を行わずに入手することと定義される。非侵襲的な手段の例には、例えば、尿から、または鼻、上皮、子宮頸部もしくは他の細胞表面の擦過によって入手した細胞標本がある。細胞標本を入手するための他の方法は、針生検または組織生検によるものである。細胞は10ml未満の容積中に収集される。より好ましくは、細胞は約5ml未満の容積中に収集され、最も好ましくは細胞は約2ml未満の容積中に収集される。
【0035】
本発明の保存液および装置による多数のアッセイの組み合わせを用いてもよく、これを単一の標本の使用および収集から行うことができる。アッセイの組み合わせの重要な局面は、必要なアッセイ特異的な処理段階の数を最小限に抑えながら、単一の細胞標本を種類の異なる多数のアッセイに用いることを可能にする、汎用細胞収集用保存液を用いる点である。例えば、細胞学的特徴をアッセイするための細胞を大容量の液体中に収集することが一般的であり、このために分子的特徴の大部分のアッセイにとっては細胞標本が過度に希釈される。先行技術の方法では、細胞学的アッセイおよび分子分析の両方に対する直接的な方法は得られない。先行技術の方法は分離濃縮段階などの余分な段階を要し、これは不便である上、細胞の分子成分の多くの分解を引き起こす可能性がある。一方、細胞診用の細胞標本は細胞形態を保つように最適化されているが、一般に核酸は同じようには保存されず、このため、標本を多くの分子アッセイに用いることができなくなる。
【0036】
本発明の方法に用いるための細胞標本は、行おうとするアッセイに合った任意の様式で固定されうるまたは処理されうる。例えば、細胞学的アッセイおよび分子アッセイの両方を、スライドガラスなどの固体基質上に固定した細胞を用いて行うことができる。しかし、分子アッセイは溶液中で行うことが好ましい。一般に、行うアッセイの必要条件により、用いるべき標本処理が決まる。
【0037】
上記のタイプの比較を、多くの異なる遺伝子および疾病状態に対して用いることもできる。すなわち、関心対象の遺伝子の発現レベルの測定値を、例えば、異なる細胞標本(同じ源からのより早期の細胞標本、または適切な参照細胞など)における同じ種類の遺伝子の発現レベルと、同じもしくは異なる細胞標本における異なる種類の遺伝子の発現レベルと、同じ細胞標本における参照遺伝子の発現レベルと、または参照細胞における参照遺伝子の発現レベルと、比較することができる。
【0038】
関心対象の遺伝子の発現は、任意の適した方法を用いて評価されうる。例えば、RNAはハイブリダイゼーション法、増幅法またはシークエンシング法を用いて検出されうり、タンパク質は糖質と同じように特異抗体を用いて検出可能されうる。発現産物の検出による遺伝子発現の特異的検出のための技法は数多く知られており、本開示のUCMとともに用いることができる。関心対象の遺伝子の発現レベルの検出および測定のための技法の一つは、関心対象の遺伝子から転写されたRNAの検出である。最も信頼性の高い比較を行うためには、比較しようとする発現レベルを同じ技法を用いて測定し、同じ様式で行う必要がある。
【0039】
細胞標本中の関心対象の遺伝子の発現レベルを測定するための有用な方法には、ダイジーン(Digene)社により国際公開公報第93/10263号に記載されたハイブリッドキャプチャー法(hybrid capture technique)(Nuovo、1997)により記載されたPCRインサイチューハイブリダイゼーション法、分枝状DNAアッセイ(Chernoff(1997))、転写媒介性増幅(TMA)(Stoflet(1988)、ならびに、ポリメラーゼ連鎖反応(PCR)、リガーゼ連鎖反応(LCR)、自律的配列複製(3SR)、核酸配列に基づく増幅(NASBA)、鎖置換増幅(SDA)およびQβレプリカーゼによる増幅(BirkenmeyerおよびMushahwar(1991);Landegren(1993))が含まれる。遺伝子発現産物の検出および測定のためのアッセイはさまざまなものが知られており、UCM中に収集した標本を用いた関心対象の遺伝子の発現レベルの決定のために適合化することができる。
【0040】
本発明は、これまでは行えなかった細胞の分析法を提供する。例えば、癌細胞および癌でない細胞の組み合わせを本発明による汎用収集用保存液中に入れた。4℃または室温で12時間、10日間、3週間および6週間にわたって貯蔵した後に、細胞の形態を検査した。スライドガラスは、パパニコロー染色およびヘマトキシリン・エオジン(H&E)などの当技術分野で周知の手順を用いる染色によって調製した。スライドガラスを光学顕微鏡で検査したところ、癌細胞に特徴的なすべての特徴が認められ、すべての場合に良好に保たれていた。スライドガラス上には、不規則な顆粒状のクロマチンを伴う通常は卵形の大きな高色素性の核、乏しい細胞質、多核細胞、核小体の存在および分裂像が認められた。加えて、スライドガラス上の細胞の分散は良好であり、細胞の集塊化は認められなかった。いずれの種類の細胞(正常および癌)とも、核および細胞質の形態は明確かつ鮮明であった。核は良好に染色され、正常細胞には細胞の成熟度に応じて異なる色調の細胞質が認められた。
【0041】
本発明の1つの態様では、溶液系での手順によって直接RNAが分析される。マイクロタイタープレートのウェル内に含まれる細胞に対してタンパク質分解酵素を添加することにより、細胞をまず溶解した。本発明に用いるための酵素の非制限的な例にはプロテイナーゼKまたはプロナーゼが含まれる。細胞を界面活性剤による溶解もしくは浸透圧溶解またはフレンチプレスに供することもできる。インキュベーションの後に、ビオチン化したDNAプローブを各ウェルに添加した。ストレプトアビジンでコーティングしたマイクロプレートに移すことにより、RNA:DNAハイブリッドを固相上に捕捉した。RNA:DNAハイブリッドに対するアルカリホスファターゼ結合抗体をハイブリダイゼーション用マイクロプレート内の各ウェルに添加し、CDP-Star(商標)などの化学発光試薬をエメラルドII(Emerald II)(Tropix)とともに各ウェルに添加することによってシグナルを発生させた。シグナルをマイクロプレートから読み取った。マイクロタイタープレートを抗RNA:DNAハイブリッド抗体でコートし、プローブを非標識RNAプローブとした点を除き、溶液系でのDNA分析をRNA分析と同様に行った。
【0042】
本発明は、試薬ならびに標本の収集および操作用の材料などの、本方法のために必要な材料の1つまたは複数を含むキットを用いて便利に行うことができる。例えば、本キットは、標本保存用の試薬、DNA配列、RNA配列および/または1つもしくは複数のDNA配列発現産物(mRNAまたはタンパク質)の特異的検出のための試薬、ならびにおよび標本操作用の容器を含みうる。DNA配列および/またはRNA配列の検出のために有用な試薬は、それらの配列に対する核酸プローブまたはタンパク質核酸プローブである。DNA配列の発現産物(タンパク質)の検出のために有用な試薬は抗体である。癌細胞に付随する異常糖鎖抗原を抗体によって検出することもできる。キットが、対照用の標本もしくは試薬、または本開示のアッセイと組み合わせる他のアッセイを行うための試薬および材料も含んでもよい。
【0043】
本発明は、本方法に適合させた装置を用いて実施しうる。同様のアッセイを行うための装置はさまざまなものが知られ、用いられており、本開示のUCM製剤、アッセイおよび方法と用いるために適合化することができる。例えば、標本のアッセイおよびアッセイにおける標本の操作のすべてまたは一部を自動化するための装置が知られている。
【0044】
本開示の方法のすべてまたは一部を、特殊用途コンピュータプログラムを用いて制御または管理することができる。本開示の方法によって収集したデータ、および組み合わせて用いた任意の他のアッセイによるデータを、特殊用途コンピュータプログラムを用いてまとめ、解析して、種々の形式で種々の目的用に出力することができる。このようなプログラムは、他の患者またはデータ管理用のコンピュータプログラムとともに用いること、またはその中に組み込むことが可能である。このようなプログラムの有用性は、組み合わせる測定および評価の数、ならびに各種の測定の全体的評価に対する相対的重要性が増大するほど増す。本開示の方法とともに用いるためのコンピュータプログラムは、汎用コンピュータ上で用いること、本開示の方法を制御するための特殊用途コンピュータもしくはコンピュータ化装置に組み入れること、またはその両方が可能である。
【実施例】
【0045】
以下の実施例は、本発明の実施のさまざまな局面を例示するためのものであり、いかなる形でも発明を制限するものではない。
【0046】
製剤
製剤127
20%エタノール
0.05%NaN3
5mM EDTA
2.5%グルタルアルデヒド-亜硫酸水素ナトリウム(G-S-B)
0.2M NaOAc-HOAc
pH 3.7
製剤128
20%エタノール
0.05%NaN3
5mM EDTA
2.5%グルタルアルデヒド-亜硫酸水素ナトリウム(G-S-B)
0.2M NaOAc-HOAc
pH 4.1
製剤130
7%ブタノール
0.05%NaN3
5mM EDTA
2.5%グルタルアルデヒド-亜硫酸水素ナトリウム(G-S-B)
0.2M NaOAc-HOAc
pH 3.7
製剤134
PreservCyt(登録商標)(Cytyc Corporation)
緩衝化メタノールを含む
細胞診標本の貯蔵限界:4℃〜37℃で3週間
製剤135
CytoRich(商標)(AutoCyte Corporation)
24%未満のアルコールを含む
15℃〜30℃で貯蔵
製剤141
20%エタノール
0.05%NaN3
5mM EDTA
2.5%グルタルアルデヒド-亜硫酸水素ナトリウム(G-S-B)
0.2M NaOAc-HOAc
pH 4.4
製剤149
10%ブタノール
0.05%NaN3
5mM EDTA
2.5%グルタルアルデヒド-亜硫酸水素ナトリウム(G-S-B)
0.2M NaOAc-HOAc
pH 4.4
製剤167
9%ブタノール
0.05%NaN3
5mM EDTA
2%PEG-1500
10mM NaOAc-HOAc
pH 4.5
【0047】
実施例1:核酸分析のための一般的な方法
核酸に関するアッセイは原則として、ダイジーン(Digene)社により国際公開公報第93/10263号に記載されたダイジーン・ハイブリッドキャプチャーHIVテスト(Digene Hybrid Capture HIV Test)によってHIV RNAを検出するための方法に従って行う。簡潔に述べると、可溶化の後に、50μlのプローブ混合液(DNAビオチン化プローブを含む)を各ウェルに添加した。プレートを密封し、ハイブリダイゼーションが起こるように65℃で1.5時間インキュベートした。ハイブリダイゼーションの後に、ストレプトアビジンでコーティングしたマイクロプレートに標本を移し、25μLの抗ハイブリッド抗体を各ウェルに添加した。プレートを室温にて1100RPMで1時間攪拌した。ウェルを65℃の洗浄バッファーで6回洗浄し、続いて蒸留水を用いて1回洗浄した。100μlの化学発光性基質を各ウェルに添加し、プレートを室温で30分間インキュベートした。続いてプレートの読み取りをDML 2000照度計で行った。データはシグナル・ノイズ比として表した。較正曲線を用いて、各検体から生じた化学発光シグナルを細胞1個当たりのmRNAコピー数に換算した。
【0048】
実施例2:形態学的分析のための一般的な方法
HPV 16陽性の癌細胞(CaSki)をUCM 127、128、141、130、149中、および2種類の市販の固定剤であるPreservCyt(Cytyc Corp.)およびCytoRich(AutoCyte)中に置いた。続いて標本を常温で貯蔵した。ベースライン用のスライドガラスは、12時間貯蔵した後に作製した。続いてスライドガラスを3週間後および6週間後にも作製した。さらに、UCM 141および149からも室温で6週間後にスライドガラスを作製した。スライドガラスは、細胞懸濁液200μlをポリカーボネート製フィルターに滴下することによって調製された。続いてフィルターをスライドガラス上に置き、ブロッティングを行った。フィルターを取り除き、スライドガラスを95%エタノール中で5分間固定した。スライドガラスを慣用的パパニコロー染色およびヘマトキシリン・エオジン(H&E)によって染色した。スライドガラスを光学顕微鏡により、さまざまな倍率を用いて評価し、カラー写真の形式で記録を行った。さらに、正常ヒト子宮頸部細胞およびCaSki細胞の混合物を用いて、より小規模の試験も行った。この混合物を2種類のUCM製剤141および149の中、ならびにPreservCytおよびCytoRich対照の中に置いた。各標本を2本のチューブに分け、室温および4℃に置いた。12時間(ベースライン)、10日間および3週間貯蔵した後に、スライドガラスを作製し、パパニコロー染色によって染色した。形態試験に関しては以下の特徴を評価した:細胞の分散、細胞の形状、核の形状、クロマチンのパターンおよび染色強度、核/細胞質比、核小体の存在、細胞質の形状および染色の色調。図1〜図24は、室温で12時間、3週間および6週間貯蔵した、種々のUCM中ならびにPreservCytおよびCytoRich対照中に貯蔵したCaSki細胞の形態を示している。3週間後および6週間後には、検討したすべての固定剤において、CaSki細胞(癌細胞)に特徴的なすべての特徴が認められ、良好に保たれていた:すなわち、不規則な顆粒状のクロマチンを伴う通常は卵形の大きな高色素性の核、乏しい細胞質、多核細胞、核小体の存在および分裂像。加えて、検討したすべての保存液において、スライドガラス上の細胞の分散は良好であり、細胞の集塊化は認められなかった。
【0049】
図25〜図72は、CaSki細胞と混合され、UCM 141、149ならびにPreservCytおよびCytoRich対照中に室温および4℃で12時間、10日間および3週間にわたり貯蔵された正常ヒト子宮頸部細胞の形態を示している。これらのスライドガラスの評価により、UCMならびにPreservCytおよびCytoRich対照において、形態が良好に保たれたことが示された。4℃および室温で3週間おいた場合には、いずれの種類の細胞(正常子宮頸部細胞およびCaSki細胞)も明確かつ鮮明な形状を示した(核および細胞質とも)。核は良好に染色され、正常細胞には細胞の成熟度に応じて異なる色調の細胞質が認められた。
【0050】
図73〜図75は、貯蔵してスライドガラス上に固定した標本の形態および染色を比較用に示す目的で、保管してある慣用的パパニコロー塗沫標本(Pap smears)を撮影したものである。
【0051】
実施例3:HC II HPV DNAアッセイの結果
UCM製剤127、128、130およびSTM(商標)(Digene)対照の検査を、ハイブリッドキャプチャーII HPV DNAテスト(Hybrid Capture II HPV DNA Test)を用いて行った。標準的なHC II HPVテストキット(Digeneカタログ番号5101-1096)を用いた。各収集用保存液(1mL)に0.8×106個のCaSki細胞(〜500コピー/細胞)を加えた。CaSki細胞のこの濃度を選択した理由は、適切な臨床検査材料が通常、約1×106個の細胞を含むことによる。続いて、CaSki細胞の同じ貯蔵物を形態学的検討ならびにDNAおよびRNAの検査に用いた。添付文書に記載された通り、標準的な容積である50μlを用い、標本の調製には何ら変更を加えなかった。同様のSTM標本を調製した。同じ数のCaSki細胞を1mLのダイジーン標本移行保存液(Digene Sample Transport Medium)(STM-この保存液はHPV検査に現在用いられている保存液である。これはDNAおよびRNAを保つが、細胞形態は保存されない)。HC II HPV検査は、第「0」日(ベースライン)ならびに室温で1週間および6週間貯蔵した後に行った。表1は、ベースライン時ならびに1週間後および6週間後に各保存液から得られた結果をS/N比として表した上で示している。
【0052】
UCM製剤127および128は、STM対照のベースラインでのS/N比に匹敵する最も高いS/N比を示し、室温で6週間貯蔵した後にもこれらの値を保った。ベースラインで得たUM 130のS/N比は、UCM 127および128よりも幾分低かった。UCM 130は6週間後もそのシグナルを保った。
【0053】
(表1) ベースライン時ならびに室温で1週間および6週間貯蔵した後に、UCM 127、128、130およびSTMに関して得られたシグナル対ノイズ比

【0054】
より小規模の形態的検討に用いた製剤UCM 141および149を、ベースライン時およびその後室温で1週間、2週間および4週間貯蔵した後に、HC II HPV DNAアッセイで検査した。CaSki細胞(1.5×106個)をこれらの保存液に加え、50μlを各アッセイごとに用いた。表2にS/N比を示した。どちらの製剤も、室温で4週間貯蔵した後に最初のシグナルを100%近く保っていた(UCM 141で98.4%、UCM 149で97.3%)。
【0055】
(表2) ベースライン時ならびに室温で1週間、2週間および4週間貯蔵した後に製剤UC 141および149に関して得られたS/N比

【0056】
さらに、PreservCytおよびCytoRich中に貯蔵した標本も本実施例のプロトコールに従って検討した。PreservCyt保存液およびCytoRich保存液にはいずれも、満足の行く分析を行えるDNAを提供する能力はないことが明らかになった。
【0057】
実施例4:HC II RNAアッセイの結果
すべての製剤のアリコート(CaSki細胞0.8×106個)を室温ではなく4℃で貯蔵し、HC II HPV RNAアッセイにて検査した。この試験に用いた試行的なRNAアッセイには、HPV 16E6/E7 RNAに対して特異的なビオチン化一本鎖DNAプローブを用いた。UCM製剤127、128および130の検査は、ベースライン時ならびに4℃で1週間および6週間貯蔵した後に行った。UCM製剤141および149の検査は、ベースライン時ならびに4℃で1週間、2週間および6週間貯蔵した後に行った。表3および4にその結果を示す。
【0058】
(表3) ベースライン時ならびに4℃で1週間および6週間貯蔵した後の、HC II RNAアッセイにおいてUCM 127、128および130に関して得られた結果

【0059】
検討したUCM製剤はすべて、ベースライン時の検査ではS/N比が同程度であった。UCM 127、128および130は、4℃で6週間貯蔵された後にも、ベースライン時の結果と比較して100%のシグナルを保った。UCM製剤141および149中の細胞内のRNAはいずれも4℃で4週間にわたり安定であるように思われ、ベースライン時の結果に近いS/N比が得られた(UCM 141で108%、UCM 149で89%)。
【0060】
(表4) ベースライン時ならびに4℃で1週間、2週間および6週間貯蔵した後の、HC II RNAアッセイにおいてUCM 141および149に関して得られた結果

【0061】
さらに、PreservCytおよびCytoRich中に貯蔵した標本も本実施例のプロトコールに従って検討した。PreservCyt保存液およびCytoRich保存液にはいずれも、満足の行く分析を行えるDNAを提供する能力はないことが明らかになった。
【0062】
本明細書中に引用した刊行物、および引用された材料は、参照として明確に組み入れられる。
【0063】
当業者は、定型的な範囲の実験により、本明細書に記載された特定の態様の多くの等価物を認識する、または確認しうると考えられる。このような等価物は添付の特許請求の範囲に含まれることが意図されている。
【0064】
参照

【特許請求の範囲】
【請求項1】
保存液中に含まれる細胞または組織が細胞学的方法および分子的方法の両方によって直接分析されうり、分析の分子的方法がRNAもしくはDNAもしくはタンパク質いずれかの分析またはRNAおよびDNAの両方の分析を含み、かつ保存液が水性(water based)であって、保存剤、固定剤および抗分解剤(anti-degradation agent)を含む、細胞または組織の収集用保存液または汎用収集用保存液(universal collection medium)。
【請求項2】
10ml未満の容積からなる、請求項1記載の汎用収集用保存液。
【請求項3】
約5ml未満の容積からなる、請求項1記載の汎用収集用保存液。
【請求項4】
約2ml未満の容積からなる、請求項1記載の汎用収集用保存液。
【請求項5】
緩衝成分、少なくとも1つのアルコール成分、固定剤成分、ならびにRNA、DNAおよびタンパク質からなる群の少なくとも1つの分解を抑制する薬剤を含む、請求項1記載の汎用収集用保存液。
【請求項6】
緩衝成分が約2.5〜約6のpH範囲内で緩衝能を有する、請求項5記載の汎用収集用保存液。
【請求項7】
緩衝成分が約3〜約5のpH範囲内で緩衝能を有する、請求項6記載の汎用収集用保存液。
【請求項8】
緩衝成分が約3.5〜約4.5のpH範囲内で緩衝能を有する、請求項7記載の汎用収集用保存液。
【請求項9】
アルコール成分がC1〜C10アルコールを含む、請求項5記載の汎用収集用保存液。
【請求項10】
アルコール成分が、メタノール、エタノール、プロパノール、ブタノールおよびペンタノールからなる群より選択される、請求項9記載の汎用収集用保存液。
【請求項11】
アルコール成分がエタノールまたはn-ブタノールを含む、請求項10記載の汎用収集用保存液。
【請求項12】
固定剤が、ポリ(エチレングリコール)およびポリ(エチレンオキシド)からなる群より選択される重合体を含む、請求項5記載の汎用収集用保存液。
【請求項13】
固定剤がポリ(エチレングリコール)である、請求項12記載の汎用収集用保存液。
【請求項14】
ポリ(エチレングリコール)の分子量が約600〜約4600の間である、請求項13記載の汎用収集用保存液。
【請求項15】
ポリ(エチレングリコール)の分子量が約1500である、請求項14記載の汎用収集用保存液。
【請求項16】
RNA、DNAおよびタンパク質からなる群の少なくとも1つの分解を抑制する薬剤が、ヌクレアーゼ阻害剤、プロテアーゼ阻害剤およびキレート剤からなる群より選択される少なくとも1つの薬剤を含む、請求項5記載の汎用収集用保存液。
【請求項17】
RNA、DNAおよびタンパク質からなる群の少なくとも1つの分解を抑制する薬剤がキレート剤を含む、請求項16記載の汎用収集用保存液。
【請求項18】
キレート剤が、ムレキシド、クロモトロプ酸、1-(1-ヒドロキシ-2-ナフチルアゾ)-2-ヒドロキシ-5-ニトロナフタレン-4-スルホン酸、EDTA(エチレンジアミン四酢酸)、o-フェナントロリンおよびチオ尿素からなる群より選択される、請求項17記載の汎用収集用保存液。
【請求項19】
キレート剤がEDTA(エチレンジアミン四酢酸)を含む、請求項18記載の汎用収集用保存液。
【請求項20】
細胞または組織に対して形態学的および生化学的な分析を行う方法であって、以下の段階を含む方法:
患者から細胞または組織を入手する段階;
細胞または組織を、保存剤、固定剤および抗分解剤(anti-degradation)を含む水性保存液中に保存する段階;
保存液中に保存された細胞または組織の形態を直接分析する段階;ならびに
保存液中に保存された細胞または組織に含まれるRNAまたはDNAまたはタンパク質のいずれかを直接分析する段階。
【請求項21】
水、保存剤、緩衝剤、固定剤、ならびにRNA、DNAおよびタンパク質からなる群の少なくとも1つの分解を抑制できる薬剤を含む、汎用収集用保存液。
【請求項22】
限定された細胞数の細胞標本(sample)を保存するための製品(article of manufacture)であって、以下を含む製品:
請求項21記載の保存液を2ml未満収容する容器;および
該容器に嵌合する蓋。
【請求項23】
延長された構成要素の遠位端が非吸収性を高めた表面を有する、延長された構成要素(menber)を有する細胞収集装置をさらに含む、請求項22記載の製品。
【請求項24】
延長された構成要素の遠位端がブラシである、請求項23記載の製品。
【請求項25】
単一の標本からの、細胞形態の検出、ならびにRNA、DNAおよびタンパク質からなる群の少なくとも1つの定量分析を可能にする、細胞標本の収集方法であって、以下の段階を含む方法:
細胞標本の大きさが限定された、細胞を患者から収集する段階;
収集した細胞を請求項21記載の保存液中に貯蔵する段階;
保存液中の細胞のアリコートを細胞形態の分析のために取り出す段階;ならびに
DNA分析、RNA分析、タンパク質分析および糖質分析からなる群より選択される定量分析のために、保存液中の細胞の第2のアリコートを取り出す段階。
【請求項26】
細胞を10ml未満の標本中に貯蔵する、請求項25記載の方法。
【請求項27】
細胞を約5ml未満の標本中に貯蔵する、請求項25記載の方法。
【請求項28】
細胞を約2ml未満の標本中に貯蔵する、請求項25記載の方法。
【請求項1】
保存液中に含まれる細胞または組織が細胞学的方法および分子的方法の両方によって直接分析されうり、分析の分子的方法がRNAもしくはDNAもしくはタンパク質いずれかの分析またはRNAおよびDNAの両方の分析を含み、かつ保存液が水性(water based)であって、保存剤、固定剤および抗分解剤(anti-degradation agent)を含む、細胞または組織の収集用保存液または汎用収集用保存液(universal collection medium)。
【請求項2】
10ml未満の容積からなる、請求項1記載の汎用収集用保存液。
【請求項3】
約5ml未満の容積からなる、請求項1記載の汎用収集用保存液。
【請求項4】
約2ml未満の容積からなる、請求項1記載の汎用収集用保存液。
【請求項5】
緩衝成分、少なくとも1つのアルコール成分、固定剤成分、ならびにRNA、DNAおよびタンパク質からなる群の少なくとも1つの分解を抑制する薬剤を含む、請求項1記載の汎用収集用保存液。
【請求項6】
緩衝成分が約2.5〜約6のpH範囲内で緩衝能を有する、請求項5記載の汎用収集用保存液。
【請求項7】
緩衝成分が約3〜約5のpH範囲内で緩衝能を有する、請求項6記載の汎用収集用保存液。
【請求項8】
緩衝成分が約3.5〜約4.5のpH範囲内で緩衝能を有する、請求項7記載の汎用収集用保存液。
【請求項9】
アルコール成分がC1〜C10アルコールを含む、請求項5記載の汎用収集用保存液。
【請求項10】
アルコール成分が、メタノール、エタノール、プロパノール、ブタノールおよびペンタノールからなる群より選択される、請求項9記載の汎用収集用保存液。
【請求項11】
アルコール成分がエタノールまたはn-ブタノールを含む、請求項10記載の汎用収集用保存液。
【請求項12】
固定剤が、ポリ(エチレングリコール)およびポリ(エチレンオキシド)からなる群より選択される重合体を含む、請求項5記載の汎用収集用保存液。
【請求項13】
固定剤がポリ(エチレングリコール)である、請求項12記載の汎用収集用保存液。
【請求項14】
ポリ(エチレングリコール)の分子量が約600〜約4600の間である、請求項13記載の汎用収集用保存液。
【請求項15】
ポリ(エチレングリコール)の分子量が約1500である、請求項14記載の汎用収集用保存液。
【請求項16】
RNA、DNAおよびタンパク質からなる群の少なくとも1つの分解を抑制する薬剤が、ヌクレアーゼ阻害剤、プロテアーゼ阻害剤およびキレート剤からなる群より選択される少なくとも1つの薬剤を含む、請求項5記載の汎用収集用保存液。
【請求項17】
RNA、DNAおよびタンパク質からなる群の少なくとも1つの分解を抑制する薬剤がキレート剤を含む、請求項16記載の汎用収集用保存液。
【請求項18】
キレート剤が、ムレキシド、クロモトロプ酸、1-(1-ヒドロキシ-2-ナフチルアゾ)-2-ヒドロキシ-5-ニトロナフタレン-4-スルホン酸、EDTA(エチレンジアミン四酢酸)、o-フェナントロリンおよびチオ尿素からなる群より選択される、請求項17記載の汎用収集用保存液。
【請求項19】
キレート剤がEDTA(エチレンジアミン四酢酸)を含む、請求項18記載の汎用収集用保存液。
【請求項20】
細胞または組織に対して形態学的および生化学的な分析を行う方法であって、以下の段階を含む方法:
患者から細胞または組織を入手する段階;
細胞または組織を、保存剤、固定剤および抗分解剤(anti-degradation)を含む水性保存液中に保存する段階;
保存液中に保存された細胞または組織の形態を直接分析する段階;ならびに
保存液中に保存された細胞または組織に含まれるRNAまたはDNAまたはタンパク質のいずれかを直接分析する段階。
【請求項21】
水、保存剤、緩衝剤、固定剤、ならびにRNA、DNAおよびタンパク質からなる群の少なくとも1つの分解を抑制できる薬剤を含む、汎用収集用保存液。
【請求項22】
限定された細胞数の細胞標本(sample)を保存するための製品(article of manufacture)であって、以下を含む製品:
請求項21記載の保存液を2ml未満収容する容器;および
該容器に嵌合する蓋。
【請求項23】
延長された構成要素の遠位端が非吸収性を高めた表面を有する、延長された構成要素(menber)を有する細胞収集装置をさらに含む、請求項22記載の製品。
【請求項24】
延長された構成要素の遠位端がブラシである、請求項23記載の製品。
【請求項25】
単一の標本からの、細胞形態の検出、ならびにRNA、DNAおよびタンパク質からなる群の少なくとも1つの定量分析を可能にする、細胞標本の収集方法であって、以下の段階を含む方法:
細胞標本の大きさが限定された、細胞を患者から収集する段階;
収集した細胞を請求項21記載の保存液中に貯蔵する段階;
保存液中の細胞のアリコートを細胞形態の分析のために取り出す段階;ならびに
DNA分析、RNA分析、タンパク質分析および糖質分析からなる群より選択される定量分析のために、保存液中の細胞の第2のアリコートを取り出す段階。
【請求項26】
細胞を10ml未満の標本中に貯蔵する、請求項25記載の方法。
【請求項27】
細胞を約5ml未満の標本中に貯蔵する、請求項25記載の方法。
【請求項28】
細胞を約2ml未満の標本中に貯蔵する、請求項25記載の方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】


【図24】


【図25】


【図26】


【図27】


【図28】


【図29】


【図30】


【図31】


【図32】


【図33】


【図34】


【図35】


【図36】


【図37】


【図38】


【図39】


【図40】


【図41】


【図42】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】


【図24】


【図25】


【図26】


【図27】


【図28】


【図29】


【図30】


【図31】


【図32】


【図33】


【図34】


【図35】


【図36】


【図37】


【図38】


【図39】


【図40】


【図41】


【図42】


【公開番号】特開2012−34699(P2012−34699A)
【公開日】平成24年2月23日(2012.2.23)
【国際特許分類】
【出願番号】特願2011−216080(P2011−216080)
【出願日】平成23年9月30日(2011.9.30)
【分割の表示】特願2002−504690(P2002−504690)の分割
【原出願日】平成13年6月21日(2001.6.21)
【出願人】(510069559)キアジェン ゲイサーズバーグ インコーポレイテッド (13)
【Fターム(参考)】
【公開日】平成24年2月23日(2012.2.23)
【国際特許分類】
【出願日】平成23年9月30日(2011.9.30)
【分割の表示】特願2002−504690(P2002−504690)の分割
【原出願日】平成13年6月21日(2001.6.21)
【出願人】(510069559)キアジェン ゲイサーズバーグ インコーポレイテッド (13)
【Fターム(参考)】
[ Back to top ]

