汚染の測定
開示しているのは、汚染物質を含むことが疑わしい培地のための好都合な試料調製方法であり、この方法は、a)既知容量の培地を、フィルターを通して流入側から流出側へ通過させることによって、フィルターの流入側で汚染物質を濃縮し、b)フィルターの流入側を、汚染物質との相互作用により各々検出可能な成分を生じる少なくとも1つの基質を含む液体ビヒクルに接触させ、c)フィルターの流入側で、検出可能な成分を液体ビヒクル中で検出させるのに十分なある時間の間、基質を汚染物質と相互作用させることを含む。さらにこの方法は、好ましくは液体ビヒクルを汚染物質から分離した後に、たとえば液体ビヒクルをフィルターを通し、汚染物質のない液体ビヒクルについて測定を行うことによって、液体ビヒクル中において検出可能な量を測定する検出工程を有していてもよい。また、開示しているのは、本発明方法を実施するためのキットである。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、環境調査および制御、特に環境試料中の汚染物質の測定に関する。より具体的には、本発明は(細菌)汚染の正確な測定を与える、その場で実施できる、簡単で、多用途で、ロバストで、信頼できる、迅速な方法に関する。さらに本発明はこのような測定を行うのに有用なキットを提供する。
【背景技術】
【0002】
微生物汚染の問題に対処するために、いくつかの試験方法が開発されている。伝統的な方法は成長を維持する栄養培地での細菌のインキュベーションに基づく。約2−14日後に、固体培地で成長できる細菌はコロニーが見えカウントできるようになるレベルまで増殖し、液体培地中で成長できる細菌はたとえば光学濃度または乾燥重量によって測定できる。検出プロセスをはかどらせ、簡単にする努力がなされてきた。これらのうち努力は放射線分析、インピーダンス、化学発光および蛍光の測定に基づく方法であった。
【0003】
細菌汚染を確認するための放射線法は一般的に細菌による放射性栄養の取り込みを利用する。放射線ラベルした細菌は、放射線ラベルを追跡することによって、分離し定量できる。この方法はいくつかの望ましくない欠点を有する。非常に感度が高いけれども、この方法は高価で取り扱いが困難でありうる放射線同位体を利用する。
【0004】
電気的インピーダンスに基づく方法は典型的には培養工程を含む。微生物が成長するのに従って、栄養培地のインピーダンスの変化を検出して微生物の成長に関連づけることができる。電気的インピーダンスに基づく方法は、伝統的な培養よりも迅速であるけれども、いまだに遅く、1−4日のインキュベーション期間を伴う。
【0005】
ATPは化学発光によって検出される。ATPの検出を使用した細菌の検出および/または定量は迅速で数分以内で実施できる。しかし、ATPは偏在し、ATP誘導発光の動力学は複雑な性質であり、この原理に基づく方法のロバストネスを低下させる。さらに、細胞におけるATPの代謝回転は非常に迅速で、細胞のATP含有量は短時間に、たとえば細胞が成長からスターベーションへ至るときに、大きな変化を経験するかもしれない。
【0006】
従来技術には、蛍光ラベルしたウンベリフェロン基材の酵素分解に基づき、放出されたウンベリフェロンから生じる蛍光の共存モニタリングを用いるいくつかの方法が記載されている。また、酵素活性を使用した細菌の検出および定量は、非細菌源からの干渉を受けることがある(この干渉はより重要ではないように見えるけれども)。さらに、時間単位あたりに形成される生成物(蛍光)の量は線形である。最小限の最小の干渉および単純な動力学は、酵素活性を使用した細菌の測定をよりロバストにする。
【0007】
米国特許第4,591,554(Koumuraら)は、非蛍光ウンベリフェロン誘導体たとえば4−メチル−ウンベリフェリル−β−D−ガラクトシド、4−メチルウンベリフェリル−α−D−ガラクトシド、4−メチルウンベリフェリル−ホスフェート、および4−メチルウンベリフェリル−ピロホスフェートを利用して微生物を迅速に検出する方法を開示している。遊離したウンベリフェロン成分の蛍光が360nmに誘起され、450nmでモニターされている。1−12時間の培養工程により感度の増強を得ている。
【0008】
米国特許第5,518,894(Berg)は、大腸菌の存在を検出する迅速な方法を開示している。この方法は、濃縮工程(ろ過)を培養工程との組み合わせを含み、存在する標的細菌の数を増加させる。加水分解したウンベリフェロン誘導体の蛍光を、大腸菌の存在を表示するものとしてモニターする。
【0009】
米国特許第5,610,029(Ehrenfeldら)は、試料中の標的微生物の有無を検出するための培養培地を開示している。この培養培地は種々の栄養および成長因子ならびに蛍光代謝物質(4−メチルウンベリフェリル−β−D−グルクロニド)を含む。
【0010】
酵素活性の蛍光発生検出の検出に基づく上述した方法の全ては、一般的に6−72時間の合計実施時間をもたらす培養工程を利用する。このことは、多くの場合、その場で実施される方法はいうまでもなく、迅速な方法の実施のための要求も満足しない。
【0011】
米国特許第5,089,395(Snyderら)は、酵素により蛍光生成物に変換される非蛍光ウンベリフェロン誘導体を使用して細菌の存在を検出することを開示している。この方法には、培養または濃縮工程はない。これらの工程がないことにより、この方法は感度がそれほど高くなく、少なくとも1000/mlの高い細菌濃度を必要とし、一般的により高い濃度が得られる。
【0012】
米国特許第5,968,762(Jadamecら)は、酵素により蛍光生成物に変換される非蛍光ウンベリフェロン誘導体を使用し細菌の存在を検出する方法を開示している。この方法は、特定波長での代謝した蛍光の、第2の特定波長に結合する代謝可能な蛍光の比を測定することに関する。310(cfu/ml)の濃度を検出するためにほぼ80分の検出時間を示している(cfu=コロニー形成単位)。
【0013】
細菌の液体試料を調べるためには、普通、液体試料のメンブランろ過を用いる。無菌メンブランフィルターを無菌化できるクローズドな機器内に入れ、細菌をフィルター上に収集する。その後、フィルターを寒天含有栄養培地上に置き、そこで培養プロセスの後にコロニーを数えることができる。フィルターを細菌中に組み込んだ蛍光発生色素で処理し、その後それをレーザー誘起蛍光によって数えてもよい。メンブランろ過を用いる全ての微生物学者は、フィルターの無菌取り扱いを確保するために採用することが必要な注意に精通している。少数の細菌を検出する場合、ろ過工程は汚染を容易に導入し、プロセスを信頼できないものにし作業者のスキルに大きく依存するものにすることがある。
【0014】
したがって、この技術において必要とされるのは、簡単に実施できロバストで信頼性のある、試料中の細菌の存在を検出する迅速な方法である。
【発明の開示】
【0015】
発明の目的
本発明の目的は、資料中の微生物および他の汚染物質の存在を決定するための、迅速で、信頼性があり、多用途でロバストな方法を提供することにより、従来技術における多くの上述した問題点および短所に対処することにある。
【0016】
発明の概要
本発明は、代わりに、ろ過またはろ過に類似した方法によって有効な微生物の濃縮工程を行えば、上述した培養工程を完全に除外することができるという驚くべき実証に基づいている。このことは従来技術に対して2つの主要な利点を意味する。というのは、これが1)感度を増し、したがって検出時間を著しく減少させ、2)たとえば消光または自己蛍光によって蛍光検出に干渉するか、または培養培地に由来する交差反応によって免疫検出に干渉するかもしれない、試料中の化合物または粒子を除去するからである。
【0017】
本発明は、一般的に、ろ過の次に培養またはレーザー計数を行う場合には適用できないであろう、使い捨てのクローズドなろ過ユニットを利用する。本発明は、分析の全プロセスの間、試料の無菌状態の、容易で、ロバストで信頼性のある取り扱いを提供する。このことは、本発明をポータブルなフィールド法として理想的にする。
【0018】
微生物および他の汚染物質は大容量から濃縮できる。このことは非常に低濃度でも迅速な検出を可能にする。事実、この方法の感度はもっぱら、フィルターによって保持すべき最小数の汚染物質によって、およびフィルターの物理特性、すなわちその構造保全性を保ちながらフィルターを通過することができる容積サイズによって設定される。それゆえ、生育可能な微生物標的個体数の量/細菌を定量するために、液体中に必要とされる細菌濃度に下限がないことは、本発明の重要な面である。したがって、この方法は、最大で1000細菌/mlの量をもつ液体中の細菌を検出するのに用いることができるが、より少量、たとえば最大で100細菌/ml、最大で10細菌/ml、さらに1細菌/ml未満が可能である。
【0019】
本発明は、たとえば、種々のソースから、かつ種々の形態で収集された試料からの微生物の定量を可能にする。試料は、液体;たとえば飲料水、温水など、工業水たとえばプロセス水および置換洗浄(CIP)水の試料、製薬水、2)空気;たとえば室内空気、工業空気、重度に汚染された作業環境からの空気、薬品製造設備からの空気、3)抽出可能な固体試料;たとえば食料品、沈殿物および植物材料など、4)表面;たとえば建物の表面、建材およびワークの表面などであろう。
【0020】
それゆえ、最も広くかつ最も一般的な範囲において、本発明は、汚染物質を含むことが疑わしい培地のための試料調製方法であって、a)既知容量の前記培地を、フィルターを通して流入側から流出側へ通過させることによって、フィルターの流入側で汚染物質を濃縮し、b)フィルターの流入側を、汚染物質との相互作用により各々検出可能な成分を生じる少なくとも1つの基質を含む液体ビヒクルに接触させ、c)フィルターの流入側で、ある時間(前記時間は検出可能な成分を液体ビヒクル中で検出させるのに十分である)の間、基質を汚染物質と相互作用させることを含む方法に関する。
【0021】
また、本発明の一部は、培地中の汚染物質の測定のためのキットであって、1)フィルターの流入側に汚染物質を保持するのに十分小さいポアサイズをもつフィルターを有する少なくとも1つの無菌フィルター機器と、2)既知容量の培地を、フィルターを通過させる手段と、3)汚染物質との相互作用時に検出可能な成分を放出する試薬(検出可能な成分の量は、試薬と相互作用した汚染物質の量と相関できる)と、4)a)既知容量の培地を得て、それを無菌フィルター機器を通過させ、b)フィルターの流入側を試薬と接触させ、c)試薬を、フィルターの流入側にあるかもしれない汚染物質と相互作用させ、d)検出可能な成分を定量的に検出するための工程を記載した説明書とを有するキットである。
【0022】
最後に、本発明は、機器に保持された汚染物質と、汚染物質に接触したときに検出可能な成分を放出する基質との間の反応のための反応容器としての、クローズドな無菌フィルター機器の使用方法に関する。
【発明を実施するための最良の形態】
【0023】
以下、多くの定義を提示して、本発明の境界を定義する。
【0024】
本明細書において用いる限り、「汚染物質」という用語は試料中の生物起源の望ましくない成分に関する。汚染物質の非限定的な例は、微生物(病原性および非病原性の両方)だけでなく、このような微生物のフラグメントである。非病原性の汚染物質は、それらが製品中に現れた場合に製品の品質に有害であるため、望ましくないであろう(例は、制御された発酵中の汚染微生物、味および味覚に影響する、食料製品中の汚染微生物などである)。
【0025】
「生育可能な」微生物は、目下の文脈において、適切な一連の環境下で代謝活性であるまたは代謝活性になり得る微生物または胞子である。したがって、この用語は、その範囲内に、容易に培養できる微生物だけでなく、培養において再現するのが困難な環境下でのみ増殖する微生物も含む。
【0026】
「フィルター」という用語は、目下の文脈において、あるサイズよりも大きい粒子の通過を遮断する機器である。しかし、この用語は、結合相手(たとえばレセプター、抗体またはこれらのフラグメント)に対して著しい結合特異性をもつ材料の通過を遮断する機器も包含する。したがって、この用語は、通常は「フィルター」とみなされない機器、たとえば遠心分離機および超遠心分離機におけるメンブラン、特異的な結合相手たとえば抗体または他の特異的に結合する物質で含浸されたメンブランも包含する。したがって、本発明によって予期されている特殊「フィルター」は、アフィニティクロマトグラフィのカラムをも含む。本発明による「フィルター」の重要な特徴は、それが、関心をもっている汚染物質を保持することができ、次の基質と汚染物質に特異的な酵素との間のインサイチュ反応を可能にして、次の基質から由来する検出可能な成分の測定を容易に行えるようにすることである。下記参照。
【0027】
「基質」という用語は、酵素によって触媒されたその化学構造における変換を受ける化学薬剤を意味する。
【0028】
「検出可能な成分」という用語は、酵素によって触媒された基質の変換の結果である化学的実体を意味し、ここで化学的実体は検出できるが基質においては検出可能でない物理的または化学的特性を含む。例は、蛍光成分、発光成分、および結合相手に高い特異性で結合する成分である。
【0029】
「信号」という用語は、それが適切な測定系において記録される限り、検出可能な成分の測定可能な特性を意味することを意図している。
【0030】
本発明の方法の望ましい実施形態
汚染物質は、典型的には細菌;真菌、たとえば糸状菌およびイースト;藻類;原生動物;細菌からの胞子;真菌胞子;および花粉、ならびにこれらのフラグメントからなる群より選択される。これらの汚染物質のすべてが病原性であるわけでないが、ある環境でのそれらの存在は非常に望ましくなく有害でさえあることは指摘するまでもないであろう。産業的な発酵における汚染微生物の存在は多くのうちの一例であり、この場合には汚染物質の存在による経済的および実際的な影響は大きいが、食品製造およびそれらの価値が美的特徴に帰する製品の製造においても汚染物質は経済的損失の原因になり得る。
【0031】
微生物のフラグメントおよび胞子は、深刻な気管疾患たとえば喘息のトリガー剤であることがわかっている。このようなフラグメント(典型的には死んだ細菌または多少とも破壊された胞子からなる)は生育可能ではないが、にもかかわらずそれらの検出および除去を保証する範囲で病原性に関連している。
【0032】
本発明の方法は種々のソースからの試料に適用でき、唯一のルールは汚染物質含有試料を培地(その性質はそれがフィルターを通して通過できることを可能にするということである)へ合体できなければならないことである。
【0033】
好都合には、培地が液体培地である。非限定的な例は、環境水、飲料水、温水、工業水、プロセス水、「置換洗浄」水、製薬水、固体材料の液体抽出物、懸濁または可溶化された表面試料、および液体工業製品たとえば化粧品、薬品、および食料品である。
【0034】
これらの液体培地のいくつかは、関心をもっている環境またはシステムからの直接の未処理試料の形態にある。他の試料は、本発明の方法の工程aに入る液体培地を生成するために取り扱う必要がある。
【0035】
ある場合には、たとえば、培地に予備ろ過をかけて、次の検出と干渉するかもしれない大きなサイズの材料をふるい落とす。このようなプレフィルターは、汚染物質を通過させるが大きなサイズの材料たとえば無関係な固体粒子を通過させないポアサイズをもつのがよい。いくつかの実施形態では、この二段階ろ過を、プレフィルターと予備ろ過された試料が通過したフィルター(主フィルター)の両方への本発明の方法の工程bおよびcの適用と組み合わせることができる。これを行うことによって、全体の汚染の基準を得るために2つの測定を追加することが可能になる。
【0036】
しかし、ある種の試料に対しては、本発明の方法をいかなるこのような初期工程によっても補う必要はない。典型的には、当該試料が、試料中で関心をもっている汚染物質に匹敵するまたはそれより大きい、いかなる有意な量の材料をも含まない場合がそうである。たとえば、多くの水または空気の試料は、これらが高度の純度(それゆえ低度の汚染)が通例であるシステムからきている場合には、いかなる精製も必要としないであろう。
【0037】
表面試料は、表面の所定の領域を、吸収表面または吸着表面を含むサンプリング機器/装置でぬぐい落とすことによって得ることができる。その後、サンプリング機器を液体の入っている適当な容器に入れて攪拌し、液体中への表面汚染物質の放出を引き起こし、次に得られた液体基質を本発明方法の対象にする。
【0038】
抽出可能な固体の試料は環境試料たとえば土壌、沈殿、植物、衣料(たとえば無菌衣類)、毛皮および羽毛などから得ることができる。このような環境試料からの汚染物質を、抽出液を用いて抽出し、次に抽出液を本発明方法の対象にする。
【0039】
試料は食料製品たとえば熱処理した食料製品、食料成分、食料製品および食料成分でありうる。また、ここでは、汚染物質は液体中での攪拌によって抽出されて抽出液体への汚染物質の放出を引き起こし、その後のその液体への本発明方法の使用を可能にする。
【0040】
工程aの前に、液体培地の粘度を減少させることも必要かもしれない。試料が実際は液体であるが、試料が本発明に従って使用されるフィルターを容易に通過しないほどの高い粘度をもつ場合にはそうである。粘度は多くの方法で減少させることができる。これらは希釈によるまたは化学薬品たとえば溶解促進剤または洗剤での処理による方法である。
【0041】
気体培地も本発明方法の対象にすることができる。本発明の実施形態を利用することによって、たとえば空気および他のガスの汚染物質の測定のための従来方法に対する代替方法が提供される。たとえば、現在使用されている多くの方法が(アレルギーの人に対するサービスとして)胞子がカウントされる空気中の真菌胞子の全般的な測定を与えるが、本発明はより小さい限定された環境において特殊な設備を必要とすることなく同じ種類の情報を得るための容易、迅速かつ便利な手段を可能にする。たとえば例6を参照のこと。その例では胞子のカウントが本発明によって決定されることを示している。
【0042】
それで、気体培地は空気たとえば無菌設備、層流空気流機器または環境空気からの空気でありうるだけでなく、入院患者に対する無菌セッティングにおいてまたは直接適用にために用いられるガスも本発明方法の対象にすることができる。
【0043】
ガスから試料を得るために、いくつかの方法論を適用できる。1つは、工程aにおいて気体培地をフィルターに通過させることによるサンプリング段階で単純に無菌フィルターを用いた後、次の工程bおよびcを適用することである。フィルターの特性は、このような場合、ガスから試料を得るのに適しているのがよく、当業者はいかなる問題もなく公的なフィルターを選択できるであろう。ガスおよび空気の試料を得るための広く用いられている機器は「Air−O−cell」カセットであり、本発明の文脈においてこれらの使用も意図している。代わりに、ガスを液体中の微生物の蓄積を促進する液体トラップに通過させ、次にこの液体を本発明方法の対象にする。この場合、試料は気体であるが、培地は実際には液体である。
【0044】
フィルターは通常、培地中の実質的にすべての汚染物質を保持するのに十分小さいポアサイズを有するであろう。すなわち、関心をもっているすべての汚染物質である。本発明の実施形態において、ある汚染物質(たとえば上述した細菌、真菌または胞子のフラグメントではない)の検出を可能にする試料を調製することにのみ関心がある場合、ポアはこのような汚染物質をフィルターを通過させるサイズに設定することができる。しかし、たとえば原生動物の細胞とある種の細菌との間には大きな差があるため、フィルターのポアサイズは変わり得る。また、限定されたサイズを有する汚染物質を「捕獲」するために、本発明方法をいくつかの並行したトラック(各々は工程aにおいてその独自のポアサイズを用いる)で実施できる。たとえば、異なるポアサイズにより得られた2つの測定の単純な引き算は、2つのポアサイズの間の間隔のサイズを有する汚染物質の存在についての情報を与えるであろう。
【0045】
したがって、ポアサイズは最大で20μm、たとえば最大で15、最大で10、最大で5、および最大で3μmであることが好ましい。胞子または微生物のフラグメントを保持するためには、より小さいポアサイズが好ましい。
【0046】
さらに、多くの実施形態においては、ポアサイズは検出可能な成分をフィルターを通過させるのに十分大きいのがよい。これは、次の検出を、強制的にフィルターを通過させて取り出すことによって排出した液体培地に関して行う場合には必須である。この文脈において、ポアサイズは少なくとも0.1μmである(しかし少なくとも0.22μmまたは0.45μmのように大きくてもよい)が、やはり好適なポアサイズは検出可能な成分の選択に依存する。
【0047】
本発明に従って用いられる少なくとも1つの基質は、汚染物質に特異的な酵素によって分解される(または他の方法で化学的に変換される)ことにより、検出可能な成分を生成する。このことは、当該酵素が測定する目標である汚染物質中で生化学的に活性であることを意味する。本発明は全体の汚染の測定および汚染物質のあるサブセットまたは種による汚染の検出の両方を可能にすることに留意すべきである。第1の場合においては、系統的に保存された酵素によって変換される基質を用いるのが便利であろう。すなわち実質的にすべての生物学的な起源において、すなわちほとんどの生存しているまたは生育可能な微生物において、非常に均質な形態で存在する酵素または酵素活性である。後者の場合においては、関連する汚染物質に対して非常に特異的な酵素によって変換される基質を用いることが便利であろう。ともかく、酵素は典型的には、カルボヒドラーゼ、プロテアーゼ、リパーゼ、エステレアーゼ、アミダーゼ、スルファターゼ、ヌクレアーゼ、およびホスファターゼたとえばアルカリ性ホスファターゼからなる群より選択される。
【0048】
好ましい実施形態においては、基質を処理する酵素は、微生物によって構造的に表現される。このことは、汚染物質中における酵素生産の誘導が不要になるという利点をもつ。さらにこれは、酵素活性の誘導が、誘導の制御を達成するのに困難であるかもしれないので、誤差および不安定性の原因になりうることを指摘することに関連している。
【0049】
それゆえ、本発明方法において用いることができる酵素は微生物/細菌の細胞中で自然に生成さえるものを含み、本発明によれば、検出可能な酵素活性は、好ましくは、構造的に表現される、微生物標的個体数/細菌の全成長段階で表現される、および/または微生物標的個体数/細菌の生理学的状態に独立して表現される活性である。酵素活性は細胞内および/または細胞外でよい。したがって、本方法は、基質を加水分解して標的微生物個体数/細菌の成長に必須の栄養成分を与える酵素から選択される酵素活性の検出および定量を含む。本発明の文脈において「必須の栄養成分」は、たとえばBrockら、微生物の生物学、プレンティス−ホール社、イングルウッドクリフス、ニュージャージー州、アメリカにおいて定義されている栄養素を示す。したがって、必須の栄養成分はそれなしでは細胞が成長できない栄養素を含み、多量栄養素および微量栄養素を含む。したがって、本発明方法は炭水化物、タンパク質、リン酸および硫酸代謝に伴う微生物/細菌酵素の検出に基づくことができる。本方法の現在好ましい実施形態は、例からわかるように、微生物のホスファターゼ酵素の検出である。特に、リン酸エステル(第一および第二アルコール、糖アルコール、環式アルコール、フェノールおよびアミンのエステル[無機リン酸を放出する]を含む)の加水分解を含むリン酸代謝を伴うアルカリ性ホスファターゼの検出が興味深い。また、この酵素はポリリン酸エステルPPiを加水分解し、PO3-4基をPPiから(および多くのヌクレオシド ジおよびトリホスフェートから、ならびにマンノース−6−ホスフェートから)グルコースへ転移し、グルコース−6−ホスフェートを形成する。例からわかるように、本発明によるアルカリ性ホスファターゼ活性の測定は微生物数のロバストな測定を与える。
【0050】
好ましい基質は、検出可能な成分として青色、緑色および赤色の生成物(蛍光または発光など)を生成する、蛍光発生基質または発色基質である。発光の検出は、関連する成分の存在についての情報を得るための非常に便利で迅速な方法である。この文脈で有用な基質は、分子プローブ:蛍光プローブおよび研究結果のハンドブック、第9版、著者:リチャード P. ホーグランド、第10章、397−448頁に開示されている。
【0051】
5−ブロモ−4−クロロ−3−インドリルホスフェート ジナトリウム塩;9h−(1,3−ジクロロ−9,9−ジメチルアクリジン−2−オン−7−イル)ホスフェート アンモニウム塩;フルオレセインジホスフェート テトラアンモニウム塩;メチルウンベリフェリル誘導体たとえば6,8−ジフルオロ−4−メチルウンベリフェリルホスフェート、4−メチルウンベリフェリルホスフェート ジクロロヘキシルアンモニウム塩三水和物、4−メチルウンベリフェリルホスフェート遊離酸;4−メチルウンベリフェリルホスフェート ジリチウム塩、4−メチルウンベリフェリルホスフェート−β−N−アセチルグルコサミニド、およびトリフルオロメチルウンベリフェリルホスフェート;4−ニトロフェニルホスフェートの塩;ならびにルソルフィンホスフェートからなる群より選択される基質を用いることが特に好ましい。
【0052】
とにかく、選択した基質にかかわらず、検出可能な成分は、最大で100ピコモル、好ましくは最大で50ピコモル、より好ましくは最大で20ピコモル、さらにより好ましくは最大で10ピコモル、最も好ましくは最大で1ピコモルの量で検出可能であるのが好ましい。特定の選択可能な成分に対する検出限界が低いほど、本発明方法の感度が高い。
【0053】
本発明によれば、単一の基質を用いることができるが、単一の測定信号値に合わせることができる複数の信号を与える検出可能な複数の成分を与える少なくとも2つの基質を用いることもできる。これは、これらの成分から得られる信号を同じ測定ウインドー内で測定でき、したがって1つの信号測定へと統合できることを意味する(単純な例は、異なる酵素による異なる基質の変換から生じるけれども、成分が同一の場合であろう)。したがって、これは、試料中の全体の汚染物質に関する情報を得るための実際的な手段であり、特にこの情報を得るために単一の基質を用いることが適していない場合にはそうである。
【0054】
区別できる複数の信号を与える検出可能な複数の成分を生成する少なくとも2つの基質を用いることもできる。このことは、汚染物質のいくつかの異なる基を個々に測定できるという利点を与える。
【0055】
本発明方法の1つの非常に魅力的な特徴は、それが生育可能な微生物の良好な測定を可能にすることである。多くの従来技術の方法では、培養を含む工程が、ある微生物を成長させず、実際にある微生物を死滅することさえあるという欠点をもつ。すべての微生物を検出可能なレベルまで成長させることができる成長条件を見出すことは単純に不可能であり、したがって培養の前後の微生物の相対的な分布は同一ではない。したがって、従来技術の測定は、試料中のすべての関連する微生物の正確な測定ではなく、与えられた一連の環境下で培養可能な微生物の測定のみを提供する。本発明はこの欠点を受けない。というのは、濃縮工程はいかなる汚染物質に有利でも不利でもなく、基質を試料培地と反応させる次の工程は培地中のいかなる微生物にも悪影響をもたない。したがって、汚染物質が生育可能な微生物である(または、いいかえれば、工程cを経た試料に関する測定による最終結果が生育可能な微生物の含有量を反映する測定である)ことが好ましい。
【0056】
生育可能な微生物の信頼性のある測定を得るには、したがって上述した基質を選択して、生育可能な微生物に特異的な酵素によって変換されるものを用いるのがよい。1つの例は、代謝的に活性な微生物において高い代謝回転をもつ、構造的に表現される酵素であろう。
【0057】
本発明の実施においては、液体ビヒクル中の基質の量が検出可能な成分の生成の速度を制限しないことが望ましい。というのは、このことは、変換する酵素の量(それゆえ汚染物質の量)のみが生成の速度を設定するという結果をもつからである。典型的には、基質/酵素の組み合わせは、検出可能な成分の生成の速度が、既知容量の培地における汚染物質の量の関数(好ましくは線形の)であることを保証するように選択されるであろう。
【0058】
多くの場合、生成した検出可能な成分の量を「汚染物質の数」に変換できることを保証することは比較的簡単であろう。たとえば(「汚染」または「汚染なし」というタイプの)定性的な結果を与えるので十分かもしれない。というのは、あるしきい値を超えたかどうかを欠点することに単に関心があるからである。いいかえれば、試料の種類およびそれがどこからきた系かについての知識が、本発明方法の単一の通過が汚染物質のカウントの正確な測定を与えることを保証するであろう。これは単純に、酵素が飽和するように工程bにおける基質の過剰を保証するという問題である。
【0059】
しかし、本方法を並行に実施して工程aでいくつかの異なる容量の培地を複数のフィルターを通過させ、少なくとも1つの容量が好適な数の汚染物質を含むようにすることが必要かもしれない。
【0060】
工程cで言及されている時間は、十分な量の検出可能な成分の形成を可能にしてその検出を可能にする時間間隔である。この時間間隔は、24時間以下が便利であるが、通常はより短く、たとえば最大で12、11、10、9、8、7、6、5、4、3、2、および1時間である。通常、時間間隔は5分以下ではなく、多くの場合に20分以下ではない。
【0061】
本発明の好ましい実施形態において、フィルターはクローズドな無菌フィルター機器の一部である。フィルター機器の無菌性は、次の測定における信号対ノイズ比に影響を与えないことを保証する。というのは、それは汚染物質自体に寄与しないからである。機器のクローズドな性質は同じ目的に役立つが、本発明方法の使用の容易性を追加する。というのは、フィルターユニットが試料の容易、実用的かつ無菌のハンドリングを促進するからである。
【0062】
好ましい機器は、使い捨てのクローズドな無菌フィルター機器、特にフィルターとフィルターハウジングを1つの不可逆的にクローズドな構造ユニットに一体化したものである。このようなフィルター機器はフィルターハウジングを損なうことなくオープンすることはできない。これらは本明細書の例で用いられているもののように商業的に入手できる。それらの小さいサイズ(典型的には、クローズドな無菌フィルター機器の最長の断面軸は10cmの長さを超えないが、長さが9または8または7または6またはさらに5cmを超えない、より小さいフィルター機器も存在する)のために、それらは現場での試料調整に非常に適している。クローズドな無菌フィルター機器は、液体のろ過のための、商業的に入手できるクローズドな/シールされたフィルターユニットから選択することができる。メンブラン材料はあらゆる入手できるメンブラン材料から選択でき、これは低タンパク質結合Durapore[登録商標](PVDF)、ナイロンメンブラン、低タンパク質結合親水性LCR(PTFE)メンブラン、セルロースアセテートなどを含む。本発明による方法の現在好ましい実施形態は、Express[登録商標]PESメンブランの使用である。
【0063】
たとえばフィルターハウジング内の液体ビヒクルに関して蛍光測定を直接実施することを可能にするウインドーを備えたフィルター機器を使用することもできる。本発明のこの実施形態は、検出可能な成分を放出する基質の変換を連続的にモニターすることに関心がある場合には、セッティングにおいて特に好ましい。下記を参照のこと。
【0064】
本発明の多くの実施形態においては、工程cにおける相互作用を、基質と汚染物質との接触を遮断することによって停止する。この遮断は、フィルター機器中の汚染物質を保持しながらフィルター機器から液体ビヒクルを排出することによって得られる。フィルターから汚染物質のない容器へ液体を単純に注ぐかまたは吸い上げることは、この結果を達成する1つの方法であるが、液体ビヒクルをフィルターの流入側から流出側の方向にフィルター機器から排出させることが好ましい。これは典型的には、フィルターの流入側に高い圧力をかけるか、またはフィルターの流出側に低い圧力をかけることによってなされる。高圧は流入側からフィルターを通して空気または既知容量の液体(たとえば適当な緩衝液または他の溶媒たとえば水)をプレスすることによって得ることができる。
【0065】
工程cにおける相互作用を他の方法によって停止することもできる。これは、たとえば基質または酵素を物理的または化学的に不活性化することによって、フィルター上で停止することができる。
【0066】
最後に、本発明によれば、相互作用を全く停止しないこともできる(基質の変換を定期的または連続的に調査するシステムに関連する)。
【0067】
検出段階
本発明は、工程cの後に、定量的または定性的に液体ビヒクル中の検出可能な成分を検出し、成分の検出を試料中の汚染物質の量または存在に相関させることを伴うさらなる工程d)を有していてもよい。
【0068】
このような検出は、当業者に一般的に知られている多くの通常の方法で実施できる。
【0069】
たとえば生育可能な微生物標的個体数/細菌の量に相関する微生物/細菌の酵素活性の検出に基づくだけでなく、本発明の方法は汚染物質の量に相関する酵素の検出を可能にするあらゆる分析手法を含む。このような手法は、例として、微生物/細菌の酵素の量を免疫学的に検出すること、および関心のある酵素活性のためのDNAおよび/またはRNA配列コーディングの検出を含む。このような手法はこの技術分野でよく知られている方法に基づくことができ、たとえば抗体(オプションで検出可能な成分でラベルされている)の使用、およびDNAまたはRNA配列に選択的にハイブリダイズするオリゴヌクレオチドプローブの使用を含む。
【0070】
測定は、免疫学的でもよいし、または検出可能な成分と特定の結合相手との間の相互作用を検出するあらゆる他の適切な方法によってもよい(すなわち、レセプター相互作用、抗体または抗体フラグメント相互作用、検出可能な成分がある種の相互作用により標準的な信号を減衰または促進する場合の減衰または促進反応などである)。しかし、工程dの検出を検出可能な成分の蛍光特性を測定することによって実施することが好ましい。これは、測定を取り扱う人にいかなる特別なスキルも必要としない、迅速、高信頼性かつ使用容易な方法である。
【0071】
上述したように、工程dにおける蛍光は、液体ビヒクルと汚染物質との接触の遮断なしに、液体ビヒクルに関して直接に測定できる。典型的には、これは、基質の変換を連続的または数回調査して、時間と検出可能な成分の量との関係を確立できる場合になされるであろう。この関係が線形であれば、所定の時点で与えられた蛍光値を、蛍光対汚染物質数の標準曲線に容易に相関できる。
【0072】
蛍光の測定はこの分野でよく知られている技術であり、励起した蛍光団からの蛍光発光よりも短い波長をもつ電磁波(典型的には紫外または可視光)により、蛍光団を励起することを必要とする。励起および蛍光波長は、各々の蛍光団に特異的であり、当業者は両方の目的に好適な波長をどのように選択するかがわかるであろう。
【0073】
一般的に、工程dにおける相関は、標準条件下(たとえば反応時間、温度など)での、汚染物質の量と検出可能な成分の量との関係を表す予め決定した標準曲線の使用を含むことが好ましい。
【0074】
本発明によれば、検出をマイクロタイターシステムで行ってもよい(検出可能な成分を他の物質たとえば抗体との相互作用により測定する場合には特に適している)。この実施形態の特別なバージョンにおいては、液体ビヒクルをフィルターの流出側からマイクロタイタープレートへ直接に通す。フィルターをマイクロタイタープレートと統合することによる効果を達成できる。
【0075】
信号の増強
汚染物質が、工程aの前または工程bに、信号を増強させる影響を受けることが有利であろう。これは、その後の検出における全体の感度を増加させるか、特定の種類の汚染物質のその後の検出を有利にするか、または特定の種類の汚染物質の検出を減少させる。
【0076】
このような信号を増強させる影響は、典型的には、酵素促進物質、選択的な温度または温度範囲、選択的なpH、選択的な塩濃度、非選択的な成長促進剤、および選択的な成長促進物質から選択される。当業者は、利用可能な様々な可能性がわかり、特定の試料、関心をもっている汚染物質、基質/酵素の組み合わせおよび検出方法に関係してこれらを選択することができるであろう。
【0077】
工程aの前に培地のインキュベーションすることによって、信号を増幅することもできる。このインキュベーションは、好ましくは、以下のことを伴う。
【0078】
−物質を誘導し、それによって検出可能な成分の検出を促進する(したがって基質の変換を促進するので一般的な促進効果)、酵素による処理、および/または
−培地を、イースト、真菌または微生物に対する選択的な物質にさらす(これはある種の汚染物質の検出を有利にする効果をもつ)、および/または
−培地を、微生物に対する非選択的な成長促進剤にさらす(全体の汚染物質の数がそれによって増加/増殖するため一般的な促進効果もある。しかし、このオプションは、試料中の生育可能な微生物の「真の」数を反映しなければならない場合には避けるべきである)、および/または
−培地を、細胞の酵素を抽出できる物質にさらす(これは工程bにおける基質の変換も促進するので第1の選択肢に匹敵する)。
【0079】
本発明のキット
本発明は、培地中の汚染物質の測定のためのキットも想定している。このキットは、
−フィルターの流入側に汚染物質を保持するのに十分小さいポアサイズをもつフィルターを有する少なくとも1つの無菌フィルター機器と、
−既知容量の培地を、フィルターを通過させる手段(たとえばシリンジ)と、
−汚染物質との相互作用時に検出可能な成分を放出する少なくとも1つの試薬(検出可能な成分の量は、試薬と相互作用した汚染物質の量と相関できる)(たとえば上で教示した基質)と、
−a)既知容量の培地を得て、それを無菌フィルター機器を通過させ、b)フィルターの流入側を試薬と接触させ、c)試薬を、フィルターの流入側にあるであろう汚染物質と相互作用させ、d)検出可能な成分を定量的に検出するための工程を記載した説明書と
を有する。
【0080】
この特定のキットを特徴づける全ての特徴は上で詳細に説明しており、上記の開示は無菌フィルター機器に関し、検出可能な成分を生成する試薬は必要な変更を加えて本発明のキットにあてはまり、その構成成分として使用できることを意味し、かつ説明書は本発明方法の実施に関連する本明細書中の教示に対応し、これらの教示は必要な変更を加えて本発明のキットに当てはまることを意味している。
【0081】
例の前提
材料と方法
使用した培地
R2A寒天(g/リットル):イースト抽出物0.5;プロテオースペプトン0.5;カゼイン加水分解物0.5;グルコース0.5;可溶性スターチ0.5;ピルビン酸ナトリウム3;リン酸水素二カリウム0.3;硫酸マグネシウム0.05;寒天−寒天12.0。
【0082】
イースト抽出物寒天(g/リットル):トリプトン(カゼイン、pancr.からのペプトン)6.0;脱水イースト抽出物3.0;寒天−寒天15.0。
【0083】
飲料水/温水培地(g/リットル):0.125イースト抽出物。
【0084】
希釈培地(g/リットル):塩化ナトリウム8.5;ペプトン(カゼイン、pancr.から)1.0.
別に記述していなければ、全ての薬品はメルクKGaA、ダルムシュタット、ドイツから入手した。
【0085】
培養可能な細菌の計数
培養可能な細菌の計数、ヘテロトロピックプレートカウント(HPC)を、飲料水中においてヨーロッパ規格DS/EN ISO6222に従って実施した。試料を、酸リンス/オートクレーブにかけたブルーキャップボトルに移し、5℃で保管してから分析した。全ての試料をサンプリングから4−5時間以内に分析した。ある容量の未処理試験試料およびペプトン希釈試験試料をペトリ皿に入れた。その後、15−20mlの溶融イースト抽出物培地を加え、穏やかに回転して注意深く混合した。その後、培地をセットした。プレートを22±2℃で68±4時間および36±2℃で44±4時間、転化およびインキュベートした。結果を、コロニー形成ユニットの数/ミリリットル水試料(cfu/ml)として示した。
【0086】
飲料水中の培養可能な細菌の計数を、標準的な操作手法(デンマーク規格DSF5984)に従って商業的な研究所(ユーロフィンズ、デンマーク)によって行った。この結果を、4つのインキュベーション温度(37、44、55および65℃)におけるcfu/ml水試料として示した。評価したcfu/mlのうち最高数をもつインキュベーションをデータ分析に用いた。
【0087】
アクリジンオレンジステインを用いる細菌の直接カウント(AODC)
全体の細菌カウントを、アクリジンオレンジ直接カウント(AODC)を用いて得た。分割試料をブラックNucleporeポリカーボネート0.2ミクロンポアサイズのフィルターにより最大150mmHgでろ過した。その後、フィルターを2容量の8ml緩衝液(クエン酸−リン酸、pH5.2)で洗った。次に、フィルターをアクリジンオレンジ(最終濃度0.02%)で3分間ステインした後、3mlの無菌化Milli−Q水で2回洗い、顕微鏡スライド上に載せた。フィルターをエピ蛍光顕微鏡を用いて分析した。各々のスライドについて、少なくとも10の顕微鏡フィールドを観察し、フィルターあたり少なくとも400個の細胞をカウントした。細菌の数を、細菌細胞の数/ml試験試料として計算した。
【0088】
4−メチルウンベリフェリルでラベルした酵素モデル基質を用いる液体試験試料における酵素活性の測定
液体試験試料を、0.22μm express 33mm無菌Millexシリンジ駆動フィルターユニット(Millpore社、ベドフォード、マサチューセッツ州、アメリカ)を通してろ過する。再使用可能なプラスチックシリンジを用い、次に、フィルターユニットを酵素基質を含む適切な緩衝液で飽和する。フィルターを固定時間インキュベートする。その後、インキュベーション混合物を、2mlのpH10.6のグリシン−NaOH緩衝液を用いて洗い流すか、または再使用可能なプラスチックシリンジを用いて空気圧をかけることによってフィルターユニットから直接に得る。分割試料をピペットで収集し、10×10mmのプラスチック蛍光キュベット(サーシュテット、ドイツ)または100マイクロリッターのキュベット(ターナーバイオシステムズ、アメリカ)へそれぞれ移す。蛍光出力を、カスタマイズしたMycoMeter蛍光分析計(ターナーバイオシステムズ、アメリカ)により、365nmの励起波長および465nmの発酵波長で測定する。酵素活性を、4−メチルウンベリフェリル誘導体の酵素分解時に放出される蛍光団である4−メチルウンベリフェロンによって生じる蛍光として示す。活性を、蛍光単位/時間単位/mlとして示す。
【0089】
例1
飲料水希釈シリーズ中における、APase活性と細菌数との間の線形性
飲料水をMycoMeter実験室の蛇口からサンプリングし、イースト抽出物を加えて125mg/lの最終濃度にした。その後、試料を室温でインキュベートした。細菌の成長を、分光光度計でOD620測定によりモニターした。細菌の成長が後期log段階(OD=0.04)に達したときに、ヘテロトロピックプレートカウント(HPC)の測定のためにサンプリングした。飲料水の分割試料を、ろ過しオートクレーブにかけた飲料水で100、250、500、750および1000倍に希釈した。その後、アルカリ性ホスファターゼ(APase)活性を、上記の材料および方法のセクションで説明した標準的な手法により、各々の希釈液について3度測定した。
【0090】
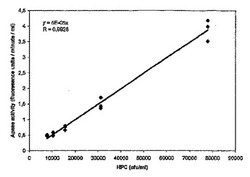
インキュベート水試料中のHPCの6回の繰り返し測定は平均で77×105cfu/mlであった。このHPC結果を、インキュベート水試料の各々の希釈液についてcfu/mlを計算するのに用いた。図1は、APase活性とHPC(飲料水希釈液から計算)との間の線形性を示している。実験1からのデータを用いて、飲料水試料中の最小の検出可能な細菌数を計算した。本発明について説明し、実験1のデータから計算した標準的な手法により、検出可能な最小の細菌数は21cfu/ml飲料水試料であった。
【0091】
試料と酵素基材との接触回数を単純に増加または減少することにより、および/またはろ過する水の量を増加または減少することにより、検出限界を需要または要求に従って増加または減少することができる。例として、1細菌/ml飲料水試料を、1リットルの飲料水試料をろ過し2.6時間インキュベートすることによって検出することができる。結果は、APase活性測定の高い感度および再現性ならびにAPase活性と広範囲の計算細菌濃度との間の強い線形関係(r=0.99、p<0.001)を示している。また、データは、試料容量を単純に増加することによって、本方法の感度を増すことができることを示している。
【0092】
例2
微量のイースト抽出物を添加した飲料水試料中のインキュベーション時間によるAPase活性の線形な増加
飲料水をMycoMeter実験室の蛇口からサンプリングし、イースト抽出物を加えて125mg/lの最終濃度にした。その後、試料を室温でインキュベートした。細菌の成長を、分光光度計でOD620測定によりモニターした。細菌の成長が後期log段階(OD=0.04)に達したときに、材料および方法のセクションで説明した標準的な手法に従ってAPase活性の測定のために水をサンプリングした。飲料水試料を、ろ過しオートクレーブにかけた飲料水で100倍に希釈した。その後、15、30、45および60分というインキュベーション時間を変えて、APase活性を3度測定した。図2はAPase活性対インキュベーション時間の散布図を示す。結果は、インキュベーション時間とAPase活性との間の線形な関係を示している。また、結果は、試料を基質分子と接触させる時間を単純に増加することによって、本方法の感度を増すことができることを示している。
【0093】
例3
飲料温水中における、APase活性と培養可能な細菌の見積もったコロニー形成ユニットとの間の相関
水試料を、1年間の期間にわたって、病院内の6つの水出口から得た。24時間以内に、水試料をAPase活性について分析した。材料および方法のセクションで説明したデンマーク規格DSF5984に従って、商業的な研究所によってHPCカウントを行った。図3はAPase活性とHPCの散布図を示す。結果は、飲料温水中におけるAPase活性とHPCとの間の正の線形な相関(r=0.93、p<0.001)を示している。
【0094】
例4
飲料水中における、APase活性と培養可能な細菌の見積もったコロニー形成ユニットとの間の相関
試料を、個人住宅、ビジネスおよび公共建物を含む飲料水系の範囲から得た。サンプリングの2−12時間以内に分析を行った。上記の材料および方法のセクションで説明した標準的な手法に従って、培養可能な細菌の計数とAPase活性の測定を行った。図4は飲料水試料中における、APase活性とHPCの散布図を示す。結果は、APase活性とHPCとの間の正の線形な相関(r=0.85、p<0.001)を示している。
【0095】
例5
飲料温水中における、APase活性とアクリジンオレンジ直接カウント(AODC)との間の相関
試料を、個人住宅、ビジネスおよび公共建物を含む飲料水系の範囲から得た。サンプリングの24時間以内に分析を行った。材料および方法のセクションで説明したように、AODCを行った。図5は飲料温水中における、APase活性とAODCの散布図を示す。結果は、APase活性とAODCとの間の強い正の線形な相関(r=0.78、p<0.001)を示している。
【0096】
例6
N−アセチルヘキソサミニダーゼ活性と真菌胞子バイオマスとの間の線形性
真菌Penicillium communeを用いた寒天培養(麦芽抽出物寒天)により、真菌胞子の懸濁液を調製した。
【0097】
6mlの胞子懸濁液を予め秤量したナイロンメンブランフィルター(0.45μm)を通してろ過し60℃で24時間乾燥することによって、懸濁液の胞子バイオマスを測定した。それぞれ50μl、100μl、250μlおよび500μlの胞子懸濁液を移すことにより、胞子懸濁液の希釈シリーズを二重に調製した。オートクレーブにかけた希釈水を各々の培養チューブに添加することによって、胞子懸濁液を希釈して全体で3mlにした。
【0098】
以下のように変更して、材料および方法のセクションで説明したように、胞子懸濁液のN−アセチルヘキソサミニダーゼ酵素活性を分析した。フィルターユニットを、酵素基質4−メチルウンベリフェリルホスフェート−β−N−アセチルグルコサミニドを含む適切な緩衝液で飽和した。インキュベーション後に、再使用可能なプラスチックシリンジを用いて圧力をかけることによって、インキュベーション混合物をフィルターユニットから直接に得た。その後、100μlの分割試料を、2mlの適切な緩衝液(pH10.6)を含むプラスチックキュベットに移すことによってアルカリ化した。
【0099】
胞子バイオマスとN−アセチルヘキソサミニダーゼ活性との間の強い正の線形な相関(r=0.9975、p<0.001)が、図6の散布図に示されている。
【図面の簡単な説明】
【0100】
【図1】計算された飲料水希釈シリーズ中のヘテロトロピックプレートカウント(HPC)[コロニー形成単位/ml水試料として表示]と、APase基質4−メチルウンベリフェリルホスフェートの酵素分解によって生成した蛍光によって決定したアルカリ性ホスファターゼ活性(APase活性)[蛍光単位/分/mlとして表示]との間の線形関係を示すグラフ。
【図2】インキュベーション時間と、APase基質4−メチルウンベリフェリルホスフェートの酵素分解によって生成した蛍光によって決定したAPase活性[蛍光単位/分/mlとして表示]との間の線形関係を示すグラフ。
【図3】APase基質4−メチルウンベリフェリルホスフェートの酵素分解によって生成した蛍光によって決定した飲用温水中のAPase活性[それぞれlog10(蛍光単位/時/100ml)およびlog10(蛍光単位/30分/250ml)として表示]と、HPC[log10(cfu/ml水試料)として表示]との間の、かなり著しい正の線形相関を示すグラフ。
【図4】APase基質4−メチルウンベリフェリルホスフェートの酵素分解によって生成した蛍光によって決定した飲用温水中のAPase活性[それぞれlog10(蛍光単位/時/100ml)およびlog10(蛍光単位/30分/250ml)として表示]と、HPC[log10(cfu/ml水試料)として表示]との間の、かなり著しい正の線形相関を示すグラフ。
【図5】APase基質4−メチルウンベリフェリルホスフェートの酵素分解によって生成した蛍光によって決定した飲用温水中のAPase活性[log10(蛍光単位/時/100ml)として表示]と、アクリジンオレンジ直接カウント(AODC)[log10(菌体/ml)として表示]との間の、かなり著しい線形相関を示すグラフ。
【図6】真菌Penicillium communeの胞子バイオマスと、N−アセチルヘキソサミニダーゼ活性(基質化4−メチルウンベリフェリル−β−N−アセチルグルコサミニドの酵素分解によって測定)との間の、かなり著しい線形相関を示すグラフ。
【技術分野】
【0001】
本発明は、環境調査および制御、特に環境試料中の汚染物質の測定に関する。より具体的には、本発明は(細菌)汚染の正確な測定を与える、その場で実施できる、簡単で、多用途で、ロバストで、信頼できる、迅速な方法に関する。さらに本発明はこのような測定を行うのに有用なキットを提供する。
【背景技術】
【0002】
微生物汚染の問題に対処するために、いくつかの試験方法が開発されている。伝統的な方法は成長を維持する栄養培地での細菌のインキュベーションに基づく。約2−14日後に、固体培地で成長できる細菌はコロニーが見えカウントできるようになるレベルまで増殖し、液体培地中で成長できる細菌はたとえば光学濃度または乾燥重量によって測定できる。検出プロセスをはかどらせ、簡単にする努力がなされてきた。これらのうち努力は放射線分析、インピーダンス、化学発光および蛍光の測定に基づく方法であった。
【0003】
細菌汚染を確認するための放射線法は一般的に細菌による放射性栄養の取り込みを利用する。放射線ラベルした細菌は、放射線ラベルを追跡することによって、分離し定量できる。この方法はいくつかの望ましくない欠点を有する。非常に感度が高いけれども、この方法は高価で取り扱いが困難でありうる放射線同位体を利用する。
【0004】
電気的インピーダンスに基づく方法は典型的には培養工程を含む。微生物が成長するのに従って、栄養培地のインピーダンスの変化を検出して微生物の成長に関連づけることができる。電気的インピーダンスに基づく方法は、伝統的な培養よりも迅速であるけれども、いまだに遅く、1−4日のインキュベーション期間を伴う。
【0005】
ATPは化学発光によって検出される。ATPの検出を使用した細菌の検出および/または定量は迅速で数分以内で実施できる。しかし、ATPは偏在し、ATP誘導発光の動力学は複雑な性質であり、この原理に基づく方法のロバストネスを低下させる。さらに、細胞におけるATPの代謝回転は非常に迅速で、細胞のATP含有量は短時間に、たとえば細胞が成長からスターベーションへ至るときに、大きな変化を経験するかもしれない。
【0006】
従来技術には、蛍光ラベルしたウンベリフェロン基材の酵素分解に基づき、放出されたウンベリフェロンから生じる蛍光の共存モニタリングを用いるいくつかの方法が記載されている。また、酵素活性を使用した細菌の検出および定量は、非細菌源からの干渉を受けることがある(この干渉はより重要ではないように見えるけれども)。さらに、時間単位あたりに形成される生成物(蛍光)の量は線形である。最小限の最小の干渉および単純な動力学は、酵素活性を使用した細菌の測定をよりロバストにする。
【0007】
米国特許第4,591,554(Koumuraら)は、非蛍光ウンベリフェロン誘導体たとえば4−メチル−ウンベリフェリル−β−D−ガラクトシド、4−メチルウンベリフェリル−α−D−ガラクトシド、4−メチルウンベリフェリル−ホスフェート、および4−メチルウンベリフェリル−ピロホスフェートを利用して微生物を迅速に検出する方法を開示している。遊離したウンベリフェロン成分の蛍光が360nmに誘起され、450nmでモニターされている。1−12時間の培養工程により感度の増強を得ている。
【0008】
米国特許第5,518,894(Berg)は、大腸菌の存在を検出する迅速な方法を開示している。この方法は、濃縮工程(ろ過)を培養工程との組み合わせを含み、存在する標的細菌の数を増加させる。加水分解したウンベリフェロン誘導体の蛍光を、大腸菌の存在を表示するものとしてモニターする。
【0009】
米国特許第5,610,029(Ehrenfeldら)は、試料中の標的微生物の有無を検出するための培養培地を開示している。この培養培地は種々の栄養および成長因子ならびに蛍光代謝物質(4−メチルウンベリフェリル−β−D−グルクロニド)を含む。
【0010】
酵素活性の蛍光発生検出の検出に基づく上述した方法の全ては、一般的に6−72時間の合計実施時間をもたらす培養工程を利用する。このことは、多くの場合、その場で実施される方法はいうまでもなく、迅速な方法の実施のための要求も満足しない。
【0011】
米国特許第5,089,395(Snyderら)は、酵素により蛍光生成物に変換される非蛍光ウンベリフェロン誘導体を使用して細菌の存在を検出することを開示している。この方法には、培養または濃縮工程はない。これらの工程がないことにより、この方法は感度がそれほど高くなく、少なくとも1000/mlの高い細菌濃度を必要とし、一般的により高い濃度が得られる。
【0012】
米国特許第5,968,762(Jadamecら)は、酵素により蛍光生成物に変換される非蛍光ウンベリフェロン誘導体を使用し細菌の存在を検出する方法を開示している。この方法は、特定波長での代謝した蛍光の、第2の特定波長に結合する代謝可能な蛍光の比を測定することに関する。310(cfu/ml)の濃度を検出するためにほぼ80分の検出時間を示している(cfu=コロニー形成単位)。
【0013】
細菌の液体試料を調べるためには、普通、液体試料のメンブランろ過を用いる。無菌メンブランフィルターを無菌化できるクローズドな機器内に入れ、細菌をフィルター上に収集する。その後、フィルターを寒天含有栄養培地上に置き、そこで培養プロセスの後にコロニーを数えることができる。フィルターを細菌中に組み込んだ蛍光発生色素で処理し、その後それをレーザー誘起蛍光によって数えてもよい。メンブランろ過を用いる全ての微生物学者は、フィルターの無菌取り扱いを確保するために採用することが必要な注意に精通している。少数の細菌を検出する場合、ろ過工程は汚染を容易に導入し、プロセスを信頼できないものにし作業者のスキルに大きく依存するものにすることがある。
【0014】
したがって、この技術において必要とされるのは、簡単に実施できロバストで信頼性のある、試料中の細菌の存在を検出する迅速な方法である。
【発明の開示】
【0015】
発明の目的
本発明の目的は、資料中の微生物および他の汚染物質の存在を決定するための、迅速で、信頼性があり、多用途でロバストな方法を提供することにより、従来技術における多くの上述した問題点および短所に対処することにある。
【0016】
発明の概要
本発明は、代わりに、ろ過またはろ過に類似した方法によって有効な微生物の濃縮工程を行えば、上述した培養工程を完全に除外することができるという驚くべき実証に基づいている。このことは従来技術に対して2つの主要な利点を意味する。というのは、これが1)感度を増し、したがって検出時間を著しく減少させ、2)たとえば消光または自己蛍光によって蛍光検出に干渉するか、または培養培地に由来する交差反応によって免疫検出に干渉するかもしれない、試料中の化合物または粒子を除去するからである。
【0017】
本発明は、一般的に、ろ過の次に培養またはレーザー計数を行う場合には適用できないであろう、使い捨てのクローズドなろ過ユニットを利用する。本発明は、分析の全プロセスの間、試料の無菌状態の、容易で、ロバストで信頼性のある取り扱いを提供する。このことは、本発明をポータブルなフィールド法として理想的にする。
【0018】
微生物および他の汚染物質は大容量から濃縮できる。このことは非常に低濃度でも迅速な検出を可能にする。事実、この方法の感度はもっぱら、フィルターによって保持すべき最小数の汚染物質によって、およびフィルターの物理特性、すなわちその構造保全性を保ちながらフィルターを通過することができる容積サイズによって設定される。それゆえ、生育可能な微生物標的個体数の量/細菌を定量するために、液体中に必要とされる細菌濃度に下限がないことは、本発明の重要な面である。したがって、この方法は、最大で1000細菌/mlの量をもつ液体中の細菌を検出するのに用いることができるが、より少量、たとえば最大で100細菌/ml、最大で10細菌/ml、さらに1細菌/ml未満が可能である。
【0019】
本発明は、たとえば、種々のソースから、かつ種々の形態で収集された試料からの微生物の定量を可能にする。試料は、液体;たとえば飲料水、温水など、工業水たとえばプロセス水および置換洗浄(CIP)水の試料、製薬水、2)空気;たとえば室内空気、工業空気、重度に汚染された作業環境からの空気、薬品製造設備からの空気、3)抽出可能な固体試料;たとえば食料品、沈殿物および植物材料など、4)表面;たとえば建物の表面、建材およびワークの表面などであろう。
【0020】
それゆえ、最も広くかつ最も一般的な範囲において、本発明は、汚染物質を含むことが疑わしい培地のための試料調製方法であって、a)既知容量の前記培地を、フィルターを通して流入側から流出側へ通過させることによって、フィルターの流入側で汚染物質を濃縮し、b)フィルターの流入側を、汚染物質との相互作用により各々検出可能な成分を生じる少なくとも1つの基質を含む液体ビヒクルに接触させ、c)フィルターの流入側で、ある時間(前記時間は検出可能な成分を液体ビヒクル中で検出させるのに十分である)の間、基質を汚染物質と相互作用させることを含む方法に関する。
【0021】
また、本発明の一部は、培地中の汚染物質の測定のためのキットであって、1)フィルターの流入側に汚染物質を保持するのに十分小さいポアサイズをもつフィルターを有する少なくとも1つの無菌フィルター機器と、2)既知容量の培地を、フィルターを通過させる手段と、3)汚染物質との相互作用時に検出可能な成分を放出する試薬(検出可能な成分の量は、試薬と相互作用した汚染物質の量と相関できる)と、4)a)既知容量の培地を得て、それを無菌フィルター機器を通過させ、b)フィルターの流入側を試薬と接触させ、c)試薬を、フィルターの流入側にあるかもしれない汚染物質と相互作用させ、d)検出可能な成分を定量的に検出するための工程を記載した説明書とを有するキットである。
【0022】
最後に、本発明は、機器に保持された汚染物質と、汚染物質に接触したときに検出可能な成分を放出する基質との間の反応のための反応容器としての、クローズドな無菌フィルター機器の使用方法に関する。
【発明を実施するための最良の形態】
【0023】
以下、多くの定義を提示して、本発明の境界を定義する。
【0024】
本明細書において用いる限り、「汚染物質」という用語は試料中の生物起源の望ましくない成分に関する。汚染物質の非限定的な例は、微生物(病原性および非病原性の両方)だけでなく、このような微生物のフラグメントである。非病原性の汚染物質は、それらが製品中に現れた場合に製品の品質に有害であるため、望ましくないであろう(例は、制御された発酵中の汚染微生物、味および味覚に影響する、食料製品中の汚染微生物などである)。
【0025】
「生育可能な」微生物は、目下の文脈において、適切な一連の環境下で代謝活性であるまたは代謝活性になり得る微生物または胞子である。したがって、この用語は、その範囲内に、容易に培養できる微生物だけでなく、培養において再現するのが困難な環境下でのみ増殖する微生物も含む。
【0026】
「フィルター」という用語は、目下の文脈において、あるサイズよりも大きい粒子の通過を遮断する機器である。しかし、この用語は、結合相手(たとえばレセプター、抗体またはこれらのフラグメント)に対して著しい結合特異性をもつ材料の通過を遮断する機器も包含する。したがって、この用語は、通常は「フィルター」とみなされない機器、たとえば遠心分離機および超遠心分離機におけるメンブラン、特異的な結合相手たとえば抗体または他の特異的に結合する物質で含浸されたメンブランも包含する。したがって、本発明によって予期されている特殊「フィルター」は、アフィニティクロマトグラフィのカラムをも含む。本発明による「フィルター」の重要な特徴は、それが、関心をもっている汚染物質を保持することができ、次の基質と汚染物質に特異的な酵素との間のインサイチュ反応を可能にして、次の基質から由来する検出可能な成分の測定を容易に行えるようにすることである。下記参照。
【0027】
「基質」という用語は、酵素によって触媒されたその化学構造における変換を受ける化学薬剤を意味する。
【0028】
「検出可能な成分」という用語は、酵素によって触媒された基質の変換の結果である化学的実体を意味し、ここで化学的実体は検出できるが基質においては検出可能でない物理的または化学的特性を含む。例は、蛍光成分、発光成分、および結合相手に高い特異性で結合する成分である。
【0029】
「信号」という用語は、それが適切な測定系において記録される限り、検出可能な成分の測定可能な特性を意味することを意図している。
【0030】
本発明の方法の望ましい実施形態
汚染物質は、典型的には細菌;真菌、たとえば糸状菌およびイースト;藻類;原生動物;細菌からの胞子;真菌胞子;および花粉、ならびにこれらのフラグメントからなる群より選択される。これらの汚染物質のすべてが病原性であるわけでないが、ある環境でのそれらの存在は非常に望ましくなく有害でさえあることは指摘するまでもないであろう。産業的な発酵における汚染微生物の存在は多くのうちの一例であり、この場合には汚染物質の存在による経済的および実際的な影響は大きいが、食品製造およびそれらの価値が美的特徴に帰する製品の製造においても汚染物質は経済的損失の原因になり得る。
【0031】
微生物のフラグメントおよび胞子は、深刻な気管疾患たとえば喘息のトリガー剤であることがわかっている。このようなフラグメント(典型的には死んだ細菌または多少とも破壊された胞子からなる)は生育可能ではないが、にもかかわらずそれらの検出および除去を保証する範囲で病原性に関連している。
【0032】
本発明の方法は種々のソースからの試料に適用でき、唯一のルールは汚染物質含有試料を培地(その性質はそれがフィルターを通して通過できることを可能にするということである)へ合体できなければならないことである。
【0033】
好都合には、培地が液体培地である。非限定的な例は、環境水、飲料水、温水、工業水、プロセス水、「置換洗浄」水、製薬水、固体材料の液体抽出物、懸濁または可溶化された表面試料、および液体工業製品たとえば化粧品、薬品、および食料品である。
【0034】
これらの液体培地のいくつかは、関心をもっている環境またはシステムからの直接の未処理試料の形態にある。他の試料は、本発明の方法の工程aに入る液体培地を生成するために取り扱う必要がある。
【0035】
ある場合には、たとえば、培地に予備ろ過をかけて、次の検出と干渉するかもしれない大きなサイズの材料をふるい落とす。このようなプレフィルターは、汚染物質を通過させるが大きなサイズの材料たとえば無関係な固体粒子を通過させないポアサイズをもつのがよい。いくつかの実施形態では、この二段階ろ過を、プレフィルターと予備ろ過された試料が通過したフィルター(主フィルター)の両方への本発明の方法の工程bおよびcの適用と組み合わせることができる。これを行うことによって、全体の汚染の基準を得るために2つの測定を追加することが可能になる。
【0036】
しかし、ある種の試料に対しては、本発明の方法をいかなるこのような初期工程によっても補う必要はない。典型的には、当該試料が、試料中で関心をもっている汚染物質に匹敵するまたはそれより大きい、いかなる有意な量の材料をも含まない場合がそうである。たとえば、多くの水または空気の試料は、これらが高度の純度(それゆえ低度の汚染)が通例であるシステムからきている場合には、いかなる精製も必要としないであろう。
【0037】
表面試料は、表面の所定の領域を、吸収表面または吸着表面を含むサンプリング機器/装置でぬぐい落とすことによって得ることができる。その後、サンプリング機器を液体の入っている適当な容器に入れて攪拌し、液体中への表面汚染物質の放出を引き起こし、次に得られた液体基質を本発明方法の対象にする。
【0038】
抽出可能な固体の試料は環境試料たとえば土壌、沈殿、植物、衣料(たとえば無菌衣類)、毛皮および羽毛などから得ることができる。このような環境試料からの汚染物質を、抽出液を用いて抽出し、次に抽出液を本発明方法の対象にする。
【0039】
試料は食料製品たとえば熱処理した食料製品、食料成分、食料製品および食料成分でありうる。また、ここでは、汚染物質は液体中での攪拌によって抽出されて抽出液体への汚染物質の放出を引き起こし、その後のその液体への本発明方法の使用を可能にする。
【0040】
工程aの前に、液体培地の粘度を減少させることも必要かもしれない。試料が実際は液体であるが、試料が本発明に従って使用されるフィルターを容易に通過しないほどの高い粘度をもつ場合にはそうである。粘度は多くの方法で減少させることができる。これらは希釈によるまたは化学薬品たとえば溶解促進剤または洗剤での処理による方法である。
【0041】
気体培地も本発明方法の対象にすることができる。本発明の実施形態を利用することによって、たとえば空気および他のガスの汚染物質の測定のための従来方法に対する代替方法が提供される。たとえば、現在使用されている多くの方法が(アレルギーの人に対するサービスとして)胞子がカウントされる空気中の真菌胞子の全般的な測定を与えるが、本発明はより小さい限定された環境において特殊な設備を必要とすることなく同じ種類の情報を得るための容易、迅速かつ便利な手段を可能にする。たとえば例6を参照のこと。その例では胞子のカウントが本発明によって決定されることを示している。
【0042】
それで、気体培地は空気たとえば無菌設備、層流空気流機器または環境空気からの空気でありうるだけでなく、入院患者に対する無菌セッティングにおいてまたは直接適用にために用いられるガスも本発明方法の対象にすることができる。
【0043】
ガスから試料を得るために、いくつかの方法論を適用できる。1つは、工程aにおいて気体培地をフィルターに通過させることによるサンプリング段階で単純に無菌フィルターを用いた後、次の工程bおよびcを適用することである。フィルターの特性は、このような場合、ガスから試料を得るのに適しているのがよく、当業者はいかなる問題もなく公的なフィルターを選択できるであろう。ガスおよび空気の試料を得るための広く用いられている機器は「Air−O−cell」カセットであり、本発明の文脈においてこれらの使用も意図している。代わりに、ガスを液体中の微生物の蓄積を促進する液体トラップに通過させ、次にこの液体を本発明方法の対象にする。この場合、試料は気体であるが、培地は実際には液体である。
【0044】
フィルターは通常、培地中の実質的にすべての汚染物質を保持するのに十分小さいポアサイズを有するであろう。すなわち、関心をもっているすべての汚染物質である。本発明の実施形態において、ある汚染物質(たとえば上述した細菌、真菌または胞子のフラグメントではない)の検出を可能にする試料を調製することにのみ関心がある場合、ポアはこのような汚染物質をフィルターを通過させるサイズに設定することができる。しかし、たとえば原生動物の細胞とある種の細菌との間には大きな差があるため、フィルターのポアサイズは変わり得る。また、限定されたサイズを有する汚染物質を「捕獲」するために、本発明方法をいくつかの並行したトラック(各々は工程aにおいてその独自のポアサイズを用いる)で実施できる。たとえば、異なるポアサイズにより得られた2つの測定の単純な引き算は、2つのポアサイズの間の間隔のサイズを有する汚染物質の存在についての情報を与えるであろう。
【0045】
したがって、ポアサイズは最大で20μm、たとえば最大で15、最大で10、最大で5、および最大で3μmであることが好ましい。胞子または微生物のフラグメントを保持するためには、より小さいポアサイズが好ましい。
【0046】
さらに、多くの実施形態においては、ポアサイズは検出可能な成分をフィルターを通過させるのに十分大きいのがよい。これは、次の検出を、強制的にフィルターを通過させて取り出すことによって排出した液体培地に関して行う場合には必須である。この文脈において、ポアサイズは少なくとも0.1μmである(しかし少なくとも0.22μmまたは0.45μmのように大きくてもよい)が、やはり好適なポアサイズは検出可能な成分の選択に依存する。
【0047】
本発明に従って用いられる少なくとも1つの基質は、汚染物質に特異的な酵素によって分解される(または他の方法で化学的に変換される)ことにより、検出可能な成分を生成する。このことは、当該酵素が測定する目標である汚染物質中で生化学的に活性であることを意味する。本発明は全体の汚染の測定および汚染物質のあるサブセットまたは種による汚染の検出の両方を可能にすることに留意すべきである。第1の場合においては、系統的に保存された酵素によって変換される基質を用いるのが便利であろう。すなわち実質的にすべての生物学的な起源において、すなわちほとんどの生存しているまたは生育可能な微生物において、非常に均質な形態で存在する酵素または酵素活性である。後者の場合においては、関連する汚染物質に対して非常に特異的な酵素によって変換される基質を用いることが便利であろう。ともかく、酵素は典型的には、カルボヒドラーゼ、プロテアーゼ、リパーゼ、エステレアーゼ、アミダーゼ、スルファターゼ、ヌクレアーゼ、およびホスファターゼたとえばアルカリ性ホスファターゼからなる群より選択される。
【0048】
好ましい実施形態においては、基質を処理する酵素は、微生物によって構造的に表現される。このことは、汚染物質中における酵素生産の誘導が不要になるという利点をもつ。さらにこれは、酵素活性の誘導が、誘導の制御を達成するのに困難であるかもしれないので、誤差および不安定性の原因になりうることを指摘することに関連している。
【0049】
それゆえ、本発明方法において用いることができる酵素は微生物/細菌の細胞中で自然に生成さえるものを含み、本発明によれば、検出可能な酵素活性は、好ましくは、構造的に表現される、微生物標的個体数/細菌の全成長段階で表現される、および/または微生物標的個体数/細菌の生理学的状態に独立して表現される活性である。酵素活性は細胞内および/または細胞外でよい。したがって、本方法は、基質を加水分解して標的微生物個体数/細菌の成長に必須の栄養成分を与える酵素から選択される酵素活性の検出および定量を含む。本発明の文脈において「必須の栄養成分」は、たとえばBrockら、微生物の生物学、プレンティス−ホール社、イングルウッドクリフス、ニュージャージー州、アメリカにおいて定義されている栄養素を示す。したがって、必須の栄養成分はそれなしでは細胞が成長できない栄養素を含み、多量栄養素および微量栄養素を含む。したがって、本発明方法は炭水化物、タンパク質、リン酸および硫酸代謝に伴う微生物/細菌酵素の検出に基づくことができる。本方法の現在好ましい実施形態は、例からわかるように、微生物のホスファターゼ酵素の検出である。特に、リン酸エステル(第一および第二アルコール、糖アルコール、環式アルコール、フェノールおよびアミンのエステル[無機リン酸を放出する]を含む)の加水分解を含むリン酸代謝を伴うアルカリ性ホスファターゼの検出が興味深い。また、この酵素はポリリン酸エステルPPiを加水分解し、PO3-4基をPPiから(および多くのヌクレオシド ジおよびトリホスフェートから、ならびにマンノース−6−ホスフェートから)グルコースへ転移し、グルコース−6−ホスフェートを形成する。例からわかるように、本発明によるアルカリ性ホスファターゼ活性の測定は微生物数のロバストな測定を与える。
【0050】
好ましい基質は、検出可能な成分として青色、緑色および赤色の生成物(蛍光または発光など)を生成する、蛍光発生基質または発色基質である。発光の検出は、関連する成分の存在についての情報を得るための非常に便利で迅速な方法である。この文脈で有用な基質は、分子プローブ:蛍光プローブおよび研究結果のハンドブック、第9版、著者:リチャード P. ホーグランド、第10章、397−448頁に開示されている。
【0051】
5−ブロモ−4−クロロ−3−インドリルホスフェート ジナトリウム塩;9h−(1,3−ジクロロ−9,9−ジメチルアクリジン−2−オン−7−イル)ホスフェート アンモニウム塩;フルオレセインジホスフェート テトラアンモニウム塩;メチルウンベリフェリル誘導体たとえば6,8−ジフルオロ−4−メチルウンベリフェリルホスフェート、4−メチルウンベリフェリルホスフェート ジクロロヘキシルアンモニウム塩三水和物、4−メチルウンベリフェリルホスフェート遊離酸;4−メチルウンベリフェリルホスフェート ジリチウム塩、4−メチルウンベリフェリルホスフェート−β−N−アセチルグルコサミニド、およびトリフルオロメチルウンベリフェリルホスフェート;4−ニトロフェニルホスフェートの塩;ならびにルソルフィンホスフェートからなる群より選択される基質を用いることが特に好ましい。
【0052】
とにかく、選択した基質にかかわらず、検出可能な成分は、最大で100ピコモル、好ましくは最大で50ピコモル、より好ましくは最大で20ピコモル、さらにより好ましくは最大で10ピコモル、最も好ましくは最大で1ピコモルの量で検出可能であるのが好ましい。特定の選択可能な成分に対する検出限界が低いほど、本発明方法の感度が高い。
【0053】
本発明によれば、単一の基質を用いることができるが、単一の測定信号値に合わせることができる複数の信号を与える検出可能な複数の成分を与える少なくとも2つの基質を用いることもできる。これは、これらの成分から得られる信号を同じ測定ウインドー内で測定でき、したがって1つの信号測定へと統合できることを意味する(単純な例は、異なる酵素による異なる基質の変換から生じるけれども、成分が同一の場合であろう)。したがって、これは、試料中の全体の汚染物質に関する情報を得るための実際的な手段であり、特にこの情報を得るために単一の基質を用いることが適していない場合にはそうである。
【0054】
区別できる複数の信号を与える検出可能な複数の成分を生成する少なくとも2つの基質を用いることもできる。このことは、汚染物質のいくつかの異なる基を個々に測定できるという利点を与える。
【0055】
本発明方法の1つの非常に魅力的な特徴は、それが生育可能な微生物の良好な測定を可能にすることである。多くの従来技術の方法では、培養を含む工程が、ある微生物を成長させず、実際にある微生物を死滅することさえあるという欠点をもつ。すべての微生物を検出可能なレベルまで成長させることができる成長条件を見出すことは単純に不可能であり、したがって培養の前後の微生物の相対的な分布は同一ではない。したがって、従来技術の測定は、試料中のすべての関連する微生物の正確な測定ではなく、与えられた一連の環境下で培養可能な微生物の測定のみを提供する。本発明はこの欠点を受けない。というのは、濃縮工程はいかなる汚染物質に有利でも不利でもなく、基質を試料培地と反応させる次の工程は培地中のいかなる微生物にも悪影響をもたない。したがって、汚染物質が生育可能な微生物である(または、いいかえれば、工程cを経た試料に関する測定による最終結果が生育可能な微生物の含有量を反映する測定である)ことが好ましい。
【0056】
生育可能な微生物の信頼性のある測定を得るには、したがって上述した基質を選択して、生育可能な微生物に特異的な酵素によって変換されるものを用いるのがよい。1つの例は、代謝的に活性な微生物において高い代謝回転をもつ、構造的に表現される酵素であろう。
【0057】
本発明の実施においては、液体ビヒクル中の基質の量が検出可能な成分の生成の速度を制限しないことが望ましい。というのは、このことは、変換する酵素の量(それゆえ汚染物質の量)のみが生成の速度を設定するという結果をもつからである。典型的には、基質/酵素の組み合わせは、検出可能な成分の生成の速度が、既知容量の培地における汚染物質の量の関数(好ましくは線形の)であることを保証するように選択されるであろう。
【0058】
多くの場合、生成した検出可能な成分の量を「汚染物質の数」に変換できることを保証することは比較的簡単であろう。たとえば(「汚染」または「汚染なし」というタイプの)定性的な結果を与えるので十分かもしれない。というのは、あるしきい値を超えたかどうかを欠点することに単に関心があるからである。いいかえれば、試料の種類およびそれがどこからきた系かについての知識が、本発明方法の単一の通過が汚染物質のカウントの正確な測定を与えることを保証するであろう。これは単純に、酵素が飽和するように工程bにおける基質の過剰を保証するという問題である。
【0059】
しかし、本方法を並行に実施して工程aでいくつかの異なる容量の培地を複数のフィルターを通過させ、少なくとも1つの容量が好適な数の汚染物質を含むようにすることが必要かもしれない。
【0060】
工程cで言及されている時間は、十分な量の検出可能な成分の形成を可能にしてその検出を可能にする時間間隔である。この時間間隔は、24時間以下が便利であるが、通常はより短く、たとえば最大で12、11、10、9、8、7、6、5、4、3、2、および1時間である。通常、時間間隔は5分以下ではなく、多くの場合に20分以下ではない。
【0061】
本発明の好ましい実施形態において、フィルターはクローズドな無菌フィルター機器の一部である。フィルター機器の無菌性は、次の測定における信号対ノイズ比に影響を与えないことを保証する。というのは、それは汚染物質自体に寄与しないからである。機器のクローズドな性質は同じ目的に役立つが、本発明方法の使用の容易性を追加する。というのは、フィルターユニットが試料の容易、実用的かつ無菌のハンドリングを促進するからである。
【0062】
好ましい機器は、使い捨てのクローズドな無菌フィルター機器、特にフィルターとフィルターハウジングを1つの不可逆的にクローズドな構造ユニットに一体化したものである。このようなフィルター機器はフィルターハウジングを損なうことなくオープンすることはできない。これらは本明細書の例で用いられているもののように商業的に入手できる。それらの小さいサイズ(典型的には、クローズドな無菌フィルター機器の最長の断面軸は10cmの長さを超えないが、長さが9または8または7または6またはさらに5cmを超えない、より小さいフィルター機器も存在する)のために、それらは現場での試料調整に非常に適している。クローズドな無菌フィルター機器は、液体のろ過のための、商業的に入手できるクローズドな/シールされたフィルターユニットから選択することができる。メンブラン材料はあらゆる入手できるメンブラン材料から選択でき、これは低タンパク質結合Durapore[登録商標](PVDF)、ナイロンメンブラン、低タンパク質結合親水性LCR(PTFE)メンブラン、セルロースアセテートなどを含む。本発明による方法の現在好ましい実施形態は、Express[登録商標]PESメンブランの使用である。
【0063】
たとえばフィルターハウジング内の液体ビヒクルに関して蛍光測定を直接実施することを可能にするウインドーを備えたフィルター機器を使用することもできる。本発明のこの実施形態は、検出可能な成分を放出する基質の変換を連続的にモニターすることに関心がある場合には、セッティングにおいて特に好ましい。下記を参照のこと。
【0064】
本発明の多くの実施形態においては、工程cにおける相互作用を、基質と汚染物質との接触を遮断することによって停止する。この遮断は、フィルター機器中の汚染物質を保持しながらフィルター機器から液体ビヒクルを排出することによって得られる。フィルターから汚染物質のない容器へ液体を単純に注ぐかまたは吸い上げることは、この結果を達成する1つの方法であるが、液体ビヒクルをフィルターの流入側から流出側の方向にフィルター機器から排出させることが好ましい。これは典型的には、フィルターの流入側に高い圧力をかけるか、またはフィルターの流出側に低い圧力をかけることによってなされる。高圧は流入側からフィルターを通して空気または既知容量の液体(たとえば適当な緩衝液または他の溶媒たとえば水)をプレスすることによって得ることができる。
【0065】
工程cにおける相互作用を他の方法によって停止することもできる。これは、たとえば基質または酵素を物理的または化学的に不活性化することによって、フィルター上で停止することができる。
【0066】
最後に、本発明によれば、相互作用を全く停止しないこともできる(基質の変換を定期的または連続的に調査するシステムに関連する)。
【0067】
検出段階
本発明は、工程cの後に、定量的または定性的に液体ビヒクル中の検出可能な成分を検出し、成分の検出を試料中の汚染物質の量または存在に相関させることを伴うさらなる工程d)を有していてもよい。
【0068】
このような検出は、当業者に一般的に知られている多くの通常の方法で実施できる。
【0069】
たとえば生育可能な微生物標的個体数/細菌の量に相関する微生物/細菌の酵素活性の検出に基づくだけでなく、本発明の方法は汚染物質の量に相関する酵素の検出を可能にするあらゆる分析手法を含む。このような手法は、例として、微生物/細菌の酵素の量を免疫学的に検出すること、および関心のある酵素活性のためのDNAおよび/またはRNA配列コーディングの検出を含む。このような手法はこの技術分野でよく知られている方法に基づくことができ、たとえば抗体(オプションで検出可能な成分でラベルされている)の使用、およびDNAまたはRNA配列に選択的にハイブリダイズするオリゴヌクレオチドプローブの使用を含む。
【0070】
測定は、免疫学的でもよいし、または検出可能な成分と特定の結合相手との間の相互作用を検出するあらゆる他の適切な方法によってもよい(すなわち、レセプター相互作用、抗体または抗体フラグメント相互作用、検出可能な成分がある種の相互作用により標準的な信号を減衰または促進する場合の減衰または促進反応などである)。しかし、工程dの検出を検出可能な成分の蛍光特性を測定することによって実施することが好ましい。これは、測定を取り扱う人にいかなる特別なスキルも必要としない、迅速、高信頼性かつ使用容易な方法である。
【0071】
上述したように、工程dにおける蛍光は、液体ビヒクルと汚染物質との接触の遮断なしに、液体ビヒクルに関して直接に測定できる。典型的には、これは、基質の変換を連続的または数回調査して、時間と検出可能な成分の量との関係を確立できる場合になされるであろう。この関係が線形であれば、所定の時点で与えられた蛍光値を、蛍光対汚染物質数の標準曲線に容易に相関できる。
【0072】
蛍光の測定はこの分野でよく知られている技術であり、励起した蛍光団からの蛍光発光よりも短い波長をもつ電磁波(典型的には紫外または可視光)により、蛍光団を励起することを必要とする。励起および蛍光波長は、各々の蛍光団に特異的であり、当業者は両方の目的に好適な波長をどのように選択するかがわかるであろう。
【0073】
一般的に、工程dにおける相関は、標準条件下(たとえば反応時間、温度など)での、汚染物質の量と検出可能な成分の量との関係を表す予め決定した標準曲線の使用を含むことが好ましい。
【0074】
本発明によれば、検出をマイクロタイターシステムで行ってもよい(検出可能な成分を他の物質たとえば抗体との相互作用により測定する場合には特に適している)。この実施形態の特別なバージョンにおいては、液体ビヒクルをフィルターの流出側からマイクロタイタープレートへ直接に通す。フィルターをマイクロタイタープレートと統合することによる効果を達成できる。
【0075】
信号の増強
汚染物質が、工程aの前または工程bに、信号を増強させる影響を受けることが有利であろう。これは、その後の検出における全体の感度を増加させるか、特定の種類の汚染物質のその後の検出を有利にするか、または特定の種類の汚染物質の検出を減少させる。
【0076】
このような信号を増強させる影響は、典型的には、酵素促進物質、選択的な温度または温度範囲、選択的なpH、選択的な塩濃度、非選択的な成長促進剤、および選択的な成長促進物質から選択される。当業者は、利用可能な様々な可能性がわかり、特定の試料、関心をもっている汚染物質、基質/酵素の組み合わせおよび検出方法に関係してこれらを選択することができるであろう。
【0077】
工程aの前に培地のインキュベーションすることによって、信号を増幅することもできる。このインキュベーションは、好ましくは、以下のことを伴う。
【0078】
−物質を誘導し、それによって検出可能な成分の検出を促進する(したがって基質の変換を促進するので一般的な促進効果)、酵素による処理、および/または
−培地を、イースト、真菌または微生物に対する選択的な物質にさらす(これはある種の汚染物質の検出を有利にする効果をもつ)、および/または
−培地を、微生物に対する非選択的な成長促進剤にさらす(全体の汚染物質の数がそれによって増加/増殖するため一般的な促進効果もある。しかし、このオプションは、試料中の生育可能な微生物の「真の」数を反映しなければならない場合には避けるべきである)、および/または
−培地を、細胞の酵素を抽出できる物質にさらす(これは工程bにおける基質の変換も促進するので第1の選択肢に匹敵する)。
【0079】
本発明のキット
本発明は、培地中の汚染物質の測定のためのキットも想定している。このキットは、
−フィルターの流入側に汚染物質を保持するのに十分小さいポアサイズをもつフィルターを有する少なくとも1つの無菌フィルター機器と、
−既知容量の培地を、フィルターを通過させる手段(たとえばシリンジ)と、
−汚染物質との相互作用時に検出可能な成分を放出する少なくとも1つの試薬(検出可能な成分の量は、試薬と相互作用した汚染物質の量と相関できる)(たとえば上で教示した基質)と、
−a)既知容量の培地を得て、それを無菌フィルター機器を通過させ、b)フィルターの流入側を試薬と接触させ、c)試薬を、フィルターの流入側にあるであろう汚染物質と相互作用させ、d)検出可能な成分を定量的に検出するための工程を記載した説明書と
を有する。
【0080】
この特定のキットを特徴づける全ての特徴は上で詳細に説明しており、上記の開示は無菌フィルター機器に関し、検出可能な成分を生成する試薬は必要な変更を加えて本発明のキットにあてはまり、その構成成分として使用できることを意味し、かつ説明書は本発明方法の実施に関連する本明細書中の教示に対応し、これらの教示は必要な変更を加えて本発明のキットに当てはまることを意味している。
【0081】
例の前提
材料と方法
使用した培地
R2A寒天(g/リットル):イースト抽出物0.5;プロテオースペプトン0.5;カゼイン加水分解物0.5;グルコース0.5;可溶性スターチ0.5;ピルビン酸ナトリウム3;リン酸水素二カリウム0.3;硫酸マグネシウム0.05;寒天−寒天12.0。
【0082】
イースト抽出物寒天(g/リットル):トリプトン(カゼイン、pancr.からのペプトン)6.0;脱水イースト抽出物3.0;寒天−寒天15.0。
【0083】
飲料水/温水培地(g/リットル):0.125イースト抽出物。
【0084】
希釈培地(g/リットル):塩化ナトリウム8.5;ペプトン(カゼイン、pancr.から)1.0.
別に記述していなければ、全ての薬品はメルクKGaA、ダルムシュタット、ドイツから入手した。
【0085】
培養可能な細菌の計数
培養可能な細菌の計数、ヘテロトロピックプレートカウント(HPC)を、飲料水中においてヨーロッパ規格DS/EN ISO6222に従って実施した。試料を、酸リンス/オートクレーブにかけたブルーキャップボトルに移し、5℃で保管してから分析した。全ての試料をサンプリングから4−5時間以内に分析した。ある容量の未処理試験試料およびペプトン希釈試験試料をペトリ皿に入れた。その後、15−20mlの溶融イースト抽出物培地を加え、穏やかに回転して注意深く混合した。その後、培地をセットした。プレートを22±2℃で68±4時間および36±2℃で44±4時間、転化およびインキュベートした。結果を、コロニー形成ユニットの数/ミリリットル水試料(cfu/ml)として示した。
【0086】
飲料水中の培養可能な細菌の計数を、標準的な操作手法(デンマーク規格DSF5984)に従って商業的な研究所(ユーロフィンズ、デンマーク)によって行った。この結果を、4つのインキュベーション温度(37、44、55および65℃)におけるcfu/ml水試料として示した。評価したcfu/mlのうち最高数をもつインキュベーションをデータ分析に用いた。
【0087】
アクリジンオレンジステインを用いる細菌の直接カウント(AODC)
全体の細菌カウントを、アクリジンオレンジ直接カウント(AODC)を用いて得た。分割試料をブラックNucleporeポリカーボネート0.2ミクロンポアサイズのフィルターにより最大150mmHgでろ過した。その後、フィルターを2容量の8ml緩衝液(クエン酸−リン酸、pH5.2)で洗った。次に、フィルターをアクリジンオレンジ(最終濃度0.02%)で3分間ステインした後、3mlの無菌化Milli−Q水で2回洗い、顕微鏡スライド上に載せた。フィルターをエピ蛍光顕微鏡を用いて分析した。各々のスライドについて、少なくとも10の顕微鏡フィールドを観察し、フィルターあたり少なくとも400個の細胞をカウントした。細菌の数を、細菌細胞の数/ml試験試料として計算した。
【0088】
4−メチルウンベリフェリルでラベルした酵素モデル基質を用いる液体試験試料における酵素活性の測定
液体試験試料を、0.22μm express 33mm無菌Millexシリンジ駆動フィルターユニット(Millpore社、ベドフォード、マサチューセッツ州、アメリカ)を通してろ過する。再使用可能なプラスチックシリンジを用い、次に、フィルターユニットを酵素基質を含む適切な緩衝液で飽和する。フィルターを固定時間インキュベートする。その後、インキュベーション混合物を、2mlのpH10.6のグリシン−NaOH緩衝液を用いて洗い流すか、または再使用可能なプラスチックシリンジを用いて空気圧をかけることによってフィルターユニットから直接に得る。分割試料をピペットで収集し、10×10mmのプラスチック蛍光キュベット(サーシュテット、ドイツ)または100マイクロリッターのキュベット(ターナーバイオシステムズ、アメリカ)へそれぞれ移す。蛍光出力を、カスタマイズしたMycoMeter蛍光分析計(ターナーバイオシステムズ、アメリカ)により、365nmの励起波長および465nmの発酵波長で測定する。酵素活性を、4−メチルウンベリフェリル誘導体の酵素分解時に放出される蛍光団である4−メチルウンベリフェロンによって生じる蛍光として示す。活性を、蛍光単位/時間単位/mlとして示す。
【0089】
例1
飲料水希釈シリーズ中における、APase活性と細菌数との間の線形性
飲料水をMycoMeter実験室の蛇口からサンプリングし、イースト抽出物を加えて125mg/lの最終濃度にした。その後、試料を室温でインキュベートした。細菌の成長を、分光光度計でOD620測定によりモニターした。細菌の成長が後期log段階(OD=0.04)に達したときに、ヘテロトロピックプレートカウント(HPC)の測定のためにサンプリングした。飲料水の分割試料を、ろ過しオートクレーブにかけた飲料水で100、250、500、750および1000倍に希釈した。その後、アルカリ性ホスファターゼ(APase)活性を、上記の材料および方法のセクションで説明した標準的な手法により、各々の希釈液について3度測定した。
【0090】
インキュベート水試料中のHPCの6回の繰り返し測定は平均で77×105cfu/mlであった。このHPC結果を、インキュベート水試料の各々の希釈液についてcfu/mlを計算するのに用いた。図1は、APase活性とHPC(飲料水希釈液から計算)との間の線形性を示している。実験1からのデータを用いて、飲料水試料中の最小の検出可能な細菌数を計算した。本発明について説明し、実験1のデータから計算した標準的な手法により、検出可能な最小の細菌数は21cfu/ml飲料水試料であった。
【0091】
試料と酵素基材との接触回数を単純に増加または減少することにより、および/またはろ過する水の量を増加または減少することにより、検出限界を需要または要求に従って増加または減少することができる。例として、1細菌/ml飲料水試料を、1リットルの飲料水試料をろ過し2.6時間インキュベートすることによって検出することができる。結果は、APase活性測定の高い感度および再現性ならびにAPase活性と広範囲の計算細菌濃度との間の強い線形関係(r=0.99、p<0.001)を示している。また、データは、試料容量を単純に増加することによって、本方法の感度を増すことができることを示している。
【0092】
例2
微量のイースト抽出物を添加した飲料水試料中のインキュベーション時間によるAPase活性の線形な増加
飲料水をMycoMeter実験室の蛇口からサンプリングし、イースト抽出物を加えて125mg/lの最終濃度にした。その後、試料を室温でインキュベートした。細菌の成長を、分光光度計でOD620測定によりモニターした。細菌の成長が後期log段階(OD=0.04)に達したときに、材料および方法のセクションで説明した標準的な手法に従ってAPase活性の測定のために水をサンプリングした。飲料水試料を、ろ過しオートクレーブにかけた飲料水で100倍に希釈した。その後、15、30、45および60分というインキュベーション時間を変えて、APase活性を3度測定した。図2はAPase活性対インキュベーション時間の散布図を示す。結果は、インキュベーション時間とAPase活性との間の線形な関係を示している。また、結果は、試料を基質分子と接触させる時間を単純に増加することによって、本方法の感度を増すことができることを示している。
【0093】
例3
飲料温水中における、APase活性と培養可能な細菌の見積もったコロニー形成ユニットとの間の相関
水試料を、1年間の期間にわたって、病院内の6つの水出口から得た。24時間以内に、水試料をAPase活性について分析した。材料および方法のセクションで説明したデンマーク規格DSF5984に従って、商業的な研究所によってHPCカウントを行った。図3はAPase活性とHPCの散布図を示す。結果は、飲料温水中におけるAPase活性とHPCとの間の正の線形な相関(r=0.93、p<0.001)を示している。
【0094】
例4
飲料水中における、APase活性と培養可能な細菌の見積もったコロニー形成ユニットとの間の相関
試料を、個人住宅、ビジネスおよび公共建物を含む飲料水系の範囲から得た。サンプリングの2−12時間以内に分析を行った。上記の材料および方法のセクションで説明した標準的な手法に従って、培養可能な細菌の計数とAPase活性の測定を行った。図4は飲料水試料中における、APase活性とHPCの散布図を示す。結果は、APase活性とHPCとの間の正の線形な相関(r=0.85、p<0.001)を示している。
【0095】
例5
飲料温水中における、APase活性とアクリジンオレンジ直接カウント(AODC)との間の相関
試料を、個人住宅、ビジネスおよび公共建物を含む飲料水系の範囲から得た。サンプリングの24時間以内に分析を行った。材料および方法のセクションで説明したように、AODCを行った。図5は飲料温水中における、APase活性とAODCの散布図を示す。結果は、APase活性とAODCとの間の強い正の線形な相関(r=0.78、p<0.001)を示している。
【0096】
例6
N−アセチルヘキソサミニダーゼ活性と真菌胞子バイオマスとの間の線形性
真菌Penicillium communeを用いた寒天培養(麦芽抽出物寒天)により、真菌胞子の懸濁液を調製した。
【0097】
6mlの胞子懸濁液を予め秤量したナイロンメンブランフィルター(0.45μm)を通してろ過し60℃で24時間乾燥することによって、懸濁液の胞子バイオマスを測定した。それぞれ50μl、100μl、250μlおよび500μlの胞子懸濁液を移すことにより、胞子懸濁液の希釈シリーズを二重に調製した。オートクレーブにかけた希釈水を各々の培養チューブに添加することによって、胞子懸濁液を希釈して全体で3mlにした。
【0098】
以下のように変更して、材料および方法のセクションで説明したように、胞子懸濁液のN−アセチルヘキソサミニダーゼ酵素活性を分析した。フィルターユニットを、酵素基質4−メチルウンベリフェリルホスフェート−β−N−アセチルグルコサミニドを含む適切な緩衝液で飽和した。インキュベーション後に、再使用可能なプラスチックシリンジを用いて圧力をかけることによって、インキュベーション混合物をフィルターユニットから直接に得た。その後、100μlの分割試料を、2mlの適切な緩衝液(pH10.6)を含むプラスチックキュベットに移すことによってアルカリ化した。
【0099】
胞子バイオマスとN−アセチルヘキソサミニダーゼ活性との間の強い正の線形な相関(r=0.9975、p<0.001)が、図6の散布図に示されている。
【図面の簡単な説明】
【0100】
【図1】計算された飲料水希釈シリーズ中のヘテロトロピックプレートカウント(HPC)[コロニー形成単位/ml水試料として表示]と、APase基質4−メチルウンベリフェリルホスフェートの酵素分解によって生成した蛍光によって決定したアルカリ性ホスファターゼ活性(APase活性)[蛍光単位/分/mlとして表示]との間の線形関係を示すグラフ。
【図2】インキュベーション時間と、APase基質4−メチルウンベリフェリルホスフェートの酵素分解によって生成した蛍光によって決定したAPase活性[蛍光単位/分/mlとして表示]との間の線形関係を示すグラフ。
【図3】APase基質4−メチルウンベリフェリルホスフェートの酵素分解によって生成した蛍光によって決定した飲用温水中のAPase活性[それぞれlog10(蛍光単位/時/100ml)およびlog10(蛍光単位/30分/250ml)として表示]と、HPC[log10(cfu/ml水試料)として表示]との間の、かなり著しい正の線形相関を示すグラフ。
【図4】APase基質4−メチルウンベリフェリルホスフェートの酵素分解によって生成した蛍光によって決定した飲用温水中のAPase活性[それぞれlog10(蛍光単位/時/100ml)およびlog10(蛍光単位/30分/250ml)として表示]と、HPC[log10(cfu/ml水試料)として表示]との間の、かなり著しい正の線形相関を示すグラフ。
【図5】APase基質4−メチルウンベリフェリルホスフェートの酵素分解によって生成した蛍光によって決定した飲用温水中のAPase活性[log10(蛍光単位/時/100ml)として表示]と、アクリジンオレンジ直接カウント(AODC)[log10(菌体/ml)として表示]との間の、かなり著しい線形相関を示すグラフ。
【図6】真菌Penicillium communeの胞子バイオマスと、N−アセチルヘキソサミニダーゼ活性(基質化4−メチルウンベリフェリル−β−N−アセチルグルコサミニドの酵素分解によって測定)との間の、かなり著しい線形相関を示すグラフ。
【特許請求の範囲】
【請求項1】
汚染物質を含むことが疑わしい培地のための試料調製方法であって、a)既知容量の前記培地を、フィルターを通して流入側から流出側へ通過させることによって、フィルターの流入側で汚染物質を濃縮し、b)フィルターの流入側を、汚染物質との相互作用により各々検出可能な成分を生じる少なくとも1つの基質を含む液体ビヒクルに接触させ、c)フィルターの流入側で、検出可能な成分を液体ビヒクル中で検出させるのに十分なある時間の間、基質を汚染物質と相互作用させることを含む方法。
【請求項2】
工程の前に、培地を、汚染物質を保持しないがより大きな粒子を保持するプレフィルターに通す請求項1に記載の方法。
【請求項3】
前記汚染物質は、細菌;真菌類、たとえば糸状菌およびイースト;藻類;原生動物;細菌からの胞子;真菌胞子;ならびに花粉およびその断片からなる群より選択される請求項1または2に記載の方法。
【請求項4】
前記培地は液体培地である請求項1ないし3のいずれか1項に記載の方法。
【請求項5】
前記液体培地は、環境水、飲料水、温水、工業水、工程水、その場での洗浄水、固体材料の液体抽出物、懸濁化または可溶化表面の試料、ならびに液体工業製品たとえば化粧品、医薬品、および食品からなる群より選択される請求項4に記載の方法。
【請求項6】
前記液体培地の粘度を、工程aの前に下げる請求項4または5に記載の方法。
【請求項7】
前記粘度を、希釈または化学薬品たとえば溶解促進剤もしくは洗剤による処理によって下げる請求項6に記載の方法。
【請求項8】
前記培地は気体培地である請求項1ないし3のいずれか1項に記載の方法。
【請求項9】
前記気体培地は、空気、たとえば無菌施設からの空気、層流空気流機器もしくは環境の空気である請求項8に記載の方法。
【請求項10】
前記フィルターは、培地中の実質的に全ての汚染物質を保持するのに十分小さいポアサイズを有する請求項1ないし9のいずれか1項に記載の方法。
【請求項11】
前記フィルターは、検出可能な成分を、フィルターを通過させるのに十分大きいポアサイズを有する請求項10に記載の方法。
【請求項12】
前記ポアサイズは最大で20μmである請求項11に記載の方法。
【請求項13】
前記ポアサイズは少なくとも0.1μmである請求項11または12に記載の方法。
【請求項14】
少なくとも1つの基質は、汚染物質に特異的な酵素によって開裂することにより、検出可能な成分を生成する請求項1ないし13のいずれか1項に記載の方法。
【請求項15】
前記酵素は、カルボヒドラーゼ、プロテアーゼ、リパーゼ、エステラーゼ、アミダーゼ、スルファターゼ、ヌクレアーゼおよびフォスファターゼたとえばアルカリフォスファターゼからなる群より選択される請求項14に記載の方法。
【請求項16】
前記酵素は、微生物によって構造的に表現される請求項14または15に記載の方法。
【請求項17】
少なくとも1つの基質は、検出可能な成分として青色、緑色および赤色蛍光生成物を生成する蛍光発生基質または発色基質である請求項14ないし16のいずれか1項に記載の方法。
【請求項18】
少なくとも1つの基質は、5−ブロモ−4−クロロ−3−インドリルホスフェート ジナトリウム塩;9h−(1,3−ジクロロ−9,9−ジメチルアクリジン−2−オン−7−イル)ホスフェート アンモニウム塩;フルオレセインジホスフェート テトラアンモニウム塩;メチルウンベリフェリル誘導体たとえば6,8−ジフルオロ−4−メチルウンベリフェリルホスフェート、4−メチルウンベリフェリルホスフェート ジクロロヘキシルアンモニウム塩三水和物、4−メチルウンベリフェリルホスフェート遊離酸;4−メチルウンベリフェリルホスフェート ジリチウム塩、4−メチルウンベリフェリルホスフェート−β−N−アセチルグルコサミニド、およびトリフルオロメチルウンベリフェリルホスフェート;4−ニトロフェニルホスフェートの塩;ならびにルソルフィンホスフェートからなる群より選択される請求項14ないし17のいずれか1項に記載の方法。
【請求項19】
前記検出可能な成分は、最大で100ピコモル、好ましくは最大で50ピコモル、より好ましくは最大で20ピコモル、さらにより好ましくは最大で10ピコモル、最も好ましくは最大で1ピコモルの量で検出可能である請求項14ないし18のいずれか1項に記載の方法。
【請求項20】
合わせて1つの単一測定信号値になる複数の信号を与える検出可能な複数の成分を生成する少なくとも2つの基質を用いる請求項1ないし19のいずれか1項に記載の方法。
【請求項21】
区別できる複数の信号を与える検出可能な複数の成分を生成する少なくとも2つの基質を用いる請求項1ないし20のいずれか1項に記載の方法。
【請求項22】
前記汚染物質が生育可能な微生物である請求項1ないし21のいずれか1項に記載の方法。
【請求項23】
前記液体ビヒクル中の基質の量は、検出可能な成分の生成速度を制限しない請求項1ないし22のいずれか1項に記載の方法。
【請求項24】
検出可能な成分の生成速度は、既知容量の基質中の汚染物質の量の関数である請求項23に記載の方法。
【請求項25】
前記関数は線形である請求項24に記載の方法。
【請求項26】
いくつかの異なる既知容量の基質を、各々、工程aにおいてフィルターを通過させ、少なくとも1つの容量が好適な数の汚染物質を含むようにする請求項1ないし25のいずれか1項に記載の方法。
【請求項27】
前記フィルターは、クローズドな無菌フィルター機器の一部である請求項1ないし26のいずれか1項に記載の方法。
【請求項28】
前記クローズドな無菌フィルター機器は、使い捨てできる請求項27に記載の方法。
【請求項29】
前記クローズドな無菌フィルター機器は、フィルターおよびフィルターハウジングを1つの不可逆的にクロ−ズドな構造ユニットに一体化する請求項27または28に記載の方法。
【請求項30】
前記クローズドな無菌フィルター機器の最長の断面軸は、10cmの長さを超えない請求項27ないし29のいずれか1項に記載の方法。
【請求項31】
工程cにおける相互作用を、基質と汚染物質との接触を遮断することによって停止する請求項1ないし30のいずれか1項に記載の方法。
【請求項32】
前記遮断を、前記フィルター機器から前記液体ビヒクルを排出させ、一方で汚染物質をフィルター機器に保持させることによって得る請求項31に記載の方法。
【請求項33】
前記液体ビヒクルを、フィルターの流入側から流出側の方向に、前記フィルター機器から排出させる請求項32に記載の方法。
【請求項34】
排出を、フィルターの流入側に高い圧力をかけるか、またはフィルターの流出側に低い圧力をかけることによって得る請求項33に記載の方法。
【請求項35】
工程cにおける相互作用をフィルター上で停止するか、または相互作用を停止しない請求項1ないし30のいずれか1項に記載の方法。
【請求項36】
工程cの後に、定量的または定性的に前記液体ビヒクル中の検出可能な成分を検出し、成分の検出を試料中の汚染物質の量または存在に相関させることを伴う工程d)を有する請求項1ないし35のいずれか1項に記載の方法。
【請求項37】
工程dにおける検出を、検出可能な成分の蛍光特性を測定することによって行う請求項36に記載の方法。
【請求項38】
工程dにおける蛍光を、液体ビヒクルで直接測定し、液体ビヒクルと汚染物質との接触を遮断しない請求項37に記載の方法。
【請求項39】
工程dにおける相関は、標準状態での汚染物質の量と検出可能な成分の量との関係を表す、予め決定された標準曲線の使用を含む請求項36ないし38のいずれか1項に記載の方法。
【請求項40】
検出をマイクロタイターシステムで行う請求項36ないし39のいずれか1項に記載の方法。
【請求項41】
汚染物質は、工程aの前または工程bにおいて、信号を増強させる影響を受ける請求項1ないし40のいずれか1項に記載の方法。
【請求項42】
信号を増強させる影響は、その後の検出における全体の感度を増加させるか、特定の種類の汚染物質のその後の検出を有利にするか、特定の種類の汚染物質の検出を減少させる請求項41に記載の方法。
【請求項43】
信号を増強させる影響は、酵素促進物質、選択的な温度または温度範囲、選択的なpH、選択的な塩濃度、非選択的な成長促進剤、および選択的な成長促進物質から選択される請求項41に記載の方法。
【請求項44】
工程aの前に培地のインキュベーションを行う請求項1ないし43のいずれか1項に記載の方法。
【請求項45】
前記インキュベーションは、
−物質を誘導し、それによって検出可能な成分の検出を促進する、酵素による処理、および/または
−培地を、イースト、真菌または微生物に対する選択的な物質にさらす、および/または
−培地を、微生物に対する非選択的な成長促進剤にさらす、および/または
−培地を、細胞の酵素を抽出できる物質にさらす
ことを伴う請求項44に記載の方法。
【請求項46】
培地中の汚染物質の測定のためのキットであって、
−フィルターの流入側に汚染物質を保持するのに十分小さいポアサイズをもつフィルターを有する少なくとも1つの無菌フィルター機器と、
−既知容量の培地を、フィルターを通過させる手段と、
−汚染物質との相互作用時に検出可能な成分を放出する少なくとも1つの試薬(検出可能な成分の量は、試薬と相互作用した汚染物質の量と相関できる)と、
−a)既知容量の培地を得て、それを無菌フィルター機器を通過させ、b)フィルターの流入側を試薬と接触させ、c)試薬を、フィルターの流入側にあるであろう汚染物質と相互作用させ、d)検出可能な成分を定量的に検出するための工程を記載した説明書と
を有するキット。
【請求項47】
機器に保持された汚染物質と、汚染物質に接触したときに検出可能な成分を放出する基質との間の反応のための反応容器としての、クローズドな無菌フィルター機器の使用方法。
【請求項1】
汚染物質を含むことが疑わしい培地のための試料調製方法であって、a)既知容量の前記培地を、フィルターを通して流入側から流出側へ通過させることによって、フィルターの流入側で汚染物質を濃縮し、b)フィルターの流入側を、汚染物質との相互作用により各々検出可能な成分を生じる少なくとも1つの基質を含む液体ビヒクルに接触させ、c)フィルターの流入側で、検出可能な成分を液体ビヒクル中で検出させるのに十分なある時間の間、基質を汚染物質と相互作用させることを含む方法。
【請求項2】
工程の前に、培地を、汚染物質を保持しないがより大きな粒子を保持するプレフィルターに通す請求項1に記載の方法。
【請求項3】
前記汚染物質は、細菌;真菌類、たとえば糸状菌およびイースト;藻類;原生動物;細菌からの胞子;真菌胞子;ならびに花粉およびその断片からなる群より選択される請求項1または2に記載の方法。
【請求項4】
前記培地は液体培地である請求項1ないし3のいずれか1項に記載の方法。
【請求項5】
前記液体培地は、環境水、飲料水、温水、工業水、工程水、その場での洗浄水、固体材料の液体抽出物、懸濁化または可溶化表面の試料、ならびに液体工業製品たとえば化粧品、医薬品、および食品からなる群より選択される請求項4に記載の方法。
【請求項6】
前記液体培地の粘度を、工程aの前に下げる請求項4または5に記載の方法。
【請求項7】
前記粘度を、希釈または化学薬品たとえば溶解促進剤もしくは洗剤による処理によって下げる請求項6に記載の方法。
【請求項8】
前記培地は気体培地である請求項1ないし3のいずれか1項に記載の方法。
【請求項9】
前記気体培地は、空気、たとえば無菌施設からの空気、層流空気流機器もしくは環境の空気である請求項8に記載の方法。
【請求項10】
前記フィルターは、培地中の実質的に全ての汚染物質を保持するのに十分小さいポアサイズを有する請求項1ないし9のいずれか1項に記載の方法。
【請求項11】
前記フィルターは、検出可能な成分を、フィルターを通過させるのに十分大きいポアサイズを有する請求項10に記載の方法。
【請求項12】
前記ポアサイズは最大で20μmである請求項11に記載の方法。
【請求項13】
前記ポアサイズは少なくとも0.1μmである請求項11または12に記載の方法。
【請求項14】
少なくとも1つの基質は、汚染物質に特異的な酵素によって開裂することにより、検出可能な成分を生成する請求項1ないし13のいずれか1項に記載の方法。
【請求項15】
前記酵素は、カルボヒドラーゼ、プロテアーゼ、リパーゼ、エステラーゼ、アミダーゼ、スルファターゼ、ヌクレアーゼおよびフォスファターゼたとえばアルカリフォスファターゼからなる群より選択される請求項14に記載の方法。
【請求項16】
前記酵素は、微生物によって構造的に表現される請求項14または15に記載の方法。
【請求項17】
少なくとも1つの基質は、検出可能な成分として青色、緑色および赤色蛍光生成物を生成する蛍光発生基質または発色基質である請求項14ないし16のいずれか1項に記載の方法。
【請求項18】
少なくとも1つの基質は、5−ブロモ−4−クロロ−3−インドリルホスフェート ジナトリウム塩;9h−(1,3−ジクロロ−9,9−ジメチルアクリジン−2−オン−7−イル)ホスフェート アンモニウム塩;フルオレセインジホスフェート テトラアンモニウム塩;メチルウンベリフェリル誘導体たとえば6,8−ジフルオロ−4−メチルウンベリフェリルホスフェート、4−メチルウンベリフェリルホスフェート ジクロロヘキシルアンモニウム塩三水和物、4−メチルウンベリフェリルホスフェート遊離酸;4−メチルウンベリフェリルホスフェート ジリチウム塩、4−メチルウンベリフェリルホスフェート−β−N−アセチルグルコサミニド、およびトリフルオロメチルウンベリフェリルホスフェート;4−ニトロフェニルホスフェートの塩;ならびにルソルフィンホスフェートからなる群より選択される請求項14ないし17のいずれか1項に記載の方法。
【請求項19】
前記検出可能な成分は、最大で100ピコモル、好ましくは最大で50ピコモル、より好ましくは最大で20ピコモル、さらにより好ましくは最大で10ピコモル、最も好ましくは最大で1ピコモルの量で検出可能である請求項14ないし18のいずれか1項に記載の方法。
【請求項20】
合わせて1つの単一測定信号値になる複数の信号を与える検出可能な複数の成分を生成する少なくとも2つの基質を用いる請求項1ないし19のいずれか1項に記載の方法。
【請求項21】
区別できる複数の信号を与える検出可能な複数の成分を生成する少なくとも2つの基質を用いる請求項1ないし20のいずれか1項に記載の方法。
【請求項22】
前記汚染物質が生育可能な微生物である請求項1ないし21のいずれか1項に記載の方法。
【請求項23】
前記液体ビヒクル中の基質の量は、検出可能な成分の生成速度を制限しない請求項1ないし22のいずれか1項に記載の方法。
【請求項24】
検出可能な成分の生成速度は、既知容量の基質中の汚染物質の量の関数である請求項23に記載の方法。
【請求項25】
前記関数は線形である請求項24に記載の方法。
【請求項26】
いくつかの異なる既知容量の基質を、各々、工程aにおいてフィルターを通過させ、少なくとも1つの容量が好適な数の汚染物質を含むようにする請求項1ないし25のいずれか1項に記載の方法。
【請求項27】
前記フィルターは、クローズドな無菌フィルター機器の一部である請求項1ないし26のいずれか1項に記載の方法。
【請求項28】
前記クローズドな無菌フィルター機器は、使い捨てできる請求項27に記載の方法。
【請求項29】
前記クローズドな無菌フィルター機器は、フィルターおよびフィルターハウジングを1つの不可逆的にクロ−ズドな構造ユニットに一体化する請求項27または28に記載の方法。
【請求項30】
前記クローズドな無菌フィルター機器の最長の断面軸は、10cmの長さを超えない請求項27ないし29のいずれか1項に記載の方法。
【請求項31】
工程cにおける相互作用を、基質と汚染物質との接触を遮断することによって停止する請求項1ないし30のいずれか1項に記載の方法。
【請求項32】
前記遮断を、前記フィルター機器から前記液体ビヒクルを排出させ、一方で汚染物質をフィルター機器に保持させることによって得る請求項31に記載の方法。
【請求項33】
前記液体ビヒクルを、フィルターの流入側から流出側の方向に、前記フィルター機器から排出させる請求項32に記載の方法。
【請求項34】
排出を、フィルターの流入側に高い圧力をかけるか、またはフィルターの流出側に低い圧力をかけることによって得る請求項33に記載の方法。
【請求項35】
工程cにおける相互作用をフィルター上で停止するか、または相互作用を停止しない請求項1ないし30のいずれか1項に記載の方法。
【請求項36】
工程cの後に、定量的または定性的に前記液体ビヒクル中の検出可能な成分を検出し、成分の検出を試料中の汚染物質の量または存在に相関させることを伴う工程d)を有する請求項1ないし35のいずれか1項に記載の方法。
【請求項37】
工程dにおける検出を、検出可能な成分の蛍光特性を測定することによって行う請求項36に記載の方法。
【請求項38】
工程dにおける蛍光を、液体ビヒクルで直接測定し、液体ビヒクルと汚染物質との接触を遮断しない請求項37に記載の方法。
【請求項39】
工程dにおける相関は、標準状態での汚染物質の量と検出可能な成分の量との関係を表す、予め決定された標準曲線の使用を含む請求項36ないし38のいずれか1項に記載の方法。
【請求項40】
検出をマイクロタイターシステムで行う請求項36ないし39のいずれか1項に記載の方法。
【請求項41】
汚染物質は、工程aの前または工程bにおいて、信号を増強させる影響を受ける請求項1ないし40のいずれか1項に記載の方法。
【請求項42】
信号を増強させる影響は、その後の検出における全体の感度を増加させるか、特定の種類の汚染物質のその後の検出を有利にするか、特定の種類の汚染物質の検出を減少させる請求項41に記載の方法。
【請求項43】
信号を増強させる影響は、酵素促進物質、選択的な温度または温度範囲、選択的なpH、選択的な塩濃度、非選択的な成長促進剤、および選択的な成長促進物質から選択される請求項41に記載の方法。
【請求項44】
工程aの前に培地のインキュベーションを行う請求項1ないし43のいずれか1項に記載の方法。
【請求項45】
前記インキュベーションは、
−物質を誘導し、それによって検出可能な成分の検出を促進する、酵素による処理、および/または
−培地を、イースト、真菌または微生物に対する選択的な物質にさらす、および/または
−培地を、微生物に対する非選択的な成長促進剤にさらす、および/または
−培地を、細胞の酵素を抽出できる物質にさらす
ことを伴う請求項44に記載の方法。
【請求項46】
培地中の汚染物質の測定のためのキットであって、
−フィルターの流入側に汚染物質を保持するのに十分小さいポアサイズをもつフィルターを有する少なくとも1つの無菌フィルター機器と、
−既知容量の培地を、フィルターを通過させる手段と、
−汚染物質との相互作用時に検出可能な成分を放出する少なくとも1つの試薬(検出可能な成分の量は、試薬と相互作用した汚染物質の量と相関できる)と、
−a)既知容量の培地を得て、それを無菌フィルター機器を通過させ、b)フィルターの流入側を試薬と接触させ、c)試薬を、フィルターの流入側にあるであろう汚染物質と相互作用させ、d)検出可能な成分を定量的に検出するための工程を記載した説明書と
を有するキット。
【請求項47】
機器に保持された汚染物質と、汚染物質に接触したときに検出可能な成分を放出する基質との間の反応のための反応容器としての、クローズドな無菌フィルター機器の使用方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】




【図2】


【図3】


【図4】


【図5】


【図6】


【公表番号】特表2007−525227(P2007−525227A)
【公表日】平成19年9月6日(2007.9.6)
【国際特許分類】
【出願番号】特願2007−501118(P2007−501118)
【出願日】平成17年2月28日(2005.2.28)
【国際出願番号】PCT/DK2005/000137
【国際公開番号】WO2005/083109
【国際公開日】平成17年9月9日(2005.9.9)
【出願人】(506294266)
【Fターム(参考)】
【公表日】平成19年9月6日(2007.9.6)
【国際特許分類】
【出願日】平成17年2月28日(2005.2.28)
【国際出願番号】PCT/DK2005/000137
【国際公開番号】WO2005/083109
【国際公開日】平成17年9月9日(2005.9.9)
【出願人】(506294266)

【Fターム(参考)】
[ Back to top ]

