油中水型乳化皮膚外用剤
【課題】ウフェナマート等の極性を有する液状薬剤を含む系であって、乳化安定性、薬剤安定性に優れ、かつ、閉塞性がありながら、べたつかず、使用性に優れる油中水型乳化皮膚外用剤を提供する。
【解決手段】以下の(a)〜(f)成分を含有する油中水型乳化皮膚外用剤:(a)液状油分を10〜20質量%、(b)ウフェナマート、ジフェンヒドラミン、クロタミトンの中の1種または2種以上の液状薬剤を1〜10質量%、(c)POE(4〜6)硬化ヒマシ油、(d)ソルビタン脂肪酸エステル、(e)ポリエーテル変性シリコーン、および(f)水。ただし(c)成分:(d)成分:(e)成分=30〜80:10〜45:5〜55(質量比)で、かつ(c)〜(e)成分の合計配合量が0.8〜8.0質量%である。さらに(g)デキストリン脂肪酸エステル、(h)平均質量分子量4,000〜20,000のポリエチレングリコールを配合してもよい。
【解決手段】以下の(a)〜(f)成分を含有する油中水型乳化皮膚外用剤:(a)液状油分を10〜20質量%、(b)ウフェナマート、ジフェンヒドラミン、クロタミトンの中の1種または2種以上の液状薬剤を1〜10質量%、(c)POE(4〜6)硬化ヒマシ油、(d)ソルビタン脂肪酸エステル、(e)ポリエーテル変性シリコーン、および(f)水。ただし(c)成分:(d)成分:(e)成分=30〜80:10〜45:5〜55(質量比)で、かつ(c)〜(e)成分の合計配合量が0.8〜8.0質量%である。さらに(g)デキストリン脂肪酸エステル、(h)平均質量分子量4,000〜20,000のポリエチレングリコールを配合してもよい。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は油中水型乳化皮膚外用剤に関する。さらに詳しくは、ウフェナマート等の液状薬剤を含む系であって、乳化安定性、薬剤安定性に優れ、かつ、皮膚表面からの過度の水分揮散を抑える皮膚閉塞性がありながら、べたつかず、使用性に優れる油中水型乳化皮膚外用剤に関する。
【背景技術】
【0002】
従来、皮膚閉塞性の高い皮膚外用剤としてワセリンを用いた非水系のワセリン軟膏が知られている。しかしワセリン軟膏は伸びが悪く、べたつくといった欠点がある。他方、水中油型乳化系のクリームはべたつき感はないものの閉塞性に劣る。
【0003】
そこで水中油型乳化系に比べ皮膚閉塞性が高く、しかもワセリン軟膏のようなべたつき感がない基剤として油中水型乳化系の基剤が考えられるが、従来、油中水型乳化系の医薬用クリームは製剤化が難しく、医薬用製剤で使用可能な界面活性剤(例えば、親油性界面活性剤であるソルビタンセスキオレート等)を用いた場合、硬度が出ず、製剤の安定性が担保できないという問題があった。また医薬用に用いる原料に制約があり、安定な処方の設計が難しかった。一般に、乳化基剤に、極性を有する液状薬剤(例えば、非ステロイド系抗炎症剤として知られているウフェナマート、抗ヒスタミン薬として知られるジフェンヒドラミン、鎮痒剤として知られるクロタミトン等)を配合すると、製剤安定性を損ねるが、特に油中水型乳化系の基剤にこれらの液状薬剤を配合する場合には顕著である。そのため、医療用、一般薬用とも油中水型乳化製剤はほとんど存在せず、しかも適度な閉塞性が期待される油中水型乳化組成物に極性を有する液状薬剤を配合することは極めて困難である。
【0004】
このような液状薬剤を安定に配合するために、例えば特開2001−181166号公報(特許文献1)では、IOB値が0.1〜2の油溶性薬剤(ウフェナマート等)と、分子中に炭素数8以上の炭素鎖を含む疎水基を2個以上有する親油性乳化剤(例えば、ポリグリセリン脂肪酸エステル、ソルビタン脂肪酸エステル、ポリオキシエチレン(以下、「POE」とも記す)ソルビット脂肪酸エステル、POE硬化ヒマシ油など)を含有する油中水型乳化皮膚外用剤組成物が記載されている。しかし該特許文献1では、保存安定性について1ヵ月間(25℃、40℃)の乳化安定性評価を行っているに過ぎず、後述する本発明のように高温(50℃)で4ヵ月間という長期間において保存安定性を維持し得るかどうかについてまでは検討されていない。また高温下で保存後の製剤中の薬剤残存率等についての検討もされていない。
【0005】
特開2006−335735号公報(特許文献2)には、油分とHLB値8以下のノニオン界面活性剤と電解質と水溶性多価アルコールを含む油中水型乳化組成物が記載され(請求項1)、ここにさらに薬効成分を含有し得ることが記載されている(請求項8、[0018]等)。しかし特許文献2には、従来より油中水型乳化系には安定的に配合することが難しいとされているウフェナマート等の液状薬剤を配合した具体的な組成について記載がなく、このような液状薬剤を系中に長期間安定に配合することを目的とするといったような記載・示唆もない。またポリエーテル変性シリコーンの配合についての記載・示唆もない。
【0006】
特開2008−1237306号公報(特許文献3)には、シリコーン系界面活性剤、油剤、油ゲル化剤、水溶性高分子、および水61〜98質量%を含有する油中水型乳化化粧料が、保湿効果があり、べたつきがなく、安定性(均一、分離等)があるということが記載され、ここにさらに非イオン性界面活性剤を配合し得ることが記載されている(特許請求の範囲の欄)。そして上記シリコーン系界面活性剤としてポリエーテル変性シリコーンが例示され([0009])、上記油ゲル化剤としてパルミチン酸脂肪エステル等が記載され([0027])、上記非イオン性界面活性剤としてPOE硬化ヒマシ油、ショ糖脂肪酸エステル等が記載され、これら非イオン性界面活性剤の好適配合量が0.05〜5質量%であることが記載されている([0049]〜[0050])。しかし特許文献3は化粧料に関するものであり、従来より油中水型乳化系には安定的に配合することが難しいとされているウフェナマート等の液状薬剤を配合した具体的な組成について記載がなく、このような高極性液状薬剤を系中に長期間安定に配合することを目的とするといったような記載・示唆もない。また特許文献3の実施例では水溶性高分子としてカチオン性架橋共重合体を用いているが、かかる化合物は本発明では用いない。
【0007】
特公平3−56776号公報(特許文献4)には、特定の非イオン界面活性剤と、液体油と、分子量2000〜300000のポリエチレングリコールと、水をそれぞれ所定量含有する油中水型乳化組成物が記載され、任意添加成分として薬効剤が「一行記載」されている(第3頁第6欄12行)。しかし特許文献4には、薬効剤を配合した具体的組成の記載はなく、従来より油中水型乳化系に安定配合するのが難しいとされていたウフェナマート等の液状薬剤を、安定に配合することを目的とするようなことの記載・示唆は一切ない。
【先行技術文献】
【特許文献】
【0008】
【特許文献1】特開2001−181166号公報
【特許文献2】特開2006−335735号公報
【特許文献3】特開2008−1237306号公報
【特許文献4】特公平3−56776号公報
【発明の概要】
【発明が解決しようとする課題】
【0009】
本発明は上記従来の事情に鑑みてなされたもので、ウフェナマート等の極性を有する液状薬剤を含む系であって、乳化安定性、薬剤安定性に優れ、かつ、閉塞性がありながら、べたつかず、使用性に優れる油中水型乳化皮膚外用剤を提供することを目的とする。
【課題を解決するための手段】
【0010】
上記課題を解決するために本発明は、以下の(a)〜(f)成分を含有する油中水型乳化皮膚外用剤を提供する。
(a)液状油分を10〜20質量%、
(b)ウフェナマート、ジフェンヒドラミン、およびクロタミトンから選ばれる1種または2種以上の液状薬剤を1〜10質量%、
(c)ポリオキシエチレン(4〜6モル付加)硬化ヒマシ油、
(d)ソルビタン脂肪酸エステル、
(e)ポリエーテル変性シリコーン、および
(f)水。
【0011】
ただし上記において、(c)成分:(d)成分:(e)成分=30〜80:10〜45:5〜55(質量比)であり、かつ(c)成分、(d)成分および(e)成分の合計配合量が0.8〜8.0質量%である。
【0012】
また本発明は、(e)成分が下記式(I)に示す化合物である、上記油中水型乳化皮膚外用剤を提供する。
【0013】

【0014】
(式中、R1は水素原子または炭素原子数1〜6のアルキル基を表し;rは50〜60の数を表し;uは2〜5の数を表し;aは8〜10、bは0〜35の数を表す。)
【0015】
また本発明は、(b)成分がウフェナマートとジフェンヒドラミンからなる液状薬剤である、上記油中水型乳化皮膚外用剤を提供する。
【0016】
また本発明は、さらに(g)デキストリン脂肪酸エステルを含有する、上記油中水型乳化皮膚外用剤を提供する。
【0017】
また本発明は、さらに(h)平均質量分子量が4,000〜20,000のポリエチレングリコールを含有する、上記油中水型乳化皮膚外用剤を提供する。
【発明の効果】
【0018】
本発明により、ウフェナマート等の極性を有する液状薬剤を含む系であって、乳化安定性、薬剤安定性に優れ、かつ、閉塞性がありながら、べたつかず、使用性に優れる油中水型乳化皮膚外用剤が提供される。
【図面の簡単な説明】
【0019】
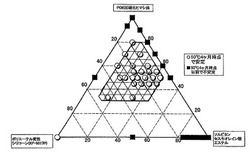
【図1】本発明におけるPOE(5)硬化ヒマシ油、ソルビタンセスキオレイン酸エステル、およびポリエーテル変性シリコーン(「KF−6017P」)の組成(質量%)と乳化安定性との関係を示す三角図である。
【発明を実施するための形態】
【0020】
以下、本発明について詳述する。
【0021】
本発明における(a)成分としての液状油分は、常温(25℃)で揮発しない流動油分をいう。具体的には、例えば、流動パラフィン、スクワラン、オレフィンオリゴマー、軽質イソパラフィン(=軽質流動パラフィン)などの炭化水素油;2−エチルヘキサン酸トリグリセリド、2−エチルヘキサン酸セチル、2−エチルヘキサン酸ペンタエリトリトール、2−エチルヘキサン酸トリメチロールプロパン、パルミチン酸2−エチルヘキシル、イソノナン酸イソセチル、ミリスチン酸イソプロピル、2−エチルヘキサン酸セチル、セバシン酸ジエチル、アジピン酸ジエチルなどのエステル油;ホホバ油、オリーブ油、マカデミアナッツ油、綿実油、茶実油、サフラワー油、米糠油などの天然系植物油;デカメチルペンタシクロシロキサン、オクタメチルテトラシクロシロキサン、ジメチルポリシロキサン、メチルフェニルポリシロキサンなどのシリコーン油、などが挙げられるが、これら例示に限定されるものでないことはもちろんである。本発明では(b)成分との相溶性、使用性、外用剤の外観等の点から炭化水素油、エステル油、シリコーン油が好ましく用いられる。(a)成分は1種または2種以上を用いることができる。
【0022】
(a)成分の配合量は、本発明皮膚外用剤全量中、10〜20質量%である。10質量%未満では(b)成分との相溶性が悪く、油相成分全体としての極性が相対的に高まり乳化性上も好ましくなく、また、内相比が高くなる結果、外用剤の硬度が高くなり、使用性、外観とも好ましくない。一方、20質量%を超えて配合すると内相比が低下し硬度が低くなり、安定性上好ましくない。
【0023】
(b)成分は極性を有する油溶性の液状薬剤成分で、本発明ではウフェナマート、ジフェンヒドラミン、およびクロタミトンの中から選ばれる1種または2種以上を用いる。ウフェナマートは非ステロイド系抗炎症剤として知られ、化学式C18H18F3NO2で示され、化学名はブチルO−[〔3−(トリフルオロメチル)フェニル〕アミノ]−ベンゾエートである。ジフェンヒドラミンは抗ヒスタミン薬として知られ、化学式C17H21NOで示される。クロタミトンは鎮痒剤として知られ、化学式C13H17NOで示される。
【0024】
(b)成分の配合量は、本発明皮膚外用剤全量中、1〜10質量%であり、好ましくは1〜6質量%である。1質量%未満では(b)成分の薬効を十分発揮することができず、一方、10質量%を超えて配合すると資源の有効利用の観点や製剤安定性上もやや不安定となり、好ましくない。
【0025】
本発明では非イオン界面活性剤として、下記の(c)成分、(d)成分、および(e)成分を組み合せて配合する。
【0026】
(c)成分はPOE(4〜6)硬化ヒマシ油である。POE付加モル数が4未満では親油性が高過ぎ、また、製品も実質上上市されておらず、一方、POE付加モル数が6を超えるもの(上市品として「ニッコールHCO−10」(日光ケミカルズ(株)製)などがある)では乳化が不安定となり、好ましくない。(c)成分は、例えば「ニッコールHCO−5」(日光ケミカルズ(株)製)、「EMALEX HC−5」(日本エマルジョン(株)製)等として市販されている。(c)成分は1種または2種以上を用いることができる。
【0027】
(d)成分はソルビタン脂肪酸エステルである。(d)成分において、脂肪酸残基としてはオレイン酸残基、イソステアリン酸残基、ラウリン酸残基を含むものが安定性等の点から好ましい。(d)成分としてはセスキオレイン酸ソルビタン、セスキイソステアリン酸ソルビタン等が具体例として挙げられる。(d)成分は、例えば「ニッコールSO−15R」、「ニッコールSI−15R」(日光ケミカルズ(株)製)、「EMALEX SPO−150」、「EMALEX SPIS−150」(日本エマルジョン(株)製)等として市販されている。(d)成分は1種または2種以上を用いることができる。
【0028】
(e)成分はポリエーテル変性シリコーンである。本発明では特に、下記式(I)
【0029】

【0030】
(式中、R1は水素原子または炭素原子数1〜6のアルキル基を表し;rは50〜60の数を表し;uは2〜5の数を表し;aは8〜10、bは0〜35の数を表す)で表されるポリエーテル変性シリコーンが好ましく用いられる。式(I)中、R1は水素原子が好ましく、またbは0が好ましい。
【0031】
ポリエーテル変性シリコーンは、例えば、「KF−6017P」(信越化学(株)製)や、「SS−2910」(東レ・ダウコーニング社)等として市販されている。(e)成分は1種または2種以上を用いることができる。
【0032】
本発明では上記(c)成分、(d)成分、(e)成分を、30〜80:10〜45:5〜55(質量比)の割合で配合する。好ましくは40〜80:10〜45:5〜50(質量比)、より好ましくは45〜80:10〜45:5〜30(質量比)である。(c)成分、(d)成分、(e)成分を上記割合で配合することにより、適度な硬さで、製剤安定性に優れ、かつ高温(50℃)で4か月間保存した後でも乳化安定性を維持することができる。
【0033】
なお(c)成分、(d)成分、(e)成分の3成分の組成(質量%)と、乳化安定性との関係を示す三角図を図1に示す。これら3成分以外の成分は、後掲の実施例1に示す配合成分および配合量とし、その系中で上記3成分の配合比率を変えた。(c)成分はPOE(5)硬化ヒマシ油(「ニッコールHCO−5」;日光ケミカルズ(株)製)を、(d)成分はセスキオレイン酸ソルビタン(「ニッコールSO−15R」;日光ケミカルズ(株)製)を、(e)成分はPEG−10ジメチコン(「KF−6017P」;信越化学(株)製)を、それぞれ用いた。図1中、交差斜線で囲む領域が本発明範囲である。
【0034】
本発明において、(c)成分、(d)成分、および(e)成分の合計配合量は0.8〜8.0質量%であり、好ましくは1.0〜6.0質量%である。3成分の合計配合量が0.8質量%未満では製剤の乳化ができず、一方、8.0質量%超では乳化に不必要な量となる。
【0035】
(f)成分は水である。水の配合量は本発明皮膚外用剤全量中、50〜80質量%が好ましく、より好ましくは55〜75質量%である。50質量%未満では内相比が低く充分な硬度が得られず製剤の安定性が悪くなる傾向がみられ、一方、80質量%を超えて配合すると内相比が高くなり外用剤の調製が困難となる傾向がみられる。
【0036】
本発明では上記(a)〜(f)成分を必須成分として配合することにより、極性を有する油溶性薬剤である(b)成分を安定して配合することができるとともに、系の乳化安定性にも優れ、かつ閉塞性に優れながら使用感(べたつかない)にも優れる。上記(c)成分、(d)成分および(e)成分は非イオン性界面活性剤成分であるが、本発明ではこれら3成分を併用しないと安定性効果が得られない。一般に、極性を有する油溶性薬剤を2種類以上組み合せて配合すると、製剤の安定性の保証が難しくなるが、本発明では、(b)成分として2種類の薬剤を組み合せて(例えば、ウフェナマートとジフェンヒドラミンとの組み合せ)配合した場合であっても、(a)成分および(c)〜(f)成分との併用により製剤の安定性を担保することができる。
【0037】
本発明では所望によりさらに(g)デキストリン脂肪酸エステルを配合してもよい。(g)成分を配合することにより、外油相を増粘し外用剤の高温安定性の効果をより一層高めることができる。(g)成分であるデキストリン脂肪酸エステルは、デキストリンまたは還元デキストリンと高級脂肪酸とのエステルである。上記デキストリンまたは還元デキストリンの平均糖重合度は、3〜100のものを用いるのが好ましい。また上記高級脂肪酸は、炭素数8〜16の飽和脂肪酸を用いるのが好ましい。具体的には、オクタン酸、ラウリン酸、ミリスチン酸、パルミチン酸などを挙げることができる。(g)成分は「レオパールKL」、「レオパールMKL」、「レオパールTT」(以上、いずれも千葉製粉(株)製)等として市販され、これらを好適に用いることができる。(g)成分は1種または2種以上を用いることができる。
【0038】
(g)成分を配合する場合、その配合量は、本発明皮膚外用剤全量中、3.0質量%以下とするのが好ましく、より好ましくは0.2〜1.2質量%である。
【0039】
本発明では所望によりさらに、(h)平均質量分子量が4,000〜20,000、好ましくは6,000〜10,000のポリエチレングリコールを配合してもよい。(h)成分を配合することにより、オストワルドライプニングの防止により乳化粒子の成長を抑え、外用剤の安定性効果をより一層高めることができる。なおポリエチレングリコールは粧原基収載名であって日局収載名ではマクロゴールといい、どちらも同じ物質をさす名称である。
【0040】
(h)成分を配合する場合、本発明皮膚外用剤全量中、0.5〜5.0質量%が好ましく、より好ましくは1.0〜3.0質量%である。
【0041】
本発明の油中水型乳化皮膚外用剤は、常法により調製することができ、乳化の方法は特に限定されるものでない。例えば、水相(内相)と油相(外相)を、それぞれ70℃程度に加温し、加温した水相を油相に徐々に添加して、乳化機で乳化し、その後、室温まで冷却する等の方法が挙げられるが、これに限定されるものでない。本発明では、水相(内相)を皮膚外用剤全量に対して50〜80質量%とするのが好ましく、より好ましくは55〜75質量%である。なお水相には(f)成分の他、水溶性成分(グリセリン、1,3−ブチレングリコール、ポリエチレングリコール6000等)が含まれる。水相配合量を上記範囲とすることで、べたつき感をより効果的に抑えることができる。
【0042】
本発明の油中水型乳化皮膚外用剤には、本発明の効果を損なわない範囲内で通常化粧品や医薬品等の皮膚外用剤に用いられる他の任意添加成分、例えば、油脂、ロウ類、炭化水素油、ワセリン、高級アルコール、高級脂肪酸、界面活性剤、紫外線吸収剤、金属イオン封鎖剤、低級アルコール、多価アルコール、粉末成分、糖、アミノ酸およびその塩、有機アミン、高分子エマルジョン、pH調整剤、皮膚栄養剤、ビタミン、酸化防止剤、酸化防止助剤、香料等を必要に応じて適宜配合することができる。
【0043】
その他の配合可能成分としては、例えば、防腐剤(メチルパラベン、エチルパラベン、ブチルパラベン等);消炎剤(例えば、グリチルリチン酸およびその誘導体、グリチルレチン酸およびその誘導体、サリチル酸およびその誘導体、ヒノキチオール、酸化亜鉛、アラントイン等);美白剤(例えば、ユキノシタ抽出物、アルブチン等);各種抽出物(例えば、オウバク、オウレン、シコン、シャクヤク、センブリ、バーチ、セージ、ビワ、ニンジン、アロエ、ゼニアオイ、アイリス、ブドウ、ヨクイニン、ヘチマ、ユリ、サフラン、センキュウ、ショウキュウ、オトギリソウ、オノニス、ニンニク、トウガラシ、チンピ、トウキ、海藻等)、賦活剤(例えば、ローヤルゼリー、感光素、コレステロール誘導体等);血行促進剤(例えば、ノニル酸ワレニルアミド、ニコチン酸ベンジルエステル、ニコチン酸β−ブトキシエチルエステル、カプサイシン、ジンゲロン、カンタリスチンキ、イクタモール、タンニン酸、α−ボルネオール、ニコチン酸トコフェロール、酢酸トコフェロール、イノシトールヘキサニコチネート、シクランデレート、シンナリジン、トラゾリン、アセチルコリン、ベラパミル、セファランチン、γ−オリザノール等);抗脂漏剤(例えば、硫黄、チアントール等);抗炎症剤(例えば、トラネキサム酸、チオタウリン、ヒポタウリン等)等が挙げられる。ただしこれら例示に限定されるものでない。
【実施例】
【0044】
以下に実施例を挙げて本発明をさらに具体的に説明するが、本発明はこれによってなんら限定されるものではない。配合量は特記しない限りすべて質量%である。なお下記実施例において、POE(5)硬化ヒマシ油は「ニッコールHCO−5」(日光ケミカルズ(株)製)を、セスキオレイン酸ソルビタンは「ニッコールSO−15R」(日光ケミカルズ(株)製)を、ポリエーテル変性シリコーンはPEG−10ジメチコンである「KF−6017P」(信越化学(株)製)を、パルミチン酸デキストリンは「レオパールKL」(千葉製粉(株))を、それぞれ用いた。
【0045】
まず初めに、本実施例で用いた試験方法、評価方法について説明する。
【0046】
[硬度]
各試料の硬度(調製日。25℃)を測定した。硬度はCurdmeter・Max Me-500(I. techno Engineering社製)による破断荷重(g)で示した。硬度は5〜30程度がクリーム基剤として好ましい。
【0047】
[乳化安定性]
各試料を50℃の恒温槽に4ヵ月間放置し、乳化安定性について目視により外観を観察した。
【0048】
(実施例1〜4、比較例1〜2)
下記表1に示す組成の薬剤含有乳化皮膚外用剤を試料として、上記試験方法、評価基準に従い、硬度、乳化安定性について評価した。結果を表1に示す。
【0049】
【表1】

【0050】
表1の結果から明らかなように、実施例1〜4では50℃、4か月経過後でも乳化安定性に優れていたが、(c)成分に代えてPOE付加モル数が多いPOE(10)硬化ヒマシ油を用いた比較例1では乳化不良となり、(e)成分を欠く比較例2では2ヵ月で分離し、良好な乳化安定性が得られなかった。なお実施例1〜4はいずれも良好な閉塞性、使用感(べたつかない)であった。
【0051】
(実施例5〜9、比較例3)
下記表2に示す組成の薬剤含有乳化皮膚外用剤を試料として、上記試験方法、評価基準に従い、硬度、乳化安定性について評価した。結果を表2に示す。
【0052】
【表2】

【0053】
表2の結果から明らかなように、実施例5〜9では50℃、4か月経過後でも乳化安定性に優れていた。これに対し、比較例3は、例えば実施例6と対比すると、ともに(c)成分、(d)成分、(e)成分が同じ配合比率であるが、これら3成分の合計量が実施例6では本発明下限値範囲内で硬度も低めであるものの、乳化安定性が得られたが、比較例3では3成分の合計量が本発明範囲より低いため、乳化しなかった。なお実施例5〜9はいずれも良好な閉塞性、使用感(べたつかない)であった。
【0054】
(実施例10〜13、比較例4〜7)
下記表3に示す組成の高極性薬剤含有乳化皮膚外用剤を試料として、上記試験方法、評価基準に従い、硬度、乳化安定性について評価した。結果を表3に示す。
【0055】
【表3】

【0056】
表3の結果から明らかなように、実施例10〜13では50℃、4ヵ月経過後でも乳化安定性に優れていたが、(c)成分、(d)成分、(e)成分のいずれかを欠く比較例4〜7は乳化不均一であったり、数週間〜数ヵ月で分離してしまい、良好な乳化安定性が得られなかった。なお実施例10〜13はいずれも良好な閉塞性、使用感(べたつかない)であった。
【0057】
(実施例14〜16)
下記表4に示す組成の薬剤含有乳化皮膚外用剤を試料として、薬剤残存率について評価した。結果を表4に示す。
【0058】
[薬剤残存率]
下記表4に示す各試料をガラス瓶に入れ、0℃、あるいは50℃の恒温槽内で、それぞれ2ヵ月間保存した後の、薬剤残存率を測定し、評価した。
【0059】
【表4】

【0060】
表4の結果から明らかなように、実施例14〜16のいずれも、0℃、50℃下において2ヵ月間経過後も薬剤残存率が極めて高かった。なお薬剤残存率で100%を超える数値が測定されたものがあるが、これは、薬剤単体で検量線を作成するにあたり、実際の測定では処方が複雑系であり、抽出等の作業や共存物の妨害等が入ってくるので、計算上100%を超えることがあるためである。なおこのような場合、安定であると考えられる0℃の値を100%とし、相対的に50℃での残存量を表示する場合もしばしばある。
【産業上の利用可能性】
【0061】
本発明により、ウフェナマート等の極性を有する液状薬剤を含む系であって、乳化安定性、薬剤安定性に優れ、かつ、閉塞性がありながら、べたつかず、使用性に優れる油中水型乳化皮膚外用剤が提供される。
【技術分野】
【0001】
本発明は油中水型乳化皮膚外用剤に関する。さらに詳しくは、ウフェナマート等の液状薬剤を含む系であって、乳化安定性、薬剤安定性に優れ、かつ、皮膚表面からの過度の水分揮散を抑える皮膚閉塞性がありながら、べたつかず、使用性に優れる油中水型乳化皮膚外用剤に関する。
【背景技術】
【0002】
従来、皮膚閉塞性の高い皮膚外用剤としてワセリンを用いた非水系のワセリン軟膏が知られている。しかしワセリン軟膏は伸びが悪く、べたつくといった欠点がある。他方、水中油型乳化系のクリームはべたつき感はないものの閉塞性に劣る。
【0003】
そこで水中油型乳化系に比べ皮膚閉塞性が高く、しかもワセリン軟膏のようなべたつき感がない基剤として油中水型乳化系の基剤が考えられるが、従来、油中水型乳化系の医薬用クリームは製剤化が難しく、医薬用製剤で使用可能な界面活性剤(例えば、親油性界面活性剤であるソルビタンセスキオレート等)を用いた場合、硬度が出ず、製剤の安定性が担保できないという問題があった。また医薬用に用いる原料に制約があり、安定な処方の設計が難しかった。一般に、乳化基剤に、極性を有する液状薬剤(例えば、非ステロイド系抗炎症剤として知られているウフェナマート、抗ヒスタミン薬として知られるジフェンヒドラミン、鎮痒剤として知られるクロタミトン等)を配合すると、製剤安定性を損ねるが、特に油中水型乳化系の基剤にこれらの液状薬剤を配合する場合には顕著である。そのため、医療用、一般薬用とも油中水型乳化製剤はほとんど存在せず、しかも適度な閉塞性が期待される油中水型乳化組成物に極性を有する液状薬剤を配合することは極めて困難である。
【0004】
このような液状薬剤を安定に配合するために、例えば特開2001−181166号公報(特許文献1)では、IOB値が0.1〜2の油溶性薬剤(ウフェナマート等)と、分子中に炭素数8以上の炭素鎖を含む疎水基を2個以上有する親油性乳化剤(例えば、ポリグリセリン脂肪酸エステル、ソルビタン脂肪酸エステル、ポリオキシエチレン(以下、「POE」とも記す)ソルビット脂肪酸エステル、POE硬化ヒマシ油など)を含有する油中水型乳化皮膚外用剤組成物が記載されている。しかし該特許文献1では、保存安定性について1ヵ月間(25℃、40℃)の乳化安定性評価を行っているに過ぎず、後述する本発明のように高温(50℃)で4ヵ月間という長期間において保存安定性を維持し得るかどうかについてまでは検討されていない。また高温下で保存後の製剤中の薬剤残存率等についての検討もされていない。
【0005】
特開2006−335735号公報(特許文献2)には、油分とHLB値8以下のノニオン界面活性剤と電解質と水溶性多価アルコールを含む油中水型乳化組成物が記載され(請求項1)、ここにさらに薬効成分を含有し得ることが記載されている(請求項8、[0018]等)。しかし特許文献2には、従来より油中水型乳化系には安定的に配合することが難しいとされているウフェナマート等の液状薬剤を配合した具体的な組成について記載がなく、このような液状薬剤を系中に長期間安定に配合することを目的とするといったような記載・示唆もない。またポリエーテル変性シリコーンの配合についての記載・示唆もない。
【0006】
特開2008−1237306号公報(特許文献3)には、シリコーン系界面活性剤、油剤、油ゲル化剤、水溶性高分子、および水61〜98質量%を含有する油中水型乳化化粧料が、保湿効果があり、べたつきがなく、安定性(均一、分離等)があるということが記載され、ここにさらに非イオン性界面活性剤を配合し得ることが記載されている(特許請求の範囲の欄)。そして上記シリコーン系界面活性剤としてポリエーテル変性シリコーンが例示され([0009])、上記油ゲル化剤としてパルミチン酸脂肪エステル等が記載され([0027])、上記非イオン性界面活性剤としてPOE硬化ヒマシ油、ショ糖脂肪酸エステル等が記載され、これら非イオン性界面活性剤の好適配合量が0.05〜5質量%であることが記載されている([0049]〜[0050])。しかし特許文献3は化粧料に関するものであり、従来より油中水型乳化系には安定的に配合することが難しいとされているウフェナマート等の液状薬剤を配合した具体的な組成について記載がなく、このような高極性液状薬剤を系中に長期間安定に配合することを目的とするといったような記載・示唆もない。また特許文献3の実施例では水溶性高分子としてカチオン性架橋共重合体を用いているが、かかる化合物は本発明では用いない。
【0007】
特公平3−56776号公報(特許文献4)には、特定の非イオン界面活性剤と、液体油と、分子量2000〜300000のポリエチレングリコールと、水をそれぞれ所定量含有する油中水型乳化組成物が記載され、任意添加成分として薬効剤が「一行記載」されている(第3頁第6欄12行)。しかし特許文献4には、薬効剤を配合した具体的組成の記載はなく、従来より油中水型乳化系に安定配合するのが難しいとされていたウフェナマート等の液状薬剤を、安定に配合することを目的とするようなことの記載・示唆は一切ない。
【先行技術文献】
【特許文献】
【0008】
【特許文献1】特開2001−181166号公報
【特許文献2】特開2006−335735号公報
【特許文献3】特開2008−1237306号公報
【特許文献4】特公平3−56776号公報
【発明の概要】
【発明が解決しようとする課題】
【0009】
本発明は上記従来の事情に鑑みてなされたもので、ウフェナマート等の極性を有する液状薬剤を含む系であって、乳化安定性、薬剤安定性に優れ、かつ、閉塞性がありながら、べたつかず、使用性に優れる油中水型乳化皮膚外用剤を提供することを目的とする。
【課題を解決するための手段】
【0010】
上記課題を解決するために本発明は、以下の(a)〜(f)成分を含有する油中水型乳化皮膚外用剤を提供する。
(a)液状油分を10〜20質量%、
(b)ウフェナマート、ジフェンヒドラミン、およびクロタミトンから選ばれる1種または2種以上の液状薬剤を1〜10質量%、
(c)ポリオキシエチレン(4〜6モル付加)硬化ヒマシ油、
(d)ソルビタン脂肪酸エステル、
(e)ポリエーテル変性シリコーン、および
(f)水。
【0011】
ただし上記において、(c)成分:(d)成分:(e)成分=30〜80:10〜45:5〜55(質量比)であり、かつ(c)成分、(d)成分および(e)成分の合計配合量が0.8〜8.0質量%である。
【0012】
また本発明は、(e)成分が下記式(I)に示す化合物である、上記油中水型乳化皮膚外用剤を提供する。
【0013】

【0014】
(式中、R1は水素原子または炭素原子数1〜6のアルキル基を表し;rは50〜60の数を表し;uは2〜5の数を表し;aは8〜10、bは0〜35の数を表す。)
【0015】
また本発明は、(b)成分がウフェナマートとジフェンヒドラミンからなる液状薬剤である、上記油中水型乳化皮膚外用剤を提供する。
【0016】
また本発明は、さらに(g)デキストリン脂肪酸エステルを含有する、上記油中水型乳化皮膚外用剤を提供する。
【0017】
また本発明は、さらに(h)平均質量分子量が4,000〜20,000のポリエチレングリコールを含有する、上記油中水型乳化皮膚外用剤を提供する。
【発明の効果】
【0018】
本発明により、ウフェナマート等の極性を有する液状薬剤を含む系であって、乳化安定性、薬剤安定性に優れ、かつ、閉塞性がありながら、べたつかず、使用性に優れる油中水型乳化皮膚外用剤が提供される。
【図面の簡単な説明】
【0019】
【図1】本発明におけるPOE(5)硬化ヒマシ油、ソルビタンセスキオレイン酸エステル、およびポリエーテル変性シリコーン(「KF−6017P」)の組成(質量%)と乳化安定性との関係を示す三角図である。
【発明を実施するための形態】
【0020】
以下、本発明について詳述する。
【0021】
本発明における(a)成分としての液状油分は、常温(25℃)で揮発しない流動油分をいう。具体的には、例えば、流動パラフィン、スクワラン、オレフィンオリゴマー、軽質イソパラフィン(=軽質流動パラフィン)などの炭化水素油;2−エチルヘキサン酸トリグリセリド、2−エチルヘキサン酸セチル、2−エチルヘキサン酸ペンタエリトリトール、2−エチルヘキサン酸トリメチロールプロパン、パルミチン酸2−エチルヘキシル、イソノナン酸イソセチル、ミリスチン酸イソプロピル、2−エチルヘキサン酸セチル、セバシン酸ジエチル、アジピン酸ジエチルなどのエステル油;ホホバ油、オリーブ油、マカデミアナッツ油、綿実油、茶実油、サフラワー油、米糠油などの天然系植物油;デカメチルペンタシクロシロキサン、オクタメチルテトラシクロシロキサン、ジメチルポリシロキサン、メチルフェニルポリシロキサンなどのシリコーン油、などが挙げられるが、これら例示に限定されるものでないことはもちろんである。本発明では(b)成分との相溶性、使用性、外用剤の外観等の点から炭化水素油、エステル油、シリコーン油が好ましく用いられる。(a)成分は1種または2種以上を用いることができる。
【0022】
(a)成分の配合量は、本発明皮膚外用剤全量中、10〜20質量%である。10質量%未満では(b)成分との相溶性が悪く、油相成分全体としての極性が相対的に高まり乳化性上も好ましくなく、また、内相比が高くなる結果、外用剤の硬度が高くなり、使用性、外観とも好ましくない。一方、20質量%を超えて配合すると内相比が低下し硬度が低くなり、安定性上好ましくない。
【0023】
(b)成分は極性を有する油溶性の液状薬剤成分で、本発明ではウフェナマート、ジフェンヒドラミン、およびクロタミトンの中から選ばれる1種または2種以上を用いる。ウフェナマートは非ステロイド系抗炎症剤として知られ、化学式C18H18F3NO2で示され、化学名はブチルO−[〔3−(トリフルオロメチル)フェニル〕アミノ]−ベンゾエートである。ジフェンヒドラミンは抗ヒスタミン薬として知られ、化学式C17H21NOで示される。クロタミトンは鎮痒剤として知られ、化学式C13H17NOで示される。
【0024】
(b)成分の配合量は、本発明皮膚外用剤全量中、1〜10質量%であり、好ましくは1〜6質量%である。1質量%未満では(b)成分の薬効を十分発揮することができず、一方、10質量%を超えて配合すると資源の有効利用の観点や製剤安定性上もやや不安定となり、好ましくない。
【0025】
本発明では非イオン界面活性剤として、下記の(c)成分、(d)成分、および(e)成分を組み合せて配合する。
【0026】
(c)成分はPOE(4〜6)硬化ヒマシ油である。POE付加モル数が4未満では親油性が高過ぎ、また、製品も実質上上市されておらず、一方、POE付加モル数が6を超えるもの(上市品として「ニッコールHCO−10」(日光ケミカルズ(株)製)などがある)では乳化が不安定となり、好ましくない。(c)成分は、例えば「ニッコールHCO−5」(日光ケミカルズ(株)製)、「EMALEX HC−5」(日本エマルジョン(株)製)等として市販されている。(c)成分は1種または2種以上を用いることができる。
【0027】
(d)成分はソルビタン脂肪酸エステルである。(d)成分において、脂肪酸残基としてはオレイン酸残基、イソステアリン酸残基、ラウリン酸残基を含むものが安定性等の点から好ましい。(d)成分としてはセスキオレイン酸ソルビタン、セスキイソステアリン酸ソルビタン等が具体例として挙げられる。(d)成分は、例えば「ニッコールSO−15R」、「ニッコールSI−15R」(日光ケミカルズ(株)製)、「EMALEX SPO−150」、「EMALEX SPIS−150」(日本エマルジョン(株)製)等として市販されている。(d)成分は1種または2種以上を用いることができる。
【0028】
(e)成分はポリエーテル変性シリコーンである。本発明では特に、下記式(I)
【0029】

【0030】
(式中、R1は水素原子または炭素原子数1〜6のアルキル基を表し;rは50〜60の数を表し;uは2〜5の数を表し;aは8〜10、bは0〜35の数を表す)で表されるポリエーテル変性シリコーンが好ましく用いられる。式(I)中、R1は水素原子が好ましく、またbは0が好ましい。
【0031】
ポリエーテル変性シリコーンは、例えば、「KF−6017P」(信越化学(株)製)や、「SS−2910」(東レ・ダウコーニング社)等として市販されている。(e)成分は1種または2種以上を用いることができる。
【0032】
本発明では上記(c)成分、(d)成分、(e)成分を、30〜80:10〜45:5〜55(質量比)の割合で配合する。好ましくは40〜80:10〜45:5〜50(質量比)、より好ましくは45〜80:10〜45:5〜30(質量比)である。(c)成分、(d)成分、(e)成分を上記割合で配合することにより、適度な硬さで、製剤安定性に優れ、かつ高温(50℃)で4か月間保存した後でも乳化安定性を維持することができる。
【0033】
なお(c)成分、(d)成分、(e)成分の3成分の組成(質量%)と、乳化安定性との関係を示す三角図を図1に示す。これら3成分以外の成分は、後掲の実施例1に示す配合成分および配合量とし、その系中で上記3成分の配合比率を変えた。(c)成分はPOE(5)硬化ヒマシ油(「ニッコールHCO−5」;日光ケミカルズ(株)製)を、(d)成分はセスキオレイン酸ソルビタン(「ニッコールSO−15R」;日光ケミカルズ(株)製)を、(e)成分はPEG−10ジメチコン(「KF−6017P」;信越化学(株)製)を、それぞれ用いた。図1中、交差斜線で囲む領域が本発明範囲である。
【0034】
本発明において、(c)成分、(d)成分、および(e)成分の合計配合量は0.8〜8.0質量%であり、好ましくは1.0〜6.0質量%である。3成分の合計配合量が0.8質量%未満では製剤の乳化ができず、一方、8.0質量%超では乳化に不必要な量となる。
【0035】
(f)成分は水である。水の配合量は本発明皮膚外用剤全量中、50〜80質量%が好ましく、より好ましくは55〜75質量%である。50質量%未満では内相比が低く充分な硬度が得られず製剤の安定性が悪くなる傾向がみられ、一方、80質量%を超えて配合すると内相比が高くなり外用剤の調製が困難となる傾向がみられる。
【0036】
本発明では上記(a)〜(f)成分を必須成分として配合することにより、極性を有する油溶性薬剤である(b)成分を安定して配合することができるとともに、系の乳化安定性にも優れ、かつ閉塞性に優れながら使用感(べたつかない)にも優れる。上記(c)成分、(d)成分および(e)成分は非イオン性界面活性剤成分であるが、本発明ではこれら3成分を併用しないと安定性効果が得られない。一般に、極性を有する油溶性薬剤を2種類以上組み合せて配合すると、製剤の安定性の保証が難しくなるが、本発明では、(b)成分として2種類の薬剤を組み合せて(例えば、ウフェナマートとジフェンヒドラミンとの組み合せ)配合した場合であっても、(a)成分および(c)〜(f)成分との併用により製剤の安定性を担保することができる。
【0037】
本発明では所望によりさらに(g)デキストリン脂肪酸エステルを配合してもよい。(g)成分を配合することにより、外油相を増粘し外用剤の高温安定性の効果をより一層高めることができる。(g)成分であるデキストリン脂肪酸エステルは、デキストリンまたは還元デキストリンと高級脂肪酸とのエステルである。上記デキストリンまたは還元デキストリンの平均糖重合度は、3〜100のものを用いるのが好ましい。また上記高級脂肪酸は、炭素数8〜16の飽和脂肪酸を用いるのが好ましい。具体的には、オクタン酸、ラウリン酸、ミリスチン酸、パルミチン酸などを挙げることができる。(g)成分は「レオパールKL」、「レオパールMKL」、「レオパールTT」(以上、いずれも千葉製粉(株)製)等として市販され、これらを好適に用いることができる。(g)成分は1種または2種以上を用いることができる。
【0038】
(g)成分を配合する場合、その配合量は、本発明皮膚外用剤全量中、3.0質量%以下とするのが好ましく、より好ましくは0.2〜1.2質量%である。
【0039】
本発明では所望によりさらに、(h)平均質量分子量が4,000〜20,000、好ましくは6,000〜10,000のポリエチレングリコールを配合してもよい。(h)成分を配合することにより、オストワルドライプニングの防止により乳化粒子の成長を抑え、外用剤の安定性効果をより一層高めることができる。なおポリエチレングリコールは粧原基収載名であって日局収載名ではマクロゴールといい、どちらも同じ物質をさす名称である。
【0040】
(h)成分を配合する場合、本発明皮膚外用剤全量中、0.5〜5.0質量%が好ましく、より好ましくは1.0〜3.0質量%である。
【0041】
本発明の油中水型乳化皮膚外用剤は、常法により調製することができ、乳化の方法は特に限定されるものでない。例えば、水相(内相)と油相(外相)を、それぞれ70℃程度に加温し、加温した水相を油相に徐々に添加して、乳化機で乳化し、その後、室温まで冷却する等の方法が挙げられるが、これに限定されるものでない。本発明では、水相(内相)を皮膚外用剤全量に対して50〜80質量%とするのが好ましく、より好ましくは55〜75質量%である。なお水相には(f)成分の他、水溶性成分(グリセリン、1,3−ブチレングリコール、ポリエチレングリコール6000等)が含まれる。水相配合量を上記範囲とすることで、べたつき感をより効果的に抑えることができる。
【0042】
本発明の油中水型乳化皮膚外用剤には、本発明の効果を損なわない範囲内で通常化粧品や医薬品等の皮膚外用剤に用いられる他の任意添加成分、例えば、油脂、ロウ類、炭化水素油、ワセリン、高級アルコール、高級脂肪酸、界面活性剤、紫外線吸収剤、金属イオン封鎖剤、低級アルコール、多価アルコール、粉末成分、糖、アミノ酸およびその塩、有機アミン、高分子エマルジョン、pH調整剤、皮膚栄養剤、ビタミン、酸化防止剤、酸化防止助剤、香料等を必要に応じて適宜配合することができる。
【0043】
その他の配合可能成分としては、例えば、防腐剤(メチルパラベン、エチルパラベン、ブチルパラベン等);消炎剤(例えば、グリチルリチン酸およびその誘導体、グリチルレチン酸およびその誘導体、サリチル酸およびその誘導体、ヒノキチオール、酸化亜鉛、アラントイン等);美白剤(例えば、ユキノシタ抽出物、アルブチン等);各種抽出物(例えば、オウバク、オウレン、シコン、シャクヤク、センブリ、バーチ、セージ、ビワ、ニンジン、アロエ、ゼニアオイ、アイリス、ブドウ、ヨクイニン、ヘチマ、ユリ、サフラン、センキュウ、ショウキュウ、オトギリソウ、オノニス、ニンニク、トウガラシ、チンピ、トウキ、海藻等)、賦活剤(例えば、ローヤルゼリー、感光素、コレステロール誘導体等);血行促進剤(例えば、ノニル酸ワレニルアミド、ニコチン酸ベンジルエステル、ニコチン酸β−ブトキシエチルエステル、カプサイシン、ジンゲロン、カンタリスチンキ、イクタモール、タンニン酸、α−ボルネオール、ニコチン酸トコフェロール、酢酸トコフェロール、イノシトールヘキサニコチネート、シクランデレート、シンナリジン、トラゾリン、アセチルコリン、ベラパミル、セファランチン、γ−オリザノール等);抗脂漏剤(例えば、硫黄、チアントール等);抗炎症剤(例えば、トラネキサム酸、チオタウリン、ヒポタウリン等)等が挙げられる。ただしこれら例示に限定されるものでない。
【実施例】
【0044】
以下に実施例を挙げて本発明をさらに具体的に説明するが、本発明はこれによってなんら限定されるものではない。配合量は特記しない限りすべて質量%である。なお下記実施例において、POE(5)硬化ヒマシ油は「ニッコールHCO−5」(日光ケミカルズ(株)製)を、セスキオレイン酸ソルビタンは「ニッコールSO−15R」(日光ケミカルズ(株)製)を、ポリエーテル変性シリコーンはPEG−10ジメチコンである「KF−6017P」(信越化学(株)製)を、パルミチン酸デキストリンは「レオパールKL」(千葉製粉(株))を、それぞれ用いた。
【0045】
まず初めに、本実施例で用いた試験方法、評価方法について説明する。
【0046】
[硬度]
各試料の硬度(調製日。25℃)を測定した。硬度はCurdmeter・Max Me-500(I. techno Engineering社製)による破断荷重(g)で示した。硬度は5〜30程度がクリーム基剤として好ましい。
【0047】
[乳化安定性]
各試料を50℃の恒温槽に4ヵ月間放置し、乳化安定性について目視により外観を観察した。
【0048】
(実施例1〜4、比較例1〜2)
下記表1に示す組成の薬剤含有乳化皮膚外用剤を試料として、上記試験方法、評価基準に従い、硬度、乳化安定性について評価した。結果を表1に示す。
【0049】
【表1】

【0050】
表1の結果から明らかなように、実施例1〜4では50℃、4か月経過後でも乳化安定性に優れていたが、(c)成分に代えてPOE付加モル数が多いPOE(10)硬化ヒマシ油を用いた比較例1では乳化不良となり、(e)成分を欠く比較例2では2ヵ月で分離し、良好な乳化安定性が得られなかった。なお実施例1〜4はいずれも良好な閉塞性、使用感(べたつかない)であった。
【0051】
(実施例5〜9、比較例3)
下記表2に示す組成の薬剤含有乳化皮膚外用剤を試料として、上記試験方法、評価基準に従い、硬度、乳化安定性について評価した。結果を表2に示す。
【0052】
【表2】

【0053】
表2の結果から明らかなように、実施例5〜9では50℃、4か月経過後でも乳化安定性に優れていた。これに対し、比較例3は、例えば実施例6と対比すると、ともに(c)成分、(d)成分、(e)成分が同じ配合比率であるが、これら3成分の合計量が実施例6では本発明下限値範囲内で硬度も低めであるものの、乳化安定性が得られたが、比較例3では3成分の合計量が本発明範囲より低いため、乳化しなかった。なお実施例5〜9はいずれも良好な閉塞性、使用感(べたつかない)であった。
【0054】
(実施例10〜13、比較例4〜7)
下記表3に示す組成の高極性薬剤含有乳化皮膚外用剤を試料として、上記試験方法、評価基準に従い、硬度、乳化安定性について評価した。結果を表3に示す。
【0055】
【表3】

【0056】
表3の結果から明らかなように、実施例10〜13では50℃、4ヵ月経過後でも乳化安定性に優れていたが、(c)成分、(d)成分、(e)成分のいずれかを欠く比較例4〜7は乳化不均一であったり、数週間〜数ヵ月で分離してしまい、良好な乳化安定性が得られなかった。なお実施例10〜13はいずれも良好な閉塞性、使用感(べたつかない)であった。
【0057】
(実施例14〜16)
下記表4に示す組成の薬剤含有乳化皮膚外用剤を試料として、薬剤残存率について評価した。結果を表4に示す。
【0058】
[薬剤残存率]
下記表4に示す各試料をガラス瓶に入れ、0℃、あるいは50℃の恒温槽内で、それぞれ2ヵ月間保存した後の、薬剤残存率を測定し、評価した。
【0059】
【表4】

【0060】
表4の結果から明らかなように、実施例14〜16のいずれも、0℃、50℃下において2ヵ月間経過後も薬剤残存率が極めて高かった。なお薬剤残存率で100%を超える数値が測定されたものがあるが、これは、薬剤単体で検量線を作成するにあたり、実際の測定では処方が複雑系であり、抽出等の作業や共存物の妨害等が入ってくるので、計算上100%を超えることがあるためである。なおこのような場合、安定であると考えられる0℃の値を100%とし、相対的に50℃での残存量を表示する場合もしばしばある。
【産業上の利用可能性】
【0061】
本発明により、ウフェナマート等の極性を有する液状薬剤を含む系であって、乳化安定性、薬剤安定性に優れ、かつ、閉塞性がありながら、べたつかず、使用性に優れる油中水型乳化皮膚外用剤が提供される。
【特許請求の範囲】
【請求項1】
以下の(a)〜(f)成分を含有する油中水型乳化皮膚外用剤。
(a)液状油分を10〜20質量%、
(b)ウフェナマート、ジフェンヒドラミン、およびクロタミトンから選ばれる1種または2種以上の液状薬剤を1〜10質量%、
(c)ポリオキシエチレン(4〜6モル付加)硬化ヒマシ油、
(d)ソルビタン脂肪酸エステル、
(e)ポリエーテル変性シリコーン、および
(f)水。
ただし上記において、(c)成分:(d)成分:(e)成分=30〜80:10〜45:5〜55(質量比)であり、かつ(c)成分、(d)成分および(e)成分の合計配合量が0.8〜8.0質量%である。
【請求項2】
(e)成分が下記式(I)に示す化合物である、請求項1記載の油中水型乳化皮膚外用剤。

(式中、R1は水素原子または炭素原子数1〜6のアルキル基を表し;rは50〜60の数を表し;uは2〜5の数を表し;aは8〜10、bは0〜35の数を表す。)
【請求項3】
(b)成分がウフェナマートとジフェンヒドラミンからなる液状薬剤である、請求項1または2記載の油中水型乳化皮膚外用剤。
【請求項4】
さらに(g)デキストリン脂肪酸エステルを含有する、請求項1〜3のいずれか1項に記載の油中水型乳化皮膚外用剤。
【請求項5】
さらに(h)平均質量分子量が4,000〜20,000のポリエチレングリコールを含有する、請求項1〜4のいずれか1項に記載の油中水型乳化皮膚外用剤。
【請求項1】
以下の(a)〜(f)成分を含有する油中水型乳化皮膚外用剤。
(a)液状油分を10〜20質量%、
(b)ウフェナマート、ジフェンヒドラミン、およびクロタミトンから選ばれる1種または2種以上の液状薬剤を1〜10質量%、
(c)ポリオキシエチレン(4〜6モル付加)硬化ヒマシ油、
(d)ソルビタン脂肪酸エステル、
(e)ポリエーテル変性シリコーン、および
(f)水。
ただし上記において、(c)成分:(d)成分:(e)成分=30〜80:10〜45:5〜55(質量比)であり、かつ(c)成分、(d)成分および(e)成分の合計配合量が0.8〜8.0質量%である。
【請求項2】
(e)成分が下記式(I)に示す化合物である、請求項1記載の油中水型乳化皮膚外用剤。

(式中、R1は水素原子または炭素原子数1〜6のアルキル基を表し;rは50〜60の数を表し;uは2〜5の数を表し;aは8〜10、bは0〜35の数を表す。)
【請求項3】
(b)成分がウフェナマートとジフェンヒドラミンからなる液状薬剤である、請求項1または2記載の油中水型乳化皮膚外用剤。
【請求項4】
さらに(g)デキストリン脂肪酸エステルを含有する、請求項1〜3のいずれか1項に記載の油中水型乳化皮膚外用剤。
【請求項5】
さらに(h)平均質量分子量が4,000〜20,000のポリエチレングリコールを含有する、請求項1〜4のいずれか1項に記載の油中水型乳化皮膚外用剤。
【図1】




【公開番号】特開2010−248169(P2010−248169A)
【公開日】平成22年11月4日(2010.11.4)
【国際特許分類】
【出願番号】特願2010−21832(P2010−21832)
【出願日】平成22年2月3日(2010.2.3)
【出願人】(000001959)株式会社資生堂 (1,748)
【Fターム(参考)】
【公開日】平成22年11月4日(2010.11.4)
【国際特許分類】
【出願日】平成22年2月3日(2010.2.3)
【出願人】(000001959)株式会社資生堂 (1,748)
【Fターム(参考)】
[ Back to top ]

